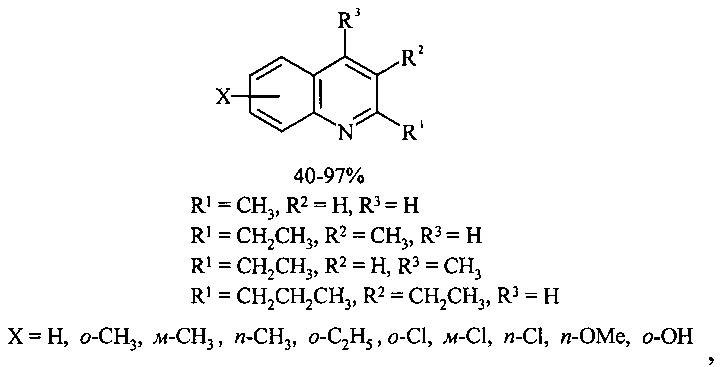
Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ХИНОЛИНОВ ИЗ АНИЛИНА, 1,2-ДИОЛОВ И ССl ПОД ДЕЙСТВИЕМ ЖЕЛЕЗОСОДЕРЖАЩИХ КАТАЛИЗАТОРОВ
Вид РИД
Изобретение
Предлагаемое изобретение относится к области органической химии, в частности к способу получения замещенных хинолинов.
Хинолин и его производные находят широкое применение в качестве синтонов при получении ингибиторов кислотной коррозии металлов, красителей и фармацевтических препаратов, проявляющих антималярийную, противосудорожную и антибактериальную активность [Larsen R.D., Corley E.G., King A.O., Carrol J.D., Davis P., Verhoeven T.R., Reider P.J., Labelle M., Gaunthier J.Y., Xiang Y.B., Zamboni R.J. // J. Org. Chem. 1996, 61, 3398-3405; Chen Y.-L., Fang K.-C, Sheu J.-Y., Hsu S.-L., Tzeng C-C. // J. Med. Chem. 2001, 44, 2374-2377; Roma G., Braccio M.D., Grossi G., Mattioli F., Ghia M. // Eur. J. Med. Chem. 2000, 35, 1021-1035; Dube D., Blouin M., Brideau C, Chan C.-C, Desmarais S., Ethier D., Falgueyret J.P., Friesen R.W., Girard M., Girard Y., Guay J., Riendeau D., Tgari P., Young R.N. // Bioorg. Med. Chem. Lett. 1988, 8, 1255-1260; Maguire M.P., Sheets K.R., McVety K., Spada A.P., Zilberstein, A. // J. Med. Chem. 1994, 37, 2129-2137].
Известные методы синтеза замещенных хинолинов основаны на реакциях доступного анилина и его производных с различными органическими субстратами под действием металлокомплексных катализаторов.
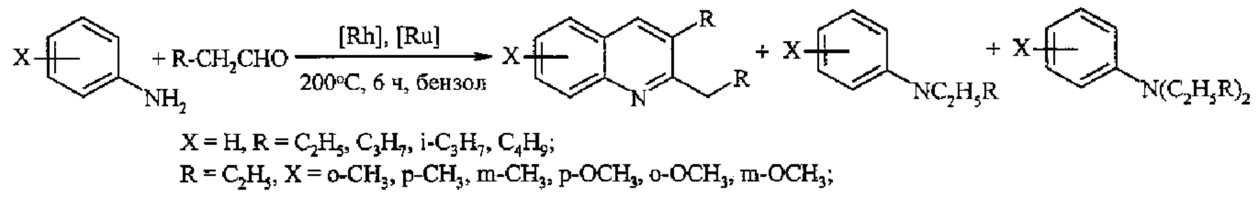
Так, конденсация анилина с алифатическими альдегидами при 200°С под действием комплексов Ru и Rh приводит к замещенным хинолинам с выходами 60-80% [Джемилев У.М., Селимов Ф.А., Хуснутдинов Р.А., Фатыхов А.А., Халилов Л.М., Толстиков Г.А. // Изв. АН СССР. Сер. хим. 1991, 6, 1407-1413].
 Недостатки метода
Недостатки метода
1. Необходимость использования дорогостоящих рутениевых и родиевых катализаторов.
2. Реакция протекает неселективно, наряду с хинолинами образуются побочные продукты: алкил- и диалкиланилины (20-40%).
3. Высокая температура - 200°С.
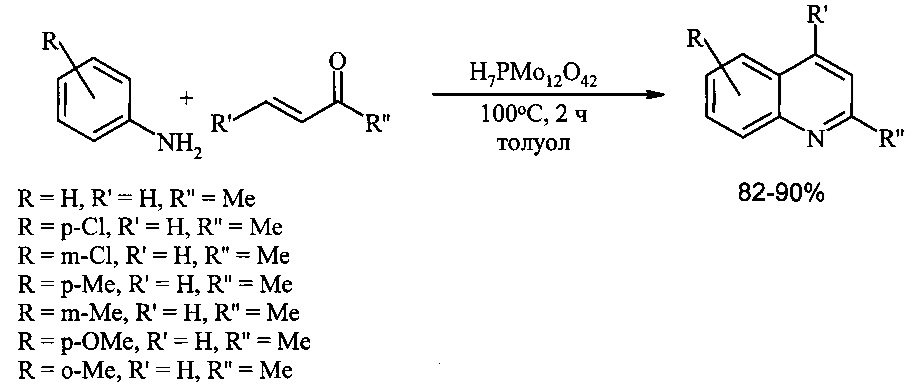
Эффективным катализатором синтеза хинолинов конденсацией анилинов с винилкетонами является фосфорно-молибденовая кислота. Реакция в присутствии H7PMo12O42 проходит в среде толуола при 80°С в течение 50 мин. Выходы хинолинов составляют 87-97% [Chaskar A., Padalkar V., Phatangare K., Langi В., Shah С. // Synt. Commun., 2010, 40(15), 2336-2340].
Недостатки метода
1. Необходимость применения труднодоступных и дорогостоящих реагентов – фосфорно-молибденовой кислоты и алкилвинилкетонов.
В работе осуществлен синтез [Cho C.S., Oh В.Н., Shim S.C. // J. Heterocyclic. Chem., 1999, 36(5), 1175-1178] алкил- и хлор-замещенные хинолинов реакцией соответствующих анилинов с 3-аминопропанолом-1, 1,3-диаминопропаном под действием рутенийсодержащего катализатора, активированного PPh3 в среде ацетона и диоксана при температуре 180°С.
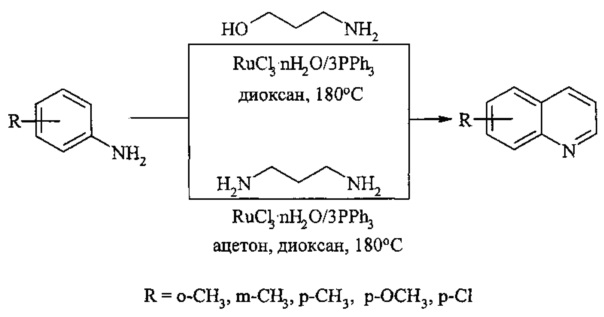
Недостатки метода
1. Необходимость применения дорогостоящих рутениевого катализатора.
2. Низкий выход целевого продукта (20-61%).
В работах [Хуснутдинов Р.И., Байгузина А.Р., Аминов Р.И., Джемилев У.М. // Журн. орг. хим. 2012, 48(5), 693-696; Хуснутдинов Р.И., Байгузина А.Р., Аминов Р.И. // Изв. АН. Сер. хим. 2013, 1, 134-138] приведены примеры синтеза хинолинов взаимодействием замещенных анилинов с алифатическими спиртами (этанол, пропанол, бутанол) и CCl4 в присутствии никель- и железосодержащих металлокомплексных катализаторов.
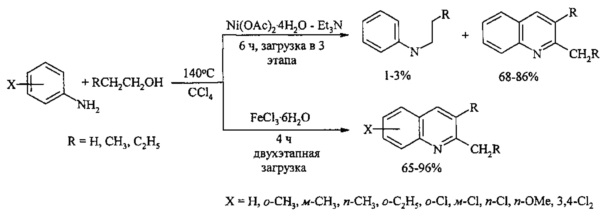
Недостатки метода
1. Использование многоэтапной загрузки исходных реагентов.
Авторами предлагается новый способ получения замещенных хинолинов взаимодействием анилина с 1,2-диолами и CCl4 под действием железосодержащих катализаторов. Следует отметить, что согласно литературным данным каталитическая конденсация анилина и его производных с 1,2-диолами, катализируемая комплексами рутения и иридия, является одним из основных путей синтеза азотгетероциклов ряда индола [Tsuji Y., Huh K.Т., Watanabe Y.J. Org. Chem., 1987, 52, 1673-1680]. В настоящей работе реализовано новое направление реакции анилинов с 1,2-диолами, приводящее к образованию хинолинов.
Задачей предлагаемого изобретения является удешевление себестоимости конечного продукта за счет использования доступного и дешевого катализатора - FeCl3⋅6H2O.
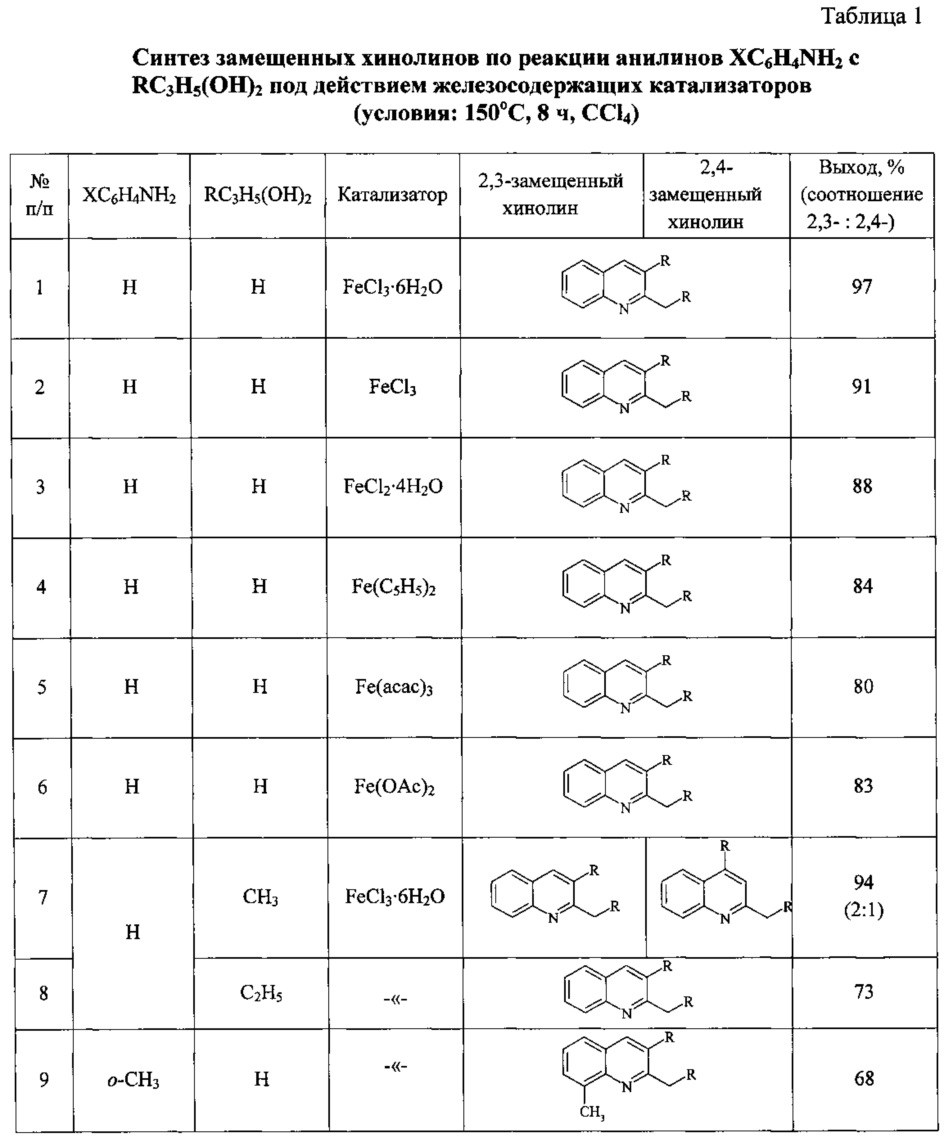
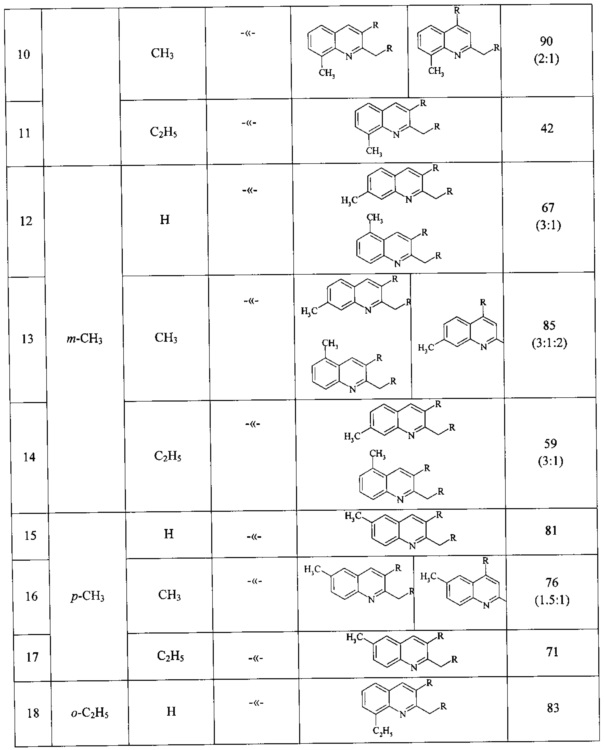
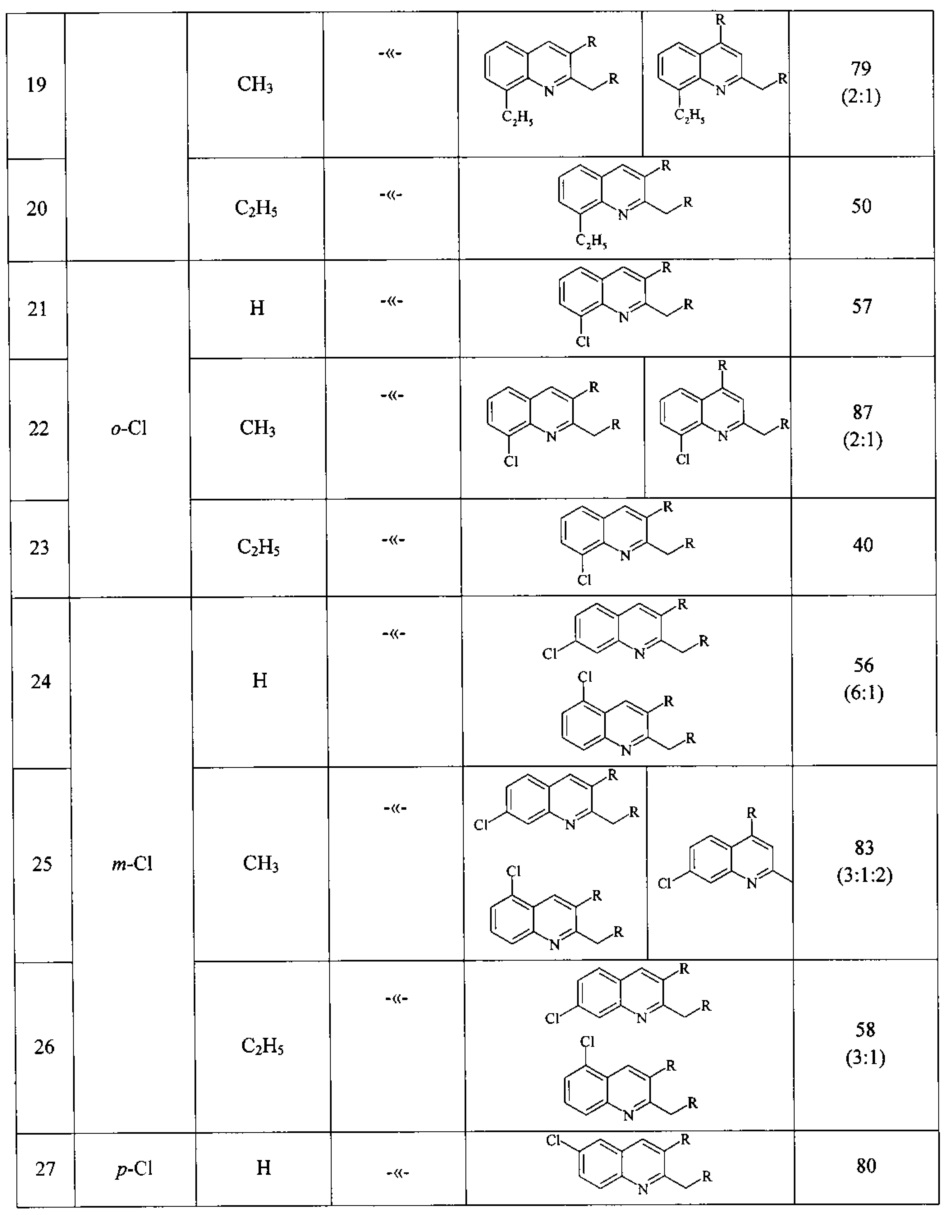
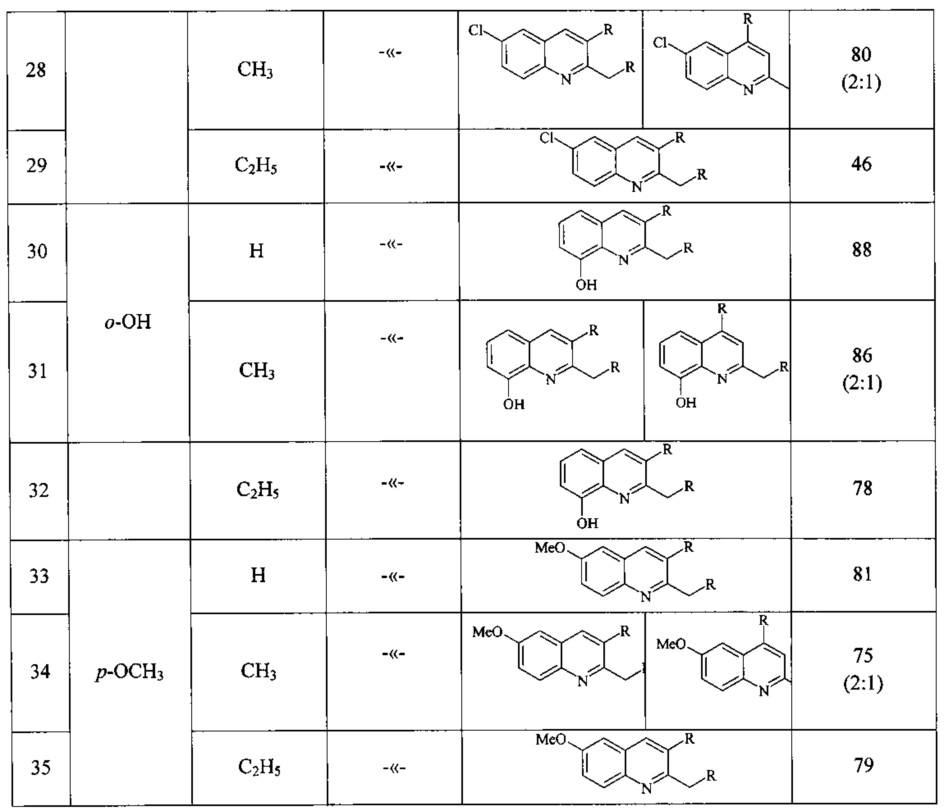
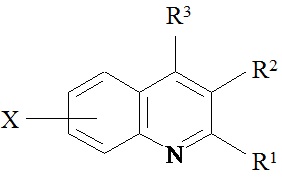
Сущность способа заключается во взаимодействии анилина и его производных общей формулы XC6H4NH2, где X=Н, о-СН3, м-СН3, п-СН3, о-С2Н5, о-Cl, м-Cl, п-Cl, п-ОМе, о-ОН, с 1,2-диолами, а именно с 1,2-этиленгликолем, 1,2-пропандиолом и 1,2-бутандиолом, под действием следующих железосодержащих катализаторов: FeCl3⋅6H2O, FeCl3, FeCl2⋅4H2O, Fe(C5H5)2, Fe(acac)3, Fe(OAc)2 и Fe2(CO)9, лучшим из которых является FeCl3⋅6H2O. Продуктами конденсации аминов с 1,2-диолами являются замещенные хинолины, выходы которых составили 40-97%. Синтез проходит при 150°С в среде CCl4 в течение 8 ч при следующих мольных соотношениях катализатора и реагентов: [FeCl3⋅6Н2О]:[XC6H4NH2]:[CCl4]:[1,2-диол]=1:100:200:400.
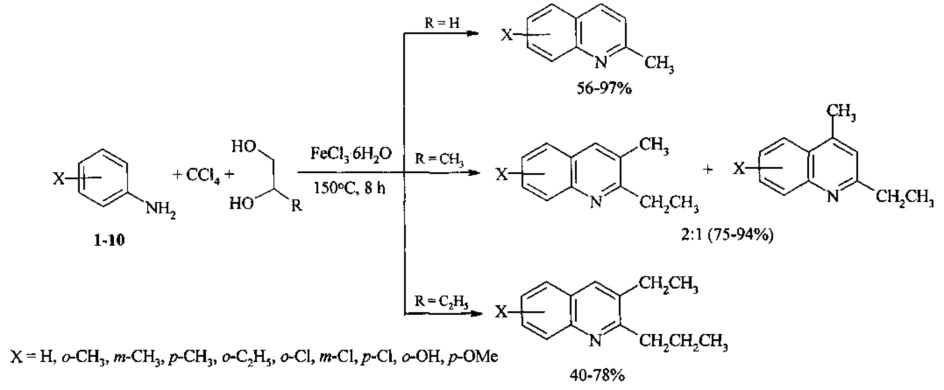
Преимущества предлагаемого метода.
1. Доступность и дешевизна исходных реагентов - анилина и его производных, CCl4, 1,2-диолов и катализатора FeCl3⋅H2O - и удешевление себестоимости и упрощение технологии.
2. Высокая селективность реакции по хинолинам и отсутствие в реакционной массе побочных продуктов - N-алкиланилинов.
3. Отсутствие побочных продуктов облегчает выделение и очистку целевых замещенных хинолинов.
4. Высокий выход замещенных хинолинов (до 97%).
Предлагаемый способ поясняется примерами:
Общая методика синтеза замещенных хинолинов
В ампулу в токе аргона загружали железосодержащий катализатор (FeCl3⋅H2O, или FeCl3, или FeCl2,⋅4H2O, или Fe(C5H5)2, или Fe(acac)3, или Fe(OAc)2, или Fe2(CO)9), замещенный анилин (орто-метиланилин или мета-метиланилин, пара-метиланилин, орто-этиланилин, орто-хлоранилин, мета-хлоранилин, пара-хлоранилин, орто-гидроксианилин, пара-метоксианилин), CCl4 и 1,2-диол (1,2-этиленгликоль, или 1,2-пропандиол, или 1,2-бутандиол). Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 150°С в течение 8 ч, затем автоклав охлаждали до ~20°С, ампулу вскрывали, реакционную массу нейтрализовали 10% водным раствором Na2CO3 (перемешивание на магнитной мешалке в течение 0.5-1 часа), органический слой экстрагировали хлористым метиленом и отфильтровывали. Растворители отгоняли, остаток перегоняли под вакуумом (Таблица 1).
Строение полученных хинолинов доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и литературными данными.
ПРИМЕР 1. Получение 2-метилхинолина.
В ампулу в токе аргона загружали 6 мг (1 ммоль) FeCl3⋅6Н2О, 0.2 мл (100 ммоль) анилина, 0.42 мл (200 ммоль) CCl4 и 0,48 мл (400 ммоль) 1,2-этиленгликоля. Реакцию и обработку реакционной массы проводили соответственно общей методике.
ПРИМЕР 2-6. Аналогично ПРИМЕРУ 1.
ПРИМЕРЫ 9, 12, 15, 18, 21, 24, 27, 30, 33.
Аналогично ПРИМЕРУ 1, но вместо анилина использовали замещенные анилины (орто-метиланилин, мета-метиланилин, пара-метиланилин, орто-этиланилин, орто-хлоранилин, мета-хлоранилин, пара-хлоранилин, орто-гидроксианилин, пара-метоксианилин).
ПРИМЕР 7. Получение 2-этил-3-метил- и 2-этил-4-метилхинолинов.
Аналогично ПРИМЕРУ 1, но вместо 1,2-этиленгликоля использовали 1,2-пропандиол.
ПРИМЕРЫ 10, 13, 16, 19, 22, 25, 28, 31, 34.
Аналогично ПРИМЕРУ 7, но вместо анилина использовали замещенные анилины (орто-метиланилин, мета-метиланилин, пара-метиланилин, орто-этиланилин, орто-хлоранилин, мета-хлоранилин, пара-хлоранилин, орто-гидроксианилин, пара-метоксианилин).
2-Метил-8-хлорхинолин. Выход 57%. Т пл. 65-68°С. Спектр ЯМР 13С (δ, м.д.): 25.19 (СН3), 122.84 (С3), 125.45 (С6), 126.32 (С4а), 127.37 (С5), 128.80 (С7), 130.13 (С8), 137.89 (С4), 148.56 (С8а), 161.87 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.84 с (3Н, СН3), 7.38-7.50 м (1Н, С3,6Н), 7.82 д (1Н, С7Н, J 7.6 Гц), 8.00 д (1Н, С4Н, J 8.4 Гц), 8.03 д (1Н, С5Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 177. 1 [М]+.
3-Метил-8-хлор-2-этилхинолин. Выход 70%. Т кип. 92-95°С/0.3 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 12.28 (СН2СН3), 18.92 (СН3), 29.74 (СН2СН3), 125.39 (С6), 129.15 (С5), 132.90 (С4а), 125.87 (С7), 128.52 (С3), 130.55 (С8), 135.69 (С4), 143.99 (С8а), 163.89 (С2). Спектр ЯМР 1H (CDCl3, δ, м.д.): 1.39 т (3Н, СН3, J 7 Гц), 2.47 с (3Н, СН3), 3.00 к (2Н, СН2, J 7.6 Гц), 7.30 т (1Н, С6Н, J 7.6 Гц), 7.57 д (1Н, С7Н, J 7.6 Гц), 7.70 д (1Н, С5Н, J 7.2 Гц), 7.77 с (1Н, С4Н). Масс-спектр, m/z (Iотн. (%)): 203.95 [М]+ (100), 205 (63), 206 (38), 177 (25), 140(18), 115 (18), 63 (10).
4-Метил-2-этилхинолин Т кип. 97-99°С/2 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 14.07 (СН2СН3), 18.67 (СН3), 32.22 (СН2), 121.54 (С3), 123.58 (С5), 125.41 (С6), 126.79 (С4а), 129.02 (С8), 129.40 (С7), 144.32 (С4), 147.70 (С8а), 163.68 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.41 т (3Н, СН3, J 6 Гц), 2.67 с (3Н, СН3), 2.98 к (2Н, СН2, J 5.2 Гц), 7.15 с (1Н, С3Н), 7.50 т (1Н, С6Н, J 8 Гц), 7.68 т (1Н, С7Н, J 8 Гц), 7.93 д (1Н, С5Н, J 8 Гц), 8.07 д (1Н, С8Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 170.10 [М]+ (100), 171 (68), 172 (9), 168 (21), 143 (31), 115 (21), 63 (7).
4,8-Диметил-2-этилхинолин. Т кип. 85°С/0.25 мм рт. ст. Спектр ЯМР 13С (δ, м.д.) 13.72 (СН2СН3), 18.92 (СН3), 18.92 (СН3), 32.26 (СН2СН3), 122.38 (С3), 122.73 (С5), 125.05 (С6), 128.17 (С4а), 128.27 (С7), 128.52 (С8), 143.99 (С8а), 144.62 (С4), 164.41 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.44 т (3Н, СН3, J 8 Гц), 2.20 с (3Н, СН3), 2.64 с (3Н, СН3), 2.95-3.04 м (2Н, СН2СН3), 7.19 с (1Н, С3Н), 7.25-7.45 м (1Н, С6Н), 7.69 д (1Н, С7Н, J 7.2 Гц), 7.82 д (1Н, С5Н, J 8.8 Гц). Масс-спектр, m/z (Iотн. (%)): 184.05 [М]+ (100), 185 (68), 157 (28), 128 (15), 115 (11), 90 (8) 77 (10), 63 (7), 51 (8).
4,7-Диметил-2-этилхинолин. Т кип. 75°С/0.35 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 14.07 (СН2СН3), 18.59 (СН3), 21.67 (СН3), 32.20 (СН2СН3), 120.77 (С3), 126.10 (С4а), 126.17 (С5), 126.53 (С6), 127.40 (С8), 139.09 (С7), 147.93 (С8а), 163.61 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.41 м (3Н, СН3), 2.54 с (3Н, СН3), 2.62 с (3Н, СН3), 2.93-2.98 м (2Н, СН2), 7.06 с (1Н, С3Н), 7.31 д (1Н, С6Н, J 8 Гц), 7.45-7.56 м (1Н, С5Н), 7.85 с (1Н, С8Н). Масс-спектр, m/z (Iотн. (%)): 184.05 [М]+ (100), 185 (62), 157 (34), 127 (18), 115 (10), 77 (9), 63 (8).
4,6-Диметил-2-этилхинолин. Т кип. 85-86°С/0.17 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 14.10 (СН2СН3), 18.77 (СН3), 21.76 (СН3), 31.76 (СН2СН3), 121.52 (С3), 122.67 (С5), 126.72 (С4а), 128.48 (С8), 131.44 (С7), 144.37 (С4), 145.53 (С8а), 162.53 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.20-1.50 м (3Н, СН3), 2.54 с (3Н, СН3), 2.65 с (3Н, СН3), 2.85-3.05 м (2Н, СН2), 7.13 с (1H, С3Н), 7.74 с (1Н, С5Н), 7.66 д (1H, С7Н, J 7.6 Гц), 7.99 д (1Н, С8Н, J 8 Гц).
4-Метил-2,8-диэтилхинолин. Т кип. 100-102°С/0.2 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 13.53 (СН2СН3), 15.24 (СН2СН3), 18.99 (СН3), 24.96 (СН2СН3), 32.17 (СН2СН3), 121.42 (С3), 125.07 (С5), 126.63 (С7), 127.22 (С4а), 127.25 (С6), 127.33 (С4), 143.16 (С8), 147.33 (С8а), 161.92 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.40-1.55 м (3Н, СН3), 1.40-1.50 м (3Н, СН3), 2.70 с (3Н, СН3), 3.01-3.06 м (2Н, СН2), 3.35-3.50 м (2Н, СН2), 7.17 с (1H, С3Н), 7.40-7.50 м (1Н, С6Н), 7.52 д (1H, С7Н, J 8 Гц), 7.85 д (1Н, С5Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 198.05 [М]+ (100), 199 (64), 182 (16), 171 (28), 157 (6), 127 (7), 115 (10), 77 (10), 63 (7), 51 (5).
4-Метил-8-хлор-2-этилхинолин. Т кип. 92-94°С/0.3 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 12.72 (СН2СН3), 18.92 (СН3), 32.26 (СН2СН3), 121.54 (С3), 123.58 (С5), 125.41 (С6), 126.79 (С4а), 129.40 (С7), 132.02 (С8), 144.32 (С4), 144.62 (С8а), 164.41 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.41 т (3Н, СН3, J 7.6 Гц), 2.67 с (3Н, СН3), 2.98 к (2Н, СН2, J 7.6 Гц), 7.15 с (1H, С3Н). 7.36 т (1Н, С6Н, J 8 Гц), 7.50 д (1H, С7Н, J 7.6 Гц), 7.83 д (1H, С5Н, J 8.8 Гц). Масс-спектр, m/z (Iотн. (%)): 203.95 [М]+ (100), 205 (84), 206 (38), 177 (23), 141 (20), 115 (16), 63 (9).
4-Метил-7-хлор-2-этилхинолин. Т кип. 95-96°С/0.25 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 13.77 (СН2СН3), 18.51 (СН3), 32.09 (СН2СН3), 121.72 (С3), 124.87 (С5), 125.21 (С6), 127.65 (С8), 127.88 (С4а), 133.74 (С7), 144.19 (С4), 148.19 (С8а), 164.80 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.28-1.39 м (3Н, СН3), 2.54 с (3Н, СН3), 2.80-3.05 м (2Н, СН2), 7.03 с (1Н, С3Н). 7.43 д (1Н, С5Н, J 7.6 Гц), 7.72 м (1Н, C6H), 7.99 с (1Н, С8Н). Масс-спектр, m/z (Iотн. (%)): 204 [М]+ (100), 205 (72), 207 (19), 177 (22), 154 (9), 115 (23), 84 (13), 75 (18), 63 (19), 51 (9).
4-Метил-6-хлор-2-этилхинолин. Спектр ЯМР 13С (δ, м.д.): 13.85 (СН2СН3), 18.54 (СН3), 32.09 (СН2), 122.28 (С3), 122.73 (С5), 125.05 (С6), 128.27 (С7), 129.02 (С8), 133.52 (С4а), 144.45 (С4), 144.95 (С8а), 163.94 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.25-1.50 м (3Н, СН3), 2.57 с (3Н, СН3), 2.70-3.05 м (2Н, СН2СН3), 7.11 с (1Н, С3Н), 7.69 д (1Н, С7Н, J 8 Гц), 7.82 с (1Н, С5Н), 8.07 д (1Н, С8Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 203.95 [М]+ (100), 205 (56), 206 (29), 177 (30), 141 (13), 115 (14), 77 (14), 63 (24), 51 (9).
4-Метил-6-метокси-2-этилхинолин. Т кип. 97-98°С/0.3 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 14.11 (СН2СН3), 20.76 (СН3), 31.45 (СН2), 55.82 (ОСН3), 121.56 (С3), 122.34 (С5), 126.35 (С4а), 128.23 (С7), 129.64 (С8), 129.83 (С6), 143.43 (С4), 145.88 (С8а), 162.98 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.20-1.35 м (3Н, СН3), 2.54 с (3Н, СН3), 2.85-3.05 м (2Н, СН2), 3.79 с (3Н, -ОСН3), 6.89 д (1Н, С7Н, J 8.4 Гц), 7.13 с (1Н, С3Н), 7.28 с (1Н, С5Н), 7.99 д (1Н, С8Н, J 8 Гц).
4-метил-8-гидрокси-2-этилхинолин. Т кип. 115-116°С/0.3 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 13.36 (СН2СН3), 18.75 (СН3), 31.29 (СН2СН3), 109.73 (С7), 112.94 (С5), 122.40 (С3), 126.93 (С4а), 127.32 (С6), 136.21 (С4), 137.62 (С8а), 152.05 (С8), 164.12 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.00-1.80 м (3Н, СН3), 2.50 с (3Н, СН3), 3.90-4.30 м (2Н, СН2СН3), 7.19 с (1H, С3Н), 7.25-7.45 м (1Н, С6Н), 7.69 д (1Н, С7Н, J 7.2 Гц), 7.82 д (1H, С5Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 187.10 [М]+ (100), 186 (30), 188 (26), 159 (27), 115 (28), 159 (27), 130 (22), 77 (25).
ПРИМЕР 8. Получение 2-пропил-3-этилхинолина.
Аналогично ПРИМЕРУ 1, но вместо 1,2-этиленгликоля использовали 1,2-бутандиол.
ПРИМЕРЫ 11, 14, 17, 20, 23, 26, 29, 32, 35.
Аналогично ПРИМЕРУ 8, но вместо анилина использовали замещенные анилины (орто-метиланилин, мета-метиланилин, пара-метиланилин, орто-этиланилин, орто-хлоранилин, мета-хлоранилин, пара-хлоранилин, орто-гидроксианилин, пара-метоксианилин).