Результат интеллектуальной деятельности: АМИНОПИРИДИНСОДЕРЖАЩИЕ ИНГИБИТОРЫ ТИРОЗИНКИНАЗЫ СЕЛЕЗЕНКИ (SYK)
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к некоторым аминопиридинсодержащим соединениям формулы (I) (называемым также в данном описании как «соединения формулы (I)»), которые являются ингибиторами киназной активности тирозинкиназы селезенки (Spleen Tyrosine Kinase - Syk). Настоящее изобретение относится также к композициям, содержащим указанные соединения, и способам их применения для лечения состояний или расстройств, связанных с нарушением активности Syk, в частности для лечения и предотвращения болезненных состояний, опосредуемых Syk. Такие болезненные состояния могут включать воспалительные, аллергические и аутоиммунные заболевания, например астму, хроническую обструктивную болезнь легких (ХОБЛ), респираторный дистресс-синдром у взрослых (ARDS), язвенный колит, болезнь Крона, бронхит, дерматит, аллергический ринит, псориаз, склеродермию, крапивницу, ревматоидный артрит, идиопатическую тромбоцитопеническую пурпуру (ITP), рассеянный склероз, рак, ВИЧ и волчанку.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Тирозинкиназа селезенки (Syk) представляет собой протеинтирозинкиназу, которая была описана в качестве ключевого медиатора передачи сигнала иммунорецепторов в организме-хозяине воспалительных клеток, в том числе мастоцитов, В-клеток, макрофагов и нейтрофилов. Эти иммунорецепторы, в том числе Fc-рецепторы и B-клеточный рецептор, имеют большое значение для аллергических заболеваний и антителоопосредуемых аутоиммунных заболеваний, и, следовательно, фармакологически воздействуя на Syk, можно, предположительно, лечить указанные расстройства.
[0003] Аллергический ринит и астма представляют собой заболевания, связанные с реакциями гиперчувствительности и воспалительными событиями, в которые вовлечены клетки множества типов, в том числе мастоциты, эозинофилы, Т-клетки и дендритные клетки. После воздействия аллергена иммуноглобулиновые рецепторы с высоким сродством к IgE и IgG становятся поперечносвязанными и активируют последующие процессы в мастоцитах и клетках других типов, приводящие к высвобождению провоспалительных медиаторов и спазмогенов дыхательных путей. В мастоците, например, поперечное связывание IgE рецептора аллергеном приводит к высвобождению медиаторов, включающих гистамин, из предварительно сформированных гранул, а также к синтезу и высвобождению вновь синтезированных липидных медиаторов, включающих простагландины и лейкотриены.
[0004] Киназа Syk является нерецепторной связанной тирозинкиназой, которая играет важную роль в трансдукции нисходящих клеточных сигналов, ассоциированных с поперечносвязывающими FcepsilonRI или рецепторами FcepsilonRI, и позиционируется в начале сигнального каскада. В мастоцитах, например, ранняя последовательность сигнализации FcepsilonRI, следующая за связыванием комплексов рецептор-IgE аллергеном, включает в себя сначала Lyn (тирозинкиназа семейства Src), а затем Syk. Поэтому ожидается, что ингибиторы активности Syk ингибируют все нисходящие каскады передачи сигналов, облегчая тем самым аллергическую реакцию немедленного типа и побочные реакции, инициированные высвобождением провоспалительных медиаторов и спазмогенов (Wong et al. 2004, Expert Opin. Investig. Drugs (2004) 13 (7) 743-762).
[0005] В последнее время в исследованиях I/II фазы лечения аллергического ринита было показано, что ингибитор киназы Syk R112 (Rigel), введенный в дозе интраназально, приводит к статистически значимому снижению PGD2, ключевого иммунного медиатора, который в значительной степени коррелирует с положительной динамикой аллергического насморка, а также является безопасным по целому ряду показателей, предоставляя тем самым первое подтверждение клинической безопасности и эффективности местного ингибитора киназы Syk (Meltzer, Eli O.; Berkowitz, Robert B.; Grossbard, Elliott B, Journal of Allergy and Clinical Immunology (2005), 115 (4), 791-796). Позднее в клинических испытаниях лечения аллергического ринита II фазы (клинический идентификатор Trials.gov NCT0015089) R112 показал недостаточную эффективность по сравнению с плацебо.
[0006] Ревматоидный артрит (Reumatoid Arthritis - RA) является аутоиммунным заболеванием, которым страдает примерно 1% населения. Оно характеризуется воспалением суставных соединений, ведущих к губительной для здоровья деструкции костной и хрящевой ткани. Недавние клинические исследования ритуксимаба, который вызывает обратимое истощение В-клеток (J.C.W. Edwards et al. 2004, New Eng. J. Med. 350: 2572-2581), показали, что целевое воздействие на функцию B-клеток является подходящей терапевтической стратегией при аутоиммунных заболеваниях, таких как RA. Клиническое полезное действие коррелирует со снижением аутореактивных антител (или ревматоидным фактором), и эти исследования подтверждают, что функция В-клеток и, несомненно, продуцирование аутоиммунных антител играют центральную роль в развивающейся патологии болезни.
[0007] Исследования с использованием клеток мышей с недостатком селезеночной тирозинкиназы (Syk) продемонстрировали статистически определимую роль этой киназы в функции В-клеток. Недостаток Syk характеризуется блокированием развития В-клеток (M. Turner et al. 1995 Nature 379: 298-302 and Cheng et al. 1995, Nature 378: 303-306). Эти исследования, а также исследования зрелых В-клеток с недостатком Syk (Kurasaki et al. 2000, Immunol. Rev. 176:19-29) показывают, что Syk необходима для дифференциации и активации В-клеток. Таким образом, ингибирование Syk у пациентов с RA, вероятно, блокирует функцию В-клеток и тем самым снижает продуцирование ревматоидного фактора. В дополнение к роли Syk в функции В-клеток и дополнительной связи с лечением RA является необходимость активности Syk в Fc-рецепторной (FcR) сигнализации. Было выдвинуто предположение, что активация FcR иммунными комплексами при RA вносит свой вклад в высвобождение множества провоспалительных медиаторов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Настоящее изобретение относится к новым соединениям, которые являются высокоэффективными ингибиторами Syk, а также к фармацевтическим композициям, содержащим указанные соединения. Поэтому соединения формулы (I), обладающие ингибиторной активностью в отношении Syk, могут применяться для лечения и предотвращения заболеваний и расстройств, опосредуемых белком Syk; такие заболевания и расстройства включают, но без ограничения, астму, COPD, ревматоидный артрит, рак и идиопатическую тромбоцитопеническую пурпуру.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖА
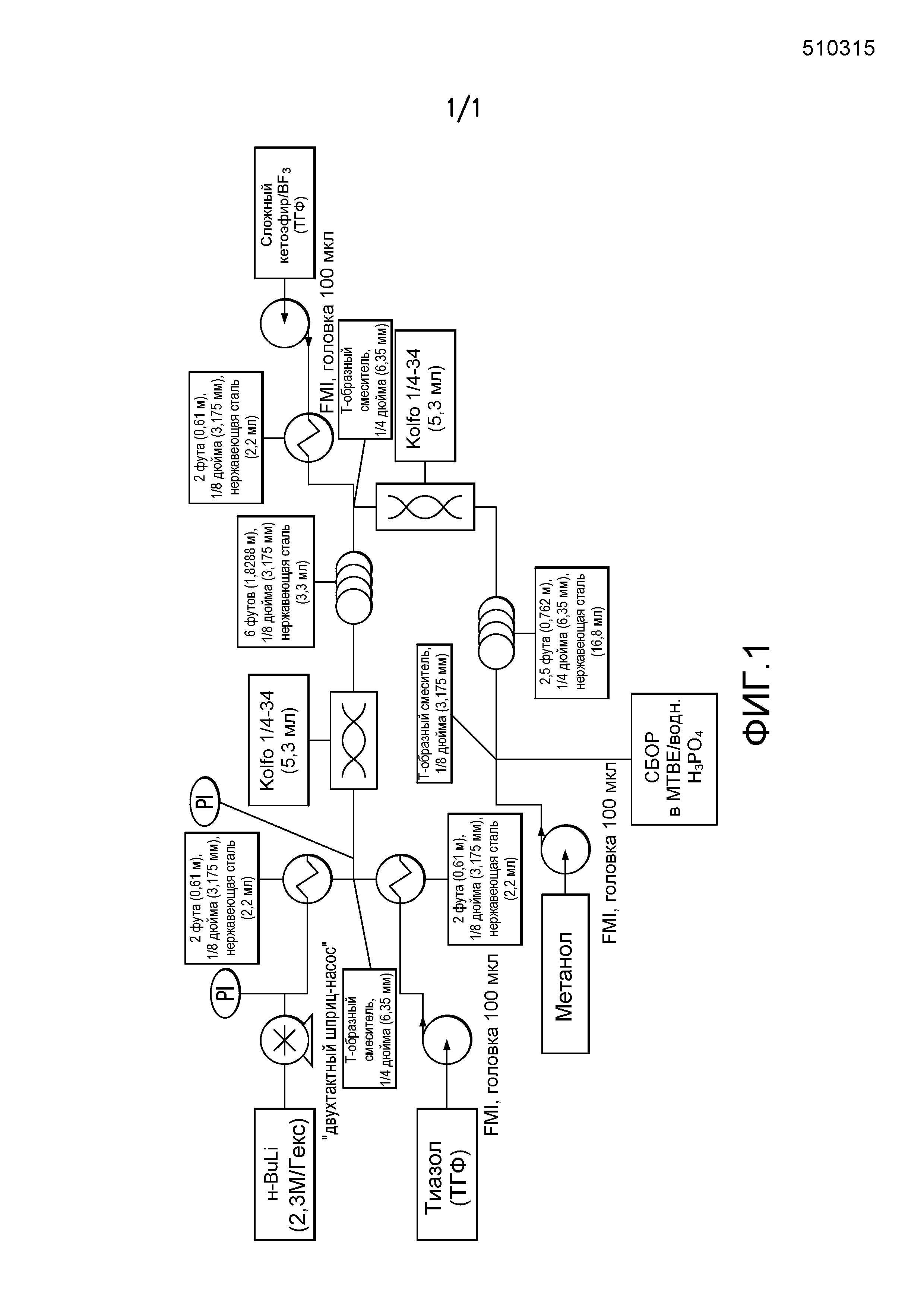
[0009] На фиг.1 представлена блок-схема установки, применяемой для получения промежуточного продукта метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0010] Значения терминов, используемых в данном описании, являются традиционно применяемыми, и значения таких терминов являются независимыми в каждом случае. Тем не менее и за исключением особо оговоренных случаев, в описании и в формуле изобретения применяются следующие определения. Химические названия, тривиальные названия и химические структуры могут использоваться взаимозаменяемо для описания одной и той же структуры. Если химическое соединение определено с использованием химической структуры и химического названия и имеет место расхождение между структурой и названием, превалирующей является структура. Эти определения применяются независимо от того, используется ли термин сам по себе или в сочетании с другими терминами, если не указано иное. Таким образом, определение "алкил" относится к "алкилу", а также "алкильным" фрагментам "гидроксиалкила", "фторалкила", "-O-алкила" и т.д.
[0011] Следует понимать, что когда в данном описании используются представленные ниже термины, они имеют следующие значения:
[0012] Термин "пациент" означает человека или млекопитающее, отличное от человека. В одном варианте осуществления пациентом является человек. В другом варианте осуществления пациентом является шимпанзе.
[0013] Термин "терапевтически эффективное количество", используемый в данном описании, относится к количеству соединения формулы (I) и/или дополнительного терапевтического средства или его композиции, которое является эффективным для достижения желаемого терапевтического, улучшающего, ингибирующего или профилактического эффекта при введении пациенту, страдающему от боли или воспалительного заболевания или расстройства. При комбинированной терапии по настоящему изобретению терапевтически эффективное количество может относиться к каждому отдельному лекарственному средству или их комбинации в целом, в которой количества всех лекарственных средств, вводимых вместе, являются эффективными, но отдельное лекарственное средство комбинации может не присутствовать в эффективном количестве.
[0014] Термин "предотвращение", используемый в данном описании в отношении рака, воспалительного заболевания или расстройства, относится к снижению вероятности раковой боли или воспалительного заболевания или расстройства.
[0015] Термин "алкил", когда используется в данном описании, относится к алифатической углеводородной группе с определенным количеством атомов углерода, в которой один из атомов водорода заменен связью. В различных вариантах осуществления изобретения алкильная группа содержит от 1 до 6 атомов углерода (С1-С6 алкил) или от 1 до 3 атомов углерода (С1-С3 алкил). Примеры алкильных групп включают, но без ограничения, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, неопентил, изопентил, н-гексил, изогексил и неогексил. В одном варианте осуществления изобретения алкильная группа является линейной. В другом варианте осуществления изобретения алкильная группа является разветвленной.
[0016] Термин "алкокси", когда используется в данном описании, относится к -O-алкилу, в котором алкильная группа представляет собой группу, определенную выше. Примеры алкоксигрупп включают, но без ограничения, метокси, этокси, н-пропокси, изопропокси, н-бутокси и трет-бутокси. Алкоксигруппа присоединяется через атом кислорода.
[0017] Термин "арил", когда используется в данном описании, относится к ароматической моноциклической или полициклической кольцевой системе, содержащей от примерно 6 до примерно 14 атомов углерода. В одном варианте осуществления изобретения арильная группа содержит от примерно 6 до 10 атомов углерода (С6-С10 арил). В другом варианте осуществления изобретения арильная группа представляет собой фенил. Примеры арильных групп включают, но без ограничения, фенил и нафтил.
[0018] Термин "циклоалкил", когда используется в данном описании, относится к насыщенному кольцу, содержащему указанное число атомов углерода в цикле, но не содержащему гетероатом. Аналогично, термин "С3-С6 циклоалкил" относится к насыщенному циклу, содержащему от 3 до 6 атомов углерода в кольце. Примеры моноциклических циклоалкилов включают циклопропил, циклобутил, циклопентил и циклогексил.
[0019] Термин "галоген", когда используется в данном описании, означает -F, -Cl, -Br или -I. В одном варианте осуществления изобретения группа галогена представляет собой -F или -Cl. В другом варианте осуществления изобретения группа галогена представляет собой -F.
[0020] Термин "фторалкил", когда используется в данном изобретении, относится к алкильной группе, которая определена выше и в которой один или несколько атомов водорода замещены на атом фтора. В одном варианте осуществления изобретения фторалкильная группа содержит от 1 до 6 атомов углерода. В другом варианте осуществления изобретения фторалкильная группа содержит от 1 до 3 атомов углерода. В еще одном варианте осуществления изобретения фторалкильная группа содержит от 1 до 3 атомов фтора. Примеры фторалкильных групп включают, но без ограничения -CH2F, -CHF2 и -CF3. Термин "C1-C3 фторалкил" относится к фторалкильной группе, содержащей от 1 до 3 атомов углерода.
[0021] Термин "гетероарил", когда используется в данном описании, означает ароматическую моноциклическую или полициклическую кольцевую систему, содержащую в кольце от примерно 5 до примерно 14 атомов, в которой от 1 до 3 атомов кольца независимо представляют собой атомы N, О или S, а остальные атомы кольца представляют собой атомы углерода. В одном варианте осуществления изобретения гетероарильная группа содержит в кольце от 5 до 10 атомов. В другом варианте осуществления изобретения гетероарильная группа представляет собой моноциклическую кольцевую систему и содержит 5 или 6 атомов в кольце. В еще одном варианте осуществления изобретения гетероарильная группа представляет собой бициклическую кольцевую систему. Гетероарильная группа присоединяется через атом углерода кольца. Примеры гетероарильных групп включают, но без ограничения, пиридил, пиразинил, фуранил, тиенил, пиримидинил, пиридон (в том числе N-замещенные пиридоны), изоксазолил, изотиазолил, оксазолил, оксадиазолил, тиазолил, пиразолил, фурил, пирролил, триазолил, 1,2,4-тиадиазолил, пиразинил, пиридазинил, хиноксалинил, фталазинил, оксиндолил, имидазо[1,2-а]пиридинил, имидазо[2,1-b]тиазолил и т.п. В одном варианте осуществления изобретения гетероарильная группа представляет собой 5-членный гетероарил. В другом варианте осуществления изобретения гетероарильная группа представляет собой 6-членный гетероарил.
[0022] Термин "замещенный" означает, что один или несколько атомов водорода на указанных атомах замещены с выбором из указанной группы при условии, что "нормальные валентности" атомов в представленных условиях не превышены и что замещение приводит к стабильным соединениям. Комбинации заместителей и/или переменных допустимы только тогда, когда такие комбинации приводят к получению стабильных соединений. Термин "стабильное соединение" или "стабильная структура" относится к соединению, которое достаточно устойчиво, чтобы выдержать выделение до нужной степени чистоты из реакционной смеси и превращение в эффективное терапевтическое лекарственное средство.
[0023] Когда любой заместитель или переменная встречается более одного раза в любом компоненте или соединении формулы (I), его определение в каждом случае не зависит от его определения в любом другом случае, если не указано иное.
[0024] Термин "в очищенной форме", когда используется в данном описании, относится к физическому состоянию соединения после его выделения из процесса синтеза (например, из реакционной смеси), природного источника или их сочетания. Термин "в очищенной форме" также относится к физическому состоянию соединения после его получения в результате процесса или процессов очистки, описанных в данном изобретении или хорошо известных специалистам данной области (например, хроматографией, перекристаллизацией и т.п.), с чистотой, достаточной для его характеристики с помощью стандартных аналитических методов, описанных в данном изобретении или хорошо известных специалистам данной области техники.
[0025] Следует также отметить, что, как подразумевается, любой атом углерода, а также гетероатом с ненасыщенными валентностями, которые представлены в тексте, схемах, примерах и таблицах в данном описании, имеет достаточное количество атомов водорода для соответствия валентностям.
[0026] Одно или несколько соединений по изобретению могут существовать как в несольватированных, так и в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п, и предполагается, что изобретение охватывает как сольватированные, так и несольватированные формы. Термин "сольват" означает физическую ассоциацию молекулы соединения настоящего изобретения с одной или несколькими молекулами растворителя. Эта физическая ассоциация включает в себя различную степень ионного и ковалентного связывания, в том числе с помощью водородных связей. В определенных случаях сольват может быть выделен, например, когда одна или несколько молекул растворителя включены в кристаллическую решетку твердого кристаллического вещества. Термин "сольват" включает в себя сольваты в фазе раствора и выделяемые сольваты. Примеры приемлемых сольватов включают, но без ограничения, этанолаты, метанолаты и т.п. Термин "гидрат" относится к сольвату, в котором молекулой растворителя является Н2О.
[0027] Соединения формулы (I) могут содержать один или несколько стереогенных центров и поэтому могут существовать в виде рацематов, рацемических смесей, индивидуальных энантиомеров, диастереомерных смесей и отдельных диастереомеров. В зависимости от природы различных заместителей в молекуле могут присутствовать дополнительные асимметрические центры. Каждый такой асимметрический центр будет независимо давать два оптических изомера, и предполагается, что все возможные оптические изомеры и диастереомеры в виде смесей и в виде чистых или частично очищенных соединений включены в объем данного изобретения. Подразумевается, что любые формулы, структуры или названия соединений, описанные в данном изобретении, для которых не указана конкретная стереохимия, означают любые существующие изомеры, которые описаны выше, и их смеси в любом соотношении. Когда стереохимия указана, это означает, что изобретение включает данный конкретный изомер в чистом виде или в виде компонента смеси с другими изомерами в любом соотношении.
[0028] Смеси диастереомеров могут разделяться на индивидуальные диастереомеры на основе их физических и химических различий в соответствии с методами, хорошо известными специалистам в данной области техники, такими как, например, хроматография и/или фракционная кристаллизация. Энантиомеры могут разделяться посредством превращения энантиомерной смеси в диастереомерную смесь реакцией с соответствующим оптически активным соединением (например, хиральным вспомогательным соединением, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделением диастереомеров и превращением (например, гидролизом) отдельных диастереомеров в соответствующие чистые энантиомеры. Кроме того, некоторые из соединений формулы (I) могут представлять собой атропизомеры (например, замещенные биарилы), и они рассматриваются как часть настоящего изобретения. Энантиомеры могут разделяться с использованием хиральной колонки ВЭЖХ.
[0029] Соединения формулы (I) также могут существовать в различных таутомерных формах, и все такие формы включены в объем данного изобретения.
[0030] Подразумевается, что все стереоизомеры (например, геометрические изомеры, оптические изомеры и т.п.) соединений по настоящему изобретению (в том числе соли и сольваты соединений, а также соли, сольваты и сложные эфиры пролекарств), которые могут существовать, например, вследствие наличия асимметрических атомов углерода в различных заместителях, в том числе энантиомерные формы (которые могут существовать даже в отсутствие асимметрических атомов углерода), ротамерные формы, атропизомеры и диастереомерные формы, охватываются настоящим изобретением. Индивидуальные стереоизомеры соединений по настоящему изобретению могут, например, по существу быть свободными от других изомеров или могут быть смешаны, например, в виде рацематов, со всеми другими, или иначе выбранными стереоизомерами. Хиральные центры по настоящему изобретению могут иметь R- или S-конфигурацию, как определено Рекомендациями IUPAC 1974.
[0031] Соединения формулы (I) могут образовывать соли, которые также входят в объем данного изобретения. Следует представлять, что ссылка на соединение формулы (I) в данном изобретении, если не указано иное, включает ссылку на их соли. Термин "соль(и)", используемый в данном описании, обозначает кислотно-аддитивные соли, образованные с неорганическими и/или органическими кислотами, а также основно-аддитивные соли, образованные с неорганическими и/или органическими основаниями. Кроме того, когда соединение формулы (I) содержит как основную группу, такую как, но без ограничения, пиридин или имидазол, так и кислотную группу, такую как, но без ограничения, группа карбоновой кислоты, могут быть образованы цвиттерионы ("внутренние соли"), которые также включены в термин "соль(и)", используемый в данном описании. Такие кислотно- и основно-аддитивные соли, используемые в рамках настоящего изобретения, являются фармацевтически приемлемыми (т.е. нетоксичными, физиологически приемлемыми) солями. Соли соединений формулы (I) могут быть образованы, например, посредством взаимодействия соединения формулы (I) с некоторым количеством кислоты или основания, таким как эквивалентное количество, в среде, такой как среда, в которой соль выпадает в осадок, или в водной среде с последующей лиофилизацией.
[0032] Примерные кислотно-аддитивных соли включают ацетаты, аскорбаты, бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфонаты, фумараты, гидрохлориды, гидробромиды, гидройодиды, лактаты, малеаты, метансульфонаты, нафталинсульфонаты, нитраты, оксалаты, фосфаты, пропионаты, салицилаты, сукцинаты, сульфаты, тартраты, тиоцианаты, толуолсульфонаты (также известные как тозилаты) и т.п. Кроме того, кислоты, которые обычно считаются подходящими для образования фармацевтически применимых солей из основных фармацевтических соединений, описаны, например, P. Stahl et al., Camille G. (eds.) Handbook of Pharmaceutical Salts. Properties, Selection and Use. (2002) Zurich: Wiley-VCH; S. Berge et al., Journal of Pharmaceutical Sciences (1977) 66(1) 1-19; P. Gould, International J. of Pharmaceutics (1986) 33 201-217; Anderson et al., The Practice of Medicinal Chemistry (1996), Academic Press, New York; а также в справочнике The Orange Book (Food & Drug Administration, Washington, D.C. on their website). Содержание этих публикаций введено в данное описание в виде ссылок.
[0033] Примеры основно-аддитивных солей включают соли аммония, соли щелочных металлов, такие как соли натрия, лития и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли с органическими основаниями (например, с органическими аминами), такими как дициклогексиламины, трет-бутиламины и соли с аминокислотами, такими как аргинин, лизин и т.п. Основные азотсодержащие группы могут быть квартернизованы с помощью таких соединений, как низшие алкилгалогениды (например, метил-, этил- и бутилхлориды, -бромиды и -йодиды), диалкилсульфаты (например, диметил-, диэтил- и дибутилсульфаты), галогениды с длинной цепью (например, децил-, лаурил- и стеарилхлориды, -бромиды и -йодиды), аралкилгалогениды (например, бензил- и фенетилбромиды) и другие.
[0034] Настоящее изобретение также включает соединения формулы (I) во всех их изолированных формах. Например, подразумевается, что идентифицированные выше соединения включают все формы соединений, такие как любые сольваты, гидраты, стереоизомеры и таутомеры.
[0035] Термин «композиция», когда используется в данном описании, включает продукт, содержащий определенные ингредиенты в определенных количествах, а также любой продукт, который прямо или косвенно получен из комбинации определенных ингредиентов в определенных количествах.
[0036] В соединениях общей формулы (I) атомы могут существовать в форме своих природных изотопов, либо один или несколько атомов могут быть искусственно обогащены конкретным изотопом с таким же атомным номером, но с атомной массой или массовым числом, которые отличаются от атомной массы или массового числа изотопа, который преимущественно распространен в природе. Настоящее изобретение подразумевает включение всех подходящих изотопных вариантов соединений общей формулы (I). Например, различные формы изотопного водорода (Н) включают протий (1Н) и дейтерий (2Н). Протий является доминирующим изотопом водорода в природе. Обогащение дейтерием может давать определенные терапевтические преимущества, такие как увеличение в условиях in vivo периода полураспада или снижение необходимой дозы, или может приводить к получению соединения, используемого в качестве стандарта для характеристики биологических образцов. Обогащенные изотопами соединения общей формулы (I) могут быть получены без излишнего эксперимента стандартными способами, хорошо известными специалистам данной области техники, или способами, аналогичными описанным в схемах и примерах, представленных в данном описании, с использованием соответствующих изотопно обогащенных реагентов и/или полупродуктов.
Соединения по изобретению
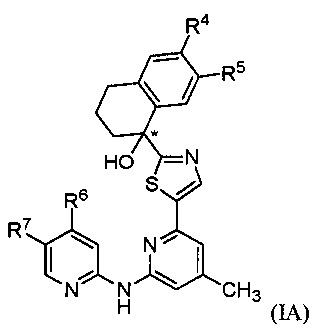
[0037] Настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где R1, R2, R3, R4, R5, R6, R7, R8, R9 ,..., n принимают значения, определенные далее. Ниже описаны варианты осуществления соединения формулы (I). Соединение формулы (IA), как подробно описано ниже, представляет собой вариант осуществления соединения формулы (I).
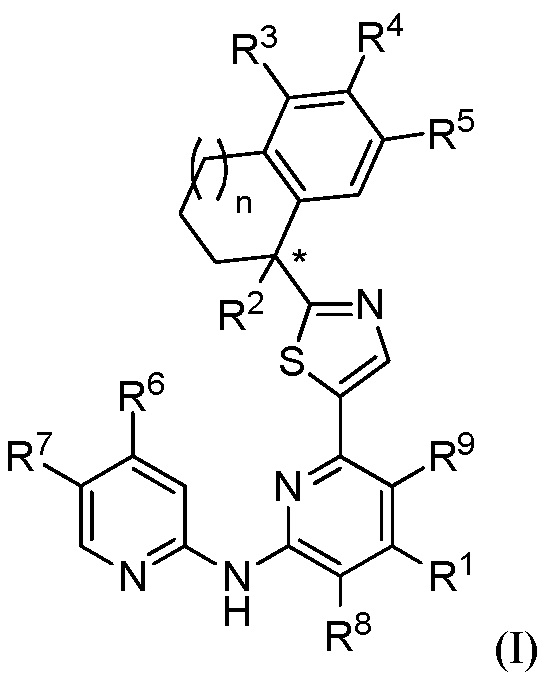
[0038] В варианте № 1 настоящее изобретение предоставляет соединение формулы (I) или его фармацевтически приемлемую соль, где
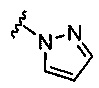
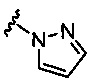
R1 выбран из группы, состоящей из:
(i) -C1-C3 алкила;
(ii) фторалкила;
(iii) -CH2OR1a,
где R1a выбран из группы, состоящей из Н и C1-C6 алкила;
(iv) -N(R1b)2,
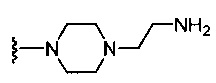
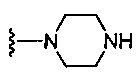
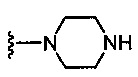
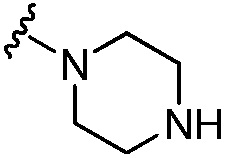
где каждый из R1b выбран из группы, состоящей из Н и C1-C3 алкила, или два R1b вместе с атомом азота, с которым они присоединены, образуют группу формулы 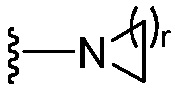 , где r равно 1, 2, 3 или 4;
, где r равно 1, 2, 3 или 4;
(v) -O-(C1-C3 алкила);
(vi) -N(H)C(О)-(C1-C3 алкила);
(vii) галогена;
(viii) H; и
(ix) морфолинила;
R2 представляет собой -ОН, -O-(C1-C3 алкил), -N(R2a)2, -N(R2a)C(О)-R2b или -F;
где каждый из R2a выбран из группы, состоящей из Н и C1-C3 алкила; и
R2b представляет собой C1-C6 алкил;
R3 представляет собой -CO2R3a, -CH2CO2R3a, -CH2CH2CO2R3a, тетразол, -C(О)N(R3b)2, -CH2OH, H, галоген, -ОН, C1-C6 алкил, -О-(C1-C3 алкил), -N(R3b)2, -CN, -C(О)N(H)S(О)2R3c, -С(О)-N(H)(R3d), -С(О)N(H)C(О)R3a, -P(О)(OR3b)2 или -B(OH)2;
где R3a выбран из группы, состоящей из Н и C1-C6 алкила;
где каждый R3b независимо выбран из группы, состоящей из Н и C1-C3 алкила;
где R3c выбран из группы, состоящей из C1-C3 алкила, С1-C3 фторалкила, С3-С6 циклоалкила и фенила, где указанный фенил является незамещенным или замещен одним или двумя С1-С3 алкилами;
где R3d выбран из группы, состоящей из -CN, -О-(C1-С3 алкила) и тетразола;
R4 представляет собой -CO2R4a, -CH2CO2R4a, -CH2CH2CO2R4a, тетразол, -C(О)N(R4b)2, -СН2ОН, Н, галоген, -ОН, C1-C6 алкил, -О-(С1-С3 алкил), -N(R4b)2, -CN, -C(О)N(H)S(О)2R4c, -C(О)-N(H)(R4d), -С(О)N(H)C(О)R4a, -P(О)(OR4b)2 или -B(OH)2;
где R4a выбран из группы, состоящей из Н и C1-C6 алкила;
где каждый R4b независимо выбран из группы, состоящей из Н и С1-С3 алкила;
где R4c выбран из группы, состоящей из C1-С3 алкила, C1-C3 фторалкила, С3-С6 циклоалкила и фенила, где указанный фенил является незамещенным или замещен одним или двумя C1-C3 алкилами;
где R4d выбран из группы, состоящей из -CN, -О-(C1-С3 алкила) и тетразола;
R5 представляет собой -CO2R5a, -CH2CO2R5a, -CH2CH2CO2R5a, тетразол, -С(О)N(R5b)2, -СН2ОН, Н, галоген, -ОН, C1-C6 алкил, -О-(C1-C3 алкил), -N(R5b)2, -CN, -C(О)N(H)S(О)2R5c, -C(О)-N(H)(R5d), -С(О)N(H)C(О)R5a, -P(О)(OR5b)2 или -B(OH)2;
где R5a выбран из группы, состоящей из Н и C1-C6 алкила;
где каждый R5b независимо выбран из группы, состоящей из Н и C1-C3 алкила;
где R5c выбран из группы, состоящей из C1-C3 алкила, C1-C3 фторалкила, С3-С6 циклоалкила и фенила, где указанный фенил является незамещенным или замещенным одним или двумя C1-C3 алкилами;
где R5d выбран из группы, состоящей из -CN, -О-(C1-С3 алкила) и тетразола;
R6 выбран из группы, состоящей из:
(i) C1-C6 алкила;
(ii) C1-C3 фторалкила;
(iii) -О-(C1-C6 алкила);
(iv) -О-(C1-C3 фторалкила);
(v) -R6a, где R6a выбран из группы, состоящей из:
(a) С3-С6 циклоалкила;
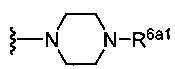
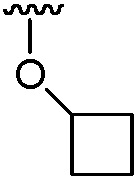
(b) группы формулы 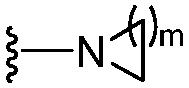 , где m равно 1, 2, 3 или 4;
, где m равно 1, 2, 3 или 4;
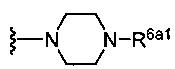
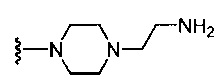
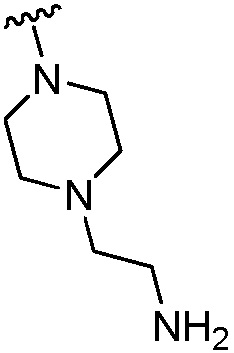
(c) группы формулы 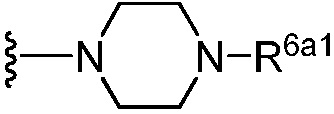 , где R6a1 представляет собой Н, C1-C3 алкил или -CH2CH2NH2; и
, где R6a1 представляет собой Н, C1-C3 алкил или -CH2CH2NH2; и
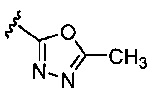
(d) 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранных из группы, состоящей из N, О и S;
где R6a является незамещенным или замещен 1-3 фрагментами R6a2, выбранными из группы, состоящей из галогена и C1-C3 алкила;
(vi) -О-R6b,
где R6b выбран из группы, состоящей из:
(a) С3-С6 циклоалкила; и
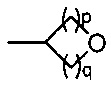
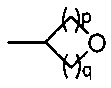
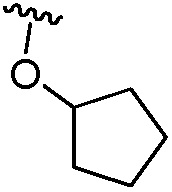
(b) группы формулы 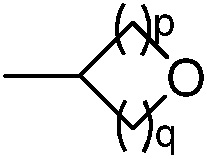 , где р равно 0, 1 или 2 и q равно 1, 2 или 3;
, где р равно 0, 1 или 2 и q равно 1, 2 или 3;
где R6b является незамещенным или замещен 1-2 фрагментами R6b1, выбранными из группы, состоящей из фтора и C1-C3 алкила;
(vii) -N(R6c)2, где каждый из R6c выбран из группы, состоящей из Н и C1-C3 алкила;
(viii) -N(H)C(О)-(C1-C3 алкила);
(ix) -N(H)C(О)О-(C1-C3 алкила);
(х) -NHC(О)-N(R6d)2, где каждый R6d представляет собой Н или C1-C3 алкил;
(xi) галогена; и
(xii) H;
R7 представляет собой Н или галоген;
R8 представляет собой Н или галоген;
R9 представляет собой Н или галоген; и
n равно 0, 1 или 2.
[0039] В варианте № 2
R2 представляет собой -ОН, -О-(C1-C3 алкил) или -N(R2a)2;
R3 представляет собой -CO2R3a, -CH2CO2R3a, -CH2CH2CO2R3a, тетразол, -C(О)N(R3b)2, -CH2OH, H, галоген, C1-C6 алкил, -О-(C1-C3 алкил) или -N(R3b)2;
R4 представляет собой -CO2R4a, -CH2CO2R4a, -CH2CH2CO2R4a, тетразол, -C(О)N(R4b)2, -CH2OH, H, галоген, C1-C6 алкил, -О-(C1-C3 алкил) или -N(R4b)2;
R5 представляет собой -CO2R5a, -CH2CO2R5a, -CH2CH2CO2R5a, тетразол, -С(О)N(R5b)2, -СН2ОН, Н, галоген, C1-C6 алкил, -О-(C1-C3 алкил) и -N(R5b)2;
R6 принимает значения, определенные в (i)-(viii), (xi) или (xii) варианта осуществления № 1;
и остальные переменные принимают значения, определенные в варианте осуществления № 1.
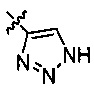
[0040] В представленной выше структурной формуле соединения формулы (I) атом углерода кольца связан с R2, и показанное тиазольное кольцо обозначено на рисунке символом "*", который показывает, что этот атом углерода является хиральным. В варианте осуществления № 3 конфигурацией этого атома углерода является R. В варианте осуществления № 4 конфигурацией этого атома углерода является S.
[0041] В варианте осуществления № 5,
когда R3 представляет собой -CO2R3a, -CH2CO2R3a, -CH2CH2CO2R3a, тетразол, -C(О)N(R3b)2 или -CH2OH, тогда R4 представляет собой Н, галоген, C1-C6 алкил, -О-(C1-C3 алкил) или -N(R4b)2 и R5 представляет собой Н или галоген; и
когда R4 представляет собой -CO2R4a, -CH2CO2R4a, -CH2CH2CO2R4a, тетразол, -C(О)N(R4b)2 или -CH2OH, тогда R3 представляет собой Н, галоген, C1-C6 алкил, -О-(C1-C3 алкил) или -N(R3b)2 и R5 представляет собой Н или галоген, и остальные переменные принимают значения, определенные в варианте осуществления № 1 или № 2.
[0042] В варианте осуществления № 6,
когда R3 представляет собой -CO2R3a, -CH2CO2R3a, -CH2CH2CO2R3a, тетразол, C(О)N(R3b)2 или -CH2OH, тогда R4 представляет собой Н и R5 представляет собой Н; и
когда R4 представляет собой -CO2R4a, -CH2CO2R4a, -CH2CH2CO2R4a, тетразол, -C(О)N(R4b)2 или -CH2OH, тогда R3 и R5 представляют Н; и остальные переменные принимают значения, определенные в варианте осуществления № 1 или № 2.
[0043] В варианте осуществления № 7 R3 представляет собой -CO2R3a, -CH2CO2R3a, -CH2CH2CO2R3a, тетразол, -C(О)NH2 или -CH2OH; и R4 и R5 не являются Н; и остальные переменные принимают значения, определенные в варианте осуществления № 1 или № 2.
[0044] В варианте осуществления № 8 R3 представляет собой -CO2R3a, -CH2CO2R3a и -CH2CH2CO2R3a; R4 и R5 представляют собой Н; и остальные переменные принимают значения, определенные в варианте осуществления № 1.
[0045] В варианте осуществления № 9 R3 представляет собой -CO2R3a; и R4 и R5 представляют собой Н; и остальные переменные принимают значения, определенные в варианте осуществления № 1 или № 2.
[0046] В варианте осуществления № 10 R3, R4 и R5 принимают значения, определенные в варианте осуществления № 8 или № 9; R3a представляет собой Н; и остальные переменные принимают значения, определенные в варианте осуществления № 1 или № 2.
[0047] В варианте осуществления № 11, R5 представляет собой Н или фтор, и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 1-5.
[0048] В варианте осуществления № 12 R6 выбран из группы, состоящей из:
(i) C1-C4 алкила;
(ii) C!-C3 фторалкила;
(iii) -О-(C1-C6 алкила);
(iv) -R6a, где R6a выбран из группы, состоящей из:
(a) С3-С6 циклоалкила,
(b) группы формулы 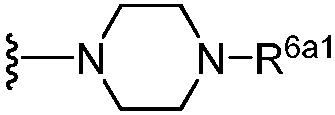 , где R6a1 представляет собой Н или -CH2CH2NH2;
, где R6a1 представляет собой Н или -CH2CH2NH2;
(c) 5-членного гетероарила, содержащего 1-3 гетероатома, выбранных из группы, состоящей из N, О и S;
где R6 является незамещенным или замещен 1-3 фрагментами R6a2, выбранными из группы, состоящей из галогена и C1-C3 алкила;
(v) -О-R6b; и
где R6b выбран из группы, состоящей из:
(a) С3-С6 циклоалкила; и
(b) группы формулы 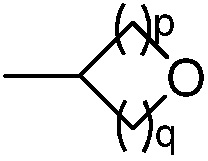 , где p равно 1 или 2 и q равно 1 или 2;
, где p равно 1 или 2 и q равно 1 или 2;
и где R6b является незамещенным;
и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 1-11.
[0049] В варианте осуществления № 13 R7 представляет собой водород или хлор, и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 1-12.
[0050] В варианте осуществления № 14 один из R8 и R9 представляет собой галоген, другой представляет собой Н, и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 1-13.
[0051] В варианте осуществления № 15 R8 и R9, оба представляют собой Н, и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 1-13.
[0052] В варианте осуществления № 16 R2 представляет собой ОН, и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 1-15.
[0053] В варианте осуществления № 17 n равно 1, и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 1-16.
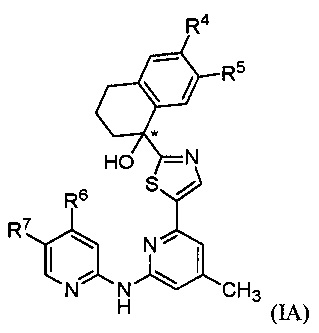
[0054] В варианте осуществления № 18 соединение формулы (I) представляет собой соединение формулы (IA)
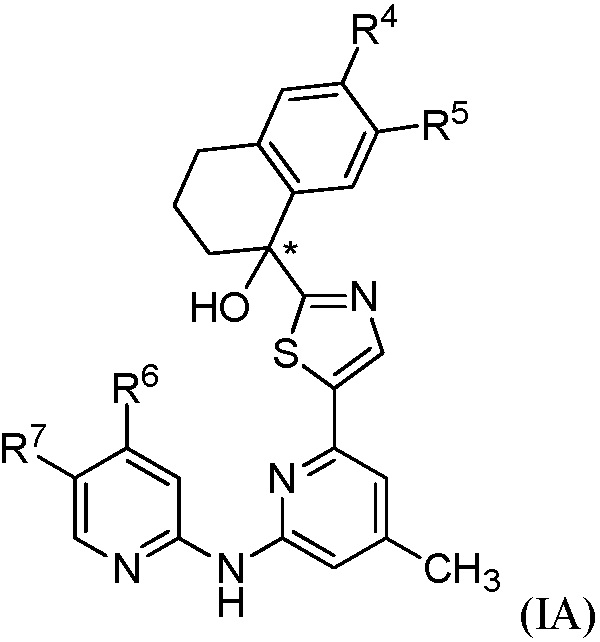 ,
,
где
R4 представляет собой -CO2R4a, -С(О)NH2 или -СН2ОН;
где R4a выбран из группы, состоящей из Н и СН3;
R5 представляет собой Н или фтор;
R6 выбран из группы, состоящей из:
(i) C1-C4 алкила;
(ii) C1-C3 фторалкила;
(iii) -О-(C1-C6 алкила);
(iv) -R6a, где R6a выбран из группы, состоящей из:
(a) C3-C6 циклоалкила,
(b) группы формулы  , где R6al представляет собой Н или -CH2CH2NH2;
, где R6al представляет собой Н или -CH2CH2NH2;
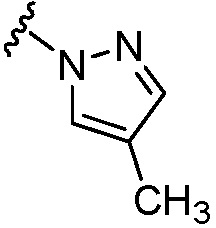
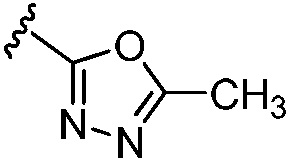
(с) 5-членного гетероарила, содержащего 1-3 гетероатома, выбранных из группы, состоящей из N, О и S (например, пиразолила, тиенила и оксадиазолила);
где R6a является незамещенным или замещен 1-3 фрагментами R6a2, выбранными из группы, состоящей из галогена и C1-C3 алкила (например, метила);
(v) -О-R6b;
где R6b выбран из группы, состоящей из:
(a) С3-С6 циклоалкила; и
(b) группы формулы  , где р равно 1 или 2 и q равно 1 или 2;
, где р равно 1 или 2 и q равно 1 или 2;
где R6b является незамещенным; и
R7 представляет собой Н или галоген.
[0055] В варианте осуществления № 19 соединение представляет собой соединение формулы (IA), где R4 представляет собой -CO2R4a, где R4a выбран из группы, состоящей из Н и СН3; и остальные переменные принимают значения, определенные в варианте осуществления № 18.
[0056] В варианте осуществления № 20 соединение представляет собой соединение формулы (IA), где R4 представляет собой -СО2Н; и остальные переменные принимают значения, определенные в варианте осуществления № 18.
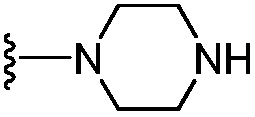
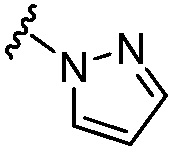
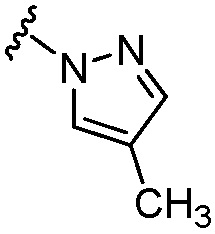
[0057] В варианте осуществления № 21 соединение представляет собой соединение формулы (IA), где R6 выбран из группы, состоящей из C1-C4 алкила, -CF3, -С(Н)F2, -О-(C1-C3 алкила), -OCF3, C3-C6 циклоалкила, 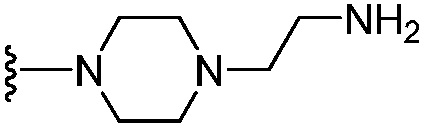 ,
,  ,
,  ,
,  ,
,  ,
, 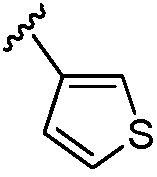 ,
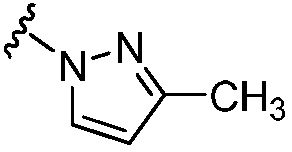
, 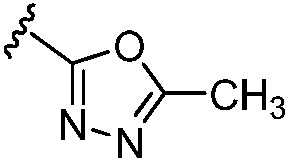 и -О-(С4-С6 циклоалкила); и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 18-20.
и -О-(С4-С6 циклоалкила); и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 18-20.
[0058] В варианте осуществления № 22 соединение представляет собой соединение формулы (IA), где R6 выбран из группы, состоящей из C1-C3 фторалкила, и остальные переменные принимают значения, определенные в любом из вариантов №№ 18-20.
[0059] В варианте осуществления № 23 соединение представляет собой соединение формулу (IA), где R7 представляет собой Н или хлор, и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 18-22.
[0060] В варианте осуществления № 24 соединение представляет собой соединение формулы (IA), где R4 представляет собой -CO2R4a, -C(О)NH2 или -СН2ОН;
где R4a выбран из группы, состоящей из Н и СН3;
R5 представляет собой Н или фтор;
R6 выбран из группы, состоящей из C1-C4 алкила, -CF3, -С(Н)F2, -О-(C1-C3 алкила), -OCF3, C3-С6 циклоалкила,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и -О-(С4-С6 циклоалкила); и
и -О-(С4-С6 циклоалкила); и
R7 представляет собой Н или хлор.
[0061] В варианте осуществления № 25 соединение представляет собой соединение формулы (IA), где R4 представляет собой -CO2R4a;
где R4a выбран из группы, состоящей из Н и СН3;
R5 представляет собой Н или фтор;
R6 выбран из группы, состоящей из C1-C4 алкила, -CF3 и -С(Н)F2; и
R7 представляет собой Н или хлор.
[0062] В варианте осуществления № 26 соединение представляет собой соединение формулы (I), где R1 представляет собой С1-С3 алкил; и остальные переменные принимают значения, определенные в варианте осуществления № 1.
[0063] В варианте осуществления № 27 соединение представляет собой соединение формулы (I), где один из R3, R4 и R5 выбран из группы, состоящей из -СО2Н, -С(О)-CN, -C(О)-N(H)OCH3, -P(О)(OCH2CH3)2, -P(О)(OH)2, тетразола, 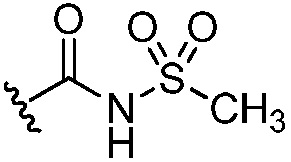 ,
, 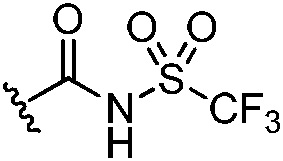 ,
, 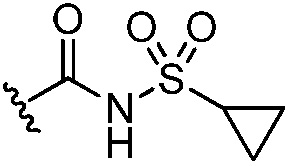 ,
, 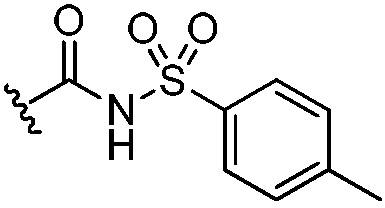 ,
, 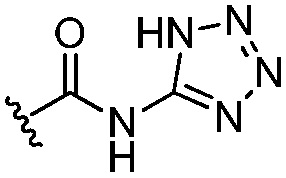 и -B(OH)2, и другие два из R3, R4 и R5 независимо представляют собой Н или галоген;
и -B(OH)2, и другие два из R3, R4 и R5 независимо представляют собой Н или галоген;
и остальные переменные принимают значения, определенные в варианте № 1.
[0064] В варианте осуществления № 28 соединение представляет собой соединение формулы (I), где
R1 представляет собой C1-C3 алкил;
R2 представляет собой -ОН;
R6 представляет собой C1-C3 фторалкил;
R7, R8 и R9, каждый представляет собой Н;
R3, R4 и R5 принимают значения, определенные в варианте № 27;
и остальные переменные принимают значения, определенные в арианте осуществления № 1.
[0065] В варианте осуществления № 29 соединение представляет собой соединение формулы (IA), где R6 выбран из группы, состоящей из C1-C4 алкила, -CF3, -С(Н)F2, -О-(C1-C3 алкила), -OCF3, C3-C6 циклоалкила,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и -О-(С4-С6 циклоалкила), и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 18-20.
и -О-(С4-С6 циклоалкила), и остальные переменные принимают значения, определенные в любом из вариантов осуществления №№ 18-20.
[0066] В варианте осуществления № 30 соединение представляет собой соединение формулы (IA), где R4 представляет собой -CO2R4a, -C(О)NH2 или -СН2ОН;
где R4a выбран из группы, состоящей из Н и СН3;
R5 представляет собой Н или фтор;
R6 выбран из группы, состоящей из C1-C4 алкила, -CF3, -С(Н)F2, -О-(C1-С3 алкила), -OCF3, C3-C6 циклоалкила,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и -О-(С4-С6 циклоалкила); и
и -О-(С4-С6 циклоалкила); и
R7 представляет собой Н или хлор.
[0067] Типичными соединениями согласно настоящему изобретению являются соединения, представленные ниже, а также их фармацевтически приемлемые соли:
5-(5-{6-[(4-трет-бутоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-[5-(6-{[4-(дифторметил)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-[5-(6-{[5-хлор-4-(трифторметил)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-{5-[6-({4-[4-(2-аминоэтил)пиперазин-1-ил]пиридин-2-ил}амино)-4-метилпиридин-2-ил]-1,3-тиазол-2-ил}-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-гидрокси-5-[5-(4-метил-6-{[4-(пиперазин-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
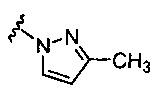
5-гидрокси-5-[5-(4-метил-6-{[4-(4-метил-1H-пиразол-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
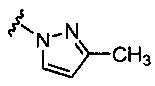
5-гидрокси-5-[5-(4-метил-6-{[4-(1Н-пиразол-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
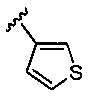
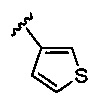
5-гидрокси-5-[5-(4-метил-6-{[4-(тиофен-3-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
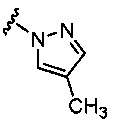
5-гидрокси-5-(5-{4-метил-6-{[4-метилпиридин-2-ил)амино]пиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-[5-(6-{[4-циклогексилокси)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-гидрокси-5-[5-(4-метил-6-{[4-(3-метил-1Н-пиразол-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-(5-{6-[(4-циклобутилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-[5-(6-{[4-(циклобутилокси)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-гидрокси-5-(5-{4-метил-6-[(4-пропилпиридин-2-ил)амино]пиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-(5-{6-[(4-этоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-[5-(6-{[4-(циклопентилокси)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-(5-{6-[(4-этилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-(5-{6-[(4-циклогексилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-гидрокси-5-[5-(4-метил-6-{[4-(пропан-2-илокси)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-гидрокси-5-[5-(4-метил-6-{[4-(5-метил-1,3,4-оксадиазол-2-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
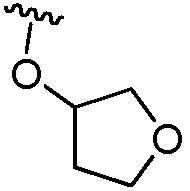
5-гидрокси-5-[5-(4-метил-6-{[4-(тетрагидрофуран-3-илокси)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
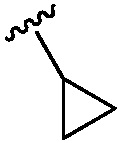
5-(5-{6-[(4-циклопропилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-гидрокси-5-[5-(4-метил-6-{[4-(1-метилэтил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-(5-{6-[(4-трет-бутилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
метил-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилат,
метил-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксилат,
3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
7-фтор-6-(гидроксиметил)-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-1,2,3,4-тетрагидронафталин-1-ол,
5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксамид,
метил-5-гидрокси-5-[5-(4-метил-6-{[4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилат,
5-гидрокси-5-[5-(4-метил-6-{[4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-[5-(3-бром-4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-[5-(5-бром-4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-[5-(3,5-дибром-4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-{5-[4-(ацетиламино)-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил]-1,3-тиазол-2-ил}-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-[5-(4-амино-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
метил-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-1-карбоксилат,
5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-1-карбоновая кислота,
1-гидрокси-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-4-карбоновая кислота,
9-гидрокси-9-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-2-карбоновая кислота,
5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-2-карбоновая кислота,
5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-1-карбоновая кислота,
3-гидрокси-3-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-5-карбоновая кислота,
метил-1-гидрокси-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-5-карбоксилат,
1-гидрокси-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-5-карбоновая кислота,
метил-1-бром-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксилат,
1-бром-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
1-циано-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-гидрокси-1-метокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
6-бром-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-1,2,3,4-тетрагидронафталин-1-ол,
5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбонитрил,
1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6-(2H-тетразол-5-ил)- 1,2,3,4-тетрагидронафталин-1-ол,
5-гидрокси-N-(метилсульфонил)-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксамид,
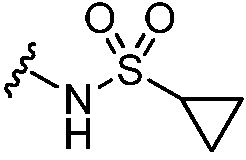
N-(циклопропилсульфонил)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
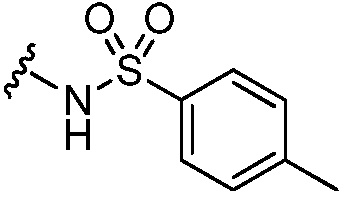
5-гидрокси-N-[(4-метилфенил)сульфонил]-5-[5-(4-метил-6-{[4-трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
N-циано-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-N-[(трифторметил)сульфонил]-5,6,7,8-тетрагидронафталин-2-карбоксамид,
5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-N-1H-тетразол-5-ил-5,6,7,8-тетрагидронафталин-2-карбоксамид,
5-гидрокси-N-метокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
диэтил-{5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-ил}фосфонат,
{5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-ил}фосфоновая кислота,
{5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-ил}бороновая кислота,
метил-5-фтор-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилат,
5-фтор-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-амино-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-(ацетиламино)-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
5-гидрокси-5-(5-{6-[(4-метоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота и
5-гидрокси-5-(5-{4-метил-6-[(4-пропоксипиридин-2-ил)амино]пиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота.
[0068] Дополнительными типичными примерами соединений настоящего изобретения являются соединения, представленные ниже, включая их фармацевтически приемлемые соли:
(5R)-5-(5-{6-[(4-трет-бутоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-[5-(6-{[4-(дифторметил)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-[5-(6-{[5-хлор-4-(трифторметил)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-{5-[6-({4-[4-(2-аминоэтил)пиперазин-1-ил]пиридин-2-ил}амино)-4-метилпиридин-2-ил]-1,3-тиазол-2-ил}-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(пиперазин-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(4-метил-1H-пиразол-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(1Н-пиразол-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(тиофен-3-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-(5-{4-метил-6-{[4-метилпиридин-2-ил)амино]пиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-[5-(6-{[4-циклогексилокси)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(3-метил-1Н-пиразол-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-(5-{6-[(4-циклобутилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-[5-(6-{[4-(циклобутилокси)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-(5-{4-метил-6-[(4-пропилпиридин-2-ил)амино]пиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-(5-{6-[(4-этоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-[5-(6-{[4-(циклопентилокси)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-(5-{6-[(4-этилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-(5-{6-[(4-циклогексилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(пропан-2-илокси)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(5-метил-1,3,4-оксадиазол-2-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(тетрагидрофуран-3-илокси)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-(5-{6-[(4-циклопропилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(1-метилэтил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-(5-{6-[(4-трет-бутилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-метил-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилат,
(5R)-метил-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксилат,
(5R)-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-7-фтор-6-(гидроксиметил)-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-1,2,3,4-тетрагидронафталин-1-ол,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5R)-метил-5-гидрокси-5-[5-(4-метил-6-{[4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилат,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-[5-(3-бром-4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-[5-(5-бром-4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-[5-(3,5-дибром-4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-{5-[4-(ацетиламино)-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил]-1,3-тиазол-2-ил}-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-[5-(4-амино-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-метил-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-1-карбоксилат,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-1-карбоновая кислота,
(5R)-1-гидрокси-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-4-карбоновая кислота,
(9R)-9-гидрокси-9-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-2-карбоновая кислота,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-1-карбоновая кислота,
(3R)-3-гидрокси-3-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-5-карбоновая кислота,
(1R)-метил-1-гидрокси-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-5-карбоксилат,
(1R)-1-гидрокси-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-5-карбоновая кислота,
(5R)-метил-1-бром-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксилат,
(5R)-1-бром-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-1-циано-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-1-метокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(1R)-6-бром-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-1,2,3,4-тетрагидронафталин-1-ол,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбонитрил,
(1R)-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6-(2H-тетразол-5-ил)- 1,2,3,4-тетрагидронафталин-1-ол,
(5R)-5-гидрокси-N-(метилсульфонил)-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5R)-N-(циклопропилсульфонил)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5R)-5-гидрокси-N-[(4-метилфенил)сульфонил]-5-[5-(4-метил-6-{[4-трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5R)-N-циано-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-N-[(трифторметил)сульфонил]-5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-N-1H-тетразол-5-ил-5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5R)-5-гидрокси-N-метокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
диэтил-{(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-ил}фосфонат,
{(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-ил}фосфоновая кислота,
{(5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-ил}бороновая кислота,
(5R)-метил-5-фтор-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилат,
(5R)-5-фтор-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-амино-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-(ацетиламино)-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5R)-5-гидрокси-5-(5-{6-[(4-метоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота и
(5R)-5-гидрокси-5-(5-{4-метил-6-[(4-пропоксипиридин-2-ил)амино]пиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота.
[0069] Дополнительными типичными примерами соединений настоящего изобретения являются соединения, представленные ниже, включая их фармацевтически приемлемые соли:
(5S)-5-(5-{6-[(4-трет-бутоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-[5-(6-{[4-(дифторметил)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-[5-(6-{[5-хлор-4-(трифторметил)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-{5-[6-({4-[4-(2-аминоэтил)пиперазин-1-ил]пиридин-2-ил}амино)-4-метилпиридин-2-ил]-1,3-тиазол-2-ил}-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(пиперазин-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(4-метил-1H-пиразол-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(1Н-пиразол-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(тиофен-3-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-(5-{4-метил-6-{[4-метилпиридин-2-ил)амино]пиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-[5-(6-{[4-циклогексилокси)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(3-метил-1Н-пиразол-1-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-(5-{6-[(4-циклобутилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-[5-(6-{[4-(циклобутилокси)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-(5-{4-метил-6-[(4-пропилпиридин-2-ил)амино]пиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-(5-{6-[(4-этоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-[5-(6-{[4-(циклопентилокси)пиридин-2-ил]амино}-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-(5-{6-[(4-этилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-(5-{6-[(4-циклогексилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(пропан-2-илокси)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(5-метил-1,3,4-оксадиазол-2-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(тетрагидрофуран-3-илокси)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-(5-{6-[(4-циклопропилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(1-метилэтил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-(5-{6-[(4-трет-бутилпиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-метил-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилат,
(5S)-метил-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксилат,
(5S)-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-7-фтор-6-(гидроксиметил)-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-1,2,3,4-тетрагидронафталин-1-ол,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5S)-метил-5-гидрокси-5-[5-(4-метил-6-{[4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилат,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-[5-(3-бром-4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-[5-(5-бром-4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-[5-(3,5-дибром-4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-{5-[4-(ацетиламино)-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил]-1,3-тиазол-2-ил}-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-[5-(4-амино-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-метил-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-1-карбоксилат,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-1-карбоновая кислота,
(5S)-1-гидрокси-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-4-карбоновая кислота,
(9S)-9-гидрокси-9-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-2-карбоновая кислота,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-1-карбоновая кислота,
(3S)-3-гидрокси-3-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-5-карбоновая кислота,
(1S)-метил-1-гидрокси-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-5-карбоксилат,
(1S)-1-гидрокси-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-инден-5-карбоновая кислота,
(5S)-метил-1-бром-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксилат,
(5S)-1-бром-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-1-циано-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-1-метокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(1S)-6-бром-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-1,2,3,4-тетрагидронафталин-1-ол,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбонитрил,
(1S)-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-6-(2H-тетразол-5-ил)- 1,2,3,4-тетрагидронафталин-1-ол,
(5S)-5-гидрокси-N-(метилсульфонил)-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5S)-N-(циклопропилсульфонил)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5S)-5-гидрокси-N-[(4-метилфенил)сульфонил]-5-[5-(4-метил-6-{[4-трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5S)-N-циано-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-N-[(трифторметил)сульфонил]-5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-N-1H-тетразол-5-ил-5,6,7,8-тетрагидронафталин-2-карбоксамид,
(5S)-5-гидрокси-N-метокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]- 5,6,7,8-тетрагидронафталин-2-карбоксамид,
диэтил-{(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-ил}фосфонат,
{(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-ил}фосфоновая кислота,
{(5S)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-ил}бороновая кислота,
(5S)-метил-5-фтор-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилат,
(5S)-5-фтор-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-амино-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-(ацетиламино)-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота,
(5S)-5-гидрокси-5-(5-{6-[(4-метоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота и
(5S)-5-гидрокси-5-(5-{4-метил-6-[(4-пропоксипиридин-2-ил)амино]пиридин-2-ил}-1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота.
[0070] Настоящее изобретение также относится к соединению формулы (I) или его фармацевтически приемлемой соли в очищенной форме.
Применение соединений
[0071] Соединения формулы (I) или их фармацевтически приемлемые соли и фармацевтические композиции, содержащие указанные соединения, могут применяться для лечения или предотвращения различных состояний или заболеваний, опосредуемых селезеночной тирозинкиназой (Syk). Такие состояния и заболевания включают, но без ограничения, следующие состояния и заболевания: (1) артрит, включая ревматоидный артрит, болезнь Стилла, псориатический артрит и остеоартрит; (2) астму и другие обструктивные заболевания дыхательных путей, включая хроническую астму, позднюю астму, гиперчувствительность дыхательных путей, бронхит, бронхиальную астму, аллергическую астму, наследственную астму, приобретенную бронхиальную астму, пылевую астму, респираторный дистресс-синдром взрослых, рецидивирующий стеноз дыхательных путей, хроническую обструктивную болезнь легких, включая эмфизему; (3) аутоиммунные заболевания или расстройства, включая заболевания или расстройства, которые определены как аутоиммунные заболевания или расстройства одного органа или клеток одного типа, например тиреоидит Хашимото, аутоиммунную гемолитическую анемию, аутоиммунный атрофический гастрит с пернициозной анемией, аутоиммунный энцефаломиелит, аутоиммунный орхит, болезнь Гудпасчера, аутоиммунную тромбоцитопению, включая идиопатическую тромбоцитопеническую пурпуру, симпатическую офтальмию, псевдопаралитическую миастению, болезнь Грейвса, первичный билиарный цирроз, хронический агрессивный гепатит, язвенный колит и мембранную гломерулопатию; расстройства, которые определены как расстройства, в которые вовлечены системные аутоиммунные расстройства, например системная красная волчанка, иммунная тромбоцитопеническая пурпура, ревматоидный артрит, синдром Шегрена, синдром Рейтера, полимиозит-дерматомиозит, системный склероз, узелковый полиартериит, рассеянный склероз и буллезный пемфигоид, а также другие аутоиммунные заболевания, в которые вовлечены В-клетки (гуморальные) или Т-клетки, в том числе синдром Когана, анкилозирующий спондилит, гранулематоз Вегенера, аутоиммунная алопеция, диабет I типа или инсулинозависимый юношеский диабет и тиреоидит; (4) карциномы или опухоли, в том числе рак пищеварительного/желудочно-кишечного тракта, рак толстой кишки, рак печени, рак кожи, в том числе мастоцима и плоскоклеточный рак, рак молочной железы, рак яичников, рак предстательной железы, лимфома и лейкоз (в том числе, но без ограничения, острый миелогенный лейкоз, хронический миелоидный лейкоз, лимфома клетки ткани, одевающей спорангий, системные неходжкинские лимфомы (НХЛ), В-клеточные лимфомы (например, предшествующая В-ALL (B-клеточная лимфобластная лейкемия), В-клеточная лимфома маргинальной зоны, хронический лимфолейкоз, диффузная В клеточная крупноклеточная лимфома, лимфома Беркитта, средостения крупноклеточной В-клеточной лимфомы), лимфома Ходжкина, лимфома природных клеток-киллеров и Т-клеточная лимфома; опухоли, стимулируемые слиянием TEL-Syk и ITK-Syk), миеломы, в том числе множественная миелома, миелопролиферативные расстройства, рак почек, рак легких, рак мышц, рак кости, рак мочевого пузыря, рак мозга, меланома, в том числе меланома ротовой полости и метастатическая меланома, саркома Капоши, пролиферативная диабетическая ретинопатия, расстройства, связанные с ангиогенезом, в том числе солидные опухоли, и рак поджелудочной железы; (5) сахарный диабет, включая диабет I типа и осложнения, вызванные диабетом; (6) глазные заболевания, расстройства или состояния, в том числе аутоиммунные заболевания глаз, кератоконъюнктивит, весенний конъюнктивит, увеит, включая увеит, связанный с болезнью Бехчета, и уевит, вызванный линзами, кератит, герпетический кератит, конический кератит, дистрофия корнеального эпителия, кератолейкома, глазная пузырчатка (ocular premphigus), разъедающая язва роговицы (Морена), склерит, офтальмопатия Грейвса, синдром Фогта-Коянаги-Харада, кератоконъюнктивит сухой (синдром «сухого глаза»), фликтенула, иридоциклит, саркоидоз, эндокринная офтальмопатия, офтальмия симпатического нерва, аллергический конъюнктивит и глазная неоваскуляризация; (7) кишечные воспаления, аллергические заболевания или состояния, в том числе болезнь Крона и/или язвенный колит, воспалительное заболевание кишечника, глютеновая энтеропатия, проктит, эозинофильный гастроэнтерит и мастоцитоз; (8) нейродегенеративные заболевания, в том числе заболевания двигательных нейронов, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Хантингтона, церебральная ишемия, или нейродегенеративное заболевание, вызванное травматическим повреждением, ударом, глутаматная нейротоксичность или гипоксия; ишемическое/реперфузионное повреждение при инсульте, миокардиальная ишемия, почечная ишемия, сердечный приступ, гипертрофия сердца, атеросклероз и артериосклероз, гипоксия органа; (9) агрегация тромбоцитов и заболевания, связанных с активацией тромбоцитов или вызванных активацией тромбоцитов, такие как атеросклероз, тромбоз, гиперплазии интимы и рестеноз после повреждения сосуда; (10) состояния, связанные с сердечно-сосудистыми заболеваниями, в том числе рестеноз, острый коронарный синдром, инфаркт миокарда, нестабильная стенокардия, рефрактерная стенокардии, окклюзионный коронарный тромб, возникающий после тромболитической терапии или после коронарной ангиопластики, тромботически опосредуемый цереброваскулярный синдром, эмболический инсульт, тромботический инсульт, преходящее ишемическое нарушение мозгового кровообращения, венозный тромбоз, тромбоз глубоких вен, легочная эмболия, коагулопатия, диссеминированное внутрисосудистое свертывание, тромботическая тромбоцитопеническая пурпура, облитерирующий тромбангиит, тромботические заболевание, связанное с гепарин-индуцированной тромбоцитопенией, тромботические осложнения, связанные с экстрокорпоральным кровообращением, тромботические осложнения, связанные с применением технических средств, таких как сердечная или другая внутрисосудистая катетеризации, внутриаортальный баллонный насос, коронарный стент или сердечный клапан, состояния, при которых необходима установка протезов и т.п.; (11) кожные заболевания, состояния или расстройства, в том числе атопический дерматит, экзема, псориаз, склеродермия, зуд и другие состояния, сопровождающиеся зудом; (12) аллергические реакции, в том числе анафилаксия, аллергический ринит, аллергический дерматит, аллергическая крапивница, ангионевротический отек (болезнь Квинке), аллергическая астма или аллергические реакции на укусы насекомых, продукты, лекарства или пыльцу; (13) отторжение трансплантата, том числе отторжение трансплантата островков или островковых клеток поджелудочной железы, отторжение трансплантата костного мозга, заболевание «трансплантат-против-хозяина», отторжение трансплантатов органов и клеток, таких клетки костного мозга, хрящи, роговицы, сердце, межпозвоночный диск, островки, почки, конечности, печень, легкие, мышцы, миобласты, нервы, клетки поджелудочной железы, кожа, тонкий кишечник или трахея, а также ксенотрансплантация; (14) рубцы низкого качества, в том числе склеродермия, повышенный фиброз, келоиды, послеоперационные рубцы, фиброз легких, спазмы сосудов, мигрень, реперфузионное повреждение и рубцы после инфаркта миокарда.
[0072] Таким образом, изобретение относится к соединениям формулы (I) и их фармацевтически приемлемым солям для применения в терапии, в частности для лечения заболеваний и состояний, опосредуемых аномальной активностью Syk. Термин «аномальная активность (нарушение активности) Syk» в настоящем описании относится к любой активности Syk, которая отличается от нормальной активности Syk, ожидаемой у конкретного пациента. Аномальная активность Syk может принимать форму, например, аномального повышения активности или аберрации по времени и/или контроль активности Syk. Такая аномальная активность может приводить, например, к гиперэкспрессии или мутации протеинкиназы, приводящей к нарушению активации или неконтролируемой активации.
[0073] В еще одном варианте осуществления настоящее изобретение относится к способам регуляции, модулирования или ингибирования Syk для предотвращения и/или лечения заболеваний, связанных с нерегулируемой активностью Syk.
[0074] В еще одном варианте осуществления настоящее изобретение относится к способу лечения пациента, страдающего расстройством, опосредуемым активностью Syk, который включает введение указанному пациенту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного. В еще одном варианте осуществления настоящее изобретение предоставляет применение соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного для получении лекарственного средства для лечения расстройства, опосредуемого активностью Syk.
[0075] В еще одном варианте осуществления изобретения указанным расстройством, опосредуемым активностью Syk, является астма. В еще одном варианте осуществления изобретения указанным расстройством является ревматоидный артрит. В еще одном варианте осуществления изобретения указанным расстройством является рак. В еще одном варианте осуществления изобретения указанным расстройством является глазной конъюнктивит.
[0076] Еще один аспект настоящего изобретения предоставляет способ лечения заболеваний, вызванных или связанных с Fc-рецепторными сигнальными каскадами, включая FceRI и/или FcgRI-опосредованную дегрануляцию, в качестве терапевтического подхода к лечению или предотвращению заболеваний, характеризующихся, вызванных на и/или связанных с высвобождением или синтезом химических медиаторов, таких Fc-рецепторных сигнальных каскадов или дегрануляции. Кроме того, Syk, как известно, играет важную роль в сигнализации активационного тирозинсодержащего мотива иммунорецепторов (ITAM), сигнализации B-клеточного рецептора, сигнализации Т-клеточного рецептора и является существенным компонентом в передаче сигнала интегрина бета (1), бета (2) и бета (3) в нейтрофилах. Таким образом, соединения настоящего изобретения могут применяться для регулирования Fc-рецепторных, ITAM, B-клеточных рецепторных и интегриновых каскадов передачи сигнала, а также клеточных ответов, вызванных посредством этих каскадов передачи сигнала. Примеры клеточных ответов, которые могут регулироваться или ингибироваться, включают, но без ограничения, респираторное прободение, клеточную адгезию, клеточную дегрануляцию, распластывание клеток, миграцию клеток, фагоцитоз, поток ионов кальция, агрегацию тромбоцитов и созревание клеток.
Композиции и способы их введения
[0077] Хотя и возможно, что для применения в терапии соединение формулы (I), а также его фармацевтически приемлемые соли могут вводиться в виде сырого химического соединения, активный ингредиент можно представить в виде фармацевтической композиции. Соответственно, настоящее изобретение также предоставляет фармацевтическую композицию, которая включает в себя соединение формулы (I) или его фармацевтически приемлемые соли и фармацевтически приемлемый носитель. Соединения формулы (I) и их фармацевтически приемлемые соли описаны выше. Носители должны быть приемлемыми в смысле совместимости с другими ингредиентами композиции и невредными для пациента. В соответствии с другим аспектом настоящего изобретения предлагается также способ получения фармацевтической композиции, включающий смешивание соединения формулы (I) или его фармацевтически приемлемой соли с одним или несколькими фармацевтически приемлемыми носителями.
[0078] Фармацевтические композиции по настоящему изобретению могут быть представлены в лекарственной форме стандартной дозы, содержащей предопределенное количество активного ингредиента на единичную (стандартную) дозу. Такая единичная доза может содержать, например, от 5 мкг до 1 г, предпочтительно от 1 мг до 700 мг, более предпочтительно от 5 мг до 100 мг соединения формулы (I) в зависимости от состояния, подлежащего лечению, способа введения, возраста, массы тела и состояния пациента. Следовательно, такие дозы могут вводиться более одного раза в день. Предпочтительными композициями стандартной дозы являются композиции, содержащие суточную дозу или суб-дозы (для введения более одного раза в день) активного ингредиента, как указано выше, или их соответствующую часть. Кроме того, такие фармацевтические композиции могут быть получены любым из способов, хорошо известных в области фармакопеи.
[0079] Фармацевтические композиции по настоящему изобретению могут быть адаптированы для введения любым подходящим способом, например пероральным (в том числе буккально или сублингвально), ректальным, местным, ингаляционным, назальным, глазным или парентеральным (включая внутривенное и внутримышечное ведение) способом. Такие композиции могут быть получены любым способом, известным в области фармации, например контактированием активного ингредиента с носителем(ями) или наполнителем(ами). Лекарственные формы включают таблетки, пастилки, дисперсии, суспензии, растворы, капсулы, кремы, мази, аэрозоли и т.п.
[0080] В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, адаптированной для введения пероральным путем, для лечения, например, ревматоидного артрита.
[0081] В еще одном варианте осуществления настоящее изобретение предоставляет фармацевтическую композицию, адаптированную для введения через нос для лечения, например, аллергического ринита.
[0082] В еще одном варианте осуществления настоящее изобретение предоставляет фармацевтическую композицию, предназначенную для введения путем ингаляции для лечения, например, астмы, COPD или ARDC.
[0083] В еще одном варианте осуществления настоящее изобретение предоставляет фармацевтическую композицию, предназначенную для введения путем ингаляции для лечения, например, астмы или COPD.
[0084] В еще одном варианте осуществления настоящее изобретение предоставляет фармацевтическую композицию, предназначенную для введения в глаза для лечения заболеваний глаз, например конъюнктивита.
[0085] В еще одном варианте осуществления настоящее изобретение предоставляет фармацевтическую композицию, предназначенную для парентерального введения (включая внутривенное введение) для лечения, например, рака.
[0086] Фармацевтические композиции по настоящему изобретению, которые адаптированы для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; пищевые пены или взбитые массы; жидкие эмульсии типа «масло-в-воде» или жидкие эмульсии типа «вода-в-масле».
[0087] Например, для перорального введения в форме таблетки или капсулы активный лекарственный компонент может быть объединен с пероральным, нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Порошки получают посредством измельчения соединения до порошка тонкого помола и смешиванием с аналогичным образом измельченным фармацевтическим носителем, таким как съедобный пищевой углевод, например крахмал или маннит. Также могут присутствовать вкусовые добавки, консерванты, дисперсанты и красители.
[0088] Капсулы получают путем приготовления порошковой смеси, как описано выше, и заполнением ею сформированных желатиновых оболочек. Вещества, повышающие скольжение, и смазывающие вещества, такие как коллоидный диоксид кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль, могут добавляться к порошкообразной смеси перед операцией заполнения капсул. Дезинтегрирующий или солюбилизирующий агент, такой как агар-агар, карбонат кальция или карбонат натрия, также могут добавляться для улучшения доступности лекарственного средства при проглатывании капсулы.
[0089] Кроме того, когда желательно или необходимо, подходящие связующие вещества, вещества, повышающие скольжение, дезинтегрирующие агенты и красители также могут вводиться в смесь. Подходящие связующие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, кукурузные подсластители, природные и синтетические камеди, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Вещества, повышающие скольжение, используемые в этих лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают, но без ограничения, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Таблетки получают, например, посредством приготовления порошкообразной смеси, грануляцией или получением вязкой массы, добавлением вещества, повышающего скольжение, и разрыхлителя с последующим прессованием в таблетки. Порошкообразную смесь получают смешиванием соединения, подходящим образом измельченного, с разбавителем или основой, как описано выше, и, необязательно, со связующим веществом, таким как карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как парафин, ускорителем резорбции, таким как четвертичная соль, и/или абсорбентом, таким как бентонит, каолин или дикальцийфосфат. Порошкообразную смесь можно подвергнуть гранулированию посредством орошения связующим веществом, таким как сироп, крахмальная паста, растительный клей акации или растворы целлюлозных или полимерных материалов, и продавливанием через сито. В качестве альтернативы гранулированию, порошкообразную смесь можно пропускать через таблетировочную машину и полученный недостаточно сформованный продукт раздробить в гранулы. Гранулы могут смазываться для предотвращения слипания с образованием матрицы таблетки посредством добавления стеариновой кислоты, стеарата, талька или минерального масла. Смесь с добавлением смазывающего вещества затем прессуют в таблетки. Соединения по настоящему изобретению также могут объединяться со свободно текучим носителем и прессоваться у таблетки непосредственно без прохождения стадий гранулирования или получения вязкой взвеси. Могут также наноситься прозрачные или непрозрачные защитные покрытия, состоящие из изолирующей шеллачной аппретуры, покрытия из сахара или полимерного материала и глянцевое покрытие из воска. Для различия стандартных доз в эти покрытия могут добавляться красители.
[0090] Жидкости для перорального введения, такие как растворы, сиропы и эликсиры, могут приготавливаться в форме препарата стандартной дозы таким образом, чтобы данное количество содержало предопределенное количество соединения. Сиропы могут быть получены посредством растворения соединения в водном растворе с подходящими вкусовыми добавками, в то время как эликсиры готовят с использованием нетоксичного спиртового носителя. Суспензии могут быть получены путем диспергирования соединения в нетоксичном наполнителе. Солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и простые полиоксиэтиленсорбитолэфиры, консерванты, вкусовые добавки, такие как масло мяты перечной, натуральные подсластители, сахарин или другие искусственные подсластители и т.п., также могут добавляться.
[0091] При необходимости композиции стандартной дозы для перорального введения могут быть микрокапсулированы. Также может быть получен препарат для длительного или постепенного высвобождения действующего вещества, например, посредством нанесения покрытия или внедрения измельченного вещества в полимеры, воск и т.п.
[0092] Соединения формулы (I) и их фармацевтически приемлемые соли могут также вводиться в форме липосомных систем доставки, таких как небольшие однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы могут быть получены из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины.
[0093] Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть доставлены с помощью моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть соединены с растворимыми полимерами в качестве носителей лекарства. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный фрагментами пальмитоила. Кроме того, соединения могут быть соединены с классом биоразлагаемых полимеров, которые могут применяться для достижения контролируемого высвобождения лекарственного средства, например, полимолочной кислотой, поли-эпсилон-капролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и сшитыми или амфипатическими блок-сополимерами гидрогелей.
[0094] Лекарственные формы для ингаляционного введения могут приготавливаться в виде аэрозолей или сухих порошков.
[0095] Для композиций, подходящих и/или адаптированных для ингаляционного введения, предпочтительно, чтобы соединение формулы (I) или его соль были представлены в форме частиц уменьшенного размера, и, более предпочтительно, форму частиц уменьшенного размера получают или можно получать микронизацией. Предпочтительный размер частиц уменьшенного размера (например, полученных микронизацией) соединения или его соли или сольвата определяется значением D50 от примерно 0,5 до примерно 10 микрон (например, при измерении с использованием лазерной дифракции).
[0096] Аэрозольные композиции, например, для ингаляционного введения, могут содержать раствор или тонкую суспензию активного вещества в фармацевтически приемлемом водном или неводном растворителе. Аэрозольные препараты могут быть представлены в виде разовой дозы или множественной дозы в стерильной форме в герметичном контейнере, который может иметь форму картриджа или дозаправки для применения с распыляющим устройством или ингалятором. Альтернативно, герметичный контейнер может представлять собой дозирующее устройство стандартной дозы, такое как назальный ингалятор разовой дозы или аэрозольный распылитель, снабженный мерным клапаном (дозирующий ингалятор), которое предназначено для утилизации после расходования содержимого контейнера.
[0097] Если лекарственная форма содержит аэрозольный распылитель, она предпочтительно содержит подходящий пропеллент под давлением, такой как сжатый воздух, диоксид углерода или органический пропеллент, такой как гидрофторуглерод (HFC). Подходящие HFC пропелленты включают 1,1,1,2,3,3,3-гептафторпропан и 1,1,1,2-тетрафторэтан. Аэрозольные лекарственные формы могут также принимать форму мелкокапельного распылителя с нагнетательным устройством (pump-atomizer). Аэрозоль под давлением может содержать раствор или суспензию активного соединения. Для этого может потребоваться введение дополнительных наполнителей, например сорастворителей и/или поверхностно-активных веществ, для улучшения дисперсионных характеристик и однородности суспензий. Препаратам в форме растворов также может потребоваться добавление сорастворителей, таких как этанол. Другие модифицирующие наполнители также могут вводиться для улучшения, например, стабильности и/или вкуса, и/или характеристик массы мелких частиц (количества и/или профиля) композиции.
[0098] Для фармацевтических композиций, подходящих и/или адаптированных для ингаляционного введения, фармацевтическая композиция предпочтительно представляет собой сухую порошкообразную композицию для введения вдыханием. Такая композиция может содержать порошкообразную основу, такую как лактоза, глюкоза, трегалоза, маннит или крахмал, соединение формулы (I) или его соль или сольват (предпочтительно в форме измельченных частиц малого размера, например, в микронизированной форме), а также, необязательно, модификатор, такой как L-лейцин или другая аминокислота и/или соли металлов стеариновой кислоты, такие как стеарат магния или кальция. Предпочтительно композиция в форме сухого порошка для ингаляции включает в себя сухую порошкообразную смесь лактозы и соединения формулы (I) или его соли. Лактоза предпочтительно представляет собой гидрат, например моногидрат лактозы, и/или предпочтительно представляет собой лактозу сорта «для ингаляций» и/или лактозу тонкого помола. Предпочтительно распределение частиц лактозы по размеру определяется следующим образом: размер 90% частиц лактозы или более (по массе или по объему) составляет менее 1000 мкм (микронов) (например 10-1000 мкм, 30-1000 мкм) в диаметре и/или размер 50% или более частиц лактозы составляет менее 500 мкм (например 10-500 мкм) в диаметре. Более предпочтительно распределение частиц лактозы по размеру определяется следующим образом: размер 90% частиц лактозы или более составляет менее 300 мкм (например 10-300 мкм, 50-300 мкм) в диаметре и/или размер 50% частиц лактозы или более составляет менее 100 мкм в диаметре. Необязательно распределение частиц лактозы по размеру определяется следующим образом: размер 90% частиц лактозы или более составляет менее 100-200 мкм в диаметре, и/или размер 50% частиц лактозы или более составляет менее 40-70 микрон в диаметре. Предпочтительно размер от примерно 3 до примерно 30% частиц лактозы (например примерно 10% частиц) (по массе или по объему) составляет менее 50 мкм или менее 20 мкм в диаметре. Например, но без ограничения, подходящей лактозой для ингаляции является лактоза E9334 лактозы (10% fines) (Borculo Domo Ingredients, Hanzeplein 25, 8017 JD Zwolle, Netherlands).
[0099] Необязательно, в особенности для композиций в форме сухих порошков, которые можно вводить ингаляцией, фармацевтическая композиции для ингаляционного введения может вводиться во множество герметичных контейнеров с предопределенным количеством композиции (например, содержащих композицию в форме сухого порошка), установленных продольно в полосы или ленты в подходящем устройстве для ингаляции. При необходимости контейнер может разрываться или открываться соскабливанием внешней оболочки, и доза композиции, например, композиции в форме сухого порошка, может вводиться путем ингаляции с помощью устройств, таких как устройство DISKUS® (GlaxoSmithKline). Другие ингаляторы сухого порошка хорошо известны специалистам в данной области техники, многие такие устройства являются коммерчески доступными, типичными примерами которых являются Aerolizer® (Novartis), Airmax™ (IV AX), ClickHaler® (Innovata Biomed), Diskhaler® (GlaxoSmithKline), Accuhaler (GlaxoSmithKline), Easyhaler® (Orion Pharma), Eclipse™ (Aventis), FlowCaps® (Hovione), HandiHaler® (Boehringer Ingelheim), Pulvinal® (Chiesi), Rotahaler® (GlaxoSmithKline), SkyeHaler™ или Certihaler™ (SkyePharma), Twisthaler (Schering-Plough), Turbuhalter® (AstraZeneca), Ultrahaler® (Aventis) и т.п.
[0100] Лекарственные формы для глазного введения могут быть приготовлены в виде растворов или суспензий с наполнителями, подходящими для применения в офтальмологии.
[0101] Лекарственные формы для назального введения могут быть приготовлены в виде аэрозолей, растворов, капель, гелей или сухих порошков.
[0102] Фармацевтические композиции, адаптированные для введения путем ингаляции, включают дусты тонкоизмельченных частиц или аэрозоли, которые могут быть получены с помощью различных видов дозирующих устройств, аэрозолей с дозированием действующего вещества под давлением, распылителей или аппаратом для вдувания.
[0103] Для получения фармацевтических композиций, подходящих и/или адаптированных для интраназального введения, соединение формулы (I) или его фармацевтически приемлемая соль или сольват может вводиться в жидкий препарат для доставки из жидкостного дозатора. Такие жидкостные дозаторы могут включать в себя, например, дозирующую насадку или отверстие для дозирования, через которое распыляется отмеренная доза жидкого препарата при силовом воздействии пользователя на механизм насоса жидкостного дозатора. Такие жидкостные дозаторы, как правило, снабжены резервуаром множества отмеренных доз жидкого препарата, причем дозы могут последовательно распыляться при последовательном приведении в действие насоса. Дозирующая насадка или отверстие может иметь конфигурацию, подходящую для введения в ноздри пользователем для дозированного распыления жидкого препарата в носовой полости. Жидкостной дозатор вышеупомянутого типа описан и проиллюстрирован в WO-A-2005/044354, содержание которой во всей полноте включено в данное описание посредством ссылки. Дозатор включает в себя корпус, в котором находится устройство выбрасывания жидкости, содержащее компрессионный насос, вмонтированный в контейнер, содержащий жидкий препарат. Корпус включает в себя по меньшей мере один боковой рычаг, который приводится в действие пальцем и который может перемещаться внутрь относительно корпуса в камеру контейнера в верхней части в корпусе, чтобы приводить в действие насос для создания давления и перекачки отмеренной дозы препарата из штока насоса через назальную насадку корпуса. Особенно предпочтительный жидкостной дозатор общего типа представлен на фиг.30-40 в WO-A-2005/044354.
[0104] Ниже приведены типичные примеры фармацевтических лекарственных форм для соединений настоящего изобретения:
|
[0105] Будет понятно, что когда соединение по настоящему изобретению вводят в комбинации с другими терапевтическими агентами, обычно вводимыми ингаляцией, внутривенно, перорально или интраназально, конечная фармацевтическая композиция может вводиться теми же способами.
[0106] Следует представлять, что помимо ингредиентов, конкретно перечисленных выше, композиции могут включать другие компоненты, традиционно применяемые в данной области и связанные с типом рассматриваемой композиции, например компоненты, подходящие для перорального введения, могут включать вкусовые добавки.
[0107] Терапевтически эффективное количество соединения по настоящему изобретению будет зависеть от ряда факторов, в том числе, например, возраста и массы тела животного, точного состояния, требующего лечения, и его тяжести, природы препарата, а также пути его введения, и в конечном счете будет установлено лечащим врачом или ветеринаром. Тем не менее, эффективное количество соединения формулы (I) для лечения заболеваний или состояний, связанных с нарушением активности Syk, обычно находится в интервале от 5 мкг до 100 мг/кг массы тела реципиента (пациента) в день, чаще находится в интервале от 5 мкг до 10 мг/кг массы тела в день. Это количество может приниматься в виде разовой дозы в день или, чаще, в нескольких (например в двух, трех, четырех, пяти или шести) суб-дозах в день таким образом, чтобы общая суточная доза была такой же. Эффективное количество соли или сольвата может определяться как доля эффективного количества соединения формулы (I) как таковой.
[0108] Композиции по изобретению могут дополнительно включать одно или несколько дополнительных терапевтических средств, как более подробно обсуждено ниже. Соответственно, в одном варианте осуществления настоящее изобретение относится к композициям, включающим (i) соединение формулы (I) или его фармацевтически приемлемую соль, (ii) одно или несколько дополнительных терапевтических средств, которые не являются соединениями формулы (I), и (iii) фармацевтически приемлемый носитель, где количества в композиции вместе эффективны для лечения одного из заболеваний или состояний, описанных выше.
Комбинированная терапия
[0109] Соединения формулы (I) или их фармацевтически приемлемые соли могут применяться в сочетании по меньшей мере с одним дополнительным терапевтическим средством в одном препарате или совместно вводиться в виде отдельных препаратов для лечения или предотвращения заболеваний и состояний, описанных в данном изобретении. Такие дополнительные терапевтические средства включают, но без ограничения, следующие лекарственные средства: (1) антагонист DP рецептора, такой как S-5751 и ларопипрант; (2) кортикостероид, например триамцинолона ацетонид, будесонид, беклометазон, флутиказон и мометазон; (3) β2-адренергический агонист, такой как сальметерол, формотерол, арформотерол, тербуталин, метапротеренол, албутерол и т.п.; (4) модификатор лейкотриена, в том числе антагонист рецептора лейкотриена, такой как монтелукаст, зафирлукаст, пранлукаст, или ингибитор липоксигеназы, включая ингибиторы 5-липооксигеназы и ингибиторы FLAP (белка, активирующего 5-липооксигеназы), такие как зилеутон; (5) антигистамин, такой как бромфенирамин, хлорфенирамин, дексхлорфенирамин, трипролидин, клемастин, дифенгидрамин, дифенилпиралин, трипеленнамин, гидроксизин, метдилазин, прометазин, тримепразин, азатадин, ципрогептадин, антазолин, фенирамин, пириламин, астемизол, терфенадин, лоратадин, цетиризин, фексофенадин, дескарбоэтоксилоратадин и т.п.; (6) противозастойное или противоотечное средство, в том числе фенилэфрин, фенилпропаноламин, псевдофедрин, оксиметазолин, эфинефрин, нафазолин, ксилометазолин, пропилгекседрин или леводезоксиэфедрин; (7) противокашлевое средство, в том числе кодеин, гидрокодон, карамифен, карбетапентан или декстраметорфан; (8) другой лиганд простагландина, в том числе агонист простагландина F, такой как латанопрост, мизопростол, энпростил, риопростил, орнопростол или росапростол; (9) диуретик; (10) нестероидные противовоспалительные средства (NSAID), такие как производные пропионовой кислоты (алминопрофен, беноксапрофен, буклоксовая кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флурбипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен, напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен), производные уксусной кислоты (индометацин, ацеметацин, алклофенак, клиданак, диклофенак, фенклофенак, фенклозиновая кислота, фентиазак, фурофенак, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, толметин, зидометацин, зомепирак), производные фенамовой кислоты (флуфенамовая кислота, меклофенамовая кислота, мефенамовая кислота, нифлумовая кислота и толфенамовая кислота), производные бифенилкарбоновой кислоты (дифлунизал и флуфенизал), оксикамы (изоксикам, пироксикам, судоксикам и теноксикам), салицилаты (ацетилсалициловая кислота, сульфасалазин) и пиразолоны (апазон, безпиперилон, фепразон, мофебутазон, оксифенбутазон, фенилбутазон); (11) ингибиторы циклооксигеназы-2 (СОХ-2), такие как целекоксиб и рофекоксиб; (12) ингибиторы фосфодиэстеразы IV типа (PDE-IV), например Ariflo, рофлумиласт; (13) антагонисты хемокиновых рецепторов, в частности CCR-1, CCR-2, CCR-3; (14) средства, понижающие уровень холестерина, такие как ингибиторы редуктазы HMG-CoA (ловастатин, симвастатин, правастатин, флувастатин, аторвастатин и другие статины), секвестранты (холестирамин и колестипол), никотиновая кислота, производные фенофибриновой кислоты (гемфиброзил, клофибрат, фенофибрат и бензафибрат) и пробукол; (15) противодиабетические средства, такие как инсулин, сульфонилмочевины, бигуаниды (метформин), ингибиторы глюкозидазы (акарбоза) и глитазоны (троглитазон, пиоглитазон, энглитазон, розиглитазон и т.п.); (16) препараты интерферона бета (интерферон бета-1а, интерферон бета-1b); (17) антихолинергические средства, такие как мускариновые антагонисты (ипратропия бромид и тиотропия бромид), а также селективные мускариновые антагонисты М3; (18) стероиды, такие как беклометазон, метилпреднизолон, бетаметазон, преднизолон, дексаметазон и гидрокортизон; (19) триптаны, обычно используемые для лечения мигрени, такие как сумитриптан и ризатриптан; (20) алендронат и лекарственные средства для лечения остеопороза; (21) другие соединения, такие как 5-аминосалициловая кислота и пролекарства, антиметаболиты, такие как азатиоприн, 6-меркаптопурин, цитотоксические химиотерапевтические противораковые средства, антагонисты брадикинина (B2), такие как FK-3657, антагонисты TP рецептора, такие как сератродаст, антагонисты нейрокинина (NK1/NK2), антагонисты VLA-4, такие как описанные в патенте США № 5510332, WO97/03094, WO97/02289, WO96/40781, WO96/22966, WO96/20216, WO96/01644, WO96/06108, WO95/15973 и WO96/31206. Кроме того, данное изобретение охватывает способ лечения заболеваний, опосредуемых простагландином D2, включающий введение пациенту, нуждающемуся в таком лечении, нетоксичного терапевтически эффективного количества соединения формулы (I), необязательно совместно с одним или несколькими такими ингредиентами, которые перечислены выше.
[0110] При введении комбинированной терапии пациенту, нуждающемуся в таком введении, терапевтические средства в комбинации либо фармацевтическая композиция или композиции, содержащие терапевтические агенты, могут вводиться в любом порядке, например последовательно, параллельно, совместно, одновременно и т.п.
[0111] В одном варианте осуществления изобретения соединение формулы (I) вводится в течение времени, когда дополнительное терапевтическое средство(а) оказывает профилактическое или терапевтическое действие или наоборот.
[0112] В другом варианте осуществления изобретения соединения формулы (I) и дополнительное терапевтическое средство(а) вводят в дозах, обычно используемых, когда такие средства используются в качестве монотерапии для лечения расстройства.
[0113] В еще одном варианте осуществления изобретения соединение формулы (I) и дополнительное терапевтическое средство(а) вводят в дозах ниже, чем дозы, обычно используемые, когда такие лекарственные средства используются в качестве монотерапии для лечения расстройства.
[0114] В одном варианте осуществления соединение формулы (I) и дополнительное терапевтическое средство(а) присутствует в одной композиции, которая подходит для перорального введения.
[0115] Соединение формулы (I) и дополнительное терапевтическое средство(а) может действовать аддитивно или синергически. Синергическая комбинация может позволить применять более низкие дозы одного или нескольких средств и/или менее частое введение одного или нескольких средств комбинированной терапии. Более низкие дозы или менее частое введение одного или более агентов может привести к снижению токсичности терапии без снижения ее эффективности.
[0116] Дозы и схема приема дополнительного терапевтического средства (средств), используемого в комбинированной терапии по настоящему изобретению для лечения или профилактики заболевания или расстройства, могут быть определены лечащим врачом с учетом утвержденных доз и схемы приема, указанных во вкладыше в упаковке, возраста, пола, общего состояния здоровья пациента, а также типа и тяжести вирусной инфекции или родственного заболевания или расстройства.
[0117] Еще один аспект настоящего изобретения представляет собой набор, содержащий терапевтически эффективное количество соединения формулы (I) или фармацевтически приемлемой соли указанного соединения, необязательно по меньшей мере одно дополнительное терапевтическое средство, указанное выше, и фармацевтически приемлемый носитель, наполнитель или разбавитель.
Способы получения соединений формулы (I)
[0118] Соединения настоящего изобретения могут быть получены различными способами, включая стандартные химические способы. Любая ранее определенная переменная будет по-прежнему принимать определенные выше значения, если не указано иное. Типичные примеры общих способов синтеза представлены ниже, и далее в примерах получены конкретные соединения формулы (I).
[0119] Соединения общей формулы (I) могут быть получены способами, известными в области органического синтеза, как частично представлено в приведенных ниже схемах синтеза. Во всех схемах, описанных ниже, понятно, что защитные группы для чувствительных или реакционно-способных групп применяются при необходимости в соответствии с общими правилами химии. Защитные группы можно применять в соответствии со стандартными методами органического синтеза (T. W. Green and P. G. M. Wuts (1991) Protecting Groups in Organic Synthesis, John Wiley & Sons). Эти группы удаляют на соответствующей стадии синтеза соединения с использованием методов, которые совершенно очевидны специалистам данной области. Выбор защитных групп, а также условия реакции и порядок реакционных стадий должны соответствовать получению соединений формулы (I). Специалистам данной области техники будет понятно, существует ли стереоцентр в соединениях формулы (I). Соответственно, настоящее изобретение включает все возможные стереоизомеры, а также не только смеси стереоизомеров (например, рацемические соединения), но и отдельные стереоизомеры. Когда желательно соединение в виде отдельного энантиомера, оно может быть получено посредством стереоспецифического синтеза, посредством разделения конечного продукта или с использованием любого стандартного промежуточного продукта. Разделение конечного продукта, полупродукта или исходного вещества может осуществляться любым подходящим способом, известным в данной области (смотрите, например, Stereochemistry of Organic Compounds by E. L. Eliel, S. H. Wilen, and L. N. Mander (Wiley-Interscience, 1994)).
[0120] Представленные ниже растворители, реагенты, защитные группы остатков и другие обозначения могут упоминаться с помощью их аббревиатур в скобках:
[0121] Me = метил; Et = этил; Pr = пропил; iPr = изопропил; Bu = бутил; t-Bu = трет-бутил; Ph = фенил; Ас = ацетил
[0122] мкл = микролитр
[0123] АсОН и НОАс = уксусная кислота
[0124] ACN = ацетонитрил
[0125] Ad = адамантил
[0126] Водн. = водный
[0127] Bn = бензил
[0128] Boc или BOC = трет-бутоксикарбонил
[0129] Bz = бензоил
[0130] Boc = трет-бутоксикарбонил
[0131] Cbz = бензилоксикарбонил
[0132] Dba = дибензилиденацетон
[0133] DBU = 1,8-диаза-7-бицикло[5.4.0]ундецен
[0134] ДХМ = дихлорметан
[0135] ДМАП = 4-диметиламинопиридин
[0136] DIBAL = гидрид диизобутилалюминия
[0137] DIEA или основания Нанига = N,N-диизопропилэтиламин
[0138] DMA = 1,2-диметилацетамид
[0139] ДМФА = диметилформамид
[0140] ДМСО = диметилсульфоксид
[0141] DTT = дитиотреитол
[0142] ЭДТА = этилендиаминтетрауксусная кислота
[0143] EtOAc = этилацетат
[0144] г = граммы
[0145] GST = глутатион S-трансфераза
[0146] час = часы
[0147] HMDS = 1,1,1,3,3,3-гексаметилдисилазан
[0148] HATU = гексафторфосфат N,N,N',N'-тетраметил-О-(7-азабензотриазол-1-ил)урония
[0149] ВЭЖХ = высокоэффективная жидкостная хроматография
[0150] HOBt = 1-гидроксибензотриазол
[0151] LDA = диизопропиламид лития
[0152] ЖХ-MC = жидкостная хроматомасс-спектрометрия
[0153] мин = минуты
[0154] мг = миллиграммы
[0155] мл = миллилитры
[0156] ммоль миллимоли
[0157] Me = метил
[0158] МеОН = метанол
[0159] MC = масс-спектрометрия
[0160] MTBE = простой метил-трет-бутиловый эфир
[0161] NBS = N-бромсукцимид
[0162] ЯМР = ядерный магнитный резонанс
[0163] PMB = 4-метоксибензил
[0164] rac = рацемическая смесь
[0165] RT или КТ = комнатная температура (температура окружающей среды, около 25°C)
[0166] нас. = насыщенный
[0167] SFC = сверхкритическая жидкостная хроматография
[0168] TBSCl = трет-бутилдиметилсилилхлорид
[0169] TBS = трет-бутилдиметилсилил
[0170] TEA = триэтиламин (Et3N)
[0171] TFA = трифторуксусная кислота
[0172] TFAA = ангидрид трифторуксусной кислоты
[0173] ТГФ = тетрагидрофуран
[0174] ТСХ = тонкослойная хроматография
[0175] TMS = триметилсилил
[0176] Tris = трис(гидроксиметил)аминометан
[0177] Xantphos = 4,5-бис(дифенилфосфино)-9,9-диметилксантен
Общие способы
[0178] Как показано на схеме I, соединения формулы (I) могут быть получены посредством связывания по методу Хека бромзамещенных аминопиридинов (S2) и замещенных тиазолов (S1). Полученные промежуточные продукты после удаления защитной группы (S3) могут подвергаться взаимодействию с замещенными бром- или хлорпиридинами (S4), а сложноэфирная группа может подвергаться гидролизу с использованием гидроксидов щелочных металлов для получения карбоновых кислот (S5).
Схема I
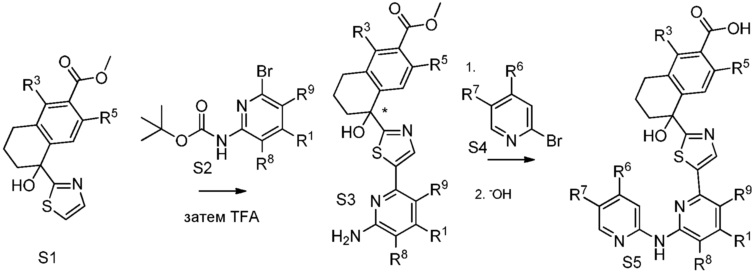
[0179] Бромзамещенные аминопиридины (S2) могут быть получены взаимодействием дибромпиридинов (S2a) и трет-бутилкарбамата (S2b), как показано на схеме II.
Схема II
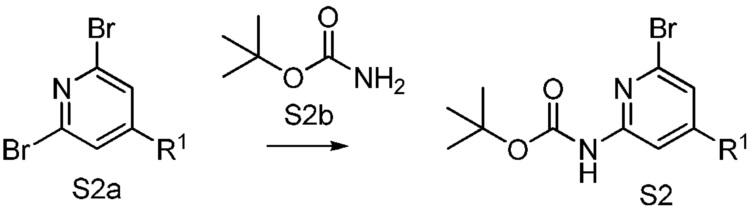
[0180] Замещенные тиазолы (S1) могут быть получены этерификацией 5-оксотетрагидронафталин-2-карбоновых кислот (S1a) с последующей реакцией Гриньяра с тиазолом, как показано на схеме III. При необходимости, замещенные тиазолы (S1) могут разделяться на очищенные энантиомеры, S1c и S1d, c использованием, например, хиральной хроматографии.
Схема III
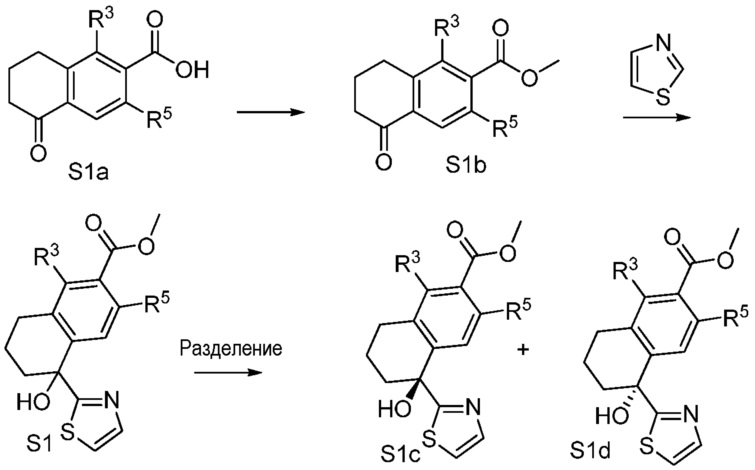
[0181] Исходные материалы и реагенты, используемые при получении описанных соединений, доступны от коммерческих поставщиков или были получены описанными в литературе способами, известными специалистам данной области техники. Например, 5-оксо-5,6,7,8-тетрагидронафталин-2-карбоновая кислота (соединение S1a), доступна от Matrix Scientific (Colombia, South Carolina). 1-Оксо-2,3-дигидро-1H-инден-5-карбоновая кислота доступна от DL Chiral Chemicals (Princeton, New Jersey). Синтез 5-оксо-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-2-карбоновой кислоты описан в J. Org. Chem., 1962, 27 (1), 70-76. 2,6-Дибром-4-метилпиридин (соединение S2a) может поставляться Aces Pharma (Branford, Connecticut).
[0182] Приведенные далее примеры представлены для дополнительной иллюстрации настоящего изобретения. Они даны только для иллюстративных целей и не должны рассматриваться как ограничение объема настоящего изобретения.
[0183] Когда в приведенных ниже примерах представлены масс-спектральные данные (МС), анализ проведен с использованием квадрупольного жидкостного хроматомасс-спектрометра Agilent Technologies 6120 (ЖХ/МС). Разделение энантиомеров обычно выполнялось с помощью сверхкритической жидкостной хроматографии с использованием колонки Chiral Technologies AD или AD-H (размер частиц неподвижной фазы от 5 до 10 микрон) с подвижной фазой СО2 и низшего спирта и/или ТГФ.
ПРИМЕРЫ
Пример получения 1 - 6-бром-4-метил-N-[4-(трифторметил)пиридин-2-ил]пиридин-2-амин (пример получения 1)
[0184] Через раствор 4-(трифторметил)пиридин-2-амина (12,0 г, 74,0 ммоль) и 2,6-дибром-4-метилпиридина (18,57 г, 74,0 ммоль) в 1,4-диоксане (240 мл) в течение пяти минут барботировали N2. К раствору добавляли трет-бутоксид натрия (7,83 г, 81 ммоль) и дихлорид 1,1'-бис(ди-трет-бутилфосфино)ферроценпалладия (1,204 г, 1,851 ммоль), раствор нагревали до 75°С и перемешивали с помощью магнитной мешалки. После завершения реакции реакционную смесь охлаждали и затем распределяли между EtOAc (200 мл) и 5% водным раствором хлорида аммония (200 мл). Слои разделяли и водный слой экстрагировали EtOAc (200 мл). Объединенные органические слои промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на силикагеле (градиент: 0-40% EtOAc/гексан) с получением 6-бром-4-метил-N-[4-(трифторметил)пиридин-2-ил]пиридин-2-амина (22,5 г, 67,7 ммоль, 92%).
МС (ESI): вычислено для C12H9BrF3N3 [M+H]+ 332, найдено 332.
1H-ЯМР (600 МГц, CDCl3) δ 8,39 (с, 1H), 7,73 (с, 1H), 7,54 (с, 1H), 7,33 (с, 1H), 7,05 (с, 1H), 6,92 (д, J=2,7 Гц, 1H), 2,31 (д, J=3,6 Гц, 3H) м.д.
Пример получения 2 - 4-метил-6-(1,3-тиазол-5-ил)-N-[4-(трифторметил)пиридин-2-ил]пиридин-2-амин (пример получения 2)
[0185] В сухую колбу загружали димерный хлорид аллилпалладия(II) (1,333 г, 3,64 ммоль) и бутилдиадамантилфосфин (5,23 г, 14,57 ммоль) в дегазированном диметилацетамиде (50 мл). В колбе создавали вакуум и снова заполняли ее аргоном (3 раза), затем реакционную смесь перемешивали при комнатной температуре в течение 10 минут. К смеси добавляли еще одну порцию дегазированного диметилацетамида (50 мл), 6-бром-4-метил-N-[4-(трифторметил)пиридин-2-ил]пиридин-2-амин (12,1 г, 36,4 ммоль), тиазол (10,36 мл, 146 ммоль), карбонат калия (15,11 г, 109 ммоль) и триметилуксусную кислоту (6,34 мл, 54,6 ммоль). В колбе создавали вакуум и заполняли ее аргоном (3 раза), затем реакционную смесь перемешивали в атмосфере аргона при 130°С в течение ночи. Реакционную смесь разбавляли EtOAc (500 мл), охлаждали до комнатной температуры, фильтровали через Celite® и концентрировали. К смеси, содержащей сырой продукт, добавляли воду, полученный осадок собирали фильтрованием и очищали флэш-хроматографией на силикагеле (этилацетат/гексаны). После очистки получали 4-метил-6-(1,3-тиазол-5-ил)-N-[4-(трифторметил)пиридин-2-ил]пиридин-2-амин (5,29 г, 15,72 ммоль, выход 43%) в виде твердого вещества желтого цвета.
МС (ESI): вычислено для C15H11F3N4S [M+H]+ 337, найдено 337.
1H-ЯМР (600 МГц, ДМСО) δ 10,21 (с, 1H), 9,14 (с, 1H), 8,59 (с, 1H), 8,52 (с, 1H), 8,47 (д, J=5,1 Гц, 1H), 7,43 (с, 1H), 7,20 (д, J=5,1 Гц, 1H), 7,11 (с, 1H), 2,30 (с, 3H) м.д.
Пример получения 3 - трет-бутил-(6-бром-4-метилпиридин-2-ил)карбамат (пример получения 3)
[0186] В колбу загружали трет-бутилкарбамат (5,6 г, 47,8 ммоль), 2,6-дибром-4-метилпиридин (12 г, 47,8 ммоль) и затем дегазированный 2-MeТГФ (120 мл). После этого последовательно добавляли твердый трет-бутоксид натрия (4,6 г, 47,8 ммоль), трис(дибензилиденацетон)палладий(0) (1,1 г, 1,2 ммоль) и 1,1'-бис(ди-трет-бутилфосфино)ферроцен (1,1 г, 2,4 ммоль), в колбе воздавали вакуум и вновь заполняли ее азотом (3 раза). Реакционный раствор нагревали до 70°С и выдерживали при данной температуре в течение 4 часов, затем охлаждали до комнатной температуры. Полученную смесь обрабатывали водой (20 мл) и EtOAc (100 мл) и фильтровали через Celite®. Органический раствор промывали насыщенным раствором соли (100 мл) и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на силикагеле с получением трет-бутил-(6-бром-4-метилпиридин-2-ил)карбамата (11,2 г, 82%) в виде твердого белого вещества.
МС (ESI): вычислено для C11H15BrN2O2 [M+H]+ 287, найдено 287.
1H-ЯМР (600 МГц, CDCl3) δ 7,70 (с, 1H), 7,13 (с, 1H), 6,95 (с, 1H), 2,29 (с, 3H), 1,49 (с, 9H) м.д.
Пример получения 4 - (R или S)-метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилат (пример получения 4А и пример получения 4В)
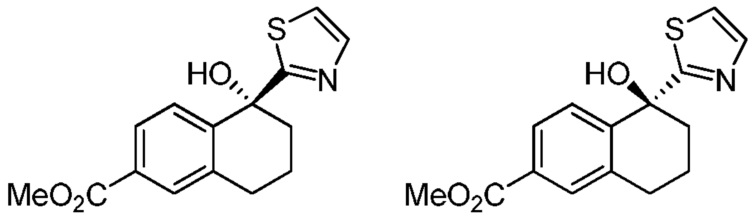
[0187] Стадия 1: К раствору 5-оксо-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (22,0 г, 116 ммоль) в метаноле (132 мл) добавляли серную кислоту (22,7 г, 231 ммоль), полученный раствор нагревали до 60°С и выдерживали при указанной температуре в течение 4 часов. При охлаждении раствора начиналась кристаллизация, после чего к раствору добавляли воду (130 мл). Суспензию фильтровали и твердый продукт сушили в вакууме с получением метил-5-оксо-5,6,7,8-тетрагидронафталина (20,6 г, 101 ммоль, 87%) в виде твердого не совсем белого вещества.
МС (ESI): вычислено для С12Н12О3 [M+H]+ 205, найдено 205.
[0188] Стадия 2: Тиазол (14,6 г, 172 ммоль) медленно добавляли к раствору комплекса хлорида изопропилмагния и хлорида лития (142 мл, 1,3 М в ТГФ, 185 ммоль), поддерживая температуру в интервале от 0 до 5°С. Полученную суспензию перемешивали в течение 1 часа и затем охлаждали до -20°С. К суспензии добавляли раствор метил-5-оксо-5,6,7,8-тетрагидронафталина (27,0 г, 132 ммоль) в ТГФ (50 мл), поддерживая температуру в интервале от 0 до 5°С, и реакционный раствор перемешивали в течение 2 часов. Полученную суспензию гасили метанолом (7,5 мл), а затем добавляли воду (50 мл) и изопропилацетат (200 мл) с последующим добавлением 2 М водного раствора HCl (50 мл). Полученный водный слой экстрагировали изопропилацетатом (100 мл), и органический слой промывали насыщенным водным раствором бикарбоната натрия (100 мл) и насыщенным раствором соли (100 мл). Полученный продукт очищали на силикагеле с получением метил-5-гидрокси-5-(1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (38,3 г, 78 ммоль). Очистка хиральной хроматографией (AD колонка; 40%-ный этанола в СО2) приводила к получению каждого энантиомера метил-гидрокси-5-(1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (18,0 г, 35 ммоль, 27% каждого изомера). Энантиомер второго элюирования (в примере получения 5 "энантиомер 2") использовали для последующей реакции.
МС (ESI): вычислено для C15H15NO3S [M+H]+ 290, найдено 290.
1H-ЯМР (600 МГц, CDCl3) δ 7,82 (с, 1H), 7,75 (дд, 1H, J=8,2, 1,7 Гц), 7,69 (д, 1H, J=3,2 Гц), 7,27 (д, 1H, J=3,2 Гц), 7,24 (с, 1H), 3,87 (с, 3H), 3,74 (с, 1H), 2,93 (дд, 1H, J=6,5, 6,5 Гц), 2,39 (ддд, 1H, J=13,3, 9,9, 3,2 Гц), 2,23 (ддд, 1H, J=13,4, 7,9, 3,1 Гц), 2,06-1,99 (м, 1H), 1,98-1,92 (м, 1H) м.д.
[0189] Далее было определено, что энантиомер 2 имеет R-конфигурацию.
Пример получения 5 - (R)-метил-5-[5-(6-амино-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоксилат (пример получения 5)
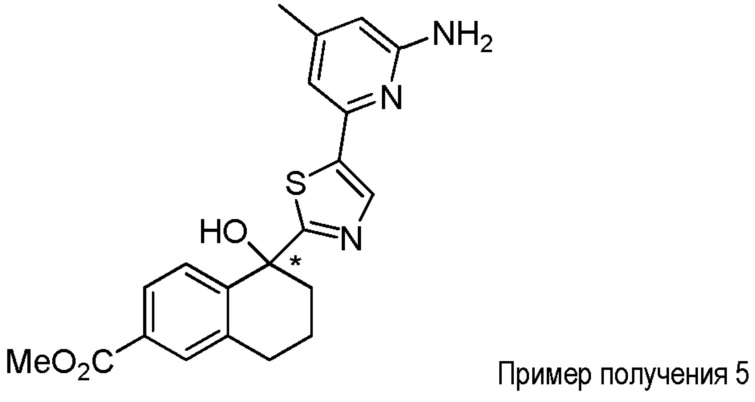
[0190] В колбу загружали бутилдиадамантилфосфин (6,1 г, 0,4 ммоль) и димер хлорида аллилпалладия (1,56 г, 4,2 ммоль) и затем дегазированный азотом диметилацетамид (98 мл). Смесь перемешивали в течение 10 минут, затем добавляли карбонат калия (17,6 г, 127 ммоль), триметилуксусную кислоту (6,5 г, 63,7 ммоль), (R)-метилгидрокси-5-(1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (энантиомер 2 примера получения 4, 11,0 г, 38,2 ммоль) и трет-бутил-6-бром-4-метилпиридин-2-илкарбамат (12,2 г, 42,5 ммоль). В колбе создавали вакуум и вновь заполняли ее азотом (3 раза), затем смесь медленно нагревали до 100°С и перемешивали при этой температуре в течение 12 часов. Суспензию охлаждали до 35°С и разбавляли этилацетатом (100 мл). После этого суспензию фильтровали через Celite® и промывали 10% водным раствором NaCl (3×100 мл). Полученный раствор концентрировали при пониженном давлении и очищали на силикагеле. В результате получали два продукта: (R)-метил-5-(5-(6-(трет-бутоксикарбониламино)-4-метилпиридин-2-ил)тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоксилат и (R)-метил-5-гидрокси-5-(5-(4-(метил-6-пиваламидопиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилат - которые обрабатывали HCl (20 мл 6 н. раствора), полученную смесь нагревали до 80°С и выдерживали при указанной температуре в течение 12 часов. Полученный раствор охлаждали до комнатной температуры и обрабатывали EtOAc (100 мл) и NaHCO3 (50 мл). Водный слой экстрагировали EtOAc (50 мл), затем упаривали и остаток очищали хроматографией на силикагеле с получением (R)-метил-5-[6-амино-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоксилата (2,6 г, 6,57 ммоль).
МС (ESI): вычислено для C15HNF3N4S [M+H]+ 396, найдено 396.
1H-ЯМР (600 МГц, CDCl3) δ 8,03 (с, 1H), 7,83 (с, 1H), 7,77 (д, 1H, J=8,2 Гц), 7,34 (д, 1H, J=8,2 Гц), 6,82 (с, 1H), 6,21 (с, 1H), 4,34 (с, 2H), 3,88 (с, 3H), 3,70 (с, 1H), 2,94 (дд, 2H, J=6,2, 6,2 Гц), 2,41 (ддд, 1H, J=13,1, 9,6, 3,2 Гц), 2,27 (ддд, 1H, J=13,5, 8,2, 3,1 Гц), 2,22 (с, 3H), 2,08-2,01 (м, 1H), 2,00-1,95 (м, 1H) м.д.
Пример получения 6 - 6-бром-N-(4-метоксипиридин-2-ил)-4-метилпиридин-2-амин (пример получения 6)
[0191] Стадия 1: К раствору 4-хлорпиридин-2-амина (3 г, 23,2 ммоль) в ДМСО (60 мл) добавляли метоксид натрия (12,6 г, 232 ммоль), полученную смесь перемешивали при 150°C в течение 3 часов, затем выливали в воду со льдом. Продукт экстрагировали EtOAc (2×100 мл) и объединенные органические слои промывали водой (50 мл) и насыщенным раствором соли (50 мл), сушили (Na2SO4) и концентрировали. Остаток очищали хроматографией на силикагеле (система растворителей 50% петролейный эфир/EtOAc) с получением 4-метоксипиридин-2-амина (460 мг, 16%) в виде твердого вещества желтого цвета.
МС (ESI): вычислено для C6H8N2O [М+Н]+ 125, найдено 125.
[0192] Стадия 2: К раствору 4-метоксипиридин-2-амина (620 мг, 5 ммоль) и 2,6-дибром-4-метилпиридина (1123 мг, 5,25 ммоль) в диоксане (18 мл) добавляли дихлорид 1,1'-бис(ди-трет-бутилфосфино)ферроценпалладия (280 мг, 0,5 ммоль) и трет-бутоксид натрия (437 мг, 5,25 ммоль). Затем смесь перемешивали с микроволновым облучением в течение 1,5 часа при 80°С. Смесь выливали в воду (50 мл) и экстрагировали этилацетатом (100 мл). Органический слой промывали водой (50 мл) и насыщенным раствором соли (50 мл), сушили и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (система растворителей 75% петролейный эфир/EtOAc). Фракции, содержащие продукт, собирали и концентрировали с получением 6-бром-N-(4-метоксипиридин-2-ил)-4-метилпиридин-2-амина (627 мг, 50%).
МС (ESI): вычислено для C12H12BrN3O [M+H]+ 294, найдено 294.
[0193] Аналогично синтезировали представленное ниже соединение:
Пример получения 6A
[0194] 6-Бром-4-метил-N-(4-пропоксипиридин-2-ил)пиридин-2-амин.
МС (ESI): вычислено для C14H16BrN3O [M+H]+ 322, найдено 322.
Пример получения 7 - N-(2-бром-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-4-ил)ацетамид (пример получения 7)
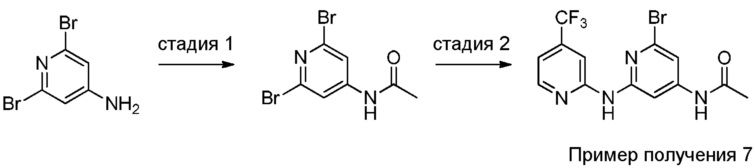
[0195] Стадия 1: К раствору 2,6-дибромпиридин-4-амина (1,0 г, 3,97 ммоль), ДМАП (0,048 г, 0,397 ммоль) и пиридина (0,482 мл, 5,95 ммоль) в ТГФ (7,94 мл) при комнатной температуре медленно добавляли уксусный ангидрид (0,412 мл, 4,37 ммоль), полученную смесь перемешивали при комнатной температуре в течение 16 часов, а затем реакционную смесь нагревали до 65°С и выдерживали при указанной температуре в течение 5 дней. После охлаждения до комнатной температуры, к смеси добавляли MeOH (5 мл) и реакционную смесь концентрировали при пониженном давлении. Полученный продукт очищали с помощью хроматографии на силикагеле (градиент: система растворителей 0-100% EtOAc/гексаны). Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении с получением N-(2,6-дибромпиридин-4-ил)ацетамида (1,10 г, 94%) в виде твердого вещества желтого цвета.
МС (ESI): вычислено для C7H6Br2N2O [M+H]+ 293, найдено 293.
[0196] Стадия 2: В пробирку для микроволновой обработки загружали мешалку, затем N-(2,6-дибромпиридин-4-ил)ацетамид (0,95 г, 3,23 ммоль), 2-амино-4-(трифторметил)пиридин (0,576 г, 3,56 ммоль), Pd(OAc)2 (0,073 г, 0,323 ммоль), Xantphos (0,281 г, 0,485 ммоль) и Cs2CO3 (2,106 г, 6,46 ммоль). В пробирке создавали вакуум и затем продували ее аргоном (3 раза), затем добавляли дегазированный диоксан (6,46 мл). Реакционную смесь герметизировали, нагревали до 100°С и выдерживали при указанной температуре в течение 3 часов, после чего охлаждали до комнатной температуры, разбавляли метанолом (10 мл) и концентрировали при пониженном давлении. Полученный продукт очищали с помощью хроматографии на силикагеле (градиент: система растворителей 0-100% EtOAc/гексаны). Фракции, содержащие продукт, собирали и концентрировали с получением N-(2-бром-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-4-ил)ацетамида (605 мг, 50%) в виде твердого белого вещества.
МС (ESI): вычислено для C13H10BrF3N4O [M+H]+ 375, найдено 375.
Пример получения 8 - 6-бром-N-(4-(1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил)пиридин-2-ил)-4-метилпиридин-2-амин (пример получения 8)
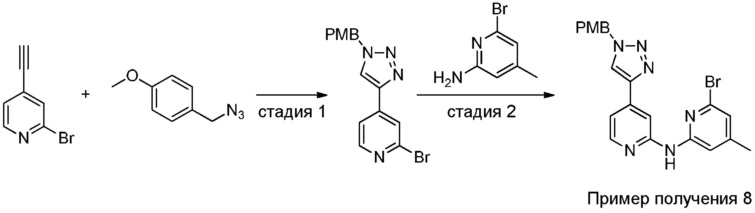
[0197] Стадия 1: В колбу, содержащую 2-бром-4-этинилпиридин (1 г, 5,49 ммоль), добавляли 4-метоксибензилазид (896 мг, 5,49 ммоль), CuSO4(H2O)5 (137 мг; 0,549 ммоль), аскорбат натрия (544 мг, 2,75 ммоль), воду (13,7 мл) и tBuOH (13,7 мл), и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Реакционную смесь разбавляли EtOAc (50 мл) и промывали насыщенным водным раствором NaHCO3 (1х20 мл) и насыщенным раствором соли (1×20 мл). Органическую фазу сушили (MgSO4), фильтровали и очищали с помощью хроматографии на силикагеле (градиент: система растворителей 30-70% EtOAc/гексаны). Продукт концентрировали с получением 2-бром-4-(1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил)пиридина (1,46 г, 77%) в виде белого порошка.
MC (ESI): вычислено для C15H13BrN4O [M+H]+ 345, найдено 345.
[0198] Стадия 2: В колбу загружали 2-бром-4-(1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил)пиридин (329 мг, 0,953 ммоль), 2-бром-4-метил-6-аминопиридин (178 мг, 0,953 ммоль), Pd(OAc)2 (21,4 мг, 0,095 ммоль), Xantphos (83 мг, 0,143 ммоль) и Cs2CO3 (621 мг, 1,91 ммол), и в колбе создавали вакуум и затем заполняли ее аргоном (3 раза). К реакционной смеси добавляли дегазированный 1,4-диоксан (3,8 мл), полученную реакционную смесь нагревали до 100°С и выдерживали при указанной температуре в течение 30 минут, после чего охлаждали и разбавляли EtOAc (20 мл). Реакционную смесь фильтровали, затем сушили и очищали хроматографией на силикагеле (градиент: система растворителей 30-60% EtOAc/гексаны). Фракции, содержащие продукт, концентрировали с получением 6-бром-N-(4-(1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил)пиридин-2-ил)-4-метилпиридин-2-амина (255 мг, 59%) в виде твердого вещества коричневого цвета.
МС (ESI): вычислено для C21H19BrN6O [M+H]+ 451, найдено 451.
Пример получения 9 - (R и S)-метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-1-карбоксилат (пример получения 9А и 9В)
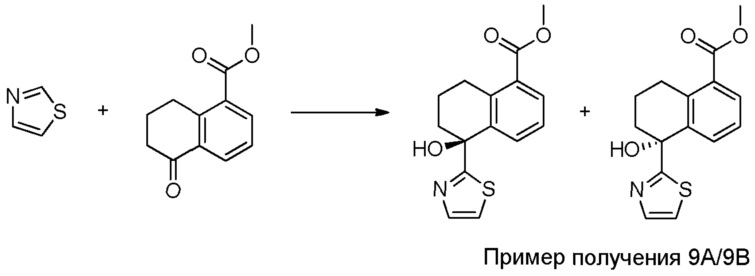
[0199] Высушенную в печи колбу продували N2, в колбу загружали комплекс хлорида изопропилмагния и хлорида лития (7,91 мл, 10,3 ммоль) и ТГФ (18,4 мл) и раствор охлаждали до 0°С. В колбу добавляли раствор тиазола (0,813 г, 9,55 ммоль) в ТГФ (9,18 мл), реакционную смесь перемешивали в течение 45 минут при 0°С и затем охлаждали до -10°С. Затем добавляли раствор метил-5-оксо-5,6,7,8-тетрагидронафталин-1-карбоновой кислоты (1,5 г, 7,34 ммоль) в ТГФ (9,18 мл), после чего реакционную смесь оставляли нагреваться до комнатной температуры в течение 4 часов. Добавляли MeOH (5 мл) и реакционную смесь распределяли между водой (50 мл) и EtOAc (50 мл). Водную фазу экстрагировали этилацетатом (2×50 мл), затем объединенные органические фазы сушили (MgSO4), фильтровали и концентрировали. Полученный продукт очищали с помощью хроматографии на силикагеле (градиент: система растворителей 0-70% EtOAc/ДХМ). Фракции, содержащие продукт, собирали и концентрировали с получением рацемического метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-1-карбоксилата в виде масла желтого цвета. Энантиомеры разделяли с помощью хиральной SFC (колонка Chiral Technology AY-H, 2,1×25 см, 5 мкМ; элюирование с: 20-50% MeOH+0,25% диметилэтиламин/CO2). При скорости истечения 70 мл/мин получали два энантиомера: при 2,38 мин и 2,79 мин.
[0200] Пример получения 9A: энантиомер более быстрого элюирования: 591 мг (28%).
МС (ESI): вычислено для C15H15NO3S [M+H]+ 290, найдено 290.
[0201] Пример получения 9B: энантиомер более медленного элюирования: 592 мг (28%).
МС (ESI): вычислено для C15H15NO3S [M+H]+ 290, найдено 290.
Пример получения 10 - метил-3-оксо-2,3-дигидро-1H-инден-5-карбоксилат (пример получения 10)
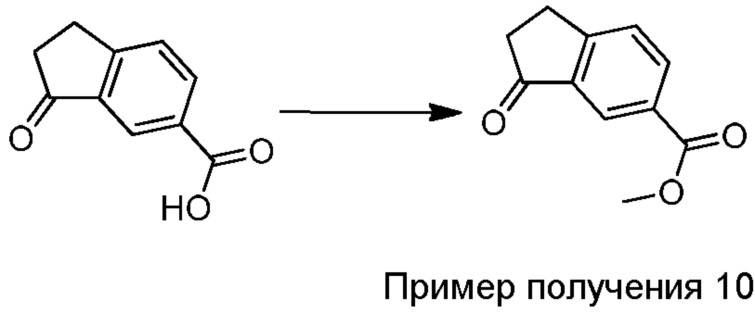
[0202] К раствору 3-оксо-2,3-дигидро-1H-инден-5-карбоновой кислоты (3 г, 17 ммоль) в ДХМ (50 мл) и MeOH (10 мл) по каплям добавляли TMSCHN2 (17 мл, 34 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали хроматографией на силикагеле (градиент: система растворителей петролейный эфир/EtOAc от 10:1 до 3:01) с получением метил-3-оксо-2,3-дигидро-1H-инден-5-карбоновой кислоты (2,0 г, 61%).
МС (ESI): вычислено для C11H10O3 [M+H]+ 191, найдено 191.
Пример получения 11 - метил-1-оксо-2,3-дигидро-1H-инден-4-карбоксилат (пример получения 11)
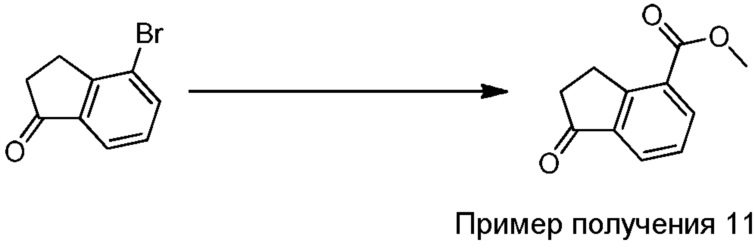
[0203] К раствору 4-бром-2,3-дигидро-1H-инден-1-она (5 г, 24 ммоль) в МеОН (120 мл) и Et3N (40 мл) добавляли Pd(PPh3)2Cl2 (200 мг) и смесь перемешивали в атмосфере СО при 2,5 МПа в течение 48 часов. Реакционный раствор концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле (петролейный эфир/EtOAc 2:1) с получением метил-1-оксо-2,3-дигидро-1H-инден-4-карбоксилата (2,9 г, 64%).
МС (ESI): вычислено для C11H10O3 [M+H]+ 191, найдено 191.
Пример получения 12 - метил-5-оксо-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-1-карбоксилат (пример получения 12A) и метил-9-оксо-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-2-карбоксилат (пример получения 12B)
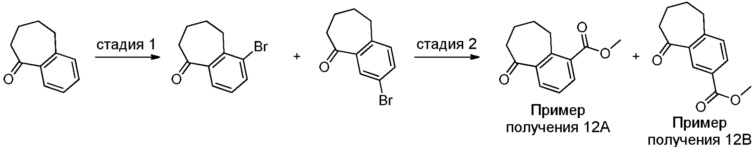
[0204] Стадия 1: 6,7,8,9-Тетрагидро-5Н-бензо[7]аннулен-5-он (8 г, 50 ммоль) по каплям добавляли в колбу, содержащую AlCl3 (16,6 г, 125 ммоль) в атмосфере N2, полученную смесь перемешивали при комнатной температуре в течение 30 минут, затем к смеси по каплям добавляли Br2 (3 мл, 60 ммоль), смесь нагревали до 80°С и выдерживали при указанной температуре в течение 5 минут. Смесь выливали в смесь конц. HCl (20 мл) и льда (200 г) и перемешивали в течение 10 минут. Затем полученную смесь экстрагировали МТВЕ и органический слой промывали насыщенным водным раствором NaHCO3 и насыщенным раствором соли, сушили, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле с получением 1-бром-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-5-она (6 г, сырой продукт) и 3-бром-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-5-она (4 г, сырой продукт), которые используют на следующей стадии без дополнительной очистки.
[0205] Стадия 2a: К раствору 1-бром-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-5-она (4 г, сырой продукт) в МеОН (30 мл) и Et3N (10 мл) добавляли Pd(PPh3)2Cl2 (400 мг), и полученную смесь перемешивали в СО (2 МПа) в течение 48 часов. Затем смесь концентрировали, и остаток очищали с помощью хроматографии на силикагеле с получением метил-5-оксо-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-1-карбоксилата (260 мг, 2,4%).
МС (ESI): вычислено [М+Н]+ 219, найдено 219.
[0206] Стадия 2b: К раствору 3-бром-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-5-она (6 г, сырой продукт) в МеОН (30 мл) и Et3N (10 мл) добавляли Pd(PPh3)2Cl2 (600 мг), и полученную смесь перемешивали в атмосфере СО (2 МПа) в течение 48 часов. Смесь концентрировали, и остаток очищали с помощью хроматографии на силикагеле с получением метил-9-оксо-6,7,8,9-тетрагидро-5Н-бензо[7]аннулен-2-карбоксилата (1,4 г, 13%).
МС (ESI): вычислено [М+Н]+ 219, найдено 219.
Пример получения 13 - 5-оксо-6,7,8,9-тетрагидро-5Н-бензоциклогептен-2-карбоновая кислота (пример получения 13)
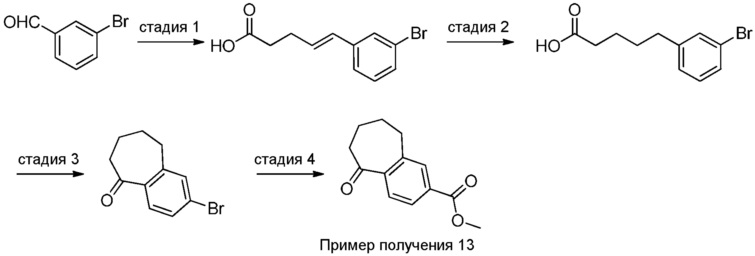
[0207] Стадия 1: К раствору бромида (3-карбоксипропил)трифенилфосфония (25 г, 58,3 ммоль) в ДМСО (53 мл) добавляли t-BuOK (12,4 г, 110,7 ммоль). Смесь перемешивали при комнатной температуре в течение 20 минут. Затем к смеси по каплям добавляли раствор 3-бромбензальдегида (9,3 г, 50,3 ммоль) в ДМСО (15 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Смесь выливали в воду и экстрагировали ДХМ. Органический слой сушили над безводным сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Сырой продукт очищают с помощью хроматографии на силикагеле (система растворителей петролейный эфир/EtOAc 5:1) с получением 5-(3-бромфенил)пент-4-еновой кислоты (4,8 г, 38%).
1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,45 (с, 1H), 7,2-7,25 (м, 1H), 7,1-7,15 (м, 2H), 6,4-6,45 (м, 1H), 6,23-6,3 (м, 1H), 2,4-2,6 (м, 4H).
[0208] Стадия 2: К раствору 5-(3-бромфенил)пент-4-еновой кислоты (4 г, 16 ммоль) в EtOAc (150 мл) добавляли Pd/C (400 мг) и 40% раствор HBr в уксусной кислоте (0,5 мл). Смесь перемешивали при комнатной температуре в атмосфере водорода (1 атм = 101,3 кПа) в течение 1 часа. Реакционную смесь фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали с помощью хроматографии на силикагеле (система растворителей петролейный эфир/EtOAc 5:1) с получением 5-(3-бром-фенил)пентановой кислоты (3,2 г, 80%).
1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,3-7,4 (м, 2H), 7,05-7,15 (м, 2H), 2,55 (с, 2H), 2,35 (с, 2H), 1,7 (м, 4H).
[0209] Стадия 3: К раствору 5-(3-бромфенил)пентановой кислоты (6 г, 23 ммоль) в хлорбензоле (300 мл) добавляли РРА (18 г), и полученную смесь кипятили с обратным холодильником в течение 8 часов. Смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали при пониженном давлении, затем очищали с помощью хроматографии на силикагеле (система растворителей петролейный эфир/EtOAc 10:1) с получением 2-бром-6,7,8,9-тетрагидробензоциклогептен-5-она (2,4 г, 42,9%).
МС (ESI): вычислено для C11H11BrO [М+Н]+ 239, найдено 239.
[0210] Стадия 4: К раствору 2-бром-6,7,8,9-тетрагидробензоциклогептен-5-она (2,5 г, 10,5 ммоль) в MeOH (30 мл) и Et3N (10 мл) добавляли Pd(PPh3)2Cl2 (250 мг), и смесь перемешивали в атмосфере СО (2 МПа) в течение 48 часов. Затем смесь концентрировали, и остаток очищали с помощью хроматографии на силикагеле (система растворителей петролейный эфир/EtOAc 10:1) с получением метилового эфира 5-оксо-6,7,8,9-тетрагидро-5Н-бензоциклогептен-2-карбоновой кислоты (1,7 г, 74%).
МС (ESI): вычислено для C13H14O3 [M+H]+ 219, найдено 219.
1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,9-7,94 (м, 1H), 7,85 (д, J=8, 1H), 7,7 (с, 1H), 3,96 (с, 3H), 3,0 (м, 2H), 2,8 (м, 2H), 1,91-1,96 (м, 2H), 1,85-1,9 (м, 2H).
Пример получения 14 - 1-бром-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилат (пример получения 14)
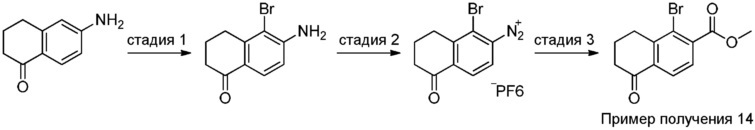
[0211] Стадия 1: В колбу загружали 6-амино-3,4-дигидро-1(2Н)-нафталинон (5,30 г; 32,9 ммоль) и ДХМ (329 мл) и полученную смесь охлаждали до 0°С. К смеси порциями в течение 1 часа добавляли N-бромсукцинимид (5,85 г, 32,9 ммоль). Затем смесь перемешивали при 0°С в течение 3 часов. Реакционную смесь гасили водным раствором бикарбоната натрия (100 мл) и затем экстрагировали ДХМ (3×100 мл). Объединенные органические фракции сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Полученный продукт очищали с помощью хроматографии на силикагеле (градиент: система растворителей 0-65% EtOAc/гексаны). Фракции, содержащие продукт, концентрировали с получением 6-амино-5-бром-3,4-дигидронафталин-1(2Н)-она (7,8 г, 87%) в виде твердого вещества светло-коричневого цвета.
МС (ESI): вычислено для C10H10BrNO 240 [M+H]+, найдено 240.
[0212] Стадия 2: К раствору 6-амино-5-бром-3,4-дигидронафталин-1(2Н)-она (7,8 г, 28,6 ммоль) в воде (20 мл) и тетрафторборной кислоте (78 мл, 429 ммоль) при 0°С медленно добавляли раствор нитрита натрия (4,93 г, 71,5 ммоль) в воде (5 мл). Затем смесь оставляли нагреваться до комнатной температуры в течение 30 минут. Смесь фильтровали, затем добавляли гексафторфосфорную кислоту (32,1 мл, 143 ммоль), и образующийся в результате осадок собирали фильтрованием с получением гексафторфосфата 1-бром-5-оксо-5,6,7,8-тетрагидронафталин-2-диазония(V) (3,22 г, 28%) в виде твердого вещества коричневого цвета.
МС (ESI): вычислено для C10H8BrN2O +251 [M]+, найдено 251.
[0213] Стадия 3: Через смесь гексафторфосфата 1-бром-5-оксо-5,6,7,8-тетрагидронафталин-2-диазония(V) (3,0 г, 6,80 ммоль) и ацетата палладия (0,076 г, 0,340 ммоль) в МеОН (30 мл, 742 ммоль) при комнатной температуре в течение часа барботировали оксид углерода, после чего реакционную смесь разбавляли ДХМ (50 мл), фильтровали и концентрировали при пониженном давлении. Вещество очищали с помощью хроматографии на силикагеле (градиент: система растворителей 0-65% EtOAc/гексаны). Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении с получением метил-1-бром-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата (243 мг, 13%) в виде твердого вещества оранжевого цвета.
МС (ESI): вычислено для C12H11BrO3 [M+H]+ 283, найдено 283.
Пример получения 15 - альтернативный способ получения (рац.)-метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (рацемическая смесь примеров получения 4А и 4В)
Реактор проточного типа
[0214] Раствор н-бутиллития (2,3 М в гексанах) нагнетается (двухтактный шприц-насос) через тройник (1/8" (3,175 мм)) с манометром и патрубком диаметром 1/8" (3,175 мм) длиной 2 фута (0,61 м) из нержавеющей стали (для предварительного охлаждения). Указанный патрубок соединен с Т-образным смесителем диаметром 1/4 дюйма (6,35 мм). Тиазол (0,5 М раствор в ТГФ) закачивается с помощью насоса (головка 100 мкл) (Fluid Metering, Inc. Syosset, New York USA) в патрубок длиной 2 фута (0,61 м) диаметром 1/8" (3,175 мм) из нержавеющей стали (для предварительного охлаждения), соединенный с тем же Т-образным смесителем. Т-образный смеситель присоединен к статическому смесителю 1/4-34 (5,3 мл) (Koflo Corporation, Cary, Illinois USA), соединенному с коленчатым патрубком (1/4" (6,35 мм)) и патрубком из нержавеющей стали (диаметр 1/4" (6,35 мм), длина 6 дюймов (0,1524 м)) (3,3 мл). Указанный патрубок длиной 6 дюймов (0,1524 м) соединен с другим Т-образным смесителем (диаметр 1/4" (6,35 мм)), который соединен также с линией подачи метил-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата и BF3 (0,5 М в ТГФ, подается с помощью насоса FMI, головка 100 мкл) и со вторым статическим смесителем Koflo 1/4-34 (5,3 мл) и далее с замкнутым контуром (1/4" (6,25 мм), длина 2,5 фута (0,762 м), 16,8 мл). Общий объем реактора составляет 30,7 мл, реактор помещен в охлаждающую баню при -45°С (±5°С, сухой лед/ацетон). Исходящий поток соединен с Т-образным смесителем (1/8" (3,175 мм)) (вне охлаждающей бани), в который подается метанол (FMI насос, головка 100 мкл) для гашения in situ, и, наконец, продукт собирается в экстракторе, содержащем MTBE и водную фосфорную кислоту (1,5 м). Блок-схема установки представлена на фиг.1.
Описание процесса и спецификация
[0215] Используемый способ является способом, включающим несколько стадий, в которых предварительно получали тиазоловый анион, который затем гасили смесью сложный кетоэфир/BF3. Продукт реакции гасили in situ метанолом.
-45°С (±5°С), τ1=0,13 мин (8 сек), τ2=0,17 мин (10 сек) (τобщ.=0,3 мин (18 сек)).
метил-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилат - 0,5 М/ТГФ, 38,50 мл/мин, содержит 1,1 экв. BF3-Et2O
тиазол - 0,5 М/ТГФ, 57,75 мл/мин (1,5 экв.)
BuLi - 2,3 M/гексаны, 8,75 мл/мин (1,05 экв.)
метанол = 7,80 мл/мин (10 экв.)
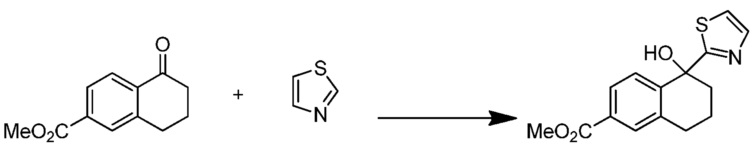
[0216] Реактор помещали на охлаждающую баню при -45°С (±5°С, сухой лед/ацетон) и включали все четыре насоса (со скоростью потока, указанной выше). Установившийся режим достигался в течение 1 минуты. Температуру охлаждающей бани поддерживали на уровне -45°С±5°С в течение всего цикла, добавляя некоторое количество сухого льда по мере необходимости. Исходящий поток собирали в перемешиваемой двухфазной смеси MTBE (4 л) и водного раствора фосфорной кислоты (1,5 М, 2,5 л). Работа насосов продолжалась в течение 2,1 часа (4,9 л раствора метил-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата, 0,5 кг, 2,45 моль). В конце работы реактор промывали тетрагидрофураном и гексаном (через линию подачи н-BuLi) в течение нескольких минут.
[0217] Слои двухфазной смеси разделяли, и органический слой промывали водой (2×4 л). Объединенные водные слои экстрагировали МТВЕ (2 л), затем объединенные органические слои концентрировали при пониженном давлении. Растворитель меняли на 2-пропанол, в процессе чего продукт кристаллизовался с получением белой суспензии. Объем суспензии доводили до примерно 3 л/кг (конечный объем 2-пропанола 1,8 л). Затем медленно, в течение часа, при комнатной температуре добавляли воду (4,2 л, конечное соотношение вода/2-пропанол 70/30, 10 л/кг). Суспензию выдерживали в течение 18 часов, а затем фильтровали, промывая смесью вода/2-пропанол (70/30, 1 л). Смесь фильтровали на вакуумной воронке, и спустя 1 час влажный осадок сушили в вакуумном сушильном шкафу в токе азота при 50°С в течение 48 часов, получая 626 г продукта в виде твердого не совсем белого вещества.
Пример 1 - аммониевая соль (R)-5-(5-(6-[(4-трет-бутоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (1)
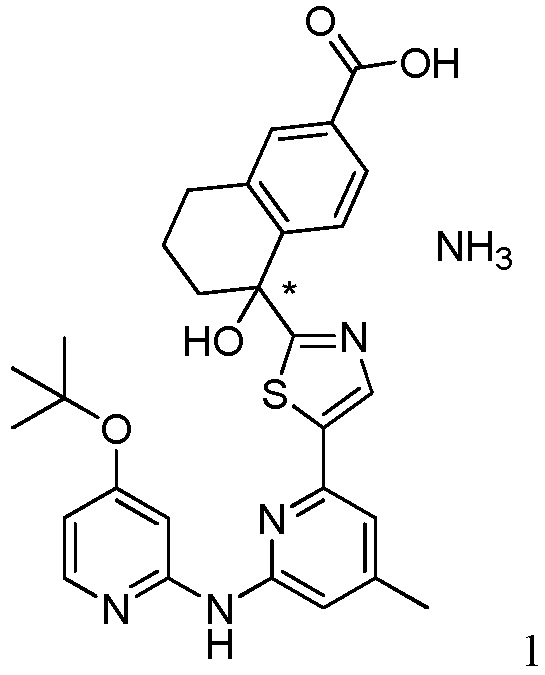
[0218] В сухую пробирку загружали магнитную мешалку, 2-бром-4-трет-бутоксипиридин (101,2 мг, 0,405 ммоль), трис(дибензилиденацетон)палладий(0) (18,52 мг, 0,020 ммоль), (9,9-диметил-9Н-ксантен-4,5-диил)бис(дифенилфосфин) (29,3 мг, 0,051 ммоль) и карбонат калия (84 мг, 0,607 ммоль). Пробирку герметизировали, вакуумировали и заполняли аргоном. (R)-Метил-5-[5-(6-амино-4-метилпиридин-2-ил)-1,3-тиазол-2-ил]-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоксилат (80 мг, 0,202 ммоль) переносили в полностью дегазированный диоксан (1011 мкл) в атмосфере аргона и затем добавляли к реакционной смеси, полученную смесь герметично закрывали и перемешивали при 100°С в течение ночи. Пробирку охлаждали до комнатной температуры, добавляли гидроксид калия (40% в воде, 567 мкл, 4,05 ммоль), и реакционную смесь оставляли перемешиваться в течение 4 часов. Реакционную смесь разбавляли ДМСО (1 мл), фильтровали через барьерный фильтр и очищали с помощью ВЭЖХ с обращенной фазой (колонка C18, вода-ацетонитрил, гидроксид аммония - модификатор) с получением аммониевой соли (R)-5-(5-{6-[(4-трет-бутоксипиридин-2-ил)амино]-4-метилпиридин-2-ил}-1,3-тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (47,4 мг, 0,087 ммоль, 43% выход) в виде твердого белого вещества.
МС (ESI): вычислено для C29H30N4O4S [M+H]+ 531, найдено 531.
1H-ЯМР (600 МГц, ДМСО) δ 9,46 (с, 1H), 8,15 (с, 1H), 8,04 (д, J=5,6 Гц, 1H), 7,59 (с, 1H), 7,55 (с, 1H), 7,50-7,47 (м, 1H), 7,34 (с, 1H), 7,19 (с, 1H), 7,06-7,01 (м, 1H), 6,50-6,44 (м, 1H), 2,80-2,74 (м, 2H), 2,36-2,30 (м, 1H), 2,25 (с, 3H), 2,07-2,01 (м, 1H), 1,96-1,88 (м, 2H), 1,43 (с, 9H) м.д.
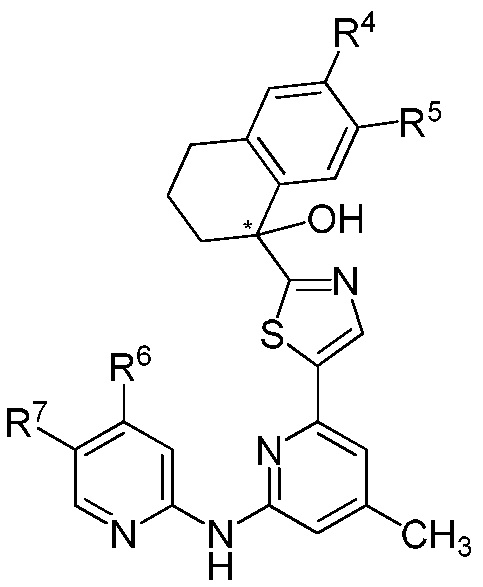
|
|
|
|
|
|
|
Пример 2 - (R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота (2)
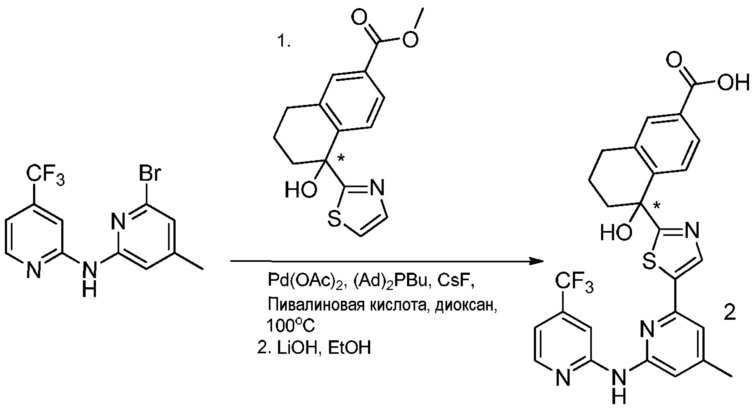
[0219] Стадия 1: Суспензию бутилди-1-адамантилфосфина (5,95 г, 16,59 ммоль) и Pd(OAc)2 (1,862 г, 8,29 ммоль) в 1,4-диоксане (100 мл) перемешивали в атмосфере азота в течение 10 минут, получая суспензию желтого цвета. Затем добавляли 6-бром-4-метил-N-(4-(трифторметил)пиридин-2-ил)пиридин-2-амин (17,39 г, 52,4 ммоль), (R)-метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилат (энантиомер 2, 12 г, 41,5 ммоль), фторид цезия (18,90 г, 124 ммоль), триметилуксусную кислоту (7,22 мл, 62,2 ммоль) и 1,4-диоксан (50 мл). В емкости создавали вакуум и продували ее азотом (3 раза), после чего смесь кипятили с обратным холодильником в атмосфере азота в течение 20 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали через Celite®, промывая этилацетатом. Органический фильтрат последовательно промывали водой и насыщенным раствором соли, сушили (Na2SO4) и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюирование: 40% этилацетат в гексанах) с получением (R)-метил-5-гидрокси-5-(5-(4-метил-6-(4-(трифторметил)пиридин-2-иламино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата в виде твердого вещества бледно-желтого цвета (18 г, выход 80%).
МС (ESI): вычислено для C27H23F3N4O3S [M+H]+ 541, найдено 541.
1H-ЯМР (500 МГц, ДМСО) δ 10,20 (с, 1H), 8,63 (с, 1H), 8,48 (д, J=5,0 Гц, 1H), 8,23 (с, 1H), 7,74 (с, 1H), 7,69 (д, J=8,2 Гц, 1H), 7,36 (с, 1H), 7,23-7,17 (м, 2H), 7,09 (с, 1H), 6,63 (с, 1H), 3,82 (с, 3H), 2,92-2,85 (м, 2H), 2,33-2,30 (м, 4H), 2,15-2,09 (м, 1H), 2,02-1,88 (м, 2H) м.д.
[0220] Стадия 2: К суспензии (R)-метил-5-гидрокси-5-(5-(4-метил-6-(4-(трифторметил)пиридин-2-иламино)пиридин-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (12,8 г, 23,68 ммоль) в EtOH (192 мл) добавляли 1 н. водный раствор LiOH (83 мл, 83 ммоль). Белую суспензию нагревали до 45°С и выдерживали при указанной температуре в течение 4 часов, в процессе чего реакционная смесь приобретала ярко-желтую окраску. Реакционную смесь охлаждали до комнатной температуры и подкисляли водной HCl до рН 4, наблюдая выпадение продукта в осадок. Осадок собирали фильтрованием с получением (R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты в виде твердого не совсем белого вещества (11,5 г, выход 92%).
МС (ESI): вычислено для C26H21F3N4O3S [M+H]+ 527, найдено 527.
1H-ЯМР (500 МГц, ДМСО) δ 12,85 (с, 1H), 10,20 (с, 1H), 8,64 (с, 1H), 8,48 (д, J=5,1 Гц, 1H), 8,23 (с, 1H), 7,72 (с, 1H), 7,66 (д, J=8,1 Гц, 1H), 7,38-7,31 (м, 2H), 7,21 (д, J=4,9 Гц, 1H), 7,10 (с, 1H), 6,60 (с, 1H), 2,92-2,82 (м, 2H), 2,40-2,33 (м, 1H), 2,30 (с, 3H), 2,15-2,08 (м, 1H), 2,03-1,88 (м, 2H) м.д.
Пример 3 - (рац.) трифторуксусная соль метил-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилата
Стадия 1:
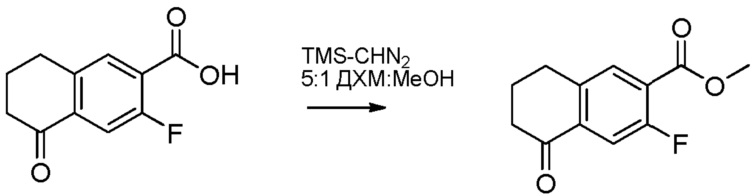
Стадия 2:
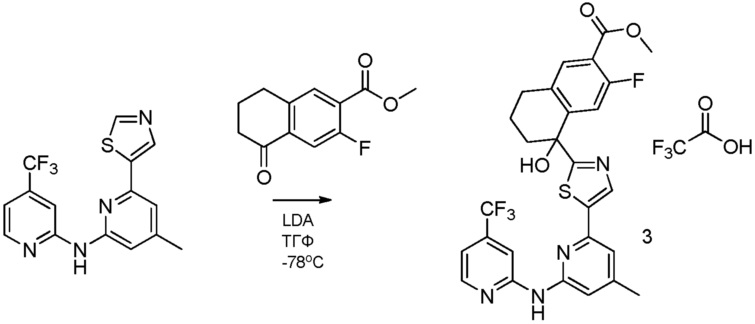
[0221] Стадия 1: 3-Фтор-5-оксо-6,7,8-тригидронафталин-2-карбоновую кислоту (1,10 г, 5,28 ммоль) растворяли в метаноле (3,52 мл) и дихлорметане (17,61 мл) при комнатной температуре. К раствору медленно добавляли триметилсилилдиазометан (2,0 М в простом диэтиловом эфире, 7,93 мл, 15,85 ммоль) до тех пор, пока раствор не приобретал стабильную желтую окраску. Растворитель удаляли в вакууме с получением метил-3-фтор-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата (1,13 г, 5,09 ммоль, выход 96%) в виде твердого вещества рыжевато-коричневого цвета.
МС (ESI): вычислено для C2H11FO3 [M+H]+ 223, найдено 223.
Полученный продукт использовали на стадии 2 без дополнительной очистки.
[0222] Стадия 2: К раствору 4-метил-6-(1,3-тиазол-5-ил)-N-[4-(трифторметил)пиридин-2-ил]пиридин-2-амина (600 мг, 1,78 ммоль) в ТГФ (5,9 мл) в атмосфере аргона при -78°С медленно добавляли диизопропиламид лития (2,0 М в ТГФ, 2,68 мл, 5,35 ммоль) и полученную смесь перемешивали при указанной температуре в течение 30 минут. К смеси добавляли раствор метил-3-фтор-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата (496 мг, 2,230 ммоль) в ТГФ (2 мл) и реакционную смесь оставляли нагреваться до комнатной температуры в течение 2 часов. По истечении дополнительных 12 часов реакционную смесь гасили метанолом (10 мл) и концентрировали при пониженном давлении. Очистка ВЭЖХ с обращенной фазой (колонка C18; элюирование: вода-ацетонитрил, TFA модификатор) приводила к получению (рац.) трифторацетата метил-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилата (355,1 мг, 0,528 ммоль, 30% выход) в виде твердого вещества желтого цвета.
МС (ESI): вычислено для C27H22F4N4O3S [M+H]+ 559, найдено 559.
1H-ЯМР (500 МГц, ДМСО) δ 10,22 (с, 1H), 8,65 (с, 1H), 8,48 (д, J=5,2 Гц, 1H), 8,26 (с, 1H), 7,69 (д, J=7,4 Гц, 1H), 7,37 (с, 1H), 7,21 (д, J=5,2 Гц, 1H), 7,14-7,06 (м, 2H), 3,82 (с, 3H), 2,89-2,77 (м, 2H), 2,41-2,32 (м, 1H), 2,30 (с, 3H), 2,13-2,06 (м, 1H), 2,00-1,85 (м, 2H) м.д.
Пример 4 - (5R)- и (5S)-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновая кислота (4, 4А и 4В)
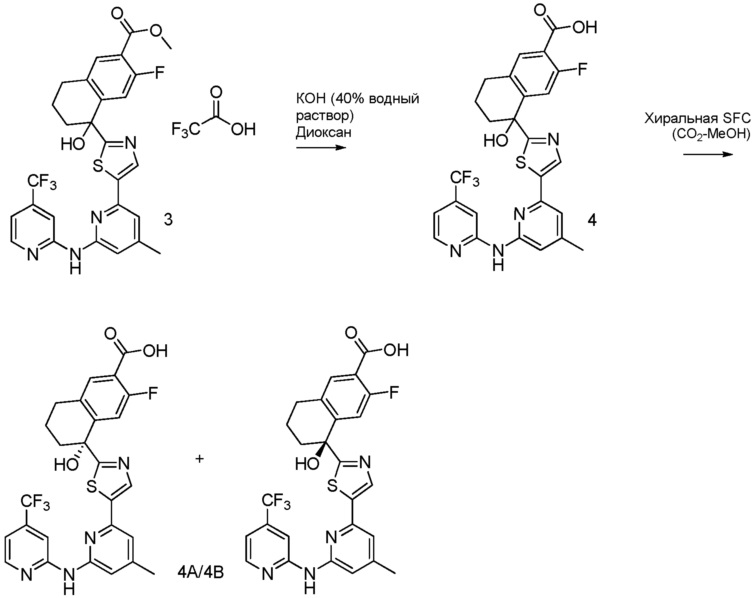
[0223] Стадия 1: К раствору трифторацетатной соли метил-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-диазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилата (200 мг, 0,297 ммоль) в тетрагидрофуране (1,2 мл) в атмосфере аргона добавляли гидроксид калия (40% водный раствор, 834 мкл, 5,95 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Значение рН доводили до 5 с помощью водного раствора HCl (2,0 М). Полученную смесь экстрагировали этилацетатом (3 раза), и объединенные органические фазы сушили (Na2SO4) и концентрировали при пониженном давлении с получением (рац.)-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (115,0 мг, 0,211 ммоль, выход 71%) в виде твердого вещества светло-желтого цвета.
МС (ESI): C26H20F4N4O3S [М+Н]+ вычислено: 545, найдено 545.
[0224] Стадия 2: 3-Фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (100 мг, 0,184 ммоль) очищали с помощью хиральной сверхкритической флюидной хроматографии (AD-H колонка; элюирование: CO2-метанол) с получением двух продуктов: (5R)- и (5S)-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты - оба продукта в виде твердого белого вещества.
[0225] Изомер 4А (изомер первого элюирования): (38,1 мг, 0,070 ммоль, выход 38%).
МС (ESI): вычислено для C26H20F4N4O3S [М+Н]+ 545, найдено 545.
1H-ЯМР (600 МГц, ДМСО) δ 10,19 (с, 1H), 8,63 (с, 1H), 8,46 (д, J=5,1 Гц, 1H), 8,23 (с, 1H), 7,62 (д, J=7,3 Гц, 1H), 7,35 (с, 1H), 7,19 (д, J=4,6 Гц, 1H), 7,07 (с, 1H), 7,03 (д, J=11,8 Гц, 1H), 6,71 (с, 1H), 2,85-2,73 (м, 2H), 2,37-2,31 (м, 1H), 2,28 (с, 3H), 2,10-2,03 (м, 1H), 1,98-1,83 (м, 2H) м.д.
[0226] Изомер 4В (38,9 мг, 0,071 ммоль, выход 39%).
МС (ESI): C26H20F4N4O3S вычислено [М+Н]+ 545, найдено 545.
1H-ЯМР (600 МГц, ДМСО) δ 10,19 (с, 1H), 8,63 (с, 1H), 8,46 (д, J=5,1 Гц, 1H), 8,23 (с, 1H), 7,62 (д, J=7,3 Гц, 1H), 7,35 (с, 1H), 7,19 (д, J=5,0 Гц, 1H), 7,07 (с, 1H), 7,03 (д, J=11,8 Гц, 1H), 6,71 (с, 1H), 2,84-2,74 (м, 2H), 2,38-2,31 (м, 1H), 2,28 (с, 3H), 2,11-2,04 (м, 1H), 1,98-1,85 (м, 2H) м.д.
Пример 5 - (рац.) трифторацетатная соль 7-фтор-6-(гидроксиметил)-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-1,2,3,4-тетрагидронафталин-1-ола (5)
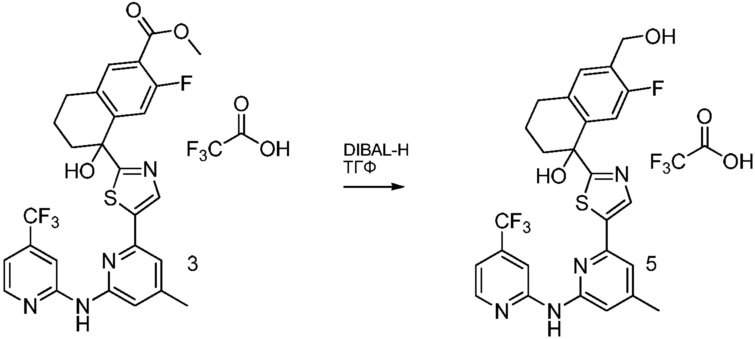
[0227] К раствору трифторацетатной соли метил-3-фтор-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилата (50 мг, 0,074 ммоль) в ТГФ (1,5 мл) в атмосфере аргона при комнатной температуре по каплям добавляли гидрид диизобутилалюминия (1,0 М в ТГФ, 223 мкл, 0,223 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакцию гасили метанолом (1,5 мл) и трифторуксусной кислотой (0,5 мл) и затем разбавляли ДМСО (1 мл). Полученную смесь фильтровали через барьерный фильтр и очищали ВЭЖХ с обращенной фазой (колонка C18; элюирование: вода-ацетонитрил, TFA модификатор) с получением трифторацетатной соли (рац.)-7-фтор-6-(гидроксиметил)-1-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-1,2,3,4-тетрагидронафталин-1-ола (6,0 мг, 0,00931 ммоль, 13% выход) в виде твердого вещества желтого цвета вещества.
МС (ESI): вычислено для C26H22F4N4O2S [M+H]+ 531, найдено 531.
1H-ЯМР (500 МГц, ДМСО) δ 10,21 (с, 1H), 8,65 (с, 1H), 8,48 (д, J=5,1 Гц, 1H), 8,23 (с, 1H), 7,36 (с, 1H), 7,24-7,19 (м, 2H), 7,09 (с, 1H), 6,89 (д, J=11,3 Гц, 1H), 4,47 (д, J=0,6 Гц, 2H), 2,83-2,73 (м, 2H), 2,40-2,33 (м, 1H), 2,30 (с, 3H), 2,11-2,04 (м, 1H), 2,02-1,86 (м, 2H).
Пример 6 - (рац.) метил-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилат (6)
Стадия 1:
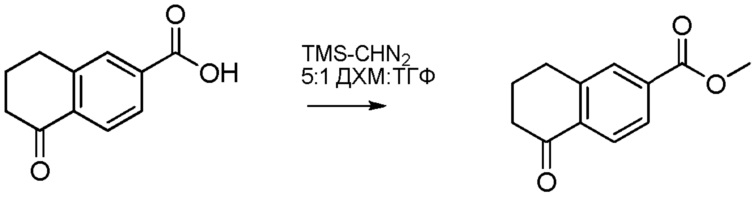
Стадия 2:
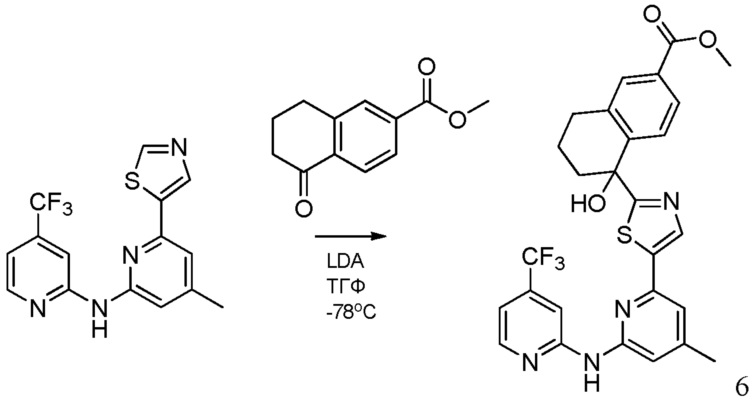
[0228] Стадия 1: К раствору 5-оксо-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (10,0 г, 52,6 ммоль) в ТГФ (52,6 мл) и MeOH (10,64 мл, 263 ммоль) при комнатной температуре по каплям добавляли триметилсилилдиазометан (2,0 М в диэтиловом эфире, 79 мл, 158 ммоль) до приобретения раствором желтой окраски и прекращения выделения газа. После этого реакционную смесь концентрировали при пониженном давлении с получением метил-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата (10,72 г, 52,5 ммоль, 100% выход) в виде твердого вещества коричневого цвета.
МС (ESI): вычислено для C12H12O3 [M+H]+ 205, найдено 205.
1H-ЯМР (500 МГц, ДМСО) δ 7,94 (д, J=8,1 Гц, 1H), 7,91 (с, 1H), 7,85 (дд, J=8,1, 1,6 Гц, 1H), 3,86 (с, 3H), 2,99 (т, J=6,0 Гц, 2H), 2,66-2,61 (м, 2H), 2,09-2,00 (м, 2H).
[0229] Стадия 2: К раствору 4-метил-6-(1,3-тиазол-5-ил)-N-[4-(трифторметил)пиридин-2-ил]пиридин-2-амина (500 мг, 1,487 ммоль) в ТГФ (5,9 мл) в атмосфере аргона при -78°С добавляли диизопропиламид лития (2,0 М в тетрагидрофуране, 2,2 мл, 4,46 ммоль), и полученную смесь перемешивали в течение 30 минут. К смеси добавляли раствор метил-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (379 мг, 1,858 ммоль) в ТГФ (2 мл), и реакционную смесь оставляли нагреваться до комнатной температуры в течение 2 часов. Реакционную смесь перемешивания в течение дополнительных 14 часов, затем гасили метанолом (10 мл) и концентрировали. Остаток очищали хроматографией на силикагеле (дихлорметан-метанол) с получением (рац.)-метил-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты в виде твердого вещества светло-коричневого цвета (718,0 мг, 1,328 ммоль, выход 89%).
МС (ESI): вычислено для C27H23F3N4O3S [M+H]+ 541, найдено 541.
1H-ЯМР (500 МГц, ДМСО) δ 10,20 (с, 1H), 8,63 (с, 1H), 8,48 (д, J=5,0 Гц, 1H), 8,23 (с, 1H), 7,74 (с, 1H), 7,69 (д, J=8,2 Гц, 1H), 7,36 (с, 1H), 7,23-7,17 (м, 2H), 7,09 (с, 1H), 6,63 (с, 1H), 3,82 (с, 3H), 2,92-2,85 (м, 2H), 2,33-2,30 (м, 4H), 2,15-2,09 (м, 1H), 2,02-1,88 (м, 2H) м.д.
Пример 7 - (рац.) трифторацетатная соль 5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты
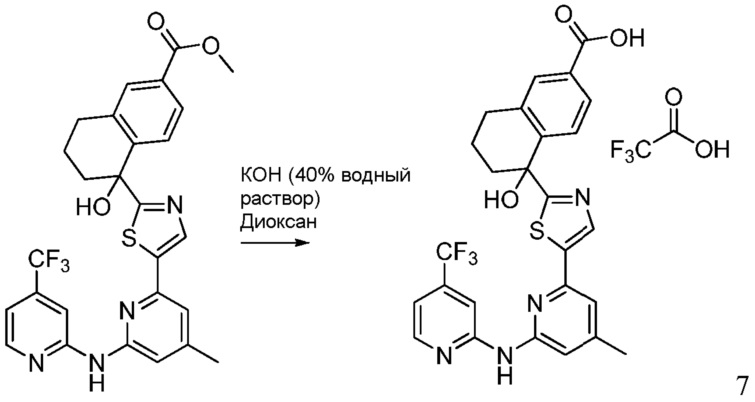
[0230] К раствору (рац.) метил-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксилата (250 мг, 0,462 ммоль) в ТГФ (1,9 мл) добавляли гидроксид калия (40% водный раствор, 1,3 мл, 9,25 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение трех дней. Реакционную смесь разбавляли метанолом (2 мл) и ДМСО (2 мл), фильтровали через барьерный фильтр и очищали с помощью ВЭЖХ с обращенной фазой (колонка С18; элюирование: вода-ацетонитрил, TFA модификатор) с получением рац. трифторацетатной соли 5-гидрокси--5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты в виде твердого вещества светло-коричневого цвета (133,8 мг, 0,209 ммоль, выход 45%).
МС (ESI): вычислено для C26H21F3N4O3S [M+H]+ 527, найдено 527.
1H-ЯМР (500 МГц, ДМСО) δ 10,21 (с, 1H), 8,63 (с, 1H), 8,48 (д, J=5,1 Гц, 1H), 8,23 (с, 1H), 7,72 (с, 1H), 7,66 (д, J=8,0 Гц, 1H), 7,36 (с, 1H), 7,33 (д, J=8,2 Гц, 1H), 7,21 (д, J=5,1 Гц, 1H), 7,10 (с, 1H), 2,92-2,83 (м, 2H), 2,41-2,33 (м, 1H), 2,31 (с, 3H), 2,16-2,07 (м, 1H), 2,04-1,90 (м, 2H) м.д.
Пример 8 - выделение трифторацетатной соли (5S)- и (5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (8 и 2)
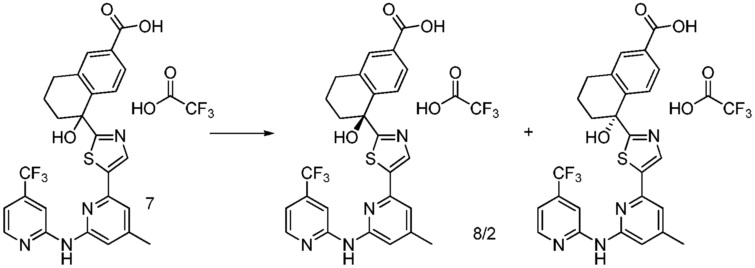
[0231] (рац.) Трифторацетатную соль 5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (70 мг, 0,109 ммоль) очищали с помощью хиральной сверхкритической флюидной хроматографии (колонка AD-H; элюирование: CO2-этанол) с получением трифторацетатных солей (5S)- и (5R)-5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновых кислот, оба продукта в виде твердого белого вещества.
Изомер 8 (энантиомер первого элюирования) (33,2 мг, 0,052 ммоль, выход 47%).
МС (ESI): вычислено для C26H21F3N4O3S [M+H]+ 527, найдено 527.
1H-ЯМР (500 МГц, ДМСО) δ 10,20 (с, 1H), 8,64 (с, 1H), 8,48 (с, 1H), 8,23 (с, 1H), 7,69 (с, 1H), 7,65 (д, J=8,2 Гц, 1H), 7,35 (с, 1H), 7,32 (д, J=8,1 Гц, 1H), 7,20 (с, 1H), 7,10 (с, 1H), 6,59 (с, 1H), 2,90-2,83 (м, 2H), 2,41-2,33 (м, 1H), 2,30 (с, 3H), 2,15-2,07 (м, 1H), 2,04-1,89 (м, 2H) м.д.
[0232] Изомер, который является тем же соединением, что и соединение, полученное в примере 2 (энантиомер второго элюирования) (34,1 мг, 0,053 ммоль, выход 49%).
МС (ESI): вычислено для C26H21F3N4O3S [M+H]+ 527, найдено 527.
1H-ЯМР (500 МГц, ДМСО) δ 10,20 (с, 1H), 8,64 (с, 1H), 8,48 (с, 1H), 8,23 (с, 1H), 7,71 (с, 1H), 7,65 (д, J=8,2 Гц, 1H), 7,35 (с, 1H), 7,32 (д, J=8,2 Гц, 1H), 7,21 (с, 1H), 7,10 (с, 1H), 6,59 (с, 1H), 2,90-2,83 (м, 2H), 2,40-2,33 (м, 1H), 2,30 (с, 3H), 2,15-2,08 (м, 1H), 2,04-1,89 (м, 2H) м.д.
Данный изомер идентифицирован как R-энантиомер.
Пример 9 - (рац.) трифторацетатная соль 5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксамида (9)
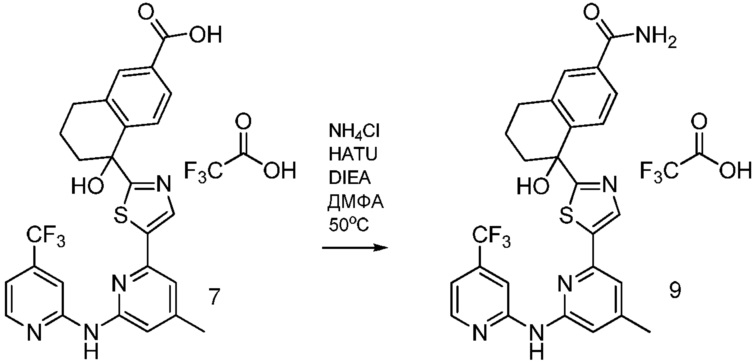
[0233] К раствору (рац.) трифторацетатной соли 5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (50 мг, 0,078 ммоль), хлорида аммония (62,6 мг, 1,171 ммоль) и O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония (44,5 мг, 0,117 ммоль) в ДМФА (781 мкл) добавляли диизопропилэтиламин (40,9 мкл, 0,234 ммоль), реакционную смесь нагревали до 50°С и выдерживали при указанной температуре в течение 16 часов. Затем реакционную смесь разбавляли ДМСО (1 мл), фильтровали через барьерный фильтр и очищали с помощью ВЭЖХ с обращенной фазой (колонка C18; элюирование: вода-ацетонитрил, TFA модификатор) с получением (рац.) трифторацетатной соли 5-гидрокси-5-[5-(4-метил-6-{[4-(трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталин-2-карбоксамида (27,4 мг, 0,043 ммоль, 43% выход) в виде твердого вещества желтого цвета.
МС (ESI): вычислено для C26H22F3N5O2S [M+H]+ 526, найдено 526.
1H-ЯМР (500 МГц, ДМСО) δ 10,21 (с, 1H), 8,64 (с, 1H), 8,48 (с, 1H), 8,22 (с, 1H), 7,88 (с, 1H), 7,64 (с, 1H), 7,57 (с, 1H), 7,35 (с, 1H), 7,28 (с, 1H), 7,25 (д, J=8,2 Гц, 1H), 7,21 (д, J=4,5 Гц, 1H), 7,11 (с, 1H), 2,89-2,80 (м, 2H), 2,39-2,32 (м, 1H), 2,30 (с, 3H), 2,15-2,07 (м, 1H), 2,04-1,89 (м, 2H) м.д.
Пример 10 - (R)-метил-5-(5-(6-((4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоксилат (10)
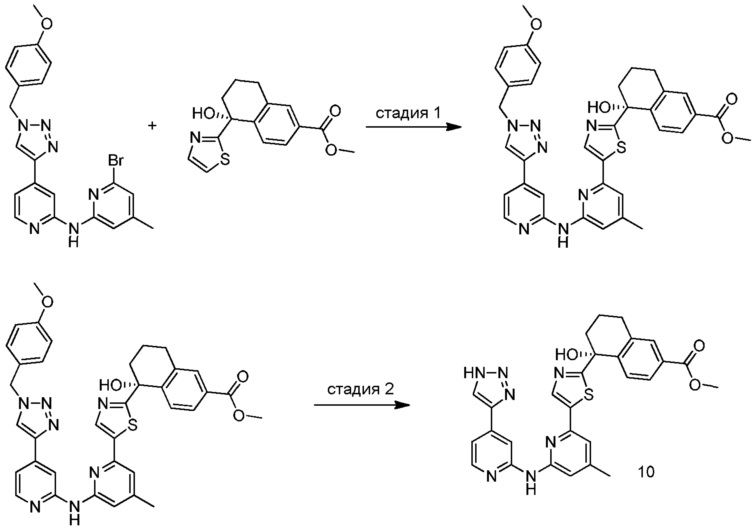
[0234] Стадия 1: В емкость для микроволновой обработки загружали 6-бром-N-(4-(1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил)пиридин-2-ил)-4-метилпиридин-2-амин (247 мг, 0,547 ммоль), (R)-метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилат (158 мг, 0,547 ммол), бутилди-1-адамантилфосфин (78 мг, 0,219 ммоль), CsF (249 мг, 1,64 ммоль), триметилуксусную кислоту (95 мкл, 0,821 ммоль) и Pd(OAc)2 (24,6 мг, 0,109 ммоль). Емкость со смесью вакуумировали и продували аргоном (3 раза), затем добавляли дегазированный 1,4-диоксан (2,0 мл), полученную реакционную смесь нагревали до 100°С и выдерживали при указанной температуре в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc (20 мл). Реакционную смесь фильтровали, концентрировали и очищали хроматографией на силикагеле (градиент: система растворителей 30-100% EtOAc/гексаны). Фракции, содержащие продукт, собирали и концентрировали с получением (R)-метил-5-гидрокси-5-(5-(6-((4-(1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил)пиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (121 мг, 34%) в виде белой пены.
МС (ESI): вычислено для C36H33N7O4S [M+H]+ 660, найдено 660.
[0235] Стадия 2: В емкость для микроволновой обработки загружали (R)-метил-5-гидрокси-5-(5-(6-((4-(1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил)пиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилат (100 мг, 0,152 ммоль) и TFA (1,53 мл), полученную смесь нагревали до 30°С и выдерживали при указанной температуре в течение 2 дней, после чего реакционную смесь концентрировали, и остаток очищали ВЭЖХ с обращенной фазой (колонка C18; элюирование: смесь MeCN/H2O, модифицированная 0,1% TFA). Фракции, содержащие продукт, собирали и лиофилизировали с получением трифторацетатной соли (R)-метил-5-(5-(6-((4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоксилата (7,5 мг, 8%) в виде белого порошка.
МС (ESI): вычислено для C28H25N7O3S [М+Н]+ 540, найдено 540.
1H-ЯМР (600 МГц, ДМСО) δ 10,36 (шир.с, 1H), 8,35 (с, 1H), 8,30 (с, 1H), 8,28 (с, 1H), 7,73 (с, 1H), 7,67 (д, J=8,0, 1H), 7,47 (с, 1H), 7,33 (д, J=8,2, 2H), 7,15 (с, 1H), 6,68 (шир.с, 2H), 3,80 (с, 3H), 2,88 (с, 2H), 2,50 (с, 1H), 2,32 (с, 3H), 2,11-2,10 (м, 1H), 2,04-1,98 (м, 1H), 1,97-1,91 (м, 1H) м.д.
Пример 11 - (R)-5-(5-(6-((4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота (11)
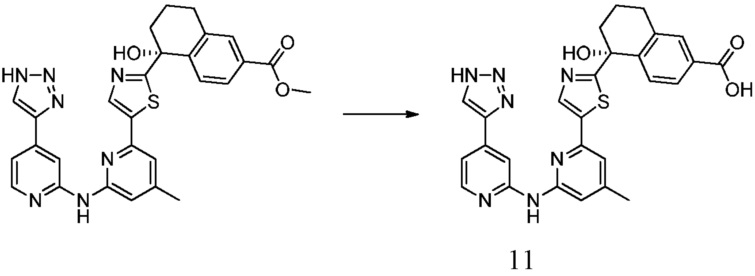
[0236] В колбу, содержащую (R)-метил-5-(5-(6-((4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоксилат (5 мг, 7,65 мкмоль) в ТГФ (695 мкл) и этаноле (69,5 мкл), добавляли КОН (6,50 мкл, 0,061 ммоль), смесь нагревали до 50°С и выдерживали при указанной температуре в течение 4 часов. Добавляли TFA (5,19 мкл, 0,067 ммоль), и смесь концентрировали при пониженном давлении. Полученный продукт очищали с помощью ВЭЖХ с обращенной фазой (колонка C18; элюирование: смесь MeCN и H2O, модифицированная 0,1% TFA). Фракции, содержащие продукт, собирали и лиофилизировали с получением трифторацетатной соли (R)-метил-5-(5-(6-((4-(1H-1,2,3-триазол-4-ил)пиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоксилата (2,5 мг, 51%) в виде твердого белого вещества.
МС (ESI): вычислено для C27H23N7O3S [M+H]+ 526, найдено 526.
1H-ЯМР (600 МГц, ДМСО) δ 12,83 (шир.с, 1H), 9,96 (шир.с, 1H), 8,39 (с, 1H), 8,30 (с, 1H), 8,27-8,22 (м, 2H), 7,70 (с, 1H), 7,64 (д, J=8,1, 1H), 7,39 (с, 1H), 7,34-7,26 (м, 2H), 7,23 (с, 1H), 6,61 (с, 1H), 2,87 (шир.с, 2H), 2,34 (т, J=11,1, 1H), 2,30 (с, 3H), 2,18-2,07 (м, 1H), 2,07-1,97 (м, 1H), 1,97-1,89 (м, 1H) м.д.
Пример 12 - соединения формулы (I), содержащие бром-заместители в R8 и/или R9 (13A, 13B и 13C)
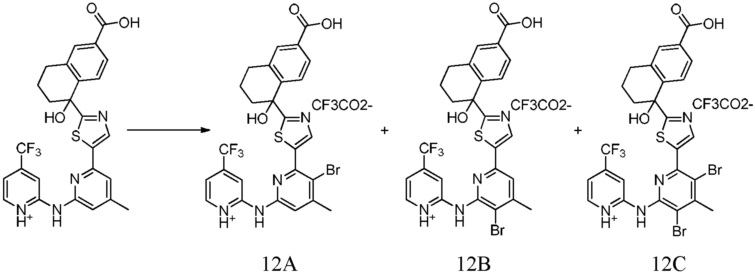
[0237] К раствору (R)-5-гидрокси-5-[5-(4-метил-6-{[4-трифторметил)пиридин-2-ил]амино}пиридин-2-ил)-1,3-тиазол-2-ил]-5,6,7,8-тетрагидронафталинкарбоновой кислоты (100 мг, 0,19 ммоль) в ДМФА (1,5 мл) при комнатной температуре порциями в течение 10 минут добавляли N-бромсукцинимид (34 мг, 0,19 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Смесь продуктов очищали ВЭЖХ с обращенной фазой (C18 колонка; элюирование: смесь MeCN и Н2О, модифицированная 0,1% TFA) с получением следующих продуктов:
[0238] 12A: трифторацетат (R)-2-((5-бром-6-(2-(6-карбокси-1-гидрокси-1,2,3,4-тетрагидронафталин-1-ил)тиазол-5-ил)-4-метилпиридин-2-ил)амино)-4-(трифторметил)пиридин-1-ия.
МС (ESI): вычислено для C26H21BrF3N4O3S [M+H]+ 605, найдено 605.
1H-ЯМР (600 МГц, ДМСО) δ 10,33 (с, 1H), 8,49 (д, J=5,1 Гц, 1H), 8,46 (с, 1H), 8,39 (с, 1H), 7,71 (с, 1H), 7,63 (д, J=8,2 Гц, 1H), 7,35 (с, 1H), 7,29 (д, J=8,2 Гц, 1H), 7,22 (д, J=5,1 Гц, 1H), 2,86 (м, 2H), 2,38 (с, 3H), 2,34 (т, J=9,9 Гц, 1H), 2,15-2,07 (м, 1H), 2,00 (м, 1H), 1,94 (м, 1H) м.д.
[0239] 12B: трифторацетат (R)-2-((3-бром-6-(2-(6-карбокси-1-гидрокси-1,2,3,4-тетрагидронафталин-1-ил)тиазол-5-ил)-4-метилпиридин-2-ил)амино)-4-(трифторметил)пиридин-1-ия.
МС (ESI): вычислено для C26H21BrF3N4O3S [M+H]+ 605, найдено 605.
1H-ЯМР (600 МГц, ДМСО) δ 8,60 (1H, с), 8,59 (с, 1H), 8,52 (д, J=5,1 Гц, 1H), 8,27 (с, 1H), 7,70 (с, 1H), 7,63 (д, J=8,2 Гц, 1H), 7,61 (с, 1H), 7,35 (д, J=5,1 Гц, 1H), 7,29 (д, J=8,2 Гц, 1H), 2,85 (м, 2H), 2,40 (с, 3H), 2,32 (м, 1H), 2,09 (м, 1H), 2,05-1,85 (м, 2H) м.д.
[0240] 12C: трифторацетат 2(R)-2-((3,5-дибром-6-(2-(6-карбокси-1-гидрокси-1,2,3,4-тетрагидронафталин-1-ил)тиазол-5-ил)-4-метилпиридин-2-ил)амино)-4-(трифторметил)пиридин-1-ия.
МС (ESI): вычислено для C26H20Br2F3N4O3S [M+H]+ 685, найдено 685.
1H-ЯМР (600 МГц, ДМСО) δ 8,78 (с, 1H), 8,53 (д, J=5,1 Гц, 1H), 8,46 (с, 1H), 8,37 (с, 1H), 7,70 (с, 1H), 7,62 (д, J=8,1 Гц, 1H), 7,36 (д, J=5,1 Гц, 1H), 7,27 (д, J=8,2 Гц, 1H), 2,86 (м, 2H), 2,65 (с, 3H), 2,32 (м, 1H), 2,11 (м, 1H), 2,00 (м, 1H), 1,96-1,88 (м, 1H) м.д.
Пример 13 - (R)-5-(5-(4-ацетамидо-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновая кислота (13A и 13B)
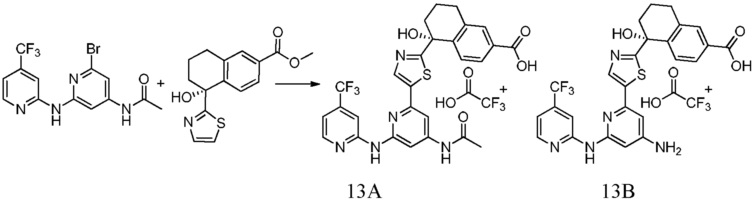
[0241] В емкость для микроволновой обработки загружали 6-бром-4-метил-N-(4-(трифторметил)пиридин-2-ил)пиридин-2-амин (200 мг, 0,533 ммоль), (R)-метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилат (154 мг, 0,533 ммоль), Pd(OAc)2 (23,94 мг, 0,107 ммоль), бутилдиадамантилфосфин (76 мг, 0,213 ммоль), CsF2 (243 мг, 1,599 ммоль) и триметилуксусную кислоту (93 мкл, 0,800 ммоль), колбу вакуумировали и продували аргоном (3 раза). К реакционной смеси добавляли дегазированный диоксан (1,8 мл), после этого смесь герметично закрывали и перемешивали при 100°С в течение 16 часов. После охлаждения до комнатной температуры, добавляли водный раствор гидроксида калия (567 мкл, 5,33 ммоль). Смесь герметично закрывали и перемешивали при комнатной температуре в течение 4 часов. Смесь разбавляли MeOH (1 мл) и ДМСО (1 мл), фильтровали и очищали ВЭЖХ с обращенной фазой (колонка C18; элюирование: смесь воды и MeCN, модифицированная 0,1% TFA). Фракции, содержащие продукт, собирали и концентрировали.
[0242] 13А: трифторацетатная соль (R)-5-(5-(4-ацетамидо-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (68 мг, 20%), твердое белое вещество.
МС (ESI): вычислено для C27H22F3N5O4S [М+Н]+ 570, найдено 570.
1H-ЯМР (600 МГц, ДМСО) δ 10,36 (с, 1H), 10,25 (с, 1H), 8,56 (с, 1H), 8,45 (д, J=5,1, 1H), 8,02 (с, 1H), 7,70 (с, 1H), 7,64 (д, J=8,1, 1H), 7,57 (с, 1H), 7,55 (д, J=1,4, 1H), 7,31 (д, J=8,2, 1H), 7,18 (д, J=4,2, 1H), 2,93-2,78 (м, 2H), 2,34 (дд, J=11,5, 7,7, 1H), 2,16-2,08 (м, 1H), 2,06 (с, 3H), 2,04-1,95 (м, 1H), 1,95-1,87 (м, 1H) м.д.
[0243] 13B: трифторацетатная соль ((R)-5-(5-(4-амино-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5-гидрокси-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (119 мг, 33%), твердое вещество светло-желтого цвета.
МС (ESI): вычислено для C25H20F3N5O3S [M+H]+ 528, найдено 528.
1H-ЯМР (600 МГц, ДМСО) δ 12,92 (шир.с, 1H), 8,56 (с, 1H), 8,15 (с, 1H), 7,71 (с, 1H), 7,65 (д, J=8,2, 1H), 7,28 (д, J=8,2, 2H), 6,76 (шир.с, 1), 6,71 (с, 1H), 6,34 (с, 1H), 2,95-2,79 (м, 2H), 2,38-2,26 (м, 1H), 2,19-2,08 (м, 1H), 2,08-1,97 (м, 1H), 1,97-1,88 (м, 1H) м.д.
Пример 14 - метил (R и S) 5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-1-карбоксилат (14A и 14B)
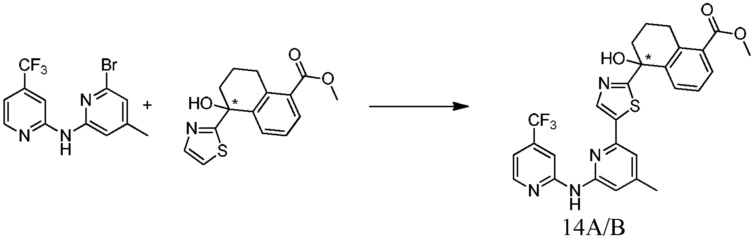
[0244] В емкость для микроволновой обработки загружали (R или S)-метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-1-карбоксилат (0,075 г, 0,259 ммоль), 6-бром-4-метил-N-(4-(трифторметил)пиридин-2-ил)пиридин-2-амин (0,095 г, 0,285 ммоль), полученный в примере 9, CsF (0,118 г, 0,778 ммоль), Pd(OAc)2 (0,012 г, 0,052 ммоль), catacxium А (0,037 г, 0,104 ммоль), триметилуксусную кислоту (0,045 мл, 0,389 ммоль) и дегазированный диоксан (1,29 мл). Смесь продували N2 в течение 5 минут, затем нагревали до 100°С и выдерживали при указанной температуре в течение 16 часов. После охлаждения до комнатной температуры, к смеси добавляли воду, и смесь экстрагировали EtOAc (3 раза). Объединенные органические фазы сушили (MgSO4), фильтровали, концентрировали и очищали хроматографией на силикагеле (градиент: система растворителей 0-100% EtOAc в ДХМ). Фракции, содержащие продукт, объединяли и концентрировали с получением (R или S)-метил-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-1-карбоксилата (14A и 14B) в виде твердого вещества желтого цвета (92 мг, 66%). Другой энантиомер получали таким же образом из антипода метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-1-карбоксилата.
[0245] 14A: МС (ESI): вычислено для C27H23F3N4O3S [M+H]+ 541, найдено 541.
1H-ЯМР (600 МГц, ДМСО) δ 10,17 (с, 1H), 8,62 (с, 1H), 8,46 (д, J=5,2, 1H), 8,19 (с, 1H), 7,65-7,55 (м, 1H), 7,43 (д, J=6,6, 1H), 7,33 (с, 1H), 7,21 (т, J=7,8, 1H), 7,18 (д, J=6,7, 1H), 7,08 (с, 1H), 6,57 (с, 1H), 3,79 (с, J=4,5, 3H), 3,07-2,89 (м, 2H), 2,31 (д, J=9,7, 1H), 2,28 (с, 1H), 2,06 (дд, J=29,6, 16,7, 1H), 1,95 (шир.с, 1H) м.д.
[0246] 14B: МС (ESI): вычислено для C27H23F3N4O3S [M+H]+ 541, найдено 541.
1H-ЯМР (600 МГц, ДМСО) δ 10,17 (с, 1H), 8,62 (с, 1H), 8,46 (д, J=5,1, 1H), 8,19 (с, 1H), 7,64-7,55 (м, 1H), 7,43 (дд, J=7,9, 1,2, 1H), 7,33 (с, 1H), 7,19 (дт, J=14,4, 7,8, 2H), 7,08 (с, 1H), 6,57 (с, 1H), 3,79 (д, J=4,5 Ha, 3H), 3,09-2,89 (м, 2H), 2,36-2,25 (м, 1H), 2,13-2,04 (м, 1H), 1,90 (ддд, J=18,8, 17,2, 8,4, 1H) м.д.
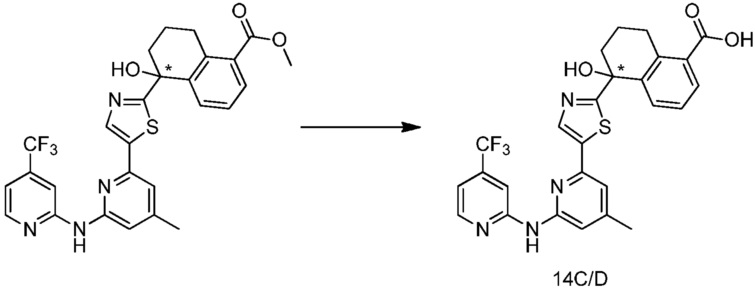
[0247] Реакции гидролиза 14А и 14В выполняли с использованием способов, аналогичных описанным примера 7, получая карбоновые кислоты 14С и 14D.
[0248] 14С/D (R или S)-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-1-карбоновая кислота.
МС (ESI): вычислено для C26H21F3M4O3S [M+H]+ 527, найдено 527.
Пример 15 - (R или S)-3-гидрокси-3-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1Н-инден-5-карбоновая кислота (15А и 15B)
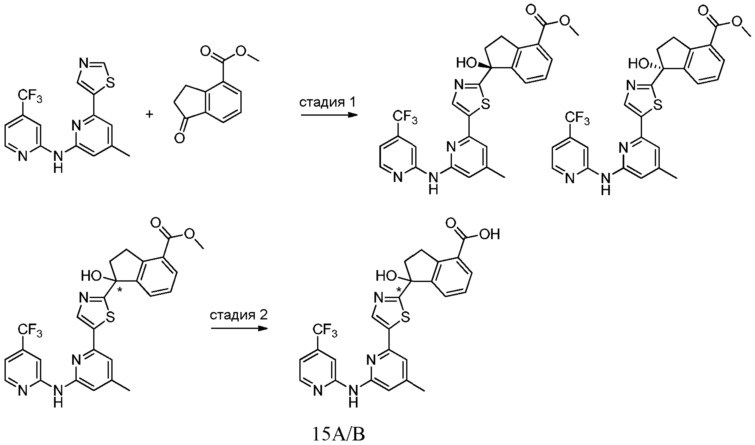
[0249] Стадия 1: Раствор 4-метил-6-(тиазол-5-ил)-N-(4- (трифторметил)пиридин-2-ил)пиридин-2-амина (380 мг, 1,13 ммоль) в 10 мл ТГФ охлаждали до -78°С, затем добавляли LDA (2,5 ммоль, свежеприготовленный), и полученную смесь перемешивали при указанной температуре в течение 30 минут. После этого к реакционной смеси добавляли раствор метил-3-оксо-2,3-дигидро-1H-инден-5-карбоксилата (1,13 ммоль) в ТГФ (3 мл), реакционную смесь нагревали до комнатной температуры в течение 4 часов и перемешивали в течение дополнительных 15 часов при комнатной температуре. Реакцию гасили добавлением насыщенного водного раствора NH4Cl (10 мл), и полученную смесь экстрагировали EtOAc (2×20 мл). Объединенные органические фазы сушили (MgSO4), фильтровали, концентрировали и остаток очищали с помощью хроматографии на силикагеле с получением рацемического метил-3-гидрокси-3-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1Н-инден-5-карбоксилата, который разделяли с помощью хиральной SFC (колонка: Chiralcel OD-H 150×4,6 мм ID, 5 мкм; элюирование с градиентом: этанол (0,05% DEA) в CO2 от 5% до 40%, скорость истечения: 2,35 мл/мин; длина волны: 220 нм) для получения каждого энантиомера.
МС (ESI): вычислено для C26H21F3N403S [M+H]+ 527, найдено 527.
[0250] Стадия 2: К раствору (R или S)-метил-3-гидрокси-3-(5 -(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1Н-инден-5-карбоксилата (энантиомер быстрого или медленного элюирования, 105 мг, 0,2 ммоль) в метаноле (6 мл) добавляли раствор гидроксида натрия (2 мл, 0,3 М, 0,6 ммоль), и смесь кипятили с обратным холодильником в течение 1 часа. Органический растворитель удаляли при пониженном давлении, и остаток разбавляли водой (10 мл). Значение рН доводили до 6 добавлением 1 М HCl, в процессе чего происходило образование белого осадка. Осадок собирали фильтрованием, промывали водой и сушили с получением (R или S)-3-гидрокси-3-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1H-инден-5-карбоновой кислоты (количественный выход) в виде белого порошка.
[0251] 15А (продукт гидролиза первого энантиомера): Полученный белый порошок дополнительно очищали с помощью препаративной ТСХ (система растворителей: петролейный эфир/EtOAc (1:1), модифицированная 0,3% AcOH). Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении с получением ацетатной соли (R или S)-3-гидрокси-3-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1Н-инден-5-карбоновой кислоты (22 мг, выход 21%).
МС (ESI): вычислено для C25H19F3N4O3S [M+H]+ 513, найдено 513.
1H-ЯМР (MeOD, 400 МГц) δ 8,67 (с, 1H), 8,44 (д, J=4,7 Гц, 1H), 8,19 (с, 1H), 7,78 (д, J=6,5 Гц, 1H), 7,20-7,34 (м, 3 H), 7,03-7,19 (м, 2H), 3,41-3,58 (м, 2H), 2,88-3,00 (м, 1H), 2,44-2,54 (м, 1H), 2,39 (с, 3H).
[0252] 15В (продукт гидролизоа второго энантиомера): (свободное основание) (R или S)-3-гидрокси-3-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1H-инден-5-карбоновая кислота (86 мг, выход 84%).
МС (ESI): вычислено для C25H19F3N4O3S [M+H]+ 513, найдено 513.
1H-ЯМР (400 МГц, MeOD) δ 8,60 (с, 1H), 8,30 (с, 1H), 8,06 (с, 1H), 7,95 (с, 1H), 7,45 (т, J=13,6 Гц, 2H), 7,35 (д, J=8 Гц, 2H), 7,02 (с, 1H), 3,55 (м, 2H), 2,93 (м, 1H), 2,45-2,55 (м, 1H), 2,42 (с, 3H).
[0253] Представленные ниже соединения получали аналогичным способом с использованием структурообразующих элементов, как описано:
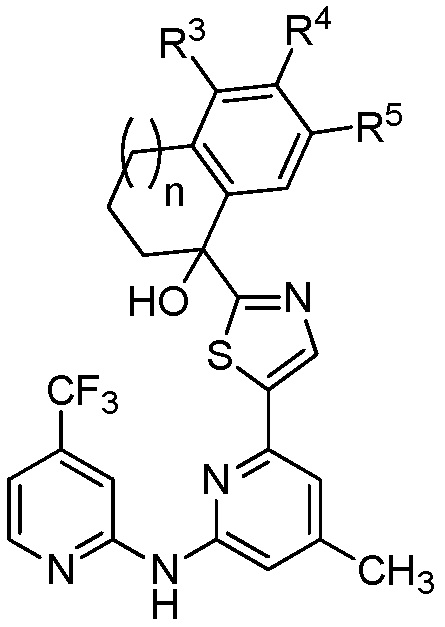
|
|
Пример 16 - (R или S)-1-гидрокси-1-(5-(4-метил-6-((4- (трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1H-инден-5-карбоновая кислота (16А и 16В)
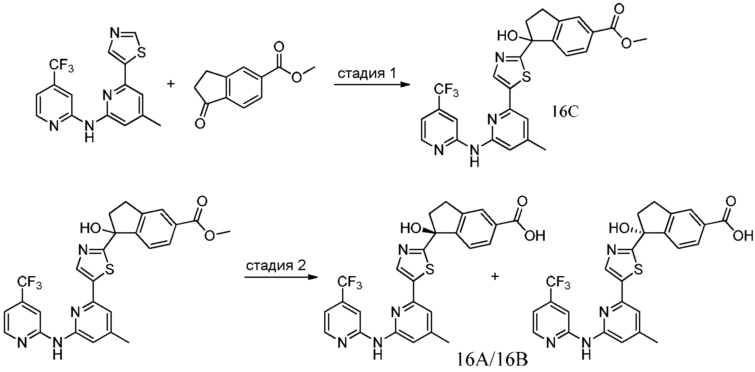
[0254] Стадия 1: Раствор 4-метил-6-(тиазол-5-ил)-N-(4- (трифторметил)пиридин-2-ил)пиридин-2-амина (1,5 г, 4,46 ммоль) в ТГФ (35,7 мл) охлаждали до -78°С. К раствору медленно добавляли LDA (2 М, 6,69 мл, 13,38 ммоль), и полученную смесь перемешивали при -78°С в течение 30 минут. В отдельной сухой колбе метил-1-оксо-2,3-дигидро-1H-инден-5-карбоновую кислоту (1,06 г, 5,57 ммоль) растворяли в ТГФ (5 мл), затем полученный раствор добавляли к реакционной смеси, которой после этого давали нагреться до комнатной температуры в течение 3 часов, а затем перемешивали при комнатной температуре в течение дополнительных 13 часов. Реакцию гасили добавлением 2 мл метанола и затем загружали непосредственно на хроматографическую колонку (силикагель; градиент: система растворителей 0-100% EtOAc/гексаны). Фракции, содержащие продукт, упаривали с получением метил-1-гидрокси-1-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1H-инден-5-карбоксилата 16C (912 мг, 39%) в виде твердого вещества светло-желтого цвета.
МС (ESI): вычислено для C26H21F3N4O3S [M+H]+ 527, найдено 527.
[0255] Стадия 2: К раствору метил-1-гидрокси-1-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1Н-инден-5-карбоновой кислоты (900 мг, 1,709 ммоль) в ТГФ (8,6 мл) добавляли водный раствор гидроксида калия (1,82 мл, 17,09 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли метанолом (10 мл) и водой (10 мл), и органические растворители удаляли при пониженном давлении. Значение рН доводили до приблизительно 3 добавлением 1 М HCl, в процессе чего происходило образование осадка. Осадок собирали фильтрованием, получая рацемический продукт: 1-гидрокси-1-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1Н-инден-5-карбоновую кислоту (749 мг, 85%) в виде твердого белого вещества. Рацемическую смесь разделяли с помощью хиральной SFC (колонка Chiral Technology IA-H 3,0×25 см, 5 мкм; элюирование: 50% MeOH/CO2, скорость истечения 70 мл/мин). В этих условиях получали два энантиомера: при 5,5 мин и 10,5 мин.
[0256] 16A: энантиомер более быстрого элюирования: (R или S)-1-гидрокси-1-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидро-1Н-инден-5-карбоновая кислота (185 мг, 25%), твердое вещество желтого цвета.
МС (ESI): вычислено для C25H19F3N4O3S [M+H]+ 513, найдено 513.
1H-ЯМР (600 МГц, ДМСО) δ 12,85 (шир.с, 1H), 10,18 (с, 1H), 8,64 (с, 1H), 8,47 (д, J=5,1, 1H), 8,21 (с, 1H), 7,83 (с, 1H), 7,75 (д, J=8,0, 1H), 7,34 (с, 1H), 7,24 (д, J=8,0, 1H), 7,20 (д, J=5,0, 1H), 7,07 (с, 1H), 6,70 (с, 1H), 3,15-3,01 (м, 2H), 2,90-2,81 (м, 1H), 2,42-2,32 (м, 1H), 2,28 (м, 3H) м.д.
[0257] 16B: энантиомер более медленного элюирования (R или S)-1-гидрокси-1-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-2,3-дигидрокарбоновая кислота (185 мг, 25%), твердое вещество желтого цвета.
МС (ESI): вычислено для C25H19F3N4O3S [М+Н]+ 513, найдено 513.
1H-ЯМР (600 МГц, ДМСО) δ 12,89 (шир.с, 1H), 10,18 (с, 1H), 8,64 (с, 1H), 8,47 (д, J=5,1, 1H), 8,21 (с, 1H), 7,83 (с, 1H), 7,75 (д, J=8,1, 1H), 7,34 (с, 1H), 7,24 (д, J=8,0, 1H), 7,20 (д, J=5,0, 1H), 7,07 (с, 1H), 6,70 (с, 1H), 3,14-3,03 (м, 2H), 2,90-2,80 (м, 1H), 2,43-2,33 (м, 1H), 2,28 (с, 3H) м.д.
Пример 17 - 1-бром-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота (17)
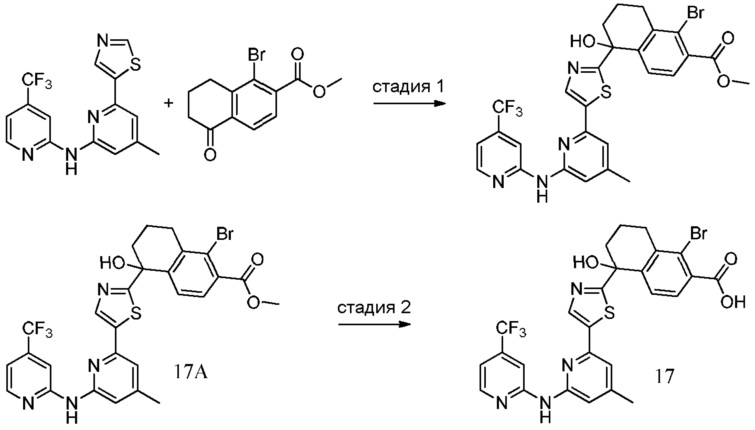
[0258] Стадия 1: В высушенную в печи колбу загружали 4-метил-6-(тиазол-5-ил)-N-(4-(трифторметил)пиридин-2-ил)пиридин-2-амин (300 мг, 0,892 ммоль) и ТГФ (7,1 мл), и раствор охлаждали до -78°С. К раствору медленно добавляли LDA (1,34 мл, 2,68 ммоль), и полученную смесь перемешивали в течение 30 минут при -78°С. В отдельной высушенной в печи колбе метил-1-бром-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилат (316 мг, 1,12 ммоль) растворяли в ТГФ (5 мл), и полученный раствор добавляли к реакционной смеси, которую после этого нагревали до комнатной температуры в течение 3 часов. Реакционную смесь гасили МеОН (5 мл) и концентрировали. Остаток очищали хроматографией на силикагеле с получением метил-1-бром-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата 17A (210 мг, 38%) в виде твердого вещества светло-желтого цвета.
МС (ESI): вычислено для C27H22BrF3N4O3S [M+H]+ 619, найдено 619.
[0259] Стадия 2: К раствору метил-1-бром-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (50 мг, 0,081 ммоль) в ТГФ (1,6 мл) добавляли водный раствор гидроксида калия (172 мкл, 1,61 ммоль), и смесь перемешивали в течение 16 часов при комнатной температуре, после чего реакционную смесь разбавляли MeOH (2 мл), фильтровали и очищали ВЭЖХ с обращенной фазой (колонка C18; элюирование: смесь воды и MeCN, модифицированная 0,1% TFA). Фракции, содержащие продукт, распределяли между буфером (рН 4, 20 мл) и EtOAc (20 мл), и слои разделяли. Водную фазу экстрагировали EtOAc (1×20 мл), затем объединенные органические фазы промывали насыщенным раствором соли (20 мл), сушили и концентрировали с получением 1-бром-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (25 мг, 52%) в виде твердого белого вещества.
МС (ESI): вычислено для C26H20BrF3N4O3S [M+H]+ 605, найдено 605.
1H-ЯМР (600 МГц, ДМСО) δ 10,17 (с, 1H), 8,62 (с, 1H), 8,46 (д, J=5,0, 1H), 8,20 (с, 1H), 7,35-7,29 (м, 3H), 7,19 (с, 1H), 7,08 (с, 1H), 6,68 (с, 1H), 2,79 (с, 3H), 2,32-2,2,24 (м, 4H), 2,06 (шир.с, 1H), 1,96 (шир.с, 2H) м.д.
Пример 18 - трифторацетатная соль 1-циано-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (18)
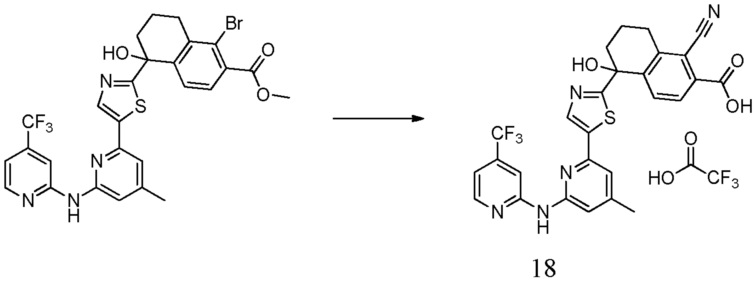
[0260] В емкость для микроволновой обработки загружали хлорид аллилпалладия (1,48 мг, 4,04 мкмоль) и х-phos (2-дициклогексилфосфино-2',4',6'-триизопропилбифенил) (6,73 мг, 0,014 ммоль) и DMA (807 мкл). Емкость вакуумировали и продували аргоном (3 раза), затем нагревали до 65°C и перемешивали при указанной температуре в течение 30 минут. Затем последовательно добавляли метил-1-бром-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилат (50 мг, 0,081 ммоль) и цианид цинка(II) (12,32 мг, 0,105 ммоль). Емкость вакуумировали и продували аргоном (3 раза), затем реакционную смесь нагревали до 100°С и выдерживали при указанной температуре в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, затем добавляли водный раствор гидроксида лития (404 мкл, 0,404 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов, после чего добавляли TFA для достижения значения рН приблизительно 4, и полученную смесь разбавляли ДМСО (1 мл) и MeCN (1 мл). Полученную смесь фильтровали и затем очищали ВЭЖХ с обращенной фазой (колонка C18; элюирование: смесь MeCN и вода, модифицированная 0,1% TFA). Фракции, содержащие продукт, концентрировали с получением трифторацетатной соли 1-циано-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (29 мг, 54%) в виде твердого белого вещества.
МС (ESI): вычислено для C27H20F3N5O3S [M+H]+ 552, найдено 552.
1H-ЯМР (600 МГц, ДМСО) δ 10,18 (с, 1H), 8,61 (с, 1H), 8,46 (д, J=5,1, 1H), 8,23 (с, 1H), 7,84 (д, J=8,3, 1H), 7,65 (д, J=8,3, 1H), 7,35 (с, 1H), 7,18 (д, J=4,9, 1H), 7,06 (с, 1H), 2,99 (д, J=5,4, 2H), 2,38-2,25 (м, 3H), 2,18-2,06 (м, 1H), 1,99 (д, J=6,3, 2H), м.д.
Пример 19 - 5-гидрокси-1-метокси-5-(5-(4-метил-6-((4- (трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота (19)
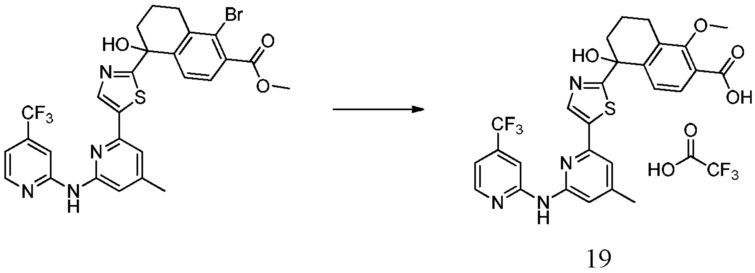
[0261] В емкость для микроволновой обработки загружали 1-бром-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилат (50 мг, 0,081 ммоль), МеОН (33 мл, 0,81 ммоль), Pd2(DBA)3 (7,39 мг, 8,07 мкмоль), BrettPhos (10,83 мг, 0,020 ммоль) и Cs2CO3 (105 мг, 0,323 ммоль). Емкость вакуумировали и продували аргоном (3 раза), затем к реакционной смеси добавляли дегазированный диоксан (807 мкл), смесь герметично закрывали, нагревали до 100°С и выдерживали при указанной температуре в течение ночи. Реакцию охлаждали до комнатной температуры и добавляли водный раствор гидроксида лития (404 мкл, 0,404 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь подкисляли TFA, разбавляли ДМСО (1 мл) и MeCN (1 мл), фильтровали и очищали ВЭЖХ с обращенной фазой (колонка С18; элюирование: смесь MeCN и воды, модифицированная 0,1% TFA). Фракцию, содержащую продукт, концентрировали с получением трифторацетатной соли 5-гидрокси-1-метокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (54 мг, 22%) в виде твердого белого вещества.
МС (ESI): вычислено для C27 H23F3N4O4S [M+H]+ 557, найдено 557.
1H-ЯМР (600 МГц, ДМСО) δ 10,16 (с, 1H), 8,61 (с, 1H), 8,46 (д, J=5,0, 1H), 8,20 (с, 1H), 7,42 (д, J=8,1, 1H), 7,33 (с, 1H), 7,18 (д, J=5,3, 1H), 7,07 (с, 1H), 7,03 (д, J=8,3, 1H), 3,72 (с, 3H), 2,86-2,78 (м, 1H), 2,76-2,68 (м, 1H), 2,34-2,30 (м, 1H), 2,28 (с, 3H), 2,10-2,04 (м, 1H), 2,01-1,83 (м, 2H) м.д.
Пример 20 - 5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбонитрил (20В)
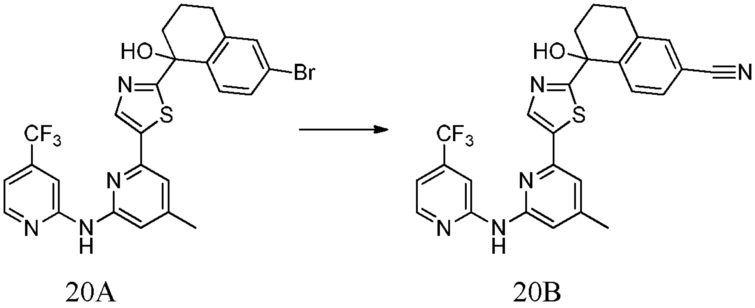
[0262] В емкость для микроволновой обработки загружали 6-бром-1-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-1,2,3,4-тетрагидронафталин-1-ол 20A (650 мг, 1,158 ммоль), цианид цинка(II) (150 мг, 1,274 ммоль) и тетракис(трифенилфосфин)палладий (134 мг, 0,116 ммоль). Емкость вакуумировали и продували аргоном (3 раза), затем к смеси добавляли дегазированный ДМФА (2316 мкл), реакционную смесь нагревали до 100°С и выдерживали при указанной температуре в течение 16 час. После охлаждения до комнатной температуры, реакционную смесь разбавляли MeOH (20 мл) и MeCN (20 мл), фильтровали через Celite® и концентрировали при пониженном давлении. Полученный сырой продукт очищали с помощью хроматографии на силикагеле (градиент: система растворителей 0-100% EtOAc/гексаны). Фракции, содержащие продукт, упаривали с получением 20B (533 мг, 91%) в виде твердого вещества светло-желтого цвета.
MC (ESI) [М+Н]+: вычислено для C26H20F3N5OS 507, найдено 507.
1H-ЯМР (600 МГц, ДМСО) δ 10,18 (с, 1H), 8,62 (с, 1H), 8,46 (д, J=5,1, 1H), 8,22 (с, 1H), 7,62 (с, 1H), 7,53 (дд, J=8,2, 1,6, 1H), 7,38 (д, J=8,2, 1H), 7,34 (с, 1H), 7,19 (д, J=5,9, 1H), 7,06 (с, 1H), 6,70 (с, 1H), 2,83 (д, J=5,8, 2H), 2,38-2,29 (м, 1H), 2,28 (с, 3H), 2,15-2,05 (м, 1H), 2,01-1,80 (м, 2H) м.д.
Пример 21 - 1-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-6-(2H-тетразол-5-ил)-1,2,3,4-тетрагидронафталин-1-ол (21)
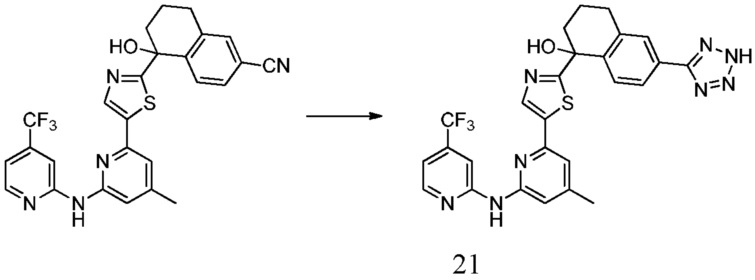
[0263] В емкость для микроволновой обработки загружали 5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбонитрил (250 мг, 0,493 ммоль), азид натрия (32,0 мг, 0,493 ммоль), бромида цинка (111 мг, 0,493 ммоль) и ДМФА (2463 мкл). Емкость герметично закрывали, смесь нагревали до 125°С и выдерживали при указанной температуре в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали, затем очищали с помощью ВЭЖХ с обращенной фазой (колонка Cl8; элюирование: система растворителей, содержащая MeCN и H2O, модифицированную 0,1% TFA). Фракции, содержащие продукт, лиофилизировали с получением 1-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-6-(2H-тетразол-5-ил)-1,2,3,4-тетрагидронафталин-1-ола (35 мг, 13%) в виде белого порошка.
МС (ESI): вычислено для C26H21F3N8OS [М+Н]+ 551, найдено 551.
1H-ЯМР (600 МГц, ДМСО) δ 10,17 (с, 1H), 8,63 (с, 1H), 8,46 (д, J=4,8, 1H), 8,22 (с, 1H), 7,81 (с, 1H), 7,75 (д, J=7,8, 1H), 7,41 (д, J=8,1, 1H), 7,34 (с, 1H), 7,18 (д, J=4,0, 1H), 7,07 (с, 1H), 6,62 (с, 1H), 2,90 (д, J=4,3, 2H), 2,42-2,33 (м, 1H), 2,28 (с, 3H), 2,19-2,07 (м, 1H), 2,07-1,90 (м, 2H) м.д.
Пример 22 - (R)-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-N-(метилсульфонил)-5,6,7,8-тетрагидронафталин-2-карбоксамид (22)
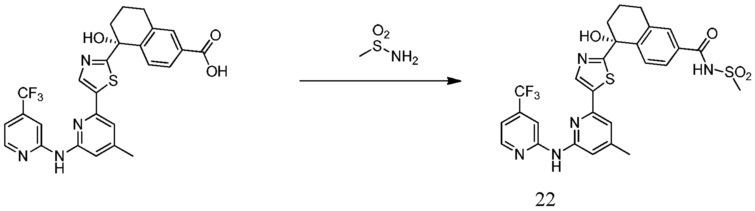
[0264] К суспензии (R)-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (20 мг, 0,038 ммоль) и метансульфонамида (4,34 мг, 0,046 ммоль) в ДХМ (2 мл) при комнатной температуре добавляли HATU (28,9 мг, 0,076 ммоль) с последующим добавлением основания Хюнига (0,040 мл, 0,228 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Растворитель удаляли при пониженном давлении, и остаток очищали ВЭЖХ с обращенной фазой (колонка C18; элюирование: система растворителей, содержащая MeCN и воду, модифицированную 0,1% TFA). Фракции, содержащие продукт, собирали и лиофилизировали с получением (R)-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-N-(метилсульфонил)-5,6,7,8-тетрагидронафталин-2-карбоксамида (22,4 мг, 82%) в виде твердого вещества светло-желтого цвета.
МС (ESI): вычислено для C27H24F3N5O4S2 [M+H]+ 604, найдено 604.
1H-ЯМР (500 МГц, ДМСО) δ 10,21 (с, 1H), 8,65 (с, 1H), 8,48 (с, 1H), 8,22 (д, J=3,9, 1H), 7,74 (с, 1H), 7,69-7,61 (м, 1H), 7,39-7,29 (м, 2H), 7,26-7,17 (м, 1H), 7,10 (с, 1H), 3,34 (с, 3H), 2,87 (м, 2H), 2,40-2,32 (м, 2H), 2,30 (с, 3H), 2,17-2,06 (м, 1H), 2,05-1,88 (м, 1H) м.д.
[0265] Представленные ниже соединения получали с использованием аналогичной методики.
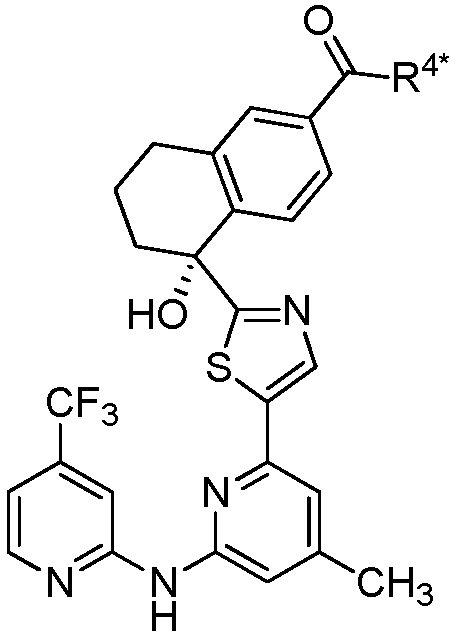
|
|
Пример 23 - (R)-диэтил-(5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-ил)фосфонат (23)
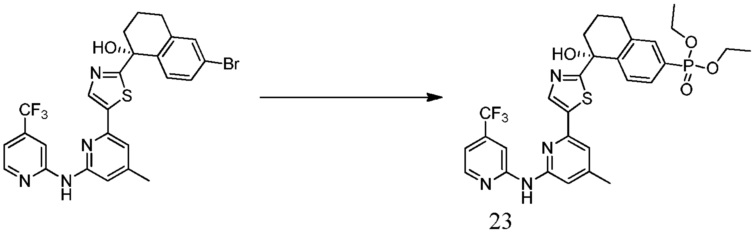
[0266] В емкость для микроволновой обработки загружали (R)-6-бром-1-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-1,2,3,4-тетрагидронафталин-1-ол (20 мг, 0,036 ммоль), тетракис(трифенилфосфин)палладий (2,058 мг, 1,781 мкмоль), EtOH (0,5 мл), диэтилфосфит (4,60 мкл, 0,036 ммоль) и Et3N (7,45 мкл, 0,053 ммоль). Емкость герметично закрывали, смесь нагревали до 100°C при микроволновом облучении и выдерживали в указанных условиях в течение часа. Реакционную смесь фильтровали и затем очищали с помощью ВЭЖХ с обращенной фазой (колонка C18; элюирование: MeCN/вода, модифицированная 0,1% TFA). Фракции, содержащие продукт, собирали и лиофилизировали с получением трифторацетатной соли (R)-диэтил-(5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-ил)фосфоната (21,6 мг, 83%) в виде твердого вещества светло-желтого цвета.
МС (ESI): вычислено для C29H30F3N4O4PS [M+H]+ 619, найдено 619.
1H-ЯМР (500 МГц, ДМСО) δ 10,21 (с, 1H), 8,65 (с, 1H), 8,49 (д, J=5,1, 1H), 8,22 (с, 1H), 7,48 (д, J=14,0, 1H), 7,45-7,38 (м, 1H), 7,38-7,31 (м, 2H), 7,21 (д, J=6,0, 1H), 7,11 (с, 1H), 4,06-3,88 (м, 4H), 2,90-2,86 (м, 2H), 2,35-2,32 (м, 1H), 2,31 (с, 3H), 2,14-2,10 (м, 1H), 2,02-1,98 (м, 2H), 1,20 (тд, J=7,0, 1,7, 6H).
Пример 24 - (R)-(5-гирокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-ил)фосфоновая кислота (24)
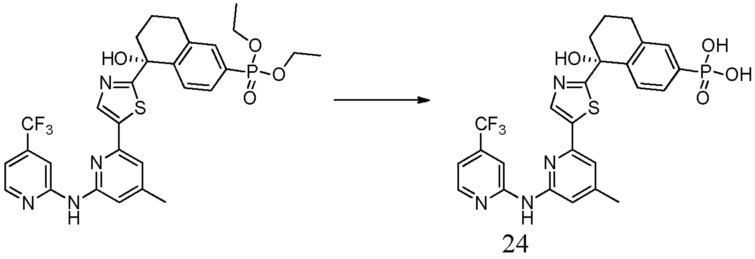
[0267] К раствору трифторацетатной соли (R)-диэтил-(5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-ил)фосфоната (19 мг, 0,031 ммоль) в EtOH (1 мл) добавляли 2 М водный раствор NaOH (0,031 мл, 0,061 ммоль), смесь нагревали до 70°С и перемешивали при указанной температуре в течение часа. Затем органический растворитель удаляли при пониженном давлении, и остаток подкисляли 2 н. HCl (31 мкл), разбавляли ДМСО (1 мл) и фильтровали. Фильтрат очищали с помощью ВЭЖХ с обращенной фазой (колонка C18; элюирование: система растворителей, состоящая из MeCN и воды и модифицированная 0,1% TFA). Фракции, содержащие продукт, собирали и лиофилизировали с получением соли трифторацетатной соли (R)-(5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-ил)фосфоновой кислоты (6,5 мг, 31%) в виде твердого вещества светло-желтого цвета.
МС (ESI): вычислено для C25H22F3N4O4PS [М+Н]+563, найдено 563.
1H-ЯМР (500 МГц, ДМСО) δ 10,21 (с, 1H), 8,64 (с, 1H), 8,49 (д, J=5,2, 1H), 8,20 (с, 1H), 7,43 (д, J=13,3, 1H), 7,38 (дд, J=12,2, 8,0, 1H), 7,35 (с, 1H), 7,26 (дд, J=8,0, 3,8, 1H), 7,21 (д, J=5,1, 1H), 7,12 (с, 1H), 2,86-2,82 (м, 2H), 2,37-2,33 (м, 1H), 2,30 (с, 3H), 2,16-2,08 (м, 1H), 2,02-1,98 (м, 1H), 1,96-1,92 (м, 1H).
Пример 25 (R) - (R)-(5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-ил)бороновая кислота (25)
[0268] Стадия 1: В емкость для микроволновой обработки загружали (R)-6-бром-1-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-1,2,3,4-тетрагидронафталин-1-ол (30 мг, 0,053 ммоль) и бис(пинаколато)дибор (27,1 мг, 0,107 ммоль), диоксан (1 мл), PdCl2(dppf)-CH2Cl2 (4,36 мг, 5,34 мкмоль) и ацетат калия (15,73 мг, 0,160 ммоль). Емкость герметично закрывали, смесь нагревали до 90°С и выдерживали при указанной температуре в течение 16 часов. После охлаждения до комнатной температуры, смесь фильтровали, и растворитель удаляли при пониженном давлении. Полученный остаток использовали без дополнительной очистки.
[0269] Стадия 2: К полученному сырому продукту добавляли этанол (2 мл) и 2 М водный раствором NaOH (1 мл, 2,000 ммоль), реакционную смесь нагревали до 70°С и перемешивали при указанной температуре в течение часа. Растворитель удаляли при пониженном давлении, остаток подкисляли 2 н. HCl (1 мл) и затем концентрировали. Остаток растворяли в ДМСО (2 мл) и фильтровали. Смесь очищали ВЭЖХ с обращенной фазой (колонка C18; элюирование: MeCN/вода, модифицированная 0,1% TFA). Фракции, содержащие продукт, собирали и лиофилизировали с получением трифторацетатной соли (R)-(5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-ил)бороновой кислоты (1,4 мг, 4,4%) в виде твердого вещества желтого цвета.
MC (ESI) [M+H]+: вычислено для C25H22BF3N4O3S 527, найдено 527.
1H-ЯМР (500 МГц, ДМСО) δ 10,24-10,17 (м, 1H), 8,67-8,60 (м, 1H), 8,55-8,45 (м, 1H), 8,25-8,17 (м, 1H), 7,58-7,50 (м, 1H), 7,51-7,45 (м, 1H), 7,38-7,31 (м, 1H), 7,24-7,19 (м, 1H), 7,18-7,13 (м, 1H), 7,13-7,08 (м, 1H), 2,85-2,75 (м, 2H), 2,40-2,32 (м, 1H), 2,30 (с, 3H), 2,13-2,04 (м, 1H), 2,02-1,87 (м, 2H).
Пример 26 - метил-5-фтор-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилат (26А)
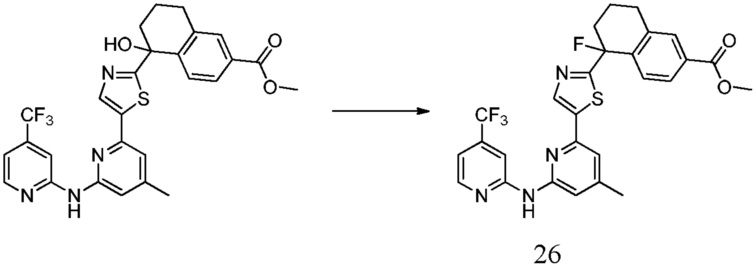
[0270] К раствору метил-(S)-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (250 мг, 0,462 ммоль) в ДХМ (2,3 мл) добавляли деоксофтор (107 мкл, 0,578 ммоль), полученную смесь герметично закрывали и перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (20 мл) и экстрагировали дихлорметаном (3×20 мл). Объединенные органические фазы сушили (MgSO4), фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (градиент: система растворителей 0-100% EtOAc/гексаны) с получением метил-5-фтор-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (166 мг, 66%) в виде твердого белого вещества.
МС (ESI): вычислено для C27H22F4N4O2S [M+H]+ 543, найдено 543.
1H-ЯМР (600 МГц, ДМСО) δ 10,22 (с, 1H), 8,59 (с, 1H), 8,46 (д, J=5,1, 1H), 8,41 (д, J=2,5, 1H), 7,83 (с, 1H), 7,77 (д, J=8,2, 1H), 7,43 (с, 1H), 7,40 (д, J=8,2, 1H), 7,18 (д, J=5,1, 1H), 7,07 (s, 1H), 3,82 (с, 3H), 3,03-2,93 (м, 1H), 2,92-2,86 (м, 1H), 2,65-2,52 (м, 1H), 2,43-2,33 (м, 1H), 2,29 (с, 3H), 1,98-1,79 (м, 2H) м.д.
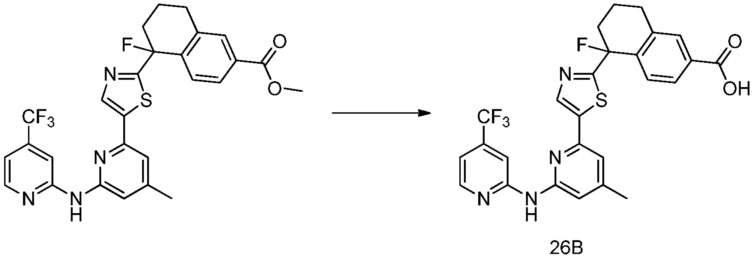
[0271] Гидролиз соединения 26 проводили в соответствии со способом, описанным в примере 7.
26B: 5-Фтор-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота.
МС (ESI): вычислено для C26H20F4N4O2S [M+H]+ 529, найдено 529.
Пример 27 - 5-амино-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота (27)
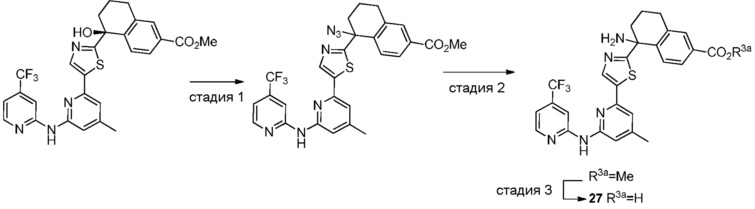
[0272] Стадия 1: К смеси (S)-метил-5-гидрокси-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (100 мг, 0,185 ммоль) и азида натрия (36,1 мг, 0,555 ммоль) в ДХМ (2 мл) при комнатной температуре добавляли TFA (0,016 мл, 0,203 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов, после чего реакционную смесь нагревали до 40°С и выдерживали при указанной температуре в течение 5 дней. Смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением сырого метил-5-азидо-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата в виде масла коричневого цвета, который использовали на следующей стадии без дополнительной очистки.
МС (ESI): вычислено для C27H22F3N7O2S [M+H]+ 566, найдено 566.
[0273] Стадия 2: К раствору сырого метил-5-азидо-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (50 мг, 0,088 ммоль) в ТГФ (1 мл) и воде (0,1 мл) при комнатной температуре добавляли триметилфосфин (1 М в ТГФ) (0,133 мл, 0,133 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Растворитель удаляли при пониженном давлении, остаток растворяли в смеси MeCN:ДМСО (1:1) и фильтровали. Фильтрат очищали с помощью хроматографии с обращенной фазой (колонка С18 колонка; элюирование: смесь MeCN/вода, модифицированная 0,1% TFA). Фракции, содержащие продукт, объединяли и лиофилизировали, получая трифторацетатную соль метил-5-амино-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата в виде твердого белого вещества (30 мг, выход 63%).
МС (ESI): вычислено для C27H24F3N5O2S [М+Н]+ 540, найдено 540.
[0274] Стадия 3: К раствору трифторацетатной соли метил-5-амино-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (30 мг, 0,056 ммоль) в EtOH (2 мл) добавляли раствор гидроксида натрия (1 мл, 2,000 ммоль), и смесь перемешивали при 70°С в течение 45 минут. Органический растворитель удаляли при пониженном давлении, остаток разбавляли водой, нейтрализовали 2 н. HCl (приблизительно 1 мл), затем экстрагировали этилацетатом, сушили над Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении, затем очищали хроматографией с обращенной фазой (колонка C18 колонка; элюирование: смесь MeCN/вода, модифицированная 0,1% TFA). Фракции, содержащие продукт, объединяли и лиофилизировали с получением трифторацетатной соли 5-амино-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты в виде твердого белого вещества (8,9 мг, 25% выход).
МС (ESI): вычислено для C26H22F3N5O2S [M+H]+ 526, найдено 526.
1H-ЯМР (600 МГц, CD3OD) δ 8,47 (с, 1H), 8,40 (с, 1H), 8,34 (д, J=5,2, 1H), 8,02 (с, 1H), 7,94 (д, J=8,2, 1H), 7,55 (д, J=8,3, 1H), 7,32 (с, 1H), 7,03 (д, J=5,1, 1H), 6,90 (с, 1H), 3,06 (т, J=6,1, 2H), 2,72-2,59 (м, 1H), 2,46-2,38 (м, 1H), 2,34 (с, 3H), 2,07 (с, 1H), 2,01-1,90 (м, 1H).
[0275] Энантиомеры 27 получали, как описано ниже.
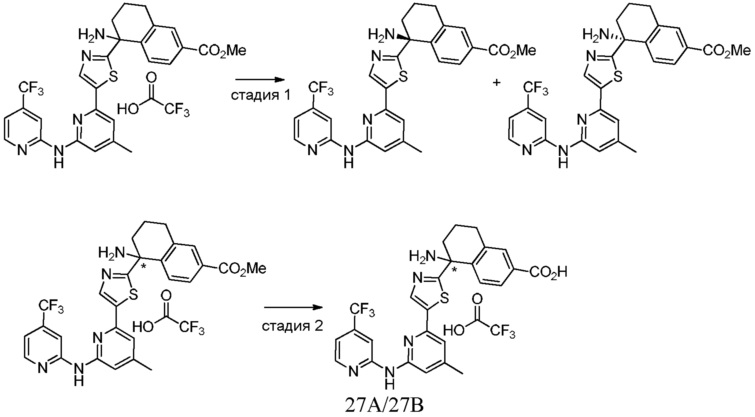
[0276] Стадия 1: Рацемическую 5-амино-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (250 мг, 0,46 ммоль) разделяли с помощью хиральной сверхкритической флюидной хроматографии (колонка: Chiral Technology AS-H 2,1×25 см, 5 мм; элюирование с градиентом: 25-75% MeOH, модифицированный 0,25% Et2NME в СО2). В этих условиях получали два энантиомера метил-5-амино-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата: элюирование при 6,06 мин и 7,93 мин. Фракции, содержащие продукт, собирали и концентрировали при пониженном давлении.
[0277] Энантиомер более быстрого элюирования: 92 мг, твердое не совсем белое вещество.
МС (ESI): вычислено для C27H24F3N5O2S [M+H]+540, найдено 540.
[0278] Энантиомер более медленного элюирования: 146 мг, твердое не совсем белое вещество.
МС (ESI): вычислено для C27H24F3N5O2S [M+H]+ 540, найдено 540.
[0279] Стадия 2: К раствору (R или S)-метил-5-амино-5-(5 - (4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (энантиомер более быстрого элюирования) (80 мг, 0,15 ммоль) в EtOH (2 мл) добавляли 1 М водный раствор NaOH (1 мл). Смесь нагревали до 70°С и перемешивали при указанной температуре в течение 1 часа, после чего органический растворитель удаляли при пониженном давлении. Остаток подкисляли добавлением HCl (1 М, 1 мл), и полученную смесь концентрировали при пониженном давлении. Остаток очищали с помощью ВЭЖХ с обращенной фазой (колонка C18; элюирование: смесь MeCN/вода, модифицированная 0,1% TFA). Фракции, содержащие продукт, лиофилизировали с получением трифторацетатной соли (R или S)-5-амино-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты в виде твердого вещества желтого цвета 27А.
МС (ESI): [М+Н]+ вычислено для C26H22F3N5O2S 526, найдено 526.
1H-ЯМР (500 МГц, ДМСО) δ 10,21 (с, 1H), 9,33 (с, 2H), 8,65 (с, 1H), 8,44 (д, J=5,2, 1H), 8,37 (с, 1H), 7,91 (с, 1H), 7,87 (д, J=8,0, 1H), 7,67 (д, J=8,2, 1H), 7,49 (с, 1H), 7,14 (д, J=5,0, 1H), 7,05 (с, 1H), 2,98-2,94 (м, 2H), 2,54-2,50 (м, 2H), 2,31 (с, 3H), 2,01-1,97 (м, 1H), 1,75-1,63 (м, 1H).
[0280] 27B: Аналогичную методику использовали для получения энантиомера трифторацетатной соли (R или S)-5-амино-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты в виде твердого вещества желтого цвета.
MC (ESI): [M+H]+ вычислено для C26H22F3N5O2S 526, найдено 526.
1H-ЯМР (500 МГц, ДМСО) δ 10,21 (с, 1H), 9,33 (с, 2H), 8,65 (с, 1H), 8,44 (д, J=5,1, 1H), 8,37 (с, 1H), 7,91 (с, 1H), 7,87 (д, J=8,3, 1H), 7,67 (д, J=8,3, 1H), 7,49 (с, 1H), 7,14 (д, J=5,1, 1H), 7,05 (с, 1H), 2,98-2,94 (м, 2H), 2,54-2,50 (м, 2H), 2,31 (с, 3H), 2,04-1,95 (м, 1H), 1,75-1,62 (м, 1H).
Пример 28 - трифторацетатная соль (рац.)-5-ацетамидо-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (28)
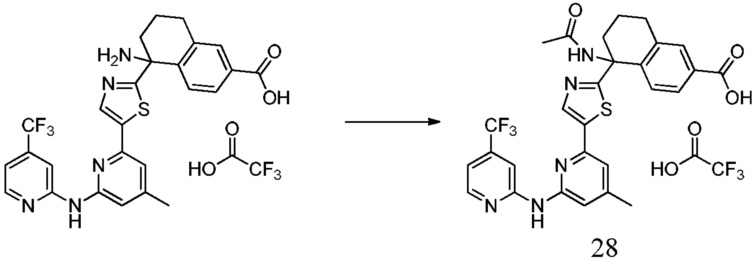
[0281] К раствору трифторацетатной соли 5-амино-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (5 мг, 0,0078 ммоль) в ДХМ (1 мл) и Et3N (2,2 мл) добавляли уксусный ангидрид (1,1 мл, 0,012 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа, после чего растворитель удаляли при пониженном давлении. Полученный остаток растворяли в метаноле (1 мл) и обрабатывали 2 М раствором NaOH (1 мл) при комнатной температуре в течение 10 минут, после этого органический растворитель удаляли при пониженном давлении. Полученную смесь подкисляли 2 н. HCl, затем очищали ВЭЖХ с обращенной фазой (колонка C18; элюирование: смесь MeCN/вода, модифицированная 0,1% TFA). Фракции, содержащие продукт, лиофилизировали с получением трифторацетатной соли 5-ацетамидо-5-(5-(4-метил-6-((4-(трифторметил)пиридин-2-ил)амино)пиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (3,7 мг, 69%) в виде твердого вещества желтого цвета.
MC (ESI): [M+H]+ вычислено для C28H24F3N5O3S 568, найдено 568.
1H-ЯМР (600 МГц, CD3OD) δ 8,37 (д, J=5,4, 1H), 8,31 (с, 1H), 8,26 (с, 1H), 7,86 (с, 1H), 7,79 (д, J=8,3, 1H), 7,51 (д, J=8,3, 1H), 7,35 (с, 1H), 7,18 (д, J=5,1, 1H), 6,95 (с, 1H), 3,09-2,89 (м, 3H), 2,49 (дд, J=11,7, 6,4, 1H), 2,38 (с, 3H), 2,01 (с, 3H), 1,96-1,92 (м, 1H), 1,89-1,79 (м, 1H) м.д.
Пример 29 - (R или S)-5-гидрокси-5-(5-(6-((4-метоксипиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновая кислота (29А и 29В)
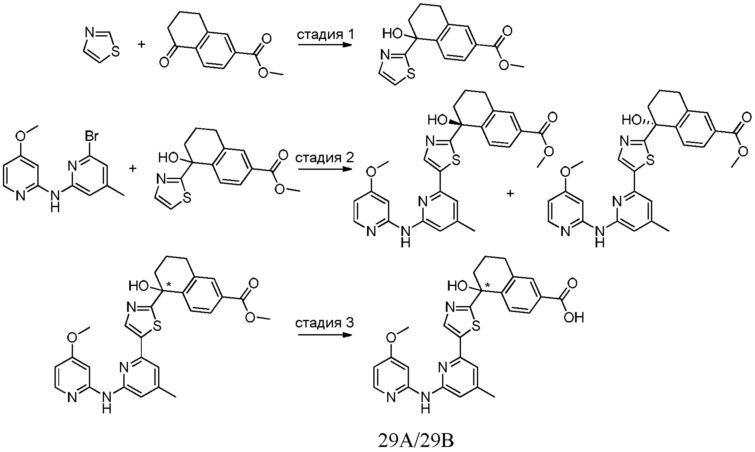
[0282] Стадия 1: Тиазол (14,6 г, 172 ммоль) медленно добавляли к раствору комплекса хлорида изопропилмагния и хлорида лития (142 мл, 1,3 М в ТГФ, 185 ммоль), поддерживая температуру между 0 и 5°С. Полученную суспензию перемешивали в течение 1 часа и затем охлаждали до -20°С. Добавляли раствор метил-5-оксо-5,6,7,8-тетрагидронафталина (27,0 г, 132 ммоль) в ТГФ (50 мл), поддерживая температуру смеси в интервале от 0 до 5°С, и раствор перемешивали в течение 2 часов. Полученную суспензию гасили метанолом (7,5 мл) и затем водой (50 мл) и изопропилацетатом (200 мл) с последующим добавлением 2 М водного раствора HCl (50 мл). Полученный водный слой экстрагировали изопропилацетатом (100 мл), органический слой промывали насыщенным водным раствором бикарбоната натрия (100 мл) и насыщенным раствором соли (100 мл). Полученное вещество очищали на силикагеле с получением метил-5-гидрокси-5-(1,3-тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (38,3 г, 57%).
МС (ESI): [M+H]+ вычислено для C15H15NO3S 290, найдено 290.
[0283] Стадия 2: К раствору Pd(OAc)2 (45 мг, 0,2 ммоль) в 1,4-диоксане (20 мл) добавляли бутилди-1-адамантилфосфин (143 мг, 0,4 ммоль), смесь перемешивали в атмосфере азота в течение 10 минут, в процессе чего происходило образование суспензии желтого цвета. Затем добавляли 6-бром-N-(4-метоксипиридин-2-ил)-4-метилпиридин-2-амин (410 мг, 1,4 ммоль), метил-5-гидрокси-5-(тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилат (289 мг, 1 ммоль), CsF (456 мг, 3 ммоль), пивалиновую кислоту (153 мг, 1,5 ммоль) и 1,4-диоксан (10 мл). Емкость с реакционной смесью вакуумировали и продували N2, затем реакционную смесь кипятили с обратным холодильником в атмосфере N2 в течение 20 часов. После охлаждения до комнатной температуры, реакционную смесь фильтровали через Celite®, органический слой промывали водой и насыщенным раствором соли, сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (система растворителей петролейный эфир/EtOAc 2:1) с получением рацемического метил-5-гидрокси-5-(5-(6-((4-метоксипиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (160 мг, общий выход 52%), который разделяли с помощью сверхкритической флюидной хроматографии (колонка: Chiralpak AS-H 150*4,6 мм ID, 5 мкм; элюирование с градиентом: 5-40% МеОН (0,05% диэтиламина) в СО2; скорость истечения 3 мл/мин при длине волны 220 нм) с получением двух энантиомеров.
MC (ESI): [M+H]+ вычислено для C27H26N4O4S 503, найдено 503.
[0284] Стадия 3: К раствору метил-(R или S)-5-гидрокси-5-(5-(6-((4-метоксипиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоксилата (энантиомер быстрого или медленного элюирования со стадии 2, 101 мг, 0,2 ммоль) в MeOH (6 мл) добавляли раствор гидроксида натрия (2 мл, 0,3 М, 0,6 ммоль), и смесь кипятили с обратным холодильником в течение 1 часа. Метанол удаляли при пониженном давлении, и остаток разбавляли 10 мл воды. Значение рН доводили до 6 с помощью 1 М HCl, в процессе чего происходило осаждение белого осадка. Осадок собирали фильтрованием, промывали водой и сушили с получением (R или S)-5-гидрокси-5-(5-(6-((4-метоксипиридин-2-ил)амино)-4-метилпиридин-2-ил)тиазол-2-ил)-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты.
[0285] 29А (энантиомер более быстрого элюирования): C26H24N4O4S. MC (ESI) [М+Н]+: вычислено 489, найдено 489.
1H-ЯМР (400 МГц, ДМСО) δ м.д. 9,63 (с, 1H), 8,19 (с, 1H), 8,00 (д, J=6 Гц, 1H), 7,63-7,78 (м, 3H), 7,26 (д, J=8,4 Гц, 2H), 7,10 (с, 1H), 6,61 (с, 1H), 6,48 (д, J=3,6 Гц, 1H), 3,87 (с, 3H), 2,85 (с, 2H), 2,25-2,32 (м, 4H), 2,06-2,11 (м, 1H), 1,92-1,97 (м, 2H).
[0286] 29В (энантиомер более медленного элюирования): C26H24N4O4S. MC (ESI) [M+H]+: вычислено 489, найдено 489.
1H-ЯМР (400 МГц, MeOD) δ м.д. 8,22 (д, J=7,2 Гц, 1H), 7,84 (с, 1H), 7,74 (д, J=7,6 Гц, 1H), 7,54, (с, 1H), 7,29 (д, J=8 Гц, 1H), 6,89-6,92 (м, 3H), 2,96-2,97 (м, 2H), 2,42-2,48 (м, 4H), 2,22-2,33 (м, 1H), 2,00-2,09 (м, 2H).
[0287] Представленную ниже пару энантиомеров также получали способом, аналогичным описанному выше в примере 29.
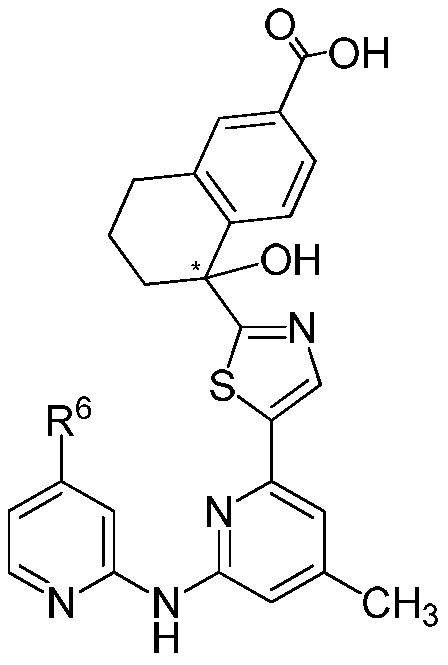
|
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
Анализ рекомбинантного фермента Syk человека методом гомогеннной флуоресценции с разрешением во времени (HTRF)
[0288] Для количественного определения эффективности соединений в ингибировании активности Syk человека использовали рекомбинантный химерный белок GST-hSyk. Рекомбинантный человеческий GST-Syk (Carna Biosciences #08-176) (конечная концентрация 5 пМ) инкубировали с ингибитором, взятым в различных концентрациях при разбавлении ДМСО (конечная концентрация 0,1%), в течение 10 минут при комнатной температуре в смеси 15 мМ Трис-HCl (рН 7,5), 0,01% Tween 20, 2 мМ DTT в 384-луночных микропланшетах. Для инициирования реакции добавляли биотинилированный пептидный субстрат (конечная концентрация 250 нМ), который содержит сайт фосфорилирования для Syk, магнезию (конечная концентрация 5 мМ) и АТФ (конечная концентрация 25 мкΜ). Конечный объем реакционного раствора составлял 10 мкл. Фосфорилирование пептида проводили в течение 45 минут при комнатной температуре. Для гашения реакции и выявления фосфорилированного продукта добавляли 2 нМ антитела европий против фосфотирозина (Perkin Elmer # AD0161) и 70 нМ SA-APC (Perkin-Elmer # CR130-100) в сочетании со смесью 15 мМ Tris, рН 7,5, 40 мМ ЭДТА, 0,01% Tween 20. Конечный объем нейтрализующего раствора составлял 10 мкл. Полученный сигнал HTRF измеряли спустя 30 минут на ридере En Vision (Perkin-Elmer) с использованием протокола флуоресценции с разрешением во времени. IC50 определяли после титрования 10 доз (от 10 мкΜ до 0,508 нМ) и построения четырехпараметрической логистической кривой с использованием анализатора данных биологического испытания. Для соединений, у которых значения IC50 ниже самой низкой концентрации теста, в графе значений IC50 указано "<0,50".
|
|
[0289] Хотя настоящее изобретение было описано со ссылками на конкретные варианты осуществления, описанные выше, при этом множество альтернатив, модификаций и других вариантов осуществления будет очевидно для специалистов данной области техники. Подразумевается, что все такие альтернативы, модификации и варианты осуществления находятся в пределах сущности и объема настоящего изобретения.