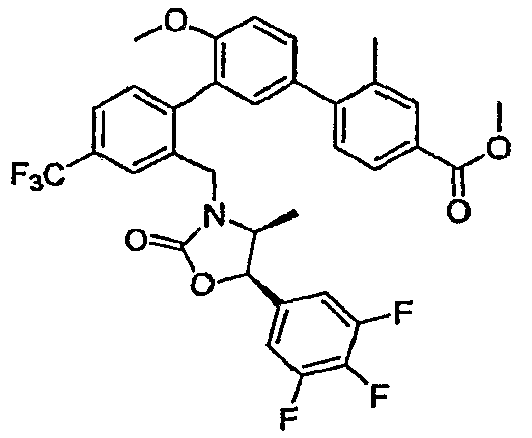
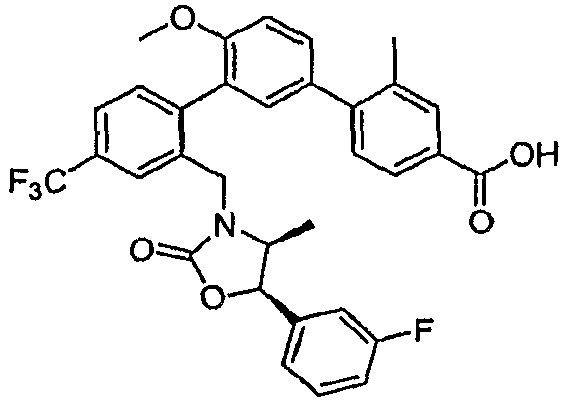
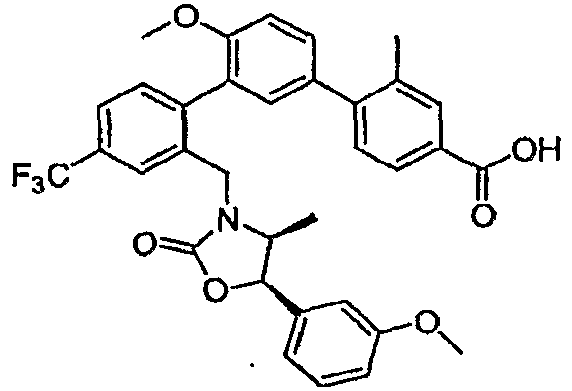
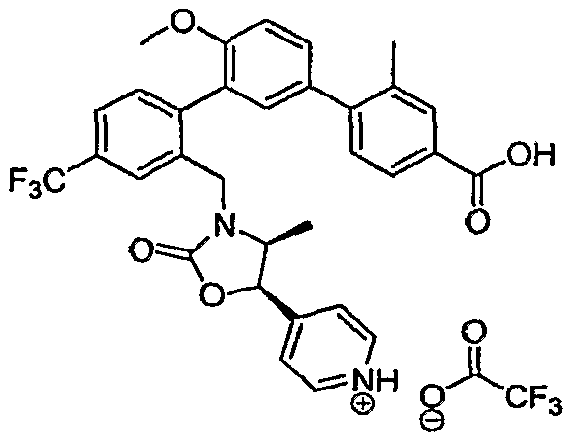
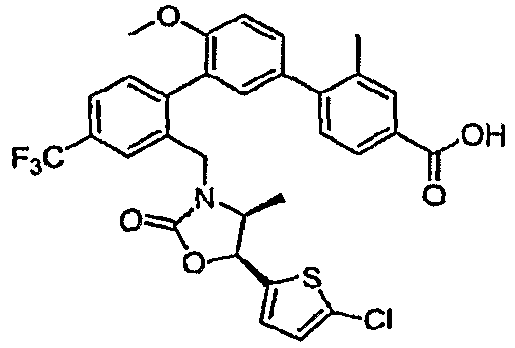
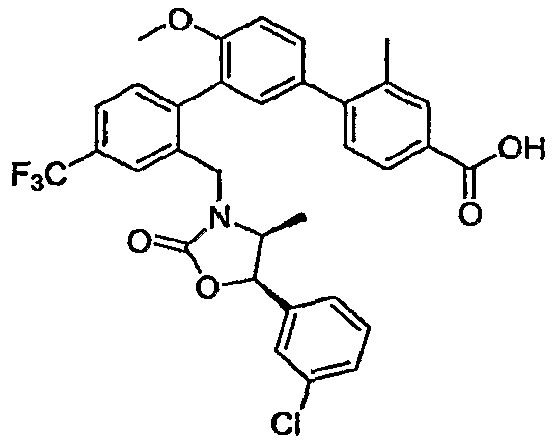
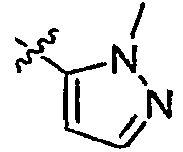
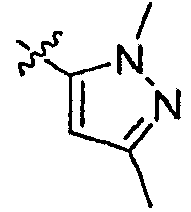
Результат интеллектуальной деятельности: ИНГИБИТОРЫ СЕТР
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к классу химических соединений, которые ингибируют белок-переносчик эфиров холестерина (СЕТР) и, таким образом, пригодны для повышения уровня HDL-холестерина, снижения уровня LDL-холестерина и для лечения и предупреждения атеросклероза.
Уровень техники
Атеросклероз и его клинические последствия, ишемическая болезнь сердца (ИБС), инсульт и заболевания периферических сосудов, ложатся поистине чудовищным бременем на системы здравоохранения индустриально развитых стран. Только в Соединенных Штатах диагноз ИБС поставлен приблизительно 13 миллионам пациентов, а ежегодно на счет ИБС относят более полумиллиона смертей. Более того, ожидается, что эта дань возрастет в течение ближайшей четверти века, поскольку эпидемия ожирения и диабета продолжает распространяться.
Давно отмечено, что у млекопитающих вариации профилей циркулирующих липопротеинов коррелируют с риском развития атеросклероза и ИБС. Клинические успехи ингибиторов HMG-CoA-редуктазы, в частности статинов, в снижении частоты возникновения коронарных заболеваний основываются на снижении циркулирующего холестерина липопротеинов низкой плотности (LDL-C), уровни которого напрямую коррелируют с повышенным риском развития атеросклероза. Недавно проведенные эпидемиологические исследования показали, что существует обратная зависимость между уровнями холестерина липопротеинов высокой плотности (HDL-C) и развитием атеросклероза, и это заставляет сделать вывод о том, что низкие уровни HDL-C в сыворотке связаны с повышенным риском развития ИБС.
Метаболическая регуляция уровней липопротеинов представляет собой сложный и динамичный процесс, включающий множество факторов. Одним из важных факторов регулирования обмена у людей является белок-переносчик эфиров холестерина (СЕТР) - находящийся в плазме гликопротеин, который катализирует движение эфиров холестерина от HDL к apoB-содержащим липопротеинам, в частности VLDL (см. Hesler, C.B. et al (1987) Purification and characterization of human plasma cholesteryl ester transfer protein. J. Biol. Chem. 262(5), 2275-2282)). В физиологических условиях следующим взаимодействием является гетерообмен, в результате которого СЕТР переносит триглицерид от apoB-содержащих липопротеинов к HDL и транспортирует холестерин от HDL к apoB липротеинам.
У людей СЕТР выполняет функцию обращения переноса холестерина, посредством которого холестерин возвращается в печень из периферических тканей. Интересно отметить, что многие животные не имеют СЕТР, в том числе животные, которые имеют высокие уровни HDL, но, как известно, устойчивы к развитию ишемической болезни сердца, например, грызуны (см. Guyard-Dangremont, V. et al., (1998) Phospholipid and cholesteryl ester transfer activities in plasma from 14 vertebrate species. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 120(3), 517-525). Были проведены многочисленные эпидемиологические исследования, связывающие эффект естественных вариаций активности СЕТР с риском развития ишемической болезни сердца, включая изучение небольшого числа известных нулевых мутаций человека (см. Hirano, K.-I., Yamashita, S. and Matsuzawa, Y. (2000) Pros and cons of inhibiting cholesteryl ester transfer protein, Curr. Opin. Lipidol. 11(6), 589-596). Указанные исследования показывают явную обратную зависимость между концентрацией HDL-C в плазме и активностью СЕТР (см. см. Inazu, A., et al. (2000) Cholesteryl ester transfer protein and atherosclerosis, Curr. Opin. Lipidol. 11(4), 389-396) и приводят к гипотезе, что фармакологическое ингибирование активности СЕТР в липидном переносе может оказать благотворное действие на людей за счет увеличения уровней HDL-C при одновременном снижении уровней LDL.
Несмотря на значительные терапевтические успехи, которые обеспечивают статины, такие как симвастатин (ZOCOR®), статины позволяют снизить риск лишь приблизительно в одной трети попыток лечения и предупреждения атеросклероза и вызываемых атеросклерозом заболеваний. В настоящее время доступно немного фармакологических способов лечения, которые заметно повышают уровни циркулирующего HDL-C. Определенные статины и некоторые фибраты дают умеренное увеличение HDL-C. Ниацин, оказывающий наиболее эффективное терапевтическое действие на повышение HDL-C, которое было документально подтверждено в клинических условиях, имеет недостаток, связанный с соблюдением пациентами режимов и схемы лечения, что частично вызвано побочными эффектами, такими как приливы. Средство, которое безопасно и эффективно повышает уровни холестерина HDL, позволило бы решить значительную, но пока неудовлетворенную медицинскую потребность за счет разработки способов фармакологической терапии, которые могли бы значительно улучшить профили циркулирующих липидов посредством механизма, дополняющего существующие способы лечения.
Новые классы химических соединений, которые ингибируют СЕТР, исследуются в различных фармацевтических компаниях или проходят клинические испытания. На рынке в настоящее время нет ингибиторов СЕТР. Клинические испытания торцетрапиба, представляющего собой ингибитор СЕТР, в компании Pfizer были недавно прекращены вследствие повышенной смертности пациентов, принимавших указанное лекарство в процессе проведения исследований по изучению последствий его действия. Необходимы новые соединения с тем, чтобы можно было получить одно или несколько фармацевтических соединений, которые безопасны и эффективны. Новые соединения, приведенные в настоящем описании, являются весьма действенными ингибиторами СЕТР.
Сущность изобретения
Соединения, имеющие Формулу I, включая фармацевтически приемлемые соли указанных соединений, являются ингибиторами СЕТР, которые пригодны для указанного ниже использования, где:
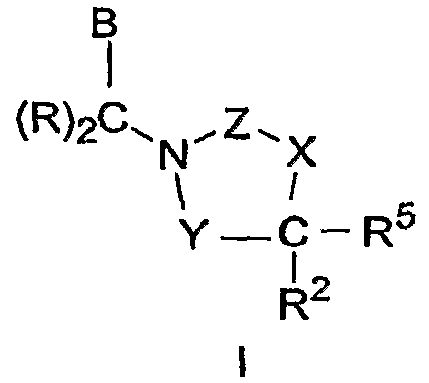
Y выбран из группы, которая включает -С(=О)- и -(CRR1)-;
X выбран из группы, которая включает -О-, -NH-, -N(C1-C5алкил)- и -(CRR6)-;
Z выбран из группы, которая включает -С(=О)-, -S(O)2- и
-С(=N-R9), где R9 выбран из группы, которая включает H, -CN и
C1-C5алкил, необязательно замещенный 1-11 атомами галогена;
каждый R независимо выбран из группы, которая включает H,
C1-C5алкил и атом галогена, где C1-C5алкил необязательно замещен 1-11 атомами галогена;
В выбран из группы, которая включает А1 и А2, где А1 имеет структуру:
R1 и R6 каждый выбран из группы, которая включает H,
-C1-C5алкил, атом галогена и -(C(R)2)nA2, где -C1-C5алкил необязательно замещен 1-11 атомами галогена;
R2 выбран из группы, которая включает H, -C1-C5алкил, атом галогена, А1 и -(C(R)2)nA2, где -C1-C5алкил необязательно замещен 1-11 атомами галогена;
где один из В и R2 обозначает А1; и один из В, R1, R2 и R6 обозначает А2 или -(C(R)2)nA2; так что соединение Формулы I включает одну группу А1 и одну группу А2;
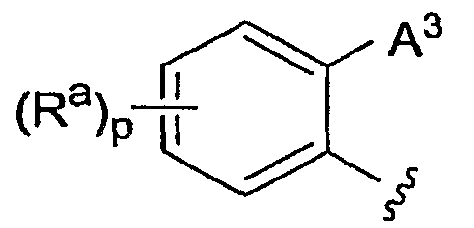
А3 выбран из группы, которая включает:
(a) ароматический цикл, выбранный из фенила и нафтила;
(b) фенильный цикл, конденсированный с (5-7)-членным неароматическим циклоалкилом, который необязательно содержит 1-2 двойные связи;
(c) (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу, где точкой присоединения А3 к фенильному циклу, к которому присоединен А3, является атом углерода; и
(d) бензогетероцикл, включающий фенильный цикл, конденсированный с (5-6)-членным гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и -S(O)x-, и необязательно 1-2 двойные связи, где точкой присоединения А3 к фенильному циклу, к которому присоединен А3, является атом углерода;
при этом А3 замещен одной группой А4 и необязательно замещен 1-4 группами Ra;
А2 выбран из группы, которая включает:
(a) ароматический цикл, выбранный из фенила и нафтила;
(b) фенильный цикл, конденсированный с (5-7)-членным неароматическим циклоалкилом, который необязательно содержит 1-2 двойные связи;
(c) (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу;
(d) бензогетероцикл, включающий фенильный цикл, конденсированный с (5-6)-членным гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и S, и необязательно 1-2 двойные связи; и
(е) -С3-С8 циклоалкил, необязательно содержащий 1-3 двойные связи;
при этом А2 необязательно замещен 1-5 замещающими группами, независимо выбранными из Ra;
А4 выбран из группы, которая включает:
(a) ароматический цикл, выбранный из фенила и нафтила;
(b) фенильный цикл, конденсированный с (5-7)-членным неароматическим циклоалкилом, который необязательно содержит 1-2 двойные связи;
(c) (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу;
(d) бензогетероцикл, включающий фенильный цикл, конденсированный с (5-6)-членным гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и -S(O)x-, и необязательно 1-2 двойные связи;
при этом в том случае, когда А4 обозначает: (a) ароматический цикл, выбранный из фенила и нафтила; (b) фенильный цикл, конденсированный с (5-7)-членным неароматическим циклоалкилом, который необязательно содержит 1-2 двойные связи; (c) (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу, где точкой присоединения гетероцикла к А3 является атом N в А4; или (d) бензогетероцикл, включающий фенильный цикл, конденсированный с (5-6)-членным гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и -S(O)x-, и необязательно 1-2 двойные связи; то А4 необязательно замещен 1-5 группами Ra;
а когда А4 обозначает (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу, где точкой присоединения гетероцикла к А3 является атом углерода в А4, то А4 замещен одной группой Re и необязательно также замещен 1-4 группами независимо выбранными из Ra;
каждый Ra независимо выбран из группы, которая включает -C1-C6алкил, -C2-C6алкенил, -C2-C6алкинил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC1-C6алкил, -ОC2-C6алкенил, -ОC2-C6алкинил, -ОC3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -С(=О)C1-C6алкил, -С(=О)C3-C8циклоалкил, -С(=О)Н, -СО2Н,-СО2C1-C6алкил, -C(=O)SC1-C6алкил, -ОН, -NR3R4, -C(=O)NR3R4, -NR3C(=О)ОC1-C6алкил, -NR3C(=О)NR3R4, -S(O)xC1-C6алкил, -S(O)yNR3R4, -NR3S(O)yNR3R4, атом галогена, -CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S и О, при этом указанный гетероцикл необязательно также включает карбонильную группу и необязательно также включает 1-3 двойные связи, где точкой присоединения указанного гетероцикла к циклу, к которому присоединен Ra, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена, -C1-C3алкила и -ОC1-C3алкила, где -C1-C3алкил и -ОC1-C3алкил необязательно замещены 1-7 атомами галогена;
при этом для соединений, в которых Ra выбран из группы, включающей -C1-C6алкил, -C2-C6алкенил, -C2-C6алкинил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC1-C6алкил, -ОC2-C6алкенил, -ОC2-C6алкинил, -ОC3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -С(=О)C1-C6алкил, -С(=О)C3-C8циклоалкил, -СО2C1-C6алкил, -C(=O)SC1-C6алкил, -NR3C(=О)ОC1-C6алкил и -S(O)xC1-C6алкил, Ra необязательно замещен 1-15 атомами галогена и необязательно замещен 1-3 замещающими группами, независимо выбранными из: (а) -ОН, (b) -CN, (c) -NR3R4, (d) -C3-C8циклоалкила, необязательно содержащего 1-3 двойные связи и необязательно замещенного 1-15 атомами галогена, (е) -ОC1-C4алкила, необязательно замещенного 1-9 атомами галогена и необязательно замещенного 1-2 замещающими группами, которые независимо выбраны из -ОC1-C2алкила и фенила, (f) -ОC3-C8циклоалкила, необязательно содержащего 1-3 двойные связи и необязательно замещенного 1-15 атомами галогена, (g) -CO2H, (h) -C(=O)CH3, (i) -СО2C1-C4алкила, который необязательно замещен 1-9 атомами галогена, и (j) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3;
каждый Rе независимо выбран из группы, которая включает -C2-C6алкенил, -C2-C6алкинил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC2-C6алкенил, -ОC2-C6алкинил, -ОC3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -С(=О)C1-C6алкил, -С(=О)C3-C8циклоалкил, -С(=О)Н, -СО2Н, -СО2C1-C6алкил, -C(=O)SC1-C6алкил, -ОН, -NR3R4, -C(=O)NR3R4, -NR3C(=О)ОC1-C6алкил, -NR3C(=О)NR3R4, -S(O)xC1-C6алкил, -S(O)yNR3R4, -NR3S(O)yNR3R4, -CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S и О, при этом указанный гетероцикл необязательно также включает карбонильную группу и необязательно также включает 1-3 двойные связи, где точкой присоединения указанного гетероцикла к циклу, к которому присоединен Rе, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена, -C1-C3алкила и -ОC1-C3алкила, где -C1-C3алкил и -ОC1-C3алкил необязательно замещены 1-7 атомами галогена;
при этом для соединений, в которых Rе выбран из группы, включающей -C2-C6алкенил, -C2-C6алкинил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC2-C6алкенил, -ОC2-C6алкинил, -ОC3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -С(=О)C1-C6алкил, -С(=О)C3-C8циклоалкил, -СО2C1-C6алкил, -C(=O)SC1-C6алкил, -NR3C(=О)ОC1-C6алкил и -S(O)xC1-C6алкил, Rе необязательно замещен 1-15 атомами галогена и необязательно замещен 1-3 замещающими группами, независимо выбранными из: (а) -ОН, (b) -CN, (c) -NR3R4, (d) -C3-C8циклоалкила, необязательно содержащего 1-3 двойные связи и необязательно замещенного 1-15 атомами галогена, (е) -ОC1-C4алкила, необязательно замещенного 1-9 атомами галогена и необязательно замещенного 1-2 замещающими группами, которые независимо выбраны из -ОC1-C2алкила и фенила, (f) -ОC3-C8циклоалкила, необязательно содержащего 1-3 двойные связи и необязательно замещенного 1-15 атомами галогена, (g) -CO2H, (h) -C(=O)CH3, (i) -СО2C1-C4алкила, который необязательно замещен 1-9 атомами галогена, и (j) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3;
n обозначает 0 или 1;
р обозначает целое число, равное 0-4;
х обозначает 0, 1 или 2;
y обозначает 1 или 2;
R3 и R4 каждый независимо выбран из H, -C1-C5алкила, -С(=О)C1-C5алкила и -S(O)yC1-C5алкила, где -C1-C5алкил во всех случаях необязательно замещен 1-11 атомами галогена; и
R5 выбран из группы, которая включает H, -ОН, -C1-C5алкил и атом галогена, где -C1-C5алкил необязательно замещен 1-11 атомами галогена.
Во всех соединениях Формулы I и нижеописанных соединениях алкильные, алкенильные и алкинильные группы, если не указано иное, могут быть линейными или разветвленными.
Подробное описание изобретения
В способах осуществления настоящего изобретения соединения имеют Формулу Ia, Ib или Id, в том числе представляют собой фармацевтически приемлемые соли.
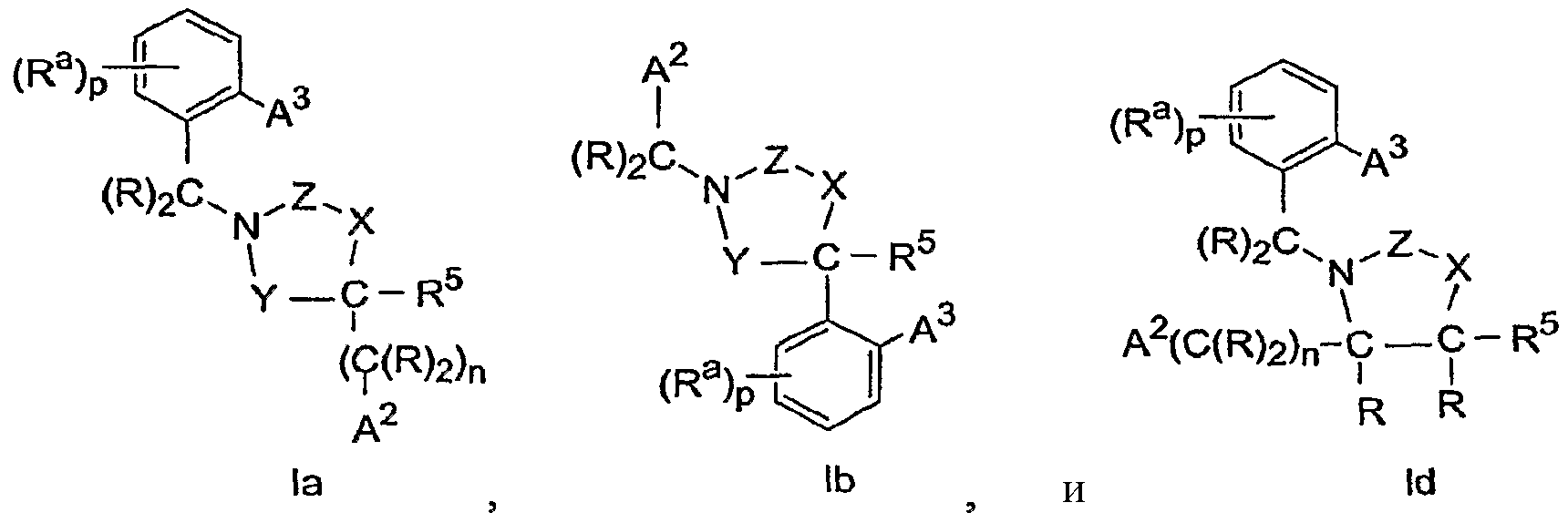
В способах осуществления настоящего изобретения группами в структурах независимо друг от друга являются следующие группы:
Y обозначает -(CRR1)-.
R и R6 каждый независимо выбраны из группы, которая включает Н и -C1-C5алкил, где -C1-C5алкил необязательно замещен 1-11 атомами галогена.
R1 выбран из группы, которая включает H, -C1-C5алкил и
-(C(R)2)nA2, где -C1-C5алкил необязательно замещен 1-11 атомами галогена;
где один из В и R2 обозначает А1; и один из В, R1 и R2 обозначает A2 или -(C(R)2)nA2; так что соединение Формулы I включает одну группу А1 и одну группу А2.
А3 выбран из группы, которая включает:
(a) ароматический цикл, выбранный из фенила и нафтила;
(b) (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу, где точкой присоединения А3 к фенильному циклу, к которому присоединен А3, является атом углерода; и
(с) бензогетероцикл, включающий фенильный цикл, конденсированный с (5-6)-членным гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и -S(O)x-, и необязательно 1-2 двойные связи, где точкой присоединения А3 к фенильному циклу, к которому присоединен А3, является атом углерода;
при этом А3 замещен одной группой А4 и необязательно замещен 1-4 группами Ra.
А2 выбран из группы, которая включает:
(a) ароматический цикл, выбранный из фенила и нафтила;
(b) (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу;
(с) бензогетероцикл, включающий фенильный цикл, конденсированный с (5-6)-членным гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и S, и необязательно 1-2 двойные связи; и
(d) -С3-С8 циклоалкил, необязательно содержащий 1-3 двойные связи;
при этом А2 необязательно замещен 1-5 замещающими группами, независимо выбранными из Ra.
Каждый Ra независимо выбран из группы, которая включает -C1-C6алкил, -C2-C6алкенил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC1-C6алкил, -С(=О)C1-C6алкил, -С(=О)Н, -СО2Н, -СО2C1-C6алкил, -ОН, -NR3R4, -NR3C(=О)ОC1-C6алкил, -S(O)xC1-C6алкил, атом галогена, -CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S и О, при этом указанный гетероцикл необязательно также включает карбонильную группу и необязательно также включает 1-3 двойные связи, где точкой присоединения указанного гетероцикла к циклу, к которому присоединен Ra, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена, -C1-C3алкила и -ОC1-C3алкила, где -C1-C3алкил и -ОC1-C3алкил необязательно замещены 1-7 атомами галогена;
при этом для соединений, в которых Ra выбран из группы, включающей -C1-C6алкил, -C2-C6алкенил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC1-C6алкил, -С(=О)C1-C6алкил, -СО2C1-C6алкил, -NR3C(=О)ОC1-C6алкил и -S(O)xC1-C6алкил, Ra необязательно замещен 1-15 атомами галогена и необязательно замещен одной замещающей группой, выбранной из: (а) -ОН, (b) -NR3R4, (с) -ОC1-C4алкила, необязательно замещенного 1-9 атомами галогена и необязательно замещенного 1-2 замещающими группами, которые независимо выбраны из -ОC1-C2алкила и фенила, и (d) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3.
Каждый Rе независимо выбран из группы, которая включает -C2-C6алкенил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -С(=О)C1-C6алкил, -С(=О)Н, -СО2Н, -СО2C1-C6алкил, -ОН, -NR3R4, -NR3C(=О)ОC1-C6алкил, -S(O)xC1-C6алкил, -CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S и О, при этом указанный гетероцикл необязательно включает также карбонильную группу и необязательно включает также 1-3 двойные связи, где точкой присоединения указанного гетероцикла к циклу, к которому присоединен Rе, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена, -C1-C3алкила и -ОC1-C3алкила, где -C1-C3алкил и -ОC1-C3алкил необязательно замещены 1-7 атомами галогена;
при этом для соединений, в которых Rе выбран из группы, включающей -C2-C6алкенил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -С(=О)C1-C6алкил, -СО2C1-C6алкил, -NR3C(=О)ОC1-C6алкил и -S(O)xC1-C6алкил, Rе необязательно замещен 1-15 атомами галогена и необязательно замещен одной замещающей группой, выбранной из: (а) -ОН, (b) -NR3R4, (с) -ОC1-C4алкила, необязательно замещенного 1-9 атомами галогена и необязательно также замещенного 1-2 замещающими группами, которые независимо выбраны из -ОC1-C2алкила и фенила, и (d) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3.
р обозначает целое число, равное 0-2.
R3 и R4 каждый независимо выбран из H и -C1-C5алкила, где
-C1-C5алкил во всех случаях необязательно замещен 1-11 атомами галогена.
R5 выбран из группы, которая включает H, -ОН, -C1-C5алкил, где -C1-C5алкил необязательно замещен 1-11 атомами галогена.
Z выбран из группы, которая включает -С(=О)-, -S(O)2- и
-C(=N-R9), где R9, выбран из группы, включающей H, -CN и СН3.
Каждый R независимо выбран из группы, включающей Н и -C1-C2алкил.
R6 выбран из группы, включающей H и -C1-C3алкил, где -C1-C3алкил необязательно замещен 1-5 атомами галогена.
R1 выбран из группы, включающей H и -C1-C3алкил и -(C(R)2)nA2, где -C1-C5алкил необязательно замещен 1-5 атомами галогена.
R2 выбран из группы, которая включает H, -C1-C3алкил, А1 и
-(C(R)2)nA2, где -C1-C3алкил необязательно замещен 1-5 атомами галогена, где один из В и R2 обозначает А1 и один из В, R1 и R2 обозначает А2 или -(C(R)2)nA2; так что соединение Формулы I включает одну группу А1 и одну группу А2.
А3 выбран из группы, которая включает:
(a) фенил;
(b) (5-6)-членный ароматический гетероцикл, содержащий 1-2 гетероатома, независимо выбранных из N, S, O и -N(O)-, где точкой присоединения А3 к фенильному циклу, к которому присоединен А3, является атом углерода; и
(с) бензогетероцикл, включающий фенильный цикл, конденсированный с 5-членным ароматическим гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и -S(O)x-, где точкой присоединения А3 к фенильному циклу, к которому присоединен А3, является атом углерода;
при этом А3 замещен одной группой А4 и необязательно замещен 1-4 группами Ra.
А2 выбран из группы, которая включает:
(a) фенил;
(b) (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи;
(с) бензогетероцикл, включающий фенильный цикл, конденсированный с 5-членным гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и S; и
(d) -С5-С6 циклоалкил;
при этом А2 необязательно замещен 1-5 замещающими группами, независимо выбранными из Ra.
Каждый Ra независимо выбран из группы, которая включает -C1-C4алкил, -C2-C4алкенил, циклопропил, -ОC1-C2алкил, -С(=О)C1-C2алкил, -С(=О)Н, -СО2Н, -СО2C1-C4алкил, -ОН, -NR3R4, -NR3C(=О)ОC1-C4алкил, -S(O)xC1-C2алкил, атом галогена, -CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-2 гетероатома, независимо выбранных из N, S и О, где точкой присоединения указанного гетероцикла к циклу, к которому присоединен Ra, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена;
при этом для соединений, в которых Ra выбран из группы, включающей -C1-C4алкил, -C2-C4алкенил, -ОC1-C2алкил, -С(=О)C1-C2алкил, -СО2C1-C4алкил, -NR3C(=О)ОC1-C4алкил и -S(O)xC1-C2алкил, алкильная группа в Ra необязательно замещена 1-5 атомами галогена, а также необязательно замещена одной замещающей группой, выбранной из: (а) -ОН, (b) -NR3R4, (с) -ОCН3, необязательно замещенного 1-3 атомами фтора и необязательно замещенного также одной фенильной группой, и (d) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3.
Каждый Rе независимо выбран из группы, которая включает -C2-C4алкенил, циклопропил, -С(=О)C1-C2алкил, -С(=О)Н, -СО2Н, -СО2C1-C4алкил, -ОН, -NR3R4, -NR3C(=О)ОC1-C4алкил, -S(O)xC1-C2алкил,-CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-2 гетероатома, независимо выбранных из N, S и О, где точкой присоединения указанного гетероцикла к циклу, к которому присоединен Rе, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена;
при этом для соединений, в которых Rе выбран из группы, включающей -C2-C4алкенил, -С(=О)C1-C2алкил, -СО2C1-C4алкил, -NR3C(=О)ОC1-C4алкил и -S(O)xC1-C2алкил, алкильная группа в Rе необязательно замещена 1-5 атомами галогена, а также необязательно замещена одной замещающей группой, выбранной из: (а) -ОН, (b) -NR3R4, (с) -ОCН3, необязательно замещенного 1-3 атомами фтора и необязательно замещенного одной фенильной группой, и (d) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3.
р обозначает целое число, равное 0-2.
R3, R4 и R5 каждый независимо выбран из H и -C1-C3алкила.
Во многих вариантах осуществления настоящего изобретения используются следующие определения:
Х обозначает -О-;
Z обозначает -С(=О)-;
Y обозначает -СНR1, где R1 выбран из -C1-C2алкила;
R и R5 обозначают Н;
R2 и В каждый выбран из А1 и А2, где один из R2 и В обозначают А1, а другой из R2 и В обозначают А2;
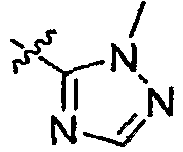
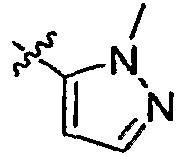
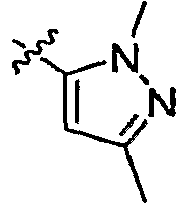
А2 выбран из группы, включающей фенил, пиридил, пиразолил, тиенил, 1,2,4-триазолил и имидазолил;
А3 выбран из группы, включающей фенил, тиазолил и пиразолил;
А4 выбран из группы, включающей фенил, пиридил, тиазолил, пиразолил, 1,2,4-триазолил, пиримидинил, пиперидинил, пирролидинил и азетидинил;
А2 необязательно замещен 1-3 заместителями, независимо выбранными из атома галогена, -ОCH3 и -ОCF3 и -C1-C3алкила, необязательно замещенного 1-3 атомами галогена;
А3 замещен одной группой А4 и необязательно замещен 1-2 заместителями, независимо выбранными атома галогена, -ОН, -ОCF3 и
-C1-C3алкила, необязательно замещенного 1-3 атомами галогена;
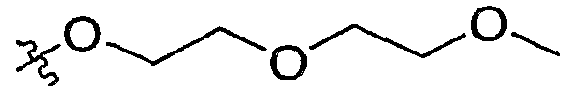
А4 необязательно замещен 1-3 заместителями, независимо выбранными из группы, которая включает: (а) -C1-C5алкил, необязательно замещенный 1-3 атомами галогена и необязательно замещенный группой -ОН, (b) -C2-C4алкенил, необязательно замещенный 1-3 атомами галогена, (с) -С(=О)C1-C2алкил, необязательно замещенный 1-3 атомами галогена и необязательно замещенный одной группой, выбранной из -ОН, -СО2СН3, -С(=О)СН3, -NR3R4 и -ОC1-C2алкиленОC1-C2алкила, (d) -С(=О)Н, (е) -СО2Н, (f) -СО2C1-C4алкил, необязательно замещенный одной группой, выбранной из -С(=О)C1-C2алкила, -ОН, -СО2СН3, -СО2Н, -NR3R4 и -ОC1-C2алкиленОC1-C2алкила, (g) -ОН, (h) -S(O)xC1-C2алкил, (i) атом галогена, (j) -CN, (k) -NO2, (l) -C(=O)NR3R4, (m) -ОC1-C2алкиленОC1-C2алкил, (n) -ОC1-C3алкил, необязательно замещенный 1-3 атомами галогена, (о) -С(=О)C1-C2алкил, необязательно замещенный 1-3 атомами галогена и необязательно замещенный одной группой, выбранной из -ОН, -СО2СН3, -NR3R4 и -ОC1-C2алкиленОC1-C2алкила, (р) -NR3C(=О)ОC1-C2алкил, (q) -NR3R4 и (r) -S(O)xNR3R4,
при условии, что если А4 обозначает гетероциклическую группу, присоединенную к А3 посредством кольцевого атома углерода в А4, то, по крайней мере, один заместитель в А4 должен быть выбран из Rе, где Rе выбран из группы, которая включает: (а) -C1-C5алкил, замещенный группой -ОН, и необязательно замещенный 1-3 атомами галогена, (b) -C2-C4алкенил, необязательно замещенный 1-3 атомами галогена, (с) -С(=О)C1-C2алкил, необязательно замещенный 1-3 атомами галогена и необязательно замещенный одной группой, выбранной из -ОН, -СО2СН3, -С(=О)СН3, -NR3R4 и -ОC1-C2алкиленОC1-C2алкила, (d) -С(=О)Н, (е) -СО2Н, (f) -СО2C1-C4алкил, необязательно замещенный одной группой, выбранной из -С(=О)C1-C2алкила, -ОН, -СО2СН3, -СО2Н, -NR3R4 и -ОC1-C2алкиленОC1-C2алкила, (g) -ОН, (h) -S(O)xC1-C2алкил, (i) -CN, (j) -NO2, (k) -C(=O)NR3R4, (l) -ОC1-C2алкиленОC1-C2алкил, (m) -С(=О)C1-C2алкил, необязательно замещенный 1-3 атомами галогена и необязательно замещенный одной группой, выбранной из -ОН, -СО2СН3, -NR3R4 и -ОC1-C2алкиленОC1-C2алкила, (n) -NR3C(=О)ОC1-C2алкил, (o) -NR3R4 и (p) -S(O)xNR3R4;
Ra выбран из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3;
R3 и R4 каждый независимо выбран из Н и СН3; и
х равно 0, 1 или 2.
В вариантах осуществления настоящего изобретения В обозначает А1, а R2 обозначает А2.
В вариантах осуществления настоящего изобретения В обозначает А2, а R2 обозначает А1.
В вариантах осуществления настоящего изобретения А2, А3 и А4 обозначают фенил.
В вариантах осуществления настоящего изобретения каждый Ra выбран из группы, которая содержит: (а) -C1-C4алкил, необязательно замещенный 1-5 атомами фтора и необязательно замещенный одной группой, выбранной из -ОН, -ОСН3 и -NR3R4; (b) -ОC1-C2алкил, необязательно замещенный 1-3 атомами фтора; (с) -C2-C4алкенил; (d) -C1-C2алкил-О-C1-C2алкилфенил; (е) циклопропил; (f) -С(=О)Н; (g) -СО2Н; (h) -СО2C1-C4алкил; (i) -OH; (j) -NR3R4; (k) -S(O)xC1-C2алкил; (l) атом галогена; (m) -CN; (n) -NO2; и (о) (5-6)-членный гетероцикл, включающий 1-2 атома кислорода, который необязательно замещен -C1-C2алкилом.
В других вариантах осуществления настоящего изобретения соединения имеют Формулу Ic, включая их фармацевтически приемлемые соли,
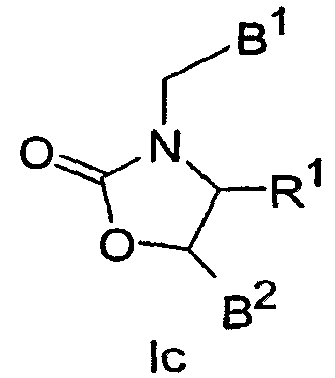
где один из В1 и В2 обозначает
а другой из В1 и В2 обозначает Ar1(Rc)u;
Ar1 выбран из группы, которая включает:
(a) ароматический цикл, выбранный из фенила и нафтила;
(b) фенильный цикл, конденсированный с (5-7)-членным неароматическим циклоалкилом, который необязательно содержит 1-2 двойные связи;
(c) (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу;
(d) бензогетероцикл, включающий фенильный цикл, конденсированный с (5-6)-членным гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и S, и необязательно 1-2 двойные связи; и
(е) -С3-С8 циклоалкил, необязательно содержащий 1-3 двойные связи;
Аr2 выбран из группы, которая включает:
(a) ароматический цикл, выбранный из фенила и нафтила;
(b) фенильный цикл, конденсированный с (5-7)-членным неароматическим циклоалкилом, который необязательно содержит 1-2 двойные связи;
(c) бензогетероцикл, включающий фенильный цикл, конденсированный с (5-6)-членным гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и S, и необязательно 1-2 двойные связи; и
(d) (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу;
R1 выбран из группы, которая включает H, -C1-C5алкил и атом галогена, где -C1-C5алкил необязательно замещен 1-11 атомами галогена;
R3 и R4 каждый независимо выбран из H, -C1-C5алкила, -С(=О)C1-C5алкила и -S(O)yC1-C5алкила, где -C1-C5алкил во всех случаях необязательно замещен 1-11 атомами галогена;
каждый Ra, Rb, Rc и Rd независимо выбран из группы, которая включает -C1-C6алкил, -C2-C6алкенил, -C2-C6алкинил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC1-C6алкил, -ОC2-C6алкенил, -ОC2-C6алкинил, -ОC3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -С(=О)C1-C6алкил, -С(=О)C3-C8циклоалкил, -С(=О)Н, -СО2Н, -СО2C1-C6алкил, -C(=O)SC1-C6алкил, -ОН, -NR3R4, -C(=O)NR3R4, -NR3C(=О)ОC1-C6алкил, -NR3C(=О)NR3R4, -S(O)xC1-C6алкил, -S(O)yNR3R4, -NR3S(O)yNR3R4, атом галогена, -CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S и О, при этом указанный гетероцикл необязательно также включает карбонильную группу и необязательно также включает 1-3 двойные связи, где точкой присоединения указанного гетероцикла к циклу, к которому присоединены Ra, Rb, Rc или Rd, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена, -C1-C3алкила и -ОC1-C3алкила, где -C1-C3алкил и -ОC1-C3алкил необязательно замещены 1-7 атомами галогена;
при этом когда Ra, Rb, Rc и Rd выбраны из группы, включающей -C1-C6алкил, -C2-C6алкенил, -C2-C6алкинил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC1-C6алкил, -ОC2-C6алкенил, -ОC2-C6алкинил, -ОC3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -С(=О)C1-C6алкил, -С(=О)C3-C8циклоалкил, -СО2C1-C6алкил, -C(=O)SC1-C6алкил, -NR3C(=О)ОC1-C6алкил и -S(O)xC1-C6алкил, то Ra, Rb, Rc и Rd необязательно замещены 1-15 атомами галогена и необязательно замещены 1-3 замещающими группами, независимо выбранными из: (а) -ОН, (b) -CN, (c) -NR3R4, (d) -C3-C8циклоалкила, необязательно содержащего 1-3 двойные связи и необязательно замещенного 1-15 атомами галогена, (е) -ОC1-C4алкила, необязательно замещенного 1-9 атомами галогена и необязательно замещенного 1-2 замещающими группами, которые независимо выбраны из -ОC1-C2алкила и фенила, (f) -ОC3-C8циклоалкила, необязательно содержащего 1-3 двойные связи и необязательно замещенного 1-15 атомами галогена, (g) -CO2H, (h) -C(=O)CH3, (i) -СО2C1-C4алкила, который необязательно замещен 1-9 атомами галогена, и (j) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3;
Rе независимо выбран из группы, которая включает -C2-C6алкенил, -C2-C6алкинил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC2-C6алкенил, -ОC2-C6алкинил, -ОC3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -С(=О)C1-C6алкил, -С(=О)C3-C8циклоалкил, -С(=О)Н, -СО2Н, -СО2C1-C6алкил, -C(=O)SC1-C6алкил, -ОН, -NR3R4, -C(=O)NR3R4, -NR3C(=О)ОC1-C6алкил, -NR3C(=О)NR3R4, -S(O)xC1-C6алкил, -S(O)yNR3R4, -NR3S(O)yNR3R4, -CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S и О, при этом указанный гетероцикл необязательно также включает карбонильную группу и необязательно также включает 1-3 двойные связи, где точкой присоединения указанного гетероцикла к циклу, к которому присоединен Rе, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена, -C1-C3алкила и -ОC1-C3алкила, где -C1-C3алкил и -ОC1-C3алкил необязательно замещены 1-7 атомами галогена;
при этом когда Rе выбран из группы, включающей -C2-C6алкенил, -C2-C6алкинил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC2-C6алкенил, -ОC2-C6алкинил, -ОC3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -С(=О)C1-C6алкил, -С(=О)C3-C8циклоалкил, -СО2C1-C6алкил, -C(=O)SC1-C6алкил, -NR3C(=О)ОC1-C6алкил и -S(O)xC1-C6алкил, то Rе необязательно замещен 1-15 атомами галогена и необязательно замещен 1-3 замещающими группами, независимо выбранными из (а) -ОН, (b) -CN, (c) -NR3R4, (d) -C3-C8циклоалкила, необязательно содержащего 1-3 двойные связи и необязательно замещенного 1-15 атомами галогена, (е) -ОC1-C4алкила, необязательно замещенного 1-9 атомами галогена и необязательно замещенного 1-2 замещающими группами, которые независимо выбраны из -ОC1-C2алкила и фенила, (f) -ОC3-C8циклоалкила, необязательно содержащего 1-3 двойные связи и необязательно замещенного 1-15 атомами галогена, (g) -CO2H, (h) -C(=O)CH3, (i) -СО2C1-C4алкила, который необязательно замещен 1-9 атомами галогена, и (j) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3;
р обозначает целое число, равное 0-4;
q обозначает целое число, равное 0-4;
u обозначает целое число, равное 0-5;
х равно 0, 1 или 2; и
y равно 1 или 2;
при этом когда Аr2 выбран из группы, которая включает:
(a) ароматический цикл, выбранный из фенила и нафтила;
(b) фенильный цикл, конденсированный с (5-7)-членным неароматическим циклоалкилом, который необязательно содержит 1-2 двойные связи;
(c) бензогетероцикл, включающий фенильный цикл, конденсированный с (5-6)-членным гетероциклом, содержащим 1-2 гетероатома, независимо выбранных из O, N и S, и необязательно 1-2 двойные связи; и
(d) (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу, где точкой присоединения указанного гетероцикла к фенильной группе, к которой присоединен гетероцикл, является гетероатом гетероцикла, то t обозначает целое число, равное 0-5, а w равно 0;
а когда Аr2 обозначает (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S, O и -N(O)-, и необязательно также включающий 1-3 двойные связи и карбонильную группу, где точкой присоединения указанного гетероцикла к фенильной группе, к которой присоединен гетероцикл, является атом углерода гетероцикла, то t обозначает целое число, равное 0-4, а w равно 1.
Варианты соединений имеют Формулу Ie, включая их фармацевтически приемлемые соли:
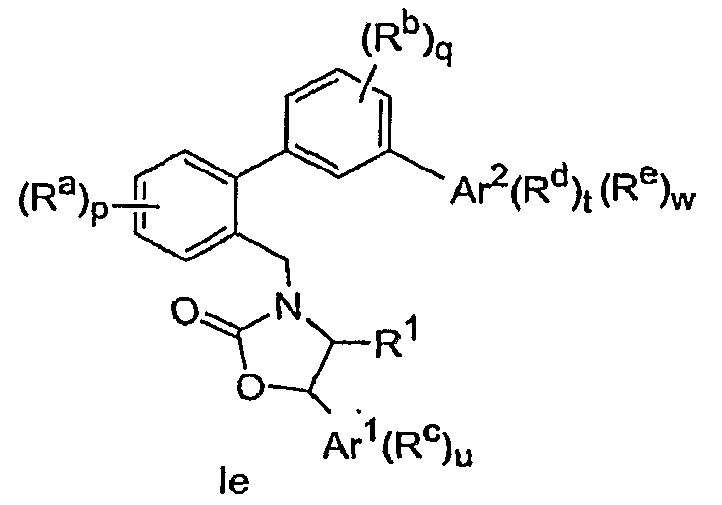
В вариантах осуществления настоящего изобретения соединение имеет Формулу If, включая его фармацевтически приемлемые соли:
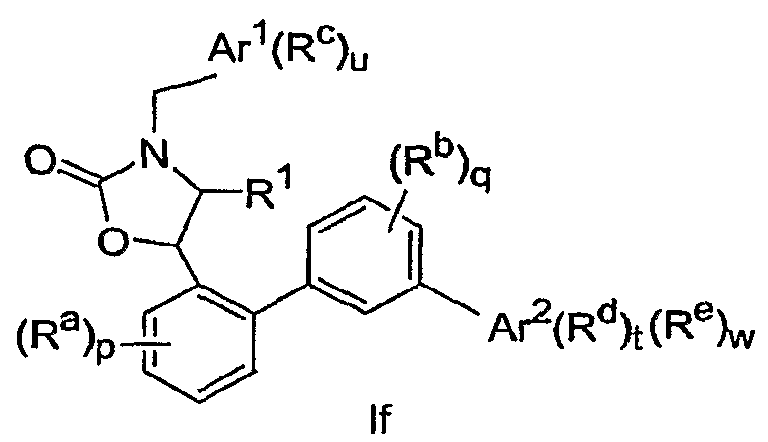
В вариантах осуществления настоящего изобретения соединение имеет Формулу Ig, включая его фармацевтически приемлемые соли:
В вариантах осуществления настоящего изобретения каждый Rd независимо выбран из группы, которая включает -C1-C4алкил, -C2-C4алкенил, циклопропил, -ОC1-C4алкил, -С(=О)C1-C4алкил, -С(=О)Н, -СО2Н, -СО2C1-C4алкил, -ОН, -NR3R4, -NR3C(=О)ОC1-C4алкил, -S(O)xC1-C2алкил, атом галогена, -CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-2 гетероатома, независимо выбранных из N, S и О, где точкой присоединения указанного гетероцикла к циклу, к которому присоединен Rd, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена;
при этом когда Rd выбран из группы, включающей -C1-C4алкил, -C2-C4алкенил, циклопропил, -ОC1-C4алкил, -С(=О)C1-C4алкил, -СО2C1-C4алкил, -NR3C(=О)ОC1-C4алкил и -S(O)xC1-C2алкил, то алкильная, алкенильная и циклопропильная группа в Rd необязательно замещена 1-5 атомами галогена и необязательно замещена одной замещающей группой, выбранной из: (а) -ОН, (b) -NR3R4, (с) -ОCН3, необязательно замещенного 1-3 атомами фтора и необязательно замещенного одной фенильной группой, и (d) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3; и
t обозначает целое число, равное 0-5.
Варианты осуществления настоящего изобретения могут иметь Формулу Ih или представлять собой ее фармацевтически приемлемую соль:
В независимых вариантах осуществления настоящего изобретения, включая фармацевтически приемлемые соли:
R1 выбран из группы, которая включает H и -C1-C5алкил, где -C1-C5алкил необязательно замещен 1-11 атомами галогена;
R3 и R4 каждый независимо выбран из H и -C1-C5алкила, где -C1-C5алкил во всех случаях необязательно замещен 1-11 атомами галогена;
каждый Ra, Rb и Rc независимо выбран из группы, которая включает -C1-C6алкил, -C2-C6алкенил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC1-C6алкил, -С(=О)C1-C6алкил, -С(=О)Н, -СО2Н, -СО2C1-C6алкил, -ОН, -NR3R4, -NR3C(=О)ОC1-C6алкил, -S(O)xC1-C6алкил, атом галогена, -CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-4 гетероатома, независимо выбранных из N, S и О, при этом указанный гетероцикл необязательно также включает карбонильную группу и необязательно также включает 1-3 двойные связи, где точкой присоединения указанного гетероцикла к циклу, к которому присоединен Ra, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена, -C1-C3алкила и -ОC1-C3алкила, где -C1-C3алкил и -ОC1-C3алкил необязательно замещены 1-7 атомами галогена;
при этом когда Ra, Rb и Rc выбраны из группы, включающей -C1-C6алкил, -C2-C6алкенил, -C3-C8циклоалкил, необязательно содержащий 1-3 двойные связи, -ОC1-C6алкил, -С(=О)C1-C6алкил, -СО2C1-C6алкил, -NR3C(=О)ОC1-C6алкил и -S(O)xC1-C6алкил, то Ra, Rb и Rd необязательно замещены 1-15 атомами галогена и необязательно замещены одной замещающей группой, выбранной из: (а) -ОН, (b) -NR3R4, (с) -ОC1-C4алкила, необязательно замещенного 1-9 атомами галогена и необязательно замещенного 1-2 замещающими группами, которые независимо выбраны из -ОC1-C2алкила и фенила, и (d) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3.
Каждый Rd независимо выбран из группы, которая включает -C1-C4алкил, -C2-C4алкенил, -ОC1-C2алкил, -С(=О)C1-C2алкил, -С(=О)Н, -СО2Н, -СО2C1-C4алкил, -ОН, -NR3R4, -NR3C(=О)ОC1-C4алкил, -S(O)xC1-C2алкил, атом галогена, -CN, -NO2 и (5-6)-членный гетероцикл, содержащий 1-2 гетероатома, независимо выбранных из N, S и О, где точкой присоединения указанного гетероцикла к кольцу, к которому присоединен Rа, является атом углерода, при этом указанный гетероцикл необязательно замещен 1-5 замещающими группами, независимо выбранными из атома галогена;
при этом когда Rd выбран из группы, включающей -C1-C4алкил, -C2-C4алкенил, -ОC1-C2алкил, -С(=О)C1-C2алкил, -СО2C1-C4алкил, -NR3C(=О)ОC1-C4алкил и -S(O)xC1-C2алкил, то алкильная или алкенильная группа в Rd необязательно замещена 1-5 атомами галогена и необязательно замещена одной замещающей группой, выбранной из (а) -ОН, (b) -NR3R4, (с) -ОCН3, необязательно замещенного 1-3 атомами фтора и необязательно замещенного одной фенильной группой, и (d) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3.
В вариантах осуществления настоящего изобретения:
р обозначает целое число, равное 0-2.
q обозначает целое число, равное 0-2.
t обозначает целое число, равное 0-3.
u обозначает целое число, равное 0-2.
х равно 0, 1 или 2.
y равно 1 или 2.
В независимых вариантах осуществления настоящего изобретения, включая фармацевтически приемлемые соли:
R1 выбран из H и -C1-C2алкила.
R3 и R4 каждый независимо выбран из H и -C1-C3алкила.
Каждый Ra, Rb и Rc независимо выбран из группы, которая включает -C1-C4алкил, -C2-C4алкенил, -ОC1-C2алкил, -С(=О)C1-C2алкил, -С(=О)Н, -СО2Н, -СО2C1-C4алкил, -ОН, -NR3R4, -NR3C(=О)ОC1-C4алкил, -S(O)xC1-C2алкил, атом галогена, -CN, -NO2;
при этом когда Ra, Rb и Rc выбраны из -C1-C4алкила, -C2-C4алкенила, -ОC1-C2алкила, -С(=О)C1-C2алкила, -СО2C1-C4алкила, -NR3C(=О)ОC1-C4алкила и -S(O)xC1-C2алкила, то алкильная и алкенильная группа в Ra, Rb и Rс необязательно замещены 1-5 атомами галогена и необязательно замещены одной группой, выбранной из: (а) -ОН, (b) -NR3R4, (с) -ОCН3, необязательно замещенного 1-3 атомами фтора и необязательно замещенного одной фенильной группой, и (d) фенила, который необязательно замещен 1-3 группами, независимо выбранными из атома галогена, -CH3, -CF3, -ОCH3 и -ОCF3.
Rd выбран из группы, которая включает -C1-C4алкил, -C2-C4алкенил, -NR3R4, -С(=О)Н, -СО2Н, -СО2C1-C4алкил, -ОН, атом галогена, -CN и -NO2, где -C1-C4алкил и -C2-C4алкенил во всех случаях необязательно замещены 1-5 атомами фтора.
р обозначает целое число, равное 1-2.
q обозначает целое число, равное 1-2.
t обозначает целое число, равное 0-3.
u обозначает целое число, равное 1-2.
х равно 0, 1 или 2.
В дополнительных вариантах осуществления настоящего изобретения, включая фармацевтически приемлемые соли:
R1, R3 и R4 каждый независимо выбран из H и -CН3.
Ra, Rb и Rc каждый независимо выбран из группы, которая включает -C1-C3алкил, -ОC1-C2алкил, атом галогена и -ОН, где -C1-C3алкил и -ОC1-C2алкил необязательно замещены 1-3 атомами фтора.
Rd выбран из группы, которая включает -C1-C3алкил, -NR3R4, -СО2Н, -СО2C1-C3алкил, атом галогена и -CN, где -C1-C3алкил и -СО2C1-C3алкил необязательно замещены 1-3 атомами фтора.
р обозначает целое число, равное 1-2.
q обозначает целое число, равное 1-2.
t обозначает целое число, равное 0-3.
u обозначает целое число, равное 1-2.
Определения
“Ac” обозначает ацетил, который представляет собой группу СН3С(=О)-.
“Алкил” означает углеродные цепи, которые могут быть линейными или разветвленными или представлять собой их комбинацию, если углеродная цепь не определена каким-либо образом. Другие группы, имеющие приставку “алк”, такие как алкокси и алканоил, также могут быть линейными или разветвленными или представлять собой их комбинацию, если углеродная цепь не определена каким-либо образом. Примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, втор- и трет-бутил, пентил, гексил, гептил, октил, нонил и т.п.
“Алкиленовые” группы представляют собой алкильные группы, которые являются дифункциональными, а не монофункциональными. Например, метил является алкильной группой, а метилен (-СН2-) является соответствующей алкиленовой группой.
“Алкенил” означает углеродные цепи, которые содержат, по крайней мере, одну двойную углерод-углеродную связь и которые могут быть линейными или разветвленными или представлять собой их комбинацию. Примеры алкенила включают винил, аллил, изопропенил, пентенил, гексенил, гептенил, 1-пропенил, 2-бутенил, 2-метил-2-бутенил и т.п.
“Алкинил” означает углеродные цепи, которые содержат, по крайней мере, одну тройную углерод-углеродную связь и которые могут быть линейными или разветвленными или представлять собой их комбинацию. Примеры алкинила включают этинил, пропаргил, 3-метил-1-пентинил, 2-гептинил и т.п.
“Циклоалкил” означает насыщенный карбоцикл, содержащий от 3 до 8 атомов углерода, если не указано иное (в частности, циклоалкил может быть определен как содержащий одну или несколько двойных связей). Данный термин включает также циклоалкил, конденсированный с арильной группой. Примеры циклоалкила включают циклопропил, циклопентил, циклогексил, циклогептил и т.п. “Циклоалкилен” означает неароматический карбоцикл, содержащий одну или несколько двойных связей.
“Арил” (и “арилен”), когда его используют для описания заместителя или группы в структурах, означает моноциклическое или бициклическое соединение, в котором циклы являются ароматическими и которое содержит в цикле лишь атомы углерода. Термин “арил” может также относиться к арильной группе, которая конденсирована с циклоалкилом или гетероциклом. Предподчительными “арилами” являются фенил и нафтил. Фенил в общем случае является наиболее предпочтительной группой.
“EDC” означает 1-этил-3-(3-диметиламинопропил)карбодиимид.
“Гетероциклил”, “гетероцикл” и “гетероциклический” означает полностью или частично насыщенный или ароматический (5-6)-членный цикл, содержащий 1-4 гетероатома, независимо выбранных из N, S и О, если не указано иное.
“Бензогетероцикл” представляет собой фенильный цикл, конденсированный с (5-6)-членным гетероциклом, содержащим 1-2 гетероатома, каждый из которых представляет собой О, N или S, где гетероцикл может быть насыщенным или ненасыщенным. Примеры включают индол, бензофуран, 2,3-дигидробензофуран и хинолин.
“DIPEA” обозначает диизопропилэтиламин.
“Атом галогена” включает фтор, хлор, бром и иод.
“HOBT” означает 1-гидроксибензотриазол.
“IPAC” означает изопропилацетат.
“Me” означает метил.
“Амин Вайнреба” означает N,O-диметилгидроксиамин.
Термин “композиция” представляет собой фармацевтическую композицию и предполагается, что он охватывает продукт, который включает активный(ые) ингредиент(ы), инертный(ые) ингредиент(ы), которые составляют носитель, а также любой продукт, который образуется, прямо или косвенно, из комбинирования, комплексования, или агрегирования любых двух или нескольких ингредиентов или при диссоциации одного или нескольких ингредиентов, или при протекании любых других типов реакций или взаимодействий одного или нескольких ингредиентов. Таким образом, фармацевтические композиции по настоящему изобретению охватывают любые композиции, которые получают смешиванием соединения по настоящему изобретению и фармацевтически приемлемого носителя.
Заместитель “тетразол” означает 2Н-тетразол-5-ильную замещающую группу и ее таутомеры.
Оптические изомеры - Диастереомеры - Геометрические изомеры - Таутомеры
Соединения Формулы I могут содержать один или несколько асимметрических центров и могут, таким образом, существовать в виде рацематов, рацемических смесей, индивидуальных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Предполагается, что настоящее изобретение включает все подобные изомерные формы соединений Формулы I и все смеси соединений. В том случае, когда структуры приведены в виде стереохимического представления, другие стереохимические структуры, такие как энантиомеры, диастереоизомеры (там, где диастереомеры возможны) и смеси энантиомеров и/или диастереомеров, включая рацемические смеси, также включены индивидуально или коллективно.
Некоторые из описываемых здесь соединений могут содержать олефиновые двойные связи и, если не указано иное, то предполагается, что они включают как Е-, так и Z-геометрические изомеры.
Некоторые из описываемых здесь соединений могут существовать в виде таутомеров. Примером является кетон и его енольная форма, известные как кето-енольные таутомеры. Соединения Формулы I охватывают индивидуальные таутомеры, а также их смеси.
Соединения Формулы I, имеющие один или несколько асимметрических центров, могут быть разделены на диастереоизомеры, энантиомеры и т.п. с помощью способов, хорошо известных из области техники.
В качестве альтернативы, энантиомеры и другие соединения с хиральными центрами могут быть синтезированы стереоспецифическим синтезом с помощью оптически чистых исходных веществ и/или реагентов с известной конфигурацией.
Некоторые из бифенильных или биарильных соединений наблюдаются в спектрах ЯМР в виде смесей атропоизомеров (ротамеров). Индивидуальные атропоизомеры, а также их смеси охватываются соединениями по настоящему изобретению.
Соли
Термин “фармацевтически приемлемая соль” относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические или органические основания и неорганические или органические кислоты. Соли, полученные из неорганических оснований, включают соли алюминия, аммония, кальция, меди, железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, натрия, цинка и т.п. Наиболее предпочтительными являются соли аммония, кальция, магния, калия и натрия. Соли в твердой форме могут существовать в виде более чем одной кристаллической структуры, а также могут быть в форме гидратов. Соли, полученные из фармацевтически приемлемых нетоксичных органических оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, в том числе встречающихся в природе замещенных аминов, циклических аминов и основных ионообменных смол, таких как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.п.
В том случае, когда соединение по настоящему изобретению является основанием, могут быть получены соли из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Подобные кислоты включают уксусную, бензольсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глютаминовую, бромистоводородную, хлористоводородную, изетионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую кислоту и т.п. Наиболее предпочтительными являются лимонная, бромистоводородная, хлористоводородная, малеиновая, фосфорная, серная и винная кислоты.
Следует понимать, что в данном описании ссылки на соединения Формулы I подразумевают также фармацевтически приемлемые соли.
Метаболиты - Пролекарства
Терапевтически активные метаболиты, при этом сами метаболиты входят в объем заявляемого изобретения, также являются соединениями по настоящему изобретению. Пролекарства, представляющие собой соединения, которые превращаются в заявляемые соединения при введении их пациенту или после того, как они были введены пациенту, также являются соединениями по настоящему изобретению.
Применение
Соединения по настоящему изобретению являются действенными ингибиторами СЕТР. Поэтому они пригодны для лечения заболеваний или состояний, которые можно лечить с помощью ингибиторов СЕТР.
Один аспект настоящего изобретения касается способа лечения или способа снижения риска развития заболевания или состояния, которое можно лечить или предупредить ингибированием СЕТР путем введения нуждающемуся в лечении пациенту терапевтически эффективного количества соединения по настоящему изобретению. Пациентом является человек или млекопитающее и наиболее часто - человек. “Терапевтически эффективное количество” представляет собой количество соединения, которое эффективно для получения желаемого клинического результата при лечении конкретного заболевания.
Заболевания или состояния, которые можно лечить с помощью соединений по настоящему изобретению, или же заболевания или состояния, риск развития которых у пациента снижается в результате лечения с помощью соединений по настоящему изобретению, включают: атеросклероз, заболевания периферических сосудов, дислипидемию, гипербеталипопротеинемию, гипоальфалипопротеинемию, гиперхолистеринемию, гипертриглицеридемию, наследственную гиперхолистеринемию, сердечно-сосудистые заболевания, стенокардию, ишемическую болезнь сердца, инсульт, инфаркт миокарда, поражение в результате реперфузии, рестеноз при ангиопластике, гипертензию, сосудистые осложнения при диабете, ожирение, наличие в крови эндотоксинов и метаболический синдром.
Соединения по настоящему изобретению наиболее эффективны для повышения HDL-C и/или снижения отношения HDL-C к LDL-C. Соединения эффективны также для снижения уровня LDL-C. Указанные изменения в HDL-C и LDL-C могут оказаться благоприятными при лечении атеросклероза, при снижении или возвращении к прежнему состоянию при развитии атеросклероза, при снижении риска развития атеросклероза или предупреждении атеросклероза.
Способы введения
Для обеспечения млекопитающего, предпочтительно человека, эффективной дозой соединения по настоящему изобретению может использоваться любой подходящий способ введения лекарства. Например, может применяться пероральный, ректальный, местный, парентеральный, внутриглазной, внутрилегочный, назальный и т.д. способ введения. Дозировочные формы включают таблетки, пастилки, дисперсии, суспензии, растворы, капсулы, кремы, мази, аэрозоли и т.п. Соединения Формулы I предпочтительно вводят перорально.
Эффективная доза используемого активного ингредиента может варьировать в зависимости от конкретного используемого соединения, способа введения, состояния, лечение которого проводят, и от тяжести состояния, лечение которого проводят. Подобные дозы легко могут быть установлены специалистом.
При лечении заболеваний, для которых показаны соединения Формулы I, в общем случае удовлетворительные результаты получают тогда, когда соединения по настоящему изобретению вводят в виде ежедневной дневной дозы, составляющей от приблизительно 0,01 мг до приблизительно 100 мг на килограмм массы тела животного или человека, которую преимущественно вводят в виде однократной дневной дозы, или в виде разделенной общей дозы от двух до шести раз в день, или в виде формы с пролонгированным высвобождением лекарственного средства. В случае взрослого человека с массой 70 кг общая дневная доза в общем случае составит от приблизительно 0,5 мг до приблизительно 500 мг. Для наиболее действенных соединений дозировка для взрослого человека может быть низкой вплоть до 0,1 мг. Режимы введения лекарственного средства можно подобрать внутри указанного диапазона или за пределами указанного диапазона с тем, чтобы получить оптимальный терапевтический ответ.
Пероральное введение обычно осуществляют с помощью таблеток. Примеры доз в виде таблеток составляют 0,5 мг, 1 мг, 2 мг, 5 мг, 10 мг, 25 мг, 50 мг, 250 мг и 500 мг. Другие пероральные формы (в частности, капсулы) также могут иметь такие же диапазоны.
Фармацевтические композиции
Другой аспект настоящего изобретения касается фармацевтических композиций, которые включают соединение Формулы I и фармацевтически приемлемый носитель. Фармацевтические композиции по настоящему изобретению в качестве активного ингредиента содержат соединение Формулы I или его фармацевтически приемлемую соль, а также фармацевтически приемлемый носитель и необязательно другие терапевтические ингредиенты. Термин “фармацевтически приемлемые соли” относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические основания или кислоты и органические основания или кислоты. Если назначают пролекарство, то фармацевтическая композиция может также включать пролекарство или его фармацевтически приемлемую соль. Фармацевтические композиции могут также состоять в основном из соединения Формулы I и фармацевтически приемлемого носителя и не содержать других терапевтических ингредиентов.
Композиции включают композиции, пригодные для перорального, ректального, местного, парентерального (включая подкожное, внутримышечное или внутривенное), глазное (офтальмологическое), легочное (назальную или трансбуккальную ингаляцию) или назальное введение, хотя наиболее подходящий путь введения в любом случае будет зависеть от типа и тяжести состояния, лечение которого проводят, и от типа активного ингредиента. Они для удобства могут представлять собой стандартную лекарственную форму и могут быть приготовлены любым известным из области фармации способом.
На практике соединения Формулы I в соответствии с обычными способами составления фармацевтических композиций могут быть получены в виде тщательно приготовленной смеси активного ингредиента с фармацевтическим носителем. Носитель может принимать самые разнообразные формы в зависимости от требуемой для введения формы, в частности перорального или парентерального (включая внутривенное) введения. При приготовлении композиций для пероральных дозировочных форм можно использовать любые фармацевтические среды, такие как, например, вода, гликоли, масла, спирты, отдушки, консерванты, красители и т.п., в случае пероральных жидких препаратов таких как, например, суспензии, эликсиры и растворы; или носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие средства, лубриканты, связующие, разрыхлители и т.п., в случае пероральных твердых препаратов, таких как, например, порошки, твердые или мягкие капсулы и таблетки, при этом пероральные твердые препараты являются предпочтительными по сравнению с жидкими препаратами.
Благодаря легкости их введения таблетки и капсулы представляют собой наиболее удобные стандартные пероральные дозировочные формы, и в этом случае, очевидно, применяют твердые фармацевтические носители. Если необходимо, на таблетки могут быть нанесены покрытия с помощью стандартных водных и неводных способов. Подобные композиции и препараты должны содержать, по меньшей мере, 0,1% активного соединения. Процент активного соединения в указанных композициях может, конечно, варьироваться и может для удобства составлять в диапазоне от приблизительно 2% до приблизительно 60% от массы дозировочной единицы. Количество активного соединения в подобных пригодных для терапевтического применения композициях таково, чтобы можно было получить эффективную дозу. Активные соединения могут также вводиться интраназально, например, в виде жидких капель или спрея.
Таблетки, пилюли, капсулы и т.п. могут также содержать связующее, такое как смола трагаканта, аравийская камедь, кукурузный крахмал или желатин; наполнители, такие как дикальцийфосфат; разрыхлитель, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота; лубриканты, такие как стеарат магния; и подсластитель, такой как сахароза или сахарин. В том случае, если дозировочной формой является капсула, она может помимо рассмотренных выше веществ содержать жидкий носитель, такой как жирная кислота.
Различные другие вещества могут содержаться в качестве покрытий или модифицировать физическую форму стандартной дозировочной единицы. Например, таблетки могут быть покрыты шеллаком, сахаром или и тем и другим одновременно. Сироп или эликсир помимо активного ингредиента могут содержать сахарозу в качестве подсластителя, метил- или пропилпарабены в качестве консервантов, краситель или отдушку, такую как отдушка с ароматом вишни или ароматом апельсина.
Соединения Формулы I могут также вводиться парентерально. Растворы или суспензии указанных активных соединений могут быть получены в воде обычно путем смешивания с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии могут быть также получены в глицерине, жидких полиэтиленгликолях и их смесях в маслах. В обычных условиях хранения и использования указанные препараты содержат консервант с целью предотвращения роста микроорганизмов.
Пригодные для инъекций фармацевтические формы включают стерильные водные растворы или дисперсии и стерильные порошки для импровизированного приготовления стерильных растворов или дисперсий. Во всех случаях лекарственная форма должна быть стерильной и должна быть жидкой в такой степени, чтобы ее можно было легко набрать шприцем. Она должна быть устойчивой в условиях приготовления и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии или грибы. Носителем может быть растворитель или дисперсная среда, содержащая, например, воду, этанол, полиол (в частности, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси и растительные масла.
Комбинированная терапия
Соединения по настоящему изобретению (в частности соединения Формулы I и Ia-Ij) могут применяться в сочетании с другими лекарствами, которые могут быть также пригодны при лечении или снижении интенсивности симптомов заболеваний или состояний, для которых пригодны соединения Формулы I. Подобные другие лекарственные средства могут вводиться по способу и в количестве, в котором их обычно используют, одновременно или последовательно с соединением Формулы I. В том случае, когда соединение Формулы I применяют одновременно с одним или несколькими другими лекарственными средствами, предпочтительной является фармацевтическая композиция в виде стандартной лекарственной формы, содержащей подобные другие лекарственные средства и соединение Формулы I. Тем не менее, комбинированная терапия включает также терапии, при которых соединение Формулы I и одно или несколько других лекарственных средств назначают по различным схемам принятия лекарств.
Если используют пероральные составы, то лекарственные средства могут объединяться в виде одной комбинированной таблетки или другой пероральной дозировочной формы или же лекарства могут быть упакованы вместе в виде раздельных таблеток и других пероральных дозировочных форм. Предполагается также, что когда их используют в сочетании с одним или несколькими активными ингредиентами, соединения по настоящему изобретению и другие активные ингредиенты могут применяться в более низких дозах, чем тогда, когда каждое из них применяют индивидуально. Таким образом, фармацевтические композиции по настоящему изобретению включают такие фармацевтические композиции, которые помимо соединения Формулы I содержат один или несколько активных ингредиентов.
Примерами других активных ингредиентов, которые могут назначаться в сочетании с соединением по настоящему изобретению (в частности, соединением Формулы I) и которые вводят либо раздельно, либо в составе той же самой фармацевтической композиции, включают, однако этим не ограничиваясь, другие соединения, которые улучшают липидный профиль пациента, такие как: (i) ингибиторы HMG-CoA-редуктазы (они в общем случае представляют собой статины, в том числе ловастатин, симвастатин, розувастатин, правастатин, флувастатин, аторвастатин, ривастатин, итавастатин, питавастатин и другие статины), (ii) вещества, усиливающие экскрецию желчных кислот (холестирамид, колестипол, диалкиламиноалкильные производные содержащего поперечные связи декстрана, Colestid®, LoCholest®, (iii) ниацин и родственные соединения, такие как никотиниловый спирт, никотинамид и никотиновая кислота и ее соли, (iv) агонисты PPARα, такие как гемфиброзил и производные фенофиброевой кислоты (фибраты), в том числе клофибрат, фенофибрат, безафибрат, ципрофибрат и этофибрат, (v) ингибиторы абсорбции холестерина, такие как сложные эфиры станола, бета-ситостерин, гликозиды стерина, такие как тиквесид; и азетидиноны, такие как эзетимиб, (vi) ингибиторы ацил-СоА:холестерин-ацилтрансферазы (АСАТ), такие как авасимиб и мелинамид, и включая селективные ингибиторы АСАТ-1 и АСАТ-2 и двойные ингибиторы, (vii) фенольные антиоксиданты, такие как пробукол, (viii) ингибиторы секреции микросомального белка-переносчика триглицеридов (МТР)/АроВ, (ix) витаминные антиоксиданты, такие как витамин С и Е и бета-каротин, (x) тиромиметики, (xi) индукторы рецептора LDL (липопротеина низкой плотности), (xii) ингибиторы агрегирования тромбоцитов, например антагонисты рецептора гликопротеина IIb/IIIa фибриногена и аспирин, (xiii) витамин В12 (известный также как цианокобаламин), (xiv) фолиевая кислота или ее фармацевтически приемлемая соль или сложный эфир, такая как натриевая соль, и соль метилглюкамина, (xv) лиганды FXR и LXR, включая как ингибиторы, так и агонисты, (xvi) агенты, которые усиливают генную экспрессию АВСА1, и (xvii) переносчики желчных кислот в подвздошной кишке.
Предпочтительные классы терапевтических соединений, которые могут применяться с соединениями по настоящему изобретению, с целью улучшения липидного профиля пациента (т.е. повышения уровня HDL-C и понижения уровня LDL-C) включают один или два статина и ингибиторы абсорбции холестерина. Наиболее предпочтительными являются комбинации соединений по настоящему изобретению с симвастатином, эзетимибом или же симвастатином и эзетимибом вместе. Предпочтительными являются также комбинации соединений по настоящему изобретению со статинами, отличными от симвастатина, такими как ловастатин, розувастатин, правастатин, флувастатин, аторвастатин, ривастатин, итавастатин и ZD-4522.
Наконец, соединения по настоящему изобретению могут использоваться с соединениями, которые пригодны для лечения других заболеваний, таких как диабет, гипертензия и ожирение, а также с другими антиатеросклеротическими соединениями. Подобные комбинации могут применяться для лечения одного или нескольких таких заболеваний, как диабет, ожирение, атеросклероз и дислипидемия, или же нескольких заболеваний, связанных с метаболическим синдромом. Указанные комбинации могут проявлять синергическую активность при лечении указанных заболеваний, что позволяет назначать уменьшенные дозы активных ингредиентов, такие как дозы, которые в противном случае оказались бы субтерапевтическими.
Примеры других активных ингредиентов, которые могут назначаться в комбинации с соединением по настоящему изобретению, включают, однако этим не ограничиваясь, соединения, которые в основном являются антидиабетическими соединениями, в том числе:
(a) агонисты и частичные агонисты PPAR-гамма, включая глитазоны и не глитазоны (в частности, пиоглитазон, энглитазон, МСС-555, розиглитазон, балаглитазон, нетоглитазон, Т-131, LY-300512 и LY-818;
(b) бигуаниды, такие как метформин и фенформин;
(с) ингибиторы протеин-тирозинфосфатазы-1В (РТР-1В);
(d) ингибиторы дипептидилпептидазы IV (DP-IV), включая видаглиптин, ситаглиптин и саксаглиптин;
(е) инсулин и миметики инсулина, такие как, например, инсулин лиспро, инсулин гларгин, инсулин цинковая суспензия и составы инсулина для ингаляции;
(f) сульфонилмочевины, такие как толбутамид, глипизид, глимепирид, ацетогексамид, хлорпропамид, глибенкламид и родственные вещества;
(g) ингибиторы α-глюкозидазы (такие как акарбоза, адипозин, камиглибоза, эмиглитат, миглитол, воглибоза, прадимицин-Q и салбостатин);
(h) двойные антагонисты PPAR-α/γ, такие как мураглитазар, тезаглитазар, фарглитазар и навеглитазар;
(i) антагонисты PPAR-δ, такие как GW501516 раскрытые в WO 97/28149;
(j) антагонисты рецептора глюкагона;
(k) GLP-1; производные GLP-1; аналоги GLP-1, такие как эксендины, например эксенатид (Byetta); и непептидильные агонисты рецептора GLP-1;
(l) GIP-1; и
(m) отличные от сульфонилмочевины средства, усиливающие секрецию инсулина, такие как меглитиниды (в частности, натеглинид и рапеглинид).
Указанные активные ингредиенты, которые могут использоваться в комбинации с настоящим изобретением, включают также соединения против ожирения, в том числе ингибиторы 5-НТ (серотонин), ингибиторы нейропептида Y5 (NPY5), агонисты рецептора мелакортина 4 (Mc4r), антагонисты/инверсные агонисты каннабиноидного рецептора 1 (СВ-1) и агонисты β3-адренергического рецептора. Они позднее более подробно приведены в данном разделе.
Указанные другие активные ингредиенты включают также активные ингредиенты, которые применяют для лечения воспалительных состояний, такие как аспирин, нестероидные противовоспалительные лекарственные средства, глюкокортикоиды, азулфедин и селективные ингибиторы циклооксигеназы-2 (СОХ-2), включая эторикоксиб, целекоксиб, рофекоксиб и Bextra.
Антигипертензивные соединения удобно использовать в комбинированной терапии с соединениями по настоящему изобретению. Примеры антигипертензивных соединений, которые могут применяться с соединениями по настоящему изобретению, включают (1) антагонисты ангиотензина II, такие как лозартан; (2) ингибиторы ангитензин-превращающего фермента (ингибиторы АСЕ), такие как эналаприл и каптоприл; (3) блокаторы кальциевых каналов, такие как нифедипин и дилтиазам; и (4) эндотелиальные антагонисты.
Соединения против ожирения могут назначаться в комбинации с соединениями по настоящему изобретению, включая: (1) средства, усиливающие секрецию гормона роста, и агонисты/антагонисты рецептора средства, усиливающего секрецию гормона роста, такие как NN703, гексарелин и МК-0677; ингибиторы протеин-тирозин фосфатазы-1В (РТР-1В); (3) лиганды каннабиноидного рецептора, такие как антагонисты или инверсные агонисты рецептора каннабиноида СВ1, такие как римонабант (Sanofi Synthelabo), АМТ-251 и SR-14778 и SR 141716A (Sanofi Synthelabo), SLV-319 (Solvay), BAY 65-2520 (Bayer); (4) серотонергические средства против ожирения, такие как фенфлурамин, дексфенфлурамин, фентермин и сибутрамин; (5) агонисты β3-адренорецептора, такие как AD9677/TAK677 (Dainippon/Takeda), CL-316243, SB 418790, BRL-37344, L-796568, BMS-196085, BRL-35135A, CGP12177A, BTA-243, Trecadrine, Zeneca D7114 и SR 59119A; (6) ингибиторы панкреатической липазы, такие как орлистат (Xenical®), Triton WR1339, RHC80267, липстатин, тетрагидролипстатин, теасапонин и диэтилумбеллиферил фосфат; (7) антагонисты нейропептида Y1, такие как BIBP3226, J-115814, BIBO 3304, LY-357897, CP-671906 и GI-264879A; (8) антагонисты нейропептида Y5, такие как GW-569180А, GW-594884A, GW-587081X, GW-548118X, FR226928, FR 240662, FR252384, 1229U91, GI-264879A, CGP71683A, LY-377897, PD-160170, SR-120562A, SR-120819A и JCF-104; (9) антагонисты рецептора фактора накопления меламина (МСН); (10) антагонисты рецептора фактора накопления меламина 1 (МСН1R), такие как T-226296 (Takeda); (11) агонисты/антагонисты рецептора фактора накопления меламина 2 (МСН2R); (12) антагонисты рецептора орексина-1, такие как SB-334867-A; (13) агонисты меланокортина, такие как Melanotan II; (14) другие агонисты Mc4r (рецептор меланокортина 4), такие как CHIR86036 (Chiron), ME-10142 и МЕ-10145 (Melacure), CHIR86036 (Chiron), PT-141 и PT-14 (Palatin); (15) агонисты 5НТ-2; (16) агонисты 5НТ2С (рецептор 2С серотонина), такие как BVT933, DPCA37215, WAY161503 и R-1065; (17) антагонисты галанина; (18) агонисты ССК; (19) агонисты ССК-А (холецистокинин-А), такие как AR-R 15849, GI 181771, JMV-180, A-71378, A-71623 и SR146131; (20) агонисты GLP-1; (21) агонисты кортикотропин-высвобождающего гормона; (22) модуляторы рецептора-3 гистамина (Н3); антагонисты/инверсные агонисты рецептора-3 гистамина (Н3), такие как хиоперамид, 3-(1Н-имидазол-4-ил)пропил N-(4-пентенил)карбамат, клобенпропит, иодофенпропит, имопроксифан и GT2394 (Gliatech); (24) ингибиторы β-гидроксистероид-дегидрогеназы-1 (ингибиторы 11β-HSD-1), такие как BVT 3498 и BVT 2733; (25) ингибиторы PDE (фосфодиэстераза), такие как теофиллин, пентоксифиллин, запринаст, силденафил, амринон, милринон, цилостамид, ролипрам и циломиласт; (26) ингибиторы фосфодиэстеразы-3В (PDE3B); (27) ингибиторы переноса NE (норпинефрин), такие как GW 320659, деспирамин, талсупрам и номифензин; (28) антагонисты рецептора грелина; (29) лептин, включая рекомбинантный лептин человека (PEG-OB, Hoffman La Roche) и рекомбинантный метионил лептина человека (Amgen); (30) производные лептина; (31) агонисты BRS3 (субтип 3 рецептора бомбезина), такие как [D-Phe6,beta-Ala11,Phe13,Nle14]Bn(6-14) и [D-Phe6,Phe13]Bn(6-13)пропиламид; (32) CNTF (цилиарные нейротрофические факторы), такие как GI-181771 (Glaxo-SmithKline), SR146131 (Sanofi Synthelabo), бутабиндид, PD170292 и PD 149164 (Pfizer); (33) производные CNTF, такие как аксокин (Regeneron); (34) ингибиторы повторного захвата моноамина, такие как сибутрамин; (35) активаторы UCP-1 (разобщающий белок-1, 2 или 3), такие как фитановая кислота, 4-[(E)-2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинил)-1-пропенил]бензойная кислота (TTNPB), и ретиноевая кислота; (36) агонисты тироидного гормона β, такие как КВ-2611 (KaroBioBMS); (37) ингибиторы FAS (синтаза жирных кислот), такие как Cerulenin и C75; (38) ингибиторы DGAT1 (диацилглицерин ацилтрансфераза 1); (39) ингибиторы DGAT2 (диацилглицерин ацилтрансфераза 2); (40) ингибиторы АСС2 (ацетил-кофермент А карбоксилаза-2); (41) антагонисты глюкокортикоида; (42) ацилэстрогены, такие как олеоил-эстрон; (43) ингибиторы переносчика дикарбоксилата; (44) пептид YY, PYY 3-36, аналоги, производные и фрагменты пептида YY, такие как BIM-43073D, BIM-43004C; (45) агонисты рецептора нейропептида Y2 (NPY2), такие как NPY3-36, N ацетил [Leu(28,31)]NPY24-36, TASP-V и цикло-(28/32)-Ас-[Lys28-Glu32]-(25-36)-pNPY; (46) агонисты нейропептида Y4 (NPY4), такие как панкреатический пептид (РР); (47) антагонисты нейропептида Y1 (NPY1), такие как BIBP3226, J-115814, BIBO 3304, LY-357897, CP-671906 и GI-264879A; (48) антагонисты опиоида, такие как налмефен (Revex®), 3-метоксиналтрексон, налоксон и налтрексон; (49) ингибиторы переносчика глюкозы; (50) ингибиторы переносчика фосфата; (51) ингибиторы 5-НТ (серотонин); (52) бета-блокаторы; (53) антагонисты рецептора нейрокинина-1 (антагонисты NK-1); (54) клобензорекс; (55) клофорекс; (56) кломинорекс; (57) клортермин; (58) циклекседрин; (59) декстроамфетамин; (60) дифеметоксидин; (61) N-этиламфетамин; (62) фенбутразат; (63) фенизорекс; (64) фенпропорекс; (65) флудорекс; (66) флуминорекс; (67) фурфурилметиламфетамин; (68) левамфетамин; (69) левофацетоперан; (70) мефенорекс; (71) метамфепрамон; (72) метамфетамин; (73) норпсевдоэфедрин; (74) пенторекс; (75) фендиметразин; (76) фенметразин; (77) пицилорекс; (78) фитофарм 57; (79) зонизамид; (80) аминорекс; (81) амфеклорал; (82) амфетамин; (83) бензфетамин и (84) хлорфентермин.
Рассмотренная выше комбинированная терапия, в которой применяют соединения по настоящему изобретению, может быть пригодна для лечения метаболического синдрома. В соответствии с одним широко используемым определением пациент с метаболическим синдромом характеризуется наличием трех или большего количества симптомов, выбранных из следующей группы, включающей пять симптомов: (1) абдоминальное ожирение; (2) гипертриглицеридемия; (3) низкий уровень холестерина липопротеинов высокой плотности (HDL); (4) высокое кровяное давление; и (5) повышенный уровень глюкозы на голодный желудок, который может быть в диапазоне, характерном для диабета 2 типа, если пациент является также диабетиком. Каждый из указанных симптомов получил клиническое определение в недавно опубликованном посвященной холестерину Третьем отчете национальной программы обучения специалистов по обнаружению, оценке и лечению высокого уровня холестерина в крови у взрослых (III Совет по лечению взрослых, или ATP III), Национальный институт здоровья, 2001, NIH Publication № 01-3670. Пациенты с метаболическим синдромом имеют повышенный риск развития макрососудистых или микрососудистых осложнений, которые перечислены выше, включая атеросклероз и ишемическую болезнь сердца. Вышеуказанные комбинации могут одновременно снизить интенсивность более одного симптома метаболического синдрома (в частности, два симптома, три симптома, четыре симптома или все пять симптомов).
Анализ СЕТР
Непрерывный in vitro анализ для определения величины IC50, с целью идентифицировать соединения, которые являются ингибиторами СЕТР, проводят по модифицированной методике, приведенной в Epps et al., с использованием BODIPY®-CE в качестве источника липидного донора сложного эфира холестерина и BODIPY®-TG в качестве липидного донора триглицерида. См. Epps et al. (1995) Method for measuring the activities of cholesteryl ester transfer protein (lipid transfer protein), Chem. Phys. Lipids, 77, 51-63.
Частицы, которые используют при поведении данного анализа, получают из следующих веществ с помощью зондовой ультразвуковой обработки в соответствии с методикой, приведенной в Epps et al. Частицы синтетического сложного эфира холестерина (СЕ) в качестве донора HDL содержат DOPC (диолеоил фосфатидил холин), BODIPY®-CE (Molcular Probes C-3927), триолеин (триглицерид), дабцил диацетиламид (недиффундирующая молекула гасителя для уменьшения фоновой люминесценции) и apoHDL. Частицы синтетического триглицерида (TG) в качестве донора HDL содержат DOPC, BODIPY®-TG и apoHDL. BODIPY®-TG синтезируют при комнатной температуре из диолеина и BODIPY, содержащего аналог жирной кислоты 4,4-дифтор-5-(2-тиенил)-4-бора-3а,4а-диаза-s-индацен-3-додекановой кислоты, (Molcular Probes) в метиленхлориде в присутствии дициклогексилкарбодиимида. Дабцил диацетиламид получают нагреванием дабцил н-сукцинимида с диацетилмином в ДМФА при температуре 95°С в течение ночи в присутствии диизопропиламина в качестве катализатора. В качестве частиц акцептора используют нативные липопротеины, выделенные из крови человека. Частицы с плотностью меньше чем 1,063 г/мл выделяют ультрацентрифугированием. Указанные частицы содержат VLDL, IDL и LDL. Концентрацию частиц выражают в виде концентрации белка, которую определяют с помощью ВСА анализа (Pierce, USA). Частицы до использования хранят при температуре 4°С.
Анализы проводят на 96-луночных планшетах Dynex Microfluor 2 с черным U-образным дном (# 7205 по каталогу). Для проведения анализа готовят коктейль, содержащий СЕТР, буфер 1Х СЕТР (50 мМ Tris, рН 7,4, 100 мМ NaCl, 1 мМ ЭДТК), 3% сыворотки человека и половину конечной концентрации частиц акцептора, и в каждую лунку планшета добавляют по 100 мкл коктейля для анализа. Тестируемые соединения в ДМСО добавляют в объеме 3 мкл. Содержимое планшета перемешивают на качалке для планшетов, а затем инкубируют при 25°С в течение 1 час. Готовят второй коктейль для проведения анализа, содержащий частицы донора, оставшиеся частицы акцептора и буфер 1Х СЕТР. Чтобы начать проведение анализа, 47 мкл второго коктейля для анализа добавляют в лунки, в которых осуществляют реакцию. Анализы проводят в конечном объеме 150 мкл. Реакции переноса СЕ проводят следующим образом: конечные концентрации веществ составляют: 2,5 нг/мкл частиц донора СЕ, 7,5 нг/мкл частиц акцептора (каждый выражают содержанием белка), буфер 1Х СЕТР, 14-30 нМ рекомбинантного СЕТР человека (экспрессируют в клетках СНО и частично очищают) и вплоть до 2% ДМСО, когда проводят испытания соединений; за протеканием реакций следят с помощью флуоресцентного планшет-ридера (Molcular Devices Spectramax GeminiXS), для которого устанавливают время прогона 45 мин при температуре 25°С, при этом образцы считывают через каждые 45 сек для Ех=480 нм и Em=511 нм с фильтром отсечки при 495 нм, настройки трубки фотоумножителя устанавливают в среднем диапазоне и при включенной калибровке осуществляют по 6 считываний для каждой лунки. Реакцию переноса TG проводят, как описано выше, за исключением того, что используют 2,5 нг/мкл частиц донора TG. Перенос TG измеряют на длине возбуждения 538 нм, а считывание проводят на длине испускания 568 нм через каждые 45 сек в течение 45 мин при температуре 37°С с фильтром отсечки при 550 нм.
Проводят оценку данных, определяя начальную скорость, которую выражают в относительных единицах флуоресценции в секунду, для псевдолинейного участка кривой, часто в диапазоне 0-500 или 1000 сек. Сравнение скоростей образцов, содержащих ингибиторы, с неингибированным (содержащим лишь ДМСО) положительным контролем дает процент ингибирования. Для расчета величины IC50 используют график зависимости процента ингибирования от логарифма концентрации ингибитора, которая хорошо описывается 4-параметрическим сигмоидальным уравнением.
ПРИМЕРЫ
Следующие схемы и примеры приведены с целью более полного разъяснения и понимания настоящего изобретения. Исходные вещества получают по известным или по приведенным ниже методикам.
Примеры не следует рассматривать как каким-либо образом ограничивающие настоящее изобретение. Объем настоящего изобретения определяется прилагаемой формулой изобретения. Соединения по настоящему изобретению имеют величины IC50, определяемые для реакции переноса СЕ, реакции переноса TG или обоих, как указано выше, которые составляют меньше или равно 50 мкМ. Величины IC50 для одной или обеих реакций обычно составляют в диапазоне 5 нМ - 15 мкМ и предпочтительно составляют в диапазоне 5 нМ - 5 мкМ, более предпочтительно в диапазоне 5 нМ - 1 мкМ, еще более предпочтительно в диапазоне 5 нМ - 200 нМ и, наиболее предпочтительно в диапазоне 5 нМ - 100 нМ.
Схема 1
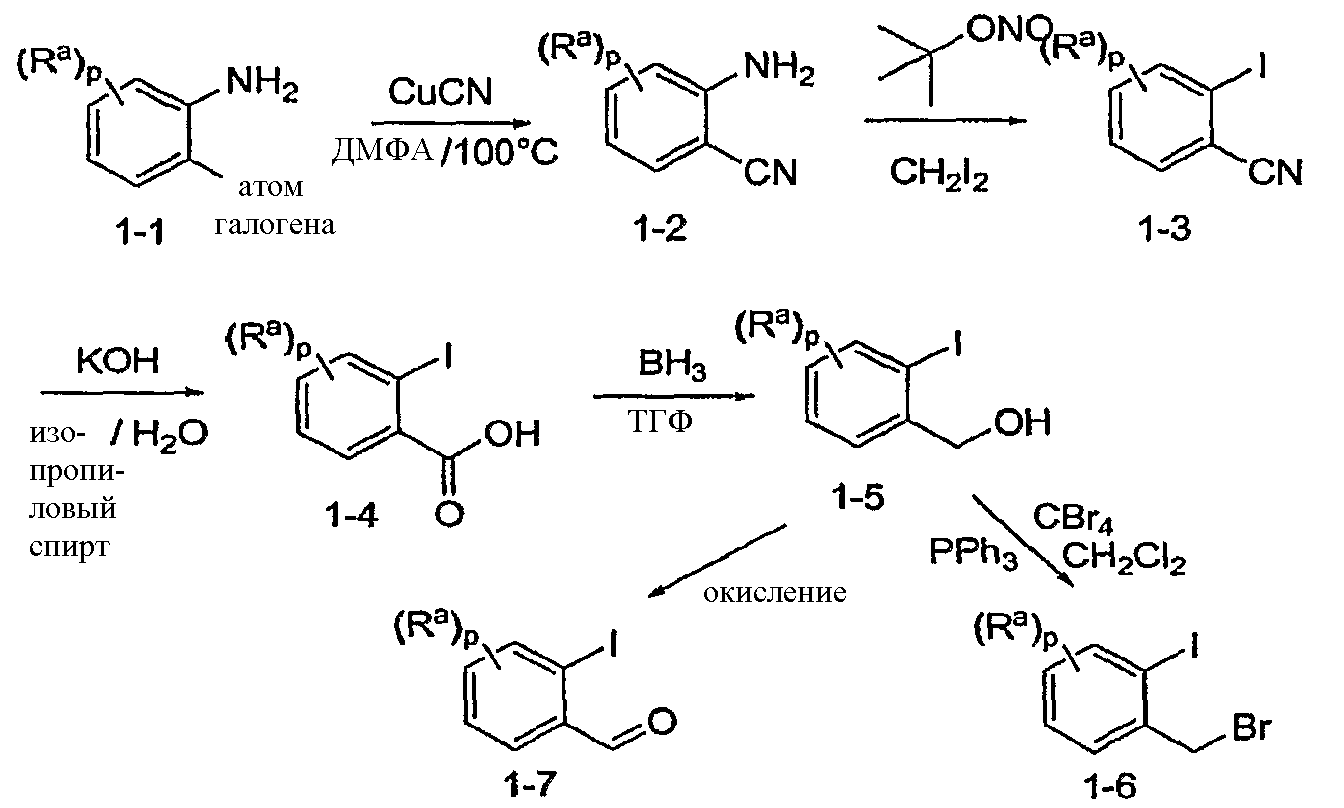
Промежуточные соединения 1-2, 1-3, 1-4, 1-5, 1-6 и 1-7, которые используют по настоящему изобретению, где значение Rа определено в формуле изобретения, могут быть приобретены или получены, как показано на Схеме 1. Соответствующим образом замещенный 2-галогенанилин 1-1, где атомом галогена предпочтительно является атом иода или брома, взаимодействует с CuCN в ДМФА при повышенной температуре с образованием соответствующего 2-цианоанилина 1-2. Иначе нитрил может быть получен взаимодейcтвием 1-1 с KCN и CuI в присутствии соли палладия(II) или в присутствии некоторых комплексов меди или никеля (см: Smith, M.B. and March, J. “March's Advanced Organic Chemistry”, 5th Ed., John Wiley and Sons, New York, pp. 867 (2001) и приведенные там ссылки). Иодиды 1-3 получают по реакции 1-2 с изоамилнитритом, н-пентилнитритом, трет-бутилнитритом и т.п. в дииодметане (см., например, Smith et al., J. Org. Chem. 55, 2543 (1990) и приведенные там ссылки). В качестве альтернативы иодид может быть получен путем образования вначале диазония с использованием изоамилнитрита, н-пентилнитрита, трет-бутилнитрита, нитрита натрия, азотистой кислоты и т.п. с последующим нагреванием в присутствии иодида, такого как иодид меди, иодид натрия, иодид калия, тетрабутиламмонийиодид и т.п. Гидролиз иодонитрила 1-3 проводят с помощью гидроксида калия в изопропаноле и воде и получают иодокислоту 1-4. Последующее восстановление бораном, алюмогидридом лития, боргидридом лития и т.п. в эфире, тетрагидрофуране, диметоксиэтане и т.п. дает 2-иодоспирты 1-5. Промежуточные соединения 1-5 можно преобразовать в бензилбромиды 1-6 с помощью таких реагентов, как трифенилфосфин и тетрабромид углерода, в растворителях, таких как дихлорметан и т.п. (см. Smith, M.B. and March, J. “March's Advanced Organic Chemistry”, 5th Ed., John Wiley and Sons, New York, pp. 518-199 (2001) и приведенные там ссылки). Промежуточные соединения 1-6 можно также превратить в альдегиды 1-7 взаимодействием с периодинаном по реакции Десса-Мартина или в условиях окисления по Сверну взаимодействием с перрутенатом тетрапропиламмония, хлорхроматом пиридиния, комплексом триоксид серы-пиридин и т.п. (см. Smith, M.B. and March, J. “March's Advanced Organic Chemistry”, 5th Ed., John Wiley and Sons, New York, pp. 1167-1171 (2001) и приведенные там ссылки).
Схема 2
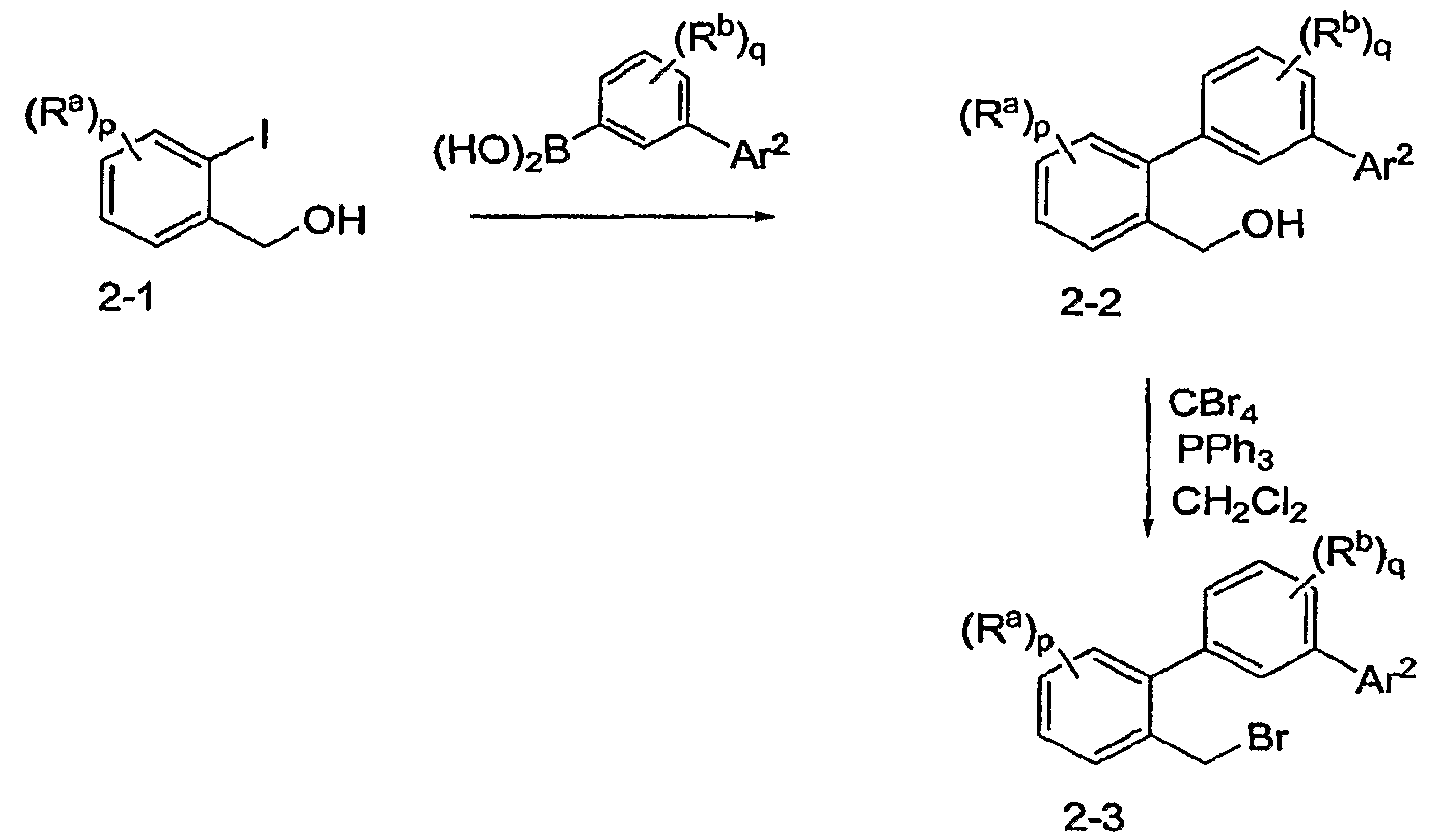
Промежуточные соединения 2-2 и 2-3, которые используют по настоящему изобретению, где значения Rа, Rb и Ar2 определены в формуле изобретения, могут быть получены, как показано на Схеме 2. Бензиловые спирты 2-1 могут быть приобретены или получены в соответствии с методикой, приведенной на Схеме 1. Промежуточные соединения 2-2 могут быть получены по реакции Сузуки, в которой соединение 2-1 сочетают с соответствующим образом замещенной арилбороновой кислотой или арилборонатным эфиром в присутствии палладиевого катализатора. Реакцию сочетания можно проводить с использованием ацетата Pd(II) и карбоната калия при кипячении в водном ацетоне. Иначе в реакции можно использовать тетракис(трифенилфосфин)палладий в смеси этанол/толуол в присутствии карбоната натрия. В качестве альтернативы, что практикуется специалистами, в реакции можно использовать ряд соединений палладия(0) и солей палладия(II) в ряде растворителей в присутствии разнообразных лигандов, оснований и промоторов, обычно, но не исключительно, при нагревании и/или при использовании ВЧ излучения. Некоторые подходящие условия проведения реакции можно найти в описании, приведенном в Miyaua et al., Chem. Rev. 95, 2457 (1995) и приведенных там ссылках, а также в монографии в Smith, M.B. and March, J. “March's Advanced Organic Chemistry”, 5th Ed., John Wiley and Sons, New York, pp. 868-869 (2001) и приведенные там ссылках. Соединения 2-3 получают из промежуточных соединений 2-2, как показано на Схеме 1.
Схема 3
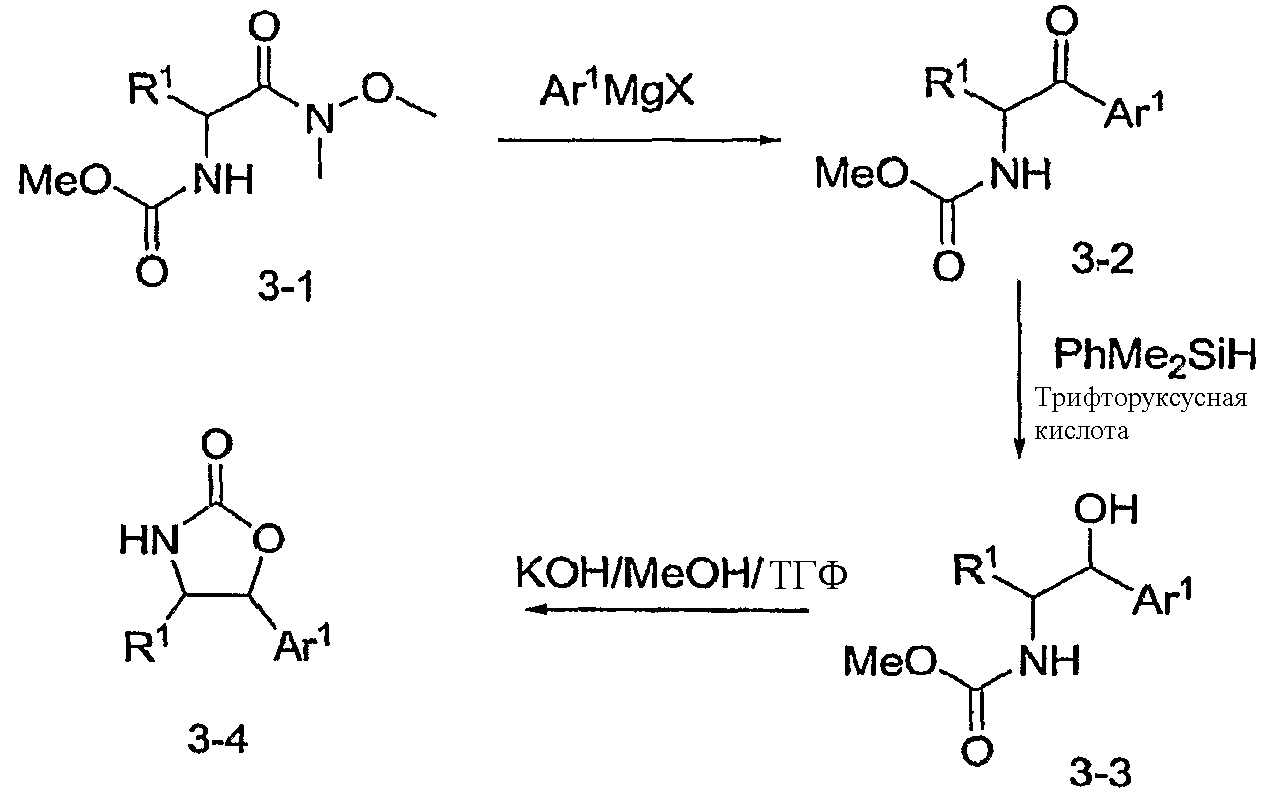
Промежуточные соединения 3-4 по настоящему изобретению, где значения R1 и Ar1 определены в формуле изобретения, могут быть получены, как показано на Схеме 3. Взаимодействием N-карбамоил-(N-метокси-N-метил)амида аминокислоты 3-1, который можно приобрести или получить известными способами, с реактивом Гриньяра или другим металлоорганическим реагентом, таким как литийорганическое соединение, получают соответствующий кетон 3-2. Восстановление указанного кетона боргидридом натрия или боргидридом цинка в спиртовом растворителе или ТГФ или т.п. или же восстановление с помощью другого восстановителя, такого как фенилдиметилсилан в ТГФ, дает спирт 3-3, который можно циклизовать в оксазолидинон 3-4 обработкой основанием, таким как КОН, в растворителе, таком как MeOH, EtOH и т.п., и в ТГФ, диоксане, диметоксиэтане и т.п.
Схема 4
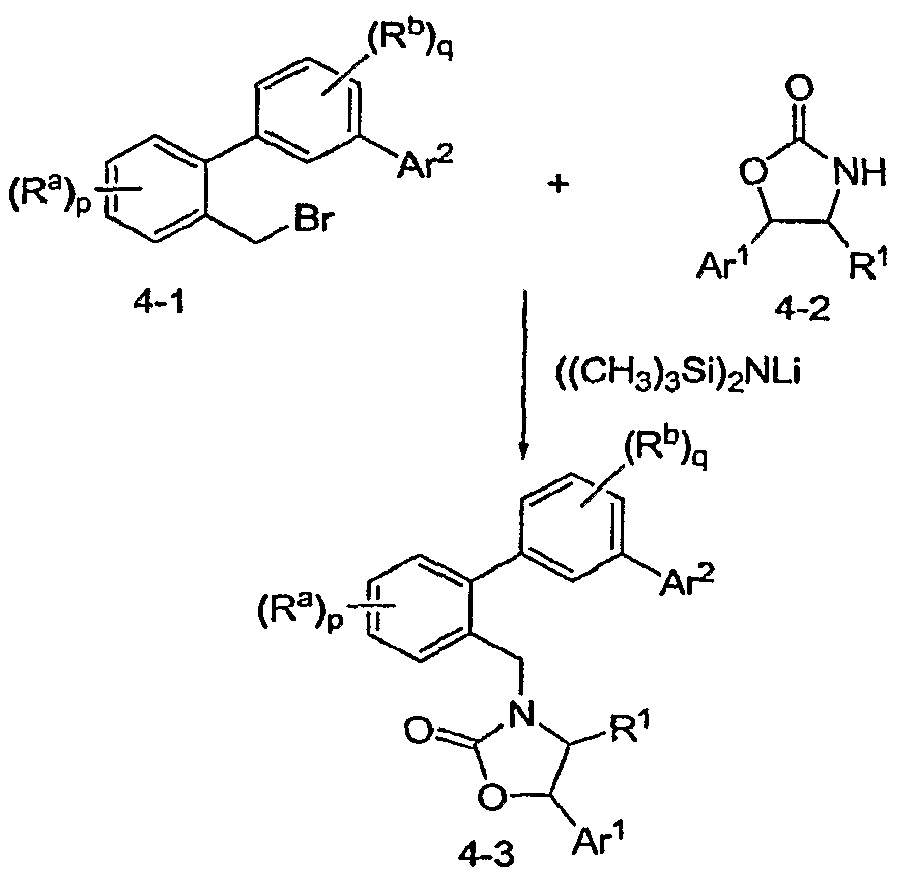
Соединения по настоящему изобретению 4-3, где значения R1, Rа, Rb, Ar1 и Ar2 определены в формуле изобретения, могут быть получены, как показано на Схеме 4. Оксазолидиноны 4-2, полученные, как показано на Схеме 3, можно алкилировать бензилбромидами 4-1, которые получают, как показано на Схеме 1, с помощью оснований, таких как гексаметилдисилиазид натрия или гидрид натрия, в растворителях, таких как тетрагидрофуран, диметоксиэтан, диэтиловый эфир и т.п., и получить продукты 4-3.
Схема 5
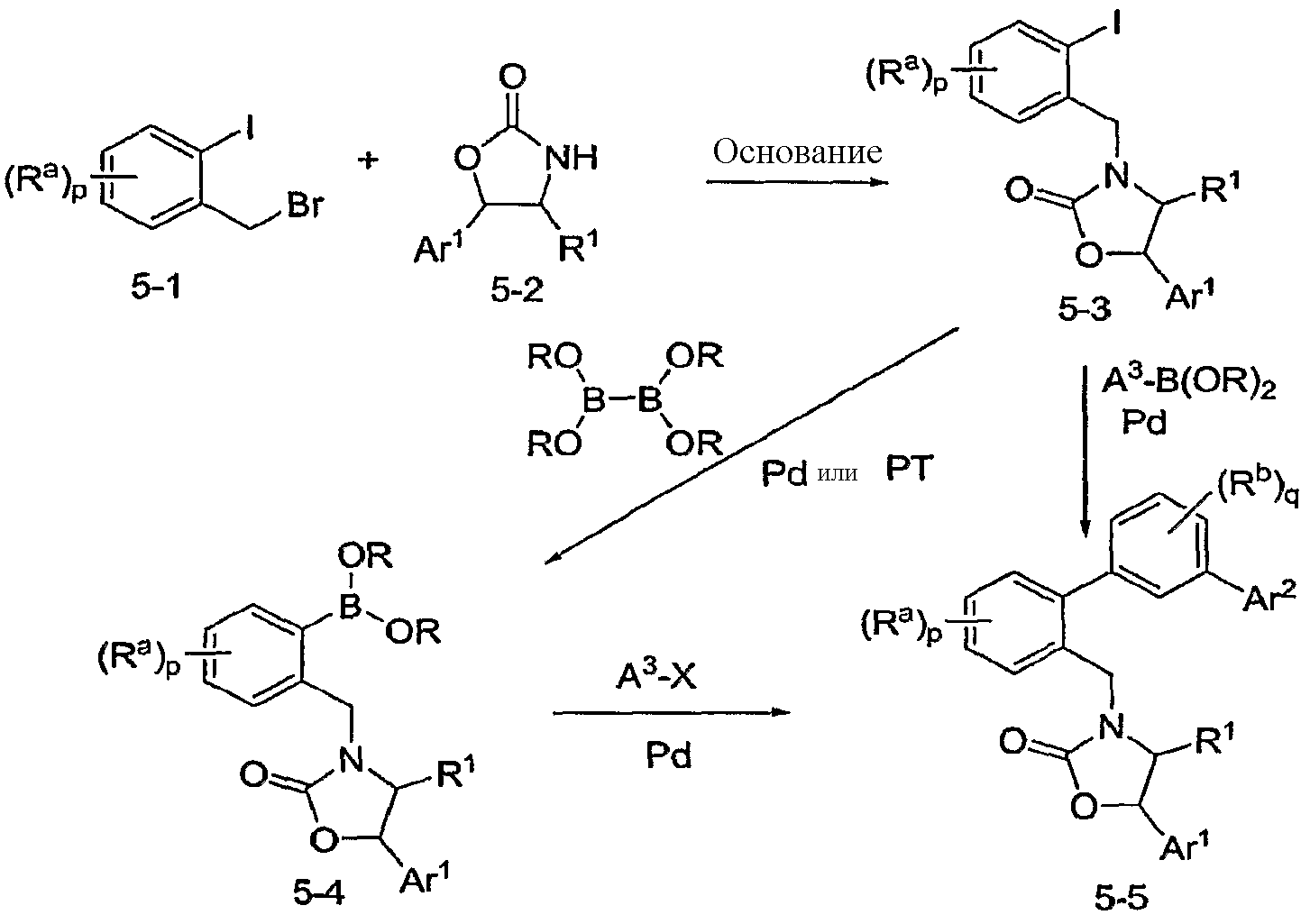
Соединения 5-4 по настоящему изобретению, где значения R1, Rа, Rb, Ar1 и Ar2 определены в формуле изобретения, могут быть получены, как показано на Схеме 5. Оксазолидиноны 5-2, полученные, как показано на Схемах 10 и 11, можно алкилировать бензилбромидами 5-1, которые получают, как показано на Схеме 1, с помощью оснований, таких как гексаметилдисилиазид натрия или гидрид натрия, в растворителях, таких как тетрагидрофуран, диметоксиэтан, диэтиловый эфир и т.п., и получить продукты 5-3. Затем получают соединения 5-5 по реакции Сузуки или реакции Стилла или их вариации с помощью катализируемого палладием перекрестного сочетания иодида 5-3 с соответствующим образом замещенной арил- или гетероарил-бороновой кислотой, -боронатным эфиром или -триалкилоловом, как описано в Miyaua et al., Chem. Rev. 95, 2457 (1995) и приведенных там ссылках, а также как описано в Meijere, A. And Diedrich, F. “Metal-Catalyzed Cross Coupling Reactions”, 2nd Ed., WILEY-VCH Verlag GmbH & Co. KgaA, Weinheim (2004) и приведенных там ссылках. Иначе арилбороновые кислоты или арилборонатные эфиры можно получить по реакции арилгалогенида 5-3 с подходящим реагентом, таким как диборан, силилборан или станнилборан и т.п., в присутствии палладиевого или платинового катализатора или металлогалогенидным обменом и обработкой подходящим электрофильным производным бора, как описано в Meijere, A. and Diedrich, F. “Metal-Catalyzed Cross Coupling Reactions”, 2nd Ed., WILEY-VCH Verlag GmbH & Co. KgaA, Weinheim (2004), глава 2. Арилбороновый реагент 5-4 можно затем ввести во взаимодействие с соответствующим образом замещенным арилгалогенидом в присутствии подходящего палладиевого катализатора и получить соединения 5-5.
Схема 6
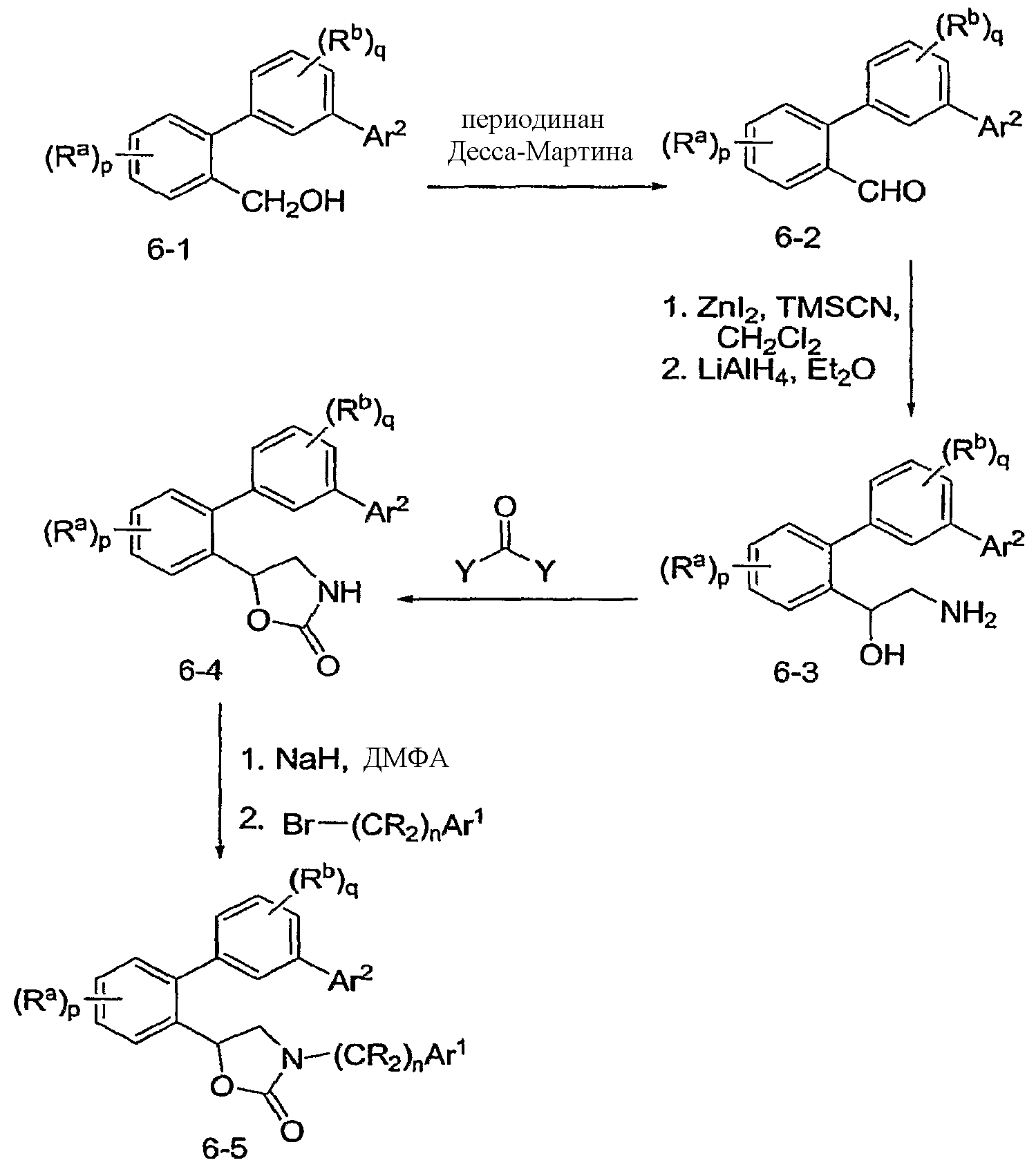
Соединения 6-5 по настоящему изобретению, где значения R1, Rа, Rb, Ar1 и Ar2 определены в формуле изобретения, могут быть получены, как показано на Схеме 6. Бензиловые спирты 6-1 можно приобрести или получить по методу, показанному на Схеме 2. Взаимодействием соединения 6-1 с периодинаном Десса-Мартина получают соответствующие бензальдегиды 6-2. Можно применять и другие способы окисления первичной гидроксильной группы в альдегиды, например проводить реакцию в условиях окисления по Сверну, использовать перрутенат тетрапропиламмония, хлорхромат пиридиния, комплекс триоксид серы-пиридин и т.п. (см. Smith, M.B. and March, J. “March's Advanced Organic Chemistry”, 5th Ed., John Wiley and Sons, New York, pp. 1167-1171 (2001) и приведенные там ссылки). 2-Амино-1-фенилэтанолы 6-3 можно получить из соединения 6-2, через промежуточно образующийся соответствующий силилированный цианогидрин, взаимодействием с триметилсилилцианидом и каталитическим количеством иодида цинка и с последующим восстановлением алюмогидридом лития или подобным восстановителем. Иначе 2-мино-1-фенилэтанолы 6-3 можно получить из соединения 6-2, через промежуточно образующийся соответствующий цианогидрин, взаимодействием с цианидом калия и с последующим восстановлением. 2-Амино-1-фенилэтанолы 6-3 можно циклизовать в оксазолидиноны 6-4, используя такие реагенты, как фосген (Y=Cl), трифосген (Y=OCCl3) или карбонилдиимидазол (Y=имидазол), с основаниями, такими как триэтиламин, диизопропилэтиламин и т.п., в растворителях, таких как дихлорметан, дихлорэтан, тетрагидрофуран, диметоксиэтан и т.п. Оксазолидиноны 6-4 можно алкилировать алкил-, гетероалкил-, арил- или гетероарилбромидами с помощью оснований, таких как гексаметилдисилиазид натрия или гидрид натрия, в растворителях, таких как тетрагидрофуран, диметоксиэтан, диэтиловый эфир и т.п., и получить продукты 6-5. Энантиочистые продукты можно получить, используя метод хиральной хроматографии.
Схема 7
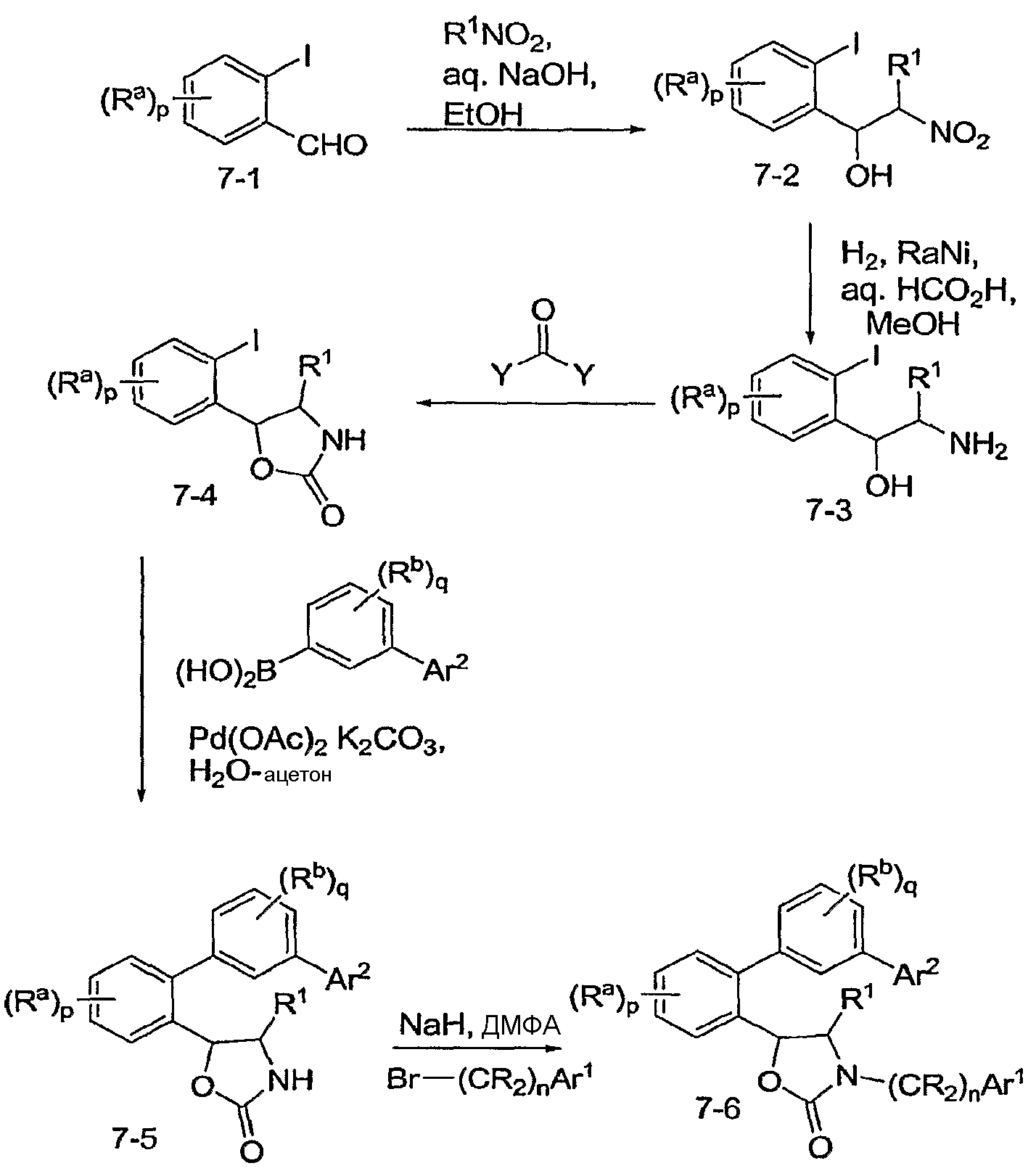
Соединения 6-6 по настоящему изобретению, где значения R1, Rа, Rb, Ar1 и Ar2 определены в формуле изобретения, могут быть получены, как показано на Схеме 7. Альдегиды 7-1 можно приобрести или получить, как показано на Схеме 1. Конденсацией соединения 7-1 с нитроалканом получают замещенные нитроалканолы 7-2. Указанная реакция может катализироваться водными растворами оснований, таких как гидроксид натрия и т.п., в растворителях, таких как этанол, метанол и т.п. Нитроалканолы 7-2 можно восстановить в аминоспирты 7-3 такими восстановителями, как никель Ренея, палладий на активированном угле или оксид платины, в присутствии газообразного водорода и водного раствора кислоты в спиртовых растворителях, таких как метанол, этанол и т.п. (см: Langer, O., et al., Bioorg. Med. Chem., 2001, 9, 677-694). Аминоспирты 7-3 можно циклизовать в оксазолидиноны 7-4, используя такие реагенты, как фосген (Y=Cl), трифосген (Y=OCCl3) или карбонилдиимидазол (Y=имидазол), с основаниями, такими как триэтиламин, диизопропилэтиламин и т.п., в растворителях, таких как дихлорметан, дихлорэтан, тетрагидрофуран, диметоксиэтан и т.п. Оксазолидиноны 7-5 получают по реакции Сузуки или реакции Стилла или их вариации с помощью катализируемого палладием перекрестного сочетания иодидов 7-4 с соответствующим образом замещенными арил- или гетероарил-бороновыми кислотами, -боронатными эфирами или производными -триалкилолова, как описано в Miyaura et al., Chem. Rev. 95, 2457 (1995) и приведенных там ссылках, а также, как описано в Smith, M.B. and March, J. “March's Advanced Organic Chemistry”, 5th Ed., John Wiley and Sons, New York, pp. 868-869 (2001) и приведенных там ссылках. Оксазолидиноны 7-5 можно алкилировать алкил-, гетероалкил-, арил- или гетероарилбромидами с использованием оснований, таких как гексаметилдисилиазид натрия или гидрид натрия, в растворителях, таких как тетрагидрофуран, диметоксиэтан, диэтиловый эфир и т.п., и получить продукты 7-6. Энантиочистые продукты можно получить, используя метод хиральной хроматографии.
Схема 8
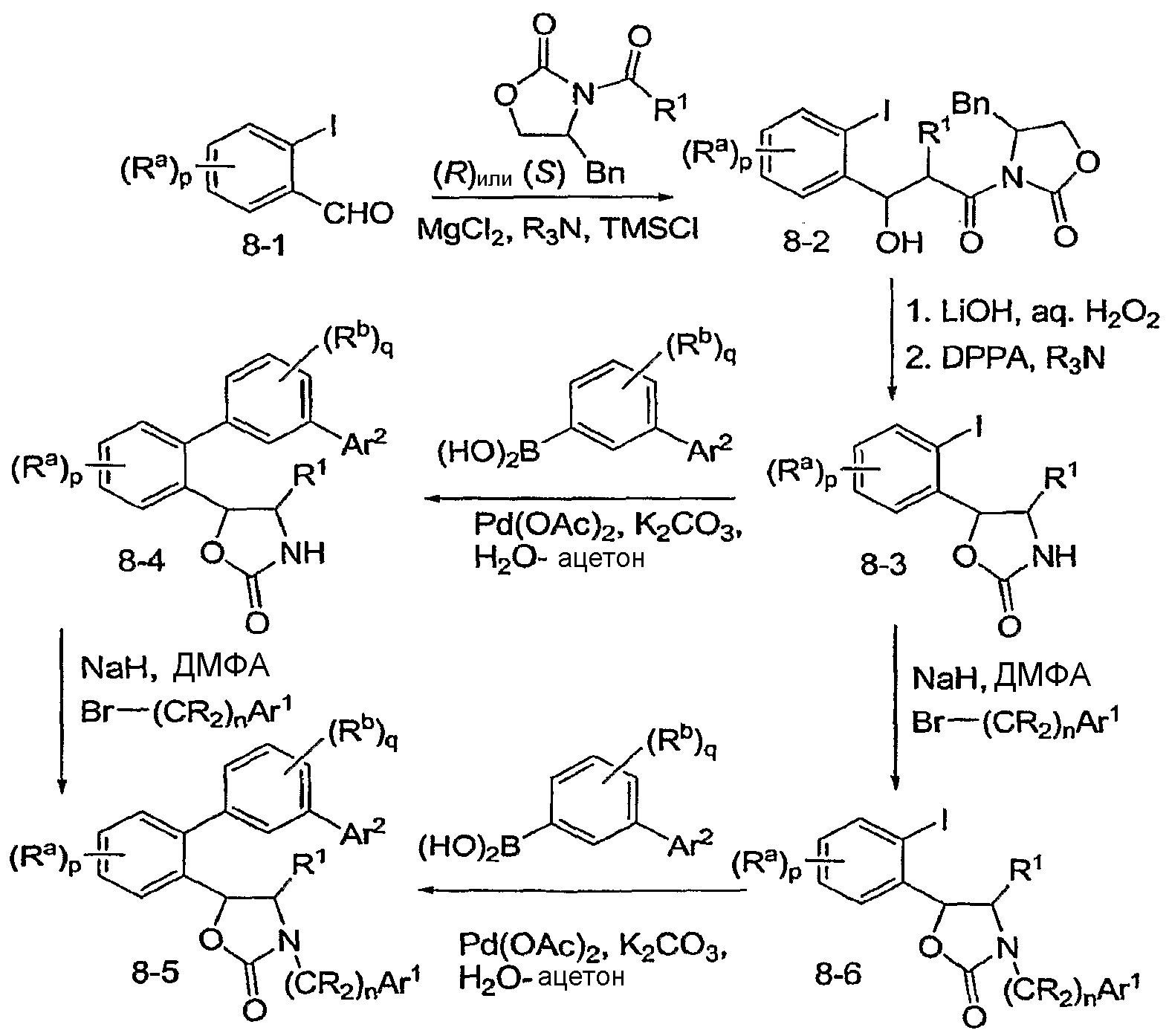
Соединения 8-5 по настоящему изобретению, где значения R, R1, Rа, A2, A3 и n определены в формуле изобретения, могут быть получены, как показано на Схеме 8. Альдегиды 8-1 можно приобрести или получить по способу, приведенному на Схеме 1. Конденсация соединения 8-1 с хиральными N-ацилоксиазолидинонами дает аддукты альдоля 8-2, как описано в Evans, D.A. et al., J. Am. Chem. Soc., 2002, 124, 392-3. Хиральные N-ацилоксиазолидиноны можно приобрести или получить, как описано в Ager, D.J.; Allen, D.A.; Schaad, D.R. Synthesis 1996, 1283-5. Соединения 8-2 можно гидролизовать в соответствующие кислоты, а затем ввести во взаимодействие с дифенилфосфоразидатом и триалкиламиновым основанием с целью осуществления перегруппировки Курциуса и получить хиральные оксиазолидиноны 8-3. Оксазолидиноны 8-4 получают по реакции Сузуки или реакции Стилла или их вариаций с помощью катализируемого палладием перекрестного сочетания иодидов 8-3 с соответствующим образом замещенными арил- или гетероарил-бороновыми кислотами, -боронатными эфирами или производными -триалкилолова, как описано в Miyaura et al., Chem. Rev. 95, 2457 (1995) и приведенных там ссылках, а также, как описано в Smith, M.B. and March, J. “March's Advanced Organic Chemistry”, 5th Ed., John Wiley and Sons, New York, pp. 868-869 (2001) и приведенных там ссылках. Оксазолидиноны 8-4 можно алкилировать алкил-, гетероалкил-, арил- или гетероарилбромидами с использованием оснований, таких как гексаметилдисилиазид натрия или гидрид натрия, в растворителях, таких как тетрагидрофуран, диметоксиэтан, диэтиловый эфир и т.п., и получить продукты 8-5. В качестве альтернативы оксазолидиноны 8-3 алкилируют соответствующими бромидами и получают соединения 8-6, которые вводят в реакцию Сузуки или реакцию Стилла или их вариации с соответствующим образом замещенными арил- или гетероарил-бороновыми кислотами, -боронатными эфирами или производными -триалкилолова, и получают продукты 8-5.
Промежуточное соединение 1
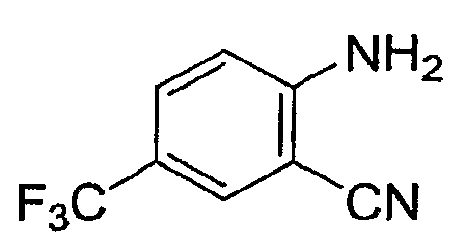
2-Амино-5-(трифторметил)бензонитрил
В 2-литровую колбу помещают 100 г (0,348 моль) 4-амино-3-иодбензотрифторида, 40 г CuCN и 750 мл ДМФА. Смесь нагревают до кипения, а затем кипятят с обратным холодильником в течение 1 час. Реакционную смесь охлаждают и выливают в 3 л воды, содержащей 300 мл концентрированного гидроксида аммония. К полученной смеси добавляют 1 л CH2Cl2. Затем смесь фильтруют через целит. Слои разделяют и водный слой вновь экстрагируют с помощью CH2Cl2. Органические экстракты объединяют и растворитель удаляют при пониженном давлении. Остаток растворяют в 1,5 л диэтилового эфира и полученный раствор промывают 1N раствором гидроксидом аммония, водным раствором бисульфита натрия, 1N водным раствором HCl и насыщенным раствором соли. Раствор сушат над безводным MgSO4 и фильтруют через плотный слой силикагеля, содержащего вверху слой MgSO4. Слой силикагеля промывают с помощью 0,5 л эфира. Эфирные растворы объединяют и концентрируют до 750 мл, а затем оставляют при комнатной температуре. Через 2 дня полученные твердые вещества отделяют, промывают гексаном и сушат при пониженном давлении, получая 2-амино-5-(трифторметил)бензонитрил. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,68 (с, 1H), 7,58 (д, J=8,5 Гц, 1H), 6,81 (д, J=8,5 Гц, 1Н), 4,80 (шир. с, 2H).
Промежуточное соединение 2
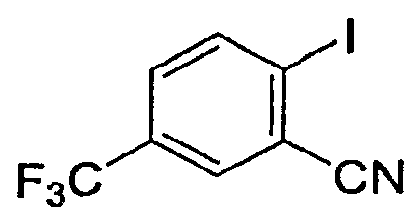
2-Иод-5-(трифторметил)бензонитрил
К раствору 2-амино-5-(трифторметил)бензонитрила (Промежуточное соединение 7, 15,1 г) и дииодметана (24 мл) в ацетонитриле (150 мл) при 35°С по каплям добавляют трет-бутилнитрит (21 мл). В процессе добавления температуру поддерживают приблизительно на уровне 35°С. Реакционную смесь выдерживают в течение 30 мин, а затем нагревают до 60°С в течение 30 мин. Реакционную смесь охлаждают, разбавляют эфиром и дважды промывают водой, дважды промывают водным раствором бисульфита натрия, водой и насыщенным раствором соли. Раствор сушат над безводным MgSO4, фильтруют через плотный слой силикагеля и концентрируют, получая масло красного цвета. Продукт очищают хроматографией на силикагеле, последовательно элюируя гексаном, смесью 3:1 гексан/CH2Cl2 и смесью 1:1 гексан/CH2Cl2, и получают 2-иод-5-(трифторметил)бензонитрил. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,10 (д, J=8,5 Гц, 1Н), 7,85 (д, J=1,8 Гц, 1H), 7,52 (дд, J=8,5, 1,8 Гц, 1Н).
Промежуточное соединение 3
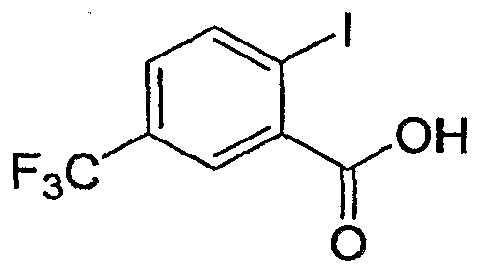
2-Иод-5-(трифторметил)бензойная кислота
Гидроксид калия (3,78 г; 0,0673 моль) добавляют к перемешиваемому раствору 2-иод-5-(трифторметил)бензонитрилу (Промежуточное соединение 8, 4 г, 0,0135 моль) в растворе изопропанол:вода 1:1 (60 мл). Реакционную смесь кипятят с обратным холодильником в течение 14 час, а затем перераспределяют между Н2О (50 мл) и EtOAc (50 мл). Водный слой экстрагируют с помощью EtOAc (50 мл) и подкисляют до рН 5 с помощью 6N раствора HCl. Водный слой дополнительно экстрагируют с помощью EtOAc (4×50 мл), экстракты объединяют и промывают насыщенным раствором соли (50 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме, получая 2-иод-5-(трифторметил)бензойную кислоту в виде твердого вещества желтого цвета. ЖХМС = 317,0 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,27 (д, J=1,6 Гц, 1Н), 8,25 (д, J= 8,2 Гц, 1Н), 7,47 (дд, J=8,2, 1,8 Гц, 1Н).
Промежуточное соединение 4
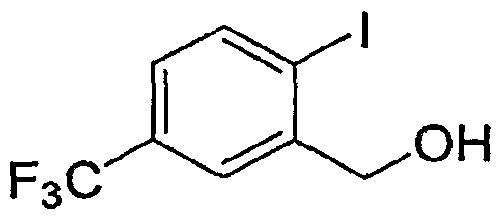
[2-Иод-5-(трифторметил)фенил]метанол
Боран-ТГФ (1,0 М раствор в ТГФ; 94 мл; 94 ммоль) в атмосфере азота добавляют к перемешиваемому раствору 2-иод-5-(трифтор-метил)бензойной кислоты (Промежуточное соединение 3, 2,97 г; 9,4 ммоль) в ТГФ (300 мл) при 0°С. Реакционную смесь кипятят с обратным холодильником в течение 90 мин, а затем осторожно прерывают реакцию с помощью 6N раствора HCl до тех пор, пока выделение газа полностью не прекратится. Реакционную смесь разбавляют водой (250 мл) и экстрагируют с помощью EtOAc (3×250 мл). Экстракты объединяют, промывают насыщенным раствором соли (300 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме. Сырое вещество очищают флэш-хроматографией на силикагеле (в градиенте 0-25% EtOAc/гексан) и получают [2-иод-5-(трифторметил)фенил]метанол в виде твердого вещества белого цвета. ЖХМС = 285,0 (М-17)+. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,97 (д, J=8,3 Гц, 1Н), 7,79 (с, 1Н), 7,28 (д, J=8,4 Гц, 1Н), 4,75 (с, 2Н).
Промежуточное соединение 5
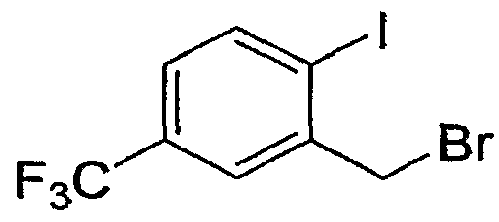
2-(Бромметил)-1-иод-4-(трифторметил)бензол
Тетрабромид углерода (1,86 г; 5,6 ммоль) и трифенилфосфин (1,47 г; 5,6 ммоль) последовательно добавляют к перемешиваемому раствору [2-иод-5-(трифторметил)фенил]метанола (Промежуточное соединение 10, 1,13 г; 3,74 ммоль) в CH2Cl2 (25 мл) при 0°С в атмосфере азота. Реакционную смесь перемешивают при комнатной температуре в течение 48 час. Добавляют второй эквивалент тетрабромида углерода (1,2 г; 3,74 ммоль) и трифенилфосфина (0,98 г; 3,74 ммоль) и реакционную смесь перемешивают еще в течение 14 час. Растворитель удаляют в вакууме и остаток очищают флэш-хроматографией на силикагеле (в градиенте 0-25% EtOAc/гексан) и получают 2-(бромметил)-1-иод-4-(трифторметил)бензол в виде прозрачного масла. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,02 (д, J=8,2 Гц, 1Н), 7,73 (д, J=1,8 Гц, 1Н), 7,26 (дд, J=8,3, 1,8 Гц, 1Н), 4,64 (с, 2Н).
Промежуточное соединение 6
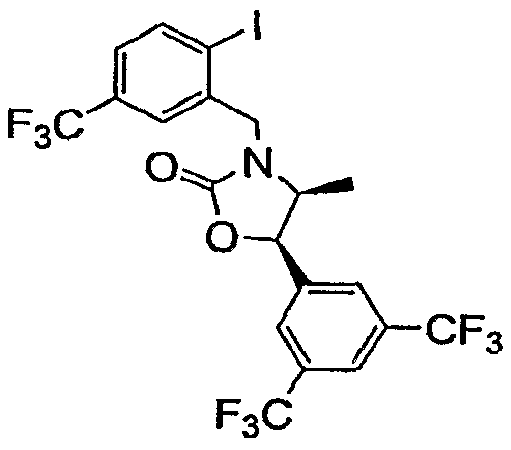
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он
К (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-ону (400 мг, 1,28 ммоль) добавляют NaH (60% в масле, 128 мг, 3,2 ммоль) и 2-(бромметил)-1-иод-4-(трифторметил)бензол (Пример 70, 466 мг, 1,28 моль), как описано в Примере 66, и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он в виде твердого вещества белого цвета. ЖХМС = 598,0 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,06 (д, J=8,2 Гц, 1Н), 7,93 (с, 1Н), 7,82 (с, 2Н), 7,61 (с, 1Н), 7,33 (дд, J=8,2, 1,4 Гц, 1Н), 5,79 (д, J=7,8 Гц, 1Н), 4,91 (д, J=16 Гц, 1Н), 4,40 (д, J=16 Гц, 1Н), 4,16-4,06 (м, 1Н), 0,83 (д, J=6,4 Гц, 3Н).
Промежуточное соединение 7
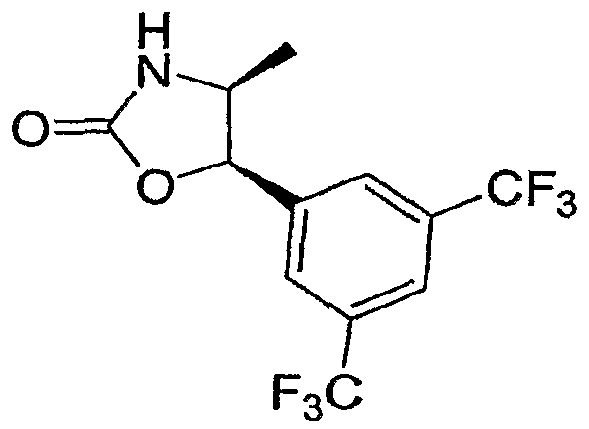
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он
Указанное промежуточное соединение получают непосредственного из хирального исходного соединения CBZ-L-аланина трехстадийным синтезом, который приведен ниже. Соединение (4R,5S)-5-[3,5-бис(три-фторметил)фенил]-4-метил-1,3-оксазолидин-2-он может быть получено аналогичным образом при использовании в качестве исходного соединения CBZ-D-аланина.
Стадия 1
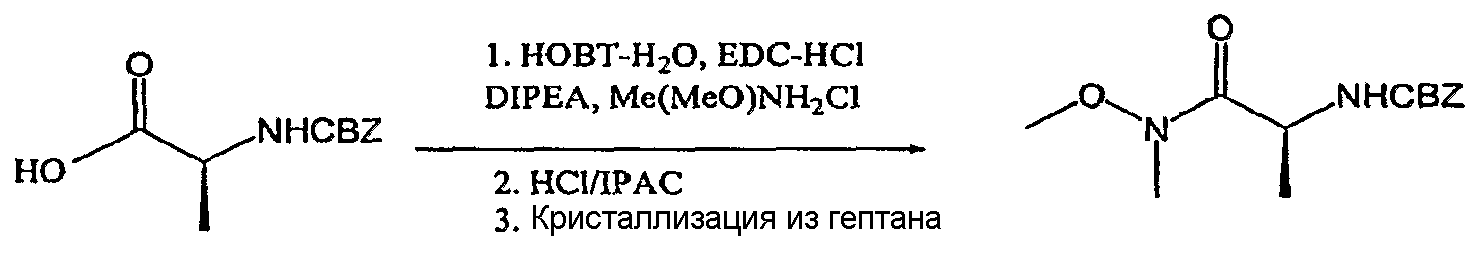
CBZ-L-аланин (6,5 кг, 28,5 моль), НОВТ-гидрат (4,8 кг, 34,8 моль), соль с HCl амина Вайнреба (3,4 кг, 36,2 моль) и ТГФ (32 л) помещают в колбу в атмосфере азота (амин Вайнреба представляет собой N,O-диметилгидроксиламин). Смесь охлаждают до 0-10°С, а затем, поддерживая температуру не более 25°С, медленно добавляют DIPEA (12,4 л). Затем при охлаждении до 15-25°С медленно добавляют EDC-HCl (7 кг, 36,2 моль). Полученную суспензию оставляют перемешиваться на ночь при температуре 20-25°С. Затем смесь охлаждают до 0-10°С и медленно добавляют 3N раствор HCl (12 л). После этого добавляют IPAC (32 л) и слои разделяют. Органический слой один раз промывают с помощью HCl (13 л) и дважды 8%-ным раствором NaHCO3 (предостережение: наблюдается вспенивание). Затем органический слой концентрируют в вакууме при 50°С приблизительно до объема 15 л. Прозрачный раствор медленно охлаждают до комнатной температуры, позволяя продукту кристаллизоваться. Медленно добавляют гептан (~70 л). Суспензию отфильтровывают, промывают гептаном (18 л) и сушат при комнатной температуре на фильтре. Получают продукт с >99,9% э.и. по данным хиральной ВЭЖХ.
Стадия 2
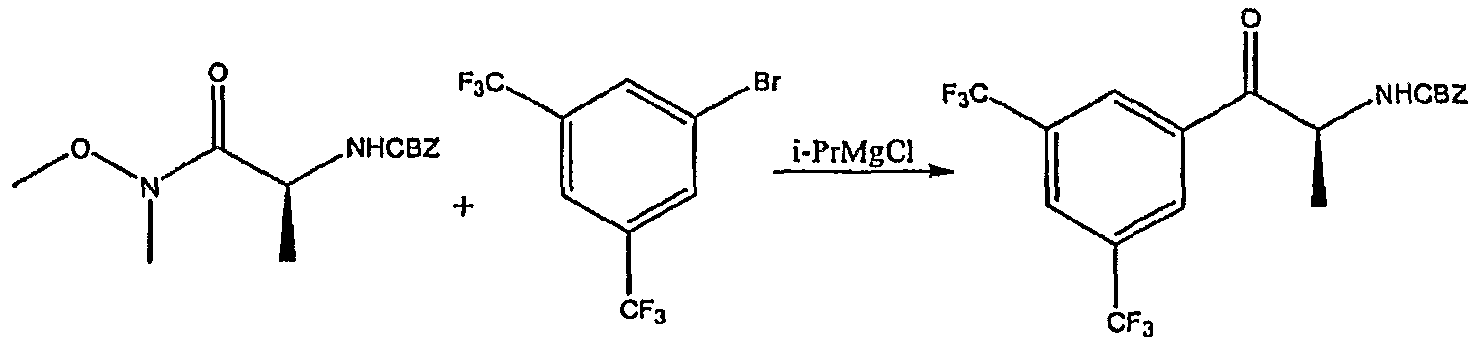
Амид Вайнреба со стадии 1 (6 кг, 22,5 моль) и 3,5-бис(трифторметил)бромбензол (4,8 л, 28,1 моль) растворяют в безводном ТГФ (24 л). Раствор продувают азотом для удаления кислорода. В этот момент содержание воды должно составлять <500 м.д. В случае необходимости можно повести азеотропное удаления воды с помощью дистилляции при атмосферном давлении. Раствор охлаждают до минус 10°С и медленно (в течение 2 час) с помощью капельной воронки добавляют iso-PrMgCl в ТГФ (56,4 моль), поддерживая температуру реакции на уровне ≤-5°С. Дают раствору нагреться до 20°С и оставляют на ночь при температуре 20°С, пока амид не составит <0,5 LCAP. Затем реакционную смесь в токе азота охлаждают до минус 10°С и медленно в течение 2 час прерывают реакцию, добавляя 5N раствор HCl (14 л) таким образом, чтобы температура поддерживалась на уровне 0-5°С. Добавляют МТВЕ (12 л) и двухфазную смесь перемешивают в течение 5 мин. После нагревания до 20-25°С дают смеси отстояться в течение 30 мин и слои разделяют. Органический слой дважды промывают водой (12 л).
Органический слой через встроенный PTFE фильтр с размерами пор 1 мкм с помощью вакуума отфильтровывают в дистилляционную колбу и концентрируют в вакууме до объема ~12 л (в интервале температур <40°С) до минимального способного перемешиваться объема. Затем раствор сушат азеотропной перегонкой с толуолом и вновь доводят до минимального способного перемешиваться объема Полученный раствор непосредственно используют на следующей стадии.
Стадия 3: Восстановление кетона (Стадия 2) в хиральный оксазолидинон:
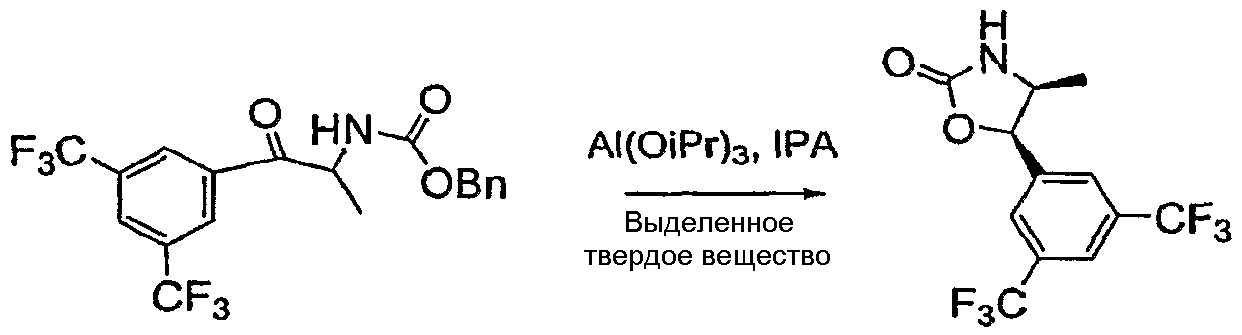
Кетон с предыдущей стадии (6 кг) нагревают при 50°С с 0,3 экв. Al(O-i-Pr)3 (790 г) в 12 л изопропилового спирта (ИПС) и 18 л толуола в течение 15,5 час. Раствор охлаждают до комнатной температуры и при энергичном перемешивании медленно добавляют гранулы твердого КОН (1,35 кг), поддерживая температуру на уровне <25°С. Приблизительно через 2 час, когда анализ по методу ВЭЖХ показывает >99,5% завершения циклизации, для прерывания реакции добавляют 33 л 1N раствор HCl, при этом температуру поддерживают на уровне <25°С. Если образуется состоящий из хлопьев слой твердых веществ, то его следует отфильтровать. Хлопьевидный слой представляет собой рацемический оксазолидинон, и его удаление повышает энантиомерный избыток. Органический слой затем промывают вначале с помощью 36 л 0,5N раствора HCl, затем с помощью 6 л ИПС вместе с 45 л воды и, наконец, с помощью 6 л ИПС вместе с 36 л воды. Органический слой отфильтровывают через встроенный фильтр. Растворитель меняют на гептан (конечный объем ~42 л) при температуре ~40°С, пока не останется <2% толуола. Оставляют на 2 час при комнатной температуре и получают Промежуточное соединение 7.
Промежуточное соединение 8
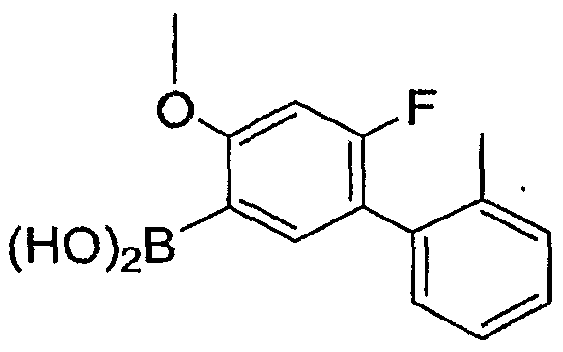
2-Метокси-4-фтор-5-(2'-метилфенил)бороновая кислота
Стадия А: 2-фтор-2'-метилбифенил-4-ил метиловый эфир
Смесь 4-бром-3-фторанизола, 2-метилфенилбороновой кислоты, тетракис(трифенилфосфин)палладия (5%мол.) и карбоната натрия (0,23 г, 2,1 ммоль) в 20 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 5 час. Анализ методом тонкослойной хроматографии (ТСХ) (EtOAc:гексан/2:98) показывает, что реакция завершена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×50 мл). Вытяжки метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после очистки методом препаративной ТСХ, используя 2% EtOAc в гексане в качестве элюента.
Стадия В: 2-фтор-5-иод-2'-метилбифенил-4-ил метиловый эфир
К смеси сульфата серебра (0,34 г, 1,11 ммоль), иода (0,28 г, 1,11 ммоль) в МеОН (10 мл) при комнатной температуре по каплям добавляют раствор полученного выше 2-фтор-2'-метилбифенил-4-ил метилового эфира (0,24 г, 1,11 ммоль) в МеОН (5 мл). Смесь перемешивают при комнатной температуре в течение 4 час до тех пор, пока смесь не приобретет светло-желтый цвет. Твердые вещества отфильтровывают и фильтрат концентрируют. Остаток очищают колоночной флэш-хроматографией, используя гексан в качестве элюента, и получают указанное в названии соединение.
Стадия С: 2-метокси-4-фтор-5-(2'-метилфенил)бороновая кислота
К раствору 2-фтор-5-иод-2'-метилбифенил-4-ил метилового эфира (0,32 г, 0,93 ммоль) в ТГФ при температуре минус 78°С по каплям с помощью шприца добавляют n-BuLi (0,48 мл, 1,22 ммоль,2,5 М раствор в гексане). Раствор перемешивают при минус 78°С в течение 30 мин. Добавляют триметиборат (0,31 мл, 2,8 ммоль). Полученную смесь перемешивают при минус 78°С в течение 3 час. Реакцию прерывают насыщенным раствором хлорида аммония. Смесь экстрагируют с помощью EtOAc (3×15 мл). Слои EtOAc объединяют и сушат над сульфатом натрия. Указанное в названии соединение используют далее после удаления растворителя.
Промежуточное соединение 9
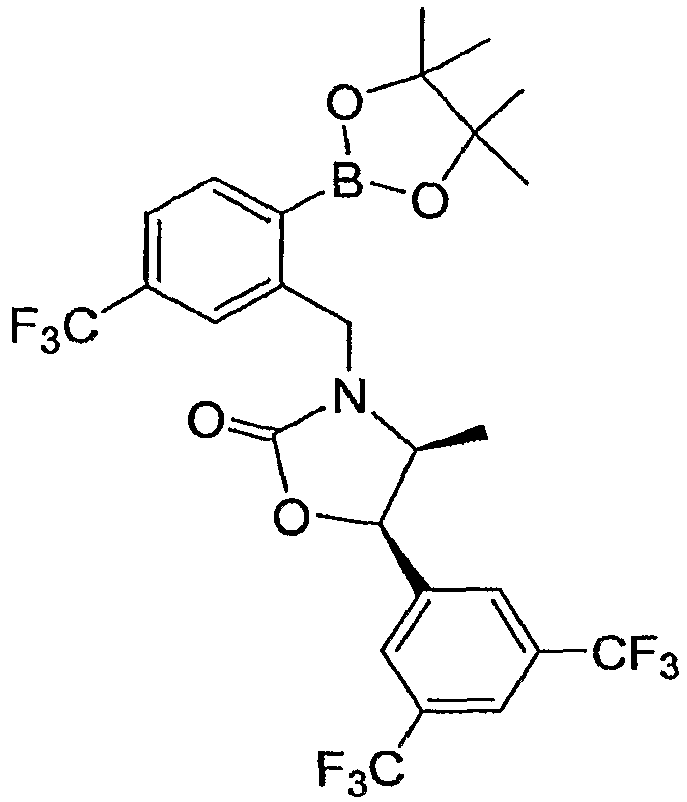
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)бензил]-1,3-оксазолидин-2-он
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он (Промежуточное соединение 6, 0,75 г, 1,25 ммоль), бис(пинаколято)диборон (339 мг, 1,5 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (214 мг, 0,262 ммоль), ацетат калия (257 мг, 2,616 ммоль) и 1,4-диоксан (2,5 мл) герметично закрывают в сосуде для ВЧ нагрева. Реакционную смесь подвергают ВЧ нагреву до температуры 140°С в течение 20 мин, а затем до температуры 130°С в течение 30 мин. Сырой продукт промывают насыщенным раствором соли, а затем экстрагируют этилацетатом. Экстракты объединяют и сушат над Na2SO4, а затем фильтруют и концентрируют в вакууме, получая масло темного цвета. Полученную смесь используют на следующей стадии без дальнейшей очистки.
Промежуточное соединение 10
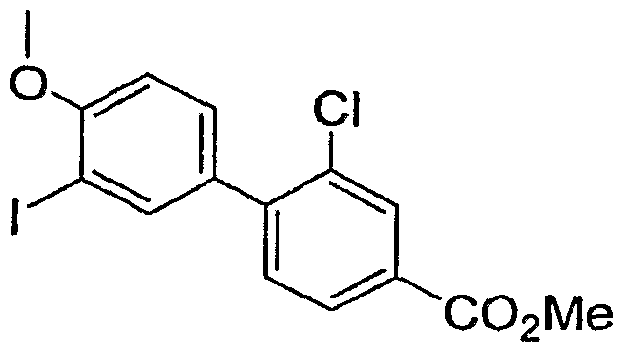
Метил 2-хлор-3'-иод-4'-метоксибифенил-4-карбоксилат
Стадия А: метил 4-иод-3-хлорбензоат
Смесь метил 4-амино-3-хлорбензоата (1,0 г, 5,4 ммоль), н-пентилнитрита (0,95 г, 8,1 ммоль) и иода (1,78 г, 7,0 ммоль) перемешивают при кипячении с обратным холодильником в течение 1 час. Смесь разбавляют метиленхлоридом (30 мл). Полученный раствор розового цвета промывают насыщенным раствором тиосульфата натрия, насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после проведения колоночной флэш-хроматографии, используя EtOAc:гексан/2:98 в качестве элюента.
Стадия В: метил 2-хлор-4'-метоксибифенил-4-карбоксилат
Смесь метил 4-иод-3-хлорбензоата (1,20 г, 4,05 ммоль), полученного на стадии А, 4-метоксифенилбороновой кислоты (1,23 г, 8,1 ммоль), тетракис(трифенилфосфин)палладия (0,23 г, 5%мол.) и карбоната натрия (0,94 г, 8,9 ммоль) в 50 мл смеси вода/EtOH/толуол (1:2:4) оставляют на ночь кипятиться с обратным холодильником. Анализ по методу ТСХ (EtOAc:гексан/1:9) показывает, что реакция завершена. Растворители удаляют. Добавляют воду (30 мл). Органические вещества экстрагируют метиленхлоридом (3×50 мл). Вытяжки метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после очистки методом колоночной флэш-хроматографии, используя EtOAc:гексан/1:9 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,16 (д, J=1,5 Гц, 1H), 7,97 (дд, J=8, 1,5Гц, 1Н), 7,43 (м, 3H), 7,01 (д, J=6,5 Гц, 2H), 4,00 (с, 3H), 3,91 (с, 3H).
Стадия С: метил 2-хлор-3'-иод-4'-метоксибифенил-4-карбоксилат
К смеси сульфата серебра (0,97 г 3,11 ммоль) и иода (0,79 г, 3,11 ммоль) в МеОН (20 мл) при комнатной температуре добавляют раствор метил 2-хлор-4'-метоксибифенил-4-карбоксилата (0,86 г, 3,11 ммоль) в смеси 1:1 МеОН/EtOH (10 мл). Смесь перемешивают при комнатной температуре в течение 6 час до тех пор, пока реакционная смесь не обесцветится. Твердые вещества отфильтровывают и фильтрат концентрируют. Указанное в названии соединение получают после очистки методом колоночной флэш-хроматографии, используя EtOAc:гексан/5:95 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,15 (д, J=1,5 Гц, 1Н), 7,97 (дд, J=8, 2Гц, 1H), 7,89 (д, J=2 Гц, 1Н), 7,46 (дд, J=8,5, 2Гц, 1H), 7,40 (д, J=8 Гц, 1H), 6,91 (д, J=8 Гц, 1Н), 3,98 (с, 6H).
Промежуточное соединение 11
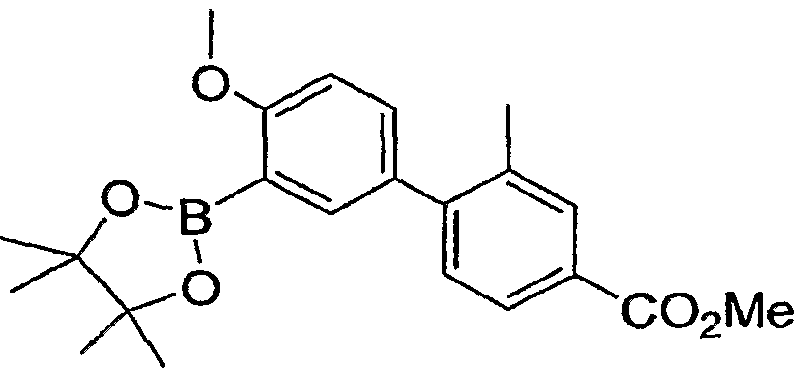
Метил 4'-метокси-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилат
3'-Иод-4'-метокси-2-метилбифенил-4-карбоксилат (500 мг, 1,308 ммоль), бис(пинаколято)диборон (353 мг, 1,57 ммоль), 1,1'-бис(дифенил-фосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (214 мг, 0,262 ммоль), ацетат калия (257 мг, 2,616 ммоль) и 1,4-диоксан (2,5 мл) помещают в герметично закрытую трубку и подвергают ВЧ нагреву до температуры 140°С в течение 20 мин, а затем до температуры 130°С в течение 30 мин. Сырой продукт промывают насыщенным раствором соли, а затем экстрагируют этилацетатом. Экстракты объединяют и сушат над Na2SO4, а затем фильтруют и концентрируют в вакууме, получая метил 4'-метокси-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилат в виде масла темного цвета, которое используют на следующей стадии без дальнейшей очистки. ЖХМС: рассчитано = 382,20; найдено = 383,41 (М+1)+.
Промежуточное соединение 12
(4R,5R)-5-[2-Иод-5-(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он
Стадия А: 2-иод-5-(трифторметил)бензальдегид
К раствору 2-иод-5-(трифторметил)бензонитрила (Промежуточное соединение 2, 42 г) в CH2Cl2 (300 мл) при минус 78°С добавляют раствор DIBAL в CH2Cl2 (175 мл, 1 М) в течение 30 мин. Образуется осадок. Реакционную смесь нагревают до 0°С. Дополнительно по каплям в течение 30 мин добавляют 25 мл раствора DIBAL. Реакционную смесь выливают в 200 мл 2N водного раствора HCl, разбавляют эфиром и перемешивают в течение 1 час. Анализ методом ТСХ показывает, что имин все еще присутствует; дополнительно добавляют 100 мл 2N водного раствора HCl и реакционную смесь оставляют перемешиваться на ночь. По данным ТСХ имин все еще присутствует, так что дополнительно добавляют 200 мл 2N водного раствора HCl и реакционную смесь перемешивают в течение 2 час. Слои разделяют и водный слой дополнительно экстрагируют эфиром. Эфирные экстракты объединяют, промывают насыщенным раствором соли, сушат над безводным MgSO4, фильтруют и концентрируют. Продукт очищают хроматографией на силикагеле, элюируя смесью 95:5 гексан/EtOAc, и получают 2-иод-5-(трифторметил)бензальдегид в виде твердого вещества белого цвета. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 10,00 (с, 1H), 8,12 (с, 1H), 8,11 (д, J=8 Гц, 1Н), 7,53 (дд, J=2 Гц, 8 Гц, 1H).
Стадия В: (4S)-4-бензил-3-{(2R,3S)-3-гидрокси-3-[2-иод-5-(трифтор-метил)фенил]-2-метилпропаноил}-1,3-оксазолидин-2-он
Смесь 1,8 г 5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-карбальдегида (Стадия А), 1,16 г (4S)-4-бензил-3-пропионил-1,3-оксазолидин-2-она, 0,048 г хлорида магния, 1,40 мл триэтиламина и 0,91 мл хлортриметилсилана в 10 мл EtOAc перемешивают при комнатной температуре в течение 24 час, а затем фильтруют через плотный слой 10×10 см силикагеля, элюируя с помощью 400 мл Et2O. Фильтрат концентрируют и добавляют 10 мл МеОН вместе с 2 каплями трифторуксусной кислоты. Полученный раствор перемешивают при комнатной температуре в течение 30 мин и концентрируют, получая масло бледно-желтого цвета. Полученный раствор очищают флэш-хроматографией на колонке Biotage Horizon, 65i, элюируя 10%-ным раствором ацетона в гексане в количестве 15 объемов колонки, и получают 1,42 г (53%) указанного в названии соединения. Масс-спектр (ESI) 516,2 (М-ОН). Спектр 1Н ЯМР (500 МГц, CDCl3) δ 8,00 (д, J=8,5 Гц, 1H), 7,76 (д, J=2 Гц, 1Н), 7,22-7,32 (м, 4H), 7,07 (шир. д, J=6,5 Гц, 2H), 5,18 (дд, J=6,5 Гц, 7,5 Гц, 1Н), 4,67 (м, 1H), 4,46 (дкв, J=6,5 Гц, 7,5 Гц, 1H), 4,17 (т, J=9 Гц, 1H), 4,11 (дд, J=3 Гц, 9 Гц, 1H), 3,97 (д, J=8 Гц, 1H), 3,19 (дд, J=7 Гц, 13,5 Гц, 1H), 2,57 (дд, J=9,5 Гц, 13,5 Гц, 1H), 1,34 (д, J=7,5 Гц, 3H).
Стадия С: (4R,5R)-5-[2-иод-5-(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он
К охлажденному до 0°С раствору (4S)-4-бензил-3-{(2R,3S)-3-гидрокси-3-[2-иод-5-(трифторметил)фенил]-2-метилпропаноил}-1,3-оксазолидин-2-она в 6 мл смеси 3:1 тетрагидрофуран-вода добавляют 0,102 г гидроксида лития в 1,5 мл воды, затем добавляют 0,554 мл 30%-ного водного раствора пероксида водорода. Полученный раствор перемешивают при 0°С в течение 1 час, после чего анализ методом ЖХ/МС показывает отсутствие исходных веществ. К холодному раствору добавляют 1,5 М раствор сульфита натрия (3,7 мл), переносят раствор в делительную воронку и экстрагируют 2×10 мл CH2Cl2. Экстракты CH2Cl2 объединяют и еще раз экстрагируют с помощью 20 мл смеси 3:1 насыщенного водного раствора NaHCO3. Водные слои объединяют и подкисляют (pH < 1) с помощью 6N раствора HCl и экстрагируют 4×10 мл EtOAc. Экстракты EtOAc объединяют, промывают с помощью 10 мл насыщенного раствора соли, сушат над Na2SO4 и концентрируют. Остаток растворяют в 10 мл толуола. Добавляют дифенилфосфорилазид (0,315 мл) и 0,24 мл триэтиламина и смесь оставляют перемешиваться на ночь при температуре 100°С, а затем охлаждают и концентрируют. Остаток очищают флэш-хроматографией на колонке Biotage Horizon, 40S, элюируя 5%-ным раствором EtOAc в гексане в количестве 1 объем колонки, с последующим градиентным элюированием EtOAc в гексане от 5 до 100% и получают 0,302 г (67%) указанного в названии соединения. Масс-спектр (ESI) 372,1 (М+1). Спектр 1Н ЯМР (500 МГц, CDCl3) δ 8,02 (д, J=8 Гц, 1H), 7,61 (д, J=1,5 Гц, 1Н), 7,32 (дд, J=2 Гц, 8 Гц, 1H), 6,16 (с, 1Н), 5,39 (д, J=4 Гц, 1H), 3,76 (дкв, J=6 Гц, 4,5 Гц, 1H), 1,62 (д, J=6 Гц, 3H).
Аналитическая ВЭЖХ на колонке Chiralpak AD, 4,6×250 мм, при элюировании 4%-ным этанолом в гептане со скоростью 0,75 мл/мин (tR=21,56 для R,R; tR=18,00 для S,S) дает 98% э.и..
Промежуточное соединение 13
Метил 2"-(бромметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Стадия А: метил 4'-метокси-2-метилбифенил-4-карбоксилат
К метил 4-бром-3-метилбензоату (92 г, 0,402 моль), (4-метоксифенил)бороновой кислоте (61,1 г, 0,402 моль), Na2CO3 (85,2 г, 0,804 моль) и PdCl2(PPh3)2 (1410 мг, 2,01 ммоль) добавляют EtOH (1,23 л) и воду (0,61 л). Реакционную смесь нагревают до 80°С в течение 1 час. Реакционную смесь охлаждают до комнатной температуры, добавляют 550 мл воды и смесь оставляют на 1 час. Образовавшиеся твердые вещества отфильтровывают и промывают раствором EtOH в Н2О (1:1, 750 мл). Твердые вещества измельчают с помощью ступки и пестика, а затем суспендируют в 250 мл Н2О при комнатной температуре в течение 1 час, затем отфильтровывают, промывают водой (2×125 мл) и сушат, получая метил 4'-метокси-2-метилбифенил-4-карбоксилат. Спектр 1Н ЯМР (400 МГц, CDCl3) δ 7,95 (с, 1H), 7,89 (д, J=7,9 Гц, 1H), 7,29 (д, J=7,9 Гц, 1H), 7,27 (д, J=8,7 Гц, 2H), 6,98 (д, J=8,7 Гц, 2H), 3,94 (с, 3H), 3,87 (с, 3H), 2,33 (с, 3H).
Стадия В: метил 3'-бром-4'-метокси-2-метилбифенил-4-карбоксилат
К раствору метил 4'-метокси-2-метилбифенил-4-карбоксилата (71,5 г, 0,279 моль) в ацетонитриле (1,43 л) и воды (572 мл) добавляют оксон (180,1 г, 0,293 моль). Затем в течение 30 мин медленно добавляют раствор KBr (38,2 г, 0,321 моль) в воде (143 мл). Реакционную смесь перемешивают в течение 2,5 час, затем добавляют воду (715 мл) и смесь оставляют на 1 час. Твердые вещества отфильтровывают и промывают следующим образом: раствором MeCN/вода (1:1, 350 мл, дважды), водой (700 мл, дважды, затем 350 мл) и сушат, получая метил 3'-бром-4'-метокси-2-метилбифенил-4-карбоксилат. Спектр 1Н ЯМР (400 МГц, CDCl3) δ 7,94 (с, 1H), 7,89 (д, J=8,1 Гц, 1H), 7,53 (д, J=2,2 Гц, 1H), 7,3-7,2 (м, 2H), 6,97 (д, J=8,4 Гц, 1H), 3,96 (с, 3H), 3,94 (с, 3H), 2,32 (с, 3H).
Стадия С: метил 2"-(гидроксиметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
К метил 3'-бром-4'-метокси-2-метилбифенил-4-карбоксилату (80,0 г, 0,239 моль), пинаколборану (72,8 г, 0,287 моль), Pd(dba)2 (4120 мг, 7,17 ммоль), P(Cy)3 (2140 мг, 7,65 ммоль) и КОАс (70,3 г, 0,717 моль) добавляют диоксан (1,2 л). Реакционную смесь нагревают до 80°С и перемешивают в течение 3 час. Затем реакционную смесь охлаждают до комнатной температуры и отфильтровывают. Твердые вещества растворяют в EtOAc (800 мл), промывают насыщенным раствором соли (400 мл, дважды) и концентрируют.
Остаток растворяют в ТГФ (300 мл) и добавляют [2-хлор-5-(трифторметил)фенил]метанол (47,1 г, 0,223 моль) и (t-Bu2P)2ферроцен PdCl2. Добавляют раствор К2СО3 (83,7 г, 0,606 моль) в воде (214 мл) и смесь нагревают до 45°С и перемешивают в течение 9 час. Реакционную смесь охлаждают до комнатной температуры, разбавляют с помощью EtOAc (428 мл) и промывают водой (428 мл) и насыщенным раствором соли (428 мл). К органическому веществу добавляют 21,5 г активированного угля (смесь Darco KB-100) и смесь перемешивают в течение 1 час. Смесь отфильтровывают, твердое вещество промывают с помощью EtOAc (428 мл). Фильтрат концентрируют и вновь растворяют в МеОН (677 мл) и оставляют на 1 час. К смеси добавляют воду (169 мл) в течение 2 час, а затем смесь оставляют на 1 час. Полученные твердые вещества промывают раствором МеОН в воде (4:1, 170 мл, трижды) и сушат, получая метил 2"-(гидроксиметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат.
Стадия D: метил 2"-(бромметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
К охлажденному до 0°С раствору метил 2"-(гидроксиметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (1,500 г, 3,49 ммоль) в CH2Cl2 (14 мл) добавляют СBr4 (2,429 г, 7,33 ммоль), а затем раствор трифенилфосфина (1,830 г, 6,98 ммоль) в CH2Cl2 (15 мл). Раствор нагревают до комнатной температуры и перемешивают в течение двенадцати часов. Реакционную смесь концентрируют, остаток очищают флэш-хроматографией на силикагеле (от 0 до 25% EtOAc/гексан) и получают метил 2"-(бромметил)-4'-метокси-2-метил-4"-(трифтор-метил)-1,1':3',1"-терфенил-4-карбоксилат. Rf=0,59 (50% EtOAc/гексан). ЖХМС=494,8 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,95 (с, 1H), 7,89 (д, J=8,0 Гц, 1H), 7,80 (с, 1H), 7,59 (д, J=7,6 Гц, 1Н), 7,40-7,33 (м, 3H), 7,21 (д, J=2,3 Гц, 1H), 7,06 (д, J=8,5 Гц, 1H), 4,44-4,39 (м, 2H), 3,93 (с, 3H), 3,82 (с, 3H), 2,37 (с, 3H).
Промежуточное соединение 14
(5R)-5-[3,5-бис(трифторметил)фенил]-3-{[4'-фтор-5'-изопропил-2'-метокси-4-(трифторметил)бифнил-2-ил]}-4,4-диметил-1,3-оксазолидин-2-он
Стадия А: бензил {2-[метокси(метил)амино]-1,1-диметил-2-оксоэтил}карбамат
N-Метилморфолин (682 мг, 741 мкл, 6,74 ммоль) и изобутилхлорформиат (460 мг, 441 мкл, 3,37 ммоль) последовательно добавляют к перемешиваемому раствору N-карбобензилокси-2-метилаланина (0,64 г, 2,69 ммоль) в сухом CH2Cl2 при 0°С в атмосфере азота. Полученную мутную смесь перемешивают при 0°С в течение 90 мин. Порциями добавляют гидрохлорид N,O-диметилгидроксиламина (316 мг, 3,24 ммоль) и смесь нагревают до комнатной температуры и перемешивают в течение 3 час. Смесь выливают в 1N раствор HCl (30 мл) и экстрагируют с помощью CH2Cl2 (3×40 мл). Экстракты объединяют, промывают 1N раствором HCl (30 мл), сушат (над Na2SO4) и концентрируют в вакууме, получая сырой продукт. Его очищают флэш-хроматографией (Si, 40×160 мм, в градиенте 0-80% EtOAc в гексане) и получают бензил {2-[метокси(метил)амино]-1,1-диметил-2-оксоэтил}карбамат. Rf = 0,47 (50% EtOAc в гексане). ЖХМС: рассчитано = 303,1; найдено = 303,2 (М+Na)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,37-7,29 (м, 5H), 5,82 (с, 1H), 5,09 (с, 2H), 3,60 (с, 3H), 3,18 (с, 3H), 1,60 (с, 6H).
Стадия В: бензил (1,1-диметил-2-оксоэтил)карбамат
Диизобутилалюмогидрид (1,77 мл, 1 М раствор в толуоле, 0,708 ммоль) добавляют к перемешиваемому раствору бензил {2-[метокси(метил)амино]-1,1-диметил-2-оксоэтил}карбамата (198,5 мг, 0,708 ммоль) в сухом ТТГФ (7,1 мл) при минус 78°С в атмосфере азота. Реакционную смесь перемешивают при минус 78°С в течение 4 час. Добавляют МеОН (100 мкл) и 1N раствор HCl (250 мкл) и реакционной смеси дают нагреться до комнатной температуры. Смесь разбавляют с помощью Et2O (50 мл) и промывают 1N раствором HCl (2×50 мл), 50%-ным насыщенным раствором NaHCO3 (50 мл) и водой (50 мл), затем сушат (MgSO4) и концентрируют в вакууме, получая бензил (1,1-диметил-2-оксоэтил)карбамат. Rf = 0,40 (20% EtOAc в гексане). ЖХМС: рассчитано = 244,1; найдено = 244,1 (М+Na)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 9,43 (с, 1H), 7,38-7,30 (м, 5H), 5,34 (с, 1H), 5,09 (с, 2H), 1,37 (с, 6H).
Стадия С: бензил {2-[3,5-бис(трифторметил)фенил]-2-гидрокси-1,1-диметилэтил}карбамат
Этилмагнийбромид (1,63 мл, 1 М раствор в ТГФ, 1,63 ммоль) по каплям при перемешивании добавляют к раствору 1-иод-3,5-бис(три-фторметил)бензола (608 мг, 317 мкл, 1,79 ммоль) в сухом ТГФ (1 мл) при комнатной температуре в атмосфере азота и реакционную смесь перемешивают в течение 30 мин. Полученный раствор добавляют к перемешиваемому раствору бензил (1,1-диметил-2-оксоэтил)карбамата (163,5 мг, 0,739 ммоль) в сухом ТГФ (1 мл) при минус 20°С и реакционной смеси в течение 3 час дают нагреться до комнатной температуры. Добавляют насыщенный раствор NH4Cl (10 мл) и воду (10 мл) и смесь экстрагируют с помощью EtOAc (3×20 мл). Объединенные экстракты сушат (над Na2SO4) и концентрируют в вакууме, получая сырой продукт. Его очищают флэш-хроматографией (Si, 25×160 мм, градиент 0-40% EtOAc в гексане) и получают бензил {2-[3,5-бис(трифторметил)фенил]-2-гидрокси-1,1-диметилэтил}карбамат. Rf = 0,40 (20% EtOAc в гексане). ЖХМС: рассчитано = 436,1; найдено = 436,0 (М+1)+. Спектр 1Н ЯМР (600 МГц, CDCl3) δ 7,80 (с, 1H), 7,77 (с, 2H), 7,39-7,33 (м, 5H), 5,12-5,08 (м, 2H), 1,36 (с, 1Н), 4,90 (д, J=4,4 Гц, 1Н), 4,81 (с, 1Н), 1,36 (с,3H), 1,23 (с,3H).
Промежуточное соединение 15
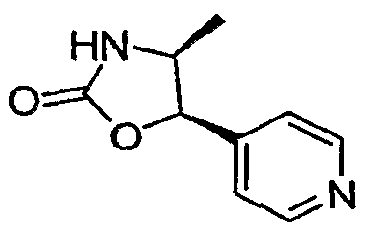
(4S,5R)-4-Метил-5-пиридин-4-ил-1,3-оксазолидин-2-он
Стадия А: бензил {(1S)-2-[метокси(метил)амино]-1-метил-2-оксоэтил}карбамат
CBZ-L-аланин (6,5 кг, 28,5 моль), НОВТ-гидрат (4,8 кг, 34,8 моль), Me(MeO)NH2Cl (3,4 кг, 36,2 моль) и ТГФ (32 л) помещают под азотом в чистую колбу. Смесь охлаждают до 0-10°С и медленно добавляют диизопропилэтиламин (12,4 л), поддерживая температуру не более 20°С. При небольшом охлаждении до 15-25°С медленно добавляют EDC-HCl (7 кг, 36,2 моль). Суспензию оставляют на ночь при температуре 20-25°С. Смесь охлаждают до 0-10°С и медленно добавляют 3N раствор HCl (13 л). Добавляют изопропилацетат (45,5 л) и слои разделяют. Органический слой промывают один раз HCl (13 л) и дважды 8% NaHCO3 (13 л). Органический слой концентрируют при 50°С в вакууме до объема <20 л. Прозрачный раствор медленно охлаждают до комнатной температуры, позволяя продукту кристаллизоваться. Медленно добавляют гептан (~70 л). Суспензию фильтруют, промывают гептаном (18 л) и сушат при комнатной температуре на фильтре. Получают бензил {(1S)-2-[метокси(метил)амино]-1-метил-2-оксоэтил}карбамат с >99,9% э.и. по данным хиральной ВЭЖХ.
Стадия В: бензил [(1S)-1-метил-2-оксо-2-пиридин-4-илэтил]карбамат
Раствор изопропилмагнийхлорида (1,6 мл, 1 М в ТГФ, 3,23 ммоль) при перемешивании в атмосфере азота добавляют по каплям к раствору бензил {(1S)-2-[метокси(метил)амино]-1-метил-2-оксоэтил}карбамата (879 мг, 3,30 ммоль) в сухом ТГФ (4,2 мл) при температуре минус 15°С. Реакционную смесь перемешивают при минус 15°С в течение 30 мин, а затем через канюлю по каплям добавляют суспензию 4-пиридилмагнийбромида в сухом ТГФ (получают, добавляя этилмагнийбромид (6 мл, 2 М в ТГФ, 6,00 ммоль) к перемешиваемому раствору 4-иодпиридина (1,35 г, 6,60 ммоль) в сухом ТГФ (45 мл) при комнатной температуре в атмосфере азота, а затем перемешивают в течение 30 мин). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 5 час. Для прерывания реакции добавляют 1N раствор HCl (15 мл) и подщелачивают смесь насыщенным раствором NaHCO3. Смесь экстрагируют с помощью EtOAc (2×50 мл) и CH2Cl2 (3×50 мл). Экстракты EtOAc и CH2Cl2 раздельно промывают насыщенным раствором соли, сушат (над Na2SO4), объединяют и концентрируют в вакууме, получая сырой продукт. Его очищают флэш-хроматографией (Si, 40×160 мм, градиент 0-100% EtOAc в гексане) и получают бензил [(2R)-1-метил-2-оксо-2-пиридин-4-илэтил]карбамат в виде бесцветного твердого вещества. Rf=0,33 (50% EtOAc/гексане). ЖХМС: рассчитано = 285,1; найдено = 285,3 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 8,85 (д, J=3,3 Гц, 2H), 7,76 (д, J=5,5 Гц, 2H), 7,36-7,32 (м, 5H), 5,70 (д, J=6,8 Гц, 1H), 5,31-5,25 (м, 1H), 5,13 (с, 2H), 1,43 (с, 3H).
Стадия С: бензил [(1S,2R)-2-гидрокси-1-метил-2-пиридин-4-илэтил]карбамат
Три-трет-бутоксиалюмогидрид лития (964 мг, 3,79 ммоль) в атмосфере азота при температуре минус 78°С добавляют к раствору бензил [(2R)-1-метил-2-оксо-2-пиридин-4-илэтил]карбамата (539,1 мг, 1,90 ммоль) в сухом EtOH (40 мл). Реакционную смесь перемешивают при минус 78°С в течение 2 час. Для прерывания реакции добавляют 2%-ный водный раствор уксусной кислоты и подщелачивают смесь насыщенным раствором NaHCO3 (~50 мл). Смесь экстрагируют с помощью EtOAc (3×100 мл), экстракты объединяют и промывают насыщенным раствором соли (50 мл), сушат (над Na2SO4) и концентрируют в вакууме, получая сырой продукт. Его очищают флэш-хроматографией (Si, 40×160 мм, градиент 0-100% EtOAc в гексане) и получают бензил [(1S,2R)-2-гидрокси-1-метил-2-пиридин-4-илэтил]карбамат в виде бесцветного твердого вещества. Rf=0,49 (EtOAc). ЖХМС: рассчитано = 287,1; найдено = 287,3 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 8,41 (д, J=5,7 Гц, 2H), 7,36-7,32 (м, 7H), 5,27 (д, J= 7,4 Гц, 1Н), 5,10 (с, 2H), 4,89 (с, 1Н), 4,02 (шир. с, 1H), 0,96 (д, J=6,7 Гц, 3H).
Стадия D: (4S,5R)-4-метил-5-пиридин-4-ил-1,3-оксазолидин-2-он
Раствор бензил [(1S,2R)-2-гидрокси-1-метил-2-пиридин-4-илэтил]карбамата в 7,5N водной смеси КОН/МеОН/ТГФ (1:2:4, 7 мл) оставляют на ночь перемешиваться при комнатной температуре. Реакционную смесь разбавляют водой (20 мл) и экстрагируют с помощью EtOAc (3×20 мл). Органические слои объединяют, сушат (над Na2SO4) и концентрируют в вакууме, получая (4S,5R)-4-метил-5-фенил-1,3-оксазолидин-2-он. ЖХМС: рассчитано = 179,1; найдено = 179,2 (М+1)+.
Промежуточное соединение 16
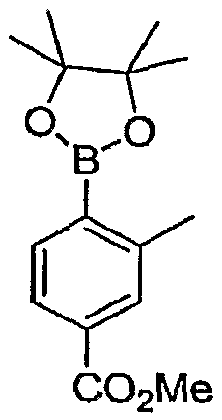
Метил 3-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоат
В круглодонную колбу помещают метил 4-бром-3-метилбензоат (200 мг, 0,878 ммоль), бис(пинаколято)диборон (277 мг, 1,089 ммоль), PdCl2(dppf)CH2Cl2 (70 мг, 0,0873 ммоль), КОАс (171 мг, 1,75 ммоль) и ДМСО (10 мл). Реакционную смесь дегазируют с помощью N2 и нагревают до 40°С в течение 1 час, до 60°С в течение 1 час, а затем 80°С в течение 12 час. Реакционную смесь разбавляют с помощью EtOAc (25 мл) и гексаном (75 мл) и органические вытяжки промывают водой (2×25 мл) и насыщенным раствором соли (50 мл). Органический слой сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают флэш-хроматографией на силикагеле (от 0 до 15% EtOAc/гексан) и получают метил 3-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоат. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,82 (с, 1Н), 7,80 (с, 2H), 3,91 (с, 3H), 2,57 (с, 3H), 1,35 (с, 12H).
Промежуточное соединение 17
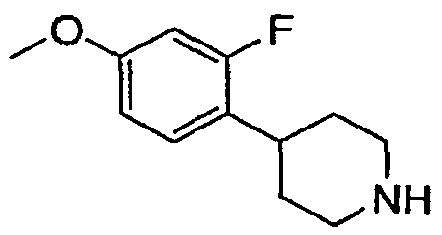
4-(2-Фтор-4-метоксифенил)пиперидин
Стадия А: 1-бензил-4-(2-фтор-4-метоксифенил)пиперидин-4-ол
К охлажденному (0°С) раствору 4-бром-3-фторанизола (1 г, 4,88 ммоль) в безводном ТГФ (7 мл) при перемешивании по каплям добавляют изопропилмагнийхлорид (2,0 м в ТГФ; 2,22 мл; 4,43 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и охлаждают до 0°С. По каплям добавляют 1-бензил-4-пиперидон (0,72 мл; 4,03 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 14 час. Прерывают реакцию с помощью насыщенного раствора NH4Cl и реакционную смесь перераспределяют между EtOAc (50 мл) и Н2О (30 мл). Водный слой экстрагируют с помощью EtOAc (3×50 мл), экстракты объединяют и промывают насыщенным раствором соли (50 мл), сушат (над MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией на силикагеле (в градиенте от 0 до 50% EtOAc/гексан) и получают 1-бензил-4-(2-фтор-4-метоксифенил)пиперидин-4-ол в виде твердого вещества светло-оранжевого цвета. ЖХМС = 315,9 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,38-7,31 (м, 5H), 7,28-7,24 (м, 1Н), 6,66 (дд, J=8,7,2,5 Гц, 1Н), 6,61 (дд, J=14,4, 2,5 Гц, 1Н), 3,79 (с, 3Н), 3,56 (с, 2Н), 2,77 (шир. д, J=10,6 Гц, 2Н), 2,54-2,48 (м, 2Н), 2,31-2,24 (м, 2Н), 1,84(д, J=12,3 Гц, 2H).
Стадия В: 1-бензил-4-(2-фтор-4-метоксифенил)-1,2,3,6-тетрагидропиридин
Смесь 1-бензил-4-(2-фтор-4-метоксифенил)пиперидин-4-ола (Стадия А; 300 мг; 0,952 ммоль) и моногидрата п-толуолсульфоновой кислоты (18 мг; 0,0952 ммоль) в бензоле (20 мл) при перемешивании нагревают до 80°С в течение 14 час. Дополнительно добавляют 100 мг моногидрата п-толуолсульфоновой кислоты и реакционную смесь нагревают до 80°С в течение 1 час. Реакционную смесь перераспределяют между EtOAc (50 мл) и Н2О (50 мл). Водный слой экстрагируют с помощью EtOAc (3×50 мл), экстракты объединяют и промывают водой (3×50 мл) и насыщенным раствором соли (50 мл), сушат (над MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией на силикагеле (в градиенте 0-10% EtOAc/гексан) и получают 1-бензил-4-(2-фтор-4-метоксифенил)-1,2,3,6-тетрагидропиридин в виде масла желтого цвета. ЖХМС = 297,9 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 9,56 (шир. с, 1Н), 7,42-7,38 (м, 2Н), 7,34 (т, J=7,3 Гц, 2Н), 7,28 (д, J=7,3 Гц, 1Н), 7,17 (т, J=8,7 Гц, 1Н), 6,64 (дд, J=8,7, 2,5 Гц, 1Н), 6,59 (дд, J=13,0, 2,5 Гц, 1Н), 5,91-5,89 (м, 1Н), 3,78 (с, 3Н), 3,66 (шир. с, 2Н), 3,18 (шир. с, 2Н), 2,71 (шир. с, 2Н), 2,54 (шир. с, 2Н).
Стадия С: 4-(2-фтор-4-метоксифенил)пиперидин
К раствору 1-бензил-4-(2-фтор-4-метоксифенил)-1,2,3,6-тетрагидропиридина (Стадия В; 117 мг; 0,393 ммоль) в МеОН (10 мл) добавляют каталитическое количество 10% Pd/С и реакционную смесь помещают в атмосферу Н2 (аппарат Парра на качалке; 45 фунтов на квадратный дюйм) на 48 час. Реакционную смесь фильтруют через целит и фильтрат концентрируют в вакууме. Остаток очищают флэш-хроматографией на силикагеле (в градиенте от 0-100% EtOAc/гексан) и получают 4-(2-фтор-4-метоксифенил)пиперидин в виде твердого вещества коричневого цвета. ЖХМС = 210,1 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,16 (т, J=8,7 Гц, 1Н), 6,68 (дд, J=8,7, 2,5 Гц, 1Н), 6,60 (дд, J=12,3, 2,5 Гц, 1Н), 3,78 (с, 3Н), 3,63 (д, J=12,6 Гц, 2Н), 3,09-2,98 (м, 2Н), 2,18 (кв, J=12,1 Гц, 2Н), 2,02 (д, J=13,3 Гц, 2Н).
Промежуточное соединение 18
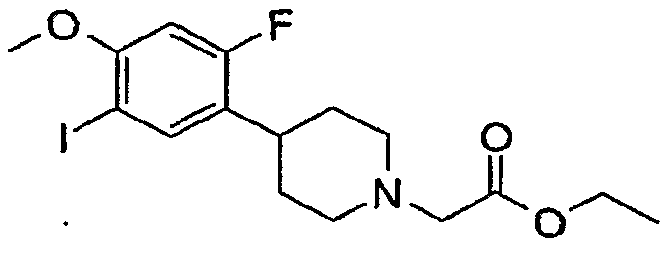
Этил [4-(2-фтор-5-иод-4-метоксифенил)пиперидин-1-ил]ацетат
Стадия А: этил [4-(2-фтор-4-метоксифенил)пиперидин-1-ил]ацетат
К раствору 4-(2-фтор-4-метоксифенил)пиперидина (40 мг; 0,19 ммоль) в ДМФА (1 мл) при перемешивании в атмосфере N2 добавляют N,N-диизопропилэтиламин (33 мкл; 0,19 ммоль), а затем этилбромацетат (21 мкл; 0,19 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 2,5 час. Реакционную смесь перераспределяют между EtOAc (10 мл) и Н2О (10 мл). Водный слой экстрагируют с помощью EtOAc (3×10 мл), экстракты объединяют и промывают насыщенным раствором соли (10 мл), сушат (над Na2SO4), фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией на силикагеле (в градиенте 0-25% EtOAc/гексан) и получают этил [4-(2-фтор-4-метокси-фенил)пиперидин-1-ил]ацетат в виде бесцветного масла. ЖХМС = 295,9 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,14 (т, J=8,7 Гц, 1Н), 6,65 (дд, J=8,5, 2,5 Гц, 1Н), 6,58 (дд, J=12,43, 2,5 Гц, 1Н), 4,20 (кв, J=7,1 Гц, 2Н), 3,77 (с, 3Н), 3,26 (с, 2Н), 3,06 (д, J=11,4 Гц, 2Н), 2,80 (тт, J=12,1, 3,7 Гц, 1Н), 2,32 (т, J=11,2 Гц, 2Н), 1,87 (квд, J=12,3, 3,3 Гц, 2Н), 1,78 (д, J=12,1 Гц, 2Н), 1,29 (т, J=7,1 Гц, 3Н).
Стадия В: этил [4-(2-фтор-5-иод-4-метоксифенил)пиперидин-1-ил]ацетат
Смесь этил [4-(2-фтор-4-метоксифенил)пиперидин-1-ил]ацетата (Стадия А; 21,6 мг; 0,073 ммоль), иода (45,6 мг; 0,146 ммоль) и сульфата серебра (37 мг; 0,146 ммоль) в МеОН (1,5 мл) перемешивают при комнатной температуре в течение 2 час. Реакционную смесь фильтруют через целит и фильтрат концентрируют в вакууме. Остаток вновь растворяют в эфире (25 мл) и промывают водой (25 мл). Водный слой экстрагируют эфиром (3×25 мл), экстракты объединяют и промывают насыщенным раствором соли (25 мл), сушат (над MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией на силикагеле (в градиенте 0-10% EtOAc/гексан) и получают этил [4-(2-фтор-5-иод-4-метоксифенил)пиперидин-1-ил]ацетат в виде масла желтого цвета. ЖХМС = 421,8 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,61 (д, J=8,3 Гц, 1Н), 6,45 (д, J=11,9 Гц, 1Н), 4,21 (кв, J=7,1 Гц, 2Н), 3,84 (с, 3Н), 3,26 (с, 2Н), 3,05 (д, J=11,2 Гц, 2Н), 2,80 (тт, J=12,0, 3,9 Гц, 1Н), 2,33 (т, J=10,6 Гц, 2Н), 1,87 (квд, J=12,3, 3,2 Гц, 2Н), 1,78 (д, J=12,1 Гц, 2Н), 1,29 (т, J=7,1 Гц, 3Н).
Промежуточное соединение 19
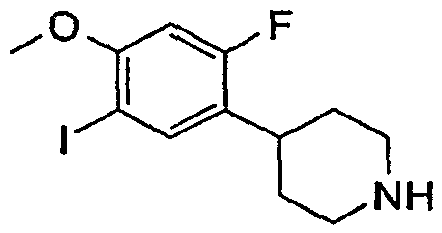
4-(2-Фтор-5-иод-4-метоксифенил)пиперидин
Стадия А: трет-бутил 4-(2-фтор-4-метоксифенил)пиперидин-1-карбоксилат
К смеси 4-(2-фтор-4-метоксифенил)пиперидина (200 мг; 0,957 ммоль) и N,N-диизопропилэтиламина (183 мкл; 1,053 ммоль) добавляют ди-трет-бутилдикарбонат (230 мг; 1,053 ммоль), как указано ранее, и получают трет-бутил 4-(2-фтор-4-метоксифенил)пиперидин-1-карбоксилат в виде бесцветного масла. ЖХМС = 254,0 (М+1-100+44)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,07 (т, J=8,7 Гц, 1Н), 6,65 (дд, J=8,5, 2,3 Гц, 1Н), 6,59 (дд, J=12,3,2,3 Гц, 1Н), 4,23 (шир. с, 2Н), 3,78 (с, 3Н), 2,91 (тт, J=12,2, 3,2 Гц, 1Н), 2,84-2,76 (м, 2Н), 1,79-1,75 (м, 2Н), 1,65-1,56 (м, 2Н), 1,48 (с, 9H).
Стадия В: 4-(2-фтор-5-иод-4-метоксифенил)пиперидин и трет-бутил 4-(2-фтор-5-иод-4-метоксифенил)пиперидин-1-карбоксилат
К смеси трет-бутил 4-(2-фтор-4-метоксифенил)пиперидин-1-карбоксилата (Стадия А; 255 мг; 0,825 ммоль) в МеОН (15 мл) при перемешивании добавляют иод (345 мг; 1,107 ммоль) и сульфат серебра (281 мг; 1,107 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 час. Реакционную смесь фильтруют через целит и фильтрат концентрируют в вакууме. Остаток вновь растворяют в эфире 50 мл и промывают водой (50 мл). Водный слой экстрагируют эфиром (3×50 мл), экстракты объединяют и промывают насыщенным раствором соли (50 мл), сушат (над MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией на силикагеле (в градиенте от 0-10% EtOAc/гексан) и получают трет-бутил 4-(2-фтор-5-иод-4-метоксифенил)пиперидин-1-карбоксилат в виде бесцветного стеклообразного вещества. Водный слой вновь экстрагируют с помощью EtOAc (3×100 мл), экстракты объединяют, сушат (над MgSO4), фильтруют и растворитель удаляют при пониженном давлении до тех пор, пока не начнет образовываться осадок. Образовавшееся твердое вещество отфильтровывают и сушат в вакуумном шкафу, получая 4-(2-фтор-5-иод-4-метоксифенил)пиперидин в виде беловатого вещества.
трет-бутил 4-(2-фтор-5-иод-4-метоксифенил)пиперидин-1-карбоксилат: ЖХМС=379,7 (М+1-100+44)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,54 (д, J=8,3 Гц, 1Н), 6,55 (д, J=12,2 Гц, 1Н), 4,23 (шир. с, 2Н), 3,85 (с, 3Н), 2,91 (тт, J=12,3, 3,5 Гц, 1Н), 2,79 (т, J=12,1 Гц, 2Н), 1,78-1,74 (м, 2Н), 1,59 (квд, J=12,6, 4,1 Гц, 2Н), 1,48 (с, 9H).
4-(2-фтор-5-иод-4-метоксифенил)пиперидин: ЖХМС=335,7 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 9,62 (шир. с, 1Н), 7,59 (д, J=8,3 Гц, 1Н), 6,56 (д, J=12,2 Гц, 1Н), 3,85 (с, 3Н), 3,64 (д, J=12,1 Гц, 2Н), 3,06-3,97 (м, 3Н), 2,21-2,12 (м, 2Н), 2,05-2,00 (м, 2Н).
Промежуточное соединение 20
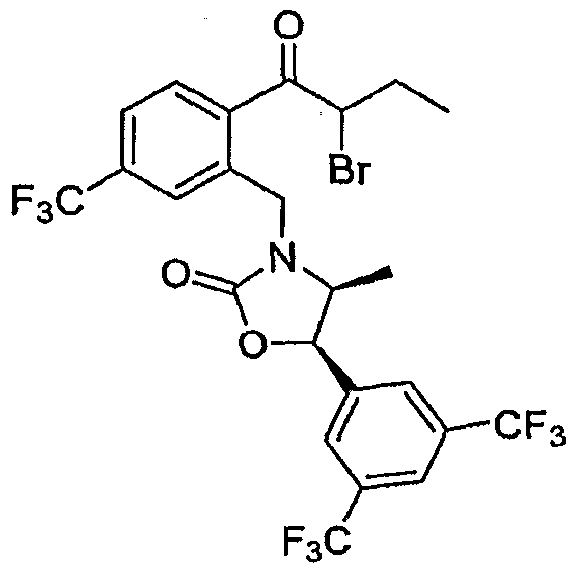
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-[2-(2-бромбутанолил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он
Стадия А: метил 2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)бензоат
Ацетат палладия (II) (0,109 г, 0,486 ммоль), DPPF (0,269 г, 0,486 ммоль), К2СО3 (2,013 г, 14,57 ммоль) и Et3N (0,677 мл, 4,86 ммоль) добавляют к раствору (4S,5R)5-[3,5-бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он (2,9 г, 4,86 ммоль) в MeCN (30 мл) и МеОН (10 мл). Реакционную смесь продувают азотом, колбу закрывают крышкой и присоединяют к ней баллон с СО. После пропускания в течение 5 мин через раствор газообразного СО через подсоединенную к баллону иглу смесь оставляют на ночь нагреваться при 70°С в токе СО из баллона. Смесь разбавляют с помощью EtOAc (300 мл), фильтруют через целит, а затем промывают водой (3×50 мл), насыщенным раствором соли (1×), сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме. Остаток очищают флэш-хроматографией на силикагеле и получают метил 2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)бензоат. ЖХМС: рассчитано = 530,1; найдено = 529,9 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 8,09 (д, J=8,1 Гц, 1Н); 7,92 (с, 1Н); 7,82 (с, 2Н); 7,79 (с, 1Н); 7,69 (д, J=8,1 Гц, 1Н); 5,75 (д, J=7,8 Гц, 1Н); 5,10 (д, J=16,2 Гц, 1Н); 4,81 (д, J=16,2 Гц, 1Н); 4,19-4,11 (м, 1Н); 3,99 (с, 3Н); 0,81 (д, J=6,5 Гц, 3Н).
Стадия В: (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(гидроксиметил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он
К раствору метил 2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)бензоата (1,55 г, 2,93 ммоль) в ТГФ (65 мл) при 0°С в атмосфере азота по каплям добавляют 1N раствор супер гидрида в ТГФ (5,86 мл, 5,86 ммоль). Реакционную смесь перемешивают при 0°С в течение 1 час. Для завершения реакции добавляют дополнительное количество супергидрида.
Реакцию осторожно прерывают водой и водный слой экстрагируют с помощью EtOAc (3×). Органические слои объединяют и промывают насыщенным раствором соли, сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме. Остаток очищают флэш-хроматографией на силикагеле и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(гидроксиметил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он. ЖХМС: рассчитано = 502,1; найдено = 502,0 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,91 (с, 1Н); 7,78 (с, 2Н); 7,65 (т, J=9,5 Гц, 2Н); 7,55 (с, 1Н); 5,72 (д, J=8,1 Гц, 1Н); 5,09 (д, J=15,5 Гц, 1Н); 4,86 (д, J=3,7 Гц, 2Н); 4,29 (д, J=15,5 Гц, 1Н); 4,06-4,00 (м, 1Н); 2,59 (с, 1Н); 0,82 (д, J=6,6 Гц, 3Н).
Стадия С: 2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)бензальдегид
К раствору (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(гидроксиметил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (510 мг, 1,017 ммоль) в CH2Cl2 (20 мл) при 0°С в атмосфере азота порциями добавляют периодинан Десса-Мартина (647 мг, 1,526 ммоль). Реакционную смесь перемешивают при 0°С в течение 1 час. Реакцию осторожно прерывают насыщенным раствором NaHCO3 и водный слой экстрагируют с помощью CH2Cl2. Органические слои объединяют, промывают насыщенным раствором соли, сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме. Остаток очищают флэш-хроматографией на силикагеле и получают 2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)бензальдегид виде твердого вещества белого цвета. ЖХМС: рассчитано = 500,1; найдено = 500,0 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 10,29 (с, 1Н); 8,04 (д, J=7,8 Гц, 1Н); 7,93 (с, 1Н); 7,85 (д, J=8,0 Гц, 1Н); 7,83 (с, 1Н); 7,82 (с, 2H); 5,77 (д, J=7,9 Гц, 1Н); 5,11 (д,J=16,5 Гц, 1Н); 4,94 (д, J=16,5 Гц, 1Н); 4,23-4,18 (м, 1Н); 0,84 (д, J=6,5 Гц, 3Н).
Стадия D: (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-бутирил-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он
К раствору 2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)бензальдегида (654 мг, 1,310 ммоль) в толуоле (25 мл) при минус 78°С в атмосфере азота по каплям добавляют 2 М раствор н-пропилмагнийхлорида (0,655 мл, 1,310 ммоль). Реакционную смесь перемешивают при минус 78°С в течение 4 час. Реакцию осторожно прерывают водой и водный слой экстрагируют с помощью EtOAc. Органические слои объединяют и промывают насыщенным раствором соли, сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме, получая смесь из продукта (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-бутирил-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она и побочного продукта (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(гидроксиметил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она в соотношении 3 к 1. Полученную смесь растворяют в CH2Cl2 (50 мл) при 0°С в атмосфере азота и порциями добавляют периодинан Десса-Мартина (834 мг, 1,965 ммоль). Реакционную смесь перемешивают при 0°С в течение 1 час. Реакцию осторожно прерывают насыщенным раствором NaHCO3 и водный слой экстрагируют с помощью CH2Cl2 (3×). Органические слои объединяют, промывают насыщенным раствором соли, сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме. Остаток очищают флэш-хроматографией на силикагеле и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-бутирил-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он. ЖХМС: рассчитано = 542,1; найдено = 542,0 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,91 (с, 1Н); 7,81 (с, 2Н); 7,79 (д, J=8,2 Гц, 2Н); 7,69 (д,J=8,0 Гц, 1H); 5,74 (д,J=7,8 Гц, 1Н); 4,91 (д, J=16,1 Гц, 1Н); 4,57 (д,J=16,1 Гц, 1Н); 4,24-4,19 (м, 1Н); 3,01-2,89 (м, 2Н); 1,82-1,72 (м, 2Н); 1,03 (т, J=7,4Гц, 3Н); 0,80 (д,J=6,5 Гц, 3Н).
Стадия Е: (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(2-бромбутанолил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он
К раствору (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-бутирил-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (300 мг, 0,554 ммоль) в CHCl3 (3 мл) при 0°С в атмосфере азота по каплям добавляют раствор брома (0,030 мл, 0,582 ммоль) в CHCl3 (2 мл). Реакционную смесь перемешивают при 0°С в течение 1 час. Реакционную смесь упаривают в вакууме. Остаток очищают флэш-хроматографией на силикагеле и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(2-бромбутанолил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он в виде твердого вещества белого цвета. ЖХМС: рассчитано = 622,0; найдено = 621,7 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3, 1:1 смесь атропоизомеров) δ 7,91 (с, 1Н); 7,85 (д, J=5,1 Гц, 1Н); 7,83-7,77 (м, 2,5H); 7,74-7,69 (м, 1,5H); 5,79 (д, J=7,8 Гц, 0,5H); 5,74 (д, J=7,9 Гц, 0,5H); 5,06-4,92 (м, 2Н); 4,57 (д, J=16,4 Гц, 0,5H); 4,47 (д, J=16,0 Гц, 0,5H); 4,24-4,16 (м, 1Н); 2,35-2,25 (м, 1Н); 2,19-2,09 (м, 1Н); 1,18-1,16 (м, 3Н); 0,80 (д, J=6,6 Гц, 1,5H); 0,78 (д, J=6,6 Гц, 1,5H).
Промежуточное соединение 21
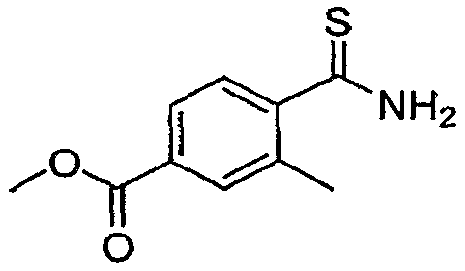
Метил 4-(аминокарбонотиоил)-3-метилбензоат
Стадия А: метил 4-циано-3-метилбензоат
В трубку для ВЧ нагрева помещают метил 4-бром-3-метилбензоат (100 мг, 0,437 ммоль), Pd(Ph3P)4 (25,2 мг, 0,022 ммоль), Zn(CN)2 (51,3 мг, 0,437 ммоль) и ДМФА (2 мл). Смесь продувают азотом и герметично закрывают. Реакционную смесь подвергают ВЧ излучению при 150°С в течение 5 мин. Смесь разбавляют с помощью EtOAc и промывают водой. Органический слой сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме. Остаток очищают флэш-хроматографией на силикагеле и получают метил 4-циано-3-метилбензоат. ЖХМС: рассчитано = 176,1; найдено = 176,1 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 8,02 (с, 1Н); 7,95 (д, J=8,1 Гц, 1Н); 7,71 (д, J=8,0 Гц, 1Н); 7,29 (с, 1H); 3,98 (с,3H); 2,64 (с, 3Н).
Стадия В: метил 4-(аминокарбонотиоил)-3-метилбензоат
К раствору метил 4-циано-3-метилбензоата (36 мг, 0,205 ммоль) в 1,4-диоксане (0,5 мл) и воде (0,500 мл) добавляют гидросульфид натрия (0,019 мл, 0,616 ммоль) и гидрохлорид триэтиламина (170 мг, 1,233 ммоль). Реакционную смесь оставляют на ночь нагреваться при температуре 55°С. Дают смеси остыть и добавляют воду. Смесь экстрагируют с помощью EtOAc. Органические слои объединяют, сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме, получая продукт в виде твердого вещества желтого цвета. ЖХМС: рассчитано = 210,1; найдено = 210,2 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,86 (с, 1Н); 7,84 (д, J=8,1 Гц, 1Н); 7,42 (д, J=7,9 Гц, 1Н); 7,16 (с, 2Н); 3,93 (с, 3Н); 2,51 (с, 3Н).
Промежуточное соединение 22
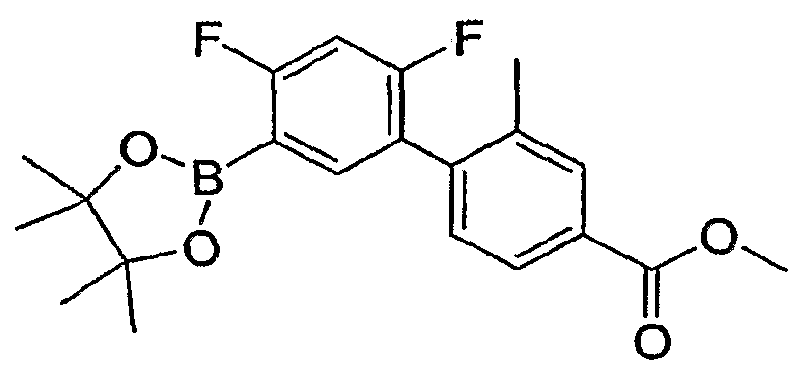
Метил 2',4'-дифтор-2-метил-5'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилат
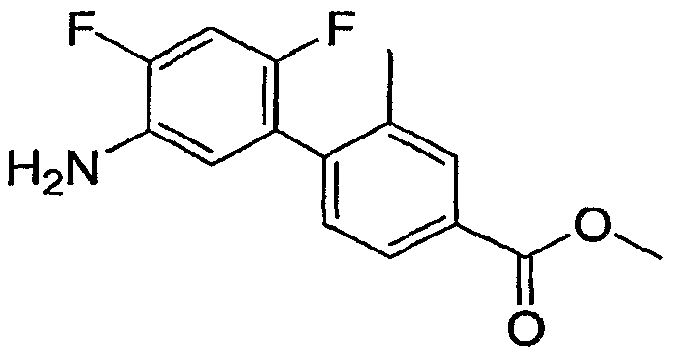
Стадия А: метил 5'-амино-2',4'-дифтор-2-метилбифенил-4-карбоксилат
5-Бром-2,4-дифторанилин (500 мг, 2,40 ммоль), метил 3-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоат (Промежуточное соединение 16, 797 мг, 2,88 ммоль), карбонат натрия (2,40 мл водного раствора, 2 М, 2,88 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (196 мг, 0,24 ммоль) и этанол (15 мл) нагревают до 80°С на масляной бане в течение 3 час, а затем оставляют на ночь охлаждаться до комнатной температуры. Летучие вещества удаляют при пониженном давлении. Полученный остаток обрабатывают по схеме DCM/насыщенный раствор соли/Na2SO4/фильтрация/концентрирование и получают масло темного цвета. Полученное масло очищают флэш-хроматографией (SiO2, картридж Biotage 40+M). Колонку элюируют смесью EtOAc/гексан в градиенте от 0% до 40%. Собирают соответствующие фракции и концентрируют в вакууме, получая указанное в названии соединение. ЖХМС: рассчитано = 277,09; найдено = 278,03(М+1)+.
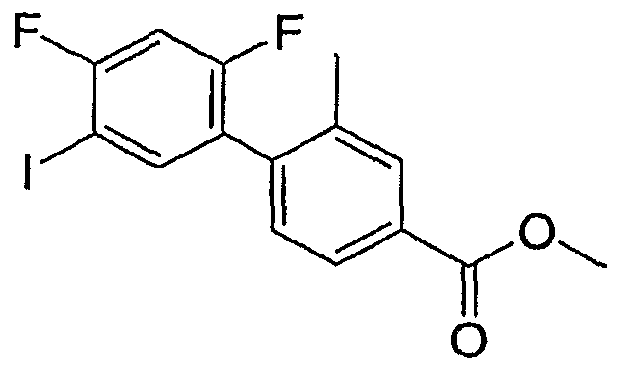
Стадия В: метил 2',4'-дифтор-5'-иод-2-метилбифенил-4-карбоксилат
Метил 5'-амино-2',4'-дифтор-2-метилбифенил-4-карбоксилат (Стадия А, 500 мг, 1,80 ммоль), 3-метилбутилнитрит (317 мг, 2,71 ммоль), иод (549 мг, 2,16 ммоль) и хлороформ (15 мл) кипятят с обратным холодильником на масляной бане в течение 5 час, а затем оставляют на ночь охлаждаться до комнатной температуры. Сырой продукт очищают флэш-хроматографией (SiO2, картридж Biotage 40+M), осуществляя градиентное элюирование смесью EtOAc/гексан. Собирают соответствующие фракции и концентрируют в вакууме, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 387,98; найдено = 388,92(М+1)+.
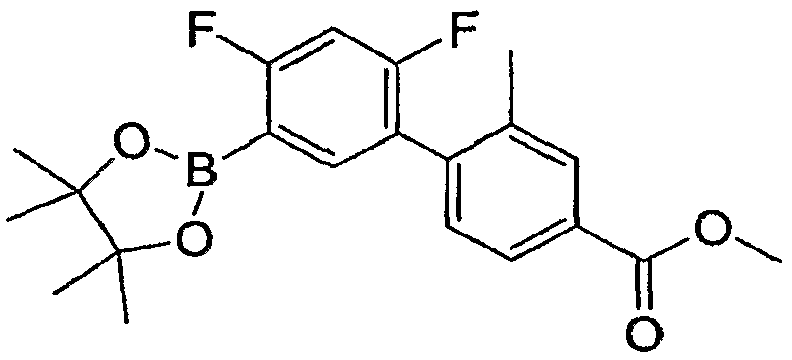
Стадия С: метил 2',4'-дифтор-2-метил-5'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилат
Метил 2',4'-дифтор-5'-иод-2-метилбифенил-4-карбоксилат (Стадия В, 1,551 г, 4,55 ммоль), бис(пинаколято)диборон (1,385 г, 5,46 ммоль), ацетат калия (0,892 г, 9,09 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (0,743 г, 0,909 ммоль) и 1,4-диоксан (10 мл) помещают в запаянную трубку и нагревают в микроволновой печи до температуры 140°С в течение 30 мин. Анализ методом ЖХМС аликвоты, взятой из реакционной смеси, показывает образование дебромированного побочного продукта и требуемой борат/бороновой кислоты. Реакционную смесь разбавляют этилацетатом и отфильтровывают. Фильтрат промывают насыщенным раствором соли, экстрагируют этилацетатом, сушат над Na2SO4, фильтруют и упаривают, получая остаток темного цвета, представляющий собой сырую смесь указанного в названии соединения, который в таком виде используют на следующей стадии. ЖХМС (ESI): рассчитано = 388,17; найдено = 389,11(М+1)+.
Промежуточное соединение 23
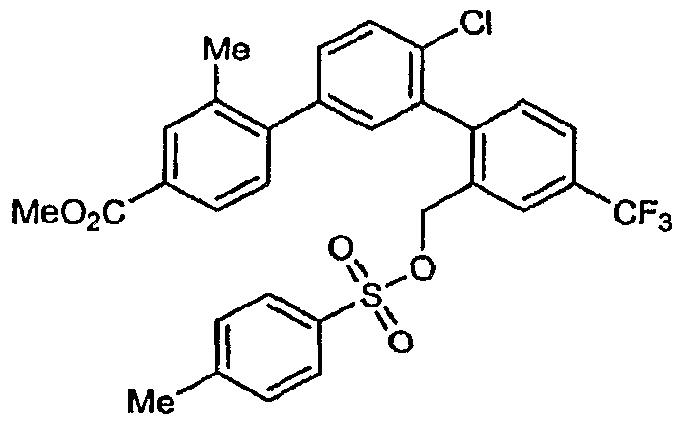
Приведенный выше триарилтозилат получают посредством следующего многостадийного процесса:
Биарилдихлорбензиловый спирт 1
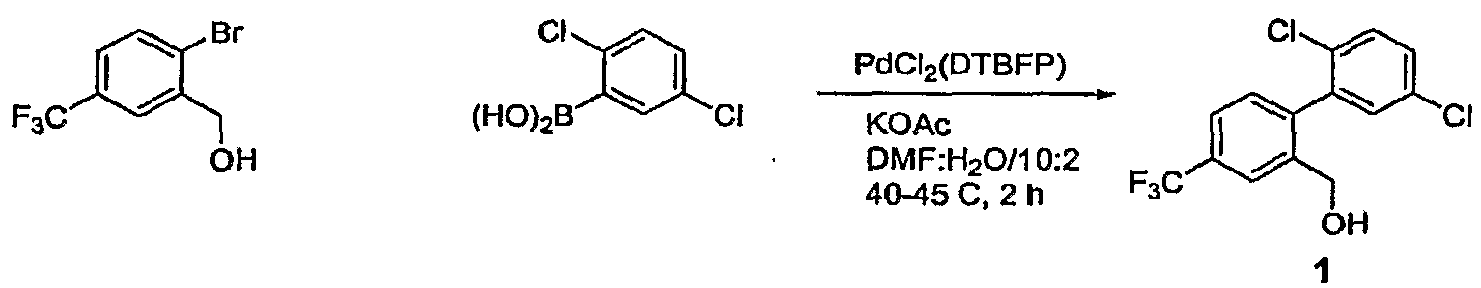
В сосуд емкостью 100 л, снабженный расположенной сверху мешалкой, термопарой, трубкой для ввода азота, капельной воронкой и рубашкой с паровым обогревом, помещают 30 л ДМФА, 8 л водного GMP, 5000 г исходного бензилового спирта и 4458 г ацетата калия. Смесь дегазируют, продувая азотом, а затем оставляют в атмосфере азота. К реакционной смеси добавляют PdCl2(DTBPF) (64,8 г) и полученную порцию нагревают до 40-45°С. (DTBPF представляет собой 1,1'-бис(ди-трет-бутилфосфино)ферроцен).
В сосуд емкостью 20 л, снабженный расположенной сверху мешалкой и трубкой для ввода азота, помещают 10 л ДМФА и 4114 г дихлорфенилбороновой кислоты. Раствор дегазируют, продувая азотом, а затем оставляют в атмосфере азота. Полученный раствор медленно в течение 1 час с помощью капельной воронки добавляют к указанной реакционной смеси. За ходом реакции следят с помощью ВЭЖХ; реакция заканчивается приблизительно через 2 час. После завершения реакции к реакционной смеси добавляют толуол (20 л) и 0,2 М раствор уксусной кислоты (20 л). Двухфазную смесь переносят в цилиндр емкостью 170 л. В емкость, где проводилась реакция, добавляют толуол (20 л) и 0,2 М раствор уксусной кислоты (20 л) и эту смесь также переносят в цилиндр емкостью 170 л. Слои разделяют и органический (верхний) слой промывают 10%-ным водным раствором хлорида натрия (2×40 л), а затем водным GMP (40 л). Потом органическую фазу фильтруют через плотный слой силикагеля (3 кг) и силикагель дополнительно промывают толуолом (2×20 л) для полного извлечения продукта. Толуольный раствор порциями концентрируют до объема 20 л, а затем промывают порциями 2×50 л гептана. Объем замеса доводят до 60 л и нагревают, чтобы полностью растворить любое выпавшее в осадок количество продукта.
В замес помещают затравку кристаллов, полученных из более ранних порций, и оставляют остывать на ночь. Смесь охлаждают до 0°С и отфильтровывают. Влажный осадок на фильтре промывают холодным гептаном (0°С, 15 л) и сушат в токе азота под вакуумом, получая требуемый биарилбензиловый спирт 1.
Биарилбензил бензоат 2
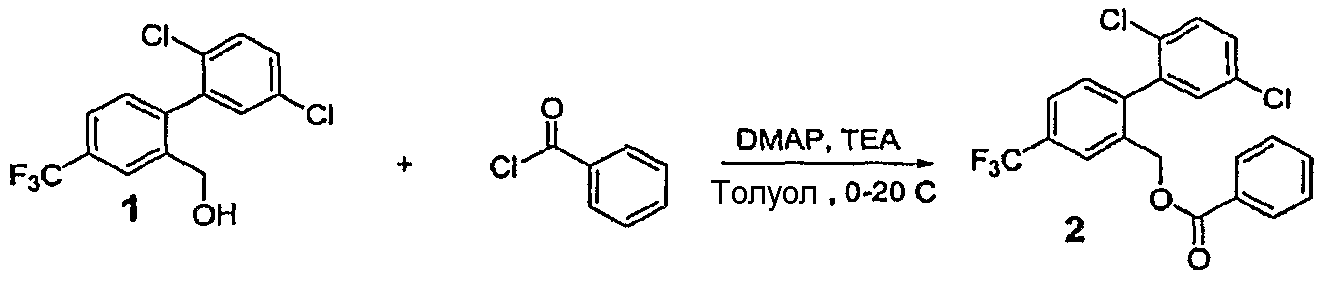
В сосуд емкостью 100 л, снабженный расположенной сверху мешалкой, термопарой, трубкой для ввода азота, капельной воронкой и рубашкой с паровым обогревом, помещают 51 л толуола, 4869 мл триэтиламина, 5100 г биарилбензилового спирта 1, полученного на предыдущей стадии, и 102 г 4-диметиламинопиридина (DMAP). Раствор охлаждают до 0°С. К замесу с помощью капельной воронки медленно в течение приблизительно 1 час добавляют бензоилхлорид (2120 мл). Добавление сопровождается выделением тепла. После завершения добавления порцию нагревают до комнатной температуры. Образуется густая суспензия. За ходом реакции следят с помощью ВЭЖХ; реакция заканчивается приблизительно через 2 час после нагрева до комнатной температуры.
В реакционный сосуд добавляют водный раствор HCl (1,0 М, 20 л) и порцию переносят в экстрактор емкостью 100 л. Нижний водный слой отделяют, порцию последовательно промывают 2×12 л 1,0 М раствором HCl, а затем 2×12 л водного GMP. Толуольный раствор сушат над безводным сульфатом натрия и фильтруют через воронку со стеклянным дном. Толуольный раствор порциями концентрируют до объема 10 л, а затем добавляют 51 л гептана, поддерживая температуру на уровне 40-45°С. Оставляют замес на ночь остывать до комнатной температуры. Затем замес охлаждают до минус 5°С и фильтруют. Влажный осадок на фильтре промывают холодным гептаном (-5°С, 16 л) и сушат в токе азота под вакуумом, получая биарилбензил бензоат 2.
Бороновая кислота 3
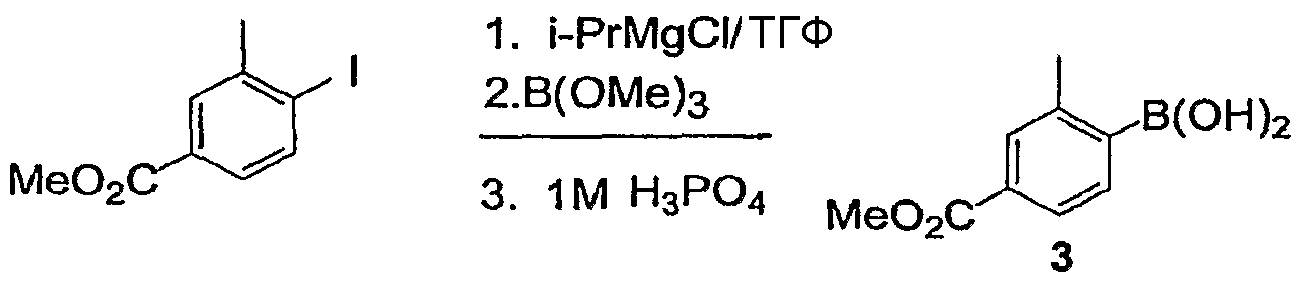
В колбу емкостью 3 л, снабженную механической мешалкой, термопарой и капельной воронкой, помещают 100 г твердого метилового эфира 4-иод-3-метилбензойной кислоты и 1,0 л сухого ТГФ. Смесь охлаждают до минус 25°С, а затем по каплям в течение 25 мин добавляют 218 мл раствора i-PrMgCl (2 М в ТГФ), поддерживая температуру на уровне <-15°С. Замес после добавления реактива Гриньяра выдерживают в течение 1 час при <-10°С. Анализ гидролизованной аликвоты показывает, что степень деиодирования составляет 97%.
Затем реакционную смесь охлаждают приблизительно до минус 20°С и завершают реакцию, добавляя триметилборат (77 г). Добавление триметилбората сопровождается экзотермической реакцией. В процессе добавления в течение 3 мин температура повышается приблизительно до минус 4°С. Полученный раствор оставляют на 1 час при температуре <0°С. Затем замес охлаждают приблизительно до минус 20°С и дополнительно прерывают реакцию, добавляя 1,0 л 1 М раствора Н3РО4. Этот процесс также является экзотермическим, при этом температура к концу добавления повышается до 3°С. Замес оставляют на ночь при комнатной температуре.
ТГФ удаляют дистилляцией при температуре <45°С при пониженном давлении. Полученной суспензии дают остыть до комнатной температуры, а затем отфильтровывают. Осадок на фильтре промывают водой (3×500 мл) и толуолом (2×250 мл), а затем сушат в вакууме в токе азота в течение 18 час, получая бороновую кислоту 3 в виде беловатого кристаллического вещества.
Триарилбензоат 4
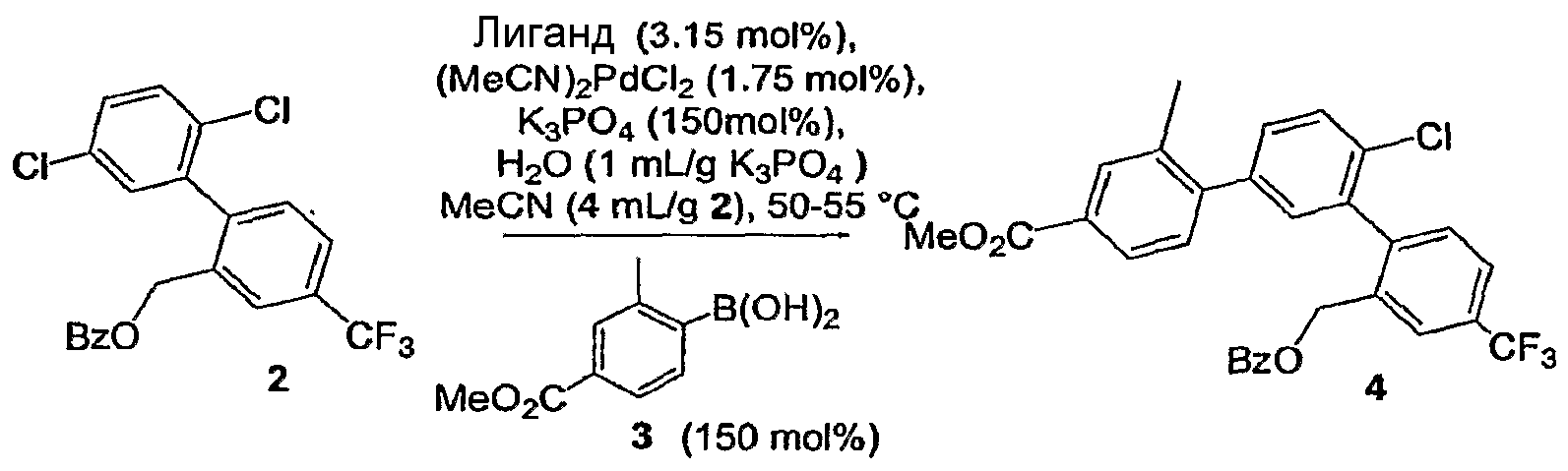
Вначале в перчаточном боксе, заполненном азотом, готовят катализатор, поместив бис(ацетонитрил)палладий дихлорид (107 мг) и 1,2-бис(ди-трет-бутифосфинометил)бензол (292 мг) в сосуд, снабженный магнитной мешалкой. Затем добавляют ацетонитрил (35 мл). Полученную суспензию перед использованием перемешивают при комнатной температуре в течение ~2 час.
В склянку Шленка емкостью 100 мл, снабженную магнитной мешалкой, трубкой для подачи азота/вакуума и перегородкой, помещают бороновую кислоту 3 (6,79 г, 35,3 ммоль) и биарилбензоат 2 (9,45 г). Сосуд продувают азотом и переносят в перчаточный бокс. Суспензию катализатора, которую готовят, как описано в предыдущем параграфе, затем в перчаточном боксе переносят в склянку Шленка. Сосуд, в котором готовили суспензию катализатора, споласкивают ацетонитрилом (5 мл); промывной раствор также переносят в склянку Шленка.
К вязкой суспензии в склянке Шленка при комнатной температуре в перчаточном боксе добавляют водный раствор К3РО4 (15,0 г 50% масс. К3РО4, 7,5 г К3РО4). Сосуд Шленка герметично закрывают, извлекают из перчаточного бокса и подсоединяют к барботеру азота. Полученную двухфазную смесь перемешивают и нагревают в течение 22 час на масляной бане, температура которой составляет 55°С, после чего по данным анализа методом ВЭЖХ количество непрореагировавшего биарилбензоата составляет 1,7% по отношению к продукту, триарилбензоату. При температуре ~30°С добавляют ацетонитрил (40 мл) и нижний водный слой отделяют. Водный слой вновь экстрагируют ацетонитрилом (3 мл) и полученный экстракт объединяют с основным органическим слоем. Реакционную смесь концентрируют до ~40% от первоначального объема, поддерживая внешнюю температуру и давление на уровне 40-42°С и 190-200 мбар. Замес охлаждают ~30° и органический слой фильтруют через воронку со стеклянным фильтрующим дном непосредственно в сосуд для проведения кристаллизации. Реакционный сосуд промывают с помощью CH3CN (17 мл), а промывочные растворы фильтруют в реакционный сосуд. Как только замес остынет, наблюдается быстрая кристаллизация триарилбензоата 4.
Быстро кристаллизующуюся смесь, которая содержится в 3-горлой круглодонной колбе емкостью 100 мл, снабженной механической мешалкой, трубкой для ввода и барботером для подачи азота и капельной воронкой, разбавляют, дополнительно добавив 43 мл CH3CN, и получают по результатам анализа ~6 мл CH3CN/г продукта в виде триарилбензоата. К густой суспензии при комнатной температуре в течение 60 мин добавляют воду (25 мл) с тем, чтобы получить ~27% об. воды (по отношению к CH3CN). Суспензию перемешивают при комнатной температуре до тех пор, пока концентрация триарилбензоата в жидкости над осадком не составит приблизительно 5,5 г/л по данным анализа методом ВЭЖХ (оставляют на ночь). Порцию охлаждают на бане со льдом до ~2°С и перемешивают приблизительно 2 час, после чего концентрация триарилбензоата 4 в жидкости над осадком составляет ~1,6 г/л. Суспензию отфильтровывают через воронку с фильтрующим дном и осадок на фильтре промывают с помощью 46 мл холодной смеси 75:25 об./об. CH3CN:вода, которая одновременно позволяет заменить растворитель. Осадок триарилбензоата на фильтре сушат в вакууме в токе азота при комнатной температуре до постоянного веса.
Триариловый спирт (5)
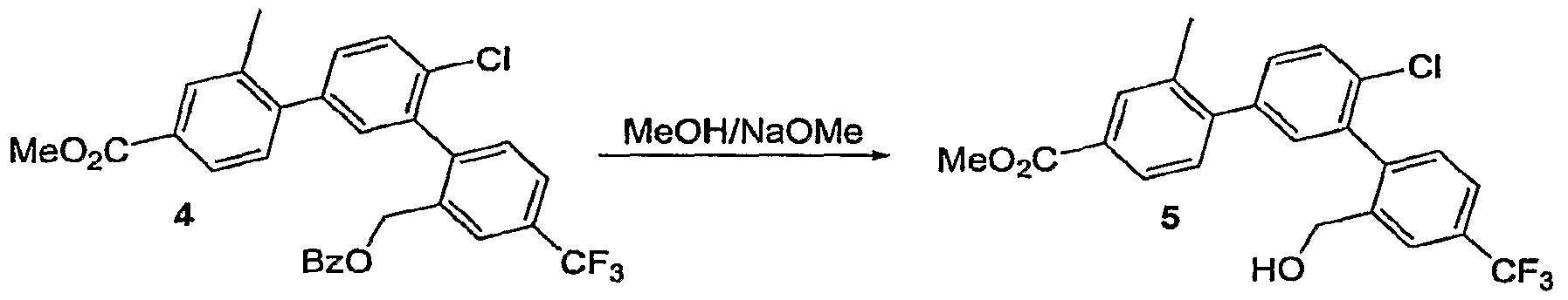
В сосуд емкостью 100 л, снабженный сверху мешалкой, линией для подачи азота и термометром, помещают 2 кг твердого триарилбензоата (4) и сухой метанол (20 л). При перемешивании барботируют азот через суспензию в течение 5 мин. К суспензии добавляют метоксид натрия (30% масс. раствор в МеОН, 210 мл) и реакционную смесь выдерживают при комнатной температуре до тех пор, пока не останется <0,15% исходного триарилбензоата (приблизительно 3-4 час). Приблизительно за 1 час до окончания реакции реакционная смесь становится гомогенной. Добавляют 5М раствор HCl (250 мл), затем толуол (10 л) и воду (15 л). Фазы разделяют, органический слой один раз промывают водой (10 л). Затем порцию концентрируют для удаления воды и остатков метанола. Триариловый спирт 5 используют на следующей стадии без дальнейшей очистки.
Триарилтозилат 6
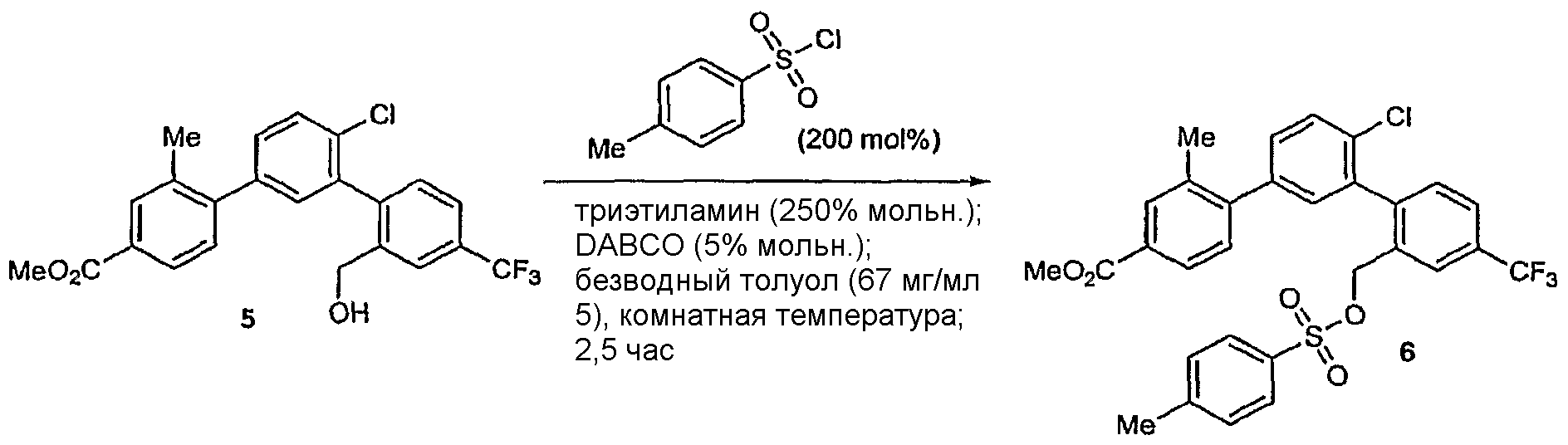
В круглодонный сосуд емкостью 75 л, снабженный сверху мешалкой, линией для подачи азота, термопарой и капельной воронкой, помещают 1490 г триарилового спирта 5 в толуоле (22,2 л). К раствору добавляют TsCl (1232 г) и перемешивают, а затем с помощью капельной воронки в течение 3 мин добавляют раствор триэтиламина (1197 мл), DABCO (19,3 г) и толуол (2,5 л). Температура внутри смеси поднимается до 32°С. За ходом реакции следят с помощью ВЭЖХ, при этом степень конверсии >99,7% достигается в течение 2 час.
После того как исходный триариловый спирт полностью вступит в реакцию, раствор фильтруют через слой силикагеля (1700 г, Merck Grade 9385) так, чтобы мутноватая суспензия превратилась в прозрачный раствор. Осадок на фильтре промывают с помощью 5,0 л толуола, промывные растворы объединяют и переносят в 100-литровый реактор/экстрактор. Раствор при перемешивании смешивают с 6,0 л 10% об./об. NaHSO4 (900 г в 9,0 л водного GMP), а затем энергично перемешивают. Фазы разделяют и водную фазу отбрасывают (рН 1). Органический (верхний) слой промывают водным GMP (2×9,0 л) и водный слой отделяют. Величина рН двух промывок составляет 1 и 4, соответственно.
Органический слой концентрируют до образования масла и растворяют в 10-14 объемах 3-7% раствора толуола в гептане. Органические вещества нагревают до тех пор, пока раствор не станет прозрачным и гомогенным (в диапазоне 60-80°С в зависимости от концентрации толуола), а затем медленно охлаждают до комнатной температуры. Затравку (используют затравку вещества из ранее полученных порций) помещают в раствор при 50°С, после чего немедленно начинается рост кристаллов. Оставляют на ночь охлаждаться до комнатной температуры, маточный раствор декантируют, а кристаллы промывают с помощью 10,0 л 10%-ного раствора толуол/гептан, а затем с помощью 6,0 л гептана. Твердое вещество ярко-белого цвета сушат 72 час в вакууме в токе азота и получают тозилат 6.
ПРИМЕР 1
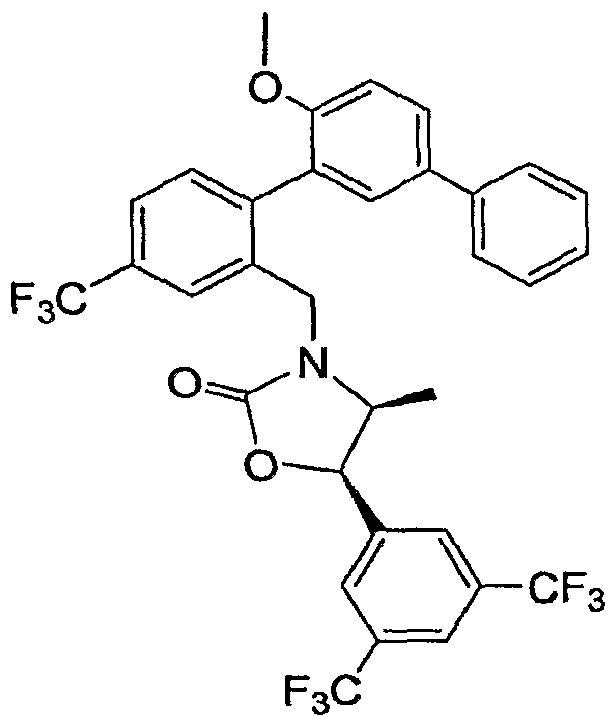
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[6'-метокси-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Стадия А
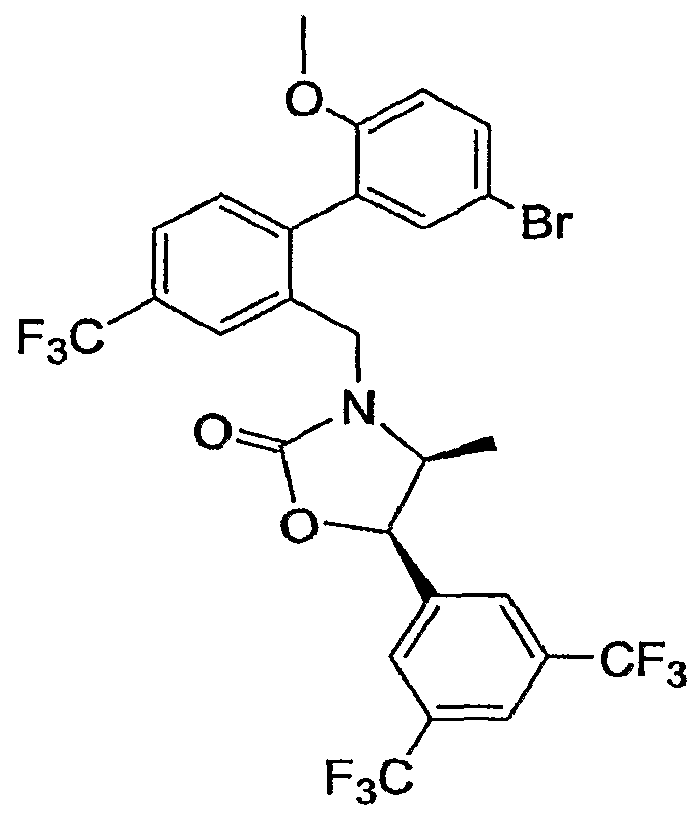
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[5'-бром-2'-метокси-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Смесь (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-иод-5-(три-фторметил)бензил]-4-метил-1,3-оксазолидин-2-она (6,80 г, 11,39 ммоль), 2-метокси-5-бромфенилбороновой кислоты (3,00 г, 12,99 ммоль) и карбоната натрия (2,65 г, 25,0 ммоль) в 200 мл смеси 1:2:4 вода:EtOH:толуол перемешивают при комнатной температуре в течение 30 мин. Добавляют каталитическое количество тетракис(трифенил-фосфин)палладия (0,66 г, 5%мол.). Смесь перемешивают при кипячении с обратным холодильником в течение 24 час. Анализ методом ТСХ (CH2Cl2:гексан/1:1) показывает отсутствие исходных веществ. Растворитель удаляют. Добавляют воду (100 мл). Смесь экстрагируют метиленхлоридом (3×100 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя CH2Cl2:гексан/6:4 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц, 1:1 смесь атропоизомеров) δ 7,88 (с, 1H), 7,74 (с, 1H), 7,72 (с, 1H), 7,67 (т, J=1 Гц, 1H), 7,62 (с, 1Н), 7,54 (м, 1H), 7,37-7,42 (м, 1H), 7,31-7,34 (м, 1H), 6,90-6,93 (м, 1H), 5,63 (д, J=8 Гц, 0,5H), 5,25 (д, J=8 Гц, 0,5H), 4,98 (д, J=15,5 Гц, 0,5H), 4,88 (д, J=16 Гц, 0,5H), 4,12 (д, J=15,5 Гц, 0,5H), 3,88 (д, J=16,5 Гц, 0,5H), 3,84 (с, 3H), 3,81 (с, 3H), 3,73 (м, 1H), 0,59 (д, J=6,5 Гц, 1,5H), 0,45 (д, J=6,5 Гц, 1,5H).
Стадия В: (4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[6'-метокси-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Смесь соединения со Стадии А (0,05 г, 0,076 ммоль), фнилбороновой кислоты (0,14 г, 0,11 ммоль), тетракис(трифенилфосфин)палладия (5%мол.) и карбоната натрия (0,018 г, 0,17 ммоль) в 7 мл смеси вода:EtOH:толуол (1:2:4) кипятят с обратным холодильником в течение 4 час. Анализ методом ТСХ (CH2Cl2:гексан/1:1) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (30 мл). Органические вещества экстрагируют метиленхлоридом (3×40 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после препаративной ТСХ, используя CH2Cl2:гексан/6:4 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц, 1:1 смесь атропоизомеров) δ 7,86(с, 0,5H), 7,84(с, 0,5H), 7,26-7,71 (м, 10H), 7,10 (дд, J=8,5, 3Гц, 1H), 6,96 (т, J=7,5 Гц, 1H), 6,86 (д, J=9 Гц, 1Н), 5,57 (д, J=8 Гц, 0,5H), 5,10 (д, J=7,5 Гц, 0,5H), 5,05 (д, J=16 Гц, 0,5H), 4,92 (д, J=16 Гц, 0,5H), 4,19 (д, J=15,5 Гц, 0,5H), 3,99 (д, J=16 Гц, 0,5H), 3,90(с, 1,5H), 3,88(с, 1,5H), 3,72 (м, 1H), 0,564(д, J=6,5Гц, L5H), 0,40 (д, J=6,5 Гц, 1,5H).
ЖХ-МС (М+1): 654,3.
Следующие соединения (Таблица 1) получают по той же методике, что и приведенная в Примере 1.
|
|
|
ПРИМЕР 21
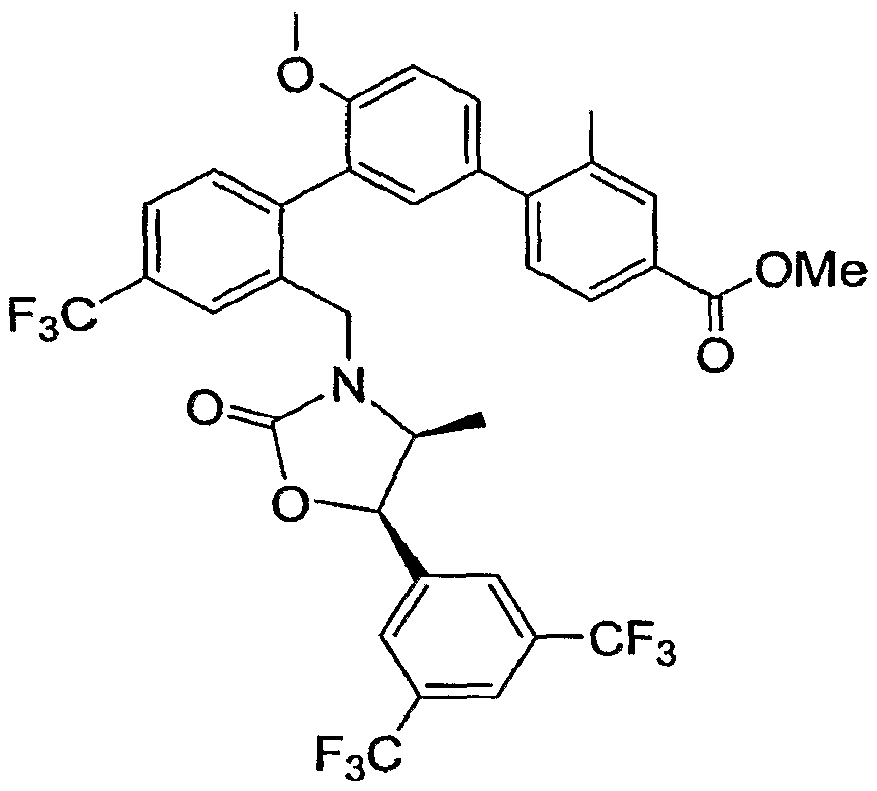
Стадия А
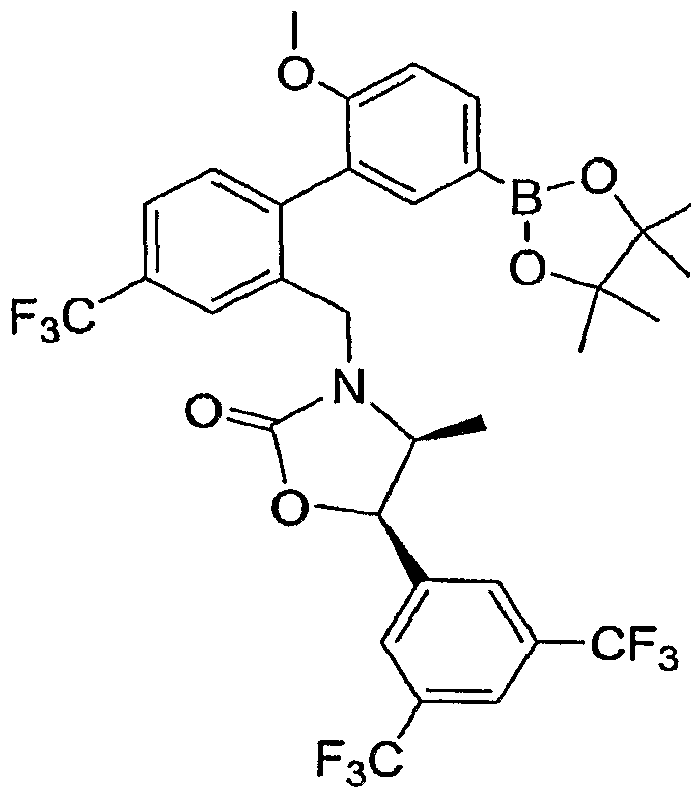
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[2'-метокси-5'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[5'-бром-2'-метокси-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он (500 мг, 0,762 ммоль), бис(пинаколято)диборон (388 мг, 1,53 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (150 мг, 0,184 ммоль), ацетат калия (150 мг, 1,53 ммоль) и 1,4-диоксан (5 мл) герметично закрывают в сосуде для ВЧ нагрева. Реакционную смесь подвергают ВЧ нагреву до температуры 140°С в течение 40 мин. Добавляют дополнительное количество бис(пинаколято)диборон (388 мг, 1,53 ммоль) и реакционную смесь подвергают ВЧ нагреву до температуры 140°С в течение 20 мин. Добавляют дополнительное количество ацетата калия (150 мг, 1,53 ммоль) и реакционную смесь подвергают ВЧ нагреву до температуры 140°С в течение 20 мин. Сырой продукт промывают водой. Полученную смесь экстрагируют помощью EtOAc. Органические экстракты объединяют и сушат над Na2SO4, а затем фильтруют и концентрируют, получая твердое вещество темного цвета. Твердое вещество очищают препаративной ВЭЖХ с обращенной фазой (колонка: Kromasil 100-5C18, 100×21,1 мм), элюируя в градиенте смеси MeCN/H2O, и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[2'-метокси-5'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он в виде темного масла. ЖХМС: рассчитано = 703,22; найдено = 704,47 (М+1)+.
Стадия В
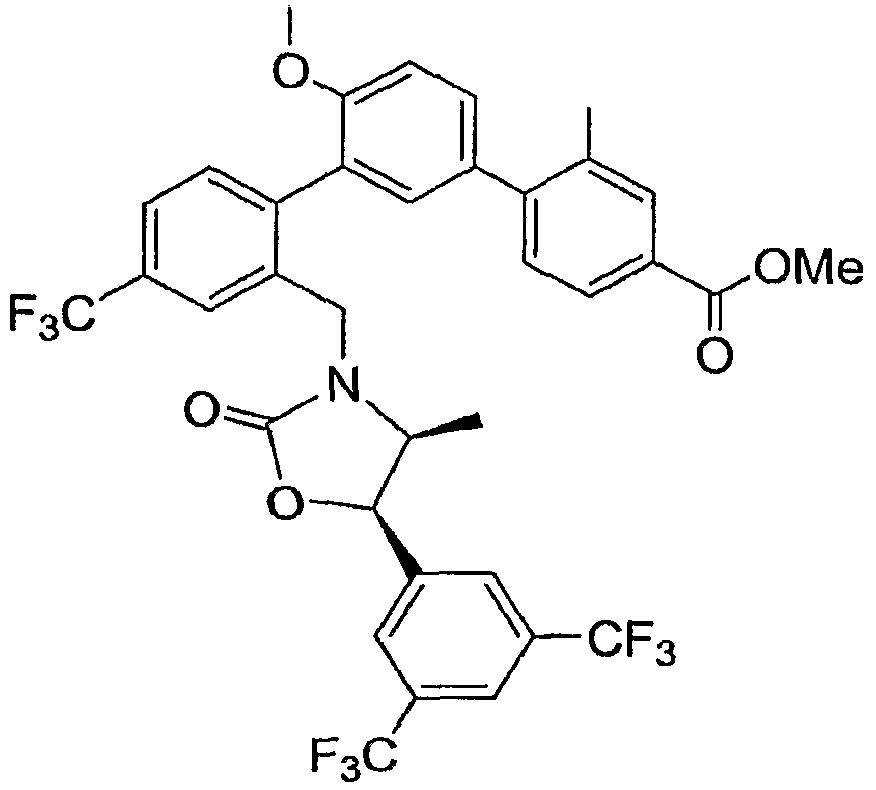
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Смесь (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[2'-метокси-5'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-она (60 мг, 0,085 ммоль), метил 4-бром-3-метилбензоата (29 мг, 0,128 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметанового аддукта (28 мг, 30%), водного раствора гидроксида калия (57 мкл, 3 М, 0,171 ммоль) и 1,4-диоксана (1 мл) помещают в герметично закрытую трубку и подвергают ВЧ нагреву до температуры 140°С в течение 15 мин. Сырую реакционную смесь очищают методом препаративной ТСХ на SiO2 (элюируют 30%-ным раствором EtOAc в гексане) и получают метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат в виде темной пены. ЖХМС: рассчитано = 725,18; найдено = 726,49 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,94 (д, J=8,5 Гц, 1H), 7,88-7,83 (м, 2H), 7,71 (с, 0,5H), 7,69 (с, 0,5H), 7,68-7,60 (м, 2H), 7,45-7,39 (м, 2H), 7,38, 7,37 (д, J=2 Гц, 1H), 7,28 (д, J=8 Гц, 0,5H), 7,24 (д, J=8 Гц, 0,5H), 7,14 (д, J=2 Гц, 1H), 7,07 (т, J=8 Гц, 1H), 5,58 (д, J=8,5 Гц, 0,5H), 5,28 (д, J=8 Гц, 0,5H), 4,96 (д, J=10 Гц, 0,5H), 4,93 (д, J=9,5 Гц, 0,5H), 4,16 (д, J=15,5 Гц, 0,5H), 3,96 (д, J=16 Гц, 0,5H), 3,92 (с, 3H), 3,86 (с, 3H), 3,82-3,93 (м, 1Н), 2,37 (с, 1,5H), 2,31 (с, 1,5H), 0,54 (д, J=6,5 Гц, 1,5H), 0,42 (д, J=6,5 Гц, 1,5H).
ПРИМЕР 22
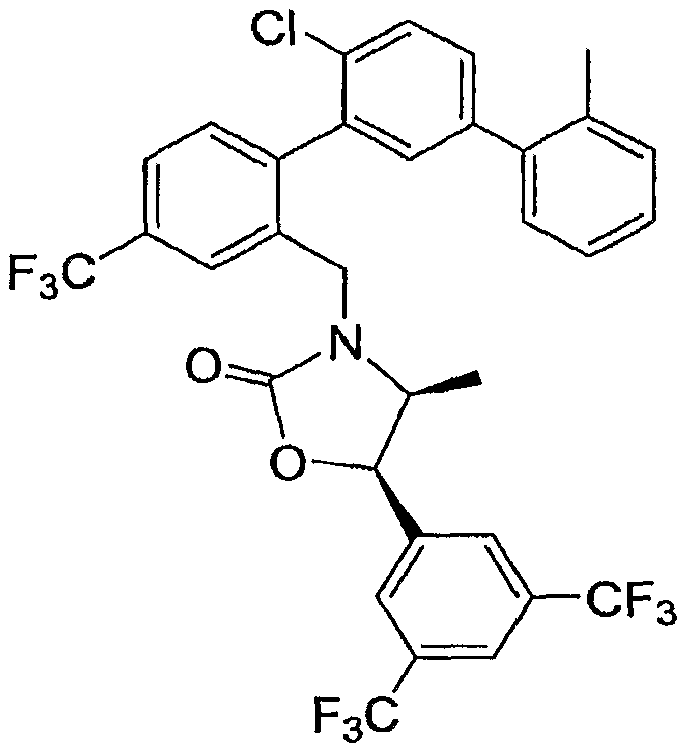
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[6'-хлор-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Стадия А
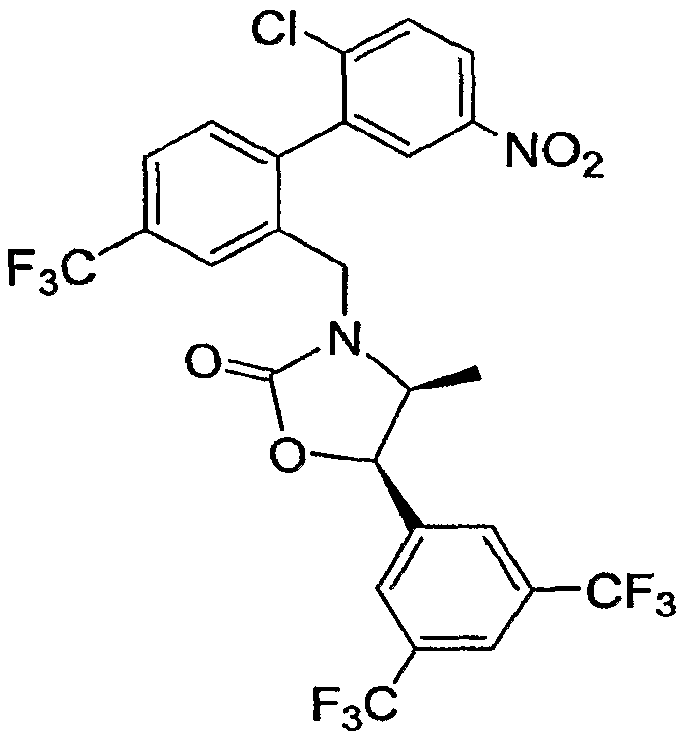
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[2'-хлор-5'-нитро-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Смесь (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2'-иод-5-(три-фторметил)бензил]-4-метил-1,3-оксазолидин-2-она (1,0 г, 1,68 ммоль), 2-хлор-5-нитрофенилбороновой кислоты (0,67 г, 3,3 ммоль), тетракис(трифенилфосфин)палладия (97 мг, 5%мол.) и карбоната натрия (0,39 г, 3,68 ммоль) в 50 мл смеси вода:EtOH:толуол (1:2:4) кипятят с обратным холодильником в течение 4 час. Анализ методом ТСХ (CH2Cl2:гексан/1:1) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (30 мл). Органические вещества экстрагируют метиленхлоридом (3×40 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после флэш-хроматографии, используя CH2Cl2:гексан/6:4 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 1:1 смесь ротамеров 8,16-8,31 (м, 1H), 8,21 (д, J=2,5 Гц, 1/2H), 8,16 (д, J=2,5 Гц, 1/2H), 7,90 (с, 1H), 7,71-7,78 (м, 5H), 7,42-7,46 (м, 1H), 5,66 (д, J=4,5 Гц, 1/2H), 5,64 (д, J=4,5 Гц, 1/2H), 4,93 (д, J=15,5 Гц, 1/2H), 4,79 (д, J=16 Гц, 1/2H), 4,03 (д, J=16Гц, 1/2H), 3,94 (м, 1H), 3,91 (д, J= 15,5 Гц, 1/2H), 0,70 (д, J=6,5 Гц, 1,5H), 0,64 (д, J=6,5 Гц, 1,5H).
Стадия В
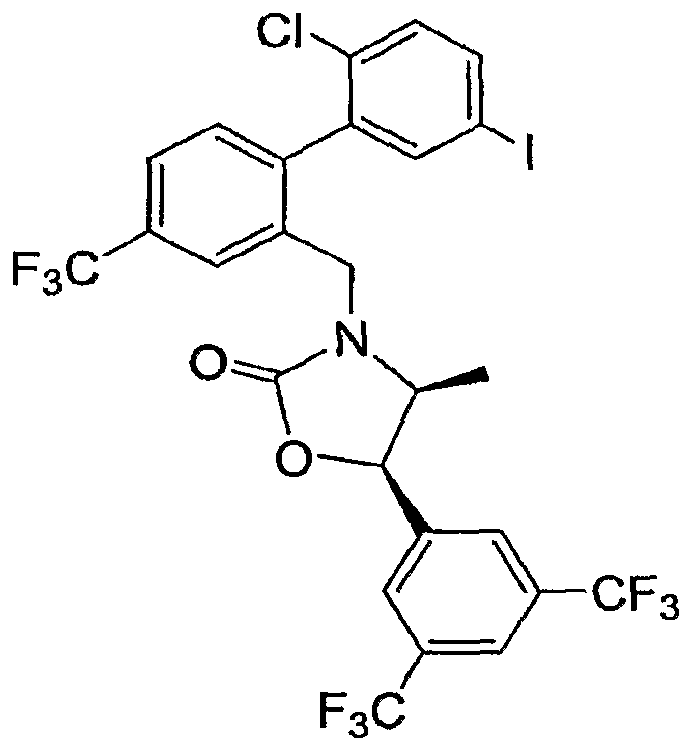
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[2'-хлор-5'-иод-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
К смеси соединения, указанного в названии на Стадии А (1,14 г, 1,82 ммоль), в EtOH (20 мл) при комнатной температуре добавляют SnCl2·H2O (5 экв.). Полученный раствор перемешивают при комнатной температуре в течение в 4 час. Анализ методом ТСХ (CH2Cl2:гексан/1:1) показывает, что реакция закончена. Добавляют EtOAc (50 мл). Смесь промывают водой (2×20 мл), насыщенным раствором соли и сушат над сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток разбавляют хлороформом (30 мл). Добавляют н-пентилнитрит (0,36 мл, 2,73 ммоль) и иод (0,55 г, 2,18 ммоль). Смесь при перемешивании кипятят с обратным холодильником в течение 1 час. Смесь разбавляют метиленхлоридом (30 мл). Полученный раствор розового цвета промывают насыщенным раствором тиосульфата натрия, насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя EtOAc:гексан/2:98 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 1:1 смесь атропоизомеров 7,90 (с, 1H), 7,77 (с, 1H), 7,70-7,75 (м, 4H), 7,65 (д, J=2,5 Гц, 1/2H), 7,61 (д, J=2,5 Гц, 1/2H), 7,40 (м, 1H), 7,28 (м, 1Н), 5,66 (д, J=8 Гц, 1/2H), 5,64 (д, J=8 Гц, 1/2H), 4,85 (д, J=15,5 Гц, 1/2H), 4,82 (д, J=14 Гц, 1/2H), 4,02 (д, J=16 Гц, 1/2H), 3,96 (м, 1/2H), 3,95 (д, J=15,5 Гц, 1/2H), 3,79 (м, 1/2H), 0,64 (д, J=6,5 Гц, 1,5 H), 0,57 (д, J=6,5 Гц, 1,5H).
Стадия С: (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[6'-хлор-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Смесь соединения, указанного в названии на Стадии В (0,064 г, 0,9 ммоль), 2-метилфенилбороновой кислоты (0,018 г, 0,14 ммоль), тетракис(трифенилфосфин)палладия (10 мг, 5%мол.) и карбоната натрия (0,048 г, 0,45 ммоль) в 7 мл смеси вода:EtOH:толуол (1:2:4) кипятят с обратным холодильником в течение 2 час. Анализ методом ТСХ (CH2Cl2:гексан/8:2) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×20 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после очистки методом препаративной ТСХ, используя раствор 18% EtOAc в гексане в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 1:1 смесь атропоизомеров 7,89 (с, 1H), 7,72 (м, 3H), 7,60 (д, J=1,5 Гц, 0,5H), 7,67,59(д, J=1,5 Гц, 0,5H), 7,48 (м, 1H), 7,38 (м, 1Н), 7,21-7,32 (м, 4H), 7,14 (д, J=7,5 Гц, 0,5H), 7,10 (т, J=7,5 Гц, 0,5H), 6,87 (т, J=7,5 Гц, 0,5H), 6,80 (д, J=7,5Гц, 0,5H), 5,62 (т, J=8,0 Гц, 1Н), 5,00 (д, J=15,5 Гц, 0,5H), 4,83 (д, J=16 Гц, 0,5H), 4,12 (д, J=16 Гц, 0,5H), 4,02 (д, J=15,5 Гц, 0,5H), 3,95 (м, 0,5H), 3,87 (м, 0,5H), 2,33 (с, 1,5H), 2,33 (с, 1,5H), 0,61 (д, J=6,5 Гц, 1,5H), 0,57 (д, J=6,5 Гц, 1,5H).
ЖХ-МС (М+): 672,2
ПРИМЕР 23
Следующее соединение получают по приведенным выше методикам (ЖХ/МС 730,4):
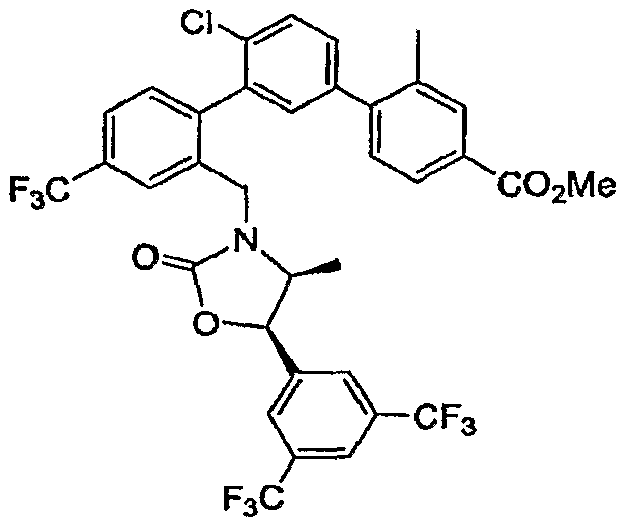
Указанное соединение (Пример 23) можно также получить по методике, приведенной для получения Промежуточных соединений 7 и 23:
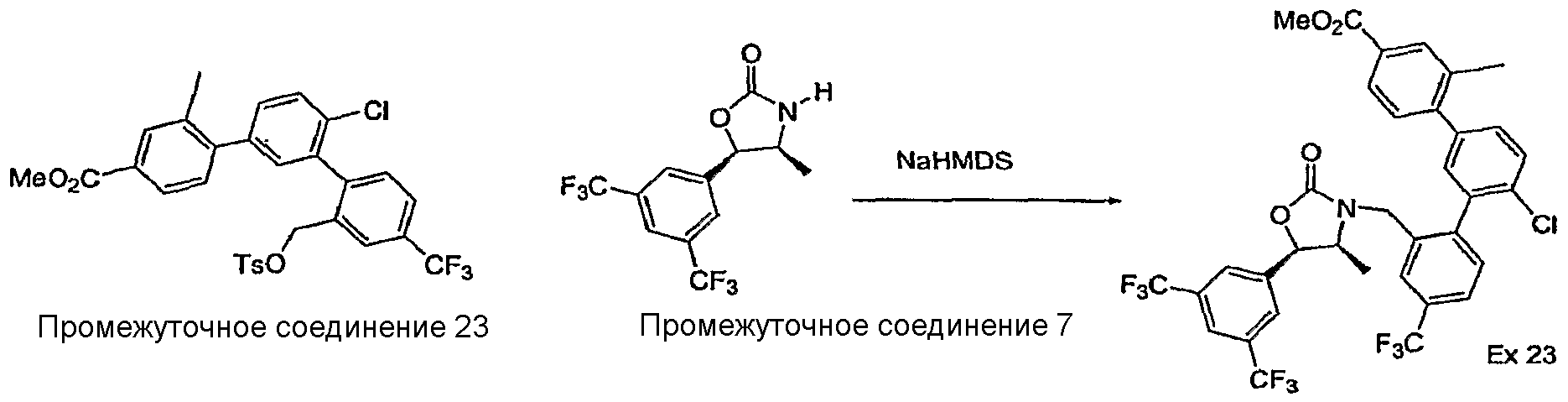
Хиральный оксазолидинон (Промежуточное соединение 7) (1,35 кг) и сухой ДМФА (30,8 л) помещают в сосуд емкостью 100 л. После охлаждения до температуры в диапазоне от минус 15 до минус 20°С добавляют NaHMDS (1,96 л 2 М раствора) и смесь перемешивают в течение 15-30 мин. К полученной натриевой соли оксазолидинона добавляют триарилтозилат (Промежуточное соединение 23, 2,2 кг) в ДМФА и смеси дают нагреться до температуры в интервале от 0 до 5°С. После того как триарилтозилат полностью вступит в реакцию, добавляют 2,44 л 5 М раствора HCl, а затем 22 л 20% раствора гептан/этилацетат. Наконец, медленно добавляют воду (11 л). Слои разделяют, органический слой дважды промывают смесью ДМФА:вода и затем дважды водой. Проводят анализ органического слоя с целью определения выхода, а затем фильтруют через слой силикагеля для удаления избытка оксазолидинона. После этого растворитель меняют на метанол, чтобы использовать продукт на других стадиях.
ПРИМЕР 24
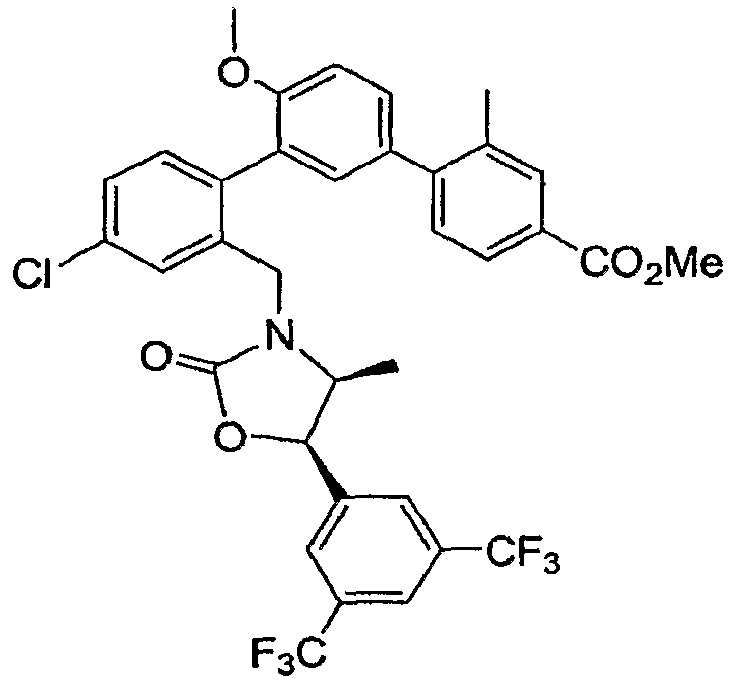
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4"-хлор-4'-метокси-2-метил-1,1':3',1"-терфенил-4-карбоксилат
Стадия А: 1-бром-2-(бромметил)-4-хлорбензол
Смесь 2-бром-5-хлортолуола (2,00 г, 9,75 ммоль), NBS (2,08 г, 11,7 ммоль) и каталитическое количество AIBN в тетрахлориде углерода (50 мл) нагревают до кипения и кипятят с обратным холодильником в течение 4 час. Анализ методом ТСХ (EtOAc:гексан/5:95) показывает отсутствие исходных веществ. Смесь фильтруют и фильтрат концентрируют. Указанное в названии соединение получают в виде твердого вещества белого цвета (2,20 г) после флэш-хроматографии, используя EtOAc:гексан/5:95 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,53 (д, J=9,0 Гц,1H), 7,47 (д, J=2,5 Гц, 1H), 7,18 (дд, J=8,5, 2,5 Гц, 1H), 4,60 (с, 2H).
Стадия В: (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-(2-бром-5-хлорбензил)-4-метил-1,3-оксазолидин-2-он
К раствору (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-она (0,050 г, 0,16 ммоль) в ТГФ (1 мл) при температуре 0°С добавляют NaH (7,6 мг, 0,19 ммоль,60%). Смесь перемешивают при 0°С в течение 30 мин. Добавляют указанное в названии соединение на Стадии А (0,059 г, 0,21 ммоль). Полученную смесь перемешивают при 0°С в течение 1 час и в течение 4 час нагревают до комнатной температуры. Реакцию прерывают с помощью насыщенного раствора хлорида аммония. Органические вещества экстрагируют этилацетатом (3×15 мл). Слои этилацетата объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после очистки методом препаративной ТСХ, используя EtOAc:гексан/2:8 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,92 (с, 1H), 7,82 (с, 2H), 7,55 (д, J=8,5 Гц, 1H), 7,43 (д, J=2,5 Гц, 1H), 7,23 (дд, J=8,5, 2,5 Гц, 1H), 5,77(д, J=8,0 Гц, 1H), 4,86 (д, J=16,0 Гц, 1H), 4,36 (д, J=16,0 Гц, 1H), 4,11 (м, 1H), 0,82 (д, J=6,5 Гц, 3H).
Стадия С: метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4"-хлор-4'-метокси-2-метил-1,1':3',1"-терфенил-4-карбоксилат
Смесь соединения, указанного в названии на Стадии В (0,068 г, 0,13 ммоль), метил 4'-метокси-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилата (Промежуточное соединение 11) (0,075 г, 0,19 ммоль), тетракис(трифенилфосфин)палладия (15 мг, 5%мол.) и карбоната натрия (0,07 г, 0,65 ммоль) в 7 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 5 час. Анализ методом ТСХ (EtOAc:гексан/1:3) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×20 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после очистки методом препаративной ТСХ, используя 10% EtOAc в гексане в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 1:1 смесь атропоизомеров 7,96 (д, J=9 Гц, 1H), 7,88 (м, 2H), 7,72 (с, 1H), 7,65 (с, 1H), 7,49 (д, J=2Гц, 0,5H), 7,39 (м, 2H), 7,36 (д, J= 2 Гц, 0,5H), 7,24-7,28 (м, 2H), 7,15 (м, 1H), 7,70 (м, 1H), 5,62 (д, J=8 Гц, 0,5H), 5,52 (д, J=8 Гц, 0,5H), 4,91 (т, J=16 Гц, 1H), 4,08 (д, J=15,5 Гц, 0,5H), 3,95 (с, 3H), 3,88 (с, 3H), 3,87(д, J=16 Гц, 0,5H), 3,84 (м, 1H), 2,39(с, 1,5H), 2,33 (с, 1,5H), 0,56 (д, J=7 Гц, 1,5H), 0,43 (д, J=6,5 Гц, 1,5H).
ПРИМЕР 25
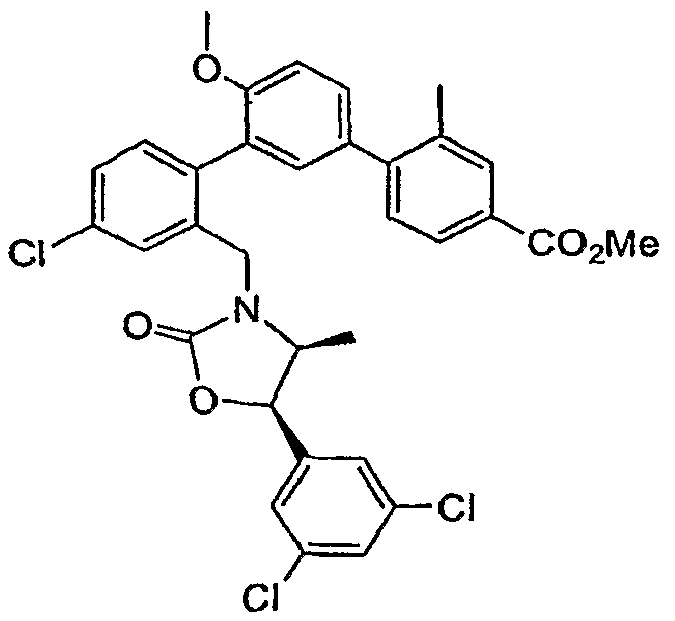
Указанное соединение получают по методике, приведенной в Примере 24, взяв в качестве исходного соединения (4S,5R)-5-[3,5-бис(хлор)фенил]-4-метил-1,3-оксазолидин-2-он. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 1:1 смесь атропоизомеров 7,96 (д, J=6,5 Гц, 1H), 7,89 (дд, J=8,1 Гц, 1H), 7,45 (м, 2H), 7,34-7,40 (м, 3H), 7,22-7,31 (м, 2H), 7,13 (д, J=2,5 Гц, 0,5H), 7,12 (д, J=2,5 Гц, 0,5H), 7,01-7,07 (м, 2H), 5,45 (д, J=8,5 Гц, 0,5H), 5,20 (д, J=8 Гц, 0,5H), 4,88 (д, J=16 Гц, 0,5H), 4,83 (д, J=15,5 Гц, 0,5H), 4,08 (д, J=15,5 Гц, 0,5H), 3,95 (с, 3H), 3,87 (с, 3H), 3,85 (д, J=16 Гц, 0,5H), 3,75 (м, 1H), 2,38 (с, 1,5H), 2,33 (с, 1,5H), 0,58 (д, J=6,5 Гц, 1,5H), 0,44 (д, J=6 Гц, 1,5H).
ЖХ-МС (М+1): 626,38
ПРИМЕР 26
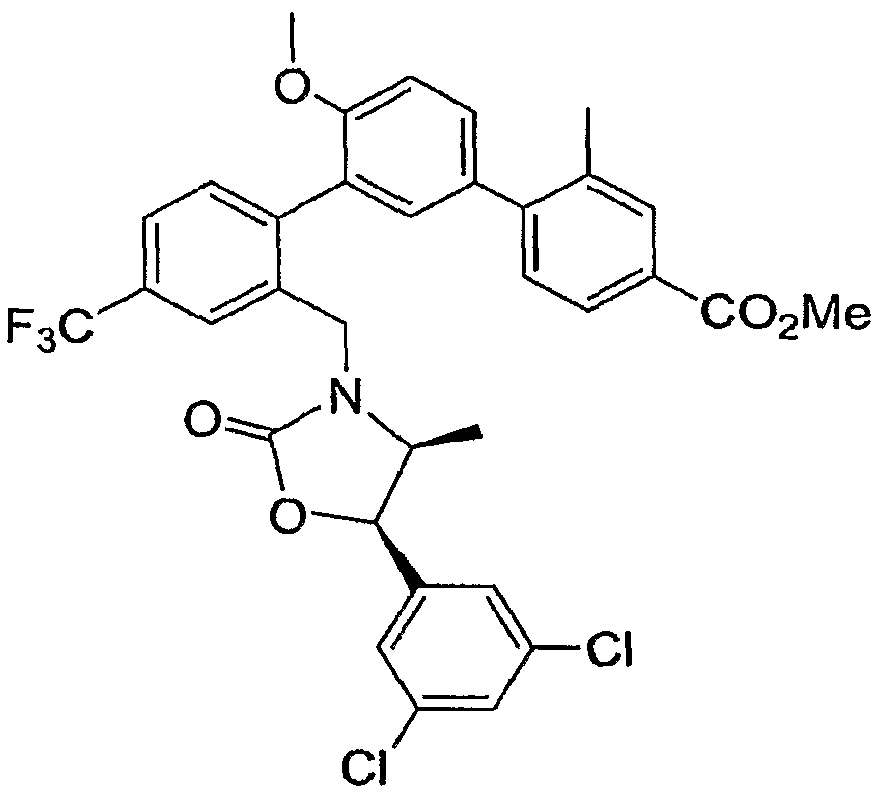
Метил 2"-{[(4S,5R)-5-[3,5-дихлорфенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
(4S,5R)-5-(3,5-Дихлорфенил)-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он (100 мг, 0,1886 ммоль), метил 4'-метокси-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилат (108 мг, 0,283 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (46 мг, 0,056 ммоль), водный раствор карбоната натрия (190 мкл, 2 М, 0,380 ммоль) и 1,4-диоксан (2 мл) помещают в герметично закрытую трубку и подвергают ВЧ нагреву до температуры 130°С в течение 30 мин, а затем до температуры 135°С в течение 15 мин, чтобы завершить реакцию. Реакционную смесь очищают методом препаративной ТСХ на SiO2 (последовательно элюируют 30%-ным раствором EtOAc в гексане, 70%-ным раствором дихлорметана в гексане, а затем 80%-ным раствором дихлорметана в гексане) и получают метил 2"-{[(4S,5R)-5-[3,5-дихлорфенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат в виде твердого вещества белого цвета. ЖХМС: рассчитано = 657,13; найдено = 658,46 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,94 (д, J=7 Гц, 1H), 7,87 (д, J=8,5Гц, 1H), 7,70 (с, 0,5H), 7,65-7,61 (м, 1,5H), 7,47-7,36 (м, 3H), 7,32 (д, 7=2 Гц, 0,5H), 7,29-7,23 (м, 1,5H), 7,11 (дд, J=6,3, 2,0 Гц, 1H), 7,08-7,02 (м, 1,5H), 7,00 (дд, J=8,3, 2,0 Гц, 0,5H), 5,41 (д, J=8,5 Гц, 0,5H), 5,16 (д, J=8,0 Гц, 0,5H), 4,91 (д, J=16 Гц, 0,5H), 4,85 (д, J=16,5 Гц, 0,5H), 4,17 (д, J=16 Гц, 0,5H), 3,98-3,90 (м, 3,5H), 3,856, 3,851 (с, 3H), 3,74-3,66 (м, 1H), 2,36, 2,32 (с, 3H), 0,55 (д, J=7 Гц, 1,5H), 0,43 (д, J=6 Гц, 1,5H).
ПРИМЕР 27
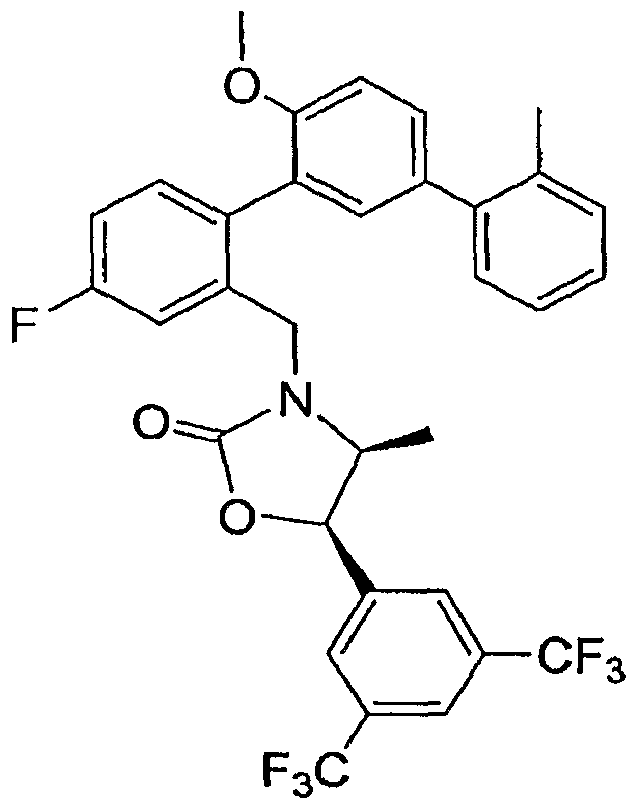
Стадия А
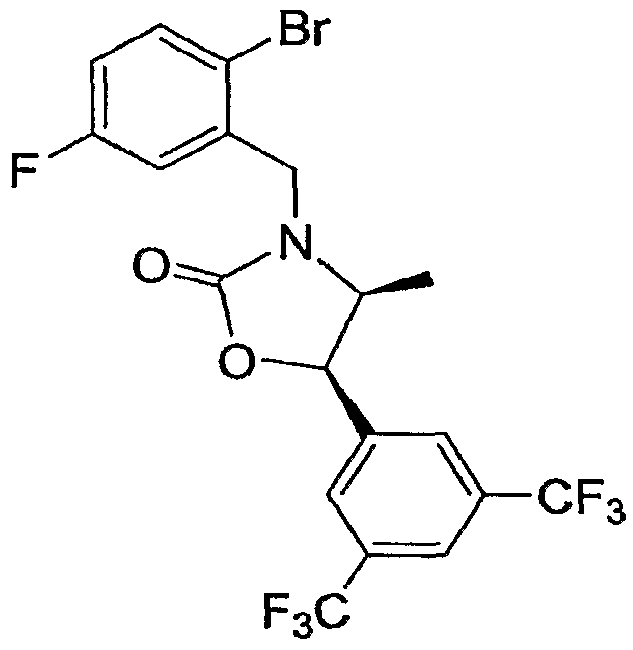
(4S,5R)-5-[3,5-Бис(трифторметил)фенил)-3-(2-бром-5-фторбензил)-4-метил-1,3-оксазолидин-2-он
К раствору (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-она (2,0 г, 6,39 ммоль) в ТГФ (40 мл) при температуре 0°С в один прием добавляют NaH (285 мг, 60% масс. в минеральном масле, 7,13 ммоль,1,1 экв.). Полученную вспененную массу перемешивают при охлаждении на бане со льдом. В реакционную смесь добавляют дополнительное количество ТГФ (50 мл). Реакционную смесь перемешивают при температуре 0°С в течение 30 мин. Добавляют раствор 2-бром-5-фторбензилбромида (1,712 г, 6,39 ммоль) в ТГФ (20 мл). Полученную смесь при охлаждении перемешивают в течение 30 мин, а затем дают ей нагреться до комнатной температуры. Реакция завершается через 3 час. Реакцию прерывают с помощью NH4Cl (насыщенный водный раствор, 80 мл). Летучие вещества удаляют в вакууме. Реакционную смесь экстрагируют с помощью EtOAc и сушат над Na2SO4. Остаток очищают флэш-хроматографией на SiO2 (картридж Biotage 40+M, проводят градиентное элюирование смесью EtOAc/гексан). (4S,5R)-5-[3,5-Бис-(трифторметил)фенил)-3-(2-бром-5-фторбензил)-4-метил-1,3-оксазолидин-2-он получают в виде прозрачного масла. ЖХ-МС: 500,09 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,88 (с, 1H), 7,79 (с, 2H), 7,55 (дд, J=8,8, 5,2 Гц, 1H), 7,17 (дд, J=8,7, 4,5 Гц, 1H), 6,95 (м, 1H), 5,74 (д, J=8,0 Гц, 1H), 4,83 (д, J=15,8, 1H), 4,54 (д, J=16,0 Гц, 1Н), 4,11 (м, 1H), 0,80 (д, J=6,6 Гц, 3H).
Стадия В
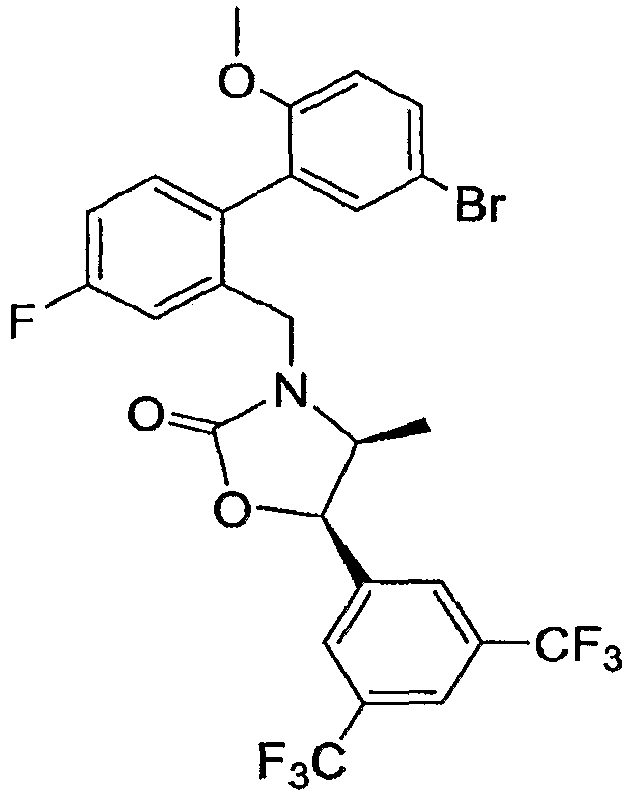
(4S,5R)-5-[3,5-Бис(трифторметил)фенил)-3-[(5'-бром-4-фтор-2'-метоксибифенил-2-ил)метил]-4-метил-1,3-оксазолидин-2-он
(4S,5R)-5-[3,5-Бис-(трифторметил)фенил]-3-(2-бром-5-фтор-бензил)-4-метил-1,3-оксазолидин-2-он (600 мг, 1,2 ммоль), (5-бром-2-метоксифенил)бороновую кислоту (319 мг, 1,38 ммоль), водный раствор карбоната натрия (1,27 мл, 2 М, 2,54 ммоль), толуол (3,5 мл) и этанол (400 мкл) смешивают и перемешивают при комнатной температуре в течение 45 мин, а затем добавляют тетракис(трифенилфосфин)палладий(0) (87 мг, 4,5%мол.). Полученную смесь для завершения реакции нагревают на масляной бане до температуры 90°С в течение 24 час. Сырую реакционную смесь разбавляют насыщенным раствором соли и экстрагируют этилацетатом. Экстракты объединяют, сушат над Na2SO4, а затем фильтруют и концентрируют в вакууме, получая масло темного цвета. Сырое масло очищают препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), осуществляя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.) и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил)-3-[(5'-бром-4-фтор-2'-метоксибифенил-2-ил)метил]-4-метил-1,3-оксазолидин-2-он. ЖХМС: рассчитано = 607,04; найдено = 607,98 (М+1)+.
Стадия С: (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[(4-фтор-6'-метокси-2"-метил-1,1':3',1"-терфенил-2-ил)метил]-4-метил-1,3-оксазолидин-2-он
(4S,5R)-5-[3,5-Бис(трифторметил)фенил)-3-[(5'-бром-4-фтор-2'-метоксибифенил-2-ил)метил]-4-метил-1,3-оксазолидин-2-он (50 мг, 0,082 ммоль), (2-метилфенил)бороновую кислоту (22 мг, 0,165 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (20 мг, 0,024 ммоль), водный раствор гидроксида калия (55 мкл, 3 М, 0,165 ммоль) и 1,4-диоксан (1 мл) помещают в герметично закрытую трубку и подвергают ВЧ нагреву до температуры 140°С в течение 20 мин для завершения реакции. Реакционную смесь очищают методом препаративной ТСХ на SiO2 (элюируют 20%-ным раствором EtOAc в гексане) и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[(4-фтор-6'-метокси-2"-метил-1,1':3',1"-терфенил-2-ил)метил]-4-метил-1,3-оксазолидин-2-он в виде прозрачного стеклообразного вещества. ЖХМС: рассчитано = 617,18; найдено = 618,16 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,84 (с, 1H), 7,68 (с, 1H), 7,62 (с, 1H), 7,36-7,32 (м, 1Н), 7,30-7,22 (м, 4H), 7,22-7,18 (м, 1,5H), 7,18-7,14 (м, 0,5H), 7,14-7,11 (м, 1H), 7,11-7,05 (м, 1H), 7,02 (т, J=8,0 Гц, 1H), 5,58 (д, J=8,5 Гц, 0,55H), 5,28 (д, J=8 Гц, 0,45H), 4,90 (д, J=3,5 Гц, 0,45H), 4,09 (д, J=15,5 Гц, 0,45H), 3,88 (д, J=16,5 Гц, O,55H), 3,844, 3,838 (с, 3H), 3,82-3,75 (м, 1H), 2,32, 2,56 (с, 3H), 0,52 (д, J=6,5 Гц, 1,35H), 0,38 (д, J=6,5 Гц, 1,65H).
ПРИМЕР 28
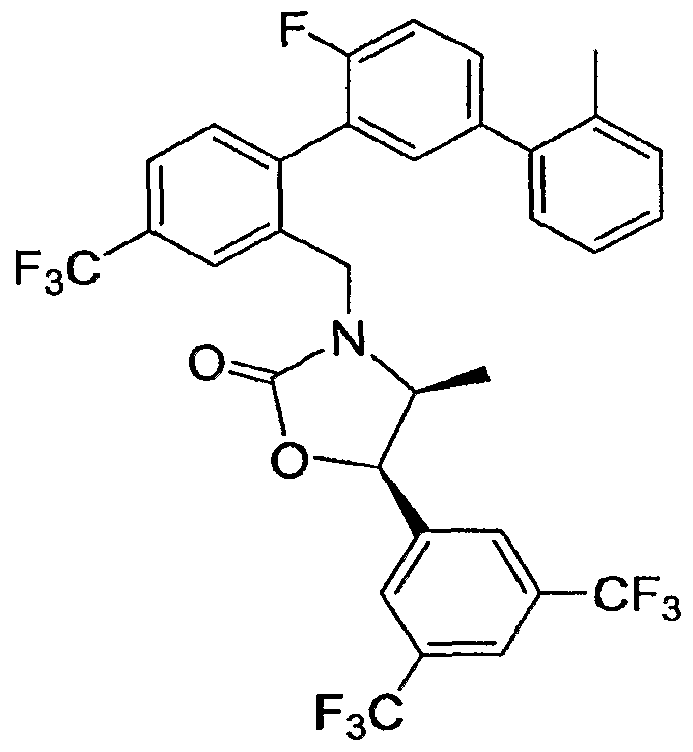
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[6'-фтор-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Стадия А
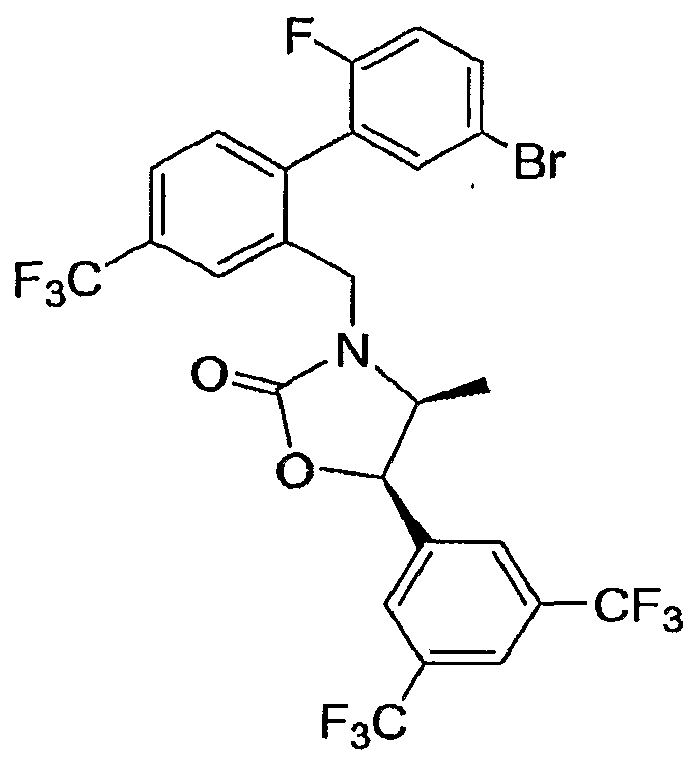
(4S,5R)-5-[3,5-Бис(трифторметил)фенил)-3-{[5'-бром-2'-фтор-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
(4S,5R)-5-[3,5-Бис-(трифторметил)фенил)-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он (500 мг, 0,837 ммоль) смешивают с (5-бром-2-фторфенил)бороновой кислотой (211 мг, 0,963 ммоль), толуолом (5 мл), этанолом (278 мкл) и водным раствором карбоната натрия (2 М, 0,89 мл, 1,78 ммоль). Полученную смесь перемешивают при 20°С в течение 30 мин, а затем добавляют тетракис(трифенилфосфин)палладий(0) (43,5 мг, 0,0376 ммоль,4,5%мол.). Полученную смесь для завершения реакции нагревают на масляной бане до температуры 90°С в течение 40 час. Реакционную смесь очищают флэш-хроматографией (SiO2, картридж Biotage 40+M). Колонку элюируют смесью этилацетат/гексан. Соответствующие фракции объединяют и концентрируют в вакууме, получая (4S,5R)-5-[3,5-бис(трифторметил)фенил)-3-{[5'-бром-2'-фтор-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он. ЖХМС: рассчитано = 645,02; найдено = 645,94 (М+1)+.
Стадия В: (4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[6'-фтор-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
(4S,5R)-5-[3,5-Бис(трифторметил)фенил)-3-{[5'-бром-2'-фтор-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он (79 мг, 0,123 ммоль), (2-метилфенил)бороновую кислоту (25 мг, 0,182 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (10 мг, 0,0122 ммоль), водный раствор гидроксида калия (82 мкл, 3 М, 0,246 ммоль) и 1,4-диоксан (1 мл) помещают в герметично закрытую трубку и подвергают ВЧ нагреву до температуры 140°С в течение 15 мин для завершения реакции. Сырую реакционную смесь очищают методом препаративной ТСХ на SiO2 (элюируют 30%-ным раствором EtOAc в гексане) и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[6'-фтор-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он в виде прозрачного стеклообразного вещества. ЖХМС: рассчитано = 655,16; найдено = 656,11 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,86 (с, 1H), 7,73 (с, 1H), 7,72-7,66 (м, 2H), 7,48 (д, J=8 Гц, 1H), 7,41-7,36 (м, 1H), 7,29-7,23 (м, 4H), 7,19-7,23 (м, 3H), 5,56 (шир. с, 1H), 4,96 (шир. с, 1Н), 4,13 (шир. д, J=46,5 Гц, 1H), 3,83 (шир. д, J=43,5 Гц, 1H), 2,29 (с, 3H), 0,56, 0,51 (шир. с, 3H).
ПРИМЕР 29
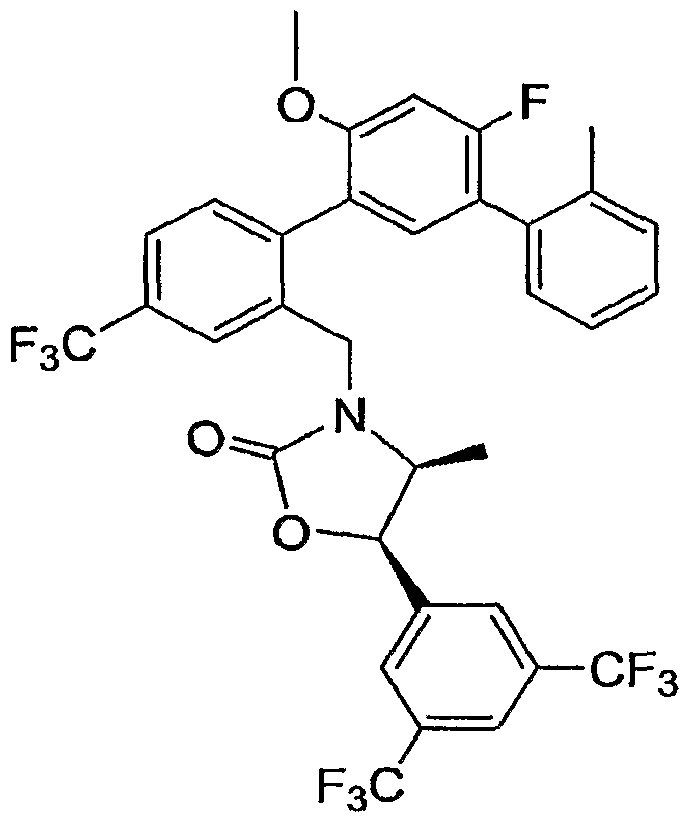
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[4'-фтор-6'-метокси-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Смесь (4S,5R)-5-[3,5-бис-(трифторметил)фенил)-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (0,050 г, 0,084 ммоль), 2-метокси-4-фтор-5-(2'-метилфенил)бороновой кислоты (избыток), тетракис(трифенилфосфин)палладия (5%мол.) и карбоната натрия (19,5 мг, 0,18 ммоль) в 7 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 4 час. Анализ методом ТСХ (CH2Cl2:гексан/1:1) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×10 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя CH2Cl2:гексан/6:4 в качестве элюента. ЖХ-МС (М+1): 686,1.
ПРИМЕР 30
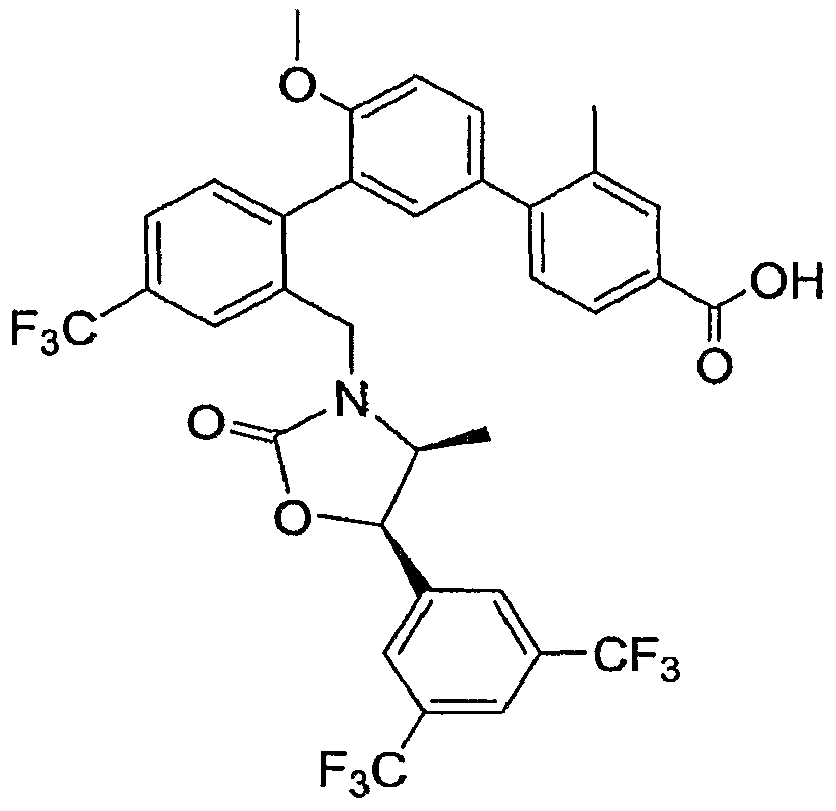
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифтор-метил)-1,1':3',1"-терфенил-4-карбоксилат (20 мг, 0,0276 ммоль), водный раствор гидроксида калия (300 мкл, 3 М, 0,90 ммоль) и этанол (2 мл) перемешивают при температуре 20°С в течение 2 час и 20 мин для завершения гидролиза. Реакционную смесь подкисляют уксусной кислотой. Смесь очищают препаративной ТСХ на силикагеле (элюируют смесью АсОН/EtOAc/гексан = 5/25/70, об./об.) и получают 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}ме-тил)-4'-метокси-2-метил4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС: рассчитано = 711,17; найдено = 712,10 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,99 (д, J=8,0 Гц, 1H), 7,92 (д, J=8,5 Гц, 1Н), 7,85 (д, J=5 Гц, 1H), 7,72-7,68 (м, 1,5H), 7,67-7,60 (м, 2,5H), 7,47-7,36 (м, 2H), 7,32 (д, J=8,0 Гц, 0,5H), 7,28 (д, J= 8,0 Гц, 0,5H), 7,15 (с, 1H), 7,08 (д, J=8,5, 7,0 Гц, 1Н), 5,58 (д, J=8,0 Гц, 0,5H), 5,29 (д, J=6,5 Гц, 0,5H), 4,97 (д, J=15,5 Гц, 0,5H), 4,94 (д, J=14 Гц, 0,5H), 4,16 (д, J=16 Гц, 0,5H), 3,96 (д, J=15,5 Гц, 0,5H), 3,87 (с, 3H), 3,83-3,74 (м, 1H), 2,38, 2,33 (с, 3H), 0,55 (д, J=6,5 Гц, 1,5H), 0,42 (д, J=1 Гц, 1,5H).
ПРИМЕР 31
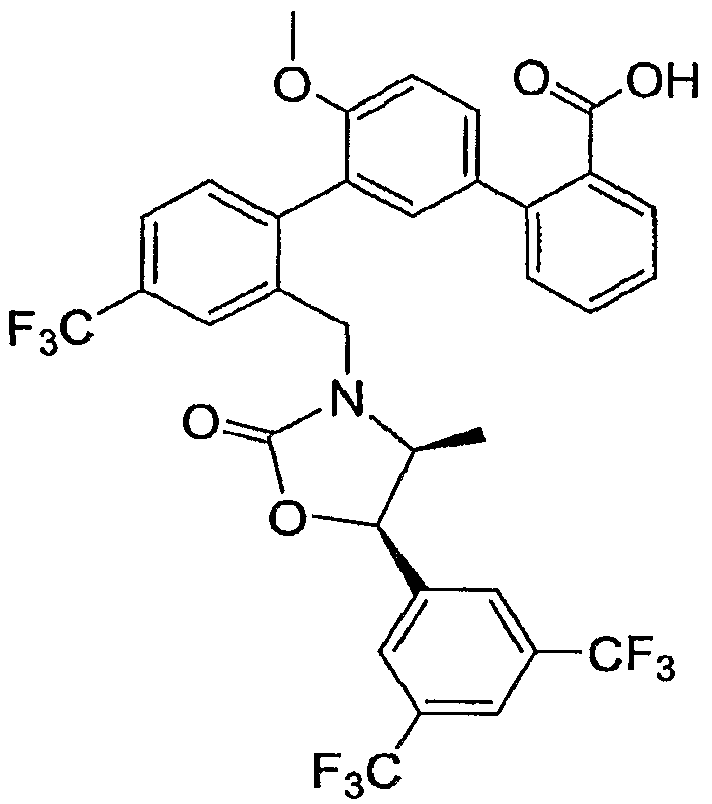
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-2-карбоновая кислота
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-2-карбоксилат (50 мг, 0,07 ммоль), водный раствор гидроксида калия (1,1 мл, 3 М, 3,3 ммоль), воду (1,5 мл) и этанол (3,6 мл) перемешивают при температуре 20°С в течение 23 час. Реакционную смесь подкисляют с помощью HCl (водный раствор, 1N). Летучие вещества удаляют при пониженном давлении. Полученную смесь экстрагируют этилацетатом и промывают насыщенным раствором соли. Объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют, получая масло. Указанное масло очищают препаративной ВЭЖХ с обращенной фазой (колонка: Kromasil 100-5C18, 100×21,1 мм), проводя градиентное элюирование смесью MeCN (0,1% об./об. TFA с буфером)/Н2О (0,1% об./об. TFA с буфером), и получают 2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-2-карбоновую кислоту. ЖХМС: рассчитано = 697,15; найдено = 698,16 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,94 (т, J=7,0 Гц, 1H), 7,85 (д, J=7,0 Гц, 1Н), 7,68-7,63 (м, 2,5H), 7,63-7,59 (м, 1,5H), 7,59-7,54 (м, 1H), 7,47-7,35 (м, 4H), 7,14 (дд, J=8,0, 2,0 Гц, 1H), 7,04 (д, J=8,5 Гц, 1Н), 5,53 (д, J=8,0 Гц, 0,4H), 5,42 (д, J=8,0 Гц, 0,6H), 5,02 (д, J=15,5 Гц, 0,6H), 4,85 (д, J=15,5 Гц, 0,4H), 4,11-4,02 (м, 0,4H), 3,87-3,77 (м, 3,6H), 0,99 (д, J=6,5 Гц, 0,6H), 0,93 (д, J=7,0 Гц, 0,4H), 0,58 (д, J=7,0 Гц, 1,2H), 0,54 (д, J=6,5Гц, 1,8H).
ПРИМЕР 32
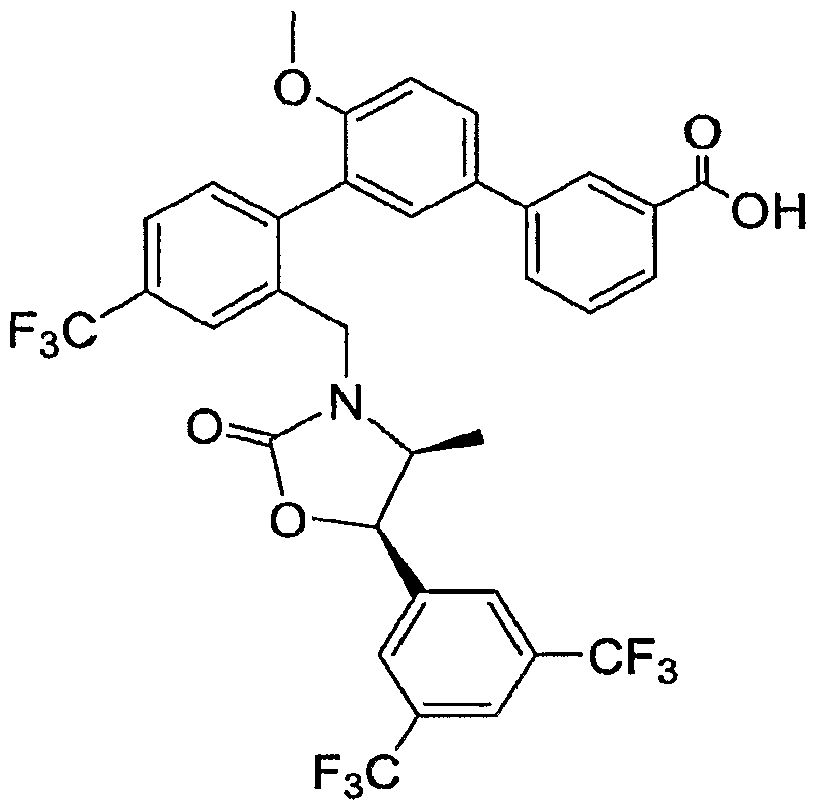
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-3-карбоновая кислота
Указанное в названии соединение из Примера 15 оставляют на ночь при комнатной температуре перемешиваться с LiOH (3 экв.) в смеси 2:1 диоксана и воды. Растворитель удаляют и водный раствор подкисляют 1N раствором HCl до рН ~4. Смесь экстрагируют с помощью EtOAc (3×10 мл). Слои EtOAc объединяют и сушат над сульфатом натрия. Указанное в названии соединение получают после препаративной ТСХ на силикагеле, используя EtOAc:гексан/1:1 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 8,32 (с, 0,5H), 8,29 (с, 0,5H), 8,08 (м, 1H), 7,46-7,85 (м, 10H), 5,61 (д, J=8 Гц, 0,5H), 5,20 (д, J=8 Гц, 0,5H), 5,04 (д, J=16 Гц, 0,5H), 4,95 (д, J=15,5 Гц, 0,5H), 4,17 (д, J=16 Гц, 0,5H), 3,97 (д, J=15,5 Гц, 0,5H), 3,91 (с, 1,5H), 3,83 (с, 1,5H), 3,79 (м, 1H), 0,58 (д, J=6,5 Гц, 1,5H), 0,42 (д, J=6,5 Гц, 1,5H).
ЖХ-МС (М+1): 698,18.
ПРИМЕР 33
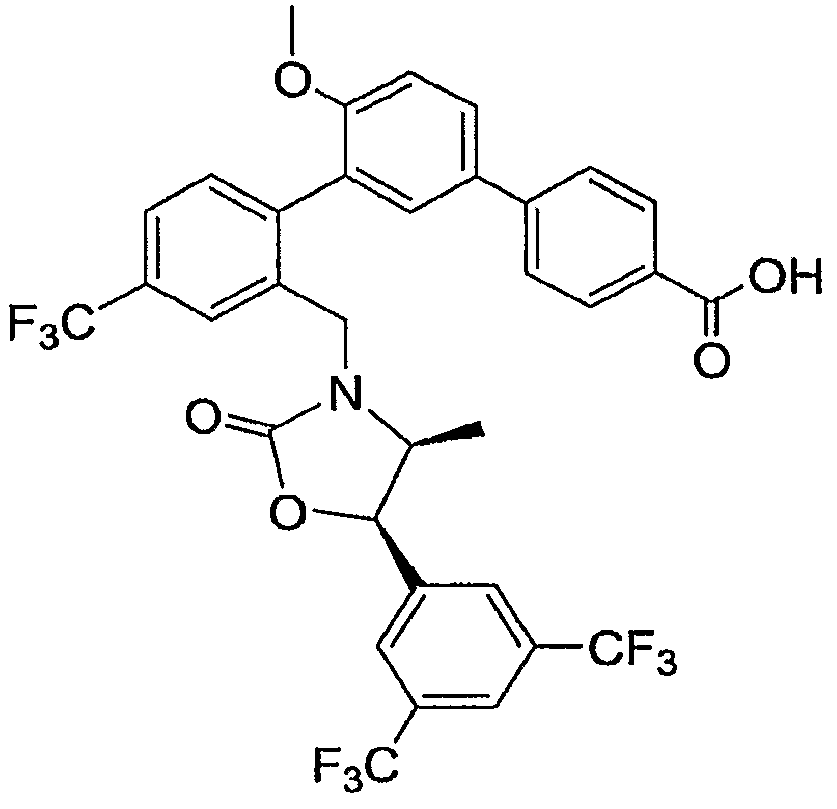
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат (10 мг, 0,014 ммоль), водный раствор гидроксида калия (150 мкл, 3 М, 0,45 ммоль) и этанол (1 мл) перемешивают при температуре 20°С в течение 2 час и 30 мин для завершения гидролиза. Реакционную смесь подкисляют с помощью HCl (водный раствор, 1N), а затем подщелачивают бикарбонатом натрия. Летучие вещества удаляют при пониженном давлении. Полученную смесь экстрагируют этилацетатом и промывают насыщенным раствором соли. Объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют, получая масло. Указанное масло очищают препаративной ТСХ на силикагеле (элюируют 50% EtOAc в гексане) и получают 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС: рассчитано = 697,15; найдено = 698,03 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,16-8,11 (м, 2H), 7,83 (д, J=8,0 Гц, 1H), 7,74-7,69 (м, 2H), 7,69-7,65 (м, 2,5H), 7,65-7,61 (м, 1,5H), 7,57 (с, 1H), 7,48-7,42 (м, 2,0H), 7,11 (дд, J=8,8, 2,5 Гц, 1Н), 5,57 (д, J=8,0 Гц, 0,5H), 5,17 (д, J=8,0 Гц, 0,5H), 4,97 (д, J=15,5 Гц, 0,5H), 4,93 (д, J=15,5 Гц, 0,5H), 4,16 (д, J=16 Гц, 0,5H), 3,95 (д, J=16,0 Гц, 0,5H), 3,88, 3,87 (с, 3H), 3,80-3,72 (м, 1Н), 0,55 (д, J=6,5 Гц, 1,5H), 0,41 (д, J=6,5 Гц, 1,5H).
ПРИМЕР 34
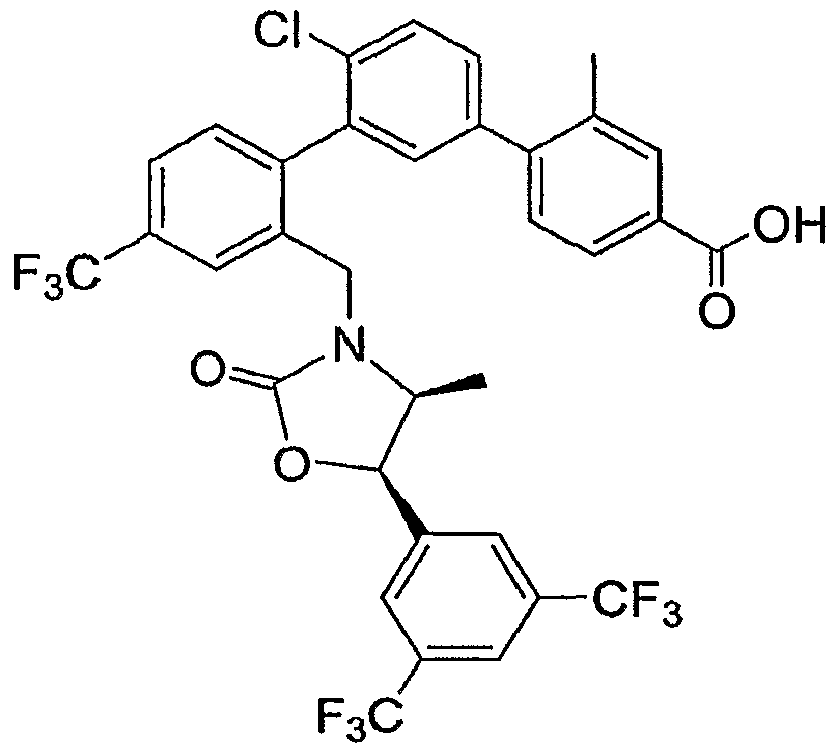
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-хлор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-хлор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат (25 мг, 0,034 ммоль), водный раствор гидроксида калия (300 мкл, 3 М, 0,90 ммоль) и этанол (2 мл) оставляют на ночь перемешиваться при температуре 20°С. Летучие вещества удаляют при пониженном давлении. Полученный остаток обрабатывают насыщенным раствором соли и экстрагируют этилацетатом. Объединенные экстракты сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая масло. Указанное масло очищают препаративной ТСХ на SiO2 (элюируют 50% EtOAc в гексане) и получают прозрачное масло. Указанное масло дополнительно очищают препаративной ВЭЖХ с обращенной фазой (колонка: Kromasil 100-5C18, 100×21,1 мм), проводя градиентное элюирование смесью MeCN (0,1% об./об. TFA)/Н2О (0,1% об./об. TFA), и получают 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-хлор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС: рассчитано = 715,12; найдено = 716,12 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,99 (д, J=8,0 Гц, 1H), 7,92 (д, J=8,5 Гц, 1H), 7,85 (д, J=5 Гц, 1H), 7,72-7,68 (м, 1,5H), 7,67-7,60 (м, 2,5H), 7,47-7,36 (м, 2H), 7,32 (д, J=8,0 Гц, 0,5H), 7,28 (д, J=8,0 Гц, 0,5H), 7,15 (с, 1H), 7,08 (дд, J=8,5, 7,0 Гц, 1H), 5,58 (д, J=8,0 Гц, 0,5H), 5,29 (д, J=6,5 Гц, 0,5H), 4,97 (д, J=15,5 Гц, 0,5H), 4,94 (д, J=14 Гц, 0,5H), 4,16 (д, J=16 Гц, 0,5H), 3,96 (д, J=15,5 Гц, 0,5H), 3,87 (с, 3H), 3,83-3,74 (м, 1H), 2,38, 2,33 (с, 3H), 0,55 (д, J=6,5 Гц, 1,5H), 0,42 (д, J=7 Гц, 1,5H).
Приведенное выше соединение (пример 34) было получено также из его метилового эфира (Пример 23) по следующей методике:
В сосуд емкостью 75 л, снабженный расположенной сверху мешалкой, термопарой, трубкой для ввода азота, капельной воронкой и рубашкой с паровым обогревом, который содержит приблизительно 12 л метанольного раствора метилового эфира триарилоксазолидинона (Пример 23, 2190 г, 3 моль), помещают ТГФ (12 л). Добавляют пероксид водорода (1800 мл 35%-ного раствора. Добавление сопровождается экзотермической реакцией, так что температура замеса поднимается с 16°С до 23°С.
Затем в реакционный сосуд помещают моногидрат гидроксида лития (378 г, 9 моль) и реакционную смесь нагревают до 60°С. За ходом реакции следят методом ВЭЖХ; реакция заканчивается через 15-16 час. Реакционную смесь охлаждают до 0-10°С и медленно добавляют водный раствор бисульфита натрия (2185 г приблизительно в 18 л воды), чтобы разложить пероксид водорода. Добавление сопровождается энергичной экзотермической реакцией. Отсутствие пероксида водорода подтверждают с помощью индикаторных бумажек EM Quant Peroxide.
Далее добавляют МТВЕ (22 л) и водный GMP (8 л) и смесь переносят в реактор емкостью 100 л. Нижний водный слой в реакторе удаляют, а верхний органический слой промывают 10%-ным раствором соли (2010 г NaCl приблизительно в 18 л водного GMP). Нижний слой удаляют, а мутный органический слой сушат над безводным сульфатом натрия.
Высушенную органическую фазу с помощью встроенного фильтра (1 мкм) отфильтровывают в сосуд емкостью 100 л, соединенный с концентратором. МТВЕ удаляют и заменяют циклогексаном. Доводят объем до 20 л. Замес нагревают до 50-65°С, чтобы полностью растворить любые выпавшие в осадок твердые вещества, а затем охлаждают приблизительно до 60°С и вносят затравку кристаллов, полученных из предыдущих замесов. Раствор оставляют на ночь охлаждаться до комнатной температуры и получают твердое вещество белого цвета. Указанное белое твердое вещество отделяют фильтрованием, промывают 2×2 л циклогексана и сушат в атмосфере азота под вакуумом.
Полученная указанным образом твердая карбоновая кислота представляет собой смесь безводного продукта и сольвата с циклогексаном (как правило, содержит 3-5% циклогексана), Сольват переводят в безводный продукт сушкой в вакуумном термическом шкафу при температуре 110-135°С, при этом точная температура зависит от конструкции и размера используемого термического шкафа.
ПРИМЕР 35
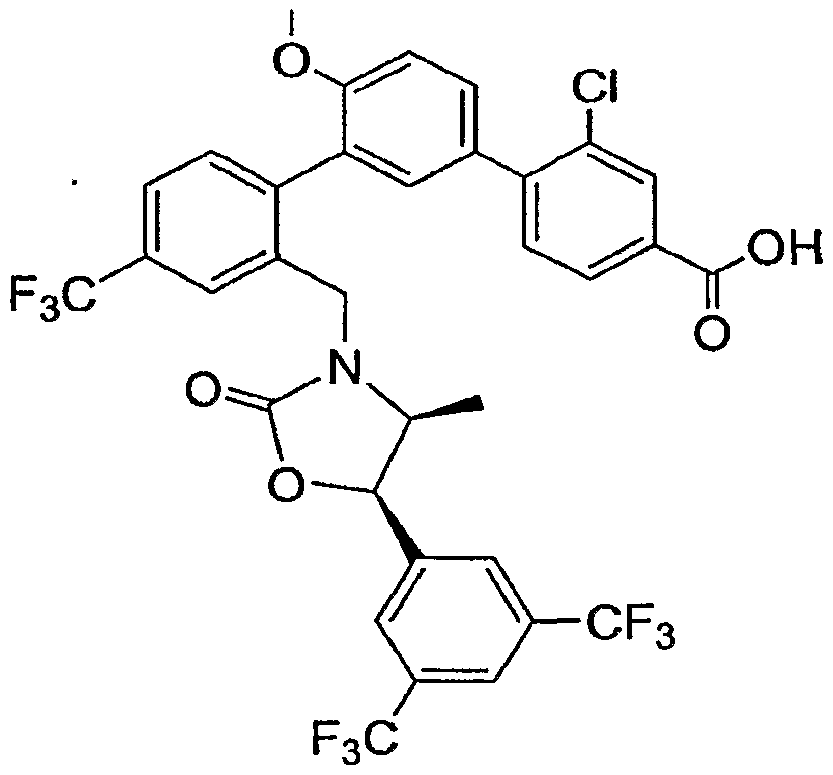
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2-хлор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Стадия А: метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2-хлор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Смесь Промежуточного продукта 9 (0,1 г), Промежуточного продукта 10 (0,1 г, 0,25 ммоль), тетракис(трифенилфосфин)палладия (5%мол.) и карбоната натрия (58 мг, 0,55 ммоль) в 7 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 2 час. Анализ методом ТСХ (EtOAc:гексан/1:9) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×15 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя CH2Cl2:гексан/8:2 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 7,10-8,20 (м, 12Н), 5,60 (д, J=8,5 Гц, 0,5H), 5,29 (д, J=8 Гц, 0,5H), 5,01 (д, J=16,5 Гц, 0,5H), 4,97 (д,J=16,5 Гц, 0,5H), 4,21 (д, J=16 Гц, 0,5H), 4,00 (д, J=16 Гц, 0,5H), 3,97 (с, 3H), 3,91 (с, 1,5H), 3,90 (с, 1,5H), 3,78 (м, 1Н), 0,55 (д, J=7 Гц, 1,5H), 0,43 (д, J=6,5 Гц, 1,5H).
Стадия В: 2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2-хлор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Указанное в названии соединение из Примера 25 оставляют на ночь перемешиваться вместе с LiOH (5 экв.) в смеси 2:1 диоксана и воды при комнатной температуре. Растворитель удаляют и водный раствор подкисляют с помощью 1N раствора HCl до рН ~4. Органические вещества экстрагируют с помощью EtOAc (3×10 мл). Слои EtOAc объединяют и сушат над сульфатом натрия. Указанное в названии соединение получают после препаративной ВЭЖХ с обращенной фазой. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 8,21 (д, J=12 Гц, 1Н), 8,04 (д, J=8 Гц, 1H), 7,87 (д, J=5,5 Гц, 1Н), 7,76 (с, 0,5H), 7,72 (с, 1H), 7,69 (с, 0,5 H), 7,67 (д, J=3,5 Гц, 1H), 7,65 (с, 1H), 7,44-7,58 (м, 3H), 7,37 (д, J=2 Гц, 0,5H), 7,35 (д, J=0,5 Гц, 0,5H), 7,13 (д, J=4Гц, 0,5H), 7,12 (д, J=5 Гц, 0,5H), 5,61 (д, J=8 Гц, 0,5H), 5,30 (д, J=12,5 Гц, 0,5H), 5,01 (д, J=12,5 Гц, 0,5H), 4,98 (д, J=13 Гц, 0,5H), 4,21 (д, J=15,5 Гц, 0,5H), 4,00 (д, J=16Гц, 0,5H), 3,91 (с, 1,5H), 3,90 (с, 1,5H), 3,80 (м, 1H), 0,56 (д, J=6,5 Гц, 1,5H), 0,44 (д, J=6,5 Гц, 1,5H).
ЖХ-МС (М+1): 732,1.
ПРИМЕР 36
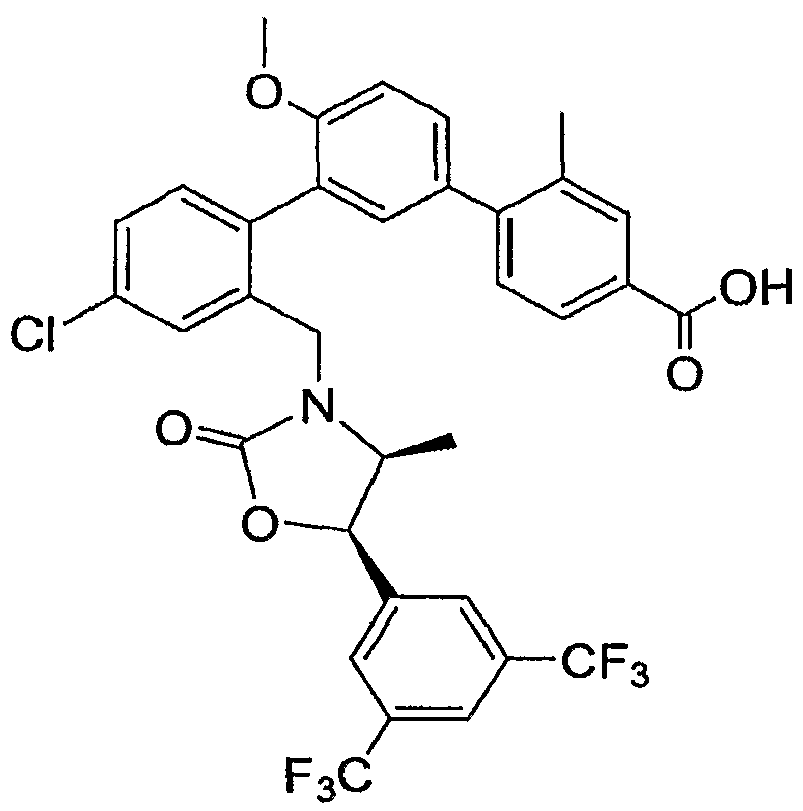
Указанное в названии соединение из Примера 24 оставляют на ночь перемешиваться вместе с LiOH (3 экв.) в смеси 2:1 диоксана и воды при комнатной температуре. Растворитель удаляют и водный раствор подкисляют с помощью 1N раствора HCl до рН ~4. Органические вещества экстрагируют с помощью EtOAc (3×10 мл). Слои EtOAc объединяют и сушат над сульфатом натрия. Указанное в названии соединение получают после препаративной ТСХ на пластинах, используя EtOAc:гексан/1:1 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 8,02 (д, J=7,5 Гц, 1H), 7,95 (д, J=7,5 Гц, 1H), 7,87 (с, 1H), 7,72 (с, 1H), 7,66 (с, 1H), 7,49 (с, 1H), 7,24-7,41 (м, 4H), 7,15 (с, 1H), 7,08 (д, J= 7 Гц, 0,5H), 7,06 (д, J=8 Гц, 0,5H), 5,62 (д, J=8,5Гц, 0,5H), 5,35 (д, J=8 Гц, 0,5H), 4,93 (д, J=16 Гц, 0,5H), 4,90 (д, J=15,5 Гц, 0,5H), 4,08 (д, J=15,5 Гц, 0,5H), 3,88 (с, 3H), 3,85 (м, 1,5H), 2,39 (с, 1,5H), 2,34 (с, 1,5H), 0,57 (д, J=6,5 Гц, 1,5H), 0,44 (д, J=6,5 Гц, 1,5H).
ЖХ-МС (М+1): 678,3.
ПРИМЕР 37
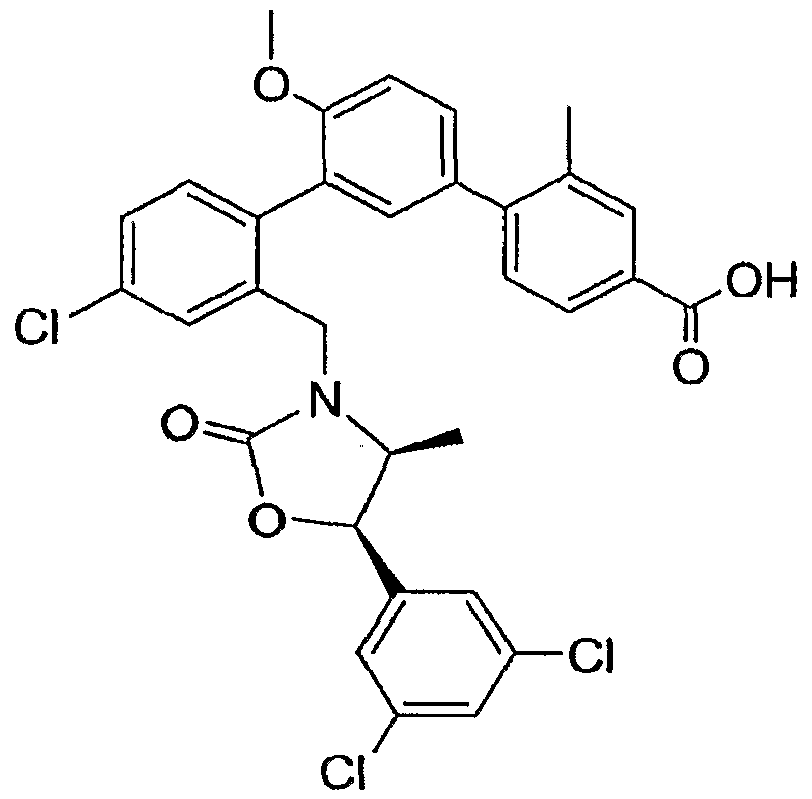
Указанное в названии соединение из Примера 25 оставляют на ночь перемешиваться вместе с LiOH (3 экв.) в смеси 2:1 диоксана и воды при комнатной температуре. Растворитель удаляют и водный раствор подкисляют с помощью 1N раствора HCl до рН ~4. Органические вещества экстрагируют с помощью EtOAc (3×10 мл). Слои EtOAc объединяют и сушат над сульфатом натрия. Указанное в названии соединение получают после препаративной ТСХ на пластинах, используя EtOAc:гексан/1:1 в качестве элюента. ЖХ-МС (М+1): 612,0.
ПРИМЕР 38
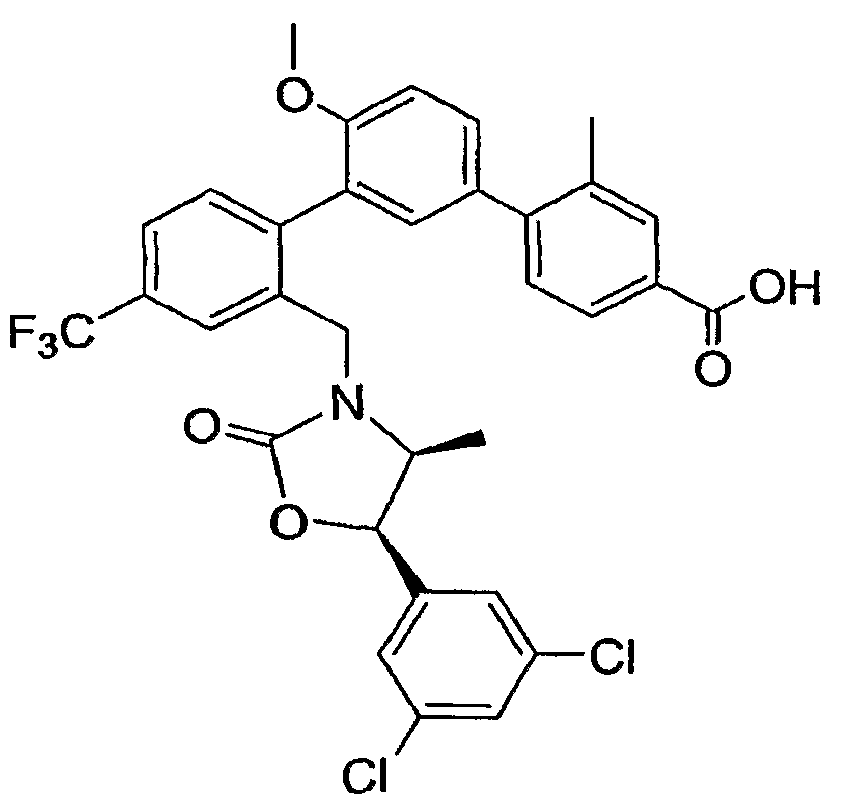
2"-{[(4S,5R)-5-(3,5-Дихлорфенил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Метил 2"-{[(4S,5R)-5-[3,5-дихлорфенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат (Пример 26) (50 мг, 0,076 ммоль), водный раствор гидроксида калия (600 мкл, 3 М, 1,8 ммоль) и этанол (4 мл) перемешивают при температуре 20°С в течение 6 час. Реакционную смесь подкисляют с помощью HCl (водный раствор, 1N), а затем подщелачивают бикарбонатом натрия. Летучие вещества удаляют при пониженном давлении. Полученную смесь экстрагируют этилацетатом и промывают насыщенным раствором соли. Органические экстракты объединяют и сушат над Na2SO4, фильтруют и концентрируют, получая масло. Указанное масло очищают препаративной ТСХ (элюируют смесью EtOAc/гексан) и получают 2"-{[(4S,5R)-5-[3,5-дихлорфенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС: рассчитано = 643,11; найдено = 644,14 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,01 (д, J=5,5 Гц, 1Н), 7,94 (д, J=8,0 Гц, 1H), 7,70 (с, 1H), 7,65-7,61 (м, 1,5H), 7,44-7,37 (м, 3H), 7,34-7,31 (м, 1H), 7,29 (д, J=8,0 Гц, 0,5H), 7,29 (д, J=8,0 Гц, 0,5H), 7,27-7,24 (м, 0,5H), 7,14 (дд, J=7,0, 2,5 Гц, 1H), 7,09-7,03 (м, 1,5H), 7,00 (дд, J=8,25, 2,0 Гц, 1Н), 5,42 (д, J=8,5 Гц, 0,55H), 5,17 (д, J=8,0 Гц, 0,45H), 4,92 (д, J=16,0 Гц, 0,55H), 4,86 (д, J=16,0 Гц, 0,45H), 4,18 (д, J=15,5 Гц, 0,55H), 3,96 (д, J=15,5 Гц, 0,45H), 3,86 (с, 3H), 3,75-3,66 (м, 1H), 2,38, 2,34 (с, 3H), 0,56 (д, J=6,5 Гц, 1,35H), 0,44 (д, J=6,5 Гц, 1,65H).
ПРИМЕР 39
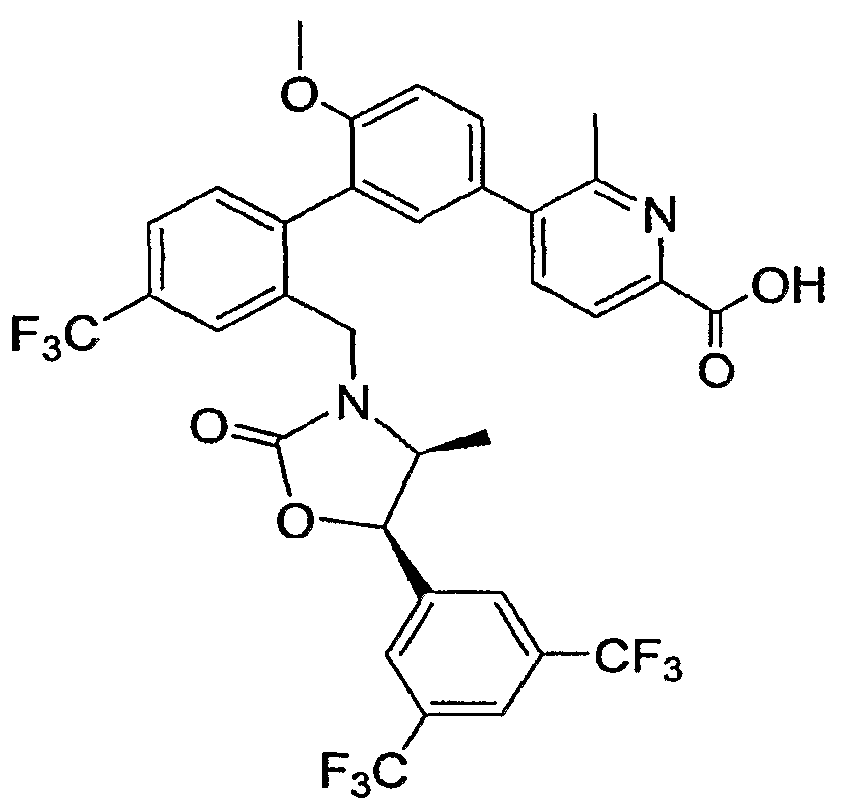
5-[2'-{[(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-метокси-4'-(трифторметил)бифенил-3-ил]-6-метилпиридин-2-карбоновая кислота
Стадия А
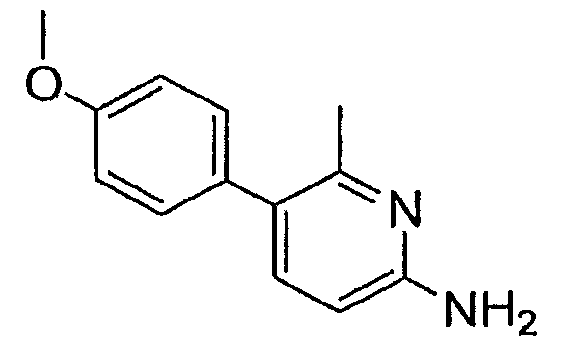
5-(4-метоксифенил)-6-метилпиридин-2-амин
(4-Метоксифенил)бороновую кислоту (1 г, 6,58 ммоль), 5-бром-6-метилпиридин-2-амин (1,23 г, 6,58 ммоль), 1,1'-бис(дифенил-фосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (537 мг, 0,658 ммоль), ацетат калия (1,29 г, 13,16 ммоль) и 1,4-диоксан (5 мл) помещают в герметично закрытую трубку и смесь подвергают ВЧ нагреву до температуры 140°С в течение 30 мин. Сырую реакционную смесь очищают колоночной флэш-хроматографией на SiO2 (картридж Biotage 40+M, этилацетат) и получают 5-(4-метоксифенил)-6-метилпиридин-2-амин в виде твердого вещества розового цвета. ЖХМС: рассчитано = 214,11; найдено = 215,17 (М+1)+.
Стадия В
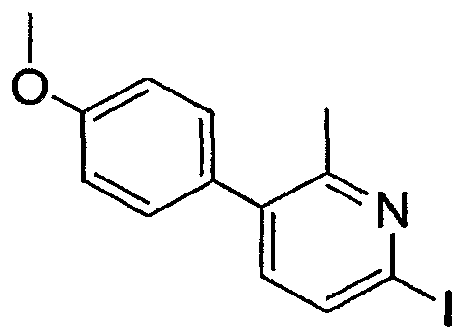
6-Иод-3-(4-метоксифенил)-2-метилпиридин
5-(4-Метоксифенил)-6-метилпиридин-2-амин (500 мг, 2,33 ммоль) и иод (710 мг, 2,8 ммоль) перемешивают в хлороформе (10 мл) при комнатной температуре в течение 12 мин, а затем добавляют н-амилнитрит (545,9 мг, 4,66 ммоль). Полученную смесь нагревают на масляной бане до 82°С в течение 1,5 час, чтобы завершить преобразование. Реакцию прерывают, добавив насыщенный водный раствор Na2S2O3. Реакционную смесь экстрагируют дихлорметаном. Органические экстракты объединяют и сушат над Na2SO4, а затем фильтруют и концентрируют. Полученный остаток очищают колоночной флэш-хроматографией на SiO2 (картридж Biotage 40+M, градиентное элюирование в смеси дихлорметан/гексан) и получают масло желтого цвета. Указанное масло далее очищают методом препаративной ТСХ на SiO2 (элюируют 80%-ным дихлорметаном в гексане) и получают 6-иод-3-(4-метоксифенил)-2-метилпиридин. ЖХМС: рассчитано = 325,00; найдено = 326,06 (М+1)+.
Стадия С
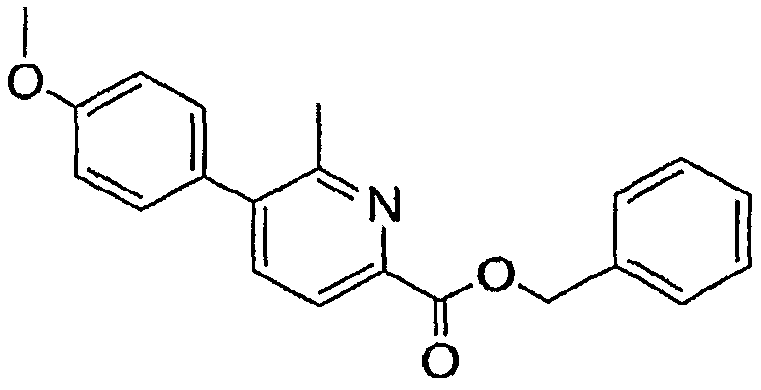
Бензил 5-(4-метоксифенил)-6-метилпиридин-2-карбоксилат
6-Иод-3-(4-метоксифенил)-2-метилпиридин (100 мг, 0,308 ммоль), бис(трифенилфосфин)палладий(II) дихлорид (22 мг, 0,031 ммоль), триэтиламин (46,7 мг, 0,462 ммоль) и бензиловый спирт (1 мл, 9,66 ммоль) смешивают в ацетонитриле (3 мл). Полученную смесь на 18 час помещают в атмосферу монооксида углерода под давлением 45 фунтов на кв. дюйм при температуре 60°С. Полученную реакционную смесь очищают методом препаративной ТСХ на SiO2 (элюируют 25% этилацетата в гексане, а затем 10% триэтиламина, 20% этилацетата в гексане) и получают бензил 5-(4-метоксифенил)-6-метилпиридин-2-карбоксилат. ЖХМС: рассчитано = 333,14; найдено = 334,13 (М+1)+.
Стадия D
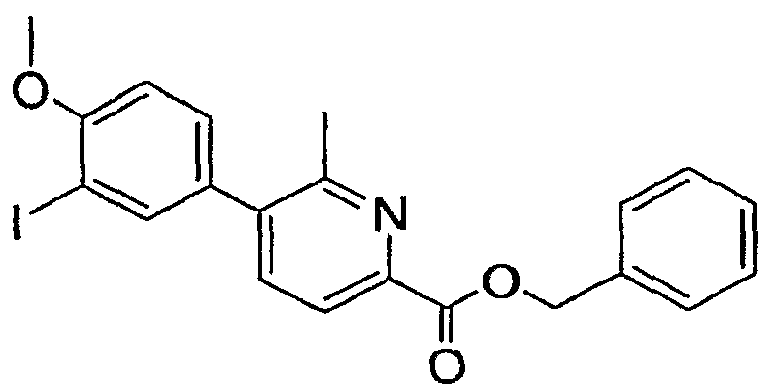
Бензил 5-(3-иод-4-метоксифенил)-6-метилпиридин-2-карбоксилат
Бензил 5-(4-метоксифенил)-6-метилпиридин-2-карбоксилат (150 мг, 0,45 ммоль), иод (228 мг, 0,898 ммоль), сульфат серебра (402 мг, 1,29 ммоль) оставляют перемешиваться в метаноле (3 мл) на ночь при комнатной температуре. Через 25 час в реакционную смесь дополнительно добавляют иод (57 мг, 0,22 ммоль) и сульфат серебра (100 мг, 0,32 ммоль). Через 1,5 час в реакционную смесь добавляют водный раствор NaHSO3 (насыщенный раствор, 20 мл), чтобы прервать реакцию. Реакционную смесь экстрагируют этилацетатом. Экстракты объединяют и сушат над Na2SO4, а затем фильтруют и концентрируют, получая прозрачное масло. Сырое масло очищают методом препаративной ТСХ на SiO2 (элюируют 30% этилацетата в гексане) и получают бензил 5-(3-иод-4-метоксифенил)-6-метилпиридин-2-карбоксилат. ЖХМС: рассчитано = 459,03; найдено = 460,17 (М+1)+.
Стадия Е
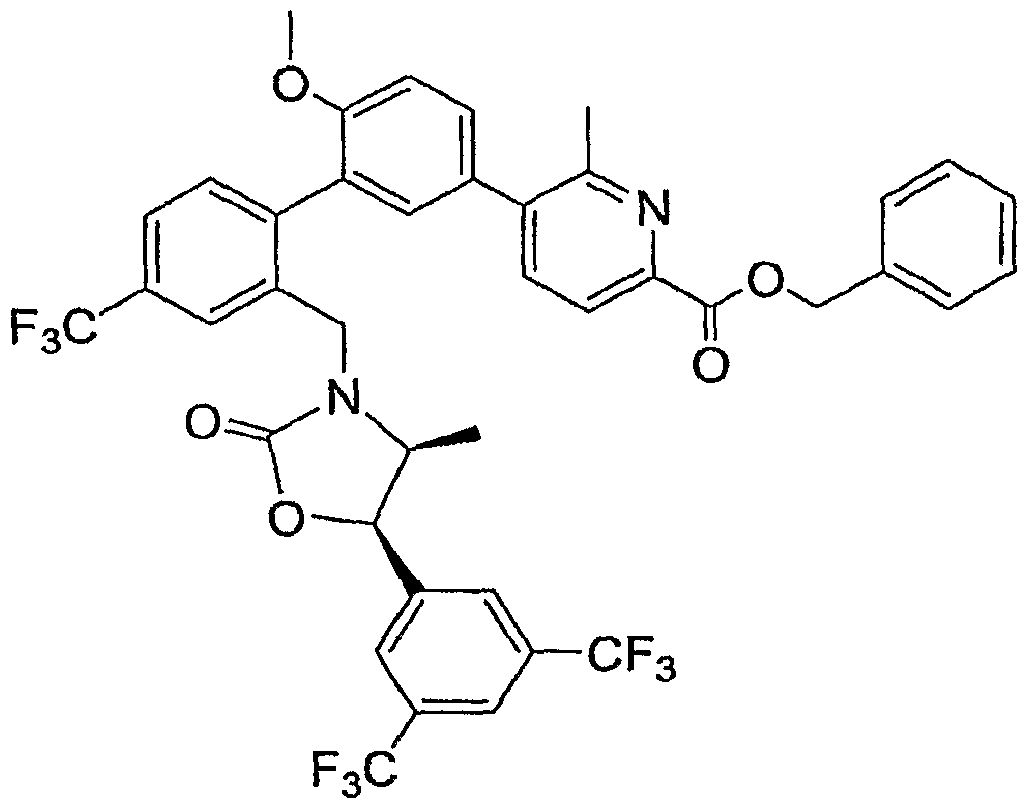
Бензил 5-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-метокси-4'-(трифторметил)бифенил-3-ил]-6-метилпиридин-2-карбоксилат
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)бензил]-1,3-оксазолидин-2-он - метан (385 мг, 0,644 ммоль) (Промежуточное соединение 9), бензил 5-(3-иод-4-метоксифенил)-6-метилпиридин-2-карбоксилат (148 мг, 0,322 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид (71 мг, 0,097 ммоль), водный раствор гидроксида калия (215 мкл, 3 М, 0,645 ммоль) и 1,4-диоксан (2 мл) помещают в трубку. Сосуд продувают азотом и герметизируют. Реакционную смесь подвергают ВЧ нагреву до температуры 120°С в течение 20 мин, а затем до температуры 140°С в течение 30 мин. К реакционной смеси добавляют воду, а затем экстрагируют этилацетатом. Экстракты объединяют и сушат над Na2SO4, а затем фильтруют и концентрируют в вакууме, получая масло темного цвета. Указанное масло очищают методом препаративной ТСХ на SiO2 (элюируют 45% этилацетата в гексане) и получают масло темного цвета. Полученное масло далее очищают препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), осуществляя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об). Соответствующие фракции объединяют и упаривают, получая масло темного цвета. Полученное масло обрабатывают водным раствором бикарбоната натрия (насыщенный раствор), а затем экстрагируют этилацетатом. Экстракты объединяют и сушат над Na2SO4, а затем фильтруют и концентрируют в вакууме, получая масло темного цвета. Это масло все еще содержит щелочные примеси. Полученное масло вновь очищают методом препаративной ТСХ на SiO2 (элюируют 50% этилацетата в гексане) и получают бензил 5-[2'-{[(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-метокси-4'-(трифторметил)бифенил-3-ил]-6-метилпиридин-2-карбоксилат. ЖХМС: рассчитано = 802,21; найдено = 803,21 (М+1)+.
Стадия F: 5-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-метокси-4'-(трифторметил)бифенил-3-ил]-6-метилпиридин-2-карбоновая кислота
Бензил 5-[2'-{[(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-метокси-4'-(трифторметил)бифенил-3-ил]-6-метилпиридин-2-карбоксилат (52 мг, 0,065 ммоль) и палладий/активированный уголь (10% масс.) (25 мг) смешивают в этаноле. Полученную смесь дегазируют и подают Н2 под давлением 45 фунтов на кв. дюйм при комнатной температуре в течение 3 час в аппарате Парра на качалке пока реакция не завершится. Реакционную смесь фильтруют через целит (521). Фильтрат концентрируют в вакууме и получают стеклообразное вещество светло-коричневого цвета. Остаток очищают препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), осуществляя градиентное элюирование в смеси MeCN/Н2О. Соответствующие фракции собирают и объединяют, а затем упаривают, получая содержащий воду остаток. Полученный остаток лиофилизуют и получают 5-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-метокси-4'-(трифторметил)бифенил-3-ил]-6-метилпиридин-2-карбоновую кислоту. ЖХМС: рассчитано = 712,16; найдено = 713,19 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,07 (с, 1H), 7,86 (с, 1Н), 7,77 (с, 1H), 7,71-7,62 (м, 4H), 7,45-7,36 (м, 2H), 7,19-7,07 (м, 2H), 5,55 (д, J=7,0 Гц, 0,55H), 5,42 (д, J=7 Гц, 0,45H), 4,99 (д, J=13 Гц, 0,5H), 4,85 (д, J=12,5 Гц, 0,5H), 4,14 (д, J=13,5 Гц, 0,5H), 3,95 (д, J=13,5 Гц, 0,5H), 3,92-3,80 (м, 4H), 2,61, 2,58 (с, 3H), 0,58 (д, J=5,0 Гц, 1,35H), 0,49 (д, J=5,5 Гц, 1,65H).
ПРИМЕР 40
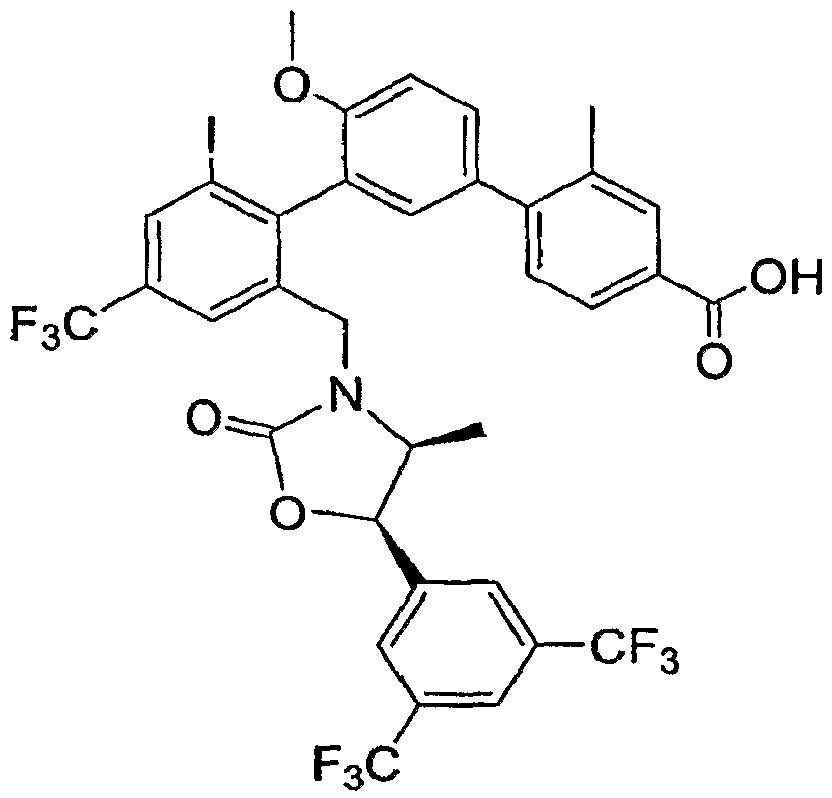
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6"-иод-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Стадия А
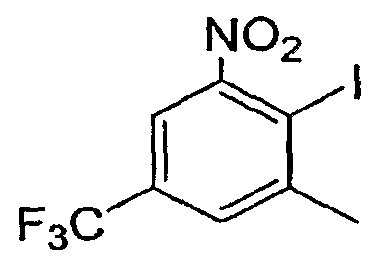
2-Метил-4-трифторметиланилин
Смесь 2-иод-4-трифторметиланилина (5,0 г, 17,42 ммоль), триметилбороксана (3,64 мл, 26,1 ммоль), тетракис(трифенилфосфин)палладия (1,0 г, 0,87 ммоль) и карбоната калия (4,82 г, 34,8) в ДМФА (10 мл) нагревают до 100°С в течение 48 час. Реакцию прерывают, добавив воду (50 мл), и экстрагируют с помощью EtOAc (3×50 мл). Слои EtOAc объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя EtOAc:гексан/1:9 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,13 (с, 1Н), 7,30 (д, J=8 Гц, 1H), 6,71 (д, J=8 Гц, 1H), 3,98 (шир. с,2H), 2,21 (с, 3H).
Стадия В: 2-метил-4-трифторметилфенил иодид
К раствору 2-метил-4-трифторметиланилина (Стадия А) (2,2 г, 12,6 ммоль) в хлороформе (20 мл) при комнатной температуре добавляют п-пентилнитрит (2,2 г, 18,9 ммоль) и иод (6,38 г, 25,1 ммоль). Смесь кипятят с обратным холодильником в течение 1 час. Разбавляют смесь метиленхлоридом (50 мл). Полученный раствор промывают насыщенным водным раствором тиосульфата натрия, насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя гексан в качестве элюента.
Стадия С: 2-метил-4-трифторметил-6-нитрофенил иодид
Смесь 1:1 H2SO4/HNO3 (20 мл) при 0°С добавляют к 2-метил-4-трифторметилфенил иодиду. Смесь перемешивают при 0°С, а затем оставляют на ночь нагреваться до комнатной температуры. Анализ методом ЖХ/МС показывает отсутствие исходных веществ. Смесь разбавляют водой и экстрагируют с помощью EtOAc (3×50 мл). Слои EtOAc объединяют, промывают раствором бикарбоната натрия и насыщенным раствором соли, а затем сушат над сульфатом натрия. Указанное в названии соединение получают после удаления растворителя. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,71 (с, 1H), 7,69 (с, 1H), 2,68 (с, 3H).
Стадия D
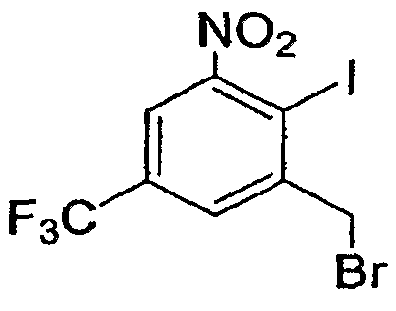
1-(Бромметил)-2-иод-3-нитро-5-(трифторметил)бензол
Смесь соединения, указанного в названии на Стадии С (0,38 г, 1,15 ммоль), NBS (0,24 г, 1,38 ммоль) и каталитическое количество AIBN в тетрахлориде углерода (5 мл) кипятят с обратным холодильником в течение 3 дней. В течение указанного периода ежедневно добавляют дополнительное количество AIBN. Смесь охлаждают и концентрируют. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя гексан в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,91 (с, 1H), 7,80 (с, 1H), 4,75 (с, 2H).
Стадия Е
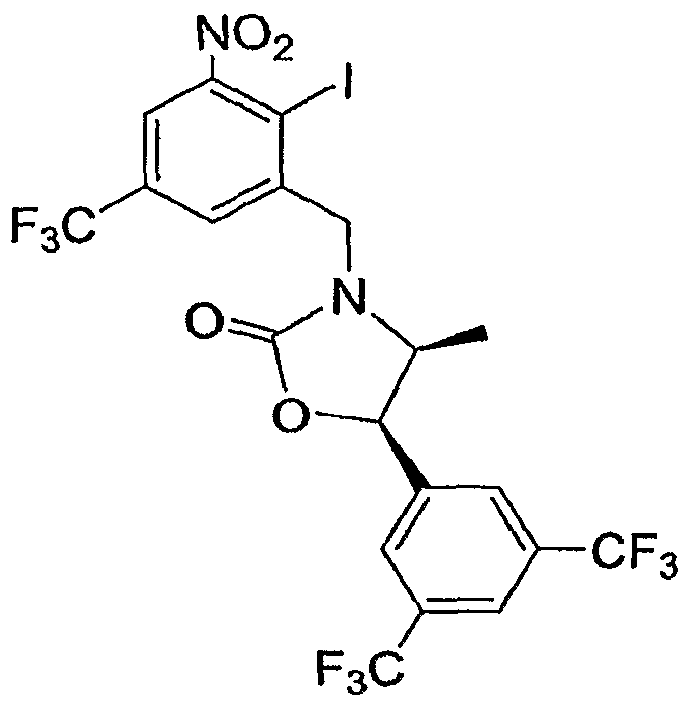
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-[2-иод-3-нитро-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он
К раствору (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-она (0,14 г, 0,44 ммоль) в ТГФ (3 мл) при 0°С добавляют NaH (21 мг, 0,53 ммоль,60%). Смесь перемешивают при 0°С в течение 30 мин. Добавляют раствор соединения, указанного в названии на Стадии D (0,15 г, 0,37 ммоль), в ТГФ (1 мл). Смесь оставляют на ночь перемешиваться при комнатной температуре. Реакцию прерывают, добавив насыщенный водный раствор хлорида аммония (5 мл) и экстрагируют с помощью EtOAc (3×15 мл). Слои EtOAc объединяют, промывают насыщенным раствором соли и затем сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя EtOAc:гексан/15:85 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,95 (с, 1H), 7,87(д, J=1,5 Гц, 1H), 7,83 (с, 2H), 7,79 (д, J=1,5 Гц, 1H), 5,83 (д, J=8 Гц, 1Н), 4,95 (д, J=16,5 Гц, 1H), 4,53 (д, J=16,5 Гц, 1Н), 4,19 (м, 1H), 0,87 (д, J=6,5 Гц, 3H).
Стадия F
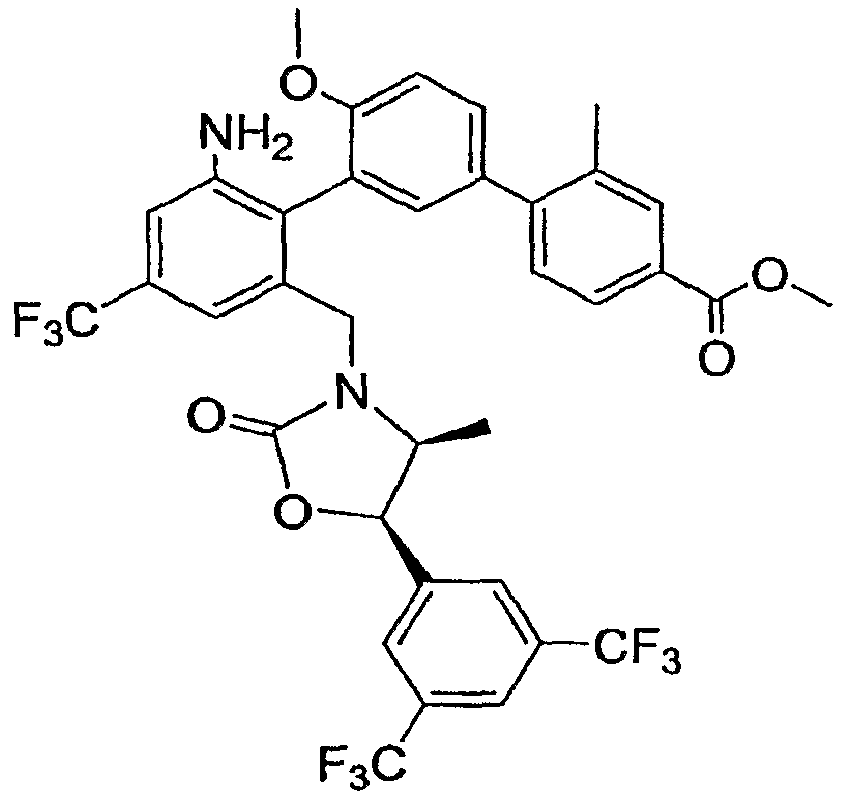
Метил 2"-амино-6"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
К раствору соединения, указанного в названии на Стадии Е (0,17 г, 0,26 ммоль), в EtOH (5 мл), добавляют дигидрат хлорид олова (0,30 г, 1,32 ммоль). Смесь перемешивают при комнатной температуре в течение 4 час. Анализ методом ЖХ-МС показывает полное расходование исходных веществ. EtOH удаляют. К остатку добавляют EtOAc (20 мл). Смесь промывают водой, насыщенным раствором соли и сушат над сульфатом натрия. После удаления растворителя получают твердое вещество белого цвета, которое смешивают с метил 4'-метокси-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилатом (Промежуточное соединение 11, избыток), тетракис(трифенилфосфин)палладием (5%мол.) и карбонатом натрия (0,062 г, 0,58 ммоль) в 7 мл смеси вода/EtOH/толуол (1:2:4) и кипятят с обратным холодильником в течение 2 час. Анализ методом ТСХ (EtOAc:гексан/1:3) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×20 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после очистки методом препаративной ТСХ, используя 20% EtOAc в гексане в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 2:1: атропоизомеров 7,96 (м, 1H), 7,88 (м, 2H), 7,73 (с, 0,66H), 7,66 (с, 0,33H), 7,44 (м, 1Н), 7,28 (м, 2H), 7,16 (м, 2H), 7,02-7,07 (м, 2H), 5,59 (д, J=8 Гц, 0,66H), 5,42 (д, J=8 Гц, 0,33H), 4,80 (д, J=12 Гц, 0,33H), 4,77 (д, J=12 Гц, 0,66H), 3,95 (с, 3H), 3,94 (м, 1Н), 3,90 (с, 2H), 3,87 (с, 1H), 3,82 (д, J=12 Гц, 1H), 2,38 (с, 1H), 2,37 (с, 2H), 0,59 (д, J=6,5 Гц, 1Н), 0,54 (д, J=6,5 Гц, 2H).
Стадия G
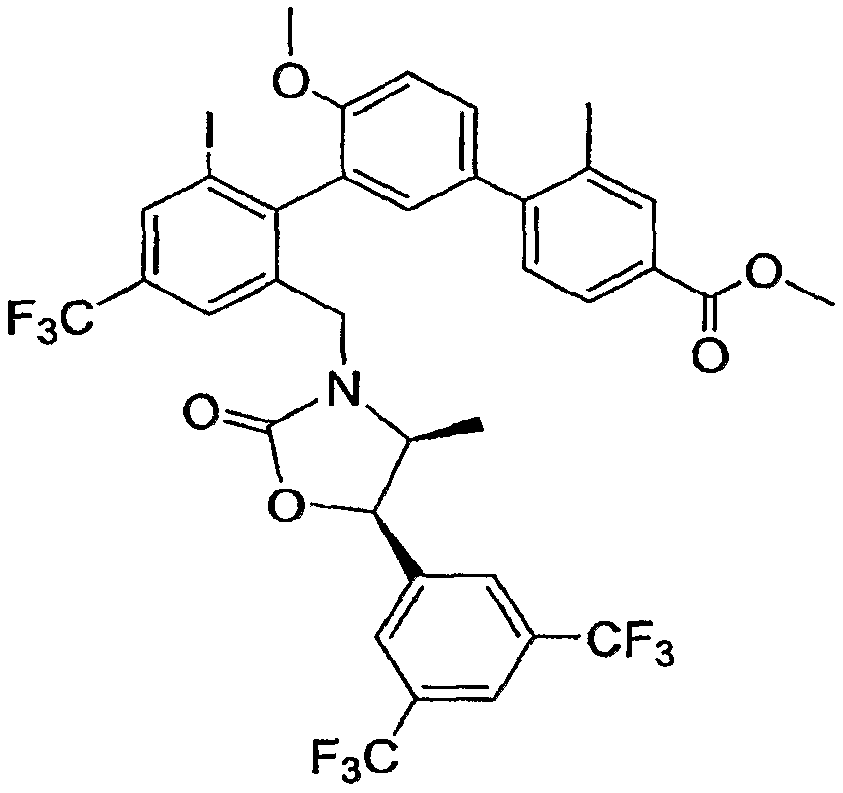
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6"-иод-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
К раствору соединения, указанного в названии на Стадии F (0,10 г, 0,135 ммоль), в хлороформе (5 мл) при комнатной температуре добавляют п-пентилнитрит (0,024 г, 0,20 ммоль) и иод (0,044 г, 0,17 ммоль). Смесь кипятят с обратным холодильником в течение 1 час. Разбавляют смесь метиленхлоридом (10 мл). Полученный раствор промывают насыщенным водным раствором тиосульфата натрия, насыщенным раствором соли и сушат над сульфатом натрия. Остаток очищают препаративной ВЭЖХ с обращенной фазой и получают указанное в названии соединение. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 2:1: атропоизомеров 8,21 (с, 1Н), 7,97 (с, 1Н), 7,88 (с, 2H), 7,72 (с, 1H), 7,76 (м, 1H), 7,44 (м, 1Н), 7,29 (м, 1Н), 7,20 (м, 1H), 7,12 (м, 1H), 7,00 (м, 1H), 5,59 (д, J=8 Гц, 0,66H), 5,53 (д, J=8 Гц, 0,33H), 4,80 (д, J=16 Гц, 1Н), 3,96 (д, J=15,5 Гц, 1H), 3,95 (с, 3H), 3,90 (м, 1H), 3,89 (с, 2H), 3,86 (с, 1H), 2,04 (с, 1Н), 2,38 (с, 2H), 0,60 (д, J=6,5 Гц, 1H), 0,54 (д, J=6,5 Гц, 2H). ЖХ-МС (М+1): 852,1.
Стадия Н: 2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6"-иод-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
К раствору соединения, указанного в названии на Стадии G (0,016 г, 0,0188 ммоль), в диоксане (2 мл) при комнатной температуре добавляют водный раствор LiOH·Н2О (0,007 г, 0,16 ммоль). Смесь перемешивают при комнатной температуре в течение 5 час. Анализ методом ТСХ (EtOAc:гексан/2:8) показывает отсутствие исходных веществ. Растворитель удаляют. Добавляют 1N раствор HCl (1 мл). Смесь экстрагируют с помощью EtOAc (3×15 мл). Слои EtOAc объединяют и сушат над сульфатом натрия. Указанное в названии соединение получают после препаративной ВЭЖХ с обращенной фазой. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 2:1: атропоизомеров 8,21 (с, 1Н), 8,01 (с, 1H), 7,94 (д, J=7,5 Гц, 1H), 7,89 (с, 1H), 7,72 (с, 1H), 7,69 (с, 1H), 7,66 (д, J=7,5 Гц, 1H), 7,45 (м, 1Н), 7,37 (м, 1Н), 7,14 (м, 1H), 7,00 (м, 1H), 5,60 (д, J=8 Гц, 0,66H), 5,54 (д, J=8 Гц, 0,33H), 4,82 (д, J=7,5 Гц, 0,33H), 4,79 (д, J=8 Гц, 0,66H), 3,99 (д, J=10 Гц, O,33H), 3,96 (д, J=9,5 Гц, 0,66H), 3,91 (м, 1H), 3,90 (с, 2H), 3,86 (с, 1H), 2,42 (с, 1H), 2,41 (с, 2H), 0,60 (д, J=7 Гц, 1H), 0,55 (д, J=6,5 Гц, 2H).
ПРИМЕР 41
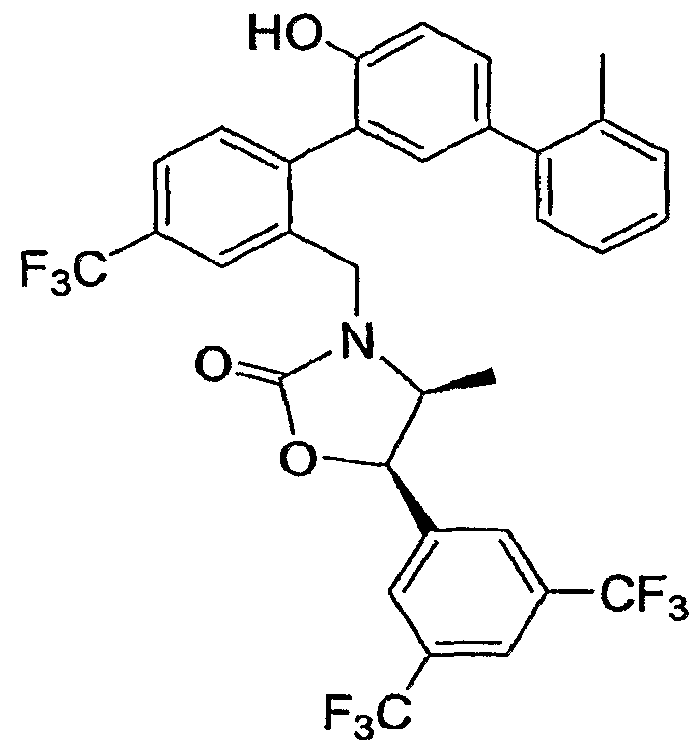
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[6'-гидрокси-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
К охлажденному раствору (на бане с температурой -78°С) (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[6'-метокси-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-она (75 мг, 0,11 ммоль) в дихлорметане (1 мл) добавляют трибромид бора (106,6 мг, 0,426 ммоль). Полученную смесь перемешивают при охлаждении (на бане с температурой -78°С) в течение 1 час, а затем оставляют на ночь нагреваться до комнатной температуры. Реакцию прерывают, добавив лед, а затем экстрагируют дихлорметаном. Экстракты объединяют, промывают насыщенным раствором соли и сушат над Na2SO4. Полученную смесь фильтруют и концентрируют. Остаток очищают методом препаративной ТСХ на SiO2 (элюируют 30% раствором этилацетата в гексане) и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[6'-гидрокси-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он. ЖХМС: рассчитано = 653,16; найдено = 654,19 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,87-7,84 (м, 1Н), 7,76 (с, 0,5H), 7,72-7,65 (м, 2,5H), 7,63 (с, 1H), 7,53-7,47 (м, 1Н), 7,33-7,23 (м, 3H), 7,23-7,16 (м, 2H), 7,12 (дд, J=10,5, 2,5 Гц, 1H), 7,04 (д, J=8,0 Гц, 0,5H), 7,02 (д, J=8,5 Гц, 0,5H), 5,64 (д, J=8,0 Гц, 0,5H), 5,32 (д, J=7,5 Гц, 0,5H), 4,98, 4,92 (д, J=16Гц, 1H), 4,23 (д, J=15,5 Гц, 0,5H), 4,07 (д, J=15,5 Гц, 0,5H), 3,89-3,82 (м, 0,5H), 3,74-3,67 (м, 0,5H), 2,32, 2,28 (с, 3H), 0,58 (д, J=7 Гц, 1,5H), 0,49 (д, J=6,5 Гц, 1,5H).
ПРИМЕР 42
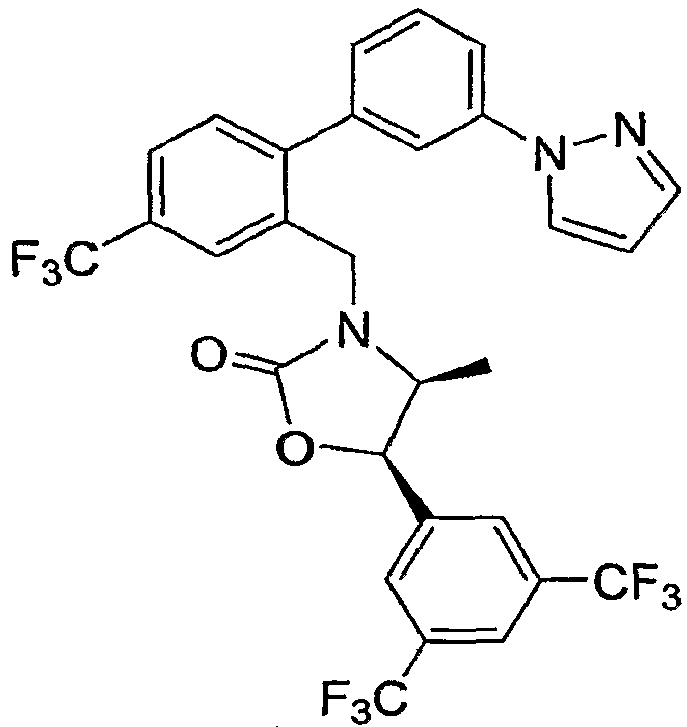
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-3-{[3'-(1Н-пиразол-1-ил)-4-(трифторметил)бифенил-2-ил]метил}-1,3-оксазолидин-2-он
Смесь (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (0,05 г, 0,084 ммоль), 3-(1Н-пиразол-1-ил)фенилбороновой кислоты (0,031 г, 0,167 ммоль), тетракис(трифенилфосфин)палладия (5%мол.) и карбоната натрия (0,019 г, 0,18 ммоль) в 7 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 4 час. Анализ методом ТСХ (EtOAc:гексан/1:1) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×10 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после очистки методом колоночной флэш-хроматографии, используя EtOAc:гексан/1:1 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,02 (д, J=2,5 Гц, 1H), 7,88 (с, 1H), 7,84 (с, 1H), 7,77 (с, 1Н), 7,76 (с, 1H), 7,75 (с, 2H), 7,73 (м, 1Н), 7,71 (м, 1H), 7,61 (т, J=7,5 Гц, 1Н), 7,53 (д, J=7,5 Гц, 1H), 7,26 (м, 1H), 6,54 (т, J=2 Гц, 1H), 5,55 (д, J=7,5 Гц, 1H), 5,02 (д, J=16 Гц, 1H), 4,21 (д,=16 Гц, 1H), 3,82 (м, 1Н), 0,54 (д, J=6,5 Гц, 3H).
ЖХ-МС (М+1): 614,3.
ПРИМЕР 43
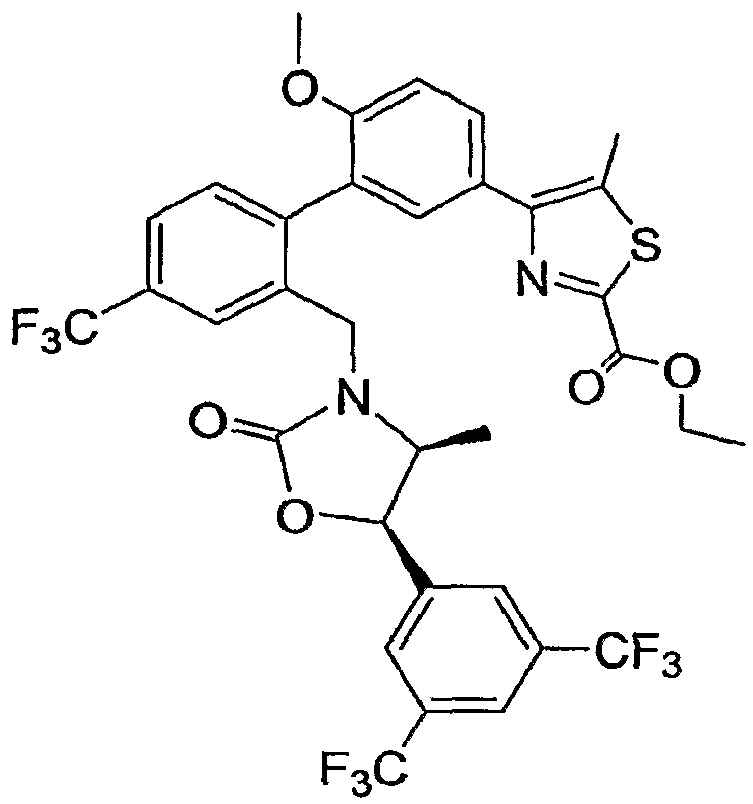
Этил 4-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-метокси-4'-(трифторметил)бифенил-3-ил]-5-метил-1,3-тиазол-2-карбоксилат
Стадия А
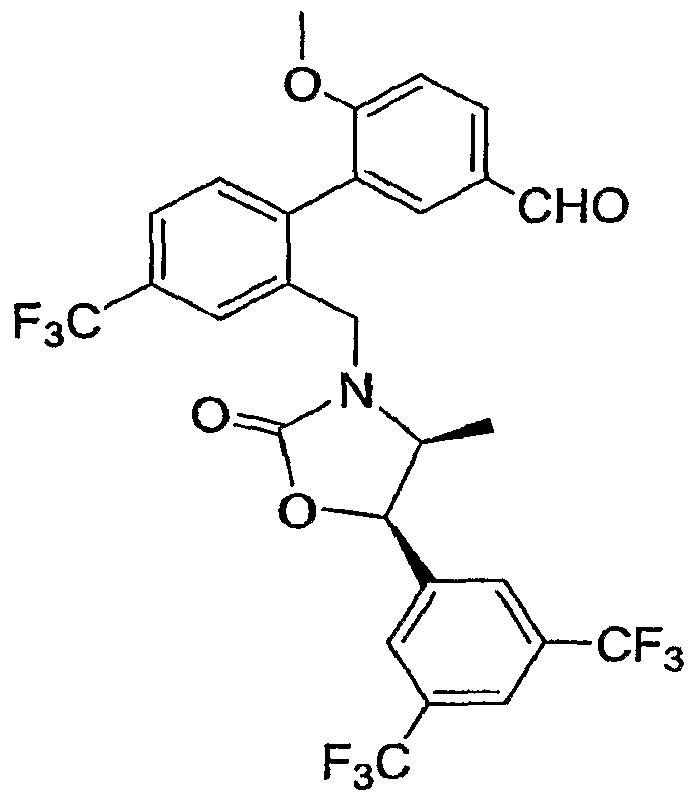
2'-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-метокси-4'-(трифторметил)бифенил-3-карбальдегид
Смесь (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (0,50 г, 0,84 ммоль), 5-формил-2-метоксифенилбороновой кислоты (0,22 г, 1,25 ммоль), тетракис(трифенилфосфин)палладия (48 мг, 5%мол.) и карбоната натрия (0,19 г, 1,84 ммоль) в 20 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 4 час. Анализ методом ТСХ (CH2Cl2:гексан/1:1) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (30 мл). Органические вещества экстрагируют метиленхлоридом (3×40 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя EtOAc:гексан/3:7 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 9,95 (с, 1H), 7,62-7,98 (м, 6H), 7,42 (м, 1H), 7,17 (м, 2H), 5,65 (д, J=8 Гц, 0,5H), 5,20 (д, J=8 Гц, 0,5H), 4,96 (д, J=15,5 Гц, 0,5H), 4,92 (д, J=16,5 Гц, 0,5H), 3,85-4,10 (м, 2H), 3,98 (с, 1,5H), 3,92 (с, 1,5H), 0,59 (д, J=6,5 Гц, 1,5H), 0,42 (д, J=6 Гц, 1,5H).
Стадия В
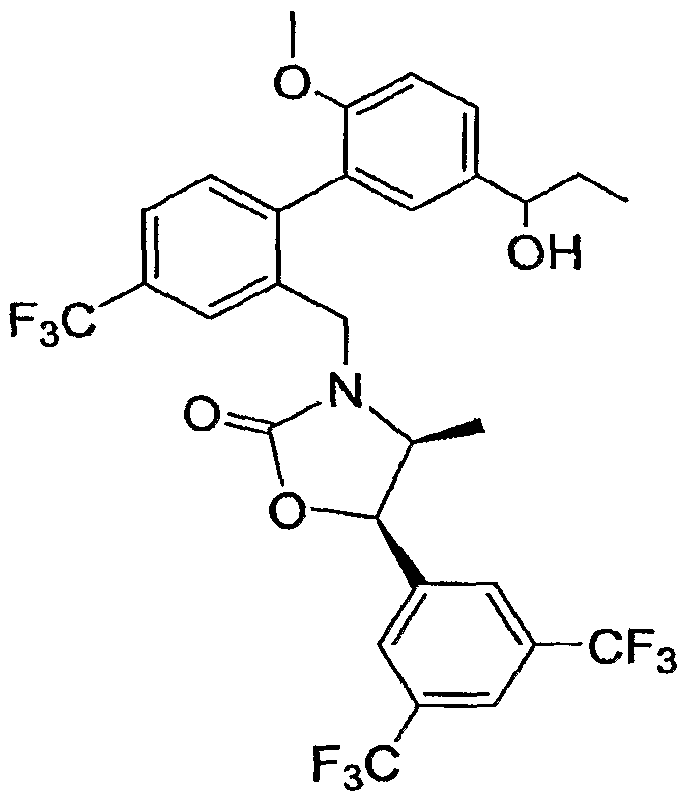
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[5'-(1-гидроксипропил)-2'-метокси-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
К раствору соединения, указанного в названии на Стадии А (0,44 г, 0,73 ммоль), в ТГФ при 0°С добавляют EtMgBr (0,87 мл, 0,87 ммоль,1 М в ТГФ). Раствор перемешивают при 0°С в течение 2 час. Реакцию прерывают с помощью насыщенного водного раствора хлорида аммония (10 мл). Органические вещества экстрагируют с помощью EtOAc (3×15 мл). Слои EtOAc объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя EtOAc:гексан/1:1 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь атропоизомеров и диастереомеров 7,86 (с, 1H), 7,61-7,71 (м, 4H), 7,18-7,47 (м, 4H), 6,99 (м, 1H), 5,28-5,49 (м, 1H), 4,92-5,07 (м, 1H), 4,61 (м, 1H), 3,92-4,14 (м, 1H), 3,97 (м, 3H), 3,66-3,79 (м, 1Н), 1,80 (м„ 2H), 0,98 (м, 3H), 0,50-0,60 (м, 3H).
Стадия С
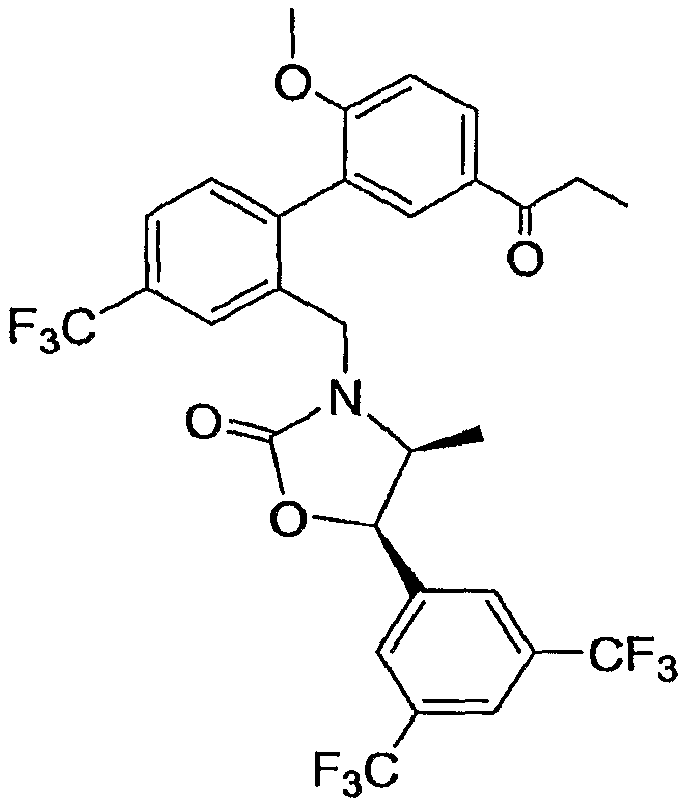
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[2'-метокси-5'-пропионил-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
К раствору соединения, указанного в названии на Стадии В (0,32 г, 0,50 ммоль), в метиленхлориде (10 мл) при комнатной температуре добавляют периодинан Десса-Мартина (0,28 г, 0,50 ммоль). Смесь перемешивают при комнатной температуре в течение 4 час. Анализ методом ТСХ (EtOAc:гексан/2:8) показывает, что реакция закончена. Смесь фильтруют и фильтрат упаривают. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя EtOAc:гексан/2:8 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1 атропоизомеров 8,06 (м, 1H), 7,86 (м, 2H), 7,62-7,75 (м, 4H), 7,40 (м, 1H), 7,07 (м, 1H), 5,65 (д, J=8 Гц, 0,5H), 5,20 (д, J=8 Гц, 0,5H), 4,97 (д, J=15 Гц, 0,5H), 4,90 (д, J=15,5 Гц, 0,5H), 4,09 (д, J=15 Гц, 0,5H), 3,94 (с, 1,5H), 3,90 (с, 1,5H), 3,84 (д, J=15,5 Гц, 0,5H), 3,70-3,82 (м, 1H), 3,00 (м, 2H), 1,22 (м, 3H), 0,59 (д, J=7 Гц, 1,5H), 0,41 (д, J=6,5 Гц, 1,5H).
Стадия D
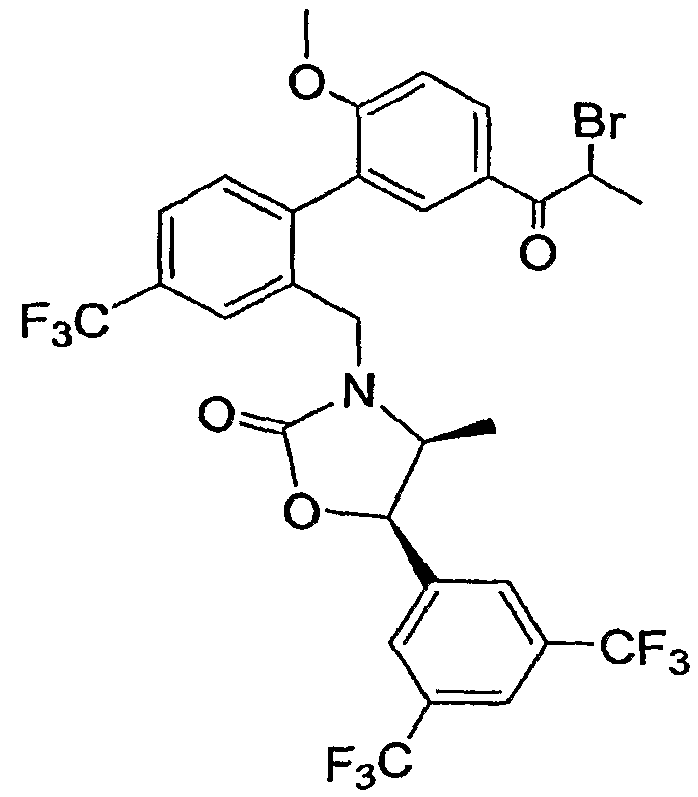
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[5'-(2-бромпропаноил)-2'-метокси-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
К раствору соединения, указанного в названии на Стадии С (0,28 г, 0,44 ммоль), в смеси 1:1 МеОН/CH2Cl2 (5 мл) при комнатной температуре добавляют тетрабутиламмоний трибромид (0,28 г, 0,57 ммоль). Смесь перемешивают при комнатной температуре в течение 24 час. Добавляют воду. Смесь экстрагируют с помощью EtOAc (3×15 мл). Слои EtOAc объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя EtOAc:гексан/2:8 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь атропоизомеров и диастереомеров 8,10-8,18 (м, 1H), 7,85-7,98 (м, 2H), 7,62-7,77 (м, 4H), 7,39-7,46 (м, 1H), 7,08-7,12 (м, 1H), 4,88-5,65 (м, 3H), 4,06-4,12 (м, 1H), 3,90 (м, 3H), 3,65-3,86 (м, 2H), 1,90 (м, 3H), 0,37-0,59 (м, 3H).
Стадия Е: этил 4-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-метокси-4'-(трифторметил)бифенил-3-ил]-5-метил-1,3-тиазол-2-карбоксилат
Смесь соединения, указанного в названии на Стадии D Примера 67 (0,040 г, 0,056 ммоль), и этил тиооксамата (11 мг, 0,084 ммоль) в EtOH (2 мл) кипятят с обратным холодильником в течение ночи. Реакционную смесь концентрируют. Указанное в названии соединение получают после препаративной ТСХ на пластинах, используя EtOAc:гексан/3:7 в качестве элюента. ЖХ-МС (М+1): 747,2.
ПРИМЕР 44
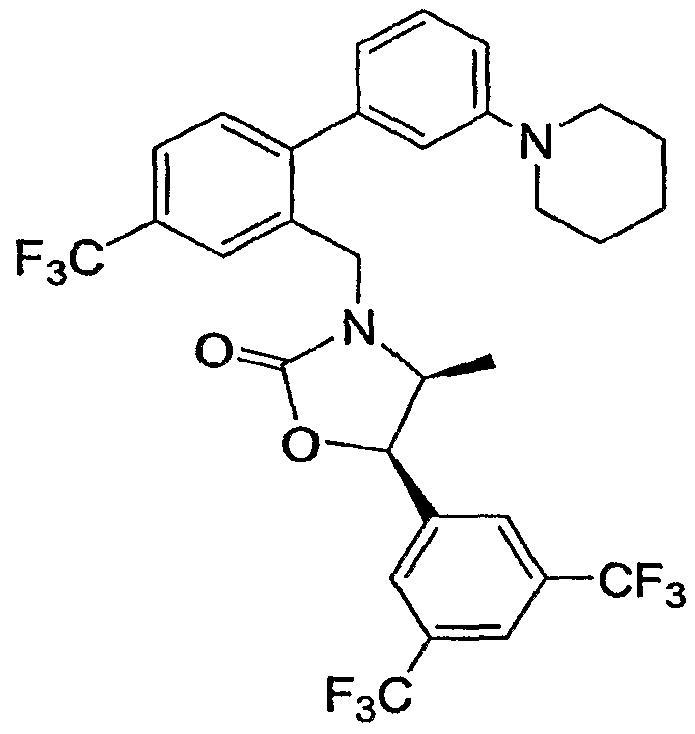
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[2'-метокси-5'-пиперидин-1-ил-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Смесь (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (0,05 г, 0,084 ммоль), 3-(пиперидино)фенилбороновой кислоты (0,040 г, 0,167 ммоль), тетракис(трифенилфосфин)палладия (5%мол.) и карбоната натрия (0,019 г, 0,18 ммоль) в 7 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 4 час. Анализ методом ТСХ (EtOAc:гексан/1:1) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×10 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя EtOAc:гексан/6:4 в качестве элюента. ЖХ-МС (М+1): 631,1.
ПРИМЕР 45
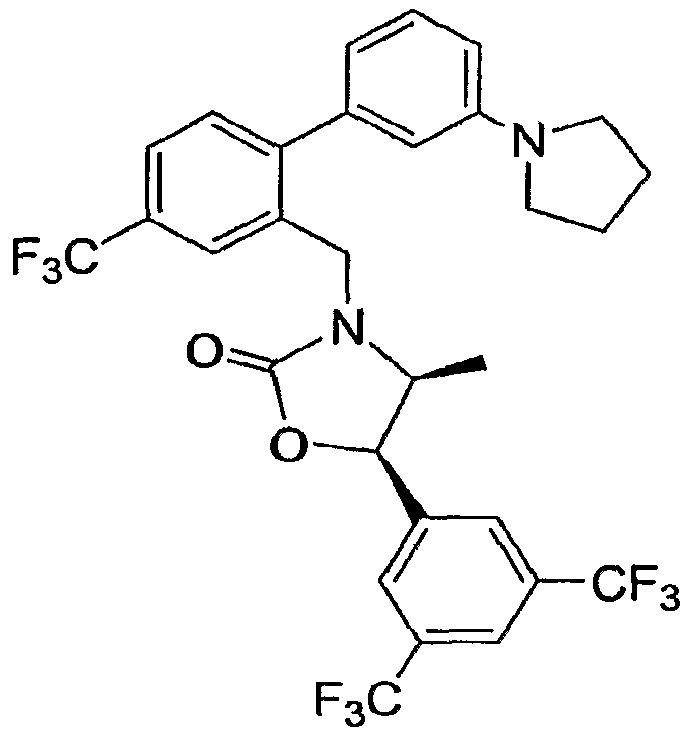
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-3-{[3'-пирролидин-1-ил-4-(трифторметил)бифенил-2-ил]метил}-1,3-оксазолидин-2-он
Смесь (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (0,05 г, 0,084 ммоль), 3-(пирролидино)фенилбороновой кислоты (0,032 г, 0,167 ммоль), тетракис(трифенилфосфин)палладия (5%мол.) и карбоната натрия (0,019 г, 0,18 ммоль) в 7 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 4 час. Анализ методом ТСХ (EtOAc:гексан/1:1) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×10 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя EtOAc:гексан/6:4 в качестве элюента. ЖХ-МС (М+1): 617,0.
ПРИМЕР 46
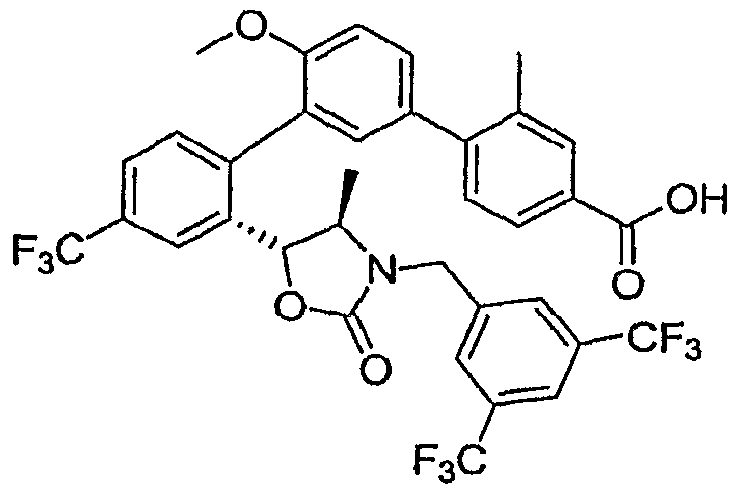
2"-({(4R,5R)-3-[3,5-Бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Стадия А
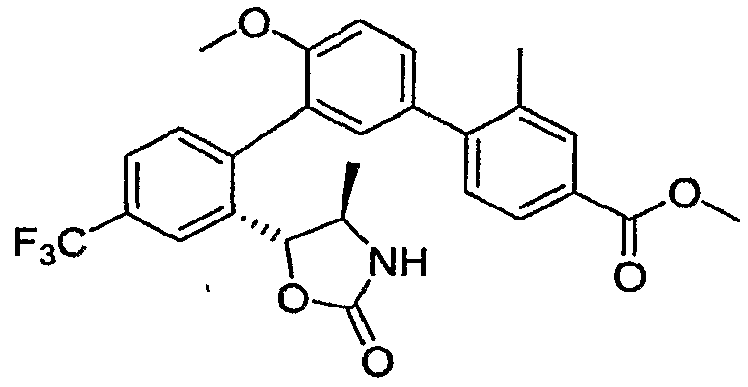
Метил 4'-метокси-2-метил-2"-[(4R,5R)-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
(4R,5R)-5-[2-Иод-5-(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он (Промежуточное соединение 12, 100 мг, 0,269 ммоль), метил 4'-метокси-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилат (Промежуточное соединение 11, 124 мг, 0,323 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (44 мг, 0,054 ммоль), водный раствор карбоната калия (270 мкл, 2 М, 0,538 ммоль) и 1,4-диоксан (2 мл) герметично закрывают в сосуде для ВЧ нагрева. Сосуд нагревают в микроволновой печи до температуры 140°С в течение 30 мин. Анализ аликвоты, взятой из реакционной смеси, методом ЖХМС показывает полное расходование исходного иодида. Сырую смесь очищают на SiO2 (препаративная ТСХ на пластинах, 50% этилацетата в гексане) и получают стеклообразное вещество. Остаток дополнительно очищают на SiO2 (препаративная ТСХ на пластинах, 10% этилацетата в дихлорметане) и получают метил 4'-метокси-2-метил-2"-[(4R,5R)-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат. ЖХМС: рассчитано = 499,16; найдено = 500,08 (М+1).
Стадия В
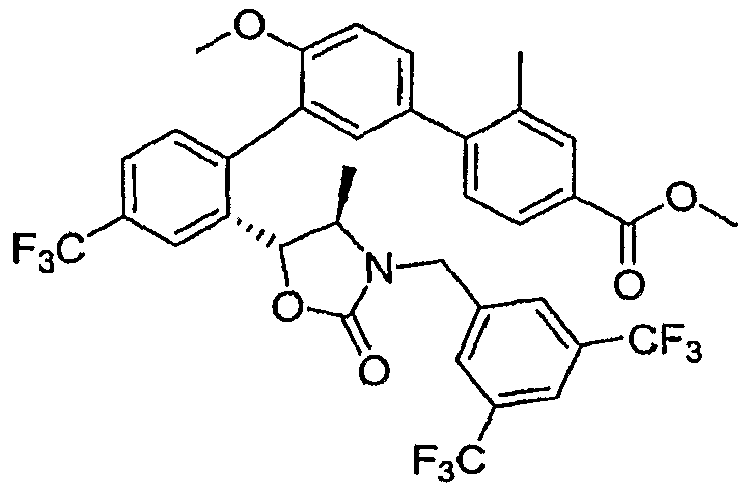
Метил 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Исходный метил 4'-метокси-2-метил-2"-[(4R,5R)-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат (40 мг, 0,080 ммоль) растворяют в безводном ТГФ (1 мл) и охлаждают на бане со льдом. К смеси добавляют гидрид натрия (60% масс. в минеральном масле, 3,5 мг, 0,088 ммоль). Реакционную смесь при охлаждении (на бане со льдом) перемешивают в течение 10 мин, а затем добавляют 1-(бромметил)-3,5-бис(трифторметил)бензол (22 мкл, 36,8 мг, 0,120 ммоль). Полученную смесь при охлаждении перемешивают в течение 20 мин, а затем баню убирают. Анализ методом ЖХМС аликвоты, взятой из реакционной смеси через 2,5 час, указывает степень конверсии около 50%. Реакционную смесь охлаждают (на бане со льдом) и прерывают реакцию с помощью NH4Cl (насыщенный водный раствор). Полученную двухфазную смесь экстрагируют этилацетатом. Органические экстракты объединяют и сушат над Na2SO4, фильтруют и концентрируют, получая масло. Указанное масло очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), осуществляя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.). Соответствующие фракции объединяют и упаривают, получая метил 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат. Выделяют также непрореагировавшие исходные вещества. ЖХМС: рассчитано = 725,18; найдено = 726,19 (М+1).
Стадия С
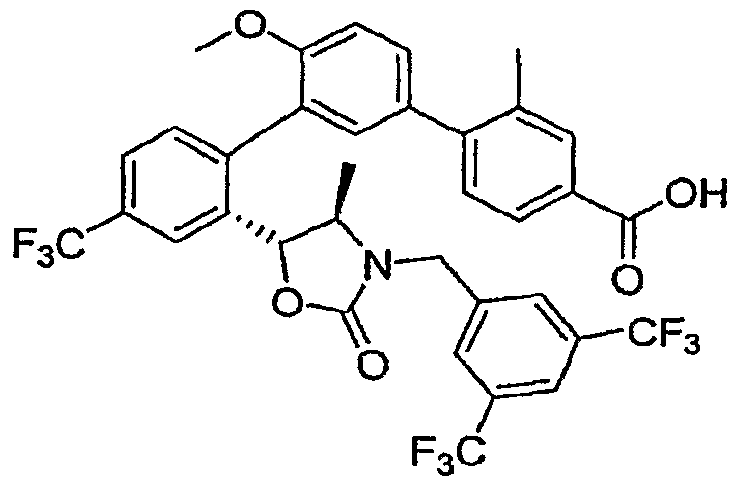
2"-{(4R,5R)-3-[3,5-Бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Метил 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат (21 мг, 0,029 ммоль), моногидрат гидроксида лития (9 мг, 0,21 ммоль), воду (0,4 мл) и 1,4-диоксан (1 мл) перемешивают при температуре 20°С в течение 2 час для завершения гидролиза. Реакционную смесь подкисляют с помощью HCl (водный раствор, 1 мл). Полученную смесь экстрагируют этилацетатом. Органические экстракты объединяют и сушат над Na2SO4, фильтруют и концентрируют, получая прозрачное масло. Указанное масло очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), осуществляя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.). Соответствующие фракции объединяют и упаривают, получая 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС: рассчитано = 711,17; найдено = 712,28 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,01 (с, 0,4H), 7,97 (с, 0,6H), 7,95 (д, J=7,0 Гц, 0,4H), 7,93 (д, J=6,5 Гц, 0,6H), 7,81 (с, 0,4H), 7,77 (с, 0,6H), 7,75 (с, 0,4H), 7,71 (с, 0,6H), 7,68 (д, J=6,5 Гц, 0,6H), 7,66 (д, J=6,5 Гц, 0,4H), 7,62 (с, 1Н), 7,55 (с, 1H), 7,41-7,35 (м, 2H), 7,32 (д, J=6,5 Гц, 0,4H), 7,23 (д, J=6,5 Гц, 0,6H), 7,16 (д, J=2 Гц, 0,4H), 7,08 (д, J=7,5 Гц, 0,6H), 7,02 (д, J=7,5 Гц, 0,4H), 6,98 (д, J=2,0 Гц, 0,6H), 5,22 (д, J=4 Гц, 0,6H), 5,13 (д, J=4,5 Гц, 0,4H), 4,82,4,75 (д, J=13,5 Гц, 1H), 4,29,4,26 (д, J=15,5 Гц, 1H), 3,86 (с, 1,8H), 3,59 (с, 1,2H), 3,53-3,48 (м, 0,4H), 3,30-3,24 (м, 0,6Н), 2,36, 2,22 (с, 3H), 0,89, 0,75 (д, J=5,5 Гц, 3H).
ПРИМЕР 47
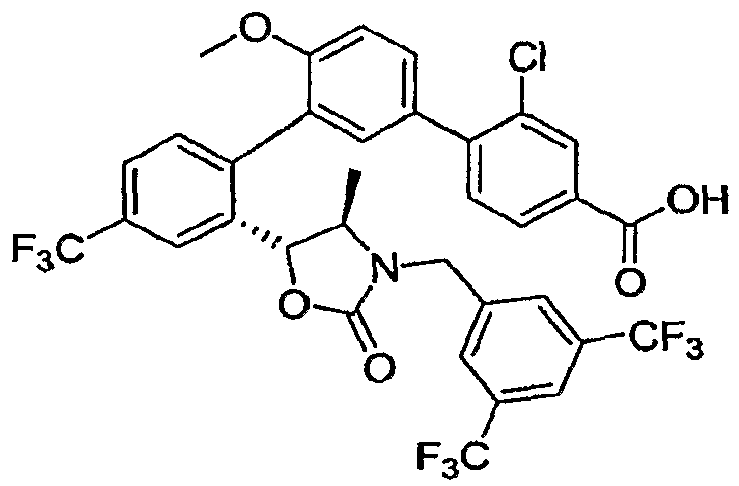
Стадия А
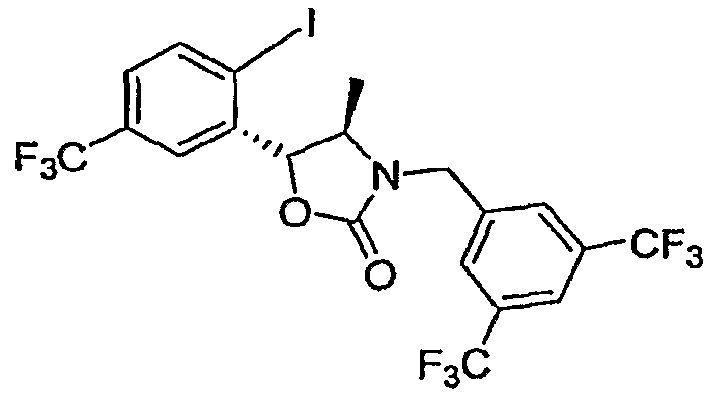
(4R,5R)-3-[3,5-Бис(трифторметил)бензил]-5-[2-иод-5-(трифтор-метил)фенил]-4-метил-1,3-оксазолидин-2-он
(4R,5R)-5-[2-Иод-5-(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он (Промежуточное соединение 12, 1,451 г, 3,910 ммоль) растворяют в безводном ТГФ (30 мл) и охлаждают на бане со льдом. В один прием в реакционную смесь добавляют гидрид натрия (60% масс. в минеральном масле, 172 мг, 4,301 ммоль). Реакционную смесь при охлаждении (на бане со льдом) перемешивают в течение 30 мин, а затем добавляют 1-(бромметил)-3,5-бис(трифторметил)бензол (1,078 мл, 1,80 мг, 5,865 ммоль). По прошествии 5 час реакционную смесь охлаждают (на бане со льдом) и прерывают реакцию, добавляя NH4Cl (насыщенный водный раствор). Реакционную смесь экстрагируют этилацетатом. Органические экстракты объединяют и сушат над Na2SO4, фильтруют и концентрируют, получая масло. Указанное масло очищают флэш-хроматографией (SiO2, картридж Biotage 40+M, EtOAc:гексан) и получают (4R,5R)-3-[3,5-бис(трифторметил)бензил]-5-[2-иод-5-(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он. ЖХМС: рассчитано = 596,98; найдено = 598,05 (М+1)+. Выделяют также 132,6 мг исходного вещества.
Стадия В
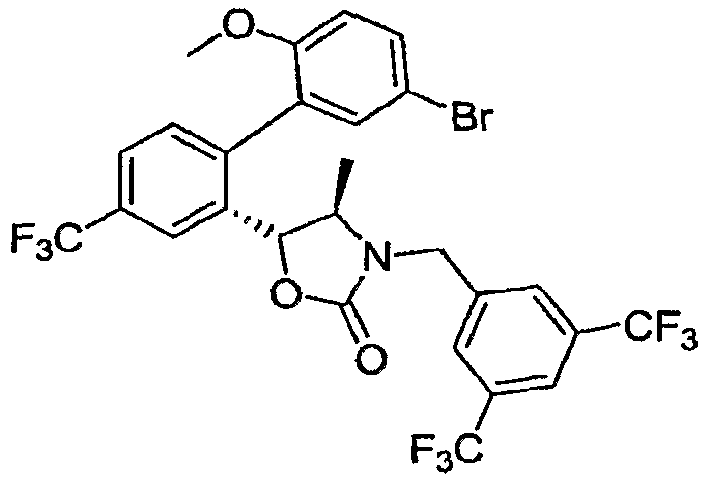
(4R,5R)-3-[3,5-Бис(трифторметил)бензил]-5-[5'-бром-2'-метокси-4-(трифторметил)бифенил-2-ил]-4-метил-1,3-оксазолидин-2-он
(4R,5R)-3-[3,5-Бис(трифторметил)бензил]-5-[2-иод-5-(трифтор-метил)фенил]-4-метил-1,3-оксазолидин-2-он (500 мг, 0,837 ммоль), (5-бром-2-метоксифенил)бороновую кислоту (222 мг, 0,962 ммоль), водный раствор карбоната натрия (0,885 мл, 2 М, 1,77 ммоль), этанол (300 мкл) и толуол (2,5 мл) перемешивают при комнатной температуре в течение 0,5 час, а затем добавляют тетракис(трифенилфосфин)палладий(0) (44 мг, 4,5%мол.). Полученную смесь нагревают до 90°С на масляной бане в течение 28,5 час, а затем оставляют на ночь перемешиваться при комнатной температуре. К реакционной смеси добавляют воду, а затем экстрагируют этилацетатом. Экстракты объединяют, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении, получая масло желтого цвета. Указанное масло очищают флэш-хроматографией (SiO2, картридж Biotage 40+M, EtOAc:гексан, градиентное элюирование) и получают (4R,5R)-3-[3,5-бис(трифторметил)бензил]-5-[5'-бром-2'-метокси-4-(трифторметил)бифенил-2-ил]-4-метил-1,3-оксазолидин-2-он. ЖХМС: рассчитано = 657,04; найдено = 597,95 (М+1)+.
Стадия С
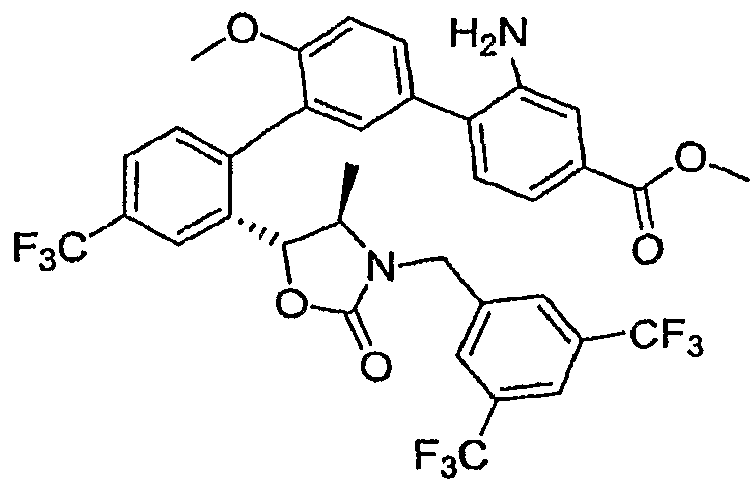
Метил 2-амино-2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Смешивают (4R,5R)-3-[3,5-бис(трифторметил)бензил]-5-[5'-бром-2'-метокси-4-(трифторметил)бифенил-2-ил]-4-метил-1,3-оксазолидин-2-он (358 мг, 0,545 ммоль), [2-амино-4-(метоксикарбонил)фенил]бороновую кислоту (214 мг, 1,1 ммоль), бис(трифенилфосфин)палладий(II) дихлорид (76,5 мг, 0,109 ммоль), водный раствор карбоната калия (545 мкл, 2 М, 1,09 ммоль) и этанол (5 мл) и нагревают до 80°С на масляной бане. Аликвоты, взятые через 2 час и 3,5 час после начала проведения реакции, показывают около 6% непрореагировавших исходных веществ. Добавляют дополнительное количество [2-амино-4-(метокси-карбонил)фенил]бороновой кислоты (50 мг, 0,256 ммоль), когда время проведения реакции составит 3 час 45 мин. Аликвота показывает отсутствие дальнейшего развития реакции. Реакционную смесь охлаждают и смешивают с насыщенным раствором соли. Летучие вещества из смеси удаляют при пониженном давлении. К полученной смеси добавляют воду и экстрагируют этилацетатом. Экстракты объединяют, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении, получая масло темного цвета. Указанное масло очищают флэш-хроматографией (SiO2, картридж Biotage 40+M, EtOAc:гексан, градиентное элюирование), а затем методом препаративной ТСХ (SiO2, 10% этилацетата в дихлорметане) и получают метил 2-амино-2"-{(4R,5R)-3-[3,5-бис(три-фторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат. ЖХМС: рассчитано = 726,18; найдено = 727,29 (М+1)+.
Стадия D
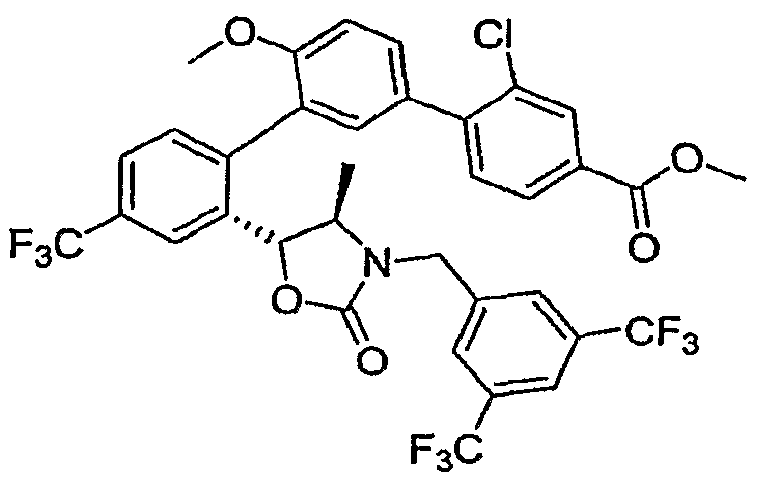
Метил 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-2-хлор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Амилнитрит (33 мкл, 29 мг, 0,248 ммоль) и хлорид меди(II) (27 мг, 0,198 ммоль) растворяют в безводном ацетонитриле (1 мл) и герметично закрывают в сосуде для ВЧ нагрева. Сосуд нагревают на масляной бане до 65°С. К горячему раствору в течение приблизительно 1 мин добавляют исходный метил 2-амино-2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат (120 мг, 0,165 ммоль,в 1 мл MeCN). Затем герметично закрытый сосуд нагревают на масляной бане до 65°С в течение 1 час. Анализ аликвоты (ЖХМС) указывает на полное завершение реакции. Раствор фильтруют и очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), осуществляя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.). Соответствующие фракции объединяют и упаривают в вакууме, получая метил 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-2-хлор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат. ЖХМС: рассчитано = 745,13; найдено = 746,12 (М+1)+.
Стадия Е: 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-2-хлор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
К раствору исходного метил 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-2-хлор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (65 мг, 0,087 ммоль) в 1,4-диоксане (2 мл) добавляют раствор моногидрата гидроксида лития (36,5 мг, 0,87 ммоль) в воде (1 мл). Смесь становится мутной и приобретает розоватую окраску (из исходного светло-желтого раствора). Аликвота, взятая через 22 мин после начала реакции, указывает на завершение реакции. Реакционную смесь подкисляют (1N HCl, водный раствор). Из реакционной смеси удаляют летучие вещества. Полученную смесь очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), осуществляя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.). Соответствующие фракции объединяют и упаривают в вакууме, получая бесцветное стеклообразное вещество. Указанное стеклообразное вещество растворяют в дихлорметане и промывают водой. Органический слой отделяют, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-2-хлор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС: рассчитано = 731,11; найдено = 732,08 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,22, 8,13 (д, J=1,5 Гц, 1H), 8,05-7,99 (м, 1H), 7,79 (с, 1H), 7,74 (с, 1H), 7,70-7,64 (м, 1H), 7,60 (с, 0,6H), 7,54-7,51 (м, 1,8H), 7,50-7,44 (м, 1H), 7,42-7,30 (м, 2H), 7,13 (д, J=2,5 Гц, 0,6H), 7,10 (д, J=9,0 Гц, 0,6H), 7,17 (д, J=8,5 Гц, 0,4H), 5,22 (д, J=4,5 Гц, 1H), 4,82, 4,77 (д, J=16 Гц, 1H), 4,27,4,22 (д, J=16 Гц, 1Н), 3,87 (с, 1,8H), 3,59 (с, 1,2H), 3,49-3,43 (м, 0,4H), 3,32-3,25 (м, 0,6H), 0,86 (д, J=6,0 Гц, 1,2H), 0,73 (д, J=6,5 Гц, 1,8H).
ПРИМЕР 48
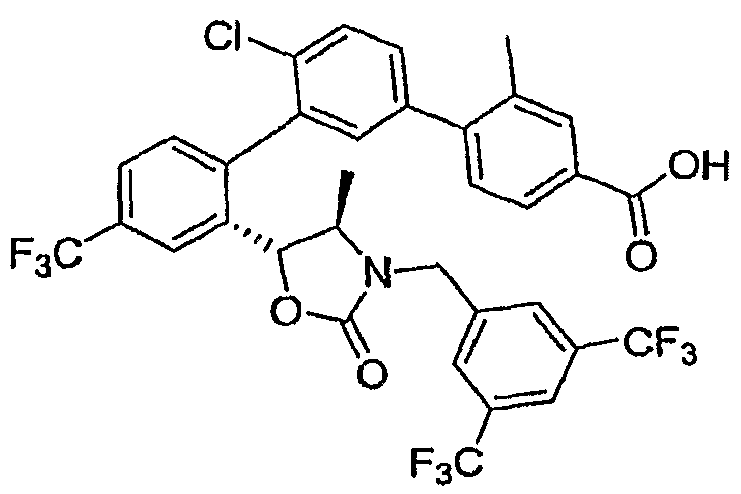
Стадия А
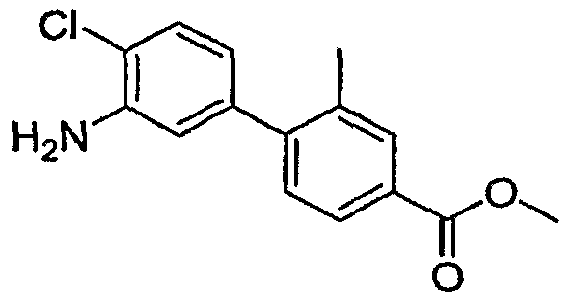
Метил 3'-амино-4'-хлор-2-метилбифенил-4-карбоксилат
Смешивают (3-амино-4-хлорфенил)бороновую кислоту (1,0 г, 5,834 ммоль), метил 4-бром-3-метилбензоат (1,337 г, 5,834 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (476 мг, 0,583 ммоль), водный раствор карбоната калия (11,57 мл, 1 М, 11,57 ммоль) и ацетон (53 мл) и нагревают на масляной бане до 70°С в течение 1,5 для завершения реакции сочетания. Летучие вещества из смеси удаляют при пониженном давлении. К полученной смеси добавляют воду, а затем экстрагируют этилацетатом. Экстракты объединяют, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении, получая масло темного цвета. Указанное масло очищают флэш-хроматографией (SiO2, картридж Biotage 40+M, 0-40% EtOAc в гексане) и получают метил 3'-амино-4'-хлор-2-метилбифенил-4-карбоксилат. ЖХМС: рассчитано = 275,07; найдено = 276,23 (М+1)+.
Стадия В
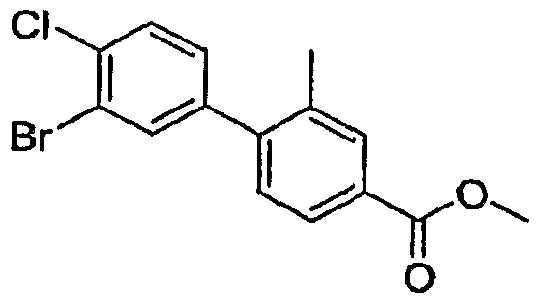
Метил 3'-бром-4'-хлор-2-метилбифенил-4-карбоксилат
Метил 3'-амино-4'-хлор-2-метилбифенил-4-карбоксилат (946 мг, 3,43 ммоль) растворяют в смеси CHBr3 (5 мл) и дихлорметана (5 мл). К полученной смеси добавляют трет-бутилнитрит (680 мкл, 530,6 мг, 5,145 ммоль). Реакционную смесь нагревают до 80°С в течение 30 мин. Анализ аликвоты (ЖХМС) указывает на полное расходование исходных веществ. Сырую смесь очищают флэш-хроматографией (SiO2, картридж Biotage 40+S) и получают метил 3'-бром-4'-хлор-2-метилбифенил-4-карбоксилат. ЖХМС: рассчитано = 339,97; найдено = 340,98 (М+1)+.
Стадия С
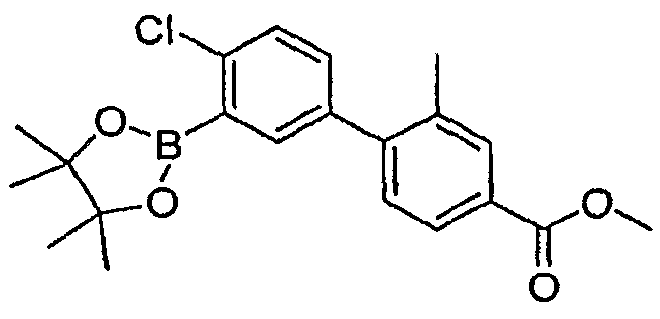
Метил 4'-хлор-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилат
Метил 3'-бром-4'-хлор-2-метилбифенил-4-карбоксилат (699 мг, 2,06 ммоль), бис(пинаколято)диборон (556 мг, 2,47 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (226 мг, 0,277 ммоль), ацетат калия (404 мг, 4,12 ммоль) и 1,4-диоксан (10 мл) герметично закрывают в сосуде для ВЧ нагрева. Сосуд нагревают в микроволновой печи до температуры 140°С в течение 45 мин. Анализ аликвоты (ЖХМС) указывает на завершение реакции. К реакционной смеси добавляют воду, а затем экстрагируют этилацетатом. Экстракты объединяют, сушат над Na2SO4, фильтруют и концентрируют, получая масло темного цвета, представляющее собой сырую смесь метил 4'-хлор-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилата, который используют на следующей стадии без дальнейшей очистки. ЖХМС: рассчитано = 386,15; найдено = 387,13 (М+1)+.
Стадия D
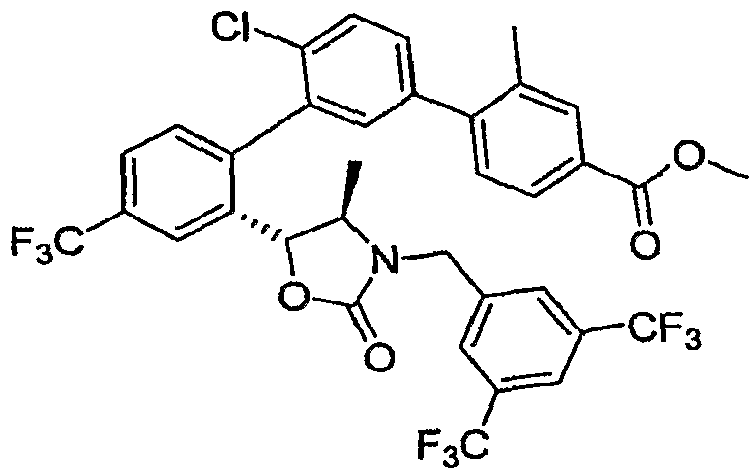
Метил 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-хлор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
(4R,5R)-3-[3,5-Бис(трифторметил)бензил]-5-[2-иод-5-(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он (103 мг, 0,172 ммоль,в 515 мкл толуола), метил 4'-хлор-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилат (100 мг, 0,259 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (14 мг, 10%), водный раствор карбоната калия (344 мкл, 2 М, 0,688 ммоль) и этанол (2 мл) герметично закрывают в сосуде для ВЧ нагрева. Сосуд нагревают с помощью ВЧ нагрева до температуры 140°С в течение 45 мин. Анализ методом ЖХ/МС показывает полное расходование исходных веществ. Сырую смесь очищают на SiO2 (препаративная ТСХ на пластинах, 50% этилацетата в гексане) и получают стеклообразное вещество. Остаток дополнительно очищают на SiO2 (препаративная ТСХ, 30% EtOAc/гексан). Остаток затем очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), осуществляя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.), и получают метил 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-хлор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат. ЖХМС: рассчитано = 729,13; найдено = 730,14 (М+1)+.
Стадия Е
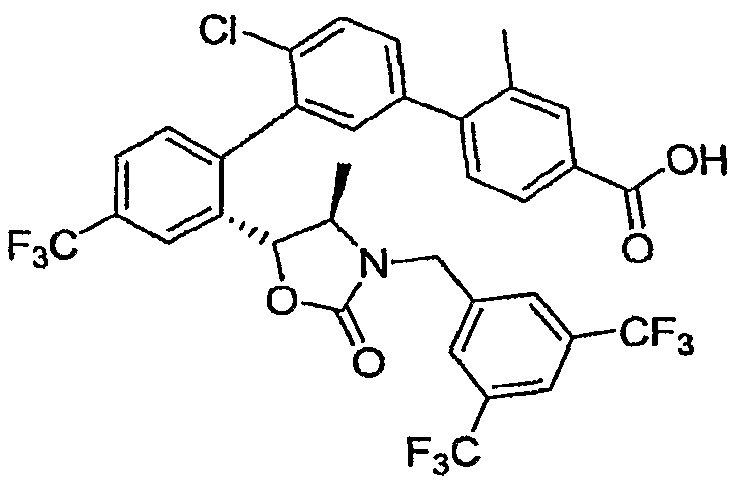
2"-{(4R,5R)-3-[3,5-Бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-хлор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
К раствору метил 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-хлор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (65 мг, 0,089 ммоль) в 1,4-диоксане (3 мл) добавляют раствор моногидрата гидроксида лития (26 мг, 0,623 ммоль) в воде (1,2 мл). Аликвота, взятая через 2 час после начала проведения реакции, указывает на прекращение реакции (присутствуют атропоизомеры). Сырую смесь подкисляют с помощью HCl (1N водный раствор, 1 мл), Мутный осадок растворяют в MeCN (2 мл). Полученный раствор очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), осуществляя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.), и получают 2"-{(4R,5R)-3-[3,5-бис(трифторметил)бензил]-4-метил-2-оксо-1,3-оксазолидин-5-ил}-4'-хлор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС: рассчитано = 715,12; найдено = 716,20 (М+1)+. Сигналы в спектре 1Н ЯМР двойные вследствие атропоизомеризма. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,04 (с, 0,5H), 8,00 (с, 0,5H), 7,98-7,93 (м, 1H), 7,80-7,75 (м, 1,5H), 7,75 (с, 0,5H), 7,74-7,69 (м, 1Н), 7,63-7,59 (м, 2H), 7,58, 7,56 (д, J=3,5 Гц, 1Н), 7,42 (д, J=7,5 Гц, 0,5H), 7,40-7,34 (м, 1,5H), 7,31 (д, J=7,5 Гц, 0,4H), 7,28 (д, J=2 Гц, 0,6H), 7,24 (д, J=8,0 Гц, 0,6H), 7,09 (д, J=2,5 Гц, 0,4H), 5,14 (д, J=5,5 Гц, 0,4H), 5,10 (д, J=4,5 Гц, 0,6H), 4,83 (д, J=16 Гц, 0,6H), 4,73 (д, J=16 Гц, 0,4H), 4,28 (д, J=16 Гц, 1H), 3,57-3,51 (м, 0,4H), 3,42-3,35 (м, 0,6H), 2,35, 2,25 (с, 3H), 0,91 (д, J=6,5 Гц, 1,8H), 0,85 (д, J=6 Гц, 1,2H).
ПРИМЕР 49
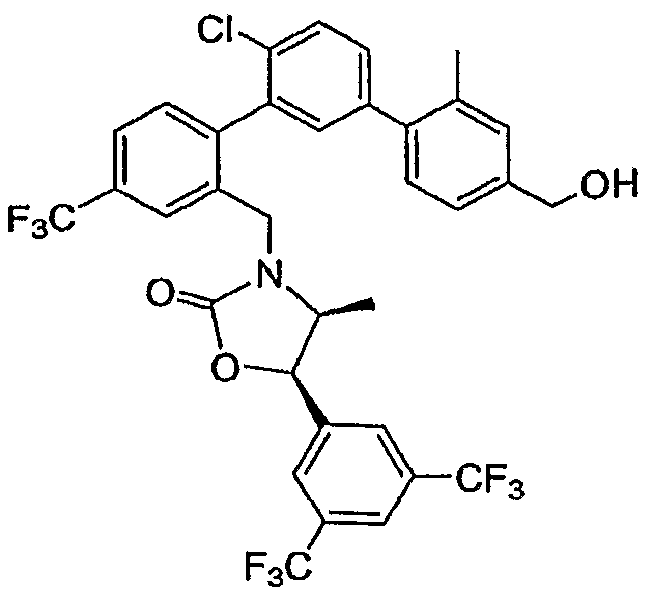
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[6'-хлор-4"-(гидроксиметил)-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
К раствору кислоты из Примера 34 (1,0 г, 1,40 ммоль) в ТГФ (15 мл) при температуре минус 78°С добавляют боран (2,79 мл, 2,79 мол, 1 М раствор в ТГФ). Раствор перемешивают при минус 78°С в течение 30 мин и медленно в течение 2 час нагревают до комнатной температуры. Анализ методом ТСХ показывает отсутствие исходных веществ (EtOAc/гексан 3:7). Добавляют воду (10 мл). Смесь экстрагируют с помощью EtOAc (3×20 мл). Слои EtOAc объединяют, промывают насыщенным раствором бикарбоната натрия, насыщенным раствором соли и сушат над сульфатом натрия. Растворитель удаляют и остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью EtOAc/гексан (30:70), и получают указанное в названии соединение в виде бесцветного твердого вещества. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 7,89 (с, 1H), 7,73 (с, 1H), 7,72 (с, 2H), 7,70 (м, 1H), 7,59 (д, J=8,0 Гц, 1H), 7,49 (д, J=8,5 Гц, 0,5H), 7,47 (д, J=8,0 Гц, 0,5H), 7,39-7,36 (м, 2H), 7,32 (с, 1H), 7,25 (м 1,5H), 7,20 (д, J= 2,0 Гц, 0,5H), 5,62 (д, J=8,0 Гц, 1H), 4,99 (д, J=15,0 Гц, 0,5H), 4,83 (д, J=16,0 Гц, 0,5H), 4,73 (с, 2H), 4,15 (с, 1Н), 4,10 (д, J=16,0 Гц, 0,5H), 4,01 (д, J=15,5 Гц, 0,5H), 3,96 (м, 0,5H), 3,86(м, 0,5H), 2,34 (с, 1,5H), 2,33 (с, 1,5H), 0,61 (д, J=6,5 Гц, 1,5H), 0,58 (д, J=6,5 Гц, 1,5H).
ПРИМЕР 50
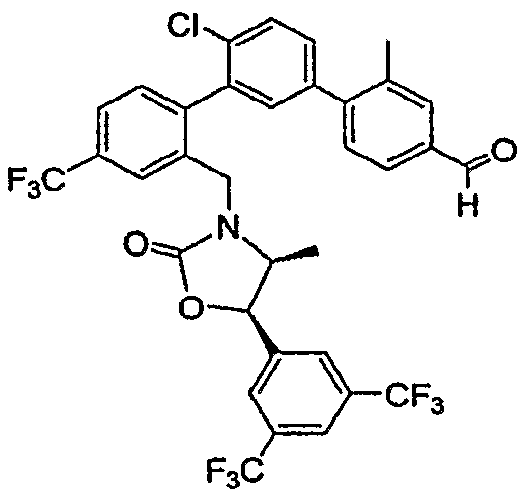
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-хлор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбальдегид
Периодинан Десса-Мартина (145 мг, 0,34 ммоль) добавляют к раствору спирта из Примера 49 (200 мг, 0,285 ммоль) в метиленхлориде (5 мл) при комнатной температуре. Полученную суспензию перемешивают при комнатной температуре в течение 1 час. Анализ методом ТСХ показывает отсутствие исходных веществ (EtOAc/гексан 2:8). Твердые вещества отфильтровывают. Фильтрат концентрируют. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью EtOAc/гексан (30:70), и получают указанное в названии соединение в виде бесцветного твердого вещества. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 6:4: атропоизомеров 10,03 (с, 1H), 7,90 (с, 2/5H), 7,89 (с, 3/5H), 7,83 (с, 1H), 7,78 (д, J=8,0 Гц, 3/5H), 7,75 (д, J=8,0 Гц, 2/5 H), 7,74 (с, 1,2H), 7,73 (с, 0,8H), 7,72 (с, 2/5H), 7,70 (с, 3/5H), 7,64 (д, J= 8,0 Гц, 1H), 7,52 (д, J=8,0 Гц, 3/5H), 7,47 (д, J=8,0 Гц, 2/5H), 7,46 (д, J=8,0 Гц, 3/5H), 7,43 (д, J= 8,0 Гц, 2/5H),7,40 (м, 1H), 7,28 (м, 1,5H), 7,23 (д, J=2,0 Гц, 0,5H), 5,64 (д, J=8,0 Гц, 1H), 5,04 (д, J=15,5 Гц, 3/5H), 4,83 (д, J=16 Гц, 2/5H), 4,09 (д, J=16 Гц, 2/5H), 4,01 (д, J=15,0 Гц, 3/5H), 4,00 (м, 2/5H), 3,91 (м, 3/5H), 2,43 (с, 1,8H), 2,41 (с, 1,2H), 0,65 (д, J=6,5 Гц, 1,8H), 0,61 (д, J=7,0 Гц, 1,2H).
ПРИМЕР 51
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[6'-хлор-4"-(1-гидроксиэтил)-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
MeMgBr (0,274 мл, 0,274 ммоль,1 М раствор) добавляют к раствору альдегида из Примера 50 (160 мг, 0,229 ммоль) в ТГФ (3 мл) при температуре минус 78°С. Раствор перемешивают при минус 78°С в течение 2 час. Добавляют насыщенный раствор хлорида аммония. Смесь экстрагируют с помощью EtOAc (3×10 мл). Слои EtOAc объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью EtOAc/гексан (30:70), и получают указанное в названии соединение в виде бесцветного твердого вещества. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 7,89 (с, 1Н), 7,72 (м, 4H), 7,58 (д, J= 8,5 Гц, 1H), 7,48 (т, 1Н), 7,38 (м, 1H), 7,32 -7,20 (м, 4H), 5,62 (д, J=8,0 Гц, 1H), 5,00 (д, J=15,5 Гц, 0,5H), 4,93 (м, 1H), 4,82 (д, J=16,0 Гц, 0,5H), 4,10 (д, J=15,5 Гц, 0,5H), 4,01 (д, J=15,5 Гц, 0,5H), 3,88 (м, 0,5H), 3,87 (м, 0,5H), 2,34 (с, 1,5H), 2,33 (с, 1,5H), 1,55 (м, 3H), 0,61 (д, J=6,5 Гц, 1,5H), 0,58 (д, J=6,5 Гц, 1,5H).
ЖХ/МС: М+-18: 698,16.
ПРИМЕР 52
(4S,5R)-3-{[4"-Ацетил-6'-хлор-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-5-[3,5-бис(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он
Периодинан Десса-Мартина (58,3 мг, 0,137 ммоль) добавляют к раствору спирта из Примера 51 (82 мг, 0,115 ммоль) в метиленхлориде (5 мл) при комнатной температуре. Полученную суспензию перемешивают при комнатной температуре в течение 1 час. Анализ методом ТСХ показывает отсутствие исходных веществ (EtOAc/гексан 2:8). Твердые вещества отфильтровывают. Фильтрат концентрируют. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью EtOAc/гексан (20:80), и получают указанное в названии соединение в виде бесцветного твердого вещества. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 7,90 (с, 1H), 7,89 (с, 1H), 7,84 (д, J=8 Гц, 1H), 7,72 (м, 4H), 7,62 (д, J=8,5 Гц, 1H), 7,51 (д, J=8,0 Гц, 0,5H), 7,46 (д, J=8,0 Гц, 0,5H), 7,40-7,34 (м, 2H), 7,26 (д, J=2,5 Гц, 0,5H), 7,21 (д, J=2,5 Гц, 0,5H), 5,62 (д, J=8,0 Гц, 1H), 5,02 (д,J= 15,5 Гц, 0,5H), 4,83 (д, J=16,0 Гц, 0,5H), 4,08 (д, J=16,0 Гц, 0,5H), 4,01 (д, J=15,5 Гц, 0,5H), 3,99 (м, 0,5H), 3,90(м, 0,5H), 2,64 (с, 3H), 2,40 (с, 1,5H), 2,39 (с, 1,5H), 0,64 (д, J=6,5 Гц, 1,5H), 0,62 (д, J=6,5 Гц, 1,5H).
ЖХ/МС: М+: 714,01.
ПРИМЕР 53
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[6'-хлор-4"-(1-гидрокси-1-метилэтил)-2"-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
MeMgBr (0,168 мл, 0,168 ммоль,1 М раствор) добавляют к раствору кетона из Примера 52 (80 мг, 0,112 ммоль) в ТГФ (3 мл) при температуре минус 78°С. Раствор перемешивают при минус 78°С в течение 2 час. Добавляют насыщенный раствор хлорида аммония. Смесь экстрагируют с помощью EtOAc (3×10 мл). Слои EtOAc объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя смесью EtOAc/гексан (30:70), и получают указанное в названии соединение в виде бесцветного твердого вещества. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 7,89 (с, 2H), 7,83 (д, J=8 Гц, 1H), 7,72 (м, 4H), 7,63 (д, J=8,5 Гц, 1H), 7,51 (д, J=8,0 Гц, 0,5H), 7,46 (д, J=8,0 Гц, 0,5H), 7,40-7,34 (м, 2H), 7,27 (д, J=2,0 Гц, 0,5H), 7,21 (д, J=2,5 Гц, 0,5H), 5,64 (д, J=8,0 Гц, 0,5H), 5,63 (д, J=8,0 Гц, 0,5H), 5,02 (д, J=16,0 Гц, 0,5H), 4,83 (д, J=16,0 Гц, 0,5H), 4,08 (д, J=16,0 Гц, 0,5H), 4,01 (д, J=15,5 Гц, 0,5H), 4,00 (м, 0,5H), 3,90(м, 0,5H), 2,41 (с, 1,5H), 2,39 (с, 1,5H), 1,60 (м, 3H), 1,28 (м, 3H), 0,64 (д, J=6,5 Гц, 1,5H), 0,62 (д, J=6,5 Гц, 1,5H).
ПРИМЕР 54
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6'-фтор-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
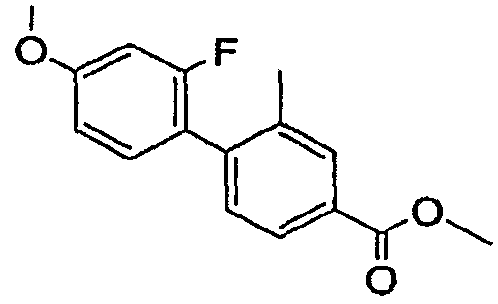
Стадия А: метил 2'-фтор-4'-метокси-2-метилбифенил-4-карбоксилат
Смесь 4-бром-3-фторанизола (500 мг, 2,44 ммоль), метил 4'-метокси-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилата (875 мг, 3,17 ммоль), тетракис(трифенилфосфин)палладия (282 мг, 5%мол.) и карбоната натрия (569 мг, 5,37 ммоль) в 20 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 4 час. Анализ методом ТСХ (CH2Cl2:гексан/1:1) показывает, что реакция завершена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×10 мл). Вытяжки метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя смесь CH2Cl2:гексан/6:4 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,98 (с, 1H), 7,92 (дд, J=8,0, 1,5 Гц, 1H), 7,29 (д, J=8,0 Гц, 1H), 7,16 (т, J=8,5 Гц, 1H), 6,80 (дд, J=8,5, 2,5 Гц, 1H), 6,77 (дд, J=11,5, 2,5 Гц, 1Н), 3,95(с, 3H), 3,88 (с, 3H), 2,28 (с, 3H).
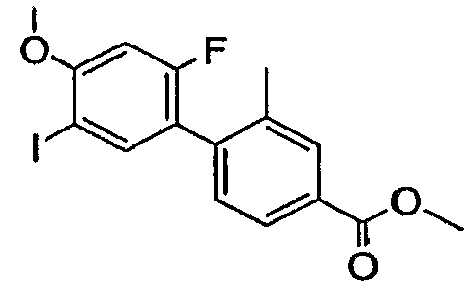
Стадия В: метил 2'-фтор-5'-иод-4'-метокси-2-метилбифенил-4-карбоксилат
Раствор соединения со Стадии А (1,30 г, 4,74 ммоль) в смеси МеОН/EtOAc (10:1) (10 мл) добавляют к смеси Ag2SO4 (1,47 г, 4,74 ммоль) и I2 (1,20 г, 4,74 ммоль) в МеОН (20 мл) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 4 час. Цвет раствора меняется от коричневого до светло-желтого. Смесь отфильтровывают. Фильтрат концентрируют. Остаток очищают флэш-хроматографией, элюируя смесью EtOAc/гексан (5:95), и получают указанное в названии соединение в виде бесцветного твердого вещества. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,98 (с, 1H), 7,92 (дд, J=8,0, 2,0 Гц, 1H), 7,67 (д, J=8,5 Гц, 1Н), 7,28 (д, J=9,0Гц, 1H), 6,69 (д, J=11,5 Гц, 1H), 3,96(с, 3H), 3,95 (с, 3H), 2,27(с, 3H).
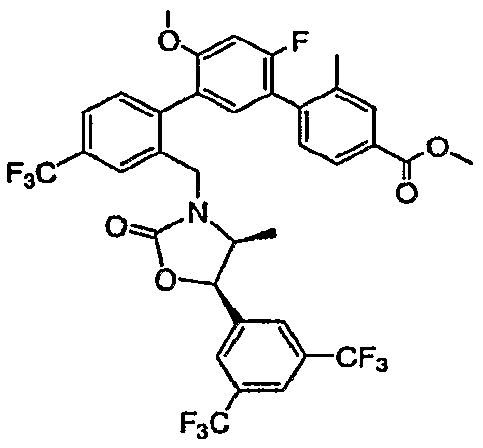
Стадия С: метил 2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6'-фтор-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)бензил]-1,3-оксазолидин-2-он - метан (1,30 г, 2,18 ммоль) (Промежуточное соединение 9), указанное в названии соединение на Стадии В (1,30 г, 3,25 ммоль), тетракис(трифенилфосфин)палладий (250 мг, 10%мол.) и карбонат натрия (507 мг, 4,79 ммоль) в 50 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 4 час. Анализ методом ТСХ (CH2Cl2:гексан/1:1) показывает, что реакция завершена. Растворители удаляют. Добавляют воду (20 мл). Органические вещества экстрагируют метиленхлоридом (3×30 мл). Вытяжки метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя смесь CH2Cl2:гексан/8:2 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 7,98 (д, J=4,5 Гц, 1H), 7,89 (с, 2H), 7,68 (м, 4H), 7,42 (т, J=6,0 Гц, 1H), 7,30 (д, J=7,5 Гц, 0,5H), 7,26 (д, J=7,5 Гц, 0,5H), 7,07 (т, J=8,0 Гц, 1Н), 6,87 (д, J=5,5 Гц, 0,5H), 6,85 (д, J= 6,0 Гц, 0,5H), 5,63 (д, J=8,0 Гц, 0,5H), 5,41 (д, J=8,0 Гц, 0,5H), 5,00 (д, J=15,5 Гц, 0,5H), 4,92 (д, J=16,0 Гц, 0,5H), 4,17 (д, J=15,5 Гц, 0,5H), 3,95 (д, J=16,0 Гц, 0,5H), 3,95 (с, 3H), 3,88 (с, 3H), 3,84(м, 1H), 2,32 (с, 1,5H), 2,28 (с, 1,5H), 0,64 (д, J=7,0 Гц, 1,5H), 0,62 (д, J=6,5 Гц, 1,5H).
ЖХ/МС: М+: 744,2.
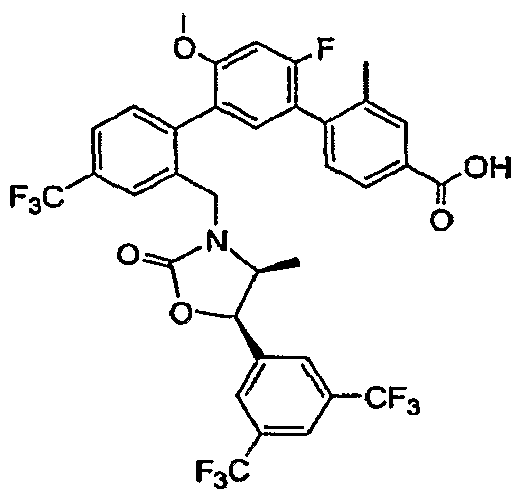
Стадия D: 2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6'-фтор-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Указанное в названии соединение на Стадии С (1,97 г) оставляют перемешиваться на ночь с LiOH (5 экв.) в смеси 2:1 диоксана и воды при комнатной температуре. Растворитель удаляют, а водную фазу подкисляют с помощью 1N раствора HCl до рН ~4. Органические вещества экстрагируют с помощью EtOAc (3×30 мл). Слои EtOAc объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, элюируя смесью EtOAc/гексан (1:1). Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1 атропоизомеров 8,03 (д, J=4,5 Гц, 1H), 7,95 (д, J=8,5 Гц, 1H), 7,89 (с, 1H), 7,73-7,65 (м, 4H), 7,43 (м, 1H), 7,34 (д, J=7,5 Гц, 0,5H), 7,29 (д, J=7,5 Гц, 0,5H), 7,08 (т, J=8,5 Гц, 1H), 6,88 (д, J=5,5 Гц, 0,5H), 6,86 (д, J=6,5 Гц, 0,5H), 5,63 (д, J=8,0 Гц, 0,5H), 5,42 (д, J=8,5 Гц, 0,5H), 5,01 (д, J=16,0 Гц, 0,5H), 4,93 (д, J=16,0 Гц, 0,5H), 4,17 (д, J=16,0 Гц, 0,5H), 3,95 (д, J=16,0 Гц, 0,5H), 3,89 (с, 3H), 3,84(м, 1H), 2,34 (с3 1,5H), 2,30 (с, 1,5H), 0,61 (д, J=7,0 Гц, 1,5H), 0,50 (д, J=6,5 Гц, 1,5H).
ПРИМЕР 55
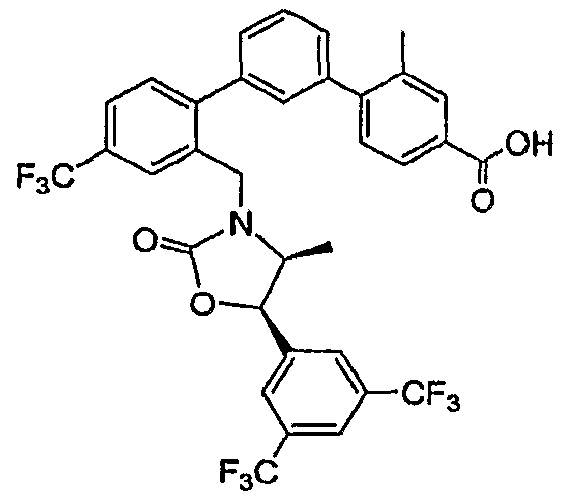
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
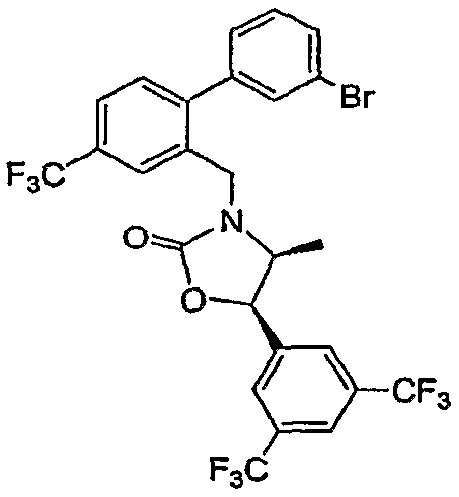
Стадия А: (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[3'-бром-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Смесь (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (2,0 г, 3,35 ммоль), 3-бромфенилбороновой кислоты (0,74 г, 3,68 ммоль) и карбонат натрия (0,71 г, 6,70 ммоль) в 21 мл смеси 1:2:4 вода:EtOH:толуол перемешивают при комнатной температуре в течение 30 мин. Добавляют каталитическое количество тетракис(трифенилфосфин)палладия (0,193 г, 5%мол.). Полученную смесь кипятят с обратным холодильником при перемешивании в течение 3 час. Растворители удаляют. Добавляют воду (10 мл). Смесь экстрагируют метиленхлоридом (3×30 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя смесь CH2Cl2:гексан/1:1 в качестве элюента.
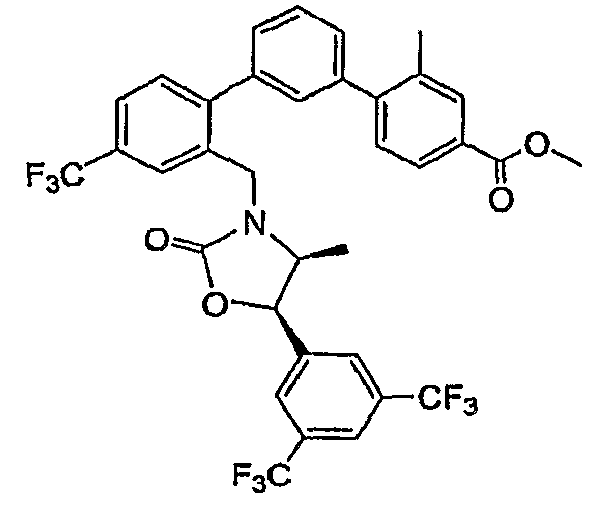
Стадия В: метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Смесь метил 4'-метокси-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилата (150 мг, 0,542 ммоль), соединения, указанного в названии на Стадии А (224 мг, 0,358 ммоль), тетракис(трифенилфосфин)палладия (20,66 мг, 5%мол.) и карбоната натрия (76 мг, 0,715 ммоль) в 14 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 1 час. Анализ методом ТСХ (CH2Cl2:гексан/1:1) показывает, что реакция завершена. Растворители удаляют. Добавляют воду (10 мл). Органические вещества экстрагируют метиленхлоридом (3×10 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя смесь CH2Cl2:гексан/8:2 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,99 (с, 1H), 7,92 (дд, J=7,5, 1,5 Гц, 1H), 7,88(с, 1H), 7,75 (с, 1H), 7,71 (с, 2H), 7,67 (м, 1H), 7,57 (т, J=7,5 Гц, 1H), 7,50 (д, J=8,0 Гц, 1H), 7,42 (м, 1H), 7,35-7,28 (м, 3H), 5,53 (д, J=8,0 Гц, 1H), 4,97 (д, J=15,5 Гц, 1H), 4,25 (д, J=16,0 Гц, 1H), 3,95 (с, 3H), 3,80 (м, 1H), 2,36 (с, 3H), 0,48 (д, J=6,5 Гц, 3H).
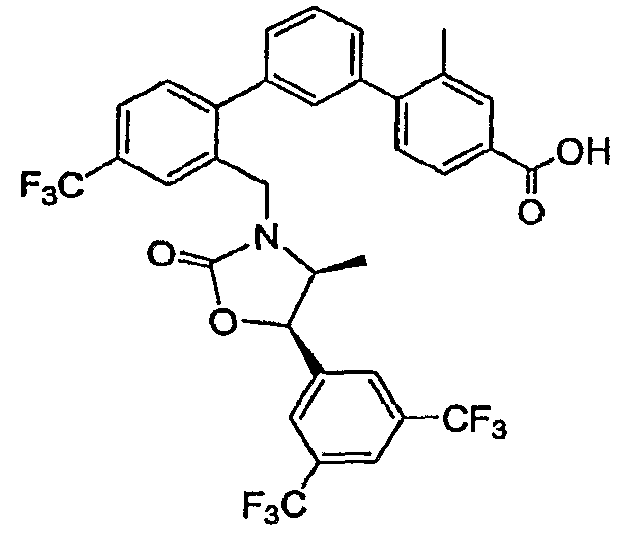
Стадия С: 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Указанное в названии соединение на Стадии В (30 мг, 0,043 ммоль) оставляют перемешиваться на ночь с LiOH (5 экв.) в смеси 2:1 диоксана и воды при комнатной температуре. Растворитель удаляют, а водный раствор подкисляют с помощью 1N раствора HCl до рН ~4. Органические вещества экстрагируют с помощью EtOAc (3×10 мл). Слои EtOAc объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение в виде бесцветного твердого вещества получают после ВЭЖХ с обращенной фазой. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,05 (с, 1H), 7,99 (д, J=8,0 Гц, 1H), 7,90(с, 1H), 7,75 (с, 1Н), 7,72 (с, 2H), 7,67 (м, 1Н), 7,59 (т, J=7,5 Гц, 1Н), 7,51 (д, J=8,0 Гц, 1Н), 7,44 (м, 1H), 7,37 (м, 2H),7,30 (м, 1H), 5,54 (д, J=8,0 Гц, 1H), 4,98 (д, J=15,5 Гц, 1Н), 4,25 (д, J=16,0 Гц, 1Н), 3,81 (м, 1H), 2,40 (с, 3H), 0,49 (д, J=6,5 Гц, 3H).
ЖХ/МС (М+1) 682,1.
ПРИМЕР 56
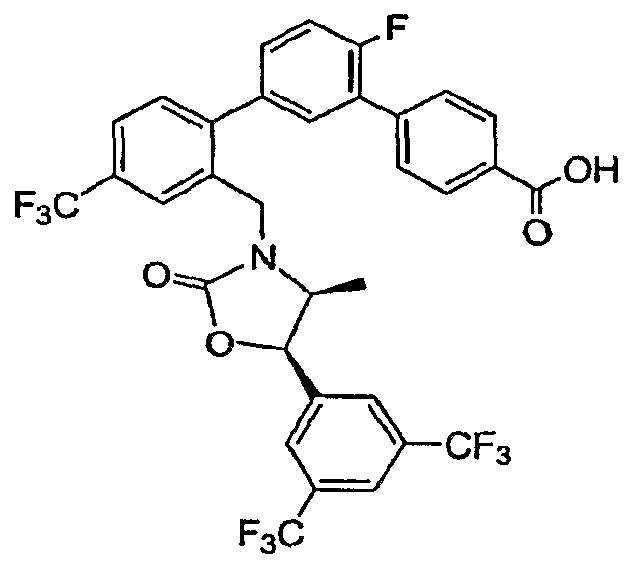
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6'-фтор-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
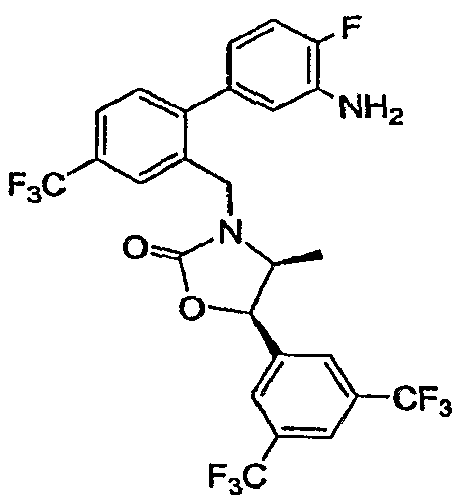
Стадия А: (4S,5R)-3-{[3'-амино-4'-фтор-4-(трифторметил)бифенил-2-ил]метил}-5-[3,5-бис(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он
Смесь (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (1,1 г, 1,84 ммоль), 3-амино-4-фторфенилбороновой кислоты (0,43 г, 2,76 ммоль), карбоната натрия (0,39 г, 3,68 ммоль) и каталитического количества тетракис(трифенилфосфин)палладия (0,213 г, 10%мол.) в 14 мл смеси 1:2:4 вода:EtOH:толуол кипятят с обратным холодильником при перемешивании в течение 2 час. Растворители удаляют. Добавляют воду (10 мл). Смесь экстрагируют метиленхлоридом (3×10 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя смесь CH2Cl2:гексан/7:3 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,89 (с, 1Н), 7,73 (с, 2H), 7,70 (с, 1H), 7,64 (д, J=8,5 Гц, 1H), 7,42 (д, J=8,0 Гц, 1H), 7,09 (дд, J=11, 8,5 Гц, 1H), 6,74 (дд, J=8,0,2,5 Гц, 1H), 6,62 (м, 1H), 5,55 (д, J=8,5 Гц, 1Н), 4,94 (д, J=15,5 Гц, 1Н), 4,23 (д, J=16,0 Гц, 1H), 3,80 (м, 1H), 1,60 (шир. с, 2H), 0,51 (д, J=6,5 Гц, 3H).
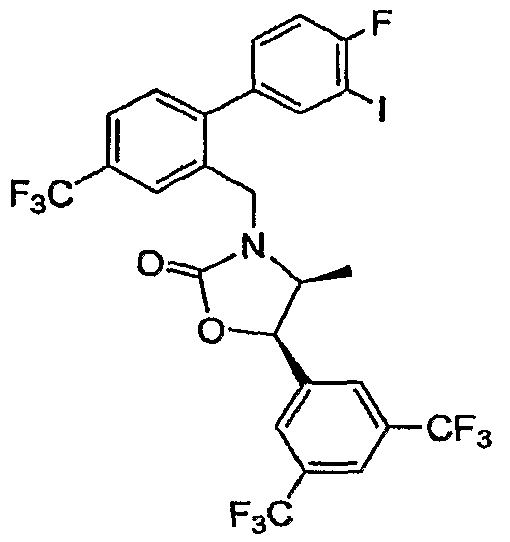
Стадия В: (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[4'-фтор-3'-иод-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
н-Пентилнитрит (0,42 г, 3,58 ммоль) и иод (0,68 г, 2,69 ммоль) добавляют к раствору соединения, указанного в названии на Стадии А (1,04 г, 1,79 ммоль) в хлороформе (10 мл). Смесь перемешивают при кипячении с обратным холодильником в течение 1 час. Реакционную смесь разбавляют метиленхлоридом (10 мл). Полученный раствор розового цвета промывают насыщенным раствором тиосульфата натрия, насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после проведения колоночной флэш-хроматографии, используя EtOAc:гексан/1:9 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,90 (с, 1Н), 7,75 (с, 2H), 7,74 (м, 1H), 7,67 (д, J=8,0 Гц, 1H), 7,42 (д, J=7,5 Гц, 1H), 7,30 (м, 2H), 7,20 (т, J=8,0, Гц, 1H), 5,55 (д, J=8,0 Гц, 1Н), 4,89 (д, J=16,0 Гц, 1H), 4,15 (д, J=16,0 Гц, 1H), 3,84 (м, 1H), 0,51 (д, J=6,5 Гц, 3H).
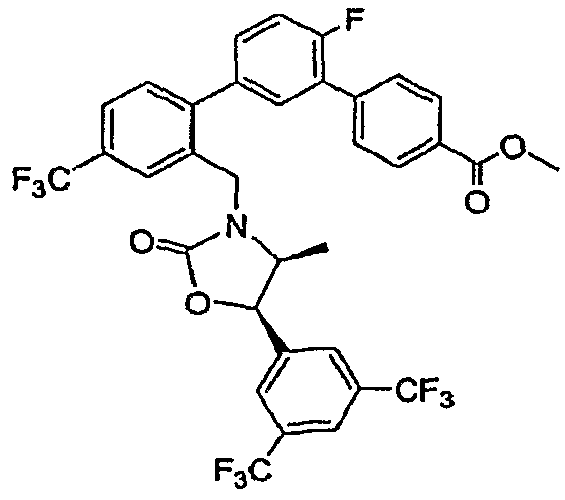
Стадия С: метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6'-фтор-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Смесь соединения, приведенного в названии на Стадии В (60 мг, 0,087 ммоль), 4-метоксикарбонилфенилбороновой кислоты (31,2 мг, 0,174 ммоль), карбоната натрия (18,4 мг, 0,174 ммоль) и каталитического количества тетракис(трифенилфосфин)палладия (20 мг, 20%мол.) в 7 мл смеси вода/EtOH/толуол (1:2:4) кипятят с обратным холодильником в течение 2 час. Растворители удаляют. Добавляют воду (10 мл). Смесь экстрагируют метиленхлоридом (3×10 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после проведения колоночной флэш-хроматографии, используя смесь CH2Cl2:гексан/7:3 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,15 (д,J= 8,5 Гц, 2H), 7,89(с, 1H), 7,74 (с, 1H), 7,72 (с, 2H), 7,67 (м, 2H), 7,49 (д, J=8,0 Гц, 1H), 7,43 (д, J=7,5 Гц, 1H), 7,32 (д, J=8,0 Гц, 2H), 5,57 (д, J=8,0 Гц, 1H), 4,97 (д, J=16,0 Нг, 1Н), 4,23 (д, J=16,0 Гц, 1H), 3,97 (с, 3H), 3,85 (м, 1H), 0,53 (д, J=6,5 Гц, 3H).
Стадия D: 2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6'-фтор-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Указанное в названии соединение на Стадии С (60 мг, 0,086 ммоль) оставляют перемешиваться на ночь с LiOH (10 экв.) в смеси 2:1 диоксана и воды при комнатной температуре. Растворитель удаляют, а водный раствор подкисляют с помощью 1N раствора HCl до рН ~4. Органические вещества экстрагируют с помощью EtOAc (3×10 мл). Слои EtOAc объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение в виде твердого бесцветного вещества получают после ВЭЖХ с обращенной фазой. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,18 (д, J=7,0 Гц, 2H), 7,87(с, 1H), 7,72 (с, 1H), 7,70 (с, 2H), 7,68 (м, 2H), 7,47 (д, J=6,5 Гц, 1Н), 7,42 (д,J=5,5 Гц, 1H), 7,32 (д, J=6,5 Гц, 2H), 5,55 (д, J=6,5 Гц, 1H)7 4,96 (д, J=13,0 Гц, 1Н), 4,21 (д, J=13,0 Гц, 1H), 3,85 (м, 1H), 0,52 (д, J=5,0 Гц, 3H).
ЖХ/МС М+ 686,06.
Следующие примеры осуществляют в соответствии с общей методикой, приведенной в Примере 56.
|
Следующие примеры осуществляют, используя (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[2'-метокси-5'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он (100 мг, 0,14 ммоль) из Примера 21 со Стадии А и соответствующие бромиды в соответствии с общей методикой, приведенной в Примере 56 на Стадии С.
|
|
ПРИМЕР 61
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-хлор-6"-иод-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
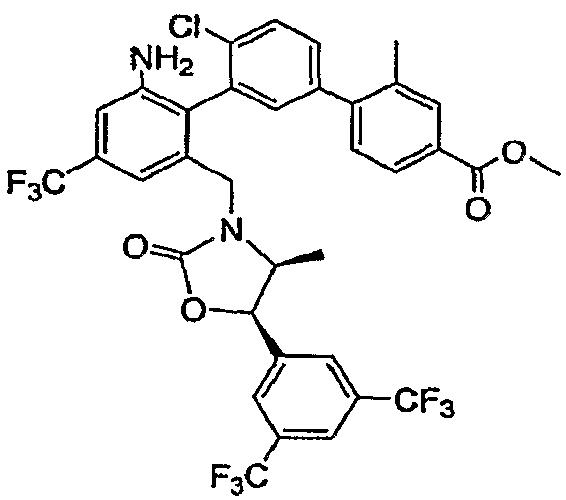
Стадия А: метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-хлор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
К раствору соединения, указанного в названии Примера 40 на Стадии Е (500 мг, 0,779 ммоль) в EtOH (10 мл) добавляют дигидрат хлорида олова (1,64 г, 7,27 ммоль). Смесь перемешивают при комнатной температуре в течение 2 час. Анализ методом ЖХ-МС показывает полное расходование исходных веществ. EtOH удаляют. К остатку добавляют EtOAc (200 мл). Смесь промывают водой, насыщенным раствором соли и сушат над сульфатом натрия. После удаления растворителя получают твердое вещество, которое смешивают с метил 4'-хлор-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилатом (Пример 48, Стадия С, 281 мг, 0,727 ммоль), тетракис(трифенилфосфин)палладием (10%мол.) и карбонатом натрия (0,154 г, 1,45 ммоль) в 32 мл смеси вода/EtOH/толуол (1:2:4) и кипятят с обратным холодильником в течение 48 час. Анализ методом ТСХ (EtOAc:гексан/2:8) показывает, что реакция закончена. Растворители удаляют. Добавляют воду (10 мл). Смесь экстрагируют метиленхлоридом (3×30 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после очистки колоночной флэш-хроматографией, используя 20% EtOAc в гексане в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,99 (с, 1H), 7,91 (дд, J=8,0, 2,0 Гц, 1H), 7,88(с, 1Н), 7,74 (с, 2H), 7,67 (д, J=8,0 Гц, 1H), 7,42 (дд, J=8,5, 2,0 Гц, 1H), 7,36 (д, J=8,0 Гц, 1H), 7,30-7,24 (м, 1Н), 7,07 (с, 1H), 7,01 (с, 1H), 5,70 (д, J=8,0 Гц, 1H), 4,83 (д, J=15,0 Гц, 1Н), 4,01 (м, 1H), 3,96 (с, 3H), 3,83 (д, J=15,0 Гц, 1H), 3,81 (шир. с, 2H), 2,42 (с, 3H), 0,68 (д, J=6,0 Гц, 3H).
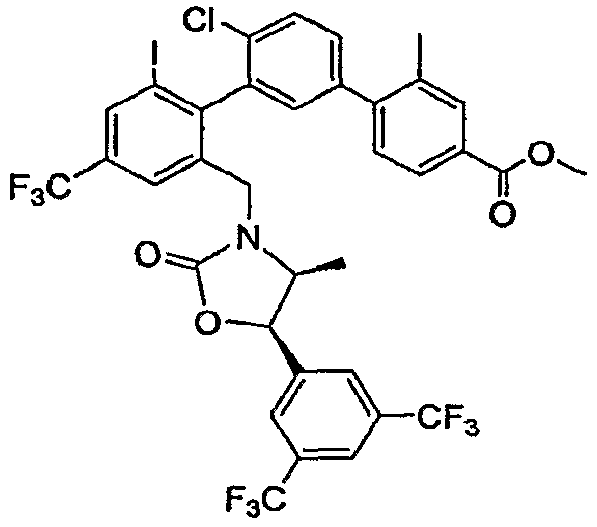
Стадия В: метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-хлор-6"-иод-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
К раствору соединения, указанного в названии на Стадии А (285 мг, 0,383 ммоль) в хлороформе (10 мл) при комнатной температуре добавляют н-пентилнитрит (67,2 мг, 0,574 ммоль) и иод (126 мг, 0,497 ммоль). Смесь кипятят с обратным холодильником в течение 1 час. Реакционную смесь разбавляют метиленхлоридом (10 мл). Полученный раствор промывают насыщенным раствором тиосульфата натрия, насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение в виде бесцветного твердого вещества получают после проведения ВЭЖХ с обращенной фазой. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,24 (с, 1H), 7,99 (с, 1H), 7,92 (д, J=8,0, Гц, 1H), 7,90(с, 1H), 7,74 (с, 2H), 7,66 (с, 1H), 7,42 (дд, J=8,5, 2,5 Гц, 1Н), 7,34 (д, J=8,0 Гц, 1H), 7,28 (м, 1Н), 7,21-7,14 (м, 1H), 5,71 (д, J=8,0 Гц, 1H), 4,78 (д, J=15,5 Гц, 1H), 3,99 (м, 2H), 3,96 (с, 3H), 2,41 (с, 3H), 0,65 (д, J=6,5 Гц, 3H).
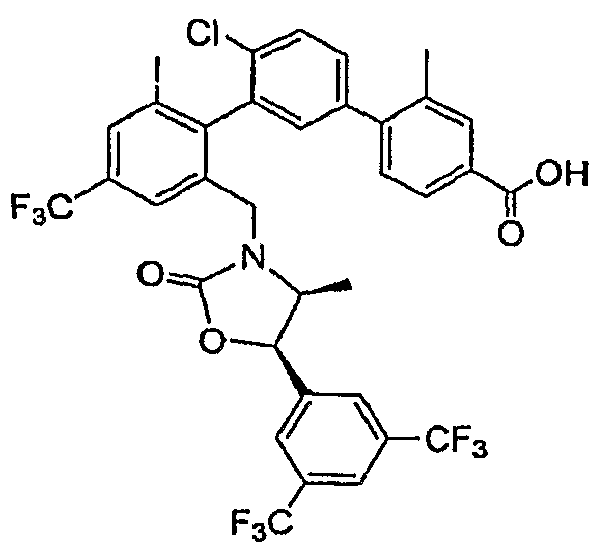
Стадия С: 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-хлор-6"-иод-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
К раствору соединения, указанного в названии на Стадии В (30 мг, 0,035 ммоль), в диоксане (2 мл) при комнатной температуре добавляют водный раствор LiOH·Н2О (7,36 мг, 0,175 ммоль). Смесь оставляют на ночь перемешиваться при комнатной температуре. Анализ методом ТСХ (EtOAc:гексан/2:8) показывает отсутствие исходных веществ. Растворитель удаляют. Добавляют 1N раствор HCl (1 мл). Смесь экстрагируют метиленхлоридом (3×10 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение в виде бесцветного твердого вещества получают после проведения ВЭЖХ с обращенной фазой.
ПРИМЕР 62
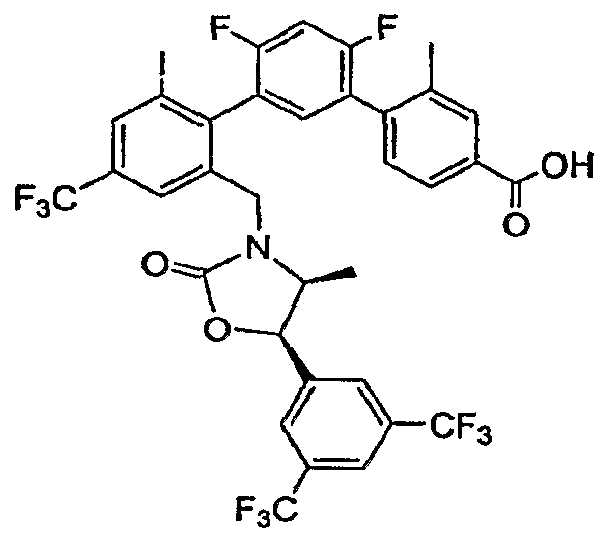
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4',6'-дифтор-6"-иод-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Указанное в названии соединение получают, используя соединение из Примера 40 со Стадии Е, и метил 4'-фтор-2-метил-3'-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бифенил-4-карбоксилат (Промежуточное соединение 22), в соответствии с методикой, приведенной в Примере 61. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1: атропоизомеров 8,26 (с, 0,5H), 8,24 (с, 0,5H), 8,06 (с, 1Н), 7,98 (д, J=8,0 Гц, 1H), 7,91 (с, 1H), 7,75 (с, 2H), 7,69 (с, 0,5 H), 7,65 (с, 0,5H), 7,39 (м, 1H), 7,16-7,04 (м, 2H), 5,66 (д, J=8,0 Гц, 0,5H), 5,64 (д, J=8,5 Гц, 0,5H), 4,88 (д, J=15,5 Гц, 0,5H), 4,81 (д, J=16,0 Гц, 0,5H), 4,02 (м, 1H), 3,91(м, 1H), 2,39 (с, 1,5H), 2,36 (с, 1,5H), 0,70 (д, J=6,5 Гц, 1,5H), 0,69 (д, J=6,5 Гц, 1,5H).
ЖХ/МС (М+1) 844,04.
Следующие примеры осуществляют, используя соединение из Примера 56 со Стадии В и соответствующие бороновые кислоты, в соответствии с общей методикой, приведенной в Примере 56 на Стадии С.
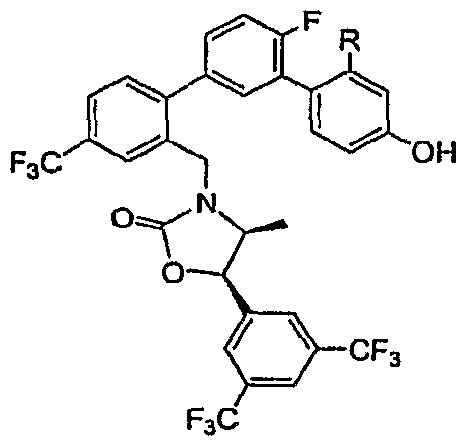
|
ПРИМЕР 65
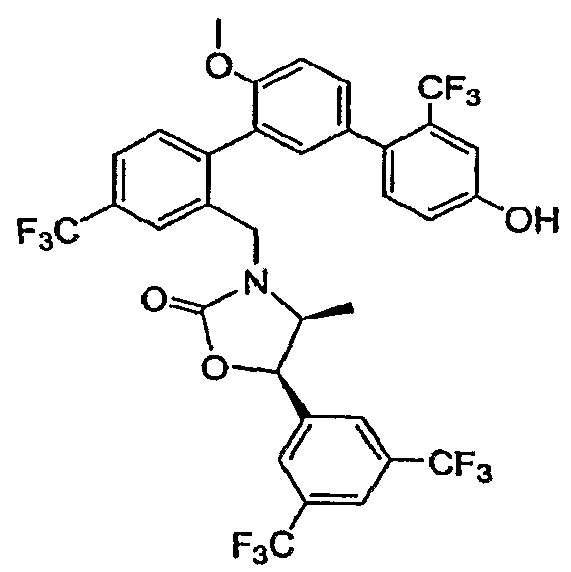
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[4''-гидрокси-6'-метокси-2",4-бис(трифторметил)-1,1':3',1"-терфенил-2-ил}-4-метил-1,3-оксазолидин-2-он
Указанное в названии соединение получают, используя промежуточное соединение из Примера 1 со Стадии А и 4-гидрокси-2-трифторметилфенилбороновую кислоту, в соответствии с методикой, приведенной в Примере 56 на Стадии С.
ЖХ/МС (М+1) 737,98.
ПРИМЕР 66
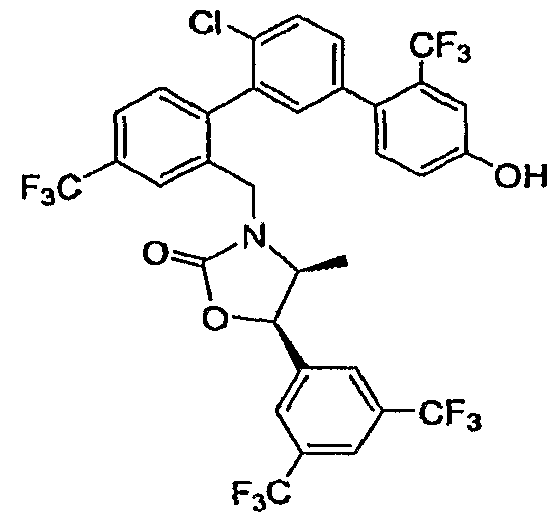
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[6'-хлор-4''-гидрокси-2",4-бис(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Указанное в названии соединение получают, используя промежуточное соединение из Примера 22 со Стадии В и 4-гидрокси-2-трифторметилфенилбороновую кислоту, в соответствии с методикой, приведенной в Примере 56 на Стадии С.
ЖХ/МС (М+1) 741,70.
ПРИМЕР 68
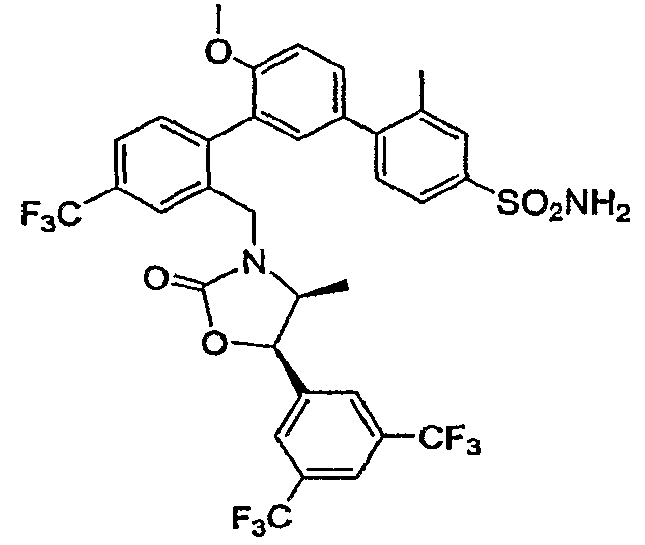
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-сульфонамид
К раствору 4-бром-3-метилбензолсульфонилхлорида (120 мг, 0,37 ммоль) в диоксане (5 мл) при комнатной температуре добавляют концентрированный NH4OH (1 мл). Смесь перемешивают при комнатной температуре в течение 4 час. Раствор соединения, указанного в названии Примера 21 на Стадии А (100 мг, 0,14 ммоль), карбоната натрия (30 мг, 0,28 ммоль) и каталитического количества тетракис(трифенилфосфин)палладия (5%мол.) в 14 мл смеси 1:2:4 вода/EtOH/толуол кипятят с обратным холодильником при перемешивании в течение 6 час. Растворители удаляют. Добавляют воду (10 мл). Смесь экстрагируют метиленхлоридом (3×10 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после проведения ВЭЖХ с обращенной фазой. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1 атропоизомеров 7,89 (с, 1H), 7,86 (д, J=7,5 Гц, 1Н), 7,79 (д, J=8,0 Гц, 1H), 7,72 (с, 2H), 7,68 (м, 2H), 7,45 (т, J=8,0 Гц, 1H), 7,39 (м, 2H), 7,13 (м, 2H), 5,60 (д, J=8,5 Гц, 0,5H), 5,38 (д, J=8,5 Гц, 0,5H), 5,00 (д, J=16,0 Гц, 0,5H), 4,94 (д, J=16,0 Гц, 0,5H), 4,17 (д, J=16,0 Гц, 0,5H), 3,99 (д, J=16,0 Гц, 0,5H), 3,90 (с, 1,5H), 3,89(с, 1,5H), 3,84 (м, 1H),2,42 (с, 1,5H), 2,37 (с, 1,5), 1,75 (шир. с, 2H), 0,59 (д, J=6,5 Гц, 1,5H), 0,48 (д, J=7,0 Гц, 1,5H).
ЖХ/МС (М+1) 747,20.
ПРИМЕР 69
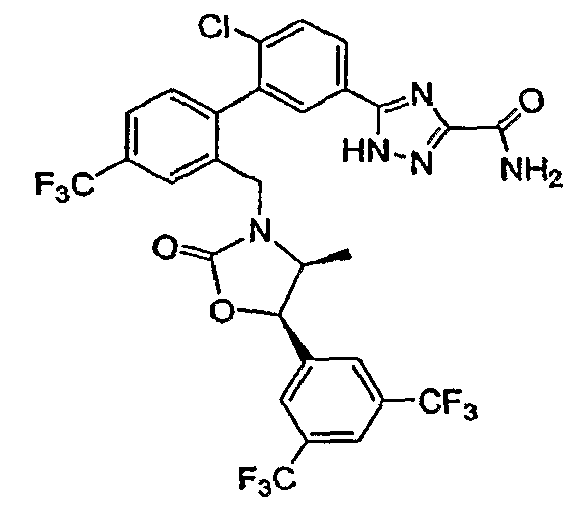
5-[2'-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-хлор-4'-(трифторметил)бифенил-3-ил]-1Н-1,2,4-триазол-3-карбоксамид
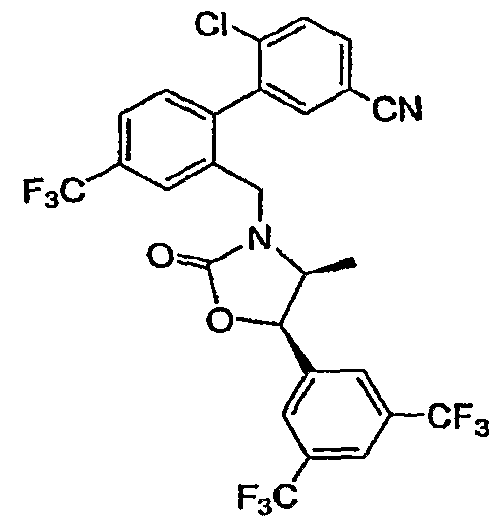
Стадия А: 2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-хлор-4'-(трифторметил)бифенил-3-карбонитрил
Смесь (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-иод-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (0,5 г, 0,837 ммоль), 2-хлор-5-цианофенилбороновой кислоты (0,228 г, 1,26 ммоль), карбоната натрия (0,18 г, 1,67 ммоль) и каталитического количества тетракис(трифенилфосфин)палладия (0,097 г, 10%мол.) в 14 мл смеси 1:2:4 вода:EtOH:толуол кипятят с обратным холодильником при перемешивании в течение 2 час. Растворители удаляют. Добавляют воду (10 мл). Смесь экстрагируют метиленхлоридом (3×10 мл). Слои метиленхлорида объединяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Указанное в названии соединение получают после колоночной флэш-хроматографии, используя смесь CH2Cl2:гексан/8:2 в качестве элюента. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ смесь 1:1 атропоизомеров 7,91 (с, 1H), 7,77-7,69 (м, 6H), 7,61 (д, J=2,0 Гц, 0,5H), 7,58 (д, J=2,0 Гц, 0,5H), 7,42 (д, J=8,0 Гц, 0,5H), 7,38 (д, J=8,0 Гц, 0,5H), 5,68 (д, J=8,0 Гц, 0,5H), 5,65 (д, J=8,0 Гц, 0,5H), 4,89 (д, J=15,5 Гц, 0,5H), 4,74 (д, J=16,0 Гц, 0,5H), 4,03 (д, J=16,0 Гц, 0,5H), 4,00 (м, 0,5H), 3,91 (д, J=16,0 Гц, 0,5H), 3,90 (м, 0,5H), 0,67 (д, J=6,5 Гц, 1,5H), 0,65 (д, J=6,5 Гц, 1,5H).
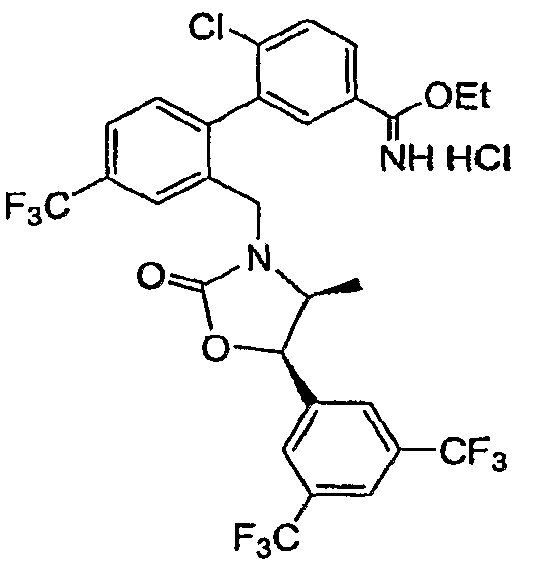
Стадия В: этил 2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-хлор-4'-(трифторметил)бифенил-3-карбоксимидоат гидрохлорид
Соединение, полученное на стадии А (100 мг, 0,165 ммоль) перемешивают с насыщенным раствором HCl в EtOH (10 мл). Растворитель перемешивают при комнатной температуре в течение 2 часов. По данным ТСХ (EtOAc/гексан 2:8), исходное вещество отсутствует. Растворитель удаляют и получают белое твердое вещество. Полученное вещество используют для следующей стадии без очистки.
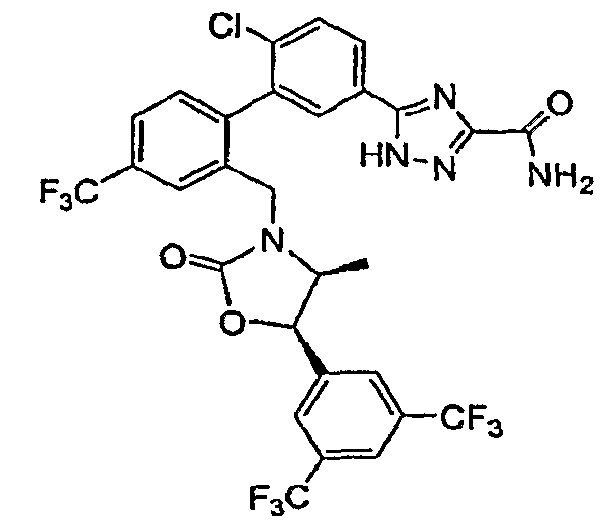
Стадия С: 5-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6-хлор-4'-(трифторметил)бифенил-3-ил]-1Н-1,2,4-триазол-3-карбоксамид
Смесь соединения, указанного в названии на Стадии В (100 мг, 0,145 ммоль), гидразида оксамовой кислоты (16,5 мг, 0,16 ммоль) и КОАс (17,1 мг, 0,174 ммоль) в EtOH (5 мл) кипятят с обратным холодильником при перемешивании в течение 2 час. Анализ методом ЖХ/МС показывает, что реакция закончена. Растворитель удаляют и указанное в названии соединение получают после очистки методом ВЭЖХ с обращенной фазой.
ЖХ/МС (М+1)+ 692,38.
ПРИМЕР 70
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[4"-(гидроксиметил)-6'-метокси-4''-метил-4-(трифторметил)-1,1':3',1"-терфенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту (2 г, 2,81 ммоль) и ТГФ (18,74 мл) перемешивают при 0°С (на бане со льдом). К полученной смеси в течение 3 мин добавляют комплекс борана и тетрагидрофурана (5,90 мл, 5,90 ммоль). Полученную смесь перемешивают при 0°С в течение 15 мин. Баню со льдом убирают. Реакционную смесь дополнительно перемешивают при комнатной температуре в течение 1 час. Анализ методом ТСХ указывает на окончание реакции. Реакцию прерывают, добавив воду (на бане со льдом). К реакционной смеси добавляют водный раствор бикарбоната натрия, экстрагируют этилацетатом, сушат над Na2SO4, фильтруют и упаривают, получая смесь темного цвета. Полученную темную смесь очищают флэш-хроматографией (SiO2, картридж Biotage 40+M). Колонку элюируют смесью EtOAc/гексан (от 0% до 40%). Собирают соответствующие фракции, объединяют и упаривают, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 697,19; найдено = 680,29 (М-ОН-)+. Спектр 1Н ЯМР (CDCl3, 400 МГц, смесь 1:1 атропоизомеров) δ 7,83 (д, J=4 Гц, 1H), 7,71 (с, 0,5H), 7,67 (с, 1H), 7,66-7,58 (м, 2,5H) 7,43 (д, J=8 Гц, 0,5H), 7,40 (д, J=8 Гц, 0,5H), 7,38-7,32 (м, 1Н), 7,28-7,23 (м, 1H), 7,22-7,14 (м, 2H), 7,12 (с, 1H), 7,05 (д, J=5,6Гц, 0,5H), 7,03 (д, J=5,6 Гц, 0,5H), 5,56 (д, J=8,4 Гц, 0,5H), 5,23 (д, J=8 Гц, 0,5H), 4,97 (д, J=10,8 Гц, 0,5H), 4,93 (д, J=10,8 Гц, 0,5H), 4,68 (с, 2H), 4,15 (д, J=15,6 Гц, 0,5H), 3,95 (д, J= 15,6 Гц, 0,5H), 3,85 (с, 1,5H), 3,83 (с, 1,5H), 3,80-3,66 (м, 1H), 2,32 (с, 1,5H), 2,26 (с, 1,5H), 0,52 (д, J=6,8 Гц, 1,5H), 0,38 (д, J=6,8 Гц, 1,5H).
ПРИМЕР 71
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2',6'-дифтор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Стадия А: 2-(2-фтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
1-Бром-2-фтор-4-метоксибензол (750 мг, 3,658 ммоль), ацетат калия (718 мг, 7,32 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (300 мг, 0,367 ммоль), бис(пинаколято)диборон (984 мг, 4,39 ммоль) и 1,4-диоксан (10 мл) герметично закрывают в сосуде для ВЧ нагрева и подвергают ВЧ нагреву до температуры 140°С в общей сложности в течение 50 мин (40 мин + 10 мин). Анализ аликвоты методом ЖХМС указывает на полное расходование исходных веществ. Реакционную смесь фильтруют через слой целита (521). Фильтрат промывают насыщенным раствором соли, экстрагируют с помощью EtOAc, сушат над Na2SO4, фильтруют, упаривают и получают смесь указанного в названии соединения в виде темного масла. Его используют как есть на следующей стадии. ЖХМС (ESI): рассчитано = 252,13; найдено = 253,09 (М+1)+.
Стадия В: метил 2,2'-дифтор-4'-метоксибифенил-4-карбоксилат
2-(2-Фтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (600 мг, 2,38 ммоль), метил 4-бром-3-фторбензоат (665 мг, 2,856 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (292 мг, 0,358 ммоль), карбонат калия (2,38 мл, водный раствор, 2 М, 4,76 ммоль) и 1,4-диоксан (10 мл) герметично закрывают и подвергают ВЧ нагреву до температуры 145°С в течение 15 мин. Анализ аликвоты указывает на образование требуемого соединения. ТСХ (20% EtOAc/гексан) дает ярко-розовое пятно @ Rf=0,4. Реакционную смесь сушат над Na2SO4, а затем очищают флэш-хроматографией (SiO2, картридж Biotage 40+M). Колонку элюируют смесью от 0% до 20% EtOAc/гексан. Собирают соответствующие фракции, объединяют и концентрируют в вакууме, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 278,08; найдено = 279,09 (М+1)+.
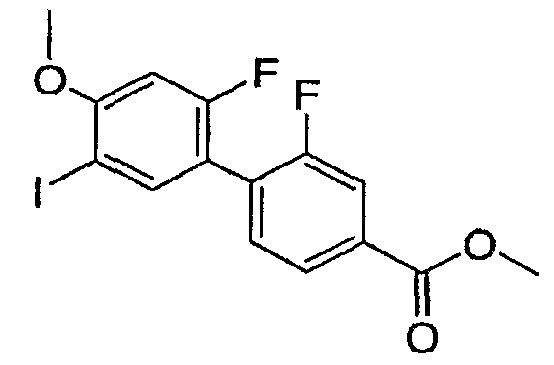
Стадия С: метил 2,2'-дифтор-5'-иод-4'-метоксибифенил-4-карбоксилат
Метил 2,2'-дифтор-4'-метоксибифенил-4-карбоксилат (585 мг, 2,10 ммоль), метанол (10 мл), иод (534 мг, 2,10 ммоль), сульфат серебра (655 мг, 2,10 ммоль) перемешивают при комнатной температуре. ЖХМС указывает на образование требуемого соединения. Реакционную смесь промывают с помощью NaHSO3 (насыщенный водный раствор). Из полученной смеси удаляют все летучие вещества. Остаток последовательно обрабатывают с помощью Na2SO4/EtOAc/фильтрация/концентрирование и получают твердое вещество светло-коричневого цвета. Сырой продукт очищают флэш-хроматографией (SiO2, картридж Biotage 40+M). Колонку элюируют смесью от 0% до 20% EtOAc/гексан. 5 основных фракций были случайно разлиты. Остальные соответствующие фракции объединяют и концентрируют в вакууме, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 403,97; найдено = 404,92 (М+1)+.
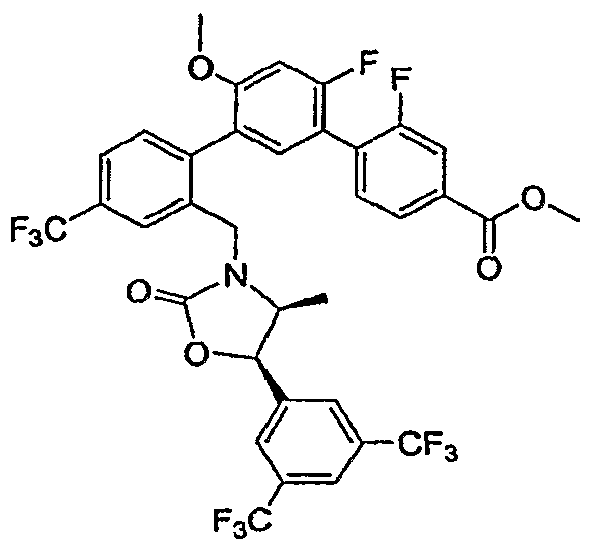
Стадия D: метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2',6'-дифтор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Метил 2,2'-дифтор-5'-иод-4'-метоксибифенил-4-карбоксилат (100 мг, 0,247 ммоль), (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)бензил]-1,3-оксазолидин-2-он (Промежуточное соединение 9, 179,2 мг, 0,30 ммоль), карбонат натрия (247 мкл, водный раствор, 2 М, 0,494 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (40 мг, 0,049 ммоль) и 1,4-диоксан (2,1 мл) нагревают до 80°С на масляной бане в течение 8 час. Анализ аликвоты указывает на образование требуемого продукта. Реакционную смесь концентрируют при пониженном давлении. Остаток обрабатывают последовательно Н2O/EtOAc/Na2SO4/фильтрация с последующим концентрированием и получают темное масло. Полученное масло очищают методом ВЭЖХ с обращенной фазой (Waters SunFire PrepC18 OBD 5μ, 30×100 мм), осуществляя градиентное элюирование смесью MeCN (0,05% TFA, об./об.)/Н2О (0,05% TFA, об./об.) (от 10 до 100% в течение 12 мин, поддерживают 100% в течение 3 мин). Соответствующие фракции собирают, объединяют и упаривают в вакууме, получая темное масло. Указанное масло далее очищают на SiO2 (препаративная ТСХ, 30% EtOAc/гексан) и получают указанное в названии соединение. ЖХМС (ESI): рассчитано = 747,15; найдено = 748,20 (М+1)+.
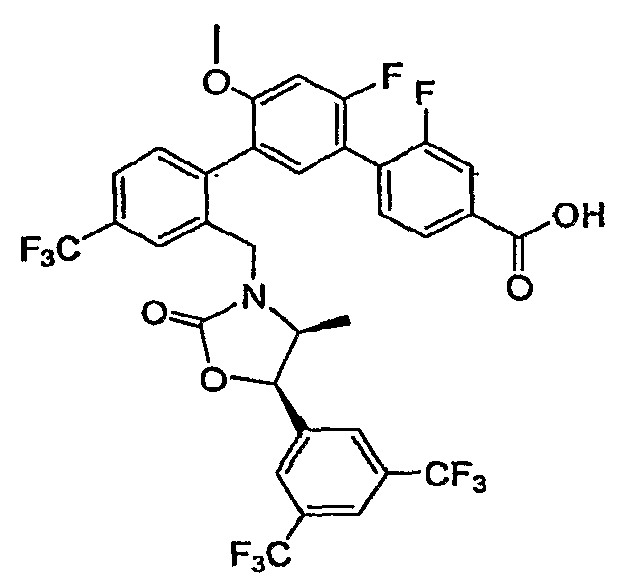
Стадия Е: 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2',6'-дифтор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2',6'-дифтор-4'-метокси-4"-(три-фторметил)-1,1':3',1"-терфенил-4-карбоксилат (50 мг, 0,067 ммоль), моногидрат гидроксида лития (28 мг, 0,67 ммоль), воду (1 мл) и 1,4-диоксан (2 мл) перемешивают при комнатной температуре в течение 2,5 час. Анализ аликвоты методом ЖХМС указывает на образование требуемого продукта и полное расходование исходных веществ. Реакционную смесь подкисляют (1N HCl, водный раствор). Летучие вещества удаляют при пониженном давлении. Остаток растворяют в MeCN и очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), элюируя смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.). Соответствующие фракции собирают, объединяют и упаривают в вакууме, получая смесь. Полученную смесь экстрагируют с помощью EtOAc. Органическую фазу отделяют, вновь промывают водой, разделяют, сушат над Na2SO4, фильтруют и упаривают, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 733,13; найдено = 734,14 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, смесь 1:1 атропоизомеров) δ 7,95 (т, J=6 Гц, 1H), 7,89-7,83 (м, 2H), 7,73 (с, 0,5H), 7,71 (с, 1H), 7,68-7,64 (м, 2H), 7,62 (с, 0,5H) 7,58 (т, J=7 Гц, 0,5H), 7,53 (т, J=7,5 Гц, 0,5H), 7,42 (д, J=8 Гц, 0,5H), 7,39 (д, J=8 Гц, 0,5H), 7,31-7,23 (м, 1H), 6,89 (д, J=4 Гц, 0,5H), 6,87 (д, J=3,5Гц, 0,5H), 5,61 (д, J=8 Гц, 0,5H), 5,29 (д, J=8 Гц, 0,5H), 5,05 (д, J=16 Гц, 0,5H), 4,93 (д, J=16 Гц, 0,5H), 4,16 (д, J=16,5 Гц, 0,5H), 3,94 (д, J=16 Гц, 0,5H), 3,89 (с, 1,5H), 3,87 (с, 1,5H), 3,85-3,72 (м, 1H), 0,59 (д, J=7Гц, 1,5H), 0,43 (д, J=6 Гц, 1,5H).
ПРИМЕР 72
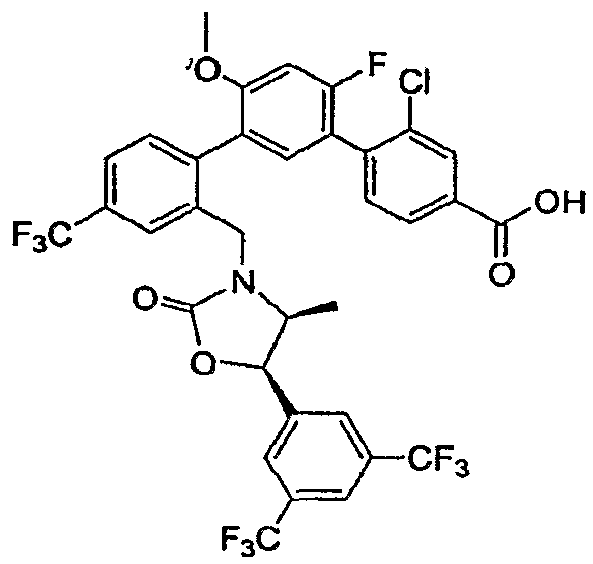
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2-хлор-6'-фтор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
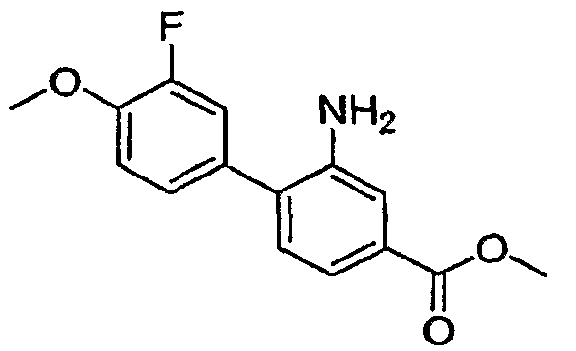
Стадия А: метил 2-амино-2'-фтор-4'-метоксибифенил-4-карбоксилат
1-Бром-2-фтор-4-метоксибензол (750 мг, 3,66 ммоль), [2-амино-4-(метоксикарбонил)фенил]бороновую кислоту (856 мг, 4,39 моль), ацетат калия (3,66 мл, 2 М водного раствора, 7,32 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (299 мг, 10%мол.) и этанол (30 мл) нагревают на масляной бане до 80°С в течение 3 час. Реакционную смесь промывают насыщенным раствором соли, экстрагируют этилацетатом, сушат над Na2SO4, фильтруют и упаривают и получают темное масло. Указанное масло очищают на SiO2 (Biotage Horizon Flash system, картридж 40+M, 0-25% EtOAc/гексан, об./об.) и получают указанное в названии соединение. ЖХМС (ESI): рассчитано = 275,10; найдено = 276,09 (М+1)+.
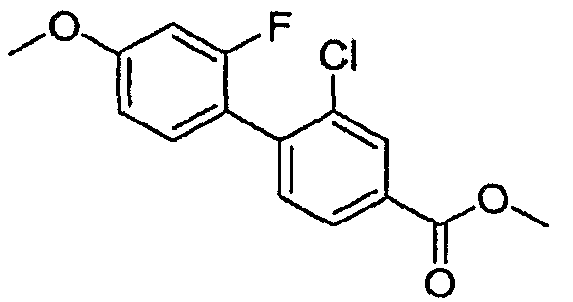
Стадия В: метил 2-хлор-2'-фтор-4'-метоксибифенил-4-карбоксилат
Амилнитрит (420 мкл, 3,19 ммоль) и хлорид меди(II) (343 мг, 2,55 ммоль) суспендируют в ацетонитриле (5 мл) и нагревают до 65°С на масляной бане при перемешивании на магнитной мешалке. К указанной горячей смеси добавляют метил 2-амино-2'-фтор-4'-метоксибифенил-4-карбоксилат (585 мг, 2,13 ммоль,в 5 мл MeCN) в течение приблизительно 1 мин. Полученную смесь нагревают до 65°С на масляной бане в течение 2 час. Реакционную смесь очищают на SiO2 (Biotage Horizon Flash system, картридж 40+M, 0-20% EtOAc/гексан, об./об.) и получают указанное в названии соединение. ЖХМС (ESI): рассчитано = 294,05; найдено = 295,03 (М+1)+.
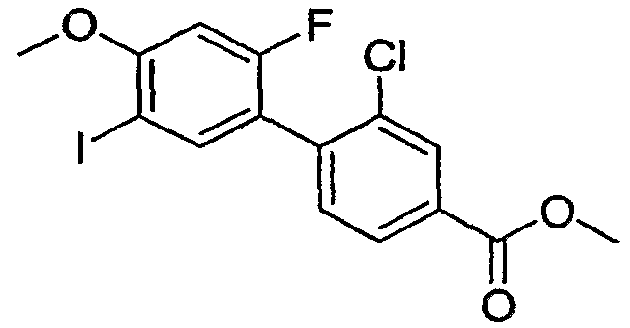
Стадия С: метил 2-хлор-2'-фтор-5'-иод-4'-метоксибифенил-4-карбоксилат
Метил 2-хлор-2'-фтор-4'-метоксибифенил-4-карбоксилат (550 мг, 1,87 ммоль), метанол (8 мл), иод (474 мг, 1,87 ммоль) и сульфат серебра (583 мг, 1,87 ммоль) перемешивают при комнатной температуре в течение 2 час. Реакционную смесь промывают с помощью NaHSO3 (насыщенный водный раствор). Из полученной смеси при пониженном давлении удаляют летучие вещества. Остаток промывают насыщенным раствором соли, экстрагируют этилацетатом, сушат над Na2SO4, фильтруют и упаривают, получая твердое вещество светло-коричневого цвета. Указанное твердое вещество очищают на SiO2 (Biotage Horizon Flash system, картридж 40+M, 0-20% EtOAc/гексан, об./об.) и получают указанное в названии соединение. ЖХМС (ESI): рассчитано = 419,94; найдено = 420,86 (М+1)+.
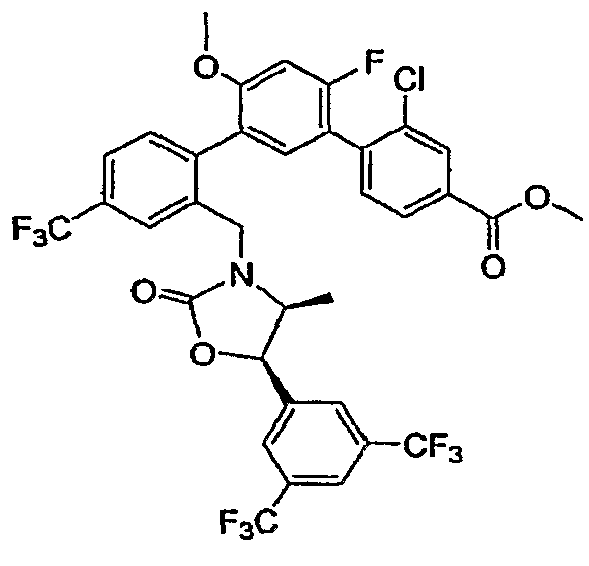
Стадия D: метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2-хлор-6'-фтор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Метил 2-хлор-2'-фтор-5'-иод-4'-метоксибифенил-4-карбоксилат (177 мг, 0,42 ммоль), (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)бензил]-1,3-оксазолидин-2-он (Промежуточное соединение 9, 250 мг, 0,42 ммоль), карбонат калия (0,42 мкл, водный раствор, 2 М, 0,84 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (51 мг, 0,06 ммоль) и 1,4-диоксан (2 мл) герметично закрывают и подвергают ВЧ нагреву до 140°С в течение 15 мин. Анализ аликвоты (ЖХМС) указывает на полное расходование исходных веществ и образование требуемого продукта. Реакционную смесь последовательно обрабатывают с помощью Н2O/EtOAc/Na2SO4/фильтрация/концентрирование и получают темное масло. Полученное масло очищают на SiO2 (препаративная ТСХ, 5% EtOAc/5% гексан/90% DCM) и получают продукт и примеси в виде темного масла. Указанное масло очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), проводя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.). Соответствующие фракции собирают, объединяют и упаривают в вакууме, получая 250 мг стеклообразного вещества темно-зеленого цвета. Анализ методом ТСХ (30% EtOAc/гексан) дает темное основное пятно и следы примесей ниже и выше пятна соединения. Указанное стеклообразное вещество темно-зеленого цвета далее очищают на SiO2 (препаративная ТСХ, 100% DCM) и получают указанное в названии соединение. ЖХМС (ESI): рассчитано = 763,12; найдено = 764,09 (М+1)+.
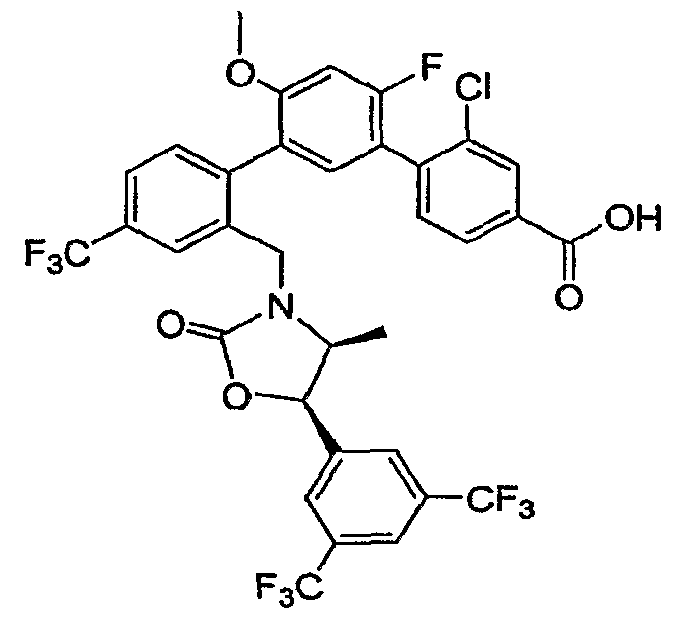
Стадия Е: 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2-хлор-6'-фтор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-2-хлор-6'-фтор-4'-метокси-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат (84,5 мг, 0,11 ммоль), моногидрат гидроксида лития (46,2 мг, 1,1 ммоль), воду (1 мл) и 1,4-диоксан (2 мл) перемешивают при комнатной температуре. Анализ методом ЖХМС аликвоты, взятой через 2 час от начала проведения реакции, указывает на полное завершение реакции. Летучие вещества удаляют при пониженном давлении. Остаток растворяют в MeCN и подкисляют с помощью HCl (1N раствор), получая прозрачный раствор. Указанный раствор очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), проводя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.). Соответствующие фракции собирают, объединяют и упаривают в вакууме, получая бесцветное стеклообразное вещество. Указанное стеклообразное вещество растворяют в DCM и промывают водой. Органические экстракты объединяют, сушат над Na2SO4, фильтруют и упаривают, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 749,10; найдено = 750,06 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, смесь 1:1 атропоизомеров) δ 8,21 (дд, J=10, 2 Гц, 1Н), 8,03 (дд, J=8,2 Гц, 1H), 7,86 (с, 1H), 7,73-7,68 (м, 1,5H), 7,68-7,62 (м, 2,5H), 7,48 (т, J=7,5 Гц, 1H), 7,41 (дд, J=11, 8 Гц, 1H), 7,17 (дд, J=8,5, 2 Гц, 1H), 6,86 (дд, J=11, 3,5 Гц, 1H), 6,60 (д, J=8 Гц, 0,5H), 5,40 (д, J=8 Гц, 0,5H), 4,94 (т, J=15 Гц, 1H), 4,18 (д, J=16 Гц, 0,5H), 3,95 (д, J=16 Гц, 0,5H), 3,87 (с, 3H), 3,85-3,74 (м, 1H), 0,56 (д, J=6,5 Гц, 1,5H), 0,46 (д, J=6,5 Гц, 1,5H).
ПРИМЕР 73
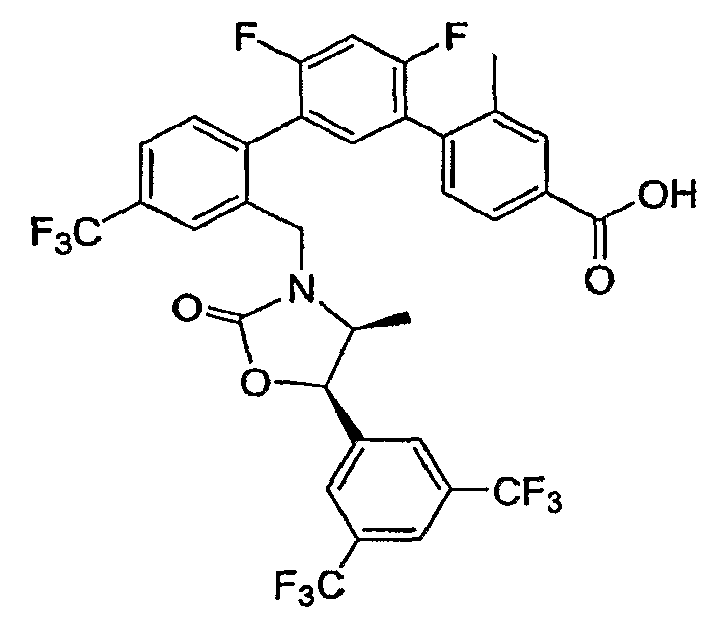
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4',6'-дифтор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
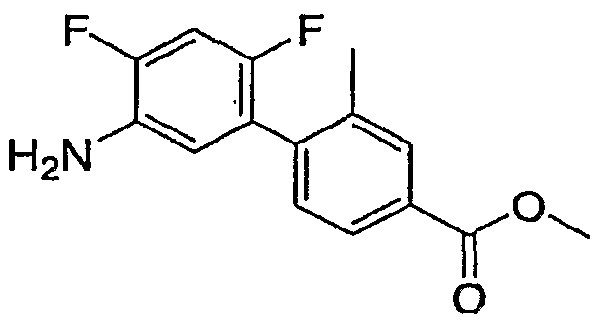
Стадия А: метил 5'-амино-2',4'-дифтор-2-метилбифенил-4-карбоксилат
1-Бром-2,4-дифторанилин (500 мг, 2,40 ммоль), метил 3-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоат (Промежуточное соединение 16, 797 мг, 2,88 ммоль), карбонат натрия (2,40 мл, 2 М водного раствора, 2,88 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (196 мг, 0,24 ммоль) и этанол (15 мл) нагревают до 80°С на масляной бане в течение 3 час, а затем оставляют на ночь остывать до комнатной температуры. Летучие вещества удаляют при пониженном давлении. Остаток последовательно подвергают обработкам DCM/насыщенный раствор соли/Na2SO4/фильтрация/концентрация и получают темное масло. Указанное масло очищают флэш-хроматографией (SiO2, картридж Biotage 40+M). Колонну промывают в градиенте от 0% до 40% EtOAc/гексан. Соответствующие фракции собирают и концентрируют в вакууме, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 277,09; найдено = 278,03 (М+1)+.
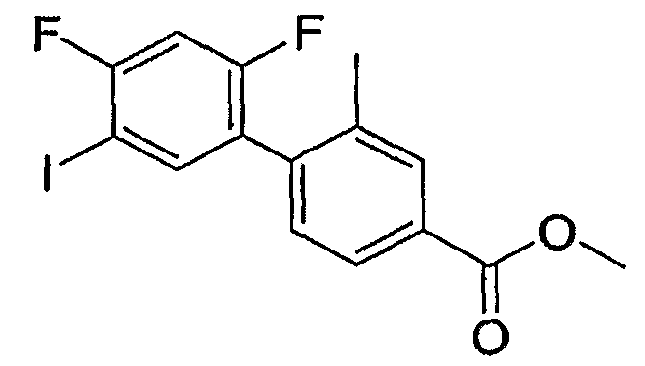
Стадия В: метил 2',4'-дифтор-5'-иод-4'-метилбифенил-4-карбоксилат
Метил 5'-амино-2',4'-дифтор-2-метилбифенил-4-карбоксилат (550 мг, 1,80 ммоль), 3-метилбутилнитрит (317 мг, 2,71 ммоль), иод (549 мг, 2,16 ммоль) и хлороформ (15 мл) кипятят с обратным холодильником на масляной бане в течение 5 час, а затем оставляют на ночь остывать до комнатной температуры. Реакционную смесь очищают флэш-хроматографией (SiO2, картридж Biotage 40+M) градиентным элюированием в смеси EtOAc/гексан. Соответствующие фракции собирают и концентрируют в вакууме, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 387,98; найдено = 388,92 (М+1)+.
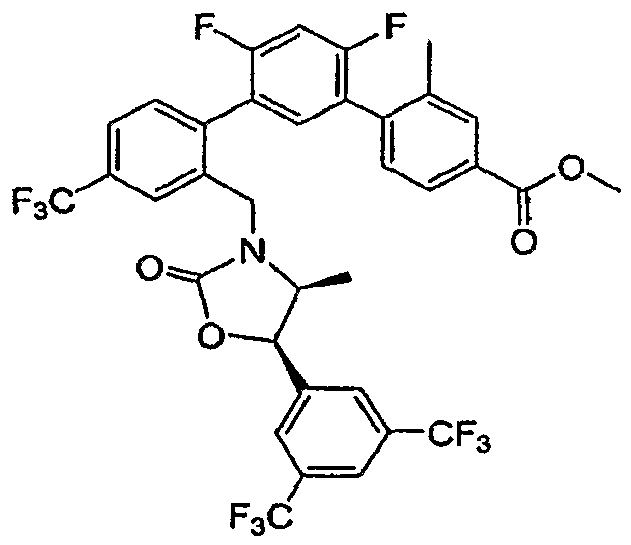
Стадия С: метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4',6'-дифтор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Метил 2',4'-дифтор-5'-иод-4'-метилбифенил-4-карбоксилат (100 мг, 0,26 ммоль,растворен в 1 мл этанола), (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)бензил]-1,3-оксазолидин-2-он (Промежуточное соединение 9, 185 мг, 0,31 ммоль,растворен в 2,2 мл 1,4-диоксана), карбонат натрия (258 мкл, 2 М водный раствор, 0,516 ммоль) и 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (42 мг, 0,05 ммоль) нагревают до 80°С в течение 2 час. Анализ аликвоты методом ЖХМС указывает на полное завершение реакции. Реакционную смесь сушат/Na2SO4, а затем наносят на 2 пластинки препаративной ТСХ (SiO2). Пластинки проявляют смесью 20% EtOAc/гексан и получают бесцветное стеклообразное вещество. Указанное стеклообразное вещество дополнительно очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), проводя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.). Соответствующие фракции собирают, объединяют и упаривают в вакууме, получая бесцветное стеклообразное вещество. Указанное стеклообразное вещество растворяют в DCM и промывают водой. Органические экстракты объединяют, сушат над Na2SO4, фильтруют и упаривают, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 731,15; найдено = 732,06 (М+1)+.
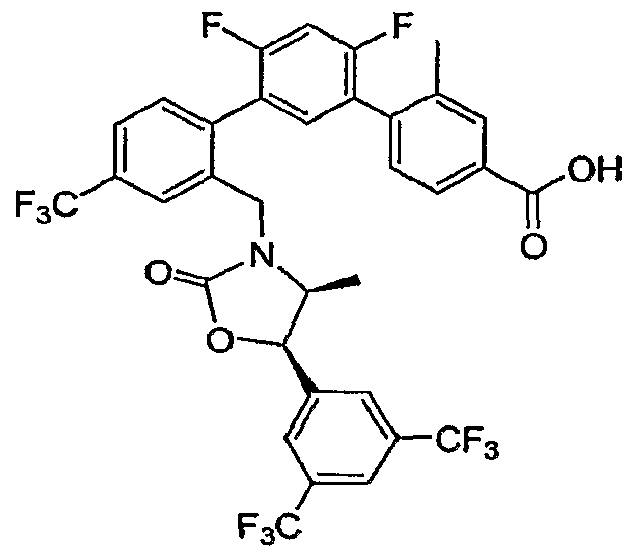
Стадия D: 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4',6'-дифтор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4',6'-дифтор-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат (73,5 мг, 0,10 ммоль), моногидрат гидроксида лития (42 мг, 1 ммоль), воду (1 мл) и 1,4-диоксан (2 мл) перемешивают при комнатной температуре в течение 2 час. Летучие вещества удаляют при пониженном давлении. Остаток растворяют в смеси MeCN/1N HCl (водный раствор) и очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), проводя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.). Соответствующие фракции собирают, объединяют и упаривают в вакууме, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 717,14; найдено = 718,17 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,04 (с, 1H), 7,97 (д, J=8 Гц, 1H), 7,88 (с, 1H), 7,74-7,67 (м,4H), 7,51-7,45 (м, 1H), 7,34 (д, J=8 Гц, 1H), 7,19 (шир. с, 1H), 7,09 (т, J=9 Гц, 1H), 5,59 (д, J=8 Гц, 1H), 5,08-4,80 (м, 1H), 4,20-3,78 (м, 2H), 2,32 (с, 3H), 0,62 (с, 3H).
ПРИМЕР 74
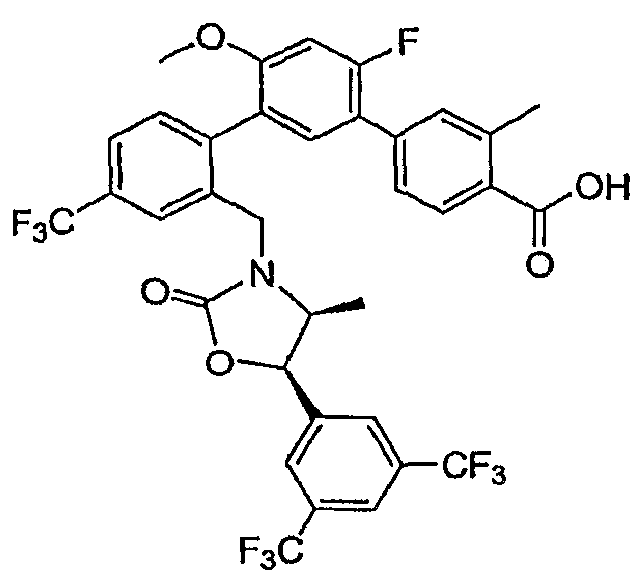
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6'-фтор-4'-метокси-3-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
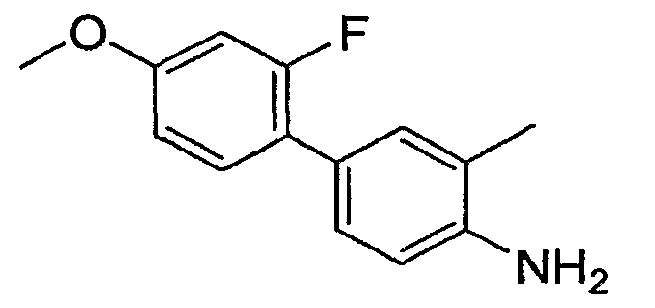
Стадия А: 2'-фтор-4'-метокси-3-метилбифенил-4-амин
(2-Фтор-4-метоксифенил)бороновую кислоту (356,7 мг, 2,1 ммоль), 4-бром-2-метиланилин (391 мг, 2,1 ммоль), карбонат калия (3,15 мл, 2 М водного раствора, 6,3 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (257 мг, 0,31%мол.) и этанол (12 мл) нагревают до 80°С на масляной бане. По данным ТСХ (40% EtOAc/гексан) и ЖХМС реакция полностью заканчивается через 1 час. Летучие вещества удаляют при пониженном давлении. Остаток последовательно подвергают обработкам DCM/насыщенный раствор соли/Na2SO4/фильтрация/концентрирование и получают темное масло. Указанное масло очищают флэш-хроматографией (SiO2, картридж Biotage 40+M). Колонну промывают в градиенте от 0% до 40% EtOAc/гексан. Соответствующие фракции собирают и концентрируют в вакууме, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 231,11; найдено = 232,09 (М+1)+.
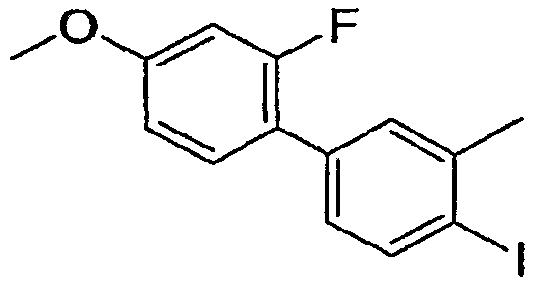
Стадия В: 2'-фтор-4'-иод-3-метилбифенил-4-ил метиловый эфир
2'-Фтор-4'-метокси-3-метилбифенил-4-амин (190 мг, 0,822 ммоль), 3-метилбутилнитрит (144,4 мг, 1,233 ммоль), иод (251 мг, 0,986 ммоль) и хлороформ (7 мл) кипятят с обратным холодильником на масляной бане в течение 3,5 час, а затем оставляют на ночь охлаждаться до комнатной температуры. Реакционную смесь очищают флэш-хроматографией (SiO2, картридж Biotage 40+M), проводя градиентное элюирование смесью EtOAc/гексан. Соответствующие фракции собирают и концентрируют в вакууме, получая указанное в названии соединение. Анализ методом ЖХМС показывает, что твердое вещество имеет чистоту приблизительно 70А %. ЖХМС (ESI): рассчитано = 341,99; найдено = 241,94 (М)+.
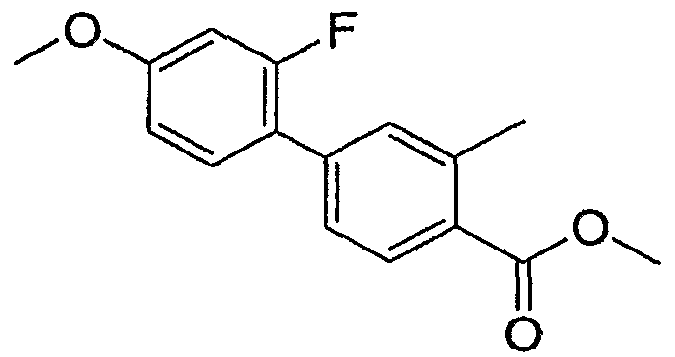
Стадия С: метил 2'-фтор-4'-метокси-3-метилбифенил-4-карбоксилат
2'-Фтор-4'-иод-3-метилбифенил-4-ил метиловый эфир (289 мг, 0,845 ммоль), хлорид транс-бис(трифенилфосфин)палладия(II) (59,3 мг, 0,08 ммоль), триэтиламин (177 мкл, 1,27 ммоль) и метанол (5 мл) встряхивают в атмосфере монооксида углерода (50 фунтов на кв. дюйм) при температуре 60°С в течение 17 час. Анализ аликвоты указывает на полное расходование исходных веществ и дает пик m/e 275 (основной пик). Реакционную смесь очищают на SiO2 (препаративная ТСХ, 20% EtOAc/гексан) и получают указанное в названии соединение. ЖХМС (ESI): рассчитано = 274,10; найдено = 275,09 (М+1)+.
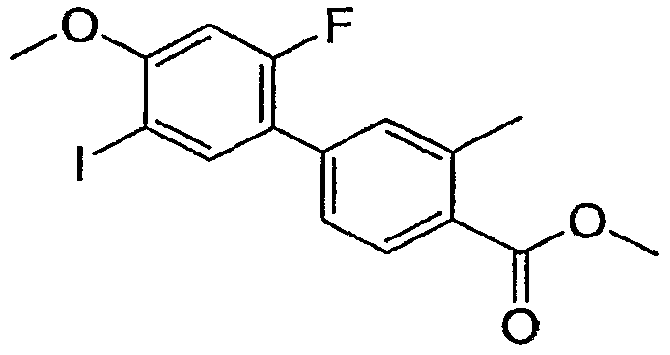
Стадия D: метил 2'-фтор-5'-иод-4'-метокси-3-метилбифенил-4-карбоксилат
Метил 2'-фтор-4'-метокси-3-метилбифенил-4-карбоксилат (100 мг, 0,365 ммоль), метанол (3 мл), иод (93 мг, 0,366 ммоль) и сульфат серебра (114 мг, 0,366 ммоль) перемешивают при комнатной температуре в течение 1,5 час. Реакцию прерывают, добавив Na2SO3 (насыщенный водный раствор). Летучие вещества удаляют из серо-коричневой смеси. Остаток последовательно подвергают обработкам Н2О/EtOAc/Na2SO4/фильтрация/концентрирование и получают указанное в названии соединение. ЖХМС (ESI): рассчитано = 400,00; найдено = 400,96 (М+1)+.
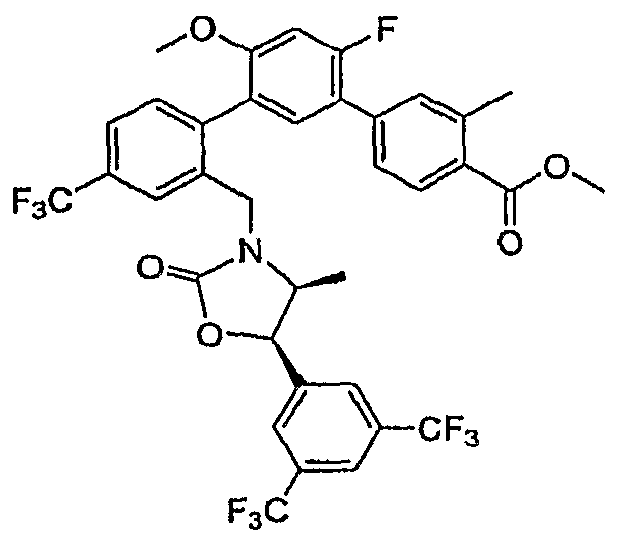
Стадия Е: метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6'-фтор-4'-метокси-3-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
Метил 2'-фтор-5'-иод-4'-метокси-3-метилбифенил-4-карбоксилат (135 мг, 0,337 ммоль), (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)бензил]-1,3-оксазолидин-2-он (Промежуточное соединение 9, 403 мг, 0,675 ммоль,растворен в 2,75 мл 1,4-диоксана), карбонат натрия (337 мкл, 2 М водный раствор, 0,674 ммоль) и 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид дихлорметановый аддукт (55 мг, 0,07 ммоль) нагревают на масляной бане до 80°С в течение 2 час, а затем оставляют на ночь остывать до комнатной температуры. Добавляют дополнительное количество (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)бензил]-1,3-оксазолидин-2-она (Промежуточное соединение 9, 200 мг, 0,335 ммоль,растворен в 2,35 мл 1,4-диоксана) и продолжают нагрев еще в течение 2 час. Анализ аликвоты указывает на присутствие М+23 (ЖХМС). Реакционную смесь охлаждают, сушат/Na2SO4, а затем наносят на пластинки препаративной ТСХ (SiO2). Пластинки проявляют смесью 30% DCM/гексан и получают 350 мг масла зеленого цвета. Указанное зеленое масло/стеклообразное вещество дополнительно очищают методом препаративной ТСХ (SiO2, 20% EtOAc/гексан) и получают указанное в названии соединение. ЖХМС (ESI): рассчитано = 743,17; найдено = 744 (М+1)+.
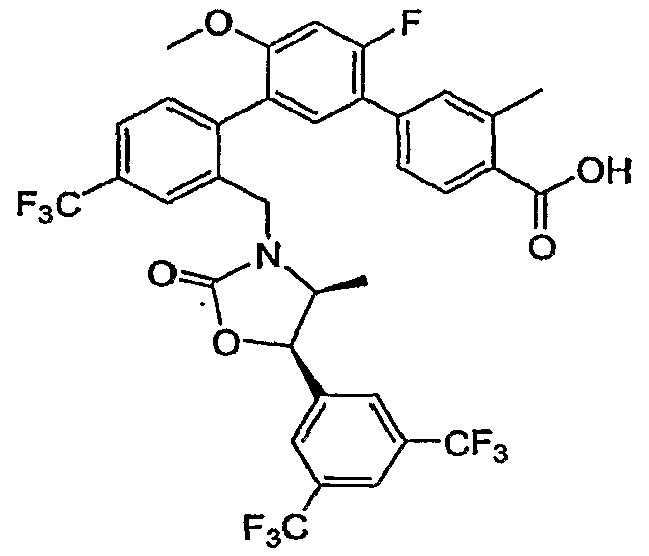
Стадия F: 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6'-фтор-4'-метокси-3-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
Метил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-6'-фтор-4'-метокси-3-метил-4"-(три-фторметил)-1,1':3',1"-терфенил-4-карбоксилат (55 мг, 0,074 ммоль), моногидрат гидроксида лития (31 мг, 0,74 ммоль), воду (1 мл) и 1,4-диоксан (2 мл) оставляют на ночь перемешиваться при комнатной температуре. Анализ аликвоты методом ЖХМС указывает на полное завершение реакции. Реакционную смесь подкисляют с помощью HCl (1N водный раствор). Летучие вещества удаляют при пониженном давлении. Остаток растворяют в смеси вода/MeCN и очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), проводя градиентное элюирование смесью MeCN (0,1% TFA, об./об.)/Н2О (0,1% TFA, об./об.). Соответствующие фракции собирают, объединяют и упаривают в вакууме, получая стеклообразное вещество светло-желтого цвета. Указанный остаток растворяют в EtOAc и промывают водой (10 мл ×2), отделяют, сушат над Na2SO4, фильтруют и концентрируют, получая указанное в названии соединение.
ЖХМС (ESI): рассчитано = 729,16; найдено = 730,15 (М+1)+.Спектр 1Н ЯМР (CDCl3, 500 МГц, смесь 1:1 атропоизомеров) δ 8,10 (т, J=7,8 Гц, 1H), 7,85 (д, J=5 Гц, 1Н), 7,70 (с, 1,5H), 7,66 (д, J=8 Гц, 1H), 7,62 (с, 1,5H), 7,47-7,38 (м, 3H), 7,30-7,25 (м, 1H), 6,85 (дд, J=12,5,3Гц, 1H), 5,61 (д, J=8Гц, 0,5H), 5,31 (д,J= 8 Гц, 0,5H), 4,94 (д, J=4,5 Гц, 0,5H), 4,91 (д, J=4 Гц, 0,5H), 4,15 (д, J=16,5 Гц, 0,5H), 3,93 (д, J=16 Гц, 0,5H), 3,86 (с, 3H), 3,86-3,76 (м, 1Н), 2,68 (с, 3H), 0,57 (д, J=6,5 Гц, 1,5H), 0,46 (д, J=6,5 Гц, 1,5H).
ПРИМЕР 75
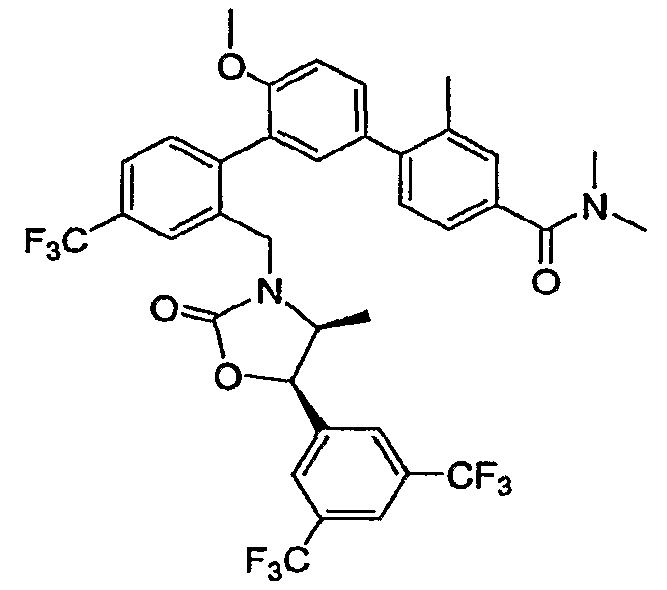
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-N,N,2-триметил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксамид
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту (Пример 30, 300 мг, 0,42 ммоль), гидрохлорид N-метилметанамина (41 мг, 0,50 ммоль), гидрохлорид N-[3-(диметиламино)пропил]-N'-этилкарбодиимида (121 мг, 0,63 ммоль), гидрат 1Н-1,2,3-бензотриазол-1-ола (86 мг, 0,56 ммоль) и триэтиламин (146 мкл, 1,05 ммоль) перемешивают в DCM (5 мл) при комнатной температуре в течение 1,5 час. Анализ аликвоты, взятой по прошествии указанного времени, показывает образование требуемого продукта и полное расходование исходных веществ. Реакционную смесь разбавляют с помощью MeCN и очищают методом препаративной ВЭЖХ с обращенной фазой (Kromasil 100-5C18, 100×21,1 мм), элюируя смесью (ацетонитрил + 0,1% TFA, об./об.)/(Н2О + 0,1% TFA, об./об.) (от 10% до 100% в течение 10 мин, затем устанавливают 100% в течение 2 мин, 20 мл/мин) и получают твердое вещество в виде пены. Указанную пену растворяют в EtOAc и промывают с помощью NaHCO3 (насыщенный водный раствор), а затем водой. Водную фазу отделяют от экстрактов. Водные фазы объединяют и вновь экстрагируют с помощью EtOAc. Экстракты объединяют, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая указанное в названии соединение. ЖХМС (ESI): рассчитано = 738,21; найдено = 739,41 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, смесь 1:1 атропоизомеров) δ 7,85 (с, 0,5H), 7,71 (с, 0,5H), 7,69 (с, 1H), 7,67-7,62 (м, 2,5H), 7,44 (д, J=8 Гц, 0,5H), 7,41 (д, J=8,5 Гц, 0,5H), 7,36 (т, J=7,5 Гц, 1Н), 7,32 (д, J=8 Гц, 1H), 7,25 (с, 0,5H), 7,23 (с, 1H), 7,19 (д, J=8 Гц, 0,5H), 7,12 (т, J= 2 Гц, 1H), 7,07 (д, J=7 Гц, 0,5H), 7,05 (д, J=7 Гц, 0,5H), 5,58 (д, J=8 Гц, 0,5H), 5,30 (д, J=8 Гц, 0,5H), 4,96 (д, J=16 Гц, 1Н), 4,16 (д, J=16 Гц, 0,5H), 3,97 (д, J=15,5 Гц, 0,5H), 3,86 (с, 3H), 3,81-3,73 (м, 1H), 3,11 (с, 3H), 3,02 (с, 3H), 2,33 (с, 1,5H), 2,27 (с, 1,5H), 0,54 (д,J=6,5Гц, 1,5H), 0,41 (д, J=6,5 Гц, 1,5H).
Следующие соединения получают в соответствии с общей методикой, приведенной в Примере 21.
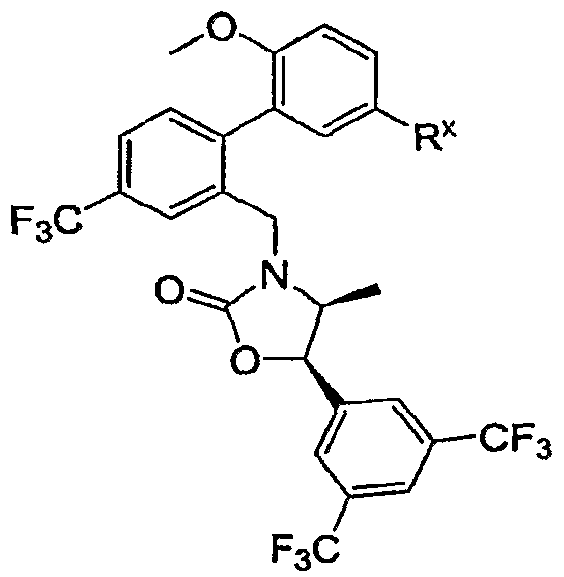
|
Следующие соединения получают в соответствии с общей методикой, приведенной в Примере 1.
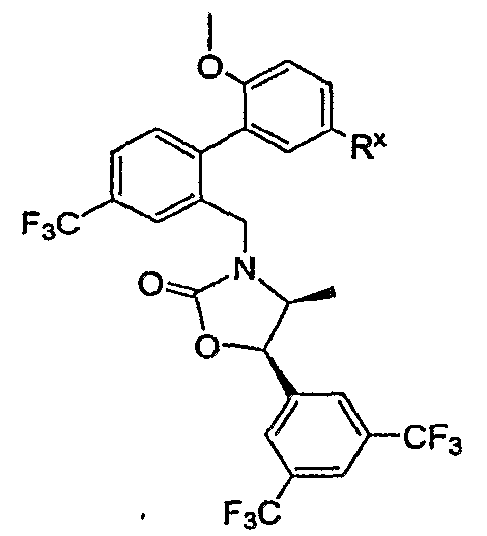
|
ПРИМЕР 83
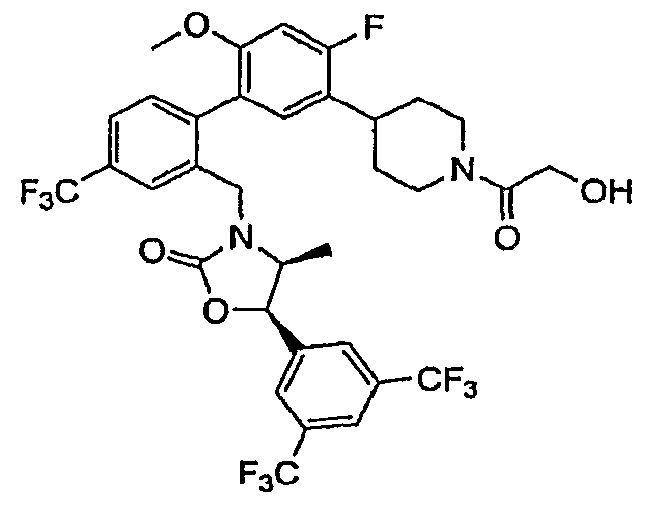
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-{[4'-фтор-5'-(1-гликолоилпиперидин-4-ил)-2'-метокси-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
Стадия А: 2-[4-(2-фтор-5-иод-4-метоксифенил)пиперидин-1-ил]-2-оксоэтил ацетат
К перемешиваемому раствору 4-(2-фтор-5-иод-4-метокси-фенил)пиперидина (50 мг; 0,149 ммоль) в ДМФА (1,2 мл) в атмосфере азота добавляют N,N-диизопропилэтиламин (26 мкл; 0,149 ммоль), а затем ацетоксиацетилхлорид (16 мкл, 0,149 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 5 час. Реакционную смесь перераспределяют между EtOAc (25 мл) и насыщенным раствором NaHCO3 (25 мл). Водный слой экстрагируют с помощью EtOAc (3×25 мл), органические фракции объединяют и промывают водой и насыщенным раствором соли (каждый раз по 25 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией на силикагеле, элюируя смесью EtOAc/гексан, и получают 2-[4-(2-фтор-5-иод-4-метоксифенил]пиперидин-1-ил-2-оксоэтил ацетат в виде бесцветного масла. ЖХМС = 435,8 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,52 (д, J=8,2 Гц, 1Н), 6,56 (д, J=12,2 Гц, 1Н), 4,76 (с, 2Н), 4,76-4,70 (м, 1H), 3,85 (с, 3Н), 3,76 (шир. д, J=13 Гц, 1Н), 3,17 (т, J=12,6 Гц, 1Н), 2,98 (тт, J=12,1, 3,4 Гц, 1Н), 2,68 (т, J=12,4 Гц, 1Н), 2,20 (с, 3Н), 1,90-1,82 (м, 2Н), 1,70-1,62 (м, 2Н).
Стадия В: 2-{4-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-фтор-6-метокси-4'-(трифторметил)бифенил-3-ил]пиперидин-1-ил}-2-оксоэтил ацетат
К смеси 2-[4-(2-фтор-5-иод-4-метоксифенил)пиперидин-1-ил]-2-оксоэтил ацетата (Стадия А; 33 мг; 0,076 ммоль) и (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)бензил]-1,3-оксазолидин-2-она (Промежуточное соединение 9, 68 мг, 0,114 ммоль) добавляют 1,1'-бис(ди-трет-бутилфосфино)ферроцен-палладий дихлорид (~5 мг), как указано ранее. Продукт очищают методом хиральной ВЭЖХ (колонка ChiralPak IA, 15% изопропанол/гептан) и получают 2-{4-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-фтор-6-метокси-4'-(трифторметил)бифенил-3-ил]пиперидин-1-ил}-2-оксоэтил ацетат в виде бесцветного стеклообразного вещества. ЖХМС = 779,0 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, смесь атропоизомеров) δ 7,86 (с, 1Н), 7,69 (с, 2Н), 7,68-7,60 (м, 2Н), 7,32 (д, J=7,8 Гц, 1Н), 6,96-6,91 (м, 1Н), 6,72 (дд, J=11,9, 2,1 Гц, 1Н), 5,59-5,54 (м, 1Н), 4,90 (д, J=15,6 Гц, 1Н), 4,80-4,65 (м, 3Н), 4,13-4,04 (м, 1Н), 3,88-3,72 (м, 2Н), 3,78 (с, 3Н), 3,21-3,04 (м, 2Н), 2,72-2,67 (м, 1Н), 2,17 (с, 3Н), 1,96-1,83 (м, 2Н), 1,70-1,59 (м, 2Н), 0,42-0,39 (м, 3Н).
Стадия С: (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[4'-фтор-5'-(1-гликолоилпиперидин-4-ил)-2'-метокси-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он
К перемешиваемому раствору 2-{4-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-фтор-6-метокси-4'-(трифторметил)бифенил-3-ил]пиперидин-1-ил}-2-оксоэтил ацетата (24 мг, 0,031 ммоль) в МеОН (1 мл) в атмосфере азота добавляют метоксид натрия (6,66 мг, 0,031 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 15 мин. Добавляют воду (10 мл) и смесь экстрагируют с помощью EtOAc (3×10 мл). Органические фракции объединяют и промывают насыщенным раствором соли (10 мл), сушат (над MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией на силикагеле (0-100% EtOAc/гексан) и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[4'-фтор-5'-(1-гликолоилпиперидин-4-ил)-2'-метокси-4-(трифторметил)бифенил-2-ил]метил}-4-метил-1,3-оксазолидин-2-он в виде смолы желтого цвета. ЖХМС = 737,1 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, смесь атропоизомеров) δ 7,87 (с, 1Н), 7,69 (с, 2Н), 7,68-7,60 (м, 2Н), 7,34-7,30 (м, 1Н), 6,96-6,91 (м, 1Н), 6,72 (д, J=11,9 Гц, 1Н), 5,44 (д, J=7,8 Гц, 1Н), 4,90 (д, J=15,8 Гц, 1Н), 4,78-4,70 (м, 1Н), 4,18-4,13 (м, 2Н), 3,78 (с, 3Н), 3,62-3,54 (м, 1Н), 3,15-3,05 (м, 2Н), 2,82-2,73 (м, 1Н), 1,96-1,84 (м, 2Н), 1,70-1,52 (м, 4 H), 0,43-0,39 (м, 3Н).
Приведенные ниже соединения получают в соответствии с общей методикой, приведенной в Примере 83.
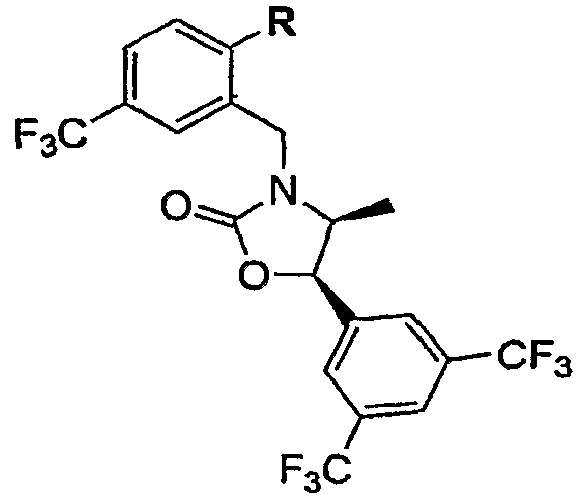
|
|
ПРИМЕР 94
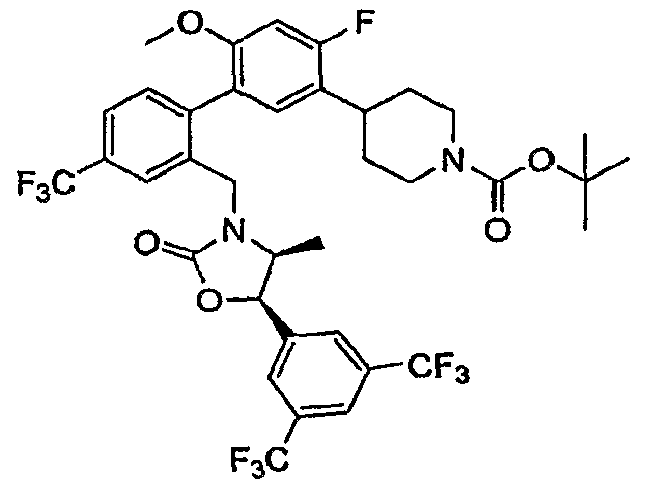
трет-Бутил 4-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-фтор-6-метокси-4'-(трифторметил)бифенил-3-ил]пиперидин-1-карбоксилат
К смеси трет-бутил 4-(2-фтор-5-иод-4-метоксифенил)пиперидин-1-карбоксилата (58 мг; 0,133 ммоль) и (4S,5R)-5-[3,5-бис(три-фторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диокса-боролан-2-ил)-5-(трифторметил)бензил]-1,3-оксазолидин-2-она (111 мг, 0,187 ммоль) добавляют 1,1'-бис(ди-трет-бутилфосфино)ферроцен-палладий дихлорид (~10 мг), как указано ранее. Продукт очищают методом хиральной ВЭЖХ (колонка ChiralPak OD, 10% изопропанол/гептан) и получают трет-бутил 4-[2'-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-фтор-6-метокси-4'-(трифторметил)бифенил-3-ил]пиперидин-1-карбоксилат в виде бесцветного стеклообразного вещества. ЖХМС = 678,8 (М+1-100)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, смесь атропоизомеров) δ 7,86 (с, 1Н), 7,69 (с, 2Н), 7,64-7,61 (м, 2Н), 7,32 (д, J=8 Гц, 1Н), 6,96 (д, J=8,4 Гц, 1Н), 6,70 (д, J=11,9 Гц, 1Н), 5,57 (д, J=8 Гц, 1Н), 4,88 (д, J=15,8 Гц, 1Н), 4,26-4,17 (м, 2Н), 3,86 (д, J=15,8 Гц, 1Н), 3,83-3,78 (м, 1Н), 3,77 (с, 3Н), 3,01-2,93 (м, 1Н), 2,84-2,75 (м, 2Н), 1,84-1,69 (м, 2Н), 1,64-1,50 (м, 2Н), 1,45 (с, 9 H), 0,38 (д, J=6,7 Гц, 3Н).
ПРИМЕР 95
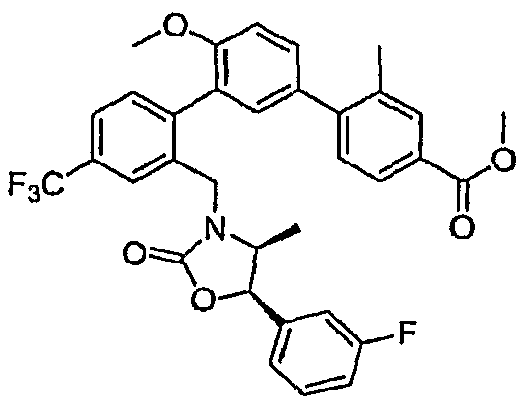
Метил 2"-{[(4S,5R)-5-(3-фторфенил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
При 0°С к раствору (4S,5R)-5-(3-фторфенил)-4-метил-1,3-оксазолидин-2-она (16,2 мг, 0,0830 ммоль) в ДМФА (1 мл) добавляют NaHMDS (83 мкл, 0,083 ммоль). Затем через канюлю добавляют раствор метил 2"-(бромметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (49 мг, 0,0996 ммоль) в ДМФА (1 мл). Через 5 мин реакцию прерывают с помощью насыщенного раствора NH4Cl (10 мл) и разбавляют с помощью EtOAc (20 мл). Водный слой экстрагируют с помощью EtOAc (20 мл) и органические фракции объединяют, промывают насыщенным раствором соли (10 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают флэш-хроматографией на силикагеле (от 5 до 25% EtOAc/гексан) и получают метил 2"-{[(4S,5R)-5-(3-фторфенил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат. ЖХМС = 608,2 (М+1-100)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, присутствуют ротамеры) δ 7,94 (д, J=5,9 Гц, 1H), 7,87 (д, J=7,8 Гц, 1H), 7,71-7,61 (м, 2H), 7,41-7,36 (м, 2H), 7,33-7,24 (м, 2H), 7,14-7,12 (м, 1H), 7,07-7,05 (м, 1H), 7,02-6,90 (м, 3H), 5,46 (д, J=8,2 Гц), 5,24 (д, J=8,2 Гц), 4,90 (д, J=15,8 Гц), 4,82 (д, J=15,8 Гц), 4,20 (д, J=15,8 Гц), 3,97 (д, J=15,8 Гц), 3,92 (с, 3H), 3,95 (с, 3H), 3,75-3,69 (м, 1H), 2,36 (с), 2,31 (с), 0,53 (д, J=6,6 Гц), 0,43 (д, J=6,6 Гц).
ПРИМЕР 96
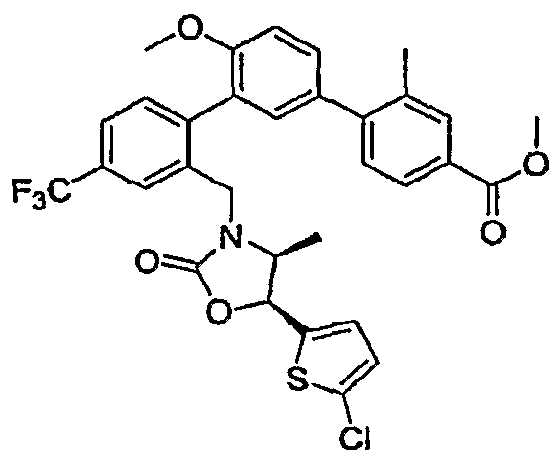
Метил 2"-{[(4S,5S)-5-(5-хлор-2-тиенил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
К раствору (4S,5S)-5-(5-хлор-2-тиенил)-4-метил-1,3-оксазолидин-2-она (39,9 мг, 0,184 ммоль) в ДМФА (1,8 мл) добавляют t-BuOK (21,1 мг, 0,183 ммоль). Реакционную смесь перемешивают в течение 15 мин, а затем через канюлю добавляют раствор метил 2"-(бромметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (90 мг, 0,184 ммоль) в ДМФА (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 час, а затем прерывают реакцию с помощью насыщенного раствора NH4Cl (10 мл) и разбавляют с помощью EtOAc (20 мл), промывают насыщенным раствором соли (10 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией с обращенной фазой (С-18, от 10 до 95% MeCN/вода с 0,1% TFA) и получают метил 2"-{[(4S,5S)-5-(5-хлор-2-тиенил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат. Rf = 0,43 (50% EtOAc/гексан). ЖХМС = 629,7 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, присутствуют ротамеры) δ 7,88-7,71 (м, 3H), 7,67-7,48 (м, 2H), 7,28-7,12 (м, 2H), 7,00-6,92 (м, 2H), 6,66-6,55 (м, 2H), 5,42 (д, J=8,0 Гц), 5,21 (д, J=8,0 Гц), 4,70 (д, J=16,0 Гц), 4,58 (д, J=16,0 Гц), 4,14 (д, J=16,0 Гц), 3,88 (д, J=16,0 Гц), 3,79 (м, 3H), 3,72-3,71 (м, 3H), 3,58-3,55 (м, 1H), 2,23 (с), 2,20 (с), 0,59 (д, J=6,4 Гц), 0,51 (д, J=6,4 Гц).
Аналогично синтезируют следующее соединение:
|
ПРИМЕР 98
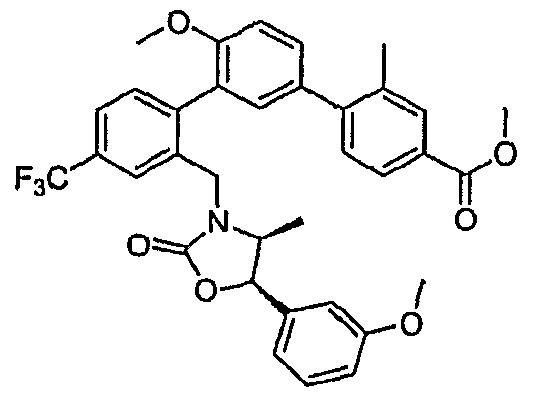
Метил 4'-метокси-2"-{[(4S,5R)-5-(3-метоксифенил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
При 0°С к раствору бензил [(1S,2R)-2-гидрокси-2-(3-метоксифенил)-1-метилэтил]карбамата (40 мг, 0,126 ммоль) в ДМФА (1,5 мл) добавляют NaHMDS (0,246 мл 1 М раствора в ТГФ, 0,246 ммоль). По прошествии 5 мин через канюлю добавляют раствор метил 2"-(бромметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (68 мг, 0,138 ммоль) в ДМФА (2,5 мл). Через 5 мин реакцию прерывают, добавив насыщенный раствор NH4Cl (10 мл), разбавляют с помощью EtOAc (20 мл), промывают насыщенным раствором соли (10 мл), сушат над Na2SO4, фильтруют и концентрируют. Очистка остатка флэш-хроматографией на силикагеле (от 0 до 25% ацетон/гексан) с последующей хроматографией с обращенной фазой (С-18, от 10 до 95% MeCN/вода с 0,1% TFA) дает метил 4'-метокси-2"-{[(4S,5R)-5-(3-метоксифенил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат. ЖХМС = 644,0 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, присутствуют ротамеры) δ 7,94-7,86 (м, 2H), 7,71-7,62 (м, 2H), 7,43-7,36 (м, 2H), 7,31-7,22 (м, 2H), 7,3 (м, 1H), 7,08-7,05 (м, 1H), 6,85-6,83 (м, 1H), 6,75-6,68 (м, 2H), 5,45 (д, J=8,0 Гц), 5,23 (д, J=8,0 Гц), 4,89 (д, J=16,0 Гц), 4,82 (д, J=16,0 Гц), 4,20 (д, J=15,8 Гц), 3,96 (д, J=15,8 Гц), 3,91 (с, 3H), 3,85 (с, 3H), 3,77-3,75 (м, 3H), 3,72-3,69 (м, 1H), 2,31 (с), 2,08 (с), 0,54 (д, J=6,4 Гц), 0,44 (д, J=6,4 Гц).
Аналогично синтезируют следующее соединение:
|
ПРИМЕР 100
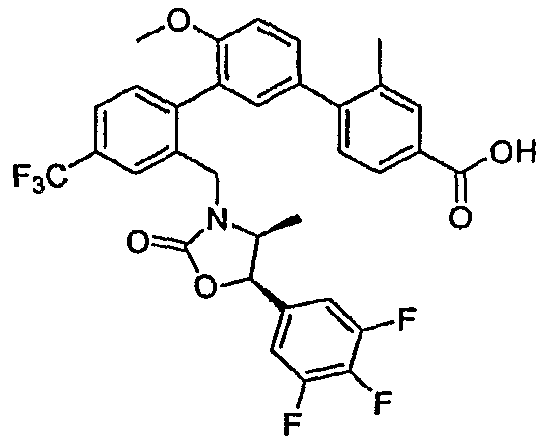
4'-Метокси-2-метил-2"-{[(4S,5R)-4-метил-2-оксо-5-(3,4,5-трифторфенил)-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
К раствору метил 4'-метокси-2-метил-2"-{[(4S,5R)-4-метил-2-оксо-5-(3,4,5-трифторфенил)-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (23 мг, 0,0358 ммоль) в МеОН (1 мл) добавляют 4 М раствор КОН (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 час, а затем прерывают реакцию, добавив 1N раствор HCl (5 мл), и разбавляют с помощью EtOAc (15 мл). Водный слой экстрагируют с помощью EtOAc (10 мл), органические экстракты объединяют, промывают насыщенным раствором соли (10 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией с обращенной фазой (С-18, от 10 до 95% MeCN/вода с 0,1% TFA) и получают 4'-метокси-2-метил-2"-{[(4S,5R)-4-метил-2-оксо-5-(3,4,5-трифторфенил)-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС = 629,9 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, присутствуют ротамеры) δ 8,01-7,93 (м, 2H), 7,70-7,62 (м, 2H), 7,43-7,38 (м, 2H), 7,33-7,30 (м, 1Н), 7,14-7,12 (м, 1Н), 7,09-7,06 (м, 1Н), 6,88-6,80 (м, 2H), 5,39 (д, J=8,0 Гц), 5,15 (д, J=8,0 Гц), 4,92 (д, J=15,6 Гц), 4,86 (д, J=15,6 Гц), 4,16 (д, J=15,8 Гц), 3,95 (д, J=15,8 Гц), 3,86 (м, 3H), 3,72-3,69 (м, 1H), 2,38 (с), 2,34 (с), 0,57 (д, J=6,6 Гц), 0,46 (д, J=6,6 Гц).
Аналогично синтезируют следующие соединения:
|
ПРИМЕР 105
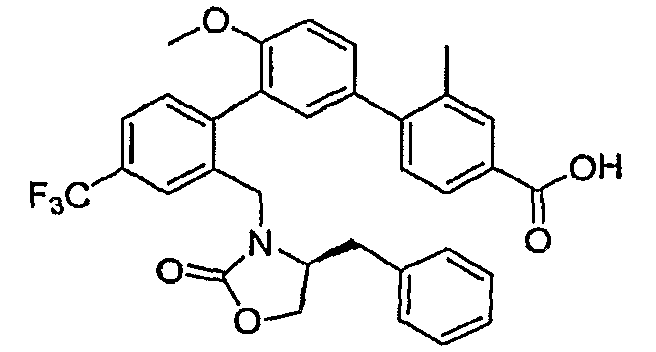
2"-{[(4S)-4-Бензил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
К раствору (4S)-4-бензил-1,3-оксазолидин-2-она (29,8 мг, 0,168 ммоль) в ДМФА (1,5 мл) добавляют t-BuOK (17,5 мг, 0,152 ммоль). По прошествии 10 мин через канюлю добавляют раствор метил 2"-(бромметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (75 мг, 0,152 ммоль) в ДМФА (1,5 мл). Реакционную смесь перемешивают в течение 30 мин, а затем прерывают реакцию, добавив насыщенный раствор NH4Cl (10 мл), разбавляют с помощью EtOAc (15 мл), промывают насыщенным раствором соли (10 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток растворяют в МеОН (2 мл) добавляют 4 М раствор КОН (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 час, а затем помещают в холодильник на 16 час. Реакционной смеси дают нагреться до комнатной температуры и перемешивают еще в течение 2 час. Прерывают реакцию, добавив 1N раствор HCl (5 мл), разбавляют с помощью EtOAc (15 мл), промывают насыщенным раствором соли (5 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией с обращенной фазой (С-18, от 10 до 95% MeCN/вода с 0,1% TFA) с последующей лиофилизацией и получают 2"-{[(4S)-4-бензил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС = 576,0 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, присутствуют ротамеры) δ 8,01-7,86 (м, 2H), 7,67-7,50 (м, 2H), 7,44-7,32 (м, 3H), 7,23-7,07 (м, 5H), 6,91-6,85 (м, 2H), 4,92-4,58 (м, 2H), 4,27 (д, J=15,6 Гц), 4,11 (д, J=15,6 Гц), 4,06-3,82 (м, 5H), 3,64-3,51 (м, 1H), 2,86-2,71 (м, 1H), 2,47-2,28 (м, 4H).
Аналогично синтезируют следующее соединение:
|
ПРИМЕР 107
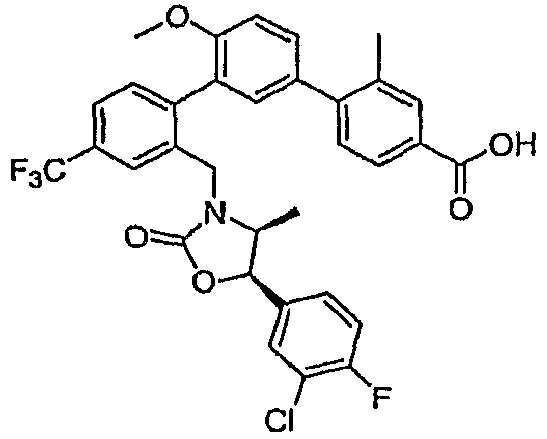
2"-{[(4S,5R)-5-(3-Хлор-4-фторфенил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
При 0°С к раствору бензил [(1S,2R)-2-(3-хлор-4-фторфенил)-2-гидрокси-1-метилэтил]карбамата (51,4 мг, 0,152 ммоль) в ДМФА (1,5 мл) добавляют NaHMDS (0,296 мл 1 М раствора в ТГФ, 0,296 ммоль). По прошествии 5 мин через канюлю добавляют раствор метил 2"-(бромметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (75 мг, 0,152 ммоль) в ДМФА (2,5 мл). Через 5 мин добавляют насыщенный раствор NaOH (3 мл) и смеси дают нагреться до комнатной температуры. Через 3 час смесь подкисляют с помощью 6N раствора HCl и концентрируют. Остаток очищают хроматографией с обращенной фазой (С-18, от 10 до 95% MeCN/вода с 0,1% TFA) с последующей лиофилизацией и получают 2"-{[(4S,5R)-5-(3-хлор-4-фторфенил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС = 627,9 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, присутствуют ротамеры) δ 7,95-7,62 (м, 2H), 7,69-7,52 (м, 2H), 7,43-7,37 (м, 2H), 7,30-7,24 (м, 1H), 7,18-7,11 (м, 2H), 7,08-6,86 (м, 3H), 5,44 (д, J=8,0 Гц), 5,18 (д, J=8,0 Гц), 4,92-4,85 (м, 1H), 4,18 (д, J=15,5), 3,96 (д, J=15,5), 3,93-3,85 (м, 3H), 3,73-3,66 (м, 1H), 2,36 (с), 2,32 (с), 0,55 (д, J=6,6 Гц), 0,44 (д, J=6,6 Гц).
ПРИМЕР 108
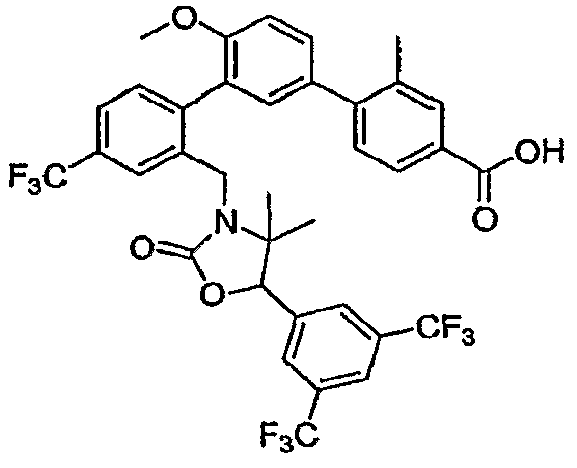
2"-({5-[3,5-Бис(трифторметил)фенил]-4,4-диметил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
К раствору бензил {2-[3,5-бис(трифторметил)фенил]-2-гидрокси-1,1-диметилэтил}карбамата (65 мг, 0,149 ммоль) в ТГФ (1,5 мл) добавляют NaH (13 мг, 0,542 ммоль) и метил 2"-(бромметил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат (91,1 мг, 0,185 ммоль). Реакционную смесь перемешивают в течение 72 час, а затем добавляют дополнительное количество NaH (36,2 мг, 1,51 ммоль). Перемешивают при комнатной температуре еще в течение 6 час, реакцию прерывают, добавив насыщенный раствор NH4Cl (10 мл) и разбавляют с помощью EtOAc (20 мл). Водный слой экстрагируют с помощью EtOAc (20 мл), органические экстракты объединяют, промывают насыщенным раствором соли (10 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией с обращенной фазой (С-18, от 10 до 95% MeCN/вода с 0,1% TFA) и получают 2"-({5-[3,5-бис(три-фторметил)фенил]-4,4-диметил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС = 726,0 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц, присутствуют ротамеры) δ 8,03-8,02 (м, 1H), 7,80-7,96 (м, 1Н), 7,89 (с, 1H), 7,79-7,76 (м, 2H), 7,62-7,59 (м, 1H), 7,42-7,31 (м, 3H), 7,22-7,08 (м, 3H), 5,26-5,28 (м, 1H), 4,81 (д, J=16,6 Гц), 4,44-4,42 (м, 1H), 4,02 (д, J=16,6 Гц), 3,85 (с, 3H), 2,37-2,35 (м, 3H), 1,24 (с), 1,06 (с), 0,56-0,54 (м, 3H).
ПРИМЕР 109

4-{2-[2-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-1,3-тиазол-4-ил}-3-метилбензойная кислота
Стадия 1: (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(4-бром-1,3-тиазол-2-ил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он
В трубку помещают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-3-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(три-фторметил)бензил]-1,3-оксазолидин-2-он (59 мг, 0,099 ммоль), 2,4-дибромтиазол (60 мг, 0,247 ммоль), DME (420 мкл), EtOH (140 мкл) и 1 М раствор Na2СО3 (296 мкл, 0,296 ммоль). Смесь дегазируют с помощью N2, а затем добавляют Pd(PPh3)4 (5,7 мг, 4,94×10-3 ммоль). Смесь вновь дегазируют с помощью N2, а затем трубку герметично закрывают и реакционную смесь нагревают до 100°С в течение 90 мин. Реакционную смесь охлаждают до комнатной температуры и разбавляют с помощью EtOAc (30 мл). Органические слои объединяют, промывают водой и насыщенным раствором соли (каждый раз по 10 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают флэш-хроматографией на силикагеле (от 5 до 25% EtOAc/гексан) и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(4-бром-1,3-тиазол-2-ил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он. Rf = 0,33 (25% EtOAc/гексан). ЖХМС = 635,0 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 7,89 (шир.с, 2H), 7,78 (с, 2H), 7,75 (д, J=8,3 Гц, 1H), 7,68 (дд, J=8,1, 1,0 Гц, 1H), 7,41 (с, 1H), 5,66 (д, J=8,0 Гц, 1H), 5,02 (д, J=15,8 Гц, 1H), 4,84 (д,J=15,8 Гц, 1H), 4,20 (м, 1H), 0,78 (д, J=6,7 Гц, 3H).
Стадия 2: метил 4-{2-[2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-1,3-тиазол-4-ил}-3-метилбензоат
В трубку помещают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(4-бром-1,3-тиазол-2-ил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он (46,0 мг, 0,073 ммоль), метил 3-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоат (30 мг, 0,11 ммоль), 1,1'-бис(ди-трет-бутилфосфино)ферроцен-палладий дихлорид (5 мг, 7,3×10-3 ммоль), ТГФ (1 мл) и 1 М раствор K2СО3 (1 мл, 1 ммоль). Смесь дегазируют с помощью N2, а затем трубку герметично закрывают и реакционную смесь нагревают до 90°С в течение 90 мин. Реакционную смесь охлаждают до комнатной температуры и разбавляют с помощью EtOAc (30 мл). Органические слои объединяют, промывают водой и насыщенным раствором соли (каждый раз по 10 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают флэш-хроматографией на силикагеле (от 5 до 40% EtOAc/гексан) и получают метил 4-{2-[2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-1,3-тиазол-4-ил}-3-метилбензоат. Rf = 0,29 (25% EtOAc/гексан). ЖХМС = 702,9 (М+1)+. Спектр 1Н ЯМР (CDCl3, 600 МГц) δ 7,97 (с, 1H), 7,92 (дд, J=8,0, 1,4 Гц, 1H), 7,85-7,86 (м, 3H), 7,69-7,72 (м, 4H), 7,53(с, 1H), 5,66 (д, J=8,0 Гц, 1H), 5,11 (д, J=16,2 Гц, 1Н), 4,95 (д, J=16,2 Гц, 1H), 4,11 (м, 1H), 3,93 (с, 3H), 2,54 (с, 3H), 0,60 (д, J=6,6 Гц, 3H).
Стадия 3: 4-{2-[2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-1,3-тиазол-4-ил}-3-метилбензойная кислота
К раствору 4-{2-[2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-1,3-тиазол-4-ил}-3-метилбензоата (35,2 мг, 0,05 ммоль) в ТГФ (2 мл) добавляют воду (800 мкл), 4N раствор КОН (75 мкл, 0,3 ммоль) и EtOH (200 мкл). Реакционную смесь перемешивают при комнатной температуре в течение 24 час, а затем подкисляют 1N раствором HCl и экстрагируют с помощью EtOAc (30 мл). Органические слои промывают водой и насыщенным раствором соли (каждый раз по 10 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают флэш-хроматографией на силикагеле (от 10 до 100% EtOAc/гексан) и получают 4-{2-[2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-1,3-тиазол-4-ил}-3-метилбензойную кислоту. ЖХМС = 688,8 (М+1)+. Спектр 1Н ЯМР (CDCl3, 500 МГц) δ 8,04 (с, 1H), 7,99 (д, J=8,0 Гц, 1H), 7,84-7,87 (м, 3H), 7,70-7,75 (м, 4H), 7,56 (с, 1H), 5,67 (д, J=8,1 Гц, 1H), 5,14 (д, J=16,2 Гц, 1H), 4,96 (д, J=16,2 Гц, 1H), 4,10 (м, 1H), 2,56 (с, 3H), 0,62 (д, J=6,6 Гц, 3H).
ПРИМЕР 110
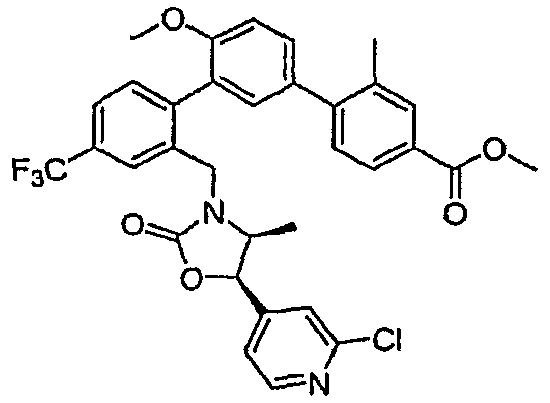
Метил 2"-{[(4S,5R)-5-(2-хлорпиридин-4-ил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
К раствору 4'-метокси-2-метил-2"-{[(4S,5R)-4-метил-2-оксо-5-пиридин-4-ил-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (175 мг, 0,296 ммоль) в CH2Cl2 (15 мл) при 0°С в атмосфере N2 добавляют 3-хлорнадбензойную кислоту (146 мг, 0,593 ммоль) в виде порошка. Смесь перемешивают при 0°С в течение 15 мин. Затем смеси дают нагреться до комнатной температуры и перемешивают еще в течение 2 час. Реакционную смесь разбавляют с помощью CH2Cl2 и промывают насыщенным раствором Na2SO3 (1×), а затем насыщенным раствором К2СO3 (2×). Органический слой сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме. Полученный остаток растворяют в POCl3 (10 мл). Полученный раствор нагревают до 110°С под азотом в течение 2 час. Затем смеси дают остыть до комнатной температуры и перемешивают 2 час. Реакционную смесь концентрируют в вакууме. Остаток разбавляют с помощью EtOAc (50 мл) и водой (10 мл) и промывают насыщенным раствором NaHCO3 (20 мл). Водный слой экстрагируют с помощью EtOAc (2×40 мл). Органические слои объединяют, сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме. Остаток очищают флэш-хроматографией на силикагеле и получают метил 2"-{[(4S,5R)-5-(2-хлорпиридин-4-ил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат. ЖХМС: рассчитано = 625,2; найдено = 625,0 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3, смесь 1:1 атропоизомеров) δ 8,40 (с, 0,5 H); 8,39 (с, 0,5 H); 7,97 (с, 1Н); 7,90 (т, J=5,8 Гц, 1Н); 7,72 (с, 0,5 H); 7,69-7,63 (м, 1,5 H); 7,48 (д, J=11,8 Гц, 0,5 H); 7,44 (с, 0,5 H); 7,43-7,37 (м, 1Н); 7,32-7,26 (м, 1Н); 7,24 (с, 0,5 H); 7,20 (с, 0,5 H); 7,16 (д, J=2,2 Гц, 0,5 H); 7,14 (д, J=2,2 Гц, 0,5 H); 7,12-7,06 (м, 1,5 H); 7,05 (д, J=5,1 Гц, 0,5H); 5,42 (д, J=8,1 Гц, 0,5 H); 5,18 (д, J=8,1 Гц, 0,5 H); 4,92 (дд, J=15,9, 18,5 Гц, 1Н); 4,19 (д, J=15,8 Гц, 0,5 H); 3,99 (д, J=15,8 Гц, 0,5 H); 3,95 (с, 3Н); 3,88 (с, 3Н); 3,81-3,75 (м, 1Н); 2,39 (с, 1,5 H); 2,35 (с, 1,5 H); 0,60 (д, J=6,5 Гц, 1,5 H); 0,49 (д, J=6,5 Гц, 1,5 H).
ПРИМЕР 111
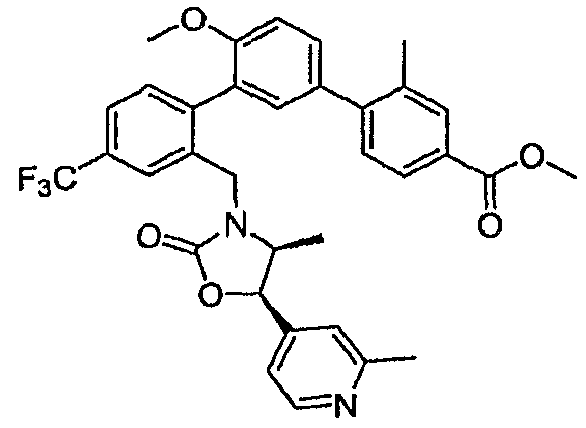
Метил 4'-метокси-2-метил-2"-{[(4S,5R)-4-метил-5-(2-метилпиридин-4-ил)-2-оксо-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
К раствору метил 2"-{[(4S,5R)-5-(2-хлорпиридин-4-ил)-4-метил-2-оксо-1,3-оксазолидин-3-ил]метил}-4'-метокси-2-метил 4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (48 мг, 0,077 ммоль) в ТГФ (1 мл) и К2СО3 (1N) (1 мл) добавляют триметилбороксин (0,107 мл, 0,768 ммоль) и 1,1'-бис(ди-трет-бутилфосфино)ферроцен-палладий дихлорид (7,1 мг, 0,011 ммоль). Смесь герметично закрывают и оставляют на ночь нагреваться до 80°С. Смесь разбавляют водой и EtOAc и фильтруют через целит. Органический слой отделяют, а водный слой экстрагируют с помощью EtOAc (2×). Органические слои объединяют, промывают насыщенным раствором соли (1×), сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме. Остаток очищают флэш-хроматографией на силикагеле и получают метил 4'-метокси-2-метил-2"-{[(4S,5R)-4-метил-5-(2-метилпиридин-4-ил)-2-оксо-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат. ЖХМС: рассчитано = 605,2; найдено = 605,0 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3, смесь 1:1 атропоизомеров) δ 8,49 (т, J=4,3 Гц, 1Н); 7,98 (т, J=6,6 Гц, 1Н); 7,91 (т, J=10,0 Гц, 1H); 7,73 (с, 0,5 H); 7,67 (с, 0,5 H); 7,65 (с, 1Н); 7,47-7,39 (м, 2Н); 7,33-7,26 (м, 1Н); 7,15 (дд, J=2,2, 5,7 Гц, 1Н); 7,09 (дд, J=6,8, 8,4 Гц, 1Н); 7,06 (с, 0,5H); 7,00 (с, 0,5H); 6,95 (д, J=4,8 Гц, 0,5H); 6,90 (д, J=4,7 Гц, 0,5 H); 5,43 (д, J=8,2 Гц, 0,5H); 5,18 (д, J=8,1 Гц, 0,5H); 4,92 (д,J=15,8 Гц, 0,5H); 4,87 (д, J=15,8 Гц, 0,5H); 4,22 (д, J=15,8 Гц, 0,5H); 4,00 (д, J=15,8 Гц, 0,5H); 3,95 (с, 3Н); 3,89 (с, 1,5H); 3,88 (с, 1,5H); 3,81-3,73 (м, 1Н); 2,57 (с, 1,5H); 2,56 (с, 1,5H); 2,39 (с, 1,5H); 2,34 (с, 1,5H); 0,57 (д, J=6,6 Гц, 1,5H); 0,47 (д, J=6,6 Гц, 1,5H).
ПРИМЕР 112
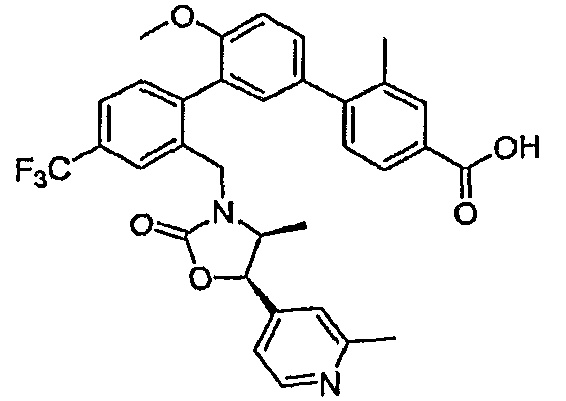
4'-Метокси-2-метил-2"-{[(4S,5R)-4-метил-5-(2-метилпиридин-4-ил)-2-оксо-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновая кислота
К раствору метил 4'-метокси-2-метил-2"-{[(4S,5R)-4-метил-5-(2-метилпиридин-4-ил)-2-оксо-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилата (30,1 мг, 0,050 ммоль) в 1,4-диоксане (1,5 мл) и воде (1,5 мл) добавляют 1 М водный раствор LiOH (0,498 мл, 0,498 ммоль). Смесь перемешивают при комнатной температуре в течение 4 час. Смесь подкисляют 1N раствором HCl. Водный слой экстрагируют с помощью EtOAc (3×). Органические слои объединяют, сушат над Na2SO4, фильтруют и растворитель упаривают в вакууме. Сырой продукт очищают препаративной ВЭЖХ с обращенной фазой (С-18), элюируя смесью MeCN/вода. Фракции собирают и лиофилизуют, получая 4'-метокси-2-метил-2"-{[(4S,5R)-4-метил-5-(2-метилпиридин-4-ил)-2-оксо-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту. ЖХМС: рассчитано = 591,2; найдено = 591,1 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3, смесь 1:1 атропоизомеров) δ 8,83 (с, 1Н); 8,02 (с, 1Н); 7,94 (т, J=10,0 Гц, 1Н); 7,72 (с, 0,5 H); 7,69 (т, J=6,0 Гц, 1Н); 7,64 (с, 0,5H); 7,49-7,43 (м, 3Н); 7,40 (д, J=5,2 Гц, 0,5H); 7,35 (д, J=5,4 Гц, 0,5H); 7,31 (м, 1H); 7,16 (дд, J=2,1, 6,0 Гц, 1Н); 7,12 (т, J=8,8 Гц, 1Н); 5,56 (д, J=8,1 Гц, 0,5H); 5,26 (д, J=8,2 Гц, 0,5H); 4,94 (дд, J=8,7, 15,7 Гц, 1Н); 4,77 (шир.с, 1H); 4,20 (д, J=15,8 Гц, 0,5H); 4,00 (д, J=15,7 Гц, 0,5H); 3,90 (с, 1,5H); 3,89 (с, 1,5H); 3,89-3,81 (м, 1Н); 2,82 (с, 1,5H); 2,81 (с, 1,5H); 2,41 (с, 1,5H); 2,36 (с, 1,5H); 0,62 (д, J=6,5 Гц, 1,5H); 0,49 (д, J=6,5 Гц, 1,5H).
ПРИМЕР 113
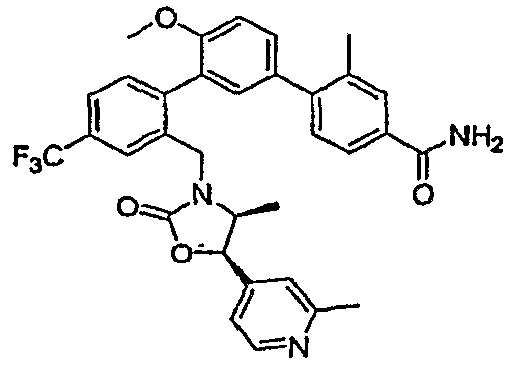
4'-Метокси-2-метил-2"-{[(4S,5R)-4-метил-5-(2-метилпиридин-4-ил)-2-оксо-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксамид
К раствору 4'-метокси-2-метил-2"-{[(4S,5R)-4-метил-5-(2-метилпиридин-4-ил)-2-оксо-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновой кислоты (15 мг, 0,025 ммоль) в CH2Cl2 (2 мл) добавляют 2 М раствор оксалилхлорида в CH2Cl2 (0,038 мл, 0,076 ммоль) и 2 капли ДМФА. Смесь под азотом перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют в вакууме. Остаток вновь растворяют в ТГФ (2 мл), а затем добавляют гидроксид аммония (0,035 мл, 0,254 ммоль) и диизопропилэтиламин (0,013 мл, 0,076 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 3 час. Реакционную смесь концентрируют в вакууме и остаток очищают препаративной ВЭЖХ с обращенной фазой (С-18), элюируя смесью MeCN/вода. Фракции собирают и лиофилизуют, получая 4'-метокси-2-метил-2"-{[(4S,5R)-4-метил-5-(2-метилпиридин-4-ил)-2-оксо-1,3-оксазолидин-3-ил]метил}-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксламид в виде порошка белого цвета. ЖХМС: рассчитано = 590,2; найдено = 590,0 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3, смесь 1:1 атропоизомеров) δ 8,49 (т, J=4,3 Гц, 1Н); 7,77 (шир.с, 1Н); 7,72 (с, 0,5H); 7,66 (шир.с, 1,5H); 7,46-7,38 (м, 3Н); 7,33-7,29 (м, 1Н); 7,14 (дд, J=2,2, 7,7 Гц, 1Н); 7,09 (дд, J=6,2, 8,5 Гц, 1Н); 7,06 (с, 0,5H); 7,01 (с, 0,5H); 6,95 (д, J=4,3 Гц, 0,5H); 6,90 (д, J=4,4 Гц, 0,5H); 6,17 (шир.с, 1Н); 5,79 (шир.с, 1Н); 5,43 (д, J=8,1 Гц, 0,5H); 5,20 (д, J=8,0 Гц, 0,5H); 4,92 (д, J=15,9 Гц, 0,5H); 4,86 (д, J=15,8 Гц, 0,5H); 4,22 (д, J=15,8 Гц, 0,5H); 4,00 (д, J=15,8 Гц, 0,5H); 3,88 (с, 1,5H); 3,87 (с, 1,5H); 3,80-3,75 (м, 1Н); 2,57 (с, 1,5H); 2,56 (с, 1,5H); 2,39 (с, 1,5H); 2,35 (с, 1,5H); 0,58 (д, J=6,5 Гц, 1,5H); 0,47 (д, J=6,5 Гц, 1,5H).
Указанные ниже примеры 114-123 осуществляют в соответствии с приведенными выше методиками.
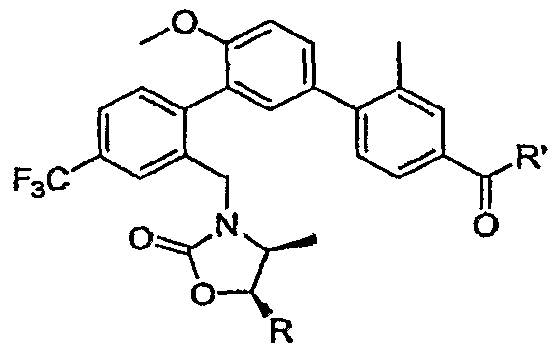
|
ПРИМЕР 124
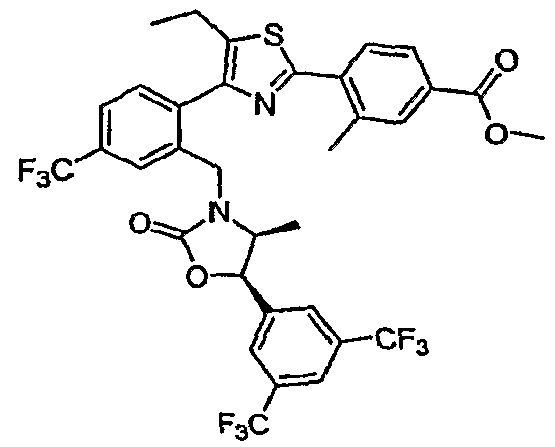
Метил 4-{4-[2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-5-этил-1,3-тиазол-2-ил}-3-метилбензоат
Раствор (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(2-бромбутаноил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (25 мг, 0,040 ммоль) и метил 4-(аминокарбонотиоил)-3-метилбензоата (16,87 мг, 0,081 ммоль) в EtOH (450 мкл) оставляют на ночь нагреваться до температуры 70°С. Реакционную смесь концентрируют в вакууме и остаток очищают методом препаративной ТСХ (Si, 1000 мкм, гексан/EtOAc (80:20)) и получают метил 4-{4-[2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-5-этил-1,3-тиазол-2-ил}-3-метилбензоат в виде бесцветного масла. ЖХМС: рассчитано = 731,2; найдено = 731,0 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,99 (с, 1Н); 7,92 (д, J=8,1 Гц, 1Н); 7,86 (д, J=8,0 Гц, 2Н); 7,79 (с, 1Н); 7,72 (д, J=7,9 Гц, 1Н); 7,69 (с, 1Н); 7,55 (д, J=7,9 Гц, 1Н); 7,29 (с, 1Н); 5,59 (д, J=8,0 Гц, 1Н); 4,91 (д, J=15,7 Гц, 1Н); 4,27 (д, J=15,7 Гц, 1Н); 4,04-3,99 (м, 1Н); 3,95 (с, 3Н); 2,88-2,76 (м, 2Н); 2,68 (с, 3Н); 1,36 (т, J=7,5 Гц, 3Н); 0,57 (д, J=6,5 Гц, 3Н).
ПРИМЕР 125
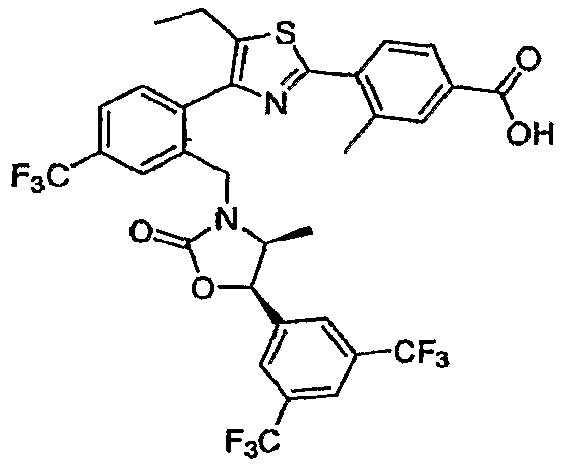
4-{4-[2-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-5-этил-1,3-тиазол-2-ил}-3-метилбензойная кислота
К раствору метил 4-{4-[2-({(4S,5R)-5-[3,5-бис(три-фторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-5-этил-1,3-тиазол-2-ил}-3-метилбензоата (11 мг, 0,015 ммоль) в 1,4-диоксане (0,4 мл) и воде (0,4 мл) добавляют 1 М водный раствор LiOH (0,151 мл, 0,151 ммоль). Смесь перемешивают при комнатной температуре в течение 2 час. Смесь подкисляют 1N раствором HCl. Водный слой экстрагируют с помощью EtOAc (3×). Органические слои объединяют, сушат (над Na2SO4), фильтруют и растворитель упаривают в вакууме. Сырой продукт очищают препаративной ВЭЖХ с обращенной фазой (С-18), элюируя смесью MeCN/вода, содержащей 0,1% TFA. Фракции собирают и лиофилизуют, получая 4-{4-[2-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4-(трифторметил)фенил]-5-этил-1,3-тиазол-2-ил}-3-метилбензойную кислоту. ЖХМС: рассчитано = 717,1; найдено = 717,0 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 8,05 (с, 1Н); 7,99 (д, J=8,1 Гц, 1Н); 7,89 (д, J=8,1 Гц, 1Н); 7,87 (с, 1Н); 7,78 (с, 1Н); 7,74 (д, J=8,0 Гц, 1Н); 7,71 (с, 2Н); 7,57 (д, J=7,9 Гц, 1Н); 5,61 (д, J=8,0 Гц, 1Н); 4,94 (д, J=15,7 Гц, 1Н); 4,25 (д, J=15,7 Гц, 1Н); 4,04-3,98 (м, 1Н); 2,89-2,76 (м, 2Н); 2,69 (с, 3Н); 1,37 (т, J=7,5 Гц, 3Н); 0,60 (д, J=6,5 Гц, 3Н).
Указанные ниже соединения синтезируют в соответствии с методикой, приведенной в Примере 124, из Промежуточного соединения 20 и соответствующих тиоамидов.
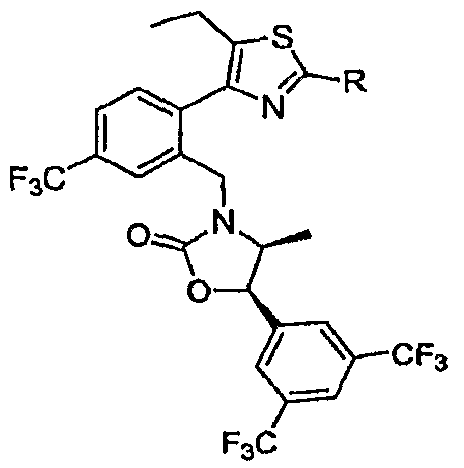
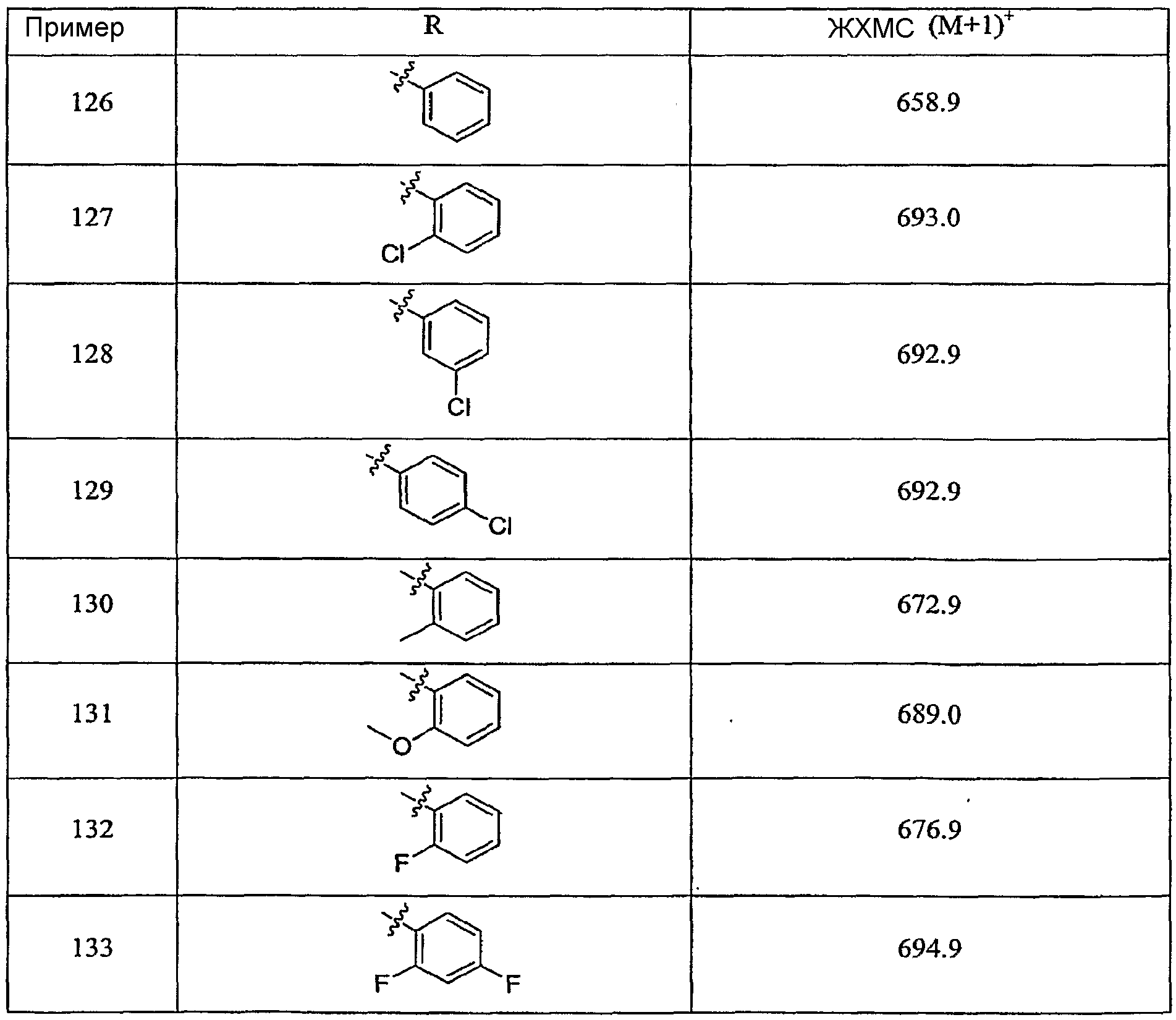
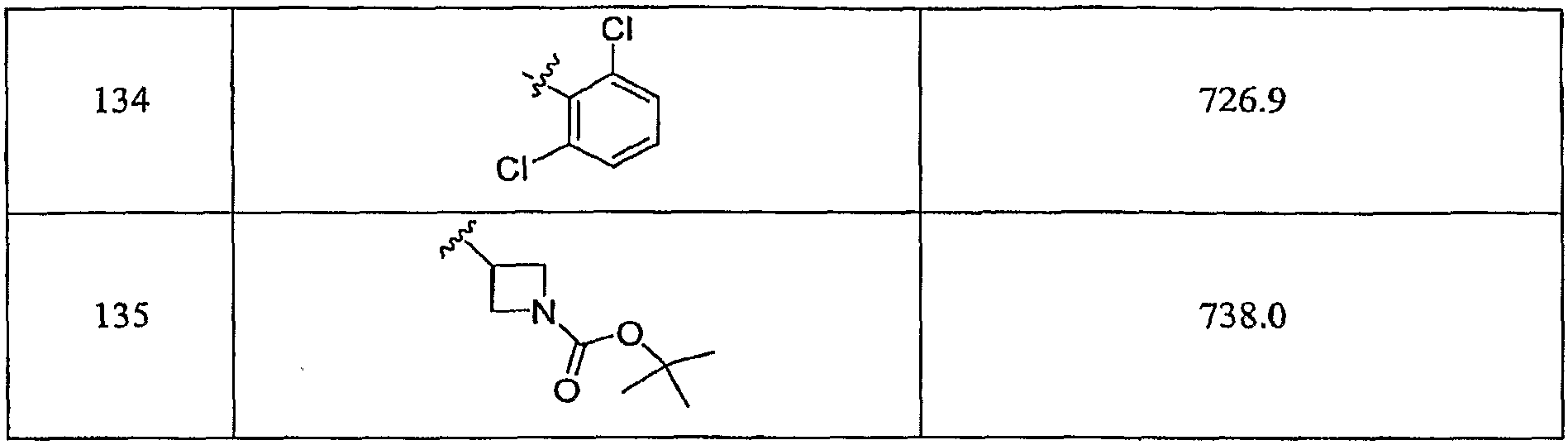 М
М
ПРИМЕР 136
(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-3-[2-(4-этил-1-фенил-1Н-пиразол-3-ил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он
К раствору (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-бутирил-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-она (300 мг, 0,554 ммоль) (46,3 мг, 0,086 ммоль)) в диметилацетале N,N-диметилформамида (0,5 мл, 3,78 ммоль) оставляют на ночь нагреваться до температуры 110°С. Реакционную смесь концентрируют в вакууме и получают сырой енаминон. Полученный енаминон растворяют в EtOH (200 мкл) и добавляют фенилгидразин (16,97 мкл, 0,171 ммоль). Смесь нагревают до температуры 80°С в течение 3 час. Реакционную смесь концентрируют в вакууме и остаток очищают препаративной ВЭЖХ с обращенной фазой (С-18), элюируя смесью MeCN/вода. Фракции второго по порядку элюируемого пика собирают и лиофилизуют, получая смесь диастереоизомеров указанного в названии соединения. Диастереоизомеры разделяют методом препаративной ТСХ (Si, 1000 мкм, гексан/EtOAc (70:30)) и получают (4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-[2-(4-этил-1-фенил-1Н-пиразол-3-ил)-5-(трифторметил)бензил]-4-метил-1,3-оксазолидин-2-он. ЖХМС: рассчитано = 642,2; найдено = 641,9 (М+1)+. Спектр 1Н ЯМР (500 МГц, CDCl3) δ 7,89 (с, 1Н); 7,87 (с, 1Н); 7,84 (с, 1Н); 7,74-7,65 (м, 5 H); 7,57 (д, J=7,9 Гц, 1Н); 7,46 (т, J=7,9 Гц, 2Н); 7,31 (д, J=7,9 Гц, 1Н); 5,59 (д, J=8,0 Гц, 1Н); 4,97 (д, J=15,5 Гц, 1Н); 4,36 (д, J=15,5 Гц, 1Н); 4,05-4,00 (м, 1Н); 2,50 (кв, J=7,5 Гц, 2Н); 1,22 (т, J=7,5 Гц, 3Н); 0,53 (д, J=6,5 Гц, 3Н).
ПРИМЕР 137
Указанное соединение получают по методике, приведенной в Примере 75. ЖХ/МС 725,2.
ПРИМЕР 138
2-Метокси-2-оксоэтил 2"-({(4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоксилат
2"-({(4S,5R)-5-[3,5-Бис(трифторметил)фенил]-4-метил-2-оксо-1,3-оксазолидин-3-ил}метил)-4'-метокси-2-метил-4"-(трифторметил)-1,1':3',1"-терфенил-4-карбоновую кислоту (Пример 30, 200 мг, 0,281 ммоль), метилгидроксиацетат (0,22 мл, 0,281 ммоль), гидрохлорид N-[3-(диметиламино)пропил]-N'-этилкарбодиимида (81 мг, 0,422 ммоль) и триэтиламин (0,059 мл; 0,422 ммоль) перемешивают в DCM (2,811 мл) при комнатной температуре в течение ночи. Анализ аликвоты методом ЖХМС указывает на образование требуемого продукта и полное расходование исходных веществ. Из реакционной смеси удаляют летучие вещества. Остаток очищают методом препаративной ВЭЖХ и получают указанное в названии соединение в виде твердого вещества светло-желтого цвета. ЖХМС (ESI): рассчитано = 783,19; найдено = 784,0 (М+1)+. Спектр 1Н ЯМР (CDCl3, 400 МГц, смесь 1:1 атропоизомеров) δ 7,99 (д, J=6,8 Гц, 1H), 7,92 (д, J=8 Гц, 1Н), 7,85 (с, 1Н), 7,72-7,68 (м, 1,5H), 7,67-7,61 (м, 2,5H), 7,45-7,36 (м, 2H), 7,32-7,26 (м, 1H), 7,13 (с, 1Н), 7,08 (д, J=5,6 Гц, 0,5H), 7,06 (д, J=5,6 Гц, 0,5H), 5,59 (д, J=8 Гц, 0,5H), 5,30 (д, J=8 Гц, 0,5H), 4,97 (д, J=14 Гц, 0,5H), 4,93 (д, J=14 Гц, 0,5H), 4,87 (с, 2H), 4,16 (д, J=15,6 Гц, 0,5H), 3,95 (д, J=16 Гц, 0,5H), 3,86 (с, 3H), 3,80 (с, 3H), 3,80-3,75 (м, 1H), 2,37 (с, 1,5H), 2,32 (с, 1,5H), 0,54 (д, J=6,8 Гц, 1,5 H), 0,42 (д, J=6,8 Гц, 1,5H).
Следующие соединения получают в соответствии с общей методикой, приведенной в Примере 138.
|
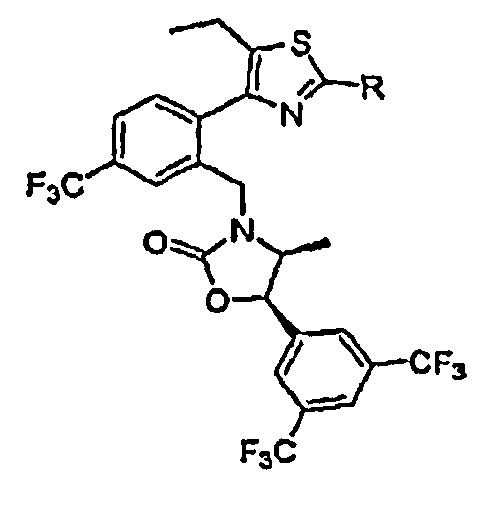
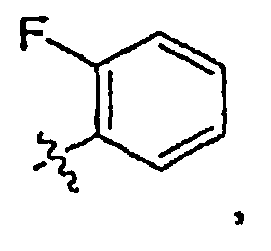
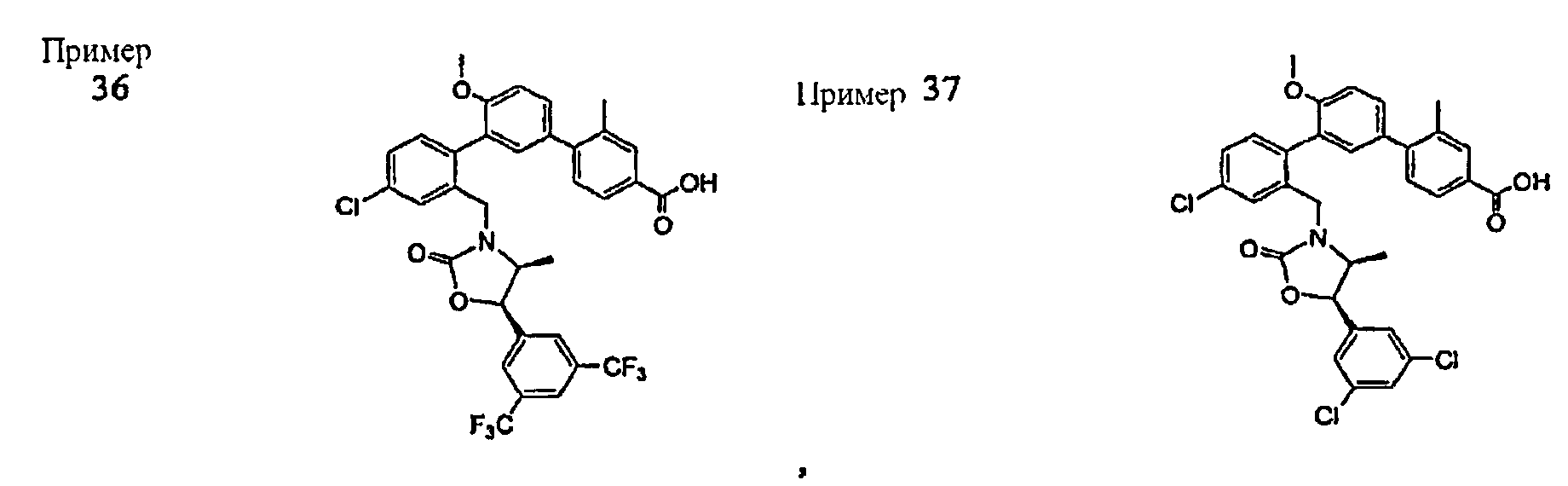
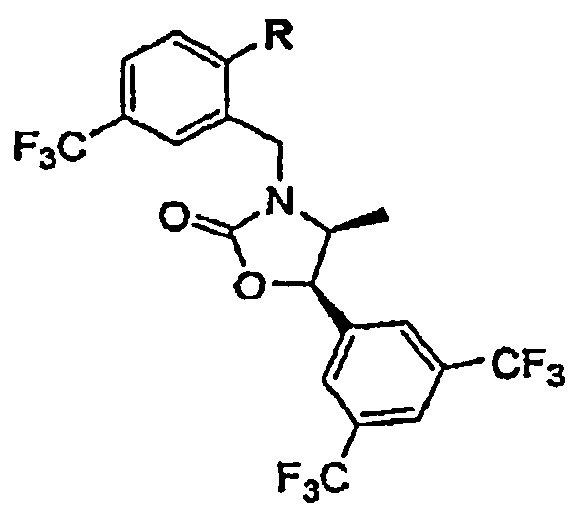
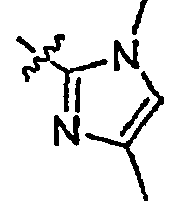
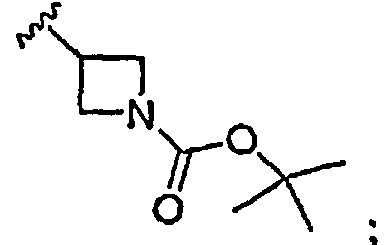
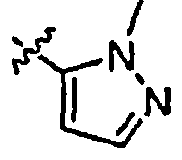
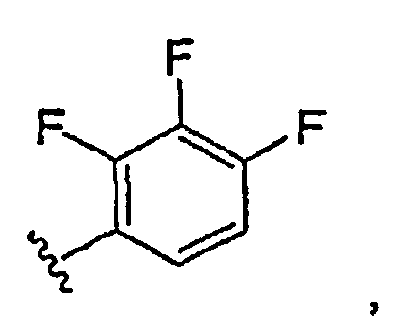
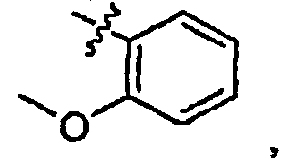
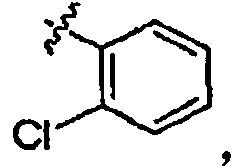
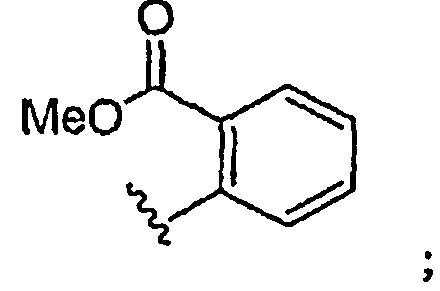
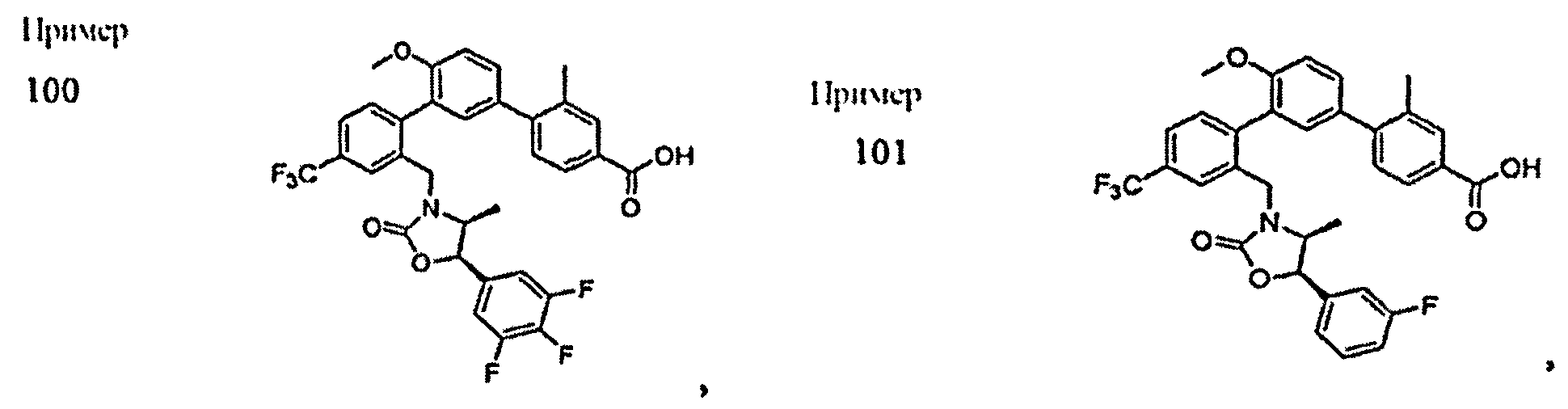
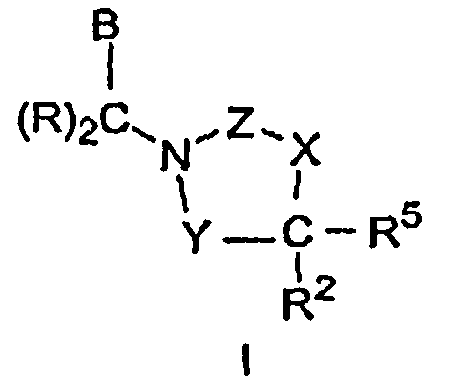
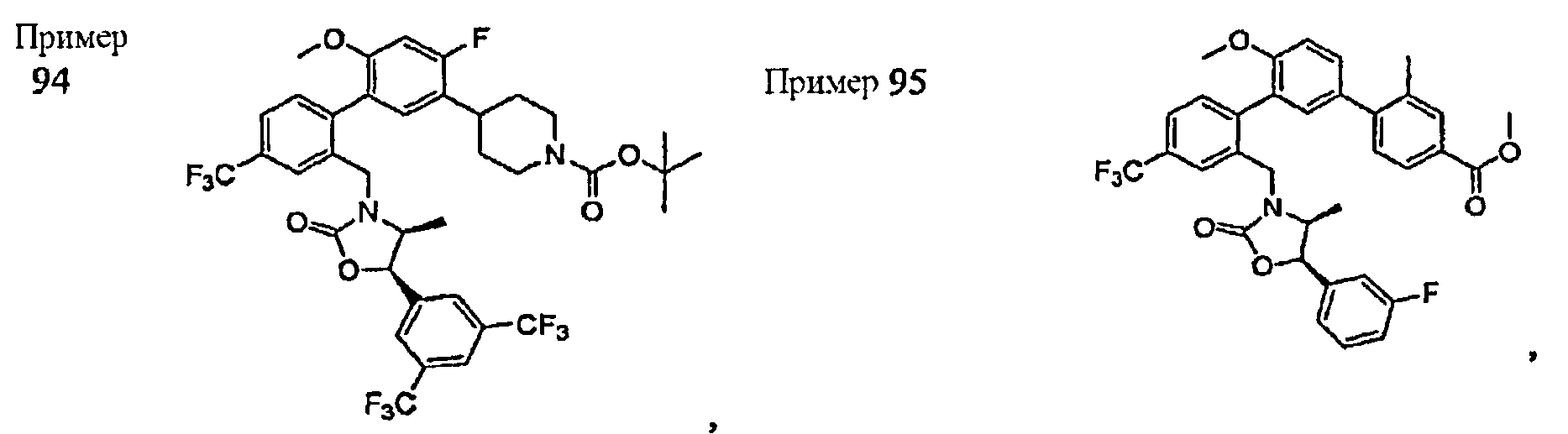
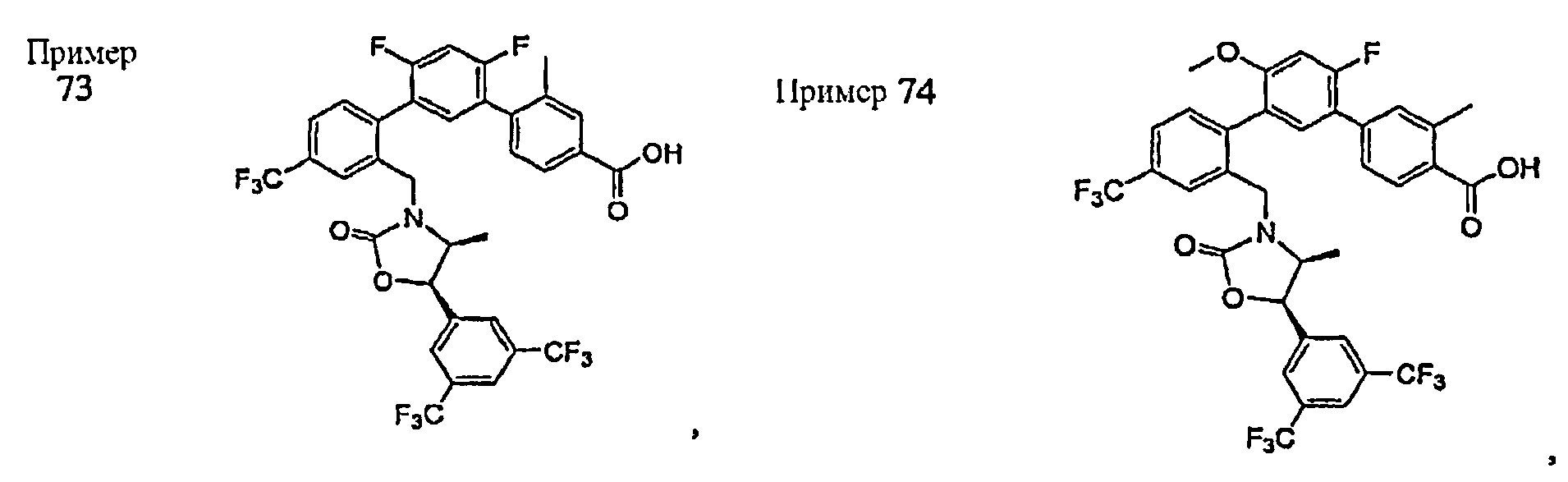
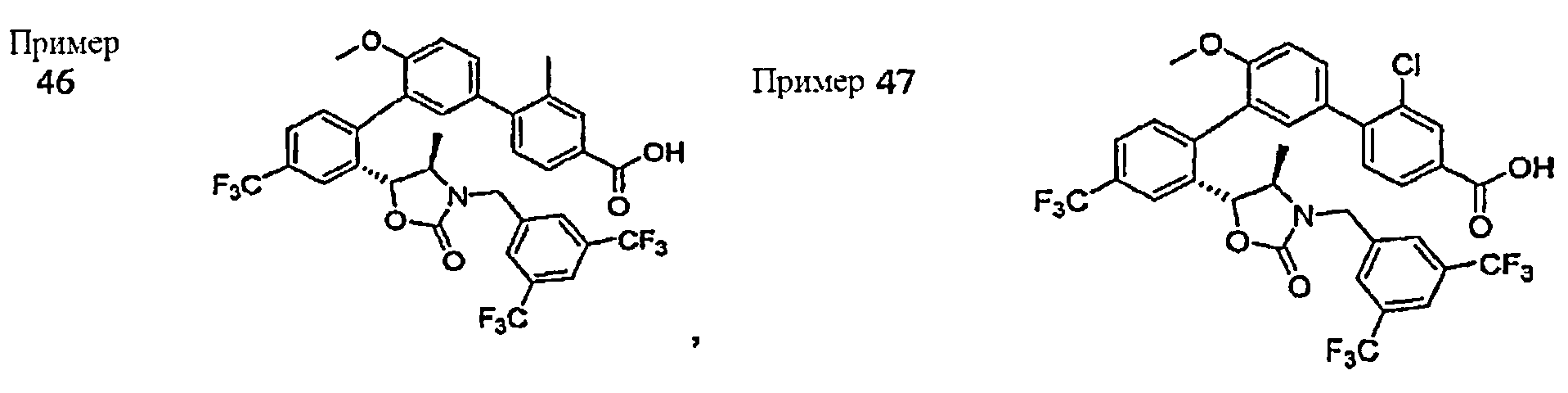
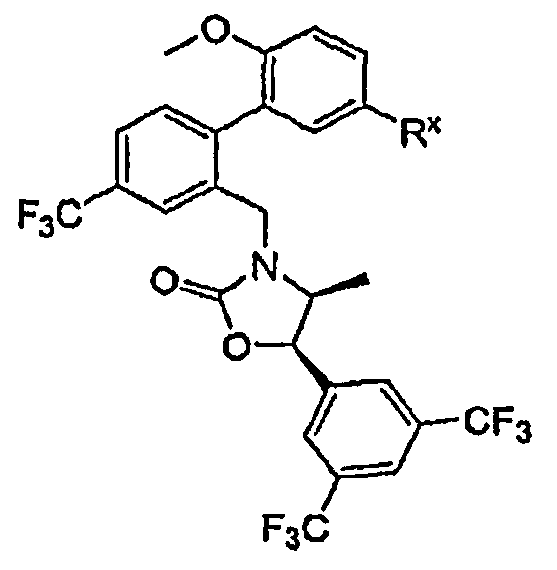
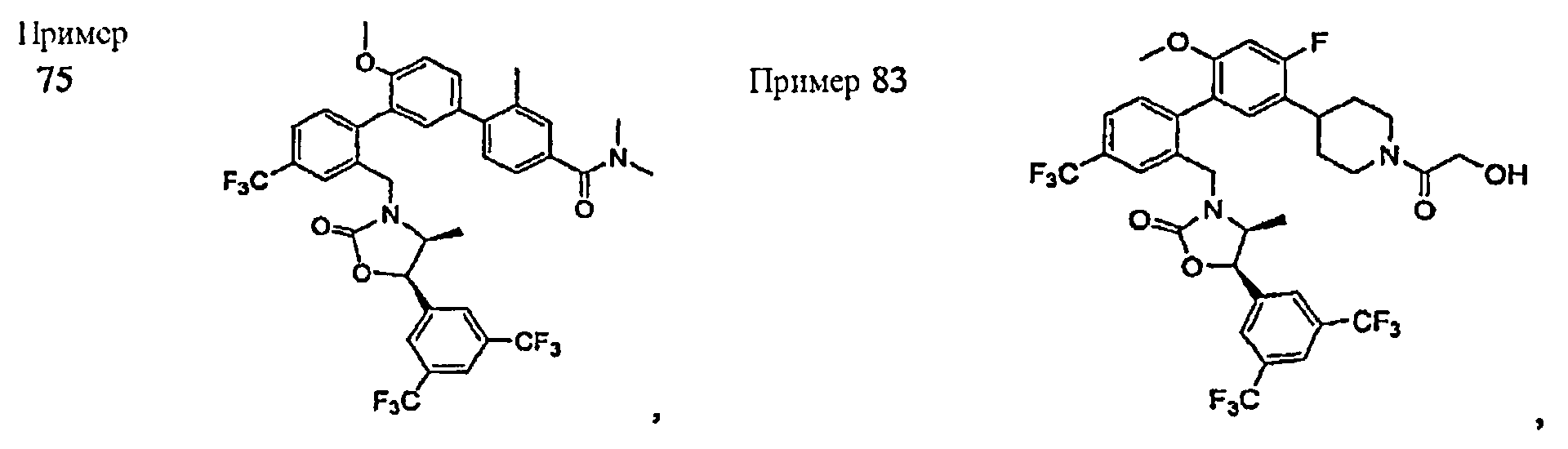
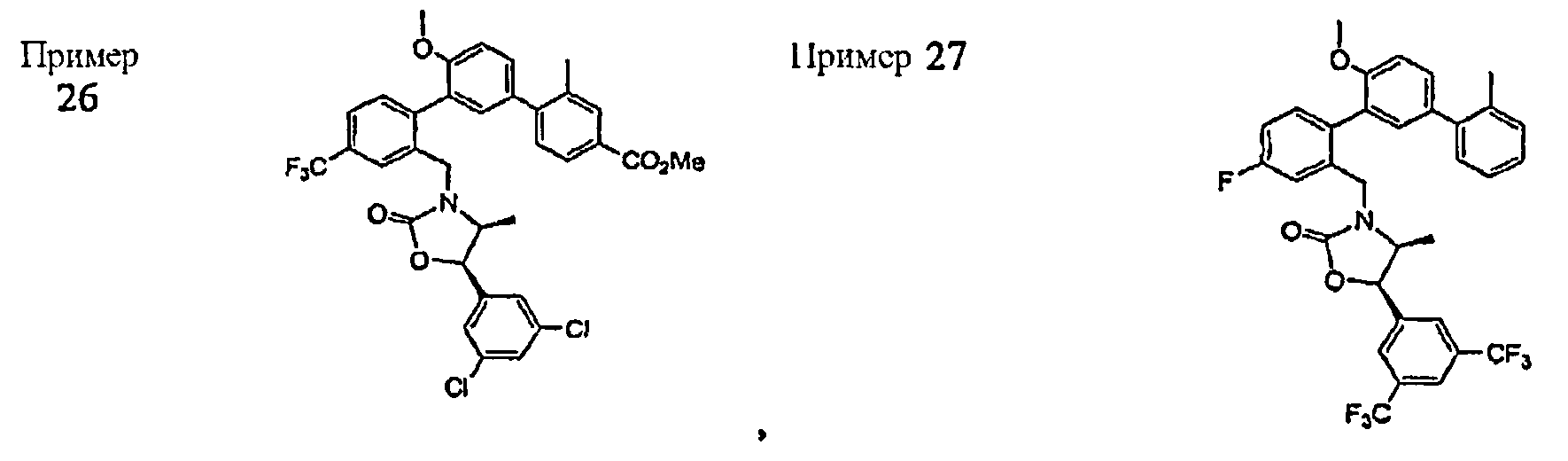
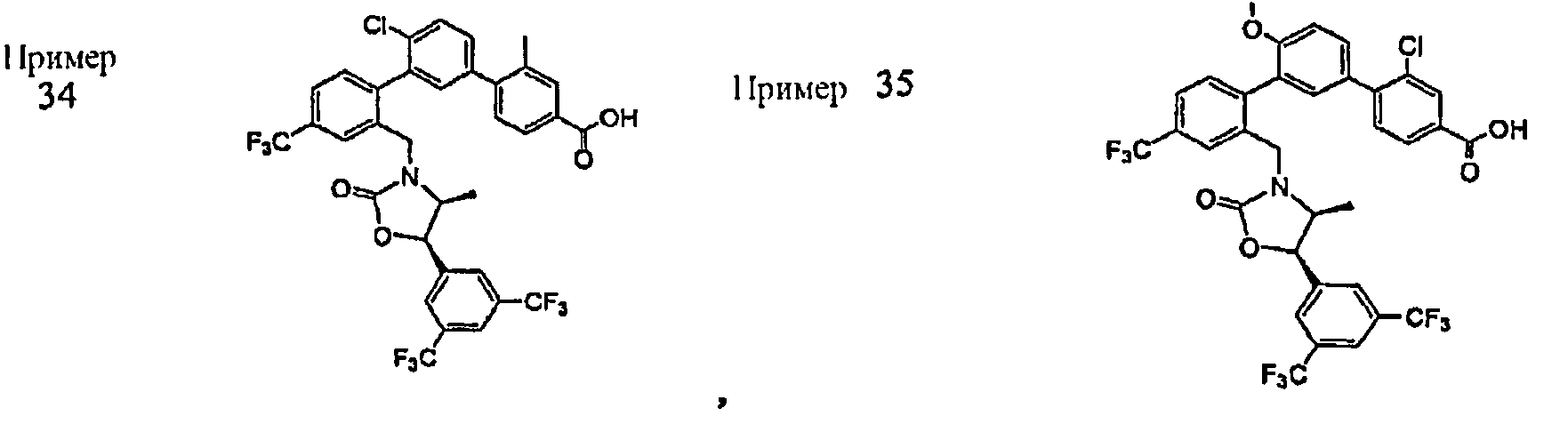
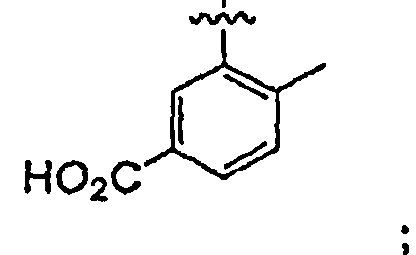
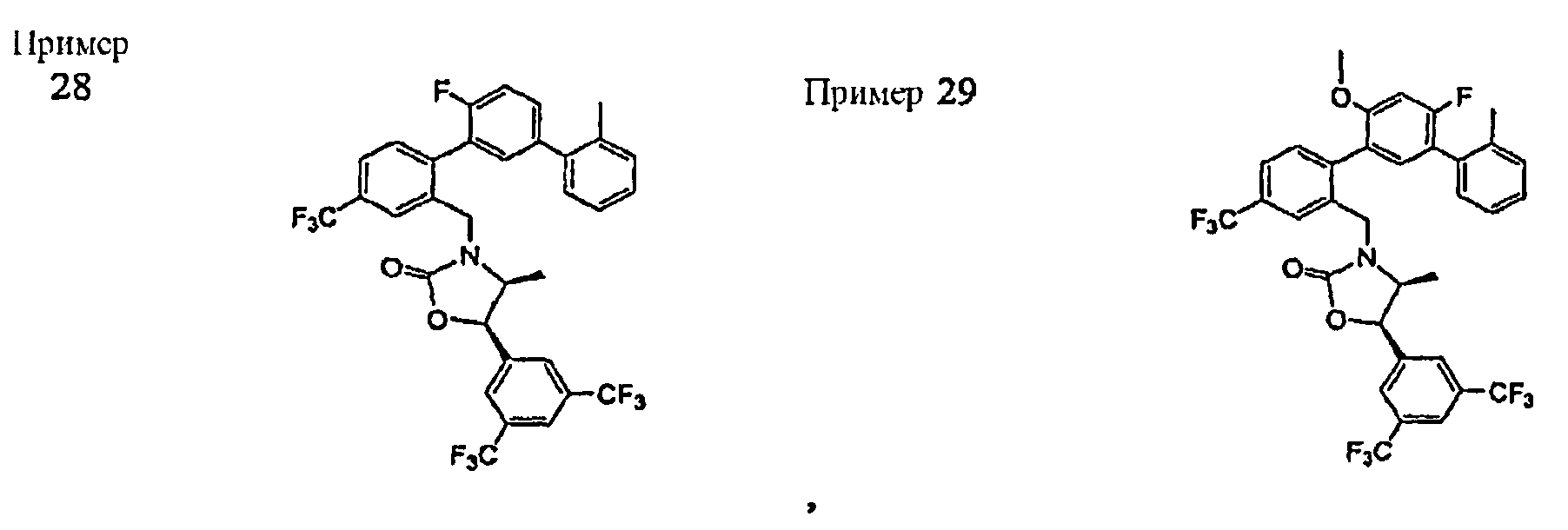
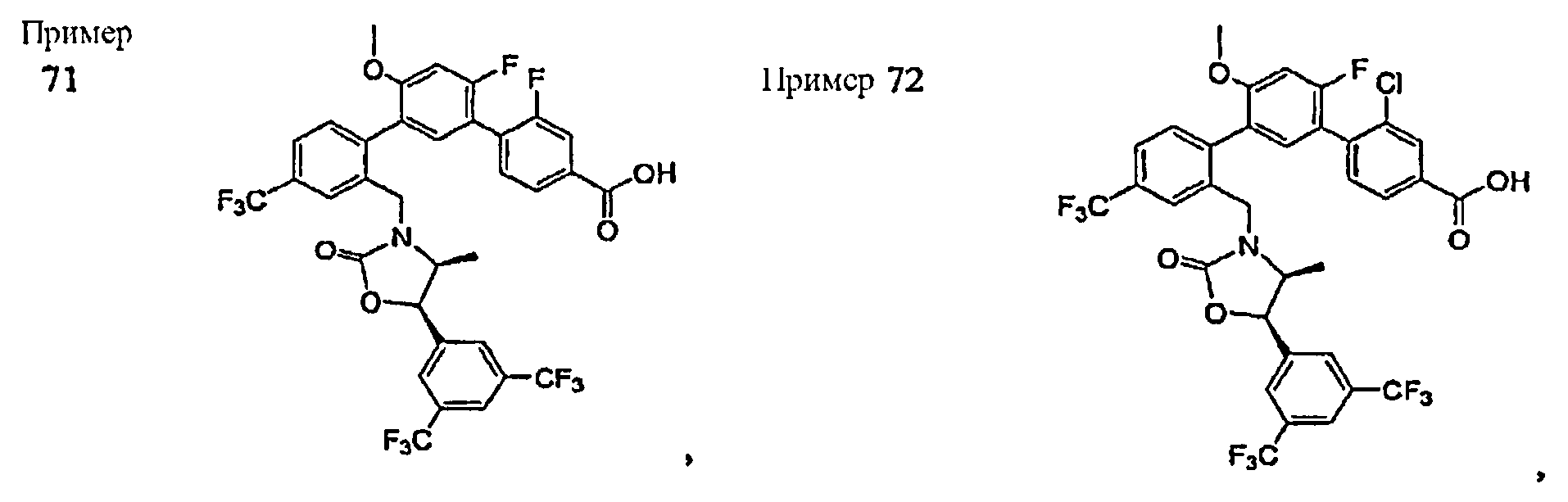

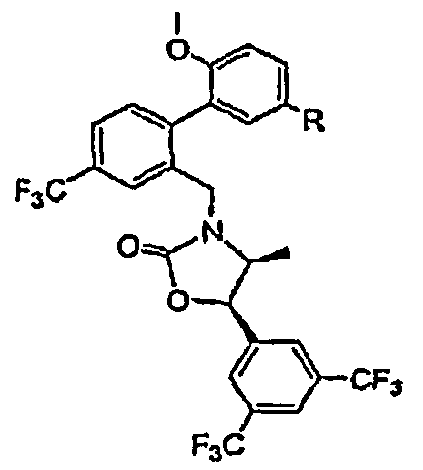
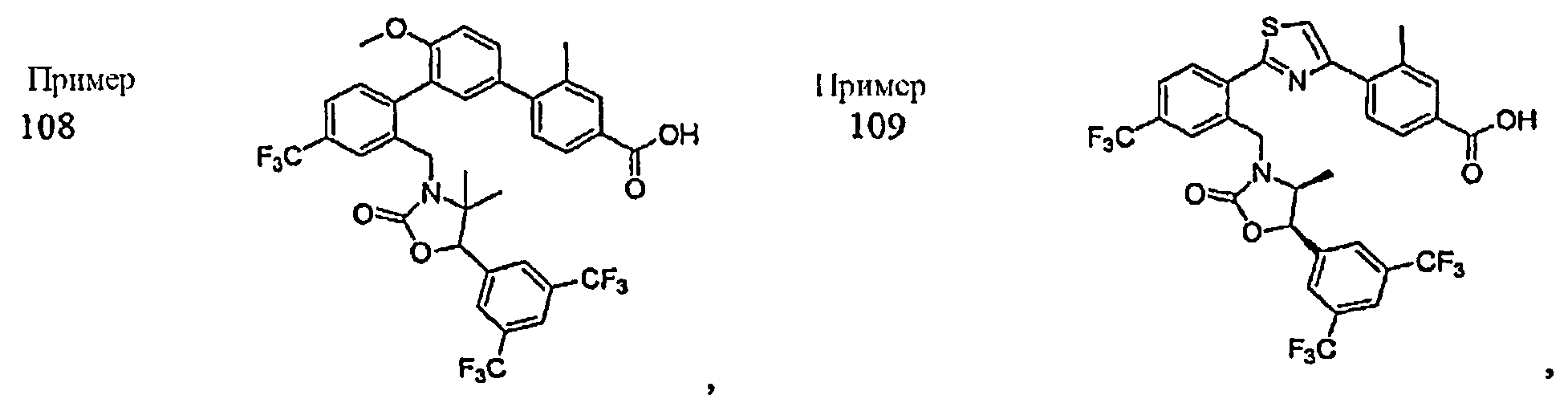
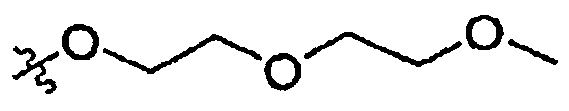
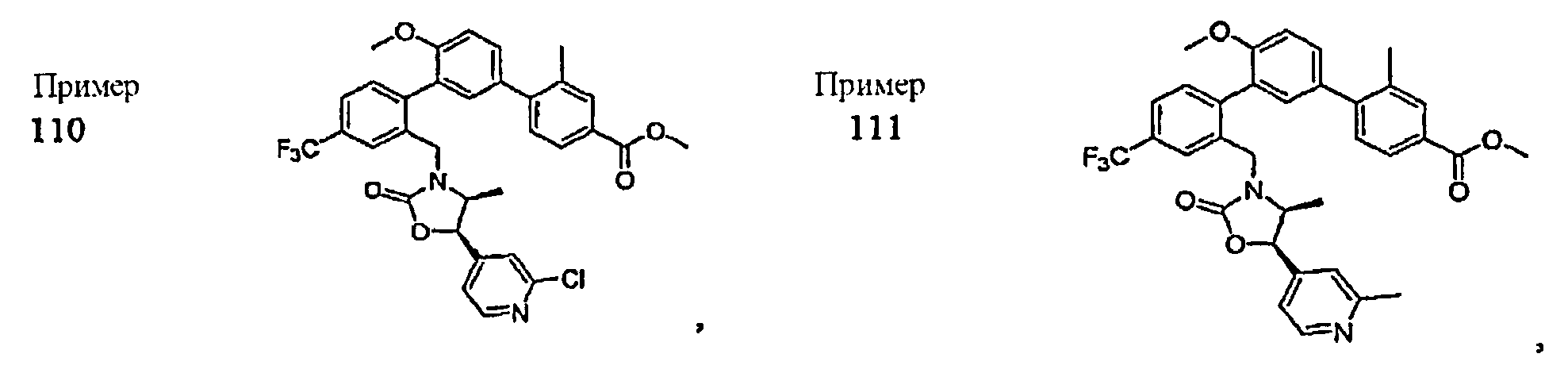
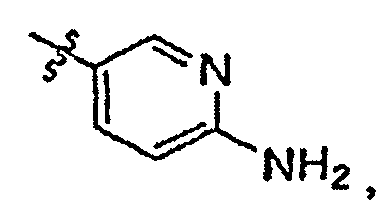
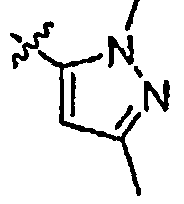
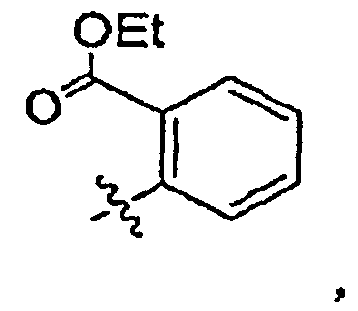
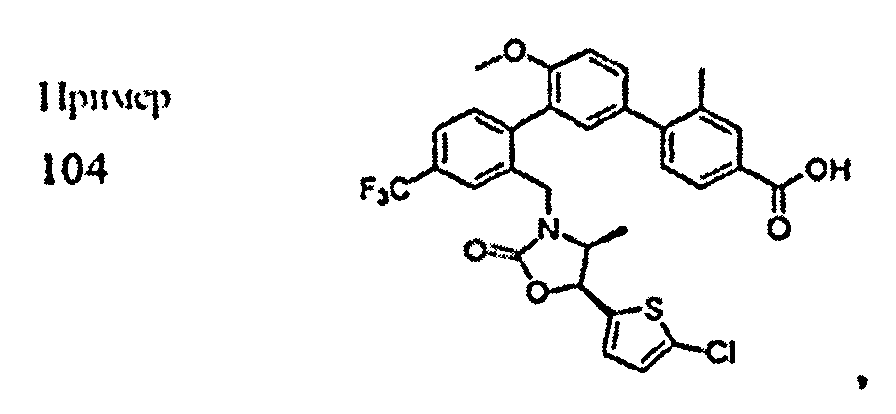
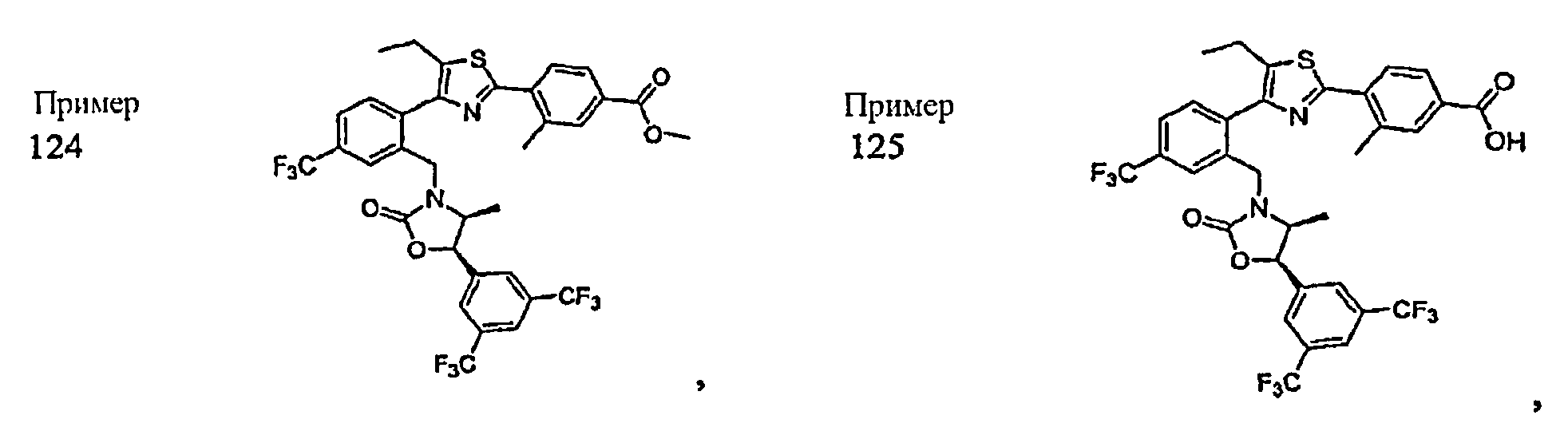
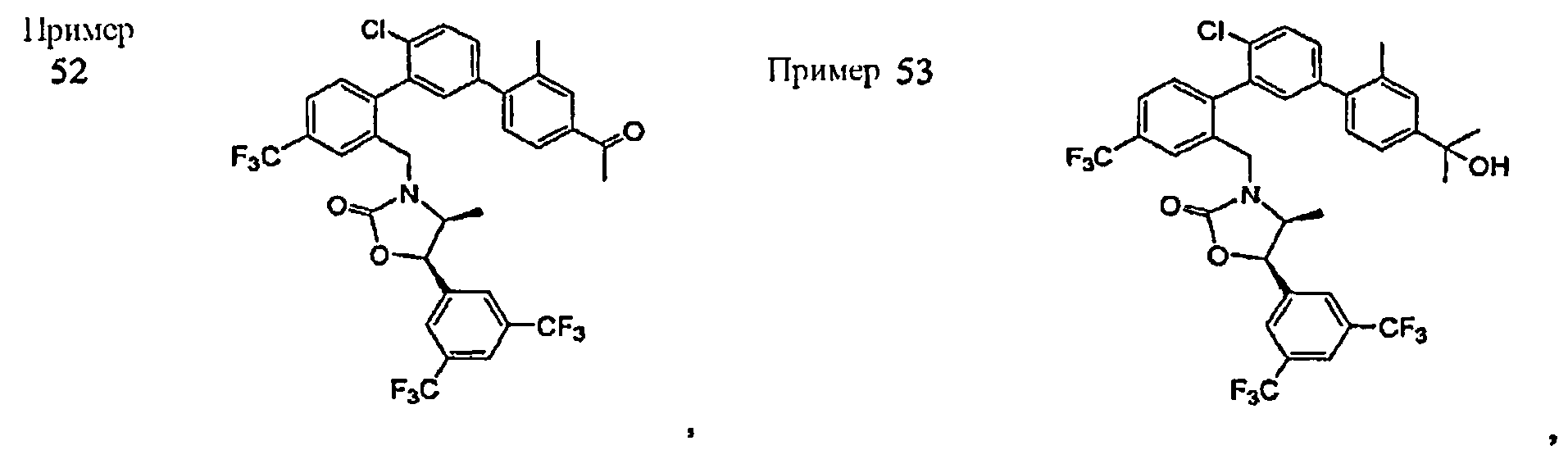
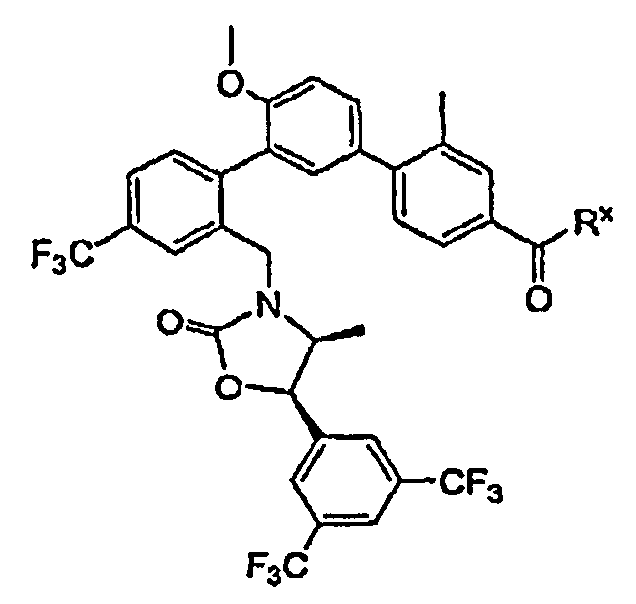
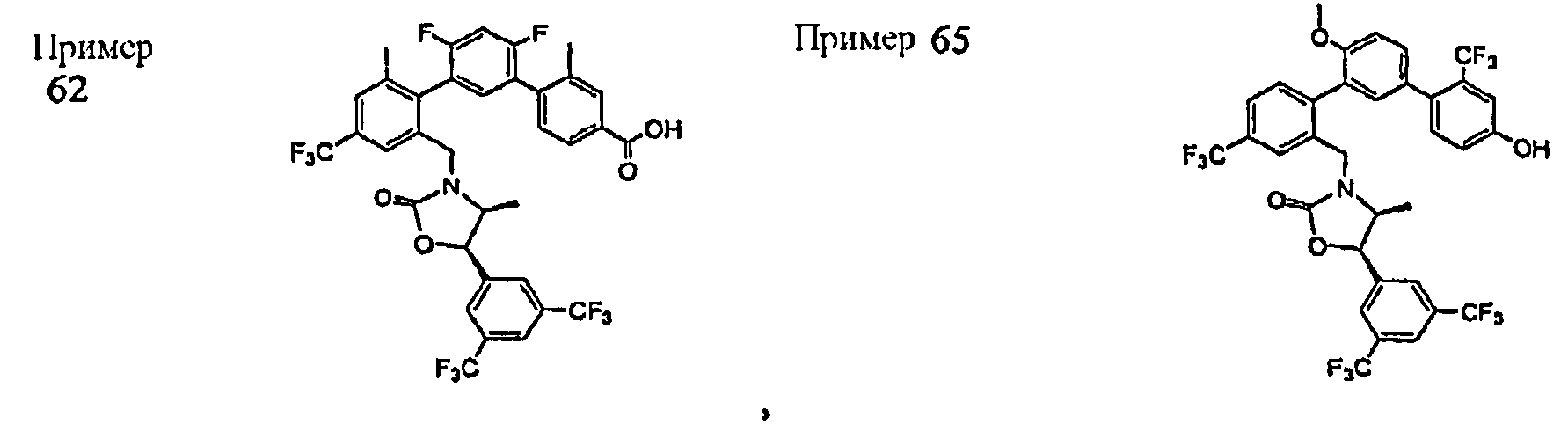
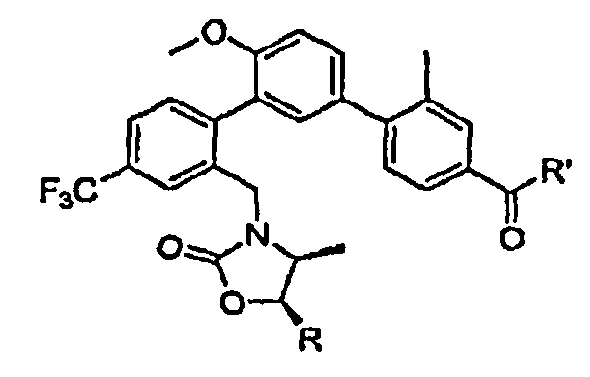
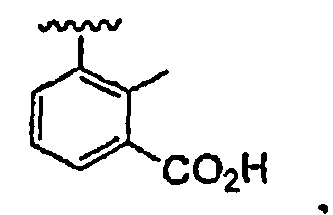
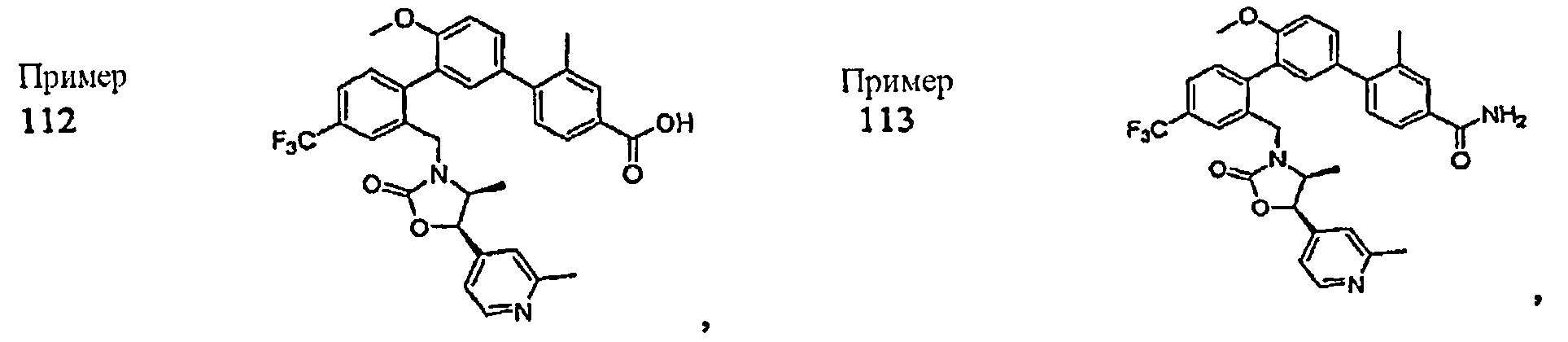
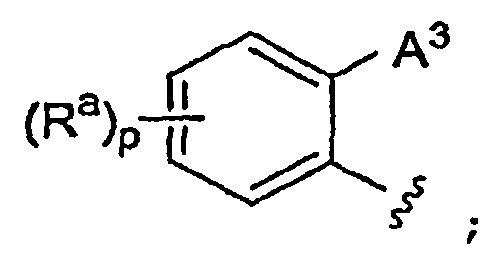
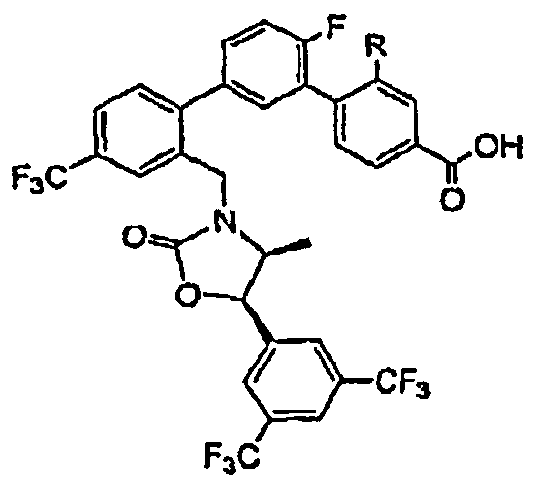
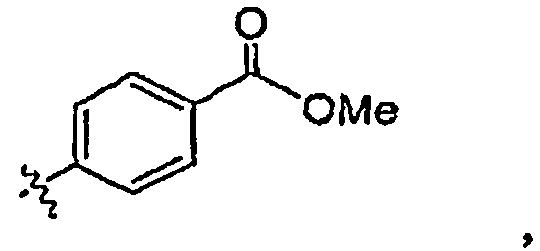
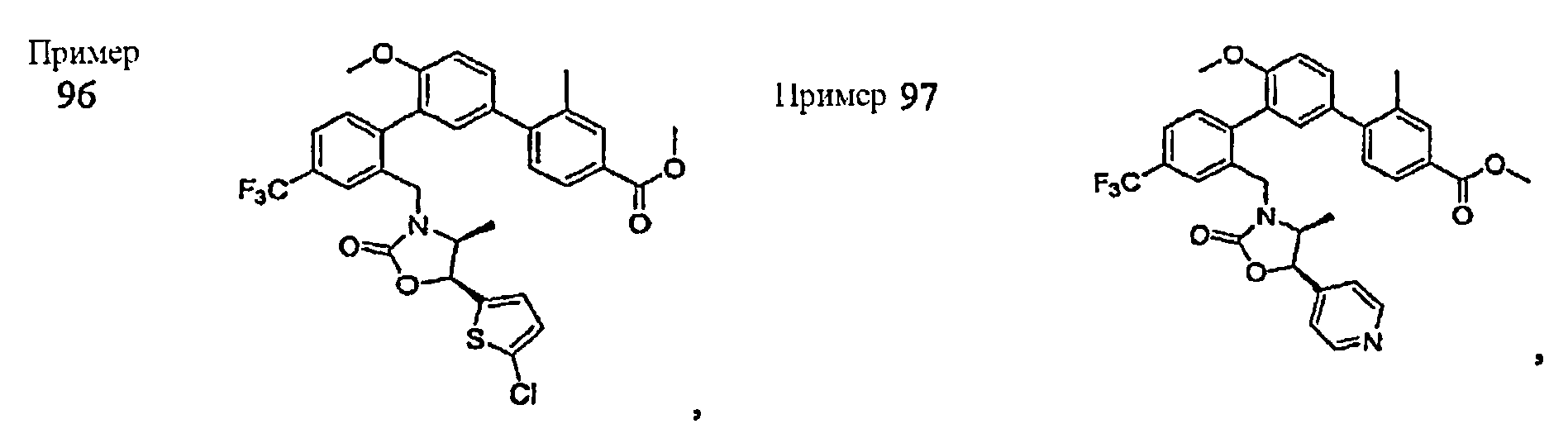
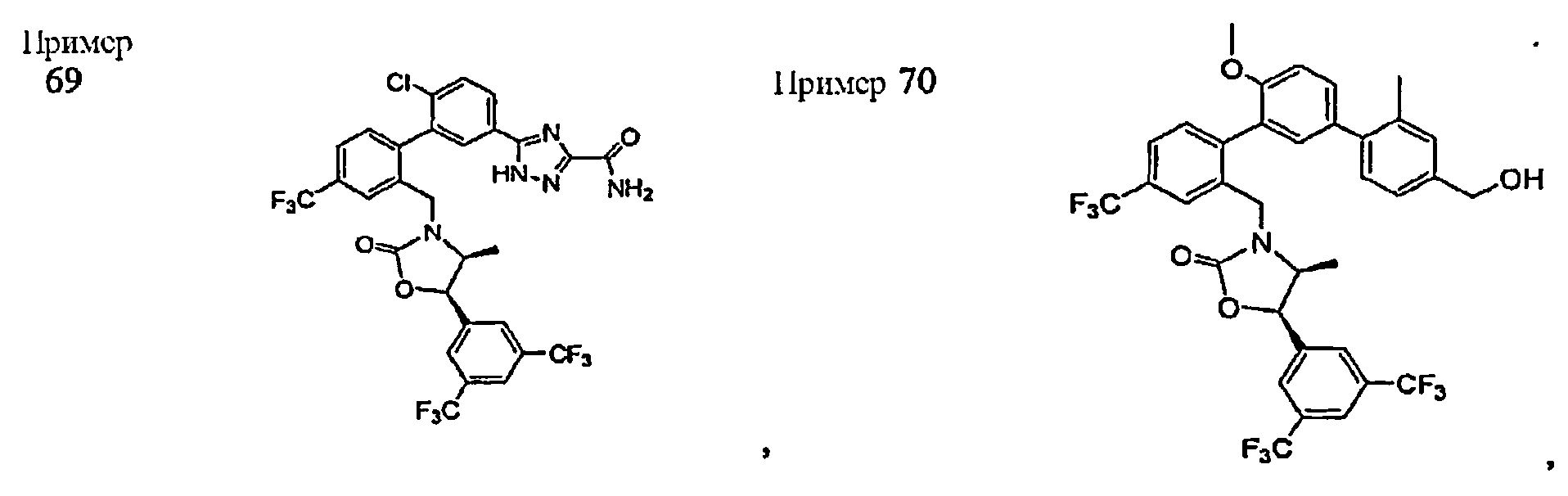
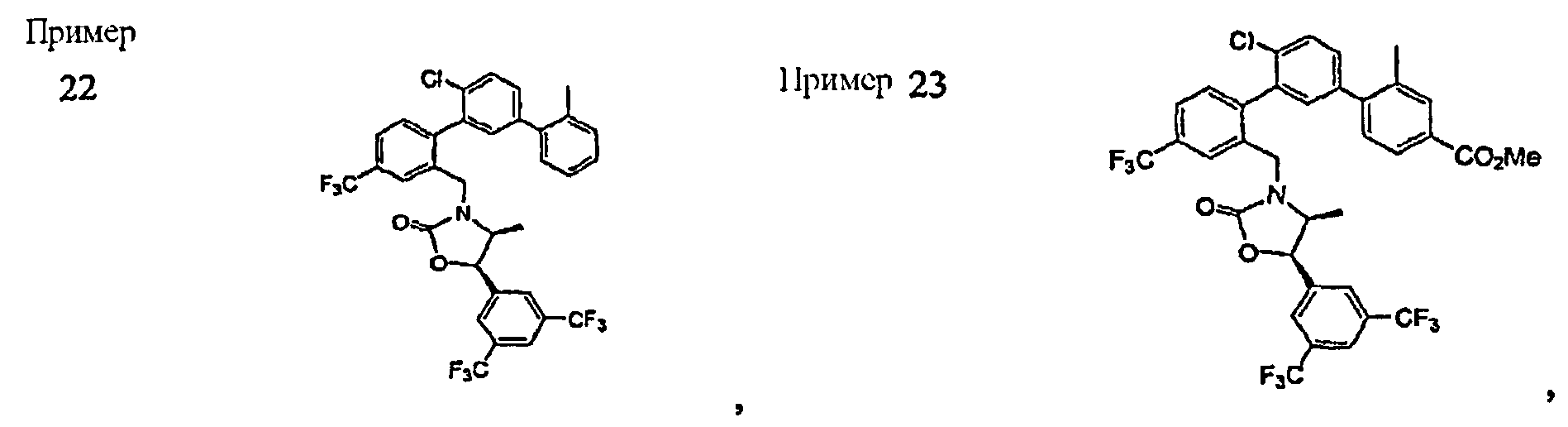
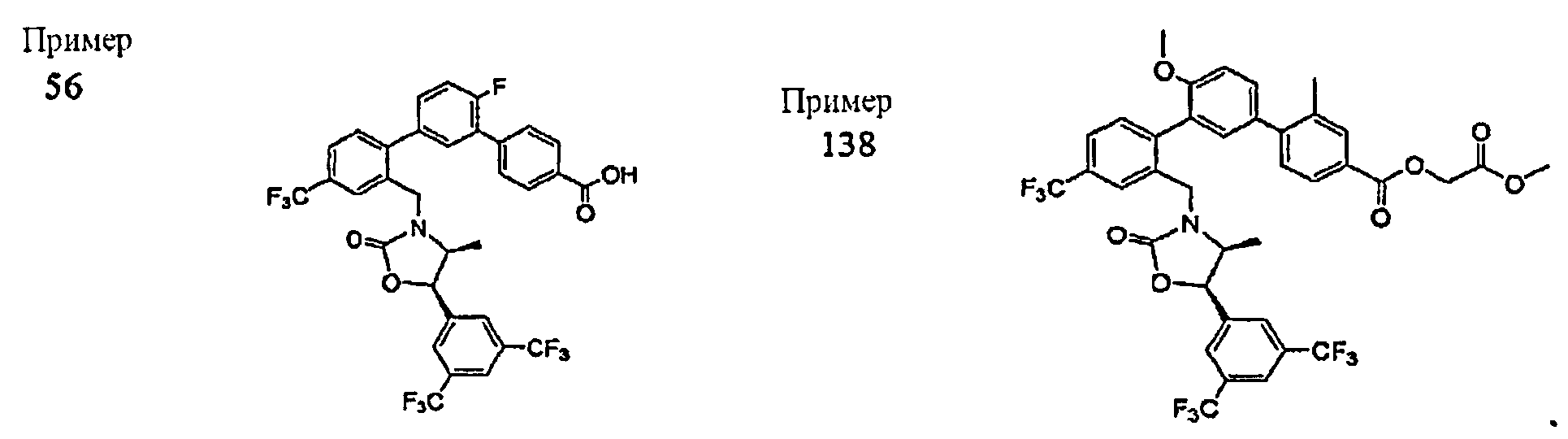
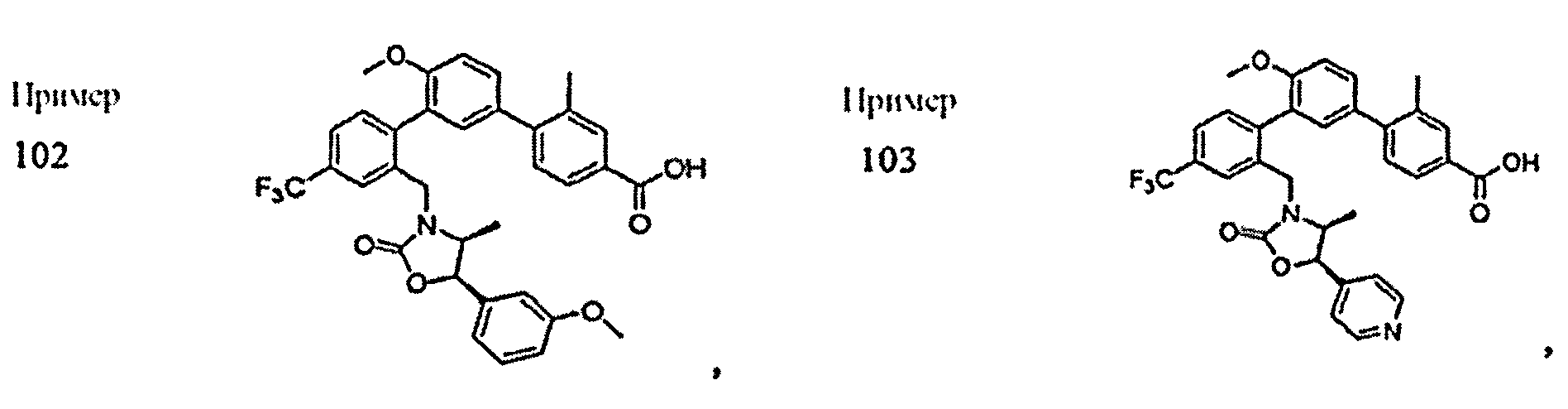
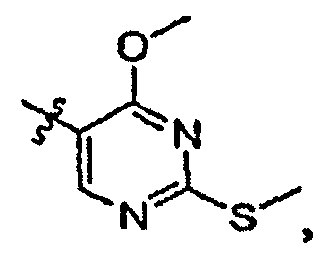
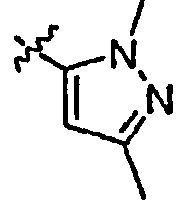
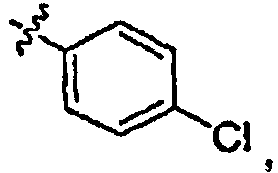
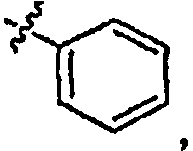
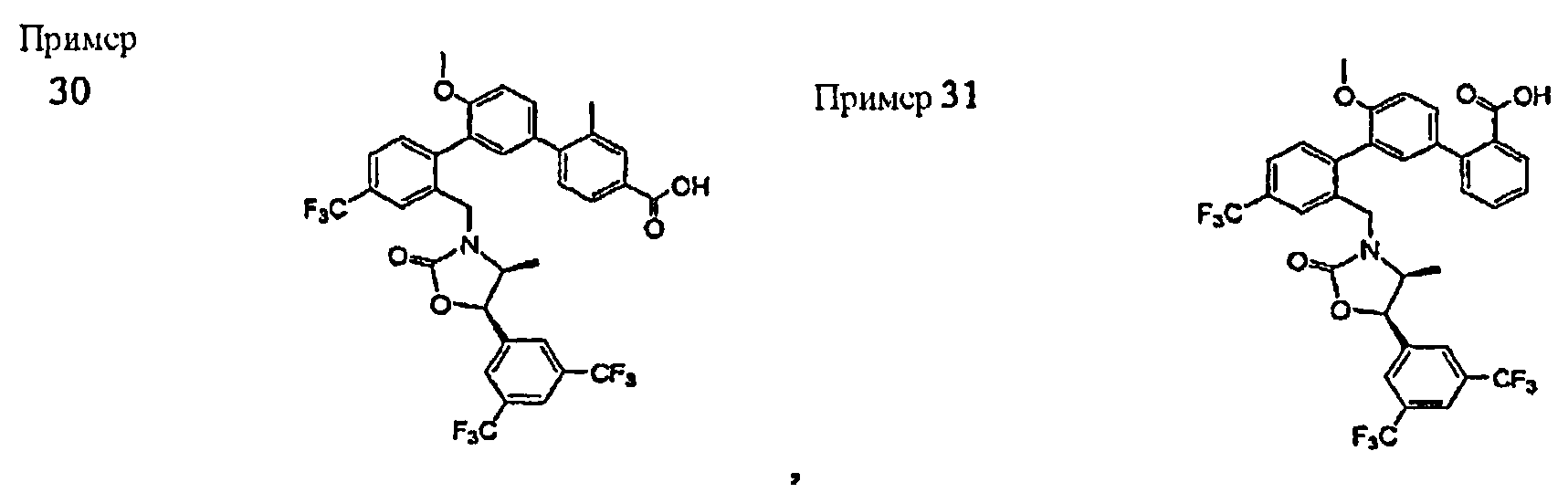
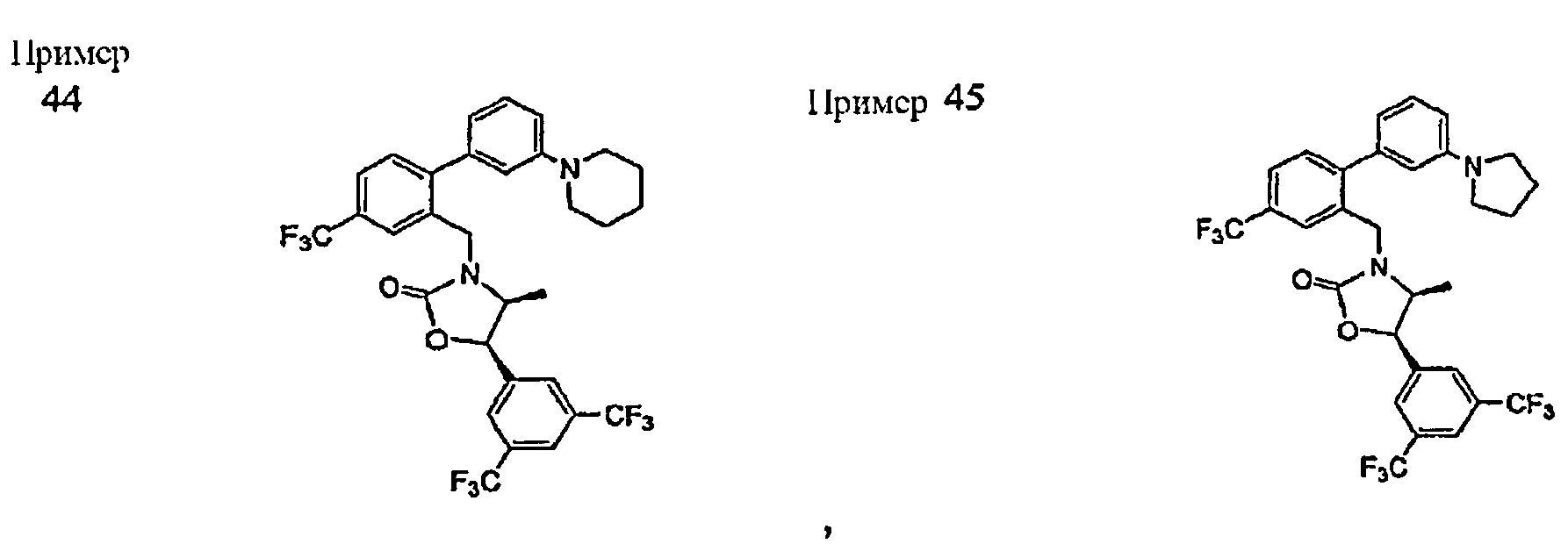
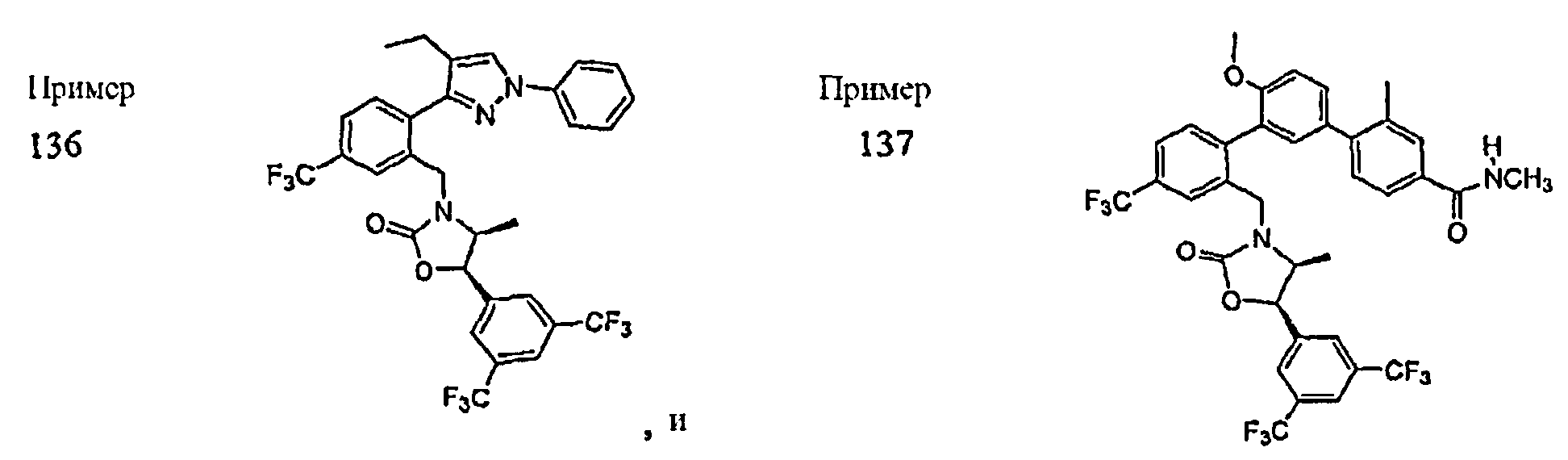
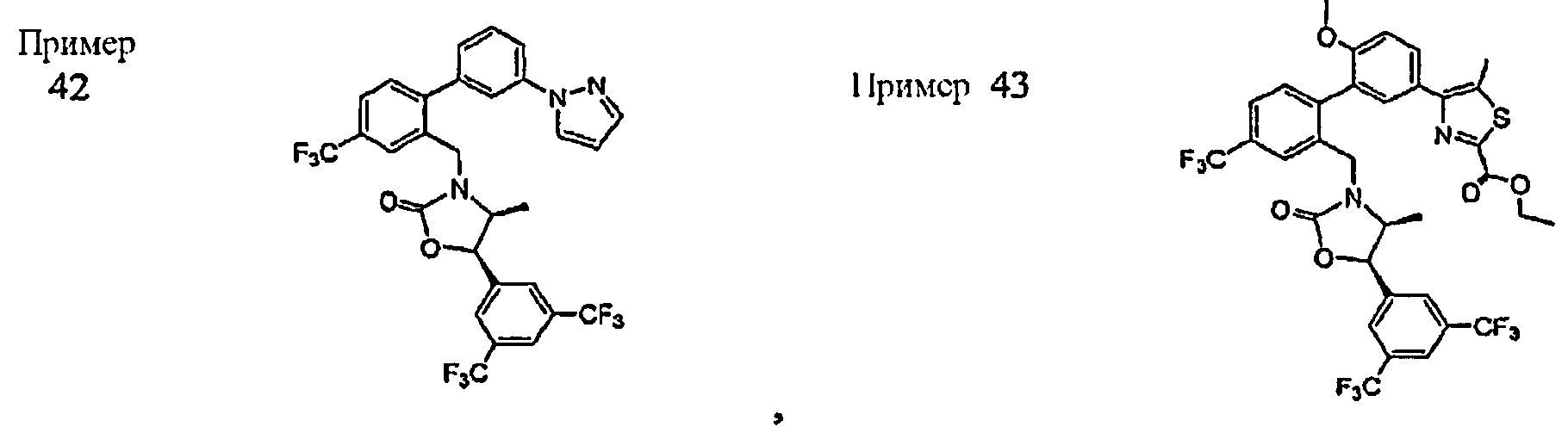
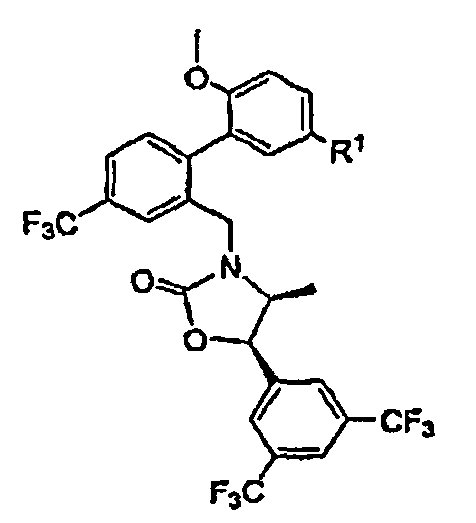
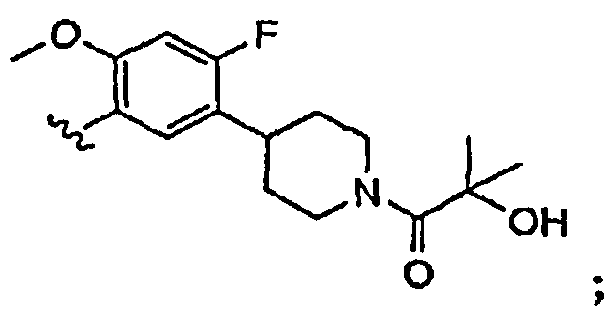
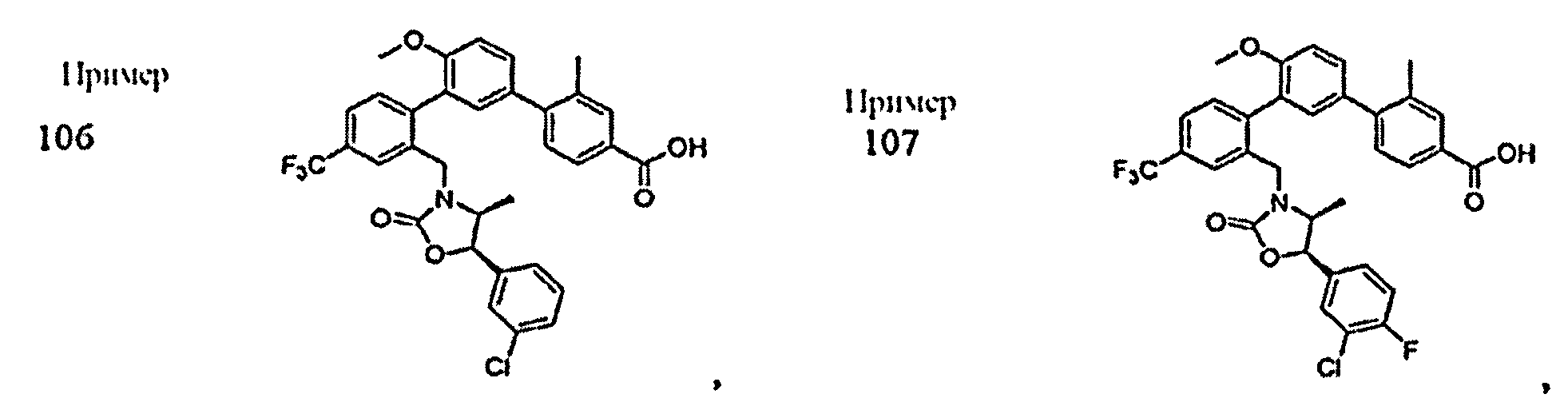
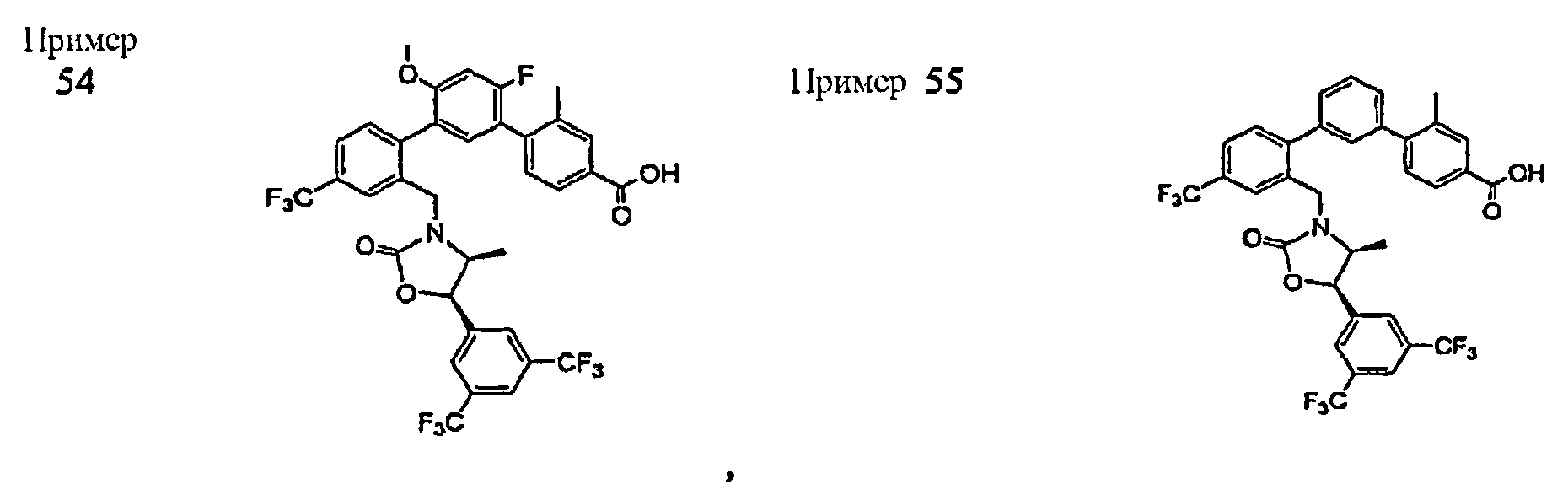
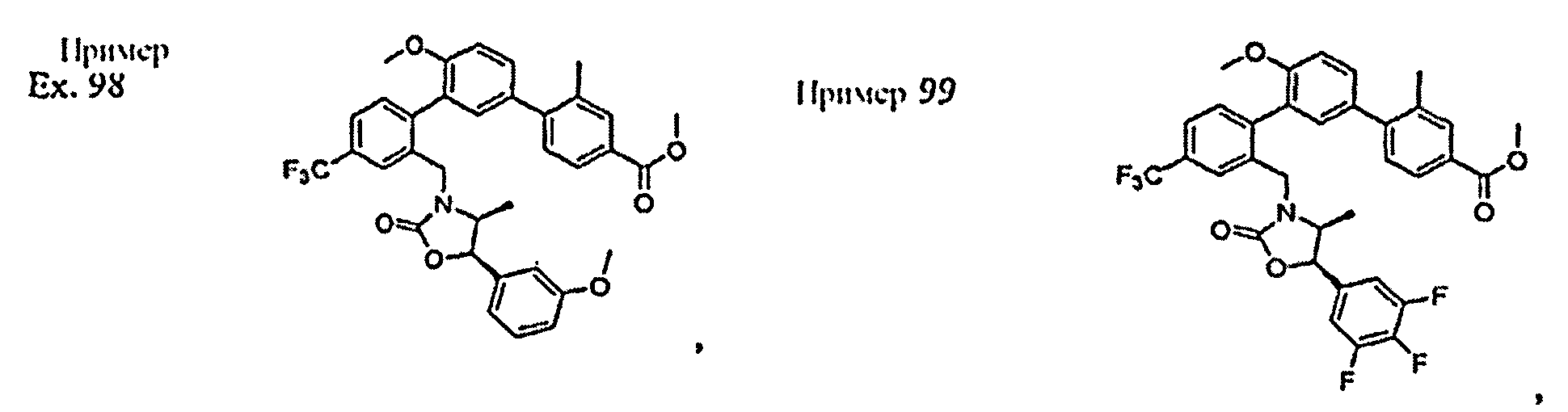
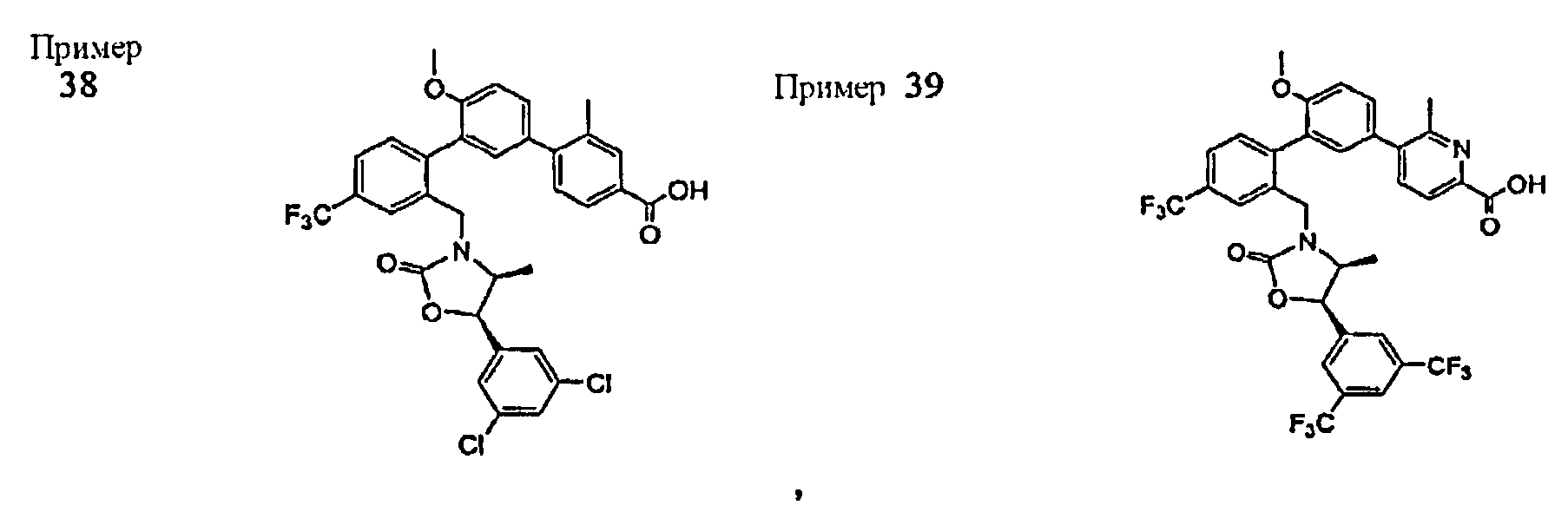
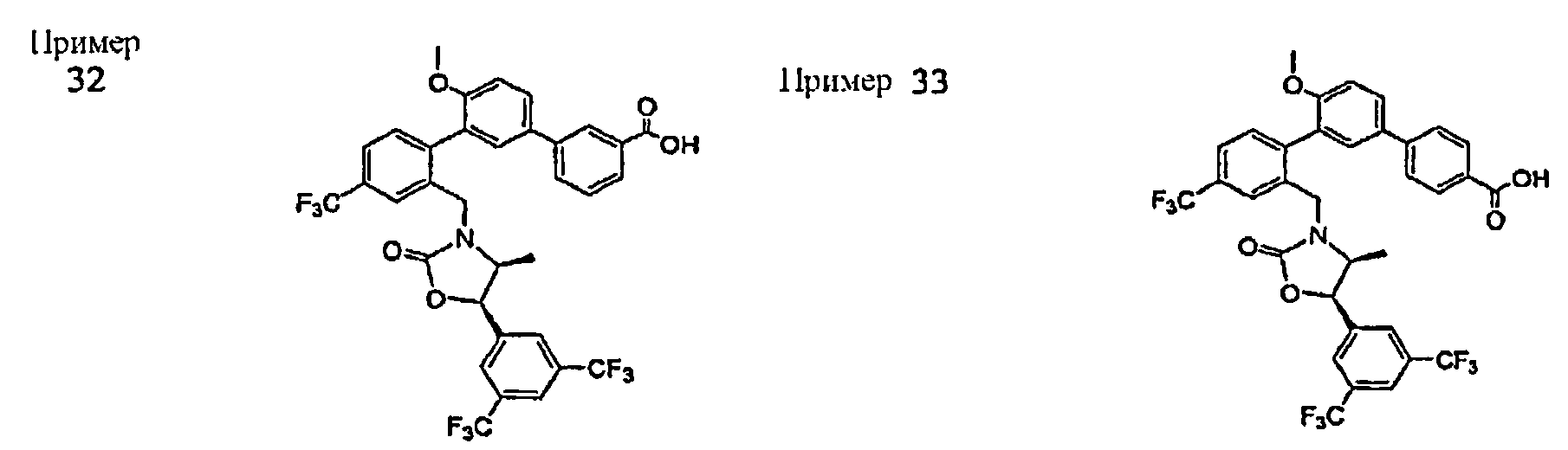
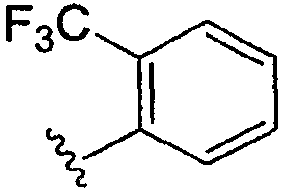
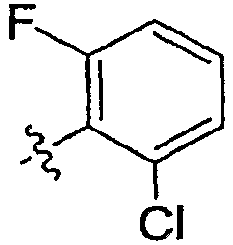
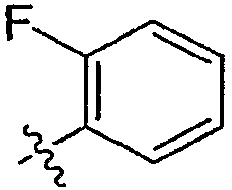
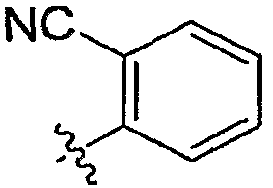
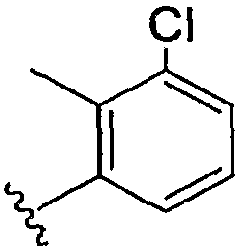
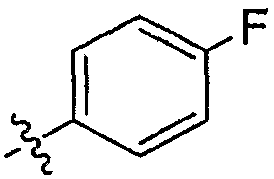
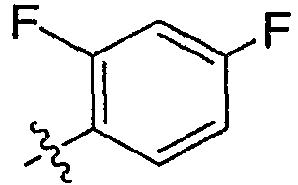
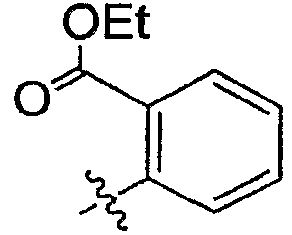
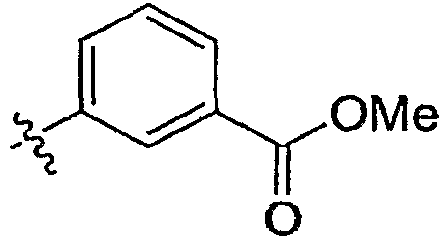
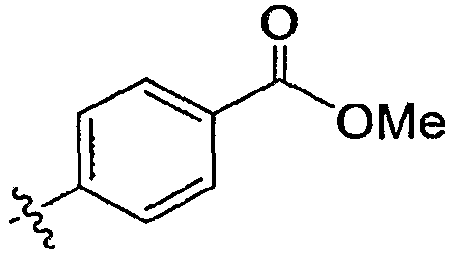
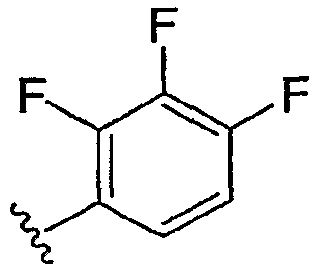
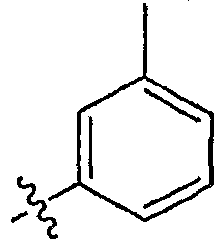
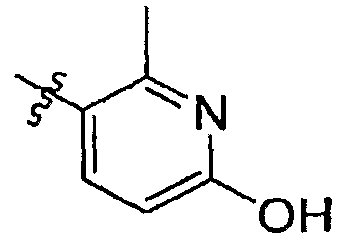
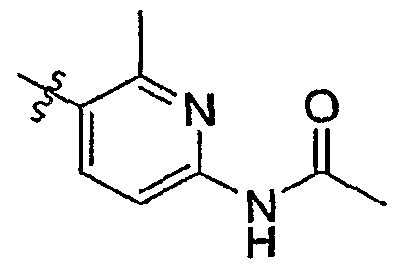
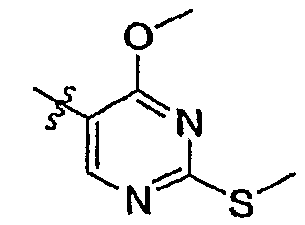
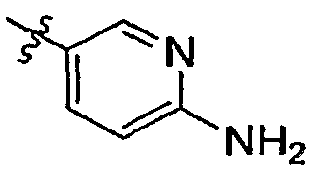
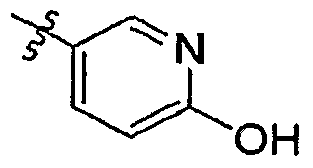
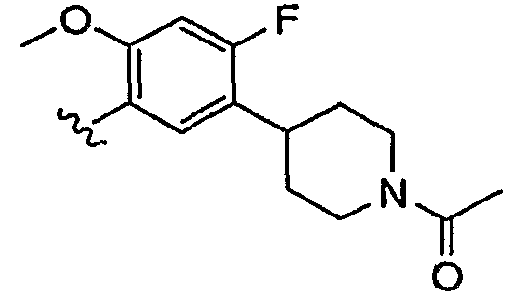
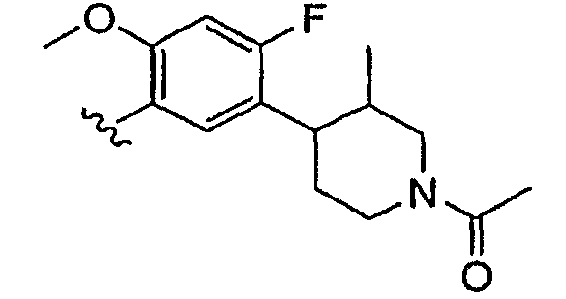 изомер А
изомер А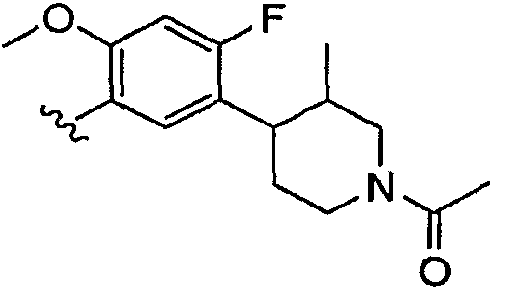 изомер В
изомер В