Результат интеллектуальной деятельности: ВАКЦИННЫЕ СОСТАВЫ ПРОТИВ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА (HPV), СОДЕРЖАЩИЕ АЛЮМИНИЕВЫЙ АДЪЮВАНТ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к составам на основе антигена вируса папилломы человека (HPV), характеризующимся повышенной стабильностью антигена после замораживания и/или лиофилизации. В частности, настоящее изобретение относится к стабильным вакцинным составам против HPV, содержащим вирусоподобные частицы (VLP) HPV, связанные с адъювантом на основе соли алюминия, и к способам получения указанных составов.
Перекрестная ссылка на родственные заявки
По этой заявке испрашивается приоритет временной заявки на патент США №61/500829, поданной 24 июня 2011 г., которая полностью включена в качестве ссылки в настоящее описание.
Уровень техники
Было проведено всестороннее исследование возможности совместного введения вакцин с соединениями, способными усиливать иммунную реакцию против представляющего интерес антигена, известными как адъюванты. Помимо усиления иммунного ответа на представляющий интерес антиген, некоторые адъюванты могут быть использованы для уменьшения количества антигена, требуемого для провокации желаемого иммунного ответа или для уменьшения числа инъекций, необходимых в клинической схеме введения антигена для индукции длительного иммунного ответа, и для защиты от возникновения заболевания.
Более 60 лет назад было установлено, что соединения алюминия обладают адъювантной активностью (см. публикации Lindblad, E.B., Immunol. and Cell Biol. 82: 497-505 (2004); Baylor et al., Vaccine 20: S18-S23 (2002)). Алюминиевые адъюванты обычно считаются безопасными при использовании в соответствующих дозах. Благодаря низкой стоимости и длительному применению в лечении людей адъюванты на основе солей алюминия являются наиболее предпочтительными адъювантами, используемыми в вакцинах, предназначенных для людей.
Вакцины, содержащие адъюванты на основе солей алюминия, обычно получают в виде жидкостей, которые чрезвычайно чувствительны к таким изменениям температуры как нагревание и замораживание. Замораживание вакцин, содержащих соли алюминия, вызывает необратимое повреждение физической структуры соли алюминия, в результате чего происходит агломерация частиц адъюванта. Вследствие этого снижается активность адъюванта, и в конечном счете утрачивается иммуногенность вакцины. По указанной причине такие вакцинные составы необходимо хранить в узком температурном диапазоне, предпочтительно от 2°С до 8°С, что требует надежного охлаждения во время транспортировки и хранения вакцины. Постоянное охлаждение не всегда является экономически возможным, особенно в развивающихся странах. Кроме того, случайное замораживание вакцин, содержащих адъюванты на основе солей алюминия, является общей проблемой как в развивающихся странах, так и в развитых странах (Clapp et al., J. Pharm. Sci. 100(2): 388-401 (2011); Matthias et al., Vaccine 25(20): 3980-86 (2007)). Транспортировка замороженной вакцины невозможна из-за непомерно высоких затрат. Проблема также состоит в том, что субъекту по неосторожности может быть введена ранее замороженная вакцина, обладающая более низкой иммуногенностью, что приведет к более низкой эффективности вакцинации.
Было предложено несколько методов решения проблем, связанных с сохранением необходимой температуры для вакцин, содержащих соль алюминия. Одним возможным решением является предотвращение замораживания путем добавления в состав таких компонентов как пропиленгликоль, полиэтиленгликоль или глицерин (Braun, L.J. et al., Vaccine 27: 4609-4614 (2009); Braun et al., Vaccine 27: 72-79 (2009)). В публикации Braun et al., см. выше, было показано, что пропиленгликоль может предотвращать вызываемую замораживанием агломерацию адъюванта в определенных вакцинах, даже в концентрациях, которые являются слишком низкими для предотвращения замораживания.
Использование лиофилизированных составов вместо жидких вакцинных составов позволяет решить некоторые вопросы, связанные с транспортировкой и хранением вакцины; однако процесс лиофилизации также связан с агрегацией частиц адъюванта и утратой иммуногенности (Маа et al., J. Pharm. Sci. 92(2): 319-332 (2003)). В публикациях Clausi et al. (J. Pharm. Sci. 97: 2049-61 (2008) и Randolph et al. (WO 2008/118691) показано, что агрегацию алюминиевого адъюванта во время замораживания и лиофилизации можно устранить, добавляя в состав трегалозу в больших концентрациях (например, 15%). В публикации Wolff et al. (Colloids & Surfaces A: Physiochem Eng. Aspects 330: 116-126 (2008)) также предложено использовать трегалозу в больших концентрациях для защиты вакин, содержащих алюминий, от холодового стресса. Кроме того, в публикации Wolff et al. предложено использовать PVP К 25, HES 450 и 200, сахарозу и сорбит в качестве компонентов состава для предотвращения агрегации алюминиевого адъюванта. Мизуно и др. (Mizuno et al., европейский патент №0130619 B1) предлагают использовать по меньшей мере одну аминокислоту или ее соль в комбинации по меньшей мере с одним сахаридом или по меньшей мере с одним коллоидным веществом.
Было бы желательно создать жидкие вакцинные составы, в которых антиген, используемый для приготовления вакцины, адсорбирован на алюминиевом адъюванте, и которые способны сохранять свои физические и иммунологические свойства при замораживании или лиофилизации.
Сущность изобретения
Настоящее изобретение относится к составам на основе антигена вируса папилломы человека (HPV), которые характеризуются более высокой стабильностью антигена. В частности, настоящее изобретение относится к стабильным вакцинным составам против HPV, содержащим вирусоподобные частицы (VLP) HPV по меньшей мере одного типа, которые адсорбированы на адъюванте на основе соли алюминия и далее включают комбинацию сахарозы и маннита и необязательно соль. Вакцинные составы по настоящему изобретению являются стабильными после замораживания-оттаивания и лиофилизации. Кроме того, настоящее изобретение относится к лиофилизированным и замороженным вакцинным составам против HPV, содержащим вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на адъюванте на основе соли алюминия, сахарозу и маннит.
Настоящее изобретение также относится к вышеописанным составам против HPV, которые включают: (а) вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на алюминиевом адъюванте, где вирусоподобные частицы HPV каждого типа присутствуют в концентрации 10-200 мкг/мл, при этом вирусоподобные частицы выбирают из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; и (b) от примерно 1% до примерно 10% масс./об. маннита и от примерно 0,5% до примерно 10% сахарозы. Составы по настоящему изобретению могут также содержать дополнительные компоненты, которые включают, но не ограничиваясь ими, соль, гистридин и поверхностно-активное вещество. Настоящее изобретение также относится к замороженным или лиофилизированным вакцинным составам против HPV, рассмотренным в настоящем описании.
Настоящее изобретение также относится к способам получения стабильных вакцинных составов. В этой связи настоящее изобретение относится к способу получения стабильного замороженного вакцинного состава против HPV, который включает: (а) получение жидкого вакцинного состава против HPV, содержащего (i) вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на адъюванте на основе соли алюминия, которые присутствуют в концентрации 10-200 мкг/мл, при этом вирусоподобные частицы выбирают из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; (ii) от примерно 1% до примерно 10% масс./об. маннита и (iii) от примерно 0,5% до примерно 10% сахарозы; и (b) замораживание жидкого состава с получением замороженного вакцинного состава. Дополнительные варианты осуществления способов по настоящему изобретению относятся к сушке замороженного состава, в результате чего получают лиофилизированный состав.
В настоящем описании и прилагаемой формуле изобретения формы единственного числа включают формы множественного числа за исключением тех случаев, когда из контекста следует обратное.
В настоящем описании изобретения и прилагаемой формуле изобретения использованы следующие термины и аббревиатуры:
Термин "SWFI" означает стерильную воду для инъекций.
Термин "BWFI" означает бактериостатическую воду для инъекций, которая является стерильной водой, содержащей антимикробное средство.
Термин "API" означает активный фармацевтический ингредиент, например, вирусоподобные частицы HPV, который является биологически активным (то есть способным вызывать соответствующую иммунную реакцию) компонентом составов по настоящему изобретению и оказывает терапевтическое или профилактическое воздействие на человека или животное, нуждающееся в таком воздействии. В использованном здесь значении API является активными ингредиентом вакцины.
"Состав" относится к композиции, содержащей активный фармацевтический или биологический ингредиент наряду с одним или несколькими дополнительными компонентами. Термин "состав" имеет взаимозаменяемые значения с терминами "фармацевтическая композиция", "вакцинная композиция" и "вакцинный состав". Составы могут быть жидкими или твердыми (например, лиофилизированными). Дополнительные компоненты включают фармацевтически приемлемые наполнители, добавки, разбавители, буферы, сахара, аминокислоты (такие как глицин, глутамин, аспарагин, аргинин или лизин), хелатообразователи, поверхностно-активные вещества, полиолы, вещества, увеличивающие объем, стабилизаторы, вещества, защищающие от лиофилизации, солюбилизаторы, эмульгаторы, соли, адъюванты, вещества, повышающие тоничность (такие как галогениды щелочных металлов, предпочтительно хлорид натрия или калия, маннит, сорбит), носители и антимикробные средства.
Приемлемые компоненты для фармацевтических составов не должны быть токсичными для реципиентов в используемых дозах и концентрациях. "Состав" обычно содержит одну дозу API, которая может быть введена одному нуждающемуся в этом человеку или животному. Термин "состав для многократного введения" означает состав, содержащий несколько доз API, которые могут быть введены субъекту несколько раз. Состав для многократного введения обычно включает антимикробное средство. Термин "состав" имеет взаимозаменяемые значения с терминами "композиция", "биологическая композиция" и "фармацевтическая композиция".
Термин "лепешка" означает сухой осадок, образующийся в результате лиофилизации или сушки вымораживанием жидкого состава. Образование лепешки является показателем влияния процесса лиофилизации на свойства лиофилизированного состава. В использованном здесь значении "сухая лепешка" означает лепешку, содержащую примерно 20% или меньше остаточной влаги. В некоторых вариантах осуществления изобретения влажность сухой лепешки равна 15% или меньше, 10% или меньше или 5% или меньше. В альтернативных вариантах осуществления изобретения влажность сухой лепешки находится в пределах от примерно 0,1% до примерно 10%, от примерно 0,1% до примерно 6%, от примерно 0,5% до примерно 10% или от 0,5% до примерно 6%.
Термин "время восстановления" означает время, необходимое для повторной гидратации сухого, лиофилизированного состава (лепешки), в результате чего восстановленный жидкий состав становится прозрачным и лепешка растворяется.
Термин "терапевтически эффективное количество" означает количество активного ингредиента (то есть терапевтического белка или антитела), достаточное для достижения требуемого терапевтического эффекта у человека или животного, например, количество, необходимое для лечения, выздоровления, предотвращения или ингибирования развития и прогрессирования заболевания или его симптомов, и/или количество, необходимое для ослабления симптомов или регрессии заболевания. Такое терапевтически эффективное количество может изменяться в зависимости от структуры и эффективности активного ингредиента и способа введения. Специалист в данной области может легко определить терапевтически эффективное количество данного антитела или белка.
Термин "лечение" означает как терапевтическое лечение, так и профилактические или превентивные меры. Пациентами, нуждающимися в лечении, являются люди и животные, имеющие нарушение или состояние, подлежащее лечению, а также пациенты, предрасположенные к возникновению нарушения, и пациенты, у которых необходимо предотвратить возникновение нарушения. В использованном здесь значении термин "лечение" также означает снижение вероятности появления нарушения, уменьшение тяжести нарушения, возникшего у пациента, и регрессию нарушения или его симптомов.
Термин "фармацевтически приемлемый носитель" означает жидкий наполнитель, разбавитель или инкансулирующее вещество, которое может быть безопасно использовано при системном введении. В зависимости от конкретного способа введения могут быть использованы разные фармацевтически приемлемые носители, хорошо известные в данной области. Указанные носители могут быть выбраны из группы, включающей сахара, крахмалы, целлюлозу и ее производные, солод, желатин, тальк, сульфат кальция, растительные масла, синтетические масла, полиолы, аргининовую кислоту, растворы с фосфатным буфером, в том числе физиологический раствор с фосфатным буфером, эмульгаторы, изотонический раствор и апирогенную воду. В частности, фармацевтически приемлемые носители могут содержать разные компоненты, такие как буфер, стерильная вода для инъекций, нормальный физиологический раствор или физиологический раствор с фосфатным буфером, сахароза, гистидин, соли и полисорбат. Такие термины как "физиологически приемлемый", "разбавитель" или "наполнитель" имеют взаимозаменяемые значения.
В настоящем описании использованы следующие дополнительные аббревиатуры: FAP=замороженный водный продукт; form. = состав; F/T = замораживание-оттаивание; 1х нормальное F/T = однократное нормальное замораживание-оттаивание, описанное в примере 1; 3х нормальное F/T = трехкратное нормальное замораживание-оттаивание, описанное в примере 1; 1х быстрое F/T = однократное быстрое замораживание-оттаивание, описанное в примере 1 (также определяемое в настоящем описании как F/T FF 1×); His = гистидин; HPV=вирус папилломы человека; ч = часы; lyo = лиофилизация или лиофилизированный в зависимости от контекста; мин = минуты; мМ = миллимолярный; PS20 = полисорбат 20; PS80 = полисорбат 80; recon. = восстановление; сек = секунды; DLS = динамическое рассеяние света; NaCl = хлорид натрия; об. = объем; VLP = вирусоподобная частица; WF = вода для инъекций; масс./об. = отношение массы к объему.
Краткое описание чертежей
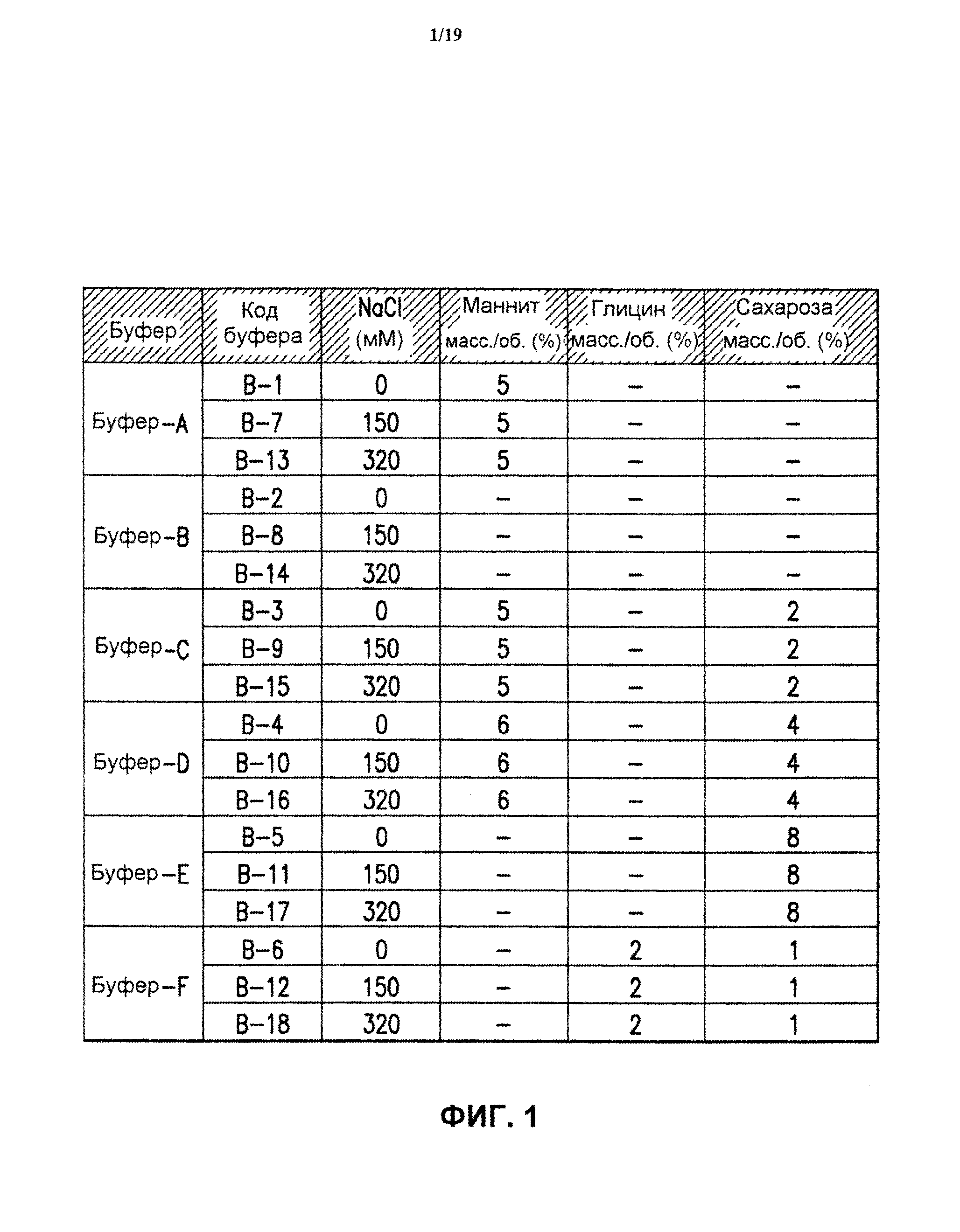
На фиг.1 показаны составы буферов, использованных в исследованиях по замораживанию-оттаиванию и лиофилизации, представленных в настоящем описании изобретения. Было использовано 6 буферов (буфер А - буфер F) и 3 варианта каждого буфера, включающих разные количества соли (0, 150 и 320 мМ хлорида натрия), в результате чего было получено 18 буферов разного состава (В-1 - В-18). Помимо указанных наполнителей, все буферы содержали 10 мМ гистидина и 0,01% полисорбата 80, рН 6,2.
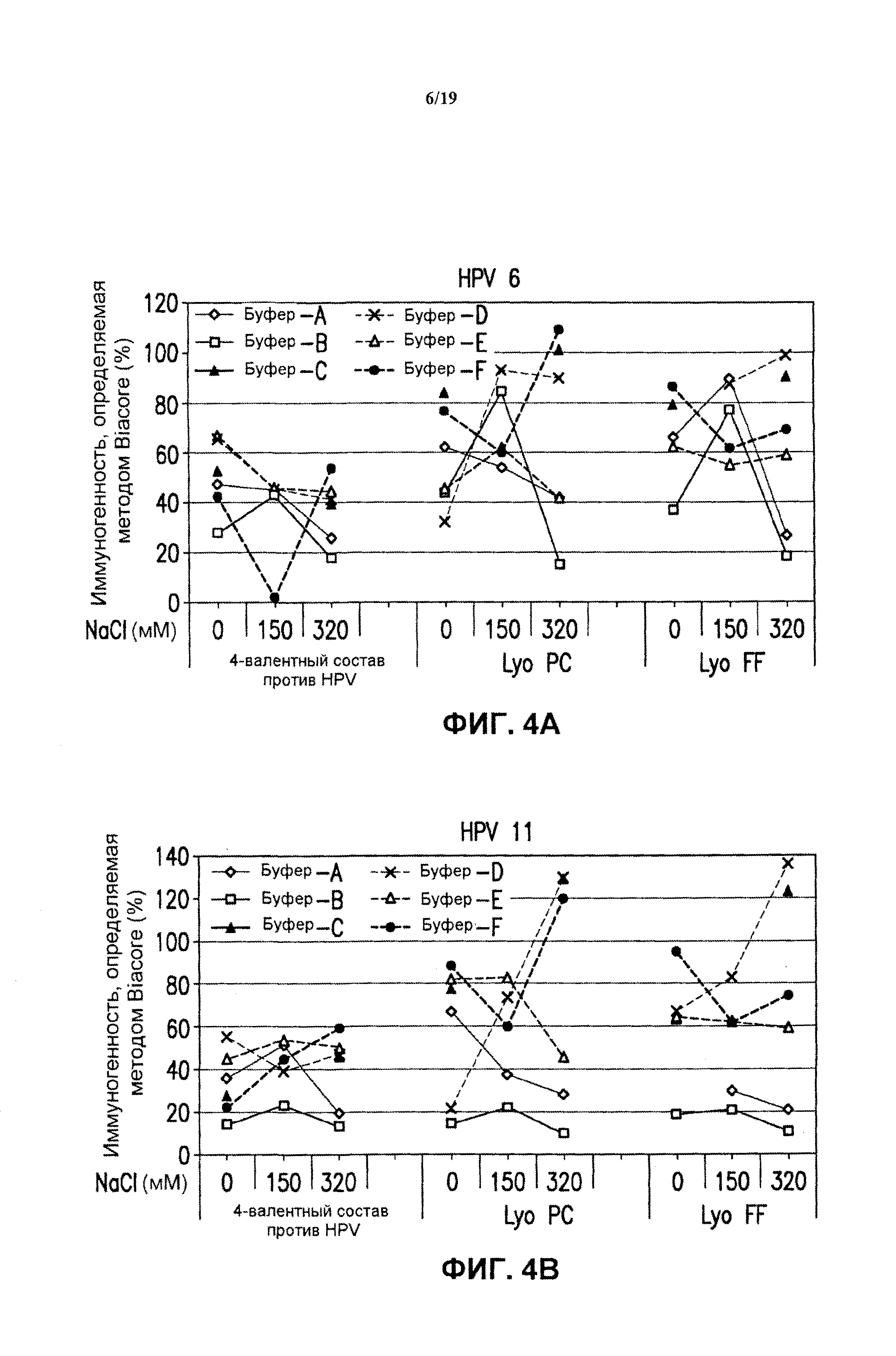
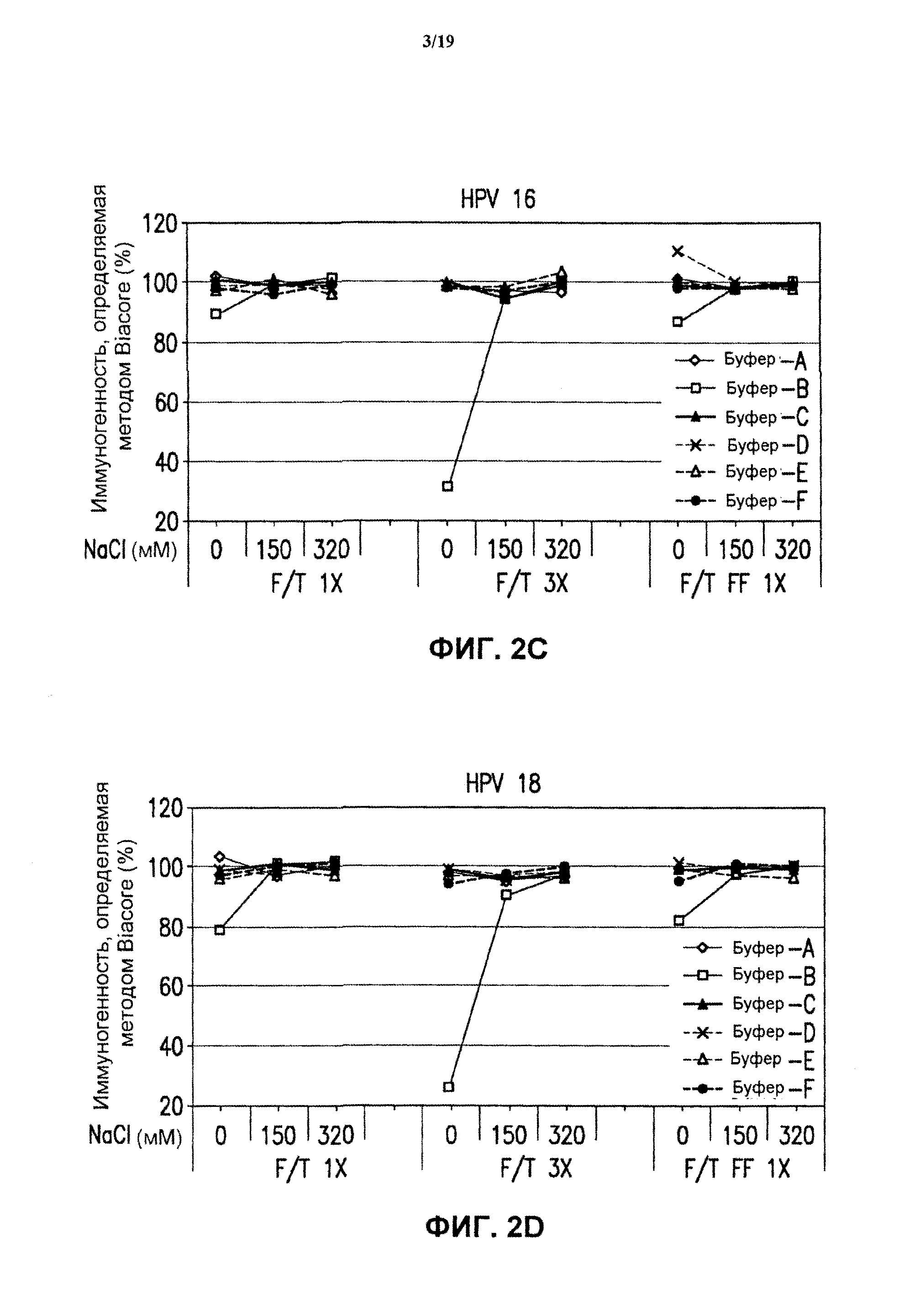
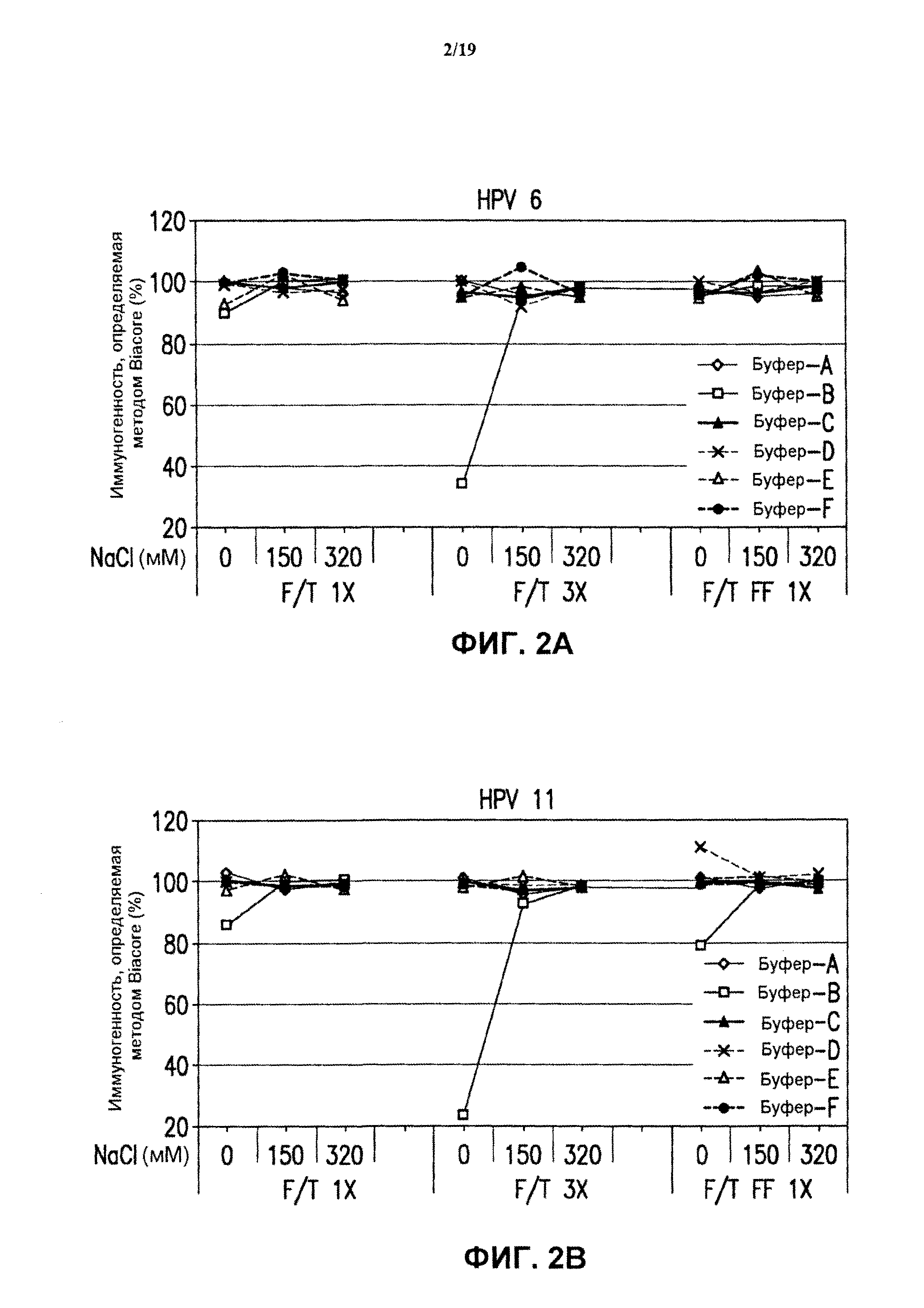
На фиг.2 представлены графики данных антигенности in vitro 4-валентных экспериментальных составов в отношении HPV каждого типа в зависимости от концентрации хлорида натрия и условий замораживания-оттаивания при использовании разных испытуемых буферов (буфер А - буфер F). См. пример 2. Графики представлены для HPV типа 6 (блок А), HPV типа 11 (блок В), HPV типа 16 (блок С) и HPV типа 18 (блок D). Вакцинные составы против HPV подвергали либо однократному быстрому замораживанию в потоке жидкого азота ("F/T FF 1×"), либо нормальному замораживанию, осуществляемому один раз ("F/T 1×") или три раза ("F/T 3×"), как описано в примере 1.
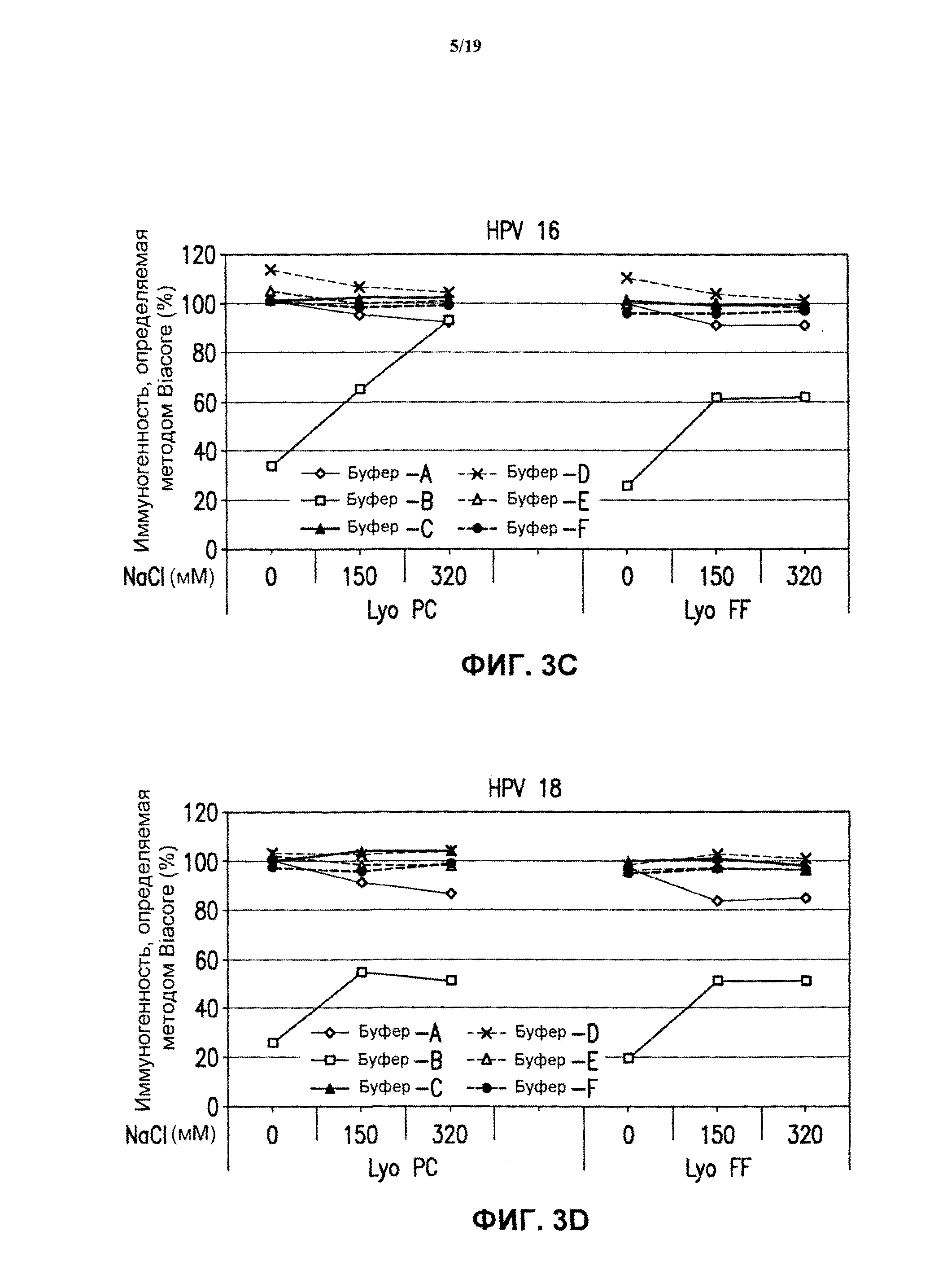
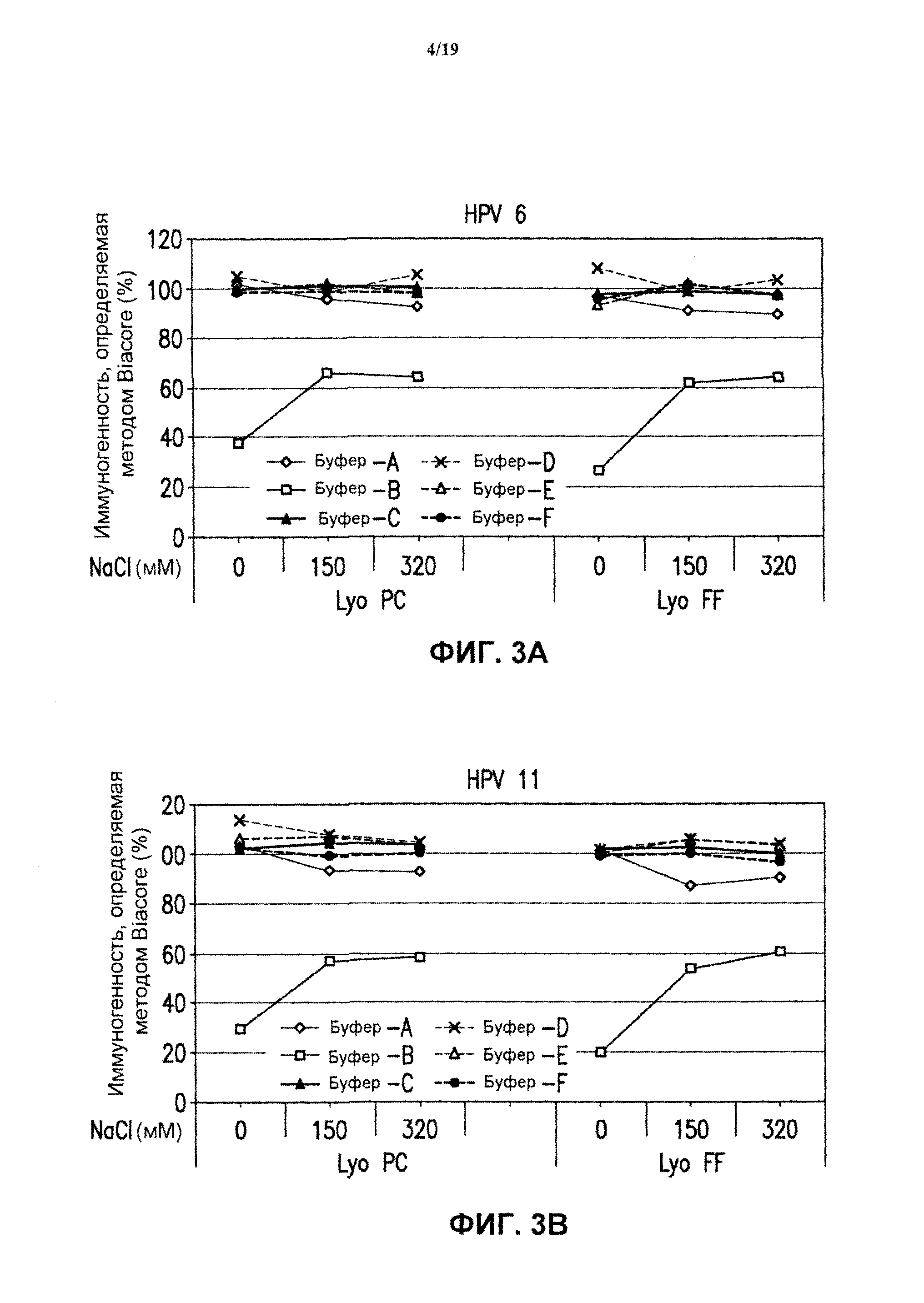
На фиг.3 представлены графики данных антигенности in vitro 4-валентных экспериментальных составов в отношении HPV каждого типа в зависимости от концентрации хлорида натрия после лиофилизации. См. пример 2. Результаты показаны для HPV типа 6 (блок А), HPV типа 11 (блок В), HPV типа 16 (блок С) и HPV типа 18 (блок D) при использовании 4-валентных составов против HPV, включающих буфер А - буфер F. Каждую из композиций лиофилизировали либо методом быстрого замораживания ("Lyo FF") в потоке жидкого азота, либо методом лиофилизации с предварительным охлаждением ("Lyo PC"), как описано в примере 1.
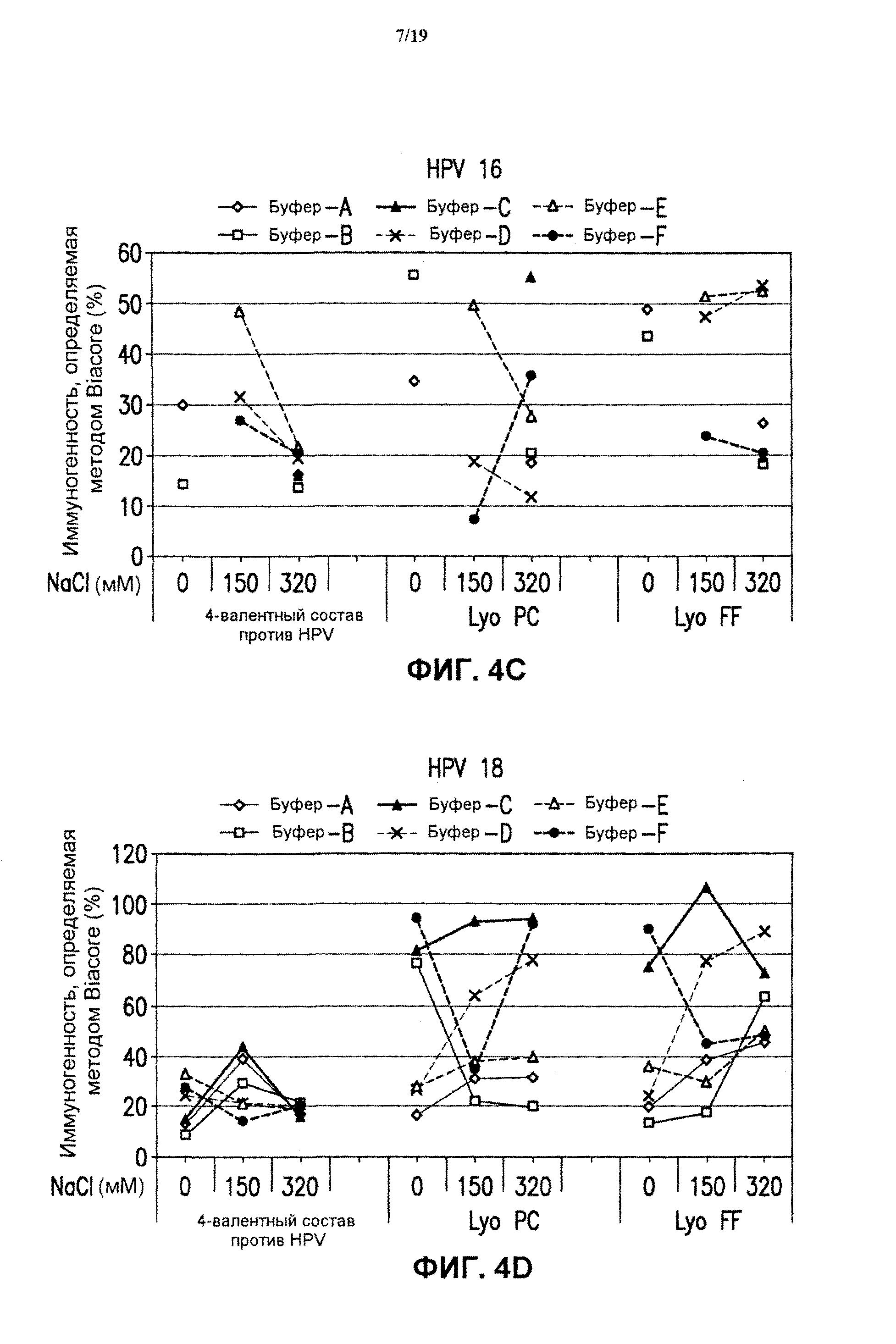
На фиг.4 представлены графики антигенности in vitro в отношении HPV каждого типа в зависимости от концентрации хлорида натрия и условий лиофилизации при использовании разных композиций буферов после хранения в течение 1 месяца при 45°С. На фиг.4 также показаны соответствующие нелиофилизированные жидкие составы, которые хранили в течение 1 месяца при 45°С. Данные представлены для тех же экспериментальных составов, которые испытывали в условиях, аналогичных показанных на фиг.2, после хранения в течение 1 месяца при 45°С.
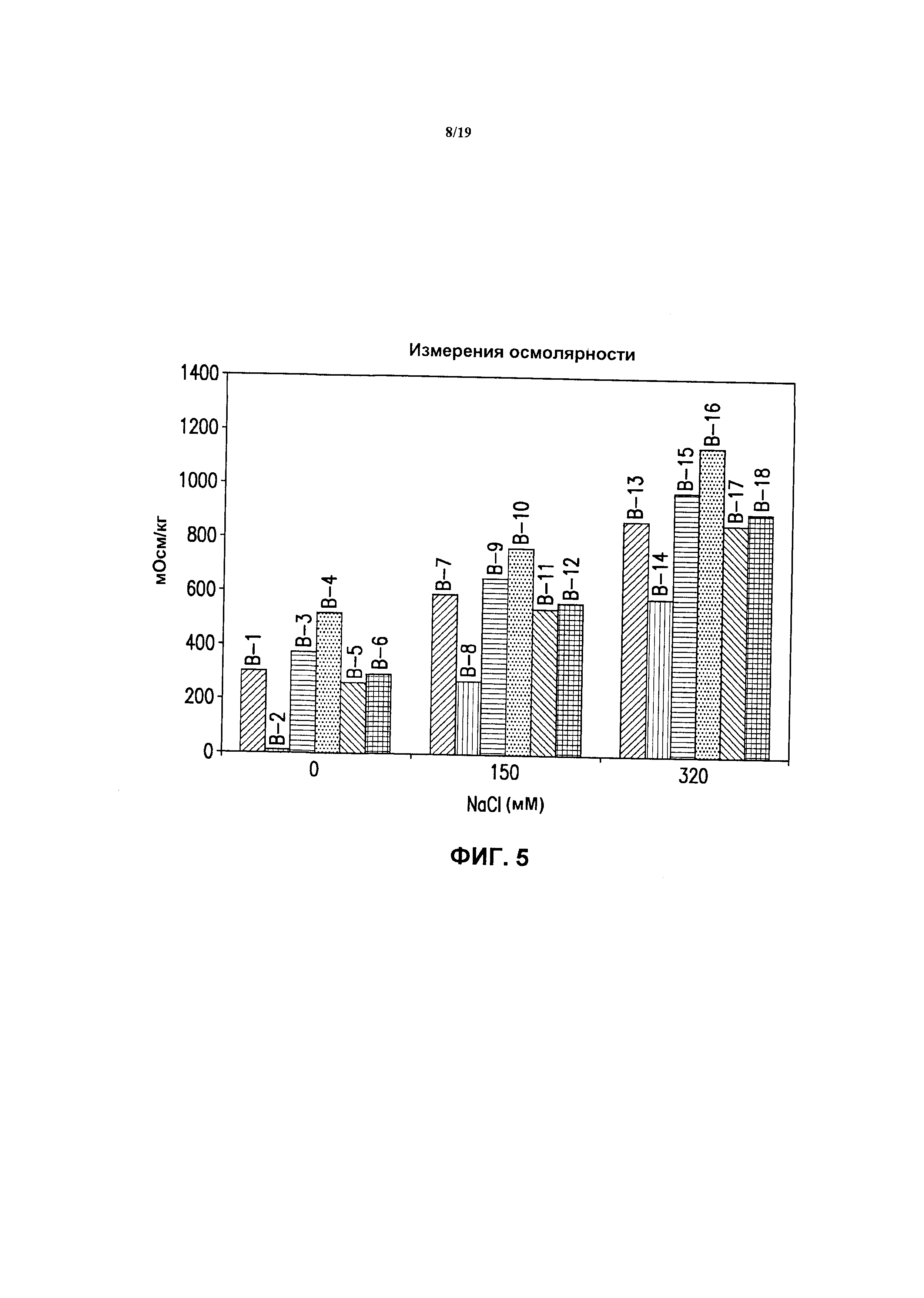
На фиг.5 представлен график измерений осмолярности (мОсм/кг) для 4-валентных экспериментальных составов против HPV в разных буферах (буфер А-буфер F), содержащих 0, 150 или 320 мМ хлорида натрия. См. пример 3.
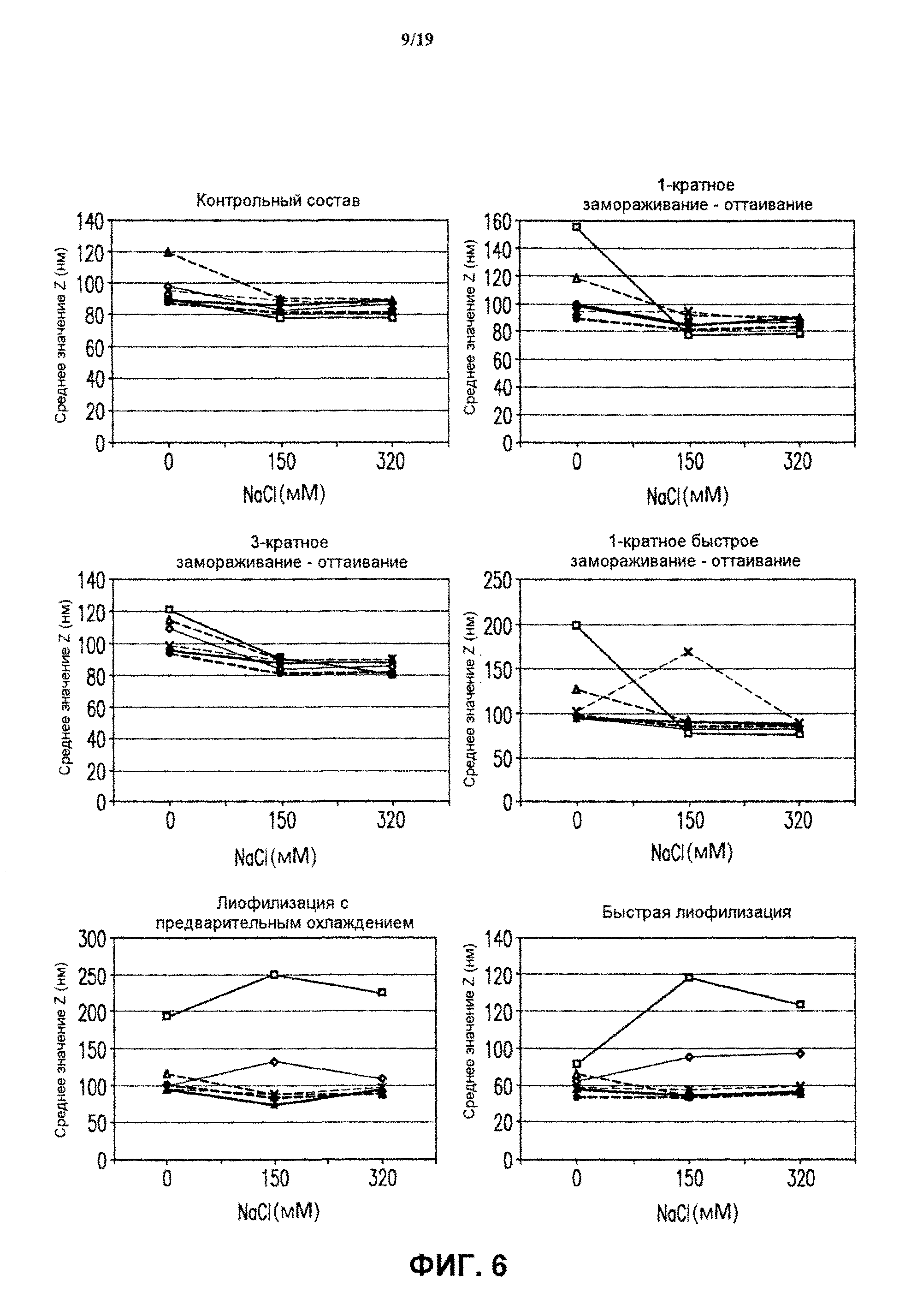
На фиг.6 представлены графики измерений размера частиц (Z-среднее, нм) для всех 4-валентных экспериментальных составов против HPV в разных буферах в зависимости от концентрации хлорида натрия после замораживания-оттаивания и лиофилизации. На всех графиках представлены результаты для буфера А (белый ромб), буфера В (белый квадрат), буфера С (черный треугольник), буфера D (черный крест), буфера Е (белый треугольник) и буфера F (черный кружок). На фиг.6 также показаны результаты для экспериментальных составов после однократного замораживания-оттаивания ("F/T 1×"), трехкратного замораживания-оттаивания ("F/T 3×"), быстрого замораживания ("F/T 1×FF"), лиофилизации методом быстрого замораживания ("Lyo FF") и лиофилизации с предварительным охлаждением ("Lyo PC"), Также представлены результаты для контрольных составов, которые не подвергали замораживанию-оттаиванию или лиофилизации. См. пример 4.
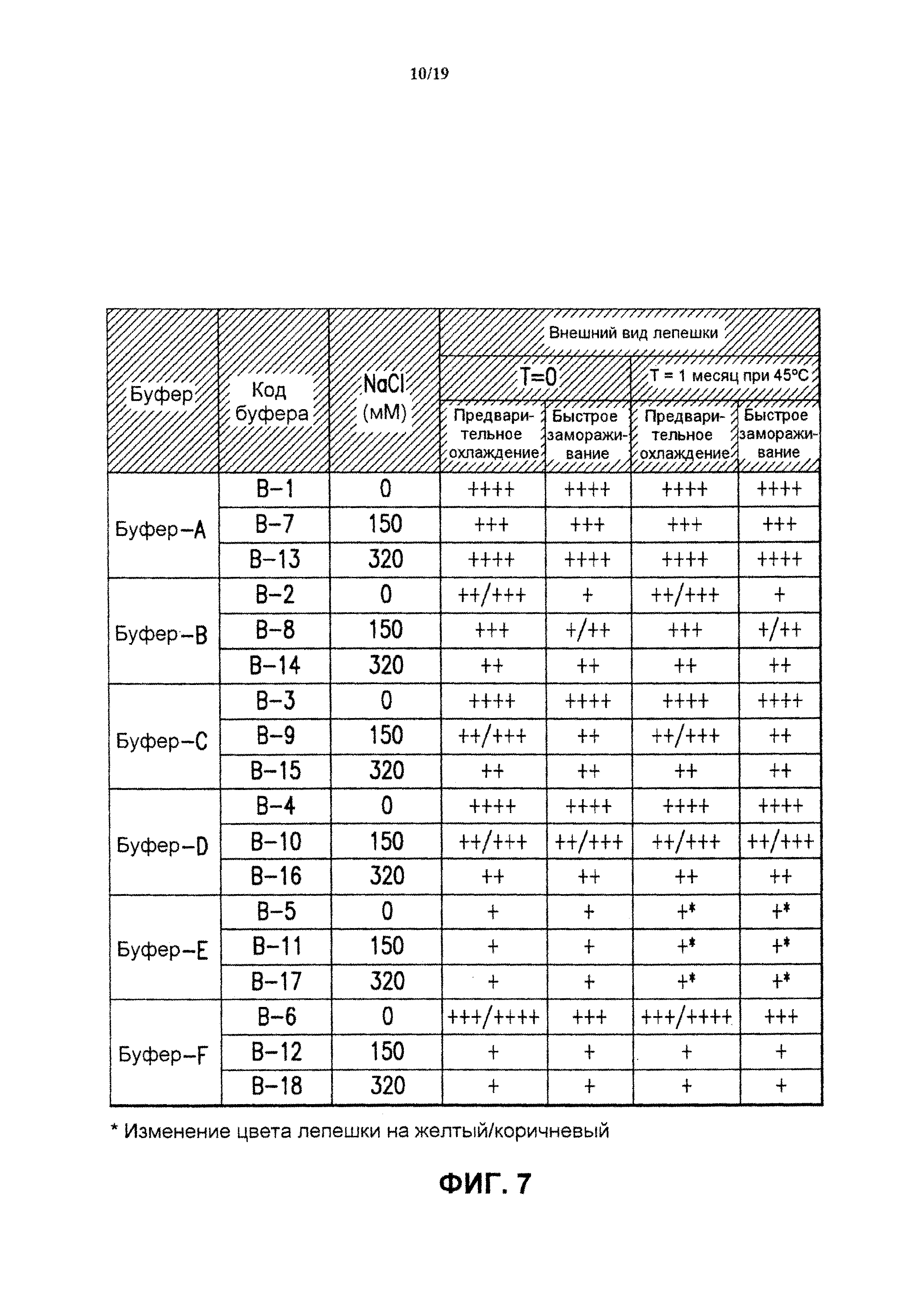
На фиг.7 показан внешний вид лепешки лиофилизированных 4-валентных составов против HPV в разных буферах (буфер А-буфер F), включающих 0, 150 или 320 мМ хлорида натрия. Составы лиофилизировали методом быстрого замораживания ("быстрое замораживание") или методом лиофилизации с предварительным охлаждением ("предварительное охлаждение"). Приведенные результаты представляют собой среднее значение для 3 образцов каждого экспериментального состава в период времени Т=0. На фиг.7 также показан внешний вид лепешки тех же составов после хранения в течение 1 месяца при 45°С. См. пример 1, таблица 2, для ознакомления с описанием показателей качества высушенных лепешек. См. пример 5.
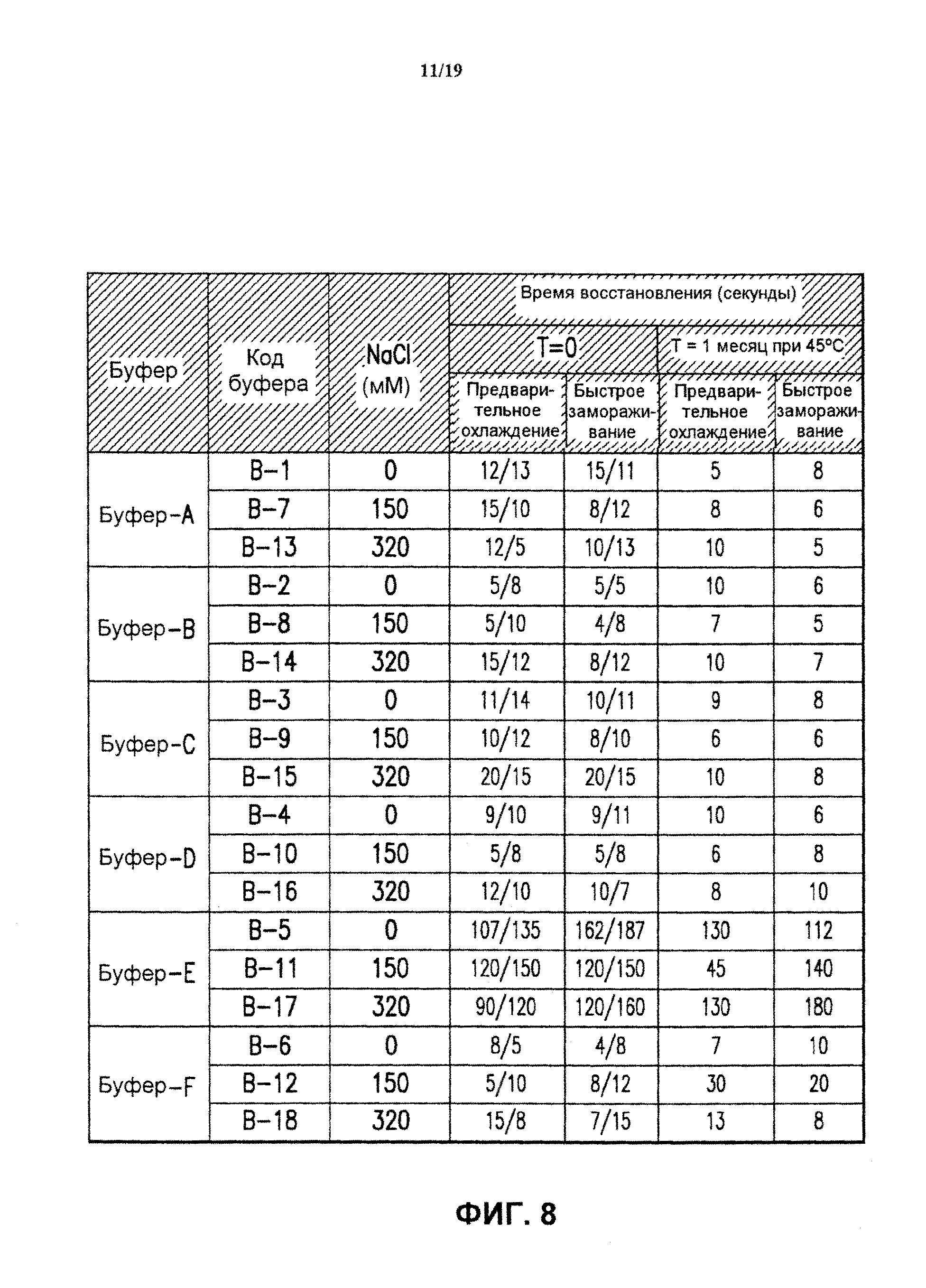
На фиг.8 показано время восстановления лиофилизированных 4-валентных составов против HPV в разных буферах (буфер А-буфер F), включающих 0, 150 или 320 мМ хлорида натрия, после добавления стерильной воды для инъекций. Составы лиофилизировали методом быстрого замораживания ("быстрое замораживание") или методом лиофилизации с предварительным охлаждением ("предварительное охлаждение"). Результаты представлены для 2 образцов каждого экспериментального состава. Также показано время восстановления тех же составов после добавления стерильной воды для инъекций после хранения в течение 1 месяца при 45°С. См. пример 5.
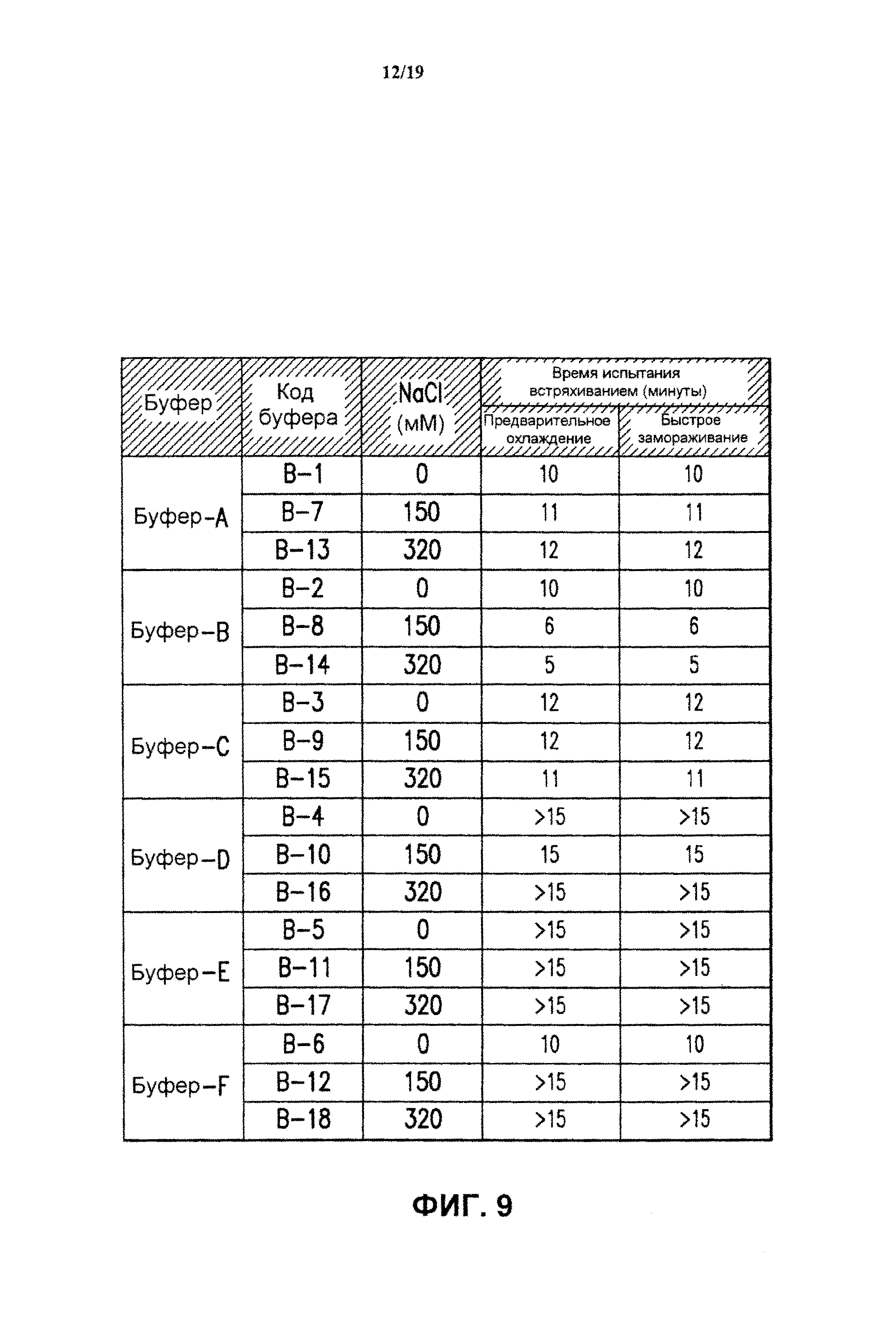
На фиг.9 показано время испытания встряхиванием лиофилизированных 4-валентных составов против HPV в разных буферах (буфер А-буфер F), содержащих 0, 150 или 320 мМ хлорида натрия, после добавления стерильной воды для инъекций. Составы лиофилизировали методом быстрого замораживания ("быстрое замораживание") или лиофилизировали методом лиофилизации с предварительным охлаждением ("предварительное охлаждение"), Результаты представлены для 3 образцов каждого экспериментального состава. См. пример 5.
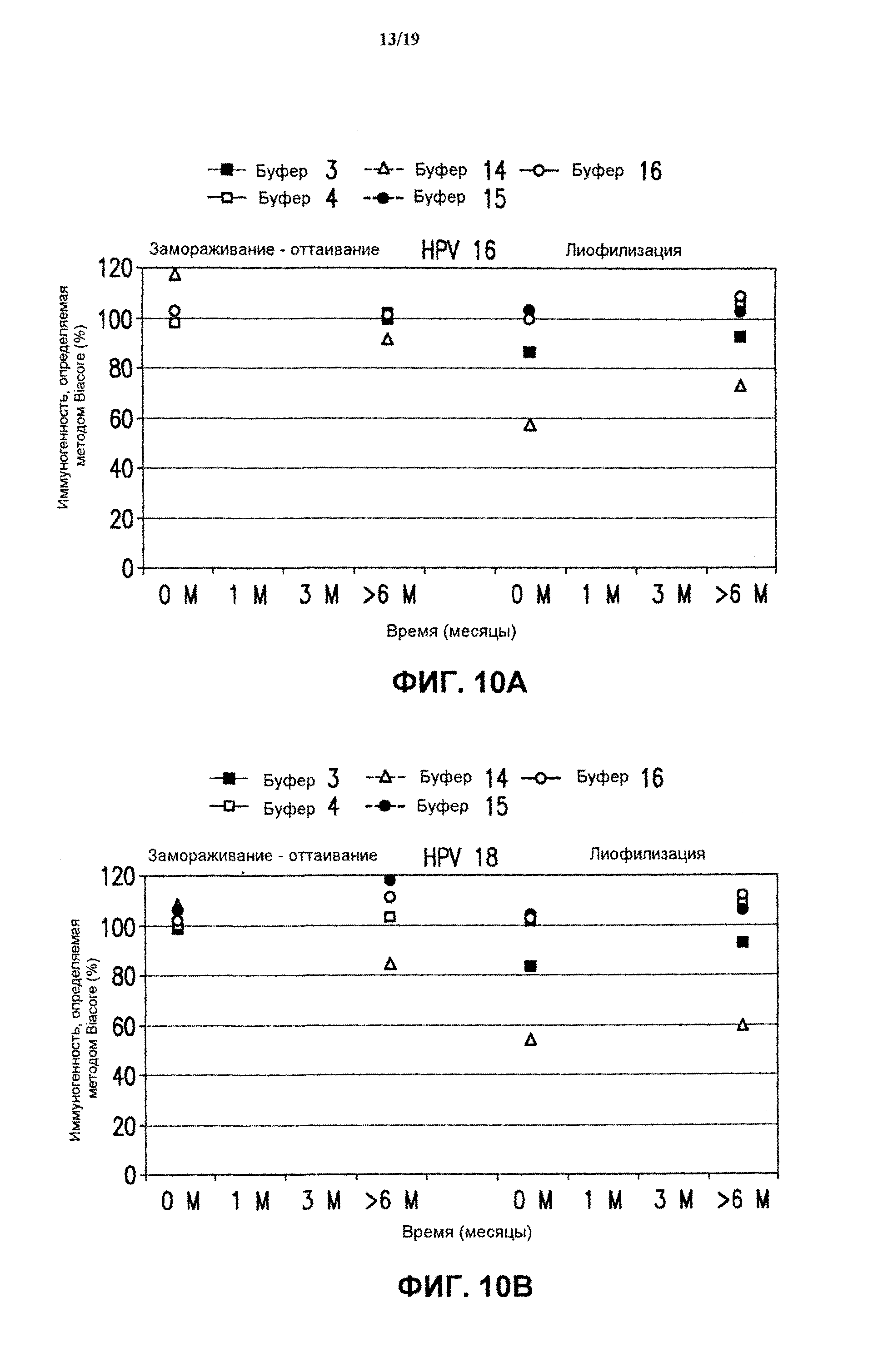
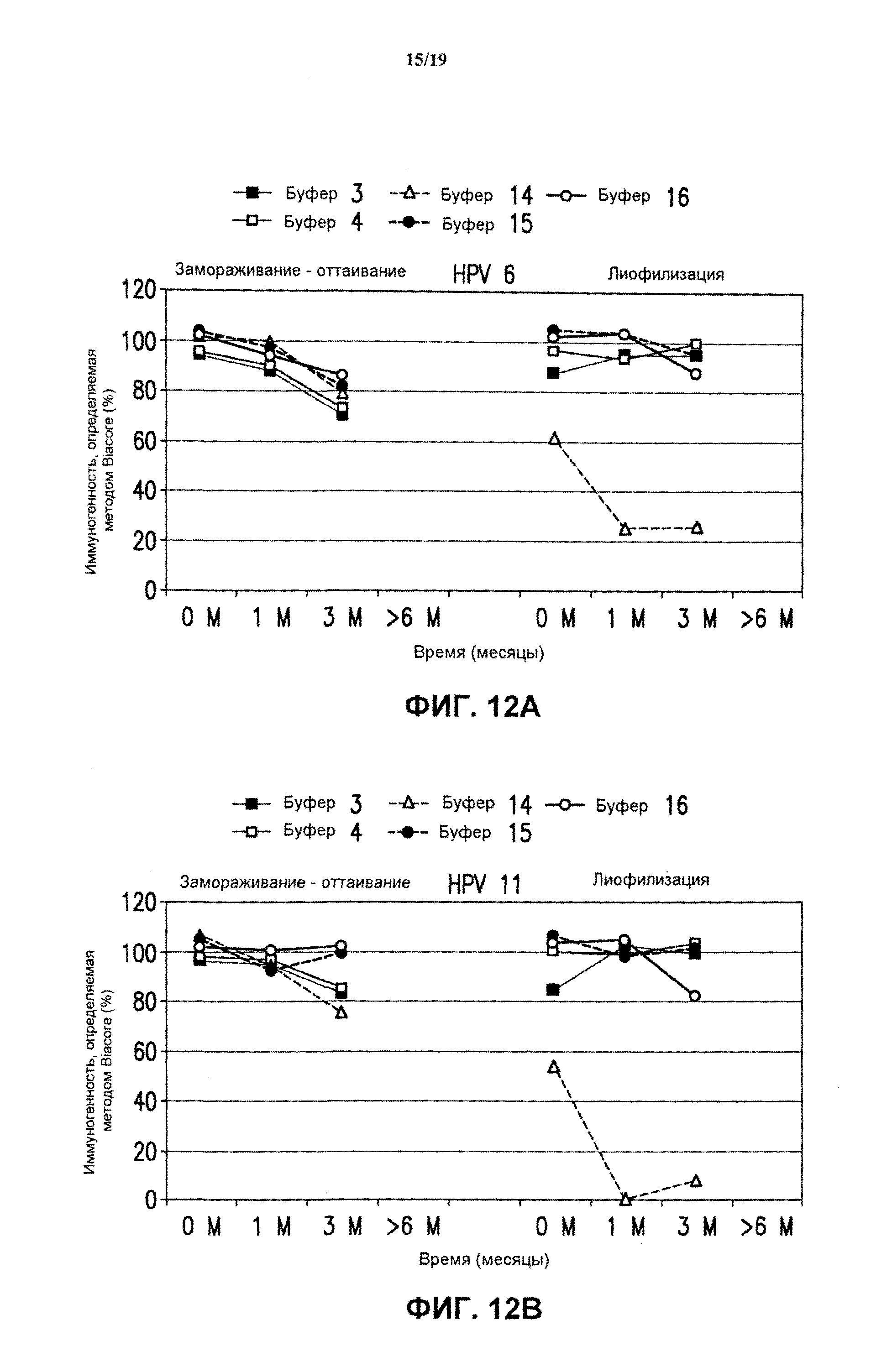
На фиг.10 представлены данные антигенности in vitro 4-валентных экспериментальных составов (буфер В-буфер D) в отношении HPV типов 16 (блок А) и 18 (блок В) после хранения в течение разных периодов времени при -70°С. Экспериментальные составы хранили после замораживания-оттаивания (F/T) или лиофилизации (LYO) в соответствии с описанием, приведенным в примере 1. На фиг.10 показана иммуногенность вакцины (%), измеренная методом Biacore, в зависимости от времени хранения. См. примеры 1 и 6.
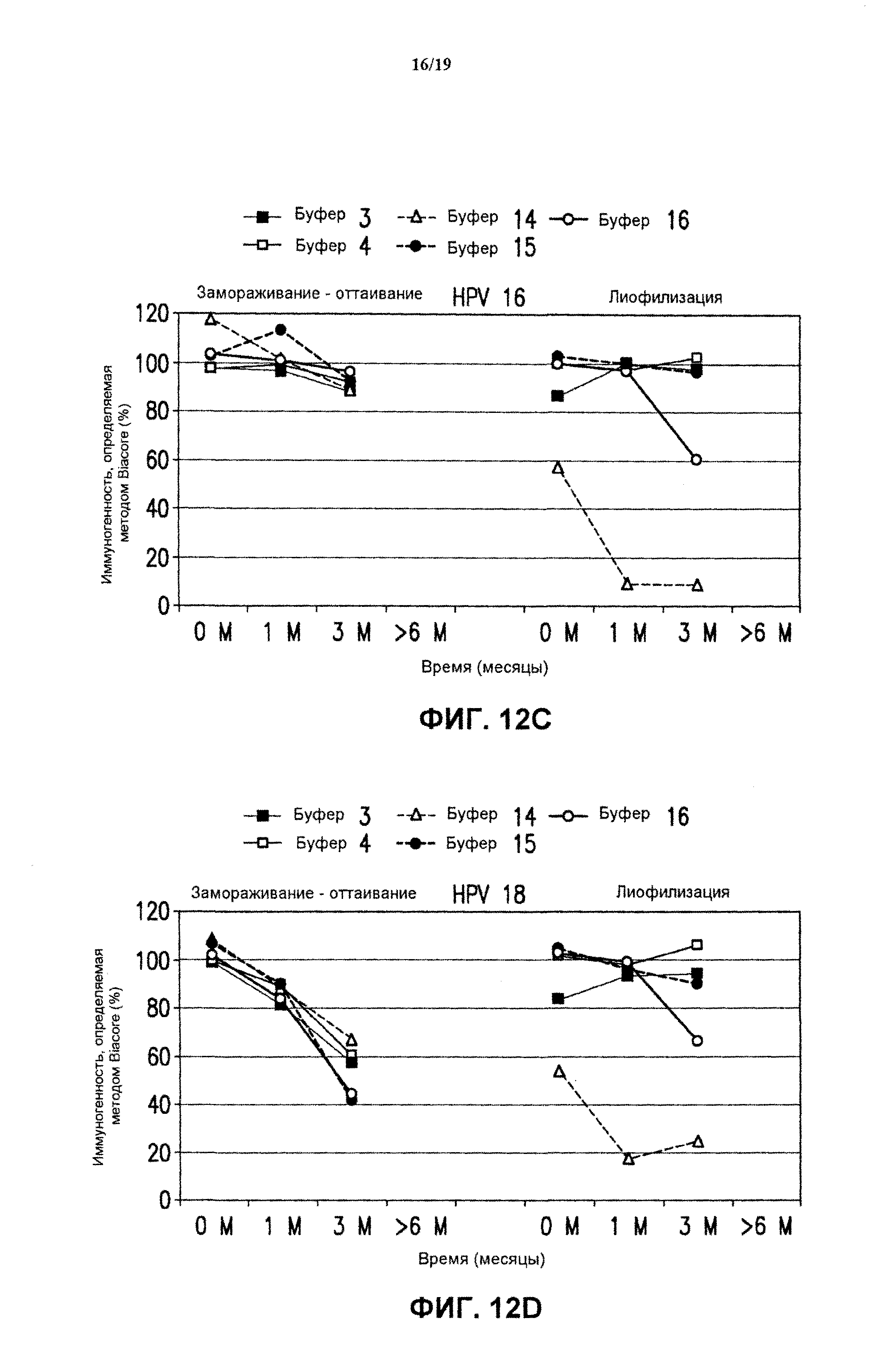
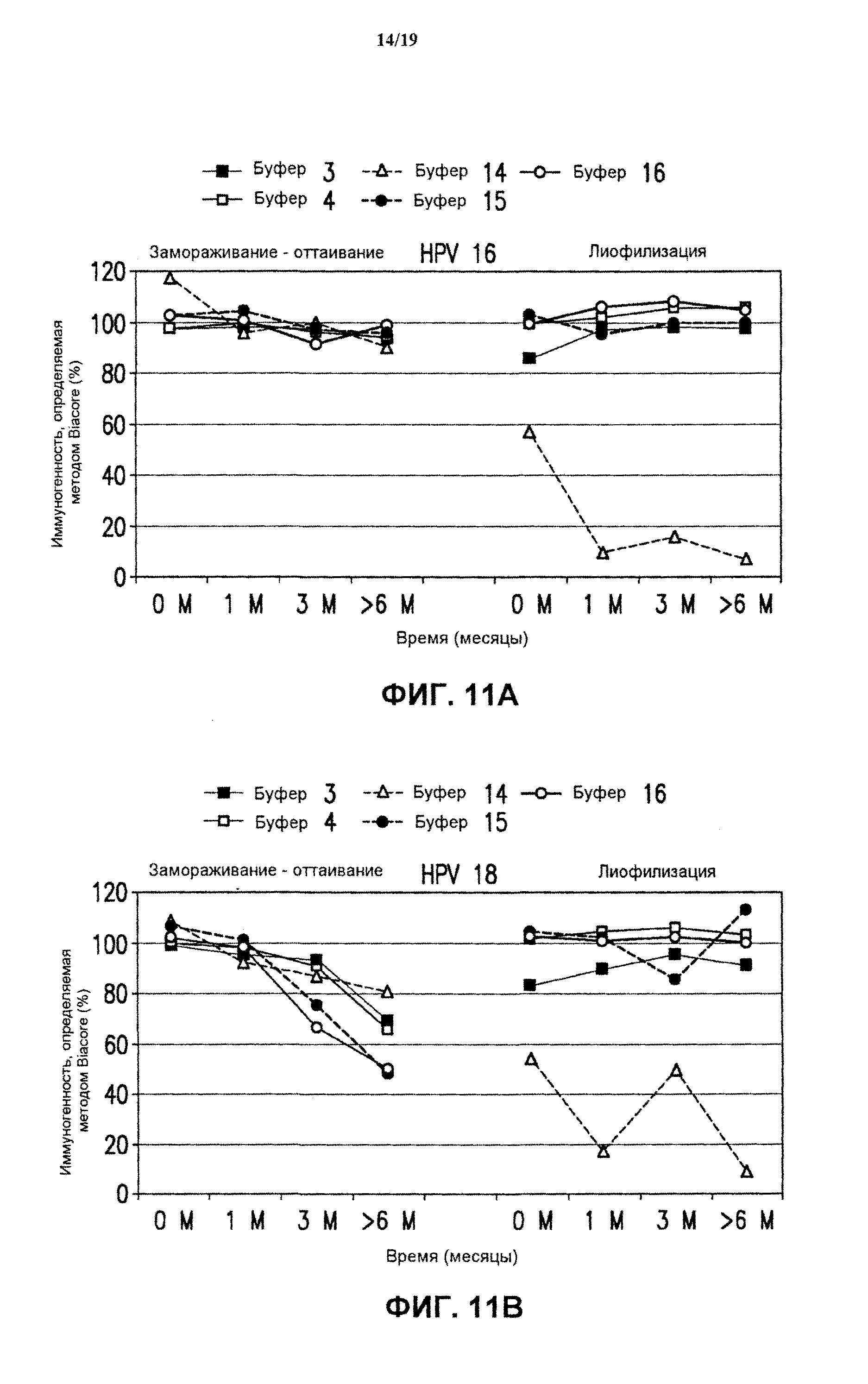
На фиг.11 представлены данные антигенности in vitro 4-валентных экспериментальных составов (буфер В-буфер D) в отношении HPV типов 16 (блок А) и 18 (блок В) после хранения в течение разных периодов времени при 25°С. Экспериментальные составы хранили после замораживания-оттаивания или лиофилизации. См. пример 6.
На фиг.12 представлены данные антигенности in vitro 4-валентных экспериментальных составов (буфер В-буфер D) в
отношении HPV всех типов после хранения при 37°С в течение разных периодов времени. Экспериментальные составы хранили после замораживания-оттаивания или лиофилизации. См. пример 6. Графики представлены для HPV типа 6 (блок А), HPV типа 11 (блок В), HPV типа 16 (блок С) и HPV типа 18 (блок D).
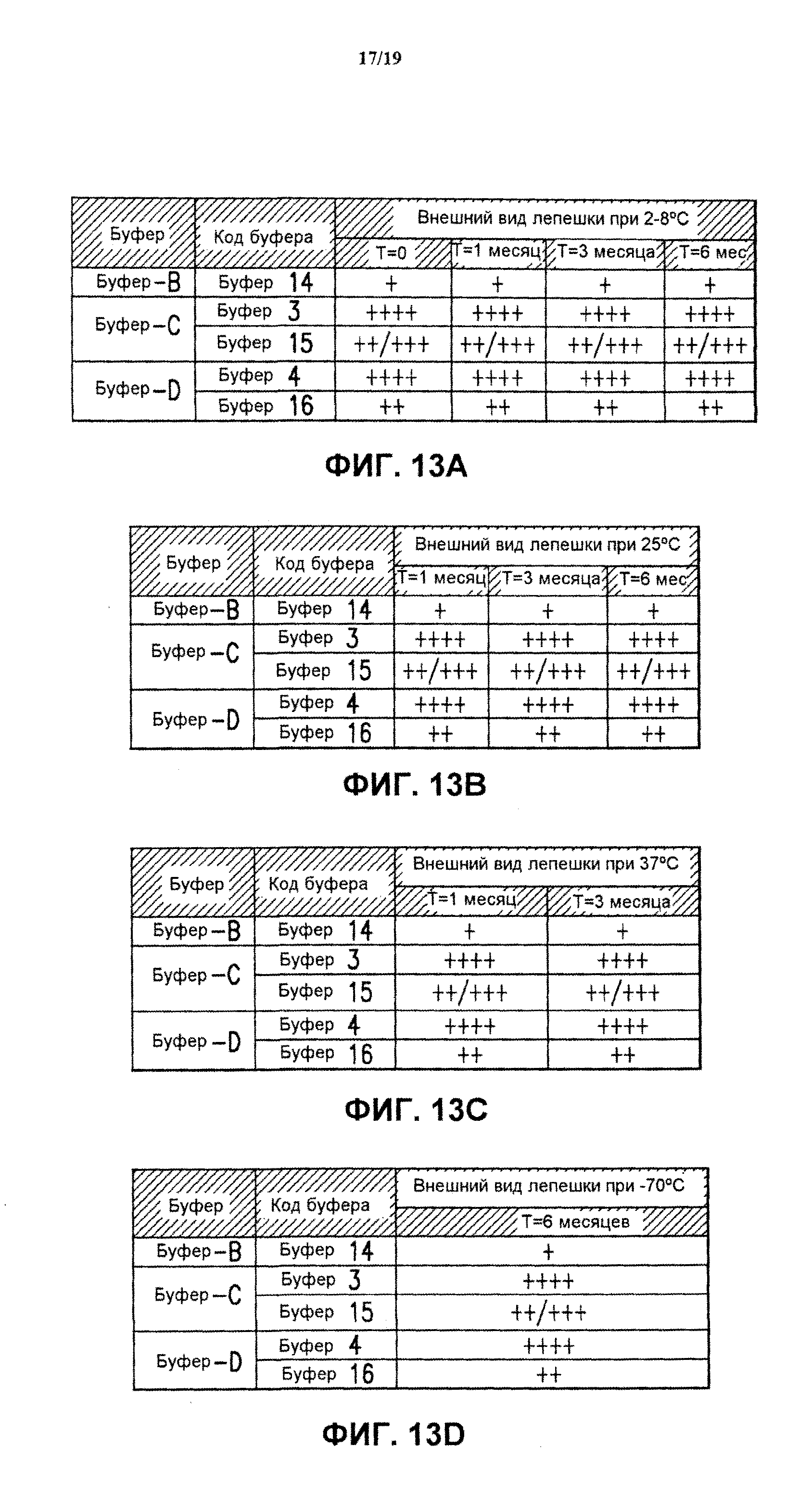
На фиг.13 показан внешний вид лепешки лиофилизированных 4-валентных составов против HPV (буфер В-буфер D) после хранения в течение нескольких месяцев при разных температурах. Приведенные результаты представляют собой среднее значение для 3 образцов каждого экспериментального состава. См. пример 1, таблицу 2, для ознакомления с описанием показателей качества высушенных лепешек. См. пример 10. Данные относятся к хранению при 2-8°С (блок А), 25°С (блок В), 37°С (блок С) и -70°С (блок D).
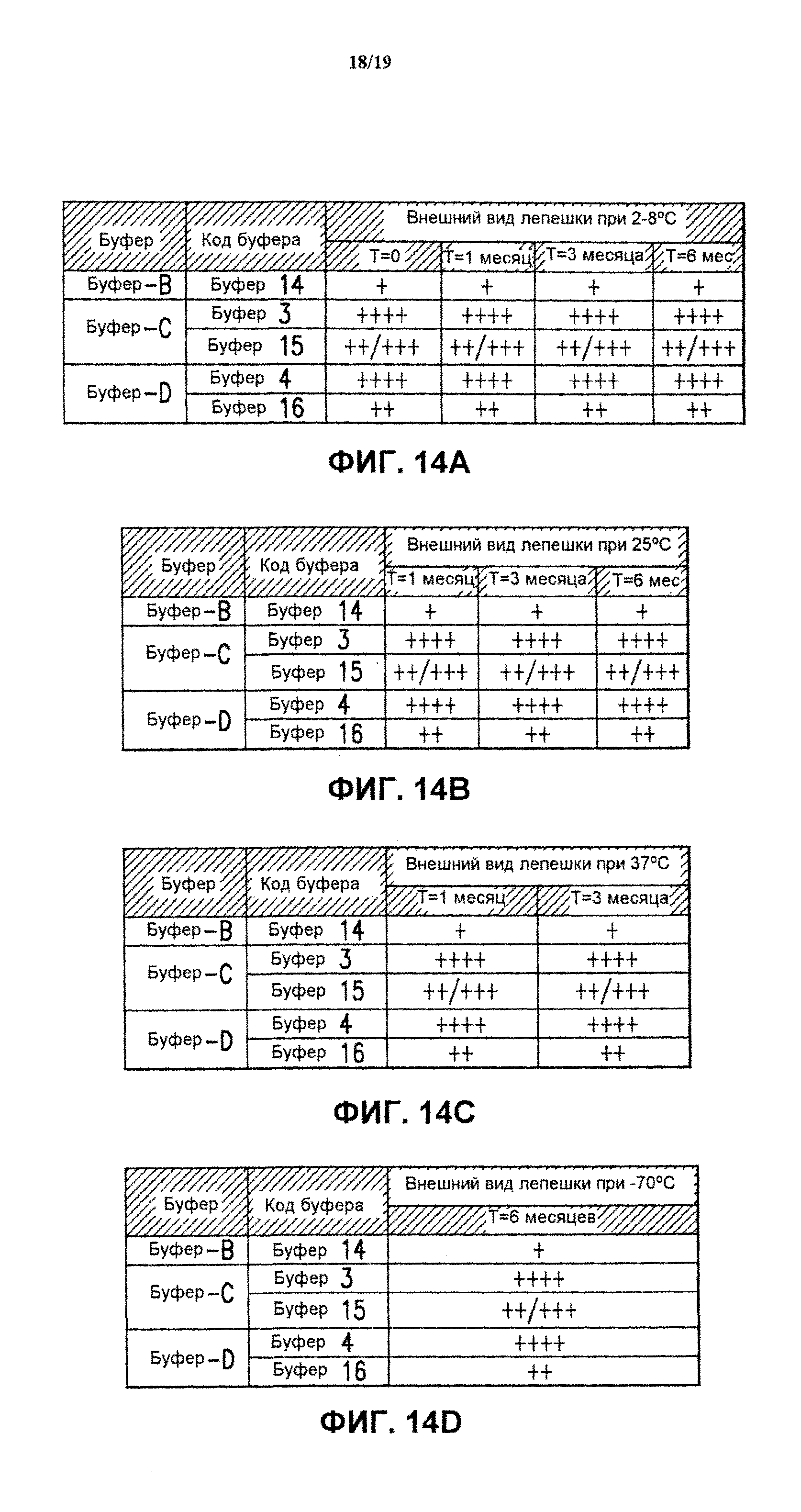
На фиг.14 показан внешний вид лепешки лиофилизированных составов, содержащих 1-кратный алюминиевый адъювант Merck (МАА), (буфер В-буфер D) после хранения в течение нескольких месяцев при разных температурах. Приведенные результаты представляют собой среднее значение для 3 образцов каждого экспериментального состава. См. пример 1, таблицу 2, для ознакомления с описанием показателей качества высушенных лепешек. См. пример 10. Данные приведены для хранения при 2-8°С (блок А), 25°С (блок В), 37°С (блок С) и -70°С (блок D).
На фиг.15 показано время испытания встряхиванием лиофилизированных 4-валентных составов против HPV (буфер В буфер D) после хранения в течение нескольких месяцев при разных температурах. Результаты приведены для 3 образцов каждого экспериментального состава. См. пример 10. Данные приведены для хранения при 2-8°С (блок А), 25°С (блок В), 37°С (блок С) и -70°С (блок D).
Подробное описание изобретения
Вакцинные составы обычно содержат алюминиевые адъюванты, используемые для усиления иммунной реакции на антиген. Вакцины, содержащие алюминиевый адъювант, являются чрезвычайно чувствительными к изменениям температуры, таким как нагревание или замораживание. Необходимы методы получения термостойких вакцинных составов, содержащих адъювант на основе соли алюминия и являющихся иммунологически активными, которые позволяют избежать снижения иммуногенности и/или эффективности. Настоящее изобретение относится к стабильным жидким или твердым замороженным и лиофилизированным вакцинным составам, которые содержат по меньшей мере один антиген, адсорбированный на адъюванте на основе соли алюминия, и комбинацию маннита и сахарозы. В соответствии с предпочтительными аспектами изобретения антиген является вирусоподобной частицей (VLP) вируса папилломы человека (HPV).
Как было указано выше, настоящее изобретение относится к вакцинному составу против вируса папилломы человека, который включает (а) вирусоподобные частицы (VLP) HPV по меньшей мере одного типа, адсорбированные на алюминиевом адъюванте; и (b) буфер, содержащий маннит и сахарозу. Вакцинные составы необязательно содержат неионогенное поверхностно-активное вещество и/или соль, такую как NaCl.
Жидкие вакцинные составы против HPV по настоящему изобретению способны сохранять физические и иммунологические свойства при (1) замораживании и оттаивании; (2) лиофилизации жидкого состава; (3) восстановлении высушенного состава и (4) восстановлении высушенного состава после хранения в течение одного месяца или более при комнатной или более высокой температуре. Таким образом, настоящее изобретение относится к вакцинному составу против HPV, описанному в разных вариантах осуществления изобретения, который является замороженным, лиофилизированным или восстановленным.
В предпочтительных вариантах осуществления данного аспекта изобретения вакцинный состав против HPV включает (а) вирусоподобные частицы (VLP) HPV по меньшей мере одного типа, адсорбированные на алюминиевом адъюванте, которые присутствуют в концентрации 10-200 мкг/мл, при этом VLP выбирают из группы, состоящей из HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; (b) от примерно 1% до примерно 10% масс./об. маннита и (с) от примерно 0,5% до примерно 10% сахарозы. В дополнительных вариантах осуществления изобретения вакцинный состав против HPV далее включает неионогенное поверхностно-активное вещество. В другом варианте осуществления изобретения вакцинный состав включает компоненты, указанные в любом предшествующем варианте осуществления изобретения, а также соль.
Дополнительные варианты осуществления изобретения относятся к вышеуказанному составу против HPV, в котором маннит присутствует в количестве от примерно 4% до примерно 10%, и сахароза присутствует в количестве от примерно 1% до примерно 5%.
Другие варианты осуществления данного аспекта изобретения относятся к составу, включающему компоненты, присутствующие в любом составе по настоящему изобретению, а также от примерно 5 мМ до примерно 100 мМ гистидина. В предпочтительных вариантах осуществления изобретения состав содержит 10 мМ гистидина.
Дополнительные варианты осуществления изобретения относятся к вакцинному составу против HPV по любому предшествующему варианту осуществления изобретения, который дополнительно включает поверхностно-активное вещество. В типичных вариантах осуществления изобретения вакцинный состав включает от примерно 0,001% до примерно 0,04% поверхностно-активного вещества. В некоторых вариантах осуществления изобретения поверхностно-активное вещество является PS20 или PS80.
В другом варианте осуществления изобретения вакцинный состав против HPV включает (а) вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на адъюванте на основе соли алюминия, которые присутствуют в концентрации, равной 10-200 мкг/мл, при этом вирусоподобные частицы выбирают из группы, состоящей из HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; (b) от примерно 5% до примерно 6% масс./об. маннита и (с) от примерно 2% до примерно 4% сахарозы. В другом варианте осуществления изобретения вакцинный состав далее включает примерно 10 мМ гистидина, от примерно 0,30 до примерно 0,35 М NaCl и/или 0,01% PS80.
Компоненты состава
Как было указано выше, комбинация маннита и сахарозы защищает вакцинные составы, содержащие алюминиевый адъювант, от стресса, вызванного замораживанием, оттаиванием или лиофилизацией. Таким образом, настоящее изобретение относится к вакционным составам, например, к вакционным составам, содержащим вирусоподобные частицы HPV, которые включают компоненты, указанные в любом предшествующем варианте осуществления изобретения, и манит в любом из следующих количеств: от примерно 1% до примерно 10% масс./об., от примерно 2% до примерно 10% масс./об., от примерно 3% до примерно 10% масс./об., от примерно 4% до примерно 10% масс./об., от примерно 5% до примерно 10% масс./об., от примерно 1% до примерно 9% масс./об., от примерно 2% до примерно 9% масс./об., от примерно 3% до примерно 9% масс./об., от примерно 4% до примерно 9% масс./об., от примерно 5% до примерно 9% масс./об., от примерно 1% до примерно 8% масс./об., от примерно 2% до примерно 8% масс./об., от примерно 3% до примерно 8% масс./об., от примерно 4% до примерно 8% масс./об., от примерно 5% до примерно 8% масс./об., от примерно 1% до примерно 7% масс./об., от примерно 2% до примерно 7% масс./об., от примерно 3% до примерно 7% масс./об., от примерно 4% до примерно 7% масс./об., от примерно 1% до примерно 6% масс./об., от примерно 2% до примерно 6% масс./об., от примерно 3% до примерно 6% масс./об. или от примерно 4% до примерно 6% масс./об. В альтернативных вариантах осуществления изобретения вакцинный состав содержит компоненты, указанные в любом варианте осуществления изобретения, и маннит в количестве 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10% масс./об. В предпочтительных вариантах осуществления изобретения композиции содержат 4%, 5% или 6% масс./об. маннита.
В других вариантах осуществления изобретения вакцинный состав против HPV содержит компоненты, указанные ва любом предшествующем варианте осуществления изобретения, и сахарозу в любых следующих количествах: от примерно 0,5% до примерно 10% масс./об., от примерно 1% до примерно 10% масс./об., от примерно 2% до примерно 10% масс./об., от примерно 3% до примерно 10% масс./об., от примерно 4% до примерно 10% масс./об., от примерно 0,5% до примерно 9% масс./об., от примерно 1% до примерно 9% масс./об., от примерно 2% до примерно 9% масс./об., от примерно 3% до примерно 9% масс./об., от примерно 4% до примерно 9% масс./об., от примерно 1% до примерно 8%, от примерно 2% до примерно 8%, от примерно 3% до примерно 8%, от примерно 4% до примерно 8%, от примерно 1% до примерно 7%, от примерно 2% до примерно 7%, от примерно 3% до примерно 7%, от примерно 4% до примерно 7%, от примерно 1% до примерно 6%, от примерно 2% до примерно 6%, от примерно 3% до примерно 6%, от примерно 4% до примерно 6% масс./об. сахарозы. В альтернативных вариантах осуществления изобретения вакцинная композиция содержит 0,5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10% масс./об. сахарозы. В предпочтительных вариантах осуществления изобретения композиции содержат 2%, 3%, 4% или 5% масс./об. сахарозы.
В конкретных вариантах осуществления изобретения вакцинные составы против HPV содержат компоненты, указанные в любом предшествующем или последующем варианте осуществления изобретения, и далее включают от примерно 5 мМ до примерно 10 мМ гистидина. В дополнительных вариантах осуществления изобретения концентрация гистидина в композиции равна от примерно 5 мМ до примерно 90 мМ, от примерно 5 мМ до примерно 80 мМ, от примерно 5 мМ до примерно 75 мМ, от примерно 5 мМ до примерно 60 мМ, от примерно 5 мМ до примерно 50 мМ, от примерно 10 мМ до примерно 90 мМ, от примерно 10 мМ до примерно 75 мМ, от примерно 10 до примерно 60 мМ, от примерно 10 мМ до примерно 50 мМ, от примерно 20 мМ до примерно 90 мМ, от примерно 20 мМ до примерно 75 мМ, от примерно 20 мМ до примерно 60 мМ или от примерно 20 мм до примерно 50 мМ. В альтернативных вариантах осуществления изобретения вакцинная композиция содержит примерно 5 мМ, примерно 10 мМ, примерно 20 мМ, примерно 30 мМ, примерно 40 мМ или примерно 50 мМ гистидина. В одном предпочтительном варианте осуществления изобретения вакцинный состав содержит примерно 10 мМ гистидина.
Любые вакцинные композиции по настоящему изобретению могут необязательно включать поверхностно-активное вещество. Поверхностно-активные вещества могут быть добавлены для уменьшения и/или предотвращения агрегации либо предотвращения и/или ингибирования разрушения белка в условиях обработки, такой как очистка, фильтрация, лиофилизация, транспортировка, хранение и доставка. Поверхностно-активные вещества, которые могут быть использованы в составах по настоящему изобретению, включают, но не ограничиваясь ими, неионогенные поверхностно-активные вещества, такие как сложные эфиры жирных кислот полиоксиэтиленсорбитана (полисорбаты, продаваемые под торговым названием твин® (Uniquema Americas LLC, Wilmington, DE)), в том числе полисорбат-20 (монолаурат полиоксиэтиленсорбитана), полисорбат-40 (монопальмитат полиоксиэтиленсорбитана), полисорбат-60 (моностеарат полиоксиэтиленсорбитана) и полисорбат-80 (моноолеат полиоксиэтиленсорбитана); полиоксиэтиленалкиловые эфиры, такие как Brij® 58 (Uniquema Americas LLC, Wilmington, DE) и Brij® 35; полоксамеры (например, полоксамер 188); тритон® Х-100 (Union Carbide Corp., Houston, ТХ) и тритон® Х-114; NP40; Span 20, Span 40, Span 60, Span 65, Span 80 и Span 85; сополимеры этилена и пропиленгликоля (например, серия плюроник® неионогенных поверхностно-активных веществ, таких как плюроник® F68, плюроник® 10R5, плюроник® F108, плюроник® F127, плюроник® F38, плюроник® L44, плюроник® L62 (BASF Corp., Ludwigshafen, Germany) и додецилсульфат натрия (SDS).
В типичных вариантах осуществления изобретения поверхностно-активное вещество является неионогенным поверхностно-активными веществом, выбираемым из группы, состоящей из полисорбата 20, полисорбата 80, Brij® 35, плюроника® F-68 и тритона®. В некоторых предпочтительных вариантах осуществления изобретения поверхностно-активное вещество является полисорбатом 20 или полисорбатом 80.
Количество поверхностно-активного вещества, вводимого в составы по настоящему изобретению, должно быть достаточным для выполнения требуемой функции, то есть должно представлять собой минимальное количество, необходимое для предотвращения агрегации белка, предотвращения или ингибирования образования частиц, уменьшения агрегации лиофилизированного или замороженного состава или восстановленного состава после добавления разбавителя, такого как BWFI, до приемлемого уровня, которое позволяет легко восстановить состав или обеспечить его стабильность во время транспортировки и/или обработки. Поверхностно-активное вещество обычно присутствует в концентрации от примерно 0,001% до примерно 0,5% (масс./об.). В предпочтительных вариантах осуществления изобретения поверхностно-активное вещество присутствует в составе (до лиофилизации) в количестве от примерно 0,005% до примерно 0,4%;
в более предпочтительных вариантах осуществления изобретения поверхностно-активное вещество присутствует в количестве от примерно 0,01% до примерно 0,3%. В особенно предпочтительных вариантах осуществления изобретения поверхностно-активное вещество присутствует в количестве примерно 0,01%.
В типичных вариантах осуществления изобретения поверхностно-активное вещество является неионогенным поверхностно-активным веществом, выбираемым из группы, состоящей из полисорбата 20, полисорбата 80, Brij® 35, плюроника® F-68 и тритона®. В некоторых предпочтительных вариантах осуществления изобретения поверхностно-активное вещество является полисорбатом 20 или полисорбатом 80. В особенно предпочтительных вариантах осуществления изобретения вакцинный состав против HPV содержит примерно 0,01% PS80.
Настоящее изобретение также относится к вакцинным составам, включающим компоненты, указанные в любом предшествующем варианте осуществления изобретения, а также соль, которая может регулировать ионную силу состава. Соли, которые могут быть использованы в вакцинных составах против HPV по настоящему изобретению, включают, но не ограничиваясь ими, NaCl, KCl, Na2SO4, (NH4)2SO4, фосфат натрия и цитрат натрия. Соль должна присутствовать в составе в концентрации от примерно 0,10 М до 1 М. Однако очень высокие концентрации являются недопустимыми из-за практических ограничений, связанных с парентеральным введением составов с высоким содержанием соли. Более предпочтительными являются средние концентрации соли, соответствующие физиологическим показателям, которые составляют от примерно 0,15 М до примерно 0,5 М при использовании 0,15 М-0,32 М NaCl. В альтернативных вариантах осуществления я вакцинные составы против HPV не содержат соли.
Значение рН вакцинных композиций по настоящему изобретению, описанных в любом предшествующем или последующем варианте осуществления, предпочтительно находится в пределах от примерно 5,5 до примерно 7,5. В конкретных вариантах осуществления изобретения значение рН композиции равно примерно 5,5, примерно 5,75, примерно 6,0, примерно 6,1, примерно 6,2, примерно 6,25, примерно 6,3, примерно 6,4, примерно 6,5, примерно 6,75, примерно 7,0, примерно 7,25 или примерно 7,5. В дополнительных вариантах осуществления изобретения значение рН находится в пределах от примерно 5,5 до примерно 7,0, от примерно 5,5 до примерно 6,5, от примерно 6,0 до примерно 7,5, от примерно 6,0 до примерно 7,0, от примерно 6,5 до примерно 7,0, от примерно 6,0 до 6,5, от примерно 6,0 до примерно 6,9, от примерно 6,2 до примерно 6,75 или от примерно 6,0 до примерно 6,75.
В некоторых обстоятельствах может быть желательно получить вакцинный состав против HPV для многократного введения, который включает несколько доз вакцины в одном флаконе. В составе для многократного введения должно быть использовано антимикробное средство, убивающее или предотвращающее рост микроорганизмов, таких как бактерии и грибы. Вакцинные составы для многократного введения, содержащие антимикробные средства, обладают несколькими преимуществами по сравнению с составами для однократного введения, выражающимися в том, что несколько доз вакцины могут быть взяты из флакона без опасения загрязнения состава микробами (Meyer et al., J. Pharm. Sci. 96(12): 3155-3167 (2007)). Предпочтительные антимикробные средства, предназначенные для использования в вакцинных составах против HPV, включают антимикробные средства, выбираемые из группы, состоящей из м-крезола, фенола и бензилового спирта (см. Bryan et al., патент США №7709010).
Составы по настоящему изобретению предпочтительно сохраняют стабильность в течение по меньшей мере 1 месяца при комнатной температуре или более низкой температуре. Стабильность состава исследуют разными методами, применяемыми для определения биофизических свойств (таких как агрегация), например, путем измерением размера частиц методом динамического рассеяния света (DLS) и сродства связывания (при помощи анализов иммуногенности с использованием устройства Biacore) API до и после замораживания или лиофилизации и/или после хранения. В некоторых вариантах осуществления изобретения составы остаются стабильными в течение 1 месяца, 3 месяцев, 6 месяцев или более 6 месяцев при комнатной или более низкой температуре (например, 20-25°С) после стресса, вызванного лиофилизацией или замораживанием-оттаиванием. В других вариантах осуществления изобретения составы остаются стабильными в течение 6 месяцев, более 6 месяцев или более года при хранении при температуре ниже комнатной (например, -70°С или 2-8°С). В других вариантах осуществления изобретения составы остаются стабильными в течение более 1 месяца или 3 месяцев при 37°С после стресса, вызванного лиофилизацией или замораживанием-оттаиванием. В предпочтительных вариантах осуществления изобретения составы по настоящему изобретению относятся к категории мониторинга ампул с вакциной (VVM) VVM30 (то есть составы остаются стабильными в течение 193 дней при 25°С или в течение 30 дней при 37°С). См. раздел "Примеры" для ознакомления с описанием системы VVM.
Как показано в настоящем описании изобретения, комбинация маннита и сахарозы в составах по настоящему изобретению позволяет вакцинным композициям, содержащим вирусоподобные частицы HPV, сохранять стабильность при -70°С или 2-8°С в течение более 6 месяцев после лиофилизации или замораживания-оттаивания. Кроме того, установлено, что составы по настоящему изобретению, включающие комбинацию маннита и сахарозы, сохраняют иммуногенность в течение >6 месяцев при 25°С или в течение 3 месяцев при 37°С после лиофилизации.
Составы по настоящему изобретению могут далее содержать дополнительные компоненты и фармацевтически приемлемые носители, которые включают, но не ограничиваясь ими, адъюванты, добавляемые для усиления иммунной реакции иммунной системы субъекта на API (вирусоподобные частицы HPV), буфер, стабилизатор, солюбилизатор, модификатор тоничности, хелатообразователь, декстран, сульфат декстрана, декстран Т40, диэтаноламин, гуанидин, хлорид кальция, цитрат натрия, альбумин, желатин, полиэтиленгликоль (PEG), липиды и гепарин. Квалифицированный специалист может легко определить, какие дополнительные наполнители необходимо ввести в требуемый вакцинный состав в зависимости от функции состава, предполагаемого способа введения, дозировки и других факторов, таких как предполагаемое время хранения и температура состава. Квалифицированный специалист, которому должно быть известно, что количество дополнительных наполнителей может изменяться, может легко определить соответствующее количество, являющееся безопасным для введения человеку или животным и эффективным для достижения требуемой цели.
Вирусоподобные частицы HPV
В настоящее время идентифицировано более 80 типов HPV, многие из которых ассоциированы с патологиями от доброкачественных пролиферативных бородавок до злокачественных карцином шейки матки (см. публикацию McMurray et al., Int. J. Exp. Pathol. 82(1): 15-33 (2001)). HPV типов 6 и 11 именуются вирусами "с низкой степенью риска" и относятся к типам HPV, которые обычно ассоциированы с доброкачественными бородавками, незлокачественными кондиломами и/или дисплазией низкой степени злокачественности слизистой оболочки половых органов или органов дыхания. Образование примерно 90% остроконечных бородавок вызвано HPV двух указанных типов. В отличие от этого HPV 16 и HPV 18 именуются вирусами "с высокой степенью риска", так как указанные типы чаще всего ассоциированы с карциномами in situ и инвазивными карциномами шейки матки, влагалища, женских наружных половых органов и анального канала. Более 70% карцином шейки матки вызваны инфекциями HPV16 и HPV18. Наряду с менее распространенными онкогенными типами HPV 31, 33, 45, 52 и 58, указанные типы являются причиной возникновения более 90% рака шейки матки (Schiffman et al., J. Natl. Cancer Inst. 85(12): 958-64 (1993)).
Вирусы папилломы являются мелкими (50-60 нм), безоболочечными, двадцатигранными ДНК-вирусами, кодирующими до восьми ранних (Е1-Е7) и два поздних (L1-L2) гена. Белок L1 является основным капсидным белком и имеет молекулярную массу 55-60 кДа. Экспрессия белка L1 или комбинации белков L1 и L2 в дрожжах, клетках насекомых, клетках млекопитающих или бактериях вызывает самосборку вирусоподобных частиц (VLP) (см. публикацию Schiller and Roden, in Papillomavirus Reviews: Current Research on Papillomaviruses; Lacey, ed. Leeds, UK: Leeds Medical Information, pp 101-12 (1996)). Вирусоподобные частицы в морфологическом отношении подобны аутентичным вирионам и могут индуцировать высокие титры нейтрализующих антител при введении животным или человеку. Так как вирусоподобные частицы не содержат потенциально онкогенного вирусного генома, такие частицы являются безопасной альтернативой использованию живого вируса при создании вакцины против HPV (см. публикацию Schiller and Hidesheim, J. Clin. Virol. 19:678-74 (2000)). По указанной причине гены L1 и L2 были признаны иммунологическими мишенями для создания профилактических и терапевтических вакцин против HPV и заболеваний, вызванных HPV.
Таким образом, вакцинные композиции по настоящему изобретению содержат вирусоподобные частицы HPV, состоящие из рекомбинантного белка L1 или рекомбинантных белков L1+L2, относящихся к HPV по меньшей мере одного типа. Белок L1 HPV или белок L1+L2 HPV может быть экспрессирован рекомбинантно путем молекулярного клонирования ДНК L1 или L1+L2 в экспрессирующем векторе, содержащем приемлемый промотор и другие необходимые элементы, регулирующие транскрипцию, и перенесен в прокариотические или эукариотические клетки-хозяева для продуцирования рекомбинантного белка. Методы таких манипуляций всесторонне описаны в публикации Sambrook et al. (Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory, Cold Spring Harbor, New York (1989)), которая включена в настоящее описание изобретения в качестве ссылки. В результате рекомбинантной экспрессии белка L1 в клетке-хозяине может происходить самосборка вирусоподобных частиц.
Рекомбинантные белки L1 HPV по настоящему изобретению могут иметь любую непроцессированную последовательность белка L1, встречающуюся в природе или характерную для любого мутированного или усеченного белка L1, способную осуществлять самосборку с образованием вирусоподобных частиц. Последовательности белка L1, пригодные для использования в настоящем изобретении, могут быть выявлены путем выделения ДНК из одного или нескольких клинических образцов, содержащих HPV выбранного типа, определения последовательности ДНК L1 HPV и трансляции последовательности ДНК в аминокислотную последовательность с использованием генетического кода. В научной литературе можно найти многие типичные последовательности L1, пригодные для использования в настоящем изобретении. См., например, патенты США №№5820870, 7250170, 7276243 и 5437951; публикацию Kirii et al. (Virology 185(1): 424-427 (1991)). Белки L1, пригодные для использования в композициях и составах по настоящему изобретению, далее включают биологически активные фрагменты и/или мутанты последовательности LI HPV, которые включают, но не ограничиваясь ими, замены, делеции и добавления аминокислот, усечения аминоконца и карбоксильного конца, при этом в результате выполнения указанных мутаций образуются белки или фрагменты белков L1, способные формировать вирусоподобные частицы. См., например, международную публикацию WO 2006/114312 и патент США №6599508.
Клетки-хозяева, пригодные для экспрессии рекомбинантного белка L1 или L1+L2 HPV и последующей самосборки вирусоподобных частиц, включают, но не ограничиваясь ими, дрожжевые клетки, клетки насекомых, клетки млекопитающих или бактерии. В типичных вариантах осуществления настоящего изобретения вирусоподобные частицы продуцированы в дрожжевых клетках, таких как дрожжи, выбираемые из группы, состоящей из Saccharomyces cerevisiae, Hansenula polymorpha, Pichia pastoris, Kluyvermyces fragilis, Kluveromyces lactis и Schizosaccharomyces pombe. Преимуществом экспрессии вирусоподобных частиц HPV в дрожжевых клетках являются низкие затраты и простота адаптации к крупномасштабному выращиванию в ферментерах.
Настоящее изобретение также относится к составам, содержащим мутантные формы вирусоподобных частиц HPV, включающие биологически активные фрагменты и/или мутанты белка L1 или L2 HPV, которые включают, но не ограничиваясь ими, замены, делеции, добавления аминокислот, усечения аминоконца и карбоксильного конца, в результате которых образуются белки или фрагменты белков, которые могут быть использованы для терапевтических или профилактических целей и пригодны для создания вакцины на основе вирусоподобных частиц HPV. Любая такая мутантная форма белка L1 HPV должна быть способна образовывать вирусоподобные частицы и вызывать иммунную реакцию против HPV требуемого типа при введении человеку.
Кроме того, специалисту в данной области должно быть известно, что белок L1 или L1+L2, используемый для самосборки вирусоподобных частиц, вводимых в составы по настоящему изобретению, может быть кодирован непроцессированным полинуклеотидом L1 или L2 HPV дикого типа или может быть кодирован фрагментом или мутантом известной последовательности дикого типа. В данной области известны полинуклеотидные последовательности дикого типа, кодирующие мРНК, экспрессирующую белок L1 или L2 HPV. Любой мутантный полинуклеотид должен кодировать белок или фрагмент белка, который по меньшей мере имитирует фармакологические свойства белка L1 или L2 HPV, включая способность образовывать вирусоподобные частицы, способные вызывать иммунную реакцию против HPV представляющего интерес типа при введении человеку. Любой такой полинуклеотид включает, но не ограничиваясь ими, замены, делеции, добавления нуклеотидов, усечения аминоконца и карбоксильного конца.
В конкретных вариантах осуществления изобретения вирусоподобные частицы HPV по меньшей мере одного типа включают HPV типа, выбираемого из группы, состоящей из HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82. Однако HPV любого типа, ассоциированный с патологическим состоянием или нарушением, пригоден для введения в составы по настоящему изобретению. В некоторых вариантах осуществления изобретения составы являются моновалентными вакцинными составами, включающими вирусоподобные частицы HPV только одного типа, например, HPV типа 16, 18, 31, 45, любых вышеуказанных типов или любого другого типа, ассоциированного с патологическим состоянием. В альтернативных вариантах осуществления изобретения составы являются двухвалентными; например, составы, включающие вирусоподобные частицы HPV типа 16 и 18. В альтернативных вариантах осуществления изобретения составы являются 3-валентными, 4-валентными, 5-валентными, 6-валентными, 7-валентными, 8-валентными, 9-валентными или 10-валентными. В некоторых предпочтительных вариантах осуществления изобретения состав является 4-валентным, например, состав, включающий вирусоподобные частицы HPV типов 6, 11, 16 и 18. В альтернативных предпочтительных вариантах осуществления изобретения составы включают вирусоподобные частицы HPV типов 6, 11, 16, 18, 31, 33, 45, 52 и 58.
Вирусоподобные частицы HPV каждого типа вводят в составы по настоящему изобретению в терапевтически эффективном количестве, которое зависит от иммуногенности экспрессированного генного продукта. Как правило, иммунологически или профилактически эффективная доза включает от примерно 10 мкг до примерно 100 мкг, предпочтительно от примерно 20 мкг до 80 мкг вирусоподобных частиц.
Концентрация вирусоподобных частиц HPV, вводимых в составы по настоящему изобретению, может изменяться, но обычно концентрация составляет от примерно 20 мкг/мл до примерно 200 мкг/мл для вирусоподобных частиц HPV каждого типа, присутствующих в составе. Более предпочтительно концентрация вирусоподобных частиц HPV каждого типа в составе составляет от примерно 40 мкг/мл до примерно 160 мкг/мл.
Адъюванты на основе соли алюминия
Как было указано выше, давно установлено, что алюминий стимулирует иммунную реакцию против совместно вводимых антигенов. Вакцинные составы по настоящему изобретению адсорбированы на алюминиевом адъюванте. Алюминиевый адъювант в композициях по настоящему изобретению не должен представлять собой осадок алюминия. Вакцины, осажденные на алюминие, могут усиливать иммунную реакцию в отношении антигена-мишени, но при этом являются высоко гетерогенными составами и не позволяют получить сопоставимые результаты (см. публикацию Lindblad E.B. Immunology and Cell Biology 82:497-505 (2004)). В отличие от этого вакцины, адсорбированные алюминием, могут быть стандартизированы, что является важной характеристикой вакцинных составов, предназначенных для введения человеку. Кроме того, считается, что физическая адсорбция требуемого антигена на алюминиевом адъюванте имеет важное значение для функционирования адъюванта, вероятно, благодаря более медленному распространению от места инъекции или более эффективному поглощению антигена антигенпрезентирующими клетками.
Алюминиевый адъювант по настоящему изобретению может представлять собой гидроксид алюминия (Al(ОН)3), фосфат алюминия (AlPO4), гидроксифосфат алюминия, аморфный сульфат гидроксифосфата алюминия (AAHS) или так называемые "квасцы" (KAl(SO4)⋅12H2O) (см. публикацию Klein et al., Analysis of aluminum hydroxyphosphate vaccine adjuvants by (27)Al MAS NMR., J. Pharm. Sci. 89(3): 311-21 (2000)). В типичных вариантах осуществления настоящего изобретения алюминиевый адъювант является гидроксифосфатом алюминия или AAHS. Предпочтительно, чтобы в указанных вариантах осуществления изобретения алюминиевый адъювант, содержащий фосфат и алюминий, присутствовал в молярном отношении фосфата (PO4) к алюминию (Al) от примерно 0,1 до примерно 1,3. В альтернативных предпочтительных вариантах осуществления изобретения отношение фосфата к алюминию находится в интервале от 0,1 до 0,70. Более предпочтительно, чтобы алюминиевый адъювант, содержащий фосфат и алюминий, присутствовал в молярном отношении PO4/Al от примерно 0,2 до примерно 0,5. В альтернативных вариантах осуществления изобретения алюминиевый адъювант является гидроксидом алюминия.
В некоторых вариантах осуществления изобретения алюминиевый адъювант является AAHS (термин AAHS использован в настоящем описании изобретения взаимозаменяемо с термином "алюминиевый адъювант Merck (МАА)"). МАА имеет нулевой заряд при нейтральном значении рН, в то время как Al(ОН)3 имеет общий положительный заряд, и AlPO4 обычно имеет общий отрицательный заряд при нейтральном значении рН. МАА обладает более высокой способностью связываться с вирусоподобными частицами HPV, чем AlOH. Кроме того, вирусоподобные частицы, адсорбитрованные МАА, могут вызывать более сильную гуморальную иммунную реакцию у мышей, чем вирусоподобные частицы, адсорбированные Al(ОН)3. Caulfield et al., Human Vaccines 3: 139-146 (2007). Не ограничиваясь какой-либо теорией, можно отметить, что общий заряд алюминиевого адъюванта может влиять на его способность связываться с антигеном вирусоподобных частиц, при этом сильно заряженные адъюванты не могут связываться с антигеном в такой же степени, что и нейтрально заряженные адъюванты. По указанной причине предпочтительно, чтобы алюминиевый адъювант, входящий в состав фармацевтических композиций по настоящему изобретению имел нулевой поверхностный заряд при нейтральном значении рН. Специалист в данной области может менять буфер, концентрацию соли и/или процентное содержание свободного фосфата для достижения нулевого поверхностного заряда при нейтральном значении рН.
Специалист в данной области может определить оптимальную дозировку алюминиевого адъюванта, которая является безопасной и эффективной для усиления иммунного ответа в отношении HPV требуемых типов. Для ознакомления с безопасным профилем алюминия, а также с количествами алюминия, вводимыми в вакцины, лицензированные FDA, см. публикацию Baylor et al., Vaccine 20: S18-S23 (2002). Эффективная и безопасная доза алюминиевого адъюванта обычно составляет 150-600 мкг/дозу (концентрация 300-1200 мкг/мл). В конкретных вариантах составов и композиций по настоящему изобретению количество алюминиевого адъюванта составляет 200-300 мкг на одну дозу вакцины. В альтернативных вариантах составов и композиций по настоящему изобретению количество алюминиевого адъюванта составляет 300-500 мкг на одну дозу вакцины.
Способы получения вакцинного состава
Другим аспектом настоящего изобретения является способ получения лиофилизированного вакцинного состава против HPV, устойчивого к стрессу, вызываемому процессом лиофилизации, который способен сохранять физические и/или иммунологические свойства жидкого состава. Таким образом, настоящее изобретение относится к способу получения стабильного лиофилизированного вакцинного состава против HPV, который включает: (а) получение жидкого вакцинного состава против HPV, содержащего (i) вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на адъюванте на основе соли алюминия, присутствующие в концентрации 10-200 мкг/мл и выбираемые из группы, состоящей из HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; (ii) от примерно 1% до примерно 10% масс./об. маннита и (iii) от примерно 0,5% до примерно 10% сахарозы; (b) замораживание жидкого состава с образованием замороженного состава; и (с) высушивание замороженного состава с получением лиофилизированного вакцинного состава против HPV. В предпочтительных вариантах осуществления данного аспекта изобретения маннит присутствует в концентрации от примерно 4% до примерно 7% масс./об. и сахароза присутствует в концентрации от примерно 1% до примерно 5% масс./об. Альтернативно в способе по настоящему изобретению могут быть использованы любые вакцинные составы против HPV, рассмотренные в настоящем описании.
В другом варианте осуществления данного аспекта изобретения жидкий вакцинный состав против HPV далее включает примерно 10 мМ гистидина, от примерно 0,30 М до примерно 0,35 М NaCl и/или 0,01% PS80. В альтернативных вариантах осуществления изобретения указанный способ включает (а) приготовление жидкого вакцинного состава против HPV, описанного в любом варианте осуществления первого аспекта изобретения, (b) замораживание жидкого состава с образованием замороженного вакцинного состава против HPV, и (с) высушивание данного состава с получением лиофилизированного или высушенного вымораживанием вакцинного состава.
Процесс лиофилизации (также известный как "сушка вымораживанием") составов включает две стадии, а именно (1) замораживание и (2) сушку. Стадию замораживания способами по настоящему изобретению, которая является первой стадией процесса лиофилизации, выполняют при температуре ниже Tg' для аморфного продукта или ниже Teu (эвтектическая температура) для продукта в кристаллическом состоянии в течение периода времени, достаточного для трансформации жидкого состава в твердое состояние. Время, необходимое для трансформации жидкого состава в твердое состояние, частично зависит от общего заполняемого объема емкости, используемой для лиофилизации состава. При больших заполняемых объемах время, необходимое для трансформации жидкого состава в твердое состояние, будет больше, чем при относительно меньших заполняемых объемах, используемых для лиофилизации сравнимого состава.
В конце стадии замораживания вода, присутствующая в жидком составе, превращается в лед, и обычно менее 20% воды (масс./масс.) присутствует в виде жидкости. Кроме того, скорость охлаждения определяет размер кристаллов льда и структуру лепешки. Например, при медленном замораживании образуется пористая лепешка с более крупными кристаллами льда. Специалист в данной области может легко определить соответствующую температуру замораживания при осуществлении способов по настоящему изобретению.
Вторая стадия процесса лиофилизации включает сушку. Стадия сушки может быть оптимизирована в зависимости от конкретного состава, температуры хранения, емкости и давления в камере. В цикл лиофилизации желательно включить дополнительные стадии, например, стадию предварительного замораживания, стадию дополнительной сушки или стадию отжига для получения лиофилизированных вакцинных составов против HPV по настоящему изобретению. Специалист в данной области может оптимизировать цикл лиофилизации конкретного состава по настоящему изобретению известными методами (см., например, WO 2011/017070).
В другом варианте осуществления данного аспекта изобретения указанный способ включает еще одну стадию, в соответствии с которой вакцинный состав восстанавливают разбавителем, получая при этом восстановленный жидкий состав. Разбавители, используемые для восстановления лиофилизированных составов по настоящему изобретению, могут представлять собой любую жидкость, которая является безопасным, стабильным и фармацевтически приемлемым носителем. В некоторых вариантах осуществления изобретения составы восстанавливают при помощи SWFI и/или BWFI. SWFI, содержащие стабилизатор, солюбилизатор, модификатор тоничности, такой как NaCl, MgCl2, CaCl2 и т.д. и их смеси, которые также могут быть использованы в способах по настоящему изобретению.
Другим аспектом изобретения является способ получения замороженного вакцинного состава против HPV, устойчивого к стрессу, вызываемому замораживанием и оттаиванием, который способен сохранять физические и/или иммунологические свойства жидкого состава. Таким образом, настоящее изобретение относится к способу получения стабильного, замороженного вакцинного состава против HPV, который включает: (а) получение жидкого вакцинного состава против HPV, включающего (i) вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на адъюванте на основе соли алюминия, которые присутствуют в концентрации 10-200 мкг/мл и выбраны из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; (ii) от примерно 1% до примерно 10% масс./об. маннита и (iii) от примерно 0,5% до примерно 10% сахарозы, и (b) замораживание жидкого состава с образованием замороженного состава. В предпочтительных вариантах осуществления данного аспекта изобретения маннит присутствует в концентрации от примерно 4% до примерно 7% и сахароза присутствует в концентрации от примерно 1% до примерно 5% масс./об.; в альтернативных предпочтительных вариантах осуществления изобретения маннит присутствует в концентрации от примерно 5% до примерно 6%; масс./об. и сахароза присутствует в концентрации от примерно 2% до примерно 4% масс./об. Альтернативно при осуществлении способа по настоящему изобретению могут быть использованы любые вакцинные составы против HPV.
В другом варианте осуществления данного аспекта изобретения жидкий вакцинный состав против HPV далее включает примерно 10 мМ гистидина, от примерно 50 мМ до примерно 350 мМ NaCl и/или 0,01% PS80. В альтернативных вариантах осуществления изобретения указанный способ включает (а) получение жидкого вакцинного состава против HPV, описанного в любом варианте осуществления первого аспекта настоящего изобретения, и (b) замораживание жидкого состава с получением замороженного вакцинного состава против HPV.
Способы применения
Настоящее изобретение также относится к способу профилактики или уменьшения вероятности инфицирования человека вирусом папилломы человека, который включает введение вакцинной композиции по настоящему изобретению.
В конкретных вариантах способов по настоящему изобретению вводимая субъекту фармацевтическая композиция включает вирусоподобные частицы HPV типов 6, 11, 16 и 18. В дополнительных вариантах осуществления изобретения композиции далее включают вирусоподобные частицы HPV типов 31, 33, 45, 52 и 58. В других вариантах осуществления изобретения композиции включают вирусоподобные частицы HPV типа 16, а также вирусоподобные частицы HPV по меньшей мере одного дополнительного типа, выбираемого из группы, состоящей из HPV6, HPV11, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82.
Вакцинные композиции по настоящему изобретению могут быть использованы отдельно в соответствующих количествах, обеспечивающих оптимальное ингибирование инфицирования HPV при минимальной токсичности. Кроме того, может быть желательно одновременно или последовательно ввести другие агенты.
Составы и композиции по настоящему изобретению могут быть введены субъекту при помощи внутримышечной инъекции, подкожной инъекции, внутрикожной инъекции или вдавливания через кожу. Также могут быть использованы другие способы введения, такие как внутрибрюшинное, внутривенное введение или ингаляция. В предпочтительных вариантах осуществления изобретения вакцины и фармацевтические композиции вводят внутримышечно.
В некоторых вариантах осуществления изобретения фармацевтические композиции и составы против HPV по настоящему изобретению вводят субъекту в виде разных комбинаций первичного/повторного введения, чтобы вызвать более сильный и продолжительный иммунный ответ. В данном случае две фармацевтические композиции вводят в режиме "первичного и повторного" введения. Например, первую композицию вводят один или несколько раз и через заранее определенный период времени, например, через 2 недели, 1 месяц, 2 месяца, шесть месяцев или другой период времени один или несколько раз вводят вторую композицию.
Две или более фармацевтические композиции против HPV, используемые в клинической практике, содержат вирусоподобные частицы HPV одного типа или нескольких типов. Однако в клинической практике может быть также желательно использовать две разные фармацевтические композиции против HPV, вводимые субъекту через определенный интервал времени. Например, вакцинную композицию, включающую вирусоподобные частицы HPV 16 и 18, вводят в один период времени и через заранее определенный период времени вводят вакцинную композицию против HPV, включающую вирусоподобные частицы HPV 31, 33, 45, 52 и 58. В таких случаях две разные вакцинные композиции против HPV могут быть введены субъекту один или несколько раз через соответствующий период времени.
Все публикации, приведенные в настоящем заявке, включены в описание изобретения в качестве ссылки для ознакомления с методами и материалами, которые могут быть использованы в связи с настоящим изобретением. Указанные публикации не следует рассматривать как признание того, что сущность настоящего изобретения не может быть раскрыта на основании предшествующего изобретения.
Несмотря на описание предпочтительных вариантов осуществления изобретения со ссылкой на прилагаемые чертежи, следует отметить, что настоящее изобретение не ограничено приведенными вариантами осуществления, и специалист в данной области может внести в настоящее изобретение разные изменения и модификации, не выходящие за пределы сущности и объема изобретения, представленного в прилагаемой формуле изобретения.
Нижеследующие примеры иллюстрируют, но не ограничивают объем изобретения.
Пример 1
Материалы и методы
(а) Получение образца. В исследованиях, рассмотренных в настоящем описании, в качестве типичной вакцины была использована четырехвалентная (типы 6, 11, 16, 18) рекомбинантная вакцина против вируса папилломы человека, известная как GARDASIL® (Merck and Co. Inc., Whitehouse Station, NJ). GARDASIL® является неинфекционной рекомбинантной четырехвалентной вакциной, полученной из хорошо очищенных вирусоподобных частиц (VLP) основного капсидного (L1) белка HPV типов 6, 11, 16 и 18. Образцы GARDASIL®, использованные в настоящем исследовании (определяемые в настоящем описании изобретения как "4-валентная вакцина против HPV" или "четырехвалентная вакцина против HVP"), были получены из последних партий в контейнерах, полученных в соответствии с описанием, приведенным ранее в научной литературе (Lowe, R.S. et al., J. Infect. Dis. 176: 1141-45 (1997); Cook, J.C. et al., Protein Expres. Purif. 17: 477-84 (1999). Белки L1 HVP конкретных типов были получены путем раздельной ферментации в рекомбинантных дрожжевых клетках Saccharomyces cervcisiae с последующей самосборкой с образованием вирусоподобных частиц. Вирусоподобные частицы были очищены несколькими химическими и физическими методами. Все очищенные водные вирусоподобные частицы были отдельно адсорбированы на заранее полученный адъювант на основе сульфата гидроксифосфата алюминия компании Merck (МАА). Компоненты моновалентной вакцины были получены в 10 мМ гистидина, 0,01% полисорбата 80 и 0,33 М хлорида натрия. Четыре отдельные моновалентные вакцины (адсорбированные адъювантом), содержащие белки HVP типов 6, 11, 16 и 18, смешивали при концентрации белков 40, 80, 80 и 40 мкг/мл с образованием четырехвалентной лекарственной формы GARDASIL®.
Для исследования длительной стабильности образцы HPV были получены в соответствии с приведенным выше описанием. Кроме того, были получены образцы, включающие 1× МАА без антигена. Для получения образцов 2× МАА в баке объединяли забуференный солевой раствор (6,1 мМ фосфата натрия и 120 мМ хлорида натрия) и 5,44% раствора алюмосульфата калия. В бак добавляли 1,0 н. раствор гидроксида натрия для осаждения адъюванта и доведения значения рН до 7,7-7,8 при 2-4°С. Раствор с требуемым значением рН концентрировали в 3 раза, пропуская через фильтры с отсечением номинальной молекулярной массы, равной 200000 (MWCO), и затем диафильтровали против 2,1 объема физиологического раствора (0,9% хлорида натрия), чтобы уменьшить содержание ионов сульфата калия. После диафильтрации адъювант разводили до требуемой концентрации алюминия, равной 900 мкг/мл (2× МАА), физиологическим раствором и 1,4% раствором бората натрия. 2× МАА разводили в отношении 1:1 физиологическим раствором (0,9% хлорид натрия) для получения 1× МАА, использованного в данном исследовании.
(b) Состав буферов. В вакцинных составах против HPV, содержащих четырехвалентный HPV, связанный с МАА, производили замену 18 буферов методом осаждения/декантации. Все буферы содержали 10 мМ гистидина, 0,01% полисорбата 80, рН 6,2 и включали разные композиции наполнителей, показанные на фиг.1.
Ниже (таблица 1) приведено краткое описание буферов, использованных в данном исследовании, с указанием идентифицирующих номеров ("код буфера").
|
Для исследования длительной стабильности в вакцинных составах против HPV, содержащих HPV четырех типов, связанные с МАА, и 1х МАА, буфер заменяли 5 вышеуказанными буферами. (Буфер В-буфер D с 0 или 320 мМ NaCl (то есть были использованы буферы В-14, В-3, В-15, В-4 и В-16). Буфер В-2 не был испытан при выполнении исследований длительной стабильности).
(с) Исследование замораживания-оттаивания. Вакцинные составы против HPV, содержащие буферы В-1-В-18 (см. таблицу 1), подвергали быстрому замораживанию (FF), подавая жидкий азот при -115°С в течение 15 минут, или нормальному замораживанию при -70°С в течение 1 часа. Быстрое замораживание производили 1 раз (1х FF), и нормальное замораживание проводили 1 раз и 3 раза. Экспериментальные составы вводили в 3 мл стеклянные пробирки с заполняемым объемом 0,6 мл. Образцы замороженной вакцины оттаивали при комнатной температуре в течение 1 часа. После выполнения циклов замораживания-оттаивания анализировали иммуногенность образцов и другие характеристики.
При выполнении исследований длительной стабильности вакцинные составы против HPV и вышеописанные составы, содержащие 1× МАА, подвергали нормальному замораживанию при -70°С и замороженные составы хранили при -70°С в течение примерно 24 часов. Экспериментальные составы вводили в 3 мл стеклянные пробирки с заполняемым объемом 0,6 мл. Образцы замороженной вакцины оттаивали при комнатной температуре в течение 1 часа. После выполнения цикла замораживания-оттаивания пробирки выдерживали при 2-8°С в течение 1 месяца до выполнения исследований длительной стабильности. Анализы иммуногенности и других характеристик образцов составов против HPV и составов, содержащих 1× МАА, выполняли в разные периоды времени.
(d) Исследование лиофилизации. Составы против HPV, содержащие буферы В-1-В-18, (см. таблицу 1) лиофилизировали методом быстрого замораживания (FF) путем подачи жидкого азота при -115°С в течение 15 минут или методом лиофилизации с предварительным охлаждением. Образцы вакцины хранили в 3 мл стеклянных пробирках с заполняемым объемом 0,6 мл. Образцы замороженной вакцины лиофилизировали, используя стандартные параметры процесса лиофилизации. Образцы помещали в предварительно охлажденный лиофилизатор при -50°С и выдерживали при -50°С в течение 1 часа. Стадию отжига выполняли при -20°С (изменяя температуру со скоростью 0,5°С/минуту) в течение 2 часов. Затем лиофилизатор снова охлаждали до -50°С (изменяя температуру со скоростью 0, 5°С/минуту) и выдерживали в течение 2,5 часа. Первичную сушку производили, нагревая лиофилизатор до -20°С при изменении температуры на 1°С в минуту под давлением 100 мторр в течение 48 часов. Вторичную сушку выполняли при температуре 10°С при изменении температуры на 0,5°С/минуту в течение 4 часов. После лиофилизации пробирки заполняли газообразным азотом, закупоривали при неполном вакууме и удаляли. Образцы лиофилизированной вакцины хранили замороженными до последующего выполнения анализа.
При выполнении исследований длительной стабильности
вакцинные составы против HPV и вакцинные составы, содержащие 1х МАА, подвергали лиофилизации, производя замораживание в предварительно охлажденном лиофилизаторе. Образцы замороженной вакцины лиофилизировали, используя стандартные параметры процесса лиофилизации, как было описано выше. Пробирки с лиофилизированной вакциной хранили замороженными до выполнения исследований длительной стабильности.
(е) Исследование улучшенной стабильности. Исследования стабильности выполняли в условиях повышенной температуры, используя все 4-валентные вакцинные составы против HPV, содержащие буферы В-1-В-18 (см. таблицу 1). Испытуемые образцы лиофилизированной 4-валентной вакцины против HPV в разных буферах вместе с соответствующими нелифилизированными 4-валентными составами против HPV подвергали воздействию повышенной температуры при 45°С в течение 1 месяца. Указанная температура была выбрана потому, что скорость инактивации вирусоподобных частиц HPV в значительной степени зависит от температуры. Образцы хранили в сертифицированных камерах для исследования стабильности. В конце исследования стабильности у образцов оценивали внешние физические характеристики, иммуногенность и другие характеристики после восстановления.
(f) Анализы антигенности in vitro. Для выделения HPV из алюминиевого адъюванта был разработан метод растворения алюминия, который включает разведение составов, содержащих HPV-алюминий, высококонцентрированным солевым раствором, содержащим цитрат и полисорбат 80. После растворения алюминия образцы вирусоподобных частиц HPV подвергали анализу антигенности in vitro методом резонанса поверхностных плазмонов.
Антигенность вирусоподобных частиц HPV in vitro определяли, измеряя сродство вирусоподобных частиц к HPV-специфическим нейтрализующим антителам методом резонанса поверхностных плазмонов в устройства Biacore® 2000 или 3000 (GE Healthcare Biosciences AB, Piscataway, NJ). Антитело против HPV иммобилизовали путем связывания с FCγ-фрагментом крысы против мышиного антитела, химически связанного с поверхностью сенсорного чипа СМ5 Biacore. Взаимодействие антигена вирусоподобных частиц HPV в жидкой фазе с антителом на поверхности сенсорного чипа регистрировали с учетом изменения показателя отражения сенсорного чипа, вызываемого связыванием антитела с антигеном. Образцы вирусоподобных частиц HPV, использованные в исследованиях составов, содержащих алюминиевый адъювант, сравнивали с исходным раствором таких же вирусоподобных частиц HPV (эталонный образец), подвергнутых замораживанию-оттаиванию, для определения антигенности in vitro.
(g) Динамическое рассеяние света (DLS). Размер частиц измеряли при комнатной температуре методом динамического рассеяния света в устройстве DynaPro® (Wyatt Technology Corp., Santa Barbara, CA). Указанное устройство калибровали, используя частицы латексного полимера стандартного размера. Образцы вирусоподобных частиц HPV, полученные вышеописанным методом растворения алюминия, измеряли методом DLS. В результате выполнения кумулятивного анализа функции автокоррекции изменений интенсивности рассеяния вследствие броуновского движения вирусоподобных частиц в растворе были получены средние коэффициенты диффузии (Koppel, D.E., J. Chem. Phys. 37: 4814-20 (1972)). Среднее значение гидродинамического диаметра Z было получено на основании средних коэффициентов диффузии при помощи уравнения Стокса-Эйнштейна. Гидродинамический размер антигенных частиц регистрировали в виде среднего гидродинамического диаметра Z (Dh). Все данные, приведенные в настоящем описании, представляют собой средние значения пяти измерений одного образца.
(h) Статическое рассеяние света (SLS). Размер частиц измеряли при комнатной температуре методом статического рассеяния света в устройстве Malvern® Mastersizer 2000 (Malvern Instruments; Worcestershire, United Kingdom). Для измерения размера частиц был использован метод лазерной дифракции. Указанное устройство калибровали, используя частицы латексного полимера стандартного размера. Образцы 1× МАА разводили водой и измеряли методом SLS. График размера частиц (0,5) в микронах (мкм), вычисленного на основании среднего значения распределения интенсивности в качестве фактора направления рассеивания, был построен в зависимости от разных условий испытания (F/T FF 1× и LYO вместе с соответствующим эталонным образцом).
(i) Измерения осмолярности. При выполнении данного исследования был использован микроосмометр Advanced® модели 3300 (Advanced Instruments Inc., Norwood, MA). Указанное устройство предназначено для измерения осмолярности 20 мкл образца методом депрессии в точке замерзания. Образец сверхохлаждали, используя специально спроектированный одноразовый держатель, удерживающий образец в термисторном зонде устройства, находящемся в фиксированном положении. После подачи импульса соленоидом и последующего замораживания образца при помощи микропроцессора фиксировали высвобождающееся тепло слияния в точке замерзания образца и отображали осмолярность на цифровом дисплее. Данное устройство калибровали, тестируя 2-5 образцов на каждом из двух уровней калибровки (50 и 850 сОсм/кг). Устройство автоматически выполняло внутреннюю калибровку после определения приемлемой воспроизводимости результатов. После калибровки устройства производили измерение эталона Clinitrol™ 290 (290 мОсм/кг) компании Advanced Instruments. Испытуемые образцы составов против HPV измеряли после измерения эталонного образца.
(j) Внешние физические характеристики сухой лепешки. Для достижения желаемой фармацевтической привлекательности при создании продукта большое внимание обычно уделяется приемлемому внешнему виду продукта. Оценка характеристик высушенной лепешки предполагает описание физических признаков, таких как цвет, плотность, однородность, усадка, разрушение или таяние. Была произведена субъективная оценка внешнего вида лиофилизированных вакцинных составов против HPV на основании приведенных ниже качественных показателей (таблица 2).
|
k) Время восстановления. Скорость восстановления является характеристикой продукта, зависящей от состава. Время восстановления высушенных вакцинных составов против HPV определяли с учетом времени полного растворения лиофилизированной лепешки при добавлении стерильной воды для инъекций, определяемого по образованию гомогенной суспензии. К каждому лиофилизированному вакцинному составу против HPV добавляли примерно 0,5-0,6 мл стерильной воды для инъекций с учетом содержания наполнителей в составе. Для сохранения требуемой концентрации вирусоподобных частиц HPV конечный объем составов после восстановления сохраняли близким к 0,6 мл.
(I) Испытание встряхиванием. Испытание встряхиванием выполняли с использованием вакцин, адсорбированных квасцами, для определения замораживания вакцинных составов в условиях охлаждения. Замораживание вакцинных составов необратимо изменяет структуру квасцов и значительно снижает иммуногенность вакцины. Замораживание вакцины на основе квасцов вызывает разрушение кристаллической решетки, что ведет к агломерации квасцов и более быстрому осаждению. Более быстрая скорость осаждения является основанием для выполнения положительного испытания встряхиванием, которое позволяет сравнить скорость осаждения испытуемых и контрольных образцов. Вакцина считается иммуногенной, если образец, который, как известно, был предварительно заморожен или лиофилизирован, характеризуется такой же скоростью осаждения, что и контрольный образец, который не был предварительно заморожен или лиофилизирован. При обнаружении более быстрой скорости осаждения испытуемого образца по сравнению с контрольным образцом вакцина считается небезопасной для использования из-за наличия агломерированных квасцов.
Для измерения скорости осаждения испытуемые и контрольные образцы перемешивали с образованием однородной суспензии вакцинных составов. После перемешивания пробирки с образцами отставляли и измеряли время осаждения. При неоднородном перемешивании вакцины или обнаружении осаждения/флокуляции на дне пробирки с более быстрой скоростью можно сделать вывод о том, что при замораживании/лиофилизации испытуемых образцов была повреждена структура квасцов с образованием больших агломерированных частиц квасцов. Все вакцинные составы против HPV, которые были подвергнуты замораживанию-оттаиванию, лиофилизации или восстановлению, исследовали при помощи испытания встряхиванием для оценки качества указанных образцов.
Пример 2
Антигенность in vitro
Антигенность 4-валентных вакцинных составов против HPV, содержащих вирусоподобные частицы HPV, оценивали in vitro при помощи анализа связывания нейтрализующего антитела (метод резонанса поверхностных плазмонов, Biacore). Биоактивность антигена исследовали в устройствах Biacore 2000 и Biacore 3000 (GE Healthcare Biosciences AB, Piscataway, NJ). В устройстве Biacore исследовали 4-валентные экспериментальные вакцинные составы против HPV, которые были подвергнуты замораживанию-оттаиванию или лиофилизации. Лиофилизированные 4-валентные составы против HPV восстанавливали стерильной водой для инъекций, как было описано в примере 1, до растворения алюминия. Все экспериментальные составы, содержащие вирусоподобные частицы HPV типа 6, 11, 16 и 18, суспендированные в буферах В-1-В-18, разводили растворяющим буфером.
Антигены вирусоподобных частиц HPV 4 типов в каждом 4-валентном вакцинном составе против HPV исследовали в отношении антигенности in vitro при помощи анализа Biacore. Условия выполнения анализа Biacore соответствовали описанным в публикации Mach et al., J. Pharm. Sci. 95: 2195-2206 (2006) при наличии некоторых изменений. Все образцы обрабатывали в соответствии с методом растворения алюминия, описанным в примере 1, для выделения антигенов вирусоподобных частиц HPV из алюминиевого адъюванта до выполнения анализа Biacore. Образец вирусоподобных частиц HPV, полученный в результате выполнения исследований с использованием алюминиевого адъюванта, сравнивали с замороженным исходным раствором тех же вирусоподобных частиц HPV для определения антигенности in vitro. Исходный раствор вирусоподобных частиц HPV, подвергнутых замораживанию-оттаиванию, был использован в качестве эталона для анализа Biacore. Образцы HPV с растворенным алюминием были использованы как есть или еще больше разведены для соответствия концентрациям эталонных замороженных исходных растворов для HPV каждого типа до выполнения измерения Biacore. Данные, полученные в результате выполнения анализа Biacore экспериментальных составов против HPV, как подвергнутых замораживанию-оттаиванию, так и лиофилизированных составов во всех буферах (В-1-В-18), нормализовали, используя контрольные составы против HPV в тех же буферах (В-1-В-18), которые не были подвергнуты оттаиванию-замораживанию или лиофилизации. Приведенные данные анализа Biacore представляли собой средние значения двух измерений каждого образца состава.
Нормализованные данные анализа Biacore для HPV каждого типа во всех экспериментальных составах против HPV после 1-кратного замораживания-оттаивания и 1-кратного быстрого замораживания приведены на фиг.2. Все 4-валентные вакцинные составы против HPV, подвергнутые замораживанию-оттаиванию, были полностью иммуногенными и вызывали почти такие же реакции при выполнении анализа Biacore, что и эталонные составы, в отношении всех четырех испытанных типов HPV, за исключением состава с буфером В-2 (буфер В+0 мМ NaCl), который не содержал никакой соли или наполнителей. Влияние на антигенность в отношении HPV всех типов было более выраженным для буфера В при отсутствии соли и наполнителей (В-2) при выполнении 3-кратного цикла замораживания-оттаивания. Не было отмечено значительного отличия в антигенности в отношении HPV всех типов в образцах, подвергнутых 1-кратному нормальному замораживанию-оттаиванию, и в образцах, подвергнутых 1-кратному быстрому замораживанию-оттаиванию. На основании полученных данных можно сделать вывод о том, что для сохранения антигенности в отношении HPV всех типов необходимо присутствие соли и наполнителей, которые позволяют составам выдерживать стресс, ассоциированный с замораживанием-оттаиванием.
Нормализованные данные анализа Biacore для HPV всех типов в разных вакцинных составах против HPV после лиофилизации с использованием предварительного охлаждения или быстрого замораживания в процессе лиофилизации (см. пример 1) приведены на фиг.3. Результаты анализа Biacore показали, что антигенность в отношении HPV всех типов снизилась для буфера В (В-2, В-8 и В-14), который не содержал никаких наполнителей, в то время как антигенность составов, содержавших остальные буферы, была идентична эталонным составам. Не было обнаружено существенного различия в антигенности в отношении HPV всех типов в образцах, подвергнутых замораживанию с предварительным охлаждением, и в образцах, подвергнутых быстрому замораживанию, в процессе лиофилизации. Вакцинные составы против HPV в буфере В-2 и в соответствующих солевых буферах (В-8 и В-14) не выдерживали процесс лиофилизации. Снижение антигенности было отмечено для HPV всех типов в составах, содержавших буфер В (В-2, В-8 и В-14). Снижение антигенности было значительно выше при отсутствии соли (В-2) и уменьшалось при увеличении концентрации соли. Для буферов, содержавших 5% маннита и соль (буфер А+150 мМ NaCl (В-7) и буфер А+320 мМ NaCl (B-13)), антигенность снизилась на 10-15% для HPV всех типов. Как показано на фиг.3, все буферы, не содержавшие комбинацию наполнителей, не выдерживали стресс, ассоциированный с процессом лиофилизации. Составы, содержавшие буферы С и D, которые включали комбинацию наполнителей, маннита и сахарозы, обеспечивали целостность вирусоподобных частиц HPV и, следовательно, сохраняли антигенность вакцины даже после процесса лиофилизации. Полученные данные свидетельствуют о роли указанных наполнителей в качестве стабилизаторов вакцины по сравнению с составами, содержавшими буфер Е (только сахароза) или буфер А (только маннит).
Лиофилизированные 4-валентные вакцинные составы против HPV (В-1-В-18), использованные в вышеописанных исследованиях лиофилизации, хранили в лиофилизированном твердом состоянии при 45°С в течение 1 месяца для оценки стабильности при хранении лиофилизированных вакцин. Нелиофилизированные жидкие 4-валентные вакцинные составы против HPV (В-1-В-18) были использованы в качестве соответствующих контрольных образцов при исследовании стабильности при хранении лиофилизированных вакцинных составов против HPV. После хранения в течение 1 месяца при 45°С у лиофилизированных составах оценивали внешние физические характеристики и затем восстанавливали стерильной водой для инъекций в соответствии с описанием, приведенным в примере 1. Антигенность испытуемых образцов оценивали методом Biacore в соответствии с описанием, приведенным в примере 1. На фиг.4 приведены нормализованные данные анализа Biacore для HPV всех типов в разных вакцинных составах против HPV после хранения в течение 1 месяца при 45°С. Антигенность в отношении HPV всех типов в нелиофилизированных жидких 4-валентных составах против HPV в разных буферах составила примерно 20-40% после хранения в течение 1 месяца при 45°С, из чего следует, что антигены вирусоподобных частиц HPV были нестабильными в жидких составах в указанных условиях хранения. С другой стороны, лиофилизированные составы против HPV в буфере С (В-3, В-9, В-15), полученные путем лиофилизации обоих типов (Lyo PC и Lyo FF), которые хранили при 45°С в течение одного месяца, характеризовались значительно более высокой антигенностью по сравнению с нелиофилизированными жидкими составами. Лиофилизированные составы против HPV, которые содержали только сахарозу в буфере Е (В-5, В-11 и В-17), приобрели окраску после хранения в течение 1 месяца при 45°С вследствие нестабильности сахарозы (разрушение). Разрушенная сахароза, предположительно, ингибировала связывание с антителом против HPV на иммобилизованном чипе, вызывая отсутствие показаний в устройстве, поэтому на фиг.4 отсутствуют некоторые точки данных. Полученные результаты показывают, что буфер С (В-3) и соответствующие ему солесодержащие буферы (В-9 и В-15) сохраняли до 80-90% антигенности вирусоподобных частиц HPV в отношении большинства типов HPV даже после хранения в течение 1 месяца при 45°С. Снижение антигенности было обнаружено для буфера D без соли (В-4), в то время как соответствующие солесодержащие буферы (В-10 и В-16) сохраняли антигенность в отношении большинства типов HPV даже после хранения в течение 1 месяца при 45°С. Таким образом, на основании профилей стабильности можно сделать вывод о том, что буферы, содержавшие комбинации маннита и сахарозы, обеспечивали получение стабильного вакцинного продукта с требуемой антигенностью.
Пример 3
Измерения осмолярности
Осмолярность была измерена во всех контрольных 4-валентных составах против HPV в разных буферах (В-1-В-18) до процесса замораживания-оттаивания или лиофилизации. Полученные результаты показывают, что значения осмолярности повышаются при увеличении концентрации соли во всех буферах (фиг.5). Величина осмолярности определяется главным образом наполнителями (маннит, сахароза и глицин) и солью (хлорид натрия), а не гистидином, антигенами HPV или МАА (как видно в случае буфера В-2, который характеризуется наименьшей осмолярностью). Осмолярность 4-валентной вакцины против HPV в буфере В-14 (подобно современному составу Gardasil®) была равна примерно 585 мОсм (фиг.5). Буферы В-13-В-18 (см. таблицу 1), за исключением буфера В-14, содержали наполнители с высокой концентрацией соли, что повышало тоничность указанных составов. В отличие от этого буферы В-1-В-12, за исключением буферов В-9 и В-10, содержали наполнители с низкой концентрацией соли, что вызывало низкие значения тоничности. Комбинация соли и наполнителей играет важную роль при определении тоничности данного 4-валентного вакцинного состава против HPV.
Пример 4
Измерения размера частиц
Размер частиц измеряли во всех 4-валентных вакцинных составах против HPV, которые представляли собой составы, подвергнутые замораживанию-оттаиванию (после 1-кратного, 3-кратного цикла нормального замораживания-оттаивания и 1-кратного цикла быстрого замораживания-оттаивания, как описано в примере 1 (с)), и лиофилизированные составы (после лиофилизации методом быстрого замораживания или лиофилизации с предварительным охлаждением, как описано в примере 1 (d)) во всех буферах (буфер А-буфер F), а также контрольные 4-валентные вакцинные составы против HPV в таких же буферах (буфер А-буфер F), которые не подвергали замораживанию-оттаиванию и лиофилизации. Все образцы обрабатывали методом растворения алюминия, описанным в примере 1 (f), для выделения антигенов вирусоподобных частиц HPV из алюминиевого адъюванта до измерения размера частиц. Распределение частиц по размерам выражено в виде среднего значения распределения по размерам всех вирусоподобных частиц HPV, присутствующих в растворе после растворения алюминия. Средние значения Z, соответствующие распределению частиц по размерам для всех 4-валентных составов против HPV в разных буферах, показаны на фиг.6.
Как показано на фиг.6, размер частиц был несколько больше в контрольных составах и составах, подвергнутых замораживанию-оттаиванию (1×, 3× и 1× FF), во всех буферах, не содержавших соли (буфер А-буфер F, содержавшие 0 мМ хлорида натрия), чем в буферах, содержавших соль (буфер А-буфер F, содержавшие 150 или 320 мМ хлорида натрия), за исключением буфера D, содержавшего 150 мМ хлорида натрия (В-10, см. фиг.1), в котором были обнаружены частицы наибольшего размера. В присутствии соли все 4-валентные составы против HPV, включая контрольные 4-валентные составы против HPV, характеризовались распределением частиц по размерам в диапазоне от 80 до 100 нм, который является типичным для вирусоподобных частиц HPV, присутствующих в растворяющем буфере. Среди разных исследованных экспериментальных составов составы в буфере С и буфере D, содержавших комбинацию наполнителей (маннит и сахароза), в меньшей степени испытали стресс, вызванный условиями замораживания-оттаивания, с точки зрения распределения вирусоподобных частиц по размерам по сравнению с составами, не включающими комбинацию наполнителей из маннита и сахарозы.
В случае лиофилизированых 4-валентных вакцинных составов против HPV распределение вирусоподобных частиц HPV по размерам было больше для буферов, не содержавших наполнителей или содержавших только маннит в качестве наполнителя (буфер А и буфер В, см. фиг.6), по сравнению с другими 4-валентными вакцинными составами против HPV (буфер С-буфер F), которые были лиофилизированы, а также по сравнению с соответствующими нелиофилизированными контрольными 4-валентными вакцинными составами против HPV. Увеличение размера частиц было значительным для лиофилизированных 4-валентных вакцинных составов против HPV в буфере А и буфере В в присутствии хлорида натрия. Распределение вирусоподобных частиц HPV по размерам в лиофилизированных составах, включающих буфер С, буфер D и буфер F, находилось в пределах нормального диапазона, равного 80-100 нм, независимо от концентрации соли и было сравнимо с соответствующими нелиофилизированными контрольными 4-валентными составами против HPV. Лиофилизированный 4-валентный состав против HPV, который содержал только сахарозу в качестве наполнителя (буфер Е), характеризовался большим распределением вирусоподобных частиц HPV по размерам при отсутствии хлорида натрия (буфер Е, содержавший 0 мМ хлорида натрия) и нормальным распределением вирусоподобных частиц HPV по размерам в диапазоне 80-100 нм в присутствии хлорида натрия (буфер Е, содержавший 150 или 320 мМ хлорида натрия).
В общем, 4-валентные вакцинные составы против HPV в буфере А, буфере В, буфере D и буфере Е, не содержавшие хлорида натрия, не выдерживали стресс, вызванный процессом замораживания-оттаивания или лиофилизации, даже когда указанные буферы содержали поверхностно-активное вещество в своем составе. Известно, что поверхностно-активные вещества обычно предотвращают агрегацию белков, испытывающих стресс, вызванный процессом замораживания-оттаивания и лиофилизации (Bhambhani et al., Am. Pharm. Rev. 13(1): 31-38 (2010); Chang et al., J. Pharm. Sci. 12: 1325-30 (1996)). С другой стороны, 4-валентные вакцинные составы против HPV в буфере С и буфере D, содержавших наполнители при наличии или отсутствии хлорида натрия, были устойчивы к стрессу, вызванному процессом замораживания-оттаивания и лиофилизации. Присутствие комбинации наполнителей (маннита и сахарозы) в указанных буферах при наличии или отсутствии хлорида натрия сохраняло целостность вирусоподобных частиц HPV, связанных с МАА, в условиях процесса замораживания-оттаивания и лиофилизации.
Пример 5
Характеристики лиофилизированных 4-валентных составов против HPV
(а) Внешние физические характеристики сухой лепешки
Внешние физические характеристики всех лиофиолизированных лепешек были сфотографированы сразу же после лиофилизации (Т=0) и после хранения в течение 1 месяца при 45°С. Внешние характеристики лепешек определяли в результате выполнения двух анализов, и на основании морфологии, цвета и других качественных признаков лепешки были классифицированы в соответствии с описанием, приведенным в примере 1 (см. таблицу 2). Как правило, для всех 4-валентных составов против HPV были получены сухие белые твердые лепешки. На фиг.7 показаны внешние физические характеристики всех лиофилизированных составов против HPV в разных буферах с использованием 3 образцов каждого состава. Привлекательные лепешки были получены для буферов В-1, В-3, В-4, В-6 и В-13 и слегка разрушенные лепешки или лепешки с трещинами и усадкой были получены для буферов В-7, В-8, В-9, В-10, В-14, В-15 и В-16. Полностью разрушенные лепешки были получены для буферов В-5, В-11, В-12, В-17 и В-18 после лиофилизации методом быстрого замораживания или с предварительным охлаждением. Кроме того, полностью разрушенная лепешка были получена для состава в буфере В-2 после лиофилизации методом быстрого замораживания. Результаты, полученные в данном исследовании, показывают, что внешние физические характеристики лепешки зависели от наполнителей. В составах, содержавших только сахарозу (В-5, В-11 и В-17) или сахарозу в комбинации с глицином и солью (В-12 и В-18), лепешки были полностью разрушены после лиофилизации методом быстрого замораживания или с предварительным охлаждением. В отличие от составов, включающих только сахарозу, привлекательные лепешки были обнаружены для составов, содержавших только маннит или сахарозу в комбинации с манитом или глицином при отсутствии соли. Качество лепешек для составов, содержавших комбинацию наполнителей из маннита и сахарозы, ухудшалось с увеличением концентрации соли.
Внешние физические характеристики всех лиофилизированных составов против HPV в разных буферах были также зарегистрированы после хранения при 45°С в течение 1 месяца. Полученные результаты показывают, что морфология или внешние физические характеристики лиофилизированных лепешек не изменились после хранения в течение 1 месяца при 45°С, за исключением составов в буферах В-5, В-11 и В-17 (буфер Е), которые приобрели окраску от желтой до коричневой вследствие нестабильности сахарозы при повышенной температуре. У составов, содержавших комбинацию сахарозы и маннита или глицина, цвет не изменился. На фиг.7 показаны внешние физические характеристики всех лиофилизированных составов против HPV в разных буферах, которые хранили в течение 1 месяца при 45°С.
(b) Время восстановления
Лиофилизированные 4-валентные вакцинные составы против HPV восстанавливали стерильной водой для инъекций (WFI) с учетом количества присутствующих наполнителей. Воду для инъекций добавляли к каждому составу в объеме от 0,50 до 0,60 мл. Конечный объем после восстановления был равен примерно 0,6 мл. Время восстановления контролировали при помощи секундомера с остановом и после лиофилизации регистрировали время полного растворения (в данном случае образования гомогенной суспензии) для всех вакцинных составов против HPV. Значения времени восстановления представлены на фиг.8 для образцов, которые были восстановлены сразу же после лиофилизации, и для образцов, которые хранили в течение 1 месяца при 45°С.
Для большинства составов время восстановления составило менее 15 секунд, в то время как состав в буфере, содержавшем только сахарозу, буфер Е (В-5, В-11 и В-17), характеризовался более медленным временем восстановления, равным 90 секундам или более. Такая же тенденция наблюдалась для образцов, которые хранили при 45°С в течение 1 месяца. Составы в буфере Е (В-5, В-11 и В-17), содержавшем только сахарозу, приобрели окраску от желтой до коричневой при хранении в течение одного месяца при 45°С.При восстановлении указанных образцов окраска составов от желтой до коричневой сохранилась вследствие разрушения сахарозы во время хранения при высокой температуре в течение одного месяца.
(с) Испытание встряхиванием
Все восстановленные лиофилизированные 4-валентные вакцинные составы против HPV были подвергнуты испытанию встряхиванием для проверки качества вакцинных составов. Время осаждения частиц квасцов на дно пробирки измеряли для каждого экспериментального состава. Время испытания встряхиванием для всех 4-валентных составов против HPV показано на фиг.9. Буфер состава, не содержащий наполнителей, но включающий соль (буфер В, содержащий 150 или 320 мМ хлорида натрия), характеризовался более быстрым временем осаждения, из чего следует, что частицы квасцов были агломерированы. Во всех других составах время осаждения превышало 10-15 минут, из чего следует, что частицы квасцов не были агломерированы. Присутствие наполнителей в 4-валентном вакцинном составе против HPV предотвращает агломерацию частиц квасцов даже после стресса, вызванного замораживанием-оттаиванием и лиофилизацией.
Исследование длительной стабильности (примеры 6-9)
Исследование длительной стабильности экспериментальных составов с однократным алюминиевым адъювантом Merck (MAA) выполняли при разной температуре хранения. Испытуемые образцы 4-валентных составов против HPV, подвергнутых замораживанию-оттаиванию и лиофилизации, и испытуемые образцы с однократным MAA в разных буферах испытывали при разных температурах хранения (-70°С, 2-8°С, 25°С и 37°С) в течение 6 месяцев, снимая показания в следующие периоды времени Т=0, Т=1 месяц, Т=3 месяца и Т=6 месяцев (см. таблицу 3 для ознакомления со схемой исследования). В конце каждого временного периода исследования стабильности определяли иммуногенность и внешние физические характеристики образцов и выполняли исследования других характеристик.
На протяжении 6 месяцев образцы хранили при определенной температуре в течение 198 дней (>6 месяцев) для определения категории мониторинга образцов вакцины (VVM) на основании теплостойкости. В системе VVM, применяемой Всемирной организацией здравоохранения (ВОЗ), использованы химические индикаторные метки времени и температуры, расположенные на пробирках с вакциной и служащие для детектирования кумулятивного воздействия на вакцину тепла с течением времени. Указанные индикаторные метки позволяют специалистам в области здравоохранения определять температуры, под воздействием которых вакцина утрачивает активность, на что указывает изменение цвета VVM, после чего вакцина должна быть уничтожена. Скорость, с которой метка изменяет цвет, является различной в зависимости от категории VVM, при этом скорость изменения цвета VVM приблизительно соответствует чувствительности вакцины в зависимости от времени и температуры.
По определению ВОЗ существуют следующие категории: VVM30 (высокая стабильность) - состав остается стабильным в течение 193 дней при 25°С, в течение 30 дней при 37°С; VVM14 (средняя стабильность) - состав остается стабильным в течение 90 дней при 25°С, в течение 14 дней при 37°С; VVM7 (умеренная стабильность) - состав остается стабильным в течение 45 дней при 25°С, в течение 7 дней при 37°С; VVM2 (низкая стабильность) - состав остается стабильным в течение 2 дней при 37°С.
|
|
Пример 6
Антигенность in vitro
Антигенность экспериментальных 4-валентных вакцинных составов против HPV оценивали при помощи анализа связывания с нейтрализующим антителом (метод резонанса поверхностных плазмонов, Biacore). Испытуемые образцы 4-валентных составов против HPV, подвергнутых замораживанию-оттаиванию и лиофилизации, хранили при -70°С, 2-8°С, 25°С и 37°С, как описано в примере 1, в течение более 6 месяцев для оценки стабильности при хранении вакцинных составов против HPV в разных буферах. Анализы биоактивности антигенов выполняли в определенные периода времени на протяжении всего исследования длительной стабильности. Образцы для анализа Biacore были получены в соответствии с описанием, приведенным в примере 2. Все экспериментальные составы содержали вирусоподобные частицы HPV типов 6, 11, 16 и 18, суспендированные в буфере В - буфере D, разбавленных растворяющим буфером. Данные анализа Biacore экспериментальных составов против HPV были нормализованы при использовании контрольных составов против HPV в таких же буферах, которые не были подвергнуты замораживанию-оттаиванию и лиофилизации. Приведенные данные анализа Biacore представляли собой средние значения двух измерений каждого образца состава.
Нормализованные данные Biacore показывают, что вакцинные составы против HPV в буфере С и буфере D, которые были подвергнуты процессу замораживания-оттаивания с последующим хранением при -70°С в течение более 6 месяцев, полностью сохранили иммуногенность и вызывали почти такие же реакции при выполнении анализа Biacore, что и эталонные образцы, в отношении HPV всех четырех испытанных типов (см. фиг.10 для ознакомления с репрезентативными данными для HPV типов 16 и 18). У вакцинного состава против HPV в буфере В (буфер 14) через 6 месяцев было обнаружено небольшое снижение иммуногенности для HPV всех четырех типов. Можно сделать вывод о том, что для сохранения антигенности HPV разных типов необходимо присутствие соли, наполнителей и/или комбинации соли и наполнителей, чтобы вакцинные составы могли выдерживать стресс, ассоциированный с замораживанием-оттаиванием и хранением.
Результаты анализа Biacore лиофилизированных составов против HPV, которые хранили при -70°С в течение более 6 месяцев, показали, что антигенность в отношении HPV всех типов была снижена при использовании буфера В (буфер 14) во все периоды времени, включая Т=0, по сравнению с составами против HPV в буфере С и буфере D (см. фиг.10 для ознакомления с репрезентативными данными для HPV типов 16 и 18). Данный показатель можно рассматривать как более высокое снижение иммуногенности в условиях замораживания-оттаивания в составе с буфером 14 после хранения в течение 6 месяцев при -70°С. Так как буфер 14 включает только соль (то есть не содержит наполнителей), указанный состав не смог выдержать стресс, вызванный процессом сушки вымораживанием (снижение иммуногенности в период времени Т=0). Днтигенность в отношении HPV всех типов в экспериментальных составах, содержащих сахарозу и маннит (буфер С и буфер D), была идентична эталонным составам, из чего следует, что указанные буферы были способны сохранять целостность вирусоподобных частиц HPV и, следовательно, антигенность вакцины при хранении при -70°С в течение более 6 месяцев после процесса лиофилизации. Выполненный анализ позволяет выявить роль комбинации указанных наполнителей в качестве стабилизатора вакцины в данных условиях испытания.
Все 4-валентные вакцинные составы против HPV (буфер В буфер D), которые были подвергнуты процессу замораживания-оттаивания, за исключением состава, включающего буфер 14, были полностью иммуногенными и вызывали почти такие же реакции при выполнении анализа Biacore, что и эталонные составы, в отношении HPV всех четырех испытанных типов после хранения при 2-8°С в течение более 6 месяцев (данные не показаны). Небольшое снижение иммуногенности в отношении HPV всех типов было обнаружено через 6 месяцев в составе с буфером 14, который был подвергнут замораживанию-оттаиванию; аналогичные результаты были получены после хранения при -70°С в течение более 6 месяцев. Таким образом, на стабильность антигенов HPV в разных буферах, содержавших соль, наполнители или комбинацию соли и наполнителей, не повлиял процесс замораживания-оттаивания и длительное хранение.
Результаты анализа Biacore лиофилизированных составов против HPV, которые хранили при 2-8°С в течение более 6 месяцев, показали, что антигенность в отношении HPV всех типов была снижена для буфера В (буфер 14) во все периоды времени, включая Т=0, по сравнению с составами против HPV в буфере С и буфере D (данные не показаны). Результаты для буфера 14, в котором отсутствует сахароза и маннит, были аналогичны результатам, полученным после хранения при -70°С, которые были приведены выше, и подтверждают вывод о том, что указанный состав не выдержал стресс, вызванный лиофилизацией и хранением вследствие отсутствия стабилизаторов. В отличие от результатов, полученных при использовании буфера В, антигенность в отношении HPV всех типов во всех экспериментальных составах с буфером С и буфером D была идентична антигенности эталонных составов. Полученные данные показывают, что лиофилизированные экспериментальные составы в буфере С и буфере D оставались стабильными при хранении на протяжении более 6 месяцев при 2-8°С, из чего следует, что комбинация наполнителей из маннита и сахарозы в буферах позволяет сохранить целостность вирусоподобных частиц HPV. Полученные результаты показывают, что состав, содержащий буфер 14, включающий соль при отсутствии маннита или сахарозы, не выдерживает стресс, вызванный лиофилизацией.
Все 4-валентные вакцинные составы против HPV (буфер В буфер D), которые были подвергнуты процессу замораживания-оттаивания с последующим хранением при 25°С в течение более 6 месяцев, были полностью иммуногенными и вызывали почти такие же реакции при выполнении анализа Biacore, что и эталонные составы, в отношении HPV типов 6, 11 и 16 в разные периоды времени (репрезентативные результаты для HPV16 и HPV18 показаны на фиг.11). Антигенность в отношении HPV 18 снизилась в составах, включающих буфер 15 и буфер 16, в периоды времени, соответствующие 3 и 6 месяцам. Снижение антигенности в отношении HPV18 было также обнаружено в составах, содержащих буфер 3 и буфер 4, но снижение антигенности было значительно меньше через 6 месяцев по сравнению с составами, содержащими буфер 15 и буфер 16. Полученные результаты показывают, что в вышеуказанных условиях присутствие наполнителей в составах против HPV типа 18, подвергнутых замораживанию-оттаиванию, не позволило выдержать тепловой стресс в течение указанного периода времени.
Результаты анализа Biacore лиофилизированных составов против HPV, хранившихся при 25°С в течение более 6 месяцев, показали, что антигенность в отношении HPV всех типов была снижена для буфера В (буфер 14) во все периоды времени, включая Т=0, по сравнению с составами против HPV в буфере С и буфере D (репрезентативные результаты для HPV типов 16 и 18 показаны на фиг.11). Снижение антигенности для буфера В было значительным после периода времени Т=0, что может быть связано с тепловой нестабильностью при 25°С после лиофилизации составов против HPV. Составы, включающие буфер С и буфер D, сохранили антигенность и вызывали почти такие же реакции при выполнении анализа Biacore, что и эталонные составы, в отношении всех четырех испытанных типов HPV в разные периоды времени. Данные стабильности при хранении, полученные для лиофилизированных составов против HPV (буфер С и буфер D) после хранения в течение 6 месяцев при 25°С, показали, что комбинация наполнителей, маннита и сахарозы, в буферах для составов позволила выдержать тепловой стресс, а также стресс, вызванный лиофилизацией, что указывает на целостность вирусоподобных частиц HPV. Результаты анализа Biacore показывают, что на утрату иммуногенности в условиях испытания повлияла температура хранения, при этом большая утрата иммуногенности была обнаружена при более высокой температуре хранения.
Все 4-валентные вакцинные составы против HPV (буфер В буфер D), которые были подвергнуты процессу замораживания-оттаивания, характеризовались снижением иммуногенности в отношении HPV всех типов после хранения в течение 1 месяца при 37°С (фиг.12). Таким образом, полученные результаты показывают, что присутствие наполнителей в составах против HPV, подвергнутых замораживанию-оттаиванию, не позволило выдержать тепловой стресс после хранения в течение 1 месяца при 37°С. Результаты анализа Biacore лиофилизированных составов против HPV, которые хранили при 37°С в течение 3 месяцев, показали, что антигенность в отношении HPV всех типов была снижена для буфера В (буфер 14) во все периоды времени, включая Т=0. После хранения в течение 3 месяцев результаты, полученные при выполнении анализа Biacore составов, включающих буфер С (буфер 3 и буфер 15) и буфер D (буфер 4), были почти идентичны эталонным составам, что свидетельствует о сохранении антигенности. Однако снижение иммуногенности в отношении HPV все типов было обнаружено в составах, включающих буфер 16, после хранения в течение 3 месяцев. Данные стабильности при хранении лиофилизированных состав против HPV после хранения в течение 1 месяца при 37°С подтвердили вывод о том, что комбинация наполнителей маннита и сахарозы в буферах для составов позволяла выдержать тепловой стресс и стресс, вызванный лиофилизацией. На утрату иммуногенности в условиях испытания повлияла температура хранения, при этом более значительная утрата иммуногенности была отмечена при более высоких температурах хранения. Как правило, время реакции, определенное на основании эквивалентности VVM (мониторинг образцов вакцины) в текущем эксперименте, попадает в категорию VVM30, которая является показателем высокой стабильности.
Пример 7
Измерения осмолярности
Осмолярность лиофилизированных составов против HPV и лиофилизированных составов, содержащих 1× МАА, которые хранили при 2-8°С в течение 1 месяца, измеряли в соответствии с описанием, приведенным в примере 1. Полученные результаты показывают, что осмолярность повышается в составах, содержащих буферы, включающие соль (буфер 14, буфер 15 и буфер 16), как в составах против HPV без адъюванта, так и в составах, содержащих 1× МАА (данные не показаны). Увеличению осмолярности в основном способствуют наполнители (маннит и сахароза) и соль (хлорид натрия), а не гистидин, антигены HPV или 1× МАА. Комбинация соли и наполнителей играет важную роль в определении тоничности данного 4-валентного вакцинного состава против HPV.
Пример 8
Измерение размера частиц
Статическое рассеяние света
Метод статического рассеяния света был использован для измерения размера частиц во всех составах, содержавших 1× МАД и 0 или 320 мМ NaCl (буфер А - буфер F), как описано в примере 1. Размер частиц в указанных составах, содержавших 1× МАА, которые подвергали быстрому замораживанию-оттаиванию (F/T FF 1×) или быстрой лиофилизации (LYO FF), сравнивали с контрольными составами в таких же буферах (буфер А-буфер F), которые не подвергали замораживанию-оттаиванию или лиофилизации.
Размер частиц 1× МАА в контрольных составах (содержащих и не содержащих соль) был равен примерно 4-9 мкм, за исключением буфера Е (буфер 5; 0 мМ хлорида натрия), в котором был отмечен значительный размер частиц, равный 25 мкм (данные не показаны). Значительная агрегация 1× МАА, на что указывает увеличение размера частиц, позволяет предположить, что добавление соли (по сравнению с буфером 5 (0 мМ хлорида натрия) в буфере 17 (320 мМ соли) предотвращает агрегацию МАА как в условиях замораживания-оттаивания, так и в условиях лиофилизации, соответственно. Кроме того, была отмечена способность комбинации наполнителей из маннита и сахарозы (сравнение буфера 5 (только сахароза) с буфером 4 и буфером 3 (комбинация сахарозы и маннита при отсутствии соли)) предотвращать агрегацию МАА. Во всех условиях испытания наименьшая агрегация при отсутствии соли была обнаружена в составах, содержавших 6% маннита и 4% сахарозы. Данное наблюдение согласуется с тенденцией длительной стабильности при хранении, имевшей место для антигенов HPV в присутствии сахарозы и маннита, что свидетельствует о способности составов, включающих указанную комбинацию, выдерживать стресс, вызванный замораживанием-оттаиванием и лиофилизацией.
Динамическое рассеяние света
Размер частиц также измеряли методом динамического рассеяния света во всех 4-валентных вакцинных составах против HPV, подвергнутых замораживанию-оттаиванию и лиофилизации с последующим хранением при разных температурах в течение 1 месяца, как описано в примере 1. Размер частиц также измеряли в контрольных вакцинных составах против HPV в таких же буферах (буфер В-буфер D), которые не подвергали замораживанию-оттаиванию или лиофилизации. Все образцы обрабатывали методом растворения алюминия, описанным в примере 1, для выделения антигенов вирусоподобных частиц HPV из алюминиевого адъюванта до измерения размера частиц. Распределение частиц по размерам выражено в виде среднего значения распределения по размерам вирусоподобных частиц HPV всех типов, присутствующих в растворе после растворения алюминия.
Полученные результаты показывают, что распределение частиц по размерам в составах против HPV, подвергнутых замораживанию-оттаиванию, которые хранили при разных температурах в течение 1 месяца, были сравнимы с контрольными составами, которые не подвергали замораживанию-оттаиванию и лиофилизации, за исключением состава против HPV в буфере 14, который хранили при 37°С в течение 1 месяца (данные не показаны). В указанном составе (буфер 14), хранившемся при 37°С в течение 1 месяца, были обнаружены частицы большого размера, что может быть связано с тепловой нестабильностью вирусоподобных частиц HPV вследствие стресса, вызванного замораживанием-оттаиванием. Полученные данные согласуются с выводом о том, что указанный состав не выдержал стресса, вызванного замораживанием-оттаиванием, из-за отсутствия наполнителей, отличных от соли. В лиофилизированных экспериментальных составах против HPV, хранившихся при разных температурах в течение 1 месяца, размер частиц был сравним с контрольными составами, которые не подвергали замораживанию-оттаиванию и лиофилизации, за исключением состава против HPV, включающего буфер 14, который хранили при 2-8°С в течение 1 месяца. Частицы большого размера, обнаруженные в указанном составе, указывают на то, что данный состав не выдержал стресса, вызванного лиофилизацией. Из всех исследованных составов против HPV составы, включающие буфер С и буфер D, содержащие комбинацию наполнителей (маннит и сахароза), в меньшей степени испытали стресс в условиях замораживания-оттаивания с точки зрения распределения вирусоподобных частиц по размерам по сравнению с составами (буфер В), которые не включали комбинацию наполнителей из маннита и сахарозы.
Полученные результаты показывают, что присутствие указанной комбинации наполнителей (маннит и сахароза) при наличии или отсутствии хлорида натрия позволяет сохранить целостность вирусоподобных частиц HPV, связанных с МАА, в условиях замораживания-оттаивания и лиофилизации.
Пример 9
Характеристики лиофилизированных 4-валентных составов против HPV и составов, содержащих 1х МАА
Внешние физические характеристики сухой лепешки
Внешние физические характеристики всех лиофилизированных лепешек фотографировали после лиофилизации (Т=0) и в разные периоды времени на протяжении всего исследования стабильности при разных температурах. Внешний вид лепешек осматривали два специалиста, которые на основании морфологии, цвета и других качественных признаков классифицировали лепешки в соответствии с описанием, приведенным в примере 1. Сухие белые твердые лепешки были получены для всех 4-валентных составов против HPV, а также для составов, содержащих 1х МАА (см. фиг.13 и 14). Внешние физические характеристики всех лиофилизированных составов против HPV сравнивали с внешними физическими характеристиками лиофилизированных составов, содержащих 1х МАА, во все периоды времени и при всех температурах хранения. Привлекательные лепешки были получены для составов, содержащих буфер 3 и буфер 4, и слегка поврежденные лепешки или лепешки с трещинами или усадкой были получены для составов, содержащих буфер 15 и буфер 16. Полностью разрушенные лепешки были получены после лиофилизации составов, содержащих буфер 14. Ни в одном из составов не было обнаружено изменение цвета вследствие теплового разрушения наполнителей. Результаты, полученные в данном исследовании, показывают, что внешние физические характеристики лепешки зависят от наполнителей состава и не зависят от температуры хранения или продолжительности хранения. Качество лепешек составов, содержащих комбинацию наполнителей из маннита и сахарозы, ухудшается при увеличении концентрации соли.
Время восстановления
Лиофилизированные 4-валентные вакцинные составы против HPV и составы, содержащие 1× МАА, восстанавливали стерильной водой для инъекций с учетом количества наполнителей. Воду для инъекций добавляли к каждому составу в объеме, равном 0,50 и 0,60 мл. Конечный объем после восстановления был равен примерно 0,6 мл. Время восстановления контролировали при помощи секундомера с остановом, и после лиофилизации регистрировали время полного растворения (в данном случае образования гомогенной суспензии) всех вакцинных составов против HPV, а также лиофилизированных составов, содержавших 1× МАА. Время восстановления всех лиофилизированных составов против HPV сравнивали со всеми лиофилизированными составами, содержавшими 1× МАА, во все периоды времени и при всех температурах хранения (данные не показаны). Почти все составы характеризовались быстрым временем восстановления, равным менее 60 секунд, независимо от температуры и продолжительности хранения.
Испытание встряхиванием
После восстановления всех лиофилизированных 4-валентных вакцинных составов против HPV и составов, содержащих 1× МАА, было выполнено испытание встряхиванием для проверки качества вакцинных составов без адъюванта и составов, включающих адъювант. Время осаждения частиц квасцов на дно пробирки измеряли для всех экспериментальных составов, которые подвергали замораживанию-оттаиванию или лиофилизации. Полученные результаты показывают, что все 4-валентные составы против HPV, содержавшие соль (буфер 14, буфер 15 и буфер 16), характеризовались более быстрым временем осаждения по сравнению с составами без соли, из чего следует, что частицы квасцов были агломерированы (см. фиг.15). Для 4-валентных составов против HPV, содержавших маннит и сахарозу при отсутствии соли (буфер 3 и буфер 4), время осаждения превышало 15 минут, из чего следует, что частицы квасцов не были агломерированы. Таким образом, присутствие наполнителей в 4-валентных вакцинных составах против HPV предотвращает агломерацию частиц квасцов даже после стресса, вызванного замораживанием-оттаиванием и лиофилизацией. Время и температура хранения не оказывали существенного влияния на результаты испытания встряхиванием.
Результаты испытания встряхиванием для составов, содержавших 1х МАА, показывают, что стресс, вызванный замораживанием-оттаиванием, не влиял на время осаждения в любой данный период времени или при любой температуре, так как все экспериментальные составы, содержавшие наполнители и соль, характеризовались временем осаждения более 15 минут, в то время как состав, содержавший только соль (буфер 14), характеризовался несколько меньшим временем осаждением, хотя время осаждения данного состава существенно не отличалось от остальных составов (данные не показаны). Для лиофилизированных составов, содержавших 1× МАА, которые включали маннит и сахарозу при отсутствии соли (буфер 3 и буфер 4), время осаждения превышало 15 минут, из чего следует, что частицы квасцов не были агломерированы. Таким образом, присутствие наполнителей в составах, содержавших 1× МАА, предотвращало агломерацию частиц квасцов после стресса, вызванного лиофилизацией. Время и температура хранения не оказывали существенного влияния на результаты испытания встряхиванием.