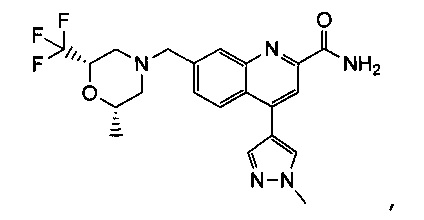
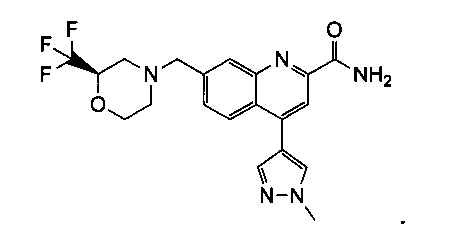
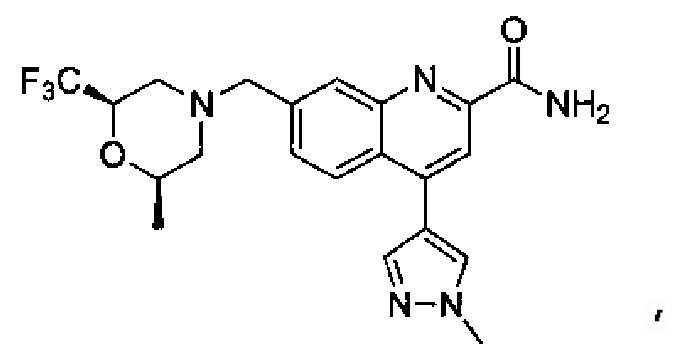
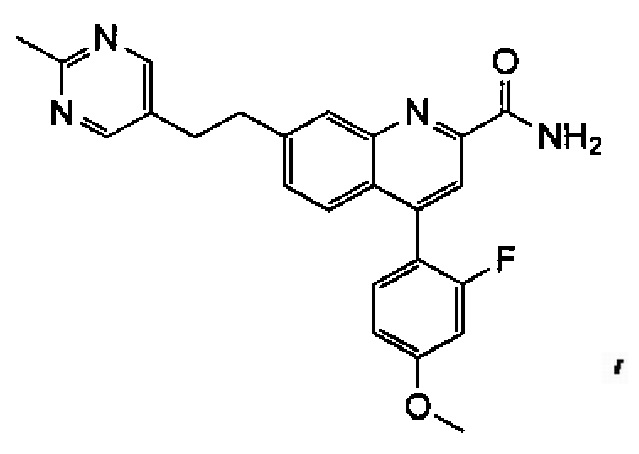
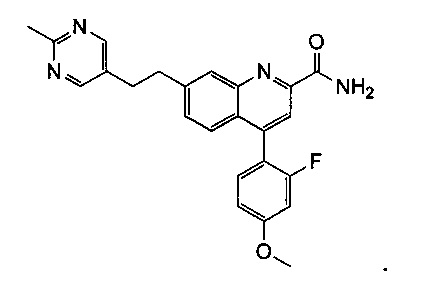
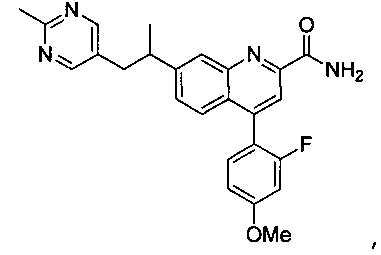
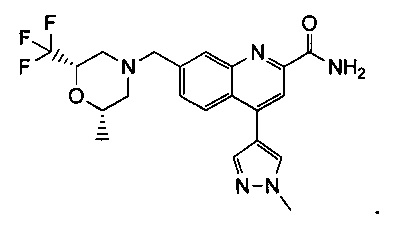
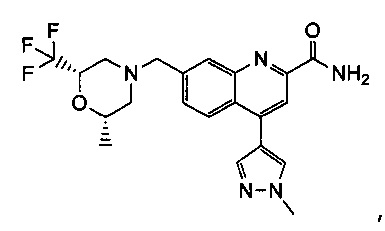
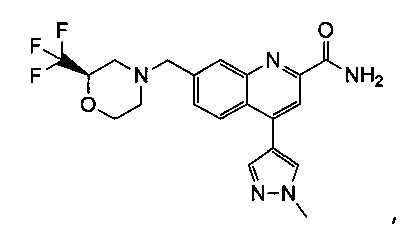
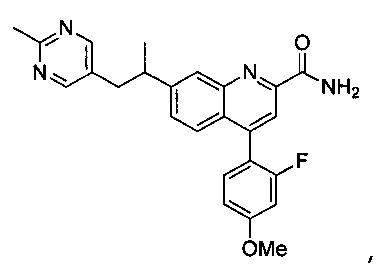
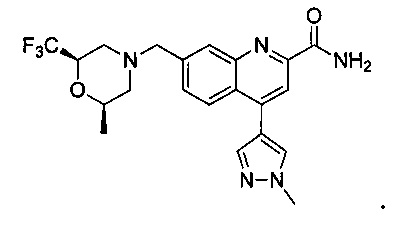
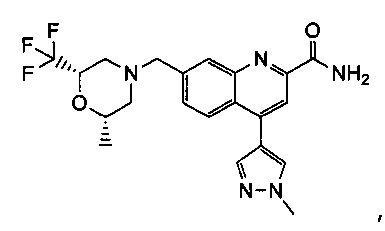
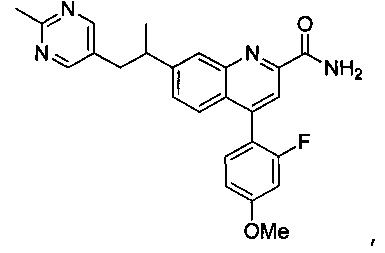
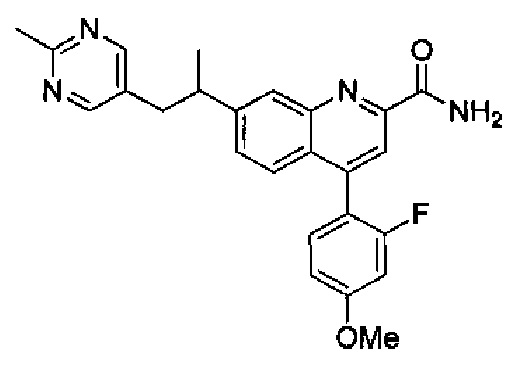
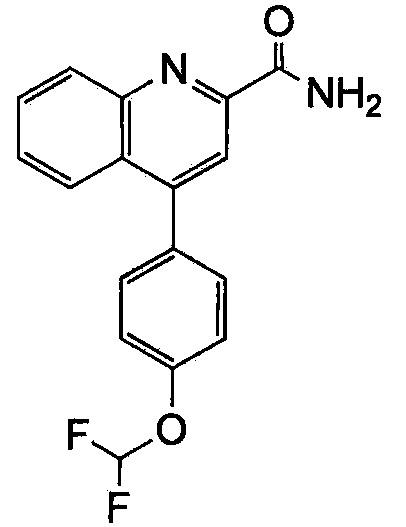
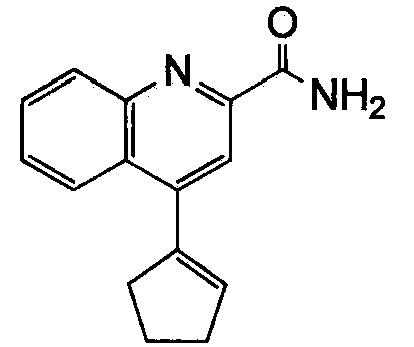
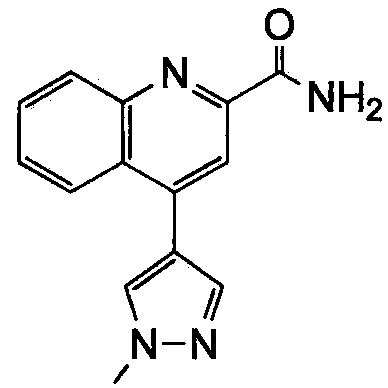
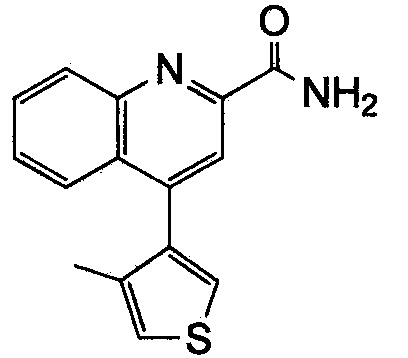
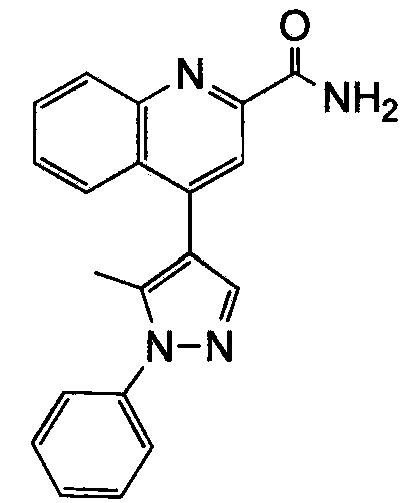
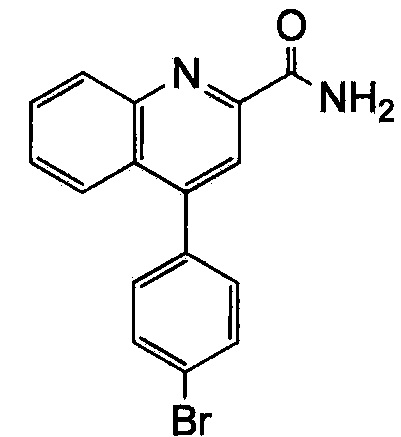
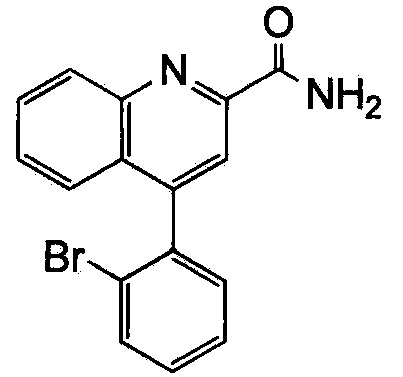
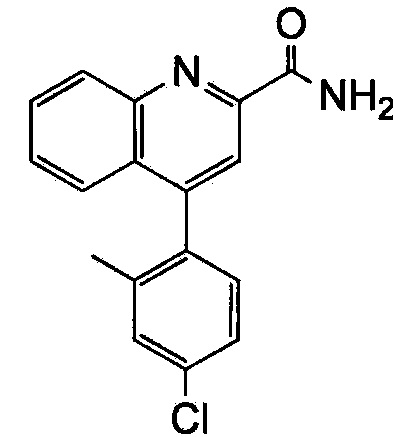
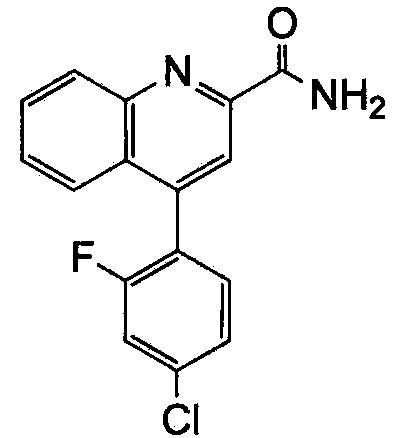
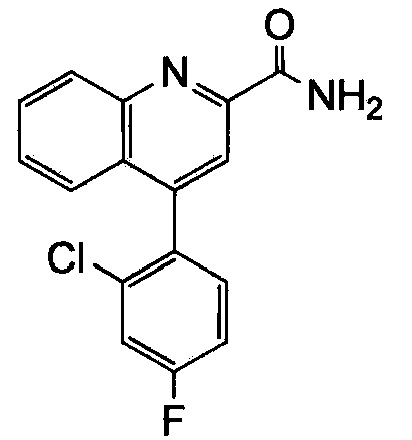
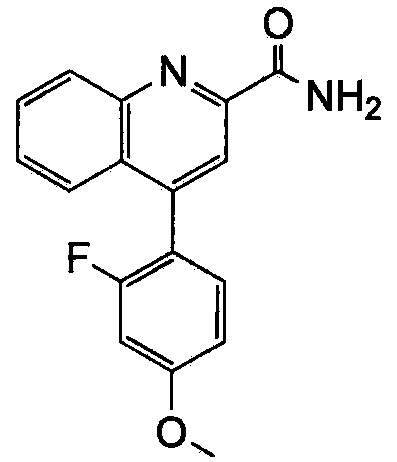
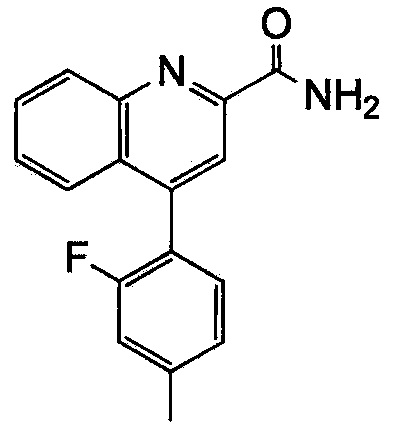
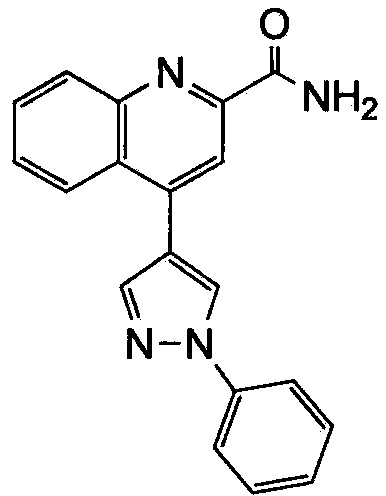
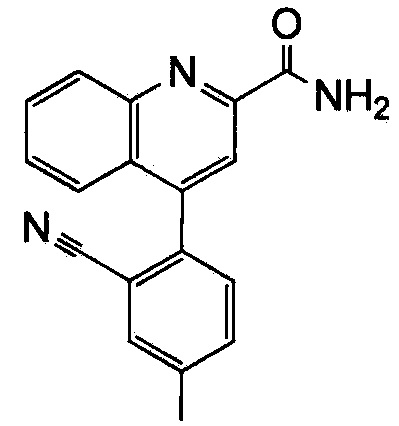
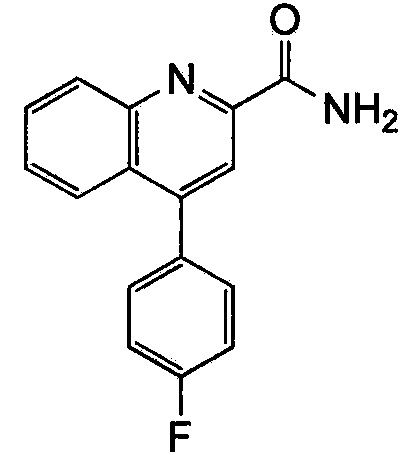
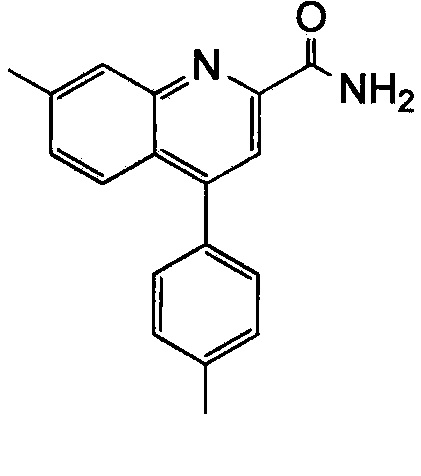
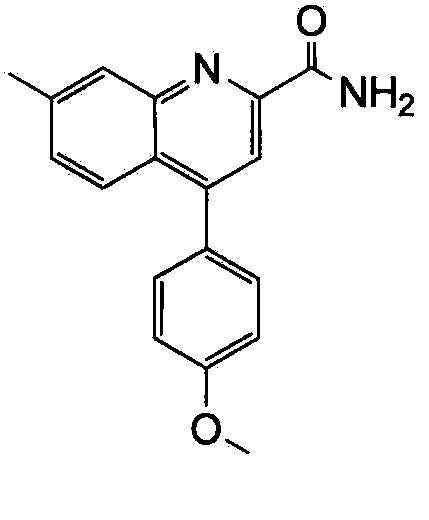
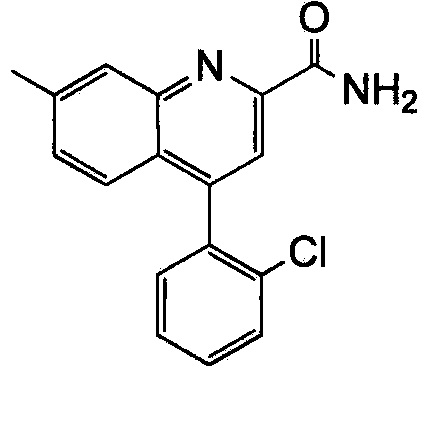
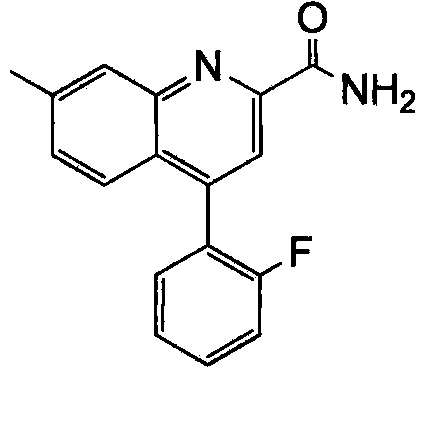
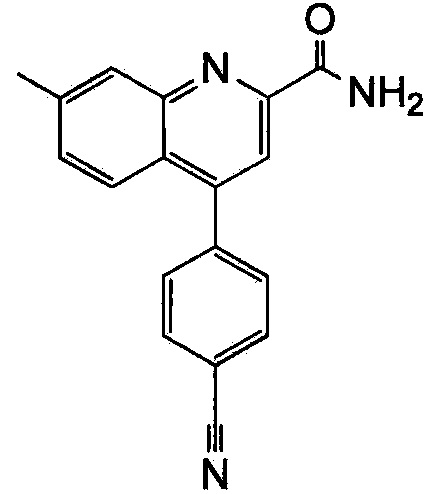
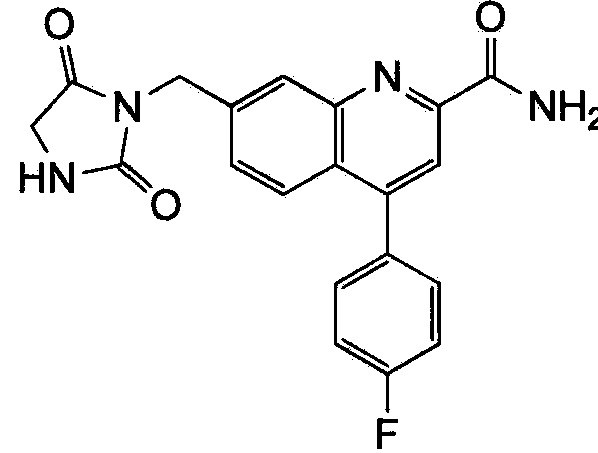
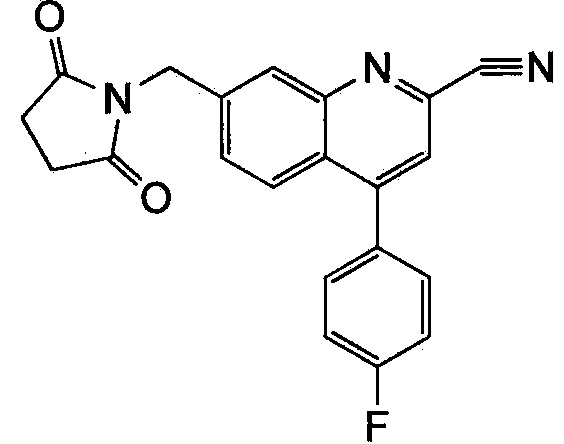
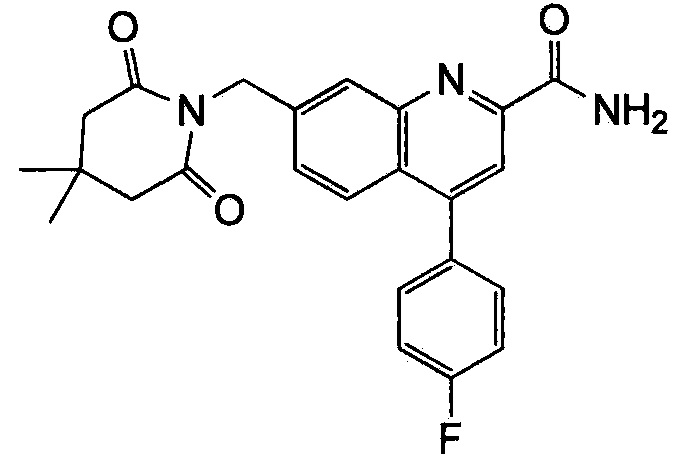
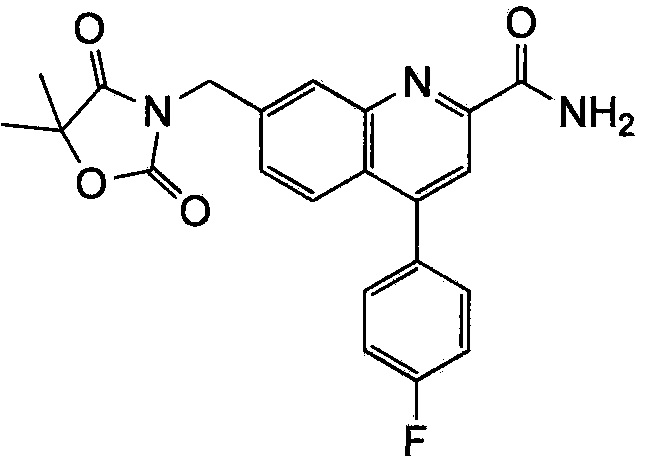
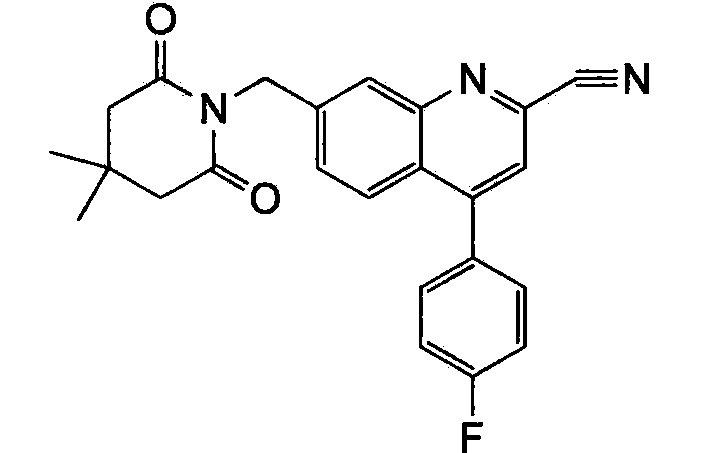
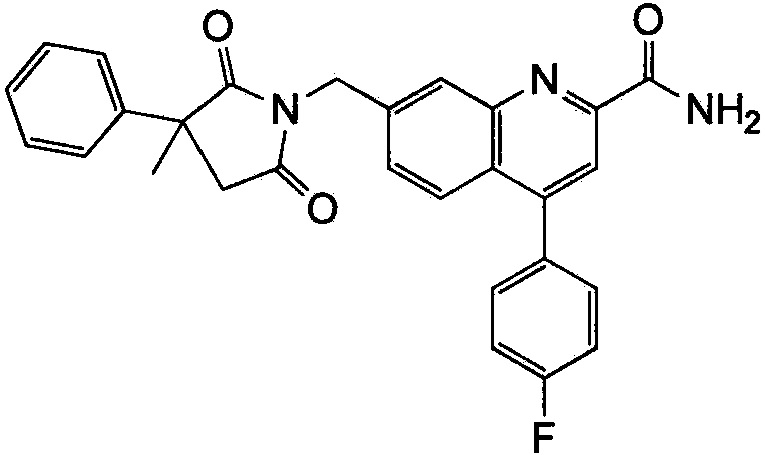
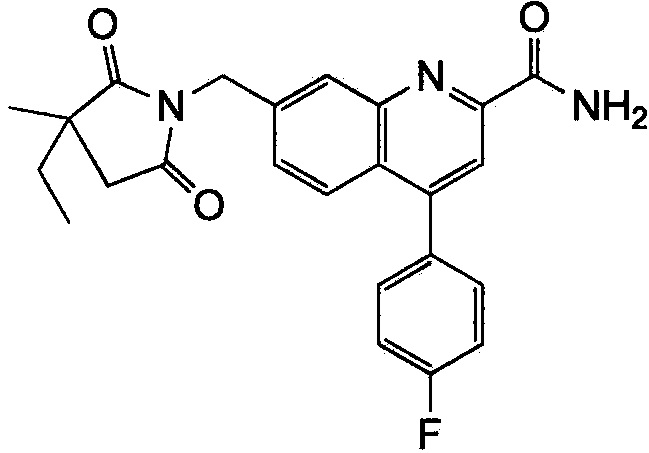
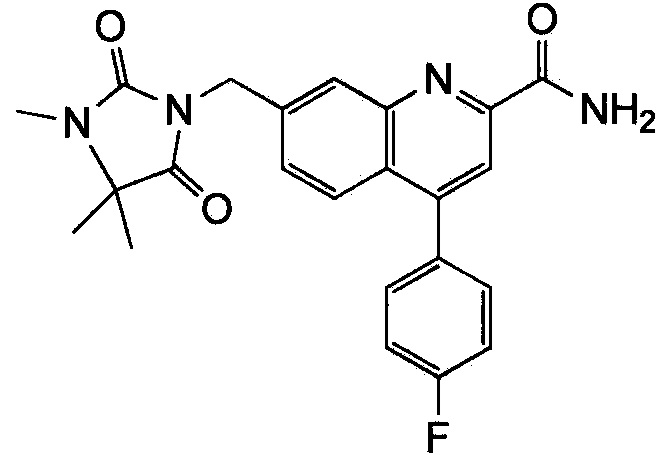
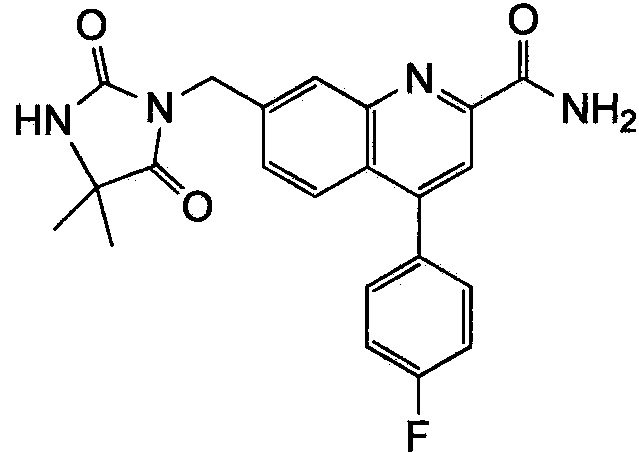
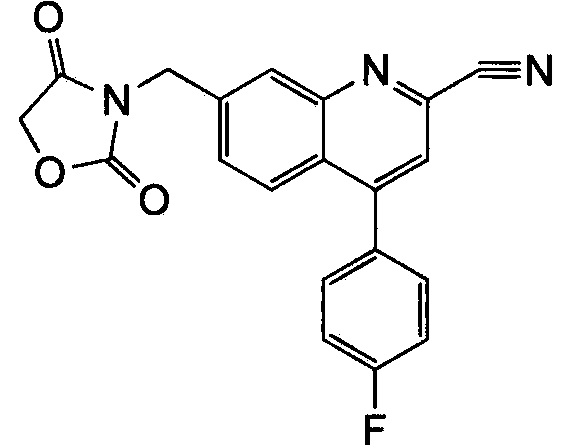
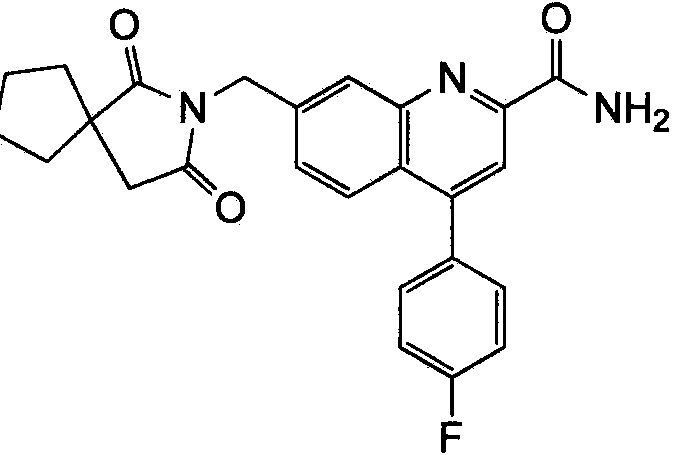
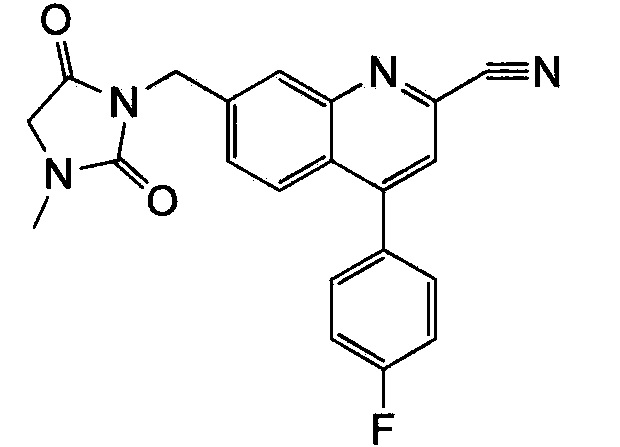
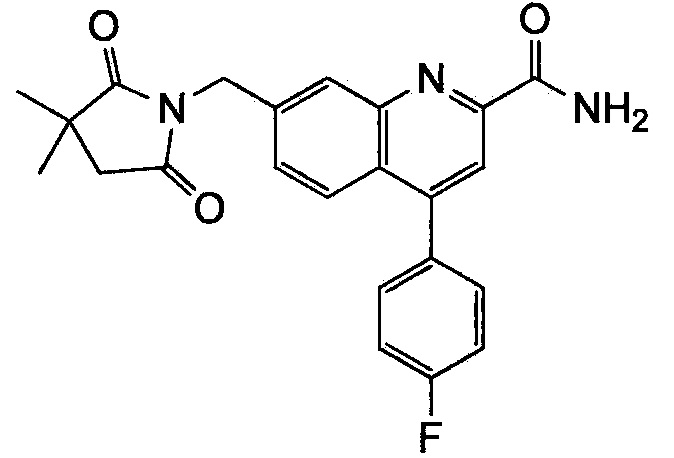
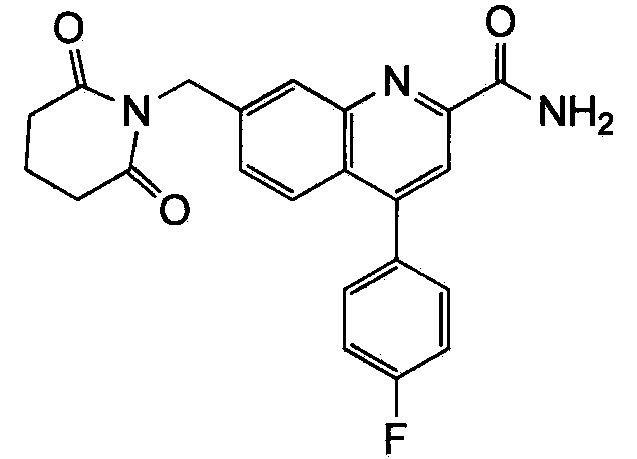
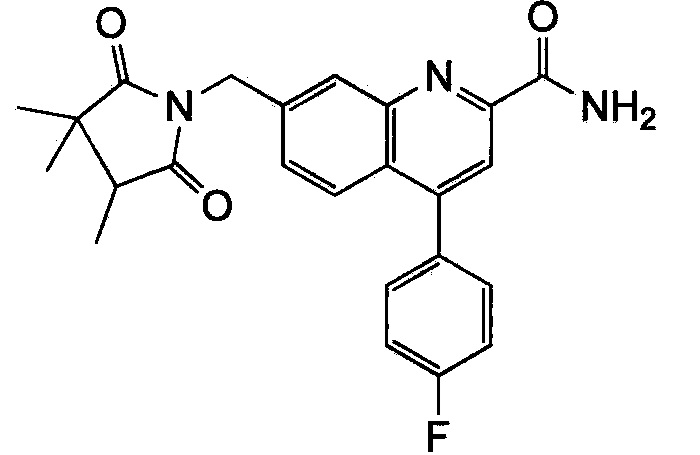
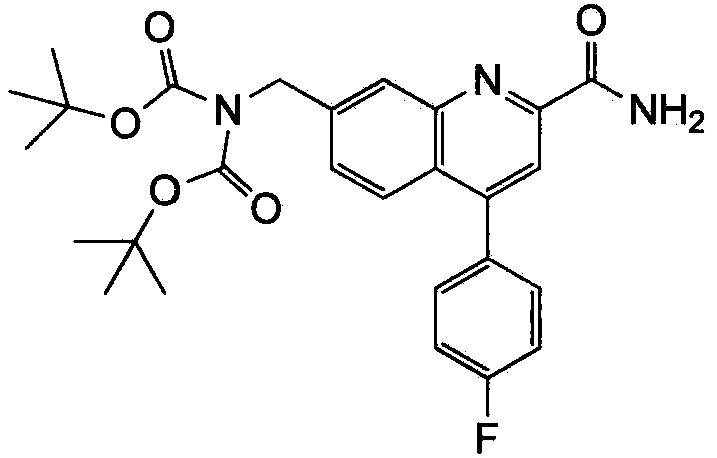
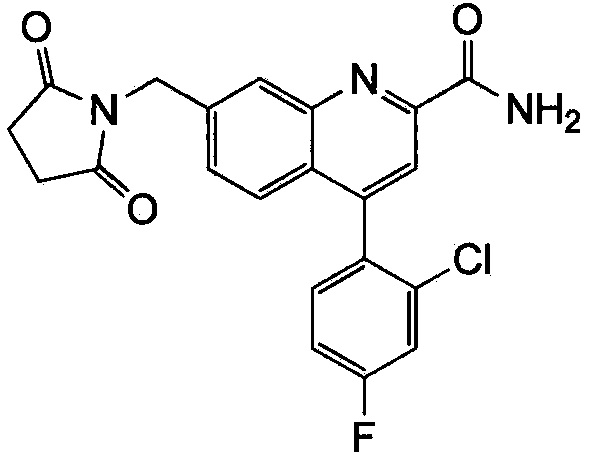
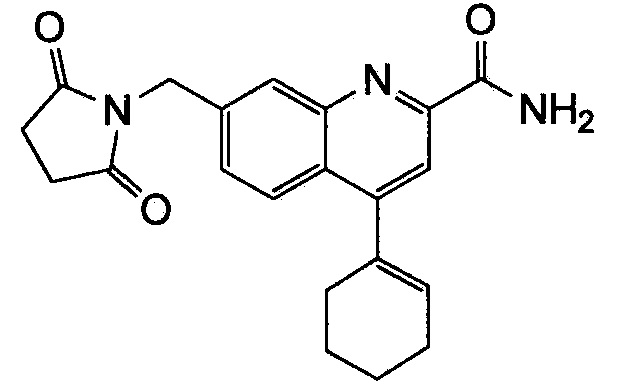
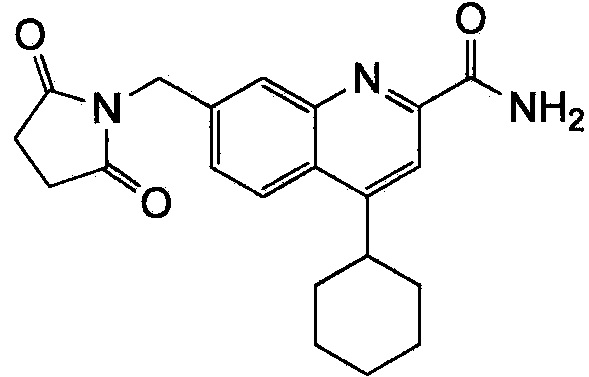
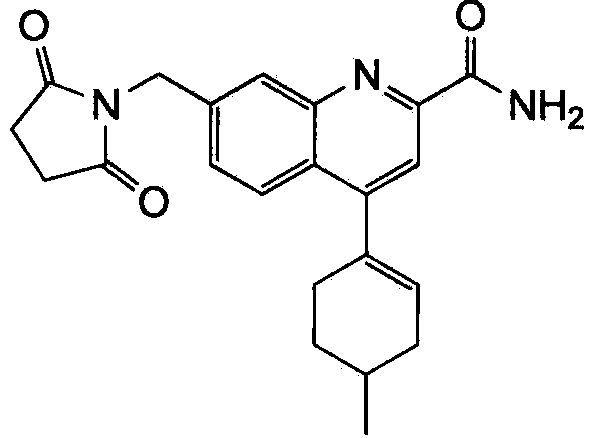
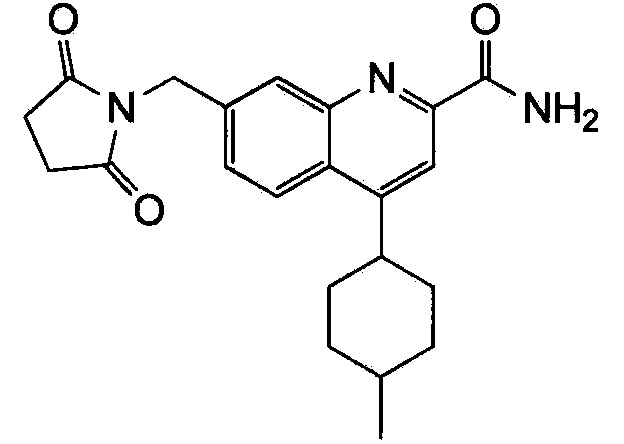
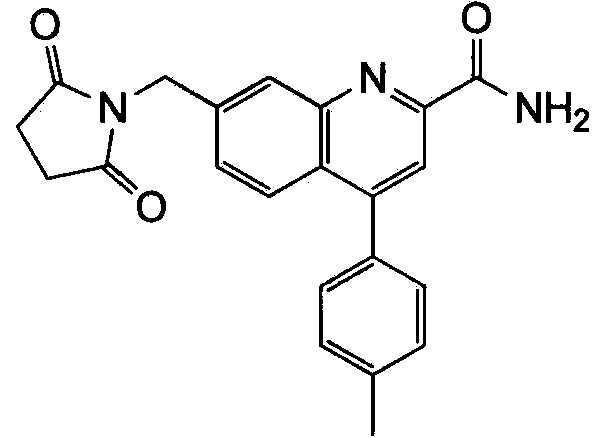
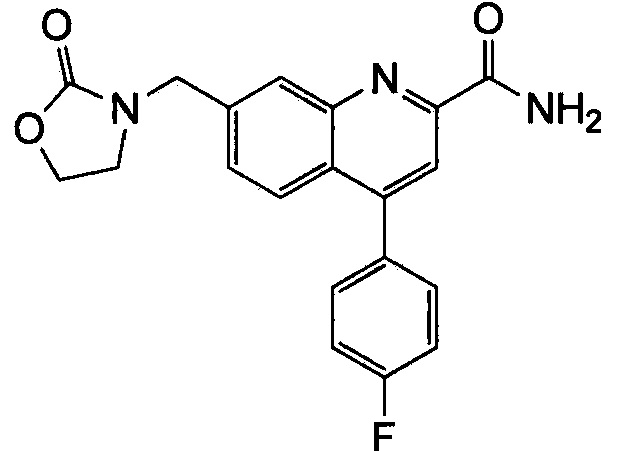
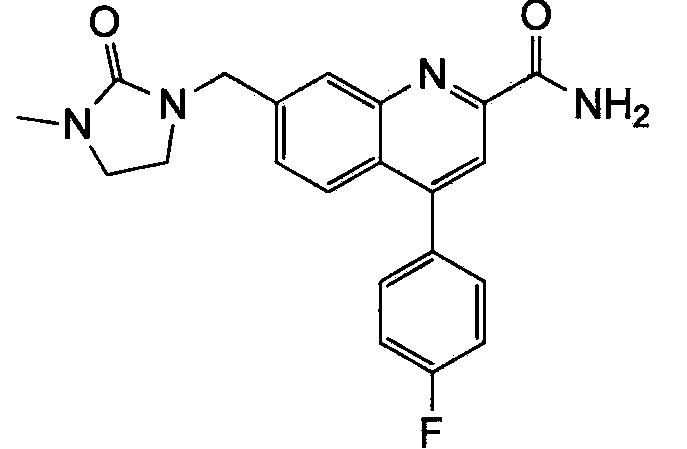
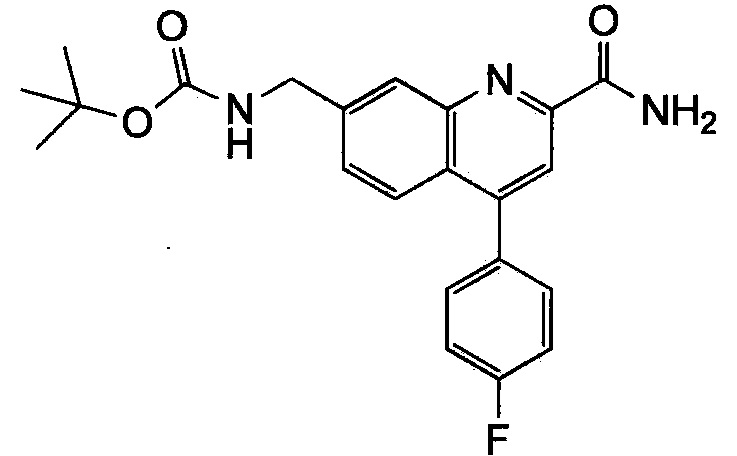
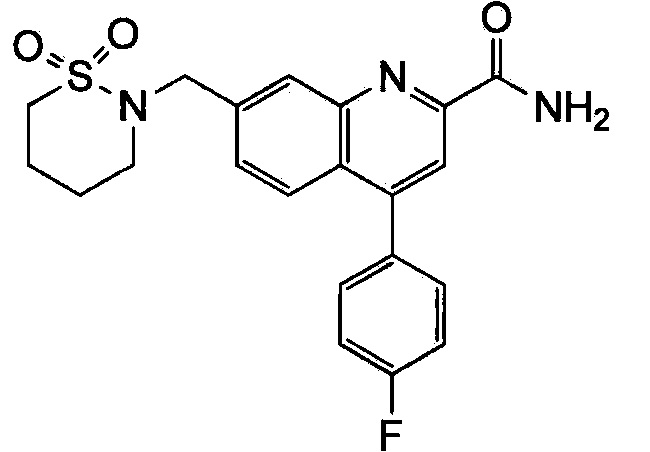
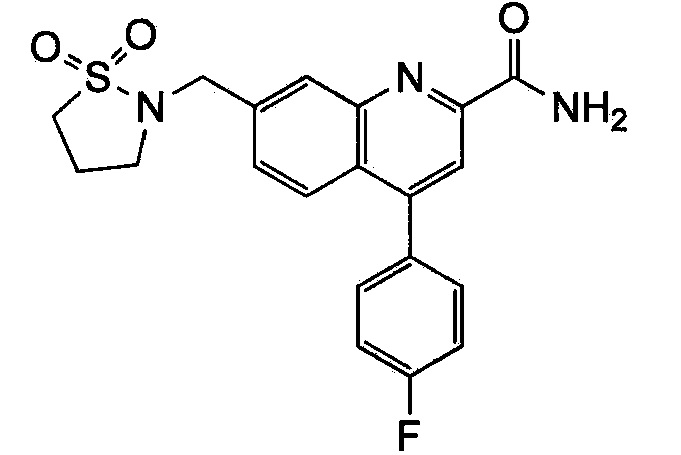
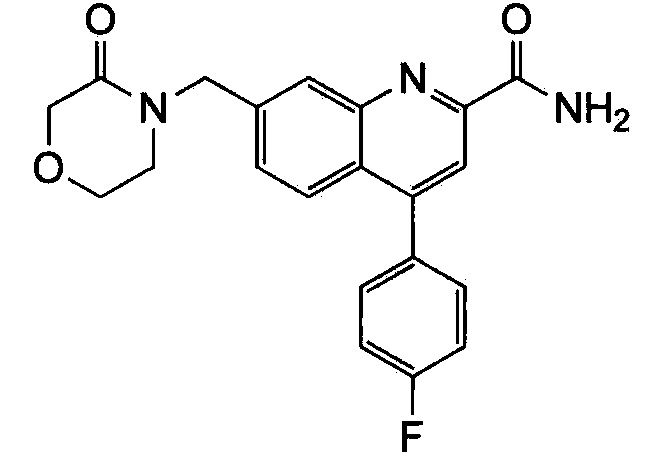
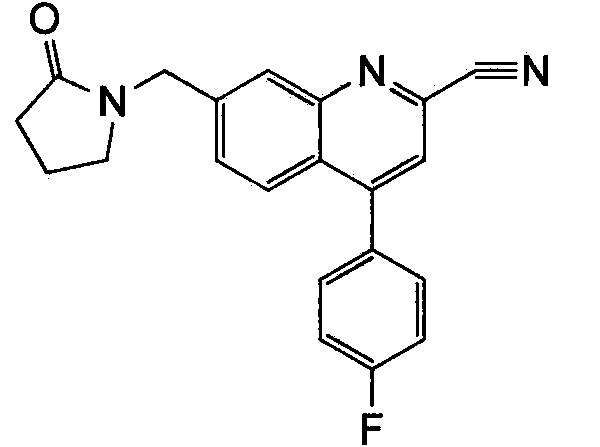
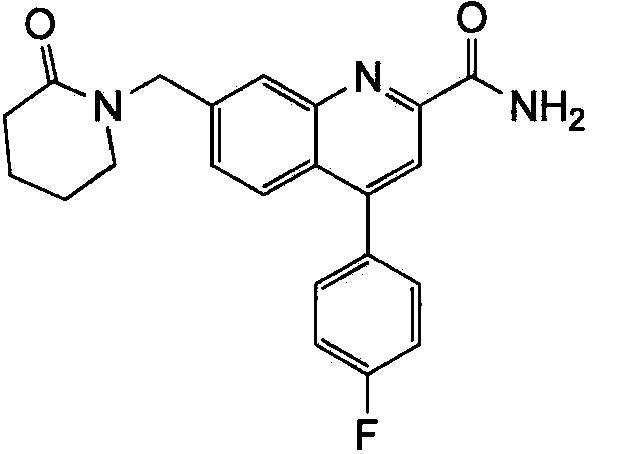
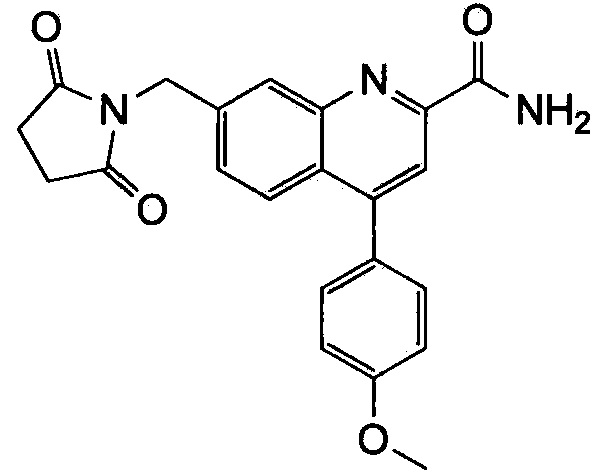
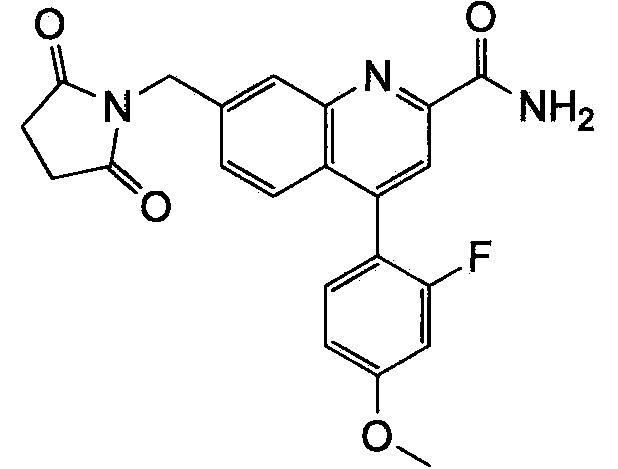
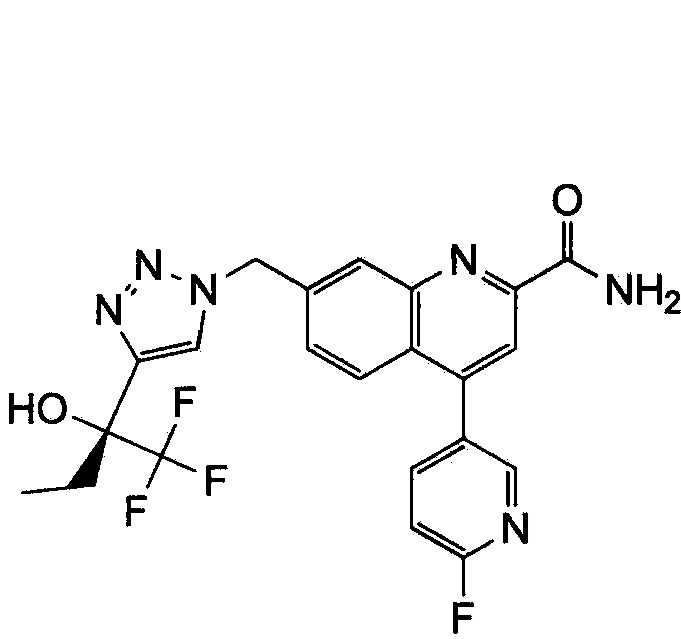
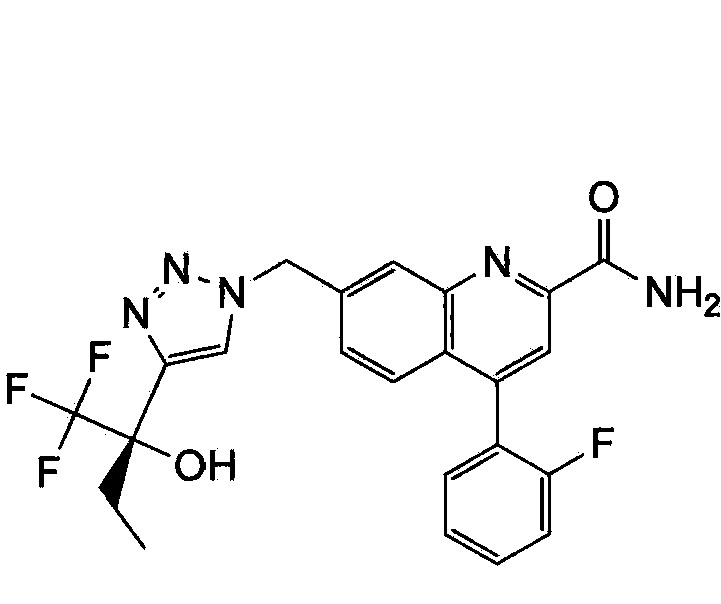
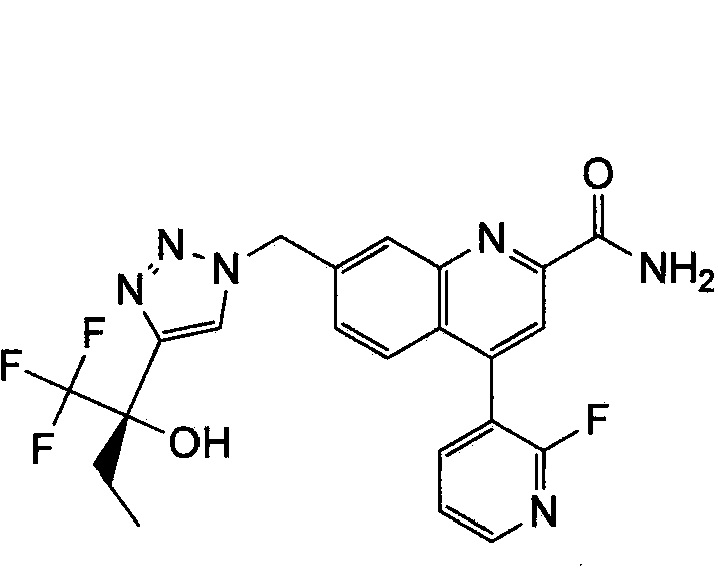
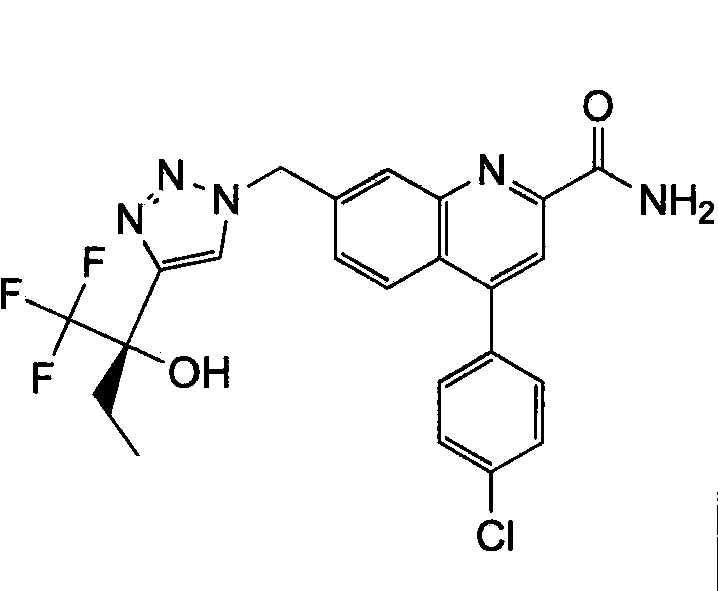
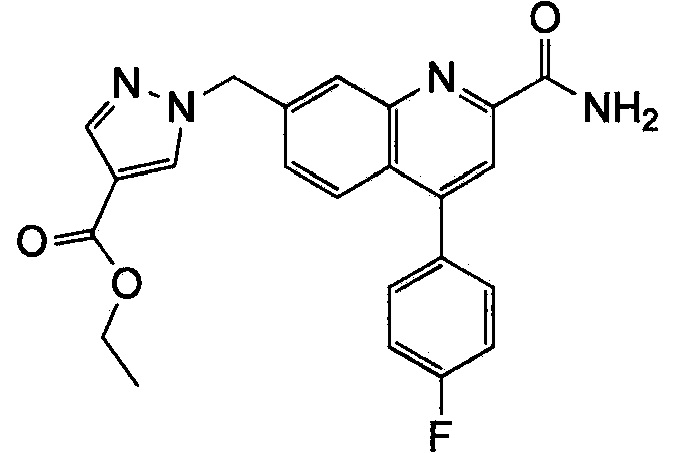
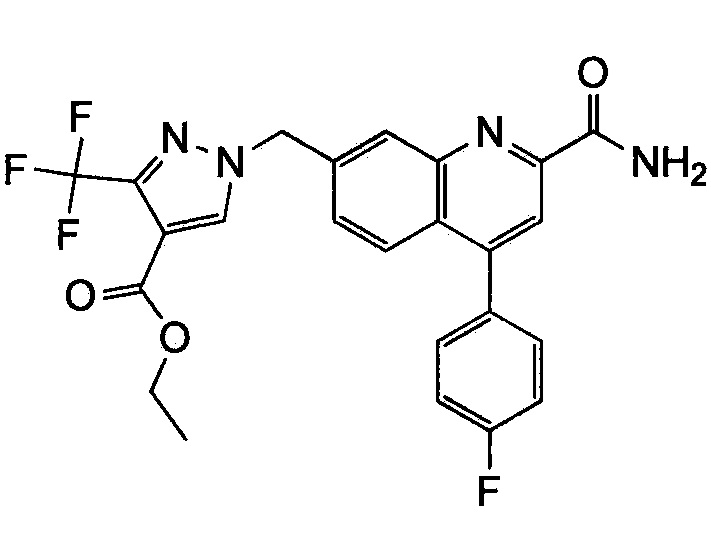
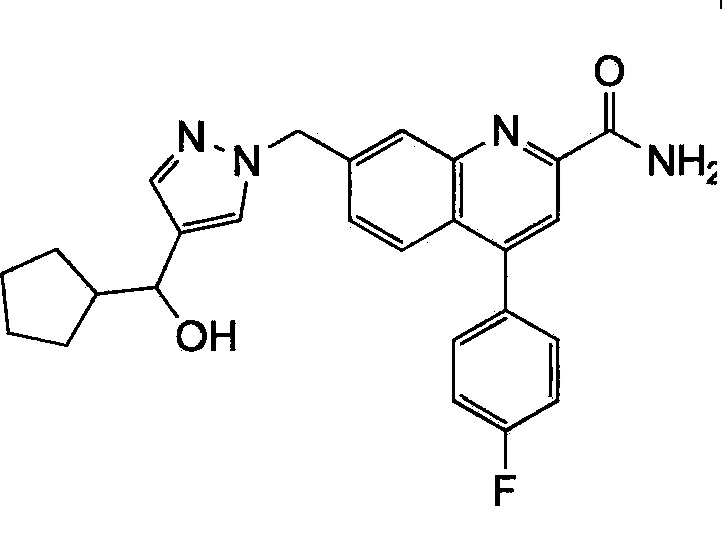
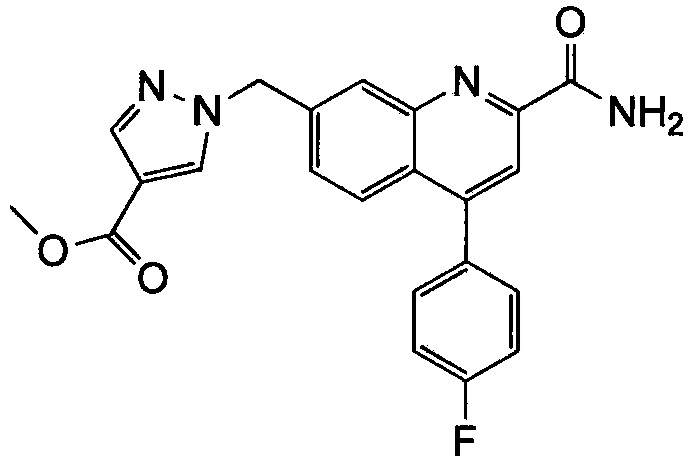
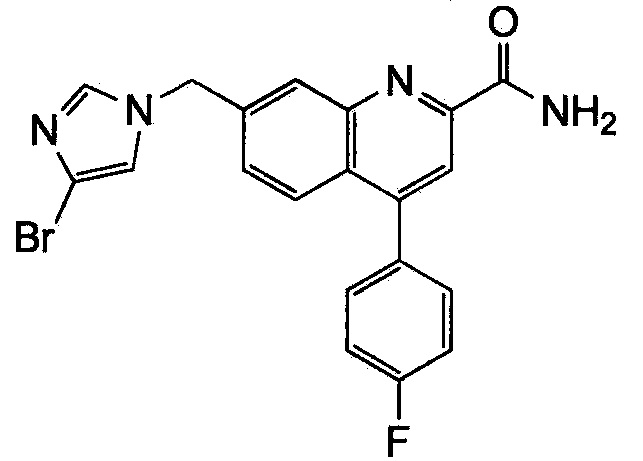
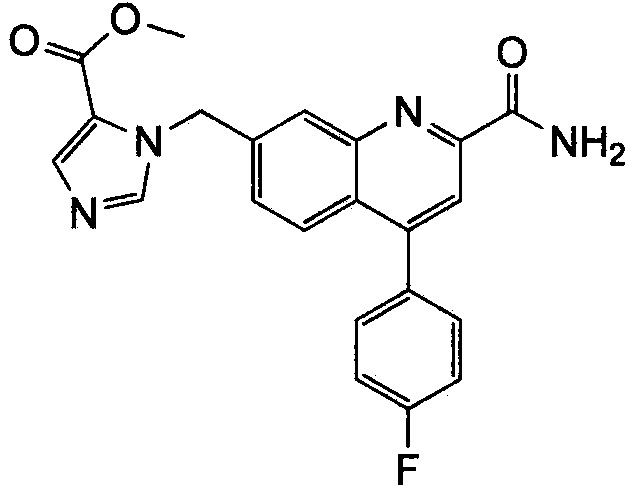
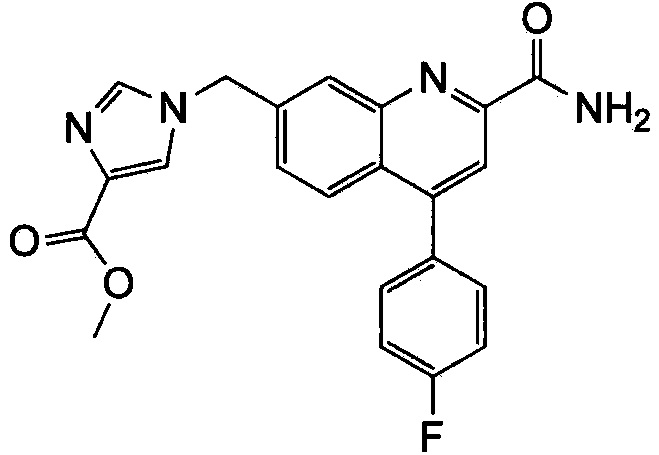
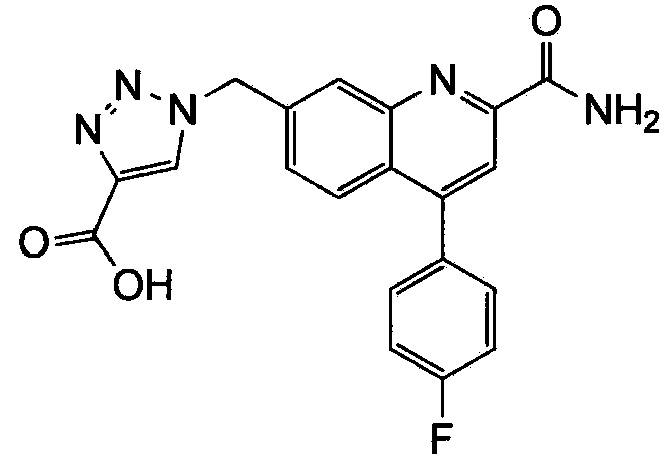
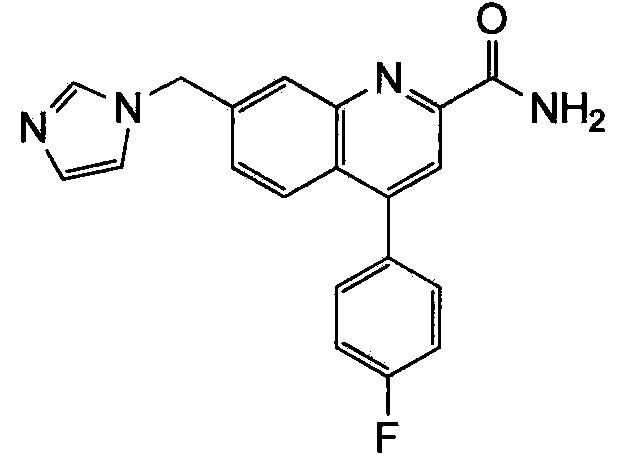
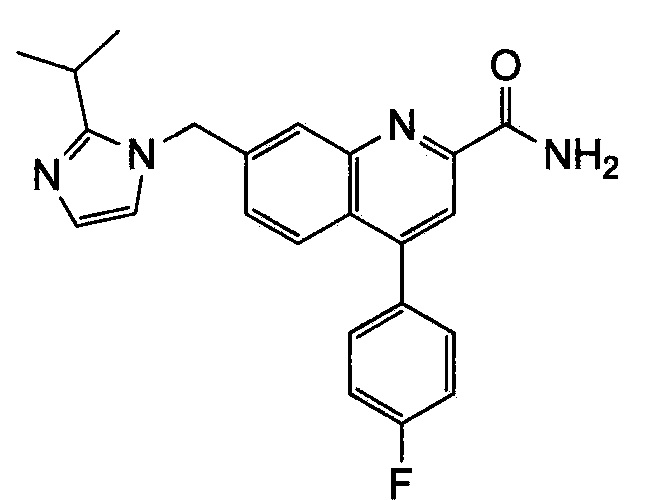
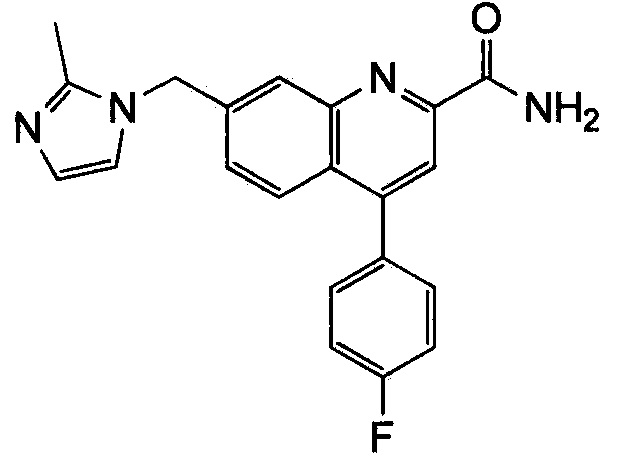
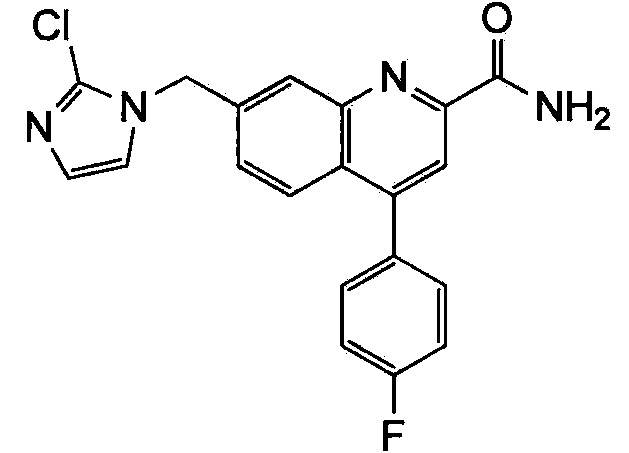
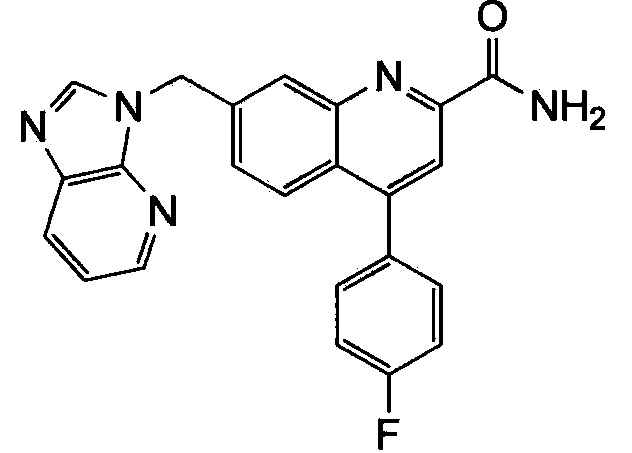
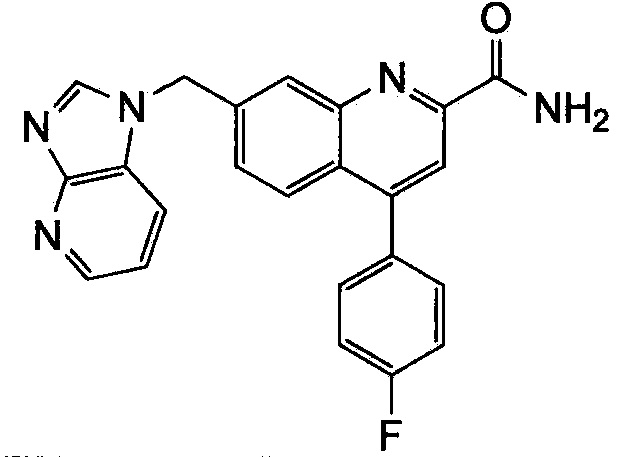
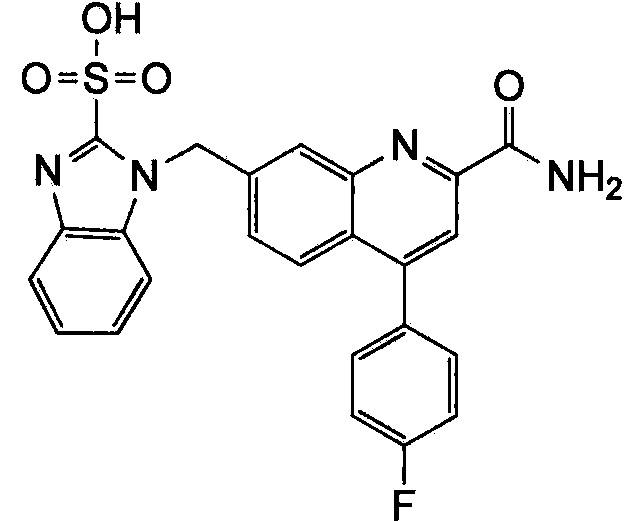
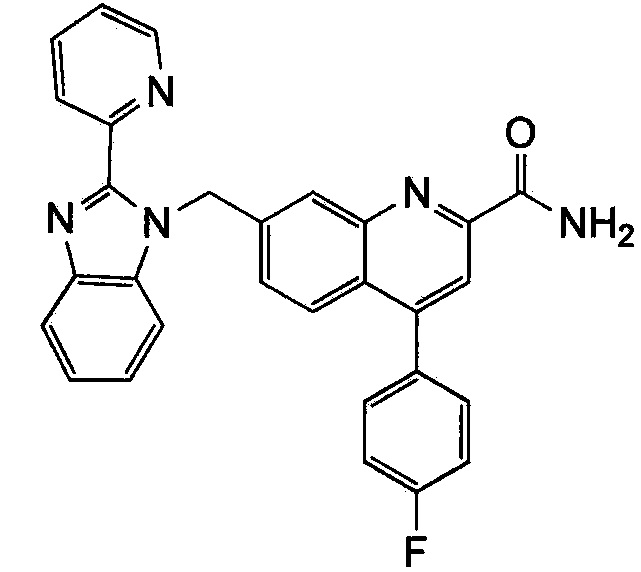
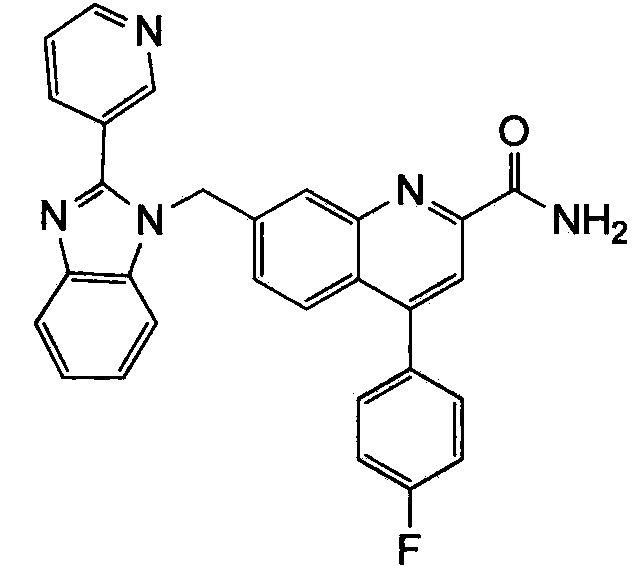
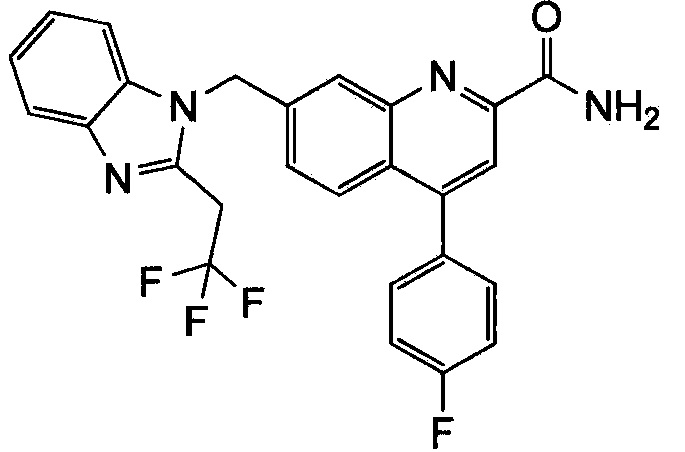
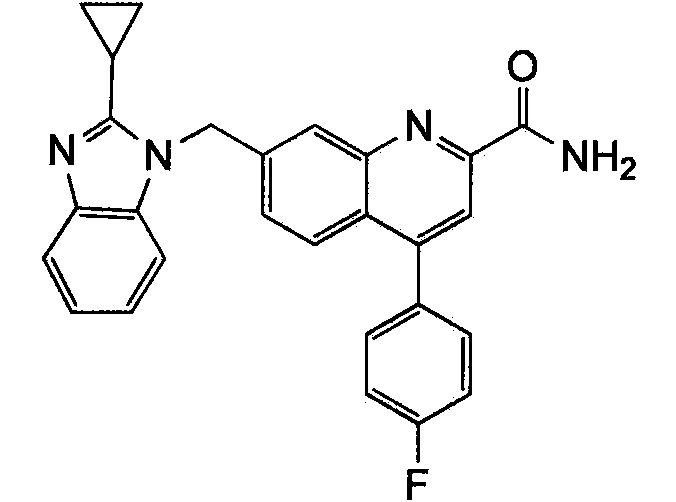
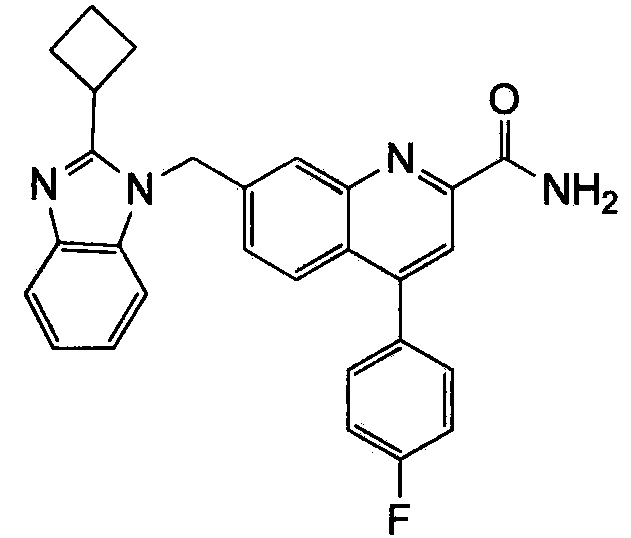
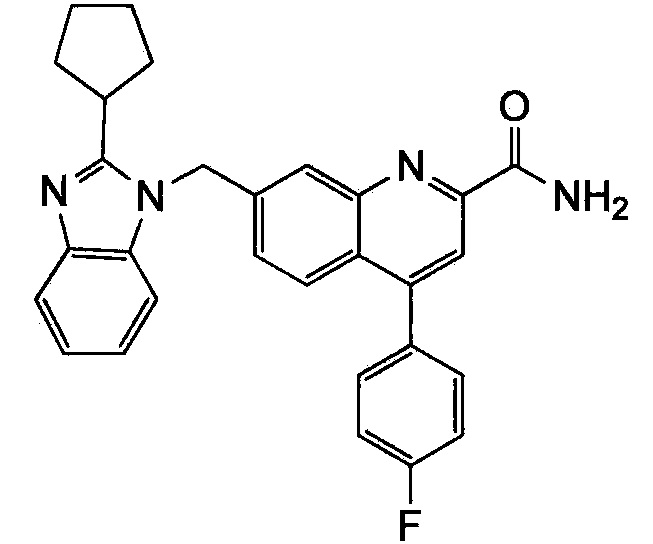
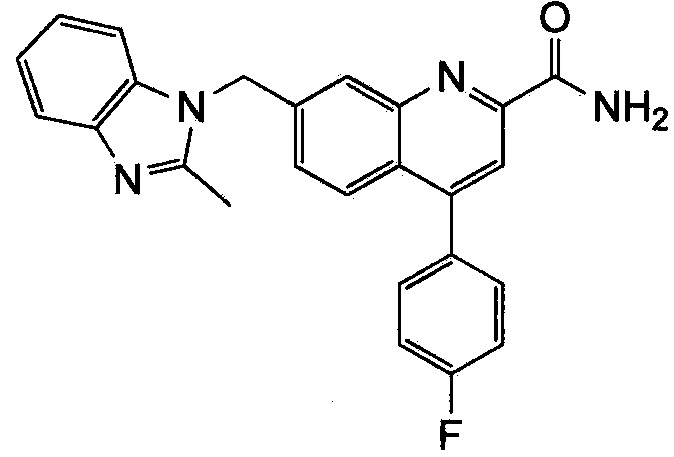
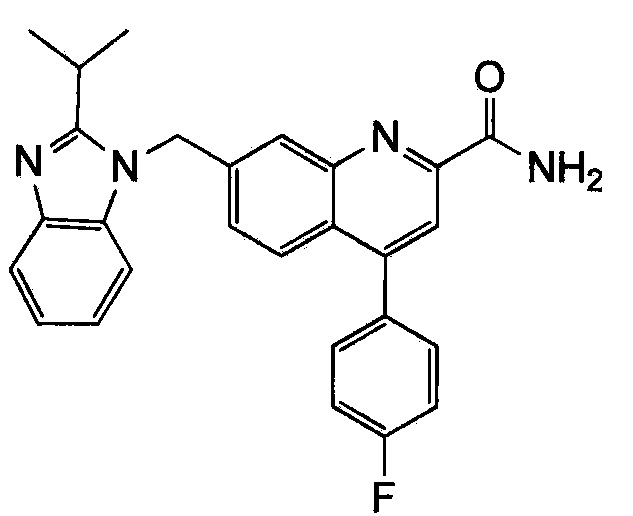
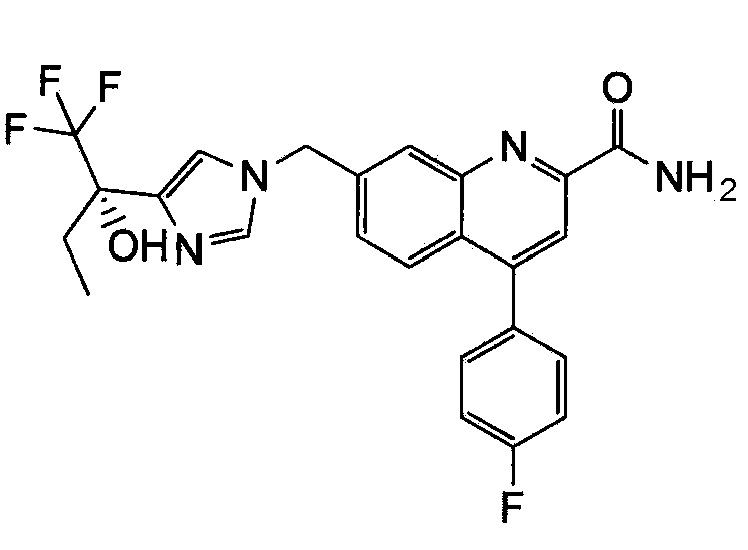
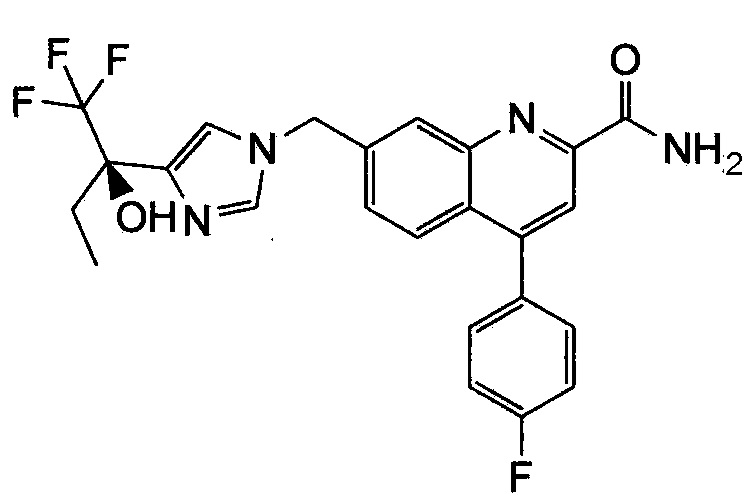
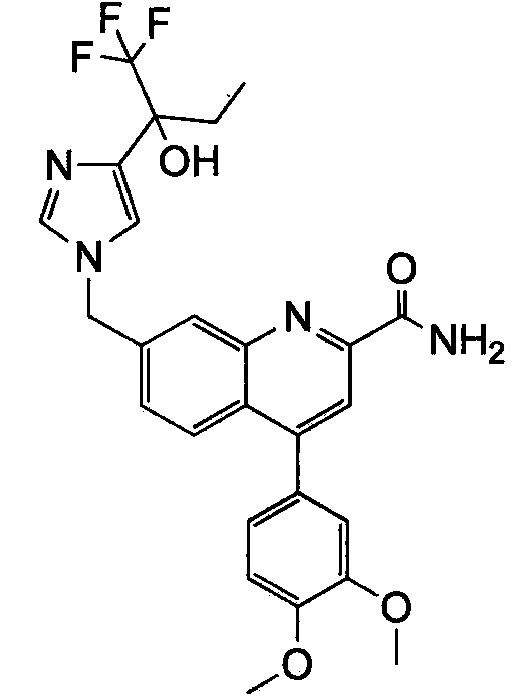
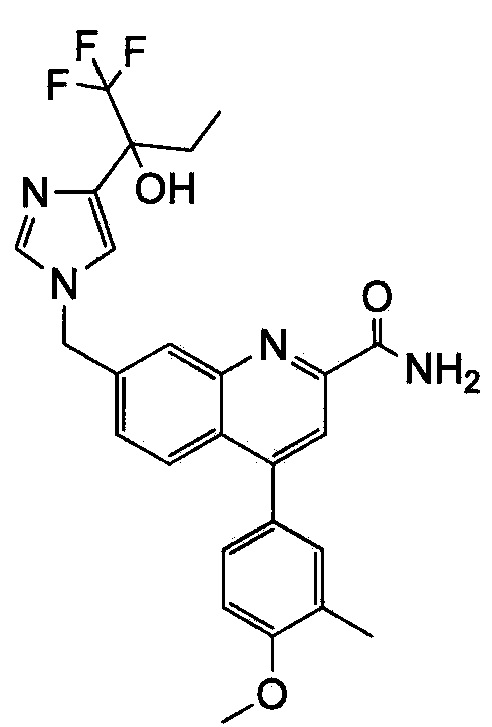
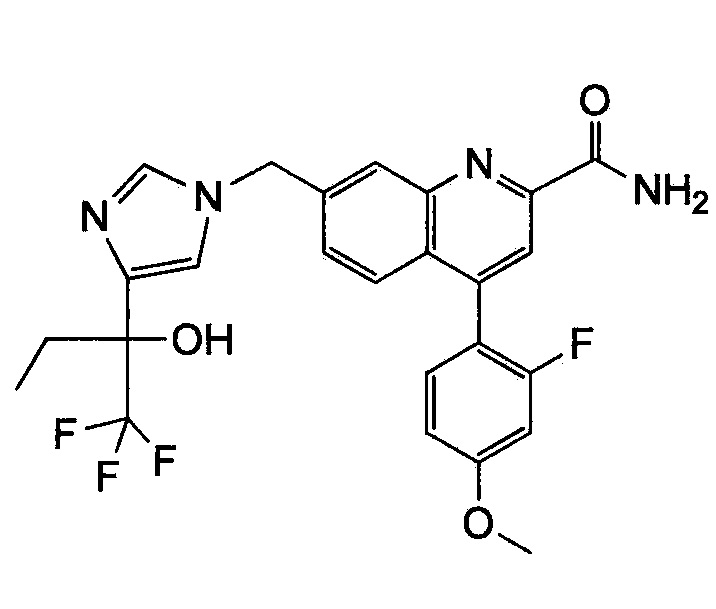
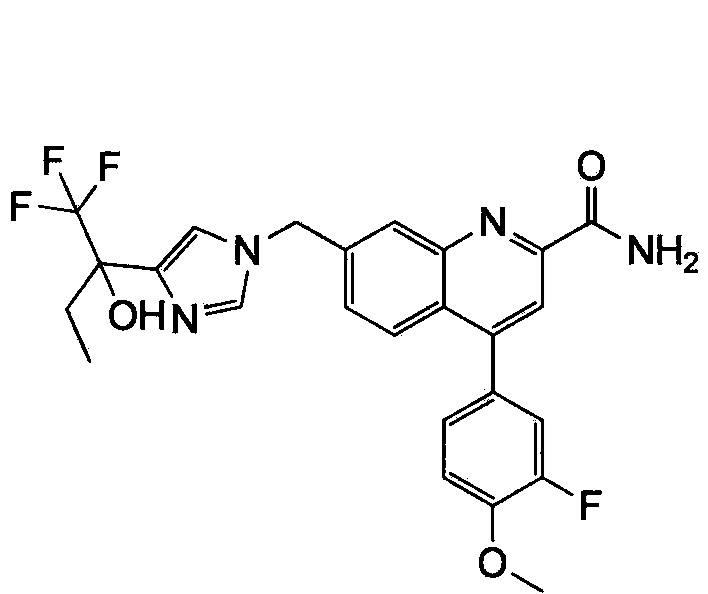
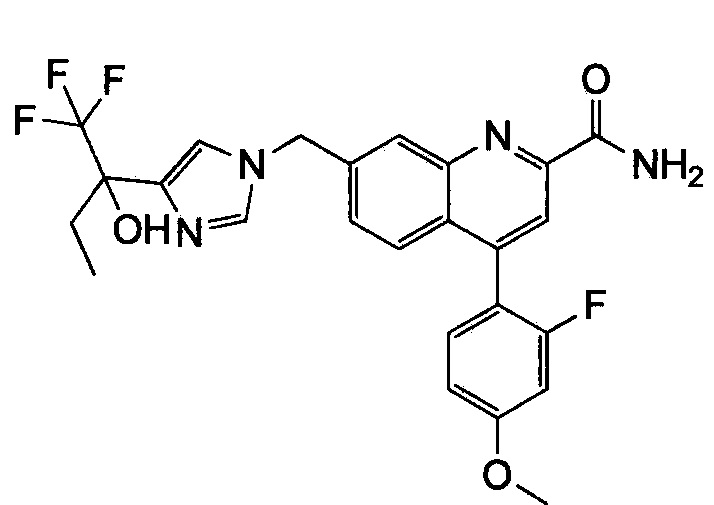
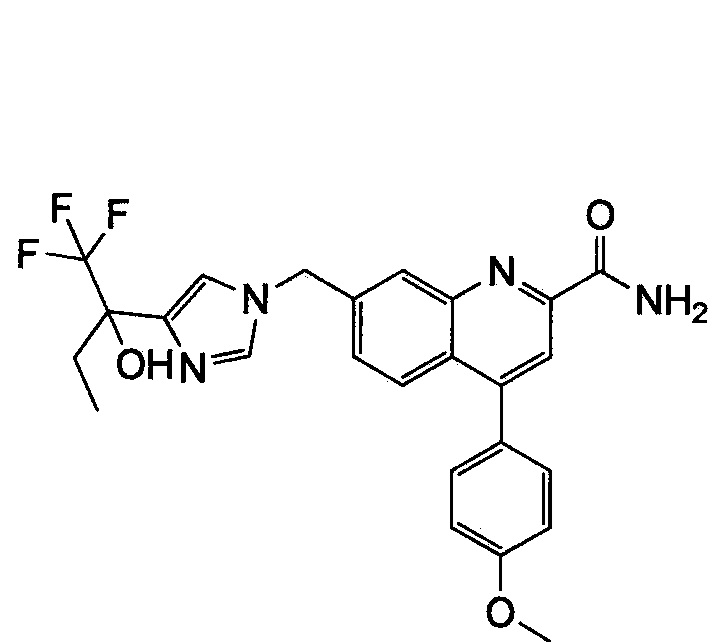
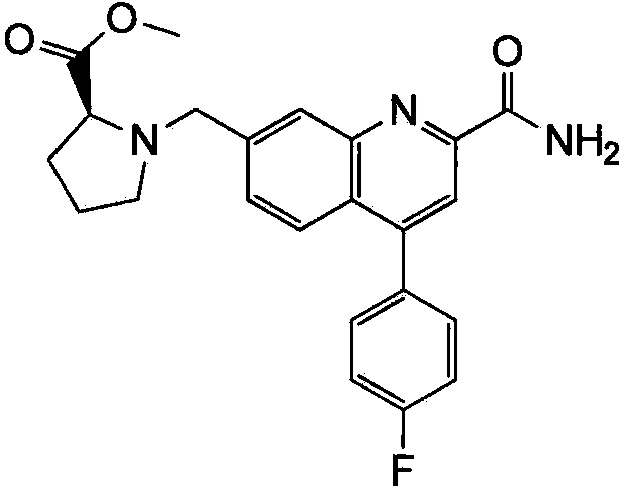
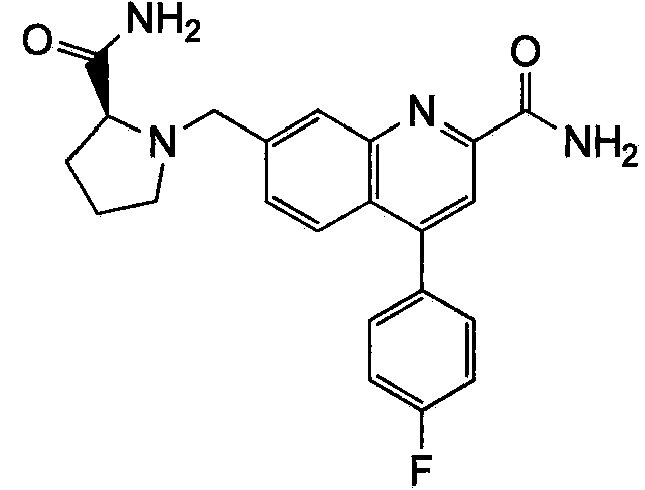
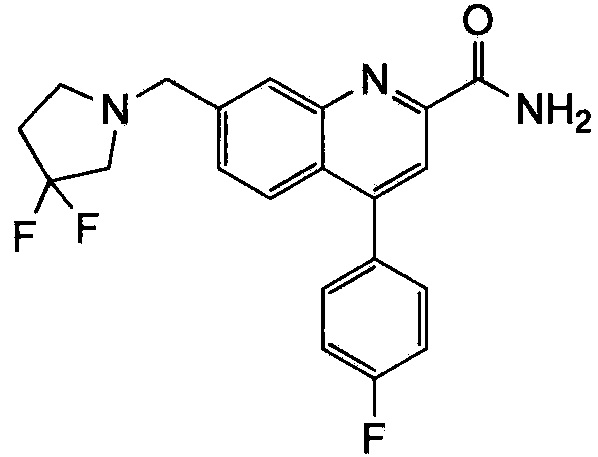
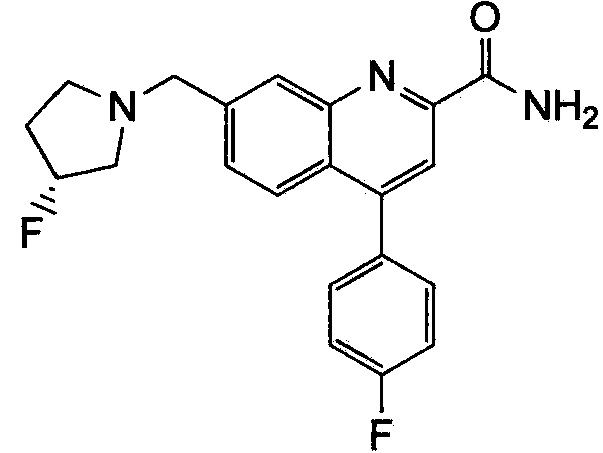
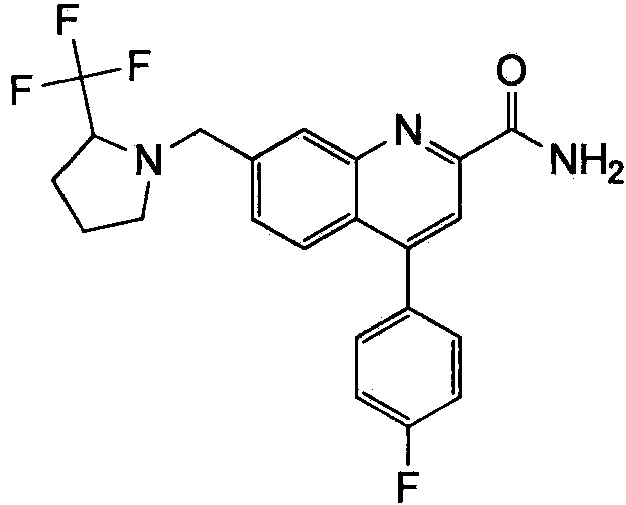
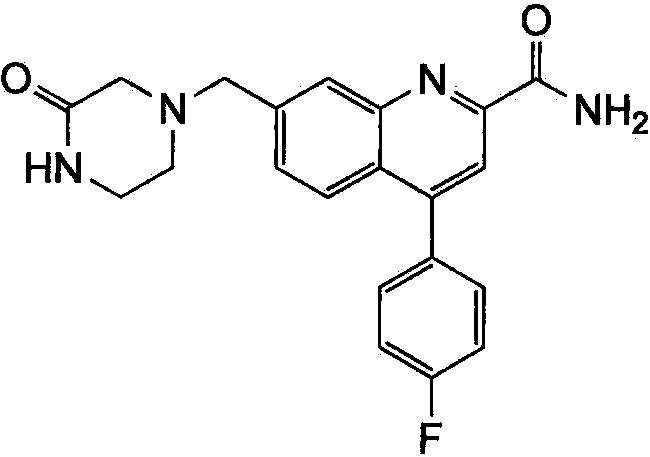
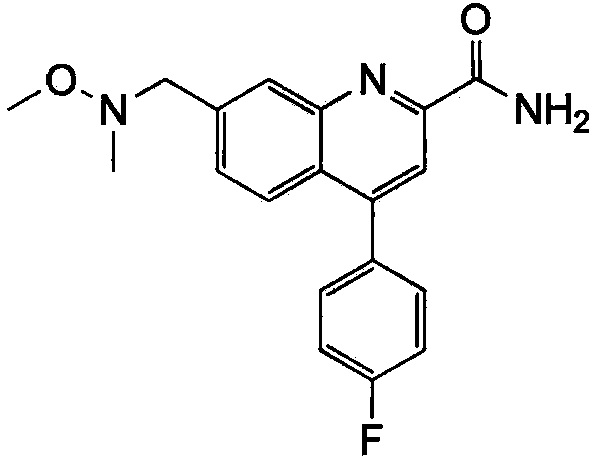
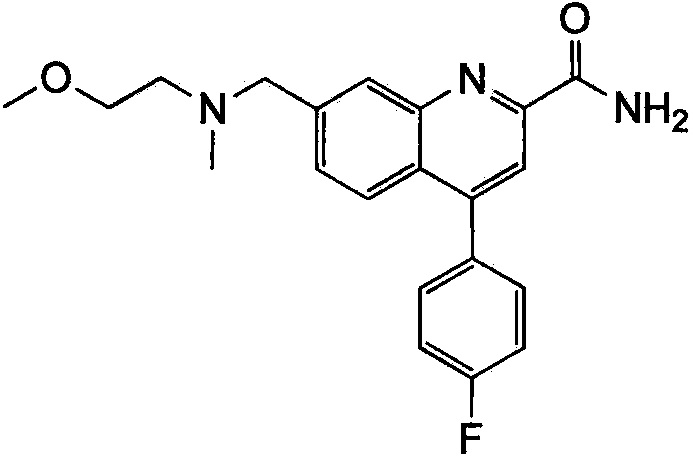
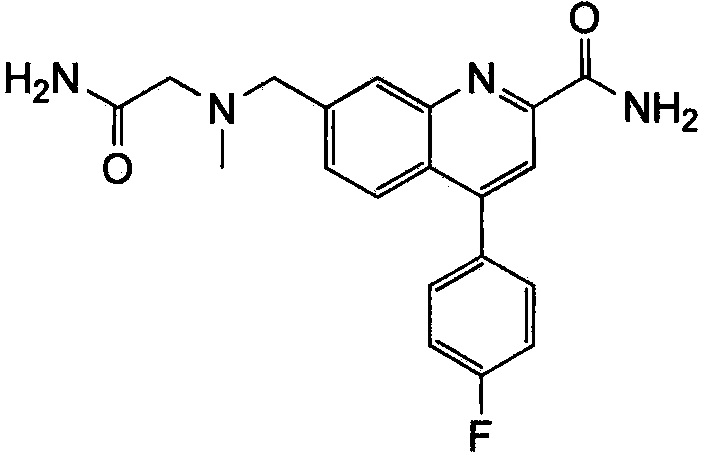
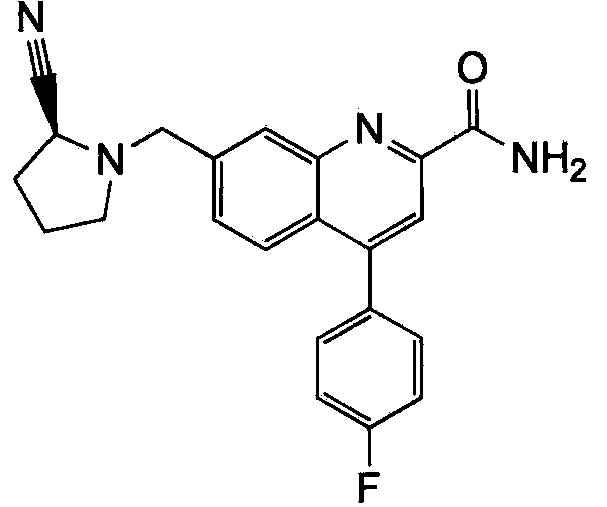
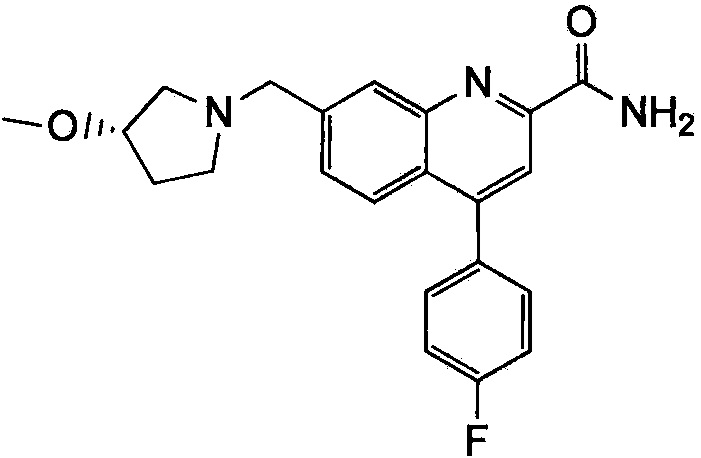
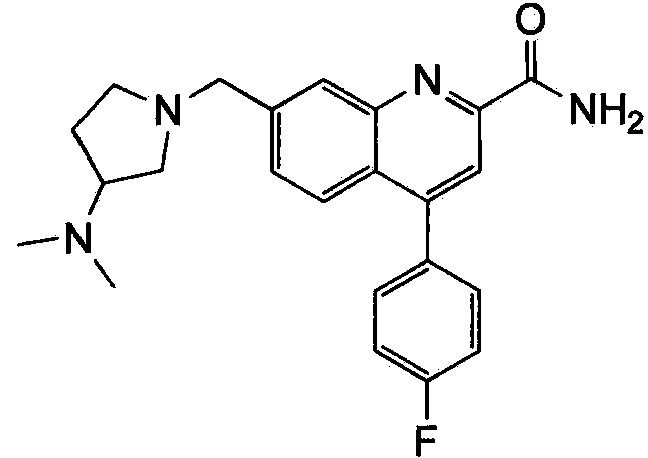
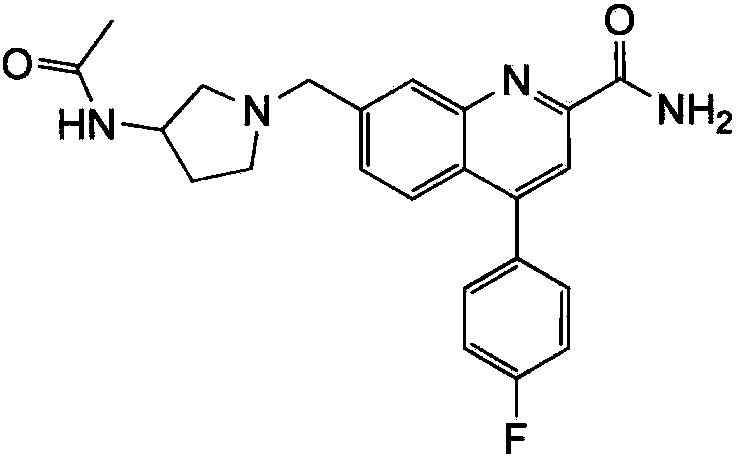
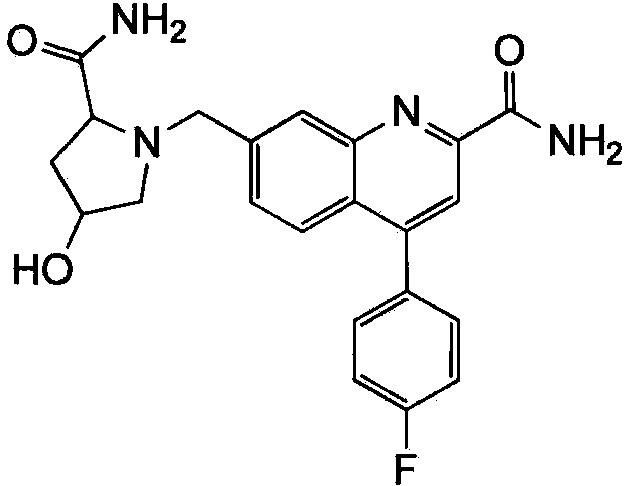
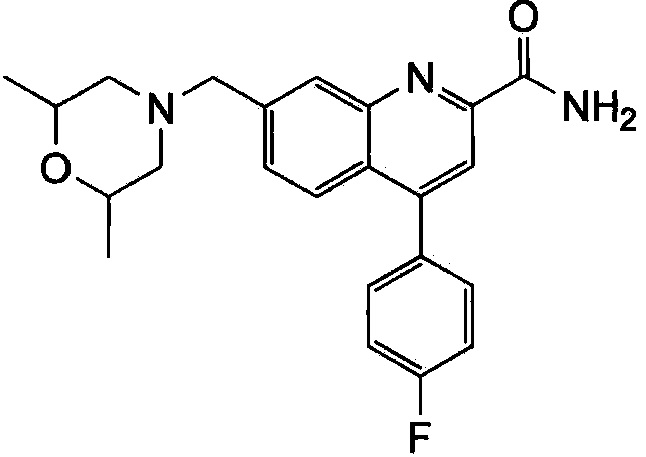
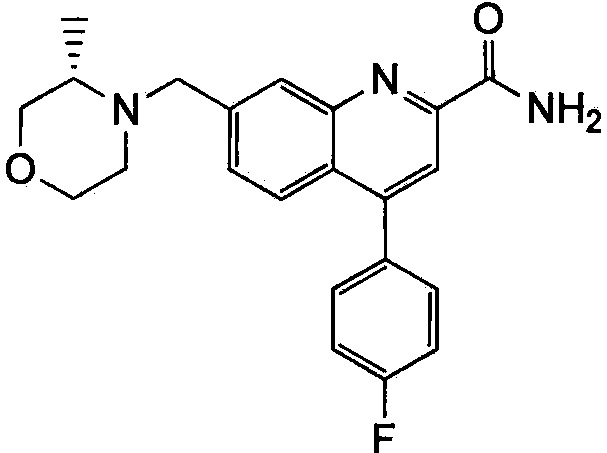
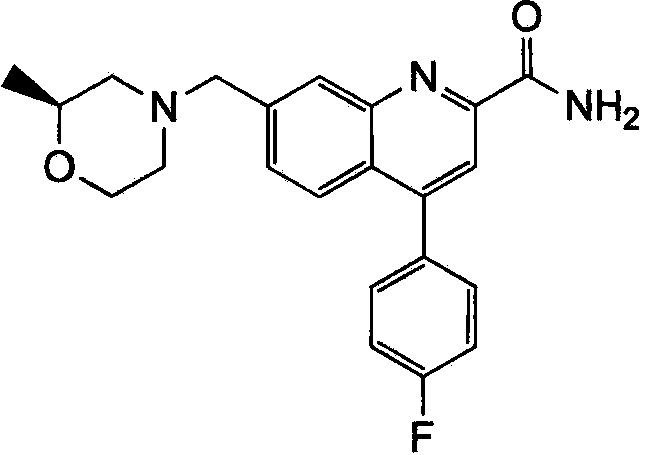
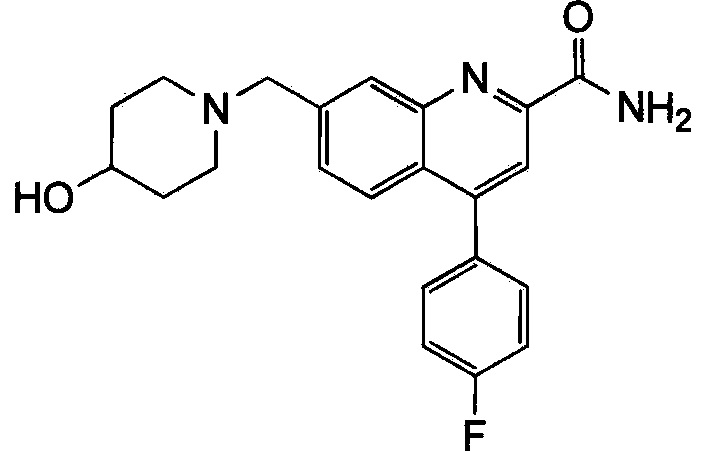
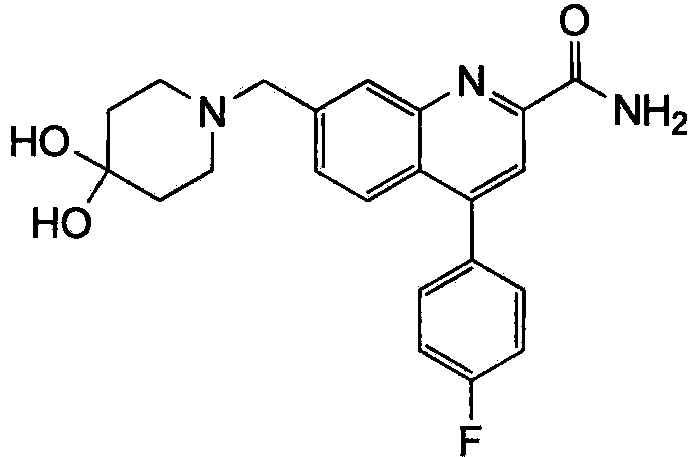
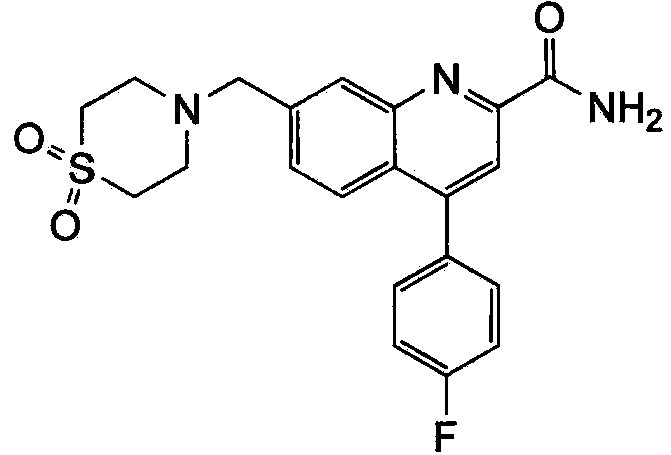
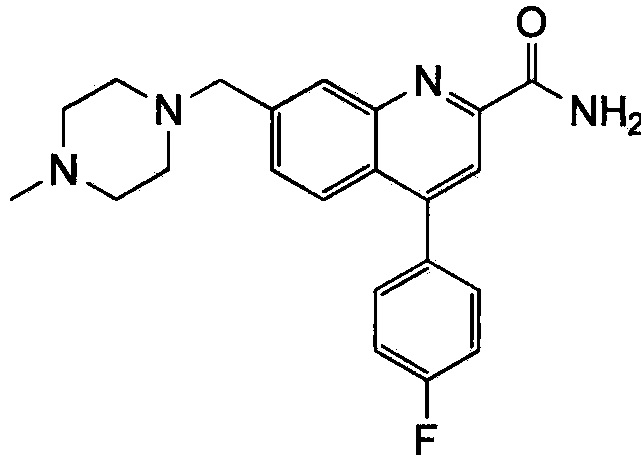
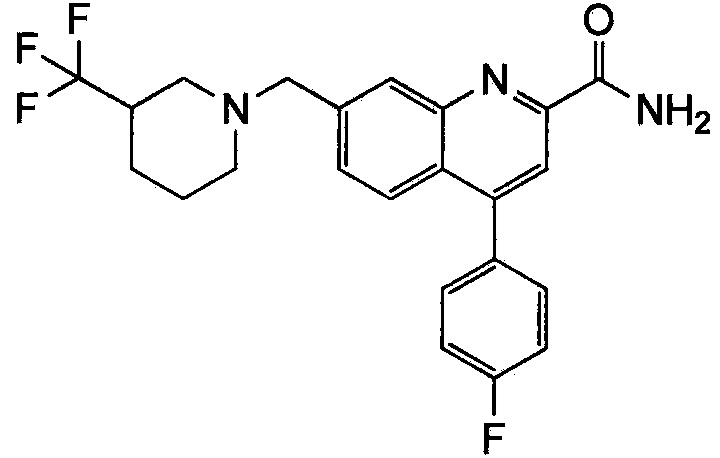
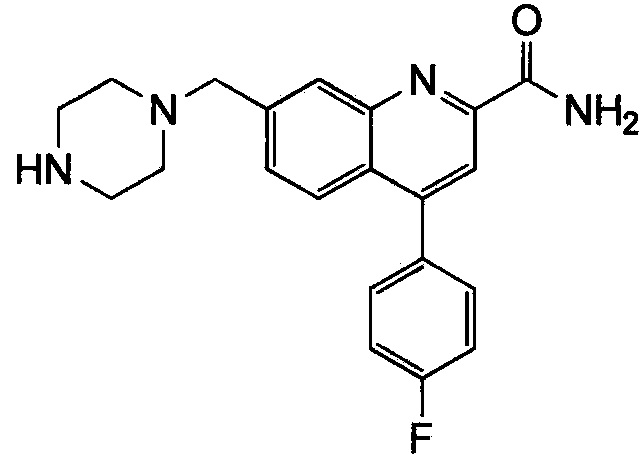
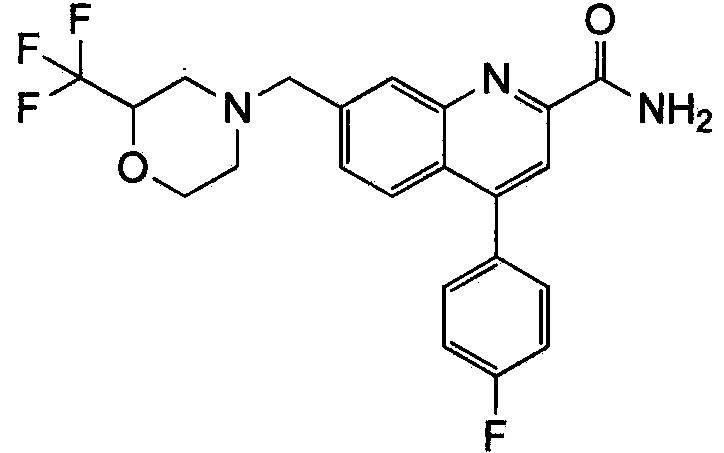
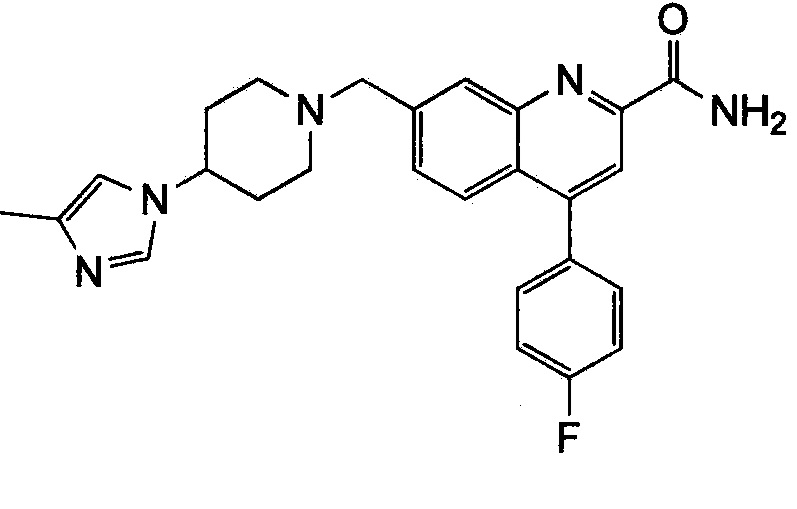
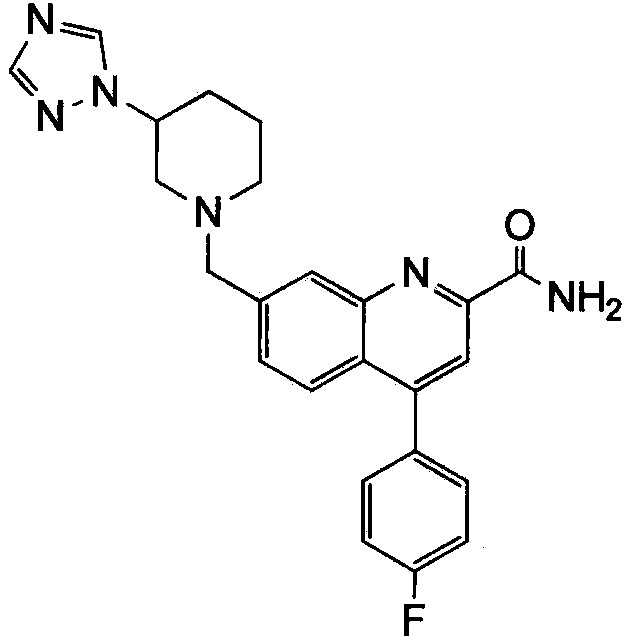
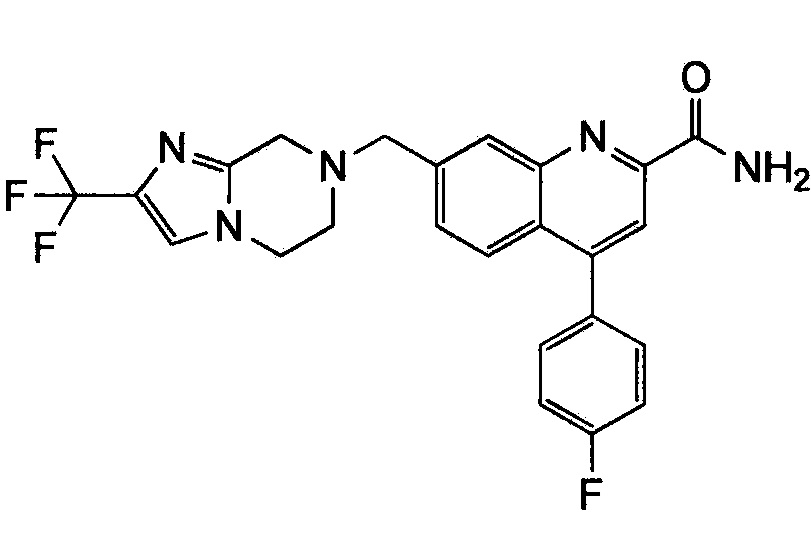
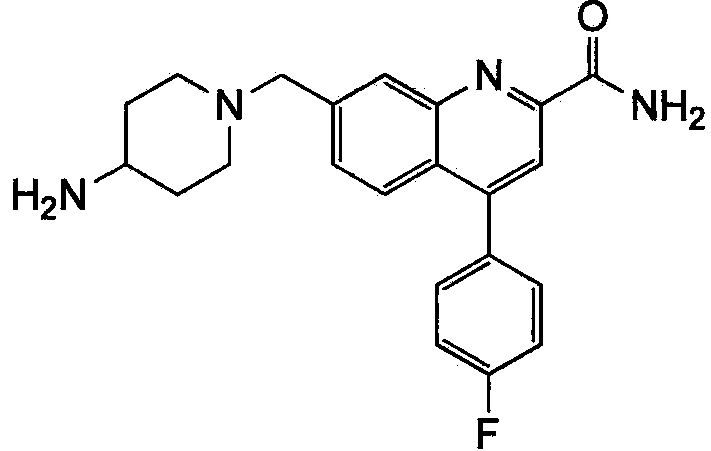
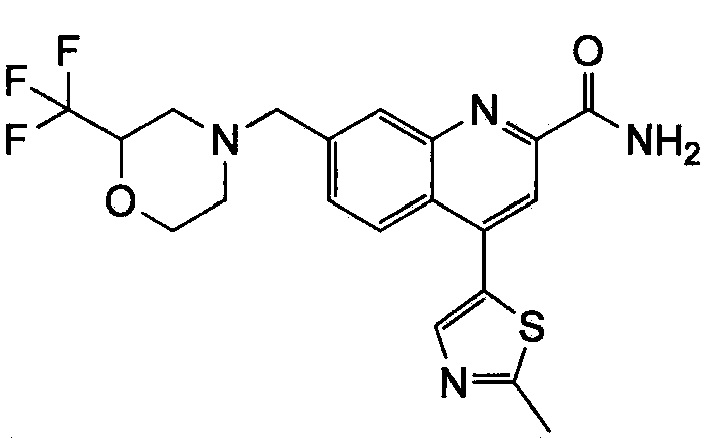
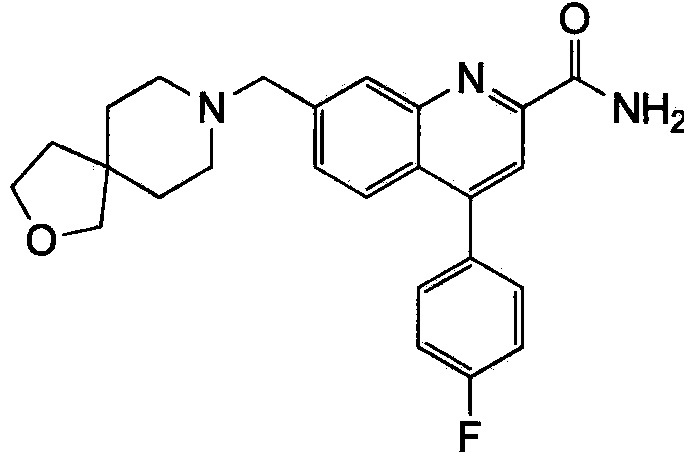
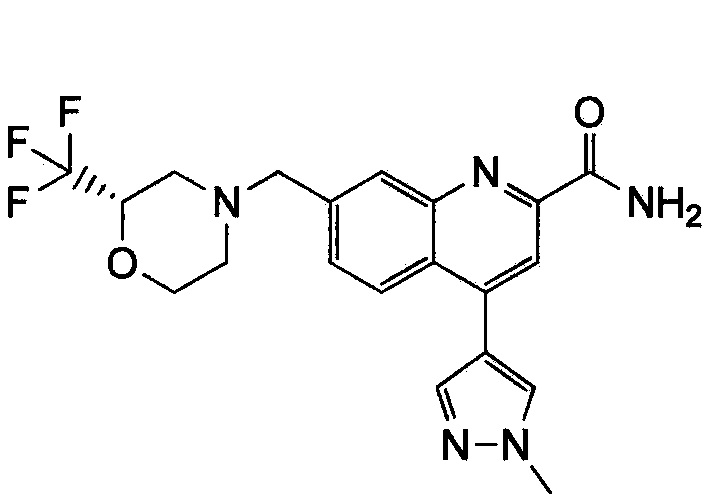
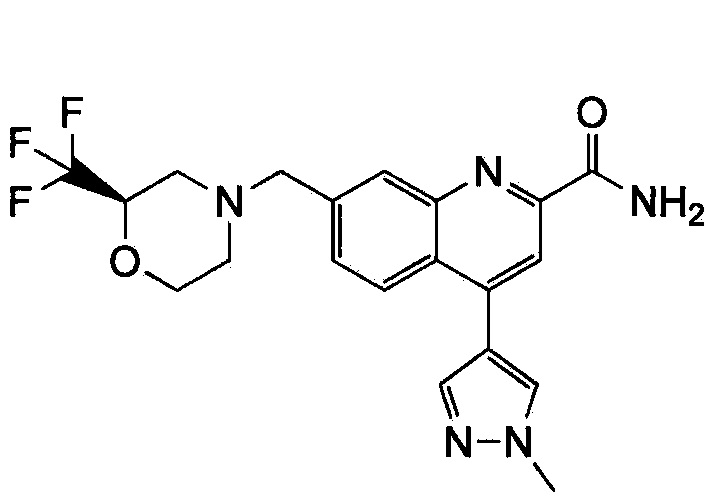
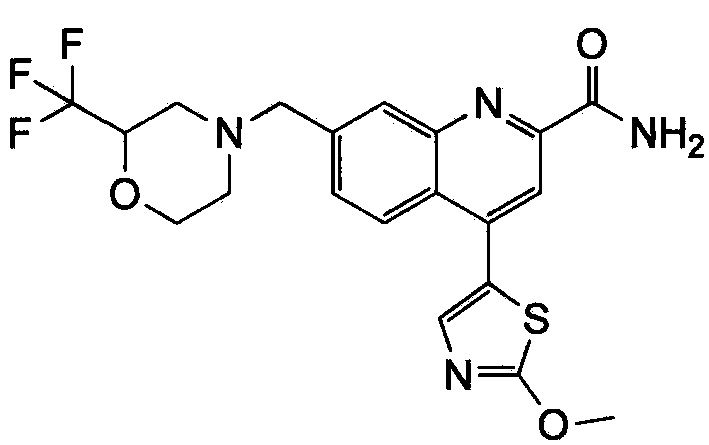
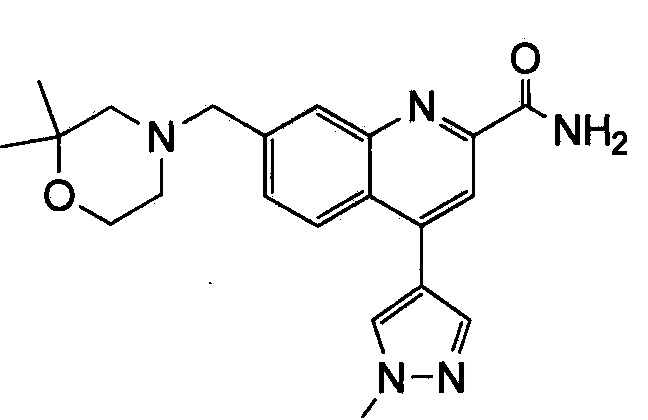
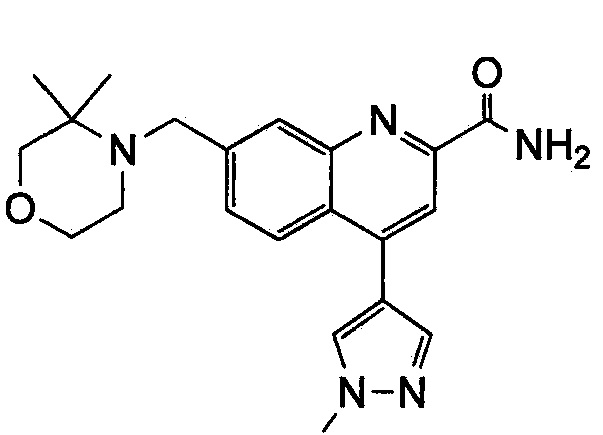
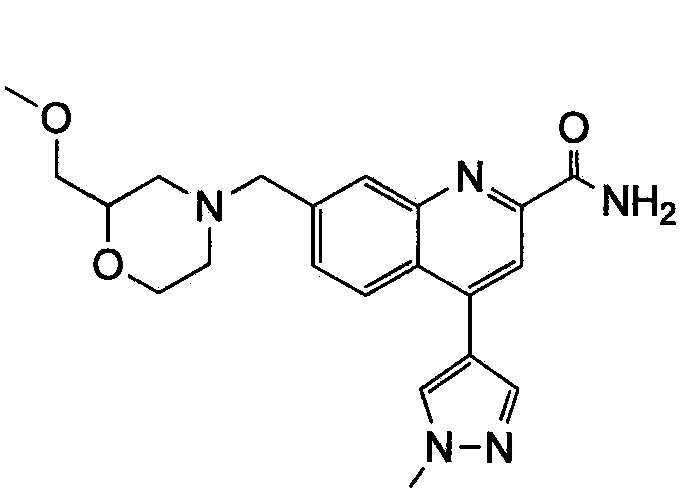
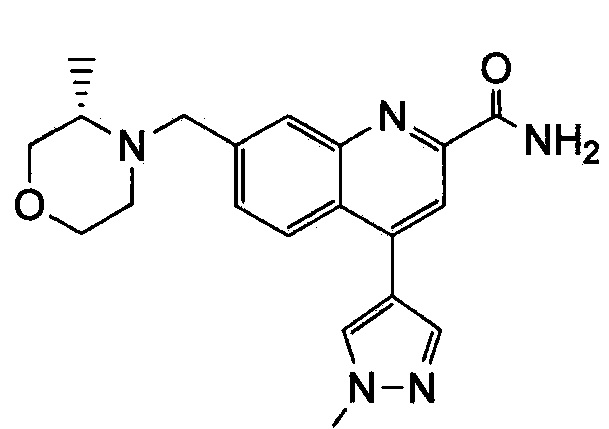
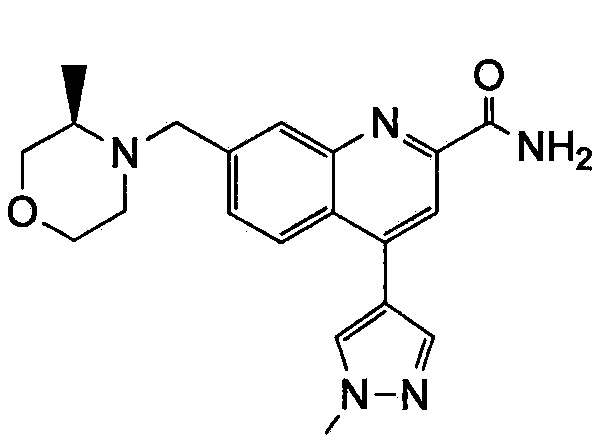
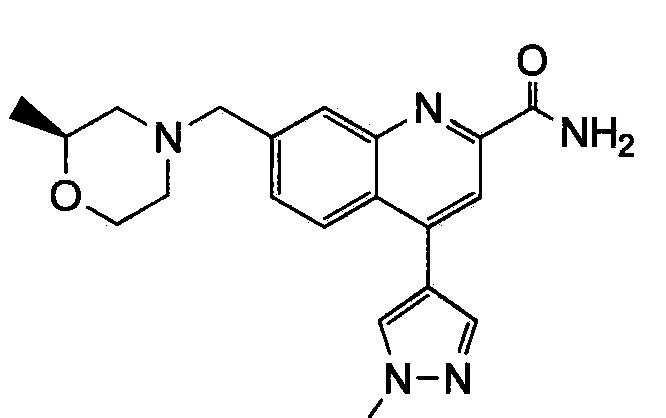
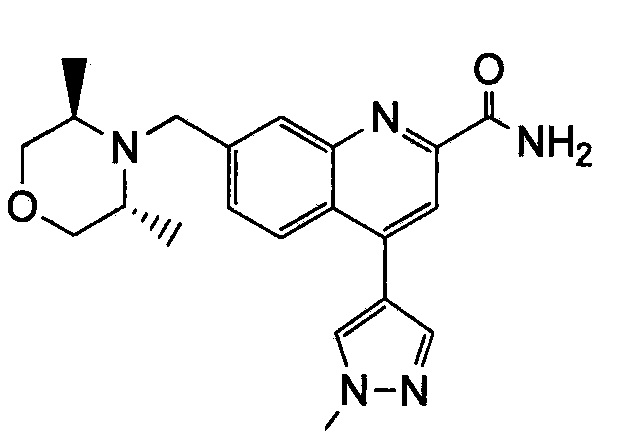
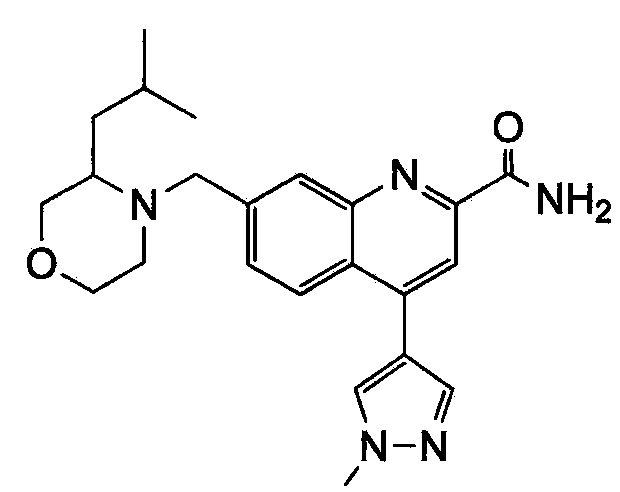
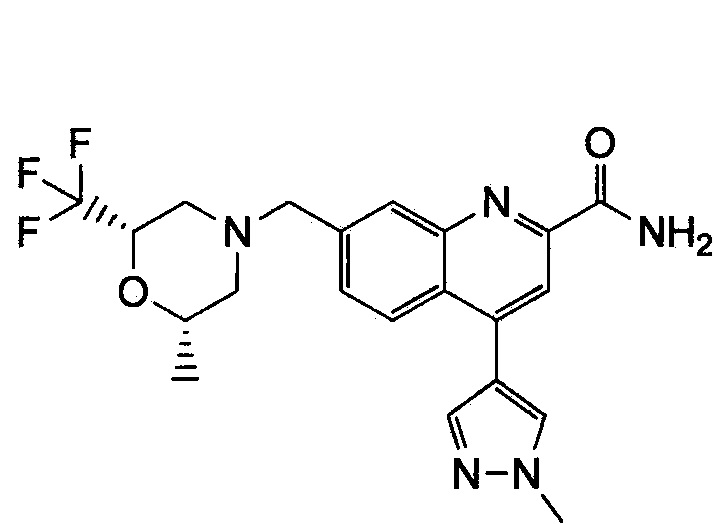
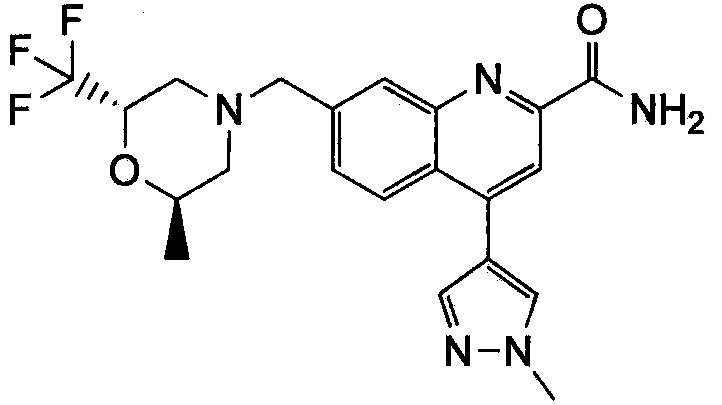
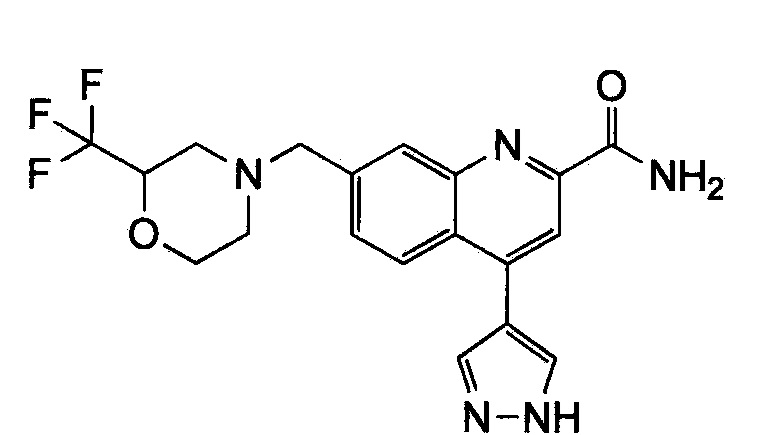
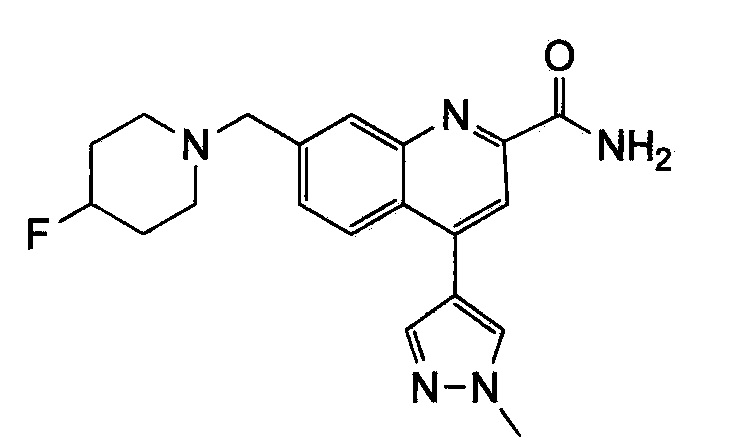
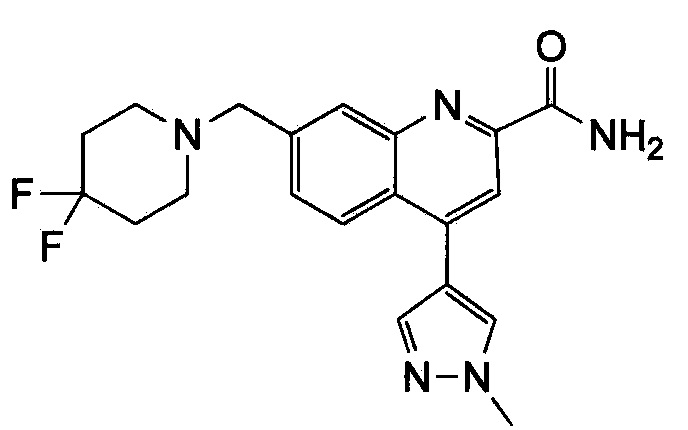
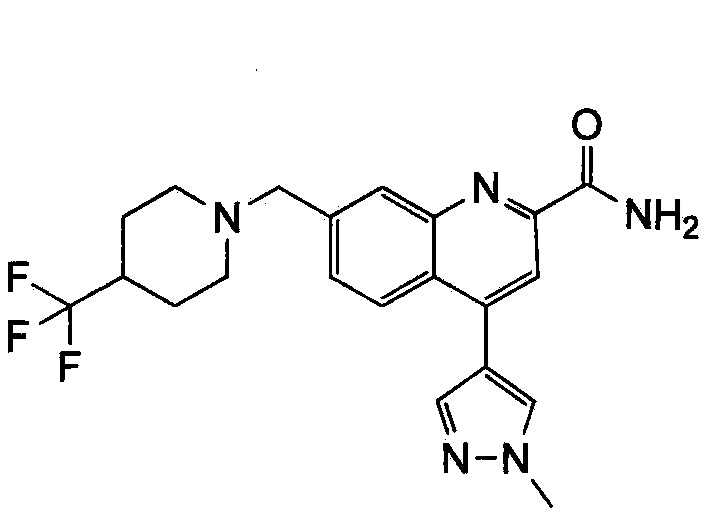
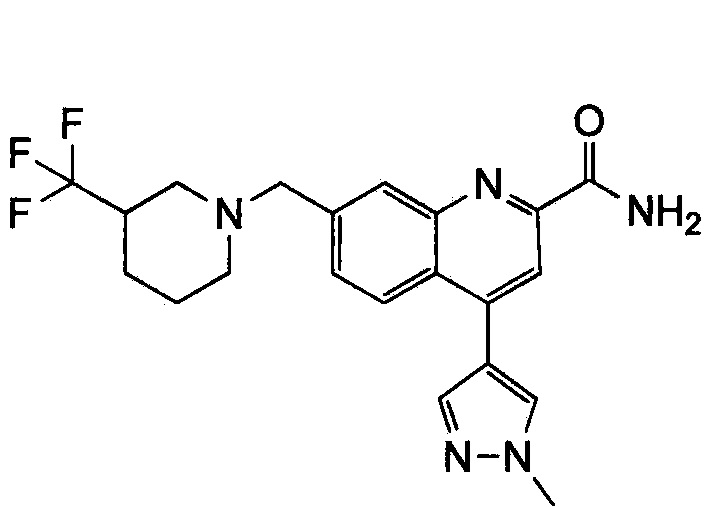
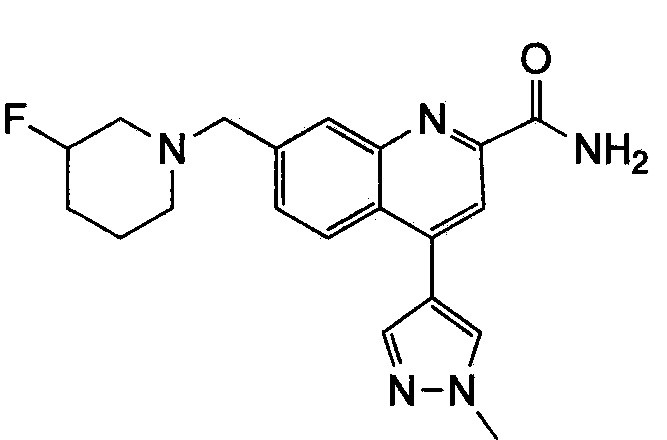
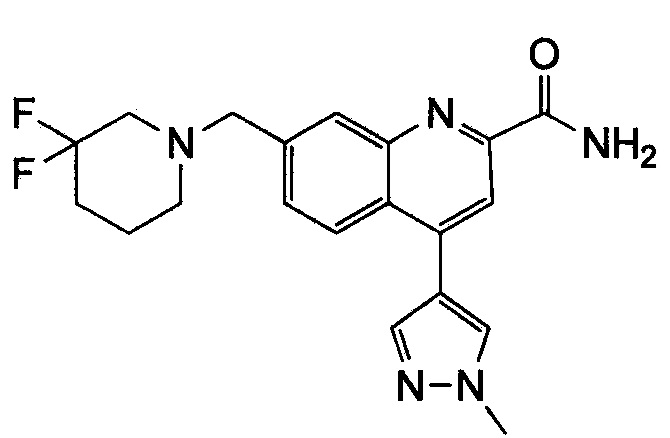
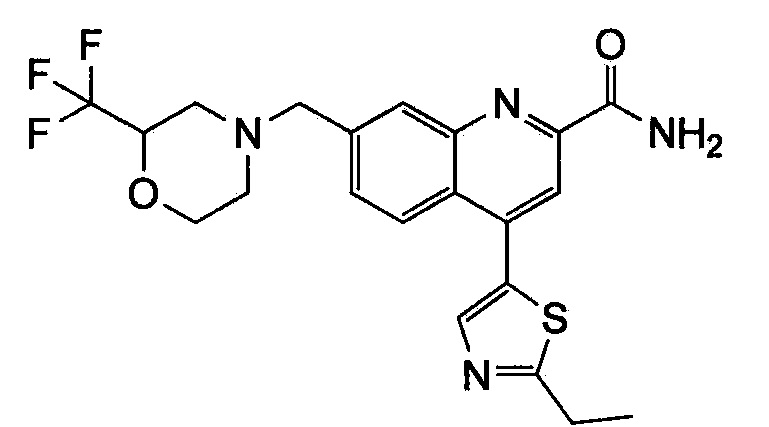
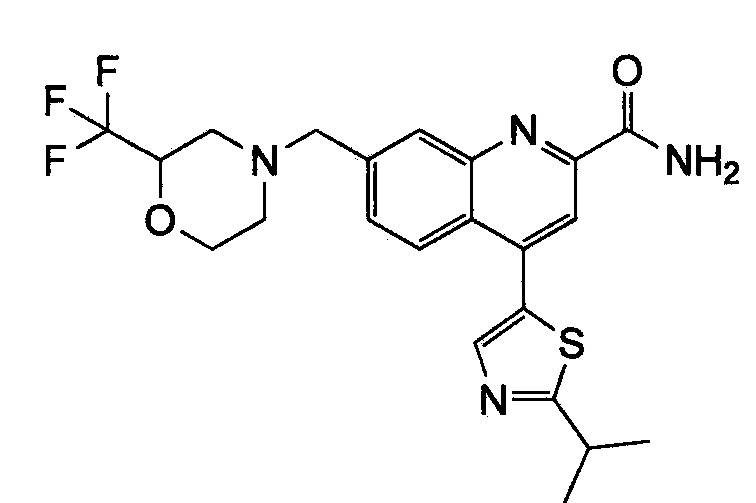
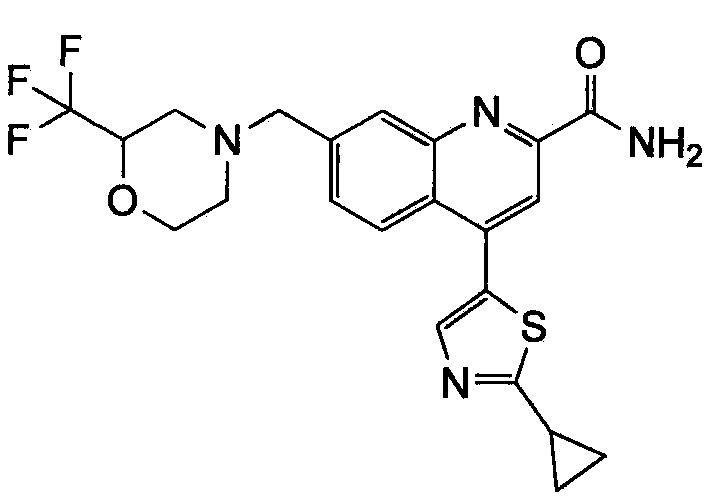
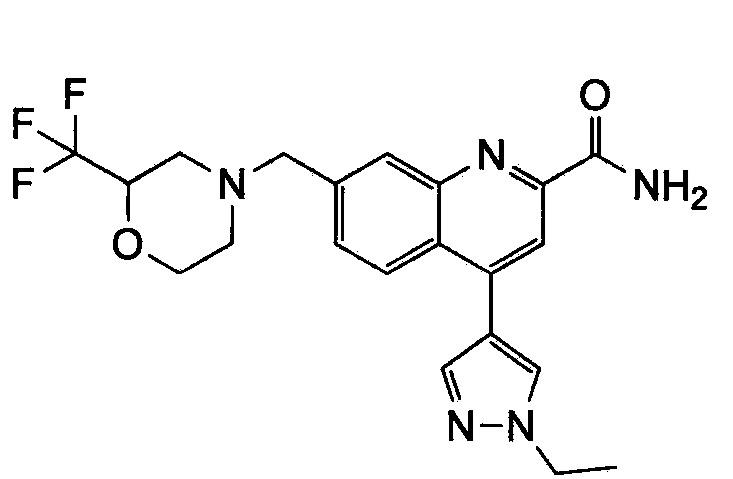
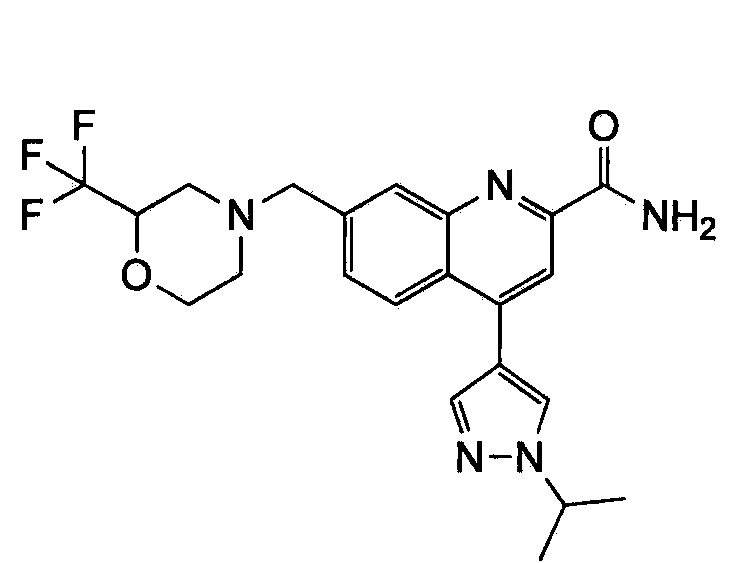
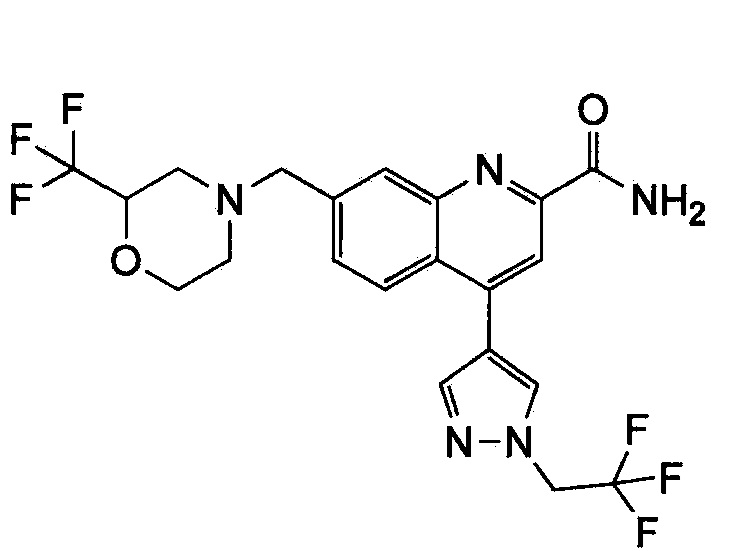
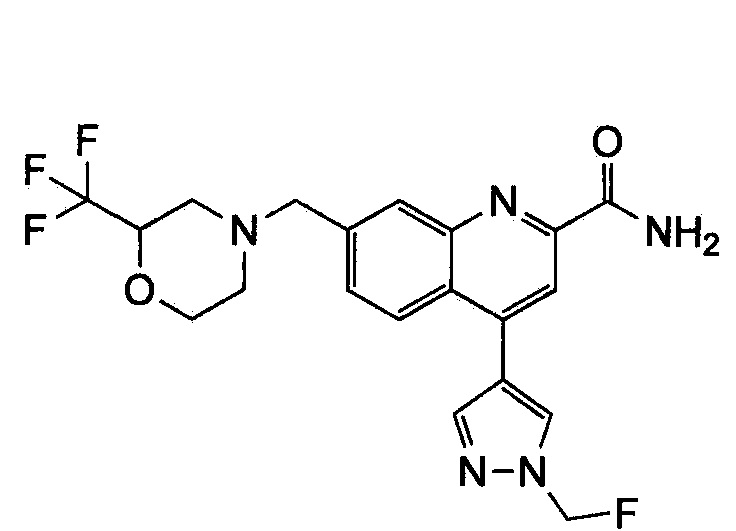
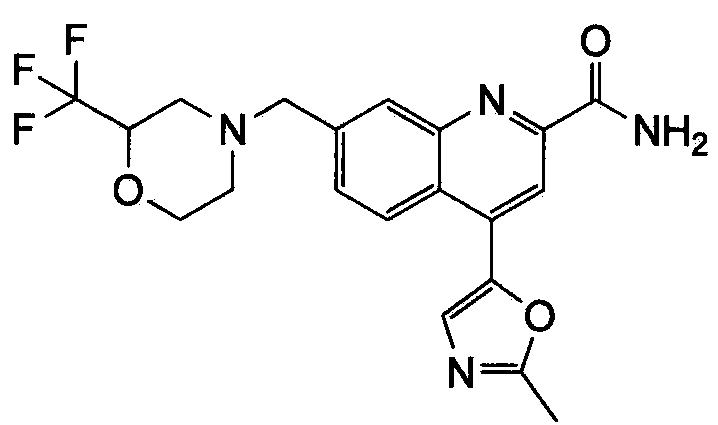
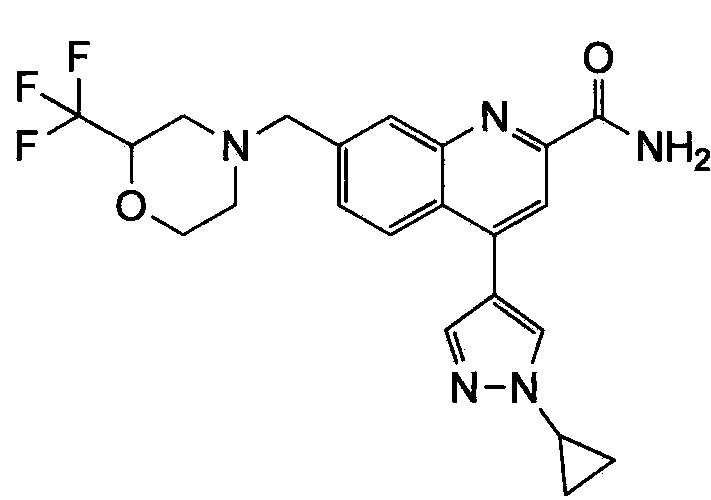
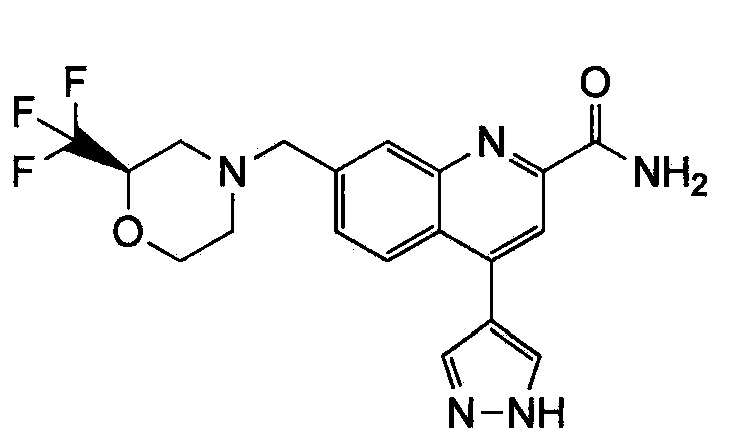
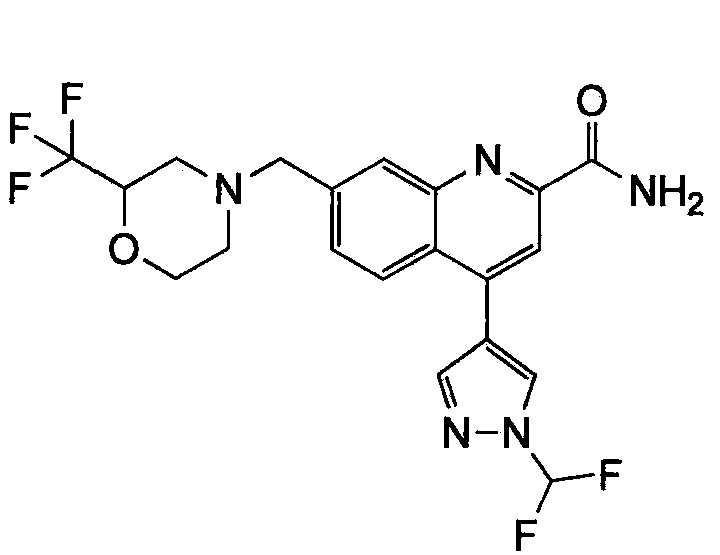
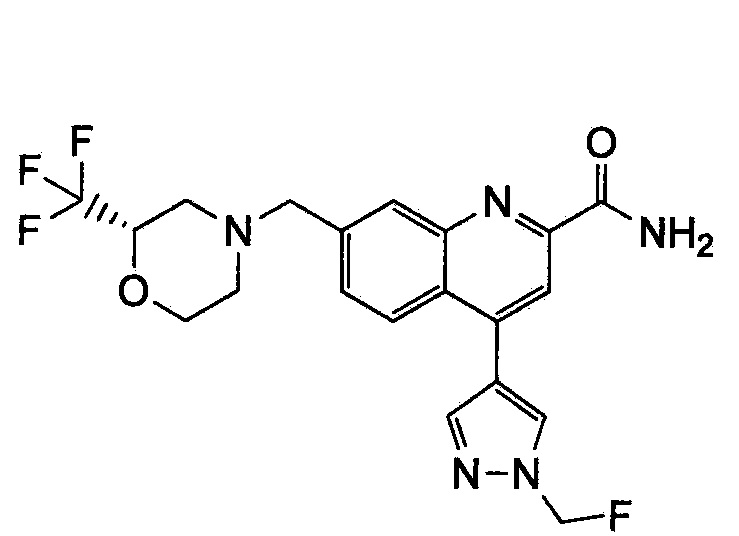
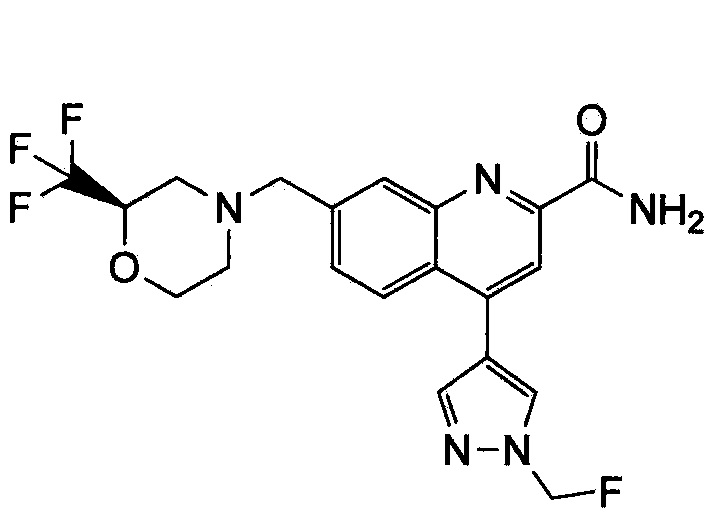
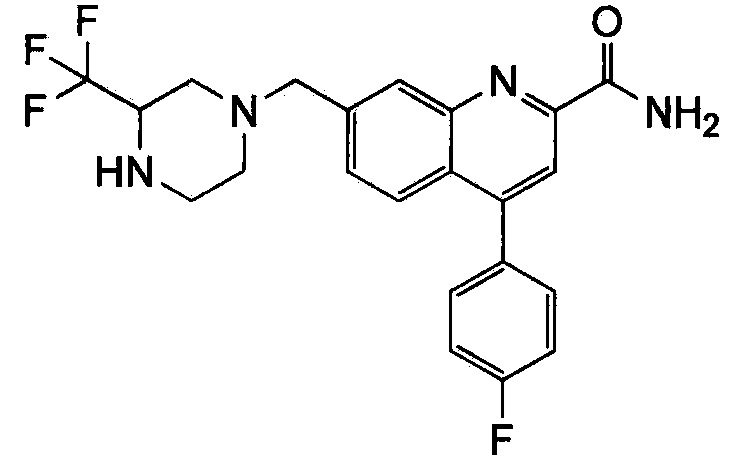
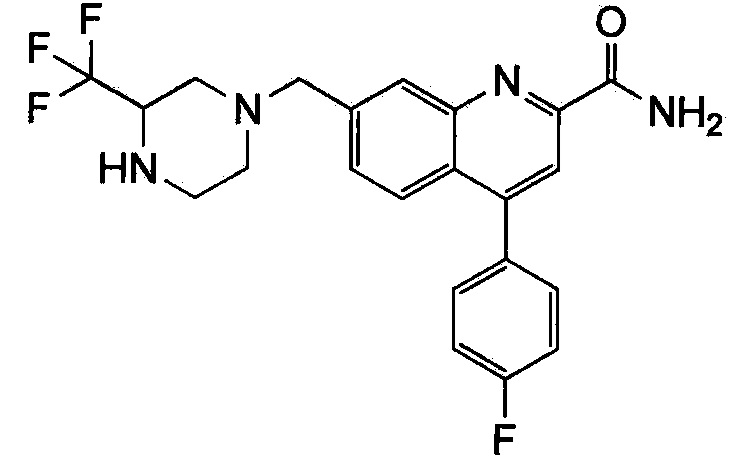
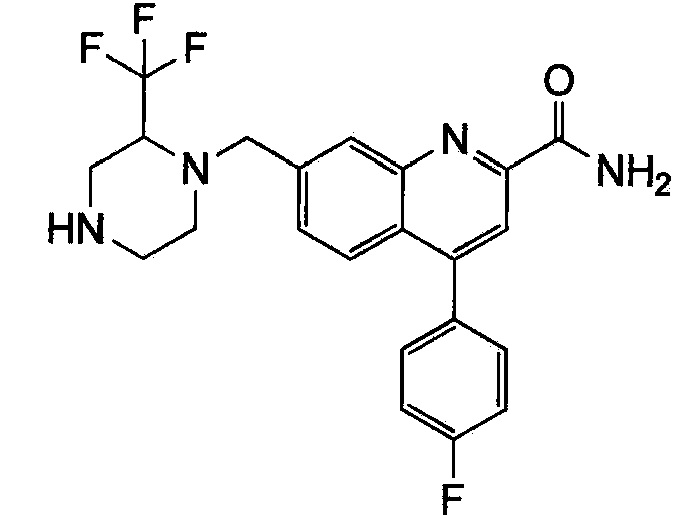
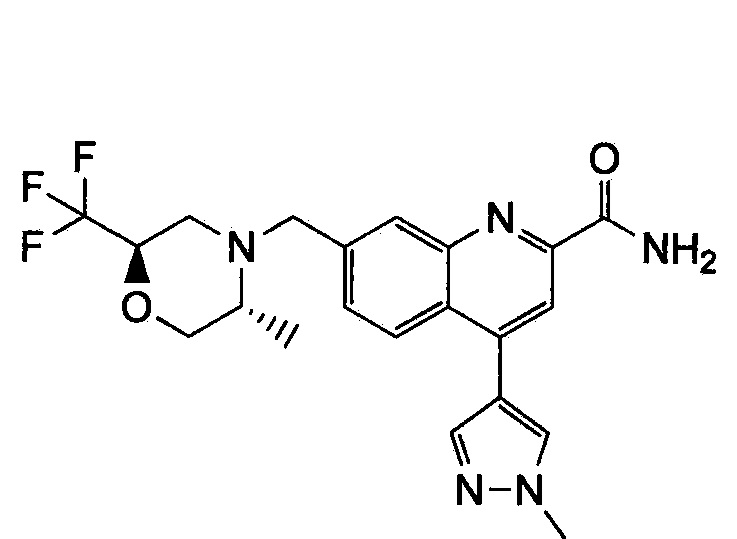
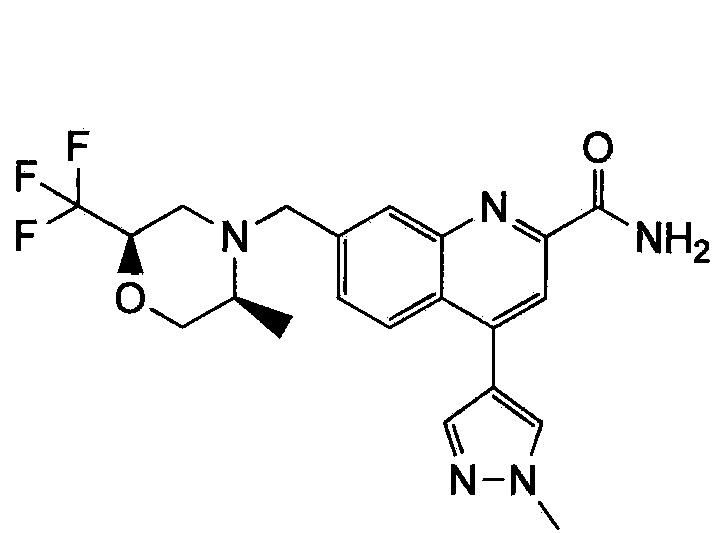
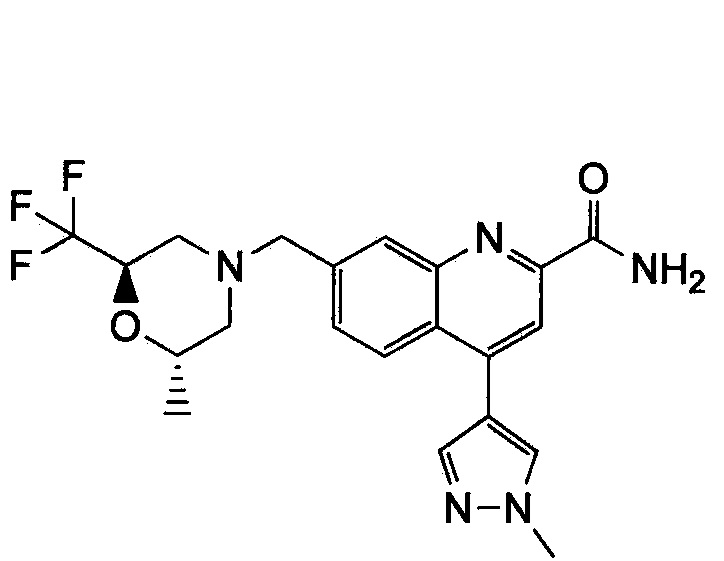
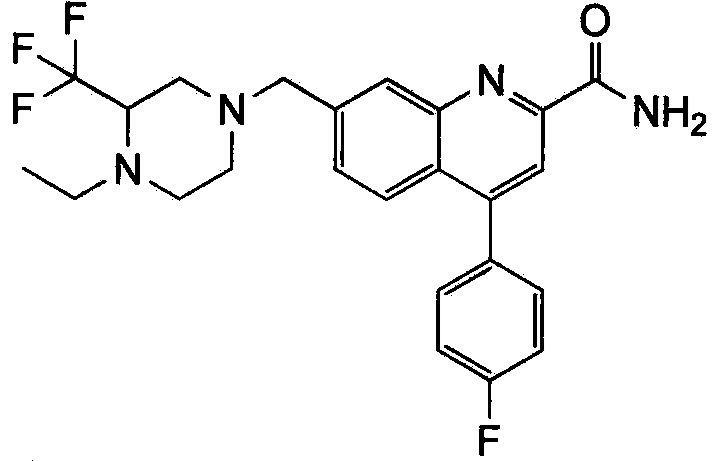
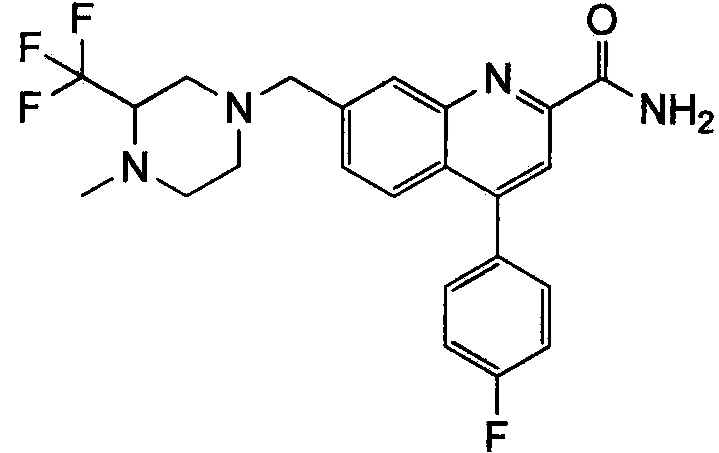
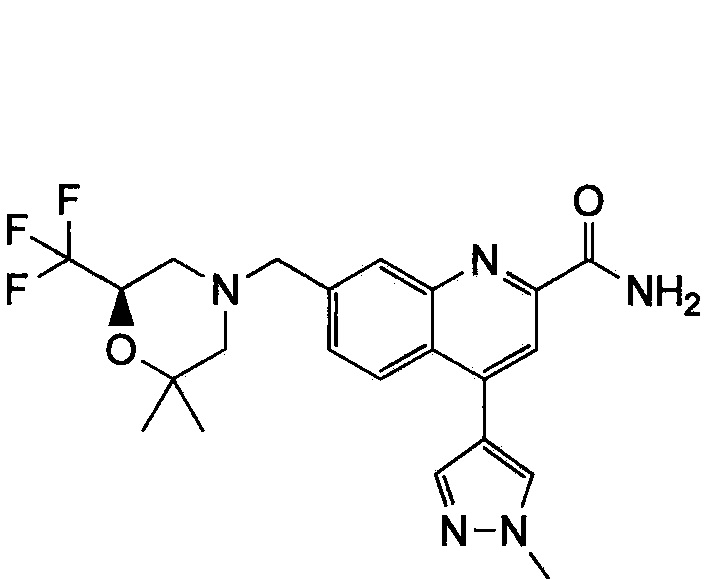
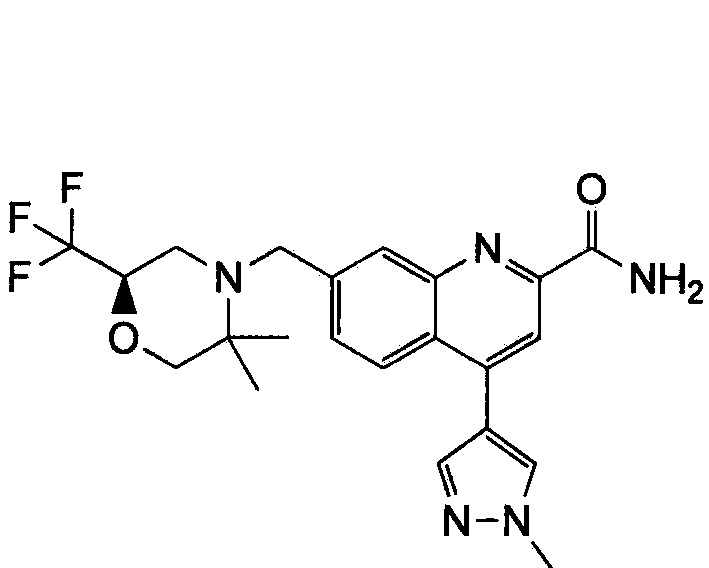
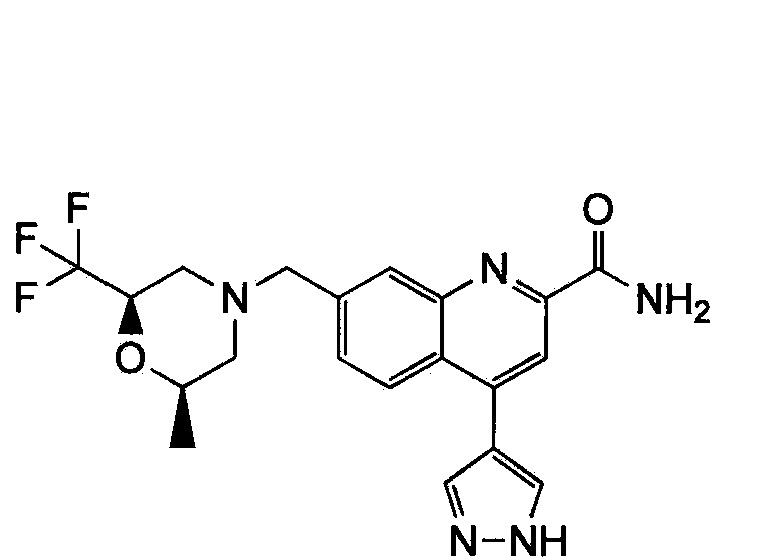
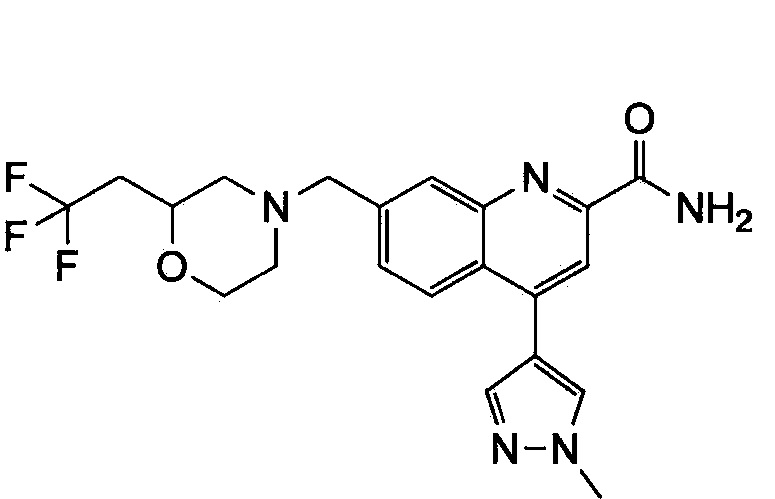
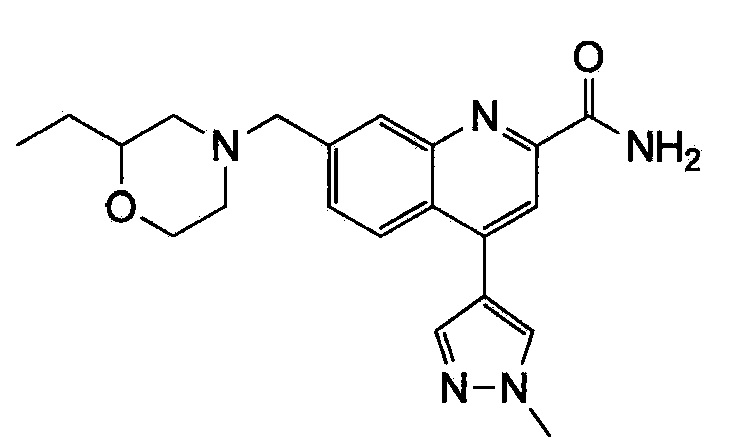
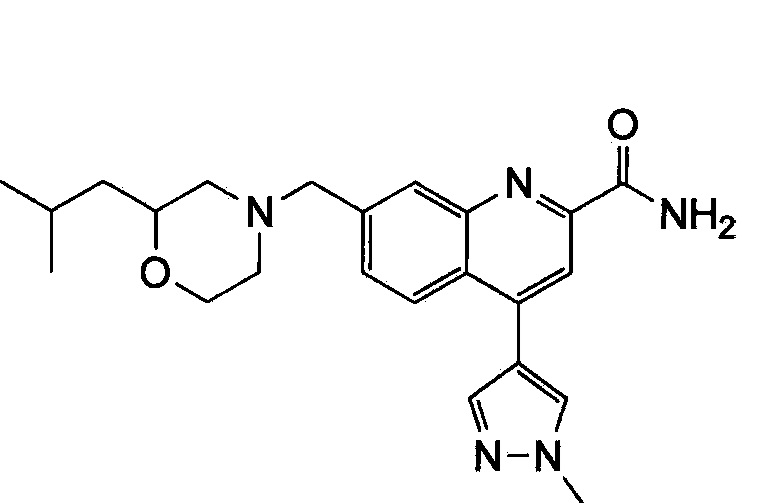
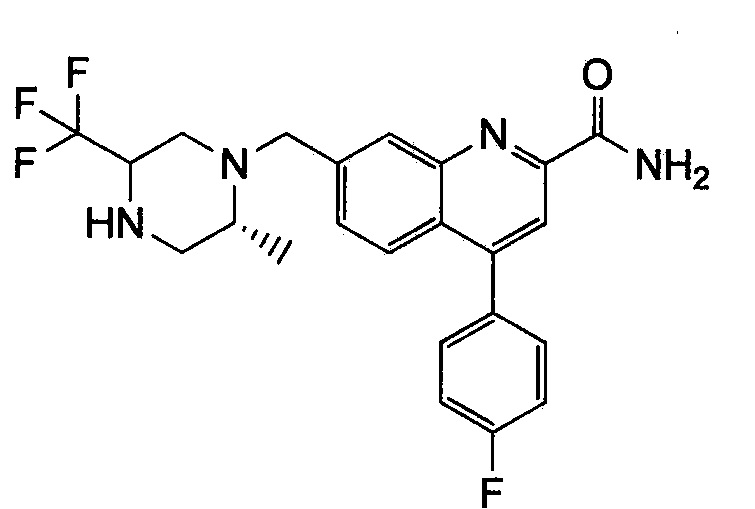
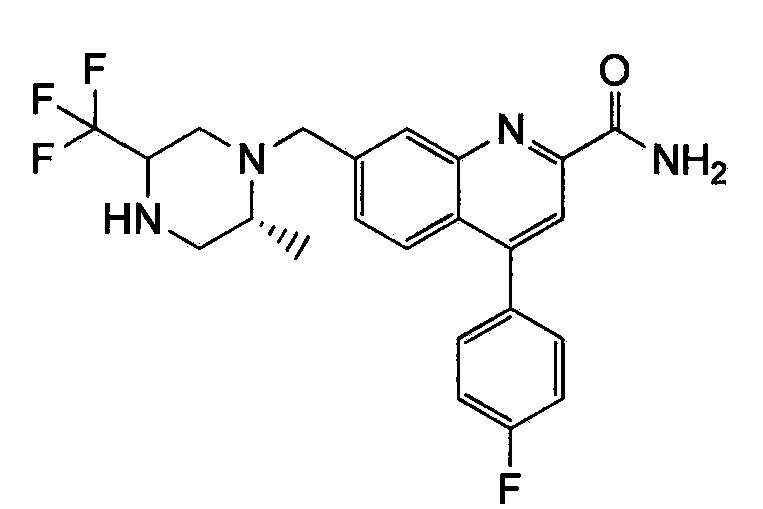
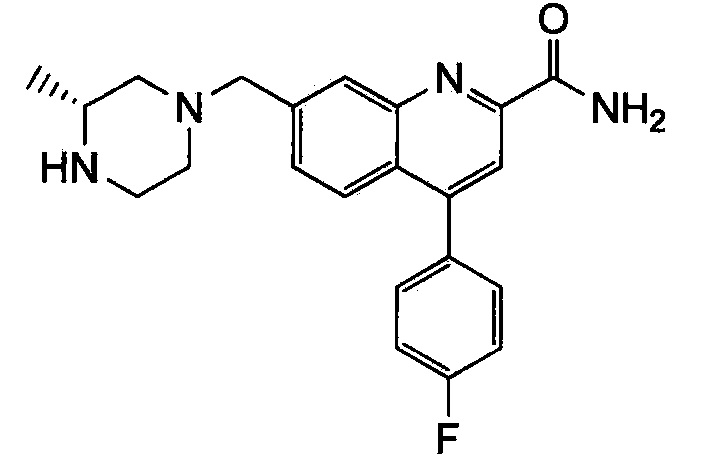
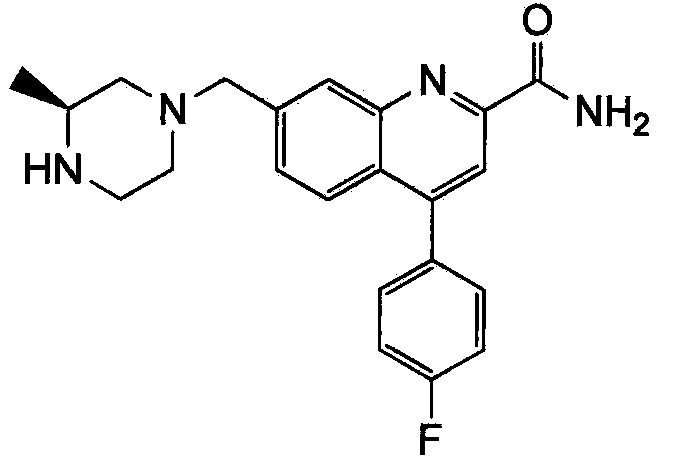
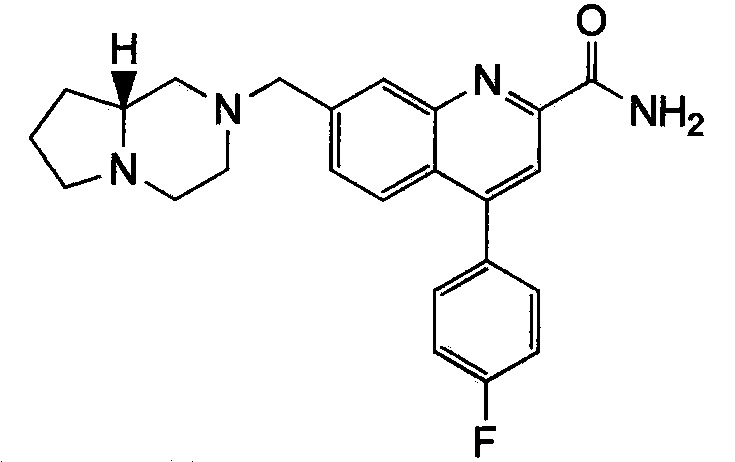
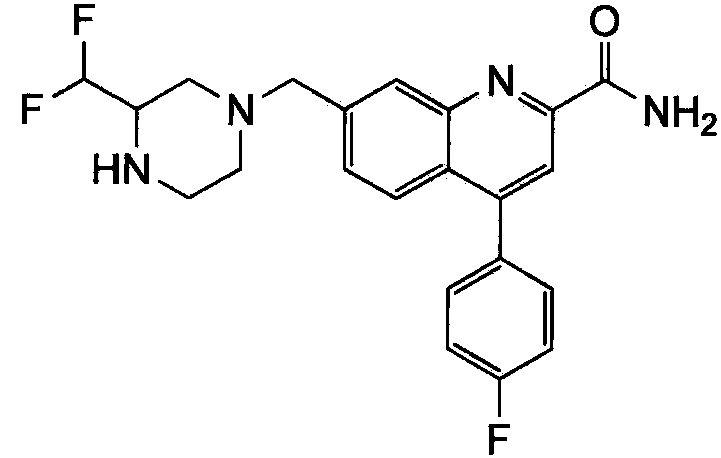
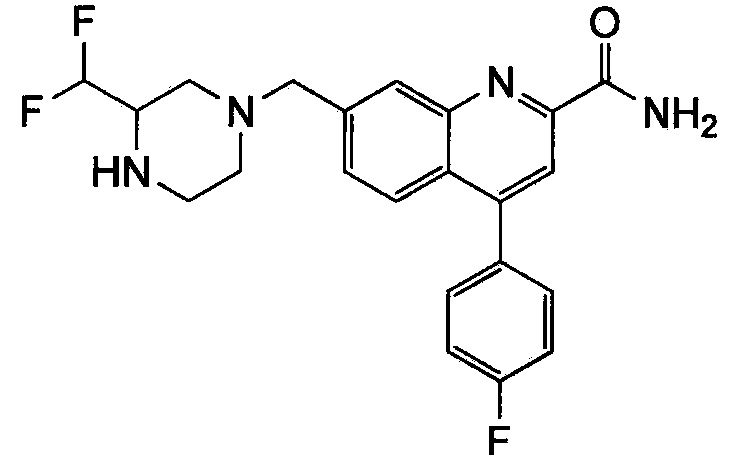
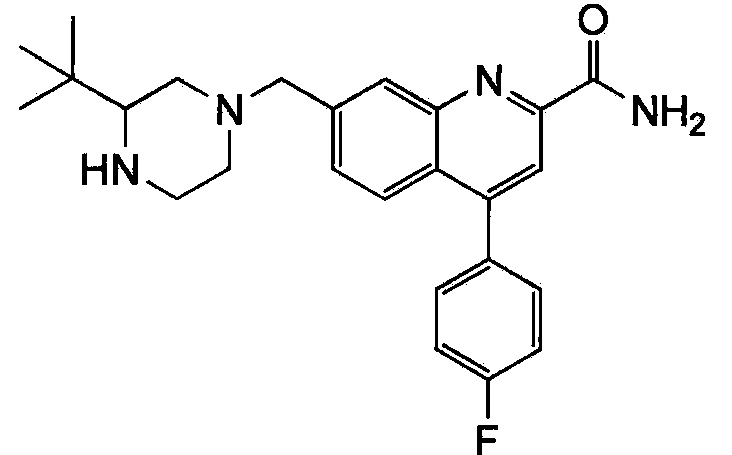
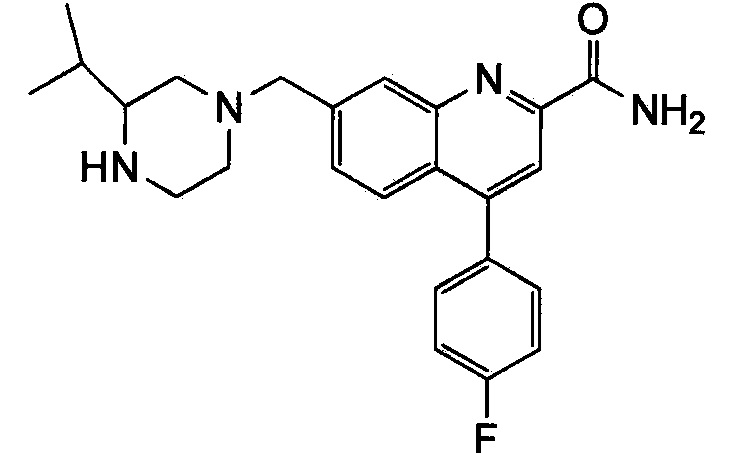
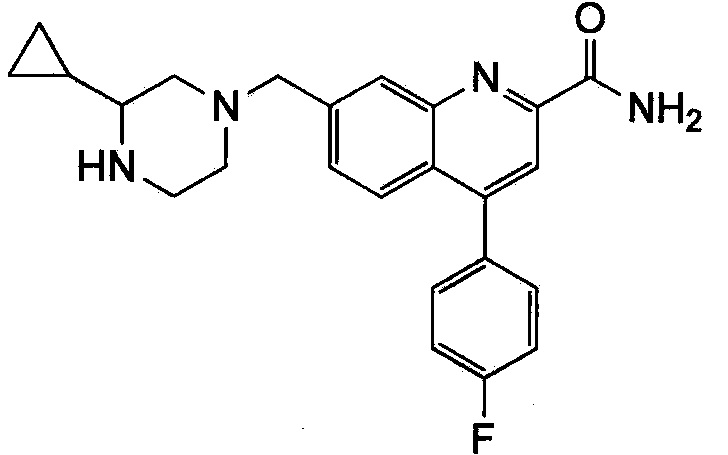
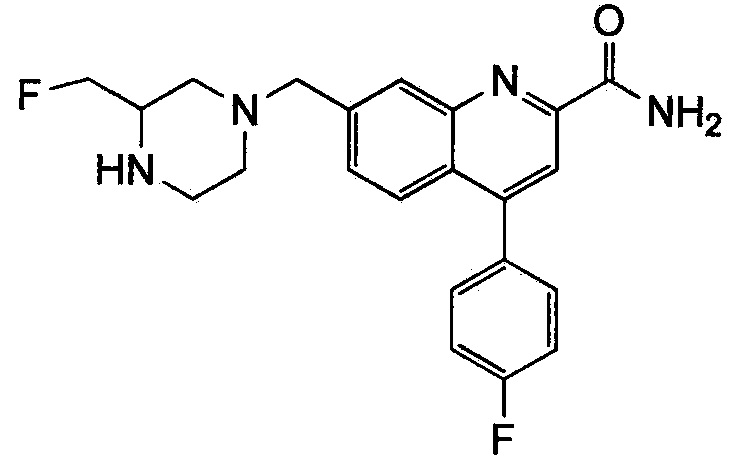
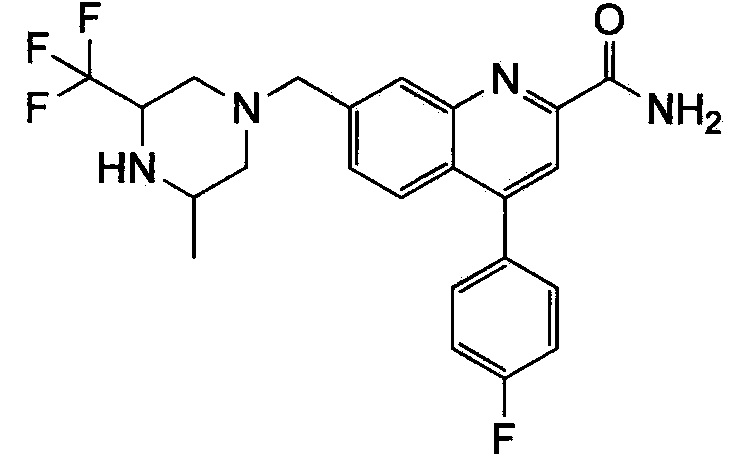
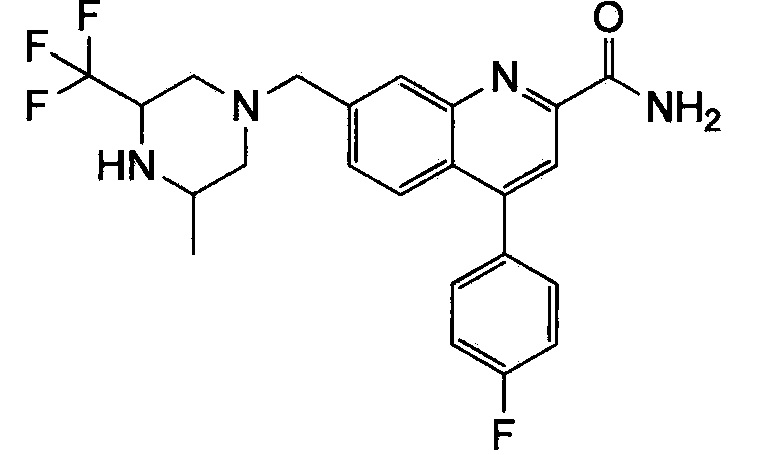
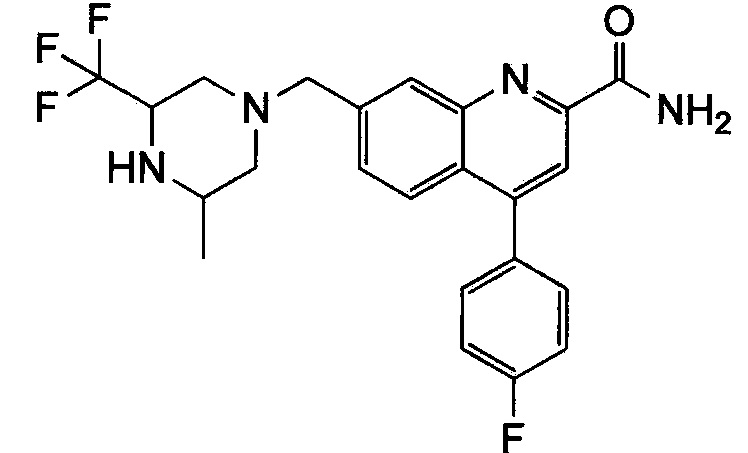
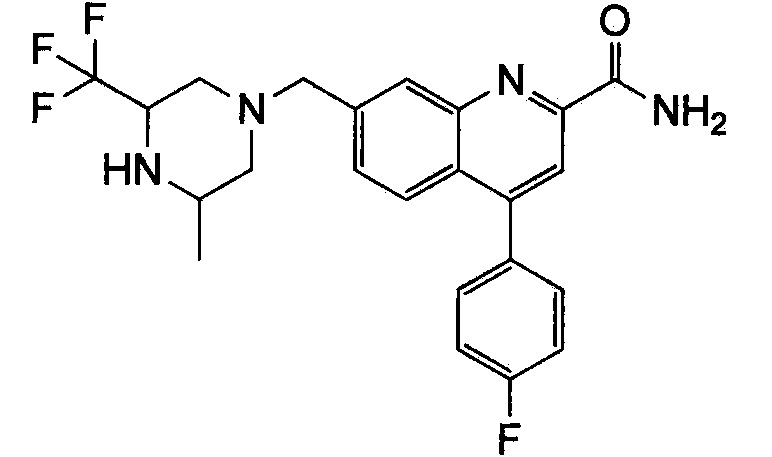
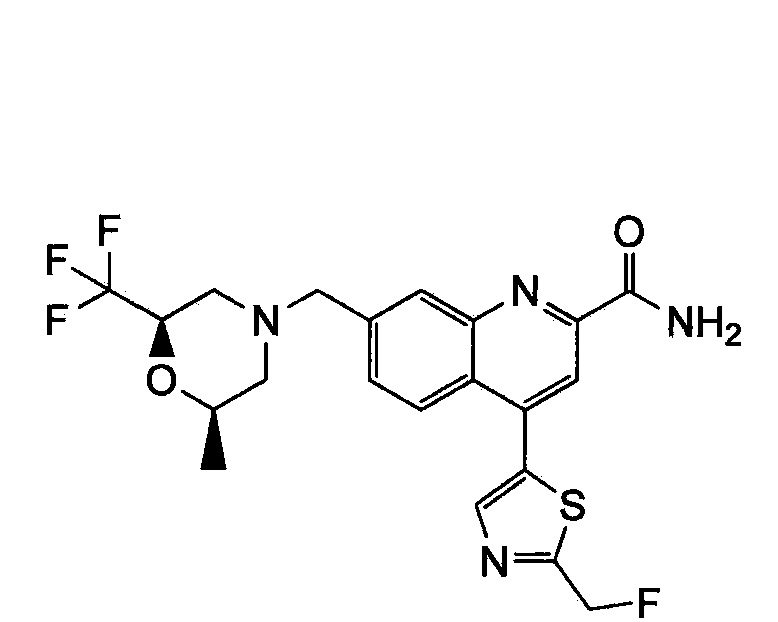
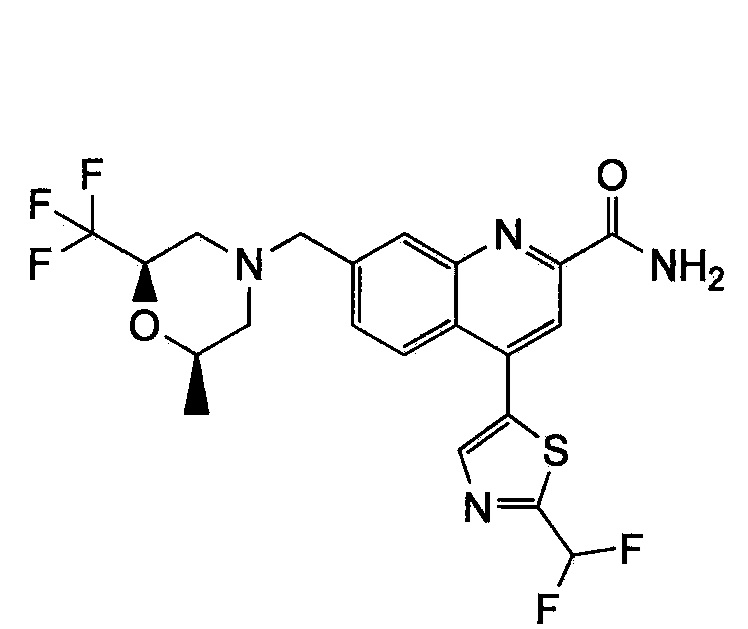
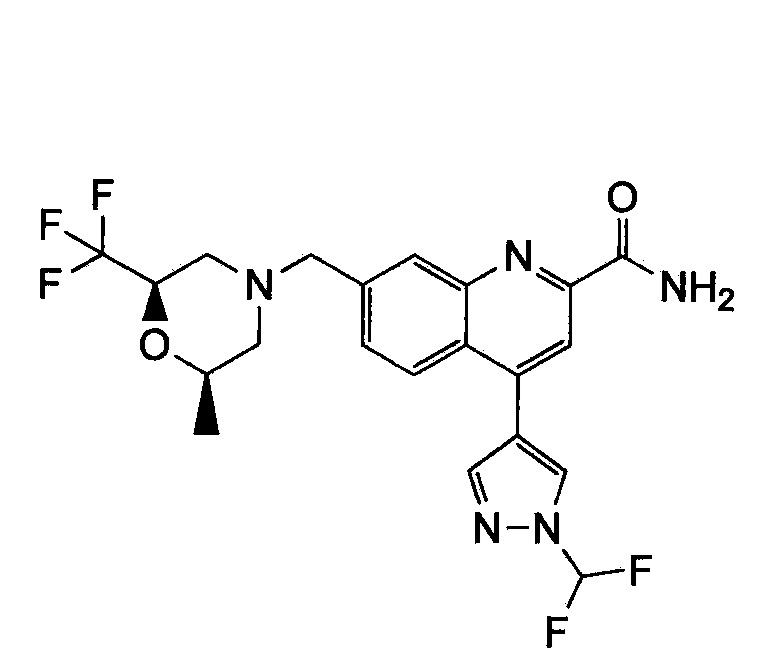
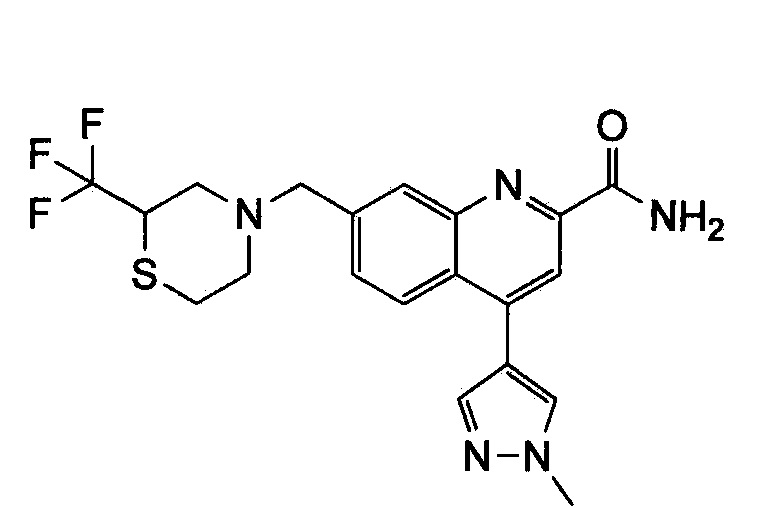
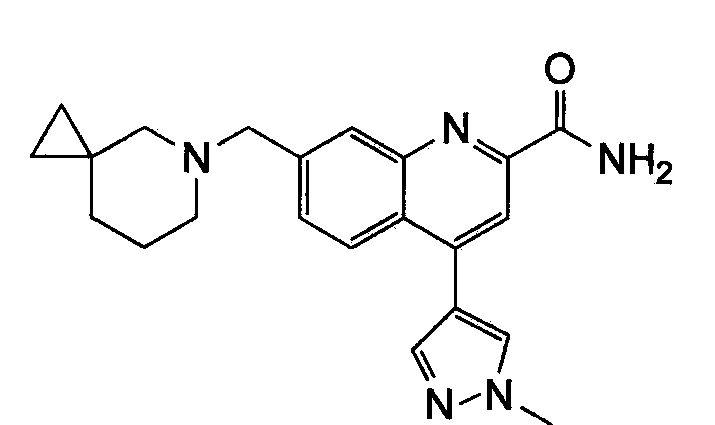
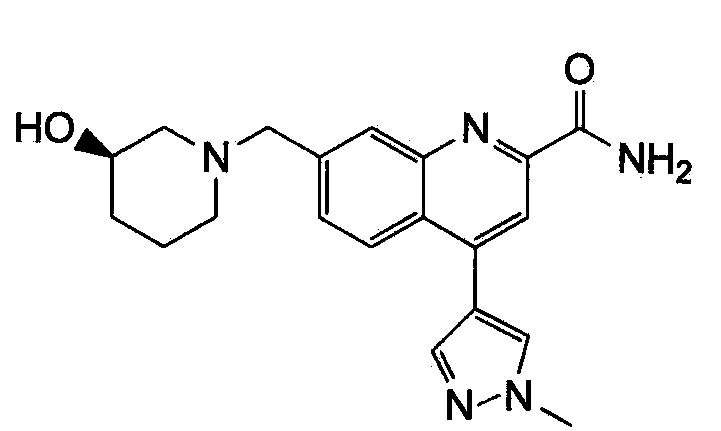
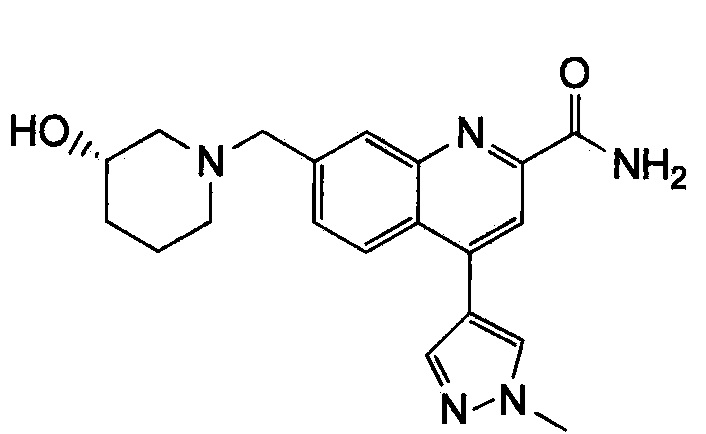
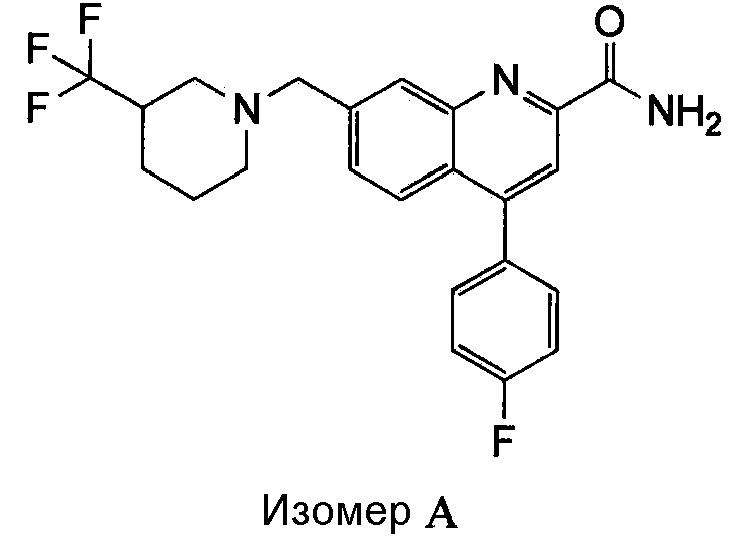
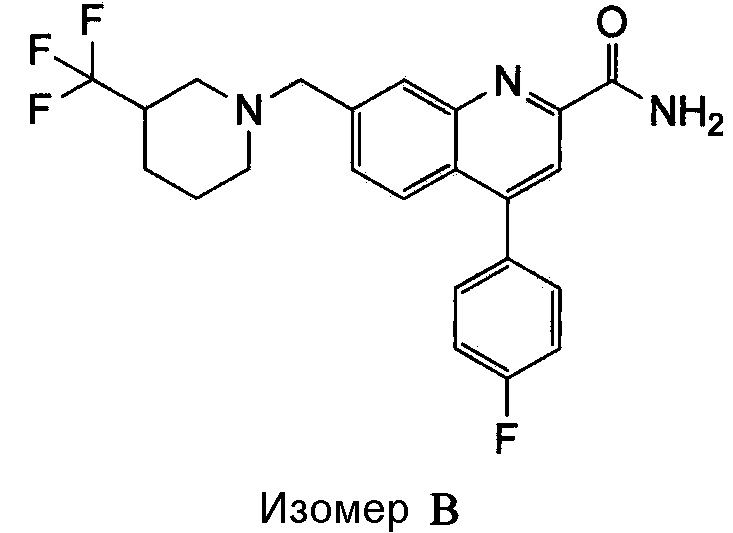
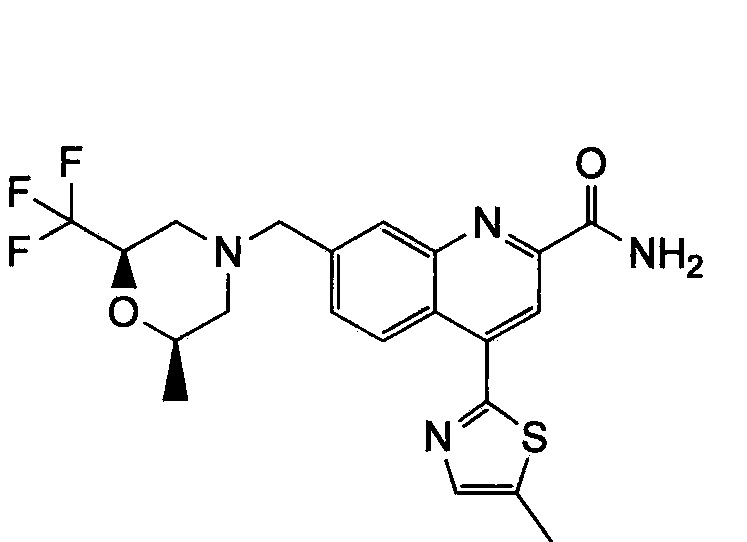
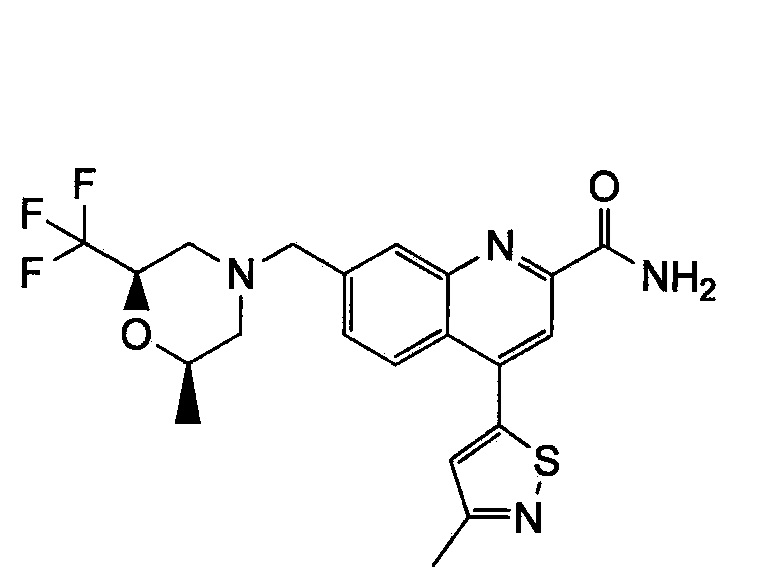
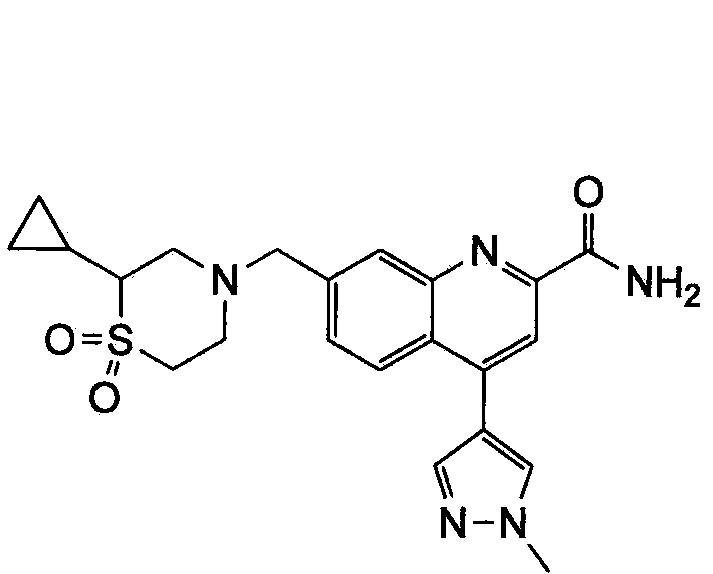
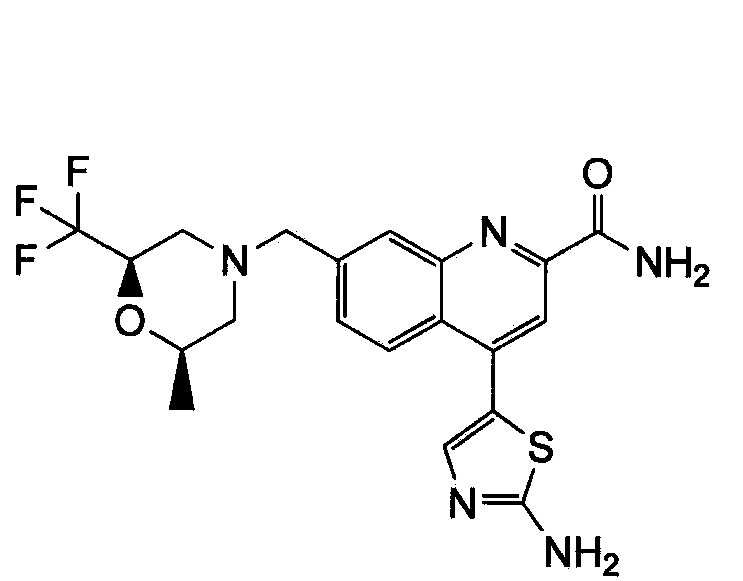
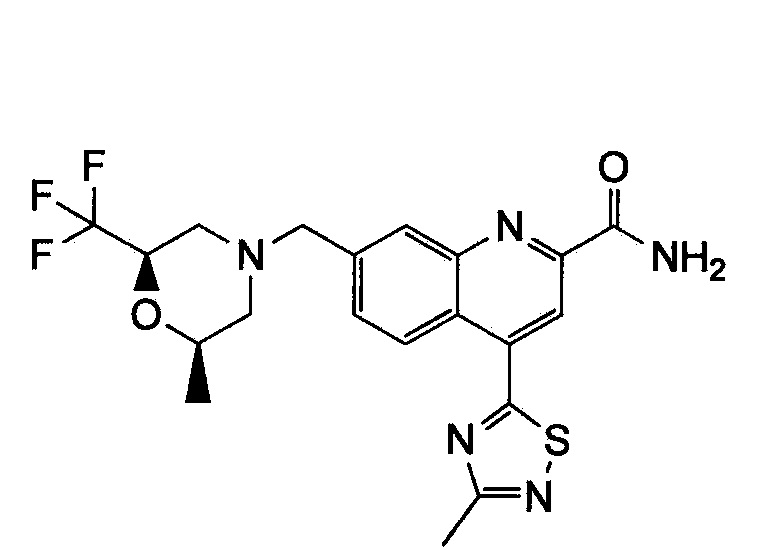
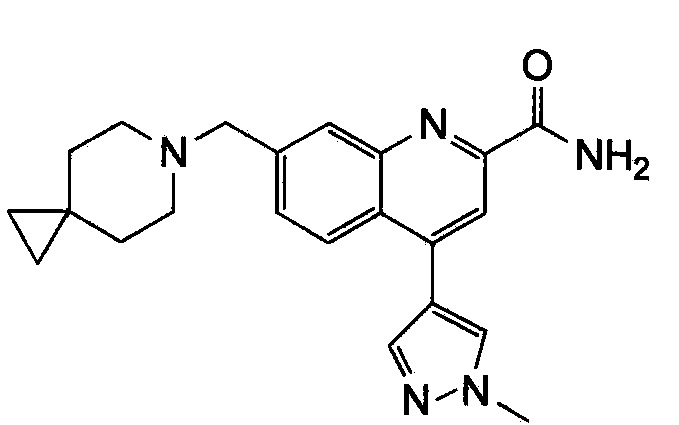
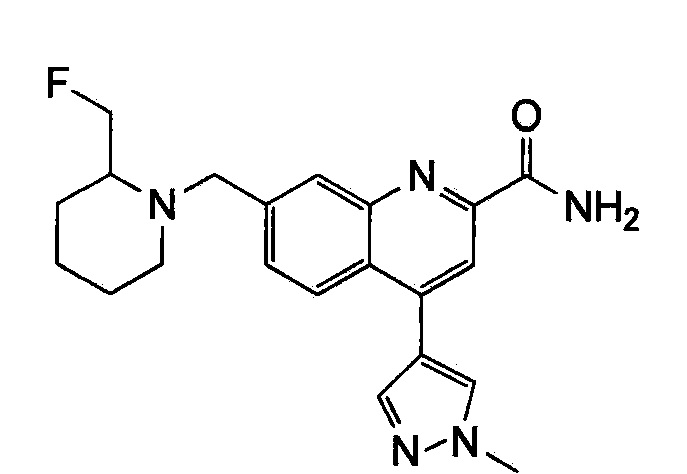
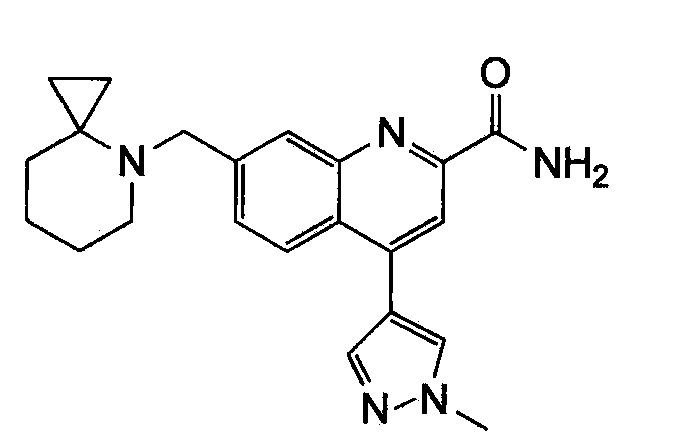
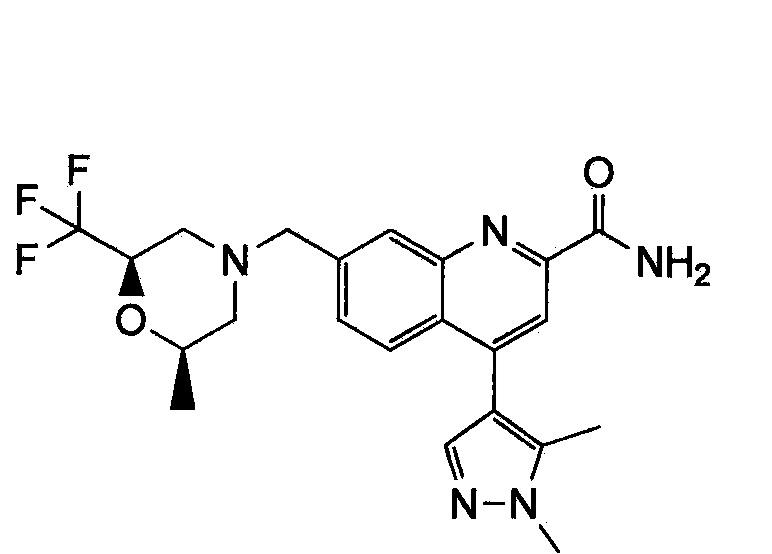
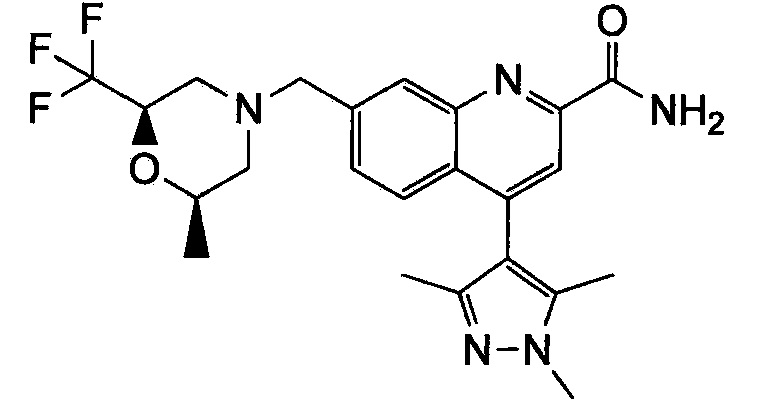
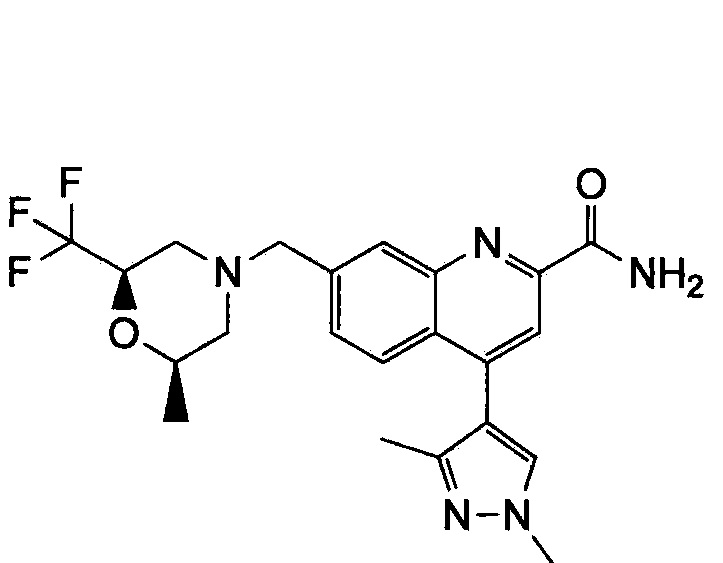
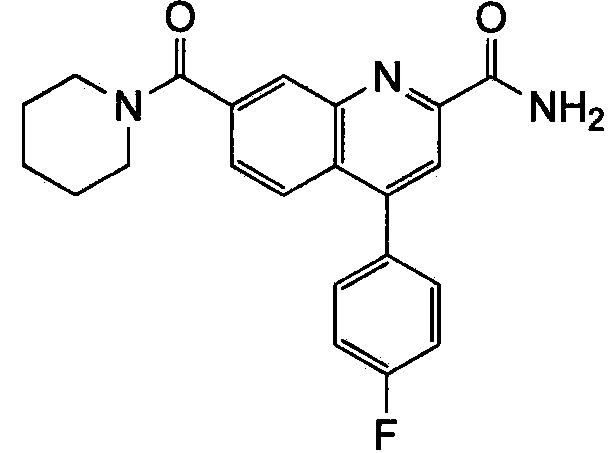
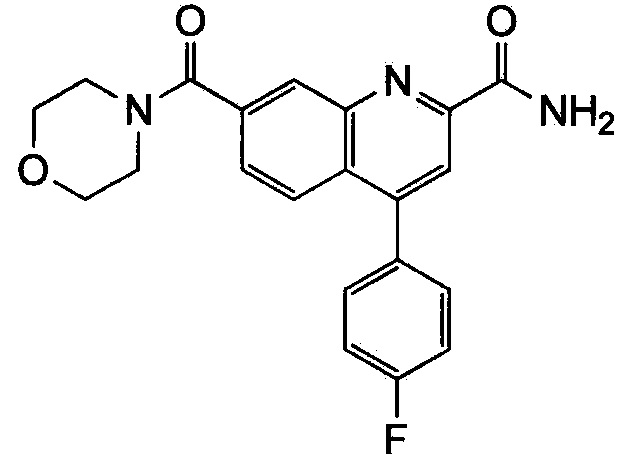
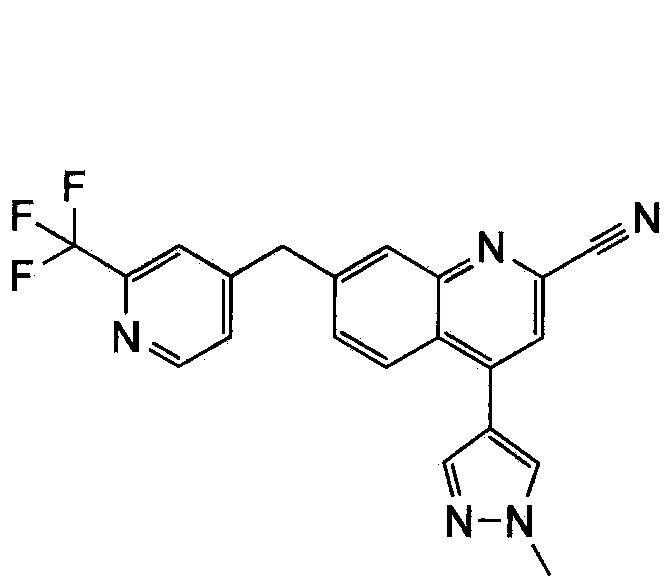
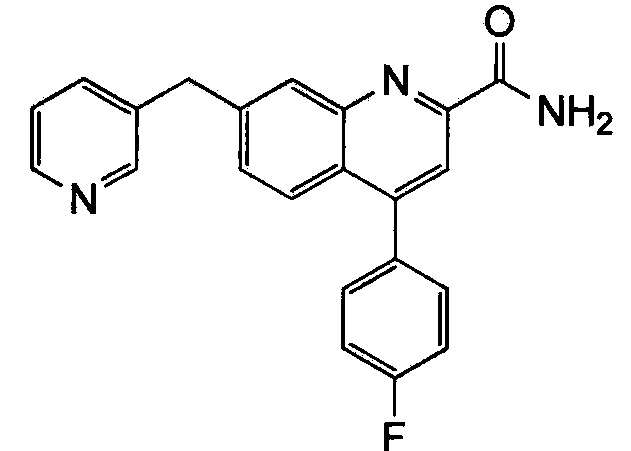
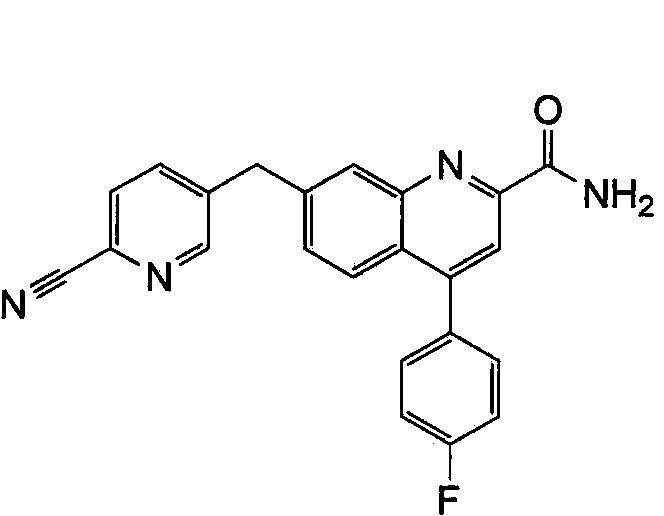
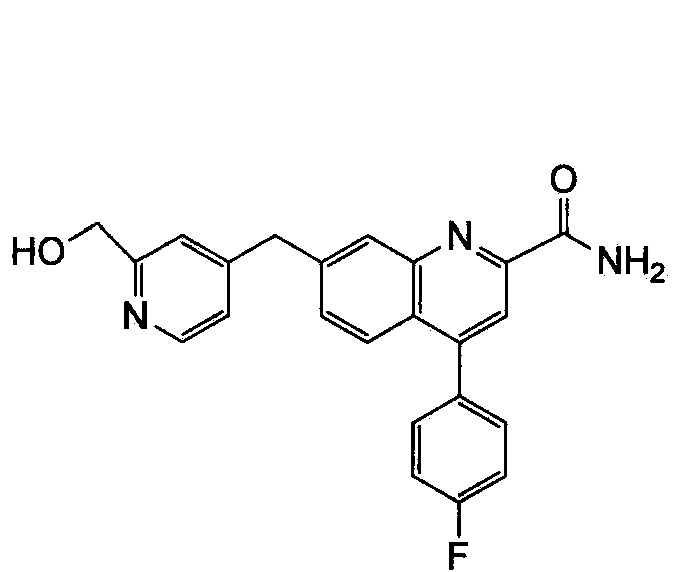
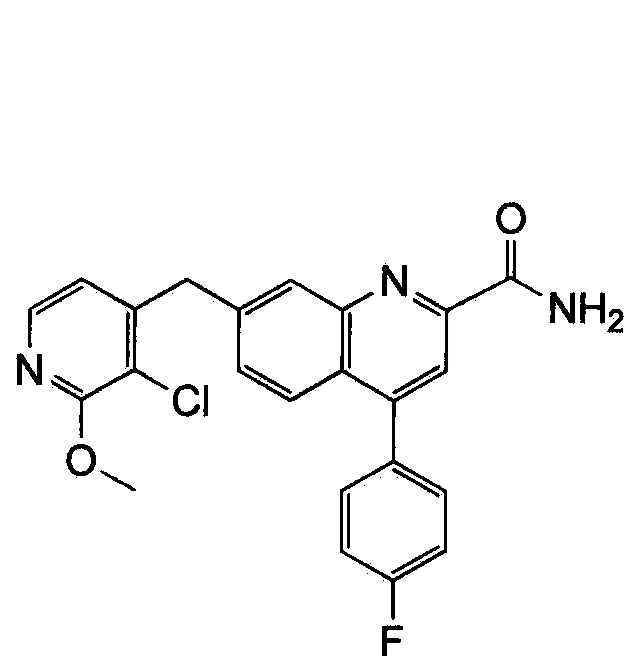
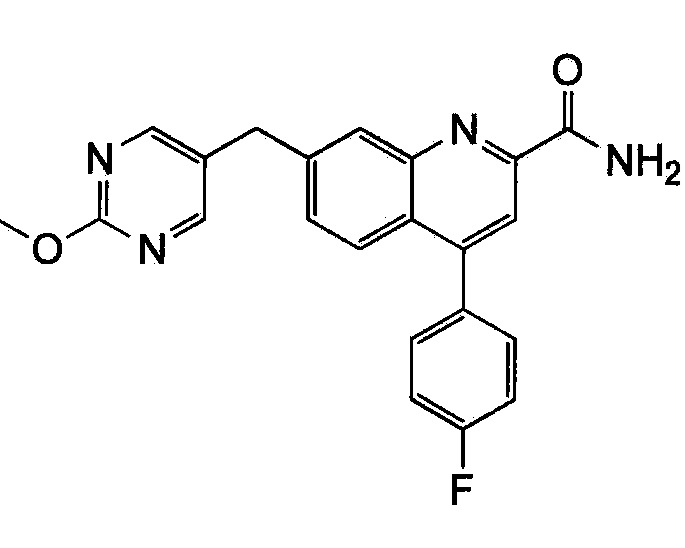
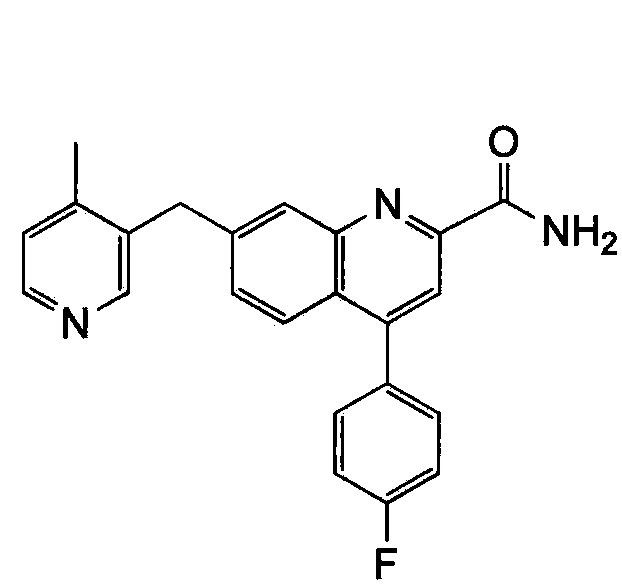
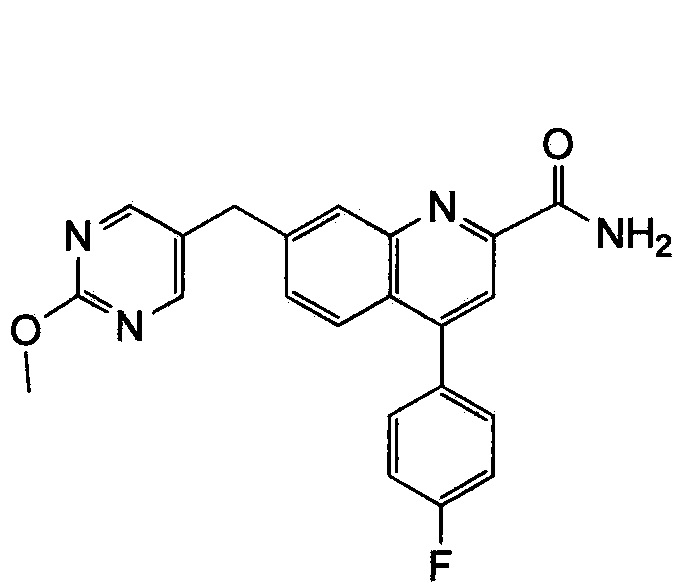
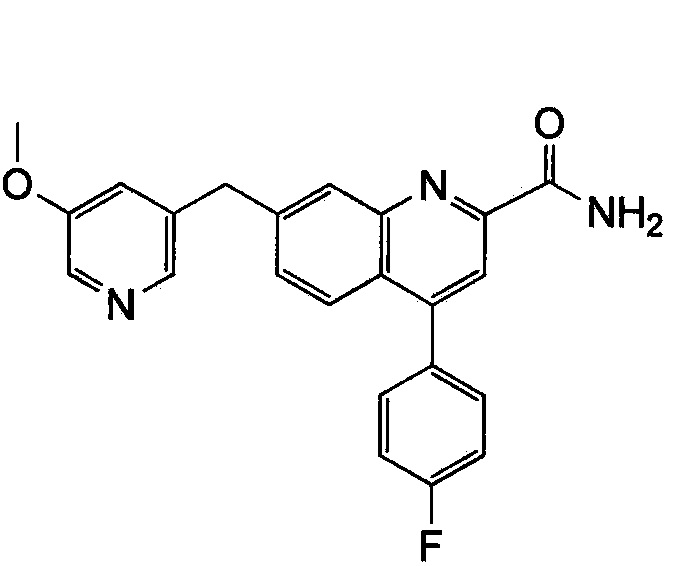
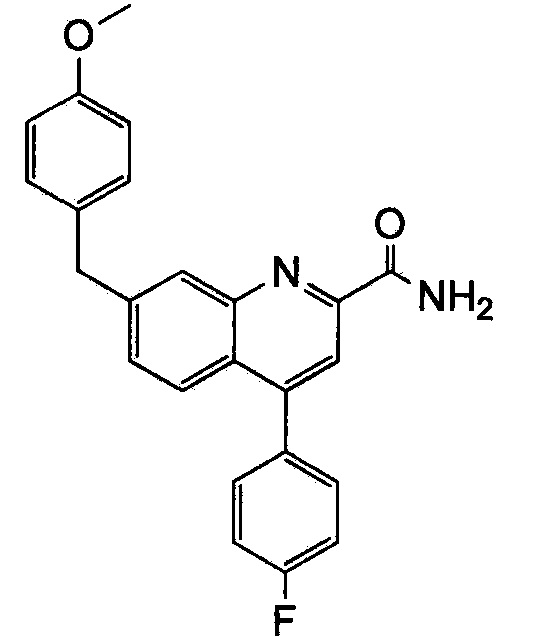
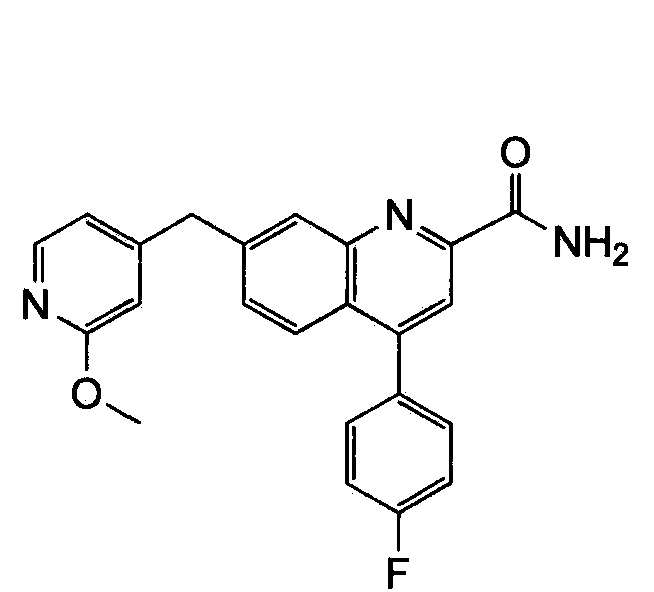
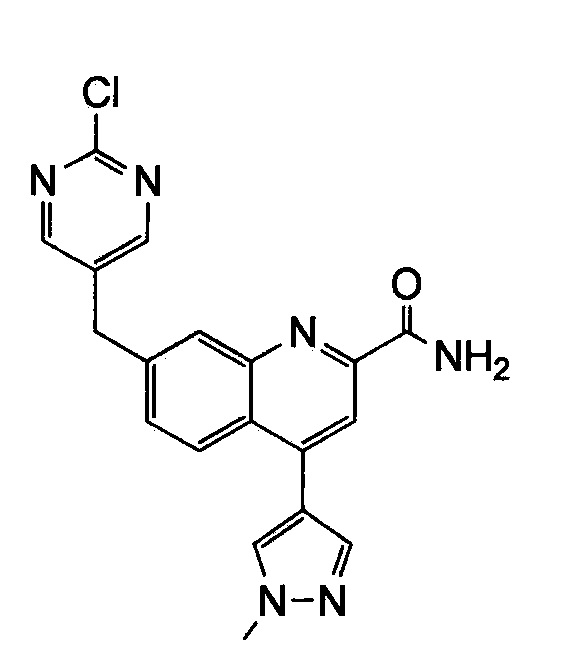
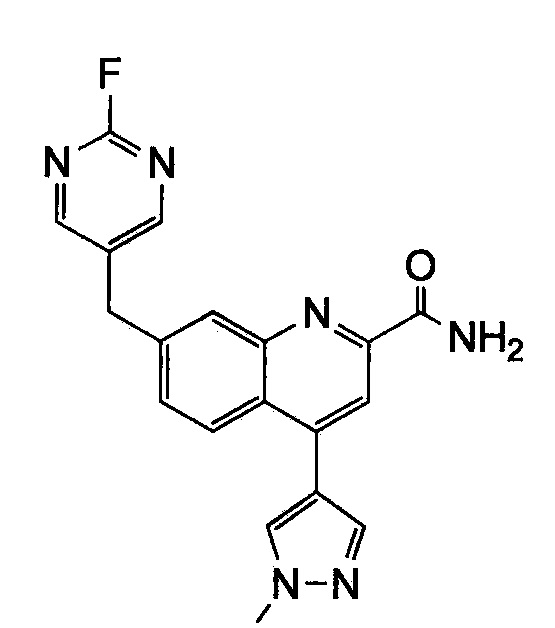
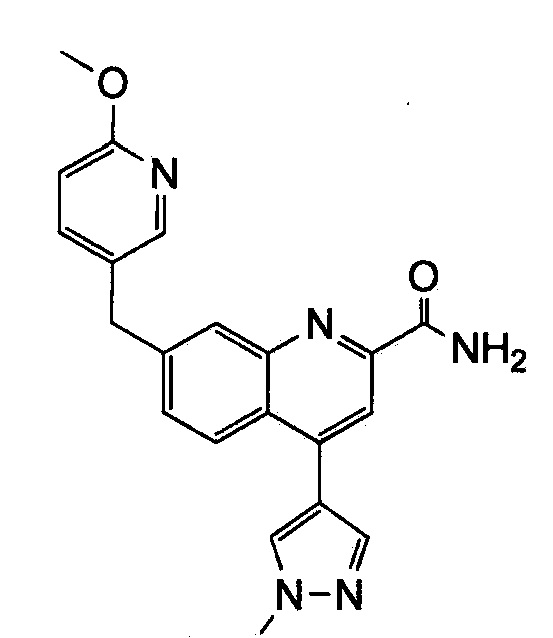
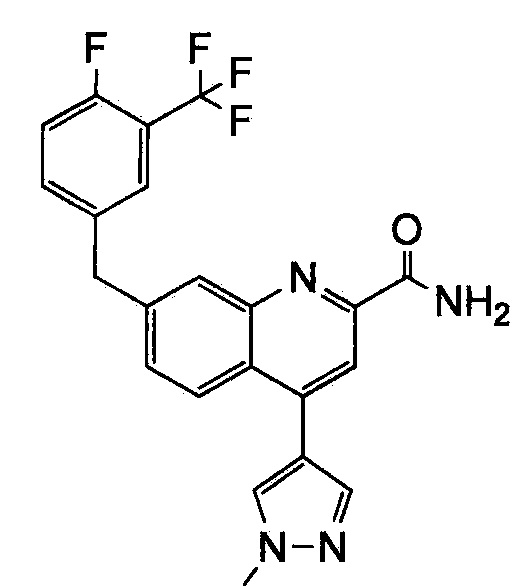
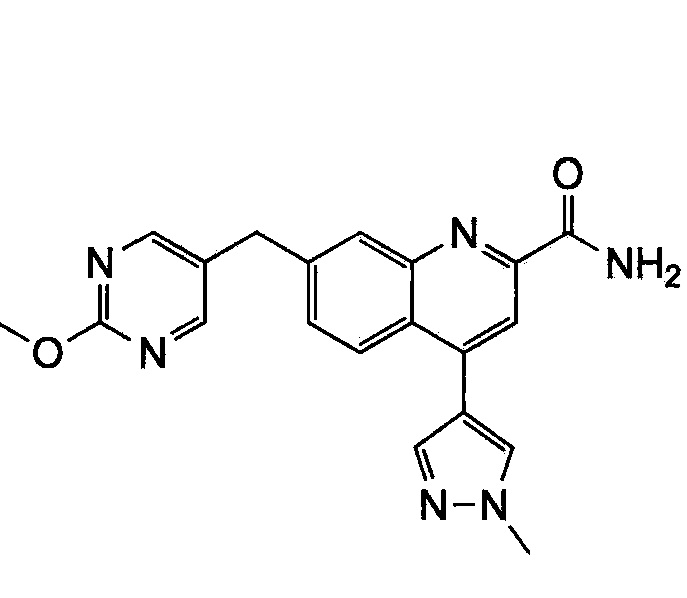
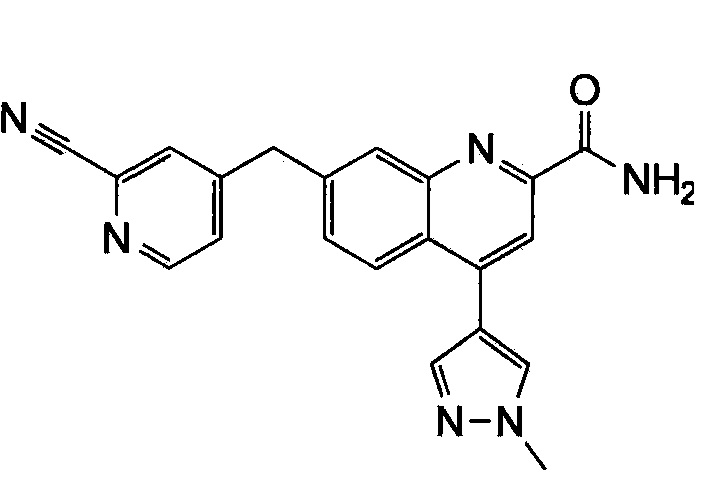
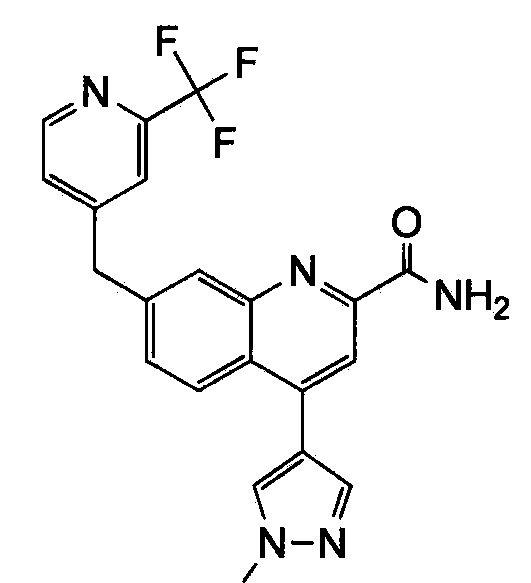
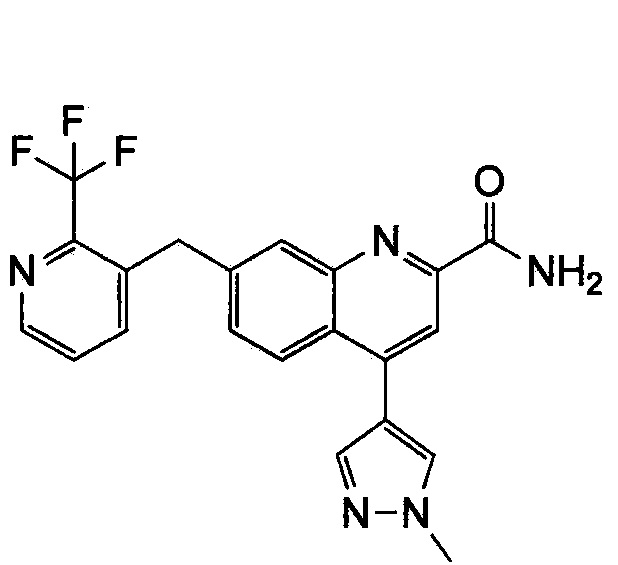
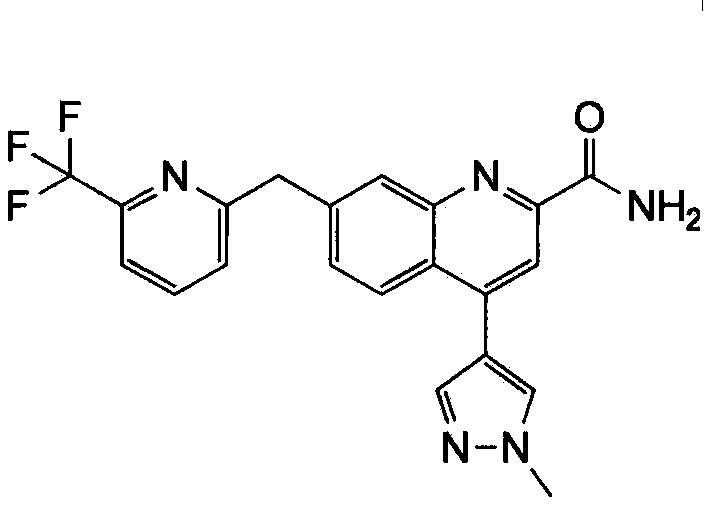
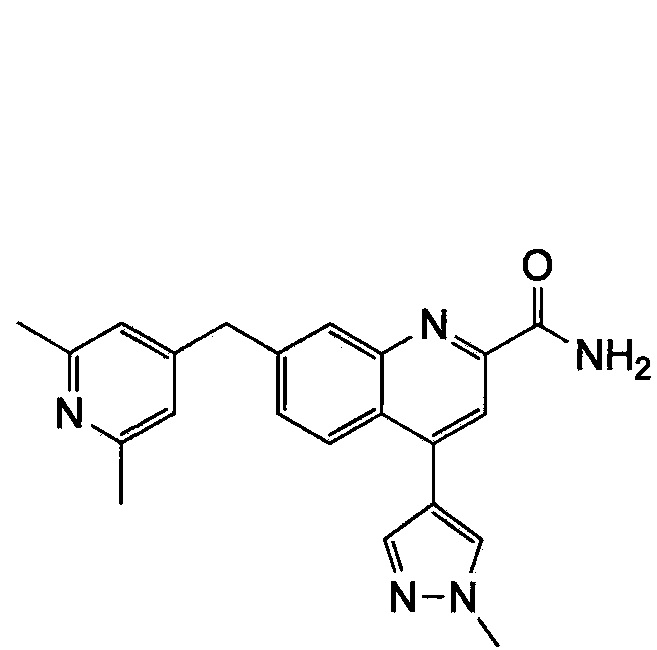
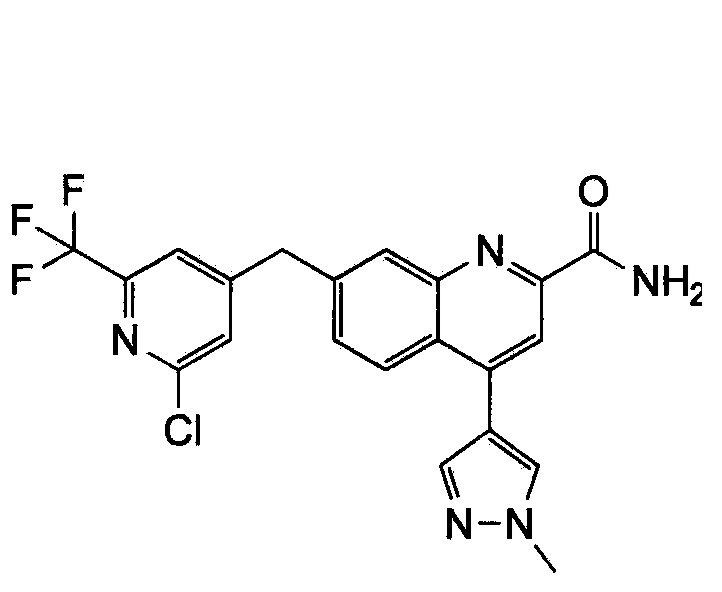
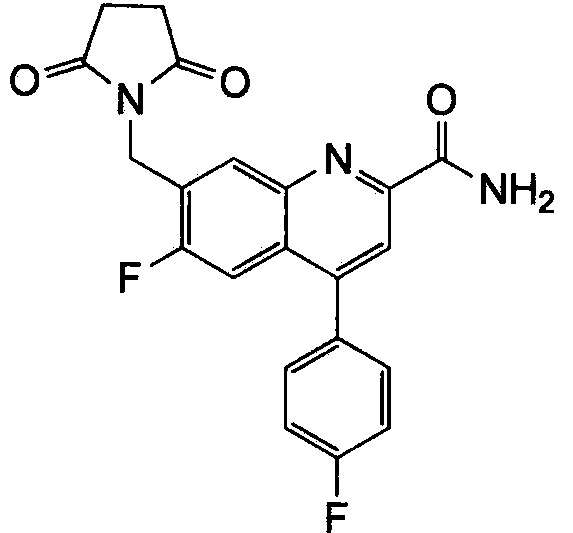
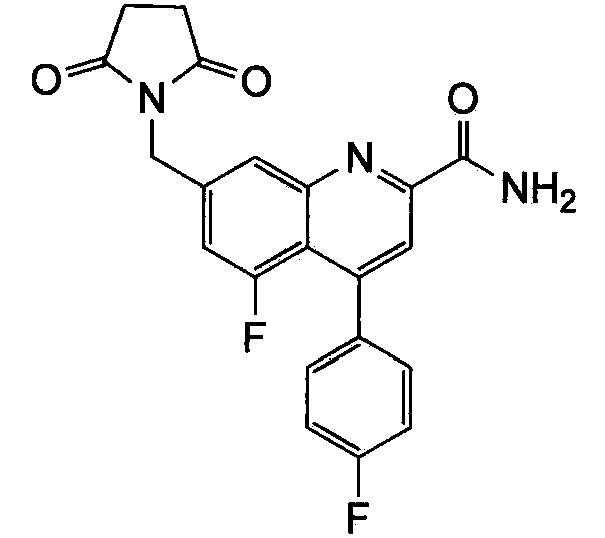
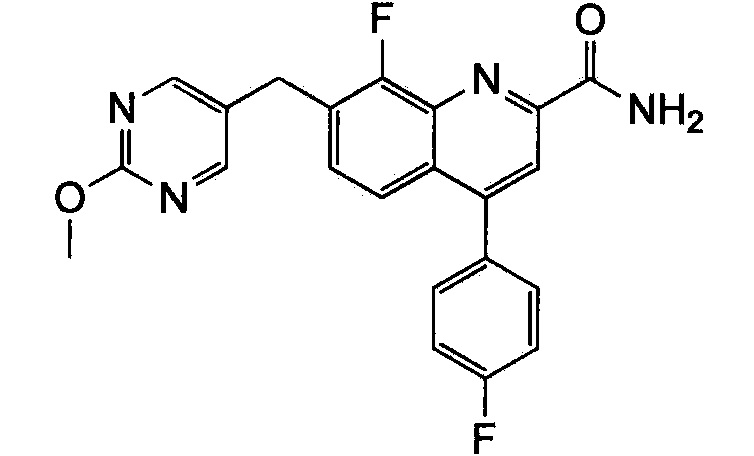
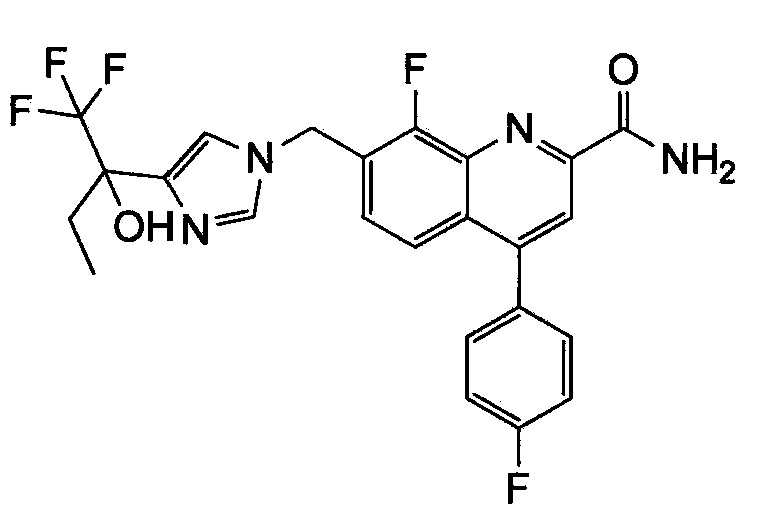
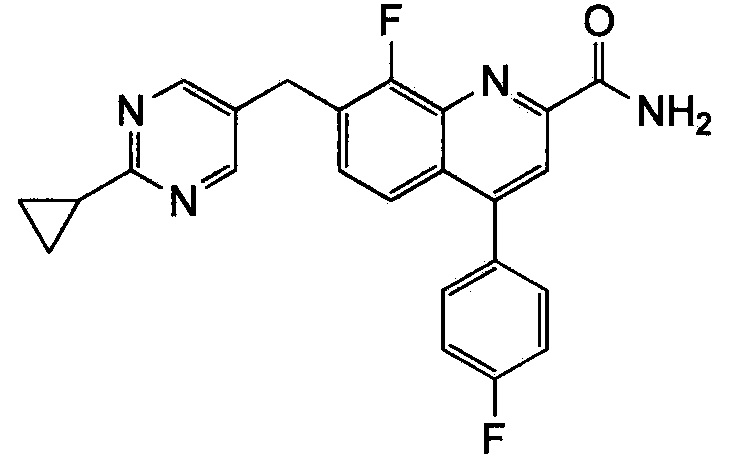
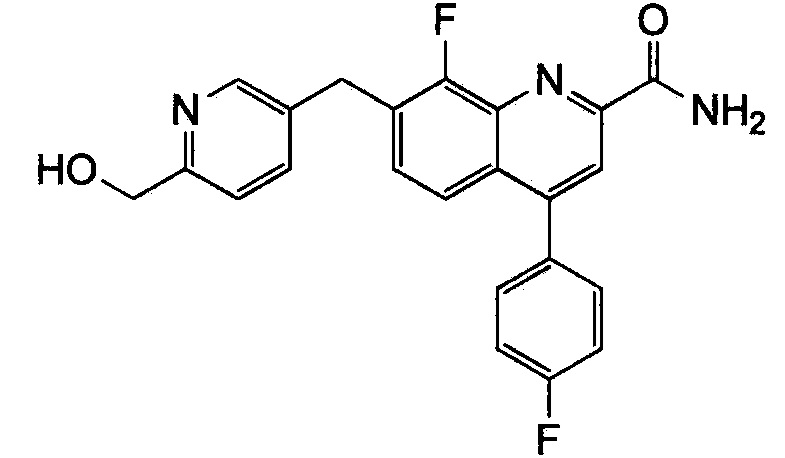
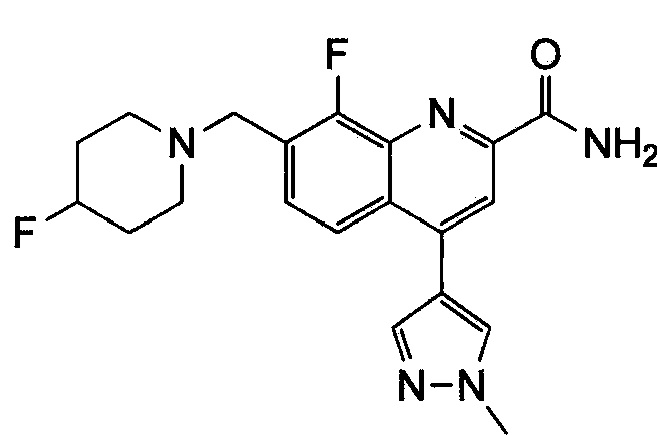
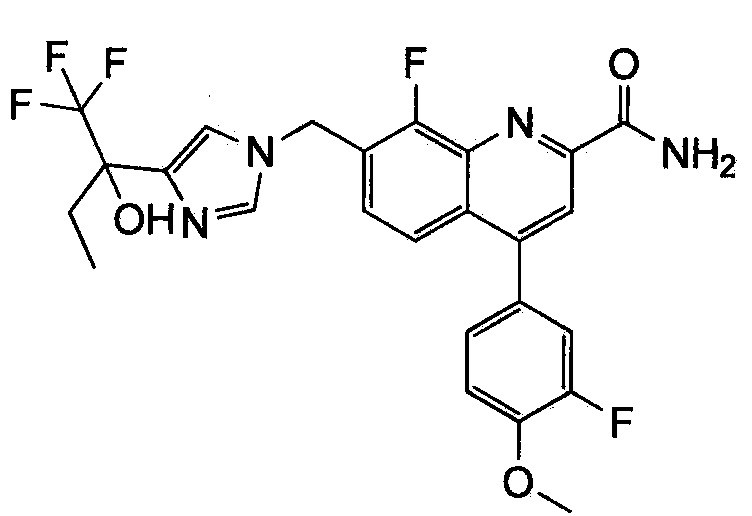
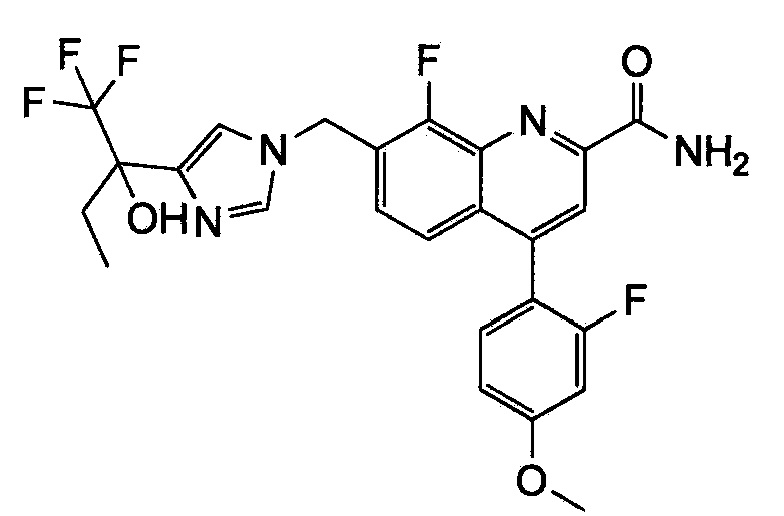
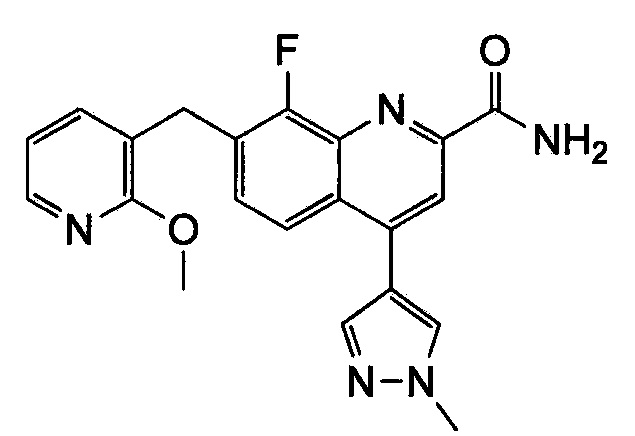
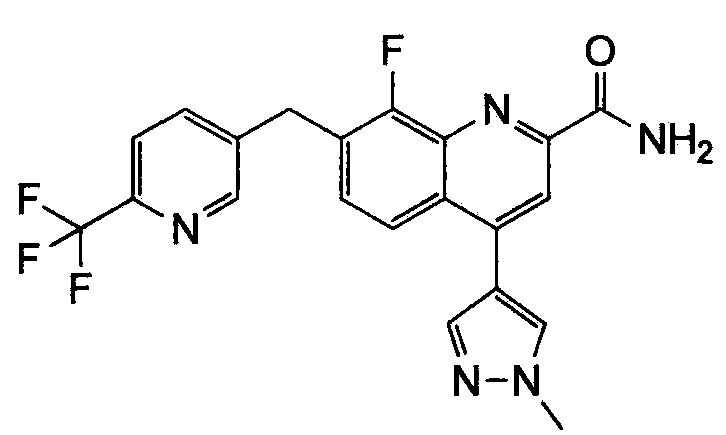
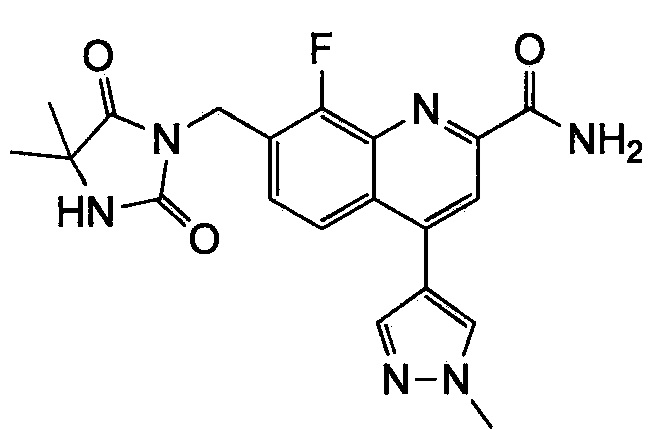
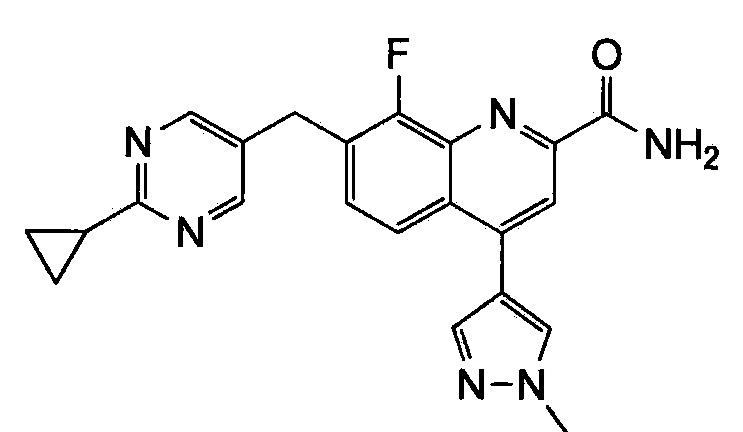
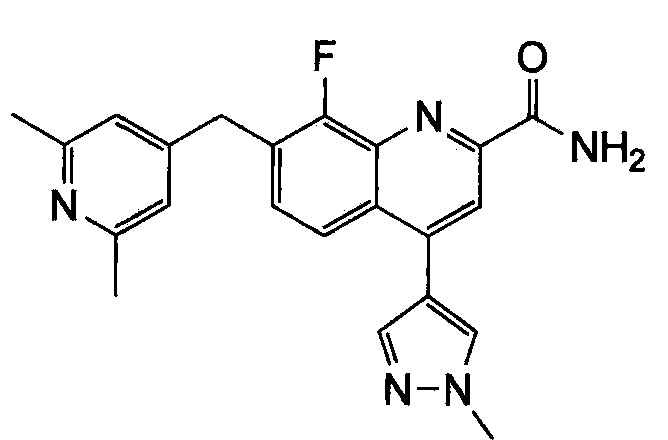
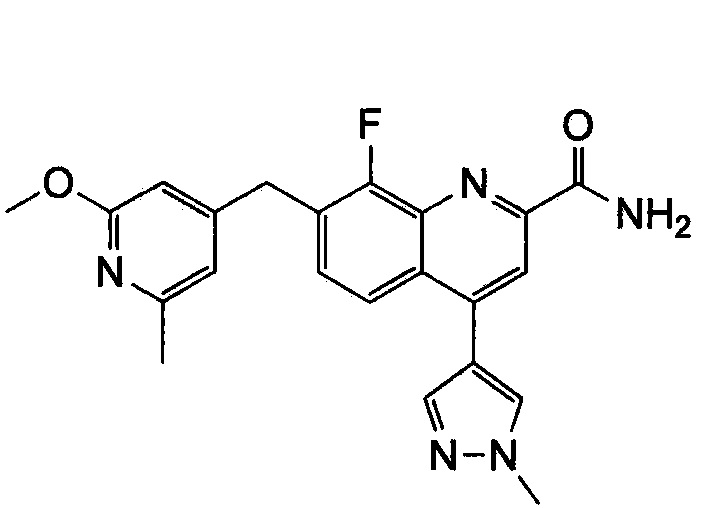
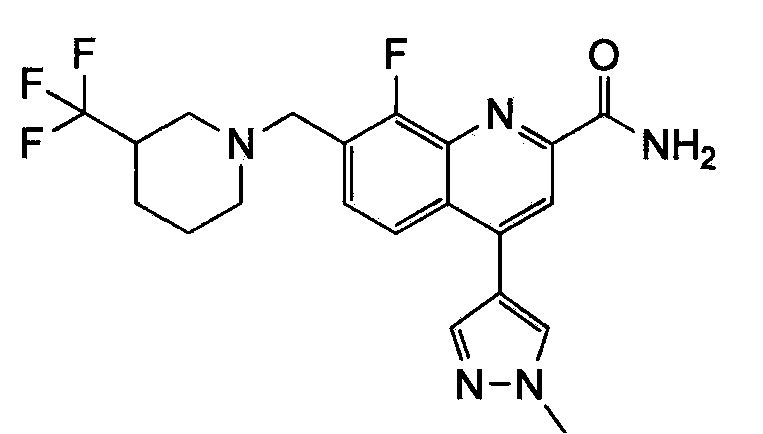
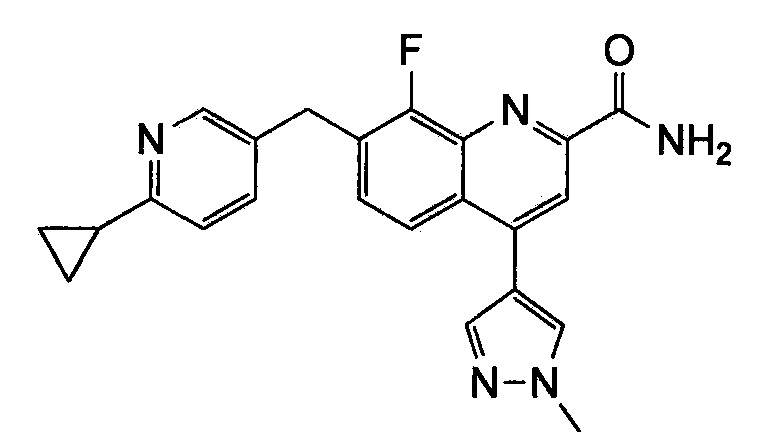
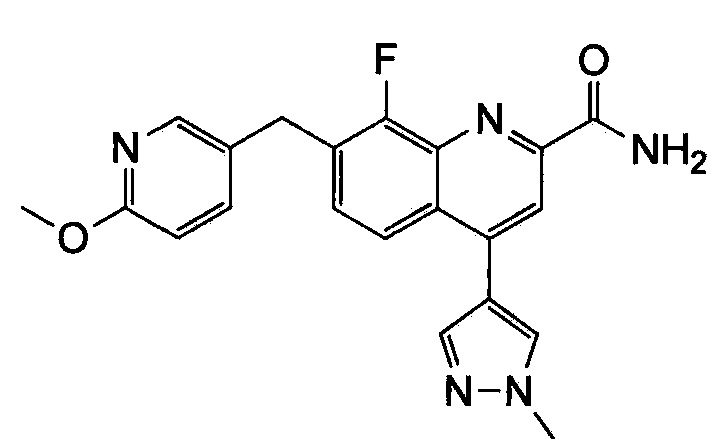
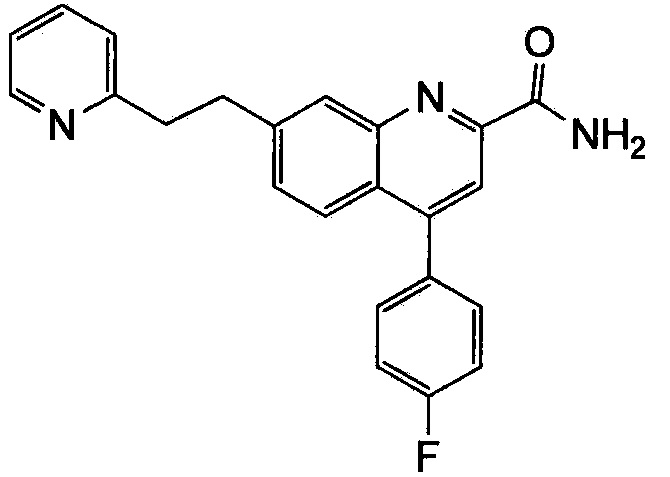
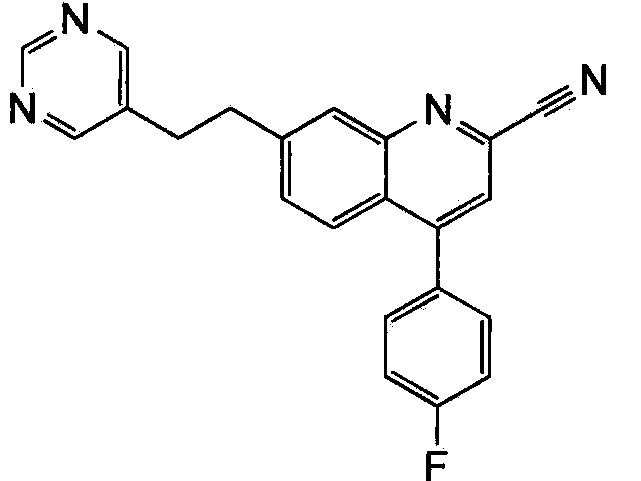
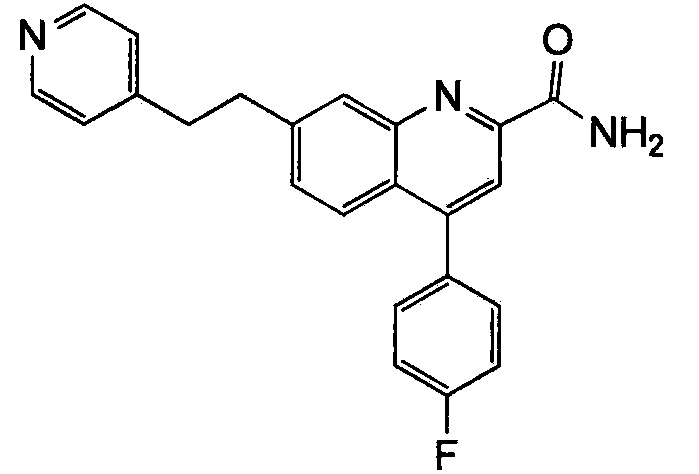
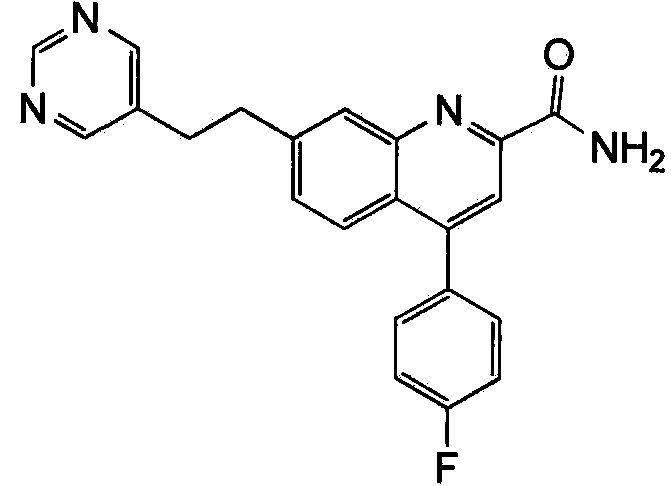
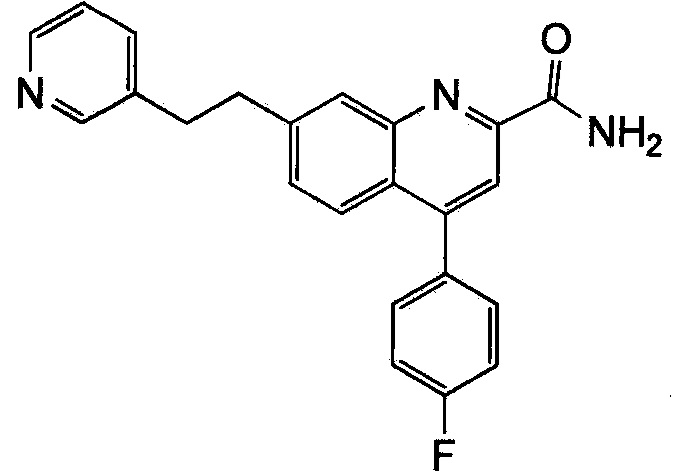
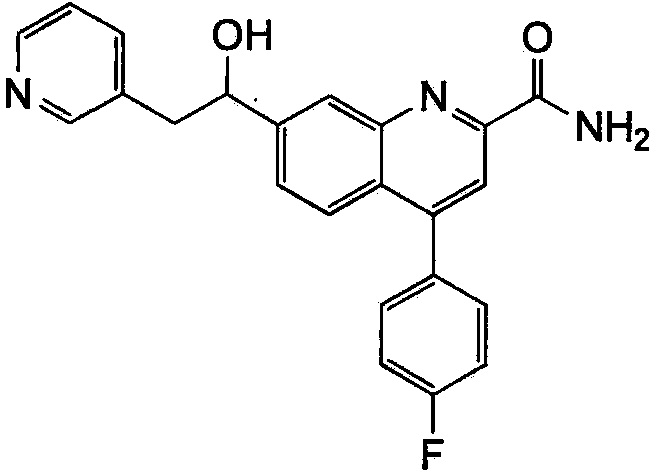
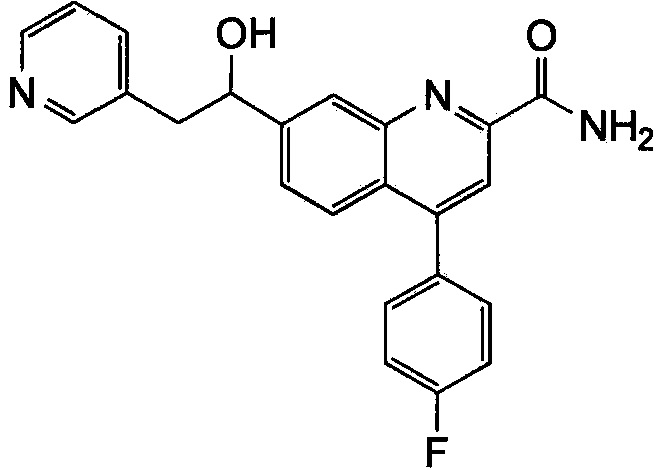
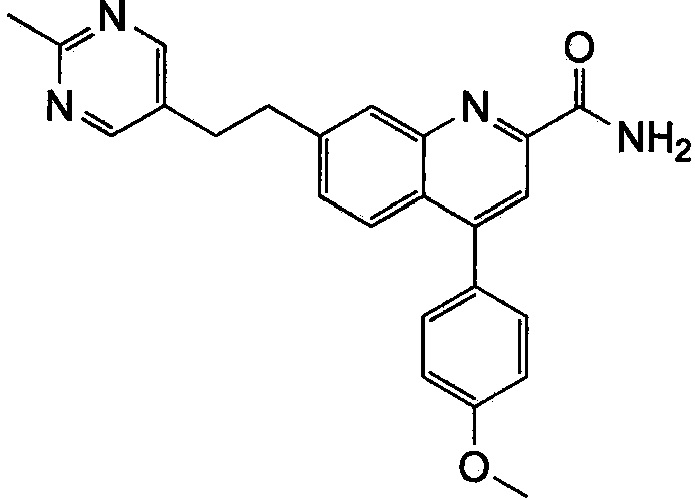
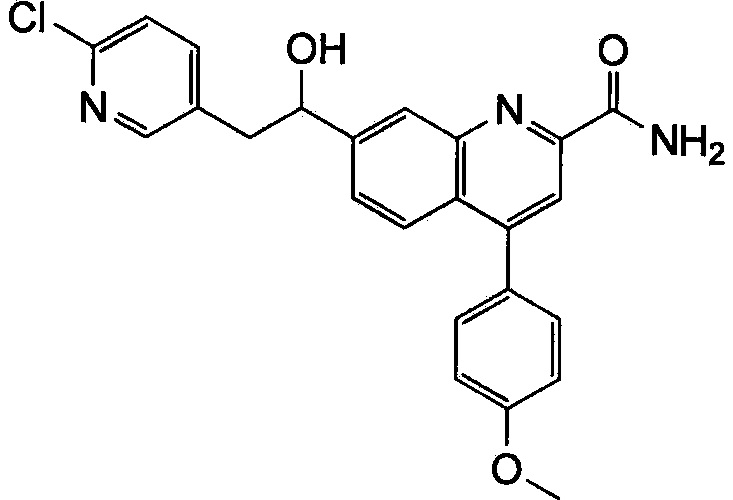
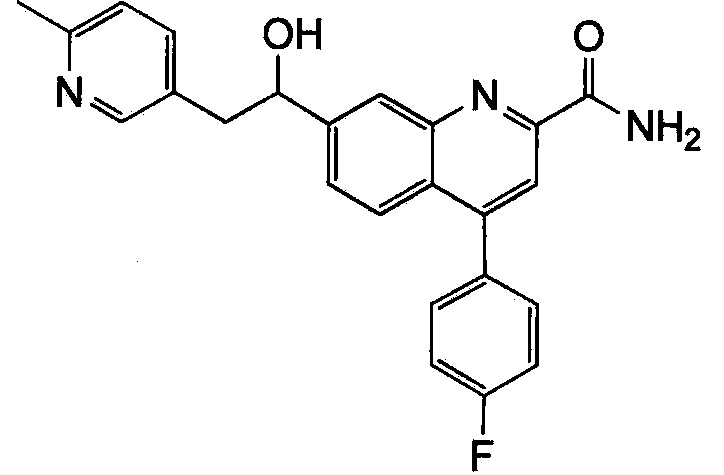
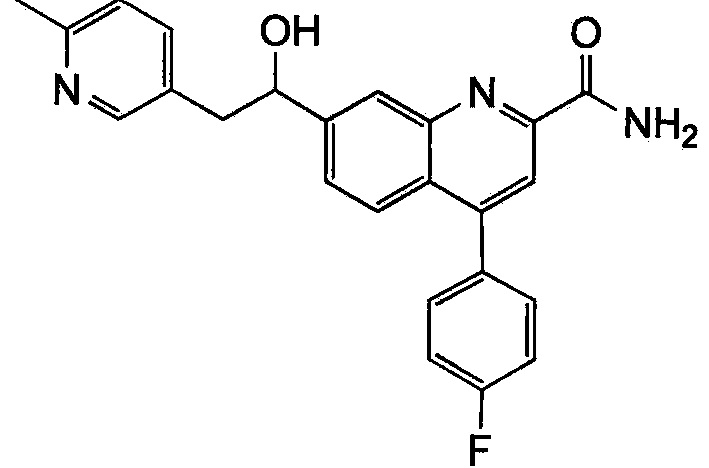
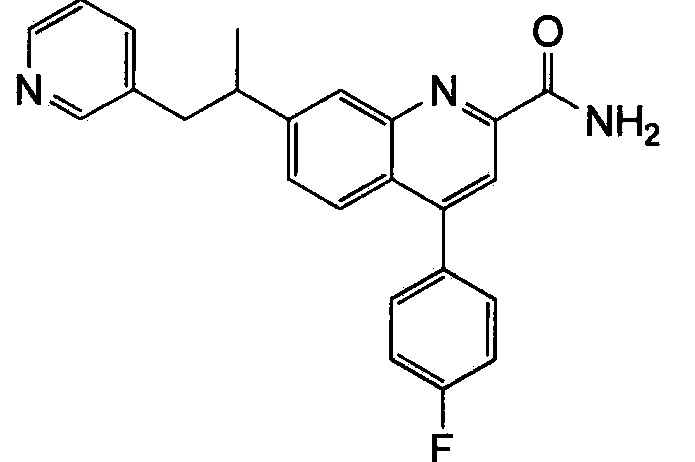
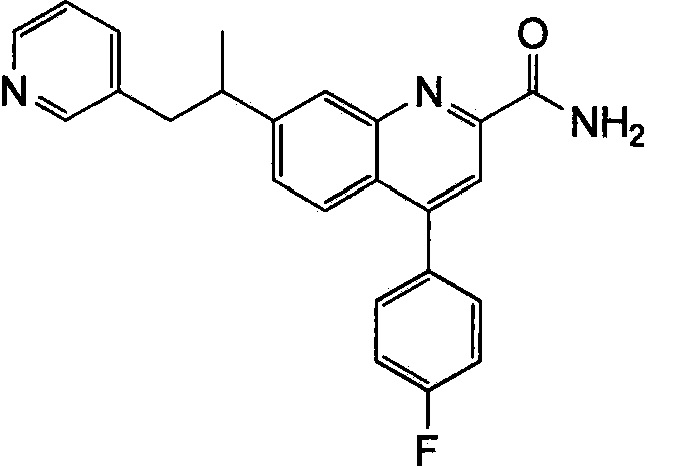
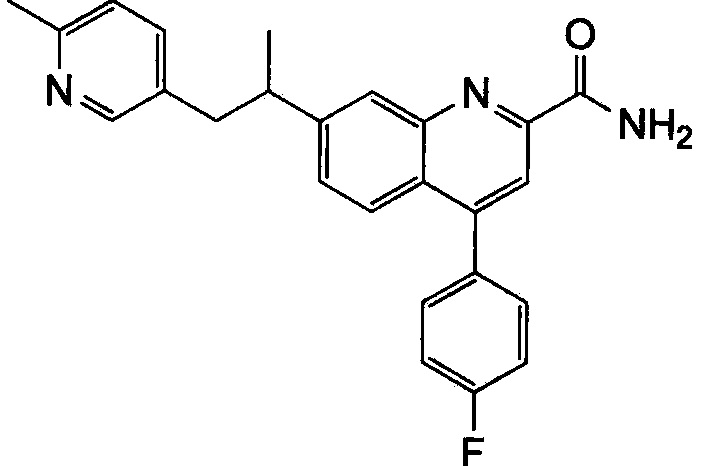
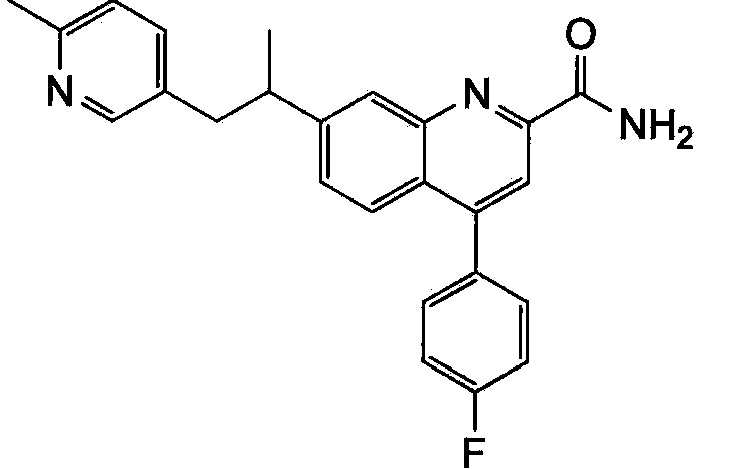
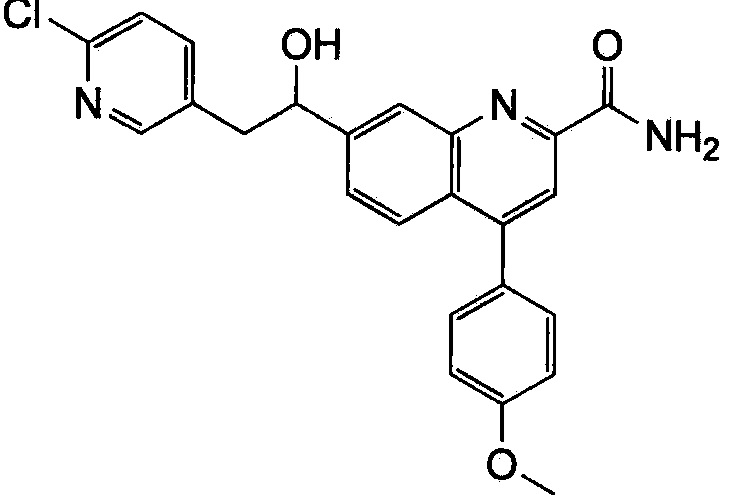
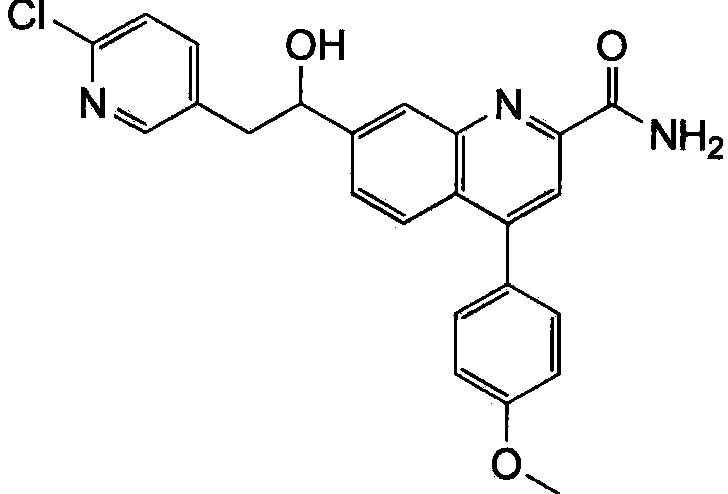
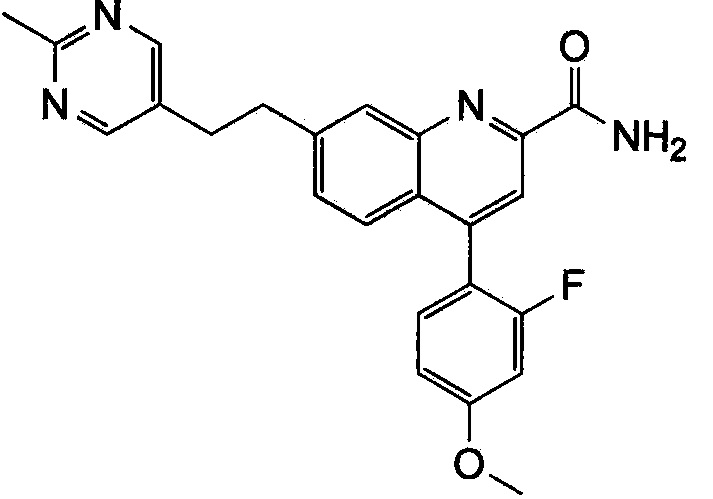
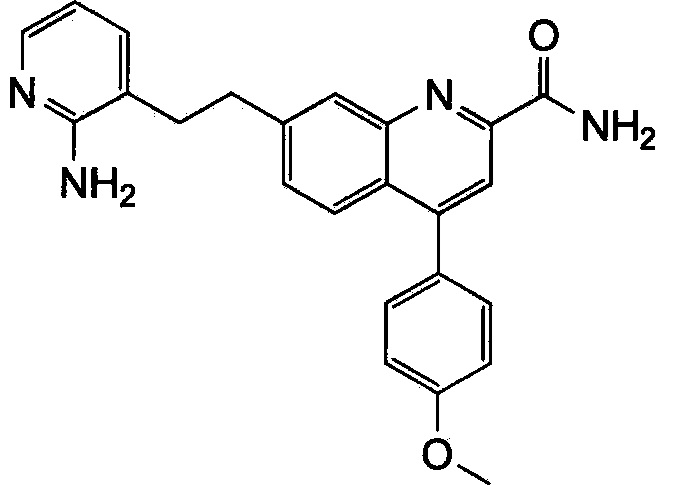
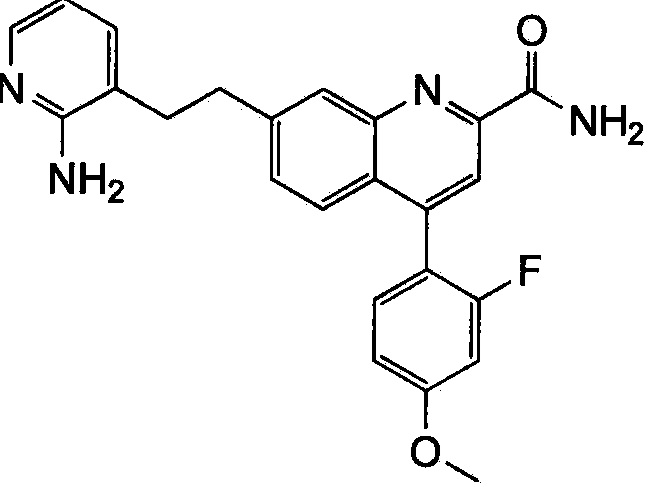
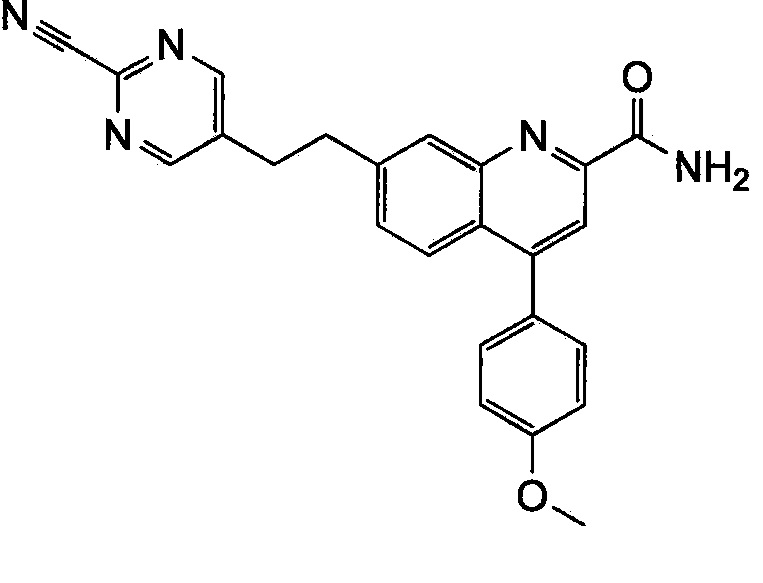
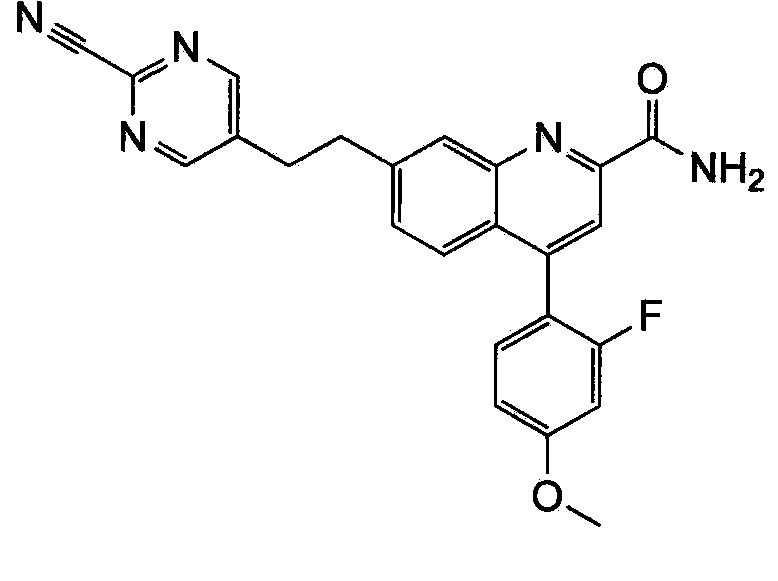
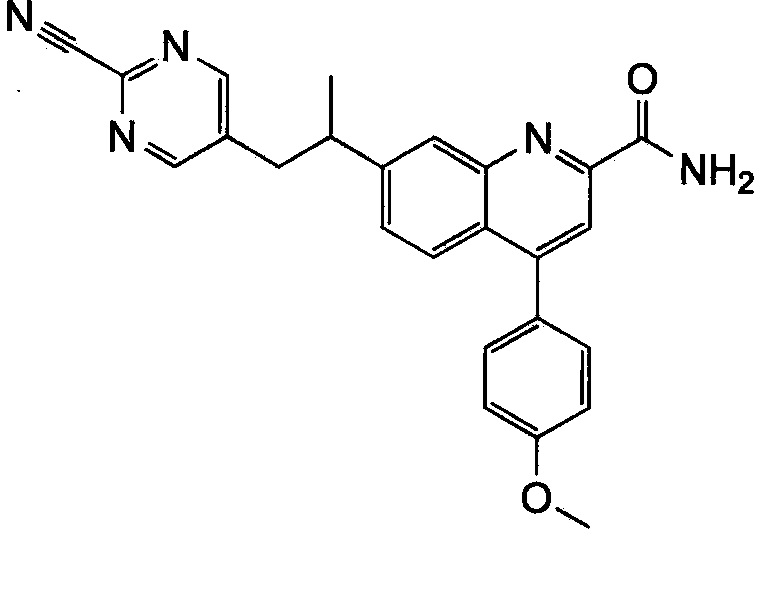
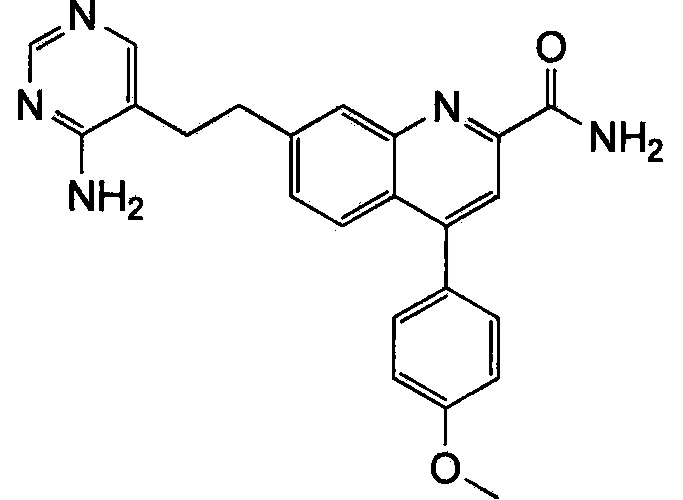
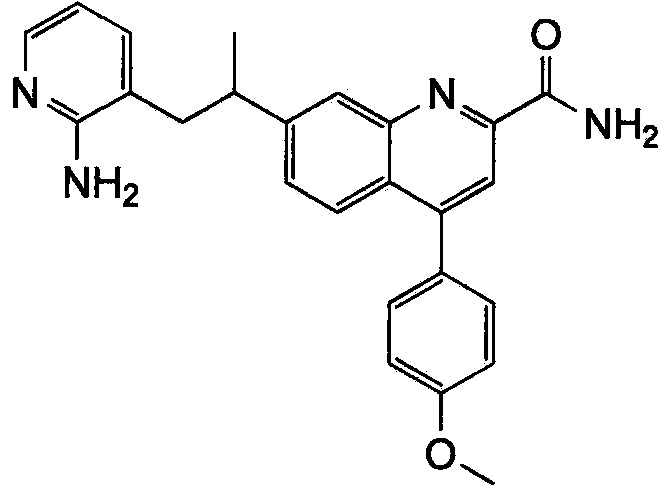
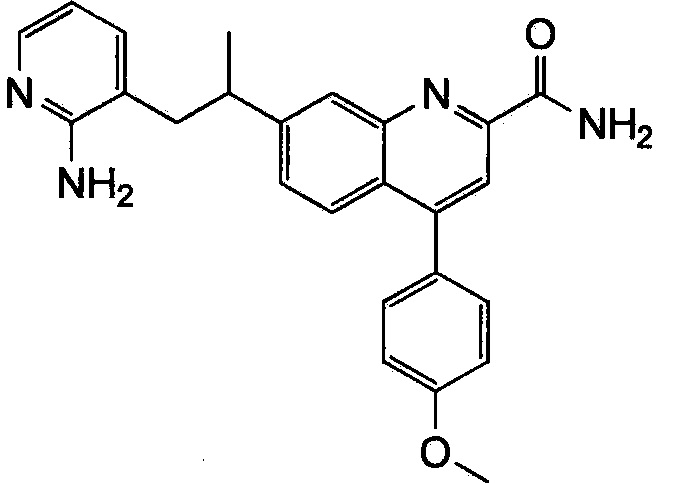
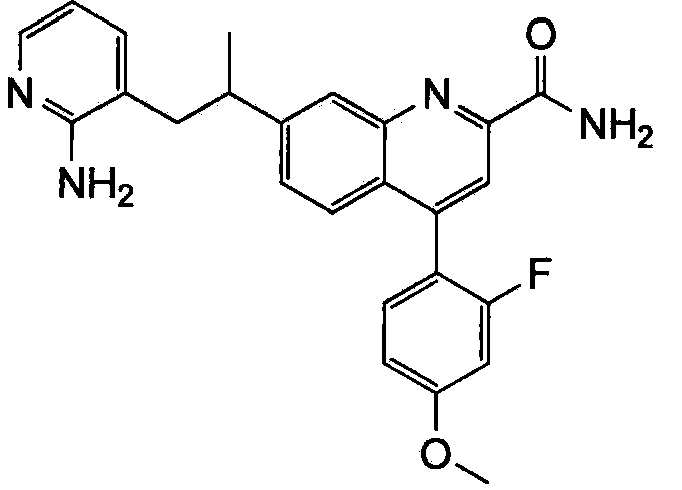
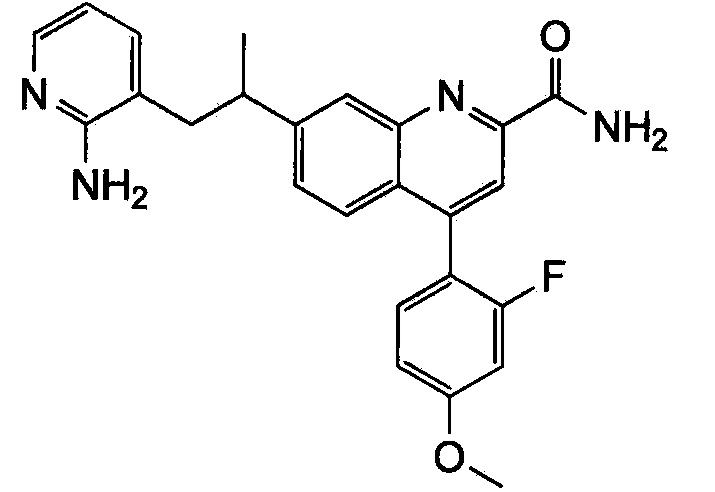
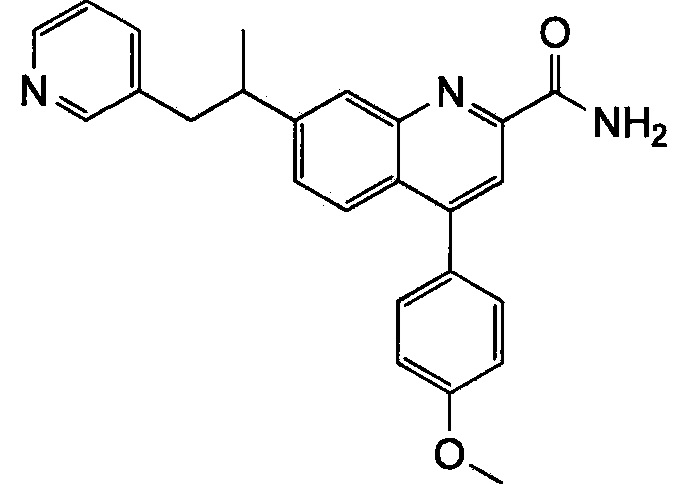
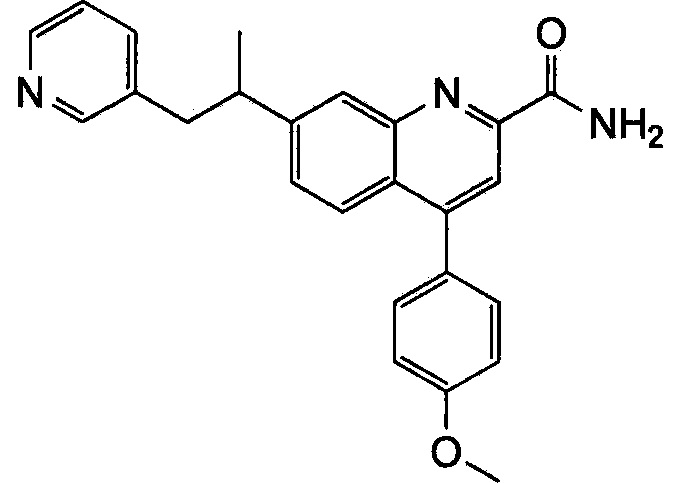
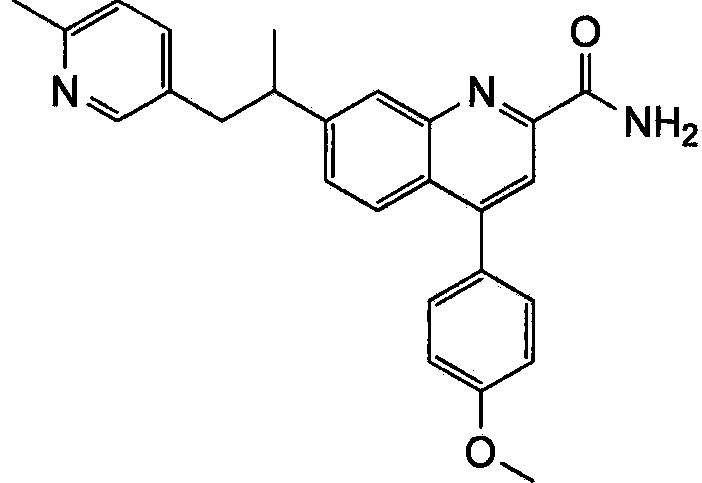
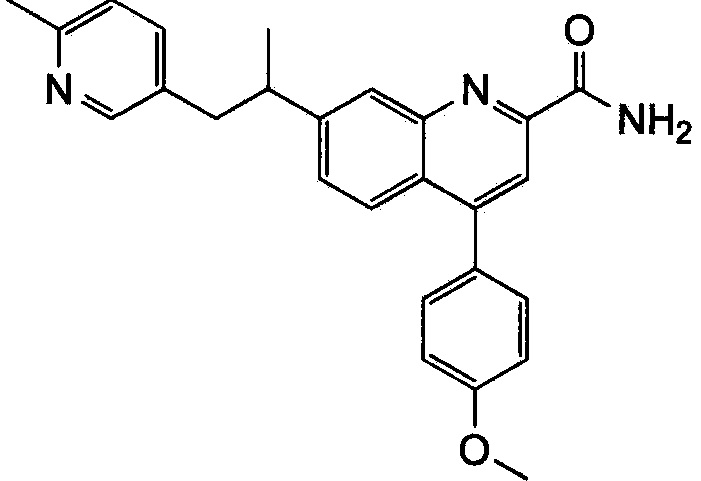
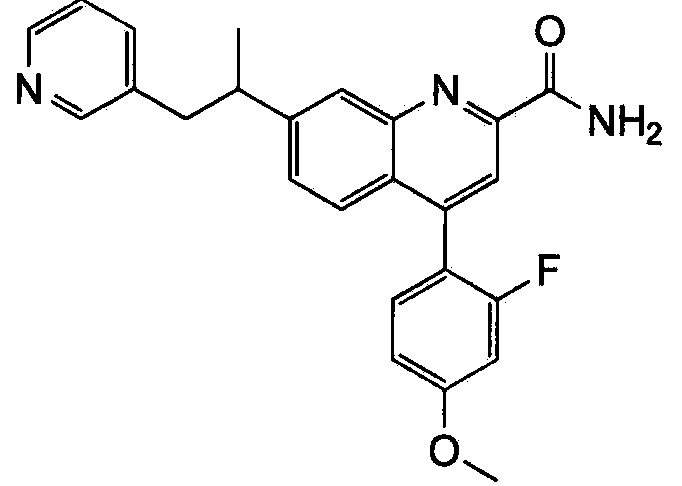
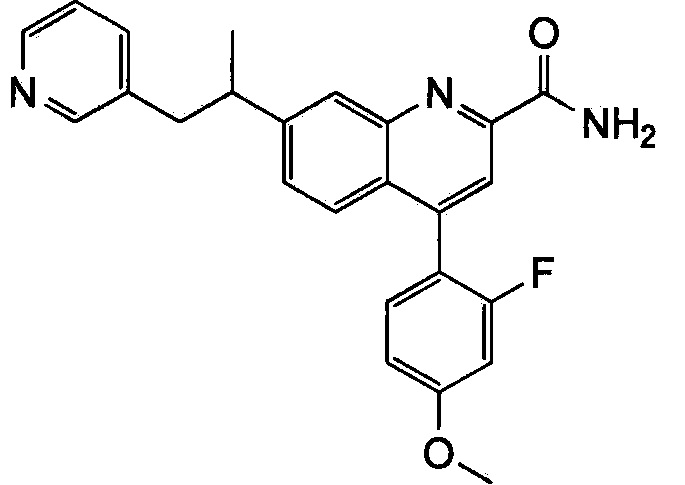
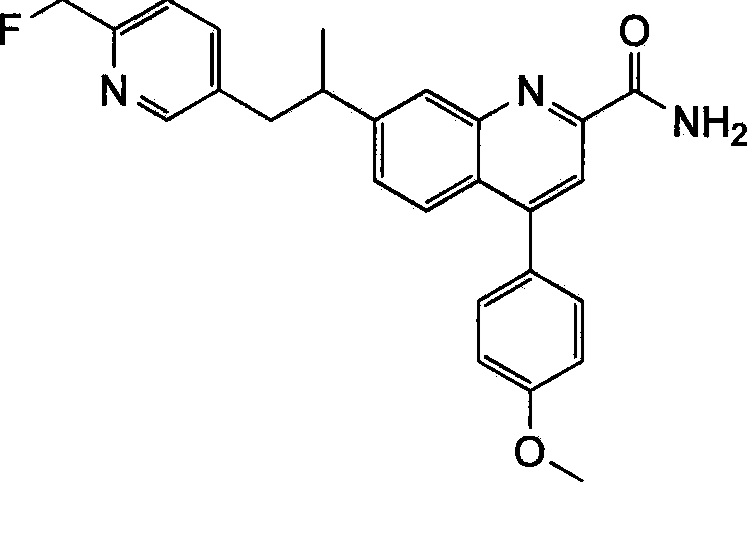
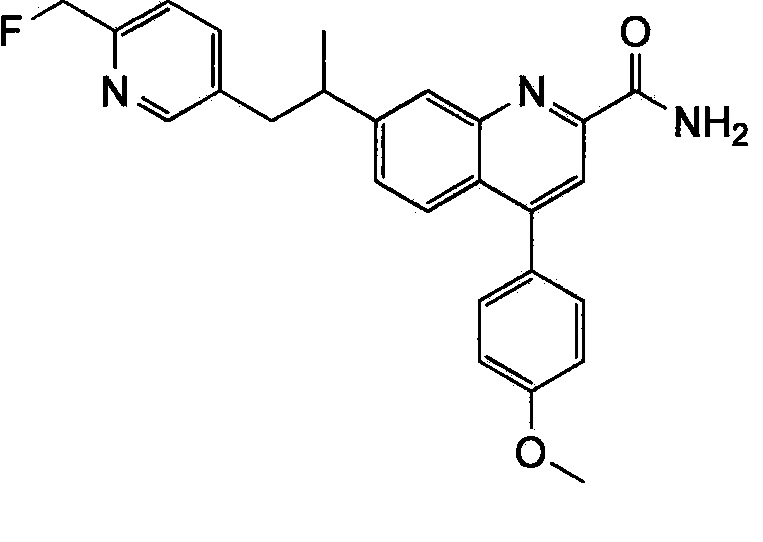
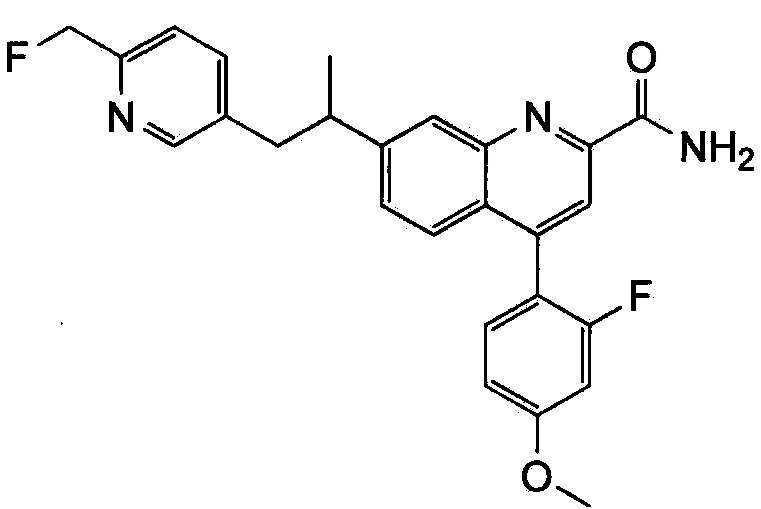
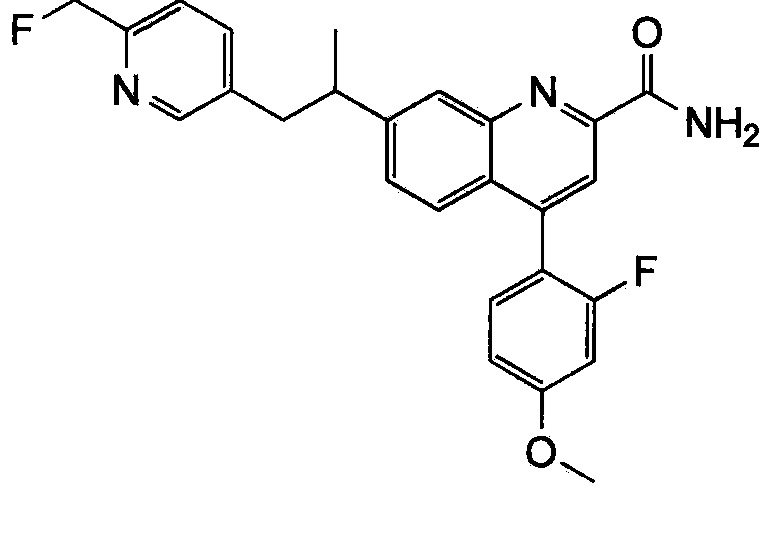
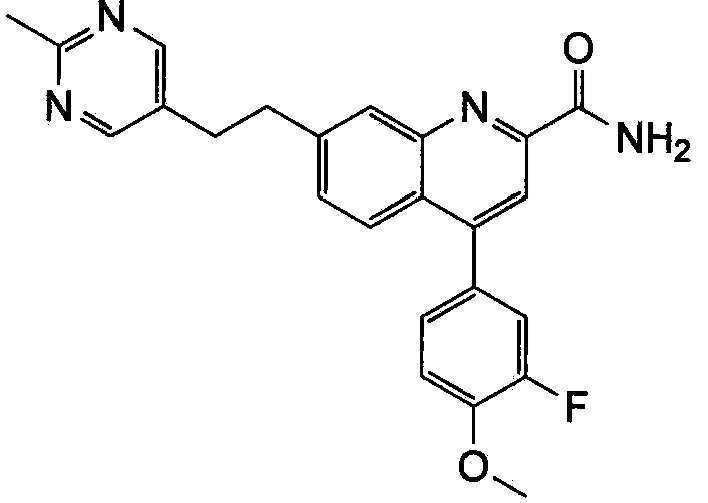
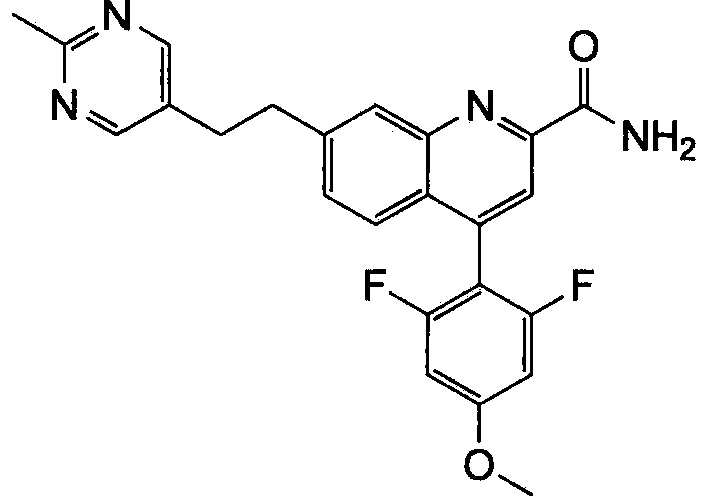
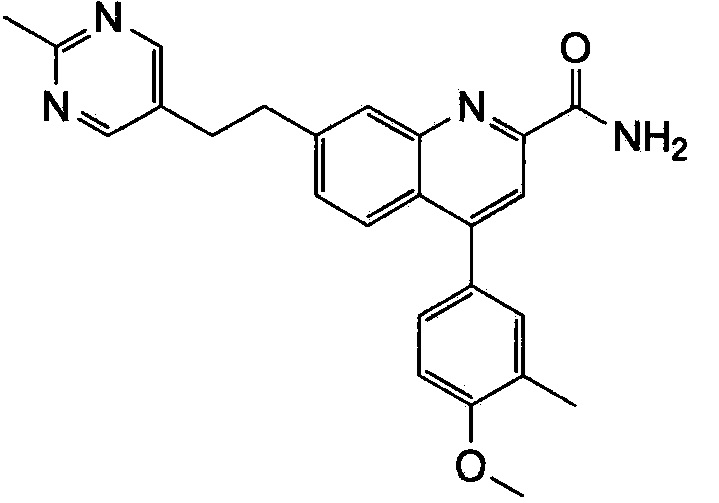
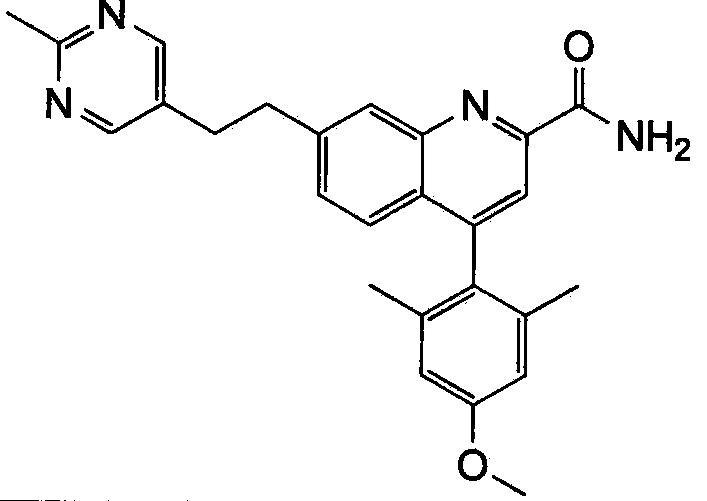
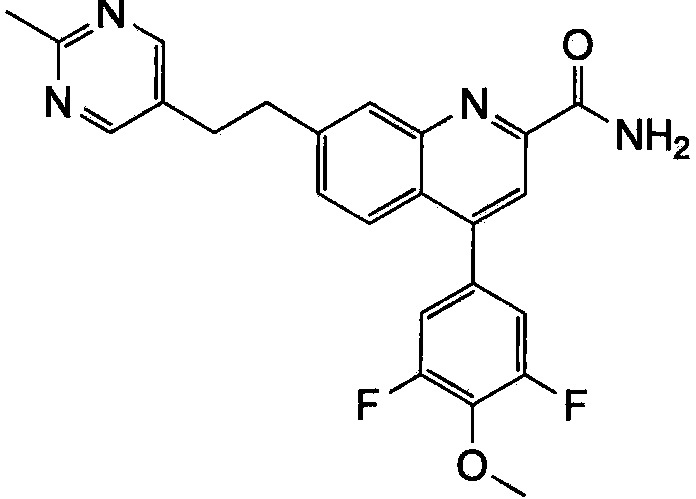
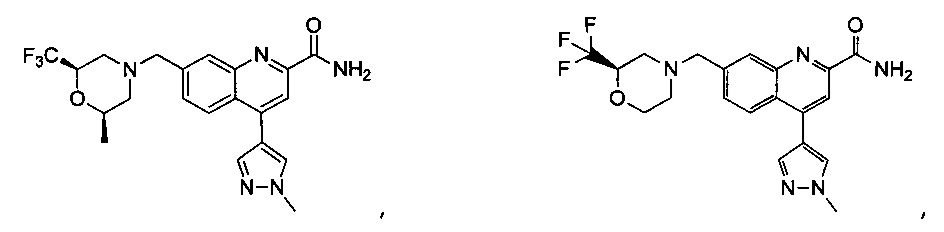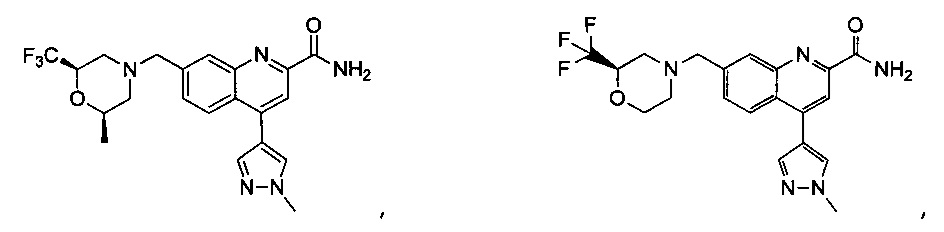Результат интеллектуальной деятельности: ХИНОЛИНКАРБОКСАМИДНЫЕ И ХИНОЛИНКАРБОНИТРИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ mGLuR2-НЕГАТИВНЫХ АЛЛОСТЕРИЧЕСКИХ МОДУЛЯТОРОВ, КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение касается некоторых хинолинкарбоксамидных и хинолинкарбонитрильных производных, их солей, содержащих их фармацевтических композиций и их применения в лечении организма человека. Хинолинкарбоксамидные производные по изобретению являются модуляторами метаботропного рецептора глутамата 2 (mGluR2) и поэтому полезны в лечении болезни Альцгеймера и других заболеваний, опосредованных рецептором mGluR2.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Болезнь Альцгеймера представляет собой общее нейродегенеративное заболевание, поражающее пожилых людей, приводящее к прогрессирующему нарушению памяти, потере речевых и зрительно-пространственных навыков и расстройствам поведения. Было продемонстрировано, что модуляция метаботропного рецептора глутамата 2, который распространен в коре головного мозга и гиппокампе и регулирует высвобождение глутамата - основного возбуждающего нейромедиатора мозга в ключевых нервных синапсах, играет главную роль в когнитивной переработке информации. Кроме того, модуляция mGluR2 улучшает когнитивное функционирование в преклинических состояниях (Higgins,G.A. et al. (2004) Pharmacological manipulation of mGlu2 receptors influences cognitive performance in the rodent. Neuropharmacology 46, 907-917).
Известно, что метаботропные рецепторы глутамата содержат один или более аллостерических участков, которые могут изменять сродство, с которым глутамат и другие лиганды mGluR связываются с первичными участками связывания или ортостерическими участками. Поскольку ортостерический участок связывания является высококонсервативным для всех известных метаботропных рецепторов глутамата, функциональная селективность может быть лучше всего достигнута через аллостерическое взаимодействие с рецептором.
Некоторые замещенные хинолинкарбоксамиды и хинолинкарбонитрилы известны из уровня техники. Смотри, например, заявки на патент США № 2008/0188521, WO2007/038865, WO1996/13500, каждая из которых раскрывает соединения как ингибиторы лейкотриенов, и заявку на патент Канады № 2169231, раскрывающую соединения как ингибиторы лейкотриенов и ингибиторы SRS-A. Сохраняется потребность в данной области в новых соединениях, являющихся эффективными в качестве неконкурентных модуляторов mGluR2 и/или негативных аллостерических модуляторов (NAM) mGluR2.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены некоторые новые замещенные хинолинкарбоксамидные и хинолинкарбонитрильные производные, которые в совокупности или в отдельности именуются здесь как "соединение (соединения) по изобретению", как описано здесь. Соединения по изобретению полезны в качестве неконкурентных антагонистов mGluR2 или негативных аллостерических модуляторов (NAM) mGluR2 и в способах лечения пациента (предпочтительно человека) от болезней или расстройств, в которые вовлечен рецептор mGluR2-NAM, таких как болезнь Альцгеймера, когнитивное нарушение, шизофрения и другие расстройства настроения, болевые расстройства и расстройства сна, посредством введения пациенту терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Изобретение также касается фармацевтической композиции, которая включает эффективное количество соединения по изобретению или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, и применения соединений и фармацевтических композиций по изобретению в лечении таких заболеваний.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
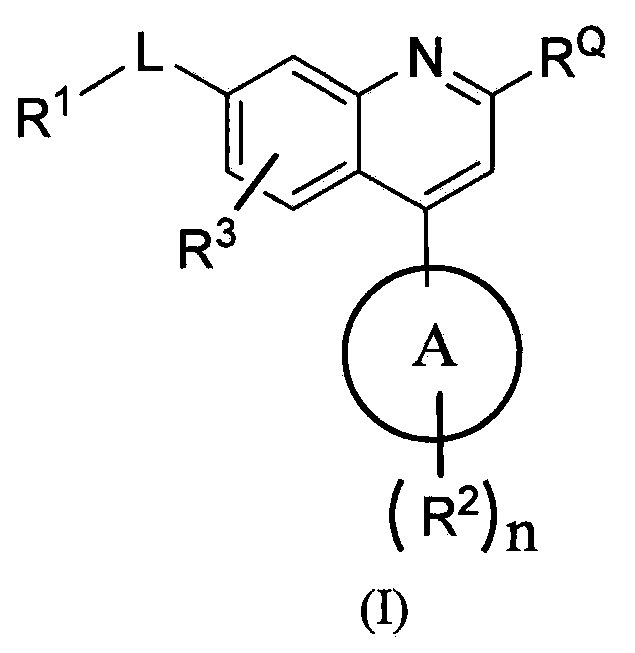
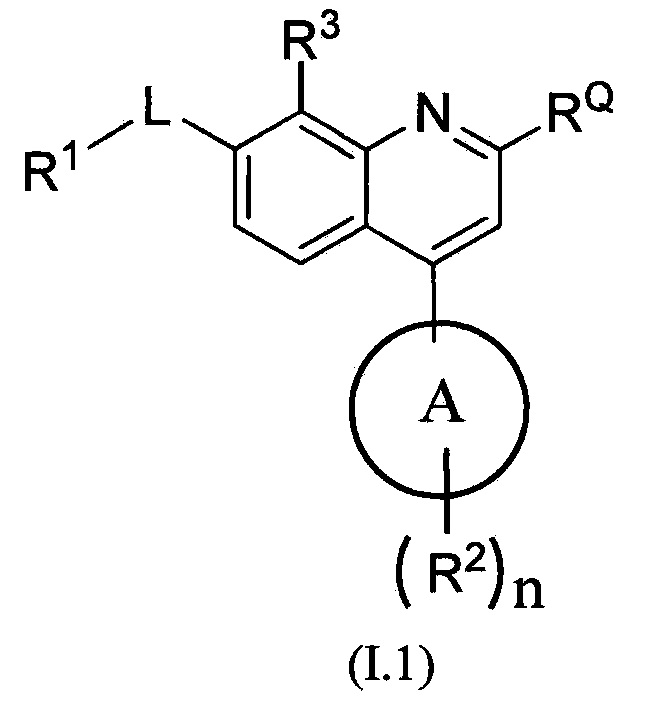
В одном из вариантов осуществления предлагаются соединения по изобретению, которые имеют структурную формулу (I):
 ,
,
или их стереоизомер, или фармацевтически приемлемая соль указанного соединения или указанного стереоизомера, где:
цикл A означает группу, выбираемую из группы, состоящей из фенила, -(C5-C6)-циклоалкила, -(C5-C6)-циклоалкенила, -пиридинила, пиримидинила, -пиразолила, -тиенила, -тиазолила, -тиадиазолила и -оксазолила;
RQ выбирают из группы, состоящей из -CN и -C(O)NH2;
-L- означает связь или двухвалентную группу, выбираемую из группы, состоящей из:
-(C(R1L)2)P-,  -C(O)-, -S(O)- и -S(O)2-;
-C(O)-, -S(O)- и -S(O)2-;
p равно 1, 2 или 3;
каждый из R1L независимо выбирают из группы, состоящей из H, -CH3, -CF3, -OH, -C(O)-, галогена, -циклопропила, -O-CH3 и -O-CF3;
R1 выбирают из группы, состоящей из:
(1) гетероциклоалкила и гетероциклоалкенила,
где указанный гетероциклоалкил и указанный гетероциклоалкенил представляют собой моноциклические или полициклические системы колец, содержащие от 3 до 10 циклических атомов, в которых 1, 2 или 3 атома каждой из указанных циклических систем представляют собой циклический гетероатом, независимо выбираемый из группы, состоящей из N, S, S(O), S(O)2 и O,
и где каждая из указанных гетероциклоалкильных групп и каждая из указанных гетероциклоалкенильных групп является незамещенной или замещенной 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, гидроксизамещенного -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, фенила, -алкилфенила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -(С3-С8)-спирогетероциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1A)C(O)-(C1-C6)-алкила, -N(R1A)2, -C(O)N(R1A)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1A групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила);
(2) гетероарила,
где указанный гетероарил представляет собой моноциклическую или полициклическую систему колец, содержащую от 5 до 10 циклических атомов, в которой 1-4 атома указанной циклической системы представляют собой циклический атом азота,
и где указанный гетероарил является незамещенным или замещенным 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, гидроксизамещенного -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, фенила, -алкилфенила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1B)C(O)-(C1-C6)-алкила, -N(R1B)2, -C(O)N(R1B)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1B групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила);
при условии, что R1 не является незамещенным или замещенным триазолилом, и при дополнительном условии, что когда R1 означает замещенный оксадиазолил, замещенный тиазолил или замещенный тиадиазолил, то -L- выбирают из группы, состоящей из -(C(R1L)2)P- и 
(3) фенила,
где указанный фенил является незамещенным или замещенным 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1C)C(O)-(C1-C6)-алкила, -N(R1C)2, -C(O)N(R1C)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1C групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила);
(4) H и -(C1-C6)-алкила;
(5) -CH2N(R1D)R1E, где:
R1D выбирают из группы, состоящей из H, -(C1-C6)-алкила и -C(O)OR1F; и
R1E выбирают из группы, состоящей из -O-(C1-C6)-алкила, гетероалкила, -алкил-C(O)N(R1F) и -C(O)OR1F,
где каждый R1F независимо выбирают из группы, состоящей из H и -(C1-C6)-алкила; и
(6) -CH2N(R1F)OR1G, где:
R1F выбирают из группы, состоящей из H, -(C1-C6)-алкила и -C(O)OR1F, и
R1G выбирают из группы, состоящей из H и -(C1-C6)-алкила;
n равно 0, 1, 2 или 3;
каждый из R2 (когда присутствует) независимо выбирают из группы, состоящей из галогена, -CN, -OH, -(C1-C6)-алкила, -O-(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-галогеналкила, циклопропила, циклобутила, циклопентила, циклогексила, -NH2, -NH(C1-C6)-алкила, -N(C1-C6-алкила)2, -С(O)O(C1-C6)-алкила и фенила; и
R3 выбирают из группы, состоящей из водорода и фтора.
В одном из вариантов осуществления предложены соединения по изобретению, которые имеют структурную формулу (I):
 ,
,
или их стереоизомер, или фармацевтически приемлемая соль указанного соединения или указанного стереоизомера, где:
цикл A означает группу, выбираемую из группы, состоящей из фенила, -(C5-C6)-циклоалкила, -(C5-C6)-циклоалкенила, -пиридинила, пиримидинила, -пиразолила и -тиенила;
RQ выбирают из группы, состоящей из: -CN и -C(O)NH2;
-L- означает связь или двухвалентную группу, выбираемую из группы, состоящей из:
-(C(R1L)2)P-, 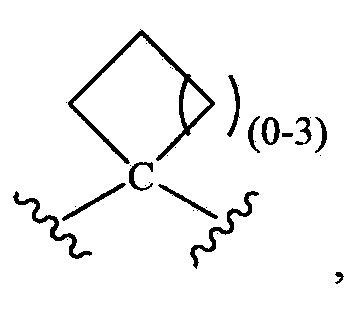 -S(O)- и -S(O)2-;
-S(O)- и -S(O)2-;
p равно 1, 2 или 3;
каждый из R1L независимо выбирают из группы, состоящей из: H, -CH3, -CF3, -OH, -C(O)-, галогена, -циклопропила, -O-CH3 и -O-CF3;
R1 выбирают из группы, состоящей из:
(1) гетероциклоалкила и гетероциклоалкенила,
где указанный гетероциклоалкил и указанный гетероциклоалкенил представляют собой моноциклические или полициклические системы колец, содержащие от 3 до 10 циклических атомов, в которых 1, 2 или 3 атома каждой из указанных циклических систем представляют собой циклический гетероатом, независимо выбираемый из группы, состоящей из N, S, S(O), S(O)2 и O,
и где каждая из указанных гетероциклоалкильных групп и каждая из указанных гетероциклоалкенильных групп является незамещенной или замещенной 1-4 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, где указанный алкил является незамещенным или замещенным гидроксилом, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, фенила, -алкилфенила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1A)C(O)-(C1-C6)-алкила, -N(R1A)2, -C(O)N(R1A)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1A групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила);
(2) гетероарила,
где указанный гетероарил представляет собой моноциклическую или полициклическую систему колец, содержащую от 5 до 10 циклических атомов, в которой 1-4 атома указанной циклической системы представляют собой циклический атом азота,
и где указанный гетероарил является незамещенным или замещенным 1-4 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, где указанный алкил является незамещенным или замещенным гидроксилом, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, фенила, -алкилфенила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1B)C(O)-(C1-C6)-алкила, -N(R1B)2, -C(O)N(R1B)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1B групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила);
при условии, что R1 не является незамещенным или замещенным триазолилом, и при дополнительном условии, что когда R1 означает замещенный оксадиазолил, замещенный тиазолил или замещенный тиадиазолил, то -L- выбирают из группы, состоящей из -(C(R1L)2)P- и 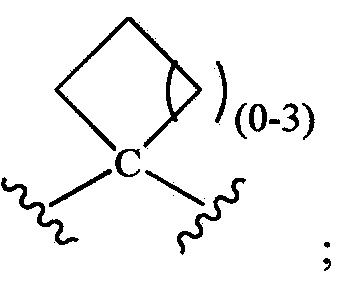
(3) фенила,
где указанный фенил является незамещенным или замещенным 1-4 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1C)C(O)-(C1-C6)-алкила, -N(R1C)2, -C(O)N(R1C)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1C групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила);
(4) H и -(C1-C6)-алкила;
(5) -CH2N(R1D)R1E, где:
R1D выбирают из группы, состоящей из H, -(C1-C6)-алкила и -C(O)OR1F; и
R1E выбирают из группы, состоящей из -O-(C1-C6)-алкила, гетероалкила, -алкил-C(O)N(R1F) и -C(O)OR1F,
где каждый R1F независимо выбирают из группы, состоящей из H и -(C1-C6)-алкила;
n равно 0, 1, 2 или 3;
каждый из R2 (когда присутствует) независимо выбирают из группы, состоящей из галогена, -CN, -OH, -(C1-C6)-алкила, -O-(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-галогеналкила, -С(O)O(C1-C6)-алкила и фенила; и
R3 выбирают из группы, состоящей из водорода и фтора.
В одном из вариантов осуществления в формуле (I) n равно 0.
В одном из вариантов осуществления в формуле (I) n равно 1.
В одном из вариантов осуществления в формуле (I) n равно 2.
В одном из вариантов осуществления в формуле (I) n равно 3.
В одном из вариантов осуществления в формуле (I) n равно 0, 1, 2 или 3, и каждый из R2 независимо выбирают из группы, состоящей из F, Cl, Br, метила, этила, пропила, изопропила, н-пропила, изобутил, н-бутила, трет-бутила, -OCH3, -OCH2CH3, -CFH2, -CF2H, -CF3, -CH2CFH2, -CH2CF2H, -CH2CF3, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2 и фенила.
В одном из вариантов осуществления предложены соединения по изобретению, которые имеют структурную формулу (II):
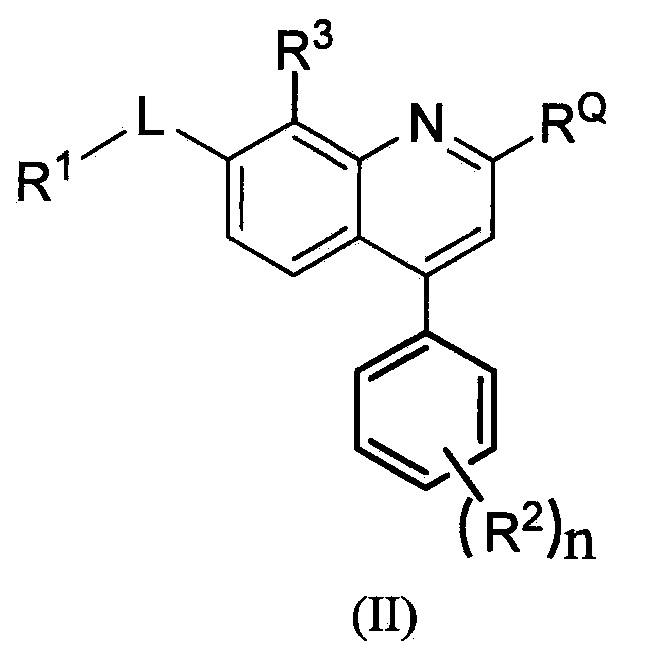 ,
,
или их фармацевтически приемлемая соль, где R1, RQ, -L-, n, R2 и R3 являются такими, как определено в формуле (I).
В альтернативном варианте осуществления формулы (II) предлагается соединение формулы (II.1):
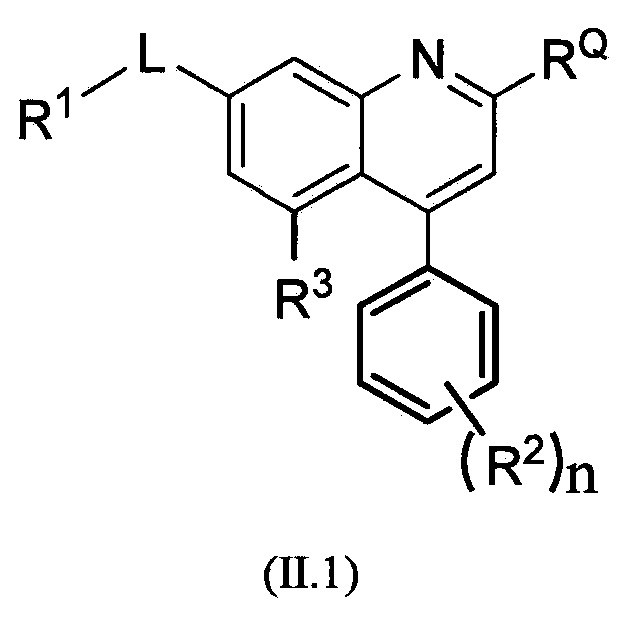 ,
,
или его фармацевтически приемлемая соль, где R1, RQ, -L-, n, R2 и R3 являются такими, как определено в формуле (I).
В другом альтернативном варианте осуществления соединений формулы (II) предложено соединение формулы (II.2):
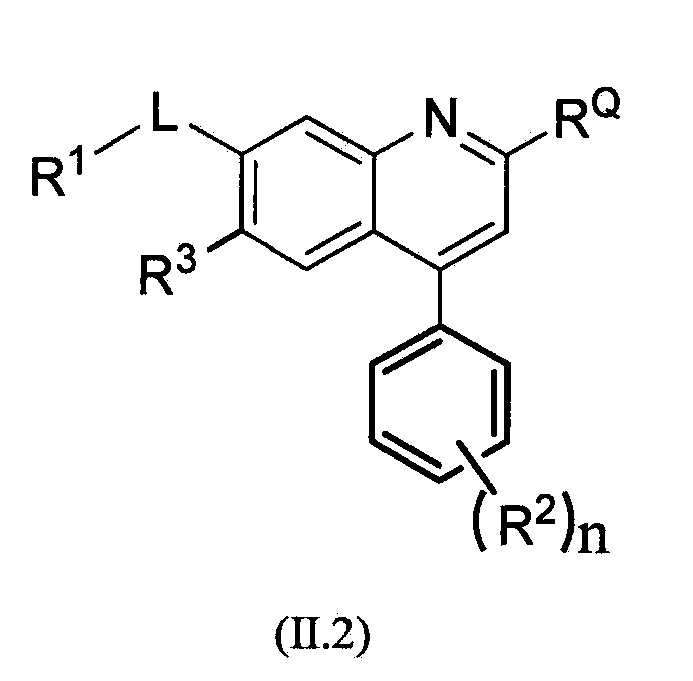 ,
,
или его фармацевтически приемлемая соль, где R1, RQ, -L-, n, R2 и R3 являются такими, как определено в формуле (I).
В одном из вариантов осуществления в каждой из формул (II), (II.1) и (II.2) n равно 0.
В одном из вариантов осуществления в каждой из формул (II), (II.1) и (II.2) n равно 1, и каждый из R2 является таким, как определено в формуле (I).
В одном из вариантов осуществления в каждой из формул (II), (II.1) и (II.2) n равно 2, и каждый из R2 независимо является таким, как определено в формуле (I).
В одном из вариантов осуществления в каждой из формул (II), (II.1) и (II.2) n равно 3, и каждый из R2 независимо является таким, как определено в формуле (I).
В одном из вариантов осуществления в каждой из формул (II), (II.1) и (II.2) n равно 0, 1, 2 или 3, и каждый из R2 независимо выбирают из группы, состоящей из галогена, -CN, -OH, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -O-(C1-C6)-галогеналкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2 и фенила.
В одном из вариантов осуществления предложены соединения по изобретению, которые имеют структурную формулу (III):
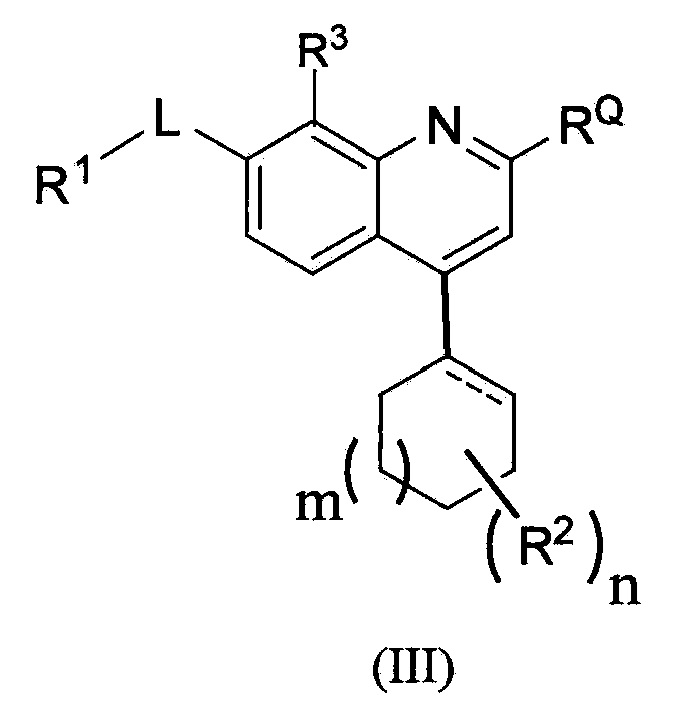 ,
,
или их фармацевтически приемлемая соль, где m равно 0, 1 или 2, пунктирная линия означает необязательную двойную связь, и R1, RQ, -L-, n, R2 и R3 являются такими, как определено в формуле (I).
В альтернативном варианте осуществления соединений формулы (III) предложено соединение формулы (III.1):
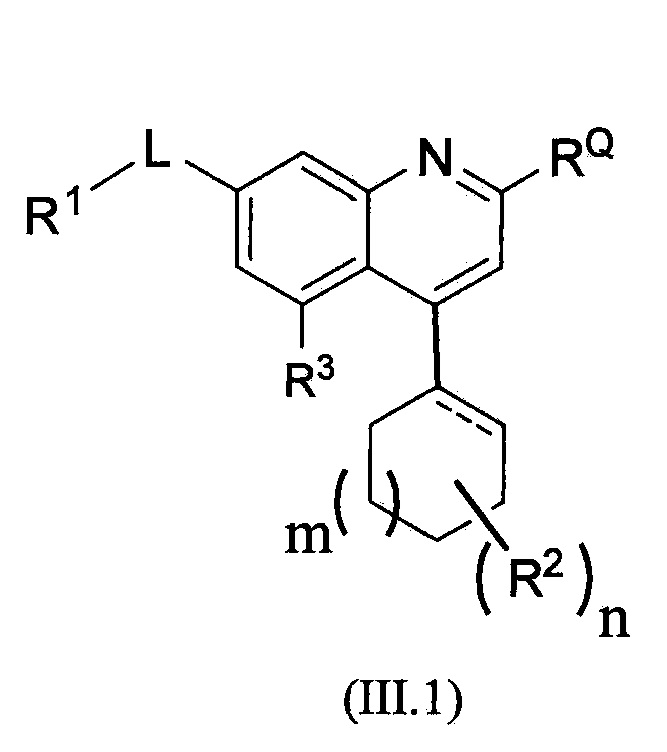 ,
,
или его фармацевтически приемлемая соль, где m равно 0, 1 или 2, пунктирная линия означает необязательную двойную связь, и R1, RQ, -L-, n, R2 и R3 являются такими, как определено в формуле (I).
В другом альтернативном варианте осуществления соединений формулы (III) предложено соединение формулы (III.2):
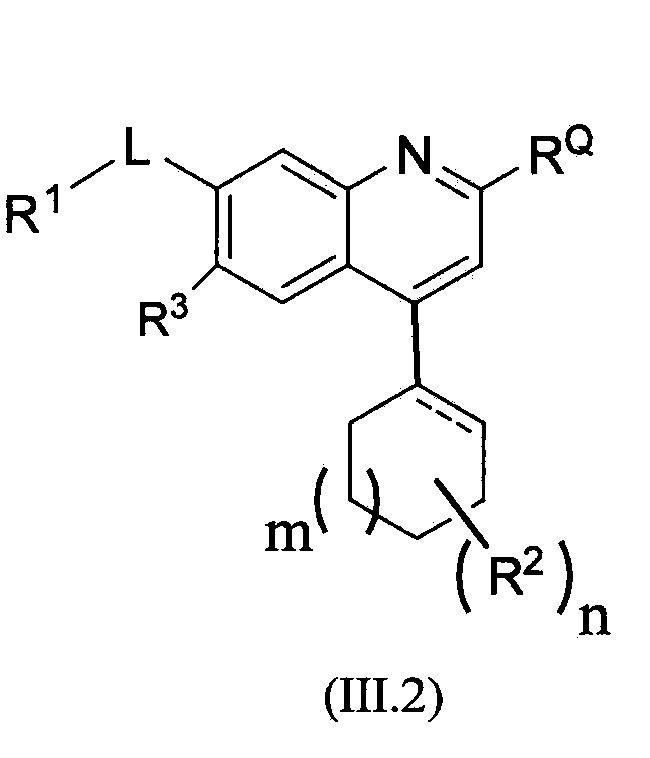 ,
,
или его фармацевтически приемлемая соль, где m равно 0, 1 или 2, пунктирная линия означает необязательную двойную связь, и R1, RQ, -L-, n, R2 и R3 являются такими, как определено в формуле (I).
В одном из вариантов осуществления в каждой из формул (III), (III.1) и (III.2) группу  выбирают из группы, состоящей из:
выбирают из группы, состоящей из:
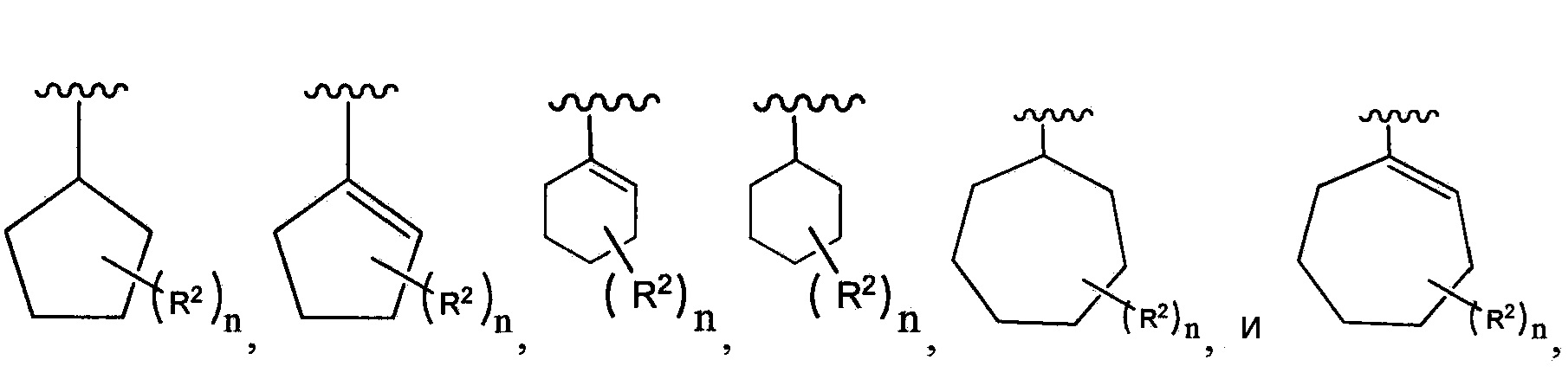
где n и каждый из R2 являются такими, как определено в формуле (I).
В одном из вариантов осуществления в каждой из формул (III), (III.1) и (III.2) каждый из R2 независимо выбирают из группы, состоящей из галогена, -CN, -OH, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -O-(C1-C6)-галогеналкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2 и фенила.
В одном из вариантов осуществления в каждой из формул (III), (III.1) и (III.2) m равно 0, и n равно 0.
В одном из вариантов осуществления в каждой из формул (III), (III.1) и (III.2) m равно 0, n равно 1, и R2 выбирают из группы, состоящей из галогена, -CN, -OH, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -O-(C1-C6)-галогеналкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2 и фенила.
В одном из вариантов осуществления в каждой из формул (III), (III.1) и (III.2) m равно 0, n равно 2, и R2 независимо выбирают из группы, состоящей из галогена, -CN, -OH, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -O-(C1-C6)-галогеналкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2 и фенила.
В одном из вариантов осуществления в каждой из формул (III), (III.1) и (III.2) m равно 0, n равно 3, и R2 независимо выбирают из группы, состоящей из галогена, -CN, -OH, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -O-(C1-C6)-галогеналкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2 и фенила.
В одном из вариантов осуществления предложены соединения по изобретению, которые имеют структурную формулу (IV):
 ,
,
или их фармацевтически приемлемая соль, где:
цикл A означает группу, выбираемую из группы, состоящей из -пиридинила, пиримидинила, -пиразолила, -тиенила, -тиазолила, -тиадиазолила и –оксазолила, и R1, RQ, -L-, n, R2 и R3 являются такими, как определено в формуле (I).
В альтернативном варианте осуществления соединений формулы (IV) предложено соединение формулы (IV.1):
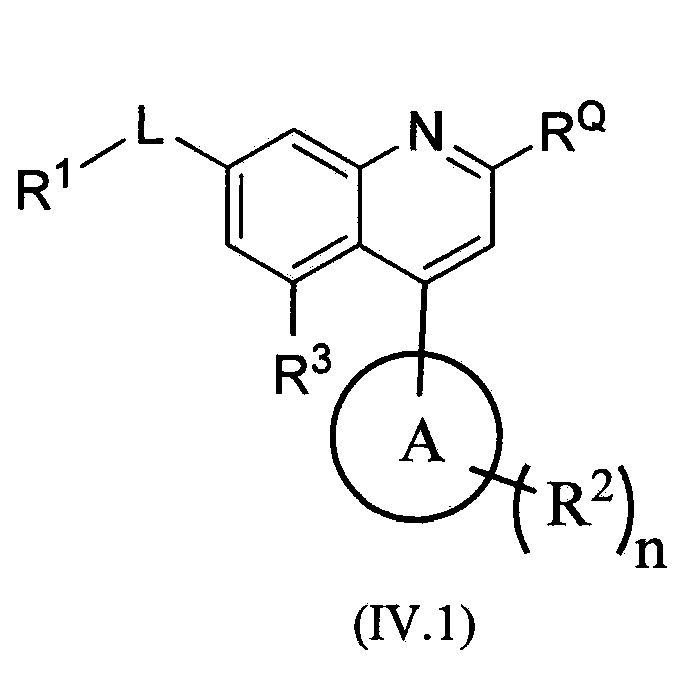 ,
,
или его фармацевтически приемлемая соль, где:
цикл A означает группу, выбираемую из группы, состоящей из -пиридинила, пиримидинила, -пиразолила, -тиенила, -тиазолила, -тиадиазолила и –оксазолила, и R1, RQ, -L-, n, R2 и R3 являются такими, как определено в формуле (I).
В другом альтернативном варианте осуществления соединений формулы (IV) предложено соединение формулы (IV.2):
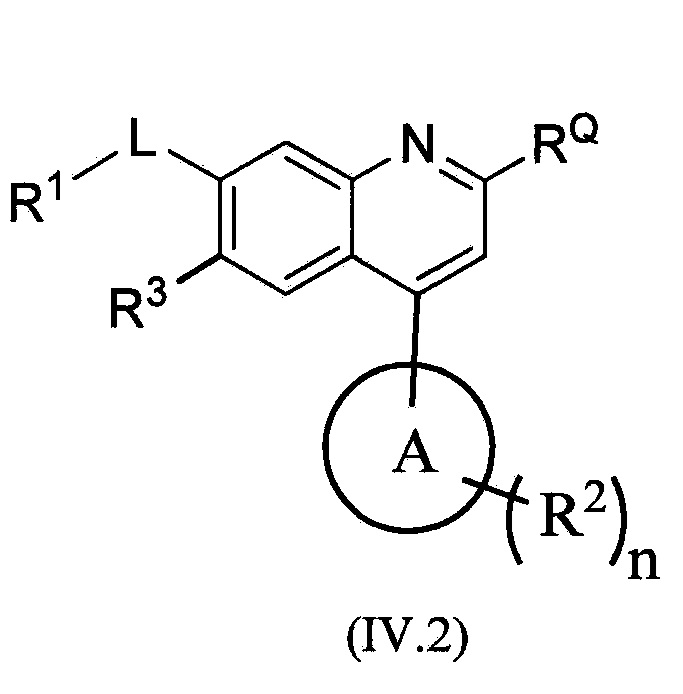 ,
,
или его фармацевтически приемлемая соль, где:
цикл A означает группу, выбираемую из группы, состоящей из -пиридинила, пиримидинила, -пиразолила, -тиенила, -тиазолила, -тиадиазолила и –оксазолила, и R1, RQ, -L-, n, R2 и R3 являются такими, как определено в формуле (I).
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает пиразолил, который является незамещенным или замещенным 1-2 R2 группами.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает тиенил, который является незамещенным или замещенным 1-3 R2 группами.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает пиридинил, который является незамещенным или замещенным 1-3 R2 группами.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает пиримидинил, который является незамещенным или замещенным 1-3 R2 группами.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает -тиазолил, который является незамещенным или замещенным 1-2 R2 группами.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает -тиадиазолил, который является незамещенным или замещенным 1 R2 группой.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает -оксазолил, который является незамещенным или замещенным 1-2 R2 группами.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) n равно 0.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) n равно 0, 1, 2 или 3, и каждый из R2 независимо выбирают из группы, состоящей из галогена, -CN, -OH, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -O-(C1-C6)-галогеналкила и фенила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) n равно 0, 1, 2 или 3, и каждый из R2 независимо выбирают из группы, состоящей из -(C1-C6)-алкила, -(C1-C6)-галогеналкила, фенила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) n равно 1, и каждый из R2 независимо выбирают из группы, состоящей из галогена, -CN, -OH, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -O-(C1-C6)-галогеналкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2 и фенила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) n равно 1, и R2 выбирают из группы, состоящей из галогена. В одном из таких вариантов осуществления R2 означает фтор.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) n равно 2, и каждый из R2 независимо выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила и фенила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает пиразолил, и группу  выбирают из группы, состоящей из:
выбирают из группы, состоящей из: 
 где каждый из R2 независимо является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из -(C1-C6)-алкила, -(C1-C6)-галогеналкила и фенила. В другом таком варианте осуществления n равно 1 или 2, и каждый из R2 независимо выбирают из группы, состоящей из -(C1-C6)-алкила и фенила.
где каждый из R2 независимо является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из -(C1-C6)-алкила, -(C1-C6)-галогеналкила и фенила. В другом таком варианте осуществления n равно 1 или 2, и каждый из R2 независимо выбирают из группы, состоящей из -(C1-C6)-алкила и фенила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает пиразолил, и группа 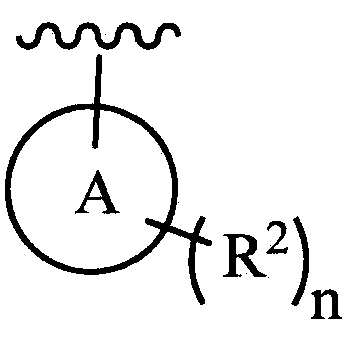 означает
означает  где каждый из R2 независимо является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из -(C1-C6)-алкила, -(C1-C6)-галогеналкила и фенила. В другом таком варианте осуществления каждый из R2 независимо выбирают из группы, состоящей из -(C1-C6)-алкила и фенила.
где каждый из R2 независимо является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из -(C1-C6)-алкила, -(C1-C6)-галогеналкила и фенила. В другом таком варианте осуществления каждый из R2 независимо выбирают из группы, состоящей из -(C1-C6)-алкила и фенила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает пиразолил, и группа 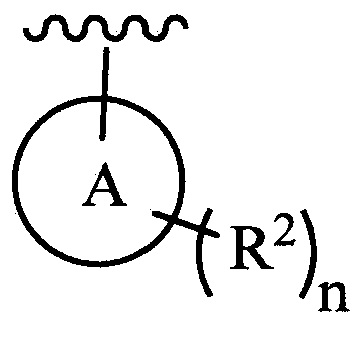 означает
означает 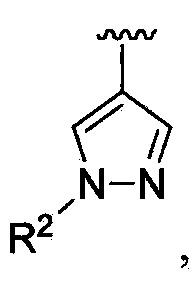 где R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из -(C1-C6)-алкила, -(C1-C6)-галогеналкила и фенила. В другом таком варианте осуществления R2 выбирают из группы, состоящей из -(C1-C6)-алкила и фенила.
где R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из -(C1-C6)-алкила, -(C1-C6)-галогеналкила и фенила. В другом таком варианте осуществления R2 выбирают из группы, состоящей из -(C1-C6)-алкила и фенила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает тиенил, и группа 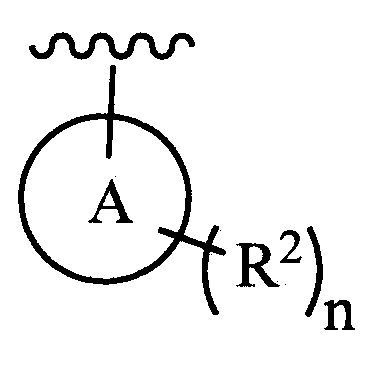 означает
означает 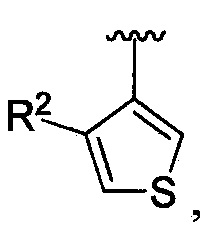 где R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
где R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает пиридинил, и группа 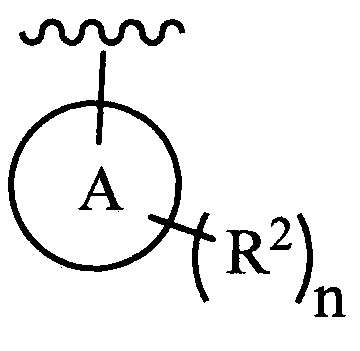 означает
означает 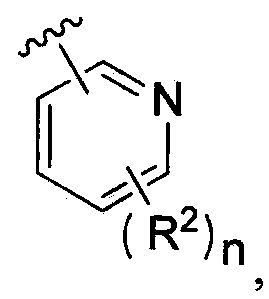 где каждый из R2 и n является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
где каждый из R2 и n является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает пиримидинил, и группа 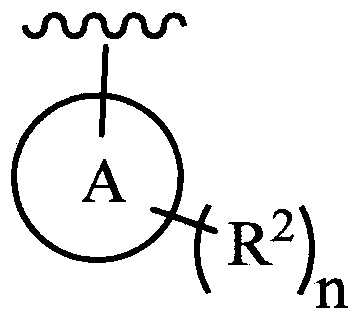 означает
означает 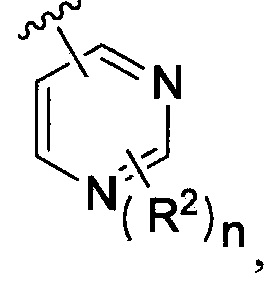 где каждый из R2 и n является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
где каждый из R2 и n является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает тиазолил, и группа 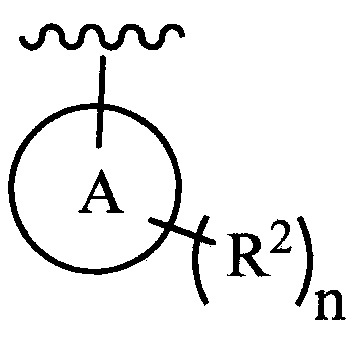 означает
означает 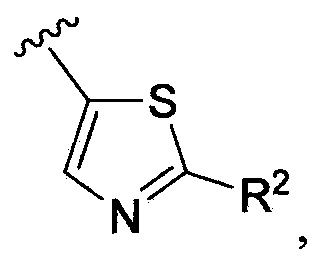 где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает тиазолил, и группа 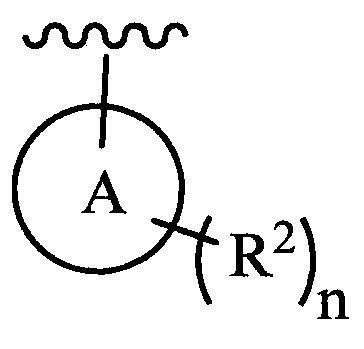 означает
означает 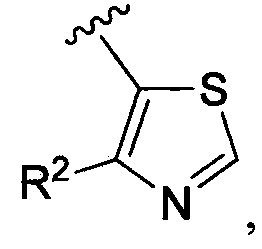 где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает тиадиазолил, и группа 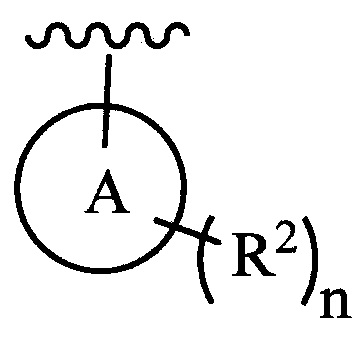 означает
означает 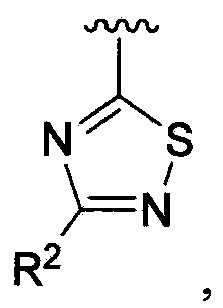 где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает тиадиазолил, и группа 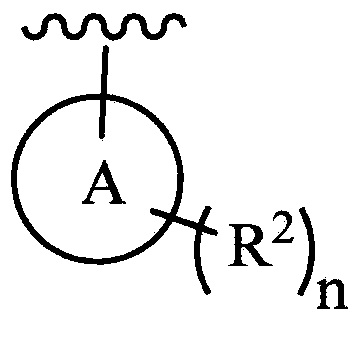 означает
означает 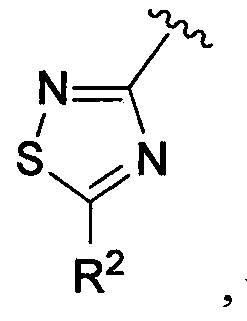 где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает оксазолил, и группа 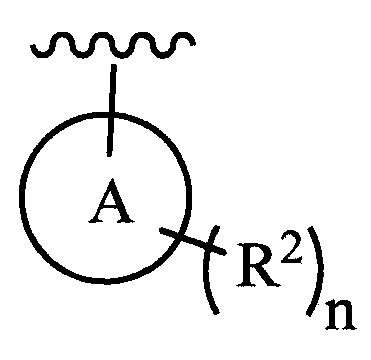 означает
означает 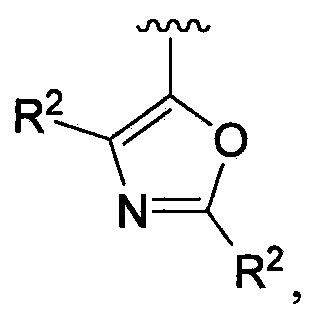 где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает оксазолил, и группа 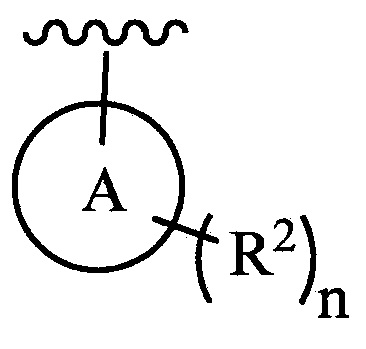 означает
означает 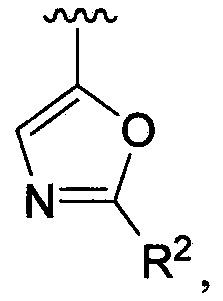 где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
В одном из вариантов осуществления в каждой из формул (IV), (IV.1) и (IV.2) цикл A означает оксазолил, и группа 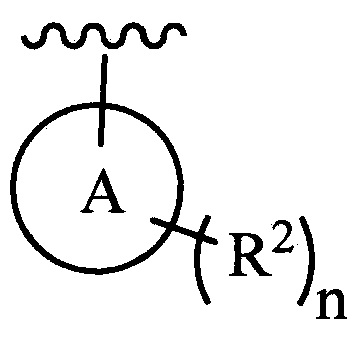 означает
означает 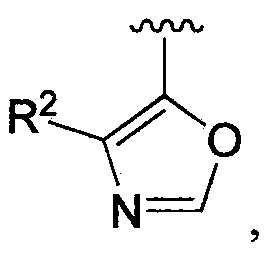 где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
где каждый из R2 является таким, как определено в формуле (I). В другом таком варианте осуществления R2 выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -циклопропила, -циклобутила и -циклопентила.
В другом варианте осуществления соединения по изобретению имеют структурную формулу (V), приведенную ниже.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2):
RQ означает CN.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2):
RQ означает -C(O)NH2.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2):
R3 означает водород.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2):
R3 означает фтор.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2):
-L- означает ковалентную связь.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2):
-L- означает -C(O)-.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2):
-L- означает -C(R1L)P-, где p равно 0, 1 или 2, и каждый из R1L является таким, как определено в формуле (I).
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2):
-L- выбирают из группы, состоящей из:
-CH2-, -CH2CH2-, -CH2CH2CH2-, -CH(CF3)-, -СН(СН3)-, -CH(CH3)CH2-, -CH2CH(CH3)-, -C(CH3)2-, -CH(OH)-, -CH2CH(OH)-, -CH(OH)CH2-, -CH(F)-, -CF2-, -C(CH3)(OH)-, -CH(OCH3)-, 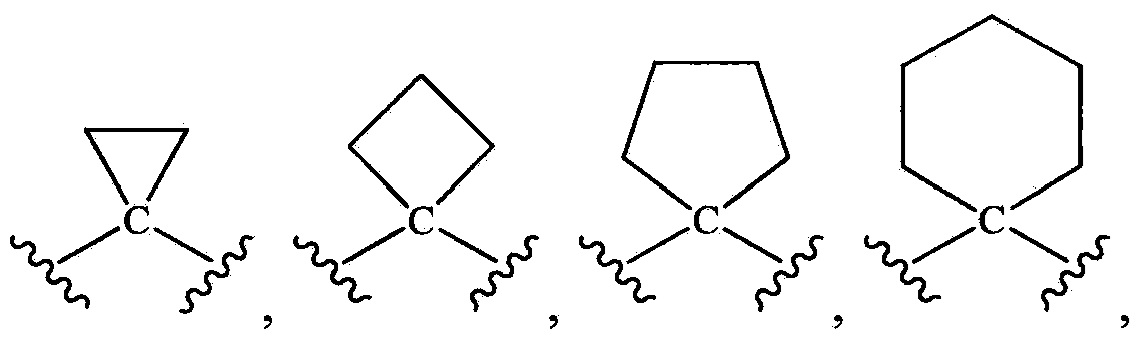 -C(O)-, -S(O)- и -S(O)2-.
-C(O)-, -S(O)- и -S(O)2-.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2):
-L- выбирают из группы, состоящей из:
-CH2-, -CH2CH2-, -СН2СН2СН2-, -CH(CF3)-, -СН(СН3)-, -СН(СН3)СН2-, -СН2СН(СН3)-, -С(СН3)2-, -СН(ОН)-, -СН2СН(ОН)-, -СН(ОН)СН2-, -CH(F)-, -CF2-, -С(СН3(ОН)-, -СН(ОСН3)-, 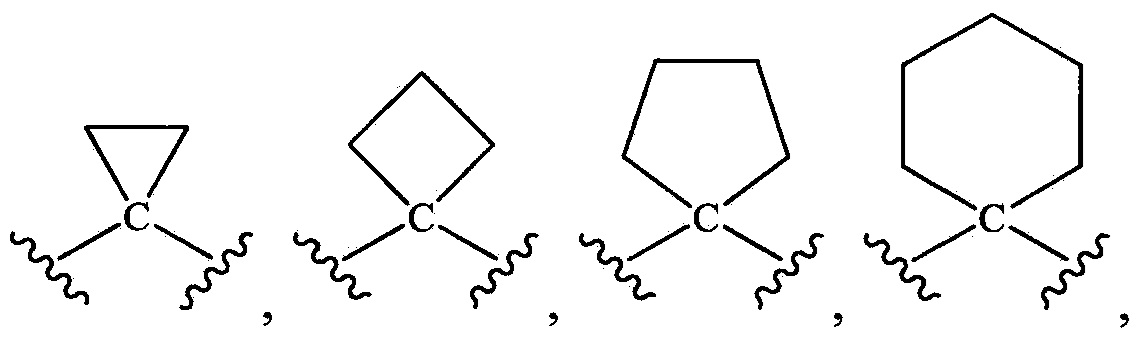 и -С(О)-.
и -С(О)-.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1 выбирают из группы, состоящей из гетероциклоалкила и гетероциклоалкенила,
где каждый из указанных гетероциклоалкилов и указанных гетероциклоалкенилов содержит 1, 2 или 3 циклических гетероатома, независимо выбираемых из группы, состоящей из N, S, S(O), S(O)2 и O, и где каждая из указанных гетероциклоалкильных групп и каждая из указанных гетероциклоалкенильных групп является незамещенной или замещенной 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, гидроксизамещенного -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, фенила, -алкилфенила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1A)C(O)-(C1-C6)-алкила, -N(R1A)2, -C(O)N(R1A)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1A групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила).
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1 выбирают из группы, состоящей из гетероциклоалкила и гетероциклоалкенила,
где каждый из указанных гетероциклоалкилов и указанных гетероциклоалкенилов содержит 1, 2 или 3 циклических гетероатома, независимо выбираемых из группы, состоящей из N, S, S(O), S(O)2 и O,
и где каждая из указанных гетероциклоалкильных групп и каждая из указанных гетероциклоалкенильных групп является незамещенной или замещенной 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, -CN, -OH, -(C1-C6)-алкила, -O-(C1-C6)-алкила, -N(H)C(O)-(C1-C6)-алкила, -C(O)NH2, -C(O)N(H)(C1-C6-алкила), -C(O)N(C1-C6-алкила)2, фенила, -(С3-С8)-спироциклоалкила, -(С3-С8)-циклоалкила, -(C1-C6)-галогеналкила и фенила. В альтернативных вариантах такого осуществления каждая из указанных гетероциклоалкильных групп и каждая из указанных гетероциклоалкенильных групп является незамещенной или замещенной 1-4 группами или, альтернативно, 1-3 группами или, альтернативно, 1-2 группами, где каждую из указанных групп независимо выбирают из группы, состоящей из оксо, -CN, -OH, -(C1-C6)-алкила, -O-(C1-C6)-алкила, -N(H)C(O)-(C1-C6)-алкила, -C(O)NH2, -C(O)N(H)(C1-C6-алкила), -C(O)N(C1-C6-алкила)2, фенила, -(С3-С8)-спироциклоалкила, -(С3-С8)-циклоалкила, -(C1-C6)-галогеналкила и фенила.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1 выбирают из группы, состоящей из гетероциклоалкила и гетероциклоалкенила,
где каждый из указанных гетероциклоалкилов и указанных гетероциклоалкенилов содержит 1, 2 или 3 циклических гетероатома, независимо выбираемых из группы, состоящей из N, S, S(O), S(O)2 и O,
и где каждая из указанных гетероциклоалкильных групп и каждая из указанных гетероциклоалкенильных групп является незамещенной или замещенной 1-5 группами, альтернативно 1-4 группами или, альтернативно, 1-3 группами или, альтернативно, 1-2 группами, независимо выбираемыми из группы, состоящей из оксо, алкила, -(С3-С8)-спироциклоалкила, -(С3-С8)-циклоалкила и-(C1-C6)-галогеналкила.
В каждом из вышеуказанных вариантов осуществления неограничивающие примеры гетероциклоалкильной части указанного необязательно замещенного гетероциклоалкила включают пиперидинил, оксетанил, пирролил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,4-диоксанил, тетрагидрофуранил, тетрагидротиофенил, бета-лактам, гамма-лактам, дельта-лактам, бета-лактон, гамма-лактон, дельта-лактон и пирролидинон, и их оксиды (включая N-оксиды).
В каждом из вышеуказанных вариантов осуществления неограничивающие примеры гетероциклоалкенильной части указанного необязательно замещенного гетероциклоалкенила включают 1,2,3,4-тетрагидропиридинил, 1,2-дигидропиридинил, 1,4-дигидропиридинил, 1,2,3,6-тетрагидропиридинил, 1,4,5,6-тетрагидропиримидинил, 2-пирролинил, 3-пирролинил, 2-имидазолинил, 2-пиразолинил, дигидроимидазолил, дигидрооксазолил, дигидрооксадиазолил, дигидротиазолил, 3,4-дигидро-2H-пиранил, дигидрофуранил, фтордигидрофуранил, 7-оксабицикло[2.2.1]гептенил, дигидротиофенил и дигидротиопиранил.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1 означает гетероарил,
где указанный гетероарил является моноциклическим или бициклическим и содержит от 1 до 3 циклических атомов азота, и где указанный гетероарил является незамещенным или замещенным 1-5 группами, альтернативно, 1-4 группами, альтернативно, 1-3 группами или, альтернативно, 1-2 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, гидроксизамещенного -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, фенила, -алкилфенила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1B)C(O)-(C1-C6)-алкила, -N(R1B)2, -C(O)N(R1B)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
и где каждую из R1B групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила),
при условии, что R1 не является незамещенным или замещенным триазолилом, и при дополнительном условии, что когда R1 означает замещенный оксадиазолил, замещенный тиазолил или замещенный тиадиазолил, то -L- выбирают из группы, состоящей из -(C(R1L)2)P- и 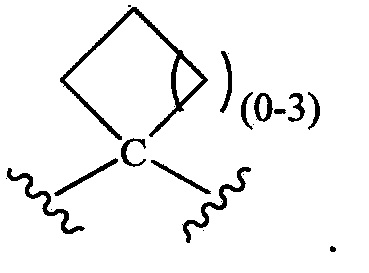
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV) (IV.1), (IV.2), (V), (V.1) и (V.2) R1 означает гетероарил,
где указанный гетероарил является моноциклическим или бициклическим и содержит от 1 до 3 циклических атомов азота, и где указанный гетероарил является незамещенным или замещенным 1-4 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, гидроксизамещенного -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, фенила, -алкилфенила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1B)C(O)-(C1-C6)-алкила, -N(R1B)2, -C(O)N(R1B)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
и где каждую из R1B групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила),
при условии, что R1 не является незамещенным или замещенным триазолилом, замещенным оксадиазолилом, замещенным тиазолилом или замещенным тиадиазолилом.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV) (IV.1), (IV.2), (V), (V.1) и (V.2) R1 означает гетероарил,
где указанный гетероарил является моно- или бициклическим и содержит от 1 до 3 циклических атомов азота,
и где указанный гетероарил является незамещенным или замещенным 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, -CN, -OH, -(C1-C6)-алкила, -O-(C1-C6)-алкила, -N(H)C(O)-(C1-C6)-алкила, -C(O)NH2, -C(O)N(H)(C1-C6-алкила), -C(O)N(C1-C6-алкила)2, фенила, -(С3-С8)-спироциклоалкила, -(С3-С8)-циклоалкила, -(C1-C6)-галогеналкила и фенила, при условии, что R1 не является незамещенным или замещенным триазолилом, замещенным оксадиазолилом, замещенным тиазолилом или замещенным тиадиазолилом. В альтернативных вариантах такого осуществления каждая из указанных гетероарильных групп является незамещенной или замещенной 1-4 группами или, альтернативно, 1-3 группами или, альтернативно, 1-2 группами, где каждую из указанных групп независимо выбирают из группы, состоящей из оксо, -CN, -OH, -(C1-C6)-алкила, -O-(C1-C6)-алкила, -N(H)C(O)-(C1-C6)-алкила, -C(O)NH2, -C(O)N(H)(C1-C6-алкила), -C(O)N(C1-C6-алкила)2, фенила, -(С3-С8)-спироциклоалкила, -(С3-С8)-циклоалкила, -(C1-C6)-галогеналкила и фенила, при условии, что R1 не является незамещенным или замещенным триазолилом, замещенным оксадиазолилом, замещенным тиазолилом или замещенным тиадиазолилом.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV) (IV.1), (IV.2), (V), (V.1) и (V.2) R1 выбирают из группы, состоящей из гетероарила,
где указанный гетероарил является моно- или бициклическим и содержит от 1 до 3 циклических атомов азота,
и где указанный гетероарил является незамещенным или замещенным 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, галогена, -(C1-C6)-алкила, гидроксизамещенного -(C1-C6)-алкила, -O-(C1-C6)-алкила, -N(R6)2, -C(O)N(R6)2, CN, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -S(O)2H, -S(O)2-(C1-C6)-алкила и -(C1-C6)-алкинила, при условии, что R1 не является незамещенным или замещенным триазолилом, замещенным оксадиазолилом, замещенным тиазолилом или замещенным тиадиазолилом. В альтернативных вариантах такого осуществления указанный гетероарил является незамещенным или замещенным 1-4 группами, альтернативно, 1-3 группами, альтернативно, 1-2 группами, где каждую из указанных групп независимо выбирают из группы, состоящей из оксо, галогена, -(C1-C6)-алкила, гидроксизамещенного -(C1-C6)-алкила, -O-(C1-C6)-алкила, -N(R6)2, -C(O)N(R6)2, CN, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -S(O)2H, -S(O)2-(C1-C6)-алкила и -(C1-C6)-алкинила, при условии, что R1 не является незамещенным или замещенным триазолилом, замещенным оксадиазолилом, замещенным тиазолилом или замещенным тиадиазолилом.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) гетероарильную часть указанного необязательно замещенного гетероарила R1 выбирают из группы, состоящей из пиридила, пиразинила, фуранила, тиенила (который иначе может упоминаться как тиофенил), пиримидинила, пиридона (включая N-замещенные пиридоны), изоксазолила, изотиазолила, оксазолила, оксадиазолила, тиазолила, тиадиазолила (включая 1,2,4-тиадиазолил), пиразолила, фуразанила, пирролила, пиразолила, пиразинила, пиридазинила, хиноксалинила, фталазинила, оксиндолила, имидазо[1,2-a]пиридинила, имидазо[2,1-b]тиазолила, бензофуразанила, индолила, азаиндолила, бензимидазолила, бензотиенила, хинолинила, имидазолила, тиенопиридила, хиназолинила, тиенопиримидила, пирролопиридила, имидазопиридила, изохинолинила, бензоазаиндолила, 1,2,4-триазинила и бензотиазолила, и их оксидов (включая N-оксиды) и бензоконденсированных модификаций, где каждый указанный оксадиазолил, тиазолил и тиадиазолил, когда присутствует, является незамещенным.
В одном из вариантов осуществления в каждой из указанных формул (V), (V.1) и (V.2) гетероарильную часть указанного необязательно замещенного гетероарила R1 выбирают из группы, состоящей из пиридила, пиразинила, фуранила, тиенила (который иначе может упоминаться как тиофенил), пиримидинила, пиридона (включая N-замещенные пиридоны), изоксазолила, изотиазолила, оксазолила, оксадиазолила, тиазолила, тиадиазолила (включая 1,2,4-тиадиазолил), пиразолила, фуразанила, пирролила, пиразолила, триазолила, пиразинила, пиридазинила, хиноксалинила, фталазинила, оксиндолила, имидазо[1,2-a]пиридинила, имидазо[2,1-b]тиазолила, бензофуразанила, индолила, азаиндолила, бензимидазолила, бензотиенила, хинолинила, имидазолила, тиенопиридила, хиназолинила, тиенопиримидила, пирролопиридила, имидазопиридила, изохинолинила, бензоазаиндолила, 1,2,4-триазинила и бензотиазолила и их оксидов (включая N-оксиды) и бензоконденсированных модификаций.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1 означает фенил, где указанный фенил является незамещенным или замещенным 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1C)C(O)-(C1-C6)-алкила, -N(R1C)2, -C(O)N(R1C)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
и где каждую из R1C групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила).
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1 означает фенил, где указанный фенил является незамещенным или замещенным 1-5 группами, независимо выбираемыми из группы, состоящей из галогена, -(C1-C6)-алкила, фенила, -O-(C1-C6)-алкила, CN, -S(O)-фенила, -S(O)2-фенила, -S(O)-(C1-C6)-алкилфенила и -S(O)2-(C1-C6)-алкилфенила. В альтернативных вариантах такого осуществления указанный фенил является незамещенным или замещенным 1-4 группами, альтернативно, 1-3 группами, альтернативно, 1-2 группами, где каждую из указанных групп независимо выбирают из группы, состоящей из галогена, -(C1-C6)-алкила, фенила, -O-(C1-C6)-алкила, CN, -S(O)-фенила, -S(O)2-фенила, -S(O)-(C1-C6)-алкилфенила и -S(O)2-(C1-C6)-алкилфенила.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1 означает фенил, где указанный фенил является незамещенным или замещенным 1-5 группами, независимо выбираемыми из группы, состоящей из галогена, -O-(C1-C6)-алкила, CN, -S(O)-фенила, -S(O)2-фенила, -S(O)-(C1-C6)-алкилфенила и -S(O)2-(C1-C6)-алкилфенила. В альтернативных вариантах такого осуществления указанный фенил является незамещенным или замещенным 1-4 группами, альтернативно, 1-3 группами, альтернативно, 1-2 группами, где каждую из указанных групп независимо выбирают из группы, состоящей из галогена, -O-(C1-C6)-алкила, CN, -S(O)-фенила, -S(O)2-фенила, -S(O)-(C1-C6)-алкилфенила и -S(O)2-(C1-C6)-алкилфенила.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1-L- выбирают из группы, состоящей из необязательно замещенного фенила, необязательно замещенного бензила и необязательно замещенного -CH2CH2-фенила, где указанные необязательные заместители представляют собой один-три заместителя, независимо выбираемых из группы, состоящей из галогена, -O-(C1-C6)-алкила, CN, -S(O)-фенила, -S(O)2-фенила, -S(O)-(C1-C6)-алкилфенила и -S(O)2-(C1-C6)-алкилфенила.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1 выбирают из группы, состоящей из H и -(C1-C6)-алкила.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1 означает -CH2N(R1D)R1E, где:
R1D выбирают из группы, состоящей из H, -(C1-C6)-алкила и -C(O)OR1F; и
R1E выбирают из группы, состоящей из -O-(C1-C6)-алкила, гетероалкила, -(C1-C6)-алкил-C(O)N(R1F) и -C(O)OR1F,
где каждый из R1F независимо выбирают из группы, состоящей из H и -(C1-C6)-алкила.
В одном из вариантов осуществления в каждой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и (V.2) R1 означает -CH2N(R1F)OR1G, где:
R1F выбирают из группы, состоящей из H, -(C1-C6)-алкила и -C(O)OR1F; и
R1G выбирают из группы, состоящей из H и -(C1-C6)-алкила;
n равно 0, 1, 2 или 3.
В одном из вариантов осуществления соединения по изобретению охватывают, в совокупности и по отдельности, каждое из типовых соединений, приведенных ниже в таблицах, и их фармацевтически приемлемые соли. Пригодные фармацевтически приемлемые соли каждого из этих соединений включают соли, рассматриваемые ниже.
ОПРЕДЕЛЕНИЯ
Используемые здесь термины имеют обычный смысл и значение таких терминов независимо в каждом случае. При этом, и за исключением особо указанных случаев, следующие определения применяются во всем описании и в формуле изобретения. Химические названия, общие названия и химические структуры могут использоваться попеременно для описания одной и той же структуры. В случае, если химическое название и структура соединения по изобретению расходятся, - контроли по структуре. Эти определения применяются независимо от того, использован ли термин отдельно или в комбинациях с другими терминами, если не указано иное. Таким образом, определение “алкил” применяется к “алкилу”, а также к “алкильной” части “гидроксиалкила”, “галогеналкила”, арилалкила-, алкиларила-, “алкокси” и проч.
Следует понимать, что в различных описанных здесь вариантах осуществления изобретения любая переменная, не явно определенная в контексте варианта осуществления, является такой, как определена в формуле (I). Предполагается, что все не явно заполненные валентности заполнены водородом.
В различных описанных здесь вариантах осуществления каждая переменная выбирается независимо от других, если не указано иное.
"Пациент" включает как человека, так и не принадлежащих к человеческому роду животных. Не принадлежащие к человеческому роду животные включают экспериментальных животных и домашних животных, таких как мыши, крысы, приматы, обезьяны, человекообразные обезьяны, шимпанзе, псовые (например, собаки) и кошачьи (например, домашние кошки).
"Фармацевтическая композиция" (или “фармацевтически приемлемая композиция”) означает композицию, пригодную для введения пациенту. Такие композиции могут содержать чистое соединение (или соединения) по изобретению или их смеси, или соли, сольваты, пролекарства, изомеры или их таутомеры, или такие композиции могут содержать один или более фармацевтически приемлемых носителей или разбавителей. Подразумевается также, что термин "фармацевтическая композиция" охватывает как нерасфасованную композицию, так и отдельные дозированные единицы, состоящие из нескольких (например, двух) фармацевтически активных веществ, таких как, например, соединение по настоящему изобретению, и дополнительного вещества, выбираемого из перечней дополнительных веществ, раскрытых ниже, наряду с любыми фармацевтически неактивными наполнителями. Нерасфасованная композиция и каждая отдельная дозированная единица могут содержать фиксированные количества вышеуказанных "нескольких фармацевтически активных веществ". Нерасфасованная композиция представляет собой материал, который еще не был формован в отдельные дозированные единицы. Иллюстративной дозированной единицей является пероральная дозированная единица, такая как таблетки, пилюли и тому подобное. Точно так же подразумевается, что описанный здесь метод лечения пациента путем введения фармацевтической композиции по настоящему изобретению также охватывает введение вышеуказанной нерасфасованной композиции и отдельных дозированных единиц.
Термин "фармацевтически приемлемый" означает, что носитель, разбавитель или наполнитель должен быть совместим с другими ингредиентами состава и безвреден для реципиента.
Термины "введение" или "вводить" соединение означают давать соединение по изобретению нуждающемуся в лечении индивидууму в форме, которая может быть введена в организм индивидуума в терапевтически полезной форме и терапевтически полезном количестве, включая, но не в порядке ограничения: пероральные лекарственные формы, такие как таблетки, капсулы, сиропы, суспензии и тому подобное; инъекционные лекарственные формы, такие как IV, IM или IP и тому подобное; трансдермальные лекарственные формы, включающие кремы, желе, порошки или пластыри; трансбуккальные лекарственные формы; ингаляционные порошки, спреи, суспензии и тому подобное и ректальные суппозитории.
Термины "эффективное количество" или "терапевтически эффективное количество" означают количество соединения или композиции по изобретению, эффективное для подавления указанных здесь заболеваний и таким образом произведение требуемого терапевтического, улучшающего, ингибирующего или профилактического эффекта.
Как использован здесь термин "лечение" или "лечить" означает любое введение соединения по настоящему изобретению и включает (1) подавление заболевания у животного, то есть наличие или проявление патологии или симптоматики у заболевшего (т.е., остановку дальнейшего развития патологии и/или симптоматики), или (2) улучшение состояния при заболевании, то есть при наличии или проявлении патологии или симптоматики у заболевшего (т.е., инверсию патологии и/или симптоматики).
“Галоген” (или "гало") означает фтор, хлор, бром или йод. Предпочтительны фтор, хлор и бром.
"Алкил" означает алифатическую углеводородную группу, которая может быть линейной или разветвленной и содержащей приблизительно 1-20 атомов углерода в цепи. Предпочтительные алкильные группы содержат приблизительно 1-12 атомов углерода в цепи. Более предпочтительные алкильные группы содержат приблизительно 1-6 атомов углерода в цепи. Разветвленные означает, что одна или более низших алкильных групп, таких как метил, этил или пропил, соединены с линейной алкильной цепью. "Низший алкил" означает группу приблизительно с 1-6 атомами углерода в цепи, которая может быть линейной или разветвленной. Неограничивающие примеры пригодных алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил, гексил, гептил, октанил и т.п., каждый из которых может быть линейным или разветвленным.
“Галогеналкил” означает алкил, как определено выше, где один или более атомов водорода на алкиле заменено галогеновой группой, определенной выше.
"Гетероалкил" означает алкильную составляющую, как определено выше, содержащую один или более атомов углерода, например один, два или три атома углерода, замененные одним или более гетероатомами, которые могут быть теми же самыми или различными, где точкой присоединения к остатку молекулы является атом углерода гетероалкильного радикала. Такие пригодные гетероатомы включают O, S, S(O), S(O)2 и -NH-, -N(алкил)-. Неограничивающие примеры включают простые эфиры, простые тиоэфиры, амины и тому подобное.
"Алкенил" означает алифатическую углеводородную группу, содержащую по меньшей мере одну углерод-углеродную двойную связь, и которая может быть линейной или разветвленной и содержащей приблизительно 2-15 атомов углерода в цепи. Предпочтительные алкенильные группы содержат приблизительно 2-12 атомов углерода в цепи и более предпочтительно приблизительно 2-6 атомов углерода в цепи. Разветвленные означает, что одна или более низших алкильных групп, таких как метил, этил или пропил, присоединены к линейной алкенильной цепи. "Низший алкенил" означает приблизительно 2-6 атомов углерода в цепи, которая может быть линейной или разветвленной. "Алкенил" может быть незамещенным или необязательно замещенным одним или более заместителями, которые могут быть теми же самыми или различными, каждый из заместителей независимо выбирают из группы, состоящей из галогена, алкила, арила, циклоалкила, циано, алкокси и -S(алкила). Неограничивающие примеры пригодных алкенильных групп включают этенил, пропенил, н-бутенил, 3-метилбут-2-енил, н-пентенил, октенил и деценил.
“Алкилен” означает дифункциональную группу, полученную удалением атома водорода из алкильной группы, определенной выше. Неограничивающие примеры алкилена включают метилен, этилен и пропилен. В более общем смысле суффикс “ен” в алкиле, ариле, гетероциклоалкиле и т.п. означает двухвалентную группу, например, -CH2CH2- означает этилен, и 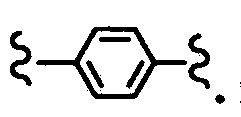 означает пара-фенилен.
означает пара-фенилен.
"Алкинил" означает алифатическую углеводородную группу, содержащую по меньшей мере одну углерод-углеродную тройную связь, и которая может быть линейной или разветвленной и содержащей приблизительно 2-15 атомов углерода в цепи. Предпочтительные алкинильные группы содержат приблизительно 2-12 атомов углерода в цепи и более предпочтительно приблизительно 2-4 атома углерода в цепи. Разветвленные означает, что одна или более низших алкильных групп, таких как метил, этил или пропил, присоединены к линейной алкинильной цепи. "Низший алкинил" подразумевает приблизительно 2-6 атомов углерода в цепи, которая может быть линейной или разветвленной. Неограничивающие примеры пригодных алкинильных групп включают этинил, пропинил, 2-бутинил и 3-метилбутинил. "Алкинил" может быть незамещенным или необязательно замещенным одним или более заместителями, которые могут быть теми же самыми или различными, каждый из заместителей независимо выбирают из группы, состоящей из алкила, арила и циклоалкила.
“Алкенилен” означает дифункциональную группу, полученную удалением водорода из алкенильной группы, определенной выше. Неограничивающие примеры алкенилена включают -CH=CH-, -C(CH3)=CH- и -CH=CHCH2-.
"Арил" означает ароматическую моноциклическую или полициклическую систему колец, содержащую приблизительно 6-14 атомов углерода, предпочтительно приблизительно 6-10 атомов углерода. Арильная группа может быть необязательно замещенная одним или более "заместителями циклической системы", которые могут быть теми же самыми или различными и такими, как здесь определено. Неограничивающие примеры пригодных арильных групп включают фенил и нафтил. "Моноциклический арил" означает фенил.
"Гетероарил" означает ароматическую моноциклическую или полициклическую систему колец, содержащую приблизительно 5-14 атомов углерода, предпочтительно приблизительно 5-10 атомов углерода, в которой один или более циклических атомов представляют собой элемент, отличный от углерода, например, азот, кислород или серу, отдельный или в комбинации. Предпочтительные гетероарилы содержат приблизительно 5-6 циклических атомов. "Гетероарил" необязательно может быть замещен одним или более заместителями, которые могут быть теми же самыми или различными, как определено здесь. Приставка аза, окса или тиа перед названием корня гетероарил означает, что по меньшей мере атом азота, кислорода или серы, соответственно, присутствует в качестве циклического атома. Атом азота гетероарила необязательно может быть окисленным до соответствующего N-оксида. “Гетероарил” может также включать гетероарил, как определено выше, конденсированный с арилом, как определено выше. Неограничивающие примеры пригодных гетероарилов включают пиридил, пиразинил, фуранил, тиенил (который альтернативно может упоминаться как тиофенил), пиримидинил, пиридон (включая N-замещенные пиридоны), изоксазолил, изотиазолил, оксазолил, оксадиазолил, тиазолил, тиадиазолил, пиразолил, фуразанил, пирролил, пиразолил, триазолил, 1,2,4-тиадиазолил, пиразинил, пиридазинил, хиноксалинил, фталазинил, оксиндолил, имидазо[1,2-a]пиридинил, имидазо[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил, бензотиенил, хинолинил, имидазолил, тиенопиридил, хиназолинил, тиенопиримидил, пирролопиридил, имидазопиридил, изохинолинил, бензоазаиндолил, 1,2,4-триазинил, бензотиазолил и тому подобное. Термин “гетероарил” также означает частично насыщенные гетероарильные составляющие, такие как, например, тетрагидроизохинолил, тетрагидрохинолил и тому подобное. Термин “моноциклический гетероарил” означает моноциклические варианты гетероарила, определенного выше, и включает 4-7-членные моноциклические гетероарильные группы, содержащие 1-4 циклических гетероатома, указанные циклические гетероатомы независимо выбирают из группы, состоящей из N, O и S, и их оксиды. Точкой присоединения к исходной составляющей является любой доступный циклический углерод или циклический гетероатом. Неограничивающие примеры моноциклических гетероарильных групп включают пиридил, пиразинил, фуранил, тиенил, пиримидинил, пиридазинил, пиридонил, тиазолил, изотиазолил, оксазолил, оксадиазолил, изоксазолил, пиразолил, фуразанил, пирролил, пиразолил, триазолил, тиадиазолил (например, 1,2,4-тиадиазолил), имидазолил и триазинил (например, 1,2,4-триазинил), и их оксиды.
"Циклоалкил" означает неароматическую моно- или полициклическую систему колец, содержащую приблизительно 3-10 атомов углерода, предпочтительно приблизительно 5-10 атомов углерода. Предпочтительные циклоалкильные кольца содержат приблизительно 5-7 циклических атомов. Циклоалкил необязательно может быть замещен одним или более заместителями, которые могут быть теми же самыми или различными, как здесь определено. Моноциклический циклоалкил означает моноциклические варианты описанных здесь циклоалкильных составляющих. Неограничивающие примеры пригодных моноциклических циклоалкилов включают циклопропил, циклопентил, циклогексил, циклогептил, циклооктил и тому подобное. Неограничивающие примеры пригодных полициклических циклоалкилов включают 1-декалинил, норборнил, адамантил и тому подобное. Дальнейшие неограничивающие примеры циклоалкила включают следующие:
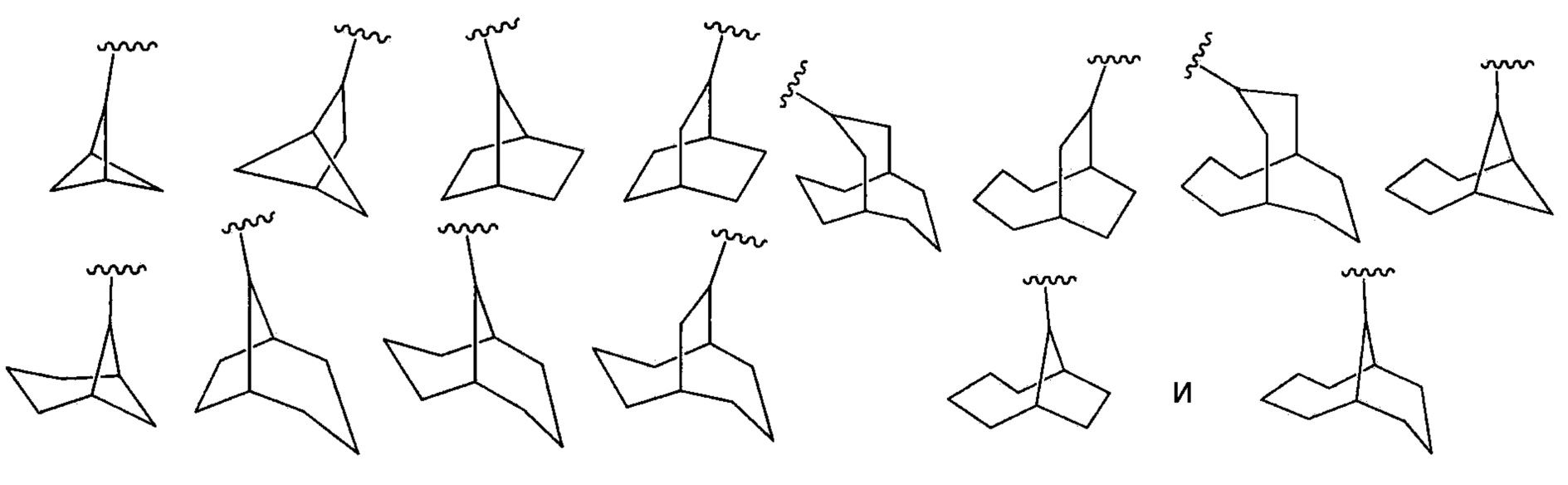 .
.
"Циклоалкенил" означает неароматическую моно- или полициклическую систему колец, содержащую приблизительно 3-10 атомов углерода, предпочтительно приблизительно 5-10 атомов углерода, которая содержит по меньшей мере одну углерод-углеродную двойную связь. Предпочтительные циклоалкенильные кольца содержат приблизительно 5-7 циклических атомов. Циклоалкенил необязательно может быть замещен одним или более заместителями, которые могут быть теми же самыми или различными, как здесь определено. Термин "моноциклический циклоалкенил" означает моноциклические варианты описанных здесь циклоалкенильных групп и включает неароматические 3-7-членные моноциклические циклоалкильные группы, которые содержат одну или более углерод-углеродных связей. Неограничивающие примеры включают циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклогепта-1,3-диенил и тому подобное. Неограничивающим примером пригодного полициклического циклоалкенила является норборниленил.
“Гетероциклоалкил” (или "гетероциклил") означает неароматическую насыщенную моноциклическую или полициклическую систему колец, содержащую приблизительно 3-10 циклических атомов, предпочтительно приблизительно 5-10 циклических атомов, в которой один или более атомов в циклической системе означают элемент, иной чем углерод, например, азот, кислород или серу, отдельно или в комбинации. Никаких смежных атомов кислорода и/или серы не присутствует в циклической системе. Предпочтительные гетероциклилы содержат приблизительно 5-6 циклических атомов. Приставка аза, окса или тиа перед названием корня гетероциклил означает, что по меньшей мере атом азота, кислорода или серы, соответственно, присутствует в качестве циклического атома. Любой -NH в гетероциклильном кольце может существовать в защищенном виде, таком как, например группа -N(Boc), -N(CBz), -N(Tos) и тому подобная; считается, что такие защиты также входят в состав изобретения. Гетероциклил необязательно может быть замещен одним или более заместителями, которые могут быть теми же самыми или различными, как здесь определено. Атом азота или серы гетероциклила необязательно может быть окисленным до соответствующего N-оксида, S-оксида или S,S-диоксида. Таким образом, термин “оксид”, когда возникает в определении переменной в описанной здесь общей структуре, означает соответствующий N-оксид, S-оксид или S,S-диоксид. “Гетероциклил” также включает циклы, в которых =O заменяет два доступных водорода на одном и том же атоме углерода (т.e., гетероциклил включает циклы с карбонильной группой в цикле). Такие =O группы могут упоминаться здесь как “оксо”. Примером такой составляющей является пирролидинон (или пирролидон): 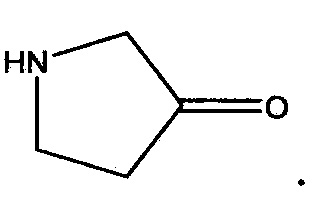 Как использован здесь, термин “моноциклический гетероциклоалкил” означает моноциклические варианты описанных здесь гетероциклоалкильных составляющих и включает 4-7-членные моноциклические гетероциклоалкильные группы, содержащие 1-4 циклических гетероатома, указанные циклические гетероатомы независимо выбирают из группы, состоящей из N,N-оксида, O,S,S-оксида, S(O) и S(O)2. Точкой присоединения к исходной составляющей является любой доступный циклический углерод или циклический гетероатом. Неограничивающие примеры моноциклических гетероциклоалкильных групп включают пиперидил, оксетанил, пирролил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,4-диоксанил, тетрагидрофуранил, тетрагидротиофенил, бета-лактам, гамма-лактам, дельта-лактам, бета-лактон, гамма-лактон, дельта-лактон и пирролидинон, и их оксиды. Неограничивающие примеры замещенного низшим алкилом оксетанила включают группу:
Как использован здесь, термин “моноциклический гетероциклоалкил” означает моноциклические варианты описанных здесь гетероциклоалкильных составляющих и включает 4-7-членные моноциклические гетероциклоалкильные группы, содержащие 1-4 циклических гетероатома, указанные циклические гетероатомы независимо выбирают из группы, состоящей из N,N-оксида, O,S,S-оксида, S(O) и S(O)2. Точкой присоединения к исходной составляющей является любой доступный циклический углерод или циклический гетероатом. Неограничивающие примеры моноциклических гетероциклоалкильных групп включают пиперидил, оксетанил, пирролил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,4-диоксанил, тетрагидрофуранил, тетрагидротиофенил, бета-лактам, гамма-лактам, дельта-лактам, бета-лактон, гамма-лактон, дельта-лактон и пирролидинон, и их оксиды. Неограничивающие примеры замещенного низшим алкилом оксетанила включают группу: 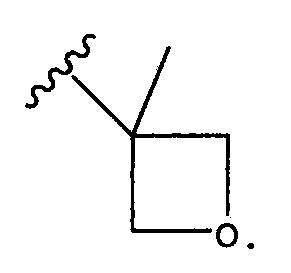
“Гетероциклоалкенил” (или "гетероцикленил") означает неароматическую моноциклическую или полициклическую систему колец, содержащую приблизительно 3-10 циклических атомов, предпочтительно приблизительно 5-10 циклических атомов, в которой один или более атомов в циклической системе означают элемент, иной чем углерод, например, азот, кислород или серу, отдельно или в комбинации, и которая содержит по меньшей мере одну углерод-углеродную двойную связь или углерод-азотную двойную связь. Никаких смежных атомов кислорода и/или серы не присутствует в циклической системе. Предпочтительные гетероцикленильные кольца содержат приблизительно 5-6 циклических атомов. Приставка аза, окса или тиа перед названием корня гетероцикленил означает, что по меньшей мере атом азота, кислорода или серы, соответственно, присутствует в качестве циклического атома. Гетероцикленил необязательно может быть замещен одним или более заместителями, которые могут быть теми же самыми или различными, как определено здесь. Атом азота или серы гетероцикленила необязательно может быть окисленным до соответствующего N-оксида, S-оксида или S,S-диоксида. Неограничивающие примеры пригодных гетероцикленильных групп включают 1,2,3,4-тетрагидропиридинил, 1,2-дигидропиридинил, 1,4-дигидропиридинил, 1,2,3,6-тетрагидропиридинил, 1,4,5,6-тетрагидропиримидинил, 2-пирролинил, 3-пирролинил, 2-имидазолинил, 2-пиразолинил, дигидроимидазолил, дигидрооксазолил, дигидрооксадиазолил, дигидротиазолил, 3,4-дигидро-2H-пиранил, дигидрофуранил, фтордигидрофуранил, 7-оксабицикло[2.2.1]гептенил, дигидротиофенил, дигидротиопиранил и тому подобное. “Гетероцикленил” также включает циклы, в которых =O заменяет два доступных водорода на одном и том же атоме углерода (т.e., гетероцикленил включает циклы с карбонильной группой в цикле). Примером такой составляющей является пирролиденон (или пирролон): 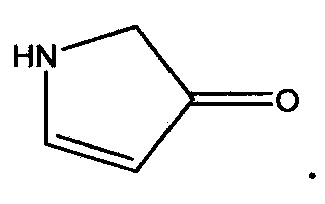 Как использован здесь, термин “моноциклический гетероциклоалкенил” означает моноциклические варианты описанных здесь гетероциклоалкенильных составляющих и включает 4-7-членные моноциклические гетероциклоалкенильные группы, содержащие 1-4 циклических гетероатома, указанные циклические гетероатомы независимо выбирают из группы, состоящей из N,N-оксида, O,S,S-оксида, S(O) и S(O)2. Точкой присоединения к исходной составляющей является любой доступный циклический углерод или циклический гетероатом. Неограничивающие примеры моноциклических гетероциклоалкенильных групп включают 1,2,3,4-тетрагидропиридинил, 1,2-дигидропиридинил, 1,4-дигидропиридинил, 1,2,3,6-тетрагидропиридинил, 1,4,5,6-тетрагидропиримидинил, 2-пирролинил, 3-пирролинил, 2-имидазолинил, 2-пиразолинил, дигидроимидазолил, дигидрооксазолил, дигидрооксадиазолил, дигидротиазолил, 3,4-дигидро-2H-пиранил, дигидрофуранил, фтордигидрофуранил, дигидротиофенил и дигидротиопиранил, и их оксиды.
Как использован здесь, термин “моноциклический гетероциклоалкенил” означает моноциклические варианты описанных здесь гетероциклоалкенильных составляющих и включает 4-7-членные моноциклические гетероциклоалкенильные группы, содержащие 1-4 циклических гетероатома, указанные циклические гетероатомы независимо выбирают из группы, состоящей из N,N-оксида, O,S,S-оксида, S(O) и S(O)2. Точкой присоединения к исходной составляющей является любой доступный циклический углерод или циклический гетероатом. Неограничивающие примеры моноциклических гетероциклоалкенильных групп включают 1,2,3,4-тетрагидропиридинил, 1,2-дигидропиридинил, 1,4-дигидропиридинил, 1,2,3,6-тетрагидропиридинил, 1,4,5,6-тетрагидропиримидинил, 2-пирролинил, 3-пирролинил, 2-имидазолинил, 2-пиразолинил, дигидроимидазолил, дигидрооксазолил, дигидрооксадиазолил, дигидротиазолил, 3,4-дигидро-2H-пиранил, дигидрофуранил, фтордигидрофуранил, дигидротиофенил и дигидротиопиранил, и их оксиды.
Следует отметить, что в содержащих гетероатом циклических системах по настоящему изобретению нет гидроксильных групп на атомах углерода, смежных с N, О или S, а также нет групп N или S на углеродах, смежных с другим гетероатомом. 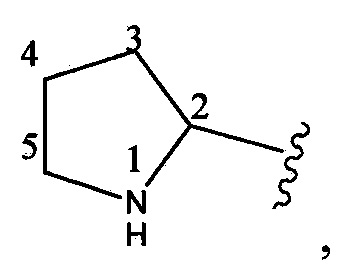 отсутствует -OH, непосредственно присоединенный к углеродам, обозначенным 2 и 5.
отсутствует -OH, непосредственно присоединенный к углеродам, обозначенным 2 и 5.
"Гидроксиалкил" означает HO-алкил- группу, в которой алкил является таким, как определено ранее. Предпочтительные гидроксиалкилы содержат низший алкил. Неограничивающие примеры пригодных гидроксиалкильных групп включают гидроксиметил и 2-гидроксиэтил.
"Цианоалкил" означает NC-алкил- группу, в которой алкил является таким, как определено ранее. Предпочтительные цианоалкилы содержат низший алкил. Неограничивающие примеры пригодных цианоалкильных групп включают цианометил и 2-цианоэтил.
"Алкокси" означает алкил-O- группу, в которой алкил является таким, как определено ранее. Неограничивающие примеры пригодных алкоксигрупп включают метокси, этокси, н-пропокси, изопропокси и н-бутокси. Связь с исходной составляющей осуществляется через кислород простого эфира.
“Спироциклоалкил” означает циклоалкильную группу, присоединенную к исходной составляющей по одному атому углерода. Неограничивающие примеры спироциклоалкила, где исходной составляющей является циклоалкил, включают спиро[2.5]октан, спиро[2.4]гептан и т.п. Неограничивающими примерами спироциклоалкила, в котором исходной составляющей является Алкильная группа, соединяющая конденсированные циклические системы колец (такая как алкильная группа в конденсированном с гетероарилом гетероарилалкиле-), необязательно может быть замещена спироциклоалкилом или другими группами, как определено здесь. Неограничивающие спироциклоалкильные группы включают спироциклопропил, спироциклобутил, спироциклогептил и спироциклогексил.
Термин “замещенные” означает, что один или более водородов на обозначенном атоме заменены, с выбором из указанной группы, при условии, что нормальная валентность обозначенного атома при существующих обстоятельствах не превышена, и что замещение приводит к стабильному соединению. Комбинации заместителей и/или переменных допустимы, только если такие комбинации приводят к стабильным соединениям. Под “стабильным соединением” или “стабильной структурой” понимают соединение, которое достаточно устойчиво, чтобы выдержать выделение в целесообразной степени чистоты из реакционной смеси и формулирование в эффективное терапевтическое средство.
Термин “необязательно замещенные” означает необязательное замещение указанными группами, радикалами или составляющими.
Когда переменная представлена в группе более одного раза, например, R6 в -N(R6)2, или переменная представлена более одного раза в приведенной здесь структуре, переменные могут быть теми же самыми или различными.
Линия ---- в качестве связи обычно означает смесь, или один из двух, возможных изомеров, например, имеющих (R)- и (S)- стереохимию. Например: 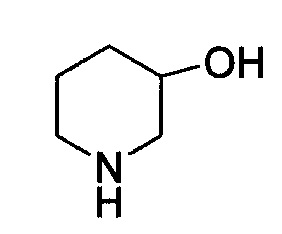 означает содержание как
означает содержание как 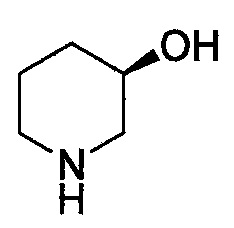 , так и
, так и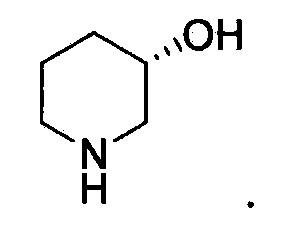
Волнистая линия ~~~~, как использована здесь, означает точку присоединения к остатку соединения. Линии, вовлеченные в циклические системы, такие как, например:  , указывают, что показанная линия (связь) может быть соединена с любыми подходящими циклическими атомами углерода.
, указывают, что показанная линия (связь) может быть соединена с любыми подходящими циклическими атомами углерода.
“Оксо” определяется как атом кислорода, связанный двойной связью с циклическим углеродом в циклоалкиле, циклоалкениле, гетероциклиле, гетероциклениле или другом описанном здесь цикле, например, 
В данном описании, где есть многократные атомы кислорода и/или серы в циклической системе, не может быть никакого смежного кислорода и/или серы, присутствующих в указанной циклической системе.
Как хорошо известно из уровня техники, связь, проведенная от конкретного атома, на конце которой не изображена никакая составляющая, означает метильную группу, связанную посредством этой связи с атомом, если не указано иное. Например:  означает
означает 
В другом варианте осуществления соединения по изобретению и/или содержащие их композиции представлены в выделенной и/или очищенной форме. Термин "очищенный", "в очищенной форме" или “в выделенной и очищенной форме” в отношении соединения означает физическое состояние указанного соединения после его извлечения из процесса синтеза (напр. из реакционной смеси) или природного источника, или в комбинации. Таким образом, термин "очищенный", "в очищенной форме" или “в выделенной и очищенной форме” применительно к соединению означает физическое состояние указанного соединения (или его таутомера или стереоизомера, или фармацевтически приемлемой соли или сольвата указанного соединения, указанного стереоизомера или указанного таутомера) после получения в результате процесса очистки или процесса, описанного здесь или хорошо известного специалисту в данной области (например, хроматографии, перекристаллизации и тому подобного), с достаточной чистотой, пригодной для применения in vivo или медицинского применения, и/или характеризации стандартными аналитическими методами, описанными здесь или хорошо известными специалисту в данной области.
Следует понимать, что любой углерод, равно как гетероатом с ненасыщенными валентностями в приведенном здесь тексте, схемах, примерах и таблицах, считается имеющим достаточное число атома (атомов) водорода для насыщения валентности.
Когда функциональная группа в соединении именуется “защищенной”, это означает, что группа находится в модифицированной форме для предотвращения нежелательных побочных реакций на защищенном участке, когда соединение подвергают взаимодействию. Пригодные защитные группы устанавливаются специалистами в данной области, а также по стандартным справочникам, таким как, например, T. W. Greene et al, Protective Groups in organic Synthesis (1991), Wiley, New York.
Другой вариант осуществления касается пролекарств и/или сольватов соединений по изобретению. Обсуждение пролекарств приведено в T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems (1987) 14 of the A.C.S. Symposium Series и в Bioreversible Carriers in Drug Design, (1987) Edward B. Roche, ed., American Pharmaceutical Association and Pergamon Press. Термин “пролекарство” означает соединение (например, лекарственный предшественник), которое превращается in vivo с образованием соединения по изобретению или фармацевтически приемлемой соли, гидрата или сольвата соединения. Превращение может осуществляться по различным механизмам (например, метаболическими или химическими процессами), такими как, например, путем гидролиза в крови. Обсуждение применения пролекарств приведено в T. Higuchi and W. Stella, “Pro-drugs as Novel Delivery Systems,” Vol. 14 of the A.C.S. Symposium Series, и в Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987.
Например, если соединение по изобретению или его фармацевтически приемлемая соль содержит функциональную группу карбоновой кислоты, пролекарство может содержать сложный эфир, полученный замещением атома водорода кислотной группы такой группой, как, например, (C1-C8)-алкил, (C2-C12)-алканоилоксиметил, 1-(алканоилокси)этил с 4-9 атомами углерода, 1-метил-1-(алканоилокси)этил с 5-10 атомами углерода, алкоксикарбонилоксиметил с 3-6 атомами углерода, 1-(алкоксикарбонилокси)этил с 4-7 атомами углерода, 1-метил-1-(алкоксикарбонилокси)этил с 5-8 атомами углерода, N-(алкоксикарбонил)аминометил с 3-9 атомами углерода, 1-(N-(алкоксикарбонил)амино)этил с 4-10 атомами углерода, 3-фталидил, 4-кротонолактонил, гамма-бутиролактон-4-ил, ди-N,N-(C1-C2)-алкиламино-(C2-C3)-алкил (такой как β-диметиламиноэтил), карбамоил-(Cl-C2)-алкил, N,N-ди-(C1-C2)-алкилкарбамоил-(C1-C2)-алкил и пиперидино-, пирролидино- или морфолино-(C2-C3)-алкил и тому подобное.
Подобным образом, если соединение по изобретению содержит спиртовую функциональную группу, пролекарство может быть образовано замещением атома водорода спиртовой группы группой, такой как, например, (C1-C6)-алканоилоксиметил, 1-((C1-C6)-алканоилокси)этил, 1-метил-1-((C1-C6)-алканоилокси)этил, (C1-C6)-алкоксикарбонилоксиметил, N-(C1-C6)-алкоксикарбониламинометил, сукциноил, (C1-C6)-алканоил, α-амино-(C1-C4)-алканоил, арилацил и α-аминоацил или α-аминоацил-α-аминоацил, где каждую из α-аминоацильных групп независимо выбирают из L-аминокислот природного происхождения, P(O)(OH)2, -P(O)(O(C1-C6)-алкила)2 или гликозила (радикала, образующегося в результате удаления гидроксильной группы полуацетальной формы карбогидрата) и тому подобного.
Если соединение по изобретению включает аминовую функциональную группу, пролекарство может быть образовано замещением атома водорода аминогруппы группой, такой как, например, R-карбонил, RO-карбонил, NRR’-карбонил, где каждый из R и R’ независимо означает (C1-С10)-алкил, (С3-С6)-циклоалкил, бензил, или R-карбонил означает природный α-аминоацил или природный α-аминоацил, -C(OH)C(O)OY1, где Y1 означает H, (C1-С6)-алкил или бензил, -C(OY2)Y3, где Y2 означает (C1-C4)-алкил и Y3 означает (C1-С6)-алкил, карбокси-(C1-С6)-алкил, амино-(C1-C4)-алкил или моно-N- или ди-N,N-(C1-С6)-алкиламиноалкил, -C(Y4)Y5, где Y4 означает H или метил и Y5 означает моно-N- или ди-N,N-(C1-С6)-алкиламино морфолино, пиперидин-1-ил или пирролидин-1-ил и тому подобное.
Одно или более соединений по изобретению могут существовать в несольватированной, равно как сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное, и подразумевается, что изобретение охватывает как сольватированные, так и несольватированные формы. "Сольват" означает физическую ассоциацию соединения по изобретению с одной или более молекулами растворителя. Эта физическая ассоциация включает различные степени ионного и ковалентного связывания, включая образование водородных связей. В некоторых случаях сольват может быть выделен, например, когда одна или более молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. "Сольват" охватывает как жидкофазные, так и изолируемые сольваты. Неограничивающие примеры пригодных сольватов включаеют этанолаты, метанолаты и тому подобное. "Гидрат" означает сольват, в котором молекулой растворителя является H2O.
Одно или более соединений по изобретению необязательно могут быть превращены в сольват. Получение сольватов общеизвестно. Так, например, M. Caira et al, J. Pharmaceutical Sci., 93(3), 601-611 (2004) описывает получение сольватов противогрибкового флуконазола в этилацетате, а также из воды. Подобные получения сольватов, полусольватов, гидратов и тому подобного описаны в E. C. van Tonder et al., AAPS PharmSciTech., 5(1), article 12 (2004) и A. L. Bingham et al., Chem. Commun., 603-604 (2001). Типичный неограничивающий способ включает растворение соединения по изобретению в заданных количествах требуемого растворителя (органического или воды или их смесей) при температуре более высокой, чем температура окружающей среды, и охлаждении раствора со скоростью, достаточной для образования кристаллов, которые затем выделяют стандартными методами. Аналитические методы, такие как, например. ИК-спектроскопия, показывают присутствие растворителя (или воды) в кристаллах в виде сольвата (или гидрата).
Другой вариант осуществления касается фармацевтически приемлемых солей соединений по изобретению. Таким образом, подразумевается, что ссылка на соединение по изобретению здесь включает ссылку на его соли, если не указано иное. Термин "соль (соли)", как использован здесь, означает кислотные соли, образованные с неорганическими и/или органическими кислотами, равно как основные соли, образованные с неорганическими и/или органическими основаниями. Кроме того, когда соединение по изобретению содержит как основную составляющую, такую как, но не в порядке ограничения, пиридин или имидазол, так и кислотную составляющую, такую как, но не в порядке ограничения, карбоновую кислоту, цвиттерионы ("внутренние соли") могут образовываться и охватываются термином "соль (соли)", как использовано здесь. Предпочтительны фармацевтически приемлемые (т.е., нетоксичные, физиологически приемлемые) соли, хотя другие соли также полезны. Соли соединениий по изобретению могут быть получены, например, взаимодействием соединения по изобретению с некоторым количеством кислоты или основания, таким как эквивалентное количество, в среде, такой как среда, в которой осаждают соль, или в водной среде с последующей лиофилизацией.
Типичные кислотно-аддитивные соли включают ацетаты, аскорбаты, бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфонаты, фумараты, гидрохлориды, гидробромиды, гидройодиды, лактаты, малеаты, метансульфонаты, нафталинсульфонаты, нитраты, оксалаты, фосфаты, пропионаты, салицилаты, сукцинаты, сульфаты, тартраты, тиоцианаты, толуолсульфонаты (также известные как тозилаты) и тому подобное. Кроме того, кислоты, которые обычно считаются пригодными для получения фармацевтически полезных солей из основных фармацевтических соединений, описаны, например, в P. Stahl et al., Camille G. (eds.) Handbook of Pharmaceutical Salts. Properties, Selection and Use. (2002) Zurich: Wiley-VCH; S. Berge et al., Journal of Pharmaceutical Sciences (1977) 66(1) 1-19; P. Gould, International J. of Pharmaceutics (1986) 33 201-217; Anderson et al., The Practice of Medicinal Chemistry (1996), Academic Press, New York и в The Orange Book (Food & Drug Administration, Washington, D.C. на их веб-сайте). Эти сведения включены здесь в качестве ссылки.
Типичные основные соли включают соли аммония, соли щелочных металлов, такие как соли натрия, лития и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли с органическими основаниями (например, органическими аминами), такими как дициклогексиламины, трет-бутиламины, и соли с аминокислотами, такими как аргинин, лизин и тому подобное. Основные азотсодержащие группы могут быть кватернизированы с агентами, такими как низшие алкилгалогениды (например, метил-, этил- и бутилхлориды, бромиды и иодиды), диалкилсульфаты (например, диметил-, диэтил- и дибутилсульфаты), длинноцепные галогениды (например, децил-, лаурил- и стеарилхлориды, -бромиды и -йодиды), аралкилгалогениды (например, бензил- и фенетилбромиды) и другие.
Предполагается, что все такие кислотные соли и основные соли представляют собой фармацевтически приемлемые соли в рамках объема изобретения, и все кислотные и основные соли считаются эквивалентными свободным формам соответствующих соединений с точки зрения изобретения.
Другой вариант осуществления касается фармацевтически приемлемых сложных эфиров соединений по изобретению. Такие сложные эфиры включают следующие группы: (1) эфиры карбоновых кислот, полученные этерификацией гидроксигрупп, в которых некарбонильную составляющую карбоксикислотной части сложноэфирной группировки выбирают из линейного или разветвленного алкила (например, ацетила, н-пропила, трет-бутила или н-бутила), алкоксиалкила (например, метоксиметила), аралкила (например, бензила), арилоксиалкила (например, феноксиметила), арила (например, фенила, необязательно замещенного, например галогеном, (C1-C4)-алкилом или (C1-C4)-алкокси или амино); (2) сульфонатные сложные эфиры, такие как алкил- или аралкилсульфонил (например, метансульфонил); (3) эфиры аминокислот (например, L-валил или L-изолейцил); (4) фосфонатные эфиры, и (5) моно-, ди-или трифосфатные эфиры. Фосфатные эфиры могут быть дополнительно этерифицированы, например C1-20-спиртом или его реакционноспособным производным, или 2,3-ди-(С6-24)-ацилглицерином.
Другой вариант осуществления касается таутомеров соединений по изобретению и их солей, сольватов, сложных эфиров и пролекарств. Также, например, все кетоенольные и иминенаминовые формы соединений входят в изобретение.
Соединения по изобретению могут содержать асимметрические или хиральные центры и поэтому существовать в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений по изобретению, равно как их смеси, включая рацемические смеси, входят в состав настоящего изобретения. Вдобавок, настоящее изобретение охватывает все геометрические и позиционные изомеры. Например, если соединение по изобретению включает двойную связь или конденсированный цикл, обе цис- и транс-формы, а также смеси, охватываются рамками объема изобретения.
Другой вариант осуществления касается диастереомерных смесей и отдельных энантиомеров соединений по изобретению. Диастереомерные смеси могут быть разделены на отдельные диастереомеры на основании их физико-химических различий, хорошо известных специалисту в данной области, методами, такими как, например, хроматография и/или фракционная кристаллизация. Энантиомеры могут быть разделены превращением энантиомерной смеси в диастереомерную смесь при взаимодействии с соответствующим оптически активным соединением (например, хиральным вспомогательным ингредиентом, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделением диастереомеров и превращением (например, гидродизом) отдельных диастереомеров в соответствующие чистые энантиомеры. Также некоторые из соединений по изобретению могут быть атропоизомерами (например, замещенными биарилами) и считаются частью настоящего изобретения. Энантиомеры могут также быть разделены использованием колонки для хиральной ВЭЖХ.
Все стереоизомеры (например, геометрические изомеры, оптические изомеры и тому подобные) соединений по изобретению (включая соли, сольваты, сложные эфиры и пролекарства соединений, а также соли, сольваты и сложные эфиры пролекарств), такие как стереоизомеры, которые могут существовать благодаря асимметрическим углеродам на различных заместителях, включая энантиомерные формы (которые могут существовать даже в отсутствие асимметрических углеродов), ротамерные формы, атропоизомеры и диастереомерные формы, рассматриваются в качестве вариантов осуществления в рамках объема настоящего изобретения как позиционные изомеры (такие как, например, 4-пиридил и 3-пиридил). (Например, если соединение по изобретению включает двойную связь или конденсированный цикл, как цис-, так и транс-формы, равно как смеси, охватываются рамками объема изобретения. Также, например, все кетоенольные и иминенаминовые формы соединений включены в изобретение).
Отдельные стереоизомеры соединений по изобретению могут, например, быть по существу свободны от других изомеров или могут быть смешанными, например, как рацематы или со всеми другими, или другими выбранными, стереоизомерами. Хиральные центры по настоящему изобретению могут иметь S- или R-конфигурацию, как определено рекомендациями ИЮПАК 1974. Предполагается, что использование терминов "соль", "сольват", “сложный эфир”, "пролекарство" и тому подобных равно применимо к соли, сольвату, сложному эфиру, пролекарству энантиомеров, стереоизомеров, ротамеров, таутомеров, позиционных изомеров, рацематов или пролекарств соединений по изобретению.
В соединениях по изобретению атомы могут иметь природный изотопный состав, или один или более атомов могут быть искусственно обогащены определенным изотопом, имеющим тот же самый атомный номер, но атомную массу или массовое число, отличные от атомной массы или массового числа преимущественно существующих в природе. Имеется в виду, что настоящее изобретение включает все подходящие изотопные вариации соединений по изобретению. Например, различные изотопные формы водорода (H) включают протий (1H) и дейтерий (2H). Протий является преобладающим водородным изотопом, найденным в природе. Дополнительные примеры изотопов, которые могут быть включены в соединения по изобретению, включают (когда присутствуют) изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl, соответственно.
В дополнительном варианте осуществления соединения по изобретению являются изотопно-мечеными для применения в качестве исследовательских и диагностических средств. Например, соединения по изобретению могут быть мечеными для применения в испытаниях на распределение в тканях соединений и/или субстрата. Изотопы трития (т.е., 3H) и углерода-14 (т.е., 14C) предпочтительны из-за легкости их получения и возможности обнаружения. В другом варианте осуществления соединения по изобретению могут быть мечены более тяжелыми изотопами, такими как дейтерий (т.е., 2H). Обогащение дейтерием соединений по изобретению может давать определенные терапевтические преимущества, вытекающие из большей метаболической стабильности (например, повышенный период полураспада in vivo или сниженные режимы дозирования), или может обеспечивать соединение, полезное в качестве стандарта для характеристики биологических образцов, и следовательно может быть предпочтительным при некоторых обстоятельствах. Изотопно-меченые соединения по изобретению обычно могут быть получены, без излишнего экспериментирования, по следующим методикам, аналогичным описанным в приведенных ниже схемах и/или примерах, заменой соответствующим изотопно-меченым реагентом не меченого изотопом реагента.
Предполагается, что полиморфные формы соединений по изобретению и солей, сольватов, сложных эфиров и пролекарств соединений по изобретению включены в настоящее изобретение.
КОМПОЗИЦИИ И ВВЕДЕНИЕ
Другой вариант осуществления представляет фармацевтические композиции, которые содержат терапевтически эффективное количество соединения по изобретению или его стереоизомера, или фармацевтически приемлемой соли указанного соединения или указанного стереоизомера и фармацевтически приемлемый носитель.
Предпочтительная дозировка соединения по изобретению составляет около 0,001-100 мг/кг массы тела/день. В особенности предпочтительная дозировка соединения по изобретению или фармацевтически приемлемой соли указанного соединения составляет около 0,01-10 мг/кг массы тела/день.
Подразумевается также, что термин "фармацевтическая композиция" охватывает как нерасфасованную композицию, так и отдельные дозированные единицы, состоящие из нескольких (например, двух) фармацевтически активных веществ, таких как, например, соединение по настоящему изобретению, и дополнительного вещества, выбираемого из перечней дополнительных веществ, раскрытых здесь ниже, наряду с любыми фармацевтически неактивными наполнителями. Нерасфасованная композиция и каждая отдельная дозированная единица могут содержать фиксированные количества вышеуказанных "нескольких фармацевтически активных веществ". Нерасфасованная композиция представляет собой материал, который еще не был формован в отдельные дозированные единицы. Иллюстративной дозированной единицей является пероральная дозированная единица, такая как таблетки, пилюли и тому подобное. Точно так же подразумевается, что описанный здесь метод лечения пациента путем введения фармацевтической композиции по настоящему изобретению также охватывает введение вышеуказанной нерасфасованной композиции и отдельных дозированных единиц.
При получении фармацевтических композиций из описанных настоящим изобретением соединений инертные, фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Препараты в твердой форме включают порошки, таблетки, диспергируемые гранулы, капсулы, крахмальные капсулы и суппозитории. Порошки и таблетки могут состоять приблизительно на 5-95 процентов из активного ингредиента. Пригодные твердые носители известны из уровня техники, например, карбонат магния, стеарат магния, тальк, сахар или лактоза. Таблетки, порошки, крахмальные капсулы и капсулы могут быть использованы в качестве твердых лекарственных форм, пригодных для перорального введения. Примеры фармацевтически приемлемых носителей и методы изготовления различных композиций могут быть найдены в A. Gennaro (ed.), Remington’s Pharmaceutical Sciences, 18th Edition, (1990), Mack Publishing Co., Easton, Pennsylvania.
Препараты в жидкой форме включают растворы, суспензии и эмульсии. Примеры материалов, полезных для составления таких препаратов в жидкой форме, включают водные или водно-пропиленгликолевые растворы для парентеральной инъекции или подсластители и замутнители для пероральных растворов, суспензий и эмульсий. Препараты в жидкой форме могут также включать растворы или суспензии для интраназального введения.
Аэрозольные препараты, пригодные для ингаляции, могут включать растворы и твердые вещества в порошкообразной форме, которые могут быть в комбинациях с фармацевтически приемлемым носителем, таким как инертный сжатый газ, например, азот.
Включаются также препараты в твердой форме, которые предназначены для превращения непосредственно перед употреблением в препараты жидкой формы либо для перорального, либо для парентерального введения. Такие жидкие формы включают растворы, суспензии и эмульсии.
Соединения по изобретению могут также доставляться трансдермально. Трансдермальные композиции могут иметь форму кремов, лосьонов, аэрозолей и/или эмульсий и могут быть включены в трансдермальный пластырь матриксного или резервуарного типа, как общепринято в соответствующей данной цели области техники.
Соединения по настоящему изобретению могут также доставляться подкожно.
Предпочтительно, соединение вводят перорально.
Предпочтительно, фармацевтический препарат существует в стандартной лекарственной форме. В такой форме препарат подразделен на соответственно доведенные до требуемого размера однократные дозы, содержащие соответствующие количества активного компонента, например, эффективное количество для достижения заданной цели.
Количество активного соединения в однократной дозе препарата может быть дифференцированным или доведенным до величины приблизительно 0,001 мг-100 мг на кг массы тела млекопитающего, предпочтительно приблизительно 0,01 мг-10 мг на кг. Фактическая используемая дозировка может изменяться в зависимости от потребностей пациента и тяжести излечиваемого состояния. Определение надлежащего режима дозирования для конкретной ситуации находится в пределах компетенции специалиста в данной области. Для удобства общая суточная доза может быть подразделена и введена порциями в течение дня по мере необходимости.
Композиции по изобретению могут дополнительно содержать одно или более дополнительных лекарственных средств, как обсуждается более подробно ниже. Таким образом, в одном из вариантов осуществления настоящее изобретение касается композиций, содержащих: (i) соединение по изобретению или его стереоизомер, или фармацевтически приемлемую соль указанного соединения или указанного стереоизомера; (ii) одно или несколько дополнительных лекарственных средств, которые не являются соединениями по изобретению; и (iii) фармацевтически приемлемый носитель, где количества в композициях совместно эффективны для лечения одного из рассматриваемых здесь заболеваний или состояний.
ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ПО ИЗОБРЕТЕНИЮ
Другой вариант осуществления касается способа лечения пациента (например, пациента-человека или экспериментального животного) от заболеваний или нарушений, в которые вовлечен рецептор mGluR2. Такие способы включают введение эффективного количества соединения по изобретению или композиции, содержащей соединение по изобретению (или его стереоизомер, или фармацевтически приемлемую соль указанного соединения или указанного стереоизомера), нуждающемуся в этом пациенту для лечения заболевания или нарушения, в которое вовлечен рецептор mGluR2.
Другой вариант осуществления касается применения соединения по изобретению для лечения заболевания или нарушения, в которое вовлечен рецептор mGluR2, путем введения эффективного количества соединения по изобретению или его фармацевтически приемлемой соли нуждающемуся в этом пациенту.
В одном из вариантов осуществления соединения по изобретению, полезные в указанных способах или указанных применениях, охватывают соединения по любой из формул (I), (I.1), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и/или (V.2), как описано выше, или по любому из вышеуказанных вариантов осуществления. В другом варианте осуществления соединения по изобретению, полезные в указанных методах и указанных применениях, охватывают соединения по примерам, например, приведенные ниже в таблицах.
Другой вариант осуществления охватывает способ применения в каждом из описанных здесь способов и/или применений соединения формулы (I.2):
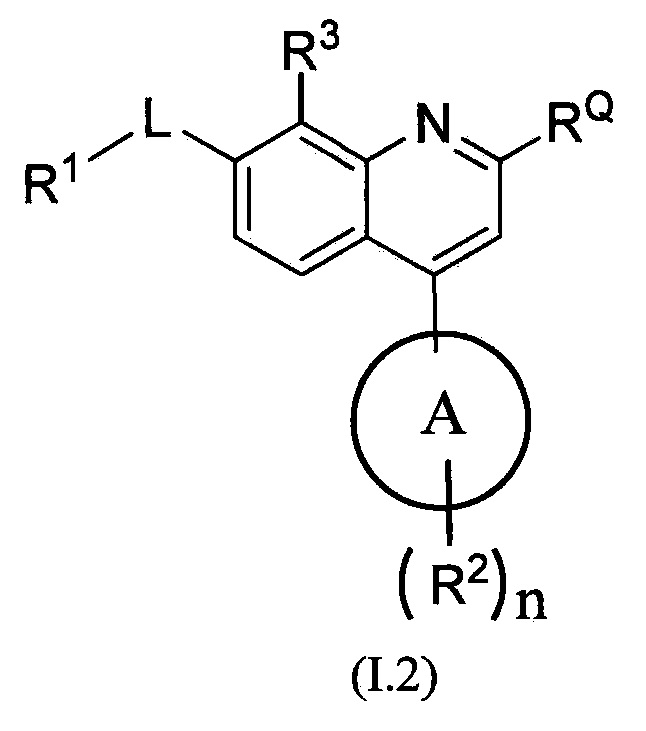 ,
,
или его стереоизомера, или фармацевтически приемлемой соли указанного соединения или указанного стереоизомера, где:
R1 означает гетероарил,
где указанный гетероарил представляет собой моноциклическую или полициклическую систему колец, содержащую от 5 до 10 циклических атомов, в которой 1-4 атома указанной циклической системы означают циклический атом азота,
и где указанный гетероарил является незамещенным или замещенным 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, гидроксизамещенного -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, фенила, -алкилфенила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1B)C(O)-(C1-C6)-алкила, -N(R1B)2, -C(O)N(R1B)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1B групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила);
и каждый из -L-, R3, RQ, цикла A, R2 и n является таким, как описано выше в формуле (I.1).
Другой вариант осуществления охватывает способ применения в каждом из описанных здесь способов и/или применений соединения формулы (V):
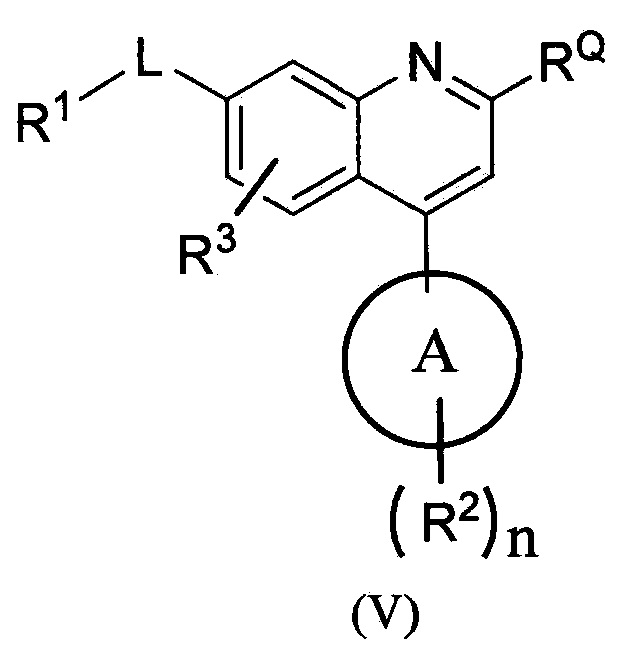 ,
,
или его стереоизомера, или фармацевтически приемлемой соли указанного соединения или указанного стереоизомера, где:
цикл A означает составляющую, выбираемую из группы, состоящей из фенила, -(C5-C6)-циклоалкила, -(C5-C6)-циклоалкенила, -пиридинила, пиримидинила, -пиразолила, -тиенила, -тиазолила, -тиадиазолила и -оксазолила;
RQ выбирают из группы, состоящей из -CN и -C(O)NH2;
-L- означает связь или двухвалентную составляющую, выбираемую из группы, состоящей из: -(C(R1L)2)P,  -C(O)-, -S(O)- и -S(O)2-;
-C(O)-, -S(O)- и -S(O)2-;
p равно 1, 2 или 3;
каждый из R1L независимо выбирают из группы, состоящей из H, -CH3, -CF3, -OH, -C(O)-, галогена, -циклопропила, -O-CH3 и -O-CF3;
R1 выбирают из группы, состоящей из:
(1) гетероциклоалкила, гетероциклоалкенила,
где указанный гетероциклоалкил и указанный гетероциклоалкенил представляют собой моноциклические или полициклические системы колец, содержащие от 3 до 10 циклических атомов, в которых 1, 2 или 3 атома каждой из указанных циклических систем представляют собой циклический гетероатом, независимо выбираемый из группы, состоящей из N, S, S(O), S(O)2 и O,
и где каждая из указанных гетероциклоалкильных групп и каждая из указанных гетероциклоалкенильных групп являются незамещенной или замещенной 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, гидроксизамещенного -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, фенила, -алкилфенила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -(С3-С8)-спирогетероциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1A)C(O)-(C1-C6)-алкила, -N(R1A)2, -C(O)N(R1A)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1A групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила);
(2) гетероарила,
где указанный гетероарил представляет собой моноциклическую или полициклическую систему колец, содержащую от 5 до 10 циклических атомов, в которой 1-4 атома указанной циклической системы представляют собой циклический атом азота,
и где указанный гетероарил является незамещенным или замещенным 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, гидроксизамещенного -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, гидроксизамещенного -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, фенила, -алкилфенила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1B)C(O)-(C1-C6)-алкила, -N(R1B)2, -C(O)N(R1B)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1B групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила);
(3) фенила,
где указанный фенил является незамещенным или замещенным 1-5 группами, независимо выбираемыми из группы, состоящей из оксо, CN, -OH, галогена, -(C1-C6)-алкила, -(C1-C6)-алкинила, -(C1-C6)-галогеналкила, -O-(C1-C6)-алкила, -(С3-С8)-циклоалкила, -алкилциклоалкила, -CH(OH)циклоалкила, моноциклического гетероарила, -алкил-моноциклического гетероарила, -(С3-С8)-спироциклоалкила, -C(O)H, -C(O)OH, -C(O)(C1-C6)-алкила, -С(O)O(C1-C6)-алкила, -N(R1C)C(O)-(C1-C6)-алкила, -N(R1C)2, -C(O)N(R1C)2, -S(O)2H, -S(O)-фенила, -S(O)-(C1-C6)-алкилфенила, -S(O)2-фенила, -S(O)2-(C1-C6)-алкилфенила, -S(O)2OH и -S(O)2-(C1-C6)-алкила,
где каждую из R1C групп независимо выбирают из группы, состоящей из H и -(C1-C6-алкила);
(4) H и -(C1-C6)-алкила;
(5) -CH2N(R1D)R1E, где:
R1D выбирают из группы, состоящей из H, -(C1-C6)-алкила и -C(O)OR1F; и
R1E выбирают из группы, состоящей из -O-(C1-C6)-алкила, гетероалкила, -алкил-C(O)N(R1F) и -C(O)OR1F,
где каждый R1F независимо выбирают из группы, состоящей из H и -(C1-C6)-алкила; и
(6) -CH2N(R1F)OR1G, где:
R1F выбирают из группы, состоящей из H, -(C1-C6)-алкила и -C(O)OR1F, и
R1G выбирают из группы, состоящей из H и -(C1-C6)-алкила;
n равно 0, 1, 2 или 3;
каждый из R2 (когда присутствует) независимо выбирают из группы, состоящей из галогена, -CN, -OH, -(C1-C6)-алкила, -O-(C1-C6)-алкила, -(C1-C6)-галогеналкила, -O-(C1-C6)-галогеналкила, циклопропила, циклобутила, циклопентила, циклогексила, -NH2, -NH(C1-C6)-алкила, -N(C1-C6-алкила)2, -С(O)O(C1-C6)-алкила и фенила; и
R3 выбирают из группы, состоящей из водорода и фтора.
Альтернативный вариант осуществления соединений формулы (V), полезных в указанных способах и указанных применениях, охватывает соединение формулы (V.1):
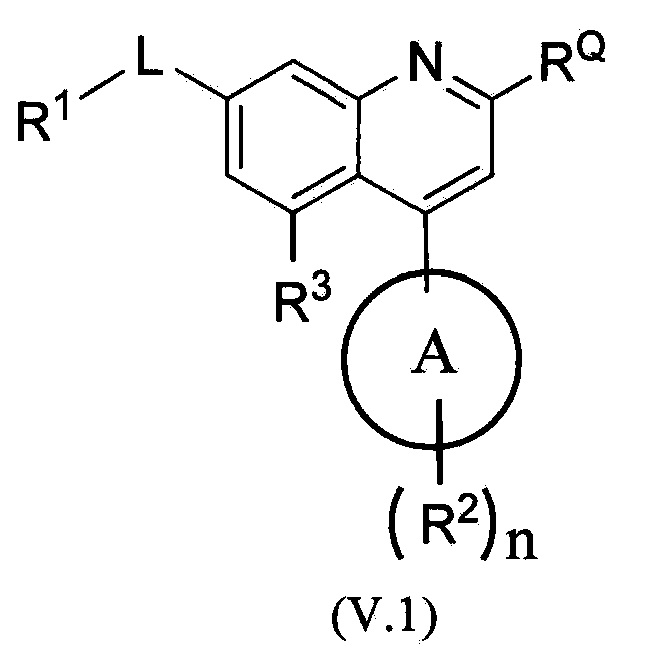 ,
,
или его стереоизомер, или фармацевтически приемлемую соль указанного соединения или указанного стереоизомера, где каждый из R1, -L-, цикл A, R2, n, R3 и RQ является таким, как определено в формуле (V).
Другой альтернативный вариант осуществления соединений формулы (V), полезных в указанных способах и указанных применениях, охватывает соединение формулы (V.2):
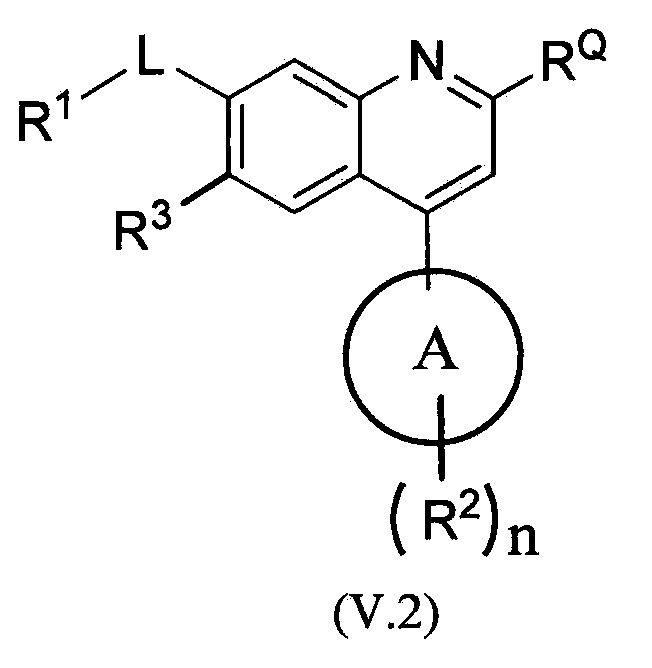 ,
,
или его стереоизомер, или фармацевтически приемлемую соль указанного соединения или указанного стереоизомера, где каждый из R1, -L-, цикл A, R2, n, R3 и RQ является таким, как определено в формуле (V).
В альтернативных вариантах осуществления формул (V), (V.1) и (V.2), где R1 означает гетероциклоалкил, гетероциклоалкенил, гетероарил или фенил, каждая из указанных R1 групп является незамещенной или замещенной 1-4 группами или, альтернативно, 1-3 группами или, альтернативно, 1-2 группами, где каждая из указанных групп является такой, как определено в формуле (V).
Заболевания или нарушения, в которые может быть вовлечен рецептор mGluR2, включают, но не в порядке ограничения, болезнь Альцгеймера, когнитивное нарушение, шизофрению, расстройства настроения, включающие депрессию и тревогу, нарушения со стороны желудочно-кишечного тракта, болевые расстройства и расстройства сна.
Дополнительные примеры болевых расстройств включают острую боль, воспалительную боль и невропатическую боль. Невропатическая боль включает, но не в порядке ограничения, постгерпетическую невралгию, повреждение нерва, "динии", например, вульводинию, фантомную боль в ампутированных конечностях, отрывы корней, болевую диабетическую невропатию, болевую травматическую мононевропатию, болевую полиневропатию. Дополнительные примеры болевых расстройств включают таламический синдром (потенциально вызываемый практически любым поражением на любом уровне нервной системы); послеоперационные болевые синдромы (например, постмастэктомический синдром, постторакотомический синдром, боль в культе); боль в костях и суставах (остеоартрит), повторяющуюся боль при движении, зубную боль, раковую боль, миофасциальный болевой синдром (мышечное повреждение, фибромиалгию); периоперационную боль (общую хирургическую, гинекологическую), хроническую боль, дисменорею, а также боль, связанную со стенокардией, и воспалительную боль различных происхождений (напр. остеоартрит, ревматоидный артрит, ревматическая болезнь, теносиновит и подагра), головную боль, мигрень и кластерную головную боль, головную боль, первичную гипералгезию, вторичную гипералгезию, первичную аллодинию, вторичную аллодинию или другую боль, вызванную повышением чувствительности центральной нервной системы.
Дополнительные примеры когнитивных расстройств включают умеренное когнитивное нарушение. Другие состояния, которые можно излечивать соединениями и композициями по изобретению, включают болезнь Паркинсона, легочную гипертензию, хроническое обструктивное заболевание легких (ХОЗЛ), астму, недержание мочи при напряжении, глаукому, трисомию (синдром Дауна), церебральную амилоидную ангиопатию, дегенеративную деменцию, наследственную церебральную геморрагию с амилоидозом голландского типа (HCHWA-D), болезнь Крейцфельда-Якоба, прионные нарушения, амиотрофический латеральный склероз, прогрессирующий надъядерный паралич, травму головы, острое нарушение мозгового кровообращения, панкреатит, миозит с включенными тельцами, другие периферические амилоидозы, диабет, аутизм и атеросклероз.
В предпочтительных вариантах осуществления соединения по изобретению полезны в лечении болезни Альцгеймера, когнитивных нарушений, шизофрении, болевых расстройствах и расстройств сна. Например, соединения могут быть полезны для профилактики деменции альцгеймеровского типа, а также для лечения деменции альцгеймеровского типа на ранних, промежуточных и поздних стадиях.
Возможные шизофренические состояния или нарушения, при которых могут быть полезны соединения по изобретению, включают одно или несколько следующих состояний или заболеваний: шизофрению или психоз, включающий шизофрению (параноидальную, гебефреническую, кататоническую или недифференцированную), шизофреноформное расстройство, шизоаффективное расстройство, бредовое расстройство, кратковременное психотическое расстройство, индуцированное психотическое расстройство, психотическое расстройство, вызванное общим состоянием здоровья и вызванное употреблением психоактивных веществ и наркотических веществ (фенциклидин, кетамин и другие диссоциативные анестетики, амфетамин и другие психостимуляторы и кокаин), психотическое расстройство, психоз, связанный с аффективными расстройствами, кратковременный реактивный психоз, шизоаффективный психоз, расстройства "шизофренического спектра", такие как шизоидные или шизотипические расстройства личности, или заболевание, связанное с психозом (таким как большая депрессия, маниакально-депрессивное (биполярное) расстройство, болезнь Альцгеймера и посттравматический стресс-синдром), включая позитивные и негативные симптомы шизофрении и другие психозы; когнитивные нарушения, включающие деменцию (связанную с болезнью Альцгеймера, ишемией, мультиинфарктной деменцией, травмой, проблемами с сосудами или острым нарушением мозгового кровообращения, ВИЧ-болезнью, болезнью Паркинсона, болезнью Хантингтона, болезнью Пика, болезнью Крейтцфельдта-Якоба, перинатальной гипоксией, другими общими состояниями здоровья или злоупотреблением психоактивными веществами); делирий, амнестические расстройства или возрастное снижение когнитивных способностей.
В другом варианте осуществления настоящее изобретение касается способа лечения шизофрении или психоза, включающего введение нуждающемуся в этом пациенту эффективного количества соединения (или композиции, доставляющей соединение) по изобретению или его стереоизомера.
Возможные состояния или нарушения сна, при которых могут быть полезны соединения по изобретению, включают повышение качества сна; улучшение качества сна; увеличение поддержания сна; повышение значения, которое рассчитывают из времени, в течение которого субъект спит, деленного на время, в течение которого субъект пытается уснуть; снижение латентного периода сна или наступления сна (времени, которое нужно для засыпания); снижение трудностей засыпания; увеличение непрерывности сна; снижение числа пробуждений во время сна; снижение ночных бессонниц; сокращение времени, затраченного на пробуждение, после первоначального наступления сна; повышение общего количества сна; снижение фрагментации сна; изменение распределения во времени, частоты или длительности фаз парадоксального сна; изменение распределения во времени, частоты или длительности фаз медленноволнового сна (т.е. стадий 3 или 4); увеличение - количественное и процентное - 2 стадии сна; стимулирование медленноволнового сна; усиление ЭЭГ-дельта активности во время сна; увеличение бодрствования в дневное время; снижение дневной сонливости; лечение или ослабление чрезмерной дневной сонливости; инсомнию; гиперсомнию; нарколепсию; прерывистый сон; приступы апноэ во сне; асомнию; ночной миоклонус; прерывания парадоксального сна; десинхроноз; связанные со сменной работой нарушения сна; диссомнию; ночные страхи; инсомнию, связанную с депрессией, расстройства эмоций/настроения, а также лунатизм и энурез и возрастные расстройства сна; вечернюю спутанность альцгеймеровского типа; состояния, связанные с суточным ритмом, а также психические и физические нарушения, связанные с путешествием через временные зоны и со скользящими графиками работы; состояния, связанные с наркотическими веществами, которые вызывают сокращения REM-сна в качестве побочного эффекта; синдромы, которые выражаются через невосстанавливающий сон и мышечную боль или приступы апноэ во сне, связанные с дыхательной недостаточностью во время сна; и состояния, которые возникают в результате пониженного качества сна.
Соединения по изобретению могут также быть использованы для лечения или предупреждения дискинезии. Кроме того, соединения по изобретению могут быть использованы для снижения толерантности и/или зависимости при опиоидном лечении боли и для лечения синдрома отмены, например, алкоголя, опиоидов и кокаина.
Субъектом или пациентом, которому вводят соединения по настоящему изобретению, обычно является человек, мужчина или женщина, для которых желательно ингибирование рецептора mGluR2, но может также охватывать других млекопитающих, таких как перечислены выше, включая собак, кошек, мышей, крыс, крупный рогатый скот, лошадей, овец, кроликов, обезьян, шимпанзе или других человекообразных обезьян или приматов, для которых желательно лечение вышеуказанных нарушений или изучение mGluR2.
Другой вариант осуществления касается лекарственного препарата или фармацевтической композиции для ингибирования рецептора mGluR2 и/или для лечения любых вышеперечисленных заболеваний или нарушений у нуждающегося в таком лечении пациента (предпочтительно человека), которые содержат соединение (или композицию, содержащую соединение) по изобретению или стереоизомер, или фармацевтически приемлемую соль указанного соединения или указанного стереоизомера и фармацевтически приемлемый носитель.
Другой вариант осуществления касается способа изготовления лекарственного препарата или фармацевтической композиции для ингибирования рецептора mGluR2-NAM и/или лечения одного или более вышеперечисленных заболеваний или состояний, состоящего в комбинировании соединения (или композиции, содержащей соединение) по изобретению или стереоизомера, или фармацевтически приемлемой соли указанного соединения или указанного стереоизомера с фармацевтически приемлемым носителем.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
Соединения и композиции по изобретению могут быть использованы в комбинациях с одним или более другими лекарственными средствами в лечении заболеваний или состояний, при которых полезны соединения по изобретению, когда желательна комбинация лекарственных средств, например, когда комбинация безопаснее или более эффективна, чем каждое из лекарственных средств по отдельности. Кроме того, соединения по изобретению могут быть использованы в комбинациях с одним или более другими лекарственными средствами, которые лечат, предупреждают, контролируют, улучшают состояние или снижают риск побочных эффектов или токсичности соединений по изобретению. Такие другие лекарственные средства могут быть введены способом и в количестве, обычно для них применяемыми, одновременно или последовательно с соединениями по настоящему изобретению. Таким образом, фармацевтические композиции по настоящему изобретению охватывают композиции, которые содержат один или более других активных ингредиентов в дополнение к соединениям по настоящему изобретению. Комбинации могут быть введены в составе комбинированного лекарственного препарата в стандартной лекарственной форме или в виде набора, или по лечебному протоколу, по которому одно или более дополнительных лекарственных средств вводят в отдельных лекарственных формах в рамках лечебной схемы. В одном из вариантов осуществления соединения по изобретению, полезные в указанных комбинациях, включают соединение по любой из формул (I), (I.1), (I.2), (II), (II.1), (II.2), (III), (III.1), (III.2), (IV), (IV.1), (IV.2), (V), (V.1) и/или (V.2), как описано здесь, или по любому из описанных здесь разнообразных вариантов осуществления. В другом варианте осуществления соединения по изобретению, полезные в указанных комбинациях, включают соединения по примерам, например, как приведено здесь в таблицах в качестве типовых соединений по изобретению.
В другом варианте осуществления соединение или композиция по изобретению могут быть использованы в комбинации с ингибиторами ацетилхолинэстеразы, такими как донепезил и ривастигмин, антагонистом NMDA, таким как мемантин, модуляторами мускариновых рецепторов, модуляторами AMPA-рецепторов, модуляторами рецептора mGluR3, модуляторами никотиновых рецепторов альфа-7 и альфа-4-бета-2, модуляторами рецепторов 5-HT6 и 5-HT4, модуляторами фосфодиэстераз (PDE), антагонистами рецептора альфа-2c, гистондеацетилазами и антиоксидантными препаратами.
В другом варианте осуществления соединение или композиция по изобретению могут быть использованы в комбинации с препаратами, которые могут изменять или модифицировать динамику развития заболевания, включая препараты бета-амилоидного модулирования, такие как ингибиторы BACE1, модуляторы гамма-секретазы, модуляторы тау и/или люминофор-тау и биологические препараты, которые модулируют бляшки, связанные с неврологическими нарушениями, включающие антитела, RNAi, miRNA, и клеточные препараты.
В другом варианте осуществления соединение или композиция по изобретению могут быть использованы в комбинации с леводопой (в присутствии или отсутствии селективного экстрацеребрального ингибитора декарбоксилазы, такого как карбидопа или бензеразид), антихолинергическими средствами, такими как бипериден (необязательно в виде гидрохлорида или лактатной соли) и гидрохлорид тригексифенидила (бензогексола), ингибиторами COMT, такими как энтакапон, ингибиторами MOA-B, антиоксидантами, антагонистами аденозинового рецептора A2a, холинергическими агонистами, антагонистами рецептора NMDA, антагонистами серотониновых рецепторов и агонистами допаминовых рецепторов, таких как алентемол, бромокриптин, фенолдопам, лизурид, наксаголид, перголид или прамипексол. Следует понимать, что допаминовый агонист может быть в форме фармацевтически приемлемой соли, например, гидробромид алентемола, мезилат бромокриптина, мезилат фенолдопама, гидрохлорид наксаголида и мезилат перголида.
Дополнительные примеры комбинаций соединений включают комбинации с лекарственными средствами для лечения боли, например, нестероидными противовоспалительными средствами, такими как аспирин, диклофенак, дифлунизал, фенопрофен, флурбипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, напроксен, оксапрозин, пироксикам, сулиндак и толметин; ингибиторами COX-2, такими как целекоксиб, рофекоксиб, валдекоксиб, 406381 и 644784; агонистами CB-2, такими как 842166 и SAB378; антагонистами VR-1, такими как AMG517, 705498, 782443, PAC20030, V114380 и A425619; антагонистами брадикининового рецептора В1, такими как SSR240612 и NVPSAA164; блокаторами и антагонистами натриевых каналов, такими как VX409 и SPI860; ингибиторами синтазы оксида азота (NOS) (включая iNOS и nNOS ингибиторы), такими как SD6010 и 274150; антагонистами глицинового сайта, включающими лакозамид; нейрональными никотиновыми агонистами, такими как ABT 894; антагонистами NMDA, такими как AZD4282; веществами, открывающими калиевые каналы; антагонистами AMPA/каинатного рецептора; блокаторами кальциевых каналов, такими как зиконотид и NMED160; ИО-модуляторами GABA-A-рецептора (например, агонист GABA-A-рецептора); ингибиторами матриксных металлопротеиназ (MMP); тромболитическими средствами; опиоидными аналгетиками, такими как кодеин, фентанил, гидроморфон, леворфанол, меперидин, метадон, морфин, оксикодон, оксиморфон, пентазоцин, пропоксифен; ингибитором миграции нейтрофилов (NIF); прамипексолом, ропиниролом; антихолинергическими средствами; амантадином; ингибиторами моноаминоксидазы B15 ("MAO-B"); агонистами или антагонистами рецептора 5HT; антагонистами mGlu5, такими как AZD9272; альфа-агонистами, такими как AGNXX/YY; нейрональными никотиновыми агонистами, такими как ABT894; агонистами или антагонистами NMDA-рецептора, такими как AZD4282; антагонистами NKI; селективными ингибиторами обратного захвата серотонина ("SSRI") и/или селективными ингибиторами обратного захвата серотонина и норэпинефрина ("SSNRI"), такими как дулоксетин; трициклическими антидепрессантами, модуляторами норэпинефрина; солью лития; вальпроатом; габапентином; прегабалином; ризатриптаном; золмитриптаном; наратриптаном и суматриптаном.
В другом варианте осуществления соединения или композиции по изобретению могут быть введены в комбинации с соединениями, полезными для лечения шизофрении или повышения качества сна и предупреждения и лечения расстройства сна и нарушений сна, включающими, например, седативные средства, снотворные средства, анксиолитики, антипсихотические средства, успокоительные средства, антигистаминные средства, бензодиазепины, барбитураты, циклопирролоны, орексиновыми антагонистами, альфа-1-антагонистами, GABA-агонистами, 5HT-2-антагонистами, включающими 5HT-2A-антагонисты и 5HT-2A/2C-антагонисты, гистаминовыми антагонистами, включающими H3-гистаминовые антагонисты, H3-гистаминовыми обратными агонистами, имидазопиридинами, малыми транквилизаторами, мелатониновыми агонистами и антагонистами, мелатонергетическими средствами, другими орексиновыми антагонистами, орексиновыми агонистами, прокинетициновыми агонистами и антагонистами, пиразолопиримидинами, блокаторами кальциевых каналов T-типа, триазолопиридинами и тому подобным, или соединение по настоящему изобретению может быть введено в сочетании с применением физических методов, таких как фототерапия или электростимуляция.
При введении комбинированного препарата нуждающемуся в таком введении пациенту, лекарственные средства в комбинации или фармацевтическую композицию или композиции, содержащие лекарственные средства, можно вводить в любом порядке, как, например, последовательно, параллельно, совместно, одновременно и т.д.
В одном из вариантов осуществления соединение по изобретению вводят в течение того времени, когда дополнительное лекарственное средство (средства) проявляет свой профилактический или терапевтический эффект, или наоборот.
В другом варианте осуществления соединение по изобретению и дополнительное лекарственное средство (средства) вводят в дозах, обычно применяемых при использовании таких препаратов в монотерапии для лечения нарушения.
В другом варианте осуществления соединение по изобретению и дополнительное лекарственное средство (средства) вводят в более низких дозах, чем дозы, обычно применяемые при использовании таких препаратов в монотерапии для лечения нарушения.
В одном из вариантов осуществления соединение по изобретению и дополнительное лекарственное средство (средства) присутствуют в одной и той же композиции, которая пригодна для перорального введения.
В некоторых вариантах осуществления соединение по изобретению и дополнительное лекарственное средство (средства) могут действовать аддитивно или синергетически. Синергетическая комбинация может позволить применение более низких дозировок одного или более препаратов и/или меньшую частоту введения одного или более препаратов комбинированной терапии. Меньшая дозировка или меньшая частота введения одного или более препаратов может снизить токсичность терапии без снижения эффективности терапии.
Дозы и режим дозирования дополнительного лекарственного средства (средств), используемого в комбинированных терапиях по настоящему изобретению для лечения или профилактики заболевания или нарушения, могут быть определены лечащим клиницистом с учетом одобренных доз и режима дозирования, указанных в листке-вкладыше в упаковке; возраста, пола и общего состояния здоровья пациента; и типа и тяжести вирусной инфекции или сходного заболевания или нарушения.
Другой вариант осуществления касается набора, содержащего терапевтически эффективное количество соединения (или композиции, содержащей соединение) по изобретению или его стереоизомера, или фармацевтически приемлемой соли указанного соединения или указанного стереоизомера, необязательно с по меньшей мере одним дополнительным вышеперечисленным лекарственным средством и фармацевтически приемлемый носитель, основу или разбавитель.
При введении комбинированного препарата нуждающемуся в таком введении пациенту лекарственные средства в комбинации или фармацевтическая композиция или композиции, содержащие лекарственные средства, могут быть введены в любом порядке, как например, последовательно, параллельно, совместно, одновременно и т.д.
В одном из вариантов осуществления соединение по изобретению вводят в течение того времени, когда дополнительное лекарственное средство (средства) проявляет свой профилактический или терапевтический эффект, или наоборот.
В другом варианте осуществления соединение по изобретению и дополнительное лекарственное средство (средства) вводят в дозах, обычно применяемых при использовании таких препаратов в монотерапии для лечения нарушения.
В другом варианте осуществления соединение по изобретению и дополнительное лекарственное средство (средства) вводят в более низких дозах, чем дозы, обычно применяемые при использовании таких препаратов в монотерапии для лечения нарушения.
В одном из вариантов осуществления соединение по изобретению и дополнительное лекарственное средство (средства) присутствуют в одной и той же композиции, которая пригодна для перорального введения.
ПРЕПАРАТИВНЫЕ ПРИМЕРЫ
В целом, соединения по изобретению могут быть получены множеством способов, известных специалисту в данной области и аналогичных известным способам. Раскрытое здесь изобретение иллюстрируется следующими препаратами и примерами, которые не следует истолковывать, как ограничивающие объем сущности изобретения. Альтернативные пути механизмов химических реакций и аналогичные структуры будут очевидны для специалиста в данной области. Практик не ограничен этими методами.
Специалисту в данной области понятно, что какой-то путь будет оптимальным в зависимости от выбора дополнительных заместителей. Кроме того, специалисту в данной области понятно, что в некоторых случаях следует регулировать порядок стадий, чтобы избежать несовместимости функциональных групп.
Полученные соединения могут быть проанализированы на состав и чистоту, а также охарактеризованы стандартными аналитическими методами, такими как, например, элементный анализ, ЯМР, масс-спектроскопия и ИК-спектры.
Специалисту в данной области понятно, что фактически используемые реагенты и растворители могут быть выбраны из ряда реагентов и растворителей, которые, как хорошо известно из уровня техники, представляют собой эффективные эквиваленты. Следовательно, когда упоминается конкретный растворитель или реагент, имеется в виду, что он является иллюстративным примером условий, требуемых для этой конкретной реакционной схемы или для нижеописанного получения.
Когда представлены ЯМР-данные, 1H-спектры получают как на Varian VXR-400 (400 МГц, 1H), Varian Gemini-300 (300 МГц), Varian Mercury VX-400 (400 МГц), Bruker-Biospin AV-500 (500 МГц), так и на Bruker Avance DRX-500 (500 МГц), и химические сдвиги приводят в м.д. с числом протонов и мультиплетностями, указанными в круглых скобках. Когда представлены ЖХ/МС-данные, анализы осуществляют, используя 1200 series Agilent 6140 Quadrupole LCMS с колонкой Zorbax SB-C18 1,8 мкМ (10-95% MeCN-H2O с 0,1% TFA за 2,7 мин, 1 мл/мин), или с помощью масс-спектрометра Applied Biosystems API-150 и колонки Gemini C18 (50×4,6 мм, 10-95% CH3CN-H2O с 0,05% TFA за 5 мин, 1 мл/мин).
Препаративные хиральные ВЭЖХ-разделения обычно осуществляют, используя суперкритическую жидкостную хроматографию, путем элюирования хиральной колонки, такой как OJ-H, (4,6×250 мм, Chiral Technologies, Inc., West Chester, Pennsylvania), мобильной фазой из изопропанола и сверхкритического CO2.
Исходные материалы и реагенты, используемые в получении описанных ниже соединений, либо поставляются частными поставщиками, такими как Aldrich Chemical Co. (Wisconsin, USA) и Acros Organics Co. (New Jersey, USA), либо получены описанными в литературе методами, известными специалистам в данной области.
В приведенных ниже схемах R1 соответствует составляющей 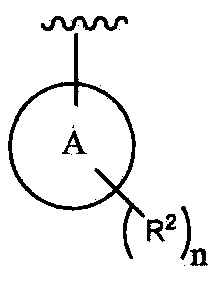 , показанной в различных вариантах осуществления соединений по изобретению, включающих формулу (I). Соединения по изобретению могут быть получены, как в общих чертах представлено схемами A-G. Получение ключевого промежуточного соединения A-9 описано ниже схемой A. 7-Метилхинолин A-1 может быть превращен в 7-метилхинолин-2-карбонитрил A-2 окислением с последующей нуклеофильной атакой цианида на активированном N-оксиде. Дальнейшее окисление A-2 с последующей обработкой POCl3 дает 4-хлор-7-метилхинолин-2-карбонитрил A-3. Катализируемым металлом сочетанием вводят группу R1, получая A-5, который затем бромируют в бензиловое положение, получая A-6. Бромид A-6 может быть замещен нуклеофилом A-7 в присутствии основания в полярном растворителе, что дает A-8. Нитрил в A-8 может впоследствии быть гидролизован до первичного амида A-9 с применением основного пероксида или в кислотных условиях.
, показанной в различных вариантах осуществления соединений по изобретению, включающих формулу (I). Соединения по изобретению могут быть получены, как в общих чертах представлено схемами A-G. Получение ключевого промежуточного соединения A-9 описано ниже схемой A. 7-Метилхинолин A-1 может быть превращен в 7-метилхинолин-2-карбонитрил A-2 окислением с последующей нуклеофильной атакой цианида на активированном N-оксиде. Дальнейшее окисление A-2 с последующей обработкой POCl3 дает 4-хлор-7-метилхинолин-2-карбонитрил A-3. Катализируемым металлом сочетанием вводят группу R1, получая A-5, который затем бромируют в бензиловое положение, получая A-6. Бромид A-6 может быть замещен нуклеофилом A-7 в присутствии основания в полярном растворителе, что дает A-8. Нитрил в A-8 может впоследствии быть гидролизован до первичного амида A-9 с применением основного пероксида или в кислотных условиях.
Соединения A-3-A-9 схемы A могут быть в дальнейшем модифицированы обработкой замещающих групп с применением общепринятых методов, известных из уровня техники, включающих (но не в порядке ограничения) кросс-сочетание, окисление, восстановление, деалкилирование, алкилирование, ацилирование и тому подобное, и такая модификация может быть осуществлена до или после снятия защиты.
Альтернативный путь к соединениям типа A-9 показан схемой B. Исходя из A-3, бромированием с последующим нуклеофильным замещением получают B-2, который подвергается катализируемому металлом кросс-сочетанию с получением цианохинолина A-8. Гидролиз нитрила в A-8 до первичного амида A-9 может быть достигнут применением условий, аналогичных условиям в схеме A. Кроме того, порядок стадий нуклеофильного замещения и гидролиза с получением A-9 по необходимости может быть изменен. Соединение B-2 схемы В может быть впоследствии модифицировано обработкой замещающих групп с применением общепринятых методов, известных из уровня техники, включающих (но не в порядке ограничения) кросс-сочетание, окисление, восстановление, деалкилирование, алкилирование, ацилирование и тому подобное, и такая модификация может быть осуществлена до или после снятия защиты.
Стадия катализируемого металлом кросс-сочетания может также быть проведена в присутствии первичного карбоксамида в C-1, как в схеме С, для синтеза соединений общей формулы A-9.
Соединения общей формулы D-4 могут быть синтезированы по приведенной ниже схеме синтеза D. Цианохинолин A-5 может быть бис-бромирован с помощью NBS, что дает гем-дибромид D-1, который может быть превращен в соответствующий альдегид D-2 с помощью нитрата серебра. Окисление до карбоновой кислоты D-3 с последующим амидным сочетанием с амином A-7 дает амид D-4. Соединения D-2-D-4 схемы D могут быть в дальнейшем модифицированы обработкой замещающих групп с применением общепринятых методов, известных из уровня техники, включающих (но не в порядке ограничения) кросс-сочетание, окисление, восстановление, деалкилирование, алкилирование, ацилирование и тому подобное, и такая модификация может быть осуществлена до или после снятия защиты.
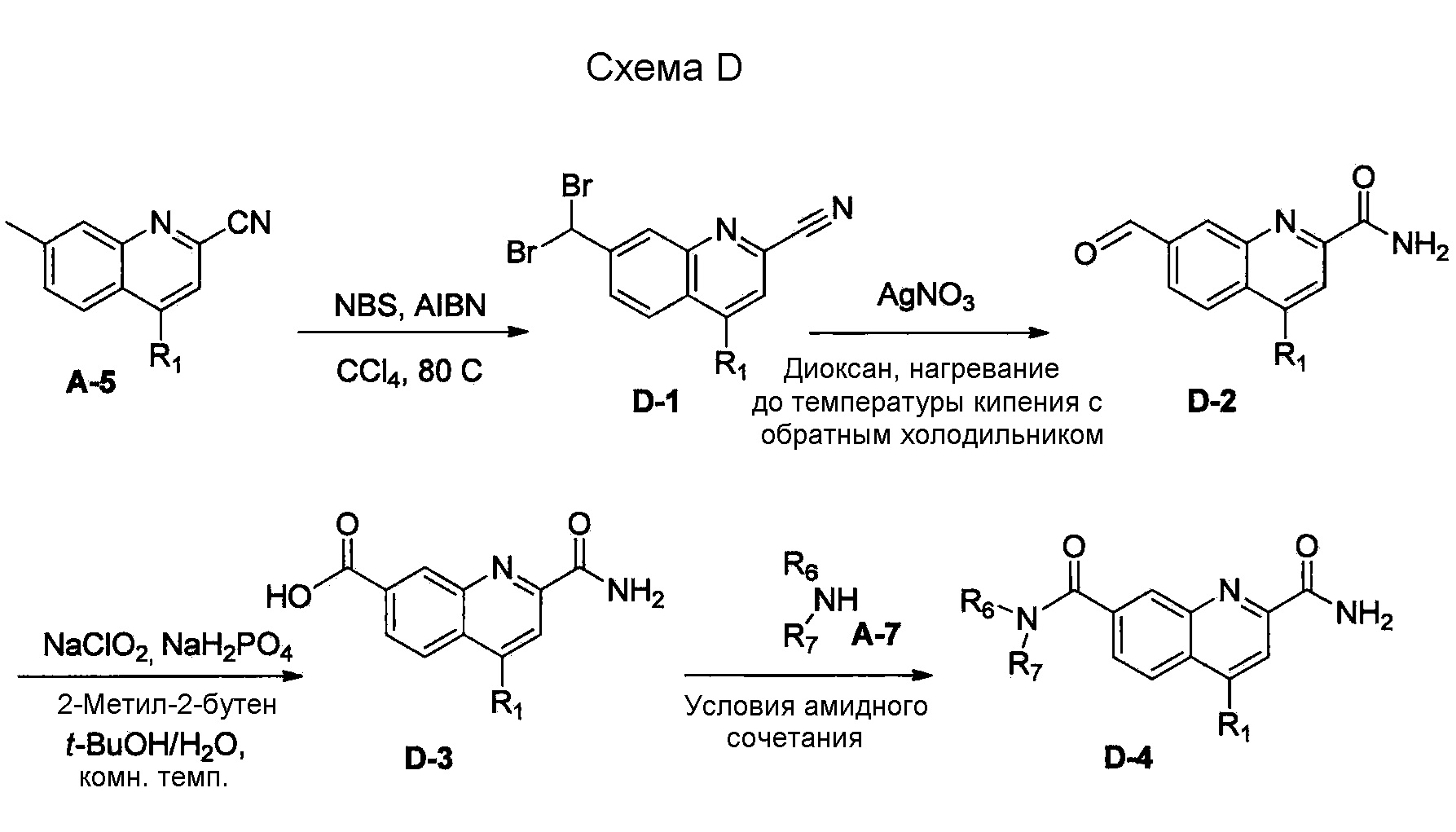
Соединения общей формулы E-1 могут быть синтезированы по приведенной ниже схеме синтеза E. Добавление металлоорганических реагентов к альдегиду D-2 дает спирт E-1. Соединение E-1 схемы E может быть впоследствии модифицировано обработкой замещающих групп с применением общепринятых методов, известных из уровня техники, включающих (но не в порядке ограничения) кросс-сочетание, окисление, восстановление, деалкилирование, алкилирование, ацилирование и тому подобное, и такая модификация может быть осуществлена до или после снятия защиты.
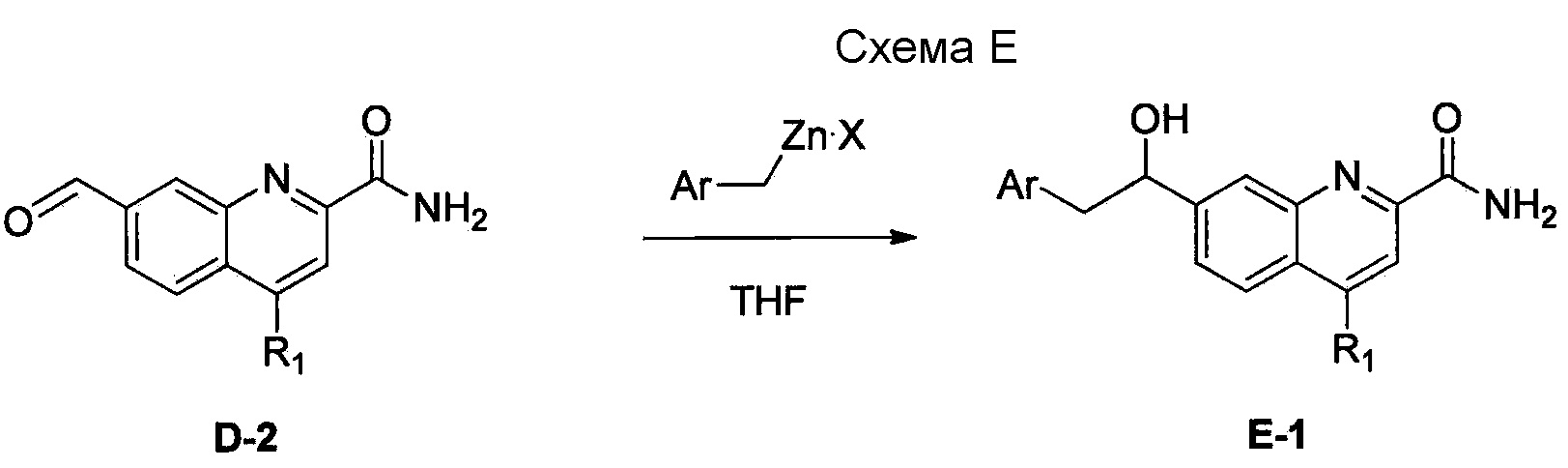
Кетокарбоксамиды F-4 могут быть получены по схеме синтеза F. Замещение бромида A-6 альдегид-содержащим нуклеофилом F-5 дает цианохинолин F-1. Гидролиз нитрила до соответствующего карбоксамида F-2 и последующее взаимодействие альдегида с металлоорганическими реагентами дает спирт F-3, который может быть окислен до F-4 окислителем, таким как перйодинан Десс-Мартина. Соединения F-1-F-4 схемы F могут быть в дальнейшем модифицированы обработкой замещающих групп с применением общепринятых методов, известных из уровня техники, включающих (но не в порядке ограничения) кросс-сочетание, окисление, восстановление, деалкилирование, алкилирование, ацилирование и тому подобное, и такая модификация может быть осуществлена до или после снятия защиты.
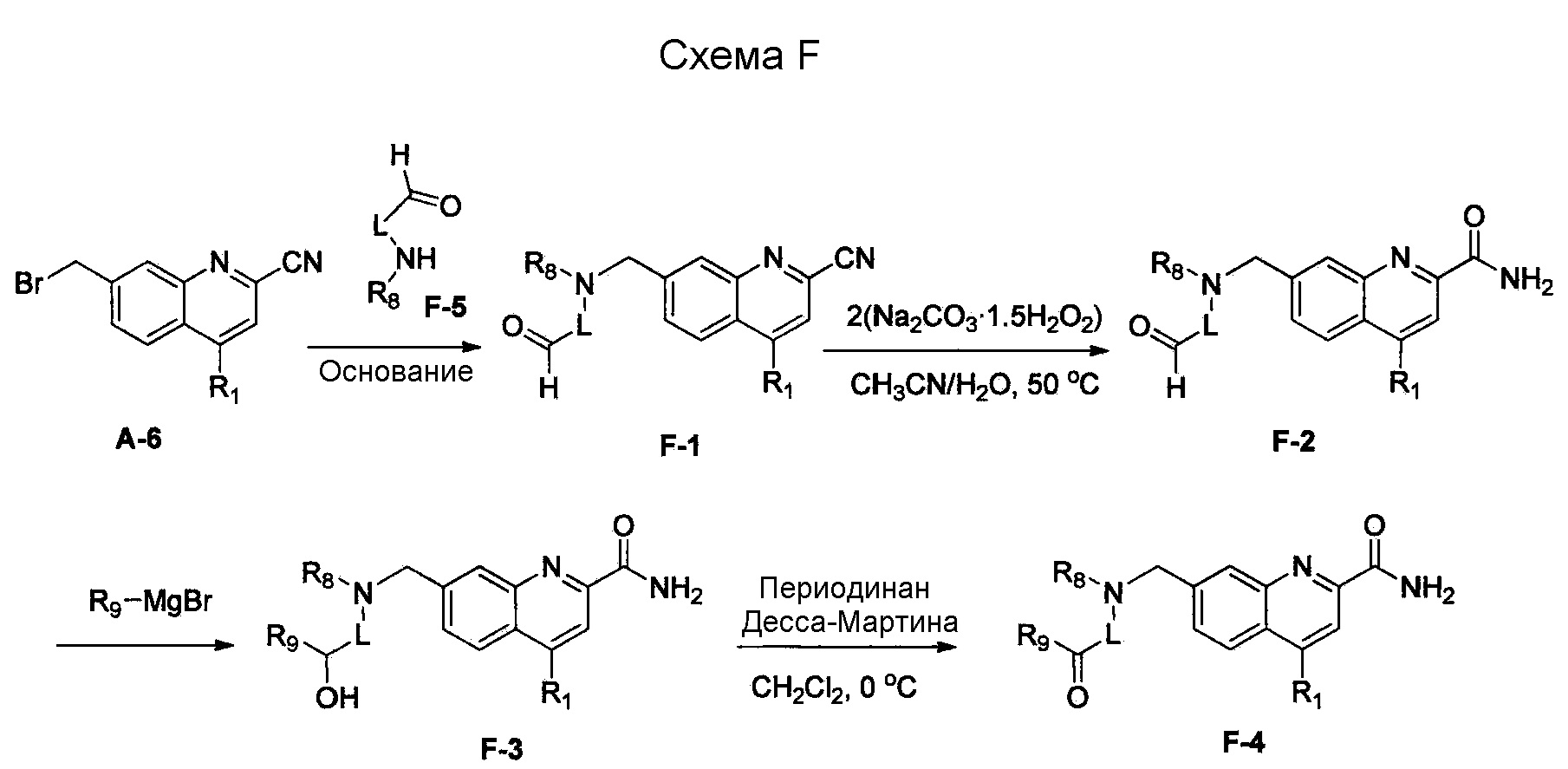
Получение ключевых соединений, таких как G-9, описано приведенной ниже схемой G. Фторзамещенный анилин G-1 может быть превращен в соответствующие бутандиоаты G-2 конденсацией с диметил-2-оксобутандиоатом в присутствии TsOH. Микроволновое облучение G-2 с последующей обработкой POCl3 дает фтор-4-хлор-7-метилхинолин-2-карбоксилат G-4. Катализируемым металлом сочетанием вводят группу R1 с получением G-5, который затем может быть бромирован в бензиловом положении с получением G-6. Бромид G-6 может быть замещен сукцинимидом в присутствии основания в полярном растворителе, что дает G-7. Гидролиз сложного эфира и последующее связывание с гидроксидом аммония дает первичный амид G-9. Соединения G-4-G-9 схемы G могут быть в дальнейшем модифицированы обработкой замещающих групп с применением общепринятых методов, известных из уровня техники, включающих (но не в порядке ограничения) кросс-сочетание, окисление, восстановление, деалкилирование, алкилирование, ацилирование и тому подобное, и такая модификация может быть осуществлена до или после снятия защиты.
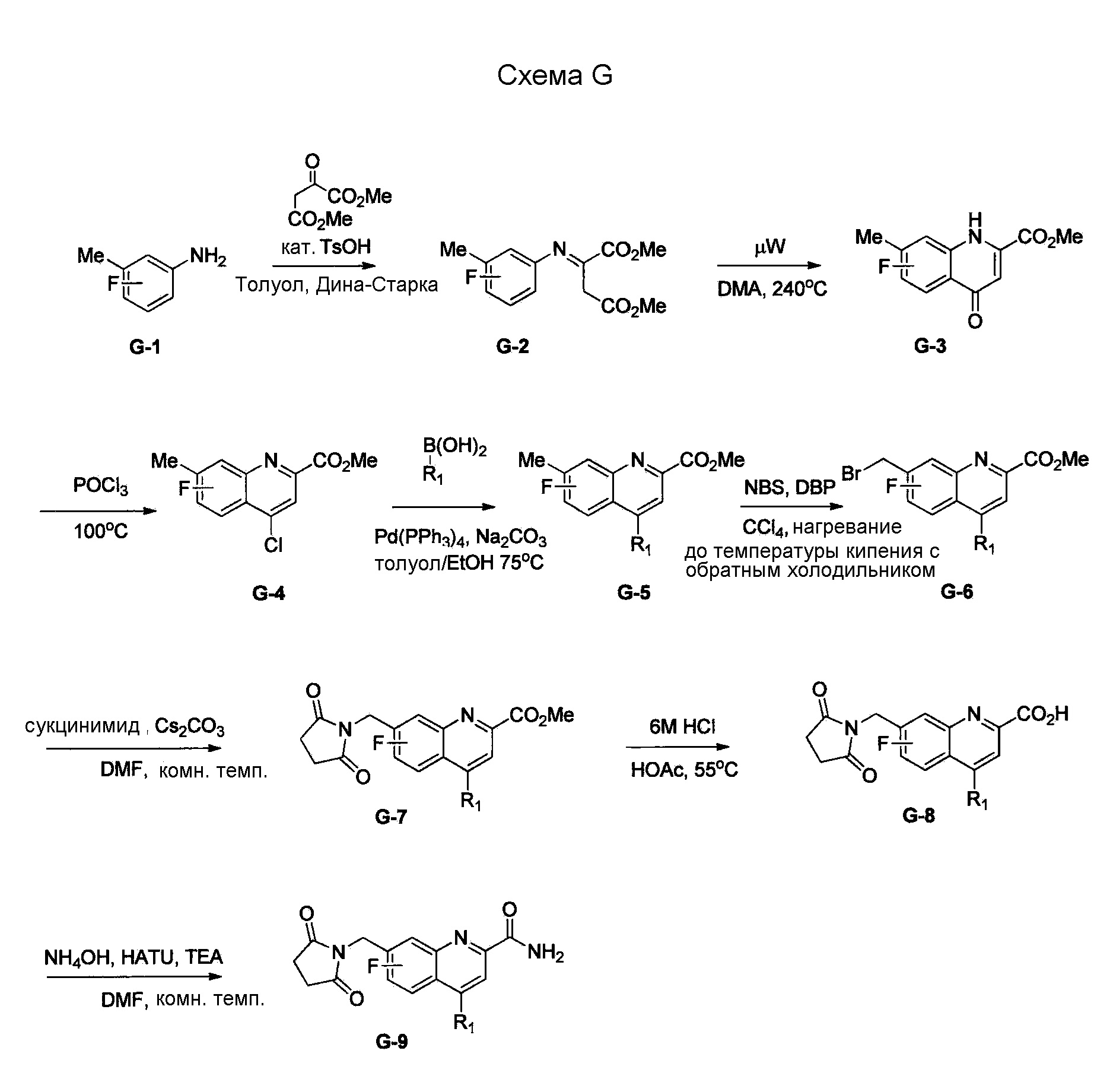
Катализируемые металлом кросс-сочетания могут быть проведены с помощью бромида A-6 и арилборных кислот, как в схеме H, для синтеза соединений общей формулы H-2. Соединения H-1 и H-2 схемы H могут быть в дальнейшем модифицированы обработкой замещающих групп с применением общепринятых методов, известных из уровня техники, включающих (но не в порядке ограничения) кросс-сочетание, окисление, восстановление, деалкилирование, алкилирование, ацилирование и тому подобное, и такая модификация может быть осуществлена до или после снятия защиты.
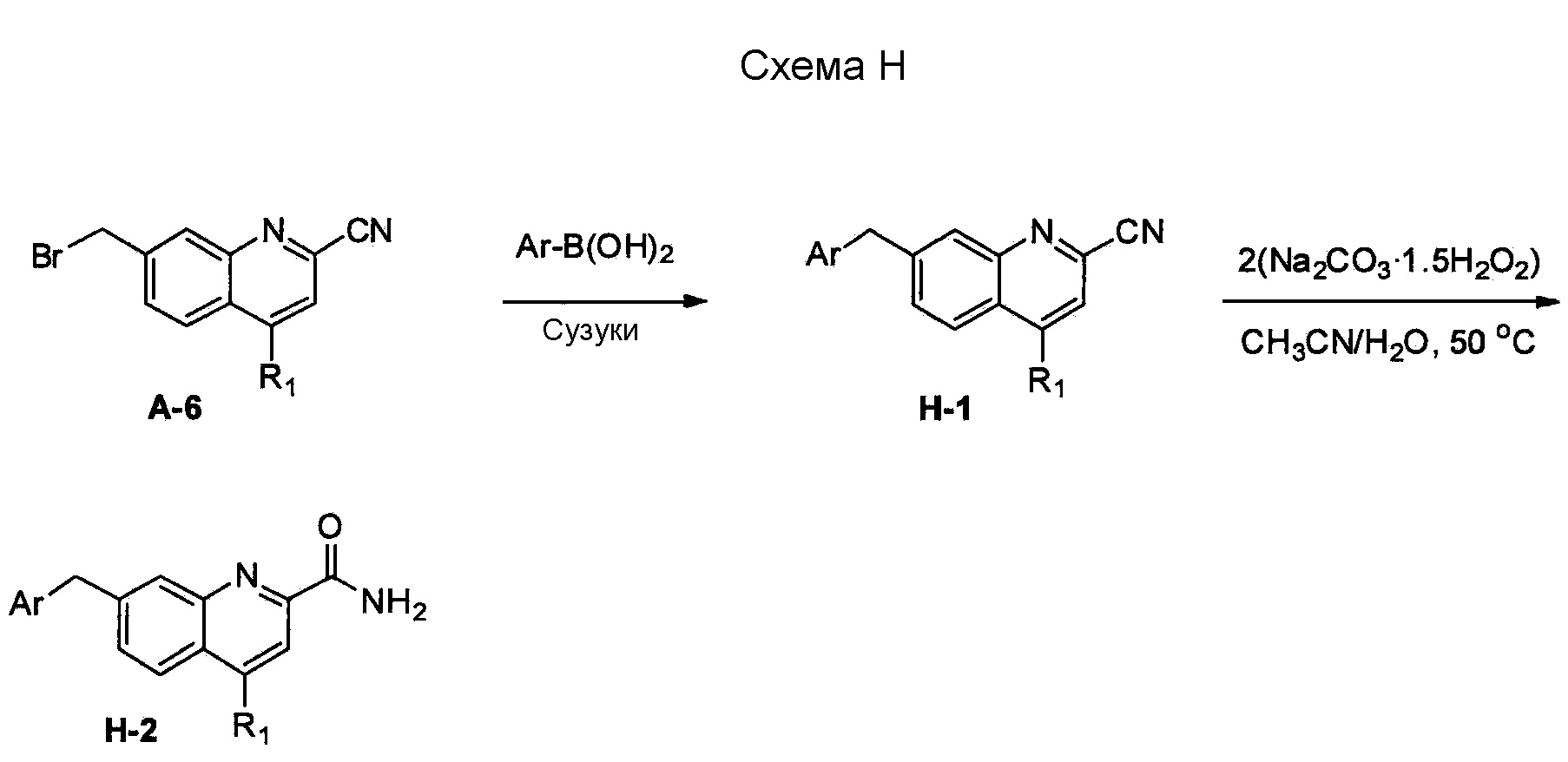
Соединения общей формулы I-6 могут быть синтезированы по схеме I. Катализируемое металлом кросс-сочетание дихлорида I-1 дает I-3 после гидролиза нитрила до сложного метилового эфира. Хлорид I-3 может быть подвергнут кросс-сочетанию с винилтрифторборатными солями, что дает стирольные соединения I-4. Гидроборирование винилового заместителя и последующее кросс-сочетание с арил- или гетероарилгалогенидами дает соединение I-5. Аминолизис сложного эфира дает I-6. Соединения I-2-I-6 схемы I могут быть в дальнейшем модифицированы обработкой замещающих групп с применением общепринятых методов, известных из уровня техники, включающих (но не в порядке ограничения) кросс-сочетание, окисление, восстановление, деалкилирование, алкилирование, ацилирование и тому подобное, и такая модификация может быть осуществлена до или после снятия защиты.
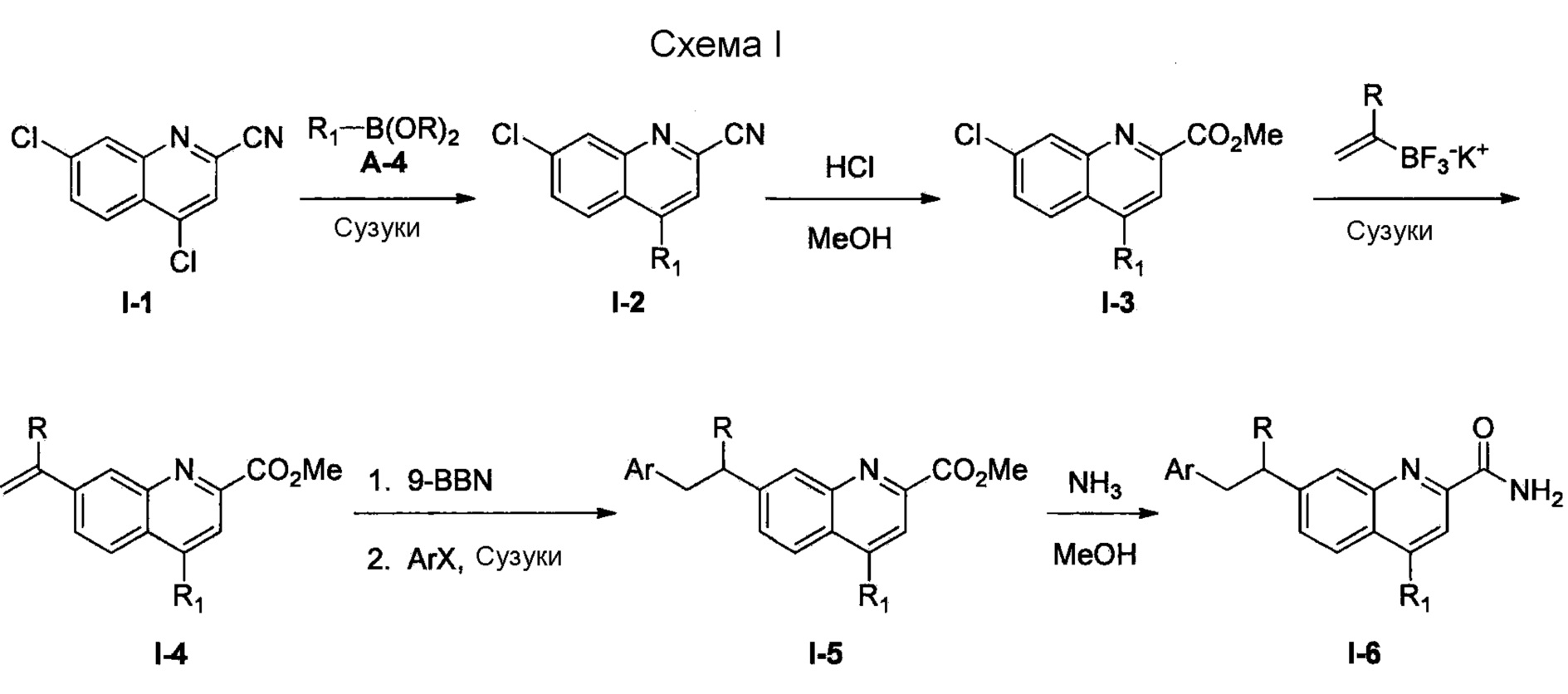
ПРИМЕРЫ
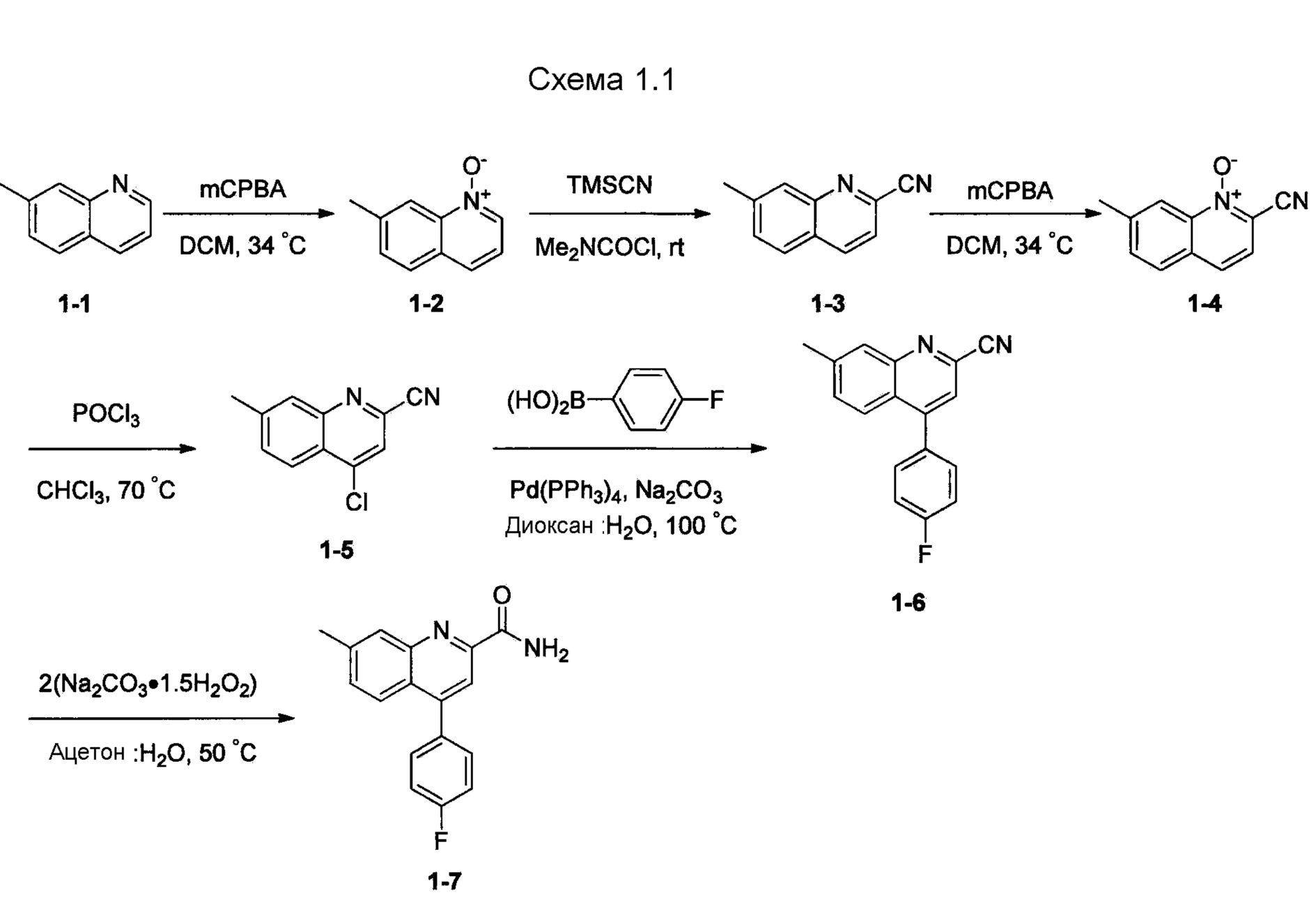
Пример 1.1: синтез 4-(4-фторфенил)-7-метилхинолин-2-карбоксамида (1-7)
N-Оксид 7-метилхинолина (1-2)
7-Метилхинолин (1-1, 240 г, 1,7 моль, 1,0 эквив.) растворяют в метиленхлориде (5 л, 0,34 М). 3-Хлорпероксибензойную кислоту (488 г, 2,2 моль, 1,3 эквив.) добавляют порциями при охлаждении так, чтобы реакционная температура не поднималась выше 34°C. После перемешивания в течение 1 ч реакционную смесь гасят 2 л 1н водного NaOH, и продукт экстрагируют метиленхлоридом. Объединенные органические слои промывают насыщенным водным бикарбонатом натрия, сушат над MgSO4 и фильтруют. Добавляют гептан, и органический слой упаривают досуха, получая 246 г N-оксида 7-метилхинолина (1-2) в виде розового твердого вещества, с которым продолжают работать без дополнительной очистки. НРМС m/z (M+H)+ 160,1 найдено, 160,2 требуется.
7-Метилхинолин-2-карбонитрил (1-3)
К раствору N-оксида 7-метилхинолина (1-2, 246 г, 1,54 моль, 1,0 эквив.) в метиленхлориде (5 л, 0,31 М) добавляют TMS-CN (414 мл, 3,1 моль, 2 эквив.) с последующим добавлением диметилкарбамоилхлорида (284 мл, 3,1 моль, 2 эквив.) и полученную смесь перемешивают при комнатной температуре в течение ночи. Раствор гасят насыщенным бикарбонатом натрия, разбавляют водой и экстрагируют дихлорметаном. Объединенные органические слои сушат над MgSO4, фильтруют, и растворитель удаляют с получением 260 г сырого вещества, которое перекристаллизовывают из метанола с получением 186 г 7-метилхинолин-2-карбонитрила (1-3) в двух порциях. НРМС m/z (M+H)+ 169,1 найдено, 169,2 требуется.
N-Оксид 7-метилхинолин-2-карбонитрила (1-4)
7-Метилхинолин-2-карбонитрил (181 г, 1,1 моль, 1,0 эквив.) растворяют в дихлорметане (3,3 л, 0,3 М). Добавляют м-хлорпербензойную кислоту (500 г, 2,9 моль, 2,6 эквив.) и реакционную смесь нагревают до 40ºC. Спустя 3 часа добавляют mCPBA (7 г, 40 ммоль, 0,04 эквив.) и смесь оставляют перемешиваться в течение ночи при комнатной температуре. Смесь экстрагируют 3 л 1н водн. NaOH, дважды промывают 20 мл дихлорметана, и объединенные органические фазы промывают ДИ (деионизированной) водой, затем сушат над MgSO4. Органику фильтруют и растворитель удаляют, получая 192 г N-оксида 7-метилхинолин-2-карбонитрила (1-4). НРМС m/z (M+H)+ 185,2 найдено, 185,2 требуется.
4-Хлор-7-метилхинолин-2-карбонитрил (1-5)
N-Оксид 7-метилхинолин-2-карбонитрила (1-4, 5,3 г, 28,8 ммоль, 1,0 эквив.) растворяют в CHCl3 (80 мл, 0,36 М) и добавляют POCl3 (16,09 мл, 173 ммоль, 6,0 эквив.). Смесь нагревают до 70°C в течение ночи, гасят на дробленом льду и экстрагируют трижды дихлорметаном. Объединенные органические слои промывают водой с последующей промывкой насыщенным водным бикарбонатом натрия, сушат над MgSO4, фильтруют, растворитель удаляют, получая сырое, желтое, твердое вещество. Перекристаллизация из смеси гептан/EtOAc дает 95 г 4-хлор-7-метилхинолин-2-карбонитрила (1-5). НРМС m/z (M+H)+ 203,2 найдено, 203,6 требуется.
4-(4-Фторфенил)-7-метилхинолин-2-карбонитрил (1-6)
4-Хлор-7-метилхинолин-2-карбонитрил (1-5, 2,47 г, 12,2 ммоль, 1,0 эквив.), 4-фторфенилбороновую кислоту (2,05 г, 14,63 ммоль, 1,2 эквив.), Pd(PPh3)4 (0,7 г, 0,61 ммоль, 0,05 эквив.) и 1М водный Na2CO3 (12,2 мл, 2,39 ммоль) добавляют в 1,4-диоксан (40 мл). Смесь дегазируют и перемешивают при 100°C в течение 16 часов, до исчезновения исходного вещества. Смесь охлаждают, добавляют насыщенный водный гидрокарбонат натрия (2 мл) и смесь экстрагируют этилацетатом (2×50 мл). Объединенные органические фракции промывают насыщенным раствором соли, сушат (MgSO4), фильтруют, и растворитель выпаривают при пониженном давлении. Остаток обрабатывают 50 мл MeOH, энергично перемешивают при к.т. в течение 1 ч, смесь фильтруют и промывают MeOH. Твердое вещество собирают и сушат в вакууме. Фильтрат концентрируют и повторно обрабатывают MeOH, получая вторую порцию белого твердого вещества, которую объединяют с первой, получая 2,75 г 4-(4-фторфенил)-7-метилхинолин-2-карбонитрила (1-6). НРМС m/z (M+H)+ 263,3 найдено, 263,3 требуется.
4-(4-Фторфенил)-7-метилхинолин-2-карбоксамид (1-7)
4-(4-Фторфенил)-7-метилхинолин-2-карбонитрил (1-6, 25 мг, 0,095 ммоль, 1,0 эквив.) растворяют в смеси ацетон (2,3 мл)/вода (1,5 мл) и добавляют перкарбонат натрия (79,0 мг, 0,477 ммоль, 5,0 эквив.). Полученную смесь перемешивают при 50°C в течение 1 часа. Смесь охлаждают и концентрируют. Сырой остаток очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA). Фракции, содержащие продукт, объединяют и обрабатывают Na2CO3. Полученную смесь экстрагируют CHCl3. Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют, что дает 4-(4-фторфенил)-7-метилхинолин-2-карбоксамид (1-7). НРМС m/z (M+H)+ 280,9 найдено, 281,3 требуется.
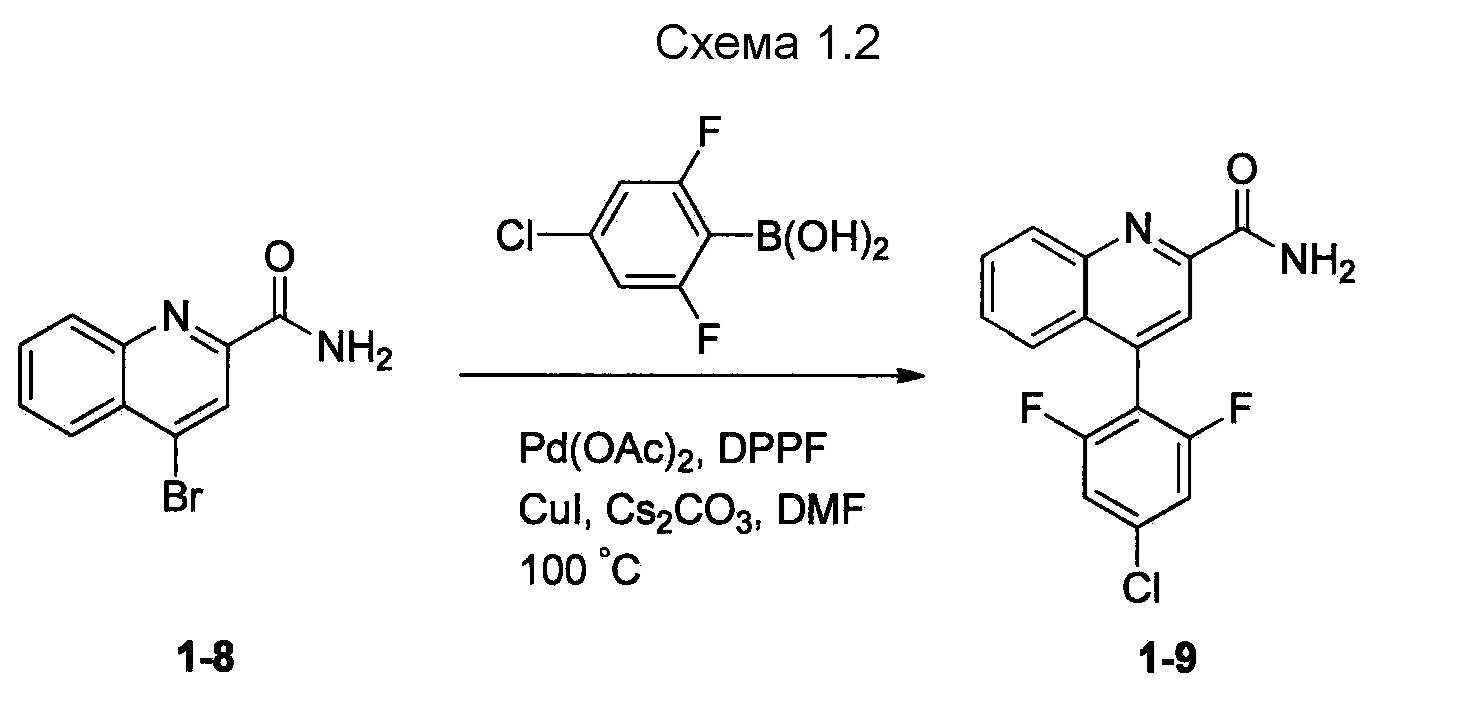
Пример 1.2: синтез 4-(2,6-дихлор-4-фторфенил)хинолин-2-карбоксамида (1-9)
4-(2,6-Дихлор-4-фторфенил)хинолин-2-карбоксамид (1-9)
4-Бромхинолин-2-карбоксамид (1-8, 50,0 мг, 0,199 ммоль, 1,0 эквив.), (2,6-дихлор-4-фторфенил)бороновую кислоту (77,0 мг, 0,398 ммоль, 2,0 эквив.), карбонат цезия (130,0 мг, 0,398 ммоль, 2,0 эквив.), Pd(OAc)2 (2,2 мг, 0,01 ммоль, 0,05 эквив.), DPPF (11,0 мг, 0,020 ммоль, 0,1 эквив.) и хлорид меди(I) (19,7 мг, 0,199 ммоль, 1,0 эквив.) добавляют в ДМФА (1,0 мл). Смесь перемешивают при 100°C в течение ночи. После охлаждения добавляют водный гидрокарбонат натрия (насыщенный, 2,0 мл) и смесь экстрагируют дихлорметаном (2×5 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 4-(2,6-дихлор-4-фторфенил)хинолин-2-карбоксамид (1-9, 6,20 мг, 9,8%) в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 8,281 (с, 1Н); 8,200-8,226 (м, 1Н); 8,175 (уш.с, 1Н); 7,801-7,843 (м, 1Н); 7,601-7,637 (м, 2Н); 7,137-7,183 (м, 2Н); 6,140 (уш.с, 1Н). НРМС m/z (M+H)+ 319,0 найдено, 319,0 требуется.
Следующие соединения получены по методикам, подобным приведенным в схемах 1.1 и 1.2, подбором соответствующего хинолинового производного и производного бороновой кислоты и представляют собой примеры соединений по изобретению.
|
|
|
|
|
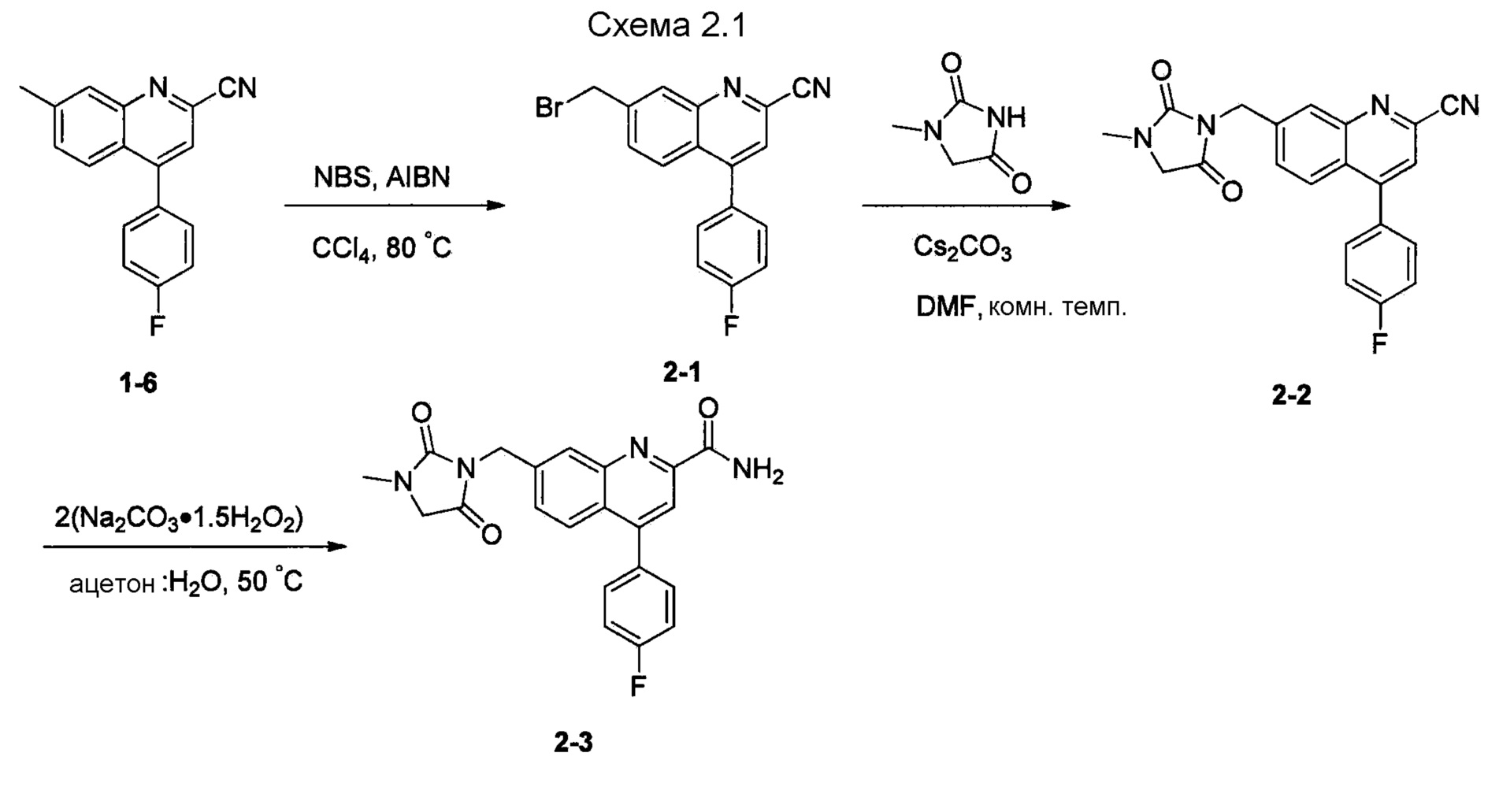
Пример 2.1: синтез 4-(4-фторфенил)-7-((3-метил-2,5-диоксоимидазолидин-1-ил)метил)хинолин-2-карбоксамида (2-3)
7-(Бромметил)-4-(4-фторфенил)хинолин-2-карбонитрил (2-1)
4-(4-Фторфенил)-7-метилхинолин-2-карбонитрил (1-6, 450 мг, 1,7 ммоль, 1,0 эквив.) растворяют в четыреххлористом углероде (8,5 мл). Добавляют NBS (310 мг, 1,7 ммоль, 1,0 эквив.) и AIBN (8 мг, 0,05 ммоль, 0,03 эквив.) и смесь нагревают до температуры кипения с обратным холодильником в течение ночи. Затем смесь охлаждают до комнатной температуры, и белый осадок фильтруют, с получением 7-(бромметил)-4-(4-фторфенил)хинолин-2-карбонитрил (2-1). НРМС m/z (M+H)+ 342,7 найдено, 342,0 требуется.
4-(4-Фторфенил)-7-[(3-метил-2,5-диоксоимидазолидин-1-ил)метил]хинолин-2-карбонитрил (2-2)
7-(Бромметил)-4-(4-фторфенил)хинолин-2-карбонитрил (2-1, 50,0 мг, 0,147 ммоль, 1,0 эквив.), 1-метилимидазолидин-2,4-дион (18,4 мг, 0,161 ммоль, 1,1 эквив.) и карбонат цезия (95,0 мг, 0,293 ммоль, 2,0 эквив.) объединяют в 1,0 мл ДМФА. Полученную смесь перемешивают при температуре окружающей среды в течение 16 часов. Твердое вещество фильтруют, и фильтрат очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 4-(4-фторфенил)-7-[(3-метил-2,5-диоксоимидазолидин-1-ил)метил]хинолин-2-карбонитрил (2-2, 48,0 мг, 87,0%) в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 8,205 (д, J=1,09 Гц, 1Н); 7,941 (д, J=8,79 Гц, 1Н); 7,681 (дд, J1=8,79 Гц, J2=1,83 Гц, 1Н); 7,647 (с, 1Н); 7,454-7,503 (м, 2Н); 7,251-7,309 (м, 2Н); 4,935 (с, 2Н); 4,049 (с, 2Н); 3,057 (с, 3Н). НРМС m/z (M+H)+ 375,1 найдено, 375,1 требуется.
4-(4-Фторфенил)-7-[(3-метил-2,5-диоксоимидазолидин-1-ил)метил]хинолин-2-карбоксамид (2-3)
4-(4-Фторфенил)-7-[(3-метил-2,5-диоксоимидазолидин-1-ил)метил]хинолин-2-карбонитрил (2-2, 44,9 мг, 0,120 ммоль, 1,0 эквив.) растворяют в смеси ацетон (1,5 мл)/вода (0,75 мл) и добавляют перкарбонат натрия (188,0 мг, 0,600 ммоль, 5,0 эквив.). Полученную смесь перемешивают при 50°C в течение двух часов. Смесь охлаждают и заливают водный NH4C1 (1,0 мл), экстрагируют этилацетатом (3×5,0 мл), сушат над MgSO4, фильтруют и концентрируют. Сырой остаток очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 4-(4-фторфенил)-7-[(3-метил-2,5-диоксоимидазолидин-1-ил)метил]хинолин-2-карбоксамид (2-3, 35,3 мг, 75,0%) в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 8,498 (уш.с, 1Н); 8,221 (д, J=1,29 Гц, 1Н); 8,180 (с, 1Н); 7,947 (д, J=8,60 Гц, 1Н); 7,672 (дд, J1=8,79 Гц, J2=1,83 Гц, 1Н); 7,532 (уш.с, 1Н); 7,462-7,512 (м, 2Н); 7,219-7,276 (м, 2Н); 4,918 (с, 2Н); 3,985 (с, 2Н); 3,040 (с, 3Н). НРМС m/z (M+H)+ 393,1 найдено, 393,1 требуется.
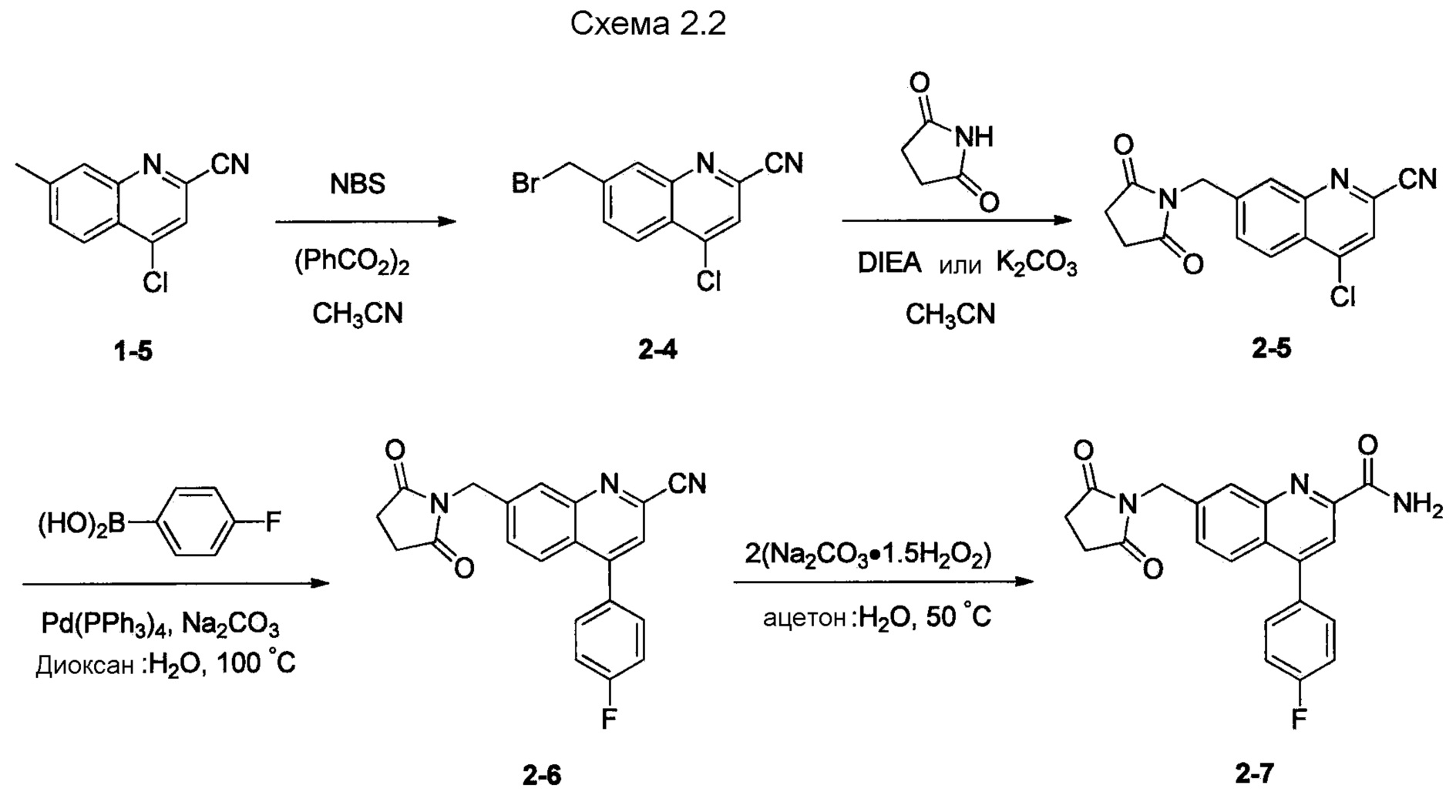
Пример 2.2: синтез 7-((2,5-диоксопирролидин-1-ил)метил)-4-(4-фторфенил)хинолин-2-карбоксамида (2-7)
7-(Бромметил)-4-хлорхинолин-2-карбонитрил (2-4)
4-Хлор-7-метил-2-хинолинкарбонитрил (1-5, 57 г, 0,37 моль, 1,0 эквив.), NBS (75 г, 0,42 моль, 1,14 эквив.) и перекись бензоила (0,8 г, 3,3 ммоль, 0,01 эквив.) перемешивают в CH3CN (30 мл, 12,3 М) при комнатной температуре. Спустя 16 ч растворитель удаляют, и остаток распределяют между AcOEt и водой, органический слой промывают водой, сушат над MgSO4 и фильтруют. После удаления растворителя остаток перекристаллизовывают из метанола, получая 60 г требуемого 7-(бромметил)-4-хлорхинолин-2-карбонитрила (2-4). НРМС m/z (M+H)+ 283,1 найдено, 282,9 требуется.
4-Хлор-7-[(2,5-диоксопирролидин-1-ил)метилlхинолин-2-карбонитрил (2-5)
К раствору сукцинимида (4,22 г, 42,6 ммоль, 1,2 эквив.), комнатной температуры в безводном ацетонитриле (89 мл, 0,4 М) добавляют основание Хунига (12,4 мл, 71,0 ммоль, 2,0 эквив.) и 7-(бромметил)-4-хлорхинолин-2-карбонитрил (2-4, 10,0 г, 35,5 ммоль). Полученную смесь нагревают в микроволновой печи до 100°C в течение 1 ч. Затем реакционную смесь охлаждают до 0°C, и образуется осадок. После чего твердые вещества собирают вакуумным фильтрованием и промывают охлажденным ацетонитрилом, что дает 4-хлор-7-[(2,5-диоксопирролидин-1-ил)метил]хинолин-2-карбонитрил (2-5), который употребляют на следующей стадии без дополнительной очистки. НРМС m/z (M+H)+ 300,2 найдено, 300,0 требуется.
7-[(2,5-Диоксопирролидин-1-ил)метил]-4-(4-фторфенил)хинолин-2-карбонитрил (2-6)
К раствору 4-фторфенилбороновой кислоты (5,96 г, 42,6 ммоль, 1,2 эквив.) комнатной температуры в смеси диоксан:вода (10:1, 177 мл, 0,2 М) добавляют бикарбонат натрия (5,96 г, 71,0 ммоль, 2,0 эквив.), 4-хлор-7-[(2,5-диоксопирролидин-1-ил)метил]хинолин-2-карбонитрил (2-5, 10,6 г, 35,5 ммоль) и Pd(PPh3)4 (4,1 г, 3,55 ммоль, 0,1 эквив.). Полученную смесь нагревают до 100°C в течение 4 час. Затем реакционную смесь охлаждают до 0°C, и образуется осадок. После чего твердые вещества собирают вакуумным фильтрованием и промывают охлажденным ацетонитрилом, что дает 7-[(2,5-диоксопирролидин-1-ил)метил]-4-(4-фторфенил)хинолин-2-карбонитрил (2-6), который употребляют на следующей стадии без дополнительной очистки. 1H ЯМР (400 МГц, CDCl3): δ 8,115 (д, J=1,10 Гц, 1Н); 7,897 (д, J=8,79 Гц, 1Н); 7,655 (дд, J1=8,79 Гц, J2=1,83 Гц, 1Н); 7,603 (с, 1Н); 7,439-7,475 (м, 2Н); 7,243-7,286 (м, 2Н); 4,909 (с, 2Н); 2,796 (с, 4Н). НРМС m/z (M+H)+ 360,3 найдено, 360,1 требуется.
7-[(2,5-Диоксопирролидин-1-ил)метил]-4-(4-фторфенил)хинолин-2-карбоксамид (2-7)
7-[(2,5-Диоксопирролидин-1-ил)метил]-4-(4-фторфенил)хинолин-2-карбонитрил (2-6, 12,8 г, 35,5 ммоль, 1,0 эквив.) растворяют в смеси ацетон (473 мл)/вода (237 мл) и добавляют перкарбонат натрия (55,7 г, 178 ммоль, 5,0 эквив.). Полученную смесь перемешивают при 50°C в течение 1,5 часов. Смесь охлаждают и заливают водный NH4Cl (насыщенный, 250 мл), экстрагируют этилацетатом (3×200 мл), сушат над Na2SO4, фильтруют и концентрируют, получая 7-[(2,5-диоксопирролидин-1-ил)метил]-4-(4-фторфенил)хинолин-2-карбоксамид (2-7, 5,5 г, 41% за 3 стадии) в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 8,216 (с, 1Н); 8,156 (с, 1Н); 8,091 (уш.с, 1Н); 7,908 (д, J=8,69 Гц, 1Н); 7,614 (дд, J1=8,79 Гц, J2=1,71 Гц, 1Н); 7,470-7,498 (м, 2Н); 7,211-7,262 (м, 2Н); 5,668 (уш.с, 1Н); 4,902 (с, 2Н); 2,776 (с, 4Н). НРМС m/z (M+H)+ 378,3 найдено, 378,1 требуется.
Следующие соединения получены по методикам, подобным приведенным в схемах 2.1 и 2.2, подбором соответствующего хинолинового производного, нуклеофила и производного бороновой кислоты и представляют собой примеры соединений по изобретению.
|
|
|
|
|
|
|
|
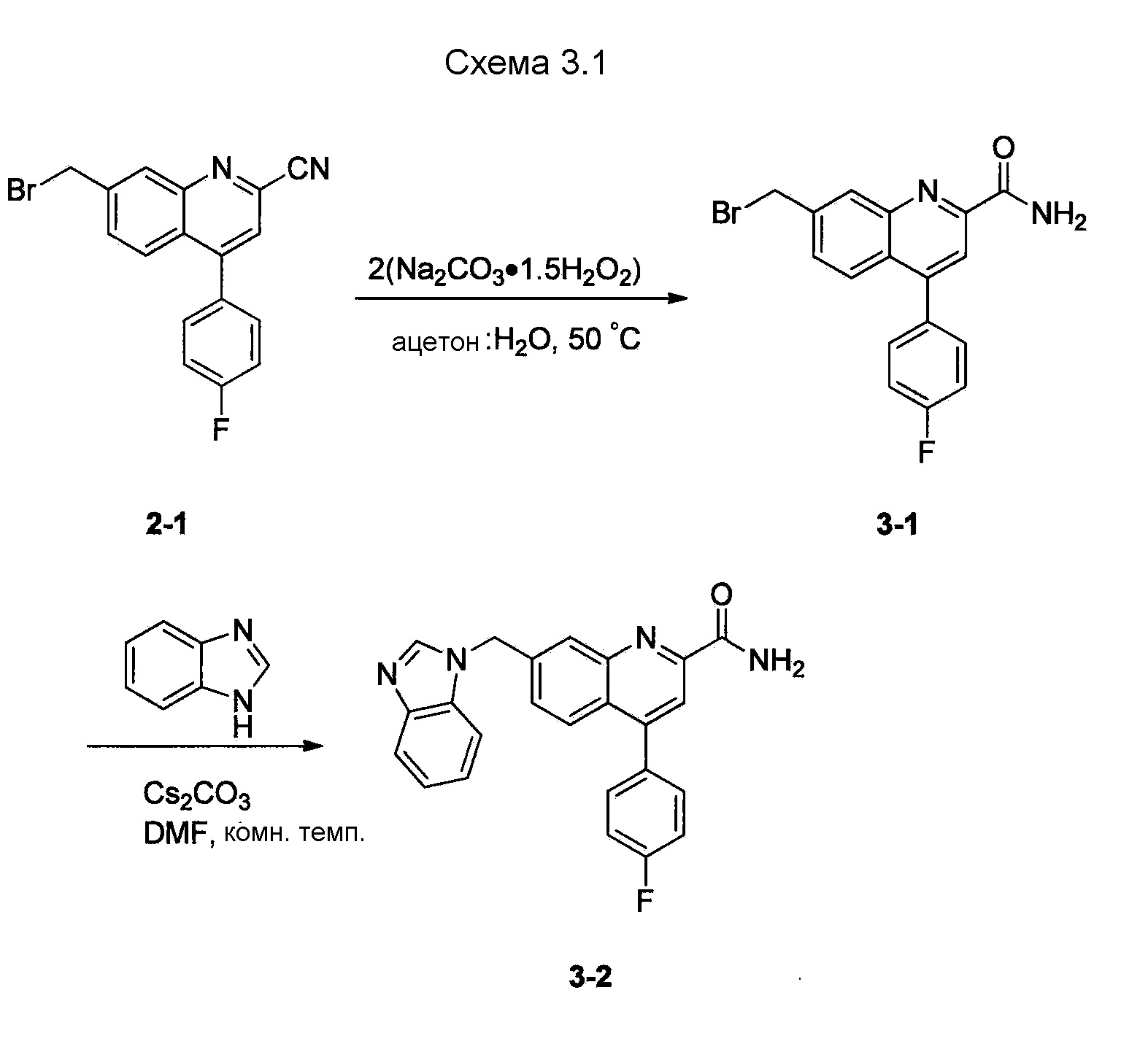
Пример 3.1: синтез 7-((1H-бензо[d]имидазол-1-ил)метил)-4-(4-фторфенил)хинолин-2-карбоксамида (3-2)
7-(Бромметил)-4-(4-фторфенил)хинолин-2-карбоксамид (3-1)
Перкарбонат натрия (2,98 г, 9,50 ммоль, 3,0 эквив.) в воде (52,8 мл) добавляют по каплям к раствору 7-(бромметил)-4-(4-фторфенил)хинолин-2-карбонитрила (2-1, 1,08 г, 3,17 ммоль, 1,0 эквив.) в ацетоне (106 мл) и реакционную смесь перемешивают в течение 1 часа при к.т. Реакционную смесь гасят насыщенным KH2PO4, и смесь экстрагируют EtOAc (3x). Объединенные органические фракции сушат (MgSO4), фильтруют, и растворитель выпаривают при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле (120 г SiO2, 0-100% EtOAc/гексаны), получая 7-(бромметил)-4-(4-фторфенил)хинолин-2-карбоксамид (3-1, 650 мг, 57%) в виде белого твердого вещества. НРМС m/z (M+H)+ 359,05 найдено, 359,19 требуется.
7-((1H-Бензо[d]имидазол-1-ил)метил)-4-(4-фторфенил)хинолин-2-карбоксамид (3-2)
Cs2CO3 (91 мг, 0,278 ммоль, 2,0 эквив.) добавляют к раствору 7-(бромметил)-4-(4-фторфенил)хинолин-2-карбоксамида (3-1, 50 мг, 0,139 ммоль, 1,0 эквив.) и бензимидазола (18,09 мг, 0,153 ммоль, 1,1 эквив.) в ДМФА (696 мкл) и реакционную смесь перемешивают при к.т. в течение 2 часов. Сырой остаток очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA). Waters Porapak® Rxn CX (6 см3) кондиционируют MeOH (5 мл). Фракции, содержащие требуемый продукт, загружают на картридж, и картридж промывают MeOH (10 мл). Требуемый продукт элюируют 2M NH3 в MeOH (5 мл), и растворитель удаляют в вакууме, получая 7-((1H-бензо[d]имидазол-1-ил)метил)-4-(4-фторфенил)хинолин-2-карбоксамид (3-2, 23,6 мг, 43%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD): δ 8,40 (с, 1Н); 8,09 (с, 1Н); 8,00-7,91 (м, 2Н); 7,73-7,70 (м, 1Н); 7,61-7,55 (м, 3Н); 7,47 (дд, J=7,2, 2,0 Гц, 1Н); 7,33-7,23 (м, 4Н); 5,80 (с, 2Н). НРМС m/z (M+H)+ 397,17 найдено, 397,42 требуется.
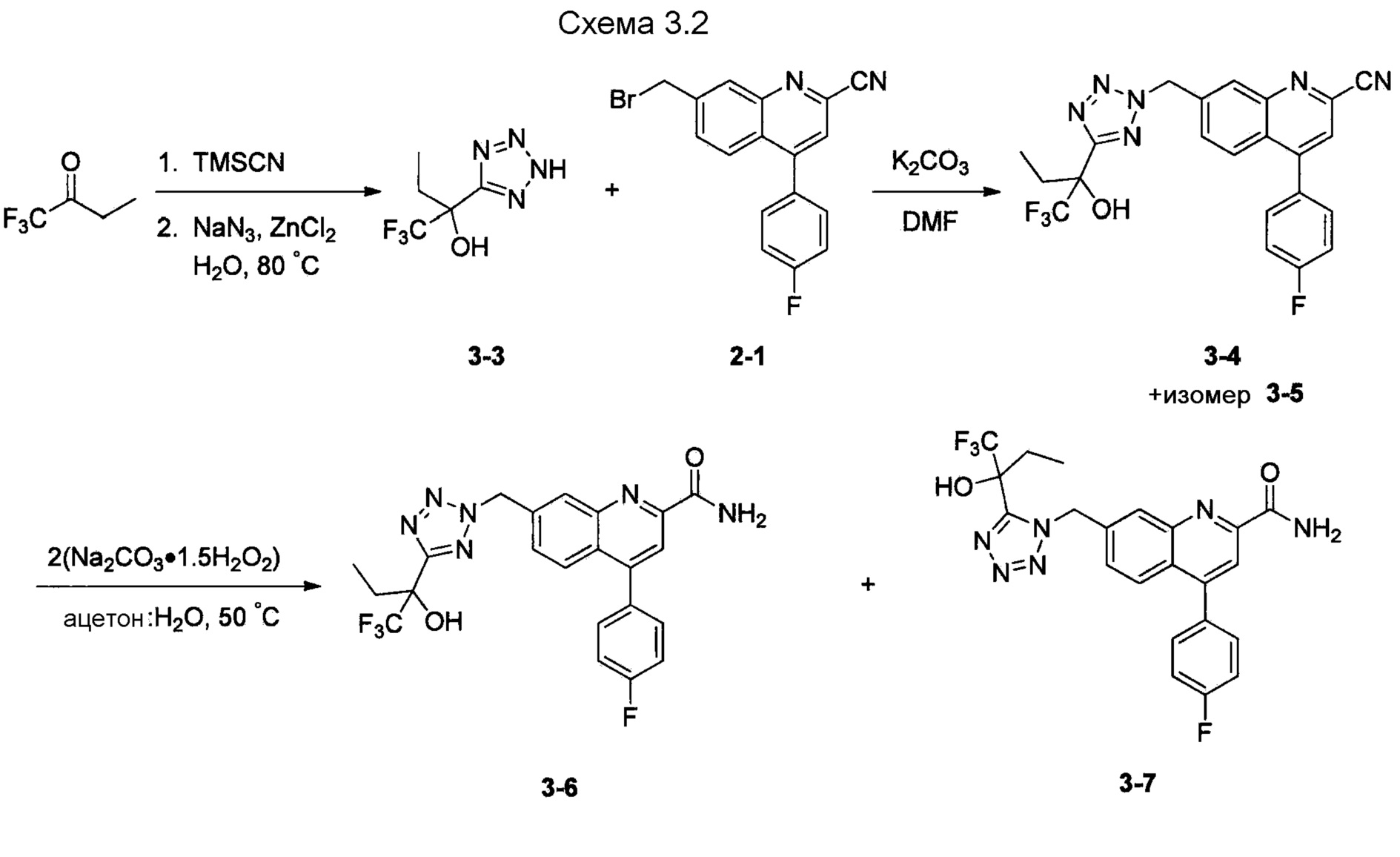
Пример 3.2: синтез 4-(4-фторфенил)-7-((5-(1,1,1-трифтор-2-гидроксибутан-2-ил)-2H-тетразол-2-ил)метил)хинолин-2-карбоксамида (3-6)
1,1,1-Трифтор-2-(2H-тетразол-5-ил)бутан-2-ол (3-3)
К 1,1,1-трифторбутан-2-ону (5,0 г, 39,7 ммоль, 1,0 эквив.) медленно добавляют триметилсилилцианид (4,7 г, 47,6 ммоль, 1,2 эквив.) и полученную смесь перемешивают в течение ночи при температуре окружающей среды. К полученной смеси добавляют воду (80 мл) с последующим добавлением хлорида цинка (5,4 г, 39,7 ммоль, 1,0 эквив.) и азида натрия (3,1 г, 47,1 ммоль, 1,2 эквив.) и смесь нагревают при 80°C в течение трех часов. Смесь охлаждают до комнатной температуры, и осадок фильтруют и сушат в вакууме, получая 1,1,1-трифтор-2-(2H-тетразол-5-ил)бутан-2-ол (3-3) в виде белого твердого вещества. НРМС m/z (M+H)+ 197,0 найдено, 197,1 требуется.
4-(4-Фторфенил)-7-{[5-(1,1,1-трифтор-2-гидроксибутан-2-ил)-2H-тетразол-2-ил]метил}хинолин-2-карбонитрил (3-4)
7-(Бромметил)-4-(4-фторфенил)хинолин-2-карбонитрил (2-1, 120 мг, 0,35 ммоль, 1,0 эквив.), 1,1,1-трифтор-2-(2H-тетразол-5-ил)бутан-2-ол (3-3, 83 мг, 0,42 ммоль, 1,2 эквив.) и карбонат калия (146 мг, 1,1 ммоль, 3,0 эквив.) объединяют в ДМФА (1,8 мл) и перемешивают при температуре окружающей среды в течение 16 часов. Твердые вещества фильтруют, и фильтрат очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 4-(4-фторфенил)-7-{[5-(1,1,1-трифтор-2-гидроксибутан-2-ил)-2H-тетразол-2-ил]метил}хинолин-2-карбонитрил (3-4) и 4-(4-фторфенил)-7-{[5-(1,1,1-трифтор-2-гидроксибутан-2-ил)-1H-тетразол-1-ил]метил}хинолин-2-карбонитрил (3-5). 1H-ЯМР (3-4) (500 МГц, CDCl3): δ 8,26 (д, J=1,7 Гц, 1Н); 7,99 (д, J=8,8 Гц, 1Н); 7,68 (с, 1Н); 7,59 (дд, J=8,8, 1,9 Гц, 1Н); 7,50-7,45 (м, 2Н); 7,31-7,25 (м, 2Н); 6,07 (с, 2Н); 2,33 (дт, J=14,3, 7,4 Гц, 1Н); 2,24-2,16 (м, 1Н); 0,84 (т, J=7,5 Гц, 3Н). НРМС m/z (M+H)+ 456,8 найдено, 457,1 требуется. 1H-ЯМР (3-5) (500 МГц, CDCl3): δ 8,15 (с, 1Н); 7,94 (д, J=8,8 Гц, 1Н); 7,65-7,61 (м, 2Н); 7,48-7,44 (м, 2Н); 7,30-7,24 (м, 2Н); 6,13 (д, J=15,0 Гц, 1Н); 6,01 (д, J=15,0 Гц, 1Н); 3,14-3,06 (уш.с, 1Н); 2,75 (дт, J=14,8, 7,5 Гц, 1Н); 2,16 (д.кв., J=14,7, 7,3 Гц, 1Н); 0,89 (т, J=7,4 Гц, 3Н). НРМС m/z (M+H)+ 456,8 найдено, 457,1 требуется.
4-(4-Фторфенил)-7-{[5-(1,1,1-трифтор-2-гидроксибутан-2-ил)-2H-тетразол-2-ил]метил}хинолин-2-карбоксамид (3-6)
4-(4-Фторфенил)-7-{[5-(1,1,1-трифтор-2-гидроксибутан-2-ил)-2H-тетразол-2-ил]метил}хинолин-2-карбонитрил (3-4, 14 мг, 0,031 ммоль, 1.0 эквив.) растворяют в смеси ацетон (0,5 мл)/вода (0,25 мл) и добавляют перкарбонат натрия (48 мг, 0,15 ммоль, 5,0 эквив.). Полученную смесь нагревают до 50°C в течение двух часов. Смесь охлаждают и заливают водный NH4C1 (1 мл), экстрагируют этилацетатом (3×5 мл), сушат над MgSO4, фильтруют и концентрируют. Сырой остаток очищают колоночной флэш-хроматографией (SiO2, 12 г ISCO колонка, 0-100% EtOAc/гексаны), получая 4-(4-фторфенил)-7-{[5-(1,1,1-трифтор-2-гидроксибутан-2-ил)-2H-тетразол-2-ил]метил}хинолин-2-карбоксамид (3-6) в виде белого твердого вещества. 1H-ЯМР (3-6) (500 МГц, CDCl3): δ 8,28 (с, 1Н); 8,17 (с, 1Н); 8,06 (с, 1Н); 7,99 (д, J=8,7 Гц, 1Н); 7,55-7,44 (м, 3Н); 6,05 (с, 2Н); 5,84 (с, 1Н); 3,92 (с, 1Н); 2,33 (дт, J=14,4, 7,4 Гц, 1Н); 2,20 (дт, J=14,3, 7,2 Гц, 1Н); 0,84 (т, J=7,4 Гц, 3Н). НРМС m/z (M+H)+ 474,9 найдено, 475,1 требуется. 1H-ЯМР (3-7) (500 МГц, CD3OD): δ 8,12 (с, 1Н); 8,08 (с, 1Н); 7,96 (д, J=8,8 Гц, 1Н); 7,64-7,55 (м, 3Н); 7,34-7,29 (м, 2Н); 6,25 (д, J=15,1 Гц, 1Н); 6,15 (д, J=15,1 Гц, 1Н); 2,57 (дд, J=14,4, 7,3 Гц, 1Н); 2,13 (д.кв., J=14,4, 7,2 Гц, 1Н); 0,78 (т, J=7,4 Гц, 3Н). НРМС m/z (M+H)+ 474,7 найдено, 475,1 требуется.
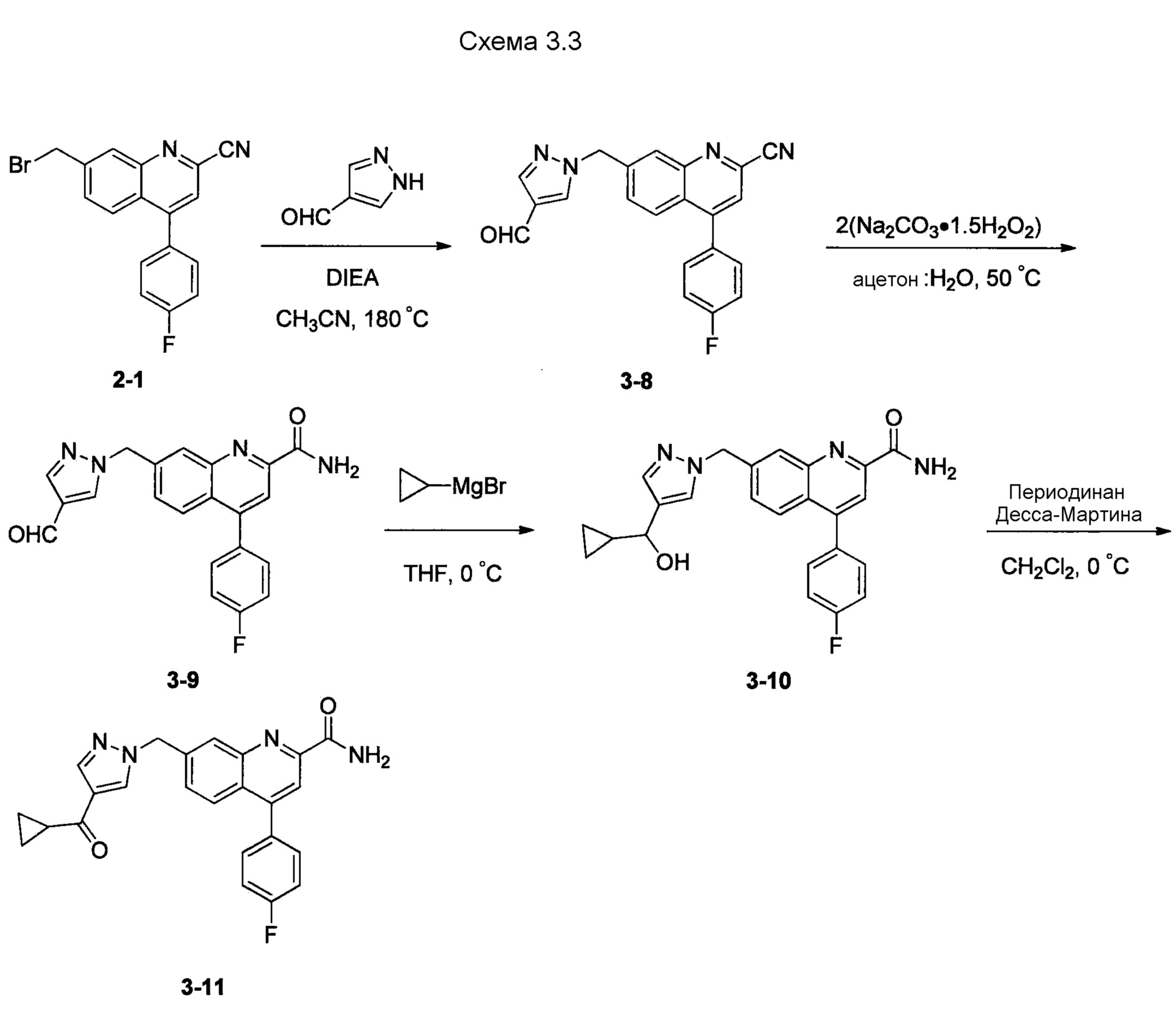
Пример 3.3: синтез 7-{[4-(циклопропилкарбонил)-1H-пиразол-1-ил]метил}-4-(4-фторфенил)хинолин-2-карбоксамида (3-11)
4-(4-Фторфенил)-7-[(4-формил-1H-пиразол-1-ил)метил]хинолин-2-карбонитрил (3-8)
7-(Бромметил)-4-(4-фторфенил)хинолин-2-карбонитрил (2-1, 100,0 мг, 0,293 ммоль, 1,0 эквив.), DIEA (0,051 мл, 0,293 ммоль, 1,0 эквив.) и 1-H-пиразол-4-карбальдегид (33,8 мг, 0,352 ммоль, 1,2 эквив.) добавляют к ацетонитрилу (1,0 мл) в реакционный сосуд для микроволнового облучения и полученную смесь облучают микроволнами при 180°C в течение 30 минут. Реакционную смесь охлаждают и концентрируют, и остаток очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 4-(4-фторфенил)-7-[(4-формил-1H-пиразол-1-ил)метил]хинолин-2-карбонитрил (3-8, 55,0 мг, 52,7%) в виде бесцветного твердого вещества. НРМС m/z (M+H)+ 357,1 найдено, 357,1 требуется.
4-(4-Фторфенил)-7-(4-формил-1H-пиразол-1-ил)метил]хинолин-2-карбоксамид (3-9)
4-(4-Фторфенил)-7-[(4-формил-1H-пиразол-1-ил)метил]хинолин-2-карбонитрил (3-8, 51 мг, 0,143 ммоль, 1,0 эквив.) растворяют в смеси ацетон (1,0 мл)/вода (0,5 мл) и добавляют перкарбонат натрия (225,0 мг, 0,716 ммоль, 5,0 эквив.). Полученную смесь перемешивают при 50°C в течение двух часов. Смесь охлаждают и выливают на водный NH4C1 (насыщенный, 1,0 мл), экстрагируют этилацетатом (3×5,0 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 4-(4-фторфенил)-7-[(4-формил-1H-пиразол-1-ил)метил]хинолин-2-карбонитрил (3-9, 40,0 мг, 74,7%) в виде бесцветного твердого вещества. ¹H ЯМР (400 МГц, CDCl3): δ 9,879 (с, 1Н); 8,262 (с, 1Н); 8,056 (уш.с, 2Н); 8,021 (уш.с, 2Н); 7,972 (д, J=8,80 Гц, 1Н); 7,462-7,512 (м, 3Н); 7,216-7,259 (м, 2Н); 5,705 (уш.с, 1Н); 5,589 (с, 2Н). НРМС m/z (M+H)+ 375,1 найдено, 375,1 требуется.
7-({4-[Циклопропил(гидрокси)метил]-1H-пиразол-1-ил}метил)-4-(4-фторфенил)хинолин-2-карбоксамид (3-10)
К раствору 4-(4-фторфенил)-7-[(4-формил-1H-пиразол-1-ил)метил]хинолин-2-карбоксамида (3-9, 36,0 мг, 0,0960 ммоль, 1,0 эквив.) при 0°C в безводном ТГФ в атмосфере азота добавляют по каплям 0,5 M циклопропилмагнийбромид в ТГФ (0,769 мл, 0,385 ммоль, 4,0 эквив.). Полученную смесь перемешивают при 0°C в течение 1 часа, гасят насыщенным водным NH4Cl, экстрагируют этилацетатом (3×5,0 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 7-({4-[циклопропил(гидрокси)метил]-1H-пиразол-1-ил}метил)-4-(4-фторфенил)хинолин-2-карбоксамид (3-10, 25,0 мг, 62,4%) в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 8,228 (с, 1Н); 8,084 (уш.с, 1Н); 7,995 (с, 1Н); 7,929 (д, J=8,81 Гц, 1Н); 7,625 (с, 1Н); 7,515 (с, 1Н); 7,442-7,506 (м, 3Н); 7,206-7,249 (м, 2Н); 5,777 (уш.с, 1Н); 5,526 (с, 2Н); 4,044 (д, J=8,48 Гц, 1Н); 1,185-1,258 (м, 1Н); 0,599-0,638 (м, 2Н); 0,331-0,454 (м, 2Н). НРМС m/z (M+H)+ 417,2 найдено, 417,2 требуется.
7-([4-(Циклопропилкарбонил)-1H-пиразол-1-ил]метил}-4-(4-фторфенил)хинолин-2-карбоксамид (3-11)
К раствору 7-({4-[циклопропил(гидрокси)метил]-1H-пиразол-1-ил}метил)-4-(4-фторфенил)хинолин-2-карбоксамида (3-10, 22 мг, 0,053 ммоль, 1,0 эквив.) комнатной температуры в метиленхлориде (1,0 мл) добавляют периодинан Десса-Мартина (67,2 мг, 0,158 ммоль, 3,0 эквив.) и смесь перемешивают при комнатной температуре в течение ночи. Добавляют водный Na2S2O3 (насыщенный, 2,0 мл) и водный гидрокарбонат натрия (насыщенный, 5,0 мл) и смесь экстрагируют этилацетатом (3×5 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 7-{[4-(циклопропилкарбонил)-1H-пиразол-1-ил]метил}-4-(4-фторфенил)хинолин-2-карбоксамид (3-11, 3,30 мг, 15,1%) в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 8,239 (с, 1Н); 8,179 (уш.с, 1Н); 8,088 (с, 1Н); 8,039 (с, 1Н); 8,017 (с, 1Н); 7,965 (д, J=8,81 Гц, 1Н); 7,466-7,510 (м, 3Н); 7,219-7,263 (м, 2Н); 6,369 (уш.с, 1Н); 5,585 (с, 2Н); 2,283-2,345 (м, 1Н); 1,187-1,225 (м, 2Н); 0,958-1,004 (м, 2Н). НРМС m/z (M+H)+ 415,2 найдено, 415,2 требуется.
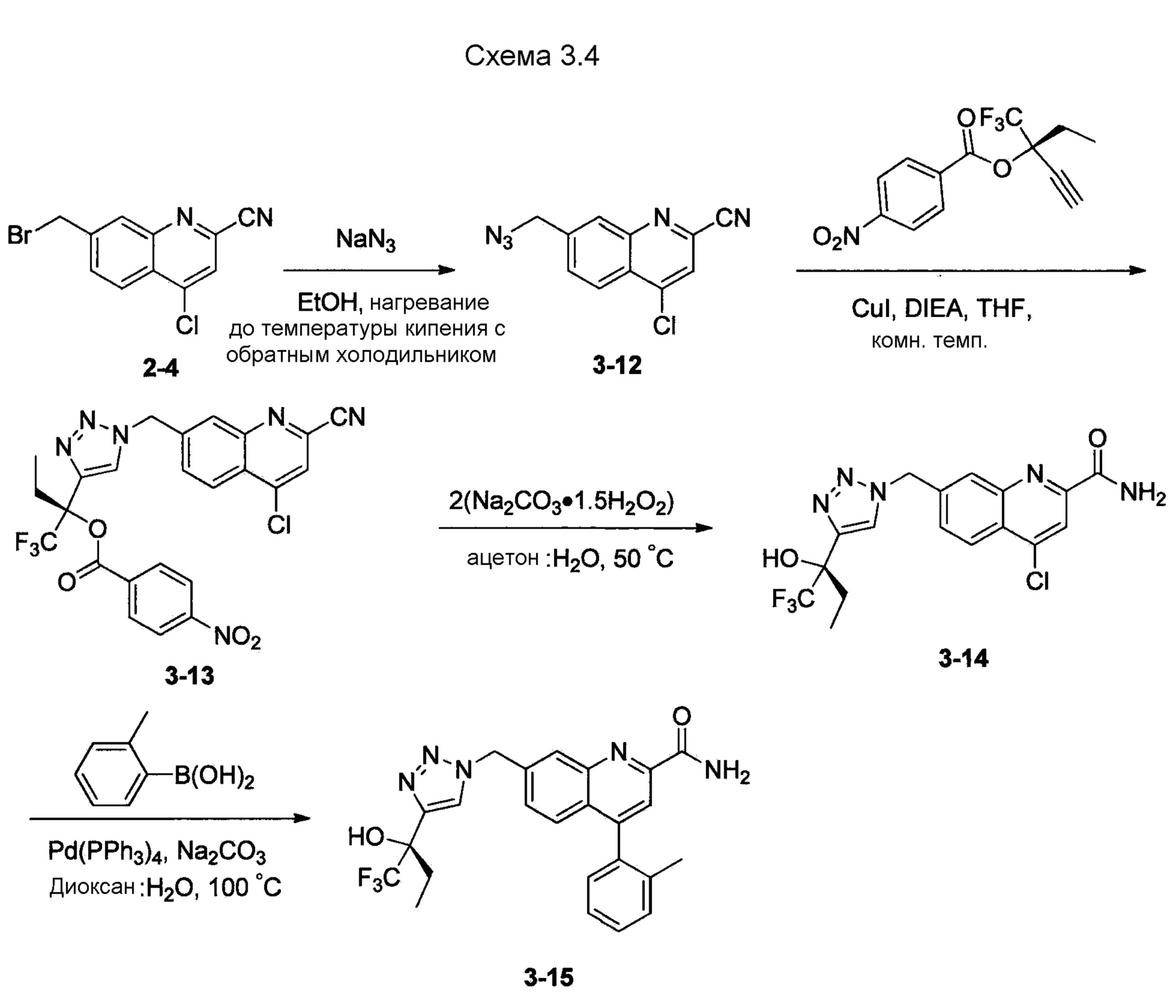
Пример 3.4: 4-(o-толил)-7-((4-(1,1,1-трифтор-2-гидроксибутан-2-ил)-1H-1,2,3-триазол-1-ил)метил)хинолин-2-карбоксамид (3-15)
7-(Азидометил)-4-хлорхинолин-2-карбонитрил (3-12)
Азид натрия (1,690 г, 26,0 ммоль, 1,3 эквив.) добавляют к перемешиваемому раствору 7-(бромметил)-4-хлорхинолин-2-карбонитрила (2-4, 5,63 г, 20,00 ммоль) в 100 мл EtOH и полученную суспензионную смесь нагревают до температуры кипения с обратным холодильником в течение 1 ч. Смесь охлаждают до к.т., добавляют воду (100 мл) и суспензию перемешивают при к.т. в течение 30 мин. Полученное твердое вещество собирают фильтрованием и сушат на воздухе, получая 7-(азидометил)-4-хлорхинолин-2-карбонитрил (3-12, 4,75 г, 97%) в виде белого твердого вещества. НРМС m/z (M+H)+ 244,1 найдено, 244,65 требуется.
(S)-2-(1-((4-Хлор-2-цианохинолин-7-ил)метил)-1H-1,2,3-триазол-4-ил)-1,1,1-трифторбутан-2-ил-4-нитробензоат (3-13)
К раствору 7-(азидометил)-4-хлорхинолин-2-карбонитрила (3-12, 1 г, 4,10 ммоль, 1 эквив.) и (S)-3-(трифторметил)пент-1-ин-3-ил-4-нитробензоата (1,360 г, 4,51 ммоль, 1,1 эквив.) в THF (ТГФ) (20,5 мл) добавляют DIEA (3,58 мл, 20,52 ммоль, 5 эквив.) и йодид меди(I) (1,172 г, 6,16 ммоль, 1,5 эквив.), затем перемешивают при к.т. в течение 2 ч. Реакцию останавливают добавлением насыщенного NH4C1. Полученную смесь экстрагируют EtOAc. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют. Остаток обрабатывают MeOH. Полученное твердое вещество собирают фильтрованием, промывают MeOH и сушат на воздухе, получая (S)-2-(1-((4-хлор-2-цианохинолин-7-ил)метил)-1H-1,2,3-триазол-4-ил)-1,1,1-трифторбутан-2-ил-4-нитробензоат (3-13, 1,58 г, 71%) в виде бесцветного твердого вещества. НРМС m/z (M+H)+ 545,4 найдено, 545,9 требуется.
4-Хлор-7-((4-[(2S)-(1,1,1-трифтор-2-гидроксибутан-2-ил)]-1H-1,2,3-триазол-1-ил)метил)хинолин-2-карбоксамид (3-14)
К (S)-2-(1-((4-хлор-2-цианохинолин-7-ил)метил)-1H-1,2,3-триазол-4-ил)-1,1,1-трифторбутан-2-ил-4-нитробензоату (3-13, 1,58 г, 2,90 ммоль, 1 эквив.) в смеси ацетон/Н2О (38,7 мл/19,33 мл) добавляют перкарбонат натрия (4,55 г, 14,50 ммоль, 5 эквив.) и смесь нагревают до 50°C в течение ночи. Реакционная смесь осталась неполной. Добавляют перкарбонат натрия (4,55 г, 14,50 ммоль, 5 эквив.) и перемешивают дополнительно 5 час. Смесь охлаждают, добавляют воде и смесь экстрагируют EtOAc. The Объединенные органические фракции промывают насыщенным раствором соли, сушат (MgSO4), фильтруют? и растворитель выпаривают при пониженном давлении, получая 4-хлор-7-((4-[(2S)-(1,1,1-трифтор-2-гидроксибутан-2-ил)]-1H-1,2,3-триазол-1-ил)метил)хинолин-2-карбоксамид (3-14, 1,09 г, 91%) в виде светло-желтого твердого вещества. НРМС m/z (M+H)+ 414,3 найдено, 414,8 требуется.
7-({4-[(1S)-1-Гидрокси-1-(трифторметил)пропил]-1H-1,2,3-триазол-1-ил}метил)-4-(2-метилфенил)хинолин-2-карбоксамид (3-15)
4-Хлор-7-({4-[(2S)-1,1,1-трифтор-2-гидроксибутан-2-ил]-1H-1,2,3-триазол-1-ил}метил)хинолин-2-карбоксамид (3-14, 8 мг, 0,02 ммоль, 1,0 эквив.), (2-метилфенил)бороновую кислоту (5 мг, 0,04 ммоль, 2 эквив.), Pd(PPh3)4 (0,7 мг, 0,0006 ммоль, 0,03 эквив.) и 2М водный Na2CO3 (0,02 мл, 0,05 ммоль, 2,5 эквив.) суспендируют в диоксане (0,4 мл) и реакционную смесь нагревают в течение ночи при 100°C. Сырую смесь фильтруют, концентрируют и очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 7-({4-[(1S)-1-гидрокси-1-(трифторметил)пропил]-1H-1,2,3-триазол-1-ил}метил)-4-(2-метилфенил)хинолин-2-карбоксамид (3-15). НРМС m/z (M+H)+ 470,1 найдено, 470,2 требуется.
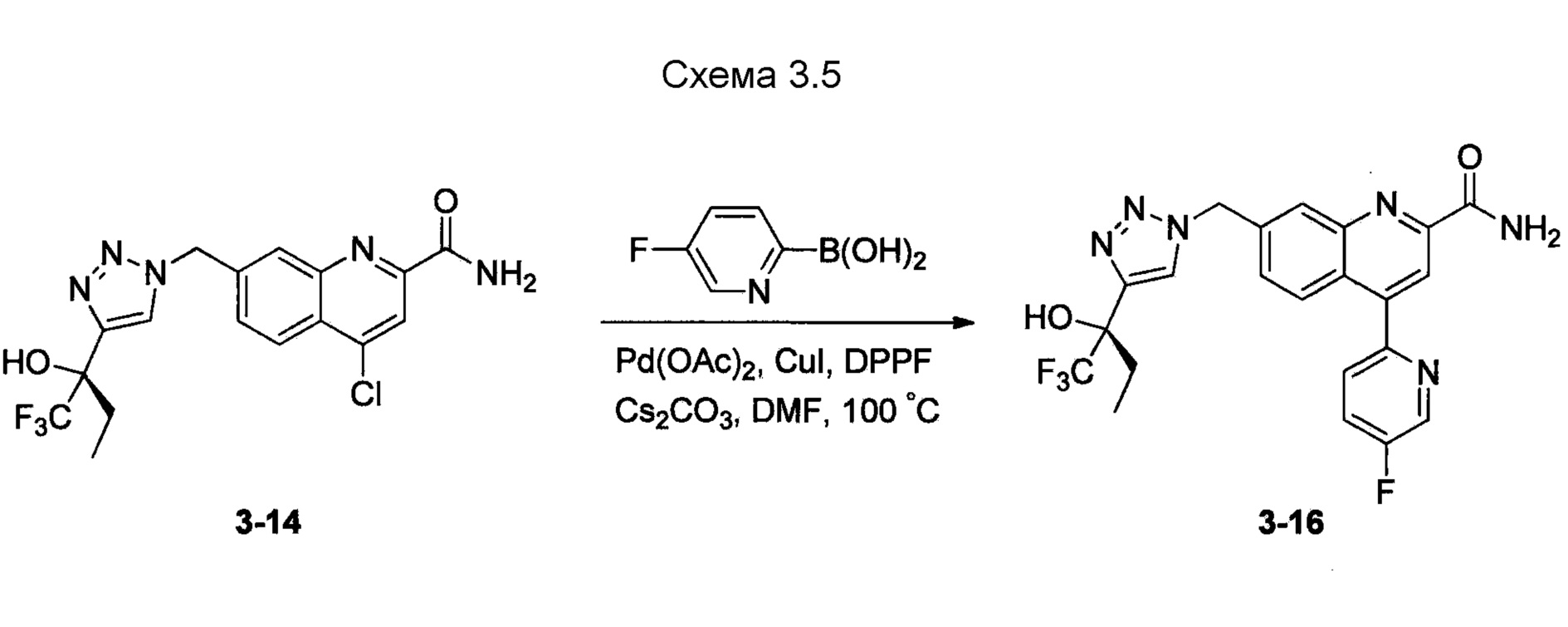
Пример 3.5: синтез 4-(5-фторпиридин-2-ил)-7-({4-[(2S)-1,1,1-трифтор-2-гидроксибутан-2-ил]-1H-1,2,3-триазол-1-ил}метил)хинолин-2-карбоксамида (3-16)
4-(5-Фторпиридин-2-ил)-7-({4-[(2S)-1,1,1-трифтор-2-гидроксибутан-2-ил]-1H-1,2,3-триазол-1-ил}метил)хинолин-2-карбоксамид (3-16)
4-Хлор-7-({4-[(2S)-1,1,1-трифтор-2-гидроксибутан-2-ил]-1H-1,2,3-триазол-1-ил}метил)хинолин-2-карбоксамид (3-14, 16,0 мг, 0,039 ммоль, 1,0 эквив.), (5-фторпиридин-2-ил)бороновую кислоту (22 мг, 0,097 ммоль, 2,5 эквив.), карбонат цезия (25 мг, 0,077 ммоль, 2,0 эквив.), DPPF (2,1 мг, 0,004 ммоль, 0,1 эквив.), хлорид меди(I) (3,8 мг, 0,039 ммоль, 1,0 эквив.) и ацетат палладия(II) (0,43 мг, 0,002 ммоль, 0,05 эквив.) объединяют и продувают аргоном. Добавляют DMF (ДМФА) (0,4 мл) и смесь нагревают при 100°C в течение 14 часов. Смесь фильтруют, очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 4-(5-фторпиридин-2-ил)-7-({4-[(2S)-1,1,1-трифтор-2-гидроксибутан-2-ил]-1H-1,2,3-триазол-1-ил}метил)хинолин-2-карбоксамид (3-16) в виде белого твердого вещества. НРМС m/z (M+H)+ 475,1 найдено, 475,2 требуется.
Следующие соединения получены по методикам, подобным приведенным в схемах 2.1, 3.1, 3.2, 3.3, 3.4 и 3.5, подбором соответствующего хинолинового производного, нуклеофила и производного бороновой кислоты и представляют собой примеры соединений по изобретению.
|
|
|
|
|
|
|
|
|
|
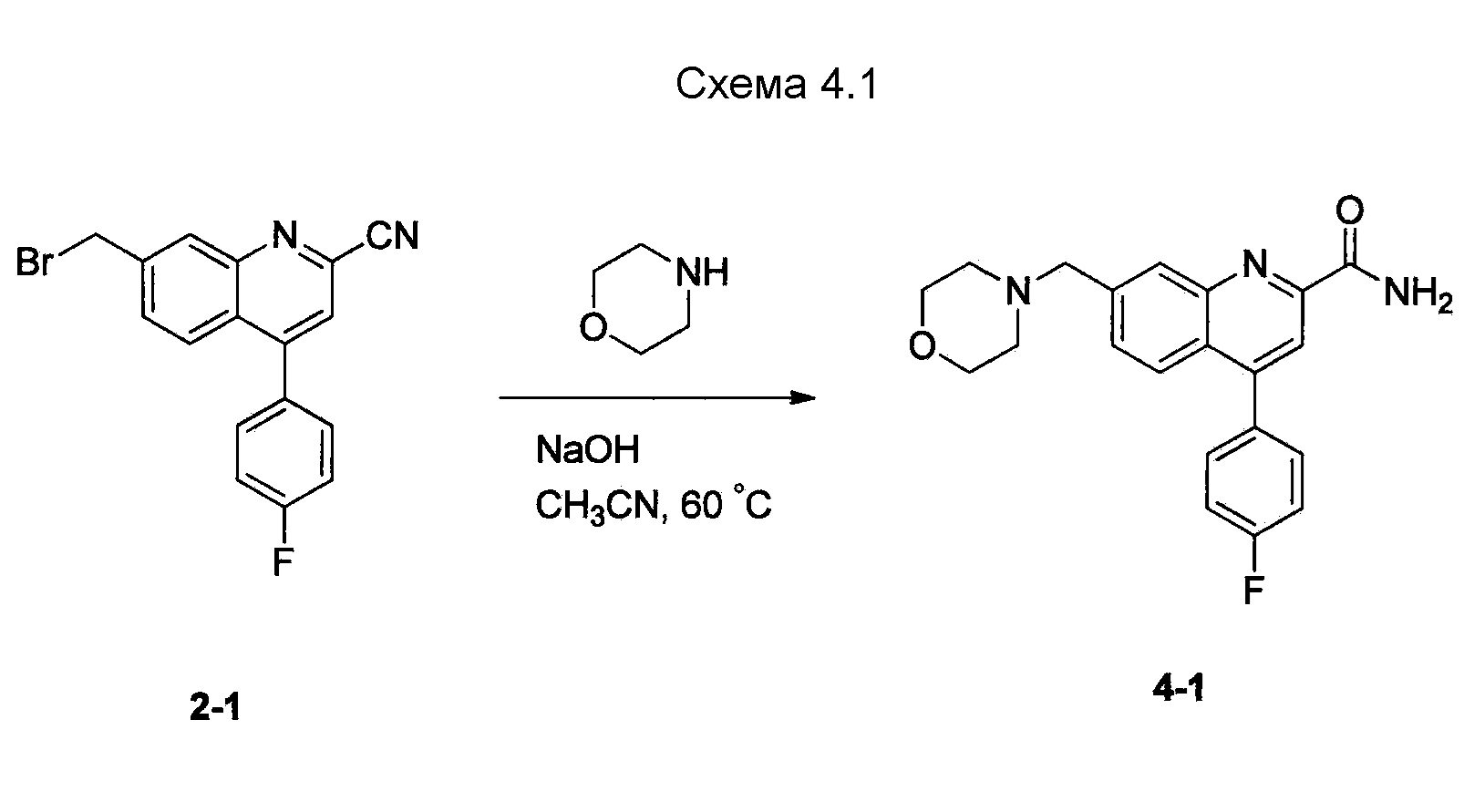
Пример 4.1: синтез 4-(4-фторфенил)-7-(морфолин-4-илметил)хинолин-2-карбоксамид (4-1)
4-(4-Фторфенил)-7-(морфолин-4-илметил)хинолин-2-карбоксамид (4-1)
К раствору 7-(бромметил)-4-(4-фторфенил)хинолин-2-карбонитрила (2-1, 311,0 мг, 0,895 ммоль, 1,0 эквив.) комнатной температуры в ацетонитриле (10,0 мл) добавляют морфолин (85,77 мг, 0,985 ммоль, 1,1 эквив.) и 5,0 M водный NaOH (2,69 мл, 13,43 ммоль, 15 эквив.) и полученную смесь перемешивают при 50°C в течение 4 дней. После охлаждения до комнатной температуры добавляют воду (100,0 мл) и смесь перемешивают в течение 30 минут. Желтое твердое вещество собирают фильтрованием с отсасыванием, промывают водой, сушат в вакууме. Твердое вещество очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 4-(4-фторфенил)-7-(морфолин-4-илметил)хинолин-2-карбоксамид (4-1, 291,0 мг, 80,0%) в виде бесцветного твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,216 (с, 1Н); 8,098 (уш.с, 2Н); 7,911 (д, J=8,54 Гц, 1Н); 7,642 (д, J=8,55 Гц, 1Н); 7,503-7,529 (м, 2Н); 7,219-7,263 (м, 2Н); 5,798 (уш.с, 1Н); 3,734 (уш.с, 6Н); 2,528 (уш.с, 2Н). НРМС m/z (M+H)+ 366,2 найдено, 366,2 требуется.
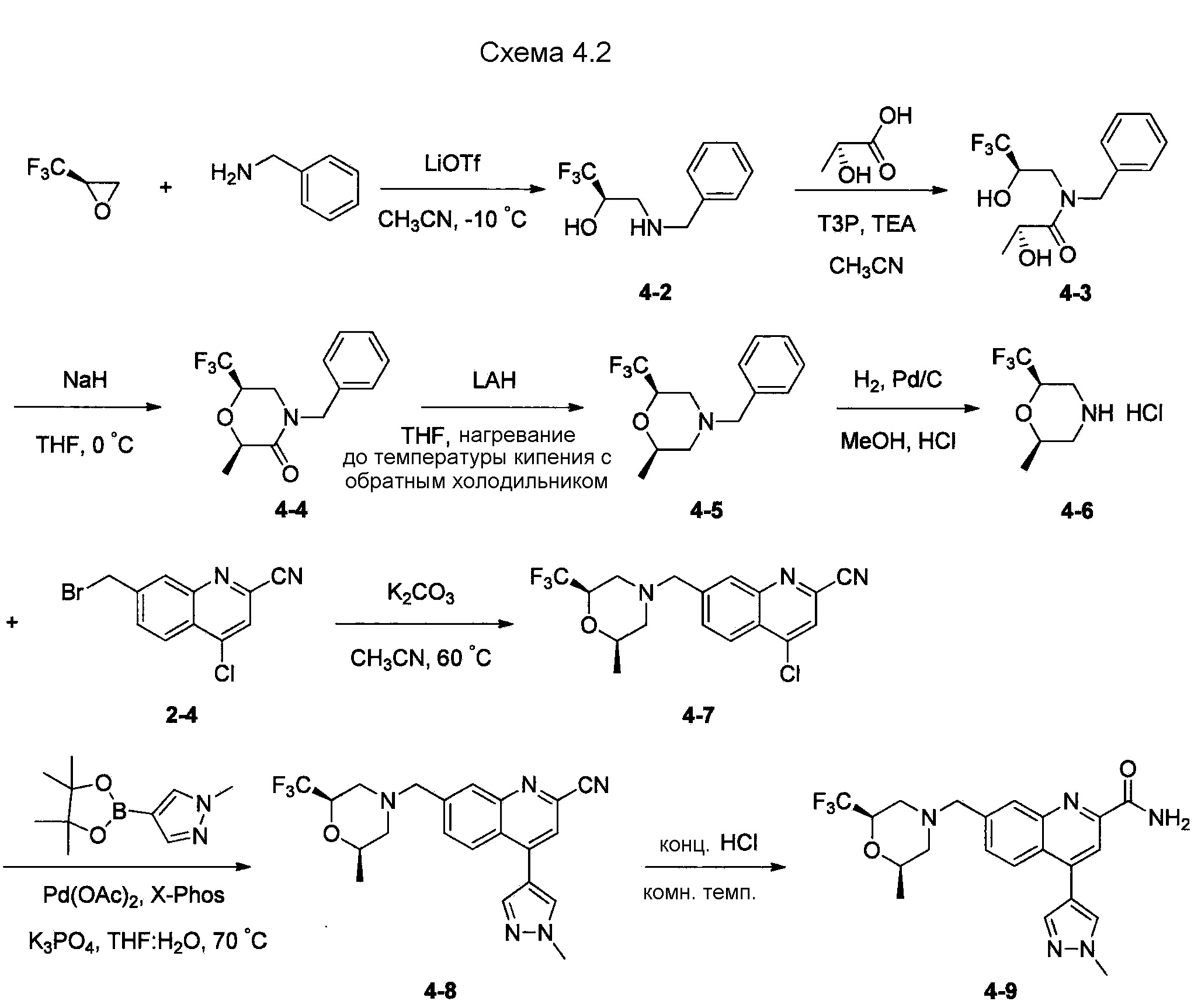
Пример 4.2: синтез 4-(1-метил-1H-пиразол-4-ил)-7-(((2R,6R)-2-метил-6-(трифторметил)морфолино)метил)хинолин-2-карбоксамид (4-9)
(R)-3-(Бензиламино)-1,1,1-трифторпропан-2-ол (4-2)
К раствору трифторметансульфоната лития (1,43 г, 9,17 ммоль) в CH3CN (30 мл) медленно добавляют (R)-(+)-3,3,3-трифтор-1,2-эпоксипропан (10,77 г, 96 ммоль) при -10°C. Спустя 5 минут медленно добавляют бензиламин (10 мл, 92 ммоль). Смесь оставляют на ночь нагреваться по мере нагревания бани до к.т. Смесь концентрируют. Сырой продукт подвергают хроматографии на силикагеле (330 г, 0-50% EtOAc/гексаны, 10-минутный градиент), получая (R)-3-(бензиламино)-1,1,1-трифторпропан-2-ол (4-2, 15,9 г, 79%) в виде белого твердого вещества. НРМС m/z (M+H)+ 220,2 вычисл.; 220,1 найдено.
(S)-N-Бензил-2-гидрокси-N-((R)-3,3,3-трифтор-2-гидроксипропил)пропанамид (4-3)
К раствору (R)-3-(бензиламино)-1,1,1-трифторпропан-2-ола (4-2, 5 г, 22,81 ммоль) в CH3CN (200 мл) добавляют DIEA (12 мл, 68,7 ммоль), (S)-2-хлорпропионовую кислоту (2,4 мл, 27,4 ммоль), затем 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфоринан-2,4,6-триоксид (16,3 мл, 27,4 ммоль), медленно, при к.т. Спустя 2,5 часа смесь концентрируют. Вещество поглощают EtOAc и промывают насыщенным NaHCO3, H2O и насыщенным раствором соли. Органический слой фильтруют через слой силикагеля, промывая этилацетатом, затем концентрируют, получая (S)-N-бензил-2-гидрокси-N-((R)-3,3,3-трифтор-2-гидроксипропил)пропанамид (4-3) в виде прозрачного масла, которое является достаточно чистым для применения на следующей стадии.
(2R,6R)-4-Бензил-2-метил-6-(трифторметил)морфолин-3-он (4-4)
Раствор (S)-N-бензил-2-гидрокси-N-((R)-3,3,3-трифтор-2-гидроксипропил)пропанамида (4-3) в THF (ТГФ) (200 мл) охлаждают до 0°C. К указанному раствору порциями добавляют NaH (60% дисперсия в минеральном масле, 1,05 г, 26,3 ммоль) в виде твердого вещества. После 1 часа охлаждения баню убирают и смеси дают нагреться до к.т. Спустя еще один час смесь гасят насыщенным раствором соли. Смесь разбавляют H2O и экстрагируют EtOAc (3x). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют, получая (2R,6R)-4-бензил-2-метил-6-(трифторметил)морфолин-3-он (4-4) в виде прозрачного масла, которое является достаточно чистым для применения на следующей стадии.
(2R,6R)-4-Бензил-2-метил-6-(трифторметил)морфолин (4-5)
К раствору (2R,6R)-4-бензил-2-метил-6-(трифторметил)морфолин-3-она (4-4) медленно добавляют 1М LAH (48 мл, 48,0 ммоль) в ТГФ, при к.т. После завершения добавления смесь нагревают до температуры кипения с обратным холодильником. Спустя 1 час смесь охлаждают до rt, затем до 0°C. Смесь медленно гасят 2M NaOH до прекращения выделения газа и образования тонкодисперсного белого осадка. Добавляют безводный MgSO4 и смесь перемешивают в течение 15 минут. Суспензию фильтруют через слой целита, промывая EtOAc, затем концентрируют. Сырой продукт подвергают хроматографии на силикагеле (120 г, 0-10% EtOAc/гексаны, 15-минутный градиент), получая (2R,6R)-4-бензил-2-метил-6-(трифторметил)морфолин (4-5, 4,1 г, 66% за 3 стадии) в виде прозрачного масла. 1H ЯМР (400 МГц, CDCl3): δ 7,35-7,26 (м, 5Н); 4,02 (д.кв.д, J=10,7, 6,4, 2,5 Гц, 1Н); 3,76-3,69 (м, 1Н); 3,60-3,48 (м, 2Н); 2,89 (д, J=11,1 Гц, 1Н); 2,73-2,68 (м, 1Н); 2,16-2,04 (м, 1Н); 1,91-1,79 (м, 1Н); 1,19 (д, J=6,3 Гц, 3Н).
(2R,6R)-2-Метил-6-(трифторметил)морфолингидрохлорид (4-6)
К раствору (2R,6R)-4-бензил-2-метил-6-(трифторметил)морфолина (4-5, 4,1 г, 15,81 ммоль) в MeOH (80 мл) добавляют концентрированную HCl (6,6 мл, 79 ммоль). Полученную смесь переносят в сосуд Парра, содержащий 10% Pd/C (1,7 г, 1,597 ммоль). Смесь гидрируют (45 фунт/кв. дюйм) в течение ночи. Смесь фильтруют через слой целита, промывая MeOH, затем концентрируют. Остаток поглощают MeOH и концентрируют (3x), получая (2R,6R)-2-метил-6-(трифторметил)морфолингидрохлорид (4-6, 3,34 г, 103%) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 4,59 (уш.с, 2Н); 4,27 (уш.с, 2Н); 3,01 (уш.с, 1Н); 2,79 (уш.с, 1Н); 1,33 (с, 3Н).
4-Хлор-7-(((2R,6R)-2-метил-6-(трифторметил)морфолино)метил)хинолин-2-карбонитрил (4-7)
(2R,6R)-2-Метил-6-(трифторметил)морфолингидрохлорид (4-6, 500 мг, 2,432 ммоль) и K2CO3 (739 мг, 5,35 ммоль) объединяют в CH3CN (10 мл) при к.т. Добавляют 7-(бромметил)-4-хлорхинолин-2-карбонитрил (2-4, 753 мг, 2,68 ммоль), весь сразу, в виде твердого вещества, затем смесь нагревают до 60°C в течение ночи. Смесь охлаждают до rt, разбавляют H2O и экстрагируют EtOAc (3x). Объединенные органические слои фильтруют через слой целита, промывая EtOAc, затем концентрируют. Сырой продукт подвергают хроматографии на силикагеле (50 г, 0-50% EtOAc/гексаны, 15-минутный градиент), получая 4-хлор-7-(((2R,6R)-2-метил-6-(трифторметил)морфолино)метил)хинолин-2-карбонитрил (4-7, 859, 96%) в виде белого пенистого вещества. 1H ЯМР (400 МГц, CDCl3): δ 8,26 (д, J=8,7 Гц, 1Н); 8,11 (с, 1Н); 7,83 (дд, J=8,6, 1,6 Гц, 1Н); 7,78 (с, 1Н); 4,09-4,01 (м, 1Н); 3,79 (м, 3Н); 2,90 (д, J=10,9 Гц, 1Н); 2,73 (д, J=11,4 Гц, 1Н); 2,28-2,17 (м, 1Н); 2,03-1,92 (м, 1Н); 1,20 (д, J=6,2 Гц, 3Н).
4-(1-Метил-1H-пиразол-4-ил)-7-(((2R,6R)-2-метил-6-(трифторметил)морфолино)метил)хинолин-2-карбонитрил (4-8)
4-Хлор-7-(((2R,6R)-2-метил-6-(трифторметил)морфолино)метил)хинолин-2-карбонитрил (4-7, 859 мг, 2,323 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (725 мг, 3,48 ммоль), Pd(OAc)2 (26 мг, 0,116 ммоль) и X-Phos (111 мг, 0,232 ммоль) объединяют в ТГФ (10 мл). Добавляют 1М K3PO4 (7 мл, 7,00 ммоль). Смесь дегазируют (3×нагнетание/N2), затем нагревают до 70°C в течение ночи. Смесь охлаждают до к.т., разбавляют H2O и экстрагируют EtOAc (3x). Объединенные органические слои фильтруют через слой целита, промывая EtOAc, затем концентрируют. Сырой продукт подвергают хроматографии на силикагеле (100 г, 50% EtOAc/гексаны), получая 4-(1-метил-1H-пиразол-4-ил)-7-(((2R,6R)-2-метил-6-(трифторметил)морфолино)метил)хинолин-2-карбонитрил (4-8, 650 мг, 67%) в виде белого твердого вещества. 1H ЯМР (399 МГц, CDCl3): δ 8,22 (д, J=8,7 Гц, 1Н); 8,10 (с, 1Н); 7,86 (с, 1Н); 7,78 (с, 1Н); 7,71 (дд, J=8,7, 1,7 Гц, 1Н); 7,63 (с, 1Н); 4,07 (м, 3Н); 3,78 (м, 3Н); 2,92 (д, J=11,0 Гц, 1Н); 2,75 (д, J=11,4 Гц, 1Н); 2,22 (т, J=10,8 Гц, 1Н); 1,97 (т, J=10,8 Гц, 1Н); 1,20 (д, J=6,3 Гц, 3Н).
4-(1-Метил-1H-пиразол-4-ил)-7-(((2R,6R)-2-метил-6-(трифторметил)морфолино)метил)хинолин-2-карбоксамид (4-9)
4-(1-Метил-1H-пиразол-4-ил)-7-(((2R,6R)-2-метил-6-(трифторметил)морфолино)метил)хинолин-2-карбонитрил (4-8, 650 мг, 1,565 ммоль) поглощают концентрированной HCl (10 мл) и перемешивают при к.т. Спустя 3 часа смесь гасят медленным добавлением ее к раствору K2CO3 (17 г) в 100 мл H2O. Реакционную колбу ополаскивают после гашения H2O, доводя общий объем H2O до 150 мл. Полученную смесь перемешивают при к.т. в течение 1 часа. Не совсем белое твердое вещество собирают фильтрованием, промывают H2O и сушат на воздухе. Сырой продукт подвергают хроматографии на силикагеле (40 г, 100% EtOAc), получая 4-(1-метил-1H-пиразол-4-ил)-7-(((2R,6R)-2-метил-6-(трифторметил)морфолино)метил)хинолин-2-карбоксамид (4-9, 592 мг, 87%) в виде белого пенистого вещества. 1H ЯМР (399 МГц, CDCl3): δ 8,27-8,22 (м, 2Н); 8,10 (уш.с, 1Н); 8,04 (с, 1Н); 7,90 (с, 1Н); 7,80 (с, 1Н); 7,65 (дд, J=8,7, 1,7 Гц, 1Н); 5,67 (уш.с, 1Н); 4,06 (м, 3Н); 3,82-3,74 (м, 3Н); 2,95 (д, J=11,0 Гц, 1Н); 2,77 (д, J=11,5 Гц, 1Н); 2,21 (т, J=10,8 Гц, 1Н); 2,05 (с, 1Н); 1,96 (т, J=10,8 Гц, 1Н); 1,20 (д, J=6,3 Гц, 3Н). НРМС m/z (M+H)+ 434,4 вычисл.; 434,3 найдено.
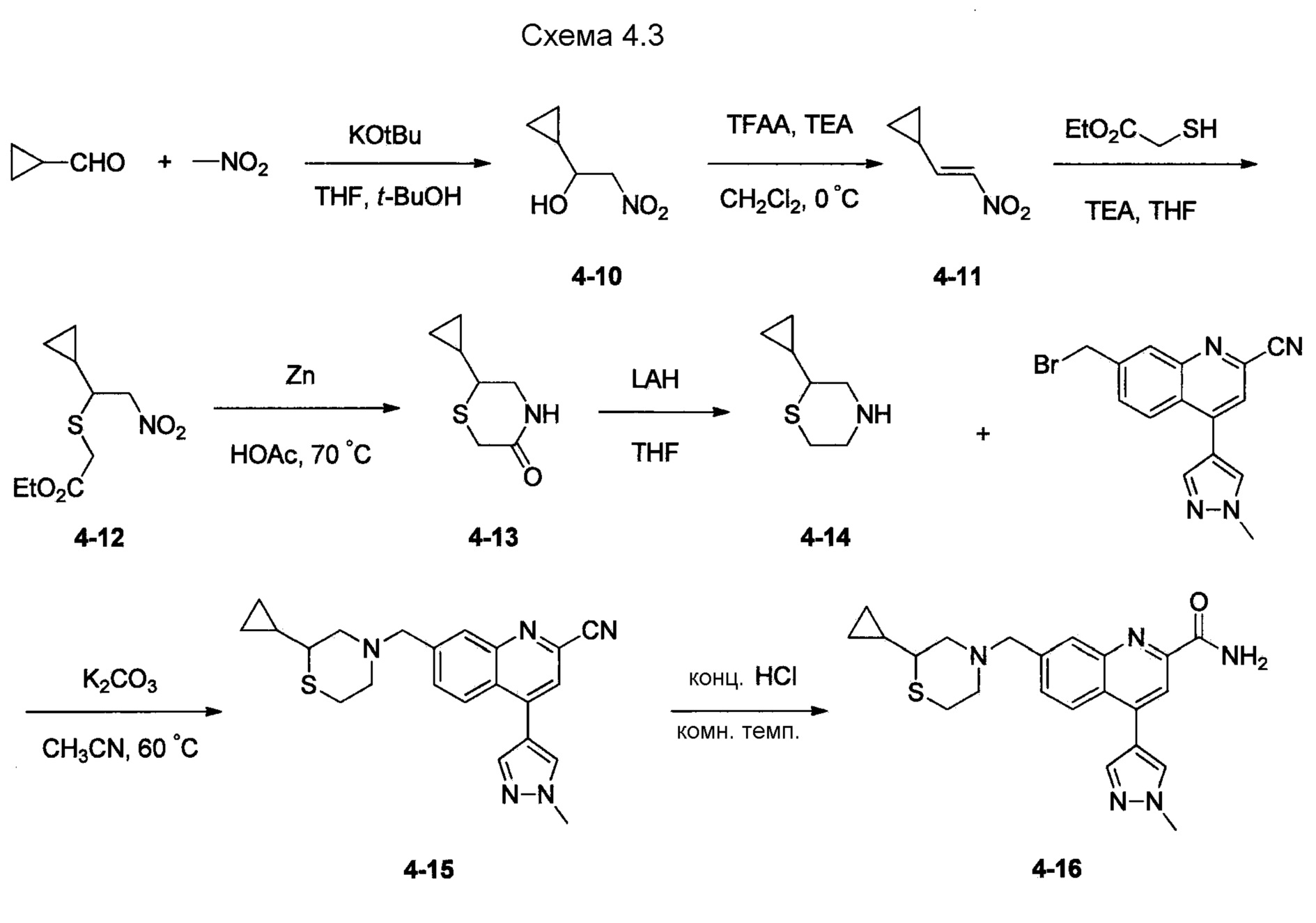
Пример 4.3: синтез 7-((2-циклопропилтиоморфолино)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксамида (4-16)
1-Циклопропил-2-нитроэтанол (4-10)
Смесь ТГФ (10 мл) и трет-BuOH (10,00 мл) охлаждают до 0°C. Добавляют циклопропанкарбоксальдегид (1,1 мл, 14,60 ммоль) и нитрометан (1,18 мл, 21,88 ммоль). После перемешивания в течение 5 минут медленно добавляют 1М KOtBu (2,92 мл, 2,92 ммоль) в ТГФ. Во время добавления образуется белое твердое вещество. Смесь оставляют на ночь нагреваться по мере нагревания бани до к.т. Смесь разбавляют насыщенным водным NH4Cl и экстрагируют CH2Cl2 (3x). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют (без нагрева), получая 1-циклопропил-2-нитроэтанол (4-10, 1,9 г, 99%) в виде прозрачного масла, которое достаточно чистое для применения на следующей стадии. 1H ЯМР (399 МГц, CDCl3): δ 4,56-4,52 (м, 2Н); 3,72-3,64 (м, 1Н); 2,42 (д, J=3,9 Гц, 1Н); 0,99-0,90 (м, 1Н); 0,68-0,59 (м, 2Н); 0,52-0,44 (м, 1Н); 0,39-0,32 (м, 1Н).
(E)-(2-Нитровинил)циклопропан (4-11)
Сырой 1-циклопропил-2-нитроэтанол (4-10, 1,9 г, 14,49 ммоль) поглощают CH2C12 (20 мл), затем охлаждают до 0°C. Добавляют TFAA (2,3 мл, 16,28 ммоль), с последующим медленным добавлением TEA (4,5 мл, 32,3 ммоль). Смесь оставляют нагреваться по мере нагревания бани до к.т. Спустя 3 часа смесь фильтруют через слой силикагеля, промывая CH2Cl2. Фильтрат концентрируют (без нагрева) до желтого масла. Масло поглощают смесью 20% Et2O/гексаны и фильтруют через слой силикагеля, промывая смесью 20% Et2O/гексаны. Фильтрат концентрируют (без нагрева), получая (E)-(2-нитровинил)циклопропан (4-11, 1,49 г, 91%) в виде сильно бледно-желтого масла, которое достаточно чистое для применения на следующей стадии. 1H ЯМР (399 МГц, CDCl3): δ 7,14 (д, J=13,2 Гц, 1Н); 6,79 (дд, J=13,2, 10,8 Гц, 1Н); 1,68-1,58 (м, 1Н); 1,19-1,11 (м, 2Н); 0,84-0,78 (м, 2Н).
Этил-2-((1-циклопропил-2-нитроэтил)тио)ацетат (4-12)
(E)-(2-Нитровинил)циклопропан (4-11, 750 мг, 6,63 ммоль) поглощают ТГФ (20 мл). Добавляют этилтиогликолят (0,88 мл, 7,98 ммоль), затем TEA (1,2 мл, 8,61 ммоль) при к.т. После перемешивания в течение ночи смесь концентрируют. Сырой продукт подвергают хроматографии на силикагеле (40 г, 0-20% EtOAc/гексаны, 10-минутный градиент), получая этил-2-((1-циклопропил-2-нитроэтил)тио)ацетат (4-12, 1,46 г, 94%) в виде прозрачного масла. 1H ЯМР (399 МГц, CDCl3): δ 4,73-4,58 (м, 2Н); 4,21 (кв., J=7,1 Гц, 2Н); 3,34 (д, J=6,2 Гц, 2Н); 2,93 (дт, J=9,9, 7,2 Гц, 1Н); 1,30 (т, J=7,1 Гц, 3Н); 1,00-0,90 (м, 1Н); 0,69 (дд, J=8,0, 1,6 Гц, 2Н); 0,47-0,36 (м, 2Н).
6-Циклопропилтиоморфолин-3-он (4-13)
Этил-2-((1-циклопропил-2-нитроэтил)тио)ацетат (4-12, 1,46 г, 6,26 ммоль) поглощают AcOH (30 мл). Добавляют цинк в порошке (4093 мг, 62,6 ммоль), затем смесь нагревают до 70°C. После перемешивания в течение ночи смесь охлаждают до к.т., разбавляют AcOH, фильтруют через слой целита, промывая AcOH, и концентрируют. Сырой продукт подвергают хроматографии на силикагеле (40 г, 0-100% EtOAc/гексаны, 10-минутный градиент), получая 6-циклопропилтиоморфолин-3-он (4-13, 355 мг, 36%) в виде янтарного масла, которое медленно затвердевает в вакууме. 1H ЯМР (399 МГц, CDCl3): δ 6,65 (с, 1Н); 3,65 (дт, J=13,2, 4,4 Гц, 1Н); 3,54-3,46 (м, 1Н); 3,32 (с, 2Н); 2,47-2,39 (м, 1Н); 0,98-0,89 (м, 1Н); 0,67-0,58 (м, 2Н); 0,41-0,25 (м, 2Н).
2-Циклопропилтиоморфолин (4-14)
Раствор 6-циклопропилтиоморфолин-3-она (4-13, 355 мг, 2,258 ммоль) в ТГФ (10 мл) охлаждают до 0°C. Медленно добавляют 2М LAH (2,3 мл, 4,60 ммоль). После завершения добавления охлаждающую баню убирают, и смеси дают нагреться до к.т. После перемешивания в течение ночи смесь охлаждают до 0°C и медленно гасят 2M NaOH до прекращения выделения газа и образования тонкодисперсного белого осадка. Добавляют безводный Na2SO4 и смесь перемешивают в течение 15 минут. Суспензию фильтруют через слой целита, промывая ТГФ, и фильтрат концентрируют, получая 2-циклопропилтиоморфолин (4-14, 242 мг, 75%) в виде светло-желтого масла, которое используют на последующих стадиях как есть.
7-((2-Циклопропилтиоморфолино)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбонитрил (4-15)
К раствору сырого 2-циклопропилтиоморфолина (4-14, 100 мг, 0,698 ммоль) в CH3CN (3 мл) добавляют K2CO3 (289 мг, 2,094 ммоль), затем 7-(бромметил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбонитрил (251 мг, 0,768 ммоль), весь сразу, в виде твердого вещества. Полученную смесь нагревают до 60°C в течение ночи. Смесь охлаждают до к.т., разбавляют EtOAc, фильтруют через слой целита, промывая EtOAc, и концентрируют. Сырой продукт подвергают хроматографии на силикагеле (25 г, 0-100% EtOAc/гексаны, 10-минутный градиент), получая 7-((2-циклопропилтиоморфолино)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбонитрил (4-15, 123 мг, 45%) в виде светло-оранжевого пенистого вещества. 1H ЯМР (399 МГц, CDCl3): δ 8,19 (д, J=8,7 Гц, 1Н); 8,09 (с, 1Н); 7,85 (с, 1Н); 7,77 (с, 1Н); 7,71 (д, J=8,8 Гц, 1Н); 7,61 (с, 1Н); 4,07 (с, 3Н); 3,85-3,70 (м, 2Н); 3,16 (дд, J=11,6, 2,7 Гц, 1Н); 3,01 (д, J=11,6 Гц, 1Н); 2,83 (ддд, J=13,4, 10,6, 2,7 Гц, 1Н); 2,61-2,53 (м, 1Н); 2,45-2,34 (м, 2Н); 2,20-2,13 (м, 1Н); 0,88-0,80 (м, 1Н); 0,61-0,44 (м, 2Н); 0,36-0,27 (м, 1Н); 0,23-0,16 (м, 1Н).
7-((2-Циклопропилтиоморфолино)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксамид (4-16)
7-((2-Циклопропилтиоморфолино)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбонитрил (4-15, 40 мг, 0,103 ммоль) поглощают концентрированной HCl (0,6 мл) и перемешивают при к.т. Спустя 4 часа смесь гасят медленным добавлением насыщенного NaHCO3. Полученную смесь экстрагируют CH2Cl2 (3x). Объединенные органические слои фильтруют через слой целита, промывая CH2Cl2, затем концентрируют. Сырой продукт подвергают хроматографии на силикагеле (25 г, 100% EtOAc), получая 7-((2-циклопропилтиоморфолино)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксамид (4-16, 28 мг, 67%) в виде не совсем белого пенистого вещества. 1H ЯМР (399 МГц, CDCl3): δ 8,22 (м, 2Н); 8,10 (с, 1Н); 8,04 (с, 1Н); 7,89 (с, 1Н); 7,80 (с, 1Н); 7,65 (д, J=8,7 Гц, 1Н); 5,62 (с, 1Н); 4,05 (с, 3Н); 3,87-3,68 (м, 2Н); 3,19 (д, J=11,6 Гц, 1Н); 3,04 (д, J=11,6 Гц, 1Н); 2,91-2,79 (м, 1Н); 2,61-2,53 (м, 1Н); 2,46-2,35 (м, 2Н); 2,23-2,15 (м, 1Н); 0,88-0,79 (м, 1Н); 0,60-0,46 (м, 2Н); 0,36-0,27 (м, 1Н); 0,26-0,18 (м, 1Н). НРМС m/z (M+H)+ 408,5 вычисл.; 408,3 найдено.
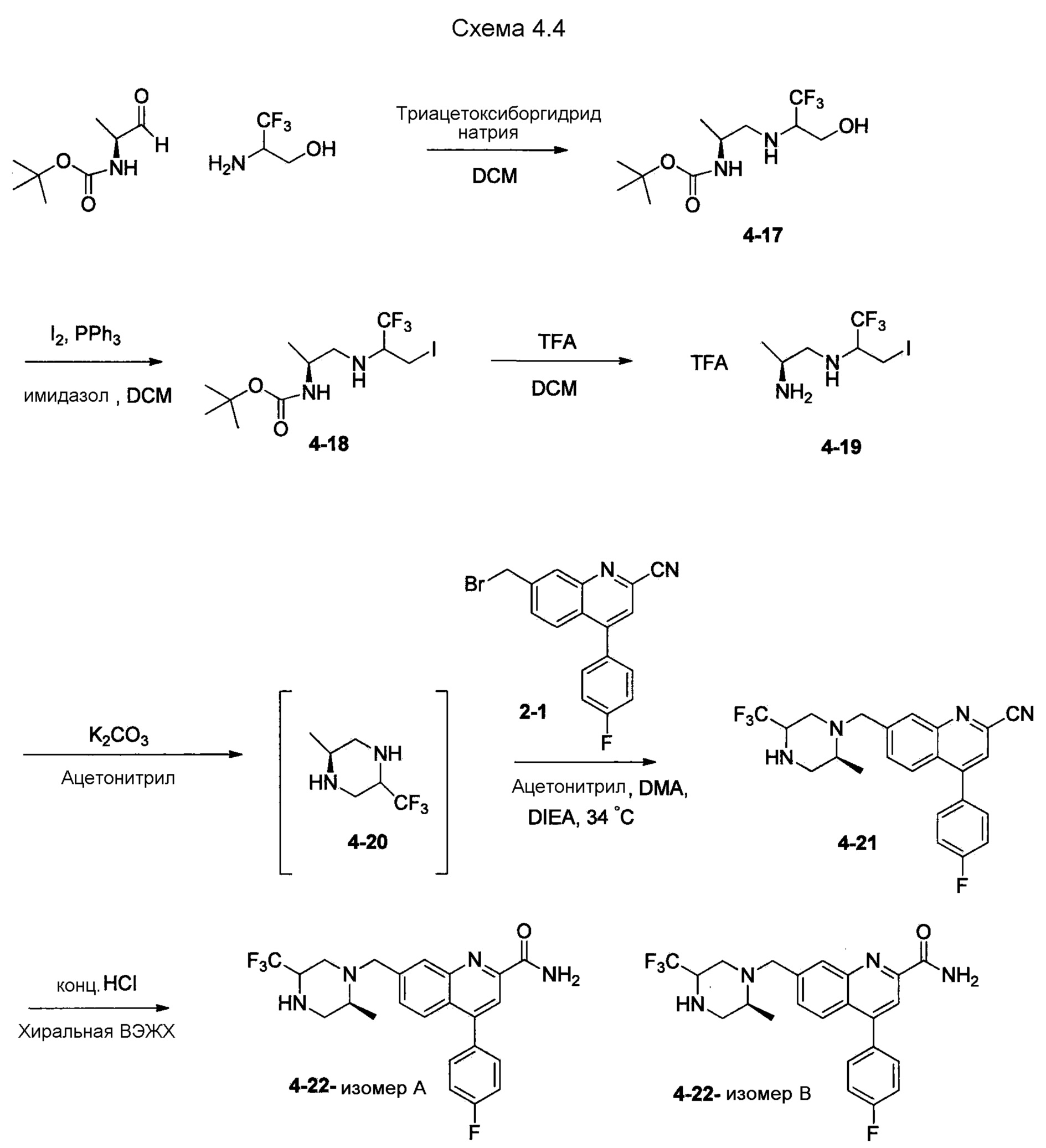
Пример 4.4: синтез 4-(4-фторфенил)-7-(((2S)-2-метил-5(R или S)-(трифторметил)пиперазин-1-ил)метил)хинолин-2-карбоксамид (4-22)
Трет-бутил-((2S)-1-((1,1,1-трифтор-3-гидроксипропан-2-ил)амино)пропан-2-ил)карбамат (4-17)
К перемешиваемому раствору (S)-трет-бутил-(1-оксопропан-2-ил)карбамата (3,15 г, 18,18 ммоль) и DCM (91 мл) добавляют 2-амино-3,3,3-трифторпропан-1-ол (2,230 г, 17,28 ммоль). Перемешивают при температуре окружающей среды в течение 10 минут и затем добавляют триацетоксиборгидрид натрия (5,78 г, 27,3 ммоль). Смесь перемешивают в течение ночи. Реакционную смесь разбавляют DCM и затем промывают 1н NaOH, насыщенным раствором соли, сушат над MgSO4, фильтруют, и растворитель удаляют, получая 4,0 грамма трет-бутил-((2S)-1-((1,1,1-трифтор-3-гидроксипропан-2-ил)амино)пропан-2-ил)карбамата в виде бесцветного масла, которое используют без дополнительной очистки. НРМС m/z (M+H)+ 287,3 найдено, 287,3 требуется.
Трет-бутил-((2S)-1-((1,1,1-трифтор-3-йодпропан-2-ил)амино)пропан-2-ил)карбамат (4-18)
К перемешиваемой смеси трифенилфосфина (связанного со смолой, 1,88 ммоль/грамм, 7,70 г, 14,67 ммоль) в DCM (48,9 мл) добавляют йод (3,72 г, 14,67 ммоль). Перемешивают в течение 15 минут. Добавляют имидазол (1,332 г, 19,56 ммоль) и перемешивают 15 минут, затем добавляют трет-бутил-((2S)-1-((1,1,1-трифтор-3-гидроксипропан-2-ил)амино)пропан-2-ил)карбамат (2,8 г, 9,78 ммоль), растворенный в DCM (48 мл), и после этого смесь нагревают до температуры кипения с обратным холодильником в течение 3 часов. Охлаждают до комнатной температуры и фильтруют через целит. Полученный раствор промывают насыщенным тиосульфатом натрия, сушат над MgSO4, фильтруют и концентрируют. Сырой остаток очищают колоночной хроматографией на силикагеле, элюируя смесью гексаны/EtOAc, что дает трет-бутил-((2S)-1-((1,1,1-трифтор-3-йодпропан-2-ил)амино)пропан-2-ил)карбамат в виде бесцветного масла. НРМС m/z (M+H)+ 397,1 найдено, 397,2 требуется.
(2S)-N1-(1,1,1-трифтор-3-иодпропан-2-ил)пропан-1,2-диамин-2,2,2-трифторацетат (4-19)
К перемешиваемому раствору трет-бутил-((2S)-1-((1,1,1-трифтор-3-йодпропан-2-ил)амино)пропан-2-ил)карбамата (1,6 г, 4,04 ммоль) и DCM (8,08 мл) добавляют TFA (6,22 мл, 81 ммоль). Перемешивают в течение 1 часа при температуре окружающей среды, и затем раствор концентрируют. Остаток азеотропно перегоняют с толуолом (3×10 мл), получая (2S)-N1-(1,1,1-трифтор-3-йодпропан-2-ил)пропан-1,2-диамин-2,2,2-трифторацетат в виде желтого масла, которое используют без дополнительной очистки. НРМС m/z (M+H)+ 297,1 найдено, 297,0 требуется.
4-(4-Фторфенил)-7-(((2S)-2-метил-5-(трифторметил)пиперазин-1-ил)метил)хинолин-2-карбонитрил (4-21)
(2S)-N1-(1,1,1-трифтор-3-йодпропан-2-ил)пропан-1,2-диамин-2,2,2-трифторацетат (1,66 г, 4,05 ммоль) и ацетонитрил (20,24 мл) объединяют и затем добавляют карбонат калия (1,678 г, 12,14 ммоль). Смесь перемешивают в течение 4 часов при температуре окружающей среды и затем фильтруют через слой целита и концентрируют до 1/3 исходного объема.
К раствору (2S)-2-метил-5-(трифторметил)пиперазина (4-20) добавляют DMA (1,76 мл), DIEA (0,614 мл, 3,52 ммоль), с последующим добавлением 7-(бромметил)-4-(4-фторфенил)хинолин-2-карбонитрила (300 мг, 0,879 ммоль). Реакционную смесь нагревают до 50°C в течение 4 часов. Реакционную смесь разбавляют EtOAc и затем промывают H2O, насыщенным раствором соли, сушат (MgSO4) и концентрируют. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью гексаны/EtOAc, что дает 4-(4-фторфенил)-7-(((2S)-2-метил-5-(трифторметил)пиперазин-1-ил)метил)хинолин-2-карбонитрил в виде бесцветного твердого вещества. НРМС m/z (M+H)+ 429,2 найдено, 429,4 требуется.
4-(4-Фторфенил)-7-(((2S)-2-метил-5(R или S)-трифторметил)пиперазин-1-ил)метил)хинолин-2-карбоксамид (4-22)
4-(4-Фторфенил)-7-(((2S)-2-метил-5-(трифторметил)пиперазин-1-ил)метил)хинолин-2-карбонитрил (275 мг, 0,642 ммоль) растворяют в концентрированной HCl (2636 мкл, 32,1 ммоль) и затем перемешивают при температуре окружающей среды в течение 4 часов. Желтый раствор медленно вливают в водный карбонат калия (12,8 мл, 5М, 64 ммоль) при 0°C. Полученную смесь экстрагируют хлороформом. Органическую часть сушат над MgSO4 и концентрируют. Остаток очищают на Chiralpak AD для препаративной ВЭЖХ, 5 см×500 см, 50 мл/мин, элюируя смесью 20% IPA/гексаны + 0,1% EtDNH, получают изомеры A и В 4-(4-фторфенил)-7-(((2S)-2-метил-5(R или S)-(трифторметил)пиперазин-1-ил)метил)хинолин-2-карбоксамида в виде бесцветных пенистых веществ. Изомер A, НРМС m/z (M+H)+ 447,3 найдено, 447,4 требуется. 1H ЯМР (500 МГц, CDCl3): 8,22 (1Н, с), 8,10 (2Н, д, J=12,11 Гц), 7,91 (1Н, д, J=8,69 Гц), 7,65 (1Н, дд, J=8,72, 1,66 Гц), 7,52 (2Н, дд, J=8,44, 5,36 Гц), 5,64 (1Н, с), 3,89 (1Н, д, J=13,93 Гц), 3,77 (1Н, д, J=13,94 Гц), 3,39-3,34 (1Н, м), 3,08-3,04 (1Н, м), 2,94-2,87 (2Н, м), 2,73 (1Н, дд, J=11,54, 8,93 Гц), 2,60 (1Н, дд, J=11,55, 3,62 Гц), 1,17 (3Н, д, J=6,41 Гц). Изомер B, НРМС m/z (M+H)+ 447,3 найдено, 447,4 требуется
1H ЯМР (500 МГц, CDCl3): 8,21 (1Н, с), 8,10 (2Н, д, J=14,50 Гц), 7,91 (1Н, д, J=8,70 Гц), 7,65 (1Н, д, J=8,75 Гц), 7,52 (2Н, дд, J=8,22, 5,34 Гц), 5,74 (1Н, с), 3,89 (1Н, д, J=13,95 Гц), 3,77 (1Н, д, J=13,95 Гц), 3,37 (1Н, т, J=7,88 Гц), 3,09-2,98 (2Н, м), 2,91 (2Н, д, J=11,86 Гц), 2,73 (1Н, т, J=10,19 Гц), 2,60 (1Н, дд, J=11,55, 3,52 Гц), 1,17 (3Н, д, J=6,36 Гц).
Аналитические данные хиральной ВЭЖХ: 1 мл/мин 20% IPa/гексаны, колонка AD 4,6×250 мм
Изомер A: 7,63 минуты
Изомер B: 8,63 минуты
Следующие соединения получены по методикам, подобным приведенным в схемах 4.1, 4.2, 4.3 и 4.4, подбором соответствующего хинолинового производного, нуклеофила и производного бороновой кислоты и представляют собой примеры соединений по изобретению.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
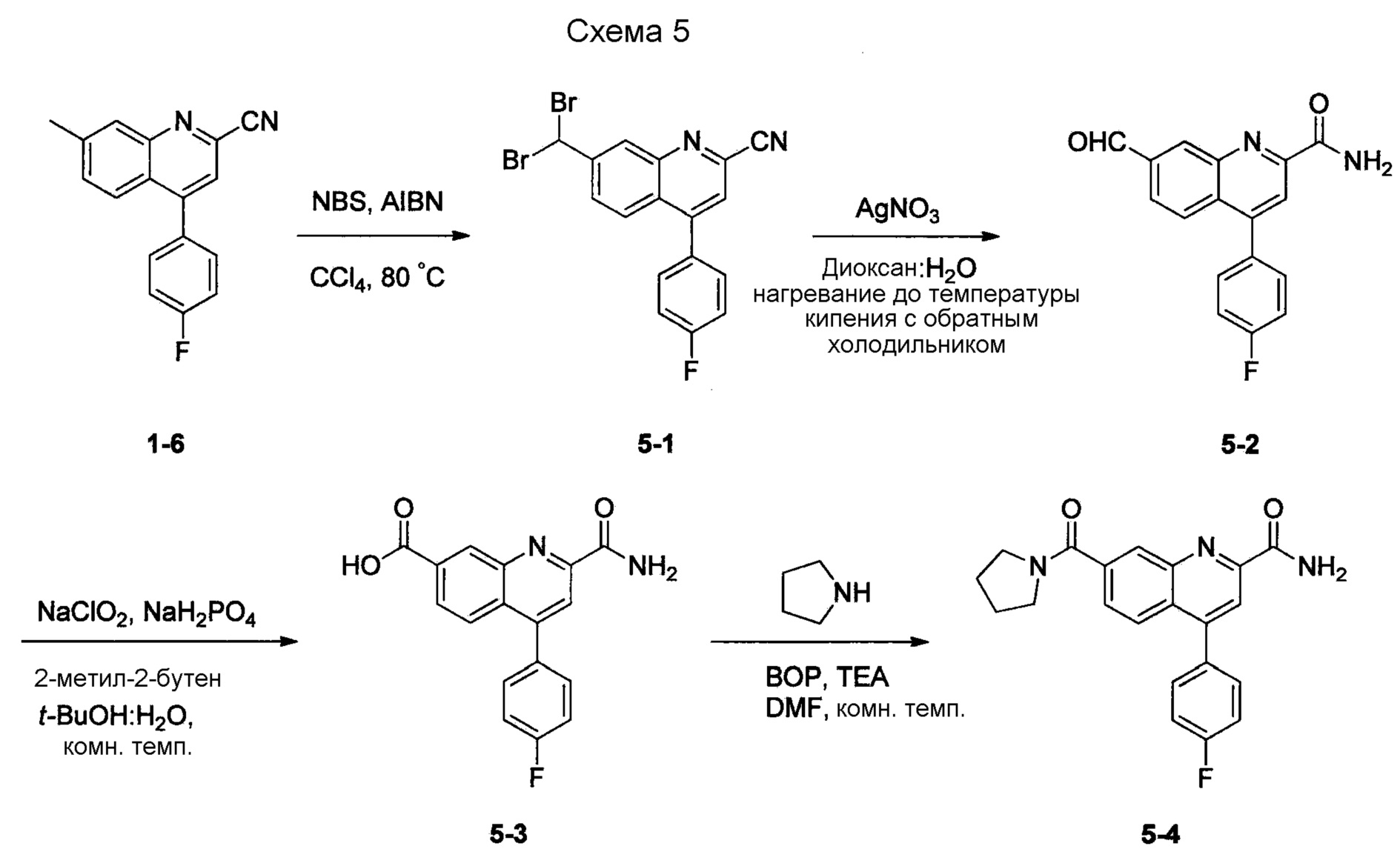
Пример 5: Синтез 4-(4-фторфенил)-7-(пирролидин-1-илкарбонил)хинолин-2-карбоксамида (5-4)
7-(Дибромметил)-4-(4-фторфенил)хинолин-2-карбонитрил (5-1)
4-(4-Фторфенил)-7-метилхинолин-2-карбонитрил (1-6, 7,86 г, 30,0 ммоль, 1,0 эквив.) растворяют в четыреххлористом углероде (150,0 мл, 0,2 М). Добавляют NBS (5,44 г, 30,6 ммоль, 1,02 эквив.) и AIBN (148,0 мг, 0,899 ммоль, 0,03 эквив.) и смесь нагревают до температуры кипения с обратным холодильником в течение 5 часов. Смесь охлаждают до комнатной температуры. и белый осадок отделяют фильтрованием. Фильтрат концентрируют, и остаток очищают колоночной хроматографией на колонке с силикагелем, элюируя смесью EtOAc/изогексан (0-50%), что дает 7-(дибромметил)-4-(4-фторфенил)хинолин-2-карбонитрил (5-1, 1,27 г, 10,1%). НРМС m/z (M+H)+ 421,1 найдено, 421,1 требуется.
4-(4-Фторфенил)-7-формилхинолин-2-карбоксамид (5-2)
К раствору 7-(дибромметил)-4-(4-фторфенил)хинолин-2-карбонитрила (5-1, 1,27 г, 3,02 ммоль, 1,0 эквив.) в 1,4-диоксане (40,0 мл, 0,075 М) добавляют суспензию нитрата серебра (2,05 г, 12,1 ммоль, 4,0 эквив.) в воде (20,0 мл). Полученную смесь нагревают до температуры кипения с обратным холодильником в течение 24 часов, затем охлаждают и фильтруют через слой целита. Фильтрат промывают этилацетатом, слои разделяют, и органический слой промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют, получая 4-(4-фторфенил)-7-формилхинолин-2-карбоксамид (5-2, 850,0 мг, 96,0%) в виде белого твердого вещества.
НРМС m/z (M+H)+ 295,1 найдено, 295,1 требуется.
2-(Аминокарбонил)-4-(4-фторфенил)хинолин-7-карбоновая кислота (5-3)
К раствору 4-(4-фторфенил)-7-формилилхинолин-2-карбоксамида (5-2, 200,0 мг, 0,680 ммоль, 1,0 эквив.) и 2-метил-2-бутена (3,96 мл, 37,4 ммоль, 55 эквив.) в t-BuOH (14,0 мл, 0,05 М) добавляют раствор хлорита натрия (553,0 мг, 6,12 ммоль, 9 эквив.) и моногидрата дигидрофосфата натрия (559,0 мг, 4,08 ммоль, 6 эквив.) в воде (6,5 мл). Полученную смесь перемешивают при комнатной температуре в течение 1 часа. Осаждается белое твердое вещество. Добавляют воду (100,0 мл) и смесь перемешивают в течение 30 минут. Твердое вещество собирают фильтрованием с отсасыванием, промывают водой, сушат в вакууме, получая 2-(аминокарбонил)-4-(4-фторфенил)хинолин-7-карбоновую кислоту (5-3, 150,0 мг, 71,1%) в виде белого твердого вещества. НРМС m/z (M+H)+ 311,1 найдено, 311,1 требуется.
4-(4-Фторфенил)-7-(пирролидин-1-илкарбонил)хинолин-2-карбоксамид (5-4)
2-(Аминокарбонил)-4-(4-фторфенил)хинолин-7-карбоновую кислоту (5-3, 50,0 мг, 0,161 ммоль, 1,0 эквив.), пирролидин (11,5 мг, 0,161 ммоль, 1,0 эквив.), BOP (93,0 мг, 0,209 ммоль, 1,3 эквив.) и TEA (0,670 мл, 0,483 ммоль, 3 эквив.) растворяют в DMF (ДМФА) (1,0 мл) и перемешивают при комнатной температуре в течение 1 часа. Смесь разбавляют метиленхлоридом, промывают водой, насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Сырой остаток очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 4-(4-фторфенил)-7-(пирролидин-1-илкарбонил)хинолин-2-карбоксамид (5-4, 50,0 мг, 85,0%) в виде бесцветного твердого вещества. ¹H ЯМР (500 МГц, CDCl₃): δ 8,324 (д, J=1,47 Гц, 1Н); 8,273 (с, 1Н); 8,251 (уш.с, 1Н); 8,026 (д, J=8,78 Гц, 1Н); 7,762 (дд, J1=8,54 Гц, J2=1,71 Гц, 1Н); 7,501-7,529 (м, 2Н); 7,246-7,286 (м, 2Н); 6,750 (уш.с, 1Н); 3,765 (тр, J=6,95 Гц, 2Н); 3,567 (тр, J=6,68 Гц, 2Н); 2,055 (квинт, J=6,78 Гц, 2Н); 1,962 (квинт, J=6,65 Гц, 2Н).
НРМС m/z (M+H)+ 364,1 найдено, 364,1 требуется.
Следующие соединения получены по методикам, подобным приведенным в схеме 5, подбором соответствующего хинолинового производного и производных бороновой кислоты и представляют собой примеры соединений по изобретению.
|
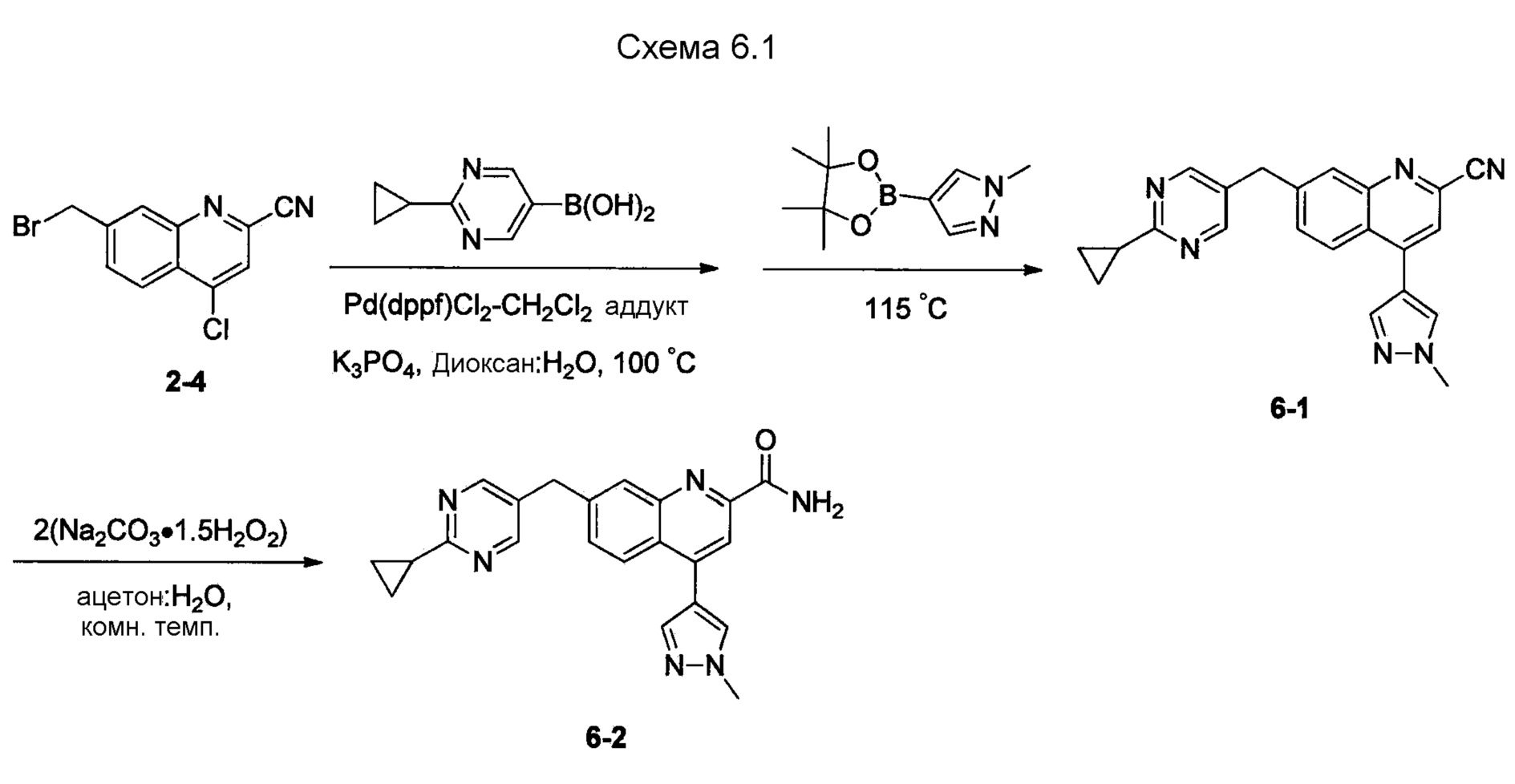
Пример 6.1: синтез 7-((2-циклопропилпиримидин-5-ил)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксамид (6-2)
7-((2-Циклопропилпиримидин-5-ил)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбонитрил (6-1)
После дегазации с помощью N2 смесь 7-(бромметил)-4-хлорхинолин-2-карбонитрила (2-4, 650 мг, 2,31 ммоль), 2-циклопропил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидина (580 мг, 2,36 ммоль), аддукта Pd(dppf)Cl2-CH2Cl2 (94 мг, 0,11 ммоль) и K3PO4 (1960 мг, 9,24 ммоль) в 1,4-диоксане (13,7 мл) и H2O (1,7 мл) нагревают при 100°C в течение 30 мин в условиях микроволнового облучения. Смесь охлаждают до комнатной температуры и добавляют 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (528 мг, 2,54 ммоль). Затем после дегазации с помощью N2 смесь нагревают при 115°C в течение 30 мин в условиях микроволнового облучения. Реакционную смесь охлаждают, разбавляют H2O (10 мл) и смесь экстрагируют этилацетатом (2×50 мл). Объединенные органические фракции промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют и растворитель выпаривают при пониженном давлении. Сырой продукт очищают колоночной хроматографией на силикагеле, элюируя смесью EtOAc/гексан (0-100%), что дает 7-((2-циклопропилпиримидин-5-ил)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбонитрил (6-1, 649 мг, 77%). НРМС m/z (M+H)+ 367,3 найдено, 367,2 требуется.
7-((2-Циклопропилпиримидин-5-ил)метил-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксамид (6-2)
7-((2-Циклопропилпиримидин-5-ил)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбонитрил (5-1, 71,3 мг, 0,19 ммоль) растворяют в ацетоне (6,5 мл) и медленно добавляют перкарбонат натрия (85 мг, 0,58 ммоль) в H2O (3,24 мл). Полученную смесь перемешивают при комнатной температуре в течение одного часа. Добавляют насыщенный NH4C1 (1,5 мл), с последующим добавлением H2O (30 мл), получая белый осадок. Твердое вещество собирают фильтрованием, промывают H2O и затем гексаном и сушат в вакууме, получая 7-((2-циклопропилпиримидин-5-ил)метил)-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксамид (6-2, 72,1 мг, 96,0%) в виде белого твердого вещества. НРМС m/z (M+H)+ 385,3 найдено, 385,2 требуется.
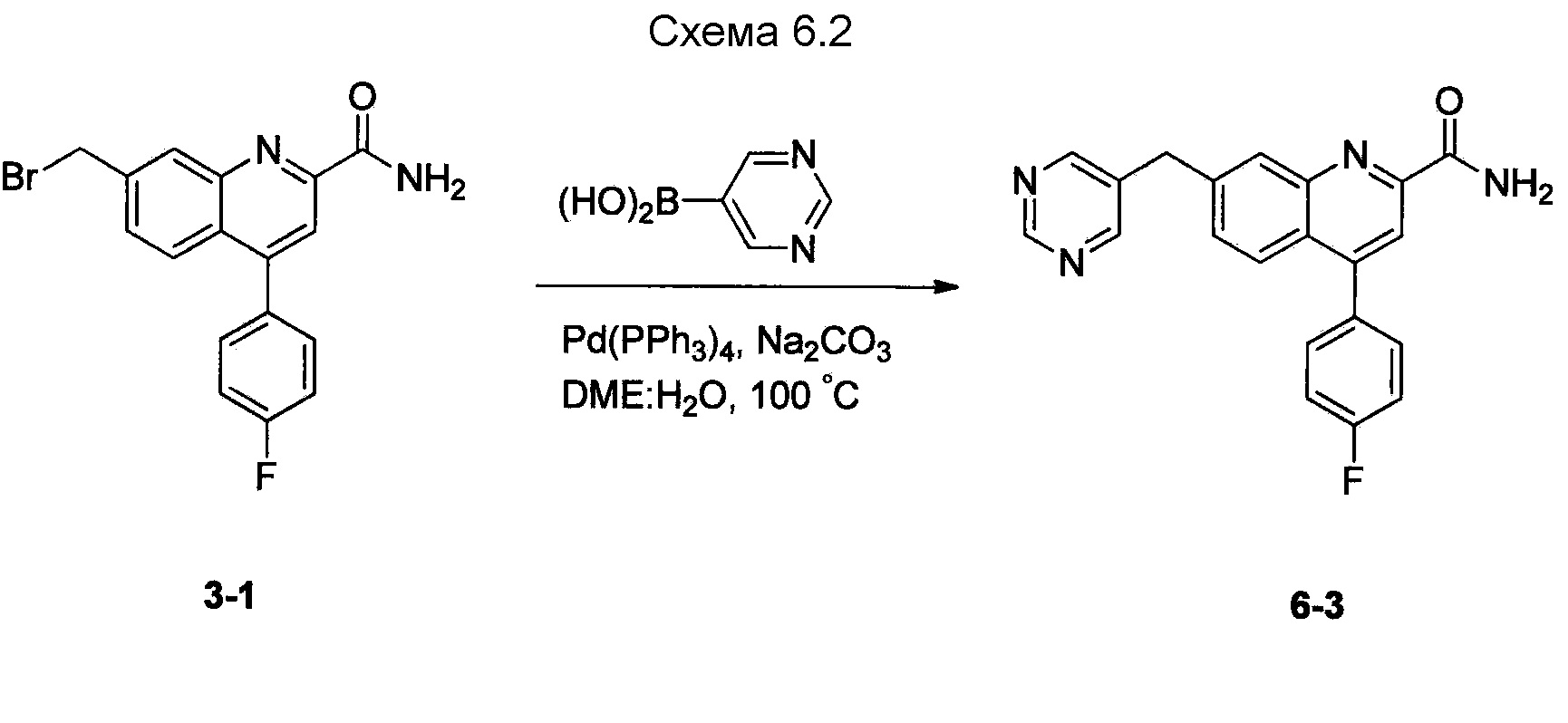
Пример 6.2: синтез 4-(4-фторфенил)-7-(пиримидин-5-илметил)хинолин-2-карбоксамида (6-3)
4-(4-Фторфенил)-7-(пиримидин-5-илметил)хинолин-2-карбоксамид (6-3)
Дегазированную смесь DME (1237 мкл)/вода (619 мкл) добавляют к 7-(бромметил)-4-(4-фторфенил)хинолин-2-карбоксамиду (3-1, 100 мг, 0,278 ммоль), пиримидин-5-илбороновой кислоте (41,4 мг, 0,334 ммоль), Pd(PPh3)4 (16,09 мг, 0,014 ммоль) и Na2CO3 (62,0 мг, 0,585 ммоль). Реакционную смесь нагревают при 100°C в микроволновой печи в течение 10 минут. Реакционную смесь гасят водой, и смесь экстрагируют этилацетатом (×3). Объединенные органические фракции сушат (MgSO4), фильтруют, и растворитель выпаривают при пониженном давлении. Сырое вещество очищают колоночной флэш-хроматографией (12 г SiO2, 0-100% EtOAc/гексаны), получая неочищенный продукт. Вещество очищают дополнительно обращенно-фазовой ВЭЖХ (20×150 мм, Waters Sunfire, растворитель A = смесь 0,1% TFA/H2O, растворитель В = смесь 0,1% TFA/MeCN, 20 мл/мин) получая, после стандартной обработки, 4-(4-фторфенил)-7-(пиримидин-5-илметил)хинолин-2-карбоксамид (6-3, 8,16 мг, выход 8,18%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 9,14 (с, 1Н); 8,68 (с, 2Н); 8,23 (с, 1Н); 8,05 (с, 1Н); 7,97 (с, 1Н); 7,93 (д, J=8,7 Гц, 1Н); 7,50 (дд, J=8,5, 5,4 Гц, 2Н); 7,42 (дд, J=8,7, 1,8 Гц, 1Н); 7,24 (т, J=8,5 Гц, 2Н); 5,64 (с, 1Н); 4,22 (с, 2Н). НРМС m/z (M+H)+ 359,2 найдено, 359,4 требуется.
Следующие соединения получены по методикам, подобным приведенным в схемах 6.1 и 6.2, подбором соответствующего хинолинового производного и производных бороновой кислоты и представляют собой примеры соединений по изобретению.
|
|
|
|
|
|
|
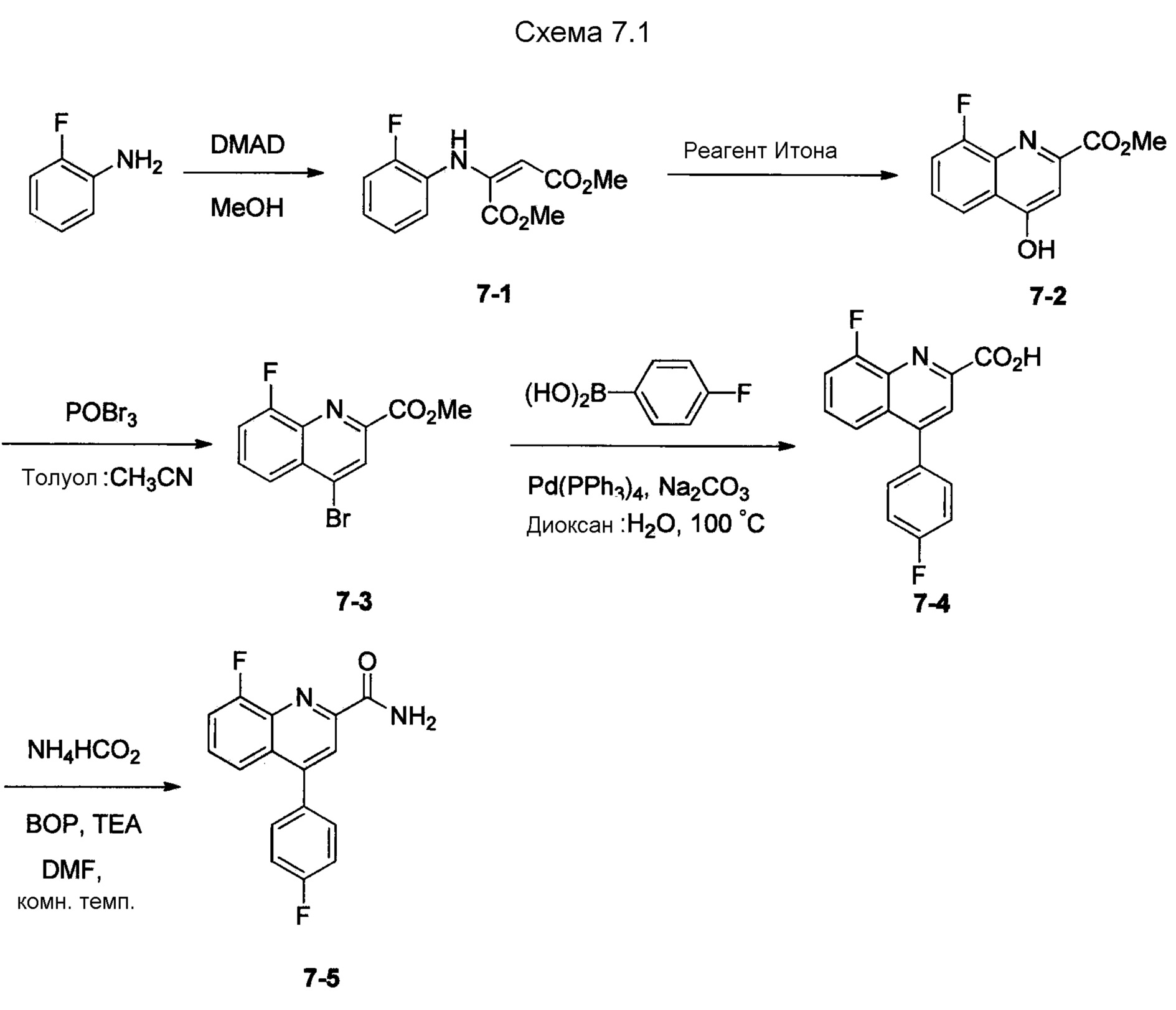
Пример 7.1: синтез 8-фтор-4-(4-фторфенил)хинолин-2-карбоксамида (7-5)
Диметил-(2E)-2-[(2-фторфенил)амино]бут-2-ендиоат (7-1)
К раствору 2-фторанилина (1,00 г, 9,00 ммоль) в MeOH (11,1 мл) при 0°C добавляют диметилацетилендикарбоксилат (DMAD, 1,34 мл, 10,8 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Смесь концентрируют, и остаток очищают на силикагеле флэш-хроматографией (градиент 0-25% EtOAc в гексанах) с получением диметил-(2E)-2-[(2-фторфенил)амино]бут-2-ендиоата (7-1, 1,9 г, 83%). НРМС m/z (M+H)+ 254,4 найдено, 254,4 требуется.
8-Фтор-4-гидроксихинолин-2-карбоксилат (7-2)
Диметил-(2E)-2-[(2-фторфенил)амино]бут-2-ендиоат (7-1, 1,90 г, 7,50 ммоль) растворяют в реагенте Итона (8,00 мл, 50,4 ммоль) и нагревают при 55°C в течение 1 ч. ЖХ-МС показывает полную конверсию. Реакционную смесь охлаждают до комнатной температуры и медленно вливают в охлажденный насыщенный раствор NaHCO3. Образовавшийся светло-желтый осадок собирают фильтрованием, промывают H2O и сушат в вакууме, получая метил-8-фтор-4-гидроксихинолин-2-карбоксилат (7-2). НРМС m/z (M+H)+ 222,4 найдено, 222,4 требуется.
Метил-4-бром-8-фторхинолин-2-карбоксилат (7-3)
К раствору 8-фтор-4-гидроксихинолин-2-карбоксилата (7-2, 0,860 г, 3,89 ммоль) в смеси ацетонитрила (0,884 мл) и толуола (8,84 мл) добавляют оксибромид фосфора (1,23 г, 4,28 ммоль). Реакционную смесь нагревают при 75°C в течение 0,5 ч. Добавляют вторую порцию оксибромида фосфора (0,50 г) и нагревают при 75°C еще 30 мин. ЖХ-МС показывает завершение реакции. Реакционную смесь охлаждают и осторожно гасят смесью лед-вода. Смесь последовательно экстрагируют CH2Cl2 и EtOAc. Объединенные органические слои сушат и концентрируют. Остаток очищают флэш-хроматографией на силикагеле (градиент 0-25% EtOAc в гексанах) с получением метил-4-бром-8-фторхинолин-2-карбоксилата (7-3). НРМС m/z (M+H)+ 284,3 найдено, 284,3 требуется.
8-Фтор-4-(4-фторфенил)хинолин-2-карбоновая кислота (7-4)
Метил-4-бром-8-фторхинолин-2-карбоксилат (7-3, 100,0 мг, 0,352 ммоль), 4-фторфенилбороновую кислоту (59,1 г, 0,422 ммоль), тетракис (20,3 мг, 0,0180 ммоль) и Na2CO3 (0,704 мл, 0,704 ммоль) добавляют в 1,4-диоксан (1,0 мл) в реакционный сосуд для микроволнового облучения. Смесь облучают в микроволновой печи при 100°C в течение 30 мин. Охлаждают до комнатной температуры, добавляют водный гидрокарбонат натрия (насыщенный, 2,0 мл) и экстрагируют этилацетатом (2×10,0 мл). Объединенные органические фракции промывают насыщенным раствором соли, сушат над MgSO4, фильтруют, и растворитель выпаривают при пониженном давлении, получая 8-фтор-4-(4-фторфенил)хинолин-2-карбоновую кислоту (7-4, 100,0 мг, 100,0%, сырая). НРМС m/z (M+H)+ 286,2 найдено, 286,2 требуется.
8-Фтор-4-(4-фторфенил)хинолин-2-карбоксамид (7-5)
Фтор-4-(4-фторфенил)хинолин-2-карбоновую кислоту (7-4, 100,0 мг, 0,351 ммоль), формиат аммония (88,0 мг, 1,40 ммоль), BOP (202,0 мг, 0,456 ммоль) и триэтиламин (0,147 мл, 1,052 ммоль) растворяют в DMF (ДМФА) (1,0 мл) и полученную смесь перемешивают при 60°C в течение 5 часов. Смесь охлаждают и разбавляют метиленхлоридом, промывают водой, насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Сырой остаток очищают обращенно-фазовой ВЭЖХ (смесь H2O/CH3CN, градиент масс./модификатор 0,1% TFA), получая 8-фтор-4-(4-фторфенил)хинолин-2-карбоксамид (7-5, 9,0 мг, 9,0%) в виде бесцветного твердого вещества. ¹H ЯМР (400 МГц, CDCl3): δ 8,209 (с, 1Н); 8,138 (уш. с, 1Н); 8,658 (д, J=8,62 Гц, 1Н); 7,379-7,493 (м, 4Н); 7,145-7,214 (м, 2Н); 6,004 (уш. с, 1Н). НРМС m/z (M+H) 285,1 найдено, 285,1 требуется.
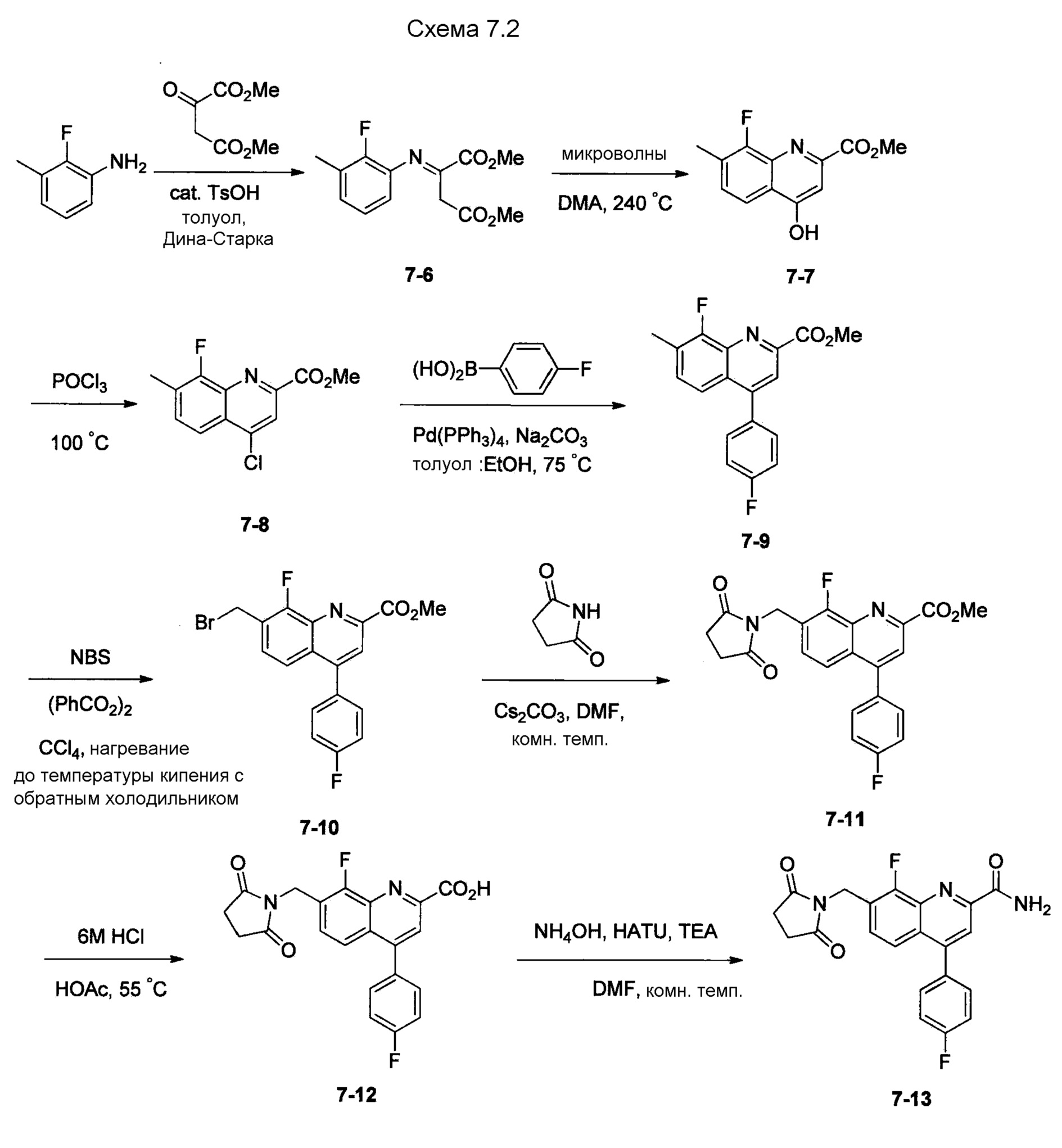
Пример 7.2: синтез 7-[(2,5-диоксопирролидин-1-ил)метил]-8-фтор-4-(4-фторфенил)хинолин-2-карбоксамида (7-13)
Диметил (2E)-2-[(2-фтор-3-метилфенил)имино]бутандиоат (7-6)
3-Амино-2-фтортолуол (4,89 г, 39,1 ммоль), диметил-2-оксобутандиоат (6,26 г, 39,1 ммоль) и тозиловую кислоту (0,223 г, 1,172 ммоль) нагревают до температуры кипения с обратным холодильником в условиях Дина-Старка в течение 1 часа. Растворитель удаляют в вакууме, и остаток очищают колоночной хроматографией на колонке с силикагелем, элюируя смесью EtOAc/гексан (0-15%), что дает диметил-(2E)-2-[(2-фтор-3-метилфенил)имино]бутандиоат (7-6, 5,48 г, 53% выход) в виде прозрачного масла, ЖХМС показывает 100% чистоту соединения, НРМС m/z (M+H)+ 268,2 найдено, 268,1 требуется.
Метил-8-фтор-7-метил-4-оксо-1,4-дигидрохинолин-2-карбоксилат (7-7)
Диметил-(2E)-2-[(2-фтор-3-метилфенил)имино]бутандиоат (7-6, 3,27 г, 12,24 ммоль) в DMA (24,47 мл) нагревают при 240°C в микроволновой печи в течение 5 мин. Растворитель выпаривают при пониженном давлении и остаток растирают с простым эфиром, получая коричневое твердое вещество. Требуемый продукт фильтруют и промывают простым эфиром до обесцвечивания вытекающего эфира, получая метил-8-фтор-7-метил-4-оксо-1,4-дигидрохинолин-2-карбоксилат (7-7, 1,23 г, 43% выход) в виде коричневого твердого вещества, ЖХМС показывает 93% чистоту, НРМС m/z (M+H)+ 236,1 найдено, 236,1 требуется.
Метил-4-хлор-8-фтор-7-метилхинолин-2-карбоксилат (7-8)
Метил-8-фтор-7-метил-4-оксо-1,4-дигидрохинолин-2-карбоксилат (7-7, 1,23 г, 5,23 ммоль) в POCl3 (11 мл) нагревают при 100°C в течение 1 часа. Избыток POCl3 удаляют в вакууме. Полученный остаток растирают с простым эфиром, затем фильтруют и промывают простым эфиром до исчезновения коричневой окраски эфира. Оставшееся твердое вещество представляет собой метил-4-хлор-8-фтор-7-метилхинолин-2-карбоксилат (7-8, 993 мг, 75% выход) со 100% чистотой по ЖХМС, НРМС m/z (M+H)+ 254,0 найдено, 254,1 требуется.
Метил-8-фтор-4-(4-фторфенил)-7-метилхинолин-2-карбоксилат (7-9)
Метил-4-хлор-8-фтор-7-метилхинолин-2-карбоксилат (7-8, 993 мг, 3,91 ммоль), (4-фторфенил)бороновую кислоту (575 мг, 4,11 ммоль) и Pd(Ph3P)4 (226 мг, 0,196 ммоль) растворяют в дегазированном толуоле (25 мл). Добавляют дегазированный EtOH (2,7 мл), с последующим добавлением дегазированного 2М водн. карбоната натрия (4,31 мл, 8,61 ммоль). Реакционную смесь нагревают при 75°C в течение ночи, затем гасят водой, и смесь экстрагируют этилацетатом (×3). Объединенные органические фракции сушат (MgSO4), фильтруют и растворитель выпаривают при пониженном давлении. Остаток растирают с простым эфиром, получая метил-8-фтор-4-(4-фторфенил)-7-метилхинолин-2-карбоксилат (7-9, 991 мг, 81% выход) в виде коричневого твердого вещества, ЖХМС показывает 89% чистоту соединения, НРМС m/z (M+H)+ 314,1 найдено, 314,0 требуется.
Метил-7-(бромметил)-8-фтор-4-(4-фторфенил)хинолин-2-карбоксилат (7-10)
Метил-8-фтор-4-(4-фторфенил)-7-метилхинолин-2-карбоксилат 7-9 (991 мг, 3,16 ммоль), перекись бензоила (102 мг, 0,316 ммоль) и NBS (591 мг, 3,32 ммоль) нагревают до температуры кипения с обратным холодильником в CCl4 в течение 5 часов. Растворитель удаляют в вакууме, и остаток очищают колоночной хроматографией на колонке с силикагелем, элюируя смесью EtOAc/гексан (0-50%), что дает метил-7-(бромметил)-8-фтор-4-(4-фторфенил)хинолин-2-карбоксилат 7-10 (1,05 г, 85% выход) в виде белого твердого вещества, ЖХМС показывает 67% чистоту соединения, НРМС m/z (M+H)+ 392,0 найдено, 392,1 требуется.
Метил-7-[(2,5-диоксопирролидин-1-ил)метил)-8-фтор-4-(4-фторфенил)хинолин-2-карбоксилат (7-11)
Cs2CO3 (1,745 г, 5,35 ммоль) добавляют к раствору сукцинимида (0,292 г, 2,94 ммоль) и метил-7-(бромметил)-8-фтор-4-(4-фторфенил)хинолин-2-карбоксилата 7-10 (1,05 г, 2,68 ммоль) в DMF (ДМФА) (13,39 мл), и реагенты перемешивают при к.т. в течение 30 мин. Реакционную смесь гасят KH2PO4 (насыщенным), и смесь экстрагируют этилацетатом (×3). Объединенные органические фракции сушат (MgSO4), фильтруют, и растворитель выпаривают при пониженном давлении. Растворитель удаляют в вакууме, и остаток очищают колоночной хроматографией на колонке с силикагелем, элюируя смесью EtOAc/гексан (0-100%), что дает метил-7-[(2,5-диоксопирролидин-1-ил)метил]-8-фтор-4-(4-фторфенил)хинолин-2-карбоксилат 7-11 в виде белого твердого вещества, ЖХМС показывает 90% чистоту соединения, НРМС m/z (M+H)+ 411,2 найдено, 411,1 требуется.
7-[(2,5-Диоксопирролидин-1-ил)метил]-8-фтор-4-(4-фторфенил)хинолин-2-карбоновая кислота (7-12)
6M HCl (2964 мкл) добавляют к раствору метил-7-[(2,5-диоксопирролидин-1-ил)метил]-8-фтор-4-(4-фторфенил)хинолин-2-карбоксилата 7-11 (629 мг, 1,482 ммоль) в уксусной кислоте (2964 мкл) и реакционную смесь нагревают при 120°C в течение 10 мин в микроволновой печи. Реакционную смесь гасят KH2PO4 (насыщенным), и смесь экстрагируют этилацетатом (×3). Объединенные органические фракции сушат (MgSO4), фильтруют, и растворитель выпаривают при пониженном давлении, получая 7-[(2,5-диоксопирролидин-1-ил)метил]-8-фтор-4-(4-фторфенил)хинолин-2-карбоновую кислоту 7-12 (499 мг, 85% выход) в виде белого твердого вещества, 100% чистоты по ЖХМС, НРМС m/z (M+H)+ 397,2 найдено, 397,1 требуется.
7-[(2,5-Диоксопирролидин-1-ил)метил]-8-фтор-4-(4-фторфенил)хинолин-2-карбоксамид (7-13)
TEA (105 мкл, 0,757 ммоль) добавляют к раствору 7-[(2,5-диоксопирролидин-1-ил)метил]-8-фтор-4-(4-фторфенил)хинолин-2-карбоновой кислоты 7-12 (100 мг, 0,252 ммоль) и HATU (96 мг, 0,252 ммоль) в ДМФА (1262 мкл). Добавляют гидроксид аммония (50,5 мкл, 0,757 ммоль) и реакционную смесь перемешивают в течение 15 мин при к.т. Реакционную смесь гасят водным гидрокарбонатом натрия (насыщенным), и смесь экстрагируют этилацетатом (x3). Объединенные органические фракции сушат (MgSO4), фильтруют и растворитель выпаривают при пониженном давлении. Остаток очищают колоночной хроматографией на колонке с силикагелем, элюируя смесью EtOAc/гексан (0-100%), что дает 7-[(2,5-диоксопирролидин-1-ил)метил]-8-фтор-4-(4-фторфенил)хинолин-2-карбоксамид 7-13 (63 мг, 63% выход) в виде белого твердого вещества, ЖХМС показывает 100% чистоту соединения. 1H ЯМР (500 МГц, CDCl3): δ 8,28 (1Н, с), 8,14 (1Н, с), 7,68 (1Н, д, J=8,85 Гц), 7,54 (1Н, дд, J=8,86, 6,65 Гц), 7,50-7,46 (2Н, м), 7,25-7,20 (2Н, м), 5,69 (1Н, с), 4,99 (2Н, с), 2,78 (4Н, с). НРМС m/z (M+H)+ 396,2 найдено, 396,1 требуется.
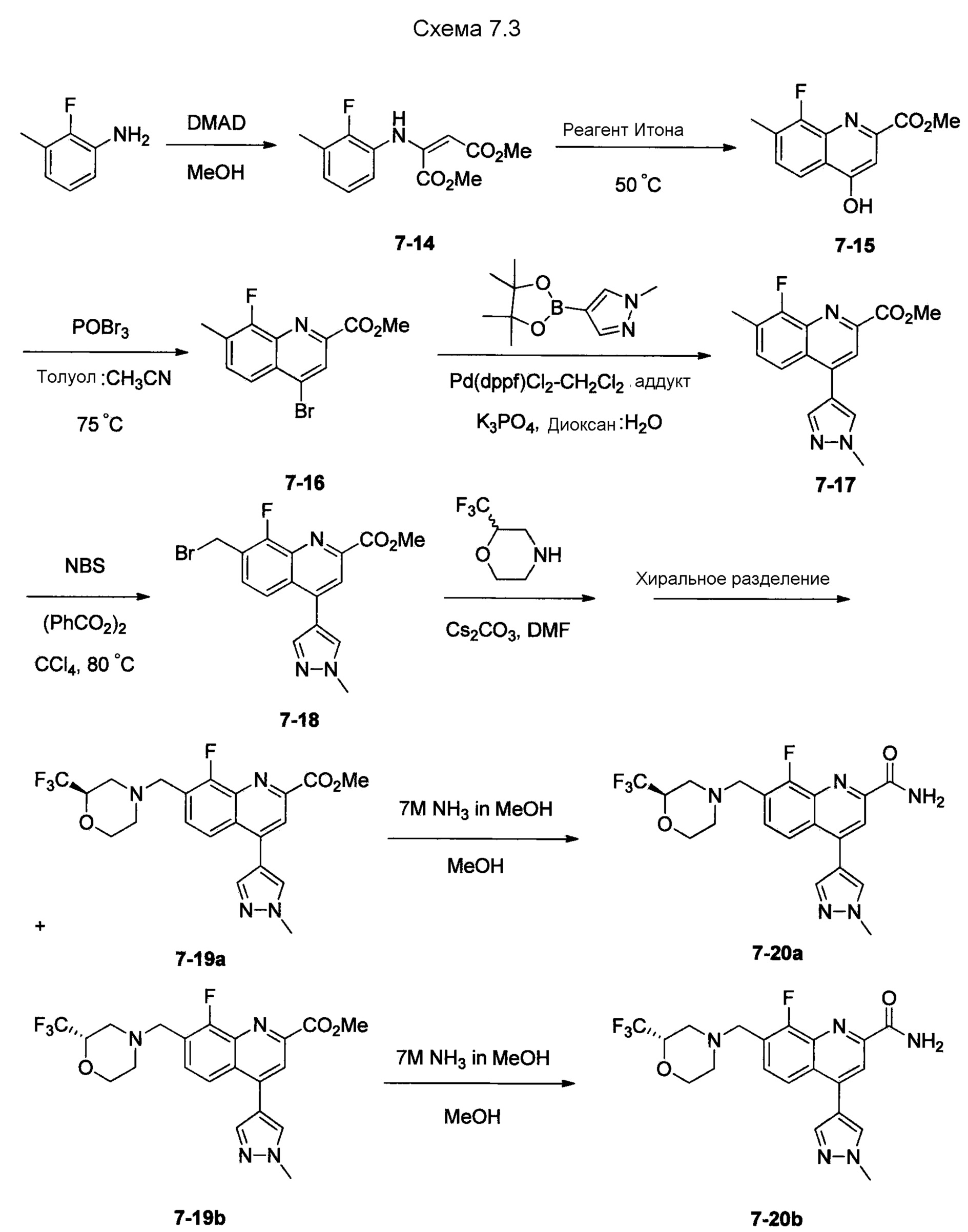
Пример 7.3: Синтез (R)- и (S)-8-фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)метил)хинолин-2-карбоксамида (7-20a и 7-20b)
(E)-Диметил-2-(2-фтор-3-метилфенилимино)сукцинат (7-14)
При 0°C диметилацетилендикарбоксилат (8,70 мл, 70,4 ммоль) добавляют по каплям к раствору 2-фтор-3-метиланилина (7,34 г, 58,7 ммоль) в MeOH (58,7 мл). После перемешивания при комнатной температуре в течение ночи реакционную смесь концентрируют досуха. Остаток очищают флэш-хроматографией на силикагеле (градиент 0-60% EtOAc/гексаны), получая (E)-диметил-2-(2-фтор-3-метилфенилимино)сукцинат (7-14, 14,59 г, 93%). НРМС m/z (M+H)+ 268,3 найдено, 268,1 требуется.
Метил-8-фтор-4-гидрокси-7-метилхинолин-2-карбоксилат (7-15)
Смесь (E)-диметил-2-(2-фтор-3-метилфенилимино)сукцината (7-14, 14,59 г, 54,6 ммоль) и реагента Итона (52,0 мл, 328 ммоль) нагревают при 50°C в течение 1 ч. После охлаждения до комнатной температуры смесь медленно добавляют к охлажденному насыщенному раствору NaHCO3 (выделяется газ!), с последующей экстракцией EtOAc (дважды). Объединенные органические фракции промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют, и растворитель выпаривают при пониженном давлении, получая метил-8-фтор-4-гидрокси-7-метилхинолин-2-карбоксилат (7-15, 11,9 г). НРМС m/z (M+H)+ 236,2 найдено, 236,1 требуется.
Метил-4-бром-8-фтор-7-метилхинолин-2-карбоксилат (7-16)
Смесь (метил-8-фтор-4-гидрокси-7-метилхинолин-2-карбоксилата (7-15, 842,1 мг, 3,58 ммоль) и POBr3 (1129 мг, 3,94 ммоль) в толуоле (8,14 мл) и CH3CN (0,81 мл) нагревают при 75°C в течение 1 ч. После охлаждения до комнатной температуры смесь вливают в смесь лед-H2O с последующей экстракцией CH2C12 (дважды). Объединенные органические фракции сушат (Na2SO4), фильтруют, и растворитель выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле (градиент 0-50% EtOAc/гексаны), получая метил-4-бром-8-фтор-7-метилхинолин-2-карбоксилат (7-16, 710 мг). НРМС m/z (M+H)+ 298,1 найдено, 298,0 требуется.
Метил-8-фтор-7-метил-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксилат (7-17)
После дегазации с помощью N2 смесь метил-4-бром-8-фтор-7-метилхинолин-2-карбоксилата (7-16, 650 мг, 2,18 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (544 мг, 2,62 ммоль), аддукта Pd(dppf)Cl2-CH2Cl2 (89 мг, 0,11 ммоль) и K3PO4 (1388 мг, 6,54 ммоль) в 1,4-диоксане (12,9 мл) и H2O (1,6 мл) нагревают при 100°C в течение 20 мин в условиях микроволнового облучения. После охлаждения до комнатной температуры реакционную смесь фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью EtOAc/гексан (0-100%), что дает метил-8-фтор-7-метил-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксилат (7-17, 481 мг, 74%). НРМС m/z (M+H)+ 300,3 найдено, 300,1 требуется.
Метил-7-(бромметил)-8-фтор-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксилат (7-18)
После дегазации с помощью N2 смесь метил-8-фтор-7-метил-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксилата (7-17, 169,2 мг, 0,57 ммоль), NBS (106 мг, 0,59 ммоль) и перекиси бензоила (13,7 мг, 0,057 ммоль) в CCl4 (2,8 мл) перемешивают при 80°C. Спустя 5 часов растворитель удаляют, и остаток распределяют между EtOAC и насыщенным NaHCO3. Органический слой промывают водой, сушат над Na2SO4 и фильтруют. Концентрация дает сырой метил-7-(бромметил)-8-фтор-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксилат, который используют без дополнительной очистки (7-18). НРМС m/z (M+H)+ 378,2 найдено, 378,0 требуется.
(R)-Метил-8-фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)метил)хинолин-2-карбоксилат (7-19a) и (S)-метил-8-фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)метил)хинолин-2-карбоксилат (7-19b)
Cs2CO3 (345 мг, 1,06 ммоль) добавляют к смеси метил-7-(бромметил)-8-фтор-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксилата (7-18, 160 мг, 0,42 ммоль) и 2-(трифторметил)морфолина (79 мг, 0,51 ммоль) в ДМФА (4,2 мл). После перемешивания при комнатной температуре в течение 2 часов смесь разбавляют EtOAc, промывают H2O, затем насыщенным раствором соли. Органический слой сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью EtOAc/гексан (0-100%), что дает метил-8-фтор-7-метил-4-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксилат в виде рацемической смеси (31,4 мг, 16%). НРМС m/z (M+H)+ 453,3 найдено, 453,1 требуется. Хиральным разделением с применением СКЖ-хроматографии получают (R)-метил-8-фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)метил)-хинолин-2-карбоксилат (7-19a, 15 мг) и (S)-метил-8-фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)-метил)хинолин-2-карбоксилат (7-19b, 14,3 мг).
(R)-8-Фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)метил)хинолин-2-карбоксамид (7-20a)
Смесь (R)-8-фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)метил)хинолин-2-карбоксамида (7-19a, 15,3 мг) в 7н NH3 в MeOH (372 мкл) перемешивают при комнатной температуре в течение 2 ч. Концентрация и промывка твердого вещества гексаном дают (R)-8-фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)метил)хинолин-2-карбоксамид (7-20a, 12,8 мг) в виде белого твердого вещества. НРМС m/z (M+H)+ 438,3 найдено, 438,3 требуется.
(S)-8-Фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)метил)хинолин-2-карбоксамид (7-20b)
Применяя ту же методику синтеза, что и для 7-20a, из (S)-8-фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)-метил)хинолин-2-карбоксамида (7-19b, 14 мг) получают (S)-8-фтор-4-(1-метил-1H-пиразол-4-ил)-7-((2-(трифторметил)морфолино)-метил)хинолин-2-карбоксамид (7-20b, 13 мг) в виде белого твердого вещества. НРМС m/z (M+H)+ 438,3 найдено, 438,3 требуется.
Следующие соединения получены по методикам, подобным приведенным в схемах 7.1, 7.2 и 7.3, подбором соответствующего анилинового производного, производных бороновой кислоты и нуклеофила и представляют собой примеры соединений по изобретению.
|
|
|
|
|
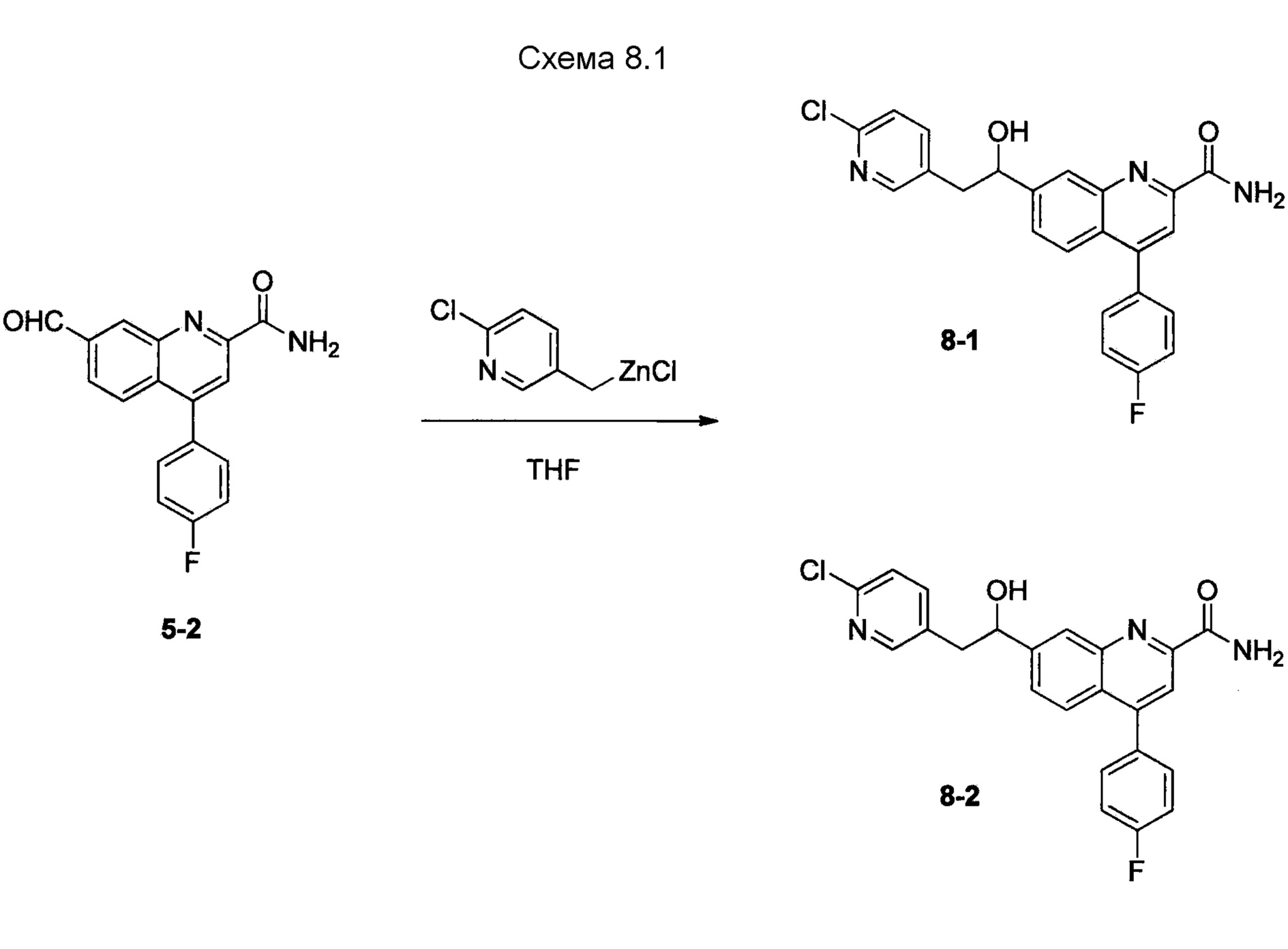
Пример 8.1: синтез 7-[2-(6-хлорпиридин-3-ил)-1-(R или S)-гидроксиэтил]-4-(4-фторфенил)хинолин-2-карбоксамида (8-1 (изомер A), 8-2 (изомер B))
7-[2-(6-Хлорпиридин-3-ил)-1-(R или S)-гидроксиэтил)-4-(4-фторфенил)хинолин-2-карбоксамид (8-1, 8-2)
К перемешиваемому раствору 4-(4-фторфенил)-7-формилхинолин-2-карбоксамида (275 мг, 0,934 ммоль) и ТГФ (2336 мкл) добавляют хлорид (2-хлор-5-пиридил)метилцинка (0,5 М ТГФ, 9345 мкл, 4,67 ммоль) по каплям за 1 минуту. Раствор нагревают до 50°C в течение 20 минут. Дают охладиться до температуры окружающей среды и затем гасят насыщенным NH4Cl. Смесь экстрагируют EtOAc. Органическую часть промывают насыщенным раствором соли, сушат (MgSO4) и концентрируют. Остаток очищают колоночной хроматографией на силикагеле, элюируя CHCl3 при переходе к смеси 70:25:5 CHCl3/EtOAc/MeOH, что дает рацемический амид в виде бесцветного твердого вещества. Рацемический амид очищают на Chiralpak AD для препаративной ВЭЖХ, элюируя 60% EtOH/гексаны + 0,1% Et2NH, 50 мл/мин, что дает 8-1 (изомер A, 38 мг, 0,090 ммоль, 9,64% выход) в виде бесцветного твердого вещества и 8-2 (изомер B, 43 мг, 0,102 ммоль, 10,91% выход) в виде бесцветного твердого вещества.
8-1 (ЖХМС, НРМС m/z (M+H)+ 422,2 найдено, 422,8 требуется.
8-2 ЖХМС, НРМС m/z (M+H)+ 422,2 найдено, 422,8 требуется.
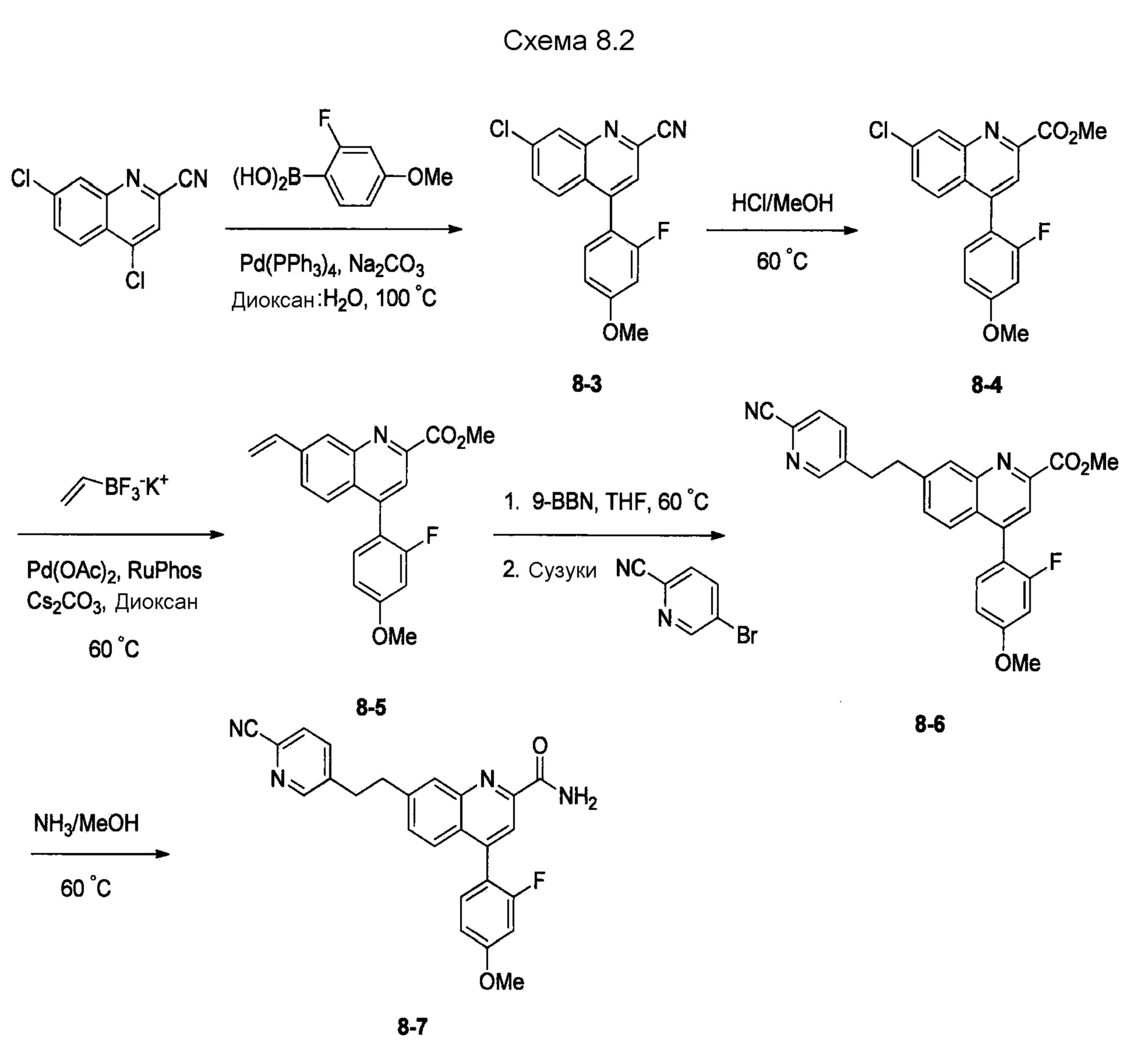
Пример 8.2: синтез 7-[2-(6-цианопиридин-3-ил)этил]-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксамид (8-7)
7-Хлор-4-(2-фтор-4-метоксифенил)хинолин-2-карбонитрил (8-3)
К перемешиваемому раствору 4,7-дихлорхинолин-2-карбонитрила (6 г, 26,9 ммоль), (2-фтор-4-метоксифенил)бороновой кислоты (5,03 г, 29,6 ммоль), 2М карбоната натрия (29,6 мл, 59,2 ммоль) в смеси 10:1 толуола (48,9 мл) и этанола (4,89 мл) добавляют тетракис(трифенилфосфин)палладий(0) (0,777 г, 0,672 ммоль). Смесь перемешивают при 75°C в атмосфере N2 в течение 18 часов. Реакционной смеси дают охладиться до температуры окружающей среды. Охлажденную реакционную смесь разбавляют EtOAc и затем промывают H2O, насыщенным раствором соли, сушат (MgSO4) и концентрируют. Остаток в большинстве случаев растворяют в теплом EtOAc (100 мл), добавляют 100 мл Et2O, оставляют стоять при температуре окружающей на 1 час. Твердое вещество собирают и промывают охлажденным Et2O (50 мл), получая 7-хлор-4-(2-фтор-4-метоксифенил)хинолин-2-карбонитрил (4,4 г, 14,07 ммоль, 52,3% выход) в виде желтого твердого вещества.
ЖХМС, НРМС m/z (M+H)+ 313,1 найдено, 313,7 требуется.
Метил-7-хлор-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксилат (8-4)
7-Хлор-4-(2-фтор-4-метоксифенил)хинолин-2-карбонитрил (4,4 г, 14,07 ммоль) суспендируют в MeOH (70,3 мл), добавляют 200 мл насыщенного HCl/MeOH и затем нагревают до 60°C в течение 4 часов. Реакционной смеси дают охладиться до температуры окружающей среды и затем концентрируют. Остаток растворяют в EtOAc и затем промывают смесью 1:1 1н NaOH/насыщенный NaHCO3, насыщенным раствором соли, сушат (MgSO4) и концентрируют, получая метил-7-хлор-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксилат (4,4 г, 12,73 ммоль, 90% выход) в виде желтого твердого вещества.
ЖХМС, НРМС m/z (M+H)+ 346,2 найдено, 346,8 требуется.
Метил-7-этенил-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксилат (8-5)
Метил-7-хлор-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксилат (1,8 г, 5,21 ммоль) растворяют в диоксане (23,43 мл), дегазируют 10 минут с помощью N2. Добавляют винилтрифторборат калия (1,395 г, 10,41 ммоль), ацетат палладия(II) (0,088 г, 0,390 ммоль), 2-бициклогексилфосфино-2',6'-диметоксибифенил (0,321 г, 0,781 ммоль) и карбонат цезия (5,09 г, 15,62 ммоль), с последующим добавлением дегазированной воды (2,60 мл). Дегазируют с помощью N2 еще 10 минут и затем смесь перемешивают при 85°C в течение 1 часа. Взаимодействие завершено. Реакционную смесь охлаждают до температуры окружающей среды и затем разбавляют EtOAc. Распределяют в смеси EtOAc с водой, промывают EtOAc-экстракт насыщенным раствором соли, сушат, используя безводный MgSO4, и затем концентрируют. Остаток очищают колоночной хроматографией на силикагеле, элюируя гексанами с переходом к EtOAc, что дает метил-7-этенил-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксилат (1,25 г, 3,71 ммоль, 71,2% выход) в виде желтого твердого вещества.
ЖХМС, НРМС m/z (M+H)+ 338,3 найдено, 338,3 требуется.
Метил-7-[2-(6-цианопиридин-3-ил)этил]-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксилат (8-6)
Метил-7-этенил-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксилат (250 мг, 0,741 ммоль) растворяют в ТГФ (1,3 мл), нагревают до 60°C и затем добавляют 9-BBN (0,5М ТГФ, 1,85 мл, 0,93 ммоль) по каплям за 5 минут. Спустя 1 час смеси дают охладиться до темрературы окружающей среды. Добавляют 5-бромпиридин-2-карбонитрил (203 мг, 1,112 ммоль), Pd2(dba)3 (33,9 мг, 0,037 ммоль), бутилди-1-адамантилфосфин (26,6 мг, 0,074 ммоль), карбонат калия (410 мг, 2,96 ммоль) и воду (135 мкл), дегазируют 5 минут с помощью N2 и затем нагревают до 90°C в запаянной пробирке в течение 30 минут. Протекает реакция, обеспечивающая охлаждение до окружающей среды. Добавляют насыщенный раствор соли и затем EtOAc. Органическую часть собирают, сушат (MgSO4) и концентрируют. Остаток очищают колоночной хроматографией на силикагеле, элюируя гексанами с переходом к EtOAc, получают метил-7-[2-(6-цианопиридин-3-ил)этил]-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксилат (160 мг, 0,362 ммоль, 48,9% выход) в виде оранжевого масла.
ЖХМС, НРМС m/z (M+H)+ 442,3 найдено, 442,4 требуется.
7-[2-(6-Цианопиридин-3-ил)этил]-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксамид (8-7)
Перемешиваемый раствор метил-7-[2-(6-цианопиридин-3-ил)этил]-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксилата (160 мг, 0,362 ммоль) и MeOH (1450 мкл) обрабатывают 5 мл 7н NH3/MeOH и затем нагревают до 60°C в запаянной пробирке в течение 30 минут. Реакционной смеси дают охладиться до температуры окружающей среды и затем концентрируют. Твердое вещество растирают с EtOH, собирают, промывают 5 мл Et2O и затем сушат в вакууме, получая 7-[2-(6-цианопиридин-3-ил)этил]-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксамид (105 мг, 0,246 ммоль, 67,9% выход) в виде бесцветного твердого вещества.
ЖХМС, НРМС m/z (M+H)+ 427,3 найдено, 427,4 требуется.
¹H ЯМР (500 МГц, DMSO): 8,68 (1Н, с), 8,27 (1Н, с), 8,01 (1Н, с), 7,97 (3Н, с), 7,83 (1Н, с), 7,64 (2Н, д, J=4,55 Гц), 7,49 (1Н, т, J=8,59 Гц), 7,09 (1Н, д, J=12,11 Гц), 7,02 (1Н, д, J=8,60 Гц), 3,89 (3Н, с), 3,19 (4Н, дд, J=18,34, 7,14 Гц).
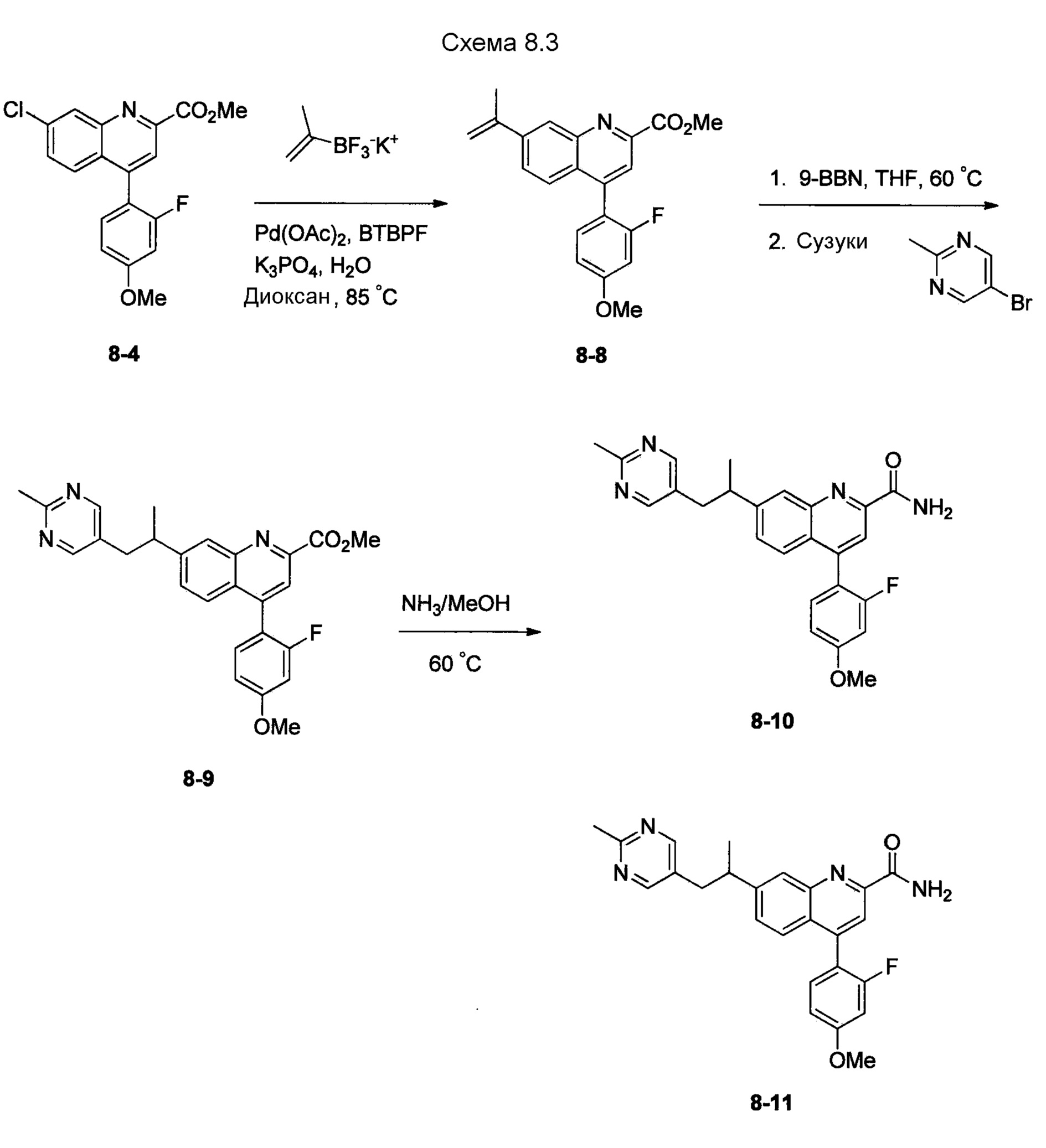
Пример 8.3: синтез 4-(2-фтор-4-метоксифенил)-7-[1-(2-метилпиримидин-5-ил)пропан-2-(R или S)-ил]хинолин-2-карбоксамида (8-10, 8-11)
Метил 4-(2-фтор-4-метоксифенил)-7-(проп-1-ен-2-ил)хинолин-2-карбоксилат (8-8)
Пинаконовый эфир изопропенилбороновой кислоты (2,67 г, 15,91 ммоль), метил-7-хлор-4-(2-фтор-4-метоксифенил)хинолин-2-карбоксилат (5 г, 14,46 ммоль), трехосновный фосфат калия (9,21 г, 43,4 ммоль) и смесь диоксан (43,8 мл)/вода (4,38 мл) объединяют и затем дегазируют азотом в течение 5 минут. Добавляют ацетат палладия(II) (0,243 г, 1,085 ммоль) и 1,1'-бис(ди-трет-бутилфосфино)ферроцен (0,515 г, 1,085 ммоль) и затем нагревают до 85°C в течение 4 часов. Реакция завершается, и смеси дают охладиться до температуры окружающей среды. Смесь разбавляют EtOAc и затем промывают H2O, насыщенным раствором соли, сушат (MgSO4) и концентрируют. Остаток очищают колоночной хроматографией на силикагеле, элюируя гексанами с переходом к EtOAc, получают метил-4-(2-фтор-4-метоксифенил)-7-(проп-1-ен-2-ил)хинолин-2-карбоксилат (3,3 г, 9,39 ммоль, 64,9% выход) в виде желтого твердого вещества.
ЖХМС, НРМС m/z (M+H)+ 352,3 найдено, 352,4 требуется.
Метил-4-(2-фтор-4-метоксифенил)-7-[1-(2-метилпиримидин-5-ил)пропан-2-ил]хинолин-2-карбоксилат (8-9)
Метил-4-(2-фтор-4-метоксифенил)-7-(проп-1-ен-2-ил)хинолин-2-карбоксилат (1,5 г, 4,27 ммоль) растворяют в ТГФ (7,8 мл), нагревают до 60°C и затем добавляют 9-BBN (0,5М ТГФ, 10,7 мл, 5,35 ммоль) по каплям за 5 минут. Спустя 1 час смеси дают охладиться до температуры окружающей среды. Добавляют 5-бром-2-метилпиримидин (0,886 г, 5,12 ммоль), Pd2(dba)3 (0,195 г, 0,213 ммоль), бутилди-1-адамантилфосфин (0,153 г, 0,427 ммоль), карбонат калия (2,360 г, 17,08 ммоль) и воду (0,776 мл), дегазируют 5 минут азотом и затем нагревают до 90°C в запаянной пробирке в течение 30 минут. Реакционной смеси дают охладиться до температуры окружающей среды. К смеси добавляют насыщенный раствор соли и затем EtOAc. Органическую часть собирают, сушат (MgSO4) и затем концентрируют. Остаток очищают колоночной хроматографией на силикагеле, элюируя CHCl3 с переходом к смеси 70:25:5 CHCl3/EtOAc/MeOH, получают метил-4-(2-фтор-4-метоксифенил)-7-[1-(2-метилпиримидин-5-ил)пропан-2-ил]хинолин-2-карбоксилат (335 мг, 0,752 ммоль, 17,62% выход) в виде оранжевого масла.
ЖХМС, НРМС m/z (M+H)+ 446,4 найдено, 446,5 требуется.
4-(2-Фтор-4-метоксифенил)-7-[1-(2-метилпиримидин-5-ил)пропан-2-(R или S)-ил)хинолин-2-карбоксамид (8-10, 8-11)
Перемешиваемый раствор метил-4-(2-фтор-4-метоксифенил)-7-[1-(2-метилпиримидин-5-ил)пропан-2-ил]хинолин-2-карбоксилата (335 мг, 0,752 ммоль) и MeOH (3008 мкл) обрабатывают 5 мл 7н NH3/MeOH и затем нагревают до 60°C в запаянной пробирке в течение 30 минут. Реакционной смеси дают охладиться до температуры окружающей среды и затем концентрируют. Твердое вещество азеотропно перегоняют с 5 мл Et2O и затем сушат в вакууме, получая рацемический продукт в виде бесцветного пенистого вещества.
Остаток очищают на Chiralpak AD для препаративной ВЭЖХ, 5 см, 40 мл/мин, элюируя 100% EtOH, получают 8-10 (изомер A, 95 мг, 0,221 ммоль, 58,7% выход) в виде бесцветного пенистого вещества и 8-11 (изомер B, 85 мг, 0,197 ммоль, 52,5% выход) в виде бесцветного пенистого вещества.
8-10, изомер A ЖХМС, НРМС m/z (M+H)+ 431,3 найдено, 431,5 требуется.
1H ЯМР (500 МГц, CDCl3): 8,32 (2Н, с), 8,21 (1Н, с), 8,05 (1Н, с), 7,89 (1Н, с), 7,73 (1Н, д, J=8,58 Гц), 7,41 (1Н, д, J=8,42 Гц), 7,34 (1Н, т, J=8,40 Гц), 6,89-6,85 (1Н, м), 6,80 (1Н, дд, J=11,53, 2,48 Гц), 5,61 (1Н, с), 3,90 (3Н, с), 3,26-3,21 (1Н, м), 3,00-2,92 (2Н, м), 2,65 (3Н, с).
8-11, изомер В ЖХМС, НРМС m/z (M+H)+ 431,4 найдено, 431,5 требуется.
1H ЯМР (500 МГц, CDCl3): 8,32 (2Н, с), 8,21 (1Н, с), 8,05 (1Н, с), 7,89 (1Н, с), 7,73 (1Н, дд, J=8,63, 2,83 Гц), 7,41 (1Н, д, J=8,49 Гц), 7,34 (1Н, т, J=8,43 Гц), 6,87 (1Н, дд, J=8,51, 2,54 Гц), 6,80 (1Н, дд, J=11,56, 2,53 Гц), 5,61 (1Н, с), 3,90 (3Н, с), 3,26-3,21 (1Н, м), 3,01-2,90 (2Н, м), 2,65 (3Н, с).
Следующие соединения получены по методикам, подобным приведенным в схемах 8.1, 8.2 и 8.3, подбором соответствующего хинолинового производного, производных бороновой кислоты и арил- или гетероарил галогенида и представляют собой примеры соединений по изобретению.
|
|
|
|
|
|
|
|
|
|
БИОЛОГИЧЕСКИЕ ИСПЫТАНИЯ
Применимость соединений по настоящему изобретению в качестве антагонистов активности метаботропных глутаматных рецепторов, в частности, активности mGluR2, может быть продемонстрирована известными в данной области методами. Содержания антагонистов определяются нижеуказанным образом. Соединения по настоящему изобретению исследуют методом анализа на основе флуоресцентного спектрофотометра для прочтения планшетов с лазерным экспонированием. Такое испытание представляет собой функциональный анализ с целью контроля мобилизации Ca2+ в цельных клетках, экспрессирующих рекомбинантный рецептор, сопряженный с нерегулярным G-белком. CHO dhfr-клетки, устойчиво экспрессирующие рекомбинантный mGluR2 человека и Gα16, нагруженные Fluo-4 AM (Invitrogen, Carlsbad CA) обрабатывают различными концентрациями антагонистов соединений и проводят мониторинг Ca2+-отклика на FLIPR384 (Molecular Devices, Sunnydale CA) для оценки агонистической активности. Затем добавляют 2500 нМ глутамата и проводят мониторинг антагонистического отклика. Строят график зависимости максимального отклика на кальций при каждой концентрации соединения для агониста или антагониста от дозы, и кривые приближают к четырехпараметрическому логистическому уравнению, получая IC50 и коэффициент Хилла, используя программное обеспечение ADA для итерационного метода подгонки нелинейной кривой (Merck & Co). В частности, соединения по примерам, показанным в приведенных выше таблицах, обладают антагонизирующей активностью в отношении рецептора mGluR2 в вышеупомянутых испытаниях, с IC50 приблизительно менее 700 нМ, что указывает на их активность в качестве антагонистов функции mGluR2. Конкретные значения IC50 для соединений по типичным примерам по изобретению приведены ниже в таблице:
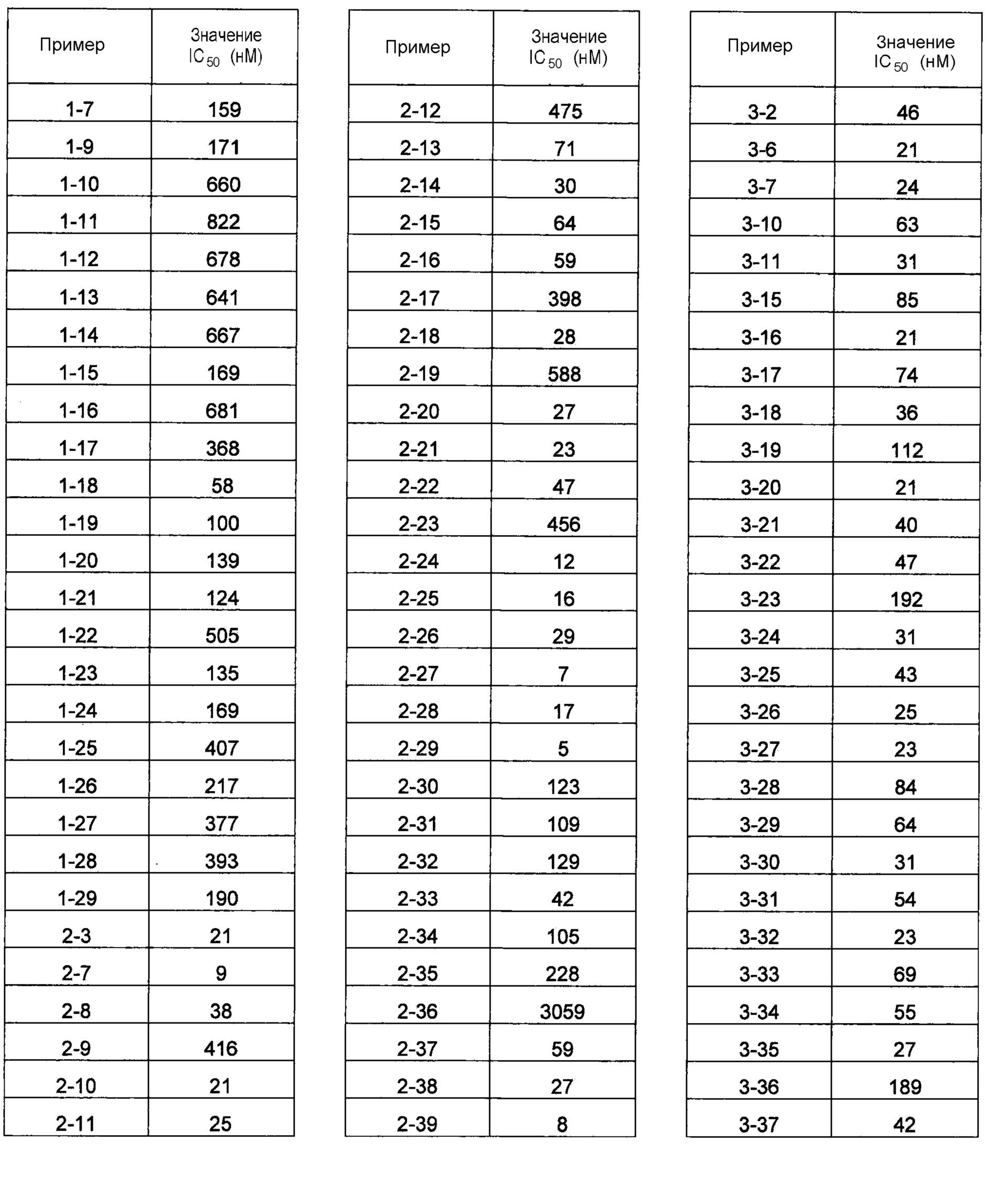
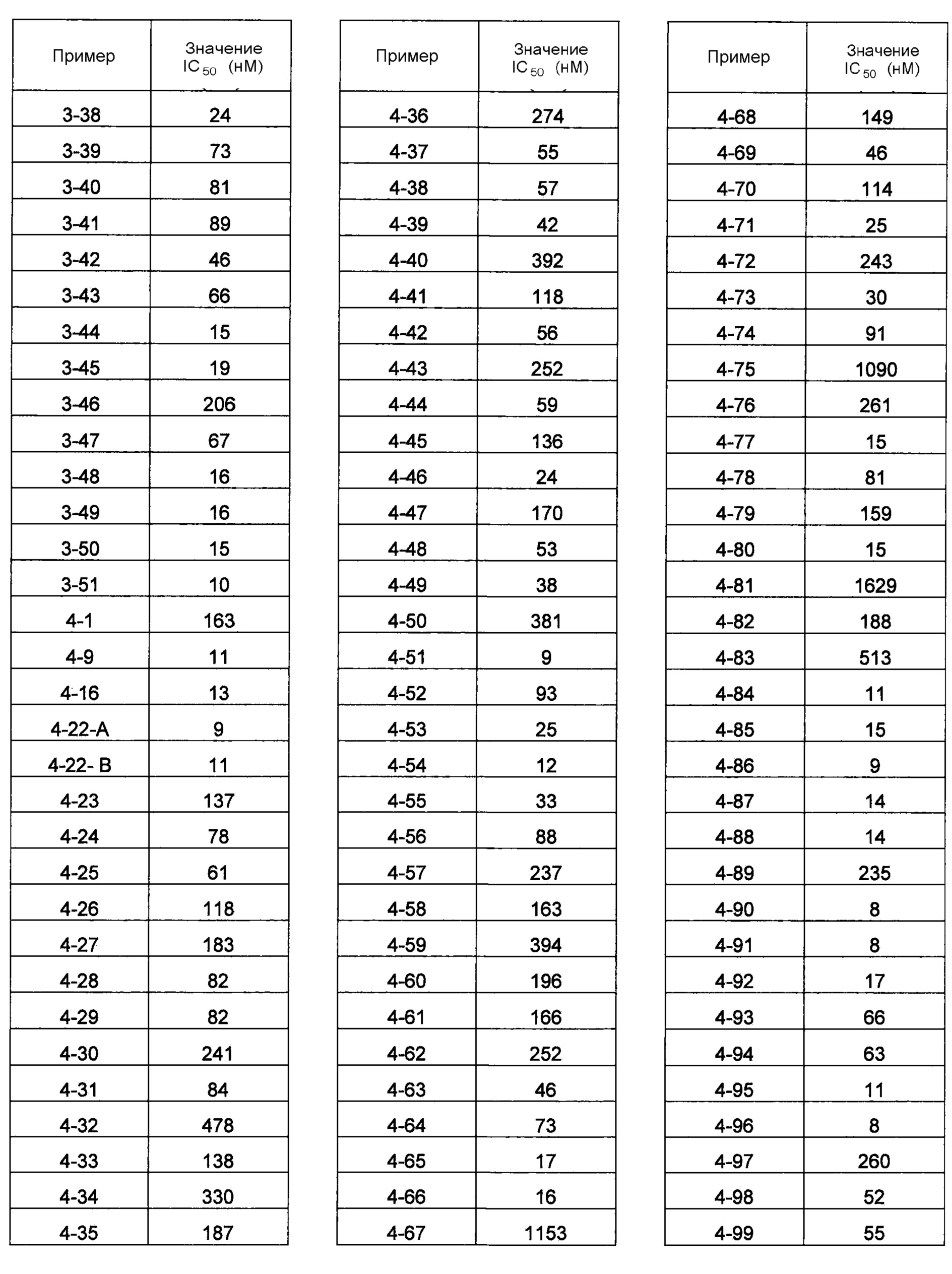
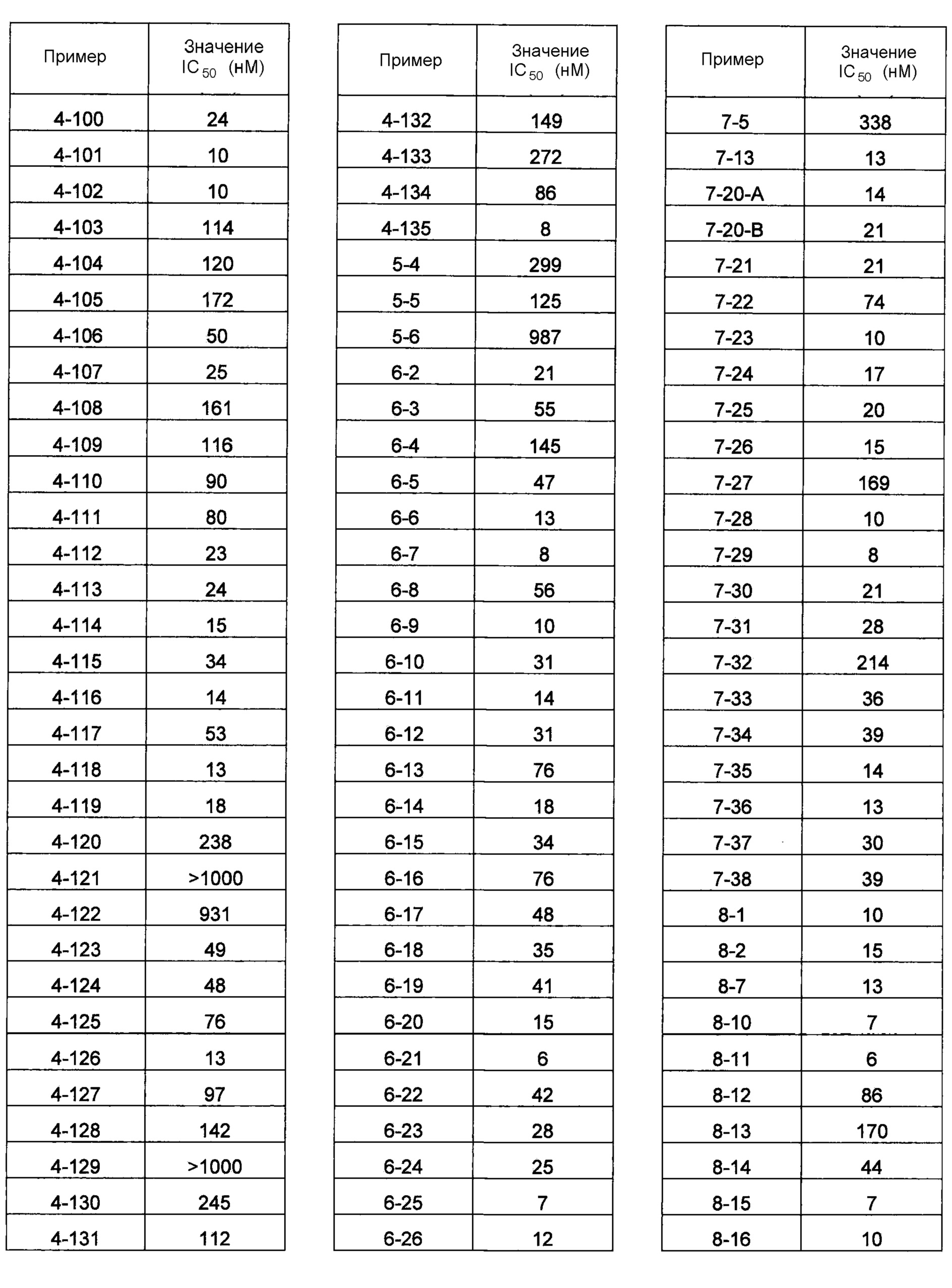
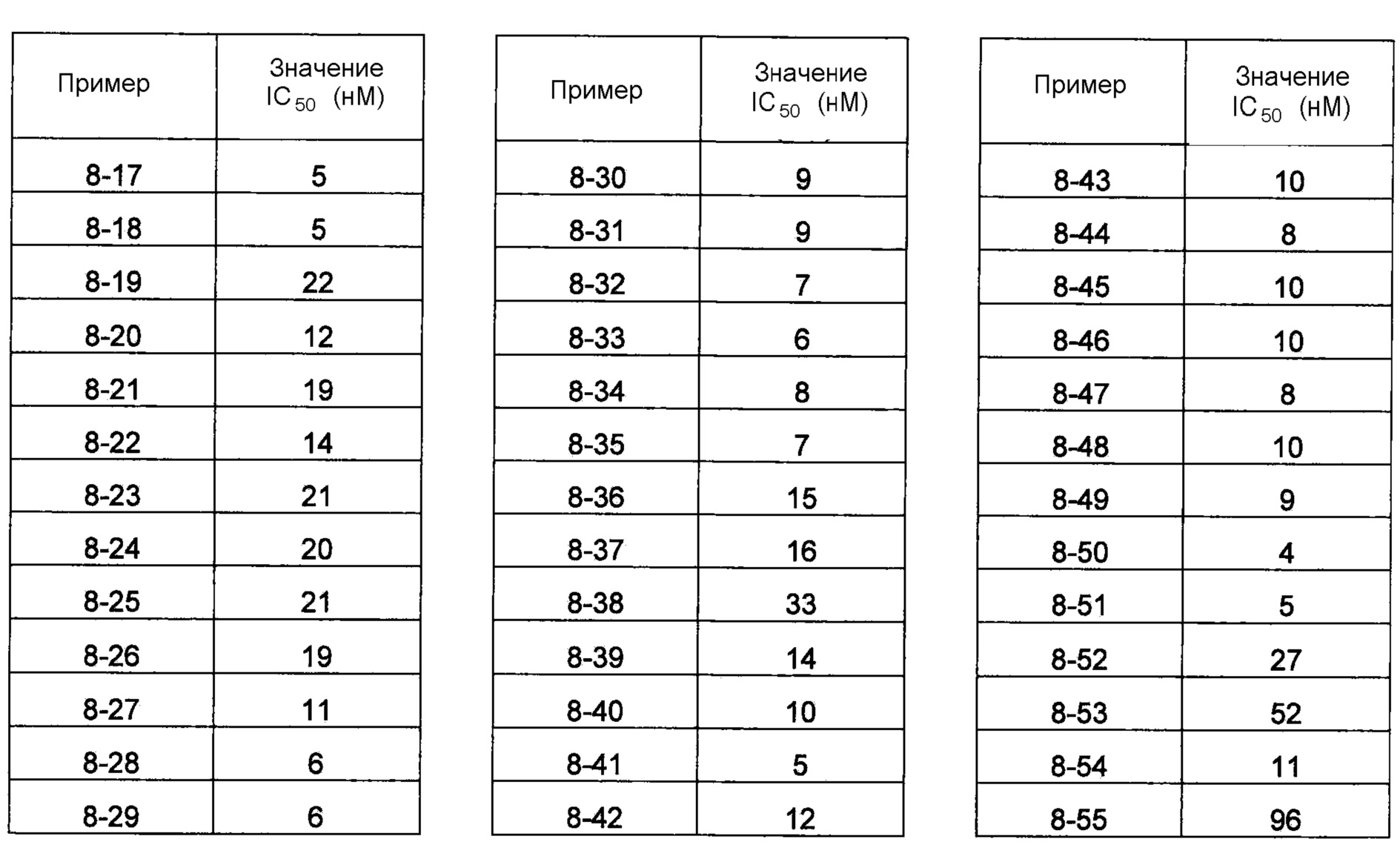
Следующие сокращения могут быть использованы по всему тексту:
Me = метил; Et = этил; t-Bu: = трет-бутил; Ar: = арил; Ph = фенил; Bn = бензил; DCE = дихлорэтилен; HMDS = гексаметилдисилазан; DMF (ДМФА) диметилформамид (ДМФА); DMFDMA = N,N-диметилацеталь диметилформамида; ТГФ = тетрагидрофуран (ТГФ); BOP = гексафторфосфат бензотриазолилокситрис(диметиламино)фосфония; Boc = трет-бутилоксикарбонил; TEA = триэтиламин; TPAP = перрутенат тетра-н-пропиламмония; NMO = N-метилморфолин-N-оксид; ClZn = Хлорцинк; dppf = дифенилферроценилфосфин; PMB = п-метоксибензил; Ms = мезил; Ac = ацетил; DMSO = диметилсульфоксид (ДМСО); DCM = дихлорметан; m-CPBA = мета-хлорпероксибензойная кислота; DMEM = среда Игла модифицированная по способу Дульбекко (с высоким содержанием глюкозы); FBS = фетальная бычья сыворотка; к.т. = комнатная температура; водн. (aq) = водный; ВЭЖХ = высокоэффективная жидкостная хроматография (ВЭЖХ); MS = масс-спектрометрия (МС).
Хотя изобретение раскрыто и иллюстрируется со ссылкой на некоторые конкретные варианты осуществления, специалисту в данной области понятно, что различные адаптации, изменения, модификации, замены, исключения или добавления методик и протоколов могут быть произведены без отступления от существа и объема настоящего изобретения. Таким образом, предполагается, что изобретение определяется объемом приложенных пунктов, и такие пункты толкуются столь широко, насколько это разумно.