Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ ЦИТОТОКСИЧЕСКИМИ ЛИМФОЦИТАМИ
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к способам лечения онкологических заболеваний, таких как рак желудка, толстой кишки, поджелудочной железы, молочной железы и меланомы, а также может быть использовано для профилактики метастазирования после хирургического лечения и в качестве сопроводительной терапии во время или после химиотерапии и/или лучевой терапии.
В терапии онкологических заболеваний все большее значение приобретают комплексные подходы лечения с использованием методов клеточной иммунотерапии, которые являются перспективными в лечении онкологических заболеваний, оказывают непосредственное воздействие на опухоль и гибель раковых клеток в первичном очаге. Методы клеточной иммунотерапии способствуют снижению риска метастазирования и рецидива опухолевого роста. Иммунотерапия непосредственно стимулирует организм на борьбу с патологическим процессом и способствует профилактике токсического действия как самой опухоли, так и химио- и лучевой терапии на организм в целом [Попович A.M. Иммунотерапия в онкологии // Справочник по иммунотерапии для практического врача. - СПб: изд-во "Диалог", 2002. С. 335-352]. Наиболее эффективным и перспективным методом иммунотерапии для лечения различных форм злокачественных новообразований считается адоптивная терапия активированными цитотоксическими лимфоцитами в сочетании с цитокинами. Данные виды клеток применяются в адъювантном или неоадъювантном режиме после хирургического лечения и в комбинации иммунотерапии с традиционными методами химио- и/или лучевой терапии при различных онкологических заболеваниях [Абакушина Е.В. и соавт. Медицинская иммунология. 2014. Т. 16, №5. С. 449-456; Абакушина Е.В. и соавт. Медицинская иммунология. 2014. Т. 16, №6. С. 567-576].
Известен «Способ лечения больных раком легкого» по патенту RU 2500435. В нем предложено из крови больного до проведения лечебной процедуры произвести забор лимфоцитов методом лимфоцитафереза и приготовить лейкоцитарную массу. Затем произвести активацию ронколейкином 20 мл лейкоцитарной массы из расчета соответственно 1000 Ед. на 1 мл путем инкубации в термостате с последующим двукратным центрифугированием. После слива надосадочной жидкости остаточную клеточную массу доводят до объема 20 мл физраствором и выполняют последовательно иммунохимиоэмболизацию под контролем рентгеноскопии. При этом вначале в бронхиальную артерию через установленную коаксиальную систему с микрокатетером вводят свежевыделенную активированную лейкоцитную массу в количестве 20 мл. Затем вводят суспензию из химиопрепарата и эмболизата.
Недостатки способа заключаются в использовании высоких концентраций интерлейкина-2 в среде для культивирования клеток и сроках культивирования клеток, не позволяющих проводить адоптивную иммунотерапию в течение длительного периода времени без дополнительного забора крови. Также элементом сложности является метод введения лимфоцитов через установленную коаксиальную систему с микрокатетером.
Известен «Способ иммунотерапии злокачественных опухолей головного мозга» по патенту RU 2262941. Способ характеризуется тем, что после удаления злокачественной опухоли головного мозга последовательно проводят курсы: цитокинотерапии, включающей в себя 3 внутримышечные инъекции лейкинферона с интервалом 48 ч, адоптивной иммунотерапии лимфокинактивированными киллерными клетками (ЛАКК), генерированными в присутствии рекомбинантного интерлейкина-2 (ИЛ-2). При этом ЛАКК вводят в ложе удаленной опухоли в комбинации с ИЛ-2 в виде 2 процедур с интервалом 24 ч. Затем проводят курс адоптивной иммунотерапии цитотоксическими лимфоцитами (ЦТЛ), генерированными путем культивирования мононуклеарных клеток крови больного с дендритными клетками, нагруженными опухолевым антигеном, в присутствии рекомбинантного ИЛ-2, и вводят их в комбинации с ним в ложе удаленной опухоли в виде двух процедур с интервалом 48 ч. После иммунотерапии ЦТЛ проводят курс вакцинотерапии дендритными клетками, нагруженными опухолевым антигеном, в сочетании с подкожными инъекциями ИЛ-2.
Недостатками способа являются: сложное культивирование с использованием дендритных клеток и антигенов опухолевых клеток; способ введения клеток, требующих специальных условий и оборудования; большие концентрации ИЛ-2, что не позволяет проводить иммунотерапию пациентам с сильно выраженным негативным ответом на введение ИЛ-2.
Известен «Способ вакцинотерапии больных онкологическими заболеваниями» по заявке RU 2013126546. В нем предложено использовать аутологичную цельноклеточную вакцину, содержащую аутологичные лимфоциты, активированные ронколейкином (из расчета 1000 ед. на 1 мл), в течение 120 часов в термостате при 37°C с периодическим встряхиванием пробирок, и культивированные совместно с аутологичными опухолевыми клетками при температуре 37°C 24 часа в среде DMEM. Забор лейкоцитов из крови больного производят накануне запланированной операции или выполнения биопсии опухоли методом лейкоцитофереза. На следующий день после забора лимфоцитов у больного предложено выполнить биопсию опухоли или хирургическую операцию по ее удалению, в процессе которой производят забор образца опухоли и проводят дезагрегацию опухоли. Среду, обогащенную активированными лимфоцитами, несущими антиген опухоли, разливают в стерильные пробирки по 5 мл. Одну дозу полученной вакцины вводят пациенту подкожно сразу же после ее получения, остальные порции доз замораживают при температуре -70°C и вводят пациенту еще два раза с интервалом в 7 дней, последующее введение доз вакцины осуществляют с интервалом 14 дней в течение 3-6 месяцев.
Недостатками способа являются: культивирование с использованием лизата опухолевых клеток; замораживание лимфоцитов, приводящее к гибели лимфоцитов и снижению их активности; применение больших концентраций ИЛ-2 для активации лимфоцитов, что не позволяет проводить иммунотерапию пациентам с сильно выраженным негативным ответом на введение ИЛ-2, а также большое количество инъекций, что ограничивает проведение вакцинотерапии пациентам, живущим в отдаленных регионах.
Известен способ «Лечение рака, комбинирующее лимфоистощающее вещество с ЦТЛ и цитокинами» по патенту RU 2447900. Способ включает получение исходных CD8+T-клеток от субъекта, введение субъекту кладрибина; контактирование исходных CD8+T-клеток с ксеногенными антигенпредставляющими клетками, нагруженными одним или несколькими пептидными антигенами, генерируя посредством этого активированные цитотоксические Т-лимфоциты (ЦТЛ), которые нацелены на клетки, экспрессирующие указанные один или несколько пептидных антигенов. Затем субъекту вводят активированные ЦТЛ и, по меньшей мере, два цитокина: ИЛ-2 и ИФН-α.
Недостатками способа являются: сложное культивирование с использованием ксеногенных антигенпредставляющих животных клеток, пептидных антигенов и введение субъекту химиотерапевтических препаратов и цитокинов, что не позволяет оценить эффект вакцинотерапии у пациентов и может вызвать выраженный негативный ответ на введение данных препаратов.
Наиболее близким к предлагаемому техническому решению является способ, изложенный в статье: «Особенности субпопуляционного состава лимфоцитов у онкологических больных при комбинированном лечении с включением адоптивной иммунотерапии» [Абакушина Е.В. и соавт. Сибирский онкологический журнал. 2015. №1. С.45-50]. В нем на этапах лечения перед проведением курса химиотерапии производят забор крови из локтевой вены. Культивирование МНК в концентрации 1-2×106 кл/мл проводят на протяжении 7-8 дней в питательной среде X-vivo 20 (Lonza, США) с добавлением 250 нг/мл ИЛ-2 (ронколейкин) и 50 нг/мл ИЛ-15 в СО2-инкубаторе при 37°C. На фоне химиотерапии на 3, 5 и 7-й день культивирования собирают необходимое количество клеток для проведения адоптивной иммунотерапии больным раком толстого кишечника и меланомой.
Недостатками данного способа является использование высоких концентраций ИЛ-15 и короткий период проведения иммунотерапии с помощью цитотоксических лимфоцитов.
Задачей изобретения является дополнение способа и устранение указанных недостатков.
Технический результат
В предлагаемом техническом решении предусматривается увеличение продолжительности безрецидивного периода после проведения иммунотерапии и уменьшение тяжелых побочных эффектов химиотерапии у пациентов.
Сущность изобретения включает взятие венозной крови у онкологического больного или донора и выделение лимфоцитов. Выделенные лимфоциты активируют в питательной среде, содержащей рекомбинантный человеческий альбумин, пируват натрия, гентамицин, L-глутамин, от 125 до 500 нг/мл рекомбинантный человеческий интерлейкин-2 (ИЛ-2) и от 2,5 до 5 нг/мл рекомбинантный человеческий интерлейкин-15 (ИЛ-15), на протяжении 9 дней в специальных флаконах с вентилируемой крышкой или в планшетах в условиях СО2-инкубатора при температуре от 36,9 до 37°C. Активированные цитотоксические лимфоциты в количестве от 2 до 10 млн ресуспендируют в клеточном продукте объемом от 0,5 до 1,0 мл. После этого вводят внутрикожно паравертебрально в 2-4 точки онкологическому больному на 3, 5, 7 и 9 день активирования. При этом оставшийся клеточный продукт распределяют в ампулы объемом 1,5-2 мл и хранят в морозильной камере для последующего использования в амбулаторном лечении.
Перечень фигур
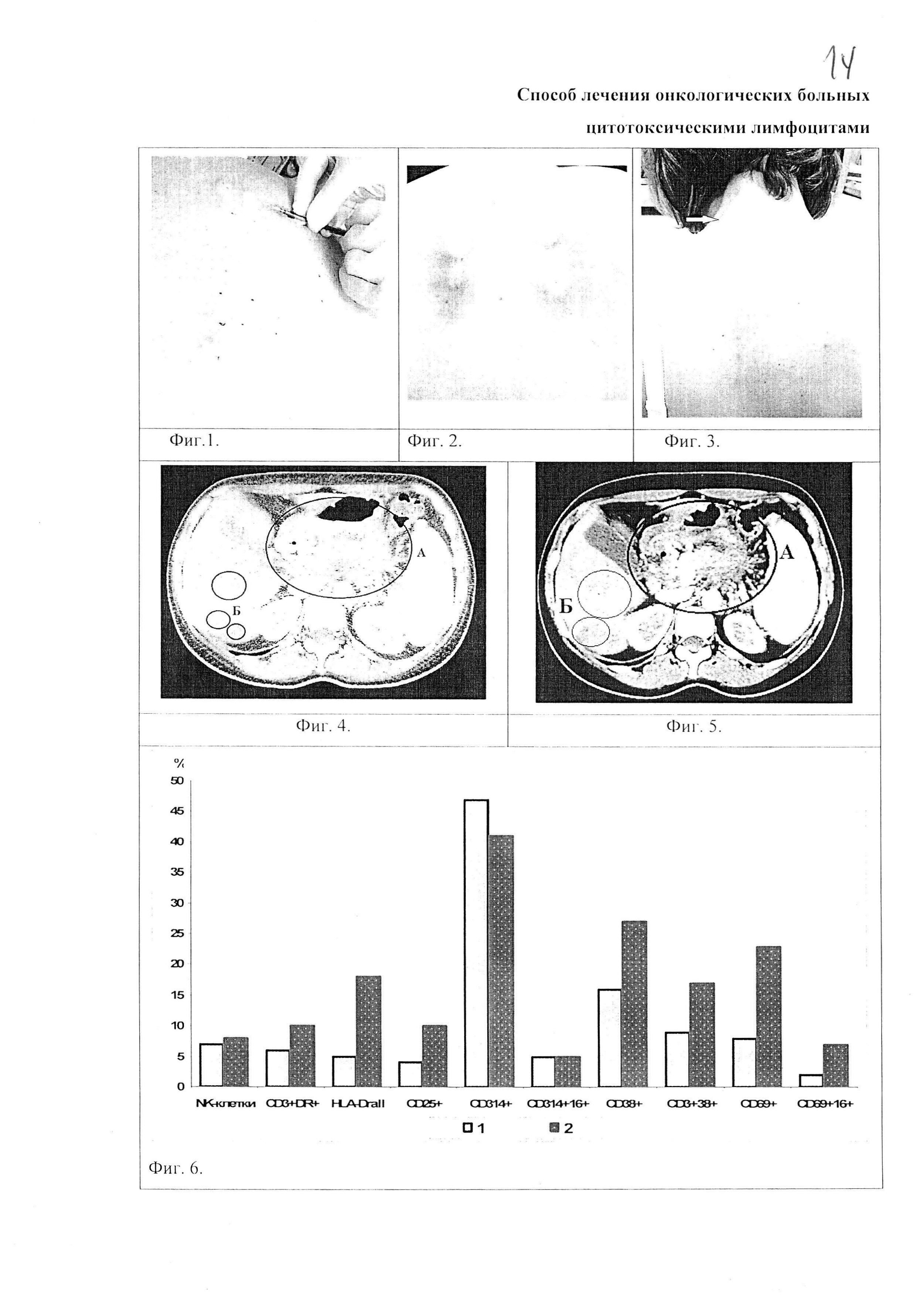
Фиг. 1. Введение активированных цитотоксических лимфоцитов внутрикожно паравертебрально.
Фиг. 2. Реакция на введение активированных цитотоксических лимфоцитов - местная гиперемия.
Фиг. 3. Реакция на введение активированных цитотоксических лимфоцитов. Увеличение заднешейного лимфоузла.
Фиг. 4. Спиральная компьютерная томография 10.14.2014 г. Ультравист 370-100 мл. До проведения иммунотерапии активированными цитотоксическими лимфоцитами: А - опухолевая масса; Б - метастатические очаги.
Фиг.5. Спиральная компьютерная томография 26.01.2015 г. Ультравист 370-50 мл. После проведения иммунотерапии активированными цитотоксическими лимфоцитами: А - опухолевая масса; Б - метастатические очаги.
Фиг. 6. Фенотип лимфоцитов больного до и после проведения лечения активированными цитотоксическими лимфоцитами: 1 - до проведения лечения; 2 - через месяц от начала проведения иммунотерапии.
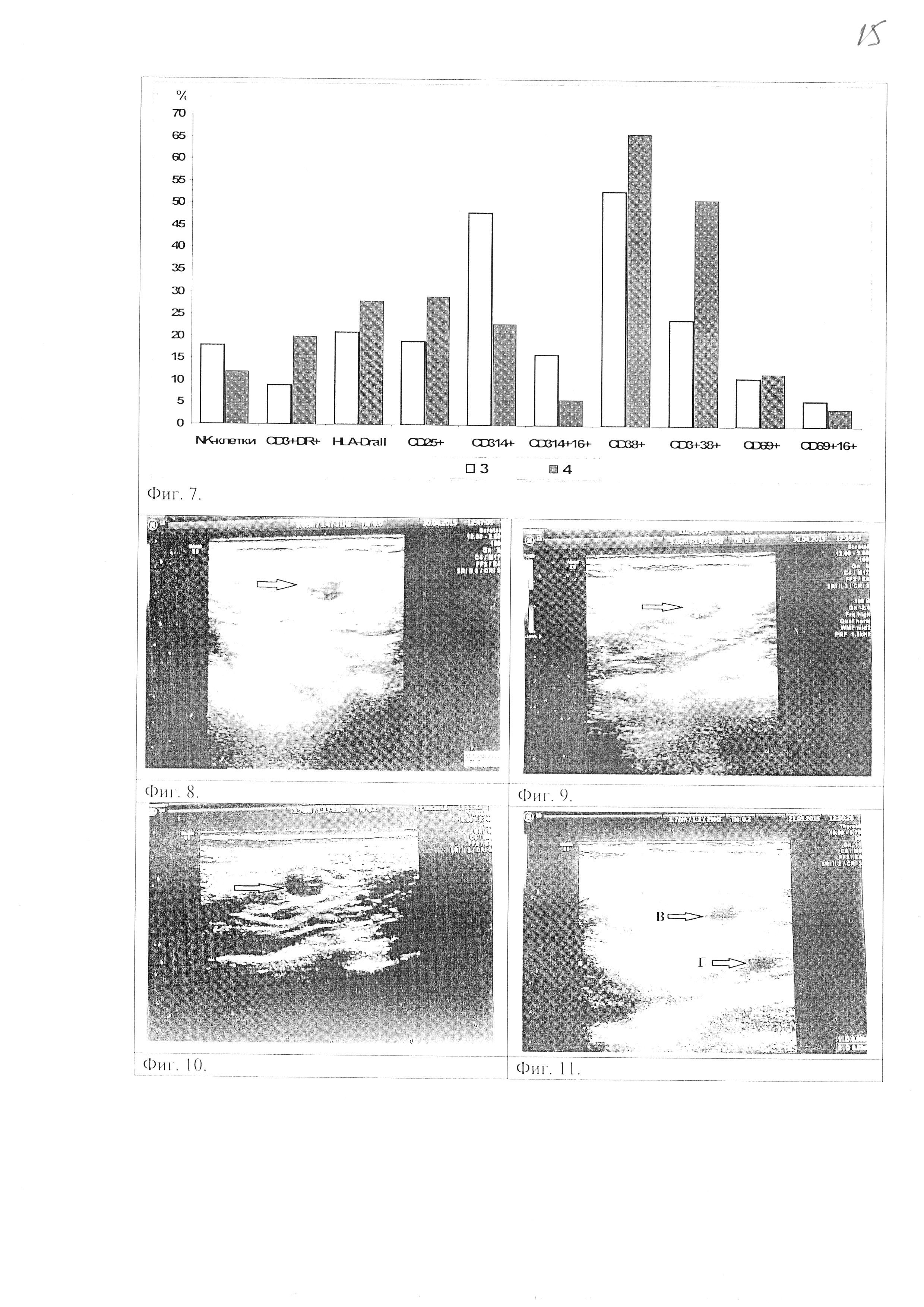
Фиг. 7. Фенотип лимфоцитов больного до и после проведения лечения активированными цитотоксическими лимфоцитами: 3 - до проведения лечения; 4 - через месяц от начала проведения иммунотерапии.
Фиг. 8. УЗИ 30.04.15 г. Реактивный лимфоузел в надключичной области слева 10×7 мм. Сразу после проведения иммунотерапии.
Фиг. 9. УЗИ 30.04.15 г. Реактивный лимфоузел в надключичной области справа 8×7 мм. Сразу после проведения иммунотерапии.
Фиг. 10. УЗИ 21.05.15 г. Надключичный лимфоузел справа 7x6 мм. Через месяц после проведения иммунотерапии.
Фиг. 11. УЗИ 21.05.15 г. Два надключичных лимфоузла слева. Через месяц после проведения иммунотерапии. В - лимфоузел размером 7×5 мм, Г - лимфоузел размером 6×5 мм.
Порядок реализации способа.
1. Выбор пациента. Субъектами для клинического исследования являются пациенты (люди) с диагнозом рак желудка, поджелудочной железы, толстой кишки, молочной железы и меланома, в том числе с метастазами и без них.
2. Для выделения лимфоцитов у больного с помощью вакуумной системы и пробирок, содержащих гепарин, берут венозную кровь и разбавляют ее в 2 раза фосфатно-солевым буфером (ФСБ) (Gibco by life technologies, Великобритания). Разбавленную кровь наслаивают на градиент Hystopague-1077 (Sigma, Великобритания) плотностью 1,077 г/см3 и центрифугируют при 2000 об/мин в течение 20 мин, что приводит к оседанию эритроцитов и гранулоцитов на дно пробирки. В результате центрифугирования лимфоциты образуют интерфазное кольцо, которое собирают пипеткой и двукратно отмывают центрифугированием в 10-кратном объеме ФСБ при 1500 об/мин.
3. Выделенные лимфоциты подсчитывают, ресуспендируют в концентрации 1-2×106 кл/мл в питательной среде, содержащей рекомбинантный человеческий альбумин, пируват натрия, гентамицин, L-глутамин, с добавлением от 125 до 500 нг/мл человеческого рекомбинантного ИЛ-2 (ронколейкин, Биотех, Россия) и от 2,5 до 5 нг/мл человеческого рекомбинантного ИЛ-15 (Immune-Tools, Германия) и активируют на протяжении 9 дней в специальных пластиковых флаконах с вентилируемой крышкой (Corning-Costar, США) или в 24-луночных планшетах (Corning-Costar, США) в условиях CO2-инкубатора при температуре от 36,9 до 37°C. В качестве питательной среды могут быть использованы X-vivo 20 (Lonza, США), RPMI-1640 или DMEM. На 3 день культивирования получают активированные цитотоксические лимфоциты.
4. Ежедневно проводят морфологическую оценку культуры лимфоцитов и визуальную оценку питательной среды на присутствие патогенной микрофлоры. Для поддержания жизнеспособности активированных цитотоксических лимфоцитов на 3, 5, 7 и 9 день активирования меняют половину объема питательной среды. В это же время собирают необходимое количество активированных цитотоксических лимфоцитов для введения пациенту, а оставшийся клеточный продукт распределяют в ампулах объемом 1,5-2 мл и хранят при температуре -30°C для дальнейшего использования. При замене питательной среды оценивают жизнеспособность клеток и их пролиферативную активность.
5. Для проведения иммунотерапии активированными лимфоцитами на 3, 5, 7 и 9 день полученные клетки собирают в количестве от 2 до 10 млн, ресуспендируют в клеточном продукте объемом от 0,5 до 1,0 мл и вводят пациенту внутрикожно паравертебрально в 2-4 точки. Затем 2 раза в неделю на протяжении 1-3 месяцев вводят также внутрикожно паравертебрально в 2-4 точки клеточный продукт в объеме 1,5-2 мл, предварительно согретый до температуры тела.
6. До начала проведения иммунотерапии, через 1 и 3 месяца от начала лечения производят забор крови у онкологических больных и с помощью метода проточной цитометрии оценивают субпопуляционный состав и маркеры активации лимфоцитов. Определяют количество В-, Т-, NKT-, NK-клеток и производят оценку поверхностной экспрессии маркеров активации лимфоцитов (HLA-DR, CD38, CD69, CD314, CD25). Для связывания антител с антигенами клеточной поверхности разрушают эритроциты с помощью лизирующего раствора. Для фенотипирования лимфоциты отмывают ФСБ центрифугированием и окрашивают конъюгированными с РЕ или FITC антителами к CD3, CD4, CD8, CD16, CD20, CD25, HLA-DR, CD38, CD56, CD69 (Beckman Coulter. Франция) и CD314 (eBioScience, США). Фенотипирование флуоресцентно меченых лимфоцитов проводят на проточном цитофлуориметре FACScan (Becton Dickinson, США) или аналогичном приборе, анализируют не менее 5000 событий.
Примеры реализации способа
Пример 1.
Пациент К. 1967 г. р. Диагноз - меланома кожи правого бедра pT3bN0snM0, IIIB, С77.4. Состояние после иссечения, проведено 6 курсов адъювантной химиотерапии (дакарбазин). В ноябре 2014 года отмечено прогрессирование заболевания - метастаз меланомы в лимфатический узел правой пахово-подвздошной области. Проведен предоперационный курс лучевой терапии, правосторонняя пахово-подвздошная лимфаденэктомия и 3 индукционных курса химиотерапии мюстофораном, на фоне которых проведено 3 курса сопроводительной терапии активированными цитотоксическими лимфоцитами и клеточным продуктом. Первый курс иммунотерапии включал 3 введения активированных лимфоцитов в количестве 16 млн и 8 введений клеточного продукта внутрикожно паравертебрально в 2-4 точки (Фиг. 1). Второй курс провели через 2 недели после первого, 3 курс - через месяц после второго. За второй и третий курс было проведено по 8 введений клеточного продукта. После второго введения активированных цитотоксических лимфоцитов увеличились заднешейные лимфоузлы, появилась гиперемия в месте инъекции и зуд (Фиг. 2, 3). На фоне проведения 3 курсов сопроводительной терапии активированными цитотоксическими лимфоцитами и введения клеточного продукта на протяжении 5 месяцев наблюдалась стабилизация процесса. Способ лечения позволил достичь стабилизации процесса и снизить побочные эффекты химиотерапии в виде лейкопении, тромбоцитопении и диспепсии.
Пример 2.
Пациент А. 1969 г. р. В анамнезе в 2001 году рак левой молочной железы T2N0M0, комбинированное лечение. Д-з: рак хвоста и тела поджелудочной железы 4 ст.T4NxM0 2А, аденокарцинома G1. Проведено 9 курсов паллиативной XT гемцитабимом и иммунотерапия аутологичными активированными лимфоцитами 2 раза в неделю внутрикожно паравертебрально в суммарной дозе 30 млн клеток с 02.14 г. по 06.14 г. В начале июля 2014 года появились боли, больная принимала обезболивающие средства. В июле 2014 г. был проведен 1 курс XT гемцитабим и капецитабин. На фоне XT больная отмечала ухудшение состояния, сильный болевой синдром, наблюдалась депрессия. В августе 2014 г. проведен повторный курс химиотерапии. С сентября проводили иммунотерапию с аллогенными активированными лимфоцитами внутрикожно паравертебрально и вводили клеточный продукт. Далее проведено 12 курсов ПХТ и иммунотерапия аллогенными активированными лимфоцитами.
С сентября 2014 года отмечалось стойкое снижение и исчезновение болевого синдрома, удовлетворительное самочувствие на фоне химиотерапии, хорошее настроение, желание лечиться. По результатам спиральной компьютерной томографии (СКТ) (Фиг. 4, 5) отмечалась положительная динамика. Метастатические очаги в печени несколько уменьшились в размерах. Очаг, который был 3,5 см стал 2 см. Жидкости по наружной поверхности печени не определяется. В селезенке сохраняется зона пониженной плотности, но размеры ее резко уменьшились до 1,4 см (ранее 6 см). В области хвоста и тела сохраняется патологическое образование, но оно стало более структурным, интенсивность его снизилась, размеры стали меньше до 48,6×43,9 мм (было 71×50×56 мм), гиподенсная зона исчезла. С момента постановки диагноза прошел 1 год (при средней продолжительности жизни больных раком поджелудочной железы 3 месяца). Нормализация показателей в общем анализе крови позволила проводить химиотерапию без удлинения интервалов между курсами.
Способ лечения позволил добиться регресса опухоли, снизить побочные эффекты химиотерапии и уменьшить болевой синдром.
Пример 3.
Пациент Ф. 1959 г. р. с диагнозом карцинома прямой кишки T3N1M1. Пациенту было проведено 70 курсов химиотерапии. С декабря 2012 года в течение 3,5 месяцев было проведено 3 курса сопроводительной терапии активированными цитотоксическими лимфоцитами и клеточным продуктом. Первый курс включал 3 введения активированных цитотоксических лимфоцитов в количестве 12 млн, а также 2 введения клеточного продукта, второй курс включал 6 введений клеточного продукта и 2 введения активированных цитотоксических лимфоцитов, третий курс включал 7 введений активированных цитотоксических лимфоцитов в количестве 29 млн внутрикожно паравертебрально в 2-4 точки. До проведения лечения активированными цитотоксическими лимфоцитами в периферической крови пациента была оценена экспрессия маркеров активации (HLA-DR, CD25, CD314, CD38 и CD69) на лимфоцитах. Экспрессия активирующего рецептора NKG2D (CD314) на всех лимфоцитах составила 47%, а на NK-клетках - 5%. Поверхностная экспрессия ранних (CD38, CD69) маркеров активации на всех лимфоцитах составляла 16% и 8% соответственно, на Т-лимфоцитах (CD38+3+) - 9%, а на NK-клетках (CD69+16+) - 2%. Поверхностная экспрессия поздних маркеров активации (HLA-DR, CD25+) на всех лимфоцитах составляла 5% и 4% соответственно, а на Т-лимфоцитах (CD3+DR+) - 5%. Через два месяца от начала проведения иммунотерапии активированными цитотоксическими лимфоцитами в периферической крови пациента было отмечено снижение экспрессии активирующего рецептора NKG2D (CD314) на всех лимфоцитах до 41%. Отмечено увеличение поверхностной экспрессии ранних маркеров активации (CD38, CD69) на всех лимфоцитах до 27% и 23% соответственно, на Т-лимфоцитах (CD38+3+) до 17%, а на NK-клетках (CD69+16+) до 7%. Поверхностная экспрессия поздних маркеров активации на всех лимфоцитах (HLA-DR, CD25+) увеличилась до 18% и до 10% соответственно, а на Т-лимфоцитах (CD3+DR+) до 10% (Фиг. 6). Таким образом, наблюдалась активация противоопухолевого звена иммунитета на фоне сопроводительной иммунотерапии. Объективно, после проведения лечения активированными цитотоксическими лимфоцитами нормализовался стул, повысился аппетит, улучшилось качество жизни. Несмотря на проведенную химиотерапию.
Пример 4.
Больная Ч. 1943 г. р. с диагнозом рак кишечника 4 стадии. У пациента в 2013 году обнаружена большая опухолевая масса в кишечнике, которая не подлежала оперативному удалению. Учитывая возраст пациента и наличие хронических заболеваний, противоопухолевое химио- и лучевая терапия не проводилась. За 6 месяцев было проведено 2 курса сопроводительной иммунотерапии активированными аллогенными цитотоксическими лимфоцитами и клеточным продуктом. Первый курс включал 8 введений активированных цитотоксических лимфоцитов в количестве 33 млн, а также 18 введений клеточного продукта; второй курс, который был проведен через месяц после первого курса, включал 9 введение аллогенных активированных цитотоксических лимфоцитов в количестве 9 млн. Несмотря на наличие большой опухолевой массы на фоне проведения лечения активированными аллогенными цитотоксическими лимфоцитами у пациента отсутствовал болевой синдром.
Пример 5.
Больная С. 1962 г. р. с диагнозом меланома кожи левого плеча T3bNIbMo (IIIB). Метастазы в лимфоузлы подмышечной области слева. В июле-августе 2013 г. проведен предоперационный курс лучевой терапии на опухоль левого плеча, оперативное лечение, 5 курсов химиотерапии (Дакарбазин). В декабре 2014 г. отмечено прогрессирование заболевания. В январе 2015 г. проведен курс химиолучевой терапии. С января 2015 г. на протяжении 5 месяцев проводился непрерывный курс лечения активированными цитотоксическими лимфоцитами и клеточным продуктом. Курс сопроводительной иммунотерапии включал 5 введений активированных лимфоцитов в количестве 29 млн и 14 введений клеточного продукта внутрикожно паравертебрально в 2-4 точки. До проведения лечения активированными цитотоксическими лимфоцитами в периферической крови пациента было оценено количество NK-клеток (CD16+56+3-) и экспрессия маркеров активации (HLA-DR, CD25, CD314, CD38 и CD69) лимфоцитов. Количество NK-клеток составляло 18%. Экспрессия активирующего рецептора NKG2D (CD314) на всех лимфоцитах составила 48%, а на NK-клетках - 16%. Поверхностная экспрессия ранних (CD38, CD69) маркеров активации на всех лимфоцитах составляла 53% и 11% соответственно, на Т-лимфоцитах (CD38+3+) - 24%, а на NK-клетках (CD69+T6+) - 6%. Поверхностная экспрессия поздних маркеров активации на всех лимфоцитах (HLA-DR, CD25+) составляла 21% и 19% соответственно, а на Т-лимфоцитах (CD3+DR+) - 9%. Через месяц от начала проведения лечения активированными цитотоксическими лимфоцитами в периферической крови пациента было отмечено снижение количества NK-клеток до 12% и экспрессии активирующего рецептора NKG2D на всех лимфоцитах до 23%, а на NK-клетках - до 6%. Отмечено увеличение поверхностной экспрессии ранних маркеров активации на всех лимфоцитах (CD38+) до 66%, а на Т-лимфоцитах (CD38+3+) до 51%. Поверхностная экспрессия поздних маркеров активации на всех лимфоцитах (HLA-DR, CD25+) увеличилась до 28% и до 29% соответственно, а на Т-лимфоцитах (CD3+DR+) до 20% (Фиг. 7).
Лечение активированными цитотоксическими лимфоцитами в монорежиме с февраля по апрель 2015 г. привело к активации противоопухолевого звена иммунитета, на фоне которого наблюдалось появление реактивных лимфоузлов и стабилизация процесса, о чем свидетельствует заключение УЗИ (Фиг. 8-9). Через месяц после проведения иммунотерапии у пациента размеры лимфоузлов несколько уменьшились (Фиг. 10-11). а в периферической крови количество активированных лимфоцитов возросло, что также подтверждает положительный эффект иммунотерапии. Способ лечения активированными цитотоксическими лимфоцитами способствовал стабилизации процесса за счет активации противоопухолевого иммунного ответа.
Подтверждение достижения технического результата.
Предлагаемое изобретение позволяет с помощью активированных цитотоксических лимфоцитов и клеточного продукта, содержащего цитокины: ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, ИФН-α, ИФН-γ и ФНО-α, выработанные лимфоцитами в процессе активации, проводить иммунотерапию онкологическим больным с целью профилактики метастазирования после хирургического лечения и токсического химиолучевого воздействия на организм.
Предложенный способ лечения онкологических больных цитотоксическими лимфоцитами является безопасным и эффективным. Способ отличается упрощенным методом проведения процедуры введения и активации цитотоксических лимфоцитов in vitro без разделения клеток на фракции и использования антигенов опухолевых клеток. Благодаря уменьшению концентраций цитокинов (ИЛ-2 и ИЛ-15) и их совместному добавлению к полной питательной среде, не содержащей белков животного происхождения, предложенный способ снижает выраженность побочных эффектов иммунотерапии цитокинами и химиотерапии. Это позволяет использовать изобретение для пациентов с сильно выраженным негативным ответом на введение ИЛ-2.
Изобретение используют для лечения онкологических больных с диагнозом рак желудка, поджелудочной железы, толстой кишки, молочной железы и меланомы с метастазами и без. Добавление комбинации ИЛ-2 и ИЛ-15 в полную питательную среду способствует повышению жизнеспособности, пролиферативной активности и функциональной противоопухолевой активности культивируемых цитотоксических лимфоцитов. Также цитокины находящиеся в культуральной среде положительно влияют на поверхностную экспрессию маркеров активации лимфоцитов периферической крови. Предлагаемый способ лечения онкологических больных цитотоксическими лимфоцитами проводят в течение длительного периода времени без дополнительного забора крови.
Способ позволяет индуцировать высокий противоопухолевый иммунный ответ, характеризующийся регрессом опухоли и уменьшением размеров метастазов, появлением реактивных лимфоузлов, с улучшением качества жизни и увеличением продолжительности безрецидивного периода, а также уменьшением тяжелых побочных эффектов от химиотерапии.