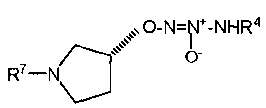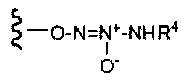Результат интеллектуальной деятельности: ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПЕРВИЧНЫХ АМИНДИАЗЕНИУМДИОЛАТОВ
Вид РИД
Изобретение
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
В WO 09103875 описываются дигидроиндольные производные диазениумдиолатов указанной формулы для лечения гипертензии и сердечнососудистых заболеваний. В WO 07144512 описываются тетразолбифенильные производные диазениумдиолатов указанной формулы для лечения гипертензии и сердечнососудистых заболеваний. В US 2005137191 описываются соединения сложного азотнокислого эфира, такие как 1,2-дихлор-4-(2-метил-бутилдисульфанил)бензол, применимые для профилактики или облегчения тканевого и/или клеточного повреждения, связанного со старением, септическим шоком, язвами, гастритом, язвенным колитом и болезнью Крона. В US 2005065194 описывается применение модулятора гена рецептора дифференцировки эндотелия, такого как 1-(2-этоксифенил)-3-(гидроксифениламино)пирролидин-2,5-дион, для модуляции опосредованной рецепторами биологической активности, например, клеточной пролиферации, стимулируемой лизофосфатидиловой кислотой, приводящей к раку яичников и другим формам рака, и для лечения таких состояний, как злокачественные заболевания, сердечнососудистые заболевания, ишемия и атеросклероз. В WO 9746521 описываются алифатические сложные эфиры азотной кислоты, применимые для лечения неврологических состояний, в частности, болезни Паркинсона, болезни Альцгеймера и болезни Хантингтона.
Настоящее изобретение относится к новым гетероциклическим производным диазениумдиолата, применимым в качестве антигипертензивных средств.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает гетероциклические производные диазениумдиолата, в том числе различные фармацевтически приемлемые соли и гидраты таких форм, и фармацевтические составы, содержащие гетероциклические производные диазениумдиолатов.
Настоящее изобретение также включает способ лечения гипертензии, легочной артериальной гипертензии (PAH), застойной сердечной недостаточности, состояний, являющихся результатом избыточной задержки жидкости в организме, сердечнососудистых заболеваний, диабета, окислительного стресса, эндотелиальной дисфункции, цирроза, позднего токсикоза беременных, остеопороза или нефропатии, включающий введение соединений по настоящему изобретению пациенту с таким состоянием или имеющему риск развития такого состояния.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ И ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
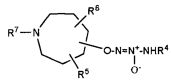
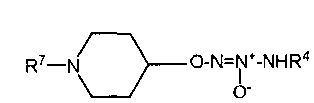
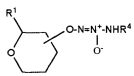
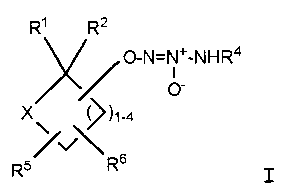
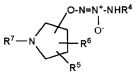
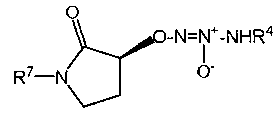
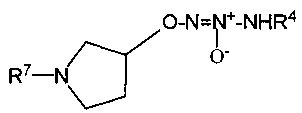
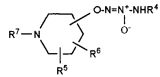
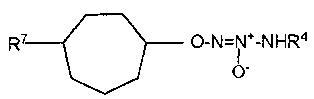
Настоящее изобретение представляет собой соединение формулы I:
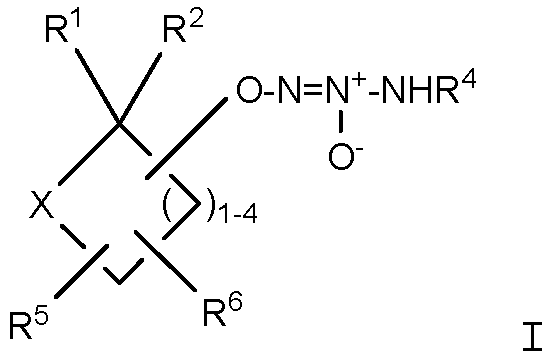
или его фармацевтически приемлемую соль, где
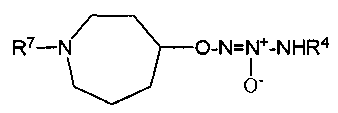
Х представляет собой O или NR7;
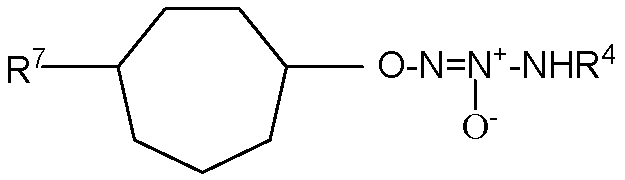
группа  присоединена к любому атому углерода кольца, отличному от атома углерода, к которому присоединены R1 и R2;
присоединена к любому атому углерода кольца, отличному от атома углерода, к которому присоединены R1 и R2;
R1 представляет собой водород, -C(O)OC1-6алкил или -C(O)OH, или вместе с R2 образует =O;
R2 представляет собой водород, или вместе с R1 образует =O;
R4 представляет собой
-C1-6алкил,
-CD2C1-5алкил,
-C2-5алкилен-OH,
-C2-5алкилен-O-C(O)C1-6алкил,
-C1-6алкилен-арил или
-CH2CH=CH2;
R5 и R6, которые присоединены к любому доступному атому углерода кольца, независимо представляют собой
водород,
дейтерий,
-C1-6алкил,
-C(O)OC1-6алкил,
-C(O)OH,
арил,
или R5 и R6, в тех случаях, когда они присоединены к одному и тому же атому углерода, вместе образуют =O;
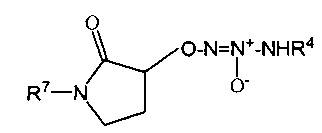
R7 представляет собой
водород,
-C1-6алкил,
-C1-6алкилен-арил,
-C1-6алкиленС(O)O-C1-6алкил,
-C1-6алкилен-CR8R9R10,
-CN,
-C(O)O-C1-6алкил,
-C(O)O-C1-6алкилен-CR8R9R10,
-C(O)C1-6алкил,
-C(O)OC3-6карбоцикл,
-C(O)CHF2,
-C(O)CF3,
-C(O)CH2OH,
-C(O)арил,
-C(O)гетероарил, где гетероарил представляет собой ненасыщенное 5- или 6-членное кольцо, имеющее 1-4 гетероатома, выбранных из N, O и S,
-C(O)C1-6алкиленОН,
-C(O)C3-6карбоцикл,
-C(O)NH2,
-C(O)NHC1-6алкил,
-C(O)NH-адамантил,
-C(O)гетероцикл, где гетероцикл представляет собой насыщенное моноциклическое 5-8-членное кольцо, имеющее 1-4 гетероатома, выбранных из N, O и S, или 7-12-членную насыщенную бициклическую кольцевую систему, имеющую 1-6 гетероатомов, выбранных из N, O и S,
-C(O)NHC3-6карбоцикл,
-C(O)N(C1-6алкил)C1-6алкил,
-C(O)NHSO2арил,
-SOC1-6алкил,
-SO2C1-6алкил,
-SO2NH(C1-6алкил),
-SO2N(C1-6алкил)(C1-6алкил),
-SO2CF3,
-SO2арил,
-SO2гетероарил, где гетероарил представляет собой ненасыщенное 5- или 6-членное кольцо, имеющее 1-4 гетероатома, выбранных из N, O и S,
арил,
ненасыщенное 5- или 6-членное гетероарильное кольцо, имеющее 1-4 гетероатома, выбранных из N, O и S, или
-C3-6карбоцикл;
где арил, алкил, алкилен, карбоцикл, гетероарил и гетероцикл являются незамещенными или замещенными 1-4 группами, независимо выбранными из -CN, галогена, -CF3, -OCF3, -C(O)NH2, -C1-6алкила, -C3-6карбоцикла, =O, -C(O)OC1-6алкила, -COOH, -C(CH3)2OH, -SO2(C1-6алкила), арила, ненасыщенного 5-членного гетероарильного кольца, имеющего 1-3 атома азота, или -OC1-6алкила,
где R8 и R9, вместе с атомом углерода, к которому они присоединены, образуют C3-6карбоцикл или 4-8-членный гетероцикл, и
где R10 представляет собой C1-6алкил;
и его фармацевтически приемлемые соли.
В одном варианте осуществления соединение представляет собой соединение формулы Ia, которая представляет собой
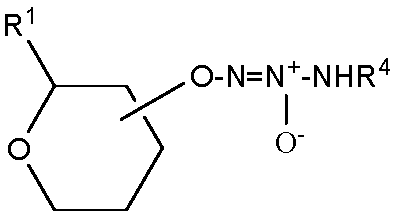 ,
, 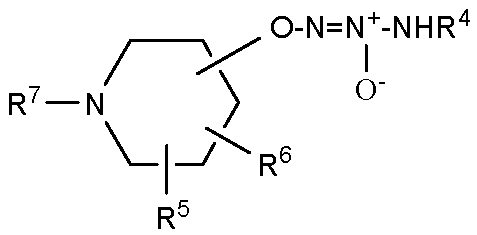 ,
, 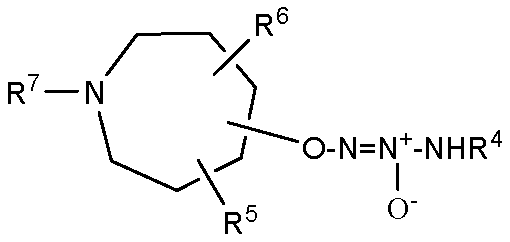 или
или 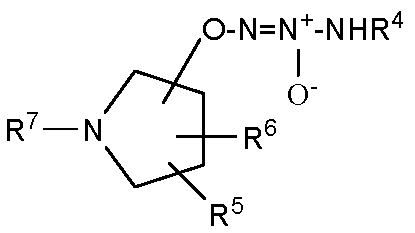 .
.
В другом варианте осуществления соединение представляет собой соединение формулы Ib, которая представляет собой
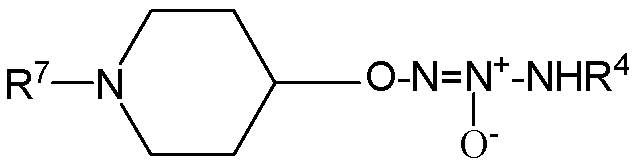 ,
, 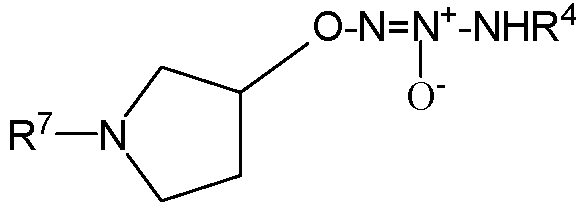 ,
, 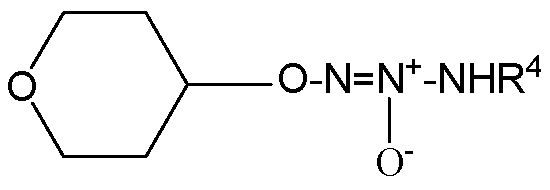 ,
, 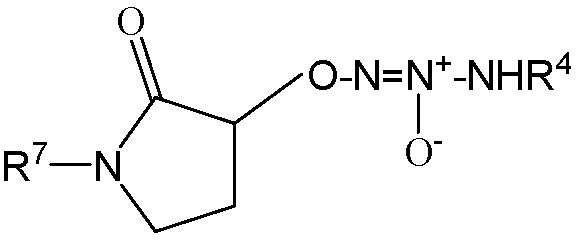 или
или 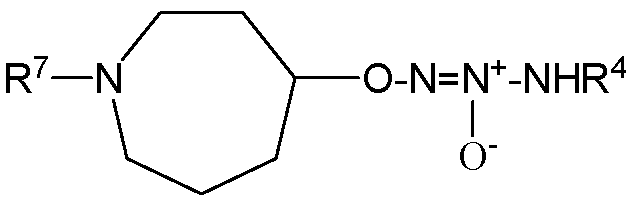 .
.
В другом варианте осуществления соединение представляет собой соединение формулы Ic, которая представляет собой
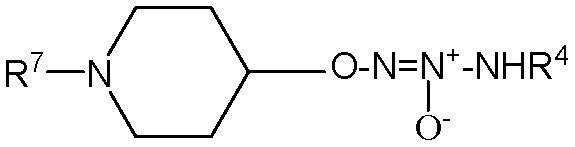 ,
, 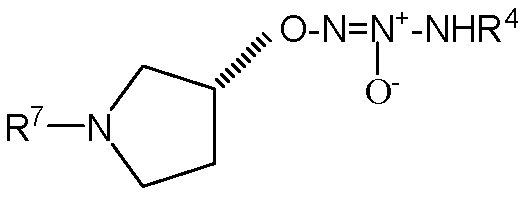 ,
, 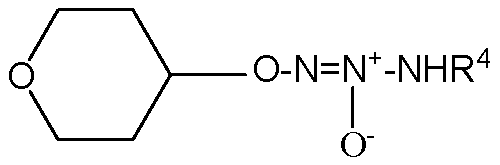 ,
, 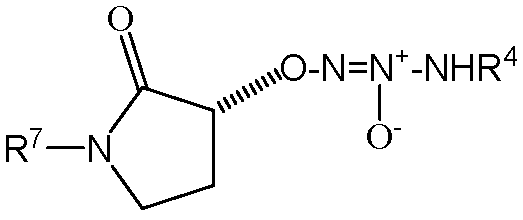 ,
,  или
или 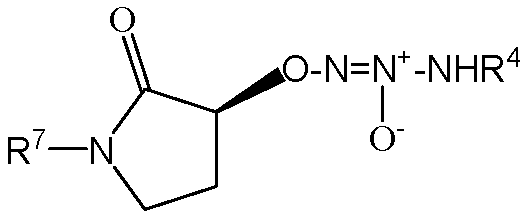 .
.
В другом варианте осуществления R1 представляет собой водород.
В другом варианте осуществления R2 представляет собой водород.
В другом варианте осуществления X представляет собой -NR7, и R7 представляет собой
-C1-6алкил,
-C1-6алкилен-CR8R9R10,
-C(O)O-C1-6алкил,
-C(O)O-C1-6алкилен-CR8R9R10,
-C(O)C1-6алкил,
-C(O)OC3-6карбоцикл,
-C(O)CF3,
-C(O)арил,
-C(O)гетероарил, где гетероарил представляет собой ненасыщенное 6-членное кольцо, имеющее 1-2 атома азота,
-C(O)NHC1-6алкил,
-C(O)NH-адамантил,
-SO2C1-6алкил,
арил или
гетероарил, где гетероарил представляет собой ненасыщенное 6-членное кольцо, имеющее 1-2 атома азота,
где арил, алкил, алкилен, карбоцикл и гетероарил являются незамещенными или замещенными 1-4 группами, независимо выбранными из -CN, -CF3, Cl, -OCF3, -C(O)NH2, -C1-6алкила, -C3-6карбоцикла, =O, -C(O)OC1-6алкила, арила, ненасыщенного 5-членного гетероарильного кольца, имеющего 3 атома азота, или -OC1-6алкила,
где R8 и R9, вместе с атомом углерода, к которому они присоединены, образуют C3-6карбоцикл или 4-8-членный гетероцикл, и
где R10 представляет собой C1-6алкил.
В другом варианте осуществления X представляет собой -NR7, и R7 представляет собой -C1-6алкил, где алкил является незамещенным или замещенным 1 или 2 -CF3.
В другом варианте осуществления X представляет собой -NR7, и R7 представляет собой -C(O)O-C1-6алкил, -C(O)C1-6алкил, -C(O)O-C1-6алкилен-CR8R9R10, -C(O)OC3-6карбоцикл, -C(O)CF3, -C(O)арил, -C(O)пиридил, -C(O)NHC1-6алкил или -C(O)NH-адамантил,
где алкил является незамещенным или замещен арилом или -CF3,
где R8 и R9, вместе с атомом углерода, к которому они присоединены, образуют C3-6карбоцикл или 4-8-членный гетероцикл, и
где R10 представляет собой C1-6алкил.
В другом варианте осуществления X представляет собой -NR7, и R7 представляет собой -SO2C1-6алкил.
В другом варианте осуществления Х представляет собой -NR7, и R7 представляет собой арил, где арил является незамещенным или замещенным 1-2 группами, независимо выбранными из -CN, -CF3, -OCF3, -CH3 или ненасыщенного 5-членного гетероарильного кольца, имеющего 3 атома азота.
В другом варианте осуществления Х представляет собой -NR7, и R7 представляет собой ненасыщенное гетероарильное 6-членное кольцо, имеющее 1-2 атома азота, где гетероарил является незамещенным или замещенным 1-4 группами, независимо выбранными из Cl, ненасыщенного 5-членного гетероарильного кольца, имеющего 3 атома азота, -CN, -CF3 и -C(O)NH2.
В одной из групп этого варианта осуществления Х представляет собой -NR7, и R7 представляет собой
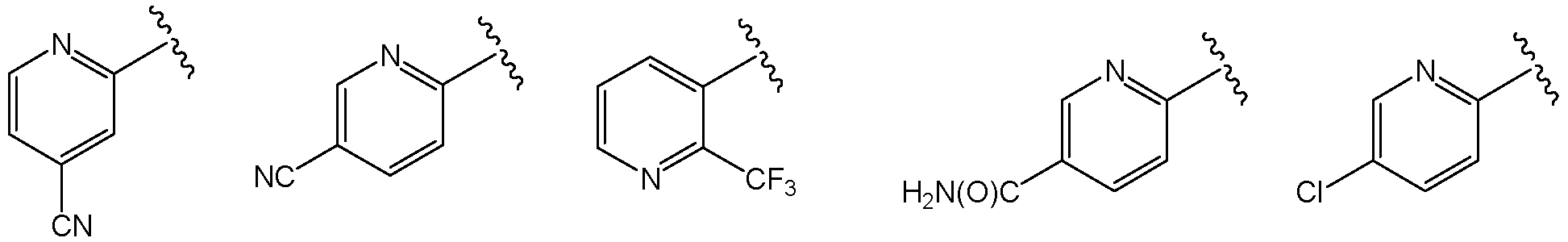
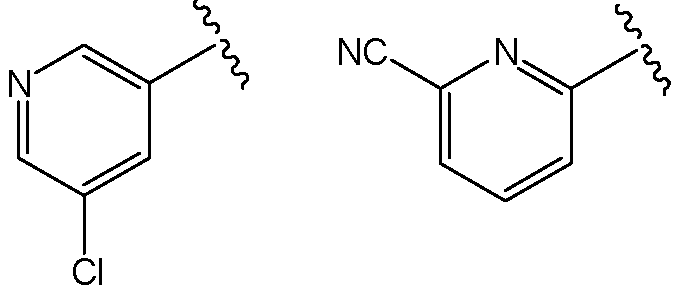 или
или 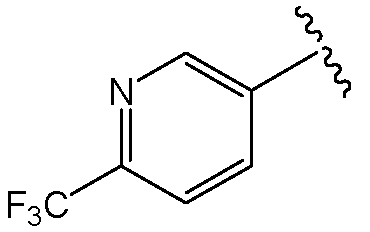 .
.
В другом варианте осуществления R1, R2, R5 и R6 представляют собой водород.
В другом варианте осуществления R1 и R2, вместе с атомом, к которому они присоединены, образуют =O, и R5 и R6 представляют собой водород.
В другом варианте осуществления R4 представляет собой -C1-6алкил.
В другом варианте осуществления R4 представляет собой -C(CH3)3.
В другом варианте осуществления Х представляет собой -NR7, и R7 представляет собой
-C1-6алкил,
-C1-6алкилен-арил,
-C1-6алкиленС(O)O-C1-6алкил,
-C1-6алкилен-CR8R9R10,
-CN,
-C(O)O-C1-6алкил,
-C(O)O-C1-6алкилен-CR8R9R10,
-C(O)C1-6алкил,
-C(O)OC3-6карбоцикл,
-C(O)CHF2,
-C(O)CF3,
-C(O)CH2OH,
-C(O)арил,
-C(O)гетероарил, где гетероарил представляет собой ненасыщенное 5- или 6-членное кольцо, имеющее 1-4 гетероатома, выбранных из N, O и S,
-C(O)C1-6алкиленОН,
-C(O)C3-6карбоцикл,
-C(O)NH2,
-C(O)NHC1-6алкил,
-C(O)NH-адамантил,
-C(O)гетероцикл, где гетероцикл представляет собой насыщенное моноциклическое 5-8-членное кольцо, имеющее 1-4 гетероатома, выбранных из N, O и S, или 7-12-членную насыщенную бициклическую кольцевую систему, имеющую 1-6 гетероатомов, выбранных из N, O и S,
-C(O)NHC3-6карбоцикл,
-C(O)N(C1-6алкил)C1-6алкил,
-C(O)NHSO2арил,
-SOC1-6алкил,
-SO2C1-6алкил,
-SO2NH(C1-6алкил),
-SO2N(C1-6алкил)(C1-6алкил),
-SO2CF3,
-SO2арил,
-SO2гетероарил, где гетероарил представляет собой ненасыщенное 5- или 6-членное кольцо, имеющее 1-4 гетероатома, выбранных из N, O и S,
арил,
ненасыщенное 5- или 6-членное гетероарильное кольцо, имеющее 1-4 гетероатома, выбранных из N, O и S, или
-C3-6карбоцикл;
где арил, алкил, алкилен, карбоцикл, гетероарил и гетероцикл являются незамещенными или замещенными 1-4 группами, независимо выбранными из -CN, галогена, -CF3, -OCF3, -C(O)NH2, -C1-6алкила, -C3-6карбоцикла, =O, -C(O)OC1-6алкила, -COOH, -C(CH3)2OH, -SO2(C1-6алкила), арила, ненасыщенного 5-членного гетероарильного кольца, имеющего 1-3 атома азота, или -OC1-6алкила,
где R8 и R9, вместе с атомом углерода, к которому они присоединены, образуют C3-6карбоцикл или 4-8-членный гетероцикл, и
где R10 представляет собой C1-6алкил.
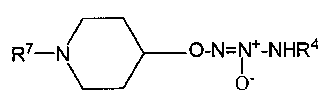
В другом варианте осуществления соединения по настоящему изобретению представляют собой
O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(трет-бутоксикарбонил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-1-[(циклогексилокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-1-[(пропан-2-илокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-1-[(2,2-диметилпропокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-1-[(циклопропилметокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-{[(3-метилоксетан-3-ил)метокси]карбонил}пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(2,2,2-трифторэтил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(трет-бутилкарбамоил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(трицикло[3.3.1.13,7]дец-1-илкарбамоил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-1-[(2-фенилпропан-2-ил)карбамоил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-1-[(1,1,1-трифтор-2-метилпропан-2-ил)карбамоил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
(±)-O2-[1-(трет-бутилкарбамоил)азепан-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-(1-ацетилпиперидин-4-ил) 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[1-(2,2-диметилпропаноил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{1-[(4-цианофенил)карбонил]пиперидин-4-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{1-[(2-метилфенил)карбонил]пиперидин-4-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
(±)-O2-[1-(пиридин-4-илкарбонил)азепан-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(метилсульфонил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[1-(метилсульфонил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[1-(трет-бутилсульфонил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
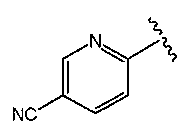
O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[1-(4-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[1-(3-цианофенил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(5-цианопиразин-2-ил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(3-цианофенил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
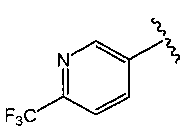
O2-{(3R)-1-[2-(трифторметил)пиридин-3-ил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(6-цианопиридин-2-ил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-1-[3-(трифторметил)фенил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
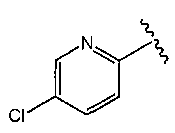
O2-[1-(5-хлорпиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[1-(5-карбамоилпиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-1-[3-(1H-1,2,3-триазол-1-ил)фенил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{1-[3-(1H-1,2,4-триазол-1-ил)фенил]пиперидин-4-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{1-[3-(1H-1,2,3-триазол-1-ил)фенил]пиперидин-4-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{1-[5-(1H-1,2,3-триазол-1-ил)пиридин-2-ил]пиперидин-4-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
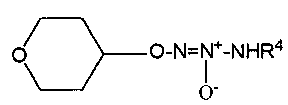
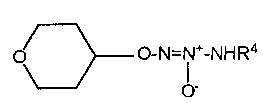
O2-(тетрагидро-2H-пиран-4-ил) 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
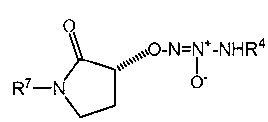
O2-[(3R)-1-(3-метилфенил)-2-оксопирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-2-оксо-1-[3-(трифторметокси)фенил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(5-хлорпиридин-3-ил)-2-оксопирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(5-цианопиридин-2-ил)-2-оксопирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат или
O2-{(3R)-2-оксо-1-[4-(трифторметил)фенил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
или его фармацевтически приемлемую соль.
В другом варианте осуществления соединения по настоящему изобретению представляют собой
O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[1-(4-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-1-[2-(трифторметил)пиридин-3-ил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(6-цианопиридин-2-ил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[1-(5-хлорпиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[1-(5-карбамоилпиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(5-хлорпиридин-3-ил)-2-оксопирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-[(3R)-1-(5-цианопиридин-2-ил)-2-оксопирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат,
O2-{(3R)-2-оксо-1-[4-(трифторметил)фенил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
или его фармацевтически приемлемую соль.
Соединения по настоящему изобретению могут быть использованы для лечения гипертензии, для лечения стенокардии, улучшения чувствительности к инсулину и для обеспечения защиты почек. Эти соединения могут быть использованы отдельно или в комбинации (например, по отдельности, но вводиться совместно, или вводиться в фиксированной дозе) с другими антигипертензивными средствами, например, такими как блокаторы рецептора ангиотензина II, диуретики, ингибиторы ACE, β-блокаторы и блокаторы кальциевых каналов.
Фармацевтически приемлемые соли включают нетоксичные соли, например, полученные из неорганических кислот, например, хлористоводородной, бромистоводородной, серной, сульфаминовой, фосфорной, азотной и подобных, или солей четвертичного аммония, которые образованы, например, из неорганических или органических кислот или оснований. Примеры кислотно-аддитивных солей включают ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, карбонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, лактобионат, лаурилсульфат, малат, малеат, мезилат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, стеарат, сукцинат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, тозилат и ундеканоат. Дополнительные конкретные анионные соли включают аскорбат, глюцептат, глутамат, глюкоронат, безилат, каприлат, изетионат, гентизат, малонат, напазилат, эдфизилат, памоат, ксинафоат и нападизилат.
Основные соли включают аммонийные соли, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-D-глюкамин и соли с аминокислотами, например, аргинином, лизином и так далее. Также основные азот-содержащие группы могут быть кватернизованы такими реагентами, как низшие алкилгалогениды, например, метил-, этил-, пропил- и бутилхлориды, бромиды и йодиды; диалкилсульфатами, как диметил, диэтил, дибутил; и диамилсульфатами, галогенидами с длиной цепью, такими как децил-, лаурил-, миристил- и стеарилхлориды, бромиды и йодиды, аралкилгалогениды такие как бензил и фенэтилбромиды и другие. Дополнительные конкретные катионные соли включают трометамин, бензатин, бенетамин, диэтиламмоний, эполамин, гидрабамин.
В тех случаях, когда соединения по настоящему изобретению содержат один хиральный центр, термин «стереоизомер» включает как энантиомеры, так и смеси энантиомеров, например, особую смесь 50:50, называемую рацемической смесью. Соединения по настоящему изобретению могут иметь многочисленные хиральные центры, образуя многочисленные стереоизомеры. Настоящее изобретение включает все стереоизомеры и их смеси. Если конкретно не упомянуто иное, ссылка на один стереоизомер применяется к любому из возможных стереоизомеров. В тех случаях, когда стереоизомерная композиция конкретно не определена, включены все возможные стереоизомеры. Где используется, структура, отмеченная «*» означает положение атома углерода, который представляет собой хиральный центр. В тех случаях, когда связи с хиральным атомом углерода изображены в виде прямых линий, должно быть понятно, что представлены обе конфигурации (R) и (S) хирального углерода, и, следовательно, оба энантиомера и их смеси.
Некоторые соединения, описанные в настоящей заявке, могут существовать в виде таутомеров. Отдельные таутомеры, а также их смеси охватываются описанными соединениями.
В соединениях общей формулы I атомы могут демонстрировать свой природный изотопный состав, или один или более этих атомов могут быть искусственно обогащены конкретным изотопом, имеющим такое же атомное число, но атомную массу или массовое число отличное от атомной массы или массового числа, преобладающих в природе. Подразумевается, что настоящее изобретение включает все подходящие изотопные варианты соединений общей формулы I. Например, различные изотопные формы водорода (H) включают обычный водород (1H) и дейтерий (2H). Обычный водород является преобладающим изотопом водорода, найденным в природе. Обогащение с получением дейтерия может предоставить определенные терапевтические преимущества, такие как увеличение периода полужизни in vivo или снижение требуемых доз, или может предоставить соединение, применимое в качестве стандарта для характеристики биологических образцов. Изотопно обогащенные соединения в пределах общей формулы I могут быть получены без проведения лишних экспериментов общепринятыми способами, хорошо известными специалистам в данной области или способами, аналогичными тем, которые описаны на схемах и в примерах в настоящей заявке, используя соответствующие изотопно-обогащенные реагенты и/или промежуточные соединения.
В контексте настоящего изобретения, за исключением тех мест, где указано, «алкил» включает как разветвленные насыщенные алифатические углеводородные группы, так и насыщенные алифатические углеводородные группы с прямой цепью, имеющие определенное число атомов углерода. Обычно используемые аббревиатуры для алкильных групп используются по всему тексту описания, например, метил может быть представлен общепринятыми аббревиатурами, включающими «Me» или CH3 или обозначение, которое представляет собой удлиненную связь, как терминальная группа, например, "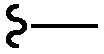 ", этил может быть представлен «Et» или CH2CH3, «Pr» или CH2CH2CH3, бутил может быть представлен «Bu» или CH2CH2CH2CH3, и так далее. «C1-4 алкил» (или «C1-C4 алкил») например, означает линейные алкильные группы или алкильные группы с разветвленной цепью, включающие все изомеры, имеющие конкретное число атомов углерода. C1-4 алкил включает н-, изо-, втор- и трет-бутил, н- и изопропил, этил и метил. Если номер конкретно не указан, "1-4 атома углерода" предназначено для линейных или разветвленных алкильных групп.
", этил может быть представлен «Et» или CH2CH3, «Pr» или CH2CH2CH3, бутил может быть представлен «Bu» или CH2CH2CH2CH3, и так далее. «C1-4 алкил» (или «C1-C4 алкил») например, означает линейные алкильные группы или алкильные группы с разветвленной цепью, включающие все изомеры, имеющие конкретное число атомов углерода. C1-4 алкил включает н-, изо-, втор- и трет-бутил, н- и изопропил, этил и метил. Если номер конкретно не указан, "1-4 атома углерода" предназначено для линейных или разветвленных алкильных групп.
Термин «алкилен» относится к любому двухвалентному алифатическому углеводородному радикалу линейному или с разветвленной цепью, имеющему число атомов углерода в определенном диапазоне. Таким образом, например, «-C1-C6 алкилен-» относится к любым C1-C6 линейным или разветвленным алкиленам, и «-C1-C4 алкилен-» относится к любому из C1-C4 линейных или разветвленных алкиленов. Группа алкиленов, представляющая особый интерес для настоящего изобретения, представляет собой -(CH2)1-6-, и подклассы, представляющие особый интерес, включают -(CH2)1-4-, -(CH2)1-3-, -(CH2)1-2- и -CH2-. Другим подклассом, представляющим интерес, является алкилен, выбранный из группы, состоящей из -CH2-, -CH(CH3)- и -C(CH3)2-. Такие выражения, как «C1-C4 алкиленфенил» и «C1-C4 алкил, замещенный фенилом» имеют одинаковое значение и используются взаимозаменяемо.
За исключением случаев, указанных в настоящей заявке, алкильные группы и алкиленовые группы могут быть незамещенными или замещенными 1-3 заместителями на любом одном или нескольких атомах углерода, галогеном, C1-C20 алкилом, CF3, NH2, -NH(C1-C6 алкилом), -N(C1-C6 алкилом)2, NO2, оксо, CN, N3, -OH, -OC(O)C1-C6 алкилом, -O(C1-C6 алкилом), C3-C10 циклоалкилом, C2-C6 алкенилом, C2-C6 алкинилом, (C1-C6 алкил)S(O)0-2-, HS(O)0-2-, (C1-C6 алкил)S(O)0-2(C1-C6 алкилом)-, HS(O)0-2(C1-C6 алкилом)-, (C0-C6 алкил)C(O)NH-, H2N-C(NH)-, -O(C1-C6 алкил)CF3, HC(O)-, (C1-C6 алкил)C(O)-, HOC(O)-, (C1-C6 алкил)OC(O)-, HO(C1-C6 алкилом)-, (C1-C6 алкил)O(C1-C6 алкилом)-, (C1-C6 алкил)C(O)1-2(C1-C6 алкилом)-, HC(O)1-2(C1-C6 алкилом)-, (C1-C6 алкил)C(O)1-2-, HOC(O)NH-, (C1-C6 алкил)OC(O)NH-, арилом, аралкилом, гетероциклом, гетероциклилалкилом, галогенарилом, галогенаралкилом, галогенгетероциклом, галогенгетероциклилалкилом, цианоарилом, цианоаралкилом, цианогетероциклом и цианогетероциклилалкилом, где такое замещение в результате приводит к образованию стабильного соединения.
Термин «арил», отдельно или в сочетании, относится к фенильной, нафтильной или инданильной группе, предпочтительно к фенильной группе. Сокращение «Ph» представляет фенил.
Термин «карбоцикл» (и его варианты, такие как «карбоциклический» или «гетероциклил») в контексте настоящего изобретения, если не указано иное, относится к C3-C8 моноциклическому насыщенному или ненасыщенному кольцу. Карбоцикл может быть присоединен к оставшейся молекуле у любого атома углерода, что в результате приводит к образованию стабильного соединения. Насыщенные карбоциклические кольца также называются циклоалкильными кольцами, например, циклопропил, циклобутил и так далее.
Термин «гетероарил» относится к ненасыщенному кольцу, имеющему определенное число атомов (например, 5 или 6 членов), включающему определенное число гетероатомов (например, 1, 2, 3 или 4 гетероатома, независимо выбранных из N, O или S), например, 5-членные кольца, содержащие один атом азота (пиррол), один атом кислорода (фуран) или один атом серы (тиофен), 5-членные кольца, содержащие один атом азоты и один атом серы (тиазол), 5-членные кольца, содержащие один атом азота и один атом кислорода (оксазол или изоксазол), 5-членные кольца, содержащие два атома азота (имидазол или пиразол), пятичленные ароматические кольца, содержащие три атома азота, пятичленные ароматические кольца, содержащие один атом кислорода, один атом азота или один атом серы, пятичленные ароматические кольца, содержащие два гетероатома, независимо выбранные из кислорода, азота и серы, 6-членные кольца, содержащие один атом азота (пиридин) или один атом кислорода (пиран), 6-членные кольца, содержащие два атома азота (пиразин, пиримидин или пиридазин), 6-членные кольца, содержащие три атома азота (триазин), тетразолильное кольцо; тиазинильное кольцо; или кумаринил. Примерами таких кольцевых систем являются фуранил, тиенил, пирролил, пиридинил, пиримидинил, индолил, имидазолил, триазинил, тиазолил, изотиазолил, пиридазинил, пиразолил, оксазолил и изоксазолил.
Термины «гетероцикл» и «гетероциклический» относятся к насыщенному моноциклическому 5-8-членному кольцу, имеющему 1-4 гетероатома, выбранных из N, O и S, или 7-12-членной насыщенной бициклической кольцевой системе, имеющей 1-6 гетероатомов, выбранных из N, O и S. Репрезентативные примеры включают пиперидинил, пиперазинил, азепанил, пирролидинил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолидинил, морфолинил, тиоморфолинил, тиазолидинил, изотиазолидинил и тетрагидрофурил (или тетрагидрофуранил).
За исключением случаев, указанных в настоящей заявке, арильные группы и карбоциклы могут быть незамещенными или замещенными 1, 2 или 3 заместителями на любом одном или нескольких доступных атомах углерода, галогеном, C1-C20 алкилом, CF3, NH2, -NH(C1-C6 алкилом), -N(C1-C6 алкилом)2, NO2, оксо, CN, N3, -OH, -O(C1-C6 алкилом), C3-C10 циклоалкилом, C2-C6 алкенилом, C2-C6 алкинилом, HS(O)0-2-, (C1-C6 алкил)S(O)0-2-, (C1-C6 алкил)S(O)0-2(C1-C6 алкилом)-, HS(O)0-2(C1-C6 алкилом)-, (C1-C6 алкил)S(O)0-2, (C1-C6 алкил)C(O)NH-, HC(O)NH-, H2N-C(NH)-, -O(C1-C6 алкил)CF3, (C1-C6 алкил)C(O)-, HC(O)-, (C1-C6 алкил)OC(O)-, HOC(O)-, (C1-C6 алкил)O(C1-C6 алкилом)-, HO(C1-C6 алкилом)-, (C1-C6 алкил)C(O)1-2(C1-C6 алкилом)-, (C1-C6 алкил)C(O)1-2-, HC(O)1-2(C1-C6 алкилом)-, (C1-C6 алкил)OC(O)NH-, HOC(O)NH-, арилом, аралкилом, гетероциклом, гетероциклилалкилом, галогенарилом, галогенаралкилом, галогенгетероциклом, галогенгетероциклилалкилом, цианоарилом, цианоаралкилом, цианогетероциклом и цианогетероциклилалкилом, там, где такое замещение в результате приводит к образованию стабильного соединения.
За исключением случаев, указанных в настоящей заявке, гетероарильные группы и гетероциклы могут быть незамещенными или замещенными 1, 2 или 3 заместителями на любом одном или нескольких доступных атомах углерода, галогеном, C1-C20 алкилом, CF3, NH2, -NH(C1-C6 алкилом), -N(C1-C6 алкилом)2, NO2, оксо, CN, N3, -OH, -O(C1-C6 алкилом), C3-C10 циклоалкилом, C2-C6 алкенилом, C2-C6 алкинилом, (C1-C6 алкил)S(O)0-2-, HS(O)0-2-, (C1-C6 алкил)S(O)0-2(C1-C6 алкилом)-, HS(O)0-2(C1-C6 алкилом)-, (C1-C6 алкил)S(O)0-2-, (C1-C6 алкил)C(O)NH-, HC(O)NH-, H2N-C(NH)-, -O(C1-C6 алкил)CF3, HC(O)-, (C1-C6 алкил)C(O)-, (C1-C6 алкил)OC(O)-, HOC(O)-, (C1-C6 алкил)O(C1-C6 алкилом)-, HO(C1-C6 алкилом)-, (C1-C6 алкил)O-, (C1-C6 алкил)C(O)1-2(C1-C6 алкилом)-, HC(O)1-2(C1-C6 алкилом)-, (C1-C6 алкил)C(O)1-2, (C1-C6 алкил)OC(O)NH-, HOC(O)NH-, арилом, аралкилом, гетероциклом, гетероциклилалкилом, галогенарилом, галогенаралкилом, галогенгетероциклом, галогенгетероциклилалкилом, цианоарилом, цианоаралкилом, цианогетероциклом или цианогетероциклилалкилом, или независимо или дополнительно замещены 1 или 2 заместителями на любом одном или нескольких доступных атомах азота, C1-C20 алкилом, оксо, C3-C10 циклоалкилом, C2-C6 алкенилом, C2-C6 алкинилом, арилом, -C(O)C1-6 алкилом, -C(O)NHC1-C6 алкилом, -C(O) NH2, -C1-C6 алкилС(O)NH2, -C1-C6 алкилОС(O)NH2, или независимо или дополнительно замещены 1 заместителем на любом одном или нескольких атомах серы C1-C20 алкилом, оксо, C3-C10 циклоалкилом, C2-C6 алкенилом, C2-C6 алкинилом, арилом, там, где такое замещение в результате приводит к образованию стабильного соединения. Замещенные гетероциклические кольца включают циклические мочевины, такие как имидазолидин-2-он и тетрагидропиримидин-2(1H)-он, которые содержат три последовательных атома, которые представляют собой азот, углерод и азот, где атом углерода замещен оксо заместителем.
Соединения по настоящему изобретению применимы для лечения гипертензии, артериальной легочной гипертензии, застойной сердечной недостаточности, стенокардии, состояний в результате чрезмерной задержки жидкости, сердечнососудистых заболеваний, диабета, окислительного стресса, эндотелиальной дисфункции, цирроза, позднего токсикоза беременных, остеопороза или нефропатии, включающему введение соединений по настоящему изобретению пациенту с таким состоянием, или имеющему риск развития такого состояния.
Настоящее изобретение также относится к применению соединений по настоящему изобретению для получения лекарственного средства для лечения и/или профилактики указанных выше заболеваний.
Указанные выше соединения по настоящему изобретению также используются в комбинации с другими фармакологически активными соединениями, включающими антагонисты рецептора ангиотензина II (например, лозартан, валсартан, кандесартан, ирбесартан, олмесартан) ингибиторы ангиотензинпревращающего фермента (например, алацеприл, беназеприл, каптоприл, церонаприл, цилазаприл, цилазаприл, делаприл, эналаприл, эналаприлат, фозиноприл, имидаприл, лизиноприл, мовелтиприл, периндоприл, хинаприл, рамиприл, спираприл, темокаприл или трандолаприл), ингибиторы нейтральной эндопептидазы (например, тиорфан и фосфорамидон), антагонисты альдостерона, ингибиторы ренина (например, мочевинные производные ди- и трипептидов (смотрите патент США № 5116835), аминокислоты и производные (патенты США 5095119 и 5104869), цепи аминокислот, соединенные непептидными связями (патент США 5114937), производные ди- и трипептидов (патент США 5106835), пептидиламинодиолы (патенты США 5063208 и 4845079) и пептидил бета-аминоациламинодиолкарбаматы (патент США 5089471); также целый ряд других пептидных аналогов, описанных в следующих патентах США 5071837; 5064965; 5063207; 5036054; 5036053; 5034512 и 4894437, и ингибиторы ренина с низкой молекулярной массой (включая диолсульфонамиды и сульфинилы (патент США 5098924), производные N-морфолино (патент США 5055466), N-гетероциклические спирты (патент США 4885292) и пиролимидазолоны (патент США 5075451); также производные пепстатина (патент США 4980283) и фтор- и хлор-производные статон-содержащих пептидов (патент США 5066643), эналкреин, RO 42-5892, A 65317, CP 80794, ES 1005, ES 8891, SQ 34017, алискирен ((2S,4S,5S,7S)-N-(2-карбамоил-2-метилпропил)-5-амино-4-гидрокси-2,7-диизопропил-8-[4-метокси-3-(3-метоксипропокси)фенил]октанамидгемифумарат) SPP600, SPP630 и SPP635), антагонисты рецептора эндотелина, сосудорасширяющие средства, блокаторы кальциевых каналов (например, амлодипин, нифедипин, верапармил, диазем, галлопамил, нилюдипин, нимодипин, никардипин), активаторы калиевых каналов (например, никорандил, пинацидил, кромакалим, миноксидил, априлкалим, лопразолам), диуретики (например, гидрохлортиазид), симпатолитики, бета-адреноблокаторы (например, пропанолол, атенолол, бисопролол, карведилол, метопролол или метопролол тартат), альфа-адреноблокаторы (например, доксазозин, теразозин, празозин или альфа-метилдопа), центральные альфа-адренергические агонисты, периферические сосудорасширяющие средства (например, гидралазин), средства, снижающие уровень липидов (например, симвастатин, ловастатин, эзетамиб, фторвастатин, правастатин), средства, изменяющие метаболизм, включающие средства, повышающие чувствительность к инсулину и родственные им соединения, включающие (i) агонисты PPARγ, такие как глитазоны (например, троглитазон, пиоглитазон, энглитазон, MCC-555, росиглитазон, балаглитазон и подобные) и другие лиганды PPAR, в том числе двойные агонисты PPARα/γ, такие как KRP-297, мураглимазар, навеглитазар, Галида, тезаглитазар, TAK-559, агонисты PPARα, например, производные фенофиброевой кислоты (гемфиброзил, клофибрат, фенофибрат и безафибрат) и селективные модуляторы PPARγ (SPPARγM), например, описанные в WO 02/060388, WO 02/08188, WO 2004/019869, WO 2004/020409, WO 2004/020408 и WO 2004/066963; (ii) бигуаниды, такие как метформин и фенформин, и (iii) ингибиторы протеинтирозинфосфатазы-1B (PTP-1B), глипизид, ингибиторы DPP-IV, такие как ситаглиптин, вилдаглиптин, алоглиптин и саксаглиптин, которые ингибируют фермент дипептидилпептидазу-IV, и которые применяются для лечения диабета, или с другими лекарственными средствами, эффективными для профилактики или лечения указанных выше заболеваний, в том числе нитропруссид и диазоксид. Такое сочетание может достигаться путем объединения двух активных ингредиентов, например, антагониста рецептора ангиотензина II и производного нитрооксициклопентана по настоящему изобретению.
Режимы дозирования для использования соединения по настоящему изобретению выбирают в соответствии с целым рядом факторов, включающих тип, разновидности, возраст, массу тела, пол и медицинское состояние пациента; тяжесть состояния, подвергаемого лечению; путь введения; функцию почек и печени пациента; и конкретно используемое соединение или его соль. Лечащий врач или ветеринар легко может определить и назначить эффективное количество лекарственного средства, необходимое для профилактики, противодействия или задержки прогрессирования патологического состояния.
Пероральные дозы соединений по настоящему изобретению при использовании для получения указанных эффектов, будут находиться в интервале, от примерно 0,0125 мг на кг массы тела в день (мг/кг/день) до примерно 7,5 мг/кг/день, предпочтительно от 0,0125 мг/кг/день до 3,75 мг/кг/день, и более предпочтительно от 0,3125 мг/кг/день до 1,875 мг/кг/день. Например, пациент с массой тела 80 кг получал бы примерно от 1 мг/день до 600 мг/день, предпочтительно от 1 мг/день до 300 мг/день, более предпочтительно от 5 мг/день до 150 мг/день, и более предпочтительно от 5 мг/день до 100 мг/день. Подходящим образом полученное лекарственное средство для однократного суточного введения, таким образом, содержало бы от 1 мг до 600 мг, предпочтительно 1 мг до 300 мг, и более предпочтительно от 25 мг до 300 мг, например, 25 мг, 50 мг, 100 мг, 150, 200, 250 и 300 мг. Преимущественно, соединение по настоящему изобретению можно вводить разделенными дозами два, три или четыре раза в день. Для введения дважды в день подходящим образом полученное лекарственное средство содержало бы от 0,5 мг до 300 мг, предпочтительно от 0,5 мг до 150 мг, более предпочтительно от 12,5 мг до 150 мг, например, 12,5 мг, 25 мг, 50 мг, 75 мг, 100 мг, 125 мг и 150 мг.
Соединения по настоящему изобретению можно вводить в таких пероральных формах, как таблетки, капсулы и гранулы. Соединения по настоящему изобретению обычно вводят в виде активных ингредиентов в смеси с подходящими фармацевтическими связующими, как описано ниже. % масс/масс выражает массовый процент указанного компонента композиции по сравнению со всей композицией. Подходящие наполнители, используемые в этих лекарственных формах, включают микрокристаллическую целлюлозу, силицифированную микрокристаллическую целлюлозу, дикальция фосфат, лактозу, маннит и крахмал, предпочтительно микрокристаллическую целлюлозу, дикальция фосфат, лактозу или их смеси. Подходящие связующие включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, кукурузные подсластители, природные и синтетические камеди, такие как акациевая, трагакантовая или альгинат натрия, карбоксиметилцеллюлозу и поливинилпирролидон. Смазывающие вещества, используемые в этих лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия, стеарилфумарат натрия, стеариновую кислоту и подобное, предпочтительно, стеарат магния. Подходящие покрывающие композиции включают водную дисперсию или органический раствор нерастворимых полимеров, например, этилцеллюлозы, ацетатцеллюлозы, ацетатбутират целлюлозы и сополимеры акрилата, коммерчески известные как Эудрагит®. Пластификаторы включают тиэтилцитрат, дибутилсебакат, дибутилфталат, триацетин и касторовое масло. Противослеживающие агенты включают тальк, каолин, коллоидный диоксид кремния или их смеси.
СПОСОБЫ СИНТЕЗА
Некоторые способы получения соединений по настоящему изобретению описаны на следующих схемах и в примерах. Исходные вещества и промежуточные соединения получают в соответствии с известными методиками или как проиллюстрировано иным образом. R11 представляет собой азот-защищающую группу, такую как -CH2CH=CHR, где R представляет собой, например, водород, C1-6алкил, например, -C(CH3)3, арил и CH2арил. M представляет собой атом или группы, которые могут быть противоионом диазениумдиолатной соли, например, литий, натрий, калий, рубидий, цезий, магний, кальций, стронций, барий или аммоний R13R14R15R16N+, где R13-R16 представляют собой водород или C1-6алкил. R12 представляет собой, например, метил, CF3 или замещенный фенил. Х представляет собой Cl или -OSO2R12.
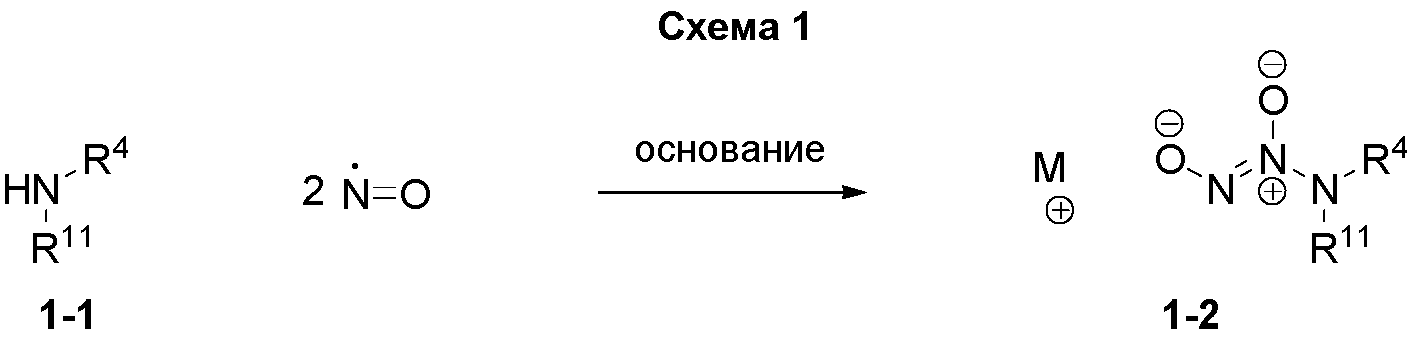
На схеме 1 описан удобный способ получения диазениумдиолатов щелочных металлов общей структуры 1-2 в настоящем изобретении. Аллиламин 1-1 обрабатывают оксидом азота при соответствующей температуре, например, при комнатной температуре, в присутствии подходящего основания, такого как гидроксид натрия, метоксид натрия, трет-бутоксид натрия, триметилсиланолат натрия или соответствующие калийные основания, в подходящем растворителе, таком как ацетонитрил, метанол, тетрагидрофуран, N,N-диметилформамид или вода. Примеры получения диазениумдиолатов натрия можно найти в литературе (Chakrapani, H.; Showalter, B. M.; Citro, M. L.; Keefer, L. K.; Saavedra, J. E. Org. Lett. 2007, 9, 4551-4554 и WO 2009/094242).
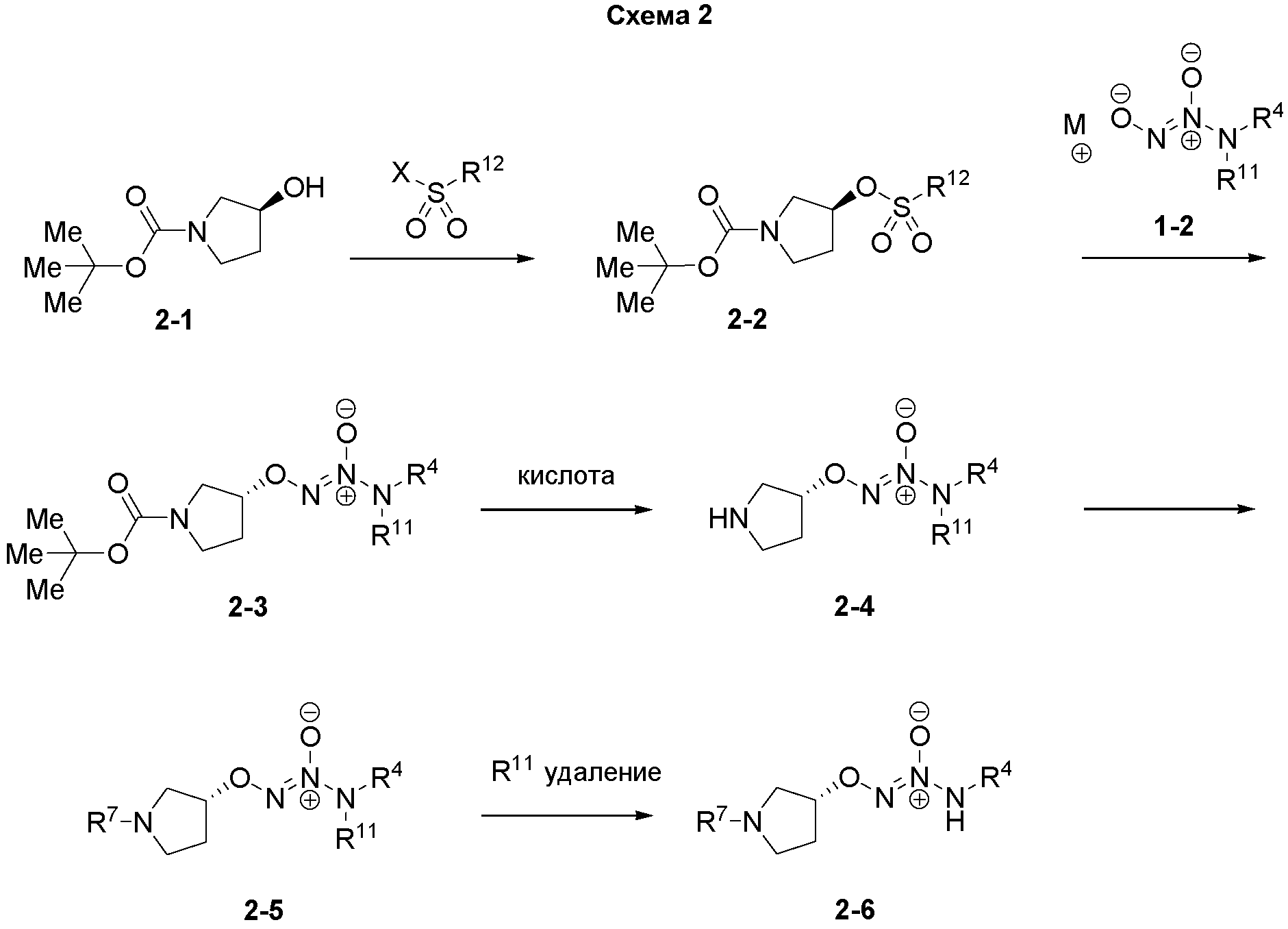
На схеме 2 представлен способ получения O2-алкилированных диазениумдиолатов общей структуры 2-6 в настоящем изобретении. Трет-бутоксикарбонил-защищенные пирролидинолы общей структуры 2-1 могут быть активированы для замещения при соответствующей температуре, например, при комнатной температуре, подходящим реагентом, таким как метансульфоновый ангидрид, бензолсульфонилхлорид, 4-(трифторметил)фенилсульфонилхлорид, в присутствии или отсутствие основания, такого как N,N-диизопропилэтиламин, триэтиламин, N-метилморфолин, пиридин или лутидин, в подходящем растворителе, таком как дихлорметан, дихлорэтан, хлороформ, ацетонитрил, тетрагидрофуран, диоксан, толуол, N,N-диметилформамид или N-метилпирролидинон. Полученный в результате сульфонат 2-2 может быть замещен соответствующей диазениумдиолатной солью щелочного металла 1-2 при соответствующей температуре, например, при комнатной температуре, в подходящем растворителе, таком как дихлорметан, дихлорэтан, хлороформ, ацетонитрил, тетрагидрофуран, диоксан, толуол, диметоксиэтан, N,N-диметилформамид или N-метилпирролидинон. В результате замещения обычно происходит инвертирование стереохимии атома углерода сульфоната. Трет-бутоксикарбонильная защищающая группа затем может быть удалена из продукта 2-3 кислотой, такой как хлористоводородная кислота, трифторуксусная кислота или фосфорная кислота, с получением функционализированных пирролидинов 2-4. Желаемая группа R7 может быть присоединена к пирролидину 2-4 с использованием соответствующего способа. Например, если R7 представляет собой ароматический или гетероароматический заместитель, соответствующий ароматический или гетероароматический галогенид может быть присоединен к соединению 2-4 с помощью соответствующей комбинации источника палладия, такого как ацетат палладия(II), хлорид палладия(II), трис(дибензилиденацетон) ди(палладий), с соответствующим лигандом, таким как трифенилфосфин, три(трет-бутил)фосфин, трициклогексилфосфин, рацемический 2,2′-бис(дифенилфосфино)-1,1′-бинафтил, 1,1′-бис(дифенилфосфино)ферроцен, 1,2-бис(дифенилфосфино)этан, 1,2-бис(дифенилфосфино)пропан, 2-(ди-трет-бутилфосфино)бифенил, 2-дициклогексилфосфино-2′,6′-диметокси-1,1′-бифенил или соответствующего паллацикла, такого как хлор[2-(дициклогексилфосфино)-3,6-диметокси-2′-4′-6′-триизопропил-1,1′-бифенил][2-(2-аминоэтил)фенил]палладий(II). Альтернативно, если R7 представляет собой электрон-дефицитную ароматическую или гетероароматическую систему, присоединение может осуществляться через нуклеофильное ароматическое соединение путем взаимодействия соответствующего ароматического или гетероароматического галогенида с соединением 2-4 в присутствии подходящего основания, такого как карбонат калия, карбонат цезия, триэтиламин, при повышенной температуре. Если R7 представляет собой ацильную или сульфонильную группу, может быть использован соответствующий ацилгалогенид или сульфонилгалогенид. Если R7 представляет собой карбамоильную группу, может быть использован соответствующий изоцианат. R11 удаляют на последней стадии. В тех случаях, когда R11 представляет собой аллильную группу, с продукта 2-5 может быть снята защита с использованием подходящей комбинации палладия или источника платины, например, ацетата палладия(II), хлорида палладия(II), трис(дибензилиденацетон) ди(палладия), дихлор(1,5-циклооктадиен)платины(II), с соответствующим лигандом, таким как трифенилфосфин, три(трет-бутил)фосфин, трициклогексилфосфин, рацемический 2,2′-бис(дифенилфосфино)-1,1′-бинафтил, 1,1′-бис(дифенилфосфино)ферроцен, 1,2-бис(дифенилфосфино)этан, 1,2-бис(дифенилфосфино)пропан, 2-(ди-трет-бутилфосфино)бифенил, 2-дициклогексилфосфино-2′,6′-диметокси-1,1′-бифенил, или соответствующим паллациклом, таким как хлор[2-(дициклогексилфосфино)-3,6-диметокси-2′-4′-6′-триизопропил-1,1′-бифенил][2-(2-аминоэтил)фенил]палладий(II), или источником гетерогенного палладия или платины, таким как палладий на угле, отравленный палладий на карбонате кальция, платина на угле, сульфидированная платина на угле, в присутствии подходящего поглотителя, такого как N,N′-диметилбарбитуровая кислота, димедон, тиосалициловая кислота, или подходящего донора водорода, такого как газообразный водород, муравьиная кислота, боргидрид натрия, триэтилсилан, трибутилстаннат.
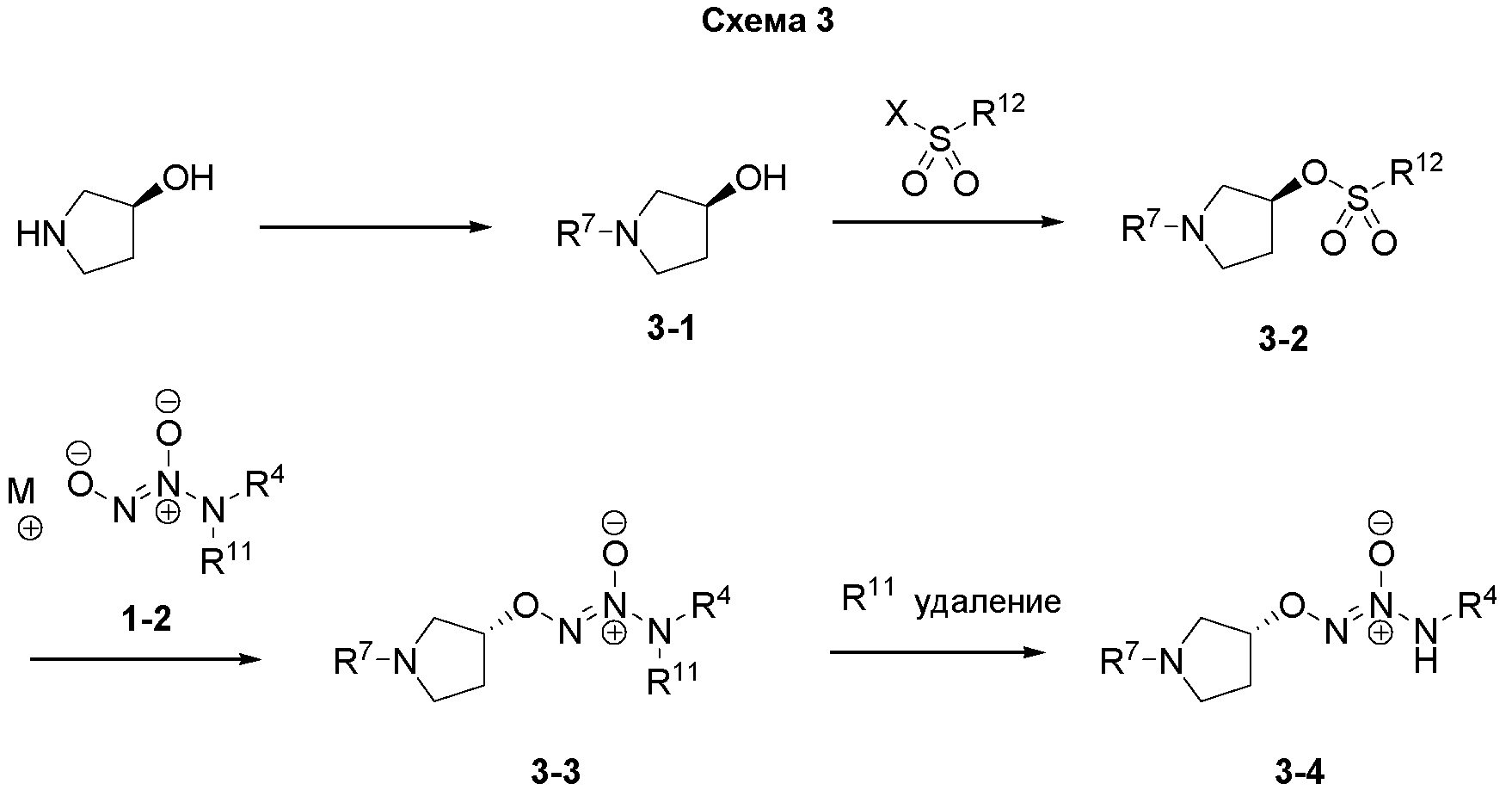
На схеме 3 описан альтернативный способ получения O2-алкилированных диазениумдиолатов общей структуры 3-4 в настоящем изобретении. Стадии сходны со стадиями, представленными на схеме 2, но порядок выполнения этих стадий изменен. R7 сначала может быть введен в пирролидинол, и продукты 3-1 могут быть активированы для замещения. Полученные в результате сульфонаты 3-2 могут быть замещены соответствующей диазениумдиолатной солью щелочного металла 1-2 с получением на выходе соединения 3-3. R11 удаляют на последней стадии. Характерные условия для выполнения преобразований были описаны выше.
ПРИМЕР 1
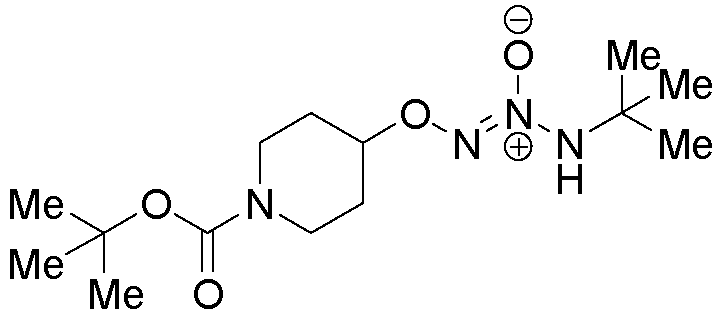
O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: трет-бутил 4-({[4-(трифторметил)фенил]сульфонил}окси)пиперидин-1-карбоксилат
К перемешиваемому дихлорметановому (50 мл) раствору трет-бутил 4-гидроксипиперидин-1-карбоксилата (3,90 г, 19,4 ммоль), 4-(диметиламино)пиридина (0,23 г, 1,9 ммоль) и триэтиламина (8,0 мл, 57 ммоль) добавляли 4-(трифторметил)бензолсульфонилхлорид (4,75 г, 19,4 ммоль). Реакционную смесь перемешивали в течение двух часов при комнатной температуре. Реакцию гасили 1,0 M хлористоводородной кислотой (100 мл) и экстрагировали простым диэтиловым эфиром (2×250 мл). Объединенные органические экстракты сушили (сульфат магния), фильтровали и концентрировали в вакууме с получением сырого продукта. Этот продукт использовали на последующей стадии без дополнительной очистки.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,06 (д, J=8,2 Гц, 2H), 7,83 (д, J=8,2 Гц, 2H), 4,79 (тт, J=7,6, 3,6 Гц, 1H), 3,62 (ддд, J=13,6, 7,4, 4,0 Гц, 2H), 3,27 (ддд, J=13,8, 7,8, 3,9 Гц, 2H), 1,86-1,79 (м, 2H), 1,75-1,68 (м, 2H), 1,44 (с, 9H).
Стадия B: O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
К перемешиваемому N,N-диметилформамидному (13 мл) раствору трет-бутил 4-({[4-(трифторметил)фенил]сульфонил}окси)пиперидин-1-карбоксилата (2,1 г, 5,1 ммоль) при 50°C добавляли 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат натрия (1,0 г, 5,1 ммоль). Реакционную смесь перемешивали при 50°C в течение 2 часов. Реакционную смесь разбавляли водой (25 мл) и экстрагировали простым диэтиловым эфиром (4×40 мл). Объединенные органические экстракты сушили (сульфат магния), фильтровали и концентрировали в вакууме с получением сырого продукта. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение в виде бесцветной жидкости.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,77 (ддт, J=17,1, 10,0, 6,7 Гц, 1H), 5,27 (дд, J=17,1, 1,6 Гц, 1H), 5,15 (д, J=10,1 Гц, 1H), 4,48-4,41 (м, 1H), 3,83-3,73 (шир.с, 2H), 3,64 (д, J=6,8 Гц, 2H), 3,14 (ддд, J=13,6, 9,0, 3,6 Гц, 2H), 2,00-1,90 (шир.с, 2H), 1,75 (дтд, J=13,3, 8,7, 4,0 Гц, 2H), 1,45 (с, 9H), 1,26 (с, 9H); ЖХ/МС: m/z 379,2 (M+Na).
Стадия C: O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
К перемешиваемому метанольному (11,8 мл) раствору O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолата (422 мг, 1,19 ммоль) добавляли сульфидированную платину на угле (5 масс.%, 462 мг, 0,118 ммоль). Реакционную смесь нагревали до 60°C при перемешивании в течение 4 часов, и две партии муравьиной кислоты (91 мкл, 2,1 ммоль) добавляли каждые 2 часа. Реакционную смесь фильтровали через диатомитовую землю и концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение в виде твердого вещества белого цвета.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,82 (с, 1H), 4,39 (тт, J=8,6, 3,9 Гц, 1H), 4,05-3,65 (м, 2H), 3,16 (ддд, J=13,6, 9,2, 3,5 Гц, 2H), 2,12-1,86 (м, 2H), 1,79 (дтд, J=13,2, 8,9, 4,1 Гц, 2H), 1,48 (с, 9H), 1,33 (с, 9H); ЖХ/МС: m/z 339,1 (M+Na).
ПРИМЕР 2
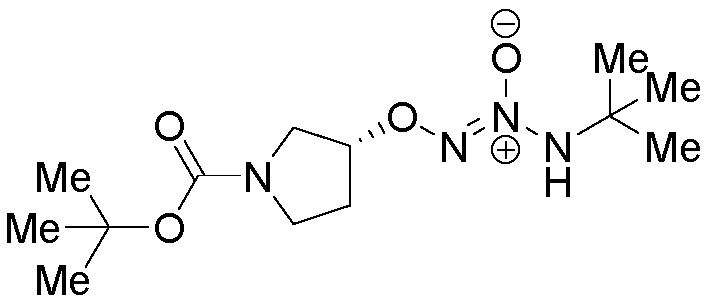
O2-[(3R)-1-(трет-бутоксикарбонил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, заменяя трет-бутил (3S)-3-гидроксипирролидин-1-карбоксилат на трет-бутил 4-гидроксипиперидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,95-5,89 (м, 1H), 4,87 (шир.с, 1H), 3,75-3,45 (м, 4H), 2,29-2,22 (м, 1H), 2,15-2,03 (м, 1H), 1,46 (с, 9H), 1,32 (с, 9H); ЖХ/МС: m/z 303,2 (M+H).
ПРИМЕР 3
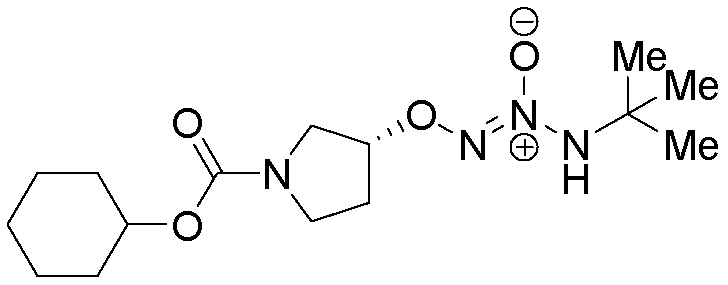
O2-{(3R)-1-[(циклогексилокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: O2-[(3R)-1-(трет-бутоксикарбонил)пирролидин-3-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, стадии A и B, заменяя трет-бутил (3S)-3-гидроксипирролидин-1-карбоксилат на трет-бутил 4-гидроксипиперидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,81 (ддт, J=17,1, 10,0, 6,7 Гц, 1H), 5,30 (д, J=17,1 Гц, 1H), 5,20 (д, J=9,1 Гц, 1H), 4,95 (шир.с, 1H), 3,69-3,43 (м, 6H), 2,27 (дд, J=13,8, 6,4 Гц, 1H), 2,13-2,06 (м, 1H), 1,47 (с, 9H), 1,29 (с, 9H); ЖХ/МС: m/z 365,1 (M+Na).
Стадия B: O2-[(3R)-пирролидин-3-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
К дихлорметановому (8 мл) раствору O2-[(3R)-1-(трет-бутоксикарбонил)пирролидин-3-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолата (1,00 г, 2,92 ммоль) при комнатной температуре добавляли 4,0 M диоксановый раствор хлористоводородной кислоты (1,46 мл, 5,84 ммоль). Реакционную смесь перемешивали в течение 16 часов и концентрировали в вакууме с получением гидрохлоридной соли названного соединения. Этот сырой продукт использовали на последующей стадии без дополнительной очистки. ЖХ/МС: m/z 243,3 (M+H).
Стадия C: O2-{(3R)-1-[(циклогексилокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
К дихлорметановому (4 мл) раствору O2-[(3R)-пирролидин-3-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолата (400 мг, 1,44 ммоль) при комнатной температуре добавляли триэтиламин (0,60 мл, 4,3 ммоль), с последующим добавлением циклогексилхлорформиата (350 мг, 2,15 ммоль). Через 2 часа реакционную смесь концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение в виде масла.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,78 (м, 1H), 5,28 (м, 1H), 5,16 (м, 1H), 4,94 (м, 1H), 4,66 (м, 1H), 3,71-3,20 (м, 6H), 2,23 (м, 1H), 2,05 (м, 1H), 1,80 (м, 2H), 1,70 (м, 2H), 1,50-1,20 (м, 15H); ЖХ/МС: m/z 391,3 (M+Na).
Стадия D: O2-{(3R)-1-[(циклогексилокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, стадия C, заменяя O2-{(3R)-1-[(циклогексилокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат на O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат.
¹Н-ЯМР (500 МГц, CDCl3) δ 6,00 (шир.с, 1H), 4,85 (м, 1H), 4,64 (м, 1H), 3,73-3,45 (м, 4H), 2,23 (м, 1H), 2,09 (м, 1H), 1,80 (м, 2H), 1,70 (м, 2H), 1,50-1,20 (м, 15H); ЖХ/МС: m/z 351,4 (M+Na).
ПРИМЕР 4
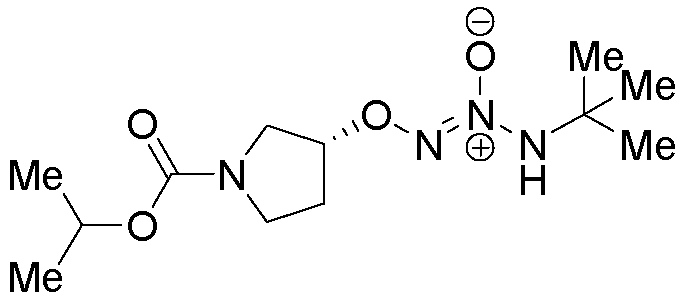
O2-{(3R)-1-[(пропан-2-илокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 3, заменяя изопропилхлорформиат на циклогексилхлорформиат на стадии C.
¹Н-ЯМР (500 МГц, CDCl3) δ 6,14 (м, 1H), 4,80 (м, 2H), 3,62-3,35 (м, 4H), 2,14 (м, 1H), 2,00 (м, 1H), 1,19 (с, 9H), 1,12 (д, J=6,0 Гц, 6H); ЖХ/МС: m/z 311,4 (M+Na).
ПРИМЕР 5
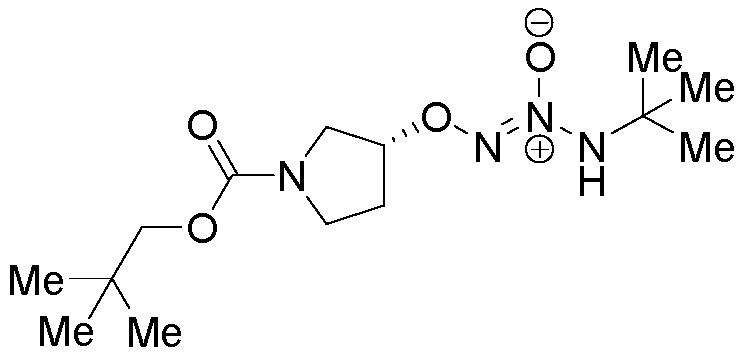
O2-{(3R)-1-[(2,2-диметилпропокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: 2,2-диметилпропил (3S)-3-гидроксипирролидин-1-карбоксилат
К смеси дихлорметана (5 мл) и воды (5 мл) добавляли бикарбонат натрия (0,96 г, 11 ммоль), с последующим добавлением (3S)-пирролидин-3-ола (1,00 г, 11,5 ммоль). Затем по каплям добавляли неопентилхлорформиат (1,71 мл, 11,5 ммоль), и полученную в результате суспензию перемешивали при комнатной температуре в течение 1,5 часа. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение.
¹Н-ЯМР (500 МГц, CDCl3) δ 4,50 (шир.с, 1H), 3,81-3,77 (м, 2H), 3,59-3,41 (м, 4H), 2,07-1,96 (м, 2H), 1,75-1,72 (м, 1H), 0,97 (с, 9H).
Стадия B: O2-{(3R)-1-[(2,2-диметилпропокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, заменяя 2,2-диметилпропил (3S)-3-гидроксипирролидин-1-карбоксилат на трет-бутил 4-гидроксипиперидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 6,00 (шир.с, 1H), 4,85 (м, 1H), 4,64 (м, 1H), 3,73-3,45 (м, 4H), 2,23 (м, 1H), 2,09 (м, 1H), 1,80 (м, 2H), 1,70 (м, 2H), 1,50-1,20 (м, 15H); ЖХ/МС: m/z 339,4 (M+Na).
ПРИМЕР 6
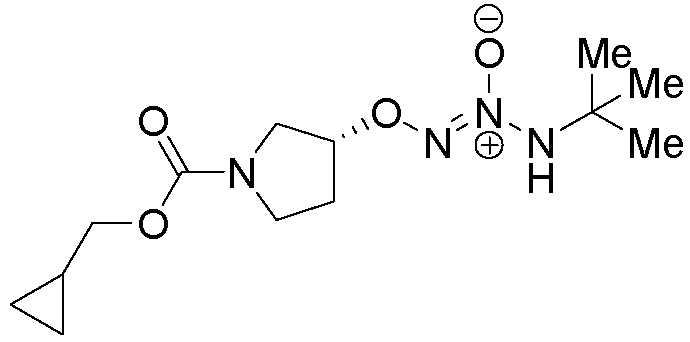
O2-{(3R)-1-[(циклопропилметокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: O2-{(3R)-1-[(циклопропилметокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
К ацетонитрильному (10 мл) раствору циклопропанметанола (0,71 мл, 9,0 ммоль) и триэтиламина (1,25 мл, 8,97 ммоль) добавляли N,N′-дисукцинимидилкарбонат (1840 мг, 7,17 ммоль). Полученную в результате смесь перемешивали при комнатной температуре в течение 16 часов, затем к ней добавляли гидрохлоридную соль O2-[(3R)-пирролидин-3-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолата (500 мг, 1,79 ммоль), с последующим добавлением еще 2,5 эквивалента триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение еще 4 часов. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,80 (м, 1H), 5,31 (м, 1H), 5,20 (м, 1H), 4,98 (м, 1H), 4,20 (д, J=7,4 Гц, 2H), 3,92 (м, 2H), 3,67 (м, 1H), 3,65 (м, 3H), 2,23 (м, 1H), 2,30 (м, 1H), 1,30 (с, 9H), 1,08 (м, 1H), 0,70 (м, 2H), 0,40 (м, 2H); ЖХ/МС: m/z 363,4 (M+Na).
Стадия B: O2-{(3R)-1-[(циклопропилметокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, стадия C, заменяя O2-{(3R)-1-[(циклопропилметокси)карбонил]пирролидин-3-ил} 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат на O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат.
¹Н-ЯМР (500 МГц, CDCl3) δ 6,00 (м, 1H), 4,84 (м, 1H), 3,85 (д, J=7,2 Гц, 2H), 3,70 (м, 1H), 3,60-3,46 (м, 3H), 2,24 (м, 1H), 2,07 (м, 1H), 1,26 (с, 9H), 1,08 (м, 1H), 0,49 (м, 2H), 0,22 (м, 2H); ЖХ/МС: m/z 323,3 (M+Na).
ПРИМЕР 7
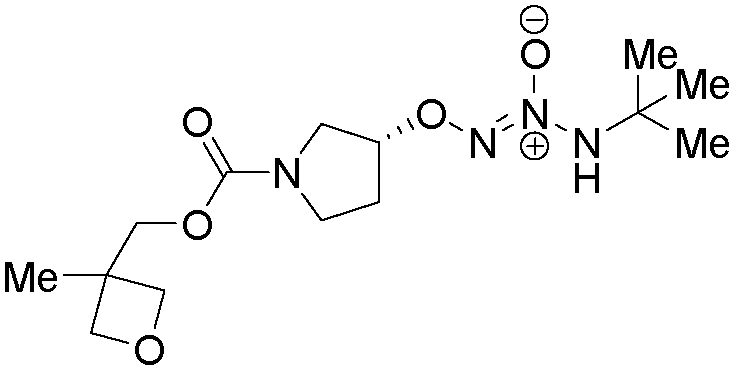
O2-[(3R)-1-{[(3-метилоксетан-3-ил)метокси]карбонил}пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 6, заменяя (3-метилоксетан-3-ил)метанол на циклопропанметанол на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,98 (м, 1H), 4,95 (м, 1H), 4,56 (м, 2H), 4,20 (м, 3H), 4,10 (м, 2H), 3,78 (м, 2H), 3,60 (м, 4H), 2,30 (м, 1H), 2,05 (м, 1H), 1,32 (с, 9H); ЖХ/МС: m/z 331,4 (M+H).
ПРИМЕР 8
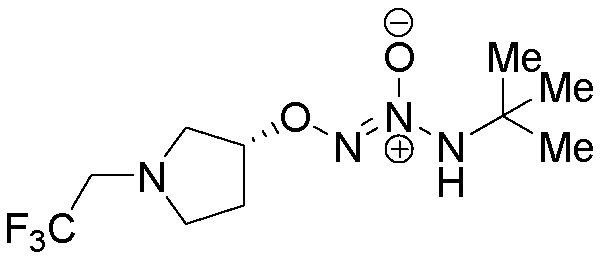
O2-[(3R)-1-(2,2,2-трифторэтил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: O2-[(3R)-1-(2,2,2-трифторэтил)пирролидин-3-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
К N,N-диметилформамидному (10 мл) раствору гидрохлоридной соли O2-[(3R)-пирролидин-3-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолата (пример 3, стадия B, 500 мг, 1,47 ммоль) добавляли триэтиламин (410 мкл, 2,95 ммоль) и 2,2,2-трифторэтил метансульфонат (1,5 ммоль). Через 1 час реакционную смесь разбавляли дихлорметаном (30 мл) и промывали насыщенным солевым раствором. Органический слой сушили (сульфат натрия), фильтровали и концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,83 (м, 1H), 5,28 (д, 1H), 5,19 (д, 1H), 4,98 (м, 1H), 3,67 (д, J=6,7 Гц, 2H), 3,29 (м, 1H), 3,16 (кв., J=9,5 Гц, 2H), 2,95 (м, 3H), 2,22-2,17 (м, 1H), 2,11-2,09 (м, 1H), 1,28 (с, 9H); ЖХ/МС: m/z 325,1 (M+H).
Стадия B: O2-[(3R)-1-(2,2,2-трифторэтил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, стадия C, заменяя O2-[(3R)-1-(2,2,2-трифторэтил)пирролидин-3-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат на O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,84 (с, 1H), 4,90-4,84 (м, 1H), 3,26 (дд, J=11,1, 6,2 Гц, 1H), 3,12 (кв., J=9,5 Гц, 2H), 2,90-2,83 (м, 3H), 2,25-2,14 (м, 1H), 2,12-2,05 (м, 1H), 1,30 (с, 9H); ЖХ/МС: m/z 285,2 (M+H).
ПРИМЕР 9
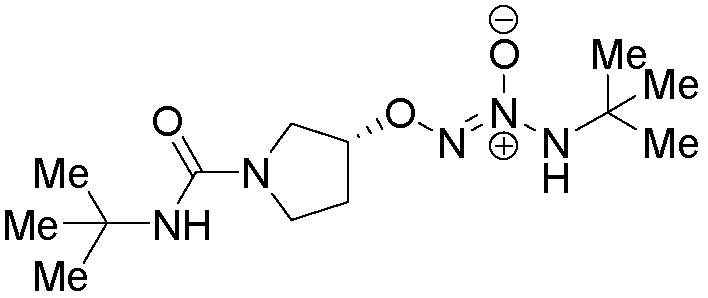
O2-[(3R)-1-(трет-бутилкарбамоил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: (3S)-N-трет-бутил-3-гидроксипирролидин-1-карбоксамид
К раствору (S)-3-гидроксипирролидина и триэтиламина (45,0 мл, 323 ммоль) в дихлорметане (200 мл) и простом диэтиловом эфире (200 мл) (19,8 мл, 244 ммоль) при 0°C добавляли трет-бутилизоцианат (28,0 мл, 245 ммоль). Реакционную смесь перемешивали в течение 1 часа при 0°C, фильтровали, и концентрировали в вакууме с получением названного соединения в виде твердого вещества белого цвета. Этот сырой продукт использовали на последующей стадии без дополнительной очистки.
¹Н-ЯМР (500 МГц, CDCl3) δ 4,50-4,45 (м, 1H), 3,50-3,34 (м, 4H), 2,08-1,93 (м, 2H), 1,35 (с, 9H); ЖХ/МС: m/z 187,3 (M+H).
Стадия B: O2-[(3R)-1-(трет-бутилкарбамоил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, заменяя (3S)-N-трет-бутил-3-гидроксипирролидин-1-карбоксамид на трет-бутил 4-гидроксипиперидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,87 (с, 1H), 4,90-4,85 (м, 1H), 4,02 (с, 1H), 3,66 (дт, J=12,1, 1,5 Гц, 1H), 3,58 (дд, J=12,1, 4,8 Гц, 1H), 3,47-3,38 (м, 2H), 2,33-2,26 (м, 1H), 2,16 (дтд, J=13,9, 9,4, 5,0 Гц, 1H), 1,34 (с, 9H), 1,31 (с, 9H); ЖХ/МС: m/z 302,2 (M+H).
ПРИМЕР 10
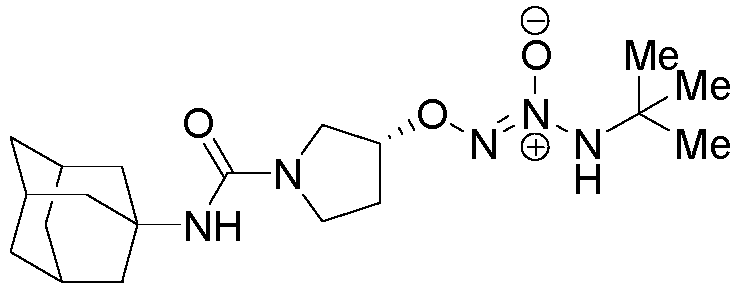
O2-[(3R)-1-(трицикло[3.3.1.13,7]дец-1-илкарбамоил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 9, заменяя 1-адамантилизоцианат на трет-бутилизоцианат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,89 (с, 1H), 4,90-4,92 (м, 1H), 3,93 (с, 1H), 3,68 (д, J=12,2 Гц, 1H), 3,62 (дд, J=12,2, 4,8 Гц, 1H), 3,49-3,42 (м, 2H), 2,42-2,31 (м, 1H), 2,22-2,15 (м, 1H), 2,10 (с, 3H), 2,01 (шир.с, 6H), 1,70 (м, 6H), 1,34 (с, 9H); ЖХ/МС: m/z 402,1 (M+Na).
ПРИМЕР 11
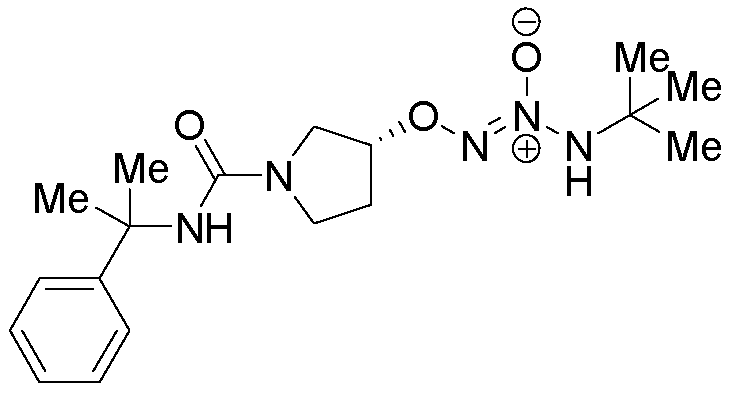
O2-{(3R)-1-[(2-фенилпропан-2-ил)карбамоил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: трет-бутил (3S)-3-[(фенилкарбонил)окси]пирролидин-1-карбоксилат
К дихлорметановому (100 мл) раствору бензойной кислоты (4,03 г, 33,0 ммоль) и N-(3-диметиламинопропил)-N′-этилкарбодиимидгидрохлорида (10,4 г, 54,0 ммоль) добавляли трет-бутил (3S)-3-гидроксипирролидин-1-карбоксилат (5,62 г, 30,0 ммоль). Реакционную смесь перемешивали в течение 6 часов при комнатной температуре, разбавляли водой (200 мл) и вносили простой диэтиловый эфир (200 мл). Объединенные органические экстракты промывали насыщенным водным бикарбонатом натрия, солевым раствором, сушили (сульфат натрия) и концентрировали в вакууме с получением названного соединения. Этот сырой продукт использовали на последующей стадии без дополнительной очистки.
Стадия B: (3S)-пирролидин-3-ил бензоат
К дихлорметановому (5 мл) раствору трет-бутил (3S)-3-[(фенилкарбонил)окси]пирролидин-1-карбоксилата (2,62 г, 9,00 ммоль) добавляли по каплям трифторуксусную кислоту (5,55 мл, 72,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Концентрирование реакционной смеси в вакууме давало трифторацетатную соль названного соединения. Этот сырой продукт использовали на последующей стадии без дополнительной очистки.
Стадия C: (2-изоцианатпропан-2-ил)бензол
К бензольному (2 мл) раствору кумиламина (1,80 г, 13,3 ммоль) и триэтиламина (1,86 мл, 13,3 ммоль) добавляли по каплям 20% толуольный раствор фосгена (17,5 мл, 33,3 ммоль). После завершения реакционную смесь нагревали до 60°C в течение 2 часов. Затем ее охлаждали до комнатной температуры, вносили простой диэтиловый эфир (20 мл) и фильтровали. Концентрирование фильтрата в вакууме давало названное соединение. Этот сырой продукт использовали на последующей стадии без дополнительной очистки.
Стадия D: (3S)-1-(2-фенилпропан-2-ил)пирролидин-3-ил бензоат
Названное соединение получали в соответствии с методиками, описанными в примере 9, стадия A, заменяя (3S)-пирролидин-3-ил бензоат на (S)-3-гидроксипирролидин и (2-изоцианатпропан-2-ил)бензол на трет-бутил изоцианат.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,03 (дд, J=8,4, 1,2 Гц, 2H), 7,59 (т, J=7,5 Гц, 1H), 7,46 (т, J=7,8 Гц, 2H), 7,42 (д, J=7,4 Гц, 2H), 7,32 (т, J=7,7 Гц, 2H), 7,22 (т, J=7,3 Гц, 1H), 5,57 (с, 1H), 4,61 (шир.с, 1H), 3,71 (дд, J=11,6, 4,8 Гц, 1H), 3,62-3,53 (м, 3H), 2,28-2,24 (м, 2H), 1,73 (с, 6H); ЖХ/МС: m/z 353,0 (M+H).
Стадия E: (3S)-1-(2-фенилпропан-2-ил)пирролидин-3-ол
К метанольному (15 мл) раствору (3S)-1-(2-фенилпропан-2-ил)пирролидин-3-ил бензоата (2,50 г, 7,09 ммоль) добавляли 4,0 M раствор гидроксида калия (3,19 мл, 12,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, и концентрировали в вакууме. Остаток растворяли в дихлорметане (50 мл), промывали водой (50 мл), сушили (сульфат натрия), и концентрировали в вакууме с получением названного соединения в виде твердого вещества белого цвета. Этот сырой продукт использовали на последующей стадии без дополнительной очистки.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,42 (д, J=7,8 Гц, 2H), 7,32 (т, J=7,7 Гц, 2H), 7,21 (т, J=7,3 Гц, 1H), 4,52 (с, 1H), 4,40 (шир.с, 1H), 3,49-3,38 (м, 3H), 3,34 (д, J=11,0 Гц, 1H), 2,04-1,91 (м, 2H), 1,71 (с, 6H); ЖХ/МС: m/z 249,2 (M+H).
Стадия F: O2-{(3R)-1-[(2-фенилпропан-2-ил)карбамоил]пирролидин-3-ил} 1-(N-трет-бутиламино) диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, заменяя (3S)-1-(2-фенилпропан-2-ил)пирролидин-3-ол на трет-бутил 4-гидроксипиперидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,45 (м, 2H), 7,35 (м, 2H), 7,24 (м, 1H), 5,90 (с, 1H), 4,92 (м, 1H), 4,52 (с, 1H), 3,71 (д, J=12,2 Гц, 1H), 3,65 (дд, J=12,2, 4,8 Гц, 1H), 3,55-3,49 (м, 2H), 2,38-2,33 (м, 1H), 2,25-2,17 (м, 1H), 1,73 (с, 3H), 1,74 (с, 3H), 1,34 (с, 9H); ЖХ/МС: m/z 364 (M+H).
ПРИМЕР 12
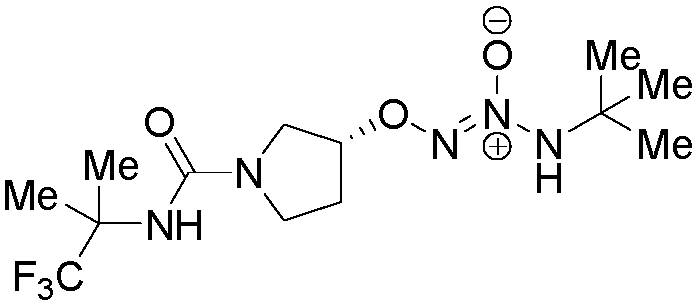
O2-{(3R)-1-[(1,1,1-трифтор-2-метилпропан-2-ил)карбамоил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 11, заменяя 2,2,2-трифтор-1,1-диметиламин на кумиламин на стадии C.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,91 (с, 1H), 4,93 (т, J=4,6 Гц, 1H), 4,22 (с, 1H), 3,72 (д, J=12,2 Гц, 1H), 3,63 (дд, J=12,2 Гц, 4,6 Гц, 1H), 3,54-3,48 (м, 2H), 2,39-2,35 (м, 1H), 2,25-2,17 (м, 1H), 1,66 (с, 3H), 1,62 (с, 3H), 1,30 (с, 9H); ЖХ/МС: m/z 356 (M+H).
ПРИМЕР 13
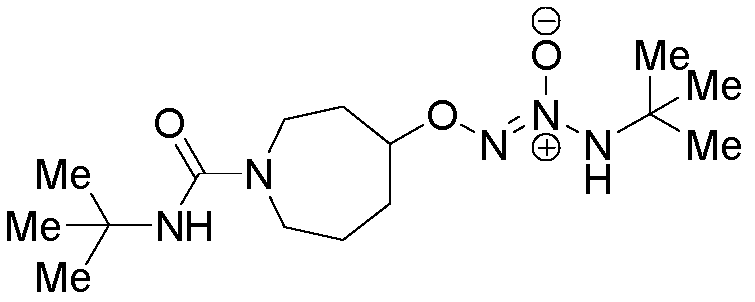
(±)-O2-[1-(трет-бутилкарбамоил)азепан-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: (±)-трет-бутил 4-гидроксиазепан-1-карбоксилат
К метанольному (250 мл) раствору трет-бутил 4-оксоазепан-1-карбоксилата (18,1 г, 85,0 ммоль) при 0°C добавляли боргидрид натрия (8,01 г, 212 ммоль). Реакционную смесь перемешивали в течение 2 часов перед концентрированием в вакууме. Остаток растворяли в дихлорметане (250 мл) и промывали насыщенным солевым раствором. Осадок удаляли фильтрованием, и фильтрат сушили (сульфат магния), фильтровали и концентрировали в вакууме с получением названного соединения.
¹Н-ЯМР (500 МГц, CDCl3) 3,87 (шир.с, 1H), 3,49-3,18 (м, 4H), 2,05-1,48 (м, 6H), 1,46 (с, 9H); ЖХ/МС: m/z 238,2 (M+Na).
Стадия B: (±)-O2-азепан-4-ил 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 3, стадии A и B, заменяя (±)-трет-бутил 4-гидроксиазепан-1-карбоксилат на трет-бутил (3S)-3-гидроксипирролидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 9,86-9,50 (м, 2H), 5,75 (ддт, J=17,1, 10,0, 6,7 Гц, 1H), 5,26 (дд, J=17,0, 1,6 Гц, 1H), 5,14 (д, J=10,1 Гц, 1H), 4,67-4,61 (м, 1H), 3,63 (д, J=6,8 Гц, 2H), 3,42-3,15 (м, 4H), 2,42-2,27 (м, 2H), 2,18-2,01 (м, 3H), 1,91-1,82 (м, 1H), 1,25 (с, 9H); ЖХ/МС: m/z 271,0 (M+H).
Стадия C: (±)-O2-[1-(трет-бутилкарбамоил)азепан-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 9, стадия A, заменяя (±)-O2-азепан-4-ил 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат на (S)-3-гидроксипирролидин.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,77 (ддт, J=17,1, 10,1, 6,7 Гц, 1H), 5,27 (дд, J=17,1, 1,6 Гц, 1H), 5,15 (д, J=10,1 Гц, 1H), 4,44 (тт, J=7,4, 3,8 Гц, 1H), 4,17 (шир.с, 1H), 3,64 (д, J=6,7 Гц, 2H), 3,49-3,39 (м, 3H), 3,27-3,19 (м, 1H), 2,15-2,07 (м, 1H), 2,03-1,88 (м, 4H), 1,72-1,58 (м, 1H), 1,35 (с, 9H), 1,26 (с, 9H); ЖХ/МС: m/z 370,1 (M+H).
Стадия D: (±)-O2-[1-(трет-бутилкарбамоил)азепан-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, стадия C, заменяя (±)-O2-[1-(трет-бутилкарбамоил)азепан-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат на O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,81 (с, 1H), 4,39 (тт, J=7,6, 3,5 Гц, 1H), 4,21 (с, 1H), 3,55-3,47 (м, 1H), 3,45 (т, J=5,7 Гц, 2H), 3,30-3,23 (м, 1H), 2,19-2,11 (м, 1H), 2,07-1,93 (м, 4H), 1,76-1,60 (м, 1H), 1,38 (с, 9H), 1,33 (с, 9H); ЖХ/МС: m/z 330,2 (M+H).
ПРИМЕР 14
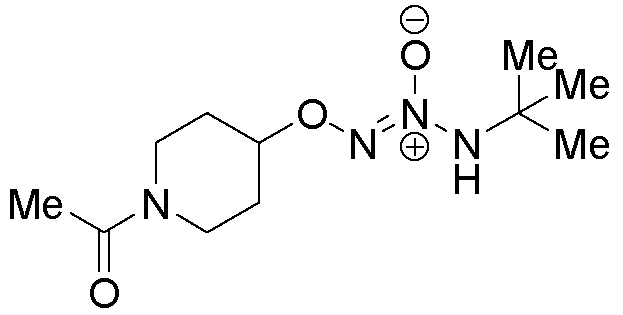
O2-(1-ацетилпиперидин-4-ил) 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: O2-(пиперидин-4-ил) 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 3, стадии A и B, заменяя трет-бутил 4-гидроксипиперидин-1-карбоксилат на трет-бутил(3S)-3-гидроксипирролидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,76 (ддт, J=17,1, 10,1, 6,7 Гц, 1H), 5,26 (дд, J=17,0, 1,6 Гц, 1H), 5,13 (дд, J=10,1, 1,5 Гц, 1H), 4,65-4,55 (м, 1H), 3,63 (д, J=6,8 Гц, 2H), 3,36-3,16 (м, 4H), 2,36-2,26 (м, 2H), 2,23-2,17 (м, 2H), 1,25 (с, 9H); ЖХ/МС: m/z 257,0 (M+H).
Стадия B: O2-(1-ацетилпиперидин-4-ил) 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
К дихлорметановому (20 мл) раствору O2-(пиперидин-4-ил) 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолата (1,18 г, 4,03 ммоль) и триэтиламина (1,40 мл, 10,1 ммоль) добавляли ацетилхлорид (0,344 мл, 4,84 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, разбавляли диэтиловым простым эфиром (40 мл), фильтровали и концентрировали в вакууме. Хроматография на силикагеле, элюирование этилацетатом/метанолом, давали названное соединение.
¹Н-ЯМР (500 МГц, CDCl3) δ 5.77 (ддт, J=17,1, 10,0, 6,7 Гц, 1H), 5,27 (дд, J=17,1, 1,6 Гц, 1H), 5,15 (дд, J=10,1, 1,5 Гц, 1H), 4,55-4,49 (м, 1H), 3,91 (ддд, J=13,5, 7,4, 4,1 Гц, 1H); 3,75-3,61 (м, 1H), 3,38 (ддд, J=13,7, 8,2, 3,9 Гц, 1H), 3,31 (ддд, J=13,9, 8,2, 3,7 Гц, 1H), 2,10 (с, 3H), 2,02-1,92 (м, 2H), 1,89-1,77 (м, 2H), 1,26 (с, 9H); ЖХ/МС: m/z 299,0 (M+H).
Стадия C: O2-(1-ацетилпиперидин-4-ил) 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, стадия C, заменяя O2-(1-ацетилпиперидин-4-ил) 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат на O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,87 (с, 1H), 4,45 (ддт, J=8,2, 7,6, 3,8 Гц, 1H), 3,98 (ддд, J=13,5, 7,1, 4,1 Гц, 1H), 3,73 (ддд, J=13,8, 7,1, 4,0 Гц, 1H), 3,42-3,30 (м, 2H), 2,12 (с, 3H), 2,05-1,95 (м, 2H), 1,95-1,74 (м, 2H), 1,32 (с, 9H); ЖХ/МС: m/z 259,3 (M+H).
ПРИМЕР 15
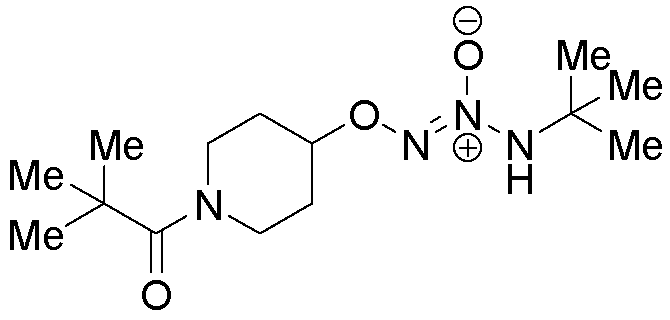
O2-[1-(2,2-диметилпропаноил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 14, заменяя пивалоилхлорид на ацетилхлорид на стадии B.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,83 (с, 1H), 4,47 (тт, J=8,1, 3,9 Гц, 1H), 4,03 (ддд, J=13,5, 6,7, 3,8 Гц, 2H), 3,39 (ддд, J=13,7, 8,7, 3,4 Гц, 2H), 2,05-1,98 (м, 2H), 1,88-1,79 (м, 2H), 1,34 (с, 9H), 1,31 (с, 9H); ЖХ/МС: m/z 301,1 (M+H).
ПРИМЕР 16
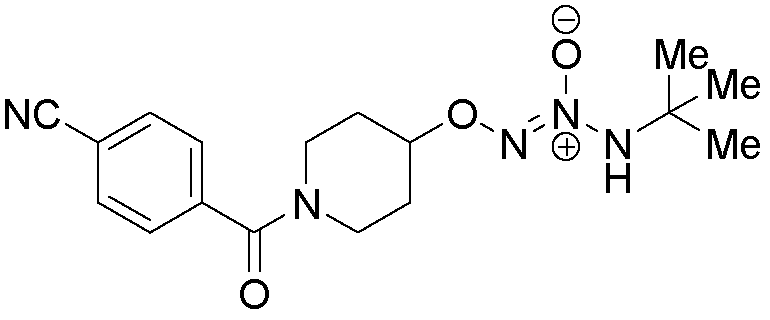
O2-{1-[(4-цианофенил)карбонил]пиперидин-4-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 14, заменяя 4-цианобензоилхлорид на ацетилхлорид на стадии B.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,75 (д, J=8,0 Гц, 2H), 7,52 (д, J=8,0 Гц, 2H), 5,87 (с, 1H), 4,56-4,50 (м, 1H), 4,20-3,94 (м, 1H), 3,65 (с, 2H), 3,44-3,13 (м, 1H), 2,16-2,01 (м, 1H), 2,10-1,85 (м, 2H), 1,98-1,72 (м, 1H), 1,34 (с, 9H); ЖХ/МС: m/z 346,1 (M+H).
ПРИМЕР 17
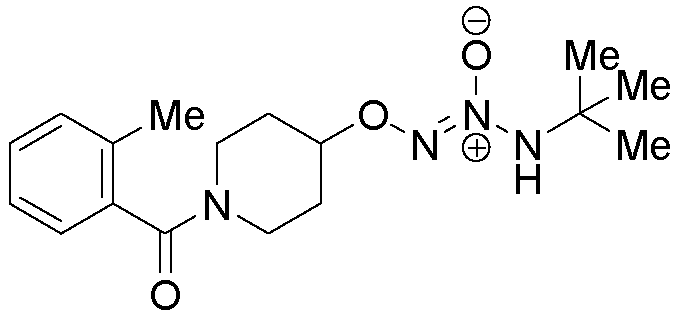
O2-{1-[(2-метилфенил)карбонил]пиперидин-4-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 14, заменяя o-толуоилхлорид на ацетилхлорид на стадии B.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,31-7,27 (м, 1H), 7,24-7,17 (м, 2H), 7,15 (д, J=7,4 Гц, 1H), 5,82 (с, 1H), 4,47 (с, 1H), 4,24-4,00 (м, 1H), 3,68-3,42 (м, 2H), 3,13 (ддд, J=13,7, 8,2, 3,7 Гц, 1H), 2,30 (с, 3H), 2,15-2,05 (м, 1H), 2,00-1,85 (м, 2H), 1,80-1,70 (м, 1H), 1,31 (с, 9H); ЖХ/МС: m/z 335,2 (M+H).
ПРИМЕР 18
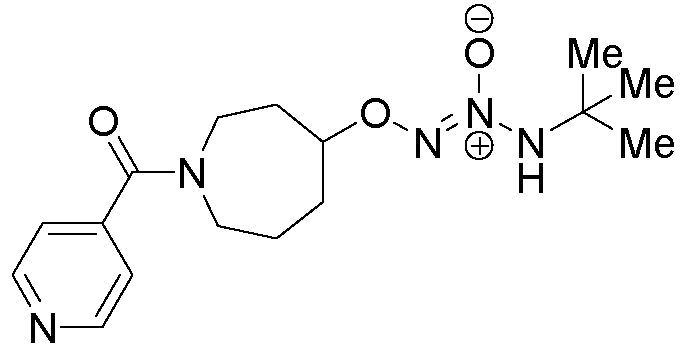
(±)-O2-[1-(пиридин-4-илкарбонил)азепан-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 14, заменяя (±)-O2-азепан-4-ил 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат (пример 13, стадия B) на O2-(пиперидин-4-ил) 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат и изоникотиноилхлорид гидрохлорид на ацетилхлорид на стадии B.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,72-8,70 (м, 2H), 7,33-7,29 (м, 2H), 5,84 (с, 1H, R1), 5,82 (с, 1H, R2), 4,55-4,43 (м, 1H), 3,84-3,64 (м, 2H), 3,52-3,26 (м, 2H), 2,29-2,15 (м, 1H), 2,13-1,75 (м, 4H), 1,65-1,55 (м, 1H), 1,34 (с, 9H, R1), 1,32 (с, 9H, R2); ЖХ/МС: m/z 336,1 (M+H).
ПРИМЕР 19
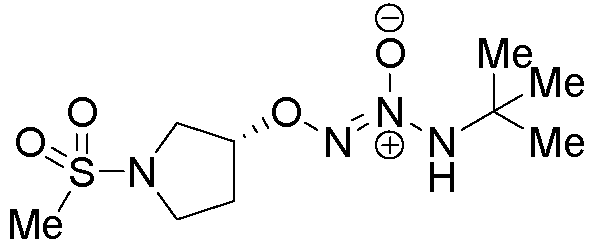
O2-[(3R)-1-(метилсульфонил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: (3S)-1-(метилсульфонил)пирролидин-3-ил метансульфонат
К дихлорметановому (200 мл) раствору (S)-3-гидроксипирролидина (5,0 г, 57 ммоль) и триэтиламина (24,0 мл, 172 ммоль) при 0°C добавляли метансульфонилхлорид (7,23 г, 63,1 ммоль). Затем добавляли 4-(диметиламино)пиридин (0,70 г, 5,7 ммоль), и эту смесь перемешивали при комнатной температуре в течение 2 часов. Смесь разбавляли дихлорметаном (50 мл), и объединенные органические слои промывали водной 1 M хлористоводородной кислотой (30 мл), водой (30 мл), насыщенным солевым раствором (30 мл), сушили (сульфат магния), фильтровали, и концентрировали в вакууме с получением названного соединения. Сырой продукт использовали на последующей стадии без дополнительной очистки.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,28 (т, J=4,5 Гц, 1H), 3,71 (д, J=12,9 Гц, 1H), 3,64 (дд, J=12,7, 4,0 Гц, 1H), 3,59 (тд, J=9,2, 2,3 Гц, 1H), 3,46 (тд, J=10,1, 6,7 Гц, 1H), 3,07 (с, 3H), 2,89 (с, 3H), 2,39-2,33 (м, 1H), 2,29-2,19 (м, 1H); ЖХ/МС: m/z 244,1 (M+H).
Стадия B: O2-[(3R)-1-(метилсульфонил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, стадии B и C, заменяя (3S)-1-(метилсульфонил)пирролидин-3-ил метансульфонат на трет-бутил 4-({[4-(трифторметил)фенил]сульфонил}окси)пиперидин-1-карбоксилат на стадии B.
¹Н-ЯМР (500 МГц, CDCl3) δ 4,93 (шир.с, 1H), 3,74-3,55 (м, 3H), 3,46-3,39 (м, 1H), 2,87 (с, 3H), 2,40-2,33 (м, 1H), 2,24-2,15 (м, 1H), 1,33 (с, 9H); ЖХ/МС: m/z 281,1 (M+H).
ПРИМЕР 20
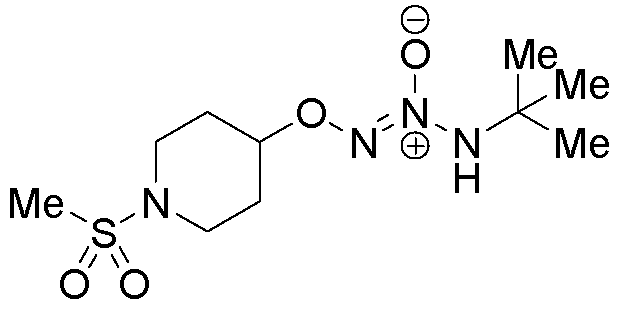
O2-[1-(метилсульфонил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: 1-(метилсульфонил)пиперидин-4-ил 4-(трифторметил)бензолсульфонат
К дихлорметановому (60 мл) раствору 4-гидроксипиперидина (2,00 г, 19,8 ммоль) и триэтиламина (4,13 мл, 29,7 ммоль) при 0°C добавляли метансульфоновый ангидрид (3,10 г, 17,8 ммоль). Реакционную смесь перемешивали в течение 1 часа, затем к ней добавляли 4-(диметиламино)пиридин (0,242 г, 1,98 ммоль), триэтиламин (4,13 мл, 29,7 ммоль) и 4-(трифторметил)бензолсульфонил хлорид (5,32 г, 21,8 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры, перемешивали в течение еще одного часа и концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение в виде твердого вещества белого цвета.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,06 (д, J=8,2 Гц, 2H), 7,85 (д, J=8,3 Гц, 2H), 4,84-4,79 (м, 1H), 3,36 (дт, J=12,3, 5,1 Гц, 2H), 3,27 (ддд, J=12,4, 8,3, 4,0 Гц, 2H), 2,79 (с, 3H), 2,11-1,90 (м, 4H); ЖХ/МС: m/z 388,0 (M+H).
Стадия B: O2-[1-(метилсульфонил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, стадии B и C, заменяя 1-(метилсульфонил)пиперидин-4-ил 4-(трифторметил)бензолсульфонат на трет-бутил 4-({[4-(трифторметил)фенил]сульфонил}окси)пиперидин-1-карбоксилат на стадии B.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,89 (с, 1H), 4,49-4,43 (м, 1H), 3,42-3,30 (м, 4H), 2,81 (с, 3H), 2,09-2,04 (м, 4H), 1,34 (с, 9H); ЖХ/МС: m/z 317,0 (M+Na).
ПРИМЕР 21
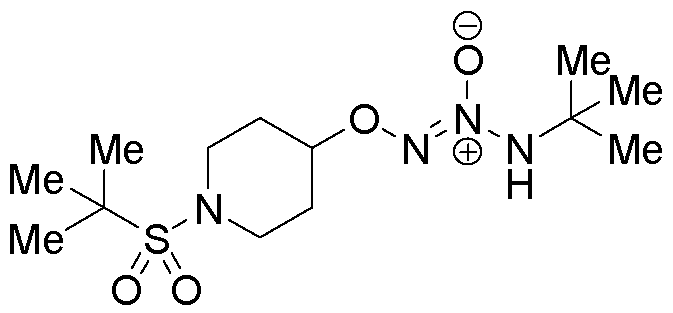
O2-[1-(трет-бутилсульфонил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: пиперидин-4-ил 4-(трифторметил)бензолсульфонат
К дихлорметановому (10 мл) раствору трет-бутил 4-({[4-(трифторметил)фенил]сульфонил}окси)пиперидин-1-карбоксилата (пример 1, стадия A, 1,20 г, 2,93 ммоль) добавляли трифторуксусную кислоту (500 мкл, 6,73 ммоль). Реакционную смесь перемешивали в течение 16 часов и концентрировали в вакууме с получением трифторацетатной соли названного соединения. Этот сырой продукт использовали на последующей стадии без дополнительной очистки. ЖХ/МС: m/z 309,9 (M+H).
Стадия B: 1-(трет-бутилсульфонил)пиперидин-4-ил 4-(трифторметил)бензолсульфонат
К тетрагидрофурановому (20 мл) раствору трифторацетатной соли пиперидин-4-ил 4-(трифторметил)бензолсульфоната (800 мг, 1,97 ммоль) при -78°C добавляли трет-бутилсульфинилхлорид (209 мкл, 2,20 ммоль). Реакционную смесь перемешивали в течение 10 минут при -78°C перед добавлением триэтиламина (1,10 мл, 7,88 ммоль). Затем эту смесь перемешивали в течение еще 2 часов при -78°C. К реакционной смеси добавляли простой диэтиловый эфир (50 мл), и объединенные органические слои промывали с использованием 1 M хлористоводородной кислоты (30 мл), водой (30 мл), насыщенным солевым раствором (30 мл), сушили (сульфат натрия), фильтровали, и концентрировали в вакууме. Полученное в результате масло растворяли в дихлорметане (20 мл), охлаждали до 0°C, и в раствор добавляли м-хлорпербензойную кислоту (374 мг, 2,17 ммоль). Ледяную баню убирали, и смесь перемешивали при комнатной температуре в течение 45 минут. Реакционную смесь промывали насыщенным бикарбонатом натрия (40 мл), водой (40 мл), насыщенным солевым раствором (40 мл), сушили (сульфат магния), фильтровали и концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение.
Стадия C: O2-[1-(трет-бутилсульфонил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, стадии B и C, заменяя 1-(трет-бутилсульфонил)пиперидин-4-ил 4-(трифторметил)бензолсульфонат на трет-бутил 4-({[4-(трифторметил)фенил]сульфонил}окси)пиперидин-1-карбоксилат на стадии B.
¹Н-ЯМР (500 МГц, CDCl3) δ 4,46 (шир.с, 1H), 3,64 (шир.с, 2H), 3,37 (шир.с, 2H), 2,13-2,01 (м, 2H), 2,03-1,82 (м, 2H), 1,38 (с, 9H), 1,33 (с, 9H); ЖХ/МС: m/z 359,3 (M+Na).
ПРИМЕР 22
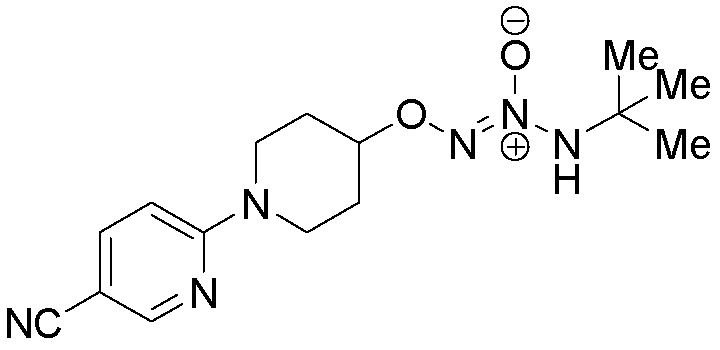
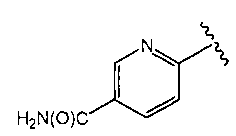
O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: 6-(4-гидроксипиперидин-1-ил)пиридин-3-карбонитрил
К N,N-диметилформамидному (100 мл) раствору 2-хлор-5-цианопиридина (36,2 г, 262 ммоль) и 4-гидроксипиперидина (27,9 г, 275 ммоль) добавляли карбонат калия (40,1 г, 290 ммоль). Реакционную смесь нагревали до 100°C и перемешивали в течение 3 часов. Смесь охлаждали до комнатной температуры, разбавляли водой (400 мл) и экстрагировали дихлорметаном (3×250 мл). Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (сульфат магния), и концентрировали в вакууме с получением названного соединения в виде твердого вещества. Этот сырой продукт использовали на последующей стадии без дополнительной очистки.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,39 (д, J=2,3 Гц, 1H), 7,58 (дд, J=9,1, 2,4 Гц, 1H), 6,62 (д, J=9,1 Гц, 1H), 4,10 (дт, J=13,6, 5,0 Гц, 2H), 4,01 (тт, J=8,3, 3,9 Гц, 1H), 3,37 (ддд, J=13,6, 9,2, 3,4 Гц, 2H), 2,61 (с, 1H), 1,99-1,92 (м, 2H), 1,62-1,53 (м, 2H); ЖХ/МС: m/z 204,2 (M+H).
Стадия B: O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, заменяя 6-(4-гидроксипиперидин-1-ил)пиридин-3-карбонитрил на трет-бутил 4-гидроксипиперидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,42 (д, J=2,3 Гц, 1H), 7,64 (дд, J=9,1, 2,3 Гц, 1H), 6,67 (д, J=9,1 Гц, 1H), 5,84 (шир.с, 1H), 4,52 (тт, J=7,6, 3,9 Гц, 1H), 4,04 (ддд, J=13,6, 7,4, 3,9 Гц, 2H), 3,59 (ддд, J=13,7, 8,0, 3,7 Гц, 2H), 2,10-2,03 (м, 2H), 1,98-1,90 (м, 2H), 1,32 (с, 9H); ЖХ/МС: m/z 319,1 (M+H).
ПРИМЕР 23
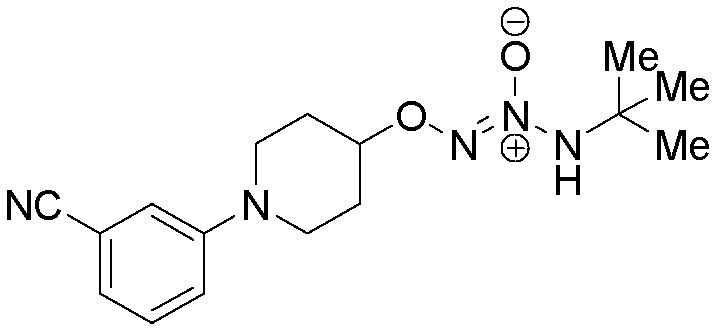
O2-[1-(3-цианофенил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: 3-(4-гидроксипиперидин-1-ил)бензонитрил
К толуольной (140 мл) суспензии трис(дибензилиденацетон)дипалладия (2,06 г, 2,25 ммоль), 2-(ди-трет-бутилфосфино)бифенила (0,839 г, 2,81 ммоль), трет-бутоксида натрия (4,05 г, 42,2 ммоль) добавляли 3-бромбензонитрил (5,11 г, 28,1 ммоль), с последующим добавлением 4-гидроксипиперидина (2,84 г, 28,1 ммоль). Реакционную смесь нагревали до 80°C в течение 5 часов, перемешивая в атмосфере азота. Эту смесь оставляли охлаждаться до комнатной температуры, фильтровали, и концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,33-7,24 (м, 1H), 7,15-7,10 (м, 2H), 7,06 (д, J=7,5 Гц, 1H), 3,95-3,87 (м, 1H), 3,57 (дт, J=12,7, 4,8 Гц, 2H), 3,00 (ддд, J=12,8, 9,5, 3,2 Гц, 2H), 2,05-1,95 (м, 2H), 1,73-1,59 (м, 2H); ЖХ/МС: m/z 203,2 (M+H).
Стадия B: O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, заменяя 3-(4-гидроксипиперидин-1-ил)бензонитрил на трет-бутил 4-гидроксипиперидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,36-7,31 (м, 1H), 7,17-7,08 (м, 3H), 5,84 (с, 1H), 4,45 (тт, J=8,4, 3,9 Гц, 1H), 3,63-3,56 (м, 2H), 3,12 (ддд, J=12,9, 8,8, 3,4 Гц, 2H), 2,18-2,11 (м, 2H), 2,04-1,95 (м, 2H), 1,35 (с, 9H); ЖХ/МС: m/z 318,2 (M+H).
ПРИМЕР 24
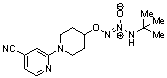
O2-[1-(4-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 22, заменяя 2-хлор-4-цианопиридин на 2-хлор-5-цианопиридин на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,29 (д, J=5,0 Гц, 1H), 6,86 (с, 1H), 6,76 (д, J=5,0 Гц, 1H), 5,85 (с, 1H), 4,51 (тт, J=8,2, 3,9 Гц, 1H), 4,02 (ддд, J=13,4, 6,6, 4,0 Гц, 2H), 3,41 (ддд, J=13,5, 8,7, 3,6 Гц, 2H), 2,14-2,06 (м, 2H), 1,96-1,86 (м, 2H), 1,34 (с, 9H); ЖХ/МС: m/z 319,3 (M+H).
ПРИМЕР 25
O2-[1-(5-хлорпиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 22, заменяя 2,5-дихлорпиридин на 2-хлор-5-цианопиридин на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,10 (д, J=2,6 Гц, 1H), 7,42 (дд, J=9,0, 2,7 Гц, 1H), 6,62 (д, J=9,1 Гц, 1H), 5,80 (с, 1H), 4,45 (тт, J=8,5, 3,9 Гц, 1H), 4,00-3,93 (м, 2H), 3,32-3,25 (м, 2H), 2,11-2,04 (м, 2H), 1,92-1,83 (м, 2H), 1,31 (с, 9H); ЖХ/МС: m/z 328,0 (M+H).
ПРИМЕР 26
O2-{1-[3-(1H-1,2,3-триазол-1-ил)фенил]пиперидин-4-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: 1-бензил-4-{[трет-бутил(диметил)силил]окси}пиперидин
К N,N-диметилформамидному (10 мл) раствору N-бензил-4-гидроксипиперидина (1,90 г, 9,93 ммоль) добавляли имидазол (1,35 г, 19,9 ммоль) и трет-бутилдиметилсилил хлорид (1,57 г, 10,4 ммоль). Через 1,5 часа реакционную смесь разбавляли водой и экстрагировали этилацетатом (3×50 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (50 мл), сушили (сульфат магния), фильтровали, и концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,36-7,21 (м, 5H), 3,75-3,65 (м, 1H), 3,49 (с, 2H), 2,72-2,63 (м, 2H), 2,26-2,12 (м, 2H), 1,78-1,71 (м, 2H), 1,62-1,53 (м, 2H), 0,88 (с, 9H), 0,04 (с, 6H); ЖХ/МС: m/z 306,1 (M+H).
Стадия B: 4-{[трет-бутил(диметил)силил]окси}пиперидин
К метанольному (28 мл) раствору 1-бензил-4-{[трет-бутил(диметил)силил]окси}пиперидина (2,80 г, 9,18 ммоль) добавляли гидроксид палладия на угле (20 масс.%, 280 мг, 0,40 ммоль) и перемешивали при атмосферном давлении водорода в течение 16 часов. Реакционную смесь фильтровали через диатомитовую землю и промывали метанолом. Фильтрат концентрировали в вакууме с получением названного соединения. Этот сырой продукт использовали на последующей стадии без дополнительной очистки.
¹Н-ЯМР (500 МГц, CDCl3) δ 3,77-3,70 (м, 1H), 3,09-3,02 (м, 2H), 2,61 (ддд, J=12,5, 9,5, 3,0 Гц, 2H), 1,82-1,72 (м, 2H), 1,42 (дтд, J=13,0, 9,0, 3,7 Гц, 2H), 0,89 (с, 9H), 0,05 (с, 6H); ЖХ/МС: m/z 216,2 (M+H).
Стадия C: 4-{[трет-бутил(диметил)силил]окси}-1-[3-(1H-1,2,3-триазол-1-ил)фенил]пиперидин
Диоксановый (5 мл) раствор 1-(3-бромфенил)-1H-1,2,3-триазола (224 мг, 1,00 ммоль) и 4-{[трет-бутил(диметил)силил]окси}пиперидина (323 мг, 1,50 ммоль) дегазировали путем барботирования азотом в колбе. Затем добавляли 2-(дициклогексилфосфино)-2′-(диметиламино)бифенил (20 мг, 0,051 ммоль), ацетат палладия(II) (11 мг, 0,050 ммоль) и трет-бутоксид натрия (384 мг, 4,0 ммоль). Реакционную смесь снова дегазировали, и колбу герметично закрывали. Смесь нагревали до 100°C в течение 20 часов и оставляли охлаждаться до комнатной температуры. Реакционную смесь разбавляли этилацетатом, промывали водой, насыщенным солевым раствором, сушили (сульфат магния), фильтровали, и концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,96 (с, 1H), 7,83 (с, 1H), 7,38-7,31 (м, 2H), 7,02 (д, J=7,9 Гц, 1H), 6,98 (д, J=8,5 Гц, 1H), 3,97-3,89 (м, 1H), 3,53 (ддд, J=12,4, 7,5, 3,5 Гц, 2H), 3,16 (ддд, J=12,5, 7,8, 3,5 Гц, 2H), 1,95-1,81 (м, 2H), 1,72-1,64 (м, 2H), 0,90 (с, 9H), 0,08 (с, 6H); ЖХ/МС: m/z 359,1 (M+H).
Стадия D: 1-[3-(1H-1,2,3-триазол-1-ил)фенил]пиперидин-4-ол
К этанольному раствору (18 мл) 4-{[трет-бутил(диметил)силил]окси}-1-[3-(1H-1,2,3-триазол-1-ил)фенил]пиперидина (1,83 г, 5,12 ммоль) добавляли концентрированную хлористоводородную кислоту (1030 мкл, 12,5 ммоль). Через 6 часов реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия (30 мл) и насыщали этилацетатом (30 мл). Реакционную смесь интенсивно перемешивали в течение 10 минут. Водный слой экстрагировали дополнительным количеством этилацетата (2×30 мл). Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (сульфат магния), фильтровали, и концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение в виде бледного желтого масла.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,97 (с, 1H), 7,83 (с, 1H), 7,37 (с, 1H), 7,36 (т, J=8,1 Гц, 1H), 7,04 (д, J=8,0 Гц, 1H), 6,98 (д, J=8,5 Гц, 1H), 3,97-3,87 (м, 1H), 3,66 (дт, J=12,7, 4,7 Гц, 2H), 3,05 (ддд, J=12,7, 9,7, 3,1 Гц, 2H), 2,07-1,98 (м, 2H), 1,75-1,66 (м, 2H); ЖХ/МС: m/z 245,2 (M+H).
Стадия E: O2-{1-[3-(1H-1,2,3-триазол-1-ил)фенил]пиперидин-4-ил} 1-(N-трет-бутиламино) диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, заменяя 1-[3-(1H-1,2,3-триазол-1-ил)фенил]пиперидин-4-ол на трет-бутил 4-гидроксипиперидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,97 (с, 1H), 7,83 (с, 1H), 7,37 (с, 1H), 7,36 (т, J=8,1 Гц, 1H), 7,06 (д, J=7,7 Гц, 1H), 6,98 (дд, J=8,4, 2,4 Гц, 1H), 5,82 (с, 1H), 4,44 (тт, J=8,5, 3,9 Гц, 1H), 3,66 (дт, J=12,8, 5,0 Гц, 2H), 3,14 (ддд, J=12,8, 9,0, 3,3 Гц, 2H), 2,21-2,08 (м, 2H), 2,04-1,95 (м, 2H), 1,32 (с, 9H); ЖХ/МС: m/z 360,2 (M+H).
ПРИМЕР 27
O2-{1-[3-(1H-1,2,4-триазол-1-ил)фенил]пиперидин-4-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 26, заменяя 1-(3-бромфенил)-1H-1,2,4-триазол на 1-(3-бромфенил)-1H-1,2,3-триазол на стадии C.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,53 (с, 1H), 8,09 (с, 1H), 7,35 (т, J=8,2 Гц, 1H), 7,31-7,24 (м, 1H), 7,05 (шир.с, 1H), 6,95 (шир.с, 1H), 5,82 (с, 1H), 4,47-4,40 (м, 1H), 3,65 (дт, J=12,6, 5,0 Гц, 2H), 3,17-3,08 (м, 2H), 2,20-2,09 (м, 2H), 2,04-1,96 (м, 2H), 1,32 (с, 9H); ЖХ/МС: m/z 328,0 (M+H).
ПРИМЕР 28
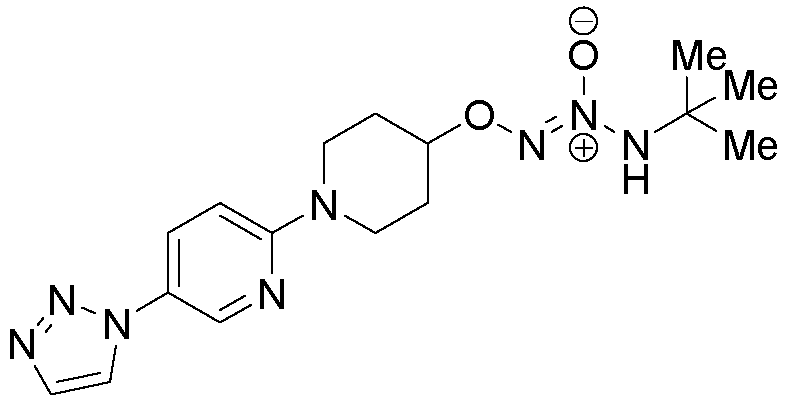
O2-{1-[5-(1H-1,2,3-триазол-1-ил)пиридин-2-ил]пиперидин-4-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 22, заменяя 2-фтор-5-(1H-1,2,3-триазол-1-ил)пиридин на 2-хлор-5-цианопиридин на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,44 (д, J=2,7 Гц, 1H), 7,90-7,81 (м, 3H), 6,79 (д, J=9,1 Гц, 1H), 5,85 (с, 1H), 4,50 (тт, J=8,2, 3,8 Гц, 1H), 4,06 (ддд, J=13,5, 6,5, 3,9 Гц, 2H), 3,43 (ддд, J=13,5, 8,7, 3,4 Гц, 2H), 2,15-2,05 (м, 2H), 1,96-1,87 (м, 2H), 1,31 (с, 9H); ЖХ/МС: m/z 361,1 (M+H).
ПРИМЕР 29
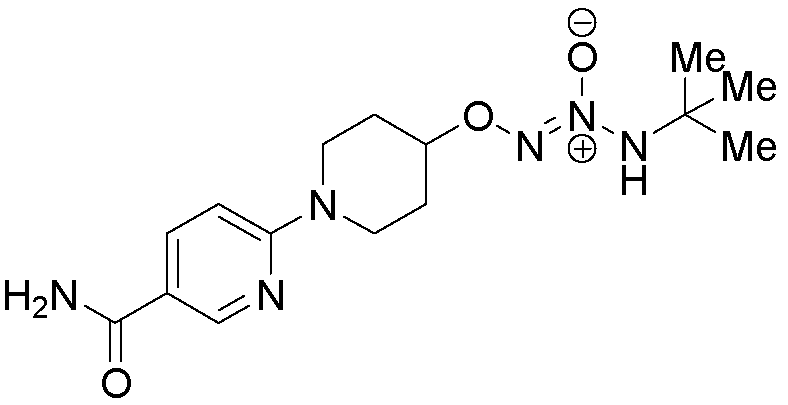
O2-[1-(5-карбамоилпиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
К раствору O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолата в воде (2 мл)/метаноле (2 мл) (пример 22, 200 мг, 0,628 ммоль) добавляли тетрагидрат пербората натрия (483 мг, 3,14 ммоль). Реакционную смесь затем нагревали до 50°C в течение 18 часов, разбавляли водой (5 мл) и экстрагировали этилацетатом (2×10 мл). Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (сульфат магния), и концентрировали в вакууме с получением названного соединения.
¹Н-ЯМР (500 МГц, (CD3)2SO) δ 8,56 (д, J=2,3 Гц, 1H), 8,02 (дд, J=9,1, 2,4 Гц, 1H), 7,82 (с, 1H), 7,21 (с, 1H), 7,00 (д, J=9,1 Гц, 1H), 4,50-4,20 (м, 1H), 4,04 (дт, J=13,7, 4,8 Гц, 2H), 3,45-3,33 (м, 2H), 2,04-1,95 (м, 2H), 1,69-1,59 (м, 2H), 1,18 (с, 9H); ЖХ/МС: m/z 337,0 (M+H).
ПРИМЕР 30
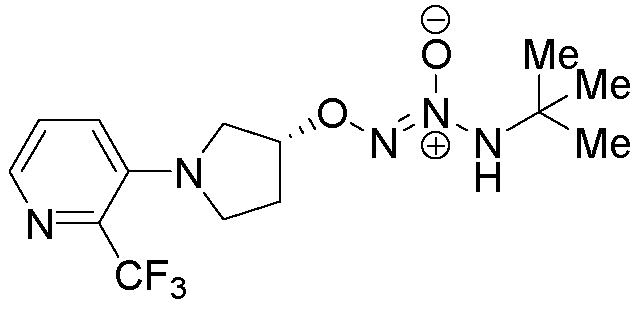
O2-{(3R)-1-[2-(трифторметил)пиридин-3-ил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: O2-{(3R)-1-[2-(трифторметил)пиридин-3-ил]пирролидин-3-ил} 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 23, стадия A, заменяя O2-[(3R)-пирролидин-3-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат (пример 3, стадия B) на 4-гидроксипиперидин и 3-бром-2-(трифторметил)пиридин на 3-бромбензонитрил.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,25-8,03 (м, 1H), 7,31-7,27 (м, 2H), 5,73 (ддт, J=17,1, 10,0, 6,7 Гц, 1H), 5,18 (д, J=17,0 Гц, 1H), 5,07-5,00 (м, 2H), 3,84 (дд, J=11,9, 4,8 Гц, 1H), 3,65-3,48 (м, 4H), 3,35 (тд, J=8,5, 2,4 Гц, 1H), 2,40-2,34 (м, 1H), 2,29-2,19 (м, 1H), 1,22 (с, 9H); ЖХ/МС: m/z 388,1 (M+H).
Стадия B: O2-{(3R)-1-[2-(трифторметил)пиридин-3-ил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, стадия C, заменяя O2-{(3R)-1-[2-(трифторметил)пиридин-3-ил]пирролидин-3-ил} 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат на O2-[1-(трет-бутоксикарбонил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,19-8,14 (м, 1H), 7,35-7,31 (м, 2H), 5,06-4,92 (м, 1H), 3,88-3,81 (м, 1H), 3,65-3,53 (м, 2H), 3,41-3,34 (м, 1H), 2,49-2,28 (м, 1H), 2,30-2,21 (м, 1H), 1,29 (с, 9H); ЖХ/МС: m/z 348,1 (M+H).
ПРИМЕР 31
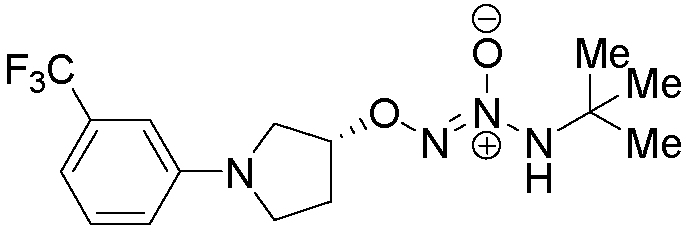
O2-{(3R)-1-[3-(трифторметил)фенил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 30, заменяя 3-бром-2-(трифторметил)пиридин на 3-бром-2-(трифторметил)пиридин на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,30 (т, J=8,0 Гц, 1H), 6,93 (д, J=7,7 Гц, 1H), 6,74 (с, 1H), 6,70 (д, J=8,5 Гц, 1H), 5,86 (с, 1H), 5,07-5,03 (м, 1H), 3,67 (дд, J=11,4, 5,0 Гц, 1H), 3,59 (д, J=11,4 Гц, 1H), 3,53 (тд, J=9,1, 7,0 Гц, 1H), 3,45 (тд, J=8,9, 2,9 Гц, 1H), 2,47-2,41 (м, 1H), 2,34-2,25 (м, 1H), 1,31 (с, 9H); ЖХ/МС: m/z 347,1 (M+H).
ПРИМЕР 32

O2-[(3R)-1-(3-цианофенил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 30, заменяя 3-бромбензонитрил на 3-бром-2-(трифторметил)пиридин на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,31-7,26 (м, 1H), 6,96 (д, J=7,4 Гц, 1H), 6,80-6,67 (м, 2H), 5,93 (с, 1H), 5,12-5,00 (м, 1H), 3,64 (дд, J=11,3, 4,9 Гц, 1H), 3,57 (д, J=11,5 Гц, 1H), 3,51 (тд, J=9,3, 6,9 Гц, 1H), 3,43 (тд, J=8,8, 2,8 Гц, 1H), 2,49-2,42 (м, 1H), 2,35-2,26 (м, 1H), 1,32 (с, 9H); ЖХ/МС: m/z 304,2 (M+H).
ПРИМЕР 33
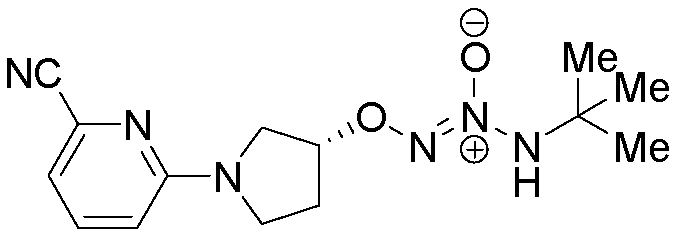
O2-[(3R)-1-(6-цианопиридин-2-ил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 22, заменяя 6-фторпиридин-2-карбонитрил на 2-хлор-5-цианопиридин и (S)-3-гидроксипирролидин на 4-гидроксипиперидин на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,47 (т, J=8,0 Гц, 1H), 6,93 (д, J=7,2 Гц, 1H), 6,53 (д, J=8,7 Гц, 1H), 5,90 (с, 1H), 5,04-4,99 (м, 1H), 3,93-3,84 (м, 2H), 3,70 (дд, J=12,8, 4,7 Гц, 1H), 3,62-3,55 (м, 1H), 2,48-2,39 (м, 1H), 2,31-2,21 (м, 1H), 1,30 (с, 9H); ЖХ/МС: m/z 305,1 (M+H).
ПРИМЕР 34
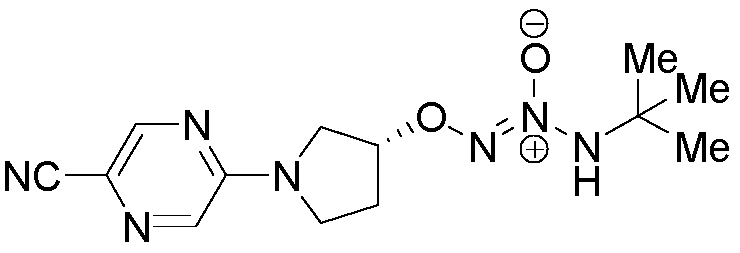
O2-[(3R)-1-(5-цианопиразин-2-ил)пирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 22, заменяя 5-бромпиразин-2-карбонитрил на 2-хлор-5-цианопиридин и O2-[(3R)-пирролидин-3-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат (пример 3, стадия B) на 4-гидроксипиперидин на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,36 (с, 1H), 7,91 (с, 1H), 5,19 (шир.с, 1H), 4,10-3,70 (м, 4H), 2,60-2,50 (м, 1H), 2,40-2,30 (м, 1H), 1,33 (с, 9H); ЖХ/МС: m/z 306,3 (M+H).
ПРИМЕР 35
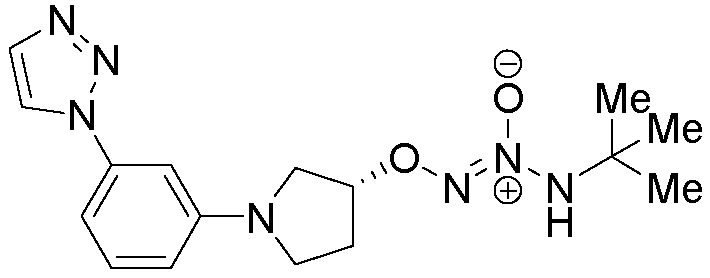
O2-{(3R)-1-[3-(1H-1,2,3-триазол-1-ил)фенил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 30, заменяя 1-(3-бромфенил)-1H-1,2,3-триазол на 3-бром-2-(трифторметил)пиридин на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,0-6,6 (м, 6H), 5,92 (с, 1H), 5,08 (шир.с, 1H), 3,8-3,5 (м, 4H), 2,6-2,1 (м, 2H), 1,33 (с, 9H); ЖХ/МС: m/z 368,1 (M+Na).
ПРИМЕР 36
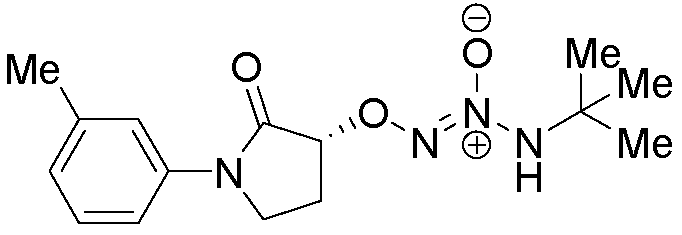
O2-[(3R)-1-(3-метилфенил)-2-оксопирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: (3S)-3-гидрокси-1-(3-метилфенил)пирролидин-2-он
(S)-3-гидроксипирролидин-2-он (1,52 г, 15,0 ммоль), 3-бромтолуол (2,57 г, 15,0 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,26 г, 0,45 ммоль), ацетат палладия(II) (0,067 г, 0,30 ммоль) и карбонат цезия (7,33 г, 22,5 ммоль) перемешивали вместе в диоксане (50 мл), и перемешивали в течение ночи при 80°C. Реакционную смесь промывали водой (150 мл), и водный слой экстрагировали дихлорметаном (3×150 мл). Объединенные органические слои сушили (сульфат натрия) и концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение в виде твердого вещества белого цвета.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,47 (с, 1H), 7,42 (д, J=8,3 Гц, 1H), 7,26 (т, J=7,9 Гц, 1H), 7,00 (д, J=7,6 Гц, 1H), 4,81 (д, J=3,1 Гц, 1H), 4,56-4,49 (м, 1H), 3,80-3,70 (м, 2H), 2,60-2,53 (м, 1H), 2,37 (с, 3H), 2,16-2,06 (м, 1H).
Стадия B: O2-[(3R)-1-(3-метилфенил)-2-оксопирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, заменяя (3S)-3-гидрокси-1-(3-метилфенил)пирролидин-2-он на трет-бутил 4-гидроксипиперидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,46 (с, 1H), 7,40 (д, J=8,3 Гц, 1H), 7,26 (т, J=7,8 Гц, 1H), 7,00 (д, J=7,6 Гц, 1H), 6,13 (с, 1H), 5,03 (т, J=7,8 Гц, 1H), 3,90 (тд, J=9,2, 3,8 Гц, 1H), 3,79 (дт, J=9,7, 7,3 Гц, 1H), 2,65-2,57 (м, 1H), 2,45-2,33 (м, 4H), 1,32 (с, 9H); ЖХ/МС: m/z 307,2 (M+H).
ПРИМЕР 37
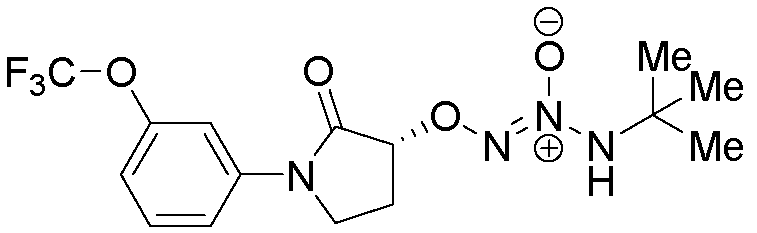
O2-{(3R)-2-оксо-1-[3-(трифторметокси)фенил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 36, заменяя 1-бром-3-(трифторметокси)бензол на 3-бромтолуол на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 7,67 (с, 1H), 7,53 (д, J=8,4 Гц, 1H), 7,38 (т, J=8,3 Гц, 1H), 7,03 (д, J=8,3 Гц, 1H), 6,15 (с, 1H), 5,04 (т, J=7,8 Гц, 1H), 3,92 (дт, J=13,3, 4,7 Гц, 1H), 3,80 (кв., J=8,2 Гц, 1H), 2,68-2,60 (м, 1H), 2,45-2,36 (м, 1H), 1,31 (с, 9H); ЖХ/МС: m/z 399,0 (M+Na).
ПРИМЕР 38
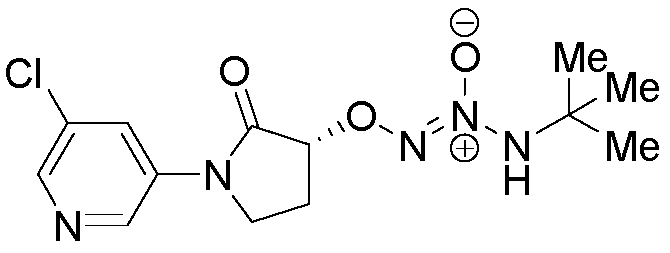
O2-[(3R)-1-(5-хлорпиридин-3-ил)-2-оксопирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 36, заменяя 3-бром-5-хлорпиридин на 3-бромтолуол на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,64 (с, 1H), 8,39 (с, 1H), 8,35 (с, 1H), 6,17 (с, 1H), 5,06 (м, 1H), 3,98 (м, 1H), 3,85 (м, 1H), 2,70 (м, 1H), 2,47 (м, 1H), 1,32 (с, 9H); ЖХ/МС: m/z 328,2 (M+H).
ПРИМЕР 39
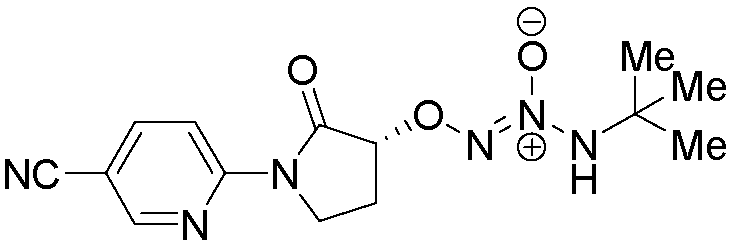
O2-[(3R)-1-(5-цианопиридин-2-ил)-2-оксопирролидин-3-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 36, заменяя 6-бромпиридин-3-карбонитрил на 3-бромтолуол на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,64 (д, J=2,2 Гц, 1H), 8,58 (д, J=8,8 Гц, 1H), 7,93 (дд, J=8,8, 2,3 Гц, 1H), 6,00 (с, 1H), 5,09 (т, J=8,1 Гц, 1H), 4,26 (ддд, J=11,5, 9,0, 3,6 Гц, 1H), 3,97 (дт, J=11,5, 7,7 Гц, 1H), 2,64 (дтд, J=13,6, 8,1, 3,7 Гц, 1H), 2,41 (дкв., J=13,6, 8,2 Гц, 1H), 1,32 (с, 9H); ЖХ/МС: m/z 319,1 (M+H).
ПРИМЕР 40
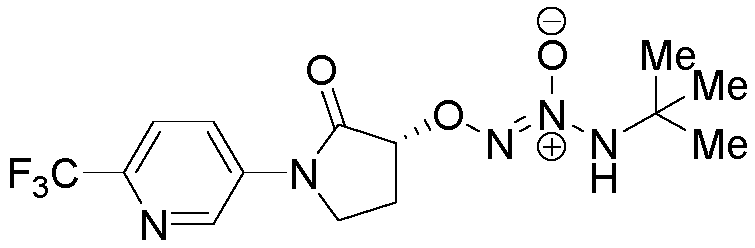
O2-{(3R)-2-оксо-1-[4-(трифторметил)фенил]пирролидин-3-ил} 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 36, заменяя 5-бром-2-(трифторметил)пиридин на 3-бромтолуол на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,84 (д, J=2,5 Гц, 1H), 8,48 (дд, J=8,7, 2,5 Гц, 1H), 7,70 (д, J=8,7 Гц, 1H), 5,07 (дд, J=8,4, 7,1 Гц, 1H), 4,03 (тд, J=9,2, 4,0 Гц, 1H), 3,90 (дт, J=9,5, 7,3 Гц, 1H), 2,72 (дтд, J=13,8, 8,1, 4,0 Гц, 1H), 2,49 (ддт, J=13,8, 8,8, 6,9 Гц, 1H), 1,31 (с, 9H); ЖХ/МС: m/z 362,2 (M+H).
ПРИМЕР 41
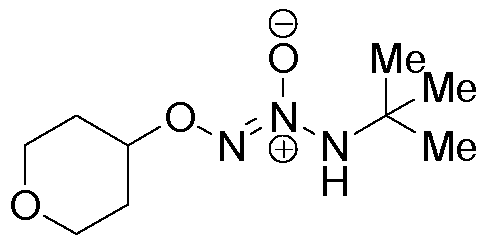
O2-(тетрагидро-2H-пиран-4-ил) 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Названное соединение получали в соответствии с методиками, описанными в примере 1, заменяя тетрагидро-2H-пиран-4-ол на трет-бутил 4-гидроксипиперидин-1-карбоксилат на стадии A.
¹Н-ЯМР (500 МГц, CDCl3) δ 5,85 (с, 1H), 4,41 (м, 1H), 3,98 (м, 2H), 3,52 (м, 2H), 2,05-1,80 (м, 4H), 1,31 (с, 9H); ЖХ/МС: m/z 240,2 (M+Na).
ПРИМЕР 42
O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадия A: 6-(4-гидроксипиперидин-1-ил)пиридин-3-карбонитрил
К N,N-диметилформамидному (100 мл) раствору 2-хлор-5-цианопиридина (36,2 г, 262 ммоль) и 4-гидроксипиперидина (27,9 г, 275 ммоль) добавляли карбонат калия (40,1 г, 290 ммоль). Реакционную смесь нагревали до 100°C и перемешивали в течение 3 часов. Эту смесь охлаждали до комнатной температуры, разбавляли водой (400 мл) и экстрагировали дихлорметаном (3×250 мл). Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (сульфат магния), и концентрировали в вакууме с получением названного соединения в виде твердого вещества. Этот сырой продукт использовали на последующей стадии без дополнительной очистки.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,39 (д, J=2,3 Гц, 1H), 7,58 (дд, J=9,1, 2,4 Гц, 1H), 6,62 (д, J=9,1 Гц, 1H), 4,10 (дт, J=13,6, 5,0 Гц, 2H), 4,01 (тт, J=8,3, 3,9 Гц, 1H), 3,37 (ддд, J=13,6, 9,2, 3,4 Гц, 2H), 2,61 (с, 1H), 1,99-1,92 (м, 2H), 1,62-1,53 (м, 2H); ЖХ/МС: m/z 204,2 (M+H).
Стадия B: 1-(5-цианопиридин-2-ил)пиперидин-4-ил 4-(трифторметил)бензолсульфонат
К дихлорметановому (50 мл) раствору 6-(4-гидроксипиперидин-1-ил)пиридин-3-карбонитрила (3,19 г, 15,7 ммоль) и триэтиламина (9,0 мл, 65 ммоль) добавляли 4-(трифторметил)бензолсульфонил хлорид (4,31 г, 17,6 ммоль). Затем добавляли 4-(диметиламино)пиридин (0,19 г, 1,6 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли простой диэтиловый эфир (100 мл) с последующим добавлением 1,0 M хлористоводородной кислоты (70 мл, 70,0 ммоль). Органический слой отделяли и промывали 1,0 M хлористоводородной кислотой (2×50 мл), насыщенным солевым раствором, сушили (сульфат магния) с получением названного соединения в виде твердого вещества. Этот сырой продукт использовали на последующей стадии без дополнительной очистки.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,39 (д, J=2,3 Гц, 1H), 8,08 (д, J=8,3 Гц, 2H), 7,85 (д, J=8,2 Гц, 2H), 7,61 (дд, J=9,0, 2,4 Гц, 1H), 6,61 (д, J=9,1 Гц, 1H), 4,94-4,88 (м, 1H), 3,87 (ддд, J=13,7, 7,9, 3,8 Гц, 2H), 3,62 (ддд, J=13,8, 7,3, 3,9 Гц, 2H), 1,97-1,90 (м, 2H), 1,89-1,81 (м, 2H); ЖХ/МС: m/z 412,0 (M+H).
Стадия C: O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат
К N,N-диметилформамидному (100 мл) раствору 1-(5-цианопиридин-2-ил)пиперидин-4-ил 4-(трифторметил)бензолсульфоната (5,99 г, 14,6 ммоль) добавляли (N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат натрия (3,51 г, 18,0 ммоль). Эту смесь нагревали до 45°C и перемешивали в течение 2 часов. Реакционную смесь разбавляли водой (75 мл) и экстрагировали этилацетатом (3×100 мл). Объединенные органические экстракты сушили (сульфат магния), фильтровали, и концентрировали в вакууме с получением сырого продукта. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали названное соединение в виде бесцветного масла, которое отверждается при стоянии.
¹Н-ЯМР (500 МГц, CDCl3) 8,39 (д, J=2,3 Гц, 1H), 7,60 (дд, J=9,0, 2,4 Гц, 1H), 6,62 (д, J=9,1 Гц, 1H), 5,78 (ддт, J=17,1, 10,1, 6,7 Гц, 1H), 5,28 (дд, J=17,1, 1,6 Гц, 1H), 5,16 (д, J=10,1 Гц, 1H), 4,62-4,55 (м, 1H), 3,99 (ддд, J=13,6, 7,2, 3,9 Гц, 2H), 3,65 (д, J=6,8 Гц, 2H), 3,51 (ддд, J=13,7, 8,2, 3,7 Гц, 2H), 2,08-2,01 (м, 2H), 1,93-1,84 (м, 2H), 1,27 (с, 9H); ЖХ/МС: m/z 359,3 (M+H).
Стадия D: O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
К перемешиваемому метанольному (150 мл) раствору O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолата (6,53 г, 18,2 ммоль) добавляли сульфидированную платину на угле (5 масс.%, 7,16 г, 1,84 ммоль). Затем добавляли муравьиную кислоту (1,4 мл, 37 ммоль). Реакционную смесь нагревали до 60°C, перемешивая в течение 2 часов, и добавляли другую порцию муравьиной кислоты (1,4 мл, 37 ммоль). Через 3 часа реакционную смесь фильтровали через диатомитовую землю и концентрировали в вакууме. Хроматография на силикагеле, элюирование смесью гексан/этилацетат, давали бесцветную жидкость. Нагревание этого вещества в циклогексане при кипячении с обратным холодильником давало названное соединение в виде твердого вещества белого цвета.
¹Н-ЯМР (500 МГц, CDCl3) δ 8,42 (д, J=2,3 Гц, 1H), 7,64 (дд, J=9,1, 2,3 Гц, 1H), 6,67 (д, J=9,1 Гц, 1H), 5,84 (шир.с, 1H), 4,52 (тт, J=7,6, 3,9 Гц, 1H), 4,04 (ддд, J=13,6, 7,4, 3,9 Гц, 2H), 3,59 (ддд, J=13,7, 8,0, 3,7 Гц, 2H), 2,10-2,03 (м, 2H), 1,98-1,90 (м, 2H), 1,32 (с, 9H); ЖХ/МС: m/z 319,1 (M+H).
ПРИМЕР 43
O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолат
Стадии A и B: 1-(5-цианопиридин-2-ил)пиперидин-4-ил 4-(трифторметил)бензолсульфонат получали в соответствии со стадиями A и B в примере 42.
Стадия C: получение O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолата
В 500-мл 3-горлую круглодонную колбу, снабженную верхней мешалкой, термоэлементом, делительной воронкой и впускным клапаном для азота, загружали 1-(5-цианопиридин-2-ил)пиперидин-4-ил 4-(трифторметил)бензолсульфонат (30,00 г, 1 экв.), бис[(1Z)-3-трет-бутил-3-(проп-2-ен-1-ил)триаз-1-ен-1-олат-2-оксид кальция (17,73 г, 93 масс.%, 0,60 экв.) и 2-Me-ТГФ (180 мл, 6 об.). Полученную в результате смесь перемешивали при 55°C в течение 8-17 ч. Добавляли 0,100 экв. бис[(1Z)-3-трет-бутил-3-(проп-2-ен-1-ил)триаз-1-ен-1-олат-2-оксида кальция (2,94 г, 93 масс.%) и полученную в результате смесь перемешивали при 55°C в течение 7-10 часов.
Реакционную смесь охлаждали до 25-30°C и добавляли порошкообразную целлюлозу Solka Flock (30 г, 100 масс.%). Полученную в результате суспензию перемешивали при комнатной температуре в течение 10 мин и фильтровали через порошкообразную целлюлозу Solka Flock (15 г, 50 масс.%), промывали с использованием 2-метил-ТГФ (180 мл, 6 об). Аналитический образец желаемого продукта O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолата в объединенных фильтратах составил 25,1 г. Реакционную смесь концентрировали до 60 мл (2 об, суммарный объем) при 30-35°C. Полученный в результате раствор охлаждали до 20°C и вносили затравку (50 мг затравки). Образовывалась суспензия, и полученную в результате суспензию перемешивали при 20°C в течение 0,5 ч. Гептан (90 мл, 3 об) добавляли по каплям на протяжении 0,5 ч. Полученную в результате суспензию перемешивали при 20°C в течение 1 ч, и при 10°C в течение 1 ч.
Кристаллический продукт O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат собирали фильтрованием, промывали смесью гептан/2-Me-ТГФ (3:1, 45 мл, 1,5 об). Суспензию промывали деионизованной водой (60 мл ×1, 2 об) и сушили деионизованной водой (30 мл ×1, 1 об), и сушили в вакууме с промыванием азотом с получением сухого продукта O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолата (23,76 г) в виде кристаллического твердого вещества беловатого цвета, Т.пл. 92,0-92,8°C.
1Н-ЯМР (500 МГц, CDCl3) δ 8,39 (д, J=2,4 Гц, 1H), 7,59 (дд, J=8,9, 2,4 Гц, 1H), 6,61 (д, J=8,9 Гц, 1H), 5,78 (ддт, J=17,1, 10,2, 6,7 Гц, 1H), 5,27 (ддд, J=17,1, 2,6, 1,4 Гц, Гц, 1H), 5,15 (ддд, J=10,2, 2,6, 1,1 Гц, 1H), 4,58 (м, 1H), 3,98 (ддд, J=13,4, 7,2, 3,9 Гц, 2H), 3,64 (дт, J=6,7, 1,1 Гц, 2H), 3,51 (ддд, J=13,4, 8,1, 3,7 Гц, 2H), 2,05 (м, 2H), 1,89 (м, 2H), 1,26 (с, 9H).
Стадия D: получение O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолата
В 250-мл 3-горлую круглодонную колбу, продутую азотом, снабженную верхней мешалкой, термоэлементом и впускным клапаном для азота, загружали O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутил-N-аллиламино)диазен-1-иум-1,2-диолат (10,0 г) и боргидрид натрия (1,306 г). Эту колбу продували азотом в течение 1 часа. Добавляли дегазированный этанол (45 мл) и суспензию медленно перемешивали при 20-22°C.
В отдельную 10-мл круглодонную колбу в атмосфере азота загружали ацетат палладия (62 мг) и DPPP (148 мг). Эту колбу продували азотом в течение 30 мин и добавляли дегазированный этанол (6,6 мл) при комнатной температуре. Эту смесь перемешивали в течение 30 мин при комнатной температуре с получением желтого гомогенного раствора.
Желтый раствор катализатора добавляли через шприц к описанной выше суспензии аллил O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолата за одну порцию. Желтую суспензию выдерживали при 25°C в течение 1 часа, а затем нагревали до 40°C в течение 4 ч. За протеканием реакции следили с помощью ВЭЖХ. Реакция была завершена >99,9% через 3,5 при 40°C.
По завершении реакции смесь охлаждали до 25°C и затравливали кристаллическим O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолатом (5 мг). Смесь выдерживали при 20°C в течение 30 мин с получением густой, но перемешиваемой суспензии. Эту суспензию охлаждали до 5°C и добавляли раствор уксусной кислоты (4,98 г) в воде (100 мл) на протяжении 30 мин, поддерживая температуру 5-10°C.
Эту суспензию выдерживали при 5-10°C в течение 30 мин. Твердые частицы желтовато-коричневого цвета фильтровали и промывали смесью вода/этанол 2:1 (20 мл), и сушили на воздухе (на воронке) в течение 3 часов. Выход сырого продукта составил 12,6 г (содержание воды приблизительно 30% масс/масс).
Твердое вещество желтовато-коричневого цвета растворяли в IPAC (120 мл) при комнатной температуре. Добавляли SiO2 (4 г) и суспензию перемешивали в течение 30 мин при комнатной температуре. Эту суспензию фильтровали через SiO2 (4 г) на протяжении 10 мин и фильтровальный осадок промывали с использованием IPAC (40 мл). Объединенные фильтраты анализировали. Количественный выход в этой точке составил 52,0 мг/мл (161 мл), 8,38 г.
Раствор IPAC повторно загружали в сосуд через совмещенный осветляющий фильтр 5 мкм и концентрировали до примерно 50 мл. Эту партию затравляли O2-[1-(5-цианопиридин-2-ил)пиперидин-4-ил] 1-(N-трет-бутиламино)диазен-1-иум-1,2-диолатом (5 мг) и оставляли перемешиваться в течение 30 мин с получением суспензии. Добавляли гептан (50 мл) и суспензионный растворитель заменяли на >90% гептан при постоянном объеме и 30-40°C. Полученную в результате суспензию (уровень IPAC при 5-10% об/об с помощью анализа ВЭЖХ) выдерживали при 20°C в течение 30 мин. Эту суспензию фильтровали и промывали гептаном (30 мл), сушили на воздухе 1 ч и в вакууме при 30°C в течение ночи с получением 8,1 г (>99,7 A% при 210 нм).
АКТИВНОСТЬ
Соединения по настоящему изобретению оценивали на эффективность в отношении снижения кровяного давления с использованием следующего телеметрического протокола у собак, описанного ниже.
Кобелям собак породы бигль (в возрасте приблизительно 1-3 года) с массой тела от 10 до 16 кг хирургическим путем имплантировали радиотелеметрические устройства DSI (модель: TL11M2-D70-PCT). Вкратце, под ингаляционным наркозом смесью изофлуран/кислород (1-3,5%/до достижения эффекта), корпус телеметрического устройства располагали и закрепляли внутрибрюшинно. После этого артериальный катетер телеметрического устройства пропускали подкожно в паховую область и вводили в бедренную артерию и продвигали до уровня нисходящей части дуги аорты. Катетер закрепляли 2-0 шелковыми лигатурами. Мышцу и подлежащую фасцию закрывали поверх катетера, используя рассасывающиеся нити, а кожу соединяли, используя нерассасывающийся шов. Животных оставляли на минимальный восстановительный период 2 недели между хирургическим вмешательством и оценкой тестируемых соединений.
Оценка соединения состояла из 3-дневной модели в дозе 3 мг/кг. В первый день соединения не вводили на протяжении 24-часового периода от сбора исходных данных. Данные о кровяном давлении и частоте сердечных сокращений собирали непрерывно в течение одноминутного периода с 10-минутными интервалами. В дни введения соединения половина животных получала исследуемый препарат, а вторая половина получала носитель, используемый для составления фармацевтической композиции. Все тестируемые вещества вводили с помощью перорального зонда в количестве 1 мг/кг. Данные выражаются либо в виде исходных значений (мм рт. ст., или ударов в минуту) или как изменение от исходного уровня (средняя величина в течение примерно 12 часов в период низкой активности до введения дозы). Изменение представляет собой СД (систолическое кровяное давление) и ПД (пульсовое давление) с течением времени и представлено ниже:
|
Проиллюстрированные соединения снижали кровяное давление на протяжении указанных периодов времени.