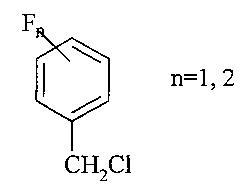
Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ МОНО- И ДИФТОРБЕНЗИЛХЛОРИДОВ
Вид РИД
Изобретение
Изобретение относится к области органического синтеза, в частности к способу получения моно- и дифторбензилхлоридов.
п-Фторбензилхлорид применяется для синтеза многочисленных лекарственных препаратов, обладающих противовоспалительной, анальгетической и жаропонижающей активностью [Н. Hirano, М. Numata, N. Shimahara, K. Kawai / Pat. USA №3544574 от 01.12.70]. Так, п-фторбензилхлорид является прекурсором антималярийного препарата - 2-диэтиламинометил-4-(7-хлор-4-хинолил) аминофторбензола [А. Sveinbjornsson, С.A. Vander Werf // J. Am. Chem. Soc. - 1951. - Vol. 73. - C. 1378-1379].
Среди фторсодержащих лекарственных препаратов особый интерес представляет «Руфинамид», препарат, обладающий противоэпилептическим действием. Он применяется для лечения синдрома Леннокса-Гасто и других судорожных заболеваний. «Руфинамид» - производное триазола (1-(2,6-дифторбензил)1Н-1,2,3-триазол-4-карбоксамид), был разработан в 2004 г. фирмой Novartis Pharma, AG, и производится Eisai. Исходным соединением для синтеза «Руфинамида» является 2,6-дифторбензилхлорид [Е. Attolino, L. Colombo, I. Mormino, P. Allegrini / Pat. EP 2230234 от 22.09.10].
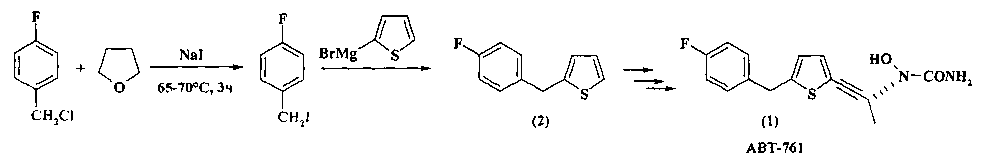
п-Фторбензилхлорид использован Abbott Laboratories для разработки новых классов ингибиторов 5-липоксигеназы - фермента, играющего важную роль в различных аллергических и воспалительных заболеваниях, включая астму, аллергический ринит, ревматоидный артрит и воспалительное заболевание кишечника. Исследователи синтезировали эффективный ингибитор 5-липоксигеназы АВТ-761 (1), содержащий в своей молекуле п-фторбензильный фрагмент.
Так, п-фторбензилхлорид служит исходным сырьем для получения 2-(4-фторбензил)тиофена (2), который в свою очередь является ключевым промежуточным соединением в синтезе АВТ-761 (1) [Y.-Y. Ku, R.R. Patel, D.P. Sawick // Tetrahedron Lett. - 1996. - №12. - С. 1949-1952].
В патенте [Л.И. Маркова, Л.Ф. Черкасская, Н.Ф. Савенков, П.С. Хохлов / Пат. СССР 386892 от 21.06.1973] описан способ получения фторбензилхлоридов, основанный на хлорировании фтортолуолов молекулярным хлором при освещении и повышенной температуре: 120-180°С. Целевой продукт выделяют ректификацией. Выход фторбензилхлорида составляет 60-70%.
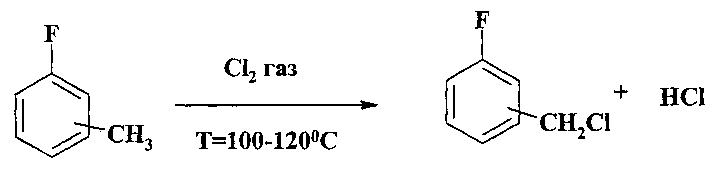
Для повышения выхода целевого продукта предлагается хлорирование вести в присутствии воды. Выход фторбензилхлоридов в присутствии воды достигает 96-98%.
Недостатки метода
1. Использование ядовитого газа хлора.
2. Выделение агрессивного HCl, что приводит к коррозии технологического оборудования.
Воронков М.Г. и Попова Э.П. исследовали фотохимическое хлорирование органических соединений хлористым сульфурилом и изучили возможность применения этой реакции для получения о-, м-, п-фторбензилхлоридов из соответствующих фтортолуолов.
При фотохимическом хлорировании хлористым сульфурилом о-, м- и п-фтортолуолов в присутствии PCl3, играющего роль катализатора, образуются соответствующие фторбензилхлориды с выходом 70-75% [М.Г. Воронков, Э.П. Попова // Изв. АН Латв. ССР. Сер. хим. - 1968. - №3. - С. 314-316].
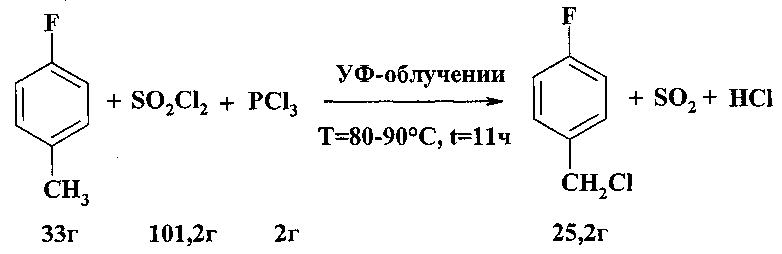
Недостатки метода
1. Необходимость проведения реакции в условиях, исключающих присутствие воды, т.к. SO2Cl2 и PCl3 гидролизуются водой с образованием кислот HCl и H3PO3.
2. Использование избытка SO2Cl2.
3. Значительная продолжительность реакции.
4. Низкий выход целевого продукта.
Эти же авторы исследовали фотохимическое хлорирование фтортолуолов свободным хлором в присутствии PCl5 [М.Г. Воронков, Э.П. Попова // Изв. АН Латв. ССР. Сер. хим. - 1966. - №4. - С. 698-699].
В работе [И.Н. Назаров, А.В. Семеновский // Изв. АН СССР. Отд. хим.н. - 1957. - №1. - С. 100-111] предложен метод получения смеси изомерных фторбензилхлоридов (выход 78%), основанный на взаимодействии фторбензола с CCl4 и параформом в присутствии хлорида цинка, играющего роль катализатора. Реакцию проводили по следующей методике: через смесь параформа, ZnCl2 и CCl4 пропускают HCl, прибавляют фторбензол, реакционную смесь выдерживают 4 часа при 50°С (12 часов при 20°С). Вымораживанием смеси изомерных фторбензилхлоридов выделяют чистый п-фторбензилхлорид (выход 20%), а из остатка перегонкой выделяют п,п′-дифтор-дифенилметан с выходом 3,35 г (5%)
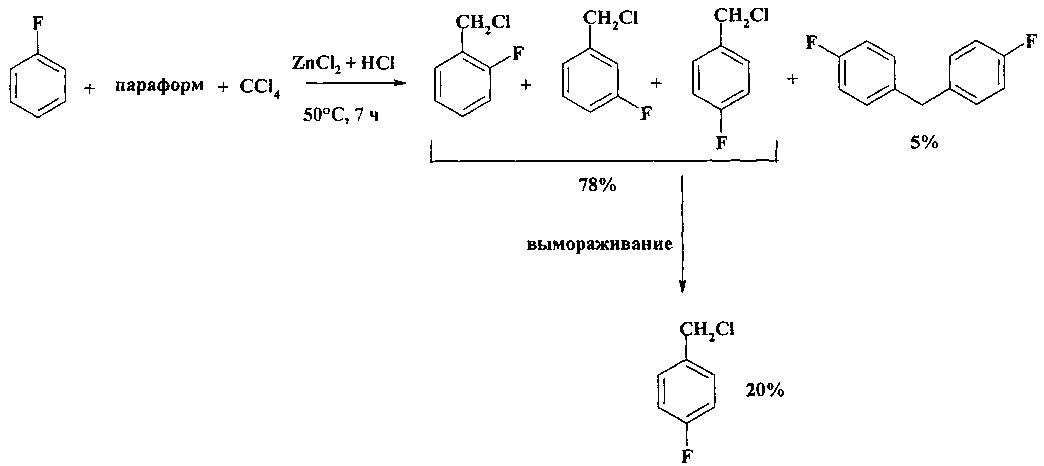
Недостатки метода:
1. Образование сложной смеси побочных продуктов.
2. Низкий выход целевого продукта.
3. Сильная коррозия оборудования хлористым водородом.
4. Значительная продолжительность эксперимента.
5. Многостадийность.
6. Параформальдегид при хранении разлагается с выделением формальдегида, который является канцерогеном.
В следующей работе [Ola G., Pavlat А., Kyn I. // Acta. Chem. Acad. Scihung. - 1955. - T. 7. - №1. - С. 85-92] хлорметилирование фторбензола осуществлено с помощью хлористого метила и формальдегида в присутствии безводного ZnCl2 (1,57:0,5:0,11). Выход п-фторбензилхлорида по данному способу составил 60,3%. При соотношении реагентов (2,05:1,87:0,41) выход п-фторбензилхлорида снижается до 42,4% из-за образования побочного продукта п,п′-дифтордифенилметана (30,8%).
При взаимодействии 1,3-дифторбензола с формальдегидом и HCl в присутствии ZnCl2 (60°С, 8 ч) также образуются два продукта: 2,6-дифторбензилхлорид и п,п′-дифтордифенилметан [Ola G., Pavlat А., Kyn I. // Magyar tud. akad kem. tud. oszt. kohl. - 1955. - T. 5. - №4. - C. 505-511].
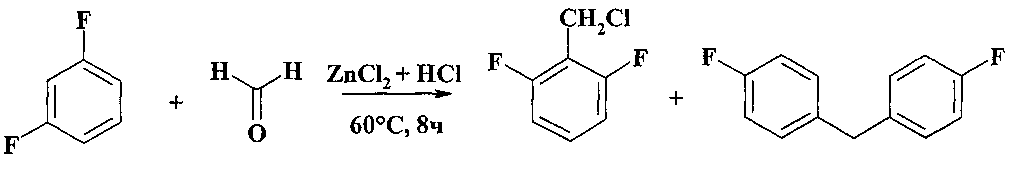
Недостатки методов
1. Необходимость работы с газами - высокотоксичным хлороводородом и формальдегидом.
2. Образование побочного продукта п,п′-дифтордифенилметана (31%), что осложняет выделение 2,6-дифторбензилхлорида.
3. Сильная коррозия оборудования из-за использования в качестве реагента HCl.
Авторами предлагается способ получения моно- и дифторбензилхлоридов, не имеющий вышеперечисленных недостатков.
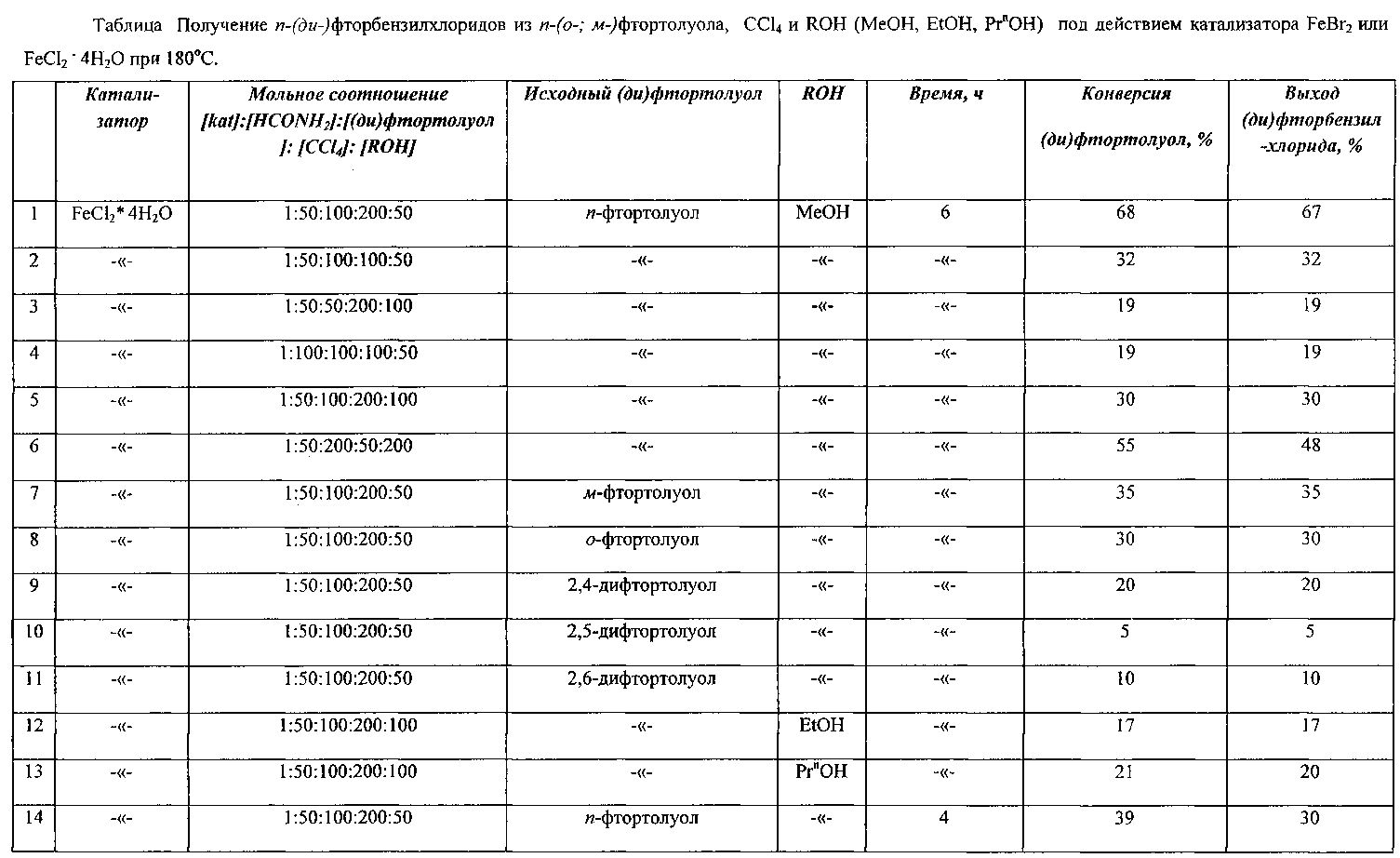
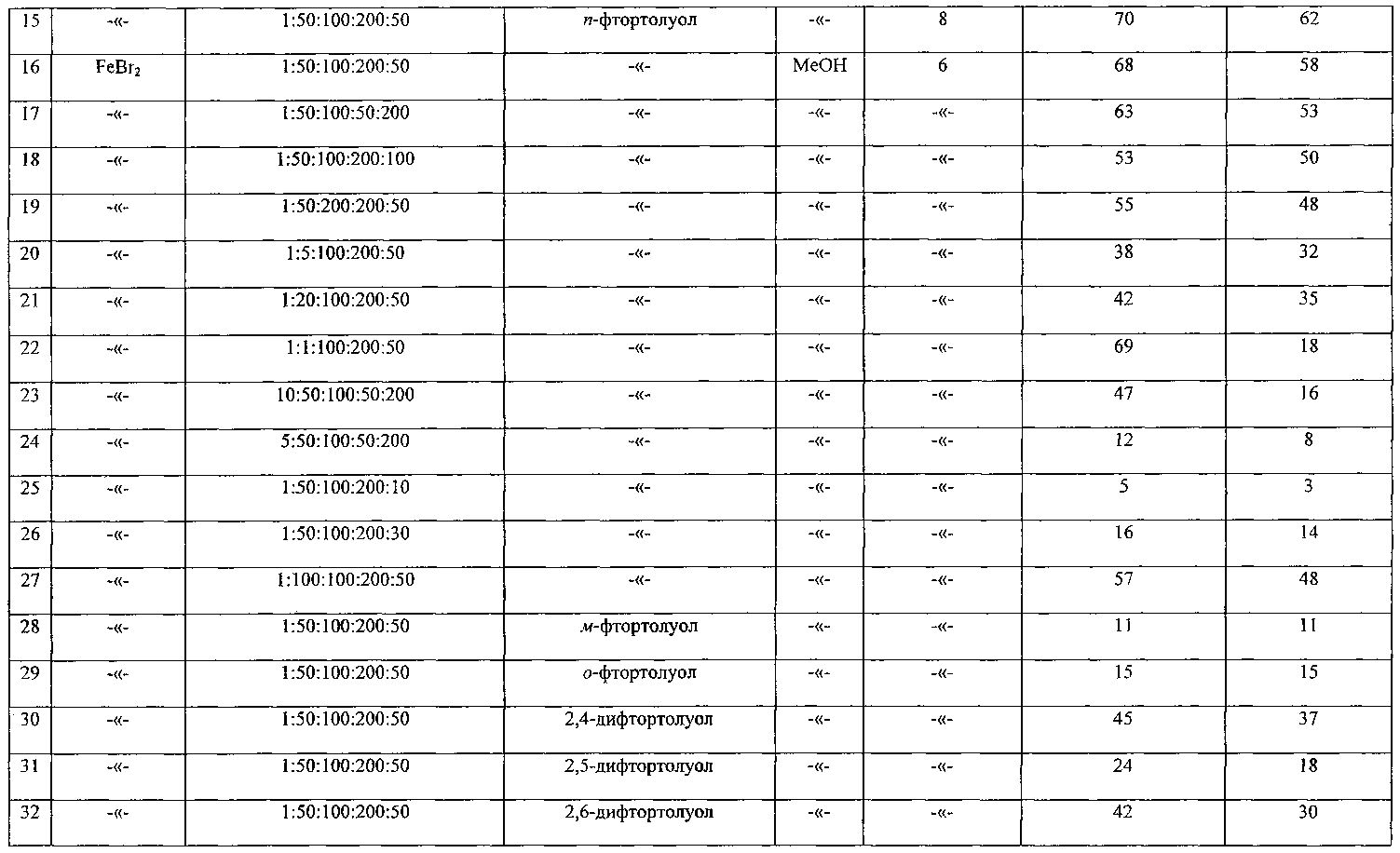
Сущность способа заключается во взаимодействии моно- или дифтортолуолов MeC6H4F и MeC6H3F2 с четыреххлористым углеродом и спиртами (MeOH, EtOH, PrnOH) в присутствии катализатора FeCl2·4H2O (или FeBr2), активированного формамидом, при 180°С в течение 4-8 ч при мольном соотношении [Fe]:[HCONH2]:[(ди)фтортолуол]:[CCl4]:[ROH]=1-10:1-100:50-200:50-200:10-200. Оптимальными для проведения реакции являются следующие соотношения катализатора и реагентов [Fe]:[HCONH2]:[(ди)фтортолуол]:[CCl4]МеОН]=1:50:100:200:50, при температуре 180°С в течение 6 ч. При температуре 180°С и продолжительности реакции 6 ч выход фторбензилхлоридов составляет 14-67%, а дифторбензилхлоридов - 18-37%. Синтез проводят в атмосфере аргона.
В отсутствие катализатора и спирта реакция не проходит.
Оптимальные условия реакции отрабатывали на примере взаимодействия п-фтортолуола с CCl4 и MeOH под действием FeCl2·4H2O (или FeBr2). Примеры, подтверждающие способ, приведены в таблице 1.
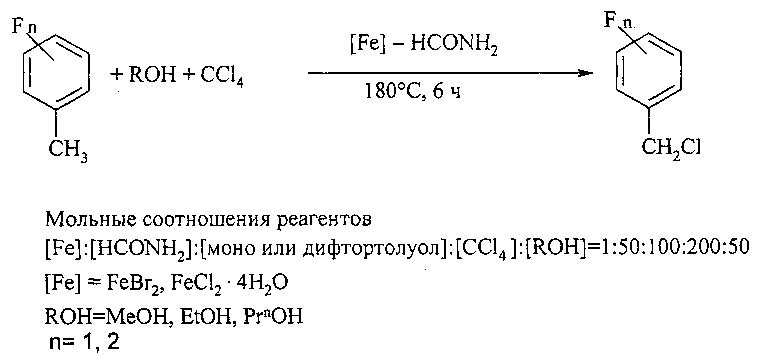
Преимущества предлагаемого метода
1. Высокая селективность процесса.
2. Доступность и дешевизна исходных реагентов и катализатора.
3. Удешевление себестоимости и упрощение технологии в целом за счет уменьшения энерго- и трудозатрат.
4. Непрореагировавшие моно- и дифтортолуолы легко отделяются от моно- и дифторбензилхлоридов перегонкой: их можно возвратить в реакцию.
Строение полученных моно- и дифторфторбензилхлоридов доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и литературными данными.
Предлагаемый способ поясняется примерами
Общий метод получения (ди-)фторбензилхлоридов
Реакции проводили в стеклянной ампуле, помещенной в микроавтоклав, при регулируемом нагреве. В ампулу загружали катализатор (FeBr2 или FeCl2·4H2O) и формамид, нагревали 5 минут, после чего добавляли четыреххлористый углерод, спирт и фтортолуол (или дифтортолуол). Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 180°С в течение 4-8 ч. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу фильтровали через бумажный фильтр. Растворитель отгоняли. Целевой продукт от исходного моно- или дифтортолуолов разделяли перегонкой под вакуумом.
ПРИМЕР 1. Реакцию проводили в стеклянной ампуле объемом 10 мл, помещенной в микроавтоклав из нержавеющей стали объемом 17 мл, при регулируемом нагреве. В ампулу загружали 0,01 г (0,00005 моль) FeCl2·4H2O и 0,13 мл (0,0025 моль) формамида, нагревали 5 минут, после чего добавляли 2,47 мл (0,01 моль) четыреххлористого углерода, 0,063 мл (0,0025 моль) MeOH и 0,55 мл (0,005 моль) п-фтортолуола. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 180°С в течение 6 ч. После выделения из реакционной массы выход п-фторбензилхлорида составляет 67%.
ПРИМЕРЫ 2-6. Опыты проводили аналогично примеру 1, результаты при разных соотношениях катализатора и реагентов приведены в таблице.
ПРИМЕР 7. Опыт проводили аналогично примеру 1 с использованием вместо п-фтортолуола 0,55 мл (0,005 моль) м-фтортолуола.
ПРИМЕР 8. Опыт проводили аналогично примеру 1 с о-фтортолуолом - 0,55 мл (0,005 моль).
ПРИМЕР 9. Опыт проводили аналогично примеру 1 с 2,4-дифтортолуолом - 0,716 мл (0,005 моль).
ПРИМЕР 10. Опыт проводили аналогично примеру 1 с 2,5-дифтортолуолом - 0,87 мл (0,005 моль).
ПРИМЕР 11. Опыт проводили аналогично примеру 1 с 2,6-дифтортолуолом - 0,72 мл (0,005 моль).
ПРИМЕР 12. Опыт проводили аналогично примеру 1 с EtOH - 0,09 мл (0,0025 моль).
ПРИМЕР 13. Опыт проводили аналогично примеру 1 с PrnOH - 0,12 мл (0,0025 моль).
ПРИМЕРЫ 14-15. Опыты проводили аналогично примеру 1, результаты при различной продолжительности эксперимента приведены в таблице.
ПРИМЕР 16. В ампулу загружали 0,01 г (0,000046 моль) FeBr2 и 0,12 мл (0,0023 моль) формамида, нагревали 5 минут, после чего добавляли 2,27 мл (0,0092 моль) четыреххлористого углерода, 0,058 мл (0,0023 моль) MeOH и 0,51 мл (0,0046 моль) п-фтортолуола. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 180°С в течение 6 ч. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу фильтровали через бумажный фильтр. Растворитель отгоняли. Целевой продукт - п-фторбензилхлорид от исходного п-фтортолуола разделяли перегонкой под вакуумом. Выход п-фторбензилхлорида составляет 58%.
ПРИМЕРЫ 17-27. Опыты проводили аналогично примеру 16, результаты при разных соотношениях приведены в таблице.
ПРИМЕР 28. Опыт проводили аналогично примеру 16 с м-фтортолуолом - 0,51 мл (0,0046 моль).
ПРИМЕР 29. Опыт проводили аналогично примеру 16 с о-фтортолуолом - 0,51 мл (0,0046 моль).
ПРИМЕР 30. Опыт проводили аналогично примеру 16 с 2,4-дифтортолуолом - 0,658 моль (0,0046 мл).
ПРИМЕР 31. Опыт проводили аналогично примеру 16 с 2,5-дифтортолуолом - 0,8 моль (0,0046 мл).
ПРИМЕР 32. Опыт проводили аналогично примеру 16 с 2,6-дифтортолуолом - 0,66 моль (0,0046 мл).
Строение полученных соединений доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и справочными данными.
Физико-химические характеристики полученных соединений
Спектральные данные полученных моно- и дифторбензилхлоридов
п-Фторбензилхлорид. Выход 58%, Ткип=82°С/26 мм рт.ст. (84-86°С/30 мм рт.ст. [Aldrich. Catalog Handbook of Fine Chemicals, 2014]). Спектр ЯМР 13C (δ, м.д., TMS): 133.47; 133.50 (C-1); 115.56; 115.84 (C-2,6); 130.43; 130.52 (C-3,5); 163.84; 166.41 (C-4); 45.50 (C-8). Спектр ЯМР 1H (δ, м.д., TMS): 6.90-7.20 (м, 2Н, С2, С6), 7.30-7.45 (м, 2Н, С3, С5), 4.58 (с, 2Н, CH2Cl). Спектр ЯМР 19F (δ, м.д.): -113.18 (м, 1F). Macc-спектр, m/z (Jотн(%)): 144[М]+, 31(2), 39(5), 44(12), 50(2), 57(18), 63(15), 81(13), 83(38), 89(6), 105(3), 107(20), 108(2), 109(100), 110(23), 117(3), 143(9), 144(47), 146(20).
о-Фторбензилхлорид. Выход 18%. Ткип=71-72°С/20 мм рт.ст. (86°С/40 мм рт.ст. [Aldrich. Catalog Handbook of Fine Chemicals, 2014]). Спектр ЯМР 13C (δ, м.д., TMS): 124.89; 124.97 (C-1); 160.25; 162.68 (C-2); 115.58; 115.79 (C-3); 130.95; 130.95 (C-4); 124.45; 124.49 (C-5); 130.49; 130.57 (C-6); 45.45 (C-8). Спектр ЯМР 1H (δ, м.д., TMS): 7.40-7.55 (м, 2Н, С3, С5), 7.30-7.45 (м, 2Н, С4, С6), 4.70 (с, 2Н, CH2Cl). Спектр ЯМР 19F (δ, м.д.): -117.51 (м, 1F). Масс-спектр, m/z (Jотн(%)):144[M]+, 31(2), 39(5), 44(12), 50(2), 57(18), 63(15), 81(13), 83(38), 89(6), 105(3), 107(20), 108(2), 109(100), 110(23), 117(3), 143(9), 144(47), 146(20).
м-Фторбензилхлорид. Выход 14%. Ткип=85-86°С/40 мм рт.ст. (176-177°С [Aldrich. Catalog Handbook of Fine Chemicals, 2014]). Спектр ЯМР 13C (δ, м.д., TMS): 139.75; 139.82 (C-1); 115.42; 115.60 (C-2); 161.56; 164.01 (С-3); 115.26; 115.47 (C-4); 130.24; 130.33 (C-5); 124.11; 124.14 (C-6); 45.50 (C-8). Спектр ЯМР 1H (δ, м.д., TMS): 7.20-7.40 (м, 2Н, С2, С5), 6.90-7.20 (м, 2Н, С4, С6), 4.57 (с, 2Н, CH2Cl). Спектр ЯМР 19F (δ, м.д.): -112.53 (м, 1F). Масс-спектр, m/z (Jотн(%)):144[M]+, 31(2), 39(5), 44(12), 50(2), 57(18), 63(15), 81(13), 83(38), 89(6), 105(3), 107(20), 108(2), 109(100), 110(23), 117(3), 143(9), 144(47), 146(20).
2,4-Дифторбензилхлорид. Выход 37%. Ткип=70-72°С/40 мм рт.ст. (60-62°С/14 мм рт.ст. [K. Inukai, Т. Ueda, Kogyo Kagaki Zasshi, Journal, 1957, ISSN: 0368-5462, https://scifmder.cas.org]). Спектр ЯМР 13C (δ, м.д., TMS): 120.86, 120.90, 121.01, 121.04(C-1); 161.79, 161.91, 164.28, 164.40 (C-2); 103.91, 104.16, 104.41 (C-3); 159.48; 159.60, 161.99, 162.11 (C-4); 111.55, 111.59, 111.76, 111.80 (C-5); 131.78, 131.84, 131.88 (C-6); 38.73; 38.75, 38.77, 38.80 (C-9). Спектр ЯМР 1H (δ, м.д., TMS): 6.70-6.90 (м, 1Н, С3, С5), 7.30-7.45 (м, 1H, С6), 4.61 (с, 2Н, CH2Cl). Спектр ЯМР 19F (δ, м.д.): -113.14 (м, 1F, F-7), -108.68 (м, 1F, F-8).
2,5-Дифторбензилхлорид. Выход 18%. Ткип=85-86°С/40 мм рт.ст. (66-64°С/14 мм рт.ст. [K. Inukai, Т. Ueda, Kogyo Kagaki Zasshi, Journal, 1957, ISSN: 0368-5462, https://scifmder.cas.org]). Спектр ЯМР 13C (δ, м.д., TMS): 126.09; 126.16, 126.25, 126.33 (C-1); 155.19, 155.23, 157.63, 157.67 (C-2); 116.97, 117.00, 117.21, 117.25 (C-3); 116.57, 116.60, 116.65, 116.69 (C-4); 157.27, 157.31, 159.69, 159.73 (C-5); 116.81, 116.84, 116.89, 16.93 (C-6); 38.68; 38.70, 38.72, 38.74 (C-9), 58.01 (C-10). Спектр ЯМР 1H (δ, м.д., TMS): 7.20-7.40 (м, 1H, С3), 6.80-7.15 (м, 1H, С4), 7.15-7.20 (м, 1H, С6), 4.61 (с, 2Н, CH2Cl). Спектр ЯМР 19F (δ, м.д.): -123.80 (м, 1F, F-7), -118.18 (м, 1F, F-8).
2,6-Дифторбензилхлорид. Выход 30%. Ткип=54-56°С/10 мм рт.ст. (76°С/22 мм рт.ст. [Aldrich. Catalog Handbook of Fine Chemicals, 2014]). Спектр ЯМР 13C (δ, м.д., TMS): 113.89; 114.08, 114.27 (C-1); 157.60, 159.89, 159.96, 160.60 (C-2,6); 111.37, 111.43, 111.56, 111.61 (C-3,5); 130.56, 130.66, 130.77 (C-4); 32.34, 32.39, 32.44 (C-9). Спектр ЯМР 1H (δ, м.д., TMS): 6.85-7.00 (м, 1H, С3, С5), 7.20-7.40 (м, 1Н, С4), 4.67 (с, 2Н, CH2Cl). Спектр ЯМР 19F (δ, м.д.): -114.94 (м, 2F, F-7,8).
Другие примеры, подтверждающие способ, приведены в таблице 1.