Результат интеллектуальной деятельности: 1-[ω-АРИЛОКСИАЛКИЛ(БЕНЗИЛ)]ЗАМЕЩЕННЫЕ 2-АМИНОБЕНЗИМИДАЗОЛЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА
Вид РИД
Изобретение
Изобретение относится к области биологически активных соединений, предназначенных для лечения и профилактики заболеваний, вызываемых патогенным для человека вирусом гриппа, и касается разработки новых веществ - производных 1-[ω-арилоксиалкил(бензил)]замещенных 2-аминобензимидазолов. Изобретение может быть использовано в лечебных учреждениях, научно-исследовательских лабораториях, а также в животноводстве и птицеводстве.
Актуальность поиска средств для терапии гриппа (семейство Orthomyxoviridae, род Influenzavirus) диктуется развитием пандемической ситуации в мире и опасностью появления в человеческой популяции высокопатогенных штаммов вируса гриппа, в частности подтипа H5N1. В настоящее время смертность от этой инфекции составляет порядка 70%, при этом заболевание, как и тяжелые формы гриппа другой этиологии, характеризуется острейшим началом и крайне тяжелым течением: высокой (более 40°C) температурой и длительной лихорадкой с резко выраженными симптомами интоксикации (сильной головной болью, ломотой, бессонницей, бредом, анорексией, тошнотой, рвотой, менингиальными симптомами, иногда энцефалитическим синдромом). Вариантом молниеносной формы может быть стремительное развитие геморрагического токсического отека легких и смертельный исход от дыхательной и сердечно-сосудистой недостаточности [Но P.L., Becker М., Chan-Yeung М.М., Int. J. Tuberc. Lung Dis. 2007 11(7):710-21].
Вирионы гриппа представляют собой сферические или нитевидные частицы диаметром 80-100 нм, покрытые липидной оболочкой с интегрированными молекулами поверхностных гликопротеинов (НА и NA) и ионного канала М2, ассоциированной со слоем мембранного белка Ml. Сердцевина вирионов представлена 8 сегментами однонитевой РНК отрицательной полярности (вРНК), ассоциированной с тремя белками полимеразного комплекса (PA, РВ1, РВ2) и молекулами нуклеопротеина (NP).
После проникновения в клетку и «раздевания» вириона сегменты генома попадают в цитоплазму, где вирусная полимераза осуществляет транскрипцию и репликацию вРНК. В результате образуются молекулы вирусспецифической матричной РНК (мРНК) и комплементарной РНК (кРНК) соответственно. На матрице кРНК впоследствии синтезируется цепь вРНК, входящая затем в состав вирионов потомства. мРНК транслируется при помощи клеточных механизмов с образованием структурных и неструктурных белков, первые из которых образуют вирионы потомства, а последние играют важные регуляторные функции в ходе жизненного цикла вируса.
2. Предшествующий уровень техники.
Вакцинация против гриппа является эффективным противоэпидемическим средством, однако вследствие постоянной смены антигенных свойств возбудителя требуется постоянный мониторинг и разработка новых вакцинных штаммов, соответствующих циркулирующим в человеческой популяции в каждый конкретный эпидемический сезон.
Химиопрофилактика и химиотерапия гриппа применяются наряду с вакцинацией для предотвращения и лечения заболевания. Несмотря на наличие в жизненном цикле вируса множества компонентов, представляющих потенциальную мишень для специфической химиотерапии, на сегодняшний день лишь два из них используются в этом качестве.
Во-первых, это белок М2 вируса гриппа, играющий роль ионного канала в вирусной мембране, который блокируют препараты адамантанового ряда - ремантадин (а-Метил-1-адамантил-метиламина гидрохлорид) и амантадин (1-аминоадамантан) [Scholtissek С, Quack G., Klenk H.D., Webster R.G., Antiviral Res. 1998, 37, 83-95].
Другой мишенью для лекарственного вмешательства является вирусная нейраминидаза - фермент, необходимый для нормального почкования вирусных частиц и проявления инфекционных свойств вируса гриппа, против которой эффективны нейраминидазные ингибиторы занамивир (5-(ацетиламино)-4-[(аминоиминометил)-амино]-2,6-ангидро-3,4,5-тридезокси-D-глицеро-D-галакто-нон-2-еноновая кислота), озелтамивир (Тамифлю™) [Colman P.M., J. Antimicrob. Chemother. 1999 Nov;44 Suppl B:17-22] и перамивир (1S,2S,3S,4R)-3-[(1S)-1-ацетамидо-2-этил-бутил]-4-(диаминометилиденамино)-2-гидроксициклопентан-1-карбоновая кислота) [Mancuso С.Е., Gabay М.Р., Steinke L.M., VanOsdol S. J., Ann. Pharmacother. 2010 44(7-8): 1240-9].
Обе группы соединений имеют свои недостатки.
В отношении группы производных адамантана можно отметить сравнительно высокую токсичность, узкий спектр действия (препараты активны против гриппа А, но не против гриппа В) и быстрое формирование устойчивости вируса к препаратам.
Для ингибиторов нейраминидазы характерны формирование резистентности вирусов и высокая стоимость синтеза, что делает эти препараты менее доступными для широкого использования.
Ограниченность выбора противовирусных препаратов является причиной низкой эффективности лечения острых и хронических вирусных инфекций [De Clercq Е., Nature Rev. Microbiol. 2004, 2, 704-720; De Clercq E., Nature Rev. Drug. Discov. 2007, Vol.6, p.1001 - 1018].
Разнообразные патогенетические и симптоматические препараты, применяемые при лечении гриппа, направлены на корректировку только реактивных процессов в организме и не устраняют причину заболевания.
Многочисленные химические соединения, не дошедшие до клинических испытаний, относятся к различным химическим классам, направлены на различные мишени в жизненном цикле вируса и демонстрируют различный уровень противогриппозной активности в клеточных культурах и в редких случаях лабораторных животных (Kim Yunjeong, Narayanan Sanjeev, Chang Kyeong-Ok, Antiviral Research 88 (2010) 227-235; Wolf Mike C, Freiberg Alexander N. et al, PNAS 2010, vol. 107, 3157-3162; Iwaia Yuma, Takahashib Hitoshi et al, Bioorganic & Medicinal Chemistry 18 (2010) 5379-5390; Doncel Gustavo F., R. Clark Meredith Antiviral Research 88 (2010) 10-18; Pleschka St., Stein M., Schoop R. and Hudson J. В., Virology Journal 2009, 6:197; Song G., Yang S., Zhang W., Cao Y., Wang P., Ding N., Zhang Z., Guo Y., Li Y., J. Med. Chem. 2009, 52, 7368-7371).
Известен препарат нуклеозин, имеющий высокую степень сродства к белку NP вируса гриппа и эффективно ингибирующий его репликацию. Однако все изоляты вируса, вызвавшего пандемию 2009 г., оказались устойчивы к этому препарату (Као R. Y., Yang Dan, et al, Nature Biotechnology, 2010, 28, 6: 600-607).
Известен также препарат Рибавирин, представляющий собой нуклеозидный аналог, эффективный против 85% РНК-геномных вирусов млекопитающих. Применение его ограничено побочными последствиями, преимущественно анемией, проявляющимися вследствие его сходства с субстратами клеточных ферментов. Являясь аналогом нуклеозидов, рибавирин эффективен в субтоксических концентрациях, и системное его применение вызывает побочные реакции, в частности анемию и тератогенный эффект при употреблении во время беременности. Преимущественно рибавирин в комбинации с интерфероном применяется при лечении гепатита, однако эффект его показан при местном (ингаляционном) применении в случае PC-вирусной и ранних стадий гриппозной инфекции.
Тем не менее, при появлении случаев заболевания человека атипичной пневмонией (SARS), а позднее - гриппом птиц подтипа H5N1 рибавирин использовался внутривенно при терапии тяжелых случаев заболевания. После использования рибавирина были отмечены случаи облегчения болезни и полного выздоровления пациентов.
Рибавирин является препаратом комплексного механизма действия. Он влияет на репликацию вируса гриппа двумя путями - прямо, вмешиваясь в полимеразные процессы при транскрипции и репликации вирусного генома, и опосредованно - угнетая клеточный фермент инозинмонофосфатдегидрогеназу и истощая тем самым клеточный пул ГТФ, необходимого для построения вирусных РНК. Поскольку основная мишень препарата - не вирусный, а клеточный фермент, то устойчивые к рибавирину штаммы вируса гриппа отмечаются крайне редко или не обнаруживаются вообще. В то же время существенные побочные эффекты (согласно рекомендациям FDA - 129 разновидностей) позволяют рекомендовать его только при тяжелых состояниях больных гриппом (DeClercq Е. //Nat. Rev. Drug Discov. 2006; 5: 1015-25; Beigel J., Bray M. //Antiviral Research 2008; 78:91-102).
Близкими аналогами изобретения являются как рибавирин, так и разработанный японскими исследователями препарат Т-705 (фавипиравир), представляющий собой высокоэффективный противовирусный аналог нуклеозида, ингибирующий вирусные полимеразы (Furuta Yousuke, Takahashi Kazumi, Shiraki Kimiyasu, Sakamoto Kenichi, Smee D.F, Barnard D. L., Gowen В. B, Julander J. G, Morrey J. D., Antiviral Research, 2009, 82, 95-102). Несмотря на высокую эффективность, точный механизм его действия не выяснен, а его химическая природа как нуклеотидного аналога предполагает, по аналогии с Рибавирином, побочные последствия при широком клиническом применении.
Задачей изобретения является расширение ассортимента ингибиторов репродукции вируса гриппа, обладающих высокой эффективностью и низкой токсичностью. Задача решается применением в качестве ингибиторов репродукции вируса гриппа арилоксиалкилзамещенных 2-аминобензимидазола.
В ряду бензимидазолов имеется много примеров структур, обладающих противовирусным действием, которые часто относятся к классу нуклеозидов [Xue F., Luo X., Ye С, Ye W., Wang Y.//Bioorg. Med. Chem. 2011; 19(8): 2641-9; Prichard M.N. Frederick S.L., Daily S., Borysko K.Z., Townsend L.B., Drach J.C. Kern E.R.// Antimicrob Agents Chemother. 2011;55(5):2442-5; Tonelli M., Simone M., Tasso В., Novelli F., Boido V., Sparatore F., Paglietti G., Pricl S., Giliberti G., Blois S., Ibba C, Sanna G., Loddo R., La Colla P.//Bioorg Med Chem. 2010; 18(8): 2937-53]. Однако такие производные нередко имеют недостаточно высокую активность, активность узкого спектра либо значительную токсичность. Эти особенности ограничивают их применение жизненными показаниями и не позволяют использовать их для терапии широко распространенных инфекций, в частности гриппа.
Раскрытие изобретения.
Техническим результатом предлагаемого изобретения является нахождение нового класса химических соединений, обладающих выраженной активностью против вируса гриппа. Указанный технический результат достигается тем, что для этой цели предложено использовать производные 1-ω-арилоксиалкил-замещенных 2-аминобензимидазолов и их фиксированных иминотаутомерных форм - 3-R-производных 1-ω-арилоксиалкил- и бензилзамещенных 2-иминобензимидазолина, имеющих общую формулу 1:
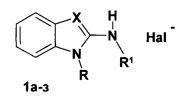
а, б X=N, R=4-ClC6H4OCH2CH2, Hal- отсутствует, a) R1 = 2-фуроил, б) R1 = 2-теноил;
в-з X=N+CH2R2, R1=H, в) R=3,4-Cl2C6H4CH2, R2=CONH2; Hal=Cl
г) R=4-FC6H4OCH2CH2, R2=CONH2; Hal=Cl
д) R=3,4-Cl2C6H4CH2, R2=CH2OH; Hal=Cl
е) R=4-ClC6H4OCH2CH2, R2=CH2OH; Hal=Cl
ж) R=4-FC6H4OCH2CH2CH2, R2=CH=CH2; Hal=Br
з) R=4-(CH3)3CC6H4OCH2CH2, R2=CH=CH2; Hal=Br
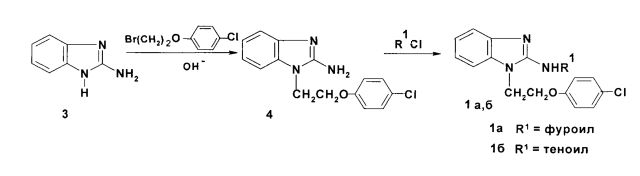
Соединения 1а, б синтезируют из 2-аминобензимидазола (3) путем алкилирования его 2-(4-хлорфенокси)этилбромидом в щелочной среде с последующим N-ацилированием образующегося 1-[2-(4-хлорфеноксиэтил)]-2-аминобензимидазола (4) хлорангидридами фуран- и тиофенкарбоновых кислот:
Соединения 1в-з также синтезируют из 1-замещенных-2-аминобензимидазолов, кватернизуя их амидом хлоруксусной кислоты (соединения 1в, 1г), этиленхлоргидрином (соединения 1д, е). Четвертичные соли 1ж, з получены путем взаимодействия 1-аллил-2-аминобензимидазола и соответствующих ω-арилоксиалкилбромидов.
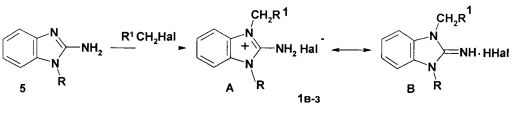
в) R=3,4-Cl2C6H4CH2, R2=CONH2; Hal=Cl-
г) R=4-FC6H4OCH2CH2, R2=CONH2; Hal=Cl-
д) R=3,4-Cl2C6H4CH2, R2=CH2OH; Hal=Cl-
е) R=4-ClC6H4OCH2CH2, R2=CH2OH; Hal=Cl-
ж) R=4-FC6H4OCH2CH2CH2, R2=CH=CH2; Hal=Br-
з) R=4-(CH3)3CC6H4OCH2CH2, R2=CH=CH2; Hal=Br-
Четвертичные соли 1в-з могут находится в виде двух таутомерных форм - аминой (А) и иминной (В).
Заявляемые соединения представляют собой бесцветные или бледно-бежевые кристаллические высокоплавкие вещества, растворимые в метаноле, ацетоне, диметилформамиде, диметилсульфоксиде, умеренно растворимые или нерастворимые в воде. Данные элементного анализа и ЯМР-спектроскопии полностью соответствуют приведенным выше структурным формулам.
Исследования биологической активности соединений, проведенные в отношении вируса гриппа, показали их высокую эффективность как ингибиторов репродукции этого вируса. В результате исследований выявлено, что соединения 1в, 1д, 1е, 1з наиболее активно влияют на репродукцию вируса гриппа, что подтверждается приведенными ниже данными.
Полученные количественные показатели ингибирования подтверждают высокую степень подавления репликации вируса гриппа в культуре клеток MDCK изученными соединениями, превышающую, например, тот же показатель у эталона сравнения - ремантадина в 12-68 раз.
Важным преимуществом соединений типа 1 является то, что некоторые из них одновременно обладают и высокой антимикробной активностью, главным образом, в отношении грамположительных патогенных бактерий, в том числе резистентных к используемым в настоящее время антимикробным препаратам [Морковник А.С., Диваева Л.Н., Зубенко А.А., Подладчикова О.Н., Фетисов Л.Н., Акопова А.Р., Пат. РФ №2423355].
Противовирусные свойства синтезированных соединений в отношении вирусов гриппа изучались в культуре клеток MDCK на модели экспериментальной гриппозной инфекции, вызванной вирусами гриппа человека A(H1N1)pdm09.
Испытание 1-арилоксиалкилпроизводных 2-аминобензимидазола 1 в опытах по угнетению репликации вирусов гриппа выявило, что эти соединения эффективно снижают инфекционную активность вируса гриппа человека A(H1N1)pdm09 (наименьшее значение EC50 составляет 0,3 мкг/мл). В качестве сравнения использован противовирусный препарат ремантадин.
Результаты испытаний представлены в таблице.
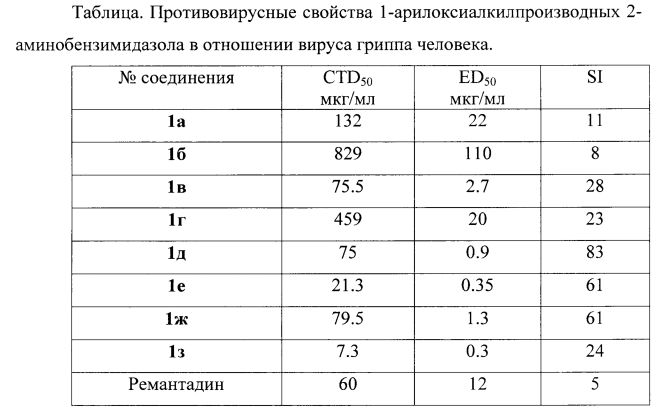
Как видно из представленных данных, изученные соединения проявляли в среднем сопоставимый уровень токсичности по сравнению с существующим противовирусным препаратом ремантадином, что выражалось в более высоких значениях 50% цитотоксических концентраций (CTD50) - от 6,3 до 829 мкг/мл. В то же время уровень противовирусной активности был намного выше (EC50=0.3-2.7, у препарата сравнения ремантадина - 12). На основании полученных результатов был рассчитан индекс селективности - отношение CTD50 к EC50. За редким исключением, противовирусная активность производных аминобензимидазола была существенной, что выражалось в высоких значениях индекса селективности (24-340), и была намного выше, чем у препарата сравнения - ремантадина (индекс селективности 5,0).
Представленные данные, таким образом, убедительно подтверждают вывод, что в условиях проведенных экспериментов 1-арилоксиалкилпроизводные 2-аминобензимидазола 1 проявляют высокую противовирусную активность в отношении вируса гриппа человека, ингибируя репликацию вируса H1N1 в 5-68 раз сильнее, чем препарат сравнения - ремантадин.
Дополнительным и весьма важным преимуществом соединений типа 1 является то, что некоторые из них обладают еще и высокой антимикробной активностью, главным образом, по отношению к грамположительным патогенным бактериям, в том числе к их резистентным формам [Морковник А.С., Диваева Л.Н., Зубенко А.А., Подладчикова О.Н., Фетисов Л.Н., Акопова А.Р., Пат. РФ №2423355].
Отмеченные преимущества заявляемого класса соединений делают этот класс соединений перспективным для использования в качестве фармпрепаратов для борьбы с гриппозной инфекцией.
Изобретение иллюстрируется следующими примерами.
Пример 1. 1-[2-(4-Хлорфеноксиэтил)]-2-(фуроил-2)-аминобензимидазол (1а).
Стадия 1. 1-[2-(4-Хлорфеноксиэтил)]-2-аминобензимидазол.
Синтез этого соединения проводился по методике, описанной ранее [Морковник А.С., Диваева Л.Н., Зубенко А.А., Подладчикова О.Н., Фетисов Л.Н., Акопова А.Р., Пат. РФ 2423355]. Т. пл. 183 - 184°С (из ацетонитрила).
Стадия 2. 1-[2-(4-Хлорфеноксиэтил)]-2-(фуроил-2)-аминобензимидазол.
К нагретому до 50°C раствору 1.4 г (5 ммоль) 2-амино-1-[2-(4-хлорфеноксиэтил)]бензимидазола в смеси 5 мл ацетонитрила и 2 мл пиридина прибавляют 0.78 г (6 ммоль) хлорангидрида пирослизиевой кислоты. Сразу же начинается выделение осадка. Смесь кипятят 2 часа, охлаждают, добавляют 2 мл воды и продукт отфильтровывают. Выход 1.5 г (79%). Далее его очищают на колонке с окисью алюминия в хлороформе (Rf0,6). Светло-бежевые кристаллы с т.пл. 183-184°C (из толуола). Спектр ЯМР 1Н (300 МГц), δ, м.д. (CDCl3): 4.38 (т, 2Н, NCH2); 4.58 (т, 2Н, ОСН2); 6.44 (т, 1Н, протон 4-Н фурильной группы); 6.78 (д, 2Н, орто-Н пара-фениленовой группы); 7.15 - 7.38 (м, 6Н, 2 мета-Н пара-фениленовой группы +5,6,7-Н + протон 5-Н фурильной группы); 7.40 (д, 1Н, 4-Н), 7.55 (с, 1Н, протон 3-Н фурильной группы), 12.02
(с, 1Н, NH). Элементный анализ. Найдено (%): С 62.64; Н 4.40; Сl 9.09; N 10.66. C20H16ClH3O3. Вычислено (%): С 62.91; Н 4.22; С1 9.29; N 11.01.
Пример 2. 1-[2-(4-Хлорфеноксиэтил)]-2-(теноил-2)-аминобензимидазол (1б).
Получают аналогично соединению 1а из 1-[2-(4-хлорфеноксиэтил)]-2-аминобензимидазола и хлорангидрида тиофенкарбоновой кислоты с выходом 67%. Бесцветные кристаллы с т.пл. 204-206°C (из толуола). Спектр ЯМР 1Н (300 МГц), δ, м.д (CDCl3): 4.36 (т, 2Н, NCH2); 4.55 (т, 2Н, ОСН2), 6.82 (д, 2Н, орто-H ArO,); 7.02 (т, 2Н, мета-H ArO); 7.15-7.18 (м, 3Н, 5,6-Hбензимидазол + 4-Hтиофен), 7.41 (дд, 2Н, 7-Hбензимидазол + 5-Hтиофен), 7.52 (д, 1Н, (4-Hбензимидазол); 7.95 (д, 1Н, 3-Hтиофен), 12.52 (с, 1Н, NH). Элементный анализ. Найдено (%): С 60.14; Н 3.88; N 10.22. C20H16ClN3O2S. Вычислено (%): С 60.37; Н 4.05; N 10.56.
Пример 3. 2-Имино-1-(3,4-дихлорбензил)-3-карбоксамидометилбензимидазолина гидрохлорид (1в)
Стадия 1. 2-Амино-1-(3,4-дихлорбензил)бензимидазол. Раствор 0.67 г КОН, 1.31 г (10 ммоль) 2-аминобензимидазола в 15 мл ДМСО перемешивают при 35°C 15 минут, а затем прикапывают 2,20 г (10 ммоль) 3,4-дихлорбензилбромида с такой скоростью, чтобы температура реакции не превышала 50°C. Смесь выдерживают при этой температуре 30 минут, охлаждают и постепенно добавляют 40 мл воды. При этом выпавший в процессе бензилирования обильный кристаллический осадок сначала растворяется, а затем выпадает ватообразный объемный осадок 2-амино-1-(3,4-дихлорбензил)бензимидазола, который фильтруют, промывают 5% раствором КОН, водой и высушивают. Выход 2.16 г (74%). Бесцветные мелкие кристаллы с т.пл. 186-186°C (из изопропанола). Спектр ЯМР 1H, (300 МГц), δ, м.д. (CDCl3): 4.52 (уш. с, 2Н, NH2); 5.09 (с, 2Н, СН2); 6.95-7.26 (м, 5Н, 3H Bn + 5,6-Hбензимидазол); 7.36 (д, 1Н, 7-Hбензимидазол); 7.48 (д, 1Н, 4-Hбензимидазол). Элементный анализ. Найдено (%): С 57.21; Н 3.46; Cl 23.87; N 14.40. C14H11Cl2N3. Вычислено (%): С 57.55; Н 3.79; С1 24.27; N 14.38.
Стадия 2. 2-Имино-1-(3,4-дихлорбензил)-3-карбоксамидометилбензимидазолина гидрохлорид.
К раствору 1.46 г (10 ммоль) 2-амино-1-(3,4-дихлорбензил)бензимидазола в 10 мл ДМФА при температуре 80°C прибавляют 0.47 г (10 ммоль) амида хлоруксусной кислоты и выдерживают при температуре 120°C 1 час. Реакционную массу охлаждают, фильтруют 3.70 г (96%) гидрохлорида 2-имино-1-(3,4-дихлорбензил)-3-карбоксамидометилбензимидазолина. Полученный в этих условиях продукт не требует дополнительной очистки. Т. пл. 289.5-290.5°C (из этанола). Спектр ЯМР 1H, (300 МГц), δ, м.д. (DMSO-d6): 4.92 (с, 2Н, CH2Bn); 5.55 (с, 2Н, СН2СО); 7.28-7.34 (м, 3H, Bn); 7.46-7.60 (м, 3H, 5,6,7-Hбензимидазол); 7.64 (д, 1Н, 4-Hбензимидазол); 9,25 (с, 2Н, =N+H2). Элементный анализ. Найдено (%): С 49.49; Н 3.65; N 14.40. C16F15Cl3N4O. Вычислено (%): С 49.83; Н 3.92; N 14.53.
Пример 4. 2-Имино-1-[2-(4-фторфеноксиэтил)]-3-карбоксамидометилбензимидазолина гидрохлорид (1г)
Получен из 1-[2-(4-фторфеноксиэтил)]-2-аминобензимидазола и амида хлоруксусной кислоты с выходом 65%. Белоснежные пластинки с т.пл. 253-254.5°C (из этанола). Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 4.25 (т, 2Н, NCH2CH2OAr); 4.65 (т, 2Н, CH2OAr); 4.98 (т, 2Н, СН2СО); 6.75 (д, 2Н, орто-R ArO); 6.82-6.95 (м, 4Н, 2 мета-H ArO + 5,6-Hбензимидазол); 7.25 - 7.40 (м, 2Н, 7-Hбензимидазол + 1H, CONH2); 7.48 (д, 1Н, 4-Hбензимидазол); 7.90 (с, 1H, CONH2); 9.65 (с, 2Н, =N+H2). Элементный анализ. Найдено (%): С 55.64; Н 4.67; N 15.00. C17H18ClFN4O2. Вычислено (%): С 55.97; Н 4.98; N 15.36.
Пример 5. 2-Имино-1-(3,4-дихлорбензил)-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1д)
Нагретый до 50°C раствор 2.92 г (10 ммоль) 2-амино-1-(3,4-дихлорбензил)бензимидазола в 20 мл ДМФА смешивают с 1.61 г (20 ммоль, 1,34 мл) этиленхлоргидрина и полученную реакционную массу кипятят 1 час. Охлаждают, фильтруют мелкие белоснежные кристаллы и тщательно промывают их ацетоном. Выход 3.64 г (91%). Т. пл. 225.5-226.5°C (из смеси метанол ДМФА 5:1). Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 3.78 (т, 2Н, NCH2Bn); 4.50 (т, 2H, NCH2CH2OH; 4.70-5.30 (уш.с, 1H, ОН); 5.50 (т, 2Н,CH2OH; 6.55 (т, 2Н, орто-H Bn); 7.00-7.25 (м, 4Н, 5,6,7-Hбензимидазол + 1 мета-Н Bn); 7.60 (д, 1Н, 4-Hбензимидазол); 9.35-9.80 (уш. с, 2Н, =N+H2). Элементный анализ. Найдено (%): С 50.79; Н 4.66; N 11.58. C16H16Cl3N3O. Вычислено (%): С 51.57; Н 4.33; N 11.27.
Пример 6. 2-Имино-1-[2-(4-хлорфеноксиэтил)]-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1е).
Получают аналогично соединению 1д по вышеописанной методике из 1-[2-(4-хлорфеноксиэтил)]-2-аминобензимидазола и этиленхлогидрина с выходом 73%. Бесцветные мелкие кристаллы с т.пл. 225-226°C (из этанола). Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 3.75 (т, 2Н, NCH2CH2OAr); 4.30 (NCH2CH2OH), 4.40 (т, 2Н, CH2OAr); 4.80 (т, 2Н, СН2ОН), 5.02 (уш. с, 1Н, ОН); 6.78 (д, 2Н, орто-H ArO,); 7.15-7.25 (м, 4Н, 2 мета-R ArO + 5,6-Hбензимидазол); 7.50 (дд, 2Н, 4, 7-Hбензимидазол), 9.45 (уш. с, 2Н, =N+H2). Элементный анализ. Найдено (%): С 55.22; Н 5.06; С1 19.00; N 11.05. C17H19Cl2N3O. Вычислено (%): С 55.40; Н 5.16; С1 19.28; N 11.00.
Пример 7. 2-Имино-1-аллил-3-[γ-(4-фторфеноксипропил)]бензимидазолина гидрохлорид (1ж).
Смесь 2.35 г (10 ммоль) 2-амино-1-аллилбензимидазола и 2.33 г (10 ммоль) γ-(4-фторфеноксипропил)бромида в 20 мл толуола кипятят 1.5 часа. Охлаждают, осадок отфильтровывают, промывают ацетоном и высушивают. Выход 2.96 г (92%). Бесцветные ватообразные кристаллы с т.пл. 217.5-219°C (из этанола). Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 2.20 (т, 2Н, CH2CH2CH2); 4.25 (т, 2Н, NCH2CH2CH2OAr); 4.55 (т, 2Н, CH2OAr); 4.95 (д, 2Н, NCH2CH=CH2); 5.65 (дд, 2Н, СН2=СН); 5.85-6.00 (м, 1Н, СН=СН2); 6.80 (т, 2Н, орто-H ArO); 6.92 (т, 2Н, мета-H ArO); 7.20 (дд, 5,6-Hбензимидазол); 7.40 (дд, 2Н, 4,7-Hбензимидазол); 9.90 (с, 2Н,=N+H2). Элементный анализ. Найдено (%): С 62.68; Н 5.44; N 11.42. C19H21ClFN3O. Вычислено (%): С 63.01; Н 5.80; N 11.61.
Пример 8. 2-Имино-1-аллил-3-[β-(4-трет-бутилфеноксиэтил)]бензимидазолина гидробромид (1з).
Получают аналогично гидрохлориду 2-имино-1-аллил-3-[γ-(4-фторфенокси)пропил]бензимидазолина из 2-амино-1-аллилбензимидазола и β-(4-трет-бутилфеноки)этилбромида с выходом 74%. Бесцветные кристаллы с т.пл. 276-277°C (из метанола). Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 1.20 [с, 9Н, С(СН3)3]; 4.08 (т, 2Н, NCH2CH2CH2OAr); 4.22 (т, 2Н, NCH2CH=CH2); 4.70 (т, 2Н, CH2ArO); 5.35 (т, 2Н, СН2=CH); 5.85-6.00 (м, 1H, СН=СН2); 6.69 (т, 2Н, орто-H ArO); 7.05 (т, 2Н, мета-H ArO); 7.26 (дд, 2Н, 5,6-Hбензимидазол); 7.50 (д, 1Н, 4-Hбензимидазол); 7.62 (д, 2Н, 7-Hбензимидазол); 9.20 (с, 2Н,=N+H2). Элементный анализ. Найдено (%): С 61.00; Н 6.22; N 9.49. C19H21ClFN3O. Вычислено (%): С 61.34; Н 6.51; N 9.76.
Пример 9. Изучение токсичности препаратов.
Токсичность продуктов была предварительно изучена в отношении клеток MDCK Клетки MDCK сеяли в 96-луночные планшеты и культивировали при 37°C в среде MEM с добавлением 10% сыворотки крупного рогатого скота в атмосфере 5% CO2 (в газопроточном инкубаторе Sanyo-175) до состояния монослоя. Из исследуемых препаратов готовили маточный раствор концентрации 10 мг/мл в диметилсульфоксиде, после чего готовили серию двукратных разведений препаратов в среде MEM от 1000 до 3.75 мкг/мл. Растворенные препараты вносили в лунки планшетов и инкубировали 2 суток при 37°C. По истечении этого срока клетки промывали 2 раза по 5 минут фосфатно-солевым буфером и количество живых клеток оценивали при помощи микротетразолиевого теста (МТТ). С этой целью в лунки планшетов добавляли по 100 мкл раствора (5 мг/мл) 3-(4,5-диметилтиазолил-2) 2,5-дифенилтетразолия бромида (ICN Biochemicals Inc., Aurora, Ohio) на физиологическом растворе. Клетки инкубировали при 37°C в атмосфере 5% CO2 в течение 2 часов и промывали 5 минут фосфатно-солевым буфером. Осадок растворяли в 100 мкл на лунку ДМСО, после чего оптическую плотность в лунках планшетов измеряли на многофункциональном ридере Victor 1420 (Perkin Elmer, Finland) при длине волны 535 нм. По результатам теста для каждого продукта определяли 50% цитотоксическую дозу (CTD50), т.е. концентрацию препарата, вызывающую гибель 50% клеток в культуре.
Пример 10. Противовирусная активность препаратов.
Определение противовирусной активности препаратов проводили на клетках MDCK в 96-луночных планшетах для клеточных культур. Соединения растворяли в поддерживающей среде для клеток, вносили в лунки панелей с клеточным монослоем и инкубировали в течение 1 часа при 36°C в атмосфере 5% CO2.
Из вируссодержащей жидкости (штамм A/California/07/09 (H1N1)v) готовили серию десятикратных разведении от 10-1 до 10-7, добавляли в лунки с препаратами и инкубировали при 36°C в течение 48 часов в атмосфере 5% CO2. По окончании срока инкубации аликвоту культуральной жидкости смешивали с равным объемом 1% куриных эритроцитов в отдельных планшетах с круглым дном. Учет результатов проводили через 60 минут инкубации при 20°C. За титр вируса в контроле и опыте принимали величину, обратную десятичному логарифму наибольшего разведения исходного вируса, способного вызвать положительную реакцию гемагглютинации в лунке, и выражали в количестве 50% инфекционных доз (ID50). Вирусингибирующее действие исследуемых соединений оценивали по снижению титра вируса в опыте по сравнению с контролем. На основании полученных данных рассчитывали 50% ингибирующую дозу ED50, т.е. концентрацию препарата, снижающую уровень вирусной репликации вдвое (на 0,3 lg ID50), и индекс селективности, или химиотерапевтический индекс (ХТИ), представляющий собой отношение CTD50 к ED50.
1-ω-Арилоксиалкил- и 1-бензилзамещенные 2-аминобензимидазолы и их фиксированные иминотаутомерные формы - 3-R-замещенные 1-ω-арилоксиалкил- и 1-бензил-2-иминобензимидазолина гидрогалогениды а, б X=N, R=4-ClCHOCHCH, Hal отсутствует, a) R = 2-фуроил, б) R = 2-теноил; в-з Х=NCHR, R=Н, в) R=3,4-ClCHCH, R=CONH; Hal=Clг) R=4-FCHOCHCH, R=CONH; Hal=Clд) R=3,4-ClCHCH, R=CHOH; Hal=Clе) R=4-ClCHOCHCH, R=CHOH; Hal=Clж) R=4-FCHOCHCHCH, R=CH=CH; Hal=Brз) R=4-(CH)ССНОСНСН, R=CH=CH; Hal=Br,обладающие активностью против вируса гриппа.![1-[ω-АРИЛОКСИАЛКИЛ(БЕНЗИЛ)]ЗАМЕЩЕННЫЕ 2-АМИНОБЕНЗИМИДАЗОЛЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА](https://fips.edrid.ru/images/rid/46/4c/1e/06f12c377b29306e153c7b842b068284.png)

