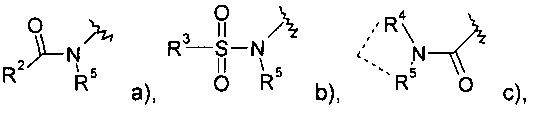Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ОКСАЗОЛИНОВ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС
Вид РИД
Изобретение
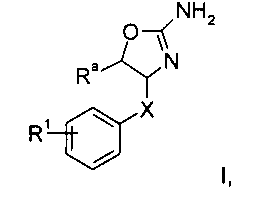
Изобретение относится к соединениям формулы
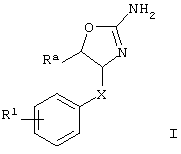 ,
,
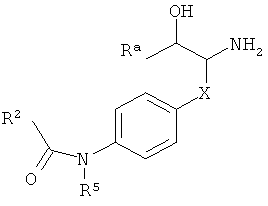
где
R3 представляет собой водород или низший алкил;
R1 представляет собой 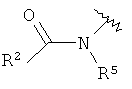 a),
a), 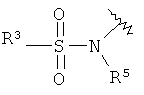 b),
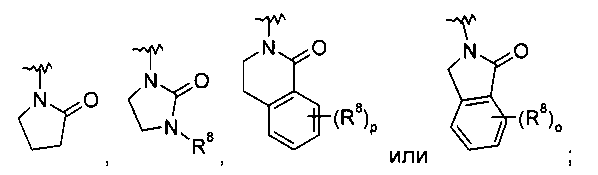
b), 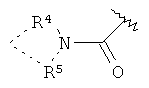 c) или может быть выбран из группы, состоящей из
c) или может быть выбран из группы, состоящей из
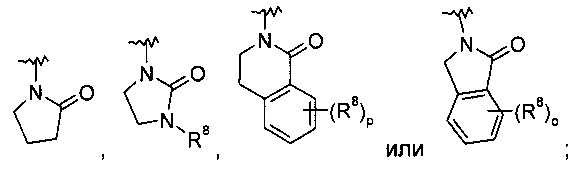
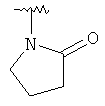 ,
, 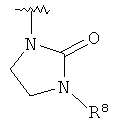 ,
, 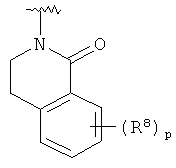 или
или 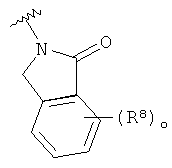 ;
;
R8 представляет собой водород, галоген или арил, возможно замещенный галогеном;
Х представляет собой связь, -(СН2)n-, -CHRCH2, -CHR(CH2)2-, -O-CHRCH2- или
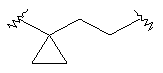 ; и R представляет собой низший алкил или низший алкил, замещенный галогеном;
; и R представляет собой низший алкил или низший алкил, замещенный галогеном;
R2 представляет собой
a) низший алкил;
b) водород;
c) NH-арил, возможно замещенный одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном;
а) NH-гетероарил, возможно замещенный одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном;
e) (CR'R”)m-циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом;
f) гетероциклоалкил, возможно замещенный галогеном или низшим алкилом, замещенным галогеном;
g) (CR'R”)m-гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, циклоалкилом, NHC(O)-низшим алкилом, циано, S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном;
h) (CR'R”)m-арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, СН2-низшим алкокси или циано;
i) -O(СН2)о-арил, возможно замещенный галогеном, низшим алкокси или низшим алкилом, замещенным галогеном;
R' и R” независимо друг от друга представляют собой водород, низший алкокси или низший алкил; или вместе с атомом С могут образовывать циклоалкильную группу;
R3 представляет собой арил или гетероарил, где указанные ароматические кольца возможно замещены одним или более заместителями, выбранными из галогена или низшего алкокси;
R4 представляет собой низший алкил, арил или гетероарил, где указанные ароматические кольца возможно замещены одним или более заместителями, выбранными из галогена, циано или низшего алкокси;
R5 представляет собой водород, низший алкил или арил, замещенный галогеном;
или R4 и R5 вместе с атомом N, к которому они присоединены, могут образовывать гетероциклическое кольцо;
R6/R7 независимо друг от друга представляют собой водород, низший алкил или (СН2)2-O-низший алкил;
m равно 0, 1 или 2;
n равно 1, 2 или 3;
о равно 0 или 1;
р равно 0, 1 или 2;
или к их фармацевтически приемлемой соли присоединения кислоты.
Изобретение включает все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры. Кроме того, настоящим изобретением также охвачены все таутомерные формы соединений формулы I.
Предпочтительным положением для R1 на фенильном кольце является пара- или мета-положение.
К настоящему времени установлено, что соединения формулы I обладают высокой аффинностью к рецепторам, ассоциированным со следовыми аминами (TAAR), особенно к TAAR1. Данные соединения можно применять в лечении депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности (ADHD), расстройств, вызванных стрессом, психотических расстройств, таких как шизофрения, неврологических заболеваний, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, и метаболических расстройств, таких как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройств потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых заболеваний.
Некоторые физиологические эффекты (т.е., воздействия на сердечнососудистую систему, понижение кровяного давления, седативное действие), описанные для соединений, которые могут связываться с адренергическими рецепторами, (WO 02/076950, WO 97/12874 или ЕР 0717037) могут рассматриваться как нежелательные побочные эффекты в случае лекарственных средств, предназначенных для лечения таких заболеваний центральной нервной системы, которые описаны выше. Поэтому желательно получить лекарственные средства, обладающие селективностью к рецептору TAAR1 по сравнению с адренергическими рецепторами. Объекты по настоящему изобретению демонстрируют селективность к рецептору TAAR1, в частности высокую селективность по сравнению с адренергическими рецепторами альфа1 и альфа2 человека и крысы.
Классические биогенные амины (серотонин, норэпинефрин, эпинефрин, допамин, гистамин) как нейромедиаторы играют важную роль в центральной и периферической нервной системе [1]. Их синтез и хранение, а также их деградация и обратный захват после высвобождения строго регулируются. Известно, что дисбаланс уровней биогенных аминов ответственен за изменение функции головного мозга при многих патологических состояниях [2-5]. Соединения, образующие второй класс эндогенных аминов, так называемые следовые амины (ТА), очень схожи с классическими биогенными аминами по своей структуре, метаболизму и субклеточной локализации. ТА включают п-тирамин, β-фенилэтиламин, триптамин и октопамин, и их уровень в нервной системе млекопитающих существенно ниже уровня классических биогенных аминов [6].
Нарушение их регуляции связано с различными психическими заболеваниями, такими как шизофрения и депрессия [7], и другими состояниями, такими как синдром дефицита внимания и гиперактивности, головная боль типа мигрени, болезнь Паркинсона, злоупотребление веществами, вызывающими зависимость, и расстройства приема пищи [8, 9].
В течение долгого времени существование ТА-специфичных рецепторов являлось всего лишь гипотезой, основанной на присутствии в ЦНС (центральной нервной системе) человека и других млекопитающих анатомически дискретных сайтов связывания, обладающих высокой аффинностью к ТА [10, 11]. Соответственно, считалось, что фармакологическое действие ТА опосредовано хорошо известными механизмами, что и действие классических биогенных аминов, то есть либо стимуляцией их высвобождения, либо ингибированием их обратного захвата, либо "перекрестным связыванием" с их рецепторными системами [9, 12, 13]. В последнее время данная точка зрения претерпела значительные изменения в связи с идентификацией нескольких членов нового семейства GPCR (G-белок-связанных рецепторов), рецепторов, ассоциированных со следовыми аминами (TAAR) [7, 14]. Обнаружено 9 TAAR-генов в геноме человека (включая 3 псевдогена) и 16 генов в геноме мыши (включая 1 псевдоген). TAAR-гены не содержат интронов (за одним исключением, TAAR2 содержит 1 интрон) и расположены рядом на одном и том же хромосомном сегменте. Филогенетическое родство генов этих рецепторов, находящееся в соответствии с высокой степенью их сходства с GPCR-фармакофором и в соответствии с фармакологическими данными, дает возможность предположить, что эти рецепторы образуют три различных подсемейства [7, 14]. TAAR1 относится к первому подклассу, состоящему из четырех генов (TAAR1-4), которые представлены в геномах человека и грызунов высококонсервативными последовательностями. ТА активируют TAAR1 через Gα. Было показано, что нарушение регуляции ТА связано с этиологией различных заболеваний, таких как депрессия, психоз, синдром дефицита внимания и гиперактивности, злоупотребление веществами, вызывающими зависимость, болезнь Паркинсона, головная боль типа мигрени, расстройства приема пищи, метаболические расстройства, и поэтому применение TAAR1-лигандов в лечении данных заболеваний может являться весьма перспективным.
Поэтому получение новых знаний о рецепторах, ассоциированных со следовыми аминами, весьма актуально.
Использованные ссылки
1. Deutch, A.Y. and Roth, R.H. (1999) Neurotransmitters. In Fundamental Neuroscience (2nd edn) (Zigmond, M.J., Bloom, F.E., Landis, S.C., Roberts, J.L, and Squire, L.R., eds.), pp.193-234, Academic Press.
2. Wong, M.L and Licinio, J. (2001) Research and treatment approaches to depression. Nat. Rev. Neurosci. 2, 343-351.
3. Carlsson, A. et al. (2001) Interactions between monoamiens, glutamate, and GABA in schizophrenia: new evidence. Annu. Rev. Pharmacol. Toxicol. 41, 237-260.
4. Tuite, P. and Riss, J. (2003) Recent developments in the pharmacological treatment of Parkinson's disease. Expert Opin. Investig. Drugs 12, 1335-1352.
5. Castellanos, F.X. and Tannock, R. (2002) Neuroscience of attention-deficit/hyperactivity disorder: the search for endophenotypes. Nat. Rev. Neurosci. 3, 617-628.
6. Usdin, Earl; Sandier, Merton; Editors. Psychopharmacology Series, Vol.1: Trace Amines and the Brain. [Proceedings of a Study Group at the 14th Annual Meeting of the American College of Neuropsychoparmacology, San Juan, Puerto Rico] (1976).
7. Lindemann, L. and Hoener, M. (2005) A renaissance in trace amines inspired by a novel GPCR family. Trend's in Pharmacol. Sci. 26, 274-281.
8. Branchek, T.A. and Blackburn, T.P. (2003) Trace amine receptors as targets for novel therapeutics: legend, myth and fact. Curr. Opin. Pharmacol. 3, 90-97.
9. Premont, R.T. et al. (2001) Following the trace of elusive amines. Proc. Natl. Acad. Sci. U.S.A. 98, 9474-9475.
10. Mousseau, D.D. and Butterworth, R.F. (1995) A high-affinity [3H]tryptamine binding site in human brain. Prog. Brain Res. 106, 285-291.
11. McCormack, J.K. et al. (1986) Autoradiographic localization of tryptamine binding sites in the rat and dog central nervous system. J. Neurosci. 6, 94-101.
12. Dyck, L.E. (1989) Release of some endogenous trace amines from rat striatal slices in the presence and absence of a monoamine oxidase inhibitor. Life Sci. 44, 1149-1156.
13. Parker, E.M. and Cubeddu, L.X. (1988) Comparative effects of amphetamine, phenylethylamine and related drugs on dopamine efflux, dopamine uptake and mazindol binding. J. Pharmacol. Exp. Ther. 245, 199-210.
14. Lindemann, L. et al. (2005) Trace amine associated receptors form structurally and functionally distinct subfamilies of novel G protein-coupled receptors. Genomics 85, 372-385.
Задачей настоящего изобретения являются новые соединения формулы I и их фармацевтически приемлемые соли, их применение в изготовлении лекарственных средств для лечения заболеваний, связанных с биологической функцией рецепторов, ассоциированных со следовыми аминами, их получение и лекарственные средства на основе соединения по изобретению для контроля и предупреждения таких заболеваний, как депрессия, тревожные расстройства, биполярное расстройство, синдром дефицита внимания и гиперактивности, расстройства, вызванные стрессом, психотические расстройства, такие как шизофрения, неврологические заболевания, такие как болезнь Паркинсона, нейродегенеративные расстройства, такие как болезнь Альцгеймера, эпилепсия, мигрень, злоупотребление веществами, вызывающими зависимость, метаболические расстройства, такие как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства потребления и ассимиляции энергии, расстройства и нарушения температурного гомеостаза, нарушения сна и циркадного ритма и сердечно-сосудистые заболевания.
Предпочтительными показаниями к применению соединений по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, диабет, тревога и синдром дефицита внимания и гиперактивности (ADHD).
Используемый в данном описании термин "низший алкил" означает группу с насыщенной прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и тому подобное. Предпочтительными алкильными группами являются группы, содержащие 1-4 атома углерода.
Используемый в данном описании термин "низший алкокси" означает группу, где алкильный остаток является таким, как определено выше, и присоединен через атом кислорода.
Используемый в данном описании термин "низший алкил, замещенный галогеном" означает алкильную группу, которая определена выше, где по меньшей мере один атом водорода заменен на атом галогена, например CF3, CHF2, CH2F, CH2CF3, CH2CH2CF3, CH2CF2CF3 и тому подобное.
Используемый в данном описании термин "низший алкокси, замещенный галогеном" означает группу, где алкильный остаток является таким, как определено выше, и присоединен через атом кислорода, и где по меньшей мере один атом водорода заменен на атом галогена.
Термин "алкинил" обозначает углеводородный остаток с прямой или разветвленной цепью, содержащий тройную связь и до 7, предпочтительно до 4, атомов углерода, такой как, например, этинил или 2-пропинил.
Термин "галоген" означает хлор, йод, фтор и бром.
Термин "циклоалкил" относится к алкиленовому кольцу, содержащему от 3 до 6 атомов углерода в кольце.
Термин "арил" относится к ароматическому углеродному кольцу, такому как фенильное или нафтильное кольцо, предпочтительно фенильному кольцу.
Термин "гетероарил" относится к ароматическому 5-6-членному моноциклическому кольцу или 9-10-членному бициклическому кольцу, которое может содержать 1, 2 или 3 гетероатома, выбранных из азота, кислорода и/или серы, такому как фурил, пиридинил, пиридазинил, пиримидинил, пиразинил, тиенил, изоксазолил, оксазолил, оксадиазолил, имидазолил, пирролил, пиразолил, триазолил, тетразолил, тиазолил, изотиазолил, тиадиазолил, бензимидазолил, индолил, индазолил, бензотиазолил, бензоизотиазолил, бензоксазолил, бензоизоксазолил, хинолинил, имидазо[4,5]пиридинил, [1,6]нафтиридинил и изохинолинил. Предпочтительными гетероарильными группами являются пиридинил, пиразолил, пиримидинил, бензимидазолил, хинолинил и изохинолинил.
Термин "гетероциклоалкил" относится к неароматическому 5-6-членному моноциклическому кольцу, которое может содержать 1, 2 или 3 гетероатома, выбранных из азота, кислорода и/или серы, такому как пиперидинил, морфолинил, тетрагидропиранил, тиоморфолинил или тиоморфолинил-1,1-ди-окси..
Термин "фармацевтически приемлемые соли присоединения кислоты" включает в себя соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и тому подобное.
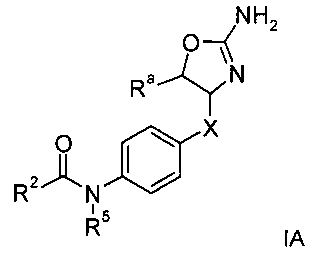
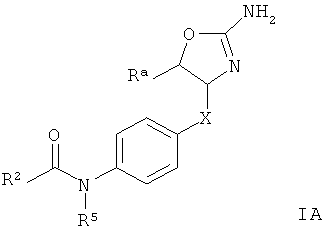
Одним из воплощений изобретения являются соединения формулы IA
или соединения, где -ISKR^-C^O^R2 может быть выбран из группы, состоящей из
 ,
,  ,
,  или
или  ;
;
где
R8 представляет собой водород, галоген или арил, возможно замещенный галогеном;
R8 представляет собой водород или низший алкил;
Х представляет собой связь, -(СН2)n-, -CHRCH2, -CHR(CH2)2-, -O-CHRCH2- или
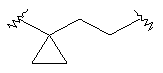 ; и R представляет собой низший алкил или низший алкил, замещенный галогеном;
; и R представляет собой низший алкил или низший алкил, замещенный галогеном;
R2 представляет собой
a) низший алкил;
b) водород;
c) NH-арил, возможно замещенный одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном;
d) NH-гетероарил, возможно замещенный одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном;
e) (CR'R”)m-циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом;
f) гетероциклоалкил, возможно замещенный галогеном или низшим алкилом, замещенным галогеном;
g) (CR'R”)m-гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, цикпоалкилом, NHC(O)-низшим алкилом, циано,
S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном;
h) (CR'R”)m-арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, СН2-низшим алкокси или циано;
i) -O(СН2)о-арил, возможно замещенный галогеном, низшим алкокси или низшим алкилом, замещенным галогеном;
R' и R” независимо друг от друга представляют собой водород, низший алкокси или низший алкил; или вместе с атомом С могут образовывать циклоалкильную группу;
R5 представляет собой водород, низший алкил или арил, замещенный галогеном;
R6/R7 независимо друг от друга представляют собой водород, низший алкил или (СН2)2-O-низший алкил;
m равно 0, 1 или 2;
n равно 1, 2 или 3;
о равно 0 или 1;
p равно 0, 1 или 2;
или их фармацевтически приемлемая соль присоединения кислоты.
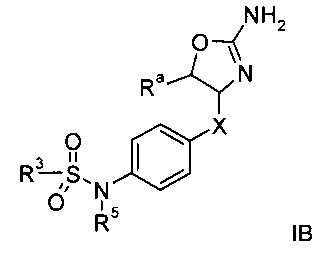
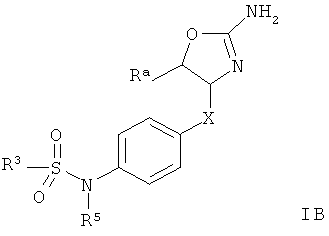
Другим воплощением изобретения являются соединения формулы IB,
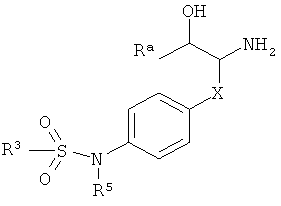
где
R3 представляет собой водород или низший алкил;
Х представляет собой связь, -(CH2)n-, -CHRCH2, -CHR(CH2)2-, -O-CHRCH2- или
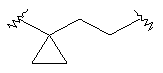 ; и R представляет собой низший алкил или низший алкил, замещенный галогеном;
; и R представляет собой низший алкил или низший алкил, замещенный галогеном;
R3 представляет собой арил или гетероарил, где указанные ароматические кольца возможно замещены одним или более заместителями, выбранными из галогена или низшего алкокси;
R5 представляет собой водород, низший алкил или арил, замещенный галогеном;
n равно 1, 2 или 3;
или их фармацевтически приемлемая соль присоединения кислоты.
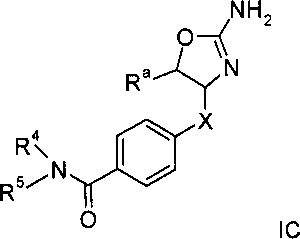
Другим воплощением изобретения являются соединения формулы IC,
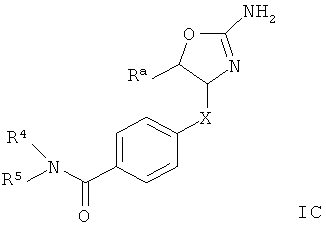
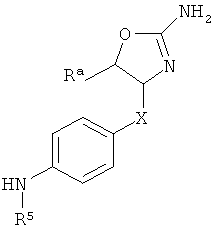
где
R3 представляет собой водород или низший алкил;
Х представляет собой связь, -(СН2)n-, -CHRCH2, -CHR(CH2)2-, -O-CHRCH2- или
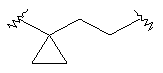 ; и R представляет собой низший алкил или низший алкил замещенный галогеном;
; и R представляет собой низший алкил или низший алкил замещенный галогеном;
R4 представляет собой низший алкил, арил или гетероарил, где указанные ароматические кольца возможно замещены одним или более заместителями, выбранными из галогена, циано или низшего алкокси;
R5 представляет собой водород, низший алкил или арил, замещенный галогеном;
или R4 и R5 вместе с атомом N, к которому они присоединены, могут образовывать гетероциклическое кольцо;
n равно 1, 2 или 3;
или их фармацевтически приемлемая соль присоединения кислоты.
Одним из воплощений изобретения являются соединения формулы IA, где Х представляет собой связь, например, следующее соединение:
(RS)-1-[4-(2-амино-4,5-дигидро-оксазол-4-ил)-фенил]-3-(4-хлор-фенил)-мочевина.
Другим воплощением изобретения являются соединения формулы IA, где Х представляет собой -(CH2)n-, например, следующие соединения:
1-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(4-хлор-фенил)-мочевина,
N-{4-[3-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-пропил]-фенил}-4-хлор-бензамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-хлор-бензамид,
1-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(3,4-дихлор-фенил)-мочевина,
1-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(4-трифторметил-фенил)-мочевина,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-фтор-бензамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-трифторметил-бензамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-хлор-бензамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-хлор-никотинамид,
5-хлор-пиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
5-хлор-пиримидин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
1-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(5-хлор-пиридин-2-ил)-мочевина,
1-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(6-хлор-пиридин-3-ил)-мочевина,
4,4-дифтор-циклогексанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
1 -метил-циклопропанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
циклопентанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
3,3-дифтор-циклобутанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фен ил}-амид,
циклобутанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
циклопропанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
циклогексанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
1-трифторметил-циклопропанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
1 -(4-хлор-фенил)-циклопропанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
5-трифторметил-пиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-трифторметил-никотинамид,
1-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(4-фтор-фенил)-имидазолидин-2-он,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-хлор-фенил)-пропионамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-циано-бензамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-этокси-бензамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-пропил-бензамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-этинил-бензамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-метоксиметил-бензамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-этокси-фенил)-ацетамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-метокси-фенил)-ацетамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-фтор-фенил)-ацетамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-хлор-фенил)-ацетамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-метокси-бензамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-хлор-фенил)-изобутирамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-бром-фенил)-2-метокси-ацетамид,
(S)-N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-метокси-2-фенил-ацетамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-хлор-фенил)-2-метокси-ацетамид,
4-трифторметил-циклогексанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(2-хлор-фенил)-пропионамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(3-трифторметил-фенил)-пропионамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(3-трифторметокси-фенил)-пропионамид,
2-метокси-пиримидин-5-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-пиразол-1-ил-никотинамид,
1Н-бензоимидазол-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
3,5-дифтор-пиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
6-фтор-пиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
6-хлор-3-фтор-пиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
4-хлор-пиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
хинолин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
5-бром-пиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
изохинолин-1-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
1-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(4-фтор-фенил)-мочевина,
1-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(3-хлор-фенил)-мочевина,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-фторпиколинамид,
N-{4-[2-((8)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-метокси-никотинамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-метил-никотинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-фторникотинамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-5-фтор-никотинамид,
3-хлор-5-трифторметил-пиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
[1,6]нафтиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
[1,8]нафтиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-бром-никотинамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2,5-дифтор-никотинамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-5,6-дихлор-никотинамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2,6-дифтор-никотинамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-циано-никотинамид,
6-бром-пиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-(2,2,2-трифтор-этокси)-никотинамид,
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-метокси-никотинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метоксипиколинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-цианопиколинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-фторникотинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-хлорпиридазин-3-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-(пиперидин-1-ил)пиримидин-5-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-хлорникотинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-(3,4-дихлорфенил)-2,2-дифторацетамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-хлорпиразин-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метоксипиразин-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-метоксипиразин-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метилпиразин-2-карбоксамид,
(S)-4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)-N-(5-хлорпиридин-2-ил)бензамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлор-2-фторбензамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,4-дихлорбензамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлор-2-метоксибензамид,
(S)-4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)-N-(4-цианофенил)бензамид,
(S)-4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)-N-(4-этинилфенил)-бензамид,
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-карбаминовой кислоты 4-хлор-бензиловый эфир,
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-карбаминовой кислоты 4-метокси-фениловый эфир,
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-карбаминовой кислоты 4-фтор-фениловый эфир,
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-карбаминовой кислоты 3-трифторметил-фениловый эфир,
1-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(5-хлор-пиримидин-2-ил)-мочевина,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-этоксипиколинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-хлор-4-метилпиколинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлор-6-метилпиколинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4,6-диметилпиколинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4,6-дихлорпиколинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-(трифторметил)пиразин-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-хлорпиразин-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-этоксипиразин-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-морфолинопиразин-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-хлор-5-метоксипиколинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-хлортиофен-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-3-циклопропил-пропанамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метилпиколин-амид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-метилизоникотинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-хлоризоникотинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-хлор-3-фторизоникотинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,6-дихлоризоникотинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-этилпиколинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,5-диметилоксазол-4-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-(диметиламино)-5-изопропилтиазол-4-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,6-диметоксипиримидин-4-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метилоксазол-4-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлор-1-метил-1Н-пиразол-3-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-1-(дифторметил)-1 Н-пиразол-3-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-трет-бугилизоникотинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-изопропилизоникотинамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,4'-бипиридин-4-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метилтиофен-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4,5-диметилтиофен-2-карбоксамид,
2-этил-6-метокси-пиримидин-4-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
N-(4-(2-((4S,5S)-2-амино-5-метил-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлорбензамид,
N-(4-(2-((4S,5R)-2-амино-5-метил-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлорбензамид,
2-изопропил-6-метокси-пиримидин-4-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-этилпиразин-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4-циклопропил-2-(трифторметил)пиримидин-5-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-этилпиразин-2-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-этилоксазол-4-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-циклопропил-оксазол-4-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-изопропил-оксазол-4-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-метил-5-(трифторметил)оксазол-4-карбоксамид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-этилоксазол-4-карбоксамид,
5-этокси-пиразин-2-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
2-хлор-6-метокси-пиримидин-4-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
5-метил-оксазол-4-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
6-трифторметил-пиридин-2-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
5-этил-пиразин-2-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид,
(S)-N-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-изопропилпиразин-2-карбоксамид или
2-хлор-6-метокси-пиримидин-4-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид.
Одним из воплощений изобретения являются другие соединения формулы IA, где Х представляет собой -CHRCH2-, например, следующие соединения:
1-{4-[(S)-1-((S)-2-амино-4,5-дигидро-оксазол-4-илметил)-пропил]-фенил}-3-(4-фтор-фенил)-мочевина или
1-{4-[(S)-1-((S)-2-амино-4,5-дигидро-оксазол-4-илметил)-пропил]-фенил}-3-(4-трифторметил-фенил)-мочевина.
Другим воплощением изобретения являются соединения формулы IA, где Х представляет собой -O-CHRCH2, например, следующее соединение:
N-{4-[(R)-1-((S)-2-амино-4,5-дигидро-оксазол-4-илметил)-2,2,2-трифтор-этокси]-фенил}-4-хлор-бензамид.
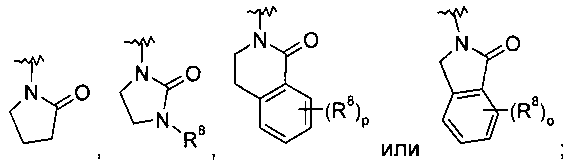
Другим воплощением изобретения являются соединения формулы IA, где -N(R5)-C(O)-R2 выбран из группы, состоящей из
 ,
,  ,
,  или
или  ;
;
при этом R8 представляет собой водород, галоген или арил, возможно замещенный галогеном, например, следующие соединения:
1-(4-{1-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-циклопропил}-фенил)-пирролидин-2-он,
1-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(4-фтор-фенил)-имидазолидин-2-он,
(S)-2-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5,6-дихлор-3,4-дигидроизохинолин-1(2Н)-он,
2-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-хлор-2,3-дигидро-изоиндол-1-он,
(S)-2-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)изоиндолин-1-он,
(S)-2-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-3,4-дигидроизохинолин-1(2Н)-он или
(S)-2-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-хлор-3,4-дигидроизохинолин-1(2Н)-он.
Одним из воплощений настоящего изобретения являются соединения формулы IB, где Х представляет собой -(CH2)n-, например, следующее соединение:
N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3,4-дихлор-бензолсульфонамид.
Другим воплощением изобретения являются соединения формулы IC, где Х представляет собой -(СН2)n-, например, следующие соединения:
4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-N-(4-хлор-фенил)-бензамид или
(S)-4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)-N-(5-этинилпиридин-2-ил)бензамид.
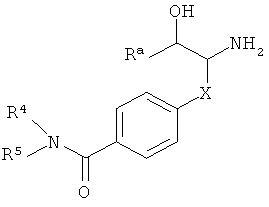
Одним из других воплощений настоящего изобретения являются соединения формулы I,
 ,
,
где
R1 представляет собой  a),
a),  b),
b),  c);
c);
Х представляет собой связь, -(CH2)n-, -CHRCH2, -CHR(CH2)2- или 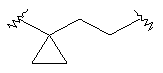 ; и R представляет собой низший алкил;
; и R представляет собой низший алкил;
R2 представляет собой
a) низший алкил,
b) водород,
c) NH-арил, возможно замещенный одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном,
d) NH-гетероарил, возможно замещенный одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном,
e) циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом,
f) гетероциклоалкил, возможно замещенный галогеном или низшим алкилом, замещенным галогеном,
g) (CR'R”)m-гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном или гетероарилом,
h) (CR'R”)m-арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, СН2-низшим алкокси или циано,
R' и R” независимо друг от друга представляют собой водород, низший алкокси или низший алкил;
R3 представляет собой арил или гетероарил, где указанные ароматические кольца возможно замещены одним или более чем одним галогеном или низшим алкокси;
R4 представляет собой низший алкил, арил или гетероарил, где указанные ароматические кольца возможно замещены одним или более чем одним галогеном или низшим алкокси;
R5 представляет собой водород, низший алкил или арил, замещенный галогеном;
или R2 и R5 могут образовывать вместе с -(CH2)3- или с -N(R6)-(CH2)2- пятичленное кольцо; и где R6 представляет собой водород или арил, возможно замещенный галогеном;
или R4 или R5 вместе с атомом N, к которому они присоединены, могут образовывать гетероциклическое кольцо;
m равно 0, 1 или 2, и
n равно 1, 2 или 3;
или их фармацевтически приемлемая соль присоединения кислоты.
Соединения формулы I по настоящему изобретению и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например, способами, описанными ниже, при этом способ включает:
а) приведение во взаимодействие соединения формулы
с бромцианом
с получением соединения формулы
 ,
,
где определения такие, как описано выше, или
при желании, превращение полученных соединений в фармацевтически приемлемые соли присоединения кислоты, или
b) приведение во взаимодействие соединения формулы
с бромцианом
с получением соединения формулы
 ,
,
где определения такие, как описано выше, или
при желании, превращение полученных соединений в фармацевтически приемлемые соли присоединения кислоты, или
c) приведение во взаимодействие соединения формулы
с R2C(O)OH или R2C(O)Cl
с получением соединения формулы
 ,
,
где определения такие, как описано выше, или
d) приведение во взаимодействие соединения формулы
с бромцианом
с получением соединения формулы
 ,
,
где определения такие, как описано выше, или
при желании, превращение полученных соединений в фармацевтически приемлемые соли присоединения кислоты.
Получение соединений формулы 1 по настоящему изобретению может быть осуществлено путем последовательного или конвергентного синтеза. Синтез соединений по изобретению показан на приведенных далее схемах 1-18. Специалистам в данной области известно, какие навыки необходимы для выполнения данной реакции и очистки полученных продуктов. Заместители и индексы, используемые в следующем далее описании способов, имеют значения, приведенные в данном описании ранее, если нет указаний на противоположное.
Более подробно, соединения формулы I могут быть получены способами, приведенными ниже, способами, приведенными в разделе Примеры, или аналогичными способами. Условия реакции, подходящие для отдельных стадий реакции, известны специалисту в данной области. Последовательность реакций не ограничена той, которая показана на схемах 1-18, однако в зависимости от исходных веществ и соответствующей им реакционной способности последовательность реакционных стадий можно легко изменять. Исходные вещества либо имеются в продаже, либо могут быть получены способами, аналогичными способам, приведенным ниже, способами, описанными в ссылках, цитированных в данном описании или в разделе Примеры, или способами, известными в данной области.
ОБЩАЯ МЕТОДИКА
Схема 1
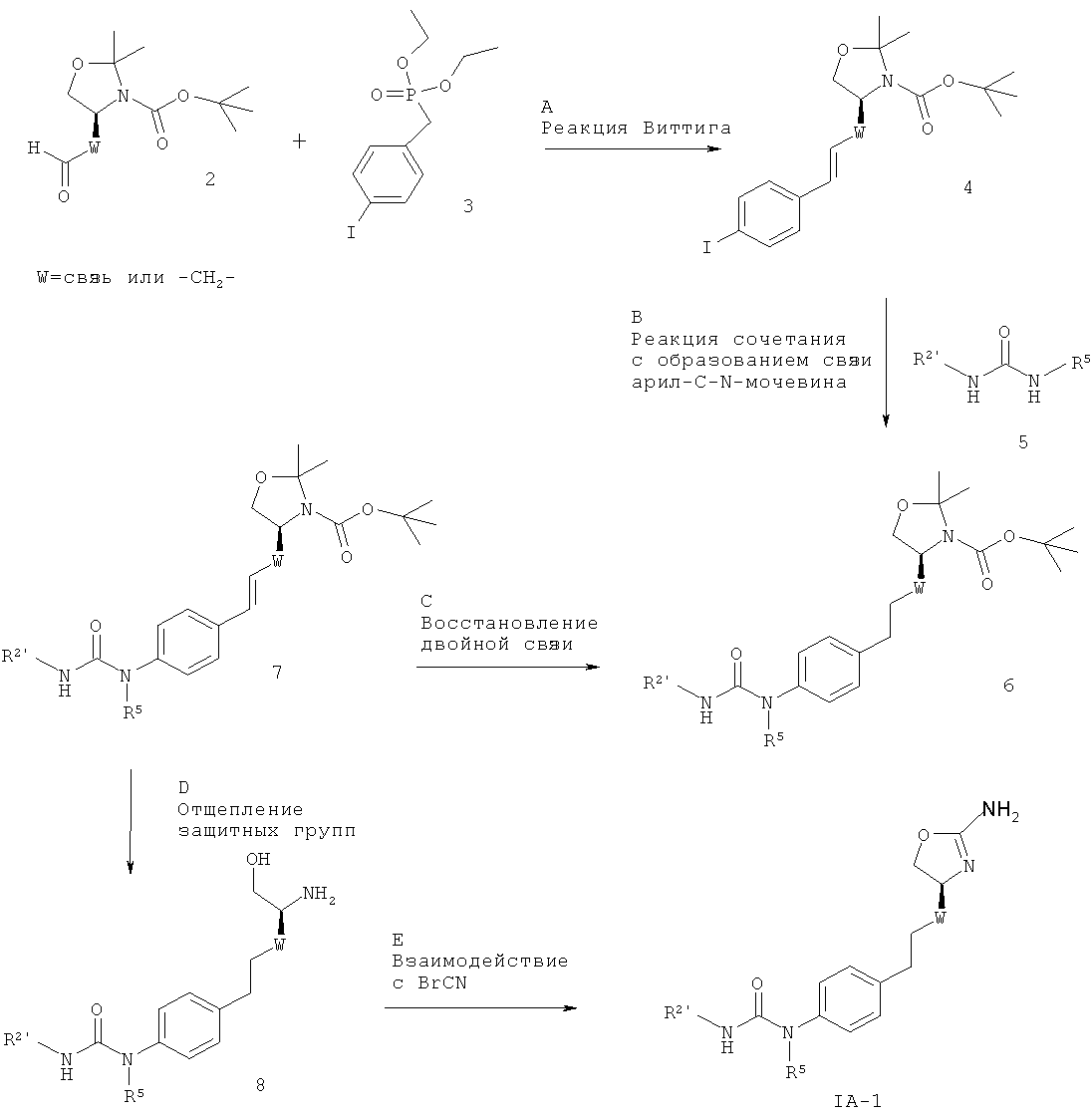
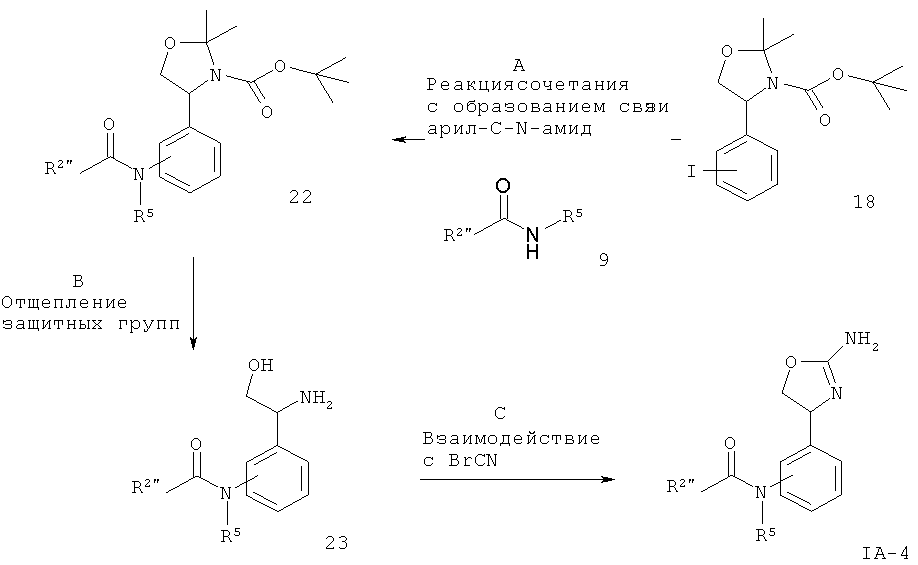
R2 представляет собой арил или гетероарил, который возможно замещен одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном, W представляет собой связь или -СН2-, а другие заместители такие, как описано выше.
Стадия А. Реакция Виттига между альдегидом 2 (W представляет собой связь: CAS 95715-87-0, или W представляет собой -CH2-: CAS 147959-19-1) и (4-иод-бензил)-фосфоновой кислоты диэтиловым эфиром 3 (CAS 173443-43-1) может быть осуществлена с использованием основания, такого как NaH, KOtBu, NaOMe, NaOEt, н-BuLi, LiHMDS (гексаметилдисилазид лития), NaHMDS, KHMDS, LDA (диизопропиламид лития), в растворителе, таком как THF (тетрагидрофуран), диоксан, ацетонитрил, 1,2-диметоксиэтан, DMF (N,N-диметилформамид), бензол, толуол или их смеси, при температурах от -78ºС до 80ºС в течение от 15 мин до 8 ч и, если целесообразно, с возможным добавлением краун-эфира для образования илида и затем конденсации этого илида с карбонильным соединением в том же растворителе при температуре от 0 до 80ºС в течение 1-24 ч. Альтернативно, основание, карбонильное соединение и возможно краун-эфир могут быть добавлены в реакционную смесь одновременно, без предварительного образования илида, при температурах от -78ºС до 80ºС.
Предпочтительными условиями являются образование илида при -78ºС с использованием LDA (полученного in situ в результате обработки N,N-диизопропил-амина с помощью н-BuLi) в качестве основания и THF в качестве растворителя, взаимодействие с эфиром фосфоновой кислоты в течение 1 часа при -78°С и затем конденсация с карбонильным компонентом с нагреванием до комнатной температуры в течение ночи.
Стадия В. Образование связи C-N может быть осуществлено в результате реакции сочетания между арилиодидом 4 и мочевинными соединениями 5 в присутствии палладиевого или медного катализатора, лиганда и основания в таких растворителях, как диоксан, DME (1,2-диметоксиэтан), THF, толуол, DMF и DMSO (диметилсульфоксид), при повышенных температурах. Например, с использованием иодида меди(1), KF/Al2O3 в качестве основания и N,N'-дибензил-этилендиамина, N,N'-бис(2-пиридил-метил)этилендиамина или 1,10-фенантролина в качестве лиганда согласно методике Hosseinzadeh и др. (Tetrahedron Lett. 2008, 49, 840-843).
Предпочтительными условиями являются иодид меди(1), KF/Al2O3 и N,N'-дибензилэтилендиамин в THF при 90ºС в течение 30 мин в герметично закрытой пробирке в условиях облучения микроволнами.
Стадия С. Восстановление алкена 6 может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси. Альтернативно, восстановление алкена может быть осуществлено под действием Мg в МеОН или под действием LiAlH4 в THF или диэтиловом эфире.
Предпочтительными условиями являются гидрирование в присутствии РtO2 в качестве катализатора с МеОН в качестве растворителя.
Стадия D. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ (комнатной температуре) в течение ночи.
Стадия Е. Циклизация аминоспирта 8 до соответствующего 2-аминооксазолина IA-1 может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии К2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 2.
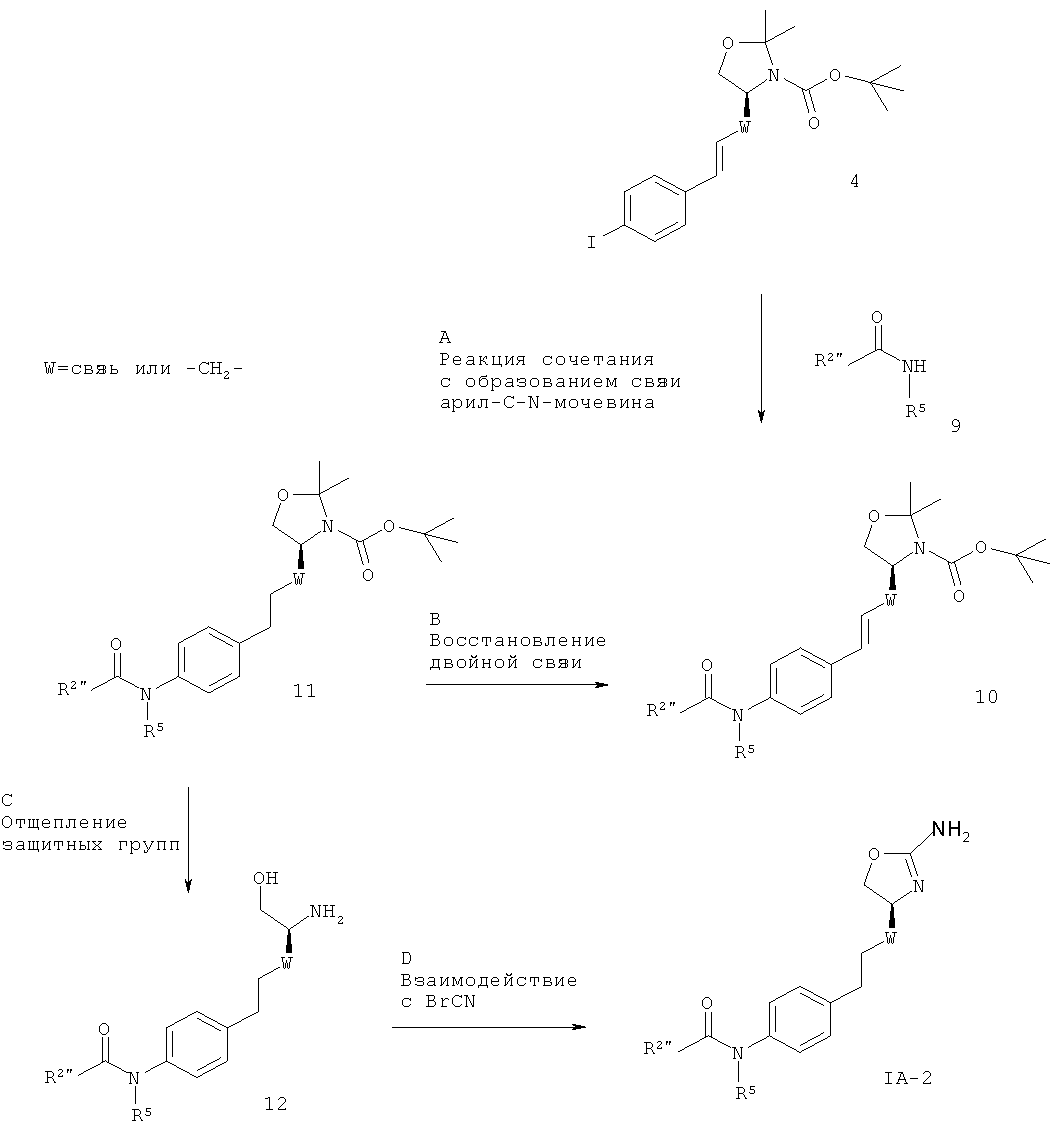
R2" представляет собой (CR'R”)m-циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом; или представляет собой
(CR'R”)m-гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, циклоалкилом, NHC(O)-низшим алкилом, циано, S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном; или представляет собой
(CR'R”)m-арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, СН2-низшим алкокси или циано;
и R' и R” независимо друг от друга представляют собой водород, низший алкокси или низший алкил либо вместе с атомом С могут образовывать циклоалкильную группу, и W представляет собой связь или -СН2-, а другие заместители такие, как описано выше.
Стадия А. Образование связи C-N может быть осуществлено в результате реакции сочетания между арилиодидом 4 и амидными соединениями 9 в присутствии палладиевого или медного катализатора, лиганда и основания в таких растворителях, как диоксан, DME, THF, толуол, DMF и DMSO, при повышенных температурах. Например, с использованием иодида меди(1), фосфата калия в качестве основания и N,N'-диметилглицина, L-пролина, глицина, N,N'-диметил-этилендиамина, 2-аминоэтанола или 1,2-этандиола в качестве лиганда.
Предпочтительными условиями являются иодид меди(I), фосфат калия и N,N'-диметилглицин в DMSO в герметично закрытой пробирке при 110ºС в течение ночи согласно методике Chen и др. (Org. Lett. 2008, 10, 4565-4568).
Альтернативными предпочтительными условиями являются иодид меди(I), фосфат калия и N,N'-диметилэтилендиамин в толуоле в герметично закрытой пробирке при 120ºС в течение ночи согласно методике Buchwald и соавторов (J. Am. Chem. Soc. 2009, 131, 78-88).
Стадия В. Восстановление алкена может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pt-C, Pd-C или никель Ренея, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, НОАс, EtOAc, CH2Cl2, CHCl3, DMF или их смеси. Альтернативно, восстановление алкена может быть осуществлено под действием Mg в МеОН или под действием LiAlH4 в THF или диэтиловом эфире.
Предпочтительными условиями являются гидрирование в присутствии PtO2 в качестве катализатора с МеОН в качестве растворителя.
Стадия С. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ течение ночи.
Стадия D. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 3
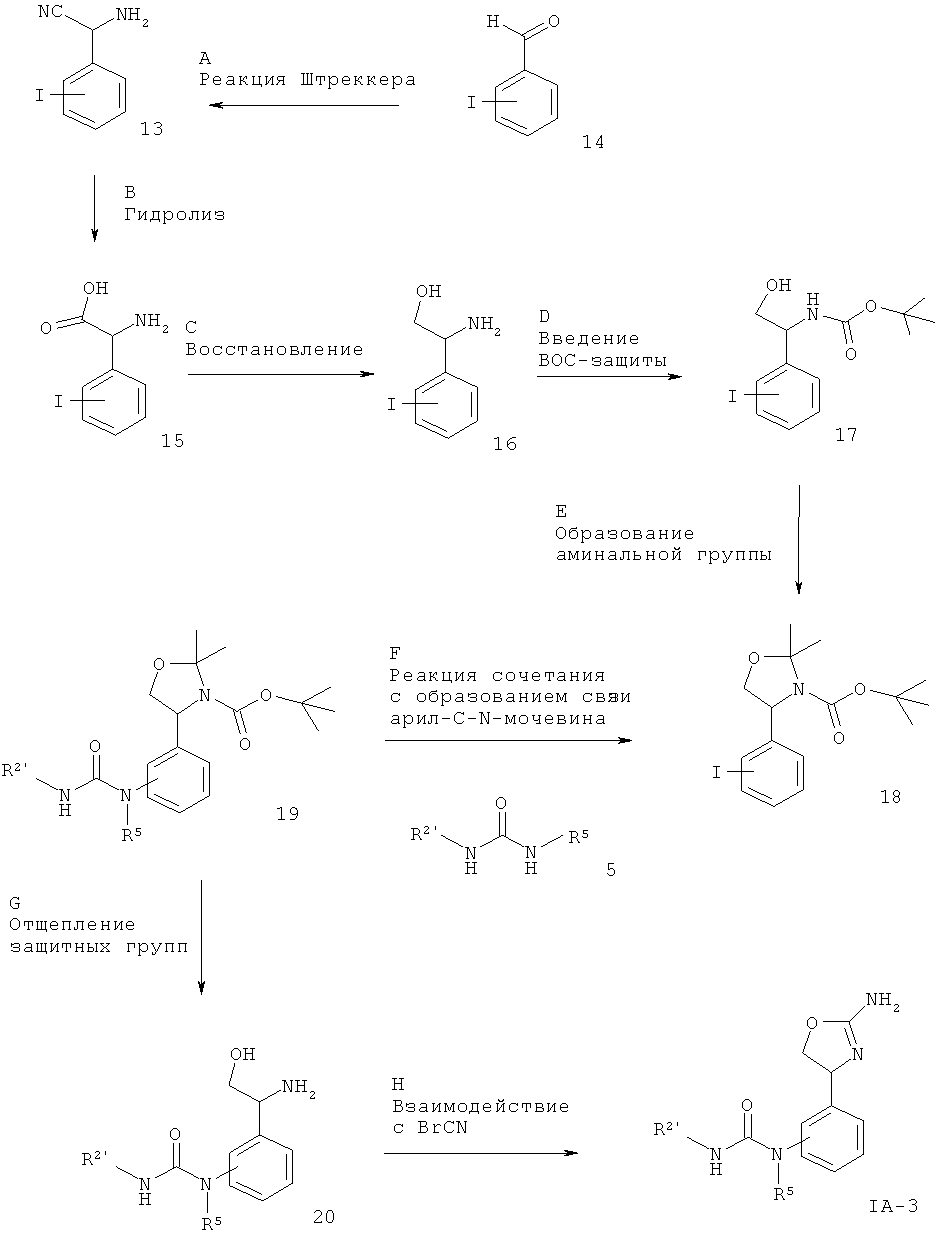
R2 представляет собой арил или гетероарил, который возможно замещен одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном, а другие заместители такие, как описано выше.
Стадия А. Аминонитрилы 13 могут быть получены в результате реакции Штрекера для 3-иод-бензальдегида или 4-иод-бензальдегида 14.
Предпочтительными условиями являются образование имина в результате обработки метанольным раствором аммиака в присутствии тетраизопропилортотитаната в метаноле при комнатной температуре с последующей обработкой триметилсилилцианидом.
Стадия В. Гидролиз нитрильной группы с получением аминокислоты 15 может быть осуществлен в результате обработки минеральной кислотой, такой как HCl, H2SO4 или Н3РО4, в системе водных растворителей при повышенной температуре.
Предпочтительными условиями являются 5 н. водный HCl при кипячении с обратным холодильником в течение ночи.
Стадия С. Восстановление кислотной группы может быть осуществлено в результате обработки с помощью LiAlH4, ВН3-THF, комплекса ВН3-Me2S в присутствии BF3-эфирата или Red-AI (бис(2-метоксиэтокси)алюмогидрид натрия) в растворителе, таком как 1,2-диметоксиэтан, THF, диэтиловый эфир или толуол, при температуре от КТ до температуры дефлегмации в течение 1-24 ч. Альтернативно, восстановление кислотной группы может быть осуществлено в результате обработки с помощью LiAlH4 в присутствии Me3SiCl в растворителе, таком как метанол, при температуре от 0ºС до КТ в течение 1-24 ч.
Предпочтительными условиями являются LiBH4/Me3SiCl в THF при КТ в течение 4 ч.
Стадия D. Введение защитной группы ВОС (трет-бутилоксикарбонил) может быть осуществлено в результате обработки ди-трет-бутилдикарбонатом в присутствии органического основания, такого как N,N-диизопропилэтиламин или триэтиламин, в непротонных растворителях, таких как дихлорметан, диоксан, THF или DMF, или с использованием неорганических оснований, таких как гидроксид натрия или карбонат натрия, в системах водных растворителей, таких как вода, водный этанол или водный метанол.
Предпочтительными условиями являются N,N-диизопропилэтиламин в THF при комнатной температуре в течение 5 часов.
Стадия Е. Введение аминальной защитной группы без отщепления кислотолабильной защитной группы ВОС может быть осуществлено в результате обработки диметоксипропаном в присутствии органической кислоты, такой как п-толуолсульфоновая кислота или камфорсульфоновая кислота, в непротонных растворителях, таких как дихлорметан, 1,2-дихлорэтан, диэтиловый эфир или диизопропиловый эфир.
Предпочтительными условиями являются п-толуолсульфоновая кислота в дихлорметане при комнатной температуре в течение ночи.
Стадия F. Образование связи C-N может быть осуществлено в результате реакции сочетания между арилиодидом 18 и мочевинными соединениями 5 в присутствии палладиевого или медного катализатора, лиганда и основания в таких растворителях, как диоксан, DME, THF, толуол, DMF и DMSO, при повышенных температурах. Например, с использованием иодида меди(I), KF/Al2O3 в качестве основания и N,N'-дибензилэтилендиамина, N,N'-бис(2-пиридил-метил)этилен-диамина или 1,10-фенантролина в качестве лиганда согласно методике Hosseinzadeh и др. (Tetrahedron Lett. 2008, 49, 840-843).
Предпочтительными условиями являются иодид меди(I), KF/Al2O3 и N,N'-дибензилэтилендиамин в THF при 90ºС в течение 30 мин в герметично закрытой пробирке в условиях облучения микроволнами.
Стадия G. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или Н3РО4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н2О, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия Н. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 4
R2” представляет собой (CR'R”)m-циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом; или представляет собой
(CR'R")m-гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, циклоалкилом, NHC(O)-низшим алкилом, циано, S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном; или представляет собой
(CR'R”)m-арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, СН2-низшим алкокси или циано;
и R' и R” независимо друг от друга представляют собой водород, низший алкокси или низший алкил либо вместе с атомом С могут образовывать циклоалкильную группу, m равно 0 или 1, а другие заместители такие, как описано выше.
Стадия А. Образование связи C-N может быть осуществлено в результате реакции сочетания между арилиодидом 18 и амидными соединениями 9 в присутствии палладиевого или медного катализатора, лиганда и основания в таких растворителях, как диоксан, DME, THF, толуол, DMF и DMSO, при повышенных температурах. Например, с использованием иодида меди(I), фосфата калия в качестве основания и N,N'-диметилглицина, L-пролина, глицина, 2-аминоэтанола или 1,2-этандиола в качестве лиганда согласно методике Chen и др. (Org. Lett. 2008, 10, 4565-4568).
Предпочтительными условиями являются иодид меди(I), фосфат калия и N,N'-диметилглицин в DMSO в герметично закрытой пробирке при 110ºС в течение ночи.
Стадия В. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия С. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 5
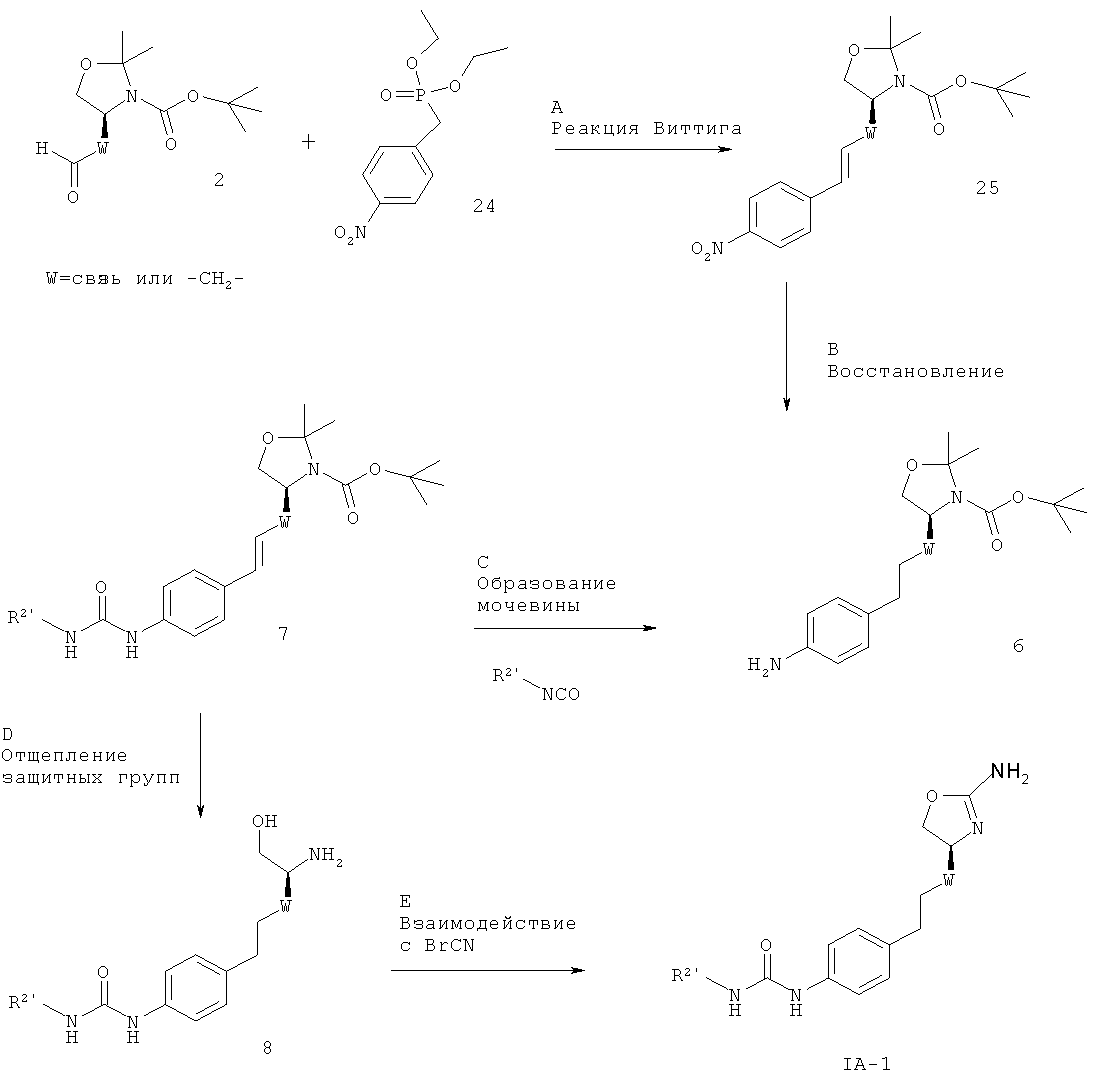
R2' представляет собой арил или гетероарил, который возможно замещен одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном, W представляет собой связь или -СН2-, а другие заместители такие, как описано выше.
Стадия А: Реакция Виттига между альдегидом 2 (W представляет собой связь: CAS 95715-87-0, или W представляет собой -СН2-: CAS 147959-19-1) и (4-нитро-бензил)-фосфоновой кислоты диэтиловым эфиром 24 (CAS 2609-49-6) может быть осуществлена с использованием основания, такого как NaH, KOtBu, NaOMe, NaOEt, н-BuLi, LiHMDS, NaHMDS, KHMDS, LDA, в растворителе, таком как THF, диоксан, ацетонитрил, 1,2-диметоксиэтан, DMF, бензол, толуол или их смеси, при температурах от -78ºС до 80ºС в течение от 15 мин до 8 ч и, если целесообразно, с возможным добавлением краун-эфира для образования илида и затем конденсации этого илида с карбонильным соединением в том же растворителе при температуре от 0 до 80ºС в течение 1-24 ч. Альтернативно, основание, карбонильное соединение и возможно краун-эфир могут быть добавлены в реакционную смесь одновременно без предварительного образования илида при температурах от -78ºС до 80ºС.
Предпочтительными условиями являются образование илида при -78ºС с использованием LDA (полученного in situ в результате обработки N,N-диизопропил-амина с помощью н-BuLi) в качестве основания и THF в качестве растворителя, взаимодействие со сложным эфиром фосфоновой кислоты в течение 1 часа при -78ºС и затем конденсация с карбонильным компонентом с нагреванием до комнатной температуры в течение ночи.
Стадия В. Одновременное восстановление алкена и нитрогруппы может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси. Альтернативно, восстановление алкена может быть осуществлено под действием Мg в МеОН или под действием LiAlH4 в THF или диэтиловом эфире.
Предпочтительными условиями являются формиат аммония в присутствии палладия на угле в МеОН при 60ºС в течение 2 часов.
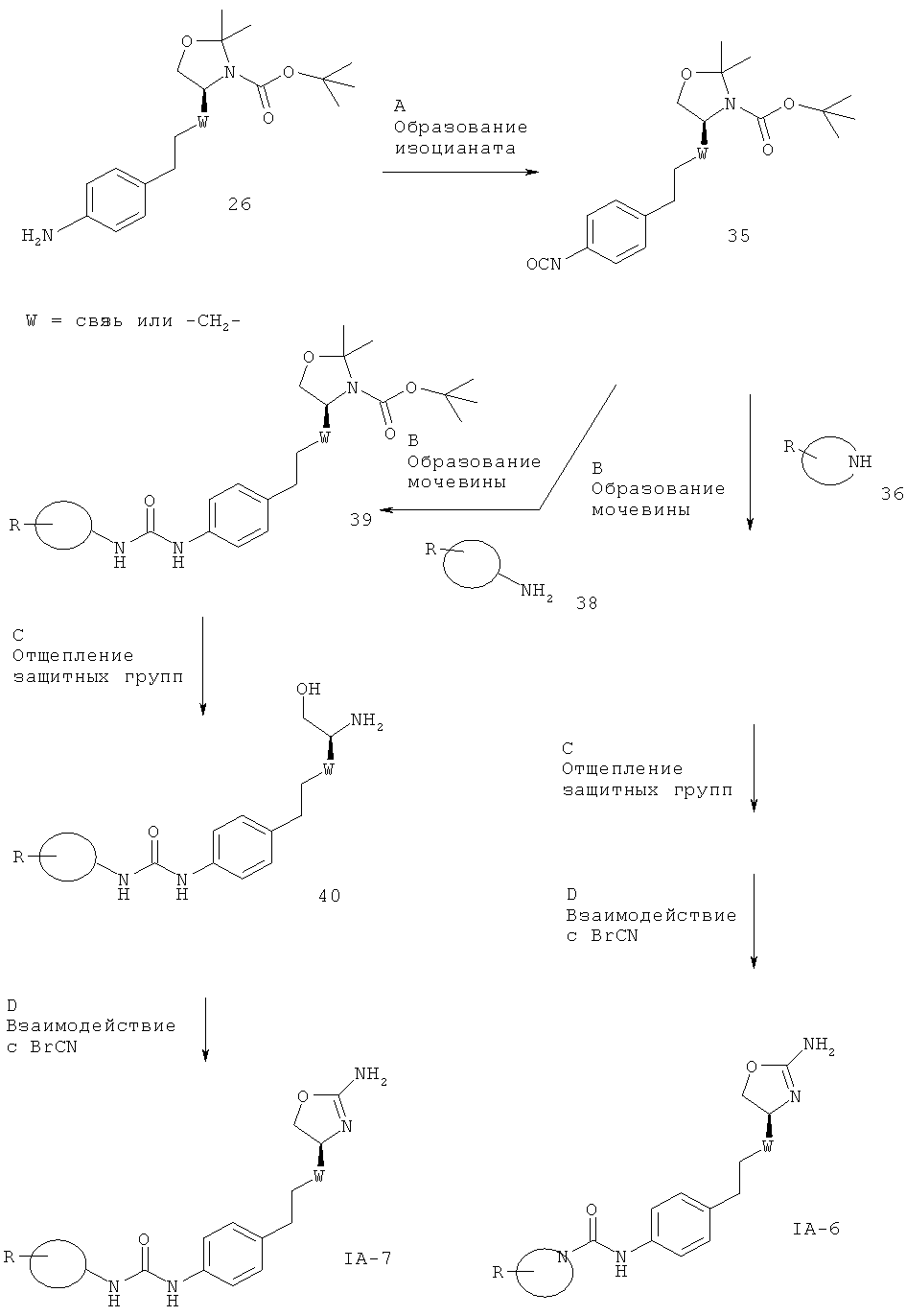
Стадия С.Образование мочевины может быть осуществлено в результате реакции сочетания между амином 26 и алкил- или арил-изоцианатными соединениями 27 в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, в галогенированных растворителях, таких как дихлорметан.
Предпочтительными условиями являются N,N-диизопропилэтиламин в дихлорметане при комнатной температуре в течение ночи.
Стадия D. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия Е. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 6
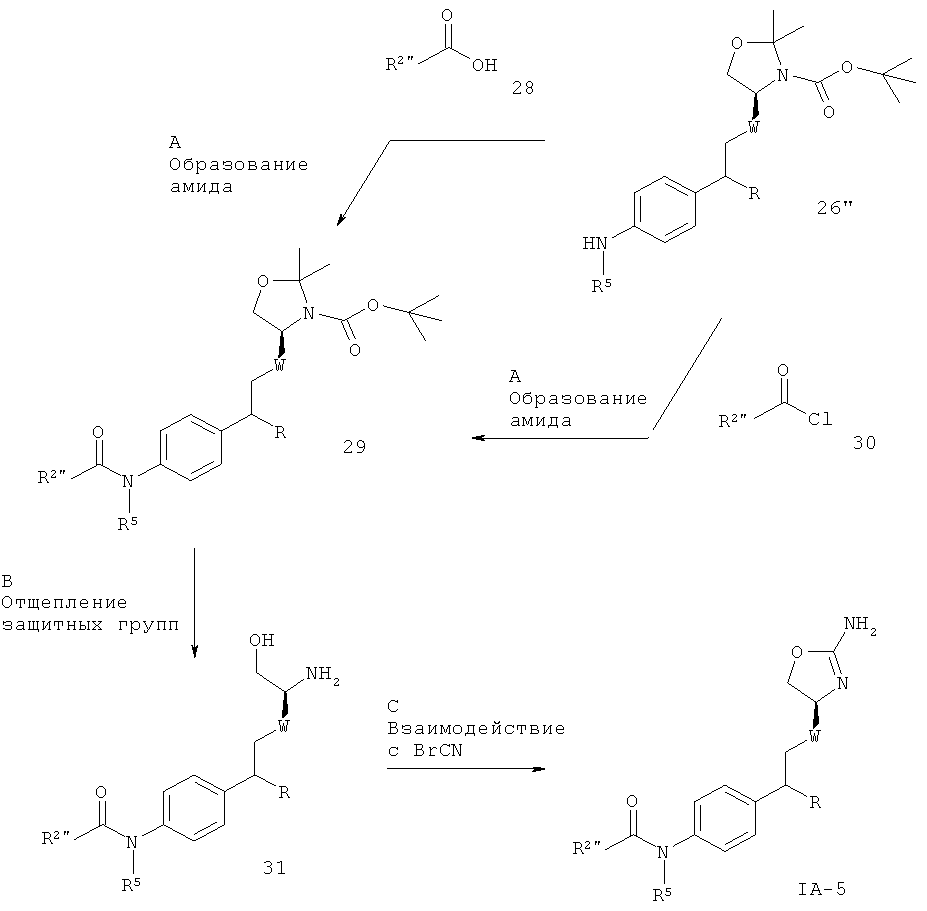
R2” представляет собой (CR'R”)m-циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом; или представляет собой
(CR'R”)m-гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, циклоалкилом, NHC(O)-низшим алкилом, циано, S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном; или представляет собой
(CR'R”)m-арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, СН2-низшим алкокси или циано;
и R' и R” независимо друг от друга представляют собой водород, низший алкокси или низший алкил либо вместе с атомом С могут образовывать циклоалкильную группу, m равно 0 или 1, а другие заместители такие, как описано выше.
W представляет собой связь или -СН2-, m равно 0 или 1, а другие заместители такие, как описано выше.
Стадия А. Образование амида может быть осуществлено в результате реакции сочетания между амином 26” и карбоновыми кислотами 28 в присутствии реагента сочетания, такого как DCC (дициклогексилкарбодиимид), EDC (1-этил-3-(3-диметиламинопропил)карбодиимид), TBTU (тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония) или HATU (гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония), в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ (трет-бутил-метиловый эфир).
Предпочтительными условиями являются TBTU с N-метилморфолином в THF при 50ºС в течение ночи.
Альтернативно, образование амида может быть осуществлено в результате реакции сочетания между амином 26” и ацилхлоридами 30 в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются триэтиламин в THF при 50ºС в течение 4 часов.
Стадия В. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или Н3РО4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия С. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии К2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 7
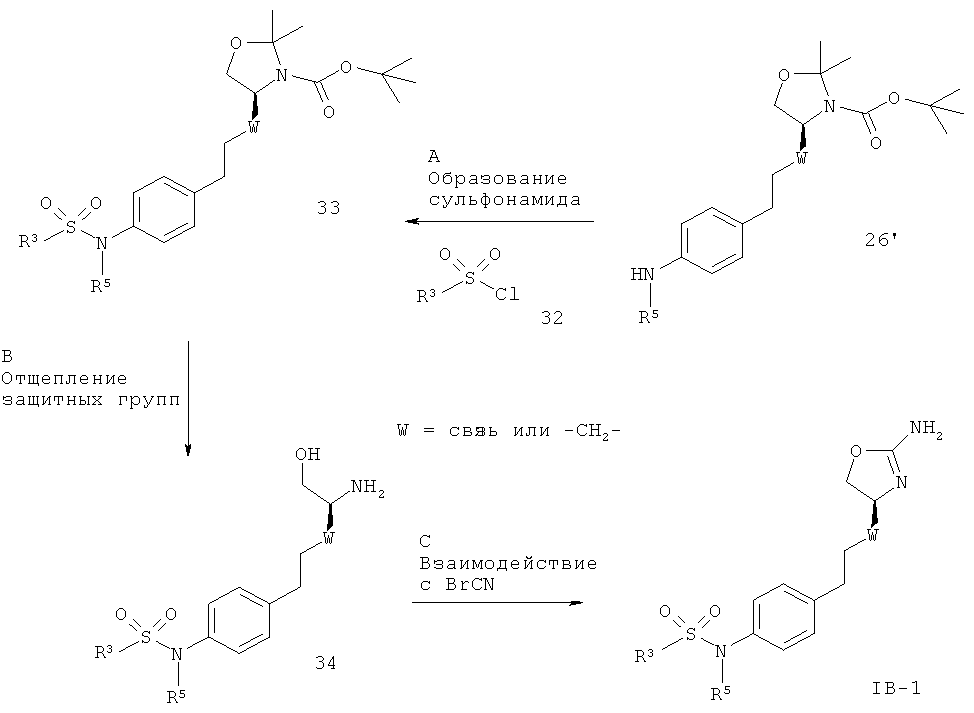
Заместители такие, как описано выше, и W представляет собой связь или -CH2-.
Стадия А. Образование сульфонамида может быть осуществлено в результате реакции сочетания между амином 26” и сульфонилхлоридами 32 в присутствии органического основания, такого как триэтиламин, N,N-диизопропил-этиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются триэтиламин в THF при 50ºС в течение 4 часов.
Стадия В. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия С. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии К2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 8
 представляет собой соответствующий гетероциклоалкил, возможно замещенный галогеном или низшим алкилом, замещенным галогеном,
представляет собой соответствующий гетероциклоалкил, возможно замещенный галогеном или низшим алкилом, замещенным галогеном,
 представляет собой циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом, или представляет собой арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, CH2-низшим алкокси или циано, или представляет собой гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, циклоалкилом, NHC(О)-низшим алкилом, циано, S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном, а другие заместители такие, как описано выше, и W представляет собой связь или -СН2-.
представляет собой циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом, или представляет собой арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, CH2-низшим алкокси или циано, или представляет собой гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, циклоалкилом, NHC(О)-низшим алкилом, циано, S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном, а другие заместители такие, как описано выше, и W представляет собой связь или -СН2-.
Стадия А. Образование изоцианата может быть осуществлено в результате обработки трифосгеном в присутствии органического основания, такого как триэтиламин или N,N-диизопропиламин, в галогенированном органическом растворителе, таком как дихлорметан или 1,2-дихлорэтан, при повышенной температуре.
Предпочтительными условиями являются триэтиламин в дихлорметане при 50ºС в течение ночи.
Стадия В. Образование мочевины может быть осуществлено в результате реакции сочетания между изоцианатом 35 и первичными аминами 38 или вторичными аминами 36 в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, в галогенированных растворителях, таких как дихлорметан.
Предпочтительными условиями являются N,N-диизопропилэтиламин в дихлорметане при комнатной температуре в течение ночи.
Стадия С. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или Н3РО4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия D. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 9
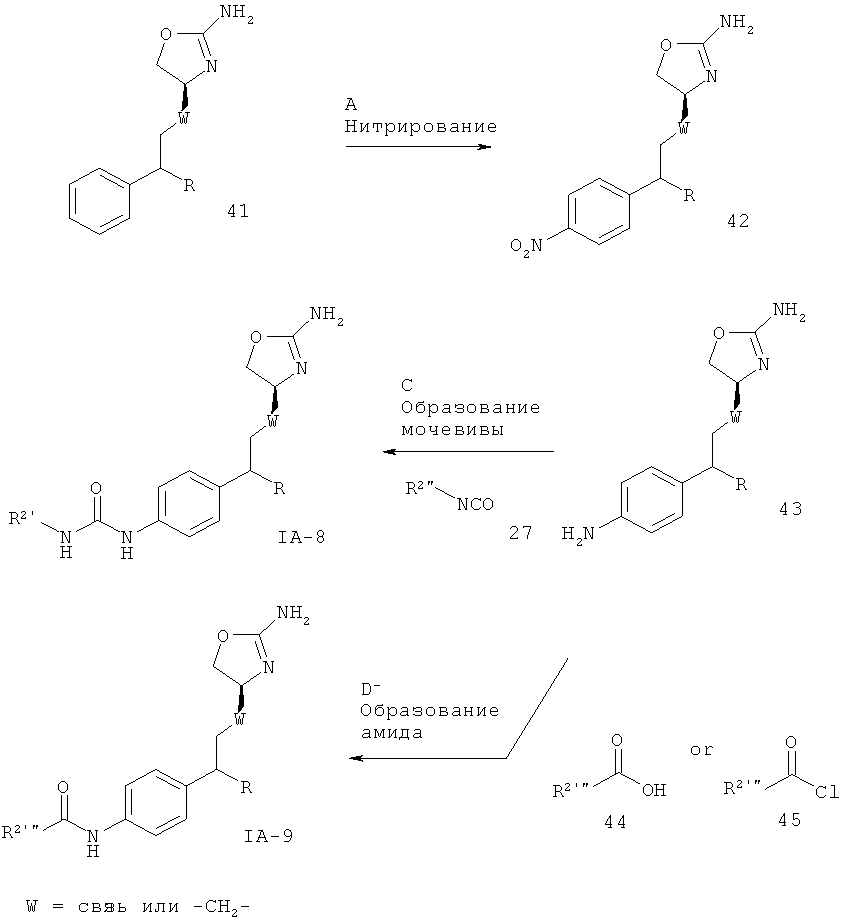
R2' представляет собой арил, возможно замещенный одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном, или гетероарил, возможно замещенный одним или более заместителями, выбранными из галогена или низшего алкила, замещенного галогеном,
R2'” представляет собой циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом, или представляет собой гетероциклоалкил, возможно замещенный галогеном или низшим алкилом, замещенным галогеном, или представляет собой (CR'R”)m-гетероарил, который описан выше, или представляет собой (CR'R”)m-арил, который описан выше, а другие заместители такие, как описано выше, и W представляет собой связь или -СН2-.
Стадия А. Нитрование может быть осуществлено в результате обработки соединения 41 нитрующим реагентом, таким как 65%-ная конц. азотная кислота, при повышенных температурах.
Предпочтительными условиями являются 60ºС в течение 3 часов.
Стадия В. Восстановление нитрогруппы может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, НОАс, EtOAc, CH2Cl2, CHCl3, DMF или их смеси. Альтернативно, восстановление алкена может быть осуществлено под действием Mg в МеОН или под действием LiAlH4 в THF или диэтиловом эфире.
Предпочтительными условиями являются формиат аммония в присутствии палладия на угле в МеОН при 60ºС в течение 2 часов.
Стадия С. Образование мочевины может быть осуществлено в результате реакции сочетания между амином 43 и алкил- или арил-изоцианатными соединениями 27 в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, в галогенированных растворителях, таких как дихлорметан.
Предпочтительными условиями являются N,N-диизопропилэтиламин в дихлорметане при комнатной температуре в течение ночи.
Стадия D. Образование амида может быть осуществлено в результате реакции сочетания между амином 43 и карбоновыми кислотами 44 в присутствии реагента сочетания, такого как DCC, EDO, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТЕМЕ.
Предпочтительными условиями являются TBTU с N-метилморфолином в THF при 50ºС в течение ночи.
Альтернативно, образование амида может быть осуществлено в результате реакции сочетания между амином 43 и ацилхлоридами 45 в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются триэтиламин в THF при 50ºС в течение 4 часов.
Схема 10
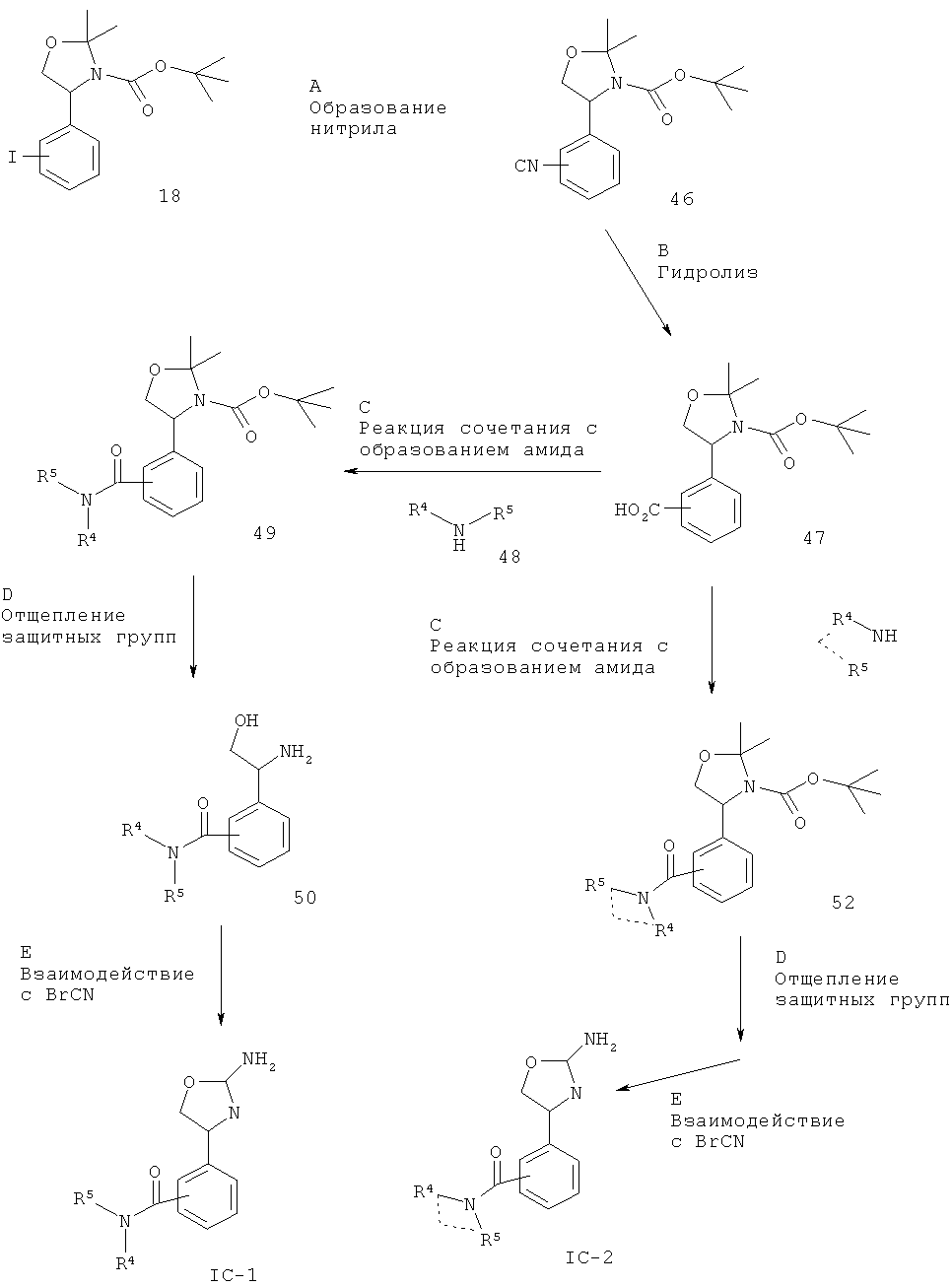
Пунктирная линия означает, что R4 и R5 могут образовывать вместе с атомом N гетероциклическое кольцо, а другие заместители такие, как описано выше.
Стадия А. Арилнитрил 46 может быть получен из арилиодида 18 в результате взаимодействия с солью цианидом металла в присутствии палладиевого катализатора в органическом растворителе, таком как DMF или DMSO, при повышенной температуре.
Предпочтительными условиями являются цианид цинка и тетракис(трифенилфосфин)палладий в DMF при 160ºС в течение 15 мин в герметично закрытой пробирке в условиях облучения микроволнами.
Стадия В. Гидролиз нитрильной группы с получением карбоновой кислоты 47 в присутствии кислотолабильной защитной группы ВОС может быть осуществлен в результате обработки щелочью, такой как КОН или NaOH, в системе водных растворителей при повышенной температуре.
Предпочтительными условиями являются 2 н. водный NaOH при 85ºС в течение ночи.
Стадия С. Образование амида может быть осуществлено в результате реакции сочетания между карбоновой кислотой 47 и ациклическими первичными или вторичными аминами 48 или циклическими вторичными аминами 51 в присутствии реагента сочетания, такого как DCC, EDC, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропил-этиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются TBTU с N-метилморфолином в THF при 50ºС в течение ночи.
Стадия D. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия Е. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 11
 представляет собой определение для структур
представляет собой определение для структур  ,
, 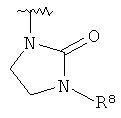 ,
, 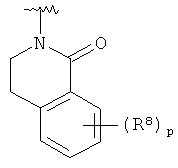 или
или 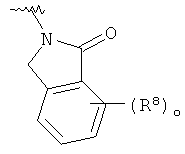 ;
;
R8 представляет собой водород, галоген или арил, возможно замещенный галогеном.
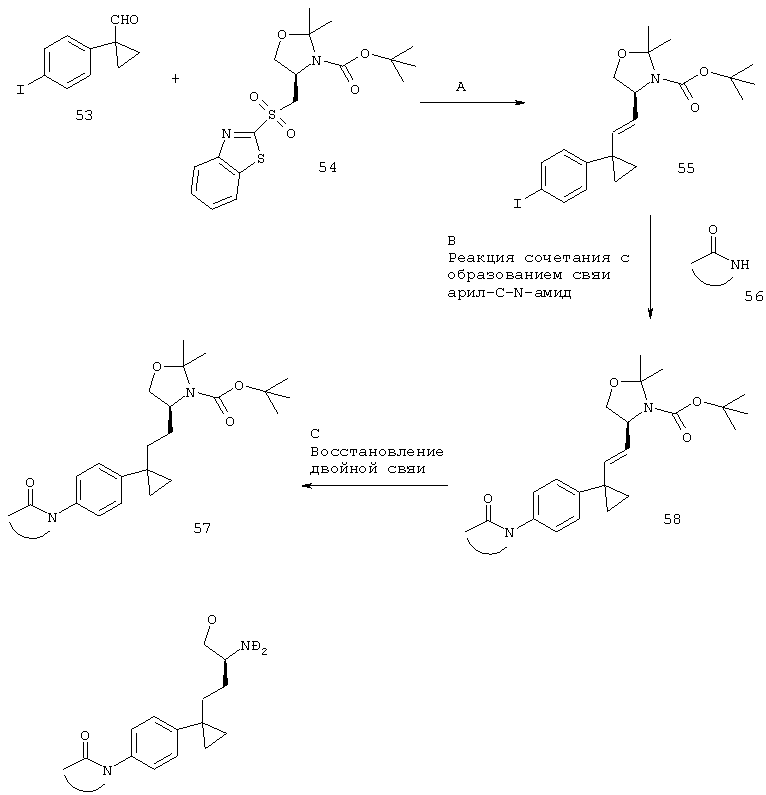
Стадия А. Реакция Жюлиа (Julia) между альдегидом 53 и бензотиазол-сульфонильным соединением 54 может быть осуществлена с использованием основания, такого как LiHMDS, NaHMDS, KHMDS, LDA, KOtBu, DBU (1,8-диазабицикло[5.4.0]ундец-7-ен), в растворителе, таком как THF, диэтиловый эфир, 1,2-диметоксиэтан, дихлорметан, DMF или их смеси, при температурах от -100ºС до КТ в течение от 15 мин до 8 ч для образования аниона и затем конденсации этого илида с карбонильным соединением в том же растворителе при температурах от -100ºС до КТ в течение 1-24 ч.
Предпочтительными условиями являются образование аниона в присутствии LiHMDS при -78ºС в THF и последующая конденсация с карбонильным компонентом в тех же условиях.
Стадия В. Образование связи C-N может быть осуществлено в результате реакции сочетания между арилиодидом 55 и амидными соединениями 56 в присутствии палладиевого или медного катализатора, лиганда и основания в таких растворителях, как диоксан, DME, THF, толуол, DMF и DMSO, при повышенных температурах. Например, с использованием иодида меди(I), фосфата калия в качестве основания и N,N'-диметилглицина, L-пролина, глицина, 2-аминоэтанола или 1,2-этандиола в качестве лиганда согласно методике Chen и др. (Org. Lett. 2008, 10, 4565-4568).
Предпочтительными условиями являются иодид меди(I), фосфат калия и N,N'-диметилглицин в DMSO в герметично закрытой пробирке при 110ºС в течение ночи.
Стадия С. Восстановление алкена может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси. Альтернативно, восстановление алкена может быть осуществлено под действием Mg в МеОН или под действием LiAlH4 в THF или диэтиловом эфире.
Предпочтительными условиями являются гидрирование в присутствии PtO2 в качестве катализатора с МеОН в качестве растворителя.
Стадия D. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl3COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия Е. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 12
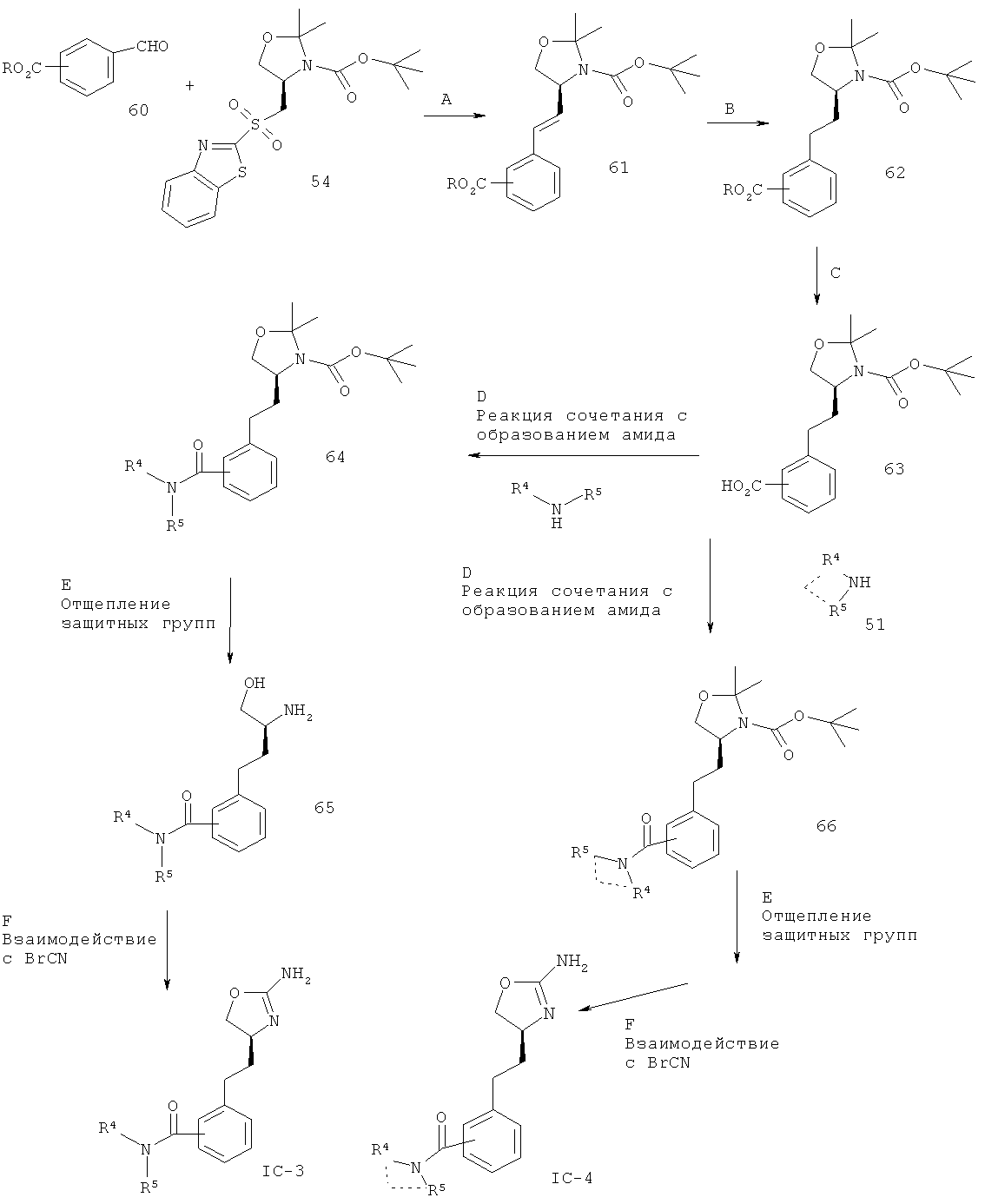
Пунктирная линия означает, что R4 и R5 вместе с атомом N образуют гетероциклическое кольцо, а другие заместители такие, как описано выше.
Стадия А. Реакция Жюлиа (Julia) между сложным эфиром формилбензойной кислоты 60 и бензотиазолсульфонильным соединением 54 может быть осуществлена с использованием основания, такого как LiHMDS, NaHMDS, KHMDS, LDA, KOtBu, DBU, в растворителе, таком как THF, диэтиловый эфир, 1,2-диметоксиэтан, дихлорметан, DMF или их смеси, при температурах от -100ºС до КТ в течение от 15 мин до 8 ч для образования аниона и затем конденсации этого илида с карбонильным соединением в том же растворителе при температурах от -100ºС до КТ в течение 1-24 ч.
Предпочтительными условиями являются образование аниона в присутствии LiHMDS при -78ºС в THF и последующая конденсация с карбонильным компонентом в тех же условиях.
Стадия В. Восстановление алкена может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси.
Предпочтительными условиями являются гидрирование в присутствии Pd на угле в качестве катализатора с МеОН в качестве растворителя.
Стадия С. Омыление сложноэфирной группы с получением карбоновой кислоты может быть осуществлено в результате обработки щелочью, такой как LiOH, КОН или NaOH, в системе водных или смешанных водно-органических растворителей при комнатной температуре.
Предпочтительными условиями являются LiOH в водном МеОН при комнатной температуре в течение 2 часов.
Стадия D. Образование амида может быть осуществлено в результате реакции сочетания между карбоновой кислотой 63 и ациклическими первичными или вторичными аминами 48 или циклическими вторичными аминами 51 в присутствии реагента сочетания, такого как DCC, EDO, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропил-этиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются TBTU с N-метилморфолином в THF при 50ºС в течение ночи.
Стадия Е. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или Н3РО4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия F. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 13
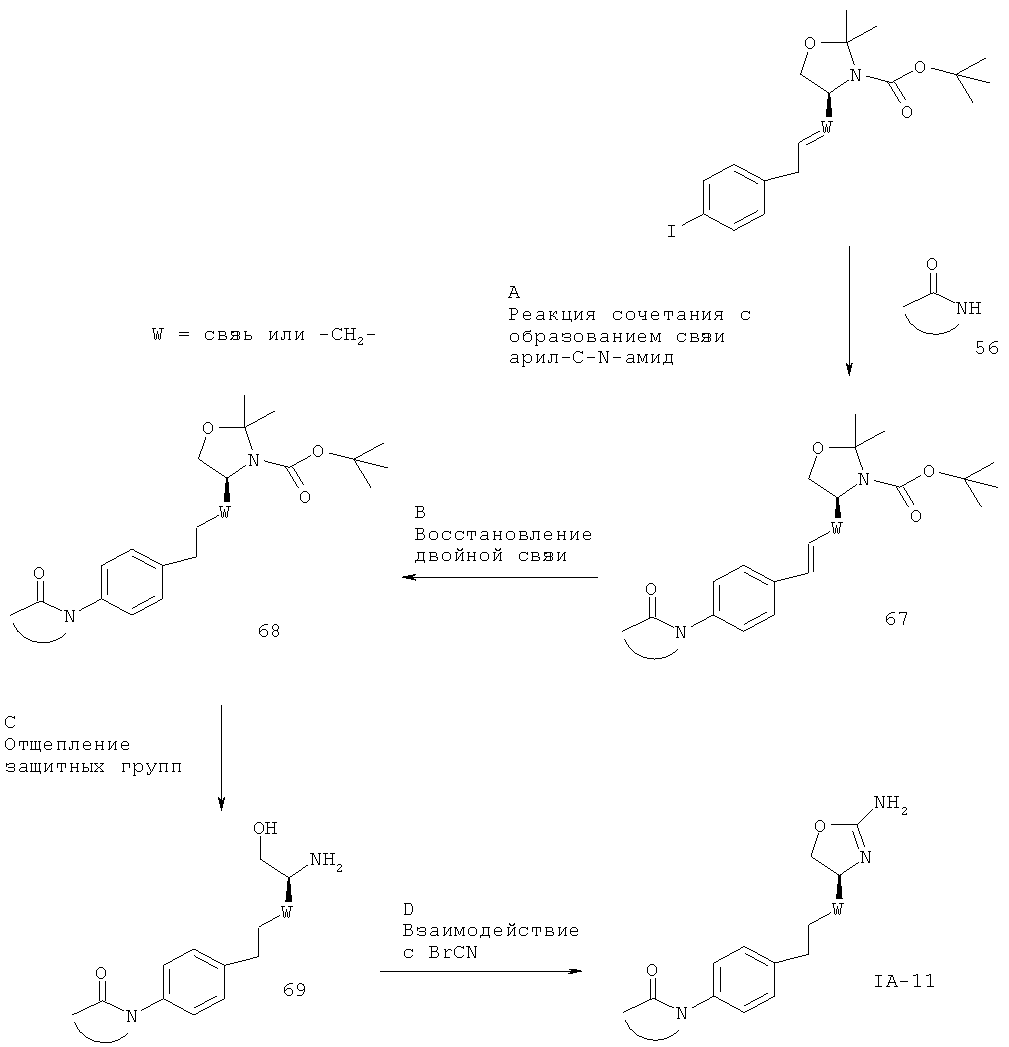
 представляет собой определение для структур
представляет собой определение для структур  ,
,  ,
,  или
или  ;
;
R8 представляет собой водород, галоген или арил, возможно замещенный галогеном;
а другие заместители такие, как описано выше, и W представляет собой связь или -СН2-.
Стадия А. Образование связи C-N может быть осуществлено в результате реакции сочетания между арилиодидом 4 и амидными соединениями 56 в присутствии палладиевого или медного катализатора, лиганда и основания в таких растворителях, как диоксан, DME, THF, толуол, DMF и DMSO, при повышенных температурах. Например, с использованием комплекса трифлата меди(I) с бензолом, карбоната цезия в качестве основания и дибензилиденацетона и транс-1,2-диаминоциклогексана в качестве лигандов согласно методике Hafner и Kunz (Synthesis, 2007, 1403-1411).
Предпочтительными условиями являются комплекс трифлата меди(I) с бензолом, карбонат цезия, дибензилиденацетон и транс-1,2-диаминоциклогексан в диоксане в герметично закрытой пробирке при 180ºС в течение 40 мин в условиях облучения микроволнами.
Стадия В. Восстановление алкена может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси. Альтернативно, восстановление алкена может быть осуществлено под действием Mg в МеОН или под действием LiAlH4 в THF или диэтиловом эфире.
Предпочтительными условиями являются гидрирование в присутствии PtO2 в качестве катализатора с МеОН в качестве растворителя.
Стадия С. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl3COOH, HOAc или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, ЕЮН или W, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия D. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 14
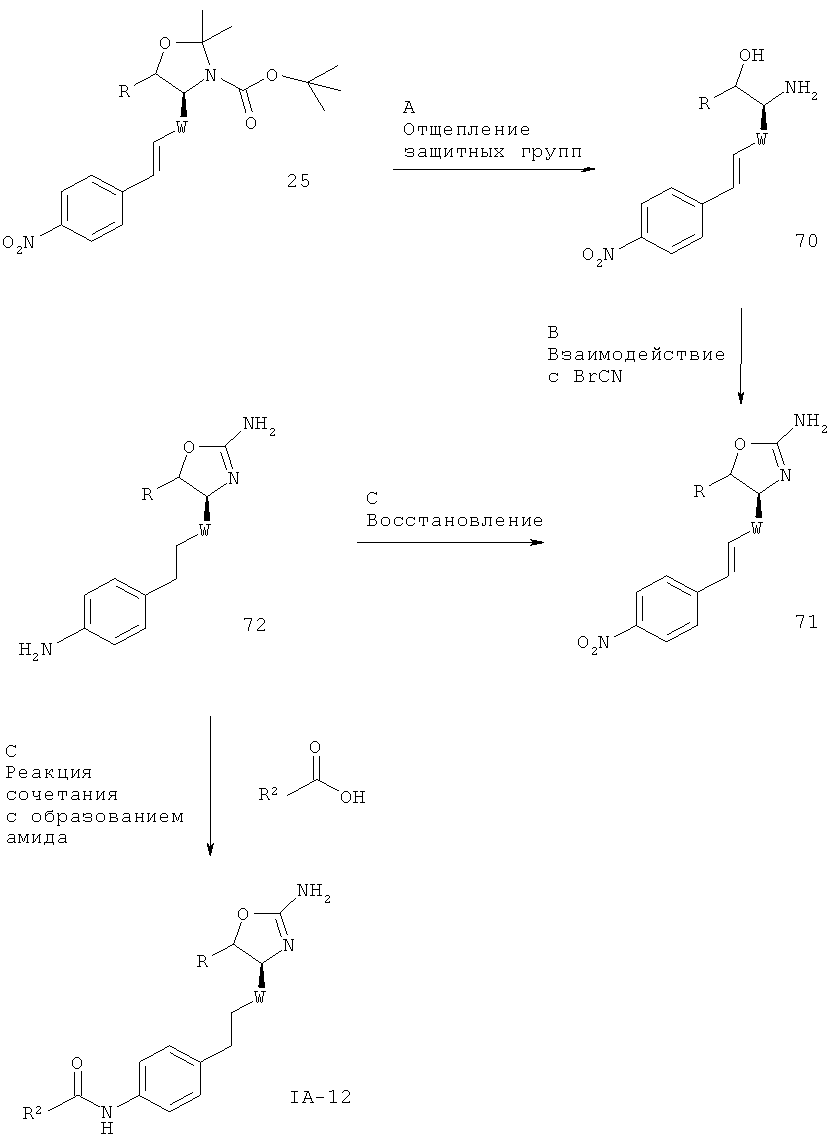
Заместители такие, как описано выше, и W представляет собой связь или -СН2-.
Стадия А. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºC в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия В. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии К2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Стадия С. Одновременное восстановление алкена и нитрогруппы может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси. Альтернативно, восстановление алкена может быть осуществлено под действием Mg в МеОН или под действием LiAlH4 в THF или диэтиловом эфире.
Предпочтительными условиями являются формиат аммония в присутствии палладия на угле в МеОН при 60ºС в течение 2 часов.
Стадия D. Образование связи C-N может быть осуществлено в результате реакции сочетания между анилином 72 и соединениями - кислотами 73 в присутствии 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолинийхлорида гидрата (CAS 3945-69-5) или 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолинийтетрафторбората (CAS 293311-03-2) в таких растворителях, как МеОН, при 0-5ºС в течение 1 часа.
Предпочтительными условиями являются обработка соединения - кислоты 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолинийхлорида гидратом в метаноле при 0ºС в течение 15 минут, с последующим добавлением анилина в метаноле и перемешиванием при 0ºС в течение 2 часов.
Схема 15
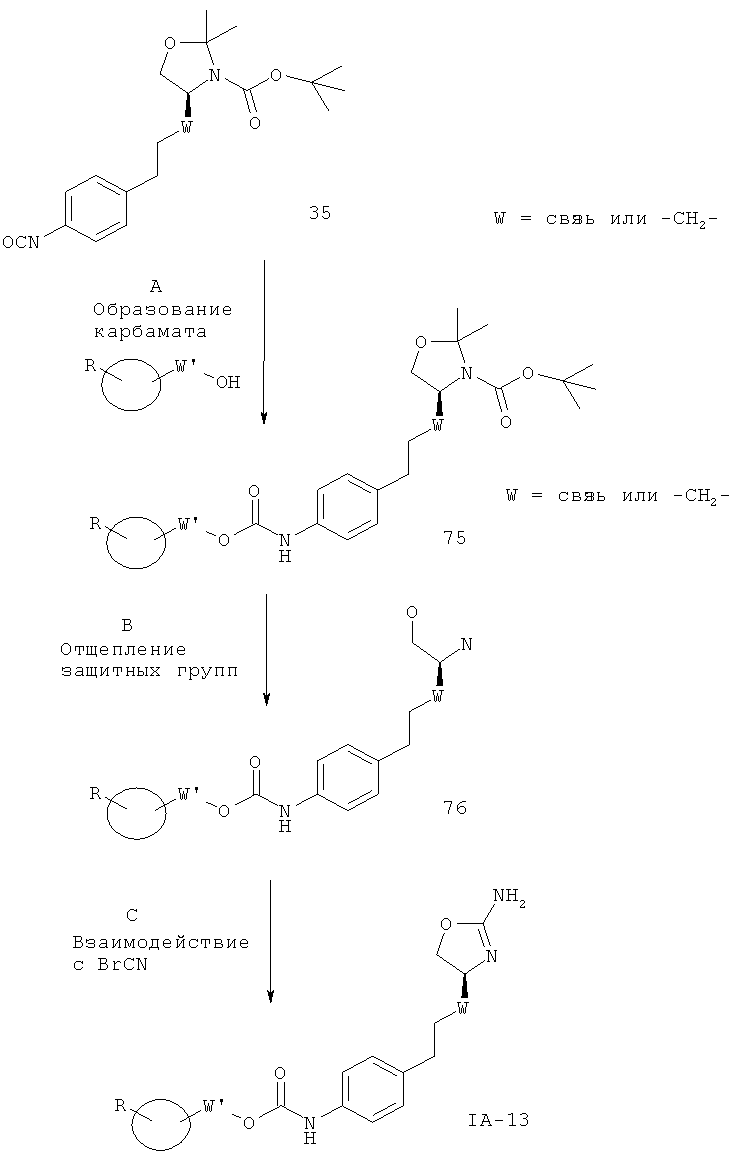
 представляет собой цикпоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом, или представляет собой арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, СН2-низшим алкокси или циано, или представляет собой гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, циклоалкилом, NHC(О)-низшим алкилом, циано, S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном, а другие заместители такие, как описано выше, и W и W' независимо представляют собой связь или -GH2-.
представляет собой цикпоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом, или представляет собой арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, СН2-низшим алкокси или циано, или представляет собой гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, циклоалкилом, NHC(О)-низшим алкилом, циано, S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном, а другие заместители такие, как описано выше, и W и W' независимо представляют собой связь или -GH2-.
Стадия А. Образование карбамата может быть осуществлено в результате реакции сочетания между изоцианатом 35 и спиртами 74 в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, при комнатной температуре или при повышенной температуре.
Предпочтительными условиями являются N,N-диизопропилэтиламин в 1,2-дихлорэтане при 110ºС в течение ночи.
Стадия В. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или Н3РО4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия С. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 16
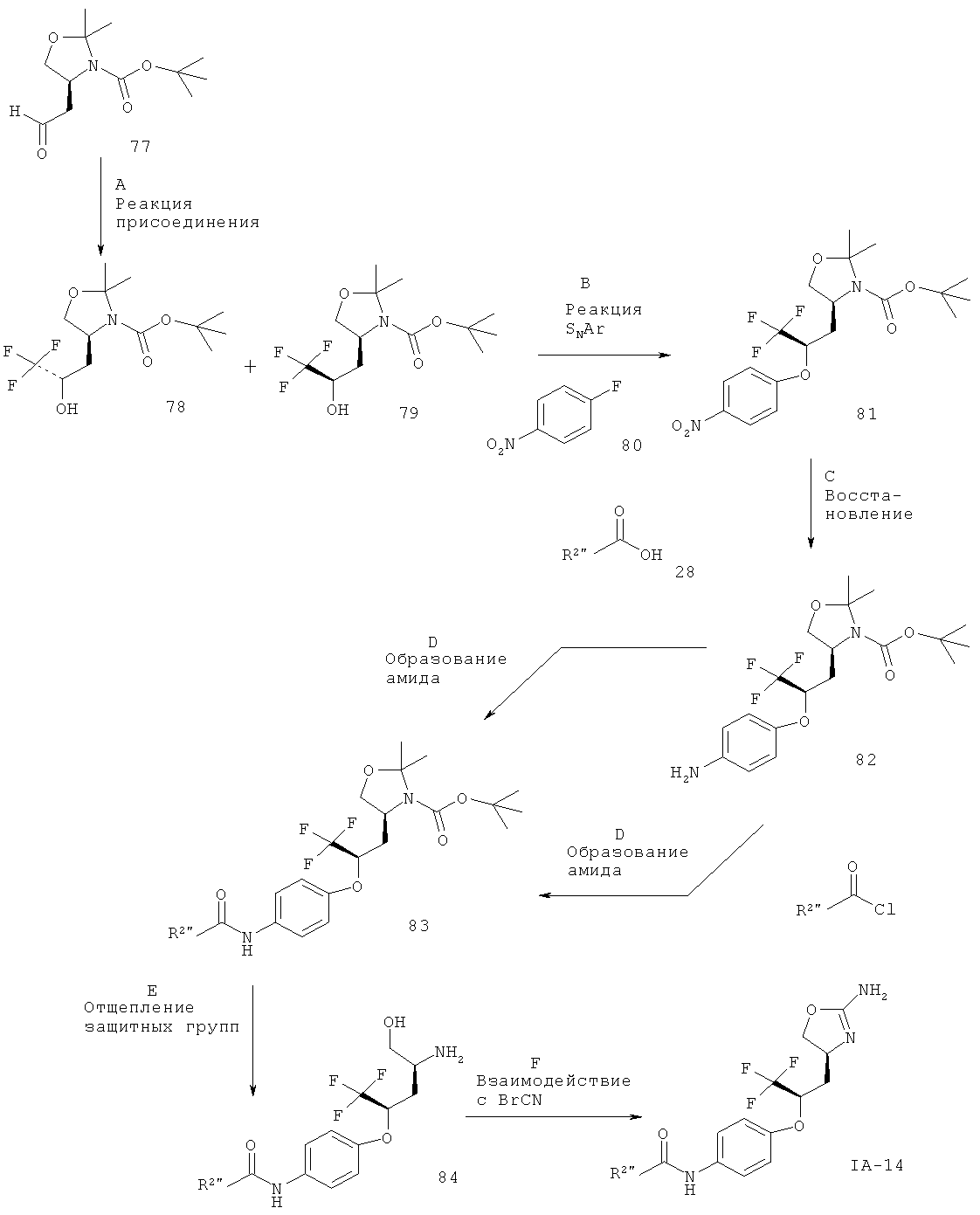
R2” представляет собой (CR'R”)m-циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом; или представляет собой
(CR'R”)m-гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, циклоалкилом, NHC(O)-низшим алкилом, циано, S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном; или представляет собой
(CR'R”)m-арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, СН2-низшим алкокси или циано;
и R' и R” независимо друг от друга представляют собой водород, низший алкокси или низший алкил либо вместе с атомом С могут образовывать циклоалкильную группу, m равно 0 или 1, а другие заместители такие, как описано выше.
Стадия А. Присоединение группы CF3 к альдегиду 77 (CAS 147959-19-1) может быть осуществлено в результате обработки (трифторметил)триметил-силаном в присутствии источника фторид-иона, такого как тетрабутиламмония фторид, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ, с последующей обработкой водной кислотой. Данная реакция позволяет получить смесь эпимерных продуктов 78 и 79, которые могут быть разделены хроматографией.
Предпочтительными условиями являются THF при температуре от 0ºС до комнатной температуры в течение 30 мин с последующей обработкой 2 н. водн. соляной кислотой при комнатной температуре в течение 30 мин.
Стадия В. Образование простого эфира может быть осуществлено в результате реакции нуклеофильного ароматического замещения (SNAr) между спиртом 79 и 1-фтор-4-нитробензолом 80 в присутствии основания, такого как NaH, KOtBu, н-BuLi, LiHMDS, NaHMDS, KHMDS, LDA, в эфирном растворителе, таком как THF, диоксан, 1,2-диметоксиэтан, диэтиловый эфир или ТВМЕ, при температуре равной или ниже комнатной температуры.
Предпочтительными условиями являются KHMDS в THF при 0ºС в течение 30 мин и затем при комнатной температуре в течение 1 часа.
Стадия С. Восстановление нитрогруппы соединения 81 может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси.
Предпочтительными условиями являются 10%-ный палладий на угле в МеОН при комнатной температуре в течение 3 часов.
Стадия D. Образование амида может быть осуществлено в результате реакции сочетания между амином 82 и карбоновыми кислотами 28 в присутствии реагента сочетания, такого как DCC, EDC, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются TBTU с N-метилморфолином в THF при 50ºС в течение ночи.
Альтернативно, образование амида может быть осуществлено в результате реакции сочетания между амином 82 и ацилхлоридами 30 в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются триэтиламин в THF при 50ºС в течение 4 часов.
Стадия Е. Одновременное отщепление защитных групп аминоспиртов может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при КТ в течение ночи.
Стадия F. Циклизация аминоспирта до соответствующего 2-аминооксазолина может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии K2СО3 в качестве основания при КТ в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Схема 17
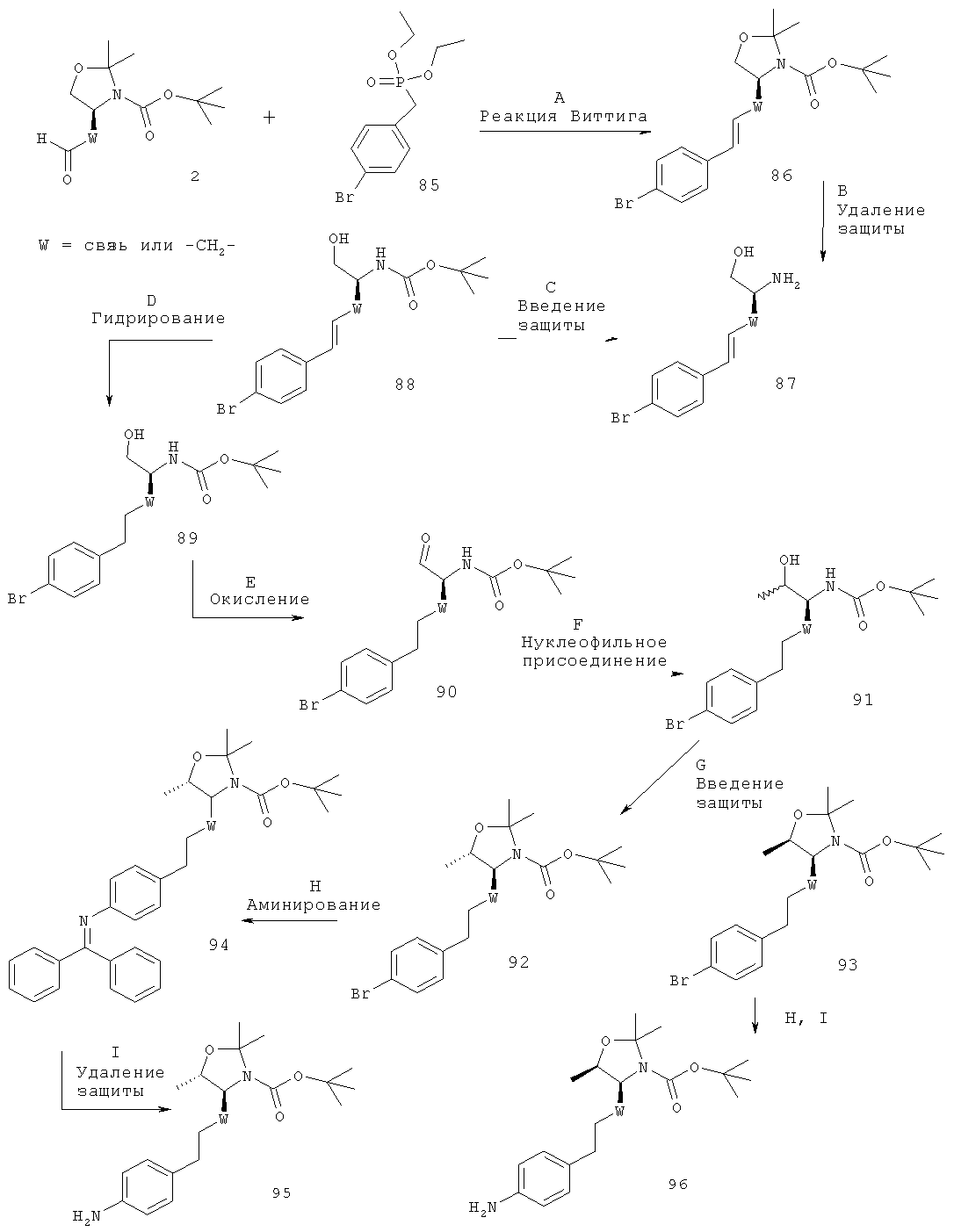
W представляет собой связь или -CH2-, а другие заместители такие, как описано выше.
Стадия А. Реакция Виттига между альдегидом 2 (W представляет собой связь: CAS 95715-87-0, или W представляет собой -СН2-: CAS 147959-19-1) и (4-бром-бензил)-фосфоновой кислоты диэтиловым сложным эфиром 85 (38186-51-5) может быть осуществлена с использованием основания, такого как NaH, KOtBu, NaOMe, NaOEt, н-BuLi, LiHMDS, NaHMDS, KHMDS, LDA, в растворителе, таком как THF, диоксан, ацетонитрил, 1,2-диметоксиэтан, DMF, бензол, толуол или их смеси, при температурах от -78ºС до 80ºС в течение от 15 мин до 8 ч и, если целесообразно, с возможным добавлением краун-эфира для образования илида и затем конденсации этого илида с карбонильным соединением в том же растворителе при температуре от 0 до 80ºС в течение 1-24 ч. Альтернативно, основание, карбонильное соединение и возможно краун-эфир могут быть добавлены в реакционную смесь одновременно без предварительного образования илида при температурах от -78ºС до 80ºС.
Предпочтительными условиями являются образование илида при -78ºС с использованием LDA (полученного in situ в результате обработки N,N-диизопропил-амина с помощью н-BuLi) в качестве основания и THF в качестве растворителя, взаимодействие со сложным эфиром фосфоновой кислоты в течение 1 часа при -78ºС и затем конденсация с карбонильным компонентом с нагреванием до комнатной температуры в течение ночи.
Стадия В. Одновременное отщепление защитных групп в соединении 86 с получением аминоспирта 87 может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение 3 часов.
Стадия С. Избирательная защита аминогруппы аминоспирта 87 может быть осуществлена в результате обработки ди-трет-бутилкарбонатом в присутствии органического основания, такого как триэтиламин, N,N-диизопропил-этиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются N,N-диизопропилэтиламин в THF при комнатной температуре в течение ночи.
Стадия D. Восстановление олефиновой связи в соединении 88 без сопутствующего расщепления связи арил-бром может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении в присутствии катализатора, такого как PtO2 или Pt/C, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси.
Предпочтительными условиями являются 10%-ная платина на угле в МеОН при комнатной температуре в течение 3 часов.
Стадия Е. Окисление спирта 89 до соответствующего альдегида 90 может быть осуществлено с использованием диметилсульфоксидных (DMSO) окисляющих реагентов, например DMSO, активированного путем применения оксалилхлорида, с последующей обработкой триэтиламином согласно способу Сверна или DMSO, активированного путем применения комплекса триоксида серы и пиридина в присутствии триэтиламина согласно способу Деринга.
Предпочтительными условиями являются комплекс триоксида серы и пиридина и триэтиламин в DMSO при температуре от 0ºС до комнатной температуры в течение 30 мин.
Стадия F. Нуклеофильное присоединение метильной группы к альдегиду 90 может быть осуществлено в результате взаимодействия с металлоорганическим реагентом, таким как хлорид метилмагния, бромид метилмагния, иодид метилмагния или метиллитий. Эту реакцию проводят в эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются бромид метилмагния в смеси THF и диэтилового эфира при 0ºС и затем при комнатной температуре в течение 4 часов. Данная реакция позволяет получить спирт 91 в виде смеси эпимеров, которые на этой стадии можно не разделять.
Стадия G. Введение защиты в виде циклической аминальной группы в спирт 91 может быть осуществлено в результате обработки 2,2-диметокси-пропаном в присутствии каталитического количества органической кислоты, такой как п-толуолсульфоновая кислота или камфорсульфоновая кислота. Эта реакция может быть проведена с использованием избытка 2,2-диметоксипропана в качестве растворителя или в присутствии дополнительных непротонных сорастворителей, таких как галогенированные растворители, такие как дихлорметан или 1,2-дихлорэтан, или эфирные растворители, такие как диэтиловый эфир, диоксан, THF или ТВМЕ. Эта реакция может быть проведена при комнатной температуре или при повышенной температуре, такой как температура дефлегмации данного растворителя.
Предпочтительными условиями являются п-толуолсульфоновая кислота в дихлорметане при комнатной температуре в течение ночи.
Данная реакция позволяет получить эпимерные продукты 92 и 93, которые на этой стадии могут быть легко разделены хроматографией.
Стадия Н. Образование связи C-N с получением имина 94 может быть осуществлено в результате реакции сочетания между арилбромидом 92 и дифенилметанимином в присутствии палладиевого или медного катализатора, лиганда и основания в таких растворителях, как диоксан, DME, THF, толуол и DMF, при повышенных температурах.
Предпочтительными условиями являются Pd2(dba)3 (трис(дибензилиден-ацетон)дипалладий(0)), BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил) и трет-бутилат натрия в толуоле при 100ºС в течение ночи.
Стадия I. Удаление защиты с имина 94 с получением анилина 95 может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pt/C или Pd/C в таких растворителях, как МеОН, EtOH, Н2О, диоксан, THF, НОАс, EtOAc, CH2Cl2, CHCl3, DMF или их смеси.
Предпочтительными условиями являются 10%-ный палладий на угле и формиат аммония в МеОН при 60ºС в течение 1 часа.
Арилбромид 93 можно превратить в анилин 96, следуя аналогичной последовательности реакций на стадиях Н и I.
Схема 18
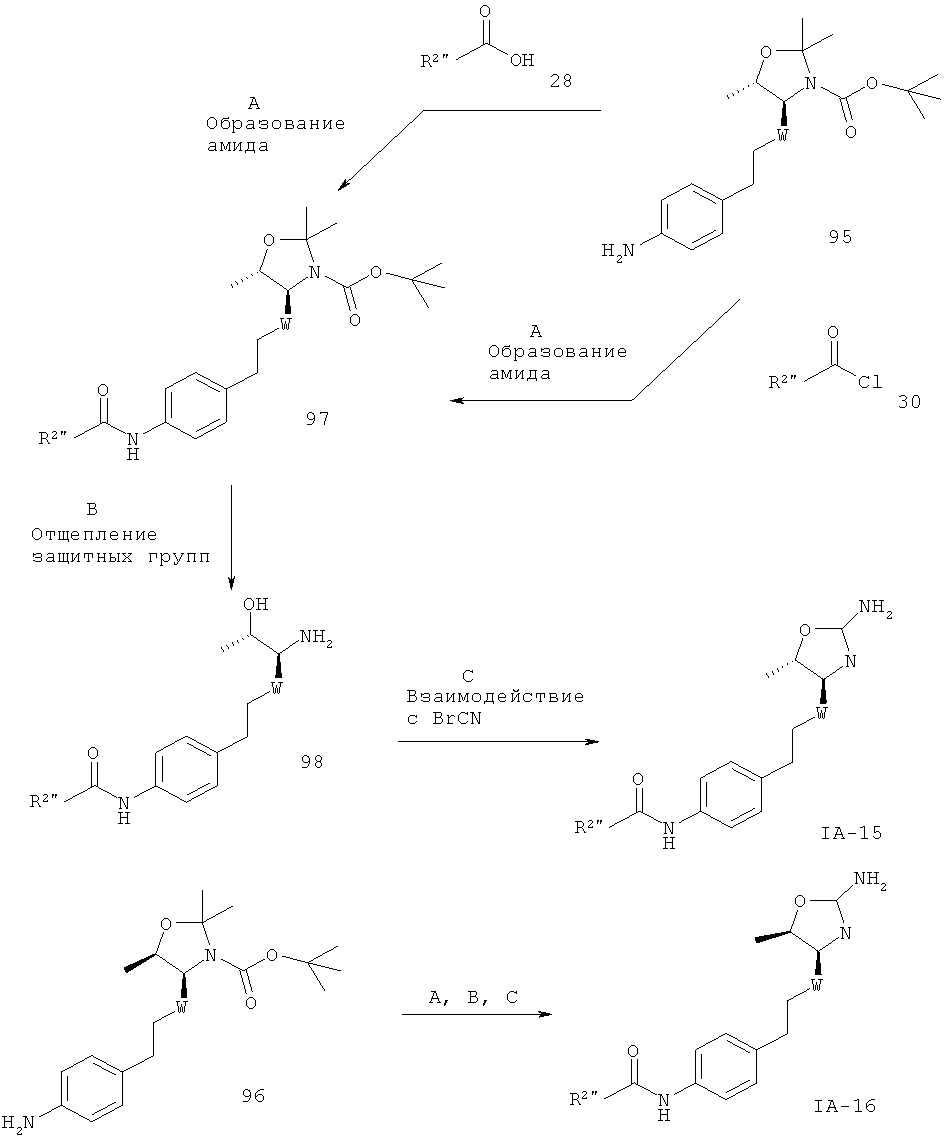
R2” представляет собой (CR'R”)m-циклоалкил, возможно замещенный галогеном, низшим алкилом, низшим алкилом, замещенным галогеном, галоген-замещенным фенилом или гетероарилом; или представляет собой
(CR'R”)m-гетероарил, возможно замещенный галогеном, низшим алкокси, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, циклоалкилом, NHC(O)-низшим алкилом, циано, S(O)2-низшим алкилом, NR6R7 либо гетероарилом или гетероциклилом, который возможно замещен галогеном; или представляет собой
(CR'R”)m-арил, возможно замещенный галогеном, низшим алкилом, замещенным галогеном, низшим алкокси, замещенным галогеном, низшим алкилом, алкинилом, низшим алкокси, СН2-низшим алкокси или циано;
и R' и R” независимо друг от друга представляют собой водород, низший алкокси или низший алкил либо вместе с атомом С могут образовывать циклоалкильную группу, m равно 0 или 1, а другие заместители такие, как описано выше.
Стадия А. Образование амида может быть осуществлено в результате реакции сочетания между амином 95 и карбоновыми кислотами 28 в присутствии реагента сочетания, такого как DCC, EDC, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются TBTU с N-метилморфолином в THF при 50ºС в течение ночи.
Альтернативно, образование амида может быть осуществлено в результате реакции сочетания между амином 95 и ацилхлоридами 30 в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ.
Предпочтительными условиями являются триэтиламин в THF при 50ºС в течение 4 часов.
Стадия В. Одновременное отщепление защитных групп в соединении 97 с получением аминоспирта 98 может быть осуществлено с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4, или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителе, таком как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80ºС.
Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80ºС в течение ночи или 4 н. HCl в диоксане при кт в течение ночи.
Стадия С. Циклизация аминоспирта 98 до соответствующего 2-аминооксазолина 1А-15 может быть осуществлена в результате обработки бромцианом в THF в качестве растворителя и в присутствии К2СО3 в качестве основания при кт в течение ночи или в результате обработки бромцианом в метаноле в качестве растворителя и в присутствии ацетата натрия в качестве основания при температуре от 0ºС до КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Предпочтительными условиями являются метанол в качестве растворителя и ацетат натрия в качестве основания при КТ в течение ночи с последующей обработкой водным раствором аммиака при комнатной температуре в течение 1 часа.
Амин 96 можно превратить в 2-аминооксазолин 1А-16, следуя аналогичной последовательности реакций на стадиях А, В и С.
Выделение и очистка соединений
Выделение и очистка соединений и промежуточных соединений, изложенных в данном описании, при желании могут быть осуществлены посредством любой подходящей методики выделения и очистки, такой как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, толстослойная хроматография, препаративная жидкостная хроматография низкого и высокого давления или комбинация этих методик. Конкретные иллюстрации подходящих методик разделения и выделения могут быть приведены посредством ссылки на подготовительные примеры и примеры, представленные в данном описании ниже. Однако, несомненно, также могут быть использованы другие эквивалентные методики разделения и выделения. Рацемические смеси хиральных соединений формулы I могут быть разделены с использованием хиральной HPLC (жидкостной хроматографии высокого давления).
Соли соединений формулы I
Соединения формулы I являются основными и могут быть преобразованы в соответствующие соли присоединения кислоты. Превращение осуществляется путем обработки по меньшей мере стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и тому подобное. Обычно, свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и тому подобное, и кислоту добавляют в том же растворителе. Температуру поддерживают в диапазоне от 0ºС до 50ºС. Полученная соль выпадает в осадок самопроизвольно или может быть выделена из раствора с использованием менее полярного растворителя.
Полученные присоединением кислоты соли основных соединений формулы 1 могут быть преобразованы в соответствующие свободные основания путем обработки по меньшей мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобное.
Соединения формулы 1 и их фармацевтически приемлемые соли присоединения (кислоты) обладают полезными фармакологическими свойствами. Конкретно, установлено, что соединения по настоящему изобретению обладают высокой аффинностью к рецепторам следовых аминов (TAAR), особенно к TAAR1.
Данные соединения были исследованы в соответствии с приведенным далее тестом.
Материалы и методы
Конструирование TAAR-экспрессирующих плазмид и стабильно трансфицированных клеточных линий
Для конструирования экспрессирующих плазмид амплифицировали последовательности, кодирующие TAAR1, из геномной ДНК человека, крысы и мыши по существу таким способом, как описано Lindemann и др. [14]. Использовали систему ПЦР (полимеразная цепная реакция) с высокоточным наращиванием цепи (Roche Diagnostics) с 1,5 мМ Mg2+ и очищенные ПЦР-продукты клонировали в клонирующий вектор pCR2.1-TOPO (Invitrogen) в соответствии с инструкциями производителя. ПЦР-продукты субклонировали в вектор pIRESneo2 (BD Clontech, Palo Alto, California) и последовательности экспрессирующих векторов подтверждали путем секвенирования перед введением их в клеточные линии.
Клетки НЕК293 (линия 293 клеток почки эмбриона человека) (АТСС (Американская коллекция типовых культур) №CRL-1573) культивировали по существу так, как описано Lindemann и др. (2005). Для получения стабильно трансфицированных клеточных линий клетки НЕК293 трансфицировали экспрессирующими плазмидами pIRESneo2, содержащими TAAR-кодирующие последовательности (описанные выше), используя липофектамин 2000 (Invitrogen) в соответствии с инструкциями производителя, и через 24 часа после трансфекции в культуральную среду добавляли G418 (Sigma, Buchs, Switzerland) (1 мг/мл). После культивирования в течение приблизительно 10 сут клоны выделяли, рассевали и тестировали в отношении их восприимчивости к следовым аминам (все соединения приобретены в Sigma), используя систему для иммуноферментного анализа (EIA) "cAMP Biotrak" (Amersham) в соответствии с предоставленной производителем методикой EIA без ацетилирования. Для всех последующих исследований использовали моноклональные клеточные линии, которые показывали стабильную EC50 (концентрацию, требуемую для достижения 50% эффекта) в течение периода культивации, составляющего 15 пассажей. Приготовление мембран и связывание радиоактивного лиганда Клетки, находящиеся в состоянии конфлюентности, смывали охлажденным во льду забуференным фосфатом физиологическим раствором без Са2+ и Mg2+, содержащим 10 мМ EDTA (этилендиаминтетраацетат), и осаждали путем центрифугирования при 1000 об/мин в течение 5 мин при 4ºС. Затем осадок дважды промывали охлажденным во льду забуференным фосфатом физиологическим раствором, клеточный осадок сразу замораживали путем погружения в жидкий азот и хранили до использования при -80ºС. Затем клеточный осадок суспендировали в 20 мл буфера HEPES(N-2-гидроксиэтил-пиперазин-N-2-этансульфоновая кислота)-ТаОН (20 мМ), рН 7,4, содержащего 10 мМ EDTA, и гомогенизировали, используя Polytron (PT 3000, Kinematica), при 10000 об/мин в течение 10 с. Гомогенат центрифугировали при 48000×g в течение 30 мин при 4ºС, осадок ресуспендировали в 20 мл HEPES-NaOH (20 мМ), рН 7,4, содержащего 0,1 мМ EDTA, (буфер А) и гомогенизировали, используя Polytron, при 10000 об/мин в течение 10 с. Затем гомогенат центрифугировали при 48000×g в течение 30 мин при 4ºС, осадок ресуспендировали в 20 мл буфера А и гомогенизировали, используя Polytron, при 10000 об/мин в течение 10 с. Концентрацию белка определяли согласно методу от Pierce (Rockford, IL). Затем гомогенат центрифугировали при 48000×g в течение 10 мин при 4ºС, (осадок) ресуспендировали в HEPES-NaOH (20 мМ), рН 7,0, содержащем MgCl2 (10 мМ) и CaCl2 (2 мМ), (буфер В) (1 г белка в мл) при 200 и гомогенизировали, используя Polytron, при 10000 об/мин в течение 10 с.
Анализ связывания выполняли при 4ºС в конечном объеме 1 мл и времени инкубации 30 мин. Радиоактивный лиганд [3H]-рац-2-(1,2,3,4-тетрагидро-1-нафтил)-2-имидазолин (рац=рацемический) использовали в концентрации, равной рассчитанной величине Kd, составляющей 60 нМ, при которой связывается приблизительно 0,1% от всего добавленного радиоактивного лиганда, и специфическое связывание составляет приблизительно 70-80% от общего связывания. Неспецифическое связывание определяли как количество [3H]-рац-2-(1,2,3,4-тетрагидро-1-нафтил)-2-имидазолина, связавшегося в присутствии соответствующего немеченого лиганда (10 мкМ). Конкурирующие лиганды тестировали в широком диапазоне концентраций (10 пМ-30 мкМ). Конечная концентрация диметилсульфоксида в анализе составляла 2%, и это не оказывало влияния на связывание радиоактивного лиганда. Каждый эксперимент выполняли в двух повторах. Инкубацию всех образцов останавливали путем быстрой фильтрации через планшеты UniFilter-96 (Packard Instrument Company) и стеклянный фильтр GF/C, который предварительно вымачивали в течение по меньшей мере 2 ч в 0,3%-ном полиэтиленимине, и с использованием клеточного харвестера Filtermate 96 (Packard Instrument Company). Затем пробирки и фильтры 3 раза промывали аликвотами холодного буфера В объемом 1 мл. Фильтры без предварительной сушки вымачивали в Ultima gold (45 мкп/лунка, Packard Instrument Company) и измеряли радиоактивность, используя сцинтилляционный счетчик для микропланшетов TopCount (Packard Instrument Company).
Ниже в таблице приведены предпочтительные соединения, которые в анализе с использованием мышиных или крысиных TAAR1 демонстрируют величину Ki (мкМ) менее 0,01 мкМ.
|
|
|
|
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут быть использованы в качестве лекарственных средств, например в форме фармацевтических препаратов. Эти фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако их также можно вводить ректально, например в форме суппозиториев, или парентерально, например в форме растворов для инъекций.
Для изготовления фармацевтических препаратов соединения формулы I можно обрабатывать, используя фармацевтически инертные неорганические или органические носители. Например, в качестве таких носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул можно использовать лактозу, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и тому подобное. Подходящими носителями для мягких желатиновых капсул являются, например растительные масла, воски, жиры, полутвердые и жидкие полиолы и тому подобное. В случае мягких желатиновых капсул носители обычно не требуются, однако это зависит от природы активного вещества. Подходящими носителями для изготовления растворов и сиропов являются, например вода, полиолы, глицерин, растительное масло и тому подобное. Подходящими носителями для суппозиториев являются, например природные или отвержденные жиры, воски, жиры, полужидкие или жидкие полиолы и тому подобное.
Помимо этого фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, корригенты, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать другие дополнительные терапевтически полезные вещества.
Лекарственные средства, содержащие соединение формулы 1 или его фармацевтически приемлемую соль и терапевтически инертный носитель, также представляют собой предмет настоящего изобретения, как и способ их изготовления, который включает внесение одного или более чем одного соединения формулы 1 и/или одной или более чем одной фармацевтически приемлемой соли присоединения кислоты и, при желании, одного или более чем одного другого терапевтически полезного вещества в форму галенова препарата для введения вместе с одним или более чем одним терапевтически инертным носителем.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются те, которые включают расстройства центральной нервной системы, например, лечение или предупреждение депрессии, психоза, болезни Паркинсона, тревоги и синдрома дефицита внимания и гиперактивности (ADHD).
Дозировку можно варьировать в широких пределах, и несомненно, в каждом конкретном случае она должна быть подобрана с учетом индивидуальных потребностей. В случае перорального введения дозировка для взрослых может изменяться от примерно 0,01 мг до примерно 1000 мг в сутки для соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточную дозу можно вводить в виде однократной дозы или в виде разделенных доз, и помимо этого также может быть превышен верхний предел, если на то имеется показание.
|
Экспериментальная часть
Пример 1
(RS)-1-[4-(2-Амино-4,5-дигидро-оксазол-4-ил)-фенил]-3-(4-хлор-фенил)-мочевина
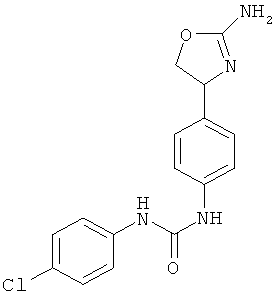
a) (RS)-Амино-(4-иод-фенил)-ацетонитрил
К перемешиваемому раствору 4-иод-бензальдегида (7,10 г) в метаноле (25 мл) добавляли последовательно раствор аммиака (35 мл; 7 М раствор в метаноле) и тетраизопропилортотитанат (10,9 мл) и полученную смесь перемешивали при КТ в течение 2 ч. Затем по каплям добавляли триметилсилилцианид (3,84 мл) и перемешивание продолжали при КТ в течение 22 часов. Реакционную смесь выливали в смесь лед-вода (100 мл) и после перемешивания полученную смесь фильтровали через целит, промывая этилацетатом. Фильтрат концентрировали в вакууме и остаток переносили в этилацетат и последовательно промывали дистиллированной водой и насыщенным рассолом. Органическую фазу затем сушили над сульфатом натрия и концентрировали в вакууме, что позволило получить (RS)-амино-(4-иод-фенил)-ацетонитрил (6,41 г; 81%) в виде желтого твердого вещества. 1H ЯМР δ (CDCl3, 300 МГц): 7.76 (2Н, d, J=7.8 Гц), 7.30 (2Н, d, J=7.8 Гц), 4.87 (1 H, br s), 1.94 (2H, br s).
b) (RS)-Амино-(4-иод-фенил)-уксусной кислоты гидрохлорид
(RS)-Амино-(4-иод-фенил)-ацетонитрил (6,40 г) суспендировали в 5 н. водн. соляной кислоте (100 мл) и смесь нагревали при температуре дефлегмации в течение ночи. Затем смесь охлаждали сначала до комнатной температуры, а затем до 0ºС, в результате чего образовывались кристаллы. Кристаллы собирали фильтрацией, промывая гептаном, и сушили в вакууме при 60ºС, что позволило получить (RS)-амино-(4-иод-фенил)-уксусной кислоты гидрохлорид (6,34 г; 82%) в виде светло-коричневого кристаллического вещества. MS (масс-спектр) (ISP (индуктивно-связанная плазма; от англ. inductively coupled plasma)): 275,9 ([M-H]-).
c) (RS)-2-Амино-2-(4-иод-фенил)-этанол
К перемешиваемому раствору боргидрида лития в THF (25,1 мл; 2 М раствор) в атмосфере аргона по каплям добавляли хлортриметилсилан (12,7 мл). К полученной суспензии добавляли порциями (RS)-амино-(4-иод-фенил)-уксусной кислоты гидрохлорид (6,30 г). Перемешивание продолжали в течение 4 ч, затем смесь охлаждали до 0ºС и гасили путем добавления по каплям метанола (4,5 мл). После перемешивания в течение 15 мин при комнатной температуре добавляли воду и затем смесь разбавляли этилацетатом. Далее добавляли насыщенный рассол и водную фазу подщелачивали (рН 14) путем добавления 5 н. водн. NaOH. Фазы разделяли и органическую фазу промывали насыщенным рассолом, затем сушили над сульфатом натрия и концентрировали в вакууме, что позволило получить (RS)-2-амино-2-(4-иод-фенил)-этанол (5,27 г; колич.) в виде желтого твердого вещества. MS (ISP): 264,1 ([М+Н]+).
d) (RS)-[2-Гидрокси-1-(4-иод-фенил)-этил1-карбаминовой кислоты трет-бутиловый эфир
К перемешиваемому раствору (RS)-2-амино-2-(4-иод-фенил)-этанола (5,20 г) в THF (150 мл) добавляли последовательно N,N-диизопропилэтиламин (4,03 мл) и ди-трет-бутилдикарбонат (5,18 г) и полученный желтый раствор перемешивали при комнатной температуре в течение 5 часов. Смесь распределяли между водой и этилацетатом и фазы разделяли. Органический слой последовательно промывали разбавленной водн. соляной кислотой, насыщенным водн. раствором бикарбоната натрия и насыщенным рассолом. Затем органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, что позволило получить (RS)-[2-гидрокси-1-(4-иод-фенил)-этил]-карбаминовой кислоты трет-бутиловый эфир (7,97 г; колич.) в виде желтого твердого вещества. MS (ISP): 386,0 ([M+Na]+), 364,0 ([М+Н]+), 308,1 ([М+Н-С4Н8]+).
e) (RS)-4-(4-Иод-Фенил)-2.2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому раствору (RS)-[2-гидрокси-1-(4-иод-фенил)-этил]-карбаминовой кислоты трет-бутилового эфира (7,97 г) в дихлорметане (400 мл) добавляли последовательно 2,2-диметоксипропан (36 мл) и п-толуолсульфоновой кислоты моногидрат (0,75 г) и смесь перемешивали при комнатной температуре в течение 18 часов. Затем смесь промывали, используя 0,5 н. водн. NaOH, фазы разделяли и органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, что позволило получить (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (7,05 г; 89%) в виде желтого твердого вещества. MS (EI): 403 (М+), 388 ([М-СН3]+), 332 ([М-СН3-С4Н8]+), 288 ([М-СН3-С4Н8-СО2]+), 57 ([C4H9]+).
f) (RS)-4-{4-[3-(4-Хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
Перемешиваемую суспензию (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира (1.60 г), 4-хлорфенилмочевины (0,81 г), фторида калия (2,88 г; 40 масс.%-ного на окиси алюминия), N,N'-дибензилэтилендиамина (0,14 мл) и иодида меди(1) (0,11 г) в THF (16 мл) в герметично закрытой пробирке нагревали при 90ºС в течение 30 минут в условиях облучения микроволнами. Затем смесь охлаждали до комнатной температуры и фильтровали через целит. Фильтрат концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (0,24 г; 14%) в виде светло-желтого твердого вещества. MS (ISP): 392,1 ([{37Cl}M+H-C4H8]+), 390,1 ([{35Cl}M+H-C4H8]+).
g) (RS)-1-[4-(1-Амино-2-гидрокси-этил)-фенил]-3-(4-хлор-фенил)-мочевина
К раствору (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (0,24 г) в ацетонитриле (3 мл) добавляли воду (9 мл) и трифторуксусную кислоту (0,33 мл). Смесь нагревали в течение ночи при 80ºС. Затем смесь охлаждали до комнатной температуры и разбавляли смесью этилацетат/THF (1:1). Полученную смесь последовательно промывали 1 н. водн. раствором гидроксида натрия и насыщенным рассолом, фазы затем разделяли и органическую фазу сушили над сульфатом натрия и концентрировали в вакууме, что позволило получить (RS)-1-[4-(1-амино-2-гидрокси-этил)-фенил]-3-(4-хлор-фенил)-мочевину (0,22 г; колич.) в виде беловатого твердого вещества. MS (ISP): 291,1 ([{37Cl}М+Н-ОН]+), 289,1 ([{35Cl}M+H-OH]+).
h) (RS)-1-[4-(2-Амино-4,5-дигидро-оксазол-4-ил)-фенил]-3-(4-хлор-фенил)-мочевина
К перемешиваемой суспензии 1-[4-(1-амино-2-гидрокси-этил)-фенил]-3-(4-хлор-фенил)-мочевины (160 мг) и ацетата натрия (129 мг) в метаноле (8 мл) по каплям добавляли раствор бромциана (72 мг) в метаноле (0,5 мл). Полученный бледно-желтый раствор затем перемешивали при комнатной температуре в течение 16 ч. По каплям добавляли водный раствор аммиака (0,4 мл; 25%-ный) и перемешивание продолжали в течение следующего часа. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (Isolute® Flash-NH2 от Separtis; градиент: гептан/дихлорметан/метанол), получая (RS)-1-[4-(2-амино-4,5-дигидро-оксазол-4-ил)-фенил]-3-(4-хлор-фенил)-мочевину (91 мг; 53%) в виде белого твердого вещества. MS (ISP): 333,2 ([{37Cl}M+H]+), 331.1 ([{35Cl}М+Н]+).
Пример 2
1-[4-((S)-2-Амино-4,5-дигидро-оксазол-4-илметил)-фенил]-3-(4-хлор-фенил)-мочевина
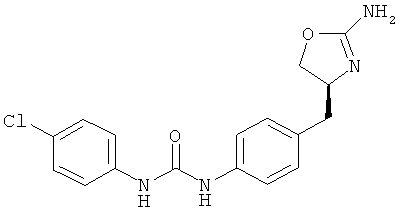
Указанное в заголовке соединение получали аналогично примеру 1(с)-1(h), исходя из 4-иод-L-фенилаланина (CAS 24250-85-9) вместо (RS)-амино-(4-иод-фенил)-уксусной кислоты гидрохлорида. Белое твердое вещество. MS (ISP): 347,1 ([{37Cl}М+Н]+), 345,1 ([{35Cl}М+Н]+).
Пример 3
1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(4-хпор-фенил)-мочевина
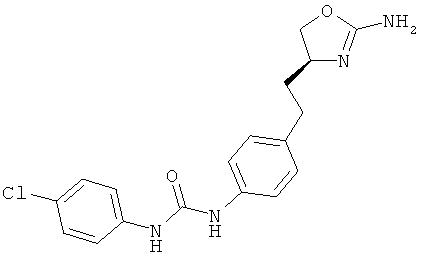
а) (S)-4-[(Е)-2-(4-Иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому раствору диизопропиламина (1,55 мл) в THF (12 мл), охлажденному до -78ºС, по каплям добавляли раствор н-бутиллития в гексане (6,88 мл; 1,6 М). Охлаждающую баню удаляли и реакционную смесь оставляли нагреваться до 10ºС, после чего вновь охлаждали до -78ºС. Затем по каплям добавляли раствор (4-иод-бензил)-фосфоновой кислоты диэтилового эфира (3,45 г; CAS 173443-43-1) в THF (8 мл) и реакционную смесь перемешивали при -78ºС в течение 1 часа. Затем по каплям в течение 15 мин добавляли раствор (R)-4-формил-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (2,14 г; CAS 95715-87-0) в THF (8 мл) и далее смесь оставляли нагреваться до комнатной температуры в течение ночи. Затем смесь разбавляли этилацетатом и подкисляли путем добавления 1 н. водн. соляной кислоты. Затем смесь последовательно промывали водой и насыщенным рассолом. Органическую фазу отделяли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (2,49 г; 68%) в виде белого твердого вещества. MS (EI): 429 (М+), 373 ([М-C4H8), 358 ([М-СН3-C4H8]+), 315 ([M-C4H8-(CH3)2C=O]+), 57 ([C4H9]+).
b) (S)-4-((Е)-2-{4-[3-(4-Хлор-фенил)-уреидо]-фенил}-винил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
Указанное в заголовке соединение получали аналогично примеру 1(f), исходя из (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Коричневое твердое вещество. MS (ISP): 496,2 ([{37Cl}M+Na]+), 494,2 ([{35Cl}M+Na]+).
c) (S)-4-(2-{4-[3-(4-Хлор-фенил)-уреидо]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (S)-4-((Е)-2-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-винил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (57 мг) в метаноле (8 мл) добавляли оксид платины(IV) (14 мг) и затем смесь перемешивали в атмосфере водорода при комнатной температуре в течение 1 часа. Затем смесь фильтровали через целит и фильтрат концентрировали в вакууме, что позволило получить (S)-4-(2-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутиловый эфир (60 мг; колич.) в виде беловатого твердого вещества. MS (ISP): 476,2 ([{37Cl}М+Н]+), 474,3 ([{35CI}М+Н]+), 420,2 ([{37Cl}M+H-C4H8]+), 418,3 ([{35Cl}M+H-C4H8]+}.
d) 1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил1-фенил}-3-(4-хлор-фенил)-мочевина
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (S)-4-(2-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 361,1 ([{37Cl}M+H]+), 359,1 ([{35Cl}М+Н]+).
Пример 4
(RS)-N-[4-(2-Амино-4,5-дигидро-оксазол-4-ил)-фенил]-4-хлор-бензамид
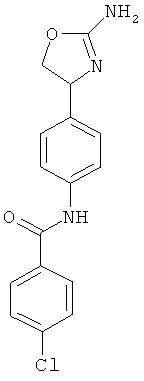
a) (RS)-4-[4-(4-Хлор-бензоиламино)-фенил1-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
Перемешиваемую суспензию (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (400 мг; Пример 1е), 4-хлорбензамида (185 мг), иодида меди(I) (20 мг), N,N'-диметилглицина (20 мг) и фосфата калия (1,05 г) в DMSO (2 мл) в герметично закрытой пробирке нагревали при 110ºС в течение ночи. Затем смесь охлаждали до комнатной температуры и очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-4-[4-(4-хлор-бензоиламино)-фенил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (297 мг; 69%) в виде белого твердого вещества. MS (ISP): 450,2 ([{37Cl}М+NH4]+), 448,2 ([{35Cl}М+NH4]+), 433,2 ([{37Cl}М+Н]+), 431,2 ([{35Cl}М+Н]+), 377,2 ([{37Cl}М+Н-C4H8]+), 375,2 ([{35Cl}М+Н-C4H8]+).
b) (RS)-N-[4-(2-Амино-4,5-дигидро-оксазол-4-ил)-фенил]-4-хлор-бензамид
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (RS)-4-[4-(4-хлор-бензоиламино)-фенил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира. Белое твердое вещество. MS (ISP): 316,1 ([{37Cl}М-Н]-), 314,1 ([{35Cl }М-Н]-).
Пример 5
(RS)-N-[4-(2-Амино-4,5-дигидро-оксазол-4-ил)-фенил]-бензамид
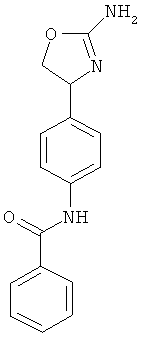
К перемешиваемой суспензии (RS)-N-[4-(2-амино-4,5-дигидро-оксазол-4-ил)-фенил]-4-хлор-бензамида (50 мг) в метаноле (3 мл) добавляли формиат аммония (100 мг) и палладий на угле (13 мг; 10 масс.%-ный) и смесь нагревали при 60ºС в течение 2 часов. Затем смесь охлаждали до комнатной температуры, фильтровали через целит и фильтрат концентрировали в вакууме. Остаток переносили в этилацетат/THF (1:1) и этот раствор последовательно промывали насыщенным водн. раствором бикарбоната натрия и насыщенным рассолом. Затем органическую фазу отделяли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (Isolute® Flash-NH2 от Separtis; градиент: гептан/дихлорметан/метанол), получая (RS)-N-[4-(2-амино-4,5-дигидро-оксазол-4-ил)-фенил]-бензамид (20 мг; 45%) в виде белого твердого вещества. MS (ISP): 282,1 ([М+Н]+).
Пример 6
(RS)-N-[3-(2-Амино-4,5-дигидро-оксазол-4-ил)-фенил]-4-хлор-бензамид
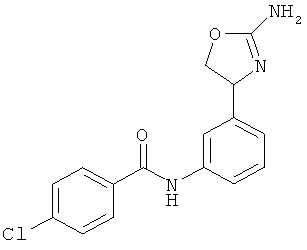
Указанное в заголовке соединение получали аналогично примеру 1(а)-1(е) и затем примеру 4, исходя из 3-иод-бензальдегида вместо 4-иод-бензальдегида. Белое твердое вещество. MS (ISP): 318,1 ([{37CI}М+Н]+), 316,1 ([{35CI}M+H]+).
Пример 7
(RS)-1-[3-(2-Амино-4,5-дигидро-оксазол-4-ил)-фенил]-3-(4-хлор-фенил)-мочевина
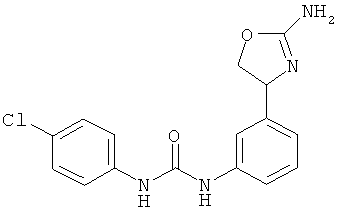
Указанное в заголовке соединение получали аналогично примеру 1, исходя из 3-иод-бензальдегида вместо 4-иод-бензальдегида. Белое твердое вещество. MS (ISP): 333,2 ([{37CI}М+Н]+), 331,2 ([{35CI}М+Н]+).
Пример 8
N-{4-[3-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-пропил]-фенил}-4-хлор-бензамид
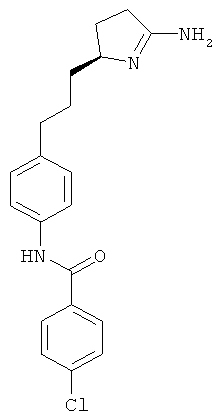
a) (S)-4-[(Е)-3-(4-Иод-фенил)-аллил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
Указанное в заголовке соединение получали аналогично примеру 3(а), исходя из (S)-2,2-диметил-4-(2-оксо-этил)-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира (CAS 147959-19-1) вместо (R)-4-формил-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Светло-желтое твердое вещество. MS (ISP): 344 ([М+Н-C4H8-CO2]+).
b) N-{4-[3-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-пропил]-фенил}-4-хлор-бензамид
Указанное в заголовке соединение получали аналогично примеру 9, исходя из (S)-4-[(Е)-3-(4-иод-фенил)-аллил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Светло-желтое твердое вещество. MS (ISP): 360,1 ([{37CI}M+H]+), 358,2 ([{35CI}М+Н]+).
Пример 9
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-хлор-бензамид
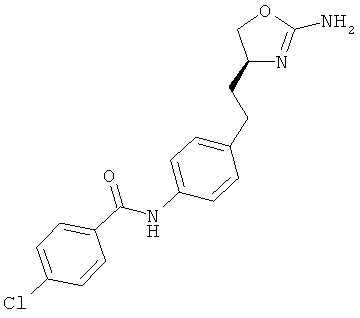
а) (S)-4-{(Е)-2-[4-(4-Хлор-бензоиламино)-фенил]-винил}-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутиловый эфир
Указанное в заголовке соединение получали аналогично примеру 4(а), исходя из (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира (пример 3(а)) вместо (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Желтое твердое вещество. MS (ISP): 457,2 ([{37Cl}M-H]-), 455,2 ([{35Cl}M-H]-).
b) (S)-4-{2-[4-(4-Хлор-бензоиламино)-фенил]-этил}-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутиловый эфир
Указанное в заголовке соединение получали аналогично примеру 3(с), исходя из (S)-4-{(Е)-2-[4-(4-хлор-бензоиламино)-фенил]-винил}-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира вместо (S)-4-((E)-2-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-винил)-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира. Белое твердое вещество. MS (ISP): 478,3 ([{37Cl}M+NH4]+), 476,3 ([{35Cl}M+NH4]+), 405,4 ([{37Cl}M+H-C4H8]+), 403,2 ([{35Cl}M+H-C4H8]+).
c) N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил]-хлор-бензамид
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (S)-4-{2-[4-(4-хлор-бензоиламино)-фенил]-этил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 346,1 ([{37Cl}М+Н]+), 344,2 ([{35Cl}M+H]+).
Пример 10
N-{3-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-хлор-бензамид
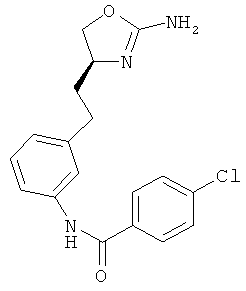
Указанное в заголовке соединение получали аналогично примеру 3(а) и затем примеру 9, исходя из (3-иод-бензил)-фосфоновой кислоты диэтилового эфира (CAS 261966-88-5) вместо (4-иод-бензил)-фосфоновой кислоты диэтилового эфира. Желтое масло. MS (ISP): 346,1 ([{37Cl}M+H]+), 344,2 ([{35Cl}М+Н]+).
Пример 11
1-{4-[(S)-1-((S)-2-Амино-4,5-дигидро-оксазол-4-илметил)-пропил]-фенил}-3-(4-хлор-фенил)-мочевина
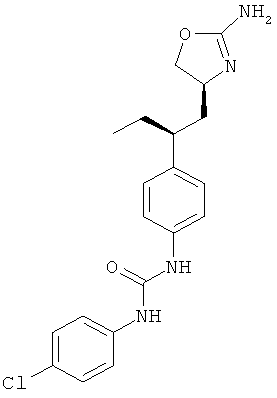
а) (S)-4-[(3)-2-(4-Нитро-фенил)-бутил]-4,5-дигидро-оксазол-2-иламин
К перемешиваемой азотной кислоте (9,5 мл; 65%-ной конц.) при комнатной температуре добавляли (S)-4-((S)-2-фенил-бутил)-4,5-дигидро-оксазол-2-иламин (1,5 г; CAS 1043495-96-0) и затем смесь нагревали при 60ºС в течение 3 часов. Затем смесь охлаждали в ледяной бане, после чего подщелачивали путем осторожного добавления 30%-ного водн. раствора гидроксида натрия. Полученную смесь разбавляли смесью этилацетат/THF (1:1) и фазы разделяли. Органическую фазу промывали насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме, получая (S)-4-[(8)-2-(4-нитро-фенил)-бутил]-4,5-дигидро-оксазол-2-иламин (1,89 г; колич.) в виде желтого твердого вещества. MS (ISP): 264,2 ([М+Н]+).
b) 1-{4-[(S)-1-((S)-2-Амино-4,5-дигидро-оксазол-4-илметил)-пропил]-фенил]-3-(4-хлор-фенил)-мочевина
Указанное в заголовке соединение получали аналогично примеру 14(b)-(с), исходя из (S)-4-[(3)-2-(4-нитро-фенил)-бутил]-4,5-дигидро-оксазол-2-иламина вместо (S)-2,2-диметил-4-[(Е)-2-(4-нитро-фенил)-винил]-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира и используя 4-хлорфенилизоцианат (CAS 104-12-1) вместо 3,4-дихлорфенилизоцианата. Белое твердое вещество. MS (ISP): 389,1 ([{37Cl}М+Н]+), 387,2 ([{35Cl}M+H]+).
Пример 12
1-{4-[(8)-1-((8)-2-Амино-4,5-дигидро-оксазол-4-илметил)-пропил]-фенил}-3-(4-фтор-фенил)-мочевина
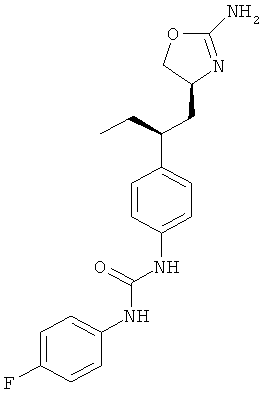
Указанное в заголовке соединение получали аналогично примеру 11, используя 4-фторфенилизоцианат (САS 1195-45-5) вместо 4-хлорфенил-изоцианата. Белое твердое вещество. MS (ISP): 371,1 ([М+Н]+).
Пример 13
1-{4-1(S)-1-((S)-2-Амино-4,5-дигидро-оксазол-4-илметил)-пропил]-фенил}-3-(4-трифторметил-фенил)-мочевина
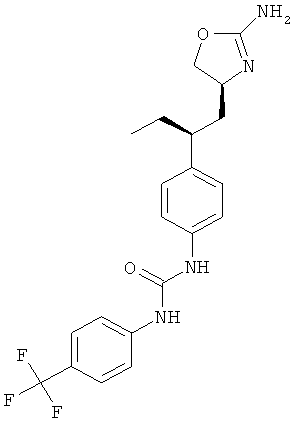
Указанное в заголовке соединение получали аналогично примеру 11, используя 4-(трифторметил)фенилизоцианат (CAS 1548-13-6) вместо 4-хлорфенилизоцианата. Белое твердое вещество. MS (ISP): 421,1 ([М+Н]+).
Пример 14
1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(3,4-дихлор-фенил-мочевина
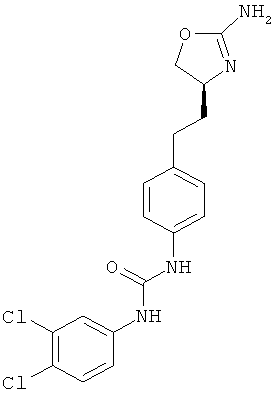
a) (S)-2,2-Диметил-4-[(Е)-2-(4-нитро-фенил)-винил]-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
Указанное в заголовке соединение получали аналогично примеру 3(а), исходя из (4-нитро-бензил)-фосфоновой кислоты диэтилового эфира (CAS 2609-49-6) вместо (4-иод-бензил)-фосфоновой кислоты диэтилового эфира. Желтое масло. MS (EI): 333 ([М-СН3]+), 292 ([М- С4Н8]+), 277 ([М-СН3-C4H8]+), 57 ([C4H9]+).
b) (S)-4-[2-(4-Амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (S)-2,2-диметил-4-[(Е)-2-(4-нитро-фенил)-винил]-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (2,08 г) в метаноле (140 мл) добавляли формиат аммония (5,66 г) и палладий на угле (0,51 г; 10 масс.%-ный) и смесь нагревали при 60ºС в течение 2 часов. Затем смесь охлаждали до комнатной температуры, фильтровали через целит и фильтрат концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (1,58 г; 82%) в виде желтого масла. MS (ISP): 321,4([М+Н]+).
c) (S)-4-(2-{4-[3-(3,4-Дихлор-фенил)-уреидо]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (180 мг) в дихлорметане (3 мл) добавляли последовательно N,N-диизопропилэтиламин (0,19 мл) и 3,4-дихлорфенилизоцианат (137 мг; CAS 102-36-3) и перемешивание продолжали при комнатной температуре в течение 18 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtoAc), получая (S)-4-(2-{4-[3-(3,4-дихлор-фенил)-уреидо]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (267 мг; 93%) в виде бесцветного аморфного твердого вещества. MS (ISP): 529,4 ([{37Cl}M+NH4]+), 527,4 ([{37Cl35Cl}М+NH4]+), 525,4 ([{35Cl}M+NH4]+), 512,2 ([{37Cl}M+H]+), 510,2 ([{37Cl35Cl}М+Н]+), 508,2 ([{35Cl}М+Н]+), 456,2 ([{37Cl}М+Н-C4H8]+), 454,2 ([{37Cl35Cl}М+Н-С4Н8]+), 452,2 ([{35Cl}M+H-C4H8]+).
d) 1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(3,4-дихлор-фенил)-мочевина
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (S)-4-(2-{4-[3-(3,4-дихлор-фенил)-уреидо]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира. Белое твердое вещество. MS (ISP): 397,1 ([{37Cl}M+H]+), 395,0 ([{37Cl35Cl}М+Н]+), 393,2 ([{35Cl}M+H]+).
Пример 15
1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(4-трифторметил-фенил)-мочевина
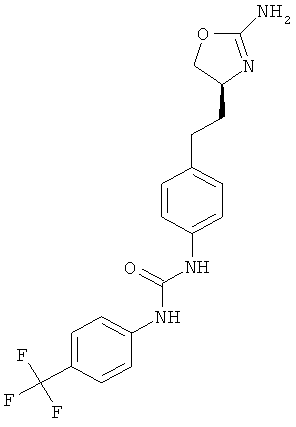
Указанное в заголовке соединение получали аналогично примеру 14(c)-(d), исходя из (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира и используя 4-(трифторметил)фенилизоцианат (CAS 1548-13-6) вместо 3,4-дихлорфенилизоцианата. Белое твердое вещество. MS (ISP): 393,2 ([М+Н]+).
Пример 16
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-фтор-бензамид
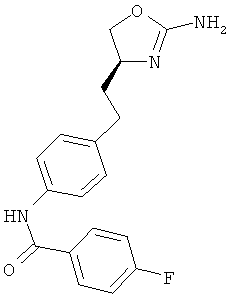
Указанное в заголовке соединение получали аналогично примеру 9, исходя из (S)-4-[(E)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 4-фторбензамид вместо 4-хлор-бензамида. Белое твердое вещество. MS (ISP): 328,3 ([М+Н]+).
Пример 17
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-трифторметил-бензамид
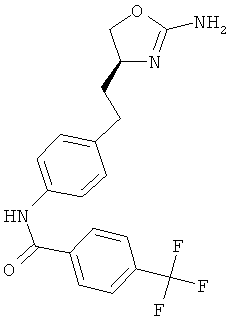
Указанное в заголовке соединение получали аналогично примеру 9, исходя из (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 4-(трифторметил)бензамид вместо 4-хлорбензамида. Белое твердое веицество. MS (ISP): 378,3 ([М+Н]+).
Пример 18
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-хлор-бензамид
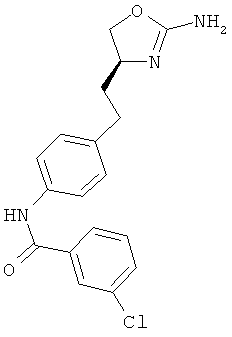
Указанное в заголовке соединение получали аналогично примеру 9, исходя из (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 3-хлорбензамид вместо 4-хлорбензамида. Белое твердое вещество. MS (ISP): 346,1 ([{37Cl}М+Н]+), 344,2 ([{35Cl}М+Н]+).
Пример 19
1-(4-{1-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-циклопропил}-фенил)-пирролидин-2-он
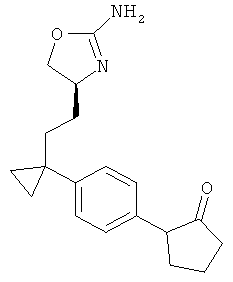
а) (S)-4-{(Z)-2-[1-(4-Иод-фенил)-циклопропил]-винил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому охлажденному (0ºС) раствору 1-(4-иод-фенил)-циклопропанкарбальдегида (1,6 г) в тетрагидрофуране (40 мл) добавляли в атмосфере аргона (R)-4-(бензотиазол-2-сульфонилметил)-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутиловый эфир (2,9 г) [CAS 1043499-96-2], затем 1 М раствор LiHMDS в THF (11,8 мл). Через 1 ч выдерживания при 0ºС охлаждающую баню удаляли и перемешивание продолжали в течение ночи. Смесь гасили путем добавления насыщ. водного NH4Cl (50 мл) и Н2О (50 мл) и экстрагировали EtOAc. Водную фазу повторно экстрагировали EtOAc. Объединенные органические фазы промывали рассолом, сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали колоночной хроматографией (SiO2; градиент: гептан → гептан/EtOAc 2:1), получая (S)-4-{(Z)-2-[1-(4-иод-фенил)-циклопропил]-винил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (2.0 г) в виде светло-желтого твердого вещества. MS (ISP): 47,3 ([М+Н]+).
b) 1-(4-{1-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-циклопропил}-фенил)-пирролидин-2-он
Указанное в заголовке соединение получали аналогично примеру 9, исходя из (S)-4-{(2)-2-[1-(4-иод-фенил)-циклопропил]-винил}-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира вместо (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя пирролидин-2-он вместо 4-хлорбензамида. Белая пенка. MS (ISP): 314,3 ([М+Н]+).
Пример 20
(RS)-Циклогексанкарбоновая кислота [4-(2-амино-4,5-дигидро-оксазол-4-ил)-фенил]-амид
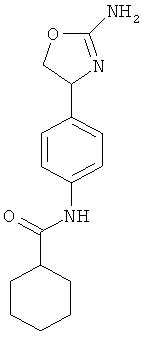
Указанное в заголовке соединение получали аналогично примеру 4, исходя из (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя циклогексанкарбоксамид вместо 4-хлорбензамида. Белое твердое вещество. MS (ISP): 288,2 ([М+Н]+).
Пример 21
(RS)-Циклопропанкарбоновой кислоты [4-(2-амино-4,5-дигидро-оксазол-4-ил)-фенил]-амид
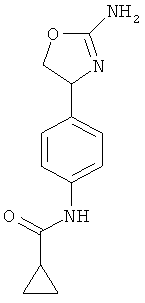
Указанное в заголовке соединение получали аналогично примеру 4, исходя из (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя циклопропанкарбоксамид вместо 4-хлорбензамида. Белое твердое вещество. MS (ISP): 246,3 ([М+Н]+).
Пример 22
(RS)-N-[4-(2-Амино-4,5-дигидро-оксазол-4-ил)-фенил]-4-фтор-бензамид
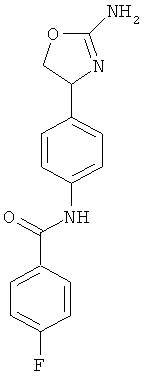
Указанное в заголовке соединение получали аналогично примеру 4, исходя из (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 4-фторбензамид вместо 4-хлорбензамида. Белое твердое вещество. MS (ISP): 300,4 ([М+Н]+).
Пример 23
(RS)-N-[4-(2-Амино-4,5-дигидро-оксазол-4-ил)-фенил]-4-трифторметил-бензамид
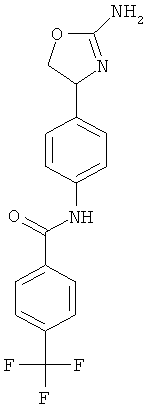
Указанное в заголовке соединение получали аналогично примеру 4, исходя из (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 4-(трифторметил)бензамид вместо 4-хлорбензамида. Белое твердое вещество. MS (ISP): 350,2 ([М+Н]+).
Пример 24
(RS)-N-[4-(2-Амино-4,5-дигидро-оксазол-4-ил)-фенил]-2-(4-хлор-фенил)-ацетамид
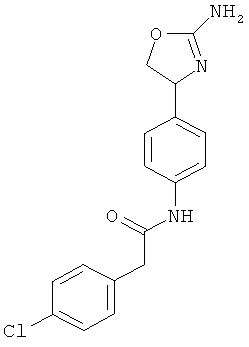
Указанное в заголовке соединение получали аналогично примеру 4, исходя из (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 2-(4-хлор-фенил)-ацетамид вместо 4-хлорбензамида. Белое твердое вещество. MS (ISP): 332,2 ([{37Cl}М+Н]+), 330,2 ([{35Cl}М+Н]+).
Пример 25
N-{4-[3-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-1-метил-пропил]-фенил}-ацетамид
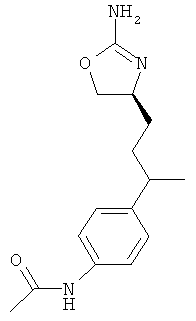
a) (S)-4-[3-(4-Амино-фенил)-бутил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
(S)-4-[3-(4-Амино-фенил)-бутил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир получали аналогично примеру 14 (а, b), исходя из [1-(4-нитро-фенил)-этил]-фосфоновой кислоты диэтилового эфира вместо (4-нитро-бензил)-фосфоновой кислоты диэтилового эфира и (S)-2,2-диметил-4-(2-оксо-этил)-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (CAS 147959-19-1) вместо (R)-4-формил-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Бесцветное масло. MS (ISP): 249,4 (М-ВОС+Н]+).
b) N-{4-[3-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-1-метил-пропил]-фенил}-ацетамид
Указанное в заголовке соединение получали аналогично примеру 31, исходя из (S)-4-[3-(4-амино-фенил)-бутил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира и используя ацетилхлорид вместо 6-хлорникотинилхлорида. Бесцветное масло. MS (ISP): 276.4 (М+Н]+).
Пример 26
N-{4-[3-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-1-метил-пропил]-фенил}-бензамид
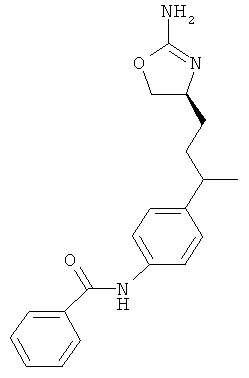
Указанное в заголовке соединение получали аналогично примеру 25, используя бензоилхлорид вместо ацетилхлорида на стадии b). Бесцветное масло. MS (ISP): 338,4 (М+Н]+).
Пример 27
N-{4-[3-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-пропил]-фенил}-N-метил-ацетамид
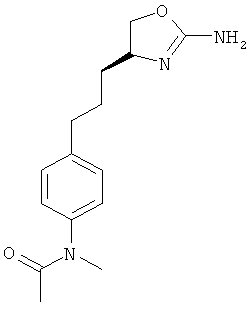
Указанное в заголовке соединение получали аналогично примеру 9, используя N-метил-ацетамид вместо 4-хлорбензамида. Белое смолообразное твердое вещество. MS (ISP): 276,4 ([М+Н]+)
Пример 28
N-{4-[3-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-пропил]-фенил}-ацетамид
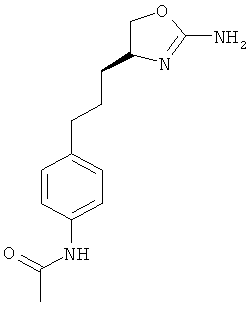
Указанное в заголовке соединение получали аналогично примеру 9, используя ацетамид вместо 4-хлорбензамида. Светло-желтое масло. MS (ISP): 262,2 ([М+Н]+).
Пример 29
N-{4-[3-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-пропил]-фенил}-N-(4-фтор-фенил)-ацетамид
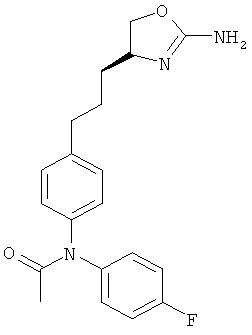
Указанное в заголовке соединение получали аналогично примеру 9, используя N-метил-ацетамид вместо 4-хлорбензамида. Желтая смола. MS (ISP): 356,4 ([М+Н]+).
Пример 30
4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-N-изопропил-бензамид
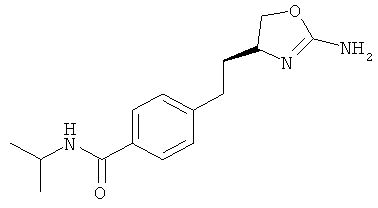
Указанное в заголовке соединение получали аналогично примеру 48, используя изопропиламина вместо 4-хлоранилина на стадии b). Светло-коричневая смола. MS (ISP): 276,2 ([M+H]+).
Пример 31
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-хлор-никотинамид
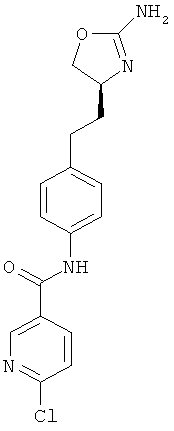
а) (S)-4-(2-{4-[(6-Хлор-пиридин-3-карбонил)-амино]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира (150 мг; пример 14(b)) в THF (4 мл) добавляли последовательно триэтиламин (0,13 мл) и 6-хлор-никотинилхлорид (107 мг; CAS 58757-38-3) и смесь нагревали при 50ºС в течение 4 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (S)-4-(2-{4-[(6-хлор-пиридин-3-карбонил)-амино]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (177 мг; 82%) в виде белого твердого вещества. MS (ISP): 484,3 ([{37Cl}M+Na]+), 482,3 ([{35Cl}M+Na]+), 462,4 ([{37Cl}M+H]+), 460,5 ([{35Cl}М+Н]+), 406,4 ([{37Cl}М+Н-C4H8]+), 404,3 ([{35Cl}M+H-C4H8]+).
b) N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-хлор-никотинамид
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (S)-4-(2-{4-[(6-хлор-пиридин-3-карбонил)-амино]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 347,1 ([{37Cl}М+Н]+), 345,2 ([{35Cl}М+Н]+).
Пример 32
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-хлор-бензолсульфонамид
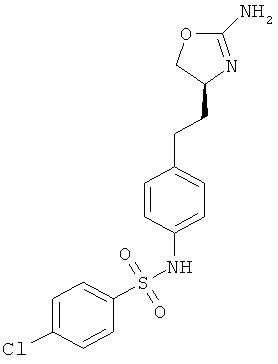
Указанное в заголовке соединение получали аналогично примеру 31, исходя из (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 4-хлорбензолсульфонилхлорид (CAS 98-60-2) вместо 6-хлорникотинилхлорида. Белое твердое вещество. MS (ISP): 382,2 ([{37Cl}М+Н]+), 380,3 ([{35Cl}М+Н]+).
Пример 33
5-Хлор-пиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
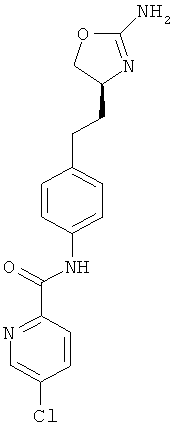
a) (S)-4-(2-{4-[(5-Хлор-пиридин-2-карбонил)-амино]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (150 мг; пример 14 (b)) в THF (4 мл) добавляли последовательно N-метилморфолин (0,21 мл), TBTU (301 мг) и 5-хлор-2-пиридинкарбоновую кислоту (111 мг; CAS 86873-60-1) и смесь нагревали при 50ºС в течение 18 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (Si02; градиент: гептан/EtOAc), получая (S)-4-(2-{4-[(5-хлор-пиридин-2-карбонил)-амино]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутиловый эфир (197 мг; 91%) в виде белого твердого вещества. MS (ISP): 484,3 ([{37Cl}M+Na]+), 482,3 ([{35Cl}M+Na]+), 462,4 ([{37Cl}М+Н]+), 460,5 ([{35Cl}М+Н]+), 406,4 ([{37Cl}М+Н-C4H8]+), 404,3 ([{35Cl}М+Н-С4Н8]+).
b) 5-Хлор-пиридин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (S)-4-(2-{4-[(5-хлор-пиридин-2-карбонил)-амино]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 347,1 ([{37Cl}М+Н]+), 345,2 ([{35Cl}M+H]+).
Пример 34
5-Хлор-пиримидин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
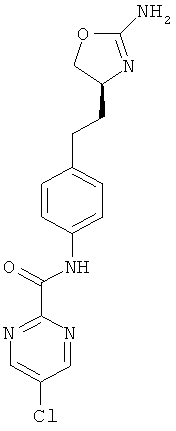
Указанное в заголовке соединение получали аналогично примеру 33, исходя из (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира и используя 5-хлор-2-пиримидинкарбоновую кислоту (CAS 38275-61-5) вместо 5-хлор-2-пиридинкарбоновой кислоты. Белое твердое вещество. MS (ISP): 348,2 ([{37Cl}М+Н]+), 346,1 ([{35Cl}М+Н]+).
Пример 35
1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(5-хлор-пиридин-2-ил)-мочевина
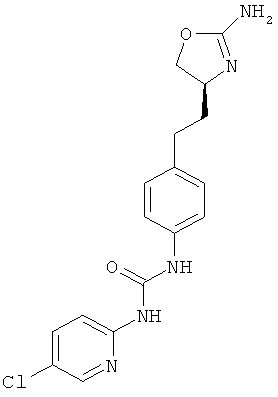
а) (S)-4-[2-(4-Изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (600 мг; пример 14 (b)) в дихлорметане (10 мл) добавляли последовательно триэтиламин (0,52 мл) и трифосген (206 мг) и смесь нагревали при 50ºС в течение 18 ч. Затем смесь концентрировали в вакууме и к остатку добавляли диэтиловый эфир. После перемешивания в течение 10 мин при комнатной температуре полученные кристаллы удаляли фильтрацией. Фильтрат концентрировали в вакууме, получая (S)-4-[2-(4-изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (610 мг; 94%) в виде желтого масла, которое сразу же использовали на следующей стадии без дополнительной очистки.
b) (S)-4-(2-{4-[3-(5-Хлор-пиридин-2-ил)-уреидо]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
Указанное в заголовке соединение получали аналогично примеру 14(с), используя (S)-4-[2-(4-изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир вместо 3,4-дихлорфенилизоцианата и 2-амино-5-хлорпиридин (CAS 1072-98-6) вместо (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Желтое твердое вещество. MS (ISP): 499,3 ([{37Cl}M+Na]+), 497,3 ([{35Cl}М+Na]+), 477,3 ([{37Cl}M+H]+), 475,3 ([{35Cl}M+H]+), 421,1 ([{37Cl}M+H-C4H8]+), 419,3 ([{35Cl}M+H-С4Н8]+).
c) 1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(5-хлор-пиридин-2-ил)-мочевина
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (S)-4-(2-{4-[3-(5-хлор-пиридин-2-ил)-уреидо]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 362,1 ([{37Cl}М+Н]+), 360,2 ([{35Cl}М+Н]+).
Пример 36
4,4-Дифтор-пиперидин-1-карбоновой кислоты
4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
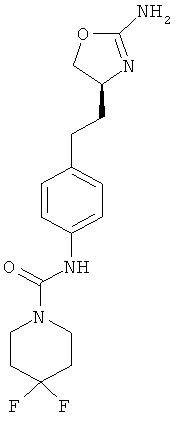
Указанное в заголовке соединение получали аналогично примеру 35(b)-(с), исходя из (S)-4-[2-(4-изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 4,4-дифтор-пиперидина гидрохлорид (CAS 144230-52-4) вместо 2-амино-5-хлорпиридина. Белое твердое вещество. MS (ISP): 353,4 ([М+Н]+).
Пример 37
Морфолин-4-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
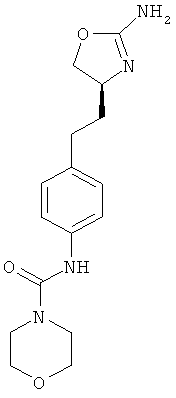
Указанное в заголовке соединение получали аналогично примеру 35(b)-(с), исходя из (S)-4-[2-(4-изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира и используя морфолин вместо 2-амино-5-хлорпиридина. Белое твердое вещество. MS (ISP): 319,2 ([М+Н]+).
Пример 38
1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(6-хлор-пиридин-3-ил)-мочевина
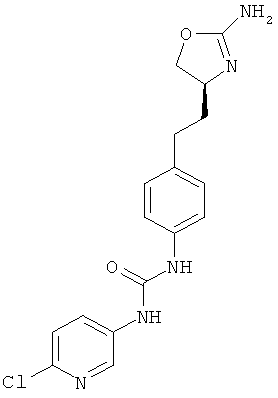
Указанное в заголовке соединение получали аналогично примеру 35(b)-(с), исходя из (S)-4-[2-(4-изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 5-амино-2-хлорпиридин (CAS 5350-93-6) вместо 2-амино-5-хлорпиридина. Белое твердое вещество. MS (ISP): 362,1 ([{37Cl}М+Н]+), 360,2 ([{35Cl}M+H]+).
Пример 39
4-Трифторметил-пиперидин-1-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
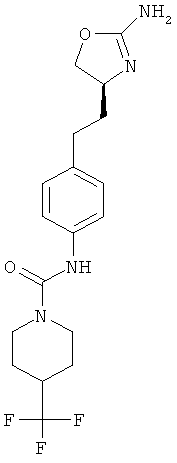
Указанное в заголовке соединение получали аналогично примеру 35(b)-(с), исходя из (S)-4-[2-(4-изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 4-(трифторметил)-пиперидина гидрохлорид (CAS 155849-49-3) вместо 2-амино-5-хлорпиридина. Белое твердое вещество. MS (ISP): 385,2 ([М+Н]+).
Пример 40
4,4-Дифтор-циклогексанкарбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
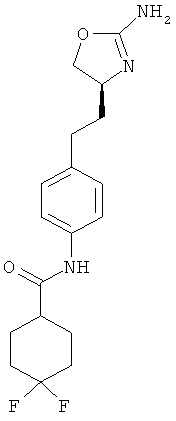
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4,4-дифторциклогексанкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 352,3 ([М+Н]+).
Пример 41
1-Метил-циклопропанкарбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
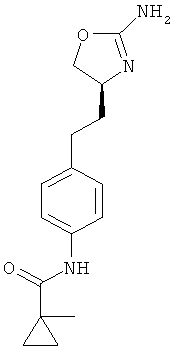
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1-метилциклопропан-1-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 288,1 ([М+Н]+).
Пример 42
Тетрагидро-пиран-4-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
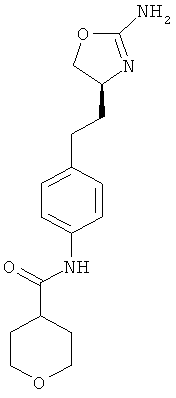
Указанное в заголовке соединение получали аналогично примеру 83, исходя из тетрагидропиран-4-ил карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 318,1 ([М+Н]+).
Пример 43
Циклопентанкарбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
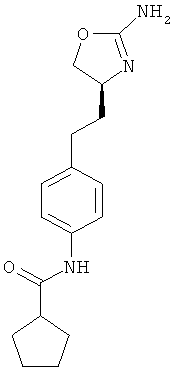
Указанное в заголовке соединение получали аналогично примеру 83, исходя из циклопентанкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 302,2 ([М+Н]+).
Пример 44
3,3-Дифтор-циклобутанкарбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
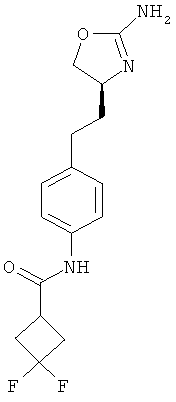
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 3,3-дифторциклобутанкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 324,3 ([М+Н]+).
Пример 45
Циклобутанкарбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
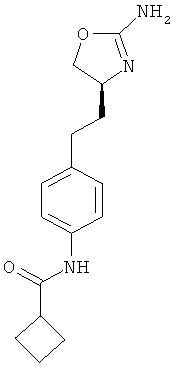
Указанное в заголовке соединение получали аналогично примеру 83, исходя из Циклобутанкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 288,1 ([М+Н]+).
Пример 46
Циклопропанкарбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
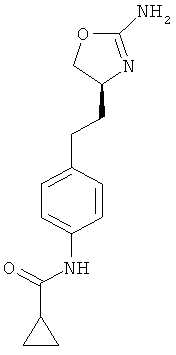
Указанное в заголовке соединение получали аналогично примеру 83, исходя из цикпопропанкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 274,2 ([М+Н]+).
Пример 47
N-{4-12-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-хлор-N-метил-бензамид
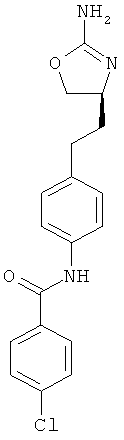
а) (S)-4-(2-{4-[(4-Хлор-бензоил)-метил-амино]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
(S)-4-{2-[4-(4-Хлор-бензоиламино)-фенил]-этил}-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутиловый эфир (109 мг) азеотропно отгоняли с толуолом, после чего растворяли в диметилформамиде (2 мл) в атмосфере аргона и охлаждали до 0ºС. Добавляли порциями NaH (55%-ный в масле; 12,2 мг) и полученную смесь перемешивали в течение 30 минут, после чего добавляли метилиодид (29,7 мкл). Затем реакционную смесь перемешивали в течение 1 часа при 0ºС и далее гасили путем добавления по каплям NaHCO3, смесь трижды экстрагировали этилацетатом, объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме, что позволило получить указанное в заголовке соединение (S)-4-(2-{4-[(4-хлор-бензоил)-метил-амино]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (110 мг) в виде желтого твердого вещества. MS (ISP): 317,3 ([M-tBu+H]+).
b) N-[4-((S)-3-Амино-4-гидрокси-бутил)-фенил]-4-хлор-N-метил-бензамид
(S)-4-(2-{4-[(4-Хлор-бензоил)-метил-амино]-фенил}-этил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (110 мг) растворяли в ацетонитриле (1 мл) и воде (2 мл) при комнатной температуре, после чего добавляли трифторуксусную кислоту (140 мкл). Реакционную смесь нагревали до 80ºС и затем перемешивали в течение 3 часов. После охлаждения до комнатной температуры добавляли этилацетат (4 мл) и раствор подщелачивали до рН 14 путем добавления 2 М водного гидроксида натрия. Смесь перемешивали в течение 5 минут и затем экстрагировали четыре раза этилацетатом, сушили над Na2SO4, фильтровали и концентрировали в вакууме, что позволило получить N-[4-((S)-3-амино-4-гидрокси-бутил)-фенил]-4-хлор-N-метил-бензамид (95 мг) в виде светло-желтого вязкого масла. MS (ISP): 333,4 ([М+Н]+).
c) N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-хлор-N-метил-бензамид
N-[4-((S)-3-амино-4-гидрокси-бутил)-фенил]-4-хлор-N-метил-бензамид (95 мг) растворяли в метаноле (3 мл) при комнатной температуре, после чего добавляли ацетат натрия (69,9 мг) и по каплям раствор бромциана (39,1 мг) в метаноле (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 36 часов, затем добавляли 25%-ный водный аммиак (214,5 мкл) и перемешивание продолжали в течение следующего часа. Растворитель выпаривали в вакууме и остаток очищали препаративной HPLC, получая N-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-хлор-N-метил-бензамид (10 мг) в виде светло-желтой пенки. Описание: MS (ISP): 316,2 ([М+Н]+).
Пример 48
4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-N-(4-хлор-фенил)-бензамид
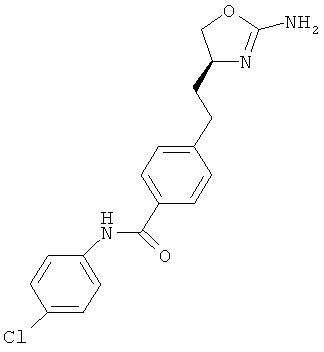
a) (S)-4-[2-(4-Карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому охлажденному (0ºС) раствору метил-4-формилбензоата (2,0 г) в тетрагидрофуране (60 мл) добавляли в атмосфере аргона (R)-4-(бензотиазол-2-сульфонилметил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (6,0 г) [CAS 1043499-96-2], затем 1 М раствор LiHMDS в THF (29,2 мл). Через 1 ч выдерживания при 0ºС охлаждающую баню удаляли и перемешивание продолжали в течение ночи. Смесь гасили путем добавления насыщ. водного NH4Cl (100 мл) и H2O (100 мл) и экстрагировали EtOAc. Водную фазу повторно экстрагировали EtOAc. Объединенные органические фазы промывали рассолом, сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали колоночной хроматографией (SiO2; градиент: гептан → гептан/EtOAc 2:1), получая 2,56 г желтого масла. Его растворяли в метаноле (10 мл), добавляли палладий на угле (10%-ный, 0,2 г) и смесь перемешивали интенсивно в течение ночи при комнатной температуре в атмосфере водорода, используя баллон. Катализатор отфильтровывали и промывали метанолом (10 мл). Добавляли раствор гидроксида лития (0,9 г) в воде (15 мл) и смесь перемешивали в течение 2 часов при комнатной температуре. Затем смесь нейтрализовали путем осторожного добавления 0,1 М водн. соляной кислоты и экстрагировали этилацетатом. Органические экстракты сушили над сульфатом натрия и концентрировали в вакууме, получая (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир в виде белого твердого вещества. MS (ISP): 348,3 ([М-Н]+).
b) 4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-N-(4-хлор-фенил)-бензамид
Указанное в заголовке соединение получали аналогично примеру 84, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)- 4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира на стадии с). Белое твердое вещество. MS (ISP): 344,1 ([{37Cl}М+Н]+), 346,2 ([{35Cl}М+Н]+).
Пример 49
Циклогексанкарбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
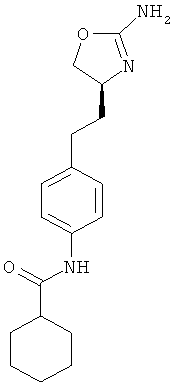
Указанное в заголовке соединение получали аналогично примеру 83, исходя из циклогексанкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтая пенка. MS (ISP): 316,2 ([М+Н]+).
Пример 50
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-ацетамид
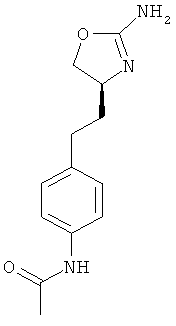
Указанное в заголовке соединение получали аналогично примеру 83, исходя из уксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 248,2 ([М+Н]+).
Пример 51
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2,2-диметил-пропионамид
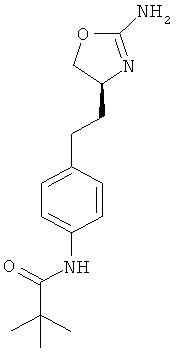
Указанное в заголовке соединение получали аналогично примеру 83, исходя из пивалиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 290,2 ([М+Н]+).
Пример 52
1-Трифторметил-циклопропанкарбоновой кислоты
{4-12-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
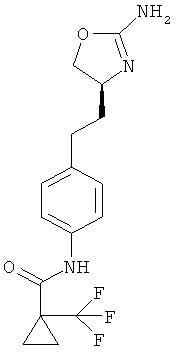
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1-(трифторметил)-циклопропан-1-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 342,2 ([M+Н]+).
Пример 53
1-(4-Хлор-фенил)-циклопропанкарбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
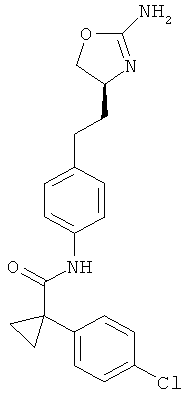
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1-(4-хлорфенил)-1-циклопропанкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 384,2 ([М+Н]+).
Пример 54
5-Трифторметил-пиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
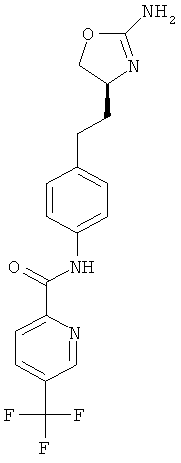
Указанное в заголовке соединение получали аналогично примеру 33, исходя из (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира и используя 5-трифторметил-пиридин-2-карбоновую кислоту (CAS 80194-69-0) вместо 5-хлор-2-пиридинкарбоновой кислоты. Белое твердое вещество. MS (ISP): 379,2 ([М+Н]+).
Пример 55
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-трифторметил-никотинамид
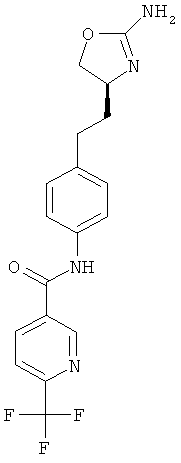
Указанное в заголовке соединение получали аналогично примеру 33, исходя из (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира и используя 6-трифторметил-никотиновую кислоту (CAS 231291-22-8) вместо 5-хлор-2-пиридинкарбоновой кислоты. Белое твердое вещество. MS (ISP): 379,3 ([М+Н]+).
Пример 56
1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(4-фтор-фенил)-имидазолидин-2-он
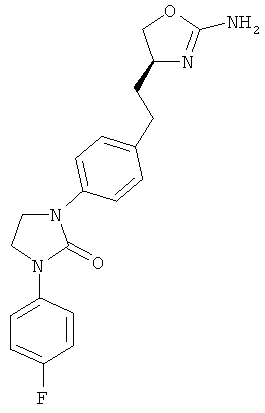
a) (S)-4-((Е)-2-{4-[3-(4-Фтор-фенил)-2-оксо-имидазолидин-1-ил]-фенил}-винил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
Перемешиваемую суспензию (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (250 мг; пример 3(а)), 1-(4-фторфенил)имидазолин-2-она (320 мг; CAS 53159-75-4), карбоната цезия (418 мг), транс-1,2-диаминоциклогексана (0,14 мл), дибензилиденацетона (54 мг) и комплекса трифлата меди(I) с бензолом (58 мг) в диоксане (3 мл) в атмосфере аргона в герметично закрытой пробирке нагревали при 180ºС в течение 40 мин в условиях облучения микроволнами. Затем смесь охлаждали до комнатной температуры и очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (S)-4-((Е)-2-{4-[3-(4-фтор-фенил)-2-оксо-имидазолидин-1-ил]-фенил}-винил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (187 мг; 67%) в виде беловатого твердого вещества. MS (ISP): 504,2 ([M+Na]+), 426,2 ([М+Н-C4H8]+).
b) 1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(4-фтор-фенил)-имидазолидин-2-он
Указанное в заголовке соединение получали аналогично примеру 9(c)-(d), исходя из (S)-4-((Е)-2-{4-[3-(4-фтор-фенил)-2-оксо-имидазолидин-1-ил]-фенил}-винил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (S)-4-{(Е)-2-[4-(4-хлор-бензоиламино)-фенил]-винил}-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира. Белое твердое вещество. MS (ISP): 369,1 ([М+Н]+).
Пример 57
1-Пиридин-4-ил-циклопропанкарбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
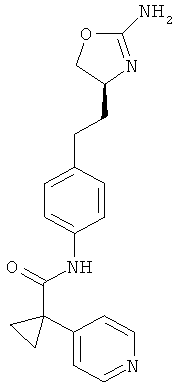
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1-(пиридин-4-ил)-циклопропанкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 349,2 ([М+Н]+).
Пример 58
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-хлор-фенил)-пропионамид
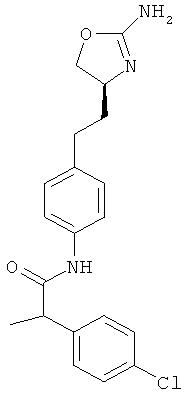
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-хлор-α-метил-бензолуксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 372,2 ([М+Н]+).
Пример 59
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-циано-бензамид
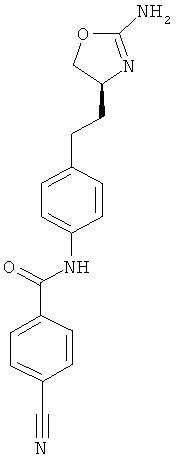
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-цианобензойной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 335,3 ([М+Н]+).
Пример 60
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-этокси-бензамид
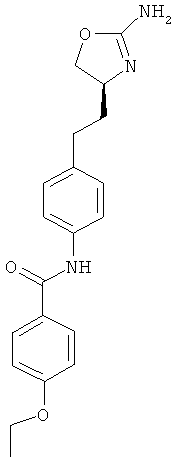
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-этоксибензойной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 354,3 ([М+Н]+).
Пример 61
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-пропил-бензамид
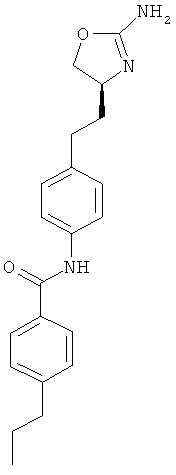
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-н-пропилбензойной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 352,3 ([М+Н]+).
Пример 62
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-этинил-бензамид
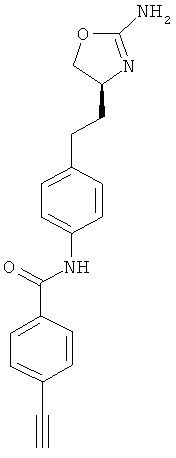
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-этинилбензойной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 334,3 ([М+Н]+).
Пример 63
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-метоксиметил-бензамид

Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-метоксиметил-бензойной кислоты (CAS 67003-50-3) и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 354,4 ([М+Н]+).
Пример 64
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3,5-дихлор-бензолсульфонамид
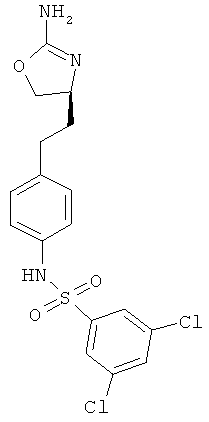
Указанное в заголовке соединение получали аналогично примеру 77, исходя из 3,5-дихлорбензол-сульфонилхлорида и (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира. Бесцветное восковидное твердое вещество. MS (ISP): 414,2 ([М+Н]+).
Пример 65
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-метокси-бензолсульфонамид
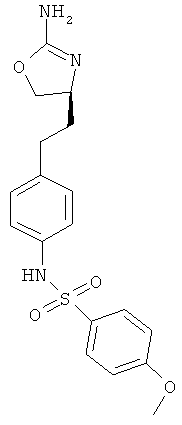
Указанное в заголовке соединение получали аналогично примеру 77, исходя из 4-метокси-бензол-сульфонилхлорида и (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Бесцветное восковидное твердое вещество. MS (ISP): 376,3 ([М+Н]+).
Пример 66
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-этокси-фенил)-ацетамид
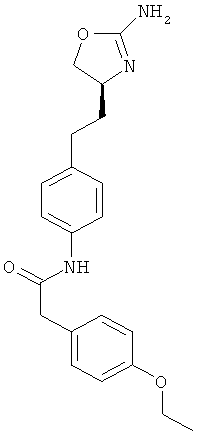
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-этоксифенилуксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 368,2 ([М+Н]+).
Пример 67
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-циано-фенил)-ацетамид
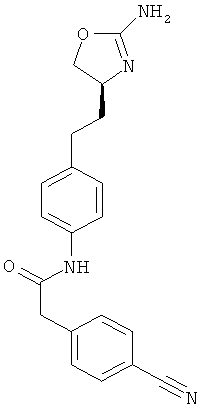
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-цианофенилуксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 349,3 ([М+Н]+).
Пример 68
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-метокси-фенил)-ацетамид
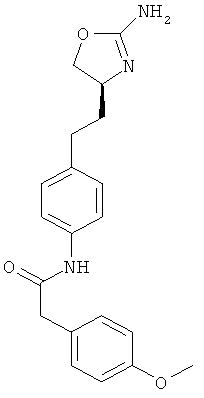
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-метоксифенилуксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 354,3 ([М+Н]+).
Пример 69
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-фтор-фенил)-ацетамид
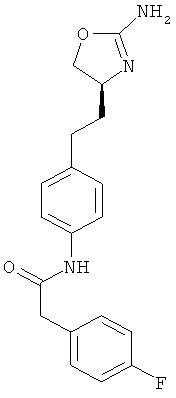
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-фторфенилуксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 342,2 ([М+Н]+).
Пример 70
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-хлор-фенил)-ацетамид
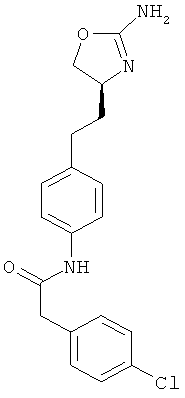
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-хлор-бензолуксусной кислоты (CAS 1878-66-6) и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 358,3 ([М+Н]+).
Пример 71
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-метокси-бензамид
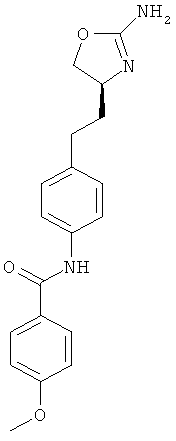
Указанное в заголовке соединение получали аналогично примеру 83, исходя из п-анисовой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 340,1 ([М+Н]+).
Пример 72
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-хлор-фенил)-изобутирамид
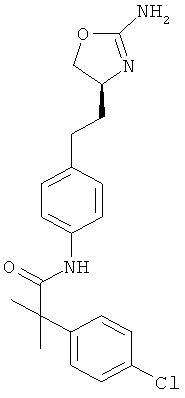
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-хлор-α,α-диметил-бензолуксусной кислоты (CAS 57225-90-8) и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белая пенка. MS (ISP): 386,3 ([М+Н]+).
Пример 73
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-бром-фенил)-2-метокси-ацетамид
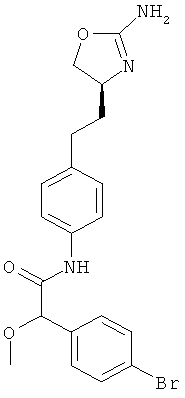
Указанное в заголовке соединение получали аналогично примеру 83, исходя из (4-бром-фенил)-метокси-уксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 434,3 ([М+Н]+).
Пример 74
(R)-N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-метокси-2-фенил-ацетамид
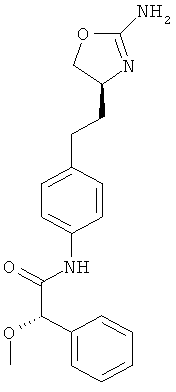
Указанное в заголовке соединение получали аналогично примеру 83, исходя из (S)-(+)-α-метоксифенилуксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветное масло. MS (ISP): 354,3 ([М+Н]+).
Пример 75
(R)-N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-метокси-2-фенил-ацетамид
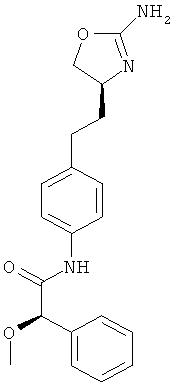
Указанное в заголовке соединение получали аналогично примеру 83, исходя из (R)-(-)-α-метоксифенилуксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое масло. MS (ISP): 354,3 ([М+Н]+).
Пример 76
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3,4-дихлор-бензолсульфонамид
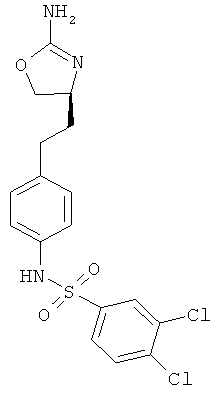
Указанное в заголовке соединение получали аналогично примеру 77, исходя из 3,4-дихлорбензол-сульфонилхлорида и (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 414,2 ([М+Н]+).
Пример 77
Изохинолин-5-сульфоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
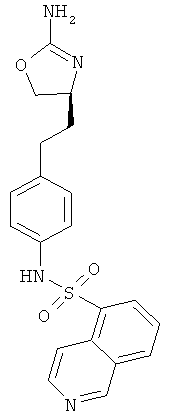
a) (S)-4-{2-[4-(Изохинолин-5-сульфониламино)-фенил]-этил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
(S)-4-[2-(4-Амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутиловый эфир (150 мг) растворяли в тетрагидрофуране при комнатной температуре, после чего обрабатывали триэтиламином (129,8 мкл) и изохинолин-5-сульфонилхлоридом (141,4 мг), затем реакционную смесь нагревали до 50ºС и перемешивали в течение 6 часов. После выпаривания растворителя в вакууме остаток очищали колоночной флэш-хроматографией (SiO2; гексан/EtOAc 3:1), что позволило получить указанное в заголовке соединение (S)-4-{2-[4-(изохинолин-5-сульфониламино)-фенил]-этил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (155 мг) в виде белого твердого вещества. MS (ISP): 512,3 ([М+Н]+).
b) Изохинолин-5-сульфоновой кислоты [4-((S)-3-амино-4-гидрокси-бутил)-фенил]-амид
(S)-4-{2-[4-(Изохинолин-5-сульфониламино)-фенил]-этил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (155 мг) растворяли в ацетонитриле (1,5 мл) и воде (3 мл), после чего добавляли трифторуксусную кислоту (68,6 мкл) при комнатной температуре. Затем реакционную смесь нагревали до 50ºС и перемешивали в течение 5 часов, а затем охлаждали при комнатной температуре и перемешивали в течение 12 часов. Добавляли этилацетат (4 мл) и затем раствор подщелачивали путем добавления 1 н. водного раствора гидроксида натрия до рН 14, после чего перемешивали в течение 15 минут. Затем эти два слоя разделяли и водный слой дважды экстрагировали этилацетатом, объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в вакууме, получая изохинолин-5-сульфоновой кислоты [4-((S)-3-амино-4-гидрокси-бутил)-фенил]-амид (109 мг) в виде желтого твердого вещества. MS (ISP): 372,2 ([М+Н]+).
с) Изохинолин-5-сульфоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
Изохинолин-5-сульфоновой кислоты [4-((S)-3-амино-4-гидрокси-бутил)-фенил]-амид (109 мг) растворяли в метаноле (3 мл) при комнатной температуре, после чего добавляли ацетат натрия (72,2 мг) и по каплям добавляли раствор бромциана (40,4 мг) в метаноле (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 36 часов, затем добавляли 25%-ный водный аммиак (55 мкл) и перемешивание продолжали в течение еще одного часа. Растворитель выпаривали в вакууме и остаток очищали хроматографией (от Isco) (колонка: Si-амин (аминированный силикагель) Silicycle, AcOEt), получая изохинолин-5-сульфоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид (7,8 мг) в виде желтого твердого вещества. Описание: MS (ISP): 397,2 ([М+Н]+).
Пример 78
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(4-хлор-фенил)-2-метокси-ацетамид
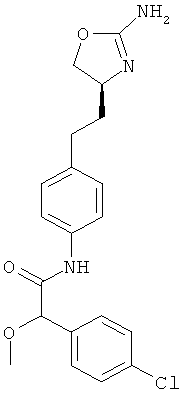
Указанное в заголовке соединение получали аналогично примеру 83, исходя из (4-хлор-фенил)-метокси-уксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 388,2 ([М+Н]+).
Пример 79
4-Трифторметил-циклогексанкарбоновой кислоты {4-12-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
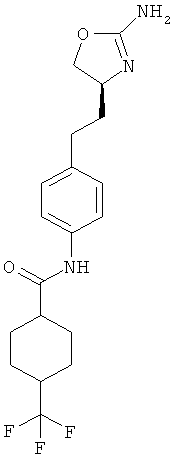
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-(трифторметил)-циклогексанкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 384,3 ([М+Н]+).
Пример 80
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(2-хлор-фенил)-пропионамид
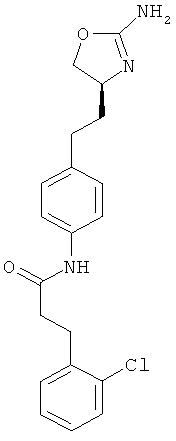
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 3-(2-хлорфенил)пропионовой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 372,2 ([М+Н]+).
Пример 81
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(3-трифторметил-фенил)-пропионамид
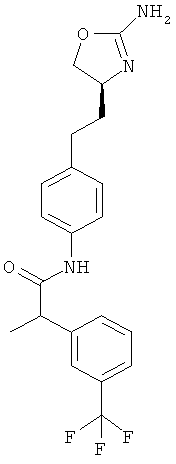
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-(3-трифторметил-фенил)-пропионовой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 406,3 ([М+Н]+).
Пример 82
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(3-трифторметокси-фенил)-пропионамид
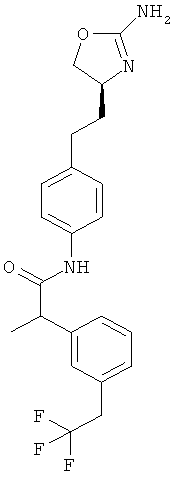
а) 2-(3-Трифторметокси-Фенил)-пропионовая кислота
Раствор диизопропиламина (3,1 мл) в тетрагидрофуране (30 мл) охлаждали до 0ºС, после чего по каплям добавляли 1,6 М н-BuLi в гексане (13,5 мл), затем перемешивали в течение 15 минут и охлаждали до -70ºС. 3-(Трифторметокси)-фенилуксусную кислоту (2 г) растворяли в тетрагидрофуране (20 мл) и по каплям добавляли в реакционную смесь, которую затем оставляли нагреваться до 0ºС, перемешивали в течение 30 минут и затем вновь охлаждали до -70ºС. Затем медленно добавляли метилиодид (0,9 мл) и раствор перемешивали в течение следующих 1,5 часа при -70ºС. Добавляли воду, раствор промывали диэтиловым эфиром, водную фазу подкисляли путем добавления 25%-ного водного HCl и затем дважды экстрагировали диэтиловым эфиром, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией (SiO2; гексан/EtOAc 3:1), что позволило получить 2-(3-трифторметокси-фенил)-пропионовую кислоту (1,5 г) в виде светло-желтого масла. MS (ISP): 232,9 ([М-Н]+).
b) N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-(3-трифторметокси-фенил)-пропионамид
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-(3-трифторметокси-фенил)-пропионовой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Бесцветная пенка. MS (ISP): 422,2 ([M+H]+).
Пример 83
2-Метокси-пиримидин-5-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
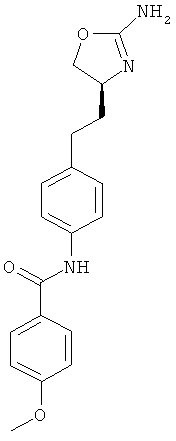
a) (Е)-(S)-2-Амино-4-(4-нитро-Фенил)-бут-3-ен-1-ол
К перемешиваемому раствору трифторуксусной кислоты (4,9 мл) в воде (24 мл) добавляли (S)-2,2-диметил-4-[(Е)-2-(4-нитро-фенил)-винил]-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (Пример 14(а)) (5,0 г) в ацетонитриле (4,0 мл). После перемешивания при 80ºС в течение 4 часов реакционную смесь охлаждали до комнатной температуры и раствор подщелачивали до рН более 11 путем добавления по каплям 1 н. раствора гидроксида натрия. Смесь трижды экстрагировали этилацетатом, объединенные органические слои сушили (MgSO4) и концентрировали в вакууме, получая (Е)-(S)-2-амино-4-(4-нитро-фенил)-бут-3-ен-1-ол в виде коричневого масла (2,5 г). 1Н-ЯМР (300 MHz, CDCl3, δ); 8.23-8.11 (m, 2H), 8.54-8.47 (m, 2H), 7.67 (d, J=16 Гц, 1Н), 6.7 (dd, J=16 и 8 Гц, 1Н). 3.78-3.69 (m, 2H), 3.58-3.42 (m,1H).
b) (S)-4-[(Е)-2-(4-Нитро-фенил)-винил]-4,5-дигидро-оксазол-2-иламин
К раствору (Е)-(S)-2-амино-4-(4-нитро-фенил)-бут-3-ен-1-ола (2,5 г) в метаноле (90 мл) при комнатной температуре добавляли ацетат натрия (3,0 г), затем по каплям в течение 15 минут добавляли раствор бромциана (1,65 г) в метаноле (10 мл). Реакционную смесь перемешивали в течение 2 суток, затем добавляли 25%-ный водный аммиак (8,2 мл) и раствор перемешивали в течение 1 часа при комнатной температуре. Растворитель выпаривали в вакууме и остаток очищали хроматографией (от Isco) (колонка: Si-амин Silicycle, AcOEt), получая (S)-4-[(Е)-2-(4-нитро-фенил)-винил]-4,5-дигидро-оксазол-2-иламин (950 мг) в виде желтого масла. MS (ISP): 234,1 ([М+Н]+).
c) (S)-4-[2-(4-Амино-Фенил)-этил]-4,5-дигидро-оксазол-2-иламин
(S)-4-[(Е)-2-(4-Нитро-фенил)-винил]-4,5-дигидро-оксазол-2-иламин (0,95 г) растворяли в метаноле (40 мл), после чего добавляли Pd/C (10%; 95 мг). Реакционную смесь гидрировали в течение 1 часа при комнатной температуре, затем катализатор отфильтровывали и промывали метанолом. Остаток концентрировали в вакууме и очищали хроматографией (от Isco) (колонка: Si-амин Silicycle, AcOEt), что позволило получить (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламин (800 мг) в виде беловатого твердого вещества. MS (ISP): 206,2 ([М+Н]+).
d) 2-Метокси-пиримидин-5-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
2-Хлор-пиримидин-5-карбоновую кислоту (23 мг) растворяли в метаноле (1 мл) и раствор охлаждали до 0ºС, после чего добавляли 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолинийхлорида гидрат (45 мг). Реакционную смесь перемешивали в течение 5 минут при 0ºС, затем по каплям добавляли раствор (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина (30 мг) в метаноле (1 мл). Перемешивание при 0ºС продолжали в течение 1 часа, после чего реакцию гасили путем добавления 1 н. раствора гидроксида натрия. Затем реакционную смесь трижды экстрагировали этилацетатом и объединенные органические слои промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали препаративной HPLC, получая 2-метокси-пиримидин-5-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид (9 мг) в виде желтого твердого вещества. MS (ISP): 342,2 ([М+Н]+).
Пример 84
(RS)-4-(2-Амино-4,5-дигидро-оксазол-4-ил)-N-(4-хлор-фенил)-бензамид
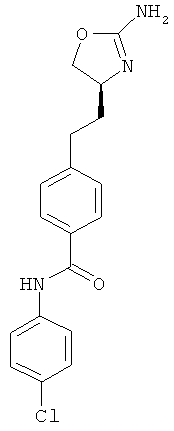
a) (RS)-4-(4-Циано-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
Перемешиваемый раствор (RS)-4-(4-иод-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутилового эфира (200 мг; пример 1(е)), цианида цинка (66 мг) и тетракис(трифенилфосфин)палладия (57 мг) в DMF (4 мл) в атмосфере аргона в герметично закрытой пробирке нагревали при 160ºС в течение 15 минут в условиях облучения микроволнами. Затем смесь выливали в ледяную воду и дважды экстрагировали этилацетатом. Объединенные органические экстракты промывали водой, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-4-(4-циано-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (82 мг; 55%) в виде бесцветного вязкого масла. MS (ISP): 325,4 ([M+Na]+), 303,4 ([М+Н]+), 247,3 ([М+Н-C4H8]+).
b) (RS)-4-(4-Карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому раствору (RS)-4-(4-циано-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира (80 мг) в этаноле (2 мл) добавляли 2 М водн. раствор гидроксида натрия (2 мл) и смесь нагревали при 85ºС в течение 18 ч. Затем смесь охлаждали до комнатной температуры и подкисляли путем добавления 1 М водн. соляной кислоты. Затем смесь экстрагировали этилацетатом. Органические экстракты сушили над сульфатом натрия и концентрировали в вакууме, получая (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (81 мг; 95%) в виде белого твердого вещества. MS (ISP): 320,2 ([М-Н]+).
c) (RS)-4-[4-(4-Хлор-фенилкарбамоил)-фенил-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (80 мг) в THF (4 мл) добавляли последовательно N-метилморфолин (0,11 мл), TBTU (160 мг) и 4-хлор-анилин (48 мг) и смесь нагревали при 50ºС в течение 18 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-4-[4-(4-хлор-фенилкарбамоил)-фенил]-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутиловый эфир (110 мг; колич.) в виде светло-желтого твердого вещества. MS (ISP): 455,2 ([{37Cl}M+Na]+), 453,2 ([{35Cl}M+Na]+), 433,3 ([{37Cl}М+Н]+), 431,4 ([{35Cl}М+Н]+), 377,3 ([{37Cl}М+Н-C4H8]+), 375,3([{35Cl}M+H-C4H8]+).
d) (RS)-4-(2-Амино-4,5-дигидро-оксазол-4-ил)-N-(4-хлор-фенил)-бензамид
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (RS)-4-[4-(4-хлор-фенилкарбамоил)-фенил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 318,3 ([{37Cl}М+Н]+), 316,2 ([{35Cl}М+Н]+).
Пример 85
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-пиразол-1-ил-никотинамид
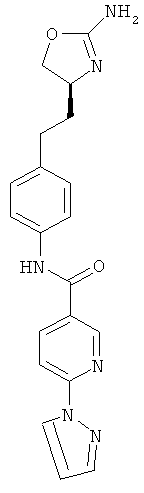
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-(1Н-пиразол-1-ил)-никотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 377,3 ([М+Н]+).
Пример 86
N-Бензоимидазол-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
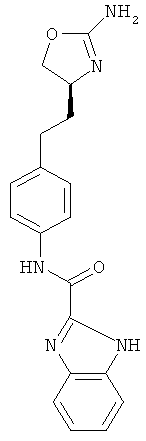
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1Н-бензимидазол-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 350,3 ([М+Н]+).
Пример 87
3,5-Дифтор-пиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
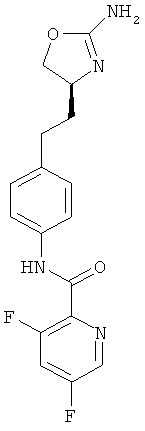
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 3,5-дифторпиридин-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 347,2 ([М+Н]+).
Пример 88
6-Фтор-пиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
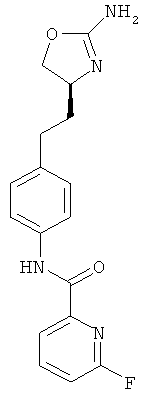
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-фторпиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 329,2 ([М+Н]+).
Пример 89
6-Хлор-3-фтор-пиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
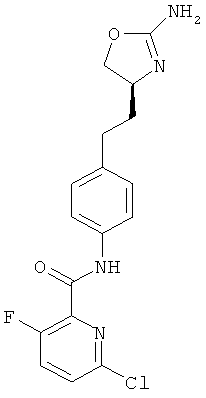
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-хлор-5-фторпиридин-6-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 363,2 ([М+Н]+).
Пример 90
4-Хлор-пиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
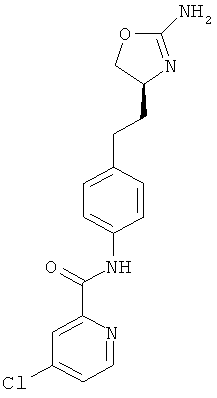
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-хлорпиколиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 345,1 ([М+Н]+).
Пример 91
Хинолин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
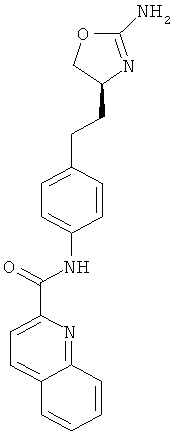
Указанное в заголовке соединение получали аналогично примеру 83, исходя из хинальдиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 361,1 ([М+Н]+).
Пример 92
5-Бром-пиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
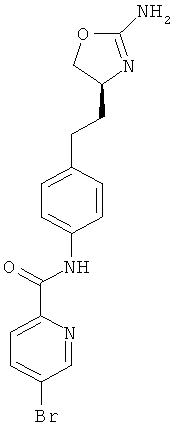
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-бром-пиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 389,2 ([М+Н]+).
Пример 93
Изохинолин-1-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
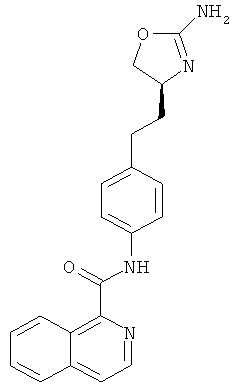
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1-изохинолинкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтая пенка. MS (ISP): 361,2 ([М+Н]+).
Пример 94
1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(4-фтор-фенил)-мочевина
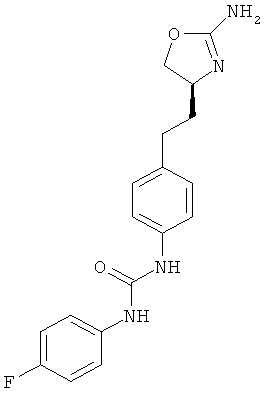
Указанное в заголовке соединение получали аналогично примеру 35(b)-(с), исходя из (S)-4-[2-(4-изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 4-фторанилин вместо 2-амино-6-хлорпиридина. Белое твердое вещество. MS (ISP): 343,3 ([М+Н]+).
Пример 95
1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(3-хлор-фенил)-мочевина
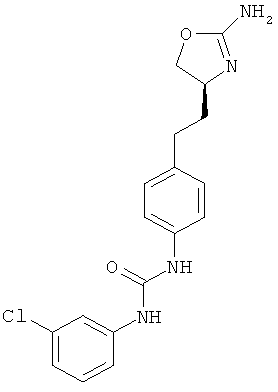
Указанное в заголовке соединение получали аналогично примеру 35(b)-(с), исходя из (S)-4-[2-(4-изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира и используя 3-хлоранилин вместо 2-амино-5-хлорпиридина. Белое твердое вещество. MS (ISP): 361,2 ([{37Cl}M+H]+), 359,2 ([{35Cl}М+Н]+).
Пример 96
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-фторпиколинамид
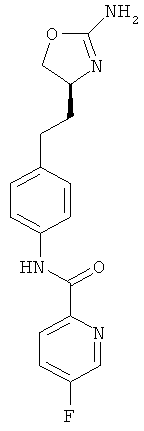
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-фторпиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 329,1 ([М+Н]+).
Пример 97
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-метокси-никотинамид
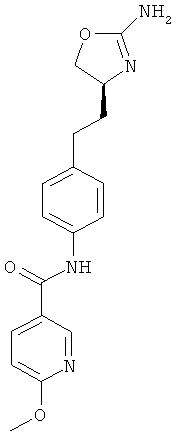
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-метоксиникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 341,1 ([М+Н]+).
Пример 98
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-метил-никотинамид
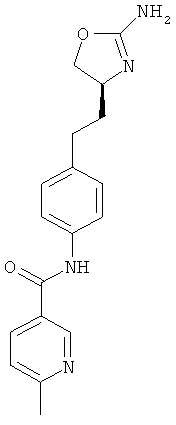
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-метилникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 325,3 ([М+Н]+).
Пример 99
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-фторникотинамид
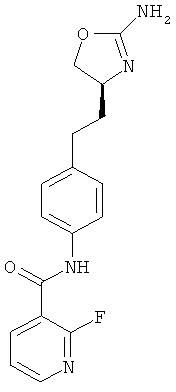
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-фторникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 329,2 ([М+Н]+).
Пример 100
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-5-фтор-никотинамид
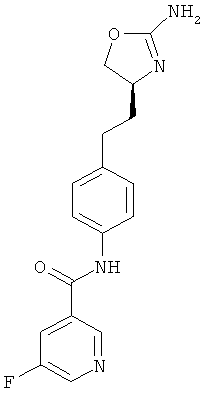
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-фтор-3-пиридинкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 329,2 ([M+H]+).
Пример 101
3-Хлор-5-трифторметил-пиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
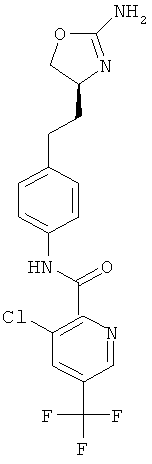
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 3-хлор-6-трифторметил-2-пиридинкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 413,2 ([М+Н]+).
Пример 102
6-Ацетиламино-N-{4-12-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-никотинамид
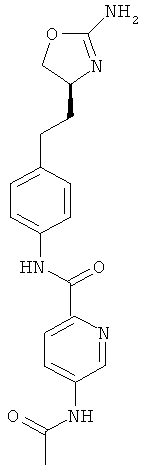
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-ацетамидоникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 368,2 ([М+Н]+).
Пример 103
3Н-Имидазо[4,5-b]пиридин-6-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
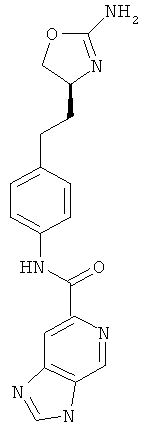
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 3Н-имидазо[4,5b]пиридин-6-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 345,1 ([М+Н]+).
Пример 104
[1,6]Нафтиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
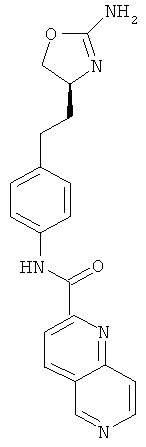
Указанное в заголовке соединение получали аналогично примеру 83, исходя из [1,6]нафтиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 362,2 ([М+Н]+).
Пример 105
[1,8]Нафтиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
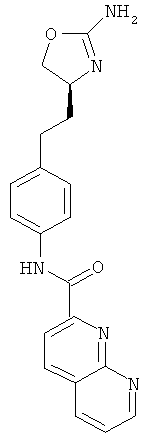
Указанное в заголовке соединение получали аналогично примеру 83, исходя из [1,8]нафтиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 362,2 ([М+Н]+).
Пример 106
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-бром-никотинамид
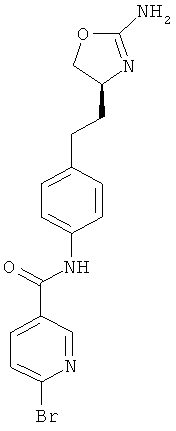
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-бром-3-пиридинкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 389,2 ([М+Н]+).
Пример 107
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2,5-дифтор-никотинамид
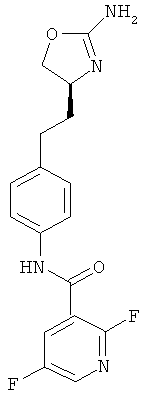
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2,5-дифтор-3-пиридинкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 347,2 ([М+Н]+).
Пример 108
1Н-Имидазол-4-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
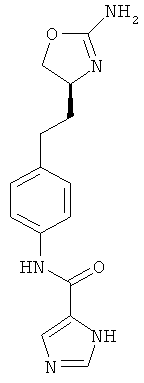
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-имидазол-карбоновой кислоты моногидрата и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 345,1 ([М+Н]+).
Пример 109
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-5,6-дихлор-никотинамид
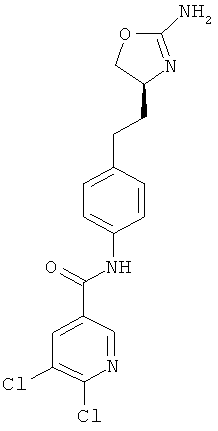
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5,6-дихлорникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 379,2 ([М+Н]+).
Пример 110
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2,6-дифтор-никотинамид
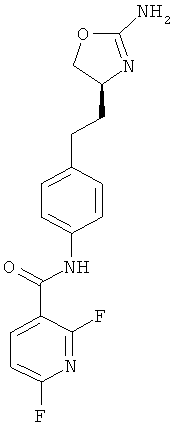
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2,6-дифторникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 347,2 ([М+Н]+).
Пример 111
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-циано-никотинамид
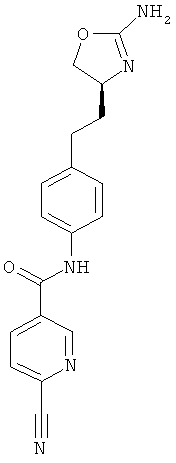
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-цианоникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 336,3 ([М+Н]+).
Пример 112
6-Бром-пиридин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
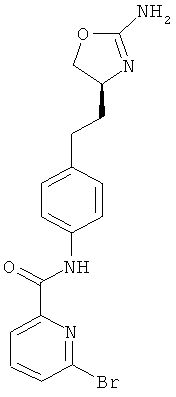
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-бром-пиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 389,2 ([М+Н]+).
Пример 113
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-(2,2,2-трифтор-этокси)-никотинамид
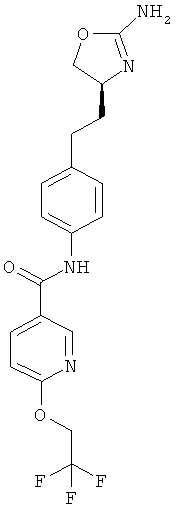
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-(2,2,2-трифторэтокси)-никотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 409,3 ([М+Н]+).
Пример 114
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-хлор-никотинамид
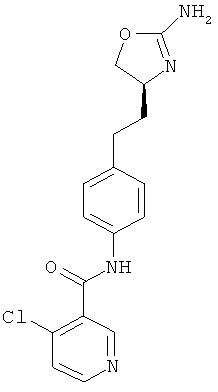
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-хлорникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 345,1 ([М+Н]+).
Пример 115
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-метокси-никотинамид
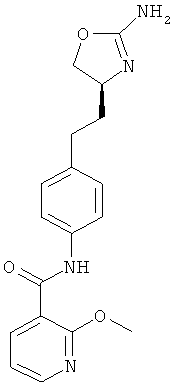
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-метоксиникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 341,1 ([M+H]+).
Пример 116
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-метилпиримидин-5-карбоксамид
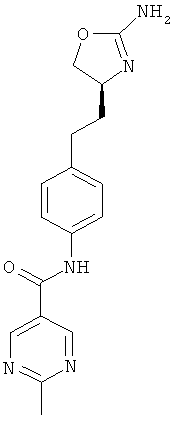
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-метил-пиримидин-5-карбоновой кислоты и (3)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 326,2 ([М+Н]+).
Пример 117
(S)-N-(4-(2-(2-Амино-4,5-дигидро-оксазол-4-ил)этил)фенил)-5-метоксипиколинамид
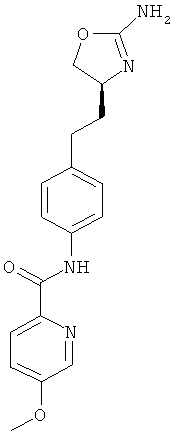
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-метокси-пиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (1SP): 341,1 ([М+Н]+).
Пример 118
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-3-фторпиколинамид
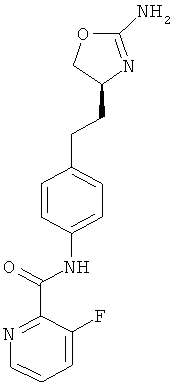
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-фторпиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 329,1 ([M+H]+).
Пример 119
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-цианопиколинамид
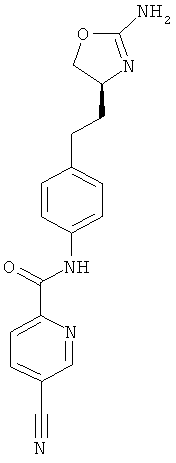
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-циано-2-пиридинкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 336,3 ([М+Н]+).
Пример 120
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-1-(6-хлорпиридин-3-ил)циклопропанкарбоксамид
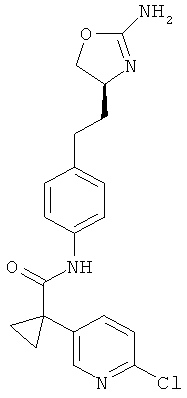
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1-(6-хлорпиридин-3-ил)циклопропанкарбоновой кислоты (CAS 854267-90-6) и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 385,2 ([М+Н]+).
Пример 121
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-фторникотинамид
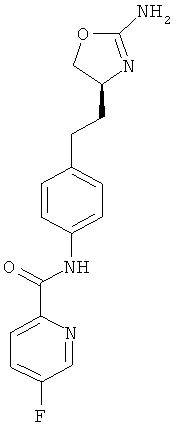
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-фторникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 329,1 ([М+Н]+).
Пример 122
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-хлорпиридазин-3-карбоксамид
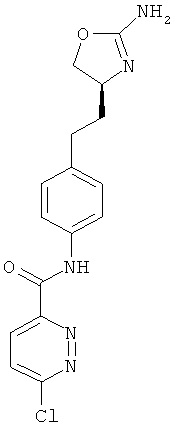
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-хлорпиридазин-3-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 346,1 ([М+Н]+).
Пример 123
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-(пиперидин-1-ил)пиримидин-5-карбоксамид
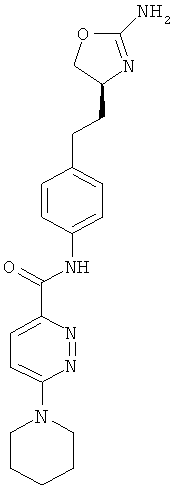
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-пиперидин-1-ил-пиримидин-5-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 395,2 ([М+Н]+).
Пример 124
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-хлорникотинамид
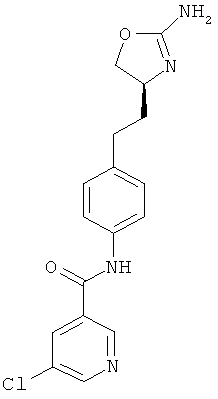
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-хлорникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 345,2 ([М+Н]+).
Пример 125
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-(3,4-дихлорфенил)-2,2-дифторацетамид
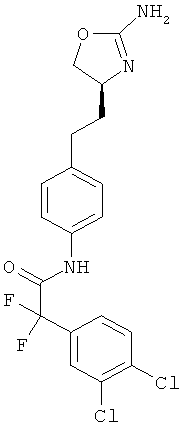
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 3,4-дихлор-α,α-дифтор-бензолуксусной кислоты (CAS 56072-00-5) и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-коричневое твердое вещество. MS (ISP): 428,2 ([М+Н]+).
Пример 126
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-хлорпиразин-2-карбоксамид
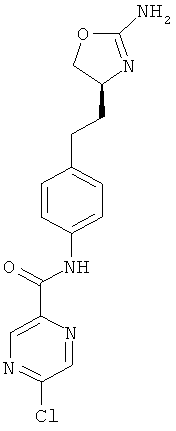
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-хлорпиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 346,1 ([M+H]+).
Пример 127
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метоксипиразин-2-карбоксамид
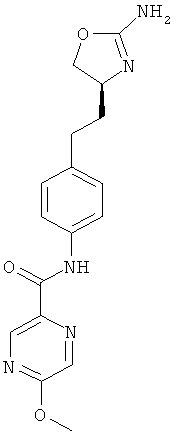
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-метоксипиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 342,1 ([М+Н]+).
Пример 128
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-метоксипиразин-2-карбоксамид
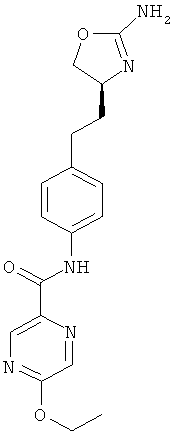
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-метоксипиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 342,1 ([М+Н]+).
Пример 129
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метилпиразин-2-карбоксамид
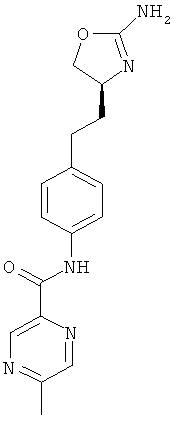
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-метилпиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 362,2 ([М+Н]+).
Пример 130
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-метилпиразин-2-карбоксамид
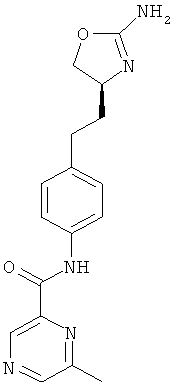
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-метилпиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 326,2 ([М+Н]+).
Пример 131
(S)-4-(2-(2-Амино-4,5-дигидро-оксазол-4-ил)этил)-М-(5-хлорпиридин-2-ил)бензамид
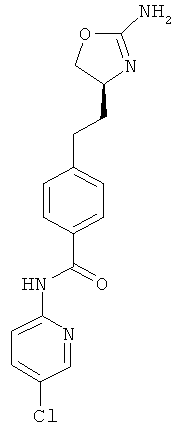
Указанное в заголовке соединение получали аналогично примеру 84, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира (эта кислота описывается в примере 48) вместо (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и 2-амино-5-хлор-пиридина вместо 4-хлоранилина на стадии с). Белое твердое вещество. MS (ISP): 345,1 ([М+Н]+).
Пример 132
(S)-4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)-N-(5-фторпиридин-2-ил)бензамид
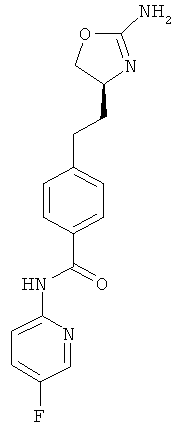
Указанное в заголовке соединение получали аналогично примеру 84, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (эта кислота описывается в примере 48) вместо (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и 2-амино-5-фтор-пиридина вместо 4-хлоранилина на стадии с). Белое твердое вещество. MS 329,1 (ISP): ([М+Н]+).
Пример 133
4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-N-(4-метокси-фенил)-бензамид
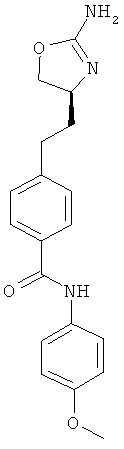
Указанное в заголовке соединение получали аналогично примеру 84, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (эта кислота описывается в примере 48) вместо (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и 2-амино-5-фтор-пиридина вместо 4-хлоранилина на стадии с). Остаток очищали препаративной HPLC, получая указанное в заголовке соединение в виде белого твердого вещества. MS (ISP): 340,2 ([М+Н]+).
Пример 134
4-[2-(2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-N-(6-метокси-пиридин-3-ил)-бензамид
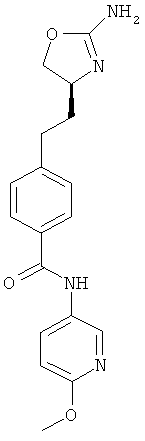
Указанное в заголовке соединение получали аналогично примеру 84, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира (эта кислота описывается в примере 48) вместо (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и 5-амино-2-метокси-пиридина вместо 4-хлоранилина на стадии с). Остаток очищали препаративной HPLC, получая указанное в заголовке соединение в виде розовой смолы. MS (ISP): 341,1 ([М+Н]+).
Пример 135
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-(6-бромпиридин-2-ил)-2,2-дифторацетамид
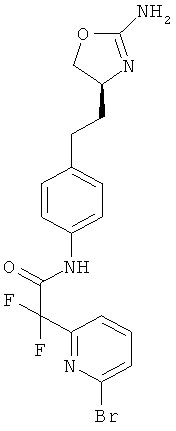
а) 6-Бром-α,α-дифтор-2-пиридинуксусная кислота
К перемешиваемому раствору 2-пиридинуксусной кислоты, 6-бром-α,α-дифторэтилового эфира (CAS 503627-77-8) (200 г) в смеси 1:1 ТНР:вода (3 мл) добавляли LiOH·H2O (45 мг) и реакционную смесь перемешивали в течение 4 часов при комнатной температуре. Затем реакционную смесь концентрировали, переносили в этилацетат и воду подкисляли до рН 1 путем добавления 2 н. HCl. Затем реакционную смесь трижды экстрагировали этилацетатом и объединенные органические слои промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали в вакууме, что позволило получить 6-бром-α,α-дифтор-2-пиридинуксусную кислоту (175 мг). MS (ISP): ([М+Н]+).
b) (S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-(6-бромпиридин-2-ил)-2,2-дифторацетамид
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-бром-α,α-дифтор-2-пиридинуксусной кислоты и (3)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 441,2 ([М+Н]+).
Пример 136
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлор-2-фторбензамид
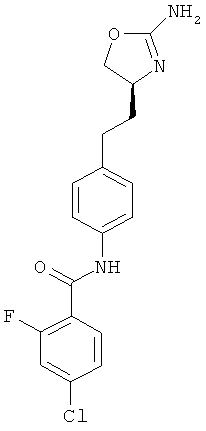
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-хлор-2-фторбензойной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 362,2 ([М+Н]+).
Пример 137
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,4-дихлорбензамид
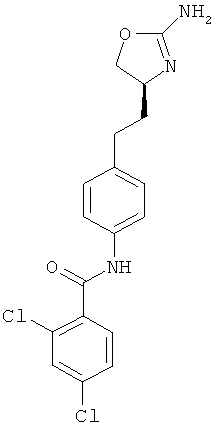
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2,4-дихлорбензойной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 378,2 ([М+Н]+).
Пример 138
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлор-2-метоксибензамид
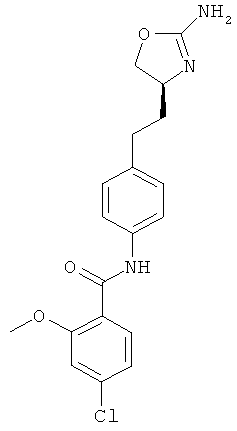
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-хлор-2-метоксибензойной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 374,2 ([М+Н]+).
Пример 139
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-морфолиноникотинамид
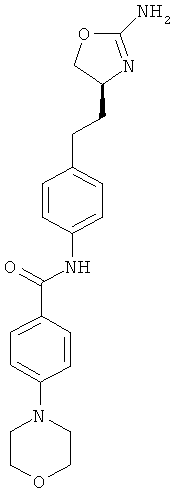
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-морфолиноникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 396,2 ([М+Н]+).
Пример 140
N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2,2-дифтор-2-пиридин-2-ил-ацетамид
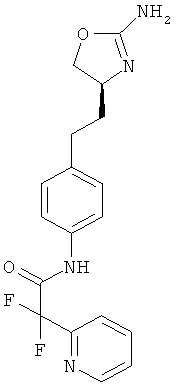
Указанное в заголовке соединение получали аналогично примеру 83, исходя из α,α-дифтор-2-пиридинуксусной кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 361,2 ([М+Н]+).
Пример 141
4-((S)-2-Амино-4,5-дигидро-оксазол-4-илметил)-N-фенил-бензамид
a) 4-((S)-2-трет-Бутоксикарбониламино-3-гидрокси-пропил)-бензойная кислота
4-((S)-2-трет-Бутоксикарбониламино-3-гидрокси-пропил)-бензойную кислоту получали из 4-((S)-2-трет-бутоксикарбониламино-3-гидрокси-пропил)-бензойной кислоты этилового эфира (CAS 885022-30-0) и гидроксида лития аналогично примеру 48 стадия а) и использовали непосредственно на следующей стадии.
b) 4-((S)-2-Амино-4,5-дигидро-оксазол-4-илметил)-N-фенил-бензамид
Указанное в заголовке соединение получали аналогично примеру 84, исходя из 4-((S)-2-трет-бутоксикарбониламино-3-гидрокси-пропил)-бензойной кислоты вместо (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и анилина вместо 4-хлоранилина на стадии с). Светло-желтое твердое вещество. MS (ISP): 296,2 ([М+Н]+).
Пример 142
(S)-4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)-N-(4-цианофенил)бензамид
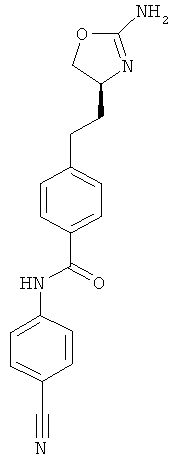
Указанное в заголовке соединение получали аналогично примеру 84, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (пример 48) вместо (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и 4-цианоанилина вместо 4-хлоранилина на стадии с). Бесцветная пенка. MS (ISP): 353,3 ([М+Н]+).
Пример 143
(S)-4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)-N-циклобутилбензамид
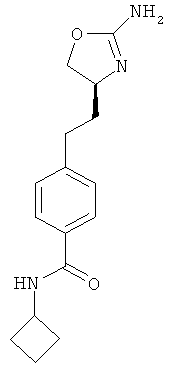
Указанное в заголовке соединение получали аналогично примеру 84, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (пример 48) вместо (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и аминоциклобутана вместо 4-хлоранилина на стадии с). Белое твердое вещество. MS (ISP): 288,1 ([М+Н]+).
Пример 144
(S)-4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)-N-(5-цианопиридин-2-ил)бензамид
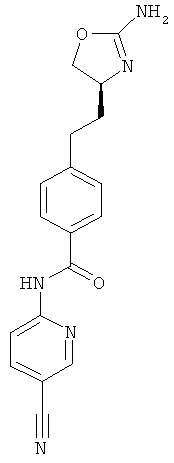
Указанное в заголовке соединение получали аналогично примеру 84, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (пример 48) вместо (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и 2-амино-6-циано-пиридина вместо 4-хлоранилина на стадии с). Белое твердое вещество. MS (ISP): 336,3 ([М+Н]+).
Пример 145
(S)-4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)-N-(4-этинилфенил)бензамид
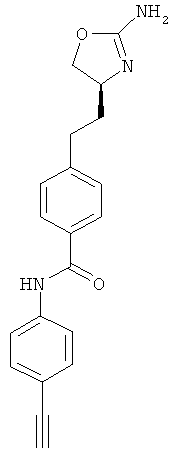
Указанное в заголовке соединение получали аналогично примеру 84, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (пример 48) вместо (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и 4-этинил-анилина вместо 4-хлоранилина на стадии с). Белое твердое вещество. MS (ISP): 334,2 ([М+Н]+).
Пример 146
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-карбаминовой кислоты 4-хлор-бензиловый эфир
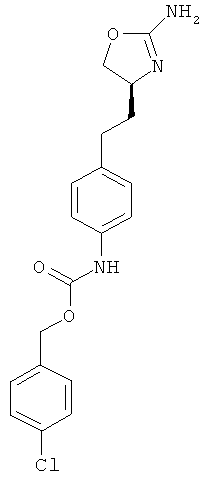
a) (S)-4-{2-[4-(4-Хлор-бензилоксикарбониламино)-фенил]-этил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (S)-4-[2-(4-изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (240 мг) в 1,2-дихлорэтане (2 мл) в выдерживающей давление пробирке добавляли последовательно N,N-диизопропилэтиламин (0,24 мл) и 4-хлор-бензиловый спирт (148 мг). Пробирку закрывали и перемешивание продолжали, нагревая реакционную смесь при 110ºС в течение 18 ч. Затем смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (S)-4-{2-[4-(4-хлор-бензилоксикарбониламино)-фенил]-этил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир (174 мг; 51%) в виде бесцветного аморфного твердого вещества. MS (ISP): 508,2 ([{37Cl}M+NH4]+), 506,2 ([{35Cl}M+NH4]+), 491,2 ([{37Cl}М+Н]+), 489,2 ([{35Cl}М+Н]+), 435,2 ([{37Cl}М+Н-C4H8]+), 433,2 ([{35Cl}M+H-C4H8]+).
b) {4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-карбаминовой кислоты 4-хлор-бензиловый эфир
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (S)-4-{2-[4-(4-хлор-бензилоксикарбониламино)-фенил]-этил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 376,3 ([{37Cl}M+H]+), 374,2 ([{35Cl}M+H]+).
Пример 147
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-карбаминовой кислоты 4-метокси-фениловый эфир
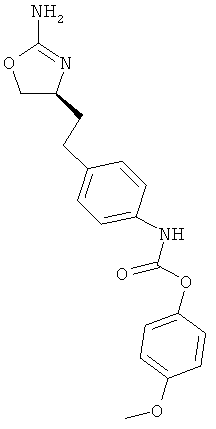
Указанное в заголовке соединение получали аналогично примеру 146, исходя из 4-метоксифенола вместо 4-хлорбензилового спирта. Белое твердое вещество. MS (ISP): 356,1 ([М+Н]+).
Пример 148
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-карбаминовой кислоты 4-фтор-фениловый эфир
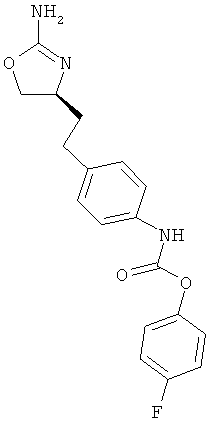
Указанное в заголовке соединение получали аналогично примеру 146, исходя из 4-фторфенола вместо 4-хлорбензилового спирта. Белое твердое вещество. MS (ISP): 344,1 ([М+Н]+).
Пример 149
{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-карбаминовой кислоты 3-трифторметил-фениловый эфир
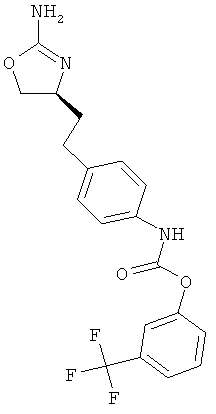
Указанное в заголовке соединение получали аналогично примеру 146, исходя из 3-трифторметилфенола вместо 4-хлорбензилового спирта. Белое твердое вещество. MS (ISP): 394,1 ([М+Н]+).
Пример 150
N-{4-[(R)-1-((S)-2-Амино-4,5-дигидро-оксазол-4-илметил)-2,2,2-трифтор-этокси]-фенил}-4-хлор-бензамид
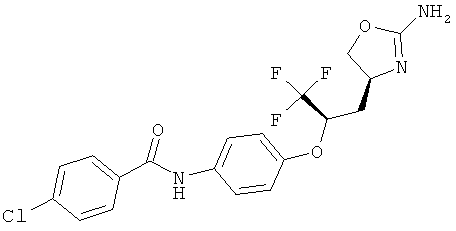
а) (S)-2,2-Диметил-4-((R)-3,3,3-трифтор-2-гидрокси-пропил)-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир и (S)-2,2-диметил-4-((S)-3,3,3-трифтор-2-гидрокси-пропил)-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К охлажденному перемешиваемому раствору (S)-2,2-диметил-4-(2-оксо-этил)-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (4,35 г; CAS 147959-19-1) и (трифторметил)триметилсилана (2,7 мл) в THF (50 мл) при 0ºС по каплям добавляли раствор фторида тетрабутиламмония (1,8 мл; 1 М раствор в THF). Реакционную смесь оставляли нагреваться до комнатной температуры и затем перемешивали в течение следующих 30 мин. Затем смесь разбавляли, используя 2 н. водн. HCl (50 мл), и перемешивание продолжали в течение следующих 30 мин. Смесь дважды экстрагировали этилацетатом и объединенные органические фазы сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (S)-2,2-диметил-4-((S)-3,3,3-трифтор-2-гидрокси-пропил)-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир в виде бесцветного вязкого масла (1,6 г; 28%, фракции, элюируемые первыми) и (S)-2,2-диметил-4-((R)-3,3,3-трифтор-2-гидрокси-пропил)-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир в виде бесцветного вязкого масла (2,0 г; 36%, фракции, элюируемые последними).
b) (S)-2,2-Диметил-4-[(R)-3,3,3-трифтор-2-(4-нитро-Фенокси)-пропил]-рксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К охлажденному перемешиваемому раствору (S)-2,2-диметил-4-((R)-3,3,3-трифтор-2-гидрокси-пропил)-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (1,99 г) и 1-фтор-4-нитробензола (0,69 мл) в THF (20 мл) при 0ºС по каплям добавляли раствор бис(триметилсилил)амида калия (7,7 мл; 1 М раствор в THF). Реакционную смесь перемешивали в течение 30 мин при 0ºС, затем оставляли нагреваться до комнатной температуры и перемешивали в течение еще одного 1 ч. Затем смесь разбавляли дихлорметаном и промывали насыщ. водн. раствором хлорида аммония. Фазы разделяли и водную фазу экстрагировали дихлорметаном. Объединенные органические фазы сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (S)-2,2-диметил-4-[(R)-3,3,3-трифтор-2-(4-нитро-фенокси)-пропил]-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир в виде желтого вязкого масла (2,7 г; 97%). MS (ISP): 435,3 ([М+Н]+), 379,3 ([М+Н-С4Н8]+), 335,4 ([М+Н-С4Н8-CO2]+).
c) (S)-4-[(R)-2-(4-Амино-Фенокси)-3,3,3-трифтор-пропил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (S)-2,2-диметил-4-[(R)-3,3,3-трифтор-2-(4-нитро-фенокси)-пропил]-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (2,66 г) в метаноле (20 мл) добавляли 10%-ный палладий на угле (326 мг) и затем смесь перемешивали в атмосфере водорода при комнатной температуре в течение 3 часов. Затем смесь фильтровали через целит и фильтрат концентрировали в вакууме, что позволило получить (S)-4-[(R)-2-(4-амино-фенокси)-3,3,3-трифтор-пропил]-2,2-диметил-оксазолидин-3-карбоновой кислоты mpem-бутиловый эфир (1,80 г; 73%) в виде желтого вязкого масла. MS (ISP): 405,4 ([М+Н]+), 349,3 ([М+Н-C4H8]+), 305,3 ([М+Н-C4H8-СО2]+).
d) N-{4-[(R)-1-((S)-2-Амино-4,5-дигидро-оксазол-4-илметил)-2,2,2-трифтор-этокси]-фенил}-4-хлор-бензамид
Указанное в заголовке соединение получали аналогично примеру 33, исходя из (S)-4-[(R)-2-(4-амино-фенокси)-3,3,3-трифтор-пропил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (S)-4-[2-(4-амино-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 4-хлор-бензойную кислоту вместо 5-хлор-2-пиридинкарбоновой кислоты. Белое твердое вещество. MS (ISP): 430,1 ([{37Cl}М+Н]+), 428,1 ([{35Cl}М+Н]+).
Пример 151
1-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-3-(5-хлор-пиримидин-2-ил)-мочевина
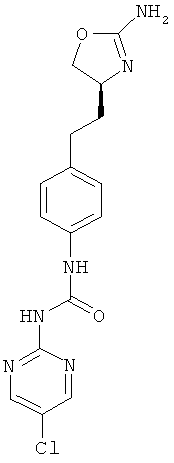
Указанное в заголовке соединение получали аналогично примеру 35(b)-(с), исходя из (S)-4-[2-(4-изоцианато-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и используя 2-амино-5-хлорпиримидин вместо 2-амино-5-хлорпиридина. Беловатое твердое вещество. MS (ISP): 363,1 ([{37Cl}М+Н]+), 361,1 ([{35Cl}М+Н]+).
Пример 152
(S)-4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)-N-(5-этинилпиридин-2-ил)бензамид
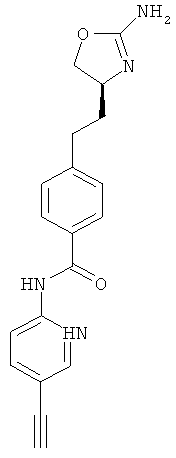
Указанное в заголовке соединение получали аналогично примеру 84, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (пример 48) вместо (RS)-4-(4-карбокси-фенил)-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и 2-амино-5-этинил-пиридина вместо 4-хлоранилина на стадии с). Белое твердое вещество. MS (ISP): 335,2 ([М+Н]+).
Пример 153
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-этоксипиколинамид
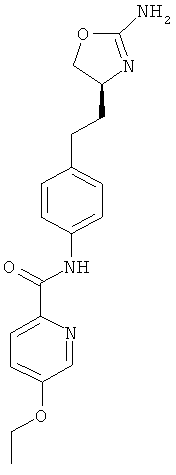
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-этокси-пиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 355,2 ([М+Н]+).
Пример 154
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-(5-фторпиридин-2-ил)-2-метилпропанамид
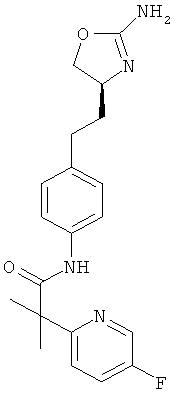
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-фтор-α,α-диметил-2-пиридинуксусной кислоты (CAS 1057395-84-2) и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS(ISP): 371,2 ([M+H]+).
Пример 155
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-хлор-4-метилпиколинамид
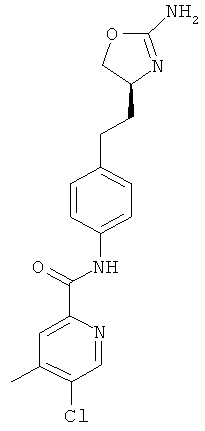
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-хлор-4-метил-пиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 359,1 ([М+Н]+).
Пример 156
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлор-6-метилпиколинамид
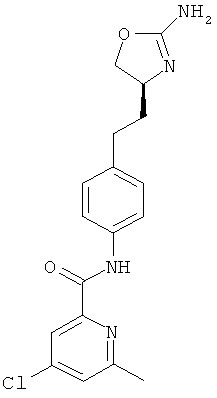
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-хлор-6-метил-пиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 359,1 ([М+Н]+).
Пример 157
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4,6-диметилпиколинамид
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4,6-диметилтпиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 339,2 ([М+Н]+).
Пример 158
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4,6-дихлорпиколинамид
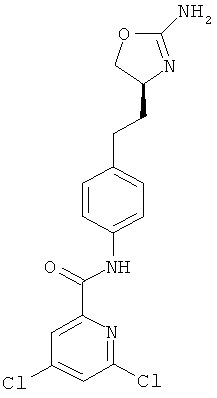
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4,6-дихлор-пиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 379,2 ([М+Н]+).
Пример 159
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-(трифторметил)пиразин-2-карбоксамид
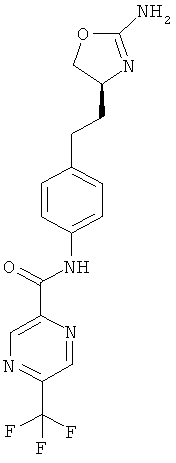
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-трифторметил-пиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Беловатое твердое вещество. MS (ISP): 380,2 ([М+Н]+).
Пример 160
(S)-N-(4-(2-(2-Амино-4,5-дигидро-оксазол-4-ил)этил)фенил)-6-хлорпиразин-2-карбоксамид
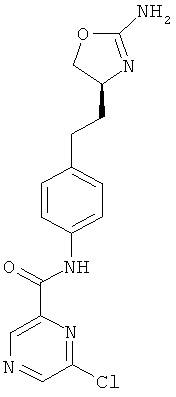
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-хлор-пиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 346,2 ([М+Н]+).
Пример 161
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-этоксипиразин-2-карбоксамид
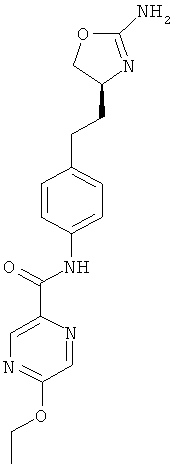
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-этокси-пиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 356,1 ([М+Н]+).
Пример 162
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-1 -(5-фторпиридин-2-ил)циклопропанкарбоксамид
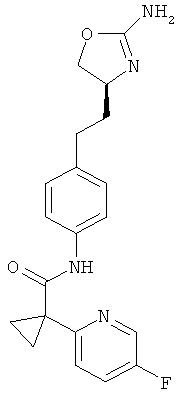
а) 1-(5-Фторпиридин-2-ил)цикпопропанкарбонитрил
Циклопропанкарбонитрил (815 мг) растворяли в THF (15 мл) и раствор охлаждали до 0ºС, после чего по каплям добавляли 0,9 М KHMDS (14,0 мл). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение следующих 15 мин. Затем полученный раствор по каплям добавляли к раствору 2,5-дифторпиридина (1,52 г) в THF (15 мл) и реакционную смесь перемешивали в течение 1 часа. Реакционную смесь гасили путем добавления водного NH4Cl, перемешивали в течение 5 мин, затем органические экстракты промывали NaHCO3 и рассолом и сушили над Na2SO4. После этого смесь концентрировали в вакууме и остаток очищали колоночной флэш-хроматографией (SiO2; градиент: гептан/EtOAc), получая указанное в заголовке соединение в виде белого твердого вещества (880 мг). MS (ISP): 163,2 ([М+Н]+).
b) 1-(5-Фтор-пиридин-2-ил)-циклопропанкарбоновая кислота
1-(5-Фторпиридин-2-ил)циклопропанкарбонитрил (880 мг) растворяли в этаноле (10 мл), после чего медленно по каплям добавляли 96%-ную серную кислоту (10 мл). Реакционную смесь оставляли перемешиваться при 60ºС в течение 24 ч. После охлаждения добавляли NaHCO3 до рН 8, затем раствор трижды экстрагировали этилацетатом, органические экстракты промывали рассолом и сушили над Na2SO4, после чего концентрировали в вакууме.
с) (S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-1-(5-фторпиридин-2-ил)циклопропанкарбоксамид
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1-(5-фтор-пиридин-2-ил)-циклопропанкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 369,2 ([М+Н]+).
Пример 163
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-морфолинопиразин-2-карбоксамид
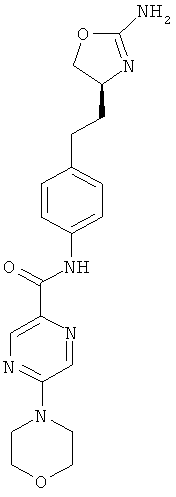
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-(морфолинил)-2-пиразинкарбоновой кислоты (CAS 946598-39-6) и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 397,2 ([М+Н]+).
Пример 164
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-морфолинопиразин-2-карбоксамид
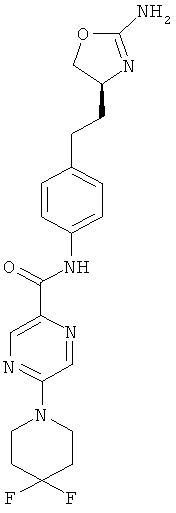
а) 5-(4,4-ДиФтор-1-пиперидинил)-2-пиразинкарбоновая кислота 5-(4,4-Дифтор-1-пиперидинил)-2-пиразинкарбоновую кислоту получали из 5-(4,4-дифтор-1-пиперидинил)-2-пиразинкарбоновой кислоты метилового эфира (CAS 1017604-27-1) и гидроксида лития аналогично примеру 48 стадия а) и использовали непосредственно на следующей стадии.
b) (S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)Фенил)-5-морфолино-пиразин-2-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-(4,4-дифтор-1-пиперидинил)-2-пиразинкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 431,1 ([М+Н]+).
Пример 165
5-(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-пиразин-2-карбоновой кислоты
{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
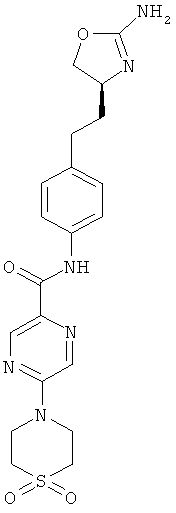
а) 5-(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-пиразин-2-карбоновой кислоты метиловый эфир
Указанное в заголовке соединение получали, проводя реакцию сочетания метил-5-хлорпиразин-2-карбоксилата с тиоморфолина 1,1'-диоксидом в присутствии TEA (триэтиламин) в диоксане при 45ºС в течение 16 часов согласно патентной заявке WO 2008040649.
b) 5-(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-пиразин-2-карбоновая кислота
5-(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-пиразин-2-карбоновую кислоту получали из 5-(1,1-диоксо-1λ6-тиоморфолин-4-ил)-пиразин-2-карбоновой кислоты метилового эфира и гидроксида лития аналогично примеру 48 стадия а) и использовали непосредственно на следующей стадии.
с) 5-(1,15-(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-пиразин-2-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-(1,1-диоксо-1λ6-тиоморфолин-4-ил)-пиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 445,2 ([М+Н]+).
Пример 166
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-((2-метоксиэтил)(метил)амино)пиразин-2-карбоксамид
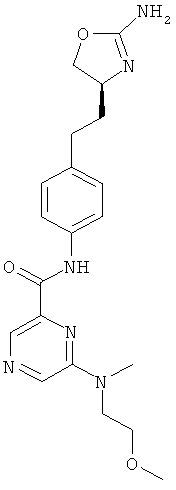
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-[(2-метокси-этил)-метил-амино]-пиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 399,2 ([М+Н]+).
Пример 167
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-(диметиламино)пиразин-2-карбоксамид
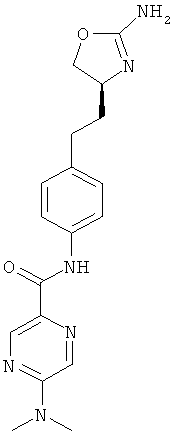
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-(диметиламино)-пиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 355,2 ([М+Н]+).
Пример 168
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-хлор-5-метоксипиколинамид
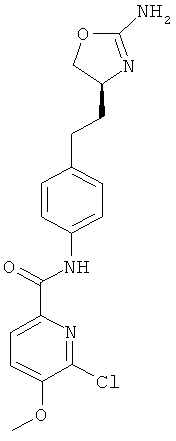
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-хлор-5-метокси-пиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 375,2 ([М+Н]+).
Пример 169
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-хлортиофен-2-карбоксамид
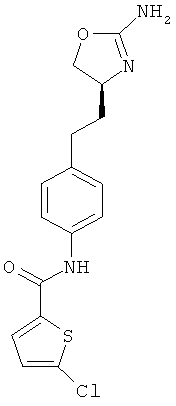
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-хлор-тиофен-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 350,2 ([М+Н]+).
Пример 170
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-3-циклопропилпропанамид
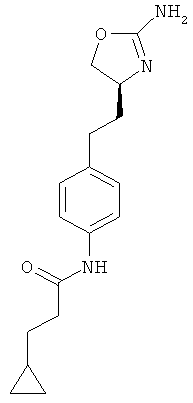
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 3-циклопропил-пропионовой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 302,2 ([М+Н]+).
Пример 171
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метилпиколинамид
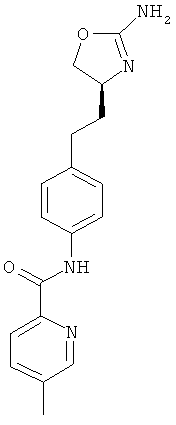
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-метилпиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 325,2 ([М+Н]+).
Пример 172
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-метилизоникотинамид
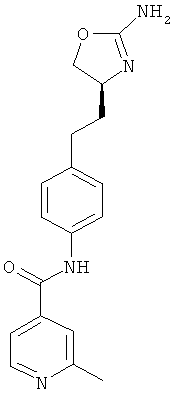
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-метилизоникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 325,2 ([М+Н]+).
Пример 173
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-хлоризоникотинамид
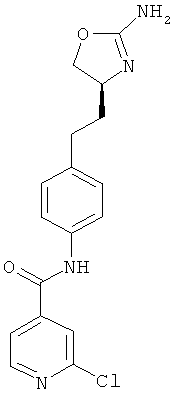
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-хлоризоникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 345,1 ([M+H]+).
Пример 174
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-хлор-3-фторизоникотинамид
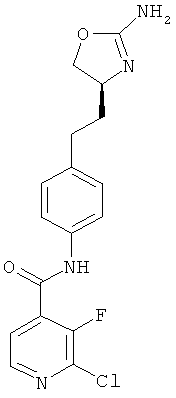
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-хлор-3-фторизоникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 363,2 ([М+Н]+).
Пример 175
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,6-дихлоризоникотинамид
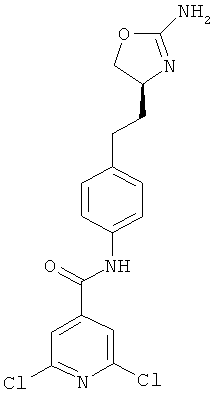
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2,6-дихлорпиридин-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 379,2 ([М+Н]+).
Пример 176
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-3-хлоризоникотинамид
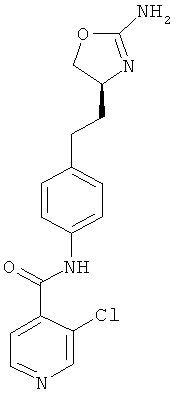
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 3-хлорпиридин-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 345,1 ([М+Н]+).
Пример 177
(S)-2-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5,6-дихлор-3,4-дигидроизохинолин-1(2Н)-он
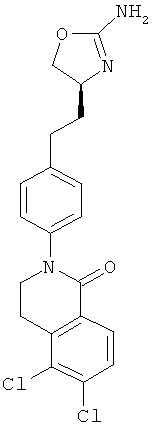
a) (S,E)-трет-Бутил-4-(4-(5,6-дихлор-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)стирил)-2,2-диметилоксазолидин-3-карбоксилат
Перемешиваемую суспензию (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (300 мг; Пример 3а), 5,6-дихлор-3,4-дигидро-2Н-изохинолин-1-она (204 мг), иодида меди(I) (13 мг), N,N'-диметилэтилендиамина (15 мкл) и фосфата калия (356 мг) в толуоле (3 мл) в герметично закрытой пробирке нагревали при 120ºС в течение ночи. Затем смесь охлаждали до комнатной температуры и очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (S,Е)-трет-бутил-4-(4-(5,6-дихлор-1-оксо-3,4-дигидроизохинолин-2(1Н)-ил)стирил)-2,2-иметилоксазолидин-3-карбоксилат (221 мг; 61%) в виде желтого аморфного твердого вещества. MS (ISP): 541,2 ([{37Cl35Cl}M+Na]+) 539,2 ([{35Cl}M+Na]+), 519,3 ([{37Cl35Cl}M+H]+), 517,2 ([{35Cl}М+Н]+), 463,2 ([{37Cl35Cl}M+H-C4H8]+), 461,2 ([{35Cl}М+Н-C4H8]+), 419,2 ([{37Cl35Cl}M+H-C4H8-CO2]+), 417,2 ([{35Cl}M+H-C4H8-CO2]+).
b) (S)-трет-Бутил-4-(4-(5,6-дихлор-1-оксо-3,4-дигидроизохинолин-2(1Н)-ил)фенетил)-2,2-диметилоксазолидин-3-карбоксилат
К перемешиваемой суспензии (S,Е)-трет-бутил-4-(4-(5,6-дихлор-1-оксо-3,4-дигидроизохинолин-2(1Н)-ил)стирил)-2,2-диметилоксазолидин-3-карбоксилата (220 мг) в метаноле (8 мл) добавляли 10%-ную платину на угле (42 мг) и затем смесь перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. Затем смесь фильтровали через целит и фильтрат концентрировали в вакууме, что позволило получить (S)-трет-бутил-4-(4-(5,6-дихлор-1-оксо-3,4-дигидроизохинолин-2(1Н)-ил)фенетил)-2,2-диметилоксазолидин-3-карбоксилат (166 мг; 75%) в виде белого аморфного твердого вещества. MS (ISP): 538,3 ([{37Cl35Cl}M+NH4]+), 536,2 ([{35Cl}M+NH4]+), 521,3 ([{37Cl35Cl}М+Н]+), 519,2 ([{35Cl}М+Н]+), 465,3 ([{37Cl35Cl}M+H-C4H8]+), 463,1 ([{35Cl}М+Н-C4H8]+).
с) N-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-4-хлор-бензамид
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (S)-трет-бутил-4-(4-(5,6-дихлор-1-оксо-3,4-дигидроизохинолин-2(1Н)-ил)фенетил)-2,2-диметилоксазолидин-3-карбоксилата вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 408,3 ([{37Cl}М+Н]+), 406,3 ([{37Cl35Cl}M+H]+), 404,2 ([{35Cl}М+Н]+).
Пример 178
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-этилпиколинамид
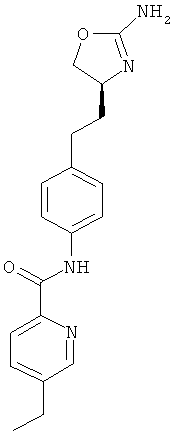
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-этилпиридин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 339,1 ([М+Н]+).
Пример 179
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,5-диметилоксазол-4-карбоксамид
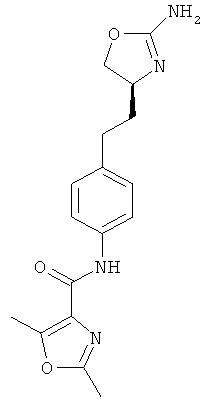
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2,5-диметил-1,3-оксазол-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 329,2 ([М+Н]+).
Пример 180
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,4-диметилоксазол-5-карбоксамид
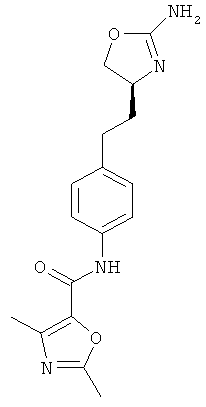
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2,4-диметилоксазол-5-карбоновой кислоты и (S-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 329,1 ([М+Н]+)
Пример 181
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-метилоксазол-4-карбоксамид
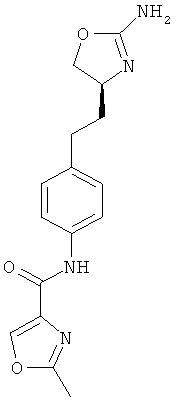
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-метил-1,3-оксазол-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 315,1 ([М+Н]+).
Пример 182
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4-метилоксазол-5-карбоксамид
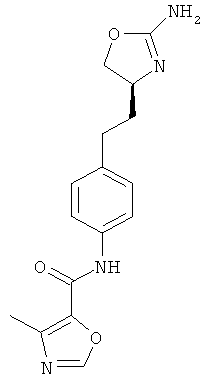
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-метилоксазол-5-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 315,1 ([М+Н]+).
Пример 183
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-этил-4-метилоксазол-5-карбоксамид
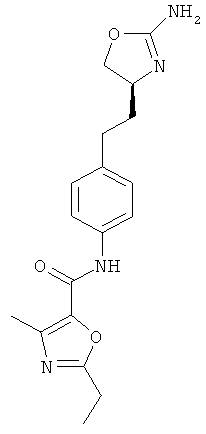
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-этил-4-метил-1,3-оксазол-5-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 343,2 ([М+Н]+).
Пример 184
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-метилтиазол-4-карбоксамид
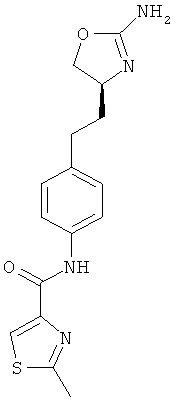
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-метилтиазол-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 331,1 ([М+Н]+).
Пример 185
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-хлор-3-фторпиколинамид
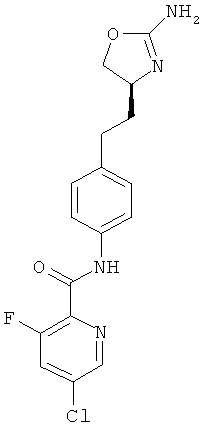
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-хлор-3-фтор-2-пиридинкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 363,2 ([М+Н]+).
Пример 186
2-{4-[2-((S)-2-Амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-хлор-2,3-дигидро-изоиндол-1-он
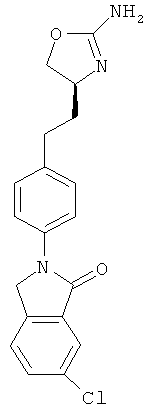
Указанное в заголовке соединение получали аналогично примеру 177, исходя из (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира и 6-хлор-1-изоиндолинона. Белое твердое вещество. 358,1 ([{37Cl}М+Н]+), 356,1 ([{35Cl}М+Н]+).
Пример 187
(S)-2-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)изоиндолин-1-она гидрохлорид
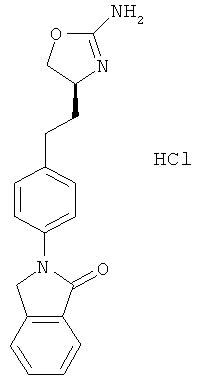
К перемешиваемому раствору 2-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-хлор-2,3-дигидро-изоиндол-1-она (9 мг) в метаноле (3 мл) добавляли 10%-ный палладий на угле (2,7 мг) и затем смесь перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. Затем смесь фильтровали через целит и фильтрат концентрировали в вакууме, что позволило получить (S)-2-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)изоиндолин-1-он гидрохлорид (9 мг; 55%) в виде белого твердого вещества. MS (ISP): 322,2 ([М+Н]+).
Пример 188
(S)-2-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-3,4-дигидроизохинолин-1(2Н)-она гидрохлорид
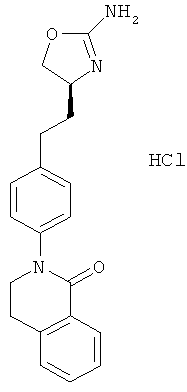
Указанное в заголовке соединение получали аналогично примеру 187, исходя из (S)-2-(4-(2-(2-амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5,6-дихлор-3,4-дигидроизохинолин-1(2Н)-она вместо 2-{4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-6-хлор-2,3-дигидро-изоиндол-1-она. Светло-желтое твердое вещество. MS (ISP): 336,3 ([М+Н]+).
Пример 189
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-(диметиламино)-5-изопропилтиазол-4-карбоксамид
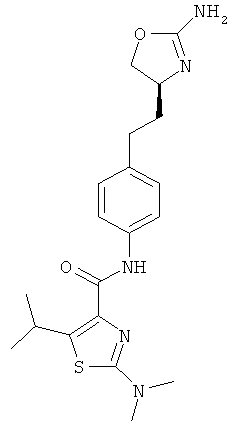
a) 2-(Диметиламино)-5-изопропилтиазол-4-карбоновая кислота Метил-2-амино-5-изопропилтиазол-4-карбоксилат (50 мг) растворяли в ацетонитриле (1 мл), получая желтый раствор. Добавляли гидроксид натрия (39,9 мг) и MeI (70,9 мг) и реакционную смесь нагревали до 60ºС в течение 1 ч. Неочищенную реакционную смесь оставляли охлаждаться до КТ и концентрировали в вакууме. Остаток переносили в 1 н. HCl и трижды экстрагировали AcOEt. Органические слои объединяли, сушили над Na2SO4 и концентрировали в вакууме, что позволило получить указанное в заголовке соединение в виде желтого масла (53 мг).
b) (S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)Фенил)-2-(диметиламино)-5-изопропилтиазол-4-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-(диметиламино)-5-изопропилтиазол-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Светло-желтое твердое вещество. MS (ISP): 402,4 ([М+Н]+).
Пример 190
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,6-диметоксипиримидин-4-карбоксамид
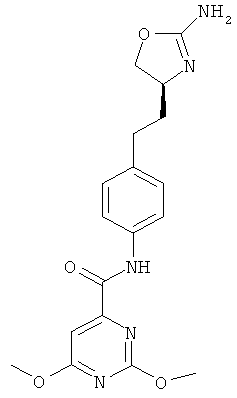
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2,6-диметоксипиримидин-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 372,2 ([М+Н]+).
Пример 191
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метилоксазол-4-карбоксамид
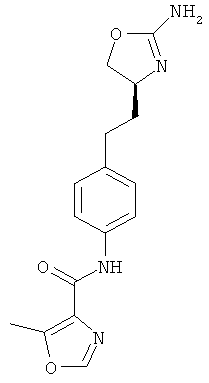
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-метил-1,3-оксазол-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 315,1 ([М+Н]+).
Пример 192
(S)-2-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-хлор-3,4-дигидроизохинолин-1(2Н)-он
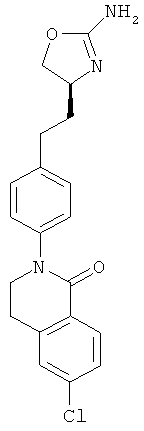
Указанное в заголовке соединение получали аналогично примеру 177, исходя из (S)-4-[(Е)-2-(4-иод-фенил)-винил]-2,2-диметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира и 6-хлор-3,4-дигидроизохинолин-1(2Н)-она. Белое твердое вещество. 372,1 ([{37Cl}М+Н]+), 370,1 ([{35Cl}M+H]+).
Пример 193
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-1,5-диметил-1Н-пиразол-3-карбоксамид
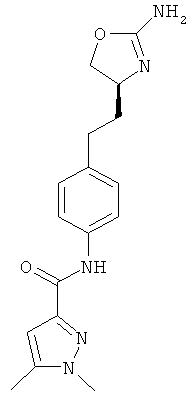
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1,5-диметил-1Н-пиразол-3-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 328,2 ([М+Н]+).
Пример 194
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлор-1-метил-1Н-пиразол-3-карбоксамид
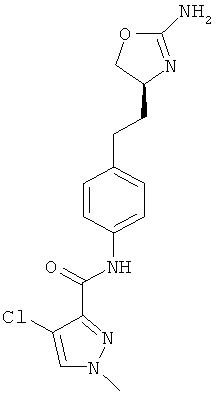
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-хлор-1-метил-1Н-пиразол-3-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 348,2 ([М+Н]+).
Пример 195
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-1-(дифторметил)-1Н-пиразол-3-карбоксамид
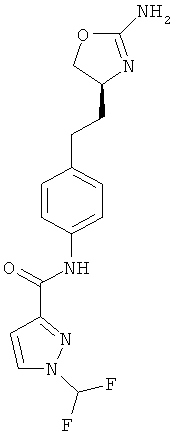
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1-(дифторметил)-1Н-пиразол-3-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 350,3 ([М+Н]+).
Пример 196
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-1-метил-1Н-пиразол-3-карбоксамид
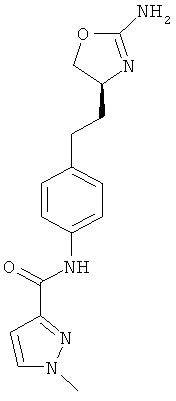
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 1-метил-1Н-пиразол-3-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 314,0 ([М+Н]+).
Пример 197
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-трет-бутилизоникотинамид
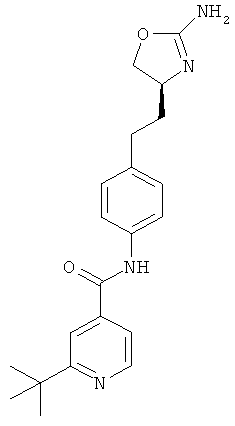
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-трет-бутилизоникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 367,2 ([М+Н]+).
Пример 198
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-изопропилизоникотинамид
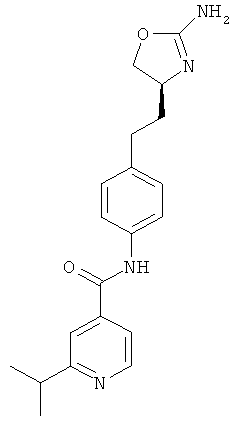
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-изопропилизоникотиновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 353,3 ([М+Н]+).
Пример 199
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,4'-бипиридин-4-карбоксамид
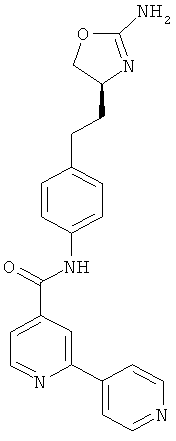
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2,4'-бипиридин-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 388,2 ([М+Н]+).
Пример 200
(R)-N-(4-(2-(2-Амино-4,5-дигидро-оксазол-4-ил)этил)фенил)-5-метилпиразин-2-карбоксамид
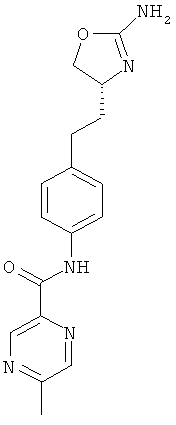
a) (R)-2,2-Диметил-4-[(Е)-2-(4-нитро-Фенил)-винил]-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
Указанное в заголовке соединение получали аналогично примеру 3(а), исходя из (4-нитро-бензил)-фосфоновой кислоты диэтилового эфира (CAS 2609-49-6) вместо (4-иод-бензил)-фосфоновой кислоты диэтилового эфира и (S)-4-формил-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (CAS 102308-32-7) вместо (R)-4-формил-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира.
b) (R)-4-[2-(4-Амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламин Указанное в заголовке соединение получали аналогично примеру 83, стадии (а)-(с), исходя из (R)-2,2-диметил-4-[(Е)-2-(4-нитро-фенил)-винил]-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (S)-2,2-диметил-4-[(Е)-2-(4-нитро-фенил)-винил]-оксазолидин-3-карбоновой кислоты трет-бутилового эфира.
c) (R)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)Фенил)-5-метил-пиразин-2-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 83, стадия (d), исходя из 5-метилпиразин-2-карбоновой кислоты и (R)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 326,2 ([М+Н]+).
Пример 201
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-метилтиофен-2-карбоксамид
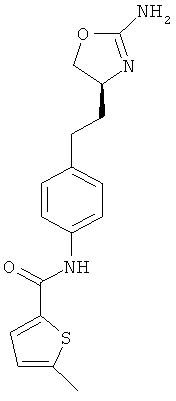
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-метил-тиофен-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 330,1 ([М+Н]+).
Пример 202
(S)-N-(4-(2-(2-Амино-4,5-дигидро-оксазол-4-ил)этил)фенил)-4,5-диметилтиофен-2-карбоксамид
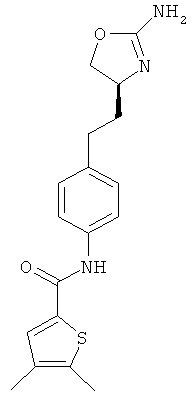
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4,5-диметил-тиофен-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 344,1 ([M+H]+).
Пример 203
2-Этил-6-метокси-пиримидин-4-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
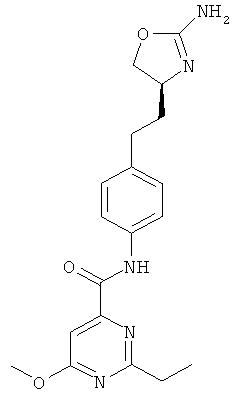
a) 2-Хлор-6-метокси-пиримидин-4-карбоновой кислоты метиловый эфир Метил-2,6-дихлорпиримидин-4-карбоксилат (1 г) объединяли с МеОН (20 мл), получая светло-желтый раствор. Добавляли карбонат калия (668 мг) и реакционную смесь перемешивали при КТ в течение 6 ч. Растворитель концентрировали в вакууме и остаток перемешивали в Et20. Суспензию фильтровали и фильтрат концентрировали в вакууме, что позволило получить указанное в заголовке соединение в виде белого твердого вещества. MS (ISP): 203,3 ([М+Н]+).
b) 6-Метокси-2-винил-пиримидин-4-карбоновой кислоты метиловый эфир 2-Хлор-6-метокси-пиримидин-4-карбоновой кислоты метиловый эфир (300 мг) объединяли с DMF (4 мл), получая бесцветный раствор. В течение 15 мин через раствор барботировали аргон. Последовательно добавляли Cu(I)I (14,1 г), винилтрибутилолово (563 г) и тетракис(трифенилфосфин)Pd (171 мг). Реакционную смесь перемешивали при 100ºС в течение ночи и затем оставляли охлаждаться до КТ, после чего выливали в насыщ. NaHCO3 и 3 раза экстрагировали EtOAc. Органические слои объединяли, промывали насыщ. NaCl, сушили над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 20 г, от 0% до 20% EtOAc в гептане). Неочищенное вещество очищали флэш-хроматографией (силикагель, 20 г, от 0% до 20% EtOAc в гептане), получая указанное в заголовке соединение в виде светло-желтого твердого вещества. MS (ISP) 195,1 ([М+Н]+).
c) 2-Этил-6-метокси-пиримидин-4-карбоновой кислоты метиловый эфир 6-Метокси-2-винил-пиримидин-4-карбоновой кислоты метиловый эфир (130 мг) объединяли с МеОН (5 мл), получая светло-желтый раствор. Добавляли 10% Pd/C (13 мг) и реакционную смесь гидрировали, используя баллон, при КТ в течение 4 часов. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме, получая указанное в заголовке соединение в виде беловатого твердого вещества. MS (ISP) 197.1 ([М+Н]+).
d) 2-Этил-6-метокси-пиримидин-4-карбоновая кислота
2-Этил-6-метокси-пиримидин-4-карбоновую кислоту получали из 2-этил-6-метокси-пиримидин-4-карбоновой кислоты метилового эфира и гидроксида лития аналогично примеру 48, стадия (а), и использовали непосредственно на следующей стадии. MS (ISP) 181,1 ([М+Н]+).
e) 2-Этил-6-метокси-пиримидин-4-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-этил-6-метокси-пиримидин-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 370,2 ([М+Н]+).
Пример 204
(S)-N-(4-(2-(2-Амино-4,5-дигидро-оксазол-4-ил)этил)фенил)-5-метил-1,2,4-оксадиазол-3-карбоксамид
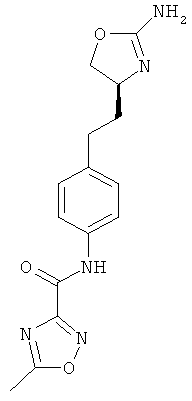
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-метил-1,2,4-оксадиазол-3-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 316,1 ([М+Н]+).
Пример 205
N-(4-(2-((4S,5S)-2-Амино-5-метил-4,5-дигидро-оксазол-4-ил)этил)фенил)-4-хлорбензамид
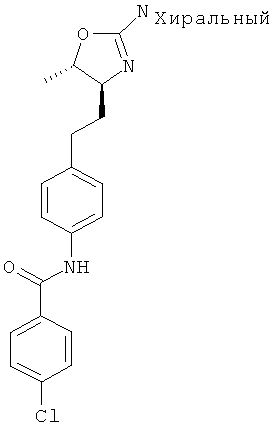
Указанное в заголовке соединение получали аналогично примеру 218, используя 4-хлорбензойную кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 360,1 ([{37Cl}M+H]+), 358,1 ([{35Cl}М+Н]+).
Пример 206
N-(4-(2-((4S,5R)-2-Амино-5-метил-4,5-дигидрооксазол-4-ил)этил)фенил)-4-хлорбензамид
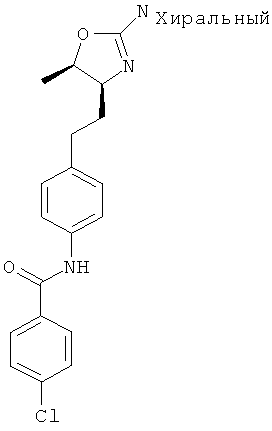
Указанное в заголовке соединение получали аналогично примеру 218, используя (4S,5R)-4-[2-(4-бром-фенил)-этил]-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир вместо (4S,5S)-4-[2-(4-бром-фенил)-этил]-2,2,5-триметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира на стадии (h) и затем 4-хлорбензойную кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 360,1 ([{37Cl}М+Н]+), 358,1 ([{35Cl}М+Н]+).
Пример 207
2-Изопропил-6-метокси-пиримидин-4-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
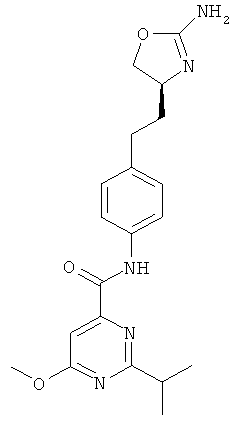
a) 2-Изопропил-6-метокси-пиримидин-4-карбоновая кислота 2-Изопропил-6-метокси-пиримидин-4-карбоновую кислоту получали аналогично примеру 203, исходя из 2-(трибутилстаннил)пропена и 2-хлор-6-метокси-пиримидин-4-карбоновой кислоты метилового эфира на стадии (b). Белое твердое вещество. MS (ISP): 195,0 ([М+Н]+).
b) 2-Изопропил-6-метокси-пиримидин-4-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-изопропил-6-метокси-пиримидин-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 384,2 ([М+Н]+).
Пример 208
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-этилпиразин-2-карбоксамид
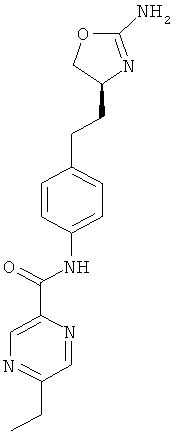
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-этилпиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 340,2 ([М+Н]+).
Пример 209
(S)-N-(4-(2-(2-Амино-4,5-дигидро-оксазол-4-ил)этил)фенил)-4-циклопропил-2-(трифторметил)пиримидин-5-карбоксамид
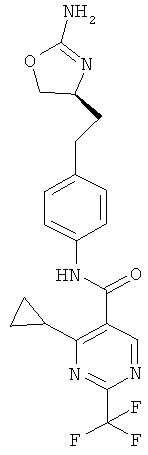
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 4-циклопропил-2-(трифторметил)пиримидин-5-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 420,2 ([М+Н]+).
Пример 210
2-Метокси-4-трифторметил-пиримидин-5-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
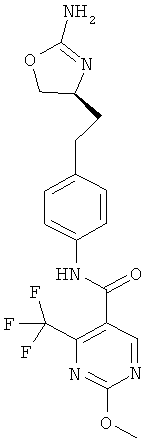
а) Метил-2-метокси-4-(трифторметил)пиримидин-5-карбоксилат Метил-2-хлор-4-(трифторметил)пиримидин-5-карбоксилат (1128 мг) растворяли в МеОН (23 мл), после чего добавляли метилат натрия (380 мг) и реакционную смесь перемешивали в течение 2 часов в герметично закрытой пробирке при 110ºС. Растворитель выпаривали, продукт растворяли в этилацетате и промывали водой, органические экстракты сушили над Na2SO4 и концентрировали в вакууме, что позволило получить указанное в заголовке соединение в виде бесцветного масла. MS (ISP) 237,0 ([М+Н]+).
b) 2-Метокси-4-(трифторметил)пиримидин-5-карбоновая кислота 2-Метокси-4-(трифторметил)пиримидин-5-карбоновую кислоту получали из метил-2-метокси-4-(трифторметил)пиримидин-5-карбоксилата и гидроксида лития аналогично примеру 48, стадия (а), и использовали непосредственно на следующей стадии. Белое твердое вещество. MS (ISP) 223,1 ([М+Н]+).
c) 2-Метокси-4-триФторметил-пиримидин-5-карбоновой кислоты {4-[2-((S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-метокси-4-(трифторметил)пиримидин-5-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 410,2 ([М+Н]+).
Пример 211
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-этилпиразин-2-карбоксамид
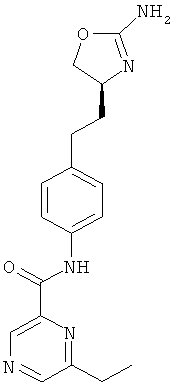
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-этилпиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 340,1 ([М+Н]+).
Пример 212
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-(метилсульфонил)пиколинамид
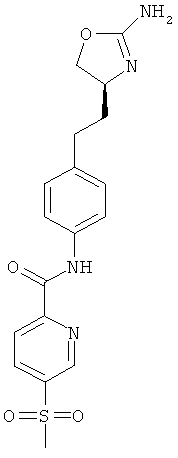
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-(метилсульфонил)-2-пиридинкарбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 389,2 ([М+Н]+).
Пример 213
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-этилоксазол-4-карбоксамид
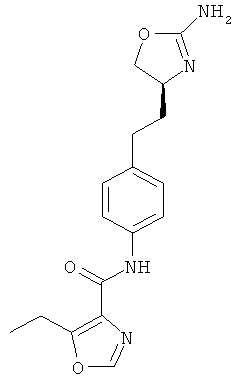
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-этил-1,3-оксазол-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 329,2 ([М+Н]+).
Пример 214
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-циклопропилоксазол-4-карбоксамид
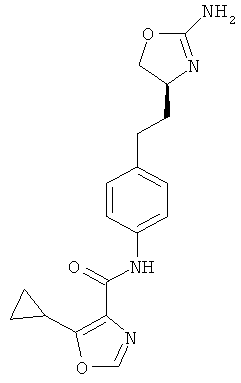
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-циклопропил-1,3-оксазол-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 341,1 ([М+Н]+).
Пример 215
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-5-изопропилоксазол-4-карбоксамид
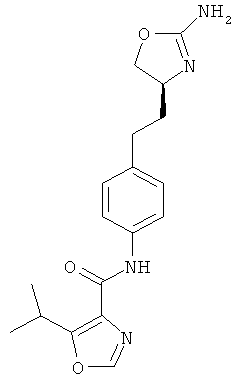
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-изопропил-1,3-оксазол-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 343,2 ([М+Н]+).
Пример 216
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-метил-5-(трифторметил)оксазол-4-карбоксамид
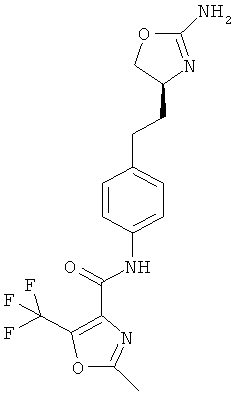
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-метил-5-(трифторметил)оксазол-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 383,1 ([М+Н]+).
Пример 217
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2-этилоксазол-4-карбоксамид
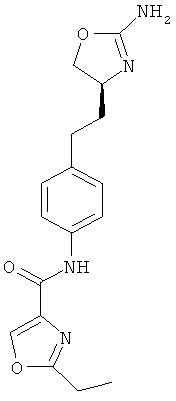
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-этил-1,3-оксазол-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 329,2 ([М+Н]+).
Пример 218
5-Этокси-пиразин-2-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
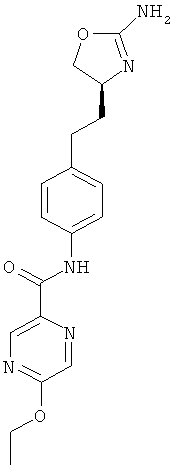
a) (S,E)-трет-Бутил-4-(4-бромстирил)-2,2-диметилоксазолидин-3-карбоксилат
Указанное в заголовке соединение получали аналогично примеру 3(а), используя (4-бром-бензил)-фосфоновой кислоты диэтиловый эфир вместо (4-иод-бензил)-фосфоновой кислоты диэтилового эфира. Желтое твердое вещество. MS (ISP): 284,0 ([{81Br}M+H-C4H8-CO2]+), 282,0 ([{79Br}M+H-C4H8-CO2]+).
b) (Е)-(S)-2-Амино-4-(4-бром-фенил)-бут-3-ен-1-ол
К раствору (S,Е)-трет-бутил-4-(4-бромстирил)-2,2-диметилоксазолидин-3-карбоксилата (13 г) в ацетонитриле (30 мл) добавляли последовательно воду (35 мл) и раствор трифторуксусной кислоты (18,3 мл) в воде (50 мл). Смесь нагревали при 80ºС в течение 3 часов. Затем смесь охлаждали до комнатной температуры и разбавляли смесью этилацетат/THF (1:1). Полученную смесь последовательно промывали 1 н. водн. раствором гидроксида натрия и насыщенным рассолом, затем фазы разделяли, органическую фазу сушили над сульфатом натрия и концентрировали в вакууме. Остаток растирали в диэтиловом эфире (40 мл) и полученные кристаллы собирали фильтрацией, что позволило получить (Е)-(S)-2-амино-4-(4-бром-фенил)-бут-3-ен-1-ол (5,59 г; 68%) в виде коричневого твердого вещества. Фильтрат концентрировали в вакууме и остаток очищали колоночной хроматографией (Si02; градиент: 0-30% МеОН в дихлорметане), что позволило получить дополнительное количество (E)-(S)-2-амино-4-(4-бром-фенил)-бут-3-ен-1-ола (2,21 г; 27%) в виде коричневого твердого вещества. MS (ISP): 227,1 ([{81Br}М+Н-NH3]+), 225,1 ([{79Br}М+Н-NH3]+).
c) [(Е)-(S)-3-(4-Бром-фенил)-1-гидроксиметил-аллил]-карбаминовой кислоты трет-бутиловый эфир
(Е)-(S)-2-Амино-4-(4-бром-фенил)-бут-3-ен-1-ол (7,8 г) и N,N-диизопропил-этиламин (11,1 мл) объединяли с THF (150 мл), получая бесцветный раствор. Реакционную смесь охлаждали до 0ºС и добавляли ди-трет-бутилкарбонат (7,17 г). Реакционную смесь перемешивали при комнатной температуре в течение ночи, что позволило получить желтый раствор. Затем реакционную смесь выливали в EtOAc и последовательно промывали 1 М водн. HCl, 1 М водн. NaOH и насыщенным рассолом. Органический слой сушили над Na2SO4, фильтровали и затем фильтрат перемешивали с углем (2 г) в течение 30 мин. Затем смесь фильтровали через целит и фильтрат концентрировали в вакууме, что позволило получить [(Е)-(S)-3-(4-бром-фенил)-1-гидроксиметил-аллил]-карбаминовой кислоты трет-бутиловый эфир в виде беловатого твердого вещества (10,8 г; 98%). MS (ISP): 344,0 ([{81Br}М+Н]+), 342,0 ([{79Br}М+Н]+), 287,9 ([{81Br}М+Н-C4H8]+), 286,0 ([{79Br}М+Н-C4H8]+).
d) [(S)-3-(4-Бром-фенил)-1-гидроксиметил-пропил1-карбаминовой кислоты трет-бутиловый эфир
К раствору [(Е)-(S)-3-(4-бром-фенил)-1-гидроксиметил-аллил]-карбаминовой кислоты трет-бутилового эфира (14,7 г) в метаноле (150 мл) добавляли 10%-ную Pt/C (1,68 г) и полученную смесь перемешивали в атмосфере Н2, используя баллон, при комнатной температуре в течение 3 часов (при этом ход реакции постоянно контролировали посредством 1H-ЯМР). Реакционную смесь фильтровали через целит и фильтрат концентрировали в вакууме, что позволило получить [(S)-3-(4-бром-фенил)-1-гидроксиметил-пропил]-карбаминовой кислоты трет-бутиловый эфир в виде желтого твердого вещества (11,5 г; 78%). MS (ISP): 346,0 ([{81Br}М+Н]+), 344,0 ([{79Br}М+Н]+), 289,9 ([{81Br}M+H-C4H8]+), 288,0 ([{79Br}M+H-С4Н8]+), 246,1 ([{81Br}M+H-C4H8-CO2]+), 244,1 ([{79Br}M+H-C4H8-CO2]+).
e) [(S)-3-(4-Бром-фенил)-1-Формил-пропил1-карбаминовой кислоты трет-бутиловый эфир
К раствору [(S)-3-(4-бром-фенил)-1-гидроксиметил-пропил]-карбаминовой кислоты трет-бутилового эфира (11,5 г) и триэтиламина (27,9 мл) в DMSO (70 мл) по каплям добавляли комплекс триоксид серы-пиридин (16,0 г), одновременно охлаждая реакционную смесь в ледяной бане. Затем смесь перемешивали при комнатной температуре в течение 30 мин, что позволило получить желтый раствор. Реакционную смесь выливали в EtOAc и последовательно экстрагировали водой и насыщенным рассолом. Органический слой сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель, гептан/EtOAc 3/1), что позволило получить [(S)-3-(4-бром-фенил)-1-формил-пропил]-карбаминовой кислоты трет-бутиловый эфир в виде желтого масла (7,3 г; 64%). MS (EI): 343 ([{81Br}M]+), 341 ([{79Br}M]+), 287 ([{81Br}М-C4H8]+), 285 ([{79Br}М-С4Н8]+), 214 ([{81Br}M-C4H8-CO2]+), 212 ([{79Br}M-C4H8-CO2]+), 171, 169, 103, 57 ([С4Н9]+).
f) {(1S,2RS)-1-[2-(4-Бром-фенил)-этил]-2-гидрокси-пропил}-карбаминовой кислоты трет-бутиловый эфир
К перемешиваемому охлажденному раствору [(S)-3-(4-бром-фенил)-1-формил-пропил]-карбаминовой кислоты трет-бутилового эфира (7,3 г) в THF (40 мл) и Et2O (30 мл) при 0ºС по каплям в течение 30 мин добавляли раствор бромида метилмагния (20,0 мл; 3 М раствор в Et2O). Затем реакционную смесь перемешивали при комнатной температуре в течение 4 часов, после чего гасили путем добавления по каплям воды (газообразование!). Затем реакционную смесь выливали в EtOAc, слои разделяли и органический слой последовательно промывали разбавленным водн. HCl (рН 5) и насыщенным рассолом, затем сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией (силикагель, градиент: от 0% до 80% EtOAc в гексане), что позволило получить {(1S,2RS)-1-[2-(4-бром-фенил)-этил]-2-гидрокси-пропил}-карбаминовой кислоты трет-бутиловый эфир в виде бесцветного аморфного твердого вещества, содержащего смесь эпимеров (5,1 г; 66%). MS (El): 303 ([{81Br}М-C4H8]+), 301 ([{79Br}M-C4H8]+), 258 ([{81Br}М-C4H8-CO2H]+), 256 ([{79Br}М-C4H8-CO2H]+), 214, 212, 171, 169, 57([С4Н9]+).
g) (4S,5S)-4-[2-(4-Бром-фенил)-этил]-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир и (4S,5R)-4-[2-(4-бром-фенил)-этил]-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
{(1S,2RS)-1-[2-(4-Бром-фенил)-этил]-2-гидрокси-пропил}-карбаминовой кислоты трет-бутиловый эфир (5,07 г), п-толуолсульфоновой кислоты моногидрат (538 мг) и 2,2-диметоксипропан (26,1 мл) объединяли с CH2Cl2 (300 мл), получая бесцветный раствор. Реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего промывали насыщ. водн. раствором NaHCO3. Слои разделяли, органический слой сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией (силикагель, градиент: от 0% до 25% EtOAc в гексане), что позволило получить (4S,5S)-4-[2-(4-бром-фенил)-этил]-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир в виде желтого масла (2,85 г; 51%; фракции, элюируемые первыми) и (4S,5R)-4-[2-(4-бром-фенил)-этил]-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир в виде желтого масла (475 мг; 8%; фракции, элюируемые последними).
h) (4S,5S)-4-{2-[4-(Бензгидрилиден-амино)-фенил]-этил}-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К раствору (4S,5S)-4-[2-(4-бром-фенил)-этил]-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (3,13 г) в толуоле (30 мл) добавляли дифенилметанимин (1,71 г) и трет-бутилат натрия (1,06 г).Реакционную смесь дегазировали, барботируя аргон через смесь в течение нескольких минут. Затем добавляли BINAP (489 мг) и Pd2(dba)3 (216 мг) и реакционную смесь перемешивали при 100ºС в течение 20 ч. Затем реакционную смесь охлаждали до комнатной температуры, выливали в EtOAc и экстрагировали водой. Органический слой отделяли, сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией (силикагель, градиент: от 0% до 30% EtOAc в гексане), что позволило получить (4S,5S)-4-{2-[4-(бензгидрилиден-амино)-фенил]-этил}-2,2,5-триметил-оксазолидин-3-карбоновой кислоты mpem-бутиловый эфир в виде желтого масла (3,2 г; 82%). MS (ISP): 499,3 ([М+Н]+).
i) (4S,5S)-4-[2-(4-Амино-фенил)-этил]-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К раствору (4S,5S)-4-{2-[4-(бензгидрилиден-амино)-фенил]-этил}-2,2,5-триметил-оксазолидин-3-карбоновой кислоты тpeт-бутилового эфира (3,23 г) в метаноле (50 мл) добавляли формиат аммония (6,13 г). Реакционную смесь дегазировали, барботируя аргон через смесь в течение нескольких минут. Добавляли 10%-ный Pd/C (207 мг) и реакционную смесь перемешивали при 60ºС в течение 1 часа. По данным ТСХ (тонкослойной хроматографии) реакция прошла полностью. Реакционную смесь фильтровали через целит и концентрировали в вакууме. Остаток очищали флэш-хроматографией (силикагель, градиент: от 0% до 100% EtOAc в гексане), что позволило получить (4S,5S)-4-[2-(4-амино-фенил)-этил]-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир в виде желтого масла (1,76 г; 81%). MS (ISP): 335,2 ([М+Н]+), 235,2 ([М-C4H8-CO2]+).
j) (4S,5S)-4-(2-{4-[(5-Этокси-пиразин-2-карбонил)-амино]-фенил}-этил)-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому раствору (4S,5S)-4-[2-(4-амино-фенил)-этил]-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (120 мг) и 5-этоксипиразин-2-карбоновой кислоты (72,4 мг) в THF (3 мл) добавляли N-метилморфолин (158 мкл) и TBTU (230 мг). Сосуд с реакционной смесью закрывали крышкой и встряхивали при 50ºС в течение ночи. Неочищенную реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией (силикагель, градиент: от 0% до 70% EtOAc в гексане), что позволило получить (4S,5S)-4-(2-{4-[(5-этокси-пиразин-2-карбонил)-амино]-фенил}-этил)-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутиловый эфир в виде белого твердого вещества (167 мг; 96%). MS (ISP): 507,3 ([M+Na]+), 502,3 ([M+NH4]+), 485,3 ([М+Н]+), 429,3 ([M-C4H8]+).
k) 5-Этокси-пиразин-2-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
Указанное в заголовке соединение получали аналогично примеру 1(g)-1(h), исходя из (4S,5S)-4-(2-{4-[(5-этокси-пиразин-2-карбонил)-амино]-фенил}-этил)-2,2,5-триметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира вместо (RS)-4-{4-[3-(4-хлор-фенил)-уреидо]-фенил}-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 370,2 ([М+Н]+).
Пример 219
2-Хлор-6-метокси-пиримидин-4-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
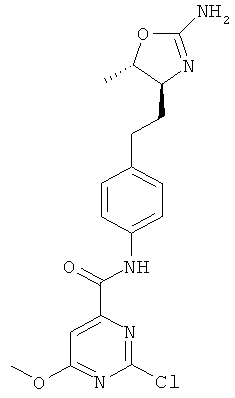
Указанное в заголовке соединение получали аналогично примеру 218, используя 2-хлор-6-метокси-пиримидин-4-карбоновую кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 392,1 ([{37Cl}M+H]+), 390,1 ([{35Cl}М+Н]+).
Пример 220
N-{4-[2-((4S,5S)-2-Амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-2-фтор-никотинамид
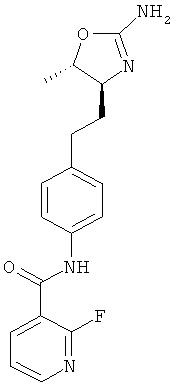
Указанное в заголовке соединение получали аналогично примеру 218, используя 2-фторникотиновую кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 343,2 ([М+Н]+).
Пример 221
6-Фтор-пиридин-2-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
Указанное в заголовке соединение получали аналогично примеру 218, используя 6-фторникотиновую кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 343,2 ([М+Н]+).
Пример 222
5-Метил-оксазол-4-карбоновой кислоты
{4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
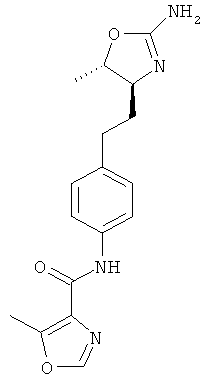
Указанное в заголовке соединение получали аналогично примеру 218, используя 5-метил-оксазол-4-карбоновую кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 329,2 ([М+Н]+).
Пример 223
2,5-Диметил-оксазол-4-карбоновой кислоты
{4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
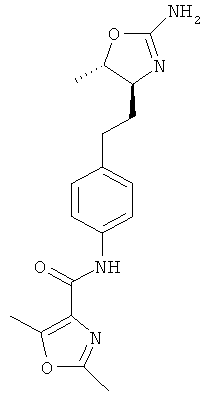
Указанное в заголовке соединение получали аналогично примеру 218, используя 2,5-диметил-оксазол-4-карбоновую кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 343,2 ([М+Н]+).
Пример 224
5-Метил-пиразин-2-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
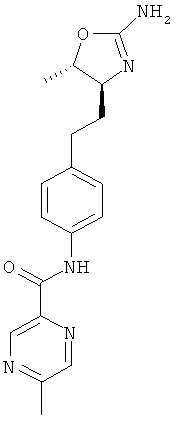
Указанное в заголовке соединение получали аналогично примеру 218, используя 5-метил-пиразин-2-карбоновую кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 340,2 ([М+Н]+).
Пример 225
4,6-Диметил-пиридин-2-карбоновой кислоты
{4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
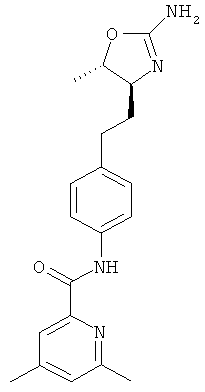
Указанное в заголовке соединение получали аналогично примеру 218, используя 4,6-диметил-пиридин-2-карбоновую кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 353,2 ([М+Н]+).
Пример 226
5-Трифторметил-пиридин-2-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
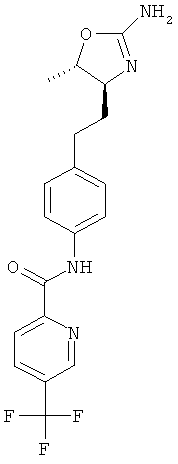
Указанное в заголовке соединение получали аналогично примеру 218, используя 5-трифторметил-пиридин-2-карбоновую кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 393,2 ([М+Н]+).
Пример 227
5-Этил-пиразин-2-карбоновой кислоты {4-[2-((4S,5S)-2-амино-5-метил-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
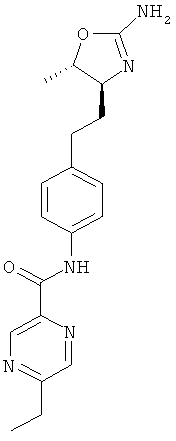
Указанное в заголовке соединение получали аналогично примеру 218, используя 5-этил-пиразин-2-карбоновую кислоту вместо 5-этоксипиразин-2-карбоновой кислоты на стадии (j). Белое твердое вещество. MS (ISP) 354,2 ([М+Н]+).
Пример 228
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-2,6-диметилпиримидин-4-карбоксамид
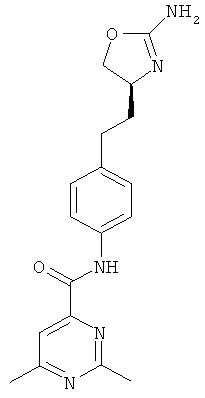
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2,6-диметил-пиримидин-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 340,1 ([M+H]+).
Пример 229
(S)-N-(4-(2-(2-Амино-4,5-дигидро-оксазол-4-ил)этил)фенил)-5-изопропилпиразин-2-карбоксамид
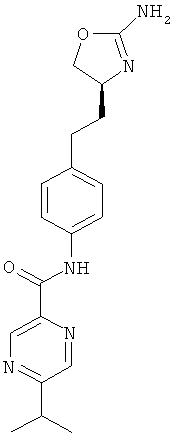
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 5-изопропилпиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 354,3 ([М+Н]+).
Пример 230
(S)-N-(4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)фенил)-6-изопропилпиразин-2-карбоксамид
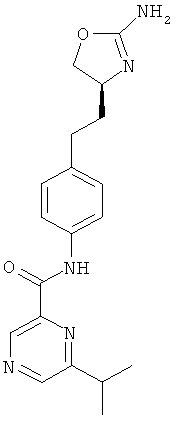
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 6-изопропилпиразин-2-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 354,3 ([М+Н]+).
Пример 231
2-Хлор-6-метокси-пиримидин-4-карбоновой кислоты
{4-[2-(S)-2-амино-4,5-дигидро-оксазол-4-ил)-этил]-фенил}-амид
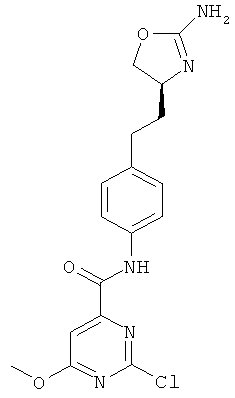
Указанное в заголовке соединение получали аналогично примеру 83, исходя из 2-хлор-6-метокси-пиримидин-4-карбоновой кислоты и (S)-4-[2-(4-амино-фенил)-этил]-4,5-дигидро-оксазол-2-иламина. Белое твердое вещество. MS (ISP): 376,3 ([М+Н]+).
Пример 232
(S)-4-(2-(2-Амино-4,5-дигидрооксазол-4-ил)этил)-N-циклогексилбензамид
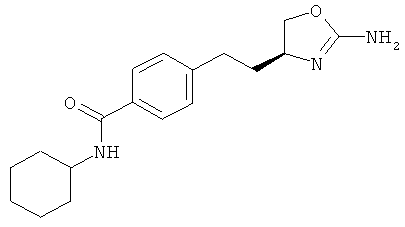
Указанное в заголовке соединение получали аналогично примеру 84, стадия с и а, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (эта кислота описывается в примере 48) и циклогексиламина, используя HATU и DIPEA (N,N-диизопропилэтиламин) в DMF для стадии реакции сочетания с образованием амида. Белое твердое вещество. MS (ISP): 316,3 ([М+Н]+).
Пример 233
(S)-4-(2-(2-Амино-4,5-дигидро-оксазол-4-ил)этил)-N-фенилбензамид
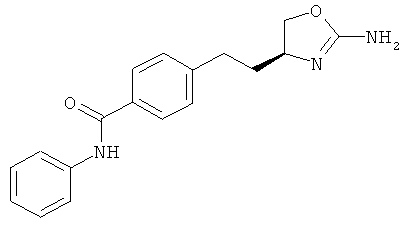
Указанное в заголовке соединение получали аналогично примеру 84, стадия end, исходя из (S)-4-[2-(4-карбокси-фенил)-этил]-2,2-диметил-оксазолидин-3-карбоновой кислоты трет-бутилового эфира (эта кислота описывается в примере 48) и анилина, используя HATU и DIPEA в DMF для стадии реакции сочетания с образованием амида. Белое твердое вещество. MS (ISP): 310,2 ([M+H]+).