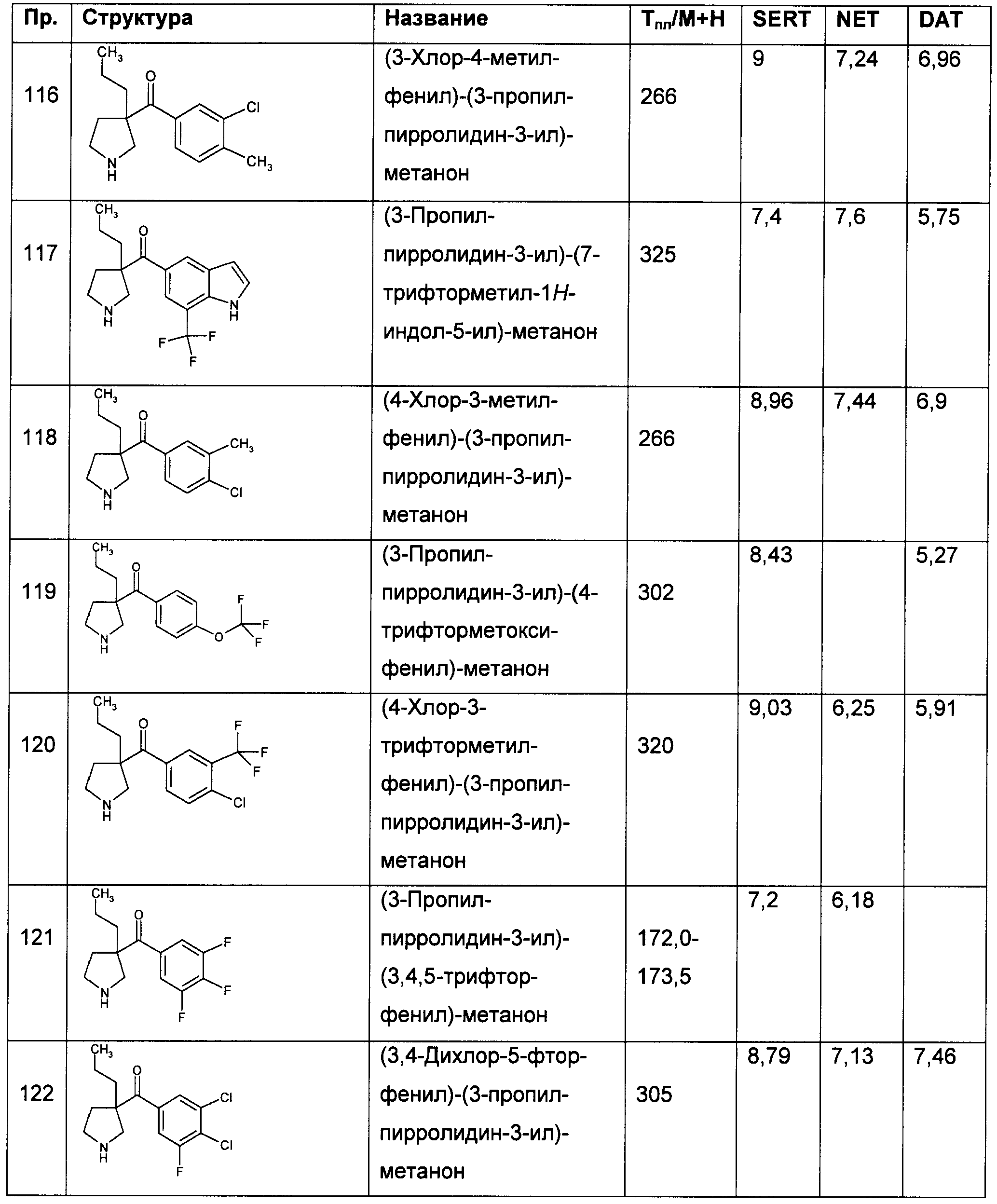
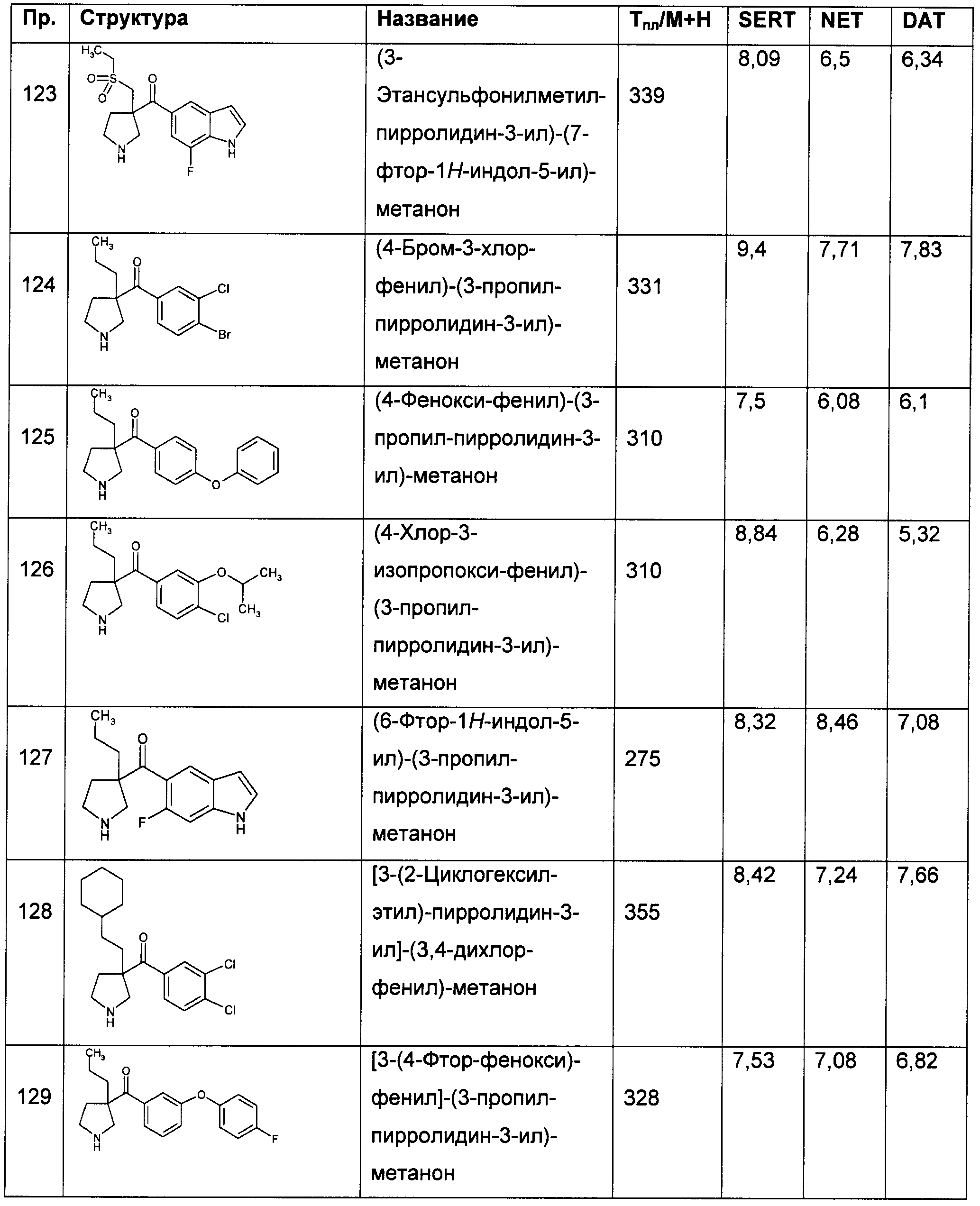
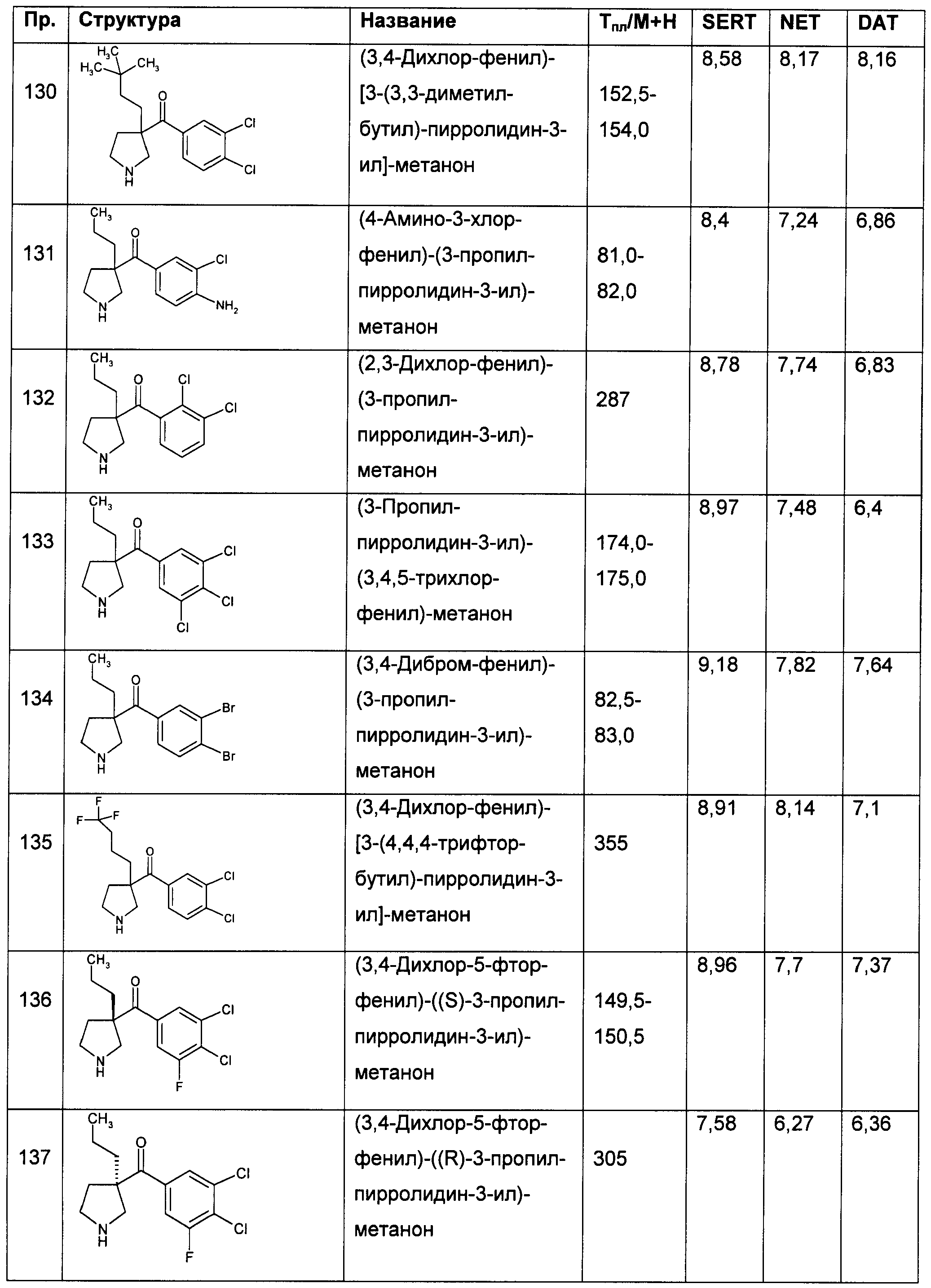
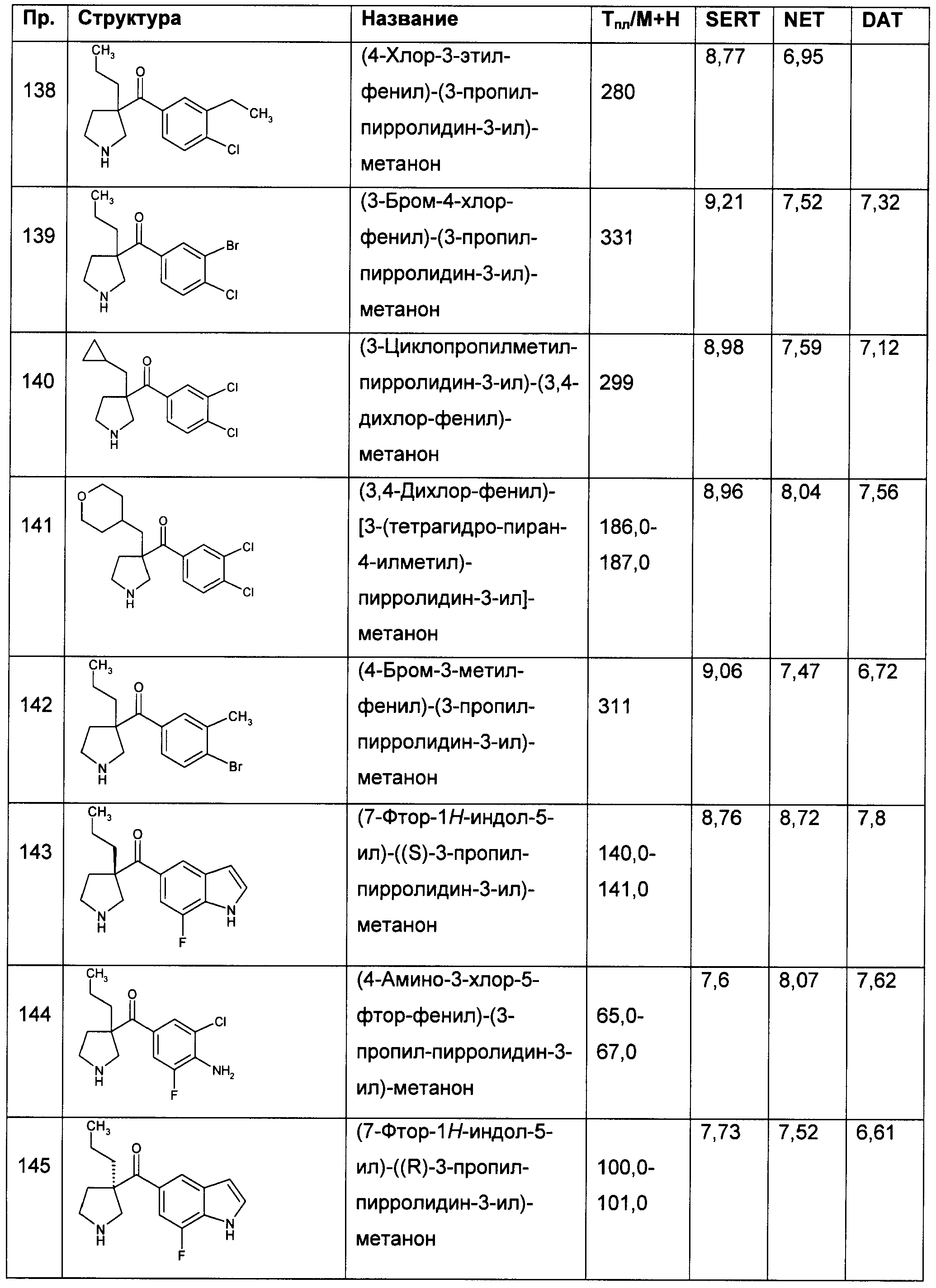
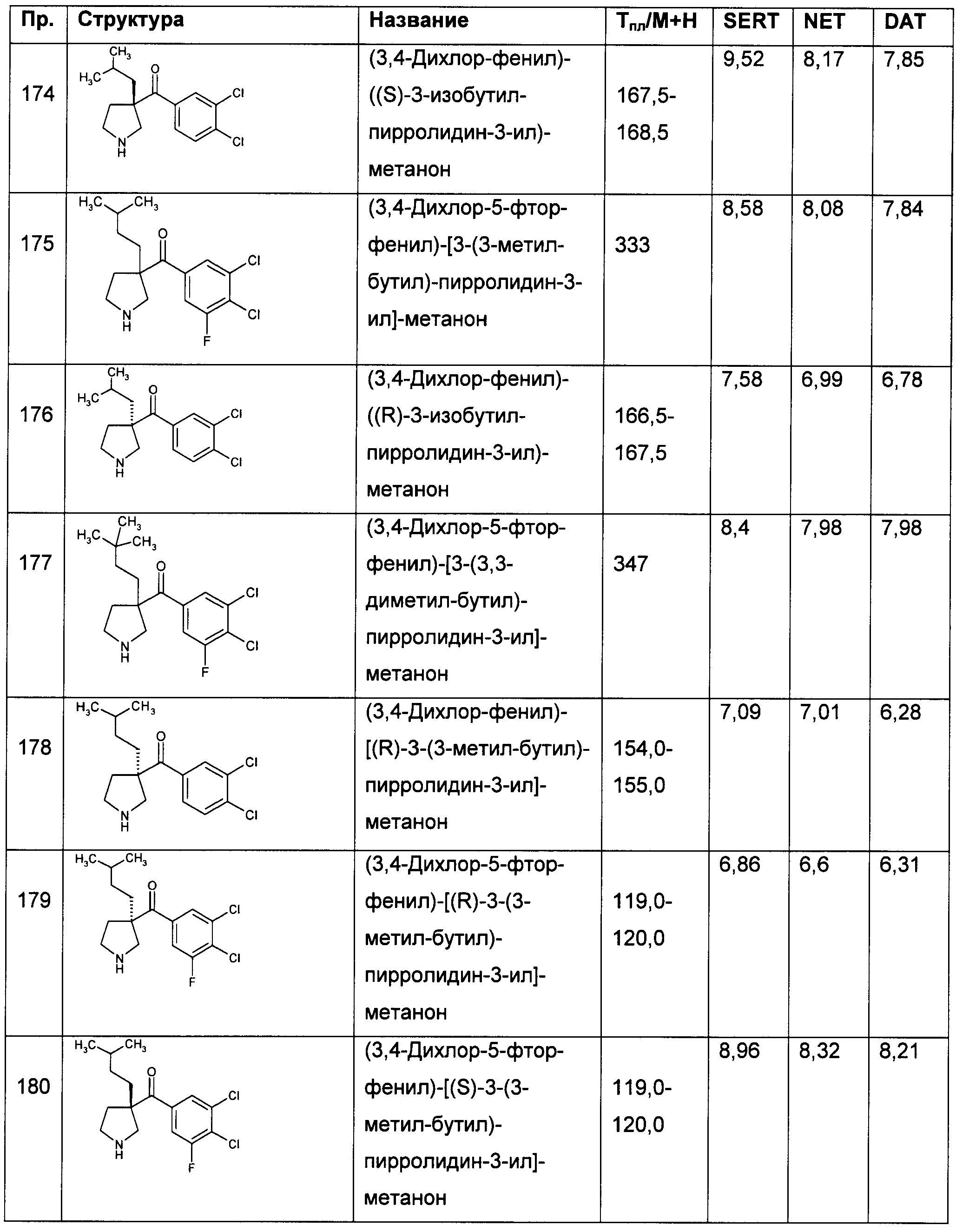
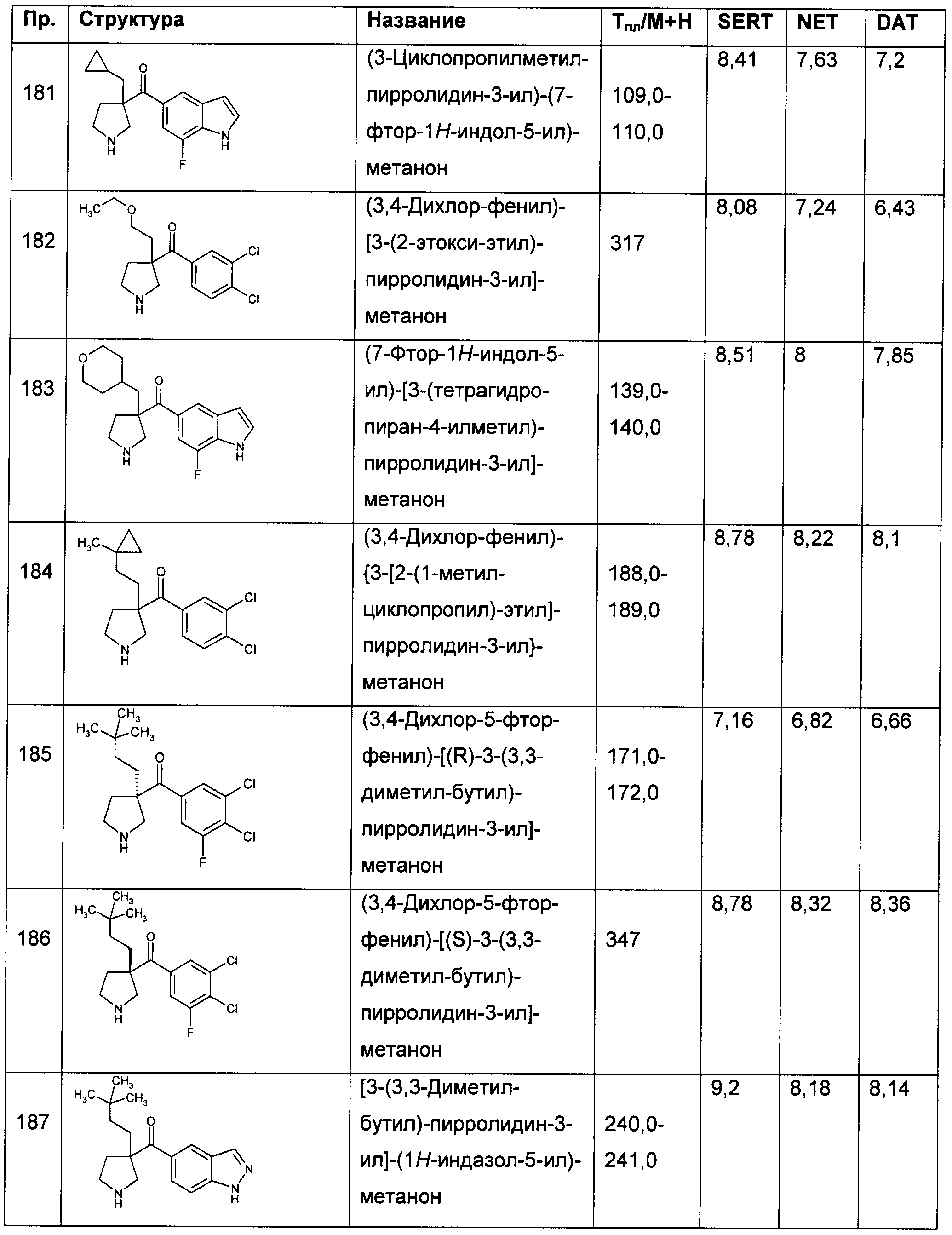
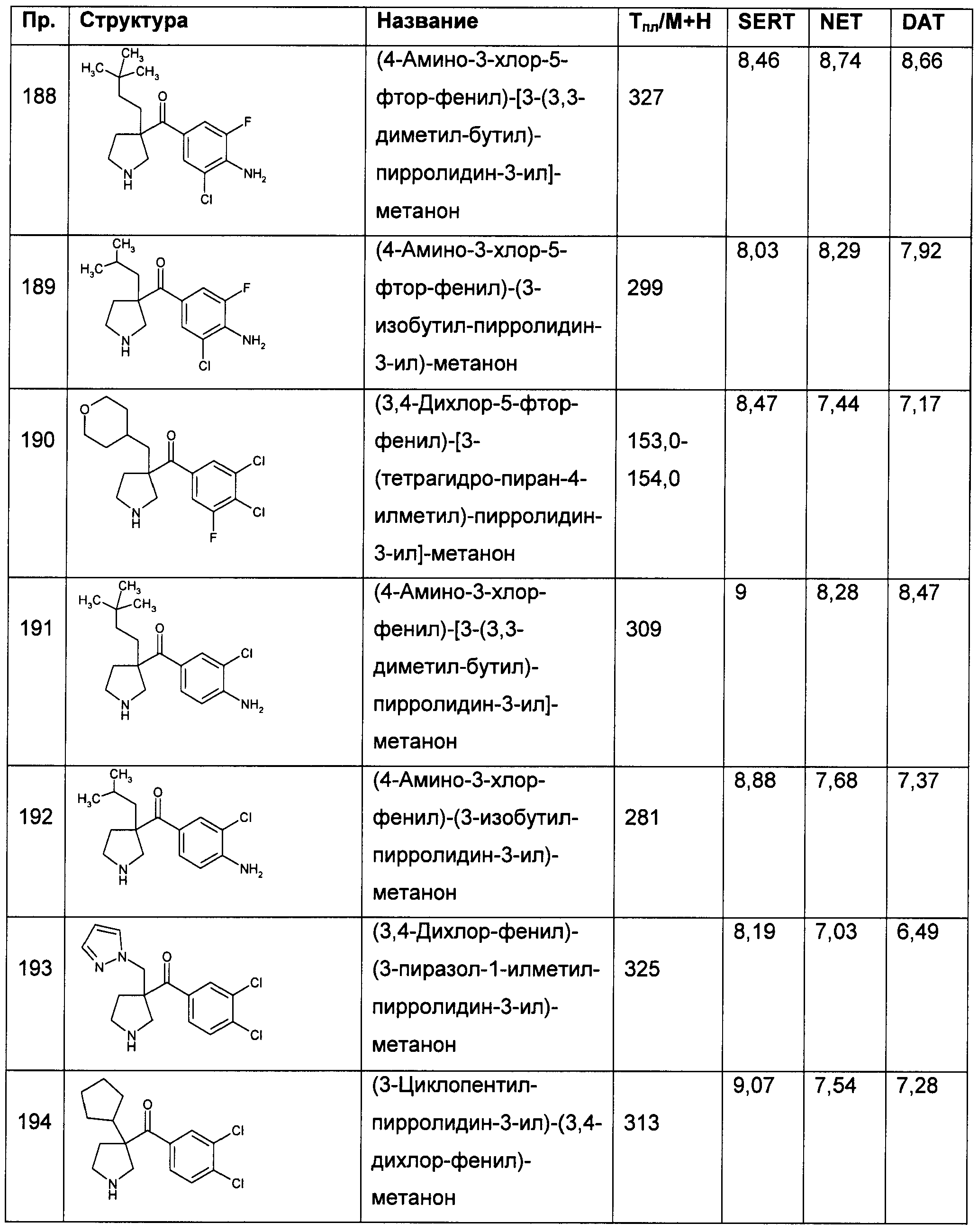
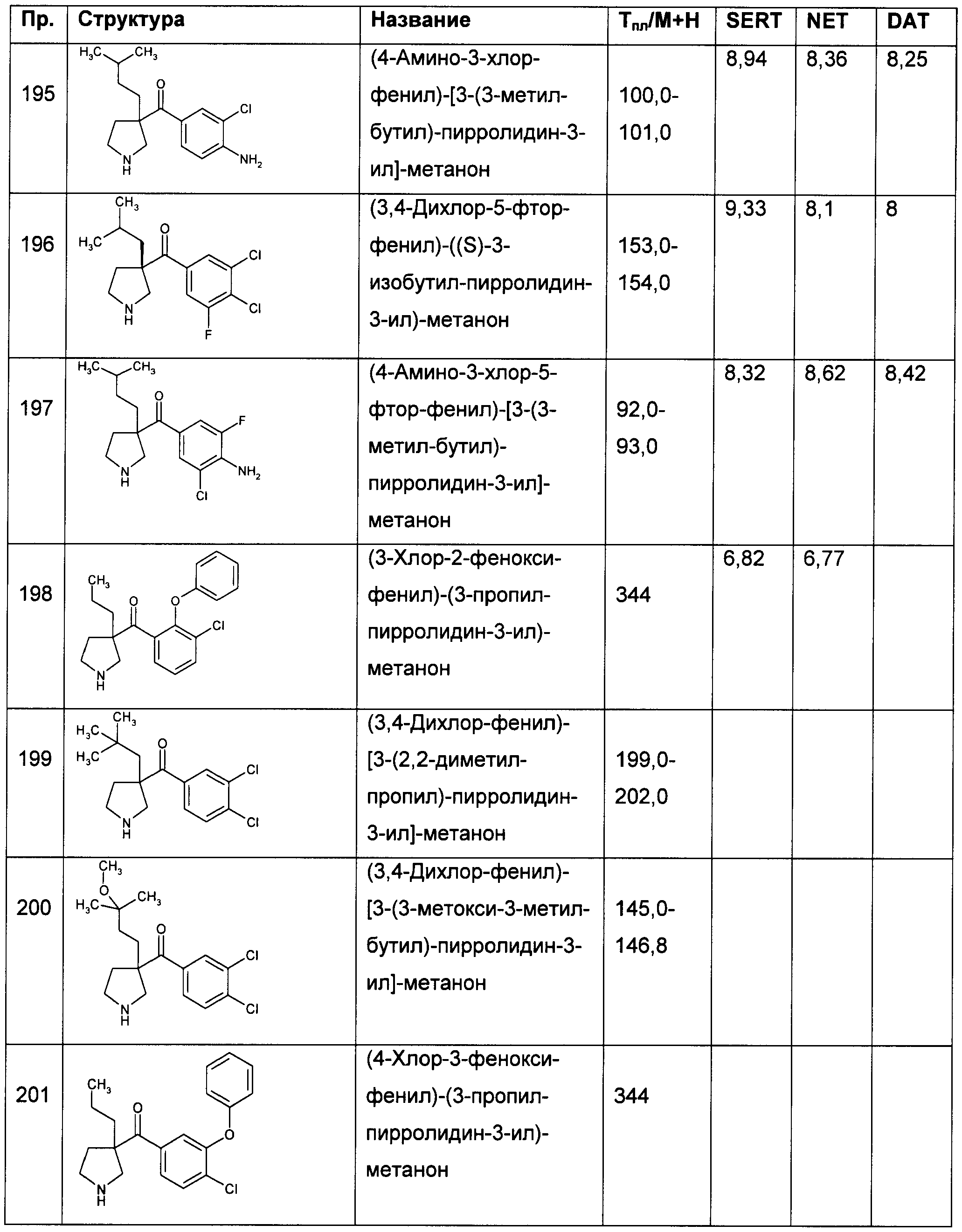
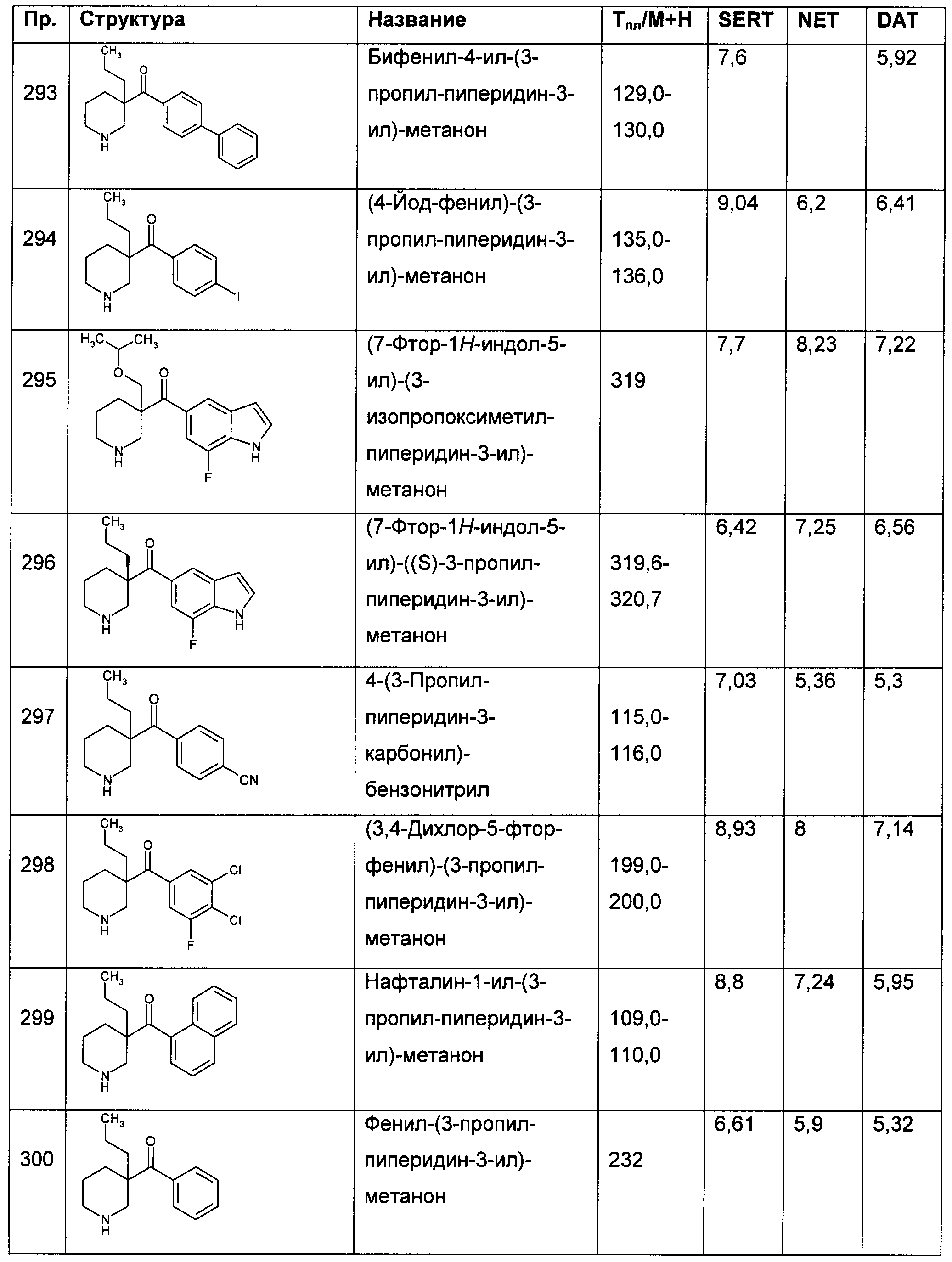
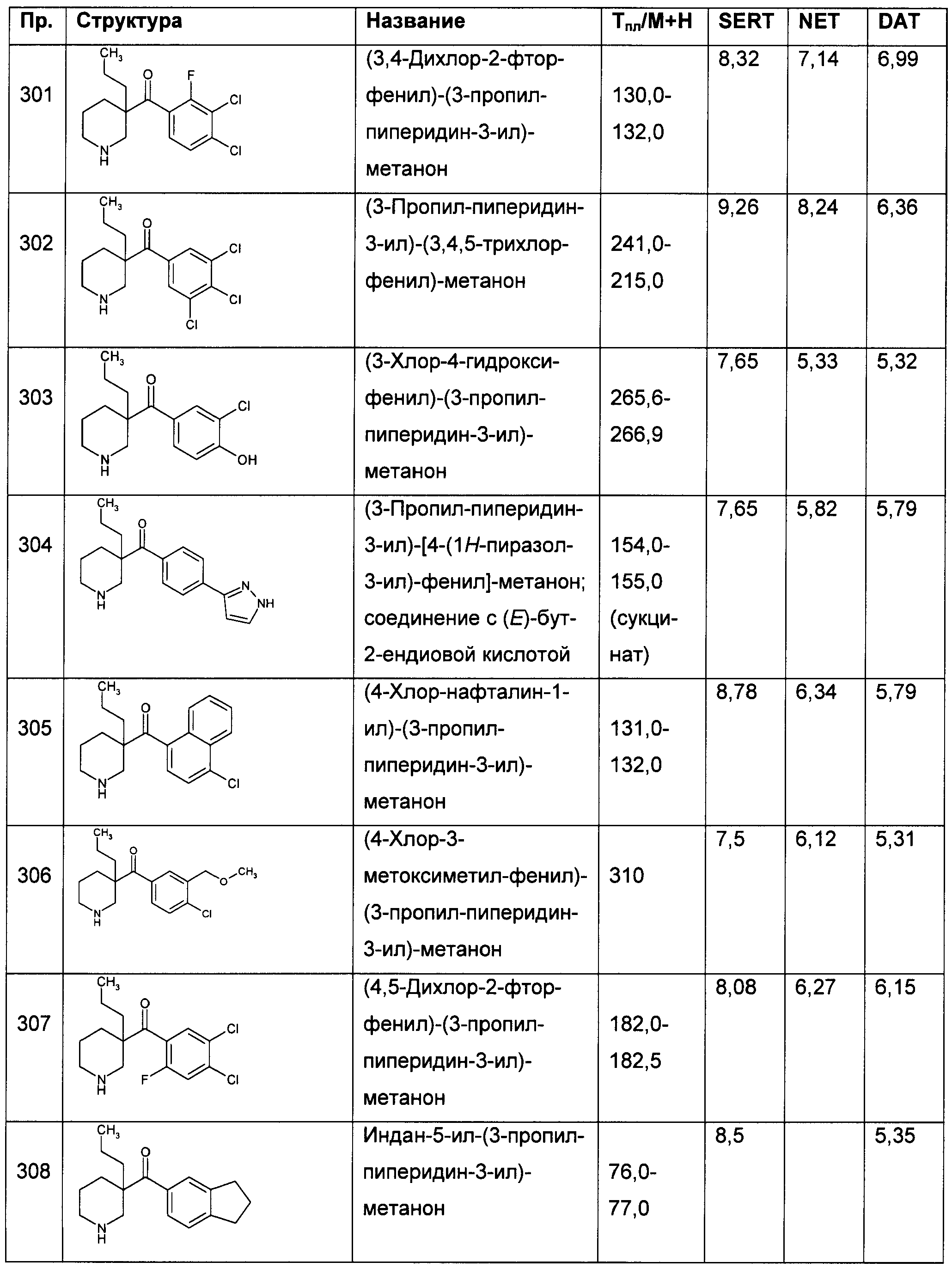
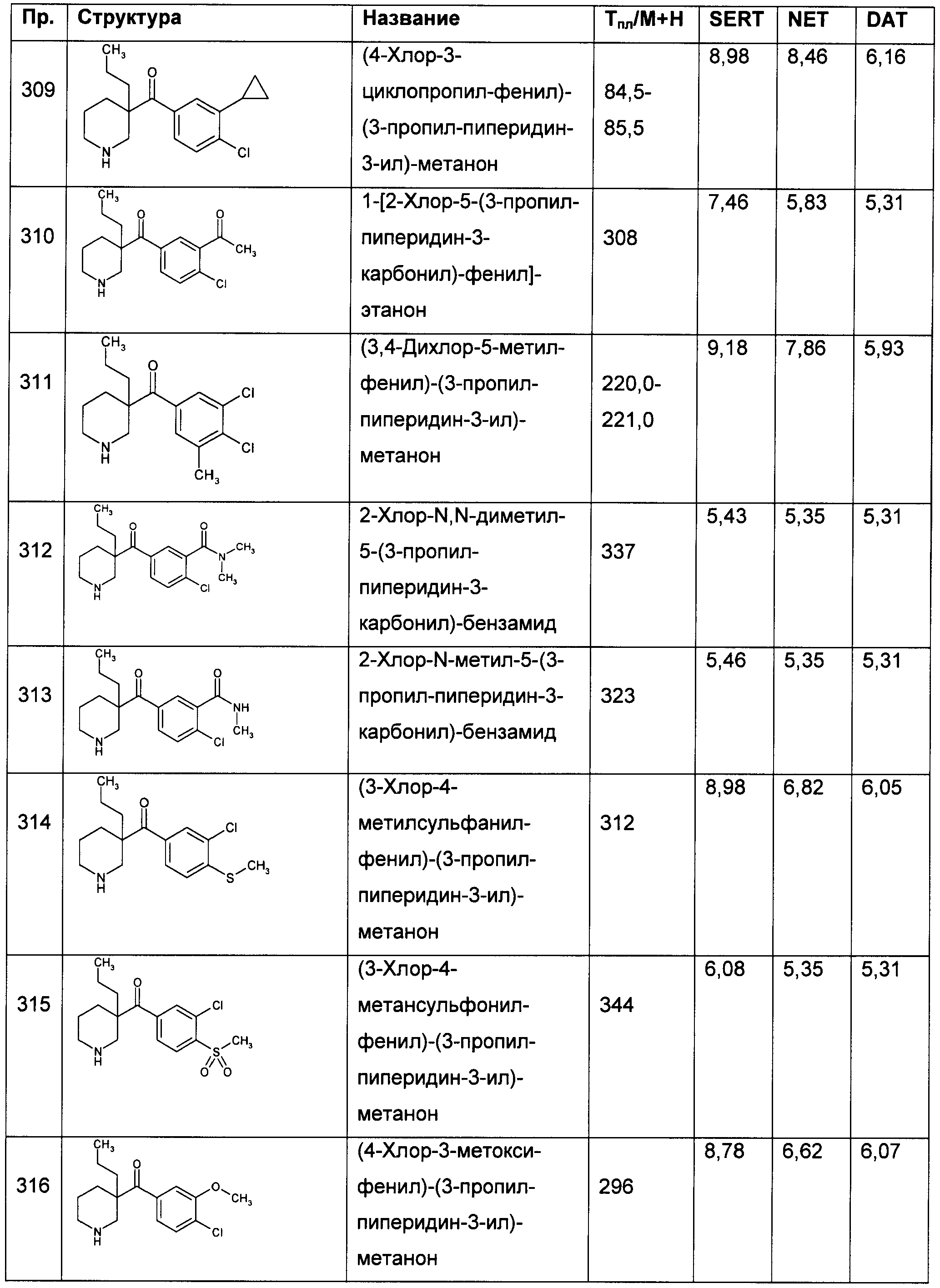
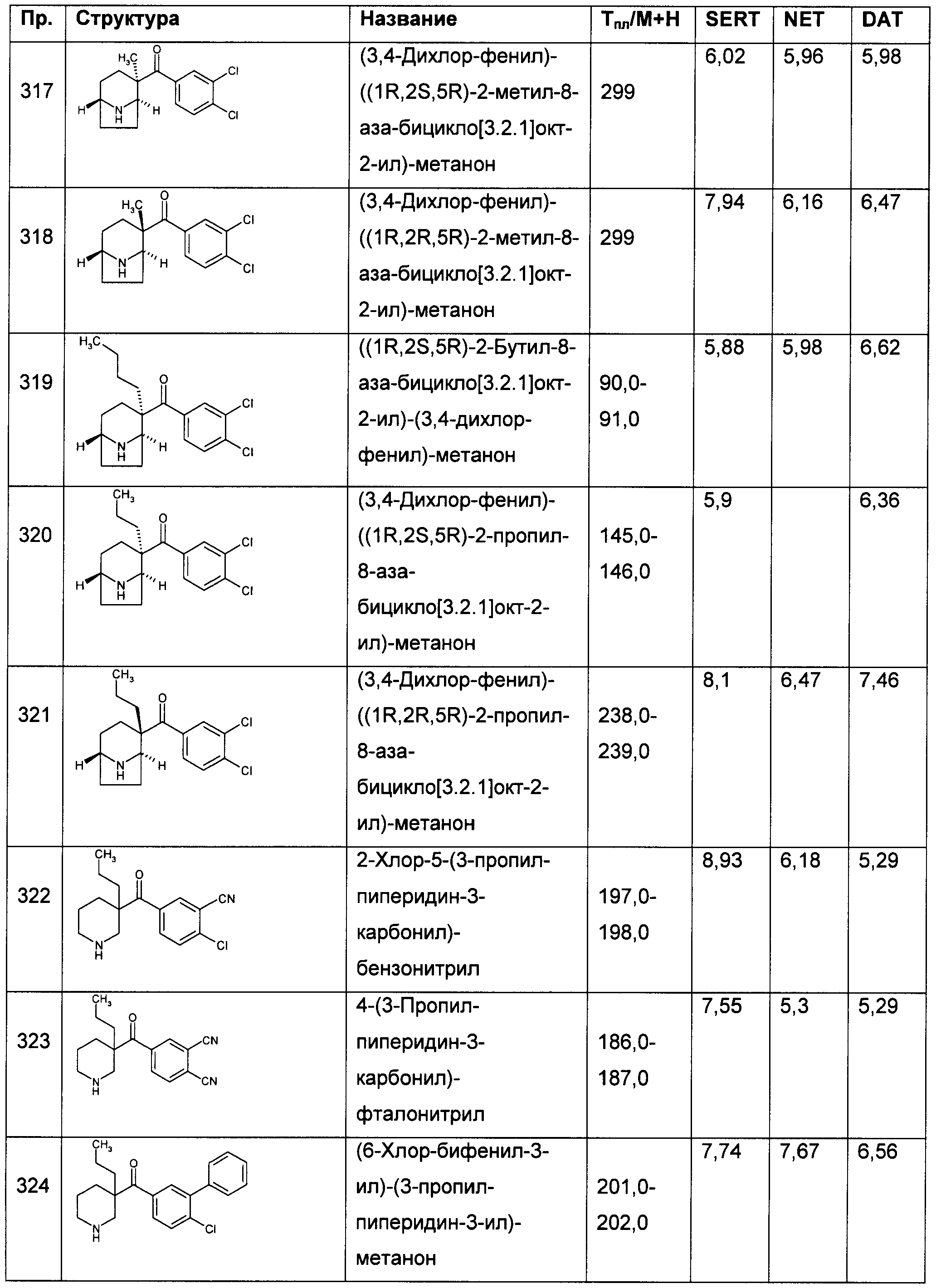
Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛПИРРОЛИДИНИЛ- И ПИПЕРИДИНИЛКЕТОНА
Вид РИД
Изобретение
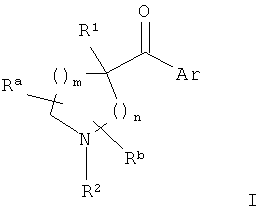
Изобретение относится к соединениям гетероарилпирролидинил- и пиперидинилкетона формулы I
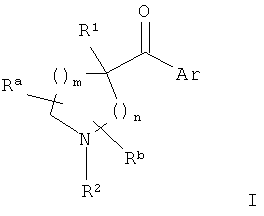
и их фармацевтически приемлемой соли,
где
m представляет собой 0-3;
n представляет собой 0-2;
Ar представляет собой:
возможно замещенный индолил;
возможно замещенный индазолил;
возможно замещенный азаиндолил;
возможно замещенный азаиндазолил;
возможно замещенный 2,3-дигидро-индолил;
возможно замещенный 1,3-дигидро-индол-2-он-ил;
возможно замещенный бензотиофенил;
возможно замещенный бензимидазолил;
возможно замещенный бензоксазолил;
возможно замещенный бензизоксазолил;
возможно замещенный бензотиазолил;
возможно замещенный бензизотиазолил;
возможно замещенный хинолинил;
возможно замещенный 1,2,3,4-тетрагидрохинолинил;
возможно замещенный хинолин-2-он-ил;
возможно замещенный изохинолинил;
возможно замещенный нафталинил;
возможно замещенный пиридинил;
возможно замещенный тиофенил;
возможно замещенный пирролил или
возможно замещенный фенил;
R1 представляет собой:
С1-6алкил;
С2-6алкенил;
С2-6алкинил;
гетеро-С1-6алкил;
гало-С1-6алкил;
гало-С2-6алкенил;
С3-7циклоалкил;
С3-7циклоалкил-С1-6алкил;
С1-6алкил-С3-6циклоалкил-С1-6алкил;
С1-6алкокси;
С1-6алкилсульфонил;
С1-6алкилсульфанил;
возможно замещенный арил;
возможно замещенный гетероарил;
гетероциклил-С1-6алкил;
арил-С1-3алкил, где арильная часть возможно замещена;
гетероарил-С1-3алкил, где гетероарильная часть возможно замещена;
арилокси;
арил-С1-6алкокси;
гетероарилокси или
гетероарил-С1-6алкокси;
R2 представляет собой:
водород или
С1-6алкил; и
каждый Ra и Rb независимо представляет собой:
водород;
С1-6алкил;
С1-6алкокси;
гало;
гидрокси или
оксо;
или Ra и Rb вместе образуют С1-2алкилен;
при условии, что, когда m представляет собой 1, n представляет собой 2 и Ar представляет собой возможно замещенный фенил, тогда R1 не является метилом или этилом.
Также согласно изобретению предложены фармацевтические композиции, способы применения и способы получения вышеупомянутых соединений.
В частности, соединения по настоящему изобретению являются полезными для лечения заболеваний, связанных с ингибиторами обратного захвата моноаминов.
Дефицит моноаминов долгое время связывали с депрессивными, анксиолитическими и другими расстройствами (см., например: Charney et al., J. Clin. Psychiatry (1998) 59, 1-14; Delgado et al., J. Clin. Psychiatry (2000) 67, 7-11; Resser et al., Depress. Anxiety (2000) 12 (Suppl 1) 2-19 и Hirschfeld et al., J. Clin. Psychiatry (2000) 61, 4-6). В частности, серотонин (5-гидрокситриптамин) и норэпинефрин считаются главными модулирующими нейромедиаторами, которые играют важную роль в регулировании настроения. Селективные ингибиторы обратного захвата серотонина (SSRls, от selective serotonin reuptake inhibitors), такие как флуоксетин, сертралин, пароксетин, флувоксамин, циталопрам и эсциталопрам, были предложены для лечения депрессивных расстройств (Masand et al., Harv. Rev. Psychiatry (1999) 7, 69-84). Ингибиторы обратного захвата норадреналина или норэпинефрина, такие как ребоксетин, атомоксетин, дезипрамин и нортриптилин, были предложены для эффективного лечения депрессивных расстройств и синдрома дефицита внимания и гиперактивности (Scates et al., Ann. Pharmacother. (2000) 34, 1302-1312; Tatsumi et al., Fur. J. Pharmacol. (1997) 340, 249-258).
Установлено, что усиление нейротрансмиссии серотонина и норэпинефрина является синергическим в фармакотерапии депрессивных и анксиолитических расстройств в сравнении с усилением только лишь нейротрансмиссии серотонина или норэпинефрина (Thase et al., Br. J. Psychiatry (2001) 178, 234, 241; Tran et al., J. Clin. Psychopharmacology (2003) 23, 78-86). Двойные ингибиторы обратного захвата и серотонина, и норэпинефрина, такие как дулоксетин, милнаципран и венлафаксин, в настоящее время разрабатываются для лечения депрессивных и анксиолитических расстройств (Mallinckrodt et al., J. Clin. Psychiatry (2003) 5(1) 19-28; Bymaster et al., Expert Opin. Investig. Drugs (2003) 12(4) 531-543). Двойные ингибиторы обратного захвата серотонина и норэпинефрина также обеспечивают возможное лечение шизофрении и других психозов, дискинезии, наркотической зависимости, когнитивных расстройств, болезни Альцгеймера, обсессивно-компульсивного поведения, синдрома нарушения внимания, приступов паники, социофобий, расстройств пищевого поведения, таких как ожирение, анорексия, булимия и «компульсивное переедание», стресса, гипергликемии, гиперлипидемии, неинсулинозависимого диабета, эпилептических заболеваний, таких как эпилепсия, и лечение состояний, связанных с неврологическим повреждением, полученным в результате инсульта, травмы мозга, церебральной ишемии, травмы головы и кровоизлияния. Двойные ингибиторы обратного захвата серотонина и норэпинефрина также обеспечивают возможные лечения расстройств и болезненных состояний мочевыводящих путей, боли и воспаления.
«Тройные» ингибиторы обратного захвата («антидепрессанты широкого спектра действия»), которые подавляют обратный захват норэпинефрина, серотонина и дофамина, недавно были признаны как полезные при лечении депрессии и других показаний ЦНС (Beer et al., J. Clinical Pharmacology (2004) 44: 1360-1367; Skohick et al., Eur J Pharmacol. (2003) Feb 14; 461(2-3): 99-104).
Также ингибиторы обратного захвата моноаминов применяются при лечении боли. Установлено, что серотонин играет роль в формировании боли в периферической нервной системе и участвует в периферической сенсибилизации и гипералгезии при воспалении и повреждении нерва (Sommer et al., Molecular Neurobiology (2004) 30(2), 117-125). Показано, что ингибитор обратного захвата серотонина-норэпинефрина дулоксетин является эффективным при лечении боли на модельных жифотных (Iyengar et al., J. Pharm. Exper. Therapeutics (2004, 311, 576-584).
Таким образом, существует потребность в соединениях, которые являются эффективными в качестве ингибиторов обратного захвата серотонина, ингибиторов обратного захвата норэпинефрина, ингибиторов обратного захвата дофамина, и/или двойных ингибиторов обратного захвата серотонина, норэпинефрина и/или дофамина, или тройных ингибиторов обратного захвата норэпинефрина, серотонина и дофамина, а также в способах получения и применения подобных соединений при лечении депрессивных, анксиолитических, мочеполовых, болевых и других расстройств. Настоящее изобретение удовлетворяет этим потребностям.
Если не указано иное, то следующие термины, используемые в данной заявке, включая описание и формулу изобретения, имеют приведенные ниже определения. Следует отметить, что используемые в описании и прилагаемой формуле изобретения формы единственного числа включают и формы множественного числа, если из контекста не следует иное.
«Агонист» относится к соединению, которое увеличивает активность другого соединения или сайта рецептора.
«Алкил» означает одновалентную линейную или разветвленную насыщенную углеводородную группировку, состоящую только из атомов углерода и водорода, имеющую от одного до двенадцати углеродных атомов.
«Низший алкил» относится к алкильной группе от одного до шести атомов углерода, т.е. С1-С6алкилу. Примеры алкильных групп включают, но не ограничиваются ими, метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил, н-гексил, октил, додецил и т.п. «Разветвленный алкил» означает изопропил, изобутил, трет-бутил и т.п.
«Алкилен» означает линейный насыщенный двухвалентный углеводородный радикал от одного до шести углеродных атомов или разветвленный насыщенный двухвалентный углеводородный радикал от трех до шести углеродных атомов, например метилен, этилен, 2,2-диметилэтилен, пропилен, 2-метилпропилен, бутилен, пентилен и т.п.
«Алкокси» означает группировку формулы -OR, где R представляет собой алкильную группировку, как определено здесь. Примеры алкокси группировок включают, но не ограничиваются ими, метокси, этокси, изопропокси, трет-бутокси и т.п.
«Алкоксиалкил» означает группировку формулы -R'-R'', где R' представляет собой алкилен и R'' представляет собой алкокси, как определено здесь. Типичные алкоксиалкильные группы включают в качестве примера 2-метоксиэтил, 3-метоксипропил, 1-метил-2-метоксиэтил, 1-(2-метоксиэтил)-3-метоксипропил и 1-(2-метоксиэтил)-3-метоксипропил.
«Алкилкарбонил» означает группировку формулы -C(O)-R', где R' представляет собой алкил, как определено здесь.
«Алкилсульфонил» означает группировку формулы -SO2-R', где R' представляет собой алкил, как определено здесь.
«Алкилсульфанил» означает группировку формулы -S-R', где R' представляет собой алкил, как определено здесь.
«Алкилсульфонилалкил» означает группировку формулы -Rb-SO2-Ra, где Ra представляет собой алкил и Rb представляет собой алкилен, как определено здесь. Типичные алкилсульфонилалкильные группы включают в качестве примера 3-метансульфонилпропил, 2-метансульфонилэтил, 2-метансульфонилпропил и т.п.
«Алкилсульфанилалкил» означает группировку формулы -Rb-S-Ra, где Ra представляет собой алкил и Rb представляет собой алкилен, как определено здесь.
«Алкилсульфонилокси» означает группировку формулы Ra-SO2-O-, где Ra представляет собой алкил, как определено здесь.
«Амино» означает группировку формулы -NRR', где каждый R и R' независимо представляет собой водород или алкил, как определено здесь. Таким образом, «амино» включает «алкиламино» (где один из R и R' представляет собой алкил и другой представляет собой водород) и «диалкиламино» (где оба R и R' представляют собой алкил).
«Алкилкарбониламино» означает группировку формулы -NR-C(O)-R', где R представляет собой водород или алкил, и R' представляет собой алкил, как определено здесь.
«Антагонист» относится к соединению, которое уменьшает или предупреждает действие другого соединения или сайта рецептора.
«Арил» означает одновалентную циклическую ароматическую углеводородную группировку, состоящую из моно-, би- или трицикпического ароматического кольца. Арильная группа может быть замещена, как определено здесь. Примеры арильных группировок включают, но не ограничиваются ими, возможно замещенные фенил, нафтил, фенантрил, флуоренил, инденил, азуленил, оксидифенил, бифенил, метилендифенил, аминодифенил, дифенилсульфидил, дифенилсульфонил, дифенилизопропилиденил, бензодиоксанил, бензодиоксилил, бензоксазинил, бензоксазинонил, бензопиперидинил, бензопиперазинил, бензопирролидинил, бензоморфолинил, метилендиоксифенил, этилендиоксифенил и подобные. Предпочтительные арилы включают возможно замещенный фенил и возможно замещенный нафтил.
«Арилокси» означает группировку формулы -OR, где R представляет собой арильную группировку, как определено здесь.
«Арилалкил» и «аралкил», которые могут быть использованы взаимозаменяемо, означают радикал -RaRb, где Ra представляет собой алкиленовую группу и Rb представляет собой арильную группу, как определено здесь; например фенилалкилы, такие как бензил, фенилэтил, 3-(3-хлорфенил)-2-метилпентил и т.п., являются примерами арилалкилов.
«Аралкокси» означает группировку формулы -OR, где R представляет собой аралкильную группировку, как определено здесь.
«Азаиндолил» означает группу формулы 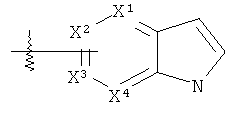 , где один или два любых Х1, Х2, Х3 и Х4 представляют собой N (аза) и другие являются углеродами.
, где один или два любых Х1, Х2, Х3 и Х4 представляют собой N (аза) и другие являются углеродами.
«Азаиндолы» могут быть замещены, как определено здесь для гетероарилов, в положении 1, 2 и 3 и в любом из положений 4 - вплоть до седьмого, которые не являются азотом. Таким образом, «азаиндолил» включает: «пирролопиримидины» вышеприведенной формулы, где Х2 и X4 представляют собой N; «пирролопиримидины» вышеприведенной формулы, где Х1 и Х3 представляют собой N; «пирролопиразины» вышеприведенной формулы, где Х1 и Х4 представляют собой N; «пирролопиридины» вышеприведенной формулы, где Х1 представляет собой N; «пирролопиридины» вышеприведенной формулы, где Х2 представляет собой N; «пирролопиридины» вышеприведенной формулы, где Х3 представляет собой N и «пирролопиридины» вышеприведенной формулы, где X4 представляет собой N. Одним предпочтительным азаиндолилом является 7-азаиндолил (Х1, Х2, Х3=С и X4=N) или пирроло[2,3-b]пиридинил. Другим предпочтительным азаиндолом является 4-азаиндолил или пирроло[3,2-b]пиридинил.
«Азаиндазолил» означает группу формулы 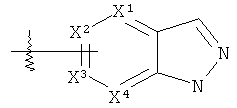 , где один или два любых Х1, Х2, Х3 и Х4 представляют собой N (аза) и другие являются углеродами. «Азаиндазолы» могут быть замещены, как определено здесь для гетероарилов, в положении 1, 2 и 3 и в любом из положений 4 - вплоть до седьмого, которые не являются азотом. Таким образом, «азаиндазолил» включает: «пиразолопиримидины» вышеприведенной формулы, где Х2 и X4 представляют собой N; «пиразолопиримидины» вышеприведенной формулы, где Х1 и Х3 представляют собой N; «пиразолопиразины» вышеприведенной формулы, где Х1 и X4 представляют собой N; «пиразолопиридины» вышеприведенной формулы, где Х1 представляет собой N; «пиразолопиридины» вышеприведенной формулы, где Х2 представляет собой N; «пиразолопиридины» вышеприведенной формулы, где Х3 представляет собой N, и «пиразолопиридины» вышеприведенной формулы, где Х4 представляет собой N.
, где один или два любых Х1, Х2, Х3 и Х4 представляют собой N (аза) и другие являются углеродами. «Азаиндазолы» могут быть замещены, как определено здесь для гетероарилов, в положении 1, 2 и 3 и в любом из положений 4 - вплоть до седьмого, которые не являются азотом. Таким образом, «азаиндазолил» включает: «пиразолопиримидины» вышеприведенной формулы, где Х2 и X4 представляют собой N; «пиразолопиримидины» вышеприведенной формулы, где Х1 и Х3 представляют собой N; «пиразолопиразины» вышеприведенной формулы, где Х1 и X4 представляют собой N; «пиразолопиридины» вышеприведенной формулы, где Х1 представляет собой N; «пиразолопиридины» вышеприведенной формулы, где Х2 представляет собой N; «пиразолопиридины» вышеприведенной формулы, где Х3 представляет собой N, и «пиразолопиридины» вышеприведенной формулы, где Х4 представляет собой N.
«Цианоалкил» означает группировку формулы -R'-R'', где R' представляет собой алкилен, как определено здесь, и R'' представляет собой циано или нитрил.
«Циклоалкил» означает одновалентную насыщенную карбоциклическую группировку, состоящую из моно- или бициклических колец. Циклоалкил может быть замещен одним или более заместителями, где каждый заместитель независимо друг от друга представляет собой гидрокси, алкил, алкокси, гало, галоалкил, амино, моноалкиламино или диалкиламино, если иное не указано особо. Примеры циклоалкильных группировок включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.п., включая их частично ненасыщенные производные.
«Циклоалкилокси» и «циклоалкокси», которые могут быть использованы взаимозаменяемо, означают группу формулы -OR, где R представляет собой циклоалкил, как определено здесь. Типичные циклоалкилокси включают цикпопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и т.п.
«Циклоалкилалкил» означает группировку формулы -R-R'', где R' представляет собой алкилен и R'' представляет собой циклоалкил, как определено здесь.
«Алкилциклоалкилалкил» означает группировку формулы
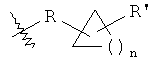
где n представляет собой 1-4, R представляет собой алкилен и R' представляет собой алкил, как определено здесь. Типичным алкилциклоалкилалкилом является 2-(1-метил-циклопропил)-этил. Типичные алкилциклоалкилалкилы включают 2-(1-метил-циклопропил)-этил и 3-(1-метил-циклопропилметил).
«Циклоалкилалкилокси» и «циклоалкилалкокси», которые могут быть использованы взаимозаменяемо, означают группу формулы -OR, где R представляет собой циклоалкилалкил, как определено здесь. Типичные циклоалкилалкокси включают циклопропилметокси, циклобутилметокси, циклопентилметокси, циклогексилметокси и т.п.
«Гетероалкил» означает алкильный радикал, как определено здесь, включая разветвленный С4-С7-алкил, где один, два или три атома водорода замещены заместителями, независимо друг от друга выбранными из группы, состоящей из -ORa, -NRbRc и -S(O)nRd (где n является целым числом от 0 до 2), исходя из предположения, что присоединение гетероалкильного радикала происходит через атом углерода, где Ra представляет собой водород, ацил, алкил, циклоалкил или циклоалкилалкил; Rb и Rc независимо друг от друга представляют собой водород, ацил, алкил, циклоалкил или циклоалкилалкил; и когда n представляет собой 0, Rd является водородом, алкилом, циклоалкилом или циклоалкилалкилом, и когда п представляет собой 1 или 2, Rd представляет собой алкил, циклоалкил, циклоалкилалкил, амино, ациламино, моноалкиламино или диалкиламино. Характерные примеры включают, но не ограничиваются ими, 2-гидроксиэтил, 3-гидроксипропил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксипропил, 1-гидроксиметилэтил, 3-гидроксибутил, 2,3-дигидроксибутил, 2-гидрокси-1-метилпропил, 2-аминоэтил, 3-аминопропил, 2-метилсульфонилэтил, аминосульфонилметил, аминосульфонилэтил, аминосульфонилпропил, метиламиносульфонилметил, метиламиносульфонилэтил, метиламиносульфонилпропил и т.п.
«Гетероарил» означает моноциклический, бициклический или трициклический радикал с 5-12 кольцевыми атомами, имеющий по меньшей мере одно ароматическое кольцо, содержащий один, два или три кольцевых гетероатома, выбранных из N, О или S, причем остальные кольцевые атомы представляют собой С, исходя из предположения, что точка присоединения гетероарильного радикала будет на ароматическом кольце. Гетероарильное кольцо может быть замещено, как определено здесь. Примеры гетероарильных группировок включают, но не ограничиваются ими, возможно замещенные имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиразинил, пиридазинил, тиофенил, фуранил, пиранил, пиридинил, пирролил, пиразолил, пиримидил, хинолинил, изохинолинил, хиназолинил, бензофуранил, бензотиофенил, бензотиопиранил, бензимидазолил, бензоксазолил, бензоксадиазолил, бензотиазолил, бензотиадиазолил, бензопиранил, индолил, изоиндолил, индазолил, триазолил, триазинил, хиноксалинил, пуринил, хиназолинил, хинолизинил, нафтиридинил, птеридинил, карбазолил, азепинил, диазепинил, акридинил и т.п.
«Гетероарилалкил» и «гетероаралкил», которые могут быть использованы взаимозаменяемо, означают радикал -RaRb, где Ra представляет собой алкиленовую группу и Rb представляет собой гетероарильную группу, как определено здесь.
Термины «гало» и «галоген», которые могут быть использованы взаимозаменяемо, относятся к заместителю фтор, хлор, бром или йод.
«Галоалкил» означает алкил, как определено здесь, в котором один или более водородов замещены одним и тем же или разными галогенами. Типичные галоалкилы включают -CH2Cl, -CH2CF3, -CH2CCl3, перфторалкил (например, -CF3) и т.п.
«Галоалкокси» означает группировку формулы -OR, где R представляет собой галоалкильную группировку, как определено здесь. Примеры галоалкокси группировок включают, но не ограничиваются ими, трифторметокси, дифторметокси, 2,2,2-трифторэтокси и т.п.
«Гидроксиалкил» относится к подгруппе гетероалкилов и относится в частности к алкильной группировке, как определено здесь, которая замещена одной или более, предпочтительно одной, двумя или тремя гидрокси-группами, при условии, что один и тот же атом углерода не связан более чем с одной гидрокси-группой. Характерные примеры включают, но не ограничиваются ими, гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 1-(гидроксиметил)-2-метилпропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксибутил, 3,4-дигидроксибутил и 2-(гидроксиметил)-3-гидроксипропил.
«Гетероциклоамино» означает насыщенный цикл, где по меньшей мере один атом в цикле является N, NH или N-алкилом и остальные атомы в цикле образуют алкиленовую группу.
«Гетероциклил» означает одновалентную насыщенную группировку, состоящую из одного-трех циклов, включающую один, два, три или четыре гетероатома (выбранных из азота, кислорода или серы). Гетероциклильное кольцо может быть замещено, как определено здесь. Примеры гетероциклильных группировок включают, но не ограничиваются ими, возможно замещенные пиперидинил, пиперазинил, гомопиперазинил, азепанил, пирролидинил, пиразолидинил, имидазолинил, имидазолидинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, тиадиазолидинил, бензотиазолидинил, бензоазолидинил, дигидрофуранил, тетрагидрофурил, дигидропиранил, тетрагидропиранил, тиаморфолинил, тиаморфолинилсульфоксид, тиаморфолинилсульфон, дигидрохинолинил, дигидроизохинолинил, тетрагидрохинолинил, тетрагидроизохинолинил и т.п. Предпочтительные гетероциклилы включают тетрагидропиранил, тетрагидрофуранил, пиперидинил, пиперазинил и пирролидинил.
«Возможно замещенный», когда используется по отношению к «арилу», «фенилу», «гетероарилу» (включая индолил, такой как индол-1-ил, индол-2-ил и индол-3-ил, 2,3-дигидроиндолил, такой как 2,3-дигидроиндол-1-ил, 2,3-дигидроиндол-2-ил и 2,3-дигидроиндол-3-ил, индазолил, такой как индазол-1-ил, индазол-2-ил и индазол-3-ил, бензимидазолил, такой как бензимидазол-1-ил и бензимидазол-2-ил, бензотиофенил, такой как бензотиофен-2-ил и бензотиофен-3-ил, бензоксазол-2-ил, бензотиазол-2-ил, тиенил, фуранил, пиридинил, пиримидинил, пиридазинил, пиразинил, оксазолил, тиазолил, изоксазолил, изотиазолил, имидазолил, пиразолил и хинолинил) или «гетероциклилу», означает арил, фенил, гетероарил или гетероциклил, который возможно замещен независимо одним-четырьмя заместителями, предпочтительно одним или двумя заместителями, выбранными из алкила, цикпоалкила, алкокси, гало, галоалкила, галоалкокси, циано, нитро, гетероалкила, амино, ациламино, моноалкиламино, диалкиламино, гидроксиалкила, алкоксиалкила, бензилокси, циклоалкилалкила, циклоалкокси, циклоалкилалкокси, алкилсульфонилокси, возможно замещенного тиофенила, возможно замещенного пиразолила, возможно замещенного пиридинила, морфолинокарбонила, -(CH2)q-S(O)rRf; -(CH2)q-NRgRh; -(CH2)q-C(=O)-NRgRh; -(CH2)q-C(=O)-C(=O)-NRgRh; -(CH2)q-SO2-NRgRh, -(CH2)q-N(Rf)-C(=O)-Ri; -(CH2)q-C(=O)-Ri или -(CH2)q-N(Rf)-SO2-Rg, где q является 0 или 1, r представляет собой 0-2, каждый Rf, Rg и Rh независимо представляет собой водород или алкил, и каждый Ri независимо представляет собой водород, алкил, гидрокси или алкокси. Определенные предпочтительные возможные заместители для «арила», «фенила», «гетероарила», «циклоалкила» или «гетероциклила» включают алкил, гало, галоалкил, алкокси, циано, амино и алкилсульфонил. Более предпочтительными заместителями являются метил, фтор, хлор, трифторметил, метокси, амино и метансульфонил.
«Уходящая группа» означает группу в значении, традиционно связанном с ней в синтетической органической химии, т.е. атом или группу, замещаемую в условиях реакции замещения. Примеры уходящих групп включают, но не ограничиваются ими, галоген, алкан- или ариленсульфонилокси, такие как метансульфонилокси, этансульфонилокси, тиометил, бензолсульфонилокси, тозилокси и тиенилокси, дигалофосфиноилокси, возможно замещенный бензилокси, изопропилокси, ацилокси и т.п.
«Модулятор» означает молекулу, которая взаимодействует с мишенью. Эти взаимодействия включают, но не ограничиваются ими, агонист, антагонист и т.п., как определено здесь.
«Возможный» или «возможно» означает, что далее описанное событие или обстоятельство может произойти, но не требуется, и что описание включает случаи, когда событие или обстоятельство происходит, и случаи, при которых оно не происходит.
«Заболевание» и «болезненное состояние» означает любое заболевание, состояние, симптом, расстройство или показание.
«Инертный органический растворитель» или «инертный растворитель» означает, что растворитель инертен при условиях реакции, описываемой в связи с этим, включая например бензол, толуол, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, хлороформ, метиленхлорид или дихлорметан, дихлорэтан, диэтиловый эфир, этилацетат, ацетон, метилэтилкетон, метанол, этанол, пропанол, изопропанол, трет-бутанол, диоксан, пиридин и т.п. Если не оговорено иное, то растворители, используемые в реакциях по настоящему изобретению, являются инертными растворителями.
«Фармацевтически приемлемый» означает, что это является пригодным при получении фармацевтической композиции, что в целом является безопасным, нетоксичным и не является нежелательным ни биологически, ни как-либо иначе неподходящим, и включает то, что является приемлемым для фармацевтического применения как в ветеринарии, так и для человека.
«Фармацевтически приемлемые соли» соединения означает соли, которые являются фармацевтически приемлемыми, как определено здесь, и которые обладают требуемой фармакологической активностью исходного соединения. Такие соли включают:
кислотно-аддитивные соли, образованные неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или образованные органическими кислотами, такими как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюкогептиловая кислота, глюконовая кислота, глутаминовая кислота, гликолевая кислота, гидроксинафтойная кислота, 2-гидроксиэтансульфоновая кислота, молочная кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, муконовая кислота, 2-нафталенсульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, винная кислота, п-толуолсульфоновая кислота, триметилуксусная кислота и т.п.; или соли, образованные либо при замещении кислотного протона в исходном соединении ионом металла, например ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; или при координации с органическим или неорганическим основанием. Приемлемые органические основания включают диэтаноламин, этаноламин, N-метилглюкамин, триэтаноламин, трометамин и т.п. Приемлемые неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия.
Предпочтительные фармацевтически приемлемые соли являются солями, образованными из уксусной кислоты, соляной кислоты, серной кислоты, метансульфоновой кислоты, малеиновой кислоты, фосфорной кислоты, винной кислоты, лимонной кислоты, натрия, калия, кальция, цинка и магния.
Следует понимать, что все ссылки на фармацевтически приемлемые соли включают формы включения растворителя (сольваты) или кристаллические формы (полиморфы), как определено здесь, той же кислотно-аддитивной соли.
«Защитная группа» или «блокирующая группа» означает группу, которая избирательно блокирует один реакционный центр в многофункциональном соединении, так чтобы химическую реакцию можно было проводить селективно по другому незащищенному реакционному центру в значении, традиционно связанном с ним в синтетической химии. Конкретные способы по данному изобретению основываются на защитных группах, чтобы блокировать реакционно-способные атомы азота и/или кислорода, присутствующие в реагирующих веществах. Например, термины «амино-защитная группа» и «азот-защитная группа» используются здесь взаимозаменяемо и относятся к тем органическим группам, которые предназначены защитить атом азота от нежелательных реакций в процессе синтеза. Типичные азот-защитные группы включают, но не ограничиваются ими, трифторацетил, ацетамидо, бензил (Bn), бензилоксикарбонил (карбобензилокси, CBZ), п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, трет-бутоксикарбонил (ВОС) и т.п. Квалифицированные специалисты знают, как выбрать группу для облегчения удаления и для возможности препятствовать следующим реакциям.
«Сольваты» означают формы включения растворителя, которые содержат либо стехиометрическое, либо нестехиометрическое количество растворителя. Некоторые соединения имеют тенденцию улавливать фиксированное молярное отношение молекул растворителя в кристаллическом твердом состоянии, таким образом образуя сольват. Если растворителем является вода, то образующийся сольват представляет собой гидрат, когда растворителем является спирт, то образующийся сольват представляет собой алкоголят. Гидраты образуются при сочетании одной или нескольких молекул воды с одним из соединений, в котором вода сохраняется в своем молекулярном состоянии в виде H2O, подобное сочетание способно образовывать один или более гидратов.
«Субъект» означает млекопитающих и немлекопитающих. Млекопитающие означают любого представителя класса млекопитающих, включая, но не ограничиваясь этим, человека; нечеловеческие приматы, такие как шимпанзе и другие виды обезьян и мартышек; сельскохозяйственные животные, такие как крупнорогатый скот, лошади, овцы, козы и свиньи; домашние животные, такие как кролики, собаки и кошки; лабораторные животные, включая грызунов, такие как крысы, мыши и морские свинки, и т.п. Примеры немлекопитающих включают, но не ограничиваются этим, птиц и т.п. Термин «субъект» не указывает на конкретный возраст и пол.
«Болезненные состояния», связанные с нейротрансмиссией серотонина, норэпинефрина и/или дофамина, включают депрессивные и анксиолитические расстройства, а также шизофрению и другие психозы, дискинезию, наркотическую зависимость, когнитивные расстройства, болезнь Альцгеймера, синдром дефицита внимания, такой как СДВГ, обсессивно-компульсивное поведение, приступы паники, социофобии, расстройства пищевого поведения, такие как ожирение, анорексия, булимия и «компульсивное переедание», стресс, гипергликемию, гиперлипидемию, неинсулинозависимый диабет, эпилептические заболевания, такое как эпилепсия, и лечение состояний, связанных с неврологическим повреждением, полученным в результате инсульта, травмы мозга, церебральной ишемии, травмы головы, кровоизлияния, и расстройства и болезненные состояния мочевыводящих путей. «Болезненные состояния», связанные с нейротрансмиссией серотонина, норэпинефрина и/или дофамина, также включают воспалительные состояния у субъекта. Соединения по изобретению вероятно полезны для лечения артрита, включая, но не ограничиваясь этим, ревматоидный артрит, спондилоартропатии, подагрический артрит, остеоартрит, системную красную волчанку и ювенильный артрит, остеоартрит, подагрический артрит и другие артритные состояния.
Как используется здесь, «депрессия» включает, но не ограничивается этим, большую депрессию, продолжительную депрессию, дистимию, психические состояния подавленного настроения, характеризующиеся чувствами грусти, отчаяния, уныния, тоски, меланхолии, ощущениями заниженной самооценки, вины и самообвинения, уход от межличностного контакта и соматические симптомы, такие как нарушения пищевого поведения и сна.
Как используется здесь, «тревога» включает, но не ограничивается этим, неприятные или нежелательные эмоциональные состояния, связанные с психофизиологическими откликами на ожидание нереальной, воображаемой или преувеличенной опасности или ущерба, и физические сопутствующие симптомы, такие как усиленный сердечный ритм, измененная частота дыхания, потение, дрожь, слабость и усталость, чувства грозящей опасности, бессилия, страха и напряжения.
«Расстройства мочевыводящих путей» или «уропатия», используемые взаимозаменяемо с «симптомами мочевыводящих путей», означают патологические изменения в мочевыводящих путях. Примеры расстройств мочевыводящих путей включают, но не ограничиваются ими, недержание мочи при напряжении, неотложное недержание мочи, доброкачественную гиперплазию предстательной железы (ДГПЖ), простатит, гиперрефлексию детрузора, обструкцию выходного отверстия, частое мочеиспускание, никтурию, неотложный позыв к мочеиспусканию, гиперактивный мочевой пузырь, тазовую гиперчувствительность, уретрит, простатодинию, цистит, идиопатическую гиперчувствительность мочевого пузыря и т.п.
«Болезненные состояния, связанные с мочевыводящими путями», или «болезненные состояния мочевыводящих путей», или «уропатия», используемые взаимозаменяемо с «симптомами мочевыводящих путей», означают патологические изменения в мочевыводящих путях, или дисфункцию гладкой мышцы мочевого пузыря или ее иннервацию, вызывающую расстройство накопления или выделения мочи. Симптомы мочевыводящих путей включают, но не ограничиваются этим, гиперактивный мочевой пузырь (также известный как гиперактивность детрузора), обструкцию выходного отверстия, недостаточность выходного отверстия и тазовую гиперчувствительность.
«Гиперактивный мочевой пузырь» или «гиперактивность детрузора» включает, но не ограничивается этим, симптоматически проявляющиеся изменения, такие как неотложный позыв к мочеиспусканию, частое мочеиспускание, изменение емкости мочевого пузыря, недержание мочи, порог мочеиспускания, нестабильные сокращения мочевого пузыря, сфинктерная спастичность, гиперрефлексия детрузора (нейрогенный мочевой пузырь), нестабильность детрузора и т.п.
«Обструкция выходного отверстия» включает, но не ограничивается этим, доброкачественную гиперплазию предстательной железы (ДГПЖ), стриктуру уретры, опухоли, низкую скорость потока мочи, трудности в возникновении позывов к мочеиспусканию, неотложный позыв к мочеиспусканию, боль в надлобковой области и т.п.
«Недостаточность выходного отверстия» включает, но не ограничивается этим, гипермобильность уретры, врожденный дефект сфинктера, смешанное недержание мочи, недержание мочи при напряжении и т.п.
«Тазовая гиперчувствительность» включает, но не ограничивается этим, тазовую боль, интерстициальный (клеток) цистит, простатодинию, простатит, вульводинию, уретрит, орхиалгию, гиперактивный мочевой пузырь и т.п.
«Боль» означает более или менее локальное ощущение дискомфорта, дистресс или агонию, возникающие вследствие раздражения определенных нервных окончаний. Существует много видов боли, включая, но не ограничиваясь этим, стреляющие боли, фантомные боли, дергающие боли, острую боль, боль при воспалении, невропатическую боль, комплексный регионарный болевой синдром, невралгию, невропатию и т.п. (Dorland's Illustated Medifical Dictionary, 28-oe издание, W.В.Saunders Company, Philadelphia, PA). Цель лечения боли заключается в том, чтобы уменьшить степень остроты боли, испытываемой субъектом, подвергающимся лечению.
«Невропатическая боль» означает боль, возникающую вследствие функциональных нарушений и/или патологических изменений, а также невоспалительных поражений в периферической нервной системе. Примеры невропатической боли включают, но не ограничиваются этим, температурную или механическую гипералгезию, температурную или механическую аллодинию, диабетическую боль, боль при ущемлении и т.п.
«Терапевтически эффективное количество» означает количество соединения, которое, когда вводится субъекту для лечения болезненного состояния, является достаточным, чтобы осуществить подобное лечение болезненного состояния. «Терапевтически эффективное количество» зависит от соединения, подвергаемого лечению болезненного состояния, тяжести или подвергаемой лечению болезни, возраста и относительного здоровья субъекта, способа и формы введения, решения лечащего врача-терапевта или ветеринарного врача и других факторов.
Термины «определенный выше» и «определенный здесь», когда относятся к параметру, включают ссылку на широкое определение параметра, а также предпочтительные, наиболее предпочтительные и самые предпочтительные определения, если они существуют.
«Подвергающееся лечению» или «лечение» болезненного состояния включает:
(1) предотвращение болезненного состояния, т.е. не вызвать появления клинических симптомов болезненного состояния у субъекта, который может быть подвержен или предрасположен к болезненному состоянию, но еще не испытывает или не проявляет симптомов болезненного состояния;
(2) подавление болезненного состояния, т.е. задержку развития болезненного состояния или его клинических симптомов, или
(3) облегчение болезненного состояния, т.е. вызывание временного или постоянного ослабления болезненного состояния или его клинических симптомов.
Термины «обработка», «взаимодействие» и «подвергать взаимодействию», когда относятся к химической реакции, означают добавление или смешивание двух или более реагентов при соответствующих условиях, чтобы получить указанный и/или требуемый продукт. Следует учесть, что реакция, в ходе которой образуется указанный и/или требуемый продукт, необязательно произойдет непосредственно при сочетании двух реагентов, которые были добавлены вначале, т.е. может быть одно или несколько промежуточных соединений, которые получатся в смеси, которая в итоге приведет к образованию указанного и/или требуемого продукта.
В общем, используемая в данной заявке номенклатура основывается на AUTONOM™ v.4.0, автоматизированной системе института Бейльштейна для создания систематической номенклатуры ИЮПАК. Показанные здесь химические структуры получены с использованием ISIS® версии 2.2. Любая открытая валентность на атоме углерода, кислорода, серы или азота в представленных здесь структурах указывает на присутствие атома водорода.
Когда в химической структуре присутствует хиральный углерод, подразумевается, что структура охватывает все стереоизомеры, связанные с этим хиральным углеродом.
Все патенты и публикации, приведенные здесь, включены сюда полностью путем ссылки на них.
Соединения по изобретению являются соединениями формулы I, как описано выше.
В конкретных воплощениях формулы I Ar представляет собой:
возможно замещенный индолил;
возможно замещенный индазолил;
возможно замещенный 2,3-дигидро-индолил;
возможно замещенный 1,3-дигидро-индол-2-он-ил;
возможно замещенный бензотиофенил;
возможно замещенный хинолинил;
возможно замещенный 1,2,3,4-тетрагидрохинолинил;
возможно замещенный азаиндолил;
возможно замещенный нафталинил;
возможно замещенный бензотиазолил;
возможно замещенный бензизотиазолил;
возможно замещенный тиофенил или возможно замещенный фенил.
В конкретных воплощениях формулы I Ar представляет собой:
возможно замещенный индолил или возможно замещенный индазолил.
В конкретных воплощениях формулы I Ar представляет собой:
возможно замещенный нафталинил или возможно замещенный фенил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный индолил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный индазолил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный азаиндолил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензотиофенил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензимидазолил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензоксазолил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензотиазолил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный хинолинил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный изохинолинил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный нафталинил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный 2,3-дигидро-индолил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный азаиндазолил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный пиридинил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный тиофенил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный пирролил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензотиазолил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензизотиазолил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный фенил.
В конкретных воплощениях формулы I Ar представляет собой замещенный фенил.
В конкретных воплощениях формулы I Ar представляет собой фенил, замещенный два или три раза.
В конкретных воплощениях формулы I Ar представляет собой индол-2-ил, индол-3-ил, индол-4-ил, индол-5-ил или индол-6-ил, каждый возможно замещен.
В конкретных воплощениях формулы I Ar представляет собой индол-2-ил, индол-5-ил или индол-6-ил, каждый возможно замещен.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный индол-5-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный индазол-5-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензотиофен-5-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензотиофен-2-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензотиофен-3-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензотиофен-5-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензотиофен-6-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный тиен-2-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный тиен-3-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензотиазол-2-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензизотиазол-3-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный нафталин-2-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный хинолин-6-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный хинолин-2-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный изохинолин-6-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный 2,3-дигидро-индол-5-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный 1,3-дигидро-индол-2-он-5-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензимидазол-5-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензоксазол-5-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный бензотиазол-5-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный 1,2,3,4-тетрагидрохинолин-6-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный хинолин-2-он-6-ил.
В конкретных воплощениях формулы I Ar представляет собой возможно замещенный пиридин-2-ил.
В воплощениях формулы I, где Ar представляет собой возможно замещенный азаиндолил, такой азаиндолил предпочтительно является пирроло[2,3-b]пиридинилом.
В конкретных воплощениях формулы I, где Ar представляет собой возможно замещенный азаиндолил, такой азаиндолил предпочтительно является пирроло[2,3-b]пиридин-5-илом.
Когда Ar является любым из индолила, индазолила, азаиндолила, азаиндазолила, 2,3-дигидро-индолила, 1,3-дигидро-индол-2-он-ила, бензотиофенила, бензимидазолипа, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, хинолинила, 1,2,3,4-тетрагидрохинолинила, хинолин-2-он-ила, изохинолинила, пиридинила, тиофенила, пирролила, нафталинила или фенила, которые возможно замещены, то подобные возможные заместители могут составлять одну, две или три группы, каждая из которых независимо выбрана из:
гало;
С1-6алкила;
гало-С1-6алкила;
гало-С1-6алкокси;
С1-6алкокси;
гидрокси;
гетеро-С1-6алкила;
циано;
нитро;
амино;
N-C1-6алкил-амино;
N,N-ди-С1-6алкиламино или
-(CH2)r-Y-(CH2)s-Z-(CH2)t-Q-(CH2)u-Rc;
где
каждый r, s, t и u независимо представляет собой 0 или 1;
Z представляет собой -С(O)- или -SO2-;
каждый Х и Y независимо представляет собой -O-, -NRd- или связь;
Rc представляет собой:
водород;
С1-6алкил;
гало-С1-6алкил;
гало-С1-6алкокси;
С1-6алкокси;
гидрокси;
гетеро-С1-6алкил;
циано;
амино;
С1-6алкил-амино или
N,N-ди-C1-6алкиламино; и
Rd представляет собой:
водород или
С1-6алкил.
Когда Ar является любым из индолила, индазолила, азаиндолила, азаиндазолила, 2,3-дигидро-индолила, 1,3-дигидро-индол-2-он-ила, бензотиофенила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, хинолинила, 1,2,3,4-тетрагидрохинолинила, хинолин-2-он-ила, изохинолинила, пиридинила, тиофенила, пирролила, нафталинила или фенила, которые возможно замещены, то подобные возможные заместители могут составлять одну, две или три группы, каждая из которых независимо выбрана из:
гало;
C1-6алкила;
гало-С1-6алкила;
гало-С1-6алкокси;
С1-6алкокси;
гидрокси;
гетеро-С1-6алкила, выбранного из:
гидрокси-С1-6алкила;
С1-6алкилсульфонил-С1-6алкила и
С1-6алкокси-С1-6алкила;
циано;
нитро;
амино;
N-C1-6алкил-амино;
N,N-ди-С1-6алкиламино;
C1-6алкил-сульфонила или
-C(O)Rc, где Rc представляет собой:
С1-6алкил;
амино;
С1-6алкил-амино или
N,N-ди-С1-6алкиламино.
Когда Ar является любым из индолила, индазолила, азаиндолила, азаиндазолила, 2,3-дигидро-индолила, 1,3-дигидро-индол-2-он-ила, бензотиофенила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, хинолинила, 1,2,3,4-тетрагидрохинолинила, хинолин-2-он-ила, изохинолинила, пиридинила, тиофенила, пирролила, нафталинила или фенила, которые возможно замещены, то подобные возможные заместители могут составлять одну или две группы, каждая из которых независимо выбрана из:
гало;
амино;
C1-6алкила;
гало-C1-6алкила;
C1-6алкокси;
гидрокси или
циано.
Предпочтительно, когда Ar является любым из индолила, индазолила, азаиндолила, азаиндазолила, 2,3-дигидро-индолила, 1,3-дигидро-индол-2-он-ила, бензотиофенила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, хинолинила, 1,2,3,4-тетрагидрохинолинила, хинолин-2-он-ила, изохинолинила, пиридинила, тиофенила, пирролила, нафталинила или фенила, которые возможно замещены, то подобные возможные заместители могут составлять одну или две группы, каждая из которых независимо выбрана из гало, амино, C1-6-алкила и гало-C1-6алкила. В некоторых воплощениях Ar замещен один или два раза гало, предпочтительно фтором.
В конкретных воплощениях формулы I Ar представляет собой фенил, замещенный один, два или три раза группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
С3-6циклоалкила;
C1-6алкилкарбонила;
C1-6алкилсульфонила;
C1-6алкилсульфанила;
гало-C1-6алкила;
C1-6алкокси;
гало-C1-6алкокси;
C1-6алкокси-С1-6алкила;
гидрокси;
циано;
возможно замещенного фенила;
возможно замещенного фенокси;
фенилсульфонила или
возможно замещенного гетероарила.
В конкретных воплощениях формулы I Ar представляет собой фенил, замещенный два или три раза группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
гало-C1-6алкила;
C1-6алкокси;
гидрокси или
циано.
В конкретных воплощениях формулы I Ar представляет собой фенил, замещенный два или три раза гало.
В конкретных воплощениях формулы I Ar представляет собой фенил, замещенный в 3- и 4-положениях и возможно замещенный во 2- или 5-положении группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
С3-6циклоалкила;
C1-6алкилкарбонила;
C1-6алкилсульфонила;
C1-6алкилсульфанила;
гало-C1-6алкила;
C1-6алкокси;
гало-C1-6алкокси;
C1-6алкокси-C1-6алкила;
гидрокси;
циано;
возможно замещенного фенила;
возможно замещенного фенокси или
возможно замещенного гетероарила.
В конкретных воплощениях формулы I Ar представляет собой фенил, замещенный в 3- и 4-положениях и возможно замещенный во 2- или 5-положении группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
гало-C1-6алкила;
C1-6алкокси;
гидрокси или
циано.
В конкретных воплощениях формулы I Ar представляет собой фенил, замещенный в 3- и 4-положениях и возможно замещенный во 2- или 5-положении гало.
В конкретных воплощениях формулы I Ar представляет собой фенил, замещенный в 3- и 4-положениях и возможно замещенный во 2- или 5-положении гало или амино.
В конкретных воплощениях формулы I Ar представляет собой пиридинил, замещенный один или два раза группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
С3-6циклоалкила;
C1-6алкилкарбонила;
C1-6алкилсульфонила;
C1-6алкилсульфанила;
гало-C1-6алкила;
C1-6алкокси;
гало-C1-6алкокси;
C1-6алкокси-C1-6алкила;
гидрокси;
циано;
возможно замещенного фенила;
возможно замещенного фенокси или
возможно замещенного гетероарила.
В конкретных воплощениях формулы I Ar представляет собой пиридинил, замещенный один или два раза группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
гало-C1-6алкила;
C1-6алкокси;
гидрокси или
циано.
В конкретных воплощениях формулы I Ar представляет собой тиофенил, замещенный один, два или три раза группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
С3-6циклоалкила;
C1-6алкилкарбонила;
C1-6алкилсульфонила;
C1-6алкилсульфанила;
гало-C1-6алкила;
C1-6алкокси;
гало-C1-6алкокси;
C1-6алкокси-C1-6алкила;
гидрокси;
циано;
возможно замещенного фенила;
возможно замещенного фенокси или
возможно замещенного гетероарила.
В конкретных воплощениях формулы I Ar представляет собой тиофенил, замещенный один или два раза группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
гало-C1-6алкила;
C1-6алкокси;
гидрокси или
циано.
В конкретных воплощениях формулы I Ar представляет собой тиофенил, замещенный один или два раза гало.
В конкретных воплощениях формулы I Ar представляет собой тиофен-2-ил, замещенный в 4- и 5-положениях и возможно замещенный в 3-положении группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
С3-6циклоалкила;
C1-6алкилкарбонила;
C1-6алкилсульфонила;
C1-6алкилсульфанила;
гало-C1-6алкила;
C1-6алкокси;
гало-C1-6алкокси;
C1-6алкокси-C1-6алкила;
гидрокси;
циано;
возможно замещенного фенила;
возможно замещенного фенокси или
возможно замещенного гетероарила.
В конкретных воплощениях формулы I Ar представляет собой тиофен-2-ил, замещенный в 4- и 5-положениях и возможно замещенный в 3-положении группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
гало-C1-6алкила;
C1-6алкокси;
гидрокси или
циано.
В конкретных воплощениях формулы I Ar представляет собой тиофен-2-ил, замещенный в 4- и 5-положениях и возможно замещенный в 3-положении гало.
В конкретных воплощениях формулы I Ar представляет собой тиофен-2-ил, замещенный в 4- и 5-положениях и возможно замещенный в 3-положении гало или амино.
В конкретных воплощениях формулы I Ar представляет собой пирролил, замещенный один, два или три раза группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
С3-6циклоалкила;
C1-6алкилкарбонила;
C1-6алкилсульфонила;
C1-6алкилсульфанила;
гало-C1-6алкила;
C1-6алкокси;
гало-C1-6алкокси;
C1-6алкокси-C1-6алкила;
гидрокси;
циано;
возможно замещенного фенила;
возможно замещенного фенокси или
возможно замещенного гетероарила.
В конкретных воплощениях формулы I Ar представляет собой пирролил, замещенный один или два раза группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
гало-C1-6алкила;
C1-6алкокси;
гидрокси или
циано.
В конкретных воплощениях формулы I Ar представляет собой пирролил, замещенный один или два раза гало.
В конкретных воплощениях формулы I Ar представляет собой пиррол-2-ил, замещенный в 4- и 5-положениях и возможно замещенный в 3-положении группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
С3-6циклоалкила;
C1-6алкилкарбонила;
C1-6алкилсульфонила;
C1-6алкилсульфанила;
гало-C1-6алкила;
C1-6алкокси;
гало-C1-6алкокси;
C1-6алкокси-C1-6алкила;
гидрокси;
циано;
возможно замещенного фенила;
возможно замещенного фенокси или
возможно замещенного гетероарила.
В конкретных воплощениях формулы I Ar представляет собой пиррол-2-ил, замещенный в 4- и 5-положениях и возможно замещенный в 3-положении группами, независимо выбранными из:
гало;
амино;
C1-6алкила;
гало-C1-6алкила;
C1-6алкокси;
гидрокси или
циано.
В конкретных воплощениях формулы I Ar представляет собой пиррол-2-ил, замещенный в 4- и 5-положениях и возможно замещенный в 3-положении гало.
В конкретных воплощениях формулы I Ar представляет собой пиррол-2-ил, замещенный в 4- и 5-положениях и возможно замещенный в 3-положении гало или амино.
В конкретных воплощениях формулы I Ar представляет собой пиридинил замещенный один или два раза гало.
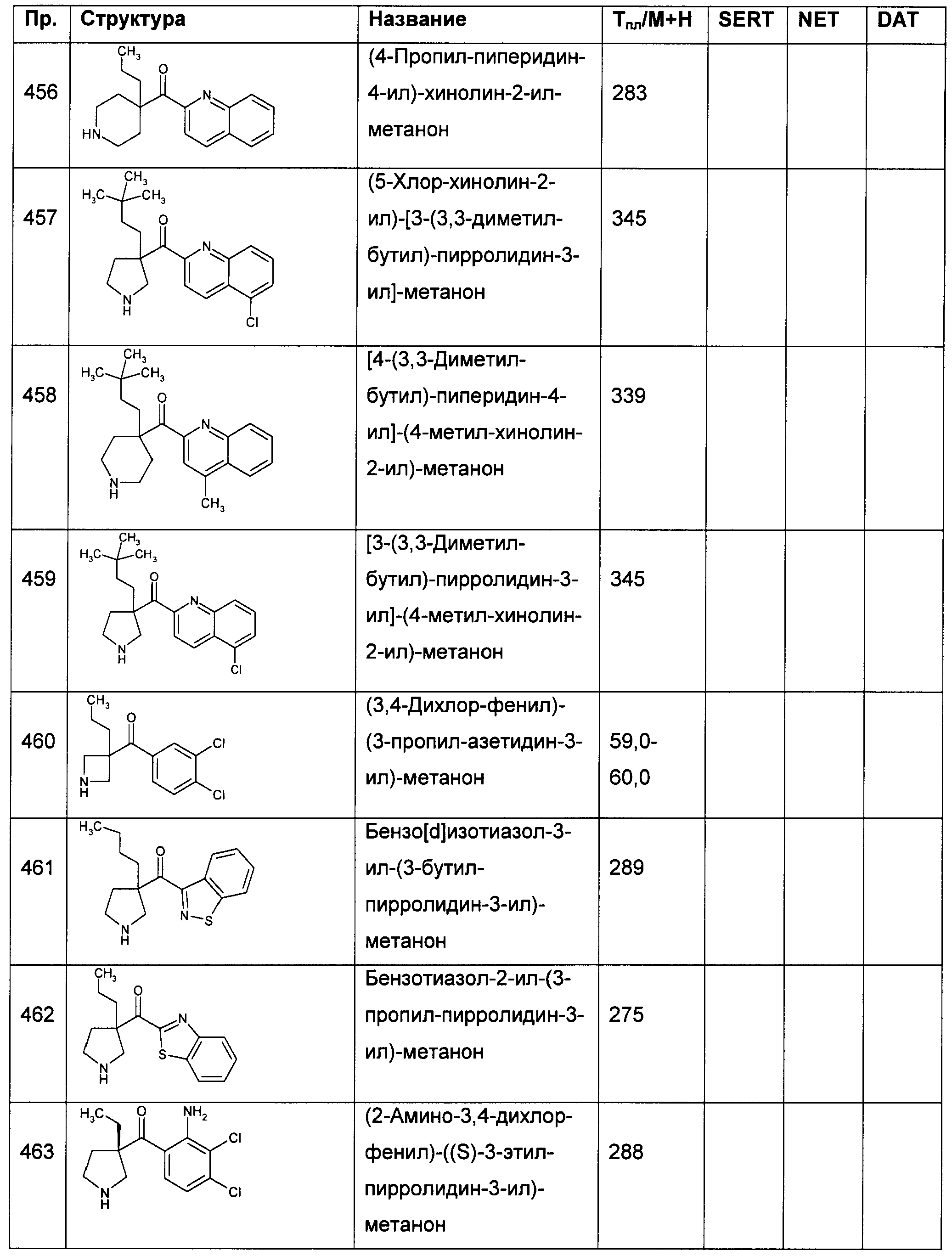
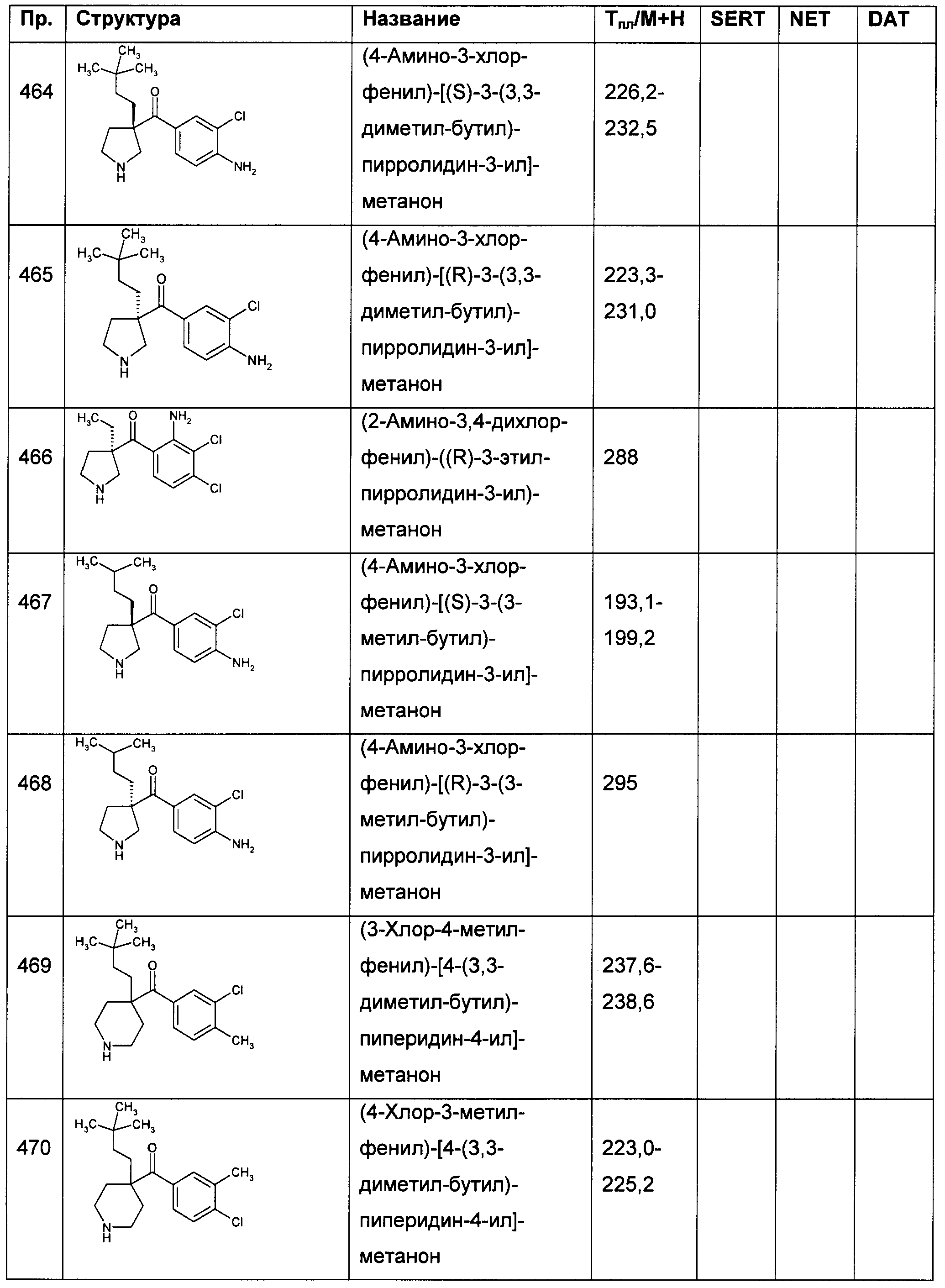
В конкретных воплощениях формулы I Ar представляет собой: 3,4-дихлор-фенил; 4-метокси-фенил; 4-метил-фенил; 4-фтор-фенил; 3-хлор-фенил; 4-хлор-фенил; 4-йод-фенил; 4-циано-фенил; 4-изопропил-фенил; 4-фенил-фенил (бифенил-4-ил); 4-пиразол-3-ил-фенил; 4-хлор-3-метокси-фенил; 4-хлор-3-этил-фенил; 4-хлор-3-циано-фенил; 4-хлор-3-фенил-фенил (6-хлор-бифенил-3-ил); 3-хлор-4-метокси-фенил; 3-хлор-4-метоксиметил-фенил; 3-хлор-4-гидрокси-фенил; 3-хлор-4-метилсульфанил-фенил; 3-хлор-4-метилсульфонил-фенил; 4-ацетил-3-хлор-фенил; 4-хлор-3-фтор-фенил; 4-хлор-3-циклопропил-фенил; 4-хлор-3-ацетил-фенил; 4-хлор-3-циано-фенил; 3-хлор-4-фтор-фенил; 3-хлор-5-фтор-фенил; 2,3-дихлор-фенил; 3,5-дихлор-фенил; 3,4-дифтор-фенил; 3,4-дибром-фенил; 3,4-дициано-фенил; 3-хлор-4-метил-фенил; 3-бром-4-хлор-фенил; 4-хлор-3-метил-фенил; 4-хлор-3-трифторметил-фенил; 4-трифторметил-фенил; 4-трифторметокси-фенил; 3,4,5-трифтор-фенил; 3,4,5-трихлор-фенил; 3,4-дихлор-5-фтор-фенил; 3,4-дихлор-5-метил-фенил; 4,5-дихлор-2-фтор-фенил; 4-бром-3-хлор-фенил; 4-хлор-3-изопропокси-фенил; 3-(4-фтор-фенокси)-фенил; 4-амино-3-хлор-фенил; 4-амино-3-фтор-фенил; 4-бром-3-метил-фенил; 4-амино-3-хлор-5-фтор-фенил; 2-амино-3,4-дихлор-фенил; 4-бром-3-хлор-5-фтор-фенил; 3-хлор-5-фтор-4-гидрокси-фенил; 4-хлор-3-фенокси-фенил или 3-хлор-4-фенокси-фенил.
В конкретных воплощениях формулы I Ar представляет собой: 3,4-дихлор-фенил; 4-хлор-3-фтор-фенил; 3-хлор-4-фтор-фенил; 3,4-дифтор-фенил; 3,4-дибром-фенил; 3-бром-4-хлор-фенил; 3,4,5-трифтор-фенил; 3,4,5-трихлор-фенил; 3,4-дихлор-5-фтор-фенил; 4,5-дихлор-2-фтор-фенил; 4-бром-3-хлор-фенил; 4-хлор-3-изопропокси-фенил; 4-амино-3-хлор-фенил; 4-амино-3-фтор-фенил; 4-амино-3-хлор-5-фтор-фенил; 2-амино-3,4-дихлор-фенил или 4-бром-3-хлор-5-фтор-фенил.
В конкретных воплощениях формулы I Ar представляет собой: 3,4-дихлор-фенил; 3,4-дихлор-5-фтор-фенил; 4-амино-3-хлор-фенил или 4-амино-3-хлор-5-фтор-фенил.
В конкретных воплощениях формулы I Ar представляет собой 3,4-дихлор-фенил.
В конкретных воплощениях формулы I Ar представляет собой 3,4-дихлор-5-фтор-фенил.
В конкретных воплощениях формулы I Ar представляет собой 4-амино-3-хлор-фенил.
В конкретных воплощениях формулы I Ar представляет собой 4-амино-3-хлор-5-фтор-фенил.
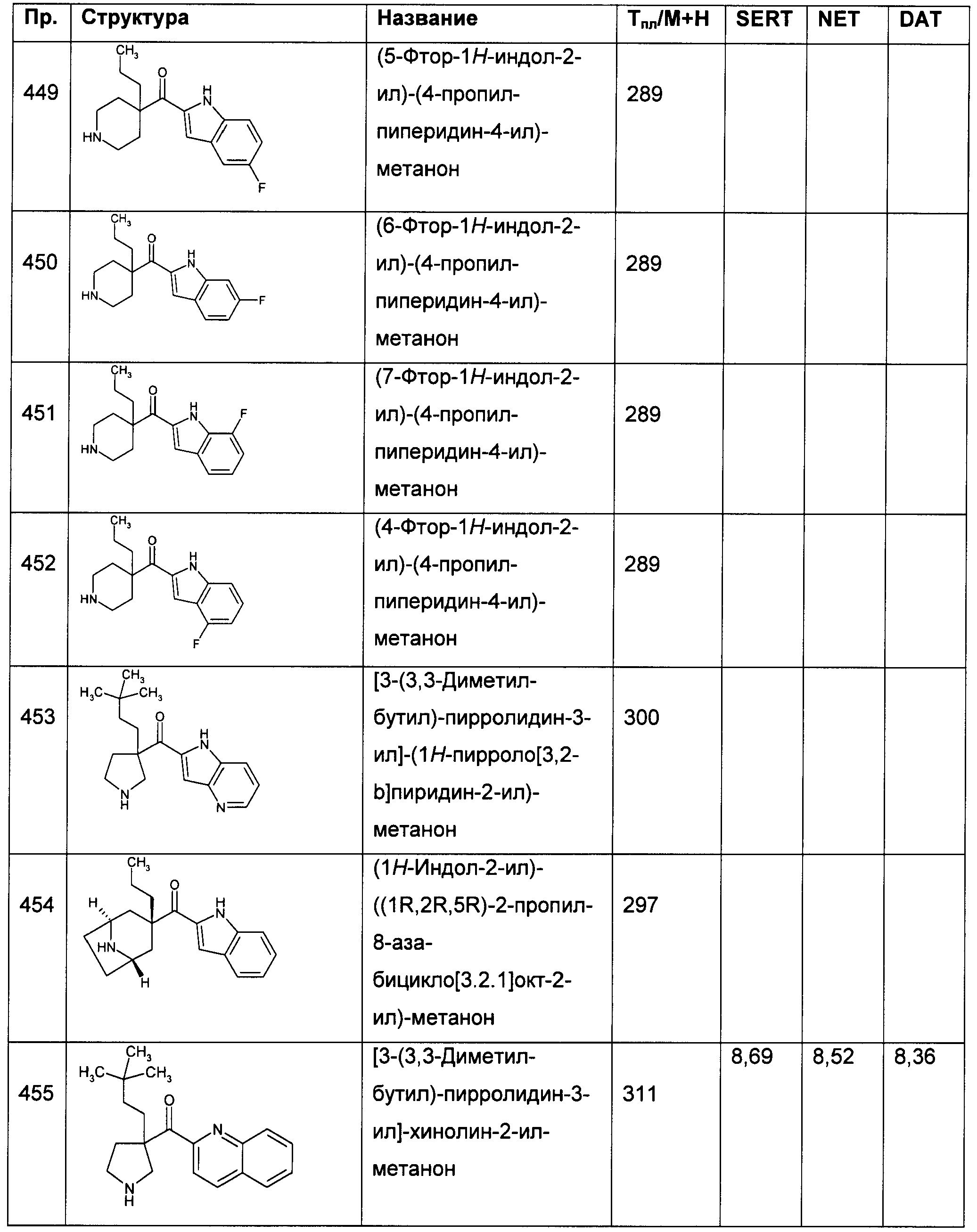
В конкретных воплощениях формулы I Ar представляет собой: индол-5-ил; 1-метил-индол-5-ил; 7-фтор-индол-5-ил; 2-метил-индол-5-ил; индол-4-ил; 7-хлор-индол-5-ил; индол-3-ил; 7-трифторметил-индол-5-ил; 6-фтор-индол-5-ил; 6,7-дифтор-индол-5-ил; индол-2-ил; 5-фтор-индол-2-ил; 1-фенилсульфонил-индол-2-ил; 1-метил-индол-2-ил; 6-фтор-индол-2-ил; 7-фтор-индол-2-ил или 4-фтор-индол-2-ил.
В конкретных воплощениях формулы I Ar представляет собой: бензотиофен-5-ил; бензотиофен-2-ил; бензотиофен-3-ил; 5-фтор-бензотиофен-2-ил; 6-фтор-бензотиофен-2-ил; 5-хлор-бензотиофен-2-ил; 7-фтор-бензотиофен-2-ил или 4-фтор-бензотиофен-2-ил.
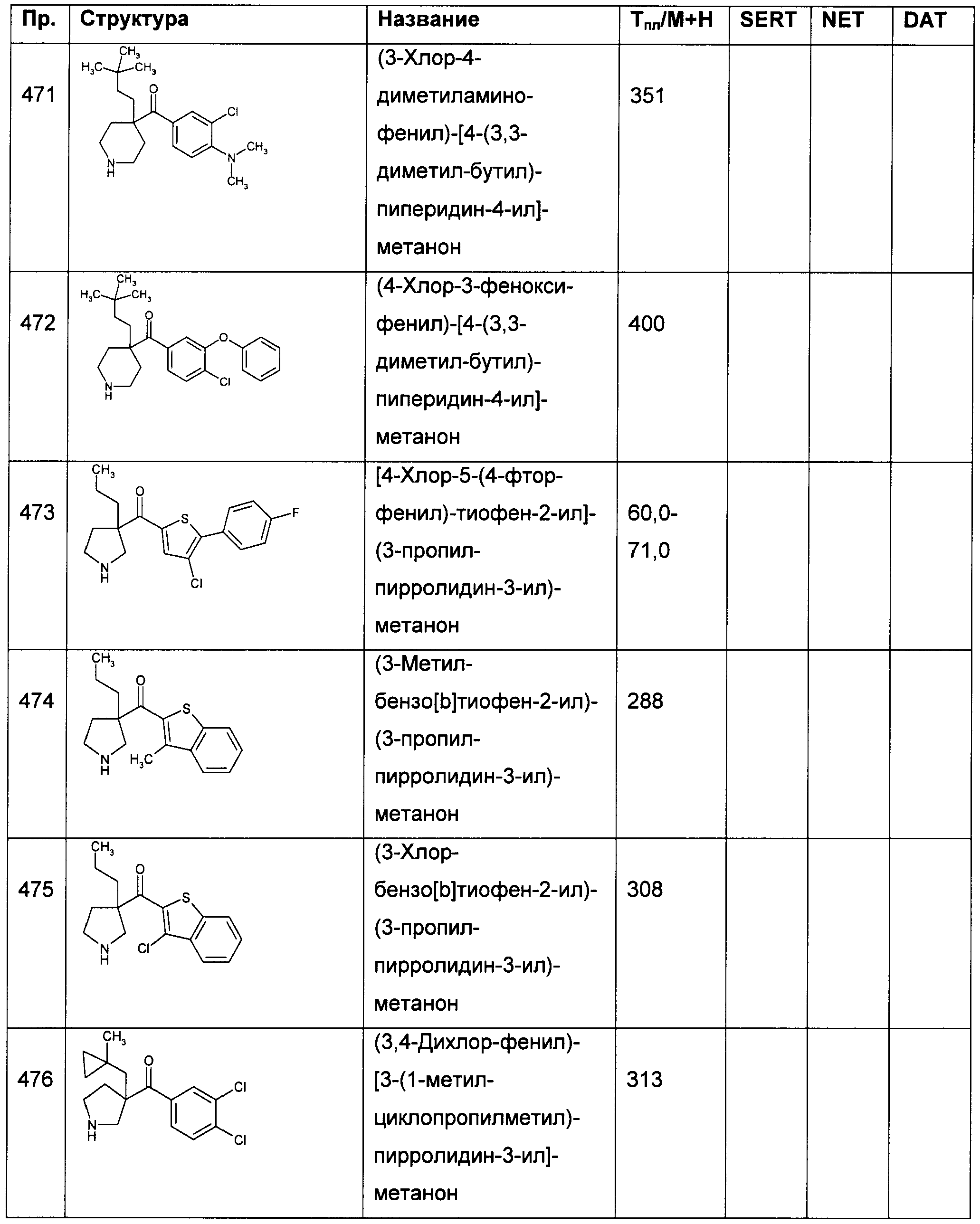
В конкретных воплощениях формулы I Ar представляет собой: 4,5-дихлор-тиофен-2-ил; 4-хлор-тиофен-2-ил; 3-хлор-тиофен-2-ил или 4-хлор-5-метил-тиофен-2-ил.
В конкретных воплощениях формулы I R2 представляет собой водород.
В конкретных воплощениях формулы I R2 представляет собой C1-6алкил.
В конкретных воплощениях формулы I R2 представляет собой метил.
В конкретных воплощениях формулы I, где Ar представляет собой возможно замещенный фенил, Ar предпочтительно является фенилом, замещенным один, два или три раза, и более предпочтительно два или три раза, любым гало, C1-6алкилом, гало-C1-6алкилом, C1-6алкокси, гидрокси или циано.
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 1, Ar представляет собой возможно замещенный индол-5-ил, R1 представляет собой возможно замещенный бензил и R2 представляет собой водород.
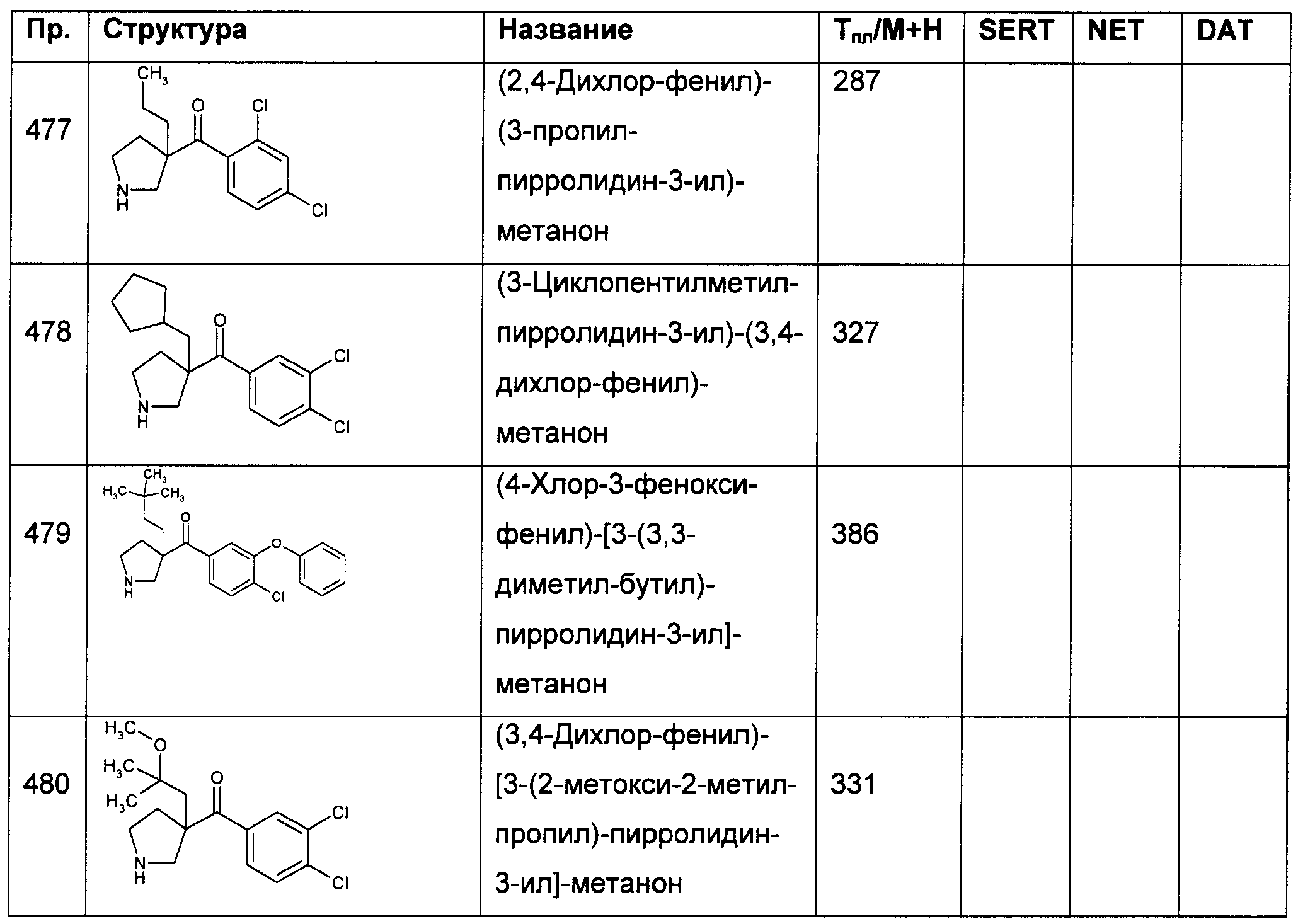
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 1, Ar представляет собой возможно замещенный индол-5-ил, R1 представляет собой С3-6алкил и R2 представляет собой водород.
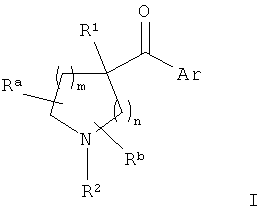
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 2, Ar представляет собой возможно замещенный индол-5-ил, R1 представляет собой возможно замещенный бензил и R2 представляет собой водород.
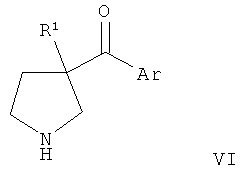
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 2, Ar представляет собой возможно замещенный индол-5-ил, R1 представляет собой С3-6алкил и R2 представляет собой водород.
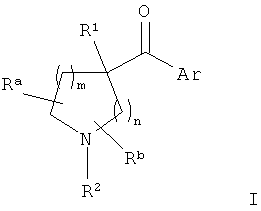
В конкретных воплощениях формулы I m представляет собой 2, n представляет собой 1, Ar представляет собой возможно замещенный индол-5-ил, R1 представляет собой возможно замещенный бензил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 2, n представляет собой 1, Ar представляет собой возможно замещенный индол-5-ил, R1 представляет собой С3-6алкил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 1, Ar представляет собой возможно замещенный индазол-5-ил, R1 представляет собой возможно замещенный бензил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 1, Ar представляет собой возможно замещенный индазол-5-ил, R1 представляет собой С3-6алкил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 2, Ar представляет собой возможно замещенный индазол-5-ил, R1 представляет собой возможно замещенный бензил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 2, Ar представляет собой возможно замещенный индазол-5-ил, R1 представляет собой С3-6алкил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 2, n представляет собой 1, Ar представляет собой возможно замещенный индазол-5-ил, R1 представляет собой возможно замещенный бензил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 2, n представляет собой 1, Ar представляет собой возможно замещенный индазол-5-ил, R1 представляет собой С3-6алкил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 1, Ar представляет собой возможно замещенный фенил, R1 представляет собой возможно замещенный бензил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 1, Ar представляет собой возможно замещенный фенил, R1 представляет собой С3-6алкил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 2, Ar представляет собой возможно замещенный индазол-5-ил, R1 представляет собой возможно замещенный бензил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 1, n представляет собой 2, Ar представляет собой возможно замещенный фенил, R1 представляет собой С3-6алкил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 2, n представляет собой 1, Ar представляет собой возможно замещенный фенил, R1 представляет собой возможно замещенный бензил и R2 представляет собой водород.
В конкретных воплощениях формулы I m представляет собой 2, n представляет собой 1, Ar представляет собой возможно замещенный фенил, R1 представляет собой С3-6алкил и R2 представляет собой водород.
В конкретных воплощениях формулы I Ra и Rb представляет собой водород.
В конкретных воплощениях формулы I один из Ra и Rb представляет собой водород и другой представляет собой C1-6алкил, гало, оксо или гидрокси.
В конкретных воплощениях формулы I Ra и Rb вместе образуют C1-6алкилен.
В конкретных воплощениях формулы I соединения по изобретению могут быть формулы II:
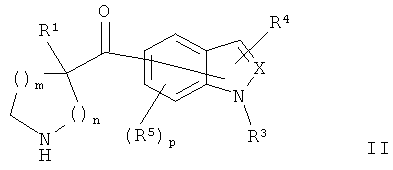
где:
p представляет собой 0-3;
Х представляет собой N или CRe;
R3 представляет собой:
водород или
C1-6алкил;
каждый R4, R5 и Re независимо представляет собой:
водород;
гало;
C1-6алкил;
гало-C1-6алкил;
гало-C1-6алкокси;
C1-6алкокси;
гидрокси;
гетеро-C1-6алкил;
циано;
нитро;
амино;
N-C1-6алкил-амино;
N,N-ди-C1-6алкиламино или
-(CH2)r-Y-(CH2)s-Z-(CH2)t-Q-(CH2)u-Rc;
где
каждый r, s, t и u независимо представляет собой 0 или 1;
Z представляет собой -С(O)- или -SO2-;
каждый Х и Y независимо представляет собой -O-, -NRd- или связь;
Rc представляет собой:
водород;
C1-6алкил;
гало-C1-6алкил;
гало-C1-6алкокси;
C1-6алкокси;
гидрокси;
гетеро-C1-6алкил;
циано;
амино;
C1-6алкил-амино или
N,N-ди-C1-6алкиламино; и
Rd представляет собой:
водород или
C1-6алкил и
m, n и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы II Х представляет собой N.
В конкретных воплощениях формулы II Х представляет собой CRe.
В конкретных воплощениях формулы II Х представляет собой СН.
В конкретных воплощениях формулы II R3 представляет собой водород.
В конкретных воплощениях формулы II R3 представляет собой C1-6алкил.
В конкретных воплощениях формулы II R3 представляет собой метил.
В конкретных воплощениях формулы II m представляет собой 1, n представляет собой 1, Х представляет собой СН, R1 представляет собой возможно замещенный бензил и R3 представляет собой водород.
В конкретных воплощениях формулы II m представляет собой 1, n представляет собой 1, Х представляет собой N, R1 представляет собой С3-6алкил и R3 представляет собой водород.
В конкретных воплощениях формулы II m представляет собой 1, n представляет собой 1, Х представляет собой СН, R1 представляет собой возможно замещенный бензил и R3 представляет собой водород.
В конкретных воплощениях формулы II m представляет собой 1, n представляет собой 1, Х представляет собой N, R1 представляет собой С3-6алкил и R3 представляет собой водород.
В конкретных воплощениях формулы I соединения по изобретению могут быть формулы III:
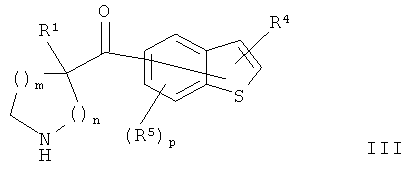
где m, n, p, R1, R4 и R5 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы II или III р представляет собой 0, 1 или 2.
В конкретных воплощениях формулы II или III р представляет собой 0, 1 или 2 и R6 представляет собой гало.
В конкретных воплощениях формулы II или III р представляет собой 0, 1 или 2 и R6 представляет собой фтор.
В конкретных воплощениях формулы II или III р представляет собой 1 и R6 представляет собой фтор.
В конкретных воплощениях формулы I или III р представляет собой 0.
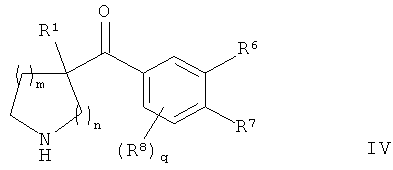
В конкретных воплощениях формулы I соединения по изобретению могут быть формулы IV:
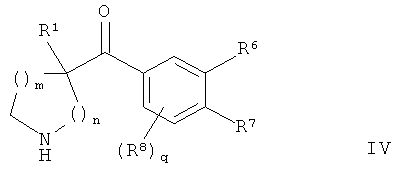
где:
q представляет собой 0 или 1;
каждый R6, R7 и R8 независимо представляет собой:
гало;
амино;
C1-6алкил;
С3-6циклоалкил;
C1-6алкилкарбонил;
C1-6алкилсульфонил;
C1-6алкилсульфанил;
гало-C1-6алкил;
C1-6алкокси;
гало-C1-6алкокси;
C1-6алкокси-C1-6алкил;
гидрокси;
циано;
возможно замещенный фенил;
возможно замещенный фенокси или возможно замещенный гетероарил;
или R6 и R7 вместе образуют С1-2алкилен или С1-2алкилен-диокси;
или R7 и R8 вместе образуют С1-2алкилен или С1-2алкилен-диокси;
и где m, n и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы IV каждый R6, R7 и R8 независимо представляет собой: гало; амино; C1-6алкил; C1-6алкилкарбонил; гало-C1-6алкил; C1-6алкокси; гало-C1-6алкокси; гидрокси или циано.
В конкретных воплощениях формулы IV один из R6, R7 и R8 представляет собой амино, и другие являются гало.
В конкретных воплощениях формулы IV q представляет собой 1, один из R6, R7 и R8 представляет собой амино, и другие являются гало.
В конкретных воплощениях формулы IV q представляет собой 1, и R6, R7 и R8 представляют собой гало.
В конкретных воплощениях формулы IV q представляет собой 0, один из R6 и R7 представляет собой амино, и другой является гало.
В конкретных воплощениях формулы IV q представляет собой 0, и R6 и R7 представляют собой гало.
В конкретных воплощениях формулы IV один из R6, R7 и R8 представляет собой фтор, и другие являются хлором.
В конкретных воплощениях формулы IV q представляет собой 1, один из R6, R7 и R8 представляет собой амино, и другие являются хлором или фтором.
В конкретных воплощениях формулы IV q представляет собой 0.
В конкретных воплощениях формулы IV q представляет собой 1.
В конкретных воплощениях формулы IV R6, R7 и R8 представляют собой гало.
В конкретных воплощениях формулы IV q представляет собой 1, R7 представляет собой амино, и R6 и R8 независимо представляют собой фтор или хлор.
В конкретных воплощениях формулы IV q представляет собой 0, R7 представляет собой амино, и R6 представляет собой фтор или хлор.
В конкретных воплощениях формулы I соединения по изобретению могут быть формулы V:
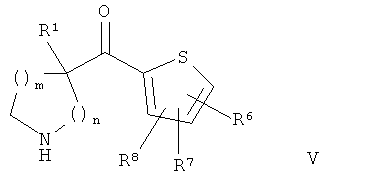
где:
каждый R6, R7 и R8 независимо представляет собой:
водород;
гало;
амино;
C1-6алкил;
С3-6циклоалкил;
C1-6алкилкарбонил;
C1-6алкилсульфонил;
C1-6алкилсульфанил;
гало-C1-6алкил;
C1-6алкокси;
гало-C1-6алкокси;
C1-6алкокси-C1-6алкил;
гидрокси;
циано;
возможно замещенный фенил;
возможно замещенный фенокси или
возможно замещенный гетероарил;
или R7 и R8 вместе образуют С1-2алкилен или С1-2алкилен-диокси;
и где m, n и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы V R8 представляет собой водород, и каждый R6 и R7 независимо представляет собой: гало; амино; C1-6алкил; C1-6алкилкарбонил; гало-C1-6алкил; C1-6алкокси; гало-C1-6алкокси; гидрокси или циано.
В конкретных воплощениях формулы V R8 представляет собой водород, и R6 и R7 представляют собой гало.
В конкретных воплощениях формулы V R8 представляет собой водород, и R6 и R7 представляют собой хлор или фтор.
В конкретных воплощениях формулы V R8 представляет собой водород, и R6 и R7 представляют собой хлор.
В конкретных воплощениях формулы V R8 представляет собой водород, один из R6 и R7 представляет собой амино, и другой представляет собой гало.
В конкретных воплощениях формулы V R6 представляет собой гало, и R7 и R8 представляют собой водород.
В конкретных воплощениях формулы V один из R6, R7 и R8 представляет собой амино, и другие представляют собой гало.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 0.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 1.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 2.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 3.
В конкретных воплощениях любой из формул I, II, III, IV или V n представляет собой 0.
В конкретных воплощениях любой из формул I, II, III, IV или V n представляет собой 1.
В конкретных воплощениях любой из формул I, II, III, IV или V n представляет собой 2.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 1 и n представляет собой 1.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 2 и n представляет собой 1.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 2 и n представляет собой 0.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 3 и n представляет собой 0.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 1 и n представляет собой 0.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 1 и n представляет собой 2.
В конкретных воплощениях любой из формул I, II, III, IV или V m представляет собой 0 и n представляет собой 1.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой:
C1-6алкил;
C1-6алкенил;
C1-6алкинил;
C1-6алкокси;
С3-7циклоалкил-C1-6алкил;
гетеро-C1-6алкил;
гало-C1-6алкил;
возможно замещенный арил;
арил-С1-3алкил, где арильная часть возможно замещена;
гетероарил-С1-3алкил, где гетероарильная часть возможно замещена.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой:
C1-6алкил;
C1-6алкенил или
арил-С1-3алкил, где арильная часть возможно замещена.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой:
С3-6алкил;
С3-6галоалкил;
С3-6циклоалкил-С1-3алкил;
С1-2алкокси-С1-3алкил;
С1-2алкил-С3-6циклоалкил-С1-3алкил;
возможно замещенный бензил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой: н-пропил; изопропил; трет-бутил; н-бутил; изобутил; н-пентил; изопентил; 2,2-диметил-пропил; 3,3-диметил-бутил; циклопентил; циклопропил-метил; циклобутил-метил; циклопентил-метил; циклогексил-метил; циклопропил-этил; циклогексил-этил; 2-(1-метил-циклопропил)-этил; 3-(1-метил-циклопропилметил; 3,3,3-трифтор-пропил; 4,4,4-трифтор-бутил; 3,3-дифтор-аллил; бензил; 3-фтор-бензил; 4-фтор-бензил; 3-метокси-бензил; 4-метокси-бензил; 3,4-дихлор-бензил; 3,4-дифтор-бензил; пиразин-2-ил-метил; тиазол-4-ил-метил; пиразол-1-ил-метил; метокси-метил; этокси-метил; изопропокси-метил; 2-метокси-этил; 2-этокси-этил; 3-метокси-3-метил-бутил; 3-этансульфонил-метил или тетрагидропиран-4-илметил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой: н-пропил; изопропил; трет-бутил; н-бутил; изобутил; н-пентил; изопентил; 2,2-диметил-пропил; 3,3-диметил-бутил; циклопентил; циклопропил-метил; циклобутил-метил; циклопентил-метил; циклогексил-метил; циклопропил-этил; циклогексил-этил; 2-(1-метил-циклопропил)-этил; 3-(1-метил-циклопропилметил; 3,3,3-трифтор-пропил или 4,4,4-трифтор-бутил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой: н-пропил; изопропил; трет-бутил; н-бутил; изобутил; изопентил; 2,2-диметил-пропил; 3,3-диметил-бутил; циклопентил; циклопропил-метил; циклобутил-метил; циклопентил-метил; циклогексил-метил; циклопропил-этил; циклогексил-этил; 2-(1-метил-циклопропил)-этил или 3-(1-метил-циклопропилметил.
В конкретных воплощениях любой из формул I, II, III, IV или V, где R1 представляет собой гетероарил-С1-3алкил, гетероарилокси, гетероарил-C1-6алкокси, гетероарильная группировка может представлять собой пиридинил, пиразинил, тиазолил или пиразолил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой: C1-6алкил; арил-C1-6алкил; С3-6циклоалкил-C1-6алкил; гетеро-C1-6алкил; гало-C1-6алкил или C1-6алкил-С1-3циклоалкил-C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой: C1-6алкил; арил-C1-6алкил; С3-6циклоалкил-C1-6алкил или C1-6алкил-С1-3циклоалкил-C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой С3-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой С3-6алкенил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой С3-6алкинил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой С2-6алкокси.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой С3-7циклоалкил-C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой С3-7циклоалкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой C1-6алкил-С3-6циклоалкил-C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой гетеро-C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой гетероциклил- C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой гетероциклил-C1-6алкил, выбранный из тетрагидропиранилметила, тетрагидрофуранилметила и пиперидинилметила.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой тетрагидропиранилметил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой гетеро-C1-6алкил, выбранный из:
гидрокси-C1-6алкила;
C1-6алкилсульфонил-C1-6алкила;
C1-6алкилсульфанил-C1-6алкила и
C1-6алкокси-C1-6алкила.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой гидрокси-C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой C1-6алкилсульфонил-C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой C1-6алкилсульфанил-C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой C1-6алкокси-C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой гало-C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой возможно замещенный арил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой возможно замещенный гетероарил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой арил-С1-3алкил, где арильная часть возможно замещена.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой гетероарил-С1-3алкил, где гетероарильная часть возможно замещена.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой гетероарил-С1-3алкил, выбранный из пиридинил-С1-3алкила, пиразинил-С1-3алкила, тиазолил-С1-3алкила и пиразолил-С1-3алкила.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой н-пропил, изопропил, н-бутил, изобутил, н-пентил или изопентил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой н-пропил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой изопропил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой н-бутил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой изобутил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой трет-бутил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой н-пентил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой изопентил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой 2,2-диметил-пропил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой 3,3-диметил-бутил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой циклопропил-метил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой 2-(1-метил-циклопропил)-этил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой 3-(1-метил-циклопропил)-метил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой:
возможно замещенный бензил;
тиазолилметил;
пиразинилметил;
возможно замещенный фенил или
C1-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой:
возможно замещенный бензил;
возможно замещенный фенил или
С3-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой возможно замещенный бензил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой возможно замещенный фенил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой С3-6алкил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой возможно замещенный фенилэтил.
В конкретных воплощениях любой из формул I, II, III, IV или V R1 представляет собой возможно замещенный гетероарил-C1-6алкил, выбранный из тиазолилметила и пиразолилметила.
В конкретных воплощениях формулы II предпочтительно каждый R4, R5 и Rс независимо выбран из:
гало;
C1-6алкила;
гало-C1-6алкила;
гало-C1-6алкокси;
C1-6алкокси;
гидрокси;
гетеро-C1-6алкила, выбранного из:
гидрокси-C1-6алкила;
C1-6алкилсульфонил-C1-6алкила и
C1-6алкокси-C1-6алкила;
циано;
нитро;
амино;
N-C1-6алкил-амино;
N,N-ди-C1-6алкиламино;
C1-6алкил-сульфонила или
-C(O)Rc, где Rc представляет собой:
C1-6алкил;
амино;
C1-6алкил-амино или
N,N-ди-C1-6алкиламино.
В конкретных воплощениях любой из формул II более предпочтительно каждый R4, R5 и Rc независимо выбран из:
гало;
C1-6алкила;
гало-C1-6алкила;
C1-6алкокси;
гидрокси или
циано.
В воплощениях формул I, II, III, IV или V, когда R1 представляет собой возможно замещенный арил, возможно замещенный гетероарил, возможно замещенный арил-С1-3алкил (включая возможно замещенный бензил) или возможно замещенный гетероарил-С1-3алкил, такие возможные заместители могут составлять одну, две или три группы, каждая из которых независимо выбрана из:
гало;
C1-6алкила;
гало-C1-6алкила;
гало-C1-6алкокси;
C1-6алкокси;
гидрокси;
гетеро-C1-6алкила;
циано;
нитро;
амино;
N-C1-6алкил-амино;
N,N-ди-C1-6алкиламино или
-(CH2)r-Y-(CH2)s-Z-(CH2)tQ-(CH2)u-Rc;
где
каждый r, s, t и u независимо представляет собой 0 или 1;
Z представляет собой -С(O)- или -SO2-;
каждый Х и Y независимо представляет собой -O-, -NRd- или связь;
Rc представляет собой:
водород;
C1-6алкил;
гало-C1-6алкил;
гало-C1-6алкокси;
C1-6алкокси;
гидрокси;
гетеро-C1-6алкил;
циано;
амино;
C1-6алкил-амино или
N,N-ди-C1-6алкиламино; и
Rd представляет собой:
водород или
C1-6алкил.
В воплощениях формул I, II, III, IV или V, когда R1 представляет собой возможно замещенный арил, возможно замещенный гетероарил, возможно замещенный арил-С1-3алкил (включая возможно замещенный бензил) или возможно замещенный гетероарил-С1-3алкил, такие возможные заместители более предпочтительно составляют одну, две или три группы, каждая из которых независимо выбрана из:
гало;
C1-6алкила;
гало-C1-6алкила;
гало-C1-6алкокси;
C1-6алкокси;
гидрокси;
гетеро-C1-6алкила, выбранного из:
гидрокси-C1-6алкила;
C1-6алкилсульфонил-C1-6алкила и
C1-6алкокси-C1-6алкила;
циано;
нитро;
амино;
N-C1-6алкил-амино;
N,N-ди-C1-6алкиламино;
C1-6алкил-сульфонила или
-C(O)Rc, где Rc представляет собой:
C1-6алкил;
амино;
C1-6алкил-амино или
N,N-ди-C1-6алкиламино.
В воплощениях формул I, II, III, IV или V, когда R1 представляет собой возможно замещенный арил, возможно замещенный гетероарил, возможно замещенный арил-С1-3алкил (включая возможно замещенный бензил) или возможно замещенный гетероарил-С1-3алкил, такие возможные заместители еще более предпочтительно составляют одну или две группы, каждая из которых независимо выбрана из:
гало;
C1-6алкила;
гало-C1-6алкила;
C1-6алкокси;
гидрокси или
циано.
В конкретных воплощениях формулы I соединения по изобретению могут быть в частности формулы VI:
где Ar и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы VI соединения по изобретению могут быть в частности формулы VIa или формулы VIб:
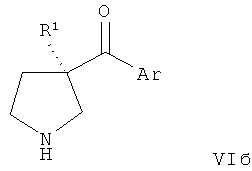
где Ar и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы I соединения по изобретению могут быть в частности формулы VII:
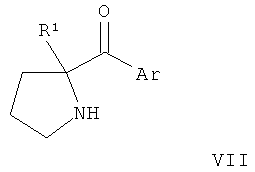
где Ar и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы VII соединения по изобретению могут быть в частности формулы VIIa или формулы VIIб:
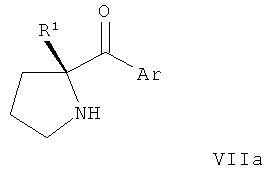
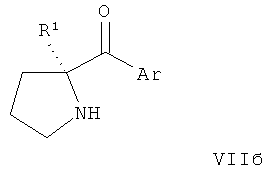
где Ar и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы I соединения по изобретению могут быть в частности формулы VIII:
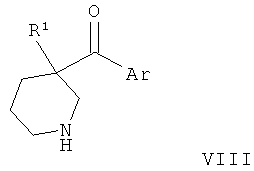
где Ar и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы VIII соединения по изобретению могут быть в частности формулы VIIIa или формулы VIIIб:
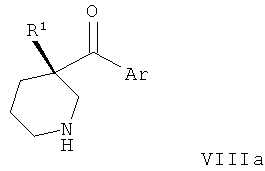
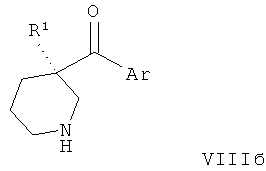
где Ar и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы I соединения по изобретению могут быть в частности формулы IX:
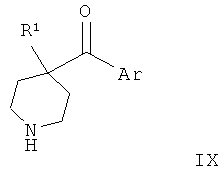
где Ar и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы I соединения по изобретению могут быть в частности формулы X:
где Ar и R1 являются такими, как определено здесь для формулы I.
В конкретных воплощениях формулы Х соединения по изобретению могут быть в частности формулы Ха или формулы Хб:
где Ar и R1 являются такими, как определено здесь для формулы I.
Характерные соединения согласно способам по изобретению показаны в таблице 1. Если не указано иное, то температуры плавления (в °С) в таблице 1 даны для хлороводородных солей.
Синтез
Соединения по настоящему изобретению могут быть получены в ходе ряда способов, изображенных на иллюстративных схемах реакций синтеза, показанных и описанных ниже.
Исходные вещества и реагенты, используемые при получении этих соединений, обычно либо доступны у торговых поставщиков, таких как Aldrich Chemical Co., либо их получают способами, известными квалифицированному специалисту в данной области техники, следуя процедурам, изложенным в ссылках, таких как Fieser and Fieser's Reagents for Organic Synthesis; Wiley & Sons: New York, 1991, тома 1-15; Rodd's Chemistry of Carbon Compounds, Elsevier Science Publishers, 1989, тома 1-5 и дополнения; и Organic Reactions, Wiley & Sons: New York, 1991, тома 1-40. Следующие схемы реакций синтеза только иллюстрируют некоторые способы, согласно которым соединения по настоящему изобретению могут быть синтезированы, и разные модификации этих схем реакций синтеза могут быть сделаны и будут предложены квалифицированному специалисту в данной области техники при ссылке на раскрытие сущности, содержащейся в этой заявке.
Исходные вещества и промежуточные соединения согласно схемам реакций синтеза могут быть выделены и очищены, если требуется, используя традиционные методики, включая, но не ограничиваясь этим, фильтрацию, дистилляцию, кристаллизацию, хроматографию и т.п. Такие вещества можно охарактеризовать, используя обычные способы, включая физические константы и спектральные данные.
Если не указано иное, то реакции, описанные здесь, предпочтительно проводить в инертной атмосфере при атмосферном давлении в реакционном температурном диапазоне от приблизительно -78°С до приблизительно 150°С, более предпочтительно от приблизительно 0°С до приблизительно 125°С и наиболее предпочтительно и удобно приблизительно при комнатной (или окружающей среды) температуре, например около 20°С.
Ниже схема А иллюстрирует одну процедуру синтеза, пригодную для получения соединений по изобретению, где Х представляет собой гало или другую уходящую группу и может быть одинаковым или разным в каждом случае, 3Г является защитной группой, и m, n, Ar и R1 являются такими, как определено здесь.
Схема А
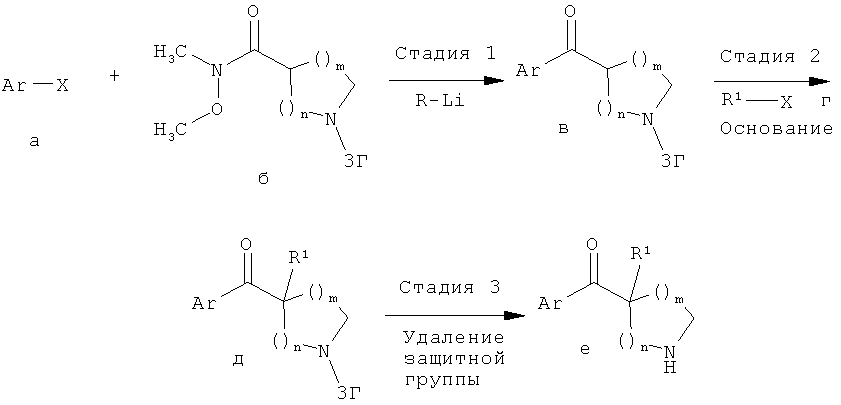
На стадии 1 схемы А арильное соединение а, такое как арил галид, взаимодействует с N-защищенным гетероциклическим амидным соединением б в присутствии сильного основания, такого как алкиллитиевый реагент, что дает арильный гетероциклический кетон в. Значения m и n в соединении б могут быть выбраны таким образом, чтобы обеспечить пирролидинил, пиперидинил, азетидинил, азепинил или подобные гетероциклические группировки. На стадии 2 алкилирование проводят в ходе реакции арильного гетероциклического кетона в с алкилирующим агентом г, что дает соединение д. Алкилирующий агент г может включать, например бензил галид, алкенил галид или другие алкилирующие реагенты. Затем удаляют защитную группу в соединении а на стадии 3, что дает соединение е, которое является соединением формулы I согласно изобретению.
Многочисленные варианты процедур схемы А возможны и будут совершенно очевидны квалифицированному специалисту в данной области техники. Например, N-алкилирование соединения е может дать соединения, где R2 представляет собой алкил. Когда группа R1, вводимая на стадии 2, представляет собой алкенил или алкинил, реакцию гидрирования можно выполнить, чтобы изменить R1 на алкил.
Схема Б показывает другой способ синтеза соединений по изобретению, где R представляет собой низший алкил, 3Г является защитной группой, Х является уходящей группой, и m, n, Ar и R1 являются такими, как определено здесь.
Схема Б
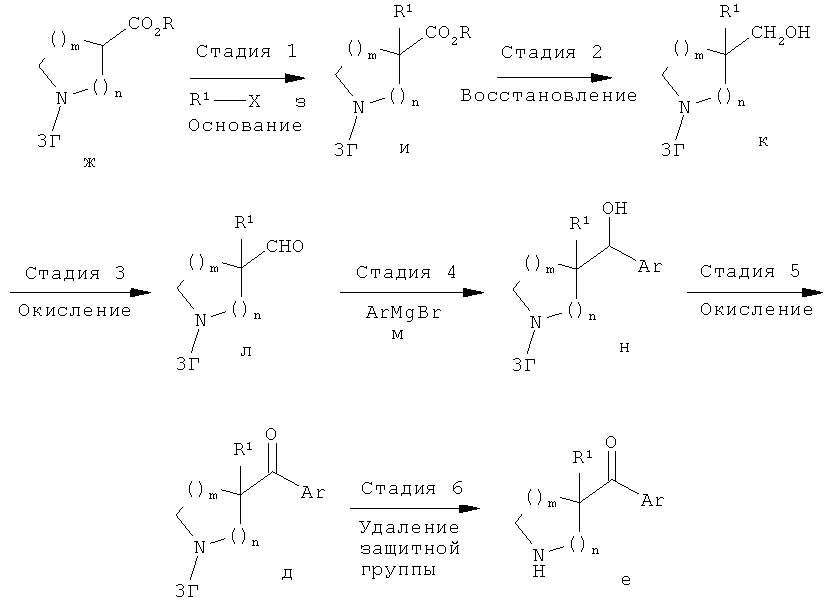
На стадии 1 схемы Б эфир карбоновой кислоты циклического амина ж обрабатывают алкилирующим агентом з в присутствии сильного основания, такого как алкиллитиевый реагент, получая алкилированный циклический амин и. Циклический амин ж может представлять собой пирролидинил, пиперидинил, азетидинил, азепинил или т.п. согласно значениям m и n, как отмечено выше. На стадии 2 эфирную группу соединения и восстанавливают до соединения к первичного спирта. Восстановление стадии 2 может быть выполнено, например, при использовании LiAlH4. Затем спиртовое соединение к подвергают частичному окислению на стадии 3, получая альдегидное соединение л. Окисление стадии 3 может быть выполнено, например, с использованием периодинана Десса-Мартина или хромата. Алкилирование проводят на стадии 4 по реакции альдегидного соединения л с арилмагнийбромидом м, получая соединение н арильный спирт. На стадии 5 спирт н окисляют до соответствующего соединения д арилкетона. Окисление может быть выполнено, например, с использованием MnO2, реагента Сверна или подобных окислителей. На стадии 6 удаляют защитную группу в соединении д арилкетоне, получая соединение е, которое является соединением формулы I согласно изобретению.
Многочисленные варианты процедур схемы Б возможны и, считается, что они находятся в объеме данного изобретении. Например, ариллитий можно использовать на стадии 4. Характерные детали получения соединений по изобретению описаны в разделе Примеры ниже.
Полезность
Соединения по изобретению пригодны для лечения заболеваний или состояний, связанных с нейротрансмиссией серотонина, нейротрансмиссией норэпинефрина и/или нейротрансмиссией дофамина. Подобные заболевания и состояния включают депрессивные и анксиолитические расстройства, а также шизофрению и другие психозы, дискинезию, наркотическую зависимость, когнитивные расстройства, болезнь Альцгеймера, синдром дефицита внимания, такой как СДВГ, обсессивно-компульсивное поведение, приступы паники, социофобии, расстройства пищевого поведения, такие как ожирение, анорексия, булимия и «компульсивное переедание», стресс, гипергликемию, гиперлипидемию, неинсулинозависимый диабет, эпилептические заболевания, такое как эпилепсия, и лечение состояний, связанных с неврологическим повреждением, полученным в результате инсульта, травмы мозга, церебральной ишемии, травмы головы и кровоизлияния.
Соединения по изобретению также пригодны для лечения заболеваний и болезненных состояний мочевыводящих путей, таких как недержание мочи при напряжении, неотложное недержание мочи, доброкачественная гиперплазия предстательной железы (ДГПЖ), простатит, гиперрефлексия детрузора, обструкция выходного отверстия, частое мочеиспускание, никтурия, неотложный позыв к мочеиспусканию, гиперактивный мочевой пузырь, тазовая гиперчувствительность, уретрит, простатодиния, цистит, идиопатическая гиперчувствительность мочевого пузыря.
Соединения по изобретению также обладают противовоспалительными и/или болеутоляющими свойствами in vivo, и, следовательно, как ожидается, найдут применение при лечении болезненных состояний, связанных с болевыми состояниями в самых разнообразных случаях, включая, но не ограничиваясь этим, невропатическую боль, боль при воспалении, боль при операции, висцеральную боль, зубную боль, предменструальную боль, центральную боль, боль вследствие ожога, мигрень или гистаминовые головные боли, повреждение нерва, неврит, невралгии, отравление, ишемическое повреждение, интерстициальный цистит, раковую боль, вирусную, паразитарную или бактериальную инфекцию, посттравматические повреждения (включая переломы и спортивные повреждения) и боль, связанную с функциональными расстройствами кишечника, такую как синдром раздраженного кишечника.
Соединения по изобретению также полезны при лечении артрита, включая, но не ограничиваясь этим, ревматоидный артрит, спондилоартропатии, подагрический артрит, остеоартрит, системную красную волчанку и ювенильный артрит, остеоартрит, подагрический артрит и другие артритные состояния.
Введение и фармацевтическая композиция
Изобретение включает фармацевтические композиции, содержащие по меньшей мере одно соединение по настоящему изобретению, или индивидуальный изомер, рацемическую или нерацемическую смесь изомеров, или его фармацевтически приемлемую соль или сольват вместе с по меньшей мере одним фармацевтически приемлемым носителем и возможно другими терапевтическими и/или профилактическими компонентами.
В общем, соединения по изобретению вводятся в терапевтически эффективном количестве любым общепринятым способом введения агентов, удовлетворяющих подобной пользе. Подходящие диапазоны дозировки обычно составляют 1-500 мг в день, предпочтительно 1-100 мг в день и наиболее предпочтительно 1-30 мг в день в зависимости от ряда факторов, таких как тяжесть подвергаемого лечению заболевания, возраста и относительного здоровья субъекта, активности используемого соединения, способа и формы введения, показания, относительно которого предназначено введение, и предпочтений и опыта вызванного врача. Любой средний специалист в области лечения подобных заболеваний способен без чрезмерного экспериментирования и, полагаясь на личные знания и сущность этой заявки, установить терапевтически эффективное количество соединений по настоящему изобретению для данной болезни.
Соединения по изобретению можно вводить в виде фармацевтических препаратов, включая пригодные для перорального (включая трансбуккальное и сублингвальное), ректального, назального, локального, пульмонального, вагинального или парентерального (включая внутримышечное, внутриартериальное, интратекальное, подкожное и внутривенное) введения, или в форме, пригодной для введения в ходе ингаляции или инсуффляции. Предпочтительным способом введения, как правило, является пероральное при использовании удобного суточного режима дозировки, который можно регулировать в зависимости от степени заболевания.
Соединение или соединения по изобретению вместе с одним или более традиционными адъювантами, носителями или разбавителями можно помещать в форму фармацевтических композиций и стандартные лекарственные формы. Фармацевтические композиции и стандартные лекарственные формы могут состоять из обычных компонентов в традиционных пропорциях с или без дополнительных активных соединений или субстратов, и стандартные лекарственные формы могут содержать любое подходящее эффективное количество активного компонента в соответствии с намеченным суточным диапазоном дозировки, который будет использоваться. Фармацевтические композиции можно применять в виде твердых веществ, таких как таблетки или наполненные капсулы, полутвердых веществ, порошков, препаратов с замедленным высвобождением, или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, или наполненных капсул для перорального применения; или в форме суппозиториев для ректального или вагинального введения; или в форме стерильных инъекционных растворов для парентерального применения. Препараты, содержащие приблизительно один (1) миллиграмм активного компонента или более широко приблизительно от 0,01 до приблизительно ста (100) миллиграмм на таблетку являются, таким образом, подходящими типичными стандартными лекарственными формами.
Соединения по изобретению могут быть созданы в большом многообразии лекарственных форм для перорального введения. Фармацевтические композиции и лекарственные формы могут содержать соединение или соединения по настоящему изобретению или их фармацевтически приемлемые соли в виде активного компонента. Фармацевтически приемлемые носители могут быть как твердыми, так и жидкими. Препараты твердой формы включают порошки, таблетки, пилюли, капсулы, облатки, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или несколько веществ, которые также могут выполнять функцию разбавителей, ароматизаторов, солюбилизаторов, смазывающих веществ, суспендирующих агентов, связывающих веществ, консервантов, дезинтегрирующих агентов или инкапсулирующих веществ. В порошках носитель обычно представляет собой тонкоизмельченное твердое вещество, которое является смесью с тонкоизмельченным активным компонентом. Для таблеток активный компонент обычно смешивают с носителем, имеющим необходимую связывающую способность, в соответствующих пропорциях и спрессовывают в требуемую форму и размер. Порошки и таблетки предпочтительно содержат приблизительно от одного (1) до приблизительно (70) процентов активного соединения. Подходящие носители включают, но не ограничиваются этим, карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, карбоксиметилцеллюлозу натрия, низкоплавкий воск, какао-масло и т.п. Предполагается, что термин «препарат» включает состав активного соединения с инкапсулирующим веществом в виде носителя, давая капсулу, в которой активный компонент с или без носителей находится в окружении носителя, который связан с ним. Точно так же состоят облатки и леденцы. Таблетки, порошки, капсулы, пилюли, облатки и леденцы могут быть в виде твердых форм, пригодных для перорального введения.
Другие формы, пригодные для перорального введения, включают препараты жидкой формы, включая эмульсии, сиропы, эликсиры, водные растворы, водные суспензии, или препараты твердой формы, которые, как предполагается, переводят непосредственно перед применением в препараты жидкой формы. Эмульсии можно получить в растворах, например, в водных пропиленгликолевых растворах, или они могут содержать эмульгирующие агенты, например, такие как лецитин, моноолеат сорбитана или гуммиарабик. Водные растворы могут быть получены при растворении активного компонента в воде и при добавлении подходящих красителей, корригентов, стабилизаторов и загустителей. Водные суспензии могут быть получены при диспергировании тонкоизмельченного активного компонента в воде с вязким веществом, таким как природные или синтетические смолы, смолистые вещества, метилцеллюлоза, карбоксиметилцеллюлоза натрия, и другими хорошо известными суспендирующими агентами. Препараты твердой формы включают растворы, суспензии и эмульсии и могут содержать в дополнение к активному компоненту красители, корригенты, стабилизаторы, буферы, искусственные и природные подсластители, диспергирующие вещества, загустители, солюбилизаторы и т.п.
Соединения по изобретению могут быть созданы для парентерального введения (например, в ходе инъекций, например болюсной инъекции или продолжительной инъекции) и могут быть представлены в форме однократной дозы в ампулах, предварительно заполненных шприцах, инфузиях небольшого объема или в контейнерах для многократного дозирования с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных наполнителях, например растворы в водном полиэтиленгликоле. Примеры масляных или неводных носителей, разбавителей, растворителей или наполнителей включают пропиленгликоль, полиэтиленгликоль, растительные масла (например, оливковое масло) и инъецируемые органические эфиры (например, этилолеат) и могут содержать дополнительные агенты, такие как консервирующие, смачивающие, эмульгирующие или суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный компонент может находиться в порошкообразной форме, полученной при асептическом выделении стерильного твердого вещества или в ходе лиофилизации из раствора, для объединения перед использованием с подходящим наполнителем, например стерильной апирогенной водой.
Соединения по изобретению могут быть приготовлены для локального введения в эпидермис в виде мазей, кремов или лосьонов или в виде трансдермального пластыря. Мази и кремы могут быть, например, созданы на водной или масляной основе с добавкой подходящих загустителей и/или гелеобразующих агентов. Лосьоны могут быть созданы на водной или масляной основе и также обычно содержат один или более эмульгаторов, стабилизаторов, диспергирующих агентов, суспендирующих агентов, загустителей или красителей. Препараты, пригодные для локального введения в полость рта, включают леденцы, содержащие активные агенты на ароматизированной основе, обычно сахарозе и гуммиарабике или трагаканте; пастилки, содержащие активный компонент на инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик; и зубные эликсиры, содержащие активный компонент в подходящем жидком носителе.
Соединения по изобретению могут быть созданы для введения в виде суппозиториев. Сначала низкоплавкий воск, такой как смесь глицеридов жирных кислот или какао-масло, растапливают, и активный компонент диспергируют до однородной массы, например, при перемешивании. Затем расплавленную гомогенную смесь выливают в подходящего размера формы, охлаждают и дают затвердеть.
Соединения по изобретению могут быть созданы для вагинального введения. Подходят пессарии, тампоны, крема, гели, пасты, пенки или спреи, содержащие в дополнение к активному компоненту носители, которые известны в данной области.
Соединения по изобретению могут быть созданы для назального введения. Растворы или суспензии вводятся непосредственно в носовую полость обычными способами, например, с помощью капельницы, пипетки или спрея. Препараты могут быть созданы в форме однократного или многократного дозирования. В случае капельницы или пипетки это может быть выполнено пациентом при вводе соответствующего предварительно определенного объема раствора или суспензии. В случае спрея это осуществляется, например, посредством дозирующего распыляющего насоса.
Соединения по изобретению могут быть созданы для аэрозольного введения, особенно в дыхательные пути, и включая интраназальное введение. Как правило, соединение имеет малый размер частиц, например порядка пяти (5) микронов или менее. Подобный размер частиц может быть получен известными в данной области способами, например микронизацией. Активный компонент помещается в находящуюся под давлением упаковку с подходящим пропеллентом, таким как хлорфторуглерод (ХФУ), например дихлордифторметан, трихлорфторметан или дихлортетрафторэтан, или диоксид углерода, или другим подходящим газом. Также аэрозоль может содержать поверхностно-активное вещество, такое как лецитин. Дозу лекарства можно регулировать с помощью дозирующего клапана. Альтернативно, активные компоненты могут быть созданы в форме сухого порошка, например порошкообразной смеси соединения на соответствующей порошкообразной основе, такой как лактоза, крахмал, производные крахмала, такие как гидроксипропилметилцеллюлоза и поливинилпирролидон (ПВП). Порошкообразный носитель будет образовывать гель в носовой полости. Порошкообразная композиция может быть представлена в форме однократной дозы, например в капсулах или картриджах, например желатиновых или блистерных упаковок, из которых порошок можно вводить посредством ингалятора.
При желании препараты можно получить с энтеросолюбильным покрытием, пригодным для введения активного компонента с замедленным или контролируемым высвобождением. Например, соединения по настоящему изобретению можно создать для трансдермальных или подкожных систем доставки лекарственного средства. Эти системы доставки являются полезными, когда необходимо замедленное высвобождение соединения, и когда решающим является согласие пациента со схемой лечения. Соединения в трансдермальных системах доставки часто закреплены на прилипающем к коже твердом носителе. Представляющее интерес соединение также можно объединить со способствующим проникновению веществом, например азоном (1-додецилазациклогептан-2-оном). Системы доставки с замедленным высвобождением вводятся подкожно в субдермальный слой хирургическим путем или в ходе инъекции. Подкожные имплантаты инкапсулируют соединение в жирорастворимую мембрану, например силоксановый каучук, или биоразлагающийся полимер, например полимолочную кислоту.
Фармацевтические препараты предпочтительно находятся в стандартных лекарственных формах. В такой форме препарат разделен на однократные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, где упаковка содержит отдельные количества препарата, такие как упакованные таблетки, капсулы и порошки в пузырьках или ампулах. Также стандартная лекарственная форма может представлять собой капсулу, таблетку, облатку или пастилку как таковую, или может представлять собой соответствующее число любых из них в упакованной форме.
Другие пригодные фармацевтические носители и их препараты описаны в Remington; The Science and Practice of Pharmacy 1995, изданном E.W.Martin, Mack Publishing Company, 19-oe издание, Easton, Pennsylvania. Характерные фармацевтические препараты, содержащие соединение по настоящему изобретению, описаны ниже.
Примеры
Следующие препараты и примеры приведены для того, чтобы дать возможность квалифицированному специалисту в данной области более четко понять и применить настоящее изобретение. Следует считать, что они не ограничивают объем изобретения, а лишь иллюстрируют и представляют его. В примерах могут быть использованы следующие аббревиатуры.
АББРЕВИАТУРЫ
|
Получение 1
5-Бром-1-триизопропилсиланил-1Н-индол
Бис(триметилсилил)амид лития (1,0 М в ТГФ, 28 мл, 28 ммоль) медленно добавляли к раствору 5-броминдола (5,00 г, 25,5 ммоль) в ТГФ (60 мл) при -78°С в атмосфере азота. Реакционную смесь перемешивали при -78°С в течение 20 минут, затем добавляли триизопропилсилилхлорид (5,7 мл, 26,8 ммоль). Полученную в результате смесь перемешивали при -78°С в течение 20 минут, затем нагревали до комнатной температуры в течение 1 часа. Реакцию гасили, добавляя насыщенный водный раствор NH4Cl, разбавляли водой и полученную в результате смесь экстрагировали EtOAc. Органический слой отделяли, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, что давало неочищенное масло, которое очищали с помощью флэш-хроматографии (100% гексан), получая 8,94 г (выход 99%) 5-бром-1-триизопропилсиланил-1Н-индол в виде бесцветного масла.
Подобным образом, используя соответствующее исходное вещество, получали следующие соединения:
5-Бром-1-триизопропилсиланил-1Н-индазол (выход 86%, желтое твердое вещество);
5-Бром-1-триизопропилсиланил-1Н-пирроло[2,3-b]пиридин (выход 87%, желтое твердое вещество);
5-Бром-2-метил-1-триизопропилсиланил-1Н-индол;
5-Бром-1-триизопропилсиланил-2,3-дигидро-1H-индол (выход 100%, белое твердое вещество);
5-Бром-1-(трет-бутил-диметил-силанил)-1Н-индол и
5-Бром-7-фтор-1-триизопропилсиланил-1Н-индол.
Получение 2
1-трет-Бутиловый эфир 2-метиловый эфир (R)-2-бензил-пирролидин-1,2-дикарбоновой кислоты
Синтез 1-трет-бутилового эфира 2-метилового эфира (R)-2-бензил-пирролидин-1,2-дикарбоновой кислоты проводили согласно способу, показанному на схеме В.
Схема В
Стадия 1 1-трет-Бутиловый эфир (R)-2-бензил-пирролидин-1,2-дикарбоновой кислоты
Смесь (R)-2-бензил-пирролидин-2-карбоновой кислоты (2,07 г, 10,1 ммоль) и пентагидрата гидроксида тетраметиламмония (1,83 г, 10,1 ммоль) в ацетонитриле (100 мл) перемешивали в азоте в течение 90 минут, затем добавляли (Вос)2O (3,31 г, 15,2 ммоль). Через 48 часов добавляли вторую часть (Вос)2O (1,10 г, 5,0 ммоль). Через 24 часа реакционную смесь концентрировали в вакууме, затем разделяли между эфиром (100 мл) и водой (50 мл). Водную фазу промывали эфиром (50 мл), затем подкисляли до рН 4 10% водной лимонной кислотой (20 мл). Полученный в результате раствор экстрагировали EtOAc и объединенные экстракты промывали солевым раствором (30 мл), высушивали над (MgSO4), фильтровали и концентрировали в вакууме, что давало 1-трет-бутиловый эфир (R)-2-бензил-пирролидин-1,2-дикарбоновой кислоты (1,26 г, 4,13 ммоль, 41%) в виде пены.
Стадия 2 1-трет-Бутиловый эфир 2-метиловый эфир (R)-2-бензил-пирролидин-1,2-дикарбоновой кислоты
К перемешиваемому раствору 1-трет-бутилового эфира (R)-2-бензил-пирролидин-1,2-дикарбоновой кислоты (1,23 г, 4,00 ммоль) в ТГФ (10 мл) и метаноле (10 мл) при 0°С в азоте добавляли TMS-диазометан (5,0 мл 2,0 М раствора в гексанах, 5,0 ммоль) по каплям. Реакционную смесь нагревали до температуры окружающей среды, затем концентрировали в вакууме до масла (1,36 г). Очистка с помощью хроматографии (диоксид кремния, 5-15% EtOAc в гексанах) давала 1-трет-бутиловый эфир 2-метиловый эфир (R)-2-бензил-пирролидин-1,2-дикарбоновой кислоты (1,03 г, 3,23 ммоль, 81%) в виде масла.
Получение 3
трет-Бутиловый эфир 2-н-бутил-2-формил-пирролидин-1-карбоновой кислоты
Синтез трет-бутилового эфира 2-бутил-2-формил-пирролидин-1-карбоновой кислоты проводили согласно способу, показанному на схеме Г.
Схема Г
Стадия 1 1-трет-Бутиловый эфир 2-метиловый эфир 2-н-бутил-пирролидин-1,2-дикарбоновой кислоты
К перемешиваемому раствору 1-трет-бутилового эфира 2-метилового эфира пирролидин-1,2-дикарбоновой кислоты (3,00 г, 13,1 ммоль) в ТГФ (50 мл) при -78°С и в азоте добавляли LHMDS (гексаметилдисилазид лития, 14,4 мл 1,0 М раствора в ТГФ, 14,4 ммоль) по каплям. Через 30 минут по каплям добавляли раствор 1-йодбутана (2,23 мл, 19,7 ммоль) в ТГФ (1 мл). Реакционную смесь перемешивали в течение 30 минут при -78°С, нагревали до температуры окружающей среды в течение 90 минут, затем гасили, добавляя насыщенный водный NH4Cl, и экстрагировали EtOAc. Объединенные экстракты промывали насыщенным водным NaHCO3 и солевым раствором, затем высушивали (MgSO4), фильтровали и концентрировали в вакууме до желтого масла (4,5 г). Очистка с помощью хроматографии (диоксид кремния, 10% EtOAc в гексанах) давала 1-mpem-бутиловый эфир 2-метиловый эфир 2-бутил-пирролидин-1,2-дикарбоновой кислоты (2,57 г, 9,01 ммоль, 69%) в виде чистого бесцветного масла.
Используя вышеприведенную процедуру и соответствующие исходные вещества, подобным образом получали:
1-трет-Бутиловый эфир 2-метиловый эфир 2-пропил-пирролидин-1,2-дикарбоновой кислоты (бесцветное масло, 85%), используя 1-йодпропан;
1-трет-Бутиловый эфир 2-метиловый эфир 2-этоксиметил-пирролидин-1,2-дикарбоновой кислоты (бесцветное масло, 76%), используя хлорметокси-этан;
1-трет-Бутиловый эфир 2-метиловый эфир 2-(3,3-дифтор-аллил)-пирролидин-1,2-дикарбоновой кислоты (бесцветное масло, 11%), используя 1,1,1-трифтор-3-йодпропан;
1-трет-Бутиловый эфир 2-этиловый эфир 2-изопропоксиметил-пирролидин-1,2-дикарбоновой кислоты (бесцветное масло, 49%) из хлорметоксиизопропилового эфира и 1-трет-бутилового эфира 2-этилового эфира пирролидин-1,2-дикарбоновой кислоты;
1-трет-Бутиловый эфир 2-этиловый эфир 2-изобутил-пирролидин-1,2-дикарбоновой кислоты (бесцветное масло, 67%) из 1-йод-2-метилпропана и 1-трет-бутилового эфира 2-этилового эфира пирролидин-1,2-дикарбоновой кислоты;
1-трет-Бутиловый эфир 2-этиловый эфир 2-циклопропилметил-пирролидин-1,2-дикарбоновой кислоты (бесцветное масло, 50%) из циклопропилметилбромида и 1-трет-бутилового эфира 2-этилового эфира пирролидин-1,2-дикарбоновой кислоты;
1-трет-Бутиловый эфир 2-метиловый эфир 5,5-диметил-2-пропил-пирролидин-1,2-дикарбоновой кислоты (бесцветное масло, 76%) из 1-йодпропана и 1-трет-бутилового эфира 2-метилового эфира 5,5-диметил-пирролидин-1,2-дикарбоновой кислоты;
1-трет-Бутиловый эфир 2-метиловый эфир (2R,4R)-4-(трет-бутил-диметил-силанилокси)-2-пропил-пирролидин-1,2-дикарбоновой кислоты (бесцветное масло, 26%) и 1-трет-бутиловый эфир 2-метиловый эфир (2S,4R)-4-(трет-бутил-диметил-силанилокси)-2-пропил-пирролидин-1,2-дикарбоновой кислоты (бесцветное масло, 30%) из 1-йодпропана и 1-трет-бутилового эфира 2-метилового эфира (2S,4R)-4-(трет-бутил-диметил-силанилокси)-пирролидин-1,2-дикарбоновой кислоты;
1-трет-Бутиловый эфир 2-метиловый эфир 2-пропил-азетидин-1,2-дикарбоновой кислоты (бесцветное масло, 80%) из 1-йодпропана и 1-трет-бутилового эфира 2-метилового эфира азетидин-1,2-дикарбоновой кислоты;
1-трет-Бутиловый эфир 2-этиловый эфир 2-пропил-пиперидин-1,2-дикарбоновой кислоты (бесцветное масло, 38%) из 1-йодпропана и 1-трет-бутилового эфира 2-этилового эфира пиперидин-1,2-дикарбоновой кислоты и
1-трет-Бутиловый эфир 2-метиловый эфир 2-(тетрагидро-пиран-4-илметил)-пирролидин-1,2-дикарбоновой кислоты.
Стадия 2 трет-Бутиловый эфир 2-н-бутил-2-гидроксиметил-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору 1-трет-бутилового эфира 2-метилового эфира 2-бутил-пирролидин-1,2-дикарбоновой кислоты (0,842 г, 2,95 ммоль) в ТГФ (30 мл) при 0°С в азоте добавляли LiAlH4 (2,95 мл 1,0 М раствора в ТГФ, 2,95 ммоль) по каплям. Через 15 минут реакционную смесь гасили, добавляя декагидрат сульфата натрия (2,5 г), затем фильтровали. Осадок на фильтре промывали ДХМ (50 мл), затем объединенные фильтраты концентрировали в вакууме, получая трет-бутиловый эфир 2-бутил-2-гидроксиметил-пирролидин-1-карбоновой кислоты (0,763 г) в виде чистого бесцветного масла, которое непосредственно использовали без дополнительной очистки.
Используя вышеприведенную процедуру и соответствующие исходные вещества, подобным образом получали:
трет-Бутиловый эфир 2-гидроксиметил-2-пропил-пирролидин-1-карбоновой кислоты (желтое масло, 94%);
трет-Бутиловый эфир 2-гидроксиметил-2-изопропоксиметил-пирролидин-1-карбоновой кислоты (бесцветное масло, 89%);
трет-Бутиловый эфир 2-гидроксиметил-2-изобутил-пирролидин-1-карбоновой кислоты (бесцветное масло, 100%);
трет-Бутиловый эфир 2-циклопропилметил-2-гидроксиметил-пирролидин-1-карбоновой кислоты (бесцветное масло, 100%);
трет-Бутиловый эфир 2-гидроксиметил-5,5-диметил-2-пропил-пирролидин-1-карбоновой кислоты (бесцветное масло, 100%);
трет-Бутиловый эфир (2S,4R)-2-гидроксиметил-2-пропил-4-(1,1,2,2-тетраметил-пропокси)-пирролидин-1-карбоновой кислоты (бесцветное масло, 100%)и
трет-Бутиловый эфир 2-гидроксиметил-2-(тетрагидро-пиран-4-илметил)-пирролидин-1-карбоновой кислоты.
Стадия 3 трет-Бутиловый эфир 2-н-бутил-2-формил-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 2-бутил-2-гидроксиметил-пирролидин-1-карбоновой кислоты (0,763 г, около 2,95 ммоль) в ДХМ (30 мл) при 0°С в азоте добавляли DMP (2,50 г, 5,90 ммоль) одной частью, затем реакционную смесь нагревали до температуры окружающей среды. Через 14 часов реакционную смесь разбавляли ДХМ (70 мл), промывали 1 н. NaOH (2×30 мл) и солевым раствором (30 мл), затем высушивали (MgSO4), фильтровали и концентрировали в вакууме. Очистка с помощью хроматографии (диоксид кремния, 10-20% EtOAc в гексанах) давала трет-бутиловый эфир 2-бутил-2-формил-пирролидин-1-карбоновой кислоты (0,359 г, 1,41 ммоль, 48%) в виде бледно-желтого масла.
Используя вышеприведенную процедуру и соответствующие исходные вещества, подобным образом получали:
трет-Бутиловый эфир 2-формил-2-пропил-пирролидин-1-карбоновой кислоты (бесцветное масло, 92%);
трет-Бутиловый эфир 2-формил-2-изопропоксиметил-пирролидин-1-карбоновой кислоты (бесцветное масло, 77%);
трет-Бутиловый эфир 2-формил-2-изобутил-пирролидин-1-карбоновой кислоты (бесцветное масло, 79%);
трет-Бутиловый эфир 2-циклопропилметил-2-формил-пирролидин-1-карбоновой кислоты (желтое масло, 85%);
трет-Бутиловый эфир 2-формил-5,5-диметил-2-пропил-пирролидин-1-карбоновой кислоты (бесцветное масло, 85%);
трет-Бутиловый эфир (2S,4R)-4-(трет-бутил-диметил-силанилокси)-2-формил-2-пропил-пирролидин-1-карбоновой кислоты (бесцветное масло, 63%) и
трет-Бутиловый эфир 2-формил-2-(тетрагидро-пиран-4-илметил)-пирролидин-1-карбоновой кислоты.
Получение 4
трет-Бутиловый эфир 2-этоксиметил-2-формил-пирролидин-1-карбоновой кислоты.
Процедура синтеза для данного получения приведена на схеме Д ниже.
Схема Д
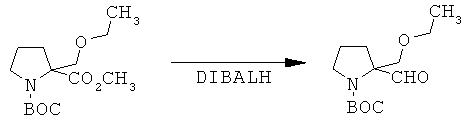
К перемешиваемому раствору 1-трет-бутилового эфира 2-метилового эфира 2-этоксиметил-пирролидин-1,2-дикарбоновой кислоты (1,00 г, 3,48 ммоль, полученного при использовании процедуры стадии 1 получения 3) в ТГФ (40 мл) при -78°С в азоте добавляли DIBALH (4,09 мл 1,7 М раствора в PhCH3, 6,96 ммоль) по каплям в течение 15 минут, так чтобы внутренняя температура не превышала -75°С. Через 4,5 часа реакционную смесь гасили, добавляя декагидрат сульфата натрия (4 г) и МеОН (0,5 мл), и затем нагревали до температуры окружающей среды. Реакционную смесь разбавляли EtOAc (50 мл) и фильтровали. Осадок на фильтре промывали EtOAc (200 мл) и объединенные фильтраты концентрировали в вакууме до бесцветного масла. Очистка с помощью хроматографии (диоксид кремния, 10-30% EtOAc в гексанах) давала трет-бутиловый эфир 2-этоксиметил-2-формил-пирролидин-1-карбоновой кислоты (0,528 г, 2,05 ммоль, 59%) в виде чистого бесцветного масла.
Используя вышеприведенную процедуру и соответствующие исходные вещества, подобным образом получали:
трет-Бутиловый эфир 2-(3,3-дифтор-аллил)-2-формил-пирролидин-1-карбоновой кислоты (бесцветное масло, 100%);
трет-Бутиловый эфир (2R,4R)-4-(трет-бутил-диметил-силанилокси)-2-формил-2-пропил-пирролидин-1-карбоновой кислоты (бесцветное масло, 36%);
трет-Бутиловый эфир 2-формил-2-пропил-азетидин-1-карбоновой кислоты (бесцветное масло, 53%) и
трет-Бутиловый эфир 2-гидроксиметил-2-пропил-пиперидин-1-карбоновой кислоты (бесцветное масло, 72%).
Получение 5
трет-Бутиловый эфир 4-формил-4-пропил-пиперидин-1-карбоновой кислоты Процедура синтеза для данного получения приведена на схеме Е ниже.
Схема Е
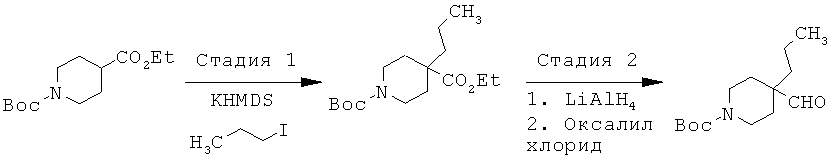
Стадия 1 1-трет-Бутиловый эфир 4-этиловый эфир 4-пропил-пиперидин-1,4-дикарбоновой кислоты
К раствору гексаметилдисилазида калия (29,1 г, 146 ммоль) в ТГФ (200 мл) при -78°С добавляли этил N-Вос-пиперидин-4-карбоксилат (25 г, 97 ммоль). Реакционную смесь перемешивали при -78°С в течение 30 минут, затем медленно добавляли 1-йодпропан (14,2 мл, 146 ммоль). Реакционную смесь перемешивали при -78°С в течение дополнительных 20 минут, затем нагревали до комнатной температуры и перемешивали в течение 1 часа. Реакцию гасили, добавляя насыщенный водный раствор NH4Cl, и экстрагировали EtOAc. Объединенные органические экстракты промывали солевым раствором, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (0% до 50% EtOAc в гексанах), что давало 19,3 г (66%) 1-трет-бутилового эфира 4-этилового эфира 4-пропил-пиперидин-1,4-дикарбоновой кислоты в виде желтого масла.
Стадия 2 трет-Бутиловый эфир 4-формил-4-пропип-пиперидин-1-карбоновой кислоты
К раствору 1-трет-бутилового эфира 4-этилового эфира 4-пропил-пиперидин-1,4-дикарбоновой кислоты (19,3 г, 64,3 ммоль) в ТГФ (120 мл) при 0°С медленно добавляли алюмогидрид лития (1,0 М в ТГФ, 65 мл, 65 ммоль). Реакционную смесь перемешивали при 0°С в течение одного часа, затем гасили, медленно добавляя твердый Na2SO4·10H2O, и перемешивали интенсивно при комнатной температуре в течение одного часа. Твердые вещества удаляли посредством фильтрации через целит, промывая EtOAc. Фильтрат концентрировали при пониженном давлении, что давало желтое масло.
В отдельной колбе растворяли оксалил хлорид (5,4 мл, 64,3 ммоль) в дихлорметане (150 мл) и охлаждали до -78°С. Диметилсульфоксид (9,1 мл, 130 ммоль) медленно добавляли и реакционную смесь перемешивали при -78°С в течение 15 минут. Вышеприведенное желтое масло, растворенное в дихлорметане (50 мл), медленно добавляли. После перемешивания при -78°С в течение 15 минут Et3N (45 мл, 322 ммоль) добавляли. Реакционную смесь нагревали до комнатной температуры в течение одного часа, затем гасили с H2O и экстрагировали дихлорметаном. Объединенные органические экстракты высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (0% до 50% EtOAc в гексанах), что давало 12,3 г (75%) трет-бутилового эфира 4-формил-4-пропил-пиперидин-1-карбоновой кислоты в виде бесцветного масла.
Пример 1
(3-Бензил-пирролидин-3-ил)-(1H-индол-5-ил)-метанон
Процедуру синтеза, описанную в этом примере, осуществляли согласно способу, показанному на схеме Ж.
Схема Ж
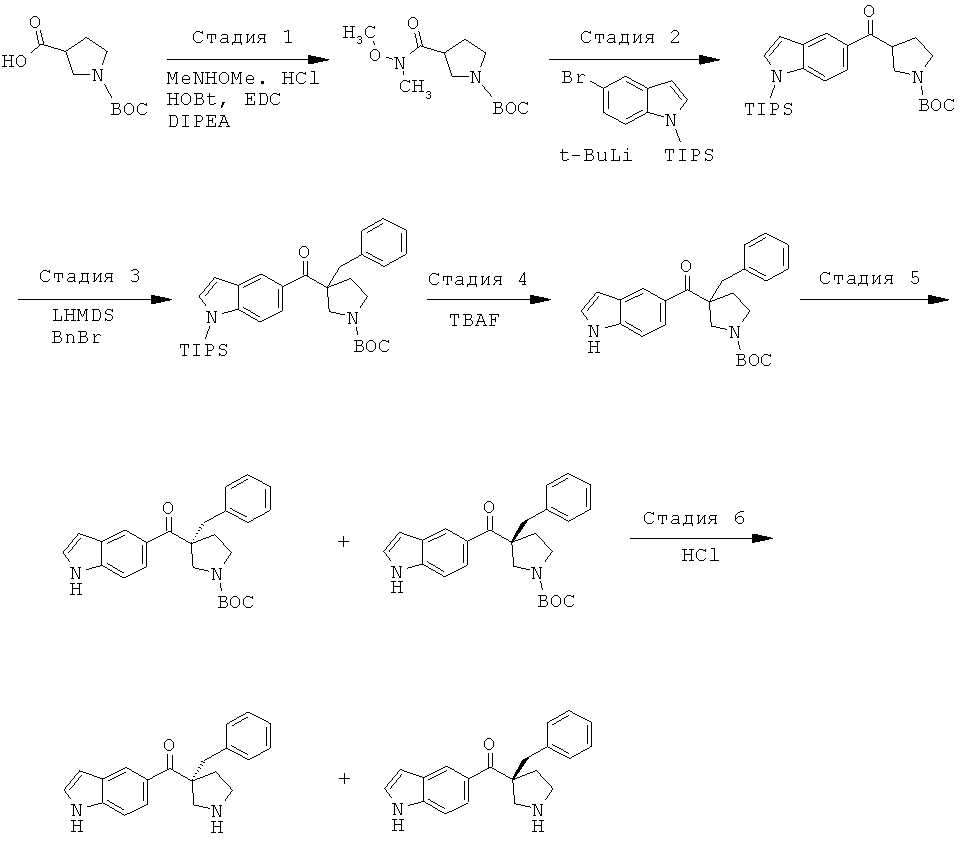
Стадия 1 трет-Бутиловый эфир 3-(метокси-метил-карбамоил)-пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир пирролидин-1,3-дикарбоновой кислоты (3,00 г, 13,93 ммоль), N,O-диметилгидроксиламин гидрохлорид (1,63 г, 16,72 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (2,94 г, 15,32 ммоль) и 1-гидроксибензотриазол (2,07 г, 15,32 ммоль) помещали в 100 мл круглодонную колбу и растворяли в ДМФА (30 мл). Диизопропилэтиламин (6,1 мл, 34,82 ммоль) медленно добавляли и реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакцию гасили, добавляя воду, и экстрагировали этилацетатом. Объединенные органические экстракты промывали водой и солевым раствором, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, что давало 2,60 г (выход 72%) трет-бутилового эфира 3-(метокси-метил-карбамоил)-пирролидин-1-карбоновой кислоты в виде бледно-желтого масла, которое использовали на следующей стадии без дополнительной очистки.
Подобным образом, при использовании процедуры стадии 1 были получены:
трет-Бутиловый эфир 4-(метокси-метил-карбамоил)-пиперидин-1-карбоновой кислоты;
трет-Бутиловый эфир 3-(метокси-метил-карбамоил)-пиперидин-1-карбоновой кислоты;
трет-Бутиловый эфир 2-(метокси-метил-карбамоил)-азетидин-1-карбоновой кислоты и
трет-Бутиловый эфир 3-(метокси-метил-карбамоил)-азепин-1-карбоновой кислоты.
Стадия 2 трет-Бутиловый эфир 3-(1-триизопропилсиланил-1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты
трет-Бутиллитий (1,7 М в пентане, 13 мл, 22,13 ммоль) добавляли к раствору 5-бром-1-триизопропилсиланил-1Н-индола (3,54 г, 10,06 ммоль) в ТГФ (35 мл) при -78°С в атмосфере азота. Бледно-желтую реакционную смесь перемешивали при -78°С в течение 15 минут, затем раствор трет-бутилового эфира 3-(метокси-метил-карбамоил)-пирролидин-1-карбоновой кислоты (2,60 г, 10,06 ммоль) в ТГФ (5 мл) медленно добавляли. Полученную в результате смесь перемешивали при -78°С в течение 30 минут, затем нагревали до комнатной температуры в течение 1 часа. Реакцию гасили, добавляя насыщенный водный раствор NH4Cl, и разделяли между водой и EtOAc. Органический слой высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Неочищенный остаток очищали с помощью флэш-хроматографии (10% до 25% EtOAc в гексане), что давало 2,66 г (выход 56%) трет-бутилового эфира 3-(1-триизопропилсиланил-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты в виде бесцветного масла.
Стадия 3 трет-Бутиловый эфир 3-бензил-3-(1-триизопропилсиланил-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты
Бис(триметилсилил)амид лития (1,0 М в ТГФ, 12,1 мл) добавляли к раствору трет-бутилового эфира 3-(1-триизопропилсиланил-1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (1,90 г, 4,03 ммоль) в ТГФ (25 мл) при 0°С в атмосфере азота. Реакционную смесь перемешивали при 0°С в течение 10 минут и затем бензилбромид (1,9 мл, 16,12 ммоль) добавляли. Полученную в результате смесь нагревали до комнатной температуры и перемешивали в течение 1,5 часов. Реакцию гасили, добавляя насыщенный водный раствор NH4Cl, затем разбавляли водой и экстрагировали EtOAc. Органический слой высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (10% до 20% EtOAc в гексане), что давало 1,55 г (выход 69%) трет-бутилового эфира 3-бензил-3-(1-триизопропилсиланил-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты в виде белой пены.
Стадия 4 трет-Бутиловый эфир 3-бензил-3-(1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты
Раствор фторида тетрабутиламмония (1,0 М в ТГФ, 1,2 мл) медленно добавляли при 0°С к раствору трет-бутилового эфира 3-бензил-3-(1-триизопропилсиланил-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (670 мг, 1,19 ммоль) в ТГФ (15 мл). Полученную в результате ярко-желтую смесь перемешивали при 0°С в течение 20 минут, затем гасили, добавляя воду. Полученную в результате смесь экстрагировали EtOAc, и объединенные органические слои высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (30% до 50% EtOAc в гексане), что давало 447 мг (выход 93%) трет-бутилового эфира 3-бензил-3-(1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты в виде белой пены.
Стадия 5 Разделение трет-бутилового эфира (+)-3-бензил-3-(1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты и трет-бутилового эфира (-)-3-бензил-3-(1Н-индол-5-карбонил)-пиоролидин-1-карбоновой кислоты
Два энантиомера трет-бутилового эфира 3-бензил-3-(1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты разделяли с помощью хиральной ВЭЖХ (используя колонку Chiralpak IA с 90/10 гексаном/EtOH, 1,4 мл/мин).
Энантиомер А:
[α]D=+8,6° (5,2 мг/1,0 мл EtOH).
Энантиомер В:
[α]D=-10,2° (5,2 мг/1,0 мл EtOH).
Стадия 6 (+)-(3-Бензил-пирролидин-3-ил)-(1Н-индол-5-ил)-метанон и (-)-(3-Бензил-пирролидин-3-ил)-(1Н-индол-5-ил)-метанон
Раствор HCl (1,0 М в МеОН, 12 мл) добавляли к раствору энантиомера А трет-бутилового эфира 3-бензил-3-(1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (257 мг, 0,635 ммоль) в МеОН (5 мл). Полученный в результате бледно-желтый раствор перемешивали при комнатной температуре в течение 6 часов, затем охлаждали до 0°С и гасили, добавляя водный NaOH (1,0 М). Смесь разбавляли водой и экстрагировали ДХМ. Объединенные органические слои высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (5% до 10% МеОН в ДХМ с 0,5% NH4OH), что давало 179 мг (выход 93%) (3-бензил-пирролидин-3-ил)-(1H-индол-5-ил)-метанон, который растворяли в смеси ДХМ/МеОН. Раствор HCl (1 М в Et2O) добавляли, полученную в результате смесь выпаривали при пониженном давлении и остаток растирали с Et2O, что давало 173 мг энантиомера А гидрохлорид (3-бензил-пирролидин-3-ил)-(1Н-индол-5-ил)-метанона в виде белого порошка. MS=305 [М+Н]+; [α]D=-26,3° (5,40 мг/1,0 мл МеОН).
Подобным образом получали энантиомер Б гидрохлорид (3-бензил-пирролидин-3-ил)-(1H-индол-5-ил)-метанона: [α]D=+24,4° (5,45 мг/1,0 мл МеОН).
Используя процедуру примера 1 с соответствующим исходным веществом, получали следующие соединения:
Гидрохлорид (3-бензил-пирролидин-3-ил)-(7-фтор-1Н-индол-5-ил)-метанона, розовый порошок, MS=324 [М+Н]+;
Гидрохлорид (1H-индол-5-ил)-[3-(3-метокси-бензил)-пирролидин-3-ил]-метанона, светло-розовый порошок, MS=335 [М+Н]+;
Гидрохлорид 3-[3-(1Н-индол-5-карбонил)-пирролидин-3-илметил]-бензонитрила, белое твердое вещество, MS=330 [М+Н]+;
Гидрохлорид [3-(3-фтор-бензил)-пирролидин-3-ил]-(1H-индол-5-ил)-метанона, оранжево-розовое твердое вещество, MS=323 [М+Н]+;
Гидрохлорид [3-(4-фтор-бензил)-пирролидин-3-ил]-(1Н-индол-5-ил)-метанона, красный порошок, MS=323 [М+Н]+;
Гидрохлорид (1H-индол-5-ил)-[3-(4-метокси-бензил)-пирролидин-3-ил]-метанона, MS=335 [М+Н]+;
Гидрохлорид [3-(3,4-дихлор-бензил)-пирролидин-3-ил]-(1H-индол-5-ил)-метанона, грязно-белый порошок, MS=374 [М+Н]+;
Гидрохлорид [3-(2-фтор-бензил)-пирролидин-3-ил]-(1H-индол-5-ил)-метанона, розовое твердое вещество, MS=323 [М+Н]+;
Гидрохлорид (3-бензил-пирролидин-3-ил)-(2-метил-1Н-индол-5-ил)-метанона, желтое твердое вещество, MS=319 [М+Н]+;
Гидрохлорид (3-бензил-пирролидин-3-ил)-(2,3-дигидро-1H-индол-5-ил)-метанона, светло-желтый порошок, MS=307 [М+Н]+;
(4-Бензил-пиперидин-4-ил)-(1H-индол-5-ил)-метанон, грязно-белый порошок, MS=319 [M+H]+;
(3-Бензил-пиперидин-3-ил)-(1H-индол-5-ил)-метанон, белое твердое вещество, MS=319 [М+Н]+: два энантиомера разделяли с помощью хиральной ВЭЖХ на колонке Chiralpak IB с 65/35 гексана/EtOH+0,1% ДЭА, 1,0 мл/мин;
Хлороводородная соль энантиомера А (белый порошок), [α]D=-126,4° (5,12 мг/1,024 мл МеОН),
Хлороводородная соль энантиомера Б (белый порошок), [α]D=+129,4° (5,26 мг/1,052 мл МеОН),
Гидрохлорид (1Н-индол-5-ил)-[3-(4-метокси-бензил)-пиперидин-3-ил]-метанона, бледно-желтый порошок, MS=349 [М+Н]+.
Гидрохлорид [3-(3-фтор-бензил)-пиперидин-3-ил]-(1H-индол-5-ил)-метанона, белое твердое вещество, MS=337 [М+Н]+
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 2
5-(3-Бензил-пирролидин-3-карбонил)-1Н-индол-3-карбонитрил
Процедуру синтеза, описанную в этом примере, осуществляли согласно способу, показанному на схеме 3.
Схема 3
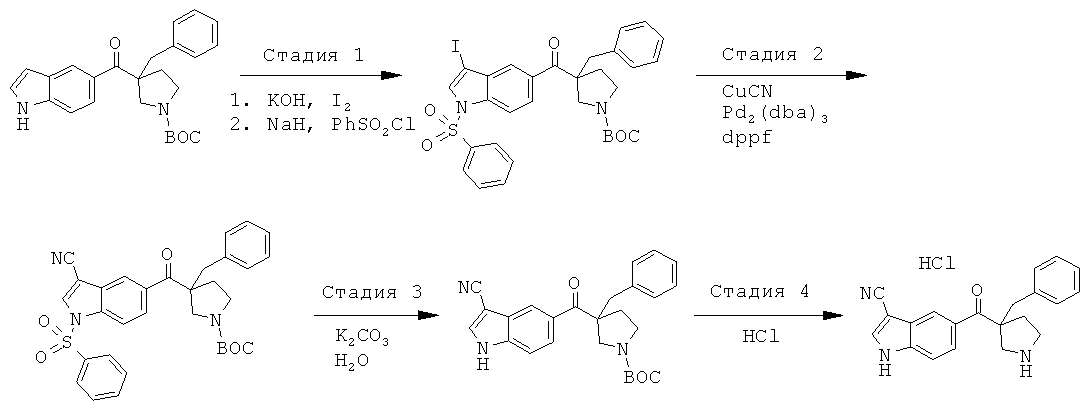
Стадия 1 трет-Бутиловый эфир 3-(1-бензолсульфонил-3-йод-1Н-индол-5-карбонил)-3-бензил-пирролидин-1-карбоновой кислоты
Свежеизмельченный гидроксид калия (35 мг, 0,617 ммоль) добавляли к раствору трет-бутилового эфира 3-бензил-3-(1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (100 мг, 0,247 ммоль) в ДМФА (1,5 мл). Затем раствор йода (63 мг, 0,247 ммоль) в ДМФА (0,5 мл) добавляли по каплям и реакционную смесь перемешивали при комнатной температуре в течение 45 минут. Реакцию гасили, добавляя водный раствор Na2S2O3, и разбавляли водой. Полученную в результате смесь экстрагировали EtOAc, объединенные органические экстракты промывали водой, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Сразу же остаток растворяли в ДМФА (2 мл) и NaH (60% в минеральном масле, 12 мг, 0,296 ммоль) добавляли к раствору. Полученную в результате смесь перемешивали в течение 20 минут, потом по каплям добавляли бензолсульфонил хлорид (38 мкл, 0,296 ммоль). Реакционную смесь перемешивали в течение 30 минут, затем гасили, добавляя воду. Полученную в результате смесь экстрагировали EtOAc, объединенные органические экстракты промывали водой, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (10% до 30% EtOAc в гексане), что давало 150 мг (выход 91%) трет-бутилового эфира 3-(1-бензолсульфонил-3-йод-1Н-индол-5-карбонил)-3-бензил-пирролидин-1-карбоновой кислоты в виде белой пены.
Стадия 2 трет-Бутиловый эфир 3-(1-бензолсульфонил-3-циано-1H-индол-5-карбонил)-3-бензил-пирролидин-1 -карбоновой кислоты
Цианид меди (I) (76 мг, 0,852 ммоль) добавляли в 25 мл круглодонную колбу, наполненную трет-бутиловым эфиром 3-(1-бензолсульфонил-3-йод-1H-индол-5-карбонил)-3-бензил-пирролидин-1-карбоновой кислоты (143 мг, 0,213 ммоль), затем 1,1'-бис(дифенилфосфино)ферроцен (24 мг, 0,043 ммоль) и трис(дибензилиденацетон) дипалладий (0) (10 мг, 0,011 ммоль). Затем 1,4-диоксан (1,5 мл) добавляли и смесь нагревали с обратным холодильником в атмосфере азота в течение одного часа. Реакционную смесь охлаждали до комнатной температуры и фильтровали через прокладку из целита. Осадок на фильтре промывали EtOAc и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (30% EtOAc в гексане), что давало 115 мг (выход 95%) трет-бутилового эфира 3-(1-бензолсульфонил-3-циано-1H-индол-5-карбонил)-3-бензил-пирролидин-1-карбоновой кислоты в виде бледно-желтой пены.
Стадия 3 трет-Бутиловый эфир 3-бензил-3-(3-циано-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты
Воду (1 мл) добавляли к раствору трет-бутилового эфира 3-(1-бензолсульфонил-3-циано-1H-индол-5-карбонил)-3-бензил-пирролидин-1-
карбоновой кислоты (100 мг, 0,175 ммоль) в МеОН (4 мл), затем карбонат калия (73 мг, 0,525 ммоль). Реакционную смесь нагревали при 50°С в течение 10 минут, затем охлаждали до комнатной температуры и разбавляли водой и солевым раствором. Полученную в результате смесь экстрагировали ДХМ, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (30% до 50% EtOAc в гексане), что давало трет-бутиловый эфир 3-бензил-3-(3-циано-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты в виде белого пенообразного твердого вещества.
Стадия 4 5-(3-Бензил-пирролидин-3-карбонил)-1H-индол-3-карбонитрил
Раствор HCl (1,0 М в МеОН, 8 мл) медленно добавляли при 0°С к раствору трет-бутилового эфира 3-бензил-3-(3-циано-1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (169 мг, 0,393 ммоль) в МеОН (2 мл). Полученную в результате бледно-желтую смесь перемешивали при комнатной температуре в течение 4 часов, затем гасили, добавляя охлажденный до 0°С водный NaOH (1,0 М). Полученную в результате смесь разбавляли водой и экстрагировали ДХМ. Объединенные органические экстракты высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Неочищенное вещество очищали с помощью флэш-хроматографии (МеОН в ДХМ с 0,5% NH4OH), что давало 42 мг 5-(3-бензил-пирролидин-3-карбонил)-1Н-индол-3-карбонитрила в виде белого пенообразного твердого вещества. Данный продукт растворяли в ДХМ и раствор HCl (1,0 М в Et2O, 1 эквивалент) добавляли. МеОН добавляли и полученную в результате смесь выпаривали при пониженном давлении. Остаток растирали с Et2O и 32 мг гидрохлорида 5-(3-бензил-пирролидин-3-карбонил)-1Н-индол-3-карбонитрила собирали в виде белого твердого вещества, MS=330 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 3
Гидрохлорид (1Н-индазол-5-ил)-(3-пропил-пирролидин-3-ил)-метанона
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме И.
Схема И
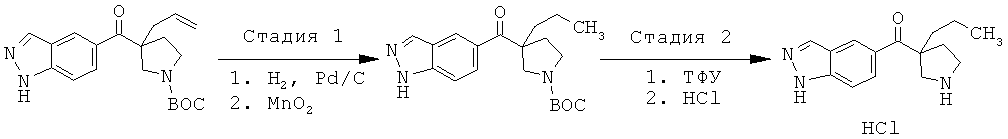
Стадия 1 трет-Бутиловый эфир 5-(3-пропил-пирролидин-3-карбонил)-индазол-1-карбоновой кислоты
трет-Бутиловый эфир 5-(3-аллил-пирролидин-3-карбонил)-индазол-1-карбоновой кислоты получали, как описано на стадиях 3 и 4 примера 1, но заменяя бензил бромид аллил бромидом. Pd/C (10%, катализатор от Degussa типа Е101 NE/W, 100 мг) добавляли к раствору трет-бутилового эфира 5-(3-аллил-пирролидин-3-карбонил)-индазол-1-карбоновой кислоты (200 мг, 0,56 ммоль) в МеОН (10 мл). Полученную в результате смесь перемешивали в атмосфере водорода (давление баллона) в течение 2,5 часов. Затем реакционную смесь фильтровали через прокладку из целита и фильтрат выпаривали при пониженном давлении, что давало 207 мг неочищенного трет-бутилового эфира 5-[гидрокси-(3-пропил-пирролидин-3-ил)-метил]-индазол-1-карбоновой кислоты в виде грязно-белой пены. Данное вещество растворяли в толуоле (8 мл) и добавляли активированный диоксид марганца (85%, 240 мг, 2,80 ммоль). Полученную в результате смесь нагревали при 100°С в течение 3 часов, затем охлаждали до комнатной температуры и фильтровали через прокладку из целита. Фильтрат выпаривали при пониженном давлении и полученный в результате остаток очищали с помощью флэш-хроматографии, что давало 86 мг трет-бутилового эфира 5-(3-пропил-пирролидин-3-карбонил)-индазол-1-карбоновой кислоты в виде белого пенообразного твердого вещества.
Стадия 2 Гидрохлорид (1H-индазол-5-ил)-(3-поопил-пирролидин-3-ил)-метанона
Удаляли защитную группу в трет-бутиловом эфире 5-(3-пропил-пирролидин-3-карбонил)-индазол-1-карбоновой кислоты, следуя процедуре, описанной на стадии 4 примера 2, гидрохлорид (1H-индазол-5-ил)-(3-пропил-пирролидин-3-ил)-метанона получали в виде белого порошка, MS=258 [М+Н]+.
Используя вышеописанную процедуру и соответствующее исходное вещество, получали следующие соединения:
гидрохлорид (1Н-индол-5-ил)-(3-пропил-пирролидин-3-ил)-метанона, MS=257 [М+Н]+;
гидрохлорид (3-бутил-пирролидин-3-ил)-(1H-индол-5-ил)-метанона, MS=271 [М+Н]+ и
гидрохлорид (1Н-индол-5-ил)-[3-(3-метил-бутил)-пирролидин-3-ил]-метанона, MS=285 [М+Н]+.
Дополнительные соединения, полученные согласно вышеописанной процедуре, показаны в таблице 1.
Пример 4
(1Н-Индол-5-ил)-(3-фенил-пирролидин-3-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме К.
Схема К
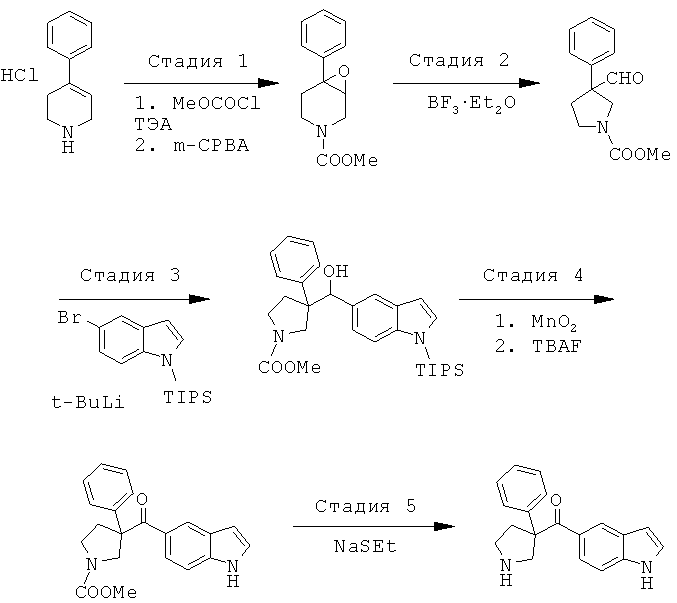
Стадия 1 Метиловый эфир 6-фенил-7-окса-3-аза-бицикло[4.1.0]гептан-3-карбоновой кислоты
Триэтиламин (2,6 мл, 19,15 ммоль) добавляли к суспензии гидрохлорида 4-фенил-1,2,3,6-тетрагидропиридина (1,50 г, 7,66 ммоль) в ДХМ (30 мл). Полученную в результате смесь перемешивали в течение 5 минут до полного растворения твердых веществ, затем охлаждали до 0°С и по каплям добавляли метил хлорформиат (0,65 мл, 8,43 ммоль). Образовывался вязкий белый осадок. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 часа, затем гасили, добавляя воду, и экстрагировали ДХМ. Объединенные органические экстракты высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, что давало 1,75 г метилового эфира 4-фенил-3,6-дигидро-2H-пиридин-1-карбоновой кислоты в виде бледно-желтого масла. Данный неочищенный продукт (7,66 ммоль) растворяли в хлороформе (30 мл) и добавляли 3-хлорпероксибензойную кислоту (77%, 2,22 г, 9,95 ммоль). Полученный в результате раствор перемешивали при комнатной температуре в течение 18 часов. Добавляли водный раствор Na2SO3 (20%, 30 мл) и полученную в результате смесь интенсивно перемешивали в течение 1 часа. Фазы разделяли и водный слой экстрагировали ДХМ. Объединенные органические экстракты промывали насыщенным водным раствором NaHCO3, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, что давало бледно-желтое масло. Данное неочищенное масло очищали с помощью флэш-хроматографии (10% до 20% EtOAc в гексане), что давало 1,68 г (выход 2 стадий 94%) метилового эфира 6-фенил-7-окса-3-аза-бицикло[4.1.0]гептан-3-карбоновой кислоты в виде бесцветного масла.
Стадия 2 Метиловый эфир 3-формил-3-фенил-пирролидин-1-карбоновой кислоты
Эфират трифторида бора (1,82 мл, 14,40 ммоль) медленно добавляли при комнатной температуре к раствору метилового эфира 6-фенип-7-окса-3-аза-бицикло[4.1.0]гептан-3-карбоновой кислоты (1,68 г, 7,20 ммоль). Наблюдалась слабо экзотермическая реакция, и через 5 минут реакционную смесь гасили, медленно добавляя насыщенный водный NaHCO3 (50 мл). Полученную в результате смесь экстрагировали EtOAc и объединенные органические экстракты промывали водой, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, что давало 1,63 г (выход 97%) метилового эфира 3-формил-3-фенил-пирролидин-1-карбоновой кислоты в виде бледно-желтого масла, которое использовали без дополнительной очистки.
Стадия 3 Метиловый эфир 3-[гидрокси-(1-триизопропилсиланил-1Н-индол-5-ил)-метил]-3-фенил-пирролидин-1-карбоновой кислоты
трет-Бутиллитий (1,7 М в пентане, 8,9 мл, 15,10 ммоль) добавляли при -78°С в атмосфере азота к раствору 5-бром-1-триизопропилсиланил-1H-индола (2,42 г, 6,86 ммоль) в ТГФ (25 мл). Полученный в результате бледно-желтый раствор перемешивали при -78°С в течение 15 минут, затем раствор метилового эфира 3-формил-3-фенил-пирролидин-1-карбоновой кислоты (1,60 г, 6,86 ммоль) в ТГФ (5 мл) медленно добавляли. Реакционную смесь перемешивали при -78°С в течение 30 минут и затем нагревали до комнатной температуры в течение 1 часа. Реакцию гасили, добавляя насыщенный водный раствор NH4Cl, и разбавляли водой. Полученную в результате смесь экстрагировали EtOAc и объединенные органические экстракты высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (10% до 50% EtOAc в гексане), что давало 1,76 г (выход 51%) метилового эфира 3-[гидрокси-(1-триизопропилсиланил-1Н-индол-5-ил)-метил]-3-фенил-пирролидин-1-карбоновой кислоты в виде белого пенообразного твердого вещества.
Стадия 4 Метиловый эфир 3-(1Н-индол-5-карбонил)-3-фенил-пирролидин-1-карбоновой кислоты
Диоксид марганца (85%, 256 мг, 2,95 ммоль) добавляли к раствору метилового эфира 3-[гидрокси-(1-триизопропилсиланил-1Н-индол-5-ил)-метил]-3-фенил-пирролидин-1-карбоновой кислоты (300 мг, 0,59 ммоль) в толуоле (8 мл). Реакционную смесь нагревали при 100°С в течение 2 часов, затем охлаждали до комнатной температуры и фильтровали через прокладку из целита. Фильтрат выпаривали при пониженном давлении, что давало 326 мг метилового эфира 3-фенил-3-(1-триизопропилсиланил-1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты в виде бесцветного пенообразного масла. Часть данного продукта (298 мг, 0,59 ммоль) растворяли в ТГФ (8 мл) и добавляли раствор фторида тетрабутиламмония (1,0 М в ТГФ, 0,60 мл, 0,59 ммоль) при 0°С. Реакционную смесь перемешивали при 0°С в течение 20 минут, затем гасили, добавляя воду. Полученную в результате смесь экстрагировали EtOAc и объединенные органические экстракты высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (30% до 50% EtOAc в гексане), что давало 167 мг (выход 2 стадий 81%) метилового эфира 3-(1Н-индол-5-карбонил)-3-фенил-пирролидин-1-карбоновой кислоты в виде белой пены.
трет-Бутиловый эфир 4-(1Н-индол-5-карбонил)-4-фенил-пиперидин-1-карбоновой кислоты получали, следуя процедуре, описанной выше, при использовании трет-бутилового эфира 4-формил-4-фенил-пиперидин-1-карбоновой кислоты (полученного, как описано в Получении 5).
Стадия 5 (1H-Индол-5-ил)-(3-фенил-пирролидин-3-ил)-метанон
Этантиолат натрия (113 мг, 1,35 ммоль) добавляли к раствору метилового эфира 3-(1H-индол-5-карбонил)-3-фенил-пирролидин-1-карбоновой кислоты (157 мг, 0,45 ммоль) в ДМФА (3 мл). Полученную в результате смесь нагревали при 100°С в течение 2 часов и затем при 120°С в течение 2 дополнительных часов. Реакционную смесь охлаждали до комнатной температуры и гасили, добавляя воду. Полученную в результате смесь экстрагировали EtOAc, объединенные органические экстракты промывали водой, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, что давало 230 мг масла, которое очищали с помощью флэш-хроматографии (МеОН/ДХМ/NH4OH), что давало 15 мг (1Н-индол-5-ил)-(3-фенил-пирролидин-3-ил)-метанона; MS=291 [М+Н]+.
Подобным образом получали (1Н-индол-5-ил)-(4-фенил-пиперидин-4-ил)-метанон, MS=305 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 5
(3-Бензил-пирролидин-3-ил)-(1-метил-1H-индол-5-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Л.
Схема Л
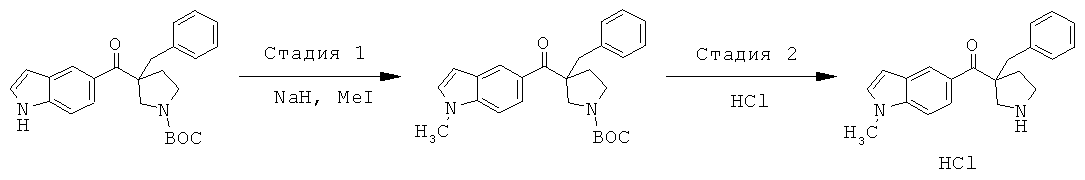
Стадия 1 трет-Бутиловый эфир 3-бензил-3-(1-метил-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты
Гидрид натрия (60% в минеральном масле, 12 мг, 0,296 ммоль) добавляли при комнатной температуре к раствору трет-бутилового эфира 3-бензил-3-(1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (100 мг, 0,247 ммоль) в ДМФА (3 мл). Полученную в результате смесь перемешивали при комнатной температуре в течение 20 минут и затем добавляли метилиодид (18 мкл, 0,296 ммоль). Затем реакционную смесь перемешивали в течение 30 минут, потом гасили, добавляя воду, и экстрагировали EtOAc. Объединенные органические экстракты промывали водой и солевым раствором, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, что давало 105 мг трет-бутилового эфира 3-бензил-3-(1-метил-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты в виде белой пены, который использовали без дополнительной очистки.
Стадия 2 (3-Бензил-пирролидин-3-ил)-(1-метил-1H-индол-5-ил)-метанон
Удаляли защитную группу в трет-бутиловом эфире 3-бензил-3-(1-метил-1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты, как описано на стадии 4 примера 1, что давало (3-бензил-пирролидин-3-ил)-(1-метил-1Н-индол-5-ил)-метанон в виде хлороводородной соли, MS=319 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 6
(3-Бензил-пирролидин-3-ил)-(3,4-дихлор-фенил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме М.
Схема М
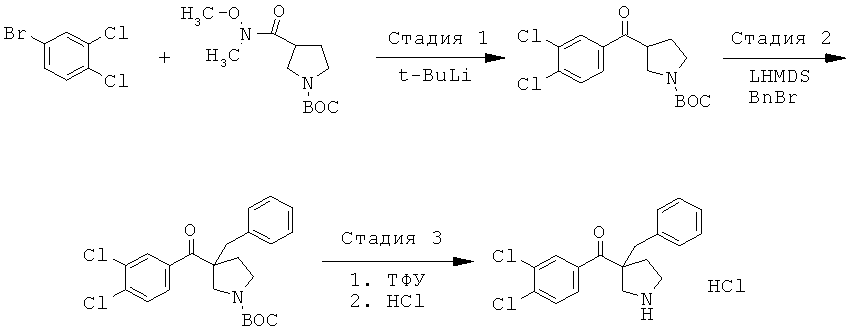
Стадия 1 трет-Бутиловый эфир 3-(3.4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты
трет-Бутиллитий (1,7 М в пентане, 2,5 мл, 4,25 ммоль) добавляли при -78°С к раствору 4-бром-1,2-дихлорбензола (435 мг, 1,93 ммоль) в ТГФ (10 мл) в атмосфере азота. Полученный в результате раствор перемешивали при -78°С в течение 15 минут и затем медленно добавляли раствор трет-бутилового эфира 3-(метокси-метил-карбамоил)-пирролидин-1-карбоновой кислоты (500 мг, 1,93 ммоль) в ТГФ (2 мл). Реакционную смесь перемешивали при -78°С в течение 20 минут и затем нагревали до комнатной температуры в течение 30 минут. Реакцию гасили, добавляя насыщенный водный NH4Cl, затем разбавляли водой и экстрагировали EtOAc. Объединенные органические экстракты высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, что давало масло, которое очищали с помощью флэш-хроматографии (10% до 30% EtOAc в гексане), что давало 143 мг (выход 22%) трет-бутилового эфира 3-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты в виде бесцветного масла.
Стадия 2 трет-Бутиловый эфир 3-бензил-3-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты
Бензил бромид (0,19 мл, 1,60 ммоль) добавляли к раствору трет-бутилового эфира 3-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты (138 мг, 0,40 ммоль) в ТГФ (5 мл) и затем бис(триметилсилил)амид лития (1,0 М в ТГФ, 1,2 мл, 1,20 ммоль) медленно добавляли при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 1,5 часа, затем гасили, добавляя насыщенный водный NH4Cl, разбавляли водой и экстрагировали EtOAc. Объединенные органические экстракты высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (10% до 20% EtOAc в гексане), что давало 40 мг (выход 23%) трет-бутилового эфира 3-бензил-3-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты в виде бесцветного масла.
Стадия 3 (3-Бензил-пирролидин-3-ил)-(3,4-дихлор-фенил)-метанон
Трифторуксусную кислоту (0,3 мл) добавляли при комнатной температуре к раствору трет-бутилового эфира 3-бензил-3-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты (40 мг, 0,092 ммоль) в ДХМ (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем выливали в водный NaOH (1,0 М), разбавляли водой и экстрагировали ДХМ. Объединенные органические экстракты высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (3% до 10% МеОН в ДХМ+0,5% NH4OH), что давало 15 мг (выход 48%) (3-бензил-пирролидин-3-ил)-(3,4-дихлор-фенил)-метанона в виде желтого масла. Данное вещество растворяли в ДХМ и раствор HCl (1,0 М в Et2O, 1,1 эквивалент) добавляли, полученную в результате смесь концентрировали при пониженном давлении и остаток растирали с Et2O, что давало 17 мг гидрохлорида (3-бензил-пирролидин-3-ил)-(3,4-дихлор-фенил)-метанона в виде белого твердого вещества; MS=334 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 7
Гидрохлорид 5-(3-бензил-пирролидин-3-карбонил)-1,3-дигидро-индол-2-она
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Н.
Схема Н
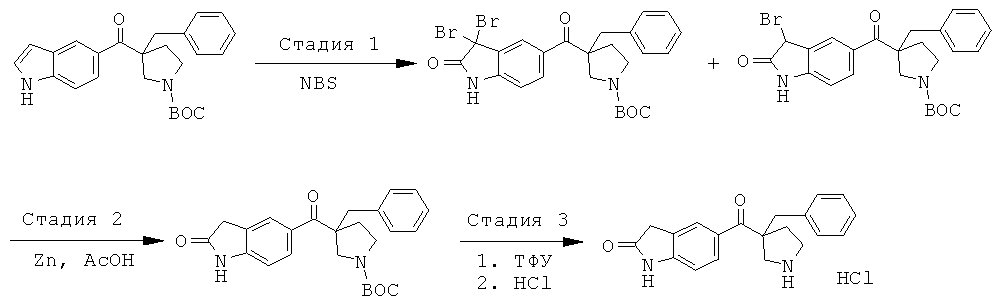
Стадия 1 трет-Бутиловый эфир 3-бензил-3-(3,3-дибром-2-оксо-2,3-дигидро-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты и трет-бутиловый эфир 3-бензил-3-(3-бром-2-оксо-2,3-дигидро-1Н-индол-5-карбонип)-пирролидин-1-карбоновой кислоты
Свежеперекристаллизованный N-бромсукцинимид (278 мг, 1,56 ммоль) добавляли частями в течение 5 минут при комнатной температуре к раствору трет-бутилового эфира 3-бензил-3-(1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (210 мг, 0,52 ммоль) в смеси t-BuOH/воды (5% воды, 8,40 мл). Реакционную смесь перемешивали в течение 1,5 часов при комнатной температуре и затем концентрировали при пониженном давлении. Остаток разделяли между водой и ДХМ, и объединенные органические экстракты высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (30% до 60% EtOAc в гексане), что давало 129 мг (выход 43%) трет-бутилового эфира 3-бензил-3-(3,3-дибром-2-оксо-2,3-дигидро-1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты в виде бледно-желтого пенообразного твердого вещества и 67 мг (выход 26%) трет-бутилового эфира 3-бензил-3-(3-бром-2-оксо-2,3-дигидро-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты в виде бледно-желтого пенообразного твердого вещества.
Стадия 2 трет-Бутиловый эфир 3-бензил-3-(2-оксо-2,3-дигидро-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты
Цинковый порошок (130 мг, 2,00 ммоль) добавляли к раствору трет-бутилового эфира 3-бензил-3-(3,3-дибром-2-оксо-2,3-дигидро-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (115 мг, 0,20 ммоль) в уксусной кислоте (4 мл). Реакционную смесь интенсивно перемешивали при комнатной температуре в течение 1 часа. Твердые вещества удаляли в ходе фильтрования и фильтрат концентрировали при пониженном давлении, что давало трет-бутиловый эфир 3-бензил-3-(2-оксо-2,3-дигидро-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты в виде пены. Такую же процедуру повторяли, используя трет-бутиловый эфир 3-бензил-3-(3-бром-2-оксо-2,3-дигидро-1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты, что давало дополнительный трет-бутиловый эфир 3-бензил-3-(2-оксо-2,3-дигидро-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты.
Стадия 3 Гидрохлорид 5-(3-бензил-пирролидин-3-карбонил)-1,3-дигидро-индол-2-она
Удаляли защитную группу в трет-бутиловом эфире 3-бензил-3-(2-оксо-2,3-дигидро-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты, следуя процедуре, описанной в примере 3, что давало гидрохлорид 5-(3-бензил-пирролидин-3-карбонил)-1,3-дигидро-индол-2-она в виде грязно-белого порошка; MS=321 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 8
(2-Бензил-пирролидин-2-ил)-(1Н-индол-5-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме О.
Схема О
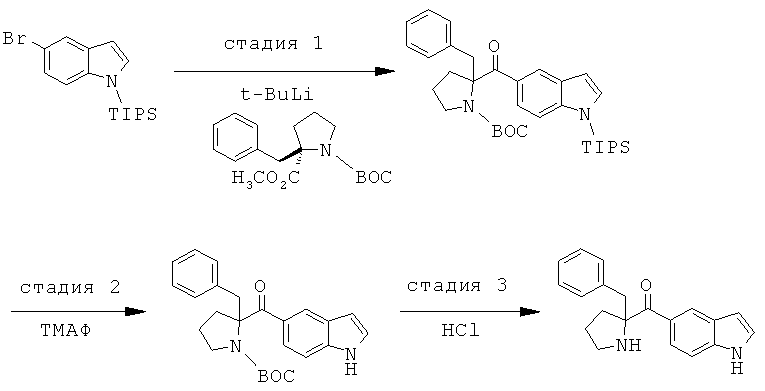
Стадия 1 трет-Бутиловый эфир 2-бензил-2-(1-триизопропилсиланил-1Н-индол-5-карбонил)-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору 5-бром-1-триизопропилсиланил-1Н-индола (0,55 г, 1,57 ммоль) в ТГФ (10 мл) при -78°С в атмосфере азота добавляли трет-бутиллитий (2,02 мл 1,55 М раствора в пентанах, 3,13 ммоль) по каплям. Через один час реакционную смесь быстро добавляли к холодному (-78°С) раствору 1-трет-бутилового эфира 2-метилового эфира (R)-2-бензил-пирролидин-1,2-дикарбоновой кислоты (0,50 г, 3,13 ммоль) в ТГФ (10 мл). Реакционную смесь перемешивали при -78°С в течение одного часа, затем нагревали до комнатной температуры и перемешивали в течение двух часов. Реакционную смесь гасили, добавляя насыщенный водный NH4Cl (20 мл), затем экстрагировали EtOAc. Объединенные экстракты промывали солевым раствором, затем высушивали (MgSO4), фильтровали и концентрировали в вакууме. Очистка с помощью хроматографии (диоксид кремния, 0-20% EtOAc в гексанах) давала трет-бутиловый эфир 2-бензил-2-(1-триизопропилсиланил-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (0,145 г, 0,259 ммоль, 16%) в виде бесцветной смолы.
Используя соответствующие исходные вещества, также получали следующее соединение:
трет-бутиловый эфир 2-бутил-2-(1-триизопропилсиланил-1Н-индазол-5-карбонил)-пирролидин-1-карбоновой кислоты (желтое масло, 31%).
Стадия 2 трет-Бутиловый эфир 2-бензил-2-(1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 2-бензил-2-(1-триизопропилсиланил-1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (0,145 г, 0,259 ммоль) в ТГФ (5 мл) при температуре окружающей среды в атмосфере азота добавляли ТМАФ (0,026 г, 0,285 ммоль). Через один час реакционную смесь концентрировали в вакууме. Очистка остатка с помощью хроматографии (диоксид кремния, 25-50% EtOAc в гексанах) давала трет-бутиловый эфир 2-бензил-2-(1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (0,045 г, 0,111 ммоль, 43%) в виде бесцветной пены.
Используя соответствующие исходные вещества, также получали следующее соединение:
трет-бутиловый эфир 2-бутил-2-(1H-индазол-5-карбонил)-пирролидин-1-карбоновой кислоты (желтое твердое вещество, 25%).
Стадия 3 (2-Бензил-пирролидин-2-ил)-(1H-индол-5-ил)-метанон
Раствор трет-бутилового эфира 2-бензил-2-(1H-индол-5-карбонил)-пирролидин-1-карбоновой кислоты (0,045 г, 0,111 ммоль) в 1 н. HCl в МеОН (2,2 мл) перемешивали в течение 14 часов при температуре окружающей среды в атмосфере азота. Водный NaOH (4 н., 0,6 мл) добавляли и реакционную смесь экстрагировали ДХМ. Объединенные экстракты промывали солевым раствором, затем высушивали (MgSO4), фильтровали и концентрировали в вакууме. Очистка остатка с помощью хроматографии (диоксид кремния, 0-10% 9:1 MeOH:NH4OH раствора в ДХМ) давала (2-бензил-пирролидин-2-ил)-(1Н-индол-5-ил)-метанон (0,021 г, 0,069 ммоль, 62%) в виде бесцветного твердого вещества, MS=305 [М+Н]+.
Используя соответствующие исходные вещества, также получали следующее соединение:
(2-Бутил-пирролидин-2-ил)-(1H-индазол-5-ил)-метанон (желтое твердое вещество, 100%), MS=306 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 9
(2-Бутил-пирролидин-2-ил)-(3,4-дихлор-фенил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме П.
Схема П
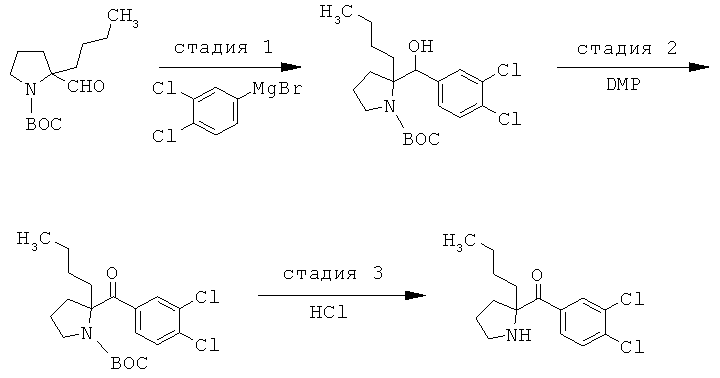
Стадия 1 трет-Бутиловый эфир 2-бутил-2-[(3,4-дихлор-фенил)-гидрокси-метил]-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 2-бутил-2-формил-пирролидин-1-карбоновой кислоты (0,753 г, 2,95 ммоль) в ТГФ (12 мл) при 0°С и в атмосфере азота добавляли 3,4-дихлорфенилмагнийбромид (11,8 мл 0,5 М раствора в пентанах, 5,9 ммоль) по каплям в течение 10 минут. Через 20 минут реакционную смесь гасили, добавляя насыщенный водный NH4Cl (30 мл), затем экстрагировали EtOAc. Объединенные экстракты промывали солевым раствором, затем высушивали (MgSO4), фильтровали и концентрировали в вакууме до желтого масла (1,9 г). Очистка с помощью хроматографии (диоксид кремния, 5-20% EtOAc в гексанах) давала трет-бутиловый эфир 2-бутил-2-[(3,4-дихлор-фенил)-гидрокси-метил]-пирролидин-1-карбоновой кислоты (0,548 г, 1,36 ммоль, 46%) в виде бесцветной смолы и в виде неразделимой смеси диастереомеров.
Используя соответствующие исходные вещества, также получали следующие соединения:
трет-Бутиловый эфир 2-[(3,4-дихлор-фенил)-гидрокси-метил]-2-пропил-пирролидин-1-карбоновой кислоты (бледно-желтое масло, 47%);
трет-Бутиловый эфир 2-[(3,4-дихлор-фенил)-гидрокси-метил]-2-этоксиметил-пирролидин-1-карбоновой кислоты (бесцветное масло, 59%);
трет-Бутиловый эфир 2-[(3,4-дихлор-фенил)-гидрокси-метил]-2-(3,3-дифтор-аллил)-пирролидин-1-карбоновой кислоты (бесцветная смола, 42%);
трет-Бутиловый эфир 2-[(3,4-дихлор-фенил)-гидрокси-метил]-5,5-диметил-2-пропил-пирролидин-1-карбоновой кислоты (бесцветная пена, 81%);
трет-Бутиловый эфир (2R,4R)-4-(трет-бутил-диметил-силанилокси)-2-[(3,4-дихлор-фенил)-гидрокси-метил]-2-пропил-пирролидин-1-карбоновой кислоты (бесцветная смола, 70%);
трет-Бутиловый эфир (2S,4R)-4-(трет-бутил-диметил-силанилокси)-2-[(3,4-дихлор-фенил)-гидрокси-метил]-2-пропил-пирролидин-1-карбоновой кислоты (бесцветное масло, 45%);
трет-Бутиловый эфир 2-[(3,4-дихлор-фенил)-гидрокси-метил]-2-пропил-азетидин-1-карбоновой кислоты (бесцветное масло, 21%) в виде отдельного диастереомера;
трет-Бутиловый эфир 2-[(3,4-дихлор-фенил)-гидрокси-метил]-2-пропил-пиперидин-1-карбоновой кислоты (бесцветное масло, 10%).
Стадия 2 трет-Бутиловый эфир 2-бутил-2-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 2-бутил-2-[(3,4-дихлор-фенил)-гидрокси-метил]-пирролидин-1-карбоновой кислоты (0,520 г, 1,29 ммоль) в ДХМ (20 мл) при 0°С в атмосфере азота добавляли DMP (0,658 г, 1,55 ммоль) за один раз. Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 30 минут, затем разбавляли ДХМ, промывали 1 н NaOH и солевым раствором, затем высушивали (MgSO4), фильтровали и концентрировали в вакууме, что давало желтое масло (0,62 г). Очистка с помощью хроматографии (диоксид кремния, 10-20% EtOAc в гексанах) давала трет-бутиловый эфир 2-бутил-2-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты (0,441 г, 1,10 ммоль, 85%) в виде прозрачной бесцветной смолы.
Используя соответствующие исходные вещества, также получали следующие соединения:
трет-Бутиловый эфир 2-(3,4-дихлор-бензоил)-2-пропил-пирролидин-1-карбоновой кислоты (белое твердое вещество, 88%);
трет-Бутиловый эфир 2-(3,4-дихлор-бензоил)-2-этоксиметил-пирролидин-1-карбоновой кислоты (бесцветный остаток, 75%);
трет-Бутиловый эфир 2-(3,4-дихлор-бензоил)-2-(3,3-дифтор-аллил)-пирролидин-1-карбоновой кислоты (желтое масло, 81%);
трет-Бутиловый эфир 2-(3,4-дихлор-бензоил)-5,5-диметил-2-пропил-пирролидин-1-карбоновой кислоты (бесцветная смола, 83%);
трет-Бутиловый эфир (2R,4R)-4-(трет-бутил-диметил-силанилокси)-2-(3,4-дихлор-бензоил)-2-пропил-пирролидин-1-карбоновой кислоты (бесцветная смола, 73%);
трет-Бутиловый эфир (2S,4R)-4-(трет-бутил-диметил-силанилокси)-2-(3,4-дихлор-бензоил)-2-пропил-пирролидин-1-карбоновой кислоты (бесцветное масло, 83%);
трет-Бутиловый эфир 2-(3,4-дихлор-бензоил)-2-пропил-азетидин-1-карбоновой кислоты (бесцветный остаток, 58%);
трет-Бутиловый эфир 2-(3,4-дихлор-бензоил)-2-пропил-пиперидин-1-карбоновой кислоты (бесцветное масло, 80%).
Стадия 3 (2-Бутил-пирролидин-2-ил)-(3,4-дихлор-фенил)-метанон
Раствор трет-бутилового эфира 2-6утил-2-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты (0,435 г, 1,09 ммоль) в 1 н. HCl в МеОН (10,9 мл) перемешивали при температуре окружающей среды в атмосфере азота в течение 14 часов. Реакционную смесь концентрировали в вакууме, затем повторно растворяли в ДХМ и концентрировали в вакууме, чтобы удалить избыток HCl. Очистка с помощью хроматографии (диоксид кремния, 0-10% МеОН в ДХМ) давала (2-бутил-пирролидин-2-ил)-(3,4-дихлор-фенил)-метанон (0,249 г, 0,740 ммоль, 68%) в виде белого порошка, MS=300 [М+Н]+.
Используя соответствующие исходные вещества, подобным образом получали следующие соединения:
(3,4-Дихлор-фенил)-(2-пропил-пирролидин-2-ил)-метанон (грязно-белое твердое вещество, 81%); MS=286 [М+Н]+;
(3,4-Дихлор-фенил)-(2-этоксиметил-пирролидин-2-ил)-метанон (белое твердое вещество, 99%); MS=302 [М+Н]+;
(3,4-Дихлор-фенил)-[2-(3,3-дифтор-аллил)-пирролидин-2-ил]-метанон (белый порошок, 97%); MS=320 [М+Н]+;
(3,4-Дихлор-фенил)-(5,5-диметил-2-пропил-пирролидин-2-ил)-метанон (бледно-желтый порошок, 97%); MS=314 [М+Н]+;
(3,4-Дихлор-фенил)-(2-пропил-азетидин-2-ил)-метанон (белый порошок, 30%) после аналитической ВЭЖХ очистки; MS=272 [М+Н]+ и
(3,4-Дихлор-фенил)-(2-пропил-пиперидин-2-ил)-метанон (желтое твердое вещество, 97%); MS=300 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 10
(4-Амино-3-хлор-фенил)-(2-бутил-пирролидин-2-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Р.
Схема Р
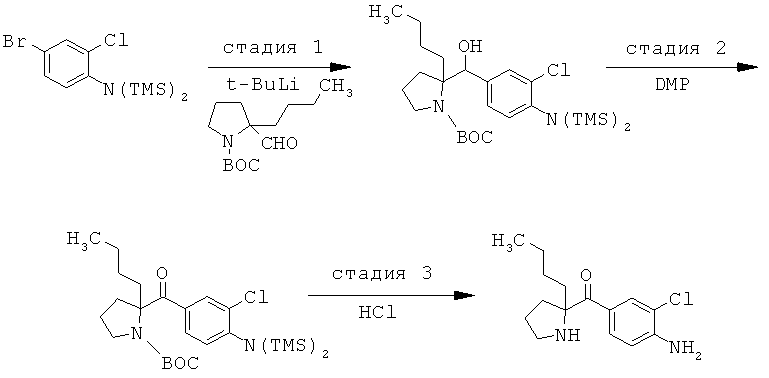
Стадия 1 трет-Бутиловый эфир 2-бутил-2-{[3-хлор-4-(1,1,1,3,3,3-гексаметил-дисилазан-2-ил)-фенил1-гидрокси-метил}-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору 2-(4-бром-2-хлор-фенил)-1,1,1,3,3,3-гексаметил-дисилазан (0,484 г, 1,38 ммоль) в эфире (14 мл) при -78°С и в атмосфере азота добавляли трет-бутиллитий (2,03 мл, 1,43 М раствор в пентанах, 2,91 ммоль) по каплям. Через 90 минут раствор трет-бутилового эфира 2-бутил-2-формил-пирролидин-1-карбоновой кислоты (0,353 г, 1,38 ммоль) в эфире (3 мл) добавляли к реакционной смеси по каплям. Через один час реакционную смесь нагревали до температуры окружающей среды и перемешивали при температуре окружающей среды в течение 30 минут. Реакционную смесь гасили, добавляя насыщенный водный NH4Cl (10 мл), и экстрагировали EtOAc. Объединенные экстракты промывали солевым раствором, затем высушивали (MgSO4), фильтровали и концентрировали в вакууме до масла (0,75 г). Очистка с помощью хроматографии (диоксид кремния, 5-20% EtOAc в гексанах) давала трет-бутиловый эфир 2-бутил-2-{[3-хлор-4-(1,1,1,3,3,3-гексаметил-дисилазан-2-ил)-фенил]-гидрокси-метил}-пирролидин-1-карбоновой кислоты (0,357 г, 0,678 ммоль, 49%) в виде бесцветного масла.
Используя соответствующие исходные вещества, также получали следующие соединения:
трет-Бутиловый эфир 2-{[3-хлор-4-(1,1,1,3,3,3-гексаметил-дисилазан-2-ил)-фенил]-гидрокси-метил}-2-пропил-пирролидин-1-карбоновой кислоты (бесцветная пена,43%);
трет-Бутиловый эфир 2-[гидрокси-(1-триизопропилсиланил-1Н-индазол-5-ил)-метил]-2-пропил-пирролидин-1-карбоновой кислоты (желтая пена, 50%);
трет-Бутиловый эфир 2-{[1-(трет-бутил-диметил-силанил)-7-фтор-1H-индол-5-ил]-гидрокси-метил}-2-пропил-пирролидин-1-карбоновой кислоты (белое твердое вещество, 49%) и
трет-Бутиловый эфир 2-циклопропилметил-2-[гидрокси-(1-триизопропилсиланил-1Н-индазоп-5-ил)-метил]-пирролидин-1-карбоновой кислоты (бесцветная смола, 62%).
Стадия 2 трет-Бутиловый эфир 2-бутил-2-[3-хлор-4-(1,1,1,3,3,3-гексаметил-дисилазан-2-ил)-бензоил]-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 2-бутил-2-{[3-хлор-4-(1,1,1,3,3,3-гексаметил-дисилазан-2-ил)-фенил]-гидрокси-метил}-пирролидин-1-карбоновой кислоты (0,357 г, 0,678 ммоль) в ДХМ (10 мл) при температуре окружающей среды в атмосфере азота добавляли DMP (0,575 г, 1,36 ммоль) за один раз. Через один час реакционную смесь разбавляли ДХМ, промывали 1 н. NaOH и солевым раствором, затем высушивали (MgSO4), фильтровали и концентрировали в вакууме до коричневого остатка (0,290 г). Очистка с помощью хроматографии (диоксид кремния, 10% EtOAc в гексанах) давала трет-бутиловый эфир 2-бутил-2-[3-хлор-4-(1,1,1,3,3,3-гексаметил-дисилазан-2-ил)-бензоил]-пирролидин-1-карбоновой кислоты (0,208 г, 0,397 ммоль, 58%) в виде прозрачного бесцветного остатка.
Используя соответствующие исходные вещества, также получали следующие соединения:
трет-Бутиловый эфир 2-[3-хлор-4-(1,1,1,3,3,3-гексаметил-дисилазан-2-ил)-бензоил]-2-пропил-пирролидин-1-карбоновой кислоты (желтое масло, 96%);
трет-Бутиловый эфир 2-пропил-2-(1-триизопропилсиланил-1Н-индазол-5-карбонил)-пирролидин-1-карбоновой кислоты (желтая пена, 77%);
трет-Бутиловый эфир 2-[1-(трет-бутил-диметил-силанил)-7-фтор-1Н-индол-5-карбонил]-2-пропил-пирролидин-1-карбоновой кислоты (желтое масло, 75%);
трет-Бутиловый эфир 2-циклопропилметил-2-(1-триизопропилсиланил-1H-индазол-5-карбонил)-пирролидин-1-карбоновой кислоты (бесцветная смола, 27%).
Стадия 3 (4-Амино-3-хлор-фенил)-(2-бутил-пирролидин-2-ил)-метанон
Раствор трет-бутилового эфира 2-бутил-2-[3-хлор-4-(1,1,1,3,3,3-гексаметил-дисилазан-2-ил)-бензоил]-пирролидин-1-карбоновой кислоты (0,205 г, 0,391 ммоль) в метанольной 1 н. HCl (7,8 мл) перемешивали при 50°С в атмосфере азота в течение 2 часов. Реакционную смесь концентрировали в вакууме, что давало (4-амино-3-хлор-фенил)-(2-бутил-пирролидин-2-ил)-метанон (0,249 г, количественный выход) в виде светло-коричневого порошка и в виде монохлороводородной соли.
Используя соответствующие исходные вещества, также получали следующие соединения согласно вышеприведенной процедуре:
(4-амино-3-хлор-фенил)-(2-пропил-пирролидин-2-ил)-метанон, (бежевое твердое вещество, 83%), MS=267 [М+Н]+;
(1H-Индазол-5-ил)-(2-пропил-пирролидин-2-ил)-метанон, (желтое твердое вещество, 57%), MS=258 [М+Н]+;
(7-Фтор-1Н-индол-5-ил)-(2-пропил-пирролидин-2-ил)-метанон, (светло-коричневая пена, 60%), MS=275 [М+Н]+;
(2-Циклопропилметил-пирролидин-2-ил)-(1Н-индазол-5-ил)-метанон, (белый порошок, 99%), MS=270 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 11
(2-Пропил-пирролидин-2-ил)-(1Н-пирроло[2,3-b]пиридин-5-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме С.
Схема С
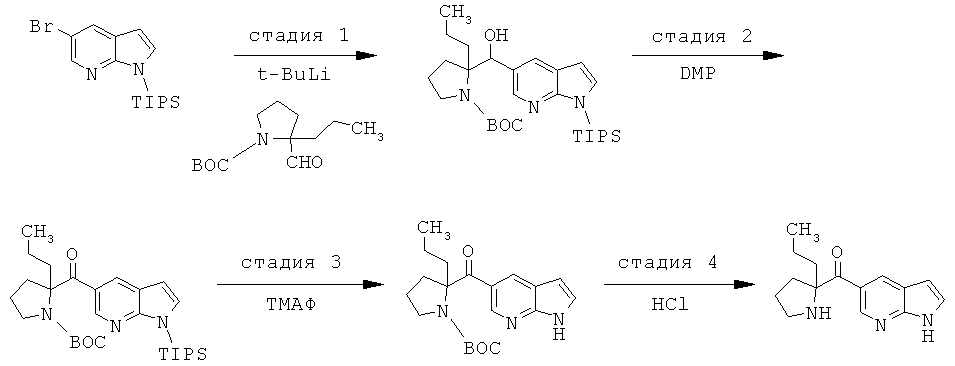
Стадия 1 трет-Бутиловый эфир 2-[гидрокси-(1-триизопропилсиланил-1Н-пирроло[2,3-b]пиридин-5-ил)-метил]-2-пропил-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору 5-бром-1-триизопропилсиланил-1H-пирроло[2,3-b]пиридина (0,587 г, 1,66 ммоль) в эфире (20 мл) при -78°С и в атмосфере азота добавляли трет-бутиллитий (2,30 мл 1,51 М раствора в пентанах, 3,49 ммоль) по каплям. Через 90 минут раствор трет-бутилового эфира 2-формил-2-пропил-пирролидин-1-карбоновой кислоты (0,400 г, 1,66 ммоль) в эфире (1 мл) добавляли к реакционной смеси по каплям. После перемешивания в течение одного часа реакционную смесь нагревали до температуры окружающей среды в течение 30 минут. Реакционную смесь гасили, добавляя насыщенный водный NH4Cl (20 мл), затем экстрагировали EtOAc. Объединенные экстракты промывали насыщенным водным NaHCO3 и солевым раствором, затем высушивали (MgSO4), фильтровали и концентрировали в вакууме до желтого масла (0,90 г). Очистка с помощью хроматографии (диоксид кремния, 5-20% EtOAc в гексанах) давала трет-бутиловый эфир 2-[гидрокси-(1-триизопропилсиланил-1H-пирроло[2,3-b]пиридин-5-ил)-метил]-2-пропил-пирролидин-1-карбоновой кислоты (0,576 г, 1,12 ммоль, 53%) в виде бесцветной смолы.
Используя соответствующие исходные вещества, также получали следующие соединения:
трет-Бутиловый эфир 2-[гидрокси-(1-триизопропилсиланил-1Н-индазол-5-ил)-метил]-2-изопропоксиметил-пирролидин-1-карбоновой кислоты (желтое масло, 79%) и
трет-Бутиловый эфир 2-[гидрокси-(1-триизопропилсиланил-1Н-индазол-5-ил)-метил]-2-изобутил-пирролидин-1-карбоновой кислоты (бесцветное масло, 56%).
Стадия 2 трет-Бутиловый эфир 2-пропил-2-(1-триизопропилсиланил-1H-пирроло[2,3-b]пиридин-5-карбонил)-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 2-[гидрокси-(1-триизопропилсиланил-1Н-пирроло[2,3-b]пиридин-5-ил)-метил]-2-пропил-пирролидин-1-карбоновой кислоты (0,528 г, 1,03 ммоль) в ДХМ (15 мл) при температуре окружающей среды в атмосфере азота добавляли DMP (0,652 г, 1,54 ммоль) за один раз. Через 90 минут реакционную смесь разбавляли ДХМ, промывали 1 н. NaOH и солевым раствором, затем высушивали (MgSO4), фильтровали и концентрировали в вакууме до коричневого масла. Очистка с помощью хроматографии (диоксид кремния, 5-10% EtOAc в гексанах) давала трет-бутиловый эфир 2-пропил-2-(1-триизопропилсиланил-1H-пирроло[2,3-b]пиридин-5-карбонил)-пирролидин-1-карбоновой кислоты (0,415 г, 0,809 ммоль, 79%) в виде желтой смолы.
Используя соответствующие исходные вещества, также получали следующие соединения:
трет-Бутиловый эфир 2-изопропоксиметил-2-(1-триизопропилсиланил-1Н-индазол-5-карбонил)-пирролидин-1-карбоновой кислоты (желтое твердое вещество, 96%) и
трет-Бутиловый эфир 2-изобутил-2-(1-триизопропилсиланил-1H-индазол-5-карбонил)-пирролидин-1-карбоновой кислоты (бесцветная смола, 49%).
Стадия 3 трет-Бутиловый эфир 2-пропил-2-(1Н-пирроло[2,3-b]пиридин-5-карбонил)-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 2-пропил-2-(1-триизопропилсиланил-1Н-пирроло[2,3-b]пиридин-5-карбонил)-пирролидин-1-карбоновой кислоты (0,415 г, 0,809 ммоль) в ТГФ (7,5 мл) при температуре окружающей среды в атмосфере азота добавляли ТМАФ (0,753 г, 8,09 ммоль). Реакционную смесь перемешивали в течение одного часа, затем разбавляли насыщенным водным NaHCO3 (30 мл) и водой (15 мл) и экстрагировали EtOAc. Объединенные органические экстракты промывали солевым раствором, высушивали (MgSO4), фильтровали и концентрировали в вакууме до бледно-желтой смолы. Очистка с помощью хроматографии (диоксид кремния, 50-100% EtOAc в гексанах) давала трет-бутиловый эфир 2-пропил-2-(1Н-пирроло[2,3-b]пиридин-5-карбонил)-пирролидин-1-карбоновой кислоты (0,247 г, 0,692 ммоль, 86%) в виде бесцветной пены.
Используя соответствующие исходные вещества, также получали следующие соединения:
трет-Бутиловый эфир 2-(1H-индазол-5-карбонил)-2-изопропоксиметил-пирролидин-1-карбоновой кислоты (белая пена, 68%);
трет-Бутиловый эфир 2-(1H-индазол-5-карбонил)-2-изобутил-пирролидин-1-карбоновой кислоты (желтая пена, 30%);
трет-Бутиловый эфир (2R,4R)-2-(3,4-дихлор-бензоил)-4-гидрокси-2-пропил-пирролидин-1-карбоновой кислоты (бесцветный остаток, 79%);
трет-Бутиловый эфир (2S,4R)-2-(3,4-дихлор-бензоил)-4-гидрокси-2-пропил-пирролидин-1-карбоновой кислоты (бесцветная смола, 79%).
Стадия 4 (2-Пропил-пирролидин-2-ил)-(1Н-пирроло[2,3-b]пиридин-5-ил)-метанон
Раствор трет-бутилового эфира 2-пропил-2-(1H-пирроло[2,3-b]пиридин-5-карбонил)-пирролидин-1-карбоновой кислоты (0,240 г, 0,672 ммоль) в 1 н. метанольной HCl (10,1 мл) перемешивали при 20°С в атмосфере азота в течение 18 часов. Реакционную смесь концентрировали в вакууме, затем растирали с ДХМ (5 мл) и концентрировали в вакууме, получая (2-пропил-пирролидин-2-ил)-(1H-пирроло[2,3-b]пиридин-5-ил)-метанон (0,215 г, 0,652 ммоль, 97%) в виде белого порошка и в виде монохлороводородной соли, MS=258 [М+Н]+.
Используя соответствующие исходные вещества, также получали следующие соединения:
(1H-Индазол-5-ил)-(2-изопропоксиметил-пирролидин-2-ил)-метанон (белое твердое вещество, 94%), MS=288 [М+Н]+;
(1H-Индазол-5-ил)-(2-изобутил-пирролидин-2-ил)-метанон (желтый порошок, 100%), MS=272[М+Н]+;
(3,4-Дихлор-фенил)-((2R,4R)-4-гидрокси-2-пропил-пирролидин-2-ил)-метанон (белое твердое вещество, 61%), MS=302 [М+Н]+ и
(3,4-Дихлор-фенил)-((2S,4R)-4-гидрокси-2-пропил-пирролидин-2-ил)-метанон (белое твердое вещество, 97%), MS=302 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 12
(5,6-Дихлор-пиридин-2-ил)-(2-пропил-пирролидин-2-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Т.
Схема Т
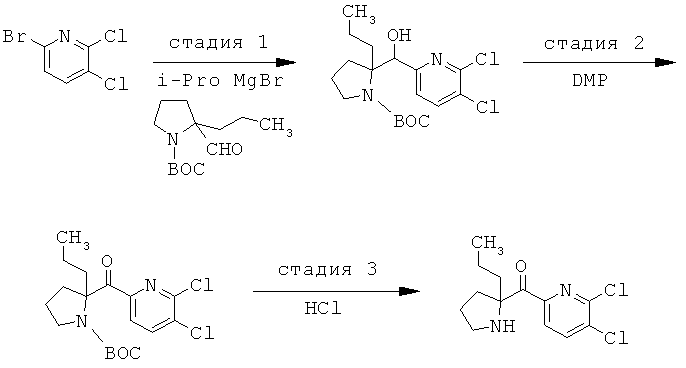
Стадия 1 трет-Бутиловый эфир 2-[(5,6-дихлор-пиридин-2-ил)-гидрокси-метил]-2-пропил-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору 2-бром-5,6-дихлор-пиридина (0,500 г, 2,20 ммоль) в ТГФ (6 мл) при 0°С и в атмосфере азота добавляли изопропилмагнийхлорид (1,21 мл 2 М раствора в ТГФ, 2,42 ммоль) по каплям. Через 2 часа раствор трет-бутилового эфира 2-формил-2-пропил-пирролидин-1-карбоновой кислоты (0,317 г, 1,32 ммоль) в ТГФ (1 мл) добавляли к реакционной смеси по каплям. Через 30 минут реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение одного часа, затем гасили, добавляя насыщенный водный NH4Cl (10 мл), и экстрагировали EtOAc. Объединенные органические экстракты промывали солевым раствором, высушивали (MgSO4), фильтровали и концентрировали в вакууме. Очистка остатка с помощью хроматографии (диоксид кремния, 0-40% EtOAc в гексанах) давала трет-бутиловый эфир 2-[(5,6-дихлор-пиридин-2-ил)-гидрокси-метил]-2-пропил-пирролидин-1-карбоновой кислоты (0,289 г, 0,745 ммоль, 56%) в виде желтого масла и в виде неразделимой смеси диастереомеров.
Используя соответствующие исходные вещества, трет-бутиловый эфир 2-[(4,5-дихлор-пиридин-2-ил)-гидрокси-метил]-2-пропил-пирролидин-1-карбоновой кислоты (оранжевое масло, 19%) также получали, используя вышеприведенную процедуру.
Стадия 2 трет-Бутиловый эфир 2-(5,6-дихлор-пиридин-2-карбонил)-2-пропил-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 2-[(5,6-дихлор-пиридин-2-ил)-гидрокси-метил]-2-пропил-пирролидин-1-карбоновой кислоты (0,288 г, 0,742 ммоль) в ДХМ (12 мл) при 0°С в атмосфере азота добавляли DMP (0,315 г, 0,742 ммоль) за один раз. Реакционную смесь перемешивали в течение одного часа, затем гасили смесью 1:1 10% водного Na2S2O3 и насыщенного водного NaHCO3 (50 мл) и экстрагировали ДХМ (3×30 мл). Объединенные органические фазы концентрировали в вакууме, что давало трет-бутиловый эфир 2-(5,6-дихлор-пиридин-2-карбонил)-2-пропил-пирролидин-1-карбоновой кислоты (0,280 г, 0,725 ммоль, 98%) в виде желтого твердого вещества, которое непосредственно использовали без дополнительной очистки.
Используя соответствующие исходные вещества, трет-бутиловый эфир 2-(4,5-дихлор-пиридин-2-карбонил)-2-пропил-пирролидин-1-карбоновой кислоты (бесцветное масло, 43%) также получали.
Стадия 3 (5,6-Дихлор-пиридин-2-ил)-(2-пропил-пирролидин-2-ил)-метанон
Раствор трет-бутилового эфира 2-(5,6-дихлор-пиридин-2-карбонил)-2-пропил-пирролидин-1-карбоновой кислоты (0,280 г, 0,725 ммоль) в 1 н. HCl в МеОН (3 мл) перемешивали при температуре окружающей среды в атмосфере азота в течение 20 часов. Реакционную смесь концентрировали в вакууме и полученный в результате остаток очищали с помощью хроматографии (диоксид кремния, 0-30% МеОН в ДХМ), что давало (5,6-дихлор-пиридин-2-ил)-(2-пропил-пирролидин-2-ил)-метанон (0,167 г, 0,522 ммоль, 72%) в виде желтого твердого вещества и в виде монохлороводородной соли, MS=287 [М+Н]+.
Используя соответствующее исходное вещество, (4,5-дихлор-пиридин-2-ил)-(2-пропил-пирролидин-2-ил)-метанон (желтая смола, 37%) также получали, MS=287 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 13
(3,4-Дихлор-5-фтор-фенил)-(2-пропил-пирролидин-2-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме У.
Схема У
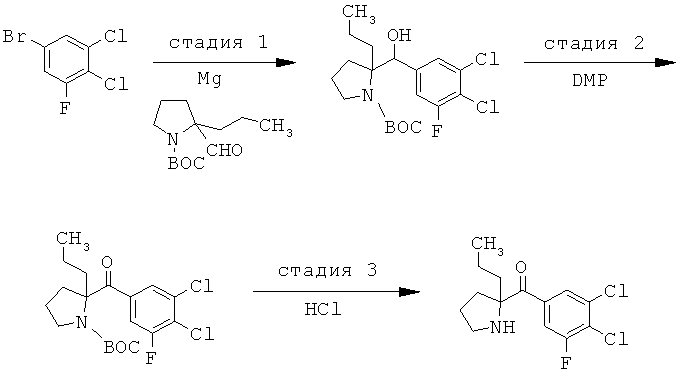
Стадия 1 трет-Бутиловый эфир 2-[(3,4-дихлор-5-фтор-фенил)-гидрокси-метил]-2-пропил-пирролидин-1-карбоновой кислоты
Перемешиваемую смесь 3,4-дихлор-5-фторфенилбромида (1,38 г, 5,66 ммоль) и магниевых стружек (0,145 г, 5,94 ммоль) в ТГФ (8 мл) нагревали с обратным холодильником в атмосфере азота в течение 30 минут, затем охлаждали до 0°С. К реакционной смеси добавляли раствор трет-бутилового эфира 2-формил-2-пропил-пирролидин-1-карбоновой кислоты (0,682 г, 2,38 ммоль) в ТГФ (2 мл) по каплям в течение 15 минут. Холодную реакционную смесь перемешивали в течение одного часа, затем гасили, добавляя насыщенный водный NH4Cl (20 мл), и экстрагировали EtOAc. Объединенные органические экстракты промывали солевым раствором, высушивали (MgSO4), фильтровали и концентрировали в вакууме до желтого масла (1,7 г). Очистка с помощью хроматографии (диоксид кремния, 0-20% EtOAc в гексанах) давала трет-бутиловый эфир 2-[(3,4-дихлор-5-фтор-фенил)-гидрокси-метил]-2-пропил-пирролидин-1-карбоновой кислоты (0,571 г, 1,41 ммоль, 50%) в виде белого твердого вещества.
Стадия 2 трет-Бутиловый эфир 2-(3,4-дихлор-5-фтор-бензоил)-2-пропил-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 2-[(3,4-дихлор-5-фтор-фенил)-гидрокси-метил]-2-пропил-пирролидин-1-карбоновой кислоты (0,533 г, 1,31 ммоль) в ДХМ (20 мл) при 0°С в атмосфере азота добавляли DMP (0,557 г, 1,55 ммоль) одной частью. Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 90 минут. Добавляли вторую часть DMP (0,110 г, 0,26 ммоль) и реакционную смесь перемешивали в течение 30 минут, затем разбавляли ДХМ, промывали 1 н. NaOH, солевым раствором (20 мл), высушивали (MgSO4), фильтровали и концентрировали в вакууме до прозрачного бесцветного масла (0,55 г). Очистка с помощью хроматографии (диоксид кремния, 5-20% EtOAc в гексанах) давала трет-бутиловый эфир 2-(3,4-дихлор-5-фтор-бензоил)-2-пропил-пирролидин-1-карбоновой кислоты (0,358 г, 0,886 ммоль, 68%) в виде прозрачной бесцветной смолы.
Стадия 3 (3,4-Дихлор-5-фтор-фенил)-(2-пропил-пирролидин-2-ил)-метанон
Раствор трет-бутилового эфира 2-(3,4-дихлор-5-фтор-бензоил)-2-пропил-пирролидин-1-карбоновой кислоты (0,346 г, 0,856 ммоль) в 1 н. метанольной HCl (8,6 мл) перемешивали при температуре окружающей среды в атмосфере азота в течение 15 часов. Реакционную смесь концентрировали в вакууме, затем повторно растворяли в ДХМ и снова концентрировали в вакууме, чтобы удалить избыток HCl, получая (3,4-дихлор-5-фтор-фенил)-(2-пропил-пирролидин-2-ил)-метанон (0,294 г, количественный выход) в виде белого порошка, MS=304 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 14
(3,4-Дихлор-фенил)-((2R,4S)-4-фтор-2-пропил-пирролидин-2-ил)-метанон и
(3,4-дихлор-фенил)-((2S,4S)-4-фтор-2-пропил-пирролидин-2-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Ф.
Схема Ф
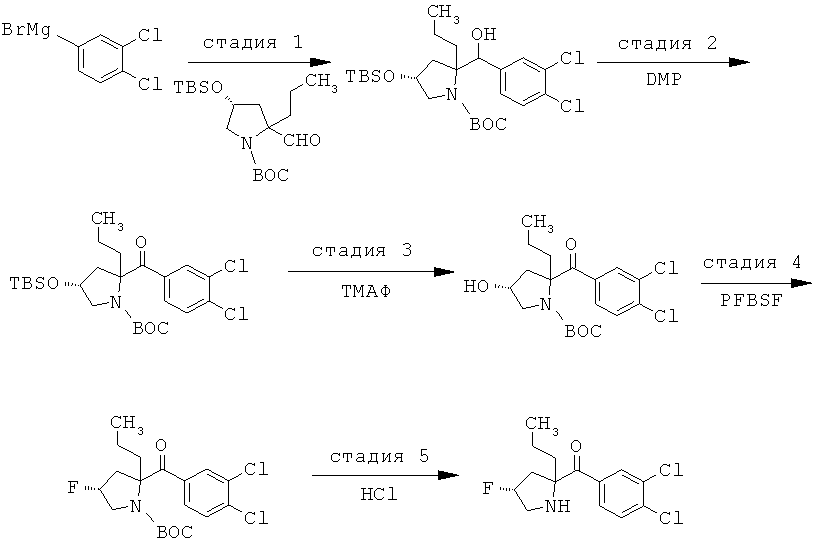
Стадия 1 трет-Бутиловый эфир (R)-4-(трет-бутил-диметил-сипанилокси)-2-пропил-2-[(3,4-дихлор-фенил)-гидрокси-метил1-пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир (R)-4-(трет-бутил-диметил-силанилокси)-2-пропил-2-[(3,4-дихлор-фенил)-гидрокси-метил]-пирролидин-1-карбоновой кислоты получали по реакции 3,4-дихлорфенилмагнийбромида с трет-бутиловым эфиром (R)-4-(трет-бутил-диметил-силанилокси)-2-формил-2-пропил-пирролидин-1-карбоновой кислоты, следуя процедуре стадии 1 примера 11.
Стадия 2 трет-Бутиловый эфир (R)-4-(трет-бутил-диметил-силанилокси)-2-пропил-2-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир (R)-4-(трет-бутил-диметил-силанилокси)-2-пропил-2-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты получали в ходе окисления трет-бутилового эфира (R)-4-(трет-бутил-диметил-силанилокси)-2-пропил-2-[(3,4-дихлор-фенил)-гидрокси-метил]-пирролидин-1-карбоновой кислоты с DMP, следуя процедуре стадии 2 примера 11.
Стадия 3 трет-Бутиловый эфир (R)-2-(3,4-дихлор-бензоил)-4-гидрокси-2-пропил-пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир (R)-2-(3,4-дихлор-бензоил)-4-гидрокси-2-пропил-пирролидин-1-карбоновой кислоты получали при обработке трет-бутилового эфира (R)-4-(трет-бутил-диметил-силанилокси)-2-пропил-2-(3,4-дихлор-бензоил)-пирролидин-1-карбоновой кислоты с ТМАФ, следуя процедуре стадии 3 примера 11.
Стадия 4 трет-Бутиловый эфир (S)-2-(3,4-дихлор-бензоил)-4-фтор-2-пропил-пирролидин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира (R)-2-(3,4-дихлор-бензоил)-4-гидрокси-2-пропил-пирролидин-1-карбоновой кислоты (0,222 г, 0,554 ммоль) в ТГФ (3 мл) при температуре окружающей среды в атмосфере азота добавляли перфторбутансульфонилфторид (0,195 мл, 1,11 ммоль), тригидрофторидтриэтиламина (0,181 мл, 1,11 ммоль) и триэтиламин (0,46 мл, 3,32 ммоль). Реакционную смесь перемешивали в течение 18 часов, затем фильтровали через прокладку из диоксида кремния, промывали EtOAc и концентрировали в вакууме, что давало трет-бутиловый эфир (S)-2-(3,4-дихлор-бензоил)-4-фтор-2-пропил-пирролидин-1-карбоновой кислоты (0,222 г, 0,551 ммоль, 99%) в виде желтой пены, который использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 5 (3,4-Дихлор-фенил)-((2R,4S)-4-фтор-2-пропил-пирролидин-2-ил)-метанон и (3,4-дихлоо-фенил)-((2S,4S)-4-фтор-2-пропил-пирролидин-2-ил)-метанон
Раствор трет-бутилового эфира (S)-2-(3,4-дихлор-бензоил)-4-фтор-2-пропил-пирролидин-1-карбоновой кислоты (0,220 г, 0,545 ммоль) в 1 н. метанольной HCl (3 мл) перемешивали при 20°С в атмосфере азота в течение 18 часов. Реакционную смесь концентрировали в вакууме, затем очищали с помощью хроматографии (диоксид кремния, 0-20% МеОН в ДХМ), что давало (3,4-дихлор-фенил)-((2R,4S)-4-фтор-2-пропил-пирролидин-2-ил)-метанон (0,048 г, 0,158 ммоль, 29%) в качестве первой фракции (желтое масло), затем (3,4-дихлор-фенил)-((2S,4S)-4-фтор-2-пропил-пирролидин-2-ил)-метанон (0,072 г, 0,238 ммоль, 44%) в качестве второй фракции (желтое масло), каждый в виде монохлороводородной соли, MS=304 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 15
(1H-Индол-5-ил)-(2-пропил-пирролидин-2-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме X.
Схема X
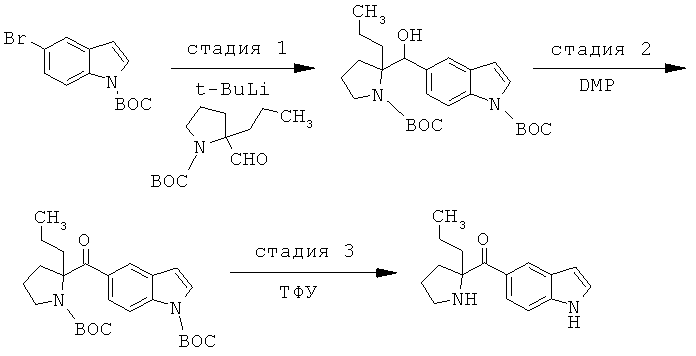
Стадия 1 трет-Бутиловый эфир 5-[(1-трет-бутоксикарбонил-2-пропил-пирролидин-2-ил)-гидрокси-метил]-индол-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 5-бром-индол-1-карбоновой кислоты (0,700 г, 2,37 ммоль) в эфире (20 мл) при -78°С и в атмосфере азота добавляли трет-бутиллитий (3,64 мл 1,43 М раствора в пентанах, 5,21 ммоль) по каплям. Через 30 минут раствор трет-бутилового эфира 2-формил-2-пропил-пирролидин-1-карбоновой кислоты (0,569 г, 2,37 ммоль) в эфире (5 мл) добавляли к реакционной смеси по каплям. Реакционную смесь перемешивали в течение одного часа, затем гасили, добавляя насыщенный водный NH4Cl, и экстрагировали EtOAc. Объединенные органические экстракты промывали насыщенным водным NaHCO3 и солевым раствором, затем высушивали (MgSO4), фильтровали и концентрировали в вакууме. Очистка с помощью хроматографии (диоксид кремния, 0-60% EtOAc в гексанах) давала трет-бутиловый эфир 5-[(1-трет-бутоксикарбонил-2-пропил-пирролидин-2-ил)-гидрокси-метил]-индол-1-карбоновой кислоты (0,466 г, 1,02 ммоль, 43%) в виде желтого масла.
Стадия 2 трет-Бутиловый эфир 5-(1-трет-бутоксикарбонил-2-пропил-пирролидин-2-карбонил)-индол-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 5-[(1-трет-бутоксикарбонил-2-пропил-пирролидин-2-ил)-гидрокси-метил]-индол-1-карбоновой кислоты (0,460 г, 1,00 ммоль) в ДХМ (10 мл) при 0°С в атмосфере азота добавляли DMP (0,652 г, 1,54 ммоль) за один раз. Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 90 минут, затем разбавляли ДХМ, промывали смесью 1:1 10% водного Na2S2O5 и NaHCO3 (50 мл), затем солевым раствором, потом высушивали (MgSO4), фильтровали и концентрировали в вакууме до желтого масла. Очистка с помощью хроматографии (диоксид кремния, 0-80% EtOAc в гексанах) давала трет-бутиловый эфир 5-(1-трет-бутоксикарбонил-2-пропил-пирролидин-2-карбонил)-индол-1-карбоновой кислоты (0,132 г, 0,289 ммоль, 29%) в виде желтого масла.
Стадия 3 (1Н-Индол-5-ил)-(2-пропил-пирролидин-2-ил)-метанон
К перемешиваемому раствору трет-бутилового эфира 5-(1-трет-бутоксикарбонил-2-пропил-пирролидин-2-карбонил)-индол-1-карбоновой кислоты (0,132 г, 0,289 ммоль) в ДХМ (3 мл) при 20°С в атмосфере азота добавляли ТФУ (1 мл). Через 14 часов реакционную смесь гасили насыщенным водным NaHCO3 и экстрагировали ДХМ. Объединенные органические фазы концентрировали в вакууме, затем очищали с помощью хроматографии (диоксид кремния, 0-30% МеОН в ДХМ), получая (1Н-индол-5-ил)-(2-пропил-пирролидин-2-ил)-метанон (0,053 г, 0,207 ммоль, 72%) в виде бежевой пены, MS=257 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 16
экзо-(3,4-Дихлор-фенил)-(2-пропил-8-аза-бицикло[3.2.1]окт-2-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Ц.
Схема Ц
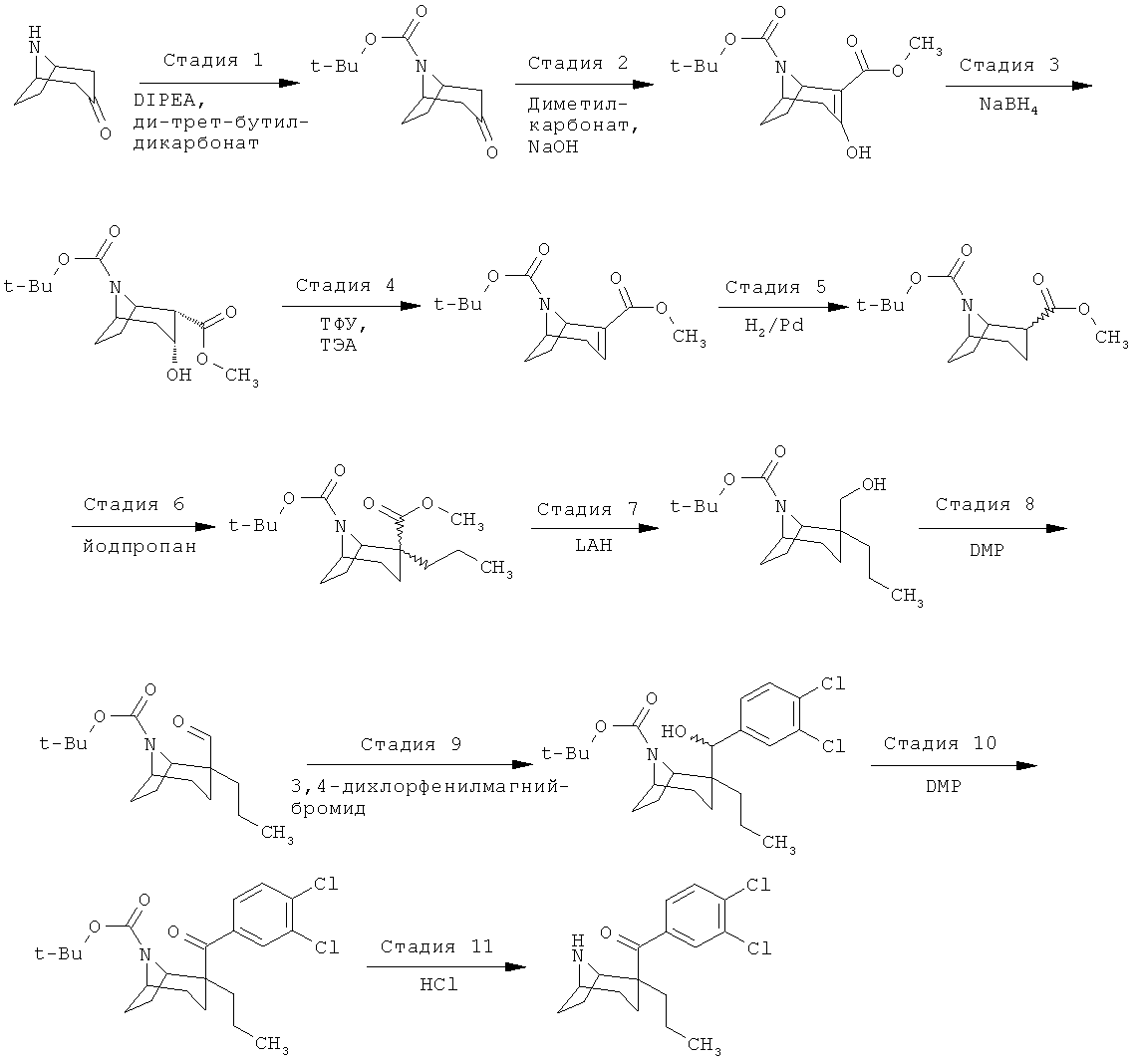
Стадия 1 трет-Бутиловый эфир 3-оксо-8-азабицикло[3.2.1]октан-8-карбоновой кислоты
Гидрохлорид 8-азабицикло[3.2.1]октан-3-она (гидрохлорид нортропинона, 10,0 г, 62 ммоль) растворяли в 1,4-диоксане (200 мл) и воде (50 мл). N,N-диизопропилэтиламин (20,0 г, 155 ммоль) и ди-трет-бутилдикарбонат (20,3 г, 93 ммоль) добавляли и реакционную смесь перемешивали при комнатной температуре в течение трех часов. Смесь разбавляли водой и экстрагировали этилацетатом. Объединенные органические экстракты промывали водой и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат/гексан), что давало трет-бутиловый эфир 3-оксо-8-азабицикло[3.2.1]октан-8-карбоновой кислоты в виде грязно-белого твердого вещества, 14 г (выход 99%).
Стадия 2 8-трет-Бутиловый эфир 2-метиловый эфир 3-гидрокси-8-азабицикло[3.2.1]окт-2-ен-2,8-дикарбоновой кислоты
трет-Бутиловый эфир 3-оксо-8-азабицикпо[3.2.1]октан-8-карбоновой кислоты со стадии 1 (14,1 г, 62 ммоль) растворяли в циклогексане (550 мл), к которому добавляли диметилкарбонат (12,4 г, 137 ммоль), затем гидрид натрия (5,0 г, 125 ммоль) и метанол (0,2 мл). Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 15 часов, затем охлаждали до комнатной температуры и добавляли воду (25 мл). Реакционную смесь концентрировали при пониженном давлении до объема 50 мл, который затем разделяли между этилацетатом и насыщенным водным хлоридом аммония. Объединенные органические экстракты промывали водой и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат/гексан), что давало 8-трет-бутиловый эфир 2-метиловый эфир 3-гидрокси-8-азабицикло[3.2.1]окт-2-ен-2,8-дикарбоновой кислоты в виде светло-желтого масла (15,4 г, выход 87%).
Стадия 3 8-трет-Бутиловый эфир экзо-2-метиловый эфир эндо-3-гидрокси-8-азабицикло[3.2.1]октан-2,8-дикарбоновой кислоты
8-трет-Бутиловый эфир 2-метиловый эфир 3-гидрокси-8-азабицикло[3.2.1]окт-2-ен-2,8-дикарбоновой кислоты со стадии 2 (15,4 г, 54 ммоль) растворяли в метаноле (350 мл). Полученный в результате раствор охлаждали на бане с сухим льдом/ацетонитрилом (-45°С). Боргидрид натрия (5,15 г, 136 ммоль, 10-40 меш) добавляли и реакционную смесь перемешивали при -45°С в течение 1,5 часа, после чего добавляли насыщенный водный хлорид аммония (50 мл). Смесь нагревали до комнатной температуры и затем концентрировали при пониженном давлении до объема 50 мл, который затем разделяли между дихлорметаном и насыщенным водным хлоридом аммония. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат/гексан), что давало 8-трет-бутиловый эфир экзо-2-метиловый эфир эндо-3-гидрокси-8-азабицикло[3.2.1]октан-2,8-дикарбоновой кислоты в виде бесцветного масла (8,1 г, выход 52%).
Стадия 4 8-трет-Бутиловый эфир 2-метиловый эфир 8-азабицикло[3.2.1]окт-2-ен-2,8-дикарбоновой кислоты
8-трет-Бутиловый эфир экзо-2-метиловый эфир эндо-3-гидрокси-8-азабицикло[3.2.1]октан-2,8-дикарбоновой кислоты со стадии 3 (8,1 г, 28 ммоль) растворяли в 1,2-дихлорэтане (120 мл), к которому добавляли триэтиламин (17,2 г, 170 ммоль) и трифторуксусный ангидрид (17,8 г, 85 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 часов, затем добавляли водный насыщенный бикарбонат натрия (150 мл) и дихлорметан (280 мл). Органическую фазу отделяли и промывали солевым раствором. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат/гексан), что давало 8-трет-бутиловый эфир 2-метиловый эфир 8-азабицикло[3.2.1]окт-2-ен-2,8-дикарбоновой кислоты в виде желтого масла (6,0 г, выход 79%).
Стадия 5 8-трет-Бутиловый эфир 2-метиловый эфир 8-азабицикло[3.2.1]октан-2,8-дикарбоновой кислоты
8-трет-Бутиловый эфир 2-метиловый эфир 8-азабицикло[3.2.1]окт-2-ен-2,8-дикарбоновой кислоты со стадии 4 (5,9 г, 22 ммоль) растворяли в этаноле (100 мл), к которому добавляли палладий (10% на угле, 0,59 г). Полученную в результате смесь встряхивали в атмосфере водорода (50 пси) в течение 2 часов при комнатной температуре, затем фильтровали через слой из целита, который промывали этилацетатом. Фильтрат концентрировали при пониженном давлении, и полученный в результате остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат/гексан), что давало 8-трет-бутиловый эфир 2-метиловый эфир 8-азабицикло[3.2.1]октан-2,8-дикарбоновой кислоты в виде смеси эндо и экзо изомеров в виде бесцветного масла (5,8 г, выход 97%).
Стадия 6 8-трет-Бутиловый эфир 2-пропил-8-аза-бицикло[3.2.1]октан-2,8-дикарбоновой кислоты
8-трет-Бутиловый эфир 2-метиловый эфир 8-азабицикло[3.2.1]октан-2,8-дикарбоновой кислоты в виде смеси эндо и экзо изомеров со стадии 5 (1,0 г, 3,7 ммоль) растворяли в тетрагидрофуране (30 мл) и добавляли 1-йодпропан (3,2 г, 19 ммоль). Полученный в результате раствор охлаждали до -76°С и обрабатывали по каплям в течение 15 минут раствором бис(триметилсилил)амида калия в толуоле (0,5 М, 11,1 мл, 5,6 ммоль). Продолжали перемешивать при -76°С в течение 1,5 часов и затем реакционную смесь медленно нагревали до 0°С в течение 3 часов. Добавляли насыщенный водный хлорид аммония и полученную в результате смесь экстрагировали этилацетатом. Объединенные органические экстракты промывали водой и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат/гексан), что давало 8-трет-бутиловый эфир 2-метиловый эфир 2-пропил-8-аза-бицикло[3.2.1]октан-2,8-дикарбоновой кислоты в виде смеси эндо и экзо изомеров в виде бледно-желтого масла (0,99 г, выход 85%).
Стадия 7 трет-Бутиловый эфир 2-гидроксиметил-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты
8-трет-Бутиловый эфир 2-метиловый эфир 2-пропил-8-аза-бицикло[3.2.1]октан-2,8-дикарбоновой кислоты (смесь эндо и экзо изомеров со стадии 6, 0,98 г, 3,1 ммоль) растворяли в тетрагидрофуране (15 мл) и полученную в результате смесь охлаждали до 0°С. Раствор алюмогидрида лития в тетрагидрофуране (1 М, 3,3 мл, 3,3 ммоль) в тетрагидрофуране добавляли по каплям в течение 10 минут и продолжали перемешивать при 0°С в течение 1,5 часов. Насыщенный водный раствор тартрата калия-натрия (10 мл) добавляли, и смесь нагревали до комнатной температуры и перемешивали в течение 15 часов. Дополнительный насыщенный водный раствор тартрата калия-натрия (10 мл) добавляли и смесь экстрагировали этилацетатом. Объединенные органические экстракты промывали водой и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат/гексан), что давало трет-бутиловый эфир 2-гидроксиметил-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты в виде разделимой смеси эндо и экзо изомеров, оба в виде бесцветных масел (0,68 г и 0,17 г, выход 76% и 19%, соответственно).
Стадия 8 трет-Бутиловый эфир экзо-2-формил-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты
трет-Бутиловый эфир экзо-2-гидроксиметил-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты со стадии 7 (0,67 г, 2,4 ммоль) растворяли в дихлорметане (25 мл). Раствор охлаждали до 0°С и добавляли периодинан Десса-Мартина (1,0 г, 2,4 ммоль). Продолжали перемешивать в течение 5 минут при 0°С, затем 1,5 часа при комнатной температуре. К реакционной смеси добавляли диэтиловый эфир (50 мл) и водный гидроксид натрия (1 М, 20 мл), затем дополнительный диэтиловый эфир (30 мл). Фазы разделяли и органическую фазу промывали водой и солевым раствором. Объединенные органические слои высушивали над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат/гексан), что давало трет-бутиловый эфир экзо-2-формил-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты в виде бесцветного масла (0,61 г, выход 90%).
Стадия 9 трет-Бутиловый эфир экзо-2-[(3,4-дихлорфенил)-гидроксиметил]-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты
трет-Бутиловый эфир экзо-2-формил-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты со стадии 8 (0,45 г, 16 ммоль) растворяли в тетрагидрофуране (4 мл). Полученный в результате раствор охлаждали до 0°С и раствор 3,4-дихлорфенилмагнийбромида в тетрагидрофуране (0,5 М, 6,4 мл, 3,2 ммоль) добавляли по каплям в течение 10 минут. Продолжали перемешивать при 0°С в течение 1,5 часов, затем добавляли водный насыщенный хлорид аммония (20 мл). Полученную в результате смесь экстрагировали этилацетатом, объединенные органические экстракты промывали водой и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат/гексан), что давало трет-бутиловый эфир экзо-2-[(3,4-дихлорфенил)-гидроксиметил]-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты в виде смеси эпимеров в виде белого твердого вещества (0,57 г, выход 83%).
Стадия 10 трет-Бутиловый эфир экзо-2-(3,4-дихлорбензоил)-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты
трет-Бутиловый эфир экзо-2-[(3,4-дихлорфенил)-гидроксиметил]-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты в виде смеси эпимеров со стадии 9 (0,56 г, 1,3 ммоль) суспендировали в ацетонитриле (14 мл). Добавляли дихлорметан (4 мл) и к полученному в результате гомогенному раствору добавляли периодинан Десса-Мартина (0,56 г, 1,3 ммоль), затем перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли диэтиловый эфир (80 мл) и водный гидроксид натрия (1 М, 20 мл). Фазы разделяли, и объединенные органические экстракты промывали водой и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (силикагель, этилацетат/гексан), что давало трет-бутиловый эфир экзо-2-(3,4-дихлорбензоил)-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты в виде грязно-белого твердого вещества (0,53 г, выход 95%).
Стадия 11 экзо-(3,4-Дихлор-фенил)-(2-пропил-8-азабицикло[3.2.1]окт-2-ил)метанон
трет-Бутиловый эфир экзо-2-(3,4-дихлорбензоил)-2-пропил-8-азабицикпо[3.2.1]октан-8-карбоновой кислоты со стадии 10 (0,15 г, 0,35 ммоль) растворяли в растворе хлороводорода в метаноле (1 М, 3,5 мл) и полученный в результате раствор перемешивали при 40°С в течение двух часов. Реакционную смесь концентрировали при пониженном давлении, получая гидрохлорид экзо-(3,4-дихлор-фенил)-(2-пропил-8-азабицикло[3.2.1]окт-2-ил)метанона в виде белой пены (0,13 г, выход 99%).
Подобным образом из трет-бутилового эфира эндо-2-гидроксиметил-2-пропил-8-азабицикло[3.2.1]октан-8-карбоновой кислоты со стадии 7, следуя стадиям 8-11, получали гидрохлорид эндо-(3,4-дихлор-фенил)-(2-пропил-8-азабицикло[3.2.1]окт-2-ил)метанона, MS=326 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 17
(5-Фтор-1Н-индол-2-ил)-(4-пропил-пиперидин-4-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Ч.
Схема Ч
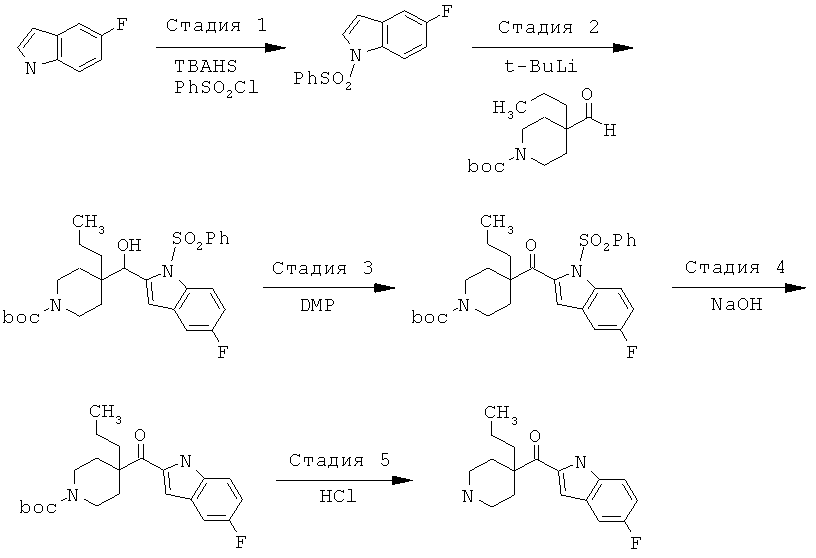
Стадия 1 1-Бензолсульфонил-5-фтор-1Н-индол
К охлажденному до 0°С раствору 5-фториндола (10 г, 74 ммоль) и гидросульфата тетрабутиламмония (3,8 г, 11 ммоль) в 200 мл толуола добавляли 200 мл 50% водного NaOH, затем добавляли бензолсульфонилхлорид (14 мл, 111 ммоль). Реакционную смесь нагревали до комнатной температуры в течение ночи. Реакционную смесь экстрагировали этилацетатом и промывали 1 М HCl, водным бикарбонатом натрия, водой и солевым раствором. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Оставшийся остаток перекристаллизовывали из этилацетата и гексанов, получая 19 г (выход 96%) 1-бензолсульфонил-5-фтор-1H-индола в виде белого кристаллического твердого вещества.
Стадия 2 трет-Бутиловый эфир 4-[(1-бензолсульфонил-5-фтор-1H-индол-2-ил)-гидрокси-метил]-4-пропил-пиперидин-1-карбоновой кислоты
К охлажденному до -78°С раствору 1-бензолсульфонил-5-фтор-1H-индола (539 мг, 1,96 ммоль) в 30 мл ТГФ медленно добавляли t-BuLi (1,5 мл, 2,54 ммоль). Реакционную смесь перемешивали в течение 30 минут, затем добавляли раствор трет-бутилового эфира 4-формил-4-пропил-пиперидин-1-карбоновой кислоты (500 мг, 1,96 ммоль) в 5 мл ТГФ. Реакционную смесь перемешивали в течение 2 часов при -78°С, затем нагревали до -20°С и гасили насыщенным водным раствором хлорида аммония. Реакционную смесь экстрагировали этилацетатом и объединенные органические слои промывали солевым раствором, высушивали (MgSO4), фильтровали и концентрировали на диоксиде кремния. Вещество хроматографировали через 25 г колонку от Thomson, элюируя 20% этилацетатом, 80% гексанами, получая трет-бутиловый эфир 4-[(1-бензолсульфонил-5-фтор-1Н-индол-2-ил)-гидрокси-метил]-4-пропил-пиперидин-1-карбоновой кислоты (319 мг, 0,6 ммоль) с выходом 53% в виде бежевой пены.
Стадия 3 трет-Бутиловый эфир 4-(1-бензолсульфонил-5-фтор-1H-индол-2-карбонил)-4-пропил-пиперидин-1-карбоновой кислоты
К раствору трет-бутилового эфира 4-[(1-бензолсульфонил-5-фтор-1H-индол-2-ил)-гидрокси-метил]-4-пропил-пиперидин-1-карбоновой кислоты (319 мг, 0,6 ммоль) в 20 мл дихлорметана добавляли периодинан Десса-Мартина (255 мг, 0,6 ммоль). Реакционную смесь перемешивали в течение 30 минут при комнатной температуре, затем гасили смесью 1:1 5% водного Na2S2O3: насыщенного водного NaHCO3. Смесь перемешивали до растворения всех твердых веществ, затем экстрагировали диэтиловым эфиром. Объединенные органические слои промывали насыщенным водным NaHCO3 и солевым раствором, высушивали (MgSO4), фильтровали и концентрировали в вакууме, что давало неочищенный трет-бутиловый эфир 4-(1-бензолсульфонил-5-фтор-1Н-индол-2-карбонил)-4-пропил-пиперидин-1-карбоновой кислоты (300 мг, 0,57 ммоль) в виде бежевого твердого вещества с выходом 95%.
Стадия 4 трет-Бутиловый эфир 4-(5-фтор-1H-индол-2-карбонил)-4-пропил-пиперидин-1-карбоновой кислоты
К раствору трет-бутилового эфира 4-(1-бензолсульфонил-5-фтор-1H-индол-2-карбонил)-4-пропил-пиперидин-1-карбоновой кислоты (290 мг, 0,55 ммоль) в 30 мл метанола добавляли 10 мл 1 М NaOH. Реакционную смесь нагревали до 80°С и перемешивали в течение одного часа, затем концентрировали в вакууме, чтобы удалить метанол. Оставшийся остаток экстрагировали этилацетатом и объединенные органические слои промывали солевым раствором, высушивали (MgSO4), фильтровали и концентрировали в вакууме, получая окрашенное желтым цветом масло. Масло хроматографировали через 12 г SiO2 колонку, элюируя 20% этилацетатом, 80% гексанами, получая 162 мг трет-бутилового эфира 4-(5-фтор-1H-индол-2-карбонил)-4-пропил-пиперидин-1-карбоновой кислоты в виде белого твердого вещества с выходом 76%.
Стадия 5 (5-Фтор-1H-индол-2-ил)-(4-пропил-пиперидин-4-ил)-метанон
162 мг трет-Бутилового эфира 4-(5-фтор-1H-индол-2-карбонил)-4-пропил-пиперидин-1-карбоновой кислоты растворяли в 1 М метанольной HCl и перемешивали при комнатной температуре в течение 24 часов. Растворитель удаляли, получая масло, которое осаждали из диэтилового эфира, что давало 132 мг гидрохлорида (5-фтор-1H-индол-2-ил)-(4-пропил-пиперидин-4-ил)-метанона в виде твердого вещества с выходом 97%, MS=289 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 18
(4-Пропил-пиперидин-4-ил)-хинолин-2-ил-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Ш.
Схема Ш
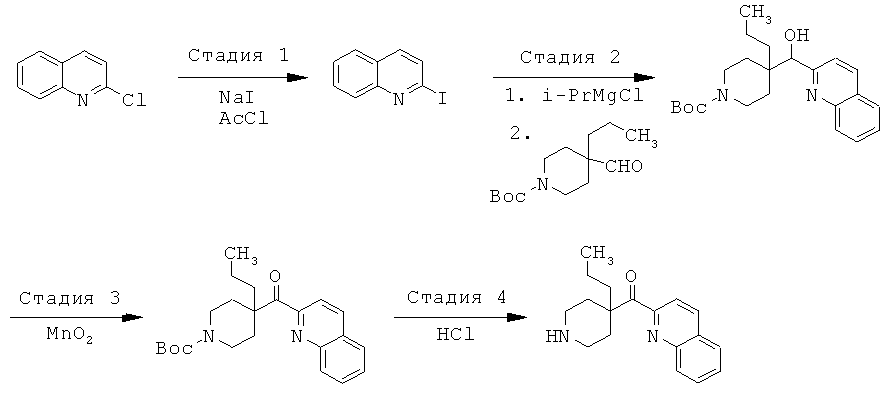
Стадия 1 2-Йодхинолин
2-Йодхинолин получали согласно процедуре Kimber с соавт. (Tetrahedron 2000, 56, 3575). К раствору 2-хлорхинолина (10,0 г, 61,5 ммоль) в CH3CN (100 мл) добавляли иодид натрия (14 г, 92,3 ммоль) и ацетилхлорид (8,8 мл, 123 ммоль). Реакционную смесь перемешивали при 100°С в течение 5 часов, затем охлаждали до комнатной температуры и гасили 10% водным K2CO3 (100 мл) и 5% водным NaHSO3 (50 мл). Водный слой экстрагировали дважды дихлорметаном, затем объединенные органические экстракты высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (0% до 20% EtOAc в гексанах), получая 9,7 г (70%) 2-йодхинолина в виде желтого твердого вещества.
Стадия 2 трет-Бутиловый эфир 4-(гидрокси-хинолин-2-ил-метил)-4-пропил-пиперидин-1-карбоновой кислоты
К раствору 2-йодхинолина (670 мг, 2,6 ммоль) в ТГФ (10 мл) при 0°С медленно добавляли изопропилмагнийхлорид (2,0 М в ТГФ, 1,6 мл, 3,2 ммоль). Реакционную смесь перемешивали при 0°С в течение 30 минут, затем раствор трет-бутилового эфира 4-формил-4-пропил-пиперидин-1-карбоновой кислоты (670 мг, 2,6 ммоль) в ТГФ (3 мл) медленно добавляли. Реакционную смесь перемешивали при 0°С в течение 30 минут, затем нагревали до комнатной температуры, гасили насыщенным водным раствором NH4Cl и экстрагировали EtOAc. Объединенные органические экстракты промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (0% до 20% EtOAc в гексанах), что давало 190 мг (19%) трет-бутилового эфира 4-(гидрокси-хинолин-2-ил-метил)-4-пропил-пиперидин-1-карбоновой кислоты в виде желтого масла.
Стадия 3 трет-Бутиловый эфир 4-пропил-4-(хинолин-2-карбонил)-пиперидин-1-карбоновой кислоты
К раствору трет-бутилового эфира 4-(гидрокси-хинолин-2-ил-метил)-4-пропил-пиперидин-1-карбоновой кислоты (190 мг, 0,5 ммоль) в толуоле (5 мл) добавляли оксид марганца (IV) (активированный, 260 мг, 3,0 ммоль). Реакционную смесь нагревали при 100°С в течение 3 часов, затем охлаждали до комнатной температуры и фильтровали через целит, промывая EtOAc. Фильтрат концентрировали и очищали с помощью флэш-хроматографии (0% до 20% EtOAc в гексанах), что давало 124 мг (67%) трет-бутилового эфира 4-пропил-4-(хинолин-2-карбонил)-пиперидин-1-карбоновой кислоты в виде бесцветного масла.
Стадия 4 (4-Пропил-пиперидин-4-ил)-хинолин-2-ил-метанон
трет-Бутиловый эфир 4-пропил-4-(хинолин-2-карбонил)-пиперидин-1-карбоновой кислоты (124 мг, 0,32 ммоль) растворяли в растворе безводном 1,0 М HCl в МеОН (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 15 часов, затем концентрировали при пониженном давлении, что давало 82 мг (80%) гидрохлорида (4-пропил-пиперидин-4-ил)-хинолин-2-ил-метанона в виде желтого твердого вещества, MS=283 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 19
[3-(3,3-Диметил-бутил)-пирролидин-3-ил]-(5-фтор-бензо[b]тиофен-3-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Щ.
Схема Щ
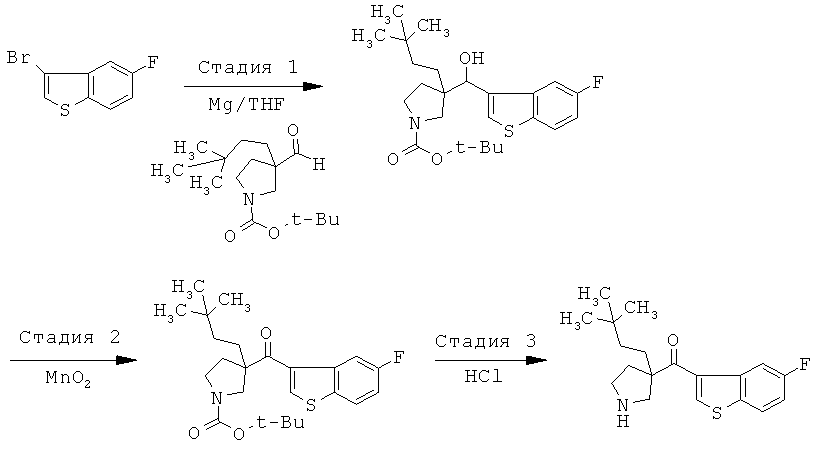
Стадия 1 трет-Бутиловый эфир 3-(3,3-диметил-бутил)-3-[(5-фтор-бензо[b]тиофен-3-ил)-гидрокси-метил]-пирролидин-1-карбоновой кислоты
Смесь 3-бром-5-фтор-бензотиофена (0,4 г, 1,73 ммоль), магния (0,051 г, 2,1 ммоль) и нескольких частиц йода в безводном тетрагидрофуране (10 мл) нагревали с обратным холодильником в течение 7 часов и затем охлаждали на бане со льдом. К реакционной смеси медленно добавляли раствор трет-бутилового эфира 3-(3,3-диметил-бутил)-3-формил-пирролидин-1-карбоновой кислоты (0,39 г, 1,38 ммоль) в безводном тетрагидрофуране (9 мл). Реакционную смесь перемешивали при температуре бани со льдом в течение одного часа и гасили насыщенным водным раствором хлорида аммония. Водный раствор экстрагировали этилацетатом, который промывали солевым раствором и высушивали над безводным сульфатом натрия. После удаления осушителя органический раствор концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (0 до 20% этилацетата в гексане), что давало трет-бутиловый эфир 3-(3,3-диметил-бутил)-3-[(5-фтор-бензо[b]тиофен-3-ил)-гидрокси-метил]-пирролидин-1-карбоновой кислоты в виде желтой пены (0,13 г, 21%), MS=436 [М+Н]+.
Стадия 2 трет-Бутиловый эфир 3-(3,3-диметил-бутил)-3-(5-фтор-бензо[b]тиофен-3-карбонил)-пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир 3-(3,3-диметил-бутил)-3-(5-фтор-бензо[b]тиофен-3-карбонил)-пирролидин-1-карбоновой кислоты получали из трет-бутилового эфира 3-(3,3-диметил-бутил)-3-[(5-фтор-бензо[b]тиофен-3-ил)-гидрокси-метил]-пирролидин-1-карбоновой кислоты при окислении с MnO2, используя процедуру стадии 3 примера 18.
Стадия 3 [3-(3,3-Диметил-бутил)-пирролидин-3-ил]-(5-фтор-бензо[b]тиофен-3-ил)-метанон
[3-(3,3-Диметил-бутил)-пирролидин-3-ил]-(5-фтор-бензо[b]тиофен-3-ил)-метанон получали из трет-бутилового эфира 3-(3,3-диметил-бутил)-3-(5-фтор-бензо[b]тиофен-3-карбонил)-пирролидин-1-карбоновой кислоты, используя процедуру стадии 4 примера 18, MS=334 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 20
(7-Фтор-бензо[b]тиофен-2-ил)-[3-(тетрагидро-пиран-4-илметил)-пирролидин-3-ил]-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Э.
Схема Э
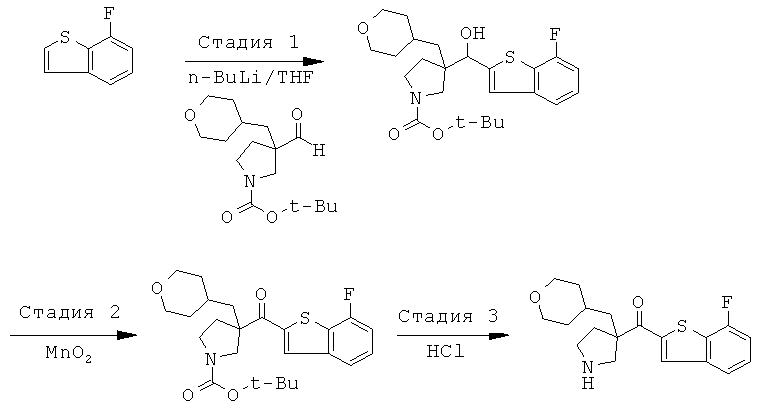
Стадия 1 трет-Бутиловый эфир 3-[(7-фтор-бензо[b]тиофен-2-ил)-гидрокси-метил]-3-(тетрагидро-проан-4-илметил)-пирролидин-1-карбоновой кислоты
К раствору 7-фтор-бензотиофена (0,22 г, 1,44 ммоль) в безводном тетрагидрофуране (10 мл) при -78°С добавляли по каплям раствор n-BuLi в гексане (1,6 М, 0,9 мл, 1,44 ммоль). Реакционную смесь перемешивали при -78°С в течение одного часа и затем раствор трет-бутилового эфира 3-формил-3-(тетрагидро-пиран-4-илметил)-пирролидин-1-карбоновой кислоты (0,3 г, 1,01 ммоль) в безводном тетрагидрофуране (5 мл) добавляли. Реакционную смесь перемешивали при -78°С в течение 3 часов, гасили насыщенным водным хлоридом аммония и разделяли между этилацетатом и насыщенным водным раствором хлорида аммония. Органическую фазу промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (10 до 45% этилацетата в гексане), что давало трет-бутиловый эфир 3-[(7-фтор-бензо[b]тиофен-2-ил)-гидрокси-метил]-3-(тетрагидро-пиран-4-илметил)-пирролидин-1-карбоновой кислоты в виде бесцветного полутвердого вещества (0,138 г, 30%). MS=450 [М+Н]+.
Стадия 2 трет-Бутиловый эфир 3-(7-фтор-бензо[b]тиофен-2-карбонил)-3-(тетрагидро-пиран-4-илметил)-пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир 3-(7-фтор-бензо[b]тиофен-2-карбонил)-3-(тетрагидро-пиран-4-илметил)-пирролидин-1-карбоновой кислоты получали из трет-бутилового эфира 3-[(7-фтор-бензо[b]тиофен-2-ил)-гидрокси-метил]-3-(тетрагидро-пиран-4-илметил)-пирролидин-1-карбоновой кислоты при окислении с MnO2, используя процедуру стадии 3 примера 18.
Стадия 3 (7-Фтор-бензо[b]тиофен-2-ил)-[3-(тетрагидро-пиран-4-илметил)-пирролидин-3-ил]-метанон
(7-Фтор-бензо[b]тиофен-2-ил)-[3-(тетрагидро-пиран-4-илметил)-пирролидин-3-ил]-метанон получали из трет-бутилового эфира 3-(7-фтор-бензо[b]тиофен-2-карбонил)-3-(тетрагидро-пиран-4-илметил)-пирролидин-1-карбоновой кислоты, используя процедуру стадии 4 примера 18, MS=348 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 21
(4-Хлор-5-метил-тиофен-2-ил)-(3-пропил-пирролидин-3-ил)-метанон
Процедуру синтеза, описанную в данном примере, осуществляли согласно способу, показанному на схеме Ю.
Схема Ю
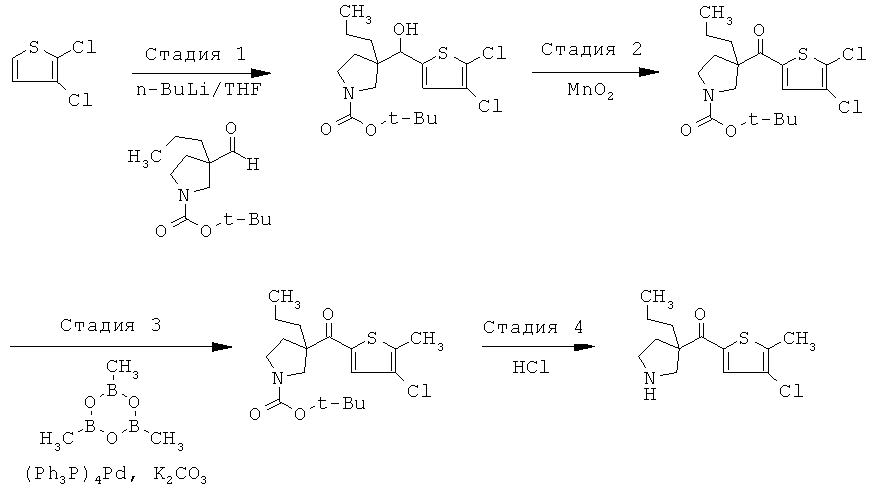
Стадия 1 трет-Бутиловый эфир 3-[(4,5-дихлор-тиофен-2-ил)-гидрокси-метил]-3-пропил-пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир 3-[(4,5-дихлор-тиофен-2-ил)-гидрокси-метил]-3-пропил-пирролидин-1-карбоновой кислоты получали из 2,3-дихлор-тиофена и трет-бутилового эфира 3-формил-3-пропил-пирролидин-1-карбоновой кислоты, используя процедуру стадии 1 примера 20.
Стадия 2 трет-Бутиловый эфир 3-(4,5-дихлор-тиофен-2-карбонил)-3-пропил-пирролидин-1-карбоновой кислоты
Смесь трет-бутилового эфира 3-[(4,5-дихлор-тиофен-2-ил)-гидрокси-метил]-3-пропил-пирролидин-1-карбоновой кислоты (0,423 г, 1,07 ммоль) и оксида марганца (IV) (1,3 г, 12,7 ммоль) в толуоле (20 мл) нагревали с обратным холодильником в течение 2 часов и фильтровали через прокладку из целита. Фильтрат промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (10% этилацетат в гексане), что давало трет-бутиловый эфир 3-(4,5-дихлор-тиофен-2-карбонил)-3-пропил-пирролидин-1-карбоновой кислоты в виде бледно-желтого твердого вещества (0,27 г, 64%). M+Na: 414.
Стадия 3 трет-Бутиловый эфир 3-(4-хлор-5-метил-тиофен-2-карбонил)-3-пропил-пирролидин-1-карбоновой кислоты
Смесь трет-бутилового эфира 3-(4,5-дихлор-тиофен-2-карбонил)-3-пропил-пирролидин-1-карбоновой кислоты (0,2 г, 0,512 ммоль), триметилбороксина (0,24 г, 1,91 ммоль), карбоната калия (0,22 г, 1,59 ммоль) и тетракис(трифенилфосфин)палладия (0) (0,06 г, 0,051 ммоль) в диоксане (10 мл) нагревали с обратным холодильником в течение трех часов, затем охлаждали до комнатной температуры. Смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (0 до 10% этилацетата в гексане), что давало трет-бутиловый эфир 3-(4-хлор-5-метил-тиофен-2-карбонил)-3-пропил-пирролидин-1-карбоновой кислоты в виде твердого вещества (0,166 г, 87%). M+Na: 394.
Стадия 4 (4-Хлор-5-метил-тиофен-2-ил)-(3-пропил-пирролидин-3-ил)-метанон
Раствор трет-бутилового эфира 3-(4-хлор-5-метил-тиофен-2-карбонил)-3-пропил-пирролидин-1-карбоновой кислоты (0,16 г, 0,43 ммоль) в смешанном растворителе метанола и дихлорметана (3 мл/3 мл) добавляли к раствору соляной кислоты в безводном эфире (1 М, 10 мл). Раствор перемешивали при комнатной температуре в течение ночи и концентрировали при пониженном давлении. Остаток растирали с гексанами и диэтиловым эфиром, что давало гидрохлорид (4-хлор-5-метил-тиофен-2-ил)-(3-пропил-пирролидин-3-ил)-метанона в виде твердого вещества (0,129 г, 97%). [М+Н]+: 272.
Подобным образом, пропуская стадию 3, получали (4,5-дихлор-тиофен-2-ил)-(3-пропил-пирролидин-3-ил)-метанон, MS=292 [М+Н]+.
Дополнительные соединения, полученные согласно вышеприведенной процедуре, показаны в таблице 1.
Пример 22
Препараты
Фармацевтические препараты для доставки разными способами изготавливают, как показано в следующих таблицах. «Активный компонент» или «активное соединение», как используется в таблицах, означает одно или более соединений формулы I.
|
Ингредиенты смешивают и дозируют в капсулы, содержащие около 100 мг каждого; одна капсула почти соответствует полной суточной дозе.
|
Ингредиенты объединяют и гранулируют, используя растворитель, такой как метанол. Затем препарат высушивают и прессуют в таблетки (содержащие около 20 мг активного соединения) на соответствующей таблетировочной машине.
|
Ингредиенты смешивают до образования суспензии для перорального введения.
|
Активный компонент растворяют в части воды для инъекции. Затем добавляют при перемешивании количество хлорида натрия достаточное, чтобы сделать раствор изотоническим. Раствор доводят до веса с остальной частью воды для инъекции, фильтруют через 0,2 микронный мембранный фильтр и упаковывают в стерильных условиях.
|
Ингредиенты плавят вместе, смешивают на паровой бане и выливают в формы, содержащие 2,5 г общей массы.
|
Все ингредиенты за исключением воды объединяют и нагревают приблизительно до 60°С при перемешивании. Затем добавляют приблизительно при 60°С при интенсивном перемешивании количество воды достаточное, чтобы из ингредиентов получить эмульсию, и потом добавляют воду приблизительно до 100 г.
Назальные спреи
Некоторые водные суспензии, содержащие приблизительно 0,025-0,5% активного соединения, получают в виде назальных спреев. Препараты могут содержать неактивные ингредиенты, такие как, например, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза натрия, декстроза и т.п. Можно добавить соляную кислоту, чтобы регулировать рН. Назальные спреи могут подаваться посредством назального впрыскивающего дозирующего насоса, обычно поставляющего около 50-100 микролитров препарата за впрыскивание. Обычный режим дозирования составляет 2-4 впрыскивания каждые 4-12 часов.
Пример 23
Скрининг антагонистов переносчика серотонина человека (hSERT от Human Serotonin Transporter) с использованием сцинтилляционного проксимального анализа (SPA от Scintillation Proximity Assay)
В данном примере для определения сродства лигандов к hSERT-переносчику использовали скрининговый анализ, основанный на конкуренции с [3Н]-циталопрамом.
Сцинтилляционный проксимальный анализ (SPA) основан на том, что для стимуляции светового излучения радиолиганд должен находиться в непосредственной близости от сцинтиллятора шариков. В данном анализе рецептор-содержащие мембраны предварительно связывали со SPA-шариками и измеряли связывание подходящего радиолиганда с переносчиком. Световое излучение было пропорционально количеству связанного радиолиганда. Вследствие значительной удаленности от сцинтиллятора несвязанный радиолиганд не давал никакого сигнала (из-за отсутствия передачи энергии).
Клетки НЕК-293 (Tatsumi et al., Eur. J. Pharmacol. 1997, 30, 249-258), стабильно экспрессирующие рекомбинантный hSERT, поддерживали со средой (DMEM (модифицированной по способу Дульбекко среде Игла) с высоким содержанием глюкозы с 10% FBS (фетальной телячьей сывороткой), 300 мкг/мл G418 и 2 мМ L-глутамином) и инкубировали при 37°С с 5% CO2. Клетки смывали из культуральных флаконов с использованием PBS (фосфатно-солевого буфера) в течение 1-2 минут. Затем клетки центрифугировали при 1000×g в секунду в течение 5 минут и ресуспендировали в PBS, перед тем как использовать в препарате мембран.
Клеточные мембраны получали с использованием буфера для препарата мембран 50 мМ Трис (рН 7,4). Клеточные мембраны получали из 1 см3 (общее количество клеток 7,5×109). Клетки гомогенизировали с использованием гомогенизатора Polytron (средний режим вскрытия в течение 4 секунд). Затем гомогенат центрифугировали при 48000×g в течение 15 минут, потом супернатант удаляли и выбрасывали, а осадок ресуспендировали в свежем буфере. После второго центрифугирования осадок снова гомогенизировали и доводили до конечного объема, который определяли в ходе анализа. Обычно порции мембран хранили в аликвотах по 3 мг/мл (масса: объем) при -80°С.
Для определения ИК50/Ki путем сцинтилляционного проксимального анализа использовали буферы 50 мМ Tris-HCl и 300 мМ NaCl (pH 7,4). Соединения по изобретению разбавляли до конечной анализируемой концентрации (FAC) от 10 мМ до 0,1 нМ (10 точек на кривую, логарифмическое (log) разбавление/полулогарифмическое (half-log) разбавление) с помощью Beckman Biomek 2000 с использованием протокола последовательного разбавления. Затем исследуемые соединения переносили в планшет (20 мкл/лунку), и добавляли радиолиганд [3Н]-циталопрам в количестве 50 мкл/лунку. Мембрану и шарики брали в соотношении 10 мкг: 0,7 мг, добавляли 0,7 мг PVT-WGA (поливинилтолуол - агглютинин из проростков пшеницы) Amersham шариков (кат. № RPQ0282V) на лунку. В планшет для анализа добавляли 130 мкл смеси мембрана: шарики. Смеси выдерживали при комнатной температуре в течение одного часа и затем подсчитывали на Packard TopCount LCS с использованием типичных параметров настройки протокола подсчета для сцинтилляционного проксимального анализа (диапазон энергий: низкий; режим эффективности: нормальный; диапазон А: 1,50-35,00; диапазон В: 1,50-256,00; время счета (мин): 0,40; вычитание фона: нет; коррекция на время полужизни: нет; индикатор гашения: tSIS, вычитание фона по карте планшета: нет; вычитание перекрестных помех: выключено).
Процент ингибирования вычисляли для каждого исследуемого соединения [(число импульсов в минуту (СРМ от counts per minute) соединения при максимальной концентрации - неспецифическое СРМ)/всего СРМ×100]. Концентрацию, обеспечивающую 50% ингибирование (ИК50), определяли с использованием итеративного метода подбора параметров нелинейного уравнения кривой с помощью программ Activity Base/Xlfit по следующему уравнению:
где макс = общее связывание, мин = неспецифическое связывание, х = концентрация (М) исследуемого соединения и n = коэффициент Хилла. Константу диссоциации для ингибирующего связывания (Ki) определяли для каждого соединения в соответствии с методом Ченга-Пруссова и затем вычисляли отрицательный логарифм (pKi) от Ki.
При использовании вышеописанного способа было установлено, что соединения по изобретению обладают сродством к переносчику серотонина человека. Например, при использовании вышеописанного анализа нафталин-2-ил-(3-пропил-пирролидин-3-ил)-метанон показывал pKi приблизительно 9,82.
Пример 24
Скрининг соединений, обладающих активностью в отношении переносчика норэпинефрина человека (hNET от Human Norepinephrine Transporter), с использованием сцинтилляционного проксимального анализа (SPA)
Для определения сродства лигандов к hNET-переносчику использовали данный анализ, основанный на конкуренции с [3Н]-низоксетином. Как и в hSERT-анализе вышеописанного примера рецептор-содержащие мембраны предварительно связывали со SPA-шариками и измеряли связывание подходящего радиолиганда с переносчиком. Световое излучение было пропорционально количеству связанного радиолиганда, а несвязанный радиолиганд не давал никакого сигнала.
Клетки НЕК-293 (Tatsumi et al., Eur. J. Pharmacol. 1997, 30, 249-258), стабильно экспрессирующие рекомбинантный hNET (Клон: HEK-hNET №2), поддерживали со средой (DMEM с высоким содержанием глюкозы с 10% FBS, 300 мкг/мл G418 и 2 мМ L-глутамином) и инкубировали при 37°С с 5% CO2. Клетки смывали из культуральных флаконов с использованием PBS в течение 1-2 минут. Затем клетки центрифугировали при 1000×g в секунду в течение 5 минут и ресуспендировали в PBS, перед тем как использовать в препарате мембран.
Клеточные мембраны получали с использованием буфера для препарата мембран 50 мМ Трис (рН 7,4). Клеточные мембраны получали из 1 см3 (общее количество клеток 7,5×109). Клетки гомогенизировали с использованием гомогенизатора Polytron (средний режим вскрытия в течение 4 секунд). Затем гомогенат центрифугировали при 48000×g в течение 15 минут, потом супернатант удаляли и выбрасывали, а осадок ресуспендировали в свежем буфере. После второго центрифугирования осадок снова гомогенизировали и доводили до конечного объема, который определяли в ходе анализа. Обычно порции мембран хранили в аликвотах по 3-6 мг/мл (масса: объем) при -80°С.
Для определения ИК50/Ki путем сцинтилляционного проксимального анализа использовали радиолиганд 3[Н]-низоксетин (Amersham кат. № TRK942 или Perkin Elmer кат. № NET1084, удельная активность: 70-87 Ки/ммоль, исходная концентрация: 1,22е-5 М, конечная концентрация: 8,25е-9 М) и буферы 50 мМ Tris-HCl, 300 мМ NaCl (рН 7,4). Соединения по изобретению разбавляли до FAC от 10 мМ до 0,1 нМ (10 точек на кривую, логарифмическое (log) разбавление/полулогарифмическое (half-log) разбавление) с помощью Beckman Biomek 2000 с использованием протокола последовательного разбавления. Затем исследуемые соединения переносили в планшет (20 мкл/лунку) и добавляли радиолиганд в количестве 50 мкл/лунку. Мембрану и шарики брали в соотношении 10 мкг: 0,7 мг, добавляли 0,7 мг PVT-WGA Amersham шариков (кат. № RPQ0282V) на лунку. В планшет для анализа добавляли 130 мкл смеси мембрана: шарики. Смеси выдерживали при комнатной температуре в течение одного часа и затем подсчитывали на Packard TopCount LCS с использованием типичных параметров настройки протокола подсчета для SPA (диапазон энергий: низкий; режим эффективности: нормальный; диапазон А: 1,50-35,00; диапазон В: 1,50-256,00; время счета (мин): 0,40; вычитание фона: нет; коррекция на время полужизни: нет; индикатор гашения: tSIS, вычитание фона по карте планшета: нет; вычитание перекрестных помех: выключено).
Процент ингибирования вычисляли для каждого исследуемого соединения [(СРМ при максимальной концентрации соединения - неспецифическое СРМ)/всего СРМ×100]. Концентрацию, обеспечивающую 50% ингибирование (ИК50), определяли с использованием итеративного метода подбора параметров нелинейного уравнения кривой с помощью программ Activity Base/Xlfit с использованием следующего уравнения:
где макс = общее связывание, мин = неспецифическое связывание, х = концентрация (М) исследуемого соединения и n = коэффициент Хилла. Константу диссоциации для ингибирующего связывания (Ki) определяли для каждого соединения в соответствии с методом Ченга-Пруссова и затем вычисляли отрицательный логарифм (pKi) от Ki.
При использовании вышеописанного способа было установлено, что соединения по изобретению обладают сродством к переносчику норэпинефрина человека. Например, при использовании вышеописанного анализа (7-фтор-1H-индол-5-ил)-[(S)-3-(3-метил-бутил)-пирролидин-3-ил]-метанон показывал pKi приблизительно 9,2.
Пример 25
Скрининг соединений, обладающих активностью в отношении переносчика дофамина человека, с использованием сцинтилляционного проксимального анализа (SPA)
Для определения сродства лигандов к переносчику дофамина использовали данный анализ, основанный на конкуренции с [3Н]-ваноксерином.
Клетки НЕК-293 (Tatsumi et al., Eur. J. Pharmacol. 1997, 30, 249-258), стабильно экспрессирующие рекомбинантный hDAT, поддерживали со средой (DMEM с высоким содержанием глюкозы с 10% FBS, 300 мкг/мл G418 и 2 мМ L-глутамином) и инкубировали при 37°С с 5% CO2. Клетки высеивали четыре часа перед экспериментом, помещая приблизительно по 30000 клеток в лунку (в PBS) на белых, покрытых непрозрачным Cell-Tak 96-луночных планшетах. Специальным буфером промывали клеточные планшеты, используя машину для мойки планшетов EL×405.
Для определения ИК50/Ki путем сцинтилляционного проксималъного анализа использовали радиолиганд [3Н]-ваноксерин (GBR 12909), удельная активность приблизительно 59 Ки/ммоль, исходная концентрация: 400 нМ, и буферы 50 мМ Tris-HCl, 300 мМ NaCl (pH 7,4). Соединения по изобретению разбавляли до FAC от 10 мМ до 0,1 нМ (10 точек на кривую, логарифмическое (log) разбавление/полулогарифмическое (half-log) разбавление) с помощью Beckman Biomek 2000 с использованием протокола 10-точечного разбавления. Смеси выдерживали при комнатной температуре в течение 30 минут и затем подсчитывали на Packard TopCount LCS с использованием типичных параметров настройки протокола подсчета для SPA (время счета (мин): 0,40; вычитание фона: нет; коррекция на время полужизни: нет; индикатор гашения: tSIS, вычитание фона по карте планшета: нет; вычитание перекрестных помех: выключено).
Процент ингибирования вычисляли для каждого исследуемого соединения [(СРМ при максимальной концентрации соединения - неспецифическое СРМ)/всего СРМ×100]. Концентрацию, обеспечивающую 50% ингибирование (ИК50), определяли с использованием итеративного метода подбора параметров нелинейного уравнения кривой с помощью программ Activity Base/Xlfit с использованием следующего уравнения:
где макс = общее связывание, мин = неспецифическое связывание, х = концентрация (М) исследуемого соединения и n = коэффициент Хилла. Константу диссоциации для ингибирующего связывания (Ki) определяли для каждого соединения в соответствии с методом Ченга-Пруссова и затем вычисляли отрицательный логарифм (pKi) от Ki.
При использовании вышеописанного способа было установлено, что соединения по изобретению обладают сродством к переносчику дофамина человека. Например, при использовании вышеописанного анализа [(S)-3-(3,3-диметил-бутил)-пирролидин-3-ил]-(7-фтор-1H-индол-5-ил)-метанон показывал pKi приблизительно 9,2.
Пример 26
Анализ болевого синдрома при использовании формалина
Самцов крыс линии Спраг Доули (180-220 г) помещают в отдельные камеры из плексигласа и дают приспособиться к условиям проведения испытания в течение 30 минут. Наполнитель, лекарственное средство или положительный контроль (2 мг/кг морфина) вводят подкожно при 5 мл/кг. Через 15 минут после дозировки формалин (5% в 50 мкл) вводят в подошвенную поверхность правой задней лапы, используя иглу №26. Сразу же крыс возвращают в наблюдательную камеру. Зеркала, размещенные вокруг камеры, позволяют беспрепятственно наблюдать за лапой, в которую был введен формалин. Продолжительность ноцицептивного поведения каждого животного регистрируется зашторенным наблюдателем с использованием автоматизированного бихевиористического таймера. Облизывание и встряхивание/поднятие задней лапы регистрируется отдельно в контейнере каждые 5 минут в течение 60 минут. Количество времени, затраченного на облизывание или встряхивание, в секундах от 0 до 5 минут считается ранней стадией, тогда как за замедленную стадию принимается количество секунд, затраченных на облизывание или встряхивание, от 15 до 40 минут. Образцы плазмы собирают.
Пример 27
Анализ болевого синдрома в толстой кишке
По 1-2 взрослых самца крыс линии Спраг Доули (350-425 г; Harlan, Indianapolis, IN) помещают в клетку с устройством ухода за животными. Крысам делают глубокую анестезию с пентобарбиталом натрия (45 мг/кг), вводимым внутрибрюшинно. Электроды размещают и закрепляют в наружных косых мышцах для электромиографической (ЭМГ) регистрации. Электродные провода располагают подкожно и выводят к задней части шеи для будущего доступа. После хирургического вмешательства крыс помещают раздельно и дают выздороветь в течение 4-5 дней до испытания.
Нисходящая ободочная кишка и прямая кишка расширяются при надувании с регулируемым давлением с помощью 7-8 сантиметрового гибкого латексного зонда, обвязанного вокруг гибкой трубки. Зонд смазывают, вставляют в толстую кишку через анальное отверстие и закрепляют, привязывая баллонный катетер к основанию хвоста. Колоректальное раздувание (CRD от colorectal distension) достигают, открывая соленоидный клапан воздушного резервуара с постоянным давлением. Внутритолстокишечное давление регулируют и непрерывно контролируют с помощью датчика давления. Отклик количественно измеряют как висцеромоторную реакцию (VMR от visceromotor response), сокращение брюшных мышц и мускулатуры задних конечностей. ЭМГ активность, вызванную сокращением наружных косых мышц, количественно измеряют, используя программное обеспечение Spike2 (Cambridge Electronic Design). Анализ каждого раздувания продолжается 60 секунд, и ЭМГ активность количественно измеряют за 20 секунд до раздувания (базовая линия), в течение 20 секунд раздувания и через 20 секунд после раздувания. Увеличение в общем числе регистрируемых единиц в ходе раздувания выше базовой линии определяется как отклик. Стабильные фоновые отклики на CRD (10, 20, 40 и 80 мм рт.ст., 20 секунд, с 4-минутным интервалом) получают у бодрствующих неусыпленных крыс перед любой обработкой.
Оценивают влияния соединений на отклики на раздувание толстой кишки в начальной стадии на модели острой висцеральной ноцицепции и модели гиперчувствительности толстой кишки, вызванной внутритолстокишечной обработкой с зимозаном (1 мл, 25 мг/мл), влитым по капле в толстую кишку с помощью иглы зондового питания, вставленной на глубину около 6 см. Каждая экспериментальная группа будет состоять из 8 крыс.
Острая висцеральная ноцицепция: Для исследования влияний лекарственного средства на острую висцеральную ноцицепцию по 1 из 3 доз лекарственного средства, наполнителя или положительного контроля (морфин, 2,5 мг/кг) вводят, затем устанавливают фоновые отклики, определяют реакции на раздувание через следующие 60-90 минут.
Висцеральная гиперчувствительность: Для исследования влияний лекарственного средства или наполнителя после внутритолстокишечной обработки с зимозаном внутритолстокишечную обработку осуществляют после определения фоновых откликов. До тестирования лекарственного средства через 4 часа оценивают отклики на раздувание, чтобы установить наличие гиперчувствительности. Обработанным с зимозаном крысам вводят по 1 из 3 доз лекарственного средства, наполнителя или положительного контроля (морфин, 2,5 мг/кг) через 4 часа после обработки с зимозаном и отклики на раздувание определяют через следующие 60-90 минут.
Пример 28
Холодовая аллодиния у крыс с хроническим повреждением при перетяжке седалищного нерва
Влияния соединений по данному изобретению на холодовую аллодинию определяют, используя модель невропатической боли в результате хронического повреждения при перетяжке (СCI от chronic constriction injury) у крыс, когда холодовую аллодинию измеряют на бане с ледяной водой с дном из металлической пластины, водой на глубине 1,5-2,0 см и температуре 3-4°С (Gogas, K.R. et al., Analgesia, 1997, 3, 1-8).
А именно, CCl, крысам делают анестезию, где находится тройное разветвление седалищного нерва, 4 перевязки (4-0 или 5-0 хромированный кетгут) располагают по окружности вокруг седалищного нерва близко к тройному разветвлению. Затем крысам дают восстановиться после хирургического вмешательства. На 4-7 дни после хирургии крыс сначала оценивают на вызванную холодом аллодинию, по отдельности помещая животных в баню с ледяной водой и регистрируя суммарное количество подъемов поврежденной лапы в течение 1 минуты: поврежденная лапа поднимается из воды. Подъемы лапы, связанные с передвижением или изменением положения тела, не регистрируются. Считается, что крысы, которые показывают 5 подъемов за минуту или более на 4-7 день после хирургического вмешательства, проявляют холодовую аллодинию и используются для последующих изучений. При изучении непосредственных эффектов наполнитель, эталонное соединение или соединения по данному изобретению вводят подкожно (п/к) за 30 минут до исследования. Влияния повторного введения соединений по данному изобретению на холодовую аллодинию определяют через 14, 20 или 38 часов после последней пероралъной дозы согласно следующему режиму: пероральное (п/о) введение наполнителя, эталонного соединения или соединения по данному изобретению при ~ 12-часовых интервалах (два раза в день) в течение 7 дней.
Хотя настоящее изобретение описано со ссылкой на его конкретные воплощения, квалифицированный специалист в данной области должен понимать, что разные изменения могут быть сделаны и эквиваленты могут быть заменены, не отклоняясь от подлинной сущности и объема изобретения. Кроме того, могут быть сделаны многочисленные модификации, чтобы приспособить конкретную ситуацию, вещество, смесь веществ, способ, стадию или стадии способа к действительной сущности и объему настоящего изобретения. Подразумевается, что все подобные модификации находятся в объеме прилагаемой формулы изобретения.