Результат интеллектуальной деятельности: АЗАЦИКЛИЧЕСКИЕ СПИРОПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ HSL
Вид РИД
Изобретение
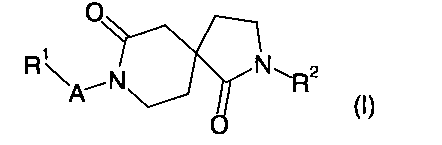
В настоящем изобретении предложены новые соединения, имеющие общую формулу (I)
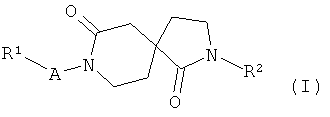
где
R1 представляет собой алкил, циклоалкил, галогеноалкил, пиперидинил, пиперазинил, морфолинил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, фенил, пиридинил, пиразинил, пиримидил или пиридазинил или, где пиперидинил, пиперазинил, морфолинил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, фенил, пиридинил, пиразинил, пиримидил и пиридазинил замещены заместителями в количестве от одного до трех, независимо выбранными из алкила, циклоалкила, циклоалкилалкила, атома галогена, галогеноалкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеноалкокси и гидроксигалогеноалкила;
R2 представляет собой фенил, пиридинил, пиразинил, пиримидил или пиридазинил, или, где фенил, пиридинил, пиразинил, пиримидил и пиридазинил замещены заместителями в количестве от одного до трех, независимо выбранными из алкила, циклоалкила, циклоалкилалкила, атома галогена, галогеноалкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеноалкокси и гидроксигалогеноалкила;
А представляет собой -(CH2)n-, -C(O)- или -S(O)2-;
n равно нулю, 1 или 2;
или их фармацевтически приемлемые соли.
Основная физиологическая роль белой жировой ткани (WAT, white adipose tissue) состоит в снабжении энергией, когда это необходимо, других тканей. У млекопитающих белая жировая ткань является основным депо энергетических запасов, накапливающим резервы топлива триацетилглицерина (TAG) в течение периодов избытка энергии. Высвобождение свободных жирных кислот (СЖК) из TAG стимулируется катехоламинами и регулируется гормонами, такими как инсулин, глюкагон и эпинефрин. Важнейшим ферментом WAT, который считают ответственным за гормонально регулируемый гидролиз триглицерида, является гормончувствительная липаза (HSL).
Нарушение регуляции липолиза адипоцитов, результатом которых являются повышенные неэстерифицированные жирные кислоты (НЭЖК) в кровообращении, связано с ожирением и сопутствующими заболеваниями, включающими развитие диабета типа 2. Субъекты, страдающие ожирением или резистентные к инсулину, имеют увеличенные депо висцеральной жировой ткани. Эти депо содержат повышенные уровни белка HSL и проявляют повышенную липолитическую активность, поскольку являются резистентными к опосредованному инсулином подавлению липолиза. Это приводит в результате к повышенным уровням свободных жирных кислот (СЖК) в плазме, что еще больше обостряет резистентность к инсулину вследствие накопления триглицеридов в тканях, иных, чем WAT, таких как печень, поджелудочная железа и мышцы. Следовательно, повышенные уровни СЖК вследствие повышенной активности HSL вносят вклад в резистентность к инсулину и усугубляют ее у индивидуумов с ожирением и диабетом типа 2. Снижение завышенных уровней СЖК и триглицеридов в плазме посредством ингибирования HSL снизило бы накопление триглицеридов в тканях, иных, чем WAT, таких как печень, мышцы и поджелудочная железа, приводя в результате к сниженной выработке глюкозы печенью, повышенному окислению жирных кислот в мышцах и улучшению функции β-клеток.
Повышенные СЖК также ассоциированы с повышенным сердечно-сосудистым риском, включающим атеросклероз и дисфункцию миокарда. Кроме того, высокая липолитическая активность и повышенные СЖК приводят к повышенной резистентности к инсулину и гипертензии у гипертензивных крыс. СЖК собираются в печени и приводят к повышенному продуцированию TAG, который упаковывается в липопротеины очень низкой плотности (ЛПОНП), которые являются секретируемыми. Поэтому снижение активности HSL снизило бы высвобождение СЖК в кровь, ограничивая, таким образом, снабжение СЖК печени для синтеза TAG. Следовательно, ингибиторы HSL могли бы обладать полезными эффектами в качестве терапии неалкогольной жировой болезни печени (НАЖБП) и неалкогольного стеатогепатита (НАСГ).
Объектами настоящего изобретения являются соединения формулы (I) и их вышеупомянутые соли и сложные эфиры, а также их применение в качестве терапевтически активных веществ, способ получения этих соединений, промежуточных соединений, фармацевтических композиций, лекарственных средств, содержащих данные соединения, их фармацевтически приемлемые соли или сложные эфиры, применение данных соединений, солей или сложных эфиров для лечения или профилактики заболеваний, в частности, при лечении или профилактике диабета, метаболического синдрома, дислипидемии, атеросклероза, ожирения, сердечно-сосудистых заболеваний, дисфункции миокарда, воспаления, неалкогольной жировой болезни печени или неалкогольного стеатогепатита, применение данных соединений, солей или сложных эфиров для получения лекарственных средств для лечения или профилактики диабета, метаболического синдрома, дислипидемии, атеросклероза, ожирения, сердечно-сосудистых заболеваний, дисфункции миокарда, воспаления, неалкогольной жировой болезни печени или неалкогольного стеатогепатита.
Термин "алкил", отдельно или в комбинации, обозначает прямоцепочечный или разветвленный алкил с количеством атомов углерода от 1 до 8, в частности, с количеством атомов углерода от 1 до 6, и более конкретно с количеством атомов углерода от 1 до 4. Примерами являются метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, метилбутил, диметилпропил, этилпропил, н-гексил, метилпентил, диметилбутил, триметилпропил и этилметилпропил. Конкретными примерами являются метил, этил, пропил, изопропил, бутил, изобутил и диметилпропил.
Термин "циклоалкил", отдельно или в комбинации, обозначает циклоалкильное кольцо с количеством атомов углерода от 3 до 8 и, в частности, с количеством атомов углерода от 3 до 6. Примерами являются циклопропил, метил-циклопропил, диметилциклопропил, циклобутил, метил-циклобутил, циклопентил, метил-циклопентил, циклогексил, метил-циклогексил, диметил-циклогексил, циклогептил и циклооктил. Конкретным примером является циклопропил.
Термин "гидрокси", отдельно или в комбинации, обозначает группу -OH.
Термин "гидроксиалкил", отдельно или в комбинации, обозначает алкил, как определено выше, где один или более чем один атом водорода замещен гидрокси. Примерами гидроксиалкила являются гидроксиметил, гидроксиэтил, гидроксипропил, гидроксиметилпропил и дигидроксипропил. Конкретными примерами являются гидроксиэтил и гидроксиметилпропил.
Термин "алкокси", отдельно или в комбинации, обозначает группу формулы алкил-O-, в которой термин «алкил» имеет ранее данное значение. Примерами являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси.
Термины "атом галогена" и "галогено", отдельно или в комбинации, обозначают фтор, хлор, бром или йод. Конкретными примерами являются фтор или хлор.
Термин "галогеноалкил", отдельно или в комбинации, обозначает алкил, как определено выше, где один или более чем один атом водорода замещен атомом галогена. Примерами галогеноалкила являются фторметил, дифторметил, трифторметил, трифторэтил, трифторметилэтил или пентафторэтил. Конкретным примером является трифторэтил.
Термин "галогеноалкокси", отдельно или в комбинации, обозначает алкокси, как определено выше, где один или более чем один атом водорода замещен атомом галогена. Примерами галогеноалкокси являются фторметокси, дифторметокси, трифторметокси, трифторэтокси, трифторметилэтокси, трифтордиметилэтокси или пентафторэтокси. Конкретными примерами являются трифторметокси и трифторэтокси.
Термин "карбонил", отдельно или в комбинации, обозначает группу -C(O)-.
Термин "сульфонил", отдельно или в комбинации, обозначает группу -S(O)2.
Термин "защитная группа" относится к группам, которые используют, чтобы блокировать реакционность функциональных групп, таких как аминогруппы или гидроксигруппы. Примерами защитных групп являются трет-бутоксикарбонил (Boc), бензилоксикарбонил (Cbz), флуоренилметоксикарбонил (Fmoc) или бензил (Bn). Конкретной защитной группой является трет-бутоксикарбонил (Boc).
Отщепление защитных групп можно проводить, используя стандартные способы, известные специалистам в данной области техники, такие как гидрогенизация, или в присутствии кислоты, например, HCl или ТФУ, или основания, например, триэтиламина.
Термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются ни биологически, ни иначе нежелательными. Соли образуют с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, в частности, соляная кислота, и с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин и тому подобное. Кроме того, эти соли могут быть получены путем присоединения неорганического основания или органического основания к свободной кислоте. Соли, образованные из неорганического основания, включают, но не ограничены ими, соли натрия, калия, лития, аммония, кальция, магния и тому подобное. Соли, образованные из органических оснований, включают, но не ограничены ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полииминные смолы и тому подобное. Конкретными фармацевтически приемлемыми солями соединений формулы (I) являются соли гидрохлориды, соли метансульфоновой кислоты и соли лимонной кислоты.
Соединения формулы (I) могут быть также сольватированными, например, гидратированными. Сольватацию можно осуществить в ходе процесса получения, либо она может происходить, например, вследствие гигроскопических свойств исходно безводного соединения формулы (I) (гидратация). Термин «фармацевтически приемлемые соли» также включает физиологически приемлемые сольваты.
"Фармацевтически приемлемые сложные эфиры" означают, что соединения общей формулы (I) могут быть дериватизированы при функциональных группах с получением производных, которые способны к обратному преобразованию исходных соединений in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные сложноэфирные производные, такие как метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Кроме того, любые физиологически приемлемые эквиваленты соединений общей формулы (I), подобные метаболически лабильным сложным эфирам, которые способны образовывать исходные соединения общей формулы (I) in vivo, находятся в пределах объема данного изобретения.
Соединения формулы (I) могут содержать несколько асимметрических центров и могут присутствовать в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, оптически чистых диастереоизомеров, смесей диастереоизомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов.
Согласно правилу Кана-Ингольда-Прелонга асимметрический атом углерода может иметь "R" или "S" конфигурацию.
Формой осуществления настоящего изобретения также являются соединения в соответствии с формулой (I), как описано выше, и их фармацевтически приемлемые соли или сложные эфиры, в частности, соединения в соответствии с формулой (I), как описано выше, и их фармацевтически приемлемые соли, более конкретно соединения в соответствии с формулой (I), как описано выше.
Следующей формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где R1 представляет собой алкил, циклоалкил, галогеноалкил, фенил или пиридинил, или, где фенил и пиридинил замещены заместителями в количестве от одного до трех, независимо выбранными из алкила, циклоалкила, циклоалкилалкила, атома галогена, галогеноалкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеноалкокси и гидроксигалогеноалкила.
Конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где R1 представляет собой алкил, фенил или фенил, замещенный атомами галогена в количестве от одного до трех.
Конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где R1 представляет собой алкил или фенил, замещенный атомами галогена в количестве от одного до трех.
Также конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где R1 представляет собой алкил.
Конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где R1 представляет собой трет-бутил или 2,2-диметилпропил.
Альтернативной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где R1 представляет собой фенил, замещенный атомами галогена в количестве от одного до трех.
Конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где R1 представляет собой хлорфенил.
Следующей формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где R2 представляет собой фенил или пиридинил, или, где фенил и пиридинил замещены заместителями в количестве от одного до трех, независимо выбранными из алкила, циклоалкила, циклоалкилалкила, атома галогена, галогеноалкила, гидрокси, гидроксиалкила, алкокси, алкоксиалкила, галогеноалкокси и гидроксигалогеноалкила.
Конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где R представляет собой фенил, замещенный заместителями в количестве от одного до трех, независимо выбранными из галогеноалкила и галогеноалкокси.
Настоящее изобретение также относится к соединениям в соответствии с формулой (I), как описано выше, где R2 представляет собой трифторэтилфенил или трифторметоксифенил.
Конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где А представляет собой -C(O)-.
Следующей конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где А представляет собой -S(O)2-.
Формой осуществления настоящего изобретения также являются соединения в соответствии с формулой (I), как описано выше, где А представляет собой -(CH2)n-.
Конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, где n равно 1.
Конкретные примеры соединений формулы (I) выбраны из
8-Бензил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-Пропил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-(2-Хлор-бензолсульфонил)-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-(2-Метил-пропан-1-сульфонил)-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-(3,3-Диметил-бутирил)-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-Метил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-Этил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-Бутил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-(2,2-Диметил-пропил)-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-(2-хлорфенилсульфонил)-2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-(3,3-диметилбутаноил)-2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.5]декан-1,7-диона; и
8-(3,3-диметилбутаноил)-2-(4-(2,2,2-трифторэтокси)фенил)-2,8-диазаспиро[4.5]декан-1,7-диона.
Следующие конкретные примеры соединений формулы (I) выбраны из
8-(2,2-Диметил-пропил)-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона;
8-(2-хлорфенилсульфонил)-2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.5]декан-1,7-диона; и
8-(3,3-диметилбутаноил)-2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.5]декан-1,7-диона.
Способы получения соединений формулы (I) являются объектом изобретения.
Получение соединений формулы (I) по настоящему изобретению можно осуществлять при последовательном или конвергентном пути синтеза. Синтезы по изобретению представлены на приведенных ниже общих схемах. Навыки, требующиеся для проведения взаимодействия и очистки полученных в результате продуктов, известны специалистам в данной области техники. В случае, когда в процессе взаимодействия получают смеси энантиомеров или диастереоизомеров, эти энантиомеры или диастереоизомеры можно разделить способами, описанными в данной заявке или известными специалистам в данной области техники, такими как, например, хиральная хроматография или кристаллизация. Заместители и индексы, используемые в последующем описании способов, имеют значение, приведенное в данной заявке.
Соединения формулы (I), как описано выше, могут быть легко получены, как изображено на схеме 1, путем нагревания соединений формулы (II) с соединением общей формулы (III) и диметилалюминия хлоридом в растворителе, таком как толуол, при температуре образования флегмы. Реакцию замыкания кольца можно также проводить в диоксане в качестве растворителя и с триметилалюминием в качестве металлорганического соединения. Это преобразование дает возможность получить соединения общей формулы (I).
Альтернативная последовательность для получения соединений общей формулы (I), и, как изображено на схеме 1, состоит в том, что сначала проводят реакцию замыкания кольца на соединениях формулы (IIa) путем взаимодействия их с соединением общей формулы (III) и диметилалюминия хлоридом, как описано выше, с получением соединений общей формулы (Ia), которые затем последовательно функционализируют с получением соединений общей формулы (I). Преобразование соединений общей формулы (Ia) в соединения общей формулы (I) можно осуществить путем взаимодействия соединений общей формулы (IV), где X представляет собой атом галогена, в частности, Cl в случае, когда A представляет собой -C(O)- или -S(O)2-, и йода или брома в случае, когда A представляет собой -(CH2)n-, в растворителе, таком как ТГФ, и с основанием, таким как гидрид натрия или н-бутиллитий, при температуре от -78°C до КТ.
Схема 1
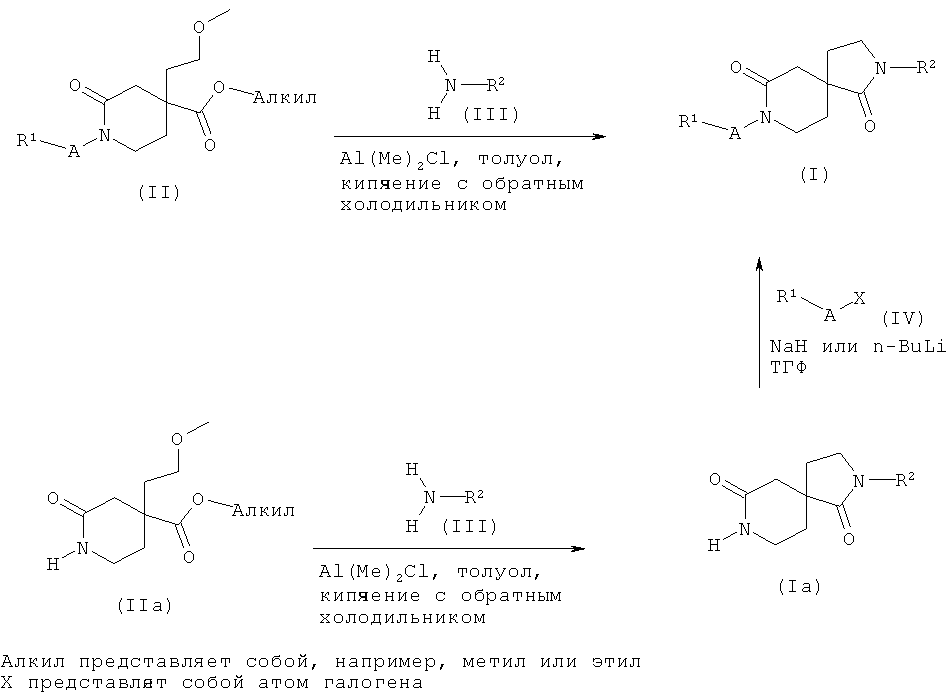
Исходные вещества, которые использованы в схеме 1, могут быть получены из имеющихся в продаже соединений или из соединений, описанных в литературе, применяя общие методы реакций, известные в данной области техники или изображенные на схеме 2.
Таким образом, в результате алкилирования соединения (V), где защитная группа представляет собой, например, Вос, LDA в качестве основания в растворителе, таком как ТГФ, при низкой температуре, такой как -5°C, с 1-бром-2-метоксиэтаном получают соединения формулы (VI). Затем соединения общей формулы (VI) могут быть селективно окислены RuCl3/NaIO4 в этилацетате/воде при КТ с получением соединений общей формулы (VII). Затем в результате последующего удаления защитной группы кислотой, такой как трифторуксусная кислота, в метиленхлориде в случае, когда защитной группой является Вое, получают соединения общей формулы (На). Преобразование соединений формулы (На) в (II) может быть достигнуто подобно тому, как описано выше, путем взаимодействия с соединениями общей формулы (IV), где X представляет собой атом галогена, в частности, Cl в случае, когда A представляет собой -C(O)- или -S(O)2-, и йода или брома в случае, когда A представляет собой -(CH2)n-, в растворителе, таком как ТГФ, и с основанием, таким как гидрид натрия или н-бутиллитий, при температуре от -78°C до КТ.
Схема 2
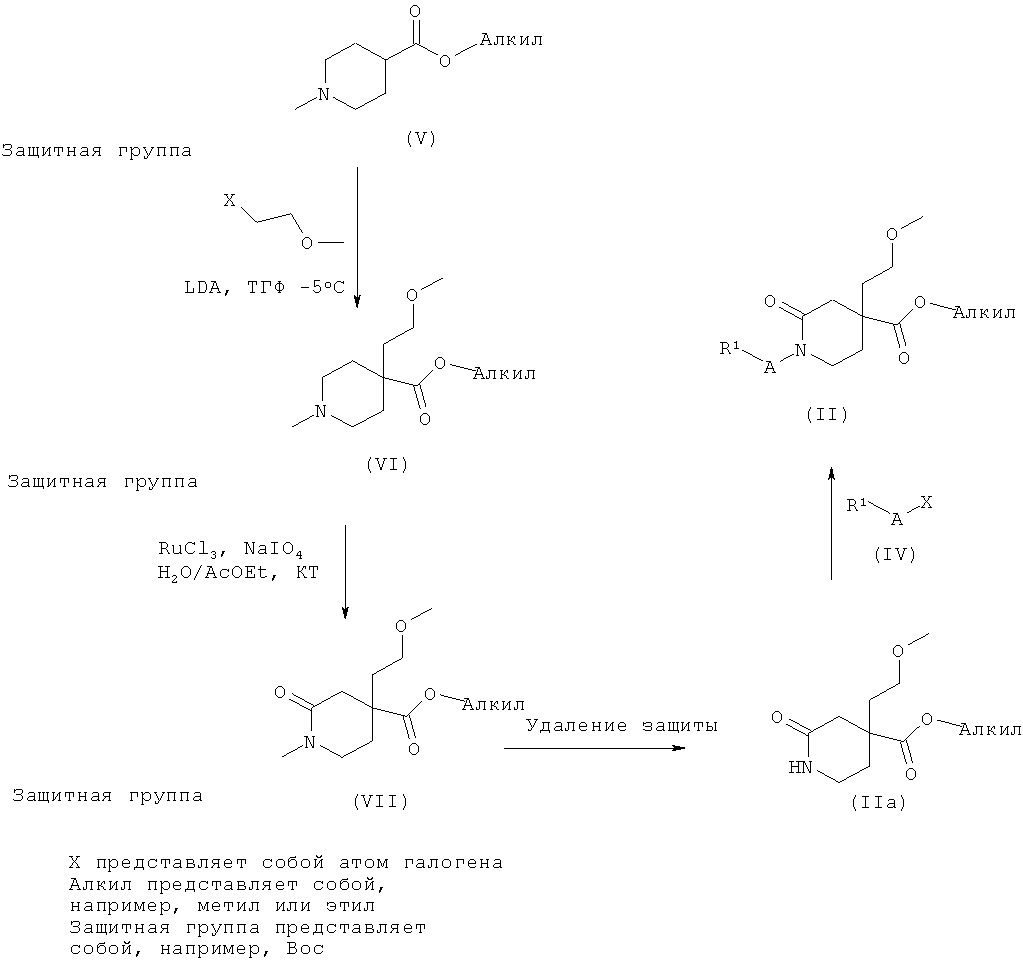
Формой осуществления настоящего изобретения также является способ получения соединения формулы (I), как определено выше

включающий взаимодействие
a) соединения формулы (II) в присутствии соединения формулы (III);
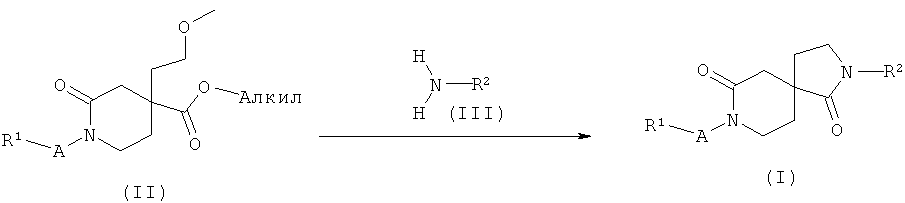
в частности, в присутствии алюминийорганического реагента формулы Al(Алкил)3 или Al(Алкил)2X, в частности, диметилалюминия хлорида или триметилалюминия, в растворителе, в частности, в толуоле, при температуре, составляющей от КТ до образования флегмы растворителя, в частности, при температуре образования флегмы толуола, где R1, R2 и А являются такими, как определено выше, и X представляет собой атом галогена, в частности, хлора; или
b) соединения формулы (Ia) в присутствии соединения формулы (IV);
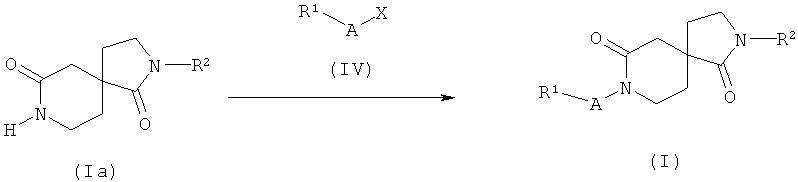
В частности, в присутствии основания, в частности, гидрида натрия или н-бутиллития, в растворителе, в частности, в ТГФ, при температуре, составляющей от -78°C до КТ, где R1, R2 и A являются такими, как определено выше, и X представляет собой атом галогена, в частности, Cl в случае, когда A представляет собой -C(O)- или -S(O)2-, и йода или брома в случае, когда A представляет собой -(CH2)n-.
Конкретные промежуточные соединения выбраны из
4-(2-Метокси-этил)-пиперидин-1,4-дикарбоновой кислоты 1-трет-бутиловый эфир 4-этиловый эфир;
4-(2-Метокси-этил)-2-оксо-пиперидин-1,4-дикарбоновой кислоты 1-трет-бутиловый эфир 4-этиловый эфир;
4-(2-Метокси-этил)-2-оксо-пиперидин-4-карбоновой кислоты этиловый эфир;
2-(4-Трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион;
4-(2-Метокси-этил)-2-оксо-1-пропил-пиперидин-4-карбоновой кислоты этиловый эфир;
2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.5]декан-1,7-дион; и
2-(4-(2,2,2-трифторэтокси)фенил)-2,8-диазаспиро[4.5]декан-1,7-дион.
Следующий объект настоящего изобретения включает соединение в соответствии с формулой (I), как описано выше, когда оно получено в соответствии с любым из описанных способов.
Объектом настоящего изобретения также являются соединения в соответствии с формулой (I), как описано выше, для применения в качестве терапевтически активного вещества.
Объектом настоящего изобретения также являются фармацевтические композиции, содержащие соединение в соответствии с формулой (I), как описано выше, и терапевтически инертный носитель.
Объектом настоящего изобретения также являются соединения в соответствии с формулой (I), как описано выше, для получения лекарственного средства для лечения или профилактики заболевания, которое вызвано расстройствами, обусловленными, например, ферментом гормончувствительной липазой.
Конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, для получения лекарственного средства для лечения или профилактики диабета, метаболического синдрома, дислипидемии, атеросклероза или ожирения.
Конкретной формой осуществления настоящего изобретения также являются соединения в соответствии с формулой (I), как описано выше, для получения лекарственного средства для лечения или профилактики сердечно-сосудистых заболеваний, дисфункции миокарда, воспаления, неалкогольной жировой болезни печени или неалкогольного стеатогепатита.
Следующей конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, для получения лекарственного средства для лечения или профилактики диабета.
Следующей конкретной формой осуществления настоящего изобретения также являются соединения в соответствии с формулой (I), как описано выше, для получения лекарственного средства для лечения или профилактики диабета типа II.
Настоящее изобретение также относится к применению соединения в соответствии с формулой (I), как описано выше, для получения лекарственного средства для лечения или профилактики диабета, метаболического синдрома, дислипидемии, атеросклероза или ожирения.
Формой осуществления настоящего изобретения также является применение соединения в соответствии с формулой (I), как описано выше, для получения лекарственного средства для лечения или профилактики сердечно-сосудистых заболеваний, дисфункции миокарда, воспаления, неалкогольной жировой болезни печени или неалкогольного стеатогепатита.
Конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, для получения лекарственного средства для лечения или профилактики диабета.
Следующей конкретной формой осуществления настоящего изобретения являются соединения в соответствии с формулой (I), как описано выше, для получения лекарственного средства для лечения или профилактики диабета типа II.
Объектом изобретения также является способ лечения или профилактики диабета, метаболического синдрома, дислипидемии, атеросклероза или ожирения, который включает введение эффективного количества соединения в соответствии с формулой (I), как описано выше.
Формой осуществления настоящего изобретения является способ лечения или профилактики сердечно-сосудистых заболеваний, дисфункции миокарда, воспаления, неалкогольной жировой болезни печени или неалкогольного стеатогепатита, который включает введение эффективного количества соединения в соответствии с формулой (I), как описано выше.
Конкретной формой осуществления настоящего изобретения является способ лечения или профилактики диабета, который включает введение эффективного количества соединения в соответствии с формулой (I), как описано выше.
Следующей конкретной формой осуществления настоящего изобретения является способ лечения или профилактики диабета типа II, который включает введение эффективного количества соединения в соответствии с формулой (I), как описано выше.
Методы анализа
Продуцирование полноразмерной гормончувствительной липазы-His6 человека:
1) Клонирование: кДНК была получена с РНК имеющейся в продаже полиA + РНК головного мозга человека и использована в качестве матрицы при перекрывающейся ПЦР с образованием полноразмерной OPC HSL человека с меткой 3'-His6. Эту полноразмерную вставку клонировали в векторе pFast-BAC, и проверяли последовательность ДНК нескольких отдельных клонов. ДНК из правильного полноразмерного клона с меткой 3'His6 использовали для трансформации штамма E.coli DH10BAC. Полученную в результате бакмидную ДНК использовали для получения концентрированного раствора титруемого бакуловируса для получения белка. Последовательность кодируемой HSL соответствует базе данных Swissprot, номер доступа Q05469, с дополнительной C-концевой His6-меткой.
2) Очистка белка: культура: 5,5 л, клетки High 5, экспрессирующие полноразмерную HSL-His6 человека, 48 ч, содержащая 25 мкМ E-64. Подсчет клеток: 1,78×1010 клеток/мл, 90% жизнеспособных.
Клетки оттаивали. На льду клетки суспендировали в буфере Base Buffer, содержащем 10% глицерина, 25 мМ Трис-Cl, 300 мМ NaCl, 10 мМ имидазола, 10 мМ 2-меркаптоэтанола, 2 мкг пепстатина/мл, 2 мкг лейпептина/мл, 2 мкг антипаина/мл, pH 8,0 при 4°C в конечном объеме 475 мл при 3,75×107 клеток/мл. Осветление проводили при 3×30 сек, Lubrol РХ добавляли до 0,2% конечной концентрации с последующим перемешиванием в течение 15 мин при 4°C и центрифугированием при 25k×g, 60 мин, 4°C. Растворимые белки смешивали с 60 мл предварительно промытой и уравновешенной Ni-NTA агарозой (Qiagen 30210) с последующим переворачиванием вверх-вниз в течение 45 мин, 4°C, центрифугированием 1000 об/мин 5 мин, и давали возможность смоле осесть в течение 5 мин. Супернатант удаляли, смолу промывали в центрифужном сосуде, используя 5 объемов Base Buffer, содержащего 0,2% Lubrol PX. Центрифугирование проводили снова, затем супернатант отбрасывали. Смолу наливали на 0,8 мкм мембрану в одноразовом устройстве для фильтрования (Nalge 450-0080) и промывали 5 объемами Base Buffer, содержащего 0,2% Lubrol PX. Затем ее промывали 30 объемами Base Buffer, содержащего 60 мМ имидазола, pH 7,5 при 4°C. Белок элюировали 5 объемами 25 мМ Трис-Cl, 300 мМ NaCl, 200 мМ имидазола, 10 мМ 2-меркаптоэтанола, pH 7,5 при 4°C путем переворачивания смолы с буфером вверх-вниз, 30 мин, 4°C. Смолу иммобилизовали на 0,2 мкм мембране одноразового фильтровального устройства (Millipore SCGP U02 RE), и элюат собирали в резервуаре. Элюат концентрировали, используя центрифужное фильтровальное устройство 30k MWCO (Sartorius Vivascience Vivacell 100, VC1022), до 20 мл. Затем его подвергали диализу в течение ночи при 4°C, два раза против 2 л 10% глицерина, 25 мМ Трис-Cl, 300 мМ NaCl, 0,2 мМ ЭДТА, 0,2 мМ ДТТ, pH 7,5 при 4°C. Белок фильтровали, используя 0,22 мкм одноразовое фильтровальное устройство (Millipore SCGP00525). Концентрацию белка вычисляли на основании поглощения при 280 нм, используя 280=0,67 см-1 мг-1. Выход составлял 235 мг суммарно. Белок хранили при -80°C.
Анализ ингибирования фермента гормончувствительной липазы (HSL) человека.
Активность фермента HSL измеряли с помощью колориметрического анализа, используя 2,3-димеркапто-1-пропанола трибутират (Aldrich, St. Louis, MO) в качестве субстрата. Обычно 1,5 мМ 2,3-димеркапто-1-пропанола трибутирата (DMPT) в 100 мМ MOPS, pH 7,2, 0,2 мг/мл БСА без жирных кислот, готовили путем соникации при 4°C до гомогенной суспензии. Тестируемые соединения (2 мМ концентрированный раствор в ДМСО) серийно разводили в 3 раза в ДМСО. Растворы соединений разводили в 24 раза в растворе, содержащем 1,5 мМ DMPT, и 18 мкл на лунку добавляли в 384-луночные микропланшеты (Corning Costar). Добавляли двенадцать микролитров на лунку HSL человека (15 мкг/мл), и реакционную смесь инкубировали при 37°C в течение 20 минут. Добавляли шесть микролитров раствора 12 мМ дитио-бис-(2-нитробензойная кислота) (DTNB) в ДМСО, 1,2% ДСН и 0,6% Тритон X-100, и смесь инкубировали при комнатной температуре в течение 15 минут. Мониторинг образования продукта проводили путем считывания поглощения при 405 нм на считывающем устройстве Envision Reader (PerkinElmer Life and Analytical Sciences, Shelton, CT).
Клеточный анализ.
Приведенный ниже анализ использовали для измерения эффекта соединений по ингибированию липолиза в интактных клетках (адипоцитах).
Клетки-предшественники адипоцитов 3T3-L1 высевали в 96-луночные планшеты при плотности 20000 клеток/лунка в 200 мкл ростовой среды (DMEM / 10% сыворотка теленка/ 1х антибиотик - противогрибковый агент) до конфлюэнтности. Через 48 часов после конфлюэнтности среду удаляли, и клетки дифференцировали до адипоцитов средой дифференциации (DMEM/10% ФБС/1х антибиотик - противогрибковый агент с добавлением: ингибитора фосфодиэстераз 1 мкМ IBMX (3-изобутил-1-метилксантин), 1 мкМ дексаметазона, 1 мкМ розиглитазона, 10 мкг/мл инсулина). Клетки инкубировали в указанной среде в течение 3 суток, а затем среду заменяли на среду после дифференциации (DMEM/ 10% ФБС с добавлением: 10 мкг/мл инсулина), и клетки инкубировали дополнительно в течение 3 суток. Затем среду заменяли на поддерживающую среду (DMEM / 10% ФБС). Клетки подпитывали каждые 3 суток поддерживающей средой до использования. Анализ липолиза можно проводить на сутки 9-14 после инициации дифференциации в 96-луночных планшетах.
Анализ липолиза проводили, как описано ниже. Адипоциты промывали 2×200 мкл бикарбонатного буфера Кребса-Рингера с Hepes (KRBH) / 3% БСА. Тестируемые соединения находились при 10 мМ в ДМСО, и их исходно разводили до 5 мМ в ДМСО. Затем их серийно разводили в 5 раз в ДМСО (от 5 мМ до 320 пМ). Затем каждое соединение разводили в 200 раз в KRBH / 3% БСА (0,5% конечного ДМСО). Полученные в результате растворы имели диапазон конечной концентрации от 25 мкМ до 1,6 пМ. Сто пятьдесят мкл разведенных соединений добавляли в каждую лунку (в трех повторах), и клетки предварительно инкубировали 30 мин при 37°C. В лунки добавляли форсколин (конечная концентрация 50 мкМ), и клетки инкубировали в течение 120 минут при 37°C. Сто мкл собирали в новый 96-луночный планшет для анализа глицерина. Количество продуцируемого глицерина определяли, используя набор для определения глицерина (Sigma).
|
Соединения формулы (I) и их фармацевтически приемлемые соли, или их сложные эфиры, как описано выше, имеют значения IC50 от 0,0001 мкМ до 1000 мкМ, конкретные соединения имеют значения IC50 от 0,001 мкМ до 500 мкМ, другие конкретные соединения имеют значения IC50 от 0,001 мкМ до 5 мкМ. Эти результаты получены путем использования вышеописанного анализа ингибирования фермента HSL (мкМ означает микромолярный).
Соединения формулы (I) и их фармацевтически приемлемые соли можно применять в качестве лекарственных средств (например, в форме фармацевтических препаратов). Эти фармацевтические препараты можно вводить внутрь, как, например, перорально (например, в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий), назально (например, в форме назальных спреев) или ректально (например, в форме суппозиториев). Однако введение можно также осуществлять парентерально, как, например, внутримышечно или внутривенно (например, в форме инъекционных растворов).
Соединения формулы (I) и их фармацевтически приемлемые соли можно обрабатывать фармацевтически инертными, неорганическими или органическими адъювантами для получения таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.д. можно использовать, например, в качестве таких адъювантов для таблеток, драже и твердых желатиновых капсул.
Подходящими адъювантами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.д.
Подходящими адъювантами для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д.
Подходящими адъювантами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Подходящими адъювантами для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полутвердые или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, вещества, увеличивающие вязкость, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, корригенты, соли для варьирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать еще другие терапевтически ценные вещества.
В соответствии с изобретением соединения формулы (I) и их фармацевтически приемлемые соли можно применять для лечения или профилактики диабета, метаболического синдрома, дислипидемии, атеросклероза, ожирения, сердечно-сосудистых заболеваний, дисфункции миокарда, воспаления, неалкогольной жировой болезни печени или неалкогольного стеатогепатита. Дозировка может варьировать в широких пределах и будет, конечно, подобрана в соответствии с индивидуальными потребностями в каждом конкретном случае. Как правило, в случае перорального введения суточная дозировка примерно от 0,1 мг до 20 мг на кг массы тела, предпочтительно примерно от 0,5 мг до 4 мг до 20 мг на кг массы тела (например, примерно 300 мг на человека), предпочтительно разделенная на 1-3 индивидуальных дозы, которые могут состоять, например, из одинаковых количеств, будет целесообразной. Однако понятно, что приведенный выше верхний предел может быть превышен, когда это показано.
Далее изобретение проиллюстрировано Примерами, которые не обладают ограничивающим характером.
В случае, когда препаративные примеры получают в виде смеси энантиомеров, чистые энантиомеры можно разделить способами, описанными в данной заявке, или способами, известными специалистам в данной области техники, такими как, например, хиральная хроматография или кристаллизация.
Примеры
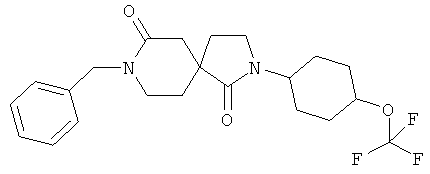
Пример 1: 8-Бензил-2-(4-триФторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
Стадия A): 4-(2-Метокси-этил)-пиперидин-1,4-дикарбоновой кислоты 1-трет-бутиловый эфир 4-этиловый эфир
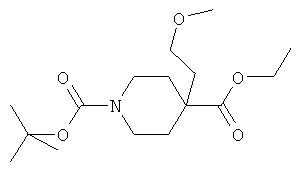
LDA (2 М раствор в ТГФ/гептане/этилбензоле, 24,48 мл, 0,049 моль) добавляли в атмосфере аргона к ТГФ (150 мл) при -5°C, затем добавляли по каплям пиперидин-1,4-дикарбоновой кислоты 1-трет-бутиловый эфир 4-этиловый эфир (6,3 г, 6 мл) в ТГФ (100 мл), и смесь перемешивали в течение 2 часов при 0°C. Затем добавляли 1-бром-2-метокси-этан (6,8 г) при 0°C, и смесь перемешивали в течение ночи при КТ. Растворитель выпаривали, остаток распределяли между AcOEt и водой. Слои разделяли, органический слой промывали рассолом, высушивали над сульфатом натрия, а затем концентрировали с получением 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты 1-трет-бутилового эфира 4-этилового эфира (8 г) в виде коричневого масла, которое было по существу чистым, и использовали в следующей стадии без дополнительной очистки. MC (ИЭР): 216,3 [(M-Boc)H+].
Стадия B): 4-(2-Метокси-этил)-2-оксо-пиперидин-1,4-дикарбоновой кислоты 1-трет-бутиловый эфир 4-этиловый эфир
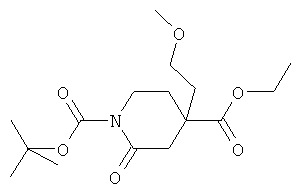
4-(2-Метокси-этил)-пиперидин-1,4-дикарбоновой кислоты 1-трет-бутиловый эфир 4-этиловый эфир (13 г) в AcOEt (300 мл) добавляли при КТ в атмосфере аргона к энергично перемешанному раствору RuCl3×H2O (1,71 г) и NaIO4 (44,078 г) в воде (300 мл). Эту смесь энергично перемешивали 30 минут при КТ. Затем добавляли воду и AcOEt, и слои разделяли. Органический слой промывали водой и рассолом, высушивали над сульфатом магния и концентрировали с получением сырого продукта в виде коричневого масла (8,78 г), который использовали в следующей стадии реакции без дополнительной очистки. МС (ИЭР): 352,17 (M+Na)+ и 230,13 [(M-C5H8O2)H+]
Стадия С): 4-(2-Метокси-этил)-2-оксо-пиперидин-4-карбоновой кислоты этиловый эфир
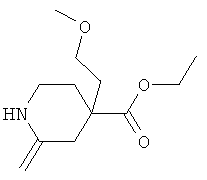
4-(2-Метокси-этил)-2-оксо-пиперидин-1,4-дикарбоновой кислоты 1-трет-бутиловый эфир 4-этиловый эфир (8,7 г), растворенный в дихлорметане (300 мл) в атмосфере аргона, обрабатывали трифторуксусной кислотой (60,32 г, 39,11 мл) и перемешивали в течение 3 часов при КТ. Затем реакционную смесь концентрировали в вакууме, остаток растворяли в AcOEt, который затем промывали 3 М водным NaOH, рассолом, и высушивали над сульфатом магния. Растворитель удаляли в вакууме, и остаток подвергали хроматографии на силикагеле (ацетон/CH2Cl2, градиент от 0 до 10%) с получением желаемого продукта в виде светло-коричневого вязкого масла (1,49 г). МС (ИЭР): 230,13 (MH+).
Стадия D): 2-(4-Трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
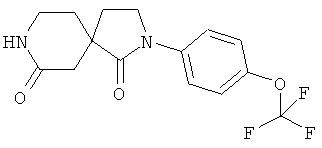
4-(2-Метокси-этил)-2-оксо-пиперидин-4-карбоновой кислоты этиловый эфир (2 г) и 4-(трифторметокси)анилин (3,09 г) растворяли в толуоле (100 мл) в атмосфере аргона при КТ, добавляли диметилалюминия хлорид в гексане (1 молярный, 39,25 мл), и смесь кипятили с обратным холодильником в течение 8 часов. Затем реакционную смесь охлаждали до КТ, разбавляли AcOEt, гасили водой (9 мл), высушивали над MgSO4, фильтровали, и растворитель выпаривали. Остаток адсорбировали на силикагеле и очищали флэш-хроматографией на силикагеле (ацетон/CH2Cl2, градиент от 0 до 40%) с получением 2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона в виде светло-коричневого твердого вещества. МС (ИЭР): 329,1 (MH+).
Стадия Е): 8-Бензил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
К NaH (0,093 г, 55% суспензия в масле), дважды промытому пентаном (по 4 мл каждый раз), добавляли при КТ в атмосфере аргона 2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион (0,093 г) в ТГФ (15 мл), и смесь перемешивали при КТ в течение 20 минут. Затем добавляли бензилбромид (0,073 г) одной порцией, и смесь перемешивали в течение 3 ч при КТ до завершения преобразования согласно масс-спектроскопии. Реакционную смесь гасили 3 М водной HCl (несколько капель), растворитель выпаривали, и остаток адсорбировали на силикагеле и подвергали хроматографии на силикагеле (AcoEt/гептан, градиент от 0 до 50%) с получением желаемого продукта (0,046 г) в виде белого твердого вещества. MC (ИЭР): 419,15(MH+).
Пример 2: 8-Пропил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
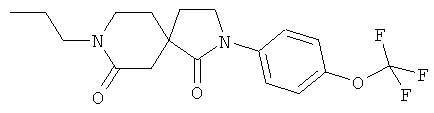
Стадия A): 4-(2-Метокси-этил)-2-оксо-1-пропил-пиперидин-4-карбоновой кислоты этиловый эфир
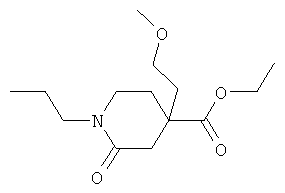
К NaH (0,38 г, 55% суспензия в масле), дважды промытому пентаном (по 6 мл каждый раз), добавляли при КТ в атмосфере аргона 4-(2-метокси-этил)-2-оксо-пиперидин-4-карбоновой кислоты этиловый эфир (0,4 г) в ТГФ (15 мл), и смесь was перемешивали при КТ в течение 5 минут. Затем добавляли 1-бромпропан (1,073 г) одной порцией, и смесь перемешивали в течение ночи при КТ до завершения преобразования согласно масс-спектроскопии. Реакционную смесь гасили 3 М водной HCl (5 капель), а затем реакционную смесь распределяли между AcOEt и водой. Слои разделяли, органический слой промывали рассолом, высушивали над сульфатом магния. Растворитель выпаривали с получением желаемого продукта в виде светло-желтого полутвердого вещества (0,2 г), который использовали непосредственно в следующей стадии без дополнительной очистки. МС (ИЭР): 272,3 (MH+).
Стадия B): 8-Пропил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
4-(2-Метокси-этил)-2-оксо-1-пропил-пиперидин-4-карбоновой кислоты этиловый эфир (0,205 г) и 4-(трифторметокси)анилин (0,268 г) растворяли в толуоле (15 мл) в атмосфере аргона при КТ. Добавляли диметилалюминия хлорид в гексане (1 молярный в гексане, 3,02 мл), и смесь кипятили с обратным холодильником в течение ночи. Затем реакционную смесь охлаждали до КТ, добавляли воду (1 мл), и смесь перемешивали при КТ в течение 15 минут. Растворитель удаляли в вакууме, остаток адсорбировали на силикагеле и очищали флэш-хроматографией на силикагеле (элюенты: AcOEt/CH2Cl2, градиент от 0 до 50%, затем AcOEt/гептан: 70%) с получением желаемого вещества (0,072 г) в виде вязкого светло-желтого масла. МС (ИЭР): 371,2 (MH+).
Пример 3: 8-(2-Хлор-бензолсульфонил)-2-(4-трифторметокси-Фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
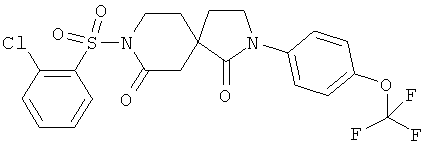
2-(4-Трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион (0,105 г), продукт примера 1, стадия D) растворяли в сухом ТГФ (10 мл), охлаждали до -78°C в атмосфере аргона, обрабатывали по каплям н-бутиллитием (1,6 молярный раствор в гексанах, 0,22 мл), а затем перемешивали в течение 20 минут при -78°C. Затем добавляли по каплям 2-хлорбензолсульфонилхлорид (0,074 г) в ТГФ (2 мл), смесь перемешивали 15 минут при -78°C, охлаждающую баню удаляли, и перемешивание продолжали еще в течение 75 минут, давая возможность температуре реакционной смеси подняться до КТ. Затем реакционную смесь концентрировали в вакууме, остаток адсорбировали на силикагеле и подвергали хроматографии на силикагеле (AcOEt/гептан, градиент от 0 до 30%) с получением желаемого продукта (0,051 г) в виде беловатого твердого вещества. МС (ИЭР): 503,0 (MH+).
Пример 4: 8-(2-Метил-пропан-1-сульфонил)-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
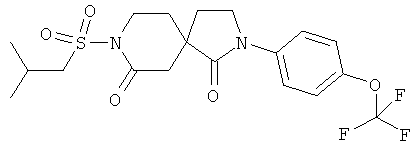
Данное вещество было получено в виде белого твердого вещества по аналогии с примером 3 из 2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона, продукта примера 1, стадия D) и 2-метил-пропан-1-сульфонилхлорида. МС (ИЭР): 466,1 (M+NH4)+.
Пример 5: 8-(3,3-Диметил-бутирил)-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
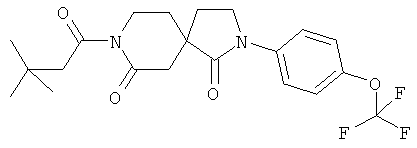
Данное вещество было получено в виде белого твердого вещества по аналогии с примером 3 из 2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона, продукта примера 1, стадия D) и 3,3-диметил-бутирилхлорида. МС (ИЭР): 427,1 (MH+).
Пример 6: 8-Метил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
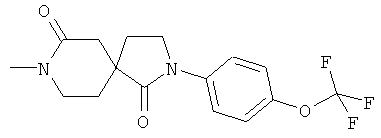
Данное вещество было получено в виде желтого полутвердого вещества по аналогии с примером 1, стадия E) из 2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона и метилиодида. МС (ИЭР): 343,1 (MH+).
Пример 7: 8-Этил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
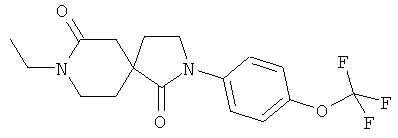
Данное вещество было получено в виде беловатого твердого вещества по аналогии с примером 1, стадия E) из 2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона и этилиодида. МС (ИЭР): 357,1 (MH+).
Пример 8: 8-Бутил-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
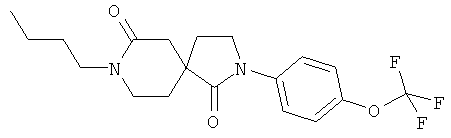
Данное вещество было получено в виде белого твердого вещества по аналогии с примером 1, стадия E) из 2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона и 1-бромбутана. МС (ИЭР): 385,1 (MH+).
Пример 9: 8-(2,2-Диметил-пропил)-2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
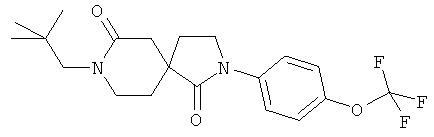
Данное вещество было получено в виде беловатого полутвердого вещества по аналогии с примером 1, стадия E) из 2-(4-трифторметокси-фенил)-2,8-диазаспиро[4.5]декан-1,7-диона и неопентилиодида. MC (ИЭР): 399,1 (MH+).
Пример 10: 8-(2-хлорфенилсульфонил)-2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
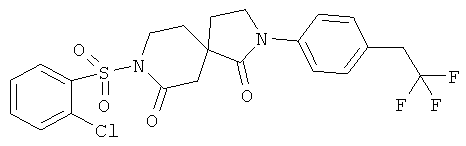
Стадия А): 2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
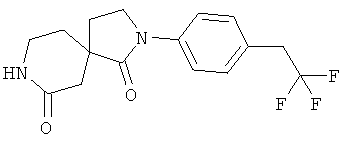
Данное вещество было получено в виде белого твердого вещества (0,72 г) по аналогии с примером 1, стадия D) из 4-(2-метокси-этил)-2-оксо-пиперидин-4-карбоновой кислоты этилового эфира (1,03 г), диметилалюминия хлорида (0,9 М в гексане, 20 мл) и 4-(2,2,2-трифторэтил)анилина (1,2 г). МС (ИЭР): 327,13 (MH+).
Стадия В): 8-(2-хлорфенилсульфонил)-2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
Данное вещество было получено в виде белого твердого вещества по аналогии с примером 3) из 2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.5]декан-1,7-диона и 2-хлорбензолсульфонилхлорида. МС (ИЭР): 501,08 (MH+).
Пример 11: 8-(3,3-диметилбутаноил)-2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.51декан-1,7-дион
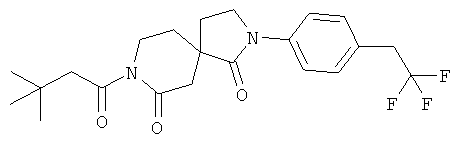
Данное вещество было получено в виде белого твердого вещества по аналогии с примером 3) из 2-(4-(2,2,2-трифторэтил)фенил)-2,8-диазаспиро[4.5]декан-1,7-диона, продукта примера 10, стадия A) и 3,3-диметил-бутирилхлорида. МС (ИЭР): 425,2 (MH+).
Пример 12: 8-(3,3-диметилбутаноил)-2-(4-(2,2,2-триФторэтокси)фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
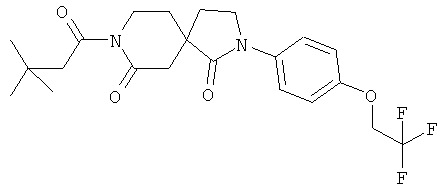
Стадия А): 2-(4-(2,2,2-трифторэтокси)фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
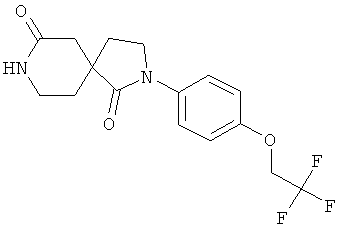
Данное вещество было получено в виде светло-коричневого твердого вещества (0,685 г) по аналогии с примером 1, стадия D) из 4-(2-метокси-этил)-2-оксо-пиперидин-4-карбоновой кислоты этилового эфира (1 г), диметилалюминия хлорида (1 M в гексане, 17,4 мл) и 4-(2,2,2-трифтор-этокси)-фениламина (1,25 г). МС (ИЭР): 343,12 (MH+).
Стадия B) 8-(3,3-диметилбутаноил)-2-(4-(2,2,2-трифторэтокси)фенил)-2,8-диазаспиро[4.5]декан-1,7-дион
Данное вещество было получено в виде белого твердого вещества по аналогии с примером 3) из 2-(4-(2,2,2-трифторэтокси)фенил)-2,8-диазаспиро[4.5]декан-1,7-диона и 3,3-диметил-бутирилхлорида. МС (ИЭР): 441,19 (MH+).
Пример А
Соединение формулы (I) можно применять способом, который как таковой известен в качестве активного ингредиента для получения таблеток приведенной ниже композиции:
|
Пример В
Соединение формулы (I) можно применять способом, который как таковой известен в качестве активного ингредиента для получения капсул приведенной ниже композиции:
|