Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ ФЕНАНТРЕН-9-КАРБОНОВОЙ КИСЛОТЫ
Вид РИД
Изобретение
Изобретение относится к области органического синтеза, в частности к способу получения алкиловых эфиров фенантрен-9-карбоновой кислоты
Фенантреновый фрагмент входит в состав фенантреноиндолизидиновых алкалоидов (тилофорин, тилокребин, антофин, диэтокситилопрофин) [l. Gellert E., Pelletier S.W.// Ed.: Academic Press: New York, 1987, 55-132], известных своей высокой цитотоксичной активностью [2. Suffness M., Cordell G.A. Brossi, A.//Ed.: Academic Press: New York, 1987, 3-355; 3. Gellert E., Rudzats R.//J. Med. Chem. 1964, 15,361; 4. Pettit G.R., Goswami A., Cragg G.M., Schmidt J.M, Zou J.C., J. Nat. Prod. 1984, 47, 913; 5. Rao K.V., Wilson R.A,//Cummings, J. Pharm. Sci., 1971, 60, 1725; 6. Banwell M.G., Bezos A., Burns C., Kruszelnicki I., Parish C.R., Su S., Sydnes M.O.//Bioorg. Med. Chem., 2006, 16, 181; 7. Wei L., Brossi A., Kendall R., Bastow K.F., Morris-Natscheke L.S., Shi Q., Lee K-H.// Bioorg. Med. Chem., 2006, 14, 6560; 8. Wei L., Shi Q., Bastow K.F., Brossi A., Morris-Natscheke L.S., Nakagawa-Goto K., Wu T-S., Pan S-L., Teng C-M., Lee K-H.//J. Med. Chem., 2007, 50(15), 3674; 9. Yang X., Shi Q., Liu Y-N., Zhao G., Bastow K.F., Lin J-C., Yang S-C, Yang P. - C, Lee K-H.// J. Med. Chem., 2009, 52(16), 5262].
Фенантрен-9-карбоновая кислота и ее метиловый эфир служат исходными соединениями в синтезе антималярийных препаратов [10. Colwell W.T., Brown V., Christie P., Lange J., Reece C., Yamamoto K., Henry D.W.// J. Med. Chem. 1972, 15(7), 771] и соединений, проявляющих высокую активность против вируса табачной мозаики [11. Wang К., Liu Y., Liu Y., Mi N., Fan Z., Liu Y., Wang Q. J. //Agric Food Chem. 2010, 58, 12337].
На основе производных фенантрена созданы фотопроводящие и электролюминесцентные материалы [12. Lewis F.D., Burch E.L.// J. Photochem. Photobiol A: Chem 1996, 96, 19; 13. Lewis F.D., Barancyk S.V., Burch E.L.// J. Am. Chem. Soc, 1992, 114, 3866; 14. Lewis F.D., Burch E.L., J. Phys.// Chem. 1996, 100, 4055; 15. Machado A.M., Munano M., Martis T.D., Davila L.Y., Giro R., Caldas M.J., Atvars T.D.Z., //Akcelrud L.C. Macromolecules, 2006, 39, 3398; 16. Liu R., Farinha J.P.S., Winnik M.A. //Macromolecules, 1999, 32, 3957].
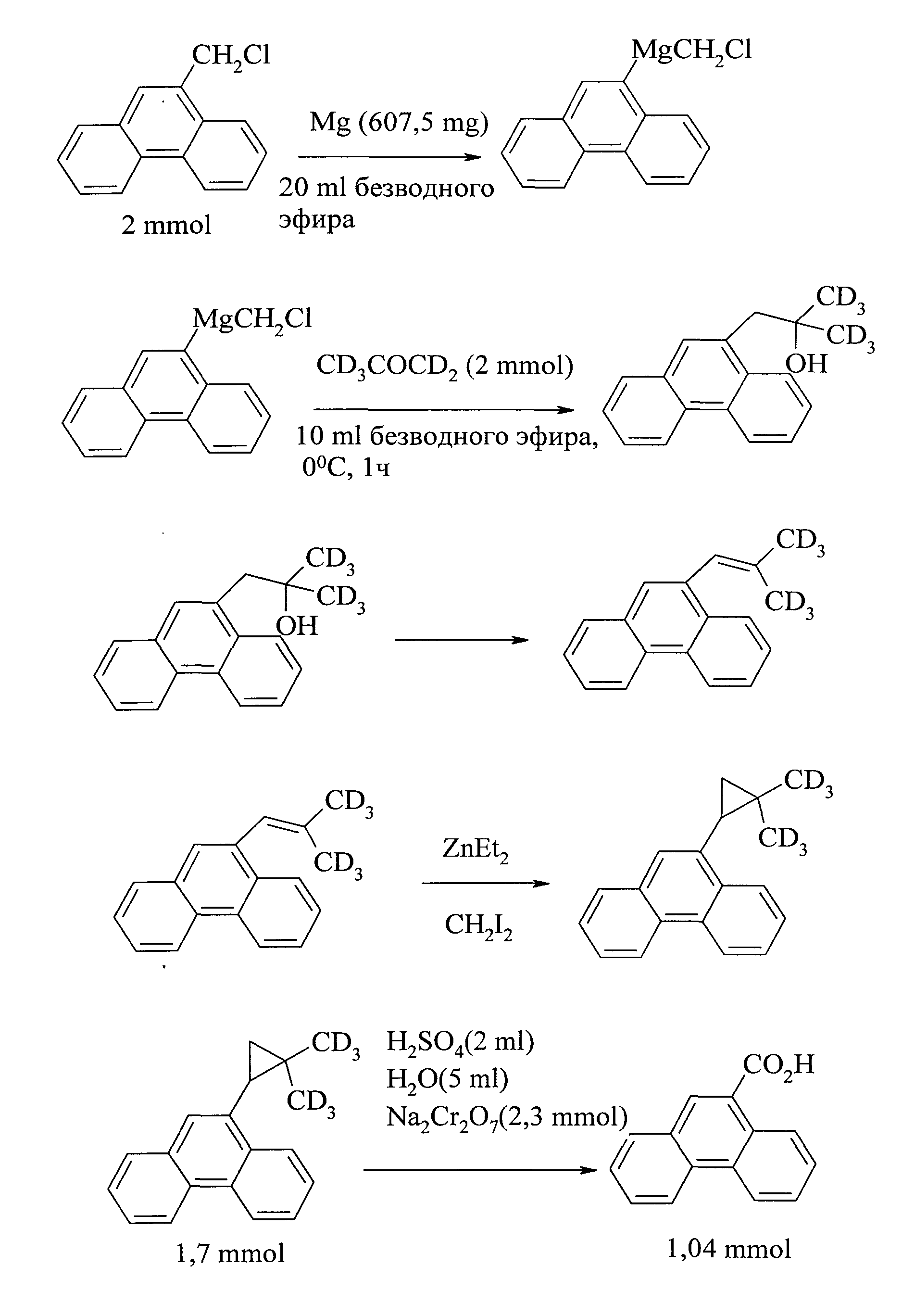
В работе [17. Wu G., Ma Y., Li Z, Xu J. // Huaxue Xuebao (1987), 45(9), 875] фенантрен-9-карбоновая кислота получена из 9-хлорметилфенантрена. Процесс многостадийный, сначала из 9-хлорметилфенантрена синтезируют магнийорганическое соединение, затем взаимодействием последнего с дейтерированным ацетоном получают 1,1-диметил-Д-2-(9-фенантрил)этанол. Дегидратацией указанного спирта и последующей реакцией с CH2I2 был получен 1,1-диметил-Д-2-(9-фенантрил)циклопропан, окисление которого приводит к фенантрен-9-карбоновой кислоте с выходом 60%.
Недостатки метода
1. Применение труднодоступных реагентов - 9-9-хлорметилфенантрена, дейтероацетона, йодистого метила.
2. Многостадийность процесса.
3. Использование токсичного, неорганического окислителя - бихромата натрия и серной кислоты - приводит к образованию большого количества отходов.
Для получения метилового эфира 9-фенантренкарбоновой кислоты 9-фенантренкарбоновую кислоту обрабатывают с помощью диазометана [18. Dixon J.A., Neiswender D.D.// J. Org. Chem. 1960, 25, 499].
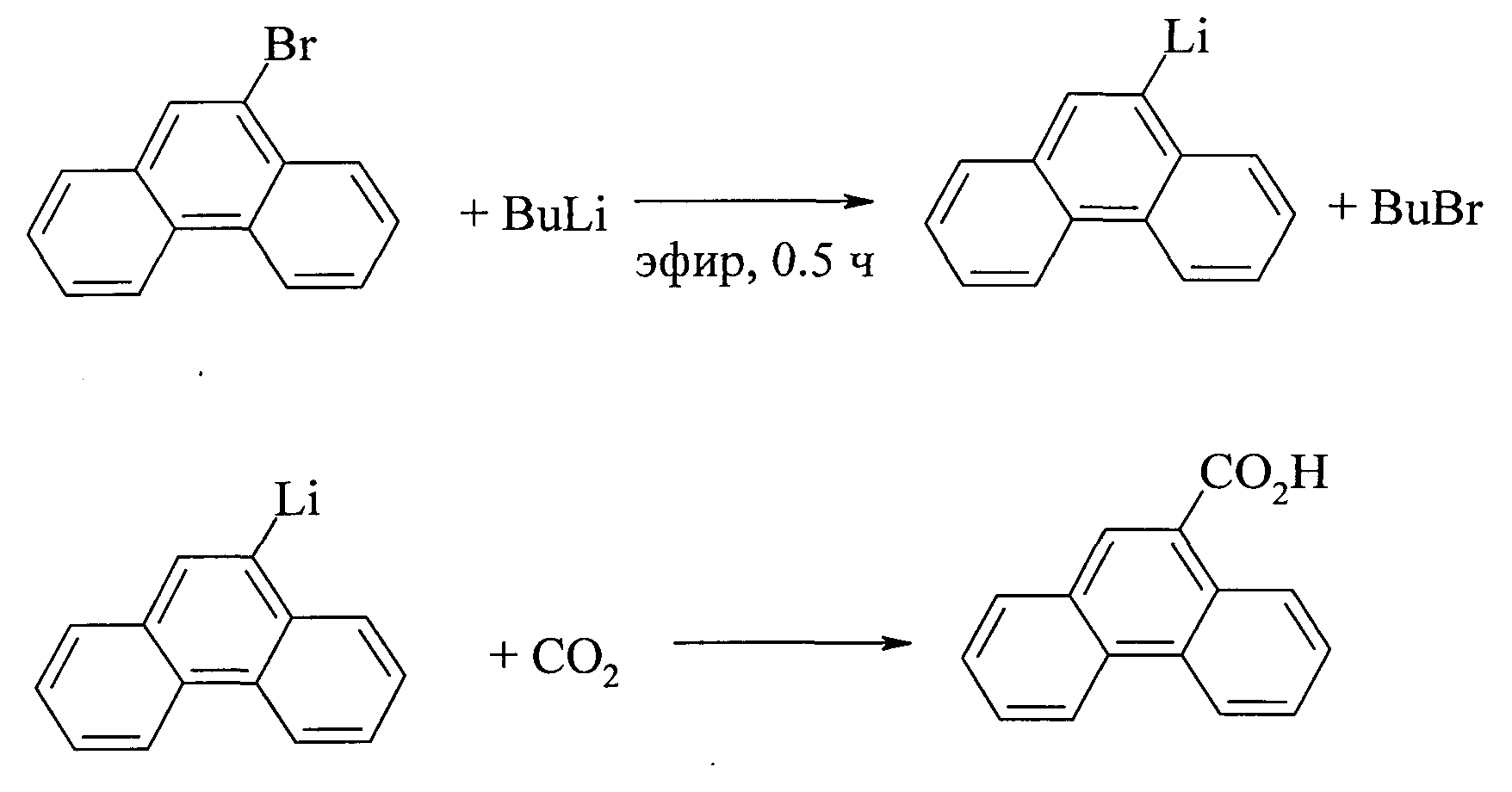
В другом методе синтеза фенантрен-9-карбоновой кислоты исходным соединением служит 9-бромфенантрен. Реакцию проводят в две стадии. На первой стадии металлированием в среде эфира получают 9-литиевое производное фенантрена, карбоксилирование которого «сухим льдом» приводит к образованию фенантрен-9-карбоновой кислоты с выходом 65% [19. CN 101016243 А 20070815 (2007)].
Недостатки метода
1. Способ является многостадийным, т.к. вначале необходимо синтезировать исходное соединение 9-бромфенантрен.
2. Необходимость проведения реакции в условиях, исключающих попадание воды в аппаратуру и реагенты.
3. Пожароопасность процесса из-за использования металлического лития и серного эфира на стадии получения 9-литиевого производного фенантрена.
В работе [20.Mueller P., Bernardinelli G., Pautex N. // Tetrahedron Lett., 1988, 29(46), 5877] синтез фенантрен-9-карбоновой осуществлен в 4 стадии, а исходным соединением служил 9-бромфенантрен. На первой стадии взаимодействием 9-бромфенантрена с магнием получали реактив Гриньяра, который при обработке диметилсульфидом превращается в 9-тиометиловый эфир фенантрена. Последний при взаимодействии с хлоркарбеном, хлороформом и этанолом дает 2.2.2-трихлор-1.1-диэтоксиэтил-9-фенантрен, кислотный гидролиз которого приводит к фенантрен-9-карбоновой кислоте с выходом ~ 25%.
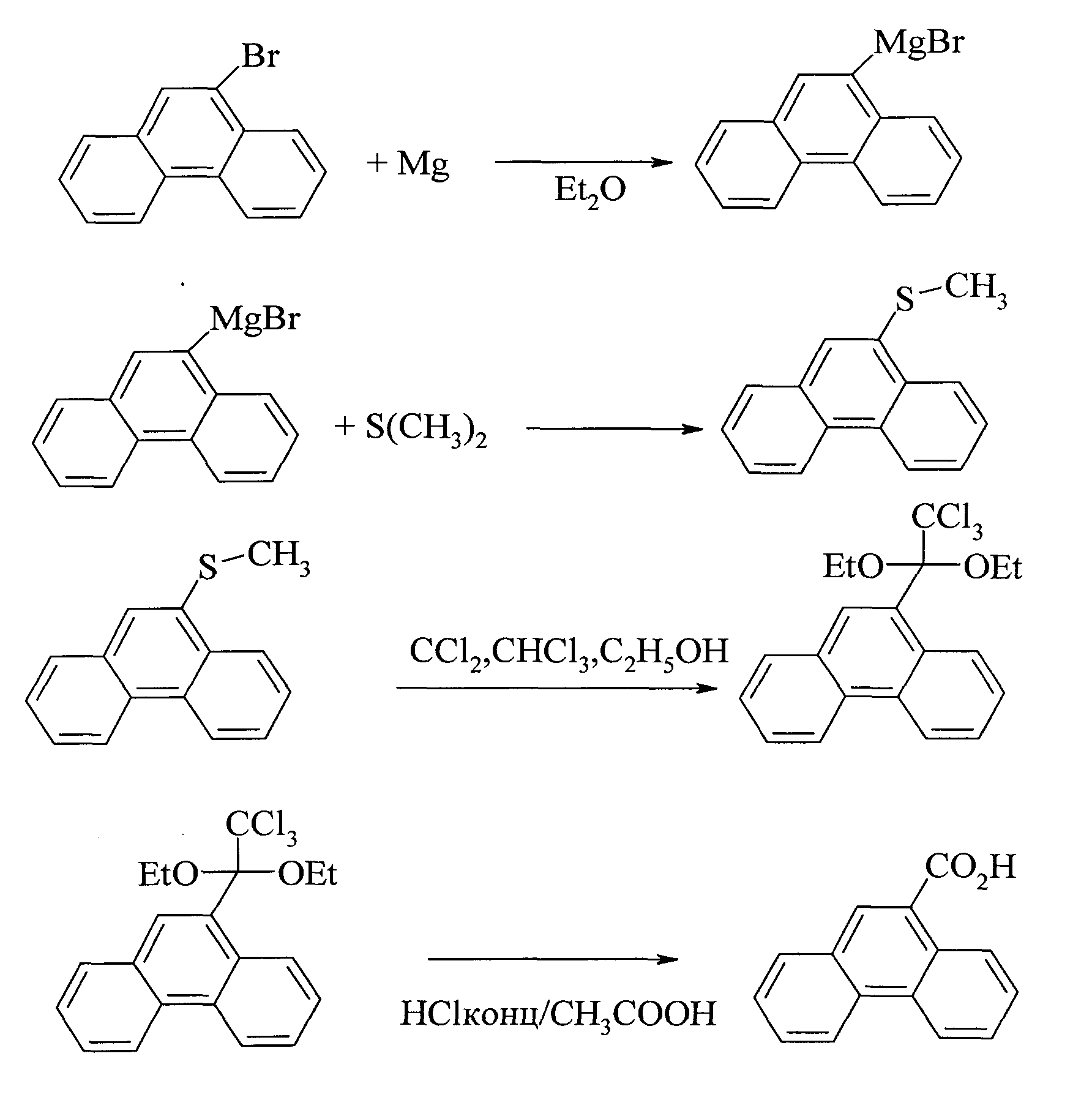
Недостатки метода
1. Многостадийность процесса
2. Пожароопасность первой стадии из-за использования в качестве растворителя серного эфира.
3. Низкий выход конечного продукта (25%).
4. Использование токсичного и легкокипящего диметилсульфида и агрессивных реагентов: НСl (конц.), уксусной кислоты.
5. Применение в качестве реагента вещества, являющегося прекурсором (хлороформ).
В работе [21.Ford L., Atefi F., Singer R., Scammells P. // Eur. J. Org. Chem., 2011, (5), 942] фенантрен-9-карбоновая кислота синтезирована взаимодействием соответствующего 9-формилфенантрена с реактивом Гриньяра в безводном серном эфире в присутствии пиридиновых ионных жидкостей в качестве катализатора. Выход фенантрен-9-карбоновой кислоты по данному способу составил 26%.
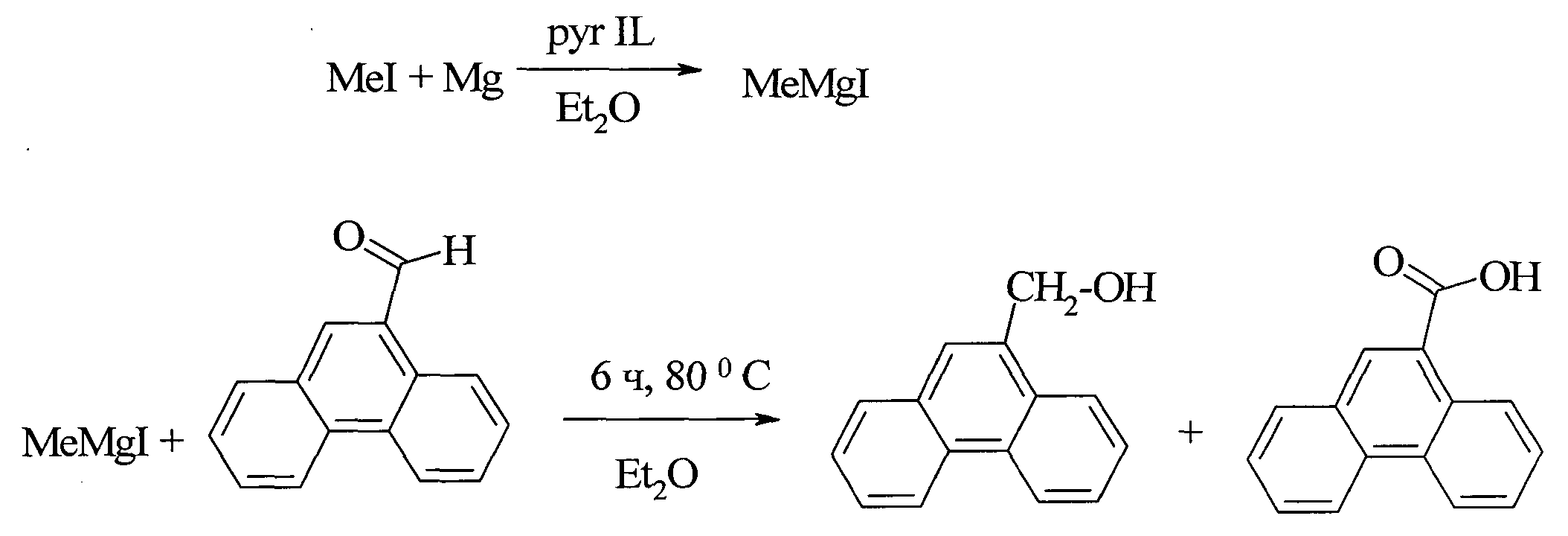
Недостатки метода
1. Применение труднодоступных исходных реагентов: 9-формилфенантрена, метилиодида и ионных жидкостей.
2. Взрыво- и пожароопасность процесса из-за необходимости использования серного эфира при получении реактивов Гриньяра.
3. Низкий выход целевого продукта.
Особый интерес представляют методы получения фенантрен-9-карбоновой кислоты непосредственно из фенантрена в одну стадию с высоким выходом.
Так, фенантрен-9-карбоновую кислоту с выходом 34% получают карбоксилированием фенантрена в присутствии кислоты Льюиса - безводного бромида АlВr3. Реакция проходит в следующих условиях: 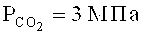 , 40°С, 24 ч, фенантрен, АlВr3 (2 экв.) [22. Suzuki Y., Hattori Т., Okuzawa Т., Miyano S. // Chem. Lett. 2002, 102]. При использовании в качестве промотора трифенилтрихлорсилана (Ph3SiCl) удается снизить температуру до 25°C, а продолжительность реакции сократить до 3 ч. Выход 9-фенантренкарбоновой кислоты зависит от природы растворителя. Лучшими растворителями являются хлор- и фторбензолы. [23. Nemoto К., Yoshida H., Egusa N., Morohashi N., Hattori T. // J. Org. Chem., 2010, 75(22), 7855].
, 40°С, 24 ч, фенантрен, АlВr3 (2 экв.) [22. Suzuki Y., Hattori Т., Okuzawa Т., Miyano S. // Chem. Lett. 2002, 102]. При использовании в качестве промотора трифенилтрихлорсилана (Ph3SiCl) удается снизить температуру до 25°C, а продолжительность реакции сократить до 3 ч. Выход 9-фенантренкарбоновой кислоты зависит от природы растворителя. Лучшими растворителями являются хлор- и фторбензолы. [23. Nemoto К., Yoshida H., Egusa N., Morohashi N., Hattori T. // J. Org. Chem., 2010, 75(22), 7855].
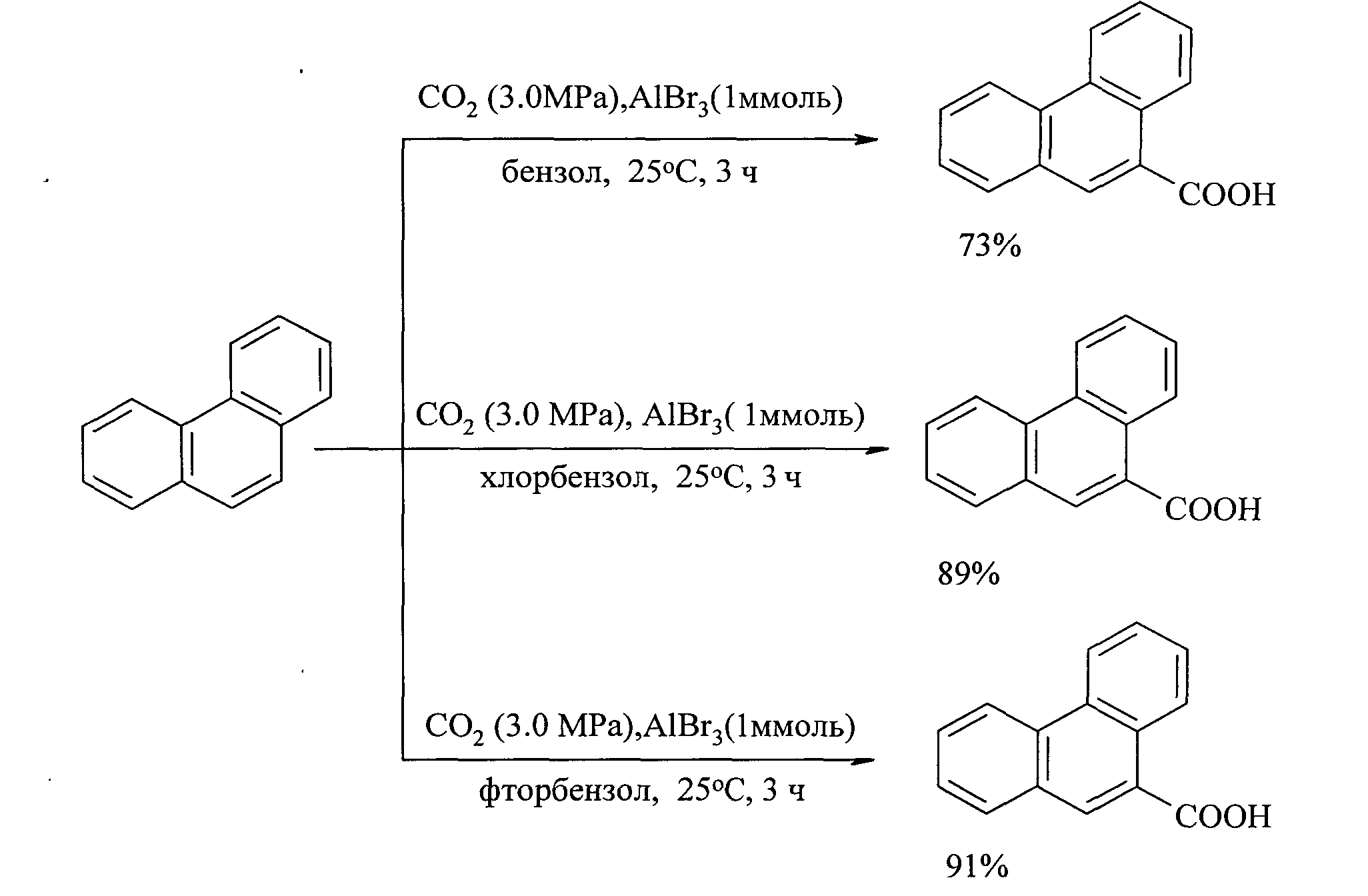
Недостатки метода:
1. Необходимость проведения реакции в условиях, исключающих попадание влаги (воды) в реактор и реагенты из-за использования в качестве катализатора безводного АlВr3.
2. Использование газообразного диоксида углерода требует применения специальной аппаратуры, работающей под давлением.
3. Применение дорогостоящих растворителей (фторбензол).
Авторами предлагается способ получения алкиловых эфиров фенантрен-9-карбоновой кислоты, не имеющий вышеперечисленных недостатков.
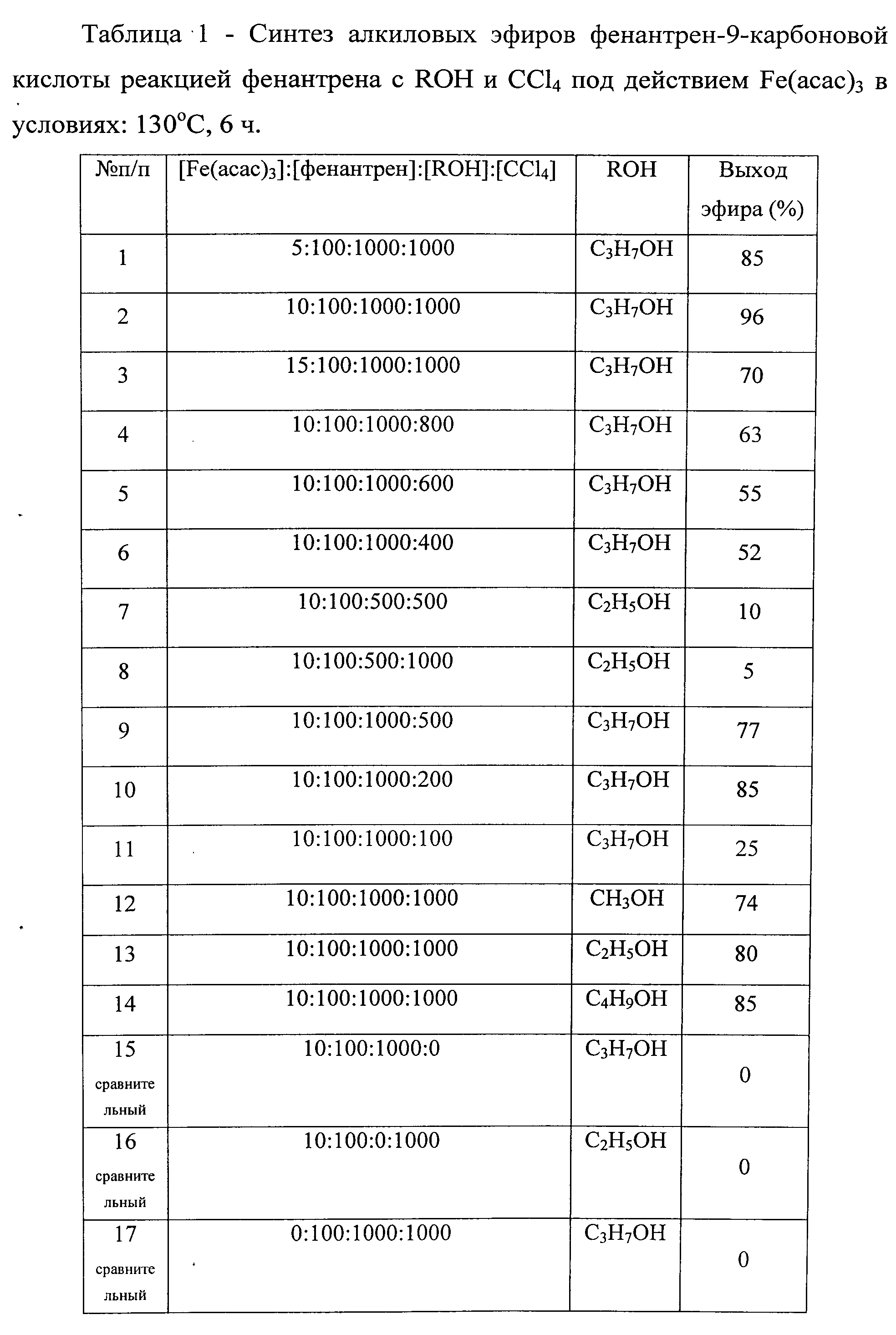
Сущность способа заключается во взаимодействии фенантрена с четыреххлористым углеродом и алифатическими спиртами: метанолом, этанолом, н-пропанолом и н-бутанолом в присутствии катализатора ацетилацетоната железа при температуре 130°С в течение 4-6 ч при следующих мольных соотношениях катализатора и реагентов: [Fе(асас)3]:[фенантрен]:[ССl4]:[спирт]=5-15:100:500-1000:100-1000. В условиях: [Fе(асас)3]:[фенантрен]:[ССl4]:[спирт]=10:100:1000:1000, 130°С, 6 ч выходы алкиловых эфиров фенантрен-9-карбоновой кислоты составляют 74%-96%. Синтез проводят в атмосфере аргона.
В отсутствие любого из компонентов: катализатора, ацетилацетона, ССЦ или спирта, реакция не проходит.
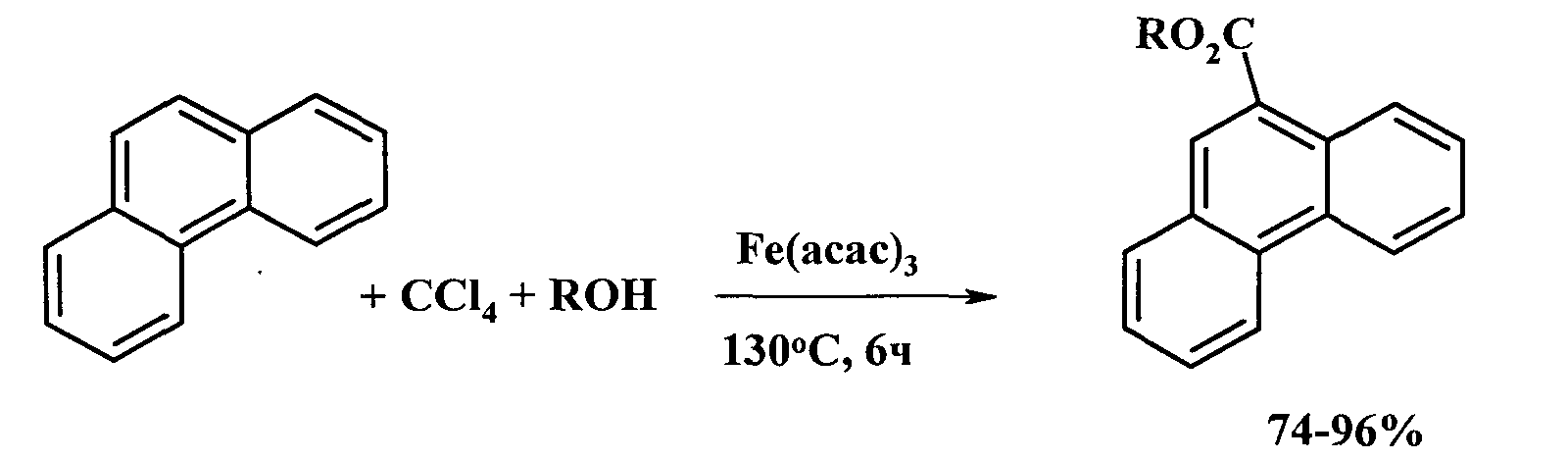
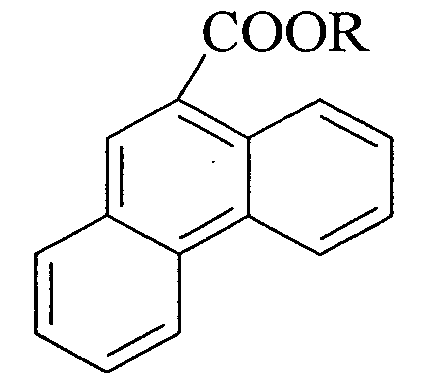
R=СН3, C2H5, n-С3Н7, n-С4Н9
Побочными продуктами реакции являются НСl, RCl и гомоэфир спирта, взятого в реакцию (ROR).
Существенные отличия предлагаемого способа от прототипа
1. Синтез алкиловых эфиров фенантрен-9-карбоновой кислоты осуществляют из фенантрена в одну стадию.
2. Для получения алкиловых эфиров фенантрен-9-карбоновой кислоты из фенантрена используют систему Fе(асас)3- CCl4-ROH.
Преимущества предлагаемого метода
1. Высокий выход целевого продукта (96% для н-пропилового эфира фенантрен-9-карбоновой кислоты).
2. Селективность процесса.
3. Отсутствие агрессивных окислителей.
4. Доступность и дешевизна исходных реагентов и катализатора.
5. Удешевление себестоимости и упрощение технологии в целом за счет уменьшения энерго- и трудозатрат из-за одностадийности процесса.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. Реакции проводили в стеклянной ампуле объемом 10 мл, помещенной в микроавтоклав из нержавеющей стали объемом 17 мл, при постоянном перемешивании и регулируемом нагреве.
В ампулу в токе аргона загружали 21,2 мг (1 ммоль) Fе(асас)3, 106 мг (10 ммоль) фенантрена, 0,575 мл (100 ммоль) четыреххлористого углерода и 0,447 (100 ммоль) спирта. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 130°С в течение 6 ч при постоянном перемешивании. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу фильтровали через бумажный фильтр, кипятили с углем. Растворитель отгоняли. Целевой эфир отделяли от непрорегировавшего фенантрена при помощи колоночной хроматографии на силикагеле, элюируя смесью петролейный эфир:этилацетат = 5:1 (колонка l=21 cm, d=1.2 cm), (фенантрен элюируется раньше, чем алкиловый эфир 9-фенантренкарбоновой кислоты).
Строение полученных соединений доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и Справочными данными.
Метиловый эфир фенантрен-9-карбоновой кислоты: 74%, Т пл. 116°С (Тпл 115-116°С [24. Sakuragi H. Tokumaru К., Itoh H., Terakawa К., Kikuchi К., Caldwell R.A., Hsu C.C. //Bull. Chem. Soc. Jpn. 1990, 63, 1049; 25. Bull. Chem. Soc. Jpn. 1993, 66, 224]). Спектр ЯМР 1Н (400 МГц, СDСl3, δ, м.д.): 7.98 (d, 1Н, С1H, J=8 Гц), 7.66 (t, 1H, C2H J=S Гц), 7.77 (t, 1H, C3H J=8 Гц), 8.71 (d, 1H, С4H J=8 Гц), 8.76 (m, 1H, C5H), 7.72 (m, 1H, C6H), 7,72 (m, 1H, C7H), 8.95 (m, 1H, C8H), 8.50 (s, 1H, C10H), 4.08 (s, 3Н, СН3). Спектр ЯМР 13С (100 МГц, СDСl3,δ,м.д.): 129.95 (C1), 128.93 (С2), 127.04 (С3), 122.66 (С4), 130.08 (С4a), 130.70 (С4b), 122.83 (С5), 127.43 (С6), 126.92 (С7), 126.83 (С8), 126.20 (С8a), 132.18 (С9), 132.43 (С10), 129.04 (С10a), 168.09 (COO), 52.29 (СН3). MS (El, 70 eV) m/z (%): 236 [М]+100), 205 (90), 177(65), 151 (15), 88 (45).
Этиловый эфир фенантрен-9-карбоновой кислоты: 80%, Т пл. 59-61°С (Тпл 61°С [26. Bestmann H.J., Häberiein H., Eisele W. // Chem. Ber. 1966, 99(1), 28-34]). Спектр ЯМР 1Н (500 МГц, СDСl3, δ, м.д.): 7.98 (d, 1H, С1H, J=8 Гц), 7.65 (t, 1H, С2H J=8 Гц), 7.73 (t, 1H, C3H J=8 Гц), 8.68 (d, 1H, C4H, J=S Гц), 8.74 (m, 1H, C5H), 7.74 (m, 1H, C6H), 7.74 (m, 1H, C7H), 8.99 (m, 1H, C8H), 8.49 (s, 1H, C10H), 4.57 (кв, 2Н, СН2), 1.54 (t, 3Н, СН3). Спектр ЯМР13С (100 МГц, СDСl3,δ, м.д.): 129.92 (C1), 128.83 (С2), 127.00 (С3), 122.65 (С4), 130.12 (С4a), 130.71 (С4b), 122.84 (С5), 127.39 (С6), 126.89 (С7), 126.89 (С8), 126.62 (С8a), 132.12 (С9), 132.17 (С10), 129.11 (С10a), 167.69 (COO), 61.22 (CH2), 14.48 (СН3). MS (EI, 70 eV) m/z (%): 250 [М]+(99), 235(5), 222 (21), 205(100), 177 (65), 165 (5), 151 (15), 88 (32).
Пропиловый эфир фенантрен-9-карбоновой кислоты. 96%, Т пл. 46-47°С. Спектр ЯМР 1H (400 МГц, СDСl3,δ,м.д.): 7.99 (d, 1H, C1H, J=S Гц), 7.66 (t, 1H, C2H J=8 Гц), 7.77 (t, 1H, C3H J=8 Гц), 8.70 (d, 1H, C4H J=S Гц), 8.76 (m, 1H, C5H), 7.72 (m, 1H, C6H), 7.72 (m, 1H, C7H), 8.93 (m, 1H, C8H), 8.48 (s, 1H, C10H), 4.45 (t, 2H, CH2), 1.93 (m, 2H, CH2), 1.93 (t, 3Н, СН3). Спектр ЯМР 13С, (100 МГц, CDCl3, δ, м.д.): δ 129.93 (С1), 128.84 (С2), 127.01 (С3), 122.26 (С4), 130.12 (С4a), 130.70 (С4b), 122.83 (С5), 127.38 (С6), 126.89 (С7), 126.66 (С8), 126.70 (С8a), 132.10 (С9), 132.10 (С10), 129.09 (С10a), 167.68 (COO), 66.85 (CH2C2Н5), 22.22 (СН2СН3), 10.68 (СН3). MS (El, 70 eV) m/z (%): 264 [M]+(93), 222 (90), 205(100), 177 (70), 151 (20), 88 (35).
н-Бутиловый эфир фенантрен-9-карбоновой кислоты (2d). 85%. Т пл. 56-57°С. Спектр ЯМР 1H (400 МГц, СDСl3,δ): 7.99 (d, 1H, С1Н, J=S Гц), 7.69 (t, 1H, С2H J=S Гц), 7.76 (t, 1H, С3H J=S Гц), 8.70 (d, 1H, C4H, J=8 Гц), 8.74 (m, 1H, C5H), 7.71 (m, 1H, C6H, 7.71 (m, 1H, C7H), 8.94 (m, 1H, C8H), 8.47 (s, 1H, C10H), 4.49 (t, 2H, CH2), 1.92-1.85 (m, 2H, CH2), 1.59-1.55 (m, 2H, CH2), 1.06 (t, 3Н, СН3). Спектр ЯМР 13С (100 МГц, СDСl3, δ, м.д.): 129.92 (С1), 127.82 (С2), 126.99 (С3), 122.64 (С4), 130.12 (С4a), 130.70 (С4b), 122.81 (С5), 127.36 (С6), 126.88 (С7), 126.65 (С8), 126.69 (С8a), 134.42 (С9), 132.08 (С10), 129.10 (С10a), 167.77 (COO), 65.12 (СН2С3Н7), 30.89 (СН2С2Н5), 19.41 (CH2СН3), 13.83 (СН3). MS (El, 70 eV) m/z (%): 278 [М]+(60), 222 (100), 205(65), 177 (70), 151 (20), 88 (10).
Другие примеры, подтверждающие способ приведены, в таблице 1.