Результат интеллектуальной деятельности: СПОСОБ ОЧИСТКИ ПОЛИПЕПТИДНЫХ РАСТВОРОВ
Вид РИД
Изобретение
В данном документе описывается способ удаления ДНК или белков клетки хозяина из растворов, таких как супернатант культивированных клеток или элюат после протеин А хроматографии, без выяснения полипептидного состава. Это достигается понижением рН раствора до значений ниже рН 6 и инкубацией раствора при данном рН.
Уровень техники
Биологические макромолекулы, такие как рекомбинантные моноклональные антитела или другие белки, используются в широком спектре диагностических и терапевтических областей. В особенности моноклональные антитела сейчас широко используются при различных тяжелых заболеваниях, таких как рак или ревматоидный артрит. Обычно, эту группу биологических молекул получают путем ферментативных процессов в бактериях, дрожжах или животных клетках. Традиционно, микробные или животные клетки удаляются из ферментативного бульона центрифугированием или фильтрацией, и далее свободный от клеток супернатант очищается от примесей, связанных с процессом ферментации, различными методами, такими как фильтрация, преципитация и хроматография.
Основными примесями, связанными с ферментативными процессами, не считая компонентов среды, являются остаточное число нуклеиновых кислот (ДНК клетки хозяина (host cell DNA (HCDNA)) и РНК) и белки клетки хозяина (БКХ) (Host Cell Proteins (HCP)), из клеток, в которых получают биологические молекулы. Для терапевтических целей в конечной лекарственной субстанции допустимые концентрации ДНК клетки хозяина (HCDNA) и белков клетки хозяина очень низкие, это делается с целью уменьшения неблагоприятных эффектов и гарантирует безопасность для пациента. Последние усовершенствования процесса ферментации привели к повышению клеточной плотности в продуцирующих биореакторах, что увеличило уровни HCP и HCDNA в свободном от клеток супернатанте и повысило требования к процессу очистки.
По этой причине, эффективные и дешевые методы для удаления большого числа HCP и HCDNA из супернатантов клеточных культур очень нужны.
O'Brien, W.D, et al. (J.Acoust. Soc. Am. 52 (1972) 1251-1255) описывают ультразвуковой метод исследования водного раствора дезоксирибонуклеиновых кислот. Vorlickova, M., et al. (Nucl. Acids Res. 27(1999) 581-586) рассказывают о димеризации гуанин-адениновх повторов цепей ДНК. Преципитация кислотами ферментативного бульона клеток млекопитающих описана у Lydersen et al. (Lydersen, B.K., et al., Ann. N.Y.Acad. Sci. 745 (1994) 222-231). Метод изоляции биомакромолекул с использованием низких значений рН и двухвалентных катионов описан в WO 2008/127305. В ЕР 1561756 и ЕР 1380589 описаны методы очистки белков.
Краткое описание изобретения
В данном документе описан способ очистки полипептидов из супернатантов культивированных клеток. Было обнаружено, что изменение рН раствора в кислотную сторону и дальнейшее инкубирование закисленного раствора в течение определенного времени приводит к тому, что нуклеиновые кислоты и белки клетки хозяина преципитируются, а целевые полипептиды остаются в растворе. После этого преципитаты и загрязняющие их компоненты клетки хозяина могут быть удалены этапом простого физического разделения. Во время обработки искомые полипептиды остаются в растворе, в то время как загрязнения от клетки хозяина преципитируются.
Одним подходом, как описано в данном документе, является метод продукции и обнаружения иммуноглобулинов, включающий следующие этапы:
1) добавление раствора, содержащего кислоту и воду, к супернатанту культивированных клеток, из которого были удалены клетки и клеточные остатки, для доведения значения рН до значений от рН 4,5 до рН 5,5, за счет чего раствор становится в значительной степени свободным от двухвалентных катионов,
2) инкубация супернатанта культивированных клеток при подведенном значении рН,
3) удаление преципитатов из проинкубированного супернатанта культивированных клеток и, таким образом, получение и обнаружение иммуноглобулинов,
где в супернатанте культивированных клеток иммуноглобулины содержатся в концентрации, которая не превышает 10 мг/мл,
где концентрация добавляемой кислоты составляет 5,5 моль/л или меньше.
В одном воплощении как минимум 90% иммуноглобулинов остаются в растворе во время этапа инкубации. В дальнейших воплощениях по меньшей мере 95% иммуноглобулинов остаются в растворе во время этапа инкубации. В другом воплощении более 98% иммуноглобулинов остаются в растворе после этапа инкубации.
В одном воплощении способ получения полипептидов состоит из следующих этапов:
а) культивирование клеток, содержащих нуклеиновые кислоты, кодирующие полипептиды,
б) удаление клеток и клеточных остатков из супернатанта культивированных клеток,
в) доведение значения рН в супернатанте культивированных клеток ниже значения рН 5,5,
г) инкубирование супернатанта культивированных клеток при подведенном значении рН,
д) удаление преципитатов из проинкубированного супернатанта культивированных клеток и, таким образом, получение полипептидов.
В другом аспекте, как это описано в данном документе, способ очистки супернатанта культивированных клеток включает следующие этапы:
а) доведение значения рН в супернатанте культивированных клеток ниже значения рН 5,5,
б) инкубирование супернатанта культивированных клеток при подведенном значении рН,
в) удаление преципитатов из проинкубированного супернатанта культивированных клеток и, таким образом, очистка супернатанта культивированных клеток.
Другим подходом является способ получения полипептидов, который включает следующие этапы:
1) изготовление клеток млекопитающих, содержащих нуклеиновые кислоты, которые кодируют полипептиды,
2) культивирование клеток в бессывороточных условиях,
3) выделение супернатанта культивированных клеток, не обязательное удаление клеток и клеточных остатков из супернатанта культивированных клеток,
4) очистка супернатанта культивированных клеток для получения полипептидов, которая включает следующие этапы:
а) добавление раствора, состоящего из воды и кислоты, к супернатанту культивированных клеток, который, по существу, не содержит двухвалентных катионов, с целью доведения значения рН до значений ниже рН 5,5,
б) инкубирование супернатанта культивированных клеток с подведенным значением рН и
в) удаление преципитатов из проинкубированного супернатанта культивированных клеток,
где супернатант культивированных клеток содержит полипептиды в концентрации не более чем 10 мг/мл,
где концентрация добавляемой кислоты составляет 5,5 моль/л или ниже.
В одном воплощении подведение значения рН производится до значений от рН 5,5 до рН 3,5. В последующих воплощениях подведение значения рН производится до значений от рН 5,5 до рН 4,5.
В одном воплощении инкубирование супернатанта культивированных клеток с подведенным значением рН производится при температуре от 1°С до 30°С. В другом воплощении инкубирование супернатанта культивированных клеток с подведенным значением рН производится при температуре от 2°С до 10°С. В следующем воплощении инкубирование супернатанта культивированных клеток с подведенным значением рН производится при температуре приблизительно 4°С.
В одном воплощении супернатант культивированных клеток с подведенным значением рН инкубируется приблизительно полчаса или больше. В другом воплощении супернатант культивированных клеток с подведенным значением рН инкубируется приблизительно от получаса до приблизительно 72 часов. В следующем воплощении супернатант культивированных клеток с подведенным значением рН инкубируется приблизительно от 2 до приблизительно 48 часов. В еще одном воплощении супернатант культивированных клеток с подведенным значением рН инкубируется приблизительно от 20 до приблизительно 32 часов. И в еще одном варианте воплощения, супернатант культивированных клеток с подведенным значением рН инкубируется приблизительно 24 часа.
В одном воплощении удаление клеток и клеточных остатков и/или удаление преципитатов делают при помощи фильтрации, осаждения или центрифугирования.
В другом воплощении супернатантом культивированных клеток является супернатант культивированных клеток млекопитающих.
В одном воплощении полипептидами являются иммуноглобулины. В другом воплощении иммуноглобулинами являются иммуноглобулины класса G. В еще одном воплощении иммуноглобулинами являются иммуноглобулины класса G подкласса IgG1 или подкласса IgG4 или же их варианты.
В одном воплощении иммуноглобулинами являются иммуноглобулины подкласса IgG1, и инкубирование производится приблизительно от 2 до приблизительно 48 часов при значениях рН от рН 4,5 до рН 3,5.
В одном воплощении иммуноглобулинами являются иммуноглобулины подкласса IgG4, и инкубирование производится приблизительно от 2 до приблизительно 30 часов при значениях рН от рН 5,5 до рН 4,5.
Подробное описание изобретения
В данном документе описан способ очистки полипептидов, включающий следующие этапы:
а) подведение значения рН супернатанта культивированных клеток, содержащего полипептиды, до значений рН от рН 3,5 до рН 5,5,
б) инкубирование супернатанта при подведенном значении рН,
в) удаление преципитатов из проинкубированного супернатанта культивированных клеток и, таким образом, очистка полипептидов.
Способ, который описан в данном документе, может быть использован для необработанного супернатанта ферментированных клеток, из которого были удалены клетки и клеточные остатки, а также после одного или более предварительных этапов очистки, таких как протеин А аффинная хроматография.
Термин «супернатант культивированных клеток» обозначает раствор, который был получен после культивирования клеток, секретирующих искомый полипептид. Супернатант помимо секретируемых полипептидов содержит также компоненты используемой среды культивируемых клеток и продукты метаболизма клеток, помимо искомого полипептида, секретируемых во время культивирования, также и другие компоненты культивируемых клеток, высвобожденные из мертвых клеток во время культивирования или из разрушенных клеток во время получения полипептида из клеток. Супернатант культивированных клеток не содержит также остатков клеток и/или интактных клеток. Этот термин также включает супернатант культивированных клеток, прошедший через один этап хроматографической очистки, такой как протеин А аффинная хроматография.
Термин «полипептид» обозначает полимер, состоящий из аминокислот, связанных пептидными связями, полученный натуральным или синтетическим путем. Полипептиды, состоящие менее чем из 20 аминокислотных остатков, могут рассматриваться как «пептиды», в то время как молекулы, состоящие из двух или более полипептидов или же включающие полипептид, состоящий более чем из 100 аминокислотных остатков, могут рассматриваться как «белки». Полипептиды могут содержать неаминокислотные компоненты, такие как карбогидратные группы, ионы металлов, карбоксильные остатки сложных эфиров. Неаминокислотные части могут быть добавлены клетками, в которых полипептиды экспрессируются, и могут варьироваться в зависимости от типа клеток. В данном документе полипептиды разбиты на группы, в зависимости от их аминокислотного состава или от последовательности нуклеотидов, которой они кодируются. Добавления, такие как карбогидратные группы, обычно неспецифичны, однако могут быть представлены. В одном воплощении, как описано в данном документе, полипептиды выбираются из иммуноглобулинов, иммуноглобулиновых фрагментов и иммуноглобулиновых конъюгатов.
Термин «иммуноглобулин» обозначает белок, состоящий из двух или более полипептидов, который главным образом кодируется генами иммуноглобулинов.
Общепризнанные гены иммуноглобулинов состоят из разных генов, которые кодируют константные регионы, и из бесчисленного множества генов, которые кодируют вариабельные регионы. Вообще иммуноглобулины состоят из двух так называемых легких цепей полипептидов (легкие цепи) и двух так называемых тяжелых цепей полипептидов (тяжелые цепи). Каждая тяжелая и каждая легкая цепь полипептидов содержит вариабельный домен (вариабельный регион) (обычно это концевые аминокислоты полипептидной цепи), включающий в себя связывающий регион, который взаимодействует с антигеном. Каждая тяжелая и каждая легкая цепь полипептидов содержит константный регион (обычно это участок с концевой карбоксильной группой). Вариабельный домен легкой и тяжелой иммуноглобулиновой цепи состоит из различных сегментов - 4-х каркасных участков (framework regions (FR)) и 3-х гипервариабельных участков (hypervariable regions (CDR)). Константные регионы иммуноглобулина непосредственного участия в связывании иммуноглобулинового антигена не принимают, но выполняют различные эффекторные функции. В зависимости от аминокислотной последовательности константных регионов тяжелых цепей иммуноглобулины делятся на классы: IgA, IgD, IgE, IgG и IgM. Некоторые классы затем делятся на подклассы (изотипы): т.е. IgG на IgG1, IgG2, IgG3 и IgG4 или IgA на IgA1 и IgA2. Тяжелые цепи константных регионов иммуноглобулинов называются в зависимости от класса, к которому принадлежит иммуноглобулин, - α(IgA), δ(IgD), ε(IgE), γ(IgG) и µ(IgM), соответственно.
Под термином «иммуноглобулиновый конъюгат» понимается полипептид, состоящий как минимум из одного домена тяжелой или легкой иммуноглобулиной цепи, конъюгированный за счет пептидных связей с другим полипептидом. Другим полипептидом является неиммуноглобулиновый пептид, например гормон, или ростовой фактор, или пептид, обладающий клеточной токсичностью, или фактор комплемента, или нечто подобное.
В одном воплощении иммуноглобулином является иммуноглобулин класса G. В другом воплощении иммуноглобулином является иммуноглобулин класса G подкласса IgG1 или подкласса IgG4 или один из их вариантов. Под термином «вариант» подразумевается полипептид, который отличается по аминокислотной последовательности от родительской полипептидной последовательности за счет качественного добавления, делеции и/или замены одного или более аминокислотных остатков в родительской аминокислотной цепи. В одном воплощении вариант будет иметь как минимум 90% аминокислотной последовательности, идентичной родительской, в другом воплощении - как минимум 95% и в еще одном - как минимум 99% идентичной аминокислотной последовательности.
Термин «подведение значения рН» в том значении, как он используется в данном документе, означает добавление кислоты в раствор, главным образом в супернатант культивированных клеток, с целью понижения рН раствора до значения рН ниже 7,0. Подведение может быть достигнуто добавлением кислотного раствора, т.е. раствора кислоты. В одном воплощении подведение рН выполняется добавлением раствора кислоты, выбранной из следующих: соляной кислоты, фосфорной кислоты, уксусной кислоты или лимонной кислоты.
Термин «инкубация» в том значении, как он использован здесь, подразумевает выдерживание соответствующего раствора при определенном значении рН. Инкубация может длиться определенное время. В одном воплощении инкубация длится приблизительно полчаса или более. В другом воплощении инкубация длится приблизительно от получаса до приблизительно 72 часов. В следующем воплощении инкубация длится приблизительно от 2 до приблизительно 48 часов. В еще одном воплощении инкубацию проводят от приблизительно 20 до приблизительно 32 часов. И в еще одном воплощении инкубация длится приблизительно 24 часа. В одном воплощении инкубация длится определенное время, как это описано раннее, при значении рН от рН 3,5 до рН 5,5, в основном при значениях рН от рН 4,5 до рН 5,5.
Термин «приблизительно» в том понимании, как он используется здесь, означает, что последовательно указанные значения - это не конкретное значение, а интервал значений. В одном воплощении интервал составляет плюс-минус 20% от значения, в другом воплощении плюс-минус 10% от значения, в еще одном воплощении плюс-минус 5% от значения. Например, термин «приблизительно 24 часа» означает интервал от 19,2 часов до 28,8 часов.
Термин «по существу свободный» означает, что этот компонент не был добавлен в раствор. Но отдельные компоненты могут присутствовать в растворе в небольшом количестве, так как они могут быть частью компонентов, из которых состоит раствор. Обычно раствор по существу свободен от компонента, когда этот компонент содержится в растворе в концентрации 1 мМ или меньше, особенно если концентрация составляет 1 мкМ или менее.
Методы получения полипептидов известны в данной области техники и включают экспрессию белков в прокариотических и эукариотических клетках с последующей изоляцией полипептидов и, обычно, очисткой до фармацевтически приемлемой чистоты. Например, для экспрессии иммуноглобулинов в клетках, нуклеиновые кислоты, кодирующие соответствующие тяжелые и легкие цепи, встраивают в экспрессирующие векторы при помощи стандартных методов. Экспрессию делают в подходящих прокариотических или эукариотических клетках, таких как СНО-клетки, NS0-клетки, SP2/0-клетки, НЕК293-клетки, COS-клетки, РЕР.С6(R)-клетки, дрожжах или клетках E.coli и получают из клеток иммуноглобулин (супернатант или лизированные клетки).
Термин «клетка», как он используется в данном документе, означает любую клеточную систему, которая может быть запрограммирована для производства полипептидов. В одном воплощении клеткой является клетка млекопитающего. В другом воплощении клетка может быть выбрана из НЕК- или СНО-клеток.
Было обнаружено, что нуклеиновые кислоты и клеточные белки культивируемых клеток преципитируются, а секретируемые полипептиды остаются в растворе, если значение рН супернатанта культивированных клеток подведено до значения рН ниже рН 5,5 и впоследствии раствор проинкубирован определенное время при этом значении рН. После чего преципитаты и компоненты хозяйских клеток вместе с ними могут быть удалены простым физическим сепарированием.
Способ, описанный в данном документе, может быть использован для любого типа супернатанта культивированных клеток, т.е. для супернатанта культивированных эукариотических и прокариотических клеток. В одном воплощении супернатантом культивированных клеток является супернатант культивированных эукариотических клеток. В другом воплощении супернатантом культивированных клеток является супернатант культивированных клеток млекопитающих. И в еще одном воплощении супернатантом культивированных клеток является супернатант культивированных СНО-, НЕК- или Sp2/0-клеток.
В наше время процесс культивирования клеток в основном ведется без добавления сыворотки животных. Таким образом, в одном воплощении супернатант культивированных клеток получают от клеток, которые выращены в бессывороточных условиях. Кроме того, в условиях, при которых сыворотка животных не используется, исключена возможность загрязнения супернатанта неизвестными компонентами из сыворотки животных и в то же время уменьшена концентрация полипептидов в супернатанте культивированных клеток. Это выгодно, как правило, для методов очистки, основанных на преципитации, так как может встречаться копреципитация получаемого полипептида, что уменьшает выход продукта после процесса очистки. Тот же эффект можно наблюдать, если в растворе присутствуют клетки или клеточные остатки. Поэтому в одном воплощении клетки и клеточные остатки удаляют из супернатанта культивированных клеток до того, как подводят значение рН.
Для способа, который описан в данном документе, концентрация полипептидов, которые должны быть очищены, не должна превышать 10 мг/мл. В одном воплощении концентрация полипептидов в супернатанте культивированных клеток колеблется от 0,1 мг/мл до приблизительно 10 мг/мл. В другом воплощении концентрация полипептидов в супернатанте культивированных клеток составляет от 1 мг/мл до 8 мг/мл. В других воплощениях концентрация полипептидов в супернатанте культивированных клеток составляет от 1 мг/мл до 5 мг/мл.
Для подведения значения рН в супернатант культивированных клеток должна быть добавлена кислота. Это может быть любая кислота, если только эта кислота не начнет необратимо связываться с полипептидом. В одном воплощении кислота выбирается из соляной кислоты, фосфорной кислоты, серной кислоты, муравьиной кислоты, уксусной кислоты, пропионовой кислоты, малоновой кислоты, янтарной кислоты, адипиновой кислоты, молочной кислоты и лимонной кислоты. Уже было сказано, что кислота добавляется в супернатант культивированных клеток в виде водного раствора. Раствор состоит из соответствующей кислоты, т.е. из свободной кислоты, и воды и по существу не содержит никаких других примесей, особенно двухвалентных катионов. Термин «свободная кислота» означает, что кислота находится в той форме, когда все атомы водорода присутствуют, т.е. они не заменены на какие-то другие катионы. Также подразумевается, что кислота, из которой был изготовлен раствор, только свободная кислота, т.е. использование кислоты в виде соли исключено. В одном воплощении кислоту выбирают из соляной кислоты, фосфорной кислоты, уксусной кислоты и лимонной кислоты. Концентрация кислоты в соответствующем растворе в одном воплощении составляет 5,5 моль/л или меньше. В другом воплощении концентрация кислоты составляет от 1 моль/л до 5,5 моль/л. В следующем воплощении концентрация кислоты составляет от 1,5 моль/л до 4 моль/л. Как альтернатива, концентрация кислоты в соответствующем растворе в одном воплощении может быть 30% или меньше. В одном воплощении концентрация кислоты составляет от 1% до 30%. В другом воплощении концентрация кислоты от 5% до 25%. В следующем воплощении концентрация кислоты - от 10% до 20%.
В общем, если в данном документе указаны значения в виде диапазона значений, то подразумевается, что крайние точки, которые указаны, тоже включены.
После подведения значения рН супернатант культивированных клеток с подведенным значением рН инкубируется определенное время. Определенное время в одном воплощении составляет приблизительно полчаса или более. В другом воплощении определенное время составляет приблизительно от получаса до примерно 72 часов. В следующем воплощении определенное время составляет приблизительно от 2 часов до приблизительно 48 часов. В еще одном воплощении определенное время составляет приблизительно от 20 часов до приблизительно 32 часов. И в еще одном воплощении определенное время составляет примерно 24 часа. В одном воплощении инкубация супернатанта культивированных клеток с подведенным значением рН проводится при температуре от 1°С до 30°С. В другом воплощении инкубация супернатанта культивированных клеток с подведенным значением рН проводится при температуре от 2°С до 10°С. И в последующих воплощениях инкубация супернатанта культивированных клеток с подведенным значением рН осуществляется при приблизительно 4°С.
По способу, который описан в данном документе, нуклеиновые кислоты клеток хозяина и белки клеток хозяина могут быть преципитированы, т.е. удалены из супернатанта культивированных клеток, без уменьшения концентрации получаемых полипептидов. Инкубация порядка 2 часов может быть достаточной для удаления большого числа нуклеиновых кислот клеток хозяина. Таким образом, в одном воплощении время инкубации составляет приблизительно 2 часа. Для преципитации белков клеток хозяина время инкубации приблизительно от 2 часов до приблизительно 48 часов может быть достаточным, и это зависит от подведенного значения рН и от полипептида. Таким образом, в одном воплощении время инкубации составляет приблизительно 2 часа при значении рН приблизительно рН 5 при температуре приблизительно 4°С.
В одном воплощении полипептидом является иммуноглобулин.
В одном воплощении иммуноглобулином является иммуноглобулин подкласса IgG1. В другом воплощении инкубация проводится от 2 часов до 48 часов при значении рН от рН 4,5 до рН 3,5, и иммуноглобулином является иммуноглобулин подкласса IgG1. В определенном воплощении инкубация проводится от 2 до 30 часов.
В одном воплощении иммуноглобулином является иммуноглобулин подкласса IgG4. В другом воплощении инкубация проводится от 2 часов до 48 часов при значении рН от рН 5,5 до рН 4,5, и иммуноглобулином является иммуноглобулин подкласса IgG4. В определенном воплощении инкубация проводится при значении рН приблизительно рН 5.
После инкубации преципитат должен быть удален. Для удаления может быть использован любой метод, с которым знаком специалист в данной области. Типичными методами являются фильтрация, седиментация и сцеживание, центрифугирование и осаждение. В одном воплощении удаление преципитатов осуществляется методом, который выбирается из седиментации, фильтрации, осаждения и центрифугирования.
После удаления преципитата может быть проведена дальнейшая очистка полипептида, например, хроматографическими методами, которыми владеет специалист в данной области. Кроме того, в одном воплощении способ, описанный в данном документе, включает этапы очистки полипептида при помощи одного или нескольких хроматографических этапов.
Для очистки иммуноглобулинов может быть использована комбинация различных этапов колоночной хроматографии. В одном воплощении может быть использована протеин А аффинная хроматография, после которой будет проведена дополнительная хроматографическая очистка, например ионообменная хроматография. Для обнаружения и очистки белков хорошо известны и широко распространены различные методы, такие как аффинная хроматография с микробными белками (например, протеин А или протеин G аффинная хроматография), ионообменная хроматография (например, катионообменная (карбоксиметиловые смолы), анионообменная (аминоэтиловые смолы) и смешаннообменная), тиоэфирная адсорбция (например, бета-меркаптоэтанол и другие SH лиганды), гидрофобные взаимодействия или адсорбционная хроматография ароматических углеводородов (например, фенил-сефароза, аза-аренофильные смолы или м-аминофенилбороновая кислота), металл-хелат-аффинная хроматография (например, Ni(II) и Cu(II)-аффинная хроматография), эксклюзионная хроматография и электрофоретические методы (такие как гель-электрофорез, капиллярный электрофорез).
Представленные ниже примеры и фигуры должны способствовать пониманию настоящего изобретения, настоящие возможности которого сформулированы в приложенных пунктах. Понятно, что могут быть сделаны модификации процедур, сформулированных здесь, без изменения сути изобретения.
Описание графических материалов
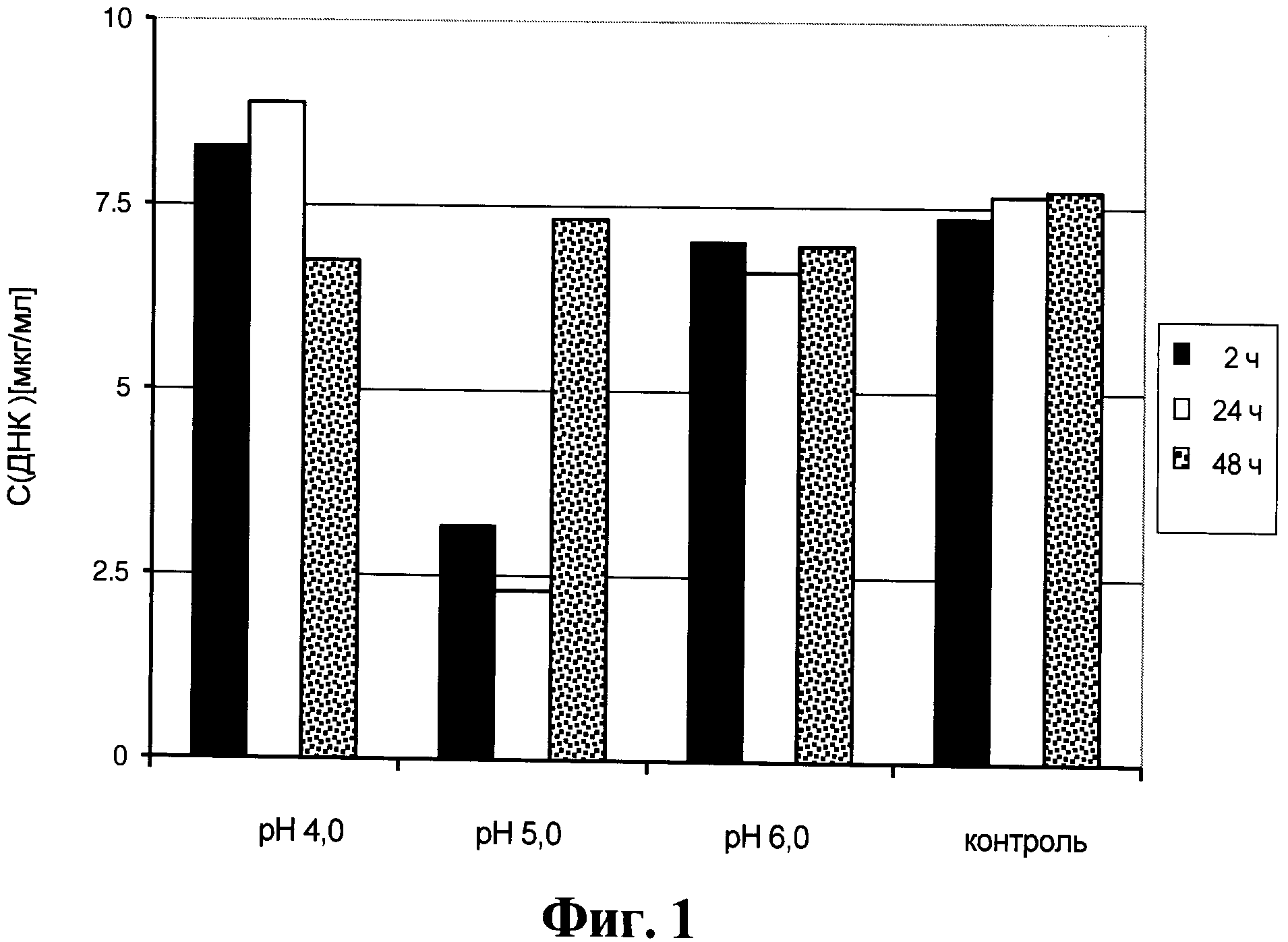
Фигура 1. Содержание ДНК клеток хозяина в супернатанте от культуры клеток для получения анти-EGFR антител, который получен способом, описанным в данном документе.
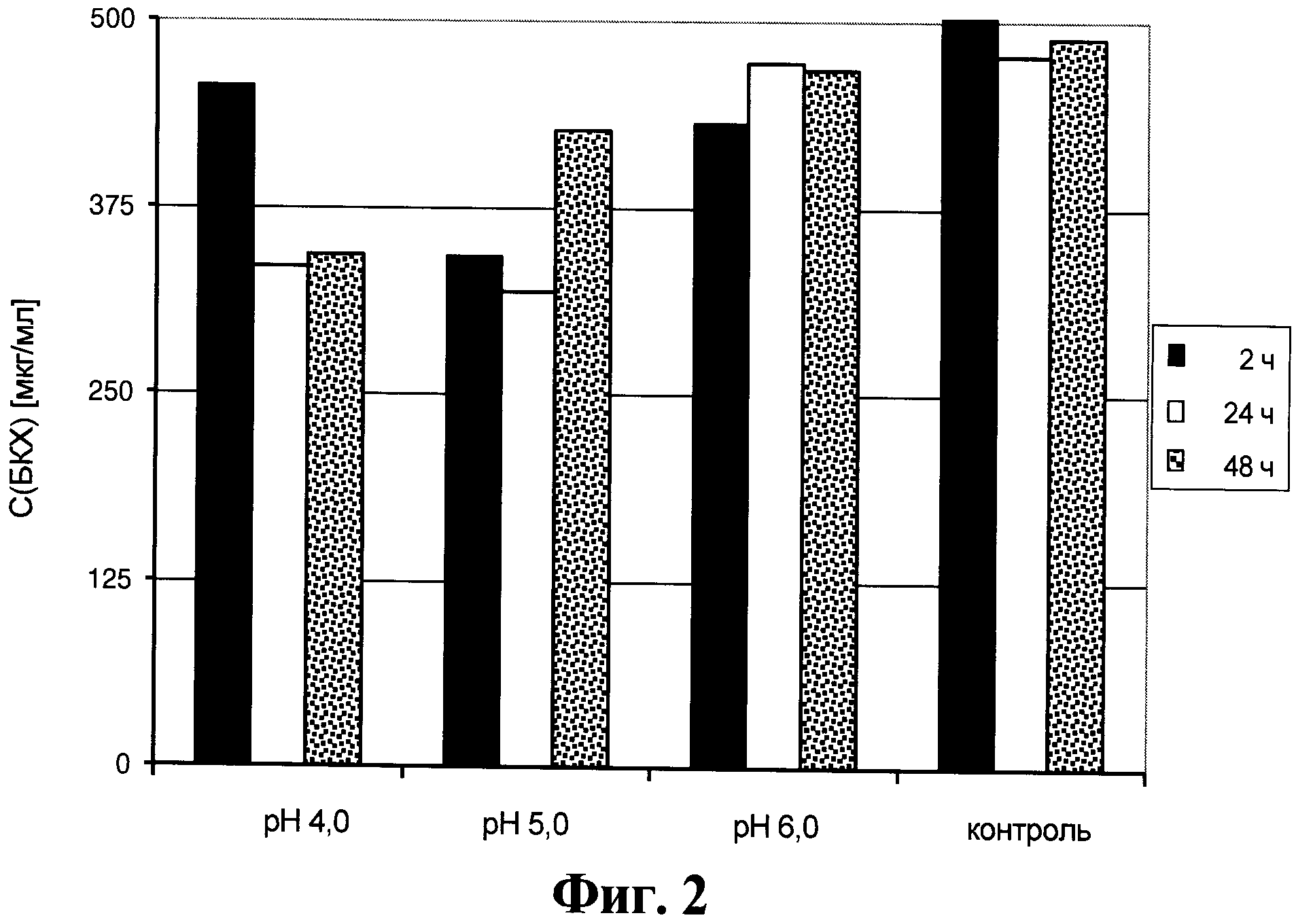
Фигура 2. Содержание белка клеток хозяина в супернатанте от культуры клеток для получения анти-EGFR антител, который получен способом, описанным в данном документе.
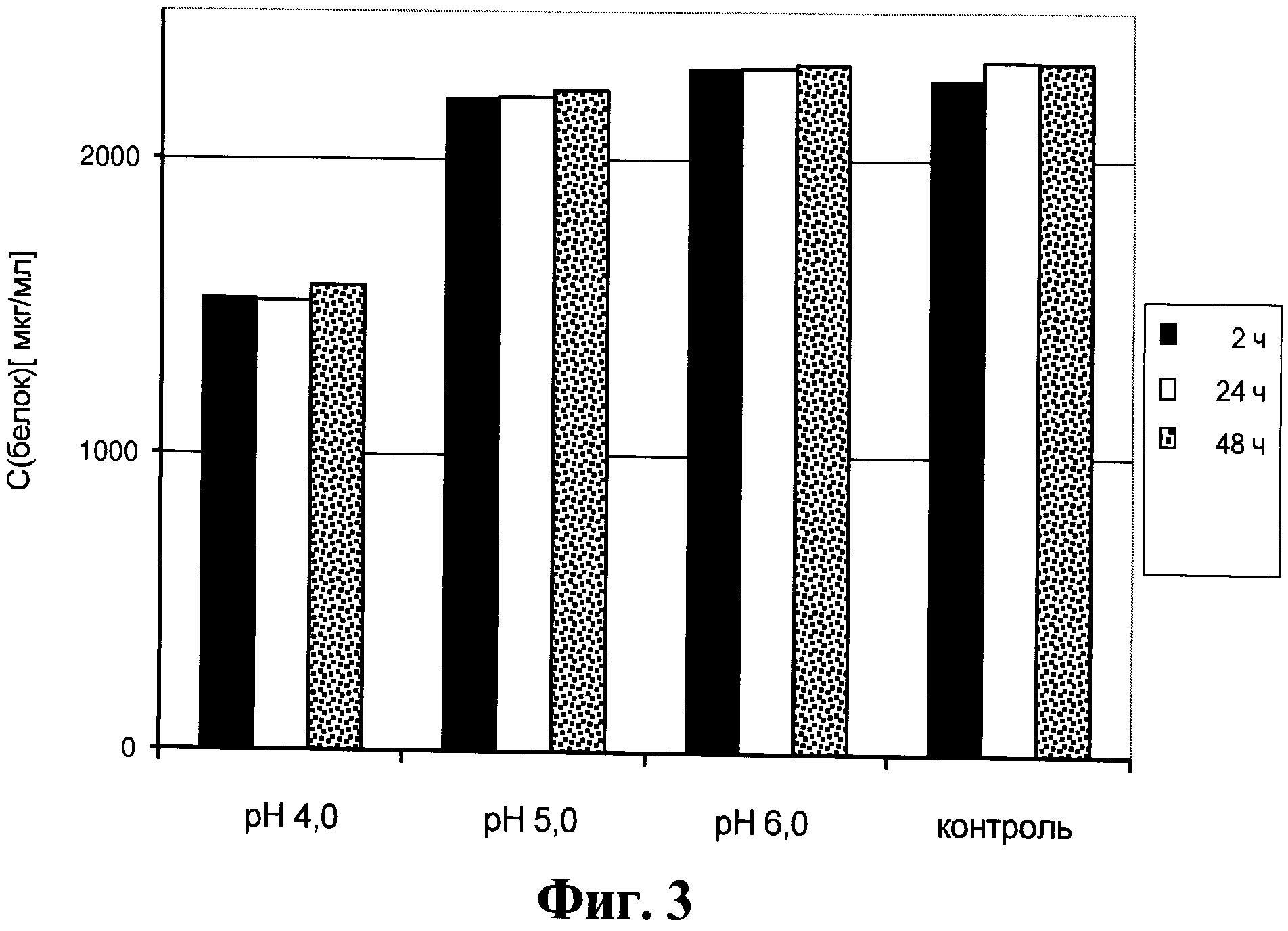
Фигура 3. Содержание антител в супернатанте от культуры клеток для получения анти-EGFR антител, который получен способом, описанным в данном документе.
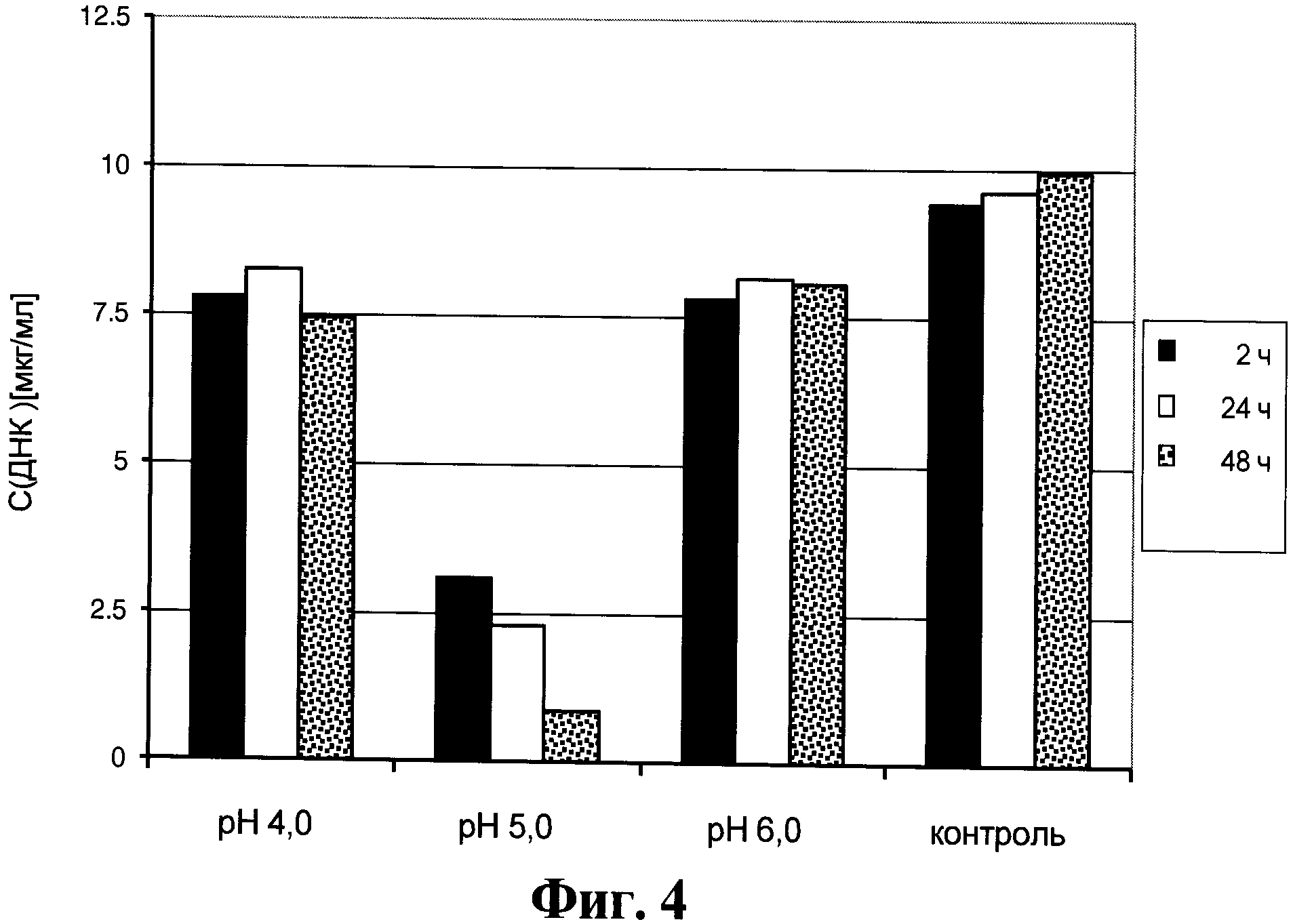
Фигура 4. Содержание ДНК клеток хозяина в супернатанте от культуры клеток для получения анти-PLGF антител, который получен способом, описанным в данном документе.
Фигура 5. Содержание белка клеток хозяина в супернатанте от культуры клеток для получения анти-PLGF антител, который получен способом, описанным в данном документе.
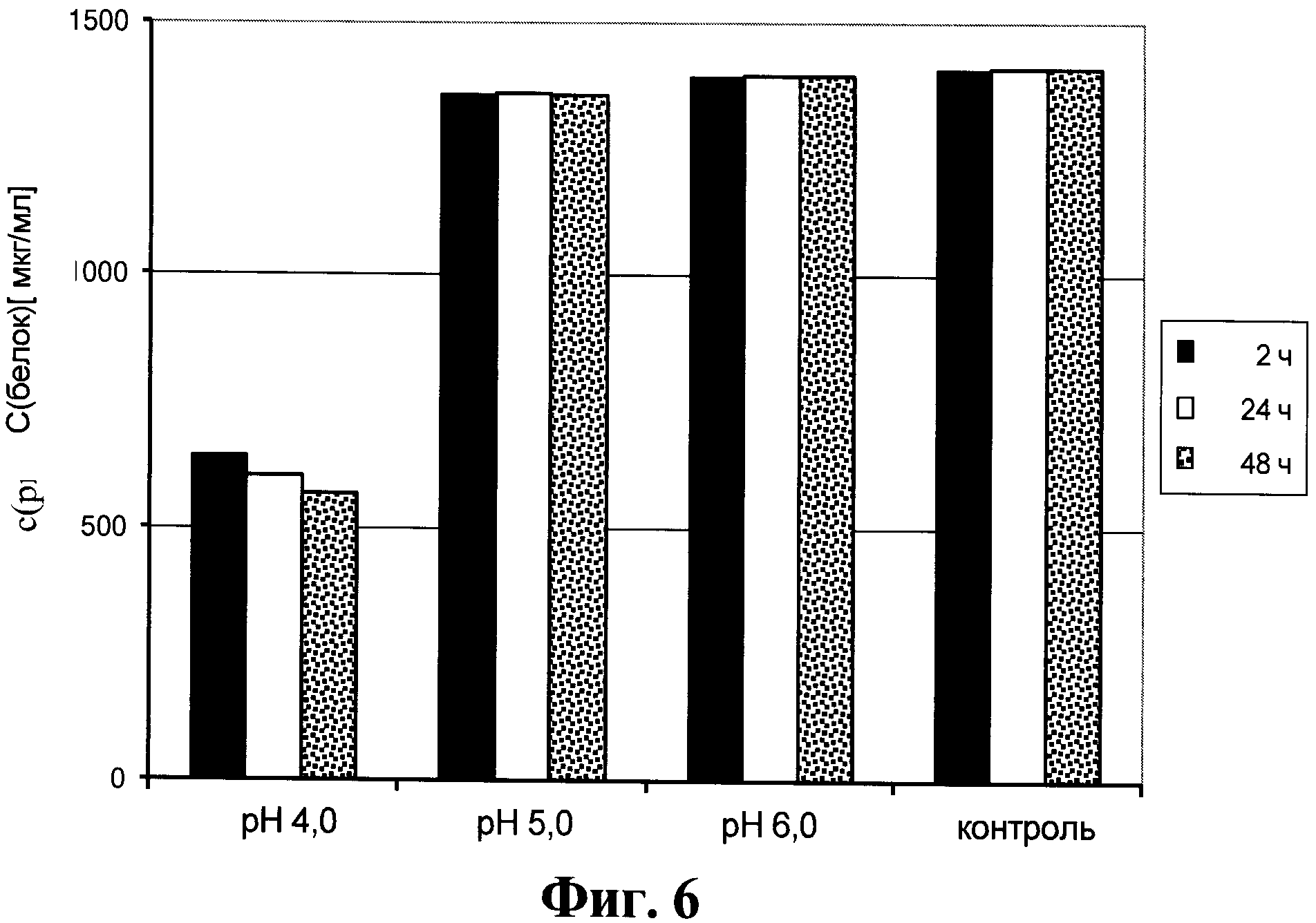
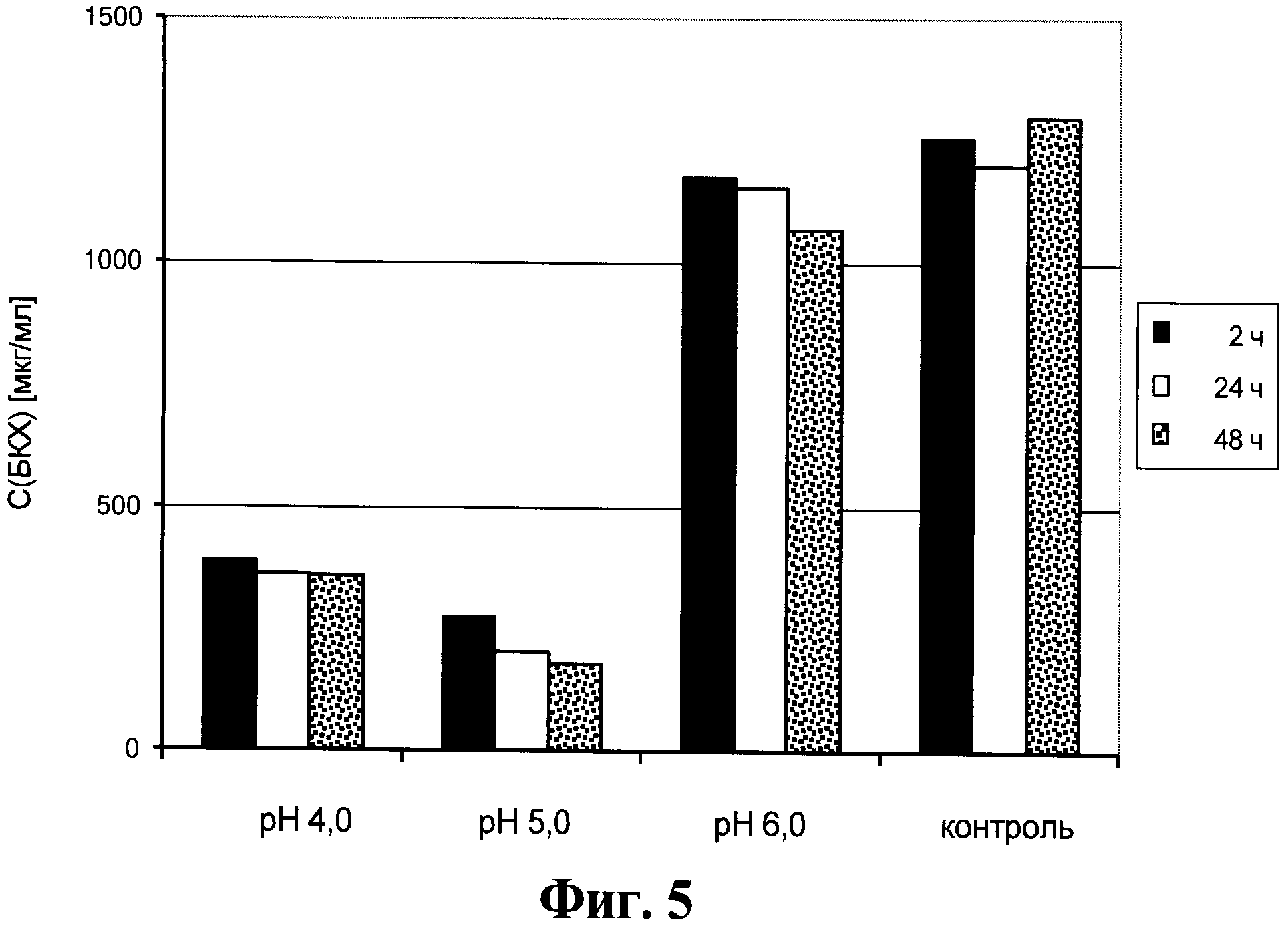
Фигура 6. Содержание антител в супернатанте от культуры клеток для получения анти-PLGF антител, который получен способом, описанным в данном документе.
Фигура 7. Содержание ДНК клеток хозяина в супернатанте от культуры клеток для получения анти-Р-селектин антител, который получен способом, описанным в данном документе.
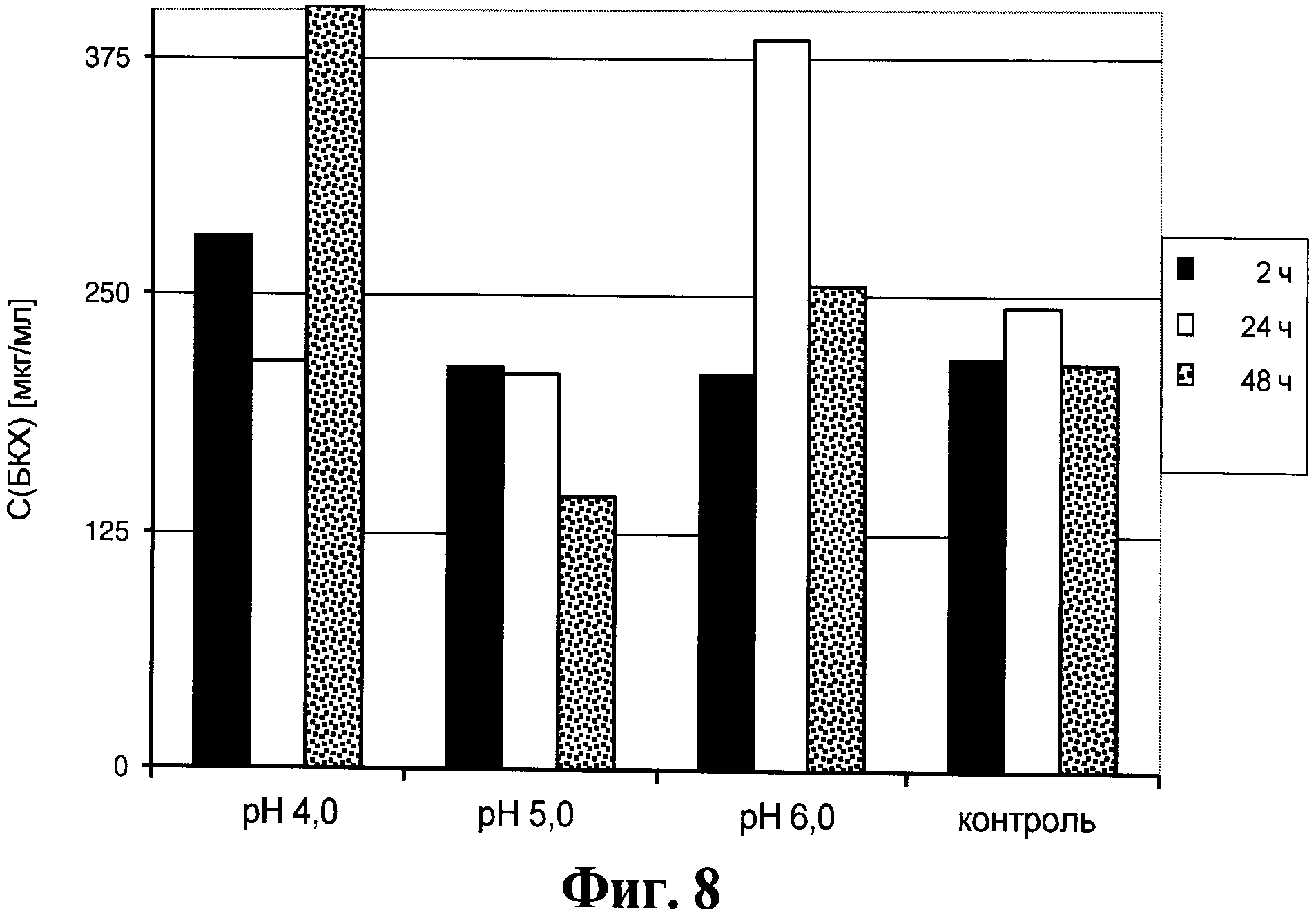
Фигура 8. Содержание белка клеток хозяина в супернатанте от культуры клеток для получения анти-Р-селектин антител, который получен способом, описанным в данном документе.
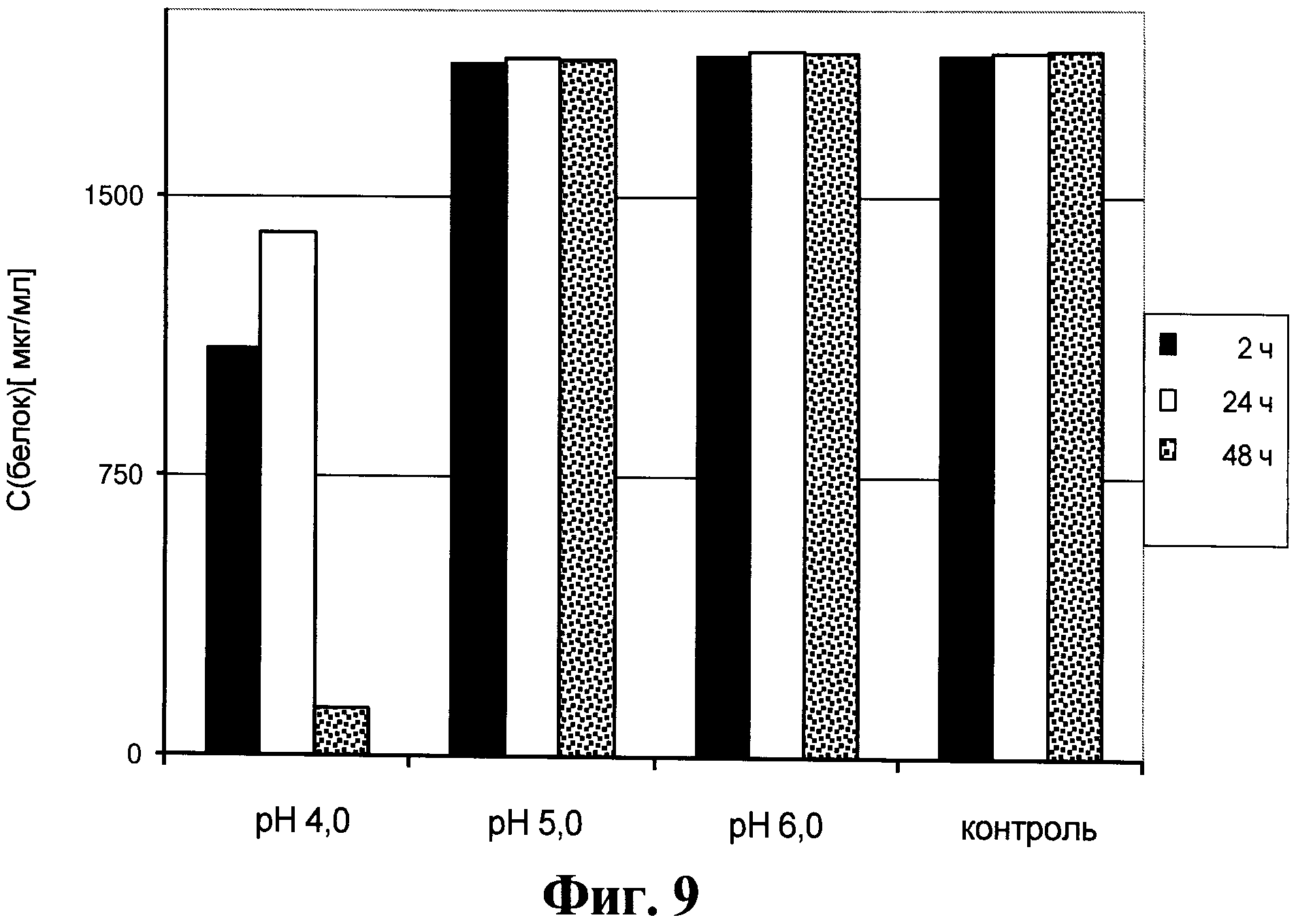
Фигура 9. Содержание антител в супернатанте от культуры клеток для получения анти-Р-селектин антител, который получен способом, описанным в данном документе.
Фигура 10. Содержание антител в супернатанте от культуры клеток для получения анти-PLGF антител, который получен способом, описанным в данном документе, в зависимости от значения рН и времени инкубации.
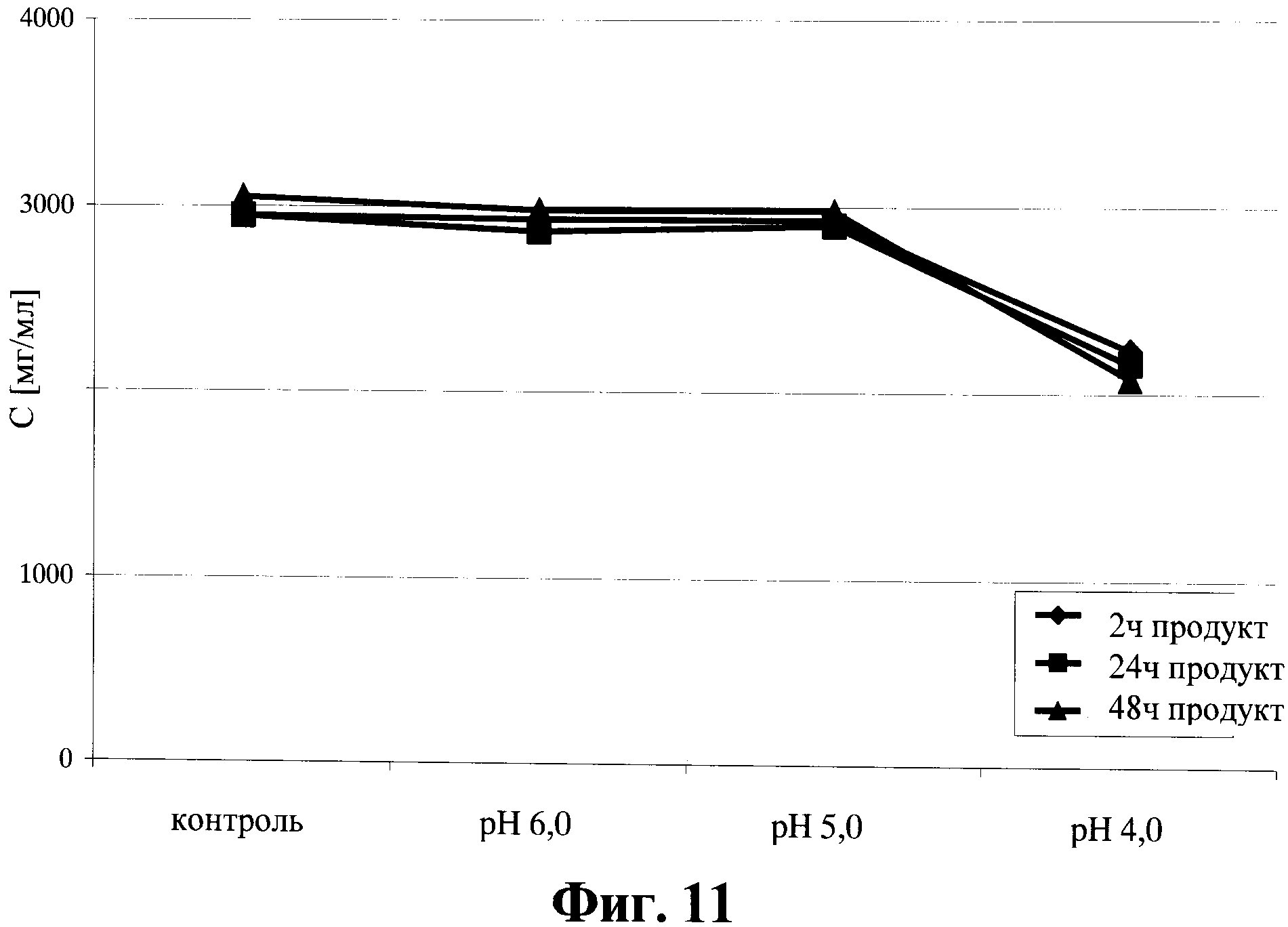
Фигура 11. Содержание антител в супернатанте от культуры клеток для получения анти-Р-селектин антител, который получен способом, описанным в данном документе, в зависимости от значения рН и времени инкубации.
Фигура 12. Содержание антител в супернатанте от культуры клеток для получения анти-НЕР3 антител, который получен способом, описанным в данном документе, в зависимости от значения рН и времени инкубации.
Пример 1
Материалы и методы
Антитела
Способ, описанный в данном документе, проиллюстрирован на примере анти-EGFR антител, которые описаны в WO 2008/017963.
Другим вариантом иммуноглобулинов являются анти-PLGF антитела, которые описаны в WO 2006/099698.
Другим вариантом иммуноглобулинов являются анти-Р-селектин антитела, которые описаны в WO 2005/100402.
Другим вариантом иммуноглобулинов являются анти-НЕРЗ антитела, которые описаны в РСТ/ЕР2010/070062.
ДНК
Остаточные количества ДНК были измерены при помощи Q-PCR ((quantitative polymerase chain reaction) - количественная ПЦР). Поэтому образцы были проинкубированы при высоких температурах для того, чтобы ДНК в образцах денатурировала. ДНК была выловлена из раствора при помощи Silica matrix и элюирована оттуда при помощи буфера, следуя инструкциям производителя. Экстракцию при помощи QIAcube robot (QIAcube робот) делали с использованием QIAamp Viral RNA Kit (оба продукта Qiagen, Hilden, Germany). Поэтому были смешаны и проинкубированы в течение 10 минут образец, лизирующий буфер и переносчик РНК (материал для связывания РНК). В каждую пробирку был добавлен этанол, и затем раствор вместе с этиловым спиртом были помещены в колонки QIAamp Viral RNA Kit и центрифугированы. После этого в колонки был добавлен отмывочный буфер, и колонки были снова центрифугированы. Затем в колонки был добавлен другой отмывочный буфер, и колонки центрифугированы снова. После добавления элюирующего буфера колонки были центрифугированы дважды.
Для измерения ДНК был использован LightCycler 2.0 (Roche Diagnostics GmbH, Mannheim, Germany). В таблице 1 параметры ПЦР обведены.
|
Во время процедуры нити ДНК красятся связывающим красителем для одноцепочечных нитей ДНК. Во время амплификации флюоресценция увеличивается пропорционально количеству ДНК.
Метод обнаружения белков клеток хозяина. НСР (host cell protein assay)
Стенки лунок микропланшета покрыты смесью сывороточного альбумина и стрептавидина. К стенкам микропланшета прикреплены козлиные поликлональные антитела против белков клеток хозяина (НСР). После этапа отмывки различные лунки микропланшета инкубируются с калибровочными последовательностями в разной концентрации и раствором образца. После инкубации несвязавшийся материал удаляется за счет отмывки буфером. Для обнаружения связавшихся белков клеток хозяина лунки микропланшета обрабатываются конъюгатом антител с пероксидазой. Фиксированная пероксидазная активность выявляется при помощи инкубирования с ABTS и измерением при длине волны 405 нм.
SEC (эксклюзионная хроматография, гель-фильтрация)
Хроматография проводилась с использованием Tosoh Haas TSK 3000 SWXL колонок на хроматографе для высокоэффективной жидкостной хроматографии ASI-100 (Dionex, Disdain, Germany). Хроматографические пики наблюдали при длине волны 280 нм при помощи ультрафиолетового детектора (UV diode array detector (Dionex)). После растворения концентрированных образцов до концентрации 1 мг/мл колонки промывали буфером, состоящим из 200 мМ дигидроген фосфата калия и 250 мМ хлорида калия, рН 7,0, до получения стабильной базовой линии. Анализ проводили при изократических условиях при скорости потока 0,5 мл/мин, порядка 30 минут при комнатной температуре. Хроматограф был вручную интегрирован c Chromeleon (Dionex, Idstein, Germany).
IEC (ионообменная хроматография)
При помощи ионообменной хроматографии были анализированы белки с неоднородным зарядом. Использовали катионообменные Хроматографические колонки Dionex ProPac и систему для высокоэффективной жидкостной хроматографии Dionex Chromeleon.
Определение белков
Для определения числа антител, которые есть в образце, был использован хроматографический метод. Использовали Poros А колонки, которые связывают Fc-фрагмент антител. Антитела связываются с колонкой и впоследствии элюируются в условиях с низким значением рН. Концентрацию белков определяли по оптической плотности (optical density (OD)) при 280 нм по отношению к длине волны 320 нм, используя молярный коэффициент светопоглощения, посчитанный на основе аминокислотной последовательности.
Пример 2
Процедура
Образцы были получены непосредственно из среды культивированных клеточных линий, секретирующих соответствующие антитела. После удаления клеток и клеточных остатков супернатант культивированных клеток был разделен на несколько аликвот, по 200 мл каждая, и значение рН было подведено до рН 4,0, рН 5,0, рН 6,0 за счет добавления 10% или 20% раствора уксусной кислоты соответственно. В аликвоте сравнения значение рН было подведено, если требовалось, приблизительно до рН 7. Аликвоты хранились при 4°С, и образцы забирались из каждой аликвоты через 2, 24 и 48 часов.
За время хранения при разных значениях рН были обнаружены разные уровни образования преципитатов. Преципитаты убирали за счет седиментации. В качестве альтернативы, преципитаты могут быть удалены фильтрацией или центрифугированием.
После удаления преципитатов чистая жидкая фаза была проанализирована на предмет содержания ДНК клетки хозяина, белков клетки хозяина (host cell protein (НСР)) и на содержание белков.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|