Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ДВУСПИРАЛЬНОЙ РИБОНУКЛЕИНОВОЙ КИСЛОТЫ (дсРНК) ИЗ КЛЕТОК ДРОЖЖЕЙ Saccharomyces cerevisiae
Вид РИД
Изобретение
Изобретение относится к способам получения двуспиральной рибонуклеиновой кислоты (дсРНК) из дрожжей и может быть использовано в биотехнологии, фармацевтической промышленности и ветеринарии для производства противовирусных и иммуномодулирующих препаратов.
Известен способ получения дсРНК из киллерных штаммов дрожжей Saccharomyces cerevisiae, включающий разрушение клеток, осаждение суммарных нуклеиновых кислот из клеточного экстракта этанолом, фракционирование и осаждение дсРНК в растворах хлористого лития, очистку дсРНК в водном растворе с помощью хлороформа или смеси хлороформа с изоамиловым спиртом и выделение целевого продукта этанолом (Дужак А.Б., Костомаха А.Н., Лобова Н.Н., Подгорный В.Ф., Носик Н.Н., Ершов Ф.И. Антибиотики и медицина // Биотехнология. 1985. - Т. 30, № 1. - С. 19-21) [1].
Для более полной очистки дсРНК авторы рекомендуют многократное фракционирование хлоридом лития, что приводит к технологическим потерям и снижению выхода целевого продукта. Кроме того, при коцентрациях LiCl 2 моль/белки не осаждаются, а при концентрациях выше 3,5 моль/л осаждаются вместе с дсРНК. А примеси белков и липополисахаридов вызывают пирогенные и аллергенные эффекты при применении препаратов в медицине и ветеринарии. Предусматриваемый известной технологией значительный расход этанола, особенно на стадии осаждения нуклеиновых кислот из клеточного экстракта, обуславливает необходимость принятия специальных мер для обеспечения пожаробезопасности производства, что ведет к увеличению себестоимости продукта.
Наиболее близким техническим решением (прототипом) является способ получения дсРНК из киллерных штаммов дрожжей Saccharomyces cerevisiae (Патент РФ № 2302464, МПК С12Р 12/34, дата публикации 10.07.2007) [2]. Способ предусматривает обработку клеток дрожжей культуральной жидкостью Arthrobacter luteus ATSS 21606 при температуре 30-40°С в течение 15-20 ч, депротоинизацию термообработкой при температуре 75-90°С в течение 5-20 мин, диафильтрацию на разделительном аппарате с полыми волокнами АР-2 с пределом отсечения 100 кДа, фракционирование растворами LiCl (2 и 4 моль/л), обработку хлороформом, осаждение дсРНК в 65%-ном растворе этанола и промывку 96%-ным раствором этанола.
Однако использование в технологии получения дсРНК таких жестких условий, как прогревание при температуре 75-90°С, приводит к «расплетанию» цепей РНК, а механические воздействия при диафильтрации (контакт с большой поверхностью и продавливание через поры под давлением) приводят к деформации структуры дсРНК и нестабильности ее при хранении. Кроме того, прогревание больших объемов до 75-90°С в течение 5-20 мин может приводить к значительным локальным перепадам температур и трудновоспроизводимости процесса получения дсРНК. В связи с вышеизложенным в технологии-прототипе обеспечиваются недостаточный выход дсРНК и его низкая интерферон-индуцирующая активность, а также длительность получения конечного продукта и высокие затраты на его производство.
Техническим результатом заявляемого изобретения является увеличение выхода дсРНК с более высокой чистотой и интерферон-индуцирующей активностью при одновременном снижении времени и затрат на его производство.
Указанный технический результат достигается тем, что в способе получения двуспиральной рибонуклеиновой кислоты (дсРНК) из клеток дрожжей Saccharomyces cerevisiae, согласно изобретению клетки дрожжей разрушают в буфере с рН 7,4, содержащим 10 мМ Трис, 20 мМ ЭДТА и 0,5 М NaCl последовательной обработкой додецилсульфатом натрия в концентрации от 0,5 до 1,0% в течение 20-25 мин при 20-25°С и хлороформом в концентрации до 25% в течение 20-25 мин при 20-25 С; полученную смесь центрифугируют при 6000 об/мин в течение 20 мин, отделяют надосадочную жидкость и ее обрабатывают додецилсульфатом натрия в концентрации от 0,5 до 1,0% в течение 20-25 мин при 4-6°С, повторно центрифугируют полученную смесь при 6000 об/мин в течение 20 мин с отделением надосадочной жидкости; концентрирование дсРНК из надосадочной жидкости проводят в 7-8%-ном растворе ПЭГ 6000 в течение не менее 5 ч при 4°С с последующим центрифугированием при 6000 об/мин в течение 20 мин и растворением полученного осажденного концентрата в воде; фракционирование нуклеиновых кислот осуществляют в 2 моль/л растворе LiCl в течение 5 ч при 4°С с последующим центрифугированием смеси при 6000 об/мин в течение 20 мин и сбором водной фазы; осаждение дсРНК из водной фазы проводят в 3,5 моль/л растворе LiCl в течение 5 ч при 4°С с последующим центрифугированием при 6000 об/мин в течение 20 мин с получением осадка и растворением его в воде, а окончательную очистку и осаждение дсРНК из раствора осуществляют 50-55%-ным раствором этанола. Полученный дсРНК лиофильно высушивают.
В качестве клеток дрожжей Saccharomyces cerevisiae используют штамм ВКПМ Y-448 указанных дрожжей.
Вариант практического осуществления предлагаемого способа иллюстрируется нижеследующими примерами.
Пример 1. Выбор способа разрушения клеток дрожжей и получения раствора дсРНК
В отличие от ДНК плазмид структура дсРНК киллерных дрожжей менее устойчива к действию деградирующих факторов, таких как изменения значений рН, температуры. Поэтому для разрушения клеток дрожжей было исследовано влияние детергентов и растворителей при температурах не выше 20°С и нейтральных значениях рН используемых буферных растворов. При этом критерием эффективности процесса являлась полнота извлечения дсРНК и оцРНК при наименьшем ее загрязнении белками и липидами клеток.
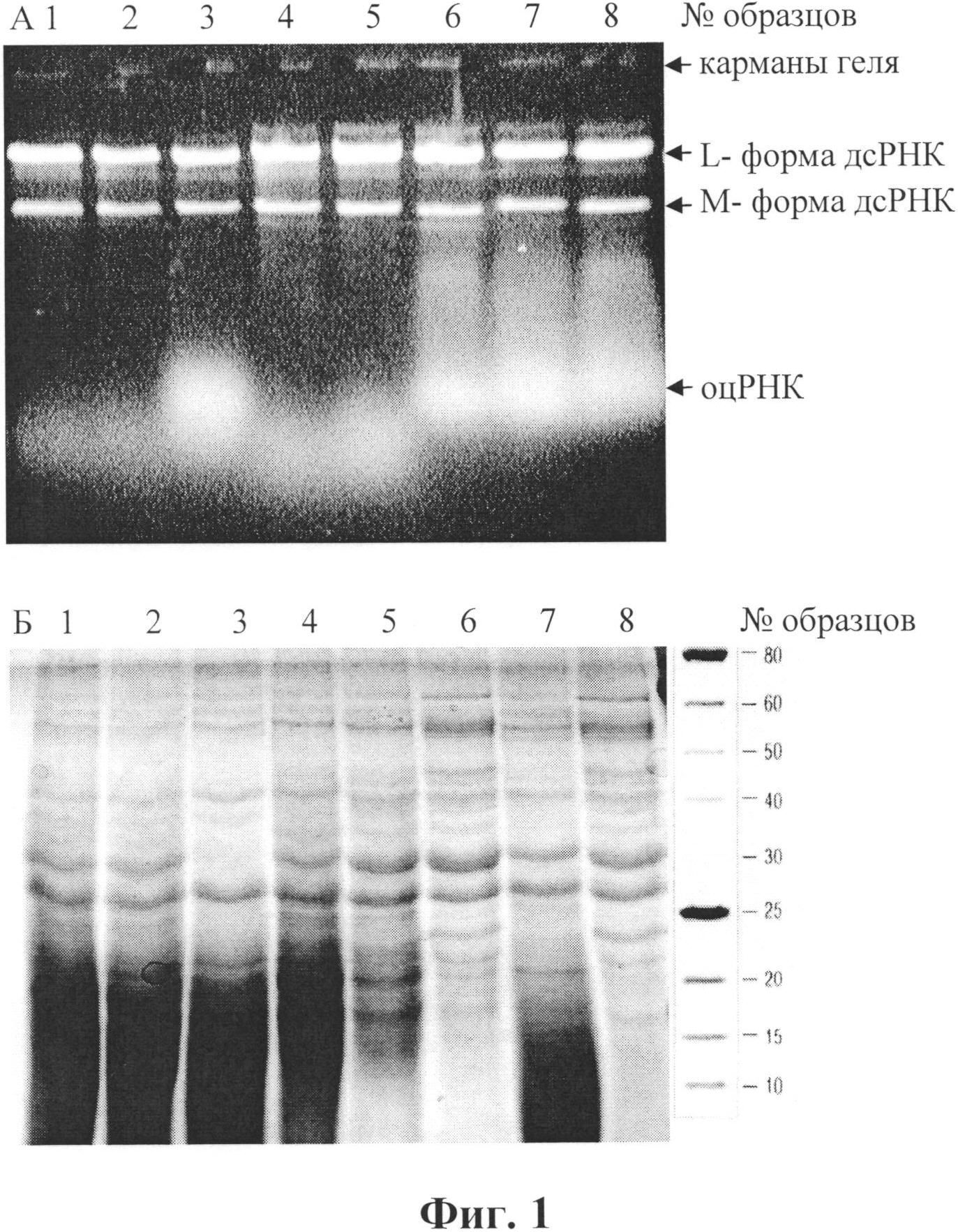
Клеточную массу суспендировали в буфере А (10 мМ Трис, 20 мМ ЭДТА, 0,5 М NaCl, рН 7,4) из расчета на 1 г клеток 2 мл раствора, делили на аликвоты, добавляли ингредиенты и проводили лизис в течение 20 минут (Процедура 1, условия приведены в табл.1). Для оценки влияния различных концентраций детергента использовали исходный 10%-ный раствор додецилсульфата натрия (SDS) и хлороформ в расчетных необходимых количествах, а также последовательности их введения в суспензию дрожжей. После внесения реактивов растворы тщательно перемешивали, не допуская ценообразования. По истечении времени лизиса (Процедура 1) часть проб центрифугировали, отбирали водные растворы и добавляли дополнительно додецилсульфат натрия (SDS) или хлороформ (Процедура 2). Пробы 4-6 перед внесением хлороформа не центрифугировали. Пробы вновь тщательно перемешивали, не допуская ценообразования, и затем центрифугировали. Выход ПК и белков в полученные растворы из клеточного материала исследовали при помощи электрофореза: нуклеиновых кислот - в 1%-ном геле агарозы, белков - в 13%-ном ПААГ. Результаты обрабатывали с использованием компьютерной программы Gel-pro31.
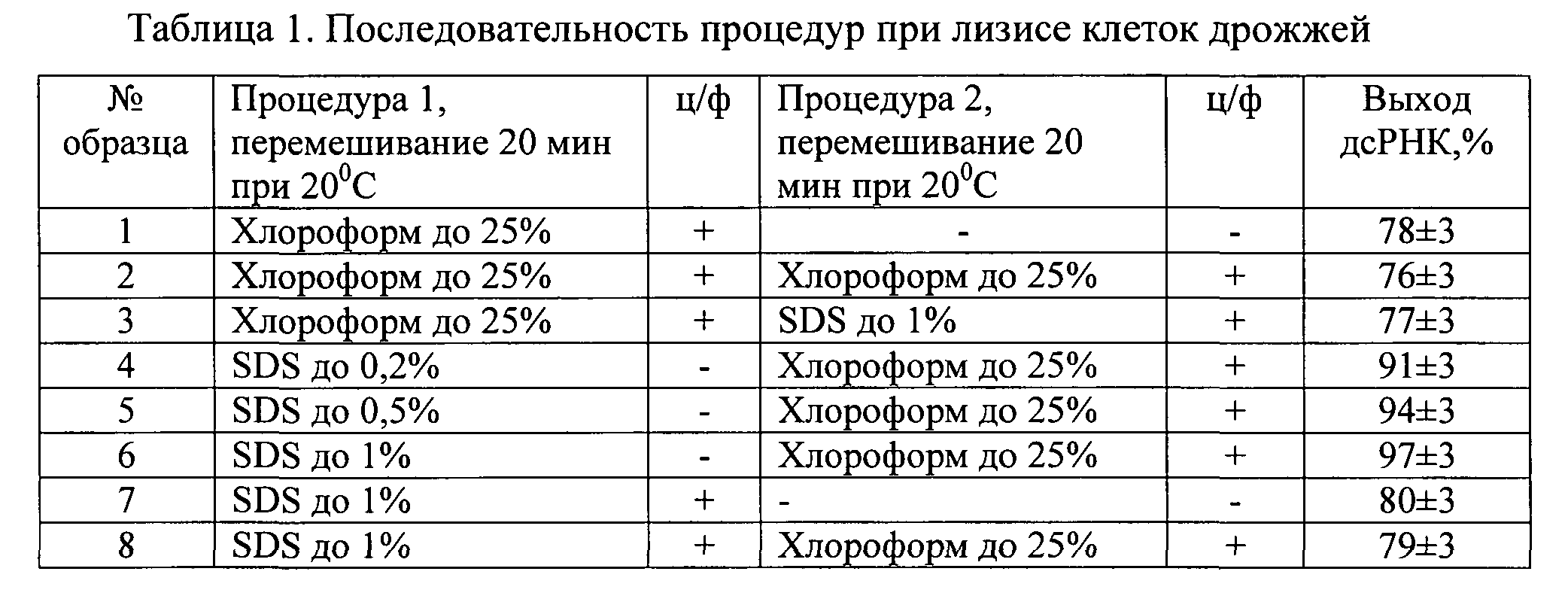
Примечание: ц/ф - центрифугирование 6000 об/мин, 20 мин.
Результаты исследований по переходу в раствор клеточного содержимого представлены на фиг. 1 в виде электрофореграмм образцов растворов после лизиса клеток (табл. 1). Верхний гель (А) - 1%-ная агароза (окраска бромистым этидием); нижний гель (Б) - 13%-ный ПААГ (окраска по Кумасси), справа - маркеры молекулярных масс белков, кДа.
На электрофореграммах видно, что обработка суспензии клеток хлороформом (25%) приводит к их разрушению и частичному выходу в раствор дсРНК и белков (дорожки № 1-3). Повторная обработка раствора, полученного после центрифугирования, хлороформом не способствовала удалению из него белков (дорожка № 2). Обработка того же раствора SDS (до 1%) приводила к удалению части белков, особенно белка с молекулярной массой 30±2 кДа (дорожка № 3). Обработка идентичной суспензии клеток SDS (1%) также вызывала разрушение и выход в раствор дсРНК в количествах, аналогичных, как при обработке хлороформом (дорожки № 7-8). Количество белков, особенно с молекулярными массами выше 30 кДа, в этом случае наблюдалось больше. При повторной обработке раствора, полученного после разрушения клеток SDS и центрифугирования, хлороформом также не наблюдалось удаления из него белков (дорожки № 7 и 8), но при этом наблюдалось удаление низкомолекулярных (ниже 20 кДа) примесей.
Последовательная (и совместная) обработка суспензии клеток SDS и хлороформом приводила к более полному разрушению клеток и выходу в раствор РНК и белков (дорожки №4-6). Отмечено, что при концентрациях раствора SDS 0,5% и 1% выход по дсРНК практически одинаковый, но при 1% концентрации SDS в растворе наблюдалось больше белкового материала и оцРНК.
Примечательно, что при таких относительно быстрых способах разрушения клеток молекулы ДНК в растворе практически не обнаруживаются (отсутствует флуоресцирующий материал в карманах геля агарозы при электрофорезе и последующей окраске бромистым этидием, фиг. 1).
Использование такого способа лизиса обеспечивает эффективную деструкцию клеток без привлечения энергоемкого технологического оборудования для механической дезинтеграции биомассы [1] и без длительной инкубации с культуральной жидкостью Arthrobacter luteus ATSS 21606 [2], что, в свою очередь, снижает затраты на производство продукта.
Пример 2. Выбор концентрации полиэтиленгликоля для концентрирования дсРНК
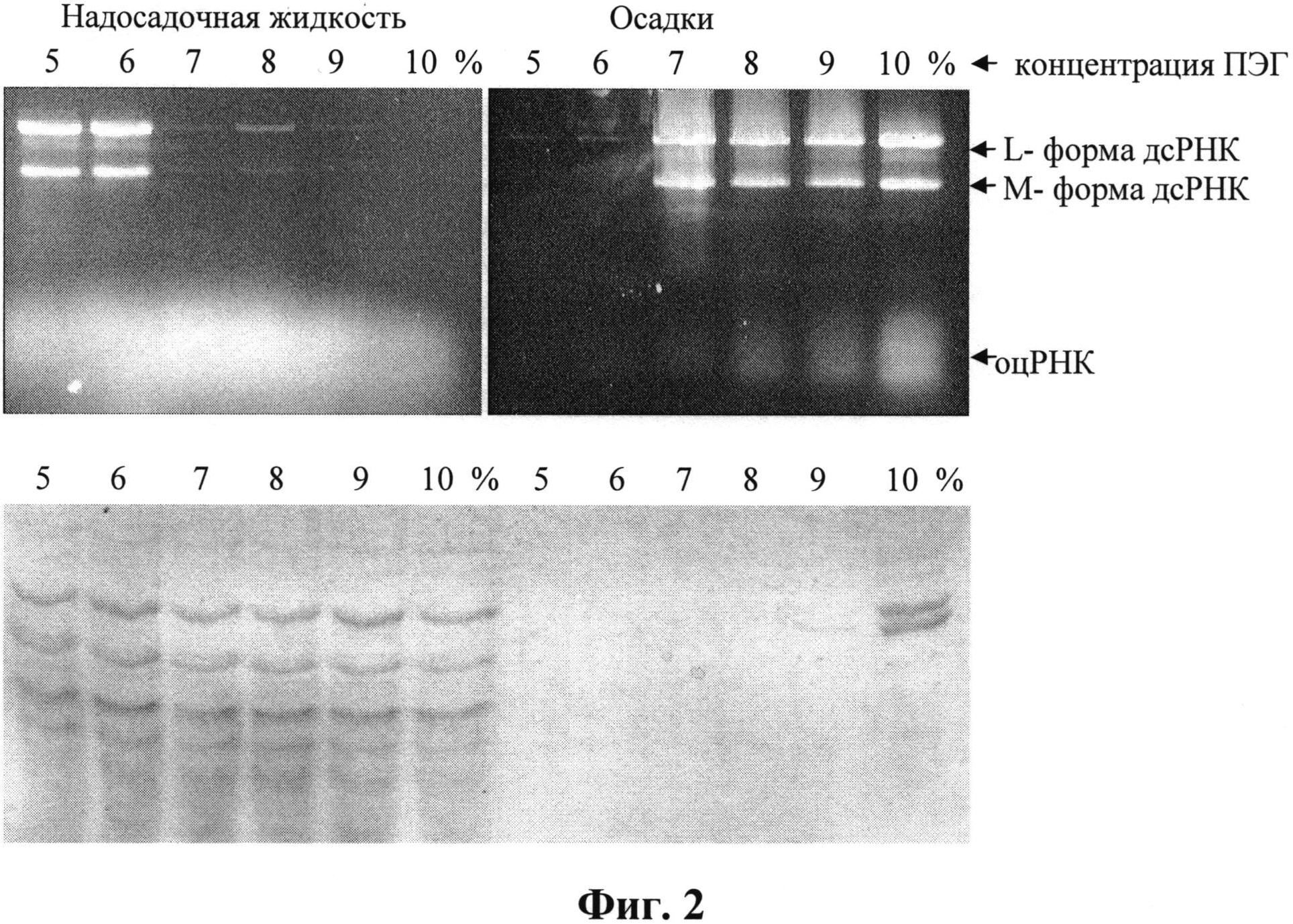
Для исследования распределения компонентов в растворах полиэтиленгликоля (ПЭГ) к лизату клеток, полученному по способу 5, добавляли сухой ПЭГ, перемешивали 20 мин до полного растворения, выдерживали 5 ч при 6°С для формирования осадка и центрифугировали 20 мин при 6000 об/мин. Анализ содержимого осадков исследовали после растворения их в буфере. Результаты анализа представлены на фиг. 2 в виде электрофореграмм образцов после фракционирования в растворах ПЭГ(5-10%). Верхний гель - 1%-ная агароза, нижний - 13%-ный ПААГ.
На фиг. 2 видно, что дсРНК исчезает из надосадочной фракции и обнаруживается в осадке при концентрации ПЭГ выше 7%, тогда как основная масса одноцепочечных РНК продолжает находиться в растворе и лишь при концентрации ПЭГ 10% начинает обнаруживаться в осадке. Белки при этом также обнаруживаются в растворе, и лишь при концентрации ПЭГ 10% в осадке наблюдались белковые полосы, преимущественно с молекулярной массой около 26 и 30 кДа.
Пример 3. Выбор концентраций хлористого лития для фракционирования дсРНК
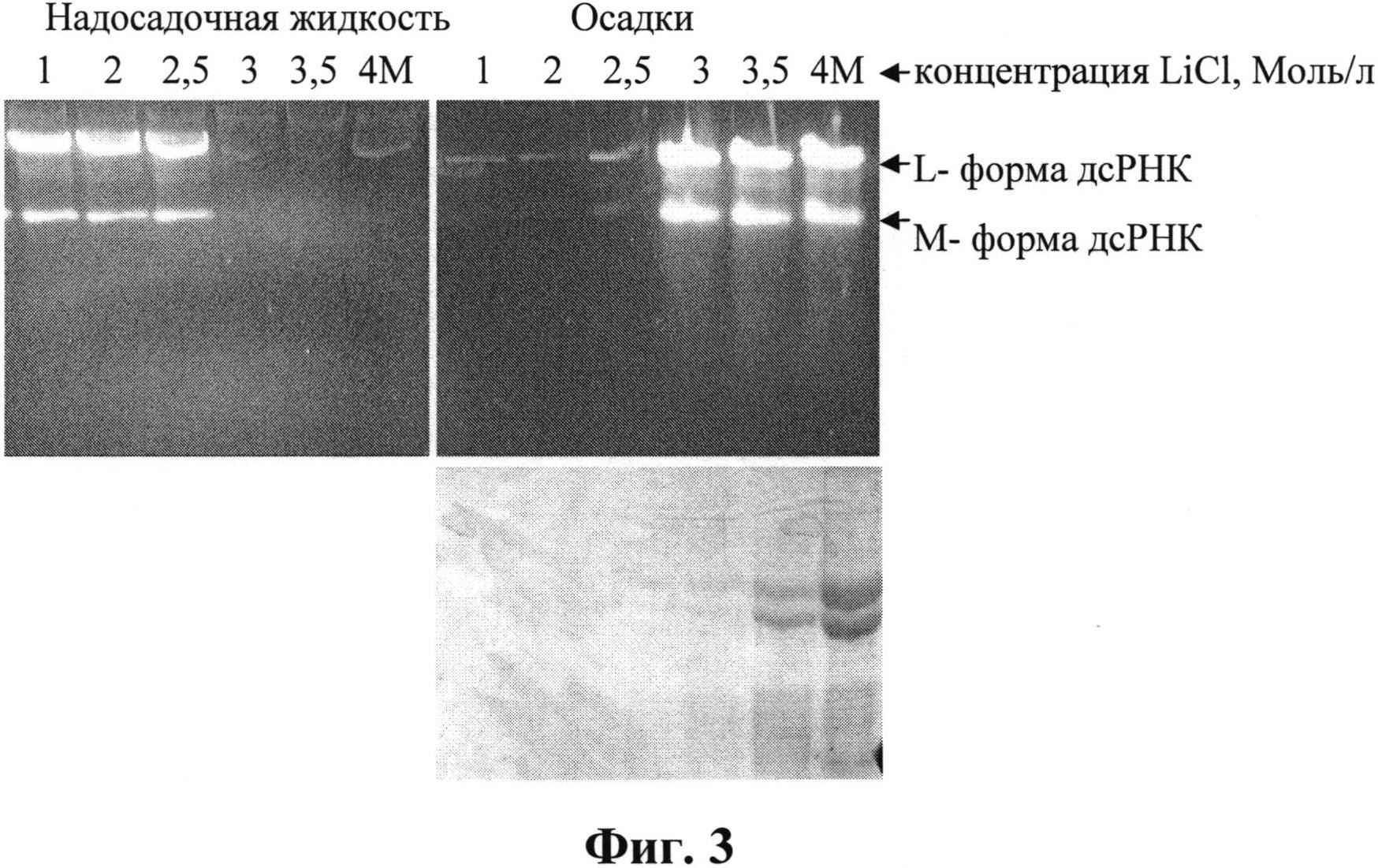
Для исследования распределения компонентов в растворах LiCl, чтобы исключить влияние других солей, использовали осадок, полученный после обработки 10%-ным раствором ПЭГ (фиг. 2), растворенный в воде. К водному раствору добавляли охлажденный раствор LiCl (8 моль/л), перемешивали и выдерживали 5 ч при 6°С для формирования осадка, затем центрифугировали 20 мин при 6000 об/мин. Анализ содержимого осадков исследовали после растворения их в воде. Результаты анализа представлены на фиг. 3 в виде электрофореграмм образцов после фракционирования в растворах LiCl (1-4 моль/л). Верхний гель-1%-ная агароза, нижний - 13%-ный ПААГ.
На фиг. 3 видно, что дсРНК исчезает из надосадочной фракции и обнаруживается в осадке при концентрациях LiCl выше 2,5 моль/л. Белки начинают обнаруживаться в осадке в следовых количествах при концентрации LiCl 3 моль/л и с увеличением концентрации соли они количественно переходят в осадок.
Пример 4. Выбор концентрации этанола для осаждения дсРНК
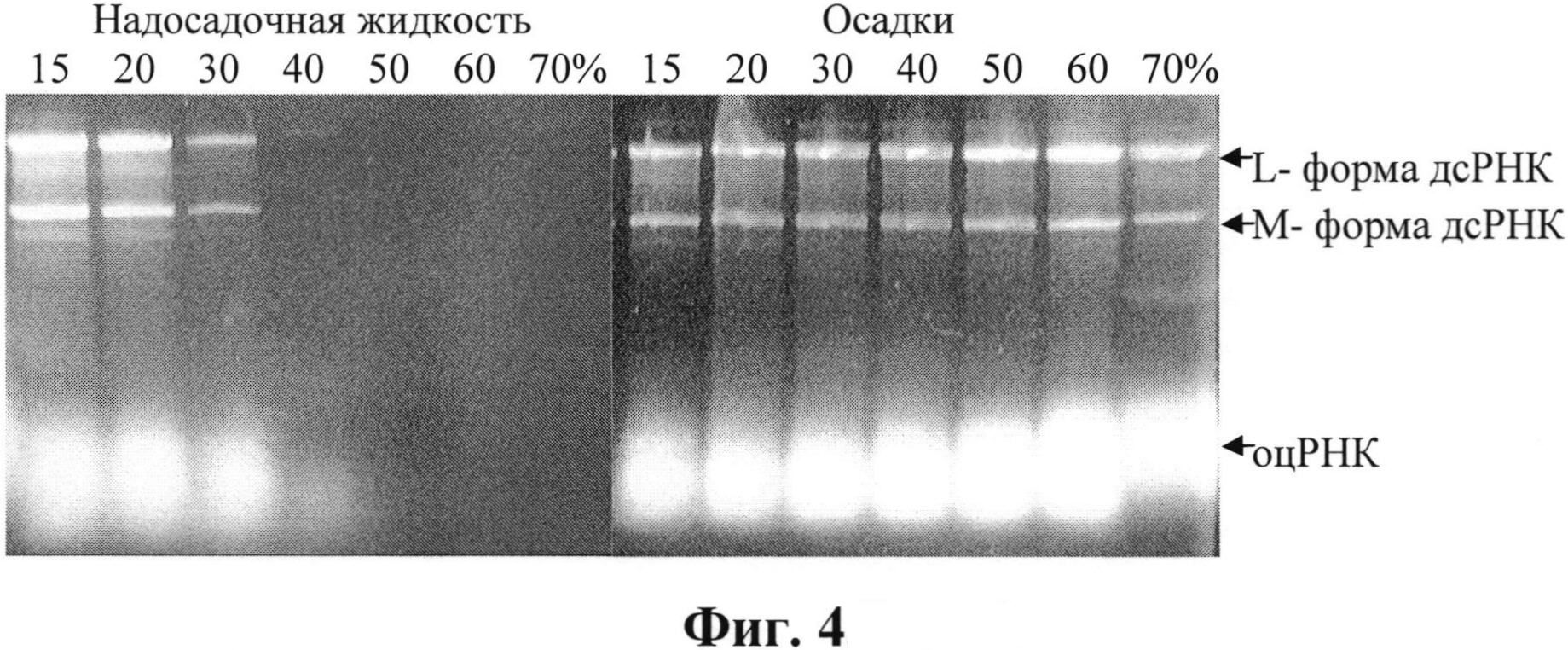
Для исследования распределения компонентов в растворах спирта к лизату клеток добавляли охлажденный этанол, перемешивали и выдерживали 5 ч при минус 20°С для формирования осадка, затем центрифугировали 20 мин при 6000 об/мин. Анализ содержимого осадков исследовали после растворения их в воде. Результаты анализа представлены на фиг. 4 в виде электрофореграмм образцов после фракционирования в растворах этанола (15-70%). Верхний гель - 1%-ная агароза, нижний - 13%-ный ПААГ.
На фиг. 4 видно, что дсРНК начинает обнаруживаться в осадке уже при концентрации этанола 15% и исчезает из надосадочной фракции в 40%-ном растворе этанола. Аналогично ведет себя и одноцепочечная РНК. Распределение белков а данном эксперименте не исследовали. По результатам этого эксперимента можно сделать вывод о том, что на стадии фракционирования этанолом дсРНК от одноцепочечной не отделяется.
Пример 5. Выделение и очистка дсРНК
На основании вышеприведенных экспериментальных данных была составлена следующая схема выделения и очистки дсРНК (табл. 2).

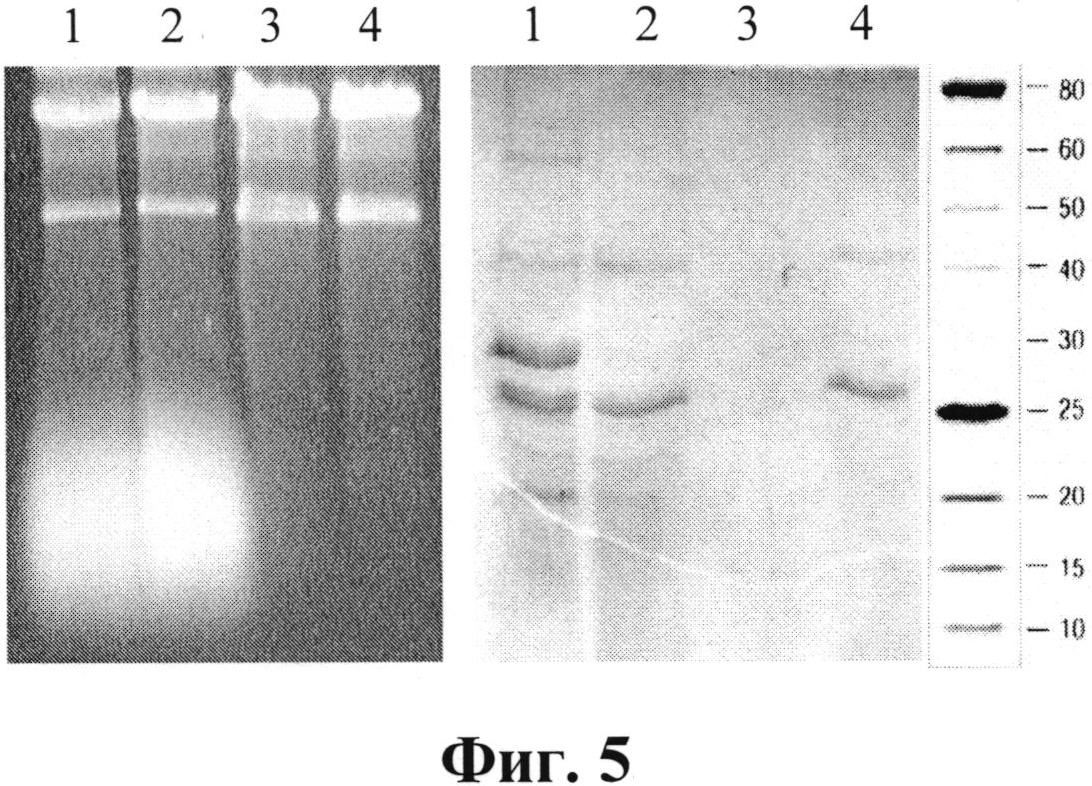
Характеристики фракций при выделении и очистке дсРНК представлены на фиг. 5. Электрофореграммы образцов растворов при выделении и очистке дсРНК содержат:
- слева - 1%-ный агарозный гель, дорожки: 1- экстракт клеток; 2 - экстракт после дополнительной обработки SDS; 3 - раствор из осадка после фракционирования ПЭГ; 4 - конечный препарат;
- справа - 13%-ный ПААГ, дорожки: 1- экстракт клеток; 2 - экстракт после дополнительной обработки SDS; 3 - раствор из осадка после фракционирования ПЭГ; 4 - надосадочный раствор при фракционировании ПЭГ. Сбоку - маркеры молекулярных масс, кДа.
Как видно из фигуры 5, дополнительная обработка экстракта SDS приводит к удалению части белков, особенно белка с молекулярной массой 30±2 кДа (дорожки 2). Осаждение дсРНК в 8%-ном растворе ПЭГ способствует освобождению ее от остальной массы белков, которые остаются в растворе (дорожки 3 и 4 ПААГ) и значительной части оцРНК (дорожка 3 агарозного геля).
Известно, что часть одноцепочечных РНК начинает осаждаться при концентрациях LiCl выше 1 моль/л, поэтому перед тем как осадить дсРНК 3,5 моль/л LiCl, предварительно добавляли его до концентрации 2 моль/л, раствор выдерживали 5 ч при 6°C, центрифугировали и для дальнейшей очистки дсРНК отбирали надосадочную фракцию.
Использование 50-55%-ного раствора этанола вместо 65% и 96%-ного [прототип, 2] позволяет снизить его расход и пожаробезопасность процесса.
Выход дсРНК из 1 г клеток дрожжей Saccharomyces cerevisiae ВКПМ Y-448 составлял не менее 90% от ее исходного содержания, 0,8-1,0 мг. Спектральные характеристики препаратов соответствовали: А260/А280=1,95±0,10, А260/А230=2,0±0,1, что свидетельствует о его высокой чистоте.
Пример 6. Определение интерферон-индуцирующей активности препарата
Определение интерферон-индуцирующей активности проводили на самцах белых беспородных мышей с массой тела 18-22 г по 5 голов в каждой группе, полученных из питомника ФБУН ГНЦ ВБ «Вектор». Свежеприготовленный раствор препарата на основе дсРНК вводили внутрибрюшинно в дозе 0,5 мг дсРНК на кг массы тела в объеме 200 мкл/мышь. Контрольной группе животных вводили изотонический раствор в том же объеме. Через 6, 24 и 48 ч после введения препарата у мышей забирали кровь на анализ. Содержание интерферона определяли микрометодом (Ершов Ф.И., Сайиткулов A.M. Микрометод для изучения индукторов интерферона in vitro/Qonp. Вирусол. - 1984. - Т. 29, №6. - С. 756-757) [3] по подавлению цитопатогенного действия тест-вируса (вируса энцефаломиокардита, (ЕМС), штамм «Колумбия») в дозе 100 ЦПДзо в перевиваемой культуре клеток мышиных фибробластов L-929, выращенных в 96 луночных культуральных панелях (полистироловых планшетах с плоским дном). За титр сывороточного интерферона принимали обратную величину его большего разведения, при котором наблюдается 50% защита клеток от цитопатогенного действия тест-вируса.
Результаты исследования интерферон-индуцирующей активности представлены в таблице 3.

Из таблицы 3 видно, что при введении мышам препарата получаемого дсРНК в дозе (10±2) мкг/животное титр интерферона в сыворотке через 6 ч достигал 640 UE, через 24 ч - 1280 UE, снижаясь до исходных значений к концу вторых суток после введения.
Таким образом, заявляемый способ позволяет получать препарат индуктора интерферона - двуспиральные рибонуклеиновые кислоты дрожжевой клетки с высокой интерферон-индуцирующей активностью, с прочной вторичной структурой. Способ не содержит таких «жестких» процедур, как механическое разрушение, обработка повышенной температурой, и позволяет сохранить высокую биологическую активность препарата.
Кроме того, процедура занимает меньше времени, не требует сложного оборудования и расхода этанола.