Результат интеллектуальной деятельности: ИСКУССТВЕННЫЙ ГЕН MEL-TCI-A0201, КОДИРУЮЩИЙ ПОЛИЭПИТОПНЫЙ БЕЛОК-ИММУНОГЕН MEL-TCI-A0201, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pMEL-TCI-A0201, ОБЕСПЕЧИВАЮЩАЯ ЭКСПРЕССИЮ ИСКУССТВЕННОГО ГЕНА MEL-TCI-A0201 И ИСКУССТВЕННЫЙ БЕЛОК-ИММУНОГЕН MEL-TCI-A0201, СОДЕРЖАЩИЙ МНОЖЕСТВЕННЫЕ CTL- И Th-ЭПИТОПЫ АНТИГЕНОВ МЕЛАНОМЫ
Вид РИД
Изобретение
Изобретение относится к искусственным белкам-иммуногенам, имеющим свойства антигенов меланомы, используемым для создания синтетических полиэпитопных иммунотерапевтических вакцин против меланомы, и может быть использовано в молекулярной биологии, генетической инженерии и медицине.
В настоящее время ведутся многочисленные исследования, направленные на разработку вакцин от различных видов рака. Известные стратегии создания таких вакцин основаны на использовании различных форм раковых антигенов, лизатов раковых клеток, полиэпитопных антигенов, содержащих по несколько Т-клеточных эпитопов, индуцирующих ответ цитотоксических (CTL - cytotoxic T-lymphocyte) и/или хелперных (Th - T-helper) Т-лимфоцитов. При этом используются самые различные подходы: использование модифицированных вирусов или бактерий, кодирующих целевой антиген; ДНК-вакцинация или использование клеточных иммунотерапевтических вакцин.
Значительный интерес представляет иммуногенность клеток меланомы. Были отмечены случаи спонтанной полной ремиссии злокачественной меланомы, ассоциированные со спонтанной индукцией как гуморального, так и Т-клеточного иммунного ответа [1]. Высокая иммуногенность меланомных опухолей позволяет предположить возможность создания эффективной терапевтической меланомной вакцины, использующей последние достижения молекулярной иммунологии и клеточных технологий.
В пионерской в данной области работе были созданы индивидуальные аутологичные вакцины: 64 пациента с меланомой IV стадии были иммунизированы препаратами аутологичной опухолевой ткани, и было показано, что антиген-специфический иммунный ответ может быть индуцирован у многих пациентов [1]. В настоящее время описан ряд высокоиммуногенных белковых антигенов, специфичных для меланомы и некоторых других видов рака, отсутствующих (или практически отсутствующих) в нормальных тканях организма человека [1-3]. Многие из этих антигенов, такие как Melan-A/MART-1, gp100, тирозиназа, MAGE-3 и NY-ESO-1, были использованы для разработки кандидатных вакцин, ряд которых в настоящее время проходит клинические испытания [1,3]. Результаты клинических испытаний свидетельствуют о незначительном количестве побочных эффектов вакцинации, таких как гиперчувствительность в месте инъекции и индукция аутоиммунных реакций, таких как витилиго (при вакцинации белками, ассоциированными с дифференцировкой меланоцитов) [1].
Считается, что наиболее эффективным для лечения неопластических заболеваний должен быть комплексный подход, включающий как хирургические методы, так и методы химиотерапии наряду с индивидуализированной иммунотерапией злокачественных опухолей. В течение последнего десятилетия были разработаны принципиально новые подходы к иммунотерапии неопластических заболеваний, основанные на использовании клеточных технологий - индукции Т-клеточного иммунного ответа ex vivo. Вакцины, создаваемые на основе клеточных технологий, продемонстрировали многообещающие результаты. В 2010 году одна из таких иммунотерапевтических вакцин - Sipuleucel-T (Provenge) - вакцина против рака простаты - была одобрена для использования в клинической практике [4].
Однако подобные вакцины имеют существенные недостатки: как правило, в настоящее время иммунотерапевтические клеточные вакцины представляют собой индивидуализированные препараты, приготавливаемые на основе лизата аутологичных опухолевых клеток, полученных хирургическим путем. Таким образом, эти препараты помимо опухолевых антигенов содержат большое количество белков, присутствующих в нормальных тканях организма - такой подход чреват развитием в дальнейшем у пациента аутоиммунных реакций, кроме того, наряду с целевыми антигенами лизаты раковых клеток могут содержать и потенциально патогенные молекулярные факторы. К тому же, при использовании такого подхода достаточно сложно добиться высокого уровня активации цитотоксических Т-лимфоцитов, поскольку презентация антигенов, захваченных в результате эндоцитоза, как правило, осуществляется по MHC-II-зависимому механизму - при этом используются незрелые дендритные клетки (ДК), обладающие высокой способностью к фагоцитозу. Показано, что способность незрелых ДК индуцировать ответ цитотоксических CD8+ Т-лимфоцитов существенно ниже, чем у зрелых ДК [5].
Один из обещающих подходов к созданию новых эффективных и безопасных вакцин - создание искусственных полиэпитопных антигенов [6,7]. Такие вакцины по сравнению с вакцинами, создаваемыми на основе более традиционных подходов, обладают следующими преимуществами, а именно:
1) они не содержат полноразмерных молекулярных структур патогенов, которые могут являться факторами патогенности и/или могут ингибировать формирование протективного иммунитета или стимулировать развитие аутоиммунных реакций;
2) полиэпитопы могут включать в свой состав большое количество CTL- и Т-хелперных эпитопов из раковых антигенов;
3) они могут быть спроектированы с учетом распространенности различных алломорф молекул HLA I класса в целевой человеческой популяции либо с учетом генетических особенностей конкретного пациента;
4) полиэпитопы могут быть сконструированы так, чтобы максимизировать эффективность процессинга и презентации большинства целевых эпитопов [8-12];
5) для увеличения эффективности индукции ответа Т-лимфоцитов целевые полиэпитопы могут содержать дополнительные сигнальные последовательности (например, N-концевой убиквитин, N-концевой лидерный пептид и C-концевой фрагмент белка LAMP-1 человека) [13-15].
В настоящее время известно большое количество искусственных вакцинных конструкций, содержащих множественные CTL-эпитопы. В частности, описана полиэпитопная конструкция, содержащая семь смежных минимальных HLA-A2-рестриктированных CTL-эпитопов ВИЧ-1 [16], поли-CTL-эпитопная вакцина против папиломавируса человека [17], поли-CTL-эпитопная вакцина против вируса гепатита С [18], полиэпитопные вакцины от меланомы [19, 20] и т.д. Иммуногенность этих конструкций была подтверждена многочисленными исследованиями, в частности [19, 20].
Наиболее близким аналогом является полиэпитопная конструкция для иммунотерапии меланомы, содержащая десять HLA-A2 эпитопов из пяти антигенов меланомы [19, прототип]. Было показано, что данная искусственная полиэпитопная вакцинная конструкция является иммуногенной, при этом линии CTL, извлеченные из вакцинированных HLA-A2 трансгенных мышей были способны лизировать клетки меланомы iv vitro. Полученные данные свидетельствуют о применимости полиэпитопных вакцин для иммунотерапии меланомы.
Вместе с этим можно отметить несколько важных моментов, которые отличают изобретение от прототипной конструкции. Во-первых, для конструировании полиэпитопа использовалось десять CTL эпитопов, тогда как заявляемый искусственный ген кодирует 19 CTL эпитопов. Во-вторых, прототип не содержит CD4+Т-хелперных эпитопов, тогда как заявляемый искусственный ген кодирует 45 Т-хелперных эпитопов антигенов меланомы, необходимых для индукции ответа CD4+Т-лимфоцитов, которые, как известно, усиливают ответы CD8+CTL [41]. В третьих, в составе прототипа эпитопы объединялись последовательно стык в стык без спейерных последовательностей, оптимизирующих связывание пептидов с ТАР и высвобождение пептидов в результате протеасомного или иммунопротеасомного расщепления, что необходимо для эффективной индукции Т-клеточного ответа [9, 22]. В-четвертых, при конструировании полиэпитопов не принималось во внимание количество нецелевых эпитопов, которые могут образовываться на стыках. В-пятых, не проводилось поиска оптимального размещения эпитопов в рамках полиэпитопной конструкции [22]. И, наконец, при оценке иммуногенных свойств прототипа не был использован положительный контроль, то есть не было проведено сравнение с иммунным ответом на полноразмерные антигены меланомы. В отличие от прототипа при оценке иммуногенности полиэтипопной конструкции MEL-TCI-A0201 было проведено сравнение его иммуногенных свойств с полноразмерным белком MART1. Было показано, что, несмотря на то что в состав MEL-TCI-A0201 входит всего четыре эпитопа MART1, его эффективность индукции Т-клеточного ответа в системе ex vivo с использованием клеток меланомы Mel Is (HLA-A*0201+, MART1+) сравнима с ответом на конструкцию, кодирующую полноразмерный антиген MART1. Учитывая, что в состав конструкции MEL-TCI-A0201 входят также CTL-эпитопы из других антигенов меланомы, таких как NY-ESO-1, MAGE-A1, MAGE-A3, MAGE-АН, MAGE-C1, то можно ожидать, что заявляемый иммуноген будет также индуцировать иммунный ответ против клеток меланомы, положительных по этим антигенам антигенам.
Техническим результатом заявляемого изобретения является создание с использованием компьютерного дизайна более оптимизированного искусственного полиэпитопного Т-клеточного иммуногена MEL-TCI-A0201, способного индуцировать специфический Т-клеточный иммунный ответ против антигенов меланомы, путем рационального размещения целевых Т-клеточных эпитопов в составе полиэпитопного иммуногена и выбора оптимальных спейсерных аминокислотных последовательностей, фланкирующих эпитопы в составе полиэпитопной конструкции
Указанный технический результат достигается путем компьтерного дизайна искусственного белка-иммуногена MEL-TCI-A0201, имеющего аминокислотную последовательность, приведенную на фиг.2, и содержащего множественные цитотоксические рестриктированные HLA-A*0201 и Т-хелперные эпитопы антигенов меланомы NY-ESO-1, MART1, MAGE-A1, MAGE-A3, MAGE-АН, MAGE-C1, объединенные с использованием спейсерных аминокислотных остатков, причем N-конец полиэпитопа содержит сигнальный пептид белка HER2 (Р04626), а С-конец включает 11 последних аминокислотных остатков белка LAMP-1 человека. Дизайн полиэпитопной конструкции нацелен на увеличение эффективности процессинга пролиэпитопной конструкции и презентации целевых эпитопов, так как имеются убедительные доказательства из уровня техники, что оптимизация процессинга увеличивает иммуногенность полиэпитопной вакцинной конструкции [9, 22]. При этом учитывается взаимное расположение эпитопов в составе полиэпитопной конструкции, рассчитывается оптимальная спейсерная последовательность для каждой пары эпитопов и минимизируется количество нецелевых эпитопов в полиэпитопной конструкции.
Указанный технический результат достигается также путем конструирования рекомбинантной плазмидной ДНК pMEL-TCI-A0201, несущей ген искусственного полиэпитопного белка MEL-TCI-A0201 под контролем промотора CMV, обеспечивающего экспрессию последнего в клетках млекопитающих, которая имеет размер 6952 п.н. и состоит из следующих фрагментов (фиг.4):
- NheI-HindIII - векторного фрагмента ДНК плазмиды pcDNA3.1(-) размером 5423 п.н.;
- NheI-HindIII - фрагмента размером 1535 п.н., содержащего ген MEL-TCI-A0201.
Для того чтобы пояснить принцип конструирования искусственного полиэпитопного белка-иммуногена MEL-TCI-A0201, приведем следующие пояснения, представленные ниже.
Поэтому поиск пептидов, способных связываться с достаточно высокой аффинностью с широким спектром аллельных вариантов молекул HLA, имеет важное значение.
Важную роль в процессинге эндогенных антигенов играет протеасома - внутриклеточный мультисубъединичный протеолитический комплекс [28, 29]. Показано, что протеасома генерирует C-конец пептидов, связывающихся с молекулами МНС класса I [30, 31], таким образом, при выборе эпитопов необходимо учитывать специфичность протеасомного расщепления целевых антигенов. Пептиды, полученные в результате расщепления белков протеасомой, избирательно связываются гетеродимерным комплексом TAP (транспортеры, ассоциированные с процессингом) и транспортируются в эндоплазматический ретикулум (ЭПР), где связываются с молекулами MHC класса I и образованные комплексы транспортируются на поверхность клетки [23-25,32].
В результате проведенного анализа литературы для дизайна полиэпитопной конструкции, предназначенной для иммунотерапии меланомы, целевые (оптимальные) эпитопы выбирались из шести наиболее иммуногенных антигенов:
1. Cancer/testis antigen 1 (CTAG1A, NY-ESO-1) (P78358) размером 180 аминокислот.
2. MART1, Melanoma antigen recognized by T-cells 1 (Q16655), размером 118 а.к.
3. MAGE-A1 (P43355) размером 309 а.к.
4. MAGE-A11 (CT1.11) (P43364) размером 429 а.к.
5. MAGE-A3 (P43357) размером 314 а.к.
6. MAGE-C1 (O60732) размером 1142 а.к.
Предсказание эпитопов в указанных антигенах проводилось с помощью созданного авторами ранее оригинального программного обеспечения TEpredict [33], позволяющего учесть (иммуно)протеасомный процессинг, аффинность связывания олигопептидов с TAP, а также провести выбор эпитопов с учетом частот встречаемости алломорф молекул HLA в целевой человеческой популяции.
При создании полиэпитопной вакцинной конструкции необходимо обеспечить максимально эффективную индукцию Т-клеточного иммунного ответа на включенные в ее состав антигенные пептиды (эпитопы).
Поставленная задача решается с помощью выбора оптимального размещения целевых Т-клеточных эпитопов в составе полиэпитопного иммуногена и выбора оптимальных спейсерных аминокислотных последовательностей для оптимизации процессинга эпитопов и увеличения иммуногенноти полиэпитопной конструкции [9-22], а также с помощью выбора специальных сигнальных последовательностей, оптимизирующих МНС I- и/или МНС II-зависимую презентацию антигена [8-15].
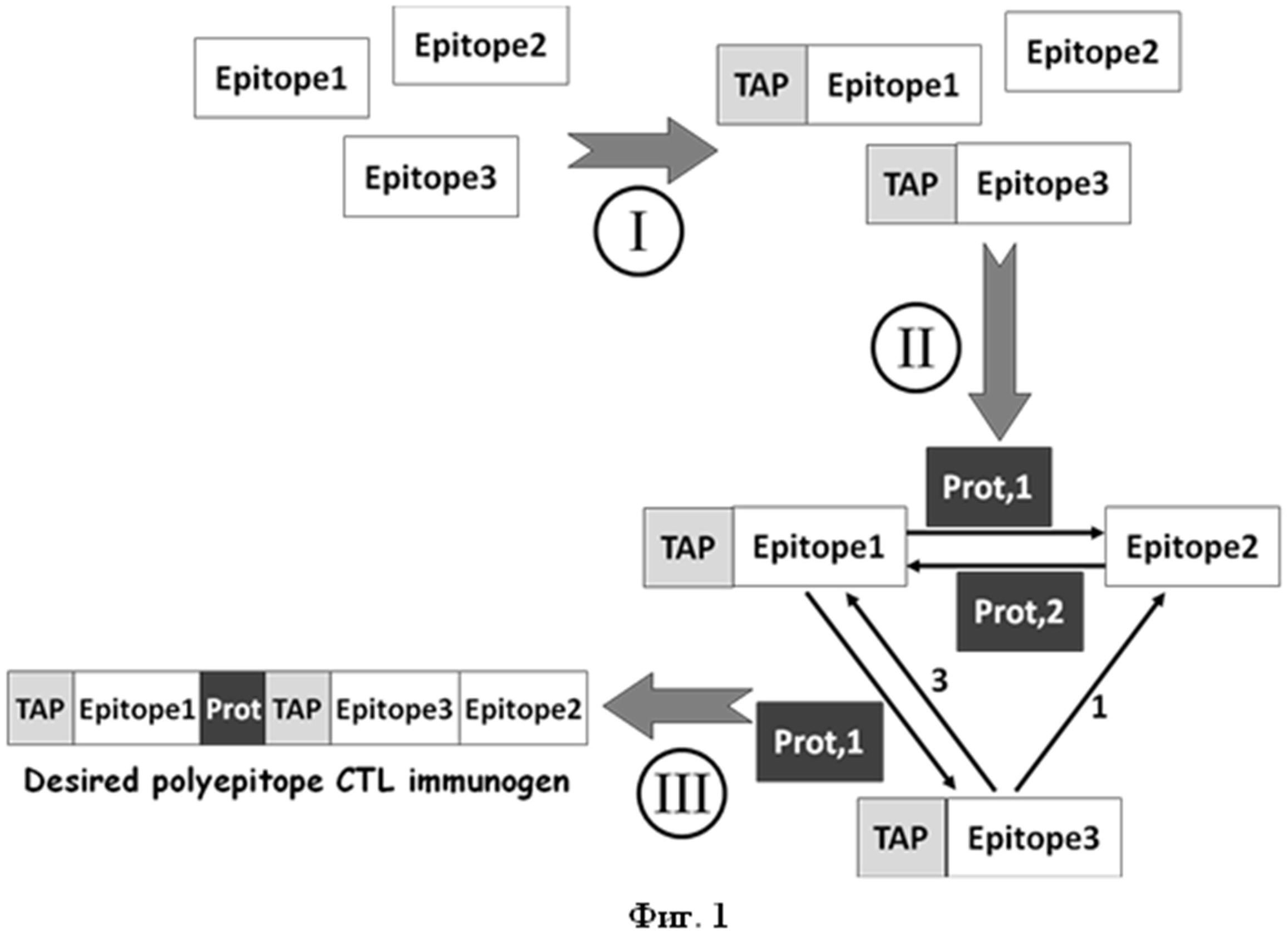
Дизайн искусственного полиэпитопного Т-клеточного иммуногена MEL-TCI-А0201 проведен с использованием разработанного авторами ранее оригинального программного обеспечения PolyCTLDesigner [34-35] (Фиг.1). Анализ лизата клеток 293Т, трансфицированных плазмидой pMEL-TCI-A0201, показал, что искусственный полиэпитопный белок MEL-TCI-A0201 не только эффективно синтезируется, но также подвергается эффективному процессингу в трансфицированных клетках (Фиг.9), что по замыслу полностью соответствует его дизайну.
Ниже приведен перечень графических материалов, иллюстрирующих заявляемое изобретение.
На фиг.1 представлен алгоритм работы программы PolyCTLDesigner.
На фиг.2 приведена аминокислотная последовательность полиэпитопного белка иммуногена MEL-TCI-A0201.
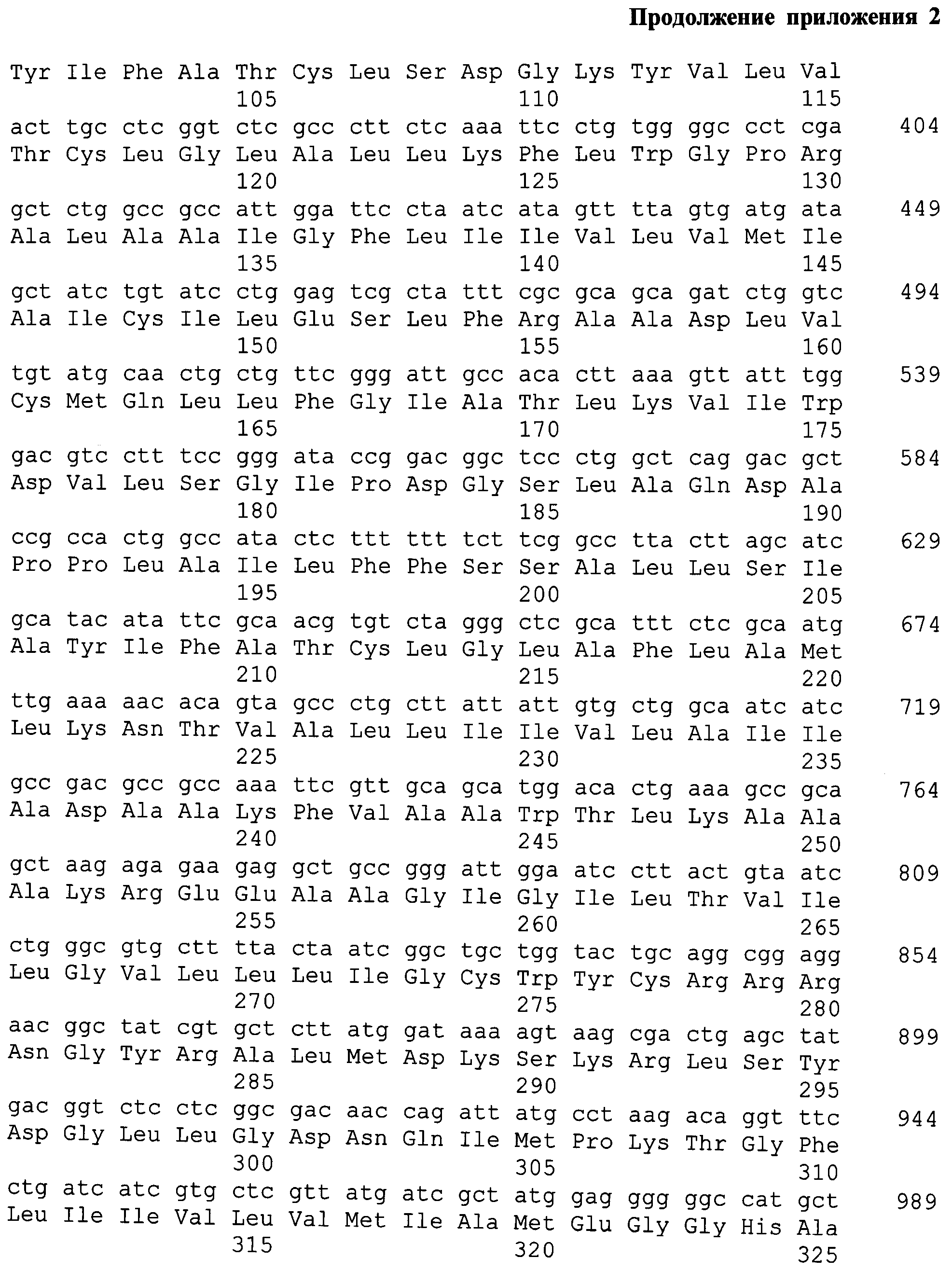
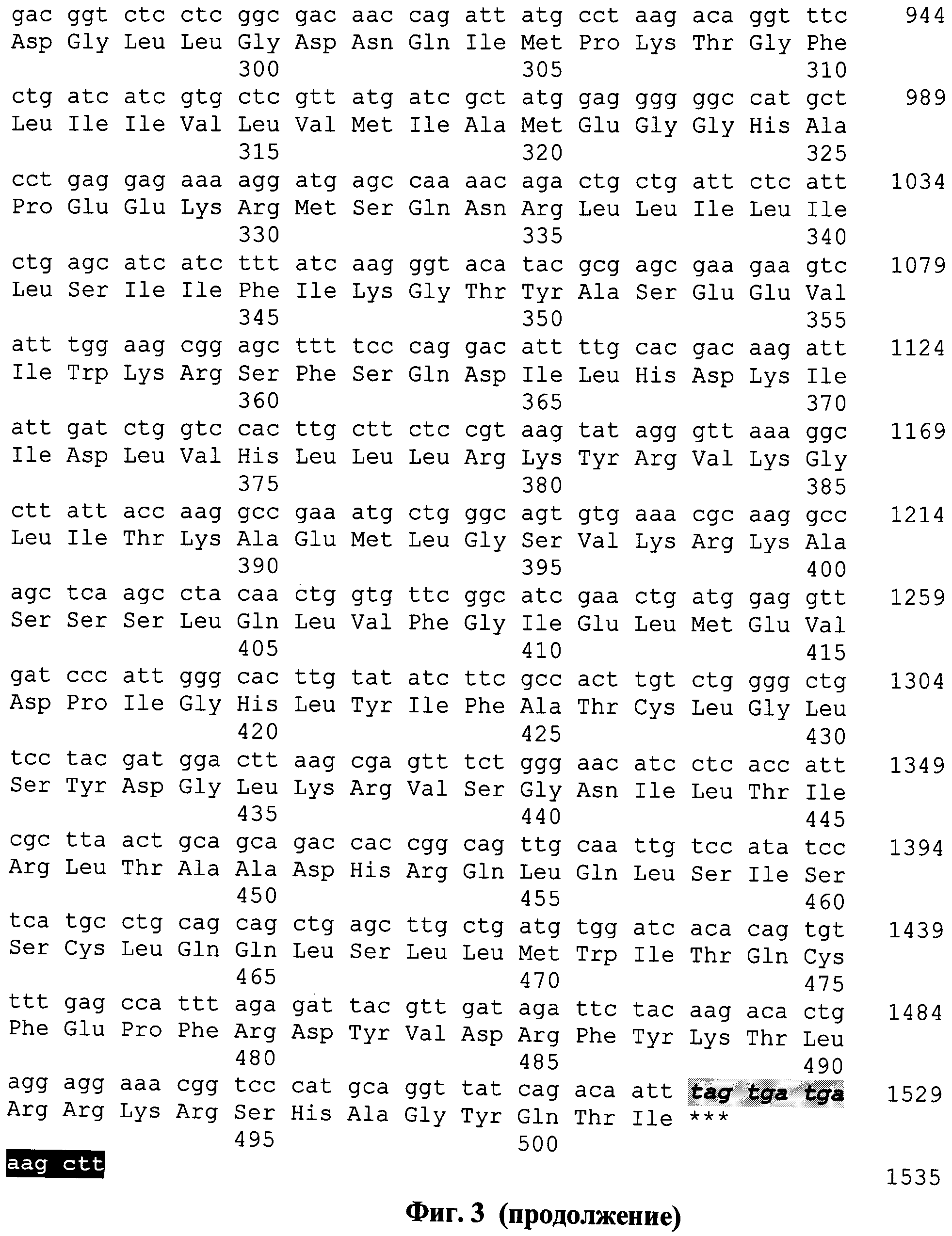
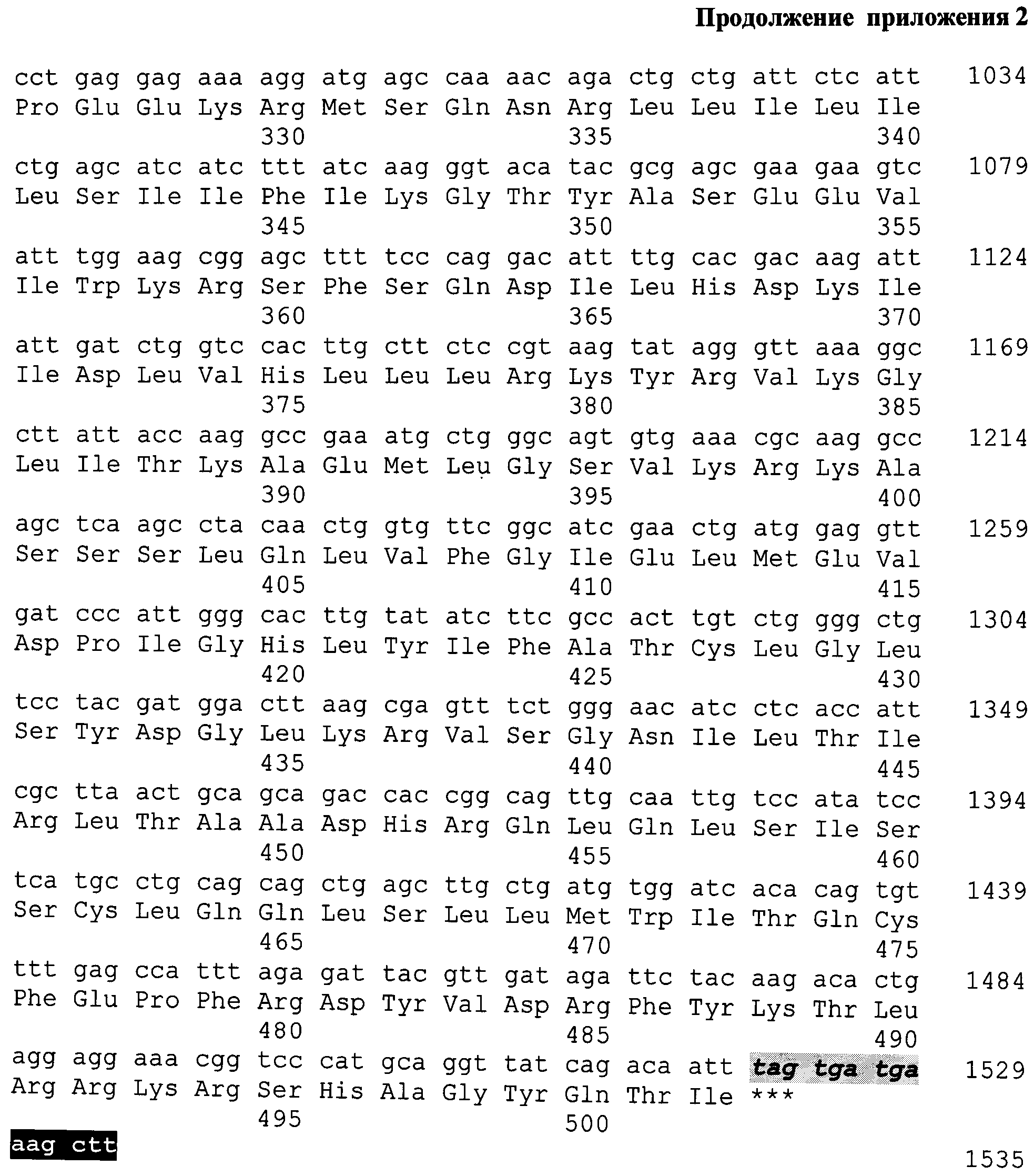
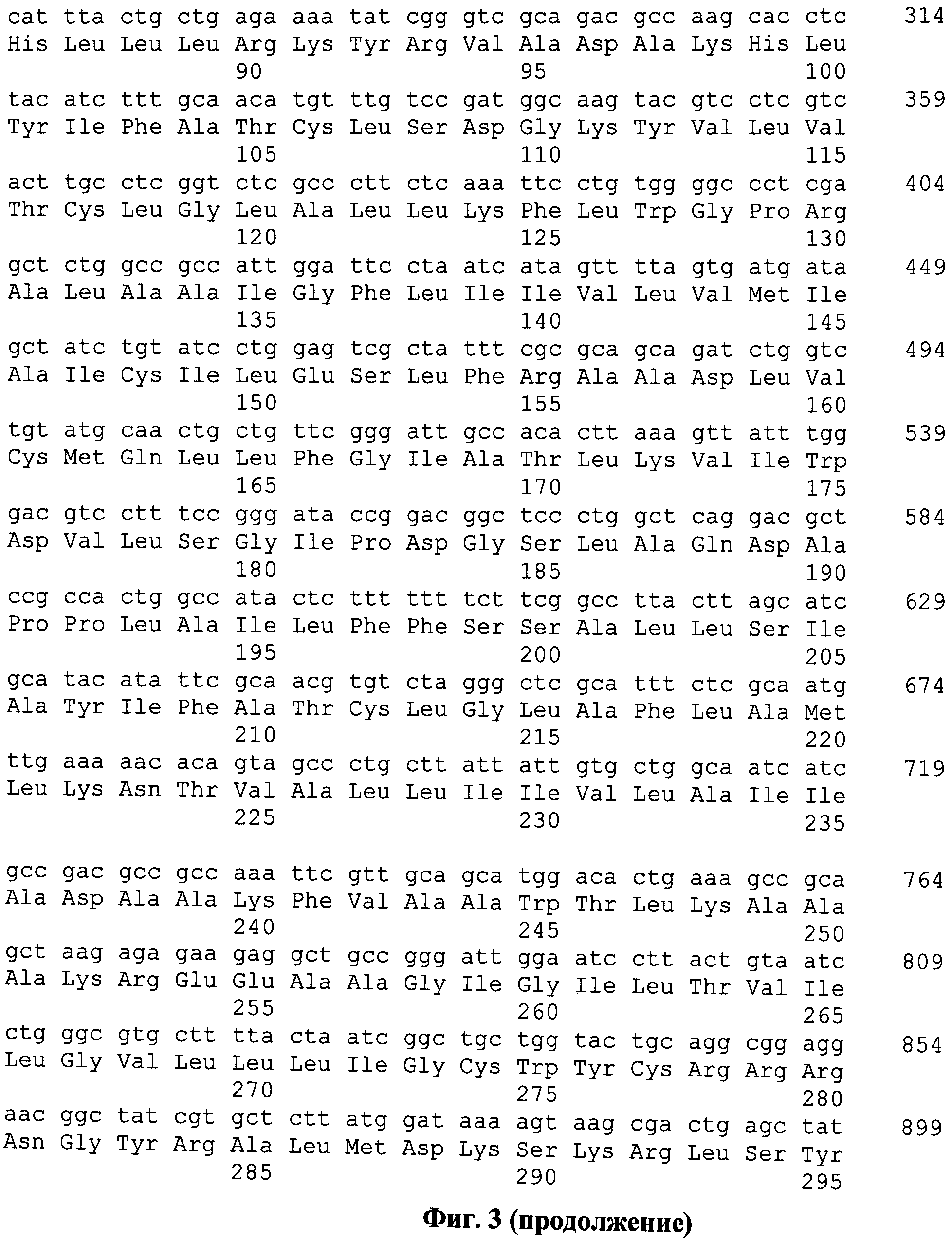
На фиг.3 представлены нуклеотидная и аминокислотная последовательности искусственного гена, кодирующего полиэпитопный иммуноген MEL-TCI-A0201.
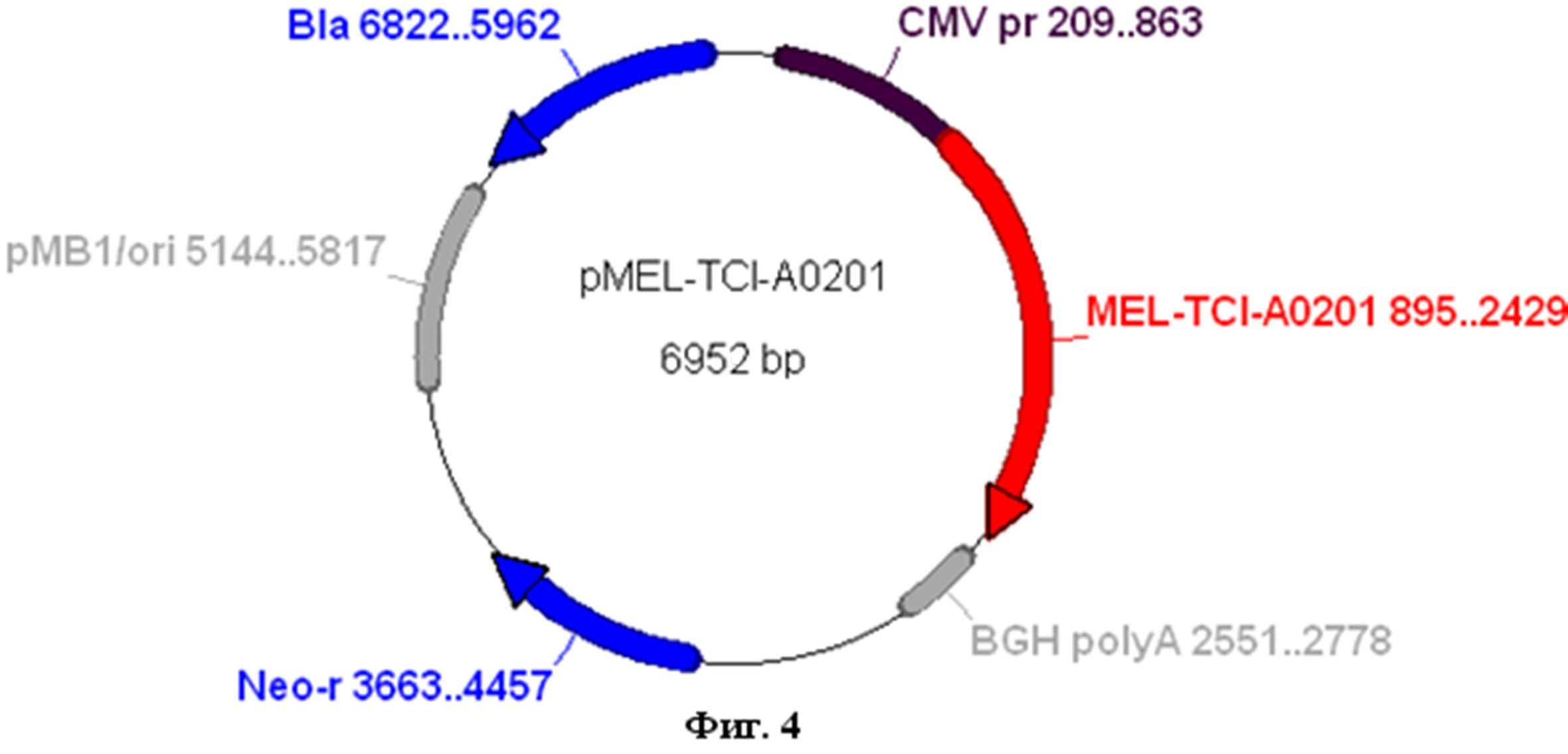
На фиг.4 изображена физическая и генетическая карта рекомбинантной плазмиды pMEL-TCI-A0201.
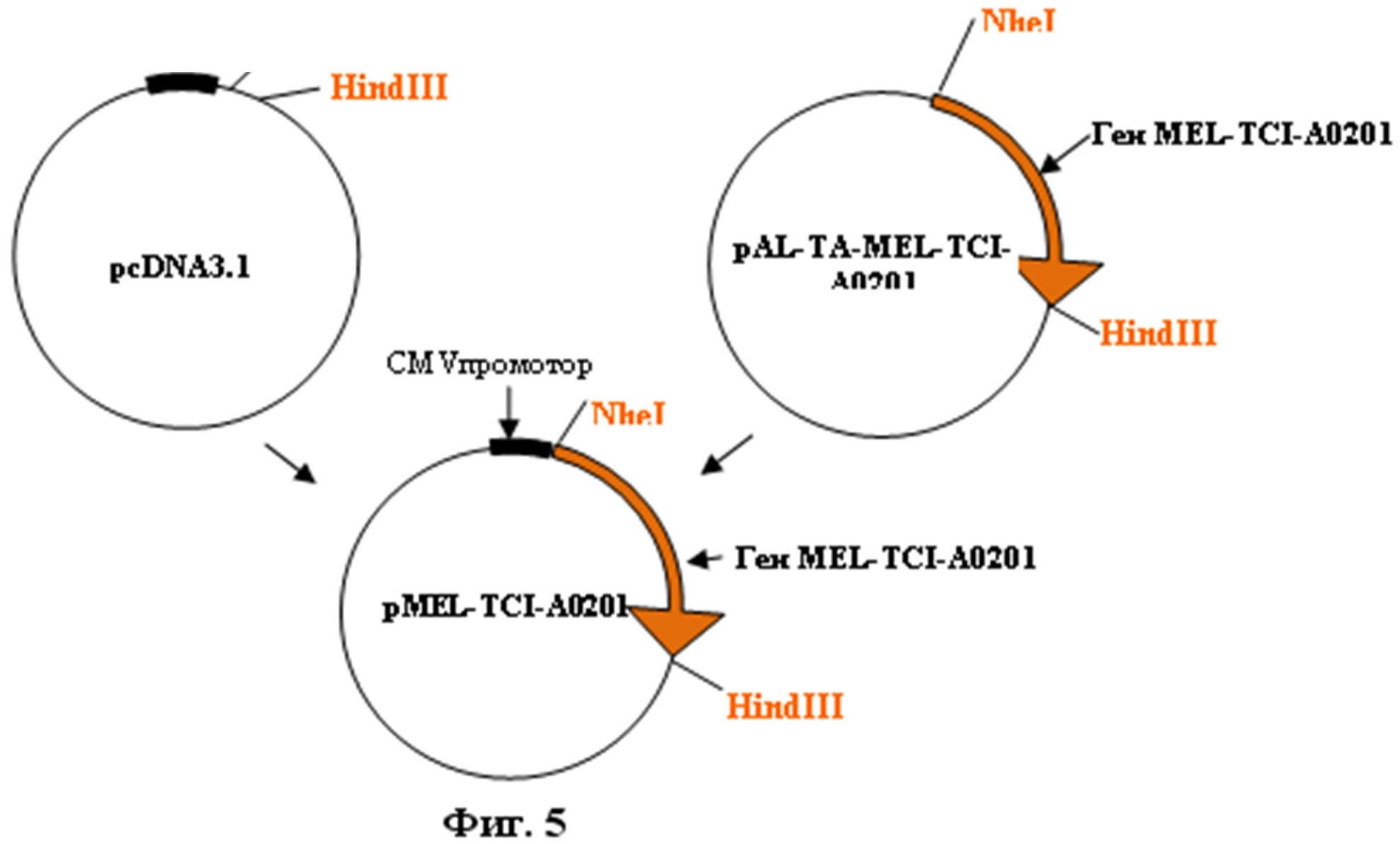
На фиг.5 приведена схема конструирования рекомбинантной плазмидной ДНК pMEL-TCI-A0201.
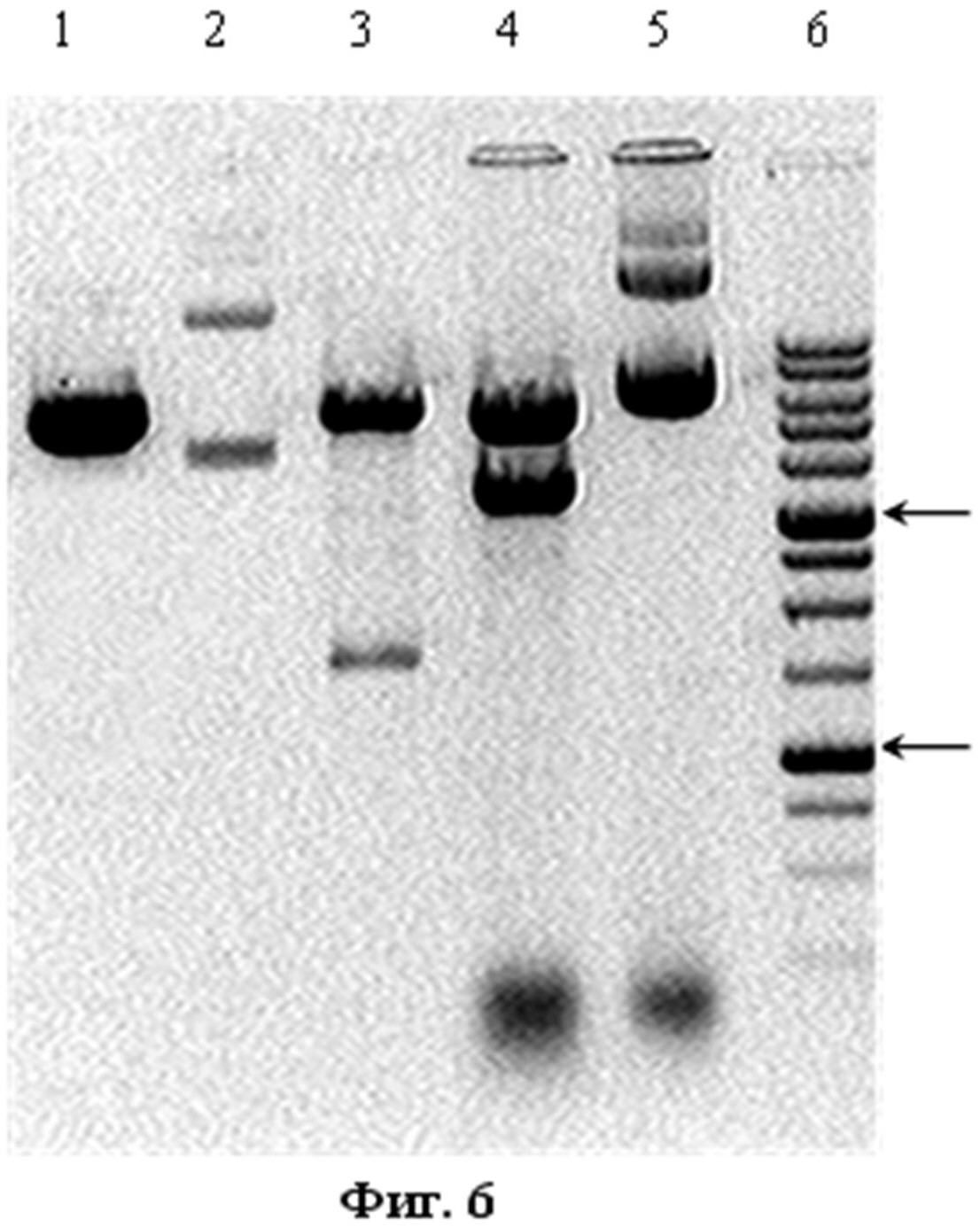
На фиг.6 представлена электрофореграмма в 1% агарозном геле. Фрагменты ДНК после гидролиза плазмид рестриктазами NheI и HindIII.
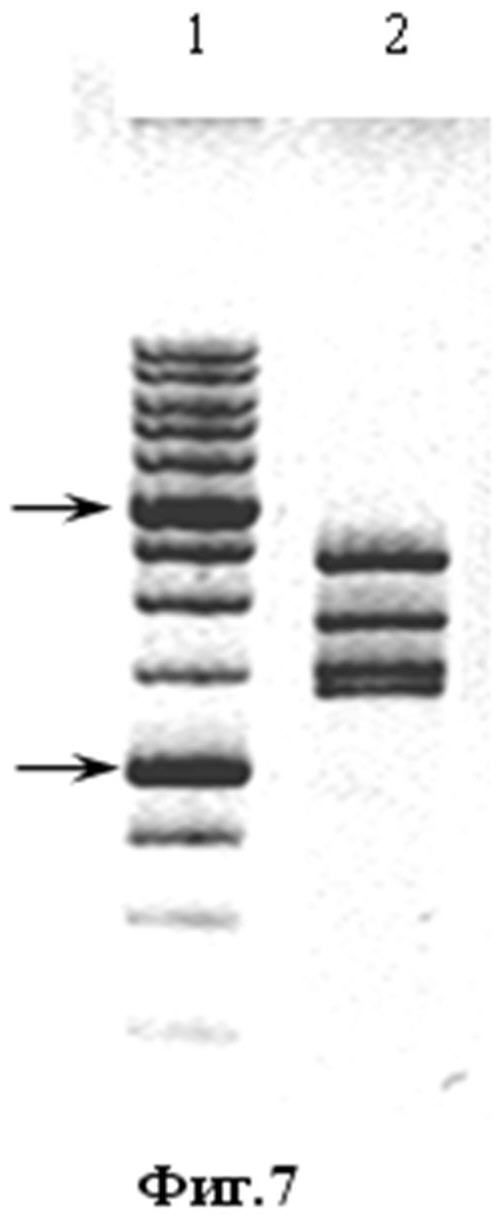
На фиг.7 изображена электрофореграмма в 1% агарозном геле. Фрагменты ДНК после гидролиза плазмиды pMEL-TCI-A0201 рестриктазами BglII и PsiI.
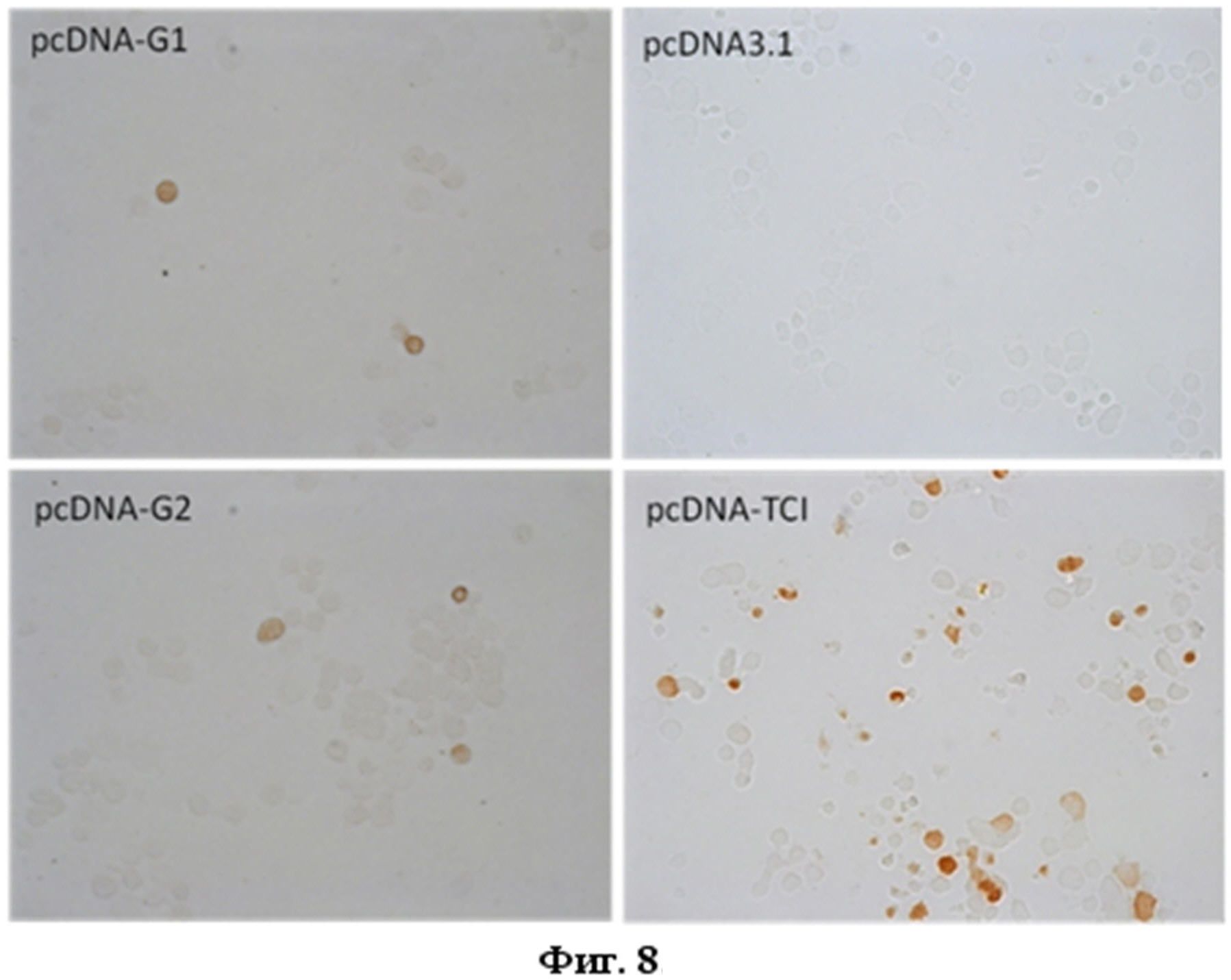
На фиг.8 представлено иммунохимическое окрашивание препаратов клеток 293Т, трансфецированных плазмидой ДНК pMEL-TCI-A0201 (pcDNA-G1).
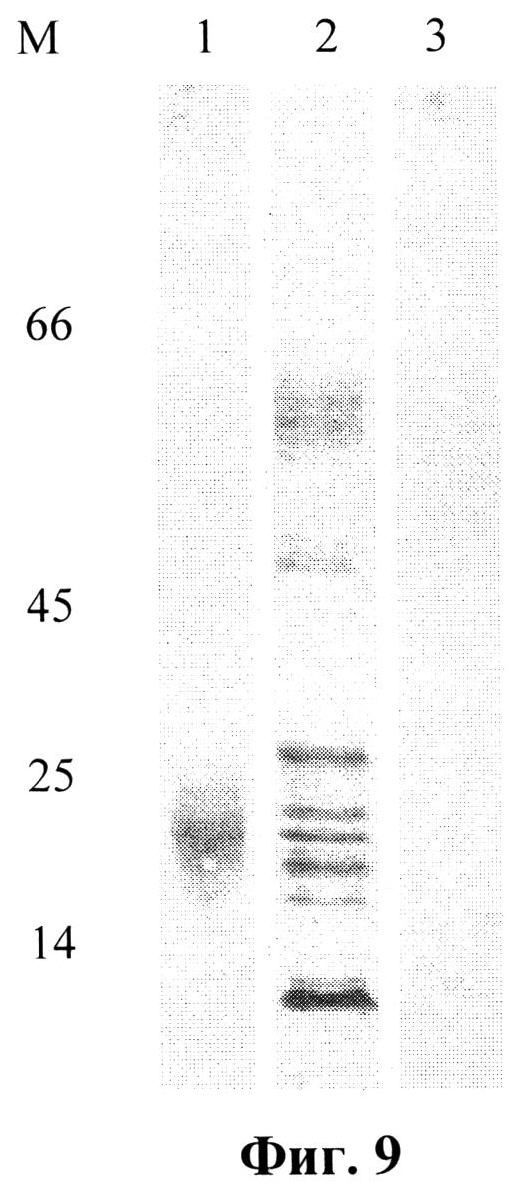
На фиг.9 приведен иммуноблотинг белков после разделения в 15% ПААГ с моноклональными антителами 29F2 (к маркерному эпитопу).
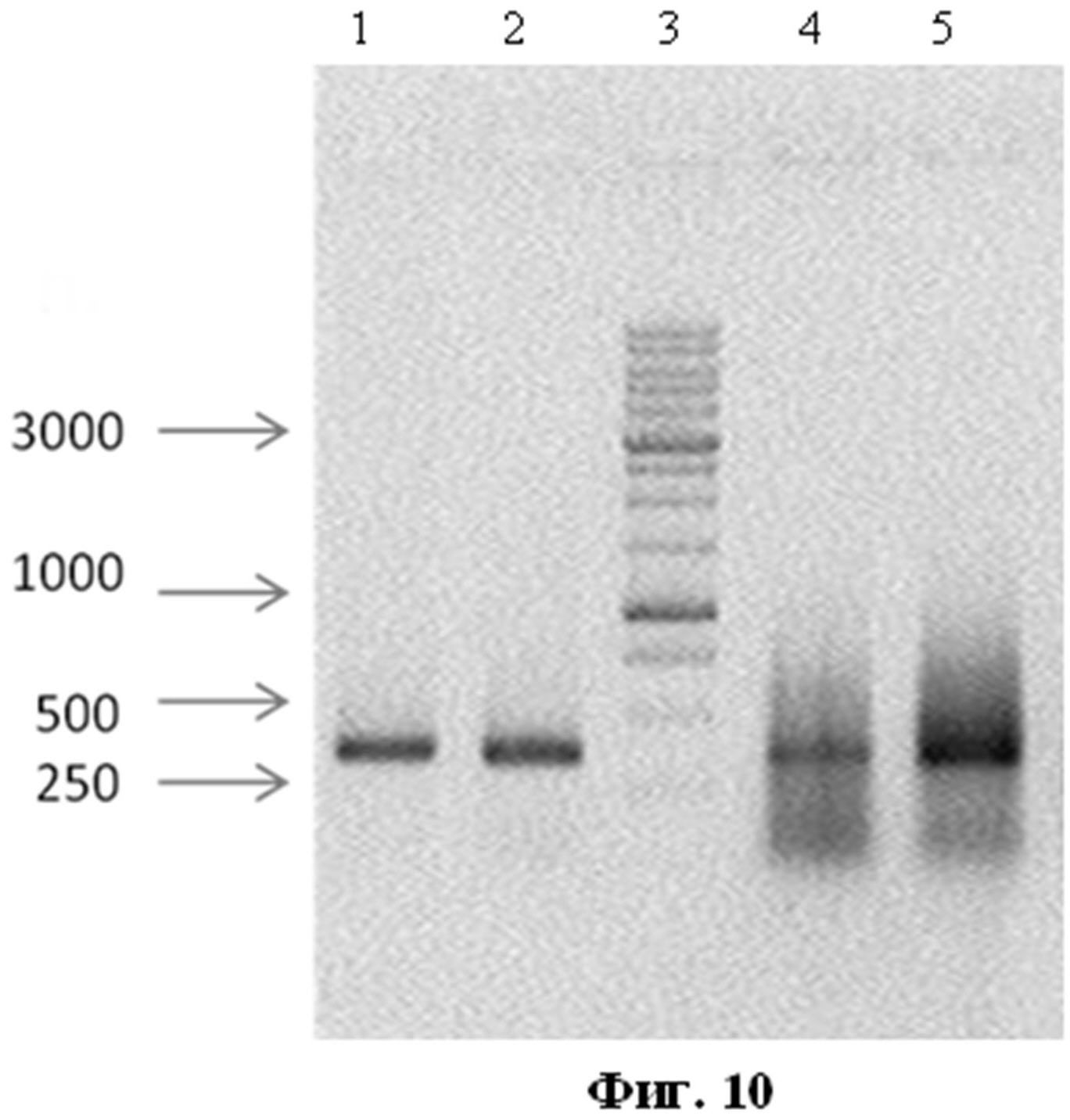
На фиг.10 представлена электрофореграмма продуктов ОТ-ПЦР в 1% агарозном геле.
На фиг.11 представлены результаты исследования иммуногенности ДНК-вакцинной конструкции pMEL-TCI-A0201, кодирующей полиэпитопный иммуноген, содержащий цитотоксические эпитопы антигенов меланомы, рестриктированные HLA-A*0201.
Дизайн и конструирование заявляемых объектов изобретения методом компьютерного моделирования.
1. Дизайн поли-CTL-эпитопного фрагмента иммуногена MEL-TCI-A0201
С помощью программы TEpredict в выбранных антигенах были предсказаны CTL-эпитопы. Для дизайна целевой полиэпитопной конструкции MEL-TCI-A0201 выбирались эпитопы, для которых предсказанное значение pIC50≥6.8, что соответствует высокой или средней аффинности связывания пептида с молекулой HLA-A*0201 Пептиды, для которых была предсказана более низкая аффинность связывания с молекулой MHC (pIC50<6.8), исключались из дальнейшего анализа. Кроме того, предсказывался протеасомный и иммунопротеасомный процессинг антигенов, а также аффинность связывания пептидов с транспортерами, ассоциированными с процессингом антигенов, и только те пептиды, для которых была предсказана достаточная аффинность связывания с TAP, и на С-конце которых был предсказан сайт расщепления, были отобраны для конструирования полиэпитопного антигена. В результате было отобрано 19 пептидов, приведенные в таблице 1.
Таблица 1
Эпитопы, выбранные для конструирования поли-CTL-эпитопного франмента целевого иммуногена
|
Далее с помощью программы PolyCTLDesigner (Фиг. 1) проводился дизайн поли-CTL-эпитопного фрагмента с использованием вырожденного спейсерного мотива [ARSP][DLIT][LGA][VKA] для оптимизации протеасомного расщепления. При выборе наилучших спейсеров для каждой пары эпитопов проводилась минимизация количества нецелевых эпитопов, образующихся при стыковке пептидов, рестриктированных аллелельным вариантом молекулы HLA I класса - A*0201. Длина полученной конструкции составила 213 а.к.о., доля спейсерных последовательностей равна 18.31 %.
На фиг. 1 представлен алгоритм работы программы PolyCTLDesigner. Примечание: I - предсказание аффинности связывания пептидов с TAP и добавление N-концевых фланкирующих а.к.о. (при необходимости); II - подбор оптимальных спейсерных последовательностей для каждой пары пептидов (спейсерная последовательность отвечает следующим критериям: обеспечивает образование сайта протеасомного расщепления на C-конце 1-го пептида, обеспечивает, по сравнению с остальными вариантами спейсера, формирование наименьшего количества нецелевых эпитопов на стыке и имеет наименьшую возможную длину) и создание направленного взвешенного графа, в котором вершины представляют целевые эпитопы, а ребра - допустимые варианты их объединения (каждому ребру соответствует набор параметров: спейсерная последовательность и вектор весов, соответствующий предсказанной эффективности сайта расщепления, количеству нецелевых эпитопов и длине спейсера); III - конструирование последовательности полиэпитопного иммуногена (искомая последовательность определяется как наиболее длинный простой путь в созданном графе, обладающий наименьшим весом).
Таким образом, был спроектирован поли-CTL-эпитопный фрагмент (213 а.к.о.) иммуногена MEL-TCI-A0201 , содержащий 19 CTL-эпитопов (рестриктированных HLA-A*0201) из шести наиболее иммуногенных меланомных антигенов.
На фиг. 2 приведена аминокислотная последовательность полиэпитопного белка иммуногена MEL-TCI-A0201. Длина полученной конструкции составила 502 а.к.о., доля спейсерных последовательностей равна 18.31 %. На N-конце расположен сигнальный пептид, показан белым полужирным шрифтом на черном фоне. После расположен поли-CTL-эпитопный фрагмент (213 а.к.о - до PADRE эпитопа AKFVAAWTLKAAA, выделенного рамкой). Спейсерные а.к.о., оптимизирующие протеасомный процессинг, выделены полужирным шрифтом и подчеркнуты. На С-конце расположен С-концевой фрагмент белка LAMP1 (RKRSHAGYQTI), показанный белым полужирным шрифтом на черном фоне. Перед ним расположен маркерный В-клеточный эпитоп белка Gag ВИЧ-1 EPFRDYVDRFYKTLR (выделен курсивом с подчеркиванием) для подтверждения экспрессии целевого белка. Между PADRE и маркерным эпитопами расположен поли-Т-хелпер эпитопный фрагмент. Серым цветом в поли-Т-хелперном фрагменте показаны аминокислотные спейсеры, оптимизирующие лизосомный процессинг полиэпитопного антигена.
2. Дизайн поли-Т-хелперного фрагмента иммуногена MEL-TCI-A0201
Для наиболее эффективной индукции Т-клеточного иммунного ответа необходимо стимулировать ответ не только CD8+, но и CD4+ Т-лимфоцитов, поэтому следующей задачей было конструирование поли-Th-эпитопного фрагмента. Для этого с помощью TEpredict проводилось предсказание в составе выбранных раковых антигенов Th эпитопов с наиболее широкой специфичностью по отношению к HLA II класса. С помощью PolyCTLDesigner было выбрано 6 фрагментов длиной от 20 до 30 а.к.о., содержавших наибольшее количество Th эпитопов с наиболее широкой специфичностью по отношению к различным алломорфам HLA II класса (табл. 2). N-концы выбранных фрагментов были продлены на 5 а.к.о. относительно начала первого эпитопа, а C-концы - на 5 а.к.о. относительно окончания последнего эпитопа.
Таблица 2
Последовательности, выбранные для конструирования поли-Т-хелперного фрагмента целевого иммуногена
|
В табл. 2 указана следующая информация: последовательность пептида, название антигена, начало и конец выбранного пептида, количество взаимодействующих с фрагментом алломорф HLA II и количество предсказанных в фрагменте Th эпитопов. Кроме того, было решено включить в состав поли-Th-эпитопной конструкции универсальный Т-хелперный эпитоп PADRE (Pan-DR epitope). Для подтверждения экспрессии целевого полипептида в его состав был включен маркерный В-клеточный эпитоп белка Gag ВИЧ-1 (Фиг. 2). Фрагменты были объединены с использованием мотива [KR][KR] - формирующего сайты расщепления для лизосомных катепсинов B и L, принимающих участие в MHC-II-зависимом процессинге антигенов.
Таким образом, был спроектирован поли-Th-эпитопный фрагмент иммуногена MEL-TCI-A0201, содержащий 45 T-хелперных эпитопов (рестриктированных не менее чем 48 аллельными вариантами молекул HLA II класса) из шести наиболее иммуногенных меланомных антигенов.
3. Проектирование итоговой полиэпитопной конструкции MEL-TCI-A0201
С помощью программы PolyCTLDesigner поли-CTL- и поли-Th-эпитопные фрагменты были объединены в одну конструкцию посредством выбранной спейсерной аминокислотной последовательности. Чтобы увеличить индукцию ответа CD4+ и CD8+ Т-лимфоцитов, дополнительно на N-конец полиэпитопа был добавлен сигнальный пептид белка HER2 (P04626), направляющий образующийся полипептид в эндоплазматический ретикулум, а на С-конец было добавлено 11 последних аминокислотных остатков белка LAMP-1 человека, обеспечивающих перенаправление полипептида из секреторного пути на деградацию в лизосомы, где его пептидные фрагменты, образующиеся в результате протеолиза, могут связываться с рециркулирующими молекулами MHC II. Подбор последовательности сигнального пептида был проведен с использованием сервера SignalP 3.0 [39]. Последовательность и общий вид итогового полиэпитопного иммуногена представлены на Фиг. 2.
4. Проектирование искусственного гена, кодирующего иммуноген MEL-TCI-A0201
Была спроектирована последовательность искусственного гена, кодирующего целевой полиэпитопный антиген MEL-TCI-A0201, оптимизированного для экспрессии в клетках человека. Для дизайна последовательности синтетического гена использовались различные программы и on-line сервисы (DNASTER, VectorNTI, NCBI-Dlast и др.), позволяющие оптимизировать последовательности генов для их высокой экспрессии в клетках человека. На 5'-конце добавлены сайт эндонуклеазы рестрикции BmtI, последовательность Козак и инициирующий кодон, на 3' - сайт Hind III и три стоп кодона. Последовательность искусственного гена имеет длину 1535 п.н. (фиг. 3).
На фиг. 3. представлены нуклеотидная и аминокислотная последовательности искусственного гена, кодирующего полиэпитопный иммуноген MEL-TCI-A0201. Последовательность искусственного гена имеет длину 1535 п.н. На 5'-конце добавлен сайт эндонуклеазы рестрикции BmtI (выделен черным цветом). Серым цветом на рисунке выделена последовательность Козак. Инициирующий кодон ATG выделен полужирным шрифтом и подчеркнут. Стоп-кодоны показаны полужирным курсивом отмечены серым цветом. На 3' - сайт HindIII (отмечен черным).
5. Конструирование рекомбинантной плазмиды, содержащей искусственный ген, кодирующий белок-иммуногены и MEL-TCI-A0201
Ген, кодирующие белок MEL-TCI-A0201, был получен химическим синтезом и клонирован в коммерческом векторе pAL-TA (Евроген, Россия). Для обеспечения экспрессии искусственного гена в эукариотических клетках он был переклонирован в экспрессионный вектор pcDNA3.1 (Invitrogen,США) по сайтам рестрикции NheI/HindIII. После трансформации клеток E.coli DH5αF' полученная рекомбинантная плазмида pMEL-TCI-A0201, содержащая целевой гены, была отобрана стандартными процедурами скрининга, используя рестрикционный анализ. Структура клонированной последовательности подтверждена секвенированием.
Сконструированная рекомбинантная плазмида ДНК pMEL-TCI-A0201 имеет размер 6952 п.н. (Фиг. 4) В составе этой плазмиды целевой ген, кодирующий искусственный полиэпитопный белок MEL-TCI-A0201, находится под контролем промотора CMV, обеспечивающего его экспрессию в клетках млекопитающих. Плазмидная ДНК pMEL-TCI-A0201 состоит из следующих фрагментов:
NheI-HindIII - векторного фрагмента ДНК плазмиды pcDNA 3.1(-) [Invitrogen, США] размером 5423 п.н., содержащего промотор CMV и последовательность BGH poly A, обеспечивающие экспрессию гена MEL- TCI-A0201 в клетках млекопитающих; ген устойчивости к ампициллину (bla) и pMB1 ori, обеспечивающие селекцию и размножение целевой плазмиды в клетках бактерий Escherichia;
NheI-HindIII - фрагмента размером 1535 п.н., содержащего ген MEL-TCI-A0201 и последовательность Козак с инициирующим кодоном ATG, полученного путем обработки рестриктазами NheI-HindIII плазмиды pAL-TA- MEL- TCI-A0201.
Кроме того, плазмида pcDNA-MEL-TCI-A0201 содержит уникальные сайты рестрикции: NruI-209, NheI-896, HindIII-2430, NarI-3792, SmaI-3605.
Молекулярная масса целевой рекомбинантной плазмидной ДНК равна 4.5×103 кДа.
Положение генов в плазмиде pMEL-TCI-A0201:
MEL- TCI-A0201 - начало (895) - конец (2429);
Neo-r - начало (3663) - конец (4457);
Bla - начало (5962) - конец (6822);
BGH polyA - начало (2551) - конец (2778);
pMB1 - начало (5144) - конец (5817);
эукариотический промотор CMV pr - начало (209) - конец (863).
Для того чтобы доказать способность полученной плазмиды индуцировать синтез соответствующего целевого полипептида в эукариотических клетках, была проведена трансфекция 293Т-клеток выделенной плазмидной ДНК. Наличие целевого полипептида в трансфецированных клетках было подтверждено с помощью моноклональных антител на маркерный эпитоп белка Gag ВИЧ-1 иммуноокрашиванием клеток и иммуноблоттингом, а также по синтезу специфической мРНК с помощью ОТ-ПЦР.
Таким образом, спроектирован искусственный белок-иммуноген MEL-TCI-A0201, содержащий множественные цитотоксические и хелперные Т-клеточные эпитопы меланомных антигенов (NY-ESO-1, MART1, MAGE-A1, MAGE-A3, MAGE-A11, MAGE-C1). На основе спроектированной аминокислотной последовательности проведен дизайн и синтезирован искусственный ген, кодирующий полиэпитопный белок-иммуноген MEL-TCI-A0201. Полученные данные подтверждают, что по иммунохимическим свойствам продукт экспрессии гена MEL-TCI-A0201 соответствует целевому иммуногену MEL-TCI-A0201.
Созданная антигенная конструкция может применяться для иммунотерапии меланомы с использованием трех различных протоколов: либо в качестве ДНК-вакцины, либо для осуществления индивидуализированной иммунотерапии на основе клеточной вакцины с использованием аутологичных зрелых ДК, трансфецированных полученной ДНК-вакцинной конструкцией, либо на основе адоптивного переноса аутологичных эффекторных Т-лимфоцитов, полученных ex vivo.
Ниже приведены примеры конкретного выполнения заявленных объектов изобретения.
Пример 1. Синтез искусственного гена, кодирующего иммуноген MEL-TCI-A0201 и получение рекомбинантной плазмиды pMEL-TCI-A0201, кодирующей целевой полиэпитопный иммуноген MEL-TCI-A0201
1.1. Синтез искусственного гена, кодирующего иммуноген MEL-TCI-A0201
Выбор метода синтеза был продиктован соображениями эффективности и точности. Наиболее оптимальным оказался метод, основанный на использовании термостабильной РНК-лигазы (NEB, USA) с последующей ПЦР и клонированием в вектор pAL-TA. Синтез олигонуклеотидов осуществлялся на синтезаторе ABI3900 (AppliedBiosystems, USA). При синтезе использовался модифицированный протокол, позволяющий получать олигонуклеотиды длинной до 90 звеньев с чистотой более 95 %. Чищеные и обессоленные олигонуклеотиды прямой цепи кинировались, затем добавлялись праймеры-подставки и проводилась реакция лигирования. Полученный лигат клонировался в вектор pAL-TA. После скрининга отбиралось по три клона, несущих вставку, из них выделяли плазмиды. Правильность синтезированной последовательности подтверждали после последующего ее секвенирования на автоматическом секвенаторе ABI3730x1.
1.2. Получение рекомбинантной плазмиды pMEL-TCI-A0201, кодирующей целевой полиэпитопный иммуноген MEL-TCI-A0201
Для конструирования плазмиды pMEL-TCI-A0201 использовали плазмиду pcDNA3.1-mycchislacZ(-) [Invitrogen, США]. Фрагмент ДНК, содержащий целевой ген, получали путем гидролиза эндонуклеазами рестрикции NheI и Hind III плазмид pAL-TA-MEL-TCI-A0201. На фиг. 5 приведена схема конструирования рекомбинантной плазмидной ДНК pcDNA-MEL-TCI-A0201.
Далее 0,5 мкг фрагмента полученного гена лигировали в стандартных условиях с 0,1 мкг плазмиды pcDNA3.1, гидролизованной эндонуклеазами рестрикции NheI и HindIII. Лигазной смесью трансформировали компетентные клетки E.coli DH5F' из клонов, выросших на среде с ампициллином, выделяли плазмидную ДНК и подвергали рестрикционному анализу с помощью эндонуклеаз рестрикции NheI, HindIII (Фиг. 6) и BglII, PsiI (Фиг. 7).
1.3. Подтверждение структуры плазмиды рестрикционным анализом
Согласно теоретически рассчитанной нуклеотидной последовательности при гидролизе плазмиды pMEL-TCI-A0201 с помощью эндонуклеаз NheI (сайт узнавания GCTAGC) и HindIII (сайт узнавания AAGCTT) должны появиться фрагменты (в п.н.) 1528 и 5329 (Фиг. 7). При гидролизе плазмиды pMEL-TCI-A0201 рестриктазами BglII (сайт узнавания AGATCT) и PsiI (сайт узнавания ACATGT) должны появляться наборы фрагментов (в п.н.) 2320, 1797, 1468, 1367 (Фиг. 7). Из данных, представленных на фиг. 6-7 видно, что подвижность фрагментов гидролизата целевой и контрольной плазмиды (pcDNA-G2) плазмиды в 1 % агарозе относительно маркера молекулярной массы и гидролизата исходной плазмиды pcDNA-TCI совпадает с теоретически рассчитанной.
На фиг. 6 представлена электрофореграмма в 1 % агарозном геле. Фрагменты ДНК после гидролиза плазмид рестриктазами NheI и HindIII, где:
1. pcDNA3.1 - гидролиз NheI и HindIII, фрагменты 5329 и 98 п.н.
2. pMEL-TCI-A0201 - нативная
3. pMEL-TCI-A0201 - гидролиз NheI и HindIII, фрагменты 1528, 5329 п.н.
4. pcDNA-G2 - гидролиз NheI и HindIII, фрагменты 3421, 5329 п.н.
5. pcDNA-G2 - нативная
6. маркер молекулярного веса 1Kb (М12). Указаны фрагменты 3000 п.н. (верхняя стрелка) и 1000 п.н. (нижняя стрелка);
На фиг. 7. Электрофореграмма в 1 % агарозном геле. Фрагменты ДНК после гидролиза плазмиды pMEL-TCI-A0201 рестриктазами BglII и PsiI.
1. маркер молекулярного веса 1Kb (М12). Указаны фрагменты 3000 п.н. (верхняя стрелка) и 1000 п.н. (нижняя стрелка);
2. pMEL-TCI-A0201, гидролиз BglII - PsiI, фрагменты 2320, 1797, 1468, 1367 п.н.
1.4. Подтверждение структуры плазмиды секвенированием
Структура гена MEL-TCI-A0201 в составе полученной рекомбинантной плазмиды pMEL-TCI-A0201 помимо рестрикционного анализа была также подтверждена секвенированием. Показано, что нуклеотидные последовательности гена в образцах совпадает с теоретически рассчитанной последовательностью.
Пример 2. Исследование способности целевого гена обеспечивать синтез белка MEL-TCI-A0201 в экариотических клетках
2.1. Трансфекция клеток 293Т рекомбинантными плазмидами
Трансфекцию клеток 293Т плазмидой pcDNA-MEL-TCI-A0201 проводили при достижении клеточной пролиферации до состояния 60-70 % монослоя. В пробирку типа Eppendorf помещали 200 мкл среды ДМЕМ, 5 мкл плазмидной ДНК (1 мг/мл) и 5 мкл FuGENE® HD Transfection Reagent (Roshe). Смесь тщательно перемешивали и инкубировали при комнатной температуре в течение 15 мин. После инкубации смесь вносили к культуре клеток и помещали в культуральный планшет в СО2-инкубатор на 4 часа. Затем в каждую лунку добавляли 1 мл среды ДМЕМ, содержащей 10 % фетальную бычью сыворотку, и помещали в СО2-инкубатор на 48 часов.
2.2. Иммуноокрашивание трансфецированных 293Т клеток
После проведения процедуры трансфекции 293Т-клеток плазмидой pMEL-TCI-A0201 клетки фиксировали 4 % раствором формальдегида 30 мин при комнатной температуре. Промывали раствором PBS 3 раза. Для удаления пероксидазной активности вносили по 200 мкл 3 % раствора азида натрия и 0.3% раствора перекиси водорода. Инкубировали при комнатной температуре в течение получаса. Промывали трижды раствором PBS. К каждой лунке добавляли 200 мкл раствора PBS и 100 мкл моноклональных антител 29F2, которые связываются с эпитопом EPFRDYVDRFYKTL р24 ВИЧ-1, входящего в состав полиэпитопной конструкции. Инкубировали 1 час при комнатной температуре. Несвязавшиеся антитела удаляли отмывкой в PBS. Специфически связавшиеся антитела выявляли с помощью меченных пероксидазой антител кролика против IgG мыши в PBS-буфере с 5 % фетальной сывороткой. Обычно использовалось разведение конъюгата антител 1/10000. Промывали буфером PBS 3 раза. Окрашивание проводили добавлением 200 мкл раствора следующего состава: 0.5 мг/мл диаминобензидин фосфата, 0.01 % раствор перекиси водорода, 50мМ трис-HCl (рН 7,4), 50мМ имидазол. Окраску проводили в темноте при комнатной температуре 3 мин, затем препарат тщательно промывали дистиллированной водой. Наличие окрашенных клеток устанавливали с помощью микроскопа Olympus.
При иммунохимическом окрашивании препаратов трансфецированных клеток в качестве отрицательного контроля использовали препараты 293Т, трансфецированные векторной плазмидой pcDNA3.1, в качестве положительного контроля - плазмиды pcDNA-TCI и pcDNA-G2, продукты экспрессии которых содержат маркерный эпитоп EPFRDYVDRFYKTL р24 ВИЧ-1.
На фиг. 8 представлено иммунохимическое окрашивание препаратов клеток 293Т, трансфецированных плазмидой ДНК pMEL-TCI-A0201 (pcDNA-G1). Векторная плазмида pcDNA3.1 - отрицательный контроль, плазмида pcDNA-TCI - положительный контроль. Окрашивание с помощью моноклональных антител 29F2 и конъюгата антител кролика против IgG мыши с пероксидазой хрена. Данные на фиг. 8 показывают, что окрашивание клеток наблюдалось только при трансфекции клеток 293Т целевой плазмидой pMEL-TCI-A0201 и плазмидами pcDNA-TCI и pcDNA-G2 (положительный контроль) и не наблюдалось при трансфекции исходным вектором pcDNA3.1, что подтверждает наличие в трансфецированных клетках продуктов экспрессии целевых генов. В случае трансфекции плазмидой pMEL-TCI-A0201 количество окрашенных клеток составило ≈1.6%. Низкий уровень окрашенных клеток при трансфекции плазмидами pMEL-TCI-A0201 и pcDNA-G2, по-видимому, обусловлен быстрой деградацией целевых иммуногенов, поскольку они были спроектированы таким образом, чтобы обеспечить высокую скорость процессинга, необходимую для освобождения CTL-эпитопов.
Действительно, согласно проведенному дизайну искусственный полиэпитопный белок MEL-TCI-A0201 содержит сигнальные последовательности (ER и LAMP-1) и аминокислотные остатки, которые по замыслу должны обеспечить эффективный процессинг целевой полиэпитопной конструкции по пути МНС I и II классов. Вместе с процессингом целевого белка, вероятно, происходит разрезание маркерного эпитопа, который узнается МКА 29F2, в результате чего снижается количество окрашенных клеток, трансфецированных плазмидой pMEL-TCI-A0201.
2.3. Определение продуктов экспрессии целевого гена в трансфецированных клетках с помощью иммуноблоттинга
Лизат клеток 293 Т, трансфецированных плазмидой pMEL-TCI-A0201, анализировали также с помощью электрофореза в 15% полиакриламидном геле с последующим переносом разделенных клеточных белков на нитроцеллюлозный фильтр и проведением окрашивания с помощью МКА антител к 29F2 и конъюгата с пероксидазой хрена (фиг.9). Лизат клеток 293Т, трансфицированных плазмидой pMEL-TCI-A0201, анализировали также с помощью электрофореза в 15% полиакриламидном геле с последующим переносом разделенных клеточных белков на нитроцеллюлозный фильтр и проведением окрашивания с помощью МКА антител к 29F2 и конъюгата с пероксидазой хрена. На фиг.9 представлен иммуноблотинг белков после разделения в 15% ПААГ с моноклональными антителами 29F2 (к маркерному эпитопу). В качестве положительного контроля мы использовали лизат 293Т-клеток, трансфицированных pcDNA-martI, а в качестве отрицательного контроля - плазмидой-вектором без вставки - pcDNA-3.1.
На дорожках:
М - маркер молекулярной массы (14, 24, 45 и 66 кД)
1 - лизат клеток 293Т, трансфицированных плазмидой pDNA-mart1
2 - лизат клеток 293Т, трансфицированных плазмидой pMEL-TCI-A0201
3 - лизат клеток 293Т, трансфицированных плазмидой pcDNA 3.1
На фиг.9 видно, что в трансфицированных клетках присутствуют целевые белки, выявляемые МКА 29F2, что подтверждает их синтез, направляемый целевыми ДНК-вакцинными конструкциями. Следует также отметить, что в случае анализа лизата клеток 293Т, трансфицированных плазмидой pcDNA-martI, видно на иммуноблоте только одну мажорную полосу, соответствующую по мол. массе целевому белку MART1 (дорожка 1). При исследовании лизата клеток 293Т, трансфицированных плазмидой pMEL-TCI-A0201, видно дискретный набор полос разной мол массы начиная от 52 КД (что соответствует расчетной мол. массе исходного белка MEL-TCI-A0201) и заканчивая низкомолекулярными пептидами. Этот факт свидетельствует о том, что искусственный полиэпитопный белок MEL-TCI-A0201 подвергается эффективному процессингу в клетке, и, следовательно, сайты процессинга, заложенные в данный белок, эффективно узнаются клеточными протеазами.
2.4. Анализ экспрессии целевых генов по определению синтеза специфической мРНК с помощью ОТ-ПЦР
Выделение суммарной РНК проводили из 0.8×106 клеток 293Т, трансфецированных плазмидами pMEL-TCI-A0201, pcDNA-G2 (положительный контроль), с использованием набора для выделения суммарной РНК фирмы Promega (cat. NZ3100) по прилагаемой инструкции. Методика выделения включает в себя стадии лизиса клеток, ДНКазного гидролиза для удаления примесей ДНК, и конечную очистку РНК на микроколонках.
Получение кДНК на РНК проводили в реакции обратной транскрипции: по 10 мкл РНК добавляли к 40 мкл реакционной смеси, содержащей в конечном объеме 50 мкл буфер REV×1, по 100 мкг/мл соответствующего для данного гена прямого праймера для ревертазы, по 0.5 мМ каждого из четырех дезоксинуклеозидтрифосфатов и по 800 ед/мл фермента - обратной транскриптазы M-MuLV (ревертазы) фирмы Сибэнзим. Реакцию синтеза кДНК проводили в течение 2-х часов при 42°C, после этого содержимое пробирок прогревали в течение 3-х мин при 95°C.
Далее полученную кДНК использовали для проведения ПЦР с использованием специфических праймеров к генам MEL-TCI-A0201, G2 (Табл.3.)
Амплификацию проводили в 25 мкл реакционной смеси, содержащей 5-10 нг кДНК, 0.2 мМ dNTPs, по 200 нг каждого из двух праймеров к соответствующему гену, 1×буфер для ПЦР и 1 единицу Taq-ДНК-полимеразы фирмы Сибэнзим.
|
Смесь помещали в амплификатор с заданной программой температурно-временных циклов: 95°C - 1 мин, 60°C, 72°C - 1 мин 20 сек; всего - 30 циклов. В конце последнего цикла ПЦР проводили завершающий синтез при 72°C в течение 5 мин. Продукты амплификации анализировали электрофорезом в 1%-ном агарозном геле.
На фиг.10 представлена электрофореграмма продуктов ОТ-ПЦР в 1% агарозном геле, где:
1, 2 - продукты ОТ-ПЦР с использованием в качестве матрицы исходных плазмид pMEL-TCI-A0201, pcDNA-G2 (положительный контроль);
3 - маркер молекулярных весов (M12 фирмы Сибэнзим);
4, 5 - продукты ОТ-ПЦР, полученные с использованием в качестве матрицы кДНК MEL-TCI-A0201, G2 трансфецированных 293Т-клеток.
Результаты, представленные на фиг.10, показывают, что размеры амплифицированных фрагментов соответствую теоретически рассчитанным продуктам амплификации (см. п.1.9). Эти данные подтверждают наличие в суммарной фракции кДНК последовательностей, кодирующих белки MEL-TCI-А0201 и G2, и, следовательно, указывает на экспрессию генов и синтез специфических мРНК.
2.5. Пример. Исследование иммуногенности ДНК-вакцинной конструкции pMEL-TCI-A0201, кодирующей полиэпитопный иммуноген, содержащий цитотоксические эпитопы антигенов меланомы, рестриктированные HLA-А*0201
Исследование иммуногенности ДНК-вакцинной конструкции pMEL-TCI-A0201, кодирующей полиэпитопный иммуноген, содержащий цитотоксические эпитопы, рестриктированные HLA-A*0201, проводилось в системе индукции Т-клеточного иммунного ответа ex vivo с использованием периферических мононуклеарных клеток крови условно-здоровых HLA-A*0201-положительных доноров. Исследование проводилось совместно с сотрудниками лаборатории молекулярной иммунологии НИИКИ СО РАМН. Разрешение на проведение этих исследований было одобрено локальным этическим комитетом при ФГУН НИИКИ СО РАМН (протокола №68 заседания этического комитета НИИКИ СОРАМН от 13 февраля 2012 г.).
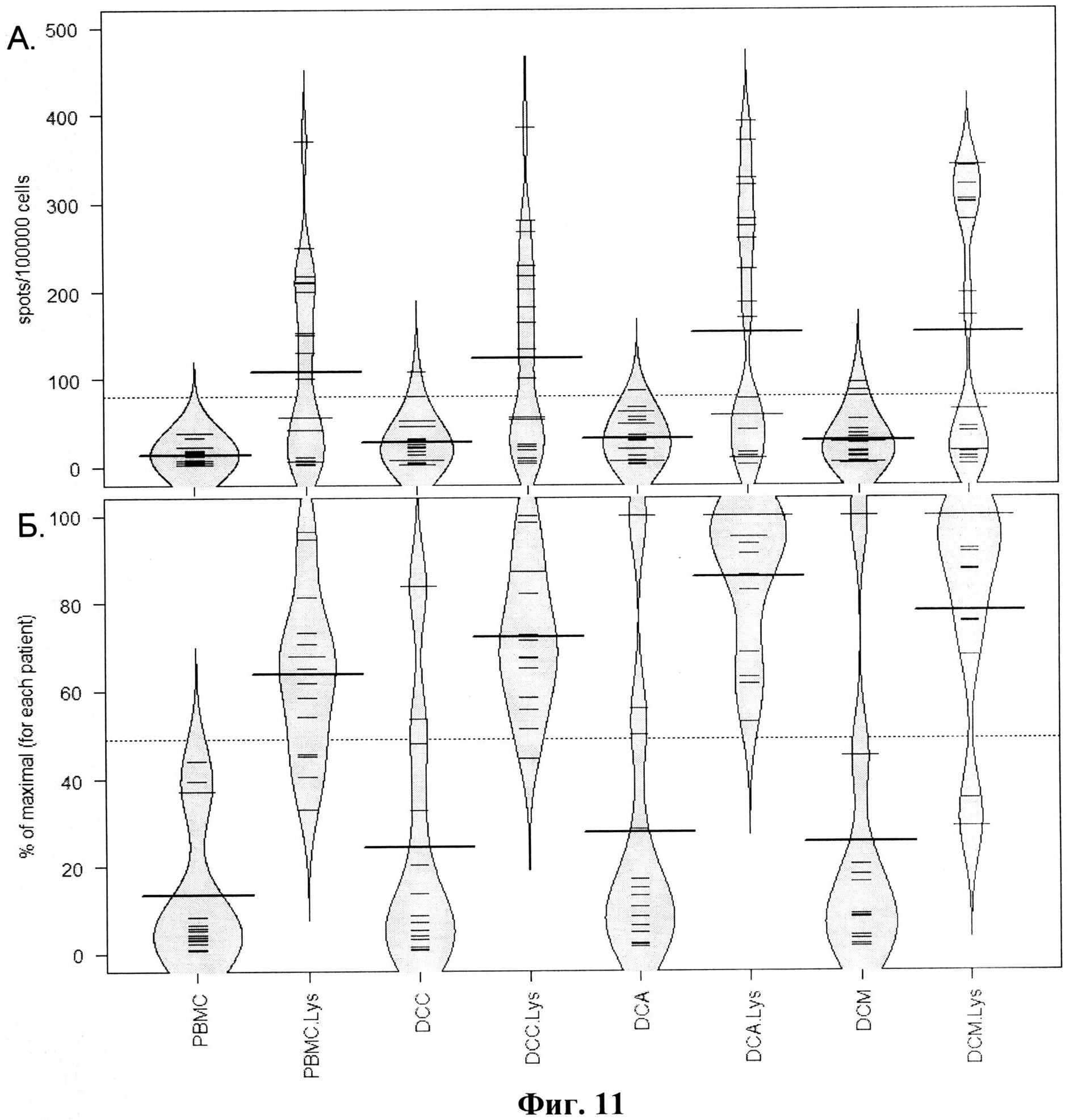
В качестве клеток-мишеней была использована культура клеток меланомы человека Mel Is (HLA-A*0201+, MART1+), любезно предоставленная Российским онкологическим научным центром имени Н.Н. Блохина РАМН. В качестве отрицательного контроля использовалась культура мононуклеарных клеток (МНК) и совместная культура МНК и дендритных клеток (ДК), трансфецированных контрольной (векторной) плазмидой. В качестве положительного контроля была использована совместная культура МНК и ДК, трансфецированных плазмидой pcDNA-mart1, кодирующей полноразмерный меланомный антиген MART1. Получение дендритных клеток и индукция их созревания проводились по методикам, описанным ранее (Хрипко et al., 2008). Трансфекция дендритных клеток ДНК-вакцинными конструкциями проводилась с помощью системы магнитной трансфекции (MATra - Magnet-Assisted Transfection) по протоколу, рекомендованному производителем (Promokine, USA). Способность полиэпитопной конструкции индуцировать специфический Т-клеточный иммунный ответ изучали в реакции IFNγ-ELISpot (Фиг.11).
Сравнение способности ДК, трансфецированных различными плазмидами, индуцировать Т-клеточный ответ (Фиг.11) показало, что в присутствии лизата клеток меланомы (Mel Is) в совместных культурах МНК и ДК, трансфецированных плазмидами pMEL-TCI-A0201 (DCA.Lys) и pcDNA-mart1 (DCM.Lys - положительный контроль), образуется достоверно большее количество IFNγ-продуцирующих клеток, чем при культивировании МНК (PBMC.Lys) (p=0.0004 и 0.0398) и ДК, трансфецированных контрольной плазмидой (DCC.Lys) (p=0.0107 и p=0.0864) в присутствии лизата.
Уровень клеток, продуцирующих IFNγ в совместной культуре МНК и ДК, трансфецированных целевой плазмидой pMEL-TCI-A0201, и при стимуляции ДК, трансфецированных плазмидой pcDNA-martI, не отличался (p=0.599). При этом группы DCC, DCA и DCM статистически не отличаются между собой, но достоверно отличны от РВМС (p<0.005).
Группы DCA.Lys и DCM.Lys (положительный контроль) отличаются от отрицательных контролей и от групп DCA и DCM (p<0.028). Статистический анализ проводился с использованием парного теста Уилкоксона с использованием FDR-коррекции.
На Фиг.11 видно, что целевая полиэпитопная конструкция и плазмида, кодирующая полноразмерный белок MART1, обеспечивают наибольшую экспрессию IFNγ. Все экспериментальные группы, в которых проводилась стимуляция лизатом клеток меланомы, демонстрируют бимодальность распределения - то есть, по-видимому, клетки части пациентов не ответили на стимуляцию лизатом. Лишь у 15 пациентов из 21 (71.4%) число IFNγ-продуцирующих клеток в присутствии лизата превысило в 4 раза среднее число клеток, продуцирующих IFNγ, в отрицательной контрольной группе РВМС в отсутствие лизата.
На Фиг.11 приведены результаты IFNγ-ELISpot для 15 пациентов, продемонстрировавших индукцию Т-клеточного ответа, - доля от максимального количества IFNγ-продуцирующих клеток, полученного для каждого из пациентов. Целевая полиэпитопная конструкция в наибольшей степени стимулирует экспрессию IFNγ. Однако и в данном случае отличия между группами DCA.Lys и DCM.Lys были статистически незначимы.
На Фиг.11 представлены следующие данные:
(А) - Количество спот-формирующих IFNγ-продуцирующих клеток (на 100000 клеток) в культуре мононуклеарных клеток периферической крови (МНК) условно-здоровых доноров и в совместной культуре с аутологичными ДК (n=21).
(Б) Доля от максимального количества спот-формирующих IFNγ-продуцирующих клеток (для каждого из пациентов) в культуре мононуклеарных клеток периферической крови (МНК) условно-здоровых доноров и в совместной культуре с аутологичными ДК (n=15). Жирной горизонтальной линией отмечено среднее значение.
РВМС (peripheral blood mononuclear cells) - контрольная культура МНК; DCC - совместная культура МНК и ДК, трансфецированных контрольной плазмидой; DCA - совместная культура МНК и ДК, трансфецированных плазмидой, специфичной для HLA-A0201 (pMEL-TCI-A0201); DCM - совместная культура МНК и ДК, трансфецированных плазмидой, кодирующей полноразмерный белок MART1; PBMC.Lys, DCC.Lys, DCA.Lys и DCM.Lys - соответствующие культуры с лизатом клеток Mel Is
Таким образом, исследования, проведенные в системе индукции Т-клеточного иммунного ответа ex vivo, показали, что спроектированная с помощью разработанных моделей и алгоритмов полиэпитопная конструкция MEL-TCI-A0201 обладает способностью индуцировать Т-клеточный иммунный ответ против антигенов меланомы человека и не уступает по эффективности полноразмерному меланомному антигену MART1. Это вполне убедительный результат, учитывая, что целевая конструкция содержит только часть CD8+Т-клеточных эпитопов из белка MART1.
Из вышеприведенных результатов следует, что создана генетическая конструкция pMEL-TCI-A0201, содержащая ген, кодирующий искусственный полиэпитопный Т-клеточный белок-иммуноген, который за счет оптимального подбора и размещения эпитопов обеспечивает высокую скорость процессинга полиэпитопной конструкции и индукцию ответа цитотоксических Т-лимфоцитов, не уступающего ответу на полноразмерный белок MART1, являющийся одним из ключевых антигеном меланомы.
Полученные результаты обеспечиваются рациональным дизайном целевой полиэпитопной конструкции, в которую кроме эпитопов белка MART1 входят эпитопы других белков-антигенов меланомы - NY-ESO-1, MAGE-A1, MAGE-A3, MAGE-АН, MAGE-C1. Учитывая, что оптимизация процессинга эпитопов увеличивает иммуногенность полиэпитопной конструкции [9], дизайн целевого иммуногена был нацелен на оптимизацию процессинга всех без исключения эпитопов, входящих в состав целевой конструкции. Это позволяет данные по иммуногенности, полученные для одних эпитопов (в данном случае для эпитопов белка MART1), экстраполировать на другие эпитопы, входящие в полиэпитопную конструкции MEE-TCI-A0201 (в данном случае эпитопы белков NY-ESO-1, MAGE-A1, MAGE-A3, MAGE-АН, MAGE-C1).
Действительно, анализ лизата клеток 293Т, трансфицированных плазмидой pMEL-TCI-A0201, показал, что искусственный полиэпитопный белок MEL-TCI-А0201 не только эффективно синтезируется, но также подвергается эффективному процессингу в трансфицированных клетках (Фиг.9), что по замыслу полностью соответствует его дизайну.
Источники научно-технической информации
1. Halama N., Zoernig I., Jaeger D. Advanced malignant melanoma: immunologic and multimodal therapeutic strategies. J Oncol. 2010; 2010:689893.
2. Parmiani G. Melanoma antigens and their recognition by Т cells. Keio J Med. 2001. 50(2):86-90.
3. Pandolfi F., Cianci R., Lolli S., Dunn I.S., Newton E.E., Haggerty T.J., Boyle L.A., Kurnick J.T. Strategies to overcome obstacles to successful immunotherapy of melanoma. Int J Immunopathol Pharmacol. 2008. 21:493-500.
4. Jahnisch H., Fussel S., Kiessling A., Wehner R., Zastrow S., Bachmann M., Rieber E.P., Wirth M.P., Schmitz M. Dendritic cell-based immunotherapy for prostate cancer. Clin Dev Immunol. 2010; 2010:517493.
5. Bonehill A., Heirman С., Tuyaerts S., Michiels A., Breckpot K., Brasseur F., Zhang Y., Van Der Bruggen P., Thielemans K. Messenger RNA-electroporated dendritic cells presenting MAGE-A3 simultaneously in HLA class I and class II molecules. J Immunol. 2004; 172:6649-57.
6. Eroshkin A.M., Karginova E.A., Gileva I.P., Lomakin A.S., Lebedev L.R., Kamyinina T.P., Pereboev A.V., Ignat′ev G.M. 1995. Design of four-helical protein as a candidate for HIV vaccine. Protein Engineering, Vol.8, No.2, pp.167-173.
7. Loktev V.B., Ilyichev A.A., Eroshkin A.M., Karpenko L.I., Pokrovsky A.G., Svyatchenko V.A., Ignat′ev G.M., Smolina M.I., Melamed N.V., Lebedeva C.D., Sandakhchiev L.S. 1996. Design of immunogens as components of a new generation of molecular vaccines. J. Biotechnology, Vol.44, pp.129-137.
8. Ishioka G.Y., Fikes J., Hermanson G., Livingston В., Crimi C., Qin M., del Guercio M.F., Oseroff C., Dahlberg C., Alexander J., Chesnut R.W., Sette A. Utilization of MHC class I transgenic mice for development of minigene DNA vaccines encoding multiple HLA-restricted CTL epitopes. J Immunol. 1999. 162(7):3915-25.
9. Livingston B.D., Newman M., Crimi C., McKinney D., Chesnut R., Sette A. Optimization of epitope processing enhances immunogenicity of multiepitope DNA vaccines. Vaccine. 2001. 19(32):4652-60.
10. Uebel S., Tampe R. Specificity of the proteasome and the TAP transporter. Curr Opin Immunol. 1999. 11(2):203-8.
11. Peters В., Bulik S., Tampe R., Van Endert P.M., Holzhutter H.G. Identifying MHC class I epitopes by predicting the TAP transport efficiency of epitope precursors. J Immunol. 2003. 171(4):1741-9.
12. Cardinaud S., Bouziat R., Rohrlich P.S., Tourdot S., Weiss L., Langlade-Demoyen P., Burgevin A., Fiorentino S., van Endert P., Lemonnier F.A. Design of a HIV-1-derived HLA-B07.02-restricted polyepitope construct. AIDS. 2009. 23(15):1945-54.
13. Varshavsky A. Ubiquitin fusion technique and its descendants. Methods Enzymol. 2000. 327:578-93.
14. Rowell J.F., Ruff A.L., Guarnieri F.G., Staveley-O′Carroll K., Lin X., Tang J., August J.T., Siliciano R.F. Lysosome-associated membrane protein-1-mediated targeting of the HIV-1 envelope protein to an endosomal/lysosomal compartment enhances its presentation to MHC class II-restricted Т cells. J Immunol. 1995. 155(4):1818-28.
15. Ruff A.L., Guarnieri F.G., Staveley-O′Carroll K., Siliciano R.F., August J.T. The enhanced immune response to the HIV gp160/LAMP chimeric gene product targeted to the lysosome membrane protein trafficking pathway. J Biol Chem. 1997. 272(13):8671-8.
16. Woodberry T, Gardner J, Mateo L, Eisen D, Medveczky J, Ramshaw IA, Thomson SA, Ffrench RA, Elliott SL, Firat H, Lemonnier FA, Suhrbier A. 1999. Immunogenicity of a human immunodeficiency virus (HIV) polytope vaccinecontaining multiple HLA A2 HIV CD8(+) cytotoxic T-cell epitopes. J. Virol. Vol.73, No.7, pp.5320-5.
17. Buyse M.-A., Baker D. HPV POLYEPITOPE CONSTRUCTS AND USES THEREOF. 2010, U.S. patent #20100272750.
18. Buyse M.-A., Maertens G., Depla E., Lasters I., Desmet J., Baker D., Chesnut R.W., Newman M., Sette A., Sidney J., Southwood S. Peptides for inducing a CTL and/or HTL response to hepatitis С virus. 2006, U.S. patent #20060093617.
19. Mateo L., Gardner J., Chen Q., Schmidt C., Down M., Elliott S.L., Pye S.J., Firat H., Lemonnier F.A., Cebon J., Suhrbier A. An HLA-A2 polyepitope vaccine for melanoma immunotherapy. J Immunol. 1999; 163:4058-63 (прототип).
20. Smith S.G., Patel P.M., Porte J., Selby P.J., Jackson AM. Human dendritic cells genetically engineered to express a melanoma polyepitope DNA vaccine induce multiple cytotoxic T-cell responses. Clin Cancer Res. 2001; 7:4253-61.
21. Бажан С.И., Белавин П.А., Серегин С.В., Бабкина И.Н., Данилюк Н.К., Сандахчиев Л.С. Искусственный белок-иммуноген TCI, содержащий множественные CTL-эпитопы основных антигенов ВИЧ-1, искусственный ген TCI, кодирующий полиэпитопный белок-иммуноген TCI. 2002, Патент РФ №2238946.
22. Bazhan S.I., Karpenko L.I., Ilyicheva T.N., Belavin P.A., Seregin S.V., Danilyuk N.K., Antonets D.V., Ilyichev A.A. Rational design based synthetic polyepitope DNA vaccine for eliciting HIV-specific CD8+Т cell responses. Mol Immunol. 2010; 47: 1507-15.
23. Oldstone M.B. 1989. Viral persistence. Cell. 56, 517-520.
24. Goldberg A.L., Rock K.L. 1992. Proteolysis, proteasomes and antigen presentation. Nature. 357, 375-379.
25. Pamer E., Cresswell P. 1998. Mechanisms of MHC class Irestricted antigen processing. Ann. Rev. Immunol. 16, 323-358.
26. URL: http://www.anthonynolan.org.uk/HIG/
27. URL: http://www.ncbi.nlm.nih.gov/gv/mhc/
28. Rock K.L., Goldberg A.L. 1999. Degradation of cell proteins and the generation of MHC class Ipresented peptides. Annu. Rev. Immunol. 17, 739-779.
29. Niedermann G., Geier E., LucchiariHartz M., HitzigerN., Ramsperger A., Eichmann K. 1999. The specificity of proteasomes: impact on MHC class I processing and presentation of antigens. Immunol. Rev. 172, 29-48.
30. Craiu A., Akopian Т., Goldberg A., Rock K.L. 1997. Two distinct proteolytic processes in the generation of a major histocompatibility complex class Ipresented peptide. Proc. Natl. Acad. Sci. USA. 94, 10850-10855.
31. Stoltze L., Dick T.P., Deeg M., Pommeri В., Rammensee H.G., Schild H. 1998. Generation of the vesicular stomatitis virus nucleoprotein cytotoxic Т lymphocyte epitope requires proteasomedependent and independent proteolytic activities. Eur. J. Immunol. 28, 4029-4036.
32. Lundegaard С., Lund O., Kesmir С., Brunak S., Nielsen M. 2007. Modeling the adaptive immune system: predictions and simulations. Bioinformatics. 23, 3265-3275.
33. Antonets DV, Maksiutov AZ. TEpredict: software for T-cell epitope prediction. Mol Biol (Mosk). 2010. 44 (1): 130-9.
34. Antonets D., Maksyutov A., Bazhan S. PolyCTLDesigner: the software for constructing highly efficient polyepitope immunogens. Application to HIV-1. Retrovirology. 2009. 6(Suppl 3): P284.
35. Antonets D.V., Bazhan S.I. PolyCTLDesigner: a computational tool for constructing polyepitope T-cell antigens. BMC Res. Notes 6 (1), 407 (2013). doi: 10.1186/1756-0500-6-407.
36. Hanke Т., Schneider J., Gilbert S.C., Hill A.V.S., McMichael A. 1998a. DNA multi-CTL epitope vaccines for HIV and Plasmodium falciparum: immunogeicity in mice. Vaccine, Vol.16, No.4, pp.426-436.
37. Lalvani A., Aidoo M., Allsopp C.E., Plebanski M., Whittle H.C., Hill A.V. 1994. An HLA-based approach to the design of a CTL-inducing vaccine against Plasmodium falciparum. Research in Immunology, Vol.145, pp.461-468.
38. Sidney J., Grey H.M., Kubo R.T., Sette A. 1996. Practical, biochemical and evolutionary implication of the discovery of HLA class I supermotifs. Immunology today, Vol.17, pp.261-266.
39. Dyrlov Bendtsen J., Nielsen H., von Heijne G., Brunak S. 2004. Improved prediction of signal peptides: SignalP 3.0. J. Mol. Biol., Vol.340, pp.783-795.
40. Хрипко О.П., Якушенко Е.В., Сенников С.В., Красильникова И.В., Козлов В.А. 2008. Использование дендритных клеток и интерлейкина-18 для модуляции иммунного ответа против HBcAginvitro. Бюллетень СО РАМН, №5 (133), С.109-113.
41. Sun J.C., Bevan M.J. 2003. Defective CDS Т cell memory following acute infection without CD4 Т cell help. Science, Vol.300. No. 5617, pp.339-342.