Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ АДЪЮВАНТА ДЛЯ ВАКЦИН
Вид РИД
Изобретение
Изобретение относится к биотехнологии и иммунологии, а именно к производству препаратов специфически стимулирующих антителообразование, и может быть использовано в медицине при конструировании и получении высокоэффективных вирусных вакцин.
Вакцинопрофилактика рассматривается в современных условиях как одно из ведущих массовых эффективных средств борьбы с инфекциями [Итоги и перспективы развития вакцинопрофилактики в XXI веке, И.В. Фельдблюм, http://www.rusmedserv.com/epidinf/m-dokl/].
В настоящее время для повышения эффективности вакцин в экспериментальных и клинических исследованиях применяют адъюванты различного происхождения: минеральные (гидроксид или фосфат алюминия и др.); растительные (сапонины - QuilA, QS21); микробные (убитые бактерии, липополисахарид и его производные, CpG-мотивы ДНК) и др.
Вследствие токсичности или недостаточной эффективности большинства адъювантов для широкого клинического использования разрешены только соли алюминия и водно-масляная эмульсия MF-59, а в некоторых странах вирусоподобные частицы (VLP - virus-likeparticles) и иммуностимулирующий комплекс (ISCOM - immunostimulatingcomplex). Зарубежные коммерческие гриппозные вакцины выпускаются лишь с одним адъювантом MF-59, и такие вакцины оказались более иммуногенными при вакцинации пожилых лиц, однако обладали повышенной реактогенностью.
Разработка новых классов адъювантов является перспективным направлением современной иммунобиологии. За последние десятилетия произошли значительные изменения в технологии производства вакцинных препаратов. Вакцины, которые проходят в настоящее время клинические испытания, значительно отличаются от традиционных вакцин. Прежде всего, это рекомбинантные вакцины на основе очищенных белков. Создание новых вакцин является в свою очередь причиной поиска новых адъювантов. Использование адъювантов позволяет уменьшить дозу антигена в вакцине, увеличить иммуногенность «слабых» антигенов, предотвращать конкуренцию антигенов в комбинированных вакцинах, увеличивать скорость развития и продолжительность иммунного ответа у привитых, индуцировать защитные свойства слизистых оболочек, а также увеличивать силу иммунного ответа у детей и лиц пожилого возраста.
В настоящее время в мировой и отечественной практике рассматриваются адъюванты в виде различных форм: липосомы, виросомы, иммуностимулирующие комплексы, наноэмульсии (MF59, SAF, Montanide), полимерные наносферы, вирусоподобные частицы и др.
Самые перспективные адъюванты, по мнению исследователей, - это наночастицы (НЧ). Одной из причин использования НЧ в качестве адъювантов является тот известный факт, что они эффективно поглощаются антигенпредставляющими клетками. Таким образом, если с НЧ связать антиген, то он будет направленно поглощаться макрофагами, что приведет к усилению иммунного ответа.
Перспективным направлением в данной области являются адъюванты на основе тритерпеноидов бересты.
При создании таких адъювантов имеются трудности, связанные с крайне низкой растворимостью в воде тритерпеноидов. Так, растворимость бетулина, как было определено, составляет менее 1 мкг/мл. Поэтому создание водорастворимой формы весьма актуально, так как должно привести к увеличению концентрации частиц и повышению эффективности адъюванта. Поиск таких форм привел к созданию сферических аморфных наночастиц на основе бересты.
Сферические аморфные наночастицы (САНЧ) на основе природного пентациклического тритерпенового вещества - бетулина (бетуленол, бетулинол, лупендиол) являются композицией биологически активных соединений. Это выгодно отличает их от всех известных видов носителей. Они, имея выраженный спектр биологической активности (противомикробное, противогрибковое, противовирусное действия, гепатопротективное, противовоспалительное, противораковое, противоаллергическое, мембранстабилизирующее, иммуномодулирующее, антиоксидантное), обладают и адъювантными свойствами.
Известны патент Российской Федерации 2322091 "Композиция биологически активных веществ и способ получения нанодисперсий ее"; A23L 1/30; A61K 36/00; опубликован 20.04.2008 и патент Российской Федерации 2322998 "Носитель лекарственных и диагностических средств"; A61K 36/185; A61K 9/10; опубликован 27.04.2008, касающиеся получения нанодисперсий экстракта бересты в качестве носителя лекарственных и диагностических средств. В патентах описан способ получения нанодисперсий, заключающийся в том, что в колбу с экстрактом бересты в тетрагидрофуране (5 мг/мл) при сильном перемешивании добавляли дистиллированную воду. Полученную дисперсию перемешивали, растворитель упаривали на роторном испарителе при температуре не выше 40°C. Затем нанодисперсию обрабатывали на ультразвуковой бане и концентрировали на роторном испарителе до 1-1.5 мг/мл. Средний размер полученных наночастиц составил 187 нм.
Недостатком данного способа является непригодность для промышленного применения - сложность масштабирования процесса, лимитирующим фактором которого является удаление органического растворителя на роторном испарителе.
Известен патент Российской Федерации 2424516 "Способ выделения смеси для получения водных дисперсий сферических наночастиц"; G01N 33/15; B82B 1/00; опубликован 20.07.2011, по выделению смеси для получения водных дисперсий сферических наночастиц из смеси плохорастворимых в воде тритерпеноидов березовой коры, включающий инжекцию избытка воды в раствор тритерпеноидов березовой коры в смешивающимся с водой органическим растворителем (тетрагидрофуран) с формированием дисперсии, содержащей сферические наночастицы и кристаллы из тритерпеноидов березовой коры, полученную дисперсию центрифугируют, отделяя от кристаллов фракцию сферических наночастиц, отделенные наночастицы упаривают с получением твердой смеси тритерпеноидов для формирования морфологически однородных сферических наночастиц путем повторной инжекции.
Недостатком данного способа получения является отсутствие стадии очистки от тетрагидрофурана. По классификации органических растворителей тетрагидрофуран относится ко второму классу негенотоксических растворителей и его содержание в лекарственных препаратах необходимо контролировать.
Известен патент Российской Федерации 2355423 "Адъювант"; A61K 47/06; C08H 5/04; опубликован 20.05.2009, который раскрывает способ приготовления адъювантов на основе бетулина в виде наночастиц. Согласно известному способу можно получить адъювант в виде 0,5% водного раствора наночастиц бетулина и в виде высушенного препарата наночастиц экстракта бересты. Адъюванты готовят следующим образом. Растворяют бересты экстракт сухой (БЭС-65) в органическом растворителе при концентрации 2,5-5 г/л; добавляют к указанному раствору большое количество воды (до 25 объемов воды по отношению к объему раствора); удаляют растворитель и основную часть воды. К полученному водному раствору наночастиц добавляют криопротектор (например, сорбит) и осуществляют лиофилизацию. Перед иммунизацией адъюванты растворяют в фосфатном буфере (pH 7,5), обрабатывают ультразвуком в течение 15 минут, после чего охлаждают.
Недостаток - сложность масштабирования процесса, лимитирующим фактором которого является удаление органического растворителя на роторном испарителе.
В качестве ближайшего аналога может быть указан способ получения адъюванта для вакцин в форме сферических аморфных наночастиц (САНЧ) из смеси тритерпеноидов бересты (Гаврилова Л.А. Наночастицы гидрофобных природных соединений как адъюванты, автореферат диссертации, Москва. 2011). Адъювант получают путем осаждения избытком воды из смешивающихся с водой растворителей, таких как тетрагидрофуран, добавления мирамистина или олеиновой кислоты до 2% от массы тритерпеноидов, удаления органического растворителя с помощью роторного испарителя, лиофилизации в присутствии криопротектора. Дополнительно при выпаривании может быть использована ультрафильтрация. Размеры сферических частиц составляют 100-400 нм. Однако, хотя данный метод позволяет повысить стабильность и эффективность адъюванта, при его осуществлении имеются потери тритерпеоидов.
Кроме того, в описанном способе получения отсутствует стадия стерилизации, что является одним из основных требований, предъявляемых к препаратам вводимым парентерально. В соответствии с Европейской фармакопеей и с действующими в России нормативными документами препараты для парентерального введения должны быть стерильными, апирогенными, нетоксичными.
Задача, решаемая изобретением, заключается в повышении качества адъюванта, позволяющая получать его в соответствии с требованиями, предъявляемыми к препаратам, вводимым парентерально: стерильность, апирогенность, атоксичность.
Технический результат, обеспечивающий решение упомянутой задачи, заключается в исключении токсичности препарата, снижении остаточной концентрации ТГФ, в обеспечении его стерильности, апирогенности, легкости масштабирования и стабильности при хранении.
Технический результат достигается тем, что в способе получения адъюванта, включающем растворение смеси тритерпеноидов бересты в тетрагидрофуране, добавление олеиновой кислоты, удаление тетрагидрофурана, добавление криопротектора и лиофилизацию, согласно изобретению получают смесь тритерпеноидов бересты в тетрагидрофуране с концентрацией 5-10 г/л, с последующим растворением в олеиновой кислоте в количестве 5-10% от массы тритерпеноидов бересты, проводят стерилизующую фильтрацию смеси, формируют гомогенную дисперсию сферических аморфных наночастиц путем добавления 25 кратного избытка 0,01 М трис буфера, pH - 9,0±0,2, при перемешивании, с последующей ультразвуковой обработкой в течение 5-10 минут, удаляют тетрагидрофуран с помощью ультрафильтрации при скорости 1,0-1,2 л/минуту, при давлении 0,6-0,8 атм, замораживают полученную концентрированную смесь с содержанием смеси терпеноидов 1 мг/мл при добавлении криопротектора ниже температуры (-35°) C, выдерживают при этой температуре 4-6 часов и лиофилизируют.
Предпочтительно процесс ультрафильтрации проводят на мембранах с порогом исключения 300 КДА.
Включение стадии обработки ультразвуком позволило в большей степени стабилизировать адъювант.
В качестве криопротектора могут быть использованы: сахароза, маннит, мальтоза, трегалоза, манноза, сорбит и т.п. Предпочтительно в способе при лиофилизации используют сахарозу как наиболее дешевый углевод.
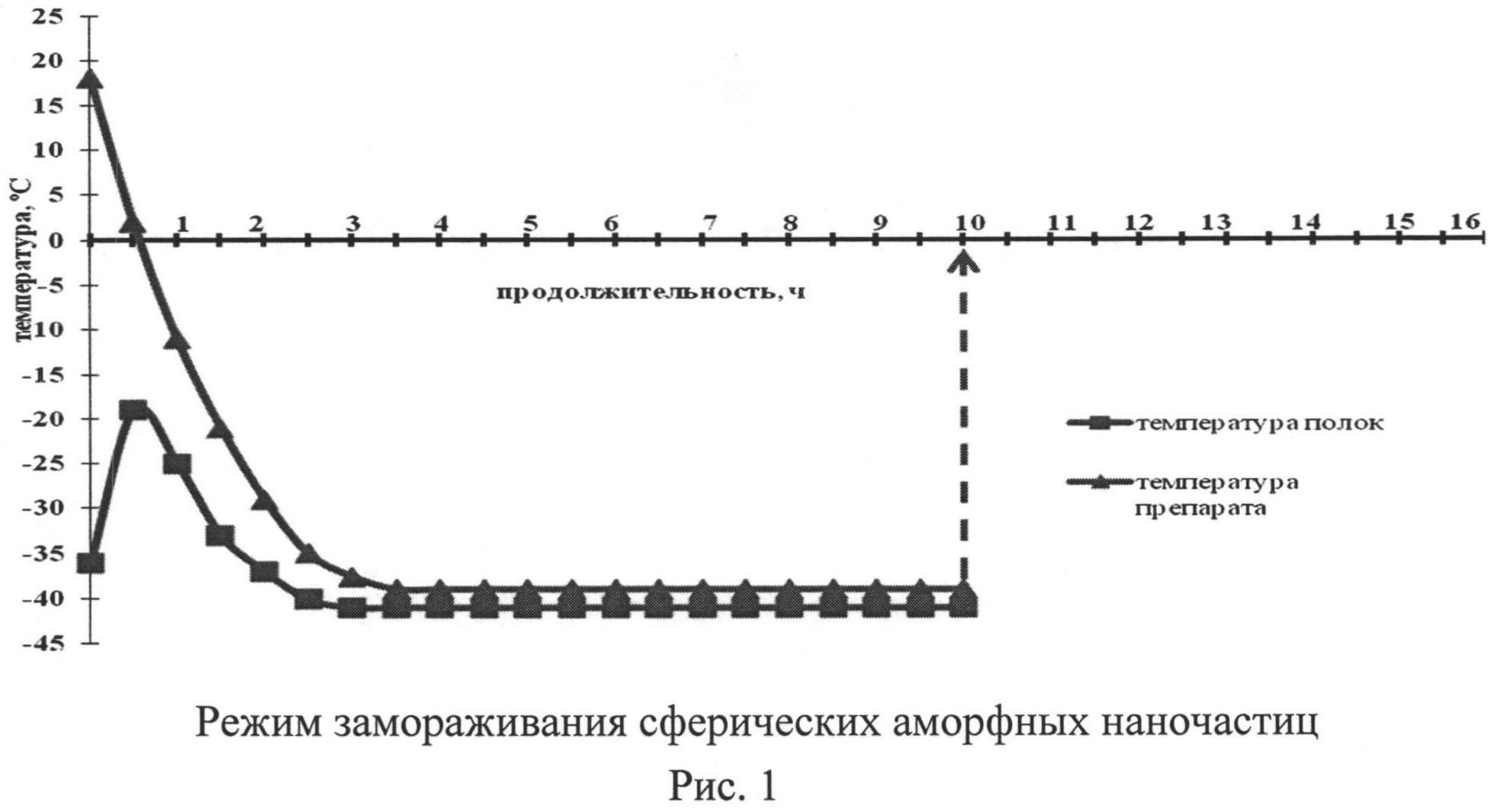
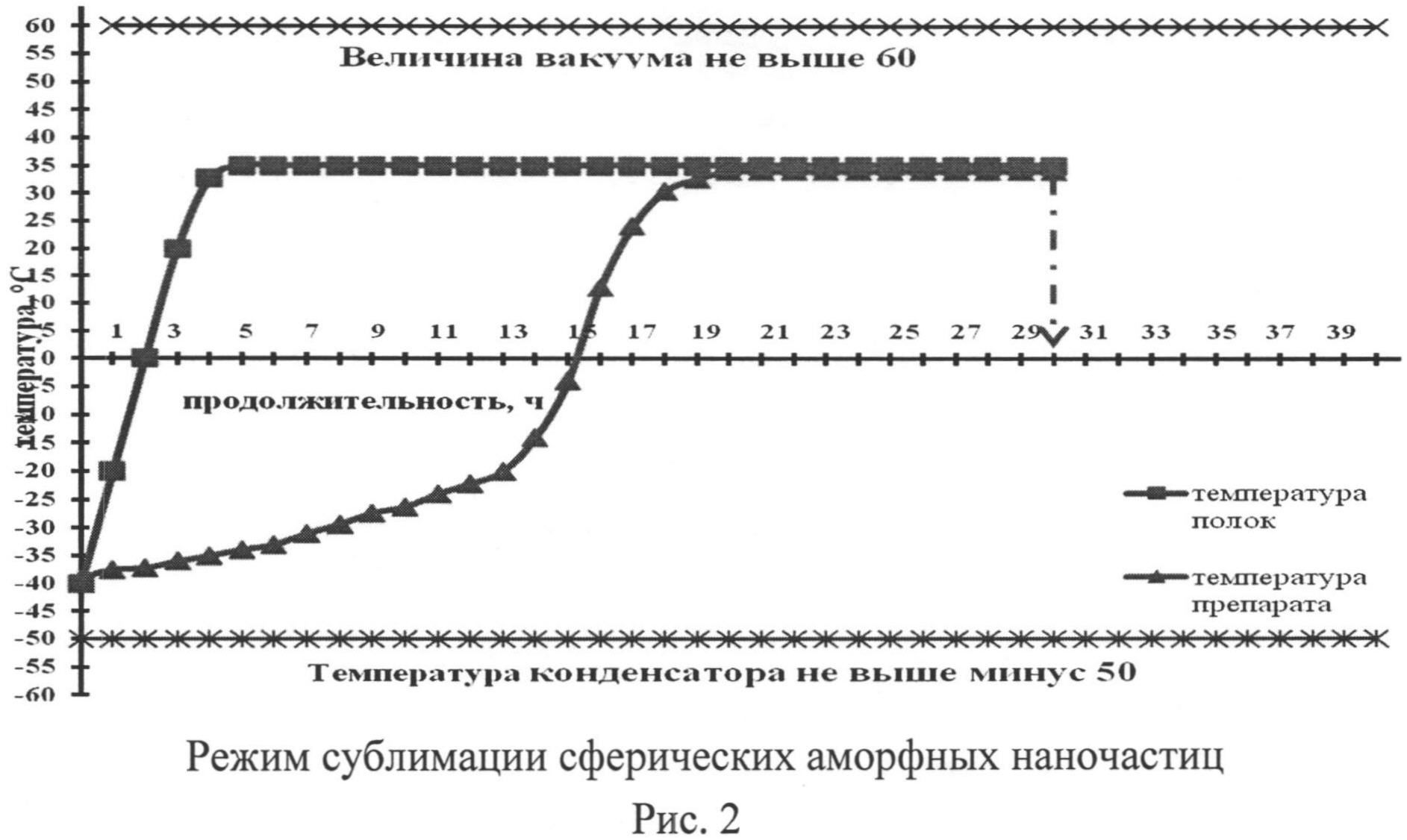
Важное значение для отработки режима лиофилизации имеет определение эвтектической температуры, при которой водный раствор переходит в твердую фазу. Важность этого этапа определяется тем, что наличие жидкой фазы, даже во внешне замороженном материале, в начале фазы сублимации может привести к необратимым явлениям, таким как нарушение целостности слоя препарата и его физической структуры. Точка эвтектики для сферических аморфных наночастиц была определена методом анализа зависимости электрического сопротивления от температуры. Лиофилизацию образцов проводили на аппарате для сублимирования ТГ-50 (Германия). По данным анализа определений эвтектической точки было установлено, что сферические аморфные наночастицы с концентрацией криопротектора 1/10-1/20 по массе имеют зону эвтектических температур минус 15±6°C. Наиболее оптимально проводят стадию лиофилизации при температуре препарата (-35°C), продолжительность стадии 15 часов; досушивают препарат адъюванта при плюсовых температурах (20-25°C) в течение 15 часов.
Наличие в составе адъюванта олеиновой кислоты в количестве 5-10% от массы тритерпеноидов бересты обеспечивает стабильность при хранении, введение стадии стерилизующей фильтрации обеспечило получение адъюванта стерильным и апирогенным, использование ультрафильтрационной очистки способствовало исключению токсичности и удаление тетрагидрофурана, снижению затрат. Совокупность отличительных признаков обеспечивает легкость масштабирования технологического процесса от лабораторного до промышленного.
Возможность осуществления изобретения может быть продемонстрирована следующими нижеприведенными примерами.
Пример 1. Получение адъюванта вирусных вакцин
С целью получения адъюванта, отвечающего требованиям к препаратам для парентерального введения, мы отработали технологию, в которой все исходные растворы должны стерилизоваться на начальных этапах производства адъюванта, и весь дальнейший технологический процесс должен проходить в стерильных условиях. Поэтому на первом этапе проводим растворение смеси тритерпеноидов бересты, содержащую мас.%: бетулин 65-71, лупеол 12-16, 3-О-кофеат бетулина 5-15 в тетрагидрофуране. К полученной смеси добавляем олеиновую кислоту в количестве 5-10% от массы тритерпеноидов бересты. Проводим стерилизацию полученной смеси, используя фильтроэлемент с модифицированным поверхностным зарядом, устойчивый к действию органических растворителей, такой как нейлоновая мембрана с диаметром пор 0,22 мкм марки NRG Pall N66+c.
С целью получения гомогенной дисперсии сферических аморфных наночастиц к стерильной смеси добавляли 25-кратный объем стерильного буфера (pH=9,0±0,2) с помощью перистальтичекого насоса при постоянном перемешивании в течение 15 минут верхнеприводной мешалкой пропеллерного типа. В результате последующей гомогенизации ультразвуком в течение 5 минут образовывались сферические аморфные наночастицы. При этом наблюдалось разрушение агрегированных частиц, всплывающих на поверхность, и дисперсия становилась гомогенной.
С целью удаления органического растворителя применяли ультрафильтрацию на полых волокнах с номинальной отсекающей молекулярной массой 300 кДа. Очистку от органических растворителей можно оптимизировать путем использования 0,01 М трис буферный раствор с pH=9,0±0,2 для 2-3-кратного разведения исходной дисперсии сферических аморфных наночастиц. При этом скорость ультрафильтрации составляла 1,0-1,2 л/минуту, давление устанавливали в пределах 0,6-0,8 атм. Нанодисперсии концентрировали до содержания основного вещества 1 мг/мл.
Лиофилизация: при добавлении криопротектора осуществляют замораживание препарата ниже температуры (-35°C) и выдерживание при этой температуре не менее 4-6 часов; проведение стадии лиофилизации при температуре препарата (-35°C), продолжительность стадии 15 часов; досушивание препарата при плюсовых температурах (20-25°C) в течение 15 часов (рис.1, 2).
По внешнему виду полученный лиофилизированный адъювант представлял собой пористую массу белого или желтовато-белого цвета с остаточной влажностью (3,5±0,5)%.
Остаточное количество ТГФ в готовом препарате определяли методом ГЖХ. Анализ полученных результатов показал, что отработанный метод ультрафильтрации обеспечивает эффективное удаление ТГФ, его концентрация в препарате составила 0,176±0,009 мг/мл. Последующая стадия лиофилизации способствовала снижению остаточной концентрации ТГФ до 0,122±0,004 мг/мл, т.е. почти на 30%. Следует отметить, что по данным ГФ XII издания, предельно допустимое количество тетрагидрофурана, принимаемое в составе суточной дозы в лекарственных средствах, не должно превышать 7,2 мг/мл, что в 2360 раз меньше, чем при введении 25 мкг САНЧ (предполагаемое содержание в одной дозе вакцинного препарата).
Предложенный способ получения сферических аморфных наночастиц, имеющих дзета-потенциал минус 44,3 мВ и средний размер 160-180 нм, обеспечивает условия, при которых не образуется кристаллических наночастиц.
Пример 2. Ресуспендирование лиофильно высушенных препаратов адъюванта
Лиофильно высушенный препарат ресуспендируют водой для инъекций. Перемешивают получившийся раствор в течение 2-3 минут, например, с помощью шейкера или мешалки, избегая вспенивая. Также рекомендуется обработка суспензии ультразвуком в течение 3-5 минут.
Пример 3. Проверка на пирогенность и стерильность
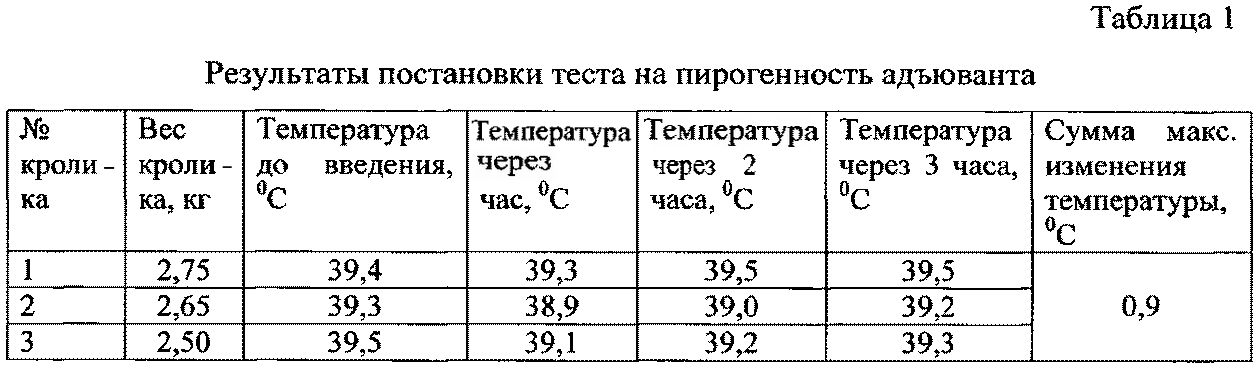
Для проверки на пирогенность регидратированный адъювант вводили кроликам по 50 мкг на килограмм массы внутривенно. При этом максимальная сумма изменения температуры у трех кроликов составила 0,9°C (табл.1), что свидетельствует об апирогености адъюванта.
Определение стерильности адъюванта проводили в соответствии с ГФ XII издания при двух режимах 22,5±2,5°C и 32,5±2,5°C. Было установлено, что адъювант стерилен.
Таким образом, разработанная технология позволяет получать адъювант стерильным и апирогенным, что удовлетворяет требованиям, предъявляемым к препаратам для парентерального введения и позволяет их использовать в качестве вакцинных адъювантов.
Пример 4. Оценка сорбционной способности адъюванта на примере дифтерийного, столбнячного анатоксинов и поверхностного антигена вируса гепатита B
Одним из основных механизмов действия адъювантов является «депо»-эффект, который реализуется за счет связывания антигена и адъюванта. При этом сорбционная способность адъюванта может реализовываться за счет электростатических взаимодействий.
При отработке технологии определяли сорбционную способность адъюванта на примере дифтерийного, столбнячного анатоксинов, поверхностного антигена вируса гепатита В. Для получения вакцинных композиций отбирали необходимое количество адъюванта с pH-9,00 и добавляли рассчитанный объем антигена, перемешивали и оставляли на 30 минут для сорбции. Затем доводили 0,9% раствором натрия хлорида до получения вакцинной дозы. Приготовленные образцы вакцин центрифугировали при 10000 об/мин, отделяли супернатант, который анализировали с помощью ИФА и по результатам титрования определяли сорбционную способность адъюванта (табл.2).
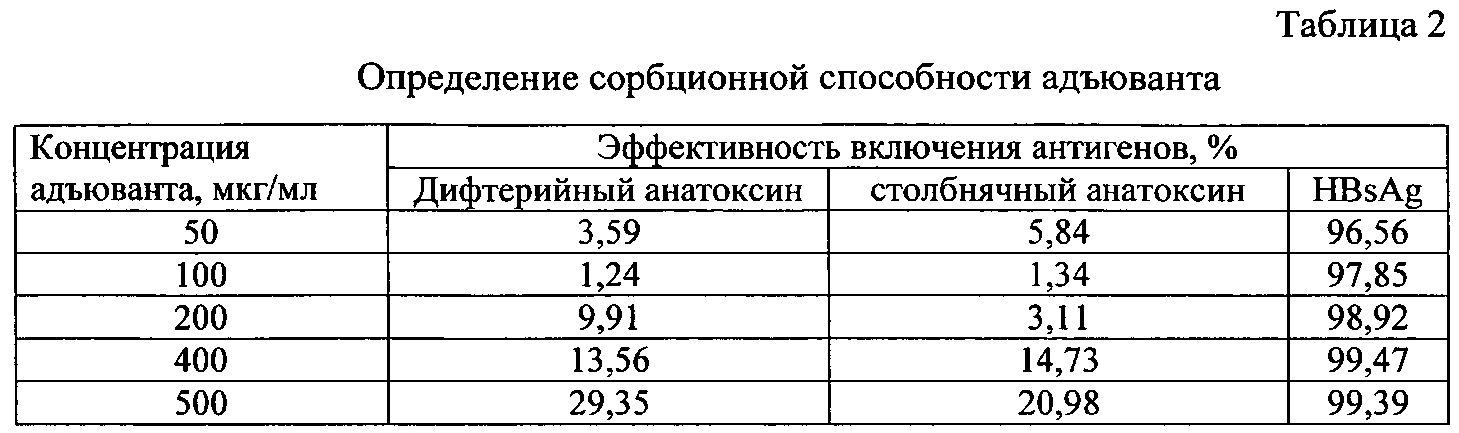
Как видно из данных таблицы, адъювант в концентрации 50 мкг/мл эффективно связывает поверхностный антиген вируса гепатита В. В свою очередь, даже при концентрации адъюванта 500 мкг/мл эффективность связывания по отношению к дифтерийному и столбнячному анатоксину составляет менее 30%.
Пример 5. Изучение адъювантных свойств на примере вакцины против гепатита B
Адъювантные свойства изучали на модели вакцины против гепатита B в опытах на морских свинках массой 350-400 г. Животным двукратно подкожно с интервалом 14 дней вводили вакцины гепатита В с различными адъювантами в объеме 0,5 мл (10 мкг HBsAg). На 14 и 28-й день после иммунизации в сыворотках морских свинок методом иммуноферментного анализа определяли антитела к поверхностному антигену вируса гепатита B.

В наших исследованиях было установлено, что экспериментальный адъювант в концентрациях значительно меньших, чем широко используемый адъювант - гель гидроксида алюминия, обеспечивает высокий иммунный ответ на вакцину против гепатита В.
Пример 6. Изучение адъювантных свойств на примере вакцины против вируса гриппа
В эксперименте с гриппозными вакцинами использовали белых мышей с массой тела 10-13 г. Иммунизацию осуществляли следующим образом: в каждую из задних лапок мышей вводили по 100 мкл свежеприготовленных растворов (с адъювантами или без них) внутримышечно из расчета 1,5 мкг гемагглютинина (ГА) на животное. Забор крови проводили через месяц после иммунизации. Специфическую активность в сыворотках мышей определяли методом ИФА.

Представленные результаты ИФА показали, что экспериментальный адъювант проявлял выраженные адъювантирующие свойства. Максимальный уровень антител у животных обеспечила вакцинная композиция с низкой дозой экспериментального адъюванта.
Пример 7. Изучение токсических свойств экспериментального адъюванта
Токсические свойства препарата оценивали в опытах по определению острой и хронической токсичности. Для изучения острой токсичности белым мышам вводили препарат внутрибрюшинно однократно в дозе 0,5 мл (25 мкг/доза) на мышь (что соответствует 2994 человеческим дозам), морским свинкам (массой 300-350 г) - подкожно в дозе 5,0 мл (250 мкг/доза) на морскую свинку (что соответствует 1851 человеческой дозе). При изучении хронической токсичности белым мышам вводили адъювант в концентрации 50 мкг/мл в дозе по 0,5 мл (25 мкг) внутрибрюшинно трехкратно (1, 4, 9 сутки) в суммарной дозе 1,5 мл на мышь (что соответствует 8982 человеческим дозам). Животным группы сравнения водили 0,9% раствор натрия хлорида по аналогичным схемам.
Результаты наблюдения показали, что однократное и многократное введение препарата не вызывало гибели животных, не приводило к снижению массы тела (табл.5, 6), изменениям волосяного покрова, некробиотическим изменениям на месте введения.
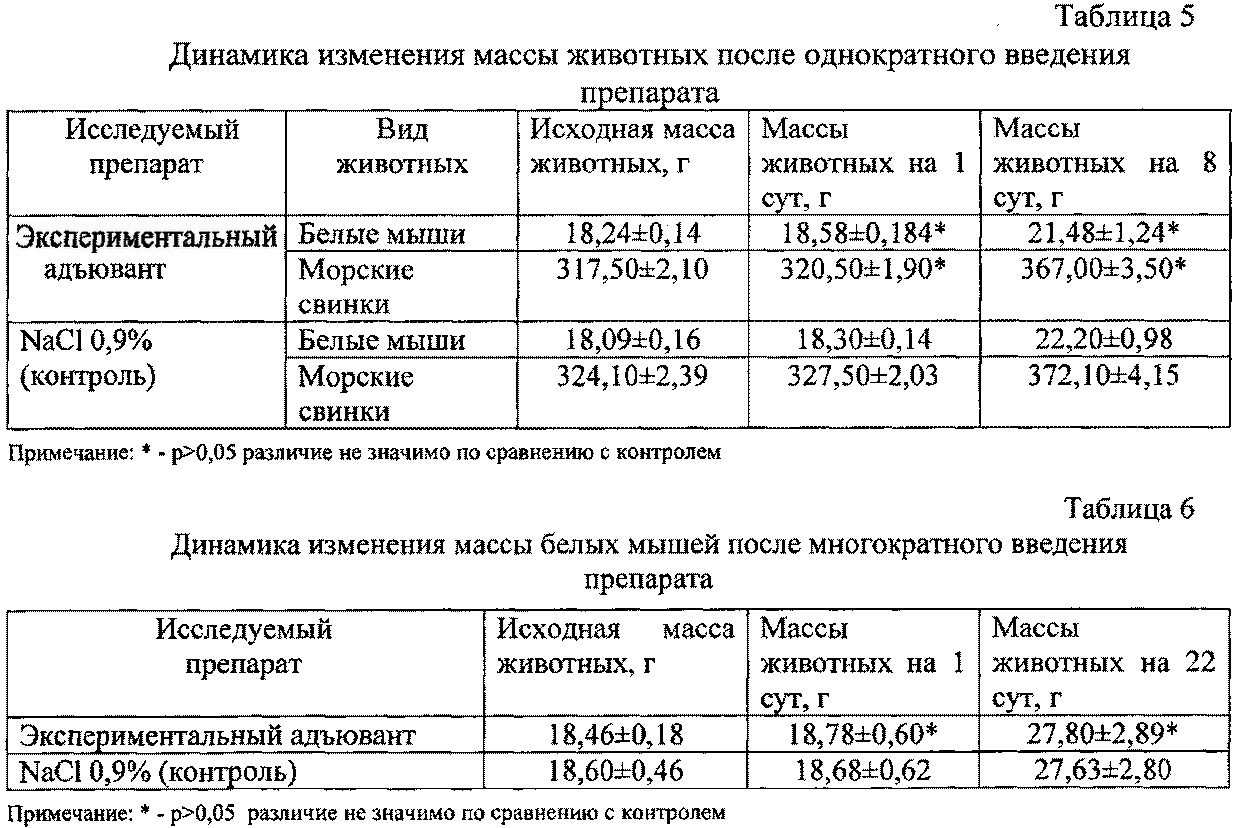
Через 24 ч и 13 суток после последней инъекции при оценке хронической токсичности в группе сравнения и опытной группе внутренние органы животных имели все характерные признаки, расположение и строение. Оболочки, выстилающие внутренние полости, влажные, серовато-розового цвета, без признаков воспаления.
Таким образом, при изучении острой и хронической токсичности было установлено, что экспериментальный адъювант не вызывает симптомов интоксикации, не обладает токсическим действием на системы и органы лабораторных животных, не способствует развитию патологических, в том числе воспалительных, дистрофических и некротических изменений.