Результат интеллектуальной деятельности: СПОСОБ ОПТИМИЗАЦИИ ЛЕЧЕНИЯ ИМАТИНИБОМ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ РЕЦЕПТОРОМ ТИРОЗИНКИНАЗЫ KIT
Вид РИД
Изобретение
Настоящее изобретение относится к способу лечения пролиферативных заболеваний, опосредованных рецептором тирозинкиназы KIT, в частности стромальных опухолей желудочно-кишечного тракта (СОЖКТ) у людей.
СОЖКТ - редкая саркома внутренних органов, которая возникает преимущественно в желудочно-кишечном тракте (ЖКТ). Саркомы СОЖКТ представляют наиболее обычный подтип сарком ЖКТ, к которым также относятся лейомиосаркомы, липосаркомы и другие более редкие гистологические подтипы. Было установлено, что СОЖКТ составляют примерно 3% от всех злокачественных опухолей. В большинстве случаев саркомы СОЖКТ встречаются в желудке (60-70%), затем в тонком кишечнике (20-30%).
В предшествующих молекулярных и иммуногистохимических исследованиях СОЖКТ было установлено, что клетки саркомы СОЖКТ положительны по CD117 - антигену на поверхности клеток, локализованному на внеклеточном домене транс-мембранного рецептора тирозинкиназы KIT, белке прото-онкогена с-КГТ и рецепторе фактора стволовых клеток. При связывании со своим лигандом, фактором стволовых клеток, KIT формирует димер, который аутофосфорилируется и активирует сигнальные каскады, приводящие к росту клеток. Мутации, которые приводят к активированной форме KIT, особенно к формам, которые активируются независимо от лиганда, известны и предположительно участвуют в определенных пролиферативных заболеваниях, например в мастоцитозах, особенно системных мастоцитозах, острых миелогенных лейкозах, СОЖКТ, синоназальной NK/T-клеточной лимфоме, семиномах и дисгерминомах. Предполагают, что практически все злокачественные формы СОЖКТ, несущие мутации c-KIT в качестве движущего фактора этого заболевания, приводят к конститутивной активации KIT, ассоциированного с метаболическим путем сигнальной трансдукции для клеточного деления и роста опухолей. Сверхэкспрессию KIT определяют иммуногистохимически по стандартному методу.
Настоящее изобретение относится к способу сведения к минимуму или к уклонению от возникновения устойчивости, к утрате эффективности и риска рецидива у людей с пролиферативным заболеванием, опосредованным рецептором тирозинкиназы KIT. Настоящее изобретение основано на установленном факте, заключающемся в том, что лечение пролиферативного заболевания, опосредованного рецептором тирозинкиназы KIT, включает введение ингибитора KIT или его фармацевтически приемлемой соли пациенту с таким пролиферативным заболеванием, может быть оптимизировано регулированием дозы ингибитора KIT или его фармацевтически приемлемой соли, применяемой конкретным пациентом, таким образом, что специфический минимальный уровень в плазме (Сmin) ингибитора KIT достигается у каждого отдельного пациента. Установлено, что часто требуется индивидуальная корректировка для каждого пациента, принимая во внимание высокую вариабельность величины Cmin у разных пациентов после введения ингибитора KIT каждому пациенту.
Понятие «пролиферативное заболевание, опосредованное рецептором тирозинкиназы KIT», используемое в настоящем изобретении, подразумевает мастоцитозы, например лейкоз тучных клеток и системный мастоцитоз, острый миелогенный лейкоз (ОМЛ), СОЖКТ, семиномы, дисгерминомы и метастатическую меланому. Понятие «пролиферативное заболевание, опосредованное рецептором тирозинкиназы KIT» означает главным образом пролиферативное заболевание системный мастоцитоз, особенно агрессивный системный мастоцитоз, и СОЖКТ, особенно СОЖКТ.
Понятие «ингибитор KIT» в контексте настоящего изобретения означает терапевтически действующее соединение, например низкомолекулярное органическое соединение или антитело, которое ингибирует действие рецептора KIT тирозинкиназы, более конкретно дикого типа KIT и определенные мутации KIT, описанные ниже. Предпочтительно ингибитор KIT ингибирует преимущественно рецептор KIT, несущий активирующие мутации.
В одном из вариантов осуществления настоящего изобретения применяемым в настоящем изобретении ингибитором является иматиниб формулы (I),
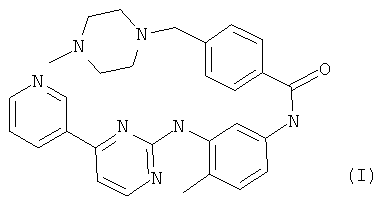
называемый в настоящем изобретении «соединением (I)», или его фармацевтически приемлемая соль. Иматиниб является ингибитором тирозинкиназы, который селективно ингибирует KIT дикого типа и определенные мутации KIT. В феврале 2002 года N-{5-[4-(4-метил-пиперазинметил)-бензоиламидо]-2-метилфенил}-4-(3-пиридил)-2-пиримидинамин мезилат (иматиниб мезилат, STI571, продукт Glivec®) был одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения взрослых пациентов с CD 117 положительной неоперабельной и/или метастатической злокачественной формой СОЖКТ.
В другом варианте осуществления настоящего изобретения применяемым в настоящем изобретении ингибитором KIT является нилотиниб или его фармацевтически приемлемая соль. Нилотиниб является ингибитором тирозинкиназы, который селективно ингибирует KIT. В 2007 году монохлорид моногидрата 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(4-метил-1Н-имидазол-1-ил)-3-(трифторметил)-фенил]бензамида (монохлорид моногидрата нилотиниба, продукт Tasigna®), имеющий структуру (II) и называемый в настоящем изобретении «соединением (II)»,
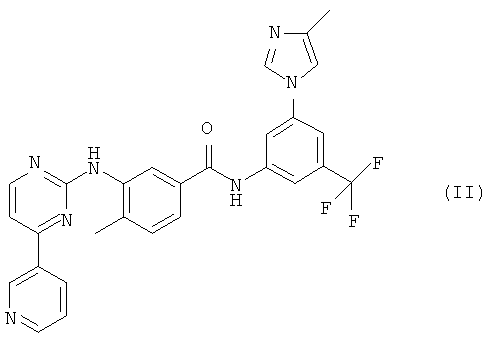
был одобрен FDA для лечения пациентов с хроническим миелолейкозом, устойчивых или не переносящих существующие методы лечения, включая лечение продуктом Glivec®. Соединение формулы (II) и способ его получения описаны в патенте US 7169791, включенном в настоящее описание в виде ссылки.
Мутации, приводящие к активированной форме KIT, указанной в настоящем изобретении, включают, но ими не ограничиваются, мутации D816F, D816H, D816N, D816Y, D816V, К642Е, Y823D, Del 550-558, Del 557-561, N822K, V654A, N822H, Del 550-558+V654A, Del 557-561+V654A, Ins503AY, V560G, 558NP, Del 557-558, Del VV559-560, F522C, Del 579, R634W, К642Е, T801I, C809G, D820Y, N822K, N822H, Y823D, Y823C и Т6701.
Настоящее изобретение предусматривает в первую очередь схему лечения для отдельных пациентов с пролиферативным заболеванием, опосредованным рецептором тирозинкиназы KIT, основанную на пониженном пороге величины Cmin, по индивидуальной схеме, причем было установлено, что эта величина коррелирует с повышенной степенью общего ответа (00) и повышенным временем до начала прогрессирования (ВДП).
Понятие «заболевание, опосредованное рецептором KIT тирозинкиназы», используемое в настоящем изобретении, означает заболевание, в котором KIT активирован мутациями или другими молекулярными механизмами или сверхэкспрессирован, в частности относится к СОЖКТ и системному мастоцитозу, более предпочтительно к СОЖКТ.
В частности, было установлено, что пациенты с СОЖКТ, у которых уровни иматиниба ниже примерно 2050 нг/мл, более конкретно, уровни иматиниба ниже примерно 1100 нг/мл, проявляют пониженную степень общего ответа (00) и более короткое время до начала прогрессирования (ВДП) по сравнению с пациентами, у которых величина превышает пороговую.
Согласно указанному выше СОЖКТ принадлежит к группе заболеваний, опосредованных рецептором KIT тирозинкиназы. Полученные результаты у пациентов с СОЖКТ, описанные в настоящем изобретении, могут быть непосредственно перенесены на целую группу заболеваний, опосредованных рецептором KIT тирозинкиназы.
Понятие «способ лечения» в контексте настоящего изобретения относится также к способу предупреждения указанных выше заболеваний, т.е. к профилактическому введению фармацевтической композиции, включающей ингибитор KIT, здоровым пациентам для предупреждения развития заболеваний, указанных в настоящем изобретении.
Понятия «подбор дозы» и «подобранная доза» в контексте настоящего изобретения предпочтительно означают, что указанная доза является пониженной или повышенной. В более широком смысле в контексте настоящего изобретения понятия «подбор дозы» и «подобранная доза» также относятся к тем ситуациям, когда доза остается неизменной.
Таким образом, один из объектов настоящего изобретения относится к способу лечения пролиферативного заболевания, опосредованного рецептором тирозинкиназы KIT, у больного человека, включающему стадии:
(а) введения заранее установленного фиксированного количества иматиниба или его фармацевтически приемлемой соли, например пероральной суточной дозы 400 мг или 600 мг иматиниба мономезилата, больному человеку с указанным заболеванием,
(б) отбора по меньшей мере одного образца крови указанного пациента, например, в первые 12 месяцев лечения, например, в течение первых 30 суток,
(в) определения величины Cmin иматиниба и
(г) подбора дозы иматиниба или его фармацевтически приемлемой соли таким образом, что Cmin иматиниба достигает по меньшей мере 1100 нг/мл, предпочтительно Cmin составляет от 1100 до примерно 2500 нг/мл у указанного пациента.
В более широком смысле настоящее изобретение предусматривает способ лечения пролиферативного заболевания, опосредованного рецептором KIT тирозинкиназы у больного человека, причем доза иматиниба или его фармацевтически приемлемой соли подбирают таким образом, что поддерживаемая величина Cmin иматиниба составляет по меньшей мере 1100 нг/мл, особенно примерно от 1100 до примерно 2500 нг/мл, предпочтительно Cmin составляет от 2050 и примерно до 2500 нг/мл у указанного пациента.
Точнее настоящее изобретение относится к способу лечения СОЖКТ у больного человека, включающему стадии:
(а) введения заранее установленного фиксированного количества иматиниба или его фармацевтически приемлемой соли человеку с заболеванием СОЖКТ, нуждающемуся в этом,
(б) отбора по меньшей мере одного образца крови указанного пациента, например, в первые 12 месяцев лечения, особенно в течение первых 3 месяцев, особенно в первые 30 суток лечения,
(в) определения минимального уровня иматиниба в плазме (Cmin) и
(г) подбора дозы иматиниба или его фармацевтически приемлемой соли таким образом, что величина Cmin иматиниба достигает по меньшей мере 1100 нг/мл, особенно примерно от 1100 и до примерно 2500 нг/мл, предпочтительно величина Cmin иматиниба достигает от 2050 и примерно до 2500 нг/мл у указанного пациента.
В одном из вариантов осуществления настоящего изобретения заранее установленное фиксированное количество, обозначенное на стадии (а), представляет терапевтически эффективное количество.
В настоящем изобретении предпочтительно на стадии (а) используют иматиниб мономезилат, например, в пероральной суточной дозе примерно от 200 и до примерно 800 мг, предпочтительно в суточной дозе примерно 400 или 600 мг.
Другим важным объектом настоящего изобретения является применение иматиниба или его фармацевтически приемлемой соли, особенно иматиниба мезилата, для получения лекарственного средства для лечения СОЖКТ, согласно которому дозу фармацевтически приемлемой соли подбирают таким образом, что у указанного пациента поддерживают величину Cmin, составляющую по меньшей мере 1100 нг/мл, особенно примерно от 1100 и до примерно 2500 нг/мл, предпочтительно величина Cmin составляет от 2050 и примерно до 2500 нг/мл.
Настоящее изобретение особенно полезно для пациентов с СОЖКТ, несущих мутацию в экзоне 11 KIT. Для такой подгруппы величина общих объективных ответов (000) составляет 67% для пациентов с величиной Cmin ниже 1100 нг/мл по сравнению со 100% для пациентов с Сmin выше 1100 нг/мл.
Соединения формулы I конкретно описаны в патентной заявке US 5521184, в частности в примере 21, сущность которой включена в настоящее изобретение в виде ссылки. Иматиниб также может быть получен в соответствии с процессами, описанными в WO 03/066613.
Для цели настоящего изобретения иматиниб предпочтительно применяют в форме мономезилата. Иматиниб мономезилат также может быть приготовлен в соответствии с процессами, описанными в патенте US 6894051, сущность которого включена в настоящее изобретение в виде ссылки. Сравнивают также соответствующие полиморфы, например кристаллические модификации, которые описаны в указанном патенте.
На стадии (а) описанного выше способа в частности суточная доза примерно от 200 и примерно до 800 мг, например 400 мг, иматиниба мономезилата вводят перорально. Иматиниб мономезилат можно вводить в дозовых формах согласно описанию в US 5521184, US 6894051, US 2005-0267125 или WO 2006/121941.
Отбор образцов крови у пациентов, требуемый в способах, описанных в настоящем изобретении, может осуществляться стандартными методами, применяемыми в данной области. Соответствующим методом определения минимального уровня в плазме (Сmin) иматиниба и N-{5-[4-(пиперазинметил)-бензоиламид]-2-метилфенил}-4-(3-пиридил)-2-пиримидинамина были описаны R. Bakhtiar и др. в J Chromatogr В Analyt Technol Biomed Life Sci. 768(2), 5 марта 2002 года, сс. 325-340.
Краткое описание фигур
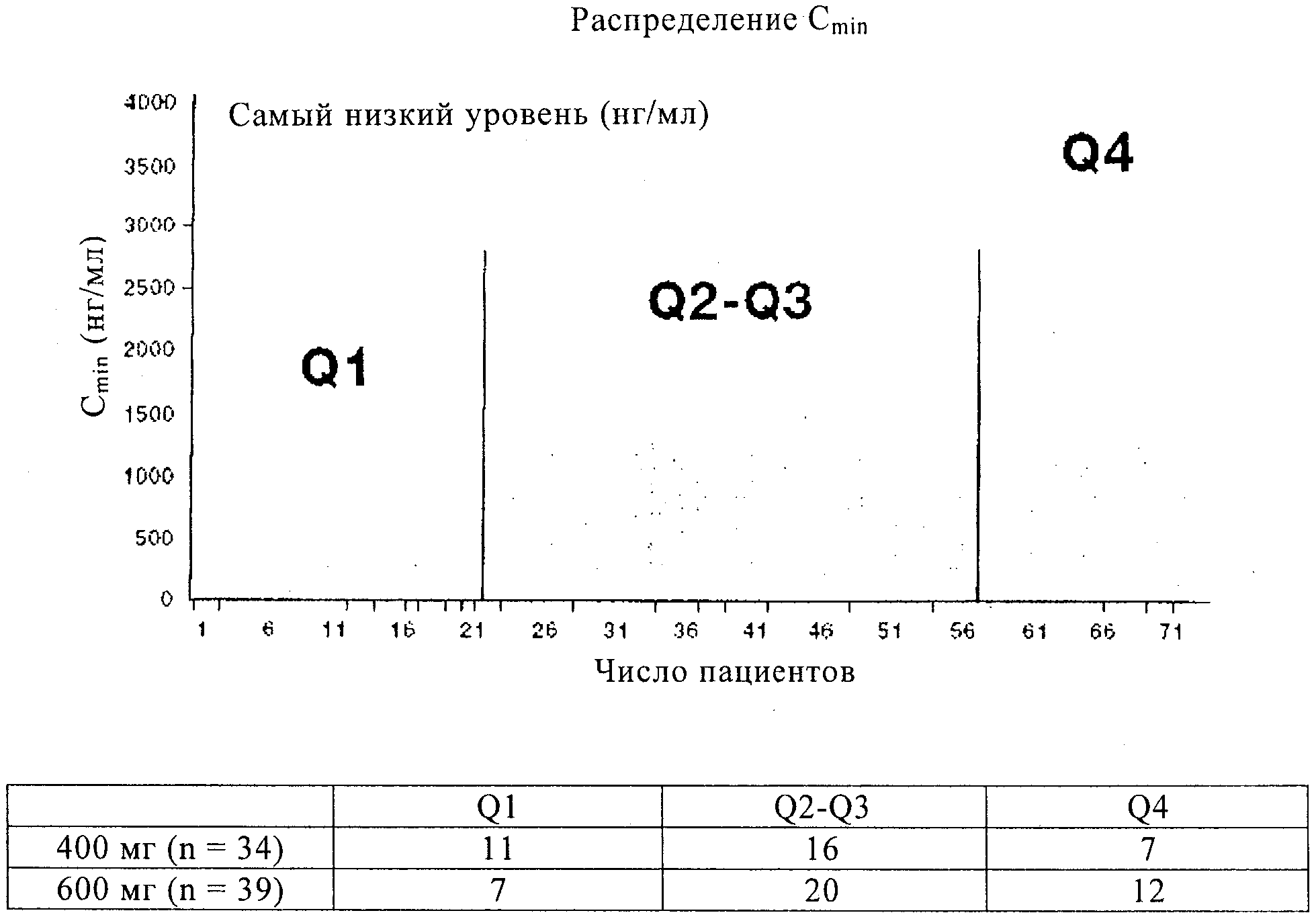
Фиг.1 представляет исследование минимального распределения иматиниба, описанное в примере 1 (данные по 400 мг и 600 мг объединены).
Пример 1. Фармакокинетика (ФК) иматиниба и ее корреляция с клиническим ответом у пациентов с неоперабельной/метастатической стромальной опухолью желудочно-кишечного тракта (СОЖКТ)
Цель
На рандомизированной фазе II исследования (В2222) рандомизируют 147 пациентов с неоперабельной/метастатической стромальной опухолью желудочно-кишечного тракта (СОЖКТ) в соотношении 1:1 для получения иматиниба (ИМ) в дозе 400 и 600 мг в сутки. Пятьдесят два процента (52%) пациентов остаются живыми на протяжении >5 лет независимо от уровня первоначальной дозы. Описывают фармакокинетику (ФК) иматиниба (ИМ) и взаимосвязь между уровнями ИМ и клиническим ответом.
Методы
Уровни ИМ в плазме анализируют в подгруппе пациентов (п=73), данные которых на 1 сутки и в устоявшемся состоянии (на 29 сутки) доступны (п=34 и 39 для 400 и 600 мг/сутки соответственно). Влияние демографических показателей пациентов и параметров химии крови на ФК ИМ оценивают, используя популяционный ФК подход. Взаимосвязь между экспозицией ИМ в плазме и клиническим результатом исследуют путем группирования пациентов в квартили, исходя из минимальных уровней ИМ (Cmin). Параметры клинических ответов оценивают, используя общие объективные ответы (000=полная ремиссия+частичная ремиссия+внезапная смертность), время до начала прогрессирования (ВДП) и мутации KIT.
Результаты
Популяционный ФК анализ показывает, что возраст, пол и масса тела пациентов оказывают незначительное воздействие на клиренс иматиниба, несмотря на то, что было установлено, что альбумин плазмы и содержание лейкоцитов на исходном уровне существенно отличаются. У пациентов с повышенным уровнем альбумина или пониженным числом лейкоцитов относительно базового уровня проявляется повышенный клиренс ИМ. Полученные клинические результаты коррелируют с минимальной экспозицией ИМ. Величины ООО достигают 12 из 18 (67%) пациентов в квартиле Q1 (Сmin<1110 нг/мл) по сравнению с 29 из 36 (81%) и 16 из 19 (84%) в Q2-Q3 (>1110<2040 нг/мл) и Q4 (>2040 нг/мл) соответственно (р=0,177 для Q1 против Q2-Q4). Среднее ВДП составляет 11,3 месяцев для пациентов в Q1 и более 30 месяцев для Q2-Q4 (р=0,0029). У пациентов с 11 KIT мутациями в экзоне (n=39) ООО составляет 67% для Q1 против 100% для Q2-Q4 (р=0,009). Мутация 9 KIT в экзоне установлена только у 12 пациентов с данными Cmin, что ограничивает эффективность каких-либо анализов корреляции в данной подгруппе. Величина AUC ИМ в плазме, пиковая концентрация и Сmin проявляют высокую корреляцию, причем Сmin ИМ обладает наилучшей корреляцией с ответом.
Заключение
Иматиниб (ИМ) проявляет хорошее всасывание при пероральном введении, но существенную вариабельность у разных пациентов при экспозиции ИМ. Пациенты с наименьшими уровнями иматиниба (<1100 нг/мл) показывают наименьшую степень общих объективных ответов ООО и наименьшее время до начала прогрессирования (ВДП).