Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ
Вид РИД
Изобретение
Изобретение относится к ряду новых производных фенотиазина, модифицированных гамма-карболиновыми фрагментами, способам их получения, содержащим их фармацевтическим композициям и к их применению в медицине. В частности, оно относится к соединениям и композициям, которые демонстрируют способность ингибировать холинэстеразы и блокировать 6-й подтип серотониновых рецепторов, 5-НТ6, что является особенно полезным для лечения ряда заболеваний центральной нервной системы.
В развитии расстройств когнитивных функций - основного симптома болезни Альцгеймера (БА) и деменций другого происхождения - важную роль играет дефицит центрального ацетилхолина, что является рациональной основой для использования ингибиторов ацетилхолинэстеразы (АХЭ, КФ 3.1.1.7) для лечения БА. Применение ингибиторов АХЭ, повышающих концентрацию нейромедиатора ацетилхолина, приводит к умеренным улучшениям познавательной функции пациентов, страдающих БА. Эти соединения, однако, вызывают нежелательные побочные эффекты, такие как тошнота и рвота [Martinez A, Castro A. Novel cholinesterase inhibitors as future effective drugs for thetreatment of Alzheimer's disease. Expert Opin. Investig. Drugs, 2006, 15, 1-12].
Селективные ингибиторы бутирилхолинэстеразы (БХЭ), как показали исследования последних лет, повышают уровень ацетилхолина в мозге и улучшают когнитивные функции у грызунов, не оказывая при этом классических побочных эффектов ингибиторов АХЭ [Greig NH, Utsuki Т, Ingram DK, Wang Y, Pepeu G, Scali C, Yu QS, Mamczarz J, Holloway HW, Giordano T, Chen D, Furukawa K, Sambamurti K, Brossi A, Lahiri DK. Selective butyrylcholinesterase inhibition elevates brain acetylcholine, augments learning and lowers Alzheimer beta-amyloid peptide in rodent. Proc. Natl. Acad. Sci. USA, 2005, 102 (47), 17213-17218].
Одним из наиболее известных производных фенотиазина является Метиленовый синий, который обладает широким спектром биологической активности [Schirmer RH, Adler Н, Pickhardt М, Mandelkow Е. "Lest we forget you-methylene blue…". Neurobiol. Aging. 2011, 32 (12), 2325. e7-16], в том числе высокой ингибиторной активностью в отношении АХЭ и БХЭ [Pfaffendorf М, Bruning ТА, Batnik HD, vanZwieten PA. The interaction between methylene blue and the cholinergic system. Br. J. Pharmacol, 1997, 122(1), 95-98], являясь обратимым ингибитором обоих ферментов [Kucukkilinc Т., Ozer I. Multi-site inhibition of human plasma cholinesterase by cationic phenoxazine and phenothiazine dyes. Arch. Biochem. Biophys., 2007, 461, 294-298]. Полагают, что ингибирование холинэстераз Метиленовым синим может быть одним из механизмов улучшения когнитивных функций у крыс [Deiana S., Harrington C.R., Wischik С.М., Riedel G., Methylthioninium chloride reverses cognitive deficits induced by scopolamine: comparison with rivastigmine. Psychopharmacology (Berl), 2009, 202, 53-65].
Однако современные подходы к лечению нейродегенеративных заболеваний требуют применения лекарственных средств с более широким спектром действия.
Один из наиболее перспективных подходов в лечении болезни Альцгеймера и других нейродегенеративных заболеваний основан на использовании соединений, активных по отношению к серотониновым 5-НТ6 рецепторам [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X., Buschmann H. Medicinal chemistry strategies to 5-НТ6 receptor ligands as potential cognitive enhancers and antiobesity agents. Drug Disc. Today. 2006, 11, 283-299]. Эти рецепторы у млекопитающих находятся исключительно в центральной нервной системе (ЦНС), причем главным образом в участках головного мозга, ответственных за обучение и память [Ge'rard С, Martres М. - Р., Lefe'vre К., Miquel М. - С, Verge' D., Lanfumey L., Doucet E., Hamon M., El Mestilcawy S. Immunolocalisation of serotonin 5-HT6 receptor-like material in the rat central nervous system. Brain Research. 1997, 746, 207-219]. Антагонисты 5-HT6 рецепторов были исследованы в различных моделях обучения и памяти, где они усиливали когнитивные функции экспериментальных животных [K.G. Liu, A.J. Robichaud. 5-НТ6 Antagonists as Potential Treatment for Cognitive Dysfunction. Drug Development Research. 2009, 70, 145-168].
Полученные данные о важной роли серотониновых рецепторов в деятельности ЦНС и развитии различных психоневрологических заболеваний активизировали процесс поиска и синтеза высокоаффинных селективных лигандов («молекулярных инструментов»), а затем и клинических кандидатов. В настоящее время значительное число лигандов серотониновых 5-НТ рецепторов находятся на разных стадиях клинических испытаний как потенциальные субстанции для лечения различных заболеваний ЦНС [http://integrity.prous.com].
Одним из известных классов блокаторов серотониновых рецепторов являются производные гамма-карболинов, проявляющие фармакологическую активность при различных поражениях ЦНС, в том числе по механизму блокирования 6-го подтипа серотониновых рецепторов. [Иващенко А.В., Митькин О.Д., Кадиева М.Г., Ткаченко С.Е. Синтез и физиологическая активность 2,3,4,5-Тетрагидро-1H-пиридо[4,3-6]индолов. Успехи химии, 2010, 79 (4), 325-347; Ivachtchenko AV, Mitkin OD, Tkachenko SE, Okun IM, Kysil VM. 8-Sulfonyl-substituted tetrahydro-l1H-pyrido[4,3-b]indoles as 5-HT6 receptor antagonists. Eur. J. Med. Chem. 2010, 45 (2), 782-789].
Однако нет указаний на то, что данные соединения обладают ингибиторной активностью в отношении холинэстераз.
Для описанных выше ингибиторов холинэстераз - производных фенотиазина - неизвестно свойство блокировать 6-й подтип серотониновых рецепторов.
Перспективным современным подходом для терапии комплексных, мультифакторных заболеваний, к которым относится БА и другие нейродегенеративные расстройства, является создание мультитаргетных лигандов, взаимодействующих с несколькими мишенями, ответственными за патогенез. Стратегия рационального дизайна мультитаргетных препаратов основывается на связывании через линкер двух фармакофоров, проявляющих активность в отношении двух различных молекулярных мишеней. [Youdim М.В., Buccafusco J.J. Multi-functional drugs for various CNS targets in the treatment of neurodegenerative disorders. Trends Pharmacol. Sci. 2005, 26, 27-35; Zhang H.Y. One-compound-multiple-targets strategy to combat Alzheimer's disease. FEBS Lett. 2005, 579, 5260-5264; Cappelli A., Gallelli A., Manini M, Anzini M., Mennuni L., Makovec F., Menziani M.C., Alcaro S., Ortuso F., Vomero, S. Further studies on the interaction of the 5-hydroxytryptamine3 (5-HT3) receptor with arylpiperazine ligands. Development of a new 5-НТ3 receptor ligand showing potent acetylcholinesterase inhibitory properties. J. Med. Chem. 2005, 48, 3564-3575; Piazzi L., Rampa A., Bisi A., Gobbi S., Belluti F., Cavalli A., Bartolini M., Andrisano V., Valenti P., Recanatini M. 3-(4-[[Benzyl(methyl)amino]methyl]phenyl)-6,7-dimethoxy-2H-2-chromenone (AP2238) inhibits both acetylcholinesterase and acetylcholinesterase-induced beta-amyloid aggregation: a dual function lead for Alzheimer's disease therapy. J. Med. Chem. 2003, 46 (12), 2279-2282].
Однако подбор пар не является предсказуемым и зависит от структуры новой молекулы в целом. Сохранение свойств обеих составляющих частей в новой молекуле зависит как от структуры каждой из частей, так и от структуры линкера.
Предлагаемое изобретение решает задачу создания мультитаргетного препарата, сочетающего в себе свойства ингибиторов холинэстераз и блокаторов 5-НТ6, что позволяет увеличить его эффективность при лечении нейродегенеративных заболеваний.
Для решения поставленной задачи предлагаются производные 1,2,3,4-тетрагидропиридо [4,3-b] индолсодержащих фенотиазинов общей формулы 1 и их хлоргидраты в качестве ингибиторов холинэстераз и блокаторов серотониновых рецепторов:
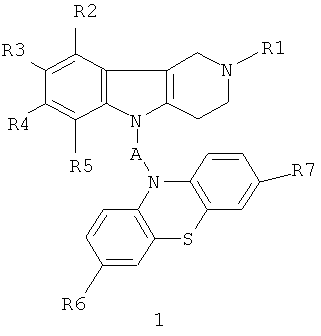
в которой R1=Н, (C1-C6) алкил;
R2, R3, R4, R5=Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси,
R6, R7=H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси, NH2, NHAlkyl, NAlkyl2;
A=CH2CH2, CH=CHCH2, CH2CH2CH2, CH2CH[(C1-C6)алкил]С(O), CH2CH2C(O)NHCH2CH2); CH2CH[(C1-C6)алкил]С(O)N[(C1-C6)алкил]СН2СН2), CH2CH(OH)CH2, CH2CH(OH)CH2NHCH2CH2, CH2CH(OH)CH2N[(C1-C6)алкил]СН2СН2, CH2CHFCH2NHCH2CH2, CH2CHFCH2N[(C1-C6)алкил]СН2СН2.
Производные 1,2,3,4-тетрагидропиридо[4,3-b]индолсодержащих фенотиазинов могут представлять собой соединения общей формулы 1.1
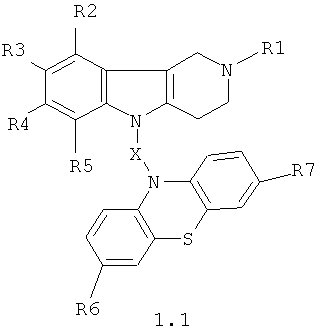
в которой R1, R2, R3, R4, R5, R6, R7 имеют значения, определенные выше для формулы 1;
X=CH2CH2, CH=СНСН2, CH2CH2CH2, СН2СН[(C1-C6)алкил]С(O), CH2CH2C(O)NHCH2CH2); СН2СН[(C1-C6) алкил]С(O)N[(C1-C6)алкил]СН2СН2).
Производные 1,2,3,4-тетрагидропиридо[4,3-b]индолсодержащих фенотиазинов могут представлять собой также соединения общей формулы 1.2
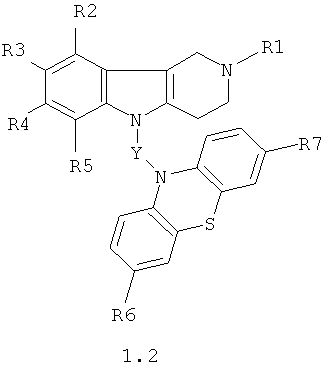
в которой R1, R2, R3, R4, R5, R6, R7 имеют значения, определенные выше для формулы 1:
Y=СН2СН(ОН)СН2, CH2CH(OH)CH2NHCH2CH2,
CH2CH(OH)CH2N[(C1-C6)алкил]СН2СН2.
Производные 1,2,3,4-тетрагидропиридо[4,3-b]индолсодержащих фенотиазинов могут представлять собой также соединения общей формулы 1.3
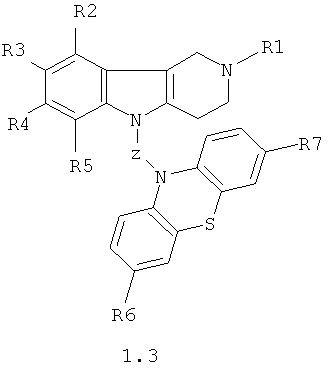
в которой R1, R2, R3, R4, R5, R6, R7 имеют значения, определенные выше для формулы 1;
Z=CH2CHFCH2NHCH2CH2 или CH2CHFCH2N[(C1-C6)алкил]СН2СН2.
Другим аспектом изобретения является способ получения хлоргидратов соединений формулы 1.1, формулы 1.2, формулы 1.3.
Способ получения хлоргидратов соединений формул 1.1, 1.2, 1.3 заключается в растворении соединений формул 1.1, 1.2, 1.3 в 10%-ном растворе HCl в изопропаноле.
Еще одним аспектом изобретения является фармакологическое средство в качестве ингибиторов холинэстераз и блокаторов серотониновых рецепторов при лечении нейродегенеративных заболеваний, содержащее активное начало и фармацевтически приемлемый носитель, отличающееся тем, что в качестве активного начала содержит эффективное количество соединения формулы 1.
Понятие «фармакологическое средство» подразумевает использование любой лекарственной формы, содержащей соединение формулы 1, которая могла бы найти профилактическое или лечебное применение в медицине в качестве ингибиторов холинэстераз и блокаторов серотониновых рецепторов при лечении нейродегенеративных заболеваний.
Понятие «эффективное количество», используемое в данной заявке, подразумевает использование того количества соединений формулы 1, которое в соединении с его показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в данной лекарственной форме.
Для получения фармакологического средства одно или несколько соединений формулы 1 смешиваются как активный ингредиент с фармацевтически приемлемым носителем, известным в медицине согласно принятым в фармацевтике способам. В зависимости от лекарственной формы препарата могут быть использованы различные носители.
Техническим эффектом предлагаемой группы соединений является создание мультитаргетного препарата, сочетающего в себе свойства ингибиторов холинэстераз (IC50=10-6-10-7 М) и блокаторов 5-НТ6 рецепторов (IC50=10-7-10-8 М), что позволяет увеличить эффективность лечения нейродегенеративных заболеваний.
Разработанный авторами структурно индивидуальный класс полифункциональных препаратов на основе оригинальных бинарных структур совмещает в себе фармакофорные группы фенотиазина и гамма-карболинов и сочетает свойства ингибиторов холинэстераз и блокаторов 6-го подтипа серотониновых рецепторов благодаря как структуре каждой из частей, так и структуре линкера, что делает их перспективными для разработки лекарственных средств более широкого спектра действия.
Как показывают примеры, указанные соединения демонстрируют высокую селективность в отношении БХЭ по сравнению с АХЭ и обладают способностью блокировать 6-й подтип серотониновых рецепторов.
Таким образом, данные соединения обладают несколькими преимуществами по сравнению с известными ингибиторами холинэстераз. С одной стороны, они преимущественно ингибируют БХЭ, т.е. не должны вызывать характерных для ингибиторов АХЭ побочных эффектов, с другой стороны, улучшение когнитивных функций при использовании данных соединений должно достигаться по двум механизмам - путем ингибирования холинэстераз и блокады 6-го подтипа серотониновых рецепторов, что должно привести к усилению терапевтического эффекта.
Кроме того, было установлено, что модифицирование фенотиазиновым фрагментом усиливает слабую антихолинэстеразную активность, присущую производным гамма-карболинов. Полученные новые бинарные соединения являются эффективными и селективными обратимыми ингибиторами БХЭ, ингибирующими фермент по смешанному типу.
Мультитаргетные препараты, сочетающие в себе свойства ингибиторов холинэстераз и блокаторов 5-НТ6 рецепторов, из уровня техники неизвестны, что сообщает предлагаемому изобретению соответствие критериям «новизна» и «изобретательский уровень».
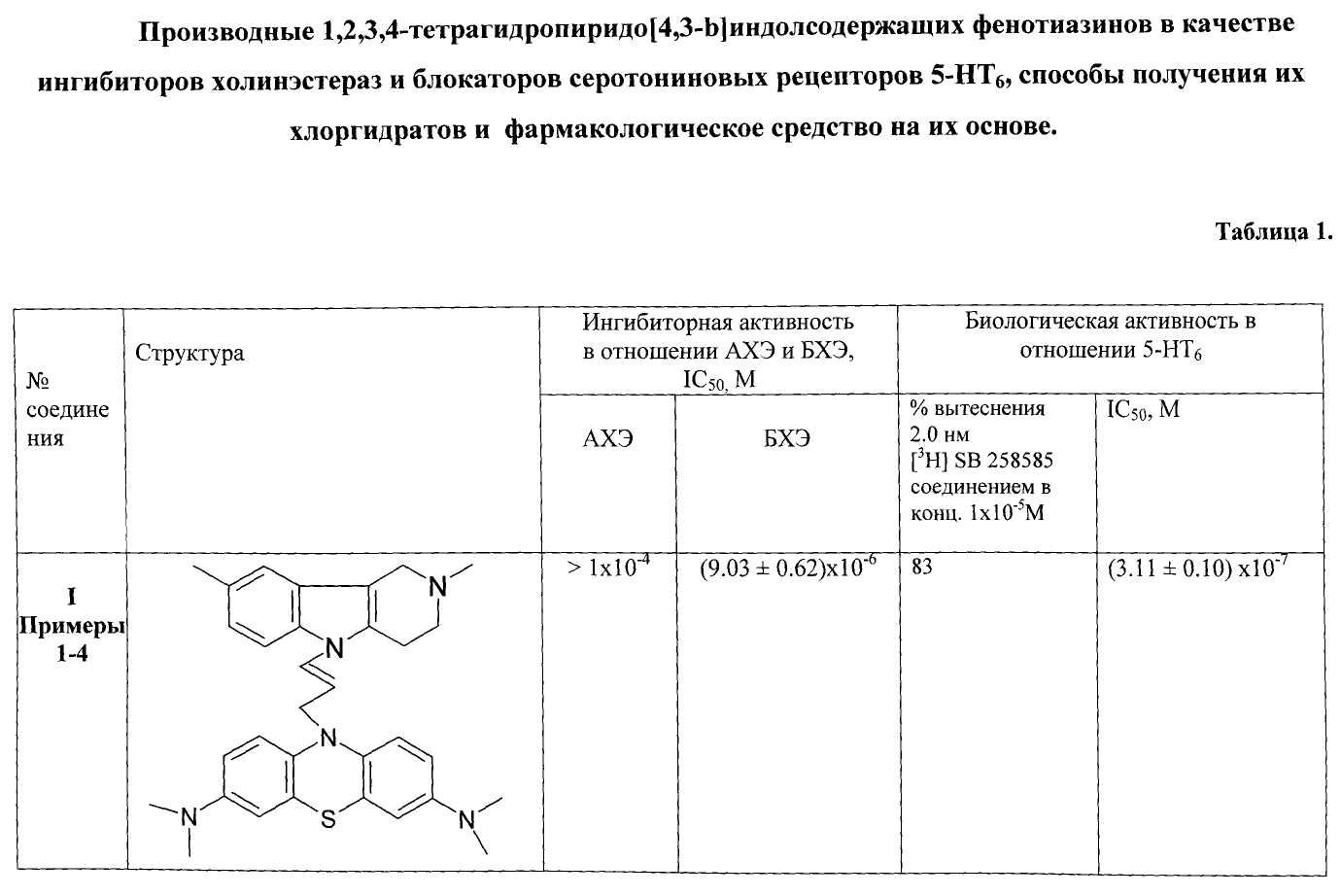
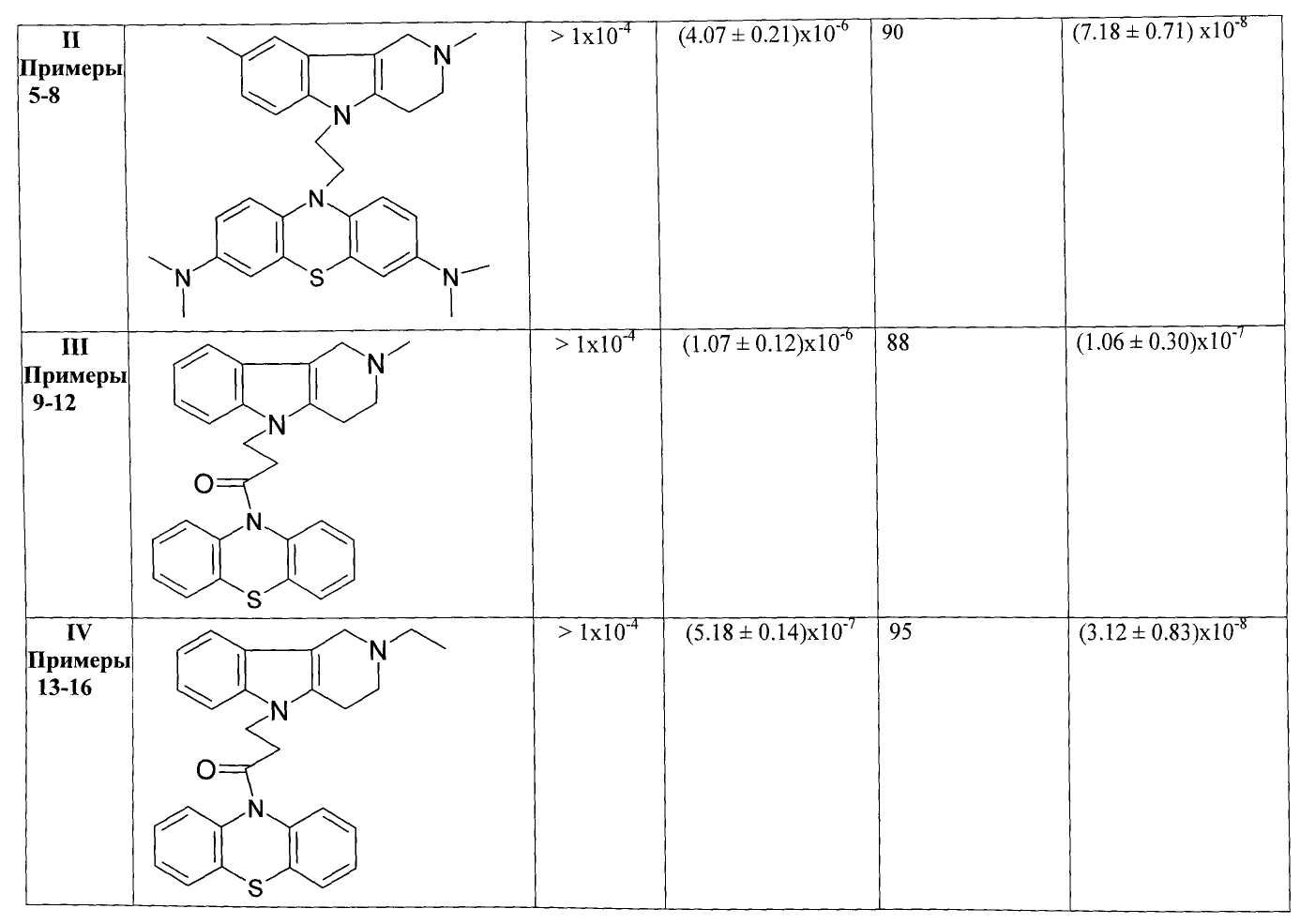
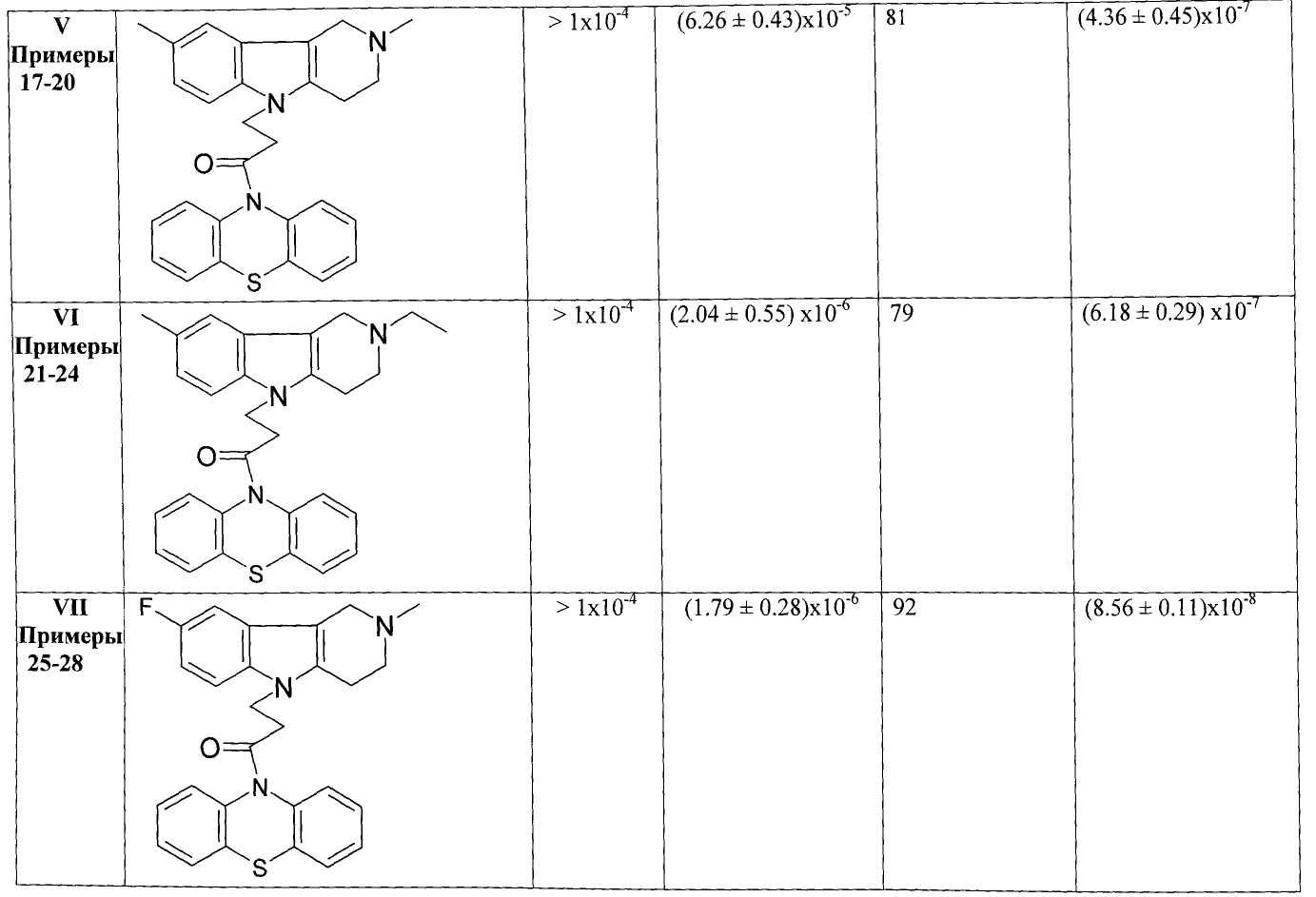
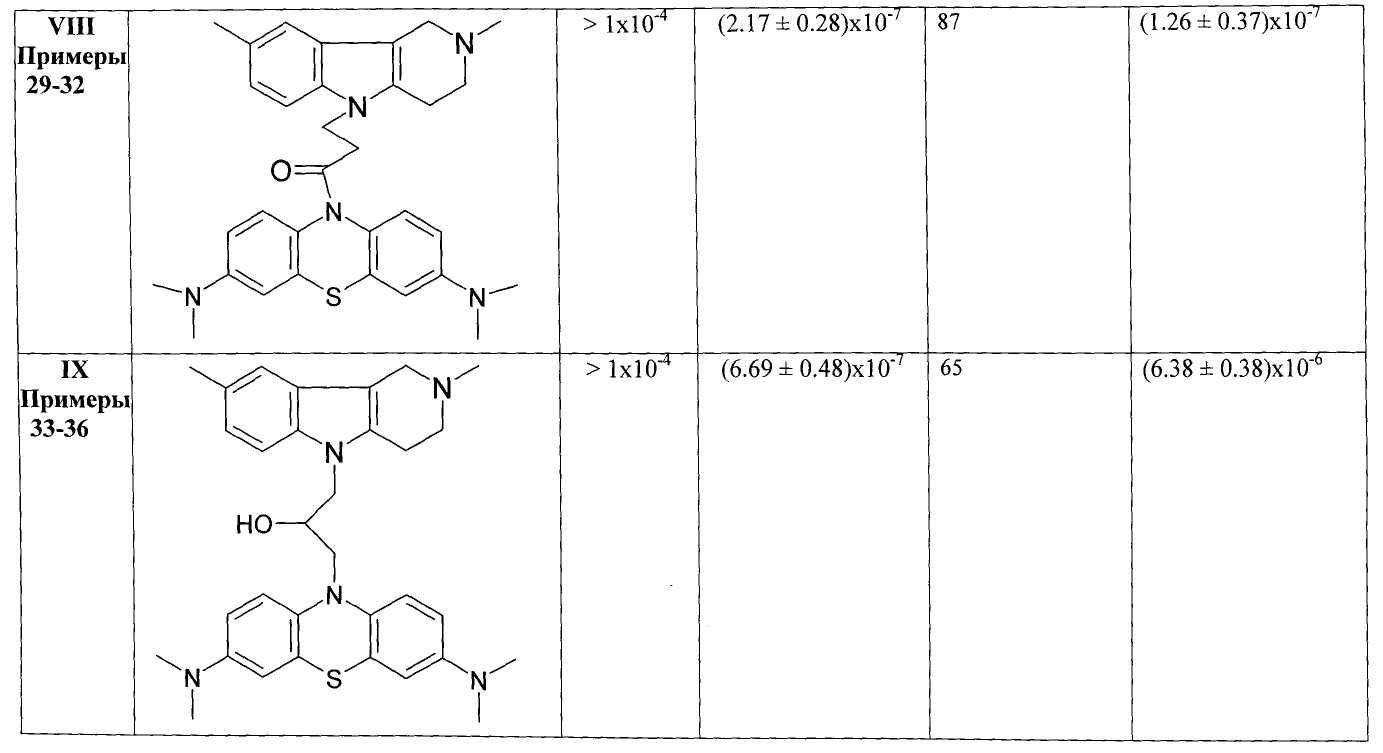
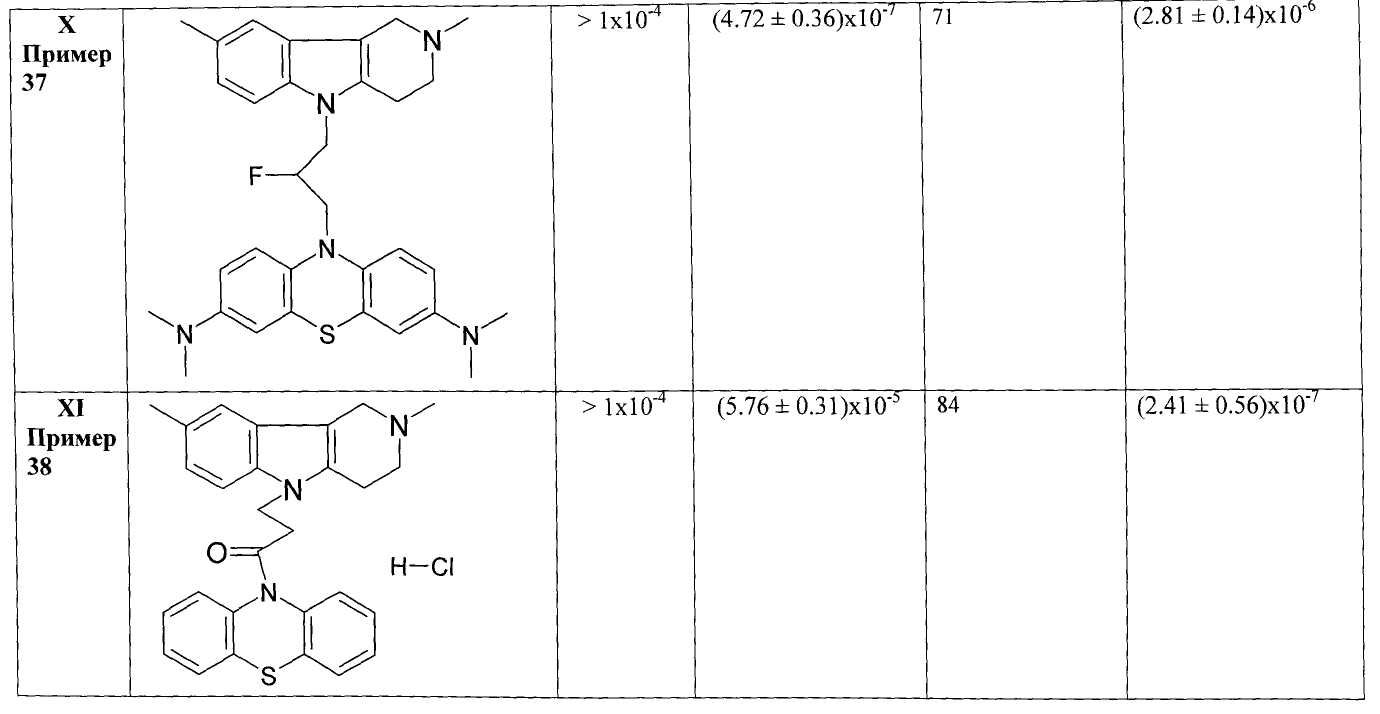
В Таблице 1 представлены результаты оценки биологической активности фенотиазиновых производных гамма-карболинов как ингибиторов АХЭ и БХЭ теплокровных и блокаторов серотониновых рецепторов 5-НТ6.
На Фиг.1 представлены в двойных обратных координатах Лайнуивера-Берка данные по кинетике ингибирования БХЭ соединением примера 9: в отсутствие ингибитора [I=0] и в присутствии трех возрастающих концентраций ингибитора: 5×10-7, 1×10-6 и 2×10-6 М, где [S] -концентрация субстрата, Vi - скорость гидролиза субстрата.
Производные 1,2,3,4-тетрагидропиридо[4,3-b]индолсодержащих фенотиазинов общей формулы 1, обладающие заявленными свойствами, можно получить путем конъюгации индольной и фенотиазиновой составляющих, соответствующих заявляемому составу и объединенных через заявляемый молекулярный спейсер. Синтетические способы для получения соединений формулы 1 и их хлоргидратов представляют четыре общие группы, иллюстрированные примерами.
Приведенные примеры подтверждают, но не ограничивают предлагаемое изобретение.
Синтез соединений формулы 1.1 (общая методика)
Процесс проводят нагреванием эквимольной смеси гамма-карболинов 2 и ацетиленсодержащих фенотиазинов 3 (схема 1) или винилсодержащих фенотиазинов 4 (схема 2) в диметилсульфоксиде (ДМСО) или диметилформамиде (ДМФА) в присутствии катализатора, выбранного из ряда: метилат натрия (MeONa), трет-бутилат калия (трет-BuOK), гидроокись калия (КОН) и фторид цезия (CsF) при температуре 120-160°C в течение 6-24 часов.
Схема 1.
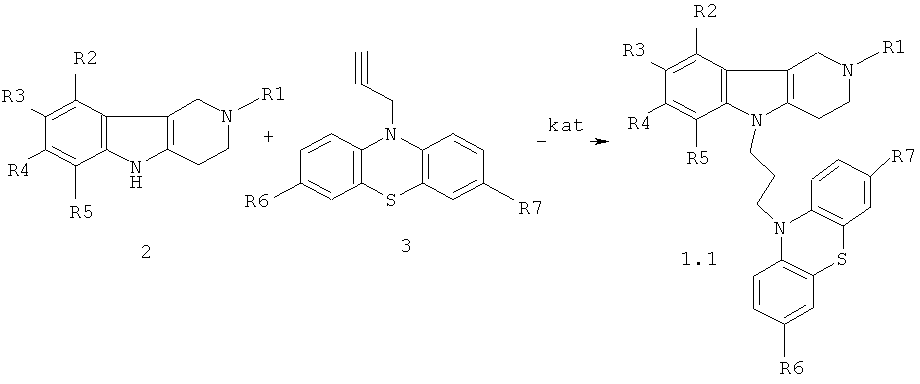
R1=Н, (C1-C6) алкил;
R2, R3, R4, R5=Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси,
R6, R7=Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси, NH2, NHAlkyl, NAlkyl;
kat=MeONa, трет-BuOK, КОН, CsF
Схема 2.
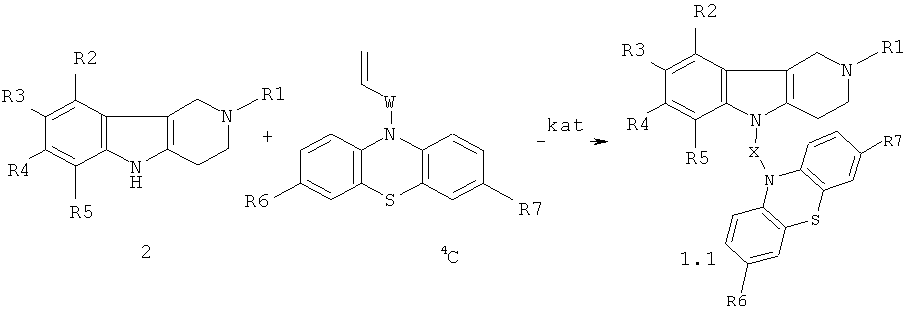
R1=H, (C1-С6) алкил;
R2, R3, R4, R5=H, F, Cl, Br, (C1-C6)алкил, (C1-C6) алкокси,
R6, R7 =H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси, NH2, NHAlkyl, NAlkyl2;
W = нет, CH2; CH[(C1-C6)алкил]С(O); C(O)NHCH2CH2); C(O)N[(C1-C6)алкил]СН2СН2; CH[(C1-C6)алкил]С(O)N[(C1-C6)алкил]СН2СН2),
X=CH2CH2, CH2CH2CH2, CH2CH[(C1-C6)алкил]С(O) CH2CH2C(O)NHCH2CH2); СН2СН[(C1-C6)алкил]С(O)N[(C1-C6)алкил]СН2СН2).
kat = MeONa, трет-BuOK, КОН, CsF
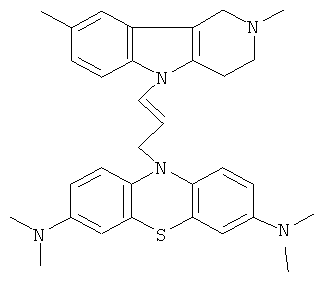
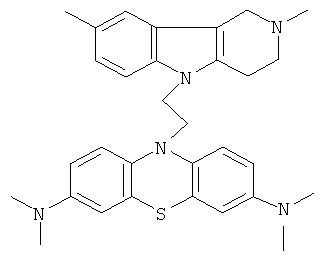
Пример 1: Способ получения 10-[3-(2,8-Диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-аллил]-N,N,N,N-тетраметил-10H-фенотиазин-3,7-диамина (I).
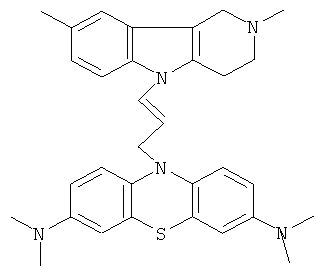
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола и 1 ммоль N,N,N,N-тетраметил-10- проп-2-инил-10Н-фенотиазин-3,7-диамина. В качестве катализатора брали 200 мг CsF в 1.5 мл ДМСО. Нагревали при перемешивании при 140-160°C в течение 8 ч. ДМСО удаляли в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 82%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.48 и 2.53 оба с (3Н, Me); 2.65 т (2Н, СН2, J=6.4 Гц); 2.70-2.86 м (4Н, СН2); 2.94 (с, 12Н, Me); 3.64 с (2Н, СН2); 6.3 (д, 1Н, СН=J=12.2 Гц), 6.5 (м, 1Н, СН=), 6.70-7.00 (м, 3Н), 7.00-7.25 (м, 2Н) 7.30 (д, 2Н, J=8.8 Гц), 7.54 (д, 2Н, J=2.2 Гц).
Пример 2; Способ получения 10-[3-(2,8-Диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-аллил]-N,N,N,N-тетраметил-10H-фенотиазин-3,7-диамина (I).
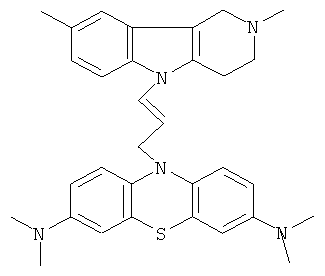
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола и 1 ммоль замещенного N,N,N,N-тетраметил-10-проп-2-инил-10H-фенотиазин-3,7-диамина, в качестве катализатора брали 300 мг MeONa в 1.5 мл ДМФА. Нагревали при перемешивании при 130-140°C в течение 8 ч. Затем ДМФА удаляли в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 78%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.48 и 2.53 оба с (3H, Me); 2.65 т (2Н, СН2, J=6.4 Гц); 2.70-2.86 м (4H, СН2); 2.94 (с, 12Н, Me); 3.64 с (2Н, CH2); 6.3 (д, 1Н, СН=, J=12.2 Гц), 6.5 (м, 1H, СН=), 6.70-7.00 (м, 3H), 7.00-7.25 (м, 2Н) 7.30 (д, 2Н, J=8.8 Гц), 7.54 (д, 2Н, J=2.2 Гц).
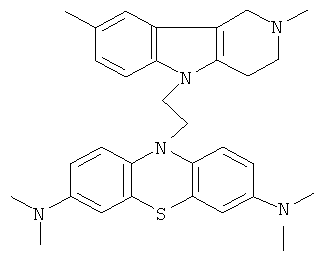
Пример 3: Способ получения 10-[3-(2,8-Диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-аллил]-N,N,N,N-тетраметил-10H-фенотиазин-3,7-диамина (I).
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль N,N,N,N-тетраметил-10-проп-2-инил-10H-фенотиазин-3,7-диамина, в качестве катализатора брали 300 мг трет-BuOK в 1.5 мл ДМСО. Нагревали при перемешивании при 120-130°C в течение 8 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 80%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.48 и 2.53 оба с (3Н, Me); 2.65 т (2Н, СН2, J=6.4 Гц); 2.70-2.86 м (4H, СН2); 2.94 (с, 12Н, Me); 3.64 с (2Н, СН2); 6.3 (д, 1Н, СН=, J=12.2 Гц), 6.5 (м, 1Н, СН=), 6.70-7.00 (м, 3H), 7.00-7.25 (м, 2Н) 7.30 (д, 2Н, J=8.8 Гц), 7.54 (д, 2Н, J=2.2 Гц).
Пример 4: Способ получения 10-[3-(2,8-Диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-аллил]-N,N,N,N-тетраметил-10H-фенотиазин-3,7-Диамина (I).
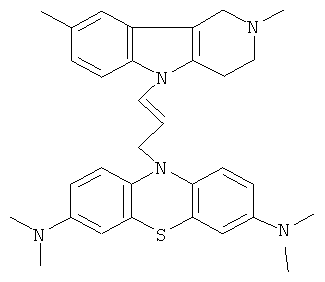
В качестве исходных веществ брали 1 Ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоля N,N,N,N-тетраметил-10-проп-2-инил-10H-фенотиазин-3,7-диамина, в качестве катализатора брали 100 мг KOH в 1.5 мл ДМФА, нагревали при перемешивании при 120-140°C в течение 8 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Желтое твердое вещество, выход: 79%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.48 и 2.53 оба с (3Н, Me); 2.65 т (2Н, СН2, J=6.4 Гц); 2.70-2.86 м (4Н, CH2); 2.94 (с, 12Н, Me); 3.64 с (2H, СН2); 6.3 (д, 1Н, СН=J=12.2 Гц), 6.5 (м, 1Н, СН=), 6.70-7.00 (м, 3H), 7.00-7.25 (м, 2Н) 7.30 (д, 2Н, J=8.8 Гц), 7.54 (д, 2Н, J=2.2 Гц).
Пример 5: Способ получения 10-[3-(2,8-Диметил-1,2,3-4-тетрагидропиридо[4,3-b]индол-5-ил)-этил]-N,N,N,N-тетраметил-10H-фенотиазин-3,7-диамина (II).
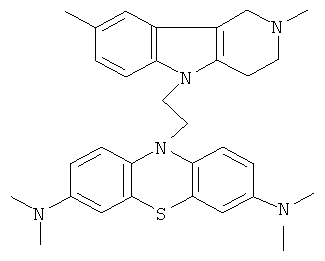
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 10-аллил-N,N,N,N-тетраметил-10H-фенотиазин-3,7,-диамина, в качестве катализатора брали 200 мг CsF в 1.5 мл ДМСО. Нагревали при перемешивании при 140-150°C в течение 8 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 86%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.50 и 2.54 оба с (3Н, Me); 2.63 т (2H, СН2, J=6.4 Гц); 2.60-2.86 м (6H, СН2); 2.96 (с, 12Н, Me); 3.64 с (2Н, CH2); 3.68 (т, 2Н, J=6.5 Гц), 6.70-7.00 (м, 3H), 7.00-7.25 (м, 2Н), 7.31 (д, 2Н, J=8.8 Гц), 7.55 (д, 2Н, J=2.2 Гц).
Пример 6: Способ получения 10-[3-(2,8-Диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-этил]N,N,N,N-тетраметил-10H-фенотиазин-3,7-Диамина (II).
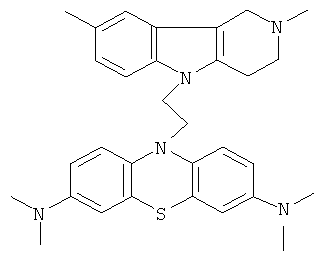
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 10-аллил-N,N,N,N-тетраметил-10H-фенотиазин-3,7,-диамина, в качестве катализатора брали 300 мг MeONa в 1.5 мл ДМФА. Нагревали при перемешивании при 150-160°C в течение 8 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 82%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.50 и 2.54 оба с (3H, Me); 2.63 т (2H, СН2, J=6.4 Гц); 2.60-2.86 м (6Н, CH2); 2.96 (с, 12Н, Me); 3.64 с (2Н, CH2); 3.68 (т, 2Н, J=6.5 Гц), 6.70-7.00 (м, 3H), 7.00-7.25 (м, 2Н), 7.31 (д, 2Н, J=8.8 Гц), 7.55 (д, 2Н, J=2.2 Гц).
Пример 7: Способ получения 10-[3-(2,8-Диметил-1,2,3<4-тетрагидропиридо[4,3-b]индол-5-ил)-этил]-N,N,N,N-тетраметил-10H-фенотиазин-3,7-диамина (II).
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 10-аллил-N,N,N,N-тетраметил-10H-фенотиазин-3,7,-диамина, 300 мг трет-BuOK в 1.5 мл ДМСО. Нагревали при перемешивании при 140-150°C в течение 18 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 85%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.50 и 2.54 оба с (3H, Me); 2.63 т (2H, CH2, J=6.4 Гц); 2.60-2.86 м (6H, CH2); 2.96 (с, 12H, Me); 3.64 с (2H, CH2); 3.68 (т, 2H, J=6.5 Гц), 6.70-7.00 (м, 3H), 7.00-7.25 (м, 2Н), 7.31 (д, 2Н, J=8.8 Гц), 7.55 (д, 2Н, J=2.2 Гц).
Пример 8: Способ получения 10-[3-(2,8-Диметил-1,2,3,4-тeтpaгидpoпиpидo[4,3-b]индoл-5-ил)-этил]-N,N,N,N-тeтpaмeтил-10H-фенотиазин-3,7-Диамина (II).
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3b]индола, 1 ммоль 10-аллил-N,N,N,N-тетраметил-10H-фенотиазин-3,7,-диамина, в качестве катализатора брали 100 мг КОН в 1.5 мл ДМФА. Нагревали при перемешивании при 150-160°C в течение 12 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 78%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.50 и 2.54 оба с (3H, Me); 2.63 т (2H, СН2, J=6.4 Гц); 2.60-2.86 м (6Н, CH2); 2.96 (с, 12Н, Me); 3.64 с (2H, CH2); 3.68 (т, 2Н, J=6.5 Гц), 6.70-7.00 (м, 3H), 7.00-7.25 (м, 2Н), 7.31 (д, 2Н, J=8.8 Гц), 7.55 (д, 2Н, J=2.2 Гц).
Пример 9: Способ получения 4-(2-Метил-1,2,3,4-тетрагидро- пиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (III).
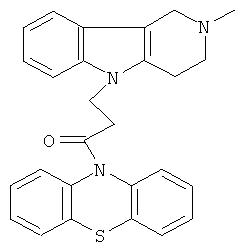
В качестве исходных веществ брали 1 ммоль 2-метил-2,3,4,5-тетрагидро-1H-пиридо [4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 200 мг CsF в 1.5 мл ДМСО. Нагревали при перемешивании при 120-140°C в течение 20 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 83%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeN); 2.68 (с, 6Н, CH2); 3.49 (с, 2Н, CH2); 4.17 (уш. с, 2Н, CH2); 6.67-6.95 (м, 8Н, CHAr); 7.00-7.16 (м, 4Н, CHAr).
Пример 10: Способ получения 4-(2-Метил-1,2,3,4-тетрагидро-пиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (III).
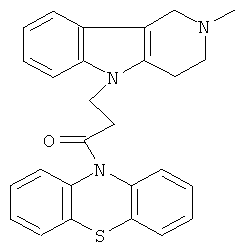
В качестве исходных веществ брали 1 ммоль 2-метил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино- фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг MeONa в 1.5 мл ДМСО. Нагревали при перемешивании при 120-140°C в течение 11 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Желтое твердое вещество, выход: 80%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeN); 2.68 (с, 6Н, СН2); 3.49 (с, 2Н, СН2); 4.17 (уш. с, 2Н, СН2); 6.67-6.95 (м, 8Н, CHAr); 7.00-7.16 (м, 4Н, CHAr).
Пример 11: Способ получения 4-(2-Метил-1,2,3,4-тетрагидро-пиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (III).
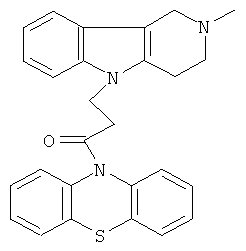
В качестве исходных веществ брали 1 ммоль 2-метил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг трет-BuOK в 1.5 мл ДМФА. Нагревали при перемешивании при 120-130°C в течение 6 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Желтое твердое вещество, выход: 81%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeN); 2.68 (с, 6Н, CH2); 3.49 (с, 2Н, CH2); 4.17 (уш. с, 2Н, CH2); 6.67-6.95 (м, 8H, CHAr); 7.00-7.16 (м, 4Н, CHAr).
Пример 12: Способ получения 4-(2-Метил-1,2,3,4-тетрагидро- пиридо[4,3-b]индол-5-ил)-(фенотиазин-10-ил)пропан-1-она (III).
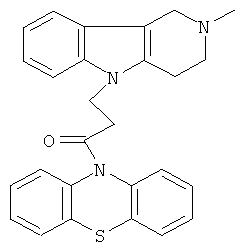
В качестве исходных веществ брали 1 ммоль 2-метил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 100 мг KOH в 1.5 мл, ДМСО нагревали при перемешивании при 130-140°C в течение 10 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 79%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeN); 2.68 (с, 6Н, CH2); 3.49 (с, 2Н, CH2); 4.17 (уш. с, 2Н, CH2); 6.67-6.95 (м, 8Н, CHAr); 7.00-7.16 (м, 4Н, CHAr).
Пример 13: Способ получения 4-(2-Этил-1,2,3,4-тетрагидро-пиридо[4,3-b]1индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (IV).
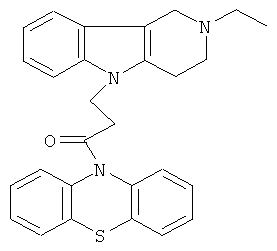
В качестве исходных веществ брали 1 ммоль 2-этил-2,3,4,5-тетрагидро-1Н-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино- фенотиазин-10-ил)пропенона, в качестве катализатора брали 200 мг CsF в 1.5 мл ДМСО. Нагревали при перемешивании при 120-140°C в течение 8 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 88%. Спектр ЯМР 1Н (CDCl3) 5, м.д.: 1.12 (т, 3H, J=6.7, Me); 2.49 (к, 2Н, J=6.7, MeCH2); 2.65 (м, 6Н, CH2); 3.46 (с, 2Н, CH2); 4.09 (уш. с, 2Н, CH2); 6.62-6.82 (м, 8Н, CHAr); 6.90-7.05 (м, 4Н, CHAr).
Пример 14: Способ получения 4-(2-Этил-1,2,3,4-тетрагидро-пиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (IV).
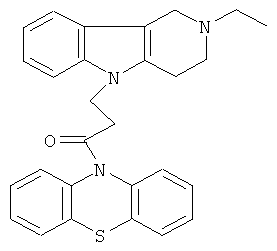
В качестве исходных веществ брали 1 Ммоль 2-этил-2,3,4,5-тетрагидро-1Н-пиридо[4,3-b]индола, 1 ммоля 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг MeONa в 1.5 мл ДМФА. Нагревали при перемешивании при 140-150°C в течение 6 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 83%. Спектр ЯМР 1Н (CDCl3) 8, м.д.: 1.12 (т, 3H, J=6.7, Me); 2.49 (к, 2Н, J=6.7, MeCH2); 2.65 (м, 6Н, СН2); 3.46 (с, 2Н, CH2); 4.09 (уш. с, 2Н, CH2); 6.62-6.82 (м, 8Н, CHAr); 6.90-7.05 (м, 4Н, CHAr).
Пример 15: Способ получения 4-(2-Этил-1,2,3,4-тетрагидро-пиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (IV).
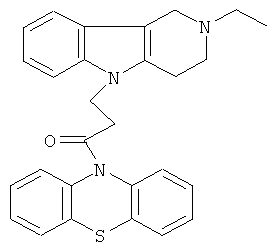
В качестве исходных веществ брали 1 ммоль 2-этил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг трет-BuOK в 1.5 мл ДМСО. Нагревали при перемешивании при 120-130°C в течение 8 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 81%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 1.12 (т, 3H, J=6.7, Me); 2.49 (к, 2Н, J=6.7, MeCH2): 2.65 (м, 6Н, CH2); 3.46 (с, 2Н, CH2); 4.09 (уш. с, 2Н, CH2); 6.62-6.82 (м, 8Н, CHAr); 6.90-7.05 (м, 4Н, CHAr).
Пример 16: Способ получения 4-(2-Этил-1,2,3,4-тетрагидро-пиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (IV).
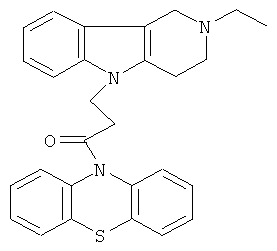
В качестве исходных веществ брали 1 ммоль 2-этил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 100 мг KOH в 1.5 мл ДМФА. Нагревали при перемешивании при 130-140°C в течение 8 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 77%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 1.12 (т, 3H, J=6.7, Me); 2.49 (к, 2Н, J=6.7, MeCH2); 2.65 (м, 6Н, CH2); 3.46 (с, 2Н, CH2); 4.09 (уш. с, 2Н, CH2); 6.62-6.82 (м, 8Н, CHAr); 6.90-7.05 (м, 4Н, CHAr).
Пример 17: Способ получения 4-(2,8-Диметил-1,2,3,4-тетрагидро-пиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (V).
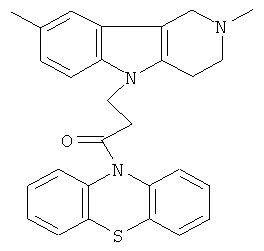
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 200 мг CsF в 1.5 мл ДМСО. Нагревали при перемешивании при 120-130°C в течение 12 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 85%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeC); 2.54 (с, 3H, MeN); 2.79 (м, 6H, CH2); 3.64 (с, 2Н, CH2); 4.34 (уш. с, 2Н, CH2); 6.92 (д, 1Н, J=8.3, CHAr); 7.02 (д, 1Н, J=8.3, CHAr); 7.14-7.28 (м, 6Н, CHAr); 7.36-7.47 (м, 3H, CHAr).
Пример 18: Способ получения 4-(2,8-Диметил-1,2,3,4-тетрагидро-пиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (V).
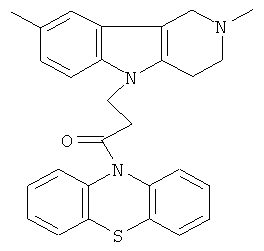
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг MeONa в 1.5 мл ДМСО. Нагревали при перемешивании при 120-130°C в течение 8 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 83%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeC); 2.54 (с, 3H, MeN); 2.79 (м, 6Н, CH2); 3.64 (с, 2Н, CH2); 4.34 (уш. с, 2Н, CH2); 6.92 (д, 1Н, J=8.3, CHAr); 7.02 (д, 1Н, J=8.3, CHAr); 7.14-7.28 (м, 6Н, CHAr); 7.36-7.47 (м, 3Н, CHAr).
Пример 19: Способ получения 4-(2,8-Диметил-1,2,3,4-тетрагидро-пиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (V).
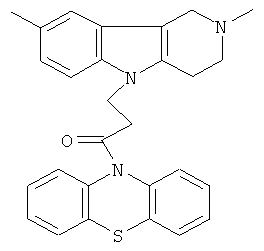
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг трет-BuOK в 1.5 мл ДМФА. Нагревали при перемешивании при 120-140°C в течение 8 ч. ДМСО (или ДМФА) удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 84%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeC); 2.54 (с, 3H, MeN); 2.79 (м, 6Н, CH2); 3.64 (с, 2H, CH2); 4.34 (уш. с, 2H, CH2); 6.92 (д, 1H, J=8.3, CHAr); 7.02 (д, 1Н, J=8.3, CHAr); 7.14-7.28 (м, 6Н, CHAr); 7.36-7.47 (м, 3Н, CHAr).
Пример 20: Способ получения 4-(2,8-Диметил-1,2,3,4-тетрагидро-пиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (V).
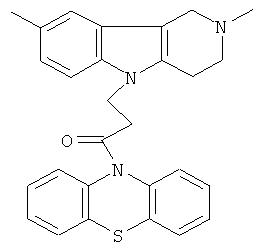
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино- фенотиазин-10-ил)пропенона, в качестве катализатора брали 100 мг КОН в 1.5 мл ДМФА. Нагревали при перемешивании при 140-150°C в течение 8 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 80%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeC); 2.54 (с, 3H, MeN); 2.79 (м, 6Н, CH2); 3.64 (с, 2Н, CH2); 4.34 (уш. с, 2Н, CH2); 6.92 (д, 1Н, J=8.3, CHAr); 7.02 (д, 1H, J=8.3, CHAr); 7.14-7.28 (м, 6Н, CHAr); 7.36-7.47 (м,3H, CHAr).
Пример 21: Способ получения 4-(8-Метил-2-этил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (VI).
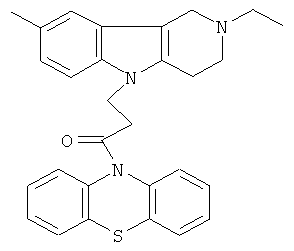
В качестве исходных веществ брали 1 ммоль 8-метил-2-этил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 200 мг CsF в 1.5 мл ДМСО. Нагревали при перемешивании при 120-130°C в течение 8 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 84%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 1.21 (т, 3H, J=7.1, MeCH2); 2.42 (с, 3H, MeC); 2.65 (к, 2Н, J=6.7, MeCH2; 2.80 (м, 6Н, CH2); 3.65 (с, 2Н, CH2); 4.32 (уш. с, 2Н, CH2); 6.92 (д, 1Н, J=8.4, CHAr); 7.00 (д, 1Н, J=8.4, CHAr); 7.08-7.28 (м, 7Н, CHAr); 7.33-7.44 (м, 2Н, CHAr).
Пример 22: Способ получения 4-(8-Метил-2-этил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она
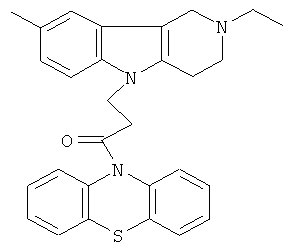
В качестве исходных веществ брали 1 ммоль 8-метил-2-этил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг MeONa в 1.5 мл ДМСО. Нагревали при перемешивании при 130-140°C в течение 8 ч. ДМСО (или ДМФА) удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 81%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 1.21 (т, 3H, J=7.1, MeCH2); 2.42 (с, 3H, MeC); 2.65 (к, 2Н, J=6.7, MeCH2); 2.80 (м, 6Н, CH2); 3.65 (с, 2Н, CH2); 4.32 (уш. с, 2Н, CH2); 6.92 (д, 1Н, J=8.4, CHAr); 7.00 (д, 1Н, J=8.4, CHAr); 7.08-7.28 (м, 7Н, CHAr); 7.33-7.44 (м, 2Н, CHAr).
Пример 23: Способ получения 4-(8-Метил-2-этил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (VI).
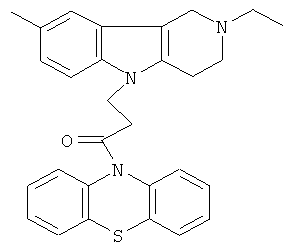
В качестве исходных веществ брали 1 ммоль 8-метил-2-этил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг трет-BuOK в 1.5 мл ДМФА. Нагревали при перемешивании при 120-130°C в течение 8 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ=1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 86%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 1.21 (т, 3H, J=7.1, MeCH2); 2.42 (с, 3H, MeC); 2.65 (к, 2Н, J=6.7, MeCH2); 2.80 (м, 6Н, CH2); 3.65 (с, 2Н, CH2); 4.32 (уш. с, 2Н, CH2); 6.92 (д, 1Н, J=8.4, CHAr); 7.00 (д, 1H, J=8.4, CHAr); 7.08-7.28 (м, 7Н, CHAr); 7.33-7.44 (м, 2Н, CHAr).
Пример 24: Способ получения 4-(8-Метил-2-этил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (VI).
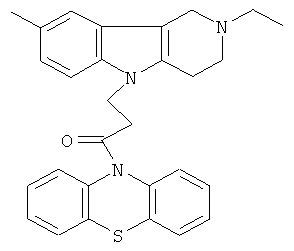
В качестве исходных веществ брали 1 ммоль 8-метил-2-этил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 100 мг КОН в 1.5 мл ДМФА. Нагревали при перемешивании при 130-140°C в течение 8 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 82%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 1.21 (т, 3H, J=7.1, МеСН2); 2.42 (с, 3H, MeC); 2.65 (к, 2Н, J=6.7, МеСН2); 2.80 (м, 6Н, CH2); 3.65 (с, 2Н, CH2); 4.32 (уш. с, 2Н, CH2); 6.92 (д, 1H, J=8.4, CHAr); 7.00 (д, 1Н, J=8.4, CHAr); 7.08-7.28 (м, 7Н, CHAr); 7.33-7.44 (м, 2Н, CHAr).
Пример 25: Способ получения 4-(2-Метил-8-фтор-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (VII).
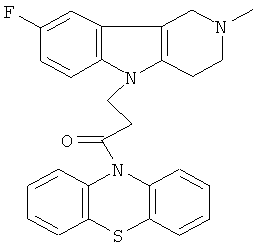
В качестве исходных веществ брали 1 ммоль 2-метил-8-фтор-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 200 мг CsF в 1.5 мл ДМСО. Нагревали при перемешивании при 130-140°C в течение 8 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 78%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.44 (с, 3Н, MeN); 2.65 (м, 4Н, CH2); 2.72 (м, 2Н, CH2); 3.49 (с, 2Н, CH2); 4.25 (уш. с, 2Н, CH2); 6.79 (дт, 1Н, J=9.0, 2.2, CHAr); 6.94-7.11 (м, 7Н, CHAr); 7.23-7.30 (м, 2Н, CHAr); 7.54 (д, 1H,J=2.2, CHAr).
Пример 26: Способ получения 4-(2-Метил-8-фтор-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она
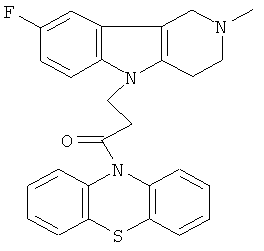
В качестве исходных веществ брали 1 ммоль 2-метил-8-фтор-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг MeONa в 1.5 мл ДМФА. Нагревали при перемешивании при 130-140°C в течение 8 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 81%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.44 (с, 3H, MeN); 2.65 (м, 4Н, CH2); 2.72 (м, 2Н, CH2); 3.49 (с, 2Н, CH2); 4.25 (уш. с, 2Н, CH2); 6.79 (дт, 1Н, J=9.0, 2.2, CHAr); 6.94-7.11 (м, 7Н, CHAr); 7.23-7.30 (м, 2Н, CHAr); 7.54 (д, 1H,J=2.2, CHAr).
Пример 27: Способ получения 4-(2-Метил-8-фтор-1,2,3,4 тетрагидропиридо[4,3-b]индол-5-ил)-1-(Фенотиазин-10-ил)пропан-1-она (VII).
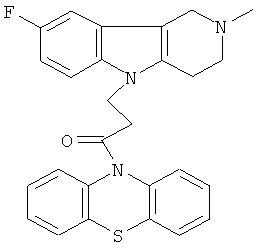
В качестве исходных веществ брали 1 ммоль 2-метил-8-фтор-2,3,4,5 тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоля 1-(3,7-бис-диметиламинс фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг трет-BuOK 1.5 мл ДМСО. Нагревали при перемешивании при 130-140°C течение 8 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продук экстрагировали хлористым метиленом. Хлористый метилен упаривали остаток хроматографировали на силикагеле (60 меш), элюен метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 82%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.44 (с, 3H, MeN); 2.65 (м, 4Н, CH2); 2.72 (м, 2Н, CH2); 3.49 (с, 2Н, CH2); 4.25 (уш. с, 2H, CH2); 6.79 (дт, 1Н, J=9.0, 2.2, CHAr); 6.94-7.11 (м, 7Н, CHAr); 7.23-7.30 (м, 2Н, CHAr); 7.54 (д, 1Н, J=2.2, CHAr).
Пример 28: Способ получения 4-(2-Метил-8-фтор-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она VII).
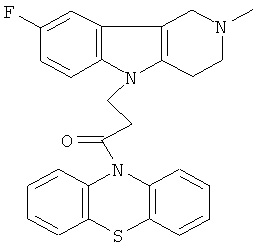
В качестве исходных веществ брали 1 ммоль 2-метил-8-фтор-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоля 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 100 мг КОН в 1.5 мл ДМФА. Нагревали при перемешивании при 120-130°C в течение 8 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 75%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.44 (с, 3H, MeN); 2.65 (м, 4Н, CH2); 2.72 (м, 2Н, CH2); 3.49 (с, 2Н, CH2); 4.25 (уш. с, 2Н, CH2); 6.79 (дт, 1Н, J=9.0, 2.2, CHAr); 6.94-7.11 (м, 7Н, CHAr); 7.23-7.30 (м, 2Н, CHAr); 7.54 (д, 1Н, J=2.2, CHAr).
Пример 29: Способ получения 1-(3,7-Бис-диметиламино-фенотиазин-10-ил)-3-(2,8-диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)пропан-1-она (VIII).
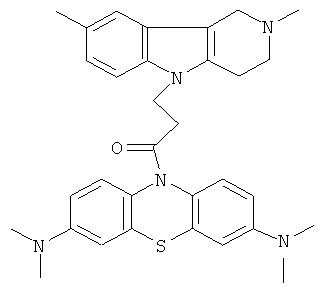
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 200 мг CsF в 1.5 мл ДМСО. Нагревали при перемешивании при 140-150°C в течение 6 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 83%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeC); 2.54 (с, 3Н, MeN); 2.79 (м, 6Н, CH2); 2.96 (с, 12Н, Me); 3.64 (с, 2Н, CH2); 4.34 (уш. с, 2Н, CH2); 6.92 (д, 1Н, J=8.3, CHAr); 7.02 (д, 1Н, J=8.3, CHAr); 7.14-7.28 (м, 4Н, CHAr); 7.36-7.47 (м, 3Н, CHAr).
Пример 30: Способ получения 1-(3,7-Бис-диметиламино-фенотиазин-10-ил)-3-(2,8-диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)пропан-1-она (VIII).
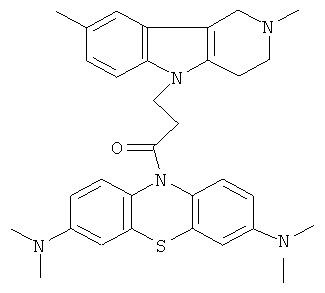
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг MeONa в 1.5 мл ДМСО. Нагревали при перемешивании при 130-140°C в течение 12 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 81%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeC); 2.54 (с, 3H, MeN); 2.79 (м, 6Н, CH2); 2.96 (с, 12Н, Me); 3.64 (с, 2Н, CH2); 4.34 (уш. с, 2Н, CH2); 6.92 (д, 1Н, J=8.3, CHAr); 7.02 (д, 1Н, J=8.3, CHAr); 7.14-7.28 (м, 4Н, CHAr); 7.36-7.47 (м, 3H, CHAr).
Пример 31: Способ получения 1-(3,7-Бис-диметиламино-фенотиазин-10-ил)-3-(2,8-диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)пропан-1-она (VIII).
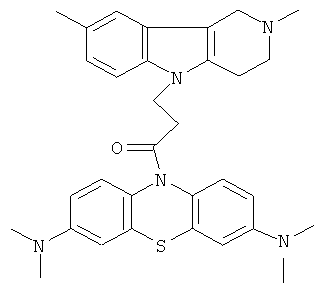
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 300 мг трет-BuOK в 1.5 мл ДМСО. Нагревали при перемешивании при 120-130°C в течение 10 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 83%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeC); 2.54 (с, 3H, MeN); 2.79 (м, 6Н, CH2); 2.96 (с, 12Н, Me); 3.64 (с, 2Н, CH2); 4.34 (уш. с, 2Н, CH2); 6.92 (д, 1Н, J=8.3, CHAr); 7.02 (д, 1H, J=8.3, CHAr); 7.14-7.28 (м, 4Н, CHAr); 7.36-7.47 (м, 3H, CHAr).
Пример 32: Способ получения 1-(3,7-Бис-диметиламино-фенотиазин-10-ил)-3-(2,8-диметил-1,2,3,4-тетрагидропиридо[4,3b]индол-5-ил)пропан-1-она (VIII).
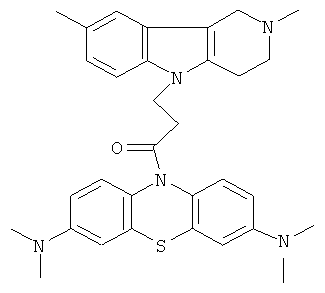
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b] индола, 1 ммоль 1-(3,7-бис-диметиламино-фенотиазин-10-ил)пропенона, в качестве катализатора брали 100 мг КОН в 1.5 мл ДМФА. Нагревали при перемешивании при 130-140°C в течение 12 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 82%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.43 (с, 3H, MeC); 2.54 (с, 3H, MeN); 2.79 (м, 6Н, CH2); 2.96 (с, 12Н, Me); 3.64 (с, 2Н, CH2); 4.34 (уш. с, 2Н, CH2); 6.92 (д, 1Н, J=8.3, CHAr); 7.02 (д, 1Н, J=8.3, CHAr); 7.14-7.28 (м, 4Н, CHAr); 7.36-7.47 (м, 3H, CHAr).
Синтез соединений общей формулы 1.2 (общая методика)
Процесс проводят нагреванием эквимольной смеси гамма-карболинов общей формулы 2 и эпоксидсодержащих фенотиазинов общей формулы 5 (схема 3) в диметилсульфоксиде или диметилформамиде в присутствии катализатора, выбранного из ряда: метилат натрия (MeONa), трет-бутилат калия (трет-BuOK), гидроокись калия (КОН) и фторид цезия (CsF) при температуре 100-140°C в течение 2-12 часов.
Схема 3
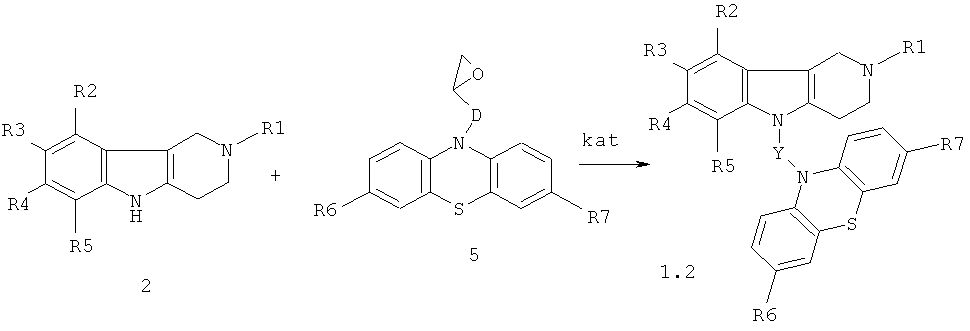
R1=Н, (C1-C6) алкил;
R2, R3, R4, R5=Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси,
R6, R7=Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси, NH2, NHAlkyl, NAlkyl2;
D=CH2; CH2NHCH2CH2; CH2N[(C1-C6)алкил]СН2СН2
Y=CH2CH(OH)CH2, CH2CH(OH)CH2NHCH2CH2,
CH2CH(OH)CH2N[(C1-C6)алкил]СН2СН2,
kat=MeONa, трет-BuOK, КОН, CsF.
Пример 33: Способ получения 1-(3,7-Бис-диметиламинофенотиазин-10-ил)-3-(2,8-диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-пропан-2-она (IX).
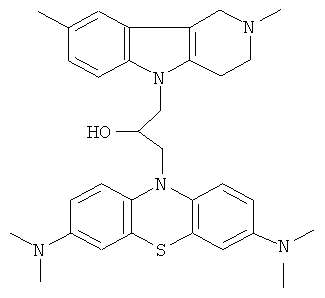
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль N,N,N,N-тетраметил-10-оксиранилметил-10Н-фенотиазин-3,7,-диамина, в качестве катализатора брали 200 мг CsF, мг в 1.5 мл ДМСО. Нагревали при перемешивании при 100-120°C в течение 6 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 88%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.50 и 2.52 оба с (3Н, Me); 2.64 т (2Н, СН2, J=6.4 Гц); 2.70-2.85 м (4H, CH2); 2.95 (с, 12Н, Me); 3.16 (дд, 1H, J=13.3, 6.2 Гц), 3.30 (дд, 1Н, J=13.3, 6.2 Гц), 3.42 (м, 1Н), 4.30-4.43 (м, 3H), 6.70-7.00 (м, 2Н), 7.01-7.26 (м, 3H), 7.30 (д, 2Н, J=8.8 Гц), 7.56 (д, 2Н, J=2.2 Гц).
Пример 34: Способ получения 1-(3,7-Бис-диметиламинофенотиазин-10-ил)-3-(2,8-диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-пропан-2-она (IX).
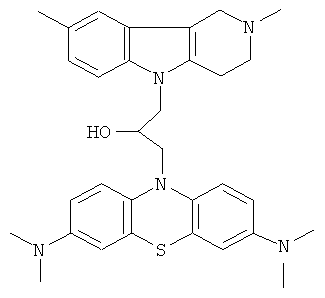
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль N,N,N,N-тетраметил-10-оксиранилметил-10Н-фенотиазин-3,7,-диамина, в качестве катализатора брали 200 мг MeONa в 1.5 мл ДМФА. Нагревали при перемешивании при 110-120°C в течение 8 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 83%. Спектр ЯМР 1H (CDCl3) δ, м.д.: 2.50 и 2.52 оба с (3Н, Me); 2.64 т (2Н, CH2, J=6.4 Гц); 2.70-2.85 м (4H, CH2); 2.95 (с, 12Н, Me); 3.16 (дд, 1Н, J=13.3, 6.2 Гц), 3.30 (дд, 1Н, 7=13.3, 6.2 Гц), 3.42 (м, 1Н), 4.30-4.43 (м, 3H), 6.70-7.00 (м, 2Н), 7.01-7.26 (м, 3H), 7.30 (д, 2Н, J=8.8 Гц), 7.56 (д, 2Н, J=2.2 Гц).
Пример 35: Способ получения 1-(3,7-Бис-диметиламинофенотиазин-10-ил)-3-(2,8-диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-пропан-2-она (IX).
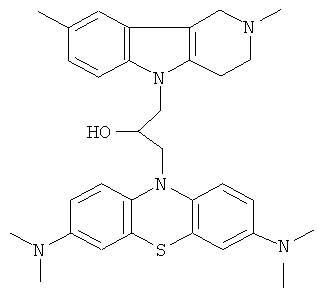
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль N,N,N,N-тетраметил-10-оксиранилметил-10Н-фенотиазин-3,7,-диамина, в качестве катализатора брали 200 мг трет-BuOK 1.5 мл ДМСО. Нагревали при перемешивании при 100-120°C в течение 12 ч. ДМСО удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 80%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.50 и 2.52 оба с (3H, Me); 2.64 т (2Н, CH2, J=6.4 Гц); 2.70-2.85 м (4H, СН2); 2.95 (с, 12Н, Me); 3.16 (дд, 1Н, J=13.3, 6.2 Гц), 3.30 (дд, 1Н, J=13.3, 6.2 Гц), 3.42 (м, 1Н), 4.30-4.43 (м, 3H), 6.70-7.00 (м, 2Н), 7.01-7.26 (м, 3H), 7.30 (д, 2Н, J-8.8 Гц), 7.56 (д, 2Н, J=2.2 Гц).
Пример 36: Способ получения 1-(3,7-Бис-диметиламинофенотиазин-10-ил)-3-(2,8-диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-пропан-2-она (IX).
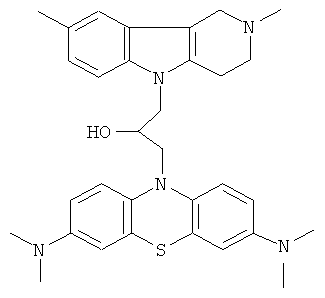
В качестве исходных веществ брали 1 ммоль 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола, 1 ммоль N,N,N,N-тетраметил-10-оксиранилметил-10Н-фенотиазин-3,7,-диамина, в качестве катализатора брали в качестве катализатора брали 200 мг КОН в 1.5 мл ДМФА. Нагревали при перемешивании при 100-110°C в течение 2 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 76%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.50 и 2.52 оба с (3H, Me); 2.64 т (2H, CH2, J=6.4 Гц); 2.70-2.85 м (4H, CH2); 2.95 (с, 12Н, Me); 3.16 (дд, 1Н, J=13.3, 6.2 Гц), 3.30 (дд, 1Н, J=13.3, 6.2 Гц), 3.42 (м, 1Н), 4.30-4.43 (м, 3H), 6.70-7.00 (м, 2Н), 7.01-7.26 (м, 3H), 7.30 (д, 2Н, J=8.8 Гц), 7.56 (д, 2Н, J=2.2 Гц)
Синтез соединений формулы 1.3 (общая методика)
Процесс проводят смешением эквимольных количеств гидроксилсодержащих коньюгатов гамма-карболинов и фенотиазинов общей формулы 6 и диэтиламиносульфотрифторида (Et2NSF3) (схема 4) в диметилсульфоксиде или диметилформамиде при температурах (-78)-0°C в течение 1-3 часов:
Схема 4.
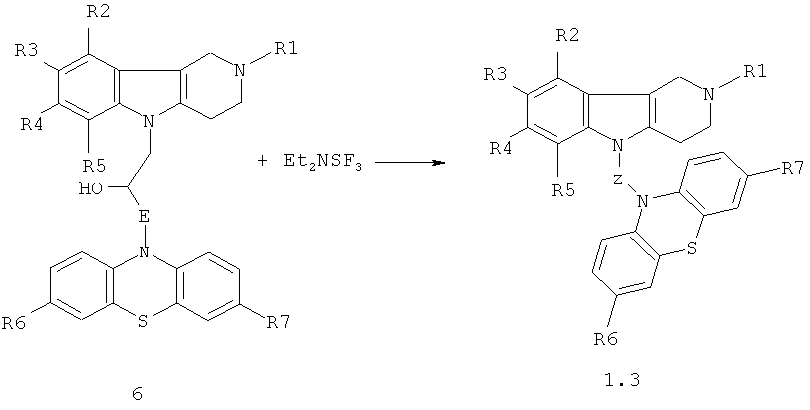
R1=H, (C1-C6) алкил;
R2, R3, R4, R5=Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси,
R6, R7=H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси, NH2, NHAlkyl, NAlkyl2;
E=CH2; CH2NHCH2CH2; CH2N[(C1-C6)алкил]СН2СН2.
Z=CH2CHFCH2NHCH2CH2, CH2CHFCH2N[(C1-C6)алкил]СН2СН2.
Пример 37: Способ получения 10-[3-(2,8-Диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-2-фторпропил]-N,N,N,N-тетраметил-10H-фенотиазин-3,7-диамина (X).
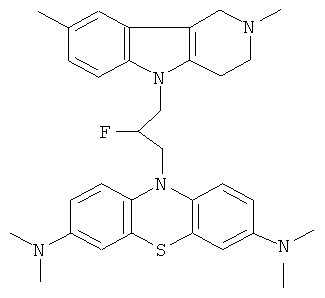
В качестве исходного вещества брали 1 ммоль 1-(3,7-Бис-диметиламинофенотиазин-10-ил)-3-(2,8-диметил-1,2,3,4- тетрагидропиридо[4,3-b]индол-5-ил)-пропан-2-она в 3.0 мл ДМСО и 1 ммоль диэтиламиносульфотрифторида. Реагенты смешивали при температуре (-78)°C. Реакционную массу перемешивали 3 часа, повышая температуру до 0°C, выливали в 10 мл воды, экстрагировали хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой желтое твердое вещество, выход: 63%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.50 и 2.53 оба с (3H, Me); 2.65 т (2Н, CH2, J=6.4 Гц); 2.70-2.85 м (4H, CH2); 2.94 (с, 12Н, Me); 3.16(дд, 1H, J=13.3, 6.2 Гц), 3.30 (дд, 1Н, J=13.3, 6.2 Гц), 3.42 (м, 1H), 3.90 (т, 1H, J=6.3 Гц), 4.40 (м, 1Н), 5.10 (дм, 1Н, JHF=48 Гц), 6.88 д (1Н, CHAr, J=8.8 Гц); 6.90 (дд, 2Н, J=8.8, 2.2 Гц), 7.01-7.20 (м, 2Н), 7.31 (д, 2Н, J=8.8 Гц), 7.54 (д, 2Н, J=2.2 Гц).
Синтез хлоргидратов соединений формулы 1.1, 1.2, 1.3 (общая методика).
Процесс проводят растворением соединений формулы 1.1, 1.2, 1.3 в 10%-ном растворе HCl в изопропаноле при температуре 50°C.
Пример 38: Способ получения Хлоргидрата 4-(2,8-диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-1-(фенотиазин-10-ил)пропан-1-она (XI).
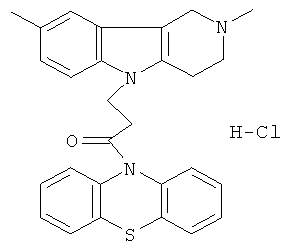
В качестве исходного вещества берут 1 ммоль 4-(2,8-диметил-1,2,3,4-тетрагидропиридо[4,3-b]индол-5-ил)-1-фенотиазин-10-ил-пропан-1-она, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 95%. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.59 (с, 3H, MeC); 2.65 (с, 3H, MeN); 2.73-2.97 (м, 4Н, CH2); 3.03-3.16 (м, 2Н, CH2); 3.44-3.65 (м, 2Н, CH2); 4.33 (уш. с, 2Н, CH2); 6.96-7.15 (м, 2Н, CHAr); 7.19-7.32 (м, 5Н, CHAr); 7.38-7.49 (м, 4Н, CHAr); 10.90 (с, 1H).
Методика биологических испытаний
Определение ингибиторной активности соединений общей формулы 1 в отношении ацетилхолинэстеразы и бутирилхолинэстеразы.
Для кинетических исследований использовали коммерческие препараты («Sigma», США) ацетилхолинэстеразы эритроцитов человека (АХЭ, КФ 3.1.1.7) и бутирилхолинэстеразы сыворотки лошади (БХЭ, КФ 3.1.1.8)
Определение активности ферментов
Активность АХЭ и БХЭ определяли методом Эллмана (λ412 нм) с использованием в качестве субстрата ацетилтиохолина (1 mM) и бутирилтиохолина (1 mM), соответственно; условия определения: 0.1 М фосфатный буфер pH 7.5, 25°C. Измерения проводили на микропланшетном спектрофотометре BioRad Benchmark Plus.
Определение величин IC50 для ингибирования АХЭ и БХЭ исследуемыми соединениями.
Для определения IC50 ингибирования АХЭ и БХЭ (IC50-концентрации ингибитора, которая требуется для снижения активности фермента на 50%) образец соответствующего фермента инкубировали с исследуемым соединением (концентрация ДМСО 2 об.%) в течение 10 минут, затем определяли остаточную активность фермента. Диапазон концентраций исследуемого соединения составлял 2×10-12-2×10-4 М. Каждый эксперимент проводили в трипликате. Измерения проводили на микропланшетном спектрофотометре BioRad Benchmark Plus. Вычисление IC50 проводили с использованием программы Origin 6.1.
Определение механизма ингибирования БХЭ исследуемыми соединениями.
Для выяснения механизма ингибирования БХЭ определяли зависимость остаточной активности фермента от концентрации ингибитора при различных концентрациях субстрата. Данные анализировали в двойных обратных координатах Лайнуивера-Берка. Вычисление кинетических констант ингибирования проводили с использованием программы Origin 6.1.
Результаты оценки антихолинэстеразной активности некоторых представителей соединений общей формулы 1, представленные в Таблице 1, свидетельствуют о том, что соединения очень слабо ингибируют АХЭ и в большинстве случаев проявляют высокую активность в отношении БХЭ (IC50=10-6-10-7 М).
Соединения ингибируют БХЭ обратимо. На Фиг.1 приведены зависимости ингибиторной активности соединением примера 9 от концентрации субстрата, полученные для 3-х возрастающих концентраций ингибитора 5×10-7, 1×10-6 и 2×10-6 М. Зависимости представлены в двойных обратных координатах - координатах Лайнуивера-Берка. Пересечение прямых зависимостей 1/V=f(1/S), полученных для разных концентраций ингибитора, в левом верхнем квадранте свидетельствует о смешанном типе ингибирования.
Таким образом, в результате исследования антихолинэстеразной активности производных гамма-карболинов, модифицированных фенотиазиновым фрагментом, установлено, что модифицирование фенотиазиновым фрагментом усиливает слабую антихолинэстеразную активность, присущую производным гамма-карболинов. Полученные новые бинарные соединения являются эффективными и селективными обратимыми ингибиторами бутирилхолинэстеразы, ингибирующими фермент по смешанному типу.
Определение связывания соединений общей формулы 1 с серотониновым рецептором 5-НТ6.
Для проведения скрининга веществ на их потенциальную способность взаимодействовать с серотониновым рецептором 5-НТб использовали метод радиолигандного связывания. Для этого готовили мембранные препараты из мозгов крыс путем гомогенизации их в стеклянном гомогенизаторе с последующим отделением плазматических мембран от ядер, митохондрий и клеточных осколков путем дифференциального центрифугирования.
Мембранный препарат для радиолигандного анализа готовили по методу [Boess F.G., Riemer С, Bos М., Bentley J., Bourson A., Sleight A.J. The 5-hydroxytryptamine6 receptor-selective radioligand [3H]Ro 63-0563 labels 5-hydroxytryptamine receptor binding sites in rat and porcine striatum. Mol. Pharmacol, 1998, 54, 577-583]. Перед извлечением стриатума мозги крыс были помещены на лед. Затем стриатумы были извлечены и помещены в гомогенизатор Поттера («тефлон-стекло») в 10 объемах 50 мМ TrisHCl буфера pH 7.4, содержащего 0.32 М сахарозу (буфер №1). Гомогенат разбавляли до 50 объемов буфером для исследования №2 (50 мМ TrisHCl, pH 7.4) и центрифугировали 10 мин при 1000 g при 4 С°. Супернатант отбирали и вновь центрифугировали 30 мин при 25000g. Осадок разводили в 50 объемах буфера 50 мМ TrisHCl, pH 7.4 и центрифугировали 15 мин при 25000 g. Осадок и его мягкий, зыбкий надслой отбирали, разводили в 50 объемах буфера 50 мМ TrisHCl, pH 7.4, инкубировали 15 мин при 37°C° и центрифугировали 15 мин при 25000×g. Полученный осадок суспендировали в буфере 50 мМ Tris-HCl, pH 7.4, и суспензию вновь центрифугировали 15 мин при 25000g. Такую процедуру отмывки проводили еще 2 раза. Конечный осадок ресуспендировали в 5 объемах буфера №2 (50 мМ TrisHCl, pH 7.4) и сохраняли в жидком азоте.
Определение связывания изучаемых соединений с 5-НТ6 рецептором проводили в соответствии с методикой, описанной в [Boess F.G., Riemer С, Bos М., Bentley J., Bourson A., Sleight A.J. The 5-hydroxytryptamine6 receptor- selective radioligand [3H]Ro 63-0563 labels 5-hydroxytryptamine receptor binding sites in rat and porcine striatum. Mol. Pharmacol., 1998, 54, 577-583]. Для этого мембранные препараты инкубировали с избирательным меченым лигандом 5-НТ6 рецепторов [3H]SB258585 (2.0 nM) без и в присутствии исследуемых соединений в течение 120 минут при комнатной температуре в среде, состоящей из 50 mM Tris-HCl, pH 7.4, 150 mM NaCl, 2 mM аскорбиновой кислоты, 0.001% BSA. Образцы после инкубации фильтровали под вакуумом на стекло-микроволоконных фильтрах G/F (Millipor, USA), предварительно смоченных в 0.3% полиэтиленимине в течение 2 часов при 4°C. Фильтры трижды промывали холодным раствором буфера 50 mM Tris-HCl, и измеряли радиоактивность с помощью жидкостного сцинтилляционного бета-анализатора (TriCarb, PerkinElmer, США) с эффективностью счета около 45%. Неспецифическое связывание, которое составляло 30% от общего связывания, определяли инкубацией мембранных препаратов с радиолигандом в присутствии 50 мкл 10 мкМ немеченого лиганда BGC 20-761.
Связывание тестируемых соединений с рецептором определяли по их способности вытеснять радиоактивный лиганд и выражали в процентах вытеснения. Процент вытеснения определяли по следующей формуле:
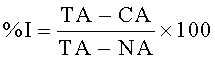 ,
,
где ТА - общая радиоактивность в присутствии только радиоактивного лиганда, СА - радиоактивность в присутствии радиолиганда и тестируемого соединения и NA - радиоактивность в присутствии радиолиганда и серотонина (5 µМ).
Результаты испытаний некоторых представителей соединений общей формулы 1, представленные в Таблице 1, свидетельствуют об активности этих соединений по отношению к 5-НТ6 рецепторам.
Таким образом, полученные результаты биологических испытаний показывают, что соединения общей формулы 1 ингибируют холинэстеразы, проявляя более высокую активность и селективноть в отношении БХЭ по сравнению с АХЭ, и являются эффективными лигандами 5-НТ6.
Следующим аспектом изобретения является фармакологическое средство для улучшения когнитивных функций и памяти, содержащее активное начало и фармацевтически приемлемый носитель, в котором в качестве активного начала содержится эффективное количество соединения формулы 1.
Фармакологическое средство, согласно изобретению, приготавливается с помощью общепринятых в данной области техники приемов и включает фармакологически эффективное количество активного агента, представляющего соединения формулы 1 ("активное начало"), составляющее обычно от 1 до 20 вес.%, или от 1 мг до 20 мг в дозируемой форме, которая представляет собой таблетку, гранулу, сфероид, шарик, пилюлю или капсулу, в сочетании с одной или более фармацевтически приемлемыми вспомогательными добавками, такими как разбавители, связующие, разрыхляющие агенты, адсорбенты, ароматизирующие вещества, вкусовые агенты. В соответствии с известными методами фармацевтические композиции могут быть представлены различными жидкими или твердыми формами. Примеры твердых лекарственных форм включают, например, таблетки, пилюли.
Как видно из приведенных примеров, применение соединений формулы 1 предлагаемого изобретения решает задачу расширения и качественного улучшения арсенала средств, применяемых при лечении нейродегенеративных заболеваний, приводящих к развитию разрушающих процессов в центральной и периферической нервной системе, за счет объединения в одной молекуле свойств ингибиторов холинэстераз и эффективных лигандов 6-ого подтипа серотониновых рецепторов (5-НТ6).
![ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ](https://fips.edrid.ru/images/rid/cd/f9/28/8b2e4091f25ec5eb439e6e71d6c9bbc7.png)
![ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ](https://fips.edrid.ru/images/rid/cd/f9/28/7e6bef3b7733c2ead09bc55590ece088.png)
![ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ](https://fips.edrid.ru/images/rid/cd/f9/28/b76c5d67d7266396b2174d89807f7e2c.jpg)
![ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ](https://fips.edrid.ru/images/rid/cd/f9/28/c59e20d74646ccc70cdc7aeaff718497.png)
![ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ](https://fips.edrid.ru/images/rid/cd/f9/28/8b77ca799b360a3db8355c6603e1a96e.png)
![ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ](https://fips.edrid.ru/images/rid/cd/f9/28/008ac5391b9cc0148cd2954d7df9e819.png)

