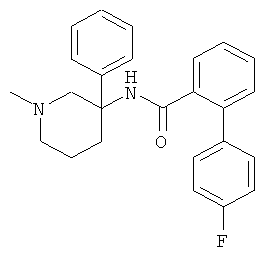
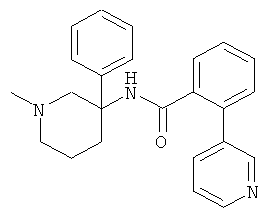
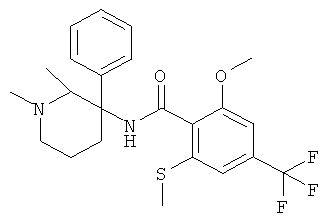
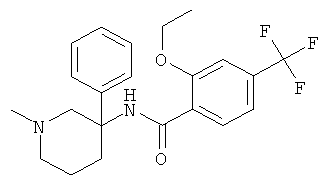
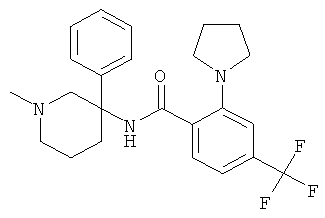
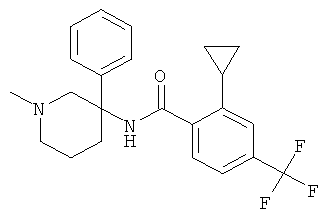
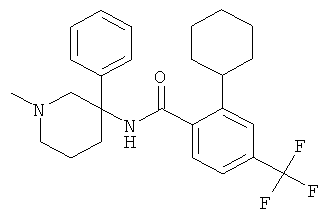
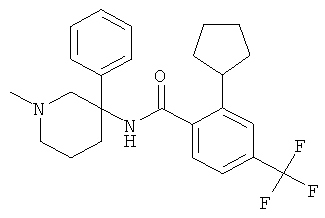
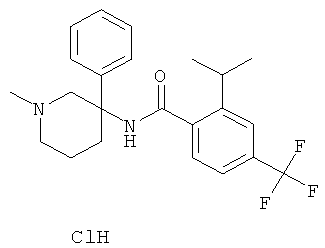
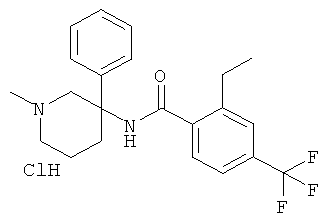
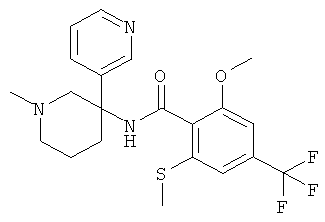
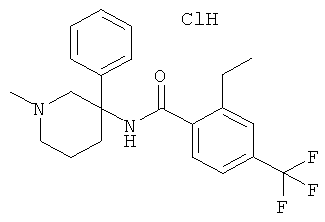
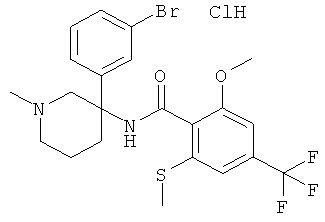
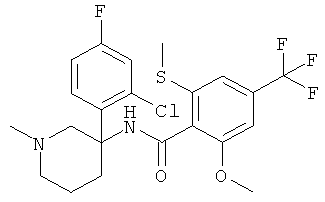
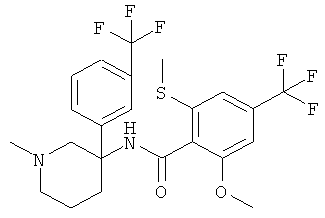
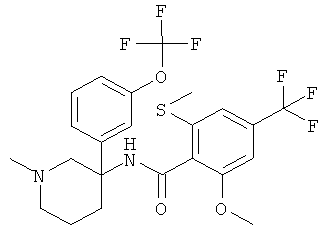
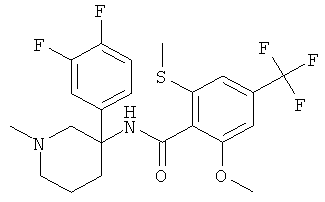
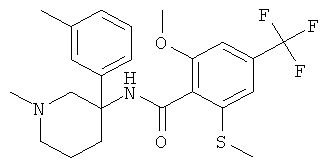
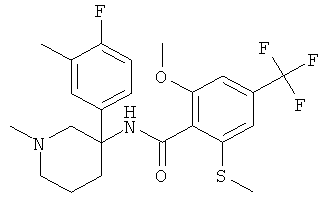
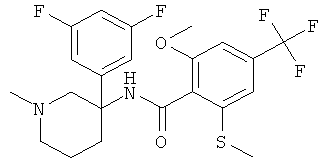
Результат интеллектуальной деятельности: АРОИЛАМИНО- И ГЕТЕРОАРОИЛАМИНО-ЗАМЕЩЕННЫЕ ПИПЕРИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ GLYT-1
Вид РИД
Изобретение
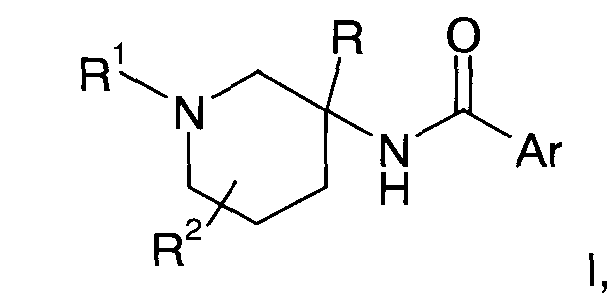
Настоящее изобретение относится к соединению общей Формулы I
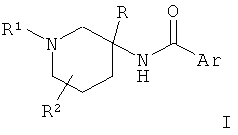
где
R1 представляет собой атом водорода, низший алкил, CD3, -(CH2)n-CHO, -(СН2)n-О-низший алкил, -(СН2)n-ОН, -(СН2)n-циклоалкил или представляет собой гетероциклоалкил;
R2 представляет собой атом водорода, атом галогена, гидрокси, низший алкил, ди-низший алкил, -ОСН2-О-низший алкил или низший алкокси; или пиперидиновое кольцо вместе с R2 образует спиро-кольцо, выбранное из 4-аза-спиро[2,5]окт-6-ила;
Ar представляет собой арил или гетероарил, которые, возможно, имеют один, два или три заместителя, выбранные из атома галогена, низшего алкила, низшего алкила, имеющего в качестве заместителей атом галогена, низшего алкокси, имеющего в качестве заместителей атом галогена, циклоалкила, низшего алкокси, S-низшего алкила, гетероарила, гетероциклоалкила, или, возможно, имеют в качестве заместителей фенил, возможно, имеющий в качестве заместителей R', и
R' представляет собой атом галогена, низший алкил, низший алкокси или низший алкокси, имеющий в качестве заместителей атом галогена, или представляет собой гетероарил;
R представляет собой низший алкил, циклоалкил, гетероциклоалкил, арил или гетероарил, где арил и гетероарил, возможно, имеют в качестве заместителей один или два R';
n имеет значение 0, 1, 2 или 3;
или к фармацевтически приемлемой соли присоединения кислоты, к рацемической смеси или к соответствующему энантиомеру и/или оптическому изомеру данного соединения.
Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим соединения Формулы I, и к их применению в лечении неврологических и психоневрологических расстройств.
Неожиданно было найдено, что соединения общей Формулы I являются хорошими ингибиторами глицинового переносчика 1 (GlyT-1) и что они обладают хорошей селективностью в отношении ингибиторов глицинового переносчика 2 (GlyT-2).
Шизофрения представляет собой прогрессирующее и изнуряющее неврологическое заболевание, характеризующееся эпизодическими позитивными симптомами, такими как бред, галлюцинации, расстройства мышления и психоз, и стойкими негативными симптомами, такими как притупленный аффект, нарушение внимания и социальная самоизоляция, и когнитивными нарушениями (Lewis DA and Lieberman JA, Neuron, 2000, 28:325-33). В течение нескольких десятилетий исследования были сконцентрированы на гипотезе "дофаминергической гиперактивности", что привело к терапевтическим вмешательствам, включающим блокаду дофаминергической системы (Vandenberg RJ and Aubrey KR., Exp.Opin. Ther. Targets, 2001, 5(4): 507-518; Nakazato A and Okuyama S, et al., 2000, Exp. Opin. Ther. Patents, 10(1): 75-98). Этот фармакологический подход плохо соответствует лечению негативных и когнитивных симптомов, которые являются лучшими показателями функционального результата (Sharma Т., Br.J.Psychiatry, 1999, 174 (suppl. 28): 44-51).
В середине 1960-х годов была предложена дополнительная модель шизофрении, основанная на психотомиметическом действии, вызываемом блокадой глутаматной системы соединениями, подобными фенциклидину (РСР) и родственным агентам (кетамину), которые являются неконкурентными антагонистами NMDA-рецептора. Интересно, что у здоровых волонтеров РСР-индуцированное психотомиметическое действие включает позитивные и негативные симптомы, а также когнитивную дисфункцию и, таким образом, сильно напоминает шизофрению у пациентов (Javitt DC et al., 1999, Biol. Psychiatry, 45: 668-679 и ссылки в данном описании). Кроме того, трансгенные мыши, экспрессирующие пониженные уровни NMDAR1-субъединицы, проявляют аномалии в поведении, подобные тем, которые наблюдают в фармакологически индуцированных моделях шизофрении, что подтверждает модель, в которой уменьшение активности NMDA-рецептора приводит к шизофреническому поведению (Mohn AR et al., 1999, Cell, 98: 427-236).
Глутаматная нейротрансмиссия, в частности активность NMDA-рецептора, играет ключевую роль в синаптической пластичности, обучении и памяти, а именно NMDA-рецепторы, по-видимому, служат в качестве дифференцированного переключателя для синхронизации порогового значения синаптической пластичности и формирования памяти (Hebb DO, 1949, The organization of behavior, Wiley, NY; Bliss TV и Collingridge GL, 1993, Nature, 361: 31-39). Трансгенные мыши, сверхэкспрессирующие МК2 В-субъединицу NMDA, проявляют повышенную синаптическую пластичность, имеют лучшие способности к обучению и лучшую память (Tang JP et al., 1999, Nature: 401: 63-69).
Таким образом, если патофизиология шизофрении включает дефицит глутамата, можно ожидать, что увеличение глутаматной трансмиссии, в частности посредством активации NMDA-рецептора, будет вызывать как антипсихотические эффекты, так и эффекты повышения когнитивной функции.
Известно, что в ЦНС аминокислота глицин имеет по меньшей мере две важные функции. Связываясь со стрихнин-чувствительными глициновыми рецепторами, она действует как тормозная аминокислота, а действуя в качестве основного коагониста глутамата на функцию рецептора N-метил-D-аспартата (NMDA), эта аминокислота оказывает влияние также на возбудительную активность. В то время как глутамат высвобождается из синаптических окончаний в зависимости от активности, глицин присутствует предположительно на более постоянном уровне и, по-видимому, модулирует/контролирует рецептор для его ответа на глутамат.
Одним из наиболее эффективных путей контроля синаптических концентраций нейромедиатора состоит в том, чтобы воздействовать на его обратный захват в синапсах. Путем удаления нейромедиаторов из внеклеточного пространства переносчики нейромедиаторов могут контролировать их внеклеточное время жизни и тем самым модулировать параметры синаптической передачи (Gainetdinov RR et al, 2002, Trends в Pharm. Sci., 23(8): 367-373).
Глициновые переносчики, которые принадлежат натрий- и хлоридзависимому семейству переносчиков нейромедиаторов, играют важную роль в терминации постсинаптических глицинергических воздействий и поддержании низкой внеклеточной концентрации глицина путем обратного захвата глицина в пресинаптических нервных окончаниях и в близлежащих тонких глиальных отростках.
Из головного мозга млекопитающих были клонированы два разных гена глициновых переносчиков (GlyT-1 и GlyT-2), которые дают начало двум переносчикам примерно с 50% гомологией аминокислотной последовательности. GlyT-1 представлен четырьмя изоформами, являющимися результатом альтернативного сплайсинга и альтернативного использования промоторов (1а, 1b, 1c и 1d). Только две из этих изоформ были найдены в головном мозге грызунов (GlyT-1a и GlyT-1b). GlyT-2 также показывает некоторую степень гетерогенности. В головном мозге грызунов были идентифицированы две изоформы GlyT-2 (2а и 2b). Известно, что GlyT-1 локализуется в ЦНС и в периферических тканях, тогда как GlyT-2 является специфичным для ЦНС.GlyT-1 имеет преимущественно глиальное распределение, и его находят не только в областях, соответствующих стрихнин-чувствительному глициновому рецептору, но также за пределами этих областей, где, как предполагается, он участвует в модуляции функции NMDA-рецептора (Lopez-Corcuera В et al., 2001, Mol. Mem. Biol., 18: 13-20). Соответственно, один из способов повышения активности NMDA-рецептора состоит в увеличении концентрации глицина в локальном микроокружении синаптических NMDA-рецепторов путем ингибирования GlyT-1-переносчика (Bergereon R. et al. 1998, Proc. Natl. Acad. Sci. USA, 95: 15730-15734; Chen L et al., 2003, J. Neurophysiol., 89 (2): 691-703).
Ингибиторы глициновых переносчиков подходят для лечения неврологических и психоневрологических расстройств. Большинство связанных с ними болезненных состояний представляют собой психозы, шизофрению (Armer RE and Miller DJ, 2001, Exp. Opin. Ther. Patents, 11 (4): 563-572), психотические расстройства настроения, такие как большое депрессивное расстройство тяжелого типа, расстройства настроения, связанные с психотическими расстройствами, такими как острый маниакальный синдром или депрессия, связанная с биполярными расстройствами, и расстройства настроения, связанные с шизофренией (Pralong ET et al., 2002, Prog. Neurobiol., 67: 173-202), аутистические расстройства (Carlsson ML, 1998, J. Neural Transm. 105: 525-535), когнитивные расстройства, такие как деменции, включая возрастную деменцию и сенильную деменцию Альцгеймеровского типа, нарушения памяти у млекопитающих, включая человека, синдромы дефицита внимания и боль (Armer RE and Miller DJ, 2001, Exp.Opin. Ther. Patents, 11 (4): 563-572).
Соответственно, увеличение активации NMDA-рецепторов посредством ингибирования GlyT-1 может привести к агентам, которые лечат психоз, шизофрению, деменцию и другие заболевания, при которых нарушены когнитивные процессы, такие как синдромы дефицита внимания или болезнь Альцгеймера.
Предметами настоящего изобретения являются соединения Формулы I per se, применение соединений Формулы I и их фармацевтически приемлемых солей в изготовлении лекарств для лечения заболеваний, на которые можно воздействовать путем активации NMDA-рецепторов посредством ингибирования GlyT-1, получение указанных соединений, лекарства на основе соединения согласно изобретению и их изготовление, а также применение соединений Формулы I в лечении или предупреждении таких заболеваний, как психозы, дисфункция памяти и обучения, шизофрения, деменция и другие заболевания, при которых нарушены когнитивные процессы, такие как синдромы дефицита внимания или болезнь Альцгеймера.
Предпочтительными показаниями для применения соединений по настоящему изобретению является шизофрения, когнитивное нарушение и болезнь Альцгеймера.
Кроме того, изобретение включает все рацемические смеси, все соответствующие энантиомеры и/или оптические изомеры.
В контексте данного описания термин "низший алкил" означает группу с насыщенной нормальной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и тому подобное. Предпочтительными алкильными группами являются группы, содержащие от 1 до 4 атомов углерода.
В контексте данного описания термин "низший алкокси" означает низшую алкильную группу, такую, как определено выше, которая связана с атомом О.
Термин "циклоалкил" означает насыщенное или частично ненасыщенное кольцо, содержащее от 3 до 7 атомов углерода, например циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил или циклогептенил. Предпочтительными циклоалкильными кольцами являются циклопропил и циклопентил.
Термин "гетероциклоалкил" означает насыщенное или частично ненасыщенное кольцо, содержащее от 3 до 6 атомов углерода, где по меньшей мере один атом углерода заменен гетероатомом, выбранным из N, S или О, например пиперазинил, пирролидинил, оксетанил, морфолинил, пиперидинил или тетрагидропиранил.
Термин "галоген" означает атом хлора, атом йода, атом фтора и атом брома.
Термин "арил" означает одновалентный циклический ароматический углеводородный радикал, состоящий из одного кольца или нескольких конденсированных колец, у которого по меньшей мере одно кольцо является ароматическим по природе, например фенил или нафтил.
Термин "низший алкил, имеющий в качестве заместителей атом галогена", означает низшую алкильную группу, такую, как определено выше, где по меньшей мере один атом водорода заменен атомом галогена, например следующие группы: CF3, CHF2, CH2F, CH2CF3, CH2CHF2, CH2CH2F, CH2CH2CF3, CH2CH2CH2CF3, CH2CH2Cl, CH2CF2CF3, CH2CF2CHF2, CF2CHFCF3, С(СН3)2CF3, СН(СН3)CF3 или CH(CH2F)CH2F.
Термин "низший алкокси, имеющий в качестве заместителей атом галогена", означает алкокси-группу, такую, как определено выше, где по меньшей мере один атом водорода заменен атомом галогена.
Термин "гетероарил" означает циклический ароматический углеводородный радикал, состоящий из одного кольца или нескольких конденсированных колец, содержащий от 5 до 14 кольцевых атомов, предпочтительно содержащий от 5 до 10 кольцевых атомов, у которого по меньшей мере одно кольцо является ароматическим по природе и который содержит по меньшей мере один гетероатом, выбранный из N, О или S, например хиноксалинил, дигидроизохинолинил, пиразинил, пиридазинил, пиразолил, пиридинил, пиридил, пиримидинил, оксадиазолил, триазолил, тетразолил, тиазолил, тиадиазолил, тиенил, фурил, имидазолил, бензофуранил, дигидробензофуранил и бензо[1,3]диоксол. Предпочтительная гетероарильная группа представляет собой пиридинил.
Термин "фармацевтически приемлемые соли присоединения кислот" включает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метан-сульфоновая кислота, пара-толуолсульфоновая кислота и тому подобное.
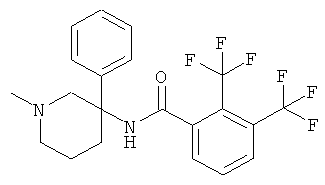
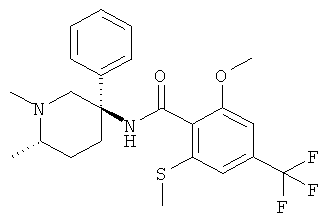
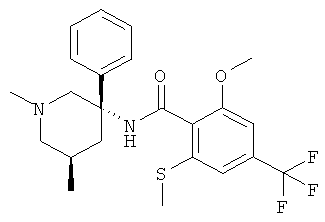
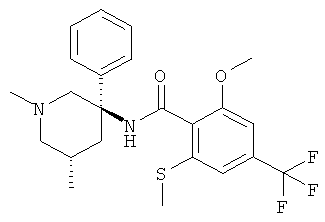
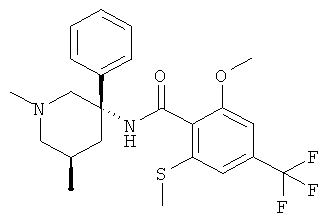
Предпочтительными соединениями Формулы I являются соединения, у которых R1 представляет собой низший алкил и Ar и R представляют собой фенил.
Особенно предпочтительными являются соединения, у которых фенильная группа Ar имеет в качестве заместителей по меньшей мере две группы CF3, например следующие соединения:
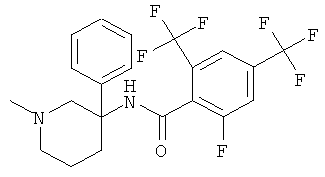
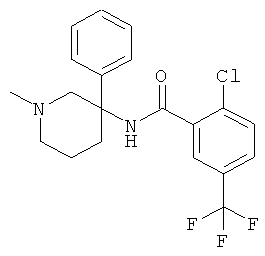
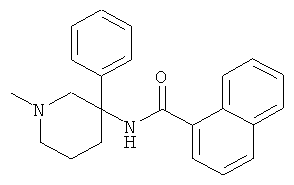
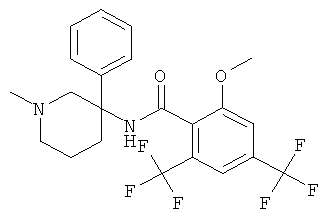
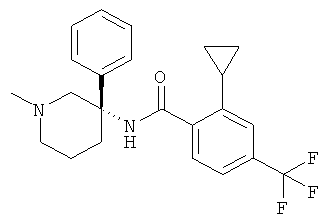
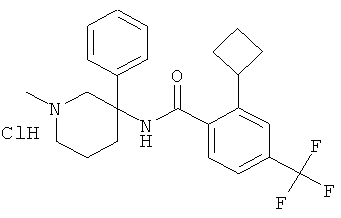
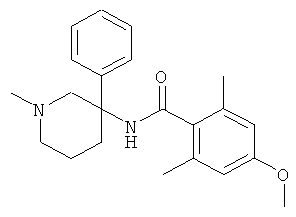
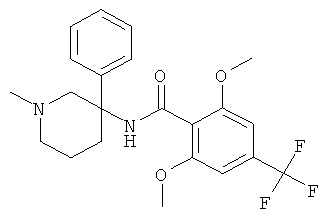
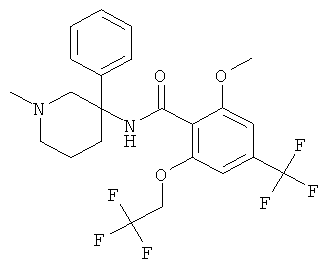
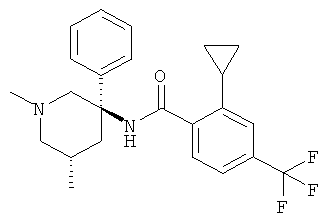
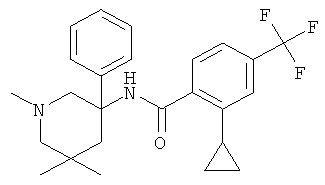
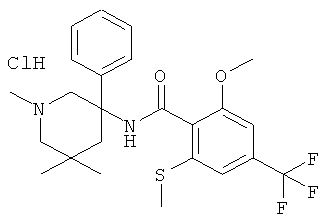
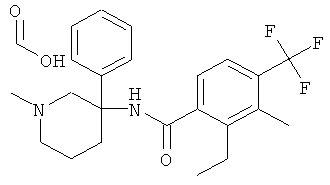
рац-2-фтор-N-(1-метил-3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид;
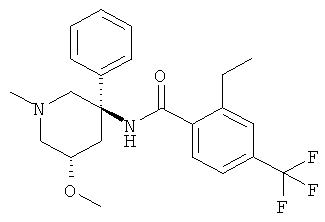
рац-2-метокси-N-(1-метил-3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид;
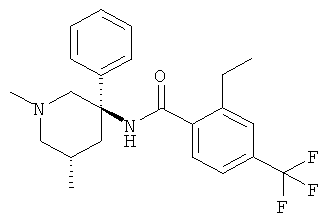
рац-2-этил-N-(1-метил-3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид;
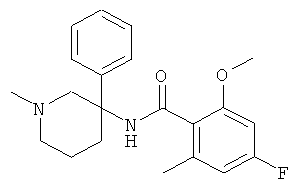
рац-N-[3-(4-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-4,6-бис-трифторметил-бензамид или
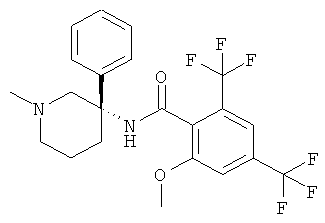
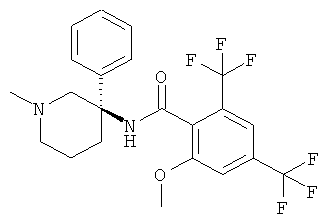
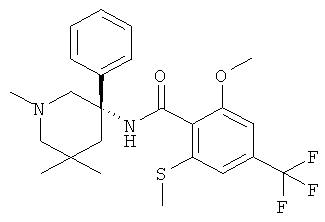
2-метокси-N-((R)-1-метил-3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид.
Другим предпочтительными соединениями являются соединения, у которых фенильная группа Ar имеет в качестве заместителей по меньшей мере одну группу CF3, например следующие соединения:
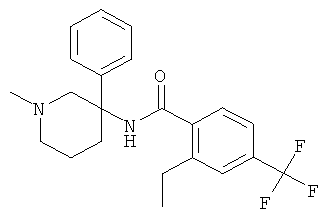
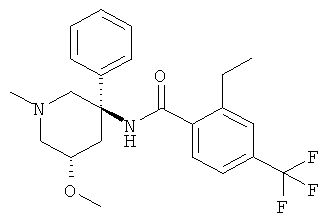
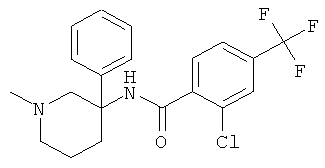
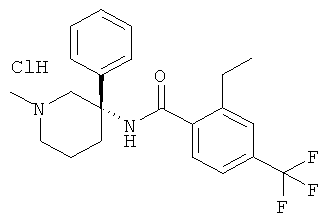
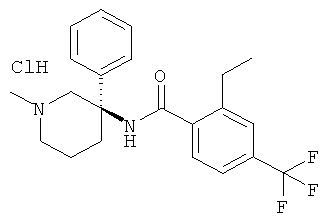
рац-2-этил-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
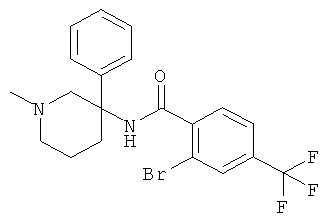
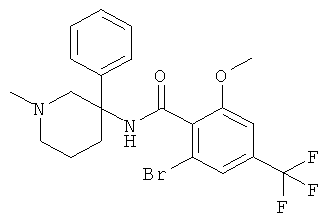
рац-2-бром-6-метокси-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-N-(1,2-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
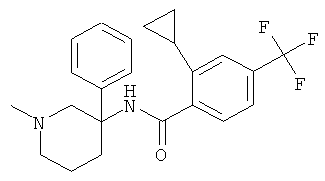
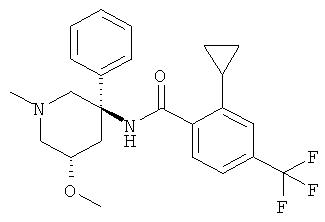
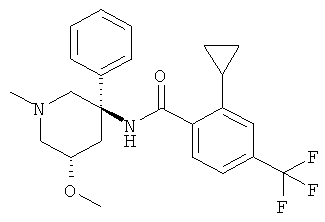
рац-2-циклопропил-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
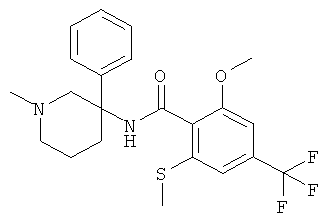
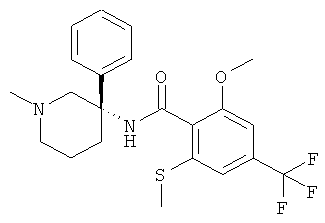
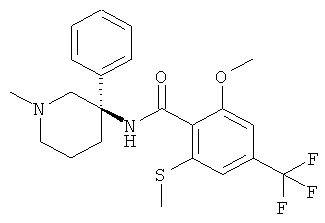
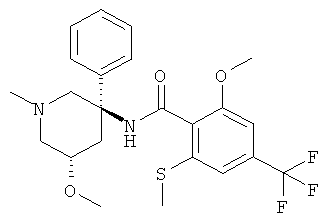
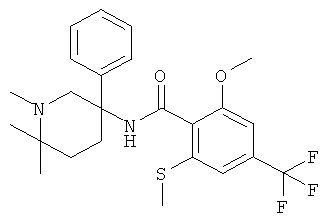
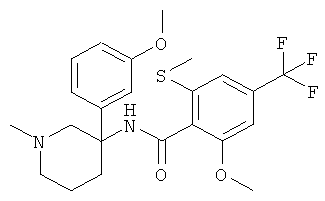
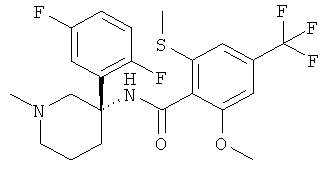
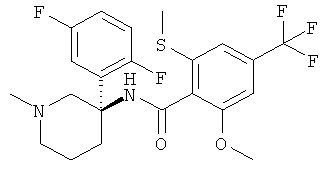
рац-2-метокси-N-(1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
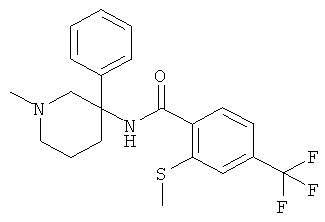
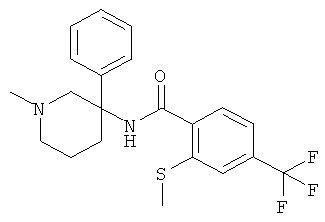
рац-N-(1-метил-3-фенил-пиперидин-3-ил)-2-метилсульфанил-4-трифторметил-бензамид;
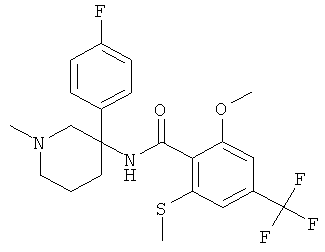
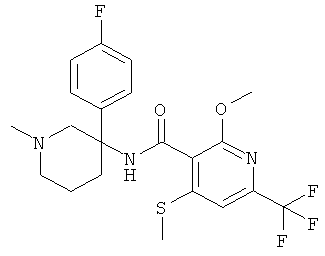
рац-N-[3-(4-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
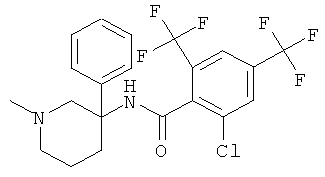
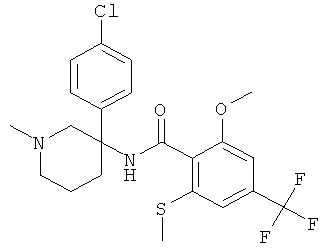
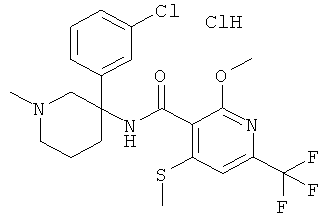
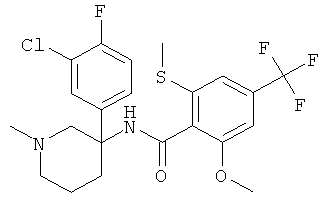
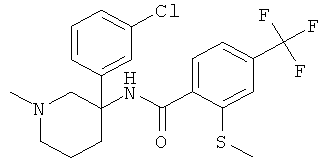
рац-N-[3-(4-хлор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
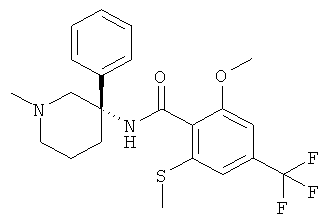
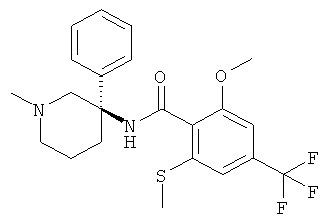
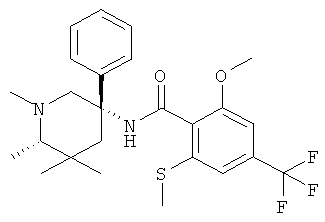
2-метокси-N-((S)-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
2-метокси-N-((R)-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
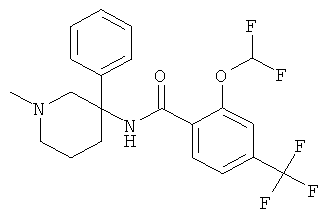
рац-2-дифторметокси-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-N-[3-(3-хлор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
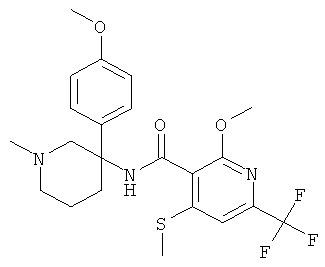
рац-2-метокси-N-[3-(4-метокси-фенил)-1-метил-пиперидин-3-ил]-6-метилсульфанил-4-трифторметил-бензамид;
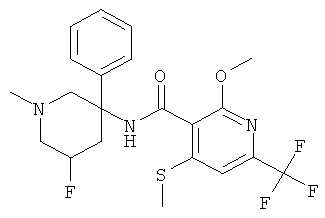
рац-N-(5-фтор-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
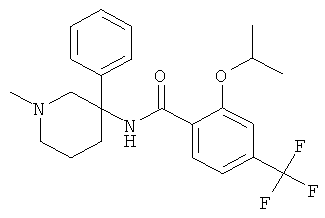
рац-N-(1-изопропил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
2-циклопропил-N-((S)-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
2-циклопропил-N-((R)-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-2-циклобутил-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
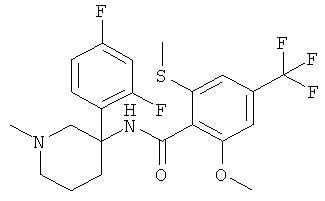
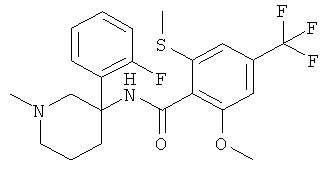
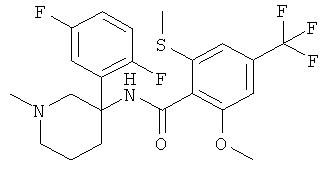
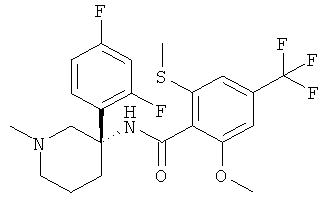
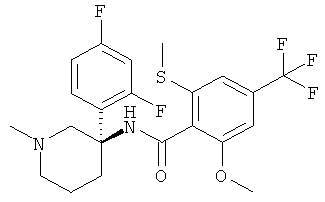
рац-N-[3-(2,4-дифтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(2-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(2,5-дифтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-изопропил-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-2-метокси-6-метилсульфанил-N-(1-метил-1,4,5,6-тетрагидро-2Н-[3,4']бипиридинил-3-ил)-4-трифторметил-бензамид;
рац-2-этил-N-(1-метил-1,4,5,6-тетрагидро-2Н-[3,4']бипиридинил-3-ил)-4-трифторметил-бензамид;
рац-2-метокси-6-метилсульфанил-N-(1-метил-1,4,5,6-тетрагидро-2Н-[3,3']бипиридинил-3-ил)-4-трифторметил-бензамид;
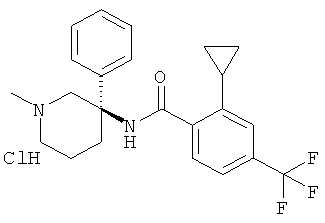
рац-2-этил-N-(1-метил-1,4,5,6-тетрагидро-2H-[3,3']бипиридинил-3-ил)-4-трифторметил-бензамида гидрохлорид;
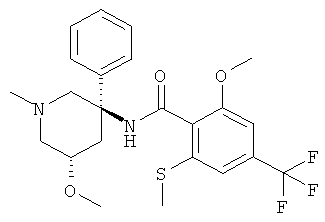
2-метокси-N-((3RS,5SR)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
2-циклопропил-N-((3RS,5SR)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
2-этил-N-((3RS,5SR)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
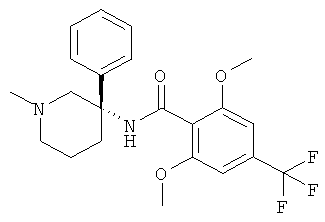
рац-2,6-диметокси-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
2-циклопропил-N-((3RS,5SR)-1,5-диметил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-2-циклопропил-4-трифторметил-N-(1,5,5-триметил-3-фенил-пиперидин-3-ил)-бензамид;
рац-2-метокси-6-метилсульфанил-4-трифторметил-N-(1,6,6-триметил-3-фенил-пиперидин-3-ил)-бензамид;
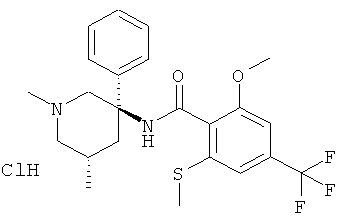
N-((3RS,5SR)-1,5-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
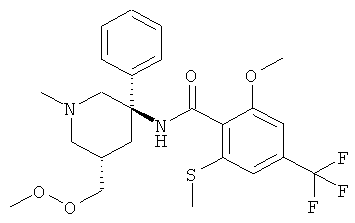
2-метокси-N-((3RS,5SR)-5-метоксиметокси-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(3-бром-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(2-хлор-4-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
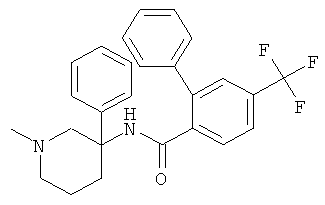
рац-2-метокси-6-метилсульфанил-N-[1-метил-3-(3-трифторметил-фенил)-пиперидин-3-ил]-4-трифторметил-бензамид;
рац-2-метокси-N-[3-(3-метокси-фенил)-1-метил-пиперидин-3-ил]-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(3-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(3-хлор-4-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(3,4-дифтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-метокси-6-метилсульфанил-N-(1-метил-3-мета-толил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-N-[3-(4-фтор-3-метил-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(3,5-дифтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-метокси-6-метилсульфанил-4-трифторметил-N-(1,5,5-триметил-3-фенил-пиперидин-3-ил)-бензамид;
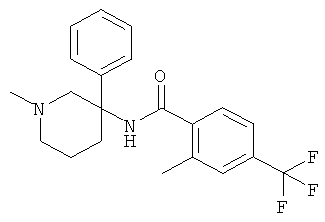
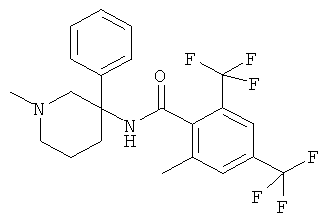
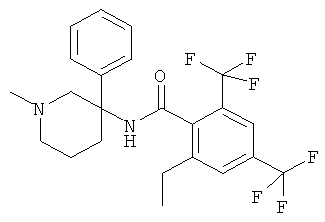
рац-2-этил-3-метил-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
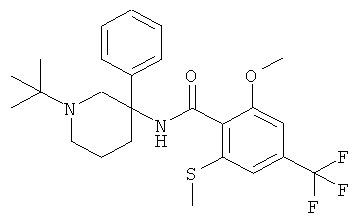
рац-N-(1-трет-бутил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
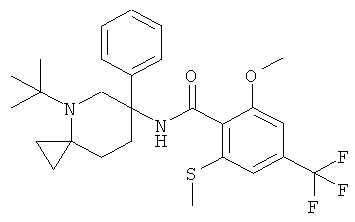
рац-2-метокси-N-(4-метил-6-фенил-4-аза-спиро[2,5]окт-6-ил)-6-метилсульфанил-4-трифторметил-бензамид;
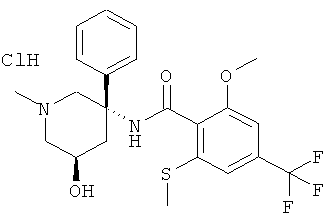
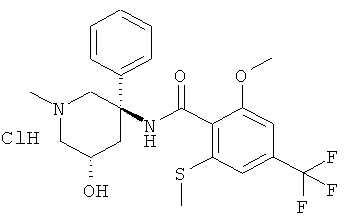
N-((3R,5S) или (3S,5R)-5-гидрокси-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
2-метокси-N-((3R,5S) или (3S,5R)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
2-метокси-N-((3S,5R) или (3R,5S)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
N-[(R или S)-3-(2-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
N-[(R или S)-3-(2,5-дифтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
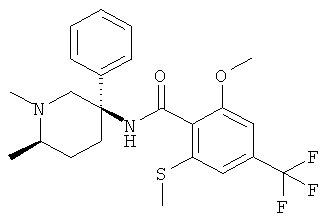
2-этил-N-((R или S)-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
2-метокси-6-метилсульфанил-4-трифторметил-N-((S или R)-1,5,5-триметил-3-фенил-пиперидин-3-ил)-бензамид;
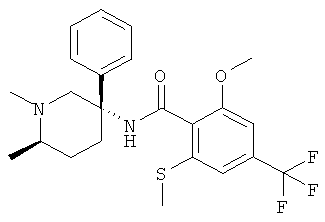
N-((3S,6S) или (3R,6R)-1,6-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
N-((3R,6R)или (3S,6S)-1,6-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
N-((3R,6S) или (3S,6R)-1,6-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
N-((3S,5R) или (3R,5S)-1,5-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
N-((3R,5S) или (3S,5R)-1,5-диметил-3-фенил-пиперидин-3-ил)-2-этил-4-трифторметил-бензамид;
2-этил-N-((3R,5S) или (3S,5R)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
2-циклопропил-N-((3R,5S) или (3S,5R)-5-метокси-1-метил-3-фенил-пиперидин-3-
ил)-4-трифторметил-бензамид или
2,6-диметокси-N-(R или (S)-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R1 представляет собой циклоалкил или гетероциклоалкил и Ar и R представляют собой фенил, например
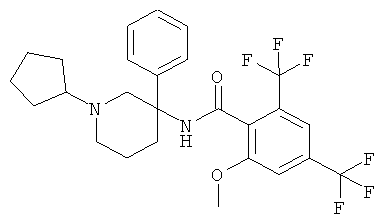
рац-N-(1-циклопентил-3-фенил-пиперидин-3-ил)-2-метокси-4,6-бис-трифторметил-бензамид,
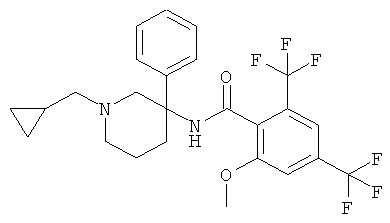
рац-N-(1-циклопропилметил-3-фенил-пиперидин-3-ил)-2-метокси-4,6-бис-трифторметил-бензамид или
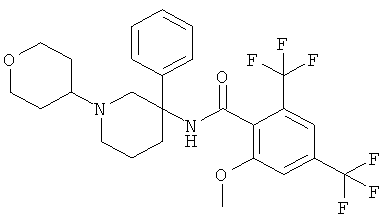
рац-2-метокси-N-[3-фенил-1-(тетрагидро-пиран-4-ил)-пиперидин-3-ил]-4,6-бис-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R1 представляет собой низший алкил, Ar представляет собой фенил и R представляет собой гетероарил, например
рац-N-(5-фтор-1'-метил-1',4',5',6'-тетрагидро-2'Н-[2,3']бипиридинил-3'-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид,
рац-2-метокси-6-метилсульфанил-N-(1-метил-1,4,5,6-тетрагидро-2Н-[3,4']бипиридинил-3-ил)-4-трифторметил-бензамид,
рац-2-этил-N-(1-метил-1,4,5,6-тетрагидро-2H-[3,4']бипиридинил-3-ил)-4-трифторметил-бензамида гидрохлорид,
рац-2-метокси-6-метилсульфанил-N-(1-метил-1,4,5,6-тетрагидро-2Н-[3,3']бипиридинил-3-ил)-4-трифторметил-бензамид или
рац-2-этил-N-(1-метил-1,4,5,6-тетрагидро-2H-[3,3']бипиридинил-3-ил)-4-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R1 представляет собой атом водорода и Ar и R представляют собой фенил, например
рац-2-циклопропил-N-(3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R2 представляет собой гидрокси, например
рац-N-(5-гидрокси-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид или
N-((3R,5S) или (3S,5R)-5-гидрокси-1 -метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R2 представляет собой атом галогена, например
рац-N-(5-фтор-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R1 представляет собой CD3, например следующие соединения:
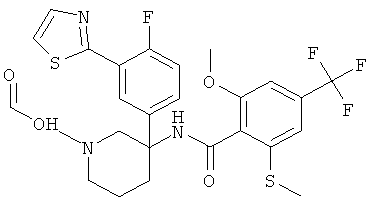
[2Н-метил]-2-метокси-N-(R) или (S)-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамида гидрохлорид.
Соединения по настоящему изобретению Формулы I и их фармацевтически приемлемые соли могут быть получены с помощью методик, известных в данной области техники, например с помощью методик, описанных ниже, которые включают а) взаимодействие соединения Формулы
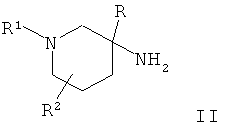
с соединением Формулы
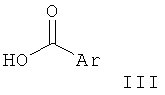
в присутствии активирующего агента, такого как HATU (орто-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат) или тионилхлорид, с получением соединения Формулы
 ,
,
где заместители являются такими, как определено выше, или b) взаимодействие соединения Формулы
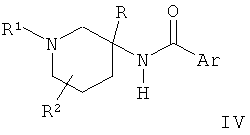 ,
,
с соединением Формулы
R1X
в присутствии основания, такого как N-этилдиизопропиламин, с получением соединения Формулы
 ,
,
где Х представляет собой атом галогена и другие заместители являются такими, как определено выше, или
с) взаимодействие соединения Формулы

с карбонильным реагентом Формулы R4-C(O)-R5
в присутствии восстанавливающего агента, такого как цианоборгидрид натрия, с получением соединения Формулы
 ,
,
где заместители являются такими, как определено выше, R4 и R5 представляют собой низший алкил или вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную или гетероциклоалкильную группу, и при желании превращение полученных соединений в фармацевтически приемлемые соли присоединения кислот.
Соединения Формулы I могут быть получены с использованием одной из методик a), b) или c) в соответствии с приведенными ниже Схемами 1-12. Исходные вещества либо имеются в продаже, либо могут быть получены в соответствии с известными методиками.
Схема 1
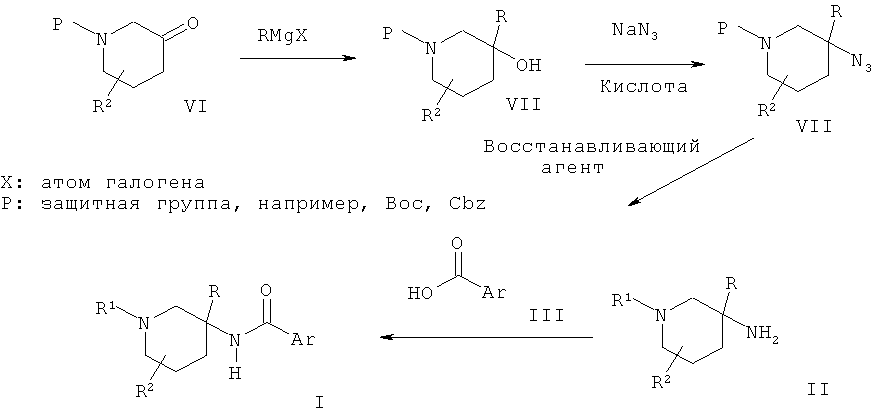
Соединения общей Формулы I могут быть получены в результате взаимодействия пиперидиновых производных Формулы II с кислотой Формулы III в присутствии активирующего агента, такого как HATU (орто-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат) или тионилхлорид. Пиперидиновые производные Формулы II могут быть получены в результате взаимодействия пиперидонового производного VI с металлоорганическим реагентом, таким как реагент Гриньяра, последующей обработки полученного спирта VII азидом натрия в присутствии кислоты, такой как ТФУ, и превращения полученного азидного производного VIII в соединение II в присутствии восстанавливающего агента, такого как алюмогидрид лития.
Схема 2
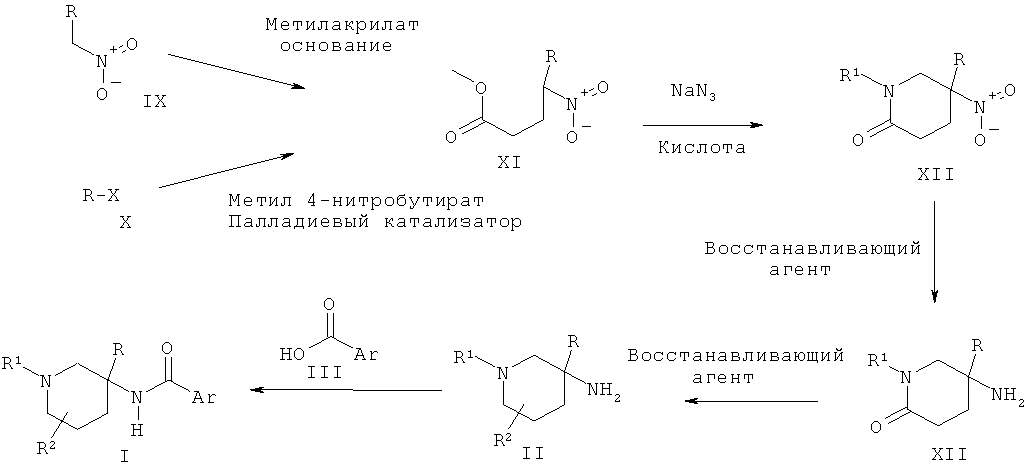
Альтернативно пиперидиновые производные Формулы II, где R2 представляет собой атом водорода, могут быть получены из нитро-пиперидоновых производных XII в результате восстановления нитро-группы восстанавливающим агентом, например никелем Ренея в атмосфере водорода или цинком в присутствии кислоты, такой как соляная кислота, и последующего восстановления полученных амино-пиперидоновых производных XIII до соединения II, которое может быть выполнено в присутствии восстанавливающего агента, такого как алюмогидрид лития. Нитро-пиперидоновые производные XII могут быть получены из нитро-производных XI с использованием внутримолекулярной реакции Манниха, выполняемой в присутствии амина R1NH2 и альдегида, такого как формальдегид.
Соединения XI могут быть получены путем присоединения нитро-метил-арильных производных IX к метилакрилату в присутствии основания, такого как Amberlyst A21 или Triton В, с использованием реакции Михаэля или в результате взаимодействия арилгалогенидных производных Х с метил 4-нитробутиратом в присутствии палладиевого катализатора, такого как Pd2dba3, лиганда, такого как 2-(ди-трет-бутилфосфино)-2'-метилбифенил, и основания, такого как карбонат цезия, в соответствии с методикой, описанной Buchwald et al. в J. Org. Chem. 2002, 106.
Схема 3
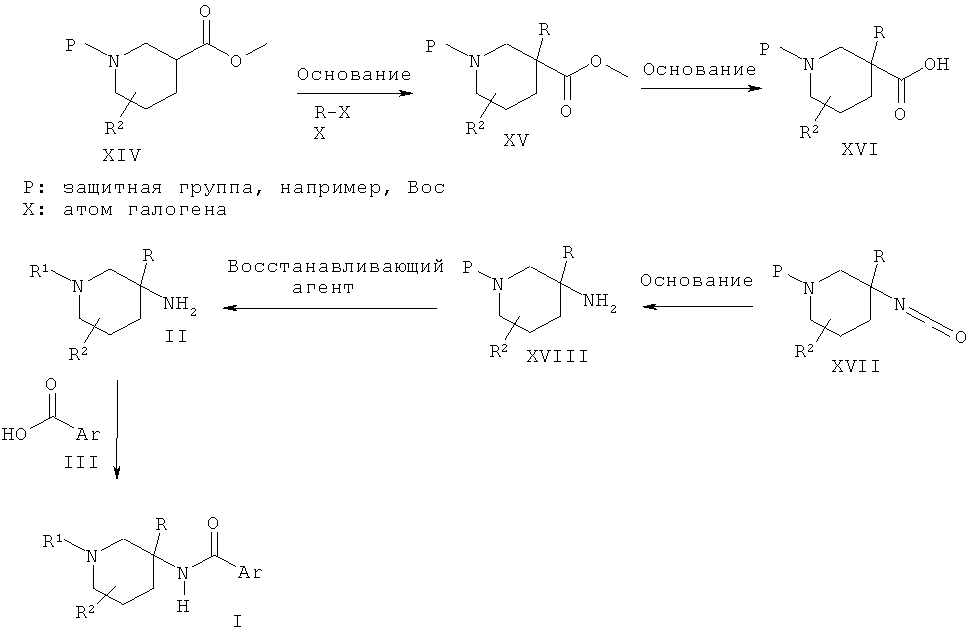
Альтернативно пиперидиновые производные Формулы II, где R представляет собой алкильную группу, могут быть получены из кислоты XVI с использованием перегруппировки Курциуса в присутствии такого реагента, как DPPA (дифенилфосфоразидат), и последующего гидролиза полученного изоцианата XVII в присутствии основания, такого как гидроксид натрия, до защищенного пиперидина XVIII, который восстанавливают до соединения II в присутствии восстанавливающего агента, такого как алюмогидрид лития. Кислота XVI может быть получена из эфира XIV в результате обработки основанием, таким как диизопропиламид лития, и алкилирующим агентом R-X и последующего
омыления полученного промежуточного соединения, эфира XV, до соединения XVI в присутствии основания, такого как гидроксид лития.
Схема 4
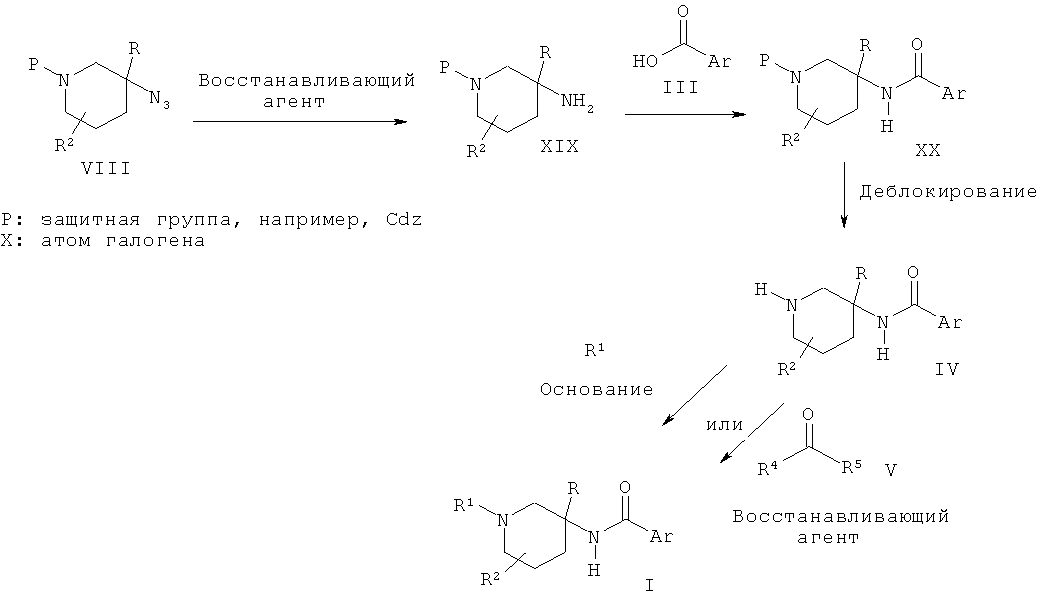
Заместители являются такими, как описано выше, R4 и R5 представляют собой низший алкил или вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную или гетероциклоалкильную группу.
Альтернативно соединения общей Формулы I могут быть получены в результате взаимодействия пиперидинового производного IV либо с алкилирующим агентом R1X в присутствии основания, такого как N-этилдиизопропиламин, либо с карбонильным реагентом V в присутствии восстанавливающего агента, такого как цианоборгидрид натрия. Пиперидиновое производное IV может быть получено в результате восстановления азида VIII таким реагентом, как боргидрид натрия, с получением аминного производного XIX, которое затем может быть подвергнуто взаимодействию с кислотой III в присутствии активирующего агента, такого как HATU или тионилхлорид, и последующего превращения полученного амидного производного XX в соединение IV путем удаления N-защитной группы.
Схема 5
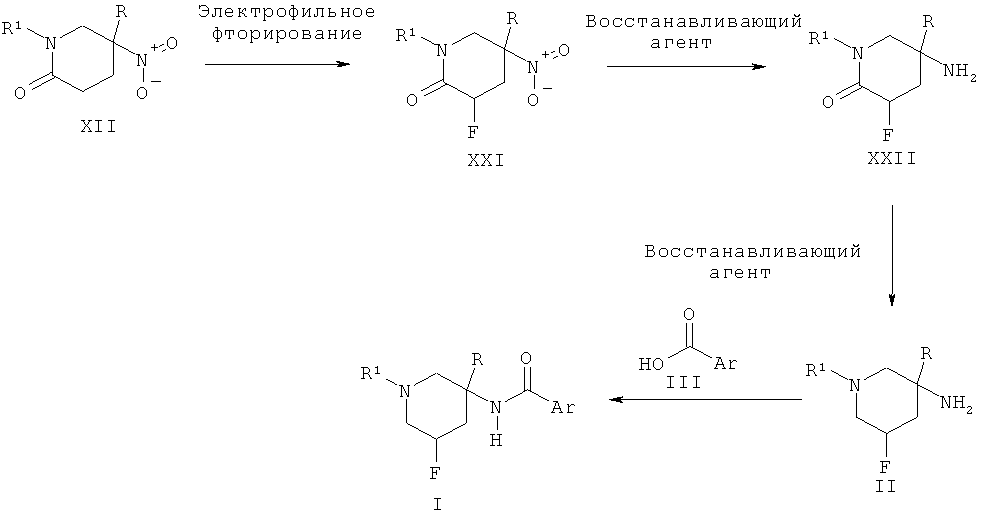
Альтернативно пиперидиновые производные Формулы II, где R2 представляет собой атом фтора, могут быть получены из фторированного нитро-пиперидона XXI путем двух последовательных восстановлений, сначала с использованием такого агента, как никель Ренея, и затем с использованием такого агента, как алюмогидрид лития. Соединение XXI может быть получено в результате взаимодействия нитро-пиперидина XII с основанием, таким как диизопропиламин лития, и последующей обработки электрофильным фторирующим агентом, таким как N-фторбензолсульфонимид.
Схема 6
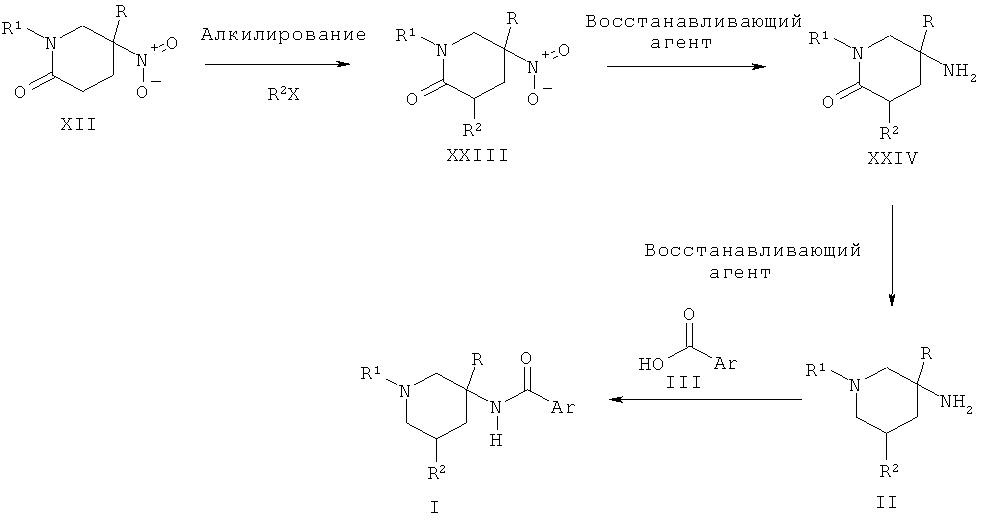
Альтернативно пиперидиновые производные Формулы II, где R2 представляет собой алкил, могут быть получены из алкилированного нитро-пиперидона XXIII путем двух последовательных восстановлений, сначала с использованием такого агента, как никель Ренея, и затем с использованием такого агента, как алюмогидрид лития. Соединение XXIII может быть получено в результате взаимодействия нитро-пиперидина XII с основанием, таким как диизопропиламин лития, и последующей обработки электрофильным алкилирующим агентом, таким как R2X, где Х представляет собой атом галогена.
Схема 7
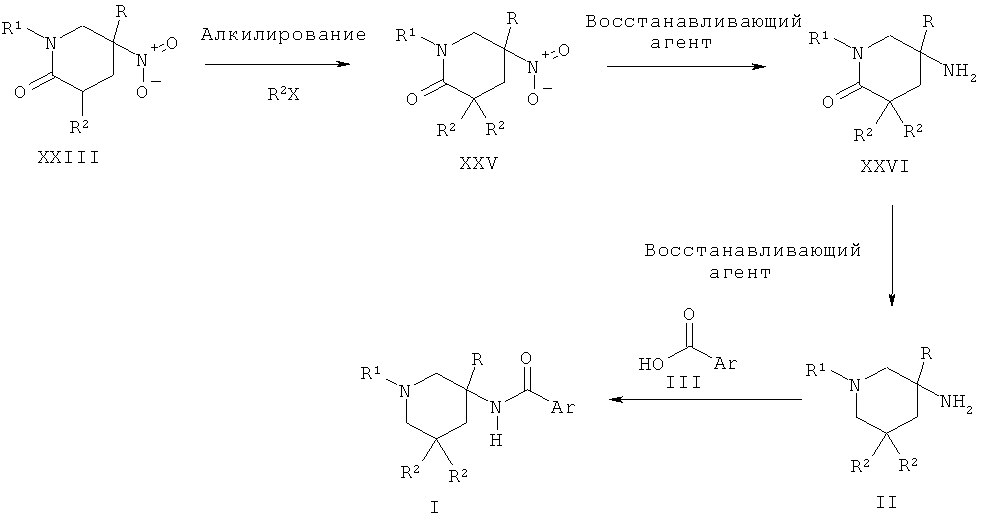
Альтернативно пиперидиновые производные Формулы II, которые содержат две геминальных алкильных группы R2, могут быть получены из бис-алкилированного нитро-пиперидона XXV путем двух последовательных восстановлений, сначала с использованием такого агента, как никель Ренея, и затем с использованием такого агента, как алюмогидрид лития. Соединение XXV может быть получено в результате взаимодействия моно-алкилированного нитро-пиперидина XXIII с основанием, таким как диизопропиламин лития, в присутствии TMEDA (тетраметилэтилендиамина) и последующей обработки электрофильным алкилирующим агентом, таким как R2X, где Х представляет собой атом галогена.
Схема 8
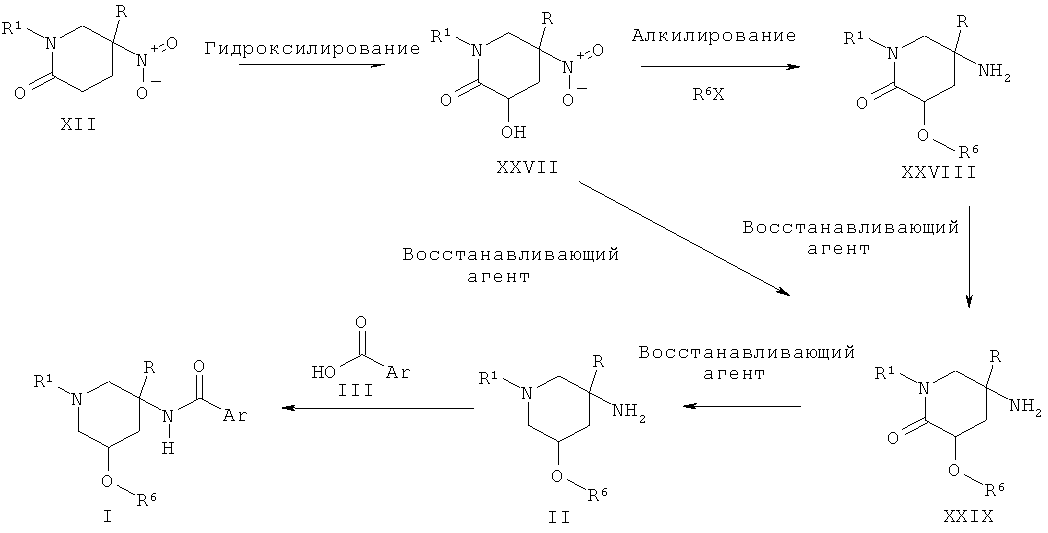
Альтернативно пиперидиновые производные Формулы II, где R2 представляет собой гидроксил (R6=Н) или алкокси-группу (R6=Алкил), могут быть получены из гидрокси нитро-пиперидона XXVII или алкокси нитро-пиперидона XXVIII путем двух последовательных восстановлений, сначала с использованием такого агента, как никель Ренея, и затем с использованием такого агента, как алюмогидрид лития. Соединение XXVIII может быть получено из соединения XXVII в результате взаимодействия с основанием, таким как гидрид натрия, и электрофильным алкилирующим агентом, таким как R6X, где Х представляет собой атом галогена. Соединение XXVII может быть получено в результате взаимодействия нитро-пиперидина XII с основанием, таким как диизопропиламин лития, и последующей обработки электрофильным гидроксилирующим агентом, таким как (оксодиперокси(пиридин) (1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидон)молибден(IV)) или бис(триметилсилил)пероксид.
Схема 9
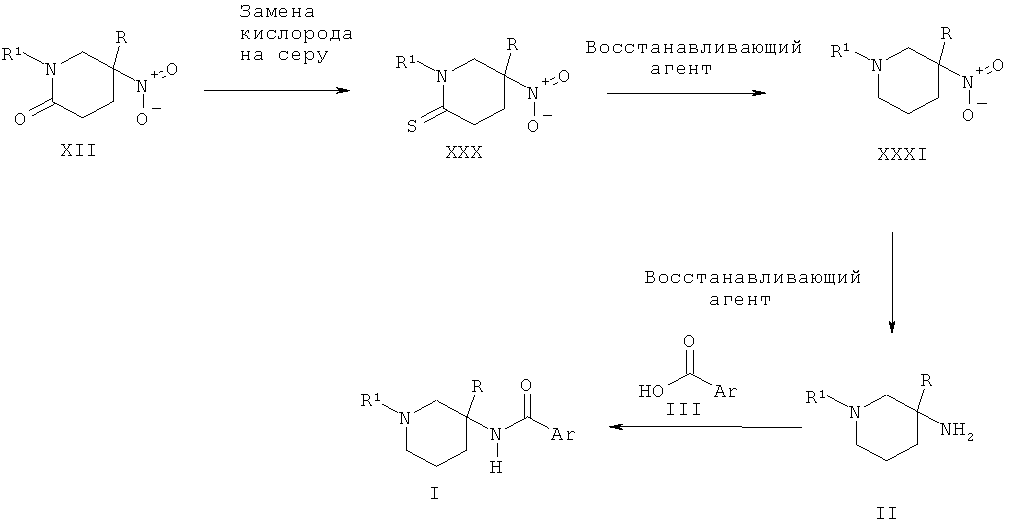
Альтернативно пиперидиновые производные Формулы II, где R представляет собой гетероарильную группу, такую как пиридин, могут быть получены из нитро-пиперидинтиона XXX путем двух последовательных восстановлений, сначала с использованием такого агента, как боргидрид натрия, и затем с использованием такого агента, как никель Ренея. Соединение XXX может быть получено из нитро-пиперидинона XXII в результате взаимодействия с реагентом Лавессона.
Схема 10
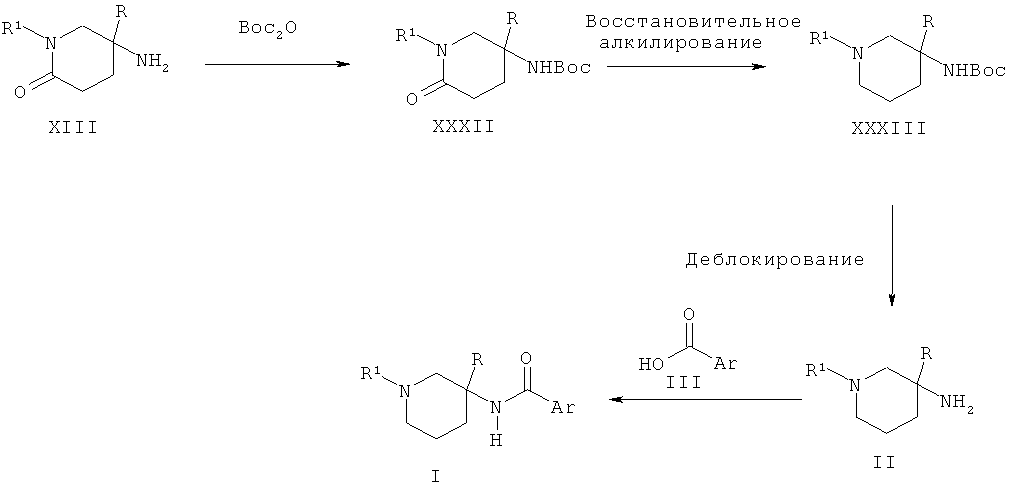
Альтернативно пиперидиновые производные Формулы II, которые содержат две геминальные метильные группы, могут быть получены из Boc-защищенного амино-пиперидинона XXXII в результате взаимодействия с бромидом метилмагния и хлоридом циркония (IV) и последующего удаления Boc-группы в кислых условиях. Соединение XXXII может быть получено в результате взаимодействия амино-пиперидона XIII с ди-трет-бутил дикарбонатом.
Схема 11
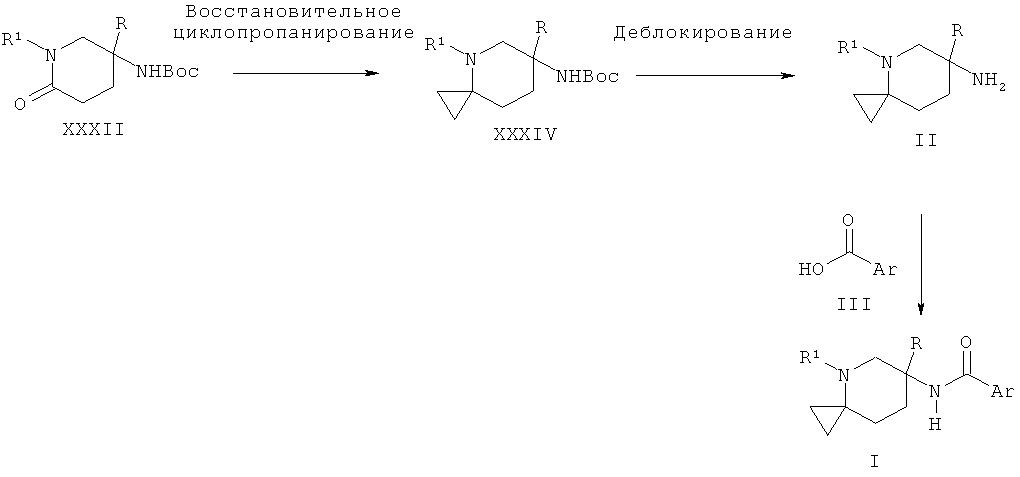
Альтернативно пиперидиновые производные Формулы II, которые содержат циклопропил, могут быть получены из Boc-защищенного амино-пиперидинона XXXII в результате взаимодействия с бромидом этилмагния и изопропоксидом титана и последующего удаления Boc-группы в кислых условиях.
Схема 12
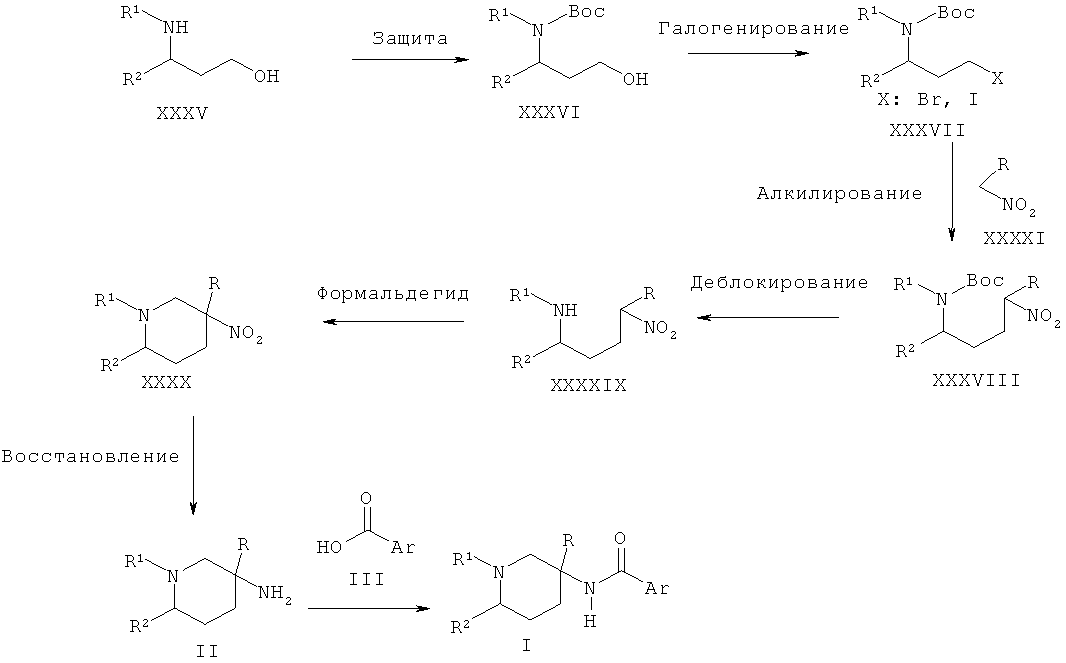
Альтернативно пиперидиновые производные Формулы II, где R2 представляет собой алкильную группу, могут быть получены из нитро-производного XXXIX с использованием внутримолекулярной реакции Манниха, выполняемой в присутствии альдегида, такого как формальдегид, и последующей обработки полученного нитро-пиперидина ХХХХ восстанавливающим агентом, таким как никель Ренея. Соединение XXXIX может быть получено путем деблокирования Boc-защищенного нитро-производного XXXVIII, которое может быть получено в результате взаимодействия нитро-производного XXXXI с галогенированным соединением XXXVII в присутствии основания, такого как н-бутиллитий. Соединение XXXVII может быть получено в результате введения защитной группы в аминоспирт XXXV и последующего галогенирования.
Рацемические смеси хиральных соединений I могут быть разделены с использованием хиральной ЖХВД.
Соли присоединения кислот основных соединений Формулы I могут быть превращены в соответствующее свободные основания путем обработки по меньшей мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобное.
Экспериментальная часть
Аббревиатуры
HATU O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат
ДМФА Диметилформамид
ДМСО Диметилсульфоксид
ТГФ Тетрагидрофуран
TMEDA Тетраметилэтилендиамин
Получение промежуточных соединений
Пример А.1
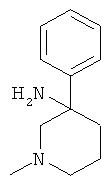
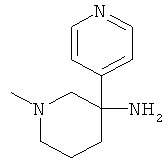
Получение рац-1-Метил-3-фенил-пиперидин-3-иламина
а) Стадия 1: рац-3-Гидрокси-3-фенил-пиперидин-1-карбоновой кислоты бензиловый эфир
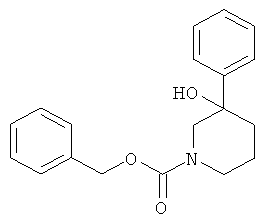
К раствору 9 мл (9 ммоль) бромида фенилмагния (1 М раствор в ТГФ) в ТГФ (13 мл) добавляли в течение 15 мин раствор 1,5 г (6,00 ммоль) 3-оксо-пиперидин-1-карбоновой кислоты бензилового эфира (имеется в продаже) в ТГФ (5 мл) при комнатной температуре. Данную смесь перемешивали в течение 30 мин и затем гасили 20% раствором хлорида аммония (4 мл), используя охлаждение в ледяной бане. Органический слой декантировали и остаток один раз экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученное неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0-50%) с выходом указанного в заголовке соединения (0,55 г, 30%) в виде белого твердого вещества. Масс-спектр (m/z): 312,0 (M+H+).
b) Стадия 2: рац-3-Азидо-3-Фенил-пиперидин-1-карбоновой кислоты бензиловый эфир
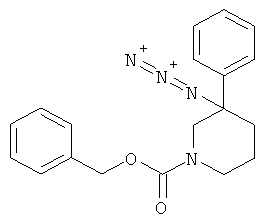
1,0 г (3,212 ммоль) 3-гидрокси-3-фенил-пиперидин-1-карбоновой кислоты бензилового эфира растворяли в холодной смеси (10°С) трифторуксусной кислоты (12,3 мл) и воды (2,0 мл). Данный раствор охлаждали до 0°С и добавляли порциями азид натрия (1,46 г, 22,48 ммоль). Температура поднималась до 10°С. Ледяную баню удаляли и смесь перемешивали в течение 3 ч при комнатной температуре. Затем смесь охлаждали в ледяной бане и подщелачивали, добавляя по каплям 25% раствор гидроксида аммония (13,0 мл), поддерживая температуру ниже 20°С. Смесь разбавляли водой (45 мл) и 3 раза экстрагировали дихлорметаном. Объединенные экстракты один раз промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки.
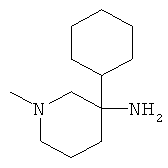
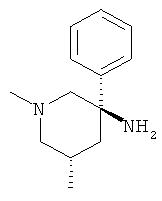
с) Стадия 3: рац-1-Метил-3-фенил-пиперидин-3-иламин
К суспензии 126 мг (3,15 ммоль) LiAIH4 в ТГФ (2,7 мл) при температуре ниже 10°С добавляли по каплям раствор 530 мг (1,576 ммоль) рац-3-азидо-3-фенил-пиперидин-1-карбоновой кислоты бензилового эфира в ТГФ (5,3 мл). Ледяную баню удаляли. Температура поднималась до 35°С. Затем смесь нагревали в течение 1 ч при 65°С в масляной бане. Затем смесь охлаждали до 0°С. Добавляли по каплям воду (125 мкл), 5 н. NaOH (125 мкл) и снова воду (0,375 мл), поддерживая температуру ниже 10°С. Смесь разбавляли этилацетатом. Добавляли сульфат натрия. Данную смесь фильтровали и фильтрат концентрировали под вакуумом. Полученное неочищенное масло очищали на силикагеле (элюент:гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (0,14 г, 47%) в виде желтого масла. Масс-спектр (m/z): 191,5 (M+H+).
Пример А.2
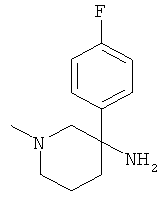
Получение рац-3-(4-Фтор-фенил)-1-метил-пиперидин-3-иламина
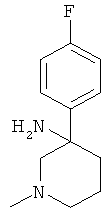
Указанное в заголовке соединение получали из 3-оксо-пиперидин-1-5 карбоновой кислоты бензилового эфира (имеется в продаже) и бромида 4-фтор-фенилмагния с использованием методики, аналогичной методике синтеза, описанной в Примере А.1 (стадии 1-3). Масс-спектр (m/z): 209,2 (М+Н+).
Пример А.3
Получение рац-3-(4-Хлор-фенил)-1-метил-пиперидин-3-иламина
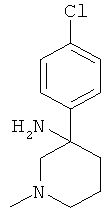
Указанное в заголовке соединение получали из 3-оксо-пиперидин-1-карбоновой кислоты бензилового эфира (имеется в продаже) и бромида 4-хлор-фенилмагния с использованием методики, аналогичной методике синтеза, описанной в Примере А.1 (стадии 1-3). Масс-спектр (m/z): 225,3 (М+Н+).
Пример А.4
Получение рац-1-Метил-3-пара-толил-пиперидин-3-иламина
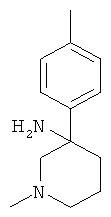
Указанное в заголовке соединение получали из 3-оксо-пиперидин-1-карбоновой кислоты бензилового эфира (имеется в продаже) и бромида 4-метил-фенилмагния с использованием методики, аналогичной методике синтеза, описанной в Примере А.1 (стадии 1-3). Масс-спектр (m/z): 205,3 (M+H+).
Пример А.5
Получение рац-1,2-Диметил-3-фенил-пиперидин-3-иламина
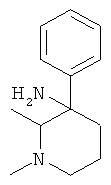
а) Стадия 1: 3-Гидрокси-2-метил-пиперидин-1-карбоновой кислоты бензиловый эфир
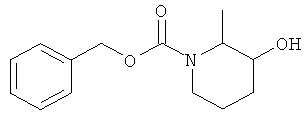
К раствору 1,4 г (9,232 ммоль) 2-метил-пиперидин-3-ола (CAS: 4766-56-7) в 9,8 мл дихлорметана в атмосфере аргона при комнатной температуре добавляли 2,57 мл (18,46 ммоль) триэтиламина. Данную смесь перемешивали в течение 15 мин и затем охлаждали до 0°С. Добавляли по каплям 1,37 мл (9,232 ммоль) хлормуравьиной кислоты бензиловый эфир. Данную реакционную смесь оставляли нагреваться до комнатной температуры и перемешивание продолжали в течение ночи. Затем смесь три раза экстрагировали водой и объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали путем колоночной флэш-хроматографии на силикагеле (элюент: гептан/этилацетат 0-30) с выходом указанного в заголовке соединения (800 мг, 34,8%) в виде бесцветного масла. Масс-спектр (m/z): 272,4 (M+Na+).
b) Стадия 2: рац-2-Метил-3-оксо-пиперидин-1-карбоновой кислоты бензиловый эфир
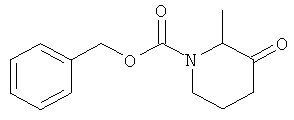
К перемешиваемому раствору 309,5 мкл (3,530 ммоль) оксалилхлорида в 3 мл дихлорметана при температуре от -50°С до -60°С добавляли раствор 873 мкл ДМСО в 2 мл дихлорметана. Данную реакционную смесь перемешивали в течение 10 мин, затем в течение 10 мин добавляли раствор 800 мг (3,209 ммоль) 3-гидрокси-2-метил-пиперидин-1-карбоновой кислоты бензилового эфира в 3 мл дихлорметана. Перемешивание продолжали дополнительно в течение 30 мин. Затем к смеси добавляли 2,24 мл (16,05 ммоль) триэтиламина. Данную реакционную смесь перемешивали в течение 15 мин, затем оставляли нагреваться до комнатной температуры, суспендировали в воде, слои разделяли и водный слой экстрагировали дихлорметаном. Объединенные органические слои дважды промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали путем колоночной флэш-хроматографии на силикагеле (элюент: гептан/этилацетат 0-40) с выходом указанного в заголовке соединения (600 мг, 76%) в виде светло-желтого масла. Масс-спектр (m/z): 270,2 (M+Na+).
с) Стадия 3: рац-1,2-Диметил-3-фенил-пиперидин-3-иламин
Указанное в заголовке соединение получали из рац-2-метил-3-оксо-пиперидин-1-карбоновой кислоты бензилового эфира и бромида фенилмагния с использованием методики, аналогичной методике синтеза, описанной в Примере А.1 (стадии 1-3). Масс-спектр (m/z): 205,2 (M+H+).
Пример А.6
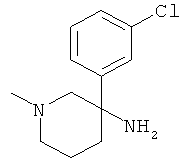
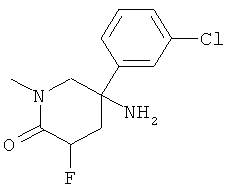
Получение рац-3-(3-Хлор-фенил)-1-метил-пиперидин-3-иламина
а) Стадия 1: рац-4-(3-Хлор-фенил)-4-нитро-масляной кислоты метиловый эфир
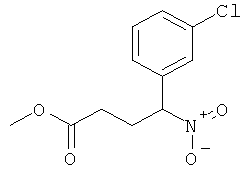
К раствору 1 г (5,828 ммоль) 1-хлор-3-нитрометил-бензола (CAS: 38362-91-3) при 0°С в 2 мл диоксана добавляли 0,512 г (5,828 ммоль) метилакрилата и затем 3,3 г Amberlyst A-21. Данную реакционную смесь перемешивали в течение ночи при комнатной температуре, фильтровали и фильтрат сушили над сульфатом натрия и концентрировали под вакуумом. Полученный неочищенный продукт очищали путем колоночной флэш-хроматографии на силикагеле (элюент: гептан/этилацетат 0-10%) с получением указанного в заголовке соединения (980 мг, 65%) в виде бесцветного масла.
b) Стадия 2: рац-5-(3-Хлор-фенил)-1-метил-5-нитро-пиперидин-2-он
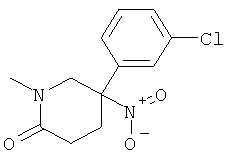
К перемешиваемому при комнатной температуре раствору 164 мкл (1,940 ммоль) метиламина (41% раствор в воде) в 1 мл диоксана добавляли по каплям 141 мкл (1,940 ммоль) формальдегида (37% раствор в воде) (экзотермическая реакция). Данную смесь перемешивали в течение 5 мин и затем добавляли за один прием раствор 0,5 г (1,940 ммоль) рац-4-(3-хлор-фенил)-4-нитро-масляной кислоты метилового эфира в 1,5 мл диоксана. Данную смесь перемешивали в течение 6 ч при 65°С. Затем смесь охлаждали до комнатной температуры, добавляли этилацетат и насыщенный раствор NaCl. Водную фазу экстрагировали 2 раза этилацетатом. Объединенные органические фазы промывали насыщенным раствором NaCl, сушили над сульфатом натрия и концентрировали под вакуумом. Полученный неочищенный продукт очищали путем колоночной флэш-хроматографии на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (395 мг, 76%) в виде бесцветного масла. Масс-спектр (m/z): 269,2 (MH+).
с) Стадия 3: рац-5-Амино-5-(3-хлор-фенил)-1-метил-пиперидин-2-он
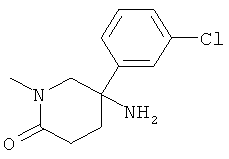
К раствору 115 мг (0,428 ммоль) 5-(3-хлор-фенил)-1-метил-5-нитро-пиперидин-2-она в 0,5 мл диоксана добавляли 2 мл 3 н. HCI и 280 мг (4,28 ммоль) цинковой пыли. Данную смесь перемешивали в течение 30 мин при комнатной температуре. Затем смесь фильтровали и полученный фильтрат подщелачивали 5 н. раствором NaOH. Добавляли этилацетат. Смесь фильтровали через подушку дикалита. Органический слой отделяли и водный слой дважды экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения (88 мг, 86%) в виде светло-желтого масла. Масс-спектр (m/z): 239,0 (МН+).
d) Стадия 4: рац-3-(3-Хлор-фенил)-1-метил-пиперидин-3-иламин
К суспензии 20 мг (0,494 ммоль) LiAIH4 в 0,5 мл ТГФ добавляли по каплям раствор 59 мг (0,247 ммоль) рац-5-амино-5-(3-хлор-фенил)-1-метил-пиперидин-2-она в 0,6 мл ТГФ при комнатной температуре. Данную смесь подвергали дефлегмации в течение 30 мин. Затем смесь охлаждали в ледяной бане и осторожно гасили путем добавления 20 мкл воды, 20 мкл 5 н. NaOH и затем 60 мкл воды. Добавляли этилацетат. Смесь фильтровали и фильтрат концентрировали под вакуумом с получением указанного в заголовке соединения (48 мг, 86%) в виде бесцветного масла. Масс-спектр (m/z): 225,2 (MH+).
Пример А.7
Получение рац-3-(4-Метокси-фенил)-1-метил-пиперидин-3-иламина
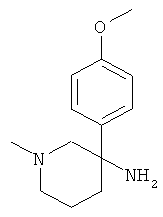
а) Стадия 1: рац-4-(4-Метокси-фенил)-4-нитро-масляной кислоты метиловый эфир
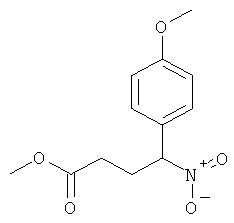
В соответствии с методикой, описанной Buchwald et al. (J. Org. Chem. 2002, 106), в реакционную колбу добавляли последовательно 187 мг (0,198 ммоль) Pd2dba3, 247 мг (0,791 ммоль) 2-(ди-трет-бутилфосфино)-2'-метилбифенила и 1,555 г (4,747 ммоль) карбоната цезия. Данную смесь помещали в атмосферу аргона и добавляли последовательно 740 мг (3,956 ммоль) 4-броманизола, 15 мл ДМЭ (диметилэтана) и затем 600 мг (3,956 ммоль) метил 4-нитробутирата. Данную смесь интенсивно перемешивали в течение 1 мин при комнатной температуре, затем колбу помещали в предварительно нагретую до 50°С масляную баню и перемешивали при этой же температуре в течение ночи. Реакционную смесь охлаждали до комнатной температуры и добавляли насыщенный раствор NH4Cl и этилацетат. Водную фазу экстрагировали 3 раза этилацетатом и объединенные органические фазы промывали солевым раствором и концентрировали под вакуумом. Полученный неочищенный продукт очищали путем колоночной флэш-хроматографии на силикагеле (элюент: гептан/этилацетат 0-20%) с выходом указанного в заголовке соединения (897 мг, 90%) в виде оранжевого масла.
b) Стадия 2: рац-3-(4-Метокси-фенил)-1-метил-пиперидин-3-иламин
Указанное в заголовке соединение получали из рац-4-(4-метокси-фенил)-4-нитро-масляной кислоты метилового эфира с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии: 2-4). Масс-спектр (m/z): 221,2 (МН+).
Пример А.8
Получение рац-5-Фтор-1'-метил-1',4',5',6'-тетрагидро-2H-[2,3']бипиридинил-3'-иламина
Указанное в заголовке соединение получали из метил 4-нитробутирата и 2-бром-5-фторпиридина с использованием методики, аналогичной методике синтеза, описанной в Примере А. 7 (стадии: 1-2). Масс-спектр (m/z): 210,2 (MH+).
Пример А.9
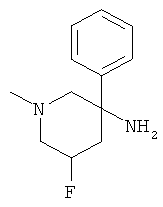
Получение рац-5-Фтор-1-метил-3-фенил-пиперидин-3-иламина
а) Стадия 1: рац-1-Метил-5-нитро-5-фенил-пиперидин-2-он
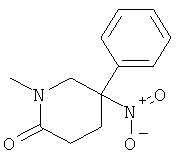
Указанное в заголовке соединение получали из нитрометил-бензола (CAS: 622-42-4) с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-2). Масс-спектр (m/z): 235,2 (MH+).
b) Стадия 2: рац-3-Фтор-1-метил-5-нитро-5-фенил-пиперидин-2-он
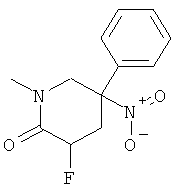
К раствору 78,4 мкл (0,555 ммоль) диизопропиламина в 2 мл ТГФ добавляли 347 мкл (0,555 ммоль) 1,6 М раствора н-BuLi в гексане при температуре -5°С. Данный раствор перемешивали в течение 15 мин при 0°С и затем охлаждали до -70°С. Добавляли по каплям раствор 100 мг (0,427 ммоль) рац-1-метил-5-нитро-5-фенил-пиперидин-2-она в 1 мл ТГФ. Полученный коричневый раствор перемешивали при -70°С в течение 45 мин. Добавляли по каплям раствор 180 мг (0,555 ммоль) N-фторбензолсульфонимида в 1 мл ТГФ. Данную смесь перемешивали в течение 1,5 ч при -70°С, гасили путем добавления 2 мл 20% раствора NH4Cl и оставляли нагреваться до комнатной температуры. Добавляли воду и этилацетат. Водный слой дважды экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученное неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (58 мг, 54%) в виде светло-желтого твердого вещества. Масс-спектр (m/z): 253,2 (М+Н).
с) Стадия 3: рац-5-Амино-3-фтор-1-метил-5-фенил-пиперидин-2-он
К раствору 55 мг (0,218 ммоль) рац-3-фтор-1-метил-5-нитро-5-фенил-пиперидин-2-она в 1,5 мл ТГФ при 0°С добавляли 100 мкл никеля Ренея (50% в воде). Данную смесь перемешивали в атмосфере водорода в течение 2 ч при 0°С. Затем смесь фильтровали и катализатор промывали, используя ТГФ. Фильтрат концентрировали под вакуумом с получением указанного в заголовке соединения (48 мг, 99%) в виде светло-желтого твердого вещества. Масс-спектр (m/z): 223,3 (М+Н).
d) Стадия 4: рац-5-Фтор-1-метил-3-фенил-пиперидин-3-иламин
Указанное в заголовке соединение получали из рац-5-амино-3-фтор-1-метил-5-фенил-пиперидин-2-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадия 4). Масс-спектр (m/z): 192,3 (M-NH2).
Пример А.10
Получение рац-5-Метоксиметокси-1-метил-3-фенил-пиперидин-3-иламина
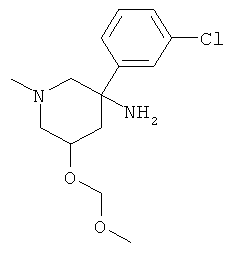
а) Стадия 1: рац-3-Гидрокси-1-метил-5-нитро-5-Фенил-пиперидин-2-он
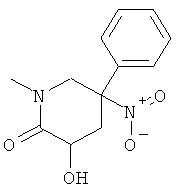
К раствору 118 мкл (0,833 ммоль) диизопропиламина в 3 мл ТГФ добавляли 520 мкл (0,833 ммоль) 1,6 М раствора н-BuLi в гексане при температуре -5°С. Данный раствор перемешивали в течение 15 мин при 0°С и затем охлаждали до -70°С. Добавляли по каплям раствор 150 мг (0,641 ммоль) рац-1-метил-5-нитро-5-фенил-пиперидин-2-она (Пример А.9, стадия 1) в 1,5 мл ТГФ. Полученный коричневый раствор перемешивали в течение 45 мин при -70°С. При -70°С добавляли порциями 517 мг (1,282 ммоль) (оксодиперокси(пиридин)(1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидон)молибдена (IV)). Данную смесь перемешивали в течение 1 ч при -70°С и затем оставляли нагреваться до 0°С. Смесь выдерживали в течение 1 ч при 0°С и затем гасили путем добавления 2,5 мл насыщенного раствора сульфита натрия. Добавляли воду и этилацетат. Водный слой один раз экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученное неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (82 мг, 51%) в виде светло-коричневого масла. Масс-спектр (m/z): 251,1 (MH+).
b) Стадия 2: рац-3-Метоксиметокси-1-метил-5-нитро-5-фенил-пиперидин-2-он
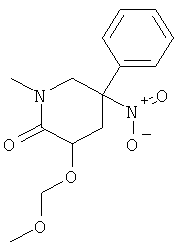
К раствору 50 мг (0,2 ммоль) рац-3-гидрокси-1-метил-5-нитро-5-фенил-пиперидин-2-она и 52 мкл (0,3 ммоль) N-этил диизопропиламина в 1,2-диметоксиэтане добавляли 23 мкл (0,3 ммоль) хлорметилметилового эфира при комнатной температуре. Через 1 ч раствор нагревали в масляной бане при 60°С в течение 20 ч. Затем смесь охлаждали до комнатной температуры. Добавляли 52 мкл (0,3 ммоль) N-этил диизопропиламина и 23 мкл (0,3 ммоль) хлорметилметилового эфира. Данную смесь нагревали в масляной бане при 60°С в течение 4 ч. Растворитель удаляли под вакуумом. Остаток переносили в этилацетат. Данную смесь один раз промывали водой. Водный слой один раз экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученное неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (30 мг, 51%) в виде желтого масла. Масс-спектр (m/z): 295,2 (MH+).
с) Стадия 3: рац-5-Амино-3-метоксиметокси-1-метил-5-фенил-пиперидин-2-он
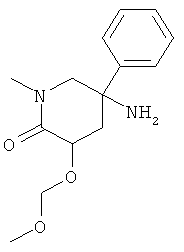
Указанное в заголовке соединение получали из рац-3-метоксиметокси-1-метил-5-нитро-5-фенил-пиперидин-2-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.9 (стадия 3). Масс-спектр (m/z): 265,1 (MH+).
d) Стадия 4: рац-5-Метоксиметокси-1-метил-3-фенил-пиперидин-3-иламин
Указанное в заголовке соединение получали из рац-5-амино-3-метоксиметокси-1-метил-5-фенил-пиперидин-2-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадия 4). Масс-спектр (m/z): 251,2 (MH+).
Пример А.11
Получение рац-3-Циклогексил-1-метил-пиперидин-3-иламина
а) Стадия 1: рац-4-Циклогексил-4-нитро-масляной кислоты метиловый эфир
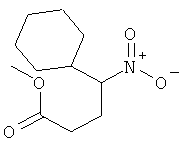
К раствору 3,18 г (22,2 ммоль) нитрометил-циклогексана (CAS: 2625-30-1) в 1 мл трет-бутанола и 0,12 мл 35% гидроксида бензилтриметиламмония в метаноле, нагретому до 40°С, добавляли 1,99 мл (22,2 ммоль) метилакрилата. Полученную желтую смесь перемешивали в течение 2 ч при 40°С, затем разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты промывали солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали. Указанное в заголовке соединение получали в виде желтоватого масла:
Масс-спектр (Е1): 198 (M•+-MeO), 183 (M•+-NO2), 151 (M-(MeO+NO2+H))•+ (100%).
b) Стадия 2: рац-5-Циклогексил-1-метил-5-нитро-пиперидин-2-он
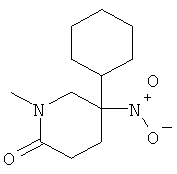
К 4,25 г (18,5 ммоль) рац-4-циклогексил-4-нитро-масляной кислоты метилового эфира добавляли 4,56 мл (32,5 ммоль) 1,3,5-триметилгексагидро-1,3,5-триазина и данную смесь нагревали до 100°С в течение 4 ч. Затем реакционную смесь охлаждали до температуры окружающей среды и адсорбировали на силикагеле, который наносили на колонку силикагеля. В результате очистки путем флэш-хроматографии с использованием градиента 10-75% этилацетата в гептане получали 2,55 г указанного в заголовке соединения в виде бесцветного масла. Масс-спектр (m/z): 240 (MH+).
с) Стадия 3: рац-5-Амино-5-циклогексил-1-метил-пиперидин-2-он
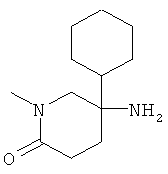
К раствору 500 мг (2,08 ммоль) рац-5-циклогексил-1-метил-5-нитро-пиперидин-2-она в 5 мл метанола добавляли 500 мг влажного никеля Ренея и данную смесь перемешивали в атмосфере водорода при нормальном давлении и температуре окружающей среды в течение 22 ч. Затем реакционную смесь фильтровали через подушку дикалита, осадок промывали метанолом и фильтрат упаривали с получением 452 мг указанного в заголовке соединения в виде бесцветного масла, которое использовали без очистки на следующей стадии.
а) Стадия 4: рац-3-Циклогексил-1-метил-пиперидин-3-ил-амин
К 2,06 мл 2,5 М раствора алюмогидрида лития в тетрагидрофуране, охлажденного до 0°С, добавляли по каплям раствор 452 мг (2,15 ммоль) рац-5-амино-5-циклогексил-1-метил-пиперидин-2-она в 6 мл тетрагидрофурана. Затем данный раствор нагревали до 65°С в течение 1 ч. Полученную мутную реакционную смесь охлаждали с помощью ледяной бани до температуры ниже 12°С и добавляли по каплям 0,13 мл воды, 0,32 мл 2 н. NaOH и затем 0,19 мл воды. Данную суспензию разбавляли трет-бутилметиловым эфиром, сушили над сульфатом натрия, фильтровали и упаривали с получением 368 мг указанного в 5 заголовке соединения в виде бесцветного масла, которое использовали без очистки на следующей стадии.
Пример А.12
Получение рац-1-Метил-3-(тетрагидро-пиран-4-ил)-пиперидин-3-иламина
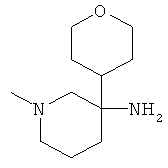
а) Стадия 1: 4-Нитрометил-тетрагидро-пиран
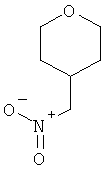
К охлажденной до 0°С перемешиваемой суспензии 1,81 г (11,8 ммоль) нитрата серебра в 6 мл ацетонитрила, помещенной в реакционную колбу, завернутую в алюминиевую фольгу, по каплям в течение 5 мин добавляли 1,60 г (8,93 ммоль) 4-бромметил-тетрагидро-пирана. Перемешивание продолжали в течение 93 ч при температуре окружающей среды. Затем реакционную смесь фильтровали и тщательно промывали диэтиловым эфиром. Полученный фильтрат смешивали с силикагелем и упаривали. Остаток наносили на колонку силикагеля и очищали путем флэш-хроматографии на силикагеле (элюент: гептан/этилацетат 9:1) с получением указанного в заголовке соединения (441 мг) в виде бесцветного масла.
b) Стадия 2: рац-1-Метил-3-(тетрагидро-пиран-4-ил)-пиперидин-3-иламин
Указанное в заголовке соединение получали из 4-нитрометил-тетрагидро-пирана с использованием методики, аналогичной методике синтеза, описанной в Примере А.11 (стадии 1-4).
Пример А.13
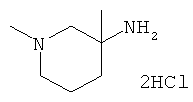
Получение рац-1,3-Диметил-пиперидин-3-иламина дигидрохлорида
а) Стадия 1: рац-3-Изоцианато-3-метил-пиперидин-1-карбоновой кислоты трет-бутиловый эфир
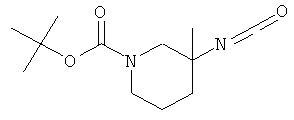
К суспензии 727 мг (3,0 ммоль) рац-3-метил-пиперидин-1,3-дикарбоновой кислоты 1-трет-бутилового эфира (CAS: 534602-47-6) в 8 мл толуола добавляли при температуре окружающей среды 0,42 мл (3,0 ммоль) триэтиламина. К полученному раствору добавляли при перемешивании 0,72 мл (3,3 ммоль) дифенилфосфорилазида и данную смесь нагревали до 90°С (выделение газа) в течение 90 мин. Затем реакционную смесь выливали на смесь лед/вода и 3 раза экстрагировали трет-бутилметиловым эфиром. Объединенные экстракты промывали солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали. Указанное в заголовке соединение получали в виде желтоватого масла, которое использовали на следующей стадии без очистки. Масс-спектр (m/z): 240 (М).
b) Стадия 2: рац-3-Амино-3-метил-пиперидин-1-карбоновой кислоты трет-бутиловый эфир
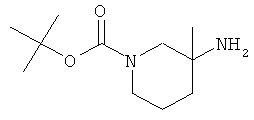
К раствору 812 мг (3,38 ммоль) рац-3-изоцианато-3-метил-пиперидин-1-карбоновой кислоты трет-бутилового эфира в 17 мл ТГФ добавляли 16,9 мл 2 н. NaOH и полученную эмульсию интенсивно перемешивали в течение 20 ч при температуре окружающей среды. Затем эмульсию разбавляли трет-бутилметиловым эфиром и три раза экстрагировали. Объединенные экстракты промывали солевым раствором до получения нейтрального pH, сушили над сульфатом натрия, фильтровали и упаривали. Полученный неочищенный продукт очищали путем колоночной хроматографии на силикагеле с использованием градиента 10-100% этилацетата в гептане, затем смеси этилацетат /МеОН с выходом 232 мг указанного в заголовке соединения в виде бесцветного масла, которое кристаллизовалось при температуре окружающей среды. Масс-спектр (m/z): 215,2(M+H).
с) Стадия 3: рац-1,3-Диметил-пиперидин-3-иламинадигидрохлорид
К 3,15 мл 1 М алюмогидрида лития в ТГФ добавляли по каплям при 5-10°С раствор 225 мг (1,05 ммоль) рац-3-амино-3-метил-пиперидин-1-карбоновой кислоты трет-бутилового эфира в 4 мл сухого ТГФ. Данную реакционную смесь нагревали до 65°С в течение 1 ч. Полученную мутную реакционную смесь охлаждали с помощью ледяной бани до температуры ниже 12°С, добавляли по каплям 0,13 мл воды, 0,32 мл 2 н. NaOH и затем еще 0,19 мл воды. Данную суспензию разбавляли трет-бутилметиловым эфиром, сушили над сульфатом натрия, фильтровали и подкисляли путем добавления 2 н. HCl в диэтиловом эфире. В результате выпаривания получали 210 мг указанного в заголовке соединения в виде бесцветного полутвердого вещества. Масс-спектр (m/z): 129,3 (М+Н).
Пример А.14
Получение рац-3-(2,4-Дифторфенил)-1-метил-пиперидин-3-иламина
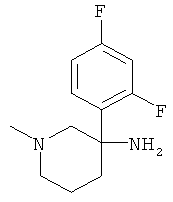
Указанное в заголовке соединение получали из 2,4-дифтор-1-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.15
Получение рац-3-(2-Фтор-фенил)-1-метил-пиперидин-3-иламина
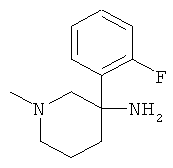
Указанное в заголовке соединение получали из 1-фтор-2-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.16
Получение рац-3-(2,5-Дифтор-фенил)-1-метил-пиперидин-3-иламина
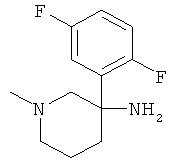
Указанное в заголовке соединение получали из 1,4-дифтор-2-нитрометил-10 бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.17 Получение рац-1-Метил-1,4,5,6-тетрагидро-2Н-[3,4']бипиридинил-3-иламина
а) Стадия 1: рац-1-Метил-3-нитро-2,3,4,5-тетрагидро-1H-[3,4']бипиридинил-6-он
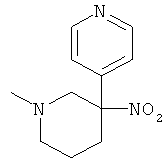
Указанное в заголовке соединение получали из 4-нитрометил-пиридина (CAS: 22918-06-5) с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-2).
b) Стадия 2: рац-1-Метил-3-нитро-2,3,4,5-тетрагидро-1H-[3,4']бипиридинил-6-тион
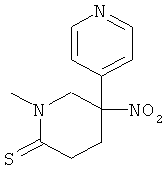
К раствору 125 мг (0,531 ммоль) рац-1-метил-3-нитро-2,3,4,5-тетрагидро-1H-[3,4']бипиридинил-6-она в 2,5 мл толуола добавляли 240 мг (0,584 ммоль) реагента Лавессона. Полученную суспензию нагревали при 80°С в масляной бане в течение 30 мин. Затем смесь концентрировали под вакуумом. Полученное неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (105 мг, 79%) в виде светло-желтого твердого вещества. Масс-спектр (m/z): 252,1 (М+Н).
с) Стадия 3: рац-1-Метил-3-нитро-1,2,3,4,5,6-гексагидро-[3,4']бипиридинил

К раствору 105 мг (0,418 ммоль) рац-1-метил-3-нитро-2,3,4,5-тетрагидро-1Н-[3,4']бипиридинил-6-тиона в 2,1 мл метанола добавляли 144 мг (3,8 ммоль) NaBH4. Данную смесь перемешивали в течение 20 мин при комнатной температуре. Добавляли воду (1,0 мл). Смесь перемешивали в течение 1 ч. Метанол удаляли под вакуумом. Остаток разбавляли водой и 3 раза экстрагировали дихлорметаном. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученное неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (53 мг, 57%) в виде желтого масла. Масс-спектр (m/z): 222,3 (М+Н).
d) Стадия 4: рац-1-Метил-1,4,5,6-тетрагидро-2H-[3,4']бипиридинил-3-иламин
К охлажденному до 0°С раствору 52 мг (0,235 ммоль) рац-1-метил-3-нитро-1,2,3,4,5,6-гексагидро-[3,4']бипиридинила в 2,0 мл ТГФ добавляли 150 мкл никеля Ренея (50% в воде). Данную смесь перемешивали при 0°С в атмосфере водорода в течение 7 ч. Катализатор отфильтровывали и фильтрат концентрировали под вакуумом с получением указанного в заголовке соединения (45 мг, 88%) в виде светло-желтого масла. Масс-спектр (m/z): 192,4 (М+Н).
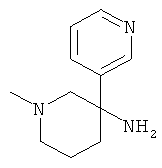
Пример А.18 Получение рац-1-Метил-1,4,5,6-тетрагидро-2H-[3,3']бипиридинил-3-иламина
а) Стадия 1: рац-1-Метил-3-нитро-2,3,4,5-тетрагидро-1Н-[3,3']бипиридинил-6-он
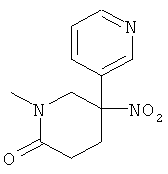
Указанное в заголовке соединение получали из 3-нитрометил-пиридина (CAS: 69966-29-6) с использованием методики, аналогичной методике синтеза, описанной в Примере А.7 (стадии 1-2).
b) Стадия 2: рац-1-Метил-1,4,5,6-тетрагидро-2Н-[3,3']бипиридинил-3-иламин
Указанное в заголовке соединение получали из рац-1-метил-3-нитро-2,3,4,5-тетрагидро-1Н-[3,3']бипиридинил-6-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.17 (стадии 2-4).
Пример А.19 Получение (3RS,5SR)-5-Метокси-1-метил-3-фенил-пиперидин-3-иламина
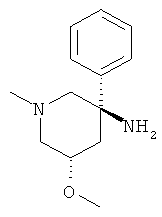
а) Стадия 1: (3SR,5RS)-3-Метокси-1-метил-5-нитро-5-фенил-пиперидин-2-он
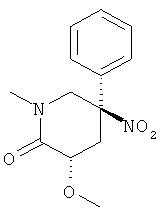
Раствор 1,15 г (4,595 ммоль) рац-3-гидрокси-1-метил-5-нитро-5-фенил-пиперидин-2-она (Пример А.10, стадия 1) в 11,5 мл ДМФА охлаждали до 0°С. Добавляли 220 мг (5,514 ммоль) NaH (60% в масле). Температура поднималась до 3°С. Смесь перемешивали в течение 15 мин при 0°С. Добавляли 430 мкл (6,893 ммоль) йодметана и данную смесь перемешивали в течение 30 мин при 0°С. Добавляли 6,5 мл воды и растворитель удаляли под вакуумом. Остаток переносили в этилацетат. Полученный раствор дважды промывали водой. Водные слои, полученные после промывания, повторно экстрагировали один раз этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученное неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (500 мг, 42%) в виде светло-коричневого твердого вещества. Масс-спектр (m/z): 265,1 (М+Н).
b) Стадия 2: (3SR,5RS)-5-Амино-3-метокси-1-метил-5-фенил-пиперидин-2-он
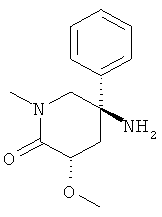
Указанное в заголовке соединение получали из (3SR,5RS)-3-метокси-1-метил-5-нитро-5-фенил-пиперидин-2-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.17 (стадия 4).
с) Стадия 3: (3RS,5SR)-5-Метокси-1-метил-3-фенил-пиперидин-3-иламин
Указанное в заголовке соединение получали из (3SR,5RS)-5-амино-3-метокси-1-метил-5-фенил-пиперидин-2-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадия 4).
Пример А.20
Получение (3RS,5SR)-1,5-Диметил-3-фенил-пиперидин-3-иламина
а) Стадия 1: (3SR,5RS)-1,3-Диметил-5-нитро-5-фенил-пиперидин-2-он
К раствору 1,6 мл (11,1 ммоль) диизопропиламина в 40 мл ТГФ добавляли 7 мл (11,1 ммоль) 1,6 М раствора н-BuLi в гексане при -5°С. Данный раствор перемешивали в течение 15 мин при 0°С и затем охлаждали до -70°С. Добавляли по каплям раствор 2 г (8,538 ммоль) рац-1-метил-5-нитро-5-фенил-пиперидин-2-она (Пример А9, стадия 1) в 20 мл ТГФ. Полученный коричневый раствор перемешивали в течение 45 мин при -70°С. Добавляли по каплям при -70°С 639 мкл (10,25 ммоль) метилйодида в ТГФ (8 мл). Данную смесь перемешивали в течение 1 ч при -70°С и затем оставляли нагреваться до 0°С. Смесь выдерживали в течение 30 мин при 0°С и затем гасили путем добавления 30 мл 20% раствора NH4Cl. Добавляли воду и этилацетат. Водный слой один раз экстрагировали этилацетатом. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (1,72 г, 81%) в виде желтого масла. Масс-спектр (m/z): 249,2 (М+Н).
b) Стадия 2: (3SR,5RS)-5-AMИHO-1,3-диметил-5-фенил-пиперидин-2-он
Указанное в заголовке соединение получали из (3SR,5RS)-1,3-диметил-5-нитро-5-фенил-пиперидин-2-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.17, (стадия 4,). Масс-спектр (m/z): 202,2 (M-NH2).
с) Стадия 3: (3RS,5SR)-1,5-Диметил-3-фенил-пиперидин-3-иламин
Указанное в заголовке соединение получали из (3SR,5RS)-5-амино-1,3-диметил-5-фенил-пиперидин-2-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадия 4). Масс-спектр (m/z): 205,3 (М+Н).
Пример А.21
Получение рац-1,5,5-Триметил-3-фенил-пиперидин-3-иламина
15
а) Стадия 1: 1,3,3-Триметил-5-нитро-5-Фенил-пиперидин-2-он
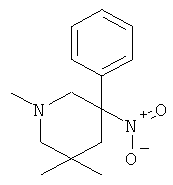
К раствору 170,7 мкл (1,208 ммоль) диизопропиламина в 4 мл ТГФ добавляли 755 мкл (1,208 ммоль) 1,6 М раствора н-BuLi в гексане при -5°С. Данный раствор перемешивали в течение 15 мин при 0°С и затем охлаждали до -70°С. Затем добавляли 300 мкл раствора НМРА (триамида гексаметилфосфорной кислоты). Добавляли по каплям 200 мг (0,805 ммоль) (3SR,5RS)-1,3-диметил-5-нитро-5-фенил-пиперидин-2-она (Пример А.20, стадия а) в 2 мл ТГФ. Полученный коричневый раствор перемешивали в течение 45 мин при -70°С. Добавляли по каплям 151 мкл (2,415 ммоль) метилйодида в ТГФ (1 мл) при -70°С. Смесь перемешивали в течение 1 ч при -70°С и затем оставляли нагреваться до 0°С. Смесь выдерживали в течение 1 ч при 0°С, затем гасили путем добавления 7 мл 20% раствора NH4Cl. Добавляли воду и этилацетат. Водный слой один раз экстрагировали этилацетатом. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (131 мг, 62%) в виде желтого масла. Масс-спектр (m/z): 263,2 (М+Н).
b) Стадия 2: рац-1,5,5-Триметил-3-фенил-пиперидин-3-иламин
Указанное в заголовке соединение получали из 1,3,3-триметил-5-нитро-5-фенил-пиперидин-2-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.20, (стадии 2-3,). Масс-спектр (m/z): 219,4 (М+Н).
Пример А.22
Получение рац-1,6,6-Триметил-3-фенил-пиперидин-3-иламина
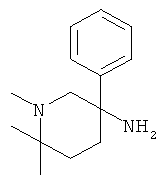
а) Стадия 1: 5-Амино-1-метил-5-фенил-пиперидин-2-он
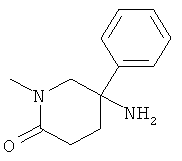
Указанное в заголовке соединение получали из 1-метил-5-нитро-5-фенил-пиперидин-2-она (Пример А.9, стадия 1) с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадия 3). Масс-спектр (m/z): 205,2 (М+Н).
b) Стадия 2: (1-Метил-6-оксо-3-фенил-пиперидин-3-ил)-карбаминовой кислоты трет-бутиловый эфир
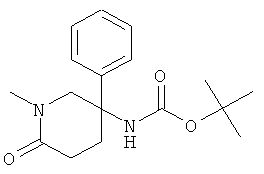
К раствору 1,5 г (7,35 ммоль) 5-амино-1-метил-5-фенил-пиперидин-2-она в 30 мл ТГФ в атмосфере азота при комнатной температуре добавляли 2,1 мл (14,7 ммоль) триэтиламина. Добавляли по каплям раствор 3,24 г (14,7 ммоль) ди-трет-бутил-дикарбоната в 15 мл ТГФ. Данную реакционную смесь перемешивали в масляной бане при 55°С в течение 7 ч и затем в течение ночи при комнатной температуре. Добавляли 100 мл воды. Данную смесь 3 раза экстрагировали этилацетатом. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (1,21 г, 54%) в виде желтого масла. Масс-спектр (m/z): 305,3 (М+Н).
с) Стадия 3: (1.6.6-Триметил-3-фенил-пиперидин-3-ил)-карбаминовой кислоты трет-бутиловый эфир
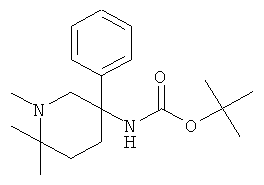
Раствор 61 мг (0,2 ммоль) (1-метил-6-оксо-3-фенил-пиперидин-3-ил)-карбаминовой кислоты трет-бутилового эфира в 2 мл ТГФ охлаждали до -20°С. Добавляли за один прием 48 мг (0,2 ммоль) хлорида циркония (IV). Температура поднималась до -12°С. Смесь перемешивали в течение 30 мин при -10°С. Добавляли по каплям 400 мкл (1,2 ммоль) 3 М раствора бромида метилмагния в диэтиловом эфире, поддерживая температуру ниже -10°С. Через 10 мин смесь оставляли нагреваться до комнатной температуры. Через 2 ч смесь охлаждали в ледяной бане и гасили путем добавления 2 мл насыщенного раствора NH4Cl. Добавляли этилацетат и воду. Органический слой отделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения (50 мг, 80%) в виде желтого масла. Масс-спектр (m/z): 319,3 (М+Н).
d) Стадия 4: рац-1,6,6-Триметил-3-фенил-пиперидин-3-иламин
К раствору 50 мг (0,157 ммоль) (1,6,6-триметил-3-фенил-пиперидин-3-ил)-карбаминовой кислоты трет-бутилового эфира в 0,3 мл диоксана добавляли 0,39 мл (1,57 ммоль) 4 М раствора HCl в диоксане при комнатной температуре. Через 30 мин добавляли 0,3 мл метанола, чтобы растворить продукт. Затем смесь перемешивали в течение 5 ч при комнатной температуре. Растворитель удаляли под вакуумом. Остаток растворяли в воде. Водный слой дважды экстрагировали этилацетатом и затем подщелачивали 2 М раствором карбоната натрия. Водный слой экстрагировали 3 раза дихлорметаном. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения (22 мг, 64%) в виде коричневого масла. Масс-спектр (m/z): 219,4 (М+Н).
Пример А.23
Получение рац-3-(3-Бром-фенил)-1-метил-пиперидин-3-иламина
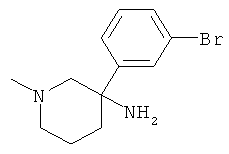
а) Стадия 1: рац-3-(3-Бром-фенил)-1-метил-3-нитро-пиперидин
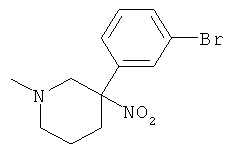
Указанное в заголовке соединение получали из 1-бром-3-нитрометил-бензола (CAS: 854634-33-6) с использованием методики, аналогичной методике синтеза, описанной в Примере А.17 (стадии 1-3). Масс-спектр (m/z): 300,3 (М+Н).
b) Стадия 2: рац-3-(3-Бром-фенил)-1-метил-пиперидин-3-иламин

Указанное в заголовке соединение получали из рац-3-(3-бром-фенил)-1-метил-3-нитро-пиперидина с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадия 3). Масс-спектр (m/z): 269,2 (М+Н).
Пример А.24
Получение рац-3-(2-Хлор-4-фтор-фенил)-1-метил-пиперидин-3-иламина
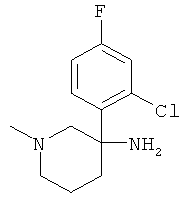
Указанное в заголовке соединение получали из 2-хлор-4-фтор-1-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.25 Получение рац-3-(5-Хлор-2-фтор-фенил)-1-метил-пиперидин-3-иламина
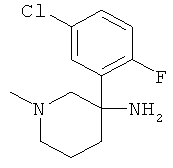
Указанное в заголовке соединение получали из 4-хлор-1-фтор-2-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.26
Получение рац-1-Метил-3-(3-трифторметил-фенил)-пиперидин-3-иламина
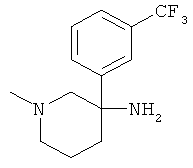
Указанное в заголовке соединение получали из 1-нитрометил-3-трифторметил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.27 Получение рац-1-Метил-3-(3-трифторметокси-фенил)-пиперидин-3-иламина
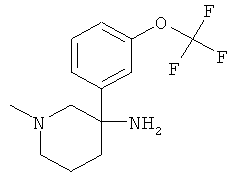
Указанное в заголовке соединение получали из 1-нитрометил-3-трифторметокси-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.28
Получение рац-3-(3-Метокси-фенил)-1-метил-пиперидин-3-иламина
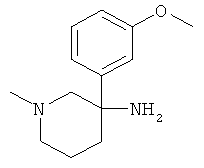
Указанное в заголовке соединение получали из 1-метокси-3-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.29
Получение рац-3-(3-Дифторметокси-фенил)-1-метил-пиперидин-3-иламина
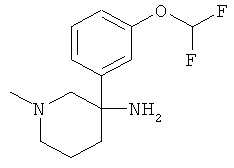
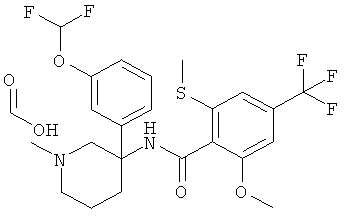
Указанное в заголовке соединение получали из 1-дифторметокси-3-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.30
Получение рац-3-(3-Фтор-фенил)-1-метил-пиперидин-3-иламина
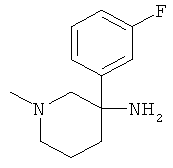
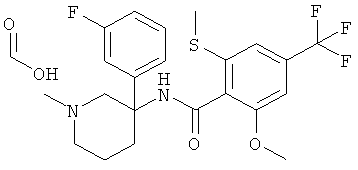
Указанное в заголовке соединение получали из 1-фтор-3-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.31
Получение рац-3-(3-Хлор-4-фтор-фенил)-1-метил-пиперидин-3-иламина
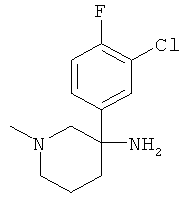
Указанное в заголовке соединение получали из 2-хлор-1-фтор-4-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.32
Получение рац-3-(3,4-Дифтор-фенил)-1-метил-пиперидин-3-иламина
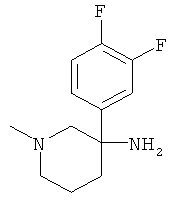
Указанное в заголовке соединение получали из 1,2-дифтор-4-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.33
Получение рац-1-Метил-3-мета-толил-пиперидин-3-иламина
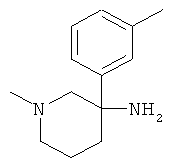
Указанное в заголовке соединение получали из 1-метил-3-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.34
Получение рац-3-(4-Фтор-3-метил-фенил)-1-метил-пиперидин-3-иламина
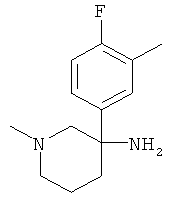
Указанное в заголовке соединение получали из 1-фтор-2-метил-4-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.35
Получение рац-3-(3,5-Дифтор-фенил)-1-метил-пиперидин-3-иламина
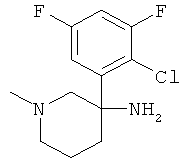
Указанное в заголовке соединение получали из 1,3-дифтор-5-нитрометил-бензола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.36
Получение рац-1-Метил-3-(3-тиазол-2-ил-фенил)-пиперидин-3-иламина
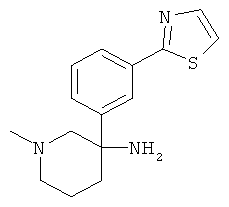
Указанное в заголовке соединение получали из 2-(3-нитрометил-фенил)-тиазола с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадии 1-4).
Пример А.37
Получение рац-1-трет-Бутил-3-фенил-пиперидин-3-иламина
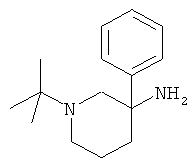
а) Стадия 1: рац-4-Нитро-4-фенил-масляной кислоты метиловый эфир
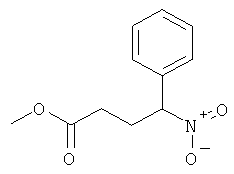
Указанное в заголовке соединение получали из нитрометил-бензола (CAS: 622-42-4) с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадия 1).
b) Стадия 2: рац-5-Нитро-5-фенил-пиперидин-2-он

К перемешиваемому раствору 2,11 г (26,88 ммоль) ацетата аммония в 15 мл этанола в атмосфере азота при комнатной температуре добавляли 980 мкл (13,44 ммоль) формальдегида (37% в воде) и затем раствор 3 г (13,44 ммоль) рац-4-Нитро-4-фенил-масляной кислоты метилового эфира в 7,5 мл этанола. Данную смесь подвергали дефлегмации в течение 26 ч, затем охлаждали до комнатной температуры и выпаривали растворитель. Добавляли воду. Полученную суспензию перемешивали в течение 15 мин, фильтровали, промывали водой, затем диэтиловым эфиром и сушили под вакуумом с выходом указанного в заголовке соединения (2,49 г, 84,1%) в виде белого твердого вещества. Масс-спектр (m/z): 221,2 (М+Н).
с) Стадия 3: рац-5-Амино-5-Фенил-пиперидин-2-он
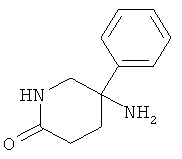
Указанное в заголовке соединение получали из рац-5-нитро-5-фенил-пиперидин-2-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.17 (стадия 4). Масс-спектр (m/z): 191,4 (М+Н).
d) Стадия 4: рац-3-Фенил-пиперидин-3-иламин
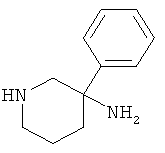
Указанное в заголовке соединение получали из рац-5-амино-5-фенил-пиперидин-2-она с использованием методики, аналогичной методике синтеза, описанной в Примере А.6 (стадия 4). Масс-спектр (m/z): 177,7 (М+Н).
е) Стадия 5: рац-2-(3-Амино-3-фенил-пиперидин-1-ил)-2-метил-пропионитрил
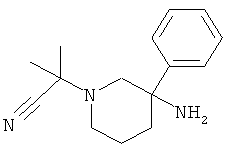
К раствору 300 мг (1,701 ммоль) рац-3-фенил-пиперидин-3-иламина в 1,3 мл уксусной кислоты добавляли по каплям 188 мкл (2,553 ммоль) ацетона. Данную смесь перемешивали в течение 5 мин при комнатной температуре. Добавляли по каплям 320 мкл (2,553 ммоль) триметилсилилцианида. Температура поднималась до 31°С. Смесь перемешивали в течение 4 ч при комнатной температуре. Затем смесь разбавляли дихлорметаном и охлаждали до 0°С. Смесь подщелачивали, добавляя по каплям 2 н. NaOH. Органический слой отделяли и водный слой дважды экстрагировали дихлорметаном. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения (315 мг, 76,1%) в виде желтого масла. Масс-спектр (m/z): 244,4 (М+Н).
f) Стадия 6; paц-1-трет-Бутил-3-фенил-пиперидин-3-иламин
К раствору 100 мг (0,411 ммоль) рац-2-(3-амино-3-фенил-пиперидин-1-ил)-2-метил-пропионитрила в 2,0 мл тетрагидрофурана над молекулярным ситом при 0°С в атмосфере азота добавляли по каплям 1,4 мкл (4,11 ммоль) 3 М раствора бромида метилмагния в диэтиловом эфире. Данную смесь перемешивали в течение 10 мин при 0°С и затем в течение 30 ч при 60°С. Затем смесь охлаждали в ледяной бане и гасили путем добавления насыщенного раствора хлорида аммония. Затем смесь 3 раза экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения (60 мг, 63%) в виде желтой смолы. Масс-спектр (m/z): 233,2 (М+Н).
Пример А.38
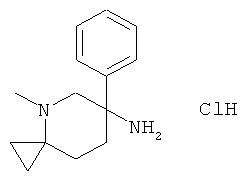
Получение рац-4-Метил-6-фенил-4-аза-спиро[2,5]окт-6-иламина гидрохлорида
а) Стадия 1: рац-(4-Метил-6-Фенил-4-аза-спиро[2,5]окт-6-ил)-карбаминовой кислоты трет-бутиловый эфир
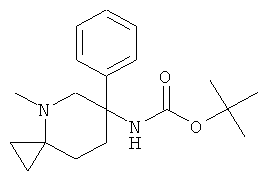
Раствор 333 мкл (1,0 ммоль) 3 М раствора бромида этилмагния в диэтиловом эфире в 4 мл ТГФ охлаждали до -70°С. Добавляли по каплям раствор 124 мкл (0,42 ммоль) изопропоксида титана в 0,4 мл ТГФ. Полученную светло-коричневую смесь перемешивали в течение 2 мин. Добавляли по каплям раствор 122 мг (0,4 ммоль) рац-(1-метил-6-оксо-3-фенил-пиперидин-3-ил)-карбаминовой кислоты трет-бутилового эфира (Пример А.22, стадия 2) в 2,4 мл ТГФ. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 3 ч.
Затем смесь охлаждали в ледяной бане и гасили путем добавления 20% раствора хлорида аммония. Добавляли воду и этилацетат. Полученную белую суспензию фильтровали через подушку дикалита. Органический слой отделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (14 мг, 11%) в виде бесцветного масла. Масс-спектр (m/z): 317,2 (М+Н).
b) Стадия 2: рац-4-Метил-6-Фенил-4-аза-спиро[2,5]окт-6-иламина гидрохлорид
Указанное в заголовке соединение получали из рац-(4-метил-6-фенил-4-аза-спиро[2,5]окт-6-ил)-карбаминовой кислоты трет-бутилового эфира с использованием методики, аналогичной методике синтеза, описанной в Примере А.22 (стадия 4). Масс-спектр (m/z): 217,4 (М+Н).
Пример В.1
Получение 2-бром-6-метокси-4-трифторметил-бензойной кислоты
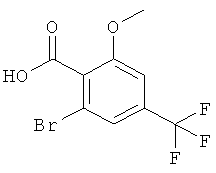
К охлажденному до -75°С ТГФ (70 мл) в течение 5 мин добавляли по каплям 36 мл (50,0 ммоль) 1,4 М раствора втор-BuLi в циклогексане, поддерживая температуру ниже -70°С. В течение 5 мин добавляли по каплям 7,5 мл (50,0 ммоль) TMEDA при температуре ниже -70°С. В течение 20 мин добавляли по каплям раствор 5,0 г (22,71 ммоль) 2-метокси-4-(трифторметил)бензойной кислоты (имеется в продаже) в ТГФ (25 мл). Полученный темно-зеленый раствор перемешивали в течение 2 ч при -75°С. Добавляли по каплям раствор 29,6 г (90,84 ммоль) 1,2-дибромтетрахлорэтана в ТГФ (30 мл). Полученную желтоватую суспензию перемешивали в течение 1 ч при -75°С и затем оставляли нагреваться до комнатной температуры. Полученный желтый раствор гасили, добавляли по каплям 60 мл воды с использованием охлаждения в ледяной бане. Смесь разбавляли этилацетатом (70 мл) и водой (30 мл). Водный слой экстрагировали этилацетатом (50 мл), подкисляли путем добавления 25% HCl и экстрагировали этилацетатом (3×50 мл). Экстракты объединяли, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт растирали в гептане, фильтровали и сушили. Твердое вещество перекристаллизовывали из гептана (7 мл) и этилацетата (2 мл) с получением указанного в заголовке соединения (815 мг, 12%) в виде белого твердого вещества. Масс-спектр (m/z): 298,9 (М-Н).
Пример В.2
Получение 2-Метокси-6-метилсульфанил-4-трифторметил-бензойной кислоты
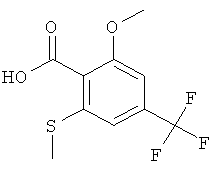
Указанное в заголовке соединение получали из 2-метокси-4-(трифторметил)бензойной кислоты (имеется в продаже) и диметилдисульфида с использованием методики, аналогичной методике синтеза, описанной в Примере В.1.
Пример В.3
Получение 2-Циклопропил-4-трифторметил-бензойной кислоты
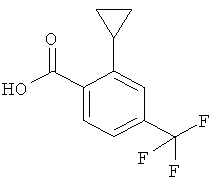
а) Стадия 1: 2-Бром-4-трифторметил-бензойной кислоты метиловый эфир
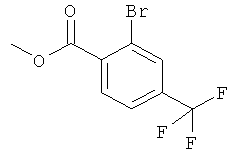
К раствору 2 г (7,434 ммоль) 2-бром-4-трифторметил-бензойной кислоты (CAS: 328-89-2) в 20 мл ДМФА в атмосфере азота при комнатной температуре добавляли 1,13 г (8,177 ммоль) карбоната калия и 557 мкл (8,921 ммоль) йодистого метила. Данную смесь перемешивали в течение ночи в атмосфере азота. Затем смесь вливали в воду (300 мл). Водный слой экстрагировали этилацетатом (2×80 мл). Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученное неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0-10%) с выходом указанного в заголовке соединения (1,75 г, 83%) в виде оранжевого масла.
b) Стадия 2: 2-Циклопропил-4-трифторметил-бензойной кислоты метиловый эфир
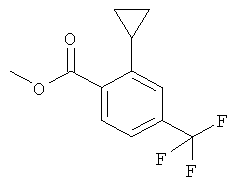
К раствору 400 мг (1,413 ммоль) 2-бром-4-трифторметил-бензойной кислоты метилового эфира, 146 мг (1,696 ммоль) циклопропилбороновой кислоты, 1,21 г (4,946 ммоль) ортофосфата калия моногидрата, 40,9 мг (0,141 ммоль) трициклогексилфосфина в 6 мл толуола и 0,3 мл воды в атмосфере азота при комнатной температуре добавляли 15,9 мг (0,0707 ммоль) ацетата палладия. Данную смесь перемешивали в масляной бане при 100°С в течение 4 ч и в течение ночи при комнатной температуре в атмосфере азота. Затем смесь охлаждали до комнатной температуры. Добавляли воду и смесь экстрагировали этилацетатом. Органический слой один раз промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученное неочищенное соединение очищали на силикагеле (элюент: гептан/этилацетат 0-10%) с выходом указанного в заголовке соединения (0,24 г, 71%) в виде желтого масла.
с) Стадия 3: 2-Циклопропил-4-трифторметил-бензойная кислота
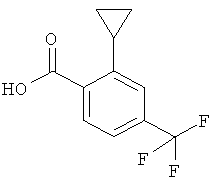
К суспензии 485 мг (1,986 ммоль) 2-циклопропил-4-трифторметил-бензойной кислоты метилового эфира в 8 мл этанола при комнатной температуре добавляли 1,99 мл (3,972 ммоль) 2 н. NaOH. Данную смесь нагревали при 80°С в масляной бане в течение 30 мин. Полученный раствор охлаждали до комнатной температуры и выпаривали этанол. Остаток разбавляли водой, подкисляли путем добавления 2 н. HCl до pH 2 и добавляли дихлорметан. Водную фазу дважды экстрагировали дихлорметаном. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (0,197 г, 27%) в виде светло-желтого твердого вещества. Масс-спектр (m/z): 229,0 (М-Н).
Пример В.4
Получение 5-Трифторметил-бифенил-2-карбоновой кислоты
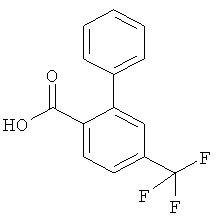
Смесь 300 мг (0,949 ммоль) 2-йод-4-трифторметил-бензойной кислоты (CAS: 54507-44-7), 239 мг (1,898 ммоль) фенилбороновой кислоты, 302 мг (2,847 ммоль) карбоната натрия и 10,7 мг (0,0475 ммоль) ацетата палладия в 4,5 мл воды перемешивали в течение 48 ч при комнатной температуре. Затем смесь фильтровали и полученный фильтрат подкисляли путем добавления 37% HCl. Затем смесь перемешивали в течение 30 мин при комнатной температуре. Твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (225 мг, 89%) в виде коричневого твердого вещества. Масс-спектр (m/z): 264,9 (M+H+).
Пример В.5
Получение 2-Изопропокси-4-трифторметил-бензойной кислоты
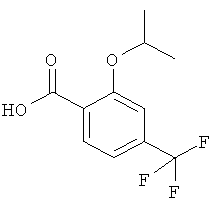
К раствору 500 мг (2,271 ммоль) 2-гидрокси-4-трифторметил-бензойной кислоты метилового эфира (CAS: 345-28-8), 209 мкл (2,725 ммоль) 2-пропанола и 706,2 мг (2,612 ммоль) трифенилфосфина в 6,5 мл тетрагидрофурана в атмосфере азота при 0°С добавляли по каплям раствор 575,2 мг (2,498 ммоль) ди-трет-бутилазодикарбоксилата в 1 мл тетрагидрофурана. Данную реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1,5 ч. Добавляли 8 мл (15,9 ммоль) 2 н. NaOH и данную реакционную смесь нагревали в течение 5 ч при 80°С. Затем реакционную смесь дважды экстрагировали 5 мл диэтилового эфира. Водный слой подкисляли с использованием охлаждения в ледяной бане 5 н. раствором HCl до pH 1. Образовавшийся осадок отфильтровывали и сушили под вакуумом с получением 444 мг (выход: 78,8%) желаемого соединения в виде белого твердого вещества. Масс-спектр (m/z): 247,0 (MH+).
Пример В.6
Получение 2-Метокси-6-метилсульфанил-4-трифторметил-бензоил хлорида
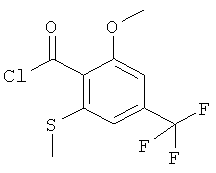
Смесь 51 мг (0,191 ммоль) 2-метокси-6-метилсульфанил-4-трифторметил-бензойной кислоты (Пример В.2) и 140 мкл (1,91 ммоль) тионилхлорида в толуоле (0,5 мл) нагревали при 80°С в масляной бане в течение 4 ч. Растворитель удаляли под вакуумом с получением указанного в заголовке соединения.
Пример В.7
Получение 2-Этил-4,6-бис-трифторметил-бензоил хлорида
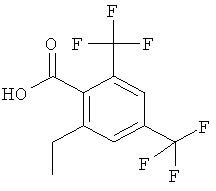
а) Стадия 1: 2-Этил-4,6-бис-трифторметил-бензойная кислота

Указанное в заголовке соединение получали из 2,4-бис-трифторметил-бензойной кислоты (имеется в продаже) и этилйодида с использованием методики, аналогичной методике синтеза, описанной в Примере В.1.
Пример В.8
Получение 2-Дифторметокси-4-трифторметил-бензойной кислоты
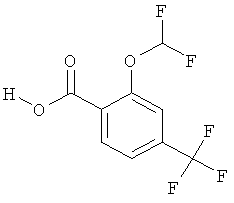
а) Стадия 1: 2-Дифторметокси-4-трифторметил-бензойной кислоты метиловый эфир
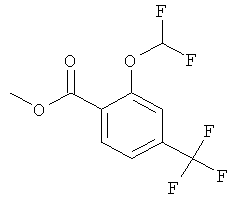
К раствору 500 мг (2,271 ммоль) 2-гидрокси-4-трифторметил-бензойной кислоты метилового эфира (CAS: 345-28-8) в 5 мл N,N-диметилформамида при комнатной температуре добавляли 470,8 мг (3,407 ммоль) карбоната калия и затем добавляли по каплям 293,4 мкл (2,725 ммоль) хлордифторуксусной кислоты метилового эфира. Данную реакционную смесь нагревали при 65°С в масляной бане в течение 22 ч. Добавляли воду и этилацетат. Органическую фазу промывали 3 раза водой. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения (449 мг) в виде розового масла, которое использовали на следующей стадии без какой-либо дополнительной очистки.
b) Стадия 2: 2-Дифторметокси-4-трифторметил-бензойная кислота
Указанное в заголовке соединение получали из 2-дифторметокси-4-трифторметил-бензойной кислоты метилового эфира с использованием методики, аналогичной методике синтеза, описанной в Примере В.3 (стадия 3). Масс-спектр (m/z): 254,9 (М-Н).
Пример В.9
Получение 2-Пирролидин-1-ил-4-трифторметил-бензойной кислоты
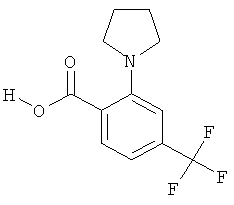
а) Стадия 1: 2-Пирролидин-1-ил-4-трифторметил-бензойной кислоты метиловый эфир
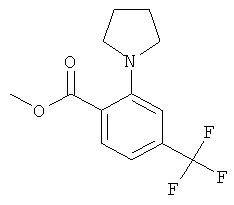
К 30 мг (0,0318 ммоль) Pd2dba3, 37,9 мг (0,106 ммоль) 2-(дициклогексилфосфино)бифенила и 315 мг (1,484 ммоль) ортофосфата калия в атмосфере аргона при комнатной температуре добавляли раствор 105,2 мкл (1,272 ммоль) пирролидина в 5,5 мл сухого толуола и затем 300 мг (1,06 ммоль) 2-бром-4-трифторметил-бензойной кислоты метилового эфира (CAS: 328-89-2). Данную реакционную смесь нагревали при 80°С в течение ночи. Затем смесь охлаждали до комнатной температуры и разбавляли дихлорметаном. Данную суспензию фильтровали. Полученный фильтрат концентрировали под вакуумом. Остаток очищали на силикагеле (элюент: гептан/этилацетат 0-10%) с получением указанного в заголовке соединения (88 мг, 30,4%) в виде оранжевого масла. Масс-спектр (m/z): 274,3 (MH+).
b) Стадия 2: 2-Пирролидин-1-ил-4-трифторметил-бензойная кислота
Указанное в заголовке соединение получали из 2-пирролидин-1-ил-4-трифторметил-бензойной кислоты метилового эфира с использованием методики, аналогичной методике синтеза, описанной в Примере В.З (стадия 3). Масс-спектр (m/z): 258,0 (М-Н).
Пример В.10
Получение 2-Циклогексил-4-трифторметил-бензойной кислоты
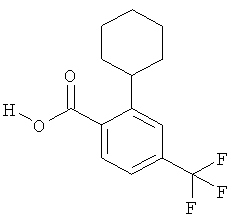
а) Стадия 1: 2-Иод-4-трифторметил-бензойной кислоты метиловый эфир
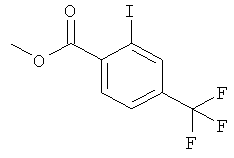
Указанное в заголовке соединение получали из 2-йод-4-трифторметил-бензойной кислоты с использованием методики, аналогичной методике синтеза, описанной в Примере В.3 (стадия 1).
b) Стадия 2: 2-Циклогексил-4-трифторметил-бензойной кислоты метиловый эфир
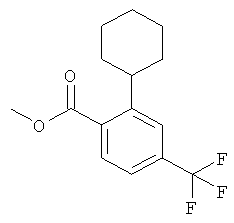
К раствору 300 мг (0,909 ммоль) 2-йод-4-трифторметил-бензойной кислоты метилового эфира, 14,4 мг (0,0455 ммоль) Pd(dppf)Cl2 и 10,6 мг (0,0545 ммоль) йодида меди (I) в ТГФ (5 мл) добавляли при комнатной температуре 2,73 мл (1,364 ммоль) бромида циклогексилцинка (0,5 М). Данную смесь перемешивали в течение 3 ч. Затем смесь нагревали до 50°С и перемешивали в течение 4 ч и при комнатной температуре в течение ночи. Затем смесь концентрировали под вакуумом и растворяли в этилацетате. Затем смесь дважды промывали 1 н. раствором HCl, дважды насыщенным раствором бикарбоната натрия и один раз солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали на силикагеле (элюент: гептан/этилацетат 0-20%) с получением указанного в заголовке соединения (176 мг, 68%) в виде светло-желтого масла. Масс-спектр (m/z): 286 (MH+).
с) Стадия 3: 2-Циклогексил-4-трифторметил-бензойная кислота
Указанное в заголовке соединение получали из 2-циклогексил-4-трифторметил-бензойной кислоты метилового эфира с использованием методики, аналогичной методике синтеза, описанной в Примере В.3 (стадия 3). Масс-спектр (m/z): 271,2(M-H).
Пример В.11
Получение 2-циклопентил-4-трифторметил-бензойной кислоты
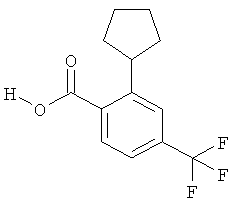
Указанное в заголовке соединение получали из 2-йод-4-трифторметил-бензойной кислоты метилового эфира и бромида циклопентилцинка с последующим омылением полученного продукта гидроксидом натрия в соответствии с методикой, аналогичной методике синтеза, описанной в Примере В. 10. Масс-спектр (m/z): 257,0 (М-Н).
Пример В.12
Получение 2-Циклобутил-4-трифторметил-бензойной кислоты
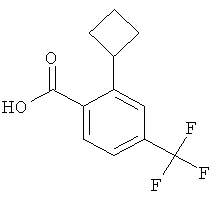
Указанное в заголовке соединение получали из 2-йод-4-трифторметил-бензойной кислоты метилового эфира и бромида циклобутилцинка с последующим омылением полученного продукта гидроксидом натрия в соответствии с методикой, аналогичной методике синтеза, описанной в Примере В. 10. Масс-спектр (m/z): 243,0 (М-Н).
Пример В.13
Получение 2-Изопропил-4-трифторметил-бензойной кислоты
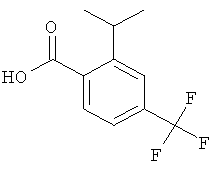
Указанное в заголовке соединение получали из 2-йод-4-трифторметил-бензойной кислоты метилового эфира и бромида 2-пропилцинка с последующим омылением полученного продукта гидроксидом натрия в соответствии с 5 методикой, аналогичной методике синтеза, описанной в Примере В. 10. Масс-спектр (m/z): 231,0 (М-Н).
Пример В.14
Получение 2,6-Диметокси-4-трифторметил-бензойной кислоты
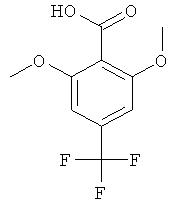
К раствору гидроксида натрия (5,66 г,141,4 ммоль) в 33 мл воды и 33 мл этанола при комнатной температуре в атмосфере азота добавляли 2,6-диметокси-4-трифторметил-бензонитрил (CAS: 51271-36-4) (3,27 г, 14,14 ммоль). Данную реакционную смесь нагревали при 90°С в масляной бане в течение 37 ч. Затем реакционную смесь охлаждали до комнатной температуры и добавляли 130 мл воды. Продукт собирали путем фильтрования и сушили с получением желтоватого твердого вещества (3,05 г). К раствору нитрозилсерной кислоты (15,6 г, 110,2 ммоль) в 9,5 мл воды при 0°С в атмосфере азота добавляли по каплям суспензию полученного выше вещества в 19 мл дихлорметана. Реакционную смесь перемешивали в течение 4,5 ч при 0°С. Затем реакционную смесь выливали на лед и экстрагировали дихлорметаном. Объединенные органические слои сушили над Na2SO4, фильтровали и сушили с получением 1,51 г продукта. Водную фазу фильтровали и белое твердое вещество сушили с получением 1,36 г продукта. Обе порции продукта смешивали с получением указанного в заголовке соединения (2,87 г, 93,7%) в виде белого твердого вещества. Масс-спектр (m/z): 249,1 (М-Н).
Пример В.15
Получение 2-Метокси-6-(2,2,2-трифтор-этокси)-4-трифторметил-бензойной кислоты
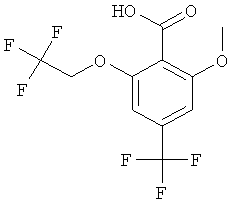
а) Стадия 1: 2-Метокси-6-нитро-4-трифторметил-бензонитрил
К раствору 3 г (11,49 ммоль) 2,6-динитро-4-трифторметил-бензонитрила (CAS: 35213-02-6) в 30 мл метанола при 0°С в атмосфере азота добавляли 2,3 мл (11,49 ммоль) 5 М метилата натрия в метаноле. Данную реакционную смесь перемешивали в течение 1,5 ч при 0°С, затем вливали в ледяную воду, перемешивали в течение 60 мин и продукт собирали путем фильтрования. Полученное неочищенное твердое вещество очищали на силикагеле (элюент: гептан/этилацетат 0-30%) с выходом указанного в заголовке соединения (2,24 г, 79%) в виде светло-желтого твердого вещества.
b) Стадия 2: 2-Метокси-6-(2,2,2-трифтор-этокси)-4-трифторметил-бензонитрил
К раствору 200 мг (0,804 ммоль) 2-метокси-6-нитро-4-трифторметил-бензонитрила в 2,4 мл 2,2,2-трифторэтанола в атмосфере аргона при 0°С добавляли по каплям раствор 81,3 мг (1,246 ммоль) гидроксида калия в 600 мкл воды. Данную смесь подвергали дефлегмации в течение 2 суток, затем охлаждали до комнатной температуры и вливали в смесь лед/вода. Полученную суспензию фильтровали и сушили под вакуумом с выходом указанного в заголовке соединения (112 мг, 47%) в виде белого твердого вещества. Масс-спектр (m/z): 317,2 (М+Н).
с) Стадия 3: 2-Метокси-6-(2,2,2-трифтор-этокси)-4-трифторметил-бензойная кислота
Указанное в заголовке соединение получали из 2-метокси-6-(2,2,2-трифтор-этокси)-4-трифторметил-бензонитрила с использованием методики, аналогичной методике синтеза, описанной в Примере В.14. Масс-спектр (m/z): 316,9 (М-Н).
Пример В.16
Получение 2-Этил-3-метил-4-трифторметил-бензоил хлорида
а) Стадия 1: 2-(2-Метокси-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазол
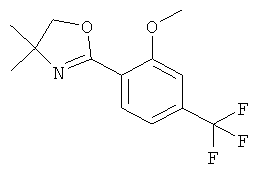
К раствору 24,98 г (113 ммоль) 4-(трифторметил)-2-метокси-бензойной кислоты в 220 мл толуола добавляли 82 мл (1,13 моль) тионилхлорида и 5 капель диметилформамида. Данную смесь нагревали до 80°С в течение 3 ч. Затем реакционную смесь концентрировали при 50°С/10 мбар (100 Па). Оставшийся хлорангидрид, 27,9 г светло-желтой жидкости растворяли в 160 мл охлажденного до 0°С дихлорметана и добавляли раствор 20,34 г (228 ммоль) 2-амино-2-метил-пропан-1-ола в 60 мл дихлорметана. Данную смесь оставляли перемешиваться в течение 16 ч при температуре окружающей среды. Полученную желтоватую суспензию разбавляли водой, водную фазу упаривали и органическую фазу 3 раза экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Полученный неочищенный продукт, N-(2-гидрокси-1,1-диметил-этил)-2-метокси-4-трифтор-метил-бензамид (33,2 г, светло-желтое масло) растворяли в 220 мл дихлорметана и охлаждали до 0°С. Затем добавляли по каплям 24,7 мл (340 ммоль) тионилхлорида и полученный светло-желтый раствор перемешивали в течение 16 ч при температуре окружающей среды. Затем pH доводили до 10 путем добавления насыщенного водного раствора Na2CO3. Водный слой отделяли и 3 раза экстрагировали трет-бутилметиловым эфиром. Объединенные органические фазы дважды промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения в виде светло-желтого масла, которое использовали без дополнительной очистки. Масс-спектр (m/z): 274,1 (M+H+).
b) Стадия 2: 2-(2-Метокси-3-метил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазол
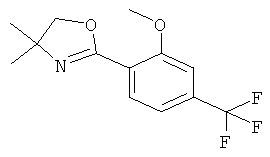
К раствору 5,465 г (20 ммоль) 2-(2-метокси-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола в 60 мл сухого ТГФ при температуре < -60°С добавляли 11,0 мл (22 ммоль) 2 М раствора диизопропиламида лития в смеси ТГФ/гептаны/этилбензол и данную смесь перемешивали в течение 1,5 ч при температуре < -60°С. К полученному темно-коричневому раствору по каплям в течение 10 мин добавляли 2,5 мл (40 ммоль) йодметана (экзотермическая реакция, Ti < -48°C). Полученный светло-коричневый раствор перемешивали при температуре < -50°С в течение 2,5 ч, затем гасили путем добавления насыщенного водного раствора NH4Cl и три раза экстрагировали /трет-бутилметиловым эфиром. Объединенные органические фазы промывали 3 раза солевым раствором, сушили над Na2SO4, фильтровали и упаривали с получением 7,002 г желтого твердого вещества, которое очищали путем флэш-хроматографии на силикагеле (5-10% AcOEt в гептане в течение 25 мин и гептан/AcOEt 90:10 в течение 20 мин) с получением указанного в заголовке соединения в виде светло-желтого масла. Масс-спектр (m/z): 288,12 (М+Н+).
с) Стадия 3: 2-(2-Этил-3-метил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазол
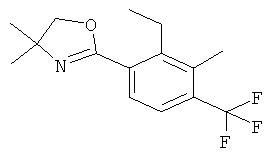
К охлажденному раствору 355 мг (1,17 ммоль) 2-(2-метокси-3-метил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола в 4 мл ТГФ по каплям в течение 20 мин при температуре < 10°С добавляли 2,35 мл (4,7 ммоль) 2 М раствора хлорида этилмагния в ТГФ. Полученный коричневый раствор перемешивали в течение 1 ч при температуре окружающей среды, затем гасили путем добавления насыщенного водного раствора NH4Cl (с использованием охлаждения в ледяной бане) и три раза экстрагировали трет-бутилметиловым эфиром. Объединенные органические фазы промывали три раза солевым раствором, сушили над Na2SO4, фильтровали и упаривали с получением 2-(2-этил-3-метил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола в виде желтого масла. Масс-спектр (ISP (ионораспыление в режиме положительных ионов)): 286,1 ((М+Н)+).
а) Стадия 4: 2-(2-Этил-3-метил-4-трифторметил-фенил)-3,4,4-триметил-4,5-дигидро-оксазол-3-ия йодид
К раствору 837 мг (2,9 ммоль) 2-(2-этил-3-метил-4-трифторметил-фенил)-4,4-диметил-4,5-дигидро-оксазола в 8 мл нитрометана добавляли 1,47 мл (23,5 ммоль) йодистого метила и данную смесь нагревали в герметично закрытой пробирке до 70°С в течение 18 ч. Полученный коричневый раствор разбавляли трет-бутилметиловым эфиром, данную суспензию фильтровали и осадок промывали трет-бутилметиловым эфиром и сушили с получением 2-(2-этил-3-метил-4-трифторметил-фенил)-3,4,4-триметил-4,5-дигидро-оксазол-3-ия йодида в виде бесцветного твердого вещества. Масс-спектр (ISP): 300,1 (М+).
е) Стадия 5: 2-Этил-3-метил-4-трифторметил-бензойная кислота
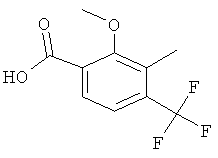
Раствор 960 мг (2,25 ммоль) 2-(2-этил-3-метил-4-трифторметил-фенил)-3,4,4-триметил-4,5-дигидро-оксазол-3-ия йодида в 10 мл МеОН и 5 мл 20% NaOH нагревали до 70°С в течение 17 ч. Полученный желтый раствор охлаждали до комнатной температуры, отгоняли МеОН и остаток подкисляли до pH 1 путем добавления концентрированной HCl и три раза экстрагировали трет-бутилметиловым эфиром. Объединенные органические фазы дважды промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали с получением 2-этил-3-метил-4-трифторметил-бензойной кислоты в виде желтого твердого вещества. Масс-спектр (ISN (ионораспыление в режиме отрицательных ионов)): 231,06((М-Н)-).
f) Стадия 6: 2-Этил-3-метил-4-трифторметил-бензоил хлорид
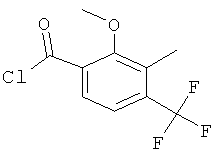
Указанное в заголовке соединение получали из 2-этил-3-метил-4-трифторметил-бензойной кислоты с использованием методики, аналогичной методике синтеза, описанной в Примере В.6.
Пример С.1
Получение N-(1,6-Диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамида
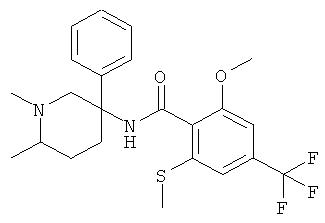
а) Стадия 1: (3-Гидрокси-1-метил-пропил)-метил-карбаминовой кислоты трет-бутиловый эфир
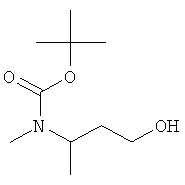
К раствору 2 г (19,39 ммоль) 3-(метиламино)-1-бутанола (имеется в продаже, CAS: 89585-18-2) в 15 мл дихлорметана в атмосфере азота при комнатной температуре добавляли 3,24 мл (23,27 ммоль) триэтиламина. Данную реакционную смесь охлаждали до 0°С и добавляли по каплям раствор 5,13 г (23,27 ммоль) ди-трет-бутил-дикарбоната в 5 мл дихлорметана. Данную реакционную смесь перемешивали при комнатной температуре в течение 2 суток, затем гасили путем добавления насыщенного раствора бикарбоната натрия. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали на силикагеле (элюент: гептан/этилацетат 0-40%) с получением указанного в заголовке соединения (3,3 г, 84%) в виде бесцветного масла. Масс-спектр (m/z): 204,3 (М+Н).
b) Стадия 2: (3-Бром-1-метил-пропил)-метил-карбаминовой кислоты трет-бутиловый эфир
К раствору 1 г (4,919 ммоль) (3-гидрокси-1-метил-пропил)-метил-карбаминовой кислоты трет-бутилового эфира в 12,5 мл дихлорметана в атмосфере азота при 0°С добавляли 1,46 г (5,411 ммоль) трифенилфосфина и затем раствор 1,79 г (5,411 ммоль) тетрабромид углерода в 3,5 мл дихлорметана. Данную реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Полученную суспензию концентрировали под вакуумом. Остаток очищали на силикагеле (элюент: гептан/этилацетат 0-15%) с получением указанного в заголовке соединения (0,74 г, 57%) в виде бесцветного масла. Масс-спектр (m/z): 210,1 (М-56).
с) Стадия 3: Метил-(1-метил-4-нитро-4-фенил-бутил)-карбаминовой кислоты трет-бутиловый эфир

К раствору 304 мг (2,219 ммоль) нитрометил-бензола (CAS: 622-42-4) в 5 мл тетрагидрофурана над молекулярным ситом и 1,29 мл НМРА, имеющему температуру -78°С, добавляли по 2,91 мл (4,654 ммоль) н-BuLi (1,6 М в гексане).
Раствор выдерживали в течение 45 мин при -78°С, затем добавляли по каплям раствор 590,7 мг (2,219 ммоль) (3-бром-1-метил-пропил)-метил-карбаминовой кислоты трет-бутилового эфира в 1,5 мл тетрагидрофурана над молекулярным ситом. Реакционную смесь выдерживали в течение 1 ч при -78°С, затем оставляли медленно, в течение 2 ч, нагреваться до -15°С. Затем смесь снова охлаждали до -78°С и гасили путем добавления 0,75 мл уксусной кислоты, затем добавляли 13 мл насыщенного хлорида аммония. Смесь снова нагревали до комнатной температуры и водную фазу экстрагировали два раза этилацетатом. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали на силикагеле (элюент: гептан/этилацетат 0-10%) с получением указанного в заголовке соединения (201 мг, 28%) в виде бесцветного масла. Масс-спектр (m/z): 323,3 (М+Н).
d) Стадия 4: Метил-(1-метил-4-нитро-4-фенил-бутил)-амин
Указанное в заголовке соединение получали из метил-(1-метил-4-нитро-4-фенил-бутил)-карбаминовой кислоты трет-бутилового эфира с использованием методики, аналогичной методике синтеза, описанной в Примере А.22 (стадия 4). Масс-спектр (m/z): 223,3 (М+Н).
е) Стадия 5: 1.2-Диметил-5-нитро-5-фенил-пиперидин
К суспензии 138 мг (0,621 ммоль) метил-(1-метил-4-нитро-4-фенил-бутил)-амина в 2,2 мл диоксана в атмосфере аргона при комнатной температуре добавляли 49,8 мкл (0,683 ммоль) формальдегида (37% в воде). Данную смесь перемешивали в течение 30 мин при комнатной температуре и затем в течение 4,5 ч при 65°С. Затем смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Добавляли сульфат натрия. Смесь фильтровали и полученный фильтрат концентрировали под вакуумом. Остаток очищали на силикагеле (элюент: гептан/этил ацетат 0-20%) с получением указанного в заголовке соединения (76 мг, 52%) в виде бесцветного масла. Масс-спектр (m/z): 235,3 (М+Н).
f) Стадия 6: 1,6-Диметил-3-фенил-пиперидин-3-иламин
Указанное в заголовке соединение получали из 1,2-диметил-5-нитро-5-фенил-пиперидина с использованием методики, аналогичной методике синтеза, описанной в Примере А.17 (стадия 4). Масс-спектр (m/z): 205,3 (М+Н).
д) Стадия 7: N-(1,6-Диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
Указанное в заголовке соединение получали из 1,6-диметил-3-фенил-пиперидин-3-иламина и 2-метокси-6-метилсульфанил-4-трифторметил-бензоил хлорида (Пример В.6) с использованием методики, аналогичной методике синтеза, описанной в Примере 16. Масс-спектр (m/z): 453,2 (М+Н).
Пример С.2
Получение N-((3RS,5SR)-1,5-Диметил-3-фенил-пиперидин-3-ил)-2-этил-4-трифторметил-бензамида
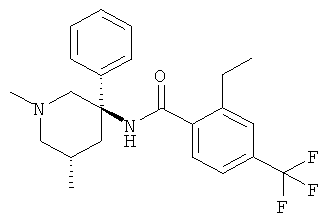
Указанное в заголовке соединение получали из (3RS,5SR)-1,5-диметил-3-фенил-пиперидин-3-иламина (Пример А.20) и 2-этил-4-трифторметил-бензойной кислоты (CAS: 854531-63-8) с использованием методики, аналогичной методике синтеза, описанной в Примере 1. Масс-спектр (m/z): 405,4 (М+Н).
Описание примеров получения соединений
Пример 1
рац-2-Хлор-N-(1-метил-3-фенил-пиперидин-3-ил)-3-трифторметил-бензамид
К раствору 33 мг (0,144 ммоль) 2-хлор-3-(трифторметил)бензойной кислоты (имеется в продаже), 75 мг (0,197 ммоль) HATU и 90 мкл (0,524 ммоль) N-этилдиизопропиламина в ДМФА (1 мл) добавляли раствор 25 мг (0,131 ммоль) рац-1-метил-3-фенил-пиперидин-3-иламина (Пример А.1) в ДМФА (0,25 мл). Данную смесь перемешивали в течение 22 ч при комнатной температуре. Растворитель удаляли под вакуумом. Остаток растворяли в этилацетате. Полученный раствор один раз промывали водой и дважды насыщенным раствором карбоната натрия. Водный слой один раз экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (27 мг, 52%) в виде светло-желтого масла. Масс-спектр (m/z): Масс-спектр (m/z): 397,2 (М+Н).
По аналогии с соединением Примера 1 соединения 2-15, приведенные в следующей Таблице, получали из соответствующих кислотных производных и пиперидиновых производных.
|
Пример 16
рац-2-Метокси-N-(1-метил-3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид
К раствору 205 мг (1,077 ммоль) рац-1-метил-3-фенил-пиперидин-3-иламина (Пример А.1) и 369 мкл (2,154 ммоль) N-этилдиизопропиламина в дихлорметане (2,5 мл) добавляли по каплям раствор 430 мг (1,4 ммоль) 2-метокси-4,6-бис-трифторметил-бензоил хлорида (CAS: 886503-47-5) в дихлорметане (2,0 мл) при комнатной температуре. Данную смесь перемешивали в течение 16 ч при комнатной температуре. Растворитель удаляли под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (340 мг, 69%) в виде светло-желтой пены. Масс-спектр (m/z): 461,4 (М+Н).
По аналогии с соединением Примера 16 соединения 17-28, приведенные в следующей Таблице, получали из соответствующих ацилхлоридных производных и соответствующих пиперидиновых производных.
|
|
Пример 29
рац-2-Метокси-N-(3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид
а) Стадия 1: рац-3-Амино-3-фенил-пиперидин-1-карбоновой кислоты бензиловый эфир
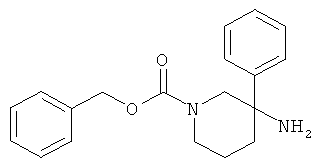
К кипящему раствору 500 мг (1,486 ммоль) рац-3-азидо-3-фенил-пиперидин-1-карбоновой кислоты бензилового эфира (Пример А.1, стадия 2) и 281 мг (7,43 ммоль) NaBH4 в ТГФ (5 мл) по каплям в течение 1,5 ч добавляли 2,0 мл метанола. Данную смесь подвергали дефлегмации дополнительно в течение 1 ч и затем перемешивали в течение ночи при комнатной температуре. Добавляли еще 114 мг (3 ммоль) NaBH4 и смесь подвергали дефлегмации в течение 2 ч. Затем смесь охлаждали в ледяной бане и подкисляли путем добавления 1 н. HCl. Смесь подщелачивали путем добавления 1 н. NaOH и три раза экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (220 мг, 48%) в виде бесцветного масла. Масс-спектр (m/z): 311,4(М+Н).
b) Стадия 2: рац-3-(2-Метокси-4.6-бис-трифторметил-бензоиламино)-3-Фенил-пиперидин-1-карбоновой кислоты бензиловый эфир
Указанное в заголовке соединение получали из рац-3-амино-3-фенил-пиперидин-1-карбоновой кислоты бензилового эфира и 2-метокси-4,6-бис-трифторметил-бензоил хлорида (CAS: 886503-47-5) с использованием методики, аналогичной методике синтеза, описанной в Примере 16.
с) Стадия 3: рац-2-Метокси-N-(3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид
К раствору 445 мг (0,767 ммоль) рац-3-(2-метокси-4,6-бис-трифторметил-бензоиламино)-3-фенил-пиперидин-1-карбоновой кислоты бензилового эфира в метаноле (4,5 мл) добавляли 44 мг 10%. Pd/C Данную смесь перемешивали в течение 1,5 ч при комнатной температуре в атмосфере водорода. Реактор продували аргоном. Катализатор отфильтровывали и фильтрат концентрировали под вакуумом с получением указанного в заголовке соединения (330 мг, 96%) в виде белой пены. Масс-спектр (m/z): 447,3 (М+Н).
Пример 30
рац-N-(1-Этил-3-фенил-пиперидин-3-ил)-2-метокси-4,6-бис-трифторметил-бензамид
К раствору 25 мг (0,056 ммоль) рац-2-метокси-N-(3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамида в 0,25 мл дихлорметана добавляли 19,7 мкл (0,112 ммоль) N-этилдиизопропиламина и затем 6,0 мкл (0,0728 ммоль) йодэтана. Раствор перемешивали в течение 20 ч при комнатной температуре. Растворитель удаляли под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (15 мг, 58%) в виде бесцветного масла. Масс-спектр (m/z): 475,2 (М+Н).
Пример 31
рац-N-(1-Изопропил-3-фенил-пиперидин-3-ил)-2-метокси-4,6-бис-трифторметил-бензамид
К раствору 35,7 мг (0,08 ммоль) рац-2-метокси-N-(3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамида в метаноле добавляли 28 мкл (0,48 ммоль) уксусной кислоты, 59 мкл (0,8 ммоль) ацетона и затем 30 мг (0,4 ммоль) цианоборгидрида натрия. Данную смесь перемешивали в течение 4 ч при комнатной температуре. Растворитель удаляли под вакуумом. Остаток переносили в этилацетат. Данную смесь один раз промывали 1 н. раствором NaOH, один раз водой и один раз солевым раствором. Водный слой один раз экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (33 мг, 85%) в виде белой пены. Масс-спектр (m/z): 489,4 (М+Н).
По аналогии с соединением Примера 31 соединения 32-34, приведенные в следующей Таблице, получали из рац-2-метокси-N-(3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамида и карбонильных производных.
|
Соединения Примеров 35-38 получены путем разделения рацемической смеси с использованием хиральной ЖХВД.
|
|
По аналогии с соединением Примера 1 соединения 39-44, приведенные в следующей Таблице, получали из соответствующих кислотных производных и соответствующих пиперидиновых производных.
|
По аналогии с соединением Примера 16 соединения 45-48, приведенные в следующей Таблице, получали из соответствующих ацилхлоридных производных и пиперидиновых производных.
|
Пример 49 рац-2-Циклопропил-N-(3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид
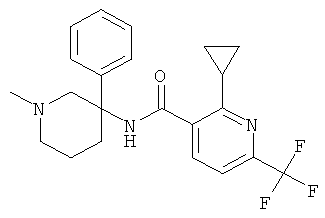
Указанное в заголовке соединение получали из рац-3-амино-3-фенил-пиперидин-1-карбоновой кислоты бензилового эфира и 2-циклопропил-4-трифторметил-бензойной кислоты (Пример В.3) с использованием методики, аналогичной методике синтеза, описанной в Примере 29. Масс-спектр (m/z): 389,1 (MH+).
Пример 50
рац-2-Метокси-6-метилсульфанил-N-(3-фенил-пиперидин-3-ил)-4-трифторметил-бензамида гидрохлорид
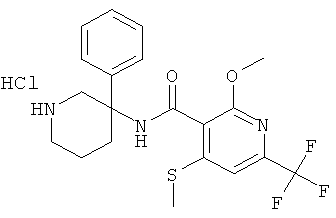
а) Стадия 1: рац-3-(2-Метокси-6-метилсульфанил-4-трифторметил-бензоиламино)-3-фенил-пиперидин-1-карбоновой кислоты бензиловый эфир
Указанное в заголовке соединение получали из рац-3-амино-3-фенил-пиперидин-1-карбоновой кислоты бензилового эфира (Пример 29, стадия 1) и 2-метокси-6-метилсульфанил-4-трифторметил-бензоил хлорида (Пример В.6) с использованием методики, аналогичной методике синтеза, описанной в Примере 16. Масс-спектр (m/z): 559,1 (MH+).
b) Стадия 2: рац-2-Метокси-6-метилсульфанил-N-(3-фенил-пиперидин-3-ил)-4-трифторметил-бензамида гидрохлорид
К раствору 50 мг (0,0895 ммоль) рац-3-(2-метокси-6-метилсульфанил-4-трифторметил-бензоиламино)-3-фенил-пиперидин-1-карбоновой кислоты бензилового эфира в 1 мл этанола в атмосфере аргона при комнатной температуре добавляли 57 мг (0,895 ммоль) формиата аммония и 50 мг 10% Pd/C. Данную смесь подвергали дефлегмации в течение 20 мин, фильтровали и полученный фильтрат концентрировали под вакуумом. Остаток переносили в воду. Водный слой подщелачивали 2 М раствором Na2CO3 и 3 раза экстрагировали дихлорметаном. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом 13,4 мг продукта, который растворяли в метаноле. Данный раствор подкисляли 1,6 М раствором HCl в метаноле. Растворитель удаляли под вакуумом с получением 13 мг указанного в заголовке соединения в виде светло-желтого твердого вещества. Масс-спектр (m/z): 425,1 (MH+).
Пример 51
рац-N-(5-Гидрокси-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
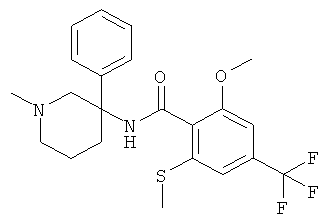
а) Стадия 1: рац-2-Метокси-N-(5-метоксиметокси-1-метил-3-Фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид
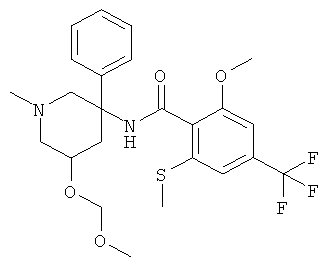
Указанное в заголовке соединение получали из рац-5-метоксиметокси-1-метил-3-фенил-пиперидин-3-иламина (Пример А.10) и 2-метокси-6-метилсульфанил-4-трифторметил-бензоил хлорида (Пример В.6) с использованием методики, аналогичной методике синтеза, описанной в Примере 16. Масс-спектр (m/z): 499,3 (MH+).
b) Стадия 2: рац-N-(5-Гидрокси-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
К раствору 17 мг (0,0341 ммоль) рац-2-метокси-N-(5-метоксиметокси-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамида в 0,5 мл метанола добавляли 102 мкл (0,102 ммоль) 1 н. раствора HCI в воде. Данную смесь перемешивали в течение 30 мин при комнатной температуре и затем при 65°С в масляной бане в течение 24 ч. Растворитель удаляли под вакуумом. Остаток переносили в воду. Водный слой подщелачивали 2 М раствором Na2CO3 и 3 раза экстрагировали дихлорметаном. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (8 мг, 52%) в виде белого твердого вещества. Масс-спектр (m/z): 455,2 (MH+).
Пример 52
рац-2-Метокси-N-[1-(2-метокси-этил)-3-фенил-пиперидин-3-ил]-6-метилсульфанил-4-трифторметил-бензамида гидрохлорид
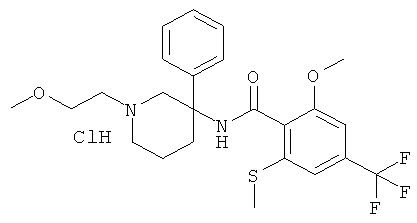
Указанное в заголовке соединение получали из рац-2-метокси-6-метилсульфанил-N-(3-фенил-пиперидин-3-ил)-4-трифторметил-бензамида гидрохлорида (Пример 50) и 2-бромэтилметилового эфира с использованием методики, аналогичной методике синтеза, описанной в Примере 30. Масс-спектр (m/z): 483,2 (MH+).
Пример 53
рац-N-[1-(2-Гидрокси-этил)-3-фенил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамида гидрохлорид
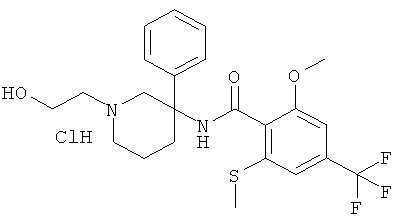
Указанное в заголовке соединение получали из рац-2-метокси-6-метилсульфанил-N-(3-фенил-пиперидин-3-ил)-4-трифторметил-бензамида гидрохлорида (Пример 50) и 2-йодэтанола с использованием методики, аналогичной методике синтеза, описанной в Примере 30. Масс-спектр (m/z): 469,2 (MH+).
Пример 54
рац-N-(1-Циклобутил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамида гидрохлорид
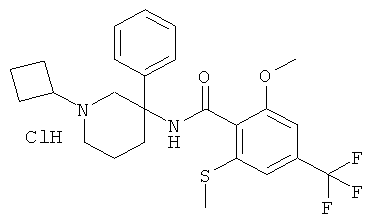
Указанное в заголовке соединение получали из рац-2-метокси-6-метилсульфанил-N-(3-фенил-пиперидин-3-ил)-4-трифторметил-бензамида гидрохлорида (Пример 50) и циклобутанона с использованием методики, аналогичной методике синтеза, описанной в Примере 31. Масс-спектр (m/z): 479,1 (MH+).
Пример 55
рац-N-(1-Изопропил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамида гидрохлорид

Указанное в заголовке соединение получали из рац-2-метокси-6-метилсульфанил-М-(3-фенил-пиперидин-3-ил)-4-трифторметил-бензамида гидрохлорида (Пример 50) и ацетона с использованием методики, аналогичной методике синтеза, описанной в Примере 31. Масс-спектр (m/z): 467,2 (MH+).
Соединения Примеров 56-57 получены путем разделения рацемической смеси с использованием хиральной ЖХВД и последующего превращения в гидрохлоридную соль с использованием HCI/Метанол.
|
Пример 58
рац-N-(3-Циклогексил-1-метил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
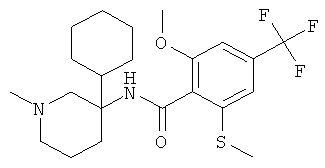
Указанное в заголовке соединение получали из рац-3-циклогексил-1-метил-пиперидин-3-иламина (Пример А.11) и 2-метокси-6-метилсульфанил-4-трифторметил-бензоил хлорида (Пример В6) с использованием методики, аналогичной методике синтеза, описанной в Примере 16. Масс-спектр (m/z): 445,2 (MH+).
Пример 59
рац-2-Метокси-6-метилсульфанил-N-[1-метил-3-(тетрагидро-пиран-4-ил)-пиперидин-3-ил]-4-трифторметил-бензамид
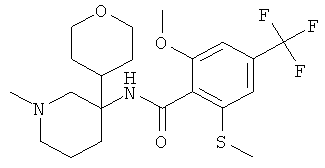
Указанное в заголовке соединение получали из рац-1-метил-3-(тетрагидро-пиран-4-ил)-пиперидин-3-иламина (Пример А.12) и 2-метокси-6-метилсульфанил-4-трифторметил-бензоил хлорида (Пример В6) с использованием методики, аналогичной методике синтеза, описанной в Примере 16. Масс-спектр (m/z): 447,2 (MH+).
Пример 60
рац-N-(1,3-Диметил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
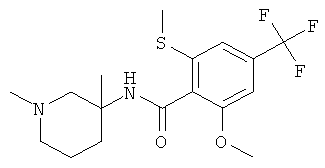
Указанное в заголовке соединение получали из рац-1,3-диметил-пиперидин-3-иламин дигидрохлорида (Пример А.13) и 2-метокси-6-метилсульфанил-4-трифторметил-бензоил хлорида (Пример В6) с использованием методики, аналогичной методике синтеза, описанной в Примере 16. Масс-спектр (m/z): 377,3 (MH+).
Соединения Примеров 61-62 получены путем разделения рацемической смеси с использованием хиральной ЖХВД.
|
Пример 63
[2Н-метил]-2-Метокси-N-(R) или (S)-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамида гидрохлорид
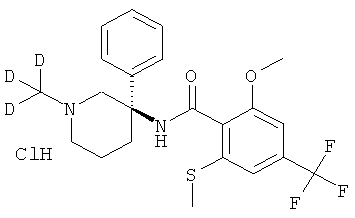
Указанное в заголовке соединение получали из 2-метокси-6-метилсульфанил-N-((R) или (S)-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамида (Пример 62) и три-дейтериометил йодида с использованием методики, аналогичной методике синтеза, описанной в Примере 30. Масс-спектр (m/z): 442,3 (MH+).
Пример 64
рац-2-Метокси-6-метилсульфанил-N-(1-оксетан-3-ил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамида гидрохлорид
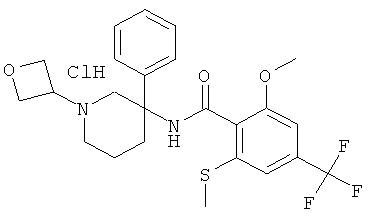
Указанное в заголовке соединение получали из рац-2-метокси-6-метилсульфанил-N-(3-фенил-пиперидин-3-ил)-4-трифторметил-бензамида гидрохлорида (Пример 50) и оксетанона с использованием методики, аналогичной методике синтеза, описанной в Примере 31. Масс-спектр (m/z): 481,1 (MH+).
Пример 65
N-((3RS,5RS)-5-Гидрокси-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
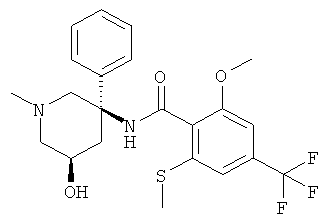
а) Стадия 1: рац-2-Метокси-N-(1-метил-5-оксо-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид
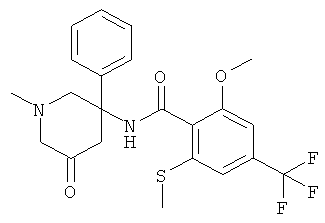
К раствору 11 мкл (0,21 ммоль) оксалилхлорида в 0,8 мл дихлорметана, имеющему температуру -50°С, в течение 15 мин добавляли раствор 17,2 мкл ДМСО в 0,2 мл дихлорметана. Данную реакционную смесь перемешивали в течение 10 мин, затем добавляли в течение 15 мин раствор 50 мг (0,11 ммоль) рац-N-(5-гидрокси-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамида (Пример 51) в 0,8 мл дихлорметана. После перемешивания в течение 30 мин добавляли 77 мкл (0,55 ммоль) триэтиламина. Реакционную смесь перемешивали в течение 15 мин, затем оставляли нагреваться до комнатной температуры и гасили водой, водный слой экстрагировали дихлорметаном. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-15%) с получением указанного в заголовке соединения (44 мг, 89%) в виде белой пены. Масс-спектр (m/z): 453,1 (MH+).
b) Стадия 2: N-((3RS,5RS)-5-Гидрокси-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид
К раствору 23 мг (0,0508 ммоль) рац-2-метокси-N-(1-метил-5-оксо-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамида в 0,46 мл метанола добавляли 3,9 мг (0,102 ммоль) боргидрида натрия. Данную смесь перемешивали в течение 30 мин при комнатной температуре, гасили путем добавления 1,0 мл 1 н. HCl и перемешивали в течение 15 мин. Добавляли воду и полученную смесь подщелачивали 2 М раствором карбоната натрия. Затем смесь 3 раза экстрагировали дихлорметаном. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный неочищенный продукт очищали на силикагеле (элюент: гептан/этилацетат 0-100%) с выходом указанного в заголовке соединения (4,5 мг, 20%) в виде белого твердого вещества. Масс-спектр (m/z): 455,2 (MH+).
По аналогии с соединением Примера 1 соединения 66-84, приведенные в следующей Таблице, получали из соответствующих кислотных производных и соответствующих пиперидиновых производных.
|
|
По аналогии с соединением Примера 16 соединения 85-105, приведенные в следующей Таблице, получали из соответствующих ацилхлоридных производных и соответствующих пиперидиновых производных.
|
Соединения Примеров 106-128 получены путем разделения рацемической смеси с использованием хиральной ЖХВД.
|
|
|
|
Соединения Формулы I и их фармацевтически приемлемые соли присоединения обладают полезными фармакологическими свойствами. Конкретно, найдено, что соединения по настоящему изобретению являются хорошими ингибиторами глицинового переносчика I (GlyT-1).
Данные соединения были исследованы с использованием тестов, приведенных в настоящем описании ниже.
Растворы и вещества
Полная среда DMEM: питательная смесь F-12 (Gibco Life Technologies), эмбриональная телячья сыворотка (FBS) 5%, (Gibco Life Technologies), пенициллин/стрептомицин 1% (Gibco Life Technologies), гигромицин 0,6 мг/мл (Gibco Life Technologies), глутамин 1 мМ (Gibco Life Technologies).
Буфер для поглощения (UB): 150 мМ NaCl, 10 мМ Hepes (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота)-Tris, pH 7,4, 1 мМ CaCl2, 2,5 мМ KCl, 2,5 мМ MgSO4, 10 мМ (+) D-глюкоза.
Клетки Flp-in™-CHO (Invitrogen, Кат.№R758-07), стабильно трансфицированные mGlyTlb кДНК.
Анализ ингибирования поглощения глицина (mGlyT-lb)
В первый день клетки млекопитающего (Flp-in™-CHO), трансфицированные mGlyT-lb кДНК, засевали с плотностью 40000 клеток/лунку в полную среду F-12 без гигромицина в 96-луночные культуральные планшеты. На второй день среду отсасывали и клетки дважды промывали буфером для поглощения. Затем клетки инкубировали в течение 20 мин при 22°С либо без потенциального ингибитора (1), либо с 10 мМ нерадиоактивного глицина (2), либо с потенциальным ингибитором в какой-либо концентрации (3). Для того чтобы получить данные для вычисления концентрации ингибитора, приводящей к 50%-ому ингибированию (например, значения ИК50, концентрации конкурирующего соединения, обеспечивающей 50%-ое ингибирование поглощения глицина), использовали диапазон концентраций потенциального ингибитора. Сразу после этого добавляли раствор, содержащий 60 нМ [3H]-глицин (11-16 Ci/ммоль) и 25 мкМ нерадиоактивный глицин. Планшеты инкубировали при слабом покачивании, реакцию останавливали путем отсасывания смеси и промывания (три раза) охлажденным до 0°С UB. Клетки лизировали сцинтилляционной жидкостью, покачивали в течение 3 часов, подсчитывали радиоактивность клеток с использованием сцинтилляционного счетчика.
Соединения, описанные в Примерах 1-60, имеют значения ИК50<1,0 мкМ. Предпочтительные значения ИК50 (<0,2 мкМ) для соединений 1-128 приведены в Таблице 1.
|
Соединения Формулы I и фармацевтически приемлемые соли соединений Формулы I могут быть использованы в качестве лекарств, например в форме фармацевтических препаратов. Данные фармацевтические препараты могут быть введены перорально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако также может быть сделано ректальное введение, например в форме суппозиториев, или парентеральное введение, например в форме растворов для инъекций.
Для изготовления фармацевтических препаратов соединения Формулы I могут быть использованы вместе с фармацевтически инертными неорганическими или органическими носителями. Например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул может быть использована лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и тому подобное. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и тому подобное. Однако в зависимости от природы активного вещества в случае мягких желатиновых капсул носители обычно не требуются. Подходящими носителями для изготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и тому подобное. Подходящими носителями для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и тому подобное.
Более того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизирующие агенты, увлажняющие агенты, эмульгаторы, подсластители, красящие вещества, корригенты, соли для регулирования осмотического давления, буферные агенты, маскирующие агенты или антиоксиданты. Они также могут содержать еще и другие терапевтически полезные вещества.
Лекарства, содержащие соединение Формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются предметом настоящего изобретения, как и способ их изготовления, который включает доведение одного или более соединений Формулы I и/или их фармацевтически приемлемых солей присоединения кислот и, если требуется, одного или более других терапевтически полезных веществ до формы галенова препарата вместе с одним или более терапевтически инертными носителями.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются показания, которые включают расстройства центральной нервной системы, например лечение или предупреждение шизофрении, когнитивного нарушения и болезни Альцгеймера.
Конечно, дозировку можно варьировать в широких пределах, и обычно в каждом конкретном случае она должна быть подобрана в соответствии с индивидуальными потребностями. В случае перорального введения доза для взрослых может меняться от приблизительно 0,01 мг до приблизительно 1000 мг в сутки соединения общей Формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточная доза может быть введена в виде однократной дозы или в виде дробных доз, и, кроме того, также может быть превышен верхний предел, когда для этого имеются показания.
Препарат таблеток (влажная грануляция)
|
Методика изготовления
1. Смешивают вещества 1, 2, 3 и 4 и смесь гранулируют с очищенной водой.
2. Сушат гранулы при 50°С.
3. Пропускают гранулы через подходящее помольное оборудование.
4. Добавляют вещество 5 и перемешивают в течение трех минут; прессуют на подходящем прессе.
Препарат капсул
|
Методика изготовления
1. Смешивают вещества 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляют вещества 4 и 5 и смешивают в течение 3 минут.
3. Заполняют подходящую капсулу.