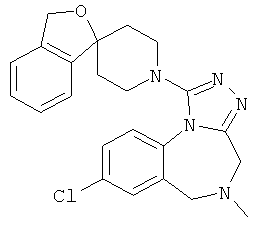
Результат интеллектуальной деятельности: СПИРО-5,6-ДИГИДРО-4Н-2,3,5,10В-ТЕТРААЗА-БЕНЗО[Е]АЗУЛЕНЫ
Вид РИД
Изобретение
Настоящее изобретение относится к спиро-дигидротетраазабензоазуленовым производным, а именно к спиро-5,6-дигидро-4Н-2,3,5,10b-тетрааза-бензо[е]азуленовым производным, которые действуют в качестве модуляторов рецептора V1a, и в частности в качестве антагонистов рецептора V1a, к получению указанных соединений, к фармацевтическим композициям, содержащим эти соединения, и их применению в качестве лекарств.
Область изобретения
Активные соединения по настоящему изобретению являются полезными в качестве лекарств периферического и центрального действия при следующих состояниях: дисменорее, мужской или женской сексуальной дисфункции, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, циррозе печени, нефротическом синдроме, тревожности, депрессивных расстройствах, обсессивно-компульсивном расстройстве, расстройствах аутистического спектра, шизофрении и агрессивном поведении.
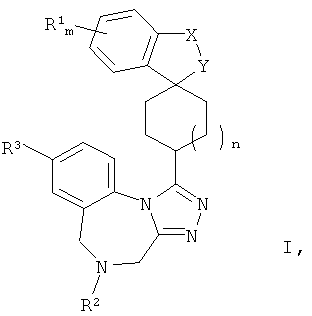
В частности, настоящее изобретение относится к спиро-дигидротетраазабензоазуленовым производным Формулы I
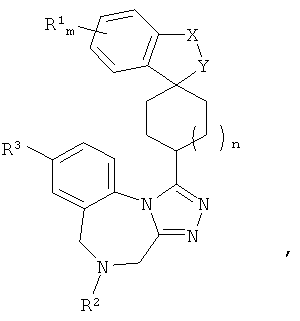
где R1, R2, R3, X, Y, Z, m и n являются такими, как описано в формуле изобретения, п.1.
Предшествующий уровень техники
Вазопрессин представляет собой пептид, состоящий из 9 аминокислот, который синтезируется, главным образом, паравентрикулярным ядром гипоталамуса. На периферии вазопрессин действует как нейрогормон и стимулирует вазоконстрикцию, гликогенолиз и антидиурез.
Известно три рецептора вазопрессина, все из которых принадлежат классу I G-белок-сопряженных рецепторов. Рецептор V1a экспрессируется в головном мозге, в печени, в гладких мышцах сосудов, в легких, в матке и семеннике. Рецептор V1b (или V3) экспрессируется в головном мозге и гипофизе, рецептор V2 экспрессируется в почках, где он регулирует реабсорбцию воды и опосредует антидиуретическое действие вазопрессина (Robben, et al. (2006) Am J Physiol Renal Physiol. 291, F257-70, "Cell biological aspects of the vasopressin type-2 receptor and aquaporin 2 water channel in nephrogenic diabetes insipidus"). Поэтому соединения, обладающие активностью в отношении рецептора V2, могут оказывать побочное действие на гомеостаз крови.
Рецептор окситоцина относится к семейству рецепторов вазопрессина и опосредует действие нейрогормона окситоцина в головном мозге и на периферии. Считается, что окситоцин оказывает центральное анксиолитическое действие (Neumann (2008) J Neuroendocrinol. 20, 858-65, " Brain oxytocin: a key regulator of emotional and social behaviours in both females and males"). Поэтому антагонисты рецептора окситоцина центрального действия могут вызывать анксиогенные эффекты, которые рассматриваются как нежелательные побочные эффекты.
В головном мозге вазопрессин действует как нейромодулятор, и его уровень повышается в мозжечковой миндалине во время стресса (Ebner, et al. (2002) Eur J Neurosci. 15, 384-8, "Forced swimming triggers vasopressin release within the amygdala to modulate stress-coping strategies in rats"). Известно, что события, вызывающие стресс, могут служить причиной глубокой депрессии и тревожности (Kendler, et al. (2003) Arch Gen Psychiatry 60, 789-96, "Life Event Dimensions of Loss, Humiliation, Entrapment, and Danger in the Prediction of Onsets of Major Depression and Generalized Anxiety") и что оба эти состояния характеризуются высокой коморбидностью, при этом тревожность часто предшествует глубокой депрессии (Regier, et al. (1998) Br J Psychiatry Suppl. 24-8, "Prevalence of anxiety disorders and their comorbidity with mood and addictive disorders"). Рецептор V1a экспрессируется во многих областях головного мозга, и в особенности в лимбических областях, таких как мозжечковая миндалина, латеральная перегородка и гиппокамп, которые играют важную роль в регуляции тревожности. Действительно, у V1a-нокаутных мышей наблюдается уменьшение уровня тревожности в тестах "крестообразный лабиринт", "открытое поле" и "темно-светлая камера" (Bielsky, et al. (2004) Neuropsychopharmacology 29, 483-93, "Profound impairment in social recognition and reduction in anxiety-like behavior in vasopressin Via receptor knockout mice"). Подавление экспрессии рецептора V1a с использованием инъекции антисмыслового олигонуклеотида в перегородку также вызывает уменьшение уровня тревожности (Landgraf, et al. (1995) Regul Pept. 59, 229-39, "V1 vasopressin receptor antisense oligodeoxynucleotide into septum reduces vasopressin binding, social discrimination abilities, and anxiety-related behavior in rats"). Вазопрессин или рецептор V1a также вовлечены в другие нейропсихологические расстройства: согласно последним генетическим исследованиям полиморфизм в последовательности промотора рецептора V1a человека связан с расстройствами аутистического спектра (Yirmiya, et al. (2006) 11, 488-94, "Association between the arginine vasopressin 1a receptor (AVPRIa) gene and autism in a family-based study: mediation by socialization skills"), показано, что интраназальное введение вазопрессина оказывает влияние на агрессивное поведение мужчин (Thompson, et al. (2004) Psychoneuroendocrinology 29, 35-48, "The effects of vasopressin on human facial responses related to social communication"), и найдено, что уровень вазопрессина повышен у пациентов, страдающих шизофренией (Raskind, et al. (1987) Biol Psychiatry 22, 453-62, "Antipsychotic drugs and plasma vasopressin in normals and acute schizophrenic patients"), и у пациентов с обсессивно-компульсивным расстройством (Altemus, et al. (1992) Arch Gen Psychiatry 49, 9-20, "Abnormalities in the regulation of vasopressin and corticotropin releasing factor secretion in obsessive-compulsive disorder").
Рецептор V1a также опосредует сердечно-сосудистое действие вазопрессина в головном мозге путем центральной регуляции артериального давления и частоты сердечных сокращений в ядре одиночного пути (Michelini and Morris (1999) Ann N Y Acad Sci. 897, 198-211, "Endogenous vasopressin modulates the cardiovascular responses to exercise"). На периферии он индуцирует сокращение гладких мышц сосудов, продолжительное ингибирование рецептора V1a улучшает гемодинамические характеристики у крыс с экспериментальным инфарктом миокарда (Van Kerckhoven, et al. (2002) Eur J Pharmacol. 449, 135-41, "Chronic vasopressin V(1A) but not V(2) receptor antagonism prevents heart failure in chronically infarcted rats"). Таким образом, ожидается, что будут полезны Vla-антагонисты с улучшенным проникновением через гемоэнцефалический барьер.
Показано, что в клинических условиях антагонист рецептора V1a вазопрессина является эффективным в ослаблении дисменореи (Brouard, et al. (2000) Bjog. 107, 614-9, "Effect of SR49059, an orally active Via vasopressin receptor antagonist, in the prevention of dysmenorrhoea"). Антагонизм рецептора V1a также вовлечен в лечение женской сексуальной дисфункции (Aughton, et al. (2008). Br J Pharmacol. doi:10,1038/bjp.2008,253, "Pharmacological profiling of neuropeptides on rabbit vaginal wall and vaginal artery smooth muscle in vitro"). На основе последних исследований в данной области можно предположить, что антагонисты рецептора V1a оказывают терапевтическое действие как в случае эректильной дисфункции, так и в случае преждевременной эякуляции (Gupta, etal. (2008) BrJ Pharmacol. 155, 118-26, "Oxytocin-induced contractions within rat and rabbit ejaculatory tissues are mediated by vasopressin V(1A) receptors and not oxytocin receptors").
Подробное описание изобретения
Задачей настоящего изобретения является получение соединений, которые действуют в качестве модуляторов рецептора V1a, и в частности в качестве антагонистов рецептора V1a. Другой задачей настоящего изобретения является получение селективных ингибиторов рецептора V1a, так как ожидается, что селективность обеспечит низкую вероятность возникновения нежелательных побочных эффектов, таких, как описано выше.
Такие V1a-антагонисты являются полезными в качестве лекарств периферического и центрального действия при следующих состояниях: дисменорее, мужской или женской сексуальной дисфункции, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, циррозе печени, нефротическом синдроме, тревожности, депрессивных расстройствах, обсессивно-компульсивном расстройстве, расстройствах аутистического спектра, шизофрении и агрессивном поведении. Предпочтительными показаниями согласно настоящему изобретению являются тревожность, депрессивные расстройства, обсессивно-компульсивное расстройство, расстройства аутистического спектра, шизофрения и агрессивное поведение.
Активность соединений в отношении рецептора V1a может быть определена в соответствии с тем, как описано в разделе Фармакологические тесты.
Нижеприведенные определения общих терминов, используемых в настоящем описании, применяются независимо от того, используются данные термины одни или в комбинации.
В контексте данного описания термин "алкил" означает насыщенную, то есть алифатическую, углеводородную группу, включая группы с нормальными или разветвленными углеродными цепями. Если не указано иное, "алкильные" группы означают группы, содержащие от 1 до 12 атомов углерода, например "С1-12-алкил". "C1-4-алкил" означает алкильные группы, содержащие от 1 до 4 атомов углерода, и "C1-7-алкил" означает алкильные группы, содержащие от 1 до 7 атомов углерода. Примерами "алкильных" групп являются метил, этил, пропил, изопропил (изо-пропил), н-бутил, изо-бутил, втор-бутил, трет-бутил и тому подобное. Предпочтительными "алкильными" группами являются метил, этил и изопропил.
Термин "алкокси" означает группу -O-R', где R' представляет собой алкил, такой, как определено выше. "С1-12-алкокси" означает алкокси-группы, содержащие от 1 до 12 атомов углерода, "C1-4-алкокси" означает алкокси-группы, содержащие от 1 до 4 атомов углерода, и "С1-7-алкокси" означает алкокси-группы, содержащие от 1 до 7 атомов углерода. Примерами "алкокси"-групп являются метокси, этокси, пропокси, трет-бутокси и тому подобное. Предпочтительными "алкокси"-группами являются метокси и трет-бутокси.
Термин "ароматический" означает присутствие в кольце секстета электронов в соответствии с правилом Хюккеля.
Термин "циано" означает группу -CN.
Термин "галогено" или "галоген" означает атом хлора, иода, фтора и брома.
Термин "галогено-С1-7-алкил" или "C1-7-галогеноалкил" означает C1-7-алкильную группу, такую, как определено выше, где по меньшей мере один из атомов водорода данной алкильной группы заменен атомом галогена, предпочтительно атомом фтора или хлора, наиболее предпочтительно атомом фтора. Примеры галогено-С1-7-алкила включают метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил или н-гексил, имеющие в качестве заместителей один или более чем один атом Cl, F, Вr или I, в частности один, два или три атома фтора или хлора, а также группы, проиллюстрированные на конкретных примерах, приведенных в данном описании ниже, но не ограничены ими. Предпочтительные галогено-С1-7-алкильные группы включают дифтор- или трифтор-метил или -этил.
Термин "гетероциклоалкил" в контексте данного описания относится к одновалентному 3-7-членному насыщенному кольцу, содержащему один или два гетероатома, выбранные из N, О или S. Примерами гетероциклоалкильных группировок являются тетрагидрофуранил, тетрагидропиранил, пирролидинил, морфолинил, тиоморфолинил, пиперидинил или пиперазинил. Гетероциклоалкил возможно имеет заместители, такие, как определено в данном описании.
Термины "гетероарил" и "5- или 6-членный гетероарил" относятся к одновалентному ароматическому 5- или 6-членному моноциклическому кольцу, у которого один или два кольцевых гетероатома выбраны из N, О или S, а остальные кольцевые атомы представляют собой С. 6-Членные гетероарилы являются предпочтительными. Примеры гетероарильных группировок включают пиридинил, пиримидинил или пиразинил, но не ограничены ими. Предпочтительной гетероарильной группировкой является пиридинил.
Термин "оксо" по отношению к заместителям гетероциклоалкила означает, что атом кислорода присоединен к гетероциклоалкильному кольцу. Следовательно, "оксо" либо может заменять два атома водорода на атоме углерода, либо может быть просто присоединен к атому серы, в этом случае атом серы присутствует в окисленной форме, то есть присутствует в виде группы, содержащей один или два атома кислорода. Предпочтительной группой, у которой "оксо" присоединен к атому серы, является группа -SO2.
При указании количества заместителей термин "один или более чем один" означает от одного заместителя до наибольшего возможного количества заместителей, то есть означает, что один или более атомов водорода, включая все атомы водорода, заменены заместителями. Предпочтительно, когда имеется один, два или три заместителя. Более предпочтительно, когда имеется один или два заместителя или один заместитель.
Термин "фармацевтически приемлемая соль" или "фармацевтически приемлемая соль присоединения кислоты" включает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метан-сульфоновая кислота, пара-толуолсульфоновая кислота и тому подобное. Соль соляной кислоты является предпочтительной.
Конкретно, настоящее изобретение относится к соединениям общей Формулы (I)
где X-Y представляет собой C(RaRb)-O, где каждый из Ra и Rb независимо представляет собой Н или C1-4-алкил,
C(RcRd)-S(O)p, где каждый из Rc и Rd независимо представляет собой Н или C1-4-алкил,
С(O)O,
СН2OСН2,
СН2СН2O, или
Z представляет собой СН или N;
R1 представляет собой галогено, циано, C1-4-алкокси или С1-4-алкил,
R2 представляет собой Н,
C1-12-алкил, незамещенный или имеющий в качестве заместителей один или более чем один ОН, галогено, циано или C1-12-алкокси,
-(CH2)q-Re, где Re представляет собой фенил или 5- или 6-членный гетероарил, каждый из которых является незамещенным или имеет один или более заместителей, независимо выбранных из А,
-(CH2)rNRiRii,
-С(O)-С1-12-алкил, где С1-12-алкил является незамещенным или имеет в качестве заместителей один или более чем один ОН, галогено, циано или C1-12-алкокси,
-C(O)(CH2)qOC(O)-C1-12-алкил,
-C(O)(CH2)qNRiRii,
-С(O)O-С1-12-алкил, где алкил является незамещенным или имеет в качестве заместителей один или более чем один ОН, галогено, циано или C1-12-алкокси,
-S(O)2-С1-12-алкил или
-S(O)2NRiRii,
каждый из Ri и Rii независимо представляет собой Н, C1-12-алкил, или Ri и Rii вместе с атомом азота, к которому они присоединены, образуют 3-7-членный гетероциклоалкил, содержащий один или два гетероатома, выбранные из N, О или S, который является незамещенным или имеет один или более заместителей, независимо выбранных из В,
А представляет собой галогено, циано, ОН, C1-7-алкил, галогено-С1-7-алкил или C1-7-алкокси,
В представляет собой оксо, галогено, ОН, C1-7-алкил или C1-7-алкокси,
R3 представляет собой Сl или F,
n имеет значение 1 или 2
m имеет значение 0, 1, 2, 3 или 4,
p имеет значение 0, 1 или 2,
q имеет значение 1, 2, 3 или 4, предпочтительно 1,
r имеет значение 2, 3 или 4,
или к фармацевтически приемлемым солям указанных соединений.
Термины "фармацевтически приемлемый носитель" и "фармацевтически приемлемое вспомогательное вещество" относятся к носителям и вспомогательным веществам, таким как разбавители или эксципиенты, которые совместимы с другими ингредиентами препарата.
Термин "фармацевтическая композиция" включает продукт, содержащий определенные ингредиенты в заранее определенных количествах или пропорциях, а также любой продукт, полученный, прямо или косвенно, в результате смешивания определенных ингредиентов в определенных количествах. Предпочтительно "фармацевтическая композиция" включает продукт, содержащий один или более чем один активный ингредиент, и возможно носитель, содержащий инертные ингредиенты, а также любой продукт, полученный, прямо или косвенно, в результате смешивания, комплексообразования или агрегирования любых двух или более ингредиентов, или в результате диссоциации одного или более чем одного ингредиента, или в результате других типов реакций или взаимодействий одного или более чем одного ингредиента.
В таблице 1 приведены аббревиатуры, используемые в настоящем описании.
|
В изобретении также предложены фармацевтические композиции, способы применения и способы получения вышеупомянутых соединений.
Соединения Формулы I могут содержать асимметрические атомы углерода. Соответственно, настоящее изобретение включает все стереоизомерные формы соединений Формулы I, включая каждый отдельный энантиомер и смеси энантиомеров, то есть отдельные оптические изомеры указанных соединений и их смеси. Соединения могут иметь дополнительные асимметрические центры, присутствие которых зависит от природы различных заместителей на молекуле. Каждый такой асимметрический центр независимо образует два оптических изомера, подразумевается, что все возможные оптические изомеры и диастереоизомеры, в виде смесей и в виде чистых или частично очищенных соединений, включены в объем настоящего изобретения. Подразумевается, что настоящее изобретение включает все такие изомерные формы указанных соединений. Независимый синтез данных диастереоизомеров или их хроматографическое разделение могут быть выполнены с использованием известных в данной области техники подходящих модификаций методологии, раскрытой в данном описании. Абсолютная стереохимическая конфигурация диастереоизомеров может быть определена путем рентгеновской кристаллографии кристаллических продуктов или кристаллических промежуточных соединений, которые, при необходимости, модифицируют реагентом, содержащим асимметрический центр с известной абсолютной конфигурацией. При желании, рацемические смеси данных соединений могут быть разделены с целью выделения отдельных энантиомеров. Такое разделение может быть выполнено с помощью методик, хорошо известных в данной области техники, например путем сочетания рацемической смеси соединений и энантиомерно чистого соединения с образованием диастереоизомерной смеси, и последующего разделения отдельных диастереоизомеров с помощью стандартных методик, таких как фракционная кристаллизация или хроматография.
Вышесказанное, в частности, относится к спироциклической концевой группе (HG) соединений Формулы I, а именно к
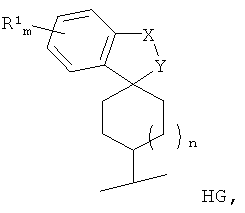
где по меньшей мере спироатом, а также Z, представляющий собой СН, являются асимметрическими атомами углерода. Подразумевается, что настоящее изобретение включает все отдельные энантиомеры концевых групп и смеси соответствующих энантиомеров.
Подразумевается также, что все варианты воплощения изобретения, описанные в данном документе, могут быть комбинированы друг с другом.
Согласно некоторым вариантам воплощения X-Y является таким, как описано выше, а именно X-Y представляет собой
C(RaRb)-O, где каждый из Ra и Rb независимо представляет собой Н или C1-4-алкил,
C(RcRd)-S(O)p, где каждый из Rc и Rd независимо представляет собой Н или C1-4-алкил и p имеет значение 0, 1 или 2,
С(O)O,
СН2OСН2 или
СН2СН2O.
Согласно некоторым вариантам воплощения каждый из Ra и Rb независимо представляет собой Н или метил; согласно некоторым вариантам воплощения Ra представляет собой Н и Rb представляет собой Н или метил.
Согласно некоторым вариантам воплощения каждый из Rc и Rd независимо представляет собой Н или метил; согласно некоторым вариантам воплощения Rc представляет собой Н и Rd представляет собой Н или метил; согласно некоторым вариантам воплощения Rc и Rd представляют собой Н. Соответственно, p имеет значение 0, 1 или 2, предпочтительно 0 или 2.
Согласно некоторым вариантам воплощения n имеет значение 1.
Согласно некоторым вариантам воплощения n имеет значение 2.
Согласно некоторым вариантам воплощения Z является таким, как описано выше, то есть представляет собой СН или N.
Согласно некоторым вариантам воплощения Z представляет собой СН. Согласно некоторым вариантам воплощения Z представляет собой N.
Согласно некоторым вариантам воплощения R1 является таким, как описано выше, то есть представляет собой галогено, циано, C1-7-алкокси или C1-7-алкил. Согласно некоторым вариантам воплощения R1 представляет собой галогено, циано, метокси или метил. Согласно некоторым вариантам воплощения R1 представляет собой галогено. Согласно некоторым вариантам воплощения R1 представляет собой F или Cl, предпочтительно F. Соответственно, m имеет значение 0, 1, 2, 3 или 4; предпочтительно 0 или 1.
Согласно некоторым вариантам воплощения R1 представляет собой галогено.
Согласно некоторым вариантам воплощения R1 представляет собой F. Согласно некоторым вариантам воплощения m имеет значение 0. Согласно некоторым вариантам воплощения m имеет значение 1.
Согласно некоторым вариантам воплощения X-Y представляет собой C(RaRb)-O, где каждый из Ra и Rb независимо представляет собой Н или метил; CH2-S(O)p, где р имеет значение 0 или 2; С(O)O; CH2OCH2 или СН2СН2O; Z представляет собой СН или N и n имеет значение 1 или 2.
Согласно некоторым вариантам воплощения X-Y представляет собой C(RaRb)-O, где каждый из Ra и Rb независимо представляет собой Н или метил; CH2-S(O)p, где p имеет значение 0 или 2; С(O)O; CH2OCH2 или CH2CH2O.
Согласно некоторым вариантам воплощения X-Y представляет собой С(Н,Ме)-O, СН2-O, CH2-S(O)2, CH2-S, С(O)O; СН2OСН2 или CH2CH2O.
Согласно некоторым вариантам воплощения X-Y представляет собой СН2-O-, С(Н,Ме)-O-, или СН2OСН2.
Согласно некоторым вариантам воплощения X-Y представляет собой C(RaRb)-O, где каждый из Ra и Rb независимо представляет собой Н или метил.
Согласно некоторым вариантам воплощения X-Y представляет собой С(Н,метил)-O.
Согласно некоторым вариантам воплощения X-Y представляет собой СН2-O.
Согласно некоторым вариантам воплощения X-Y представляет собой CH2-S(O)p, где p имеет значение 0 или 2.
Согласно некоторым вариантам воплощения X-Y представляет собой CH2-S(O)2.
Согласно некоторым вариантам воплощения X-Y представляет собой CH2-S.
Согласно некоторым вариантам воплощения X-Y представляет собой С(O)O.
Согласно некоторым вариантам воплощения X-Y представляет собой СН2OСН2.
Согласно некоторым вариантам воплощения X-Y представляет собой СН2СН2O.
Согласно некоторым вариантам воплощения изобретения R3 представляет собой Сl или F.
Согласно некоторым вариантам воплощения изобретения R3 представляет собой Сl.
Согласно некоторым вариантам воплощения изобретения R3 представляет собой F.
Согласно некоторым вариантам воплощения изобретения R2 является таким, как описано выше.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой H,
C1-7-алкил, незамещенный или имеющий в качестве заместителей один или более чем один ОН, предпочтительно С1-7-алкил,
-СН2-пиридинил,
-С(O)-С1-7-алкил,
-C(O)CH2NRiRii, где каждый из Ri и Rii независимо выбран из C1-7-алкила,
-С(O)O-С1-7-алкил, или
-S(O)2NRiRii, где каждый из Ri и Rii независимо выбран из C1-7-алкила.
Примерами R2 являются Н, метил, изо-пропил, гидроксиэтил, пиридин-2-ил-метил, метилкарбонил, N,N-диметиламино-метил-карбонил, метоксикарбонил, трет-бутоксикарбонил или N,N-диметиламиносульфонил. Предпочтительно R2 представляет собой метил или изо-пропил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой Н.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой C1-7-алкил, незамещенный или имеющий в качестве заместителей один или более чем один ОН, предпочтительно C1-7-алкил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой метил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой изо-пропил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой гидроксиэтил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой-СН2-пиридинил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой пиридин-2-ил-метил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой-С(O)-С1-7-алкил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой метилкарбонил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой-C(O)CH2NRiRii, где каждый из Ri и Rii независимо выбран из С1-7-алкила.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой N,N-диметиламино-метил-карбонил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой -С(O)O-С1-7-алкил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой метоксикарбонил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой трет-бутоксикарбонил.
Согласно некоторым вариантам воплощения изобретения R2 представляет собой S(O)2NRiRii, где каждый из Ri и Rii независимо выбран из C1-7-алкила.
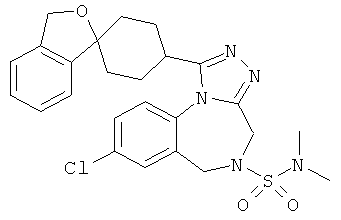
Согласно некоторым вариантам воплощения изобретения R2 представляет собой N,N-диметиламиносульфонил.
Согласно некоторым вариантам воплощения изобретения спироциклические концевые группы выбраны из
(1s,4's)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ила,
(1r,4'r)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ила,
1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ила,
7-фтор-1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ила,
6-фтор-1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ила,
5-фтор-1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ила,
3-метил-1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ила
3H-спиро[2-бензофуран-1,4'-пиперидин]-3-он-1'-ила,
1'H,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ила,
2,2-диоксидо-1'Н,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ила,
1H-спиро[изохромен-4,4'-пиперидин]-1'-ила,
3,4-дигидро-1'H-спиро[изохромен-1,4'-пиперидин]-1'-ила,
(4S)-3'Н-спиро[азепан-4,1'-[2]бензофуран]-ила или
(4R)-3'H-спиро[азепан-4,1'-[2]бензофуран]-ила.
Согласно некоторым вариантам воплощения спироциклическая концевая группа HG представляет собой
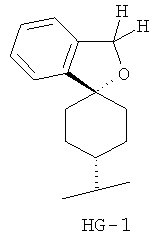
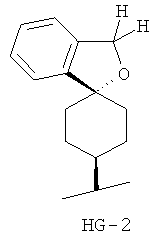
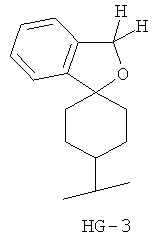
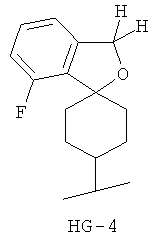
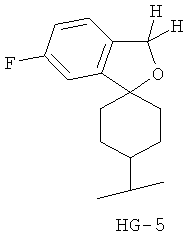
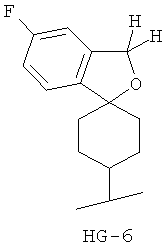
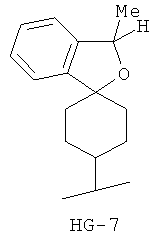
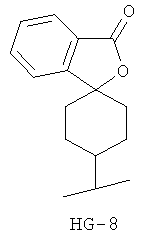
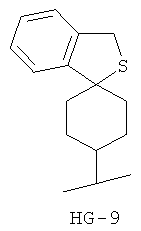
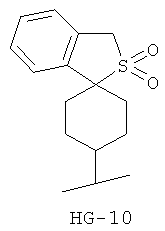
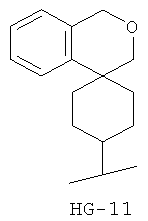
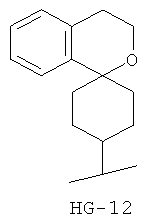
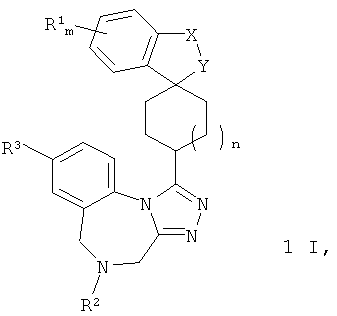
Согласно одному из вариантов воплощения изобретения предложено соединение Формулы 1
где X-Y представляет собой C(RaRb)-O, где каждый из Ra и Rb независимо представляет собой Н или метил,
CH2-S(O)p, где p имеет значение 0 или 2,
С(O)O,
CH2OCH2,
СН2СН2O, Z представляет собой СН или N;
R1 представляет собой галогено, и m имеет значение 0 или 1;
R2 представляет собой Н,
C1-7-алкил, незамещенный или имеющий в качестве заместителей один или более чем один ОН, предпочтительно С1-7-алкил,
-СН2-пиридинил,
-С(O)-С1-7-алкил,
-C(O)CH2NRiRii, где каждый из Ri и Rii независимо выбран из C1-7-алкила,
-С(O)O-С1-7-алкил или
-S(O)2NRiRii, где каждый из Ri и Rii независимо выбран из C1-7-алкила;
R3 представляет собой Сl или F, предпочтительно Сl,
n имеет значение 1 или 2,
или его фармацевтически приемлемая соль.
Согласно одному из вариантов воплощения изобретения предложено соединение Формулы I, которое представляет собой соединение Формулы I'

где HG выбрана из групп HG-1-HG-14, таких, как описано выше, R2 представляет собой Н,
C1-7-алкил, незамещенный или имеющий в качестве заместителей один или более чем один ОН, предпочтительно C1-7-алкил,
-СН2-пиридинил,
-С(O)-С1-7-алкил,
-C(O)CH2NRiRii, где каждый из Ri и Rii независимо выбран из C1-7-алкила,
-С(O)O-С1-7-алкил или
-S(O)2NRiRii, где каждый из Ri и Rii независимо выбран из C1-7-алкила;
R3 представляет собой Сl или F, предпочтительно Сl,
n имеет значение 1 или 2,
или его фармацевтически приемлемая соль.
Примеры соединений по изобретению приведены ниже в Экспериментальной части и Таблице 2.
|
Предпочтительные соединения по изобретению описаны в разделе Примеры. Особенно предпочтительными соединениями являются:
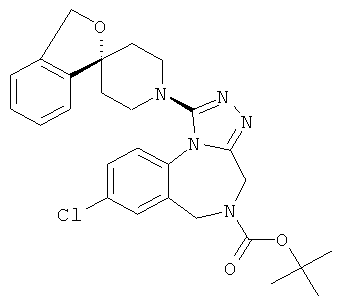
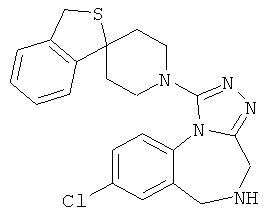
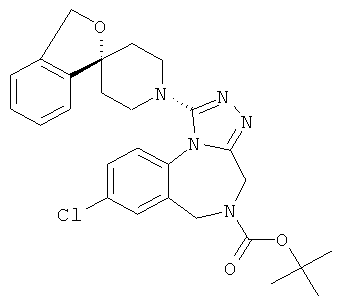
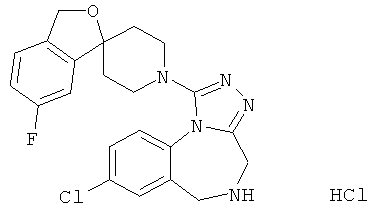
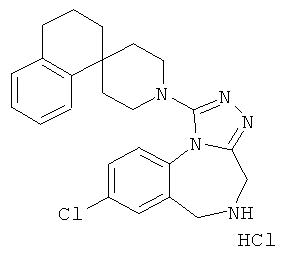
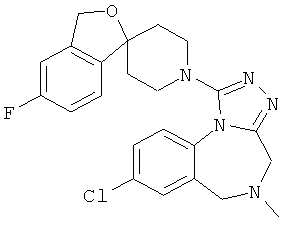
трет-бутил 8-хлор-1-[(1r,4'r)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-карбоксилат;
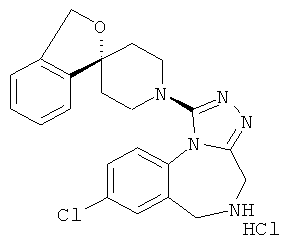
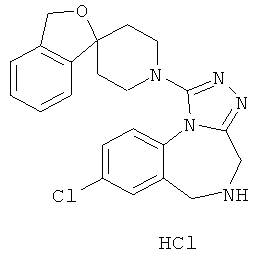
8-хлор-1-[(1r,4'r)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид;
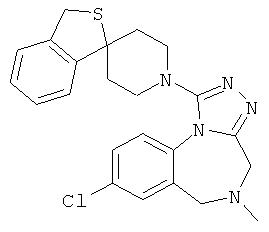
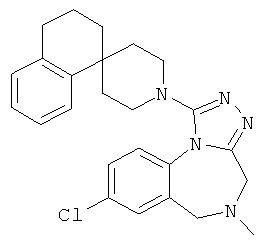
8-хлор-5-метил-1-[(1r,4'r)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
8-хлор-1-[(1s,4's)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид;
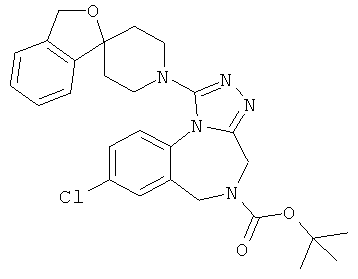
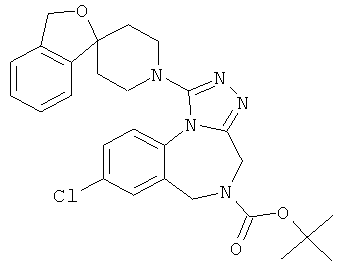
трет-бутил 8-хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилат;
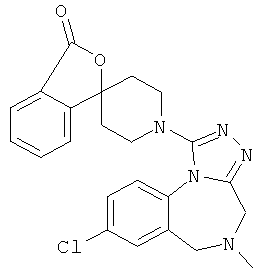
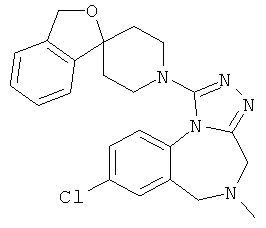
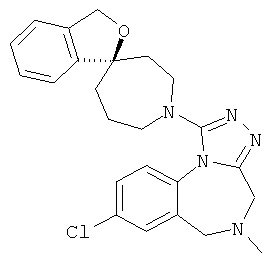
8-хлор-5-метил-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
8-хлор-5-изопропил-1-(1'H,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
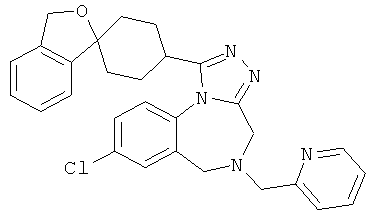
8-хлор-5-(пиридин-2-илметил)-1-(1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
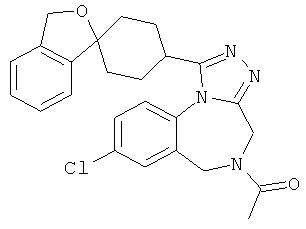
5-ацетил-8-хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
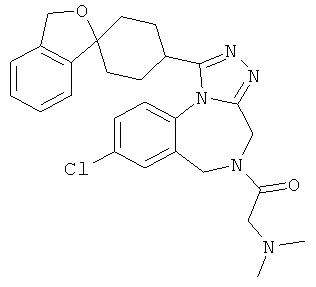
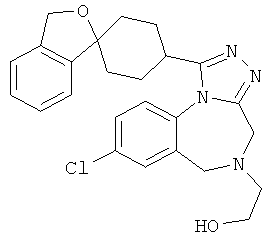
2-[8-хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-ил]-N,N-диметил-2-оксоэтанамин;
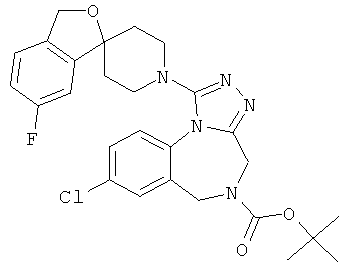
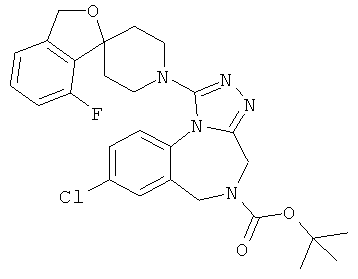
трет-бутил 8-хлор-1-(6-фтор-1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-карбоксилат;
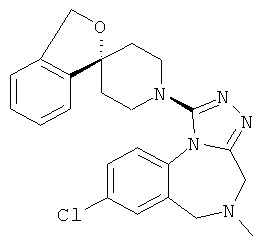
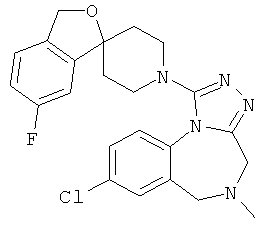
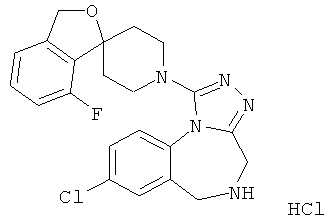
8-хлор-1-(6-фтор-1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
8-хлор-1-(7-фтор-1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
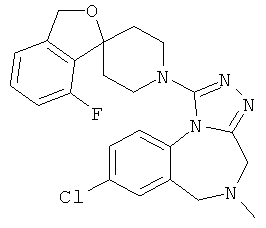
8-хлор-1-(5-фтор-1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
трет-бутил 8-хлор-1-(3-метил-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилат;
8-хлор-5-метил-1-(3-метил-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
1'-(8-хлор-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3Н-спиро[2-бензофуран-1,4'-пиперидин]-3-он;
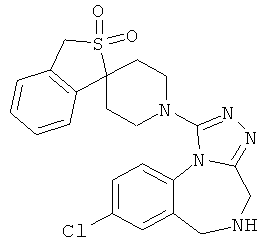
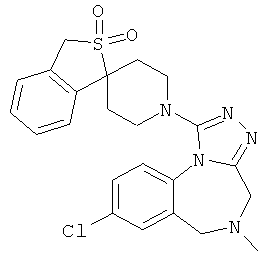
8-хлор-5-метил-1-(1'H,3Н-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
8-хлор-1-(2,2-диоксидо-1'Н,3Н-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин;
1'-(8-хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-1Н-спиро[изохромен-4,4'-пиперидин];
1'-(8-хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3,4-дигидроспиро[изохромен-1,4'-пиперидин];
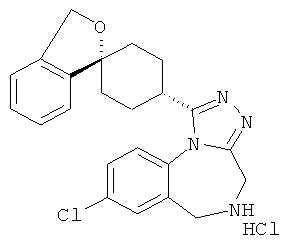
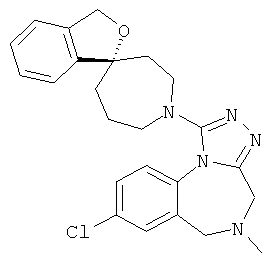
(+)-1-(8-хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'Н-спиро[азепан-4,1'-[2]бензофуран] или
(-)-1-(8-хлор-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'Н-спиро[азепан-4,1'-[2]бензофуран].
Наиболее предпочтительными являются следующие соединения:
(+)-1-(8-хлор-5-метил-5,6-дигидро-4Н-(1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'Н-спиро[азепан-4,1'-[2]бензофуран],
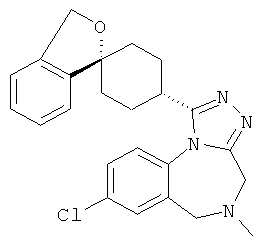
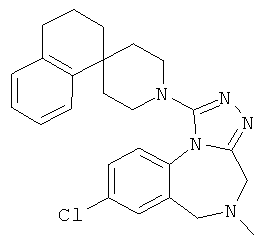
8-хлор-5-метил-1-[(1r,4'r)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин,
8-хлор-5-метил-1-(3-метил-1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин,
(-)-1-(8-хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'Н-спиро[азепан-4,1'-[2]бензофуран],
8-хлор-5-метил-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин,
1'-(8-хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-1Н-спиро[изохромен-4,4'-пиперидин],
8-хлор-1-(6-фтор-1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин,
8-хлор-5-изопропил-1-(1'H,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин или
8-хлор-1-(5-фтор-1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин.
Согласно одному из вариантов воплощения изобретения соединения Формулы (I) по изобретению могут быть получены в соответствии со способом, включающим стадию взаимодействия соединения Формулы (II)
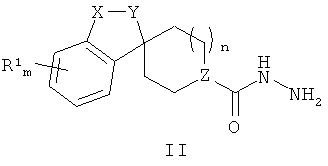
с соединением Формулы (III)
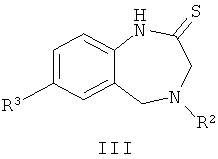
с получением соединения Формулы (1-1), где R1, R2, X-Y, m и n являются такими, как определено выше в описании Формулы (I), и Z представляет собой СН.
Согласно другому варианту воплощения соединения Формулы (I) по изобретению могут быть получены в соответствии со способом, включающим стадию взаимодействия соединения Формулы (IV)
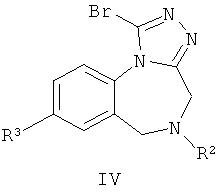
с соединением Формулы (V)
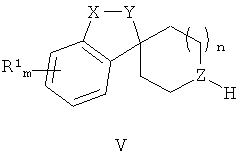
с получением соединения Формулы (1-2), где R1, R2, X-Y, m и n являются такими, как определено выше в описании Формулы (I), и Z представляет собой N.
Согласно одному из вариантов воплощения изобретения предложено соединение согласно любому из воплощений, которое может быть получено описанным выше способом.
Согласно одному из вариантов воплощения изобретения предложено соединение согласно любому из воплощений, полученное описанным выше способом.
Согласно одному из вариантов воплощения изобретения предложено соединение согласно любому из воплощений для применения в качестве терапевтически активного вещества.
Согласно одному из вариантов воплощения изобретения предложено соединение согласно любому из воплощений для применения в предупреждении или лечении дисменореи, мужской или женской сексуальной дисфункции, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, цирроза печени, нефротического синдрома, тревожности, депрессивных расстройств, обсессивно-компульсивного расстройства, расстройств аутистического спектра, шизофрении и агрессивного поведения.
Согласно одному из вариантов воплощения изобретения предложена фармацевтическая композиция, содержащая соединение согласно любому из воплощений.
Согласно одному из вариантов воплощения изобретения предложена фармацевтическая композиция, содержащая соединение согласно любому из воплощений, полезная в предупреждении или лечении дисменореи, мужской или женской сексуальной дисфункции, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, цирроза печени, нефротического синдрома, тревожности, депрессивных расстройств, обсессивно-компульсивного расстройства, расстройств аутистического спектра, шизофрении и агрессивного поведения.
Согласно одному из вариантов воплощения изобретения предложено применение соединения согласно любому из воплощений в приготовлении лекарства.
Согласно одному из вариантов воплощения изобретения предложено применение соединения согласно любому из воплощений в приготовлении лекарства, полезного для предупреждения или лечения дисменореи, мужской или женской сексуальной дисфункции, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, цирроза печени, нефротического синдрома, тревожности, депрессивных расстройств, обсессивно-компульсивного расстройства, расстройств аутистического спектра, шизофрении и агрессивного поведения.
Согласно одному из вариантов воплощения изобретения предложено применение соединения согласно любому из воплощений в предупреждении или лечении дисменореи, мужской или женской сексуальной дисфункции, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, цирроза печени, нефротического синдрома, тревожности, депрессивных расстройств, обсессивно-компульсивного расстройства, расстройств аутистического спектра, шизофрении и агрессивного поведения.
Согласно одному из вариантов воплощения изобретения предложен способ терапевтического и/или профилактического лечения дисменореи, мужской или женской сексуальной дисфункции, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, цирроза печени, нефротического синдрома, тревожности, депрессивных расстройств, обсессивно-компульсивного расстройства, расстройств аутистического спектра, шизофрении и агрессивного поведения, включающий введение соединения, такого, как определено в любом из воплощений, человеку или животному.
Способы получения соединений согласно настоящему изобретению описаны более подробно на следующих общих схемах и в методиках А-Н.
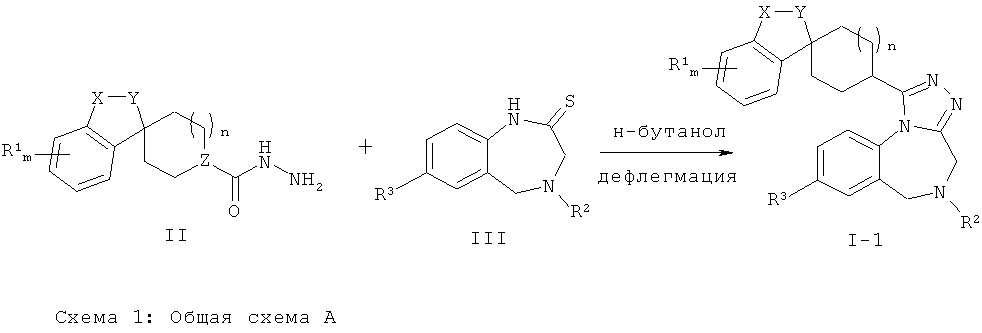
Схема 1: Общая Схема А
Соединения Формулы (1-1) (соединения Формулы (I), где Z представляет собой СН) могут быть получены путем термической конденсации гидразидного производного Формулы (II) и тиолактамного производного Формулы (III). Соединения Формулы (II) могут быть получены в соответствии с Общей Схемой Е, как описано ниже. Синтез соединений Формулы (III) приведен на Общей Схеме D ниже. Общая Схема А дополнительно проиллюстрирована общей методикой I, описанной ниже.
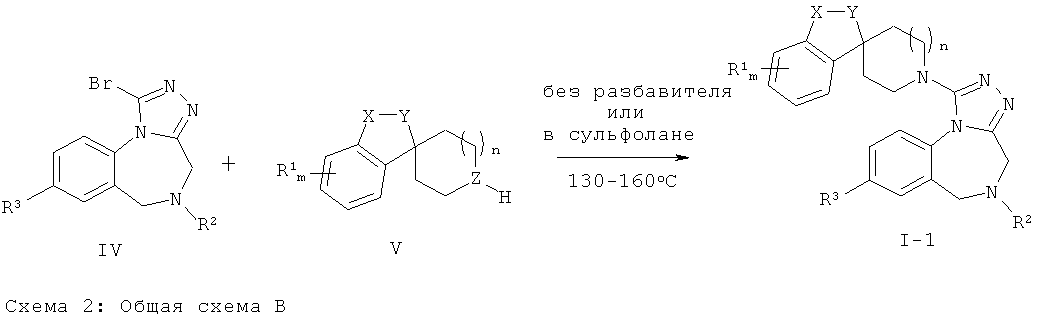
Соединения Формулы (1-2) (соединения Формулы (I), где Z представляет собой N) могут быть получены путем термической конденсации бромтриазольного промежуточного соединения Формулы (IV) и аминного производного Формулы (V). Синтез соединений Формулы (IV) приведен на Общей Схеме D ниже. Соединения Формулы (V) либо имеются в продаже, либо могут быть получены из имеющихся в продаже исходных веществ с использованием методик, известных в данной области техники. Альтернативно, соединения Формулы (V) могут быть получены в соответствии с Общими Схемами F, G или Н, как описано ниже.
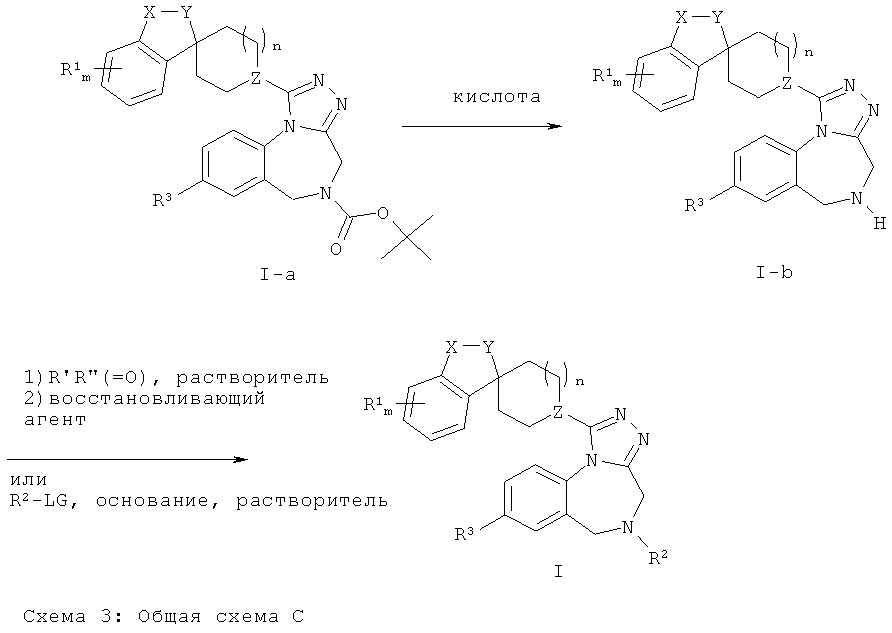
Соединения Формулы (I), где R2 не является Н, могут быть получены из соединений Формулы (1-b) (соединений Формулы (I), где R2 представляет собой Н) в соответствии с методиками, известными в данной области техники, например путем обработки соединения Формулы (1-b) неорганическим основанием, таким как карбонатная соль, или органическим основанием, таким как третичный амин, и электрофильным реагентом R2-LG (где LG представляет собой уходящую группу, например, атом галогена или сульфонил), который либо имеется в продаже, либо может быть легко получен из известных исходных веществ в соответствии с методиками, хорошо известными в данной области техники. Альтернативно, соединения Формулы (I) могут быть получены путем восстановительного алкилирования в результате последовательной обработки соединения Формулы (1-b) кетоном или альдегидом и подходящим восстанавливающим агентом, например боргидридным производным, таким как боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид натрия. Соединения Формулы (1-b) могут быть получены путем отщепления заместителя R2 у соединения Формулы 1 с использованием методик, известных в данной области техники. Соединения Формулы (1-b) удобно получать в виде соли или свободного основания (после обработки водным основанием) путем обработки соединений Формулы (I-а) (соединений Формулы (I), где R2 представляет собой трет-бутоксикарбонил) кислотой в подходящем растворителе, например метансульфоновой кислотой в дихлорметане или тетрагидрофуране или соляной кислотой в метаноле. Общая Схема С дополнительно проиллюстрирована общими методиками II и III, описанными ниже.
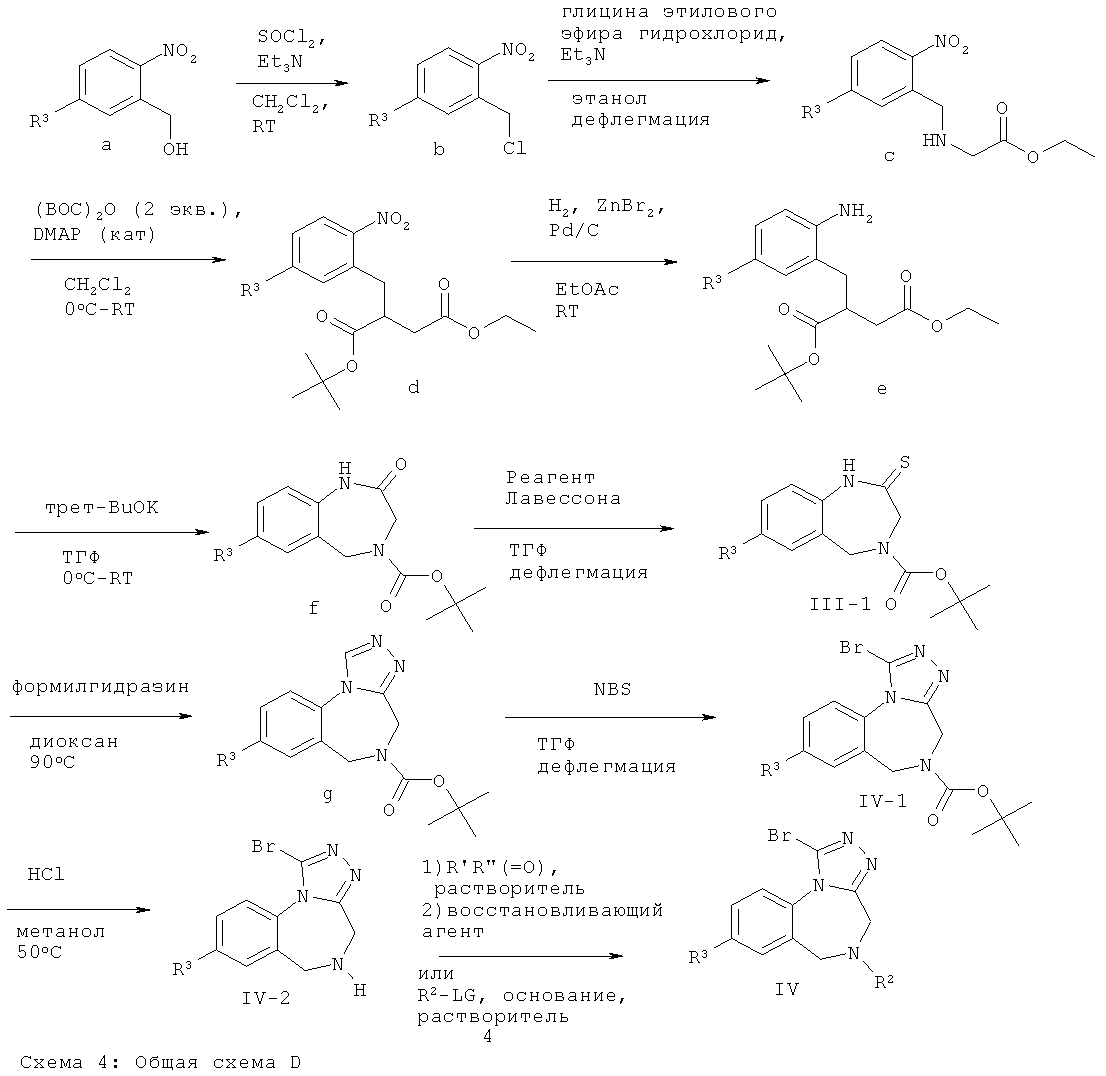
Тиолактамные производные Формулы (III-1) (соединения Формулы (III), где R2 представляет собой трет-бутоксикарбонил) и бромтриазольные производные Формул (IV), (IV-1) (соединения Формулы (IV), где R2 представляет собой трет-бутоксикарбонил) и (IV-2) (соединения Формулы (IV), где R2 представляет собой Н) могут быть получены следующим образом. 2-Нитробензиловый спирт Формулы (а) превращают в бензилхлорид Формулы (b) с использованием хлорирующего реагента, такого как тионилхлорид, в присутствии третичного амина в качестве органического основания. Алкилирование соединения Формулы (b) гидрохлоридом этилового эфира глицина в присутствии третичного амина в качестве органического основания и N-защита полученного соединения Формулы (с) с использованием ди-трет-бутил-дикарбоната и каталитического количества 4-N,N-диметиламинопиридина приводят к получению соединений Формулы (d). Нитро-группа может быть избирательно восстановлена путем гидрогенизации в присутствии палладия на активированном угле, который предварительно обрабатывают галогенидом цинка, таким как бромид цинка, с получением анилиновых промежуточных соединений Формулы (е). Циклизацию до лактамов Формулы (f) осуществляют путем обработки соединений Формулы (е) подходящим основанием, например трет-бутилатом калия, в тетрагидрофуране. Тиолактамное производное Формулы (111-1) получают путем обработки соединения Формулы (f) реагентом Лавессона (2,4-бис-(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфидом) или пентасульфидом фосфора при повышенной температуре.
Тиолактам Формулы (111-1) может быть превращен в триазольное производное Формулы (g) путем конденсации с формилгидразином. Соединение Формулы (IV-1) (соединение Формулы (IV), где R2 представляет собой трет-бутоксикарбонил) может быть получено в результате взаимодействия соединения Формулы (g) с подходящим бромирующим агентом, таким как N-бромсукцинимид. Соединения Формулы (IV-2) (соединения Формулы (IV), где R2 представляет собой Н) получают в виде соли или свободного основания (после обработки водным основанием) путем обработки соединений Формулы (IV-1) кислотой в подходящем растворителе, например метансульфоновой кислотой в дихлорметане или тетрагидрофуране или соляной кислотой в метаноле. Соединения Формулы (IV), где R2 не является Н, могут быть получены с использованием известных в данной области техники методик, например путем обработки соединения Формулы (IV-2) неорганическим основанием, таким как карбонатная соль, или органическим основанием, таким как третичный амин, и электрофильным реагентом R2-LG (где LG представляет собой уходящую группу, например, атом галогена или сульфонил), который либо имеется в продаже, либо может быть легко получен из известных исходных веществ в соответствии с методиками, хорошо известными в данной области техники. Альтернативно, соединения Формулы (IV) могут быть получены путем восстановительного алкилирования в результате последовательной обработки соединения Формулы (I-b) кетоном или альдегидом и подходящим восстанавливающим агентом, например борогидридным производным, таким как боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид натрия. Соединения Формулы (IV-3) (соединения Формулы (IV), где R2 представляет собой метил) могут быть получены путем восстановительного метилирования с использованием параформальдегида.
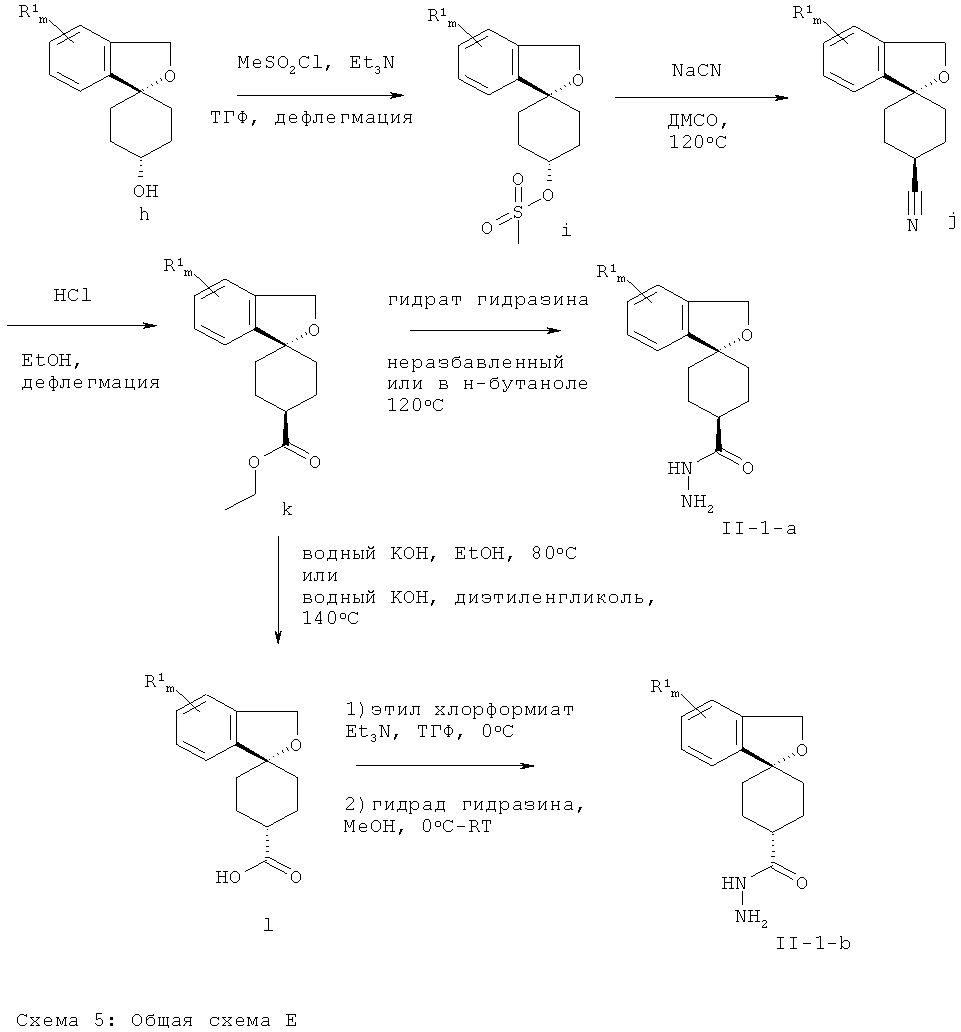
Гидразидные промежуточные соединения Формулы (II-1) (соединения Формулы (II), где X-Y представляет собой СН2-O и n имеет значение 1) могут быть получены, как описано в данном изобретении ниже, из промежуточных соединений Формулы (II) (вторичных спиртов), в качестве исходных веществ. Промежуточные соединения Формулы (h) могут быть получены в соответствии с методикой, описанной в литературе (F.J.Urban, G.Anderson; Organic Process Research & Development 1999, 3, 460-464). Метансульфоновой кислоты эфир Формулы (i) может быть получен путем обработки соединения Формулы (h) метансульфохлоридом в присутствии третичного амина в качестве основания. Обработка соединения Формулы (i) цианидом натрия в диметилсульфоксиде приводит к получению нитрильного производного Формулы (j), которое может быть сольволизовано до сложноэфирного промежуточного соединения Формулы (k) в растворе хлористого водорода в этаноле при температуре дефлегмации. Соединение Формулы (k) может быть превращено в гидразидное производное Формулы (II-1-а) (соединение Формулы (II-1), где гидразидная и фенильная группы находятся в цис-положении относительно друг друга) путем нагревания с гидратом гидразина. Альтернативно, сложноэфирное производное Формулы (k) может быть гидролизовано с эпимеризацией до карбоновой кислоты Формулы (I) с использованием гидроксида калия в этаноле при 80°С или в диэтиленгликоле при 140°С. Гидразидное производное Формулы (II-1-b) (соединение Формулы (II-1), где гидразидная и фенильная группы находятся в транс-положении относительно друг друга) может быть получено в результате активации кислотного промежуточного соединения Формулы (I), например, этил хлорформиатом, тионилхлоридом, оксалилхлоридом или конденсирующим агентом для пептидного синтеза и последующего взаимодействия с гидразином.
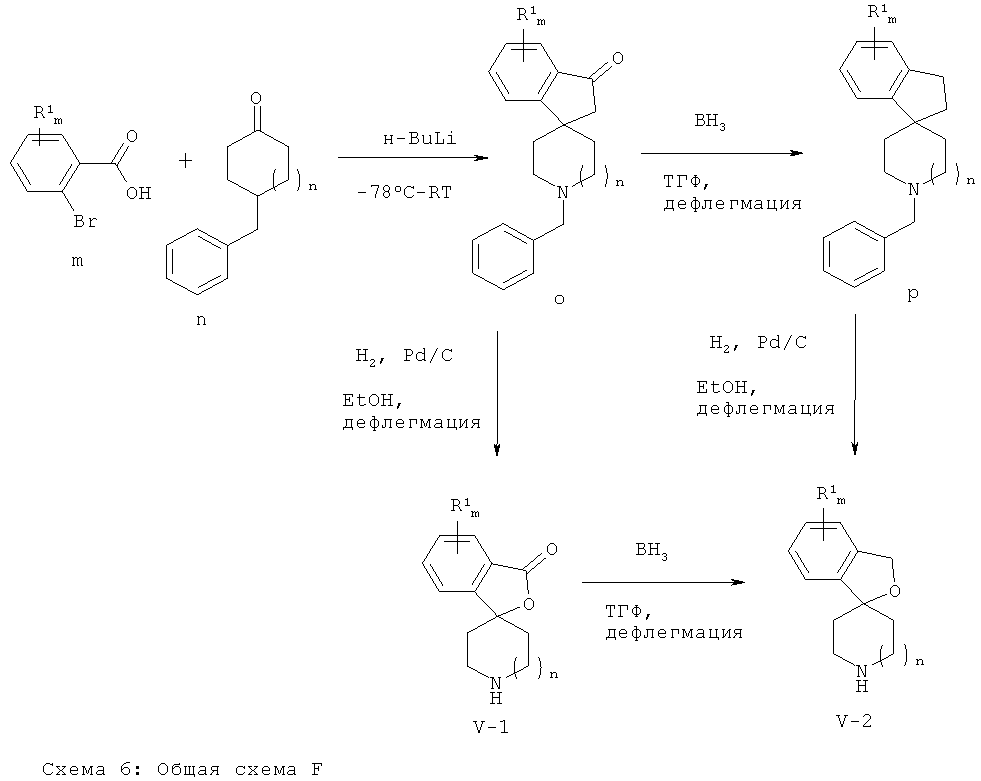
Аминные промежуточные соединения Формул (V-1) (соединения Формулы (V), где X-Y представляет собой С(=O)-O) и (V-2) (соединения Формулы (V), где X-Y представляет собой СН2-O) могут быть получены следующим образом: Двойное литирование производного 2-бромбензойной кислоты Формулы (m) путем депротонирования и бром-литиевого обмена с использованием алкиллитиевого реагента и последующее добавление к циклическому кетоновому производному Формулы (n) приводят к получению спиролактонового производного Формулы (о). Восстановление карбонильной группы лактона Формулы (о) приводит к получению соединения Формулы (p). Аминные производные Формул (V-1) и (V-2) получают путем гидрогенолитического N-дебензилирования соединений Формул (о) и (p), соответственно, в присутствии палладиевого катализатора.
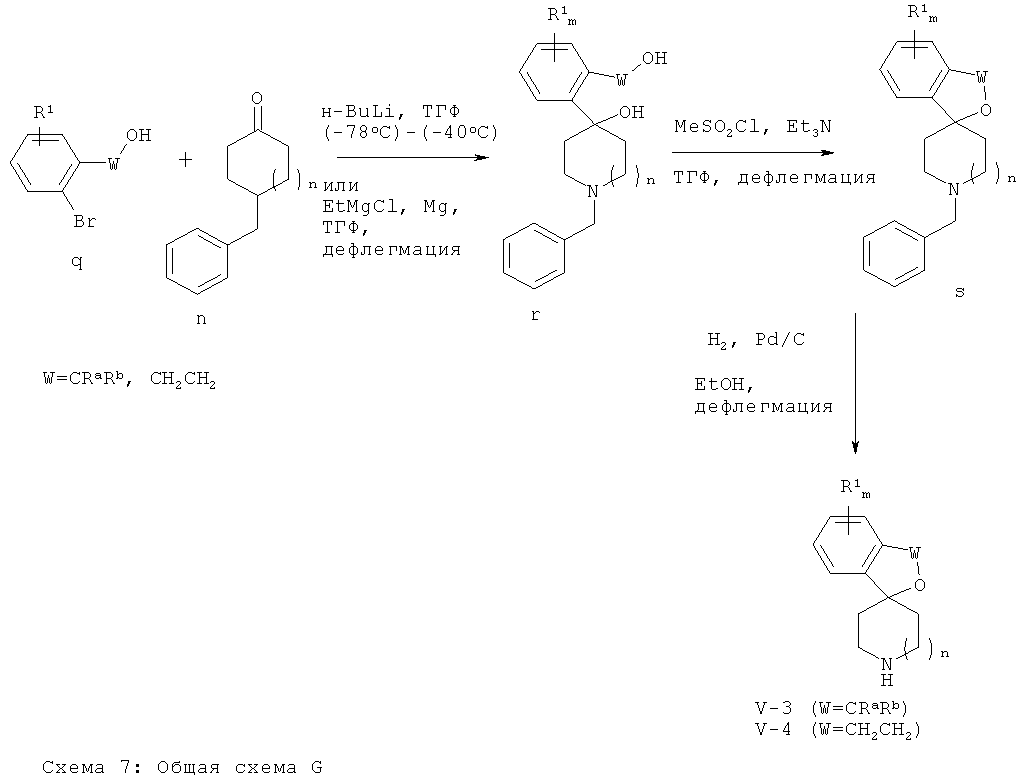
Аминные промежуточные соединения Формул (V-3) (соединения Формулы (V), где X-Y представляет собой CRaRb-O) и (V-4) (соединения Формулы (V), где X-Y представляет собой CH2-CH2-O) могут быть получены следующим образом: Двойное металлирование производного 2-бромарил-замещенного алифатического спирта Формулы (q) путем O-депротонирования и обмена брома на металл с использованием магния, реагента Гриньяра или алкиллитиевого реагента и последующее добавление к циклическому кетоновому производному Формулы (n) приводят к получению спиро-производного Формулы (s). Аминные производные Формул (V-3) и (V-4) получают путем гидрогенолитического N-дебензилирования соединения Формулы (s) в присутствии палладиевого катализатора.
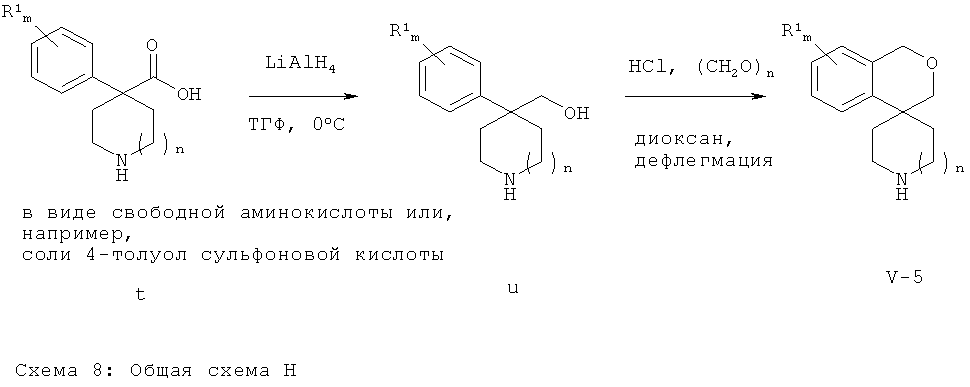
Аминные промежуточные соединения Формулы (V-5) (соединения Формулы (V), где X-Y представляет собой СН2-O-СН2) могут быть получены следующим образом. Пиперидиновое или азепановое производное Формулы (t), которое в положении 4 имеет в качестве геминальных заместителей арильную группу и группу карбоновой кислоты, может быть восстановлено до аминоспиртового производного Формулы (u) восстанавливающим агентом, таким как алюмогидрид лития. Циклизация производного Формулы (u) с использованием формальдегида в присутствии соляной кислоты приводит к получению спиро-производного Формулы (V-5).
Соединения по настоящему изобретению проявляют активность в отношении рецептора V1a. Данные соединения являются селективными ингибиторами рецептора V1a, и поэтому, по-видимому, имеется низкая вероятность того, что эти соединения будут вызывать нежелательные побочные эффекты. V1a-Активность соединений может быть измерена, как описано ниже.
Соответствующие фармацевтически приемлемые соли с кислотами могут быть получены с использованием стандартных методик, известных специалисту в данной области техники, например путем растворения соединения Формулы I в подходящем растворителе, таком как, например, диоксан или ТГФ, и добавления подходящего количества соответствующей кислоты. Полученные продукты обычно могут быть выделены путем фильтрации или хроматографии. Превращение соединения Формулы I в фармацевтически приемлемую соль с основанием может быть осуществлено путем обработки соединения соответствующим основанием. Одна из возможных методик получения такой соли включает добавление 1/n эквивалента основной соли, такой как, например, М(ОН)n, где М представляет собой катион металла или аммония и n представляет собой количество гидроксид-анионов, к раствору соединения в подходящем растворителе (например, в этаноле, смеси этанола и воды, смеси тетрагидрофурана и воды) и удаление растворителя путем выпаривания или лиофилизации.
Когда в разделе Примеры не описаны методики синтеза, соединения Формулы I, а также все промежуточные соединения могут быть получены с использованием аналогичных методик или в соответствии с методиками, приведенными в данном описании. Соответствующие исходные вещества либо имеются в продаже, либо являются известными в данной области техники, либо могут быть получены с помощью методик, известных в данной области техники, или аналогичных методик.
Следует понимать, что соединения общей Формулы 1 по настоящему изобретению могут быть модифицированы по функциональным группам с получением производных, которые in vivo способны превращаться в исходные соединения.
Фармакологические тесты
V1a-рецептор человека клонировали путем ОТ-ПЦР (полимеразной цепной реакции с участием обратной транскриптазы) из суммарной РНК печени человека. После секвенирования, подтверждающего идентичность амплифицированной последовательности, кодирующую последовательность субклонировали в экспрессирующий вектор. Для доказательства аффинности соединений по настоящему изобретению к V1a-рецептору человека, выполняли анализ связывания. Клеточные мембраны получали из клеток НЕК293, временно трансфицированных полученным экспрессирующим вектором и выращенных в 20-литровом ферментаторе, в соответствии со следующим протоколом.
50 г клеток ресуспендируют в 30 мл свежеприготовленного и охлажденного до 0°С буфера для лизиса (50 мМ HEPES, 1 мМ ЭДТА, 10 мМ MgCl2 (рН доводят до 7,4)+полная смесь ингибиторов протеаз (Roche Diagnostics)). Гомогенизируют с помощью POLYTRON в течение 1 мин и разрушают ультразвуком на льду 2×2 мин при интенсивности 80% (ультразвуковой аппарат Vibracell). Данный препарат центрифугируют 20 мин при 500 g при 4°С, осадок удаляют, и супернатант центрифугируют 1 час при 43000 g при 4°С (19000 об/мин). Осадок ресуспендируют в смеси 12,5 мл буфера для лизиса+12,5 мл 20% сахарозы и гомогенизируют с использованием POLYTRON в течение 1-2 мин. Концентрацию белка определяют методом Бредфорда, и аликвоты хранят при -80°С до их использования. Для анализа связывания 60 мг SPA-шариков с ядром из силиката иттрия (Amersham) смешивают с аликвотой мембран в буфере для связывания (50 мМ Трис, 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 10 мМ MgCl2) в течение 15 минут при перемешивании. Затем в каждую лунку 96-луночного планшета добавляют по 50 мкл смеси шариков и мембран и затем по 50 мкл 4 нМ 3Н-вазопрессина (American Radiolabeled Chemicals). Для измерения общего связывания в соответствующие лунки добавляют 100 мкл буфера для связывания, для измерения неспецифического связывания -100 мкл 8,4 мМ холодного вазопрессина и для измерения связывания исследуемых соединений - 100 мкл из последовательных разведений каждого соединения в 2% ДМСО. Планшет инкубируют 1 ч при комнатной температуре, центрифугируют 1 мин при 1000 g и подсчитывают на счетчике Packard Top-Count. Из значений, полученных для каждой лунки, вычитают значение неспецифического связывания, и полученные значения нормируют на значение максимального специфического связывания, принятое за 100%.
Значение ИК50 (концентрации, требуемой для 50% ингибирования связывания) рассчитывают путем подгонки кривой с использованием модели нелинейной регрессии (XLfit), и значение Ki рассчитывают с использованием уравнения Cheng-Prussoff.
Следующие репрезентативные данные показывают антагонистическую активность соединений по настоящему изобретению в отношении рецептора V1a человека (см. табл. 3).
|
Фармацевтические композиции
Соединения Формулы I, а также их фармацевтически приемлемые соли присоединения кислот можно применять в качестве лекарств, например, в форме фармацевтических препаратов. Данные фармацевтические препараты можно вводить перорально, например, в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение также можно выполнять ректально, например, в форме суппозиториев, или парентерально, например, в форме инъекционных растворов.
Изготовление таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул может включать обработку соединений Формулы I и их фармацевтически приемлемых солей присоединения кислот вместе с фармацевтически инертными, неорганическими или органическими эксципиентами. В качестве таких эксципиентов, например, для таблеток, драже и твердых желатиновых капсул могут быть использованы лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и так далее.
Эксципиентами, подходящими для мягких желатиновых капсул, являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и так далее.
Эксципиентами, подходящими для изготовления растворов и сиропов, являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и так далее. Эксципиентами, подходящими для инъекционных растворов, являются, например, вода, спирты, полиолы, глицерин, растительные масла и так далее. Эксципиентами, подходящими для суппозиториев, являются, например, натуральные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и так далее.
Кроме того, данные фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красящие вещества, корригенты, соли для изменения осмотического давления, буферные агенты, маскирующие агенты или антиоксиданты. Они также могут дополнительно содержать другие терапевтически полезные вещества.
Доза может меняться в широких пределах и, конечно, в каждом конкретном случае соответствует индивидуальным требованиям. Обычно в случае перорального введения подходящая суточная доза для человека должна составлять приблизительно от 10 до 1000 мг соединения общей Формулы I, хотя при необходимости вышеупомянутый верхний предел может быть также превышен.
Настоящее изобретение проиллюстрировано следующими не ограничивающими его примерами. Все значения температуры приведены в градусах Цельсия.
Примеры композиций по изобретению включают следующие композиции.
Пример А
Таблетки, имеющие следующую композицию, изготавливают стандартным способом (см. Табл. 4).
|
Технология изготовления
1. Смешивают ингредиенты 1, 2, 3 и 4 и гранулируют с очищенной водой.
2. Сушат гранулы при 50°С.
3. Пропускают гранулы через подходящее помольное оборудование.
4. Добавляют ингредиент 5 и перемешивают в течение трех минут; прессуют на подходящем прессе.
Пример В-1
Изготовление капсул, имеющих следующую композицию см. Табл. 5).
|
|
Технология изготовления
1. Смешивают ингредиенты 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляют ингредиенты 4 и 5 и перемешивают в течение 3 минут.
3. Заполняют подходящую капсулу.
Соединение Формулы I, лактозу и кукурузный крахмал сначала смешивают в смесителе и затем в измельчителе. Смесь снова переносят в смеситель, добавляют тальк (и стеарат магния), и тщательно перемешивают. Данной смесью с помощью специального устройства наполняют капсулы, например твердые желатиновые капсулы.
Пример В-2
Изготовление мягких желатиновых капсул, имеющих следующую композицию (см. Табл. 6, 7).
|
|
Технология изготовления
Соединение Формулы I растворяют в теплой расплавленной массе других ингредиентов, и данной смесью наполняют мягкие желатиновые капсулы подходящего размера. Заполненные мягкие желатиновые капсулы обрабатывают с использованием стандартных методик.
Пример С
Изготовление суппозиториев, имеющих следующую композицию (см. Табл. 8).
|
Технология изготовления
Суппозиторную массу плавят в стеклянном или стальном сосуде, тщательно перемешивают и охлаждают до 45°С. Затем к этой смеси добавляют тонкоизмельченное соединение Формулы I, и перемешивают до тех пор, пока соединение не будет полностью диспергировано. Данную смесь заливают в формы для суппозиториев подходящего размера, оставляют охлаждаться, и затем суппозитории извлекают из форм и по отдельности упаковывают в вощеную бумагу или металлическую фольгу.
Пример D
Приготовление инъекционных растворов, имеющих следующую композицию (см. табл. 9).
|
Технология изготовления
Соединение Формулы 1 растворяют в смеси полиэтиленгликоля 400 и воды для инъекционных растворов (используя только часть воды). рН доводят до 5,0 путем добавления уксусной кислоты. Объем доводят до 1,0 мл путем добавления оставшегося количества воды. Полученный раствор фильтруют, раствором заполняют пробирки (с использованием подходящего допустимого избытка раствора) и стерилизуют.
Пример Е
Изготовление пакетиков, содержащих следующую композицию:
|
Технология изготовления
Соединение Формулы I смешивают с лактозой, микрокристаллической целлюлозой и натриевой солью карбоксиметилцеллюлозы и гранулируют со смесью поливинилпирролидона и воды. Полученный гранулят смешивают со стеаратом магния и вкусовыми добавками, и данную смесь насыпают в пакетики.
Экспериментальная часть
Следующие примеры 1-37 даны для иллюстрации изобретения. Их следует рассматривать не как ограничение объема изобретения, а только как примеры, типичные для данного изобретения.
Гидразидные промежуточные соединения Формулы (II) Гидразид 1 (1r,4'r)-3Н-Спиро[2-бензофуран-1,1'-циклогексан]-4'-карбогидразид а) (1s,4's)-3Н-Спиро[2-бензофуран-1,1'-циклогексан]-4'-ол
К раствору 3Н,4'H-спиро[2-бензофуран-1,1'-циклогексан]-4'-она (2,5 г, 12 ммоль) в этаноле (36 мл) добавляли боргидрид натрия (0,69 г, 18 ммоль) при комнатной температуре с использованием охлаждения в водяной бане. После перемешивания в течение 16 ч к реакционной смеси добавляли 2 М водный раствор хлористого водорода. Растворитель выпаривали, и водный остаток экстрагировали двумя порциями этилацетата. Объединенные органические слои промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии с использованием в качестве элюента смеси н-гептан/этилацетат получали указанное в заголовке соединение (1,95 г, 78,9%) в виде светло-желтого твердого вещества.
Масс-спектр, m/е: 204 (M+).
b) (1s,4's)-3H-Спиро[2-бензофуран-1.1'-циклогексан1-4'-ил метансульфонат
К раствору (1s,4's)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-ола (0,70 г, 3,4 ммоль) и триэтиламина (0,48 мл, 3,4 ммоль) в дихлорметане (17 мл) добавляли метансульфохлорид (0,27 мл, 3,4 ммоль) при 0-5°С. Перемешивали в течение 1 ч и затем промывали водой и солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения (0,91 г, 94%) в виде желтоватого твердого вещества.
Масс-спектр, m/е: 341 (М+АсО-).
c)(1r,4'r)-3Н-Спиро[2-бензофуран-1,1'-циклогексан]-4'-карбонитрил
Раствор (1s,4's)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил метансульфоната (0,91 г, 3,2 ммоль) и цианида натрия (0,31 г, 6,4 ммоль) в диметилсульфоксиде (6,4 мл) перемешивали в течение 30 мин при 120°С. Реакционную смесь оставляли охлаждаться до комнатной температуры и разбавляли 1 М водным раствором карбоната натрия. Экстрагировали тремя порциями трет-бутилметиловаго эфира, затем объединенные органические слои промывали двумя порциями воды и солевым раствором, сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии с использованием в качестве элюента смеси н-гептан/этилацетат получали указанное в заголовке соединение (0,41 г, 60%) в виде бесцветного масла.
Масс-спектр, m/е: 213 (М+).
d) Этил (1r,4'r)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-карбоксилат
Смесь (1r,4'r)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-карбонитрила (0,40 г, 1,9 ммоль) и раствора концентрированной соляной кислоты (4,7 мл, 56 ммоль) в этаноле (20 мл) нагревали при температуре дефлегмации в течение 72 ч. После охлаждения до комнатной температуры реакционную смесь выливали на лед и подщелачивали 32% водным раствором гидроксида натрия. Затем смесь экстрагировали двумя порциями трет-бутилметилового эфира. Объединенные органические слои промывали 1 М водным раствором гидроксида натрия, сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии с использованием в качестве элюента смеси н-гептан/этилацетат получали указанное в заголовке соединение (0,20 г, 41%) в виде белого твердого вещества.
Масс-спектр, m/е: 260 (М+).
е) (1r,4'r)-3H-Спиро[2-бензофуран-1.1'-циклогексан]-4'-карбогидразид
Смесь этил (1r,4'r)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-карбоксилата (0,2 г, 0,8 ммоль) и гидрата гидразина (0,04 мл, 0,7 ммоль) нагревали при температуре дефлегмации в течение 4 ч. Добавляли еще одну порцию гидрата гидразина (0,04 мл, 0,7 ммоль), и реакционную смесь нагревали при температуре дефлегмации дополнительно в течение 18 ч. После охлаждения до комнатной температуры добавляли н-бутанол (0,5 мл) и еще одну порцию гидрата гидразина (0,07 мл, 1,4 ммоль), и реакционную смесь нагревали при температуре дефлегмации еще в течение 4 часов. Смесь оставляли охлаждаться до комнатной температуры, разбавляли этилацетатом (30 мл) и промывали 1 М водным раствором гидроксида натрия (30 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения (0,16 г, 87%) в виде белого твердого вещества.
Масс-спектр, m/е: 247 (М+Н+).
Гидразид 2 (1s,4's)-3Н-Спиро[2-бензофуран-1,1'-циклогексан]-4'-карбогидразид
а) (1s,4's)-3H-Спиро[2-бензофуран-1.1'-циклогексан1-4'-карбоновая кислота
Получение 1-й партии неочищенного указанного в заголовке соединения. Смесь (1r,4'r)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-карбонитрила (0,15 г, 0,70 ммоль) в этаноле (7 мл) и 2 М водном растворе гидроксида калия (0,88 мл) нагревали при температуре дефлегмации в течение 16 ч. Затем реакционную смесь разбавляли диэтиленгликолем (10 мл) и перемешивали в течение 4 ч при 130°С. После охлаждения до комнатной температуры реакционную смесь разбавляли трет-бутилметиловым эфиром и экстрагировали двумя порциями 0,5 М водного раствора гидроксида натрия. Объединенные водные слои промывали трет-бутилметиловым эфиром и затем подкисляли раствором концентрированной соляной кислоты. Кислотный водный слой экстрагировали двумя порциями трет-бутилметилового эфира. Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали под вакуумом с получением неочищенного указанного в заголовке соединения (0,05 г) в виде светло-коричневого твердого вещества.
Получение 2-й партии неочищенного указанного в заголовке соединения. Смесь (1r,4'r)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-карбонитрила (0,48 г, 2,3 ммоль) в диэтиленгликоле (15 мл) и 3 М водном растворе гидроксида калия (7,5 мл) перемешивали в течение 72 ч при 140°С. После охлаждения до комнатной температуры реакционную смесь разбавляли трет-бутилметиловым эфиром и экстрагировали двумя порциями 0,5 М водного раствора гидроксида натрия. Объединенные водные слои промывали трет-бутилметиловым эфиром и затем подкисляли раствором концентрированной соляной кислоты. Кислотный водный слой экстрагировали двумя порциями трет-бутилметилого эфира. Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали под вакуумом с получением неочищенного указанного в заголовке соединения (0,4 г).
Две партии неочищенного указанного в заголовке соединения объединяли и очищали путем флэш-хроматографии с получением чистого указанного в заголовке соединения (0,30 г, 57%) в виде белого твердого вещества.
Масс-спектр, m/е: 231 (M-H+).
b) (1s,4's)-3Н-Спиро[2-бензофуран-1.1'-циклогексан]-4'-карбогидразид
К раствору (1s,4's)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-карбоновой кислоты (0,16 г, 0,67 ммоль) и триэтиламина (0,098 мл, 0,70 ммоль) в тетрагидрофуране (7 мл) добавляли этил хлорформиат (0,067 мл, 0,70 ммоль) при 0°С. Данную реакционную смесь перемешивали в течение 30 мин. Аммониевые соли отфильтровывали, и полученный фильтрат добавляли к раствору гидрата гидразина (0,065 г, 1,3 ммоль) в метаноле (7 мл). Данную реакционную смесь перемешивали в течение 18 ч при комнатной температуре. Добавляли этилацетат (100 мл) и затем промывали 1 М водным раствором гидроксида натрия (100 мл) и солевым раствором (100 мл). Объединенные водные слои экстрагировали этилацетатом (100 мл). Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения (0,16 г, 96%) в виде белого твердого вещества.
Масс-спектр, m/е: 247 (M+H+).
Промежуточное соединение Формулы (III-1)
7-Хлор-2-тиооксо-1,2,3,5-тетрагидро-бензо[е][1,4]диазепин-4-карбоновой кислоты трет-бутиловый эфир
а) 4-Хлор-2-хлорметил-1-нитро-бензол
К раствору 5-хлор-2-нитробензилового спирта (80 г, 0,42 моль) и триэтиламина (64 мл, 0,46 моль) в дихлорметане (840 мл) добавляли по каплям в течение 30 мин тионилхлорид (34 мл, 0,46 моль), поддерживая температуру внутри смеси ниже 32°С путем охлаждения в водяной бане. Данную реакционную смесь перемешивали в течение 3 ч. Растворитель выпаривали, и остаток растирали в теплом трет-бутилметиловом эфире (970 мл). Аммониевые соли удаляли путем фильтрования, и фильтрат концентрировали под вакуумом с получением указанного в заголовке соединения (85 г, 99%) в виде коричневого масла, которое без очистки использовали на следующей стадии.
Масс-спектр, m/е: 205 (M+).
b) (5-Хлор-2-нитро-бензиламино)-уксусной кислоты этиловый эфир
Смесь 4-хлор-2-хлорметил-1-нитро-бензола (85 г, 0,41 моль), глицина этилового эфира гидрохлорида (70 г, 0,50 моль) и триэтиламина (121,4 мл, 0,8665 моль) в этаноле (1000 мл) нагревали при температуре дефлегмации в течение 8 ч. Растворитель выпаривали, и остаток растирали в теплом трет-бутилметиловом эфире. Аммониевые соли удаляли путем фильтрования, и фильтрат концентрировали под вакуумом с получением указанного в заголовке соединения (111 г, 99%) в виде аморфного коричневого твердого вещества, которое без очистки использовали на следующей стадии.
Масс-спектр, m/е: 273 (M+H+).
c) [трет-Бутоксикарбонил-(5-хлор-2-нитро-бензил)-амино]-уксусной кислоты этиловый эфир
Раствор (5-хлор-2-нитро-бензиламино)-уксусной кислоты этилового эфира (110 г, 0,403 моль), ди-трет-бутил-дикарбоната (180 г, 0,807 моль) и 4-N,N-диметиламинопиридина (2,51 г, 0,0202 моль) в дихлорметане (1200 мл) перемешивали в течение 2 ч при 0°С и затем в течение 16 ч при комнатной температуре. Растворитель выпаривали, и полученный неочищенный продукт очищали путем флэш-хроматографии, используя в качестве элюента смесь циклогексан/этилацетат, с выходом указанного в заголовке соединения (76,4 г, 51%) в виде светло-желтого вязкого масла.
Масс-спектр, m/е: 373 (М+H+).
d) [(2-Амино-5-хлор-бензил)-трет-бутоксикарбонил-амино]-уксусной кислоты этиловый эфир
К раствору [трет-бутоксикарбонил-(5-хлор-2-нитро-бензил)-амино]-уксусной кислоты этилового эфира (69,0 г, 0,186 моль) в этилацетате (1200 мл) добавляли бромид цинка (8,5 г, 0,037 моль). Через 15 мин реакционную смесь продували аргоном. После добавления палладиевого катализатора (10% на активированном угле, 7,9 г, 0,0074 моль) смесь гидрогенизировали при атмосферном давлении в течение приблизительно 48 ч, пока расход газообразного водорода не составил приблизительно 13 л. Катализатор удаляли путем фильтрования, и полученный фильтрат промывали двумя порциями насыщенного водного раствора бикарбоната натрия и двумя порциями солевого раствор. Органический слой сушили над безводным сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения (60,6 г, 95,5%) в виде желтого воскообразного твердого вещества. Масс-спектр, m/е: 343 (M+H+).
e) 7-Хлор-2-оксо-1,2,3,5-тетрагидро-бензо[1,4]диазепин-4-карбоновой кислоты трет-бутиловый эфир
К раствору [(2-амино-5-хлор-бензил)-трет-бутоксикарбонил-амино]-уксусной кислоты этилового эфира (60 г, 0,18 моль) в тетрагидрофуране (600 мл) небольшими порциями добавляли трет-бутилат калия (22 г, 0,19 моль) при 5°С, используя для охлаждения баню с ледяной водой. После завершения добавления охлаждающую баню удаляли, и реакционную смесь перемешивали в течение 3 ч при комнатной температуре, затем добавляли воду (400 мл), насыщенный водный раствор хлорида аммония (280 мл) и этилацетат (800 мл). Через 10 мин осадок собирали путем фильтрования. Органический слой фильтрата отделяли, сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток объединяли с осадком, который был ранее собран путем фильтрования, и проводили кристаллизацию из горячего этилацетата с получением указанного в заголовке соединения (46 г, 88%) в виде белого твердого вещества.
Масс-спектр, m/е: 295 (M-H+).
f) 7-Хлор-2-тиооксо-1,2,3,5-тетрагидро-бензо[е][1,4]диазепин-4-карбоновой кислоты трет-бутиловый эфир
Смесь 7-Хлор-2-оксо-1,2,3,5-тетрагидро-бензо[1,4]диазепин-4-карбоновой кислоты трет-бутилового эфира (41,1 г, 0,139 моль) и 2,4-бис-(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфида (31,5 г, 0,0763 моль) в тетрагидрофуране (1100 мл) нагревали при температуре дефлегмации в течение 3 ч. Растворитель выпаривали, и остаток растирали в трет-бутилметиловом эфире. Осадок удаляли путем фильтрования, и фильтрат концентрировали досуха. Остаток кристаллизовали из горячего этанола с получением указанного в заголовке соединения (37,5 г, 86,4%) в виде светло-желтого твердого вещества.
Масс-спектр, m/е: 311 (M-H+).
Промежуточные соединения Формулы (IV)
Бромтриазол 1
1-Бром-8-хлор-4H,6Н-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутиловый эфир
a) 8-Хлор-4H,6H-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутиловый эфир
К раствору 7-хлор-2-тиооксо-1,2,3,5-тетрагидро-бензо[е][1,4]диазепин-4-карбоновой кислоты трет-бутилового эфира (10,0 г, 32,0 ммоль) в диоксане (200 мл) при 90°С добавляли в течение периода времени, составляющего 4 часа, формилгидразин (10,7 г, 160 ммоль). Данную реакционную смесь перемешивали в течение ночи при 90°С, затем упаривали. Остаток очищали путем хроматографии (силикагель 300 г; гептан:этилацетат, 8:2-0:1) с получением 8-хлор-4Н,6Н-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (7,71 г, 75%) в виде белого твердого вещества.
Масс-спектр, m/е: 379 ([М+CH3COO-]).
b) 1-Бром-8-хлор-4H,6H-2,3,5,10b-тетрааза-бензо[e]азулен-5-карбоновой кислоты трет-бутиловый эфир
К 8-хлор-4Н,6H-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутиловому эфиру (7,00 г, 21,8 ммоль) в тетрагидрофуране (140 мл) добавляли N-бромсукцинимид (4,50 г, 24,0 ммоль). Данную смесь перемешивали в кипящем тетрагидрофуране в течение 2 часов. Растворитель удаляли под вакуумом, и остаток очищали путем хроматографии (силикагель 50 г; гептан:этилацетат, 1:9-1:0) с получением 1-бром-8-хлор-4H,6Н-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (7,39 г, (85%) в виде белого твердого вещества.
Масс-спектр, m/е: 401 (М+H+).
Бромтриазол 2
1-Бром-8-хлор-5,6-дигидро-4Н-2,3,5,10b-тетрааза-бензо[е]азулен
Раствор 1-бром-8-хлор-4Н,6Н-2,3,5,10b-тетрааза-бензоазулен-5-карбоновой кислоты трет-бутилового эфира (3,0 г, 7,6 ммоль) в 1,25 М растворе хлористого водорода в метаноле (60 мл, 76 ммоль) нагревали в течение 10 мин при 50°С. Затем реакционную смесь вливали в 1 М водный раствор гидроксида натрия (200 мл) и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения (1,9 г, 84%) в виде светло-желтого твердого вещества.
Масс-спектр, m/е: 255 (M+H+).
Бромтриазол 3
1-Бром-8-хлор-5-метил-5,6-дигидро-4Н-2,3,5,10b-тетрааза-бензоазулен
Смесь 1-бром-8-хлор-5,6-дигидро-4Н-2,3,5,10b-тетрааза-бензо[е]азулена (1,9 г, 6,4 ммоль) и параформальдегида (1,5 г, 51 ммоль) в метаноле (64 мл) нагревали при температуре дефлегмации в течение 16 ч. После охлаждения до 0°С добавляли цианоборгидрид натрия (0,8 г, 13 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 3 ч. Смесь гасили 1 М водным раствором гидроксида натрия (200 мл), затем водный слой экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии на аминопропил-модифицированном силикагеле с использованием в качестве элюента смеси н-гептан/этилацетат получали указанное в заголовке соединение (0,61 г; чистота: приблизительно 85% согласно данным 1H-ЯМР) в виде белого твердого вещества.
Масс-спектр, m/е: 313 (M+H+).
Аминные промежуточные соединения Формулы (V)
Амин 1
5-Фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]
а) 1'-Бензил-5-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин]-3-он
К перемешиваемому раствору 2-бром-5-фторбензойной кислоты (5,0 г, 21,9 ммоль) в тетрагидрофуране (30 мл) при -70°С добавляли по каплям в течение 1 часа 1,6 М раствор н-бутиллития в гексане (44 мл, 70,1 ммоль). Через 3 часа добавляли по каплям раствор 1-бензил-4-пиперидона (8,5 г, 43,8 ммоль) в тетрагидрофуране (20 мл). Данную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Затем смесь вливали в перемешиваемую смесь воды (150 мл) и диэтилового эфира (150 мл). Водный слой экстрагировали диэтиловым эфиром (2×40 мл), подкисляли путем добавления 5 н. HCl (20 мл) до рН 2 и кипятили в течение 1 часа. Затем смесь охлаждали до 0°С, подщелачивали путем добавления 5 н. NaOH до рН 10 и быстро экстрагировали дихлорметаном (3×80 мл). Объединенные экстракты промывали водой (80 мл), сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Неочищенное масло хроматографировали на силикагеле (элюент: гептан/этилацетат 1:1) с получением 1'-бензил-5-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]-3-она (2,27 г, (33%) в виде светло-желтого твердого вещества.
Масс-спектр, m/е: 312 (M+H+).
о) 5-Фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин]-3-он
1'-Бензил-5-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин]-3-он (0,622 г, 2 ммоль) суспендировали в этаноле (6 мл). Данную смесь подкисляли путем добавления нескольких капель 37% HCl. Добавляли 10% Pd/C (65 мг, 0,06 ммоль). Данную смесь подвергали дефлегмации в атмосфере водорода в течение 1 часа, затем охлаждали до комнатной температуры, продували аргоном и разбавляли дихлорметаном. Отфильтровывали катализатор, и фильтрат концентрировали под вакуумом. Полученное белое твердое вещество растворяли в воде (20 мл). Данный раствор подщелачивали 2 М раствором Na2CO3 и 3 раза экстрагировали дихлорметаном. Объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали под вакуумом с получением 5-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]-3-она (0,42 г, (96%) в виде белого твердого вещества.
Масс-спектр, m/е: 222 (М+H+).
с) 5-Фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]
К суспензии 5-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]-3-она (420 мг, 1,9 ммоль) в тетрагидрофуране (4,2 мл) добавляли по каплям 1 М раствор боргидрида в тетрагидрофуране (3,8 мл, 3,8 ммоль) при 0°С. Данную смесь подвергали дефлегмации в течение ночи и затем охлаждали до 0°С. Добавляли по каплям 5 н. HCl (2 мл). Затем смесь подвергали дефлегмации в течение 5 часов, охлаждали до 0°С, разбавляли водой и подщелачивали путем добавления 5 н. NaOH (pH 10). Затем смесь 3 раза экстрагировали этилацетатом. Объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Остаток перемешивали с диэтиловым эфиром и фильтровали. Фильтрат концентрировали под вакуумом с получением 5-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин] (0,22 г, 55%) в виде светло-желтого масла.
Масс-спектр, m/е: 208 (М+H+).
Амин 2
6-Фтор-3H-спиро [2-бензофуран-1,4'-пиперидин]
a) 1'-Бензил-6-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин]-3-он
Указанное в заголовке соединение получали в соответствии с описанной выше методикой синтеза 1'-бензил-5-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин]-3-она (с использованием 2-бром-4-фторбензойной кислоты вместо 2-бром-5-фторбензойной кислоты) в виде желтоватого твердого вещества (выход: (41%).
Масс-спектр, m/е: 312 (M+H+).
b) 1'-Бензил-6-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин]
К суспензии 1'-бензил-6-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]-3-она (3 г, 9,6 ммоль) в тетрагидрофуране (40 мл) добавляли по каплям 1 М раствор боргидрида в тетрагидрофуране (20 мл, 20 ммоль) при 0°С. Данную смесь подвергали дефлегмации в течение ночи и затем охлаждали до 0°С. Добавляли по каплям 5 н. HCl (2 мл). Затем смесь подвергали дефлегмации в течение 5 часов, охлаждали до 0°С, разбавляли водой и подщелачивали путем добавления 5 н. NaOH (pH 10). Затем смесь 3 раза экстрагировали этилацетатом. Объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Остаток хроматографировали на силикагеле (элюент: гептан:этилацетат 8:2) с получением 1'-бензил-6-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин] (2 г, 71%) в виде бесцветного масла.
Масс-спектр, m/е: 298 (M+H+).
c) 6-Фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин]
К раствору 1'-бензил-6-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин] (1 г, 3,4 ммоль) в этаноле (10 мл) добавляли 10% Pd/C (100 мг, 0,09 ммоль). Данную смесь подвергали дефлегмации в атмосфере водорода в течение 8 часов, затем охлаждали до комнатной температуры и продували аргоном. Отфильтровывали катализатор, и фильтрат концентрировали под вакуумом с получением 6-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин] (0,67 г, (96%) в виде белого твердого вещества.
Масс-спектр, m/е: 208 (M+H+).
Амин 3
7-Фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]
а) 1'-Бензил-7-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]-3-он
Указанное в заголовке соединение получали в соответствии с описанной выше методикой синтеза 1'-бензил-5-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]-3-она (с использованием 2-бром-3-фторбензойной кислоты вместо 2-бром-5-фторбензойной кислоты) в виде белого твердого вещества (выход: 20%).
Масс-спектр, m/е: 312 (M+H+).
b) 1'-Бензил-7-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]
Указанное в заголовке соединение получали в соответствии с описанной выше методикой синтеза 1'-бензил-6-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин] в виде белого твердого вещества (выход: 82%).
Масс-спектр, m/е: 298 (M+H+).
c) 7-Фтор-3H-спиро[2-бензофуран-1,4'-пиперидин]
К раствору 1'-бензил-6-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин] (1 г, 3,4 ммоль) в этаноле (10 мл) добавляли 10% Pd/C (100 мг, 0,09 ммоль). Данную смесь подвергали дефлегмации в атмосфере водорода в течение 8 часов, затем охлаждали до комнатной температуры и продували аргоном. Отфильтровывали катализатор, и фильтрат концентрировали под вакуумом с получением 6-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин] (0,67 г, (96%) в виде белого твердого вещества.
Масс-спектр, m/е: 208 (M+H+).
Амин 4 (RS)-3-Метил-3Н-спиро[2-бензофуран-1,4'-пиперидин]
a) (RS)-1-(2-Бром-фенил)-этанол
К раствору 2'-бромацетофенона (15 г, 74,6 ммоль) в МеОН (150 мл) в атмосфере аргона при комнатной температуре добавляли NaBH4 (4,23 г, 0,11 моль). Данную реакционную смесь перемешивали в течение 24 ч при комнатной температуре, затем гасили путем добавления воды. Добавляли 5 н. HCl до получения рН 6-7. Выпаривали МеОН. Остаток растворяли в диэтиловом эфире и промывали один раз водой и один раз солевым раствором. Органическую фазу сушили над Na2SO4 и концентрировали под вакуумом. Остаток хроматографировали на силикагеле (элюент: гептан: этилацетат 1:1) с получением (RS)-1-(2-бром-фенил)-этанола (14,8 г, 99%) в виде бесцветного масла.
b) (RS)-1-Бензил-4-[2-(1-гидрокси-этил)-фенил]-пиперидин-4-ол
К перемешиваемому раствору (RS)-1-(2-бром-фенил)-этанола (8,0 г, 39,8 ммоль) в тетрагидрофуране (40 мл) при -70°С добавляли по каплям в течение 20 мин 1,6 М раствор н-бутиллития в гексане (57,2 мл, 91,5 ммоль). Через 2 часа добавляли по каплям раствор 1-бензил-4-пиперидона (10,2 мл, 55,7 ммоль) в тетрагидрофуране (32 мл). Данную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Затем смесь вливали в перемешиваемую смесь воды (200 мл) и диэтилового эфира (200 мл). Водный слой экстрагировали диэтиловым эфиром (2×100 мл). Объединенные экстракты промывали водой (80 мл), сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Неочищенное масло хроматографировали на силикагеле (элюент:гептан/этилацетат 3:7) с получением (RS)-1-бензил-4-[2-(1-гидрокси-этил)-фенил]-пиперидин-4-ола (6,1 г, 49%) в виде белого твердого вещества.
Масс-спектр, m/е: 312 (М+H+).
c) (RS)-1'-Бензил-3-метил-3Н-спиро[2-бензофуран-1,4'-пиперидин]
К раствору (RS)-1-бензил-4-[2-(1-гидрокси-этил)-фенил]-пиперидин-4-ола (3 г, 9,6 ммоль) в тетрагидрофуране (30 мл) добавляли триэтиламин (2,95 мл, 21,2 ммоль), диметиламинопиридин (120 мг, 0,96 ммоль) и метансульфонилхлорид (0,84 мл, 10,6 ммоль). Данную реакционную смесь подвергали дефлегмации в течение 3 часов, охлаждали до комнатной температуры, гасили водой (15 мл) и этилацетатом (15 мл). Органическую фазу сушили над Na2SO4 и концентрировали под вакуумом с получением (RS)-1'-бензил-3-метил-3Н-спиро[2-бензофуран-1,4'-пиперидин] в виде оранжевого масла (2,95 г, выход количественный).
Масс-спектр, m/е: 294 (M+H+).
d) (RS)-3-Метил-3H-спиро[2-бензофуран-1,4'-пиперидин]
Указанное в заголовке соединение получали в соответствии с описанной выше методикой синтеза 6-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин] в виде бесцветного масла (выход: 72%).
Масс-спектр, m/е: 204 (M+H+).
Амин 5
3,4-Дигидроспиро[изохромен-1,4'-пиперидин]
а) 1-Бензил-4-[2-(2-гидрокси-этил)-фенил]-пиперидин-4-ол
К раствору 2-бромфенилэтилового спирта (1,9 г, 9,6 ммоль) в тетрагидрофуране (25 мл) добавляли 1,6 М раствор н-бутиллития в н-гексане (14 мл, 23 ммоль) при -60°С. После перемешивания в течение 30 мин добавляли в течение 15 мин раствор 1-бензил-4-пиперидона (2,6 г, 14 ммоль) в тетрагидрофуране (10 мл) при -40°С. Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 72 ч при комнатной температуре. Затем смесь гасили путем добавления насыщенного водного раствора хлорида аммония (30 мл). Смесь подщелачивали до рН 11 2 М водным раствором карбоната натрия (50 мл) и затем экстрагировали тремя 100-мл порциями трет-бутилметилового эфира. Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали под вакуумом. Летучие примеси удаляли путем перегонки в вакууме (Кугельрор) при 170°С и давлении 1-2 мбар (100-200 Па). В результате флэш-хроматографии оставшегося неочищенного продукта с использованием в качестве элюента смеси дихлорметан /метанол получали указанное в заголовке соединение (2,3 г, 53%) в виде темно-коричневого масла.
Масс-спектр, m/е: 312 (М+Н+).
b) 1'-Бензил-3.4-дигидроспиро[изохромен-1,4'-пиперидин]
К раствору 1-бензил-4-[2-(2-гидрокси-этил)-фенил]-пиперидин-4-ола (2,0 г, 6,6 ммоль) и триэтиламина (1,9 мл, 14 ммоль) в сухом тетрагидрофуране (50 мл) добавляли метансульфохлорид (0,48 мл, 6,2 ммоль) при комнатной температуре. Данную реакционную смесь нагревали при температуре дефлегмации в течение 4 ч. Затем смесь гасили водой, подщелачивали 1 М водным раствором гидроксида натрия и экстрагировали тремя порциями этилацетата. Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали под вакуумом. Полученный неочищенный продукт очищали путем флэш-хроматографии, используя в качестве элюента смесь н-гептан/этилацетат, с выходом указанного в заголовке соединения (0,40 г, 21%) в виде желтого масла.
Масс-спектр, m/е: 294 (M+H+).
c) 3,4-[1,4'-пиперидин]
Раствор 1'-бензил-3,4-дигидроспиро[изохромен-1,4'-пиперидин] (0,40 г, 1,3 ммоль) в этаноле (15 мл) продували аргоном. Добавляли палладиевый катализатор (10% Pd на активированном угле, 0,14 г), и затем реакционный сосуд наполняли газообразным водородом. Смесь перемешивали в течение 18 ч при комнатной температуре. Катализатор удаляли путем фильтрования, и фильтрат концентрировали под вакуумом с получением указанного в заголовке соединения в виде белого твердого вещества (0,23 г; чистота: приблизительно 88% согласно данным 1H-ЯМР; с примесью 1'-этил-3,4-дигидроспиро[изохромен-1,4'-пиперидин]).
Масс-спектр, m/е: 204 (M+H+).
Амин 6
1H-Спиро[изохромен-4,4'-пиперидин]
a) (4-Фенил-пиперидин-4-ил)-метанол
К раствору 4-фенил-4-пиперидинкарбоновой кислоты 4-толуол-сульфоната (2,0 г, 5,3 ммоль) в сухом тетрагидрофуране (10 мл) добавляли 1 М раствор алюмогидрида лития в тетрагидрофуране при 0°С.Данную реакционную смесь нагревали при температуре дефлегмации в течение 90 мин. После охлаждения до 0°С добавляли последовательно воду (0,4 мл), 2 М водный раствор гидроксида натрия (0,6 мл) и воду (0,8 мл). Полученную белую суспензию перемешивали в течение 10 мин и разбавляли тетрагидрофураном (40 мл). Добавляли безводный сульфат натрия (18 г), и затем суспензию перемешивали дополнительно в течение 10 мин. Осадок удаляли путем фильтрования, и фильтрат концентрировали под вакуумом с получением неочищенного указанного в заголовке соединения (0,65 г, 64%) в виде белого твердого вещества.
Масс-спектр, m/е: 192 (M+H+).
b) 1Н-Спиро[изохромен-4,4'-пиперидин]
Смесь (4-фенил-пиперидин-4-ил)-метанола (0,1 г, 0,5 ммоль), параформальдегида (0,11 г, 3,7 ммоль), 1,4-диоксана (5 мл) и раствора концентрированной соляной кислоты (1,3 мл) нагревали при температуре дефлегмации в течение 80 ч. Затем реакционную смесь разбавляли этилацетатом (100 мл) и промывали 0,5 М водным раствором гидроксида натрия. Водный слой экстрагировали этилацетатом (100 мл). Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали под вакуумом. Полученный неочищенный продукт очищали путем флэш-хроматографии, используя в качестве элюента дихлорметан/метанол, с выходом указанного в заголовке соединения (0,053 г, 50%) в виде желтого твердого вещества.
Масс-спектр, m/е: 204 (M+H+).
Амин 7
(RS)-3'H-Спиро[азепан-4,1'-[2]бензофуран]
a) (RS)-1-Бензил-4-(2-гидроксиметил-фенил)-азепан-4-ол
К раствору 2-бромбензилового спирта (7,8 г, 42 ммоль) в тетрагидрофуране (80 мл) добавляли по каплям 2,8 М раствор этилмагния хлорида в тетрагидрофуране (15 мл, 42 ммоль). Реакция проходила с выделением тепла, скорость добавления этилмагния хлорида подбирали таким образом, чтобы поддерживать слабую дефлегмацию. После завершения добавления этилмагния хлорида добавляли порциями магниевую стружку (1,0 г, 42 ммоль). Данную смесь нагревали при температуре дефлегмации в течение 2 ч, затем добавляли раствор 1-бензил-азепан-4-она (8,5 г, 42 ммоль) в тетрагидрофуране (40 мл). Реакционную смесь нагревали дополнительно в течение 4 ч при температуре дефлегмации. Охлаждали до комнатной температуры и затем медленно добавляли насыщенный раствор хлорида аммония (50 мл), воду (100 мл) и этилацетат (300 мл). Слои разделяли и органический слой концентрировали с получением зеленого масла. В результате колоночной флэш-хроматографии с использованием в качестве элюента смеси гептан/этилацетат (2:1) получали указанное в заголовке соединение в виде светло-желтого масла (8,0 г, 61%).
b) (RS)-1-Бензил-3'Н-спиро[азепан-4,1'-[2]бензофуран]
К раствору (RS)-бензил-4-гидроксиметил-фенил)-азепан-4-ола (7,0 г, 22 ммоль) и триэтиламина (3,1 мл, 22 ммоль) в тетрагидрофуране (80 мл) добавляли раствор метансульфохлорида (1,7 мл, 22 ммоль) в тетрагидрофуране (20 мл) при 0°С. После завершения добавления смесь оставляли нагреваться до комнатной температуры. Перемешивали в течение 2 ч и затем добавляли вторую порцию триэтиламина (3,1 мл, 22 ммоль). Перемешивание продолжали в течение ночи. Затем реакционную смесь распределяли между водой и этилацетатом. Слои разделяли, и органический слой концентрировали под вакуумом. В результате колоночной флэш-хроматографии с использованием в качестве элюента смеси гептан/этилацетат получали указанное в заголовке соединение в виде светло-желтого масла (4,0 г, 61%).
Масс-спектр, m/е: 294 (M+H+).
c) (RS)-3'H-Спиро[азепан-4,1'-[2]бензофуран]
Раствор (RS)-1-бензил-3'H-спиро[азепан-4,1'-[2]бензофуран] (4,00 г, 13,6 ммоль) в метаноле (50 мл) помещали в автоклав и продували аргоном. Добавляли палладиевый катализатор (10% Pd на активированном угле, 1 г) и затем автоклав наполняли газообразным водородом под давлением 5 бар (5·105 Па). Смесь перемешивали в течение ночи при комнатной температуре. Катализатор удаляли путем фильтрования, и полученный фильтрат концентрировали под вакуумом. Остаток распределяли между этилацетатом и водным раствором гидроксида натрия (рН 14). Слои разделяли, и водный слой экстрагировали этилацетатом.
Объединенные органические слои сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде белого твердого вещества (2,5 г, 90%).
Масс-спектр, m/е: 204 (М+H+).
Примеры
Общая методика I: Конденсация гидразида и тиолактама с получением триазола
Смесь гидразидного производного Формулы (II) (1-1,5 экв.) и тиолактама Формулы (III) (1 экв.) в н-бутаноле (0,1-0,2 М) нагревают при температуре дефлегмации в течение 16-72 ч. После охлаждения до комнатной температуры растворитель выпаривают, и остаток очищают путем флэш-хроматографии с получением N-BOC-производного Формулы (I-I-а). В данных реакционных условиях N-BOC-группа может быть частично или полностью удалена путем нагревания с получением вторичного амина Формулы I-b) в качестве добавочного или единственного продукта.
Общая методика II: Удаление М-ВОС-группы
Раствор N-BOC-производного общей Формулы (I-а) (1 экв.) в 1,25 М растворе хлористого водорода в метаноле (10-20 экв. HCl) нагревают в течение 15-60 мин при 50°С. После охлаждения до комнатной температуры реакционную смесь концентрируют под вакуумом с получением вторичного амина общей Формулы (I-b) в виде гидрохлоридной соли. Свободное основание может быть получено путем распределения полученной гидрохлоридной соли между 1 М водным раствором гидроксида натрия и органическим растворителем, например этилацетатом или дихлорметаном. Слои разделяют, и водный слой экстрагируют двумя порциями органического растворителя. Объединенные органические слои сушат над безводным сульфатом натрия, фильтруют и концентрируют под вакуумом с получением соединения Формулы (I-b) в виде свободного основания.
Общая методика III: Восстановительное N-алкилирование
Смесь соединения Формулы (I-b) в виде свободного основания или в виде гидрохлоридной соли (1 экв., 0,1-0,2 М), триэтиламина (1 экв., когда используют гидрохлоридную соль соединения Формулы (I-b)) и альдегида или кетона (8 экв.) в метаноле нагревают при температуре дефлегмации в течение 2-6 ч. После охлаждения до 0°С добавляют цианоборгидрид натрия (2-3 экв.). Данную реакционную смесь перемешивают в течение 3-16 ч при комнатной температуре и гасят путем добавления 1 М водного раствора гидроксида натрия. Водный слой экстрагируют этилацетатом. Объединенные органические слои сушат над безводным сульфатом натрия и концентрируют под вакуумом. В результате флэш-хроматографии получают N-алкильное производное Формулы (I).
Пример 1
трет-Бутил 8-хлор-1-[(1r,4'r)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-карбоксилат
Указанное в заголовке соединение получали в виде белой пены в соответствии с общей методикой I (выход: 65%).
Гидразид: (1r,4'r)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-карбоновая кислота.
Тиолактам: 7-хлор-2-тиооксо-1,2,3,5-тетрагидро-бензо[е][1,4]диазепин-4-карбоновой кислоты трет-бутиловый эфир.
Масс-спектр, m/е: 507 (M+H+).
Пример 2
8-Хлор-1-[(1r,4'r)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид
Указанное в заголовке соединение получали в виде белого твердого вещества из трет-бутил 8-хлор-1-[(1r,4'r)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-карбоксилата в соответствии с общей методикой II (количественный выход).
Масс-спектр, m/е: 407 (M+H+).
Пример 3
8-Хлор-5-метил-1-[(1r,4'r)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
Указанное в заголовке соединение получали в виде белого твердого вещества из 8-хлор-1-[(1r,4'r)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорида и параформальдегида в соответствии с общей методикой III (выход: 84%).
Масс-спектр, m/е: 421 (М+Н+).
Пример 4
трет-Бутил 8-хлор-1-[(1s,4's)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилат
Указанное в заголовке соединение получали в виде белой пены в соответствии с общей методикой I (выход: 60%).
Гидразид: (1s,4's)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-карбогидразид.
Тиолактам: 7-хлор-2-тиооксо-1,2,3,5-тетрагидро-бензо[е][1,4]диазепин-4-карбоновой кислоты трет-бутиловый эфир.
Масс-спектр, m/е: 507 (M+H+).
Пример 5
8-Хлор-1-[(1s,4's)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид
Указанное в заголовке соединение получали в виде белого твердого вещества из трет-бутил 8-хлор-1-[(1s,4's)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилата в соответствии с общей методикой II (количественный выход).
Масс-спектр, m/е: 407 (M+H+).
Пример 6
8-Хлор-5-метил-1-[(1s,4's)-3H-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
Указанное в заголовке соединение получали в виде белого твердого вещества из 8-хлор-1-[(1s,4's)-3Н-спиро[2-бензофуран-1,1'-циклогексан]-4'-ил]-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорида и параформальдегида в соответствии с общей методикой III (выход: 77%).
Масс-спектр, m/е: 421 (M+H+).
Пример 7
трет-Бутил 8-хлор-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилат
Смесь 1-бром-8-хлор-4H,6H-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (1,00 г, 2,50 ммоль) и 3Н-спиро[2-бензофуран-1,4'-пиперидин] (1,89 г, 10,0 ммоль) плавили в течение ночи при 130°С. После охлаждения до комнатной температуры смесь суспендировали в этилацетате и фильтровали. Полученный фильтрат концентрировали под вакуумом. В результате хроматографии на силикагеле с использованием этилацетата получали трет-бутил 8-хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилат (0,38 г, 30%) в виде светло-желтого твердого вещества.
Масс-спектр, m/е: 508 (M+H+).
Пример 8
8-Хлор-1-(1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид
Указанное в заголовке соединение получали в виде светло-желтого твердого вещества из трет-бутил 8-хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилата в соответствии с общей методикой II (количественный выход).
Масс-спектр, m/е: 408 (M+H+).
Пример 9
8-Хлор-5-метил-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
К суспензии 8-хлор-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорида (38 мг, 0,086 ммоль) в метаноле (1,2 мл) добавляли триэтиламин (18 мкл, 0,13 ммоль) и параформальдегид (22 мг, 0,68 ммоль). Данную смесь нагревали при температуре дефлегмации в течение 2 ч. После охлаждения в ледяной бане добавляли цианоборгидрид натрия (10 мг, 0,128 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре, гасили водой, разбавляли 1 М водным раствором гидроксида натрия и экстрагировали тремя порциями этилацетата. Объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Полученное неочищенное вещество очищали путем хроматографии на силикагеле (картридж Flashpack (2 г), элюент: этилацетат, затем этилацетат: метанол 9:1) с выходом 8-хлор-5-метил-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина (21 мг, 58%) в виде белой пены.
Масс-спектр, m/е: 422 (M+H+).
Пример 10
8-Хлор-5-изопропил-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
К раствору 8-хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорида (50 мг, 0,12 ммоль) в ацетонитриле (2 мл) и дихлорметане (1 мл) добавляли ацетон (50 мкл, 0,68 ммоль) и триацетоксиборгидрид натрия (43 мг, 0,20 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 2 суток, и затем растворитель удаляли путем перегонки. В результате хроматографии (силикагель: 10 г; дихлорметан/метанол, 95:5-8:2) получали 8-хлор-5-изопропил-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин (21 мг, 38%) в виде бесцветного масла.
Масс-спектр, m/е: 450 (M+H+).
Пример 11
2-[8-Хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-ил]этанол
8-Хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид (0,10 г, 0,25 ммоль) и гликолевый альдегид (0,15 г, 0,25 ммоль) в дихлорметане (1 мл) перемешивали в течение 2 ч при комнатной температуре. Добавляли муравьиную кислоту (37,4 мкл, 0,98 ммоль) и цианоборгидрид натрия (16,2 мг, 0,25 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли 0,1 н. водный раствор гидроксида натрия (50 м). В результате экстракции дихлорметаном и хроматографии (а: силикагель (20 г), дихлорметан/метанол; b: силикагель (10 г), этилацетат/гептан; с: силикагель (5 г), дихлорметан/метанол и d: колонка Flasch-NH2 Isolute (10 г), этилацетат) получали 2-[8-хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-ил]этанол (3,5 мг, 3%) в виде белого твердого вещества.
Масс-спектр, m/е: 452 (М+Н+).
Пример 12
8-Хлор-5-(пиридин-2-илметил)-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
8-Хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид (100 мг, 0,25 ммоль), 2-пиколил хлорида гидрохлорид (45 мг, 0,27 ммоль) и N-этилдиизопропиламин (47,1 мкл, 0,27 ммоль) в диметилформамиде (2 мл) перемешивали в течение ночи при 50°С. Затем добавляли вторую порцию 2-пиколил хлорида гидрохлорида (100 мг), и перемешивание продолжали при 50°С в течение ночи. Добавляли 2-(бромметил)пиридина гидробромид (100 мг) и N-этилдиизопропиламин (0,10 мл), и данную смесь перемешивали в течение ночи при 50°С. Растворитель удаляли, и остаток очищали путем хроматографии (первая хроматография: колонка Flash-NH2 Isolute (20 г), этилацетат; вторая хроматография: силикагель (20 г), этилацетат /метанол) с получением 8-хлор-5-(пиридин-2-илметил)-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина (49 мг, 40%) в виде белого твердого вещества.
Масс-спектр, m/е: 499 (M+H+).
Пример 13
8-Хлор-N,N-диметил-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-сульфонамид
Смесь 8-хлор-1-(1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорида (50,0 мг, 0,12 ммоль), диметилсульфамоилхлорида (13,3 мкл, 0,12 ммоль) и пиридина (9,9 мкл, 0,123 ммоль) растворяли в дихлорметане (2 мл) и перемешивали в течение ночи при 40°С. Растворитель удаляли путем перегонки, и остаток очищали путем хроматографии (силикагель (20 г), этилацетат /метанол) с получением 8-хлор-N,N-диметил-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-сульфонамида (35 мг, 55%) в виде белого твердого вещества.
Масс-спектр, m/е: 515 (M+H+).
Пример 14
Метил 8-хлор-1-(1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6М)-карбоксилат
8-Хлор-1-(1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид (100 мг, 0,25 ммоль), триэтиламин (85,8 мкл, 0,61 ммоль), метилхлорформиат (21 мкл, 0,27 ммоль) и 4-N,N-диметиламинопиридин (3 мг, 24,5 мкмоль) в дихлорметане (2 мл) перемешивали в течение 1 ч при комнатной температуре. Затем реакционную смесь добавляли к насыщенному водному раствору гидрокарбоната натрия. Экстрагировали этилацетатом, растворитель удаляли путем перегонки и очищали путем хроматографии (SiO2 (10 г), дихлорметан/метанол) с получением метил 8-хлор-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилата (76 мг, 66%) в виде белого твердого вещества.
Масс-спектр, m/е: 466 (M+H+).
Пример 15
5-Ацетил-8-хлор-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
Смесь 8-хлор-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорида (75 мг, 0,18 ммоль) и ацетилхлорида (66 мкл, 0,92 ммоль) в дихлорметане перемешивали в течение 2,5 суток при комнатной температуре. Растворитель удаляли путем перегонки и остаток очищали путем хроматографии (силикагель (10 г), дихлорметан/метанол 8:2). Полученное вещество суспендировали в 0,1 М водном растворе гидроксида натрия и экстрагировали этилацетатом и дихлорметаном с выходом 5-ацетил-8-хлор-1-(1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина (49 мг, 59%) в виде светло-желтого твердого вещества.
Масс-спектр, m/е: 450 (M+H+).
Пример 16
2-[8-Хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-ил]-N,N-диметил-2-оксоэтанамин
Смесь 8-хлор-1-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина (0,30 г, 0,74 ммоль), N-этилдиизопропиламина (0,51 мл, 2,94 ммоль) и диметиламиноацетил хлорида гидрохлорида (0,21 г, 1,10 ммоль) в ТГФ (12 мл) перемешивали при комнатной температуре в течение ночи. В результате экстракции дихлорметаном и хроматографии (колонка Flasch-NH2 Isolute (20 г), этилацетат) получали 2-[8-хлор-1-(1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-ил]-N,N-диметил-2-оксоэтанамин (93 мг, 26%) в виде белого твердого вещества.
Масс-спектр, m/е: 493 (M+H+).
Пример 17
трет-Бутил 8-хлор-1-(6-фтор-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4М-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-карбоксилат
Смесь 1-бром-8-хлор-4H,6Н-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (0,16 г, 0,4 ммоль) и 6-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин] (0,36 г, 1,76 ммоль) нагревали при 130°С в течение 3 часов. После охлаждения смесь суспендировали в этилацетате и фильтровали. В результате хроматографии на силикагеле с использованием этилацетата получали трет-бутил 8-хлор-1-(6-фтор-1'Н,3Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилат (0,11 г, 52%) в виде светло-желтой пены.
Масс-спектр, m/е: 526 (М+Н+).
Пример 18
8-Хлор-1-(6-фтор-1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид
Указанное в заголовке соединение получали в виде белой пены из трет-бутил 8-хлор-1-(6-фтор-1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилата в соответствии с общей методикой II (количественный выход).
Масс-спектр, m/е: 426 (M+H+).
Пример 19
8-Хлор-1-(6-фтор-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
Указанное в заголовке соединение получали в виде желтоватого твердого вещества из 8-хлор-1-(б-фтор-1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорида и параформальдегида в соответствии с общей методикой III (выход: 88%).
Масс-спектр, m/е: 440 (M+H+).
Пример 20
трет-Бутил 8-хлор-1-(7-фтор-1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-карбоксилат
Смесь 1 -бром-8-хлор-4Н,6Н-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (0,16 г, 0,4 ммоль) и 7-фтор-3Н-спиро[2-бензофуран-1,4'-пиперидин] (0,33 г, 1,6 ммоль) нагревали при 130°С в течение 2 часов. После охлаждения до комнатной температуры смесь суспендировали в этилацетате и фильтровали. В результате хроматографии на силикагеле с использованием этилацетата получали трет-бутил 8-хлор-1-(7-фтор-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилат (0,15 г, 69%) в виде светло-желтой пены.
Масс-спектр, m/е: 526 (M+H+).
Пример 21
8-Хлор-1-(7-фтор-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид
Указанное в заголовке соединение получали в виде белой пены из трет-бутил 8-хлор-1-(7-фтор-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилата в соответствии с общей методикой II (количественный выход).
Масс-спектр, m/е: 426 (М+H+).
Пример 22
8-Хлор-1-(7-фтор-1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
Указанное в заголовке соединение получали в виде желтоватого твердого вещества из 8-хлор-1-(7-фтор-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорида и параформальдегида в соответствии с общей методикой III (выход: 76%).
Масс-спектр, m/е: 440 (M+H+).
Пример 23
8-Хлор-1-(5-фтор-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
Смесь 1-бром-8-хлор-5-метил-5,6-дигидро-4H-2,3,5,10b-тетрааза-бензоазулена (50 мг, 0,16 ммоль), тетрабутиламмония бромида (10 мг, 0,031 ммоль) и 5-фтор-3H-спиро[2-бензофуран-1,4'-пиперидин] (66 мг, 0,32 ммоль) в сульфолане (0,5 мл) перемешивали в течение 20 ч при 160°С. Растворитель удаляли путем перегонки в вакууме (Кугельрор) (140°С, 1-2 мбар (100-200 Па)). В результате флэш-хроматографии на аминопропил-модифицированном силикагеле с использованием смеси н-гептан/этилацетат и дополнительной очистки путем препаративной ЖХВД с использованием в качестве элюента смеси н-гептан/2-пропанол (70:30) получали указанное в заголовке соединение (9 мг, 13%) в виде белого твердого вещества.
Масс-спектр, m/е: 440 (M+H+).
Пример 24
(RS)-трет-Бутил 8-хлор-1-(3-метил-1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-карбоксилат
Смесь 1-бром-8-хлор-4H,6Н-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (0,16 г, 0,4 ммоль) и (RS)-3-метил-3H-спиро[2-бензофуран-1,4'-пиперидин] (0,32 г, 1,6 ммоль) нагревали при 130°С в течение 3 часов. После охлаждения до комнатной температуры смесь суспендировали в этилацетате и фильтровали. В результате хроматографии на силикагеле с использованием этилацетата получали (RS)-трет-бутил 8-хлор-1-(3-метил-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-карбоксилат (0,076, 36%) в виде светло-коричневой пены.
Масс-спектр, m/е: 522 (М+H+).
Пример 25
(RS)-8-Хлор-1-(3-метил-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорид
Указанное в заголовке соединение получали в виде желтоватого твердого вещества из (RS)-трет-бутил 8-хлор-1-(3-метил-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-карбоксилата в соответствии с общей методикой II (количественный выход).
Масс-спектр, m/е: 422 (M+H+).
Пример 26
(RS)-8-Хлор-5-метил-1-(3-метил-1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
Указанное в заголовке соединение получали в виде белого твердого вещества из (RS)-8-хлор-1-(3-метил-1'Н,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина гидрохлорида и параформальдегида в соответствии с общей методикой III (выход: 25%).
Масс-спектр, m/e: 436 (M+H+).
Пример 27
1'-(8-Хлор-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3H-спиро[2-бензофуран-1,4'-пиперидин]-3-он
Смесь 1-бром-8-хлор-5-метил-5,6-дигидро-4Н-2,3,5,10b-тетрааза-бензоазулена (50 мг, 0,16 ммоль), тетрабутиламмония бромида (10 мг, 0,031 ммоль) и 3H-спиро[2-бензофуран-1,4'-пиперидин]-3-она (65 мг, 0,32 ммоль) в сульфолане (0,5 мл) перемешивали в течение 20 ч при 160°С. Затем реакционную смесь вливали в воду и экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали под вакуумом. Оставшийся сульфолан выпаривали путем перегонки в вакууме (Кугельрор) (120°С, 1-2 мбар (100-20 Па)). В результате препаративной ЖХВД с использованием в качестве элюента смеси н-гептан/2-пропанол (70:30) получали указанное в заголовке соединение (10 мг, 14%) в виде светло-желтого твердого вещества.
Масс-спектр, m/e: 436 (M+H+).
Пример 28
8-Хлор-1-(1'H,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
а) трет-Бутил 8-хлор-1-(1'Н,3H-спиро[2-бензотиофен-1.4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6Н)-карбоксилат
Смесь 1-бром-8-хлор-4Н,6H-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (0,3 г, 0,75 ммоль) и 3H-спиро[2-бензотиофен-1,4'-пиперидин] (1,5 г, 7,5 ммоль) перемешивали в течение 24 ч при 140°С. Затем реакционную смесь сразу наносили на колонку для флэш-хроматографии с аминопропил-модифицированным силикагелем и элюировали, используя смесь н-гептан/этилацетат, с получением неочищенного трет-бутил 8-хлор-1-(1'Н,3Н-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-a][1,4]бензодиазепин-5(6Н)-карбоксилата (0,11 г, 27%) в виде желтого масла, который использовали на следующей стадии без дополнительной очистки.
b) 8-Хлор-1-(1'H,3Н-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
Раствор неочищенного трет-бутил 8-хлор-1-(1'Н,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилата (0,092 г, приблизительно 0,18 ммоль), полученного на предыдущей стадии, в 1,25 М растворе хлористого водорода в метаноле (1,4 мл, 1,8 ммоль) нагревали в течение 3 ч при 50°С. Затем реакционную смесь вливали в 1 М водный раствор гидроксида натрия (30 мл) и экстрагировали этилацетатом (2×30 мл). Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии на аминопропил-модифицированном силикагеле с использованием в качестве элюента смеси н-гептан/этилацетат получали указанное в заголовке соединение (0,045 г, 60%) в виде белого твердого вещества.
Масс-спектр, m/е: 424 (M+H+).
Пример 29
8-Хлор-5-метил-1-(1'H,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
Смесь 8-хлор-1-(1'Н,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина (0,041 г, 0,097 ммоль) и параформальдегида (0,023 г, 0,77 ммоль) в метаноле (1 мл) нагревали при температуре дефлегмации в течение 5 ч. После охлаждения до комнатной температуры добавляли цианоборгидрид натрия (0,012 г, 0,19 ммоль) при 0°С. Затем реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч. Смесь гасили 1 М водным раствором гидроксида натрия (30 мл) и затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии на аминопропил-модифицированном силикагеле с использованием в качестве элюента смеси н-гептан/этилацетат получали указанное в заголовке соединение (0,020 г, 48%) в виде желтоватого твердого вещества.
Масс-спектр, m/е: 438 (M+H+).
Пример 30
8-Хлор-1-(2,2-диоксидо-1'H,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
а) трет-Бутил 8-хлор-1-(2,2-диоксидо-1'Н,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-4H[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилат
Смесь 1-бром-8-хлор-4H,6H-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (0,3 г, 0,75 ммоль) и 3Н-спиро[2-бензотиофен-1,4'-пиперидин] 2,2-диоксида (1,8 г, 7,5 ммоль) перемешивали в течение 24 ч при 140°С. Затем реакционную смесь сразу наносили на Si(CH2)3NH2-силикагель и хроматографировали, используя в качестве элюента смеси н-гептан/этилацетат, с получением неочищенного трет-бутил 8-хлор-1-(2,2-диоксидо-1'Н,3Н-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилата (0,13 г, 31%) в виде желтого масла, который использовали на следующей стадии без дополнительной очистки.
b) 8-Хлор-1-(2,2-диоксидо-1'Н,3Н-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4H-[1,2,4]триазоло[4.3-а][1,4]бензодиазепин
Раствор неочищенного трет-бутил 8-хлор-1-(2,2-диоксидо-1'Н,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилата (0,11 г, приблизительно 0,20 ммоль), полученного на предыдущей стадии, в 1,25 М растворе хлористого водорода в метаноле (1,6 мл, 2,0 ммоль) нагревали в течение 3 ч при 50°С. Затем реакционную смесь вливали в 1 М водный раствор гидроксида натрия (30 мл) и экстрагировали двумя 30-мл порциями этилацетата. Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии на аминопропил-модифицированном силикагеле с использованием в качестве элюента смеси н-гептан/этилацетат получали указанное в заголовке соединение (0,036 г, 32%) в виде белого твердого вещества.
Масс-спектр, m/е: 456 (М+H+).
Пример 31
8-Хлор-1-(2,2-диоксидо-1'Н,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин
Смесь 8-хлор-1-(2,2-диоксидо-1'H,3H-спиро[2-бензотиофен-1,4'-пиперидин]-1'-ил)-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепина (0,032 г, 0,070 ммоль) и параформальдегида (0,017 г, 0,57 ммоль) в метаноле (1 мл) нагревали при температуре дефлегмации в течение 5 ч. После охлаждения до комнатной температуры добавляли цианоборгидрид натрия (0,009 г, 0,14 ммоль) при 0°С. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч. Затем смесь гасили 1 М водным раствором гидроксида натрия (30 мл) и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии на аминопропил-модифицированном силикагеле с использованием в качестве элюента смеси н-гептан/этилацетат получали указанное в заголовке соединение (0,011 г, 26%) в виде желтоватого твердого вещества.
Масс-спектр, m/е: 470 (M+H+).
Пример 32
1'-(8-Хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-1H-спиро[изохромен-4,4'-пиперидин]
a) 1'-(8-Хлор-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-1Н-спиро[изохромен-4,4'-пиперидин]
Смесь 1-бром-8-хлор-4H,6Н-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (0,25 г, 0,63 ммоль) и 1Н-спиро[изохромен-4,4'-пиперидин] (0,51 г, 2,5 ммоль) в сульфолане (5 мл) перемешивали в течение 74 ч при 140°С. Растворитель выпаривали путем перегонки в вакууме (Кугельрор) (150°С, 1-2 мбар (100-200 Па)). После добавления 1,25 М раствора хлористого водорода в метаноле (5,0 мл, 6,3 ммоль) смесь нагревали в течение 2 ч при 50°С. Затем смесь оставляли охлаждаться до комнатной температуры, обрабатывали 1 М водным раствором гидроксида натрия (30 мл) и экстрагировали четырьмя 30-мл порциями этилацетата. Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии на аминопропил-модифицированном силикагеле с использованием в качестве элюента смеси н-гептан/этилацетат получали 1'-(8-хлор-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-1H-спиро[изохромен-4,4'-пиперидин] (0,13 г; чистота: 80%) в виде коричневого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
Масс-спектр, m/е: 422 (M+H+).
b) 1'-(8-Хлор-5-метил-5,6-дигидро-4H[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-1H-спиро[изохромен-4,4'-пиперидин]
Смесь неочищенного продукта 1'-(8-хлор-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-1H-спиро[изохромен-4,4'-пиперидин] (0,10 г, 0,24 ммоль), полученного на предыдущей стадии, и параформальдегида (0,057 г, 1,9 ммоль) в метаноле (2 мл) нагревали при температуре дефлегмации в течение 4 ч. После охлаждения до комнатной температуры добавляли цианоборгидрид натрия (0,03 г, 0,47 ммоль) при 0°С. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч. Затем смесь гасили 1 М водным раствором гидроксида натрия (30 мл) и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии на аминопропил-модифицированном силикагеле с использованием в качестве элюента смеси н-гептан/этилацетат получали указанное в заголовке соединение (0,047 г, 45%) в виде желтого твердого вещества.
Масс-спектр, m/е: 436 (M+H+).
Пример 33
трет-Бутил 8-хлор-1-(3,4-дигидро-1'H-спиро[изохромен-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилат
Смесь 1-бром-8-хлор-4Н,6Н-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (0,72 г, 0,18 ммоль) и 3,4-дигидроспиро[изохромен-1,4'-пиперидин] (0,11 г, 0,54 ммоль) перемешивали в течение 72 ч при 130°С. Затем реакционную смесь вливали в воду (50 мл) и экстрагировали тремя 50-мл порциями этилацетата. Объединенные органические слои промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии на аминопропил-модифицированном силикагеле с использованием в качестве элюента смеси н-гептан/2-пропанол получали указанное в заголовке соединение (0,062 г, 66%) в виде белого твердого вещества.
Масс-спектр, m/е: 522 (M+H+).
Пример 34
1'-(8-Хлор-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3,4-дигидроспиро[изохромен-1,4'-пиперидин] гидрохлорид
Указанное в заголовке соединение получали в виде желтоватого твердого вещества из трет-бутил 8-хлор-1-(3,4-дигидро-1'Н-спиро[изохромен-1,4'-пиперидин]-1'-ил)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-5(6H)-карбоксилата в соответствии с общей методикой II (выход: 88%).
Масс-спектр, m/е: 422 (М+Н+).
Пример 35
1'-(8-Хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3,4-дигидроспиро[изохромен-1,4'-пиперидин]
Указанное в заголовке соединение получали в виде белого твердого вещества из 1'-(8-хлор-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3,4-дигидроспиро[изохромен-1,4'-пиперидин] гидрохлорида и параформальдегида в соответствии с общей методикой III (выход: 50%).
Масс-спектр, m/е: 436 (M+H+).
Пример 36
(+)-1-(8-Хлор-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'Н-спиро[азепан-4,1'-[2]бензофуран] и
Пример 37
(-)-1-(8-Хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'H-спиро[азепан-4,1'-[2]бензофуран]
а) (RS)-1-(8-Хлор-5,6-дигидро-4H[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'Н-спиро[азепан-4.1'-[2]бензофуран]
Смесь 1-бром-8-хлор-4Н,6Н-2,3,5,10b-тетрааза-бензо[е]азулен-5-карбоновой кислоты трет-бутилового эфира (0,2 г, 0,5 ммоль) и (RS)-3'Н-спиро[азепан-4,1'-[2]бензофуран] (0,31 г, 1,5 ммоль) перемешивали в течение 24 ч при 130°С и в течение 5 ч при 160°С. Добавляли еще одну порцию (RS)-3'Н-спиро[азепан-4,1'-[2]бензофуран] (0,38 г, 0,19 ммоль), и реакционную смесь перемешивали в течение 18 ч при 160°С. Реакционную смесь оставляли охлаждаться до комнатной температуры. Добавляли 1,25 М раствор хлористого водорода в метаноле (4,0 мл, 5,0 ммоль), и данную смесь нагревали в течение 30 мин при 50°С. Затем смесь оставляли охлаждаться до комнатной температуры, обрабатывали 1 М водным раствором гидроксида натрия (50 мл) и экстрагировали двумя 50-мл порциями дихлорметана. Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали под вакуумом. В результате флэш-хроматографии с использованием в качестве элюента смеси дихлорметаном /метанол получали указанное в заголовке соединение (0,23 г; чистота: 90%) в виде желтого твердого вещества.
Масс-спектр, m/е: 422 (M+H+).
b) (RS)-1-(8-Хлор-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'Н-спиро[азепан-4.1'-[2]бензофуран]
Указанное в заголовке соединение получали в виде желтоватого твердого вещества из (RS)-1-(8-хлор-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'H-спиро[азепан-4,1'-[2]бензофуран] и параформальдегида в соответствии с общей методикой III (выход: 56%).
Масс-спектр, m/е: 436 (M+H+).
c) (+)-1-(8-Хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'Н-спиро[азепан-4,1'-[2]бензофуран]
и
d) (-)-1-(8-Хлор-5-метил-5.6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'Н-спиро[азепан-4,1'-[2]бензофуран]
(+)-1-(8-Хлор-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'H-спиро[азепан-4,1'-[2]бензофуран] и (-)-1-(8-хлор-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'H-спиро[азепан-4,1'-[2]бензофуран] получали путем разделения (RS)-1-(8-хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'H-спиро[азепан-4,1'-[2]бензофуран] (0,116 г, 0,266 ммоль) с использованием хиральной ЖХВД (колонка: Chiralpak AD) и элюирования смесью н-гептан/этанол (3:1).
(+)-1-(8-Хлор-5-метил-5,6-дигидро-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'H-спиро[азепан-4,1'-[2]бензофуран] (0,036 г, 31%) получали в виде светло-желтого твердого вещества.
(Масс-спектр, m/е: 436 (M+H+)).
(-)-1-(8-Хлор-5-метил-5,6-дигидро-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-1-ил)-3'Н-спиро[азепан-4,1'-[2]бензофуран] (0,037 г, 32%) получали в виде светло-желтого твердого вещества.
(Масс-спектр, m/е: 436 (M+H+), [α]D=-17,8 (с=0,141, CHCl3, 20°С).
![СПИРО-5,6-ДИГИДРО-4Н-2,3,5,10В-ТЕТРААЗА-БЕНЗО[Е]АЗУЛЕНЫ](https://fips.edrid.ru/images/rid/c4/69/ae/fd652097cd2c62513bde831dc8951eef.png)
![СПИРО-5,6-ДИГИДРО-4Н-2,3,5,10В-ТЕТРААЗА-БЕНЗО[Е]АЗУЛЕНЫ](https://fips.edrid.ru/images/rid/c4/69/ae/11a623c910c039897c94967a33858fd2.png)