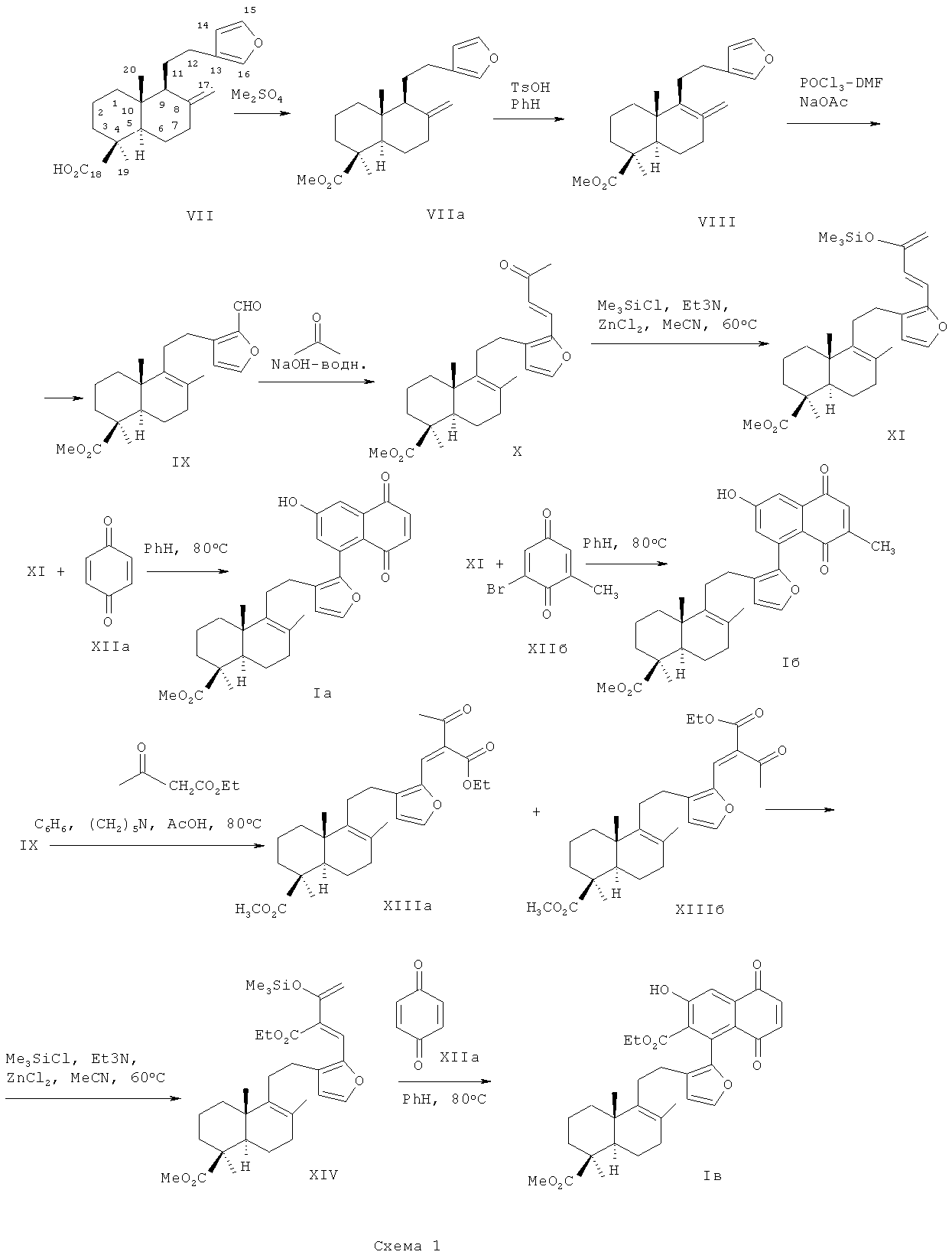Результат интеллектуальной деятельности: 6-ГИДРОКСИНАФТОХИНОНЫ ЛАБДАНОВОГО ТИПА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА
Вид РИД
Изобретение
Изобретение относится к органической химии, конкретно - к новым оптически активным нафтохинонам, содержащим фрагмент лабданового дитерпеноида, формулы (Iа-в):
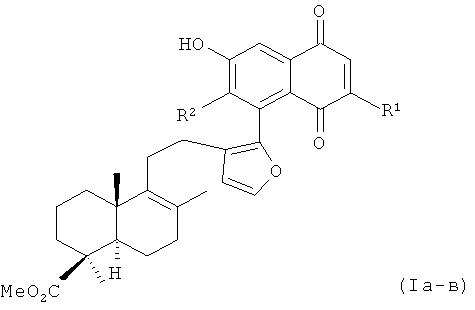
где R1=R2=Н(Ia); R1=Me, R2=H(Iб); R1=H, R2=CO2Et (Iв),
обладающим значительной цитотоксичностью по отношению к опухолевым клеткам человека.
Указанные свойства позволяют предполагать возможность использования соединений в медицине в качестве фармацевтического препарата.
В последние годы при создании противоопухолевых агентов внимание уделяется поиску ингибиторов тканевой инвазии опухолевых клеток и индукторам апоптоза опухолевых клеток [Fenteany, G.; Zhu, S. Cur. Top. Med. Chem. 2003, v.3 (4), p.593-616]. Соединения обоих типов найдены в ряду сестертерпеноидов и лабдановых дитерпеноидов. В качестве перспективных ингибиторов инвазии опухолевых клеток рассматриваются хинон- и гидрохинонсодержащие ди- и сестертерпеноиды морских губок - стронгулофорин-26 (II) [Warabi K., Patrik B.O., Austin P., Roskelley C.D., Roberge M., Andersen R.J., J. Nat. Prod. 2007, v.70 (5), p.736-740], авинозол (III) [Diaz-Marrero A.R., Austin P., Van Soest R., Matainaho T., Roskelley C.D., Roberge M., Andersen R.J., Org. Lett. 2006, v.8 (17), p.3749-3752]. Соединения проявляют значительную цитотоксичность по отношению к опухолевым клеткам, а также обладают антиинвазивной активностью в тестах связывания: IC50 (доза, ингибирующая инвазию опухолевых клеток на 50%) соединений (II, III) составляет 1-50 мкг/мл (клетки рака груди MDA-MB-231) и 20-50 мкг/мл (клетки карциномы LS 174Т) [Diaz-Marrero A.R., Austin P., Van Soest R., Matainaho Т., Roskelley C.D., Roberge M., Andersen R.J., Org. Lett. 2006, v.8 (17), p.3749-3752]. Соединения (II, III) являются малодоступными метаболитами.
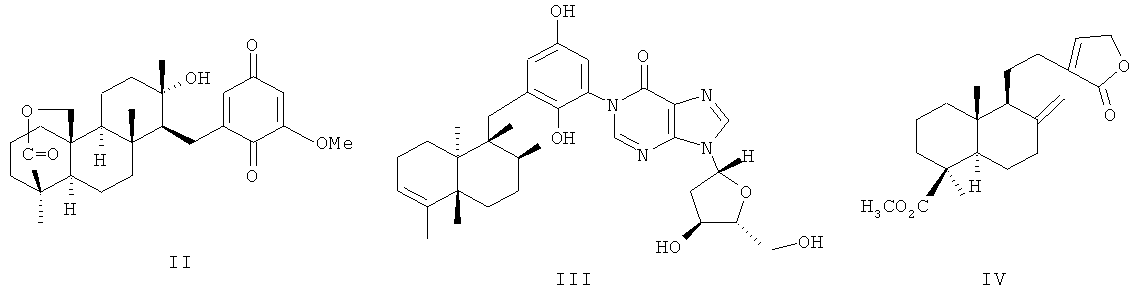
Активным противоопухолевым агентом является природный лабданоид пинусолид (IV). Это соединение является аналогом по свойствам заявляемых соединений. Пинусолид (IV) содержится в нейтральной части живицы кедра сибирского Pinus sibirica R.Mayr.
Антилейкемический и хемопривентивный потенциал пинусолида был изучен in vitro на клеточной линии лимфомы Беркитта BJAB. Было показано, что пинусолид не только снижает пролиферативную активность опухолевых клеток в относительно низких концентрациях, но и специфично индуцирует апоптоз у 70% клеток в концентрации 100 мкМ. Апоптоз клеток BJAB опосредован потерей потенциала митохондриальной мембраны. В сущности, пинусолид в концентрации 100 мкМ приводит к потере потенциала митохондриальной мембраны, указывая на то, что это соединение использует механизм митохондриального апоптоза в соответствующем сигнальном пути гибели клетки. Значительная индукция апоптоза пинусолидом (100 мкМ) наблюдалась также в эксперименте ex vivo. Фрагментация ДНК происходила как в первичных лимфобластных клетках, так и в лейкемических. Пинусолид ex vivo преодолевает антрациклиновую устойчивость первичных лимфобластов, полученных от пациентов с высоким риском ОЛЛ (острая лимфобластная лейкемия) и слабым ответом на химиотерапию [Е.Е.Shults, J.Velder, H.-G.Schmalz, S.V.Chernov, T.V.Rubalova, Y.V.Gatilov, G.Henze, G.A.Tolstikov, A.Prokop. // Bioorg. Med. Chem. Lett., 2006, v.16 (16), p.4228-4232; Koo K.A., Lee M.K., Kim S.H., Jeong E.J., Kim S.Y., Oh Т.Н., Kim Y.C. Pinusolide and 15-methoxypinusolidic acid attenuate the neurotoxic effect of staurosporine in primary cultures of rat cortical cells. // Br. J. Pharmacol., 2007, v.150 (1), p.65-71].
Авторы работы [Han B.H., Yang H.O., Kang Y.-H., Suh D.-Y., Go H.J., Song W.-J., Kim Y.Ch., Park M.K. In Vitro Platelet-Activating Factor Receptor Binding Inhibitory Activity of Pinusolide Derivatives: A Structure-Activity Study. // J. Med. Chem. 1998, v.41 (14), p.2626-2630] охарактеризовали пинусолид (IV) в качестве нового антагониста фактора агрегации тромбоцитов. В опытах с использованием тромбоцитов кролика было получено значение IC50 для агрегации тромбоцитов, вызванной ФАТ (фактор агрегации тромбоцитов) от 19 до 5 мкМ при снижении концентрации ФАТ от 500 до 5 нМ. ЕД50 in vivo составило 1.1 мг/кг для внутривенного введения и 69.0 мг/кг per os.
Пинусолид (2 мг/кг) также проявляет местное противовоспалительное действие в эксперименте на ухе мыши; активность соединения сравнима с гидрокортизоном [Koo K.A., Sung S.H., Kim Y.C. A New Neuroprotective Pinusolide Derivative from the Leaves of Biota orientalis II Chem. Pharm. Bull, 2002, v.50(6), p.834-836].
Основным недостаткам фармакологического действия пинусолида (IV) является его использование в значительных дозах (IC50 100 мкМ), однако в связи с селективностью фармакологического (антипролиферативного и апоптозиндуцирующего) эффекта, связанного с активацией каспазы-3 указанного эпоксилабданоида, получение его структурных аналогов представляет значительный интерес для создания противоопухолевых агентов с направленным действием на цикл деления клетки.
Аналогом по строению заявляемых соединений является азлактон 16-формилметилламбертианата (V), обладающий антиоксидантной, гепатопротекторной и гемостимулирующей активностью [Патент RU 2353620. Харитонов Ю.В., Шульц Э.Э., Сорокина И.В., Толстикова Т.Г., Баев Д.С., Жукова Н.А., Толстиков Г.А. (Z)-метил-16-(5-оксо-2-фенилоксазол-4-илиденметил)-15,16-эпокси-8(17),13(16),14-лабдатриен-18-оат, обладающий антиоксидантной, гепатопротекторной и гемостимулирующей активностью. Опубл. 27.04.2009, бюл. №12; С.А. 2009, 150, P495008k].
Аналогом по свойствам заявляемых соединений [помимо природных меротерпеноидов (II, III) и лабданового дитерпеноида (IV)] является растительный тритерпеноид бетулиновая кислота (VI).
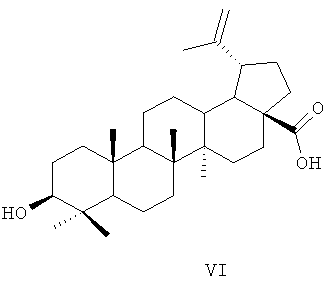
Описаны некоторые биологические эффекты агента (VI), включающие антивирусную, антипаразитарную, антибактериальную активности и в частности задержку роста опухолевых клеток [Eiznhamer D.A, Xu Z.Q. Betulinic acid: a promising anticancer candidate // I. Drugs, 2004, v.7 (4), p.359-373]. Противоопухолевая активность была показана на клеточной линии меланомы [Liu W.K., Но J.С., Cheung F.W., Liu В.P., Ye W.С, Che С.N. Apoptotic activity of betulinic acid derivatives on murine melanoma B16 cell line // Eur. J. Pharmacol. 2004, v.498(1-3), p.71-78], при головной и шейной плоскоклеточной карциномы [Eder-Czembirek С, Czembirek С, Erovic ВМ et al. Combination of betulinic acid with cisplatin-different cytotoxic effects in two head and neck cancer cell lines. // Oncol. Rep. 2005, v.14 (5), p.667-671], лейкемии [Ehrhardt H., Fulda S., Fuhrer M., Debatin K.M., Jeremias I. Betulinic acid-induced apoptosis in leukemia cells // Leukemia. 2004, v.18(8), p.1406-1412] и других опухолевых клеточных линий [Yun Y., Han S., Park E., Yim D., Lee C.K. Immunomodulatory activity of betulinic acid by producing proinflammatory cytokines and activation of macrophages // Arch. Pharm. Res. 2003, v.26(12), p.1087-1095].
В 2000 году бетулиновая кислота (VI) была включена в программу RAID (Rapid Access to Intervention Development) Национального института рака, как потенциальный противоопухолевый агент (http://dtp.nci.nih.gov/docs/small_mol/status_small_mol.html). В настоящее время препарат на основе бетулиновой кислоты проходит клинические исследования в США в качестве средства для лечения злокачественной меланомы (http://clinicaltrials.gov/show/NCT00346502).
Задачей изобретения, является создание новых средств, обладающих способностью подавлять рост опухолевых клеток человека, на основе доступного растительного метаболита ламбертиановой кислоты (VII).
Поставленная задача решается новыми химическими соединениями - 6-гидроксинафтохинонами лабданового типа, формулы (Ia-в), обладающими способностью к подавлению роста опухолевых клеток человека СЕМ-13, МТ-4 и U-937.

где R1=R2=Н(Ia); R1=Me, R2=H(Iб); R1=H, R2=CO2Et (Iв).
Способ получения соединений (Ia-в) реализуется по показанной на схеме 1 последовательности превращений ламбертиановой кислоты (VII). Метилирование ламбертиановой кислоты (VII) дает метиловый эфир (VIIa), обработка которого p-толуолсульфокислотой в бензоле гладко приводит к 8(9),13(16),14-лабдатриену (VIII) (выход 89%) [Ю.В.Харитонов, Э.Э.Шульц, М.М.Шакиров, Г.А.Толстиков. Синтетические трансформации высших терпеноидов. XVII. Внутримолекулярная циклизация фурфуриламидов лабданового типа. Журнал органической химии. 2008, т.44 (4), с.521-528]. Формилирование соединения (VIII) в условиях реакции Вильсмайера-Хаака приводит к метиловому эфиру 16-формилфломизоиковой кислоты (IX) (выход 78%) [Миронов М.Е., Харитонов Ю.В., Шульц Э.Э., Шакиров М.М., Гатилов Ю.В., Толстиков Г.А. Синтетические трансформации высших терпеноидов. XXIII. Синтез изоиндолинонов на основе дитерпеноидов. Журнал органической химии. 2010, т.46 (12), с.1855-1867]. Альдольно-кротоновая конденсация терпеноидного альдегида (IX) с ацетоном протекает с образованием кетона (X) (выход 94%). Реакция кетона (X) с избытком триметилхлорсилана в ацетонитриле в присутствии безводных хлорида цинка и триэтиламина приводит к образованию (1-терпенил)-3-триметилсилоксибутадиена (XI) (выход 92%). При кипячении диена (XI) с бензохиноном (XIIa) бензоле присутствии L-пролина и хроматографировании продуктов реакции на силикагеле выделяют 8-замещенный 6-гидрокси-1,4-нафтохинон (Ia) (выход 70%).
Взаимодействие диена (XI) с 2-бром-6-метилбензохиноном (XIIб) при нагревании в бензоле в присутствии L-пролина протекает как последовательное циклоприсоединение и дегидробромирование и приводит к образованию 8-замещенного 6-гидрокси-2-метил-1,4-нафтохинона (I6) (выход 68%).
Соединение (Iв) синтезировали в три стадии из альдегида (IX). При конденсации терпенового альдегида (IX) с ацетоуксусным эфиром получают 4-терпенил-3-этоксикарбонил-3-бутен-2-оны в виде смеси (Z)- и (E)-изомеров (ХIIIа, ХIIIб) (выход 89%, соотношение ~1:1, по данным ЯМР спектра), которые легко разделяют колоночной хроматографией на силикагеле. Взаимодействие смеси изомерных кетонов (XIIIa, б) с триметилхлорсиланом в ацетонитриле в присутствии хлорида цинка и триэтиламина приводит к 2-этоксикарбонил-3-триметилсилоксибутадиен терпенового типа (XIV) (выход 96%). При взаимодейстии 2-этоксикарбонилзамещенного силоксидиена (XIV) с бензохиноном (XIIa) получают терпеноидный 6-гидрокси-7-этоксикарбонилнафтохинон (Iв) (35%).
Техническим результатом изобретения является создание новых производных лабданоидов (Ia-в), обладающих способностью к подавлению роста опухолевых клеток человека. Новые соединения получают путем химической модификации доступного растительного метаболита Pinus sibirica R.Mayr. - ламбертиановой кислоты (VII), которая легко выделяется из лесопромышленного продукта - кедровой живицы или из хвои кедра, являющейся многотоннажным отходом лесосеки [Т.Г.Толстикова, И.В.Сорокина, М.П.Долгих., Ю.В.Харитонов, С.В.Чернов, Э.Э.Шульц, Г.А.Толстиков. Нейротропная активность аддуктов ламбертиановой кислоты с N-замещенными малеинимидами. Химико-фармацевтический журнал. 2004, т.38 (10), с.13-15]. Физико-химические константы новых, впервые полученных соединений, приведены в примерах 1-3.
Биологическая активность соединений (Ia-в) изучалась путем определения способности к подавлению роста опухолевых клеток СЕМ-13, МТ-4 и U-937. Цитотоксическую активность устанавливали путем определения CCID50 - доза, ингибирующая жизнеспособность опухолевых клеток на 50%. Для определения CCID50 использовали стандартный МТТ тест, как описано в рекомендациях [Mosmann Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. // J Immunol Methods, 1983, v.16 (1), p.55-63; Wilson J.K., Sargent J.M., Elgie A.W., Hill J.G., Taylor C.G. A feasibility study of the MTT assay for chemosensitivity testing in ovarian malignancy // Br. J. Cancer, 1990, v.62 (2), p.189-194]. Результаты изучения цитотоксической активности приведены в табл.1.
|
Из данных таблицы 1 видно, что заявляемые соединения (Ia-в) обладают способностью подавлять рост опухолевых клеток человека. Наибольшей цитотоксической активностью обладает соединение (Ia). Цитотоксическая доза соединения (Ia) составляет 3.4 мкМ для клеток T-клеточных лейкозов СЕМ-13, 5.8 мкМ - для клеток моноцитов человека U-937 и 4.3 мкМ - для клеток Т-клеточной лейкемии МТ-4. Это соединение оказалось в 20 раз более активным ингибитором жизнеспособности опухолевых клеток СЕМ-13 и МТ-4, и в 8 раз более активным ингибитором жизнеспособности опухолевых клеток U-937, чем исходное ламбертиановая кислота (VII). Соединения (Ia-в) более активно, чем пинусолид, подавляют рост опухолевых клеток моноцитов человека U-937 (CCID50=4.4-9.2 мкМ) и T-клеточной лейкемии (CCID50=4.3-15.1 мкМ). Соединения (Ia, б) в более низкой концентрации подавляют рост клеток лейкемии МТ-4, чем бетулоновая кислота (VI).
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение (1S,4aS,8aR)-Метил 5-{2-[2-(6-гидрокси-1,4-диоксо-1,4-дигидронафталин-8-ил)-фуран-3-ил]этил}-1,4а,6-триметил-1,2,3,4,4а,7,8,8а-октагидронафталин-1-карбоксилата (Ia).
1. (1S,4aR,5S,8aR)-Метил 5-[2-(фуран-3-ил)этил]-1,4а-диметил-6-метилендекагидро-нафталин-1-карбоксилат (метилламбертианат) (VIIa).
К раствору 2.5 г ламбертиановой кислоты (IV) в 50 мл этанола добавляют 1.99 г диметилсульфата и при перемешивании в течение 15 мин прикапывают раствор 2.2 г гидроокиси калия в 22 мл воды. Температура не должна превышать 40°C. Реакционную массу перемешивают 2 ч при комнатной температуре, затем добавляют 100 мл воды, продукт экстрагирируют хлористым метиленом (4×50 мл). Объединенный экстракт промывают 1%-ным водн. раствором NaOH (2×25 мл), водой (3×25 мл) и сушат сульфатом магния. Растворитель упаривают, в остатке получают 2.38 г (91%) метилового эфира ламбертиановой кислоты (VIIa) в виде масла. 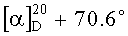 (c 1.3, в хлороформе). Данные спектров ЯМР 1H и 13C соответствуют приведенным в работе [Dauben W.G., German V.F. The structure of lambertianic acid. A new diterpenic acid. // Tetrahedron. 1966, v.22 (2), p.679-683].
(c 1.3, в хлороформе). Данные спектров ЯМР 1H и 13C соответствуют приведенным в работе [Dauben W.G., German V.F. The structure of lambertianic acid. A new diterpenic acid. // Tetrahedron. 1966, v.22 (2), p.679-683].
2. (1S,10S)-Метил-5-[2-(фуран-3-ил)этил]-1,6,10-триметил-1,2,3,4,5,6,9,10-окта гидронафталин-1-карбоксилат (метил-15,16-эпокси-8(9),13(16),14-лабдатриен-18-оат) (VIII).
К раствору 1.00 г (3.02 ммоль) метилового эфира ламбертиановой кислоты (VIIa) в 10 мл бензола добавляют 0.01 г (0.06 ммоль) безв. p-толуолсульфокислоты. Реакционную смесь кипятят 2 ч, растворитель выпаривают в вакууме, остаток хроматографируют на колонке с силикагелем (элюент - петролейный эфир). Получают 0.89 г (89%) соединения (VIII) в виде масла. [α]580+23.4 (c 3.1, EtOH). Данные спектров ЯМР 1H и 13C соответствуют приведенным в работе [Ю.В.Харитонов, Э.Э.Шульц, М.М.Шакиров, Г.А.Толстиков. Синтетические трансформации высших терпеноидов. XVII. Внутримолекулярная циклизация фурфуриламидов лабданового типа. Журнал органической химии. 2008, т.44 (4), с.521-528].
3. (1S,4aS,8aR)-Метил 5-[2-(2-формилфуран-3-ил)этил]-1,4а,6-триметил-1,2,3,4,4а,7,8,8а-октагидронафталин-1-карбоксилат (Метил 16-формил-8(9),13(16),14-лабдатриеноат) (IX).
К перемешиваемому раствору 8.80 г (26.7 ммоль) дитерпеноида (VIII) в 40 мл ДМФА добавляют по каплям 4.80 мл (52.5 ммоль) POCl3 (температура 20°C). Реакционную массу выдерживают при периодическом перемешивании 48 ч, затем выливают на 70 мл ледяной воды. К полученной смеси добавляют 20 мл насыщенного водного раствора NaOAc, образовавшийся органический слой отделяют, водный слой экстрагируют эфиром. Объединенные экстракты промывают 5%-ным водным раствором соды и высушивают над MgSO4. Растворитель упаривают в вакууме, остаток хроматографируют на Al2O3 (20:1, петролейный эфир-эфир, 4:1). Фракции, содержащие продукт, кристаллизуют из гексана, получают 7.48 г (78%) метил 16-формил-8(9),13(16),14-лабдатриеноата (IX). Т.пл. 55-58°C. 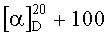 (с 0.55, CHCl3). Данные спектров ЯМР 1H и 13C соответствуют приведенным в работе [Миронов М.Е., Харитонов Ю.В., Шульц Э.Э., Шакиров М.М., Гатилов Ю.В., Толстиков Г.А. Синтетические трансформации высших терпеноидов. XXIII. Синтез изоиндолинонов на основе дитерпеноидов. Журнал органической химии. 2010, т.46 (12), с.1855-1867].
(с 0.55, CHCl3). Данные спектров ЯМР 1H и 13C соответствуют приведенным в работе [Миронов М.Е., Харитонов Ю.В., Шульц Э.Э., Шакиров М.М., Гатилов Ю.В., Толстиков Г.А. Синтетические трансформации высших терпеноидов. XXIII. Синтез изоиндолинонов на основе дитерпеноидов. Журнал органической химии. 2010, т.46 (12), с.1855-1867].
4. (1S,4aS,8aR,E)-Метил 1,4а,6-триметил-5-{2-[2-(3-оксобут-1-енил)фуран-3-ил]этил}-1,2,3,4,4а,7,8,8а-октагидронафталин-1-карбоксилат (X).
К раствору 5.0 г (14 ммоль) терпенового альдегида (IX) в 25 мл ацетона при интенсивном перемешивании прибавляют 0.28 г NaOH (7 ммоль) в 8.0 мл H2O. Реакционную смесь перемешивают 5 ч при комнатной температуре, затем упаривают. К остатку добавляют 50 мл хлористого метилена и 5 мл 10%-ного водного раствора HCl. Слои разделяют, органический слой промывают дистиллированной водой до pH 7, сушат над MgSO4, упаривают в вакууме, остаток хроматографируют на силикагеле (элюент-петролейный эфир-диэтиловый эфир, 4:1). Выделяют 5.25 г (94%) соединения (X) в виде масла, 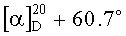 (c 0.34, CHCl3). ИК спектр, ν, см-1: 3141, 3112, 2952, 1722, 1680, 1664, 1612, 1564, 1464, 1439, 1376, 1361, 1235, 1191, 1162, 1142, 1097, 1039, 970, 893, 825, 794, 756. УФ спектр (EtOH), λмакс, нм (lgε): 202 (4.08), 330 (3.86). Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.75 с (3H, C20H3) 1.00 т.д (1H, Н3, J 13.5, 4.5), 1.19 с (3H, С19Н3), 1.22 м (1H, Hl), 1.30 д.д (1H, Н5, J 12.5, 1.8), 1.51 м (1Н, Н2), 1.62 с (3H, С17Н3), 1.72 м (1H, H6), 1.81-1.92 м (3H, H1,2,6), 1.96 м (2Н, Н7), 2.08 м (2Н, H11), 2.18 д.м (1H, Н3, Jгем 13.5), 2.28 с (3H, С4'H3), 2.53 м (2Н, H12), 3.60 с (3H, OCH3), 6.38 д (1H, H14, J 1.5), 6.55 д (1H, Н1', J 15.8), 7.30 д (1H, Н2', J 15.8), 7.39 д (1H, Н15, J 1.5). Спектр ЯМР 13С, δ, м.д.: 17.33 к (С20), 19.13 т (C2), 19.43 к (С17), 20.33 т (С6), 25.32 т (С12), 27.63 к (С4'), 27.97 к (С19), 28.62 т (C11), 36.84 т (С7), 36.88 т (С1), 37.21 т (С3), 39.14 с (С10), 43.43 с (С4), 50.64 к (OCH3), 53.00 д (С5), 112.95 д (С14), 122.09 д (С2'), 126.71 д (С1'), 127.53 с (С8), 131.79 с (С13), 137.77 с (С9), 144.06 д (С15), 145.98 с (С16), 177.53 с (C18), 197.21 с (С3'). Масс-спектр, m/z (Iотн., %): 398 (0.6), 358 (0.3), 339 (0.9), 283 (0.6), 265 (0.8), 249 (7), 189 (26), 150 (100), 133 (13), 108 (30), 83 (24), 59 (24). Найдено: m/z 398.2444 [М]+. С25Н35О4. Вычислено: M 398.2452.
(c 0.34, CHCl3). ИК спектр, ν, см-1: 3141, 3112, 2952, 1722, 1680, 1664, 1612, 1564, 1464, 1439, 1376, 1361, 1235, 1191, 1162, 1142, 1097, 1039, 970, 893, 825, 794, 756. УФ спектр (EtOH), λмакс, нм (lgε): 202 (4.08), 330 (3.86). Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.75 с (3H, C20H3) 1.00 т.д (1H, Н3, J 13.5, 4.5), 1.19 с (3H, С19Н3), 1.22 м (1H, Hl), 1.30 д.д (1H, Н5, J 12.5, 1.8), 1.51 м (1Н, Н2), 1.62 с (3H, С17Н3), 1.72 м (1H, H6), 1.81-1.92 м (3H, H1,2,6), 1.96 м (2Н, Н7), 2.08 м (2Н, H11), 2.18 д.м (1H, Н3, Jгем 13.5), 2.28 с (3H, С4'H3), 2.53 м (2Н, H12), 3.60 с (3H, OCH3), 6.38 д (1H, H14, J 1.5), 6.55 д (1H, Н1', J 15.8), 7.30 д (1H, Н2', J 15.8), 7.39 д (1H, Н15, J 1.5). Спектр ЯМР 13С, δ, м.д.: 17.33 к (С20), 19.13 т (C2), 19.43 к (С17), 20.33 т (С6), 25.32 т (С12), 27.63 к (С4'), 27.97 к (С19), 28.62 т (C11), 36.84 т (С7), 36.88 т (С1), 37.21 т (С3), 39.14 с (С10), 43.43 с (С4), 50.64 к (OCH3), 53.00 д (С5), 112.95 д (С14), 122.09 д (С2'), 126.71 д (С1'), 127.53 с (С8), 131.79 с (С13), 137.77 с (С9), 144.06 д (С15), 145.98 с (С16), 177.53 с (C18), 197.21 с (С3'). Масс-спектр, m/z (Iотн., %): 398 (0.6), 358 (0.3), 339 (0.9), 283 (0.6), 265 (0.8), 249 (7), 189 (26), 150 (100), 133 (13), 108 (30), 83 (24), 59 (24). Найдено: m/z 398.2444 [М]+. С25Н35О4. Вычислено: M 398.2452.
5. (1S,4aR,8aR,E)-Метил 1,4а,6,8а-триметил-5-(2-{2-[3-(триметилсилокси)бута-1,3-диенил]фуран-3-ил}этил)-1,2,3,4,4а,7,8,8а-октагидронафталин-1-карбоксилат (XI).
К перемешиваемой суспензии 0.27 г (2 ммоль) безводного хлористого цинка и 5 мл (36 ммоль) триэтиламина при нагревании до 60°C в токе аргона последовательно прибавляют раствор 3.98 г (10 ммоль) кетона (X) в 40 мл ацетонитрила и 3.8 мл (30 ммоль) триметилхлорсилана. Реакционную массу перемешивают 2 ч (температура масляной бани 90-100°C), затем добавляют 2 мл триэтиламина и 1 мл триметилхлорсилана и продолжают нагревание еще 3 ч. После охлаждения добавляют 50 мл безводного диэтилового эфира, в токе аргона отфильтровывают образовавшийся осадок. Маточный раствор упаривают в вакууме водоструйного насоса, остаток аналогично обрабатывают 50 мл безводного диэтилового эфира. Маслообразное соединение подвергают очистке путем перколирования через слой дезактивированного силикагеля (масса силикагеля 6 г, диаметр колонки 3 см, элюент - безводный диэтиловый эфир). После упаривания получают соединение (XI) (выход 92%), в виде светло-коричневого маслообразного вещества, устойчивого в атмосфере аргона. Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.23 с (9Н, OSi(CH3)3), 0.75 с (3H, C20H3), 1.01 т.д (1Н, Н3, J 13.4, 4.0), 1.19 с (3H, С19Н3), 1.23 м (1Н, Н1), 1.33 м (1H, Н5), 1.53 м (1H, Н2, Jгем 13.6), 1.66 с (3H, С17Н3), 1.70-2.12 м (7Н, H1,2,3,6,6,7,7), 2.20 м (2H, H11), 2.45 м (2H, H12), 3.61 с (3H, OCH3); 4.36 c, 4.41 с (2H, H4'), 6.28 д (1H, H14, J 1.5), 6.45 д, 6.60 д (2Н, Н1',2', J 15.8), 7.27 д (1H, H15, J 1.5). Спектр ЯМР 13С, δ, м.д.: 0.15 к ((CH3)3OSi), 17.69 к (С20), 19.60 т (С2), 19.89 к (С17), 20.81 т (С6), 25.68 т (С12), 28.42 к (С19), 29.61 т (С11), 34.29 т (С7), 37.18 т (С1), 37.70 т (С3), 39.59 с (С10), 43.87 с (С4), 51.09 к (ОСН3), 53.49 д (С5), 96.48 т (С4'), 112.66, (С14), 115.02 д (С1'), 123.37 д (С2'), 124.65 с (C13), 127.49 с (С8), 138.65 с (С9), 141.73 д (С15), 147.95 с (С16), 154.91 с (С3'), 178.06 с (С18).
6. (1S,4aS,8aR)-Метил 5-{2-[2-(6-гидрокси-1,4-диоксо-1,4-дигидронафталин-8-ил)-фуран-3-ил]этил}-1,4а,6-триметил-1,2,3,4,4а,7,8,8а-октагидронафталин-1-карбоксилат (Iа).
К раствору 1.9 г (4 ммоль) диена (XI) в 20 мл бензола в токе аргона добавляют 0.39 г (3.6 ммоля) бензохинона (XIIa) (предварительно возгоняют) и 0.041 г (0.36 ммоль) L-пролина. Реакционную смесь кипятят 12 ч, растворитель удаляют в вакууме, остаток растворяют в 50 мл хлористого метилена, раствор промывают дистиллированной водой (3×20 мл), сушат MgSO4, затем упаривают. Остаток хроматографируют на колонке с силикагелем, последовательно выделяют кетон (X) (элюент-петролейный эфир-диэтиловый эфир 4:1) и соединение (Ia) (элюент-хлороформ-метанол 100:1), которое очищают кристаллизацией из эфира. Выход 1.42 г (70%). Т.пл. 125-127°C. 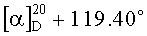 (с 0.02, CHCl3). ИК-спектр, см-1: 3430, 2952, 1724, 1697, 1668, 1595, 1576, 1500, 1455, 1419, 1332, 1279, 1230, 1208, 1194, 1162, 1141, 1086, 1060, 1045, 981, 892, 848, 810, 756. УФ спектр (EtOH), λмакс, нм (lgε): 201 (4.55), 244 (4.07), 366 (3.46). Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.69 с (3H, С20Н3), 0.94 т.д (1H, Н3, J 13.4, 4.3), 1.05 т.д (1Н, Н1, J 12.9, 4.0), 1.17 с (3H, С19Н3), 1.22-1.27 м (1H, Н5), 1.41 д (1Н, H2, J 13.7), 1.48 с (3H, С17Н3), 1.63-1.75 м (3H, Н1,2,6), 1.79-2.02 м (3H, Н6,7,7), 2.11-2.22 м (3H, Н3,11,11), 2.30-2.36 м (2Н, H12), 3.62 с (3H, ОСН3), 6.46 д (1H, H14, J 1.6), 6.80 д (1H, H2', J 10.0), 6.87 д (1H, Н3′, J 10.0), 7.14 д (1H, Н7′, J 2.5), 7.43 д (1Н, H15, J 1.6), 7.62 д (1Н, H5′, J 2.5), 8.01 уш.с (1H, OH). Спектр ЯМР 13C, δ, м.д.: 17.56 к (С20), 19.38 т (С2), 19.49 к (С17), 20.66 т (C6), 25.73 т (C12), 28.26 к (C19), 29.09 т (C11), 34.11 т (С7), 37.00 т (С1), 37.51 т (С3), 39.38 с (С10), 43.80 с (C4), 51.15 к (OCH3), 53.32 д (С5), 111.89 д (С14), 113.54 д (С5′), 122.15 с (С13), 123.62 с (С8′a), 124.39 д (С7′), 127.48 с (С8), 133.90 с (С8′), 135.45 с (С4′a), 136.25 д (С3′), 138.44 с (С9), 140.44 д (С2′), 141.52 д (C15), 147.04 с (С16), 160.22 с (С6′), 178.52 с (С18), 183.22 с (С1′), 185.16 с (С4′). Масс-спектр, m/z (Iотн., %): 499.3 (6.02), 91.1 (100), 249.1 (72.78), 250.2 (23.16), 43.0 (20.98). Найдено: m/z 502.2344 [M]+. C31H34O6. Вычислено: M 502.2350.
(с 0.02, CHCl3). ИК-спектр, см-1: 3430, 2952, 1724, 1697, 1668, 1595, 1576, 1500, 1455, 1419, 1332, 1279, 1230, 1208, 1194, 1162, 1141, 1086, 1060, 1045, 981, 892, 848, 810, 756. УФ спектр (EtOH), λмакс, нм (lgε): 201 (4.55), 244 (4.07), 366 (3.46). Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.69 с (3H, С20Н3), 0.94 т.д (1H, Н3, J 13.4, 4.3), 1.05 т.д (1Н, Н1, J 12.9, 4.0), 1.17 с (3H, С19Н3), 1.22-1.27 м (1H, Н5), 1.41 д (1Н, H2, J 13.7), 1.48 с (3H, С17Н3), 1.63-1.75 м (3H, Н1,2,6), 1.79-2.02 м (3H, Н6,7,7), 2.11-2.22 м (3H, Н3,11,11), 2.30-2.36 м (2Н, H12), 3.62 с (3H, ОСН3), 6.46 д (1H, H14, J 1.6), 6.80 д (1H, H2', J 10.0), 6.87 д (1H, Н3′, J 10.0), 7.14 д (1H, Н7′, J 2.5), 7.43 д (1Н, H15, J 1.6), 7.62 д (1Н, H5′, J 2.5), 8.01 уш.с (1H, OH). Спектр ЯМР 13C, δ, м.д.: 17.56 к (С20), 19.38 т (С2), 19.49 к (С17), 20.66 т (C6), 25.73 т (C12), 28.26 к (C19), 29.09 т (C11), 34.11 т (С7), 37.00 т (С1), 37.51 т (С3), 39.38 с (С10), 43.80 с (C4), 51.15 к (OCH3), 53.32 д (С5), 111.89 д (С14), 113.54 д (С5′), 122.15 с (С13), 123.62 с (С8′a), 124.39 д (С7′), 127.48 с (С8), 133.90 с (С8′), 135.45 с (С4′a), 136.25 д (С3′), 138.44 с (С9), 140.44 д (С2′), 141.52 д (C15), 147.04 с (С16), 160.22 с (С6′), 178.52 с (С18), 183.22 с (С1′), 185.16 с (С4′). Масс-спектр, m/z (Iотн., %): 499.3 (6.02), 91.1 (100), 249.1 (72.78), 250.2 (23.16), 43.0 (20.98). Найдено: m/z 502.2344 [M]+. C31H34O6. Вычислено: M 502.2350.
Пример 2. Получение (1S,4aS,8aR)-Метил 5-{2-[2-(6-гидрокси-2-метил-1,4-диоксо-1,4-дигидронафталин-8-ил)фуран-3-ил]этил}-1,4а,6-триметил-1,2,3,4,4а,7,8,8а-октагидронафталин-1-карбоксилата (Iб).
Стадии 1-5 выполняются по методикам, приведенным в описании примера 1.
6. 1S,4aS,8aR)-Метил 5-{2-[2-(6-гидрокси-2-метил-1,4-диоксо-1,4-дигидронафталин-8-ил)фуран-3-ил]этил}-1,4а,6-триметил-1,2,3,4,4а,7,8,8а-октагидронафталин-1-карбоксилат (I6).
К раствору 1.9 г (4 ммоль) диена (XI) в 20 мл бензола в токе аргона добавляют 0.72 г (3.6 ммоля) 2-бром-6-метилбензохинона (ХIIб) (предварительно возгоняют) и 0.041 г (0.36 ммоль) L-пролина. Реакционную смесь кипятят 12 ч, растворитель удаляют в вакууме, остаток растворяют в 50 мл хлористого метилена, раствор промывают дистиллированной водой (3×20 мл), сушат MgSO4, затем упаривают. Остаток хроматографируют на колонке с силикагелем, последовательно выделяют кетон (X) (элюент-петролейный эфир-диэтиловый эфир 4:1) и соединение (I6) (элюент-хлороформ-метанол 100:1), которое очищают дополнительной перекристаллизацией из эфира. Получают 1.26 г (68%) соединения (I6). Т.пл. 162-164°C. 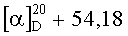 (c 0.27, CHCl3). ИК спектр, см-1: 3424, 2957, 2928, 2874,1725,1680, 1665, 1597, 1570, 1500, 1480, 1376, 1331, 1254, 1238, 1208, 1172, 1154, 1139, 1091, 956, 943, 890, 874, 744, 604. УФ спектр (EtOH), λмакс., нм (lgε): 201 (4.31), 267 (3.97), 361 (2.80), 372 (2.77). Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.66 с (3H, C20H3), 0.91 т.д (1H, H3, J 13.6, 4.7), 1.00 т.д (1Н, Н1, J 14.3, 5.4), 1.14 c (3H, С19Н3), 1.23 м (1H, H5), 1.38 м (1H, Н2), 1.44 с (3H, С17Н3), 1.56-1.74 м (4Н, H1,2,6,6), 1.83-2.01 м (3H, H7,7,11), 2.07 с (CH3) 2.11-2.19 м (2Н, H3,11), 2.32 м (2Н, H12), 3.59 с (3H, ОСН3), 6.44 д (1H, H14, J 1.7), 6.73 д (1Н, Н2′, J 1.6), 7.08 д (1H, Н7′, J 2.6), 7.43 д (1Н, Н15, J 1.7), 7.59 д (1H, Н5′, J 2.6), 8.01 уш.с (1Н, OH). Спектр ЯМР 13С, δ, м.д.: 16.79 к (СН3), 17.51 к (С20), 19.34 т (С2), 19.45 к (С17), 20.64 т (С6), 25.68 т (С12), 28.24 к (С19), 29.10 т (С11), 34.10 т (С7), 36.96 т (С1), 37.50 т (С3), 39.36 с (С10), 43.77 с (С4), 51.11 к (ОСН3), 53.30 д (С5), 111.80 д (C14), 113.30 д (С5′), 121.68 с (С13), 123.92 с (С8′а), 124.33 д (С7′), 127.19 с (С8), 133.53 д (С3′), 133.89 с (С8′), 135.76 с (С4'а), 138.46 с (С9), 141.34 д (С15), 147.46 с (С16), 150.08 с (С2′), 160.15 с (С6′), 178.44 с (С18), 183.55 с (С1′), 185.18 с (C4′). Масс-спектр, m/z (Iотн., %): 516.3 (14.58), 57.0 (100), 42.9 (80.84), 55.0 (70.68), 71.0 (66.62). Найдено: m/z 516.2505 [M]+. C32H36O6. Вычислено: М 516.2506.
(c 0.27, CHCl3). ИК спектр, см-1: 3424, 2957, 2928, 2874,1725,1680, 1665, 1597, 1570, 1500, 1480, 1376, 1331, 1254, 1238, 1208, 1172, 1154, 1139, 1091, 956, 943, 890, 874, 744, 604. УФ спектр (EtOH), λмакс., нм (lgε): 201 (4.31), 267 (3.97), 361 (2.80), 372 (2.77). Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.66 с (3H, C20H3), 0.91 т.д (1H, H3, J 13.6, 4.7), 1.00 т.д (1Н, Н1, J 14.3, 5.4), 1.14 c (3H, С19Н3), 1.23 м (1H, H5), 1.38 м (1H, Н2), 1.44 с (3H, С17Н3), 1.56-1.74 м (4Н, H1,2,6,6), 1.83-2.01 м (3H, H7,7,11), 2.07 с (CH3) 2.11-2.19 м (2Н, H3,11), 2.32 м (2Н, H12), 3.59 с (3H, ОСН3), 6.44 д (1H, H14, J 1.7), 6.73 д (1Н, Н2′, J 1.6), 7.08 д (1H, Н7′, J 2.6), 7.43 д (1Н, Н15, J 1.7), 7.59 д (1H, Н5′, J 2.6), 8.01 уш.с (1Н, OH). Спектр ЯМР 13С, δ, м.д.: 16.79 к (СН3), 17.51 к (С20), 19.34 т (С2), 19.45 к (С17), 20.64 т (С6), 25.68 т (С12), 28.24 к (С19), 29.10 т (С11), 34.10 т (С7), 36.96 т (С1), 37.50 т (С3), 39.36 с (С10), 43.77 с (С4), 51.11 к (ОСН3), 53.30 д (С5), 111.80 д (C14), 113.30 д (С5′), 121.68 с (С13), 123.92 с (С8′а), 124.33 д (С7′), 127.19 с (С8), 133.53 д (С3′), 133.89 с (С8′), 135.76 с (С4'а), 138.46 с (С9), 141.34 д (С15), 147.46 с (С16), 150.08 с (С2′), 160.15 с (С6′), 178.44 с (С18), 183.55 с (С1′), 185.18 с (C4′). Масс-спектр, m/z (Iотн., %): 516.3 (14.58), 57.0 (100), 42.9 (80.84), 55.0 (70.68), 71.0 (66.62). Найдено: m/z 516.2505 [M]+. C32H36O6. Вычислено: М 516.2506.
Пример 3. Получение (1S,4aR,5S,8aR)-Метил-5-(2-{2-[5-(хлорметил)-1,2,4-оксадиазол-3-ил]-фуран-3-ил}этил)-1,4а-диметил-6-метилендекагидронафталин-1-карбоксилата (Iв).
Стадии 1-3 выполняются по методикам, приведенным в описании примера 1.
4. (1S,4aS,8aR,Z)- и (1S,4aS,8aR,E)-Метил 5-{2-[2-(2-этоксикарбонил-3-оксобут-1-енил)фуран-3-ил]этил}-1,4а,6-триметил-1,2,3,4,4а,7,8,8а-октагидронафталин-1-карбоксилаты (XIIIa, б).
а. К раствору 4.0 г (11.2 ммоль) альдегида (IX) в 40 мл бензола добавляли 2.13 мл ацетоуксусного эфира (16.7 ммоль), 0.22 мл пиперидина (2.2 ммоль), 0.50 мл уксусной кислоты (8.8 ммоль), 0.015 г молекулярных сит 3Å и 0.13 г (1.10 ммоль) L-пролина. Реакционную смесь кипятят с обратным холодильником 8 ч (контроль ТСХ), упаривают досуха, остаток растворяют в 50 мл хлористого метилена, промывают водой (3×10 мл), органический слой сушат MgSO4. Остаток после упаривания хроматографируют на силикагеле (элюент петролейный эфир-диэтиловый эфир, 4:1). Получают 4.77 г (90%) смеси соединений (XIIa, б).
Соединения (XIIIa, б) разделяют колоночной хроматографией на силикагеле (элюенты-гексан для (Z)- и гексан-этиэтиловый эфир, 5:1 - для (E)-изомера).
(Z)-изомер (XIIIa): 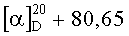 (с 0.55, CHCl3). ИК-спектр, см-1: 557, 669, 694, 758, 799, 870, 897, 920, 984, 1038, 1090, 1165, 1202, 1231, 1340, 1375, 1431, 1466,1555, 1620, 1661, 1724, 2883, 2953, 3142, 3431. Спектр ЯМР 1Н, δ, м.д. (J, Гц): 0.74 с (3H, С20Н3), 1.01 т.д (1Н, Н3, J 13.3, 4.4), 1.19 с (3H, С19Н3), 1.22 т.д (1H, Н1, J 13.9, 3.4), 1.31 м (1H, H5), 1.35 т (3H, CO2CH2CH
3, J 7.2), 1.54 м (1Н, Н2), 1.62 с (3Н, С17Н3), 1.70 к.д (1Н, H6, J 12.7, 5.8), 1.81 д.т (1H, Н1, J 13.5, 3.5), 1.85 м (1Н, Н2), 1.93 м (2Н, Н6,7), 2.00-2.08 м (2Н, Н7,11), 2.21 м (2Н, Н3,11), 2.32 с (3H, С4′Н3), 2.55 м (2Н, Н12,12), 3.61 с (3H, OCH3), 4.38 к (2Н, CO2CH
2CH3, J 7.2), 6.41 д (1Н, H14, J 1.9), 7.29 с (1H, Н1′), 7.42 д (1H, Н15, J 1.7). Спектр ЯМР 13C, δ, м.д.: 14.04 к (CO2CH2
CH3), 17.65 к (С20), 19.45 т (С2), 19.77 к (C17), 20.64 т (С6), 25.87 т (С12), 26.32 к (С4′), 28.30 к (С19), 29.06 т (С11), 34.14 т (С7), 37.21 т (C1), 37.51 т (С3), 39.47 с (С10), 43.75 с (С4), 51.01 к (OCH3), 53.29 д (С5), 61.42 т (CO2
CH2CH3), 113.47 д (C14), 123.47 д (С1′), 128.09 с (С8), 128.13 с (С3′), 135.68 с (С13), 137.85 с (С9), 144.61 с (С16), 145.87 д (С15), 168.02 с (CO2CH2CH3), 177.86 с (С18), 193.48 с (С2′). Масс-спектр, m/z (Iотн., %): 470.3 (1.03), 176.1 (100.00), 221.1 (84.69), 201.7 (72.95), 189.2 (34.48), 161.0 (28.95). Найдено: m/z 470.2655 [M]+. C28H38O6. Вычислено: M 470.2663.
(с 0.55, CHCl3). ИК-спектр, см-1: 557, 669, 694, 758, 799, 870, 897, 920, 984, 1038, 1090, 1165, 1202, 1231, 1340, 1375, 1431, 1466,1555, 1620, 1661, 1724, 2883, 2953, 3142, 3431. Спектр ЯМР 1Н, δ, м.д. (J, Гц): 0.74 с (3H, С20Н3), 1.01 т.д (1Н, Н3, J 13.3, 4.4), 1.19 с (3H, С19Н3), 1.22 т.д (1H, Н1, J 13.9, 3.4), 1.31 м (1H, H5), 1.35 т (3H, CO2CH2CH
3, J 7.2), 1.54 м (1Н, Н2), 1.62 с (3Н, С17Н3), 1.70 к.д (1Н, H6, J 12.7, 5.8), 1.81 д.т (1H, Н1, J 13.5, 3.5), 1.85 м (1Н, Н2), 1.93 м (2Н, Н6,7), 2.00-2.08 м (2Н, Н7,11), 2.21 м (2Н, Н3,11), 2.32 с (3H, С4′Н3), 2.55 м (2Н, Н12,12), 3.61 с (3H, OCH3), 4.38 к (2Н, CO2CH
2CH3, J 7.2), 6.41 д (1Н, H14, J 1.9), 7.29 с (1H, Н1′), 7.42 д (1H, Н15, J 1.7). Спектр ЯМР 13C, δ, м.д.: 14.04 к (CO2CH2
CH3), 17.65 к (С20), 19.45 т (С2), 19.77 к (C17), 20.64 т (С6), 25.87 т (С12), 26.32 к (С4′), 28.30 к (С19), 29.06 т (С11), 34.14 т (С7), 37.21 т (C1), 37.51 т (С3), 39.47 с (С10), 43.75 с (С4), 51.01 к (OCH3), 53.29 д (С5), 61.42 т (CO2
CH2CH3), 113.47 д (C14), 123.47 д (С1′), 128.09 с (С8), 128.13 с (С3′), 135.68 с (С13), 137.85 с (С9), 144.61 с (С16), 145.87 д (С15), 168.02 с (CO2CH2CH3), 177.86 с (С18), 193.48 с (С2′). Масс-спектр, m/z (Iотн., %): 470.3 (1.03), 176.1 (100.00), 221.1 (84.69), 201.7 (72.95), 189.2 (34.48), 161.0 (28.95). Найдено: m/z 470.2655 [M]+. C28H38O6. Вычислено: M 470.2663.
(E)-изомер (XIIIб): 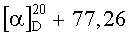 (с 0.55, CHCl3). ИК-спектр, см-1: 598, 669, 696, 756, 872, 986, 1036, 1094, 1186, 1232, 1331, 1371, 1447, 1462, 1562, 1622, 1720, 2883, 2953, 3144, 3429. Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.74 с (3H, С20Н3), 1.01 т.д (1H, Н3, J 13.3, 4.3), 1.18 с (3H, С19Н3), 1.21 м (1H, Н1), 1.28 т (3H, CO2CH2CH
3, J 7.0), 1.32 м (1H, Н5), 1.54 м (1H, Н2), 1.62 с (3H, С17Н3), 1.70 к.д (1H, H6, J 12.5, 5.7), 1.80 т.д (1H, Н1, J 13.6, 3.5), 1.85 м (1H, Н2), 1.94 м (2Н, Н6,7), 1.99-2.08 м (2Н, Н7,11), 2.18 м (2Н, Н3,11), 2.45 с (3H, С4′Н3), 2.54 м (2Н, Н12,12), 3.60 с (3H, OCH3), 4.23 к (2Н, CO2CH
2CH3, J 7.2), 6.37 д (1H, H14, J 1.8), 7.32 с (1H, Н1′), 7.39 д (1H, Н15, J 1.6). Спектр ЯМР 13С, δ, м.д.: 14.05 к (CO2CH2
CH3), 17.62 к (С20), 19.44 т (С2), 19.78 к (С17), 20.64 т (С6), 25.73 т (С12), 28.28 к (С19), 29.04 т (С11), 31.13 к (С4′), 34.16 т (С7), 37.16 т (С1), 37.52 т (С3), 39.45 с (С10), 43.74 с (C4), 50.08 к (OCH3), 53.28 д (С5), 61.13 т (CO2
CH2CH3), 113.18 д (С14), 123.12 д (С1′), 127.99 с (C8), 127.81 с (С3′), 133.87 с (С13), 137.94 с (С9), 144.80 с (С16), 145.51 д (С15), 164.60 с (CO2CH2CH3), 177.88 с (С18), 202.60 с (С2′). Масс-спектр, m/z (Iотн., %): 470.3 (1.93), 176.1 (100), 222.1 (66.77), 207.1 (60.49), 264 (48.11), 189.2 (48.11). Найдено: m/z 470.2636 [M]+. C28H38O6. Вычислено: M 470.2663.
(с 0.55, CHCl3). ИК-спектр, см-1: 598, 669, 696, 756, 872, 986, 1036, 1094, 1186, 1232, 1331, 1371, 1447, 1462, 1562, 1622, 1720, 2883, 2953, 3144, 3429. Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.74 с (3H, С20Н3), 1.01 т.д (1H, Н3, J 13.3, 4.3), 1.18 с (3H, С19Н3), 1.21 м (1H, Н1), 1.28 т (3H, CO2CH2CH
3, J 7.0), 1.32 м (1H, Н5), 1.54 м (1H, Н2), 1.62 с (3H, С17Н3), 1.70 к.д (1H, H6, J 12.5, 5.7), 1.80 т.д (1H, Н1, J 13.6, 3.5), 1.85 м (1H, Н2), 1.94 м (2Н, Н6,7), 1.99-2.08 м (2Н, Н7,11), 2.18 м (2Н, Н3,11), 2.45 с (3H, С4′Н3), 2.54 м (2Н, Н12,12), 3.60 с (3H, OCH3), 4.23 к (2Н, CO2CH
2CH3, J 7.2), 6.37 д (1H, H14, J 1.8), 7.32 с (1H, Н1′), 7.39 д (1H, Н15, J 1.6). Спектр ЯМР 13С, δ, м.д.: 14.05 к (CO2CH2
CH3), 17.62 к (С20), 19.44 т (С2), 19.78 к (С17), 20.64 т (С6), 25.73 т (С12), 28.28 к (С19), 29.04 т (С11), 31.13 к (С4′), 34.16 т (С7), 37.16 т (С1), 37.52 т (С3), 39.45 с (С10), 43.74 с (C4), 50.08 к (OCH3), 53.28 д (С5), 61.13 т (CO2
CH2CH3), 113.18 д (С14), 123.12 д (С1′), 127.99 с (C8), 127.81 с (С3′), 133.87 с (С13), 137.94 с (С9), 144.80 с (С16), 145.51 д (С15), 164.60 с (CO2CH2CH3), 177.88 с (С18), 202.60 с (С2′). Масс-спектр, m/z (Iотн., %): 470.3 (1.93), 176.1 (100), 222.1 (66.77), 207.1 (60.49), 264 (48.11), 189.2 (48.11). Найдено: m/z 470.2636 [M]+. C28H38O6. Вычислено: M 470.2663.
5. (1S,4aS,8aR)-Метил 5-(2-{2-[2-(этоксикарбонил)-3-(триметилсилокси)бута-1,3-диенил]фуран-3-ил}этил)-1,4а,6-триметил-1,2,3,4,4а,7,8,8а-октагидронафталин-1-карбоксилат (XIV).
К перемешиваемой суспензии 0.27 г (2 ммоль) безводного хлористого цинка и 5 мл (36 ммоль) триэтиламина при нагревании до 60°C в токе аргона последовательно прибавляют раствор 4.7 г (10 ммоль) смеси кетонов (XIIIa, б) в 60 мл ацетонитрила и 3.8 мл (30 ммоль) триметилхлорсилана. Реакционную массу перемешивают 2 ч (температура масляной бани 80-90°C), затем добавляют 2 мл триэтиламина и 1 мл триметилхлорсилана и продолжают нагревание еще 3 ч. После охлаждения добавляют 50 мл безводного диэтилового эфира, в токе аргона отфильтровывают образовавшийся осадок. Маточный раствор упаривают в вакууме водоструйного насоса, остаток аналогично обрабатывают 50 мл безводного диэтилового эфира. Маслообразное соединение подвергают очистке путем перколирования через слой дезактивированного силикагеля (масса силикагеля 6 г, диаметр колонки 3 см, элюент - безводный диэтиловый эфир). После упаривания получают 4.66 г (86%) диена (XIV) в виде светло-коричневого масла. Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.25 с [9Н, OSi(CH3)3], 0.74 с (3H, С20Н3), 1.01 м (1H, Н3), 1.19 с (3H, С19Н3), 1.26 м (2Н, Н1,5), 1.33 т (3H, CO2CH2CH 3, J 7.1), 1.57 м (1H, Н2), 1.64 с (3H, С17Н3), 1.67-2.07 м (7Н, Н1,2,3,6,6,7,7), 2.20 м (2Н, Н11), 2.46 м (2Н, Н12), 3.61 с (3Н, OCH3), 4.35 к (2Н, CO2CH 2CH3, J 7.1), 4.41 с (2Н, H4′), 6.30 д (1H, Н14, J 1.8), 6.71 с (1H, Н1′), 7,28 д (1H, Н15, J 1.8). Спектр ЯМР 13C, δ, м.д.: 0.18 к (OSi(CH3)3), 14.15, 14.39 к (CO2CH2 CH3), 17.72 к (С20), 19.58 т (С2), 20.68 к (С17), 20.79 т (С6), 25.84, 25.98 т (С12), 28.41 к (С19), 29.17, 29.44 т (С11), 34.28 т (С7), 37.20 т (С1), 37.66 т (С3), 39.59 с (С10), 43.74 с (С4), 51.09 к (OCH3), 53.48 д (С5), 59.28, 61.26 т (CO2 CH2CH3), 94.34 т (C4′), 112.59 д (С14), 113.58 д (С1′), 127.65, 127.90 с (С13), 128.20, 128.41 с (С8), 135.78 с (С2′), 137.97, 138.49 с (С9), 143.22 д (С15), 145.86 с (С16), 152.24 с (С3′), 167.98, 169.61 с (CO2CH2CH3), 178.02 с (С18).
6. (1S,4aS,8aR)-Метил 5-{2-[2-(6-гидрокси-7-этоксикарбонил-1,4-диоксо-1,4-дигидронафталин-8-ил)фуран-3-ил]этил}-1,4а,6-триметил-1,2,3,4,4а,7,8,8а-октагидронафталин-1-карбоксилат (Iв).
К раствору 2.17 г (4 ммоль) диена (XIV) в 20 мл бензола в токе аргона добавляют 0.38 г (3.3 ммоль) бензохинона (XIIa) (предварительно возгоняют) и 0.04 г (0.36 ммоль) L-пролина. Реакционную смесь нагревают до кипения и выдерживают 12 ч, затем растворитель удаляют в вакууме, остаток растворяют в 50 мл хлористого метилена, промывают дистиллированной водой (3×20 мл), сушат MgSO4, затем упаривают. Остаток хроматографируют на колонке с силикагелем, последовательно выделяют 0.33 г (15%) непрореагировавшего диена (XIV), 0.52 г смеси кетонов (XIIIa, б) (элюент-петролейный эфир-диэтиловый эфир 4:1) и 1.2 г фракций, содержащих продукт реакции (элюенты-хлороформ, хлороформ-метанол 100:1). Последующей хроматографией фракций, содержащих продукт, и перекристаллизацией из эфира получают 0.82 г (35%) терпеноидного 6-гидрокси-7-этоксикарбонилнафтохинона (Iв). Т.пл. 51-54°C. 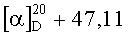 (с 0.45, CHCl3). ИК спектр, ν, см-1: 3334, 2956, 2925, 2854, 1724, 1671, 1615, 1573, 1508, 1462, 1440, 1375, 1342, 1271, 1236, 1190, 1155, 1139, 1106, 1090,1041, 1015, 984, 900, 850, 810, 756. УФ спектр (EtOH), λмакс., нм (lgε): 203 (4.41), 256 (4.06), 307 (3.53), 503 (2.49). Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.59, 0.61 с (3H, С20Н3), 0.85 т (3H, CO2CH2CH
3, J 7.1), 0.81 м (1H, Н3), 0.93 м (1Н, Н1), 1.05 т (3H, CO2CH2CH
3, J 7.1), 1.11, 1.12 с (3H, С19Н3), 1.16 м (1Н, Н5), 1.36, 1.42 с (3H, С17Н3), 1.53 д.м (1H, Н2, Jгем 12.6), 1.61 м (1Н, H6), 1.65-1.86 м (3H, Н2,6,11), 1.89-1.93 м (3H, Н7,11), 1.98-2.08 м (H, Н3,7,12) 2.12 д.д (1H, Н12, J 13.6, 2.8), 3.57 с (3H, OCH3), 4.12 к (2Н, CO2CH
2CH3, J 7.1), 6.41 д (1H, H14, J 1.6), 6.79 д (1Н, Н2′, J 9.2), 6.89 д (1Н, Н3′, J 9.2), 7.48 д (1H, Н15, J 1.6), 7.78 с (1H, H5′), 11.27 с, 11.29 с (1H, OH). Спектр ЯМР 13С, δ, м.д.: 13.48, 13.95 к (CO2CH2
CH3), 17.45, 17.46 к (С20), 19.11, 19.22 к (С17), 19.36 т (С2), 20.57 т (С6), 25.39, 25.46 т (С12), 28.22, 28.24 к (С19), 28.53, 28.66 т (С11), 34.01 т (С7), 36.78 т, 36.89 т (С1), 37.43 т (С3), 39.30 с (C10), 43.66 с (С4), 50.93 к (OCH3), 53.21 д, 53.25 д (С5), 62.46 т (СН2), 111.69, 111.75 д (С14), 117.25 д (C5′), 121.16 с (С13), 124.02 с (С7′), 127.11 с (C8), 134.31 с (С8′), 136.33 д (С3′), 136.84 с (С4′а), 138.28 с (C9), 140.81, 140.82 д (С15), 141.21 д (С2′), 144.20 с (С16), 164.13 с (С6′), 169.55 с (CO2CH2CH3), 177.82 с (C18), 182.43 с (С1′), 183.79 с (С4′). Масс-спектр. Найдено: m/z 574.2563 [M]+. C34H38O8. Вычислено: M 574.2561.
(с 0.45, CHCl3). ИК спектр, ν, см-1: 3334, 2956, 2925, 2854, 1724, 1671, 1615, 1573, 1508, 1462, 1440, 1375, 1342, 1271, 1236, 1190, 1155, 1139, 1106, 1090,1041, 1015, 984, 900, 850, 810, 756. УФ спектр (EtOH), λмакс., нм (lgε): 203 (4.41), 256 (4.06), 307 (3.53), 503 (2.49). Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.59, 0.61 с (3H, С20Н3), 0.85 т (3H, CO2CH2CH
3, J 7.1), 0.81 м (1H, Н3), 0.93 м (1Н, Н1), 1.05 т (3H, CO2CH2CH
3, J 7.1), 1.11, 1.12 с (3H, С19Н3), 1.16 м (1Н, Н5), 1.36, 1.42 с (3H, С17Н3), 1.53 д.м (1H, Н2, Jгем 12.6), 1.61 м (1Н, H6), 1.65-1.86 м (3H, Н2,6,11), 1.89-1.93 м (3H, Н7,11), 1.98-2.08 м (H, Н3,7,12) 2.12 д.д (1H, Н12, J 13.6, 2.8), 3.57 с (3H, OCH3), 4.12 к (2Н, CO2CH
2CH3, J 7.1), 6.41 д (1H, H14, J 1.6), 6.79 д (1Н, Н2′, J 9.2), 6.89 д (1Н, Н3′, J 9.2), 7.48 д (1H, Н15, J 1.6), 7.78 с (1H, H5′), 11.27 с, 11.29 с (1H, OH). Спектр ЯМР 13С, δ, м.д.: 13.48, 13.95 к (CO2CH2
CH3), 17.45, 17.46 к (С20), 19.11, 19.22 к (С17), 19.36 т (С2), 20.57 т (С6), 25.39, 25.46 т (С12), 28.22, 28.24 к (С19), 28.53, 28.66 т (С11), 34.01 т (С7), 36.78 т, 36.89 т (С1), 37.43 т (С3), 39.30 с (C10), 43.66 с (С4), 50.93 к (OCH3), 53.21 д, 53.25 д (С5), 62.46 т (СН2), 111.69, 111.75 д (С14), 117.25 д (C5′), 121.16 с (С13), 124.02 с (С7′), 127.11 с (C8), 134.31 с (С8′), 136.33 д (С3′), 136.84 с (С4′а), 138.28 с (C9), 140.81, 140.82 д (С15), 141.21 д (С2′), 144.20 с (С16), 164.13 с (С6′), 169.55 с (CO2CH2CH3), 177.82 с (C18), 182.43 с (С1′), 183.79 с (С4′). Масс-спектр. Найдено: m/z 574.2563 [M]+. C34H38O8. Вычислено: M 574.2561.
Пример 4. Исследование активности соединений формулы (Ia-в)
В работе использовали линии опухолевых клеток человека МТ-4, СЕМ-13 (клетки T-клеточных лейкозов человека) и U-937 (клетки моноцитов человека). Клетки культивировали в среде RPMI-1640, содержащей 10% сыворотки крови эмбрионов крупного рогатого скота, 2 ммоль/л L-глутамина, 80 мкг/мл гентамицина и 30 мг/мл линкомицина, при температуре 37°C в CO2 инкубаторе. Исследуемые вещества, растворяли в ДМСО и добавляли к клеточной культуре в необходимых концентрациях. Использовали по 3 лунки на каждую концентрацию. Для эксперимента использовали клетки на 3 сутки культивирования после оценки морфологии, подсчета концентрации и жизнеспособности клеток. Клетки СЕМ-13, U-937 или МТ-4 помещали в лунки 96-луночного планшета («Cel-Cult», Англия) по 100 мкл в лунку, в посевной концентрации 0.5×106 клеток в мл. Исследуемые вещества добавляли к клеткам, получая конечные концентрации 0.01-1000 мкМ, используя по 3 лунки на каждую концентрацию. Клетки, инкубируемые в тех же условиях без добавления препаратов, являлись контрольными. Клетки культивировали 72 часа. Водный раствор МТТ (5 мг/мл) профильтровывали через 0.22 мкм фильтр («Flow laboratories», Англия), добавляли в каждую исследуемую культуру в соотношении 1:10 к ее объему, смесь инкубировали 3-4 часа при температуре 37°C в CO2 инкубаторе. По окончании инкубации супернатант осторожно удаляли, затем в каждую анализируемую лунку добавляли по 100 мкл ДМСО. Осадок ресуспендировали и 30 мин инкубировали в темноте при комнатной температуре до полного растворения кристаллов формазана.
Оптическую плотность (OD) образцов измеряли на мультилуночном спектрофотометре BioRad 680 (США) при длине волны, равной 490 нм. Процент ингибирования роста клеток определяли по формуле 100 - (среднее значение OD в опыте/среднее значение OD в контроле)×100. Полученное значение для контрольного триплета (первые три лунки без добавления соединений, параллельных для каждого исследуемого экспериментального агента) принималось за 100%. Рассчитывали среднее значение и ошибку среднего для каждой концентрации анализируемого соединения. По результатам строили диаграмму зависимости жизнеспособности клеток (%) от концентрации исследуемого цитотоксического вещества, определяли дозу, на 50% ингибирующую жизнеспособность клеток (CCID50), а также стандартную ошибку (SE) показателя ЦД50.
Соединение (Ia) ингибирует рост опухолевых клеток человека СЕМ-13, U-937 и МТ-4 в концентрациях 3.4, 5.8 и 4.3 мкМ соответственно. Цитотоксическая активность этого соединения проявляется в более низких дозах по сравнению с цитотоксичностью аналога по свойствам пинусолида (IV). Дозы, ингибирующие жизнеспособность опухолевых клеток на 50%, для соединения (IV) в этих же условиях составляют 9.2, 34.1 и 49.1 мкМ.
Соединение (Iб) проявляет свой цитотоксический эффект в концентрациях 12.2, 4.4 и 6.6 мкМ соответственно, эффективные дозы этого соединения для клеток СЕМ-13 и МТ-4 практически одинаковы с эффективными концентрациями пинусолида (II). При этом соединение (16) ингибирует рост клеток моноцитов человека U-937 в 2.3 раза меньшей дозе, чем пинусолид (II).
Соединение (Iв) подавляет рост опухолевых клеток человека СЕМ-13, U-937 и МТ-4 в концентрациях 7.5, 9.2 и 15.1 мкМ соответственно.
Соединение (Ia) является наиболее активным цитотоксическим агентом.
Таким образом, заявляемое изобретение обладает следующими преимуществами, а именно:
- новые соединения формулы (Ia-в) обладают способностью ингибировать рост опухолевых клеток человека в микромолярных концентрациях;
- заявляемые соединения (Ia-в) синтезируются из доступного растительного сырья - хвои или живицы кедра сибирского.