Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 6,7-ЗАМЕЩЕННЫХ 2,3,5,8-ТЕТРАГИДРОКСИ-1,4-НАФТОХИНОНОВ (СПИНАЗАРИНОВ)
Вид РИД
Изобретение
Изобретение относится к органической химии, конкретно к способу получения 6,7-замещенных производных 2,3,5,8-тетрагидрокси-1,4-нафтохинонов (спиназаринов), которые могут найти применение в медицине и косметологии.
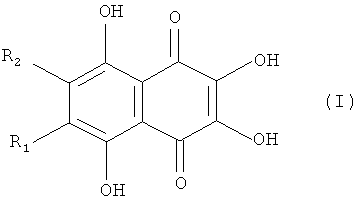
Полигидроксилированные производные нафтазарина (5,8-дигидрокси-1,4-нафтохинона) - природные соединения общей формулы (I), выделяемые из растений, грибов, микроорганизмов и морских животных, образуют группу соединений с практически полезными свойствами [Thomson R.H. Naturally occurring quinones. London-New York: Chapman and Hall, 1987. 3rd ed. 732 p.; Blackie Academic and Professional, London - New York, 1997, 4th ed., 746 p.]. Они проявляют выраженные антигрибковые и антимикробные свойства [GB 2159056 A, 1984].
|
Специфической особенностью производных нафтазарина является легкость таутомерных переходов между хиноидной и бензеноидной частями нафтазаринового ядра, которая обуславливает реакционную спрособность атомов (групп), присоединенных к различным кольцам нафтазаринового ядра и появлению у них антиокислительной активности [Изв. АН СССР, сер. хим. 1985, №7, с.1471-1476]. Описано применение метилспиназарина в качестве средства для лечения нервных расстройств и снижения кровяного давления [JP 7399389, 1977]. Предложено использовать полигидроксинафтохиноны, а также их хлор- и алкоксипроизводные в качестве средств для крашения человеческих волос [GB 2110723 A, 1982, GB 2119411А, 1983]. Примером биологически-активных полигидроксинафтазаринов является эхинохром - наиболее доступный пигмент морских ежей, соединение формулы (I), с R1=Et, R2=ОН, на основе которого создан лекарственный препарат «Гистохром®», применяемый для лечений ишемической болезни сердца, инфаркта миокарда, травм и ожогов глаз [Хим. - Фарм. журнал 2003, т. 37. №1, с.49-53].
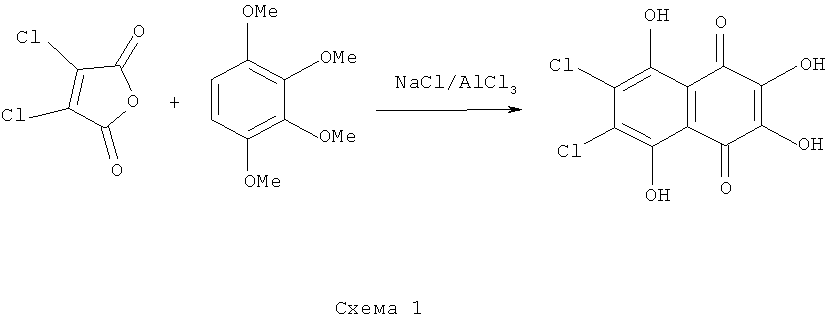
Известны способы получения 6,7-замещенных спиназаринов, в которых исходят из метоксипроизводных 1,2,3,4-тетрагидроксибензола и производных малеинового ангидрида (схема 1) [Tetrahedron 1968, v.24, р.2969-2978; Austr.J.Chem. 1987, v.40, p.119-1120].
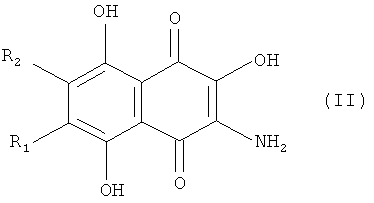
Среди известных способов предпочтительными, с точки зрения промышленного применения, являются способы, которые включают прямое замещение атомов хлора в доступных 6,7-замещенных 2,3-дихлорнафтазаринах формулы (II) [RU 2022959 С1, 15.11.1994].
Прототипом заявляемого технического решения является разработанный раннее заявителем, способ получения 6,7-замещенных 2,3-дигидроксинафтазаринов общей формулы I, где R1 и R2 представляют собой одновременно Н, Me, Cl, или R1=Н, a R2=Me, Et, tert-Bu, Cl, ОМе, OEt; R1=-Me, a R2=Cl, OMe, OEt, ОН; R1=Et, a R2=Cl, OMe, OEt, ОН, в котором исходят из доступных 6,7-замещенных аминогидроксинафтохинонов формулы IV, получаемых из 6,7-замещенных 2,3-дихлорнафтазаринов по схеме 2:

где R1 и R2 оба одновременно обозначают Н, Me, Cl;
или R1=H, а R2=Me, Et, t-Bu, Cl, OMe, OEt;
или R2=H, a R1=Me, Et, t-Bu, Cl, OMe, OEt;
или R1=Me, a R2=H, Cl, OMe, OEt, OH;
или R2=Me, a R1=H, Cl, OMe, OEt, OH;
или R1=Et, a R2=H, Cl, OMe, OEt, OH;
или R2=Et, a R1=H, Cl, OMe, OEt, OH [RU 2437870 C2, 20.07.2011].
Соединения формулы III и IV заявлены в вышеупомянутом патенте как промежуточные соединения, используемые в способе-прототипе.
В известном способе превращение соединения формулы IV в соединение формулы I происходит путем кислотно-катализируемого гидролиза. Для конверсии аминонафтазарина в спиназарин используют реакционную смесь диметилсульфоксид-муравьиная кислота-вода при весовом соотношении реагентов соответственно 22:20:3 при температуре 90-110°С, предпочтительно при температуре кипения с обратным холодильником в течение 1.5-4.5 час.
Можно предположить, что аминогруппа протонируется под действием слабой органической муравьиной кислоты, затем диметилсульфоксид замещает аминогруппу, с последующим восстановлением-отщеплением диметилсульфида и образованием промежуточного окисленного соединения, которое далее медленно восстанавливается под действием муравьиной кислоты в целевое соединение формулы I.
Недостатком указанной системы реагентов, применяемой для конверсии аминонафтазарина формулы IV в спиназарин формулы I, являются умеренные выходы целевых продуктов (в среднем 50-76%), длительность проведения процесса, обусловленная использованием значительного количества высококипящего диметилсульфоксида. Для его удаления (отмывки) смесь разбавляют водой, затем экстрагируют целевой продукт из водного раствора, экстракт упаривают, с последующим хроматографическим выделением спиназарина формулы I. Длительность процесса составляет 1.5-4.5 ч.
Задача изобретения - устранение недостатков, присущих способу-прототипу.
Задача решена тем, что в известном способе получения 6,7-замещенных-2,3,5,8-тетрагидрокси-1,4-нафтохинонов (спиназаринов) формулы I,
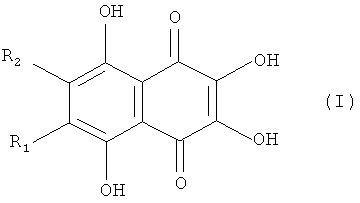
где R1 и R2 оба одновременно обозначают Н, Me, Cl или
R1=H, а R2=Me, Et, t-Bu, Cl, ОМе;
R1=Me, a R2=Cl, ОМе, OEt, ОН;
R1=Et, a R2=Cl, ОМе, OEt, OH;
путем нагревания 6,7-замещенного 3-амино-2,5,8-тригидрокси-1,4-нафтохинона формулы II

где R1 и R2 оба одновременно обозначают H, Me, Cl;
или R1=H, а R2=Me, Et, t-Bu, Cl, ОМе;
или R2=H, a R1=Me, Et, t-Bu, Cl, ОМе;
или R1=Me, a R2=Cl, ОМе, OEt;
или R2=Me, a R2=Cl, ОМе, OEt, OH;
или R1=Et, a R2=Cl, ОМе, OEt;
или R2=Et, a R1=Cl, ОМе, OEt, OH
в реакционной смеси при температуре 90-110°С, предпочтительно при температуре кипения с обратным холодильником, согласно изобретению в качестве реакционной смеси используют смесь муравьиная кислота-вода-серная кислота-диметилсульфоксид при весовом соотношении реагентов соответственно 40:7:3:2 и процесс проводят в течение 10-30 мин.
Промежуточные соединения формулы IV, являющиеся исходными соединениями в заявляемом способе, обозначены в заявке, как соединения формулы II.
Технический результат, обеспечиваемый изобретением, заключается в повышении выхода целевого продукта, в среднем, с 50-76 до 80-88% по сравнению со способом-прототипом, в сокращении времени проведении процесса в 3-9 раз, что обусловлено уменьшением количества используемого высококипящего диметилсульфоксида и упрощением процедуры выделения целевого продукта. Предлагаемый способ осуществляют в мягких условиях с применением доступных и дешевых реагентов.
Авторы полагают, что резкое ускорение реакции и повышение выхода спиназаринов связано с добавлением к реакционной среде серной кислоты, т.к. в этом случае реализуется другой механизм кислотно-катализируемой трансформации. Это позволяет в 10 раз уменьшить количество высококипящего диметилсульфоксида и упрощает процедуру выделения целевых продуктов.
Заявляемый способ позволяет получать соединения формулы I, имеющие хлор- и алкоксизаместители и другие кислотолабильные группы, которые могут быть использованы в фармации или в косметике в качестве средств для крашения волос.
Изобретение иллюстрируется примерами конкретного выполнения.
Пример 1 Получение 2,3,5,8-тетрагидрокси-1,4-нафтохинона.
3-Амино-2,5,8-тригидрокси-1,4-нафтохинон 44.2 мг (0.20 ммоль) растворяют при перемешивании в смеси 4 мл муравьной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят 30 мин с обратным холодильником, затем реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие красные кристаллы отфильтровывают, промывают водой, высушивают и получают 39.5 мг (89%) известного 2,3,5,8-тетрагидрокси-1,4-нафтохинона (спиназарина). Спектр ЯМР 1Н (300 МГц, CDCl3, δ, ТМС): 6.68 (2Н, β-ОН), с 7.22 с (2Н, ArH), 11.67 с (2Н, α-ОН). Масс-спектр (m/z, 70 эВ): 222 (М+, 100).
Пример 2 Получение 2,3,5,8-тетрагидрокси-6-метил-1,4-нафтохинона.
К раствору 47 мг (0,20 ммоль) 3-амино-2,5,8-тригидрокси-6-метил-1,4-нафтохинона и 3-амино-2,5,8-тригидрокси-7-метил-1,4-нафтохинона в смеси 4 мл муравьиной кислоты, 1 мл 25% серной кислоты добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 39 мг (83%) известного 2,3,5,8-тетрагидрокси-6-метил-1,4-нафтохинона (метилспиназарина), т.пл. 233-236°С. Спектр ЯМР 1Н (300 МГц, CDCl3, δ, ТМС): 2.32 с (3Н, ArCH3), 6.66 уш. с (2Н, β-ОН), 7.05 с (1Н, ArH), 11.66 с (1Н, α-ОН), 12.10 с (1Н, α-ОН). Масс-спектр (m/z, 70 эВ): 236 (М+, 100).
Пример 3. Получение 2,3,5,8-тетрагидрокси-6-этил-1,4-нафтохинона.
К раствору 50 мг (0,2 ммоль) смеси 3-амино-2,5,8-тригидрокси-6-этил-1,4-нафтохинона и 3-амино-2,5,8-тригидрокси-7-этил-1,4-нафтохинона в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 40 мг (80%) известного 2,3,5,8-тетрагидрокси-6-этил-1,4-нафтохинона (этилспиназарина), т.пл. 230-234°С. Спектр ЯМР 1Н (500 МГц, CDCl3, δ, ТМС): 1.26 т (3Н, J=7,5 Гц ArCH2CH 3), 2.73 к (2Н, J=7,5 Гц, ArCH 2CH3), 6.66 уш. с (2Н, β-ОН), 7.06 с (1Н, ArH), 11.69 с (1Н, α-ОН), 12.15 с (1Н, α-ОН). Масс-спектр (m/z, 70 эВ): 250 (М+, 100).
Пример 4. Получение 2,3;5,8-тетрагидрокси-6-трет.-бутил-1,4-нафтохинона.
К раствору 55,4 мг (0,2 ммоль) 3-амино-2,5,8-тригидрокси-6- трет.-бутил-1,4-нафтохинона и 3-амино-2,5,8-тригидрокси-7-трет.-бутил-1,4-нафтохинона в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 44,5 мг (80%) известного 6-трет.-бутил-2,3,5,8-тетрагидрокси-1,4-нафтохинонона, т.пл. 174-175°С (ацетон). Спектр ЯМР 1Н (300 МГц, CDCl3, δ, ТМС): 1.43 с (9Н, (СН 3)3С-Ar), 6.72 уш. c (2Н, β-ОН), 7.16 с (1Н, ArH), 11.73 с (1Н, α-ОН), 12.87 с (1Н, α-ОН). Масс-спектр (m/z, 70 эB): 278 (M+, 100).
Пример 5. Получение 2,3,5,8-тетрагидрокси-6,7-диметил-1,4-нафтохинона.
3-Амино-2,5,8-тригидрокси-6,7-диметил-1,4-нафтохинон 49,8 мг (0,2 ммоль) растворяют в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 43.2 мг (86%) известного 2,3,5,8-тетрагидрокси-6,7-диметил-1,4-нафтохинона. Спектр ЯМР 1Н (500 МГц, DMSO-d6, δ, ТМС): 2.18 с (6Н, ArCH 3), 10.36 уш. с (2Н, β-ОН), 12.88 уш.с (2Н, α-ОН). Масс-спектр (m/z, 70 эВ): 250 (М+, 100).
Пример 6. Получение 2,3,5,8-тетрагидрокси-6-хлор-1,4-нафтохинона.
Смесь 52 мг (0,2 ммоль) 3-амино-2,5,8-тригидрокси-6-хлор-1,4-нафтохинона и 3-амино-2,5,8-тригидрокси-7-хлор-1,4-нафтохинона растворяют в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 38 мг (74%) известного 2,3,5,8-тетрагидрокси-6-хлор-1,4-нафтохинона, т.пл. 206-209°С. Спектр ЯМР 1Н (500 МГц, CDCl3, δ, ТМС): 6.62 с (1Н, β-ОН), 6.72 с (1Н, β-ОН), 7.35 с (1Н, ArH), 11.56 с (1Н, α-ОН), 12.16 (1Н, α-ОН). Масс-спектр (m/z, 70 эВ): 256/258 (M+, 52).
Пример 7. Получение 2,315,8-тетрагидрокси-6-метокси-1,4-нафтохинона.
К раствору 50,2 мг (0,2 ммоль) 3-амино-2,5,8-тригидрокси-6-метокси-1,4-нафтохинона и 3-амино-2,5,8-тригидрокси-7-метокси-1,4-нафтохинона в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 42.4 мг (84%). известного 2,3,5,8-тетрагидрокси-6-метокси-1,4-нафтохинона. Спектр ЯМР 1Н (300 МГц, DMSO-d6, δ, ТМС): 3.91 с (3Н, ArOCH 3), 6.75 с (1Н, ArH), 10.44 уш. с (2Н, β-ОН), 12.73 уш. с (2Н, α-ОН). Масс-спектр (m/z, 70 эВ): 252 (М+, 100).
Пример 8. Получение 2,3,5,8-тетрагидрокси-6,7-дихлор-1,4-нафтохинона.
3-Амино-2,5,8-тригидрокси-6,7-дихлор-1,4-нафтохинон 58 мг (0,2 ммоль) растворяют при перемешивании и нагревании в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают красные иглы 49.5 мг (85%) известного 2,3,5,8-тетрагидрокси-6,7-дихлор-1,4-нафтохинона, т.пл. 255-257°С. Спектр ЯМР 1Н (500 МГц, CDCl3, δ, ТМС): 6.70 уш. с (2Н, (β-ОН), 12.26 с (2Н, α-ОН). Масс-спектр (m/z, 70 эВ): 290/292 (М+, 60).
Пример 9. Получение 2,3,5,8-тетрагидрокси-6-метил-7-хлор-1,4-нафто-хинона.
К раствору 54 мг (0,2 ммоль) 3-амино-2,5,8-тригидрокси-6-метил-7-хлор-1,4-нафтохинона и 3-амино-2,5,8-тригидрокси-7-метил-6-хлор-1,4-нафтохинона в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 45.5 мг (84%) известного 2,3,5,8-тетрагидрокси-7-метил-6-хлор-1,4-нафтохинона. Спектр ЯМР 1Н (300 МГц, CDCl3, δ, ТМС): 2.32 с (3Н, ArCH 3), 3.34 уш. с (2Н, β-ОН), 10.54 уш.с (1Н, α-ОН), 12.73 уш. с (1Н, α-ОН). Масс-спектр (m/z, 70 эВ): 270/272 (М+, 56).
Пример 10. Получение 2,3,5,8-тетрагидрокси-7-метил-6-метокси-1,4-нафтохинона.
К раствору 53,0 мг (0,2 ммоль) 3-амино-2,5,8-тригидрокси-7-метил-6-метокси-1,4-нафтохинона и 3-амино-2,5,8-тригидрокси-6-метил-7-метокси-1,4-нафтохинона в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 42.6 мг (80%) известного 2,3,5,8-тетрагидрокси-7-метил-6-метокси-1,4-нафтохинона. Спектр ЯМР 1Н (500 МГц, CDCl3, δ, ТМС): 2.22 с (3Н, ArCH 3), 4.03 с (3Н, ArOCH 3), 6.66 уш. с (2Н, β-ОН), 12.19 с (1Н, α-ОН), 12.22 с (1Н, α-ОН). Масс-спектр (m/z, 70 эВ): 266 (М+, 100), 248 (54).
Пример 11. Получение 2,3,5,8-тетрагидрокси-7-хлор-6-этил-1,4-нафто-хинона.
К раствору 56,6 мг (0,2 ммоль) 3-амино-2,5,8-тригидрокси-7-хлор-6-этил-1,4-нафтохинона и 3-амино-2,5,8-тригидрокси-6-хлор-7-этил-1,4-нафтохинона в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 45.6 мг (80%) известного 2,3,5,8-тетрагидрокси-7-хлор-6-этил-1,4-нафтохинона. Спектр ЯМР 1Н (300 МГц, CDCl3, δ, ТМС): 1.13 т (3Н, J=7,4 Гц, ArCH2CH 3), 2.83 кв (2H, J=7,4 Гц, ArCH 2CH3), 3.28 уш. с (2H, β-ОН), 10.56 уш. с (1Н, α-ОН), 12.73 (1Н, α-ОН). Масс-спектр (m/z, 70 эВ): 284/286 (М+, 100).
Пример 12. Получение 2,3,5,8-тетрагидрокси-7-метокси-6-этил-1,4-нафто-хинона.
К раствору 55,8 мг (0,2 ммоль) 3-амино-2,5,8-тригидрокси-7-метокси-6-этил-1,4- в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 43,5 мг (82%) известного 2,3,5,8-тетрагидрокси-7-метокси-6-этил-1,4-нафтохинона. Спектр ЯМР 1Н (500 МГц, CDCl3, δ, ТМС): 1.16 т (3Н, СН2СН 3, J=7.0 Гц), 2.73 кв (2H, СН 2СН3), 4.05 с (3Н, ArOCH 3), 6.62 уш. с (2H, β-ОН), 12.19 с (1Н, α-ОН), 12.24 с (2H, α-ОН). Масс-спектр (m/z, 70 эВ): 280 (М+, 100).
Пример 13. Получение 2,3,5,8-тетрагидрокси-7-этил-6-этокси-1,4-нафтохинона.
К раствору 58,6 мг (0,2 ммоль) 3-амино-2,5,8-тригидрокси-7-этил-6-этокси-1,4-нафтохинона и 3-амино-2,5,8-тригидрокси-6-этил-7-этокси-1,4-нафтохинона в смеси 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 48.8 мг (83%) известного 2,3,5,8-тетрагидрокси-7-этил-6-этокси-1,4-нафтохинона Спектр ЯМР 1Н (300 МГц, CDCl3, δ, ТМС): 1.16 т (3Н, J=7,5 Гц, ArCH2CH 3), 1.43 т (3Н, J=7,5 Гц, ОСН2СН 3), 2.74 к (2H, J=7,5 Гц, ArCH 2CH3), 4.31 к (2H, J=7,5 Гц, ОСН 2СН3), 6.67 уш. с (2H, β-ОН), 12.26 уш. с (2H, α-ОН). Масс-спектр (m/z, 70 эВ): 294 (М+, 100).
Пример 14. Получение 2,3,5,8-тетрагидрокси-6-метил-7-этокси-1,4-нафто-хинона.
К раствору 55,8 мг (0,2 ммоль) смеси 3-амино-2,5,8-тригидрокси-7-метил-6-этокси-1,4-нафтохинона и 3-амино-2,5,8-тригидрокси-6-метил-7-этокси-1,4-нафтохинона в 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 30 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 45 мг (80%) известного 2,3,5,8-тетрагидрокси-6-метил-7-этокси-1,4-нафтохинон. Т.пл. 156-159°С. Спектр ЯМР 1Н (500 МГц, CDCl3, δ, ТМС): 1.42 т (3Н, J=7,5 Гц, OCH2CH 3), 2.22 с (3Н, ArCH 3), 4.30 кв (2Н, J=7,5 Гц, ОСН 2СН3), 6.58 с (1Н, β-ОН), 6.73 с (1Н, β-ОН), 12.21 с (1Н, α-ОН), 12.23 с (1Н, α-ОН). Масс-спектр (m/z, 70 эВ): 280 (М+, 100).
Пример 15. Получение 2,3,5,6,8-пентагидрокси-6-метил-1,4-нафтохинона.
3-Амино-2,5,6,8-тетрагидрокси-7-метил-1,4-нафтохинон 50,2 мг (0,2 ммоль) растворяют при перемешивании в 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 10 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтровывают, промывают водой, высушивают и получают 40.3 мг (80%) известного 2,3,5,6,8-пентагидрокси-6-метил-1,4-нафтохинона. Т.пл. 218-221°С. Спектр ЯМР 1Н (500 МГц, CDCl3, δ, ТМС): 2.19 с (3Н, ArCH 3), 6.34 уш. с (1Н, β-ОН), 6.55 уш. с (1Н, β-ОН), 6.77 уш. с (1Н, β-ОН), 12.03 с (1Н, α-ОН), 12.26 (1Н, α-ОН). Масс-спектр (m/z, 70 эВ): 252 (М+, 100).
Пример 16. Получение 2,3,5,6,8-пентагидрокси-6-этил-1,4-нафтохинона.
3-Амино-2,5,6,8-тетрагидрокси-7-этил-1,4-нафтохинон 53 мг (0,2 ммоль) растворяют при перемешивании в 4 мл муравьиной кислоты и 1 мл 25% серной кислоты, добавляют 200 мкл диметилсульфоксида и кипятят с обратным холодильником 10 мин. Реакционную смесь охлаждают до комнатной температуры и выливают в 20 мл ледяной воды. Выпавшие кристаллы отфильтроввывают, промывают водой, высушивают и получают 42.6 мг (80%) известного 2,3,5,6,8-пентагидрокси-6-этил-1,4-нафтохинона (эхинохрома) идентичного природному образцу. Спектр ЯМР 1Н (500 МГц, CDCl3, δ, ТМС): 1.17 т (3Н, J=7,5 Гц, ArCH2CH 3), 2.73 к (2Н, J=7,5 Гц, ArCH 2CH3), 6.54 (3Н, β-ОН), 12.05 с (1Н, α-ОН), 12.27 (1Н, α-ОН). Масс-спектр (m/z, 70 эВ): 266
(М+, 100).
Способ получения 6,7-замещенных 2,3,5,8-тетрагидрокси-1,4-нафтохинонов (спиназаринов) формулы I где R и R оба одновременно обозначают Н, Me, Cl илиR - H, a R - Me, Et, t-Bu, Cl, OMe;R - Me, a R - Cl, OMe, OEt, OH;R - Et, a R - Cl, OMe, OEt, OH;путем нагревания 6,7-замещенного 3-амино-2,5,8-тригидрокси-1,4-нафтохинона формулы II где R и R оба одновременно обозначают Н, Me, Cl;или R - H, a R - Me, Et, t-Bu, Cl, OMe;или R - H, a R - Me, Et, t-Bu, Cl, OMe;или R - Me, a R - Cl, OMe, OEt;или R - Me, a R - Cl, OMe, OEt, OH;или R - Et, a R - Cl, OMe, OEt;или R - Et, a R - Cl, OMe, OEt, OHв реакционной смеси при температуре 90-110°С, предпочтительно при температуре кипения с обратным холодильником, отличающийся тем, что в качестве реакционной смеси используют смесь муравьиная кислота-вода-серная кислота-диметилсульфоксид при весовом соотношении реагентов соответственно 40:7:3:2 и процесс проводят в течение 10-30 мин.