Результат интеллектуальной деятельности: Кардиопротекторная фармацевтическая субстанция и способ ее получения
Вид РИД
Изобретение
Изобретение относится к медицине и фармацевтической промышленности и касается получения новой биоактивной субстанции и ее применения в качестве протектора тканей сердца и активатора митохондриальных функций кардиомиобластов и может быть использовано для профилактики и/или лечения ишемии и инфаркта миокарда, а также в качестве молекулярного инструмента при исследованиях биохимических и физиологических процессов в тканях сердца.
Известно много кардиопротекторных препаратов прямого и непрямого действия, применямых в клинике и медико-биологических экспериментах. Среди кардиопротекторов прямого действиях могут быть выделены средства, влияющие на энергетические процессы (Триметазидин, АТФ-ЛОНГ, Аспаркам, Мексидол, Кратал); селективные эффекторы медленных кальциевых каналов (Фелодипин, Верапамил); ингибиторы Na+ каналов (Карипозид, Амилорид); электроноакцепторы (Цитохром C, Энергостим.); антиоксиданты (Липин, Ритмокор, Мексидол, Кислота аскорбиновая) и некоторые другие.
В качестве прототипа заявляемого лекарственного средства нами выбран Мексикор® (его аналоги Мексидол®, Мексиприм®), субстанция которого - этилметилгидроксипиридина сукцинат имеет некоторое структурное сходство с заявляемой субстанцией, поскольку содержит пиридиновый фрагмент с зарядом на атоме азота. Мексикор® уменьшает проявления систолической и диастолической дисфункций левого желудочка сердца. Считается, что в основе действия мексикора лежит антиоксидантная активность. Препарат тормозит свободнорадикальные процессы при ишемии/реперфузии миокарда и стимулирует активность ферментов биомембран: фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы, а также восстанавливает митохондриальные процессы, увеличивает синтез АТФ и креатинфосфата.
Однако в настоящее время многие механизмы действия мексикора не изучены. Так, например, не известно уменьшение инфарктной зоны при ишемии/реперфузии миокарда под действием этого препарата.
Задачей настоящего изобретения является создание новой нецитотоксической по отношению к клеткам сердечной мышцы субстанции, уменьшающей повреждения сердечной мышцы, вызванные ишемией/реперфузией.
Задача решена применением неопетрозида А ([5-O-(4-гидроксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилата) в качестве фармацевтической субстанции, обладающей противоишемическими и противоинфарктными свойствами и активирующей митохондриальные функции, для изготовления кардиопротекторных лекарственных препаратов.
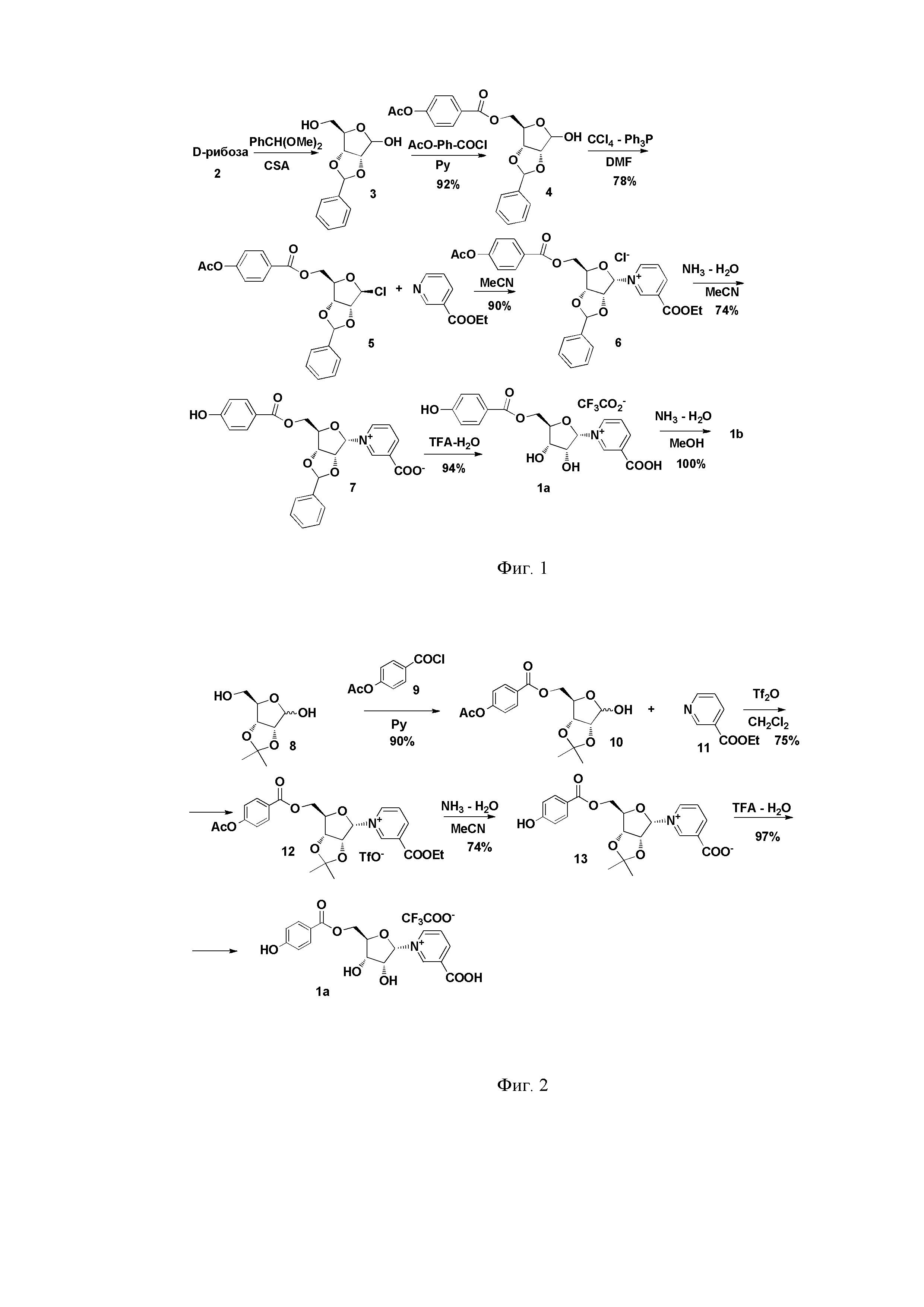
Прототипом заявляемого способа получения неопетрозида А (NPS A) является, разработанный раннее заявителями, синтез этого соединения по схеме 1. (Shubina L. K., Makarieva T. N., Yashunsky D. V., Nifantiev N. E., Denisenko V. A., Dmitrenok P. S., Dyshlovoy S. A., Fedorov S. N., Krasokhin V. B., Jeong S. H., Han J., Stonik V. A. Pyridine nucleosides neopetrosides A and B from a marine Neopetrosia sp. sponge. Synthesis of neopetroside A and its β-riboside analogue // Journal of Natural Products, 2015, Vol. 78, N. 6, P. 1383-1389). Схема способа-прототипа представлена на фиг. 1.
Способ-прототип включает следующие стадии:
1. Получение 2,3-O-бензилиден-D-рибозы (3) путем обработки D-рибозы (2) диметоксиметилбензеном при катализе камфорсульфокислотой.
2. Получение 2,3-O-бензилиден-5-O-(4-ацетоксибензоил)-D-рибозы (4) путем ацилирования соединения 3 пара-ацетокси-бензоил хлоридом в пиридине.
3. Получение хлорида 2,3-O-бензилиден-5-O-(4-ацетоксибензоил)-β-D-рибофуранозида (5) путем обработки соединения 4 трифенилфосфином в диметилформамиде (DMF).
4. Получение хлорида этил 1-[2,3-O-бензилиден-5-O-(4-ацетоксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилата (6) путем обработки соединения 5 этилникониатом в ацетонитриле.
5. Получение неопетрозида А в солевой форме (1а) путем снятия защитных групп в соединении 6 в водном растворе трифторуксусной кислоты (TFA).
6. Получение неопетрозида А в бетаиновой форме (1b) путем обработки солевой формы водным раствором аммиака.
Общий выход неопетрозида А составляет 24-28%.
К недостаткам способа-прототипа можно отнести использование малодоступных синтонов, длительность способа и сравнительно низкий выход целевого продукта.
Задачей изобретения является усовершенствование способа получения неопетрозида А, свободного от недостатков, присущих способу-прототипу.
Предлагаемый синтез представлен на фиг. 2.
Задача решена тем, что в способе получения неопетрозида А, согласно изобретению, в качестве исходного соединения используют 2,3-ацетонид-D-рибозу (8), которую ацилируют пара-ацетоксибензоил хлоридом (9) в пиридине с получением 2,3-O-ацетонид-5-O-(4-ацетоксибензоил)-D-рибозы (10), затем полученное соединение обрабатывают этилникониатом (11) с трифторметилсульфонивым ангидридом в хлористом метилене с получением 1-[2,3-O-ацетонид-5-O-(4-ацетоксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилата (12), затем в водном растворе аммиака снимают ацетатную защитную группу, получая 1-[2,3-O-ацетонид-5-O-(4-гидроксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилат (13), затем полученное соединение обрабатывают кислотой с образованием неопетрозида А ([5-O-(4-гидроксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилата) в солевой форме.
Общий выход неопетрозида А составяет 40 - 45%.
Заявляемый способ синтеза неопетрозида А имеет ряд преимуществ перед способом-прототипом. NPS A синтезирован из таких доступных синтонов, как ацетонидное производное D-рибозы, п-гидроксибензойная и никотиновая кислоты. В новом синтезе применена ацетонидная защитная группа вместо бензилиденовой группы, т.е. использовано новое исходное соединение - 2,3-ацетонид-D-рибоза. Это изменение позволяет ускорить выделение целевого соединения, т.к. позволяет избежать использования промежуточного хлорсодержащего производного по сравнению со способом-прототипом, что сокращает время синтеза и уменьшает затраты на растворители и реагенты. Кроме того, число стадий в синтезе неопетрозида А было сокращено с шести до четырех стадий в результате использования коммерчески доступного 2,3-ацетонид-D-рибозы, а также изменения условий формирования N-гликозидной связи (использование Tf2O в CH2Cl2 вместо Ph3P в CCl4).
Выход целевого продукта увеличился в 1,5 раза по сравнению с выходом по способу-прототипу.
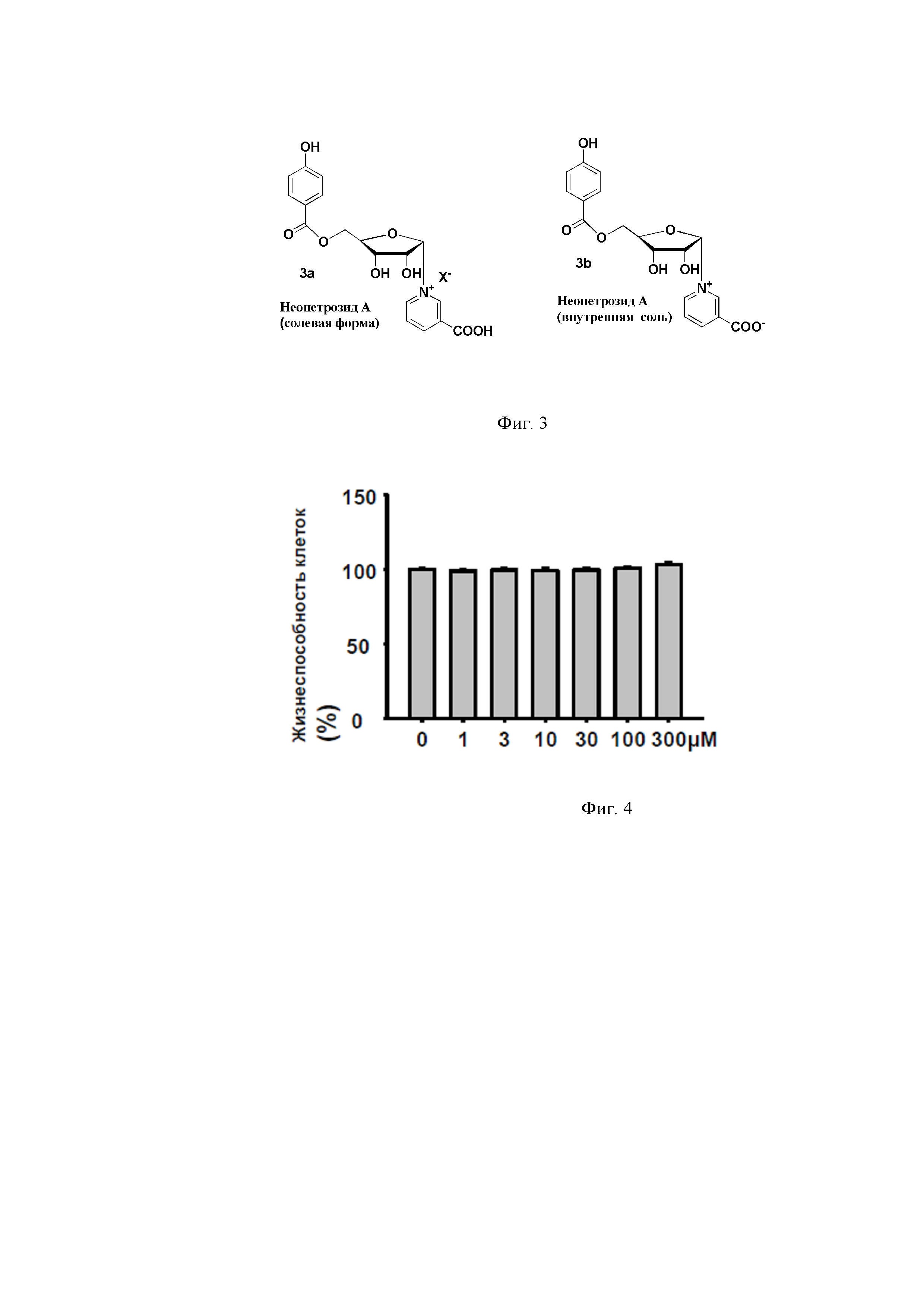
Неопетрозид А - устойчивое соединение, хорошо растворимое в воде. Оно также растворимо в пиридине и метаноле, но хуже растворяется в других органических растворителях. Имеются две формы этого соединения, которые могут быть получены в кислой и нейтральной средах: это внутренняя соль (бетаиновая форма) и обычная соль с положительным зарядом на азоте пиридинового цикла и отрицательным - на противоионе. Следует отметить, что обе формы продемонстрировали одни и те же биологические свойства, однако в описанных ниже экспериментах использовали солевую форму, полученную полным синтезом. На фиг. 3 представлены две формы неопетрозида А: 3а - солевая форма, 3б - внутренняя соль.
Неопетрозид A (3b) (внутренняя соль) - светло-желтое аморфное вещество; УФ (EtOH) λmax (log ε) 260 (3.5); КД (EtOH) λmax (Δε) = 275 (+0.21) нм; ИК (KBr) νmax 3417, 1708, 1642, 1608, 1385 см-1; HRESIMS m/z 376.1033 [M+H]+ (выч. для C18H17NO8376.1027); и 398.0854 [M+Na]+ (выч. для C18H17NNaO8, 398.0846).
Синтетический NPS А полностью идентичен природному веществу, что показано прямым сравнением их спектральных свойств. Результаты Сравнение 1H ЯМР данных природного и синтетического неопетрозида А во внутренней и внешней солевых формах в CD3OD (500 МГц) представлены в таблице.
Изобретение иллюстрируется примерами конкретного выполнения.
Пример 1. Синтез 2,3-O-ацетонид-5-O-(4-ацетоксибензоил)-D-рибозы (10)
К перемешиваемому раствору 2,3-ацетонид-D-рибозы (8) (240 мг, 1.33 ммоль) в пиридине (3 мл) добавляют хлорангидрид п-ацетоксибензойной кислоты (9, 313 мг, 1.6 ммоль, 1.2 экв.). Смесь перемешивают при комнатной температуре в течение 30 мин, разбавляют хлористым метиленом, промывают 1М раствором соляной кислоты, водой, насыщенным раствором бикарбоната натрия, высушивают фильтрованием через гигроскопическую вату и концентрируют в вакууме. Остаток очищают на силикагеле в системе этилацетат-толуол (1:3), получая 421 мг (90 %) 2,3-O-ацетонид-5-O-(4-ацетоксибензоил)-D-рибозы (10) в виде смеси аномеров: HRESIMS режим позитивных ионов: m/z 375.1059 [M+Na]+; рассчитано для C17H20O8Na 375.1056.
Пример 2. Синтез 1-[2,3-O-ацетонид-5-O-(4-ацетоксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилата (12)
К перемешиваемому раствору 2,3-O-ацетонид-5-O-(4-ацетоксибензоил)-D-рибозы (10) (120 мг, 0.34 ммоль) и этилового эфира никотиновой кислоты 11 (154 мг, 1.02 ммоль, 3.0 экв.) в хлористом метилене (1.5 мл) при 0°C добавляют ангидрид трифторметансульфокислоты (0.154 мл, 0.98 ммоль, 2.7 экв.). Смесь перемешивают при комнатной температуре в течение 30 мин, разлагают метанолом и упаривают досуха. Остаток обрабатывают эфиром, раствор выбрасывают, а осадок очищают на силикагеле в градиенте метанол-хлористый метилен (0 ➜ 5%). Получают 162 мг (75%) 1-[2,3-O-ацетонид-5-O-(4-ацетоксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилата (12): Rf 0.52 (15%MeOH-CHCl3); [α]D22 -3° (c 1, МеОН); δH (600 MHz, CD3OD): 0.99 и 1.28 (оба с, 6Н, Me2C); 1.36 (т, 3Н, J = 7.1, СООСН2СН3), 2.33 (с, 3Н, Ас); 4.49 (к, 2Н, СООСН2СН3), 4.75 (дд, 1Н, J = 3.9 и 12.9, Н-5'а), 4.87 (уш.д, Н-5'b), 4.99 (м, 1Н, Н-4'), 4.70-4.79 (м, 2H, H-2' и H-3'), 6.63 (д, 1Н, J = 5.2, Н-1'), 7.20 и 8.02 (оба д, 4Н, J = 8.5, H-2'', H-3'', H-5'', H-6''), 8.25 (м, 1Н, Н-5), 9.12 (д, 1Н, J=8.0, H-4), 9.36 (д, 1Н, J=6.2, H-6), 9.59 (с, 1Н, Н-2); HRESIMS режим позитивных ионов: m/z 486.1761 [М]+; рассчитано для C25H28NO9486.1759.
Пример 3. Синтез 1-[2,3-О-ацетонид-5-O-(4-гидроксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилата (13)
К перемешиваемому раствору 1-[2,3-О-ацетонид-5-O-(4-ацетоксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилата (12) (150 мг, 0.236 ммоль) в ацетонитриле (2 мл) добавляют водный раствор аммиака (1.4 М, 2.5 мл). Смесь перемешивают при комнатной температуре в течение 4 ч, разбавляют водой и упаривают досуха на роторном испарителе. Остаток очищают на силикагеле в градиенте (90%МеОН-Н2О)-хлористый метилен (25 → 50%), Получают 72 мг (74%) 1-[2,3-О-ацетонид-5-O-(4-гидроксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилата (13): Rf 0.36 (CHCl3-МеОН-H2O 10:10:1); HRESIMS режим позитивных ионов: m/z 416.1341 [М+Н]+; рассчитано для C21H21NO8416.1340.
Пример 4. Синтез неопетрозид А в солевой форме
Раствор 1-[2,3-О-ацетонид-5-O-(4-гидроксибензоил)-α-D-рибофуранозил]пиридиниум-3-карбоксилата (13) (65 мг, 0.157 ммоль) в 90% водной трифторуксусной кислоте (2 мл) выдерживают при комнатной температуре в течение 1 ч, упаривают с водой. Получают 74 мг (97%) чистого неопетрозида А (1а): Rf 0.36 (CHCl3/МеОН/H2O, 10:10:1); [α]D19+20 (с 1, H2O); δH (600 MHz, CD3OD): 4.37 (дд, 1Н, J=3.8 и 4.6, Н-3'), 4.51 (дд, 1Н, J=4.5 и 12.3, H-5'а), 4.59 (дд, 1Н, J=3.5 и 12.3, H-5'b), 4.80 (м, 1Н, Н-2'), 4.98 (м, 1Н, Н-4'), 6.54 (д, 1Н, J=5.2, Н-1'), 6.86 (д, 2Н, J=8.5, Н-3'', Н-5''), 7.93 (д, 2Н, J=8.5, Н-2'', Н-6''), 8.17 (дд, 1Н, J=6.8 и 7.9, Н-5), 9.02 (дд, 1Н, J=1.3, 8.0, Н-4), 9.12 (дд, 1Н, J=1.4 и 6.2, Н-6), 9.38 (с, 1Н, Н-2); HRESIMS режим позитивных ионов: m/z 398.0849 [M+Na]+; рассчитано для C18H17NO8Na 398.0846.
Пример 5. Исследование цитотоксичности NPS А
Исследование проводили по отношению к h9c2 клеткам крыс. Следует отметить, что кардиомиобласты крысы линии h9c2 широко используются в экспериментах при изучении кардиотонических лекарственных средств и других препаратов, действующих на сердечно-сосудистую систему. Для оценки цитотоксичности клетки поместили на 96-луночный планшет, в каждую лунку - по 2×104 кл. Через 16 часов в каждую лунку добавили различные количества водного раствора NPS А и оставили стоять 24 ч при 37°С. Жизнеспособность клеток измеряли с помощью количественного анализа с МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолом) (Sigma-Aldrich, USA). Степень превращения МТТ в формазан, а оно осуществляется в митохондриях живых клеток, количественно определяли путем измерения оптической плотности при 570 нм с использованием микропланшет-ридера (Molecular Device, Саннивейл, США).
Полученные результаты исследований по изучению цитотоксичности NPS А приведены на фигуре 4. Установлено, что NPS А не токсичен по отношению к кардиомиобластам вплоть до концентрации 300 μМ.
Пример 6. Исследование влияния NPS А на кардиомиобласты
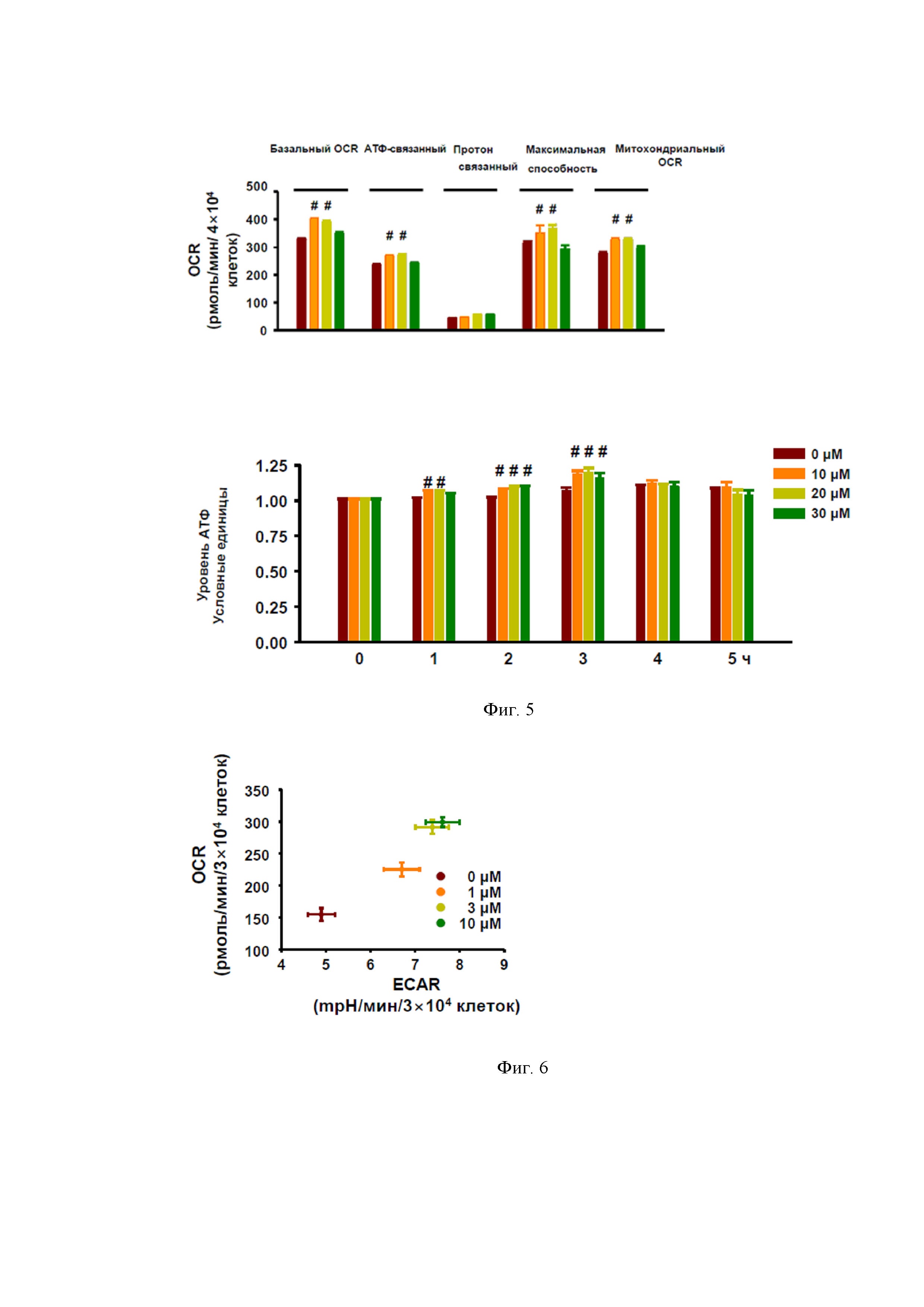
Характерной особенностью действия NPS А является улучшение функций кардиомиобластов и активация их метаболизма. Обнаружено, что NPS А регулирует окислительное фосфорилирование, гликолиз, АТФ-сопряженное дыхание, общую и митохондриальную скорости потребления кислорода (OCR) в h9c2 линии кардиомиобластов. Одновременно с этим было показано, что это соединение стимулирует синтез АТФ и повышает уровень АТФ в этих клетках. Полученные данные представлены на фигуре 5.
OCR измеряли с помощью анализатора XF24 (Seahorse Bioscience, Billerica, MA, USA), как описано в инструкциях производителя. Клетки h9c2 помещали в XF24 планшет по 2×104 кл. на лунку (Bioscience, Billerica, MA, США). Через 16 ч к клеткам добавляли растворы NPS А различной концентрации. Через 1 ч среду заменяли 500 мкл раствора модифицированной среды DMEM из XF-набора (Bioscience, Billerica, MA, США), а затем инкубировали при 37°C без CO2 в течение 1 ч. OCR измеряли с помощью анализатора XF24 и программного обеспечения XF24. После измерения OCR результаты анализа XF24 были нормализованы на количество клеток. Число клеток для каждой лунки подсчитывали с использованием автоматизированного счетчика клеток Luna™ (Logos, США).
Митохондриальные уровни АТФ были измерены с помощью набора ToxGlo™ (Promega, США) в соответствии с протоколом производителя. В кратком изложении, клетки h9c2 помещали в 96 луночный планшет для тканевых культур (в 60-мм лунке содержалось 2×106 кл.). Через 16 ч клетки обрабатывали 0, 3 или 10 μМ растворами NPS А и оставляли на 1 ч. Обработанные клетки собирали и ресуспендировали с помощью пипетки до тех пор, пока клетки не были равномерно распределены в объеме лунки. Ресуспендированные h9c2 клетки помещали (2×104 кл./лунку) в 96-луночный планшет с прозрачным дном каждой лунки. Планшеты центрифугировали при 200G в течение 10 мин, среды удаляли и заменяли (в каждой лунке) на 50 мкл свежей среды, не содержащей глюкозы, но с добавлением 10 мМ галактозы. Планшет инкубировали при 37°C в увлажненной атмосфере в CO2-инкубаторе в течение 90 мин. Аналитический раствор из набора (100 мкл) добавляли в каждую лунку, и затем планшет инкубировали при комнатной температуре в течение 30 мин. Люминесценцию измеряли с помощью фотометра (Molecular Device, США).
Положительные влияние NPS А на связанный с выработкой энергии метаболизм в кардиомиобластах и их митохондриях наблюдали в диапазоне относительно низких концентраций этого вещества (от 10 до 20 μM) с последующим незначительным снижением эффектов при концентрации 30 μM (фиг. 5).
Интересно, что максимальное положительное воздействие на уровни АТФ и на усвоение мембранами кислорода наблюдается через 3 ч после внесения NPS А, а далее медленно достигаются значения, характерные для интактных клеток. Обработка кардиомиобластов NPS А в концентрациях 1, 3 и 10 мкМ повышает OCR и степень внеклеточного подкисления (ECAR). При этом NPS увеличивает не только клеточную (базальную) ECAR и клеточный (базальный) OCR, но и их отношение. Полученные результаты представлены на фигуре 6.
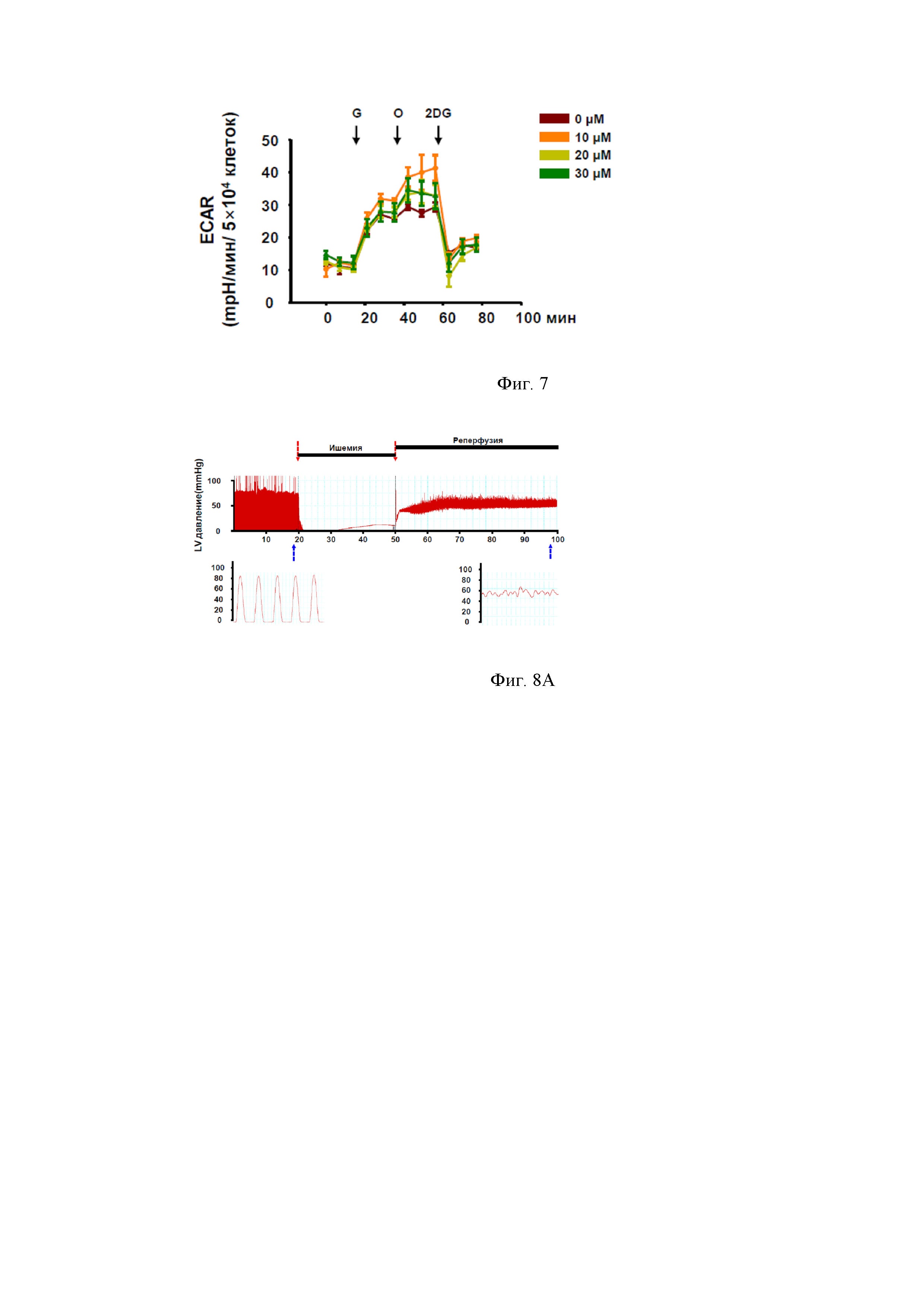
Способность NPS А стимулировать гликолиз была определена с использованием анализатора XF24 в его приложении к исследованию гликолиза, что позволило изучить гликолиз, емкость гликолиза и резерв гликолиза в клетках, обработанных различными концентрациями NPS А в течение 1 часа. H9c2 клетки обрабатывали NPS А, затем вводили 10 мМ глюкозы (G), 1 мкМ олигомицина (O) и 10 мм 2 дезоксиглюкозы (2DG) в указанной последовательности. Обработка H9c2 клеток 10 мкМ NPS А привела к наиболее интенсивному гликолизу по сравнению с опытами, в которых использовали более высокие концентрации (20 и 30 мкМ) NPS А. Полученные данные представлены на фигуре 7.
Таким образом, обработка клеток неопетрозидом А интенсифицирует процессы, связанные с получением энергии в кардиомиобластах, стимулируя гликолиз и окислительное фосфорилирование, что приводит к усиленному синтезу АТФ.
Пример 7. Исследование кардиопротекторных свойств
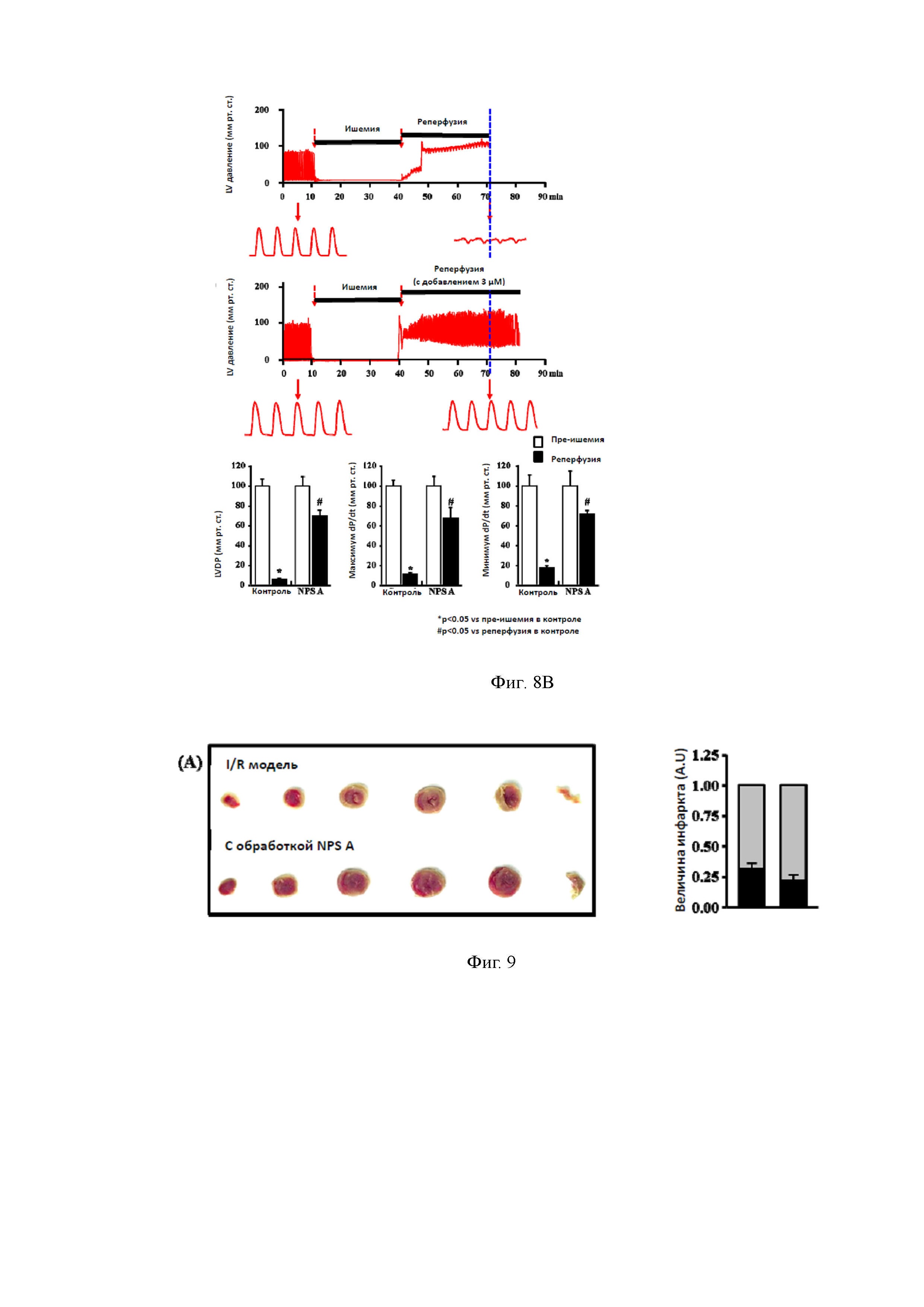
Однако наиболее перспективные для использования в медицине свойства NPS А связаны с его способностью уменьшать повреждения в сердце, вызванные ишемией/реперфузией (I/R). Это было показано при изучении эффектов NPS А на кровяное давление в левом желудочке (ЛЖ) сердца и на формирование инфаркта миокарда в I/R условиях в опытах на крысах ex vivo. В этих экспериментах использовали 8-недельных самцов Sprague Dawley крыс (200-250 г весом каждый), которых анестезировали с помощью пентобарбитала натрия (100 мг/кг, внутрибрюшинно). Полость грудной клетки животных обнажали и вводили в аорту канюлю, позволяющую вводить различные растворы в сердце. Каждое сердце перфузировали раствором NT, уравновешенным 95% O2 и 5% CO2, в системе Лангендорфа в течение 10 мин при 37°С, чтобы удалить всю кровь из сердца. Как показано на фигурах 8А и 8В, сердце было заблокировано, чтобы вызвать глобальную ишемию (30 мин) с последующей реперфузией (50 мин). При этом давление крови в левом желудочке (ЛЖ) сердца животных резко уменьшалось, и нарушался сердечный ритм.
В экспериментах по изучению влияния NPS A на гемодинамику в условиях ишемии/реперфузии это соединение в дозе 10 мкМ вводили через 30 минут после того, как была инициирована глобальная ишемия (в начале реперфузии).
На фиг. 8A представлено моделирование ишемии/реперфузии ех vivo (положительный контроль). На фиг. 8Б проиллюстрировано применение NPS А препятствует падению кровяного давления в ЛЖ и восстанавливает частоту сердечных сокращений после ишемии / реперфузии. Обозначения: LVDP- давление крови в левом желудочке.
Эксперименты показали, что необработанные NPS A сердца имеют пониженное давление в ЛЖ после глобальной ишемии миокарда (фиг. 8А), в то время как применение NPS А предохраняет их от падения кровяного давления в ЛЖ (фиг. 8В). Сердечный ритм (по показаниям кровяного давления в ЛЖ) был восстановлен после применения препарата NPS А.
Кроме того, обработанные NPS А сердца показали меньший размер зоны инфаркта, вызванного ишемией/реперфузией, по сравнению с необработанными этим препаратом сердцами. Области сердца, не подвергнувшиеся инфаркту, выявляли при обработке с 1% раствором трифенилтетразолий хлорида, который был перфузирован в течение 20 минут, причем инфарктные зоны слабо прокрашивались красителем, тогда как здоровая ткань была окрашена в более темный (красный) цвет. Размер зоны инфаркта был рассчитан с помощью Multi Gauge программного обеспечения (Fujifilm, Япония).
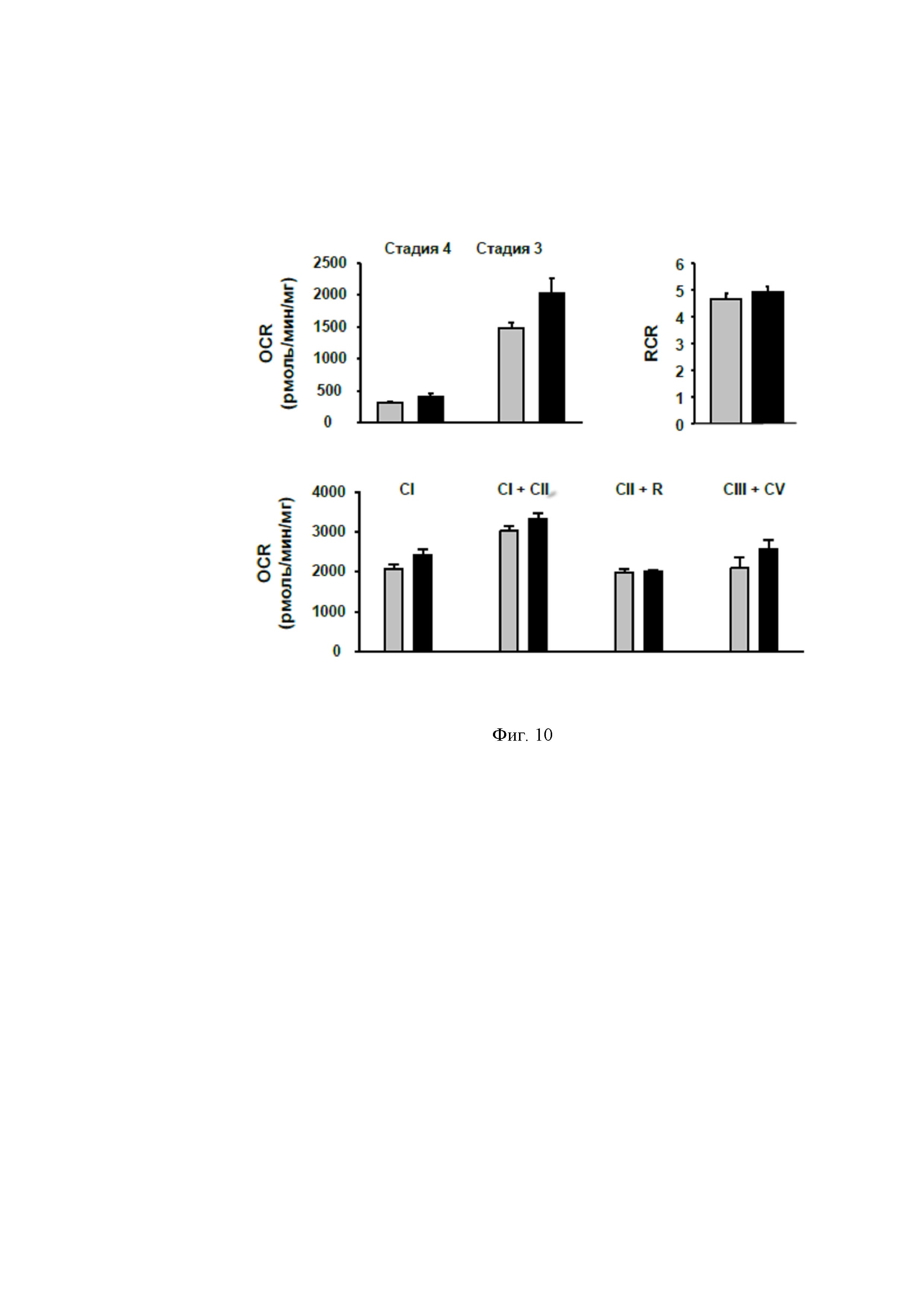
На фигуре 9 представлены зоны инфаркта при ввведении животным различных концентраций NPS А после ишемии. Каждое сердце крысы использовали не только для тестирования на вышеуказанных модельных системах, но и для выделения кардиомиоцитов и митохондрий. Показано, что NPS А не влияет на способность кардиомиоцитов к сокращению. На выделенных из сердец крыс митохондриях он демонстрирует изменения в митохондриальных биохимических превращениях. В самом деле, OCR в стадии 3 митохондриального дыхания было уменьшено в митохондриях, выделенных из кардиомиобластов контрольной I/R группы крыс по сравнению с крысами, получившими NPS A после ишемии, а в стадии 4 дыхания не было изменено в митохондриях какой-либо группы животных.
Таким образом, обработка NPS A предохраняет от повреждений митохондрии в фазе 3 дыхания. В результате дыхательный коэффициент управления (RCR) слегка увеличивался в условиях повреждений, вызванных ишемией/реперфузией после применения NPS A. На фигуре 10 показано, как NPS А стимулирует окислительное фосфорилирование в митохондриях, изолированных из сердца крысы.
Эти результаты согласуются с тем, что NPS А не только демонстрирует свой потенциал в отношении сохранения гемодинамики, но и вызывает восстановление митохондриального дыхания, что отчасти объясняет уменьшение зоны инфаркта при применении этого обладающего кардиопротекторными свойствами препарата.
По своим свойствам, неопетрозид А, скорее относится к кардиопротекторам, влияющим на энергетические процессы в сердечной ткани, о чем свидетельствует активация им митохондриальных функций кардиомиобластов (окислительного фосфорилирования, синтеза АТФ, усвоения митохондриями кислорода и др.).
В то же время неопетрозид А существенно отличается от мексикора, как механизмами, так и особенностями своего действия. Мексикор и близкие к нему лекарства способны уменьшать клинические проявления оксидативного стресса при остром коронарном синдроме и уменьшать частоту и продолжительность ишемии (Лукьянова Л.Д. Метаболические эффекты 3-оксипиридина. Хим. фарм. журнал, 1990, 8, 8-11; Голиков П.А., и др. Сб. трудов VI научно-практической конф., Москва, 2004, с. 482-492).
Неопетрозид А, подобно мексикору, уменьшает образование активных форм кислорода, хотя для него не известны антиоксидантные свойства. Неопетрозид А действует на сердечные ткани на митохондриальном уровне, а мексикор, скорее, проявляет свое положительное действие при взаимодействии с плазматическими мембранами клеток. Оба препарата, неопетрозид А и мексикор, улучшают состояние ишемизированного миокарда, но, кроме того, неопетрозид А уменьшает зону некроза при инфаркте миокарда, а такой эффект для мексикора, насколько нам известно, не характерен.
Еще более существенные различия имеются в молекулярных механизмах действия этих препаратов. В частности, NPS A в отличие от других ранее известных препаратов, регулирующих энергетические процессы, может влиять на выживаемость клеток сердечной мышцы, ингибируя киназу гликогенсинтазы-3β и, в меньшей степени, киназу гликогенсинтазы-3α (GSK-3β и GSK-3α). Было установлено, что ИК50 заявляемого препарата в отношении этих киназ равны 124 мкМ и 140 мкМ, соответственно.
Известно, что ишемия стимулирует окислительный стресс в сердечной мышце. Тетра-бутилгидропероксид (TBHP) в дозе 50 мкМ индуцирует дефосфорилирование GSK3β и гибель клеток в результате повышения в них концентрации активных форм кислорода (ROS), эти концентрации определяли с помощью MitoSOX Red анализатора (Molecular Probes, США), λ/λ возбуждение/эмиссия: 510/580 нм. Обработка неопетрозидом А вызывает дозозависимое увеличение содержания фосфорилированной формы GSK-3β в кардиомиобластах и предотвращает ROS-индуцированную гибель этих клеток. Соотношение фосфорилированной и нефосфорилированной форм GSK-3β устанавливали в клеточном лизате после центрифугирования при 14000 об/мин в течение 15 мин при 4°C. Концентрацию белков определяли с использованием Bradford protein assay (Bio-Rad, США), после чего 30 мкг белка подвергали электрофоретическому разделению в 10% SDS на полиакриламидном геле. Полосы переносили на нитроцеллюлозную мембрану (Whatman, Германия) и инкубировали со специфическими антителами. Вестерн блот анализ выполняли с использованием Вестерн блоттинг детекторного набора Ab signal™ (AbClon, Республика Корея), полосы визуализировали на LAS-3000 Plus imager (Fuji Photo Film Company, Япония).
Фермент GSK3β известен как модулятор функционирования высокопроницаемых митохондриальных пор (mPTPs). В последнее время эти поры привлекли большой интерес, поскольку они играют важную роль в гибели клеток сердца при ишемии и некрозе сердечной мышцы. Неопетрозид А как ингибитор GSK-3β способен предотвращать открытие mPTPs, что во многом определяет его действие на кардиомиобласты. Мы подтвердили такое ингибирование открытия пор, изучив изменения митохондриального мембранного потенциала (ΔΨm) в кардиомиобластах с помощью флуоресцентного красителя тетраметилродамина на флуориметре Invitrogen, (США), λ/λ возбуждение/эмиссия: 549/574. Обработанные TBHP H9c2 клетки показывали время зависимое уменьшение ΔΨm, а обработка неопетрозидом А предотвращала такое уменьшение мембранного потенциала.
Таким образом, NPS A имеет необычный механизм действия, связанный с ингибированием фермента GSK-3β и предотвращением открытия высокопроницаемых мембранных пор в митохондриях клеток сердца.
Ранее применение NPS A в качестве активного вещества, действующего на клетки сердца, в медицине или в биомедицинских экспериментах, известно не было. Возможность использования препаратов этого типа для лечения сердечно-сосудистых заболеваний и изучения процессов, связанных с ишемией, определяется его способностью защищать и восстанавливать миокард в условиях ишемии / реперфузии и уменьшать зоны некроза при инфаркте миокарда.
Препараты, содержащие это активное вещество и соответствующие вспомогательные вещества, в различных лекарственных формах (таблетки, инъекционные растворы и др.) могут применяться пациентами, страдающими от сердечно-сосудистых заболеваний. Кроме того, сама субстанция может найти применение в биомедицинских исследованиях, направленных на изучение сердечно-сосудистых заболеваний, способов их предотвращения и лечения, в частности, в экспериментах на животных или на клеточных линиях.