Результат интеллектуальной деятельности: БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО
Вид РИД
Изобретение
Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к биспецифическому антителу, способному специфически связываться с PD-1 и CD3, соответственно (в настоящем документе обозначено как «биспецифическое антитело против PD-1/CD3»), и фармацевтической композиции, содержащей указанное антитело в качестве активного ингредиента, а также к применению указанного антитела в терапии.
Предшествующий уровень техники
[0002] PD-1 представляет собой иммуносупрессивный рецептор, относящийся к семейству иммуноглобулинов и представляет собой молекулу, имеющую функцию супрессии сигналов иммунной активации Т-клеток, активированных путем стимулирования посредством рецептора антигена. Анализ мышей с нокаутом PD-1, и тому подобное, показал, что сигнальные пути PD-1 играют важную роль в супрессии аутоиммунных заболеваний, таких как аутоиммунная дилятационная кардиомиопатия, волчано-подобный синдром, аутоиммунный энцефаломиелит, системная красная волчанка, болезнь «трансплантат против хозяина», сахарный диабет I типа и ревматоидный артрит. Соответственно, было указано, что средство усиления сигнального пути PD-1 может быть профилактическим или терапевтическим средством для аутоиммунных заболеваний.
[0003] Биспецифические антитела, распознающие PD-1, были известны ранее, как средство усиления сигнального пути PD-1 (ссылки на патенты 1-3). Биспецифические антитела состоят из сайта распознавания антигена антитела, распознающего CD3, который представляет собой элемент Т-клеточного рецепторного комплекса, и сайта распознавания антигена антитела, распознающего PD-1, связанных друг с другом посредством методов генной инженерии. Биспецифические антитела обладают активностью, усиливающей ингибирующий сигнал PD-1 против Т-клеточного рецепторного комплекса за счет повышения частоты приведения PD-1 в непосредственную близость с Т-клеточным рецепторным комплексом. Кроме того, в патентных документах также утверждается, что биспецифические антитела против PD-1 можно использовать для профилактики или лечения аутоиммунных заболеваний.
[0004] Где, побочным явлением в случае белкового состава является инфузионная реакция или синдром высвобождения цитокинов, возникающий сразу после введения состава. Существует необходимость в составах, при использовании которых такие реакции снижены или подавлены.
[0005] Для биспецифического антитела против PD-1/CD3 по настоящему изобретению стимуляция выработки цитокина после введения, которая как считается, является причиной вышеупомянутых нежелательных реакций, значительно уменьшена. Поэтому, ожидается, что биспецифическое антитело против PD-1/CD3 будет фармацевтическим препаратом, в котором подавлено проявление этого нежелательного побочного действия.
[0006] До сих пор не сообщалось о биспецифических антителах, имеющих такие характеристики.
Список цитируемой литературы
Ссылки на патенты
[0007] Ссылка на патент 1: Международная публикация № WO2003/011911
Ссылка на патент 2: Международная публикация № WO2004/072286
Ссылка на патент 3: Международная публикация № WO2013/022091
Сущность изобретения
Техническая задача
[0008] Цель настоящего изобретения состоит в получении нового фармацевтического средства для профилактики, подавления симптомов прогрессирования или рецидива аутоиммунных заболеваний, и тому подобное, или их лечения.
Решение задачи
[0009] Авторы настоящего изобретения тщательно изучили и сфокусировали свои исследования на биспецифическом антителе против PD-1/CD3 по настоящему изобретению в качестве средства, способного решить вышеуказанную задачу. Авторы настоящего изобретения также подтвердили, что биспецифическое антитело против PD-1/CD3 может быть средством, при котором снижено проявление реакций, называемых инфузионная реакция или синдром высвобождения цитокинов, и пришли к созданию настоящего изобретения.
[0010] Кроме того, авторы настоящего изобретения обнаружили, что биспецифическое антитело против PD-1/CD3 имеет характеристики, обеспечивающие взаимодействие между PD-1 и PD-L1 в качестве их лиганда, и обнаружили, что такие характеристики вносят вклад в усиление или поддержание действия биспецифического антитела против PD-1/CD3.
[0011] То есть настоящее изобретение относится к следующим объектам.
[1] Биспецифическое антитело или фрагмент антитела против PD-1/CD3, имеющее первое плечо, специфически связывающееся с PD-1, и второе плечо, специфически связывающееся с CD3,
где первое плечо, специфически связывающееся с PD-1, содержит любую одну VH, выбранную из:
(A) вариабельной области тяжелой цепи (в настоящем документе, «вариабельная область тяжелой цепи» может сокращенно быть обозначена как «VH»), имеющей
(a) определяющую комплементарность область 1 вариабельной области тяжелой цепи (в настоящем документе, «определяющая комплементарность область 1 вариабельной области тяжелой цепи» может быть сокращено обозначена как «VH-CDR1»), содержащую аминокислотную последовательность SEQ ID NO:6;
(b) определяющую комплементарность область 2 вариабельной области тяжелой цепи (в настоящем документе, «определяющая комплементарность область 2 вариабельной области тяжелой цепи» может быть сокращено обозначена как «VH-CDR2»), содержащую аминокислотную последовательность SEQ ID NO:7; и
(c) определяющую комплементарность область 3 вариабельной области тяжелой цепи (в настоящем документе, «определяющая комплементарность область 3 вариабельной области тяжелой цепи» может быть сокращено обозначена как «VH-CDR3»), содержащую аминокислотную последовательность SEQ ID NO:8;
(B) VH, имеющей
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:9;
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:10; и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:11;
(C) VH, имеющей
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:12;
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:13, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:14;
(D) VH, имеющей
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:15;
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:16; и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:17; и
(E) VH, имеющей
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:18;
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:19; и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:20; и
где второе плечо, специфически связывающееся с CD3, содержит VH, имеющую
(a) VH-CDR1, содержащую аминокислотную последовательность в SEQ ID NO:37;
(b) VH-CDR2, содержащую аминокислотную последовательность в SEQ ID NO:38; и
(c) VH-CDR3, содержащую аминокислотную последовательность в SEQ ID NO:39.
[2] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1], где от одного до пяти произвольных аминокислотных остатков можно, соответственно, заменить на другую аминокислоту (аминокислоты) (предпочтительно, на консервативную аминокислоту (аминокислоты)) в любой одной или более VH-CDR, выбранных из VH-CDR1, VH-CDR2 и VH-CDR3 в первом плече, специфически связывающемся с PD-1; и/или произвольный аминокислотный остаток (от одного до пяти остатков) можно, соответственно, заменить на другую аминокислоту (аминокислоты) (предпочтительно, на консервативную аминокислоту (аминокислоты)) в любой одной или более VH-CDR, выбранным из VH-CDR1, VH-CDR2 и VH-CDR3 во втором плече, специфически связывающемся с CD3.
[3] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1] или [2], где
(i) VH первого плеча, специфически связывающегося с PD-1, имеет:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:6,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:7, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:8; и
(ii) VH второго плеча, специфически связывающегося с CD3, имеет:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:37,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:38, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:39.
[4] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1] или [2], где
(i) VH первого плеча, специфически связывающегося с PD-1, имеет:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:9,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:10, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:11; и
(ii) VH второго плеча, специфически связывающегося с CD3, имеет:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:37,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:38, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:39.
[5] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1] или [2], где
(i) VH первого плеча, специфически связывающегося с PD-1, имеет
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:12,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:13, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:14, и
(ii) VH второго плеча, специфически связывающегося с CD3, имеет:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:37,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:38, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:39.
[6] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1] или [2], где
(i) VH первого плеча, специфически связывающегося с PD-1, имеет:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:15,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:16, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:17; и
(ii) VH второго плеча, специфически связывающегося с CD3, имеет:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:37,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:38, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:39.
[7] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1] или [2], где
(i) VH первого плеча, специфически связывающегося с PD-1, имеет:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:18,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:19, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:20; и
(ii) VH второго плеча, специфически связывающегося с CD3, имеет:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:37,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:38, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:39.
[8] Биспецифическое антитело или фрагмент антитела против PD-1/CD3, имеющее первое плечо, специфически связывающееся с PD-1, и второе плечо, специфически связывающееся с CD3,
где первое плечо, специфически связывающееся с PD-1, содержит VH, имеющую:
(a) VH-CDR1, содержащую аминокислотную последовательность HYJ1LH [где J1 представляет G (глицин) или (аланин), и буквенные обозначения, представленные J1 или по-другому, представляют однобуквенное сокращение аминокислоты, соответственно]
(b) VH-CDR2, содержащую аминокислотную последовательность WJ2NTNTU2NPTX2AQGFTG [где J2 представляет L (лейцин) или I (изолейцин), U2 представляет E (глутаминовая кислота) или G (глицин), X2 представляет F (фенилаланин) или Y (тирозин), и буквенные обозначения, представленные J2, U2 или X2, или по-другому, представляют, соответственно, то же, что и выше] и
(c) VH-CDR3, содержащую аминокислотную последовательность GDJ3VVPTTIWNYYU3X3MZ3V [где J3 представляет M (метионин) или L (лейцин), U3 представляет H (гистидин) или Y (тирозин), X3 представляет F (фенилаланин) или Y (тирозин), Z3 представляет D (аспарагиновая кислота) или E (глутаминовая кислота), и буквенные обозначения, представленные J3, U3, X3 или Z3, или другие буквенные обозначения представляют, соответственно, то же, что и выше] и;
где второе плечо, специфически связывающееся с CD3, содержит VH, имеющую:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:37,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:38, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:39.
[9] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [8], где
(a) J1 представляет G (глицин), J2 представляет L (лейцин), U2 представляет E (глутаминовая кислота), X2 представляет F (фенилаланин), J3 представляет M (метионин), U3 представляет H (гистидин), X3 представляет F (фенилаланин), а Z3 представляет D (аспарагиновая кислота);
(b) J1 представляет G (глицин), J2 представляет I (изолейцин), U2 представляет G (глицин), X2 представляет Y (тирозин), J3 представляет L (лейцин), U3 представляет H (гистидин), X3 представляет Y (тирозин), а Z3 представляет E (глутаминовая кислота);
(c) J1 представляет A (аланин), J2 представляет L (лейцин), U2 представляет E (глутаминовая кислота), X2 представляет Y (тирозин), J3 представляет M (метионин), U3 представляет Y (тирозин), X3 представляет Y (тирозин), а Z3 представляет D (аспарагиновая кислота); или
(d) J1 представляет A (аланин), J2 представляет L (лейцин), U2 представляет E (глутаминовая кислота), X2 представляет F (фенилаланин), J3 представляет M (метионин), U3 представляет H (гистидин), X3 представляет F (фенилаланин), а Z3 представляет D (аспарагиновая кислота).
[10] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[9], где каркасная область 1 (в настоящем документе, может быть сокращено обозначена как «FR1»), каркасная область 2 (в настоящем документе, может быть сокращено обозначена как «FR2») и каркасная область 3 (в настоящем документе, может быть сокращено обозначена как «FR3») в каркасной области (в настоящем документе, «каркас» может быть сокращено обозначена как «FR») в VH первого плеча, специфически связывающегося с PD-1, соответствуют аминокислотным последовательностям, кодируемым геном IGHV7-4-1 зародышевой линии V или ее геном с соматической мутацией (мутациями), соответственно.
[11] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [10], где каркас 4 (в настоящем документе, «каркас 4» может быть сокращено обозначен как «FR4») область в VH первого плеча, специфически связывающегося с PD-1, включает в себя аминокислотную последовательность (исключая аминокислотную последовательность, включенную в VH-CDR3), кодируемую геном JH6c зародышевой линии J или ее геном с соматической мутацией (мутациями).
[12] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [10] или [11], где FR область в VH первого плеча, специфически связывающегося с PD-1, кодируется геном IGHV7-4-1 зародышевой линии V с соматической мутацией (мутациями), и где FR область содержит FR1 область, в которой в аминокислотной последовательности SEQ ID NO:21, за счет соматической мутации лизин в позиции 13 представляет собой или может быть заменен глютамином, аланин в позиции 16 представляет собой или может быть заменен валином, или лизин в позиции 19 представляет собой или может быть заменен метионином, соответственно, или они представляют собой или могут быть реализованы в виде произвольного множества их комбинаций.
[13] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [10]-[12], где FR область VH в первом плече, специфически связывающемся с PD-1, кодируется геном IGHV7-4-1 зародышевой линии V с соматической мутацией (мутациями), и где FR область содержит FR2 область, в которой в аминокислотной последовательности SEQ ID NO:21, валин в позиции 37 представляет собой или может быть заменен лейцином за счет соматической мутации.
[14] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [10]-[13], где FR область VH в первом плече, специфически связывающемся с PD-1, кодируется геном IGHV7-4-1 зародышевой линии V с соматической мутацией (мутациями), и где FR область содержит FR3 область, в которой в аминокислотной последовательности SEQ ID NO:21, за счет соматической мутации серин в позиции 77 представляет собой или может быть заменен треонином, или цистеин в позиции 84 представляет собой или может быть заменен серином или аспарагином, соответственно, или они представляют собой или могут быть реализованы в виде произвольного множества их комбинаций.
[15] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [10]-[14], где FR4 область VH первого плеча, специфически связывающегося с PD-1, кодируется геном JH6c зародышевой линии J с соматической мутацией (мутациями) (исключая участок гена, кодирующий VH-CDR3), и где в аминокислотной последовательности (Trp-Gly-Lys-Gly-Thr-Thr*-Val-Thr-Val-Ser-Ser)(SEQ ID NO:41) FR4 области, лизин (Lys) представляет собой или может быть заменен глютамином или аспарагином, и/или треонин (Thr), помеченный звездочкой, представляет собой или может быть заменен лейцином.
[16] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[15], где VH первого плеча, специфически связывающегося с PD-1, содержит любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5, или аминокислотную последовательность, которая по меньшей мере идентична на 80%, 90%, 95%, 98% или 99% по аминокислотной последовательности.
[17] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1] и [3]-[7], где VH первого плеча, специфически связывающегося с PD-1, содержит любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5.
[18] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[17], где VH второго плеча, специфически связывающегося с CD3, содержит аминокислотную последовательность SEQ ID NO:36, или аминокислотную последовательность, которая по меньшей мере на 80%, 90%, 95%, 98% или 99% идентична по аминокислотной последовательности.
[19] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1] и [3]-[18], где VH второго плеча, специфически связывающегося с CD3, содержит аминокислотную последовательность SEQ ID NO:36.
[20] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1], где VH первого плеча, специфически связывающегося с PD-1, содержит любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5; а VH второго плеча, специфически связывающегося с CD3, содержит аминокислотную последовательность SEQ ID NO:36.
[21] Биспецифическое антитело или фрагмент антитела против PD-1/CD3, имеющее первое плечо, специфически связывающееся с PD-1, и второе плечо, специфически связывающееся с CD3, в котором VH первого плеча, специфически связывающегося с PD-1, содержит любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5, или аминокислотную последовательность, которая по меньшей мере на 80%, 90%, 95%, 98% или 99% идентична по аминокислотной последовательности; и где VH второго плеча, специфически связывающегося с CD3, содержит аминокислотную последовательность SEQ ID NO:36, или аминокислотную последовательность, которая по меньшей мере на 80%, 90%, 95%, 98% или 99% идентична по аминокислотной последовательности.
[22] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1] или [3], где VH первого плеча, специфически связывающегося с PD-1, содержит аминокислотную последовательность SEQ ID NO:1; и где VH второго плеча, специфически связывающегося с CD3, содержит аминокислотную последовательность SEQ ID NO:36.
[23] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1] или [4], где VH первого плеча, специфически связывающегося с PD-1, содержит аминокислотную последовательность SEQ ID NO:2; и где VH второго плеча, специфически связывающегося с CD3, содержит аминокислотную последовательность SEQ ID NO:36.
[24] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1] или [5], где VH первого плеча, специфически связывающегося с PD-1, содержит аминокислотную последовательность SEQ ID NO:3; и где VH второго плеча, специфически связывающегося с CD3, содержит аминокислотную последовательность SEQ ID NO:36.
[25] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1] или [6], где VH первого плеча, специфически связывающегося с PD-1, содержит аминокислотную последовательность SEQ ID NO:4; и где VH второго плеча, специфически связывающегося с CD3, содержит аминокислотную последовательность SEQ ID NO:36.
[26] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [1] или [7], где VH первого плеча, специфически связывающегося с PD-1, содержит аминокислотную последовательность SEQ ID NO:5; и где VH второго плеча, специфически связывающегося с CD3, содержит аминокислотную последовательность SEQ ID NO:36.
[27] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[26], где первое плечо, специфически связывающееся с PD-1, и/или второе плечо, специфически связывающееся с CD3, имеет вариабельную область легкой цепи (в настоящем документе, «вариабельная область легкой цепи» может быть сокращено обозначена как «VL»), имеющую
(a) определяющую комплементарность область 1 вариабельной области легкой цепи (в настоящем документе, «определяющая комплементарность область 1 вариабельной области легкой цепи» может быть сокращено обозначена как «VL-CDR1»), содержащую аминокислотную последовательность SEQ ID NO:26;
(b) определяющую комплементарность область 2 вариабельной области легкой цепи (в настоящем документе, «определяющая комплементарность область 2 вариабельной области легкой цепи» может быть сокращено обозначена как «VL-CDR2»), содержащую аминокислотную последовательность SEQ ID NO:27; и
(c) определяющую комплементарность область 3 вариабельной области легкой цепи (в настоящем документе, «определяющая комплементарность область 3 вариабельной области легкой цепи» может быть сокращено обозначена как «VL-CDR3»), содержащую аминокислотную последовательность SEQ ID NO:28, соответственно.
[28] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[27], где первое плечо, специфически связывающееся с PD-1, и/или второе плечо, специфически связывающееся с CD3, имеют VL, содержащую аминокислотную последовательность SEQ ID NO:25, соответственно.
[29] Биспецифическое антитело или фрагмент антитела против PD-1/CD3, имеющее первое плечо, специфически связывающееся с PD-1, и второе плечо, специфически связывающееся с CD3, в котором (A) первое плечо, специфически связывающееся с PD-1, имеет VH, содержащую любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5, и VL, содержащую аминокислотную последовательность SEQ ID NO:25; и
(B) второе плечо, специфически связывающееся с CD3, имеет VH, содержащую аминокислотную последовательность SEQ ID NO:36; и VL, содержащую аминокислотную последовательность SEQ ID NO:25.
[30] Биспецифическое антитело или фрагмент антитела против PD-1/CD3, имеющее первое плечо, специфически связывающееся с PD-1, и второе плечо, специфически связывающееся с CD3,
где первое плечо, специфически связывающееся с PD-1, перекрестно конкурирует за (1) связывание с PD-1 с первым плечом, специфически связывающимся с PD-1, имеющим VH, содержащую любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5; и VL, содержащую аминокислотную последовательность SEQ ID NO:25, или за (2) связывание с PD-1 с вариабельной областью моноклонального антитела, специфически связывающегося с PD-1, имеющего одинаковые VH и VL.
[31] Биспецифическое антитело или фрагмент антитела против PD-1/CD3, имеющее первое плечо, специфически связывающееся с PD-1, и второе плечо, специфически связывающееся с CD3, где связывание с PD-1 первого плеча, специфически связывающегося с PD-1, испытывает перекрестную конкуренцию (1) со стороны первого плеча, специфически связывающегося с PD-1, имеющего VH, содержащую любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5; и VL, содержащую аминокислоту SEQ ID NO:25, или (2) со стороны вариабельной области моноклонального антитела, специфически связывающегося с PD-1, имеющего одинаковые VH и VL.
[32] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по пункту [30] или [31], где второе плечо, специфически связывающееся с CD3, кроме того перекрестно конкурирует за (1) связывание с CD3 со вторым плечом, специфически связывающимся с CD3, имеющим VH, содержащую аминокислотную последовательность SEQ ID NO:36; и VL, содержащую аминокислотную последовательность SEQ ID NO:25, или за (2) связывание с CD3 с вариабельной областью моноклонального антитела, специфически связывающегося с CD3, имеющего одинаковые VH и VL.
[33] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по пункту [30] или [31], где второе плечо, специфически связывающееся с CD3, содержит VH, имеющую:
(a) VH-CDR1, содержащую аминокислотную последовательность в SEQ ID NO:37;
(b) VH-CDR2, содержащую аминокислотную последовательность в SEQ ID NO:38; и
(c) VH-CDR3, содержащую аминокислотную последовательность в SEQ ID NO:39.
[34] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из пунктов [30], [31] и [33], где VH во втором плече, специфически связывающемся с CD3, содержит аминокислотную последовательность SEQ ID NO:36, или аминокислотную последовательность, которая по меньшей мере идентична на 80%, 90%, 95%, 98% или 99% по аминокислотной последовательности.
[35] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по пункту [30] или [31], где VH второго плеча, специфически связывающегося с CD3, содержит аминокислотную последовательность SEQ ID NO:36.
[36] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из пунктов [30], [31] и [33]-[35], где второе плечо, специфически связывающееся с CD3, имеет VL, имеющую:
(a) VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:26;
(b) VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:27; и
(c) VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:28.
[37] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из пунктов [30], [31] и [33]-[35], где второе плечо, специфически связывающееся с CD3, имеет VL, содержащую аминокислотную последовательность SEQ ID NO:25.
[38] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[37], где PD-1/CD3 биспецифическим антителом является IgG антитело.
[39] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [38], где IgG антителом по предыдущему пункту [38] является IgG1 или IgG4 антитело.
[40] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [38], где IgG антителом по предыдущему пункту [38] является IgG1 антитело.
[41] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [38], где IgG антителом по предыдущему пункту [38] является IgG4 антитело.
[42] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [40], где в двух константных областях тяжелых цепей IgG1 антитела по предыдущему пункту [40] лейцины в позиции 235 согласно системе нумерации ЕС замещены глицином, и/или глицины в позиции 236 согласно системе нумерации ЕС замещены аргинином, соответственно.
[43] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [40] или [42], где в константной области тяжелой цепи, имеющей VH первого плеча, специфически связывающегося с PD-1, как лейцин в позиции 351 согласно системе нумерации ЕС, так и треонин в позиции 366 согласно системе нумерации ЕС замещены лизином, а в константной области тяжелой цепи, имеющей VH второго плеча, специфически связывающегося с CD3, лейцин в позиции 351 согласно системе нумерации ЕС заменен аспарагиновой кислотой, а лейцин в позиции 368 согласно системе нумерации ЕС заменен глутаминовой кислотой.
[44] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [40] или [42], где в константной области тяжелой цепи, имеющей VH первого плеча, специфически связывающегося с PD-1, лейцин в позиции 351 согласно системе нумерации ЕС заменен аспарагиновой кислотой, а лейцин в позиции 368 согласно системе нумерации ЕС заменен глутаминовой кислотой, а в константной области тяжелой цепи, имеющей VH второго плеча, специфически связывающегося с CD3, как лейцин в позиции 351 согласно системе нумерации ЕС, так и треонин в позиции 366 согласно системе нумерации ЕС замещены лизином.
[45] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [40] и [42]-[44], где в двух константных областях тяжелых цепей IgG1 антитела по любому из предыдущих пунктов [40] и [42]-[44] Каждый лизин в позиции 447 согласно системе нумерации ЕС удален.
[46] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [41], где в двух константных областях тяжелых цепей IgG4 антитела по предыдущему пункту [41] серины в позиции 228 согласно системе нумерации ЕС замещены пролином, соответственно.
[47] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[38], [40], [42] и [44], где тяжелая цепь, имеющая VH первого плеча, специфически связывающегося с PD-1, имеет константную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:23.
[48] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[38], [40], [42] [44] и [47], где тяжелая цепь, имеющая VH второго плеча, специфически связывающегося с CD3, имеет константную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:24.
[49] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[48], где легкая цепь, имеющая VL первого плеча, специфически связывающегося с PD-1, и/или легкая цепь, имеющая VL второго плеча, специфически связывающегося с CD3, имеет/имеют константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:29.
[50] Биспецифическое антитело или фрагмент антитела против PD-1/CD3, имеющее первое плечо, специфически связывающееся с PD-1, и второе плечо, специфически связывающееся с CD3, в котором:
(A) тяжелая цепь, имеющая VH первого плеча, специфически связывающегося с PD-1, имеет VH, содержащую любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5, и константную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:23;
(B) легкая цепь, имеющая VL первого плеча, специфически связывающегося с PD-1, имеет VL, содержащую аминокислотную последовательность SEQ ID NO:25, и константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:29;
(C) тяжелая цепь, имеющая VH второго плеча, специфически связывающегося с CD3, имеет VH, содержащую аминокислотную последовательность SEQ ID NO:36, и константную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:24; и
(D) легкая цепь, имеющая VL второго плеча, специфически связывающегося с CD3, имеет VL, содержащую аминокислотную последовательность SEQ ID NO:25, и константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:29.
[51] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[50], где первое плечо, специфически связывающееся с PD-1, обеспечивает взаимодействие между PD-1 и PD-L1.
[52] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[51], где выработка цитокина достаточно уменьшена.
[53] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[50], где первое плечо, специфически связывающееся с PD-1, обеспечивает взаимодействие между PD-1 и PD-L1, и где выработка цитокина достаточно уменьшена.
[54] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по предыдущему пункту [52] или [53], где цитокин включает в себя по меньшей мере IL-2, IFN-γ или TNF-α.
[55] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[54], где PD-1 представляет собой человеческий PD-1, а CD3 представляет собой человеческий CD3, соответственно.
[56] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[55], где CD3 представляет собой CD3ε.
[57] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[56], где биспецифическое антитело против PD-1/CD3 представляет собой моноклональное антитело.
[58] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[57], где биспецифическое антитело против PD-1/CD3 представляет собой выделенное антитело.
[1-1] Фармацевтическая композиция, содержащая биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[58] и фармацевтически приемлемый носитель.
[2-1] Фармацевтическое средство для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения аутоиммунного заболевания, содержащее биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[58] в качестве активного ингредиента.
[2-2] Фармацевтическое средство по предыдущему пункту [2-1], где аутоиммунным заболеванием является болезнь Бехчета, системная красная волчанка, хроническая дискоидная красная волчанка, рассеянный склероз (системная склеродермия и прогрессирующий системный склероз), склеродермия, полимиозит, дерматомиозит, узелковый периартериит (узелковый полиартериит и микроскопический полиангиит), аортальный синдром (артериит Такаясу), ревматоидный артрит со злокачественными заболеваниями, ревматоидный артрит, ювенильный идиопатический артрит, спондилоартрит, смешанное заболевание соединительной ткани, синдром Шегрена, болезнь Стилла у взрослых, васкулит, аллергический гранулематозный васкулит, гиперчувствительный васкулит, ревматоидный васкулит, васкулит крупных сосудов, АНЦА-ассоциированный васкулит (например, гранулематоз с полиангиитом и эозинофильный гранулематоз с полиангиитом), синдром Когана, RS3PE, височный артериит, ревматическая полимиалгия, фибромиалгия, синдром антифосфолипидных антител, эозинофильный фасциит, IgG4-связанное заболевание (например, первичный склерозирующий холангит, аутоиммунный инсулит), синдром Гийена-Барре, тяжелая миастения, хронический атрофический гастрит, аутоиммунный гепатит, неалкогольный стеатогепатит, первичный билиарный цирроз, синдром Гудпасчера, быстропрогрессирующий гломерулонефрит, мегалобластная анемия, аутоиммунная гемолитическая анемия, пернициозная анемия, аутоиммунная нейтропения, идиопатическая тромбоцитопеническая пурпура, базедова болезнь (болезнь Грейвcа (гипертиреоидизм)), болезнь Хашимото, аутоиммунная недостаточность надпочечников, первичный гипотиреоз, болезнь Аддисона (хронический гипоадренокортицизм), болезнь Аддисона неизвестного происхождения, сахарный диабет I типа, медленно прогрессирующий сахарный диабет I типа (латентный аутоиммунный сахарный диабет взрослых), очаговая склеродермия, псориаз, псориатический артрит, буллезный пемфигоид, пемфигус, пемфигоид, гестационный герпес, линеарный IgA-зависимый буллезный дерматоз, приобретенный буллезный эпидермоз, очаговая алопеция, витилиго, вульгарное витилиго, нейромиелит зрительного нерва, хроническая воспалительная демиелинизирующая полинейропатия, многофокальная моторная нейропатия, саркоидоз, гигантоклеточный артериит, боковой амиотрофический склероз, болезнь Харада, аутоиммунная оптическая нейропатия, азооспермия неизвестного происхождения, привычный аборт, воспалительная болезнь кишечника (например, язвенный колит, и болезнь Крона), целиакия, анкилозирующий спондилоартрит, тяжелая астма, хроническая крапивница, трансплантационный иммунитет, семейная средиземноморская лихорадка, эозинофильный хронический риносинусит, дилатационная кардиомиопатия, системный мастоцитоз или миозит с включениями телец.
[2-3] Фармацевтическое средство для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения болезни «трансплантат против хозяина» (GVHD), содержащее биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[58] в качестве активного ингредиента.
[2-4] Фармацевтическое средство для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения сахарного диабета I типа, содержащее биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[58] в качестве активного ингредиента и вводимое вместе с любым одним или более средствами, выбираемыми из препарата инсулина (например, человеческого инсулина, инсулина гларгин, инсулина лизпро, инсулина детемир, инсулина аспарт и тому подобное), препарата сульфонилмочевины (например, глибенкламида, гликлазида или глимепирида), быстродействующего промотора секреции инсулина (например, натеглинида), препарата бигуанид (например, метформина), средства, влияющего на инсулинорезистентность (например, пиоглитазона), ингибитора α-глюкозидазы (например, акарбозы, воглибозы и тому подобное), средства для лечения диабетической невропатии (например, эпалрестата, мексилетина, имидаприла и тому подобное), препарата-аналога GLP-1 (например, лираглутида, эксенатида, ликсисенатида и тому подобное) и ингибитора DPP-4 (например, ситаглиптина, вилдаглиптина, алоглиптина и тому подобное).
[2-5] Фармацевтическое средство для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения рассеянного склероза, содержащее биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[58] в качестве активного ингредиента и вводимое вместе с любым одним или более средствами, выбираемыми из стероидного средства (например, кортизона ацетата, гидрокортизона, гидрокортизона натрия фосфата, гидрокортизона натрия сукцината, флудрокортизона ацетата, преднизолона, преднизолона ацетата, преднизолона натрия сукцината, преднизолона бутилацетата, преднизолона натрия фосфата, галопредона ацетата, метилпреднизолона, метилпреднизолона ацетата, метилпреднизолона натрия сукцината, триамсинолона, триамсинолона ацетата, триамсинолона ацетонида, дексаметазона, дексаметазона ацетата, дексаметазона натрия фосфата, дексаметазона пальмитата, параметазона ацетата или бетаметазона и тому подобное), интерферона β-1a, интерферона β-1b, глатирамера ацетата, митоксантрона, азатиоприна, циклофосфамида, циклоспорина, метотрексата, кладрибина, адренокортикотропного гормона (ACTH), кортикотропина, мизорибина, такролимуса, финголимода и алемтузумаба.
[2-6] Фармацевтическое средство для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения системной красной волчанки, содержащее биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[58] в качестве активного ингредиента и вводимое вместе с любым одним или более средствами, выбираемыми из стероидного средства (например, стероидных средств, упомянутых в предыдущем пункте [2-5]), иммуносупрессивного средства (например, циклоспорина, такролимуса или финголимода) и белимумаба.
[2-7] Фармацевтическое средство для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения ревматоидного артрита, содержащее биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[58] в качестве активного ингредиента и вводимое вместе с любым одним или более средствами, выбираемыми из стероидного средства (например, стероидных средств, упомянутых в предыдущем пункте [2-5]), противоревматического средства (например, метотрексата, сульфазалазина, буцилламина, лефлуномида, мизорибина, такролимуса и тому подобное), антицитокинового средства (например, инфликсимаба, адалимумаба, тоцилизумаба, этанерцепта, голимумаба, сертолизумаба) и абатацепта.
[2-8] Фармацевтическое средство для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения аутоиммунного заболевания, содержащее биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[58] в качестве активного ингредиента и вводимое вместе с любым одним или более средствами, описанными в предыдущих пунктах [2-4]-[2-7].
[2-9] Фармацевтическое средство для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения заболеваний, упомянутых в предыдущих пунктах [2-4]-[2-8], вводимое пациенту, которому вводят любое одно или более лекарственных средств, упомянутых в предыдущих пунктах [2-4]-[2-7].
[2-10] Фармацевтическое средство для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения заболеваний, упомянутых в предыдущих пунктах [2-4]-[2-8], вводимое после введения любого одного или более лекарственных средств, упомянутых в предыдущих пунктах [2-4]-[2-7].
[2-11] Фармацевтическое средство для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения заболеваний, упомянутых в предыдущих пунктах [2-4]-[2-8], вводимое перед введением любого одного или более лекарственных средств, упомянутых в предыдущих пунктах [2-4]-[2-7].
[3-1] Состав для внутривенной инъекции, содержащая биспецифическое антитело или фрагмент антитела против PD-1/CD3 по любому из предыдущих пунктов [1]-[58] и фармацевтически приемлемый носитель.
[3-2] Состав для внутривенной инъекции по пункту [3-1] Для применения для профилактики, подавления прогрессирования симптомов, подавления рецидива и/или лечения аутоиммунного заболевания.
[3-3] Состав для внутривенной инъекции по предыдущему пункту [3-1] или [3-2] Для применения в капельной инфузии.
[4-1] Выделенный полинуклеотид или его фрагмент, кодирующий тяжелую цепь, имеющую VH первого плеча, специфически связывающегося с PD-1, составляющего любое одно из PD-1/CD3 биспецифических антител, выбранную из предыдущих пунктов [1]-[58].
[4-2] Выделенный полинуклеотид или его фрагмент, кодирующий VH первого плеча, специфически связывающегося с PD-1, составляющего любое одно из PD-1/CD3 биспецифических антител, выбранную из предыдущих пунктов [1]-[58].
[4-3] Выделенный полинуклеотид или его фрагмент в предыдущих пунктах [4-1] или [4-2], где VH первого плеча, специфически связывающегося с PD-1, кодируется полинуклеотидом, содержащим последовательность в любой из SEQ ID NO: 30-34.
[4-4] Выделенный полинуклеотид или его фрагмент, включая полинуклеотид, содержащий последовательность в любой из SEQ ID NO: 30-34.
[5-1] Вектор экспрессии, имеющий полинуклеотид по любому из предыдущих пунктов [4-1]-[4-4].
[6-1] Клетка животного, в которую трансфицирован вектор экспрессии по предыдущему пункту [5-1] или которая трансформирована вектором для трансфекции.
[7-1] Способ профилактики, подавления симптомов прогрессирования или рецидива и/или лечения аутоиммунного заболевания, включающий введение пациенту эффективного количества биспецифического антитела против PD-1/CD3 или фрагмента антитела по любому из предыдущих пунктов [1]-[58].
[8-1] Биспецифическое антитело или фрагмент антитела против PD-1/CD3, выбираемого из предыдущих пунктов [1]-[58], используемого для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения аутоиммунного заболевания.
[9-1] Применение биспецифического антитела против PD-1/CD3 или фрагмента антитела, выбираемого из предыдущих пунктов [1]-[58] Для получения фармацевтического средства для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения аутоиммунного заболевания.
[10-1] Выделенное моноклональное антитело или фрагмент антитела против PD-1, которое перекрестно конкурирует за связывание с PD-1 с антителом, специфически связывающимся с PD-1, имеющее VH, содержащую любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5, и VL, содержащую аминокислотную последовательность SEQ ID NO:25.
[10-2] Выделенное моноклональное антитело или фрагмент антитела против PD-1, где связывание с PD-1 выделенного моноклонального антитела или фрагмента антитела против PD-1 испытывает перекрестную конкуренцию со стороны антитела, специфически связывающегося с PD-1, имеющего VH, содержащую любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5, и VL, содержащую аминокислотную последовательность SEQ ID NO:25.
[10-3] Выделенное моноклональное антитело или фрагмент антитела против PD-1, имеющего любую одну VH, выбранную из:
(A) VH, имеющей:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:6,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:7, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:8,
(B) VH, имеющей:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:9,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:10, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:11,
(C) VH, имеющей:
(a) VH-CDR1 содержащее аминокислотную последовательность SEQ ID NO:12,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:13, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:14,
(D) VH, имеющей:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:15,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:16, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:17, и
(E) VH, имеющей:
(a) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:18,
(b) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:19, и
(c) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:20, и VL, имеющая:
(a) VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:26,
(b) VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:27, и
(c) VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:28.
[10-4] Выделенное моноклональное антитело или фрагмент антитела против PD-1 по предыдущему пункту [10-3], где произвольный аминокислотный остаток (от одного до пяти остатков) в любой одной или более CDR, выбранную из VH-CDR1, VH-CDR2 и VH-CDR3 можно заменить другой аминокислотой (аминокислотами) (предпочтительно, консервативной аминокислотой (аминокислотами)).
[10-5] Выделенное моноклональное антитело или фрагмент антитела против PD-1 по предыдущему пункту [10-3] или [10-4], имеющего VH, содержащую любую аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5, или VH, содержащую аминокислотную последовательность, имеющую по меньшей мере 80%, 90%, 95%, 98% или 99% идентичность его аминокислотной последовательности, и VL, содержащую аминокислотную последовательность SEQ ID NO:25.
[10-6] Выделенное моноклональное антитело или фрагмент антитела против PD-1 по любому из предыдущих пунктов [10-1]-[10-5], где PD-1 представляет собой человеческий PD-1.
[10-7] Выделенное моноклональное антитело или фрагмент антитела против PD-1 по любому из предыдущих пунктов [10-1]-[10-6], где антитело против PD-1 представляет собой IgG антитело.
[10-8] Выделенное моноклональное антитело или фрагмент антитела против PD-1 по предыдущему пункту [10-7], где IgG антитело, описанное в предыдущем пункте [10-7], представляет собой IgG1 антитело или IgG4 антитело.
[10-9] Выделенное моноклональное антитело или фрагмент антитела против PD-1 по предыдущему пункту [10-7], где IgG антитело, описанное в предыдущем пункте [10-7], представляет собой IgG1 антитело.
[10-10] Выделенное моноклональное антитело или фрагмент антитела против PD-1 по предыдущему пункту [10-7], где IgG антитело, описанное в предыдущем пункте [10-7], представляет собой IgG4 антитело.
Результаты изобретения
[0012] Поскольку индуцируемость выработки цитокина PD-1/CD3 биспецифическим антителом по настоящему изобретению уменьшена, то возникновение инфузионной реакции или синдрома высвобождения цитокинов после введения уменьшено. Кроме того, биспецифическое антитело против PD-1/CD3 обеспечивает взаимодействие между PD-1 и PD-L1, и как ожидается усиливает или поддерживает воздействие на предотвращение, подавление симптомов прогрессирования или рецидива аутоиммунного заболевания и/или его лечение.
Краткое Описание Чертежей
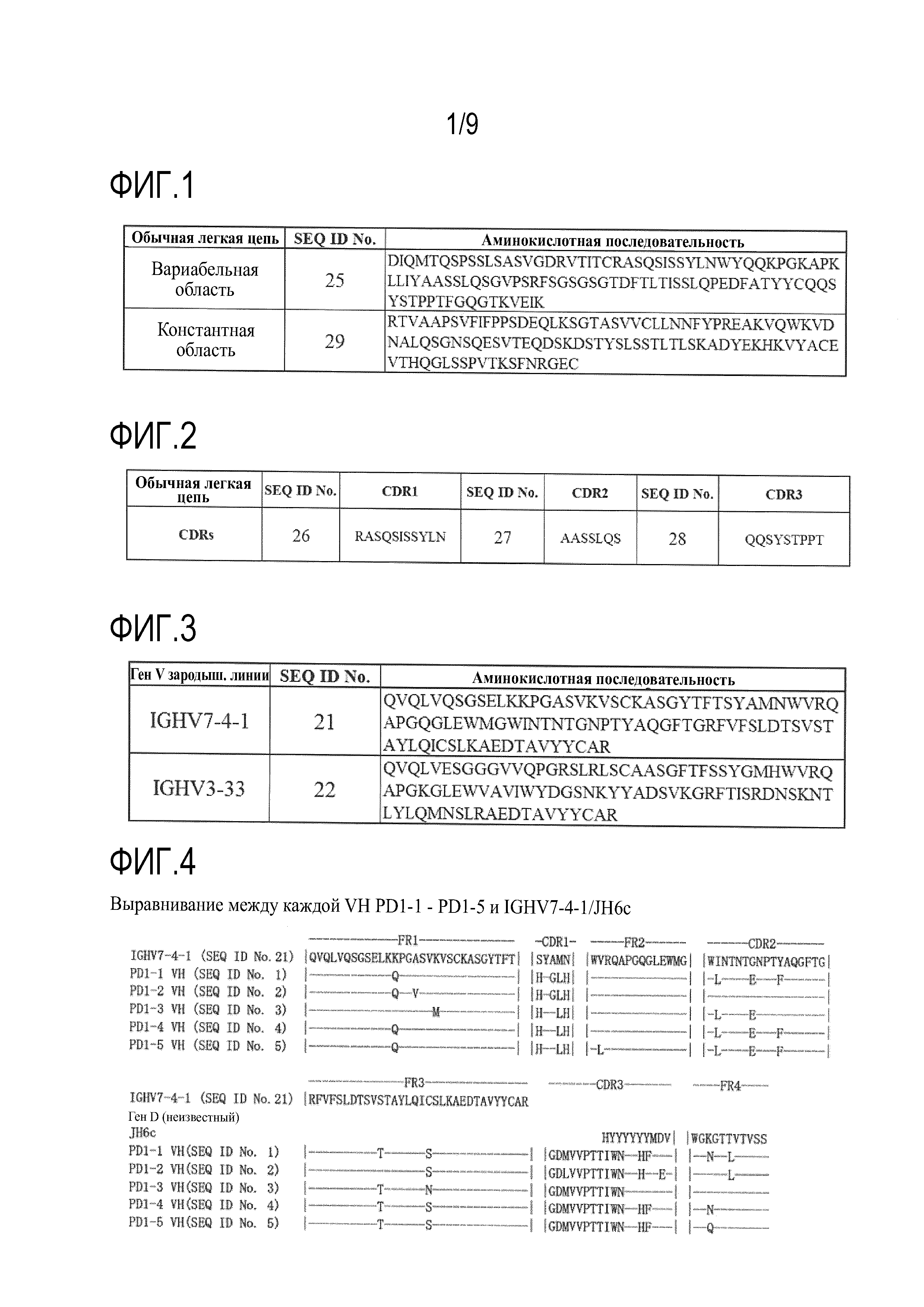
[0013] На фиг.1 представлена каждая аминокислотная последовательность VL и константной области обычной легкой цепи.
На фиг.2 представлена аминокислотная последовательность каждой CDR в VL обычной легкой цепи.
На фиг.3 представлены аминокислотные последовательности, кодируетсяные генами: IGHV7-4-1 и IGHV3-33 зародышевой линии V, соответственно.
На фиг.4 представлено выравнивание последовательности среди VH каждого клона антител, специфически связывающихся с PD-1 (которые в настоящем документе могут сокращенно называться «антитело против PD-1»), и генов IGHV7-4-1 и JH6c зародышевой линии. На чертеже в аминокислотной последовательности каждого клона «-» представляет ту же аминокислоту, что и аминокислота соответствующего гена IGHV7-4-1 или JH6c зародышевой линии, и часть с упрощенными символами каждой аминокислоты представляет аминокислоту, отличающуюся от аминокислоты гена зародышевой линии.
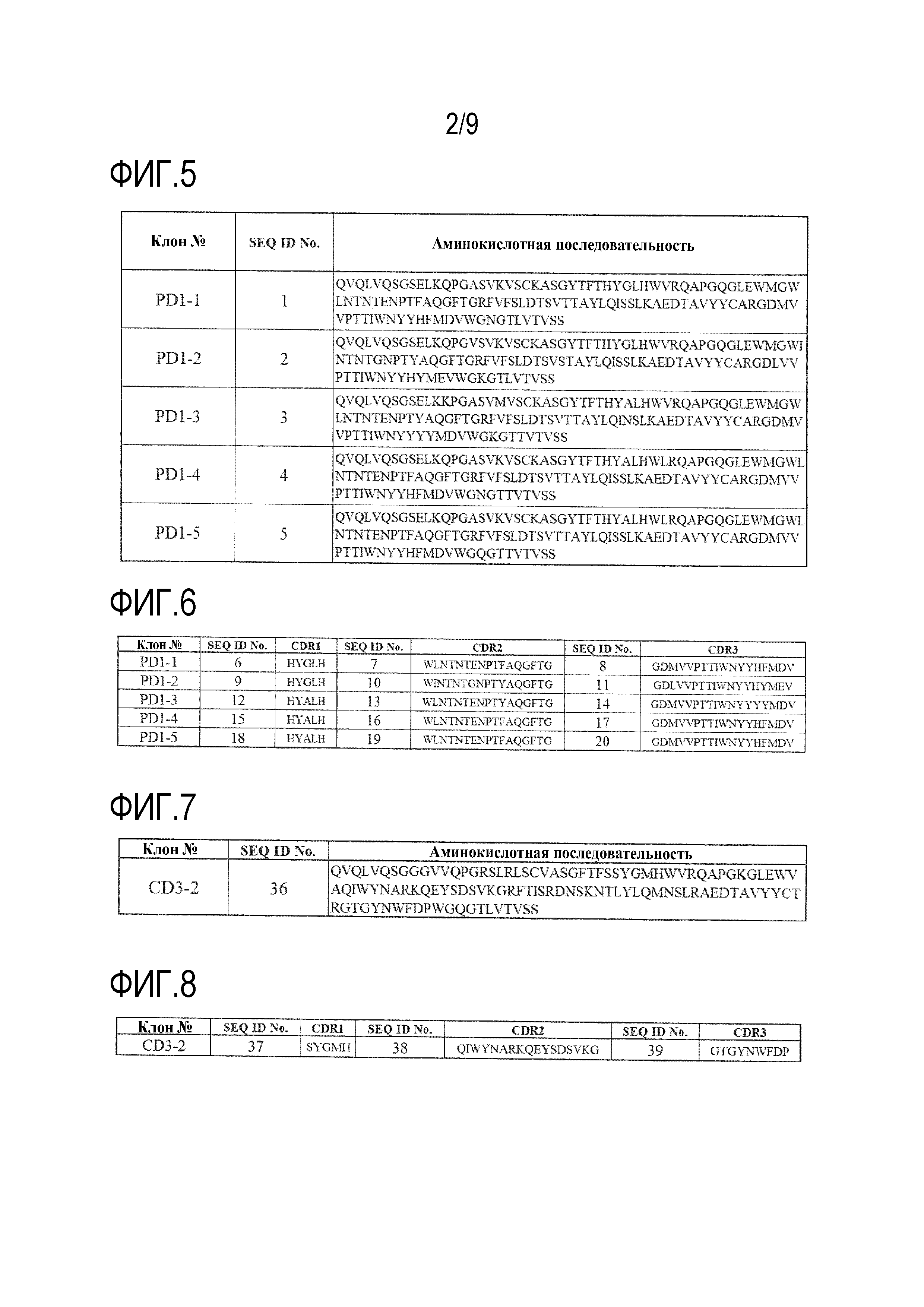
На фиг.5 представлена аминокислотная последовательность VH каждого клона антитела против PD-1.
На фиг.6 представлена аминокислотная последовательность каждой CDR в VH каждого клона антитела против PD-1.
На фиг.7 представлена аминокислотная последовательность VH клона CD3-2 в виде антитела, специфически связывающегося с CD3 (которое в настоящем документе может быть сокращено обозначена как «антитело против CD3»).
На фиг.8 представлена аминокислотная последовательность каждой CDR в VH клона CD3-2 в виде антитела против CD3.
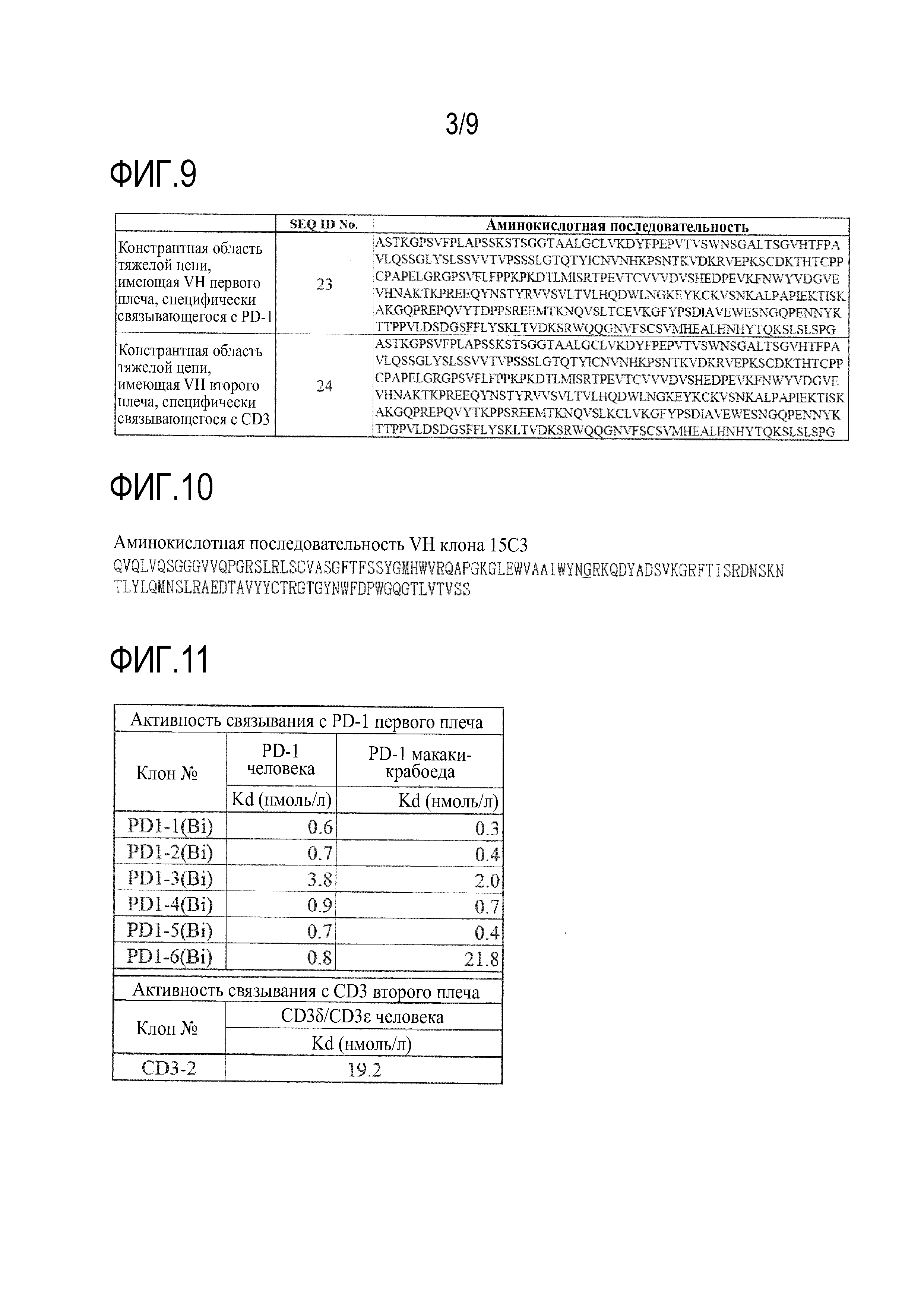
На фиг.9 представлена аминокислотная последовательность константной области в каждой тяжелой цепи биспецифического моноклонального антитела против PD-1/CD3.
На фиг.10 представлена аминокислотная последовательность VH клона 15C3 антитела против CD3, описанного в WO2005/118635. Здесь следует заметить, что подчеркнутая аминокислота представляет 55-ый глицин, который преобразуется в аланин при получении клона CD3-1.
На фиг.11 представлены результаты измерения Biacore, демонстрирующие активность связывания с PD-1 и CD3 каждого клона биспецифического моноклонального антитела против PD-1/CD3.
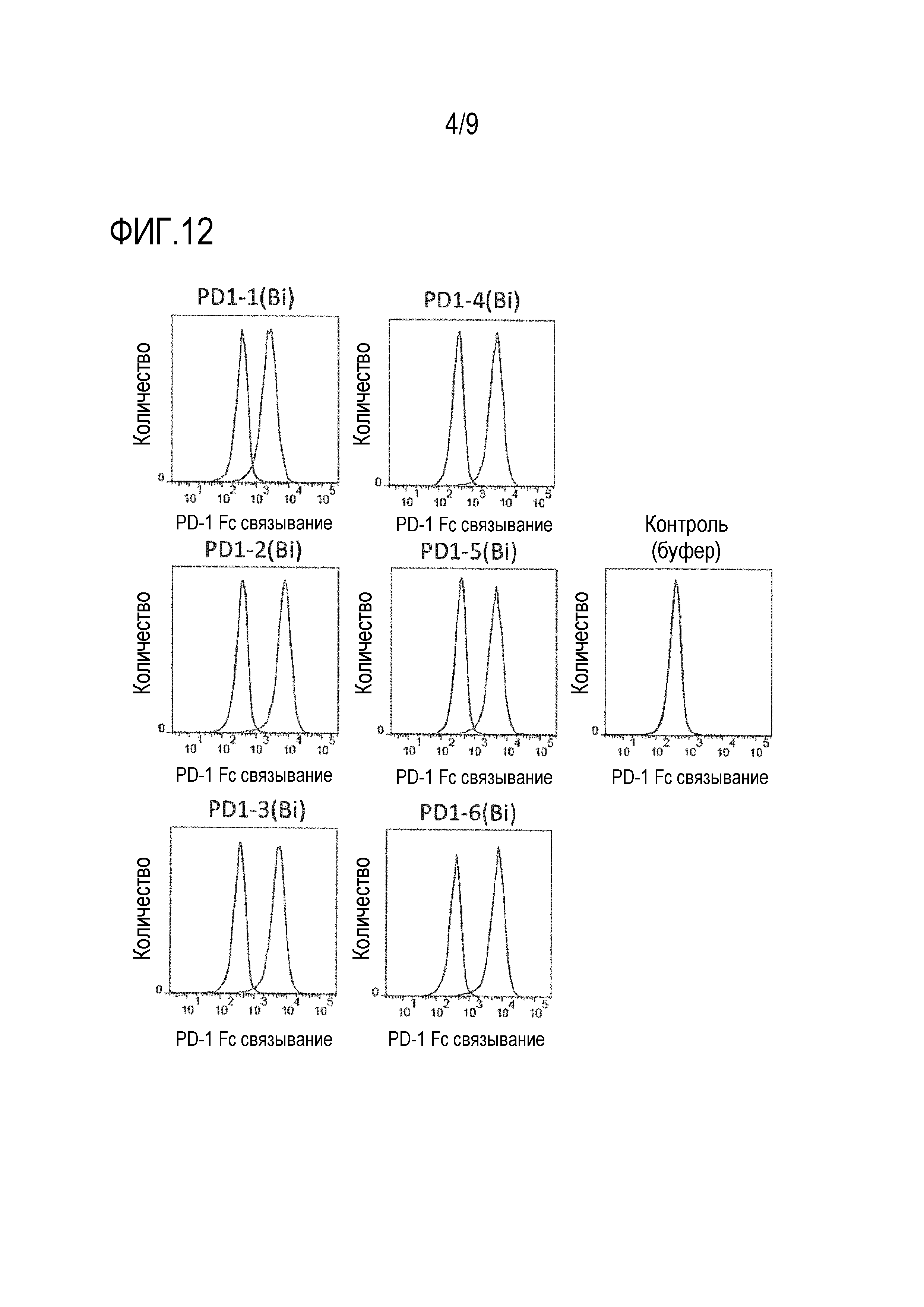
На фиг.12 показана проточная цитометрия, демонстрирующая свойство одновременного связывания с PD-1 и CD3 каждого клона биспецифического моноклонального антитела против PD-1/CD3.
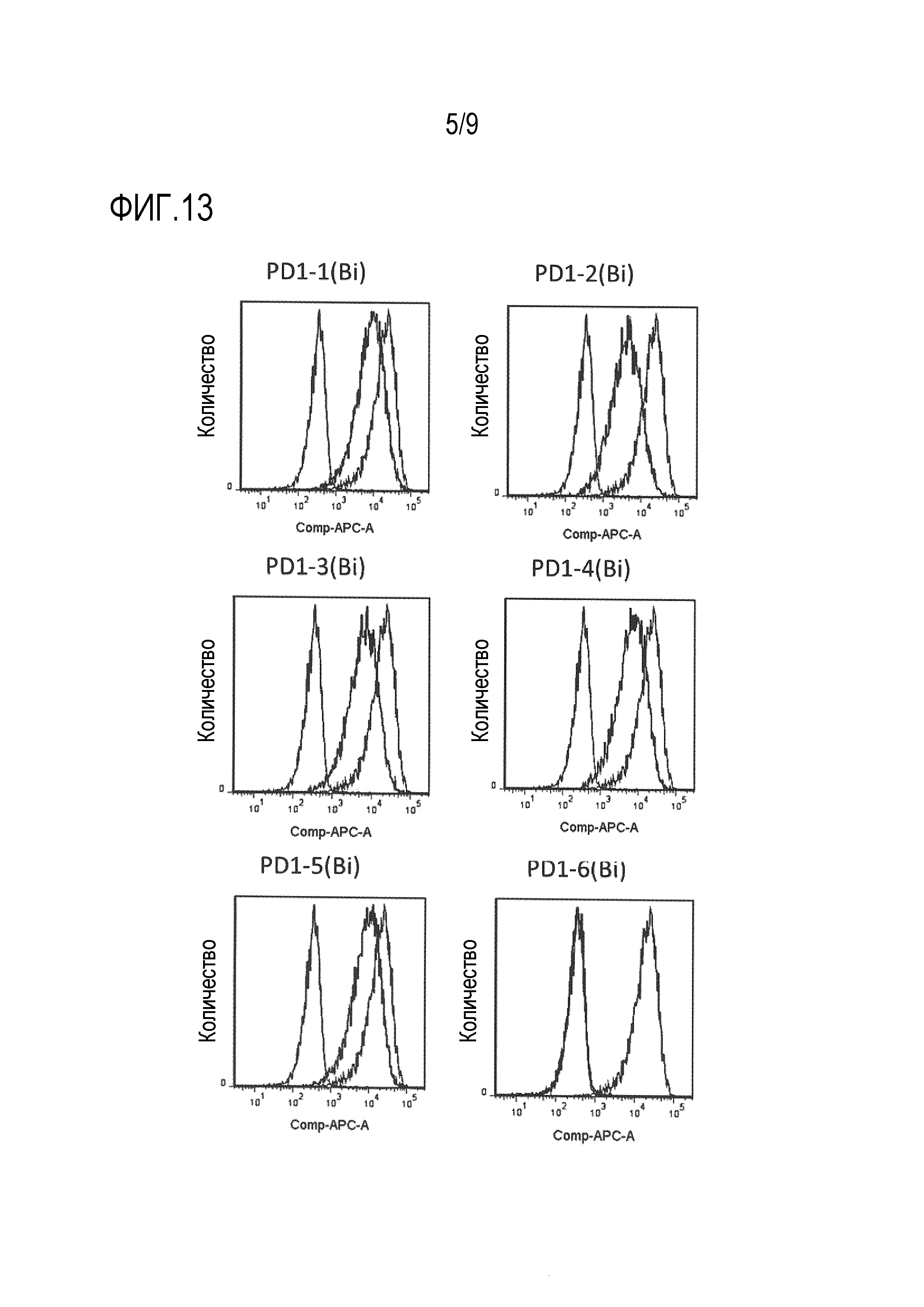
На фиг.13 показана проточная цитометрия, демонстрирующая влияние на взаимодействие с PD-1/PD-L1 каждого клона биспецифического моноклонального антитела против PD-1/CD3.
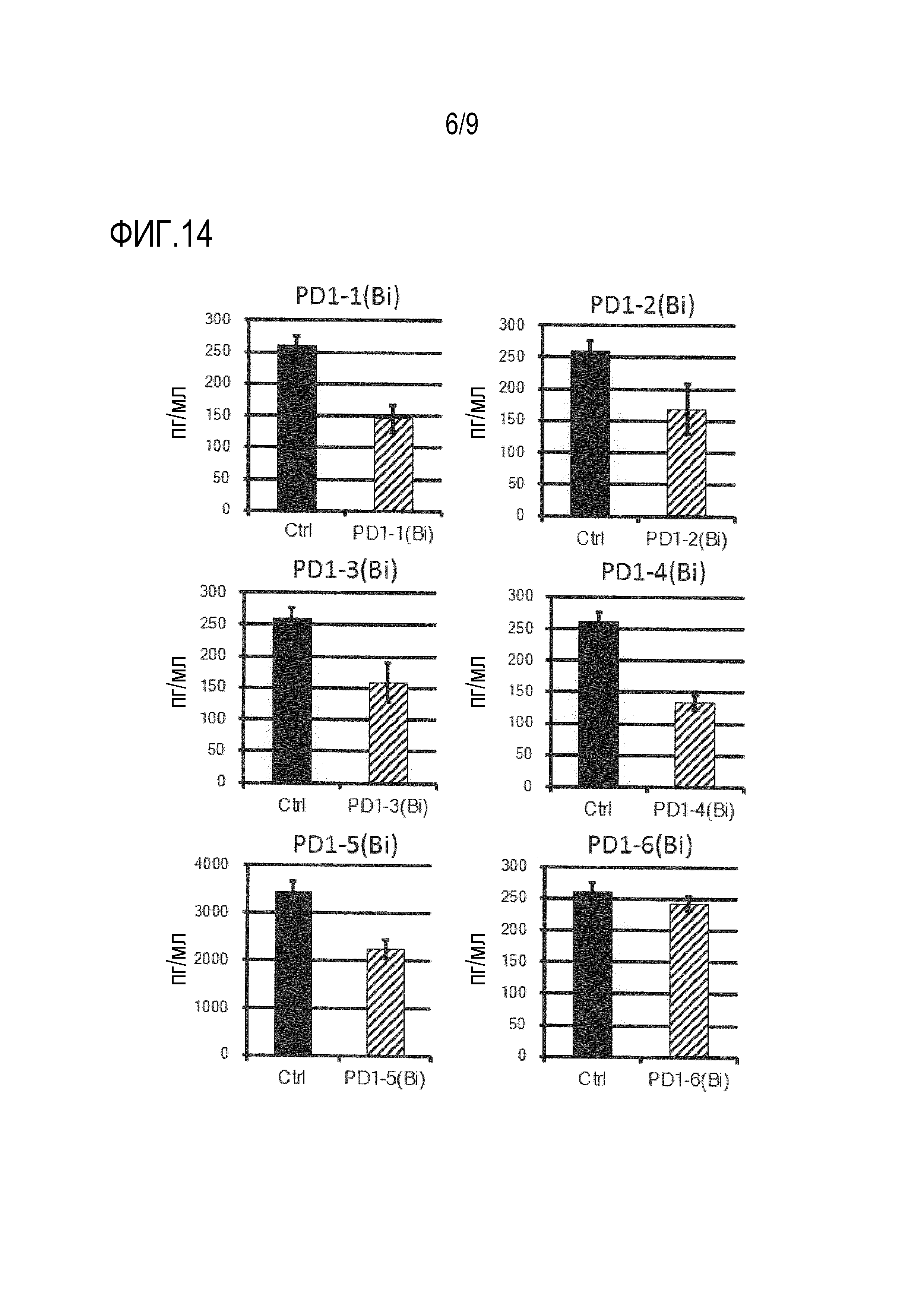
На фиг.14 представлено влияние на выработку IFN-γ в активированных T-клетках человека каждого клона биспецифического моноклонального антитела против PD-1/CD3. Здесь следует заметить, что на чертеже «Ctrl» представляет контрольную группу.
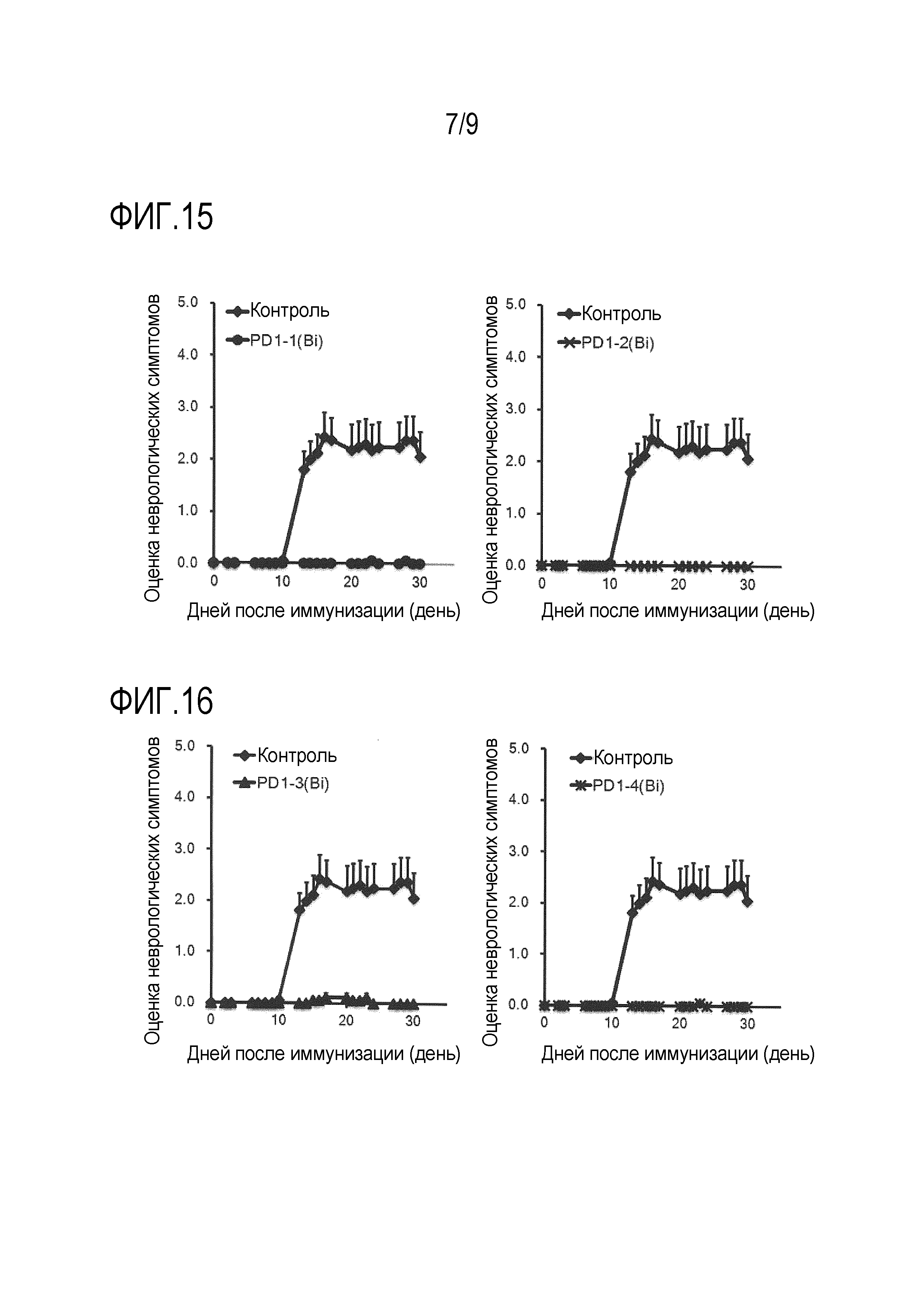
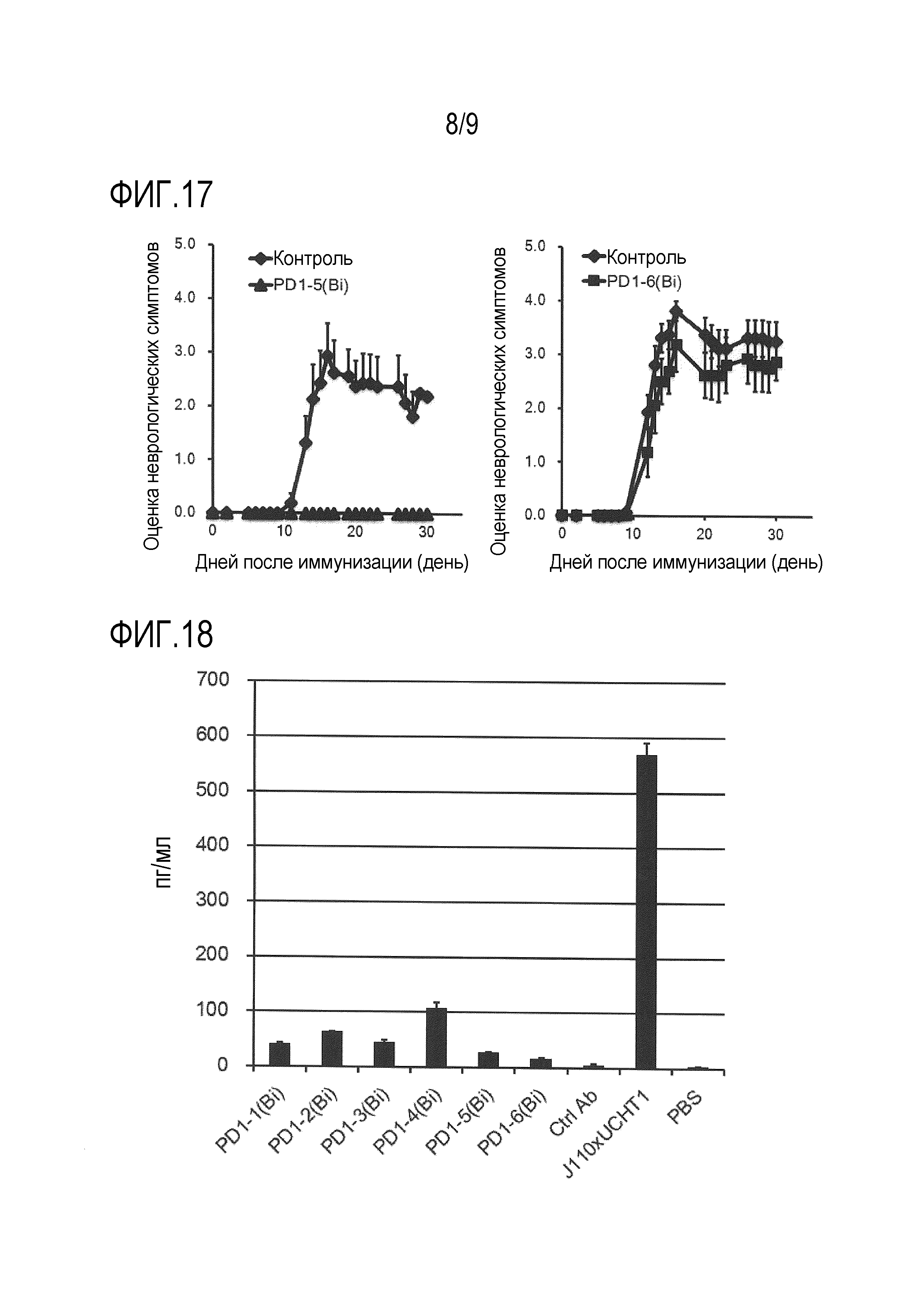
На фиг. 15 представлено терапевтическое действие клонов биспецифического моноклонального антитела против PD-1/CD3 (PD1-1(Bi) и PD1-2(Bi)) в экспериментальной мышиной модели аллергического энцефаломиелита (EAE модели).
На фиг. 16 представлено терапевтическое действие клонов биспецифического моноклонального антитела против PD-1/CD3 (PD1-3(Bi) и PD1-4(Bi)) в экспериментальной мышиной модели аллергического энцефаломиелита.
На фиг. 17 представлено терапевтическое действие клонов биспецифического моноклонального антитела против PD-1/CD3 (PD1-5(Bi) и PD1-6(Bi)) в экспериментальной мышиной модели аллергического энцефаломиелита.
На фиг. 18 представлены результаты воздействия на выработку цитокина в человеческой мононуклеарной клетке периферической крови каждого клона биспецифического моноклонального антитела против PD-1/CD3.
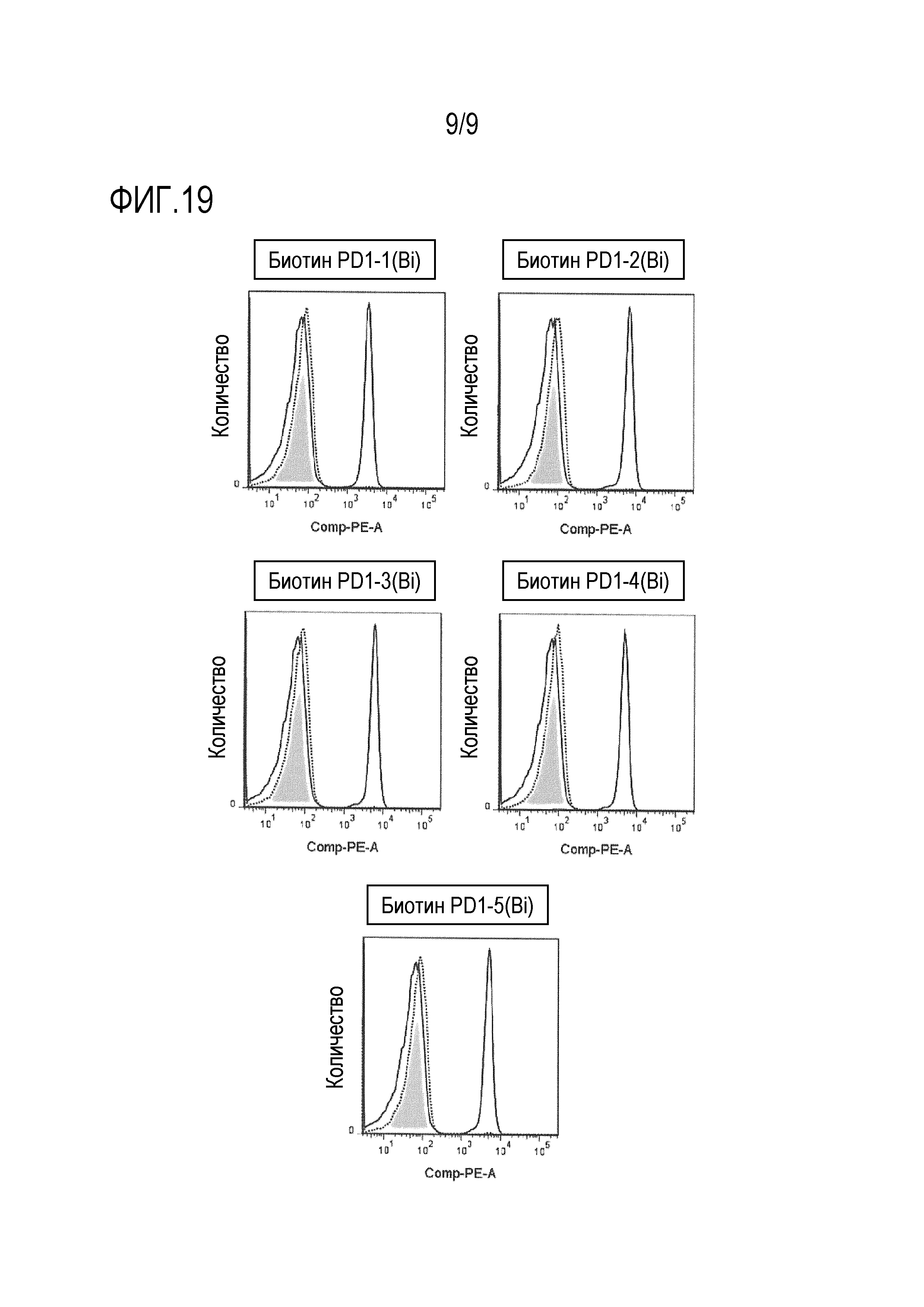
На фиг. 19 представлена перекрестная конкурентная активность PD1-5(Bi) против связывания с PD-1 каждого клона биспецифического моноклонального антитела против PD-1/CD3.
Описание вариантов осуществления
[0014] PD-1 (белок запрограммированной гибели клеток-1) человека представляет собой белок мембранного типа, состоящий из аминокислотной последовательности, представленной номером доступа в GenBank NP_005009. В настоящем описании термин «PD-1», если специально не указано иное, можно использовать в значении, включающем в себя все его изоформы, и его варианты, в которых сохранены эпитопы для «первого плеча, специфически связывающегося с PD-1» в настоящем изобретении. В настоящем изобретении PD-1 предпочтительно является человеческий PD-1.
[0015] CD3 представляет собой белок мембранного типа, который образует Т-клеточный рецепторный комплекс путем связывания с T-клеточным рецептором. В настоящем описании термин «CD3», если специально не указано иное, можно использовать в значении, включающем в себя подтип (подтип ε, δ, γ и ζ) и его варианты, в котором сохранены эпитопы для «второго плеча, специфически связывающегося с CD3», по настоящему изобретению. В настоящем изобретении CD3 представляет собой предпочтительно CD3ε и человеческий CD3, а более предпочтительно человеческий CD3ε.
[0016] В настоящем описании термин «выделить» означает, что отдельный по существу чистый компонент получают путем идентификации, отделения и/или очистки от примесей, включая множество или большое число компонентов, извлекаемых из клетки-хозяина.
[0017] В настоящем описании термин «моноклональное антитело» означает антитело, полученное из группы по существу однородных антител, связывающихся с одним и тем же специфическим антигеном.
[0018] В этом описании термин «биспецифическое антитело» означает антитело, обладающее специфичностью связывания с двумя разными молекулами антигенов или эпитопами в молекуле. Кроме того, термин «биспецифическое моноклональное антитело» означает биспецифическое антитело, полученное из группы по существу однородных антител.
[0019] Настоящее изобретение относится к биспецифическому антителу, способному специфически связываться с PD-1 и CD3 (в настоящем описании может быть сокращено обозначена как «биспецифическое антитело против PD-1/CD3»). В настоящем изобретении биспецифическое антитело против PD-1/CD3 представляет собой предпочтительно биспецифическое моноклональное антитело против PD-1/CD3, а более предпочтительно выделенное биспецифическое моноклональное антитело против PD-1/CD3 и еще более предпочтительно выделенное биспецифическое моноклональное антитело против человеческого PD-1/человеческого CD3. В настоящем документе «выделенное биспецифическое моноклональное антитело против человеческого PD-1/человеческого CD3» означает выделенное биспецифическое моноклональное антитело для человеческого PD-1 и человеческого CD3.
[0020] Примеры вариантов осуществления биспецифического антитела против PD-1 включают в себя, например, диатела, биспецифические sc(Fv)2, биспецифические миниантитела, биспецифические F(ab')2, биспецифические гибридные антитела, ковалентные диатела (биспецифические DART), биспецифические (FvCys)2, биспецифические F(ab'-zipper)2, биспецифические (Fv-zipper)2, биспецифические трехцепочечные антитела и биспецифические mAb2 и тому подобное.
[0021] Диатело представляет собой димер одноцепочечных пептидов, в котором VH и VL, распознающие разные антигены, связаны друг с другом пептидным линкером (Proc. Natl. Acad. Sci. USA, 1993, Vol. 90, № 14, pp. 6444-6448).
[0022] Биспецифическое sc(Fv)2 представляет собой низкомолекулярное антитело, модифицированное таким образом, что две пары VH/VL в двух антителах, распознающих разные антигены, связаны друг с другом пептидным линкером в непрерывную одноцепочечную форму (см. J. Biological Chemistry, 1994, 269: pp. 199-206).
[0023] Биспецифическое F(ab')2 представляет собой низкомолекулярное антитело, в котором Fab'-фрагменты антител, распознающих два разных антигена, ковалентно связаны, например, посредством дисульфидной связи.
[0024] Биспецифическое миниантитело представляет собой низкомолекулярное антитело, в котором низкомолекулярные фрагменты антител, модифицированные таким образом, что CH3 домены константной области антител связаны с scFv, распознающими разные антигены, ковалентно связаны, например, дисульфидными связями на CH3 доменах (см. Biochemistry, 1992, Vo. 31, No.6, pp. 1579-1584).
[0025] Биспецифическое гибридное антитело представляет собой интактное антитело, в котором комплексы тяжелая цепь/легкая цепь, распознающие два разных антигена, ковалентно связаны друг с другом, например, дисульфидной связью.
[0026] В настоящем изобретении примеры формы предпочтительного биспецифического антитела включают в себя биспецифическое гибридное антитело.
[0027] Биспецифическое гибридное антитело можно получить, например, из гибридомы с использованием метода межвидовой гибридомы (см. US4474893). Альтернативно, биспецифическое гибридное антитело можно получить путем секреции из клетки млекопитающего животного, совместно экспрессирующей четыре типа кДНК, соответственно, кодирующих тяжелую цепь и легкую цепь антител, распознающих разные антигены.
[0028] Моноклональные антитела, используемые в настоящем изобретении, можно получить с помощью гибридомного метода (см. Например, Kohler and Milstein et al. Natur (1975), Vol. 256, p.495-97, Hongo et al. Hybridoma (1995), Vol. 14, No. 3, pp.253-260, Harlow et al. Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press (1988), Vol. 2) и Hammerling et al. Monoclonal Antibodies and T-Cell Hybridomas, pp.563-681 (Elsevier, N.Y. 1981)), метода рекомбинантной ДНК (см. Например, US4816567), метода фагового дисплея (см. Например, Ladner et al. US5223409, US5403484 и US5571698, Dower et al. US5427908 и US5580717, McCafferty et al. US5969108 и US6172197, и Griffiths et al. US5885793, US6521404, US6544731, US6555313, US6582915 и US6593081).
[0029] Антитело или моноклональное антитело при введении человеку можно получить в форме химерного антитела, гуманизированного антитела или полного человеческого антитела, чтобы уменьшить или устранить его антигенность.
[0030] Термин «химерное антитело» означает антитело, последовательность константной области и последовательность вариабельной области которого получены у другого млекопитающего. Примеры химерного антитела включают в себя антитело, последовательность вариабельной области которого получена из мышиного антитела, а последовательность константной области получена из человеческого антитела. Химерное антитело можно получить путем связывания гена, кодирующего вариабельную область антитела, выделенного из вышеупомянутой продуцирующей антитела гибридомы, выделенной с помощью гибридомного метода, метода рекомбинантной ДНК или метода фагового дисплея с помощью хорошо известных методик, с геном, кодирующим константную область антитела человеческого происхождения с использованием хорошо известного способа (см., например, Cabilly et al. US4816567).
[0031] Термин «гуманизированное антитело» означает антитело, полученное, например, путем трансплантации последовательности определяющей комплементарность области (CDR) антитела, полученного из зародышевой линии млекопитающего, не являющегося человеком, такого как мышь, в человеческие каркасные последовательности человеческого антитела. Также гуманизированное антитело можно получить путем связывания генов, кодирующих CDR области антитела, выделенного из вышеупомянутой продуцирующей антитела гибридомы, выделенной с помощью вышеупомянутого метода, с геном, кодирующим каркасную область антитела человеческого происхождения с использованием хорошо известного способа (см., например, Winter, US5225539 и US5530101; Queen et al. US5585089 и US6180370.
[0032] Термин «антитело человека» или «полное человеческое антитело» означает антитело, в котором как вариабельная область, состоящая из каркасных областей и CDR областей, так и константная область получены из последовательностей иммуноглобулина зародышевой линии человека. человеческое антитело, подлежащее использованию в настоящем изобретении, можно получить с помощью способа с использованием мыши, трансформированной для получения человеческих антител, например, мыши Humab (см. Например, Lonberg и Kay et al. US5545806, US5569825, US5625126, US5633425, US5789650, US5877397, US5661016, US5814318, US5874299 и US5770429), мыши KM (см. Например, Ishida et al. WO2002/43478), мыши Xeno (см. Например, US5939598, US6075181, US6114598, US6150584 и US6162963) или мыши Tc (см. Например, Tomizuka et al. Proc. Natl. Acad. Sci. USA (2000), pp.722-727). человеческое антитело также можно получить с использованием мышей SCID, которым трансплантировали человеческие иммунные клетки таким образом, что при иммунизации происходит ответ человеческих антител (см. Например, US5476996 и US5698767 to Wilson et al). Кроме того, человеческое антитело, используемое в настоящем изобретении, также можно получить с помощью вышеупомянутого метода фагового дисплея.
[0033] В настоящем описании термин «фрагмент антитела» биспецифического антитела против PD-1/CD3 является частью полноразмерного антитела и является антителом, имеющим антигенсвязывающую часть против PD-1 и антигенсвязывающую часть против CD3. Его примеры включают в себя F(ab′)2 и тому подобное. В настоящем документе антигенсвязывающая часть означает минимальную единицу антитела, которая может связываться с его антигеном, и, например, она состоит из трех CDR в каждой из VH и VL и каркасных областей для выстраивания CDR таким образом, чтобы антиген-мишень можно было распознавать с помощью комбинации этих CDR.
[0034] В настоящем описании термин «общая легкая цепь» означает легкую цепь, которую можно связать с двумя или более разными тяжелыми цепями, и которая может проявлять способность связывания с каждым антигеном (De Wildt RM, J. Mol. Biol. (1999), Vol. 285, pp.895-901, De Kruif et al. J. Mol. Biol. (2009), Vol. 387, pp.548-58, WO2004/009618, WO2009/157771 и WO2014/051433). Предпочтительные примеры такой обычной легкой цепи включают в себя легкую цепь, кодируемую ген зародышевой линии человеческой легкой цепи κ IgVκ1-39*01/IGJκ1*01 (номенклатуры базы данных IМGT) (в настоящем документе, сокращенно «общая легкая цепь IGVK1-39/JK1»). Более предпочтительные примеры включают в себя легкую цепь, содержащую VL, имеющую CDR1, содержащую аминокислотную последовательность SEQ ID NO:26, CDR2, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR3, содержащую аминокислотную последовательность SEQ ID NO:28, и еще более предпочтительные примеры включают в себя легкую цепь, содержащую VL, содержащую аминокислотную последовательность SEQ ID NO:25. Кроме того, предпочтительные примеры константной области обычной легкой цепи включают в себя константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:29. Каждая аминокислотная последовательность VL и константной области обычной легкой цепи, используемых в настоящем изобретении, показана на фиг. 1 представлен, а аминокислотная последовательность каждой CDR вариабельной области показана на фиг. 2.
[0035] В настоящем описании термин «изотип» означает класс антитела (например, IgM или IgG), которое кодируетсяо генами константной области тяжелой цепи. Предпочтительные примеры изотипа для биспецифического антитела против PD-1/CD3 по настоящему изобретению включают в себя IgG, а более предпочтительно, IgG1 или IgG4. Предпочтительным является используемый в данном документе IgG1, связывание которого с Fc-рецептором устранено или уменьшено. Конкретно, IgG1 антитело, связывание которого с Fc-рецептором устранено или уменьшено, можно получить путем замены, делеции или вставки произвольной аминокислоты константной области тяжелой цепи. Его примеры включают в себя антитело, в котором лейцин в позиции 235 согласно системе нумерации ЕС заменен глицином, и/или глицин в позиции 236 согласно системе нумерации ЕС заменен аргинином в каждой из двух константных областей тяжелых цепей или шарнирной области. Кроме того, чтобы уменьшить гетерогенность антитела, предпочтительным является антитело, в котором была удалена аминокислота на С-конце, например, лизин в позиции 447 согласно системе нумерации ЕС. Кроме того, когда биспецифическое антитело представляет собой IgG4, для запрета перестановки в молекуле антитела предпочтительным является вариант, в котором заменяют, удаляют или вставляют произвольную аминокислоту в константной области его тяжелой цепи. Например, предпочтительным является антитело, у которого серин, находящийся в шарнирной области и в позиции 228 согласно системе нумерации ЕС, заменен пролином. Здесь следует заметить, что в описании позиции аминокислот, предназначенных для CDR и каркасов в вариабельной области антитела, указаны согласно нумерации Kabat (см. Sequences of Proteins of Immunological Interest (National Institute of Health, Bethesda, Md. 1987 and 1991)). Кроме того, аминокислоты в константной области представлены согласно системе нумерации ЕС на основе позиций аминокислот по Kabat (см. Sequences of proteins of immunological interest, NIH Publication No. 91-3242).
[0036] В Fc-областях биспецифического антитела против PD-1/CD3 по настоящему изобретению произвольные аминокислоты в них можно заменить таким образом, чтобы две разные тяжелые цепи легко связывались друг с другом. Примеры предпочтительных вариантов осуществления включают в себя биспецифическое антитело против PD-1/CD3, у которого в константной области тяжелой цепи, имеющей VH первого плеча, специфически связывающегося с PD-1, лейцин в позиции 351 согласно системе нумерации ЕС заменен лизином, а треонин в позиции 366 согласно системе нумерации ЕС заменен лизином; и у которого в константной области тяжелой цепи, имеющей VH второго плеча, специфически связывающегося с CD3, лейцин в позиции 351 согласно системе нумерации ЕС заменен аспарагиновой кислотой, а лейцин в позиции 368 согласно системе нумерации ЕС заменен глутаминовой кислотой. Примеры также включают в себя биспецифическое антитело против PD-1/CD3, у которого в константной области в тяжелой цепи, имеющей VH первого плеча, специфически связывающегося с PD-1, лейцин в позиции 351 согласно системе нумерации ЕС заменен аспарагиновой кислотой, а лейцин в позиции 368 заменен глутаминовой кислотой; и у которого в константной области в тяжелой цепи, имеющей VH второго плеча, специфически связывающегося с CD3, лейцин в позиции 351 согласно системе нумерации ЕС заменен лизином, а треонин в позиции 366 согласно системе нумерации ЕС заменен лизином.
[0037] Первое плечо, специфически связывающееся с PD-1
В настоящем описании «первое плечо, специфически связывающееся с PD-1» (которое в настоящем документе может быть сокращено обозначена как «первое плечо»), означает часть антитела, содержащую по меньшей мере VH антитела, специфически связывающуюся с PD-1 (которое в настоящем документе может быть сокращено обозначена как «антитело против PD-1»), независимо от того, содержится ли оно в части антитела или фрагменте антитела, или существует не как часть, но как отдельное тело. Например, такое первое плечо состоит из VH антитела против PD-1 и VL обычной легкой цепи, составляющей то же антитело против PD-1. Кроме того, примеры первого плеча также включают в себя Fab-часть антитела, содержащую VH и VL. В настоящем документе термин «специфически связывающееся с PD-1» используют в качестве признака, что оно может связываться непосредственно с PD-1 с активностью связывания, составляющей аффинность по меньшей мере 1×10-5 M, предпочтительно 1×10-7 M, и более предпочтительно более чем 1×10-9 M (константа диссоциации (значение Kd)), и по существу не связывается с другими рецепторными элементами, относящимися к так называемому рецептору семейства CD28, например, по меньшей мере, CD28, CTLA-4 и ICOS. Кроме того, «антитело» в «антитело, специфически связывающееся с PD-1» или в «антитело против PD-1» означает полноразмерное антитело, состоящее из двух тяжелых цепей и двух легких цепей, связанных дисульфидными связями, и предпочтительно моноклональное антитело.
[0038] В настоящем документе примеры «первого плеча, специфически связывающегося с PD-1» включают в себя:
(a) VH-CDR1, содержащую аминокислотную последовательность HYJ1LH [где J1 представляет G (глицин) или (аланин), и в настоящем документе буквенные обозначения, представленные J1 или по-другому, представляют однобуквенное сокращение аминокислоты, соответственно];
(b) VH-CDR2, содержащую аминокислотную последовательность WJ2NTNTU2NPTX2AQGFTG [где J2 представляет L (лейцин) или I (изолейцин), U2 представляет E (глутаминовая кислота) или G (глицин), X2 представляет F (фенилаланин) или Y (тирозин), и в настоящем документе буквенные обозначения, представленные J2, U2 или X2 или по-другому, представляют, соответственно, то же, что и выше]; и
(c) VH-CDR3, содержащую аминокислотную последовательность GDJ3VVPTTIWNYYU3X3MZ3V [где J3 представляет M (метионин) или L (лейцин), U3 представляет H (гистидин) или Y (тирозин), X3 представляет F (фенилаланин) или Y (тирозин), Z3 представляет D (аспарагиновая кислота) или E (глутаминовая кислота), и в настоящем документе буквенные обозначения, представленные J3, U3, X3 или Z3 или другие буквенные обозначения представляют, соответственно, то же, что и выше].
[0039] В настоящем документе предпочтительные варианты осуществления «первого плеча, специфически связывающегося с PD-1» включают в себя варианты, содержащие:
(1a) VH, имеющую каждую VH-CDR, в которой J1 в последовательности HYJ1LH в виде VH-CDR1 представляет G (глицин); в WJ2NTNTU2NPTX2AQGFTG в виде VH-CDR2 J2 представляет L (лейцин), U2 представляет E (глутаминовая кислота), а X2 представляет F (фенилаланин), соответственно; в последовательности GDJ3VVPTTIWNYYU3X3MZ3V в виде VH-CDR3 J3 представляет M (метионин), U3 представляет H (гистидин), X3 представляет F (фенилаланин), а Z3 представляет D (аспарагиновая кислота), соответственно;
(2a) VH, имеющую каждую VH-CDR, в которой J1 в последовательности HYJ1LH в виде VH-CDR1 представляет G (глицин); в WJ2NTNTU2NPTX2AQGFTG в виде VH-CDR2 J2 представляет I (изолейцин), U2 представляет G (глицин), а X2 представляет Y (тирозин), соответственно; в последовательности GDJ3VVPTTIWNYYU3X3MZ3V в виде VH-CDR3 J3 представляет L (лейцин), U3 представляет H (гистидин), X3 представляет Y (тирозин), а Z3 представляет E (глутаминовая кислота), соответственно;
(3a) VH, имеющую каждую VH-CDR, в которой J1 в последовательности HYJ1LH в виде VH-CDR1 представляет A (аланин); в WJ2NTNTU2NPTX2AQGFTG в виде VH-CDR2 J2 представляет L (лейцин), U2 представляет E (глутаминовая кислота), а X2 представляет Y (тирозин), соответственно; в последовательности GDJ3VVPTTIWNYYU3X3MZ3V в виде VH-CDR3 J3 представляет M (метионин), U3 представляет Y (тирозин), X3 представляет Y (тирозин), а Z3 представляет D (аспарагиновая кислота), соответственно; и
(4a) VH, имеющую каждую VH-CDR, в которой J1 в последовательности HYJ1LH в виде VH-CDR1 представляет A (аланин); в WJ2NTNTU2NPTX2AQGFTG в виде VH-CDR2 J2 представляет L (лейцин), U2 представляет E (глутаминовая кислота), а X2 представляет F (фенилаланин), соответственно; J3 представляет M (метионин), U3 представляет H (гистидин), в последовательности GDJ3VVPTTIWNYYU3X3MZ3V в виде VH-CDR3 X3 представляет F (фенилаланин), а Z3 представляет D (аспарагиновая кислота), соответственно.
[0040] Кроме того, в виде предпочтительных примеров другого варианта осуществления «первое плечо, специфически связывающееся с PD-1», содержит любую одну VH, выбранную из:
(1b) VH, имеющей VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:6, VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:7, и VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:8;
(2b) VH, имеющей VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:9, VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:10, и VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:11;
(3b) VH, имеющей VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:12, VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:13, и VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:14;
(4b) VH, имеющей VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:15, VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:16, и VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:17; и
(5b) VH, имеющей VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:18, VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:19, и VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:20.
[0041] Кроме того, «первое плечо, специфически связывающееся с PD-1» по настоящему изобретению включает в себя те, у которых 1-5 произвольный аминокислотный остаток (остатки) замещен/замещены другой аминокислотой (аминокислотами) (предпочтительно, своей консервативной аминокислотой (аминокислотами) в каждой VH-CDR любой одной из VH, выбранную из вышеупомянутых (1a)-(4a) или (1b)-(5b), и которые имеют по существу ту же активность связывания с PD-1, что и исходное первое плечо без всяких замен аминокислоты (аминокислот). Например, что касается VH-CDR1, один аминокислотный остаток заменен его консервативной аминокислотой. Что касается VH-CDR2 или VH-CDR3, один или два аминокислотных остатка замещен/замещены его консервативной аминокислотой (аминокислотами), соответственно. В настоящем документе замена консервативной аминокислотой означает способность к замене на остаток, имеющий аналогичную боковую цепь. Например, группа аминокислот, имеющих алифатическую боковую цепь, включает в себя глицин, аланин, валин, лейцин и изолейцин; группа аминокислот, имеющих алифатическую гидроксильную боковую цепь, включает в себя серин и треонин; группа аминокислот, имеющих содержащую амид боковую цепь, включает в себя аспарагин и глютамин; группа аминокислот, имеющих ароматическую боковую цепь, включает в себя фенилаланин, тирозин и триптофан; группа аминокислот, имеющих основную боковую цепь, включает в себя лизин, аргинин и гистидин; а группа аминокислот, имеющих содержащую серу боковую цепь, включает в себя цистеин и метионин. Предпочтительные примеры замены консервативной аминокислотой включают в себя замену между валином, лейцином и изолейцином, замену между фенилаланином и тирозином, замену между лизином и аргинином и замену между аланином и валином, а также замену между аспарагином и глютамином. Кроме того, в настоящем документе выражение «которые имеют по существу ту же активность связывания с PD-1, что и исходное первое плечо без всяких замен аминокислоты (аминокислот)», упомянутое выше, означает, что активность связывания с PD-1 первого плеча с заменой одной и той же аминокислотой (аминокислотами) составляет 95% или более, предпочтительно 98% или более, и более предпочтительно 99% или более по сравнению с активностью исходного первого плеча без всяких замен одной и той же аминокислотой (аминокислотами).
[0042] Кроме того, «первое плечо, специфически связывающееся с PD-1» по настоящему изобретению включает в себя плечо, которое содержит VH, имеющее каждую VH-CDR, имеющую вышеупомянутую специфическую аминокислотную последовательность, и в которых каркас VH кодируется специфическим геном зародышевой линии или ее геном с соматической мутацией (мутациями). Например, VH, представленная любой одной, выбранной из вышеупомянутых (1a)-(4a) или (1b)-(5b), может кодирован рекомбинантным геном VDJ, где геном зародышевой линии V является IGHV7-4-1, а геном зародышевой линии J является JH6c или ее геном с соматической мутацией (мутациями). В настоящем документе аминокислотная последовательность, кодируется геном IGHV7-4-1 зародышевой линии V, соответствует аминокислотной последовательности SEQ ID NO:21 (Фиг. 3).
[0043] Каркасы VH первого плеча, специфически связывающегося с PD-1, по настоящему изобретению могут кодированы рекомбинантным геном зародышевой линии VDJ с соматической мутацией (мутациями). Например, поскольку FR1, FR2 и FR3 VH, представленной любой одной, выбранной из вышеупомянутых (1a)-(4a) или (1b)-(5b), у которой геном зародышевой линии V является IGHV7-4-1, отличается от аминокислотной последовательности, кодируется геном IGHV7-4-1, в позиции аминокислоты, показанной на фиг. 4, они подвергаются соматической мутации в каждой из позиций. Например, что касается области FR1, в аминокислотной последовательности SEQ ID NO:21, лизин в позиции 13 можно заменить глютамином, аланин в позиции 16 можно заменить валином, или лизин в позиции 19 можно заменить метионином, соответственно, или их можно заменить в произвольном множестве их комбинаций. Что касается области FR2, валин в позиции 37 в аминокислотной последовательности SEQ ID NO:21, заменен лейцином. Что касается области FR3, в аминокислотной последовательности SEQ ID NO:21, серин в позиции 77 можно заменить треонином, или цистеин в позиции 84 можно заменить серином или аспарагином, соответственно, или их можно заменить в произвольном множестве их комбинаций. Кроме того, что касается области FR4 VH, представленной любой одной, выбранной из вышеупомянутых (1a)-(4a) или (1b)-(5b), в аминокислотной последовательности (Trp-Gly-Lys-Gly-Thr-Thr*-Val-Thr-Val-Ser-Ser) (SEQ ID NO:41) области FR4, полученной из J гена JH6c, лизин (Lys) можно заменить глютамином или аспарагином, и/или треонин (Thr), помеченный звездочкой, можно заменить лейцином. Каждая из FR1, FR2, FR3 и FR4, содержащих комбинацию любой аминокислотной замены (замен), упомянутых выше, не оказывает существенного воздействия на функции первого плеча, специфически связывающегося с PD-1, и их можно использовать в качестве каркасов.
[0044] Кроме того, «первое плечо, специфически связывающееся с PD-1» по настоящему изобретению включает в себя варианты, когда имеют каждую CDR, имеющую приведенную выше аминокислотную последовательность, и у которых аминокислотные последовательности FR в VH кодируются специфическим геном зародышевой линии или ее геном с соматической мутацией (мутациями). Примеры такого первого плеча включают включает в себя варианты, которые имеют VH, содержащую любую аминокислотную последовательность из SEQ ID NO: 1-5.
[0045] Кроме того, примеры такого «первого плеча, специфически связывающегося с PD-1», включают включает в себя варианты, которые имеют VH, содержащую аминокислотную последовательность, имеющую по меньшей мере 80% идентичность, предпочтительно по меньшей мере 90% идентичность, более предпочтительно по меньшей мере 95% идентичность, еще более предпочтительно по меньшей мере 98% идентичность и еще более предпочтительно по меньшей мере 99% идентичность с аминокислотной последовательностью, приведенной в любой одной, выбранной из SEQ ID NO:1-5, и у которых отличие от аминокислотной последовательности VH в исходном первом плече не оказывает существенного воздействия на активность связывания с PD-1 (в настоящем документе, может быть сокращено обозначена как «гомологичное первое плечо»). В настоящем документе термин «% идентичность», используемый при сравнении идентичности аминокислотных последовательностей, определен, как процентное значение аминокислотной последовательности, идентичной эталонной аминокислотной последовательности (в настоящем документе эталонной аминокислотной последовательности, в которой при необходимости сделать идентичность последовательностей максимальной был введен пропуск) при выравнивании двух последовательностей. Кроме того, в настоящем документе выражение «отличие от аминокислотной последовательности VH в исходном первом плече не оказывает существенного воздействия на активность связывания с PD-1» означает, что активность связывания с PD-1 гомологичного первого плеча составляет 95% или более, предпочтительно 98% или более, и более предпочтительно 99% или более к активности связывания исходного первого плеча.
[0046] В еще одном варианте осуществления «первое плечо, специфически связывающееся с PD-1» по настоящему изобретению также включает в себя плечо, которое имеет вариабельную область (в настоящем документе вариабельная область включает в себя составляющие ее VH и VL) антитела против PD-1 и перекрестно-конкурируют (1) за связывание с PD-1 с первым плечом, имеющим VH любой одной, выбранной из вышеупомянутых (1a)-(4a) или (1b)-(5b), или VH, содержащую любую аминокислотную последовательность из SEQ ID NO:1-5, и VL обычной легкой цепи, или (2) за связывание с PD-1 с вариабельной областью моноклонального антитела, специфически связывающегося с PD-1, имеющего одинаковые VH и VL, и кроме того включает в себя варианты, когда имеют вариабельную область антитела против PD-1, где связывание с PD-1 испытывает перекрестную конкуренцию (3) со стороны первого плеча, имеющего VH любой одной, выбранной из вышеупомянутых (1a)-(4a) или (1b)-(5b), или VH, содержащую любую аминокислотную последовательность из SEQ ID NO:1-5, и VL обычной легкой цепи, или (4) со стороны вариабельной области моноклонального антитела, специфически связывающегося с PD-1, имеющего одинаковые VH и VL. В настоящем документе выражение «перекрестная конкуренция за связывание с PD-1» означает, что она подавляет связывание первого плеча с PD-1, независимо от его степени, за счет связывания с эпитопом, который является таким же или частично перекрывает эпитоп первого плеча, приведенного для примера в этом описании, или что связывание с PD-1 антитела, связывающегося с эпитопом, который является таким же или частично перекрывает эпитоп иллюстративного первого плеча, подавляется иллюстративным первым плечом, независимо от его степени. Перекрестную конкуренцию можно оценить с помощью анализа конкурентного связывания. Например, ее можно определить с использованием анализа Biacore, анализа ELISA, проточной цитометрии, иммуноферментного анализа (ELISA), способа переноса энергии флуоресценции (FRET) и технологии флуориметрического анализа в микрообъеме (FMAT (зарегистрированная торговая марка)).
[0047] Примеры первого плеча, перекрестно-конкурирующего за связывание с PD-1 с первым плечом, имеющим VH в вышеупомянутом (5b), и VL обычной легкой цепи, включают в себя первое плечо, имеющее VH любой одной, выбранной из вышеупомянутых (1b)-(4b), и VL обычной легкой цепи (предпочтительно, VL, имеющую VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:26, VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:27, и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:28) и кроме того первое плечо, имеющее VH, содержащую любую аминокислотную последовательность из SEQ ID NO: 1-4, и VL обычной легкой цепи (предпочтительно, VL, содержащую аминокислотную последовательность SEQ ID NO:25).
[0048] Кроме того, примеры первого плеча, перекрестно-конкурирующего за связывание с PD-1 с первым плечом, имеющим VH любой одной, выбранной из вышеупомянутых (1b)-(4b), или VH, содержащую любую аминокислотную последовательность из SEQ ID NO: 1-4, и VL обычной легкой цепи, включают в себя первое плечо, имеющее VH в вышеупомянутом (5b), и VL обычной легкой цепи (предпочтительно, VL, имеющую VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:26, VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:27, и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:28), и кроме того первое плечо, имеющее VH, содержащую аминокислотную последовательность в SEQ ID NO: 5, и VL обычной легкой цепи (предпочтительно VL, содержащую аминокислотную последовательность SEQ ID NO:25).
[0049] В настоящем документе предпочтительные примеры «первого плеча, специфически связывающегося с PD-1» по настоящему изобретению включают в себя первое плечо, имеющее VH любой одной, выбранной из вышеупомянутых (1b)-(5b). Кроме того, как упоминалось выше, предпочтительное первое плечо также включает в себя плечи, в которых 1-5 произвольных аминокислотных остатков замещены другой аминокислотой (аминокислотами) (предпочтительно, своей консервативной аминокислотой (аминокислотами) в каждой CDR VH, и замена аминокислотой (аминокислотами) по существу не оказывает влияния на активность связывания с PD-1. Кроме того, как упоминалось выше, предпочтительное первое плечо включает в себя варианты, когда имеют VH, в которой аминокислотные последовательности каркасов кодируются геном IGHV7-4-1 зародышевой линии V, или J геном JH6c, или геном (генами) с соматической мутацией (мутациями). Кроме того, более предпочтительные примеры первого плеча включают включает в себя варианты, которые имеют VH, содержащую любую аминокислотную последовательность из SEQ ID NO: 1-5.
[0050] Кроме того, первое плечо, специфически связывающееся с PD-1, по настоящему изобретению предпочтительно имеет обычную легкую цепь, и предпочтительные примеры такой обычной легкой цепи включают в себя легкую цепь, зашифрованную как обычная легкая цепь IGVK1-39/JK1. Более предпочтительные примеры включают в себя легкую цепь, содержащую VL, имеющую CDR1, содержащую аминокислотную последовательность SEQ ID NO:26, CDR2, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR3, содержащую аминокислотную последовательность SEQ ID NO:28, и еще более предпочтительные примеры включают в себя легкую цепь, содержащую VL, содержащую аминокислотную последовательность SEQ ID NO:25. Кроме того, предпочтительные примеры константной области обычной легкой цепи включают в себя константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:29.
[0051] Кроме того, предпочтительные примеры «первого плеча, специфически связывающегося с PD-1», включают в себя те, которые обеспечивает взаимодействие между PD-1 и PD-L1, взаимодействие между PD-1 и PD-L2, или оба этих взаимодействия. В настоящем документе выражение «обеспечивает взаимодействие между PD-1 и PD-L1, взаимодействие между PD-1 и PD-L2, или оба этих взаимодействия» означает, что даже когда имеется биспецифическое антитело против PD-1/CD3 по настоящему изобретению с 20-кратным превышением концентрации растворимой формы PD-L1 или PD-L2, взаимодействие между PD-L1 и PD-1, взаимодействие между PD-L2 и PD-1, или оба этих взаимодействия сохраняются на 50% или более, предпочтительно на 70% или более, и более предпочтительно на 80% или более по сравнению с тем, когда не имеется биспецифического антитела против PD-1/CD3 по настоящему изобретению. Кроме того, определение «обеспечивает взаимодействие между PD-1 и PD-L1, взаимодействие между PD-1 и PD-L2, или оба этих взаимодействия» может иметь то же значение, что и «которые по существу не подавляют взаимодействие между PD-1 и PD-L1, взаимодействие между PD-1 и PD-L2 или оба этих взаимодействия».
[0052] На фиг. 5 показана зависимая связь между каждым клоном моноклонального антитела против PD-1, полученным для конструирования биспецифического антитела против PD-1/CD3 по настоящему изобретению, и аминокислотной последовательностью его VH и его номерами SEQ ID. На фиг. 6 показана зависимая связь между аминокислотной последовательностью каждой CDR в VH каждого клона моноклонального антитела против PD-1 и номер SEQ ID его.
[0053] Второе плечо, специфически связывающееся с CD3
В настоящем описании «второе плечо, специфически связывающееся с CD3», (которое в настоящем документе может быть сокращено обозначена как «второе плечо»), означает часть антитела, имеющую по меньшей мере VH антитела, специфически связывающуюся с CD3 (которая в настоящем документе может быть сокращено обозначена как «антитело против CD3»), независимо от того, содержится ли оно в части антитела или фрагменте антитела, или существует не как часть, но как отдельное тело. Например, такое второе плечо состоит из VH антитела против CD3, и VL обычной легкой цепи, составляющей то же антитело против CD3, и дополнительно включает в себя Fab-часть антитела, содержащую VH и VL. В настоящем документе выражение «специфически связывающееся с CD3» используют в качестве признака, что антитело может связываться непосредственно с CD3 с активностью связывания с аффинностью по меньшей мере 1×10-5 M, предпочтительно 1×10-7 M, и более предпочтительно более чем 1×10-9 M (константа диссоциации (значение Kd)) и по существу не связывается с другим белком. Кроме того, «антитело» в «антителе, специфически связывающемся с CD3» или «антителе против CD3» означает полноразмерное антитело, которое состоит из двух тяжелых цепей и двух легких цепей, связанных дисульфидными связями, и предпочтительно его моноклональное антитело.
[0054] В настоящем документе примеры «второго плеча, специфически связывающегося с CD3», включают в себя плечо, которое содержит VH, имеющую: (1c) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:37, VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:38, и VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:39.
[0055] Кроме того, «второе плечо, специфически связывающееся с CD3», по настоящему изобретению включает в себя варианты, в которых 1-5 произвольных аминокислотных остатков замещены другой аминокислотой (аминокислотами) (предпочтительно, своей консервативной аминокислотой (аминокислотами) в каждой CDR VH в вышеупомянутом (1c), и которые имеют по существу ту же активность связывания с CD3, что и исходное второе плечо без всяких замен одной и той же аминокислотой (аминокислотами). Например, что касается CDR1, один аминокислотный остаток заменен его консервативной аминокислотой. Что касается CDR2 или CDR3, один или два аминокислотных остатка замещен/замещены его консервативной аминокислотой (аминокислотами), соответственно. В настоящем документе выражение «которые имеют по существу ту же активность связывания с CD3, что и исходное второе плечо без всяких замен одной и той же аминокислотой (аминокислотами)», упомянутое выше, означает, что активность связывания с CD3 второго плеча с заменой аминокислоты составляет 95% или более, предпочтительно 98% или более, и более предпочтительно 99% или более по сравнению с активностью исходного второго плеча без всяких замен одной и той же аминокислотой (аминокислотами). Здесь следует заметить, что примеры «замены консервативной аминокислотой (аминокислотами)» в каждой VH-CDR второго плеча включают в себя упомянутые выше примеры замены аминокислоты в первом плече.
[0056] Кроме того, «второе плечо, специфически связывающееся с CD3», в настоящем изобретении также включает в себя включает в себя варианты, которые содержат VH, имеющую каждую CDR, содержащую специфическую аминокислотную последовательность, упомянутую выше, и в которых аминокислотные последовательности FR VH кодируются специфическим геном зародышевой линии или ее геном с соматической мутацией (мутациями). Например, VH вышеупомянутого (1c) кодируется рекомбинантным геном VDJ, где геном зародышевой линии V является IGHV3-33 или ее ген с соматической мутацией (мутациями). В настоящем документе аминокислотная последовательность, кодируется V геном IGHV3-33 зародышевой линии (SEQ ID NO:22), показана на фиг. 3.
[0057] Кроме того, «второе плечо, специфически связывающееся с CD3», по настоящему изобретению также включает в себя варианты, которые содержат каждую CDR, имеющую вышеупомянутую специфическую аминокислотную последовательность, и в которых аминокислотные последовательности FR в VH кодируются специфическим геном зародышевой линии или ее геном с соматической мутацией (мутациями). Примеры такого второго плеча включают включает в себя варианты, которые имеют VH, содержащую аминокислотную последовательность SEQ ID NO:36.
[0058] Кроме того, примеры такого «второго плеча, специфически связывающегося с CD3», включают в себя те, которые имеют VH, содержащую аминокислотную последовательность, имеющую по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 98% и еще более предпочтительно по меньшей мере 99% идентичность с аминокислотной последовательностью SEQ ID NO:36, и в которых отличие от аминокислотной последовательности VH исходного второго плеча не оказывает существенного воздействия на активность связывания с CD3 (в настоящем документе, может быть сокращено обозначена как «гомологичное второе плечо»). В настоящем документе выражение «отличие от аминокислотной последовательности VH исходного второго плеча не оказывает существенного воздействия на активность связывания с CD3» означает, что активность связывания гомологичного второго плеча с CD3 составляет 95% или более, предпочтительно 98% или более и более предпочтительно 99% или более от активности связывания исходного второго плеча.
[0059] В еще одном варианте осуществления «второе плечо, специфически связывающееся с CD3», по настоящему изобретению включает в себя включает в себя варианты, которые содержат вариабельную область антитела против CD3 (в настоящем документе вариабельная область включает в себя составляющие ее VH и VL), перекрестно-конкурирующего за (1) связывание с CD3 со вторым плечом, имеющим VH в вышеупомянутом (1c), или VH, содержащую аминокислотную последовательность SEQ ID NO:36, и VL обычной легкой цепи, или за (2) связывание с CD3 с вариабельной областью моноклонального антитела, специфически связывающегося с CD3, имеющего одинаковые VH и VL. В настоящем документе «перекрестная конкуренция за связывание с CD3» означает, что она подавляет связывание второго плеча с CD3 независимо от его степени, за счет связывания с эпитопом, который является таким же или частично перекрывает второе плечо, приведенное для примера в настоящем описании. В настоящем документе перекрестную конкуренцию можно аналогично оценить с помощью того же способа, который описан в отношении «первого плеча, специфически связывающегося с PD-1».
[0060] В настоящем документе предпочтительные примеры «второго плеча, специфически связывающегося с CD3», по настоящему изобретению включают в себя второе плечо, имеющее VH в вышеупомянутом (1c). Кроме того, как упоминалось выше, предпочтительные примеры второго плеча также включают в себя те, в которых 1-5 произвольный аминокислотный остаток (остатки) замещен/замещены другой аминокислотой (аминокислотами) (предпочтительно, своей консервативной аминокислотой (аминокислотами) в каждой CDR VH, и замена аминокислоты по существу не оказывает влияния на активность связывания с CD3. Кроме того, как упоминалось выше, предпочтительные примеры второго плеча включают включает в себя варианты, которые имеют VH, в которой аминокислотные последовательности каркасов кодируются геном зародышевой линии IGHV3-33 или ее геном с соматической мутацией (мутациями). Также, более предпочтительные примеры второго плеча включают включает в себя варианты, которые имеют VH, содержащую аминокислотную последовательность SEQ ID NO:36.
[0061] В настоящем документе, на фиг.7 показаны зависимые связи между клонами антител против CD3 для конструирования биспецифических антител против PD-1/CD3 по настоящему изобретению, их аминокислотными последовательностями VH и их номерами SEQ ID, соответственно. На фиг.8 показаны зависимые связи между аминокислотными последовательностями CDR в VH клонов антител против CD3 и их номерами SEQ ID, соответственно.
[0062] «Второе плечо, специфически связывающееся с CD3», по настоящему изобретению предпочтительно содержит обычные легкие цепи, и предпочтительные примеры такой обычной легкой цепи включают в себя обычную легкую цепь IGVK1-39/JK1. Более предпочтительные примеры включают в себя легкую цепь, содержащую VL, имеющую CDR1, содержащую аминокислотную последовательность SEQ ID NO:26, CDR2, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR3, содержащую аминокислотную последовательность SEQ ID NO:28, и еще более предпочтительные примеры включают в себя легкую цепь, содержащую VL, содержащую аминокислотную последовательность SEQ ID NO:25. Кроме того, предпочтительные примеры константной области обычной легкой цепи включают в себя константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:29.
[0063] Предпочтительные примеры «второго плеча, специфически связывающегося с CD3», по настоящему изобретению включают в себя второе плечо, специфически связывающееся с CD3ε.
[0064] Примеры предпочтительного изотипа биспецифического антитела против PD-1/CD3 по настоящему изобретению включают в себя IgG антитело, еще более предпочтительно IgG1 антитело или IgG4 антитело, и более предпочтительно IgG1 антитело.
[0065] С другой стороны, предпочтительным вариантом осуществления биспецифического антитела против PD-1/CD3 по настоящему изобретению является, например, биспецифическое антитело против PD-1/CD3,
где первое плечо, специфически связывающееся с PD-1, содержит:
(A) VH, в которой 1-5 произвольный аминокислотный остаток (остатки) можно заменить другой аминокислотой (аминокислотами) (предпочтительно, консервативной аминокислотой (аминокислотами)) в любой одной или более CDR, выбранную из VH-CDR1, VH-CDR2 и VH-CDR3 в VH, представленной любой одной, выбранной из вышеупомянутых (1a)-(4a) или (1b)-(5b); и
(B) VL обычной легкой цепи, имеющую CDR1, содержащую аминокислотную последовательность SEQ ID NO:26, CDR2, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR3, содержащую аминокислотную последовательность SEQ ID NO:28; и
где второе плечо, специфически связывающееся с CD3, содержит:
(C) VH, в которой 1-5 произвольный аминокислотный остаток (остатки) можно заменить другой аминокислотой (аминокислотами) (предпочтительно, консервативной аминокислотой (аминокислотами)) в любой одной или более CDR, выбранную из VH-CDR1, VH-CDR2 и VH-CDR3 в VH, представленной в выше упомянутом (1c); и
(D) VL обычной легкой цепи, имеющую CDR1, содержащую аминокислотную последовательность SEQ ID NO:26, CDR2, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR3, содержащую аминокислотную последовательность SEQ ID NO:28.
[0066] Более предпочтительным вариантом осуществления биспецифического антитела против PD-1/CD3 по настоящему изобретению является, например, биспецифическое антитело против PD-1/CD3,
где первое плечо, специфически связывающееся с PD-1, содержит:
(A) VH любой одной, выбранной из приведенных выше (1a)-(4a) или (1b)-(5b), и
(B) VL обычной легкой цепи, имеющую CDR1, содержащую аминокислотную последовательность SEQ ID NO:26, CDR2, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR3, содержащую аминокислотную последовательность SEQ ID NO:28; и
где второе плечо, специфически связывающееся с CD3, содержит:
(C) VH в приведенном выше (1c); и
(D) VL обычной легкой цепи, имеющую CDR1, содержащую аминокислотную последовательность SEQ ID NO:26, CDR2, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR3, содержащую аминокислотную последовательность SEQ ID NO:28.
[0067] Кроме того, еще одним предпочтительным вариантом осуществления биспецифического антитела против PD-1/CD3 по настоящему изобретению является, например, биспецифическое антитело против PD-1/CD3,
в котором первое плечо, специфически связывающееся с PD-1, содержит:
(A) VH, содержащую любую аминокислотную последовательность из SEQ ID NO: 1-5, или VH, содержащую аминокислотную последовательность, имеющую по меньшей мере 80% идентичность с аминокислотной последовательностью той же VH; и
(B) VL обычной легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:25; и
где второе плечо, специфически связывающееся с CD3, содержит,
(C) VH, содержащую аминокислотную последовательность SEQ ID NO:36, или VH, содержащую аминокислотную последовательность, которая по меньшей мере идентична на 80% с аминокислотной последовательностью той же VH; и
(D) VL обычной легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:25.
[0068] Другие варианты осуществления более предпочтительно включают в себя, например, биспецифическое антитело против PD-1/CD3,
в котором первое плечо, специфически связывающееся с PD-1, содержит:
(A) VH, содержащую любую аминокислотную последовательность из SEQ ID NO: 1-5; и
(B) VL обычной легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:25; и
в котором второе плечо, специфически связывающееся с CD3, содержит:
(C) VH, содержащую аминокислотную последовательность SEQ ID NO:36; и
(D) VL обычной легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:25.
[0069] В биспецифическом антителе против PD-1/CD3 по настоящему изобретению в случае, когда антитело представляет собой IgG1 антитело, предпочтительным является IgG1 антитело, в котором лейцин в позиции 235 согласно системе нумерации ЕС заменен глицином, и/или глицин в позиции 236 согласно системе нумерации ЕС заменен аргинином в двух константных областях тяжелых цепей или шарнирной области. Кроме того, предпочтительным является биспецифическое антитело, в котором была удалена аминокислота C-конца тяжелой цепи, например, лизин в позиции 447 согласно системе нумерации ЕС. Кроме того, в случае, когда биспецифическое антитело против PD-1/CD3 представляет собой IgG4 антитело, предпочтительным является антитело, в котором серин, находящийся в шарнирной области и в позиции 228 согласно системе нумерации ЕС, заменен пролином.
[0070] Кроме того, предпочтительный вариант осуществления в случае, когда биспецифическое антитело против PD-1/CD3 представляет собой IgG1 антитело, включает в себя варианты, в которых в константной области тяжелой цепи, имеющей VH первого плеча, специфически связывающегося с PD-1, лейцин в позиции 351 согласно системе нумерации ЕС заменен лизином, а треонин в позиции 366 заменен лизином, а в константной области тяжелой цепи, имеющей VH второго плеча, специфически связывающегося с CD3, лейцин в позиции 351 заменен аспарагиновой кислотой, а лейцин в позиции 368 заменен глутаминовой кислотой. Кроме того, также предпочтительным является IgG1 антитело, в котором в константной области тяжелой цепи, имеющей VH первого плеча, специфически связывающегося с PD-1, лейцин в позиции 351 согласно системе нумерации ЕС заменен аспарагиновой кислотой, а лейцин в позиции 368 заменен глутаминовой кислотой, а в константной области тяжелой цепи, имеющей VH второго плеча, специфически связывающегося с CD3, лейцин в позиции 351 заменен лизином, а треонин в позиции 366 заменен лизином.
[0071] Примеры предпочтительного варианта осуществления биспецифического IgG1 антитела против PD-1/CD3, в котором осуществлены все вышеупомянутые аминокислотные замены в константной области тяжелой цепи, включают в себя те, в которых тяжелая цепь, имеющая VH первого плеча, специфически связывающегося с PD-1, содержит константную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:23, а тяжелая цепь, имеющая VH второго плеча, специфически связывающегося с CD3, содержит константную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:24. Эти аминокислотные последовательности показаны на фиг. 9.
[0072] Наиболее предпочтительными вариантами осуществления биспецифического антитела против PD-1/CD3 по настоящему изобретению являются клон PD1-1(Bi), клон PD1-2(Bi), клон PD1-3(Bi), клон PD1-4(Bi) и клон PD1-5(Bi), полученные с помощью способа, описанного в примере 8 настоящего описания.
[0073] Предпочтительные признаки биспецифического антитела против PD-1/CD3 по настоящему изобретению включают в себя: (1) обеспечение взаимодействия между PD-1 и PD-L1, взаимодействия между PD-1 и PD-L2 или обоих взаимодействий; и/или (2) достаточное уменьшение выработки цитокина. В настоящем документе выражение «обеспечение взаимодействия между PD-1 и PD-L1, взаимодействия между PD-1 и PD-L2 или обоих взаимодействий» означает то же, что описано относительно «первого плеча, специфически связывающегося с PD-1». С другой стороны, выражение «достаточное уменьшение выработки цитокина» означает, что, например, во время внутривенного введения или через 24 часа после этого введения путем капельной инфузии биспецифического антитела против PD-1/CD3 по настоящему изобретению, например, концентрация цитокина, включая IL-2, IFN-γ и/или TNF-α в крови или ткани не увеличивается, или увеличивается только до такой степени, что ее можно подавить путем введения стероидов.
[0074] Способ получения и очистки биспецифического антитела против PD-1/CD3
Биспецифическое антитело против PD-1/CD3 и фрагмент антитела по настоящему изобретению также можно получить с помощью способа, раскрытого в WO2014/051433, WO2013/157953 или WO2013/157954.
[0075] Конкретно, биспецифическое антитело против PD-1/CD3 и фрагмент антитела по настоящему изобретению можно получить с помощью вектора экспрессии переносимого гена, в который был вставлен (1) полинуклеотид, кодирующий тяжелую цепь, содержащую VH первого плеча, специфически связывающегося с PD-1, (2) полинуклеотид, кодирующий тяжелую цепь, содержащую VH второго плеча, специфически связывающегося с CD3, и (3) полинуклеотид, кодирующий обычную легкую цепь, соответственно, в клетки животных-млекопитающих для их трансформации, и затем путем экспрессии и секреции как тяжелой цепи, так и обычной легкой цепи.
[0076] В настоящем документе можно использовать любые клетки-хозяева для экспрессии биспецифического антитела против PD-1/CD3 по настоящему изобретению при условии, что в них можно провести перенос генов с использованием вектора экспрессии и обеспечить экспрессию переносимого вектора экспрессии. Клетками-хозяевами предпочтительно являются клетки насекомых, такие как SF-9 и SF-21, более предпочтительно клетки млекопитающих, такие как клетки мышей, такие как клетки CHO, клетки BHK, клетки SP2/0 и клетки миеломы NS-0, клетки приматов, такие как клетки COS и Vero, клетки MDCK, клетки BRL 3A, гибридома, клетки опухоли, иммортализованные первичные клетки, W138, HepG2, HeLa, HEK293, HT1080 или эмбриональные клетки сетчатки, такие как PER.C6. Здесь следует заметить, что при выборе системы экспрессии векторы экспрессии и хозяев в виде клеток-хозяев млекопитающих можно использовать для обеспечения того, чтобы антитело было надлежащим образом гликозилировано. Для получения антитела, гликозилированные структуры которого соответствуют гликозилированным структурам для человека, предпочтительно используют человеческие линии клеток, предпочтительно PER.C6.
[0077] Выработку белков в клетках-хозяевах, трансформированных с помощью переноса генов векторами экспрессии, можно проводить со ссылкой на, например, Current Protocols in Protein Science (1995), Coligan JE, Dunn BM, Ploegh HL, Speicher DW, Wingfield PT, ISBN 0-471-11184-8, Bendig, 1988. Кроме того, общие рекомендации, методики и практические способы сделать максимальной продуктивность культуры клеток-хозяев можно осуществлять со ссылкой на Mammalian Cell Biotechnology: a Practical Approach (M. Butler, ed. IRL Press, 1991). Экспрессия антител в клетках-хозяевах описана, например, в таких публикациях, как EP0120694, EP0314161, EP0481790, EP0523949, US4816567, WO2000/63403 и тому подобное.
[0078] В настоящем документе условия культивирования клеток-хозяев можно оптимизировать с помощью хорошо известного способа, и таким образом можно оптимизировать выработку белков. Примеры культивирования включают в себя периодическое культивирование, питательное культивирование, непрерывное культивирование и культивирование на пустотелых волокнах в чашке Петри, роллер-флаконе или реакционной камере. Для продуцирования рекомбинантного белка культурой клеток в большом масштабе и непрерывно предпочтительной является пролиферация клеток в суспензионной жидкости. Кроме того, более предпочтительным является культивирование клеток в условиях без сыворотки животного или человеческого происхождения или некоторых компонентов сыворотки животного или человеческого происхождения.
[0079] Антитело, экспрессируемое в клетках-хозяевах и затем извлекаемое из клеток или культуры клеток с помощью хорошо известных способов, можно очистить с использованием хорошо известных способов. Примеры способа очистки включают в себя метод иммунной преципитации, метод центрифугирования, фильтрацию, эксклюзионную хроматографию, аффинную хроматографию, катионо и/или анионо обменную хроматографию, хроматографию с гидрофобным взаимодействием и тому подобное. Кроме того, можно предпочтительно использовать аффинную хроматографию белка А или белка G (см. Например, US4801687 и US5151504).
[0080] Моноклональное антитело против PD-1
настоящее изобретение включает в себя «моноклональное антитело, специфически связывающееся с PD-1» (в настоящем документе, может быть сокращено обозначена как «моноклональное антитело против PD-1») для конструирования биспецифического антитела против PD-1/CD3 по настоящему изобретению и фрагмент антитела.
[0081] Одним вариантом осуществления моноклонального антитела против PD-1 по настоящему изобретению является моноклональное антитело, способное специфически связываться с PD-1, путем связывания VH и VL обычной легкой цепи настоящего изобретения. В настоящем документе выражение «специфически связывающееся с PD-1» используют в качестве признака, что оно может связываться непосредственно с PD-1 с активностью связывания (константой диссоциации (значением Kd)), составляющей аффинность по меньшей мере 1×10-5 M, предпочтительно 1×10-7 M, и более предпочтительно более чем 1×10-9 M, и по существу не связывается с рецепторными элементами, относящимися к так называемому рецептору семейства CD28, например, CD28, CTLA-4 и ICOS. В настоящем документе «антитело» в «моноклональном антителе, специфически связывающемся с PD-1», или «антителе против PD-1» означает полноразмерное антитело, состоящее из двух тяжелых цепей и двух легких цепей, связанных дисульфидными связями. Кроме того, «фрагмент моноклонального антитела, специфически связывающегося с PD-1», представляет часть полноразмерного антитела и антитело, содержащее по меньшей мере антигенсвязывающую часть, и примеры которого включают в себя Fab, Fab′, Fv, scFv, F(ab′)2 и тому подобное.
[0082] Примеры моноклонального антитела против PD-1 по настоящему изобретению включают включает в себя варианты, которые имеютлюбую одну VH, выбранную из приведенных выше (1a)-(4a) или (1b)-(5b), составляющих VH «первого плеча, специфически связывающегося с PD-1», или VH, содержащую любую аминокислотную последовательность из SEQ ID NO: 1-5, и VL обычной легкой цепи согласно настоящему описанию.
[0083] Кроме того, моноклональное антитело против PD-1 по настоящему изобретению включает в себя варианты, в которых 1-5 произвольный аминокислотный остаток (остатки) замещен/замещены другой аминокислотой (аминокислотами) (предпочтительно, своей консервативной аминокислотой (аминокислотами) в каждой CDR любой одной из VH, выбранную из вышеупомянутых (1a)-(4a) или (1b)-(5b), и которые имеют по существу ту же активность связывания с PD-1, что и моноклональное антитело против PD-1, имеющее исходную VH без всяких замен одной и той же аминокислотой (аминокислотами). Например, что касается CDR1, один аминокислотный остаток заменен его консервативной аминокислотой. Что касается CDR2 или CDR3, один или два аминокислотный остаток (остатки) замещен/замещены его консервативными аминокислотами, соответственно. В настоящем документе выражение «которые имеют по существу ту же активность связывания с PD-1, что и моноклональное антитело против PD-1, имеющее исходную VH без всяких замен одной и той же аминокислотой (аминокислотами)» означает, что активность связывания с PD-1 моноклонального антитела против PD-1 с заменой аминокислоты (аминокислоты) составляет 95% или более, предпочтительно 98% или более, и более предпочтительно 99% или более по сравнению с активностью моноклонального антитела против PD-1, имеющего исходную VH без всяких замен одной и той же аминокислотой (аминокислотами).
[0084] Кроме того, примеры моноклонального антитела против PD-1 по настоящему изобретению включают в себя те, которые содержат VH, имеющую каждую CDR, содержащую специфическую аминокислотную последовательность, упомянутую выше, и в которых каркасные аминокислотные последовательности VH кодируются специфическим геном зародышевой линии или ее геном с соматической мутацией (мутациями), и примеры которых включают в себя специфическую VH, кодируемую специфическим геном зародышевой линии или ее геном с соматической мутацией (мутациями), который описан в отношении вышеупомянутого «первого плеча, специфически связывающегося с PD-1».
[0085] Кроме того, в моноклональных антителах против PD-1 по настоящему изобретению примеры тех, которые имеют VH, содержащую каждую CDR в любой одной из VH, выбранную из приведенных выше (1a)-(4a) или (1b)-(5b), и в которых аминокислотные последовательности FR кодируются специфическим геном зародышевой линии или ее геном с соматической мутацией (мутациями), включают включает в себя варианты, которые имеют VH, содержащую любую аминокислотную последовательность из SEQ ID NO: 1-5. Кроме того, примеры такого моноклонального антитела против PD-1 включают включает в себя варианты, которые имеютаминокислотную последовательность VH, имеющую по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 98%, еще более предпочтительно по меньшей мере 99% идентичность с аминокислотной последовательностью, приведенной в любой одной, выбранной из SEQ ID NO: 1-5, и имеют активность связывания с PD-1, по существу такую же, что и моноклональное антитело против PD-1, имеющее исходную VH. В настоящем документе выражение «имеющее активность связывания с PD-1, по существу такую же, что и моноклональное антитело против PD-1, имеющее исходную VH», означает, что оно имеет 95% или более, предпочтительно 98% или более, и более предпочтительно 99% или более активность связывания с PD-1 по сравнению с активностью моноклонального антитела против PD-1, имеющего исходную VH.
[0086] Кроме того, другие варианты осуществления моноклонального антитела против PD-1 по настоящему изобретению также включают в себя моноклональное антитело против PD-1, перекрестно-конкурирующее за связывание с PD-1 с моноклональным антителом против PD-1, имеющим любую одну VH, выбранную из вышеупомянутых (1a)-(4a) или (1b)-(5b), или аминокислотную последовательность VH, приведенную в любой из SEQ ID NO: 1-5, и моноклональное антитело против PD-1, связывание которого с PD-1 испытывает перекрестную конкуренцию со стороны моноклонального антитела против PD-1, имеющего любую одну VH, выбранную из вышеупомянутых (1a)-(4a) или (1b)-(5b), или VH, содержащих любую аминокислотную последовательность из SEQ ID NO: 1-5.
[0087] Предпочтительные признаки моноклонального антитела против PD-1 по настоящему изобретению включают в себя обеспечение взаимодействия между PD-1 и PD-L1, взаимодействия между PD-1 и PD-L2 или обоих взаимодействий, а также биспецифическое антитело против PD-1/CD3 по настоящему изобретению.
[0088] Полинуклеотид, кодирующий биспецифическое антитело против PD-1/CD3
Полинуклеотид, кодирующий биспецифическое антитело против PD-1/CD3, содержит: (1) полинуклеотид, кодирующий тяжелую цепь, имеющую VH первого плеча, специфически связывающегося с PD-1, (2) полинуклеотид, кодирующий тяжелую цепь, имеющую VH второго плеча, специфически связывающегося с CD3, и (3) полинуклеотиды, кодирующие обычные легкие цепи. В настоящем документе полинуклеотид, кодирующий тяжелую цепь, имеющую VH первого плеча, специфически связывающегося с PD-1, включает в себя полинуклеотид, кодирующий VH первого плеча, специфически связывающегося с PD-1, и полинуклеотид, кодирующий константную область тяжелой цепи, имеющей VH. Аналогично, полинуклеотид, кодирующий тяжелую цепь, имеющую VH второго плеча, специфически связывающегося с CD3, включает в себя полинуклеотид, кодирующий VH второго плеча, специфически связывающегося с CD3, и полинуклеотид, кодирующий константную область тяжелой цепи, имеющей VH.
[0089] Полинуклеотидом, кодирующим биспецифическое антитело против PD-1/CD3, могут быть любые полинуклеотиды при условии, что они кодируют каждую из частей, составляющих биспецифическое антитело против PD-1/CD3, и может быть любая геномная ДНК, кДНК, синтезированная ДНК, РНК и гибрид ДНК-РНК. В качестве кодона, кодирующего одну аминокислоту, известно от одного до шести типов кодонов. Например, Phe соответствует TTT или TTC, Leu соответствует TTA, TTG, CTT, CTC, CTA или CTG, Ile соответствует ATT, ATC или ATA, Met соответствуют ATG, Val соответствует GTT, GTC, GTA или GTG, Ser соответствует TCT, TCC, TCA или TCG, Pro соответствует CCT, CCC, CCA или CCG, Thr соответствует ACT, ACC, ACA или ACG, Ala соответствует GCT, GCC, GCA или GCG, Tyr соответствует TAT или TAC, His соответствует CAT или CAC, Gln соответствует CAA или CAG, Asn соответствует AAT или AAC, Lys соответствует AAA или AAG, Asp соответствует GAT или GAC, Glu соответствует GAA или GAG, Cys соответствует TGT или TGC, Trp соответствует TGG, Arg соответствует CGT, CGC, CGA или CGG, Ser соответствует AGT или AGC, Arg соответствует AGA или AGG, и Gly соответствует GGT, GGC, GGA или GGG, соответственно. Соответственно, полинуклеотид, кодирующий биспецифическое антитело против PD-1/CD3, включает в себя полинуклеотиды, в которых кодоны, соответствующие каждой аминокислоте, произвольно объединены. Предпочтительные примеры полинуклеотида, кодирующего VH первого плеча, специфически связывающегося с PD-1, включают в себя полинуклеотид, имеющий последовательность оснований, приведенную в любой из SEQ ID NO: 30-34, кодирующую VH клонов PD1-1 - PD1-5, соответственно. Предпочтительные примеры полинуклеотида, кодирующего VH второго плеча, специфически связывающегося с CD3, включают в себя полинуклеотид, имеющий последовательность оснований SEQ ID NO:40. Кроме того, предпочтительные примеры полинуклеотида, кодирующего вариабельную область обычной легкой цепи, включают в себя полипептид, имеющий последовательность оснований SEQ ID NO:35.
[0090] Фармацевтическое применение
Биспецифическое антитело против PD-1/CD3 по настоящему изобретению полезно для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения аутоиммунных заболеваний или болезни «трансплантат против хозяина» (GVHD).
[0091] Примерами заболеваний, которые можно предотвратить, прогрессирование или рецидив симптомов которых можно подавить, и/или которые можно лечить с помощью биспецифического антитела против PD-1/CD3 по настоящему изобретению, являются болезнь Бехчета, системная красная волчанка, хроническая дискоидная красная волчанка, рассеянный склероз (системная склеродермия, и прогрессирующий системный склероз), склеродермия, полимиозит, дерматомиозит, узелковый периартериит (узелковый полиартериит, и микроскопический полиангиит), аортальный синдром (артериит Такаясу), ревматоидный артрит со злокачественными заболеваниями, ревматоидный артрит, ювенильный идиопатический артрит, спондилоартрит, смешанное заболевание соединительной ткани, синдром Шегрена, болезнь Стилла у взрослых, васкулит, аллергический гранулематозный васкулит, гиперчувствительный васкулит, ревматоидный васкулит, васкулит крупных сосудов, АНЦА-ассоциированный васкулит (например, гранулематоз с полиангиитом и эозинофильный гранулематоз с полиангиитом), синдром Когана, RS3PE, височный артериит, ревматическая полимиалгия, фибромиалгия, синдром антифосфолипидных антител, эозинофильный фасциит, IgG4-связанное заболевание (например, первичный склерозирующий холангит, аутоиммунный инсулит), синдром Гийена-Барре, тяжелая миастения, хронический атрофический гастрит, аутоиммунный гепатит, неалкогольный стеатогепатит, первичный билиарный цирроз, синдром Гудпасчера, быстропрогрессирующий гломерулонефрит, мегалобластная анемия, аутоиммунная гемолитическая анемия, пернициозная анемия, аутоиммунная нейтропения, идиопатическая тромбоцитопеническая пурпура, базедова болезнь (болезнь Грейвcа (гипертиреоидизм)), болезнь Хашимото, аутоиммунная недостаточность надпочечников, первичный гипотиреоз, болезнь Аддисона (хронический гипоадренокортицизм), болезнь Аддисона неизвестного происхождения, сахарный диабет I типа, медленно прогрессирующий сахарный диабет I типа (латентный аутоиммунный сахарный диабет взрослых), очаговая склеродермия, псориаз, псориатический артрит, буллезный пемфигоид, пемфигус, пемфигоид, гестационный герпес, линеарный IgA-зависимый буллезный дерматоз, приобретенный буллезный эпидермоз, очаговая алопеция, витилиго, вульгарное витилиго, нейромиелит зрительного нерва, хроническая воспалительная демиелинизирующая полинейропатия, многофокальная моторная нейропатия, саркоидоз, гигантоклеточный артериит, боковой амиотрофический склероз, болезнь Харада, аутоиммунная оптическая нейропатия, азооспермия неизвестного происхождения, привычный аборт, воспалительная болезнь кишечника (например, язвенный колит, и Болезнь Крона), целиакия, анкилозирующий спондилоартрит, тяжелая астма, хроническая крапивница, трансплантационный иммунитет, семейная средиземноморская лихорадка, эозинофильный хронический риносинусит, дилатационная кардиомиопатия, системный мастоцитоз или миозит с включениями телец.
[0092] В настоящем изобретении термин «лечение» означает исцеление или улучшение заболевания или уменьшение проявления его симптомов. Термин «предотвращение» означает предотвращение начала заболевания или его симптомов или задержка на некоторый период. Термин «подавление прогрессирования симптомов» означает подавление прогрессирования или ухудшения симптомов для остановки прогрессирования состояния болезни. Значение «предотвращения» включает в себя подавление рецидива. Термин «подавление рецидива» означает предотвращение рецидива какого-то заболевания или синдрома или уменьшение возможности рецидива.
[0093] Биспецифическое антитело против PD-1/CD3 по настоящему изобретению обычно вводят системно или местно через парентеральное введение. Конкретные примеры таких способов введения включают в себя инъекционное введение, интраназальное введение, транспульмональное введение, чрескожное введение и тому подобное. Примеры инъекционного введения включают в себя внутривенную инъекцию, внутримышечную инъекцию и внутрибрюшинную инъекцию. Для внутривенной инъекции предпочтительной является капельная внутривенная инфузия. Ее доза варьирует в зависимости от возраста, веса тела, симптомов, терапевтического действия, способа введения, периода лечения и тому подобное. Его разовая доза для одного взрослого пациента обычно находится в пределах диапазона от 0,1 мкг/кг до 300 мг/кг и особенно предпочтительно в пределах диапазона от 0,1 мг/кг до 10 мг/кг, от одного до нескольких раз в день путем парентерального введения, или в пределах диапазона от одного часа до 24 часов в день путем внутривенного поддерживающего введения. Разумеется, как упоминалось выше, поскольку доза варьирует в зависимости от разных условий, достаточная доза может быть ниже, чем вышеупомянутая доза, или может быть нужно введение больше чем указано выше.
[0094] Состав
При получении состава биспецифического антитела против PD-1/CD3 по настоящему изобретению, подлежащей использованию в качестве инъекционного или инфузионного раствора для капельной инфузии, инъекционный или инфузионный раствор может быть в любой форме водного раствора, суспензии или эмульсии или может быть составлен в виде твердого средства вместе с фармацевтически приемлемым носителем таким образом, чтобы средство было растворено, суспендировано или эмульсифицировано в растворителе во время применения. Примеры растворителя, который используют в инъекционном или инфузионном растворе для капельной инфузии, включают в себя дистиллированную воду для инъекции, физиологический раствор, растворы глюкозы и изотонические растворы (например, в которых могут быть растворены хлорид натрия, хлорид калия, глицерин, маннит, сорбит, борная кислота, боракс, пропиленгликоль и тому подобное).
[0095] В настоящем документе примеры фармацевтически приемлемых носителей включают в себя стабилизаторы, солюбилизаторы, суспендирующие средства, эмульгаторы, смягчающие средства, буферные средства, консерванты, обеззараживающие средства, регуляторы pH и антиоксиданты. В качестве стабилизаторов можно использовать разные аминокислоты, альбумин, глобулин, желатин, маннитол, глюкозу, декстран, этиленгликоль, пропиленгликоль, полиэтиленгликоль, аскорбиновую кислоту, бисульфит натрия, тиосульфат натрия, эдетат натрия, цитрат натрия, дибутилгидрокситолуол и тому подобное. В качестве солюбилизаторов можно использовать спирты (например, этанол), полиолы (например, пропиленгликоль, полиэтиленгликоль и тому подобное), неионные поверхностно-активные вещества (например, Полисорбат 20 (зарегистрированная торговая марка), Полисорбат 80 (зарегистрированная торговая марка), HCO-50 и тому подобное) и тому подобное. В качестве суспендирующих средств можно использовать моностеарат глицерила, моностеарат алюминия, метилцеллюлозу, карбоксиметилцеллюлозу, гидроксиметилцеллюлозу, лаурилсульфат натрия и тому подобное. В качестве эмульгаторов можно использовать аравийскую камедь, альгинат натрия, трагакант и тому подобное. В качестве смягчающих средств можно использовать бензиловый спирт, хлорбутанол, сорбитол и тому подобное. В качестве буферных средств можно использовать фосфатный буфер, ацетатный буфер, боратный буфер, карбонатный буфер, цитратный буфер, Tris буфер, буфер глутаминовой кислоты, буфер эпсилон аминокапроновой кислоты и тому подобное. В качестве консервантов можно использовать метилпарагидроксибензоат, этилпарагидроксибензоат, пропилпарагидроксибензоат, бутилпарагидроксибензоат, хлорбутанол, бензиловый спирт, хлорид бензалкония, дегидроацетат натрия, эдетат натрия, борную кислоту, боракс и тому подобное. В качестве обеззараживающих средств можно использовать хлорид бензалкония, парагидроксибензойную кислоту, хлорбутанол и тому подобное. В качестве регуляторов pH можно использовать гидрохлорную кислоту, гидроксид натрия, фосфорную кислоту, уксусную кислоту и тому подобное. В качестве антиоксидантов можно использовать (1) водные антиоксиданты, такие как аскорбиновая кислота, цистеин гидрохлорид, бисульфат натрия, метабисульфит натрия и сульфит натрия, (2) маслорастворимые антиоксиданты, такие как аскорбил пальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, лецитин, пропилгаллат и α-токоферол, и (3) средства образования металлохелатов, такие как лимонная кислота, этилендиаминтетрауксусная кислота, сорбитол, винная кислота и фосфорная кислота и тому подобное.
[0096] инъекционный или инфузионный раствор для капельной инфузии можно получить путем проведения стерилизации в заключительном процессе или обеззараживающей обработки, например, проведения стерилизации путем фильтрации с помощью фильтра и тому подобное и последующего заполнения асептического контейнера. Инъекционный или инфузионный раствор для капельной инфузии можно использовать путем растворения высушенного в вакууме или лиофилизированного асептического порошка (который может включать в себя порошок фармацевтически приемлемого носителя) в подходящем растворителе во время применения.
[0097] Комбинированное применение или комбинированная состав
Кроме того, биспецифическое антитело против PD-1/CD3 по настоящему изобретению можно использовать в комбинации с другим средством, которое используют для профилактики, подавления прогрессирование симптомов или рецидива аутоиммунного заболевания и/или его лечения. В настоящем изобретении примеры формы введения при таком комбинированном применении с другими средства (комбинированное применение) могут включать в себя форму комбинированной состава, содержащей оба ингредиента в одной готовой форме, или форму, вводимую в виде отдельных готовых форм. Такое комбинированное применение может дополнять профилактическое, подавляющее прогрессирование симптомов, подавляющее рецидивы и/или терапевтическое действие другого средства или может поддерживать или уменьшать дозу или частоту введения другого средства. В настоящем изобретении в случае раздельного введения биспецифического антитела против PD-1/CD3 и другого средства, оба средства можно вводить одновременно в течение некоторого периода времени, а затем можно вводить только биспецифическое антитело против PD-1/CD3 или другое средство. Альтернативно, сначала можно вводить биспецифическое антитело против PD-1/CD3 по настоящему изобретению, а после завершения введения можно вводить другое средство. Сначала можно вводить другое средство, а затем можно вводить биспецифическое антитело против PD-1/CD3 по настоящему изобретению. Способ введения может быть одинаковым или отличаться друг от друга. В настоящем изобретении также может быть представлен набор, содержащий готовую форму, содержащую биспецифическое антитело против PD-1/CD3 по настоящему изобретению и готовую форму, содержащую другое средство. Дозу другого средства можно выбирать соответствующим образом на основе дозы при клиническом применении. Другое средство может представлять собой комбинацию двух или более типов произвольных средств в надлежащем соотношении. Примеры другого средства включают в себя не только те, что уже известны, но также те, что будут открыты в будущем.
[0098] Например, когда биспецифическое антитело против PD-1/CD3 по настоящему изобретению применяют для предотвращения, подавления симптомов прогрессирования или рецидива и/или лечения сахарного диабета I типа, его можно использовать в комбинации, например, с любым одним или более средством (средствами), выбираемыми из препарата инсулина (например, человеческого инсулина, инсулина гларгин, инсулина лизпро, инсулина детемир, инсулина аспарт и тому подобное), препарата сульфонилмочевины (например, глибенкламида, гликлазида или глимепирида), быстродействующего промотора секреции инсулина (например, натеглинида), препарата бигуанида (например, метформина), средства, влияющего на инсулинорезистентность (например, пиоглитазона), ингибитора α-глюкозидазы (например, акарбозы, воглибозы и тому подобное), средства для лечения диабетической невропатии (например, эпалрестата, мексилетина, имидаприла и тому подобное), препарата-аналога GLP-1 (например, лираглутида, эксенатида, ликсисенатида и тому подобное) и ингибитора DPP-4 (например, ситаглиптина, вилдаглиптина, алоглиптина и тому подобное) и тому подобное.
[0099] Кроме того, например, когда биспецифическое антитело против PD-1/CD3 по настоящему изобретению применяют для предотвращения, подавления симптомов прогрессирования или рецидива и/или лечения рассеянного склероза, его можно использовать в комбинации с любым одним или более средством (средствами), выбираемыми из стероидного средства (например, кортизона ацетата, гидрокортизона, гидрокортизона натрия фосфата, гидрокортизона натрия сукцината, флудрокортизона ацетата, преднизолона, преднизолона ацетата, преднизолона натрия сукцината, преднизолона бутилацетата, преднизолона натрия фосфата, галопредона ацетата, метилпреднизолона, метилпреднизолона ацетата, метилпреднизолона натрия сукцината, триамсинолона, триамсинолона ацетата, триамсинолона ацетонида, дексаметазона, дексаметазона ацетата, дексаметазонатрия фосфата, дексаметазона пальмитата, параметазона ацетата или бетаметазона), интерферона β-1a, интерферона β-1b, глатирамера ацетата, митоксантрона, азатиоприна, циклофосфамида, циклоспорина, метотрексата, кладрибина, адренокортикотропного гормона (ACTH), кортикотропина, мизорибина, такролимуса, финголимода или алемтузумаба и тому подобное.
[0100] Кроме того, например, когда биспецифическое антитело против PD-1/CD3 по настоящему изобретению применяют для предотвращения, подавления симптомов прогрессирования или рецидива и/или лечения системной красной волчанки, его можно использовать в комбинации с любым одним или более средством (средствами), выбираемыми из стероидного средства (например, стероидных средств, упомянутых выше), иммуносупрессивного средства (например, циклоспорина, такролимуса или финголимода) и белимумаба.
[0101] Например, когда биспецифическое антитело против PD-1/CD3 по настоящему изобретению применяют для предотвращения, подавления симптомов прогрессирования или рецидива и/или лечения ревматоидного артрита, его можно использовать в комбинации с любым одним или более средством (средствами), выбираемыми из стероидного средства (например, стероидных средств, упомянутых выше), противоревматического средства (например, метотрексата, сульфазалазина, буцилламина, лефлуномида, мизорибина, такролимуса и тому подобное), антицитокинового средства (например, инфликсимаба, адалимумаба, тоцилизумаба, этанерцепта, голимумаба, сертолизумаба и тому подобное) и абатацепта и тому подобное.
[0102] В случае применения биспецифического антитела против PD-1/CD3 по настоящему изобретению для предотвращения, подавления симптомов прогрессирования или рецидива и/или лечения другого аутоиммунные заболевания, биспецифическое антитело против PD-1/CD3 по настоящему изобретению можно использовать в комбинации с любым одним или более вышеупомянутым другим средством (средствами).
[0103] В настоящем документе настоящее изобретение будет описано более подробно с помощью следующих примеров, но объем настоящего изобретения ими не ограничен. Специалист в данной области может сделать разные изменения и модификации на основе описания настоящего изобретения, и такие изменения и модификации также включены в настоящее изобретение.
Примеры
[0104] Пример 1: Иммунизация мышей MeMo с использованием рекомбинантного человеческого белка слияния PD-1-Fc
В качестве способа получения первого плеча, специфически связывающегося с PD-1, по настоящему изобретению, выбран способ иммунизации мышей MeMo (см. WO2009/157771) с рекомбинантным человеческим белком PD-1. Мыши MeMo представляют собой мышей, генетически модифицированных таким образом, чтобы связать фрагмент гена, содержащий нерекомбинантный участок гена тяжелой цепи V человека, D участок гена и J участок гена, а также рекомбинантный ген зародышевой линии κ легкой цепи IgVκ1-39*01/IGJκ1*01 человека, с мышиным геном константной области. Путем прямой иммунизации можно получить разнообразие мышей MeMo с белком-мишенью антитела, антителами, состоящими из тяжелых цепей и обычных легких цепей.
[0105] Двенадцать мышей MeMo MS5B/MS9 в возрасте 12-16 недель иммунизировали рекомбинантным человеческим белком слияния PD-1-Fc (системы R&D, серийный номер 1086-PD), который эмульсифицировали с использованием адъюванта MM Gerbu (Gerbu Biotechnik, серийный номер #3001) с интервалом 14 дней. На 0, 14 и 28 день после иммунизации подкожно вводили рекомбинантный человеческий слитый белок PD-1-Fc. Позже подкожно вводили рекомбинантный человеческий слитый белок PD-1-Fc, растворенный в PBS. На 21, 35, 56, 77 и 98 день после иммунизации титр антител в сыворотке оценивали с помощью проточной цитометрии с использованием линий Т-клеток HEK293 с принудительной экспрессией человеческого PD-1. Когда линии T-клеток HEK293 с принудительной экспрессией человеческого PD-1 окрашивали в разведенной в 1000 раз сыворотке, для конструирования библиотеки фагового дисплея в качестве контроля использовали мышиную лимфатическую ткань, значение MFI которой было не менее чем в три раза выше чем, значение MFI линий T-клеток HEK293, не экспрессирующих человеческий PD-1. Мышей, удовлетворяющих критериям создания конструкции библиотеки, дополнительно иммунизировали рекомбинантным белком слияния PD-1-Fc в течение трех дней с даты оценки титра антител, и у них собирали селезенки и паховые лимфатические узлы. Мышей, у которых титр антител в сыворотке против PD-1 человека и PD-1 макака-крабоеда составлял 1/100 или более и титр антител не увеличивался при дополнительной иммунизации, также подвергали воздействию такого же способа, а затем у них собирали селезенки и паховые лимфатические узлы. Из этих лимфоидных тканей извлекали РНК, а затем проводили синтез кДНК.
[0106] Пример 2: Конструирование библиотеки фагового дисплея для получения антитела против PD-1, имеющего первое плечо, специфически связывающееся с PD-1 (иммунизация белком)
Реакцию ПЦР проводили с использованием ДНК, полученной в примере 1, и праймеров, специфических к семейству вариабельных областей тяжелой цепи иммуноглобулина. Полученный продукт ПЦР расщепляли ферментами рестрикции SfiII и XhoI и вводили в фагмидный вектор MV1473 [имеющий ген (ген зародышевой линии κ легкой цепи IgVκ1-39*01/IGJκ1*01 человека), кодирующий обычную легкую цепь], расщепленный теми же ферментами рестрикции, для конструирования библиотеки.
[0107] Пример 3: Скрининг антитела против PD-1, имеющего первое плечо, специфически связывающееся с PD-1
Фаговый отбор на основе свойства связывания с PD-1 проводили с использованием планшетов, покрытых человеческим белком слияния PD-1-Fc, человеческим меченым белком слияния PD-1-His, меченым белком слияния PD-1-His макаки-крабоеда или мышиным меченым белком слияния PD-1-His. При использовании человеческого белка слияния PD-1-Fc во время инкубации с фагом добавляли человеческий IgG (SIGMA, серийный номер I4506) для абсорбции Fc-реактивных клонов. Обогащали связывающееся фаги, которые могут связываться с человеческим PD-1, PD-1 макаки-крабоеда и мышиным PD-1. фаги, которые могут связываться с PD-1 макаки-крабоеда, обогащали путем использования отбора линий Т-клеток HEK293, экспрессирующих PD-1 макаки-крабоеда. Для получения эталонного планшета получали клоны TG1 штамма Escherichia coli, трансформированные фагами, полученными путем отбора.
[0108] Кроме того, на основе свойства связывания с PD-1 на планшете, покрытом человеческим белком слияния PD-1-Fc, проводили фаговый отбор с использованием экстракта из периплазматического пространства клонов, полученных в вышеупомянутом отборе. Здесь следует заметить, что в качестве критериев отбора клоны с сигналами, в три раза превышающими сигналы (значение OD450), полученные из лунок отрицательного контроля (PBS), определили в качестве положительных клонов.
[0109] Пример 4: последовательность ДНК для клонов-кандидатов в антитело против PD-1, имеющее первое плечо, специфически связывающееся с PD-1
Получали последовательность ДНК для гена вариабельной области тяжелой цепи положительных клонов, полученных путем скрининга в примере 3. Проанализированные последовательности ДНК классифицировали на суперкластеры (группа, имеющая CDR3 одинаковой длины, и аминокислотная последовательность CDR3 составляет 70% или является более гомологичной) и кластеры (группа, в которой аминокислотные последовательности CDR3 тяжелой цепи - одинаковые). Получили девятьсот и двадцать четыре клона, которые классифицировали на суперкластеры 146 типов и кластеры 194 типов.
[0110] Пример 5: Скрининг на основе оценки свойства связывания с клетками, экспрессирующими PD-1
Из каждого из классифицированных суперкластеров для их выделения скринировали клоны моноклонального антитела против PD-1, удовлетворяющие следующим условиям:
(1) соматическую мутацию (мутации) вводили в CDR область (области) с высокой частотой;
(2) включен ген зародышевой линии VH с высокой частотой использования, и
(3) получали высокий сигнал при скрининге свойства связывания с человеческим белком слияния PD-1-Fc.
[0111] Оценку проводили путем обнаружения связывания с линиями клеток CHO-S, экспрессирующими человеческий PD-1, и линиями клеток CHO-S, экспрессирующими PD-1 макаки-крабоеда, с поликлональными антителами против мышиного IgG с использованием Fab-фрагментов, содержащихся в этих экстрактах из периплазматического пространства. Среди оцененных 117 клонов (105 типов кластеров) признали, что 22 клона, содержащих моноклональное антитело против PD-1, клоны PD1-1, PD1-2, PD1-3 и PD1-4 могут связываться с линиями клеток CHO-S, экспрессирующими человеческий PD-1.
[0112] Пример 6: Получения продукта моноклонального антитела против PD-1 с замененными аминокислотами, имеющего первое плечо, специфически связывающееся с PD-1
Клон PD1-1 и PD1-4 содержит мотив дезамидирования (Asn-Gly) в каркасе 4 вариабельной области тяжелой цепи, соответственно. Для получения первого плеча с уменьшенным риском дезамидирования получили вариант, в котором был преобразован мотив дезамидирования. Клон PD1-5 получили таким образом, что аспарагин (Asn) в позиции 119 согласно системе нумерации ЕС клона PD1-4 был заменен на глютамин с помощью хорошо известного метода сайт-специфической мутации, которая была выделена. Свойство связывания с экспрессирующими человеческий PD-1 клетками CHO-S этого клона было одинаковым с клоном PD1-4.
[0113] Пример 7: Скрининг моноклональных антител против CD3, имеющих второе плечо, специфически связывающееся с CD3
Для получения Fab, связывающегося с CD3, имеющего большую стабильность и кроме того уменьшенную гетерогенность заряда, антитело против CD3, имеющее «второе плечо, специфически связывающееся с CD3», по настоящему изобретению получали с помощью следующего способа с использованием клона антител против CD3, имеющих VH клона 15C3 антитела против CD3, описанного в WO2005/118635 и обычной легкой цепи IGVK1-39/JK1.
[0114] За счет преобразования подчеркнутого 55-го глицина в аминокислотной последовательности VH 15C3, показанного на фиг. 10, в аланин получили клон CD3-1 антител против CD3, имеющих свойство связывания с человеческим CD3, одинаковое с клоном, и имеющих улучшенную гетерогенность заряда.
[0115] Кроме того, для получения множества Fab, связывающихся с CD3, для улучшения взаимодействия VH/VL с обычной легкой цепью (IgVκ1-39*01/IGJκ1*01) на основе VH клона CD3-1 сконструировали библиотеку фагового дисплея, экспрессирующую множество Fab, содержащих варианты VH клона CD3-1, в котором этот аминокислотный остаток был заменен. Эту фаговую библиотеку подвергли скринингу с использованием клеток HBP-ALL или рекомбинантного человеческого белка CD3ε-Fc. Фаги, связывающееся с рекомбинантным человеческим белком CD3ε-Fc, химически элюировали и использовали для повторного заражения бактерий. Извлекли множество выживших колоний бактерий, затем из них извлекли фаги, а затем скринировали с помощью проточной цитометрии на основе связывания с CD3, экспрессируемым на поверхности клетки. Все фаги, связывающееся с CD3, подвергали ПЦР для отбора колоний для амплификации кДНК, кодирующей их VH, и определяли их последовательности ДНК.
[0116] В результате полученный клон CD3-2 антител против CD3, имеющих VH, содержащую аминокислотную последовательность SEQ ID NO:36, проявлял свойство связывания с CD3 и однородность заряда, эквивалентную клону CD3-1.
[0117] Пример 8: Получение биспецифического моноклонального антитела против PD-1/CD3
Вектор экспрессии, экспрессирующий каждую тяжелую цепь первого плеча, специфически связывающегося с PD-1, получили путем связывания ДНК, кодирующих вариабельные области тяжелой цепи клонов PD1-1 - PD1-5 и PD1-6 моноклонального антитела против PD-1, соответственно, выбранных в примере 5, с ДНК, кодирующими константные области тяжелых цепей IgG1, соответственно. С другой стороны, вектор экспрессии, экспрессирующий тяжелую цепь второго плеча, специфически связывающегося с CD3, получили путем связывания ДНК, кодирующей вариабельную область тяжелой цепи клона CD3-2 моноклонального антитела против CD3, выбранного в примере 7, с ДНК, кодирующей константную область тяжелой цепи IgG1. В настоящем документе в качестве генов, экспрессирующих такие константные области тяжелых цепей, что касается первого плеча, специфически связывающегося с PD-1, использовали ген, экспрессирующий Fc-область, имеющую вариант L351D/L368E (вариант DE). Что касается второго плеча, специфически связывающегося с CD3, использовали ген, экспрессирующий Fc-область, имеющую вариант L351K/T366K (вариант KK). Эти векторы экспрессии конструировали таким образом, чтобы они дополнительно содержали ген, кодирующий обычную легкую цепь IGVK1-39/JK1 таким образом, чтобы экспрессировать вместе. Кроме того, гены, экспрессирующие эти константные области тяжелых цепей, модифицировали для экспрессии тех, в которых лейцин в позиции 235 был заменен глицином, и кроме того глицин в позиции 236 был заменен аргинином в константной области тяжелой цепи, чтобы устранить активность эффектора Fc, и кроме того лизин в позиции 447 на С-конце константной области тяжелой цепи был удален, чтобы избежать процессирования после трансляции. Оба этих вектора экспрессии осуществляли перенос генов в клетку Free Style 293F для получения антител в супернатантах культуры. Супернатанты культуры собирали, а затем обрабатывали посредством аффинной хроматографии белка А для очистки клона PD1-1(Bi), клона PD1-2(Bi), клона PD1-3(Bi), клона PD1-4(Bi) и клона PD1-5(Bi) биспецифических моноклональных антител против PD-1/CD3 по настоящему изобретению, соответственно. Кроме того, клон PD1-6(Bi) также получен с помощью того же способа. Здесь следует заметить, что эти клоны биспецифических моноклональных антител против PD-1/CD3 имеют первые плечи, специфически связывающиеся с PD-1, полученные из моноклонального антитела против PD-1: клоны PD1-1, PD1-2, PD1-3, PD1-4 и PD1-5, а также клон PD1-6, используемые при их получении, они соответствуют этим клонам моноклональных антител против PD-1, соответственно.
[0118] Пример 9: Оценка свойства связывания биспецифического моноклонального антитела против PD-1/CD3
Посредством анализа Biacore с использованием человеческого внеклеточного рекомбинантного белка PD-1, слитого с человеческим IgG1-Fc, или меченого 6×His внеклеточного рекомбинантного белка слияния PD-1 макаки-крабоеда, оценивали аффинность связывания с каждым рекомбинантным белком PD-1 первого плеча биспецифических моноклональных антител против PD-1/CD3, полученных в примере 8. Здесь следует заметить, что для иммобилизации рекомбинантных белков использовали сенсорный чип Series S Sensor Chip CM5 (GE Health Care, серийный номер 29-1049-88). Аналогично, посредством анализа Biacore с использованием внеклеточного рекомбинантного белка CD3δ/CD3ε, слитого с человеческим IgG1-Fc, оценивали аффинность связывания с CD3 второго плеча антител. На фиг. 11 представлена аффинность связывания (значение Kd) с PD-1 первого плеча и аффинность связывания с CD3δ/CD3ε второго плеча в отношении каждого клона.
[0119] Пример 10: Подтверждение свойства связывания биспецифического моноклонального антитела против PD-1/CD3
Подтвердили, что биспецифические моноклональные антитела против PD-1/CD3, полученные в примере 8, могут специфически связываться с PD-1 и CD3, одновременно.
[0120] Сначала, клоны PD1-1(Bi) - PD1-6(Bi) добавляли к линиям T-клеток Jurka с дефицитом человеческого PD-1 (линия T-клеток человека), экспрессирующим человеческий CD3, соответственно, и которые инкубировали на льду в течение 15 минут. После промывания этих клеток добавляли растворимые рекомбинантные белки PD-1 (R&D системы, серийный номер 1086-PD-050), меченые 3-кратным количеством биотина, и инкубировали на льду в течение 15 минут. После промывания этих клеток к ним добавляли 100 мкл меченого Alexa Fluor 488 стрептавидина 1,25 мкг/мл (BioLegend, серийный номер 405235) и инкубировали на льду в течение 15 минут. После промывания этих клеток с помощью проточной цитометрии оценивали связывающееся количество растворимого рекомбинантного белка PD-1. На фиг. 12 представлены результаты анализа.
[0121] Все клоны связывались с PD-1 и CD3 одновременно. Здесь следует заметить, что неспецифическое связывание в этой системе связывания обнаружено не было.
[0122] Пример 11: Оценка свойства связывания первого плеча биспецифического моноклонального антитела против PD-1/CD3
Для оценки результатов связывания с PD-1/PD-L1 первого плеча биспецифических моноклональных антител против PD-1/CD3, полученных в примере 8, проводили анализ конкурентного связывания в отношении связывания с PD-1 клонов биспецифических моноклональных антител и растворимых рекомбинантных белков PD-L1. Сначала, клоны PD1-1(Bi) - PD1-6(Bi) добавляли к линиям клеток CHO-S, экспрессирующим человеческий PD-1, соответственно, и инкубировали на льду в течение 30 минут. К ним добавляли растворимые рекомбинантные белки PD-L1 (R&D системы, серийный номер 156-B7-100), меченые 1/20 количеством биотина, и инкубировали на льду в течение 30 минут. После промывания этих клеток к ним добавляли меченый PE стрептавидин (BD Pharmingen, серийный номер 554061) и инкубировали на льду в течение 30 минут. После промывания этих клеток с помощью проточной цитометрии оценивали связывающееся количество растворимых рекомбинантных белков PD-L1. На фиг. 13 представлены результаты анализа.
[0123] Хотя клоны PD1-1(Bi) - PD1-5(Bi) представлены в количестве в 20 раз больше количества растворимого рекомбинантного белка PD-L1, они обеспечивали связывание растворимого рекомбинантного белка PD-L1 с PD-1. С другой стороны, PD1-6(Bi) полностью ингибировал связывание растворимого рекомбинантного белка PD-L1 с PD-1 в тех же условиях.
[0124] Пример 12: супрессирующее действие In vitro биспецифического моноклонального антитела против PD-1/CD3 на активированные T-клетки CD4
Супрессирующее действие активированных T-клеток на выработку IFN-γ оценивали с использованием CD4-положительных T-клеток, полученных из периферической крови здорового человека (LONZA, серийный номер 2W-200) (человеческие T-клетки). Человеческие T-клетки высевали на планшет для культивирования клеток, на котором антитела против TCRVβ8 человека (Thermo Scientific, серийный номер TCR1750) находились в твердой фазе, к ним добавляли антитела против CD28 человека (BioLegend, серийный номер 302923), и подвергали активирующей обработке в течение 72 часов. В настоящем документе, человеческие T-клетки, которые подвергали активирующей обработке, культивировали в течение ночи в свежей среде, содержащей 100 Единиц/мл человеческого IL-2 (R&D системы, серийный номер 202-IL). Кроме того, собранные человеческие T-клетки высевали на другой планшет для культивирования клеток, на котором антитела против TCRVβ8 человека находились в твердой фазе, и к ним также добавляли антитела против CD28 человека, а затем снова проводили активирующую обработку. В это время к ним добавляли клоны PD1-1(Bi) - PD1-6(Bi), соответственно, а затем через 96 часов после повторной активирующей обработки с помощью ELISA количественно оценивали IFN-γ, содержащийся в супернатанте культуры (пг/мл). На фиг. 14 представлены результаты. Подтвердили супрессирующую активность выработки IFN-γ клонов PD1-1(Bi) - PD1-5(Bi). Супрессирующая активность выработки IFN-γ клона PD1-6(Bi) имеет тенденцию к уменьшению больше, чем у других клонов. В качестве контрольного антитела использовали антитело, полученное путем иммунизации столбнячным анатоксином по той же методике, как для получения первого плеча, которое представляет собой не-специфическое антитело.
[0125] Пример 13: результаты In vivo биспецифического моноклонального антитела против PD-1/CD3 в экспериментальной мышиной модели аллергического энцефаломиелита (модель EAE)
Результаты In vivo биспецифического моноклонального антитела против PD-1/CD3 по настоящему изобретению оценивали в модели EAE с использованием мышей C57BL/6 с нокином человеческого CD3ε/человеческого PD-1, у которых ген CD3ε и ген PD-1 заменили человеческим геном CD3ε и человеческим геном PD-1, соответственно. Погибшие микобактерии туберкулеза H37Ra (BD Biosciences, серийный номер 231141) и неполный адъювант Фрейнда (BD Biosciences, серийный номер 263910) смешивали друг с другом для получения полного адъюванта Фрейнда (CFA), содержащего 4 мг/мл погибших микобактерий туберкулеза H37Ra. 1 мг/мл пептида MOG (ANASPEC, серийный номер AS-60130) и равное количество CFA смешивали друг с другом для получения эмульсии в качестве стимулирующего средства модели EAE. 200 мкл стимулирующего средства подкожно вводили в корень основания хвоста мышей C57BL/6. В день проведения иммунизации и на 2 день в хвостовую вену вводили 200 мкл 1 мкг/мл коклюшного токсина (SIGMA-ALDRICH, серийный номер P7208), соответственно. В настоящем документе, на 6 и 7 день иммунизации мышам C57BL/6 один раз в день внутрибрюшинно вводили 2 мг/кг клонов PD1-1 (Bi) - PD1-6 (Bi), соответственно. Неврологические симптомы после иммунизации оценивали в соответствии с методом Onuki, et al. (Onuki M, et al. Microsc Res Tech 2001; 52: 731-9). В баллах оценивали степень неврологических симптомов (норма: 0 баллов, расслабление хвоста: 1 балл, частичный паралич задних конечностей: 2 балла, паралич задних конечностей: 3 балла, паралич передних конечностей: 4 балла и умирание или смерть: 5 баллов). Если наблюдалось множество неврологических симптомов, в качестве неврологического симптома в день оценки использовали более высокий балл. Неврологический симптом умерших мышей оценивали до 5 до завершения наблюдения. На фиг. 15-17 представлены результаты оценок. Здесь следует заметить, что мышей C57BL/6 с нокином человеческого CD3ε/человеческого PD-1 получали путем скрещивания мыши с нокином человеческого CD3ε, полученной согласно способу, описанному в Genesis. 2009 Jun; 47(6): 414-22, с мышью с нокином человеческого PD-1 с помощью хорошо известного способа.
[0126] В модели EAE начало неврологических симптомов было заметно подавлены в отношении любого из клонов PD1-1 - PD1-5(Bi), но в отношении клона PD1-6(Bi) существенного супрессирующего действия не наблюдалось.
[0127] Пример 14: Оценка действия in vitro биспецифического моноклонального антитела против PD-1/CD3 на высвобождение цитокина из моноцита периферической крови человека
С целью анализа активности высвобождения цитокина биспецифического моноклонального антитела против PD-1/CD3, провели эксперимент, в котором к человеческим мононуклеарным клеткам периферической крови (в настоящем документе, называемым «PBMC человека») добавляли клоны биспецифических моноклональных антител против PD-1/CD3 по настоящему изобретению или биспецифическое scDb против PD-1/CD3 (J110×UCHT1), раскрытое в патентном документе 2. Каждый клон биспецифических моноклональных антител против PD-1/CD3 и J110×UCHT1 добавляли к PBMC человека (LONZA, серийный номер CC-2702) таким образом, чтобы их концентрации составляли 30 мкг/мл и 10 мкг/мл, соответственно, а затем культивировали в течение 24 часов. После культивирования в течение 24 часов каждый IL-2, содержащийся в их супернатантах культуры, количественно оценивали с помощью мультиплексного иммуноанализа (BIO-RAD, серийный номер M50000007A). На фиг. 18 представлены результаты. Здесь следует заметить, что количество выработки IL-2 (пг/мл) на фигуре представлено в виде значение ± стандартная ошибка (N=3).
[0128] J110×UCHT1 заметно индуцировало выработку IL-2. Однако выработка IL-2 в отношении любого клона биспецифических моноклональных антител против PD-1/CD3 была низкой.
[0129] Пример 15: Оценка перекрестной конкурентной активности для связывания с PD-1 каждого клона биспецифических моноклональных антител против PD-1/CD3 с PD1-5(Bi)
Проводили перекрестный конкурентный анализ для оценки перекрестной конкурентной активности связывания с PD-1 каждого клона PD1-1(Bi) - PD1-5(Bi) биспецифического моноклонального антитела против PD-1/CD3, полученного в примере 8, с PD1-5(Bi).
[0130] Сначала, к клеткам линии CHO-S, экспрессирующим человеческий PD-1, добавляли клон PD1-5(Bi), затем инкубировали на льду в течение двадцати минут. Кроме того, к этим клеткам добавляли сотую часть количества меченых биотином клонов PD1-1(Bi) - PD1-5(Bi), сравниваемых с уже добавленным клоном PD1-5(Bi), соответственно, затем инкубировали на льду в течение 20 минут. Те клетки, к которым добавляли меченый PE стрептавидин (BD Pharmingen, номер модели 554061) промывали, а затем инкубировали на льду в течение 20 минут. После промывания этих клеток связывающееся количество меченых биотином клонов PD1-1(Bi) - PD1-5(Bi) измеряли с использованием проточной цитометрии. На фиг. 19 представлен этот результат.
[0131] Было показано, что клон PD1-5(Bi) может ингибировать каждое связывание клонов PD1-1(Bi) - PD1-5(Bi) с PD-1, и таким образом, что клон PD1-5(Bi) может перекрестно конкурировать с их связыванием с PD-1.
Промышленная применимость
[0132] Биспецифическое антитело или фрагмент антитела против PD-1/CD3 по настоящему изобретению полезно для профилактики, подавления симптомов прогрессирования или рецидива и/или лечения аутоиммунных заболеваний или болезни «трансплантат против хозяина» (GVHD).
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ОНО ФАРМАСЬЮТИКАЛ КО., ЛТД.
<120> Биспецифическое антитело
<130> P18-199WO
<150> JP 2018-021498
<151> 2018-02-09
<150> JP 2018-153149
<151> 2018-08-16
<160> 41
<170> PatentIn version 3.5
<210> 1
<211> 127
<212> Белок
<213> Homo sapiens
<400> 1
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Gln Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Gly Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Phe Ala Gln Gly Phe
50 55 60
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His
100 105 110
Phe Met Asp Val Trp Gly Asn Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 2
<211> 127
<212> Белок
<213> Homo sapiens
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Gln Pro Gly Val
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Gly Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Asn Thr Gly Asn Pro Thr Tyr Ala Gln Gly Phe
50 55 60
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Leu Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His
100 105 110
Tyr Met Glu Val Trp Gly Lys Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 3
<211> 127
<212> Белок
<213> Homo sapiens
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Met Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Tyr Ala Gln Gly Phe
50 55 60
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr Tyr
100 105 110
Tyr Met Asp Val Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 4
<211> 127
<212> Белок
<213> Homo sapiens
<400> 4
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Gln Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Ala Leu His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Phe Ala Gln Gly Phe
50 55 60
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His
100 105 110
Phe Met Asp Val Trp Gly Asn Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 5
<211> 127
<212> Белок
<213> Homo sapiens
<400> 5
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Gln Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Ala Leu His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Phe Ala Gln Gly Phe
50 55 60
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His
100 105 110
Phe Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 6
<211> 5
<212> Белок
<213> Homo sapiens
<400> 6
His Tyr Gly Leu His
1 5
<210> 7
<211> 17
<212> Белок
<213> Homo sapiens
<400> 7
Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Phe Ala Gln Gly Phe Thr
1 5 10 15
Gly
<210> 8
<211> 18
<212> Белок
<213> Homo sapiens
<400> 8
Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His Phe Met
1 5 10 15
Asp Val
<210> 9
<211> 5
<212> Белок
<213> Homo sapiens
<400> 9
His Tyr Gly Leu His
1 5
<210> 10
<211> 17
<212> Белок
<213> Homo sapiens
<400> 10
Trp Ile Asn Thr Asn Thr Gly Asn Pro Thr Tyr Ala Gln Gly Phe Thr
1 5 10 15
Gly
<210> 11
<211> 18
<212> Белок
<213> Homo sapiens
<400> 11
Gly Asp Leu Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His Tyr Met
1 5 10 15
Glu Val
<210> 12
<211> 5
<212> Белок
<213> Homo sapiens
<400> 12
His Tyr Ala Leu His
1 5
<210> 13
<211> 17
<212> Белок
<213> Homo sapiens
<400> 13
Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Tyr Ala Gln Gly Phe Thr
1 5 10 15
Gly
<210> 14
<211> 18
<212> Белок
<213> Homo sapiens
<400> 14
Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr Tyr Tyr Met
1 5 10 15
Asp Val
<210> 15
<211> 5
<212> Белок
<213> Homo sapiens
<400> 15
His Tyr Ala Leu His
1 5
<210> 16
<211> 17
<212> Белок
<213> Homo sapiens
<400> 16
Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Phe Ala Gln Gly Phe Thr
1 5 10 15
Gly
<210> 17
<211> 18
<212> Белок
<213> Homo sapiens
<400> 17
Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His Phe Met
1 5 10 15
Asp Val
<210> 18
<211> 5
<212> Белок
<213> Homo sapiens
<400> 18
His Tyr Ala Leu His
1 5
<210> 19
<211> 17
<212> Белок
<213> Homo sapiens
<400> 19
Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Phe Ala Gln Gly Phe Thr
1 5 10 15
Gly
<210> 20
<211> 18
<212> Белок
<213> Homo sapiens
<400> 20
Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His Phe Met
1 5 10 15
Asp Val
<210> 21
<211> 98
<212> Белок
<213> Homo sapiens
<400> 21
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Asn Thr Gly Asn Pro Thr Tyr Ala Gln Gly Phe
50 55 60
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Cys Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 22
<211> 98
<212> Белок
<213> Homo sapiens
<400> 22
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 23
<211> 329
<212> Белок
<213> Homo sapiens
<400> 23
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Gly Arg Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Asp Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Glu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 24
<211> 329
<212> Белок
<213> Homo sapiens
<400> 24
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Gly Arg Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Lys Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Lys Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 25
<211> 107
<212> Белок
<213> Homo sapiens
<400> 25
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 26
<211> 11
<212> Белок
<213> Homo sapiens
<400> 26
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 27
<211> 7
<212> Белок
<213> Homo sapiens
<400> 27
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 28
<211> 9
<212> Белок
<213> Homo sapiens
<400> 28
Gln Gln Ser Tyr Ser Thr Pro Pro Thr
1 5
<210> 29
<211> 107
<212> Белок
<213> Homo sapiens
<400> 29
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 30
<211> 381
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (1)..(381)
<400> 30
cag gtg cag ctg gtg caa tct ggg tct gag ttg aag cag cct ggg gcc 48
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Gln Pro Gly Ala
1 5 10 15
tca gtg aag gtt tcc tgt aag gct tct gga tac acc ttc act cac tat 96
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
ggt ttg cat tgg gtg cga cag gcc cct gga caa ggg ctt gag tgg atg 144
Gly Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
gga tgg ctc aac acc aac act gag aac cca acg ttt gcc cag ggc ttc 192
Gly Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Phe Ala Gln Gly Phe
50 55 60
aca gga cgg ttt gtc ttc tcc ttg gac acc tct gtc acc acg gca tat 240
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Thr Thr Ala Tyr
65 70 75 80
ctg cag atc agc agc ctg aag gct gag gac act gcc gta tat tac tgt 288
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcg aga ggg gat atg gta gta ccg act act ata tgg aac tac tac cac 336
Ala Arg Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His
100 105 110
ttc atg gac gtc tgg ggc aac ggc acc ctg gtc acc gtc tcg agt 381
Phe Met Asp Val Trp Gly Asn Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 31
<211> 381
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (1)..(381)
<400> 31
cag gtg cag ctg gtg caa tct ggg tct gag ttg aag cag cct ggg gtc 48
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Gln Pro Gly Val
1 5 10 15
tca gtg aag gtt tcc tgc aag gct tct gga tac acc ttc act cac tat 96
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
ggt tta cat tgg gtg cga cag gcc cct gga caa ggg ctt gag tgg atg 144
Gly Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
gga tgg atc aac acc aac act ggg aac cca acg tat gcc cag ggc ttc 192
Gly Trp Ile Asn Thr Asn Thr Gly Asn Pro Thr Tyr Ala Gln Gly Phe
50 55 60
aca gga cgg ttt gtc ttc tcc ttg gac acc tct gtc agc acg gca tat 240
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
ctg cag atc agc agc cta aag gct gaa gac act gcc gtg tat tac tgt 288
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcg aga ggg gat tta gta gta cca act act ata tgg aac tac tac cac 336
Ala Arg Gly Asp Leu Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His
100 105 110
tac atg gag gtc tgg ggc aaa ggc acc ctg gtc acc gtc tcg agt 381
Tyr Met Glu Val Trp Gly Lys Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 32
<211> 381
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (1)..(381)
<400> 32
cag gtg cag ctg gtg caa tct ggg tct gag ttg aag aag cct ggg gcc 48
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
tca gtg atg gtt tcc tgc aag gct tct gga tac acc ttc act cac tat 96
Ser Val Met Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
gct ttg cat tgg gtg cgc cag gcc cct gga caa ggg ctt gag tgg atg 144
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
gga tgg ctc aat acc aac act gag aat cca acg tat gcc cag ggc ttc 192
Gly Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Tyr Ala Gln Gly Phe
50 55 60
aca gga cgg ttt gtc ttc tcc ttg gac acc tct gtc acc acg gca tat 240
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Thr Thr Ala Tyr
65 70 75 80
ctg cag atc aac agc cta aag gct gag gac act gcc gtg tat tac tgt 288
Leu Gln Ile Asn Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcg aga ggg gat atg gta gta cca act act ata tgg aac tac tac tac 336
Ala Arg Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr Tyr
100 105 110
tac atg gac gtc tgg ggc aaa ggg acc acg gtc acc gtc tcg agt 381
Tyr Met Asp Val Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 33
<211> 381
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (1)..(381)
<400> 33
cag gtg cag ctg gtg caa tct ggg tct gag ttg aag cag cct ggg gcc 48
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Gln Pro Gly Ala
1 5 10 15
tca gtg aag gtt tcc tgt aag gct tct gga tac acc ttc act cac tat 96
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
gct ttg cat tgg ttg cga cag gcc cct gga caa ggg ctt gag tgg atg 144
Ala Leu His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
gga tgg ctc aac acc aac act gag aac cca acg ttt gcc cag ggc ttc 192
Gly Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Phe Ala Gln Gly Phe
50 55 60
aca gga cgt ttt gtc ttc tct ttg gac acc tct gtc acc acg gca tat 240
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Thr Thr Ala Tyr
65 70 75 80
ctg cag atc agc agc ctg aag gct gag gac act gcc gta tat tac tgt 288
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcg aga ggg gat atg gta gta ccg act act ata tgg aac tac tac cac 336
Ala Arg Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His
100 105 110
ttc atg gac gtc tgg ggc aac ggg acc acg gtc acc gtc tcg agt 381
Phe Met Asp Val Trp Gly Asn Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 34
<211> 381
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (1)..(381)
<400> 34
cag gtg cag ctg gtg caa tct ggg tct gag ttg aag cag cct ggg gcc 48
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Gln Pro Gly Ala
1 5 10 15
tca gtg aag gtt tcc tgt aag gct tct gga tac acc ttc act cac tat 96
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
gct ttg cat tgg ttg cga cag gcc cct gga caa ggg ctt gag tgg atg 144
Ala Leu His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
gga tgg ctc aac acc aac act gag aac cca acg ttt gcc cag ggc ttc 192
Gly Trp Leu Asn Thr Asn Thr Glu Asn Pro Thr Phe Ala Gln Gly Phe
50 55 60
aca gga cgt ttt gtc ttc tct ttg gac acc tct gtc acc acg gca tat 240
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Thr Thr Ala Tyr
65 70 75 80
ctg cag atc agc agc ctg aag gct gag gac act gcc gta tat tac tgt 288
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcg aga ggg gat atg gta gta ccg act act ata tgg aac tac tac cac 336
Ala Arg Gly Asp Met Val Val Pro Thr Thr Ile Trp Asn Tyr Tyr His
100 105 110
ttc atg gac gtc tgg ggc cag ggg acc acg gtc acc gtc tcg agt 381
Phe Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 35
<211> 321
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (1)..(321)
<400> 35
gac atc cag atg acc cag tct cca tcc tcc ctg tct gca tct gta gga 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
gac aga gtc acc atc act tgc cgg gca agt cag agc att agc agc tac 96
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
tta aat tgg tat cag cag aaa cca ggg aaa gcc cct aag ctc ctg atc 144
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
tat gct gca tcc agt ttg caa agt ggg gtc cca tca agg ttc agt ggc 192
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
agt gga tct ggg aca gat ttc act ctc acc atc agc agt ctg caa cct 240
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
gaa gat ttt gca act tac tac tgt caa cag agt tac agt acc cct cca 288
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Pro
85 90 95
acg ttc ggc caa ggg acc aag gtg gag atc aaa 321
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 36
<211> 118
<212> Белок
<213> Homo sapiens
<400> 36
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gln Ile Trp Tyr Asn Ala Arg Lys Gln Glu Tyr Ser Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Thr Gly Tyr Asn Trp Phe Asp Pro Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 37
<211> 5
<212> Белок
<213> Homo sapiens
<400> 37
Ser Tyr Gly Met His
1 5
<210> 38
<211> 17
<212> Белок
<213> Homo sapiens
<400> 38
Gln Ile Trp Tyr Asn Ala Arg Lys Gln Glu Tyr Ser Asp Ser Val Lys
1 5 10 15
Gly
<210> 39
<211> 9
<212> Белок
<213> Homo sapiens
<400> 39
Gly Thr Gly Tyr Asn Trp Phe Asp Pro
1 5
<210> 40
<211> 354
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (1)..(354)
<400> 40
cag gtg cag ctg gtg cag tct ggc ggc gga gtg gtg cag ccc ggc aga 48
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
agc ctg aga ctg agc tgc gtg gcc agc ggc ttc acc ttc agc agc tac 96
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
ggc atg cac tgg gtc cgc cag gcc cct ggc aag gga ctg gaa tgg gtg 144
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
gcc cag atc tgg tac aac gcc cgg aag cag gaa tac tct gac agc gtg 192
Ala Gln Ile Trp Tyr Asn Ala Arg Lys Gln Glu Tyr Ser Asp Ser Val
50 55 60
aag ggc cgg ttc acc atc agc cgg gac aac agc aag aac acc ctg tac 240
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
ctg cag atg aac agc ctc cgg gcc gag gac acc gcc gtg tac tac tgt 288
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
acc cgg ggc acc ggc tac aat tgg ttc gac cct tgg ggc cag ggc acc 336
Thr Arg Gly Thr Gly Tyr Asn Trp Phe Asp Pro Trp Gly Gln Gly Thr
100 105 110
ctg gtc acc gtc tcc agt 354
Leu Val Thr Val Ser Ser
115
<210> 41
<211> 11
<212> Белок
<213> Homo sapiens
<400> 41
Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser
1 5 10
<---