Результат интеллектуальной деятельности: Трансформант Ogataea haglerorum - продуцент термостабильной α-амилазы
Вид РИД
Изобретение
Область техники
Изобретение относится к области биотехнологии и генетической инженерии и касается получения трансформанта дрожжей Ogataea haglerorum, продуцирующего термостабильную α-амилазу и содержащего в составе хромосомной ДНК экспрессионную кассету, в состав которой входит синтетическая последовательность гена с оптимизированными для метилотрофных дрожжей кодонами, кодирующая целевой фермент.
Уровень техники
α-Амилаза (α-1,4-глюкан-4-глюканогидролаза, Е.С.3.2.1.1) - эндо-фермент, гидролизующий α-1,4-гликозидные связи в молекуле крахмала и таким образом разлагающий амилозную компоненту крахмала.
α-Амилаза - один из лидеров мирового рынка ферментов, на долю которого приходится 25-30% рынка [Biotechnol Appl Biochem., 2021, 1-10. DOI: 10.1002/bab.2140].
Источником генов, кодирующих α-амилазы. являются растения, животные и микроорганизмы, однако доминирующим источником α-амилаз для промышленного применения являются бактерии и грибы [Process Biochem., 2003, 38, 1599-1616. https://doi.org/10.1016/S0032-9592(03)00053-α-Амилаза используется в пищевой промышленности для разжижения крахмалсодержащего растительного сырья с целью получения глюкозо-фруктозных сиропов. Ферментативная конверсия крахмала включает 3 стадии: желатинизации, разжижения и осахаривания. Первые две стадии протекают при высокой температуре: желатинизацию крахмальных гранул проводят при температуре 105-110°С и рН 5,8-6,5 в течение 5 мин, а разжижение крахмала осуществляют при температуре 95°С в течение 2-3 ч, поэтому требуются термостабильные α-амилазы, которые имеют температурный оптимум около 90°С [Appl Biochem Biotechnol., 2010, 160 (8), 2401-2414. DOI: 10.1007/s12010-009-8735-4].
Другое важное применение α-амилазы - текстильная промышленность, где ее используют для расшлихтовки тканей. Этот процесс протекает при высокой температуре (80°С) непродолжительное время (10 мин), и в нем используют термостабильные α-амилазы [WO 99/35325].
Также α-амилазы применяются в моющих средствах, в бумажной и спиртовой промышленности [Process Biochem., 2003, 38, 1599 - 1616. https://doi.org/10.1016/S0032-9592(03)00053-01.
Максимально требованиям промышленного процесса гидролиза крахмала соответствуют α-амилазы из различных видов Bacillus [US2012252101; СА2798504; US2012282672; Int J Biol Macromol., 2010, 47(2), 288-91. DOI: 10.1016/j.ijbiomac.2010.04.006].
Термостабильные α-амилазы из В. licheniformis, В. amiloliquefaciens и В. stearothermophilus и их мутантные варианты, имеющие высокую гомологию аминокислотных последовательностей (не менее 79%) и являющиеся индустриально важными, относят к классу Termamyl-like α-амилаз [WO 99/23211, US20030170769 А1]. Среди них α-амилаза из В. licheniformis отличается исключительной температурной стабильностью (более 80%) активности остается после прогрева при температуре 90°С в течение 30 мин, оптимальная температура активности - 80-85°С) и низкой потребностью в ионах кальция [J. of Biological Chemistry, 1989, 264(32), 18933-18938], далее следует α-амилаза из В. stearothermophilus (остаточная активность 60% после прогрева при 80°С в течение 60 мин [Applied and Environmental Microbiology, 1983, 46(5), 1059-1065], в то время как α-амилаза из В. amiloliquefaciens быстро инактивируется при 90°С (время полужизни при 90°С почти в 100 раз ниже, чем у α-амилазы из В. licheniformis), но обладает более высокой удельной активностью, чем α-амилаза из В. licheniformis [J. of Biological Chemistry, 1989, 264(32), 18933-18938; Can. J. Microbiol., 2004, 50, 1-17. doi: 10.1139/W03-076].
В источниках известности описаны продуценты термостабильной α-амилазы на основе метилотрофных дрожжей Komagataella phaffii (Pichia pastoris), которые являются широко используемым модельным организмом для экспрессии гетерологичных генов под контролем сильного регулируемого метанолом промотора гена АОХ1.
Описан трансформант P. pastoris GS115, содержащий ген с оптимизированными для дрожжей P. pastoris кодонами (BlAmy-opt), кодирующий природную α-амилазу В. licheniformis (GenBank М38570). Трансформант при культивировании в колбах в богатой среде продуцирует α-амилазу с активностью 420 ед./мл КЖ через 144 ч культивирования при 30°С [BioMed Research International, 2015, Article ID 248680, 9 P. http://dx.doi.org/10.1155/2015/248680].
Описан трансформант P. pastoris GS115, содержащий ген с предпочтительными для дрожжей P. pastoris кодонами (Pic-bla), кодирующий α-амилазу из В. licheniformis WX-02 (NCBI Reference Sequence: СР012110.1). Трансформант при культивировании в колбах в богатой среде продуцирует α-амилазу с активностью 900 ед./мл КЖ через 168 ч культивирования при 28°С [3 Biotech, 2019, 9, 427. https://doi.org/10.1007/s13205-019-1943-x].
Еще одной известной метилотрофной системой для гетерологичной экспрессии являются термотолерантные дрожжи Ogataea (Hansenula). Дрожжи рода Ogataea, как и дрожжи P. pastoris, обладают уникальной организацией и регуляцией метаболизма в присутствии метанола благодаря наличию сильных промоторов, индуцируемых метанолом. Подобно Р. pastoris, дрожжи рода Ogataea сочетают преимущества простоты выращивания на недорогой ростовой среде с высокой секретирующей способностью, а также при культивировании в биореакторе позволяют получать биомассу с высокой плотностью клеток, что способствует высокому выходу целевого продукта [FEMS Yeast Res., 2005, 5, 1079-1096; Microb. Cell Fact, 2006, 5, 39; Curr Microbiol. 2014, 69, 143-148. DOI 10.1007/s00284-014-0568-x; FEMS Microbiology Letters, 2019, 366, fnz052. doi: 10.1093/femsle/fnz052].
В отличие от P. pastoris дрожжи рода Ogataea являются термотолерантными, что позволяет проводить ферментацию при температуре 37°С. Повышение температуры процесса ферментации снижает контаминацию и затраты на охлаждение биореактора [Appl. Microbiol. Biotechnol., 2010, 85, 861-867. doi: 10.1007/s00253-009-2248-5] и в результате сокращает длительность ферментации.
Для дрожжей О. haglerorum разработаны генетические технологии конструирования штаммов-продуцентов, включая экспрессионные вектора и метод введения ДНК в клетки реципиента [Биотехнология, 2019, 35 (6), 51-56]. Дрожжи О. haglerorum использовали для получения продуцентов α-маннаназы из В. subtilis, фитазы из Е. coli [RU2747782, RU2764793, RU2771079].
В настоящее время для достижения свойств фермента, требуемых для ферментативного гидролиза крахмала, включающих высокую термостабильность и удельную активность, и низкую зависимость от ионов кальция используют гибридные белки (химеры), в частности, полученные путем объединения последовательностей ДНК, кодирующих α-амилазы из различных бацилл как дикого типа, так и мутантных [ЕР 0252666, WO 97/41213, WO 99/46399, WO 99/23211, US 2010144575, US 2012208251].
В качестве реципиентов для продукции α-амилазы для промышленного применения используют В. licheniformis, В. amyloliquefaciens, В. subtilis, В. stearothermophilus [Biotechnol Appl Biochem. 2021; 1-10. DOI: 10.1002/bab.2140].
В работе [WO 99/46399] описана гибридная α-амилаза типа Termamyl, зрелый пептид которой состоит с N-конца из аминокислотных остатков от α-амилазы из В. amyloliquefaciens, а с 36-ой аминокислоты из аминокислотных остатков от α-амилазы из В. licheniformis с заменами H156Y, А181Т, N190F, A209V Q264S.
Большим преимуществом дрожжей по сравнению с бациллярными продуцентами является то, что в них преимущественно секретируются рекомбинантные белки и мало собственных секреторных белков.
Однако известно, что процесс экспрессии гетерологичных генов и биосинтез белка достаточно избирателен и зависит от видовой принадлежности штамма-реципиента [Applied and Environmental Microbiology, 1983, 46(5), 1059-1065] и уж тем более результат экспрессии невозможно предсказать при выборе штамма-продуцента из другого царства микроорганизмов.
Работ по экспрессии химерных генов α-амилаз в дрожжах нами не выявлено.
Технической проблемой, на решение которой направлено заявляемое изобретение является совершенствование методик конструирования дрожжевых штаммов-продуцентов термостабильной α-амилазы.
Раскрытие сущности изобретения
Техническим результатом заявляемого изобретения является расширение арсенала дрожжевых рекомбинантных микроорганизмов, продуцирующих α-амилазу.
Технический результат достигается путем получения трансформанта дрожжей Ogataea haglerorum продуцирующего и секретирующего в культуральную жидкость термостабильную α-амилазу, содержащего в составе хромосомы оптимизированный синтетический ген, кодирующий указанную α-амилазу, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO:1.
Указанная последовательность синтезирована на основе последовательности, описанной в [WO 99/46399], путем оптимизации кодонов для метилотрофных дрожжей О. haglerorum.
Оптимизацию нуклеотидной последовательности для гена, кодирующего гибридную α-амилазу типа Termamyl, осуществляют на основании данных о частоте встречаемости кодонов (http://www.kazusa.or.jp/codon/P.html). Полученная последовательность (далее AMYsyni), размером 1467 п. н. приведена в перечне последовательностей под номером SEQ ID NO:1. Последовательность синтезирована в компании Twist (https://www.twistbioscience.com/) по заказу НИЦ «Курчатовский институт»-ГосНИИгенетика.
Краткое описание чертежей
Изобретение проиллюстрировано следующими фигурами.
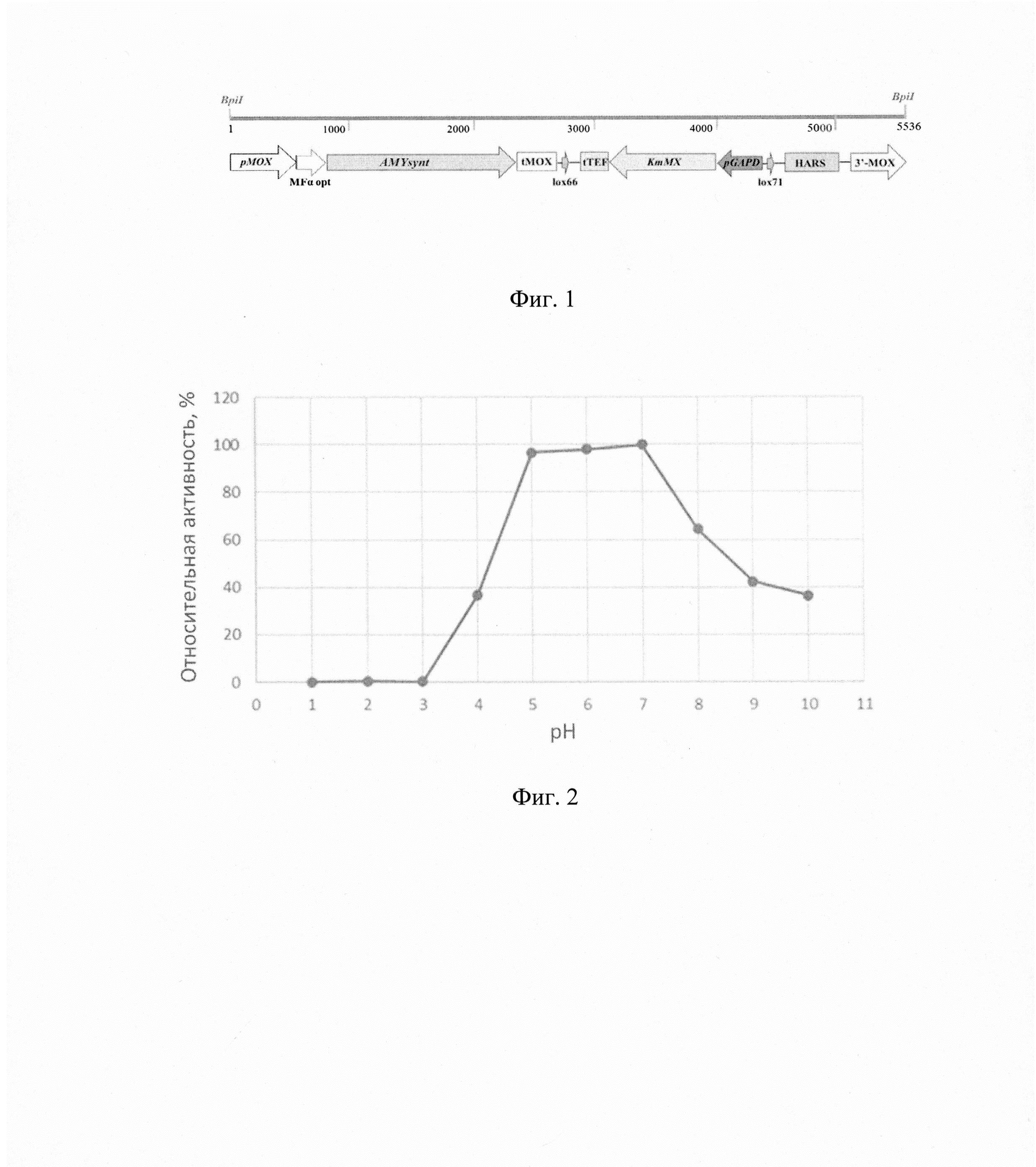
Фиг. 1 - Экспрессионная кассета.
Фиг. 2 - Относительная активность α-амилазы при разных значениях рН.
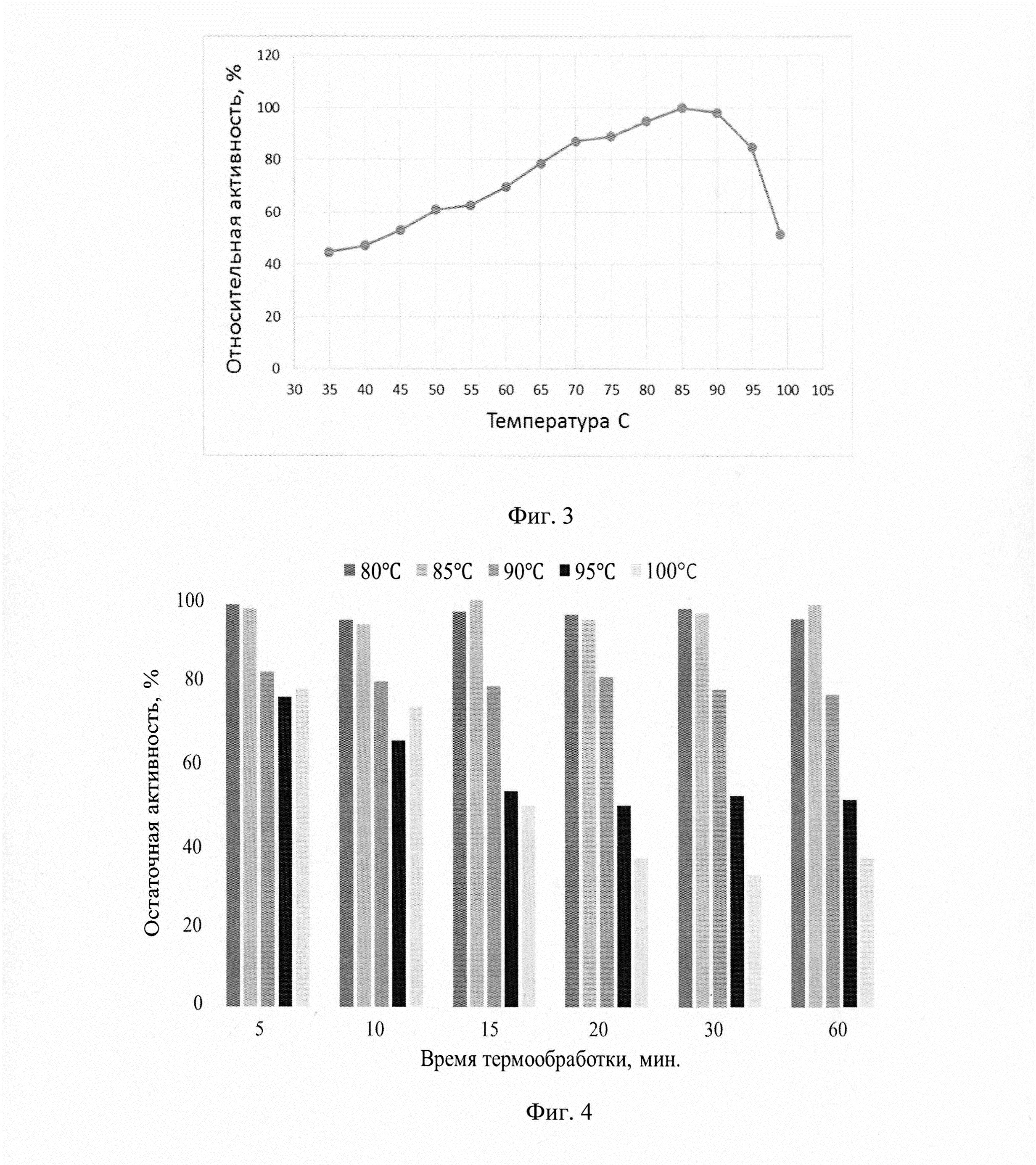
Фиг. 3 - Относительная активность α-амилазы при различных значениях температуры.
Фиг. 4 - Остаточная активность α-амилазы после прогревания КЖ с ферментом при температурах 80-100°С в течение 5, 10, 15, 20, 30 и 60 минут.
Фиг. 5 - SDS-PAGE электрофорез рекомбинантной α-амилазы, где:
М - маркер молекулярного веса (кДа)
1 - Бесклеточная КЖ, полученная после культивирования штамма О. haglerorum N388;
2 - Бесклеточная КЖ, обработанная ферментом EndoH;
Осуществление изобретения
Получение заявляемого трансформанта включает:
- трансформацию в клетки дрожжей Ogataea haglerorum экспрессионной кассеты, содержащей
- синтетический ген, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID N0:1, названный AMYsynt и кодирующий термостабильную α-амилазу,
- промотор, работающий в дрожжах Ogataea (Hansenula),
- сигнальный пептид для осуществления секреции фермента в культуральную жидкость,
- терминатор,
- маркерный ген с регуляторными элементами, HARS и, предпочтительно,
- сайт для гомологичной интеграции в хромосомную ДНК.
Процесс трансформации экспрессионной кассеты в клетки дрожжей Ogataea (Hansenula) осуществляют, в частности, методом электоропорации [Yeast Metabolic Engineering: Methods and Protocols, Methods in Molecular Biology, 2014, 1152, Chapter 3, 43-62. DOI 10.1007/978-1-4939-0563-8_3] или методом с использованием ацетата лития [Curr. Genet. 1990, 18, 169-170. https://doi.org/10.1007/BF003126061, а интеграцию экспрессионной кассеты осуществляют путем гомологичной или негомологичной рекомбинации;
Получают трансформант дрожжей Ogataea haglerorum - продуцент термостабильной α-амилазы.
Для повышения продуктивности полученного трансформанта проводят:
- удаление селективного маркера, обеспечивающего устойчивость дрожжей к генетицину (G418), за счет индукции рекомбинации по lox-сайтам в присутствии cre-рекомбиназы;
- увеличение числа копий экспрессионной кассеты в хромосомной ДНК трансформанта О. haglerorum путем повторной трансформации кассетой;
- анализ полученных трансформантов на способность секретировать активную α-амилазу в культуральную жидкость в процессе ферментации.
Осуществляют отбор наиболее продуктивного штамма Ogataea haglerorum N388, из которого затем за счет рекомбинации по lox-сайтам в присутствии сrе-рекомбиназы получают безмаркерный штамм Ogataea haglerorum N404.
Конструирование экспрессионной кассеты осуществляют стандартными методами генетической инженерии [Sambrook J., Maniatis Т., Fritsch Е. Molecular cloning: a laboratory manual. - N.Y.: Cold Spring Harbor Laboratory, 1989] с использованием генетических элементов, подходящих для работы с дрожжами рода Ogataea (Hansenula). В качестве промоторов могут быть использованы, например, МОХ, FMD, DAS, TPS1, FLD1, PHO1, YNT1, YNI1, YNR1, GAP, ACT, РМА1, АОХ, MAL, АМО, TEF1, РЕХ14, РЕХ11 [FEMS Yeast Research, 2005, 5, 1079-1096. doi:10.1016/j.femsyr.2005.06.004; Curr Microbiol., 2014, 69, 143-148. DOI 10.1007/s00284-014-0568-x; FEMS Microbiol Lett., 2018, 365, fny238, 6 p.doi: 10.1093/femsle/fny238; FEMS Yeast Res., 2012, 12, 271-278. DOI: 10.1111/j.1567-1364.2011.00772.x].
В качестве сигнальных пептидов используют, например, лидерную последовательность PHO1, пре-про-лидерную последовательность MFα из Saccharomyces cerevisiae или Ogataea thermomethanolica, GAM1 из Schwanniomyces occidentalis [FEMS Yeast Research, 2005, 5, 1079-1096. doi:10.1016/j.femsyr.2005.06.004; Curr Microbiol., 2014, 69, 143-148. DOI 10.1007/s00284-014-0568-x; Appl Biochem Biotechnol., 2016, 178(4), 710-724. doi: 10.1007/s12010-015-1904-8].
В качестве терминаторов транскрипции используют, например, последовательности генов МОХ, AMO1, РН05, АОХ1 [Appl. Microbiol. Biotechnol, 2000, 54, 741-750; FEMS Yeast Res., 2012, 12, 271-278. DOI: 10.1111/j.1567-1364.2011.00772.x; FEMS Yeast Research, 2003, 4, 185-193. doi:10.1016/S1567-1356(03)00148-X; FEMS Yeast Research, 2003, 4, 175-184. doi: 10.1016/S1567-1356(03)00150-8].
В качестве селективных маркеров используют, например, гены резистентности к антибиотикам зеоцину, или генетицину (G418), или гигромицину В, или норзеотрицину, или бластицидину, а также гены, комплементирующие ауксотрофные мутации в геноме дрожжей рода Ogataea, такие как LEU2, HIS3, TRP3, ADE2, URA3, МЕТ6, ADE11 [FEMS Yeast Res, 2012, 12, 271-278. DOI: 10.1111/j.1567-1364.2011.00772.x; Yeast, 1995, 11,343-353].
В качестве последовательностей, обеспечивающих эффективную трансформацию и автономную репликацию, используют, например, HARS1, HARS2, HARS3, HARS 36 [Mol. Gen Genet. 1986, 202, 302-308; Yeast, 1995, 11, 343-353; Journal of Bacteriology, 1996, 178 (15), 4420-4428].
В качестве сайтов для гомологичной интеграции используют, например, последовательности генов МОХ, TRP, URA3, LEU2, GAP, кластер генов для рибосомальной ДНК, HARS, АМО, TEF1 [FEMS Yeast Research, 2005, 5, 1079-1096. doi:10.1016/j.femsyr.2005.06.004; FEMS Yeast Research, 2003, 4, 185-193. doi:10.1016/S1567-1356(03)00148-X; FEMS Yeast Res, 2012, 12, 271-278. DOI: 10.1111/j.1567-1364.2011.00772.x] или другие последовательности, гомологичные участкам хромосомы дрожжей рода Ogataea.
Поставленная задача решена также тем, что получен штамм О. haglerorum N388 ВКПМ Y-4980 - продуцент термостабильной α-амилазы, устойчивый к генетицину (G418).
Поставленная задача решена также тем, что получен штамм О. haglerorum N404 - ВКПМ Y-5018 - продуцент термостабильной α-амилазы, чувствительный к генетицину (G418).
В источниках известности не описаны дрожжи вида О. haglerorum, продуцирующие рекомбинантную α-амилазу. Их способность продуцировать и секретировать фермент термостабильную α-амилазу впервые показана нами.
Пример 1. Получение трансформанта дрожжей Ogataea haglerorum - продуцента термостабильной α-амилазы
Трансформант дрожжей О. haglerorum получают путем введения в штамм-реципиент О. haglerorum ВКПМ Y-2584 [Int. J. Syst. Evol. Microbiol., 2017, 67, 2465-2469. DOI 10.1099/ijsem.0.002012] экспрессионной кассеты, содержащей синтетический ген с оптимизированными для метилотрофных дрожжей кодонами, кодирующий α-амилазу.
Для конструирования экспрессионной плазмиды используют вектор pMOX-MFopt-HARS (6966 п. н.), полученный на основе вектора рМОХ-Km-HARS [Биотехнология, 2019, 35(6), 51-56], в котором фрагмент ДНК, содержащий сигнальную последовательность MFα Saccharomyces cerevisiae, заменяют на сигнальную последовательность MFα opt, оптимизированную по кодоновому составу для дрожжей рода Ogataea, приведенную в перечне последовательностей под номером SEQ ID NO:2. Последовательность SEQ ID NO:2 идентична последовательности нуклеотидов сигнального пептида MFα Saccharomyces cerevisiae на 89,7% согласно программе AlignX в Vector NTI.
Последовательность SEQ ID NO:1 встраивают в состав вектора рМОХ-MFopt-HARS по сайтам EcoRI и NotI и получают экспрессионную плазмиду pMOX-AMYsynt размером 8433 п. н.
Плазмиду pMOX-AMYsynt обрабатывают ферментом BpiI и выделяют экспрессионную кассету размером 5536 п. н. (фиг.1), в состав которой входят следующие генетические элементы:
1. Синтетический ген AMYsynt, встроенный в рамку считывания с нуклеотидной последовательностью оптимизированного сигнального пептида MFα opt из дрожжей Saccharomyces cerevisiae, транскрипция которого находится под контролем промотора рМОХ, наработанного с использованием хромосомной ДНК штамма Ogataea polymorpha ВКПМ Y-1546 (линия CBS4732).
2. Терминатор транскрипции tMOX, наработанный с использованием хромосомной ДНК штамма Ogataea polymorpha ВКПМ Y-1546.
3. Дрожжевой селективный маркер KmMX, фланкированный сайтами lox66 и lox71, транскрипция которого находится под контролем промотора pGAPD гена глицеральдегид-3-фосфат дегидрогеназы, наработанного с использованием хромосомной ДНК штамма Ogataea polymorpha ВКПМ Y-1546 и терминатора транскрипции tTEF. Устойчивость дрожжей Ogataea haglerorum к антибиотику генетицину (G418) обеспечивает маркер KmMX.
4. Последовательность HARS, наработанную с использованием хромосомной ДНК штамма Ogataea polymorpha ВКПМ Y-916 (линия DL1), обеспечивающую сохранение трансформируемой ДНК в клетках реципиентного штамма и являющуюся возможным местом интеграции.
5. Область интеграции - нуклеотидная последовательность 3'- области региона МОХ.
Экспрессионную кассету трансформируют в штамм О. haglerorum ВКПМ Y-2584. Компетентные клетки готовят, как описано [Valeria Mapelli (ed.), Yeast Metabolic Engineering: Methods and Protocols, Methods in Molecular Biology. - Vol.1152. - Chapter 3. DOI 10.1007/978-l-4939-0563-8_3, © Springer Science+Business Media, LLC 2014]. Электропорацию проводят на электропораторе GenePulser Xcell (Bio-Rad) при 1500 В, 200 Ом, 25uF. После электропорации к клеткам добавляют 1 мл жидкой среды YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) с добавлением глюкозы (2 мас. %), переносят клеточную суспензию в стерильные пробирки на 1,5 мл и инкубируют при 37°С в течение 60 мин при качании.
Селекцию трансформантов проводят на агаризованной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы (2 мас. %) и генетицина (G418) в количестве 300 мкг/мл при температуре 37°С в течение 3-х суток.
Отбор наиболее продуктивных трансформантов осуществляют по результатам их культивирования по следующей схеме:
- Посевную культуру выращивают в пробирках (50 мл) с 5 мл жидкой питательной среды YP с добавлением глюкозы (2 мас. %) при 37°С в течение 24 ч на качалке (250 об/мин). Посев ферментационной среды осуществляют в соотношении 1/40.
- Ферментацию проводят при 37°С на качалке (250 об/мин) в питательной среде YP с добавлением глюкозы (2 мас. %) в течение 6 дней. Через 24 ч культивирования начинают индукцию метанолом, который добавляют в количестве 3 об.%, затем такое же количество метанола добавляют на 48 ч культивирования. В качестве контроля используют штамм О. haglerorum ВКПМ Y-2584, содержащий экспрессионный вектор pMOX-MFopt-HARS.
Продуктивность трансформантов О. haglerorum оценивают по активности секретированной α-амилазы. Для этого клетки трансформантов осаждают центрифугированием, а супернатант используют для определения амилазной активности по методу с 3,5-динитросалициловой кислотой (ДНС) [Anal. Chem. - 1959. - Vol.31. - No. 3. - P.426-428], используя глюкозу как стандарт. В качестве субстрата используют растворимый крахмал.
Стандартная реакционная смесь состоит из 0,1 мл раствора 1% субстрата (вес/объем) в 0,1 М фосфатном буфере, рН 7,0 и 0,1 мл образца фермента (супернатант). Перед проведением реакции образцы фермента разбавляют в 10, 100, 300, 500, 800, 1000 раз стерильной водой. Время реакции 10 минут. Затем в пробирки добавляют 0,3 мл 1% раствора ДНС, перемешивают и помещают пробирки в термостат на 98°С на 5 мин. Оптическую плотность всех образцов (калибровка, опытные пробы, контрольные пробы) определяют при длине волны 540 нм в плашках на 96 лунок на спектрофотометре Multiskan spectrum (Thermo Fisher Scientific, США) с помощью программы Skanlt RE for MSS 2.4.4. Все измерения проводят трижды.
За единицу ферментативной активности α-амилазы (1 ед.) принимают количество фермента, действующего на субстрат с высвобождением 1 μМ восстанавливающих Сахаров (глюкозы) за одну минуту в следующих условиях проведения реакции: температура 70°С, рН 7,0, продолжительность гидролиза 10 минут.
Среди проверенных трансформантов отбирают наиболее продуктивный, стабильный трансформант О. haglerorum N372, который при культивировании в пробирках продуцируют α-амилазу с активностью 795 ед./мл КЖ.
Тестирование на стабильность наследования признака «устойчивость к генетицину» проводят следующим образом. Трансформант О. haglerorum N372 растят в неселективных условиях, в жидкой среде YP с глюкозой (2 мас. %), в пробирках на качалке при 37°С в течение 24 ч, затем производят пять последовательных пересевов культуры из неселективных условий в пробирки со свежей средой YP, содержащей глюкозу (2 мас. %). Пробирки инкубируют на качалке при 37°С в течение 24 ч. Затем рассевают культуру до отдельных колоний на чашки Петри с агаризованной неселективной средой YP, содержащей глюкозу (2 мас. %). С помощью репликатора отбирают 100 независимых колоний и анализируют их на способность расти на селективной среде YP с глюкозой (2 мас. %) и генетицином (300 мкг/мл) и контрольной среде - YP с глюкозой (2 мас. %). Отсутствие колоний, не растущих на селективной среде с антибиотиком, указывает на то, что экспрессионная кассета содержится в клетках трансформантов в составе хромосомной ДНК.
Пример 2. Получение штамма О. haglerorum N388, устойчивого к генетицину
Для повышения продуктивности трансформанта, которую оценивают по активности α-амилазы в культуральной жидкости, проводят повторную трансформацию экспрессионной кассетой, для чего из хромосомной ДНК трансформанта О. haglerorum N372 удаляют селективный маркер KmMX методом рекомбинации по lox сайтам в присутствии Cre рекомбиназы [FEMS Yeast Res. 2014, 14, 1048-1054. DOI: 10.1111/1567-1364.12197]. От трансформанта отбирают колонию, которая не растет на среде YP с глюкозой (2 мас. %) и генетицином (300 мкг/мл), но растет на полной среде без антибиотика, и называют О. haglerorum N382. Клон О. haglerorum N382, чувствительный к генетицину, культивируют в пробирках в YP среде с глюкозой (2%) с последующей индукцией метанолом и измеряют активность α-амилазы. Клон О. haglerorum N382 продуцирует α-амилазу с активностью 800 ед./мл КЖ.
Компетентные клетки О. haglerorum N382 трансформируют экспрессионной кассетой (фиг.1). Анализируют 24 независимых трансформанта, устойчивых к генетицину. Отбор наиболее продуктивных трансформантов осуществляют по результатам их культивирования в пробирках. В качестве контроля проводят культивирование в пробирке родительского штамма О. haglerorum N382. Отбирают один стабильный, наиболее продуктивный трансформант О. haglerorum N388, который продуцирует α-амилазу с активностью 2150 ед./мл КЖ за 144 ч культивирования, является устойчивым к генетицину и содержит минимум две копии экспрессионной кассеты.
Отобранный трансформант О. haglerorum N388, устойчивый к генетицину (G418), депонируют в Биоресурсном центре Всероссийская Коллекция Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» - ГосНИИгенетика (117545 Москва, 1-ый Дорожный проезд, д.1) как штамм Ogataea haglerorum N388 ВКПМ Y-4980.
Штамм Ogataea haglerorum N388 ВКПМ Y-4980 характеризуется следующими признаками:
Культурально-морфологическая характеристика заявляемого штамма:
При культивировании при температуре 37°С в течение 48 ч на агаризованной среде YP с добавлением глюкозы - 2 (мас. %) и генетицина (300 мкг/мл) клетки имеют овальную форму, 3-4 мкм в диаметре. Клетки почкуются, при этом почкование истинное, многостороннее. Истинного мицелия не образуют.
Споруляция происходит при инкубации культуры на агаризованной среде следующего состава (мас. %): хлорид калия - 0.5, ацетат натрия - 1.0, агар - 2.0, вода - остальное при 25°С в течение 3-4 дней. Аски имеют тетраэдрическую форму, включают до 4-х аскоспор.
На агаризованной среде YP с добавлением глюкозы (2, мас. %) и генетицина (300 мкг/мл) колонии светло-бежевого цвета с ровным краем, матовой поверхностью, линзовидным профилем и пастообразной консистенцией.
При росте в жидкой среде YP с добавлением глюкозы - 2 (мас. %) и генетицина (300 мкг/мл) при 37°С в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок не образует.
Физиолого-биохимические признаки заявляемого штамма: Штамм способен к росту как в аэробных, так и в анаэробных условиях. В качестве единственного источника углерода штамм способен использовать глюкозу, глицерин, метанол, этанол, L-рамнозу, сахарозу, мальтозу; не способен ассимилировать D-глюконат, L-арабинозу, сукцинат, лактозу, крахмал.
Штамм способен синтезировать α-амилазу при культивировании в пробирках в жидкой среде YP с глюкозой (2 мас. %) в условиях индукции метанолом.
Пример 3. Получение штамма О. haglerorum N404, чувствительного к генетицину
Устойчивость штамма к антибиотикам затрудняет его использование в промышленности, т.к. требует дополнительных затрат при утилизации клеточной биомассы, и получение антибиотикочувствительного штамма помогает в решении этой проблемы.
Из трансформанта О. haglerorum N388 удаляют ген KmMX, обеспечивающий клеткам дрожжей устойчивость к генетицину, методом рекомбинации по lox - сайтам в присутствии Cre - рекомбиназы [FEMS Yeast Res. 2014, 14, 1048-1054. DOI: 10.1111/1567-1364.12197].
Трансформант О. haglerorum N388 выращивают в жидкой питательной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) с добавлением глюкозы (2 мас. %) и генетицина в количестве 300 мкг/мл при 37°С в течение 6 ч до достижения культурой оптической плотности (OD600) 1,5. Клетки собирают центрифугированием (здесь и далее 6000 об/мин) в течение 10 мин при комнатной температуре, ресуспендируют в буфере TED состава: 100 мМ Tris-HCl, 50 мМ EDTA, рН 8.0, 25 мМ дитиотрейтола, приготовленном на воде SQ, инкубируют при 37°С в течение 15 мин и собирают центрифугированием в течение 10 мин при комнатной температуре. Далее клетки промывают дважды холодным буфером STM состава: 270 мМ сахароза, 10 мМ Tris-HCl, рН 8.0, 1 мМ MgCl2, приготовленном на воде SQ, собирают центрифугированием в течение 10 мин при температуре 5°С. Обработанные таким образом клетки ресуспендируют в холодном растворе STM в концентрации 1-5×109 клеток на 1 мл. Аликвоту объемом 60 мкл клеточной суспензии переносят в охлажденный эппендорф, добавляют 200 нг ДНК плазмиды с Cre рекомбиназой и инкубируют на льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при 1500 В, 200 Ом, 25 uF. После электропорации к клеткам добавляют 1 мл жидкой среды YP с глюкозой (2 мас. %), переносят клеточную суспензию в стерильные пробирки на 1,5 мл и инкубируют при 37°С в течение 60 мин при качании.
Селекцию трансформантов проводят на агаризованной среде YP с глюкозой (2 мас. %) и гигромицином в количестве 200 мкг/мл при температуре 37°С в течение 4-х суток.
Биомассу трех независимых трансформантов переносят в три пробирки с 3 мл среды YP с гигромицином в количестве 200 мкг/мл и метанолом, используемым в качестве источника углерода и индуктора биосинтеза Cre рекомбиназы. Пробирки инкубируют при 37°С в течение 48 ч при качании. Затем делают рассев культуры из пробирок до отдельных колоний на среду YP с глюкозой (2 мас. %) на три чашки Петри. Чашки инкубируют в термостате при 37°С в течение 72 ч. Анализируют 100 независимо отобранных колоний с каждой чашки. В лунки репликатора добавляют 200 мкл стерильной воды, в каждую лунку репликатора переносят с помощью зубочистки биомассу одной колонии, затем делают реплику из репликатора на три чашки Петри со средами YP с глюкозой (2 мас. %), YP с глюкозой (2 мас. %) и генетицином в количестве 300 мкг/мл и YP с глюкозой (2 мас. %) и гигромицином в количестве 200 мкг/мл. Чашки инкубируют в термостате при 37°С в течение 48 ч. Отбирают колонии, которые растут на среде YP с глюкозой (2 мас. %), но не растут на средах с антибиотиками.
Проводят культивирование отобранных колоний в пробирках по следующей схеме:
- Посевную культуру выращивают в пробирках (50 мл) с 5 мл жидкой питательной среды YP с добавлением глюкозы (2 мас. %) при 37°С в течение 24 ч на качалке (250 об/мин). Посев ферментационной среды осуществляют в соотношении 1/40.
- Ферментацию проводят при 37°С на качалке (250 об/мин) в питательной среде YP с добавлением глюкозы (2 мас. %) в течение 5 дней. Через 24 ч культивирования начинают индукцию метанолом, который добавляют в количестве 3 об.%, затем такое же количество метанола добавляют на 48 ч культивирования. В качестве контроля используют штамм О. haglerorum N388.
Продуктивность чувствительных к антибиотикам генетицину и гигромицину колоний О. haglerorum оценивают по активности секретированной α-амилазы. Для этого клетки трансформантов осаждают центрифугированием, а супернатант используют для определения амилазной активности по методу с 3,5-динитросалициловой кислотой (ДНС) [Anal. Chem. - 1959. - Vol.31. - No. 3. - P.426-428], используя глюкозу как стандарт. В качестве субстрата используют растворимый крахмал.
Отбирают клон N404, который продуцирует α-амилазу с активностью 2350 ед./мл за 144 ч культивирования в пробирках при температуре 37°С, что сравнимо с продуктивностью родителя - штамма О. haglerorum N388.
Клон О. haglerorum N404 депонирован в Биоресурсном центре Всероссийская Коллекция Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» (117545 Москва, 1-ый Дорожный проезд, д.1) как штамм Ogataea haglerorum N404 ВКПМ Y-5018.
Штамм Ogataea haglerorum N404 ВКПМ Y-5018 характеризуется следующими признаками:
Культурально-морфологическая характеристика заявляемого штамма:
При культивировании при температуре 37°С в течение 48 ч на агаризованной среде YP с добавлением глюкозы - 2 (мас. %) клетки имеют овальную форму, 3-4 мкм в диаметре. Клетки почкуются, при этом почкование истинное, многостороннее. Истинного мицелия не образуют.
Споруляция происходит при инкубации культуры на агаризованной среде следующего состава (мас. %): хлорид калия - 0.5, ацетат натрия - 1.0, агар - 2.0, вода - остальное при 25°С в течение 3-4 дней. Аски имеют тетраэдрическую форму, включают до 4-х аскоспор.
На агаризованной среде YP с добавлением глюкозы (2, мас. %) колонии светло-бежевого цвета с ровным краем, матовой поверхностью, линзовидным профилем и пастообразной консистенцией.
При росте в жидкой среде YP с добавлением глюкозы - 2 (мас. %), при 37°С в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок не образует.
Физиолого-биохимические признаки заявляемого штамма:
Штамм способен к росту как в аэробных, так и в анаэробных условиях.
В качестве единственного источника углерода штамм способен использовать глюкозу, глицерин, метанол, этанол, L-рамнозу, сахарозу, мальтозу; не способен ассимилировать D-глюконат, L-арабинозу, сукцинат, лактозу, крахмал.
Штамм способен синтезировать α-амилазу при культивировании в пробирках в жидкой среде YP с глюкозой (2 мас. %) в условиях индукции метанолом.
Пример 4. Культивирование штамма Ogataea haglerorum N388 в колбах
Посевную культуру штамма готовят в пробирке в 5 мл среды YP с глюкозой (2 мас. %). Пробирку инкубируют при 37°С в течение 20 ч на качалке (250 об/мин). В колбу на 0,75 л со 100 мл жидкой среды YP с глицерином (2 мас. %) переносят 2,5 мл посевной культуры и колбу инкубируют при 37°С на качалке (250 об/мин) в течение 144 часов. Метанол (3 об.%) добавляют к культуре через 24 и 48 часов культивирования. Биомассу отделяют центрифугированием в течение 15 мин.
Активность «-амилазы определяют по методу ДНС при температуре 70°С и рН 7,0.
Проводят по три независимых культивирования.
Штамм Ogataea haglerorum N388 продуцирует α-амилазу, активность фермента составляет, соответственно, 2200, 2080, 2470 ед./мл КЖ через 144 ч культивирования.
Пример 5. Культивирование штамма Ogataea haglerorum N404 в колбах Посевную культуру штамма готовят в пробирке в 5 мл среды YP с глюкозой (2 мас. %). Пробирку инкубируют при 37°С в течение 20 ч на качалке (250 об/мин). В колбу на 0,75 л со 100 мл жидкой среды YP с глицерином (2 мас. %) переносят 2,5 мл посевной культуры и колбу инкубируют при 37°С на качалке (250 об/мин) в течение 144 часов. Метанол (3 об.%) добавляют к культуре через 24 и 48 часов культивирования. Биомассу отделяют центрифугированием в течение 15 мин.
Активность α-амилазы определяют по методу ДНС при температуре 70°С и рН 7,0.
Проводят по три независимых культивирования.
Штамм Ogataea haglerorum N404 продуцирует α-амилазу, активность фермента составляет, соответственно, 2310, 2240, 2500 ед./мл КЖ через 144 ч культивирования.
Пример 6. Характеристика рекомбинантной α-амилазы рН-профилъ активности рекомбинантной α-амилазы
Для определения оптимального значения рН для функционирования фермента активность α-амилазы по отношению к субстрату (1% раствор растворимого крахмала, вес/объем) измеряют в диапазоне значений рН 1.0-10.0 с использованием 0,1М растворов цитратного (рН 1,0 - 3,0), ацетатного (рН 4,0-5,0), фосфатного (рН 6,0-8,0) и боратного (рН 9,0-10,0) буферов. Реакцию проводят при температуре 70°С в течение 10 мин. Относительную активность рассчитывают, как процент от средней максимальной активности фермента, измеренной в трех независимых реакциях в диапазоне значений рН 1.0-10.0.
Результаты измерений, приведены на фиг.2. Полученные результаты показывают, что рекомбинантная α-амилаза, синтезированная дрожжами Ogataea haglerorum проявляет наибольшую активность в диапазоне рН 5,0-7,0 с оптимумом при рН 7,0.
Температурный профиль активности рекомбинантной α-амилазы
Для определения температурного профиля активности фермента α-амилазы проводят реакции образцов с субстратом (1% раствор растворимого крахмала, вес/объем) в 0,1М фосфатном буфере (рН 7,0) в диапазоне температур от 35 до 100°С с шагом 5°С. Относительную активность рассчитывают, как процент от средней максимальной активности фермента, измеренной в трех реакциях в диапазоне значений температур от 35 до 100°С. Результаты приведены на фиг.3.
Наибольшую активность рекомбинантная α-амилаза проявляет в интервале температур от 65 до 95°С (сохраняет не менее 80% активности), с оптимумом при 85°С.
Термостабильность рекомбинантной α-амилазы при разных температурах
Определение термостабильности рекомбинантного фермента при различных температурах проводят путем предварительного прогревания культуральной жидкости, содержащей фермент, при температурах 80, 85, 90, 95 и 100°С в течение 5, 10, 15, 20, 30 и 60 минут. Образцы охлаждают до комнатной температуры. После чего проводят реакцию с субстратом при температуре 70°С в 0,1М фосфатном буфере (рН 7,0). Относительную активность рассчитывают, как процент от значения активности непрогретого фермента. Измерения проводят в трех повторностях. Результаты приведены на фиг.4.
Полученные результаты показывают, что фермент практически не теряет активности при прогревании при температурах 80°С и 85°С в течение 60 мин. Если рекомбинантную α-амилазу выдержать при температурах 90, 95 и 100°С в течение 5 мин, фермент сохраняет более 75% активности. Выдерживание α-амилазы при температуре 95°С или 100°С более длительное время приводит к снижению активности фермента, однако даже после прогревания при температуре 100°С в течении 60 мин рекомбинантный фермент не инактивируется, остаточная активность составляет 30%. Таким образом, рекомбинантная α-амилаза, синтезируемая дрожжами Ogataea haglerorum, является термостабильным ферментом. Определение молекулярного веса рекомбинантной α-амилазы Для определения молекулярного веса рекомбинантной α-амилазы проводят электрофоретическое разделение белков из образца КЖ в 12%) полиакриламидном геле в денатурирующих условиях (SDS-PAGE) в камере для вертикального электрофореза Mini-PROTEAN Tetra Bio-Rad (Bio-Rad США). Для визуализации белков используют Кумасси бриллиантовый синий R250 (фиг.5). Как показал анализ аминокислотной последовательности, проведенный с использованием программы NetNGlyc 1.0 Server, в аминокислотной последовательности α-амилазы содержится пять потенциальных сайтов N-гликозилирования Asn-Arg-Thr, однако с наибольшей вероятностью гликозилированы только три из них. Для дегликозилирования рекомбинантной α-амилазы используют фермент EndoH (Endoglycosidase Н from Streptomyces plicatus, Sigma-Aldrich, США).
Дегликозилирование рекомбинантной α-амилазы в КЖ проводят в течение 3 часов при 37°С в соответствии с инструкцией производителя.
Установлено, что рекомбинантная α-амилаза, синтезированная дрожжами О. haglerorum представляет собой гликозилированный белок с молекулярным весом 65-100 кДа.
Молекулярный вес N-дегликозилированного белка составляет приблизительно 56 кДа (расчетное значение 55,65 кДа по программе Protein Parameters: https://protparam.net/index.html).
В таблице 1 приведено сравнение свойств полученной α-амилазы из штамма Ogataea haglerorum N404 ВКПМ Y-5018 и термостабильных α-амилаз, полученных в клетках дрожжей P. pastoris.


Таким образом, по своим свойствам рекомбинантная α-амилаза, наработанная клетками термотолерантных метилотрофных дрожжей О. haglerorum, сравнима с α-амилазами типа Termamyl, наработанными дрожжами P. pastoris (Табл. 1)
Полученная α-амилаза сравнима также с коммерческой α-амилазой BAN (гибридная termamyl - like α-амилаза с заменами H156Y, А181Т, N190F, A209V Q264S, наработанная в Bacillus amyloliquefaciens), и α-амилазой Termamyl wt из Bacillus licheniformis, которые сохраняют 57% и 52% активности, соответственно, после инкубации фермента при 95°С в течение 30 мин [US7625737].
α-Амилаза, наработанная в дрожжах О. haglerorum, сохраняет 52% активности после выдерживания образца КЖ (рН 6,5) без субстрата при температуре 95°С в течение 30 мин, что позволяет использовать ее в технологических процессах, протекающих при высоких температурах, в частности в пищевой промышленности для разжижения крахмалсодержащего растительного сырья с целью получения глюкозо-фруктозных сиропов, в текстильной промышленности для расшлихтовки тканей.
Полученные штаммы Ogataea haglerorum N388 ВКПМ Y-4980 и Ogataea haglerorum N404 ВКПМ Y-5018 продуцируют термостабильную α-амилазу в колбах в богатой среде с активностью в среднем, соответственно, 2250 ед./мл КЖ и 2350 ед./мл КЖ через 144 ч культивирования, что значительно выше показателей трансформантов дрожжей P. pastoris GS115, синтезирующих в колбах в богатой среде α-амилазу из В. licheniformis с активностью 420 ед./мл через 144 ч культивирования [BioMed Research International, 2015, Article ID 248680, 9 P. http://dx.doi.org/10.1155/2015/248680] или α-амилазу из В. licheniformis WX-02 с активностью 900 ед./мл через 168 ч культивирования [3 Biotech, 2019, 9, 427. https://doi.org/10.1007/s13205-019-1943-x].
Штамм Ogataea haglerorum N404 ВКПМ Y-5018 в отличие от Ogataea haglerorum N388 ВКПМ Y-4980 не содержит маркер устойчивости к генетицину (G418), что дает ему преимущество при использовании в промышленности. После культивирования бесклеточную КЖ используют для выделения и очистки фермента, а клеточную биомассу утилизируют, и устойчивость штаммов к антибиотикам - это серьезная угроза для экологии и для здравоохранения. Получение антибиотикочувствительных штаммов является важной мерой по профилактике и контролю распространения резистентности в окружающей среде, решению проблемы утилизации устойчивых к антибиотикам штаммов.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="ru"
nonEnglishFreeTextLanguageCode="ru" dtdVersion="V1_3" fileName="Yeast
transformant Ogataea haglerorum-producer of thermostable
alpha-amylase.xml" softwareName="WIPO Sequence"
softwareVersion="2.1.2" productionDate="2022-09-20">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2022119881/20(041870)</ApplicationNumberText>
<FilingDate>2022-07-20</FilingDate>
</ApplicationIdentification>
<ApplicantName languageCode="ru">Национальный исследовательский
центр "Курчатовский институт"</ApplicantName>
<ApplicantNameLatin>National Research Centre "Kurchatov
Institute"</ApplicantNameLatin>
<InventionTitle languageCode="ru">Трансформант дрожжей Ogataea
haglerorum-продуцент термостабильной альфа-амилазы.</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>1467</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1467</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>attactaaaacttctgccgttaatggtactttgatgcagtactttgaat
ggtatactcctaacgacggtcaacactggaaaagattgcagaatgatgctgaacacttgtctgatatcgg
tattactgccgtttggattccaccagcttacaagggaacttctcaagctgatgttggttacggtgcttac
gacttgtatgatttgggtgagtttcaccaaaaaggtactgttagaaccaagtacggtactaaaggagagt
tgcaatctgctatcaaatctttgcactccagagacattaacgtttacggtgatgttgtcatcaaccacaa
aggtggtgctgatgctaccgaagatgttactgctgttgaagtcgatccagctgacagaaacagagttatt
tctggagaacacttgattaaagcctggacccactttcactttccaggaagaggatctacttactccgatt
ttaaatggtactggtatcactttgacggaaccgattgggacgagtccagaaagttgaacagaatctataa
gtttcaaggaaagacctgggattgggaagtttccaatgaatttggtaactacgactatttgatgtatgcc
gacatcgattatgaccaccctgatgtcgttgcagaaattaagagatggggtacttggtatgccaatgaat
tgcaattggacggtttcagattggatgctgtcaaacacattaaattttcttttttgagagattgggttaa
ccacgtcagagagaaaactggtaaggaaatgtttactgttgctgaatattggtctaatgacttgggtgcc
ttggaaaactacttgaacaaaaccaactttaatcactctgtctttgacgttccattgcactatcagttcc
acgctgcatctactcagggaggtggttacgatatgagaaaattgttgaacggtactgtcgtttccaagca
cccattgaaatctgttacctttgtcgataaccacgatacccagccaggacaatctttggagtccactgtc
caaacctggtttaagccattggcttacgccttcattttgaccagagagtctggataccctcaggttttct
acggtgatatgtacggtactaaaggagactcccagagagaaattcctgccttgaaacacaaaattgaacc
tatcttgaaagctagaaaacagtatgcttacggagcacagcacgattacttcgaccaccacgacattgtc
ggttggactagagaaggtgactcttccgttgctaattccggtttggctgccttgattactgacggaccag
gtggagctaagagaatgtacgtcggtagacaaaacgccggtgagacttggcacgacattaccggaaacag
atccgagccagttgtcatcaactctgaaggatggggagagtttcacgtcaacggtggatctgtttccatt
tacgttcaaagatagtaa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>273</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..273</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgagatttccttcgatttttaccgcagttctgttcgcagcatcctccg
cattggctgctccagtcaacactaccacagaagatgaaaccgcacaaattccggctgaagctgtcatcgg
ttactcggatctggaaggcgatttcgatgttgctgttttgccattttccaactcgaccaataacggactg
ttgtttatcaatactaccattgcctcgattgctgctaaggaagaaggcgtgtctctggagaagagagagg
ctgaagcttacgta</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---