Результат интеллектуальной деятельности: Рекомбинантная плазмида pET32-Trex Vic, обеспечивающая синтез химерного белка прохимозина Vicugna pacos, и штамм Escherichia coli BL21(DE3)pLysE pET32-Trx Vic-продуцент химерного белка прохимозина Vicugna pacos
Вид РИД
Изобретение
Изобретение относится к генетической конструкции (плазмиде), обеспечивающей синтез химерного белка - прохимозина (ПроХн) альпака (Vicugna pacos), который, после активации и превращения в активный фермент - химозин (Хн) - предназначен для коагуляции молока при изготовлении любых видов сычужных сыров и рекомбинантному штамму Е. coli - продуценту химерного белка ПроХн, который, после активации и превращения в Хн, может быть использован в биотехнологии и пищевой промышленности.
Традиционно, для производства сыров используется сычужный фермент (СФ), препарат, получаемый из сычугов телят-молокопоек, основным действующим агентом которого является аспартатная эндопептидаза - химозин (ЕС 3.4.23.4) [1]. Химозин (Хн) коровы гидролизуют ключевую пептидную связь - Phe105-Met106 - в молекуле каппа-казеина, что приводит к дестабилизации казеиновых мицелл и образованию сычужного сгустка. До недавнего времени, по совокупности технологических свойств, коровий химозин (Хн) считался эталонным молокосвертывающим ферментом (МФ) для сыроделия [1, 2].
Химозин коровы состоит из 323 аминокислотных остатков, с низким содержанием основных R-групп. В молекуле химозина имеются три дисульфидных мостика: Cys45-Cys50, Cys206-Cys210, Cys249-Cys282. [3]. В рибосомах фермент транслируется в виде неактивного предшественника (прекурсора) с молекулярной массой (ММ) ~43,0 кД, -препрохимозина. Пре-фрагмент или сигнальный пептид, состоит из 16 аминокислотных остатков. В процессе трансляции мРНК, сигнальный пептид, внедряется в мембрану эндоплазматического ретикулума (ЭПР) и "протаскивает" за собой молекулу препрохимозина. После проникновения во внутреннее пространство ЭПР сигнальный пептид элиминируется и прекурсор превращается в прохимозин. Прохимозин (ПроХн) - неактивный предшественник (зимоген) химозина, полипептид с ММ 40,8 кД, который состоит из 365 аминокислотных остатков. Про-фрагмент состоит из 42 аминокислотных остатков и блокирует активный центр фермента, что создает стерическое препятствие для контакта с молекулами субстрата и обеспечивает ферментативную неактивность зимогена. Кроме ингибирующего действия, про-фрагмент играет важную роль в процессе фолдинга и стабилизации третичной структуры ПроХн [4]. Образование активного фермента происходит по механизму аутокаталитической активации. При кислых значениях рН с N-терминального участка молекулы прохимозина элиминируется фрагмент из 42 аминокислот, что приводит к образованию химозина (ММ=35,6 кД) [5].
В связи с постоянным ростом производства сыров, начиная с середины 20 века, во всем мире ощущается острый дефицит СФ [2]. Проблема дефицита сырья для получения препаратов натурального Хн коровы инициировала поиски его заменителей. Было найдено несколько натуральных МФ (прежде всего, речь идет о Хн верблюда и северного оленя), способных составить конкуренцию Хн коровы, но их промышленное получение не было осуществлено из-за отсутствия достаточной сырьевой базы [6-10].
Современной альтернативой натуральному химозину коровы являются его генноинженерные аналоги [11-20]. Методы генной инженерии позволяют получать молокосвертывающие протеазы любых видов млекопитающих, не ограничиваясь только теми видами животных, которые широко используются в сельскохозяйственной практике человека.
Первое сообщение о получении рекомбинантного химозина (рХн) коровы в системе экспрессии Escherichia coli, появилось в 1980 году, в работе Uchiyama et al. [13]. В период с 1980 по 2019 год были получены рекомбинантные химозины коровы [12,13], овцы [14, 15], козы [16] одногорбого верблюда [17], яка [11], буйвола [18, 19], альпака [20]. Большинство этих ферментов, по совокупности технологических характеристик, не могут сравниться с химозином коровы. Исключением является рХн одногорбого верблюда, который по удельной молокосвертывающей активности (МА) и специфичности (соотношению МА и общей протеолитической активности (ПА)) превосходит Хн коровы, но уступает ему по термостабильности [17, 21]. На сегодняшний день, в сыроделии "эталонными" считаются два МФ - Хн коровы и Хн верблюда - причем, в коммерческом варианте оба выпускаются в виде генно-инженерных ферментов. Открытие и внедрение в сыродельную практику рХн верблюда позволяет предполагать, что в природе существуют и другие МФ, которые превосходят Хн коровы и одногорбого верблюда по технологическим свойствам. Этот факт является предпосылкой для поиска новых рекомбинантных коагулянтов молока не коровьего происхождения.
Последовавшие вслед за работой Uchiyama et al. [13] попытки синтеза коровьего прохимозина в Е. coli столкнулись с целым рядом трудностей, главными из которых были проблемы, связанные обеспечением эффективного рефолдинга целевого белка [22-24]. В системе экспрессии Е. coli рекомбинантый прохимозин (рПроХн) накапливается в виде внутриклеточных телец включения. Нерастворимая форма прохимозина предполагает его выделение и растворение в денатурирующих условиях (8 М мочевина), с последующей ренатурацией и получением зимогена с корректной конформацией, для проведения активации и получения Хн, обладающего МА [25]. Неэффективное восстановление "правильной" пространственной структуры рПроХн, приводит к снижению выхода активного Хн.
Проблема рефолдинга эукариотических белков, синтезированных в прокариотической системе экспрессии, не решена и в настоящее время. По-прежнему актуальной задачей является создание процедуры рефолдинга, обеспечивающей формирование корректной вторичной и третичной структуры рекомбинантных Cys-содержащих зимогенов и активных ферментов, в том числе рХн. [26, 27]. Для повышения эффективности рефолдинга рПроХн, получаемого из телец включения, предпринимались попытки использовать фермент дисульфидизомеразу и шаперон GroE [27, 28] которые не дали желаемого результата. Также была апробирована процедура окислительного восстановления [29] и, так называемые, "водные двухфазные системы" [30]. Однако и эти методические приемы привели лишь к частичному увеличению выхода активного химозина.
Одним из путей "обхода" проблемы рефолдинга гетерологичных белков, синтезируемых в прокаритотических системах экпрессии, является использование эукариотических продуцентов, например Aspergillus niger [12, 17]. В последние годы для получения экспериментальных препаратов рХн все чаще используются дрожжевые системы экспрессии на основе организмов рода Komagataella (ранее - Pichia) [11, 18, 19, 31]. Эти системы экспрессии работают под контролем мощного промотора АОХ1, но их существенным недостатком является необходимость использования метанола в качестве индуктора. Успех решения задачи производства рХн в эукаритах во многом зависит не только от выбора продуцента, но и "комплементарности" его системы экспрессии генетическому материалу целевого белка. Так, например, в Aspergillus oryzae, используя промотор альфа-амилазы продуцента, не удалось добиться продукции рХн больше 10 мг/л, тогда как протеаза Rhisomucor, в этой же системе, экспрессировалась на уровне 3000 мг/л [32].
Для большого сегмента научно-исследовательских и скриннинговых работ, использование хорошо изученных и простых прокариотических систем экспрессии предпочтительнее и намного выгоднее, чем получение стабильных эукариотических продуцентов, поэтому разработка методических подходов и приемов эффективного рефолдинга рекобинантных белков и, в частности, рПроХн, получаемого в системе E.coli, по-прежнему актуальна.
Известна заявка на изобретение (US 2002/0164696, A1, С12Р, 21/02, C12N, 5/06, опубл. 07.11.2002 г. ) [33] в котором описан способ получения химозина верблюда и других химозинов не коровьего происхождения. Для этого ген химозина верблюда был встроен в плазмиду pGAMpR, с последующей трансформацией Aspergillus niger var. Awamori штамм dgr246pyrG. Авторы заявляют, что использование рекомбинантного химозина верблюда позволяет получать молоксвертывающий фермент с улучшенными по сравнению с химозином коровы свойствами.
Недостатком данного изобретения может быть то, что авторы для экспрессии гена химозина используют систему Aspergillus niger. Несмотря на известные достоинства этой системы для получения белков млекопитающих, в первую очередь наличия системы гликозилирования, до сих пор не описаны универсальные и «сильные» промоторы обеспечивающие стабильные и высокие выходы целевого белка. Авторы показывают динамику роста активности культуральной среды в ходе культивирования рекомбинантного штамма содержащего ген химозина верблюда. Поскольку в патенте не охарактеризован выход целевого продукта, невозможно понять: является ли этот рост отражением накопления активного фермента или он обусловлен процессом рефолдинга рХн, оценить это в данном изобретении не предоставляется возможным, т.к. не описан выход целевого продукта.
Еще одним недостатком генетической конструкции данного изобретения может быть то, что авторы используют природный ген Camelus dromedarius. Из-за отличий в механизмах транскрипции, трансляции и посттрансляционных модификаций (высших и низших эукариот), при переносе гетерологичного гена в систему экспрессии организма-реципиента выход продукта и его стабильность может значительно снизиться [34, 35]. В нашем изобретении проведена оптимизация последовательности гена для экспрессии в организме продуцента.
Наиболее близким аналогом (прототипом) является препарат рекомбинантного химозина и способ его получения (заявка США №20070166785, А1, МПК С12Р 21/06, С07Н 21/04, опубл. 19.07.2007 г.) [36]. В данном изобретении описывается получение рекомбинантного прохимозина Bos taurus в системе Escherichia coli, которое включает стадию амплификации природного гена прохимозина Bos taurus, его встройку в экспрессионный вектор pET21b, трансформацию полученной рекомбинантной плазмидой клеток Е. coli, культивирование рекомбинантного штамма Е. coli для получения прохимозина, превращение указанного прохимозина в химозин. В патенте представлены протоколы культивирования штамма-продуцента и методы очистки, ренатурации и активации прохимозина.
Недостатком конструкции и продуцента на основе Е. coli, является необходимость проведения процесса рефолдинга рекомбинантного химозина, обеспечивающего формирование активного фермента. Этот процесс, связанный с восстановление природной структуры белка, требует значительных временных затрат и существенно осложняет работу.
В заявляемом техническом решении проведен инжиниринг структуры прохимозина, в состав которого включен белок тиоредоксин. Этот белок обладает шаперонной активностью, а так же способен катализировать реакции дисульфидного обмена в белках. Благодаря этому удается увеличить эффективность процесса рефолдинга целевого белка.
Техническим результатом заявленного изобретения является создание химерной генетической конструкции "прохимозин-тиоредоксин", а на ее основе - рекомбинантного штамма Escherichia coli - продуцента прохимозина (Vicugna pacos), который обеспечивает высокую скорость рефолдинга целевого фермента.
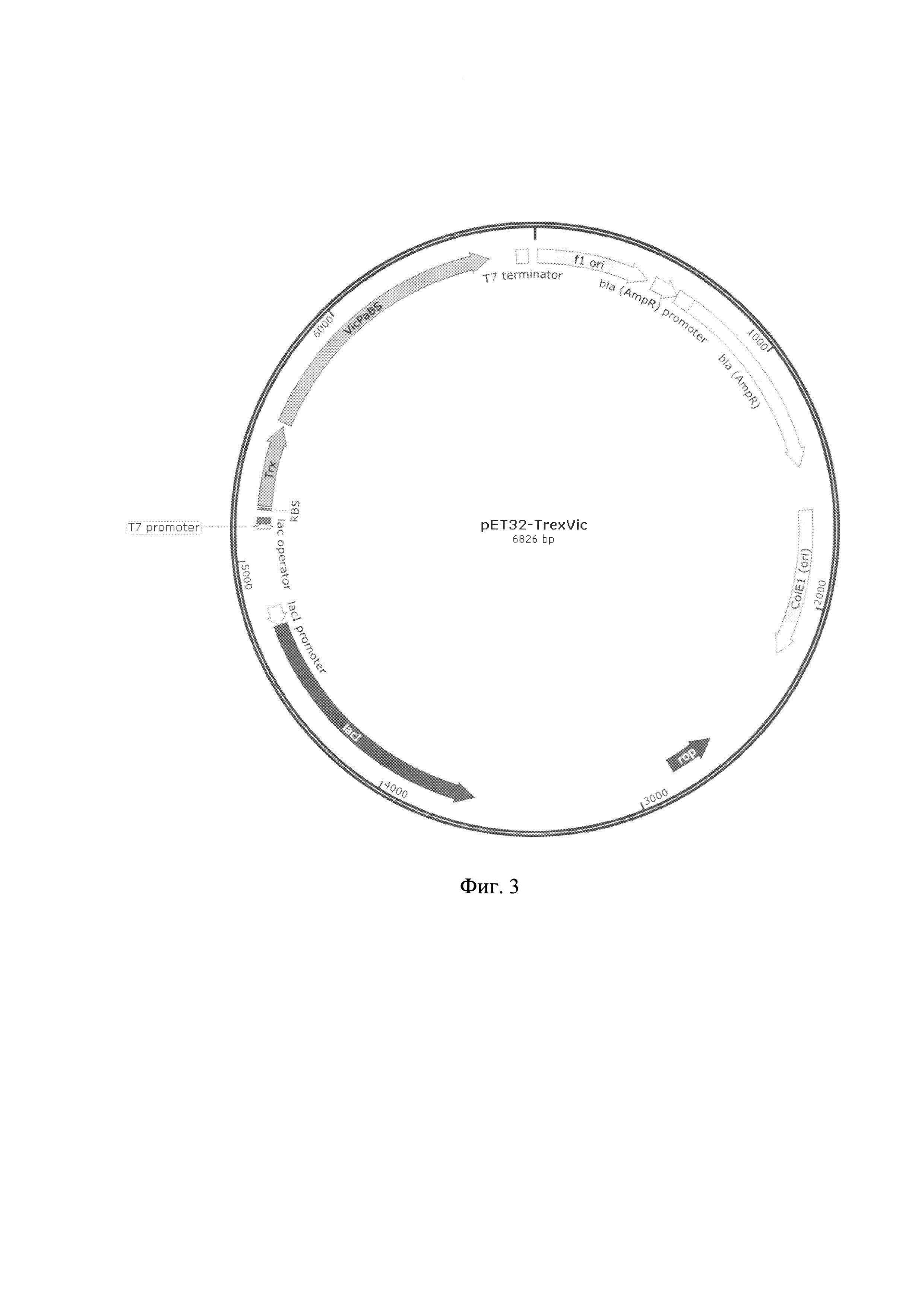
Указанный технический результат достигается созданием рекомбинантной плазмиды pET32-TrxVic размером 6826 пар оснований (п.о.), характеризующейся физической и генетической картой, представленной на фиг. - 3, обеспечивающей синтез химерного белка прохимозина Vicugna pacos размером 52 кДа в клетках Escherichia coli BL21(DE3)pLysE, содержащей рекомбинантный ген химерного белка прохимозина Vicugna pacos, имеющей нуклеотидную последовательность SEQ ID NO: 1 от нуклеотида в положении 5209 п. о. до нуклеотида в положении 6649 п. о., кодирующей целевой химерный белок прохимозин Vicugna pacos с полной аминокислотной последовательностью SEQ ID N0:2, встроенный по сайтам рестрикции FauND I и HindIII в область полилинкера вектора рЕТ32а, содержащего промотор и терминатор РНК-полимеразы фага Т7.
Указанный технический результат достигается также созданием рекомбинантного штамма Escherichia coli BL21(DE3)pLysE/pET32-TrxVic - продуцента химерного белка прохимозина Vicugna pacos E.coli, полученного трансформацией рекомбинантной плазмидой pET32-TrexVic по п. 1.
Заявляемый штамм Escherichia coli BL21(DE3)pLys/pET32-TrxVic - продуцент рекомбинантного прохимозина Vicugna pacos, обеспечивающего (после активации и превращения в активный рХн) специфический гидролиз пептидной связи Phe105-Met106 в молекуле к-казеина и предназначенного для выработки любых сычужных сыров, получают следующим образом.
При разработке штамма продуцента рекомбинантного прохимозина, была выбрана последовательность Vicugna pacos. Выбор последовательности прохимозина, а не препрохимозина или химозина объяснятся следующим. Химозин синтезируется в организме животных в форме препрохимозина. Препрохимозин - белок, состоящий из 365 аминокислотных остатков, 16 из которых являются гидрофобной лидерной последовательностью, которая играет важную роль в секреции химозина через клеточную мембрану [4], для экспрессии в прокариотической системе она не требуется. В проведенных ранее исследованиях было установлено, что экспрессия зрелого химозина ведет к наработке продукта, не обладающего молокосвертывающей активностью (МА) [37].
Для обеспечения высокого и стабильного выхода целевого продукта была проведена оптимизация кодонного состава выбранной последовательности прохимозина Vicugna pacos для экспрессии в E.coli. В ходе теоретического дизайна проведена замена кодонов, используемых в клетках эукариот на кодоны, используемые прокариотами. В состав нуклеотидной последовательности гена на N-конец добавлена последовательность белка-шаперона тиоредоксина (фиг. 1). Оптимизированная последовательность была синтезирована.
В качестве вектора экспрессии выбрана плазмида рЕТ32а. После клонирования синтезированной последовательности в составе вектора, полученной рекомбинантной плазмидой была проведена трансформация бактериальных клеток Neb stable для наработки плазмидной ДНК.
В качестве продуцента выбран штамм E.coli BL21(DE3)pLysE. Выбор штамма-реципиента обусловлен тем, что он несет ген РНК-полимеразы фага Т7, которая необходима для обеспечения эффективной транскрипции целевых генов, находящихся в векторной конструкции под контролем промотора фага Т7, а также тем, что данный штамм дефектен по синтезу протеаз, что существенно повышает выход синтезируемых гетерологичных белков.
При культивировании штамм E.coli BL21(DE3)pLysE/pET32-TrxVic, обеспечивает синтез химерного прохимозина Vicugna pacos на уровне 40% от общего бактериального белка.
Благодаря добавлению последовательности тиоредоксина удается увеличить эффективность процесса рефолдинга прохимозина Vicugna pacos.
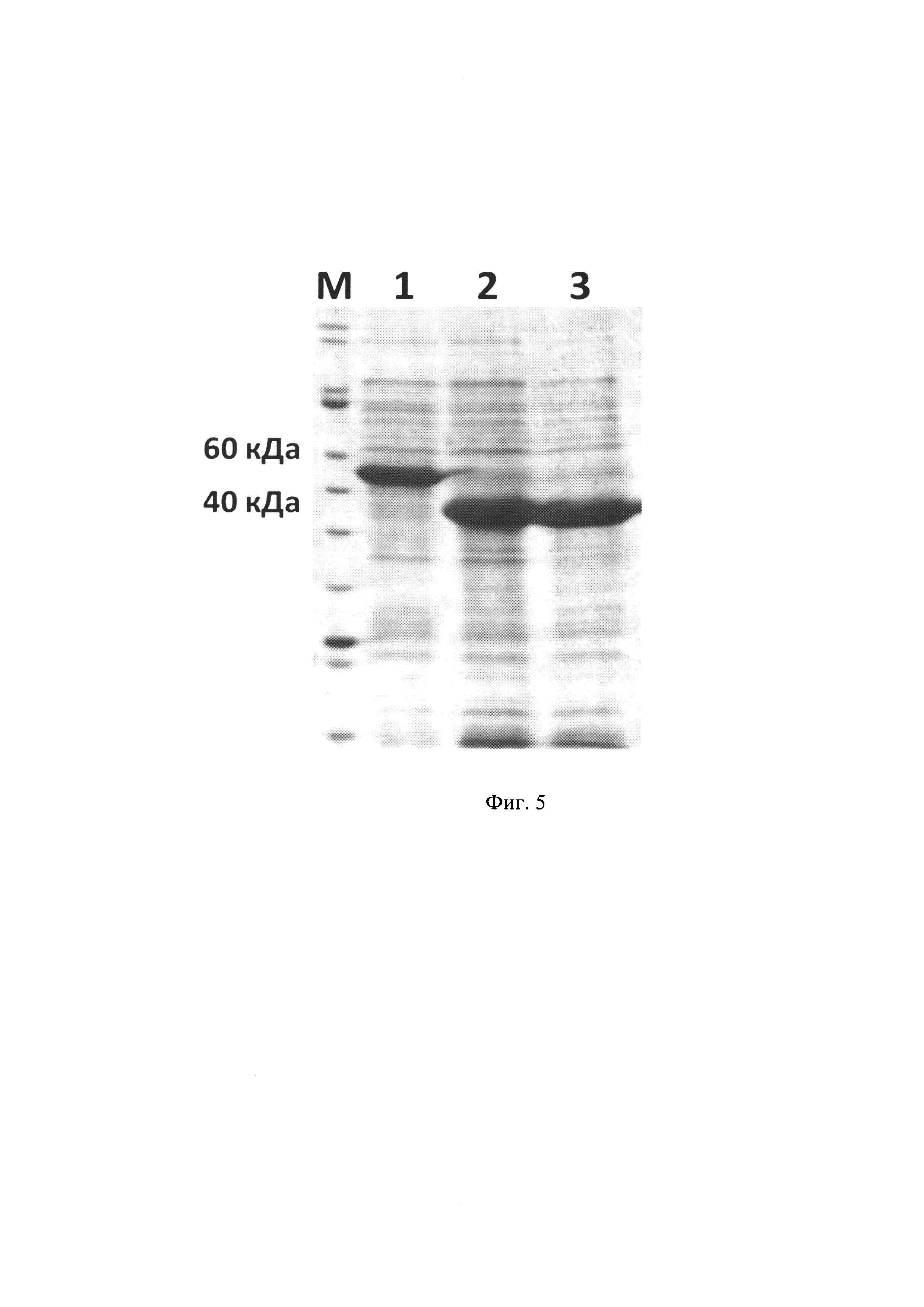
Изобретение иллюстрируется следующими графическими фигурами. На фиг. 1 приведена нуклеотидная последовательность гена химерного белка прохимозина TrxVic. На фиг. 2 представлена структура аминокислотной последовательности химерного белка тиоредоксин-прохимозина Vicugna pacos. На фиг. 3 изображена физическая и генетическая карта рекомбинантной плазмиды pET32-TrexVic, содержащая последовательность химерного белка прохимозина Vicugna pacos. На фиг. 5 представлена фотография электрофоретического разделения препарата химерного белка прохимозина Vicugna pacos в ПААГ. 1 - образец химерного рекомбинантного химозина Vicugna pacos включающего последовательность тиоредоксина (получен с использованием заявляемой плазмиды и штамма-продуцента), 2 - образец рекомбинантного прохимозина Vicugna pacos (без тиоредоксина), 3 - образец рекомбинантного прохимозина В Bos taurus, М -маркер молекулярной массы.
Для лучшего понимания сущности предлагаемого изобретения ниже приведены примеры его осуществления. Все стандартные генно-инженерные и микробиологические манипуляции, а также амплификацию и секвенирование ДНК проводили по известным методикам [38].
Пример 1. Синтез, встройка и анализ фрагмента ДНК, включающего полную кодирующую последовательность гена прохимозина альпака слитого с последовательностью белка тиоредоксина (Trx).
Заявляемая плазмида содержит следующие, существенные для ее функционирования и экспрессии целевого белка, структурные элементы:
- нуклеотидную последовательность белка тиоредоксина (Trx) для коэкспрессии слитых белков
- промотор бактериофага Т7, обеспечивающий эффективную транскрипцию контролируемой мРНК; нетранслируемую область терминации транскрипции бактериального оперона, терминатор РНК-полимеразы фага Т7, обеспечивающий эффективное окончание транскрипции;
- бактериальный оперон bla (AmpR), кодирующий белок бета-лактамазу, являющуюся селективным маркером для трансформации штаммов Е. coli;
- бактериальный участок инициации репликации типа ColE1 (ori), обеспечивающий репликацию плазмиды в штаммах Е. coli.
Выбранная нуклеотидная последовательность гена прохимозина альпака ХР_006197500.1 была синтезирована на автоматическом синтезаторе ABI 3400 DNA/RNA Synthesizer. Синтезированный ген был клонирован в составе клонирующего вектора pGH («ДНК синтез», г. Москва). Для амплификации гена прохимозина альпака проводили ПЦР с использованием олигонуклеотидных праймеров, содержащих сайты гидролиза для последующей встройки продукта реакции в экспрессионный вектор: Trx_Vic_F (содержащий сайт Msp20I) и Trx_Vic_R (содержащий сайт HindIII) (таблица 1). Реакцию проводи с помощью PfuSE ДНК полимеразы (НПО "СибЭнзим", Россия) на ПЦР-амплификаторе «БИС» фирмы ООО "БИС-Н" (Россия). Реакционная смесь, объемом 50 мкл, содержащая 2 мкг ДНК (плазмиды pGH с геном химозина), 10 пкМ каждого праймера (pET21a+proChym-(S) и рЕТ21а+Chym(B), 67 мМ трис-HCl (рН 8,8), 15 мМ сульфата аммония, 2,5 мМ хлористого магния, 0,01% Твин-20, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ, дГТФ по 2,5 мМ) и 1 ед. PfuSE ДНК полимеразы (НПО "СибЭнзим", Россия); реакцию осуществляли при следующих параметрах: 50 с - 96°С, 30 с - 60°С, 1 мин - 72°С (30 циклов).

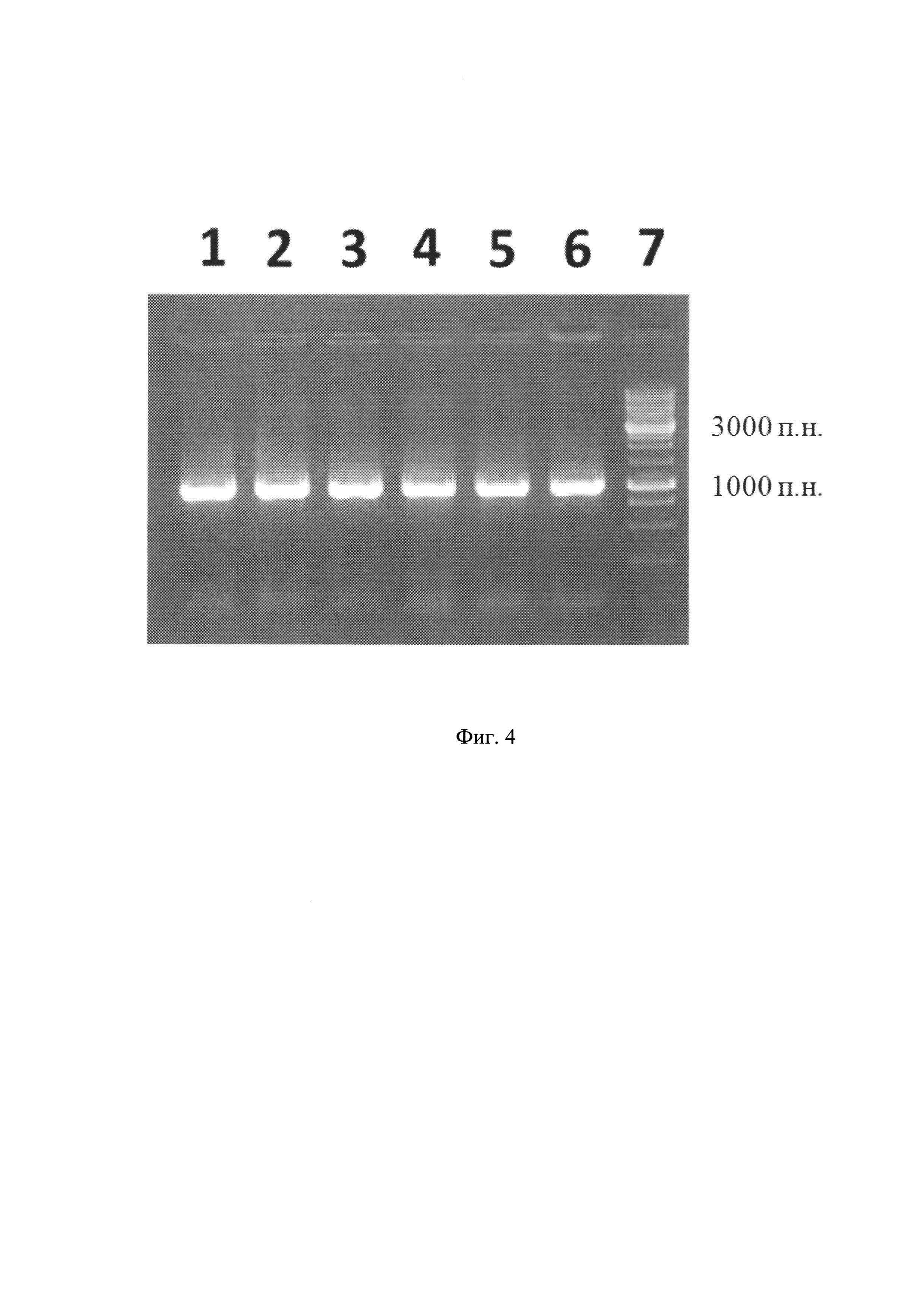
После завершения амплификации компоненты реакционной смесь разделяли методом электрофореза в 1% агарозном геле и выявляли продукт реакции - единичный фрагмент размером 1111 п. н. (Фиг 4). Фрагмент выделяли из геля с помощью набора «Gel Extraction Kit» фирмы Qiagen (Германия). Затем проводили гидролиз выделенного ПЦР-продукта и предварительно наработанного и очищенного вектора рЕТ32а(-) эндонуклеазами рестрикции Msp20I и HindIII («СибЭнзим», Россия) в условиях, рекомендованных производителем.
Плазмидную ДНК после ферментативного гидролиза фракционировали методом ЭФ в 1% геле агарозе. Рестрицированный вектор выделяли из агарозного геля с использованием набора «Gel Extraction Kit» фирмы Qiagen (Германия). Реакцию лигирования проводили с использованием ДНК-лигазы бактериофага Т4 («СибЭнзим», Россия). Реакция проводилась при +4°С в течение ночи. Полученной лигазной смесью трансформировали (как описано в примере 2) химически компетентные клетки Е. coli штамм NEB ("New England Biolabs", Великобритания).
После трансформации клоны отбирали на селективной агаризованнной среде LB с антибиотиком ампициллином (50 мг/мл). Наличие вставки гена прохимозина в рекомбинантной плазмиде проверяли при помощи анилитической ПЦР. Разделение продуктов амплификации проводили в 1%-м агарозном геле с последующим окрашиванием бромистым этидием (0,5 мкг/мл). Положительные колонии, вносили в 5 мл среды LB с ампициллином (50 мкг/мл) и растили в течение ночи на орбитальном шейкере при 37°С и 170 об/мин. Затем плазмидную ДНК выделяли из бактериальных клеток с помощью коммерческих наборов DNA mini kit фирмы «Qiagen» (Германия) согласно рекомендациям производителя. Нуклеотидную последовательность полученных плазмид подтверждали секвенированием методом Сэнгера в ЦКП «Геномика» СО РАН (Россия).
Секвенирование плазмидной ДНК положительных клонов в районе встройки гена прохимозина альпака позволило отобрать клоны с отсутствием дефектов встраиваемого гена (вставки, делеции, замены), после чего из отобранных клонов была наработана и выделена плазмидная ДНК.
Пример 2. Получение рекомбинантного штамма Escherichia coli BL21(DE3) pLysE/pET32-TrxVic
С целью получения штамма-продуцента рекомбинантного прохимозина Vicugna pacos была проведена трансформация клеток Е. coli BL21(DE3) pLysE сконструированной рекомбинантной плазмидой pET32-TrexVic (Фиг 3), с использованием хлористого кальция.
Культуру клеток подращивали до ODλ600=0.5 единиц оптической плотности (е.о.п.), 1,5 мл суспензии центрифугировали при 6000 об/мин в течение 2 мин на центрифуге "Eppendorf 5415 R". Осадок клеток суспензировали в 700 мкл 0,2М CaCl2, инкубировали при 4°С в течение 15 мин, затем клетки осаждали центрифугированием 4000 об/мин 3 мин. Осадок клеток суспендировали в 100 мкл 0,2М CaCl2. К суспензии клеток добавляли 50-70 нг плазмидной ДНК, инкубировали 30 мин при 4°С, затем в течение 5 мин при 37°С. К суспензии клеток добавляли 1 мл среды LB и инкубировали при 37°С в течение 1 часа. Отбирали 100 мкл культуры и рассевали ее на чашку Петри с агаризованной средой с добавлением ампициллина до концентрации 100 мкг/мл. Остаток культуры осаждали центрифугированием при 4000 об/мин в течение 3 мин, отбирали супернатант, суспендировали в 100 мкл LB и высевали на чашку с агаризованной средой LB, содержащей 100 мкг/мл ампициллина. Чашки инкубировали в термостате при 37°С в течении ночи. На следующий день идентифицировали отдельные колонии BL21(DE3) pLysE/pET32-TrxVic.
Штамм E.coli BL21 (DE3) pLysE, несущий рекомбинантную плазмиду рЕТ32-TrexVic, - продуцент рекомбинантного прохимозина Vicugna pacos характеризуется следующими признаками: высокой физиологической стабильностью (снижение активности продуцируемого фермента после 50 генераций не превышает 20%) и высоким выходом активного продукта.
Клетки хорошо растут на стандартных питательных средах. Время генерации около 30 мин в жидкой LB-среде. На 2-2,5% питательном агаре "Difco" образуются круглые, гладкие, желтоватые колонии с ровными краями. При выращивании на жидких LB- и YT-средах образуется интенсивная ровная мутность.
Физиолого-биохимические признаки
Оптимальная температура культивирования - от 16 до 42°С, оптимум рН - 7,6. Источником азота служат органические соединения (в виде триптона, дрожжевого экстракта).
Существенным при использовании данных штаммов является их чувствительность к канамицину (до 25 мкг/мл). Проявляют устойчивость к ампициллину (до 100 мкг/мл), обусловленную наличием плазмид pET32-TrexVic.
Один из отобранных клонов обозначали как Escherichia coli BL21(DE3) pLysE/pET32-TrxVic, выращивали его в 5 мл жидкой среды LB, содержащей 100 мг/л ампиницилина до ODλ600=5,0 е.о.п., добавляли к культуре равный объем стерильного 30% глицерина, разливали по 500 мкл в стерильные 1.5 мл пробирки, замораживали и хранили при - 70°С.
Пример 3. Наработка биомассы BL21(DE3) pLysE/pET32-TrxVic и выделение рекомбинантного прохимозина Vicugna pacos
Индивидуальные колонии рекомбинантного штамма Е. coli, трансформированные плазмидой pET32-TrexVic, культивировали в течение ночи, на орбитальном шейкере, в среде LB, при 37°С и 180 об/мин. Инокулят, в соотношении 1:100, переносили в колбу Эрленмейера, содержащую среду LB и растили до оптической плотности (при λ=600 нм) равной 0,8. Добавляли индуктор (изопропил-β-D-1-тиогалактопиранозид), до конечной концентрации 0,1 мМ. Клетки дополнительно культивировали на шейкере в течение 12 часов при 25°С и 160 об/мин. Биомассу бактериальных клеток осаждали центрифугированием при 5000 G в течении 20 минут. Осадок растворяли, из расчета 20 мл на 1 грамм, в лизирующем буфере (8% сахароза, 50 мМ Трис, 20 мМ ЭДТА, 5% Triton Х100 рН=8,0) с использованием ультразвукового гомогенизатора Soniprep 150 Plus ("MSE", Китай). Осадок, содержащий тельца включения, отделяли центрифугированием (20000 G в течение 25 мин, 4°С) и растворяли в в базовом буфере (50 мМ KH2PO4, 150 мМ NaCl, рН=10,7), содержащем 8М мочевину.
После разделения все фракции были проанализированы в 12% ПААГ на наличие целевого белка. Результаты показали, что весь целевой белок находится в нерастворимой фракции и его процентное содержание от общего количества белков составляет порядка 40% (фиг 5).
Пример 4. Рефолдинг и активация рекомбинантного прохимозина Vicugna pacos
Рефолдинг целевого белка и его очистку от мочевины проводили диализом в две стадии. Раствор рекомбинантного прохимозина в 8 М мочевине, разбавляли базовым буфером до конечной концентрации белка 180 мкг/мл. Доводили рН раствора до 8,0±0,1 с помощью 1М HCl и диализовали против буфера А (20 mM Tris; 150 тМ NaCl) при 4°С, меняя раствор каждые 12 часов 3 раза.
Для подтверждения наличия молокосвертывающей активности профермент активировали.
Активацию прохимозина проводили путем ступенчатого понижения и повышения рН. Все операции выполняли в пластиковой посуде, при комнатной температуре. Для контроля исходной МА рекомбинантного прохимозина, отбирали аликвоту неактивированного фермента.
Для активации в образец рекомбинантного прохимозина, при постоянном перемешивании, вносили 2,0М HCl до рН 3,0. Останавливали перемешивание и инкубировали смесь при рН 3,0±0,1 в течение 2 часов. По истечении времени инкубации, доводили рН образца до 5,8±0,1, используя 0,5М NaOH. В активированном таким способом образце определяли МА.
Пример 5. Определение молокосвертывающей активности рекомбинантного химозина
Для определения МА использовали стандартизированный сухой молочный субстрат ("Субстрат СТ.3"), выпускаемый ВНИИМС (г. Углич). Для подготовки к работе 25,0 гр. субстрата растворяли в 230 мл 0,01N CaCl2 в течение 1 ч при комнатной температуре и постоянном перемешивании. Доводили рН полученной смеси до 6,5±0,1, используя 1,0М NaOH. Конечный объем раствора доводили до 250 мл 0,01 N CaCl2.
Активность исследуемых образцов определяли относительно отраслевого контрольного образца сычужного фермента (ОКО СФ), аттестованного по МА, выпускаемого ОАО "Московский завод сычужного фермента". Для подготовки к работе, к 1,0 г ОКО СФ добавляли 80 мл дистиллированной воды, перемешивали 30 минут при 20-25°С, доводили объем смеси до 100 мл и выдерживали на водяной бане при 35°С в течение 15 мин. Перед определением МА исследуемые образцы выдерживали 15 минут при 35°С.
Определение МА проводили при 35°С. В сухую стеклянную пробирку вносили 2,5 мл раствора стандартизированного субстрата и прогревали при 35°С в течение 5 минут. В пробирку с субстратом добавляли 0,25 мл исследуемого образца, включали секундомер, содержимое пробирки сразу же тщательно перемешивали. Продолжительность свертывания субстрата отмечали по секундомеру с момента внесения образца до появления первых хлопьев коагуляции субстрата. Появление хлопьев проверяли путем периодического нанесения стеклянной палочкой капли реакционной смеси на стенку пробирки.

Молокосвертывающую активность исследуемых образцов выражали в условных единицах на 1 мл препарата (усл. ед./мл) и рассчитывали по формуле:

где:
А - аттестованная молокосвертывающая активность ОКО СФ в условных единицах;
T1 - продолжительность свертывания субстрата с ОКО СФ;
Т2 - продолжительность свертывания субстрата с исследуемым образцом.
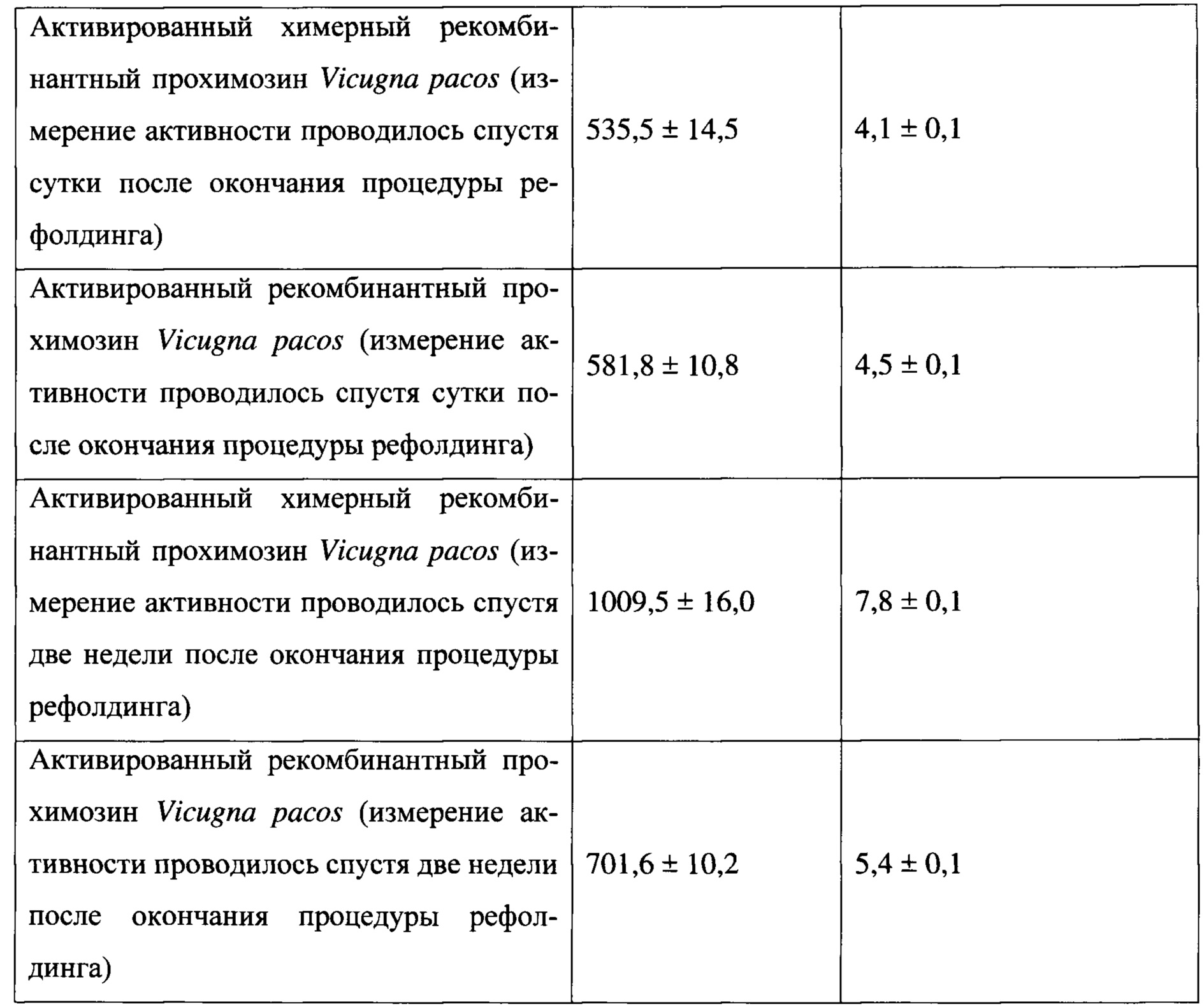
Для перевода условных единиц МА в международные молокосвертывающие единицы (IMCU) использовали понижающий коэффициент 129,1. Результаты исследования представлены в таблице 2.
Сравнительная ферментативная активность показала, что скорость рефолдинга химерного рекомбинатного прохимозин Vicugna pacos выше скорости рефолдинга рекомбинатного прохимозин Vicugna pacos.
СПИСОК ИСПОЛЬЗОВАННЫХ источников
1. Harboe М., Broe M.L., Qvist K.B. In: Technology of Cheesemaking. Law BA, Tamime AY, Eds., John Wiley & Sons., 2010, Ch. 3. The Production, Action and Application of Rennet and Coagulants.- P. 98-129.
2. Jacob, M. Recent advances in milk clotting enzymes / M. Jacob, D. Jaros, H. Rhom // Int. J. Dairy Technol.- 2011.- V. 64.- N. 1.- P. 14-33.
3. Gilliland, G. L. The three-dimensional structure of recombinant bovine chymosin at 2.3 A resolution / G.L. Gilliland, E. L. Winborne, J. Nachman, A. Wlodawer // Proteins.- 1990.- N 8.-P. 82-101.
4. Khan, A.R. Molecular mechanisms for the conversion of zymogens to active proteolytic enzymes. Review / A.R. Khan, M.N.G. James // Prot. Sci.- 1998.- V 7.- P. 815-836
5. Kageyama, T. Pepsinogens, progastricsins, and prochymosins: structure, function, evolution, and development / T. Kageyama // Cell. Mol. Life Sci.- 2002.-V 59(2).- P.288-306.
6. Wangoh, J. Extraction of camel rennet and its comparison with calf rennet extract / J. Wangoh, Z. Farah, Z. Puhan // Milchwissenschaft.- 1993.- N 48.- P. 322-325.
7. Suzzi, G. Influence of pig rennet on fatty acid composition, volatile molecule profile, texture and sensory properties of Pecorino di Farindola cheese / G. Suzzi, G. Sacchetti, F. Patrignani, A. Corsetti, R. Tofalo, M. Schirone, G. Fasoli, F. Gardini, G. Perpetuuini, R. Lanciotti // J. Sci. Food Agriculture.- 2014.- V. 95(11).- P. 2252-2263.
8. Ельчанинов, В.В. Практические аспекты использования молокосвертывающего фермента из сычугов северного оленя / В.В. Ельчанинов, А.Н. Белов, М.С. Уманский, А.Д Коваль, Е.А. Авданина, В.П. Вистовская, А.В. Кригер // Сыроделие и маслоделие. - 2006. - №5. - С. 5-7.
9. Feijoo-Siota L., Blasco L., Rodriguez-Rama J.L.,  J., De Miguel Т.,
J., De Miguel Т.,  A, Villa T.G. Recent patents on microbial proteases for the dairy industry. Recent Adv. in DNA and Gene Sequences.- 2014.- V.8.- N. 1.- P. 44-55.
A, Villa T.G. Recent patents on microbial proteases for the dairy industry. Recent Adv. in DNA and Gene Sequences.- 2014.- V.8.- N. 1.- P. 44-55.
10. Payie, K.G. Construction, expression and characterization of a chimaeric mammalian-plant aspartic proteinase. / K.G. Payie, T. Tanaka, S. Gal, R.Y. Yada // Biochem. J.- 2003. - V. 372. - P. 671-678.
11.  F. Large-scale production of yak (Bos grunniens) chymosin A in Pichia pastoris / F.
F. Large-scale production of yak (Bos grunniens) chymosin A in Pichia pastoris / F.  M. inan // Protein Expression and Purification.- 2019.- V. 154. - P. 126-133
M. inan // Protein Expression and Purification.- 2019.- V. 154. - P. 126-133
12. Flamm, E.L. How FDA approved chymosin: a case history / E.L. Flamm // Bio/Technology.-1991.- V.9.- N. 4. - P. 349-351.
13. Uchiyama, H. Purification of prorennin mRNA and its translation in vitro / H. Uchiyama, T. Uozumi, T. Beppu, K. Arima // Agric. Biol. Chem.- 1980. - V 44. - P. 1373-1381.
14.  J. Complete primary structure of lamb preprochymosin deduced from cDNA / J. Pungercar, B. Strukelj, F. Gubensjek, V. Turk, and I. Kregar // Nucleic Acids Res.- 1990.- N. 18. - P. 4602-4608.
J. Complete primary structure of lamb preprochymosin deduced from cDNA / J. Pungercar, B. Strukelj, F. Gubensjek, V. Turk, and I. Kregar // Nucleic Acids Res.- 1990.- N. 18. - P. 4602-4608.
15. Rogelj, I. Recombinant Lamb Chymosin as an Alternative Coagulating Enzyme in Cheese Production /I. Rogelj, B. Perko, A. Francky, V. Penca, J. Purgencar // J. Dairy Sci.- 2001. - N 84.- P. 1020-1026.
16. Vega-Hernandes, M.C. Molecular cloning and expression in yeast of caprine prochymosin / M.C. Vega-Hernandes, A. Gomes-Coello, J. Villar, F. Claverie-Martin // Journal of Biotechnology. - 2004.- N 1-2. - P.69-79.
17. Kappeler, S.R. Characterization of recombinant camel chymosin reveals superior properties for the coagulation of bovine and camel milk / S.R. Kappeler, H. (J.) M. van den Brink, H. Rahbek-Nielsen, Z. Farah, Z. Puhan, E.B. Hansen, E. Johansen // Biochemical and Biophysical Research Communications.- 2006. - V. 2. - N. 342. - P. 647-654.
18. Vallejo, J.A. Cloning and Expression of Buffalo Active Chymosin in Pichia pastoris / J.A. Vallejo, J.M. Ageitos, M. Poza, T.G. Villa // J. Agricultural and Food Chemistry.- 2008.- V. 56 (22).- P. 10606-10610.
19. Vallejo, J.A. Short communication: A comparative analysis of recombinant chymosins / J.A. Vallejo, J.M. Ageitos, M. Poza, T.G. Villa // Journal of Dairy Science.- 2012. - V. 95.- N. 2. - P. 609-613.
20. Беленькая, С.В. Некоторые биохимические свойства рекомбинантного химозина альпака (Vicugna pacos L.) / С.В. Беленькая, А.П. Рудометов, Д.Н. Щербаков, Д.В. Балабова, А.В. Кригер, А.Н. Белов, А.Д. Коваль, В.В. Ельчанинов // Прикладная биохимия и микробиология.- 2018.- Т. 54.- №6.- С.585-593.
21. Bansal, N. Suitability of recombinant camel (Camelus dromedarius) chymosinas as a coagulant for Cheddar cheese / N. Bansal, M.A. Drake, P. Piraino, M.L. Broe, M. Harboe, P.F. Fox, P.H.L. McSweeney // International Dairy Journal.- 2009.- V.19.- P. 510-517.
22. McCaman, M.T. Enzymatic properties and processing of bovine prochymosin synthesized in Escherichia coli / M.T. McCaman, W.H. Andrews, J.G. Files // J. Biotechnol.- 1985.- V 2.- P. 177-190.
23. Kawaguchi, Y. Production of chymosin in Escherichia coli cells and its enzymatic properties / Y. Kawaguchi, S. Kosugi, K. Sasaki, T. Uozumi, T. Beppu // Agric. Biol. Chem.- 1987.- V 51.-P. 1871-1877.
24. Kawaguchi, Y. Renaturation and activation of calf prochymosin produced in an insoluble form in Escherichia coli / Y. Kawaguchi, N. Shimizu, K. Nishimori, T. Uozumi, T. Beppu // J. Biotechnol.- 1984.- V 1.- P. 307-315.
25. Shoemaker, J.M. Examination of calf prochymosin accumulation in Escherichia coli: disulphide linkages are a structural component of prochymosin-containing inclusion bodies / M. Shoemaker, A.H. Brasnett, F.A.O. Marston // EMBO J.- 1985.- V 4.- P. 775-780.
26. Chen, H. Functional Implications of Disulfide Bond, Cys206-Cys210, in Recombinant Prochymosin (Chymosin) / H. Chen, G. Zhang, Y. Zhang, Y.Dong, K. Yang // Biochemistry.-2000.- V. 39.- P. 12140-12148.
27. Wei, C. Chaperone-mediated refolding of recombinant prochymosin / C. Wei, Y. Zhang, K. Yang // J. Prot. Chem.- 2000.- V. 19.- N. 6.- P. 449-456.
28. Wei, C. Oxidative refolding of recombinant prochymosin / C. Wei, B. Tang, Y. Zhang, K. Yang // Biochem. J.- 1999.- V. 340.- P. 345-351.
29. Menzella, H.G. High recovery of prochymosin from inclusion bodies using controlled air oxidation / H.G. Menzella, H.C. Gramajo, E.A. Ceccarelli // Prot. Expr. Purif.- 2002.- V. 25(2).-P. 248-255.
30. Reh, G. Partition features and renaturation enhancement of chymosin in aqueous two-phase systems / G. Reh, D. Spelzini, G.  G.
G.  B. Farruggia // J. Chromatogr. В.- 2007.- V. 860(1).- P. 98-105.
B. Farruggia // J. Chromatogr. В.- 2007.- V. 860(1).- P. 98-105.
31. Wang, N. Expression and characterization of camel chymosin in Pichia pastoris / N. Wang, K.Y. Wang, G. Li, W. Guo, D. Liu // Protein Expr. Purif.- 2015.- V. 111.- P. 75-81ю
32. Cheese Chemistry, Physics and Microbiology, Third edition, Volume I: General Aspects. Rennets: General and Molecular Aspects / M.J.C. Grabbe.; P.F.Fox, P.L.H. McSweeney, T.M. Cogan, T.P. Guinee, eds.- London, UK: Elsevier Academic Press, 2004.- P. 19-45.
33. Заявка США 2002/0164696, A1, C12P, 21/02, C12N, 5/06, опубл. 07.11.2002 г.
34. Feng Z. et al. Codon optimization of the calf prochymosin gene and its expression in Kluyveromyces lactis // World Journal of Microbiology and Biotechnology. - 2010. - T. 26. -№. 5.-P. 895-901.
35. Menzella H. G. Comparison of two codon optimization strategies to enhance recombinant protein production in Escherichia coli // Microbial cell factories. - 2011. - T. 10. - №. 1. - P. 15.
36. Заявка США №20070166785, A1, МПК C12P 21/06, C07H 21/04, опубл. 19.07.2007 г.
37. Рудометов А.П. Сравнение экспрессии нуклеотидной последовательности химозина и прохимозина теленка в Е. coli BL21 и оценка молокосвертывающей активности полученных рекомбинантных белков / А.П. Рудометов, С.В. Беленькая, Е.А. Колосова и др. // Международный научно-исследовательский журнал. - 2016. - №10 (52) Часть 4. - С.37-40.
38. Маниатис Т., Фрич Э, Сэмбрук Дж. Молекулярное клонирование, М.: Мир, 1984; Клонирование ДНК. Методы. Под ред. Д.Гловера, Пер. с англ., Москва, Мир, 1988; Saiki R.K., Gelfand D.H., Stoffel S., Sharf S.J., Higuehi R., Horn G.T., Mullis K.B., Eriich H.A. Science, 1988. V.239, №4839, p.487-491; Sanger F., Nicklen S., Coulson A.R. Proc. Nat. Acad. Sci. USA, 1977, V. 74, p. 5463-5467.
Приложение
<110> АлтГУ
<120> Рекомбинантная плазмида pET32-TrexVic, обеспечивающая синтез химерного белка прохимозина В Bos taurus, и штамм Escherichia coli BL21(DE3)pLysE pET32- TrxVic – продуцент химерного белка прохимозина Vicugna pacos
<160> SEQ ID NO 2
<210> SEQ ID NO:1
<211> 1440
<212> DNA
<213> Artificial Sequence
<220>
<223> Нуклеотидная последовательность гена TrxVic химерного белка прохимозина Vicugna pacos.
<400> 1
ATGAGCGATAAAATTATTCACCTGACTGACGACAGTTTTGACACGGATGTACTCAAAGCGGACGGGGCGATCCTCGTCGATTTCTGGGCAGAGTGGTGCGGTCCGTGCAAAATGATCGCCCCGATTCTGGATGAAATCGCTGACGAATATCAGGGCAAACTGACCGTTGCAAAACTGAACATCGATCAAAACCCTGGCACTGCGCCGAAATATGGCATCCGTGGTATCCCGACTCTGCTGCTGTTCAAAAACGGTGAAGTGGCGGCAACCAAAGTGGGTGCACTGTCTAAAGGTCAGTTGAAAGAGTTCCTCGACGCTAACCTGGCCGGTTCTGGTTCTGGCAGCGGTATTACCAGAATCCCACTTCACAAAGGCAAGACTCTGCGTAAAGCGTTGAAAGAGCATGGATTACTCGAGGACTTTCTTCAGCGGCAGCAGTACGCCGTGAGTTCAAAATATTCTTCACTTGGCAAAGTCGCTAGAGAACCATTGACTTCATATCTTGACTCACAATATTTCGGTAAAATCTATATAGGGACCCCGCCGCAAGAGTTCACAGTCGTGTTCGACACAGGATCCTCAGATCTCTGGGTCCCATCTATTTATTGTCGTTCCAACGTGTGTAAAAACCATCATCGCTTCGATCCAAGAAAATCCAGTACCTTCCGCAACCTCGGGAAGCCTCTGTCAATACATTATGGAACCGGCAGCATGGAAGGCTTTTTAGGCTATGACACTGTTACTGTATCCAACATTGTGGATCCAAATCAGACAGTAGGGCTTAGCACCGAACAGCCGGGCGAAGTTTTTACCTATAGTGAGTTTGATGGTATCCTGGGGTTGGCTTACCCTAGCTTGGCGTCAGAATATAGCGTTCCAGTCTTCGATAATATGATGGACCGGCACCTCGTCGCCCAAGATCTCTTCTCCGTGTATATGGATCGGAACGGTCAAGGGAGTATGCTGACCTTGGGCGCGATAGACCCAAGCTATTACACTGGATCATTGCACTGGGTGCCAGTGACCGTCCAGCAGTACTGGCAGTTTACAGTGGACTCAGTCACGATCAATGGCGTCGCGGTGGCTTGTGTTGGTGGCTGCCAGGCAATTTTGGATACGGGCACGAGTGTGCTGTTCGGACCGTCATCAGACATACTGAAGATCCAAAAAGCGATAGGGGCAACAGAGAACCGCTACGGTGAATTCGACGTTAATTGCGGTAGTCTGCGCAGTATGCCGACAGTTGTGTTCGAGATCAACGGACGGGACTACCCACTCAGCCCGTCAGCTTATACGTCAAAAGACCAGGGATTCTGTACGTCTGGTTTTCAGGGTGATAACAACAGTGAACTTTGGATACTTGGCGATGTATTTATCCGCGAGTATTACTCTGTTTTTGATCGGGCAAACAATCGTGTTGGGCTGGCCAAAGCCATTTAA (1440 нуклеотида)
<210> SEQ ID NO:2
<211> 479
<212> DNA
<213> Artificial Sequence
<220>
<223> Аминокислотная последовательность химерного белка TrxVic прохимозина Vicugna pacos.
.
<400> 2
MSDKIIHLTDDSFDTDVLKADGAILVDFWAEWCGPCKMIAPILDEIADEYQGKLTVAKLNIDQNPGTAPKYGIRGIPTLLLFKNGEVAATKVGALSKGQLKEFLDANLAGSGSGSGITRIPLHKGKTLRKALKEHGLLEDFLQRQQYAVSSKYSSLGKVAREPLTSYLDSQYFGKIYIGTPPQEFTVVFDTGSSDLWVPSIYCRSNVCKNHHRFDPRKSSTFRNLGKPLSIHYGTGSMEGFLGYDTVTVSNIVDPNQTVGLSTEQPGEVFTYSEFDGILGLAYPSLASEYSVPVFDNMMDRHLVAQDLFSVYMDRNGQGSMLTLGAIDPSYYTGSLHWVPVTVQQYWQFTVDSVTINGVAVACVGGCQAILDTGTSVLFGPSSDILKIQKAIGATENRYGEFDVNCGSLRSMPTVVFEINGRDYPLSPSAYTSKDQGFCTSGFQGDNNSELWILGDVFIREYYSVFDRANNRVGLAKAI
(479 аминокислотных остатка)