Результат интеллектуальной деятельности: Рекомбинатная плазмида pET21a-ProChym, обеспечивающая синтез химерного белка прохимозина В Bos taurus, и штамм Escherichia coli BL21(DE3)pLysE pET21a-ProChym - продуцент химерного белка прохимозина В Bos Taurus
Вид РИД
Изобретение
Изобретение относится к генетической конструкции (плазмиде), обеспечивающей синтез химерного белка прохимозина В Bos Taurus, предназначенного для гидролиза пептидной связи Phe105-Met106 в молекуле каппа-казеина при изготовлении сыров твердых и полутвердых сортов и рекомбинантному штамму Е. coli - продуценту химерного белка прохимозина В Bos Taurus и может быть использовано в области биотехнологии и пищевой промышленности.
Производство сыра - наиболее рентабельная сфера в молочной промышленности. Ключевой стадией производства сыра является свертывание молока, с использованием молокосвертывающих ферментных препаратов (МФП). Свертывание молока в данном процессе условно разделяется на две, частично перекрывающиеся фазы - первичную или ферментативную и вторичную - агрегационную. Во время первичной фазы, под действием молокосвертывающего фермента, в молекуле каппа-казеина (к-казеина) происходит разрыв связи Phe105-Met106. В результате образуются два фрагмента - пара-κ-CN (остатки 1-105), N-терминальный гидрофобный участок, и гидрофильный С-терминальный казеинмакропептид (остатки 106-169). Гидрофобный пара-κ-казеин остается в мицелле, а гидрофильный анионный казеинмакропептид "отходит" в сыворотку. Таким образом, в ходе первой фазы свертывания, под действием химозина (или других молокосвертывающих ферментов) стабильность мицелл нарушается, за счет удаления с их поверхности гликомакропептидного участка к-казеина [1, 2, 3, 4].
В результате устранения стабилизирующего "волоскового" слоя, мицеллы получают возможность сблизиться настолько, что начинается их агрегация - наступает вторичная фаза свертывания. В конечном итоге, агрегация дестабилизированных мицелл приводит к формированию молочного сгустка. Таким образом, специфический гидролиз связи Phe105-Met106 обеспечивает образование молочного сгустка со свойствами необходимыми при изготовлении сыров [3, 4].
В природе существует множество ферментов, обладающих протеолитической активностью. Однако, классическим МФП, обеспечивающим максимальный выход и высокое качество сыра, считается сычужный фермент (СФ). Основным действующим агентом СФ является химозин - фермент, относящийся к классу аспарагиновых протеаз (ЕС 3.4.23.4). Объемы производства сыров ежегодно увеличиваются, вследствие повышения спроса на этот продукт. Увеличение объемов производства сыров неразрывно связано с увеличением потребности в молокосвертывающих препаратах. В связи с этим, начиная со второй половины XX века, наблюдается мировой дефицит сычужного фермента.
Проблема дефицита СФ связана с острой нехваткой сырья для его производства - сычугов телят-молокопоек. Это обусловлено тем, что в условиях снижения поголовья скота, из-за резкого возрастания его продуктивности, экономически нецелесообразно забивать молодняк, питающийся молоком. Эпидемия "скрэпи" - прионового заболевания сельскохозяйственных животных - привела к дополнительному сокращению сырьевой базы натуральных МСФ. Мировой дефицит СФ инициировал поиски его заменителей среди природных молокосвертывающих протеиназ животного, растительного и микробного происхождения, которые продолжаются и в настоящее время.
Наиболее близкие химозину коагулянты, такие как говяжий пепсин, некоторые микробные, растительные и микрофунгиальные протеазы, применяются в настоящее время в качестве его заменителей при производстве определенных видов сыров. Однако, в отличие от натурального химозина, почти все его известные аналоги имеют повышенный уровень неспецифической протеолитической активности, а некоторые часто превосходят химозин и по термостабильности, что приводит к более глубокому гидролизу казеинов, снижению выхода сыра и ухудшению его органолептических характеристик [6, 7, 8, 9].
Современное решение проблемы дефицита СФ - это не только поиск новых сырьевых источников, но и создание технологий производства рекомбинантного химозина. Широкое использование рекомбинантного химозина в качестве МСФ связано с рядом преимуществ этого фермента по сравнению с другими протеазами. К ним относятся: возможность крупномасштабного производства фермента; низкая неспецифическая протеолитическая активность; предсказуемость реакции коагуляции; отсутствие компонентов тканей сельскохозяйственных животных; наличие сертификатов кошерности.
Рекомбинантный химозин является одним из первых рекомбинантных ферментов, получившим широкое распространение в промышленности. В настоящее время описано несколько подходов по получения рекомбинантного химозина.
Известна международная заявка на изобретение (WO 2009/027572, А1, МПК C12N 9/64; C12N 15/69; C12N 15/81, опубл. 05.03.2009 г.) [14] в котором описан способ получения активного химозина буйвола, без процесса аутокаталитической промежуточной активации, опосредованной низким значением рН, для коагуляции молока. Для этого ген химозина буйвола был встроен в ДНК дрожжей Pichia pastoris. При культивировании химозин секретируется во внеклеточную среду в активной форме. Таким образом, авторы заявляют, что использование этого рекомбинантного химозина буйвола, который не подвергается процессу активации с помощью рН, является дополнительным преимуществом по сравнению с предшествующим уровнем техники, избегая промежуточного процесса активации для получения сырных масс.
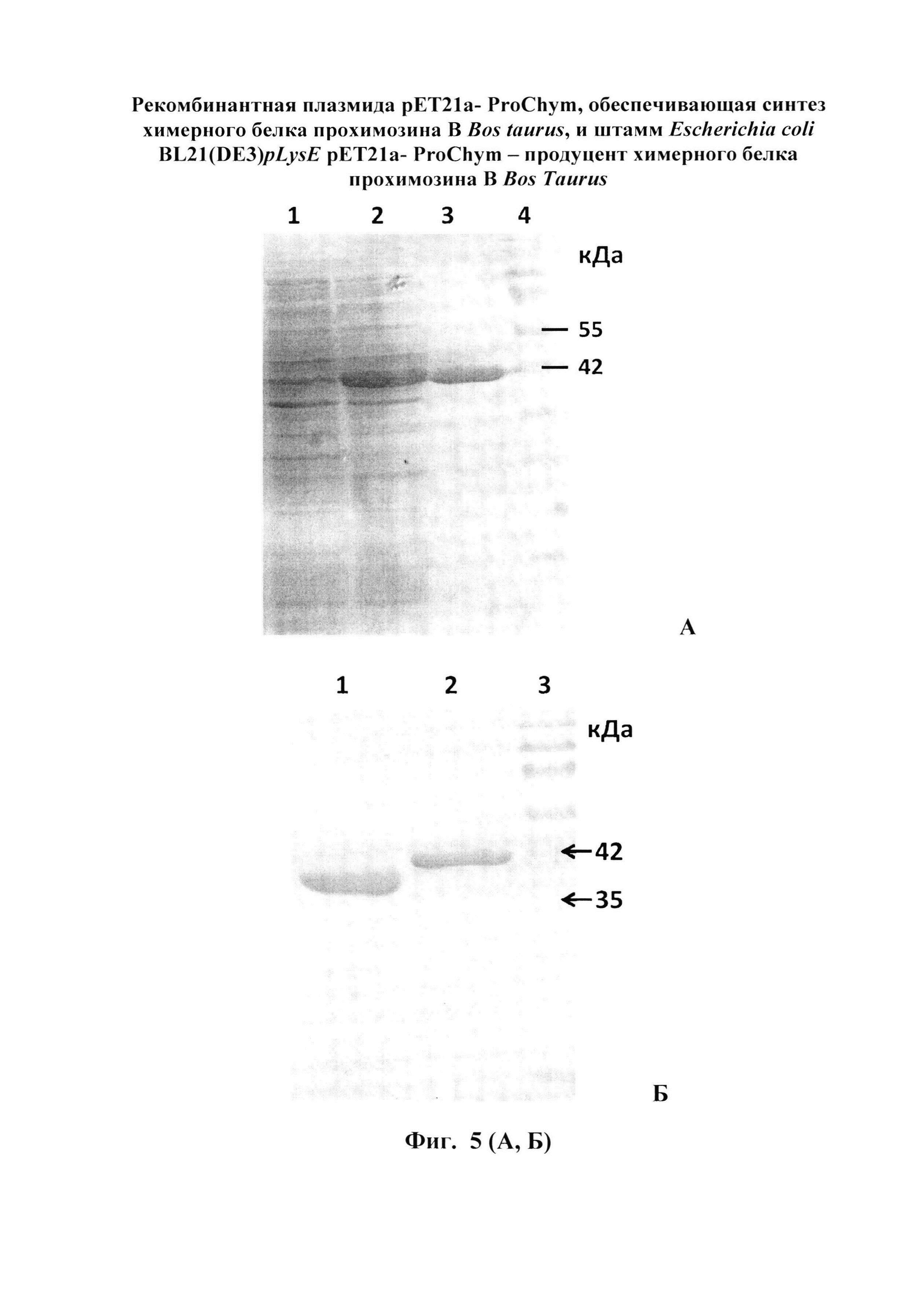
Недостатком генетической конструкции данного изобретения может быть то, что авторы используют природный ген Bubalus arnee bubalus. При переносе гена в другой организм реципиент из-за отличий в механизмах транскрипции, трансляции и посттрансляционных модификаций (высших и низших эукариот) может значительно снизиться выход продукта и его стабильность [10, 11]. Оценить это в данном изобретении не предоставляется возможным, т.к. не описан выход целевого продукта. Так же в генетической конструкции отсутствуют какие-либо аминокислотные метки (например, 6×His), которые дают возможность получать высокоочищенный продукт. В данном изобретении, авторы, для определения молокосвертывающей активности, используют культуральный супернатант, не учитывая, что при ферментации в культуральную среду наряду с целевым белком, могут секретироваться и дрожжевые протеазы и другие белки. Данное обстоятельство не позволяет точно оценить специфичность получаемого химозина. В изобретении не раскрыто использование данного продукта в стандартизированных условиях производства сыра. В нашем изобретении получен химозин со степенью чистоты 98% (Фигура 5, Б), который используют для определения ферментативных свойств указанного конечного продукта.
Активный рекомбинантный химозин, используемый для сыроделия, получают путем активации прохимозина. Поэтому для встройки в вектор экспрессии используют последовательность прохимозина [12, 13].
Наиболее близким аналогом (прототипом) является препарат рекомбинантного химозина и способ его получения (заявка США №20070166785, А1, МПК С12Р 21/06, С07Н 21/04, опубл. 19.07.2007 г.) [15]. В данном изобретении описывается получение рекомбинантного прохимозина Bos taurus в системе Escherichia coli, которое включает стадию амплификации природного гена прохимозина Bos taurus, его встройку в экспрессионный вектор рЕТ21b, трансформацию полученной рекомбинантной плазмидой клеток Е. coli, ферментирование указанной Е. coli для получения прохимозина, методы очистки, ренатурации и активации прохимозина для определения его молокосвертывающей активности.
Недостатком генетической конструкции в прототипе и, как следствие, продуцента - рекомбинантного химозина, так же как и в описанном выше аналоге (WO, 2009/027572), является неоптимизированный под выбранную систему экспрессии ген прохимозина, что особенно отражается при переносе гена из эукариотической клетки в прокариотическую вследствие чего снижается выход продукта и его стабильность [10, 11]. В заявляемом техническом решении ген прохимозина был оптимизирован (Codon Optimization OnLine) для экспрессии в прокариотических клетках. Помимо этого в прототипе не приведены данные о конечной чистоте продукта в результате чего в конечном продукте могут оставаться бактериальные белки, что может повлиять на характеристики продукта.
Техническим результатом заявленного изобретения является создание генетической конструкции и на ее основе рекомбинантного штамма Escherichia coli - продуцента прохимозина В Bos taurus, который обеспечивает более высокую продукцию прохимозина (до 40% от общего белка клетки) с чистотой до 98% (пример 4, фигура 5, А, Б).
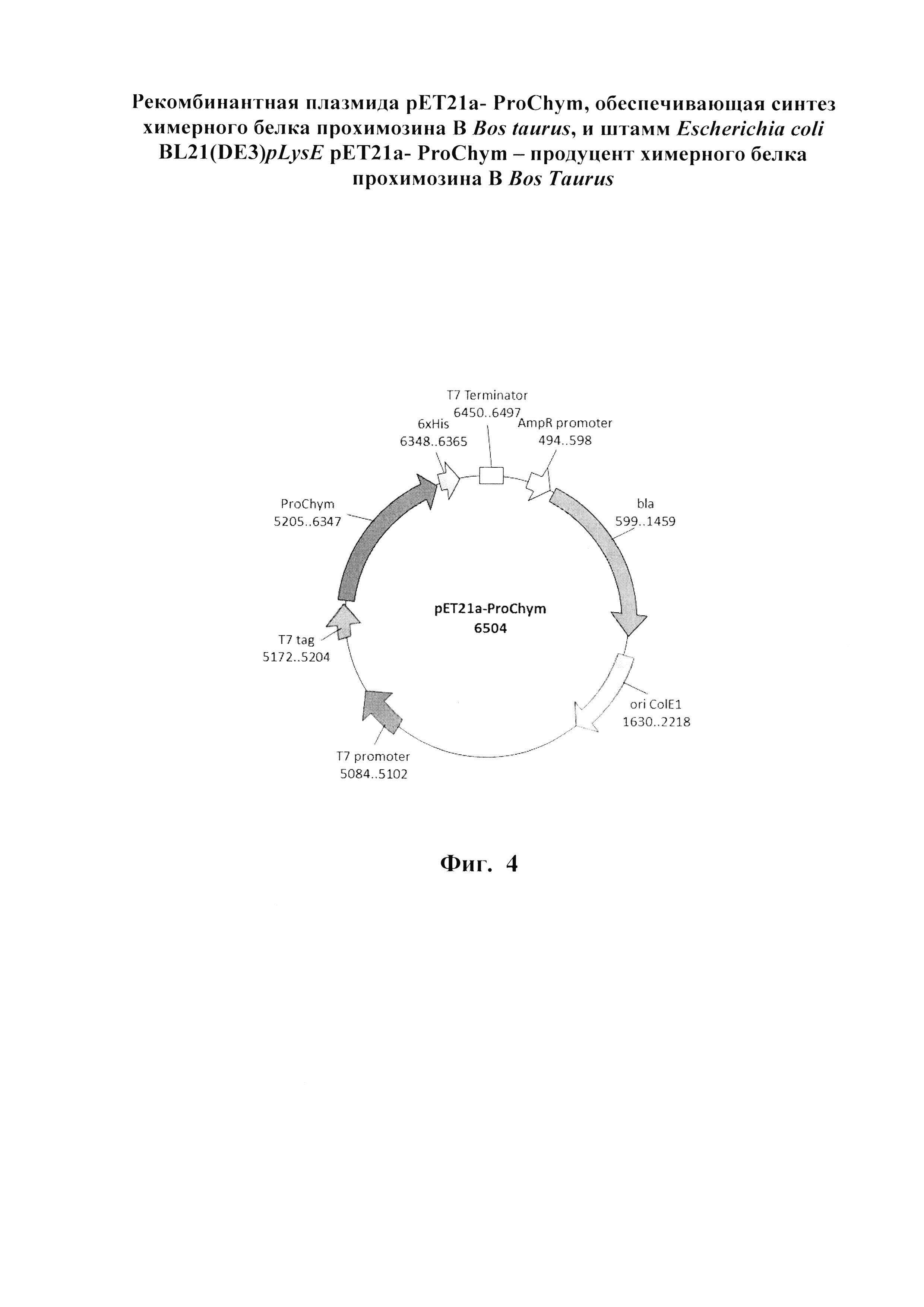
Указанный технический результат достигается созданием рекомбинантной плазмиды рЕТ21а- ProChym размером 6504 пар оснований (п.о.), характеризующейся физической и генетической картой, представленной на фиг. 4, обеспечивающей синтез химерного белка прохимозина В Bos taurus размером 41 кДа в клетках Escherichia coli BL21(DE3)pLysE, содержащей рекомбинантный ген белка прохимозина В Bos taurus, имеющий нуклеотидную последовательность SEQ ID NO: 1 (см. фиг. 1 и приложение) от нуклеотида в положении 5205 п.о. до нуклеотида в положении 6347 п.о., кодирующий целевой химерный белок прохимозин В Bos taurus с полной аминокислотной последовательностью SEQ ID NO: 2 (см. фиг. 3 и приложение), встроенный по сайтам рестрикции FauND I и Sfr274 I в область полилинкера вектора рЕТ21а, содержащего промотор и терминатор РНК-полимеразы фага Т7.
Указанный технический результат достигается также созданием рекомбинантного штамма Escherichia coli BL21(DE3)pLysE рЕТ21а- ProChym - продуцента химерного белка прохимозина В Bos taurus E.coli, полученного трансформацией рекомбинантной плазмидой рЕТ21а- ProChym по п. 1 и депонированного в Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным номером В-1362.
Заявляемый штамм Escherichia coli BL21(DE3)pLysE/ рЕТ21а- ProChym - продуцент рекомбинантного прохимозина В Bos taurus, обеспечивающего специфический гидролиз пептидной связи Phe105-Met106 в молекуле к-казеина и предназначенного для использования при изготовлении сыров твердых и полутвердых сортов, получают следующим образом.
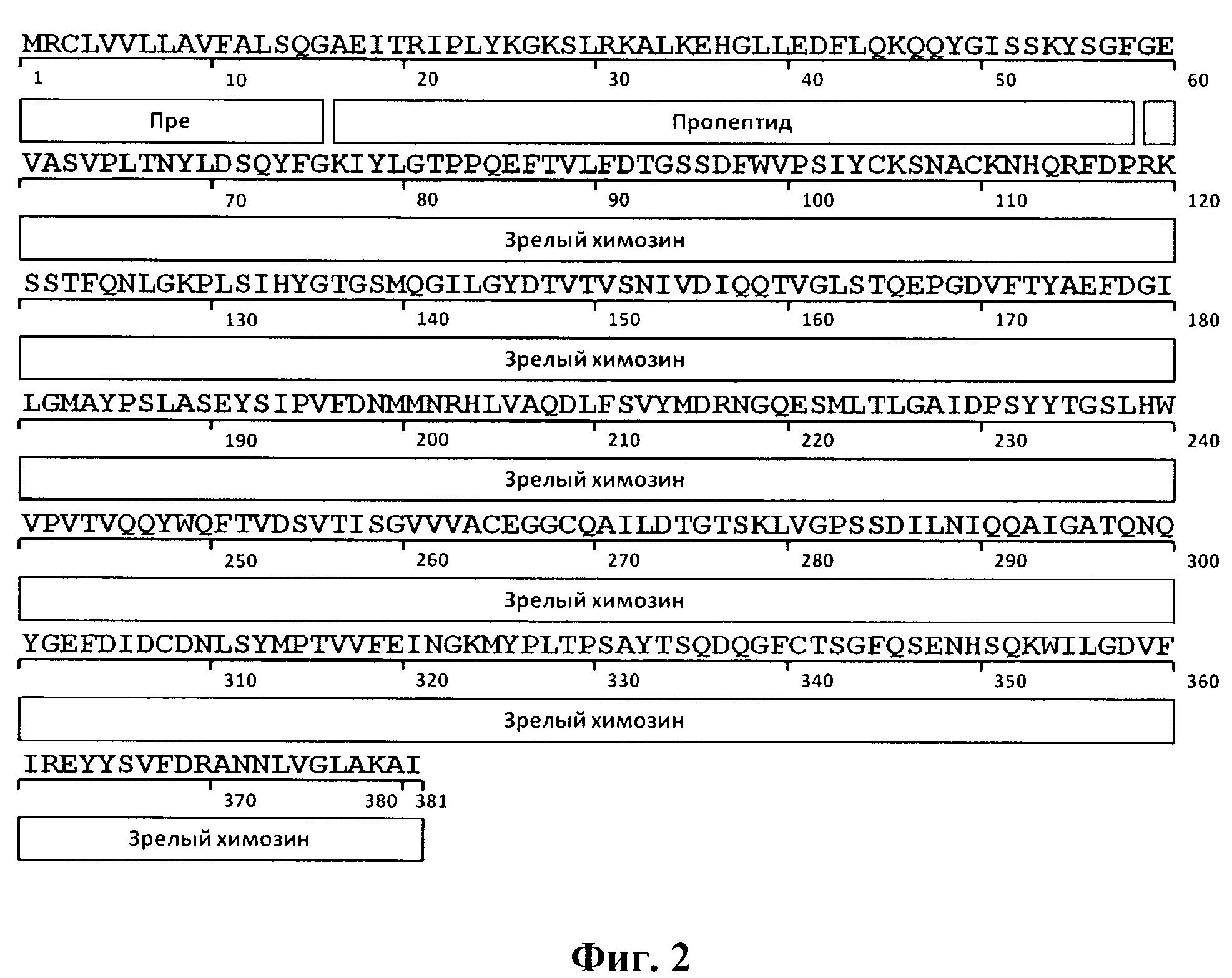
При разработке штамма продуцента рекомбинантного прохимозина, была выбрана последовательность Bos taurus В (Swiss-ProtID:P00794). Выбор последовательности прохимозина В, а не препрохимозина или химозина объяснятся следующим. Химозин синтезируется в организме животных в форме препрохимозина. Препрохимозин - это белок, состоящий из 365 аминокислотных остатков, 16 из которых являются гидрофобной лидерной последовательностью, которая играет важную роль в секреции химозина через клеточную мембрану, для экспрессии в прокариотической системе она не требуется [16]. В проведенных ранее исследованиях было установлено, что экспрессия зрелого химозина ведет к наработке продукта, не обладающего молокосвертывающей активностью (МА) [17]. Существуют две альтернативные формы химозина - химозин А и В. Эти формы отличаются друг от друга одним аминокислотным остатком, аспартатом или глицином в положении 244 соответственно, при этом химозин В встречается чаще и имеет более стабильную структуру (Фиг 1) [18].
Для обеспечения высокого и стабильного выхода целевого продукта была проведена оптимизация кодонного состава выбранной последовательности прохимозина В Bos taurus для экспрессии в E.coli. В ходе теоретического дизайна проведена замена кодонов, используемых в клетках эукариот на кодоны, используемые прокариотами. В состав нуклеотидной последовательности гена на N-конец добавлена последовательность экспрессионного тага Т7. Оптимизированная последовательность была синтезирована.
В качестве вектора экспрессии выбрана плазмида рЕТ21а. После клонирования синтезированной последовательности в составе вектора, полученной рекомбинантной плазмидой была проведена трансформация бактериальных клеток ТОР10 для наработки плазмидной ДНК.
В качестве продуцента выбран штамм E.coli BL21(DE3)pLysE. Выбор штамма-реципиента обусловлен тем, что он несет ген РНК-полимеразы фага Т7, которая необходима для обеспечения эффективной транскрипции целевых генов, находящихся в векторной конструкции под контролем промотора фага Т7, а также тем, что данный штамм дефектен по синтезу протеаз, что существенно повышает выход синтезируемых гетерологичных белков.
При культивировании штамм E.coli BL21(DE3)pLysE/pET21a-ProChym, обеспечивает синтез рекомбинантного, ферментативно-активного прохимозина В Bos taurus на уровне 40% от общего бактериального белка (см. Фигура 5, А).
Благодаря оптимизации кодоного состава и добавлению последовательности тага Т7 увеличивается выход целевого белка, так как в исследованиях было показано что прохимозин нарабатывается в небольших количествах без добавления данного региона [17]. На С-конце гена заложен фрагмент, кодирующий шесть гистидинов (6×His), для возможности вести очистку и концентрирование целевого белка с помощью металл-хелатной хроматографии.
Изобретение иллюстрируется следующими графическими фигурами. На фиг. 1 приведена нуклеотидная последовательность гена химерного белка прохимозина ProChym. На фиг. 2 представлена структура аминокислотной последовательности препрохимозина В Bos taurus (Swiss-ProtID:P00794). На фиг. 3 приведена аминокислотная последовательность химерного белка прохимозина В Bos taurus, кодируемого геном ProChym. На фиг. 4 изображена физическая и генетическая карта рекомбинантной плазмиды рЕТ21a-ProChym, содержащая последовательность химерного бкелка прохимозина Bos taurus. На фиг. 5А, Б представлены фотографии электрофоретического разделения: (фиг. 5, А) - лизата клеток E.coli BL21(DE3)pLysE/pET21a-ProChym в 12% ПААГ (1 - отрицательный контроль (культура Е. coli BL21(DE3)pLysE без плазмиды); 2 - лизат клеток Е. coli BL21(DE3)pLysE рЕТ21а- ProChym; 3 - лизат дебриса Е. coli BL21(DE3)pLysE рЕТ21а- ProChym после гомогенизирования и отделения от растворимой фракции; 4 - маркер молекулярной массы); (фиг. 5, Б) - электрофорез в ПААГ препарата химерного белка прохимозина В Bos taurus (1 - образец рекомбинантного химозина В Bos taurus транслируемого в BL21(DE3)pLysE без пропептида, 2 - образец рекомбинантного химерного белка прохимозина В Bos taurus (получен с использованием заявляемой плазмиды и штамма-продуцента), 3 - маркер молекулярной массы).
Для лучшего понимания сущности предлагаемого изобретения ниже приведены примеры его осуществления. Все стандартные генно-инженерные и микробиологические манипуляции, а также амплификацию и секвенирование ДНК проводили по известным методикам (Маниатис Т., Фрич Э, Сэмбрук Дж. Молекулярное клонирование, М.: Мир, 1984 [19]; Клонирование ДНК. Методы. Под ред. Д. Гловера, Пер. с англ., Москва, Мир, 1988 [20]; Saiki R.K., Gelfand D.H., Stoffel S., Sharf S.J., Higuehi R., Horn G.T., Mullis K.B., Eriich H.A. Science, 1988. V. 239, №4839, p. 487-491; Sanger F., Nicklen S., Coulson A.R. Proc. Nat. Acad. Sci. USA, 1977, V. 74, p. 5463-5467) [21].
Пример 1. Синтез, встройка и анализ фрагмента ДНК, включающего полную кодирующую последовательность гена прохимозина В Bos taurus.
Заявляемая плазмида содержит следующие существенные для ее функционирования и экспрессии целевого белка структурные элементы:
- промотер бактериофага Т7, обеспечивающий эффективную транскрипцию контролируемой мРНК; рекомбинантный ген, кодирующий целевой химерный белок (ген прохимозина В Bos taurus); нетранслируемую область терминации транскрипции бактериального оперона, обеспечивающую эффективное окончание транскрипции;
- бактериальный оперон blа, кодирующий белок бета-лактамазу, являющуюся селективным маркером для трансформации штаммов Е. coli;
- бактериальный участок инициации репликации типа ColEl, обеспечивающий репликацию плазмиды в штаммах Е. coli.
Выбранная нуклеотидная последовательность гена прохимозина В Bos taurus (Swiss-ProtID:P00794) была синтезирована на автоматическом синтезаторе ABI 3400 DNA/RNA Synthesizer. Синтезированный ген был клонирован в составе клонирующего вектора pGH («ДНК синтез», г. Москва). Для получения гена прохимозина Bos taurus проводили ПНР с использованием олигонуклеотидных праймеров, соответствующих начальной части pET21a+proChym-(S) (содержит пропептид и таг Т7 обеспечивающий повышенный уровень экспрессии целевого белка) и концевой рЕТ21а+Chym (В) с помощью высокоточной ДНК-полимеразы AmpliTaq Gold фирмы Thermo Fisher Scientific (США) (таблица 1).
ПЦР проводили с использованием ПЦР-амплификатора «БИС» фирмы ООО БИС-Н (Россия). Реакционная смесь объемом 50 мкл, содержащая 2 мкг ДНК (плазмиды pGH с геном химозина), 10 пкМ каждого праймера (pET21a+proChym-(S) и рЕТ21а+Chym(B), 67 мМ трис-HCl (рН 8,8), 15 мМ сульфата аммония, 2,5 мМ хлористого магния, 0,01% Твин-20, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ, дГТФ по 2,5 мМ) и 1 ед. ДНК-полимеразы AmpliTaq Gold фирмы Thermo Fisher Scientific (США); реакцию осуществляли при следующих параметрах: 50 с - 96°С, 30 с - 60°С, 1 мин - 72°С (30 циклов).

По окончанию реакционную смесь разделяли электрофорезом в 1% агарозном геле и выявляли продукт реакции - единичный фрагмент размером 1.1 т.п.н. Фрагмент выделяли из геля с помощью набора «Gel Extraction Kit» фирмы Qiagen (Германия). Затем выделенный ПЦР-продукт и предварительно наработанную и очищенную плазмиду рЕТ21а обрабатывали эндонуклеазами рестрикции FauND I и Sfr274I («СибЭнзим», г. Новосибирск).
Реакцию гидролиза проводили в условиях рекомендованных производителем. С целью очистки рестрицированного вектора плазмидную ДНК наносили на 1%-й агарозный гель и выделяли из геля с использованием набора «Gel Extraction Kit» фирмы Qiagen (Германия). Реакцию лигирования проводили с использованием ДНК-лигазы бактериофага Т4 («СибЭнзим», г. Новосибирск). Реакция проводилась при +4°С в течение ночи. Полученной лигазной смесью трансформировали (как описано в примере 2) химически компетентные клетки Е. coli штамм ТОР10.
После трансформации клоны отбирали на агаризованнной среде LB, содержащей антибиотик ампициллин (50 мг/мл). Плазмидную ДНК из колоний выделяли методом щелочного лизиса. Для анализа наличия вставки гена прохимозина в рекомбинантной плазмиде использовали ПЦР со специфичными праймерами (таблица 1, праймеры 1 и 2). Разделение продуктов амплификации проводили в 1%-м агарозном геле с последующим окрашиванием бромистым этидием (0,5 мкг/мл). Положительные колонии, вносили в 5 мл среды LB с ампициллином (50 мкг/мл) и растили в течение ночи при 37°С при 170 об/мин. Затем плазмидную ДНК выделяли из бактериальных клеток с помощью коммерческих наборов DNA mini kit фирмы «Qiagen» согласно рекомендациям производителя. Первичную структуру полученных плазмид подтверждали секвенированием. Секвенирование проводили по методу Сэнгера в ЦКП «Геномика» СО РАН (г. Новосибирск).
Секвенирование плазмидной ДНК положительных клонов в районе встройки гена прохимозина В коровы позволило отобрать клоны с отсутствием дефектов встраиваемых генов (вставки, делеции, замены), после чего из отобранных клонов была наработана и выделена плазмидная ДНК.
Пример 2. Получение рекомбинантного штамма Escherichia coli BL21(DE3) PLysE/pET21a- ProChym
Полученной рекомбинантной плазмидой рЕТ21a-ProChym была проведена трансформация клеток Е. coli BL21(DE3) pLysE с использованием хлористого кальция. Культуру клеток подращивали до ODλ600=0.5. о.е. 1,5 мл суспензии центрифугировали 6000 об/мин 2 мин на центрифуге "Eppendorf 5415 R". Осадок клеток суспензировали в 700 мкл 0,2М СаСl2, инкубировали при 4°С в течение 15 мин, затем клетки осаждали центрифугированием 4000 об/мин 3 мин. Осадок клеток суспензировали в 100 мкл 0,2М СаСl2. К суспензии клеток добавляли 50-70 нг плазмидной ДНК, инкубировали 30 мин при 4°С, затем в течение 5 мин при 37°С. К суспензии клеток добавляли 1 мл среды LB и инкубировали при 37°С в течение 1 часа. 100 мкл культуры рассевали на чашку Петри с агаризованной средой с добавлением ампициллина до концентрации 100 мкг/мл. Остаток культуры осаждали центрифугированием 4000 об/мин 3 мин, отбирали супернатант, суспендировали в 100 мкл LB и высевали на чашку с агаризованной средой LB, содержащей 100 мкг/мл ампициллина. Чашки помещали в термостат 37°С и инкубировали в течении ночи. На следующий день были идентифицированы отдельные колонии BL21 (DE3)pLysE/pET21a- ProChym.
Штамм E. coli BL21 (DE3) pLysE, несущий рекомбинантную плазмиду рЕТ21a-ProChym, - продуцент рекомбинантного прохимозина В Bos taurus характеризуются следующими признаками: высокой физиологической стабильностью (снижение активности продуцируемого фермента после 50 генераций не превышает 20%) и высоким выходом активного продукта.
Клетки хорошо растут на обычно используемых питательных средах.. При выращивании на жидких LB- и YT-средах образуется интенсивная ровная мутность.
Физиолого-биохимические признаки
Оптимальная температура культивирования - от 30 до 37°С, оптимум рН - 7,6. Источником азота служат органические соединения (в виде триптона, дрожжевого экстракта).
Существенным при использовании данных штаммов является их чувствительность к канамицину (до 25 мкг/мл). Проявляют устойчивость к ампициллину (до 100 мкг/мл), обусловленную наличием плазмид рЕТ21а-Chym.
Один из отобранных клонов обозначали как Escherichia coli BL21(DE3) pLysE/pET21a- ProChym, выращивали его в 5 мл жидкой среды LB, содержащей 100 мг/л ампиницилина до ODλ600=5,0, добавляли к культуре равный объем стерильного 30% глицерина, разливали по 500 мкл в стерильные 1.5 мл пробирки, заморозили и храним при - 70°С.
Пример 3. Наработка биомассы BL21 (DE3) pLysE/ рЕТ21а- ProChym и выделение рекомбинантного прохимозина В Bos taurus
Полученные клоны Е. coli штамма BL21 (DE3) pLysE после трансформации рекомбинантной плазмидой рЕТ21a- ProChym наращивали в 5 мл среды YT×2 в течение ночи. Полученную ночную культуру добавляли по 1,5 мл в колбы объемом 750 мл содержащих 150 мл среды YT×2 и растили до плотности ODλ600=0,8. После этого в культуры вносили ИПТГ до конечной концентрации 1 мкМ для индукции промотора фага Т7 и продолжали культивирование в течение 5 часов при температуре 37°С, 170 об/мин. Биомассу бактериальных клеток осаждали центрифугированием (7000 об/мин), затем биомассу гомогенизировали в лизирующем буфере с использованием ультразвукового гомогенизатора Soniprep 150 Plus. Дебрис отделяли центрифугированием при 16000 rpm в течение 15 мин, 4°С.
Биомассу бактериальных клеток осаждали центрифугированием (7000 об/мин, 9000 g). Осадок суспендировали в лизирующем буфере (20 мМ Трис, 300 мМ NaCl, 0.1% Twin 20, рН=8,0) с использованием ультразвукового гомогенизатора Soniprep 150 Plus. Дебрис (осадок, формируемый в результате центрифугирования суспензии гомогенизированной ткани и содержащий полуразрушенные клетки) отделяли центрифугированием при 16000 rpm (31000 g) в течение 15 мин, при 4°С.
После разделения обе фракции были проанализированы в 12% ПААГ на наличие целевого белка. Результаты показали, что весь целевой белок находится в нерастворимой фракции (Фигура 5, А).
Пример 4. Очистка рекомбинатного прохимозина В Bos taurus
Так как в примере 3 было показано, что целевой белок находится в тельцах включения, для последующей очистки дебрис растворяли в базовом буфере (20 мМ Трис, 300 мМ NaCl, рН=8), содержащем 8М мочевину.
Поскольку в нуклеотидную последовательность С-терминальных участков рекомбинантного белка был заложен фрагмент 6×His, его очистку проводили с помощью металл-хелатной хроматографии на Ni-NTA агарозе.
Колонку, содержащую Ni-NTA агарозу, уравновешивали базовым буфером: 20 мМ Трис, 300 мМ NaCl, 8М мочевина, рН=8,0. Дебрис после дезинтеграции растворяли в базовом буфере с 8 М мочевиной и наносили на колонку. Промывали колонку 10 объемами промывочного буфера (базовый буфер с 8 М мочевиной + 20 мМ имидазола). Десорбцию связанных с сорбентом белков, проводили базовым буфером со ступенчато (шаг 50 мМ) повышающейся (20-300 мМ) концентрацией имидазола. Было установлено, что рекомбинантный прохимозин элюируется при концентрации имидазола 250 мМ. Количественный анализ показал, что на 1 литр культуральной среды нарабатывается 1.5 г прохимозина (Фигура 5). При этом масса очищенного прохимозина составляет от 30 до 40% общей массы клеток BL21 (DE3) pLysE/ рЕТ21а- ProChym. Чистоту белка контролировали с помощью электрофореза в 12%-м полиакриламидном геле (фиг. 5, А).
Пример 5 Реанатурация и активация рекомбинантного прохимозина В Bos tauru
Рефолдинг целевого белка, элюированного с металл-хелатного сорбента, и его очистку от мочевины и имидазола проводили диализом. Диализ проводили в две стадии: однократно против буфера содержащего 50 мМ Трис, 300 мМ NaCl, рН=10.25, не более 5 часов. Затем четырехкратно против раствора, содержащего 50 мм Трис, рН=7,5.
После диализа была определена концентрация образцов используемых для определения молокосвертывающей активности. Так же для сравнения был взят ранее полученный рекомбинантный химозин В Bos taurus транслируемый в BL21 (DE3) pLysE без про пептида, то есть не требующий активации.
№1. Рекомбинантный прохимозин с=0.2 мг/мл
№2. Рекомбинантный химозин с=0.8 мг/мл
Для подтверждения наличия специфической ферментативной активности был проведен анализ молокосвертывающей активности. Для этого фермент необходимо было перевести в активную форму.
Активацию прохимозина проводили путем ступенчатого понижения и повышения рН. Все операции выполняли в пластиковой посуде, при комнатной температуре. Для контроля исходной молокосвертывающей активности (МА) рекомбинантного прохимозина, отбирали аликвоту неактивированного фермента.
Для активации в образец рекомбинантного прохимозина, при постоянном перемешивании, вносили 2,0М НСl до рН 3,0. Останавливали перемешивание и инкубировали смесь при рН 3,0 в течение 2 часов. По истечении времени инкубации, доводили рН образца до 6,2, используя 0,5М NaOH. В активированном таким способом образце определяли МА.
Пример 6 Определение молокосвертывающей активности рекомбинантного активированного химозина (после активации прохимозин переходит в химозин)
Для определения МА использовали стандартизированный сухой молочный субстрат ("Субстрат СТ.3"), выпускаемый ВНИИМС (г. Углич). Для подготовки к работе 25,0 гр. субстрата растворяли в 230 мл 0,01N СаСl2 в течение 1 ч при комнатной температуре и постоянном перемешивании. Доводили рН полученной смеси до 6,5, используя 1,0М NaOH. Конечный объем раствора доводили до 250 мл 0,01 N СаСl2.
Активность исследуемых образцов определяли относительно отраслевого контрольного образца сычужного фермента (ОКО СФ), аттестованного по МА, выпускаемого ОАО "Московский завод сычужного фермента". Для подготовки к работе, к 1,0 г ОКО СФ добавляли 80 мл дистиллированной воды, перемешивали 30 минут при 20-25°С, доводили объем смеси до 100 мл и выдерживали на водяной бане при 35°С в течение 15 мин. Перед определением МА исследуемые образцы выдерживали 15 минут при 35°С.
Определение МА проводили при 35°С. В сухую стеклянную пробирку вносили 2,5 мл раствора стандартизированного субстрата и прогревали при 35°С в течение 5 минут. В пробирку с субстратом добавляли 0,25 мл исследуемого образца, включали секундомер, содержимое пробирки сразу же тщательно перемешивали. Продолжительность свертывания субстрата отмечали по секундомеру с момента внесения образца до появления первых хлопьев коагуляции субстрата. Появление хлопьев проверяли путем периодического нанесения стеклянной палочкой капли реакционной смеси на стенку пробирки.

Молокосвертывающую активность исследуемых образцов выражали в условных единицах на 1 мл препарата (усл. ед./мл) и рассчитывали по формуле:
МА=0,01*А*Т1/Т2, где:
А - аттестованная молокосвертывающая активность ОКО СФ в условных единицах;
Т1 - продолжительность свертывания субстрата с ОКО СФ;
Т2 - продолжительность свертывания субстрата с исследуемым образцом.
Для перевода условных единиц МА в международные молокосвертывающие единицы (IMCU) использовали понижающий коэффициент 129,1. Результаты исследования представлены в таблице 2.
Сравнительная ферментативная активность показала, что рекомбинатный прохимозин после активации проявляет высокую молокосвертывающую активность (примеры 3 и 4).
Источники научно-технической и патентной информации
1. Horne, D.S. Casein structure, self-assembly and gelation / D.S. Horne // Current Opinion in Colloid and Interface Sci. - 2002. - V 7. - P. 456-461.
2. Green, M.L. Studies on the mechanism of clotting of milk / M.L. Green // Neth. Milk Dairy J. - 1973. - V 27. - P. 278-285.
3. Cheese Chemistry, Physics and Microbiology, Third edition, Volume I: General Aspects. Rennet-induced Coagulation of Milk / D.S. Horne, J.M. Banks.; P.F. Fox, P.L.H. McSweeney, T.M. Cogan, T.P. Guinee, eds. - London, UK: Elsevier Academic Press, 2004. - P. 47-70.
4. Осинцев, A.M Теоретическое и экспериментальное исследование процессов, лежащих в основе свертывания молока / A.M. Осинцев. - Кемеровский технологический институт пищевой промышленности. - Кемерово, 2003. - 120 С.
5. Harboe M., Broe M.L., Qvist K.B. In: Technology of Cheesemaking. Law BA, Tamime AY, Eds., John Wiley & Sons., 2010, Ch. 3. The Production, Action and Application of Rennet and Coagulants, pp. 98-129. DOI: 10.1002/9781444323740. ch3.
6. Jacob M., Jaros D., Rhom H. Recent advances in milk clotting enzymes. International Journal of Dairy Technology, 2011, vol. 64, no. 1, pp. 14-33. DOI: 10.1111/j.1471-0307.2010.00633.x.
7. Shah M.A., Mir S.A., Paray M.A. Plant proteases as milk-clotting enzymes in cheesemaking: a review. Dairy Science and Technology, 2014, vol. 94, no. 1, pp. 5-16. DOI: 10.1007/s13594-013-0144-3.
8. Ельчанинов B.B., Уманский M.C., Белов A.H., Коваль А.Д., Шелепов В.Г. Молокосвертывающий фермент из сычугов северного оленя. 1. Выделение и краткая характеристика Сыроделие и маслоделие, 2005, №4, стр. 13-16.
9. Lebedev L.R., Kosogova Т.А., Teplyakova T.V., Kriger A.V., Elchaninov V.V., Belov A.N., Koval' A.D. Study of technological properties of milk-clotting enzyme from Irpex lacteus (Irpex lacteus (Fr.) Fr.). Foods and Raw Materials, 2016, vol. 4, no. 2, pp. 58-65. DOI: 10.21179/2308-4057-2016-2-58-65.
10. Feng Z. et al. Codon optimization of the calf prochymosin gene and its expression in Kluyveromyces lactis // World Journal of Microbiology and Biotechnology. - 2010. - T. 26. - №.5. - P. 895-901.
11. Menzella H.G. Comparison of two codon optimization strategies to enhance recombinant protein production in Escherichia coli // Microbial cell factories. - 2011. - Т. 10. - №.1. - P. 15.
12. Marston F.A.O. et al. Purification of calf prochymosin (prorennin) synthesized in Escherichia coli // Nature Biotechnology. - 1984. - T. 2. - №.9. - P. 800-804.
13. Yonezawa M. et al. Role of the amino-terminal amino acid sequences determining the in vitro refolding process of prochymosin polypeptide // Journal of biotechnology. - 1993. - T. 28. - №.1. - P. 85-97.
14. WO 2009/027572, A1, МПК C12N 9/64; C12N 15/69; C12N 15/81, опубл. 05.03.2009 г.
15. Заявка США №20070166785, A1, МПК С12Р 21/06, С07Н 21/04, опубл. 19.07.2007 г. (прототип).
16. Rao S. Extraction and purification of chymosin from buffalo calves. PhD thesis, Natl. Dairy Res. Inst., Karnal, India, 1984.
17. Рудометов А.П. Сравнение экспрессии нуклеотидной последовательности химозина и прохимозина теленка в Е. coli BL21 и оценка молокосвертывающей активности полученных рекомбинантных белков / А.П. Рудометов, С.В. Беленькая, Е.А. Колосова и др. // Международный научно-исследовательский журнал. - 2016. - №10 (52) Часть 4. - С. 37-40.
18. Pitts J.Е., Dhanraj V., Dealwis C.G., Mountafounis D., Nugent P., Orphrayoon P. Multidisciplinary cycles for protein engineering: Site directed mutagenesis and X-ray structural studies of aspartic proteinases // Scand JClin Lab Invest. 1992. 52(suppl. 210). P. 39-50.
19. Маниатис Т., Фрич Э, Сэмбрук Дж. Молекулярное клонирование, М.: Мир, 1984; Клонирование ДНК. Методы. Под ред. Д. Гловера, Пер. с англ., Москва, Мир, 1988.
20. Saiki R.K., Gelfand D.H., Stoffel S., Sharf S.J., Higuehi R., Horn G.T., Mullis K.B., Eriich H.A. Science, 1988. V. 239, №4839, p. 487-491.
21. Sanger F., Nicklen S., Coulson A.R. Proc. Nat. Acad. Sci. USA, 1977, V. 74, p. 5463-5467.