Результат интеллектуальной деятельности: МЕЧЕНЫЕ ХИМЕРНЫЕ ЭФФЕКТОРНЫЕ МОЛЕКУЛЫ И ИХ РЕЦЕПТОРЫ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Данная заявка заявляет приоритет согласно 35 U.S.C. § 119(e) предварительной заявки на патент США № 61/919201, поданной 20 декабря 2013 г., которая включена в данный документ в полном объеме посредством ссылки.
ИНФОРМАЦИЯ О ПРАВИТЕЛЬСТВЕННОЙ ПОДДЕРЖКЕ
Настоящее изобретение выполнено при государственной поддержке в рамках гранта/контракта № CA136551, присужденного Национальными институтами здравоохранения (National Institutes of Health). Государство обладает определенными правами на настоящее изобретение.
ИНФОРМАЦИЯ О ПЕРЕЧНЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Перечень последовательностей, прилагающийся к данной заявке, представлен в текстовом формате вместо бумажной копии и, таким образом, включен посредством ссылки в настоящее описание. Название текстового файла, содержащего перечень последовательностей, 360056_426WO_SEQUENCE_LISTING.txt. Текстовый файл имеет размер 32,3KB, был создан 22 декабря 2014 г. и подается в электронном виде посредством EFS-Web.
ПРЕДПОСЫЛКИ
Область техники, к которой относится изобретение
Настоящее раскрытие относится к гибридным белкам, содержащим кассету с меткой и, более конкретно, к меченым химерным эффекторным молекулам (Key-ChEM), и меченым химерным молекулам антигенных рецепторов (T-ChARM), и рекомбинантным клеткам-хозяевам, продуцирующим такие гибридные белки, где рекомбинантные клетки-хозяева можно идентифицировать, отделить, отсортировать, вызвать пролиферацию, отследить, устранить и/или использовать в качестве терапевтического средства (например, в адоптивной иммунотерапии).
Уровень техники
Способы иммунотерапии на основе Т-клеток начали развиваться, когда были обнаружены активные по отношению к опухоли Т-клетки среди популяции инфильтрировавших опухоль лимфоцитов (TIL) (Clark et al., Cancer Res. 29:705, 1969). Одна стратегия, известная как адоптивный перенос Т-клеток, включает в себя выделение инфильтрирующих опухоль лимфоцитов, предварительно отобранных на реакционную способность относительно опухоли, клональное размножение активных по отношению к опухоли Т-клеток, индуцированных антителами к CD3 и к CD28 в присутствии IL-2 и, наконец, инфузию размноженной популяции клеток обратно пациенту с опухолью (вместе с химиотерапией и повторяющимся введением IL-2) (Dudley et al., Science 298:850, 2002). Данная форма адоптивной Т-клеточной терапии инфильтрирующими опухоль лимфоцитами является технически громоздкой и приводит к полной ремиссии только у незначительной части пациентов с меланомой и редко эффективна при других формах рака (Besser et al., Clin. Cancer Res. 16:2646, 2010).
Выделение активных по отношению к опухолям Т-клеточных клонов привело к развитию еще одного иммунотерапевтического подхода - созданию рекомбинантных Т-клеточных рецепторов (TCR), специфичных к конкретным антигенам, которые вводятся в Т-клетки с помощью векторной системы доставки для придания специфичности к ассоциированному с опухолью пептиду, презентируемому молекулой MHC, экспрессируемой на клетке опухоли. Аналогичный подход вводит синтетический рецептор, называемый химерным антигенным рецептором (CAR), который содержит антиген-связывающий домен, который, например в контексте противоопухолевой терапии, может связываться с опухоль-специфическим или ассоциированным антигеном, связан с одним или более внутриклеточными компонентами, содержащими эффекторные домены, такие как TCR и/или костимулирующие сигнальные домены. В отличие от TIL, основные процедуры для Т-клеточной иммунотерапии при помощи TCR или CAR представляют собой генетическую модификацию человеческих Т-клеток трансгеном, кодирующим часть, нацеливающую на опухоль, размножение ex vivo рекомбинантных Т-клеток и переливание размноженных Т-клеток обратно пациентам. В случае адоптивной терапии Т-клетками с CAR состав синтетической структуры CAR, а также качество и чистота генетически сконструированных Т-клеток будут определять in vivo терапевтическую эффективность против опухолей. Но существуют проблемы с размножением и отбором популяций рекомбинантных клеток, а также с уверенностью в том, что клетки являются достаточно эффективными и специфичными in vivo, чтобы избежать серьезных аутоиммунных побочных эффектов.
В настоящее время остается потребность в области иммунотерапии в композициях и способах идентификации, эффективных отделения/отсортировки, селективного размножения, отслеживания in vivo и контроля или устранения сконструированных клеток, таких как сконструированные иммунные клетки (например, T-клетки).
КРАТКОЕ ОПИСАНИЕ
В определенных аспектах настоящее раскрытие направлено на одноцепочечный гибридный белок, содержащий внеклеточный компонент и внутриклеточный компонент, соединенные гидрофобным участком, где внеклеточный компонент содержит домен связывания, который специфически связывает мишень, кассету с меткой и соединительную область, содержащую шарнир, и где внутриклеточный компонент содержит эффекторный домен.
В некоторых аспектах настоящее раскрытие направлено на химерную молекулу антигенного рецептора, содержащую гибридный белок, имеющий одну или более внеклеточных кассет с метками, (a) расположенных на амино-конце внеклеточного домена связывания, (b) встроенную внутри внеклеточного домена связывания или (c) расположенную между и соединенную с внеклеточным доменом связывания и внутриклеточным компонентом, содержащим эффекторный домен.
В дополнительных аспектах настоящее раскрытие направлено на одноцепочечный гибридный белок, содержащий гидрофобный участок, расположенный между и соединенный с внеклеточным компонентом и внутриклеточным компонентом, где внеклеточный компонент содержит кассету с меткой и соединительную область, содержащую шарнир, и где внутриклеточный компонент содержит эффекторный домен.
В других дополнительных аспектах настоящее раскрытие направлено на способ активации клетки, такой как Т-клетка (например, отличная от природной Т-клетка), включающий приведение в контакт клетки с доменом связывания, специфичным к кассете с меткой, где клетка содержит молекулу нуклеиновой кислоты, кодирующую гибридный белок в соответствии с данным раскрытием, и домен связывания, специфичный к кассете с меткой, прикреплен к твердой поверхности.
В других дополнительных аспектах настоящее раскрытие направлено на способ стимуляции пролиферации клеток, такой как пролиферация Т-клеток, включающий приведение в контакт клетки (например, отличной от природной Т-клетки) с доменом связывания, специфичным к кассете с меткой, и фактором роста, представляющим собой цитокин, на время, достаточное для роста клеток, где клетка содержит молекулу нуклеиновой кислоты, кодирующую гибридный белок в соответствии с данным раскрытием, и домен связывания, специфичный к кассете с меткой, прикреплен к твердой поверхности.
В других определенных аспектах настоящее раскрытие направлено на способ идентификации клетки, такой как Т-клетка, включающий приведение в контакт образца, содержащего клетку, такую как Т-клетка (например, отличная от природной Т-клетка), с доменом связывания, специфичным к кассете с меткой, где клетка содержит молекулу нуклеиновой кислоты, кодирующую гибридный белок в соответствии с данным раскрытием, и домен связывания, специфичный к кассете с меткой, содержит детектируемую часть, и обнаружение присутствия клетки, экспрессирующей гибридный белок, в образце.
В определенных дополнительных аспектах настоящее раскрытие направлено на способ отсортировки Т-клетки, включающий приведение в контакт образца, содержащего отличную от природной Т-клетку, с доменом связывания, специфичным к кассете с меткой, где отличная от природной Т-клетка содержит молекулу нуклеиновой кислоты, кодирующую гибридный белок в соответствии с данным раскрытием, и домен связывания, специфичный к кассете с меткой, содержит детектируемую часть, и отсортировку отличной от природной T-клетки, экспрессирующей гибридный белок, от других клеток, не экспрессирующих гибридный белок, в образце.
В определенных аспектах настоящее раскрытие направлено на способ накопления или отделения Т-клетки, включающий приведение в контакт образца, содержащего отличную от природной Т-клетку, с доменом связывания, специфичным к кассете с меткой, где отличная от природной Т-клетка содержит молекулу нуклеиновой кислоты, кодирующую гибридный белок в соответствии с данным раскрытием, и домен связывания, специфичный к кассете с меткой, содержит детектируемую часть, и накопление или отделение отличной от природной T-клетки, экспрессирующей гибридный белок, от других клеток, не экспрессирующих гибридный белок, в образце.
В дополнительных аспектах настоящее раскрытие направлено на способ истощения определенных Т-клеток, включающий приведение в контакт отличной от природной Т-клетки с доменом связывания, специфичным к кассете с меткой, где отличная от природной Т-клетка содержит молекулу нуклеиновой кислоты, кодирующую гибридный белок в соответствии с данным раскрытием, и где связывание домена связывания, специфичного к кассете с меткой, приводит к клеточной гибели Т-клеток, экспрессирующих гибридный белок.
Эти и другие аспекты настоящего изобретения станут очевидными при обращении к нижеследующим подробному описанию и прилагающимся графическим материалам. Все ссылки, раскрытые в данном документе, включены, таким образом, посредством ссылки в полном объеме, как если бы каждая была включена отдельно.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
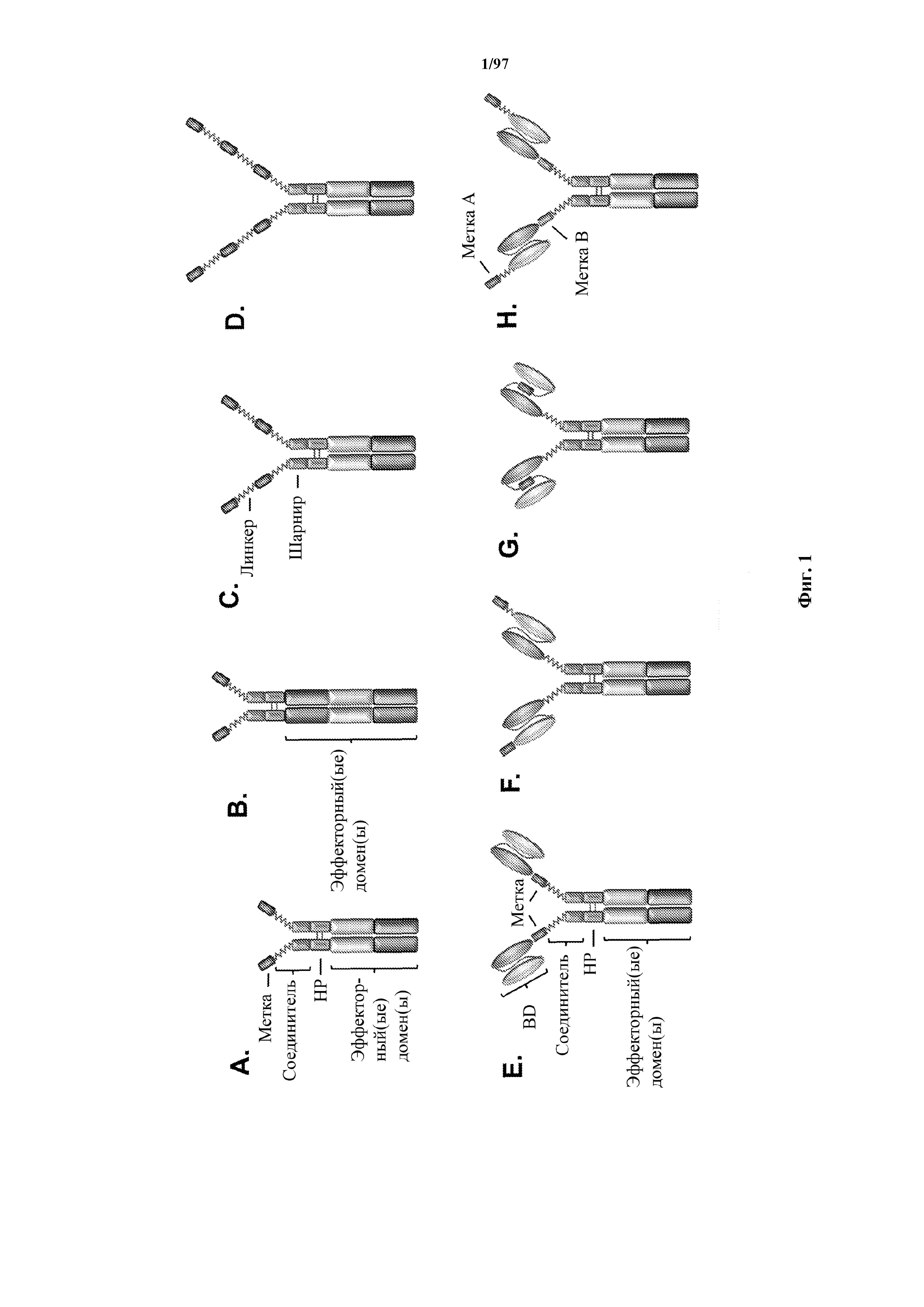
На фигурах 1A-1H показаны иллюстрации различных одноцепочечных химерных эффекторных молекул, содержащих одну или более кассет с аффинными метками (A-D, упоминаются в данном документе как Key-ChEM) и факультативно содержащих один или более специфических доменов связывания (E-G, упоминаются в данном документе как T-ChARM). Одноцепочечные ChEM и ChARM содержат внутриклеточный домен. Кассеты с метками могут быть аффинной меткой любого типа, такой как Strep tag® II (SEQ ID NO:1), Myc-меткой (SEQ ID NO:7), V5-меткой (SEQ ID NO:8), Flag®-меткой (SEQ ID NO:3), His-меткой, или другими пептидами или молекулами, которые распознаются неэндогенным родственным партнером связывания (например, рецептором, белком, антителом). Как показано, Key-ChEM может содержать (A, B) одну кассету с меткой, (C) две кассеты с метками (Key-ChEM2), (D) три кассеты с метками (Key-ChEM3) или более. Кроме того, химерные молекулы могут иметь несколько эффекторных доменов (например, молекулы из A и C-G имеют два, тогда как молекула, показанная на B, имеет три эффекторных домена) и кассеты с метками могут располагаться в различных областях молекулы Key-ChEM или T-ChARM. В данных конкретных примерах T-ChARM имеют одну кассету с меткой, расположенную между специфическим доменом связывания и эффекторным доменом (E), на дистальном конце (например, амино-конце) специфического домена связывания (F), встроенную внутрь специфического домена связывания (G) (например, расположенную в гибком линкере между цепями VH и VL из scFv) и имеют две различные метки — одну на C-конце домена связывания и другую на N-конце домена связывания (H). T-ChARM могут также иметь две, три или более кассет с метками, как показано для Key-ChEM. Как видно из этих иллюстраций, кассета с меткой может соединяться с другим компонентом Key-ChEM или T-ChARM или с другой меткой через линкерный блок (например, гибкий линкерный блок (GlyxSer)n). Длина линкера может быть адаптирована, чтобы быть длиннее или короче, для достижения наилучшего взаимодействия специфического домена связывания с целевым лигандом или антигеном и для достижения наилучшего взаимодействия между клеткой, экспрессирующей ChEM или T-ChARM, и целевой клеткой.
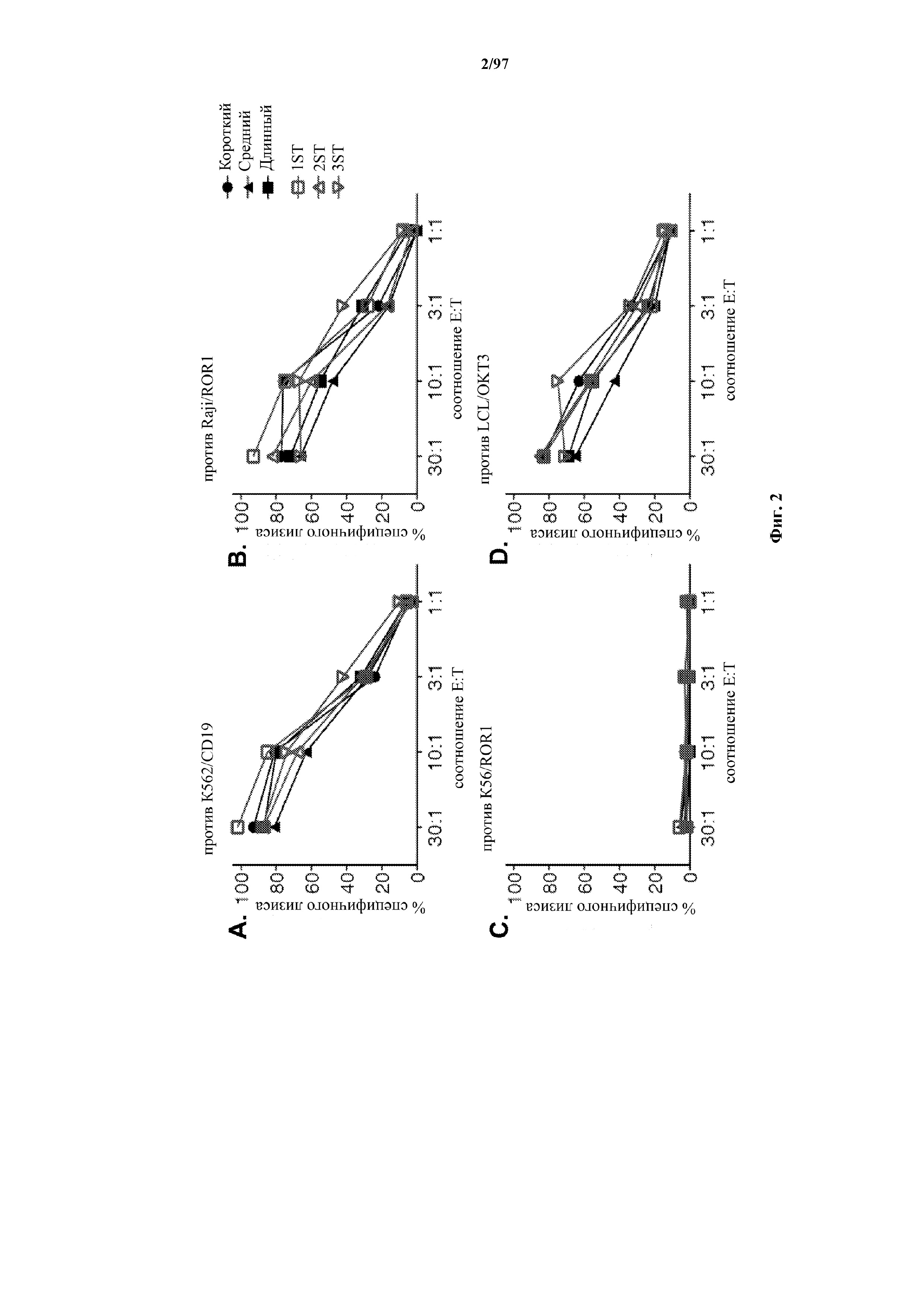
На фигурах 2A-2D показана цитолитическая активность человеческих эффекторных Т-клеток, экспрессирующих различные виды T-ChARM к CD19 и обычные CAR к CD19 (без кассеты с меткой и с короткими, средними и длинными спейсерными доменами), по отношению к клеткам лейкоза K562, трансфицированным для экспрессии CD19 или ROR1 (контроль), клеткам лимфомы CD19+ /ROR1+ Raji и В-клеткам, трансформированным EBV, которые экспрессируют мембраносвязанное одноцепочечное моноклональное антитело к CD3 (scFv OKT3) для активации всех эффекторных Т-клеток.
На фигурах 3A-3F показаны результаты мультиплексного анализа цитокинов (Luminex®) в отношении супернатантов, полученных через 24 часа после того, как Т-клетки, экспрессирующие различные T-ChARM к CD19 (A-C) и обычные CAR к CD19 (D-F), совместно культивировали с клетками K562, экспрессирующими либо CD19 (A и D), либо ROR1 (отрицательный контроль; B и E), и с PMA/иономицином (положительный контроль; C и F).
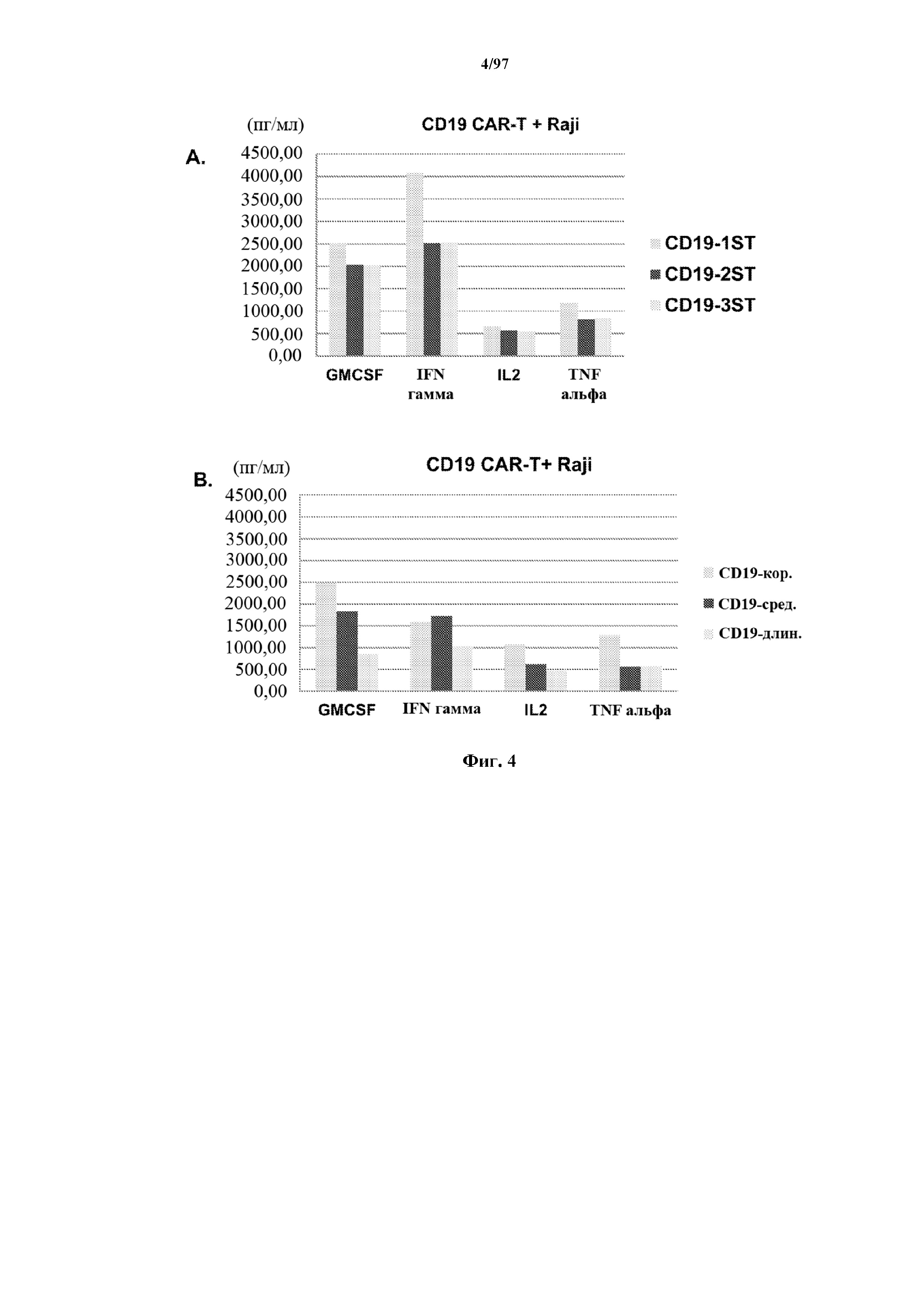
На фигурах 4A и 4B показаны результаты мультиплексного анализа цитокинов (Luminex®) в отношении супернатантов, полученных через 24 часа после того, как Т-клетки, экспрессирующие различные T-ChARM к CD19 (A) и CAR к CD19 (B), совместно культивировали с клетками CD19+ Raji.
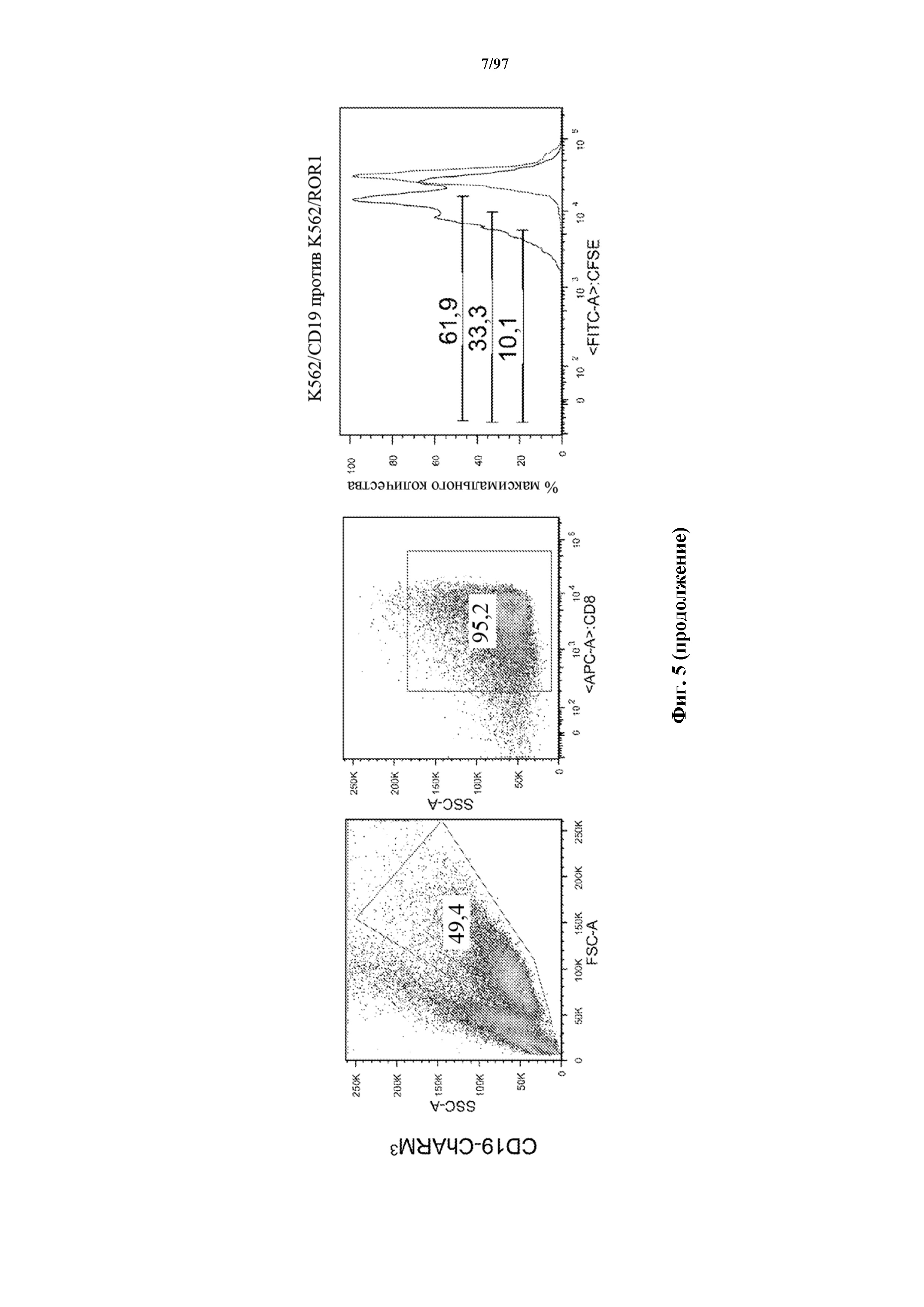
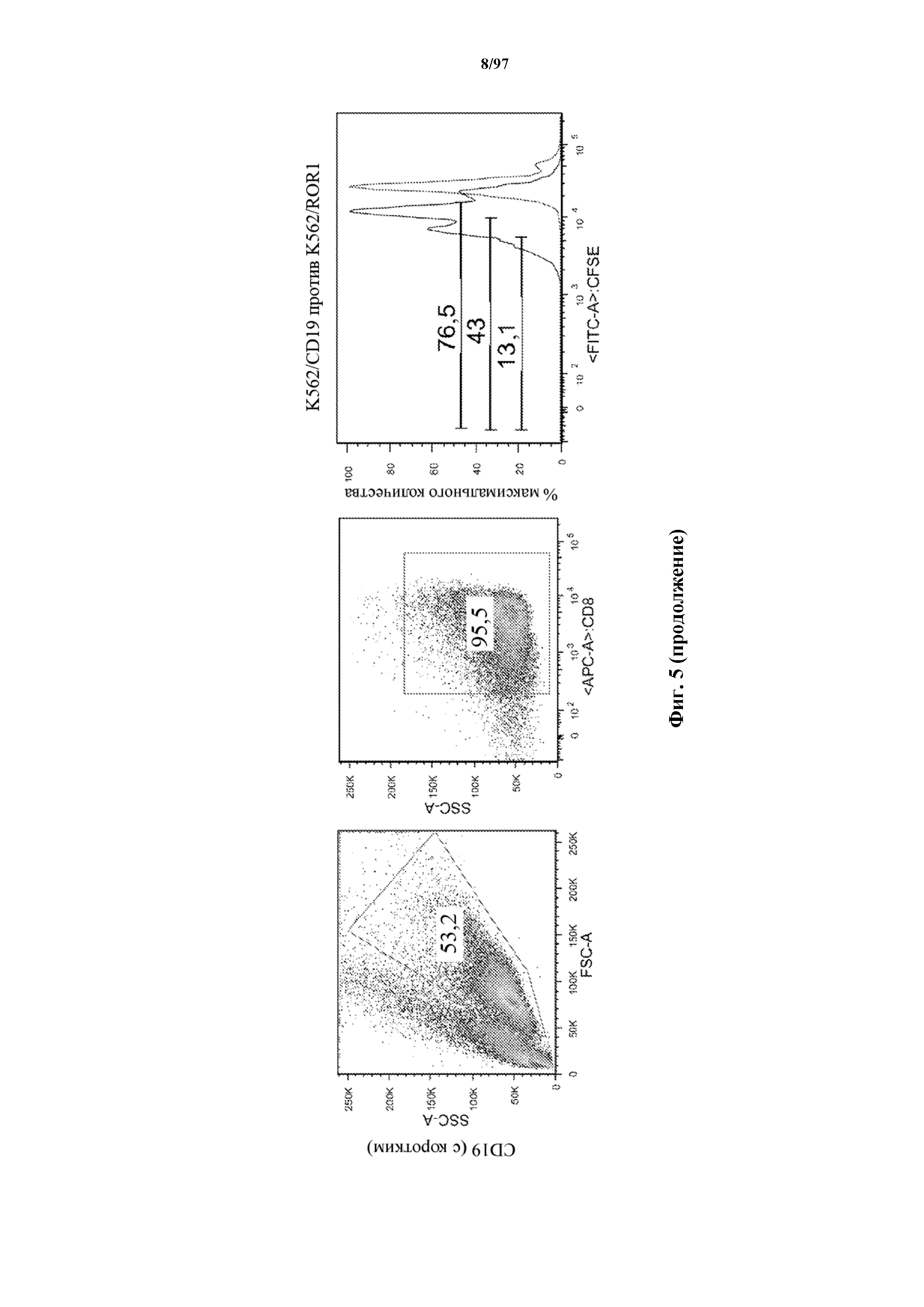
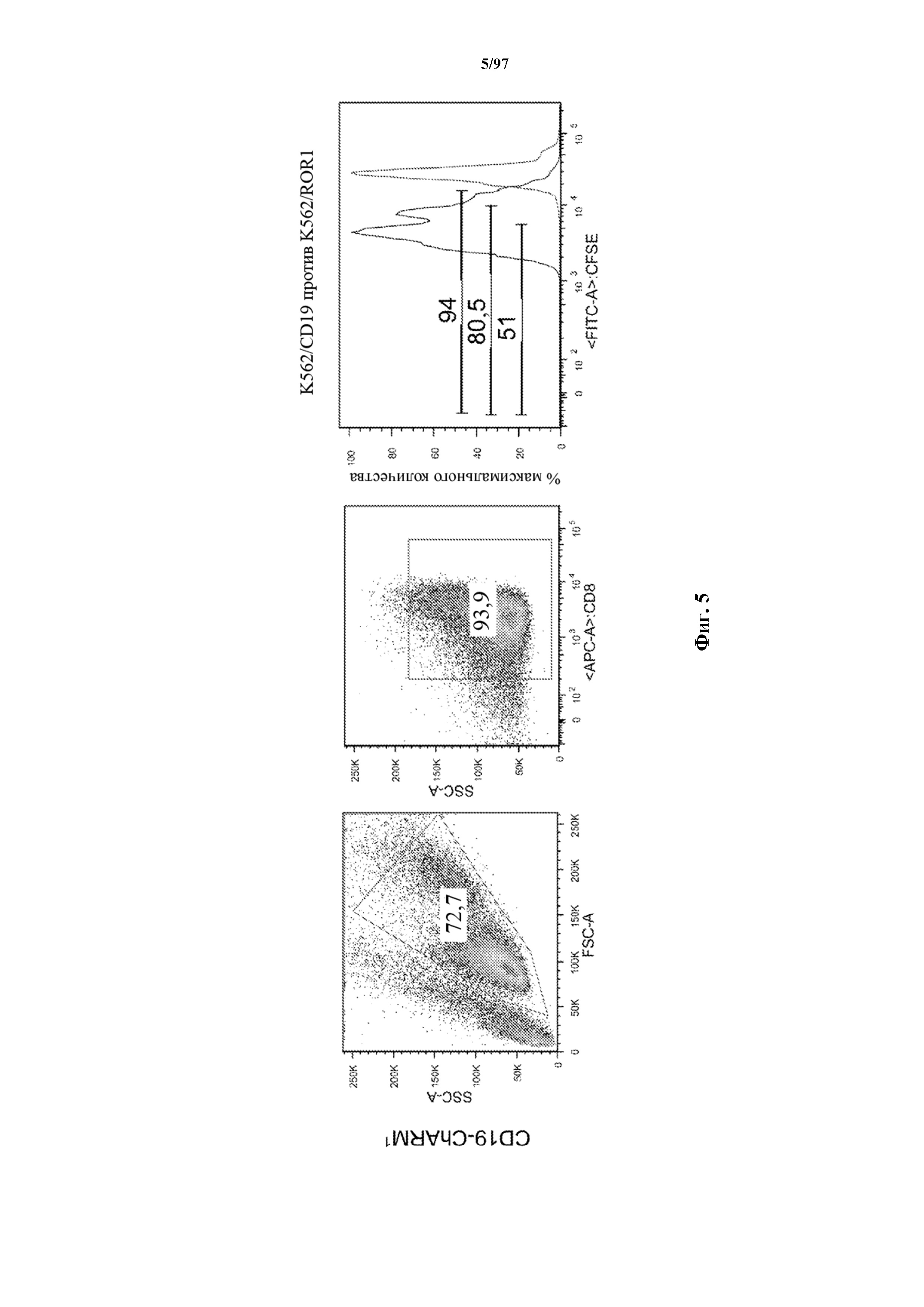
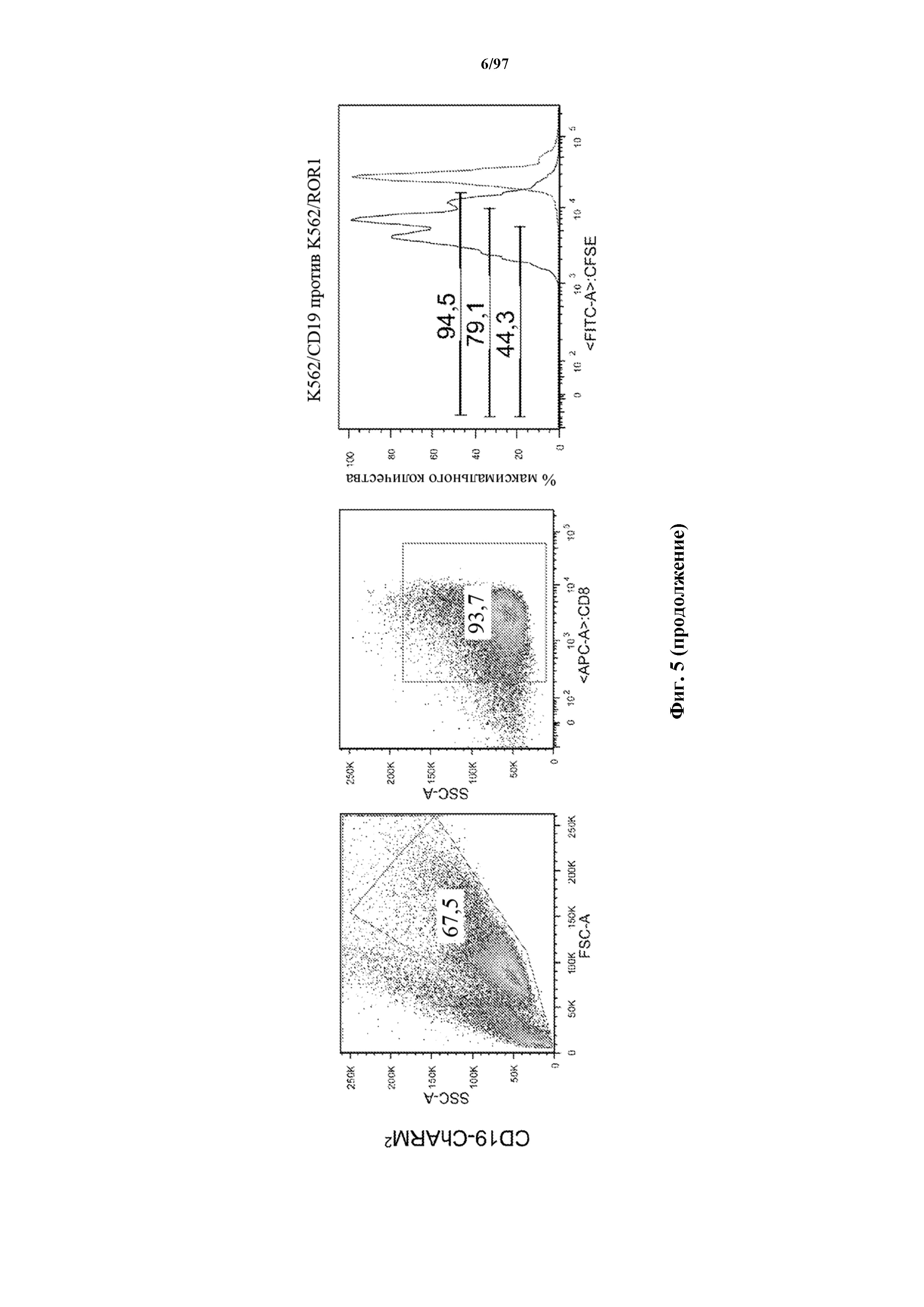
На фигуре 5 показаны результаты анализа пролиферации Т-клеток, где разбавление карбоксифлуоресцеинового красителя указывает, что CD8+ Т-клетки к CD19, экспрессирующие T-ChARM (содержащие одну, две или три кассеты с метками) или обычные CAR (CD19 (с длинным)), пролиферировали в ответ на опухолевые клетки, экспрессирующие CD19 (синий), в то время как не пролиферировали в присутствии опухолевых клеток, экспрессирующих ROR1 (красный).
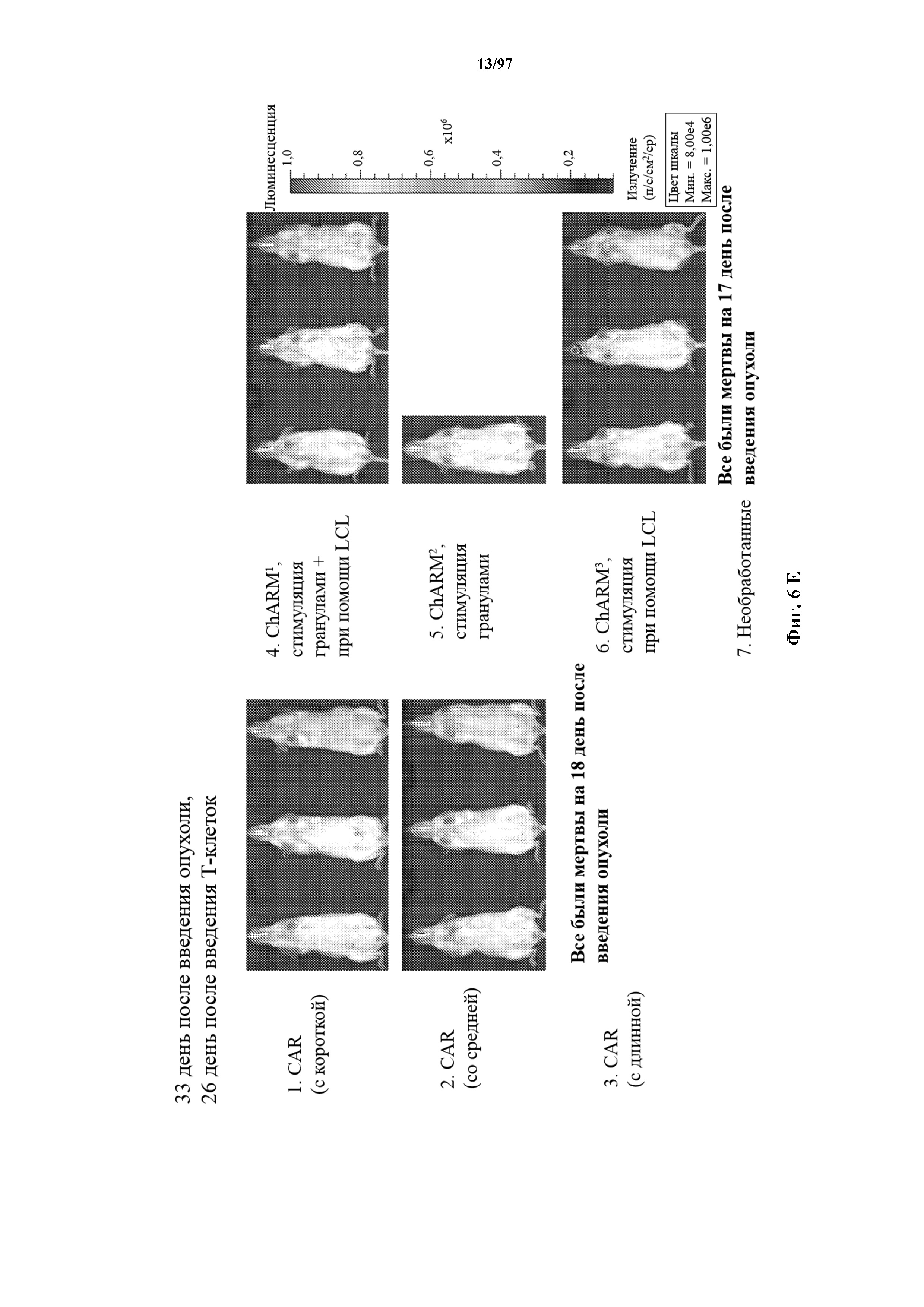
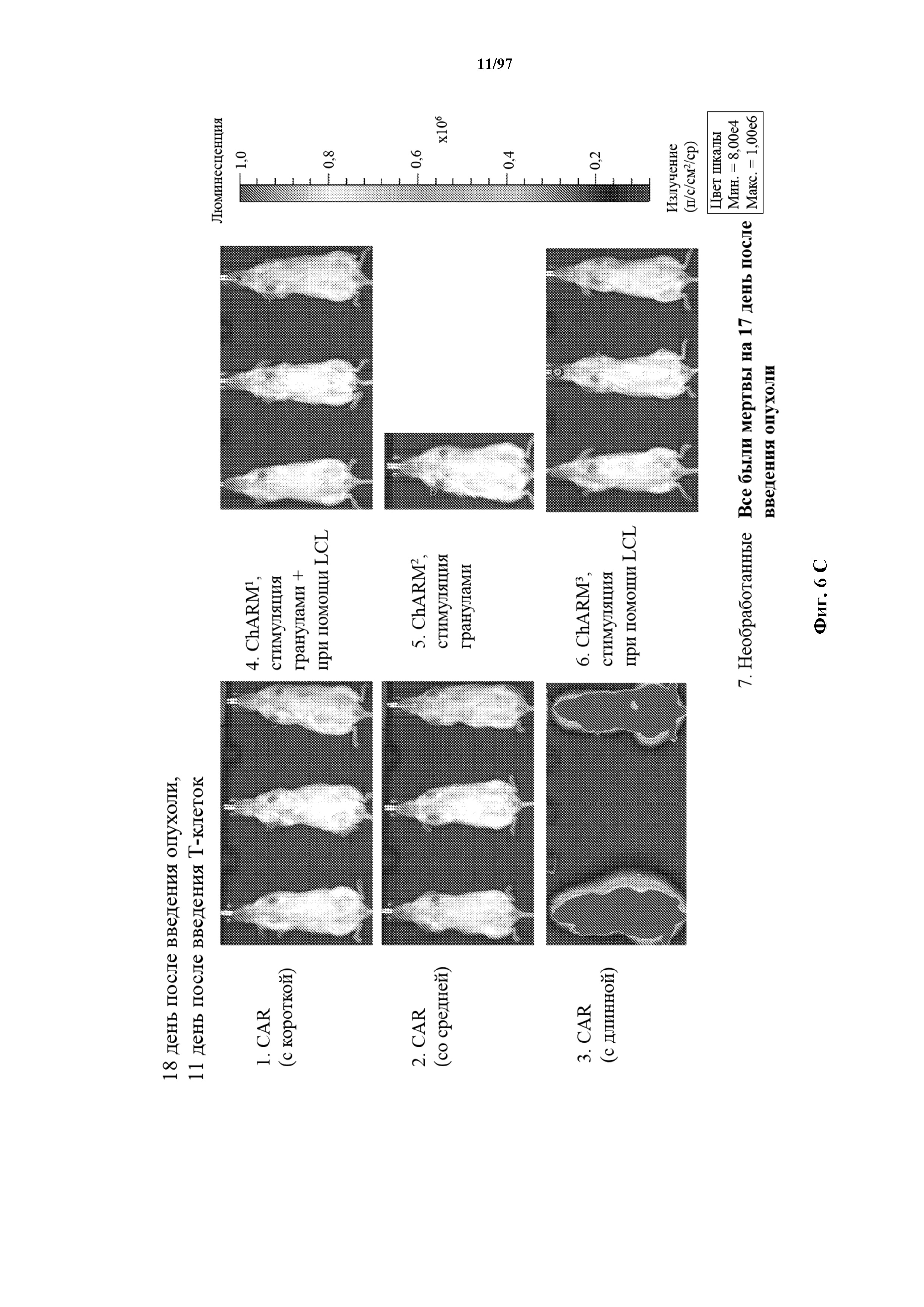
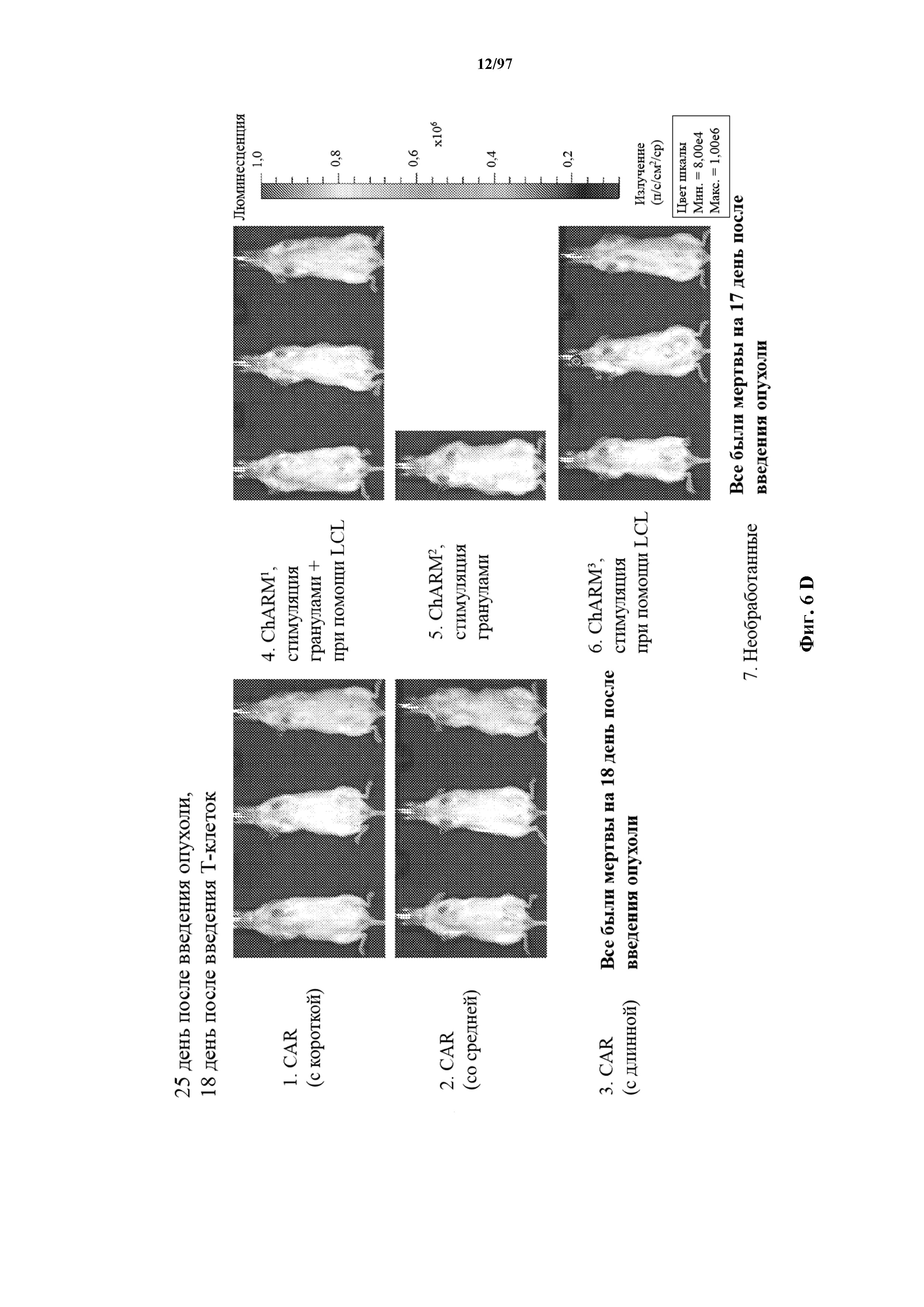
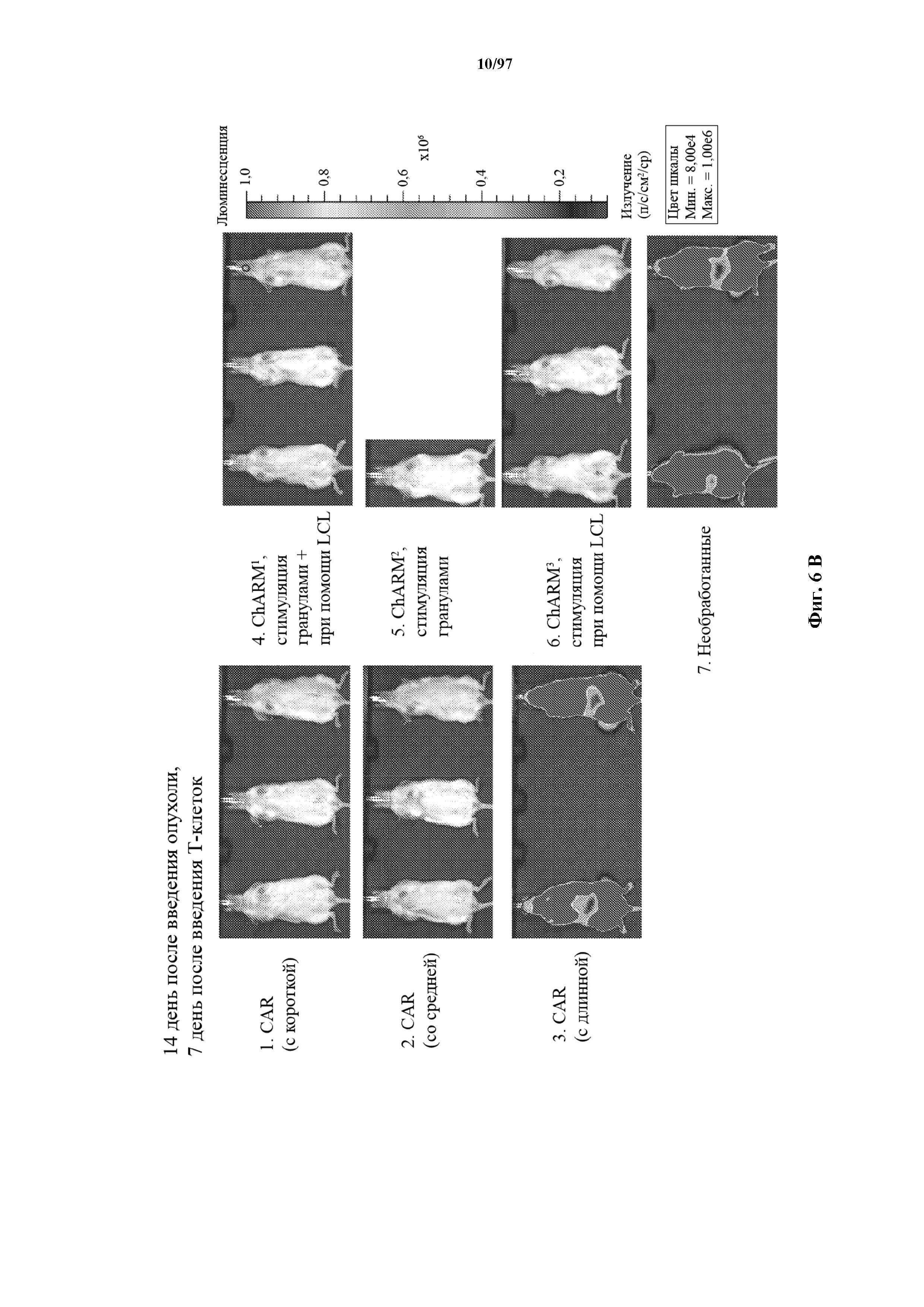
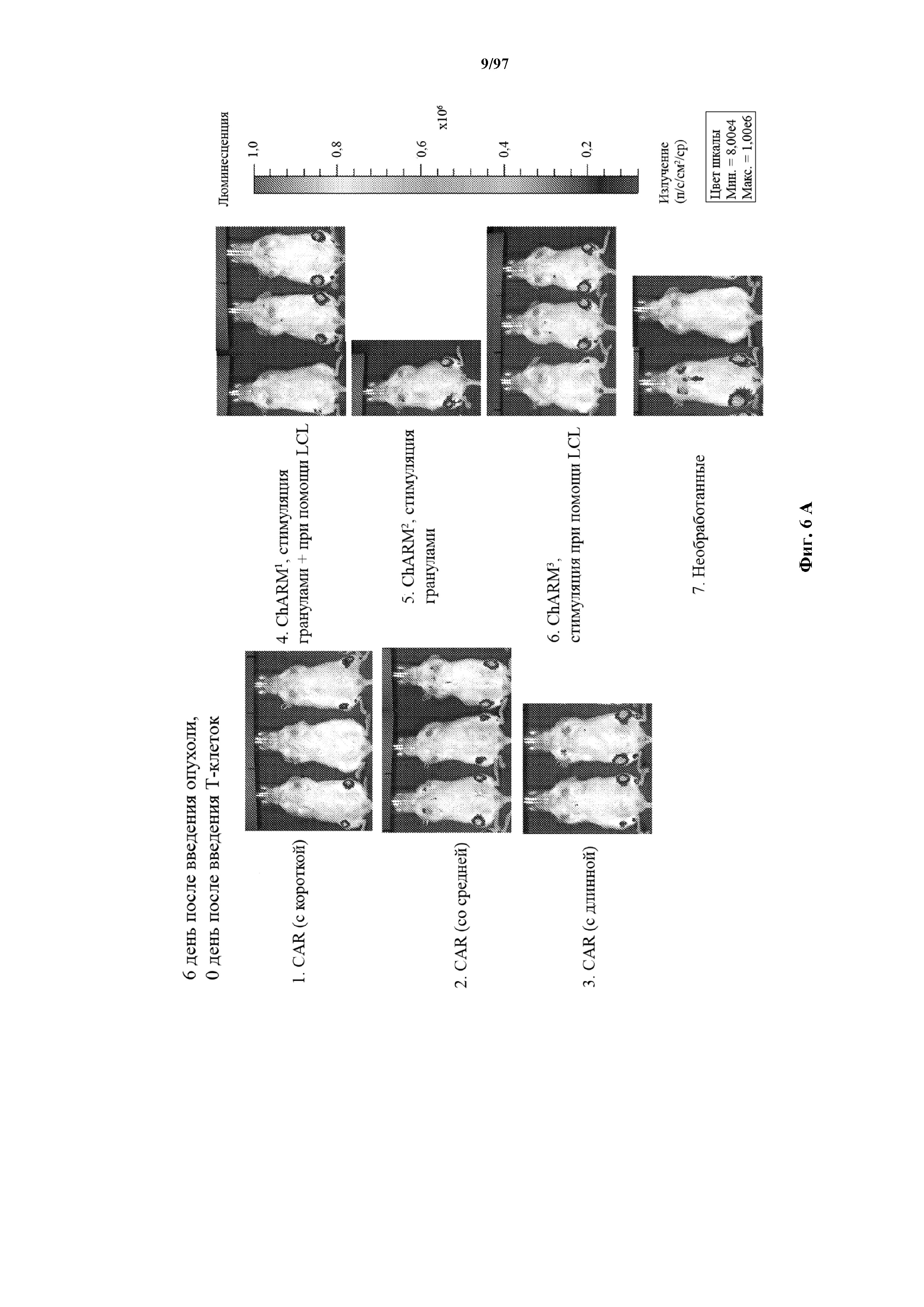
На фигурах 6A-6E показано, что человеческие Т-клетки к CD19, экспрессирующие T-ChARM (содержащий одну, две или три кассеты с метками) или обычные CAR (содержащие короткие или средние соединительные области), могут уничтожать развившиеся опухоли Raji у мышей NSG. В этих экспериментах клетки Raji трансфицируют для экспрессии гена люциферазы светлячка и рост опухоли измеряют с помощью введения мышам люциферина и биолюминесцентной визуализации.
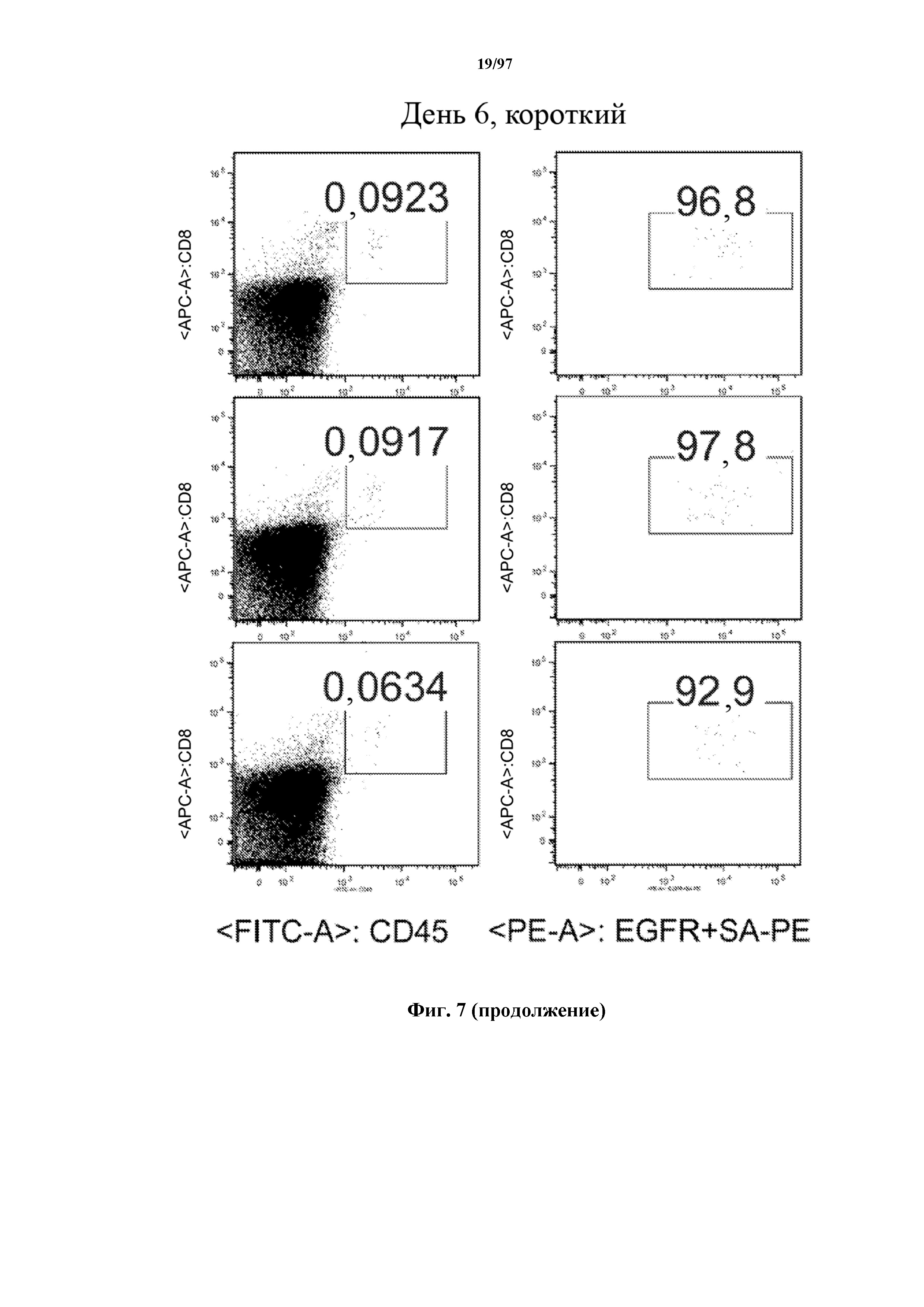
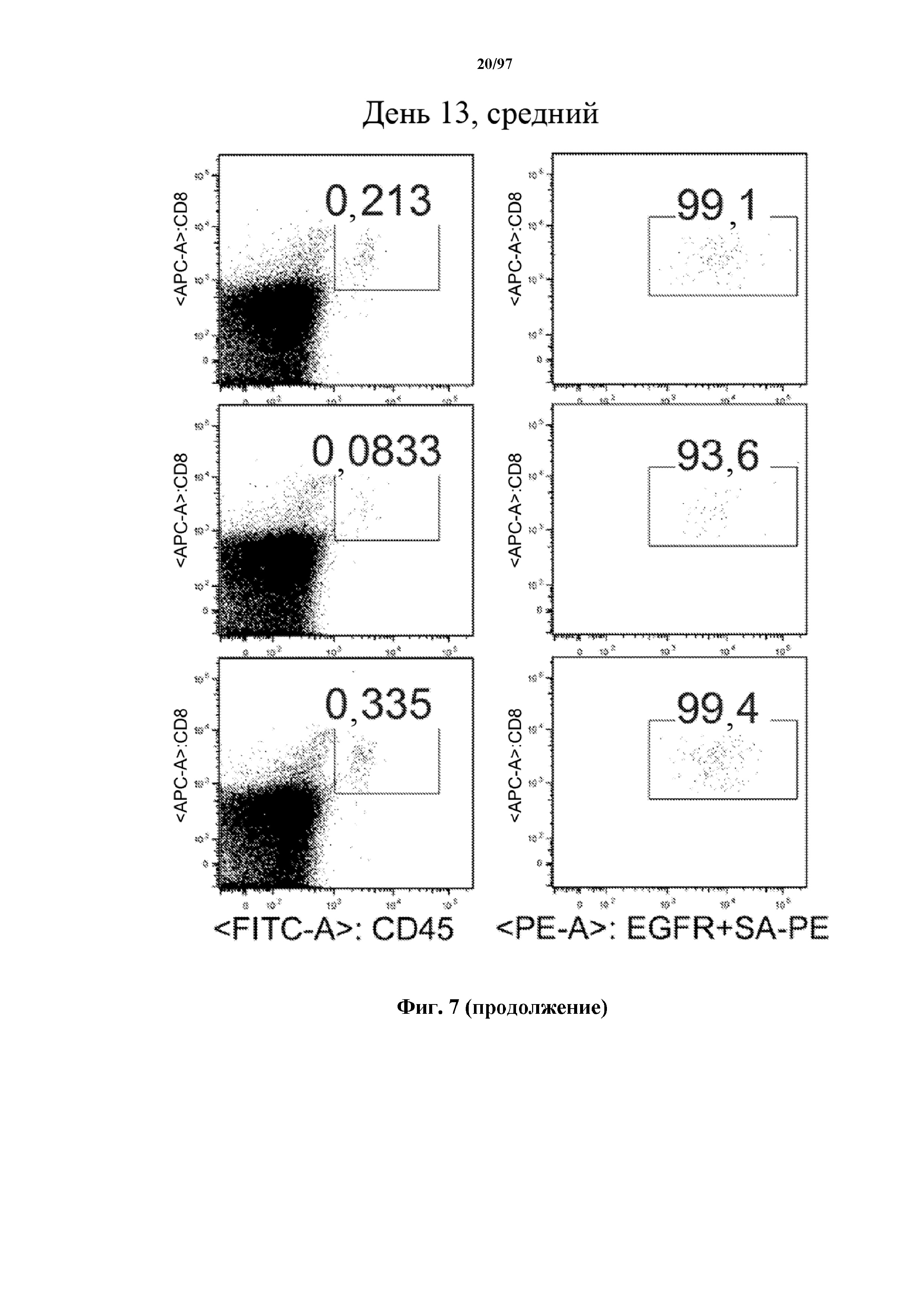
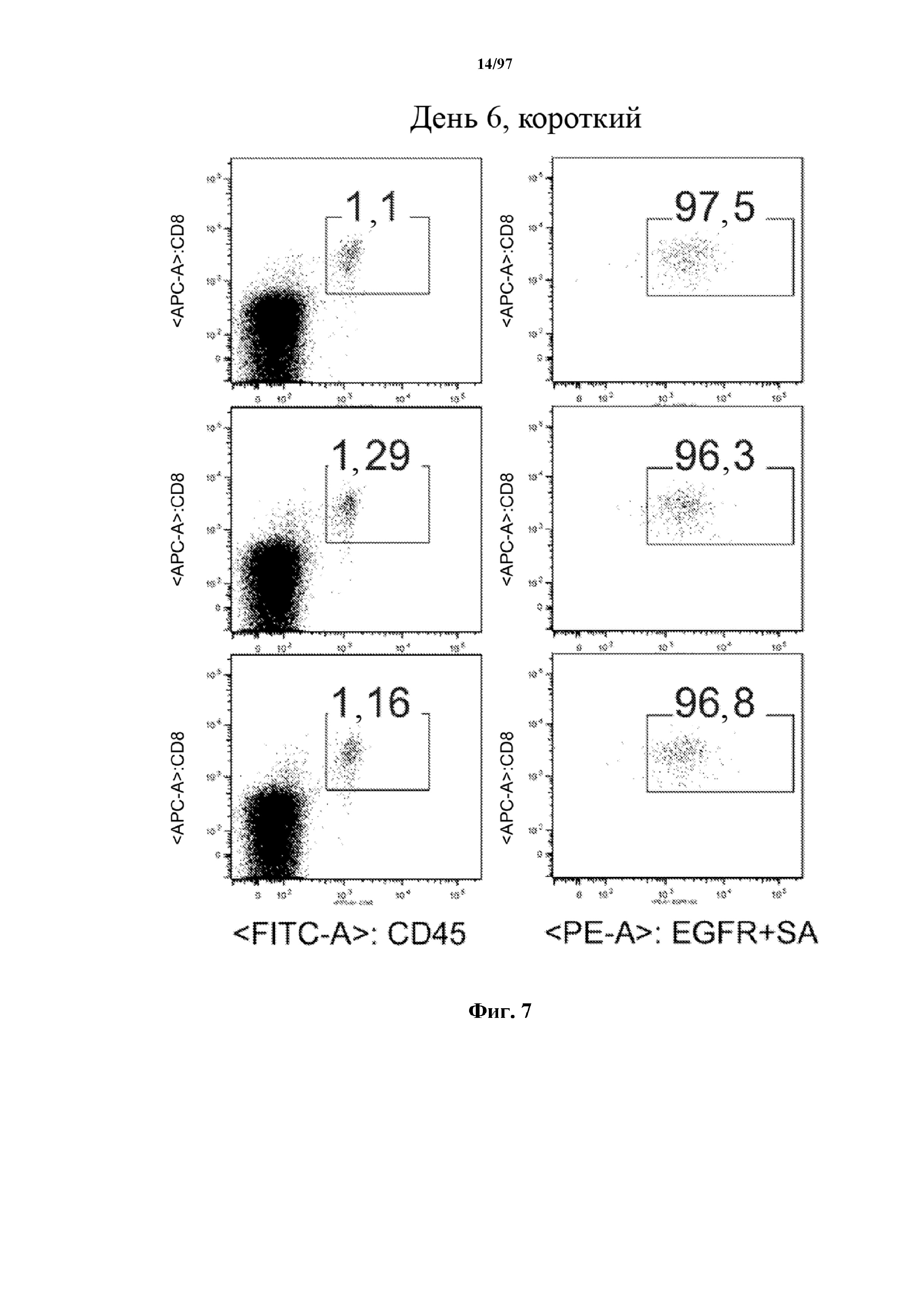
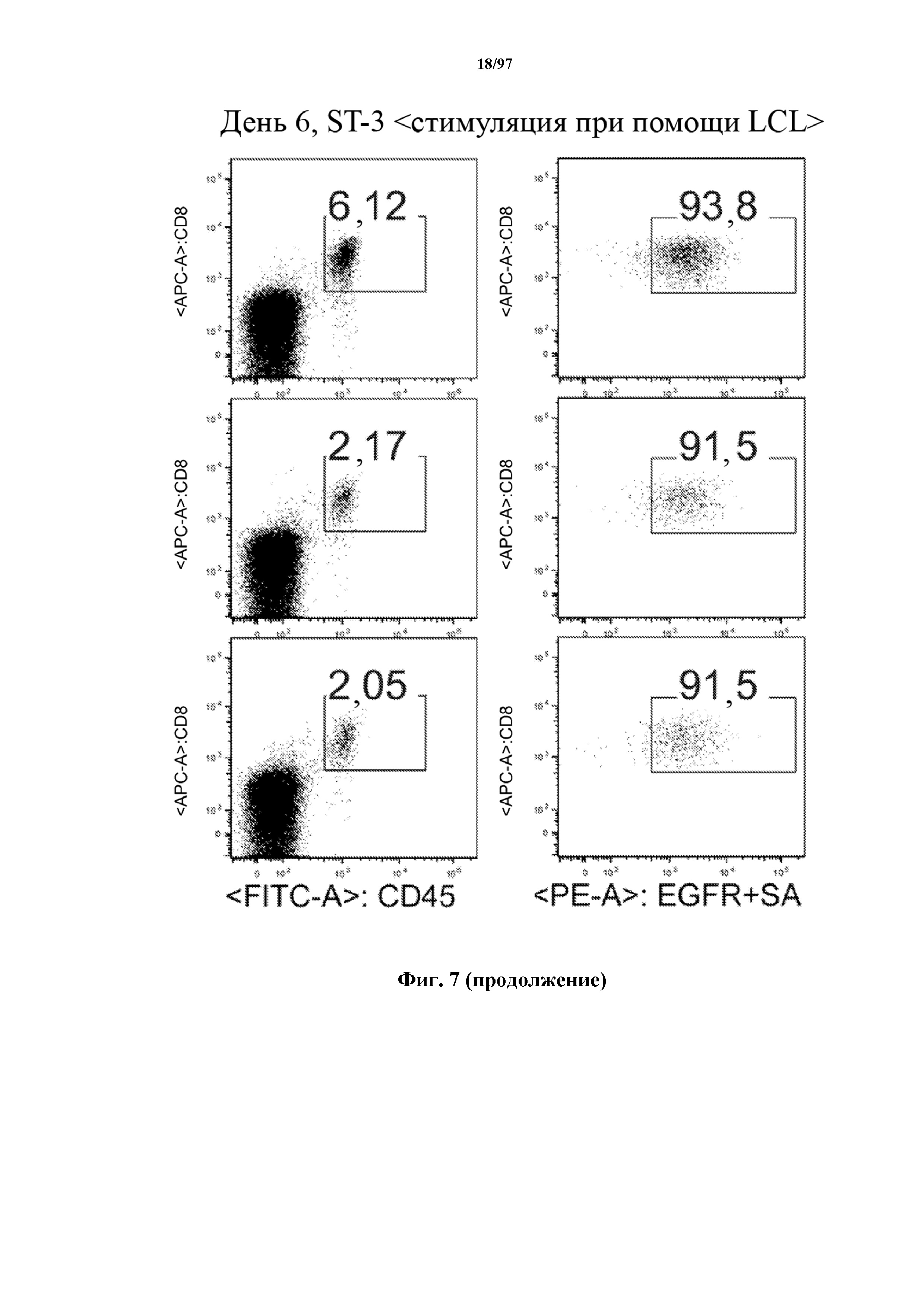
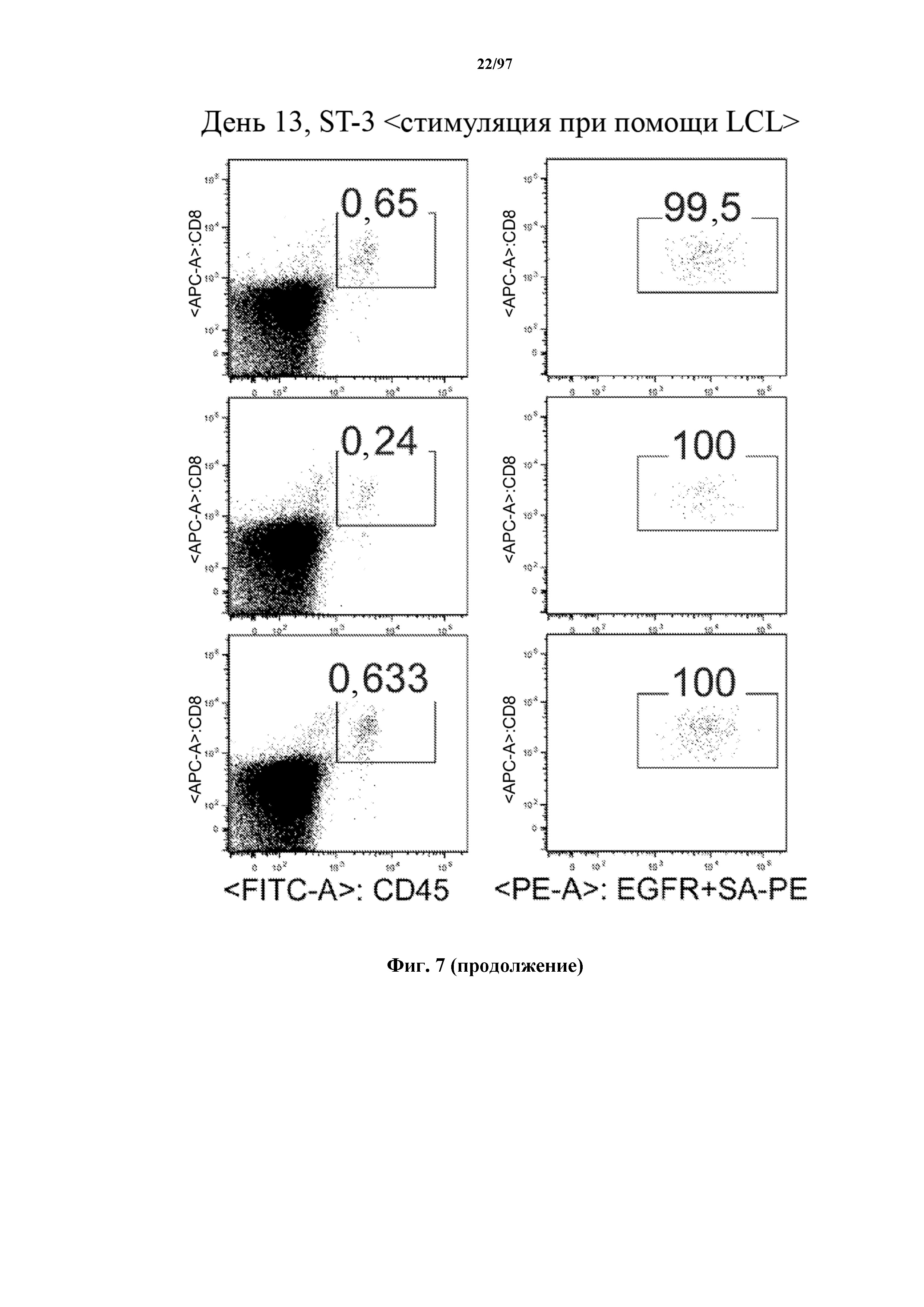
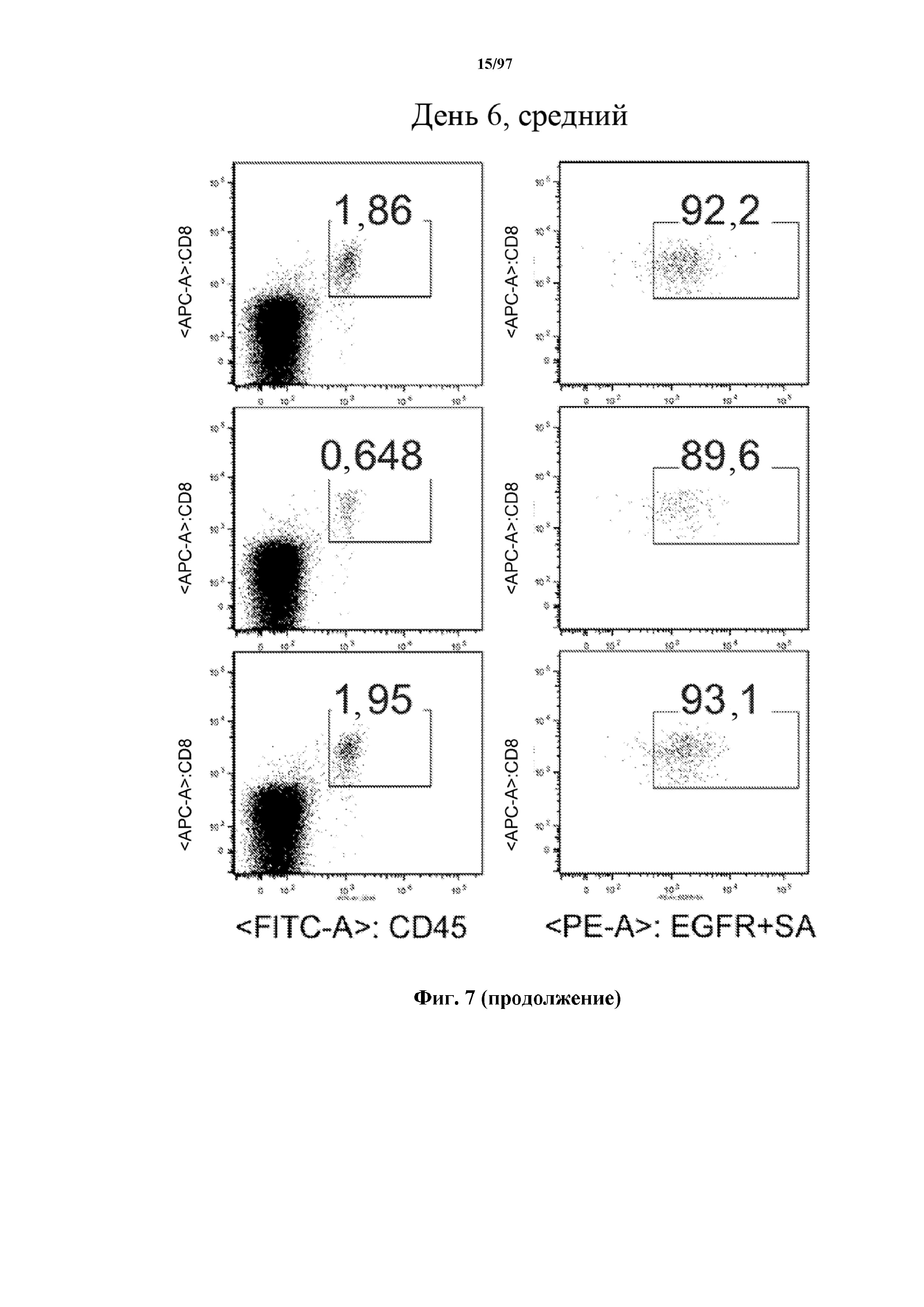
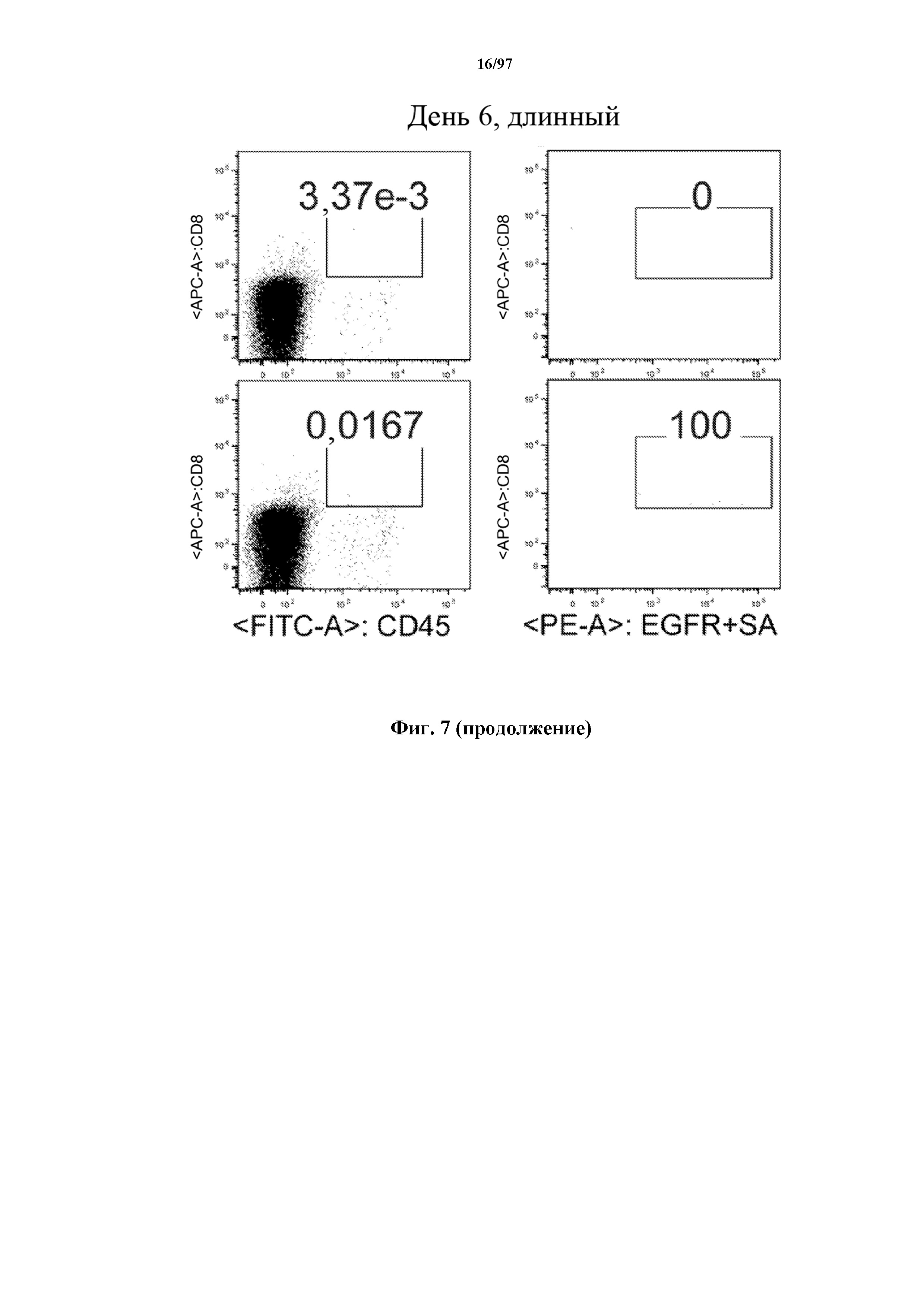
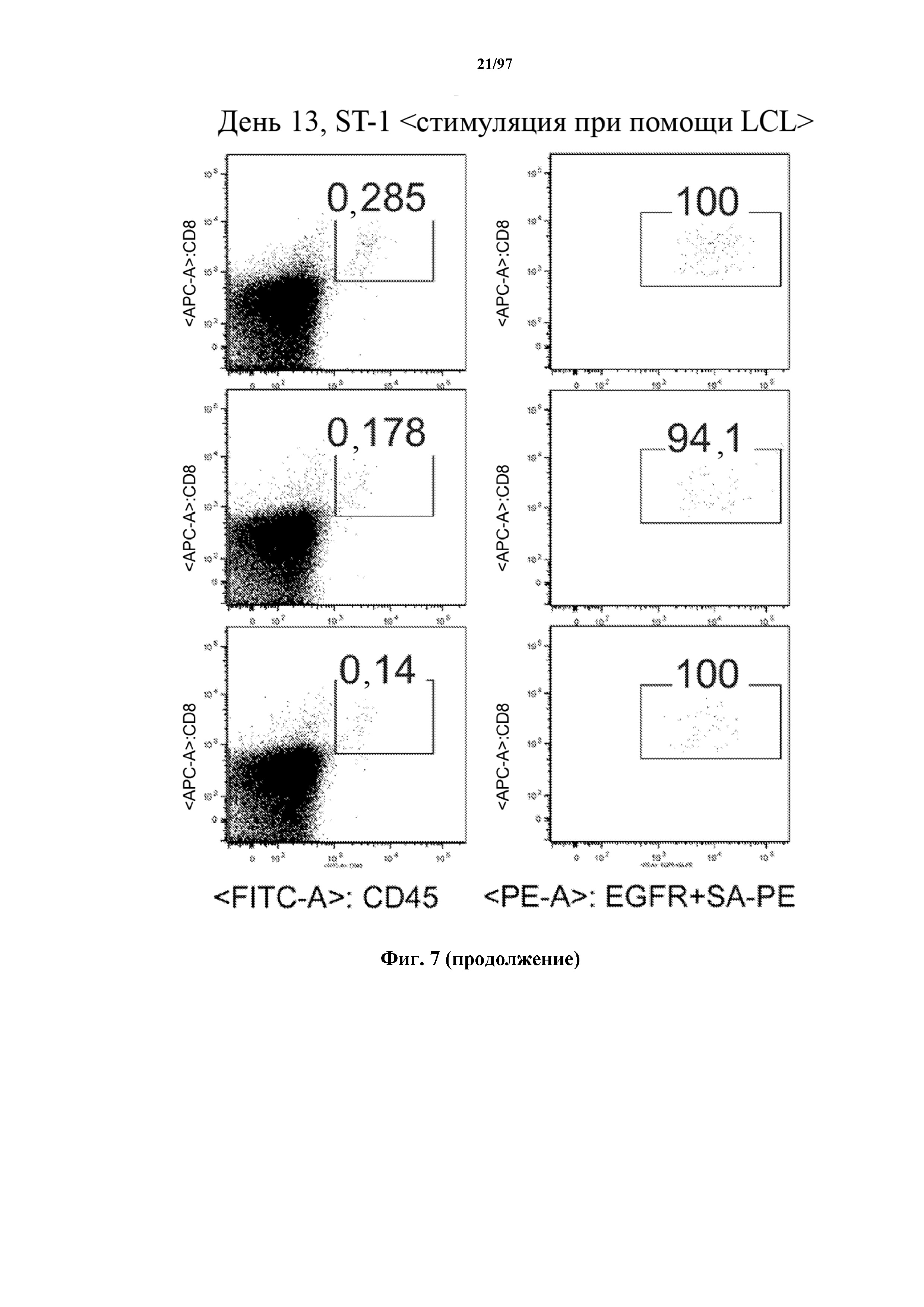
На фигуре 7 показано, что человеческие Т-клетки, экспрессирующие CAR и T-ChARM к CD19, могут сохраняться в крови после адоптивного переноса мышам NSG, которых инокулировали лимфомой Raji. Человеческие Т-клетки отличают с помощью окрашивания моноклональными антителами, специфичными к человеческим молекулам клеточной поверхности CD8 и CD45.
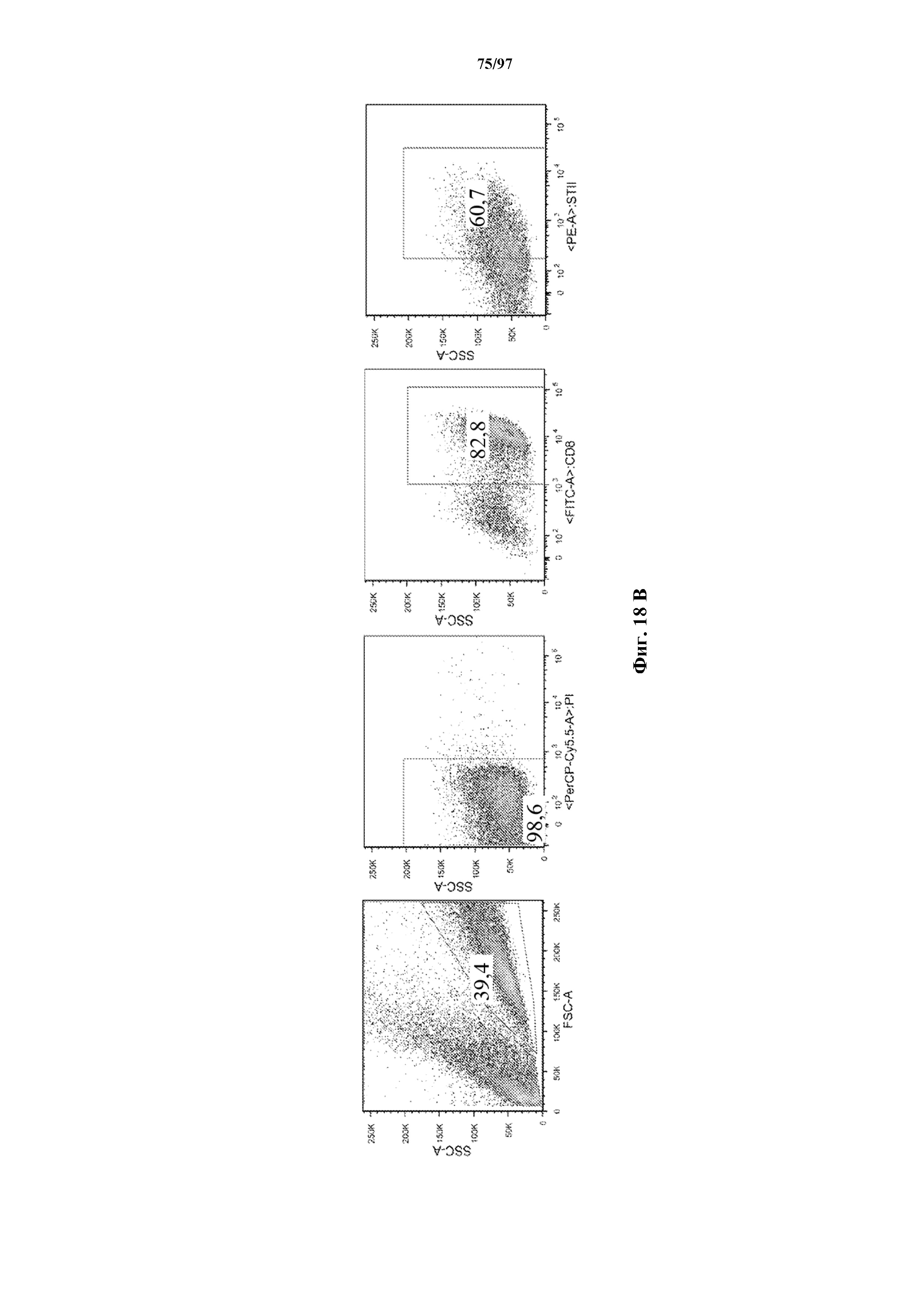
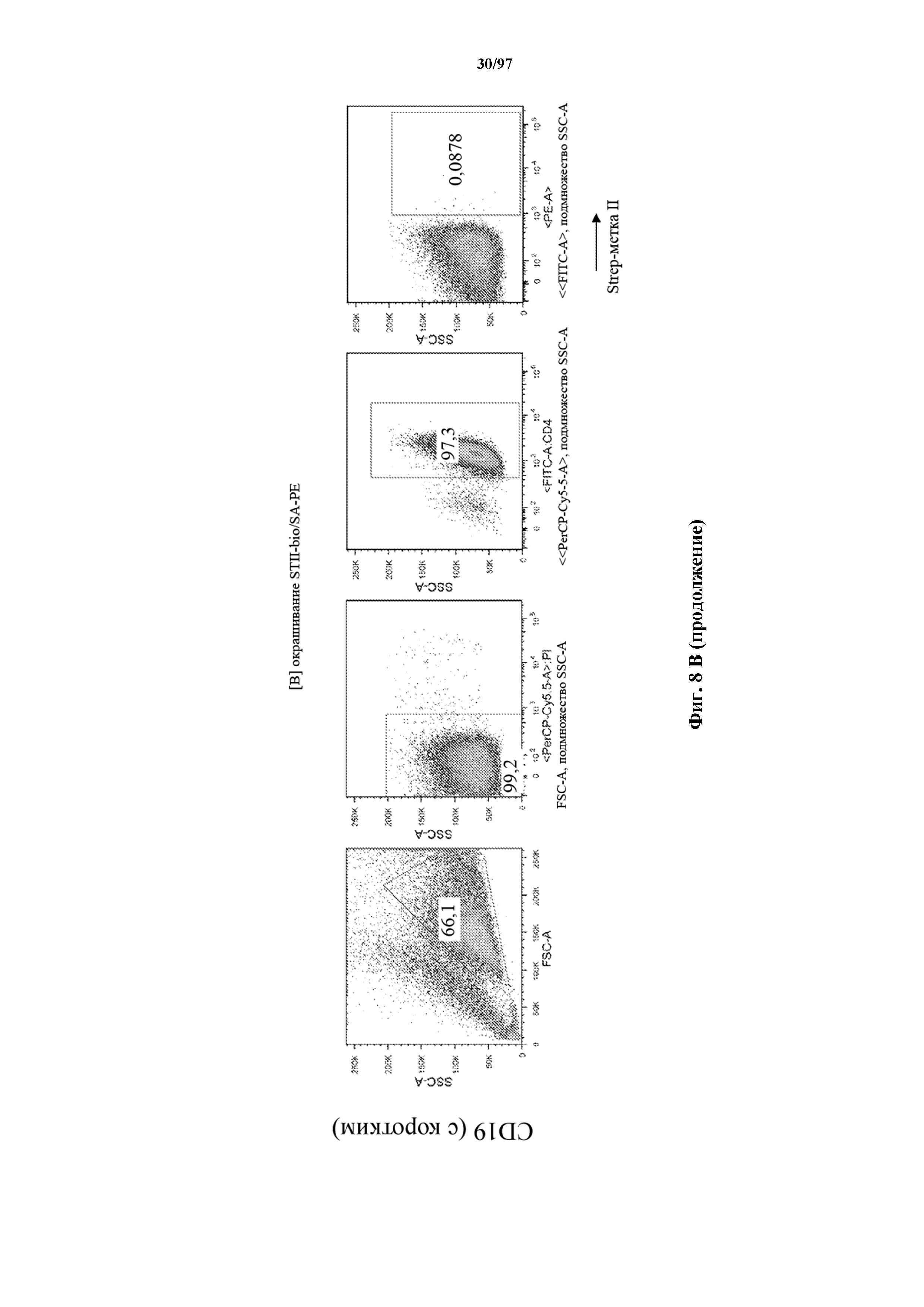
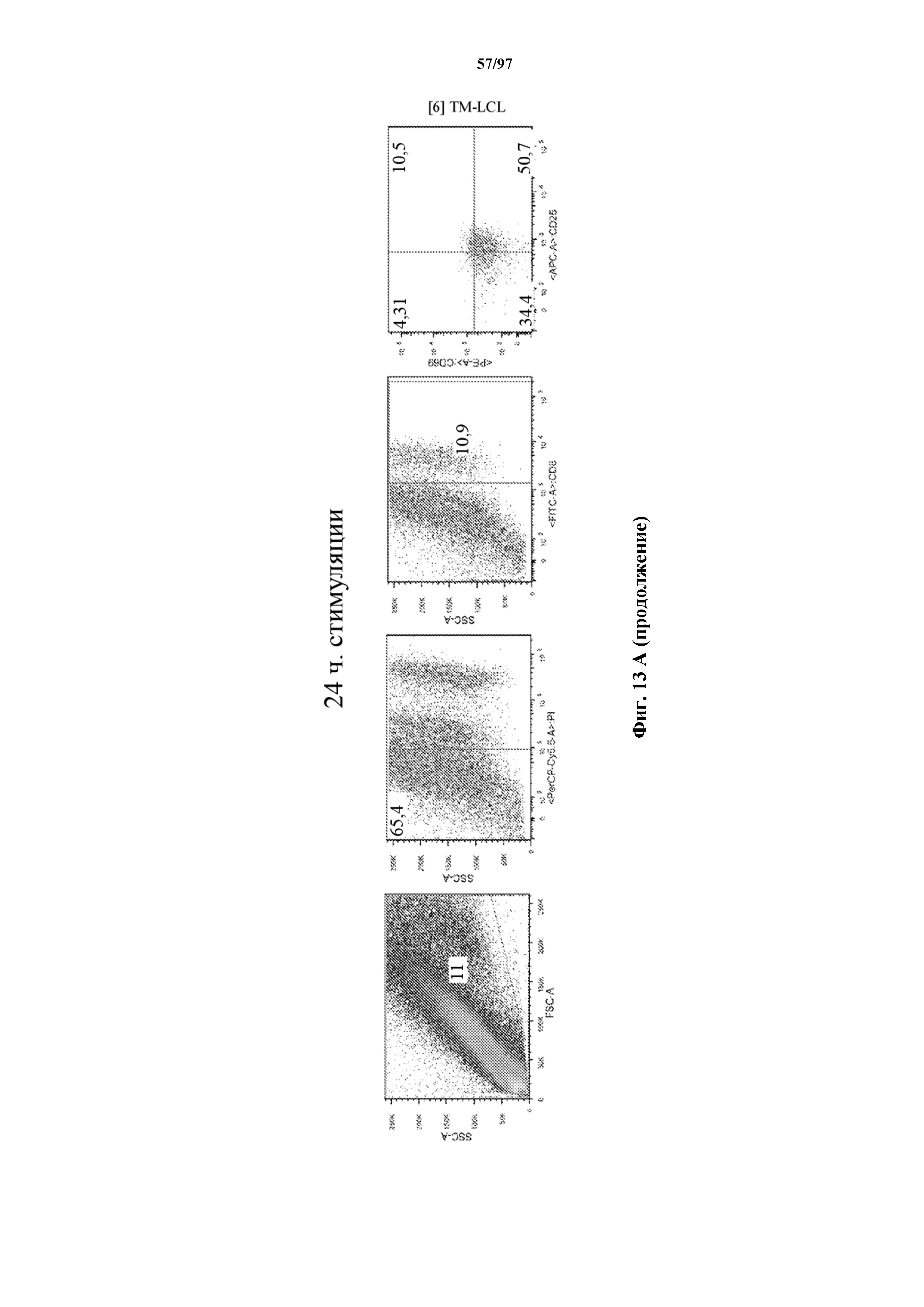
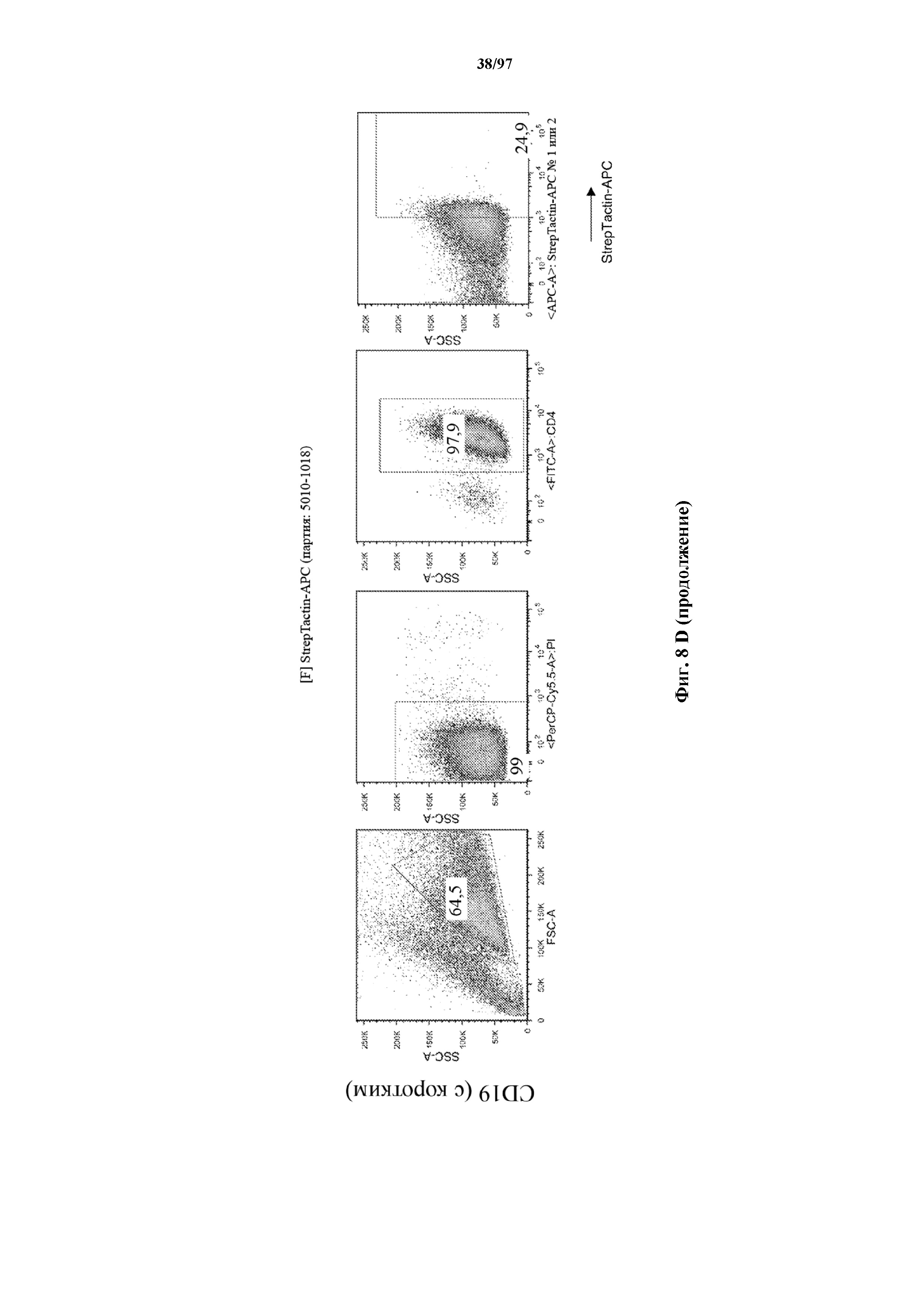
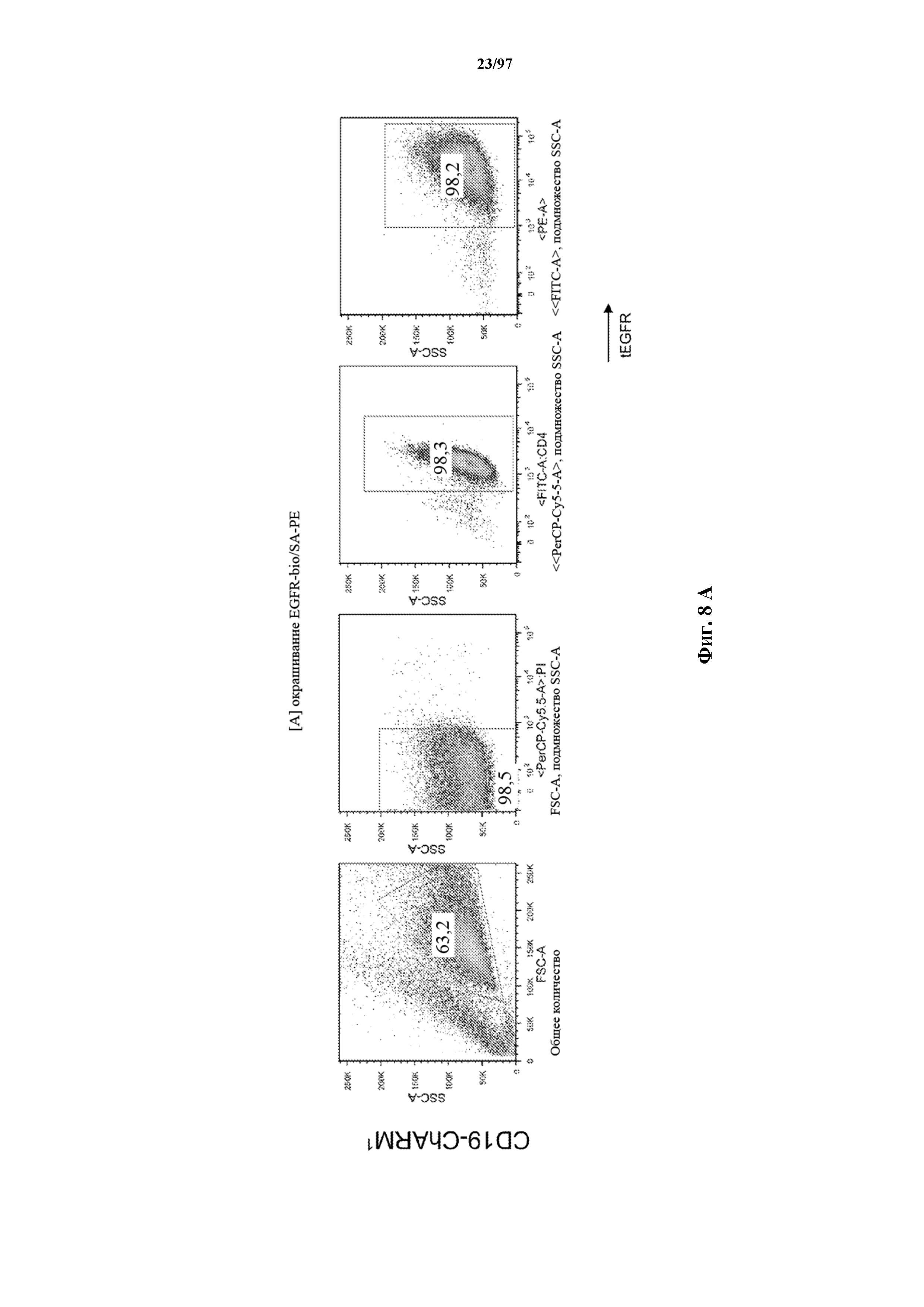
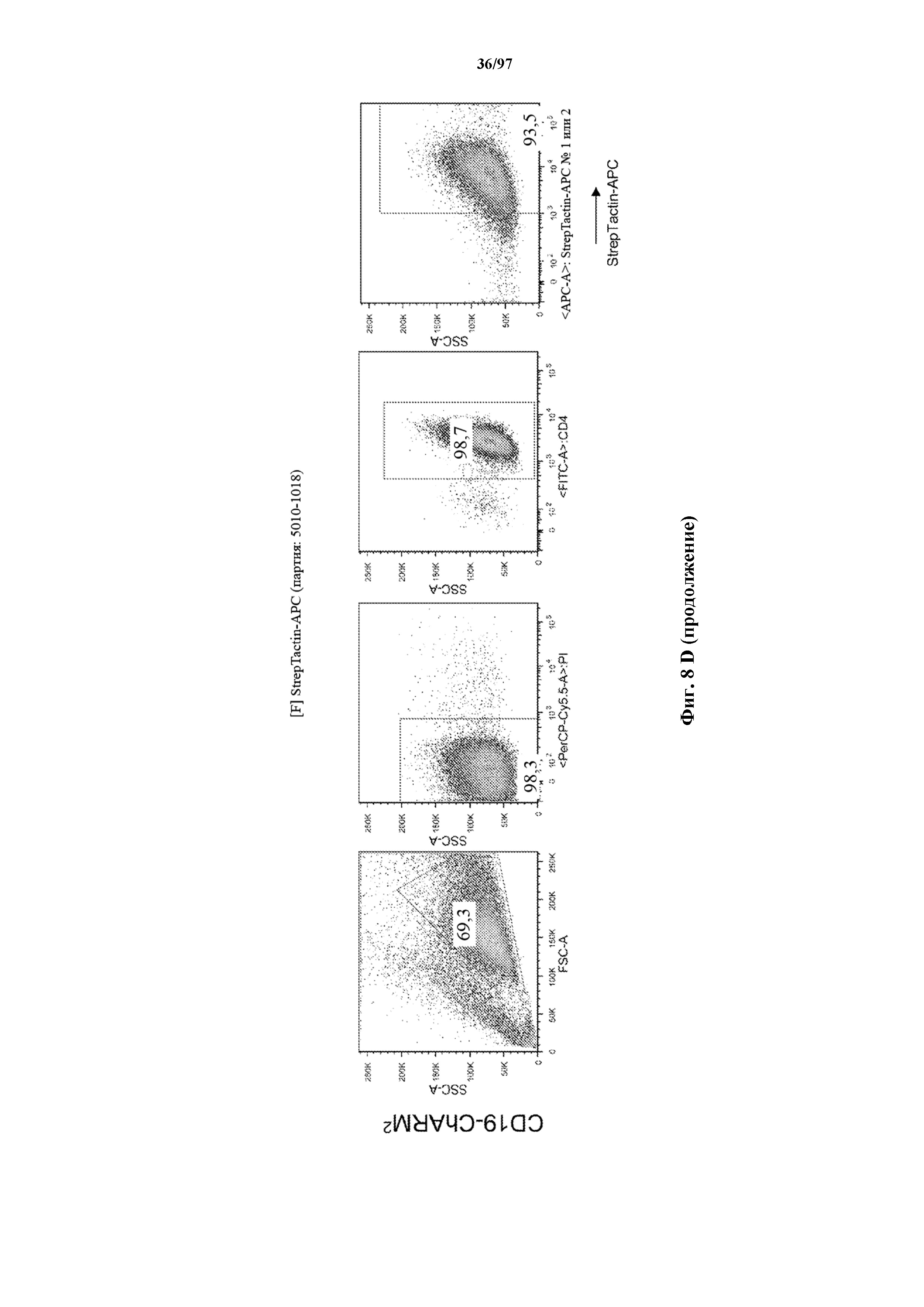
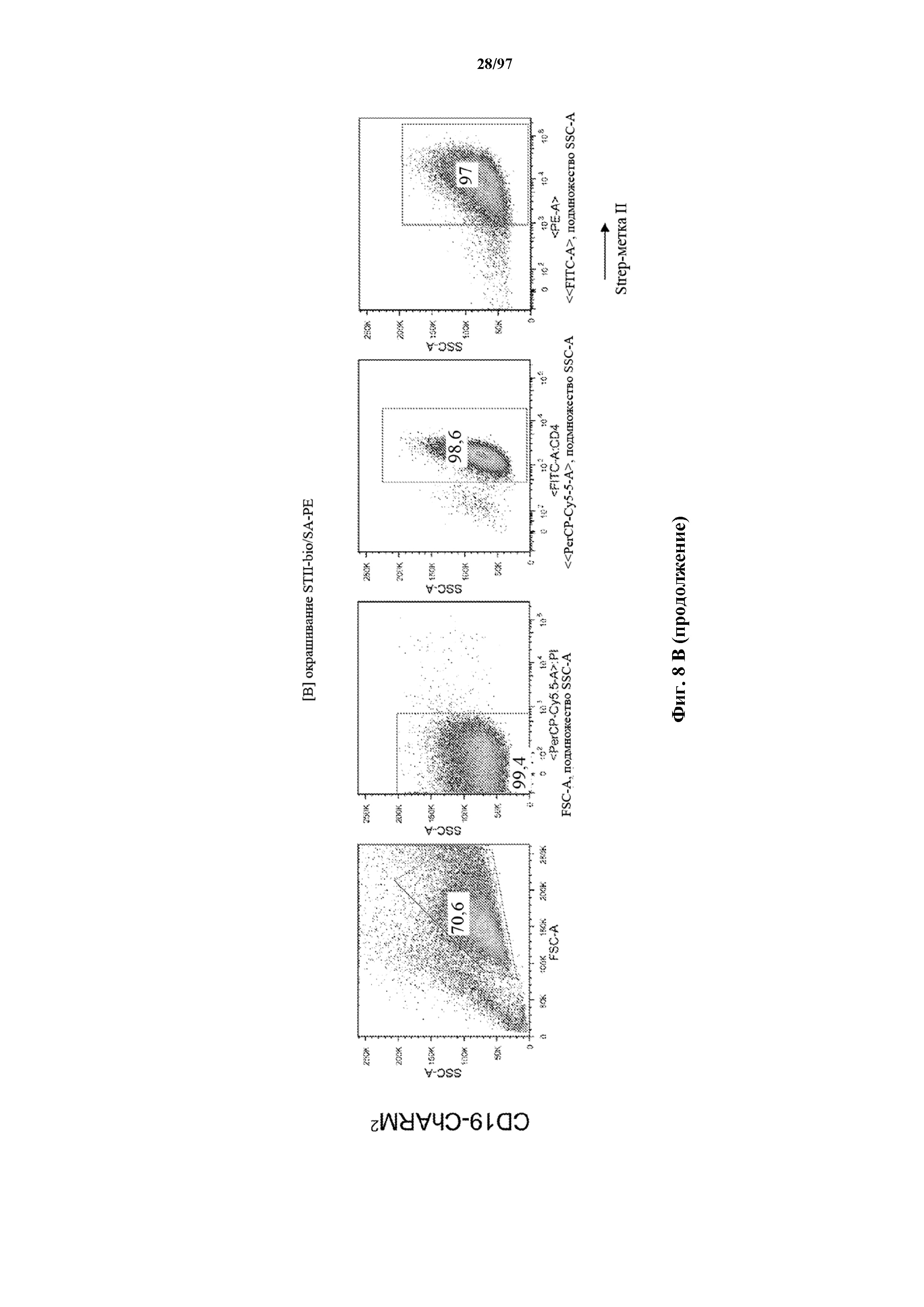
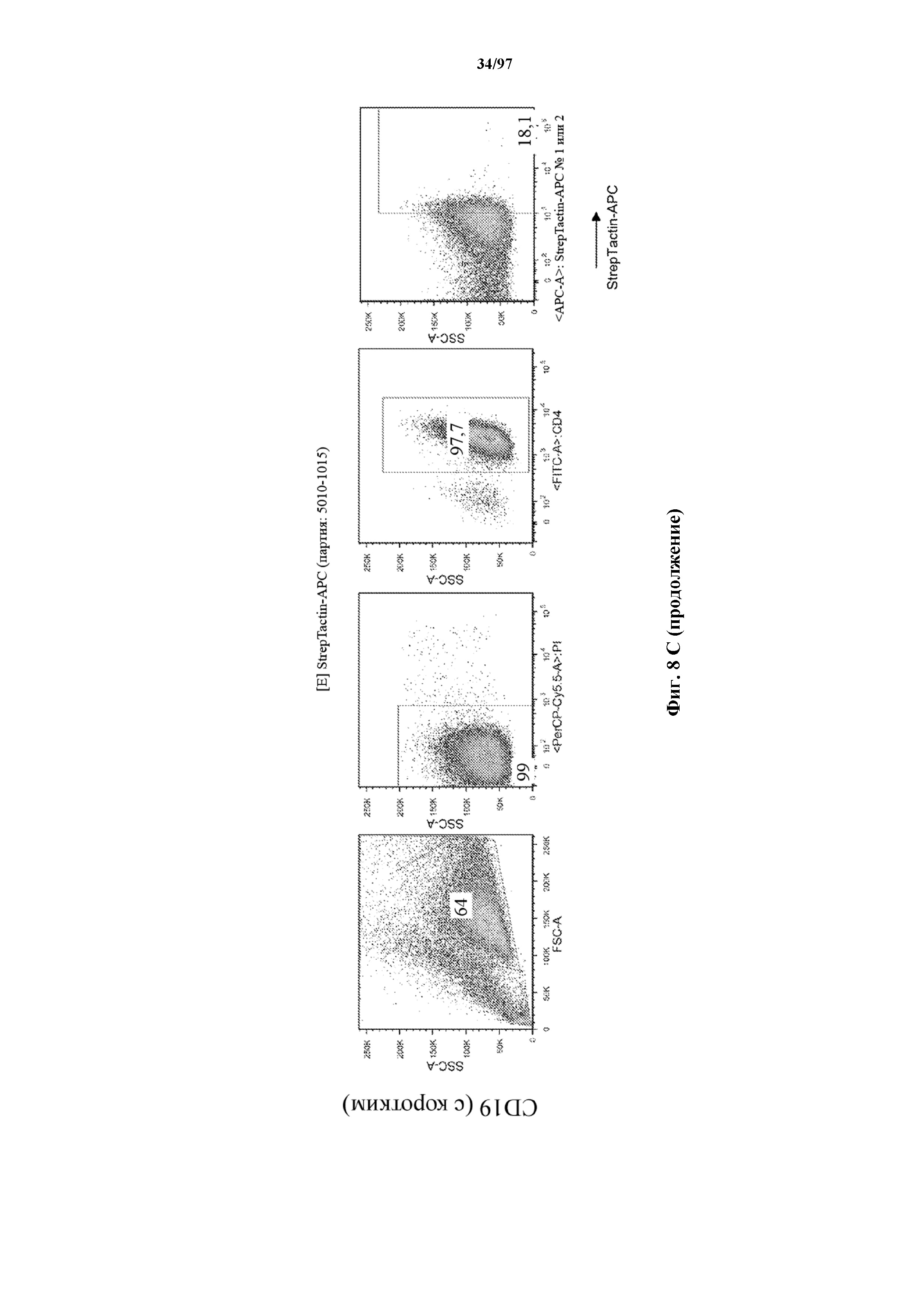
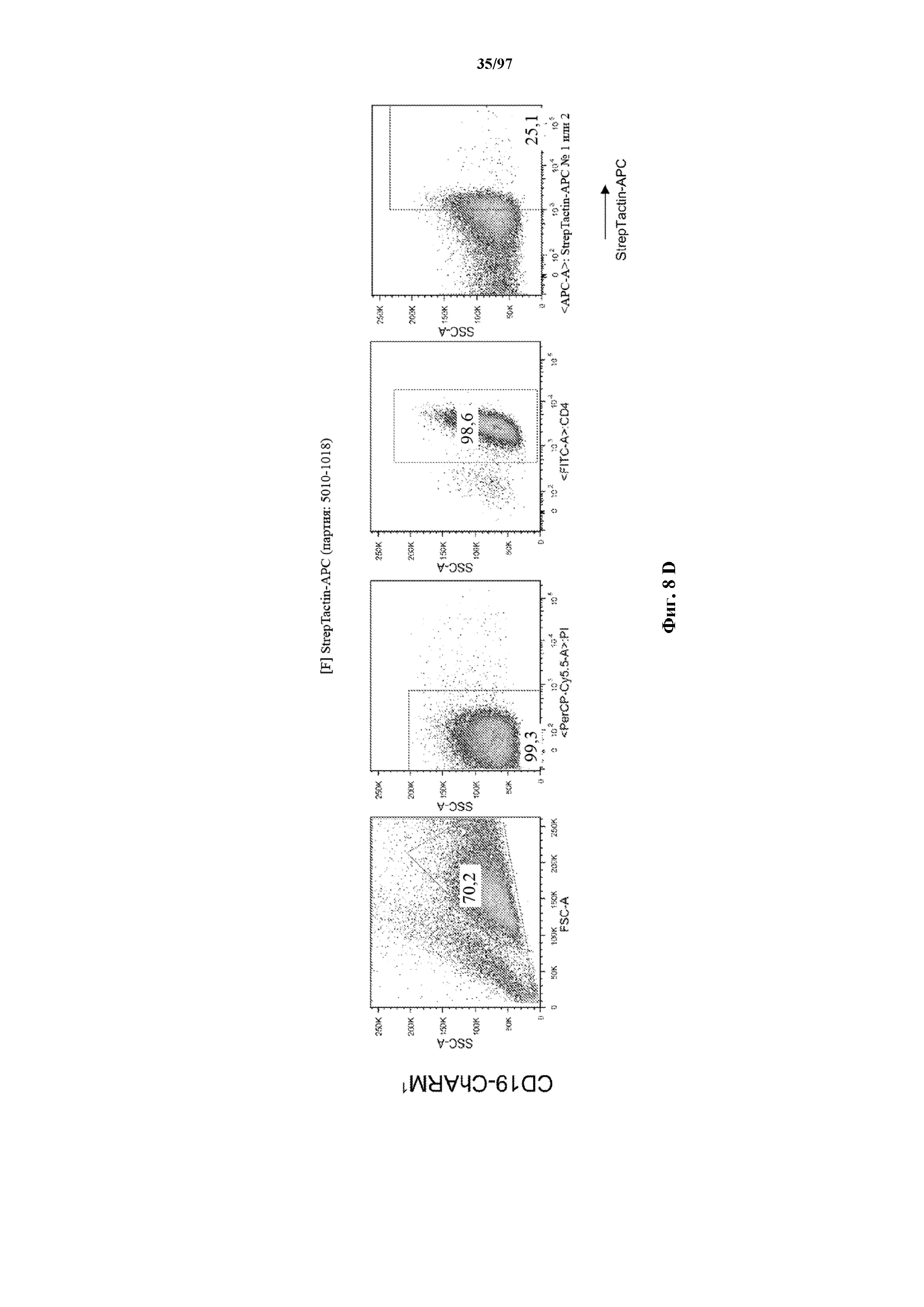
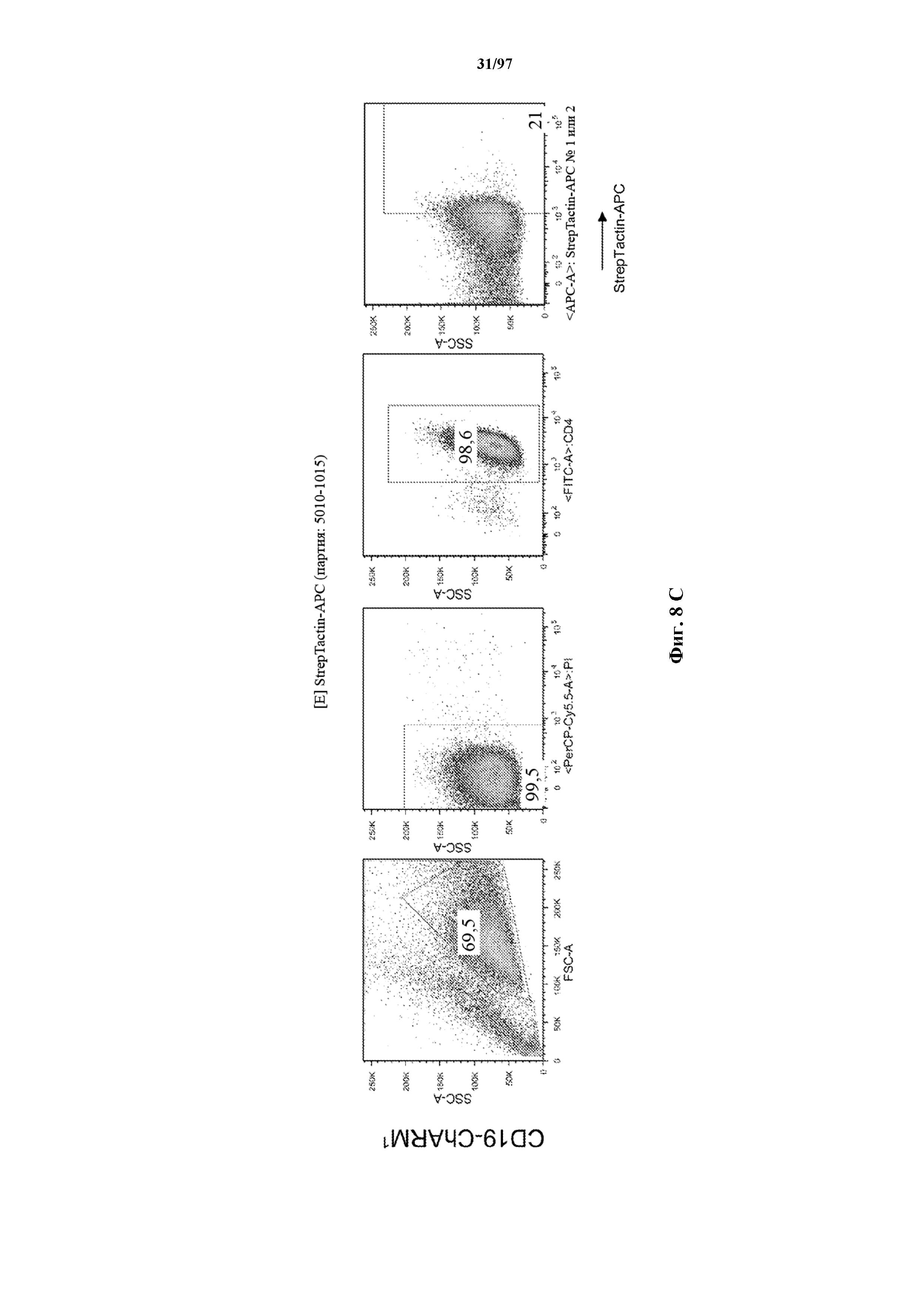
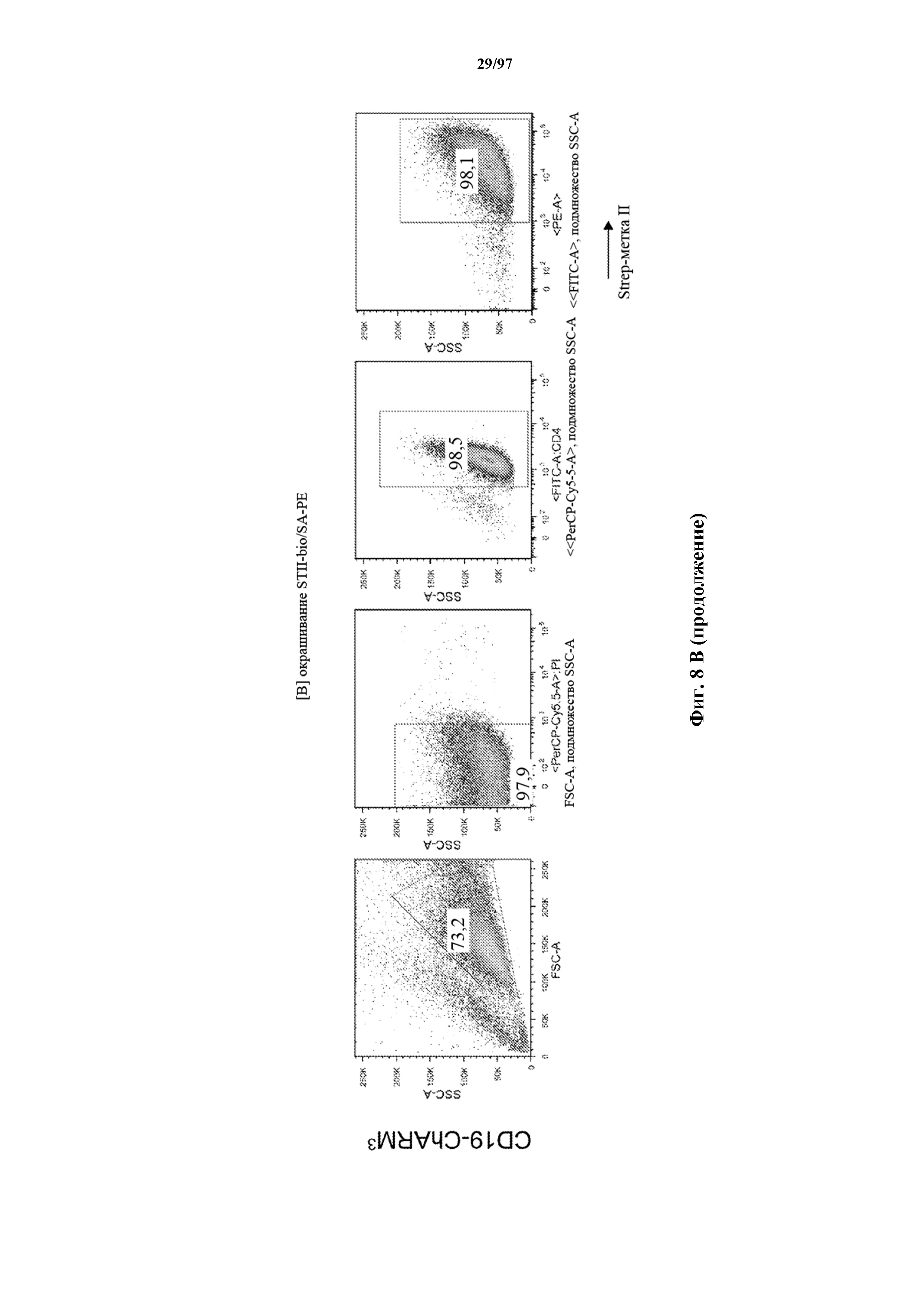
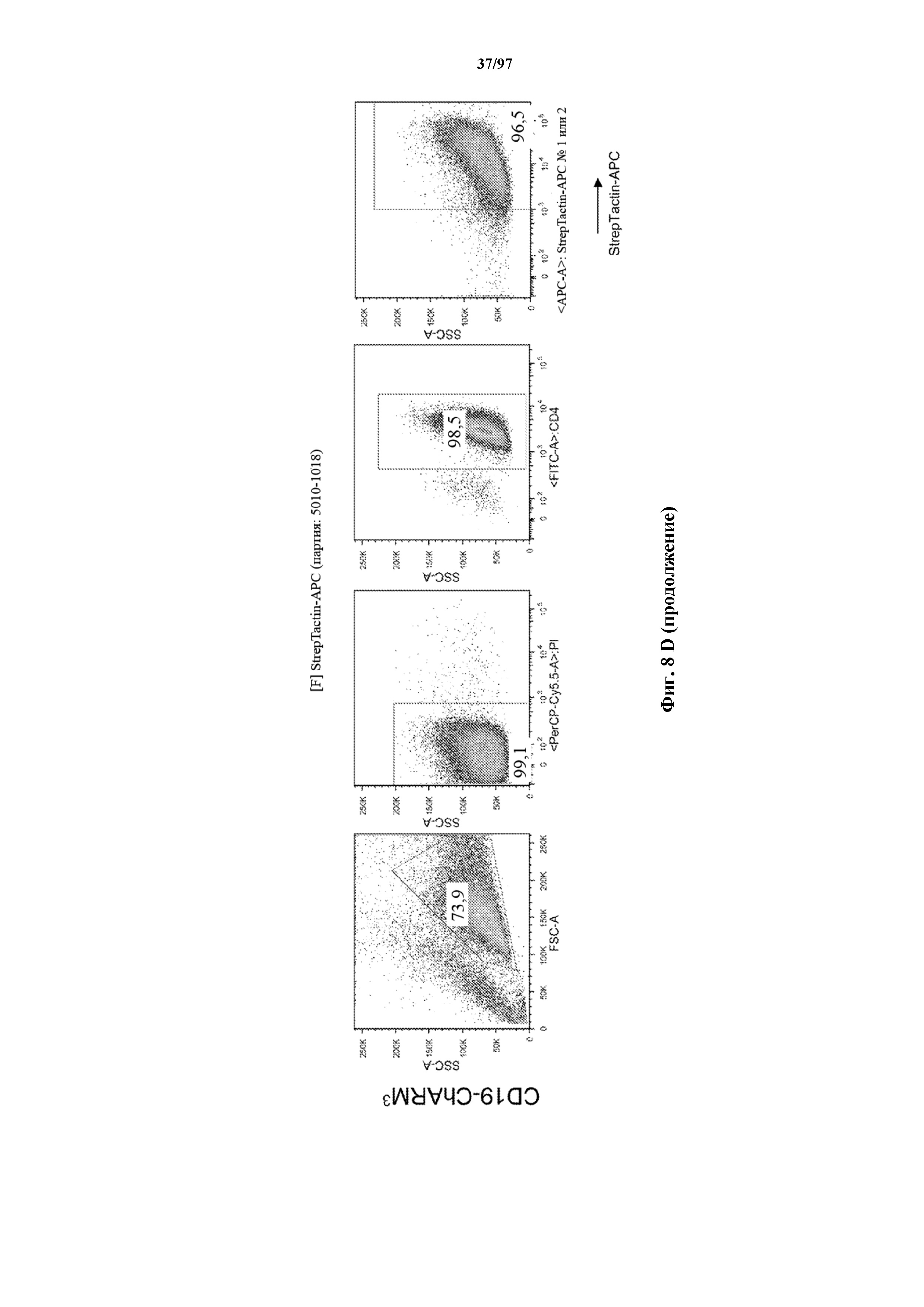
На фигурах 8A-8D показано, что Т-клетки, экспрессирующие T-ChARM, можно идентифицировать с помощью проточной цитометрии с использованием специфичного к метке связывающего средства. В примерах очищенные Т-клетки с T-ChARM обнаруживают с помощью маркера экспрессии tEGFR (A), обнаруживают с помощью антитела к Strep-метке II (STII) (B) или со StrepTactin APC (C, D).
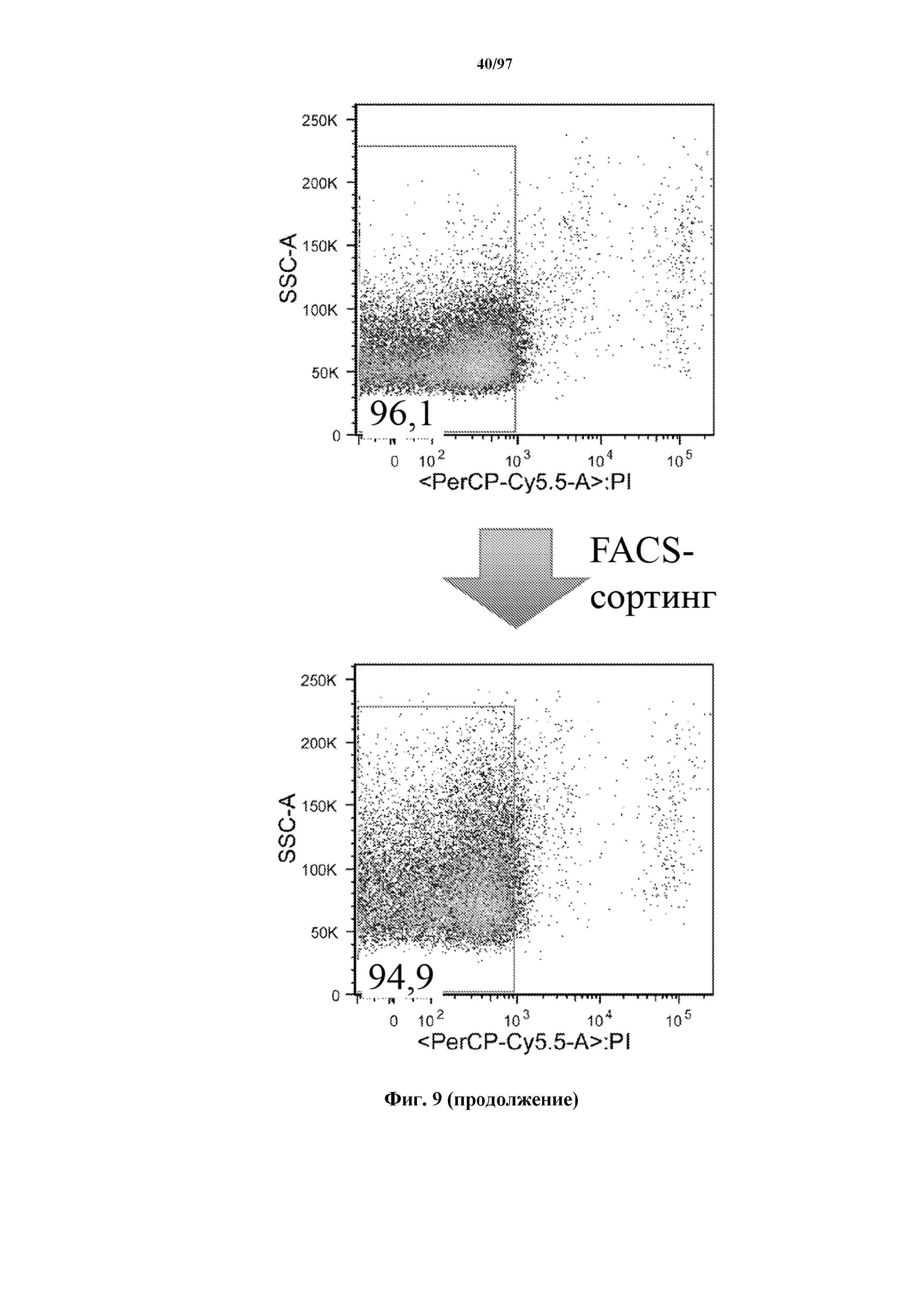
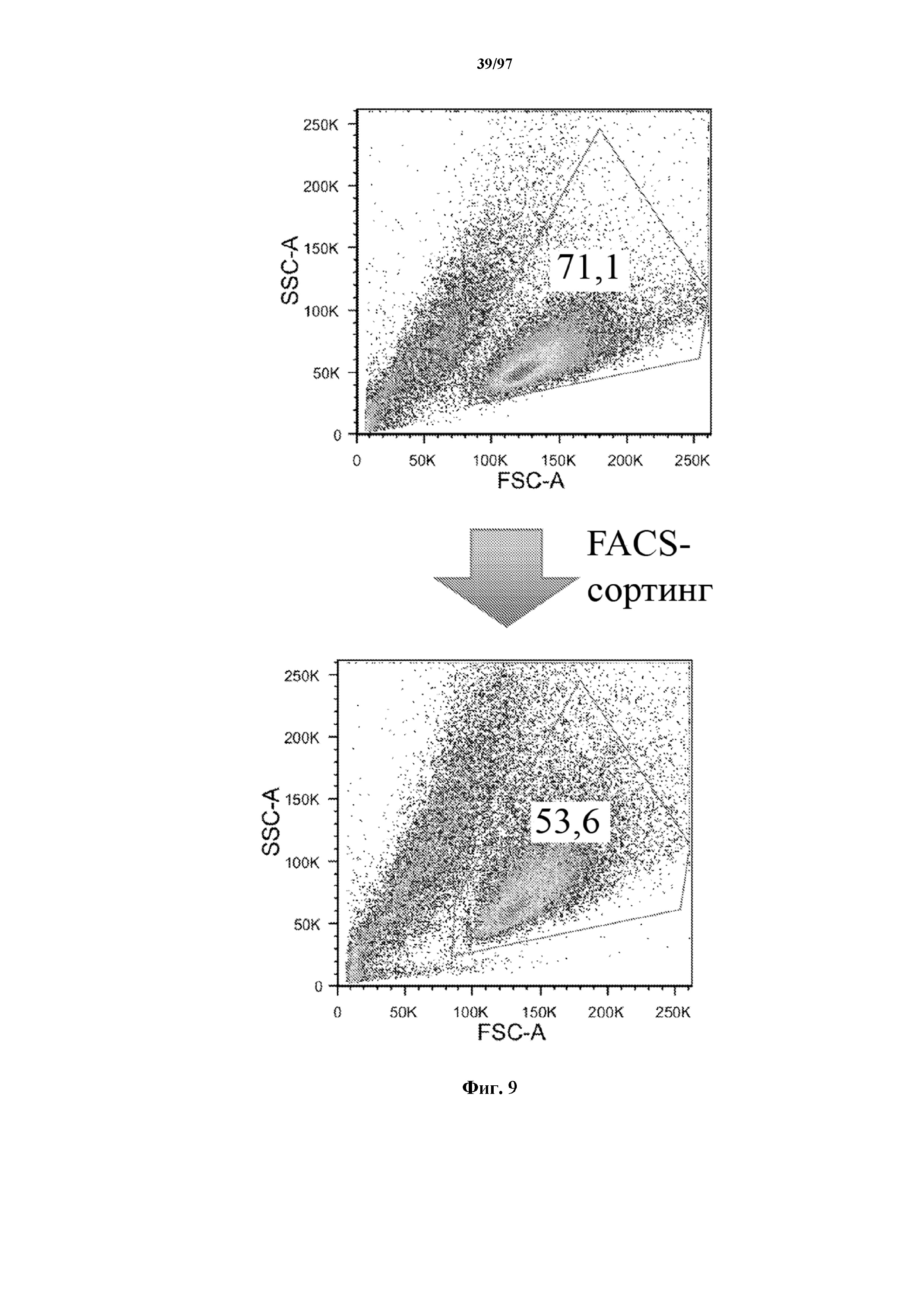
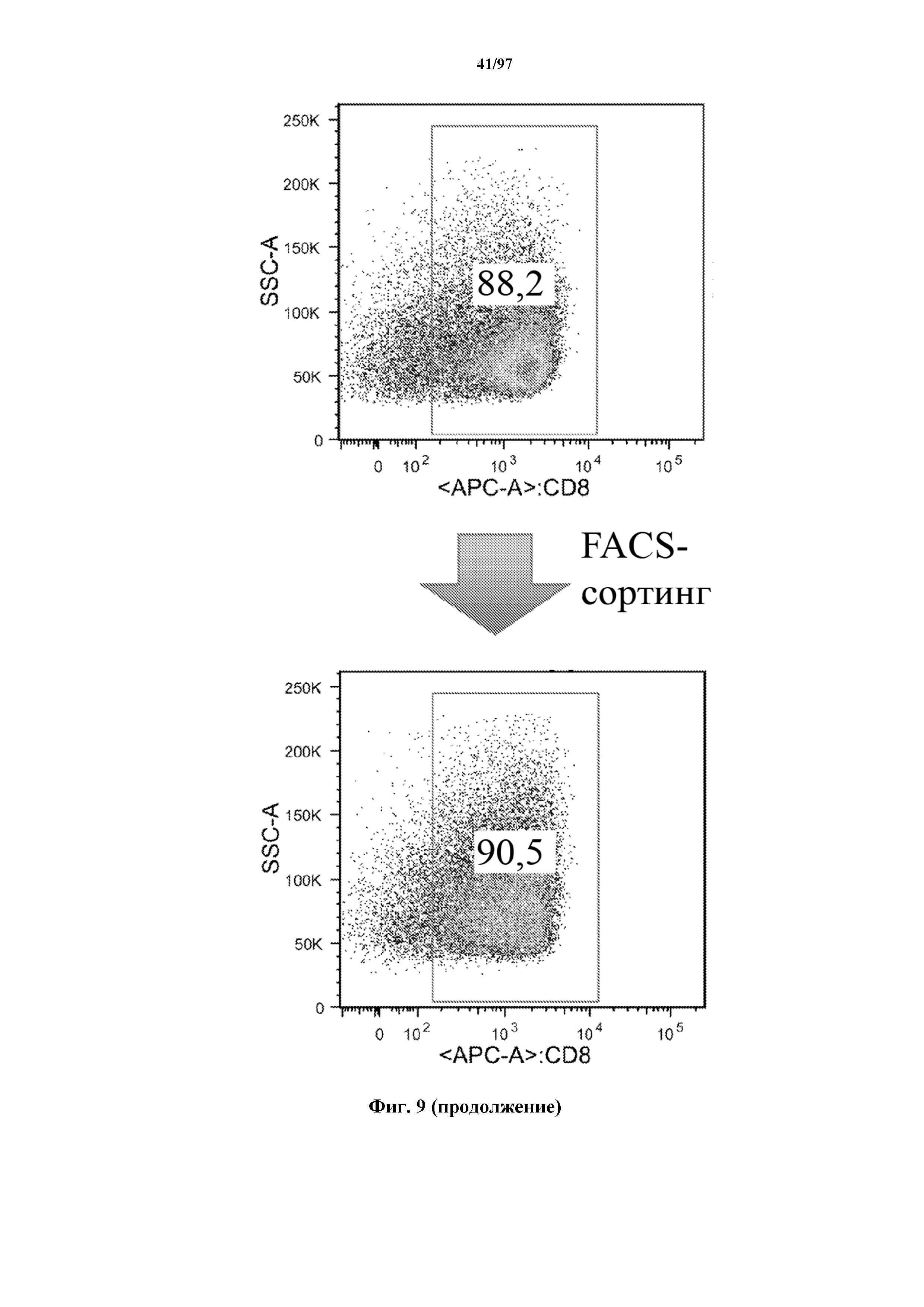
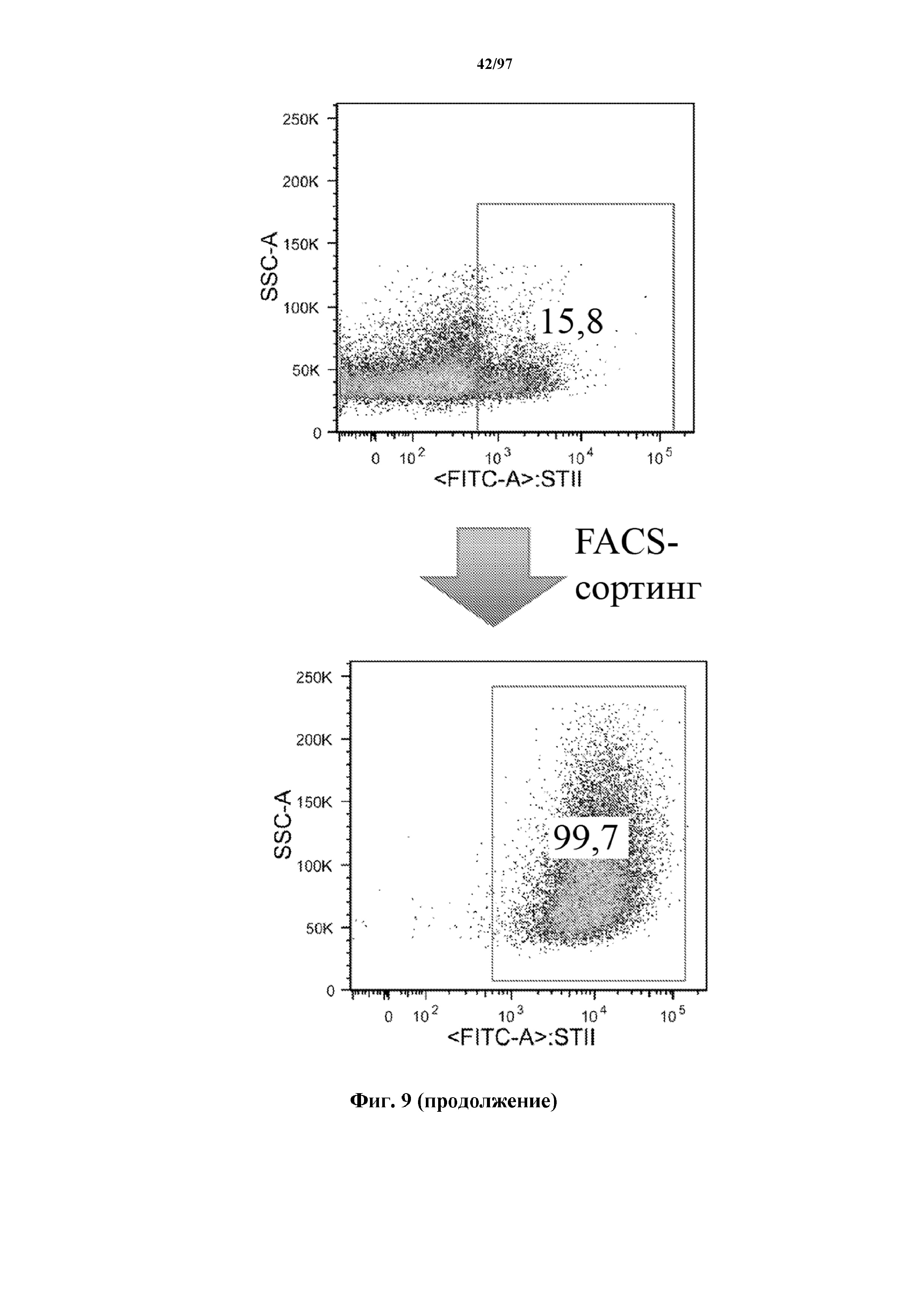
На фигуре 9 показано, что Т-клетки, экспрессирующие T-ChARM, можно отсортировать с помощью проточной цитометрии со степенью чистоты от низкой (15% в примере) до высокой (99% в примере) с использованием специфичного к метке связывающего средства, соединенного с флуорохромом. В примере метка представляет собой StrepTag II и специфичное к метке связывающее средство представляет собой моноклональное антитело к STII, соединенное с флуорохромом.
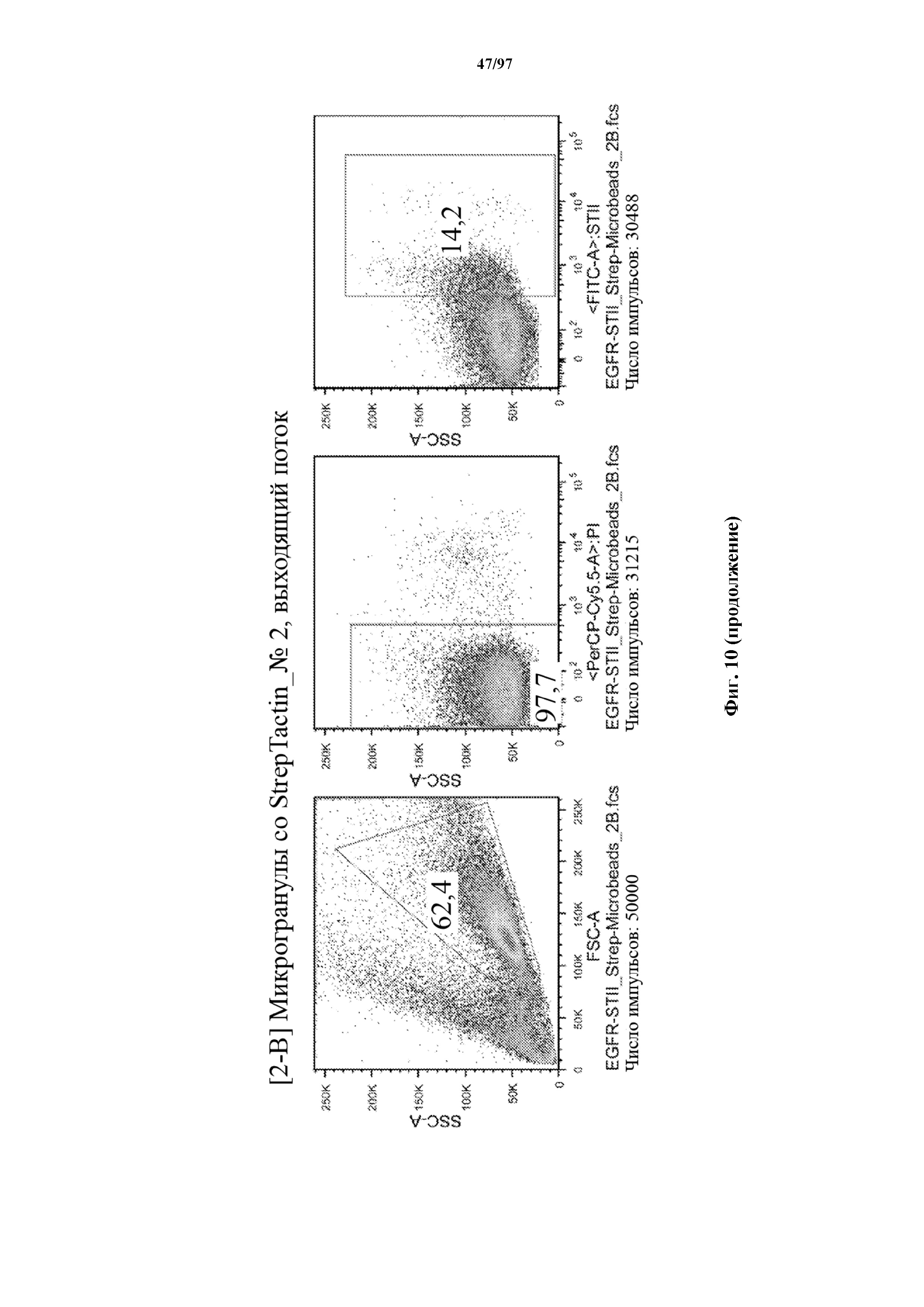
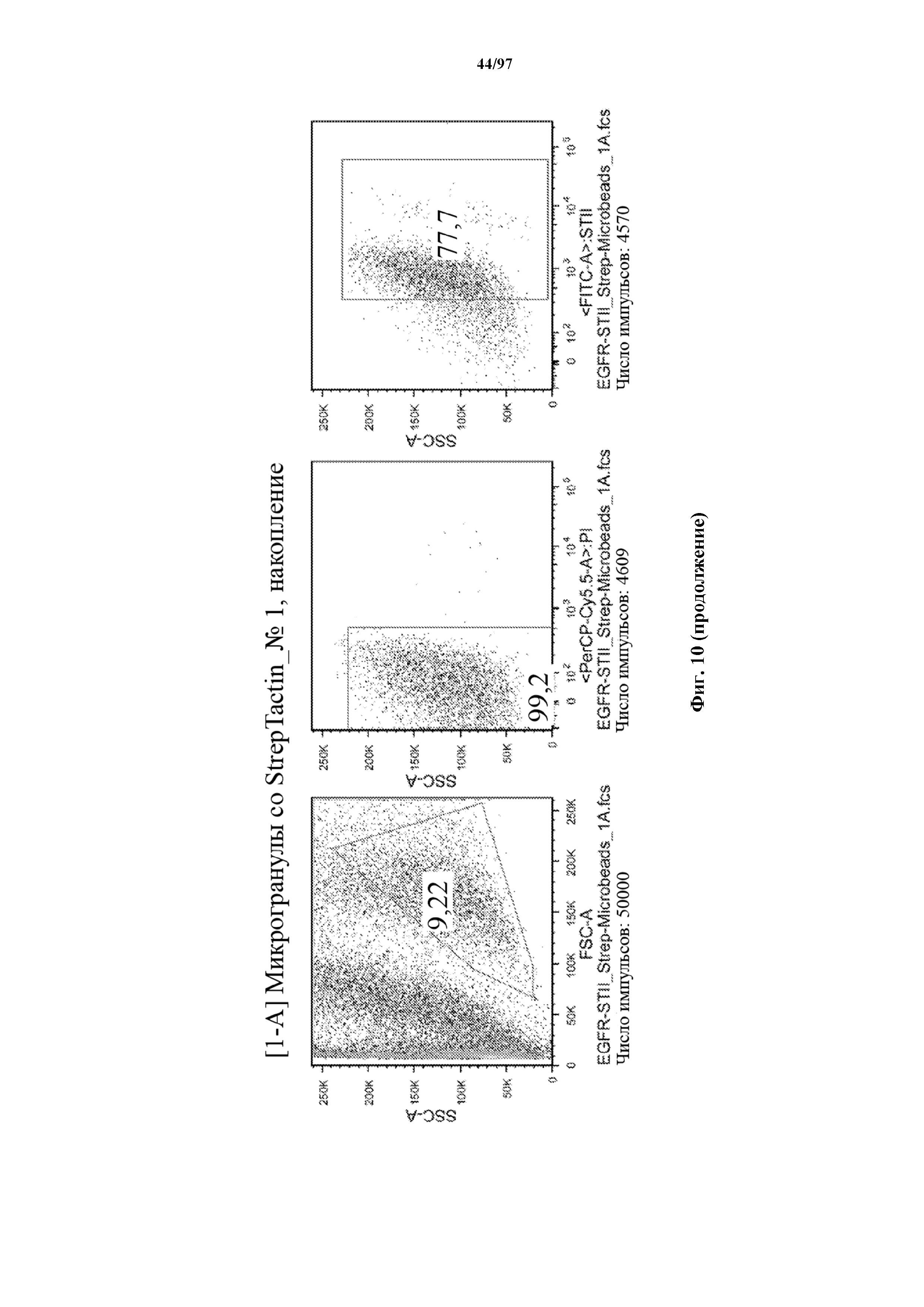
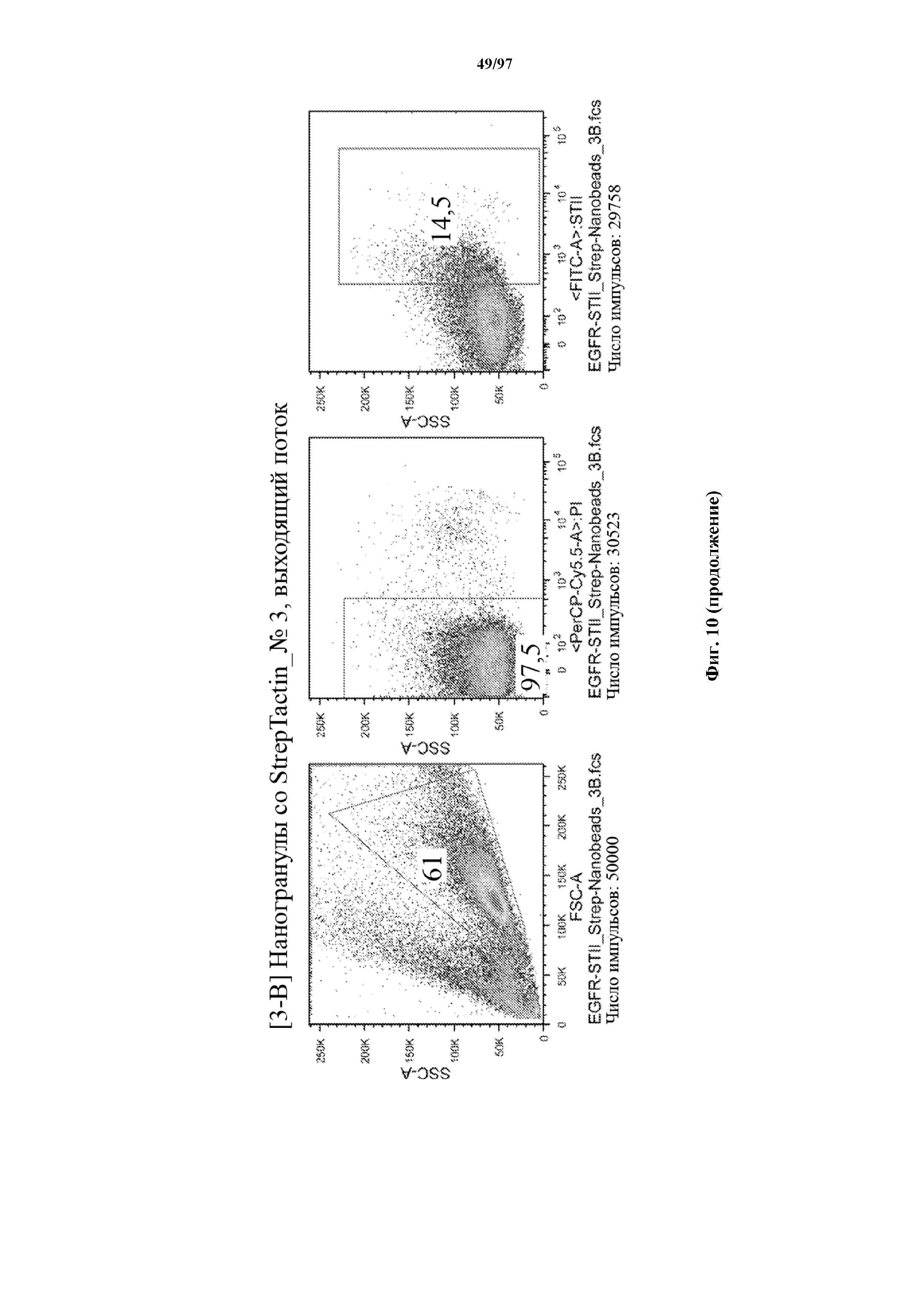
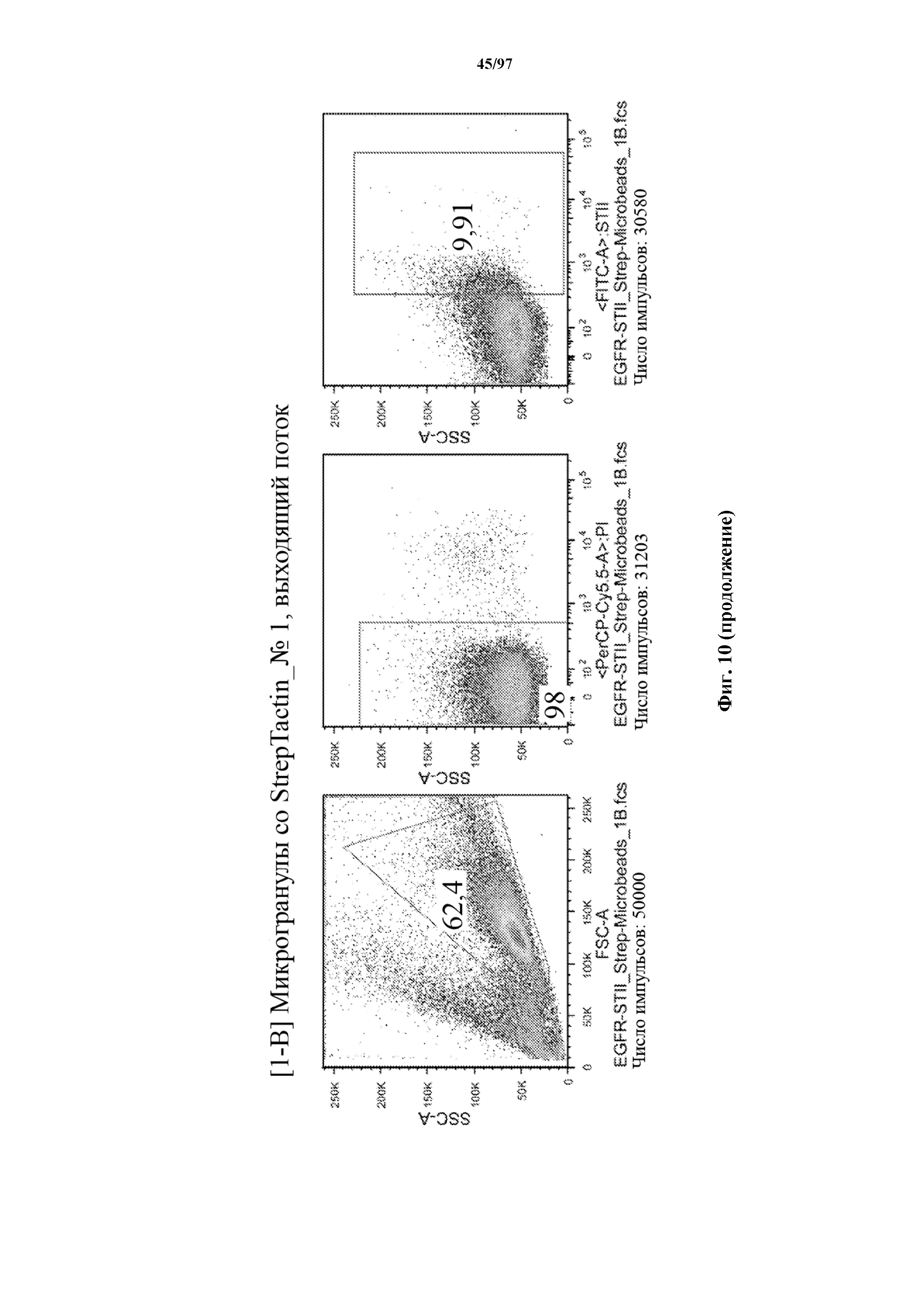
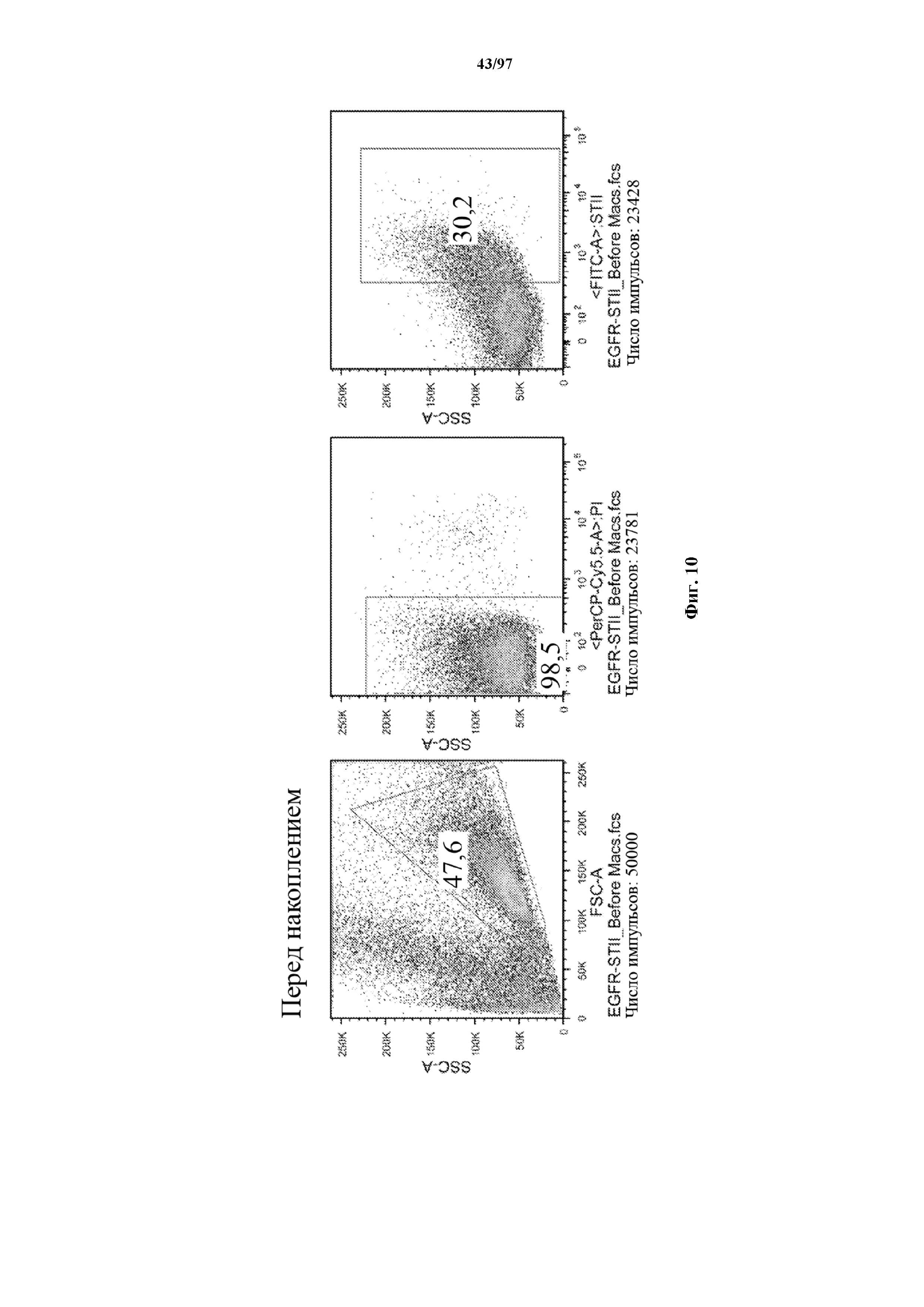
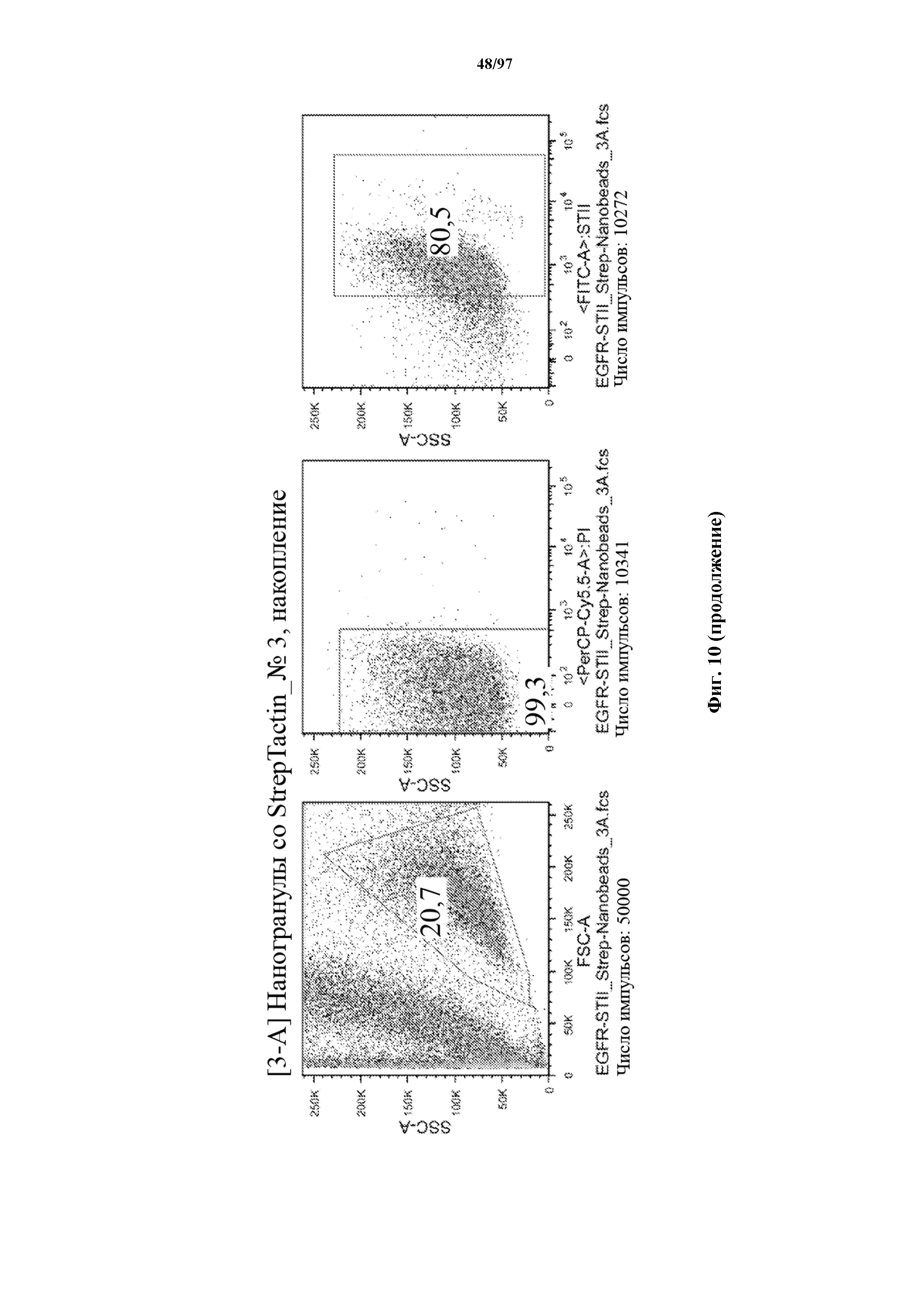
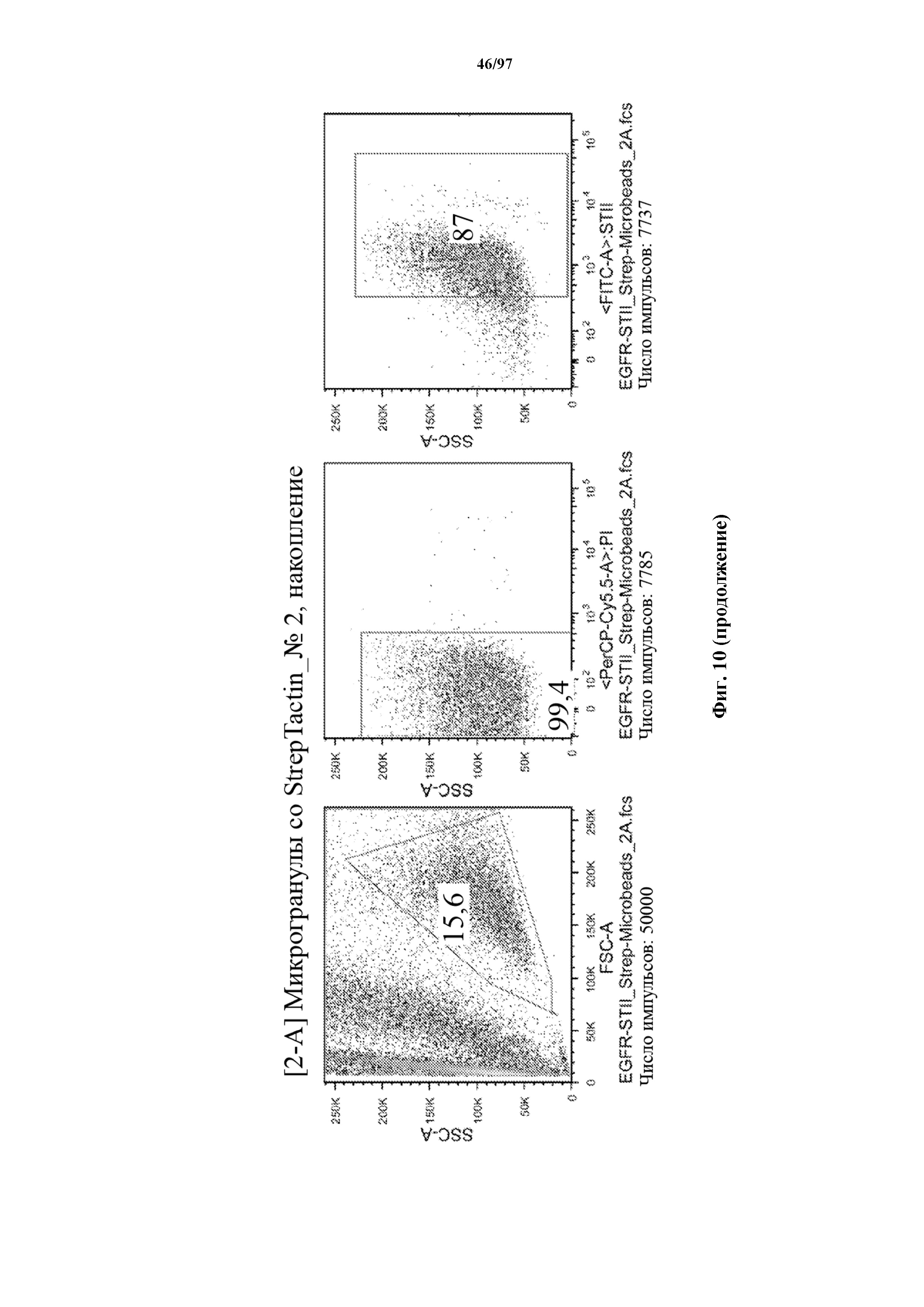
На фигуре 10 показано прямое накопление Т-клеток, экспрессирующих T-ChARM (содержащего три кассеты с метками Strep-tag), с использованием гранул Strep-Tactin® различного размера. На секциях слева показано окрашивание фракции с накопленными клетками, а на секциях справа показан выходящий поток (фракция без накопленных клеток).
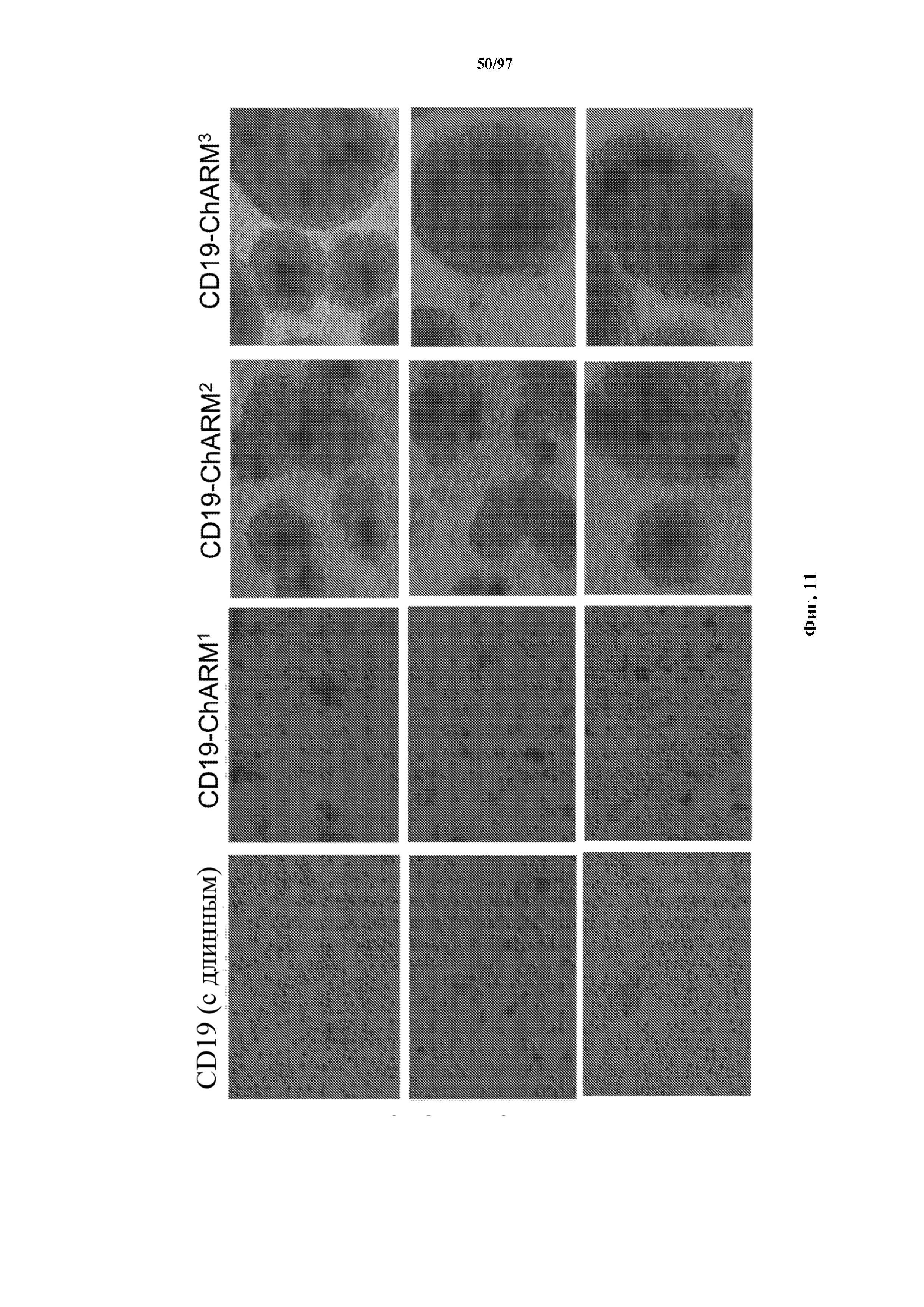
На фигуре 11 показаны световые микрофотографии Т-клеток, экспрессирующих T-ChARM (содержащий одну, две или три кассеты с метками) или обычный CAR к CD19 (CD19 с длинным), которые совместно культивировали с гранулами, соединенными со связывающим лигандом (Strep-Tactin®), специфичным в отношении последовательности метки. На микрофотографиях показана селективная кластеризация и пролиферация Т-клеток с T-ChARM.
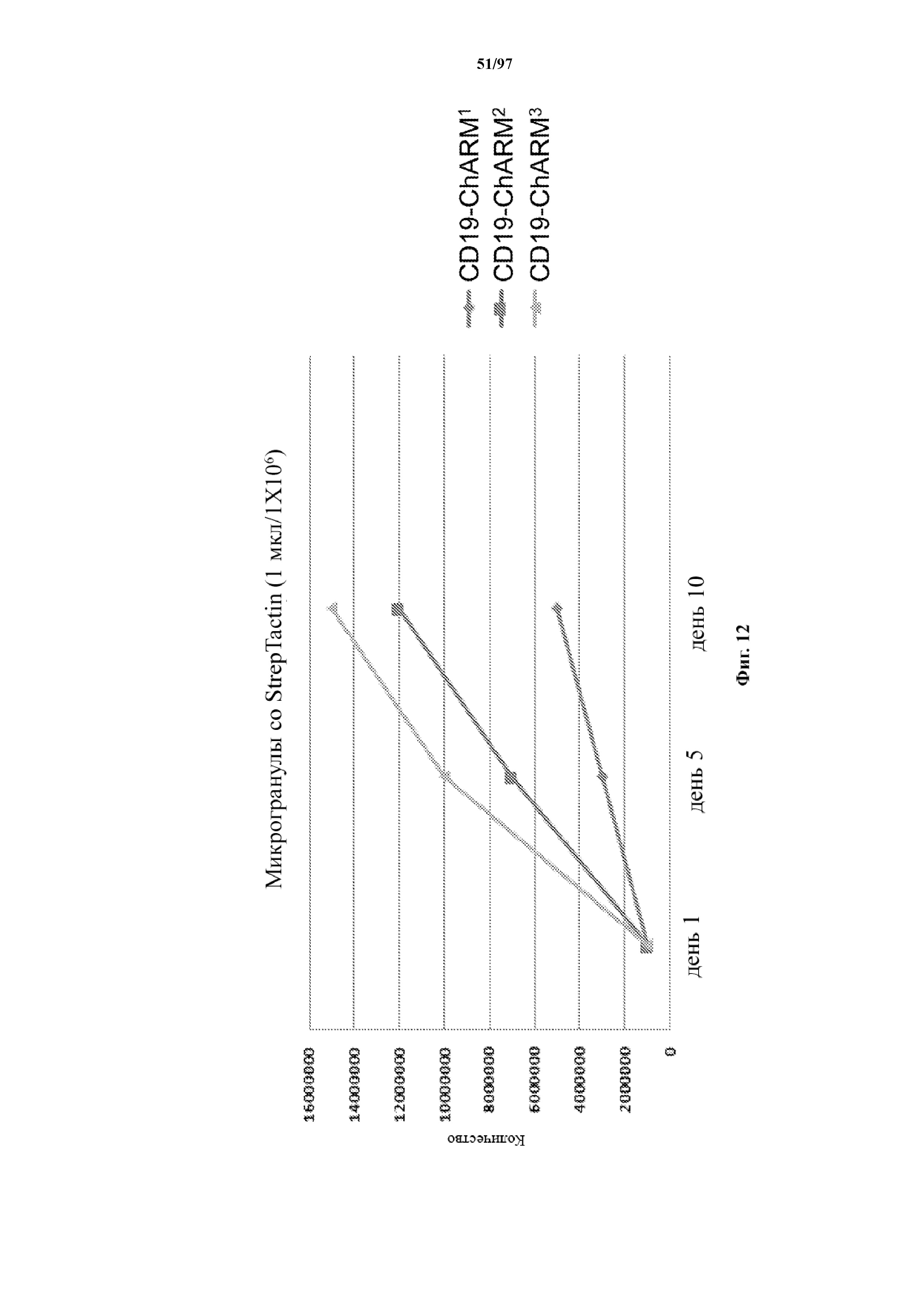
На фигуре 12 показана кривая роста Т-клеток, экспрессирующих T-ChARM (содержащих одну, две или три кассеты с метками), на протяжении 10 дней культивирования с микрогранулами со Strep-Tactin®.
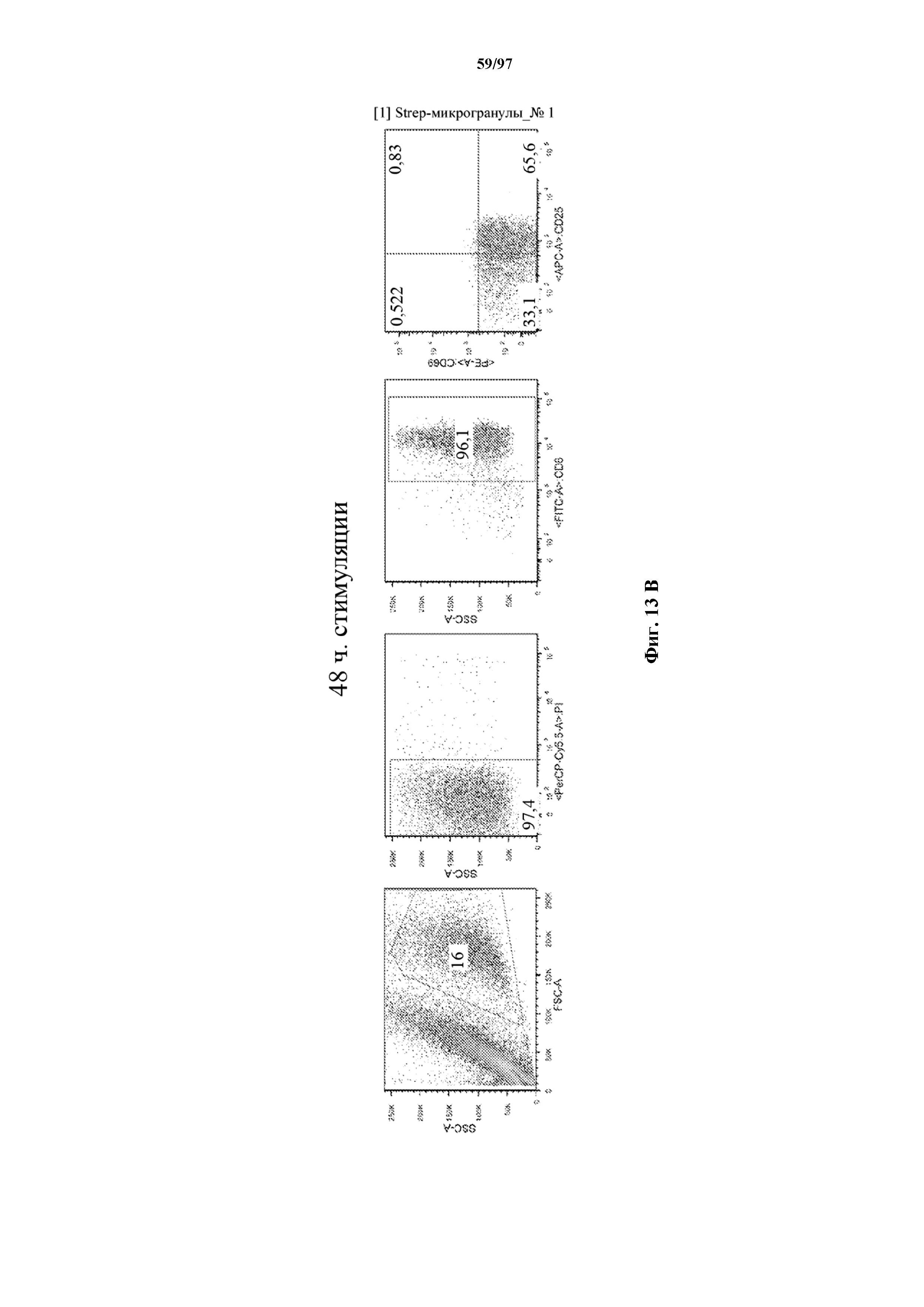
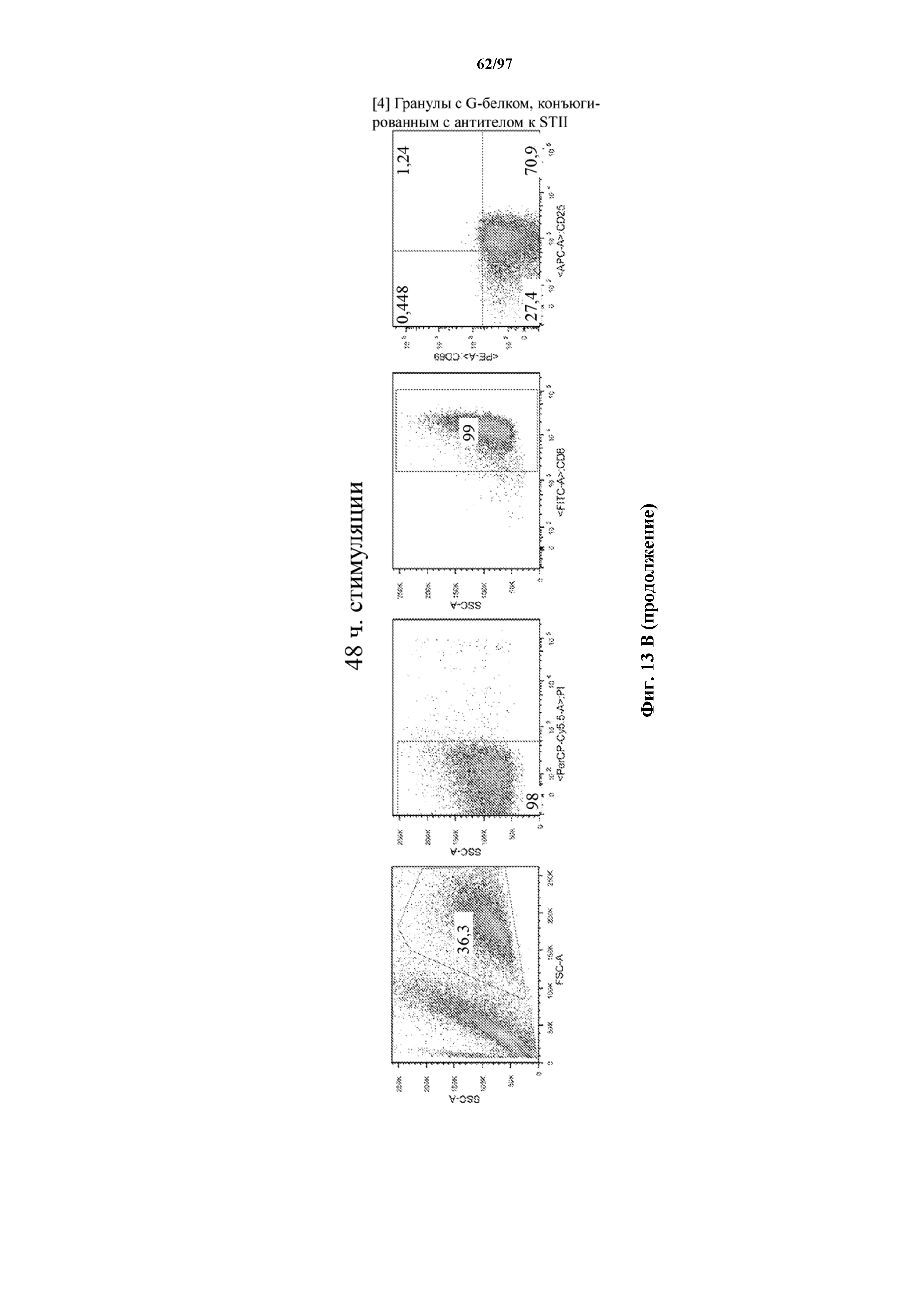
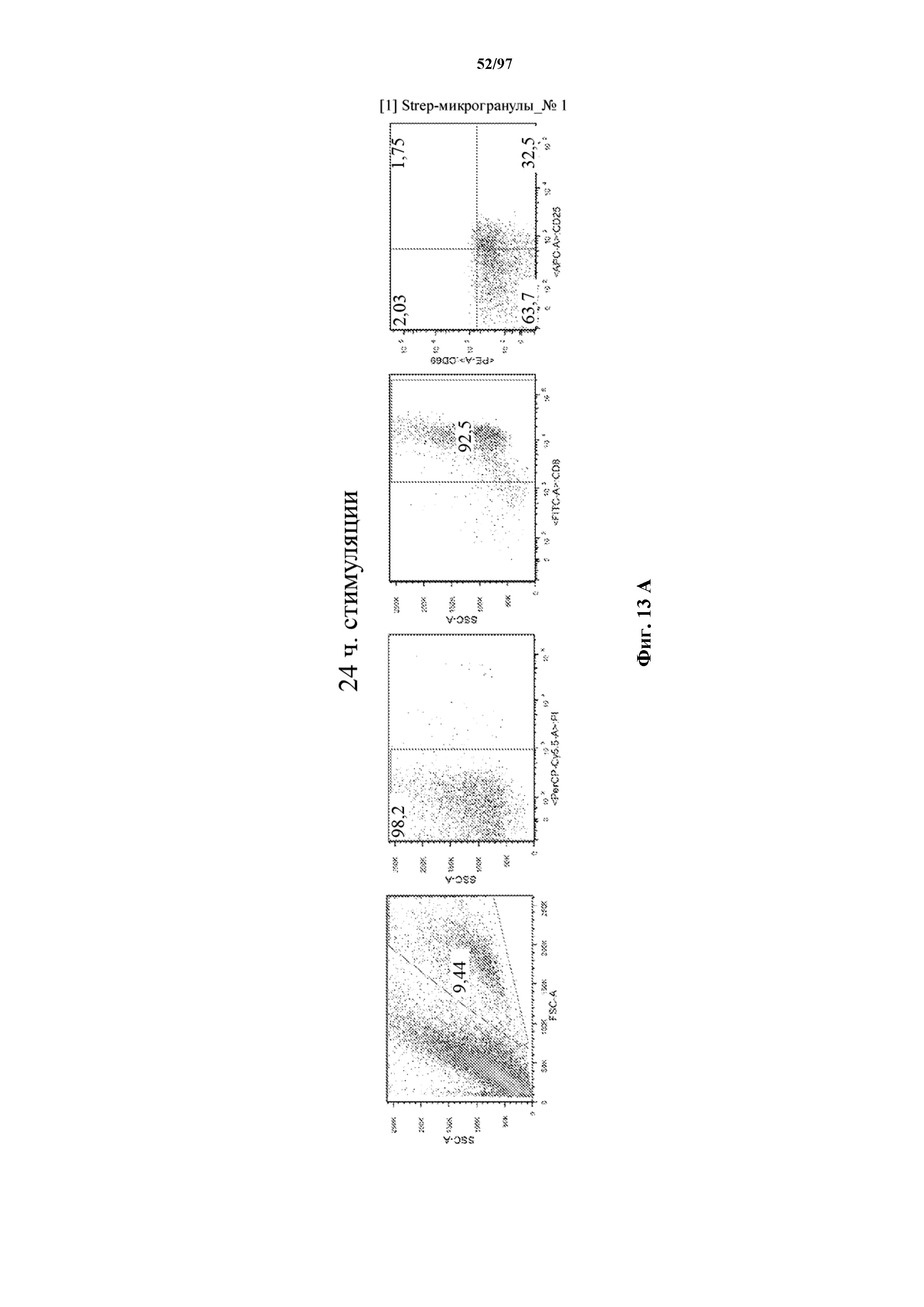
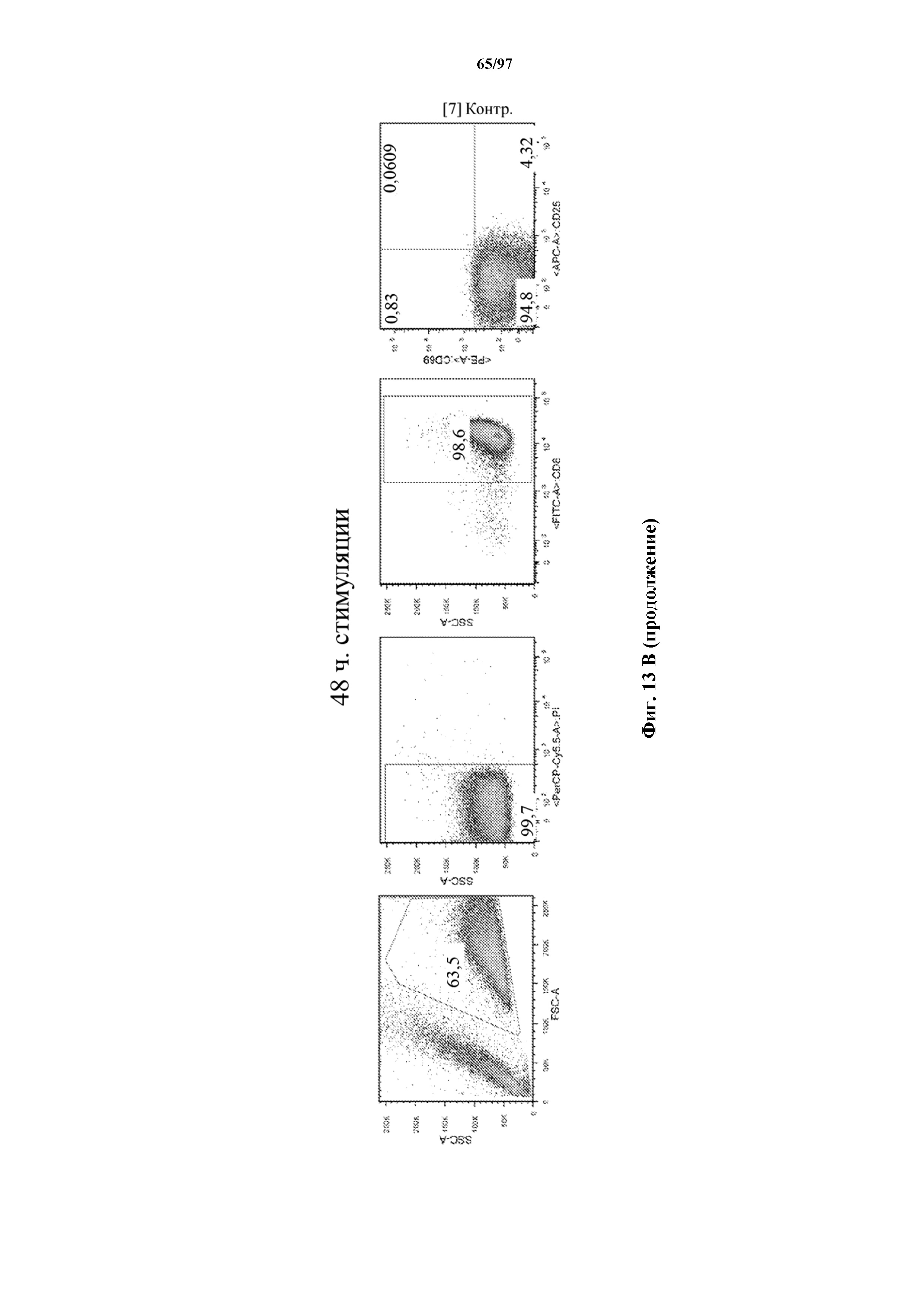
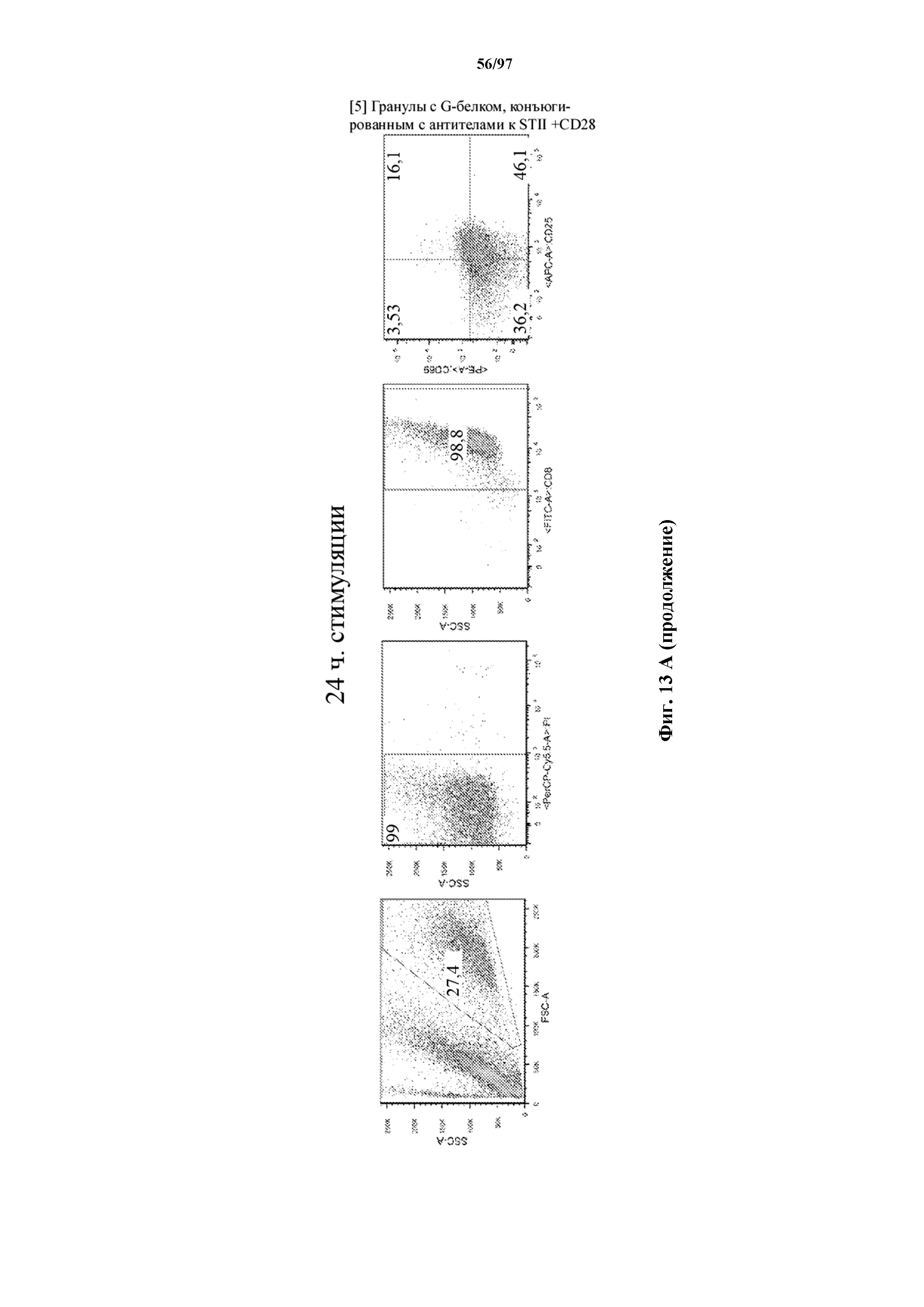
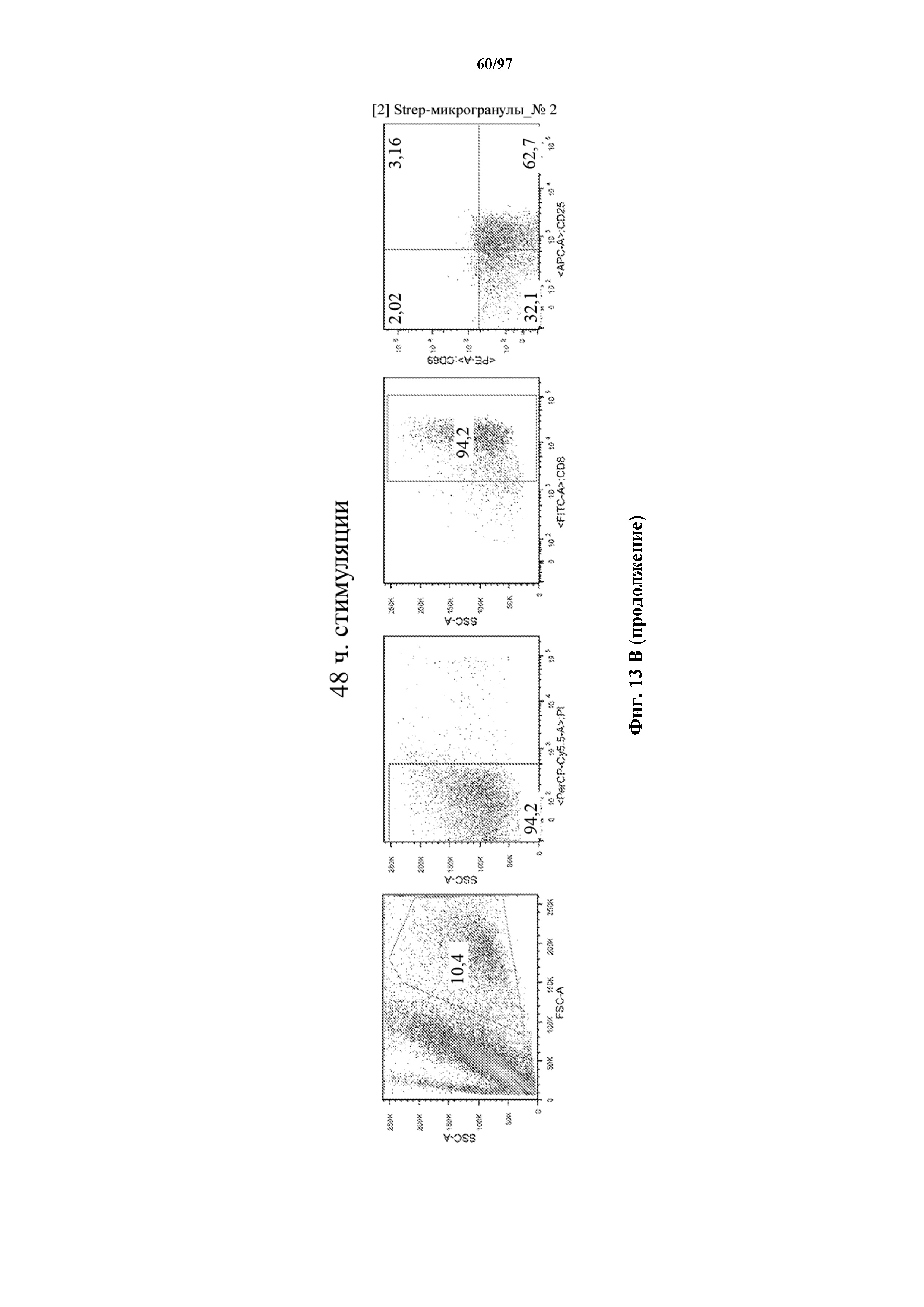
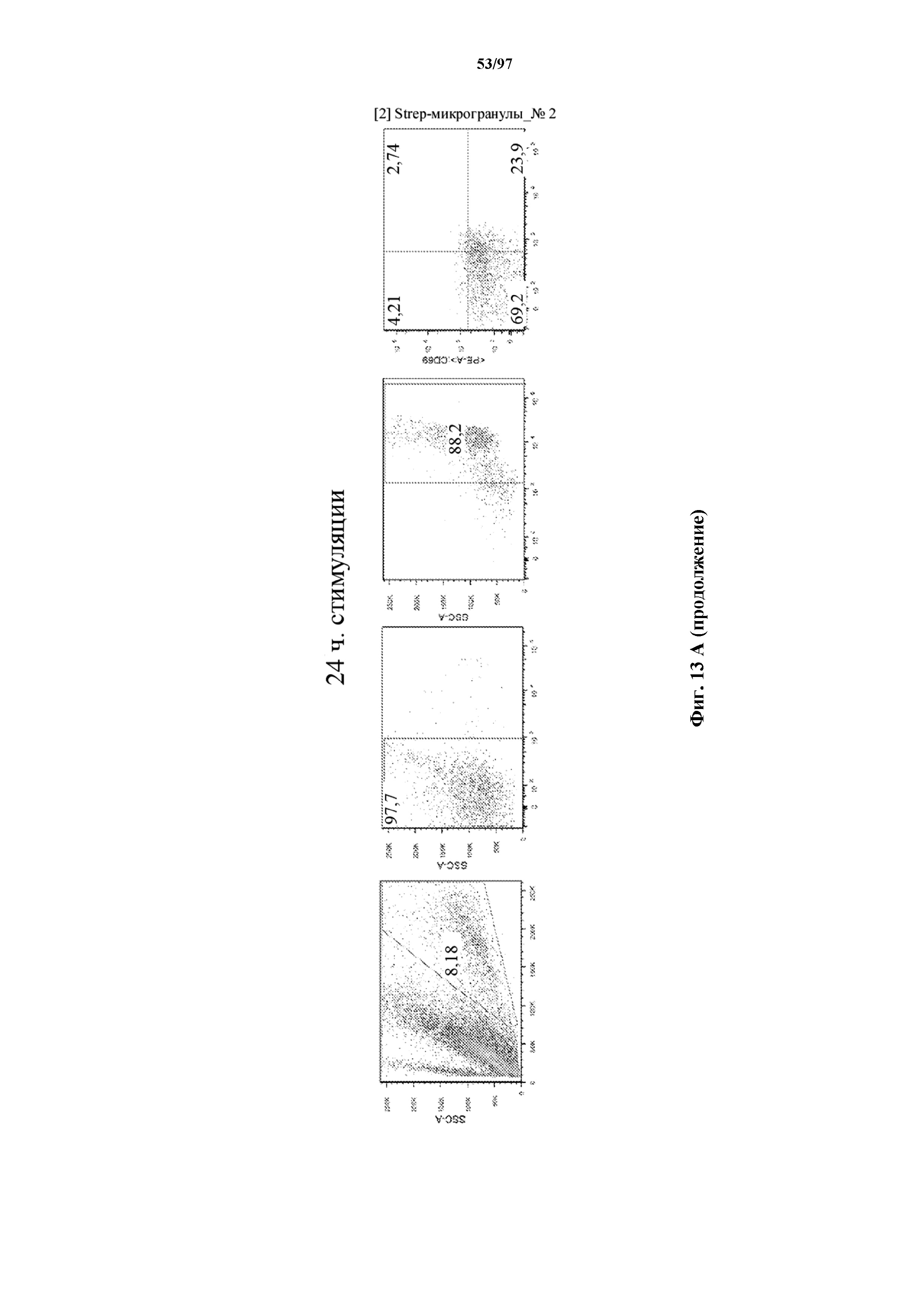
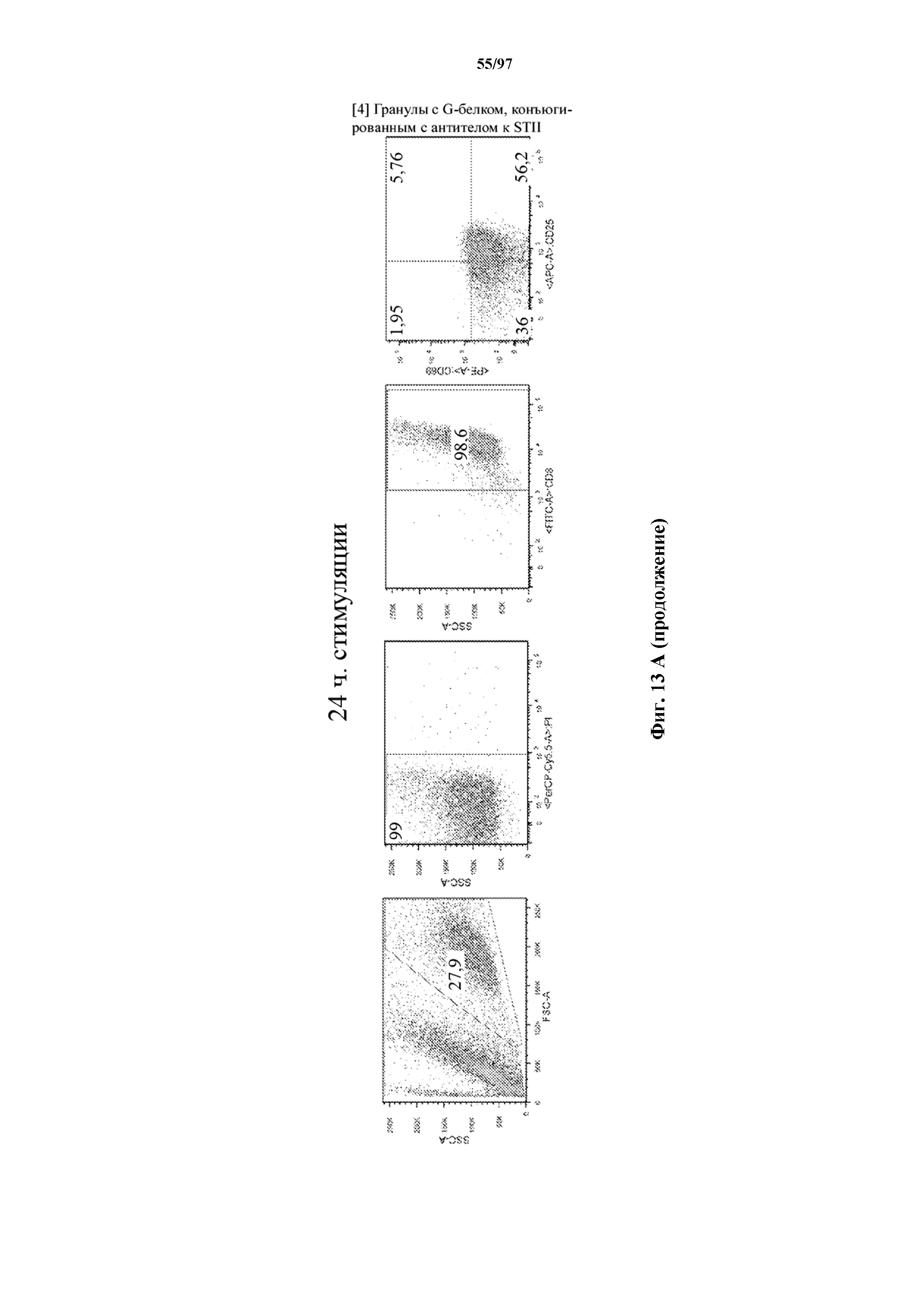
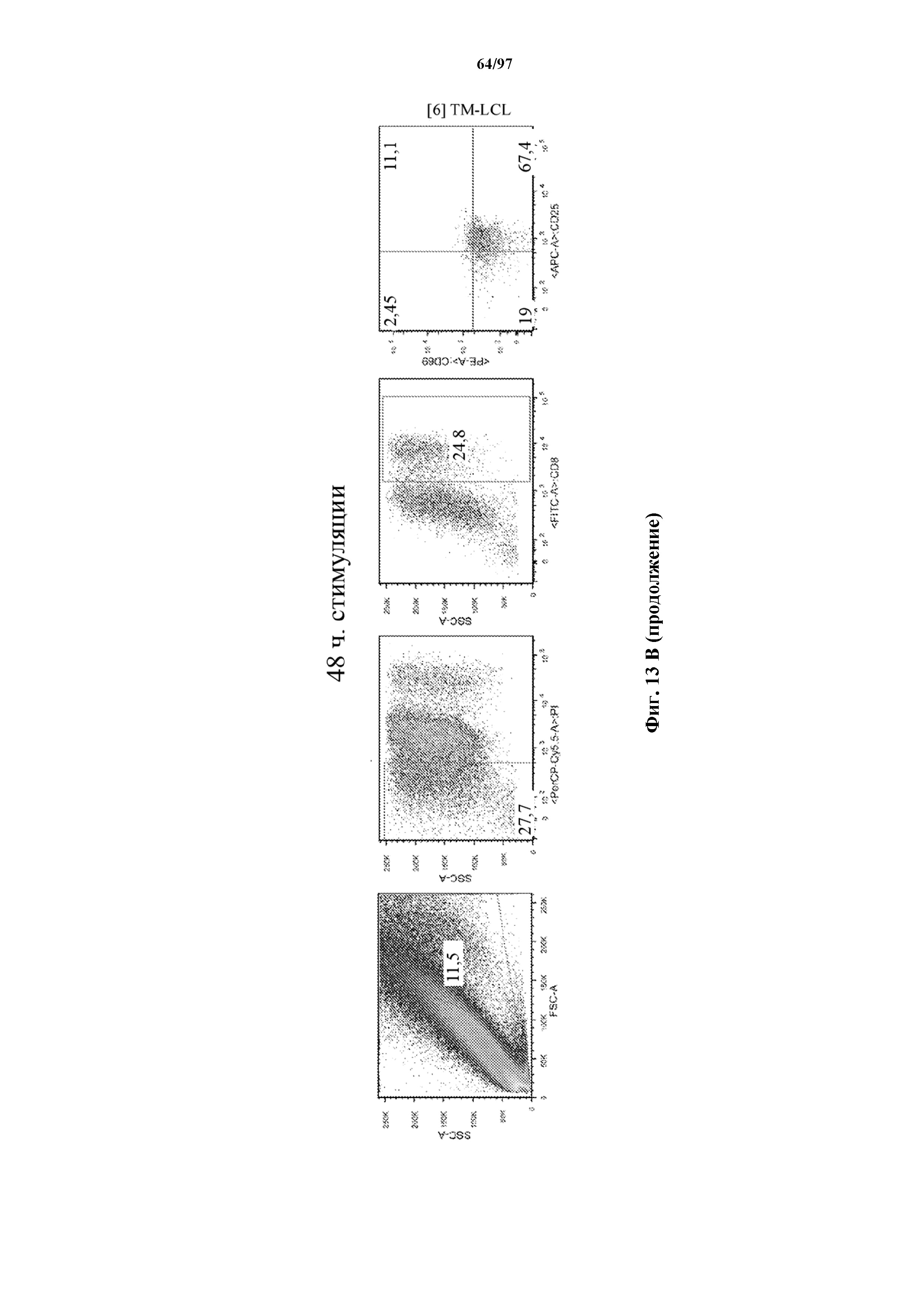
На фигурах 13A и 13B показана активация Т-клеток, экспрессирующих T-ChARM, определенная по повышенной регуляции CD25 и CD69 после связывания кассеты с меткой либо микрогранулами Streptactin, наногранулами либо моноклональным антителом к StrepTag II по отдельности или в комбинации с моноклональным антителом к CD28. Данные показаны после (A) 24 часов и (B) 48 часов стимуляции.
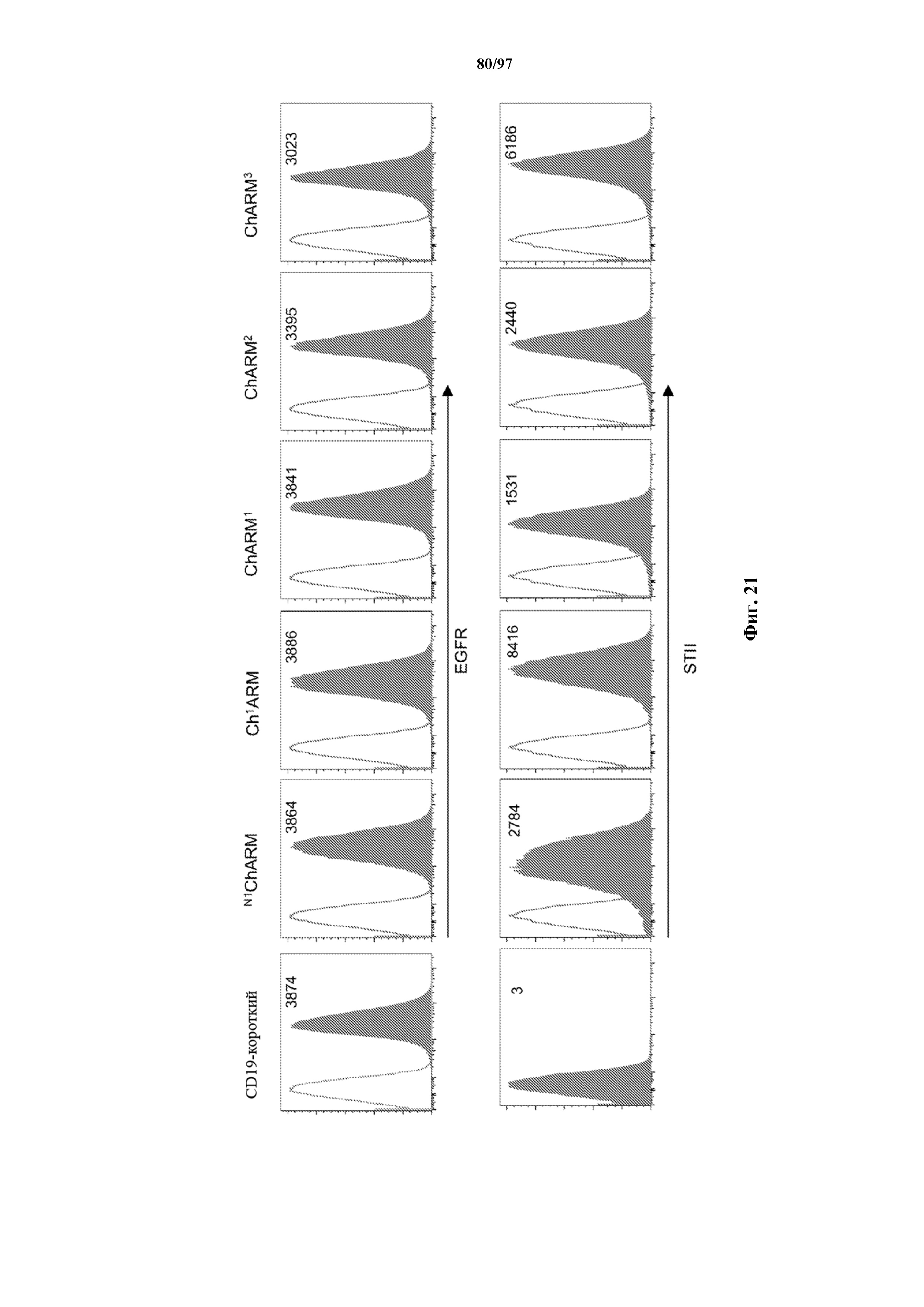
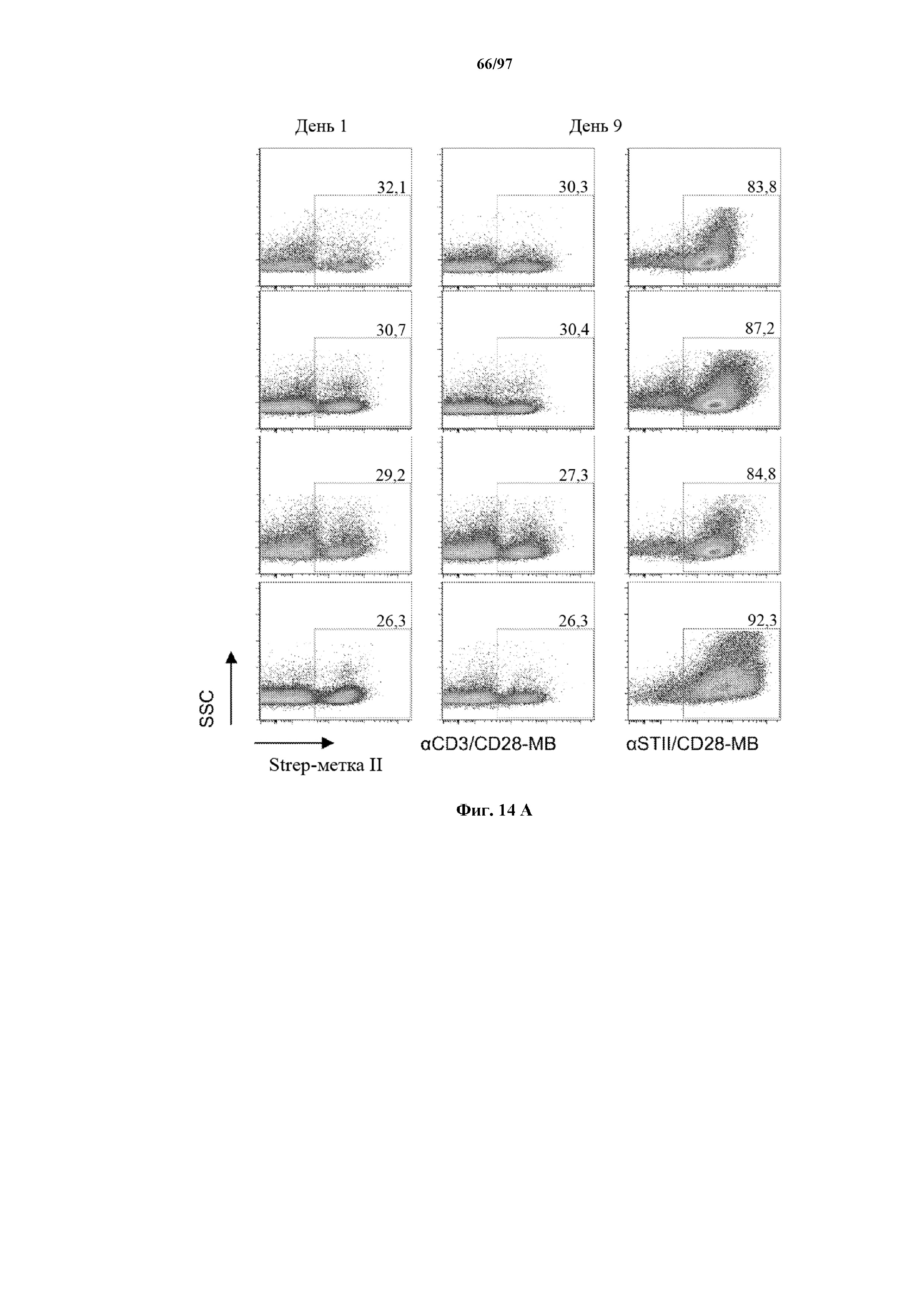
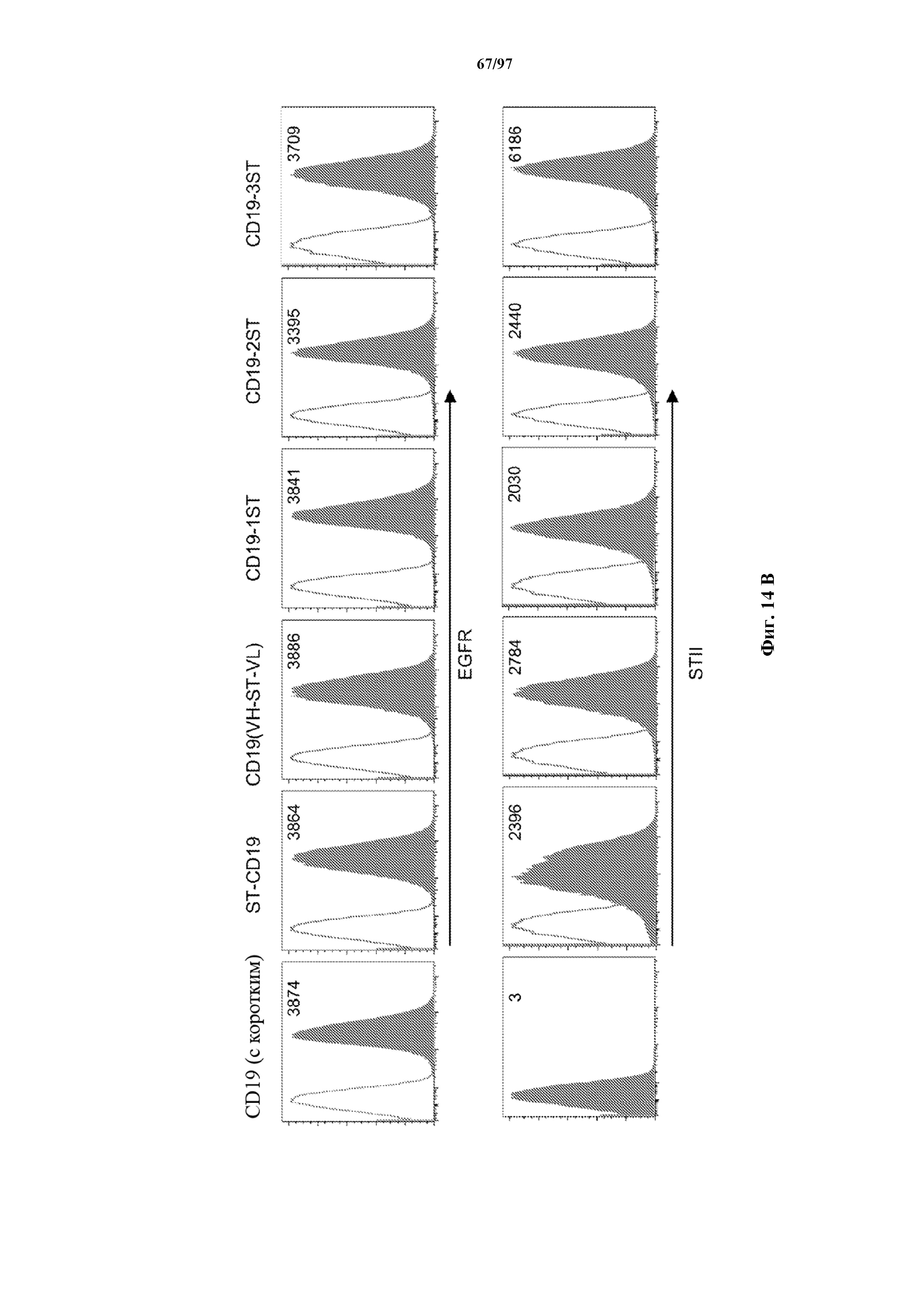
На фигурах 14A и 14B показано селективное размножение Т-клеток, экспрессирующих T-ChARM. Неотсортированные Т-клетки (CD8+ и CD4+), трансдуцированные T-ChARMV1/4-1BB и T-ChARM1/CD28, культивировали с микрогранулами (MB) с антителами к Strep-метке/CD28 в течение 9 дней. Процентное содержание клеток с T-ChARM оценивали с помощью (A) проточной детекции экспрессии Strep-метки на Т-клетках до и после культивирования. Культивированные клетки, обработанные только MB с антителом к CD3/CD28, использовали в качестве контроля. (B) Отсортированные с помощью FACS EGFR+ Т-клетки с ChARM к CD19 после размножения иммортализованной линии CD19+ B-клеток (TM-LCL). Окрашено с помощью антител к EGFR (верхний ряд) и к Streptag II (нижний ряд) соответственно.
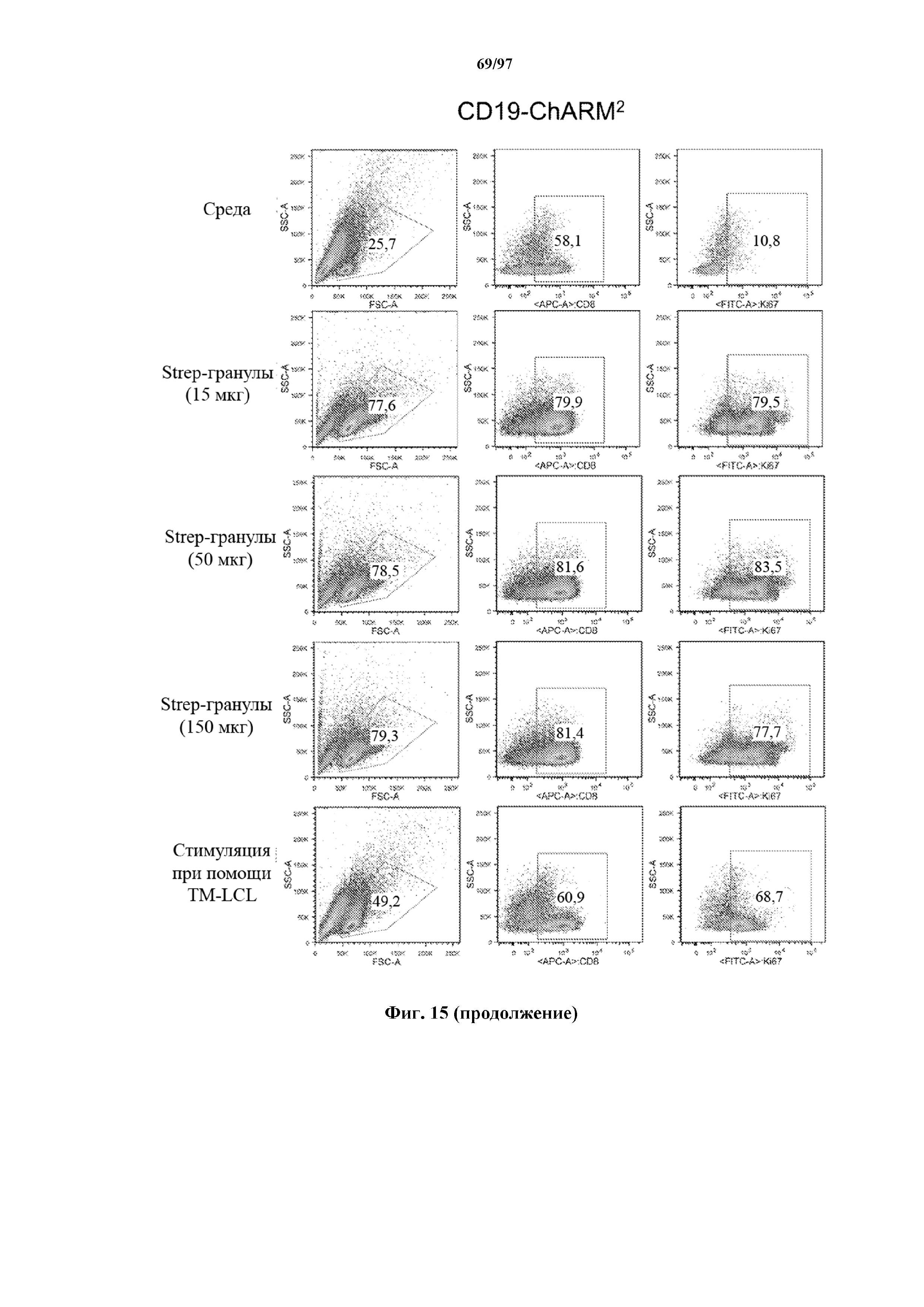
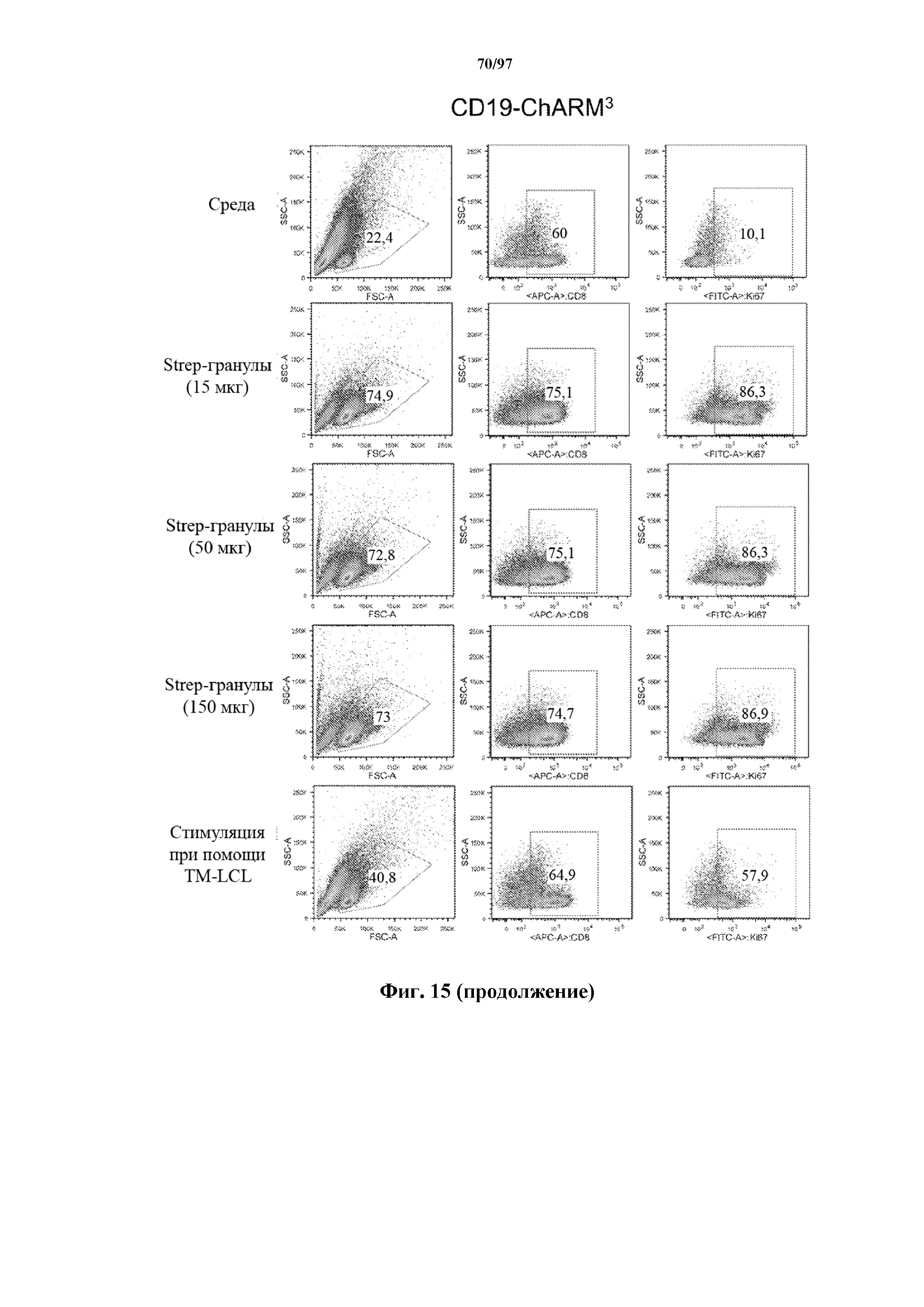
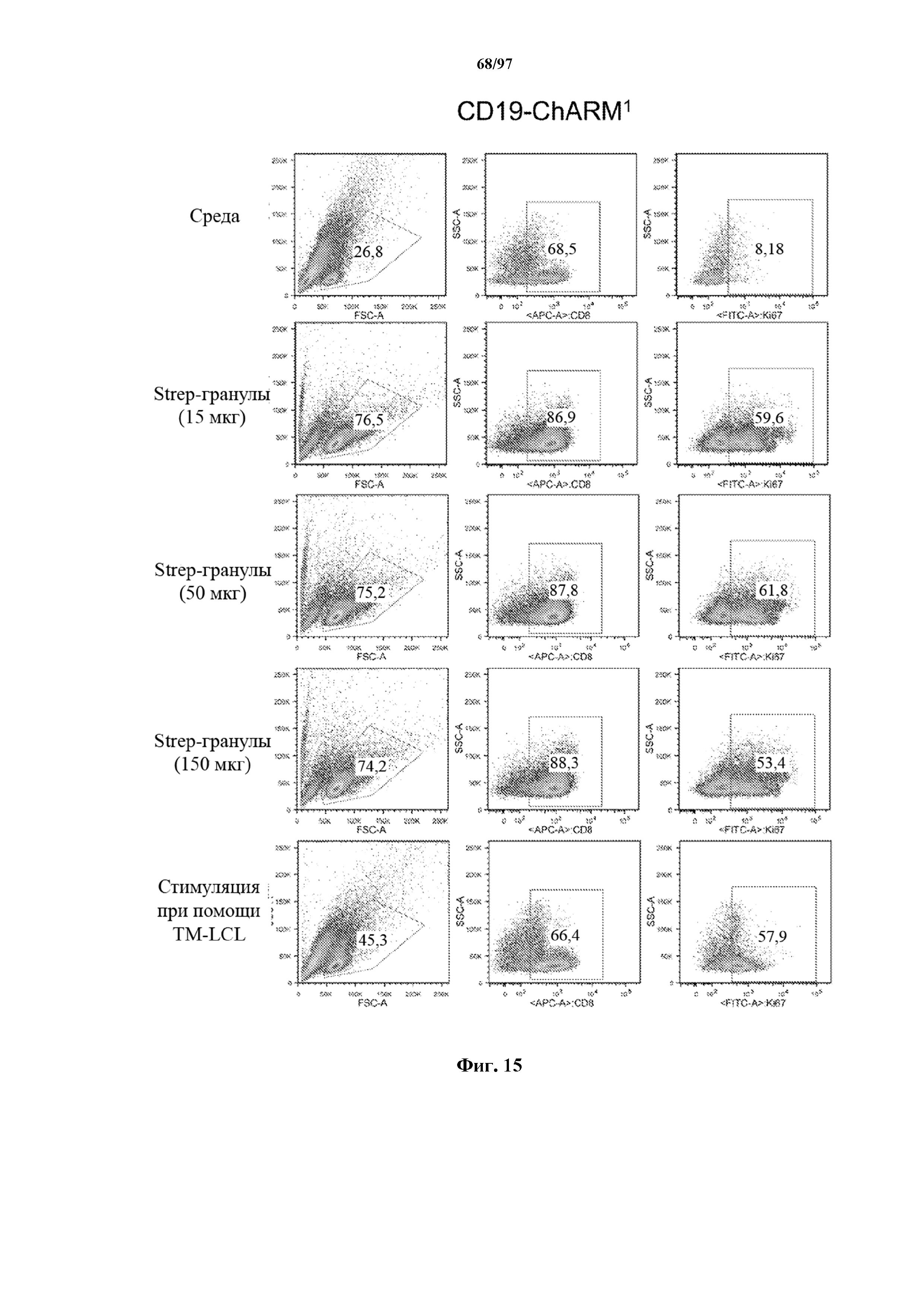
На фигуре 15 показана пролиферация Т-клеток, экспрессирующих T-ChARM к CD19 (содержащих одну, две или три кассеты с метками), измеренная по уровню белка Ki-67 через 7 дней после стимуляции различным количеством гранул Strep-Tactin®. На нижней секции показана экспрессия Ki-67 в Т-клетках, экспрессирующих T-ChARM, после стимуляции через компонент T-ChARM, связывающий антитело к CD19, с помощью CD19+ EBV-LCL (TM-LCL).
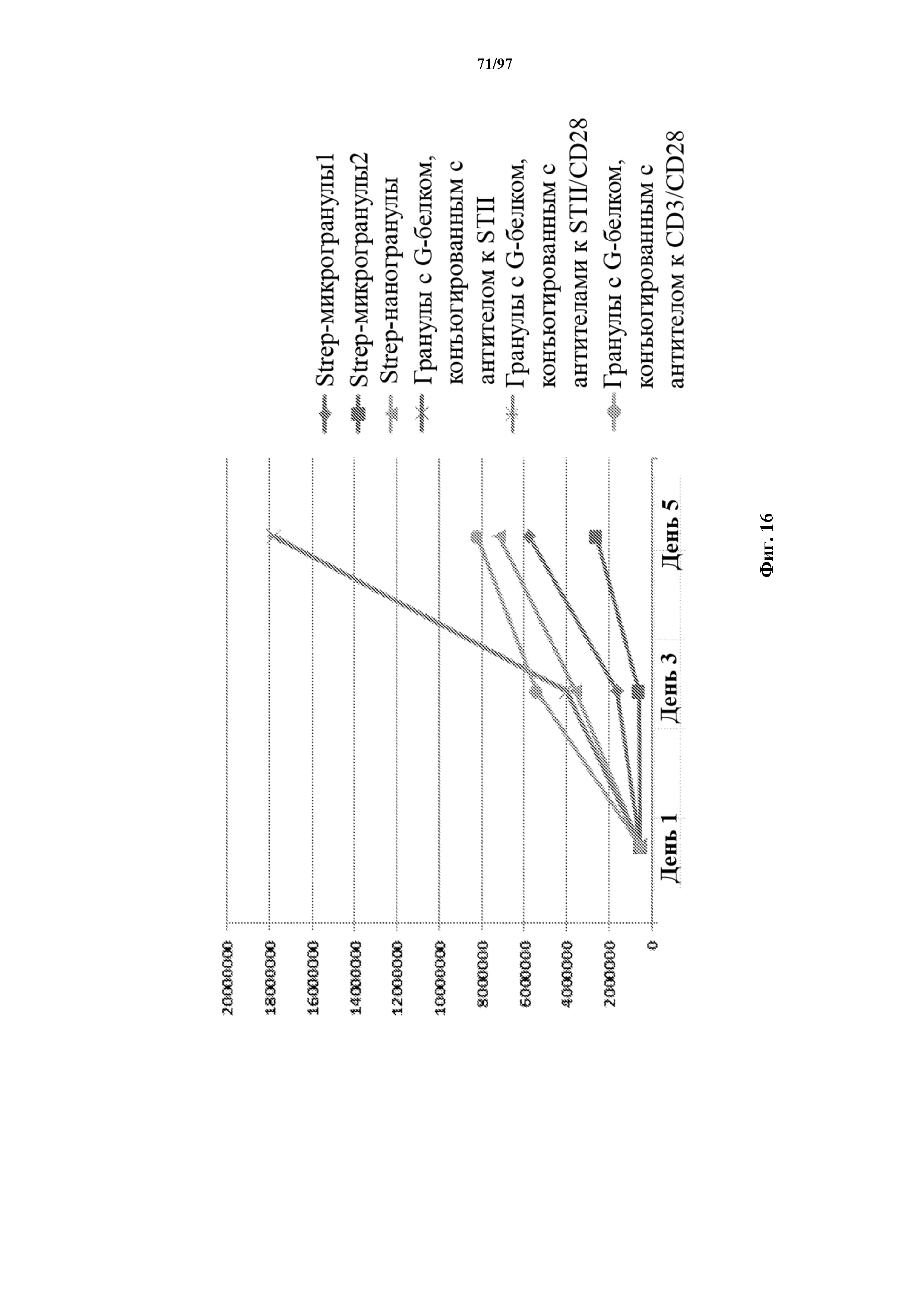
На фигуре 16 показана кривая роста Т-клеток, экспрессирующих T-ChARM, культивированных на различного вида гранулах, конъюгированных со Streptactin, антителом к Streptag II или антителом к CD3/CD28.
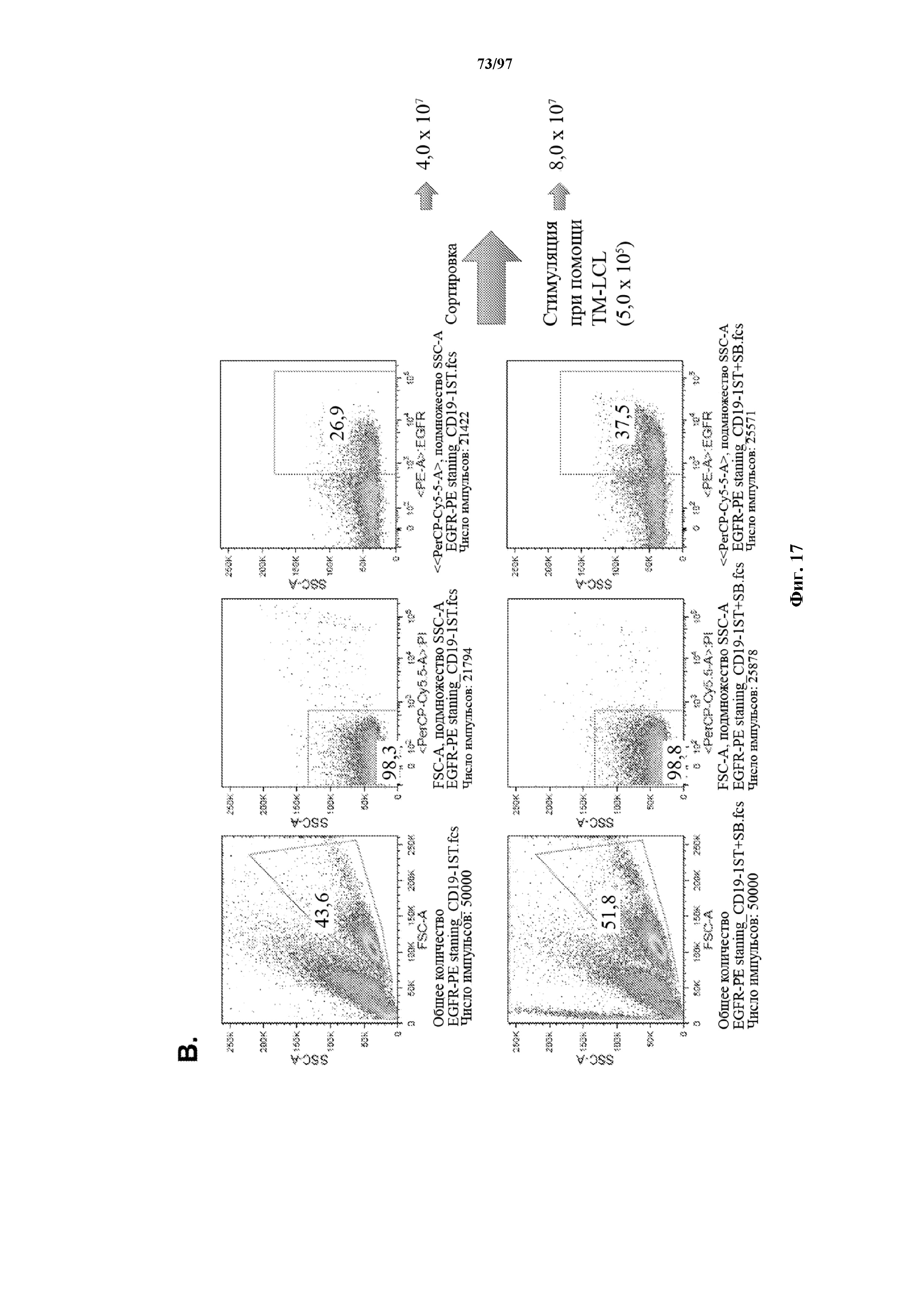
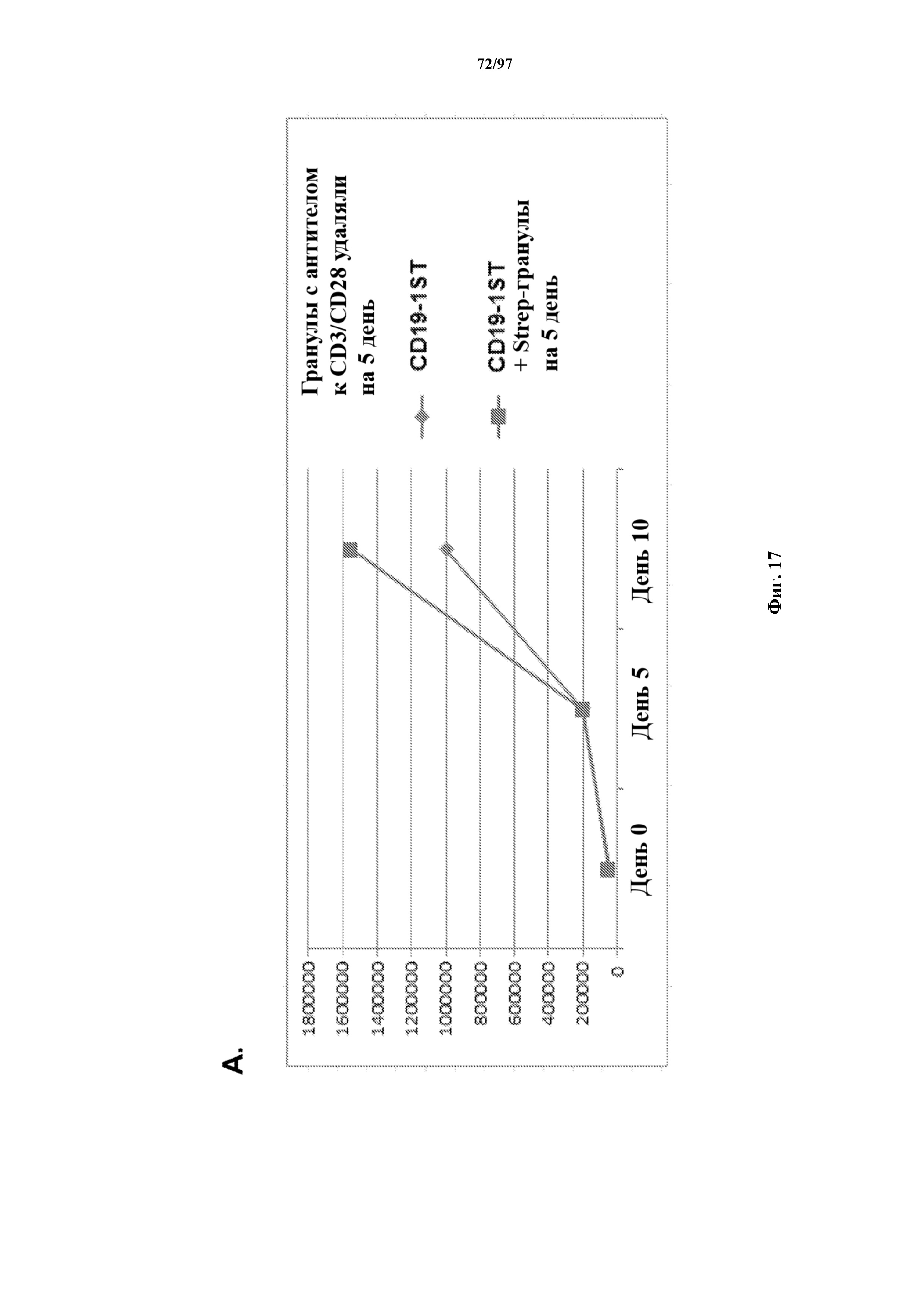
На фигурах 17A и 17B показано селективное размножение Т-клеток, экспрессирующих T-ChARM к CD19, на гранулах Strep-Tactin (A). Т-клетки, экспрессирующие T-ChARM к CD19, в дальнейшем можно размножать путем стимуляции через химерный рецептор к CD19 с помощью CD19+ LCL (B).
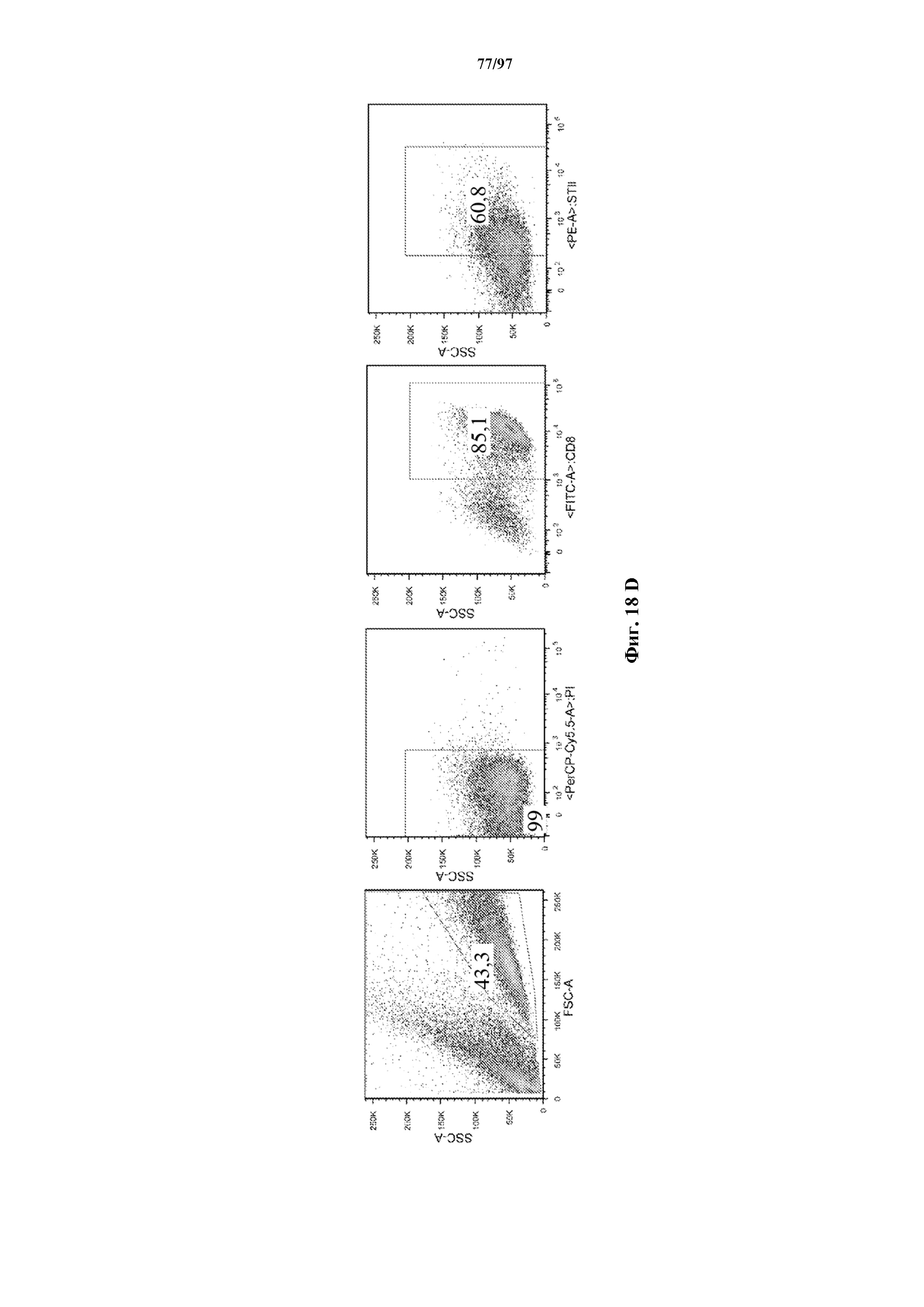
На фигурах 18A-18D показано, что Т-клетки можно трансдуцировать T-ChARM двух типов (эффекторный домен 4-1BB/CD3ζ (A и B) или CD28/CD3ζ (C и D)) после культивирования в присутствии IL-7 и IL-15 без предварительной активации с помощью гранул с антителом к CD3/CD28. Трансдуцированные Т-клетки, экспрессирующие T-ChARM, можно подвергать селективному размножению и накапливать их путем добавления в культуру гранул с антителом к Strep-метке II (B и D) (даже в отсутствии стимуляции гранулами с антителом к CD3/CD28), но они не размножаются, если гранулы с антителом к Strep-метке II не добавлены в культуру (A и C).
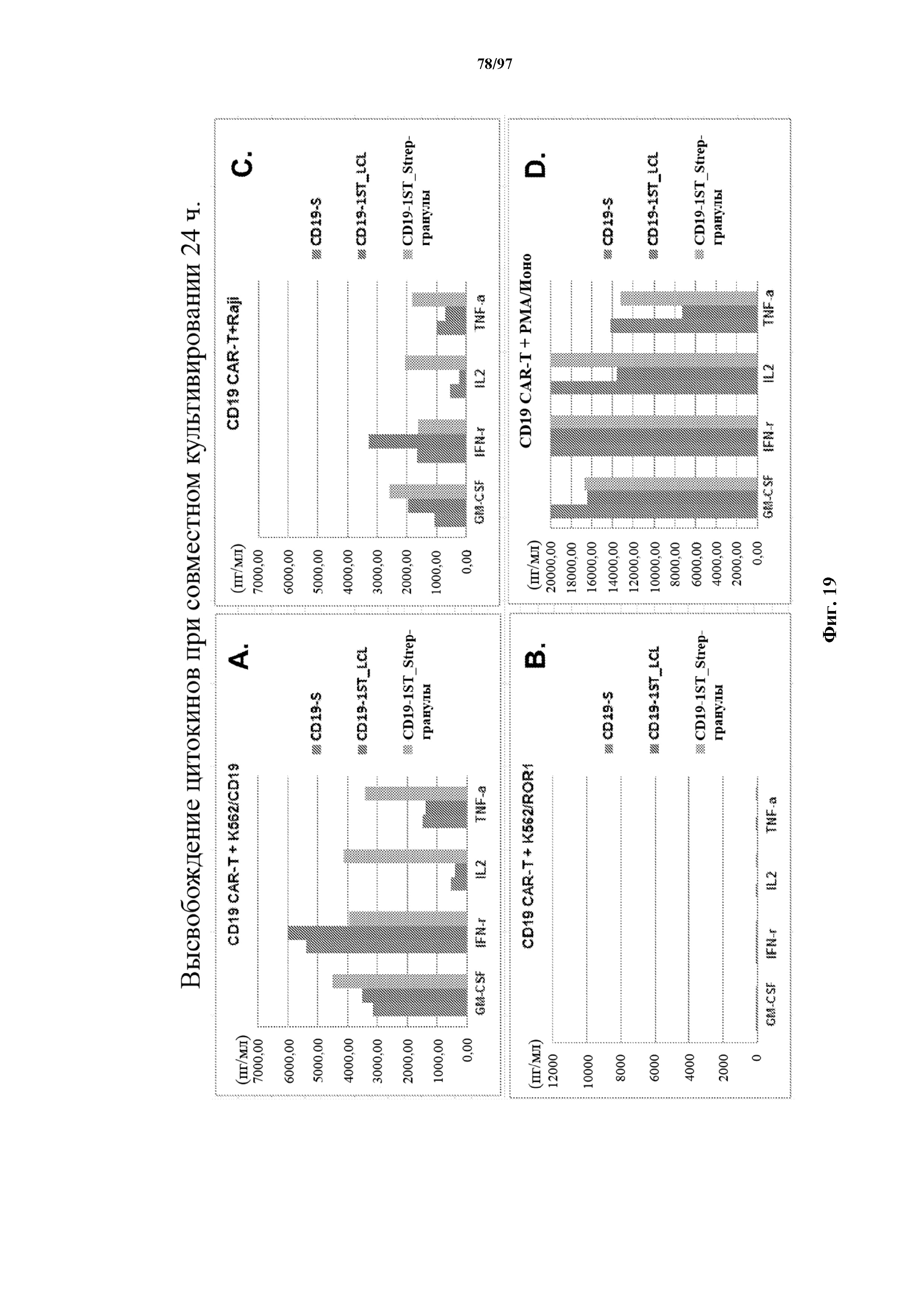
На фигурах 19A-19D показано, что Т-клетки с T-ChARM1 к CD19, которые размножали путем стимуляции микрогранулами со Strep-Tactin®, сохраняют сопоставимую или превосходящую способность к продуцированию цитокинов (GM-CSF, интерферон-γ, IL-2 и TNF-α) при повторной стимуляции CD19-положительными опухолевыми клетками (A. K562/CD19; B- Raji) по сравнению с контрольными Т-клетками, которые экспрессируют CAR к CD19 (с коротким) (CD19-S). Клетки K562 (C) и PMA-иономицин (D) служили в качестве отрицательного и положительного контроля соответственно.
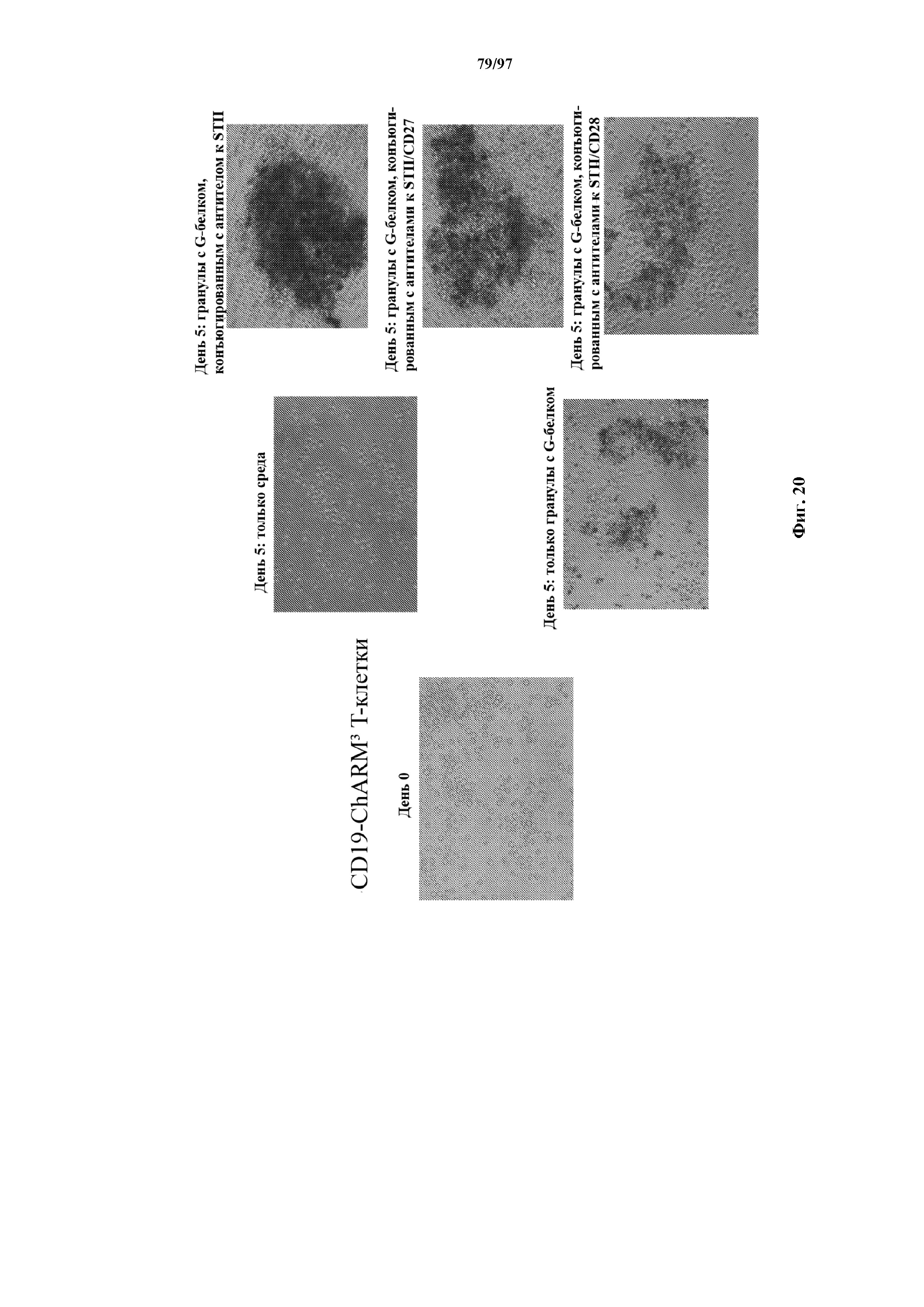
На фигуре 20 показано, что Т-клетки, экспрессирующие T-ChARM, можно индуцировать с образованием кластеров и с пролиферацией только гранулами с антителом к Strep-метке или гранулами, содержащими антитела к Strep-метке и к CD27 или содержащими антитела к Strep-метке и к CD28.
На фигуре 21 показан анализ проточной цитометрии (MFI) отсортированных с помощью FACS EGFR+ Т-клеток с ChARM к CD19 после размножения иммортализованной линии CD19+ B-клеток (TM-LCL). Окрашено с помощью антител к EGFR (верхний ряд) и к Streptag II (нижний ряд) соответственно.
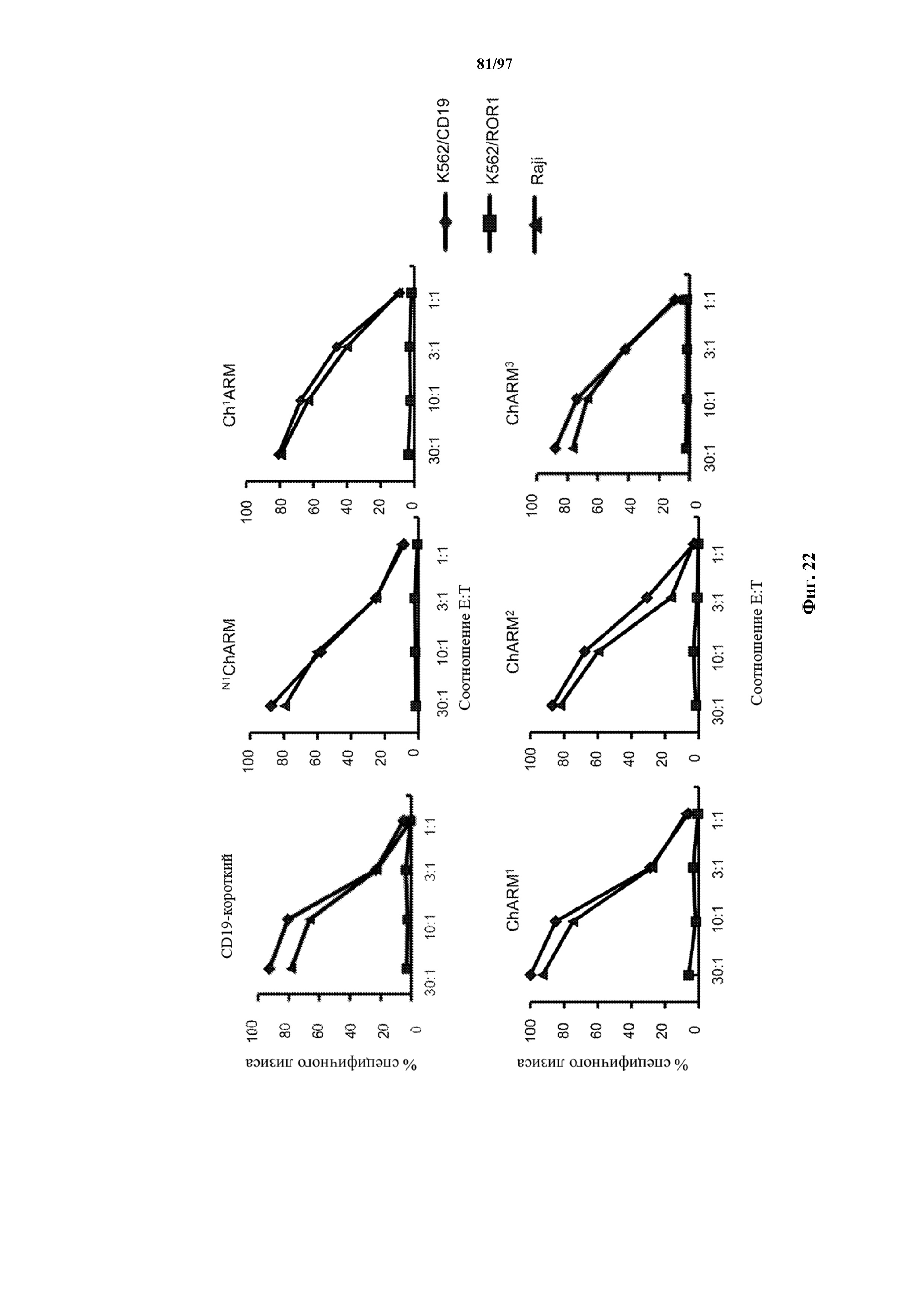
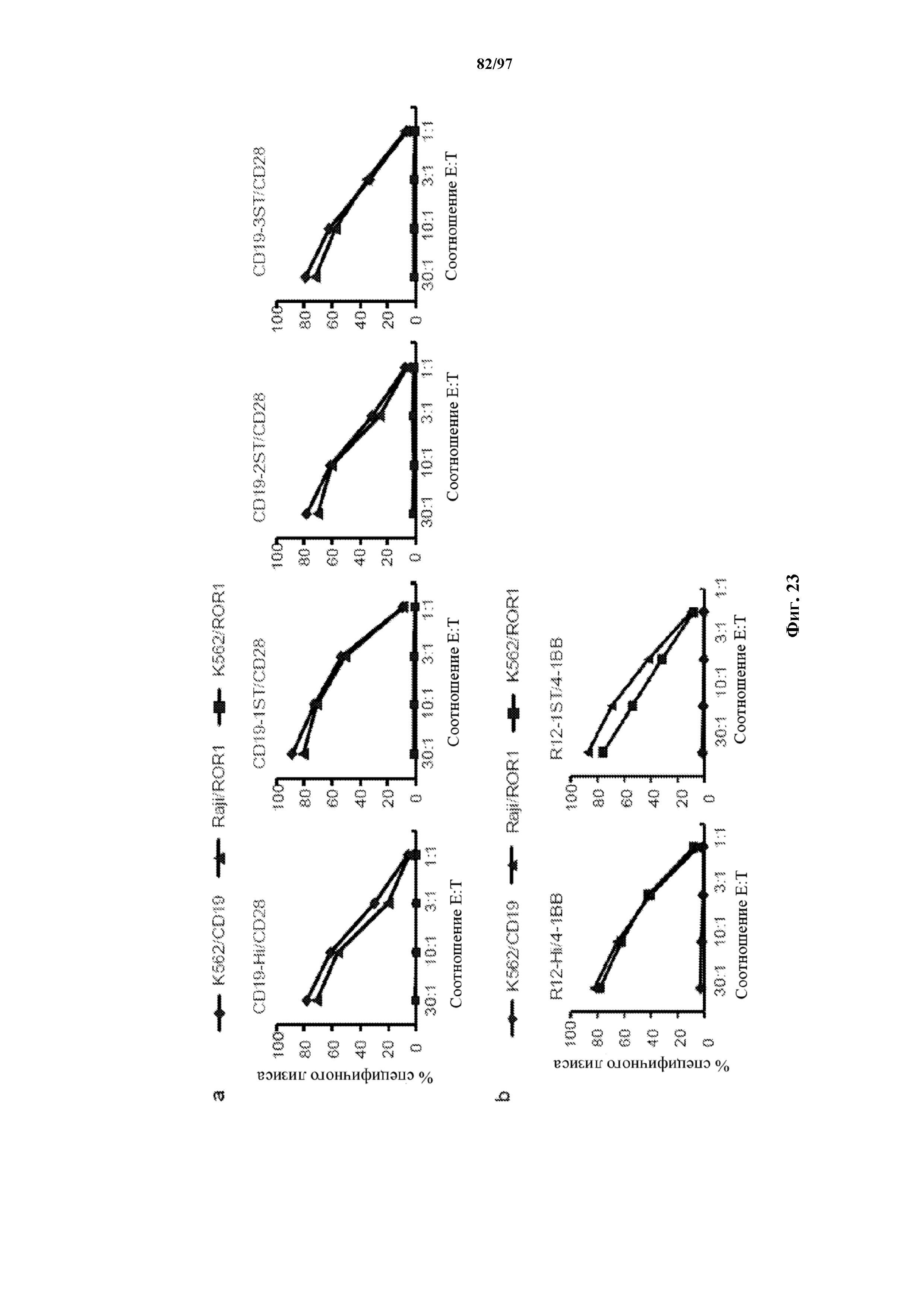
На фигуре 22 показаны результаты анализа с высвобождением хрома для изучения цитотоксического эффекта Т-клеток (эффекторов), трансдуцированных различными ChARM к CD19, относительно клеток K562, трансдуцированных CD19 (K562/CD19) или ROR1 (K562/ROR1), или CD19+ опухолевых клеток Raji (мишени). E/T = соотношение эффектор/мишень.
На фигурах 23A и 23B показана цитотоксическая активность T-клеток, экспрессирующих (A) рецептор к CD19 с коротким, T-ChARM1, T-ChARM2, T-ChARM3 с эффекторным доменом CD28/CD3ζ, и (B) имеющих R12 к ROR1 с коротким и T-ChARM1 с эффекторным доменом 41BB/CD3ζ. Клетки исследовали на цитолитическую активность по отношению к клеткам K562, трансдуцированным CD19 (K562/CD19) или ROR1 (K562/ROR1), или CD19+ опухолевым клеткам Raji (мишени). E/T = соотношение эффектор/мишень.
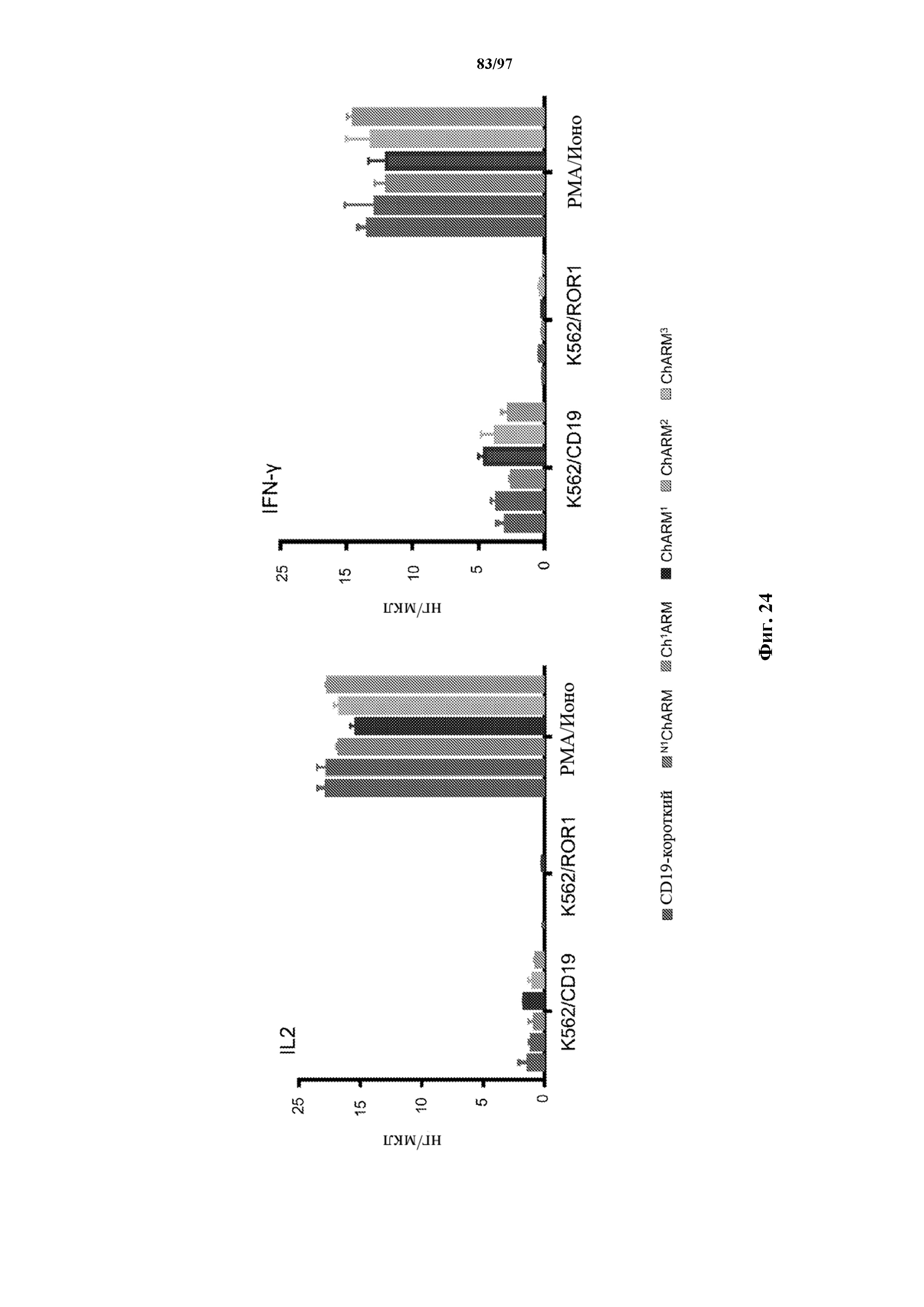
На фигуре 24 показана продукция IL2/IFN-γ Т-клетками (эффекторами), трансдуцированными различными T-ChARM к CD19, относительно клеток K562, трансдуцированных CD19 (K562/CD19) или ROR1 (K562/ROR1), или CD19+ опухолевых клеток Raji (мишень).
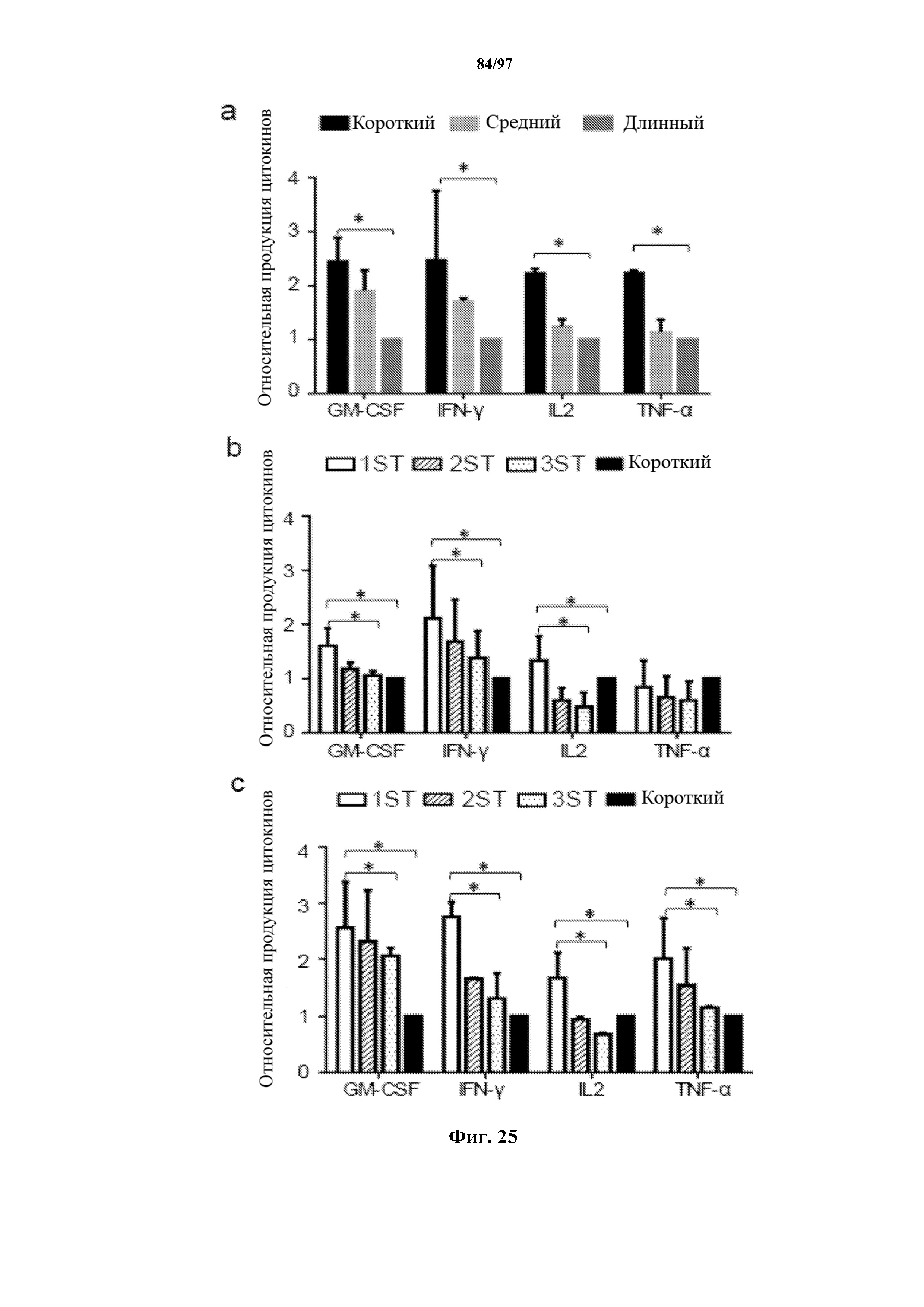
На фигурах 25A-25C показан мультиплексный анализ цитокинов, Luminex, в трех повторах супернатантов совместной культуры Т-клеток, трансдуцированных ChARM, с CD19+ клетками Raji (в соотношении 1:4) через 24 ч. Данные получены из трех независимых экспериментов с использованием Т-клеток от разных доноров, и все данные выражены как средние значения ± SD. Выполнили тест с использованием t-критерия Стьюдента. * P<0,01. (A) Сравнение продукции цитокинов CD8+ T-клетками, экспрессирующими CAR к CD19 с длинным (CH3-CH2-шарнир), средним (CH3-шарнир) и коротким (только шарнир) спейсерами. Данные мультиплексного анализа цитокинов 3 независимых экспериментов нормализовали (высвобождение цитокинов с помощью CD19-CAR ’длинный/41BB’ =1); (B) сравнение продукции цитокинов CD8+ T-клетками, экспрессирующими T-ChARM1 (1ST), T-ChARM2 (2ST), T-ChARM3 (3ST) к CD19 с эффекторным доменом 4-1BB/CD3ζ по сравнению с CAR-короткий к CD19 с эффекторным доменом 4-1BB/CD3ζ; данные мультиплексного анализа цитокинов 3 независимых экспериментов нормализовали (высвобождение цитокинов с помощью CD19-CAR-короткий: Hi/4-1BB = 1); и (C) сравнение продукции цитокинов CD8+ T-клетками, экспрессирующими T-ChARM1 (1ST), T-ChARM2 (2ST), T-ChARM3 (3ST) к CD19 с эффекторным доменом CD28/CD3ζ по сравнению с CAR-короткий к CD19 с эффекторным доменом CD28/CD3ζ; данные мультиплексного анализа цитокинов 3 независимых экспериментов нормализовали (высвобождение цитокинов с помощью CD19-CAR-короткий: Hi/CD28 = 1).
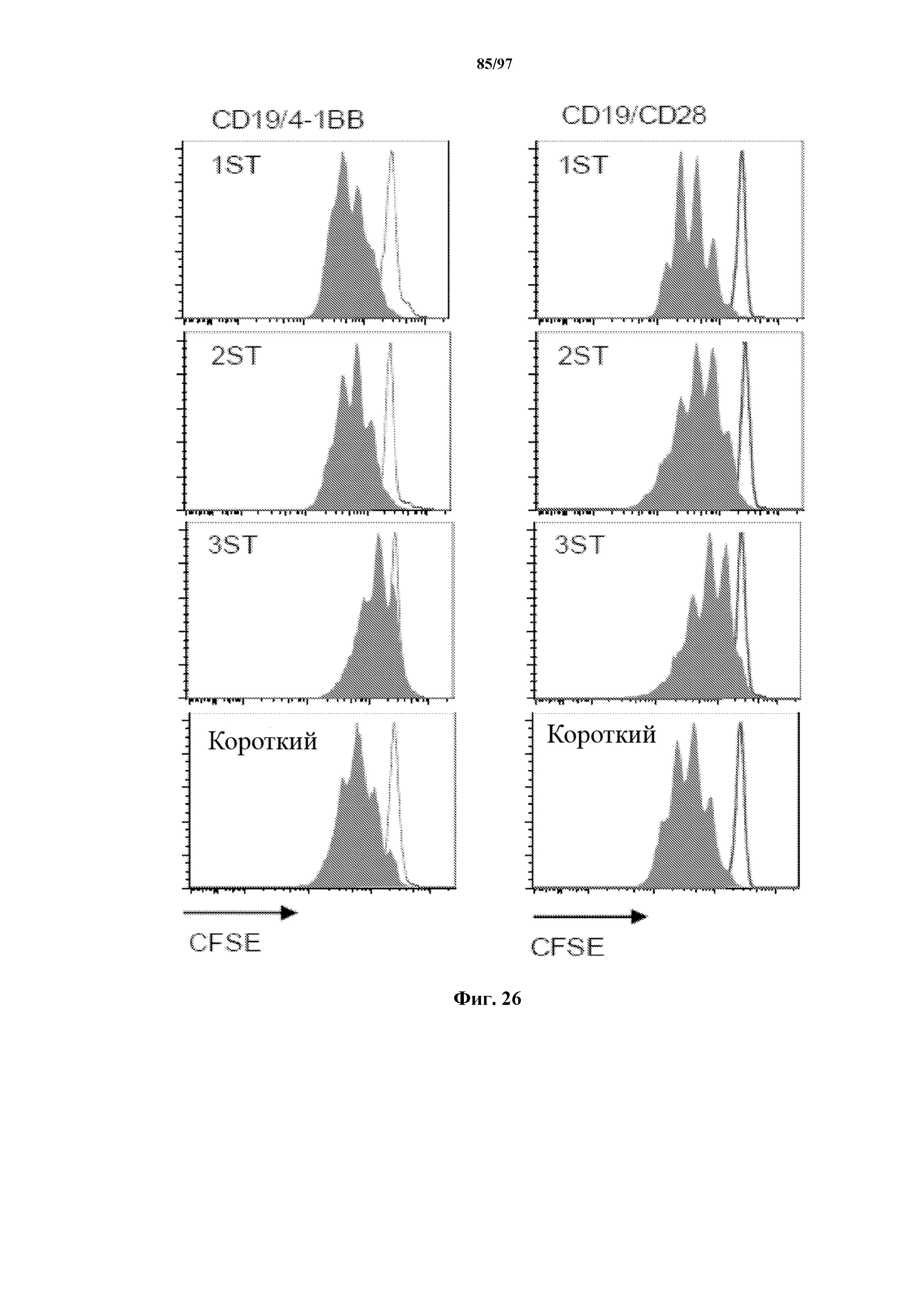
На фигуре 26 показано разбавление красителя CFSE, использованное для измерения пролиферации Т-клеток, экспрессирующих ChARM с 4-1BB или CD28 к CD19, через 5 дней после стимуляции с помощью CD19+ опухолевых клеток Raji (сплошной серый) или только средой (серые линии) без добавления экзогенных цитокинов.
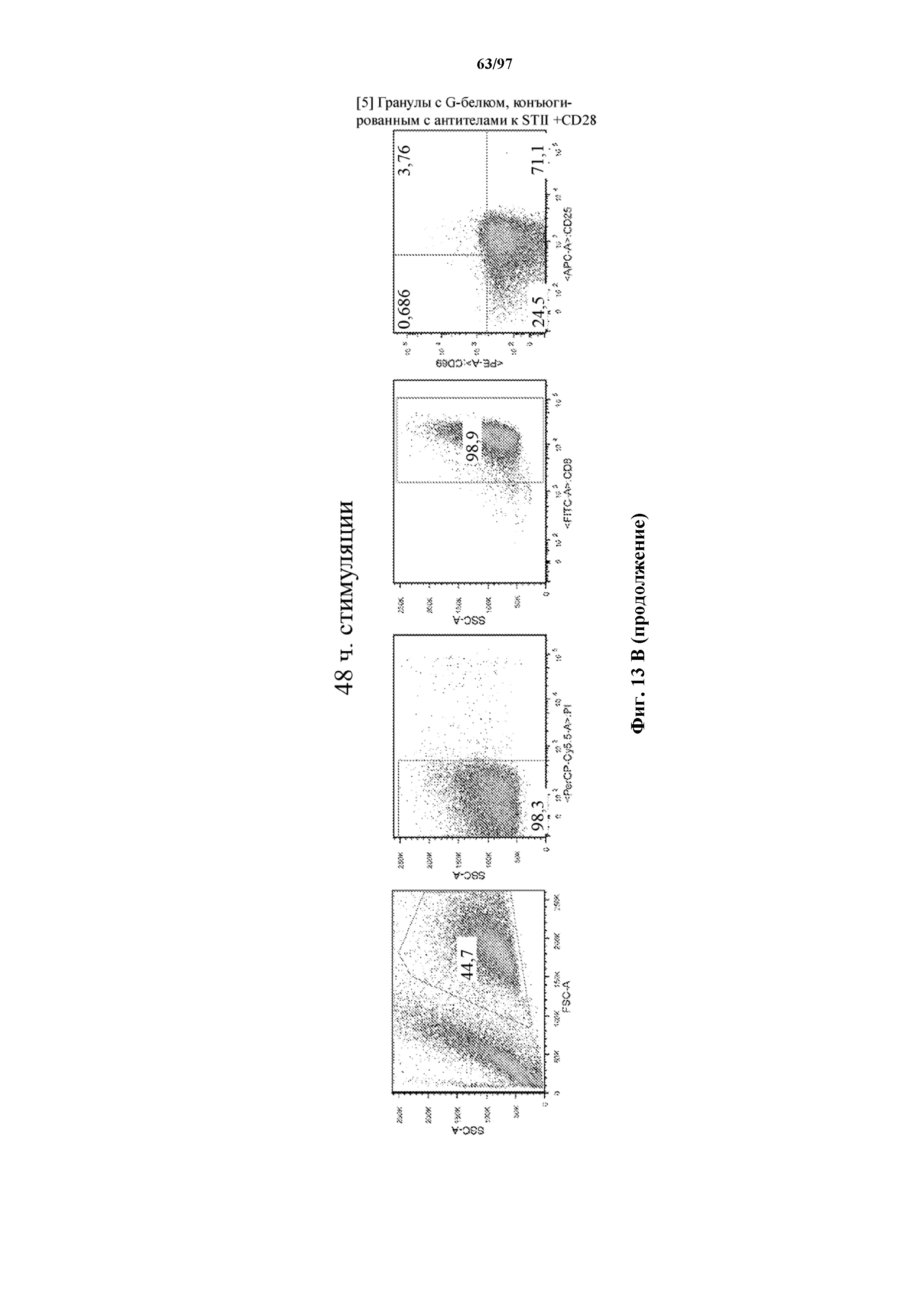
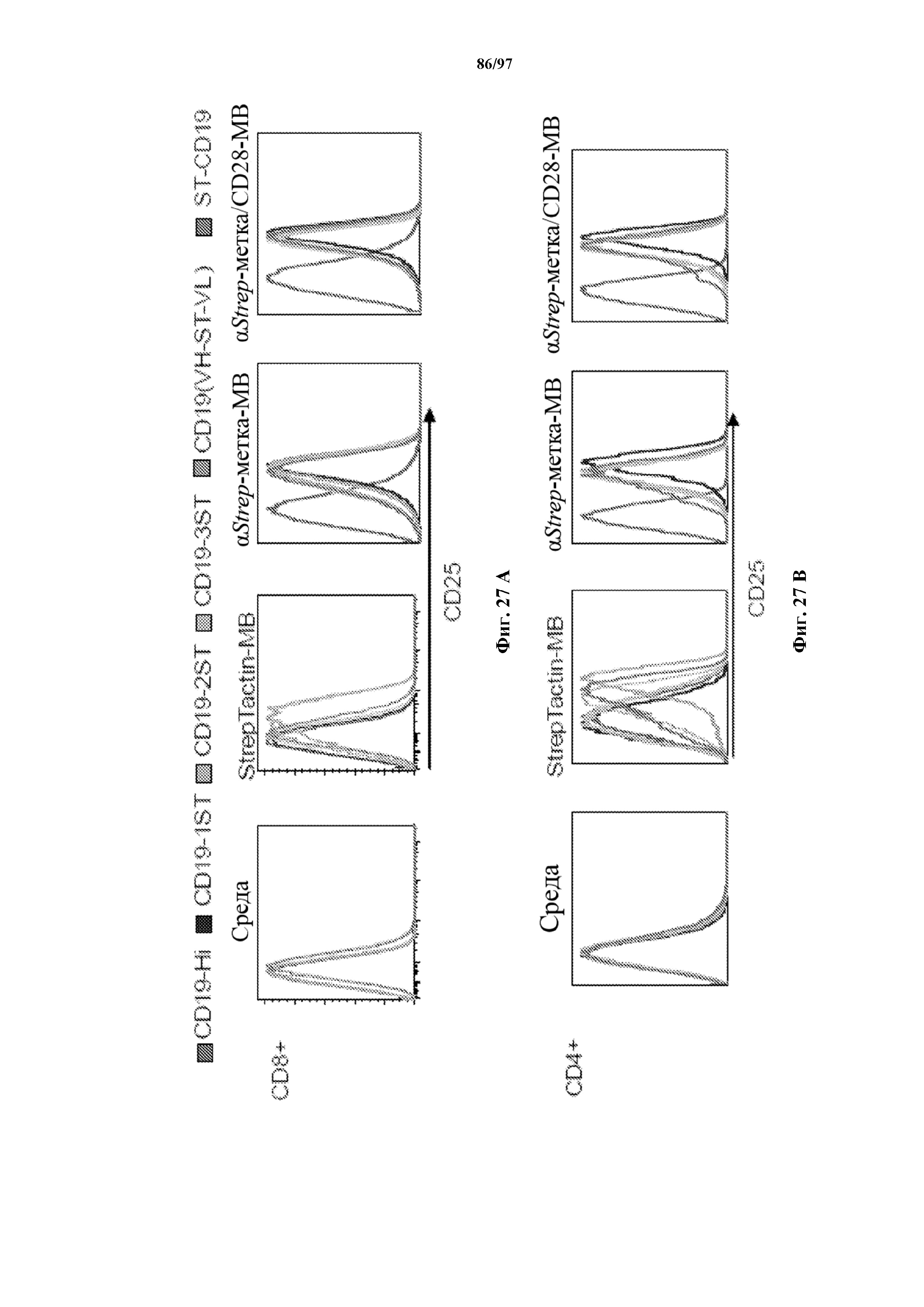
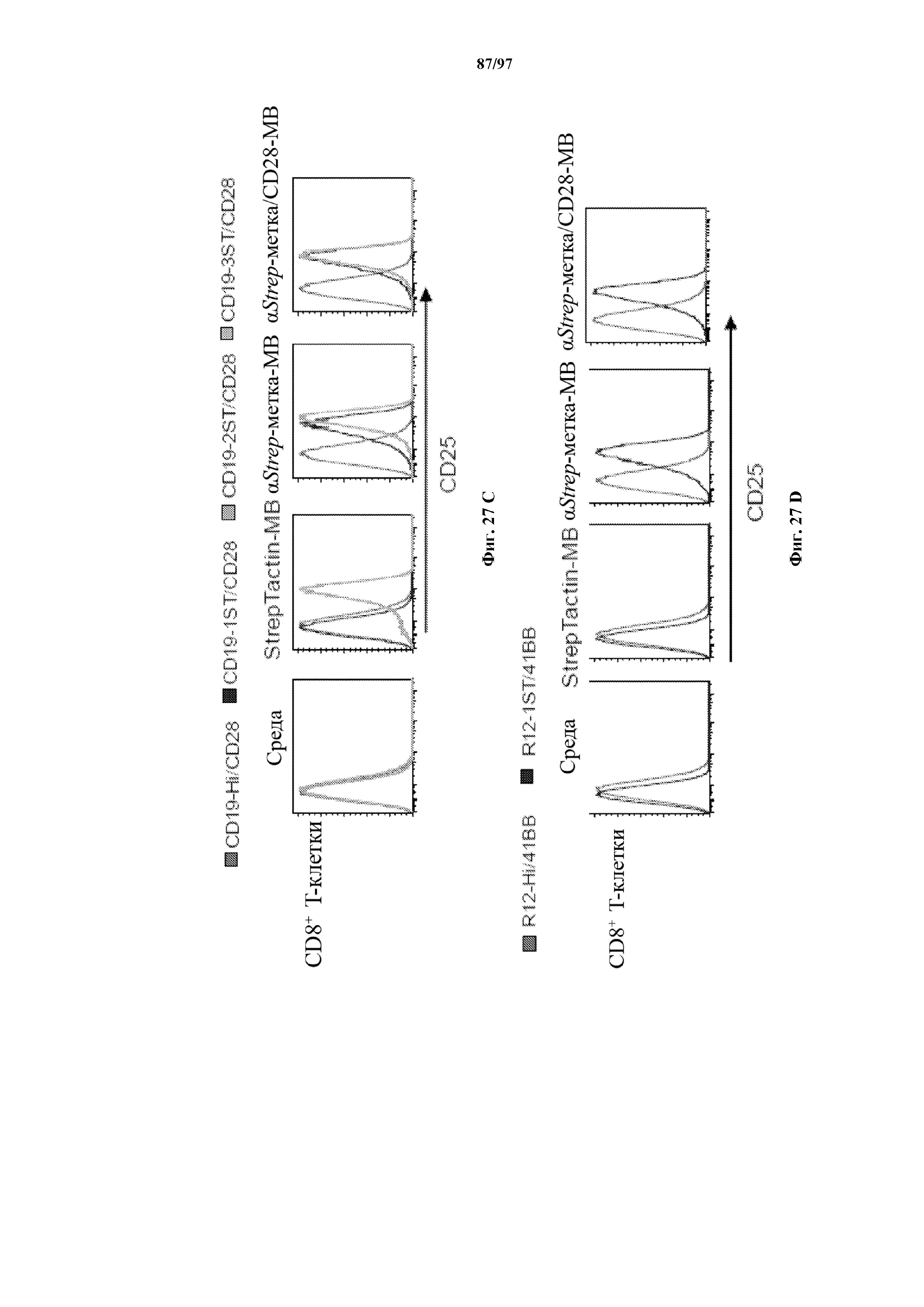
На фигурах 27A-27D показаны отсортированные с помощью FACS EGFR+ с ChARM к CD19 (A) CD8+ T-клетки (CD19-Hi/4-1BB, ST-CD19/4-1BB, CD19(VH-ST-VL)/4-1BB; CD19-1ST/4-1BB, CD19-2ST/4-1BB, CD19-3ST/4-1BB CAR); (B) CD4+ T-клетки (CD19-Hi/4-1BB, ST-CD19/4-1BB, CD19(VH-ST-VL)/4-1BB; CD19-1ST/4-1BB, CD19-2ST/4-1BB, CD19-3ST/4-1BB CAR); (C) CD8+ T-клетки с ChARM к CD19 (CD19-Hi/CD28, CD19-1ST/CD28, CD19-2ST/CD28, CD19-3ST/CD28 CAR) и (D) T-клетки с ChARM R12 к ROR1 (R12-Hi/4-1BB, R12-1ST/4-1BB), которые стимулировали с помощью микрогранул, покрытых StrepTactin (StrepTactin-MB), микрогранула, покрытых антителом к Streptag или антителами к Streptag/CD28 (αStrep-метка-MB и αStrep-метка/CD28-MB) в культуре с IL2. Через 48 часов после стимуляции клетки собирали и оценивали маркер Т-клеточной активации, CD25, с помощью проточной цитометрии. Необработанные клетки (среда) использовали в качестве контролей.
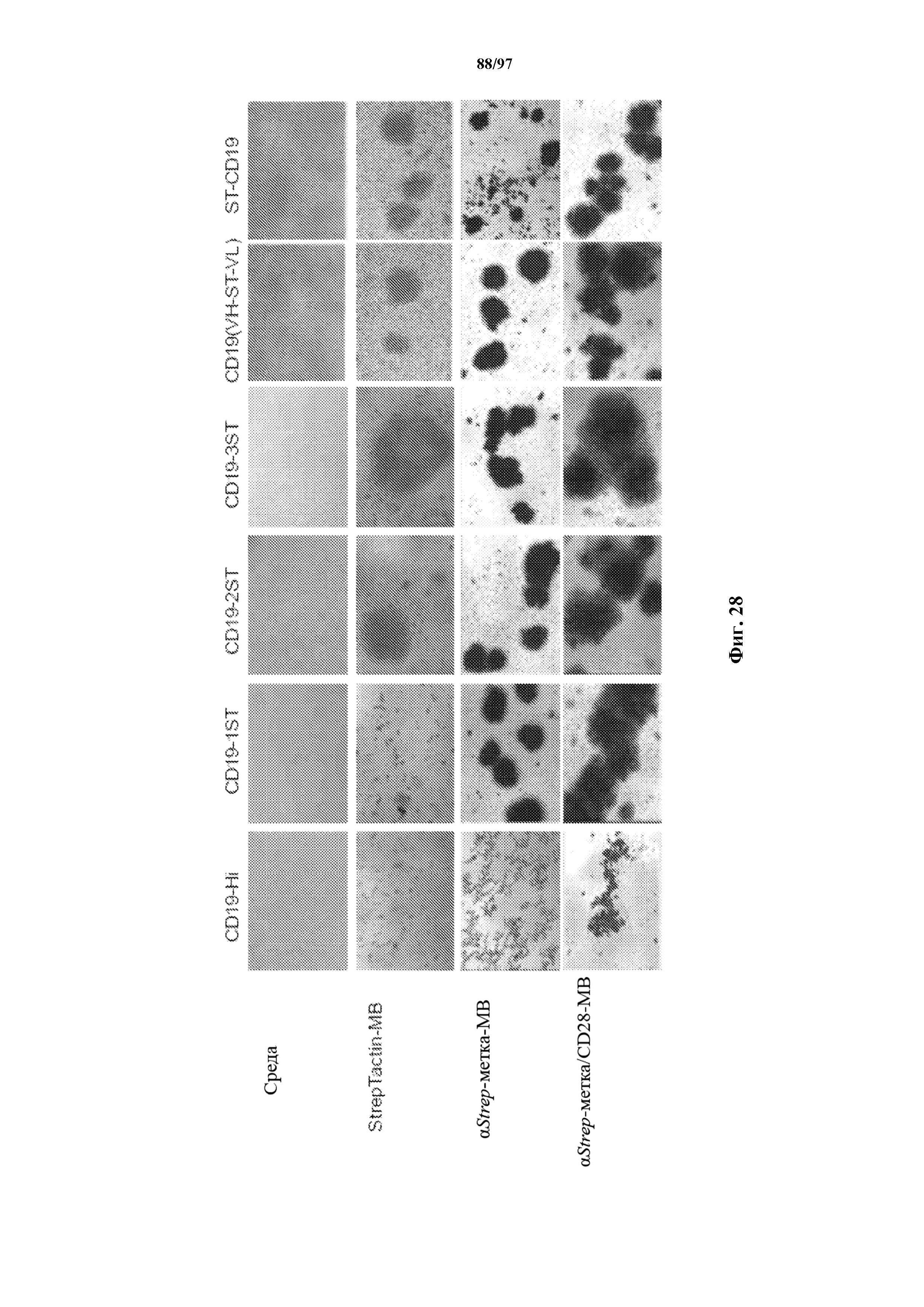
На фигуре 28 показаны характерные изображения с микроскопа отсортированных с помощью FACS EGFR+ Т-клеток (CD8+) с ChARM с 4-1BB к CD19, которые стимулировали с помощью StrepTactin-MB, αStrep-метка-MB и αStrep-метка/CD28-MB в присутствии IL2. Необработанные клетки (среда) использовали в качестве контроля. Изображения с микроскопа сделаны через 48 ч. после стимуляции.
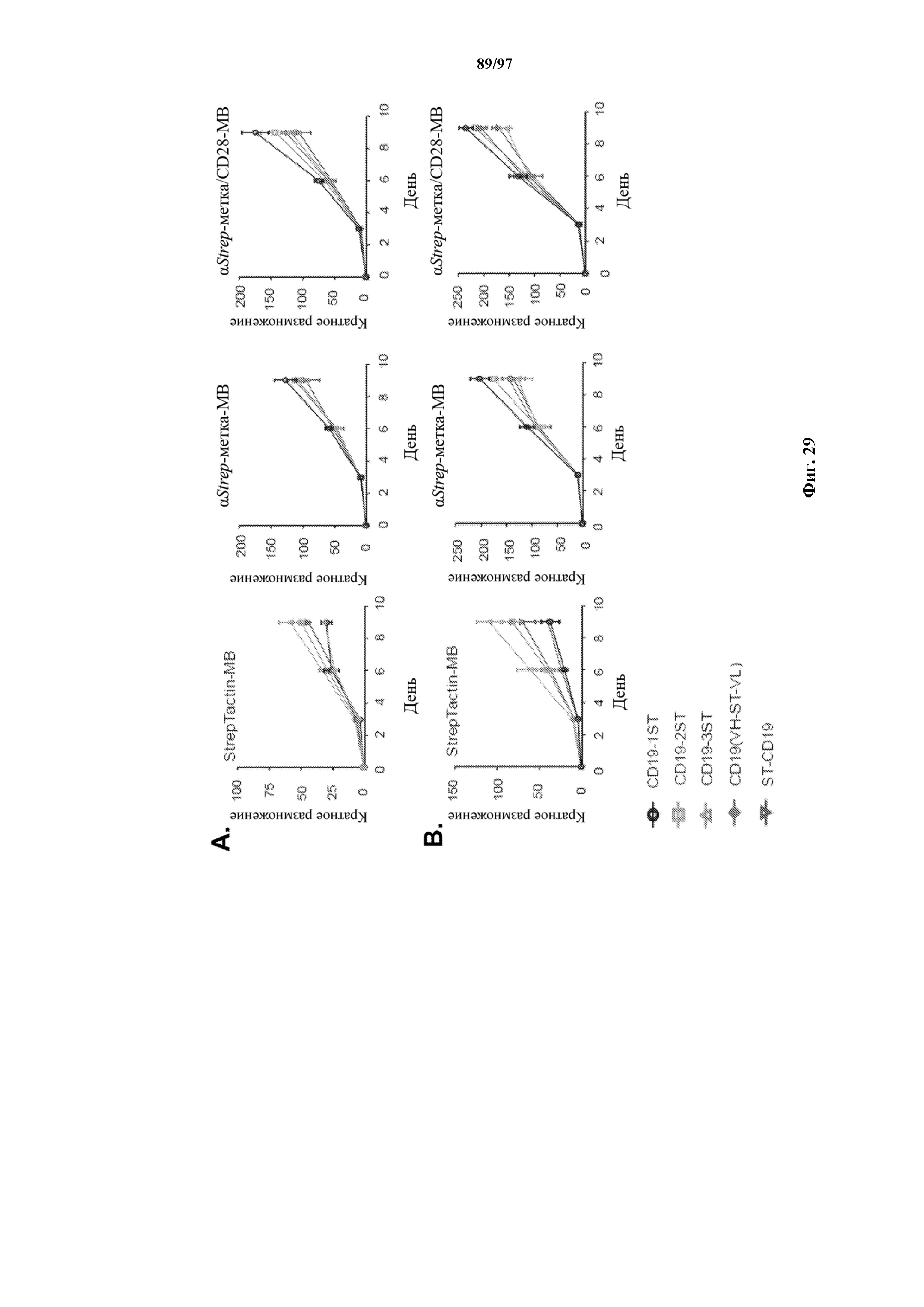
На фигурах 29A и 29B показаны кривые роста Т-клеток с ChARM. Отсортированные с помощью FACS EGFR+ (A) CD8+ и (B) CD4+ T-клетки с ChARM к CD19 культивировали в среде CTL со StrepTactin-MB, αStrep-метка-MB и α Strep-метка/CD28-MB в присутствии IL2.
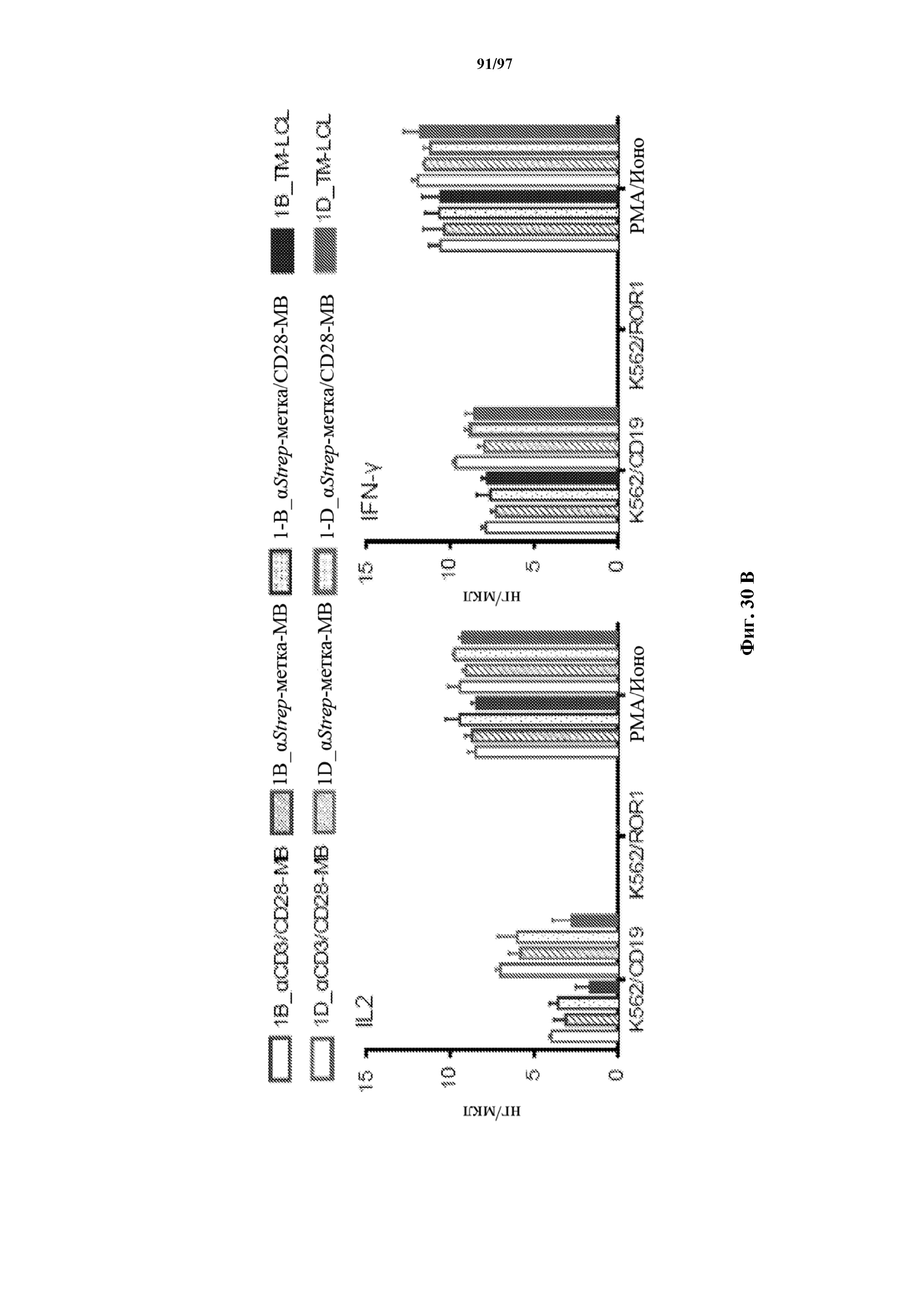
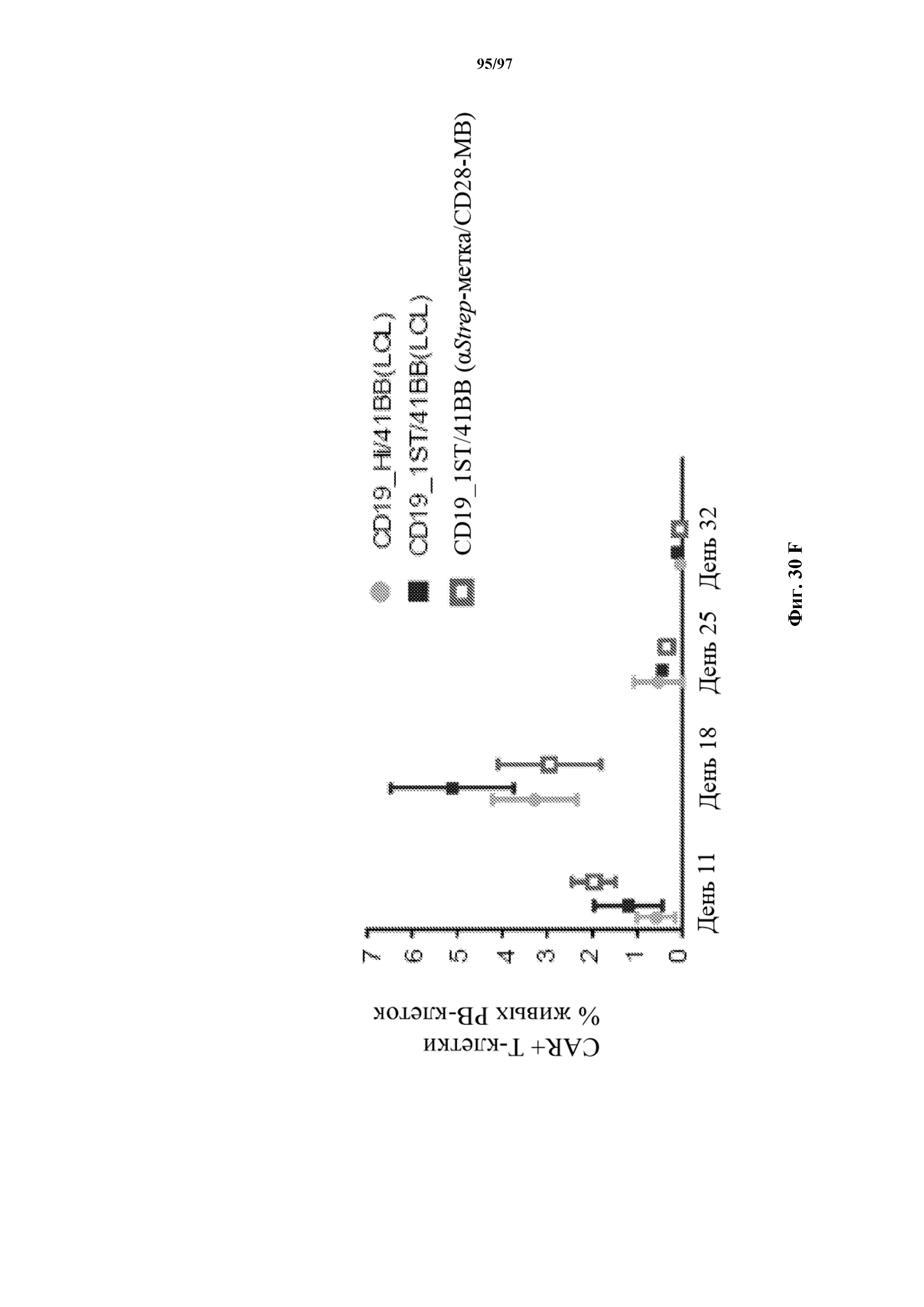
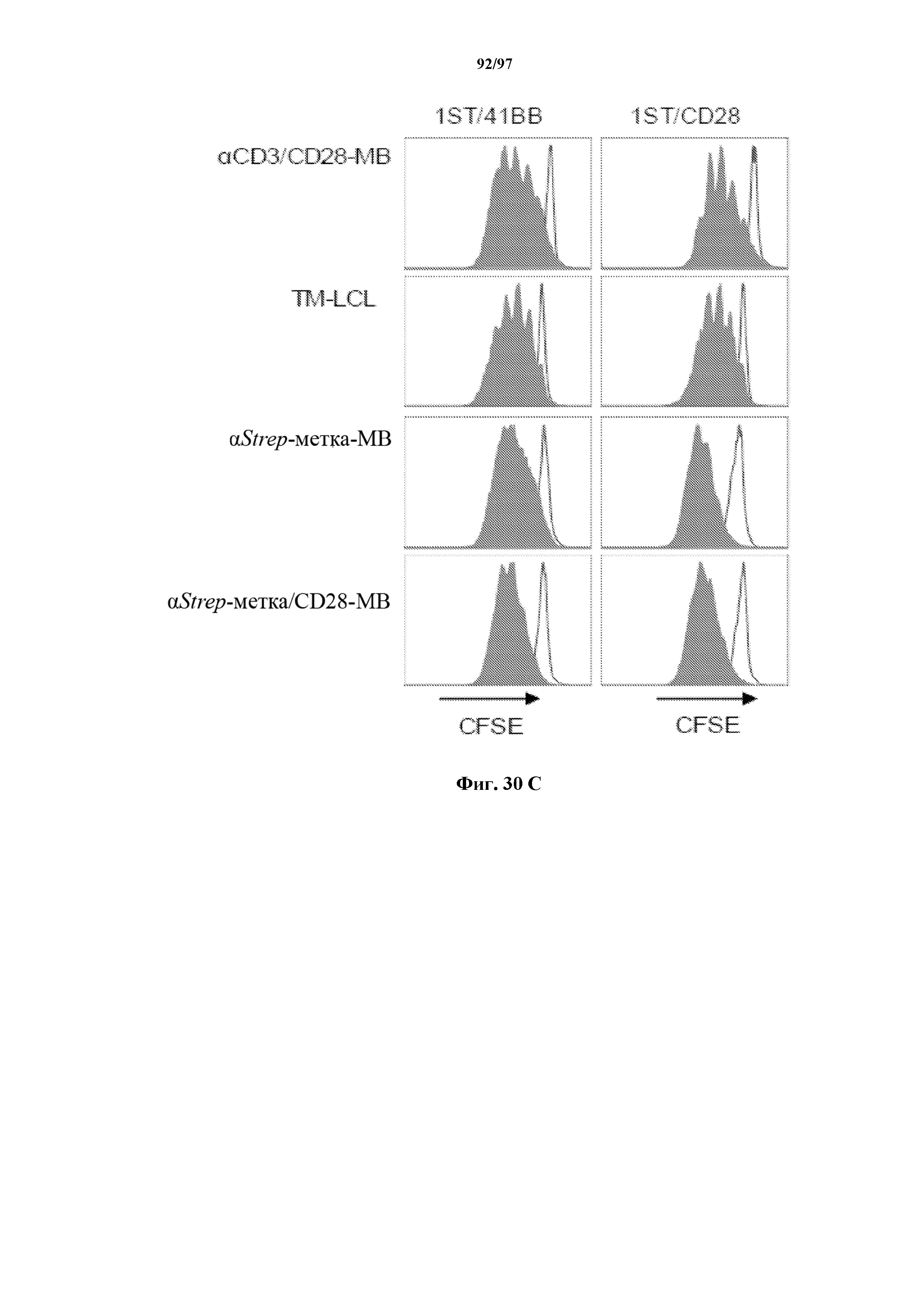
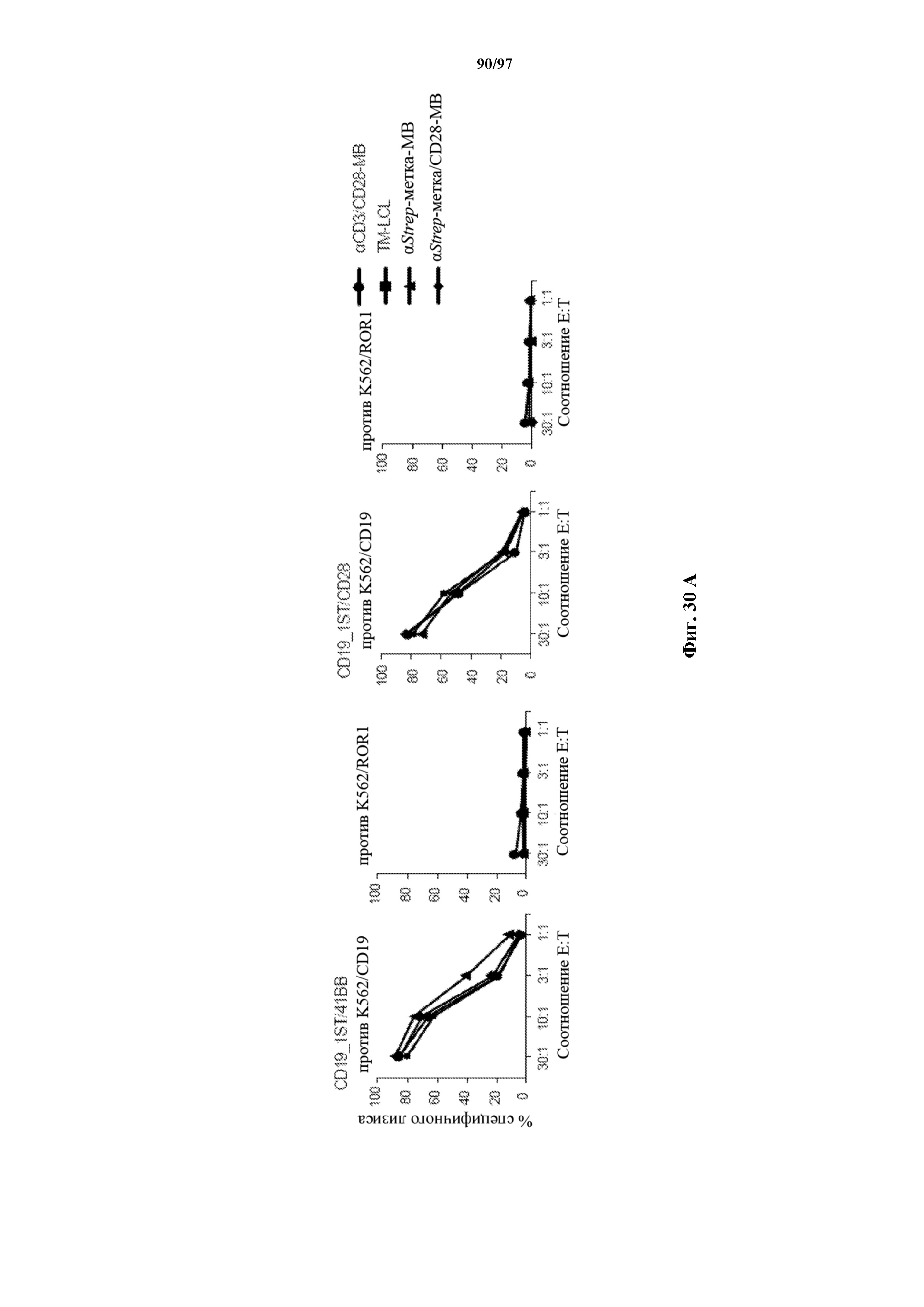
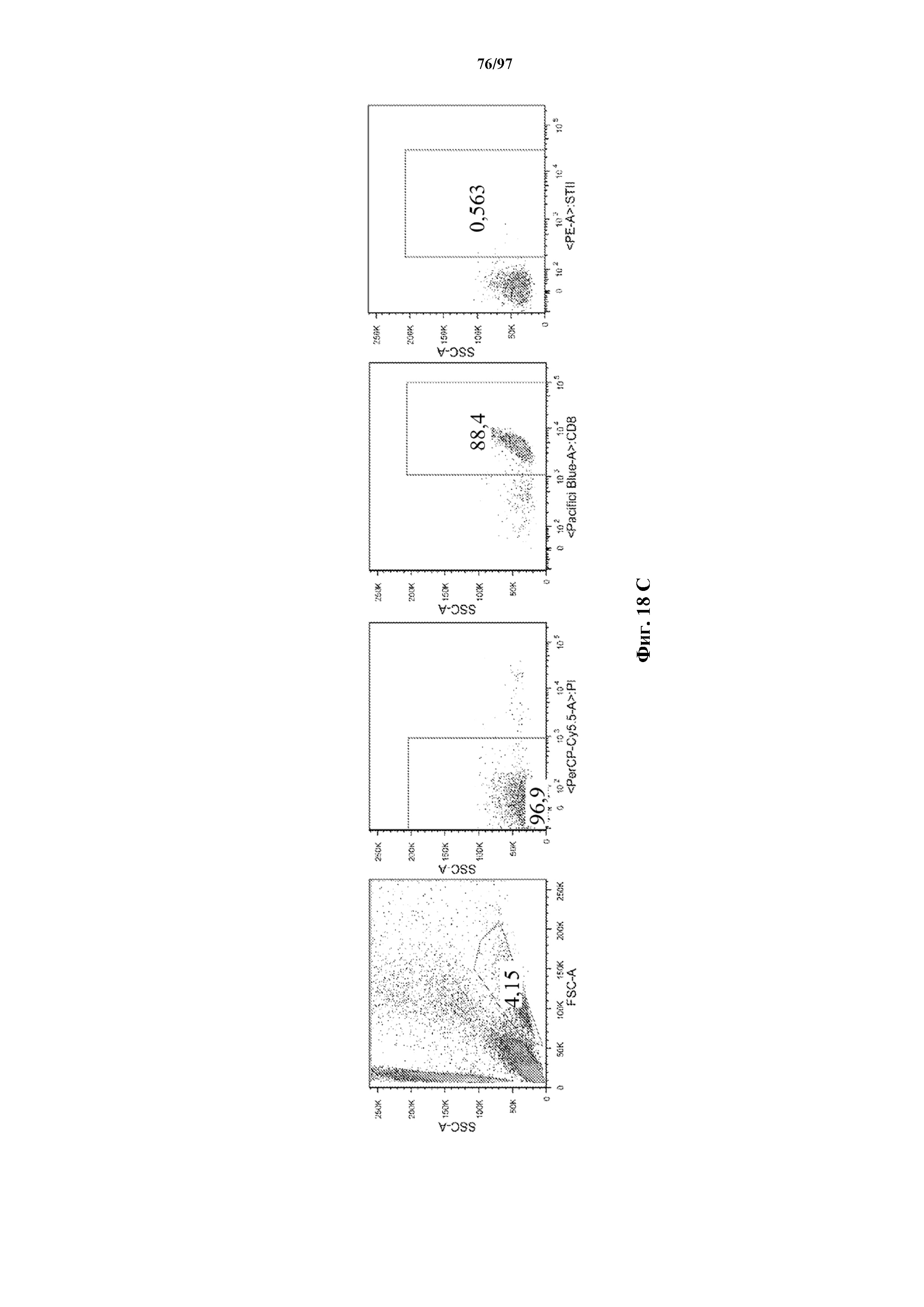
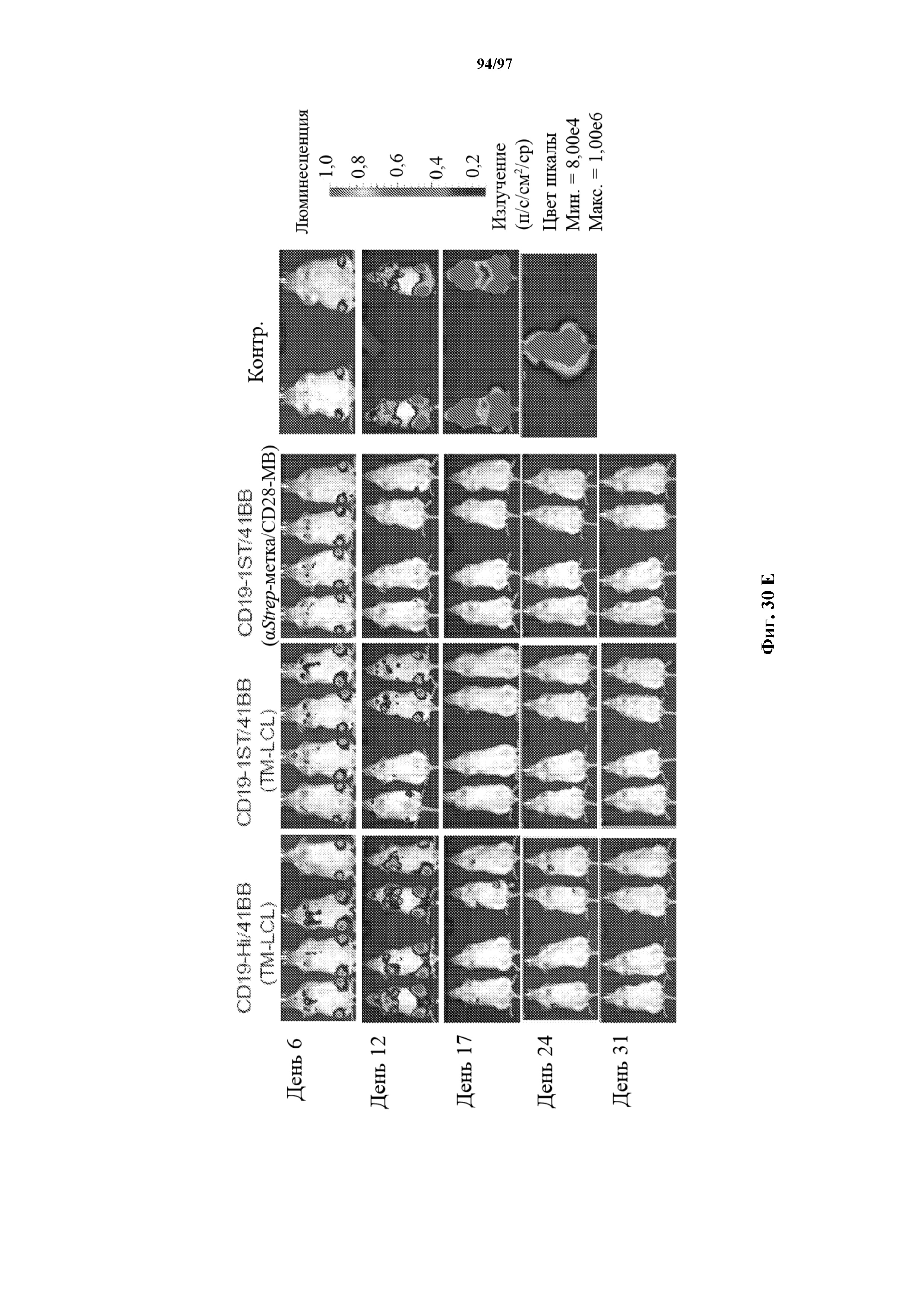
На фигурах 30A-30F показаны стимулированные с помощью микрогранул с антителом к CD3/CD28 CD8+ T-клетки, трансдуцированные CAR к CD19-1ST/4-1BB или CD19-1ST/CD28; после окрашивания EGFR и отсортировки чистые T-клетки с CAR размножали с TM-LCL или αStrep-метка-MB или α Strep-метка/CD28-MB в течение 8 дней. Исследования функциональности in vitro провели для оценки функции Т-клеток с CAR до (αCD3/CD28-MB) или после размножения (TM-LCL или αStrep-метка-MB или αStrep-метка/CD28-MB). (A) Анализы на высвобождение хрома проводили для изучения цитолитического эффекта Т-клеток с ChARM относительно целевых клеток (K562/CD19) или контрольных клеток (K562/ROR1), E/T: соотношение эффектор/мишень; (B) продукцию цитокинов измеряли с помощью ELISA с оценкой IFN-γ и IL2 в супернатантах, полученных через 24 часа из совместных культур 5 x 104 Т-клеток с ChARM к CD19 с целевыми клетками (K562/CD19) или контрольными клетками (K562/ROR1); Т-клетки, стимулированные PMA/иономицином, использовали в качестве положительного контроля, (n=3; * P<0,05); (C) анализ пролиферации с CFSE Т-клеток с ChARM через 5 дней после стимуляции целевыми клетками (K562/CD19) (сплошной серый) или контрольными клетками (K562/ROR1) (серые линии) без добавления экзогенных цитокинов; для анализа объединяли по три лунки и анализировали пролиферацию живых (PI-), EGFR-положительных Т-клеток с CAR; (D) проточная детекция экспрессии CD45RO, CD62L, CD28 и CD27 на Т-клетках с ChARM перед (αCD3/CD28-MB) или после размножения (TM-LCL или αStrep-метка-MB или αStrep-метка/CD28-MB); (E) когорты мышей инокулировали Raji-ffluc с помощью инъекции в хвостовую вену на 1 день, и затем 5 x 106 CD8+ Т-клеток с ChARM (CD19-Hi/4-1BB и CD19-1ST/4-1BB), которые размножали либо на CD19+ B LCL, либо на αStrep-метка/CD28-MB, вводили через 7 дней после приживления опухоли; прогрессирование и распространение опухоли оценивали с помощью последовательной биолюминесцентной визуализации после инъекции люциферинового субстрата; и (F) сохраняемость Т-клеток с ChARM к CD19 после адоптивного переноса мышам NSG/Raji; проточно-цитометрический анализ Т-клеток с ChARM в периферической крови (взятие крови из орбиты глаза) когорты мышей, обработанных Т-клетками, трансдуцированными различными ChARM, в разные моменты времени после инфузии Т-клеток; частоту CD8+ tEGFR+ и ChARM+ T-клеток использовали в виде процентного содержания живых клеток периферической крови.
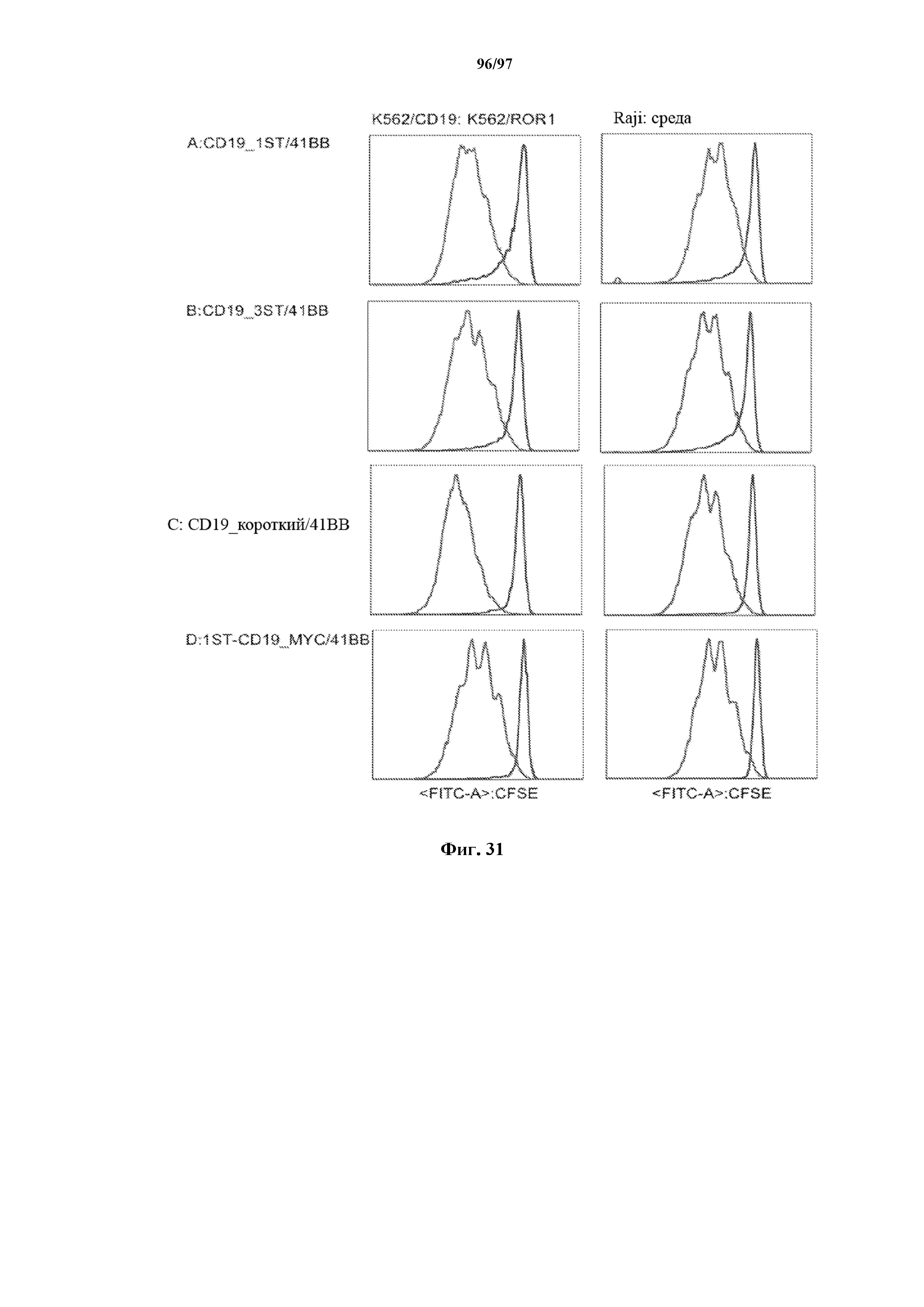
На фигуре 31 показано разбавление красителя CFSE, использованное для измерения пролиферации Т-клеток с CD19-СAR-короткий, T-ChARM1, T-ChARM3 и Myc-ChARM с 4-1BB через 5 дней после стимуляции с помощью CD19 (K562/CD19), ROR1 (K562/ROR1), только среды или CD19+ опухолевых клеток Raji без добавления экзогенных цитокинов.
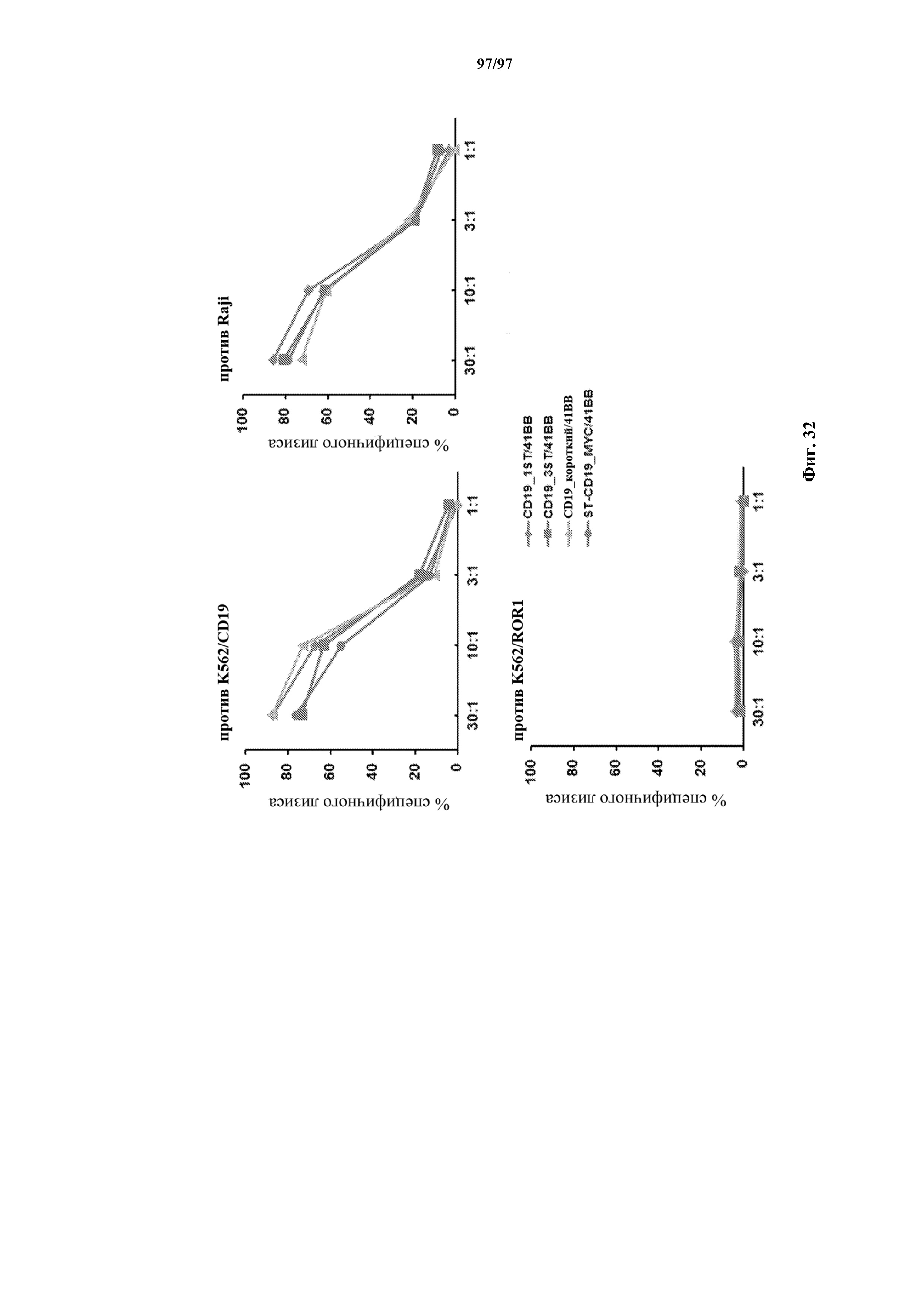
На фигуре 32 показаны анализы с высвобождением хрома, проведенные для изучения цитолитического эффекта Т-клеток с CD19-CAR-короткий, T-ChARM1, T-ChARM3 и Myc-ChARM с 4-1BB относительно целевых клеток (K562/CD19) или контрольных клеток (K562/ROR1). E/T: соотношение эффектор/мишень.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее раскрытие предусматривает композиции и способы для получения различных гибридных белков, содержащих одну или более кассет с аффинными метками, которые являются химерными эффекторными молекулами (ChEM), функционирующими подобно «ключу» для доступа к любому из различных биологических путей и его управления (т. e. включения, или выключения, или модулирования). Эти химерные эффекторные молекулы упоминаются в данном документе как Key-ChEM. Молекулы нуклеиновых кислот, кодирующие такие гибридные белки, можно использовать для получения модифицированных клеток-хозяев, в которых специфические клеточные ответы, такие как пролиферация или уничтожение, вызываются, контролируются или и то, и другое. Например, определенные типы клеток-предшественников можно получить от субъекта, модифицировать для экспрессии гибридного белка, содержащего кассету с меткой, вызвать пролиферацию и затем переливать обратно субъекту для конкретного терапевтического эффекта (например, восстановления истощенной иммунной системы субъекта). В качестве альтернативы, такие гибридные белки, содержащие метку, могут дополнительно иметь домен связывания, специфичный к конкретной мишени (например, к опухолевому антигену). В таких примерах такие гибридные белки представляют собой меченые химерные молекулы антигенных рецепторов (T-ChARM), которые можно вводить в конкретную клетку и затем использовать для идентификации, отсортировки, активации или размножения этой модифицированной клетки. В определенных вариантах осуществления такие меченые химерные молекулы трансдуцируют и экспрессируют в клетках, таких как иммунные клетки (например, T-клетки).
В определенных аспектах настоящее раскрытие дополнительно предусматривает способы селективных активации, стимуляции пролиферации, идентификации, отсортировки, накопления, отделения, отслеживания и истощения клеток (например, T-клеток), содержащих молекулу нуклеиновой кислоты, кодирующую гибридный белок, имеющий одну или более кассет с метками (Key-ChEM или T-ChARM). Кроме того, данное раскрытие предусматривает Key-ChEM или T-ChARM, а также клетки, композиции и способы применения Key-ChEM или T-ChARM по данному раскрытию в различных терапевтических применениях, в том числе в лечении заболевания у субъекта (например, рака, инфекционного заболевания, воспалительного заболевания, иммунологического заболевания, возрастного заболевания).
Перед тем, как перейти к более подробному изложению настоящего раскрытия, для его понимания может быть полезным привести определения некоторых терминов, используемых в данном документе. Дополнительные определения изложены на всем протяжении настоящего раскрытия.
В настоящем описании любой диапазон концентраций, процентный диапазон, диапазон соотношений или диапазон целых чисел следует понимать с включением значения любого целого числа в пределах указанного диапазона и, при необходимости, его долей (таких как одна десятая и одна сотая целого числа), если не указано иное. Кроме того, любой числовой диапазон, указанный в данном документе, относящийся к любому из физических признаков, такому как субъединицы, размер или толщина полимера, следует понимать с включением любого целого числа в пределах указанного диапазона, если не указано иное. Используемое в данном документе выражение «приблизительно» означает ± 20% к указанному диапазону, значению или позиции, если не указано иное. Следует понимать, что формы единственного числа, используемые в данном документе, относятся к «одному или более» перечисленным компонентам. Использование предлогов альтернативы (например, «или») следует понимать как обозначение либо одной, одной и другой либо любой комбинации альтернатив. Используемые в данном документе выражения «включает», «имеет» и «содержит» используют синонимично, при этом подразумевают, что выражения и их варианты толкуют как неограничивающие.
Кроме того, следует понимать, что индивидуальные соединения, или группы соединений, полученные из различных комбинаций структур и заместителей, описанных в данном документе, раскрываются в настоящей заявке в той же степени, как если бы каждое соединение или группа соединений были изложены отдельно. Таким образом, выбор конкретных структур или конкретных заместителей находится в пределах объема настоящего раскрытия.
Выражение «состоящий, по сути, из» ограничивает объем пункта формулы изобретения конкретными материалами или этапами или тем, что существенно не влияет на основные характеристики заявленного изобретения. Например, домен белка, область, блок, или кассета (например, домен связывания, шарнирная область, линкерный блок, кассета с меткой), или белок (который может иметь одно или более из доменов, областей, блоков или кассет) «состоит, по сути, из» конкретной аминокислотной последовательности, когда аминокислотная последовательность домена, области, блока, кассеты или белка включает в себя удлинения, делеции, мутации или их комбинации (например, аминокислоты на амино- или карбокси-конце или между доменами), которые, в комбинации, составляют не более 20% (например, не более 15%, 10%, 8%, 6%, 5%, 4%, 3%, 2% или 1%) от длины домена, области, блока, кассеты или белка и не оказывают существенного влияния (т. e. не уменьшают активность более чем на 50%, например не более чем на 40%, 30%, 25%, 20%, 15%, 10%, 5% или 1%) на активность домена(ов), области(ей), блока(ов), кассеты(кассет) или белка (например, сродство связывания мишени у связывающего белка или кассеты с меткой).
Термин «домен связывания» (также называемый «областью связывания» или «связывающей частью»), используемый в данном документе, относится к молекуле, такой как пептид, олигопептид, полипептид или белок, которая обладает способностью специфически и нековалентно ассоциироваться, сопрягаться или объединяться с целевой молекулой (например, CD19, CD20, CD22, ROR1, мезотелином, PD-L1, PD-L2, PSMA). Домен связывания включает в себя любой встречающийся в природе, синтетический, полусинтетический или полученный рекомбинантным способом партнер связывания для биологической молекулы или другой мишени, представляющей интерес. В некоторых вариантах осуществления домен связывания представляет собой антиген-связывающий домен, такой как антитело или Т-клеточный рецептор (TCR) или функциональный домен связывания или его антиген-связывающий фрагмент. Иллюстративные домены связывания включают одноцепочечные вариабельные области антитела (например, доменные антитела, sFv, scFv, Fab), эктодомены рецепторов (например, TNF-α), лиганды (например, цитокины, хемокины), антиген-связывающие области T-клеточных рецепторов (TCR), такие как одноцепочечные TCR (scTCR), или синтетические полипептиды, выбранные по специфической способности связываться с биологической молекулой.
Используемое в данном документе выражение «специфически связывается» относится к ассоциации или сопряжению домена связывания или его гибридного белка с целевой молекулой со сродством или Ka (т. e. равновесной константой ассоциации для конкретного взаимодействия связывания с единицами 1/M) равной или большей 105 M-1, в то же время без существенных ассоциации или сопряжения с любыми другими молекулами или компонентами в образце. Домены связывания (или их гибридные белки) могут классифицироваться как домены связывания (или их гибридные белки) с «высоким сродством» или домены связывания (или их гибридные белки) с «низким сродством». Домены связывания с «высоким сродством» относятся к доменам связывания с Ka по меньшей мере 107 M-1, по меньшей мере 108 M-1, по меньшей мере 109 M-1, по меньшей мере 1010 M-1, по меньшей мере 1011 M-1, по меньшей мере 1012 M-1 или по меньшей мере 1013 M-1. Домены связывания с «низким сродством» относятся к доменам связывания с Ka до 107 M-1, до 106 M-1, до 105 M-1. Альтернативно, сродство может быть определено как равновесная константа диссоциации (Kd) конкретного взаимодействия связывания с единицами M (например, от 10-5 M до 10-13 M). В определенных вариантах осуществления домен связывания может характеризоваться «повышенным сродством», что относится к подвергнутому отбору или разработанному с помощью генной инженерии домену связывания с более сильным связыванием с целевым антигеном, чем у домена связывания дикого типа (или исходного). Например, повышенное сродство может быть связано с Ka (равновесной константой ассоциации) для целевого антигена, которая выше, чем у домена связывания дикого типа, или связано с Kd (константой диссоциации) для целевого антигена, которая меньше, чем у домена связывания дикого типа, или связано со скоростью диссоциации (Koff) для целевого антигена, которая меньше, чем у домена связывания дикого типа. Различные анализы известны для идентификации доменов связывания по настоящему раскрытию, которые специфически связывают конкретную мишень, а также для определения степеней сродства домена связывания или гибридного белка, такие как анализ вестерн-блот, ELISA и Biacore® (см. также, например, Scatchard et al., Ann. N.Y. Acad. Sci. 51:660, 1949; и патенты США №№ 5283173, 5468614 или их эквиваленты).
Используемый в данном документе термин «гетерологичный», или «неэндогенный», или «экзогенный» относится к любому из гена, белка, соединения, молекулы или активности, которые не являются нативными для клетки-хозяина или субъекта, или представляет собой любое из гена, белка, соединения, молекулы или активности, нативных для хозяина или клетки-хозяина, но которые были изменены или подвергнуты мутации, так что структура, активность или и то, и другое различны у нативной и мутированной молекулы. В определенных вариантах осуществления гетерологичные, неэндогенные или экзогенные молекулы (например, рецепторы, лиганды) могут не быть эндогенными для клетки-хозяина или субъекта, но вместо этого нуклеиновая кислота, кодирующая такие молекулы, может быть добавлена в клетку-хозяина путем конъюгации, трансформации, трансфекции, электропорации или тому подобного, где добавленная молекула нуклеиновой кислоты может интегрироваться в геном клетки-хозяина или может существовать в виде внехромосомного генетического материала (например, в виде плазмиды или другого самореплицирующегося вектора). Термин «гомологичный» или «гомолог» относится к молекуле или активности, обнаруженной или полученной из клетки-, вида- или штамма-хозяина. Например, гетерологичные или экзогенные молекула или ген, кодирующий молекулу, могут быть гомологичными нативным молекуле или гену, который кодирует молекулу, хозяина или клетки-хозяина соответственно, но могут иметь измененные структуру, последовательность, уровень экспрессии или их комбинации. Неэндогенная молекула может быть получена от того же вида, от другого вида или их комбинации.
Используемый в данном документе термин «эндогенный» или «нативный» относится к гену, белку, соединению, молекуле или активности, которая в норме присутствует у хозяина или в клетке-хозяине.
Используемое в данном документе выражение «кассета с меткой» относится к уникальной пептидной последовательности, прикрепленной, слитой или являющейся частью белка, представляющего интерес, с которой гетерологичная или неэндогенная родственная связывающая молекула (например, рецептор, лиганд, антитело или другой партнер связывания) способна специфически связываться, где свойство связывания может использоваться для обнаружения, идентификации, отделения или очистки, отслеживания, накопления или нацеливания меченого белка или клеток, экспрессирующих меченый белок, особенно если меченый белок является частью гетерогенной популяции белков или другого материала, или если клетки, экспрессирующие меченый белок, являются частью гетерогенной популяции клеток (например, такого биологического образца, как периферическая кровь). В определенных вариантах осуществления клетка, экспрессирующая меченый белок, может вступать в контакт с гетерологичной или неэндогенной родственной связывающей молекулой и индуцировать биологический ответ, такой как стимуляция активации клеток, пролиферации клеток или гибели клеток. В предусмотренных гибридных белках способность кассеты(кассет) с меткой специфически связываться родственной(ыми) связывающей(ими) молекулой(ами) отличается от или дополняет способность домена(ов) связывания специфически связываться с целевой(ыми) молекулой(ами). Кассета с меткой, как правило, не является антиген-связывающей молекулой, например не является антителом или TCR или его антиген-связывающей частью.
Используемый в данном документе термин «шарнирная область» или «шарнир» относится к (a) шарнирной последовательности иммуноглобулина (состоящей, например, из верхней и коровой областей) или ее функциональному фрагменту или варианту, (b) междоменной (стволовой) области С-лектина типа II или ее функциональному фрагменту или варианту или к (c) стволовой области молекулы кластера дифференцировки (CD) или ее функциональному фрагменту или варианту. Используемое в данном документе выражение «шарнирная область иммуноглобулина дикого типа» относится к встречающимся в природе верхним и средним шарнирным аминокислотным последовательностям, расположенным между и соединяющим домены CH1 и CH2 (для IgG, IgA и IgD) или расположенным между и соединяющим домены CH1 и CH3 (для IgE и IgM), обнаруженным в тяжелой цепи антитела. В определенных вариантах осуществления шарнирная область является человеческой и в конкретных вариантах осуществления включает в себя шарнирную область IgG человека.
Используемый в данном документе термин «соединительная область» относится к одному или более белкам, полипептидам, олигопептидам, пептидам, доменам, областям, блокам, кассетам, мотивам или любой их комбинации, которые соединяют два или более из белков, полипептидов, олигопептидов, пептидов, доменов, областей, блоков, кассет, мотивов или любой их комбинации в гибридном белке. Например, соединительная область может обеспечивать спейсерную функцию для облегчения взаимодействия двух одноцепочечных гибридных белков или располагать один или более доменов связывания таким образом, что полученная полипептидная структура сохраняет специфическое сродство связывания с целевой молекулой или сохраняет сигнальную активность (например, активность эффекторного домена) или и то, и другое. В определенных вариантах осуществления соединительная область может содержать «линкерный блок», который представляет собой аминокислотную последовательность, имеющую от приблизительно двух до приблизительно 500 аминокислот, которая может обеспечивать гибкость и пространство для конформационного движения между двумя областями, доменами, мотивами, кассетами или блоками, соединенными линкером. Иллюстративные линкерные блоки включают те, которые имеют от одного до приблизительно десяти повторов GlyxSery, где x и y независимо являются целыми числами от 0 до 10 при условии, что x и y оба не равняются 0 (например, (Gly4Ser)2 (SEQ ID NO:67), (Gly3Ser)2 (SEQ ID NO:68), Gly2Ser или их комбинация, такая как (Gly3Ser)2Gly2Ser) (SEQ ID NO:69). В определенных других вариантах осуществления соединительная область может иметь линкерный блок, который содержит одну или более константных областей тяжелой цепи иммуноглобулина, такую как только CH3 или CH2CH3. В дополнительных вариантах осуществления соединительная область может содержать шарнирную область или кассету с меткой. Каждый такой соединительный компонент не является взаимоисключающим. Например, соединительная область может содержать шарнир и один или более линкерных блоков, или соединительная область может содержать шарнир, один или более линкерных блоков и одну или более кассет с метками. Иллюстративные соединительные области могут варьировать по длине, например, от приблизительно пяти до приблизительно 500 аминокислот, или от приблизительно десяти до приблизительно 350 аминокислот, или от приблизительно 15 до приблизительно 100 аминокислот, или от приблизительно 20 до приблизительно 75 аминокислот, или от приблизительно 25 до приблизительно 35 аминокислот.
Термин «гидрофобный участок», используемый в данном документе, означает любую аминокислотную последовательность, имеющую трехмерную структуру, которая является термодинамически стабильной в клеточной мембране и обычно находится в диапазоне длин от приблизительно 15 аминокислот до приблизительно 30 аминокислот. Структура гидрофобного домена может включать альфа-спираль, бета-цилиндр, бета-лист, бета-спираль или любую их комбинацию.
Используемый в данном документе «эффекторный домен» представляет собой внутриклеточную часть гибридного белка или рецептора, которая может непосредственно или опосредованно стимулировать биологический или физиологический ответ в клетке при получении соответствующего сигнала. В определенных вариантах осуществления эффекторный домен является частью белка или белкового комплекса, который принимает сигнал при связывании, или он непосредственно связывается с целевой молекулой, что приводит в действие сигнал от эффекторного домена. Эффекторный домен может непосредственно стимулировать клеточный ответ, если он содержит один или более сигнальных доменов или мотивов, таких как активационный тирозинсодержащий мотив иммунорецепторов (ITAM). В других вариантах осуществления эффекторный домен будет опосредованно стимулировать клеточный ответ путем ассоциации с одним или более другими белками, которые прямо стимулируют клеточный ответ.
«Линкер вариабельной области» в конкретном случае относится к последовательности, включающей от пяти до приблизительно 35 аминокислот, которая соединяет вариабельную область тяжелой цепи иммуноглобулина с вариабельной областью легкой цепи иммуноглобулина, или соединяет Vα/β и Cα/β цепи Т-клеточного рецептора (например, Vα-Cα, Vβ-Cβ, Vα-Vβ), или соединяет каждую пару Vα-Cα, Vβ-Cβ, Vα-Vβ с шарниром или гидрофобным доменом, что обеспечивает спейсерную функцию и гибкость, достаточную для взаимодействия двух доменов субсвязывания, так что полученный одноцепочечный полипептид сохраняет специфическое сродство связывания с той же целевой молекулой, что и антитело или Т-клеточный рецептор. В определенных вариантах осуществления линкер вариабельной области содержит от приблизительно десяти до приблизительно 30 аминокислот или от приблизительно 15 до приблизительно 25 аминокислот. В конкретных вариантах осуществления линкерный пептид вариабельной области содержит от одного до десяти повторов GlyxSery, где x и y независимо являются целыми числами от 0 до 10 при условии, что x и y оба не равняются 0 (например, Gly4Ser (SEQ ID NO:10), Gly3Ser (SEQ ID NO:71), Gly2Ser или (Gly3Ser)n(Gly4Ser)1 (SEQ ID NO:72), (Gly3Ser)n(Gly2Ser)n (SEQ ID NO:73), (Gly3Ser)n(Gly4Ser)n (SEQ ID NO:72) или (Gly4Ser)n (SEQ ID NO:10), где n является целым числом равным 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10) и где соединенные вариабельные области образуют функциональный иммуноглобулиноподобный домен связывания (например, scFv, scTCR). Иллюстративные линкеры вариабельной области включают аминокислотные последовательности, изложенные под SEQ ID NO:44, 65-69 и 71-73, и (Gly4Ser)n (SEQ ID NO:10), где n равняется 3, как обнаружено в T-ChARM с аминокислотной последовательностью, изложенной под SEQ ID NO:57.
Термины «соединительные аминокислоты» или «соединительные аминокислотные остатки» относится к одному или более (например, приблизительно 2-20) аминокислотным остаткам между двумя смежными мотивами, областями или доменами полипептида, таким как между доменом связывания и смежной линкерной областью, или между гидрофобным доменом и смежным эффекторным доменом, или на одном или обоих концах линкерной области, которая связывает два мотива, две области или два домена (например, между линкером и смежным доменом связывания и/или между линкером и смежным шарниром). Соединительные аминокислоты могут быть результатом моделирования конструкции гибридного белка (например, аминокислотные остатки, полученные в результате применения сайта для рестрикционного фермента при конструировании молекулы нуклеиновой кислоты, кодирующей гибридный белок). Например, одна соединительная аминокислота, аспарагин, кодируемая кодоном AAT, находится между последовательностью нуклеиновой кислоты, кодирующей сигнальную последовательность для секреции (SEQ ID NO:63), и последовательностью, кодирующей кассету с меткой (SEQ ID NO:38), в T-ChARM, кодируемом последовательностью нуклеиновой кислоты, изложенной под SEQ ID NO:58. Аналогично, соединительная аминокислота аспарагин (N) находится между аминокислотной последовательностью гибкого линкера GGSGSG (SEQ ID NO:65) и аминокислотной последовательностью метки WSHPQFEK (SEQ ID NO:1), обнаруженной в T-ChARM с аминокислотной последовательностью, изложенной под SEQ ID NO:54.
Термины, понятные специалисту в области техники антител, имеют значение, приобретенное в данной области техники, если иное прямо не указано в данном документе. Термин «антитело» относится к интактному антителу, содержащему по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, соединенные между собой дисульфидными связями, а также к антиген-связывающему участку интактного антитела, который имеет или сохраняет способность связывать целевую молекулу. Моноклональное антитело или его антиген-связывающий участок может быть отличным от человеческого, химерным, гуманизированным или человеческим, предпочтительно гуманизированным или человеческим. Структура и функция иммуноглобулинов рассматриваются, например, в Harlow et al., Eds., Antibodies: A Laboratory Manual, Chapter 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988).
Например, термины «VL» и «VH» относятся к вариабельной связывающей области легкой и тяжелой цепи антитела соответственно. Вариабельные связывающие области содержат дискретные, четко определенные подобласти, известные как «определяющие комплементарность области» (CDR) и «каркасные области» (FR). Термин «CL» относится к «константной области легкой цепи иммуноглобулина» или «константной области легкой цепи», т. e. к константной области из легкой цепи антитела. Термин «CH» относится к «константной области тяжелой цепи иммуноглобулина» или «константной области тяжелой цепи», которая дополнительно делится в зависимости от изотипа антитела на домены CHI, CH2 и CH3 (IgA, IgD, IgG) или CH1, CH2, CH3 и CH4 (IgE, IgM). «Fab» (антиген-связывающий фрагмент) представляет собой часть антитела, которая связывается с антигенами и включает в себя вариабельную область и CH1 тяжелой цепи, связанной с легкой цепью через межцепочечные дисульфидные связи.
Используемый в данном документе термин «участок Fc-области» относится к сегменту константной области тяжелой цепи Fc-фрагмента (область «кристаллизующегося фрагмента» или Fc-область) антитела, который может включать в себя один или более константных доменов, таких как CH2, СН3, СН4, или любую их комбинацию. В определенных вариантах осуществления участок Fc-области включает в себя домены CH2 и CH3 из антитела IgG, IgA или IgD или любую их комбинацию или домены CH3 и CH4 из антитела IgM или IgE и любую их комбинацию. В других вариантах осуществления структура CH2CH3 или CH3CH4 характеризуется доменами подобластей из антитела того же изотипа и является человеческой, такой как из IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE или IgM человека (например, CH2CH3 из IgG1 человека). Для справки, Fc-область отвечает за эффекторные функции иммуноглобулина, такие как ADCC (антитело-зависимая клеточно-опосредованная цитотоксичность), CDC (комплемент-зависимая цитотоксичность) и фиксация комплемента, связывание с Fc-рецепторами (например, CD16, CD32, FcRn), больший период полураспада in vivo относительно полипептида без Fc-области, связывание белка A и, возможно даже, плацентарный перенос (см. Capon et al., Nature 337:525, 1989). В определенных вариантах осуществления участок Fc-области, находящийся в гибридных белках по настоящему раскрытию, будет способен к опосредованию одной или более из этих эффекторных функций или будет лишен одной или более из этих активностей или всех в результате, например, одной или более мутаций, известных из уровня техники.
Кроме того, антитела имеют шарнирную последовательность, которая, как правило, расположена между Fab и Fc-областью (но нижний сегмент шарнира может включать аминоконцевой участок Fc-области). Для справки, шарнир иммуноглобулина действует в качестве гибкого спейсера, позволяя Fab-участку свободно двигаться в пространстве. В отличие от константных областей, шарниры структурно разнообразны, варьируя как по последовательности, так и по длине между классами иммуноглобулинов и даже среди подклассов. Например, шарнирная область IgG1 человека является свободно гибкой, что позволяет Fab-фрагментам вращаться вокруг их осей симметрии и перемещаться внутри сферы с центром на первом из двух дисульфидных мостиков между тяжелыми цепями. Для сравнения, шарнир IgG2 человека является относительно коротким и содержит жесткую полипролиновую двойную спираль, стабилизированную с помощью четырех дисульфидных мостиков между тяжелыми цепями, которые ограничивают гибкость. Шарнир IgG3 человека отличается от других подклассов своей уникальной внедоменной шарнирной областью (приблизительно в четыре раза длиннее, чем шарнир IgG1), содержащей 62 аминокислоты (в том числе 21 пролин и 11 цистеинов), образующей негибкую полипролиновую двойную спираль и обеспечивающей большую гибкость, поскольку Fab-фрагменты находятся относительно далеко от Fc-фрагмента. Шарнир IgG4 человека короче, чем у IgG1, но имеет такую же длину, что и у IgG2, и его гибкость является промежуточной между гибкостью у IgG1 и IgG2.
«T-клеточный рецептор» (TCR) относится к молекуле, находящейся на поверхности T-клеток (или T-лимфоцитов), которая совместно с CD3, как правило, отвечает за распознавание антигенов, связанных с молекулами главного комплекса гистосовместимости (MHC). В большинстве T-клеток TCR представляет собой связанный дисульфидными связями гетеродимер высоковариабельных α и β цепей (также известных как TCRα и TCRβ соответственно). В меньшей субпопуляции T-клеток TCR представляет собой гетеродимер вариабельных γ и δ цепей (также известных как TCRγ и TCRδ соответственно). Каждая цепь TCR является представителем суперсемейства иммуноглобулинов и содержит один N-концевой вариабельный домен иммуноглобулина, один константный домен иммуноглобулина, трансмембранную область и короткий цитоплазматический «хвост» на C-конце (см. Janeway et al., Immunobiology: The Immune System in Health and Disease, 3rd Ed., Current Biology Publications, p. 4:33, 1997). TCR, как используется в настоящем раскрытии, может быть получен от различных видов животных, в том числе человека, мыши, крысы, кошки, собаки, козы, лошади или других млекопитающих. TCR могут быть связанными с клеткой (т. e. иметь трансмембранную область или домен) или могут быть в растворимой форме.
«Молекулы главного комплекса гистосовместимости» (молекулы MHC) относятся к гликопротеинам, которые доставляют пептидные антигены на клеточную поверхность. Молекулы MHC класса I являются гетеродимерами, состоящими из трансмембранной α-цепи (с тремя α-доменами) и нековалентно связанного β2 микроглобулина. Молекулы MHC класса II состоят из двух трансмембранных гликопротеинов, α и β, оба из которых проходят через мембрану. Каждая цепь имеет два домена. Молекулы MHC класса I доставляют пептиды, продуцирующиеся в цитозоле, на клеточную поверхность, где комплекс пептид:MHC распознается CD8+ T-клетками. Молекулы MHC класса II доставляют пептиды, продуцирующиеся в везикулярной системе, на клеточную поверхность, где они распознаются CD4+ T-клетками. Молекула MHC может быть получена от различных видов животных, в том числе человека, мыши, крысы или других млекопитающих.
«Вектор» представляет собой молекулу нуклеиновой кислоты, способную переносить другую нуклеиновую кислоту. Векторами могут быть, например, плазмиды, космиды, вирусы или фаг. «Вектор экспрессии» представляет собой вектор, способный управлять экспрессией белка, кодируемого одним или более генами, находящимися в векторе, когда он находится в соответствующем окружении.
«Ретровирусы» представляют собой вирусы с РНК-геномом. «Гаммаретровирус» относится к роду семейства Retroviridae. Иллюстративные гаммаретровирусы включают вирус, поражающий стволовые клетки мышей, вирус лейкоза мышей, вирус лейкоза кошачьих, вирус саркомы кошачьих и вирусы ретикулоэндотелиоза птиц.
«Лентивирус» относится к роду ретровирусов, способных инфицировать делящиеся и неделящиеся клетки. Некоторые примеры лентивирусов включают HIV (вирус иммунодефицита человека: в том числе HIV 1 типа и HIV 2 типа); вирус инфекционной анемии лошадей; вирус иммунодефицита кошачьих (FIV); бычий вирус иммунодефицита (BIV) и вирус иммунодефицита обезьян (SIV).
«Гемопоэтическая клетка-предшественник» представляет собой клетку, полученную из гемопоэтической стволовой клетки или фетальной ткани, способную к дальнейшей дифференцировке в зрелые типы клеток (например, клетки T-клеточной линии дифференцировки). В определенных вариантах осуществления являются пригодными гемопоэтические клетки-предшественники CD2410 Lin- CD117+. Как определено в данном документе, гемопоэтические клетки-предшественники могут включать эмбриональные стволовые клетки, способные к дальнейшей дифференцировке в клетки T-клеточной линии дифференцировки. Гемопоэтические клетки-предшественники могут быть получены от различных видов животных, в том числе человека, мыши, крысы или других млекопитающих. «Клетка-предшественник тимоцит» или «тимоцит» представляет собой гемопоэтическую клетку-предшественника, присутствующую в тимусе.
«Гемопоэтические стволовые клетки» относятся к недифференцированным гемопоэтическим клеткам, способным к самообновлению также in vivo, к практически неограниченному размножению in vitro и способным к дифференцировке в другие типы клеток, включая клетки T-клеточной линии дифференцировки. Гемопоэтические стволовые клетки могут быть выделены, например, без ограничения из эмбриональной печени, костного мозга, пуповинной крови.
«Эмбриональные стволовые клетки», или «ES-клетки», или «ESC» относятся к недифференцированным эмбриональным стволовым клеткам, обладающим способностью интегрироваться и становиться частью зародышевой линии развивающегося эмбриона. Эмбриональные стволовые клетки способны к дифференцировке в гемопоэтические клетки-предшественники и любую ткань или орган. Эмбриональные стволовые клетки, пригодные для применения в данном документе, включают клетки из клеточной линии J1 ES, клеточной линии 129J ES, клеточной линии стволовых клеток мышей D3 (Американская коллекция типовых культур), клеточных линий R1 или E14K, полученных от мышей 129/Sv, клеточных линий, полученных от мышей Balb/c и C57Bl/6, и эмбриональные стволовые клетки человека (например, из WiCell Research Institute, Висконсин, или ES cell International, Мельбурн, Австралия).
«Клетки T-клеточной линии дифференцировки» относятся к клеткам, у которых наблюдается по меньшей мере одна фенотипическая характеристика T-клетки или ее клетки ранней стадии дифференцировки или предшественника, которая отличает клетки от других лимфоидных клеток и клеток эритроидной или миелоидной линий дифференцировки. Такие фенотипические характеристики могут включать экспрессию одного или более белков, специфичных для T-клеток (например, CD3+, CD4+, CD8+), или физиологический, морфологический, функциональный или иммунологический признак, характерный для T-клетки. Например, клетками T-клеточной линии дифференцировки могут быть предшественники или клетки ранней стадии дифференцировки, коммитированные в направлении T-клеточной линии дифференцировки; незрелые и неактивированные CD25+ T-клетки; клетки, которые прошли коммитирование в направлении CD4 или CD8 линии дифференцировки; клетки-предшественники тимоциты, которые являются CD4+CD8+ дважды положительными; моноположительными CD4+ или CD8+; TCRαβ или TCRγδ или зрелые и функционально-способные или активированные T-клетки.
«Молекула нуклеиновой кислоты» или полинуклеотиды могут быть в форме РНК или ДНК, что включает кДНК, геномную ДНК и синтетическую ДНК. Молекула нуклеиновой кислоты может быть двунитевой или однонитевой и в случае однонитевой может представлять собой кодирующую нить или некодирующую (антисмысловую нить). Кодирующая молекула может иметь кодирующую последовательность, идентичную кодирующей последовательности, известной из уровня техники, или может иметь другую кодирующую последовательность, которая в результате избыточности или вырожденности генетического кода или в результате сплайсинга может кодировать тот же полипептид.
«Лечить», или «лечение», или «облегчение» относится к медицинскому контролю заболевания, нарушения или состояния у субъекта (например, человека или отличного от человека млекопитающего, такого как примат, лошадь, собака, мышь, крыса). В целом, соответствующую дозу или схему лечения, включающую клетку-хозяина, экспрессирующую Key-ChEM или T-ChARM по настоящему раскрытию, и необязательно вспомогательное средство, вводят/применяют в количестве, достаточном, чтобы вызвать терапевтическую или профилактическую пользу. Терапевтическая или профилактическая/предупредительная польза включает в себя улучшение клинического исхода; уменьшение или ослабление симптомов, ассоциированных с заболеванием; снижение степени проявления симптомов; улучшение качества жизни; более длительный период состояния без признаков заболевания; уменьшение степени заболевания, стабилизацию болезненного состояния; задержку прогрессирования заболевания; ремиссию; выживание; длительное выживание или любую их комбинацию.
Термин «терапевтически эффективное количество» или «эффективное количество» гибридного белка или клетки, экспрессирующей гибридный белок по настоящему раскрытию (например, Key-ChEM, T-ChARM), относится к такому количеству соединения или клеток, которое достаточно для получения облегчения одного или более симптомов заболевания, подлежащего лечению, статистически значимым образом. Когда речь идет об индивидуальном активном ингредиенте или клетке, экспрессирующей один активный ингредиент, вводимый отдельно, терапевтически эффективная доза относится только к эффектам такого ингредиента или клетки, экспрессирующей этот ингредиент. Когда речь идет о комбинации, терапевтически эффективная доза относится к объединенным количествам активных ингредиентов или объединенным вспомогательному активному ингредиенту с клеткой, экспрессирующей активный ингредиент, что приводит к терапевтическому эффекту при введении последовательно или одновременно. Еще одна комбинация может представлять собой клетку, экспрессирующую более одного активного ингредиента, как, например, два разных T-ChARM, T-ChARM и TCR, T-ChARM и CAR или их комбинации.
Дополнительные определения приводятся по всему настоящему раскрытию.
Key-ChEM и T-ChARM
В определенных аспектах настоящее раскрытие предусматривает одноцепочечный гибридный белок, называемый Key-ChEM, который содержит внеклеточный компонент и внутриклеточный компонент, соединенные гидрофобным участком, где внеклеточный компонент содержит кассету с меткой и соединительную область, содержащую шарнир, и где внутриклеточный компонент содержит эффекторный домен. В определенных вариантах осуществления соединительная область дополнительно содержит линкерный блок или одну или более кассет с метками, расположенных в пределах соединительной области. В определенных других вариантах осуществления одна или более кассет с метками соединены с соединительной областью при помощи линкерного блока.
В дополнительных вариантах осуществления Key-ChEM гибридный белок содержит от амино-конца к карбокси-концу: кассету с меткой, соединительную область, содержащую шарнир, гидрофобный участок и внутриклеточный компонент, содержащий эффекторный домен (см., например, фигуры 1 A и 1 B). В других дополнительных вариантах осуществления Key-ChEM гибридный белок содержит от амино-конца к карбокси-концу: первую соединительную область, кассету с меткой, вторую соединительную область, содержащую шарнир, гидрофобный участок и внутриклеточный компонент, содержащий эффекторный домен. В других дополнительных вариантах осуществления Key-ChEM гибридный белок содержит от амино-конца к карбокси-концу: первую кассету с меткой, первую соединительную область, вторую кассету с меткой, вторую соединительную область, содержащую шарнир, гидрофобный участок и внутриклеточный компонент, содержащий эффекторный домен (см., например, фигуру 1 C). В других дополнительных вариантах осуществления Key-ChEM гибридный белок содержит от амино-конца к карбокси-концу: первую кассету с меткой, первую соединительную область, вторую кассету с меткой, вторую соединительную область, третью кассету с меткой, третью соединительную область, содержащую шарнир, гидрофобный участок и внутриклеточный компонент, содержащий эффекторный домен (см., например, фигуру 1 D).
В других определенных вариантах осуществления Key-ChEM гибридный белок дополнительно содержит нековалентно ассоциированный домен связывания, такой как домен связывания, ассоциированный с кассетой с меткой (т. e. многоцепочечный T-ChARM). В других вариантах осуществления Key-ChEM нековалентно ассоциированный домен связывания является биспецифичным, где первая связывающая концевая часть является специфичной к кассете с меткой, а вторая связывающая концевая часть является специфичной к мишени, отличной от кассеты с меткой, или первая и вторая связывающие части обе являются специфичными к кассете с меткой. В других вариантах осуществления Key-ChEM нековалентно ассоциированный домен связывания является мультиспецифичным, где первая концевая часть связывается с кассетой с меткой, а вторая концевая часть является специфичной к одной или более мишеням, отличным от кассеты с меткой. В таких вариантах осуществления Key-ChEM содержит мультимерный белок. В некоторых вариантах осуществления такие Key-ChEM, содержащие один или более нековалентно ассоциированных доменов связывания, содержат гетеромультимеры.
В других аспектах настоящее раскрытие предусматривает одноцепочечный гибридный белок, называемый T-ChARM, который содержит внеклеточный компонент и внутриклеточный компонент, соединенные гидрофобным участком, где внеклеточный компонент содержит домен связывания, который специфически связывает мишень, кассету с меткой и соединительную область, содержащую шарнир, и где внутриклеточный компонент содержит эффекторный домен. В определенных вариантах осуществления домен связывания T-ChARM представляет собой scFv, scTCR, эктодомен рецептора или лиганд.
В дополнительных вариантах осуществления T-ChARM гибридный белок содержит от амино-конца к карбокси-концу: внеклеточный домен связывания, кассету с меткой, соединительную область, содержащую шарнир, гидрофобный участок и внутриклеточный компонент, содержащий эффекторный домен (см., например, фигуру 1E). В других дополнительных вариантах осуществления T-ChARM гибридный белок содержит от амино-конца к карбокси-концу: внеклеточный домен связывания, первую соединительную область, кассету с меткой, вторую соединительную область, содержащую шарнир, гидрофобный участок и внутриклеточный компонент, содержащий эффекторный домен. В других дополнительных вариантах осуществления T-ChARM гибридный белок содержит от амино-конца к карбокси-концу: внеклеточный домен связывания, первую кассету с меткой, первую соединительную область, вторую кассету с меткой, вторую соединительную область, содержащую шарнир, гидрофобный участок и внутриклеточный компонент, содержащий эффекторный домен. В других дополнительных вариантах осуществления T-ChARM гибридный белок содержит от амино-конца к карбокси-концу: внеклеточный домен связывания, первую кассету с меткой, первую соединительную область, вторую кассету с меткой, вторую соединительную область, третью кассету с меткой, третью соединительную область, содержащую шарнир, гидрофобный участок и внутриклеточный компонент, содержащий эффекторный домен.
В других определенных вариантах осуществления T-ChARM гибридный белок содержит от амино-конца к карбокси-концу: кассету с меткой, внеклеточный домен связывания, соединительную область, содержащую шарнир, гидрофобный участок и внутриклеточный компонент, содержащий эффекторный домен (см., например, фигуру 1 F). В других вариантах осуществления T-ChARM гибридный белок содержит от амино-конца к карбокси-концу: внеклеточный домен связывания scFv или scTCR, содержащий линкер вариабельной области, содержащий кассету с меткой, расположенную между вариабельными областями (например, на или ближе к N-концу линкера вариабельной области, на или ближе к C-концу линкера вариабельной области или встроенную ближе к середине линкера вариабельной области), соединительную область, содержащую шарнир, гидрофобный участок и внутриклеточный компонент, содержащий эффекторный домен Иллюстративная кассета с меткой, встроенная в линкер вариабельной области, содержит GGSGSG(X)nWSHPQFEKGSGSG (SEQ ID NO:45), где X является необязательным, может быть любой аминокислотой, и n равняется 0, 1, 2, 3, 4 или 5. В SEQ ID NO:54 присутствует такой линкер вариабельной области, имеющий встроенную метку, где n равняется 1, и X представляет собой аспарагин (N).
Key-ChEM или T-ChARM может быть связанным с клеткой (например, экспрессироваться на клеточной поверхности) или может быть в растворимой форме. В определенных вариантах осуществления молекулы нуклеиновой кислоты, кодирующие гибридные белки Key-ChEM или T-ChARM, могут быть кодон-оптимизированы для повышения или увеличения до максимума экспрессии в определенных типах клеток, таких как T-клетки (Scholten et al., Clin. Immunol. 119:135, 2006).
В других вариантах осуществления Key-ChEM или T-ChARM может дополнительно содержать цитотоксический компонент (например, химиотерапевтические лекарственные средства, такие как антимитотические (например, виндезин), антифолаты, алкилирующие средства (например, темозоломид), бактериальные токсины, рицин, противовирусные, радиоизотопы, радиоактивные металлы), которые пригодны для специфического уничтожения или повреждения раковой клетки, инфицированной клетки или другой пораженной болезнью клетки. В дополнительных вариантах осуществления Key-ChEM или T-ChARM может дополнительно содержать детектируемый компонент (например, биотин, флуоресцентную часть, радионуклид), который пригоден для отслеживания или визуализации раковых клеток, инфицированных клеток или других тканей (например, ткани, подвергающейся аутоиммунной атаке). В других дополнительных вариантах осуществления Key-ChEM или T-ChARM может дополнительно содержать функциональный компонент (например, иммуностимулирующую часть, цитокин, иммуномодулятор, белок иммуноглобулин или тому подобное).
Составные части гибридных белков по настоящему раскрытию дополнительно подробно описаны в данном документе.
Кассета с меткой
Кассета с меткой, содержащаяся в одноцепочечном гибридном белке согласно настоящему раскрытию (например, Key-ChEM или T-ChARM), будет представлять собой внеклеточный компонент, который может специфически связываться с родственным рецептором или партнером связывания (например, антителом) с высоким сродством или авидностью, где родственный рецептор или партнер связывания является гетерологичным или неэндогенным для хозяина или клетки, экспрессирующей Key-ChEM или T-ChARM. В пределах структуры одноцепочечного гибридного белка кассета с меткой может располагаться (a) непосредственно с амино-конца соединительной области, (b) быть помещена между линкерными блоками и соединять их, (c) непосредственно с карбокси-конца домена связывания, (d) быть помещена между доменом связывания (например, scFv) и эффекторным доменом и соединять их, (e) быть помещена между субъединицами домена связывания и соединять их или (f) на амино-конце одноцепочечного гибридного белка по настоящему раскрытию. В определенных вариантах осуществления одна или более соединительных аминокислот могут располагаться между и соединять кассету с меткой и гидрофобный участок, или располагаться между и соединять кассету с меткой и соединительную область, или располагаться между и соединять кассету с меткой и линкерный блок, или располагаться между и соединять кассету с меткой и домен связывания.
Иллюстративные кассеты с метками включают Strep-метку (которая относится к оригинальной Strep® метке, Strep® метке II или любому ее варианту; см., например, патент США № 7981632, Strep-метки из которого включены в данный документ посредством ссылки), His-метку, Flag-метку (SEQ ID NO:3), Xpress-метку (SEQ ID NO:4), Avi-метку (SEQ ID NO:5), кальмодулиновую метку (SEQ ID NO: 19), полиглутаматную метку, HA-метку (SEQ ID NO:6), Myc-метку (SEQ ID NO:7), Nus-метку, S-метку, SBP-метку, SofTag 1 (SEQ ID NO:9), SofTag 3 (SEQ ID NO:32), V5-метку (SEQ ID NO:8), CREB-связывающий белок (CBP), глутатион-S-трансферазу (GST), связывающий мальтозу белок (MBP), зеленый флуоресцентный белок (GFP), тиоредоксиновую метку или любую их комбинацию. В определенных вариантах осуществления кассета с меткой представляет собой Strep-метку с аминокислотной последовательностью Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID NO:1) или Trp-Arg-His-Pro-Gln-Phe-Gly-Gly (SEQ ID NO:2). В других вариантах осуществления кассета с меткой может представлять собой сконструированный способами генной инженерии сайт сродства, такой как минимальный сайт хелатирования (например, HGGHHG, SEQ ID NO:33).
Кассеты с метками могут присутствовать в нескольких копиях в гибридных белках по настоящему раскрытию. Например, гибридный белок по настоящему раскрытию может иметь одну, две, три, четыре или пять кассет с метками (например, Strep-меткой). В определенных вариантах осуществления соединительная область Key-ChEM или T-ChARM включает в себя одну кассету с меткой, две кассеты с метками, три кассеты с метками, четыре кассеты с метками или пять кассет с метками. Каждая из множества кассет с метками может быть такой же или отличной. Иллюстративные варианты осуществления включают в себя Key-ChEM или T-ChARM, имеющий Strep-метку и кассету со Strep-меткой, или His-метку и кассету со Strep-меткой, или HA-метку и кассету со Strep-меткой, или Myc-метку и кассету со Strep-меткой. В качестве альтернативы, Key-ChEM или T-ChARM будет иметь несколько кассет с метками одного типа или с одинаковой аминокислотной последовательностью, как, например, две, три, четыре или пять кассет со Strep-метками (например, Strep-меткой II).
Например, Key-ChEM или T-ChARM может иметь по меньшей мере две различные кассеты с метками. В некоторых вариантах осуществления первая кассета с меткой может обеспечивать сигнал стимуляции и отличная от нее вторая кассета с меткой может использоваться для ассоциации с проявляющим реагентом или ассоциации с конъюгатом антитело-токсин или с конъюгатом антитело-визуализирующее средство. В дополнительных вариантах осуществления две или более первых кассет с метками могут располагаться в разных областях Key-ChEM или T-ChARM. В определенных вариантах осуществления первая кассета с меткой располагается в соединительной области, и вторая кассета с меткой располагается на амино-конце или карбокси-конце или на том и другом Key-ChEM или T-ChARM (см., например, фигура 1 H).
В определенных вариантах осуществления кассета с меткой содержит от приблизительно пяти до приблизительно 500 аминокислот, или от приблизительно шести до приблизительно 100 аминокислот, или от приблизительно семи до приблизительно 50 аминокислот, или от приблизительно восьми до приблизительно 20 аминокислот. В некоторых вариантах осуществления кассета с меткой имеет от семи до десяти аминокислот. Предпочтительно, кассета с меткой является неиммуногенной или минимально иммуногенной. По сути, кассета с меткой может функционировать в качестве идентификатора или маяка для обеспечения идентификации, накопления, отделения, стимуляции пролиферации, активации, отслеживания или устранения клеток, экспрессирующих Key-ChEM или T-ChARM.
В определенных вариантах осуществления кассета с меткой располагается в соединительной области гибридного белка по настоящему раскрытию. Например, соединительная область может дополнительно содержать линкерный блок, смежный с кассетой с меткой, где линкерный блок с кассетой с меткой имеет аминокислотную последовательность (Gly-Gly-Gly-Gly-Ser)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID NO:20), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(Gly-Gly-Gly-Gly-Ser)2 (SEQ ID NO:21), (Gly-Gly-Gly-Gly-Ser)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(Gly-Gly-Gly-Ser)2-Gly-Gly-Ser-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID NO:22), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(Gly-Gly-Gly-Ser)2-Gly-Gly-Ser-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(Gly-Gly-Gly-Gly-Ser)2 (SEQ ID NO:23), (Gly-Gly-Gly-Gly-Ser)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(Gly-Gly-Gly-Ser)2-Gly-Gly-Ser-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(Gly-Gly-Gly-Gly-Ser)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID NO:24) или Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(Gly-Gly-Gly-Gly-Ser)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(Gly-Gly-Gly-Ser)2-Gly-Gly-Ser-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(Gly- Gly-Gly-Gly-Ser)2 (SEQ ID NO:25).
Одноцепочечный гибридный белок, содержащий одну или более кассет с метками, описываемых в данном документе, будет способен ассоциироваться с родственным партнером связывания, где родственный партнер связывания является гетерологичным для хозяина или клетки, экспрессирующей гибридный белок, содержащий кассету с меткой, описываемую в данном документе. В определенных вариантах осуществления кассета с меткой, присутствующая в одноцепочечном Key-ChEM или T-ChARM по настоящему раскрытию, представляет собой Strep-метку, использующую стрептавидин, стрептактин или и то, и другое в качестве родственного партнера связывания, или распознается антителами, специфичными к Strep-метке. В определенных вариантах осуществления родственный партнер связывания (например, рецептор, белок, антитело) может быть растворимым, частью матричной композиции или конъюгированным с твердой поверхностью (например, планшетом, гранулой). Иллюстративные твердые поверхности включают гранулы и частицы (например, микро- и нано-), такие как магнитные гранулы и частицы.
В вариантах осуществления одноцепочечного гибридного белка T-ChARM белковый комплекс может образовываться между гибридным белком и родственным партнером связывания для кассеты с меткой, который является результатом связывания между кассетой с меткой и партнером связывания. В определенных вариантах осуществления T-ChARM содержит домен связывания scFv или scTCR, где кассета с меткой расположена в линкере вариабельной области (между субъединицами домена связывания). В других вариантах осуществления T-ChARM содержит кассету с меткой, расположенную на амино-конце домена связывания. В таких белковых комплексах или структурах гибридного белка домен связывания T-ChARM будет сохранять свою специфичность по отношению к мишени или свое специфическое сродство связывания мишени.
Соединительная область и шарнир
Соединительная область, содержащая шарнир, в одноцепочечном гибридном белке согласно настоящему раскрытию может располагаться (a) непосредственно с амино-конца от гидрофобного участка, (b) быть вставленной между кассетой с меткой (например, Strep-меткой) и эффекторным доменом и соединять их, (c) непосредственно с карбокси-конца от домена связывания или (d) быть вставленной между линкерным блоком и эффекторным доменом и соединять их. Одноцепочечный гибридный белок, содержащий соединительную область с шарниром, описываемый в данном документе, будет способен ассоциироваться с другим одноцепочечным гибридным белком с образованием димера (например, гомодимера или гетеродимера), где димер Key-ChEM или T-ChARM будет содержать одну или более кассет с метками, способных к связыванию родственного партнера связывания, и димер T-ChARM будет дополнительно содержать домен связывания, который сохраняет свою специфичность по отношению к мишени или свое специфическое сродство связывания мишени.
Соединительная область может состоять только из шарнира, только из линкерных блоков, из шарнира и линкерных блоков или из шарнира, одного или более линкерных блоков и одной или более кассет с метками. В определенных вариантах осуществления линкерные блоки содержат от приблизительно двух до приблизительно 20 аминокислот, которые образуют гибкую структуру. Иллюстративные линкерные блоки включают CH2CH3 иммуноглобулина, CH3 иммуноглобулина или один или более GlyxSery, где x и y независимо являются целыми числами от 0 до 10 при условии, что x и y оба не равняются 0 (например, (Gly4Ser)2 (SEQ ID NO:67), (Gly3Ser)2 (SEQ ID NO:68), Gly2Ser или их комбинация, как например (Gly3Ser)2Gly2Ser) (SEQ ID NO:69). В дополнительных вариантах осуществления соединительная область содержит кассету с меткой. Например, соединительная область включает от одной до пяти кассет с метками, где каждая кассета с меткой соединяется с одним или двумя линкерными блоками, содержащими (GlyxSery)n, где n является целым числом от 1 до 10, и x и y независимо являются целыми числами от 0 до 10 при условии, что x и y оба не равняются 0. Иллюстративные линкерные блоки характеризуются аминокислотной последовательностью Gly-Gly-Gly-Gly-Ser (SEQ ID NO:10), (Gly-Gly-Gly-Gly-Ser)2 (SEQ ID NO:11), (Gly-Gly-Gly-Ser)2-Gly-Gly-Ser (SEQ ID NO:12), которая может присутствовать в любой комбинации в пределах соединительной области.
В определенных вариантах осуществления шарнир, присутствующий в одноцепочечном Key-ChEM или T-ChARM по настоящему раскрытию, может быть шарнирной областью иммуноглобулина, такой как шарнирная область иммуноглобулина дикого типа или измененная шарнирная область иммуноглобулина. В определенных вариантах осуществления шарнир представляет собой шарнирную область человеческого иммуноглобулина дикого типа. В других определенных вариантах осуществления один или более аминокислотных остатков можно добавлять с амино- или карбокси-конца шарнирной области иммуноглобулина дикого типа как часть модели конструкции гибридного белка. Например, один, два или три дополнительных соединительных аминокислотных остатка могут присутствовать на амино-конце или карбокси-конце шарнира, или шарнир может содержать концевую или внутреннюю делецию и иметь добавление одного, двух или трех дополнительных соединительных аминокислотных остатков.
В определенных вариантах осуществления шарнир представляет собой измененный шарнир иммуноглобулина, в котором один или более цистеиновых остатков в шарнирной области иммуноглобулина дикого типа замещены одним или более другими аминокислотными остатками. Иллюстративные измененные шарниры иммуноглобулина включают шарнирную область иммуноглобулина IgG1, IgG2 или IgG4 человека, имеющую один, два или три цистеиновых остатка, обнаруженных в шарнире человеческого IgG1, IgG2 или IgG4 дикого типа, замещенных одним, двумя или тремя отличными аминокислотными остатками (например, серином или аланином). В определенных вариантах осуществления шарнирный полипептид содержит или является последовательностью, которая по меньшей мере на 80%, по меньшей мере на 81%, по меньшей мере на 82%, по меньшей мере на 83%, по меньшей мере на 84%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% идентична шарнирной области иммуноглобулина дикого типа, такой как шарнир человеческого IgG1 дикого типа, шарнир человеческого IgG2 дикого типа или шарнир человеческого IgG4 дикого типа.
В дополнительных вариантах осуществления шарнир, присутствующий в одноцепочечном Key-ChEM или T-ChARM по настоящему раскрытию, может представлять собой шарнир, который не основан или не получен из шарнира иммуноглобулина (т. e. шарнир не иммуноглобулина дикого типа или измененный шарнир не иммуноглобулина). Примеры таких шарниров включают пептиды, содержащие от приблизительно пяти до приблизительно 150 аминокислот стволовой области C-лектинов II типа или молекул CD, в том числе пептиды, содержащие от приблизительно восьми до приблизительно 25 аминокислот, или пептиды, содержащие от приблизительно семи до приблизительно 18 аминокислот, или их варианты.
«Стволовая область» молекулы С-лектина II типа или CD относится к части внеклеточного домена молекулы С-лектина II типа или CD, которая располагается между доменом, подобным лектину C-типа (CTLD; например, подобным CTLD рецепторов натуральных клеток-киллеров), и гидрофобным участком (трансмембранным доменом). Например, внеклеточный домен CD94 человека (номер доступа в GenBank AAC50291.1) соответствует аминокислотным остаткам 34-179, но CTLD соответствует аминокислотным остаткам 61-176, так что стволовая область молекулы CD94 человека содержит аминокислотные остатки 34-60, которые располагаются между гидрофобным участком (трансмембранным доменом) и CTLD (см. Boyington et al., Immunity 10:75, 1999; в отношении описания других стволовых областей см. также Beavil et al., Proc. Nat’l. Acad. Sci. USA 89:753, 1992 и Figdor et al., Nat. Rev. Immunol. 2:77, 2002). Эти молекулы С-лектина II типа или CD могут также иметь соединительные аминокислоты между стволовой областью и трансмембранной областью или CTLD. В другом примере белок NKG2A человека (номер доступа в GenBank P26715.1) из 233 аминокислот имеет гидрофобный участок (трансмембранный домен) в пределах аминокислот 71-93 и внеклеточный домен в пределах аминокислот 94-233. CTLD включает в себя аминокислоты 119-231, и стволовая область включает в себя аминокислоты 99-116, которые могут фланкироваться дополнительными соединительными аминокислотами. Другие молекулы С-лектина II типа или CD, а также их внеклеточные лиганд-связывающие домены, стволовые области и CTLD, известны из уровня техники (см., например, номера доступа в GenBank NP 001993.2; AAH07037.1; NP_001773.1; AAL65234.1; CAA04925.1 для последовательностей CD23, CD69, CD72, NKG2A и NKG2D человека и их описаний соответственно).
«Производное» шарнира стволовой области или его фрагмента из молекулы С-лектина II типа или CD включает в себя последовательность, содержащую от приблизительно восьми до приблизительно 150 аминокислот, в которой одна, две или три аминокислоты стволовой области молекулы С-лектина II типа или CD дикого типа имеют делецию, вставку, замену или любую их комбинацию. Например, производное может содержать одну или более аминокислотных замен и/или аминокислотную делецию. В определенных вариантах осуществления производное стволовой области является более устойчивым к протеолитическому расщеплению по сравнению с последовательностью стволовой области дикого типа, как, например, полученная из аминокислот от приблизительно восьми до приблизительно 20 аминокислот из NKG2A, NKG2D, CD23, CD64, CD72 или CD94.
В определенных вариантах осуществления шарниры стволовой области могут содержать от приблизительно семи до приблизительно 18 аминокислот и могут образовывать α-спиральную суперспиральную структуру. В определенных вариантах осуществления шарниры стволовой области содержат 0, 1, 2, 3 или 4 цистеина. Иллюстративные шарниры стволовых областей включают фрагменты стволовых областей, такие как части, содержащие от приблизительно десяти до приблизительно 150 аминокислот из стволовых областей из CD69, CD72, CD94, NKG2A и NKG2D.
Альтернативные шарниры, которые можно использовать в одноцепочечных Key-ChEM или T-ChARM по настоящему раскрытию, происходят из частей рецепторов клеточной поверхности (междоменных областей), которые соединяют иммуноглобулин-подобные V-домены или иммуноглобулин-подобные C-домены. Области между Ig-подобными V-доменами, где рецептор клеточной поверхности содержит несколько Ig-подобных V-доменов последовательно, и между Ig-подобными C-доменами, где рецептор клеточной поверхности содержит несколько последовательно расположенных Ig-подобных C-областей, также рассматриваются как шарниры, пригодные в одноцепочечных Key-ChEM или T-ChARM по настоящему раскрытию. В определенных вариантах осуществления шарнирные последовательности, состоящие из междоменных областей рецептора клеточной поверхности, могут дополнительно содержать встречающийся в природе или добавленный мотив, такой как коровая шарнирная последовательность IgG, с обеспечением одной или более дисульфидных связей для стабилизации образования димера Key-ChEM или T-ChARM. Примеры шарниров, включают медждоменные области между Ig-подобными V- и Ig-подобными C-областями из CD2, CD4, CD22, CD33, CD48, CD58, CD66, CD80, CD86, CD150, CD 166 или CD244.
В определенных вариантах осуществления шарнирные последовательности имеют от приблизительно 5 до приблизительно 150 аминокислот, от приблизительно 5 до приблизительно 10 аминокислот, от приблизительно 10 до приблизительно 20 аминокислот, от приблизительно 20 до приблизительно 30 аминокислот, от приблизительно 30 до приблизительно 40 аминокислот, от приблизительно 40 до приблизительно 50 аминокислот, от приблизительно 50 до приблизительно 60 аминокислот, от приблизительно 5 до приблизительно 60 аминокислот, от приблизительно 5 до приблизительно 40 аминокислот, например от приблизительно 8 до приблизительно 20 аминокислот или от приблизительно 10 до приблизительно 15 аминокислот. Шарниры могут быть в основном гибкими, но могут также обеспечивать более жесткие характеристики или могут содержать, главным образом, α-спиральную структуру с минимальным содержанием β-листовой структуры.
В определенных вариантах осуществления шарнирная последовательность является стабильной в плазме и сыворотке и устойчива к протеолитическому расщеплению. Например, первый лизин в верхней шарнирной области IgG1 может быть подвергнут мутации или удален для сведения к минимуму степени протеолитического расщепления, и шарниры могут включать в себя соединительные аминокислоты. В некоторых вариантах осуществления шарнирная последовательность может содержать встречающийся в природе или добавленный мотив, такой как коровая структура шарнира иммуноглобулина CPPCP (SEQ ID NO:26), который придает способность к формированию дисульфидной связи или нескольких дисульфидных связей для стабилизации образования димера.
Гидрофобный участок
Гидрофобный участок, содержащийся в одноцепочечном гибридном белке по настоящему раскрытию (например, Key-ChEM или T-ChARM), позволит гибридному белку данного раскрытия ассоциироваться с клеточной мембраной таким образом, что часть гибридного белка будет располагаться внеклеточно (например, кассета с меткой, соединительная область, домен связывания), а часть будет располагаться внутриклеточно (например, эффекторный домен). Гидрофобный участок, как правило, будет располагаться в пределах фосфолипидного бислоя клеточной мембраны. В определенных вариантах осуществления одна или более соединительных аминокислот могут располагаться между и соединять гидрофобный участок и эффекторный домен, или располагаться между и соединять гидрофобный участок и соединительную область, или располагаться между и соединять гидрофобный участок и кассету с меткой.
В определенных вариантах осуществления гидрофобный домен представляет собой трансмембранный домен, как, например, полученный из интегрального мембранного белка (например, рецептора, молекулы кластера дифференцировки (CD), фермента, переносчика, молекулы клеточной адгезии и тому подобного). В конкретных вариантах осуществления гидрофобный участок представляет собой трансмембранный домен из CD4, CD8, CD27 или CD28. В определенных вариантах осуществления трансмембранный домен представляет собой трансмембранный домен из CD28 с аминокислотной последовательностью, изложенной под SEQ ID NO:16.
Эффекторный домен
Эффекторный домен, содержащийся в одноцепочечном гибридном белке по настоящему раскрытию (например, Key-ChEM или T-ChARM), будет представлять собой внутриклеточный компонент и будет способен передавать функциональные сигналы в клетку. В определенных вариантах осуществления одноцепочечный Key-ChEM или T-ChARM будет димеризоваться со вторым одноцепочечным Key-ChEM или T-ChARM соответственно, где димеризация позволяет внутриклеточному компоненту, содержащему эффекторный домен, находиться в непосредственной близости и стимулировать сигнальную трансдукцию при воздействии подходящего сигнала. В дополнение к образованию таких димерных белковых комплексов эффекторные домены могут дополнительно ассоциироваться с другими сигнальными факторами, такими как костимулирующие факторы, с образованием комплексов из нескольких белков, которые вызывают внутриклеточный сигнал. В определенных вариантах осуществления эффекторный домен будет опосредованно стимулировать клеточный ответ путем ассоциации с одним или более другими белками, которые непосредственно стимулируют клеточный ответ. Эффекторный домен может включать в себя один, два, три или более рецепторных сигнальных домена, костимулирующих домена или их комбинации. Любой внутриклеточный компонент, содержащий эффекторный домен, костимулирующий домен или и то, и другое из любой из множества сигнальных молекул (например, рецепторов сигнальной трансдукции), можно использовать в гибридных белках по настоящему раскрытию.
Эффекторный домен, пригодный в гибридных белках по настоящему раскрытию, может быть из белка сигнального пути Wnt (например, LRP, Ryk, ROR2), сигнального пути NOTCH (например, NOTCH1, NTOCH2, NOTCH3, NOTCH4), сигнального пути Hedgehog (например, PTCH, SMO), рецепторных тирозинкиназ (RTK) (например, семейства рецепторов эпидермального фактора роста (EGF), семейства рецепторов фактора роста фибробластов (FGF), семейства рецепторов фактора роста гепатоцитов (HGF), семейства инсулиновых рецепторов (IR), семейства рецепторов тромбоцитарного фактора роста (PDGF), семейства рецепторов фактора роста эндотелия сосудов (VEGF), семейства рецепторов тропомицин-рецепторной киназы (Trk), семейства рецепторов эфрина (Eph), семейства рецепторов AXL, семейства рецепторов тирозинкиназы лейкоцитов (LTK), семейства рецепторов тирозинкиназы с иммуноглобулиноподобными и EGF-подобными доменами 1 (TIE), семейства орфанных рецепторов, подобных рецепторной тирозинкиназе (ROR), семейства рецепторов дискоидинового домена (DDR), семейства рецепторов с перестройкой во время трансфекции (RET), семейства рецепторов, подобных тирозиновой протеинкиназе (PTK7), семейства рецепторов, родственных рецепторной тирозинкиназе (RYK), семейства рецепторов специфической мышечной киназы (MuSK)); G-белок-связанных рецепторов, GPCR (Frizzled, Smoothened); серин/треонинкиназных рецепторов (BMPR, TGFR) или цитокиновых рецепторов (IL1R, IL2R, IL7R, IL15R).
В определенных вариантах осуществления эффекторный домен содержит сигнальный домен рецептора лимфоцитов или содержит аминокислотные последовательности с одним или множеством активационных тирозинсодержащих мотивов иммунорецепторов (ITAM). В других дополнительных вариантах осуществления эффекторный домен содержит цитоплазматический участок, который ассоциирован с цитоплазматическим сигнальным белком, где цитоплазматический сигнальный белок представляет собой рецептор лимфоцитов или его сигнальный домен, белок, содержащий множество ITAM, костимулирующий фактор или любую их комбинацию.
Иллюстративные эффекторные домены включают полученные из 4-1BB (например, SEQ ID NO:17), CD3ε, CD3δ, CD3ζ (например, SEQ ID NO:18), CD27, CD28 (например, SEQ ID NO:35), CD79A, CD79B, CARD11, DAP10, FcRα, FcRβ, FcRγ, Fyn, HVEM, ICOS, Lck, LAG3, LAT, LRP, NOTCH1, Wnt, NKG2D, OX40, ROR2, Ryk, SLAMF1, Slp76, pTα, TCRα, TCRβ, TRIM, Zap70, PTCH2 или любую их комбинацию.
В конкретных вариантах осуществления эффекторный домен Key-ChEM или T-ChARM по настоящему раскрытию представляет собой CD3ζ и CD28, представляет собой CD3ζ и 4-1BB или представляет собой CD3ζ, CD28 и 4-1BB.
Домен связывания
Описываемый в данном документе одноцепочечный гибридный белок T-ChARM по настоящему раскрытию содержит домен связывания, который специфически связывает мишень. Связывание мишени доменом связывания может блокировать взаимодействие между мишенью (например, рецептором или лигандом) и другой молекулой и, например, вмешиваться в, уменьшать или устранять определенные функции мишени (например, сигнальную трансдукцию), или связывание мишени может индуцировать определенные биологические пути или идентифицировать мишень для устранения.
Домен связывания может быть любым пептидом, который специфически связывает представляющую интерес мишень. Источники доменов связывания включают вариабельные области антител от различных видов (которые могут быть в форме антител, sFv, scFv, Fab, «grababody» на основе scFv или растворимых VH-доменов или доменных антител), в том числе человека, грызунов, птиц или овец. Дополнительные источники доменов связывания включают вариабельные области антител от разных видов, таких как верблюдовые (от верблюдов, дромадеров или лам; Ghahroudi et al., FEBS Lett. 414:521, 1997; Vincke et al.,J. Biol. Chem. 284:3273, 2009; Hamers- Casterman et al., Nature 363:446, 1993 и Nguyen et al., J. Mol. Biol. 275:413, 1998), акулы-няньки (Roux et al., Proc. Nat'l. Acad. Sci. (USA) 95:11804, 1998), американский гидролаг (Nguyen et al., Immunogen. 54:39, 2002) или миноговые (Herrin et al., Proc. Nat'l. Acad. Sci. (USA) 105:2040, 2008 и Alder et al. Nat. Immunol. 9:319, 2008). Эти антитела могут образовывать антиген-связывающие области с использованием только вариабельной области тяжелой цепи, т. e. эти функциональные антитела являются гомодимерами только тяжелых цепей (называемые «антителами, состоящими только из тяжелых цепей») (Jespers et al., Nat. Biotechnol. 22:1161, 2004; Cortez-Retamozo et al., Cancer Res. 64:2853, 2004; Baral et al., Nature Med. 12:580, 2006 и Barthelemy et al., J. Biol. Chem. 283:3639, 2008).
Альтернативные источники доменов связывания по настоящему раскрытию включают в себя последовательности, которые кодируют случайные пептидные библиотеки, или последовательности, которые кодируют сконструированное многообразие аминокислот в областях петли альтернативных, отличных от антител каркасов, таких как scTCR (см., например, Lake et al., Int. Immunol.11:745, 1999; Maynard et al., J. Immunol. Methods 306:51, 2005; патент США № 8361794), домены фибриногена (см., например, Weisel et al., Science 230:1388, 1985), домены Kunitz (см., например, патент США № 6423498), смоделированные белки анкириновых повторов (DARPin) (Binz et al., J. Mol. Biol. 332:489, 2003 и Binz et al., Nat. Biotechnol. 22:575, 2004), фибронектин-связывающие домены (аднектины или монотела) (Richards et al., J. Mol. Biol. 326:1475, 2003; Parker et al., Protein Eng. Des. Selec. 18:435, 2005 и Hackel et al. (2008) J. Mol. Biol. 381:1238-1252), минибелки с цистеиновыми узлами (Vita et al. (1995) Proc. Nat'l. Acad. Sci. (USA) 92:6404-6408; Martin et al. (2002) Nat. Biotechnol. 21:71, 2002 и Huang et al. (2005) Structure 13:755, 2005), домены тетратрикопептидных повторов (Main et al., Structure 11:497, 2003 и Cortajarena et al., ACS Chem. Biol. 3:161, 2008), домены богатых лейцином повторов (Stumpp et al.,J. Mol. Biol. 332:471, 2003), липокалиновые домены (см., например, WO 2006/095164, Beste et al., Proc. Nat'l. Acad. Sci. (USA) 96:1898, 1999 и Schönfeld et al., Proc. Nat'l. Acad. Sci. (USA) 106:8198, 2009), V-подобные домены (см., например, публикацию заявки на выдачу патента США 2007/0065431), лектиновые домены C-типа (Zelensky and Gready, FEBS J. 272:6179, 2005; Beavil et al., Proc. Nat'l. Acad. Sci. (USA) 89:753, 1992 и Sato et al., Proc. Nat'l. Acad. Sci. (USA) 100:7779, 2003), mAb2 или Fcab™ (см., например, публикации PCT-заявок на выдачу патентов №№ WO 2007/098934; WO 2006/072620), белки с повторами армадилло (см., например, Madhurantakam et al., Protein Sci. 21:1015, 2012; публикация PCT-заявки на выдачу патента № WO 2009/040338), аффилин (Ebersbach et al., J. Mol. Biol. 372:172, 2007), аффитело, авимеры, ноттины, финомеры, атримеры, белок-4, ассоциированный с цитотоксическим Т-лимфоцитом (Weidle et al., Cancer Gen. Proteo. 10:155, 2013) или подобные (Nord et al., Protein Eng. 8:601, 1995; Nord et al., Nat. Biotechnol. 15:772, 1997; Nord et al., Euro. J. Biochem. 268:4269, 2001; Binz et al., Nat. Biotechnol. 23:1257, 2005; Boersma and Pluckthun, Curr. Opin. Biotechnol. 22:849, 2011).
Домены связывания по настоящему раскрытию можно получать как описано в данном документе или с помощью различных способов, известных из уровня техники (см., например, патенты США №№ 6291161 и 6291158). Например, домены связывания по настоящему раскрытию могут быть идентифицированы путем скрининга фаговой библиотеки Fab для Fab-фрагментов, которые специфически связываются с представляющей интерес мишенью (см. Hoet et al., Nat. Biotechnol. 23:344, 2005). Кроме того, общепринятые стратегии получения гидридом с использованием представляющей интерес мишени в качестве иммуногена в подходящих системах (например, мышах, HuMAb mouse®, TC mouse™, KM-mouse®, ламах, курах, крысах, хомячках, кроликах и др.) можно использовать для создания доменов связывания по настоящему раскрытию.
В некоторых вариантах осуществления домен связывания представляет собой одноцепочечный Fv-фрагмент (scFv), который содержит области VH и VL, специфичные к представляющей интерес мишени. В определенных вариантах осуществления области VH и VL являются человеческими. Иллюстративные области VH и VL включают в себя сегменты специфичного моноклонального антитела к CD19, FMC63, (см., например, SEQ ID NO:51 и 52 соответственно).
В определенных вариантах осуществления домен связывания содержит или представляет собой последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентична аминокислотной последовательности вариабельной области легкой цепи (VL) (например, из FMC63, SEQ ID NO:52; из R12, SEQ ID NO:56) или вариабельной области тяжелой цепи (VH) (например, из FMC63, SEQ ID NO:51; из R12, SEQ ID NO:55) или обеим, где каждый CDR содержит ноль изменений или не более одного, двух или трех изменений по сравнению с моноклональным антителом или его фрагментом или производным, которое специфически связывается с представляющей интерес мишенью (например, CD 19, ROR1).
В определенных вариантах осуществления VH-область домена связывания по настоящему раскрытию может быть получена из или на основе VH известного моноклонального антитела и может содержать одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) вставок, одну или более (например, 2, 3, 4, 5, 6, 7,8, 9, 10) делеций, одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) аминокислотных замен (например, консервативных аминокислотных замен или неконсервативных аминокислотных замен) или комбинацию вышеуказанных изменений по сравнению с VH известного моноклонального антитела. Вставка, делеция или замена может находиться в любом месте в VH-области, в том числе на амино- или карбокси-конце или на обоих концах данной области, при условии, что каждый CDR содержит ноль изменений или не более одного, двух или трех изменений, и при условии, что домен связывания, содержащий модифицированную VH-область, по-прежнему может специфически связывать свою мишень со сродством, подобным сродству домена связывания дикого типа.
В дополнительных вариантах осуществления VL-область в домене связывания по настоящему раскрытию получают из или на основе VL известного моноклонального антитела, и она содержит одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) вставок, одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) делеций, одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) аминокислотных замен (например, консервативных аминокислотных замен) или комбинацию вышеуказанных изменений по сравнению с VL известного моноклонального антитела. Вставка, делеция или замена может находиться в любом месте VL-области, в том числе на амино- или карбокси-конце или на обоих концах данной области, при условии, что каждый CDR содержит ноль изменений или не более одного, двух или трех изменений, и при условии, что домен связывания, содержащий модифицированную VL-область, по-прежнему может специфически связывать свою мишень со сродством, подобным сродству домена связывания дикого типа.
VH- и Vl-домены могут располагаться в любой ориентации (т. e. от амино-конца к карбокси-концу, VH-VL или VL-VH) и могут соединяться аминокислотной последовательностью (например, имеющей длину от приблизительно пяти до приблизительно 35 аминокислот), способной обеспечивать спейсерную функцию, так что два субдомена связывания могут взаимодействовать с образованием функционального домена связывания. В определенных вариантах осуществления линкер вариабельной области, который соединяет домены VH и VL, включает в себя относящиеся к семейству (GlynSer), такие как (Gly3Ser)n(Gly4Ser)1 (SEQ ID NO:72), (Gly3Ser)1(Gly4Ser)n (SEQ ID NO:72), (Gly3Ser)n(Gly4Ser)n (SEQ ID NO:72) или (Gly4Ser)n (SEQ ID NO:10), где n представляет собой целое число от 1 до 5. В определенных вариантах осуществления линкер представляет собой (Gly-Gly-Gly-Gly-Ser)3 (SEQ ID NO:13) или Gly-Gly-Gly-Ser)4 (SEQ ID NO:14). В определенных вариантах осуществления эти линкеры на основе (GlynSer) используются для связи доменов VH и VL в домене связывания, и эти линкеры могут также использоваться для связи домена связывания с соединительной областью или с кассетой с меткой или для связи кассеты с меткой с эффекторным доменом. В определенных других вариантах осуществления кассета с меткой представляет собой часть или располагается в пределах линкера на основе (GlynSer), используемого для связи доменов VH и VL в домене связывания. В других дополнительных вариантах осуществления линкер на основе (GlynSer) может использоваться для соединения одной или более кассет с метками с N-концевой частью домена связывания T-ChARM.
В некоторых вариантах осуществления домен связывания представляет собой одноцепочечный T-клеточный рецептор (scTCR), содержащий цепи Vα/β и Cα/β (например, Vα-Cα, Vβ-Cβ, Vα-Vβ) или содержащий пару Vα-Cα, Vβ-Cβ, Vα-Vβ, специфичную к представляющей интерес мишени (например, комплексу пептид-MHC).
В определенных вариантах осуществления домен связывания содержит или представляет собой последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентична аминокислотной последовательности Vα, Vβ, Cα или Cβ TCR, где каждый CDR содержит ноль изменений или не более одного, двух или трех изменений, из TCR или его фрагмента или производного, которое специфически связывается с представляющей интерес мишенью.
В определенных вариантах осуществления Vα, Vβ, Cα или Cβ-область домена связывания по настоящему раскрытию может быть получена из или на основании Vα, Vβ, Cα или Cβ из известного TCR (например, TCR с высоким сродством) и содержать одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) вставок, одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) делеций, одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) аминокислотных замен (например, консервативных аминокислотных замен или неконсервативных аминокислотных замен) или комбинацию вышеуказанных изменений по сравнению с Vα, Vβ, Cα или Cβ из известного TCR. Вставка, делеция или замена может находиться в любом месте в Vα, Vβ, Cα или Cβ-области, в том числе на амино- или карбокси-конце или на обоих концах данной области, при условии, что каждый CDR содержит ноль изменений или не более одного, двух или трех изменений, и при условии, что домен связывания, содержащий модифицированную Vα-, Vβ-, Cα- или Cβ-область, по-прежнему может специфически связывать свою мишень со сродством, подобным сродству дикого типа.
Целевая молекула, которая специфически связывается доменом связывания, содержащимся в одноцепочечном гибридном белке T-ChARM по настоящему раскрытию, может находиться на представляющей интерес клетке или в ассоциации с ней («целевая клетка»). Иллюстративные целевые клетки включают в себя раковую клетку, клетку, связанную с аутоиммунным заболеванием или нарушением или с воспалительным заболеванием или нарушением, и инфекционные организм или клетку (например, бактерию, вирус, инфицированную вирусом клетку). Клетка инфекционного организма, такого как паразит млекопитающего, также предусматривается в качестве целевой клетки.
В определенных вариантах осуществления домены связывания одноцепочечного гибридного белка T-ChARM по настоящему раскрытию распознают мишень, выбранную из антигена опухоли, В-клеточной мишени, представителя суперсемейства рецепторов TNF, представителя семейства Hedgehog, рецепторной тирозинкиназы, протеогликан-родственной молекулы, представителя суперсемейства TGF-β, Wnt-связанной молекулы, T-клеточной мишени, мишени, представляющей собой дендритную клетку, мишени, представляющей собой NK-клетку, мишени, представляющей собой моноцитарную/макрофагальную клетку, или ангиогенной мишени. В дополнительных вариантах осуществления домены связывания одноцепочечного гибридного белка T-ChARM по настоящему раскрытию связывают рецепторный белок, такой как периферические мембранные рецепторные белки или трансмембранные рецепторные белки.
В определенных вариантах осуществления одноцепочечный гибридный белок T-ChARM по настоящему раскрытию специфически связывает мишень, такую как CD3, CEACAM6, c-Met, EGFR, EGFRvIII, ErbB2, ErbB3, ErbB4, EphA2, IGF1R, GD2, O-ацетил-GD2, O-ацетил-GD3, GHRHR, GHR, FFT1, KDR, FFT4, CD44v6, CD151, CA125, CEA, CTLA-4, GITR, BTLA, TGFBR2, TGFBR1, IL6R, gp130, Lewis A, Lewis Y, TNFR1, TNFR2, PD1, PD-L1, PD-L2, HVEM, MAGE-A, мезотелин, NY-ESO-1, PSMA, RANK, ROR1, TNFRSF4, CD40, CD137, TWEAK-R, HLA, пептиды, полученные из опухоли или патогена, связанные с HLA (такие как из hTERT, тирозиназы или WT-1), LTβR, LIFRβ, LRP5, MUC1, OSMRβ, TCRα, TCRβ, CD19, CD20, CD22, CD25, CD28, CD30, CD33, CD52, CD56, CD80, CD81, CD86, CD123, CD171, CD276, B7H4, TLR7, TLR9, PTCH1, PTCH1, Robo1, α-фетопротеин (AFP), Frizzled, OX40 (также называемый CD134) или CD79b. В определенных вариантах осуществления одноцепочечный гибридный белок T-ChARM по настоящему раскрытию специфически связывает патоген-специфичную молекулу, экспрессированную на инфицированных клетках, такую как молекулы из аденовируса, буньявируса, герпесвируса (например, вируса Эпштейна-Барра, цитомегаловируса), паповавируса, папилломавируса (например, вируса папилломы человека, HPV), парамиксовируса, пикорнавируса, рабдовируса (например, вируса бешенства), ортомиксовируса (например, вируса гриппа), поксивируса (например, вируса коровьей оспы), реовируса, ретровируса, лентивируса (например, вируса иммунодефицита человека, HIV), флавивируса (например, вируса гепатита C, HCV; вируса гепатита B, HBV).
Клетки-хозяева и нуклеиновые кислоты
В определенных аспектах настоящее раскрытие предусматривает молекулы нуклеиновых кислот, которые кодируют любой один или более из Key-ChEM или T-ChARM, описанных в данном документе. Такие молекулы нуклеиновых кислот могут быть вставлены в соответствующий вектор (например, вирусный вектор или невирусный плазмидный вектор) для введения в клетку-хозяина, представляющую интерес (например, гемопоэтическую клетку-предшественника, Т-клетку).
Используемый в данном документе термин «рекомбинантный» или «отличный от природного» относится к организму, микроорганизму, клетке, молекуле нуклеиновой кислоты или вектору, которое включает в себя по меньшей мере одно генетическое изменение или было модифицировано путем введения экзогенной молекулы нуклеиновой кислоты, где такие изменения или модификации вводят с помощью способов генной инженерии. Генетические изменения включают в себя, например, модификации с введением экспрессируемых молекул нуклеиновых кислот, кодирующих белки, гибридные белки или ферменты, или другие добавления молекул нуклеиновых кислот, делеции, замены или другие функциональные нарушения генетического материала клетки. Дополнительные модификации включают в себя, например, некодирующие регуляторные области, в которых модификации изменяют экспрессию гена или оперона. В определенных вариантах осуществления клетка, такая как Т-клетка, полученная от субъекта, может быть преобразована в отличную от природной или рекомбинантную клетку (например, отличную от природной или рекомбинантную Т-клетку) путем введения нуклеиновой кислоты, которая кодирует Key-ChEM или T-ChARM, описываемые в данном документе, и в результате чего клетка экспрессирует расположенные на клеточной поверхности Key-ChEM или T-ChARM.
Вектор, который кодирует нуклеокапсид вируса, называют в данном документе «вирусным вектором». Существует большое количество доступных вирусных векторов, пригодных для применения с композициями настоящего раскрытия, в том числе те, которые идентифицированы для применений в генной терапии человека (см. Pfeifer and Verma, Ann. Rev. Genomics Hum. Genet. 2:177, 2001). Подходящие вирусные векторы включают в себя векторы на основе РНК-вирусов, такие как векторы, полученные на основе ретровируса, например, векторы на основе вируса мышиного лейкоза Молони (MLV), и включают в себя более сложные векторы, полученные на основе ретровирусов, например, векторы, полученные на основе лентивируса. Векторы, полученные на основе HIV-1, относятся к этой категории. Другие примеры включают лентивирусные векторы, полученные из HIV-2, FIV, вируса инфекционной анемии лошадей, SIV и вируса Меди-Висна (лентивируса овец). Способы использования ретровирусных и лентивирусных вирусных векторов и пакующих клеток для трансдукции клеток млекопитающих-хозяев вирусными частицами, содержащими трансгены химерных антигенных рецепторов, известны в данной области техники и были ранее описаны, например, в патенте США № 8119772; Walchli et al., PLoS One 6:327930, 2011; Zhao et al., J. Immunol. 174:4415, 2005; Engels et al., Hum. Gene Ther. 14:1155, 2003; Frecha et al., Mol. Ther. 18:1748, 2010; Verhoeyen et al., Methods Mol. Biol. 506:97, 2009. Ретровирусные и лентивирусные векторные конструкции и системы экспрессии также коммерчески доступны.
В определенных вариантах осуществления вирусный вектор применяют для введения неэндогенной последовательности нуклеиновой кислоты, кодирующей Key-ChEM, или неэндогенной последовательности нуклеиновой кислоты, кодирующей T-ChARM, специфичного к мишени. Вирусный вектор может представлять собой ретровирусный вектор или лентивирусный вектор. Вирусный вектор может также включать последовательности нуклеиновых кислот, кодирующие маркер трансдукции. Маркеры трансдукции для вирусных векторов известны в данной области и включают маркеры отбора, которые могут придавать устойчивость к лекарственным средствам, или детектируемые маркеры, такие как флуоресцентные маркеры, или белки клеточной поверхности, которые могут быть выявлены с помощью таких способов, как проточная цитометрия. В конкретных вариантах осуществления вирусный вектор дополнительно содержит ген-маркер для трансдукции, включающий зеленый флуоресцентный белок, внеклеточный домен CD2 человека или усеченный EGFR человека (huEGFRt; см. Wang et al., Blood 118:1255, 2011). Если геном вирусного вектора содержит множество последовательностей нуклеиновых кислот, которые необходимо экспрессировать в клетке-хозяине в виде отдельных транскриптов, то вирусный вектор может также содержать дополнительные последовательности между двумя (или более) транскриптами, что обеспечивает возможность бицистронной или мультицистронной экспрессии. Примеры таких последовательностей, применяемых в вирусных векторах, включают участки внутренней посадки рибосомы (IRES), участки расщепления фурином, вирусный пептид 2A или любую их комбинацию.
Другие векторы также можно применять для доставки полинуклеотидов, в том числе векторы на основе вирусной ДНК, включая, например, векторы на основе аденовируса и векторы на основе адено-ассоциированного вируса (AAV); векторы, полученные из вирусов простого герпеса (HSV), в том числе ампликон-векторы, HSV с недостаточной репликацией и аттенуированный HSV (Krisky et al., Gene Ther. 5:1517, 1998).
Другие векторы, ранее разработанные для применений в генной терапии, также можно применять с композициями и способами по настоящему раскрытию. Такие векторы включают векторы, полученные из бакуловирусов и α-вирусов (Jolly, D J. 1999. Emerging Viral Vectors, pp 209-40 в Friedmann T. ed. The Development of Human Gene Therapy. New York: Cold Spring Harbor Lab) или плазмидные векторы (такие как «спящая красавица» и другие транспозонные векторы). В некоторых вариантах осуществления вирусный или плазмидный вектор дополнительно содержит генный маркер трансдукции (например, зеленый флуоресцентный белок, huEGFRt).
В определенных вариантах осуществления гемопоэтические клетки-предшественники или эмбриональные стволовые клетки модифицированы так, чтобы содержать неэндогенную молекулу нуклеиновой кислоты, которая кодирует Key-ChEM или T-ChARM по настоящему раскрытию. Гемопоэтические клетки-предшественники могут включать в себя клетки-предшественники тимоциты или индуцированные плюрипотентные стволовые клетки, которые могут быть получены или происходить из эмбриональной ткани печени, костного мозга, пуповинной крови или периферической крови. Гемопоэтические клетки-предшественники могут быть получены от человека, мыши, крысы или других млекопитающих. В конкретных вариантах осуществления используют клетки-предшественники тимоциты CD24lo Lin- CD117+.
В определенных вариантах осуществления условия культивирования подразумевают культивирование гемопоэтических клеток-предшественников, экспрессирующих гибридные белки по настоящему раскрытию, в течение времени, достаточного, чтобы индуцировать пролиферацию или дифференцировку. Клетки удерживать в культуре, как правило, в течение от приблизительно 3 дней до приблизительно 5 дней, или от приблизительно 4 до приблизительно 10 дней, или от приблизительно 5 до приблизительно 20 дней. Будет понятно, что клети можно удерживать в течение соответствующего количества времени, необходимого для получения желаемого результата, т. e. необходимых состава клеток или уровня пролиферации. Например, для получения состава клеток, содержащего, главным образом, незрелые и неактивированные T-клетки, клетки можно удерживать в культуре в течение от приблизительно 5 до приблизительно 20 дней. Клетки можно удерживать в культуре в течение от приблизительно 20 до приблизительно 30 дней для получения состава клеток, содержащего, главным образом, зрелые T-клетки. Неадгезивные клетки также можно собирать из культуры в различные моменты времени, как, например, от приблизительно нескольких дней до приблизительно 25 дней. В определенных вариантах осуществления гемопоэтические клетки совместно культивируют на линиях стромальных клеток (патент США № 7575925; Schmitt et al., Nat. Immunol. 5:410, 2004; Schmitt et al., Immunity 17:749, 2002).
В культуру можно добавлять один или более цитокинов, которые стимулируют коммитирование и дифференцировку гемопоэтических клеток-предшественников. Цитокины могут быть человеческими или отличными от человеческих. Типичные примеры цитокинов, которые можно применять, включают всех представителей семейства FGF, включая FGF-4 и FGF-2; Flt-3-лиганд, фактор стволовых клеток (SCF), тромбопоэтин (TPO) и IL-7. Цитокины можно применять в комбинации с гликозаминогликаном, таким как гепарин сульфат.
В некоторых вариантах осуществления клетками, способными экспрессировать гибридный белок по настоящему раскрытию на клеточной поверхности, являются T-клетки, в том числе первичные клетки или клеточные линии, полученные от человека, мыши, крысы или других млекопитающих. При получении от млекопитающего Т-клетка может быть получена из различных источников, включая кровь, костный мозг, лимфатический узел, тимус или другие ткани или жидкости. T-клетка может быть накоплена или очищена. T-клеточные линии хорошо известны из уровня техники, некоторые из них описаны в Sandberg et al., Leukemia 21:230, 2000. В определенных вариантах осуществления применяют Т-клетки, лишенные эндогенной экспрессии цепей α и β TCR. Такие T-клетки могут естественным образом не иметь эндогенной экспрессии цепей α и β TCR или могут быть модифицированы с блокированием экспрессии (например, T-клетки от трансгенных мышей, которые не экспрессируют цепи α и β TCR, или клетки, которые подвергли манипуляции для ингибирования экспрессии цепей α и β TCR) или с нокаутом α-цепи TCR, β-цепи TCR или обоих генов. В определенных вариантах осуществления клетками, способными экспрессировать гибридный белок по настоящему раскрытию на клеточной поверхности, являются не Т-клетки или клетки Т-клеточной линии дифференцировки, а клетки, являющиеся клетками-предшественниками, стволовыми клетками или клетками, которые были изменены для экспрессии антитела к CD3 на клеточной поверхности.
В определенных вариантах осуществления Т-клетка-хозяин, трансфицированная для экспрессии Key-ChEM или T-ChARM по настоящему раскрытию, является функциональной Т-клеткой, такой как вирус-специфичная Т-клетка, специфичная к опухолевому антигену цитотоксическая Т-клетка, наивная Т-клетка, стволовая Т-клетка памяти, Т-клетка центральной или эффекторной памяти или регуляторная CD4+ CD25+ T-клетка.
В культуру можно добавлять один или более факторов роста-цитокинов, которые стимулируют пролиферацию Т-клеток, экспрессирующих Key-ChEM или T-ChARM по настоящему раскрытию. Цитокины могут быть человеческими или отличными от человеческих. Иллюстративные факторы роста-цитокины, которые можно применить для стимуляции пролиферации Т-клеток, включают IL2, IL15 или подобные.
Применения
Заболевания, которые можно лечить с использованием клеток, экспрессирующих Key-ChEM или T-ChARM, описываемые в настоящем раскрытии, включают рак, инфекционные заболевания (вирусные, бактериальные, протозойные инфекции), иммунные заболевания (например, аутоиммунные) или заболевания, связанные со старением (например, физиологическим старением). Адоптивная иммунная и генная терапия представляют собой перспективные способы лечения различных типов рака (Morgan et al., Science 314:126, 2006; Schmitt et al., Hum. Gene Ther. 20:1240, 2009; June, J. Clin. Invest. 117:1466, 2007) и инфекционных заболеваний (Kitchen et al., PLoS One 4:38208, 2009; Rossi et al., Nat. Biotechnol. 25:1444, 2007; Zhang et al., PLoS Pathog. 6:e1001018, 2010; Luo et al., J. Mol. Med. 89:903, 2011).
Разнообразные формы рака, включая солидные опухоли и формы лейкоза, восприимчивы к композициям и способам, раскрытым в данном документе. Иллюстративные типы рака, которые можно лечить, включают аденокарциному молочной железы, предстательной железы и толстой кишки; все формы бронхогенного рака легкого; миелоидный лейкоз; меланому; гепатому; нейробластому; папиллому; апудому; хористому; бранхиогенную опухоль; злокачественный карциноидный синдром; карциноидную болезнь сердца и виды эпителиомы (например, крациносаркому Уокера, базально-клеточную эпителиому, базальную плоскоклеточную карциному, карциному Брауна-Пирса, внутрипротоковый рак, опухоль Эрлиха, карциному Кребса 2, карциному из клеток Меркеля, слизеобразующий рак, немелкоклеточный рак легкого, овсяноклеточный рак, папиллокарциному, фиброзный рак, рак бронха, бронхогенный рак, плоскоклеточный рак и переходноклеточный рак). Дополнительные типы рака, которые можно лечить, включают ассоциированные с гистиоцитами нарушения; злокачественный гистиоцитоз; лейкоз; болезнь Ходжкина; иммунопролиферативную болезнь тонкого кишечника; неходжкинскую лимфому; плазмоцитому; ретикулоэндотелиоз; меланому; хондробластому; хондрому; хондросаркому; фиброму; фибросаркому; гигантоклеточные опухоли; гистиоцитому; липому; липосаркому; мезотелиому; миксому; миксосаркому; остеому; остеосаркому; хордому; краниофарингиому; дисгерминому; гамартому; мезенхимому; мезонефрому; миосаркому; амелобластому; цементому; одонтому; тератому; тимому; трофобластическую опухоль. Кроме того, следующие типы рака также рассматриваются как поддающиеся лечению: аденома; холангиома; холестеатома; циклиндрома; цистаденокарцинома; цистаденома; гранулезоклеточная опухоль; арренобластома; гепатома; гидраденома; инсулома; опухоль из клеток Лейдига; папиллома; опухоль из клеток Сертоли; текаклеточная опухоль; лейомиома; лейомиосаркома; зернисто-клеточная миобластома; миома; миосаркома; рабдомиома; рабдомиосаркома; эпендимома; ганглионеврома; глиома; медуллобластома; менингиома; невринома; нейробластома; эпендимома; нейрофиброма; неврома; параганглиома; нехромаффинная параганглиома. Типы рака, которые можно лечить, также включают ангиокератому; ангиолимфоидную гиперплазию с эозинофилией; склерозирующую ангиому; ангиоматоз; гломангиому; гемангиоэндотелиому; гемангиому; гемангиоперицитому; гемангиосаркому; лимфангиому; лимфангиомиому; лимфангиосаркому; пинеалому; карциносаркому; хондросаркому; листовидную цистосаркому; фибросаркому; гемангиосаркому; леймиосаркому; лейкосаркому; липосаркому; лимфангиосаркому; миосаркому; миксосаркому; рак яичников; рабдомиосаркому; саркому; новообразования; нейрофиброматоз и дисплазию шейки матки.
Иллюстрацией различных гиперпролиферативных нарушений, восприимчивых к терапии при помощи Key-ChEM или T-ChARM, являются формы B-клеточного рака, в том числе B-клеточные лимфомы (такие как различные формы болезни Ходжкина, неходжкинская лимфома (NHL) или лимфомы центральной нервной системы), лейкозы (такие как острый лимфобластный лейкоз (ALL), хронический лимфолейкоз (CLL), злокачественный ретикулоэндотелиоз, бласттрансформация В-клеток при хроническом миелоидном лейкозе) и миеломы (такие как множественная миелома). Дополнительные формы В-клеточного рака включают мелкоклеточную лимфоцитарную лимфому, B-клеточный пролимфоцитарный лейкоз, лимфоплазмоцитарную лимфому, лимфому маргинальной зоны селезенки, плазмаклеточную миелому, солитарную плазмоцитому кости, экстраоссальную плазмоцитому, экстранодальную В-клеточную лимфому маргинальной зоны лимфоидной ткани слизистых (MALT), нодальную В-клеточную лимфому маргинальной зоны, фолликулярную лимфому, лимфому из клеток мантийной зоны, диффузную В-крупноклеточную лимфому, В-крупноклеточную лимфому средостения (из тимуса), внутрисосудистую В-крупноклеточную лимфому, первичную выпотную лимфому, лимфому/лейкоз Беркитта, формы B-клеточной пролиферации с неопределенным потенциалом злокачественности, лимфогранулематоз и посттрансплантационное лимфопролиферативное расстройство.
Воспалительные и аутоиммунные заболевания включают артрит, ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, полихондрит, псориатический артрит, псориаз, дерматит, полимиозит/дерматомиозит, миозит с включенными тельцами, воспалительный миозит, токсический эпидермальный некролиз, системную склеродермию и склероз, CREST-синдром, воспалительное заболевание кишечника, болезнь Крона, неспецифический язвенный колит, респираторный дистресс-синдром, респираторный дистресс-синдром взрослых (ARDS), менингит, энцефалит, увеит, колит, гломерулонефрит, аллергические состояния, экзему, астму, состояния, включающие инфильтрацию Т-клеток и хронические воспалительные реакции, атеросклероз, аутоиммунный миокардит, нарушение адгезии лейкоцитов, системную красную волчанку (SLE), подострую кожную красную волчанку, дискоидную волчанку, миелит при системной красной волчанке, энцефалит при системной красной волчанке, ювенильный диабет, рассеянный склероз, аллергический энцефаломиелит, нейромиелит зрительного нерва, острый ревматизм, хорею Сиденгама, иммунные реакции, ассоциированные с острой гиперчувствительностью и гиперчувствительностью замедленного типа, опосредованными цитокинами и Т-лимфоцитами, туберкулез, саркоидоз, гранулематоз, в том числе гранулематоз Вегенера и болезнь Чарга-Стросса, агранулоцитоз, васкулит (в том числе аллергический васкулит/ангиит, ANCA и ревматоидный васкулит), апластическую анемию, анемию Даймонда-Блекфана, иммунную гемолитическую анемию, в том числе аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию, истинную эритроцитарную аплазию (PRCA), дефицит фактора VIII, гемофилию А, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, связанные с диапедезом лейкоцитов, воспалительные заболевания центральной нервной системы (CNS), синдром полиорганной недостаточности, миастению гравис, заболевания, опосредованные комплексом антиген-антитело, легочный гемосидероз с гломерулонефритом, антифосфолипидный синдром, аллергический неврит, болезнь Бехчета, синдром Каслмана, синдром Гудпасчера, миастенический синдром Ламберта-Итона, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, отторжение трансплантата паренхиматозных органов, болезнь «трансплантат против хозяина» (GVHD), буллезный пемфигоид, обыкновенную пузырчатку, формы аутоиммунной полиэндокринопатии, формы серонегативной спондилоартропатии, болезнь Рейтера, синдром скованного человека, гигантоклеточный артериит, нефрит, ассоциированный с нарушенным выведением иммунных комплексов, IgA-нефропатию, формы IgM-полиневропатии или опосредованную IgM невропатию, идиопатическую тромбоцитопеническую пурпуру (ITP), тромбоцитопенический акроангиотромбоз (TTP), пурпуру Шенлейна-Геноха, аутоиммунную тромбоцитопению, аутоиммунное заболевание яичек и яичников, в том числе аутоиммунные орхит и оофорит, первичный гипотиреоз, аутоиммунные эндокринные заболевания, в том числе аутоиммунный тиреоидит, хронический тиреоидит (тиреоидит Хашимото), подострый тиреоидит, идиопатический гипотиреоз, болезнь Аддисона, болезнь Грейвса, аутоиммунные полигландулярные синдромы (или синдромы полигландулярной эндокринопатии), диабет I типа, также известный как инсулин-зависимый сахарный диабет (IDDM) и синдром Шихана, аутоиммунный гепатит, лимфоидный интерстициальный пневмонит (HIV), облитерирующий бронхиолит (без пересадки), неспецифическую интерстициальную пневмонию (NSIP), синдром Гийена-Барре, васкулит крупных сосудов (в том числе ревматическую полимиалгию и гигантоклеточный артериит (синдром Такаясу), васкулит средних сосудов (в том числе болезнь Кавасаки и узелковый полиартериит), узелковый полиартериит (PAN), анкилозирующий спондилоартрит, болезнь Бергера (IgA-нефропатию), быстро прогрессирующий гломерулонефрит, первичный билиарный цирроз печени, целиакию-спру (глютеновую энтеропатию), криоглобулинемию, криоглобулинемию, ассоциированную с гепатитом, латеральный амиотрофический склероз (ALS), ишемическую болезнь сердца, семейную средиземноморскую лихорадку, микроскопический полиангиит, синдром Когана, синдром Вискотта-Олдрича и облитерирующий тромбангиит.
В конкретных вариантах осуществления способ лечения субъекта с использованием Key-ChEM или T-ChARM, раскрытых в данном документе, включает лечение острого миелоцитарного лейкоза, острого лимфобластного лейкоза и хронического миелоцитарного лейкоза.
Инфекционные заболевания включают в себя заболевания, связанные с возбудителями инфекции, которые включают любое из множества бактерий (например, патогенных E. coli, S. typhimurium, P. aeruginosa, B. anthracis, C. botulinum, C. difficile, C. perfringens, H. pylori, V. cholerae, Listeria spp., Rickettsia spp., Chlamydia spp. и тому подобное), микобактерий и паразитов (в том числе любого из известных паразитарных представителей Protozoa). Инфекционные вирусы включают вирусы эукариотических клеток, такие как аденовирус, буньявирус, герпесвирус, паповавирус, папилломавирус (например, HPV), парамиксовирус, пикорнавирус, рабдовирус (например, вирус бешенства), ортомиксовирус (например, вирус гриппа), поксвирус (например, вирус коровьей оспы), реовирус, ретровирус, лентивирус (например, HIV), флавивирус (например, HCV, HBV) или тому подобное. В определенных вариантах осуществления инфекцию, вызванную цитозольными патогенами, антигены которых обрабатываются и презентируются молекулами MHC класса I, лечат с использованием Key-ChEM или T-ChARM по настоящему раскрытию.
Key-ChEM или T-ChARM по настоящему раскрытию могут быть введены субъекту в связанной с клеткой форме (например, генная терапия популяции целевых клеток (зрелых T-клеток (например, CD8+ или CD4+ T-клетки) или других клеток Т-клеточной линии дифференцировки)). В конкретном варианте осуществления клетки Т-клеточной линии дифференцировки, экспрессирующие Key-ChEM или T-ChARM, вводимые субъекту, являются сингенными, аллогенными или аутологичными клетками. В других вариантах осуществления Key-ChEM или T-ChARM можно вводить субъекту в растворимой форме. Растворимые TCR известны из уровня техники (см., например, Molloy et al., Curr. Opin. Pharmacol. 5:438, 2005; патент США № 6759243).
Фармацевтические композиции, включающие в себя Key-ChEM или T-ChARM по настоящему раскрытию, можно вводить способом, подходящим для заболевания или состояния, подлежащего лечению (или предупреждению), определяемым специалистами в области медицины. Соответствующая доза, подходящая длительность и частота введения композиций будут определяться такими факторами, как состояние пациента, габариты, тип и тяжесть заболевания, конкретная форма активного ингредиента и способ введения. Настоящее раскрытие предусматривает фармацевтические композиции, содержащие клетки, экспрессирующие Key-ChEM или T-ChARM, раскрытые в данном документе, и фармацевтически приемлемые носитель, растворители или наполнитель. Пригодные наполнители включают воду, физиологический раствор, декстрозу, глицерин или подобное и их комбинации.
Преимуществом настоящего раскрытия является то, что клетки, экспрессирующие Key-ChEM или T-ChARM, вводимые пациенту, можно подвергнуть истощению с помощью родственного партнера связывания для кассеты с меткой. В определенных вариантах осуществления настоящее раскрытие предусматривает способ истощения Т-клеток, экспрессирующих Key-ChEM или T-ChARM, с помощью антитела, специфичного для кассеты с меткой, с помощью родственного партнера связывания, специфичного для кассеты с меткой, или с помощью Т-клетки вторичного иммунного ответа, экспрессирующей CAR и имеющей специфичность по отношению к кассете с меткой. В определенных вариантах осуществления кассета с меткой предусматривает иммунодеплецию Т-клеток, экспрессирующих Key-ChEM или T-ChARM по настоящему раскрытию. Устранение сконструированных Т-клеток можно осуществлять с использованием средств для истощения, специфичных к кассете с меткой. Например, если используют Strep-метку, тогда можно применять антитело к Strep-метке, scFv к Strep-метке или Streptactin, каждый из которых слит или конъюгирован с токсичным для клетки реагентом (таким как токсин, радиоактивный металл), или можно применять биспецифичный scFv к Strep-метке/CD3 или Т-клетку с CAR к Strep-метке.
В других определенных вариантах осуществления клетки, экспрессирующие Key-ChEM или T-ChARM по настоящему раскрытию, можно идентифицировать, отсортировать, накапливать или отделять путем связывания с антителами, имеющими специфичность по отношению к кассете с меткой (например, антитела к метке), или с помощью других белков, специфически связывающих кассету с меткой (например, Streptactin связывается со Strep-меткой), которые конъюгированы с гранулами, планшетом для клеточной культуры или любой другой матрицей твердой поверхности. В определенных вариантах осуществления такие клетки сортируют, накапливают или отделяют с помощью аффинной колонки.
В определенных вариантах осуществления настоящее раскрытие предусматривает способ селективной активации Т-клетки путем приведения в контакт отличной от природной или рекомбинантной Т-клетки, экспрессирующей Key-ChEM или T-ChARM, с доменом связывания, специфичным к кассете с меткой и прикрепленным к твердой поверхности или в виде части биосовместимой матрицы (например, альгината, матрицы базальной мембраны (Matrigel®), биополимера). Рекомбинантная Т-клетка содержит экзогенную молекулу нуклеиновой кислоты, кодирующую гибридный белок Key-ChEM или T-ChARM по настоящему раскрытию. Например, T-клетку, экспрессирующую Key-ChEM или T-ChARM, можно активировать с помощью гранул, покрытых или конъюгированных с родственным партнером связывания (например, антителом), специфичным к кассете с меткой. Например, если кассета с меткой представляет собой Strep-метку, тогда для индукции активации Т-клеток можно применить гранулы, покрытые StrepTactin, или гранулы, конъюгированные с антителом к Strep-метке. В определенных вариантах осуществления способ включает активацию ex vivo рекомбинантных T-клеток, экспрессирующих Key-ChEM или T-ChARM по настоящему раскрытию, и необязательно дополнительную экспрессию химерного антигенного рецептора (CAR). Такие активированные Т-клетки пригодны в способах лечения заболеваний, описанных в данном документе.
В другом аспекте настоящее раскрытие предусматривает способ селективной стимуляции пролиферации рекомбинантной Т-клетки, экспрессирующей Key-ChEM или T-ChARM по настоящему раскрытию. В определенных вариантах осуществления способ включает селективную пролиферацию ex vivo Т-клеток, экспрессирующих Key-ChEM или T-ChARM, с помощью партнера связывания для метки, такого как антитело. В дополнительных вариантах осуществления способ включает размножение функциональных Т-клеток (например, вирус-специфичных, специфичных к TAA (опухолеассоциированному антигену) CTL или специфических подклассов Т-клеток, таких как наивные T-клетки, стволовые T-клетки памяти, T-клетки центральной или эффекторной памяти, регуляторные CD4+ CD25+ T-клетки) с партнером связывания для метки, таким как антитело, которое необязательно может быть выполнено в присутствии партнера связывания для костимулирующей молекулы (такого как антитело к CD27 или к CD28). В определенных вариантах осуществления партнеры связывания, представляющие собой антитела к метке, можно использовать для активации трансдуцированной Key-ChEM (например, Wnt или Notch Key-ChEM) гемопоэтической стволовой клетки, эмбриональной стволовой клетки или тканевой стволовой клетки (например, нервной стволовой клетки) к самообновлению, пролиферации или дифференцировке в один или более требуемых фенотипов для терапевтического применения.
В других дополнительных вариантах осуществления Key-ChEM или T-ChARM позволяет селективно стимулировать пролиферацию Т-клеток in vivo при экспрессии Key-ChEM или T-ChARM по настоящему раскрытию. В определенных вариантах осуществления T-клетка, экспрессирующая CAR, содержащий кассету с меткой, позволяет in vivo размножить Т-клетку с CAR при контакте с клетками, экспрессирующими лиганд (например, в том числе клеточные лиганды Т-клеток-супрессоров PD-L1, PD-L2). Такие размноженные Т-клетки пригодны в способах лечения заболеваний, описанных в данном документе. В определенных вариантах осуществления пролиферацию или размножение клеток, экспрессирующих Key-ChEM или T-ChARM, раскрытые в данном документе, индуцируют in vivo, что можно вызвать с помощью партнера связывания для кассеты с меткой (такого как антитело к метке) и необязательно партнера связывания для костимулирующей молекулы (такого как антитело к CD27 или к CD28).
В некоторых дополнительных вариантах осуществления клетки, экспрессирующие Key-ChEM или T-ChARM, раскрытые в данном документе, активируют in vivo, как, например, в месте опухоли. Например, композиция (например, альгинат, матрица базальной мембраны (Matrigel®), биополимер или другая матрица) или носитель (например, микрогранула, наночастица или другая твердая поверхность), содержащий партнера связывания для кассеты с меткой (такого как антитело к метке) и партнера связывания для костимулирующей молекулы (такого как антитело к CD27 или CD28), могут быть использованы для локальной активации в месте опухоли (например, солидной опухоли) Т-клетки, экспрессирующей Key-ChEM или T-ChARM, раскрытые в данном документе.
В определенных вариантах осуществления рекомбинантные клетки, экспрессирующие Key-ChEM или T-ChARM, можно обнаруживать или отслеживать in vivo с помощью антител, которые связывают со специфичностью кассету с меткой (например, антител к метке), или с помощью других родственных связывающих белков, которые специфически связывают последовательность кассеты с меткой (например, Streptactin связывается со Strep-меткой), где партнеры связывания для кассеты с меткой конъюгированы с флуоресцентным красителем, радиоактивной меткой, наночастицей с оксидом железа или другим визуализирующим средством, известным из уровня техники, для детекции с помощью рентгеновского анализа, КT-сканирования, МРТ-сканирования, ПЭТ-сканирования, ультразвукового исследования, проточной цитометрии, систем визуализации в ближней инфракрасной области спектра или других методов визуализации (см., например, Yu et al., Theranostics 2:3,2012).
В дополнительных вариантах осуществления клетки, экспрессирующие Key-ChEM или T-ChARM по настоящему раскрытию, можно применять в диагностических способах или способах визуализации, включая способы, используемые применительно к показаниям или состояниям, указанным в данном документе.
ПРИМЕРЫ
Пример 1
Химерные эффекторные молекулы-ключи (Key-ChEM) и меченые молекулы антигенных рецепторов (T-ChARM) и их производные
Иллюстративные химерные гибридные белки, содержащие одну или более кассет с аффинными метками, показаны на фигуре 1. Кассеты с метками являются, как правило, небольшими (т. e. минимально иммуногенными или неиммуногенными) и не ассоциированы или не связаны с какой-либо молекулой, эндогенной по отношению к хозяину или клетке-хозяину. Метки специфически связываются с гетерологичным родственным рецептором (например, лигандом, антителом или другим партнером связывания), при этом связывание можно применять в отношении данных химерных эффекторных молекул (ChEM) в качестве «ключа» для доступа к и управления (т. e. включения, или выключения, или модулирования) любым из множества клеточных путей (называемые в данном документе как Key-ChEM). Эти меченые химерные гибридные белки могут дополнительно содержать домен связывания, специфичный к конкретной мишени (например, к опухолевому антигену). Например, меченые химерные гибридные белки включают в себя химерные молекулы антигенного рецептора (называемые в данном документе как T-ChARM).
Иллюстративная молекула нуклеиновой кислоты, кодирующая Key-ChEM (фигура 1 A), содержит следующие элементы (от 5' к 3'): Strep tag® II (SEQ ID NO:38, кодирующая пептид Trp-Ser-His-Pro-Gln-Phe-Glu-Lys, изложенный под SEQ ID NO:1), соединительный участок, в том числе линкерный блок (SEQ ID NO:42, кодирующая пептид (Gly-Gly-Gly-Gly-Ser)2, изложенный под SEQ ID NO:11) и модифицированный шарнир из IgG4 (SEQ ID NO:27, кодирующая пептид Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Pro-Cys-Pro, изложенный под SEQ ID NO:15), трансмембранный домен CD28 (SEQ ID NO:27, кодирующая пептид, изложенный под SEQ ID NO:16) и внутриклеточный компонент, включающий в себя эффекторный домен, содержащий участок 4-1BB (SEQ ID NO:29, кодирующая пептид, изложенный под SEQ ID NO:17) и участок CD3ζ (SEQ ID NO:30, кодирующая пептид, изложенный под SEQ ID NO:18; Kowolik et al., Cancer Res.66:10995, 2006). Эту молекулу нуклеиновой кислоты, кодирующую Key-ChEM (одна метка), клонировали в лентивирусный вектор epHIV7, как описано в Yam et al. (Mol. Ther. 5:479, 2002) и Wang et al. (Blood 118:1255, 2011).
Лентивирусный вектор epHIV7 получили из вектора pHIV7 путем замещения цитомегаловирусного промотора из pHIV7 на промотор EF-1 (Wang et al., 2011; Yam et al., 2002). Лентивирусный вектор также кодирует усеченный полипептид EGFR человека (huEGFRt), который лишен внеклеточных N-концевых лиганд-связывающих доменов и внутриклеточной рецепторной тирозинкиназной активности, но сохраняет нативную аминокислотную последовательность, трансмембранную типа I локализацию на клеточной поверхности и конформационно интактный связывающий эпитоп для моноклонального антитела к EGFR, цетуксимаба (Wang et al., 2011). Лентивирусные векторы скоординировано экспрессируют Key-ChEM и huEGFRt, разделенные саморасщепляющейся последовательностью T2A (Szymczak et al., Nat. Biotechnol. 22:589, 2004), где huEGFRt служит в качестве альтернативного эпитопа для отбора Key-ChEM-положительных клеток с помощью биотинилированного цетуксимаба в сочетании с иммуномагнитными микрогранулами с антителом к биотину.
Иллюстративная молекула нуклеиновой кислоты, кодирующая T-ChARM (фигура 1 E), содержит следующие элементы: scFv, содержащий сегменты генов VH и VL из CD19-специфичного моноклонального антитела FMC63 (SEQ ID NO:36; Wang et al., 2011), Strep tag® II (SEQ ID NO:38, кодирующая пептид Trp-Ser-His-Pro-Gln-Phe-Glu-Lys, изложенный под SEQ ID NO:1), соединительный участок, в том числе линкерный блок (SEQ ID NO:39, 40 или 41, кодирующая пептид (Gly-Gly-Gly-Gly-Ser)2, изложенный под SEQ ID NO:11) и шарнир из IgG4 (SEQ ID NO:27), трансмембранный домен CD28 (SEQ ID NO:28) и внутриклеточный компонент, включающий в себя эффекторный домен, содержащий участок 4-1BB (SEQ ID NO:29) и участок CD3ζ (SEQ ID NO:30). Иллюстративный T-ChARM, содержащий две метки (T-ChARM2), отличается от T-ChARM с одной меткой (T-ChARM1) включением второго линкерного блока (кодирующего пептид (Gly-Gly-Gly-Ser)2-Gly-Gly-Ser, изложенный под SEQ ID NO:12) между первой и второй Strep-метками. Иллюстративный T-ChARM, содержащий три метки (T-ChARM3), отличается от T-ChARM с двойной меткой включением третьего линкерного блока (кодирующего пептид (Gly-Gly-Gly-Gly-Ser)2, изложенный под SEQ ID NO:11) между второй и третьей Strep-метками. В определенных вариантах осуществления scFv включает в себя области VH и VL из ROR1-специфичного R12 моноклонального антитела (Yang et al., PLoS One 6:e21018, 2011), изложенного под SEQ ID NO:57, и линкер вариабельного домена, изложенный под SEQ ID NO:13. Кроме того, T-ChARM как к CD19, так и к ROR1 в качестве альтернативы конструировали с внутриклеточным компонентом, включающим в себя эффекторный домен, содержащий участок CD28 (SEQ ID NO:35) вместо участка 4-1BB.
В определенных вариантах осуществления любой из гибридных белков, описанных в данном документе, содержит от амино-конца к карбокси-концу: внеклеточный домен связывания scFv или scTCR, кассету с меткой, соединительную область, содержащую шарнир из IgG, трансмембранный домен и внутриклеточный компонент, содержащий эффекторный домен. В некоторых вариантах осуществления эффекторный домен содержит спаренные 4-1BB и CD3ζ, CD27 и CD3ζ, CD28 и CD3ζ, OX40 и CD3ζ, CD28, 4-1BB и CD3ζ, OX40, 4-1BB и CD3ζ или CD28, OX40 и CD3ζ. Как определено в данном документе, эффекторный домен для любой из этих молекул может представлять собой весь внутриклеточный участок или может включать только эффекторный участок выбранной молекулы.
Иллюстративная молекула нуклеиновой кислоты, кодирующая T-ChARM (N1ChARM; фигура 1 F; SEQ ID NO:58), имеющий N-концевую метку, содержит следующие элементы: секреторную сигнальную последовательность (SEQ ID NO:63, кодирующая пептид MLLLVTSLLLCELPHPAFLLIP, изложенный под SEQ ID NO:47, который отщепляется от зрелого белка), соединительную аминокислоту аспарагин, Strep tag® II (SEQ ID NO:38, кодирующая пептид Trp-Ser-His-Pro-Gln-Phe-Glu-Lys, изложенный под SEQ ID NO:1), линкерный блок (SEQ ID NO:42, кодирующая пептид (Gly-Gly-Gly-Gly-Ser)2, изложенный под SEQ ID NO:11), scFv из сегментов генов VH и VL из CD19-специфичного моноклонального антитела FMC63 (SEQ ID NO:36; Wang et al., 2011), шарнир из IgG4 (SEQ ID NO:27), трансмембранный домен CD28 (SEQ ID NO:28) и внутриклеточный компонент, включающий в себя эффекторный домен, содержащий участок 4-1BB (SEQ ID NO:29) и участок CD3ζ (SEQ ID NO:30).
Иллюстративная молекула нуклеиновой кислоты, кодирующая T-ChARM (Ch1 ARM; фигура 1 G; SEQ ID NO:59), имеющий метку, встроенную в линкер вариабельной области, содержит следующие элементы: секреторную сигнальную последовательность (SEQ ID NO:63, кодирующая пептид MLLLVTSLLLCELPHPAFLLIP, изложенный под SEQ ID NO:47, который отщепляется от зрелого белка), сегмент гена VH из CD19-специфичного моноклонального антитела FMC63 (кодирующий аминокислотную последовательность, изложенную под SEQ ID NO:51), первый линкерный блок (кодирующий пептид Gly-Gly-Ser-Gly-Ser-Gly, изложенный под SEQ ID NO:65), соединительную аминокислоту аспарагин, Strep tag® II (SEQ ID NO:38, кодирующая пептид Trp-Ser-His-Pro-Gln-Phe-Glu-Lys, изложенный под SEQ ID NO:1), второй линкерный блок (кодирующий пептид Gly-Ser-Gly-Ser-Gly, изложенный под SEQ ID NO:66), сегмент гена VL из CD19-специфичного моноклонального антитела FMC63 (кодирующий аминокислотную последовательность, изложенную под SEQ ID NO:52), шарнир из IgG4 (SEQ ID NO:27), трансмембранный домен CD28 (SEQ ID NO:28) и внутриклеточный компонент, включающий в себя эффекторный домен, содержащий участок 4-1BB (SEQ ID NO:29) и участок CD3ζ (SEQ ID NO:30).
Молекулы нуклеиновых кислот, кодирующие каждый из этих иллюстративных T-ChARM (например, с одинарной, двойной или тройной меткой, N-концевой меткой, вставленной меткой, с указанными scFv), отдельно клонировали в лентивирусный вектор epHIV7, как описано в Yam et al. (Mol. Ther. 5:479, 2002) и использовали для трансдукции Т-клеток, как описано в примерах в данном документе. В определенных вариантах осуществления молекулы нуклеиновой кислоты, кодирующие Key-ChARM по настоящему раскрытию, кодон-оптимизировали перед клонированием в лентивирусный вектор epHIV7. Супернатанты с лентивирусом, кодирующим T-ChARM, получили в клетках 293T, совместно трансфицированных каждой из лентивирусных векторных плазмид и упаковочными векторами pCHGP-2, pCMV-Rev2 и pCMV-G с использованием реагента для трансфекции Calphos (Clontech, Маунтин-Вью, Калифорния). Среду заменяли через 16 часов после трансфекции и лентивирусы собирали через 24, 48 и 72 часа.
Пример 2
Получение рекомбинантных T-клеток и экспрессия T-ChARM
CD8+ и CD4+ выделяли из PBMC от нормальных доноров с помощью набора для выделения CD8+/CD4+ T-клеток (Miltenyi Biotec), активировали с помощью гранул с антителом к CD3/CD28 (Life Technologies) согласно инструкциям изготовителя и трансдуцировали лентивирусным супернатантом (как указано в каждом примере) (MOI = 3) с добавлением 0,8 мг/мл полибрена (Millipore, Бедфорд, Массачусетс) на 3 день после активации путем центрифугирования при 2100 об./мин. в течение 45 мин. при 32°C. T-клетки размножали в среде RPMI, 10% человеческой сыворотки, 2 мM L-глутамина и 1% пенициллина-стрептомицина (среда CTL) с добавлением рекомбинантного человеческого (rh) IL-2 до конечной концентрации 50 ед./мл каждые 48 часов. После размножения аликвоту из каждой трансдуцированной Т-клеточной линии окрашивали конъюгированным с биотином антителом к EGFR и стрептавидином-PE (Miltenyi, Оберн, Калифорния). tEGFR+ T-клетки отделяли путем отсортировки на клеточном сортере FACS-Aria (Becton Dickinson). Затем субпопуляцию tEGFR+ T-клеток стимулировали облученными (8000 рад) CD19+ B-LCL в соотношении T-клетки:LCL 1:7 и размножали в течение 8 дней в среде CTL с добавлением 50 ед./мл rh IL-2 каждые 48 часов или с использованием протокола быстрого размножения для T-ChARM R12 (Riddell and Greenberg, J. Immunol. Methods 128:189, 1990).
Следующие конъюгированные антитела использовали для фенотипирования и анализа методом проточной цитометрии: CD4, CD8, CD25, CD137, CD45, аннексин V, CD62L, CD27, CD28 (BD Biosciences), антитело к Streptag II (Genscript), антитело к EGFR (ImClone Systems Incorporated, Бранчбург, Нью-Джерси); StrepTavidin-PE (BD Biosciences, Сан-Хосе, Калифорния). Окрашивание пропидиум йодидом (PI, BD Biosciences) проводили для распознавания живых/мертвых клеток в соответствии с указаниями изготовителя. Проточный цитометрический анализ проводили на FACS Canto II, отсортировку-очистку на FACS AriaII (Becton Dickinson, Франклин Лейкс, Нью-Джерси) и данные анализировали с использованием программного обеспечения FlowJo (Treestar, Ашленд, Орегон).
Для изучения экспрессии T-ChARM на клеточной поверхности трансдуцированные Т-клетки отсортировывали по экспрессии EGFRt и оценивали с помощью окрашивания флуорохромом, меченным моноклональным антителом к Streptag. Средняя интенсивность флуоресценции (MFI) окрашивания EGFR была аналогичной у T-клеток, трансдуцированных каждым из T-ChARM и CAR CD19-коротким, что указывало на то, что введение метки в CAR с получением ChARM не мешало экспрессии трансгенов (фигура 21). Моноклональное антитело к Streptag специфически окрашивало T-клетки, трансдуцированные различными T-ChARM, независимо от положения или количества последовательностей меток в каждом из ChARM. Значение MFI окрашивания антителом к Streptag было выше для Т-клеток, трансдуцированных T-ChARM2 и T-ChARM3 по сравнению с T-ChARM1, предположительно, из-за большего чиста сайтов на каждом T-ChARM2 и T-ChARM3 для связывания конъюгата антитело-флуорохром (фигура 21).
Пример 3
Цитолитическая активность Т-клеток, экспрессирующих T-ChARM
Эффекторную функцию in vitro для основной массы CD8+ T-клеток, сконструированных для экспрессии T-ChARM1, T-ChARM2 или T-ChARM3 (scFv) к CD19, сравнивали с эффекторной функцией Т-клеток, сконструированных для экспрессии CAR к CD19, содержащих соединительные области различной длины - только шарнир из IgG4 (короткий), CH3 и шарнир из IgG4 (средний) и CH2CH3 и шарнир из IgG4 (длинный) соответственно - в анализе с высвобождением хрома. Коротко, целевые клетки метили с 51Cr (PerkinElmer, Норуолк, Коннектикут) в течение ночи, промывали и инкубировали в трех повторах при 1-2 x 103 клеток/лунку с эффекторными Т-клетками при различных соотношениях эффектор:мишень (E:T). Супернатанты собирали для γ-радиометрии после инкубации в течение 4 часов и рассчитывали специфический лизис с использованием стандартной формулы. В качестве целевых клеток использовали Raji/ROR1 (естественные CD19+, трансдуцированные для экспрессии неродственного антигена ROR1) и K562/CD19 (трансдуцированные для экспрессии CD19) с K562/ROR1 (естественными CD19-, трансдуцированными для экспрессии неродственного антигена RОR1), использованными в качестве отрицательного контроля, и клетками LCL-OKT3 (трансдуцированными для экспрессии антитела к CD3 на клеточной поверхности), использованными в качестве положительного контроля. Клетки лимфобластоидной клеточной линии (LCL), сконструированные для экспрессии связанного с мембраной scFv к CD3 (LCL-OKT3), использовали в качестве эталонного стандарта максимального потенциала активации Т-клеточной линии, поскольку эти OKT3-экспрессирующие клетки активируют Т-клетки посредством связывания CD3-комплекса.
T-клетки, экспрессирующие каждую из различных конструкций T-ChARM и CAR к CD19, не были цитотоксическими относительно клеток K562/ROR1 (фигура 2 C), но активировались, становясь цитолитическими, в присутствии экспрессирующих антитело к CD3 клеток LCL/OKT3 (фигура 2 D). Кроме того, Т-клетки, экспрессирующие T-ChARM или CAR, подтвердили специфическую цитолитическую активность в отношении CD19+ клеток, клеток Raji (фигура 2 B) и K562/CD19 (фигура 2 A). Аналогичные результаты получали, когда метку располагали на амино-конце T-ChARM (N1ChARM) или встраивали в scFv (VH-метка-VL; Ch1 ARM) (см. фигуру 22). Кроме того, эффективность лизиса не была затронута использованными эффекторным доменом (CD28 вместо 4-1BB; см. фигуру 23 A), доменом связывания (к ROR1 вместо к CD19; см. фигуру 23 B) или мишенью (на фигуре 32 показан цитолитический эффект ChARM, меченного Myc). Клетки, экспрессирующие T-ChARM, уничтожали клетки опухоли с той же эффективностью, что и клетки с CAR, содержащим короткий, средний и длинный спейсеры Fc IgG4.
Пример 4
Высвобождение цитокинов Т-клетками, экспрессирующими T-ChARM, при совместном культивировании с клетками K562
Для анализа секреции цитокинов эффекторные (E) клетки (Т-клетки, экспрессирующие T-ChARM и CAR к CD19) и целевые (T) клетки (K562/CD19 и K562/ROR1, отрицательный контроль) совместно культивировали в трех повторах при соотношении E:T 4:1, инкубировали 24 часа и затем в супернатантах измеряли уровни GM-CSF, IFN-γ, IL-2 и TNF-α с использованием мультиплексного анализа цитокинов (Luminex®).
Из результатов (фигура 3 D) видно, что клетки, экспрессирующие CAR к CD19 с короткой соединительной областью, продуцируют большие количества цитокинов после контакта с целевыми клетками, чем Т-клетки, экспрессирующие CAR к CD19 со средней или длинной соединительной областями. Аналогичную картину наблюдали с клетками, экспрессирующими T-ChARM к CD19, где (фигура 3 A) клетки с T-ChARM1, имеющие более короткий линкер и одну метку, продуцируют большее количество цитокинов после контакта с целевыми клетками, чем клетки с T-ChARM2 или T-ChARM3, имеющие две метки и три метки соответственно. Уровни продуцируемых цитокинов были сходными для клеток с T-ChARM к CD19 и CAR к CD19, хотя клетки, экспрессирующие T-ChARM, индуцировали значительно более высокий уровень продукции IFN-γ, чем клетки, экспрессирующие CAR. На фигурах 3 B и 3 E показано, что продукция цитокинов не индуцировалась в клетках K562, которые не экспрессируют CD19. На фигурах 3 C и 3 F показаны результаты положительного контроля, который представляет собой стимуляцию PMA/иономицином. Аналогичные результаты наблюдали при изучении конструкций N1ChARM и Ch1 ARM (см. фигуру 24). Кроме того, иерархия продукции цитокинов и пролиферации Т-клеток, трансдуцированных ChARM к CD19, не зависела от костимулирующего домена (4-1BB или CD28), используемого в ChARM (фигура 25).
Пример 5
Высвобождение цитокинов Т-клетками, экспрессирующими молекулы T-ChARM, при совместном культивировании с клетками В-клеточной лимфомы Raji
T-клетки, экспрессирующие различные T-ChARM или CAR к CD19, совместно культивировали с CD19+ клетками Raji в течение 24 часов, и супернатанты изучали в мультиплексном анализе цитокинов (Luminex®). Для анализа секреции цитокинов эффекторные (E) клетки (Т-клетки, экспрессирующие T-ChARM и CAR к CD19) и целевые (T) клетки (Raji) совместно культивировали в трех повторах при соотношении E:T 2:1, инкубировали 24 часа и затем в супернатантах измеряли уровни GM-CSF, IFN-γ, IL-2 и TNF-α с использованием мультиплексного анализа цитокинов (Luminex®).
Результаты указывают, что Т-клетки, экспрессирующие T-ChARM к CD19 с одной, двумя или тремя кассетами с метками, способны продуцировать намного более высокие уровни IFN-γ и GM-CSF при совместном культивировании с клетками Raji (фигура 4 A) по сравнению с Т-клетками, экспрессирующими любой из обычных CAR к CD19 (фигура 4 B).
Пример 6
Пролиферация T-клеток, экспрессирующих молекулы T-ChARM
Для анализа клеточной пролиферации Т-клетки, экспрессирующие T-ChARM или CAR к CD19, метили с помощью 0,2 мкM карбоксифлуоресцеинсукцинимидилового сложного эфира (CFSE, Invitrogen), который связывается с внутриклеточными белками и делает клетки видимыми при проточной цитометрии в канале FITC. После внесения метки клетки промывали и высевали в трех повторах с клетками-стимуляторами в соотношении 4:1 (K562/CD19 или K562/ROR1, отрицательный контроль) в среду CTL без экзогенных цитокинов. После инкубирования в течение 72 часов клетки метили PI для исключения мертвых клеток из анализа. Образцы анализировали с помощью проточной цитометрии и клеточное деление живых CD3+ Т-клеток оценивали по степени разбавления CFSE (т. e. разбавление красителя является индикатором пролиферации, так как концентрация метки разбавляется наполовину с каждым делением клетки).
Для анализа лунки трех повторов объединяли и измеряли пролиферацию живых CD8+ T-клеток. Крайний левый столбец представляет собой график прямого светорассеяния/бокового светорассеяния общего числа клеток, средний столбец представляет собой график гейтированных относительно CD8+ T-клеток и крайний правый столбец представляет собой гистограмму, показывающую разбавление CFSE в субпопуляции CD8+ T-клеток (увеличенное разбавление слева). Красный пик в крайнем правом столбце указывает на отсутствие деления клеток, а голубые пики представляют указание ≥3, 2 или 1 клеточное деление, и три числа в каждой из гистограмм указывают процент клеток, которые имеют разбавленный CFSE и подверглись более чем 3, 2 или 1 клеточному делению соответственно. Из гистограммы видно, что Т-клетки, экспрессирующие T-ChARM и CAR интенсивно пролиферировали в течение 72 часов после стимуляции совместным культивированием с клетками K562/CD19 (синий), но не с клетками отрицательного контроля K562/ROR1 (красный) (фигура 5). Среднее число клеточных делений было выше у Т-клеток, экспрессирующих T-ChARM1 и T-ChARM2, по сравнению с Т-клетками, экспрессирующими T-ChARM3 или CAR (с длинным). Аналогичным образом, уровень пролиферации не зависел от костимулирующего домена (4-1BB или CD28), используемого в ChARM (фигура 26), и не зависел от используемой метки (на фигуре 31 показана равная пролиферация при использовании Myc-метки).
Пример 7
In vivo адоптивный перенос Т-клеток, экспрессирующих молекулы T-ChARM
Самок мышей NOD.CB17-Prkdcscid/J (NOD/SCID) или NOD.Cg-Prkdescid112rgtm1Wjl/SzJ (NSG) возрастом от шести до восьми недель получали из Jackson Laboratory или разводили своими силами. Мышам вводили внутривенно (i. v.) 0,5 x 106 опухолевых клеток лимфомы Raji, трансфицированных люциферазой светлячка (Raji-ffluc), через хвостовую вену и позволяли опухоли прижиться в течение 6 дней. На 7 день мышам вводили одну внутривенную (i. v.) инъекцию 5 x 106 T-клеток, трансдуцированных одной из человеческих Т-клеток с T-ChARM1, T-ChARM2, T-ChARM3, CAR (с коротким), CAR (со средним) и CAR (с длинным) (scFv) к CD19. Для подтверждения приживления опухоли проводили биолюминесцентную визуализацию на 6 день после инокуляции Raji-ffluc (фигура 6 A). Для контроля противоопухолевой активности адоптивной Т-клеточной терапии проводили биолюминесцентную визуализацию на 7 день (фигура 6 B), 11 день (фигура 6 C), 18 день (фигура 6 D) и 26 день (фигура 6 E) после введения T-клеток.
Для биолюминесцентной визуализации опухолевых клеток мышам вводили внутрибрюшинные (i. p.) инъекции люциферинового субстрата (CaliperFife Sciences, Гопкинтон, Массачусетс), ресуспендированного в PBS (15 мкг/г массы тела). Мышей анестезировали изофлураном в индукционной камере и поддавали визуализации с помощью системы визуализации in vivo Xenogen IVIS (Caliper Life Sciences) через 10, 12 и 14 минут после инъекции люциферина в режиме отсортировки небольшого количества при времени обнаружения 1 секунда -1 минута для получения ненасыщенных изображений. Люциферазную активность анализировали с помощью программного обеспечения Living Image Software (Caliper Life Sciences) и поток фотонов анализировали в представляющих интерес областях, которые охватывали все тело каждой отдельной мыши.
На биолюминесцентных изображениях видно, что Т-клетки, экспрессирующие T-ChARM1, T-ChARM2 или T-ChARM3 к CD19, уничтожали опухоль также эффективно, как и Т-клетки, экспрессирующие CAR (с коротким) или CAR (со средним) к CD19, тогда как T-клетки, экспрессирующие CAR (с длинным), были не очень эффективны для данной конкретной конструкции и/или мишени (фигура 6).
Пример 8
In vivo устойчивость T-клеток, экспрессирующих молекулы T-ChARM
Когорту мышей NSG, несущих опухоли Raji, обрабатывали 5 x 106 человеческих Т-клеток, экспрессирующих CAR/huEGFRt или T-ChARM/huEGFRt к CD19, и через 3 недели анализировали периферическую кровь (взятие крови из орбиты глаза) с помощью проточной цитометрии с использованием моноклональных антител к huEGFR, к CD8 человека и к CD45 человека. Количество CD8+ huEGFRt+ (Wang et al., 2011) T-клеток показано в виде процентного содержания от живых клеток периферической крови на фигуре 7. Уровень детектируемых huEGFRt коррелирует с уровнем Т-клеток, экспрессирующих T-ChARM.
Хотя Т-клетки, экспрессирующие CAR (с длинным) к CD19 не были систематически видны через 3 недели, все другие Т-клетки, экспрессирующие CAR и T-ChARM к CD19, легко обнаруживали в периферической крови мышей NSG в течение по меньшей мере 3 недель после адоптивного переноса и уничтожения опухоли. Из этих результатов видно, что Т-клетки, экспрессирующие CAR и T-ChARM к CD19, могут сохраняться в течение длительного периода времени in vivo и опосредовать противоопухолевую активность.
Пример 9
Идентификация T-клеток, экспрессирующих молекулы T-ChARM
Т-клетки, экспрессирующие T-ChARM/huEFRt к CD19, окрашивали комплексами антитело к EGFR-биотин/стрептавидин-PE, антитело к Strep-метке II-FITC, Strep-Tactin®-APC (аллофикоцианин) и затем анализировали с помощью проточной цитометрии. Т-клетки, трансдуцированные CAR (с коротким) к CD19, использовали в качестве контроля. Все из трансдуцированных T-клеток с T-ChARM и CAR (с коротким) к CD19 положительно окрашивались моноклональным антителом к EGFR, что указывало на то, что они трансдуцированы и экспрессируют huEGFRT (фигура 8 A).
Из результатов видно, что Т-клетки, трансдуцированные T-ChARM2 и T-ChARM3, можно легко отличить от нетрансдуцированных клеток с помощью реагентов, которые окрашивают последовательность метки, экспрессируемую в клетках с T-ChARM (фигура 8 B, C). Т-клетки, трансдуцированные T-ChARM1, T-ChARM2 и T-ChARM3, но не CAR (с коротким) к CD19, положительно окрашивались антителом к Strep-метке II-FITC (фигура 8 B). Те, которые были с большим числом копий последовательности метки, имели повышенный сигнал окрашивания. Клетки с T-ChARM также окрашивались Streptactin APC (фигура 8 C), что показывало, что в случае Strep-метки можно использовать более одного реагента для окрашивания, чтобы обнаружить Т-клетки.
Пример 10
Отсортировка T-клеток, экспрессирующих молекулы T-ChARM
Т-клетки, трансдуцированные T-ChARM2, окрашивали антителом к Strep-метке, меченным FITC, и затем отсортировывали с помощью настольного клеточного сортера FACS (клеточный сортер BD FACSAria II, BD Biosciences, Сан-Хосе, Калифорния). На фигуре 9 показаны популяции клеток до отсортировки (верхний ряд) и после отсортировки (нижний ряд). На самой дальней правой секции (после отсортировки) показано, что Т-клетки, экспрессирующие T-ChARM2, накопили из 15,8% популяции клеток до популяции клеток, которая составляла более 99% Т-клеток с T-ChARM2.
Пример 11
Накопление Т-клеток, экспрессирующих молекулы T-ChARM, с помощью иммуномагнитного отбора
Клетки инкубировали со Streptactin-микрогранулами или наногранулами (IBA, Геттинген, Германия), затем загружали на колонку MACS (Miltenyi Biotec) в магнитном сепараторе. Колонку промывали 3 раза 3 мл буфера MACS. Затем колонку удаляли из сепаратора и магнитные гранулы со Streptactin® с прикрепленными Т-клетками, экспрессирующими Strep-метку, промывали, уверенно толкая поршень в колонку. Т-клетки, трансдуцированные T-ChARM3, смешанные с контрольными Т-клетками, метили одним из следующих видов гранул: микрогранулы со Strep-Tactin № 1 (как правило, используются для очистки белков, размер приблизительно от 0,5 до 1,5 мкм); микрогранулы со Strep-Tactin № 2 (как правило, используются для выделения клеток с помощью Fab Streptamers® [Strep-меченый Fab-фрагмент], размер приблизительно 0,5 мкм); наногранулы со Strep-Tactin № 3 (как правило, используются для выделения клеток с помощью стрептамеров MHC I [Strep-меченый мономер MHCI], размер приблизительно 100 нм); загружали на колонку MACS® (Miltenyi) и вставляли в магнитный сепаратор. Непосредственно выходящую и удержанную фракции отдельно окрашивали антителом к Strep-метке, меченным FITC, и анализировали способом проточной цитометрии.
В первом ряду фигуры 10 показаны популяции клеток до нанесения на колонку с гранулами со Strep-Tactin, тогда как во втором, третьем и четвертом рядах на фигуре 10 показаны популяции клеток из каждого образца после прохождения через колонку с гранулами № 1, № 2 и № 3 соответственно. Во втором ряду показано, что была некоторая потеря клеток, которая могла быть обусловлена размером микрогранул со Strep-Tactin № 1, не позволяющего некоторым клетками проходить через колонку. В целом, по данным видно, что любой тип испытанных гранул со Strep-Tactin был пригоден для прямого накопления Т-клеток, экспрессирующих T-ChARM.
Пример 12
Активация Т-клеток, экспрессирующих T-ChARM на клеточной поверхности, с помощью реагентов, связывающих метку
Активация и пролиферация Т-клеток требует двух сигналов: опосредованного вовлечением Т-клеточного антиген-специфического рецептора (TCR) и костимулирующего сигнала, наиболее типично, связывания CD28 с CD80 и CD86 (Ledbetter et al., Blood 75:1531, 1990). Соответственно, были разработаны микрогранулы, покрытые моноклональным антителом к CD3/CD28, для обеспечения обоих необходимых сигналов и неспецифических активации и размножения T-клеток для клинических применений (Riddell and Greenberg, 1990). Стимуляция Т-клеток антителом к CD3/CD28 также облегчает трансдукцию ретровирусными или лентивирусными векторами, которые кодируют CAR, но не селективное размножение трансдуцированных Т-клеток.
T-клетки, трансдуцированные T-ChARM3 к CD19, культивировали в течение 48 ч. в среде CTL либо без обработки (отрицательный контроль), либо с одним из следующих видов обработки: (a) микрогранулы со Strep-Tactin® № 1; (b) микрогранулы со Strep-Tactin № 2; (c) наногранулы со Strep-Tactin № 3; (d) гранулы с G-белком, конъюгированным с антителом к Strep-метке (размер приблизительно 2 мкм); (e) гранулы с G-белком, дважды конъюгированным с антителом к Strep-метке /антителом к CD28, или (f) совместно культивировали с облученными клетками TM-LCL с 50 ед./мл IL2 (положительный контроль). Для определения того, были ли клетки активированы после культивирования в течение 24 ч. и 48 ч., клетки исследовали на присутствие CD25/CD69 с использованием иммунофлуоресцентного окрашивания и проточной цитометрии. T-клетки экспрессируют de novo молекулы активации, в том числе CD69 и CD25, после активации через рецептор на Т-клеточной поверхности или при передаче сигнала через CAR, который экспрессирует CD3ζ. CD69 является одним из самых ранних маркеров активации клеточной поверхности и может быть вовлечен в проходящий процесс активации. Синтез CD25 (α-цепи рецептора IL2), наряду с самим IL2, индуцируется активацией Т-клеток при первоначальном контакте с антигеном.
По данным неожиданно обнаружили, что связывание Strep-метки Т-клеток, экспрессирующих T-ChARM, посредством гранул, покрытых либо Strep-Tactin, либо антителом к Strep-метке, в значительной степени активировало эти Т-клетки, и дополнительно обнаружили, что размер гранул также может оказывать влияние на уровень активации Т-клеток (фигура 13).
В дальнейших экспериментах с дополнительными конструкциями микрогранулы со Strep-Tactin индуцировали положительную регуляцию CD25 на CD8+ (фигура 27 A) и CD4+ (фигура 27 B) T-клетках, которые экспрессируют ChARM2 и ChARM3, но не на T-клетках, которые экспрессируют ChARM1 или CAR без метки, что указывало на то, что сродство ChARM1 для связывания микрогранул со Strep-Tactin является субоптимальным для основанной на ChARM активации T-клеток. Однако микрогранулы, покрытые антителом к Strep-метке, имеющие сродство связывания со Strep-меткой (KD = ~10 нМ) в 100 раз более высокое, чем у Strep-Tactin (KD = ~1 мкM), активировали различные Т-клетки с ChARM вне зависимости от числа копий или расположения метки в ChARM (фигуры 27 A и B). Следует отметить, что опосредованную связыванием со Strep-меткой активацию можно обнаружить как в T-клетках с 4-1BB и CD28 ChARM (фигура 27 C), так и в T-клетках с ChARM, нацеленных не на CD19 (фигура 27 D, ROR1-нацеленные ChARM1 R12).
Пример 13
Пролиферация Т-клеток, экспрессирующих T-ChARM на клеточной поверхности, с помощью реагентов, связывающих метку
Т-клетки, трансдуцированные T-ChARM1, T-ChARM2, T-ChARM3 к CD19 и CAR (с длинным) (отрицательный контроль), отдельно культивировали в среде CTL с микрогранулами со Strep-Tactin® и 50 ед./мл IL2. По изображению, полученному при помощи микроскопа, на 5 день видно, что Т-клетки, экспрессирующие T-ChARM2 и T-ChARM3, неожиданно формировали крупные кластеры вокруг гранул, что указывает на пролиферацию клеток на гранулах со Strep-Tactin, которая не наблюдалась у Т-клеток, экспрессирующих CAR (с длинным) к CD19 (фигура 11). Т-клетки, экспрессирующие T-ChARM1, показали менее обширные клеточные кластеры, но присутствовало явное размножение клеток, поскольку больше клеток было видно на планшете по сравнению с отрицательным контролем. В дополнительных экспериментах различные Т-клетки, экспрессирующие разные ChARM (в том числе N1ChARM и Ch1 ARM), характеризовались кластерами пролиферации в течение только 48 часов после стимуляции либо микрогранулами со StrepTactin, либо микрогранулами с антителом к Streptag (фигура 28). Т-клетки с CAR с обычным коротким спейсером (CD19-Hi) использовали в качестве отрицательного контроля.
Определяли кривую роста Т-клеток, экспрессирующих T-ChARM, при культивировании на микрогранулах со Strep-Tactin® (см. фигуры 12 и 29). В общей сложности приблизительно 1 x 106 Т-клеток, трансдуцированных T-ChARM1, T-ChARM2 и T-ChARM3 к CD19, отдельно высевали в среду CTL с микрогранулами со Strep-Tactin, микрогранулами, покрытыми моноклональным антителом к Strep-метке или моноклональными антителами к Strep-метке/CD28 (фигура 28), в присутствии 50 ед./мл IL2 и 5 нг/мл IL15 и культивировали в течение 10 дней. Количество клеток для каждой лунки подсчитывали на 3, 6 и 9 день. По данным видно, что Т-клетки, трансдуцированные T-ChARM3, имели самые высокие темпы роста в течение 9 дней при стимуляции гранулами со Strep-Tactin. При стимуляции гранулами со Strep-Tactin CD8+ или CD4+ T-клетки с ChARM к CD19 размножались в приблизительно 20 - приблизительно 100 раз и наибольшую степень размножения наблюдали у Т-клеток с ChARM3 (фигуры 29 A и B). Гранулы, покрытые антителом к Strep-метке и моноклональными антителами к Strep-метке /CD28, индуцировали даже больший рост (в 100-250 раз) у общего количества Т-клеток с ChARM, и в отличие от стимуляции гранулами со StrepTactin, CD8+ и CD4+ T-клетки, экспрессирующие ChARM1, демонстрировали тенденцию к большей степени размножения, чем Т-клетки, экспрессирующие ChARM2 или ChARM3. T-клетки, которые экспрессировали CD28 ChARM или ChARM к ROR1, также эффективно размножались с гранулами с антителами к Strep-метке/CD28, что показывало применимость данного подхода для размножения Т-клеток с ChARM с различными костимулирующими доменами и специфичностью к различным опухолевым мишеням (данные не показаны).
В другом анализе кривой роста в общей сложности приблизительно 5 x 105 Т-клеток, трансдуцированных T-ChARM3 к CD19, высевали в среду CTL с 50 ед./мл IL2; одними из следующих гранул: (a) микрогранулы со Strep-Tactin № 1, (b) микрогранулы со Strep-Tactin № 2, (c) наногранулы со Strep-Tactin № 3, (d) гранулы с G-белком, конъюгированным с антителом к Strep-метке, (e) гранулы с G-белком, дважды конъюгированным с антителом к Strep-метке /антителом к CD28, или (f) гранулы с двойным антителом к CD3/CD28 (положительный контроль); и культивировали в течение 7 дней. Количество клеток для каждой лунки подсчитывали на 3 день, 5 день и 7 день. По данным видно, что гранулы с G-белком, дважды конъюгированным с антителом к Strep-метке /антителом к CD28, стимулируют максимальную пролиферацию Т-клеток, экспрессирующих T-ChARM3, на 5 день, что было значительно лучше, чем у положительного контроля с антителом к CD3/CD28 (фигура 16). Реагенты, захватывающие Strep-метку, отличные от микрогранул со Strep-Tactin № 2, стимулировали пролиферацию Т-клеток, экспрессирующих T-ChARM, до приблизительно такого же уровня, что и положительный контроль с антителом к CD3/CD28.
Для дополнительного подтверждения пролиферации Т-клеток, экспрессирующих T-ChARM, измеряли уровень белка Ki-67 в качестве суррогатного критерия пролиферации. Ki-67 представляет собой ядерный белок, ассоциированный с и, возможно, необходимый для клеточной пролиферации. T-клетки, трансдуцированные T-ChARM3 к CD19, культивировали в течение 5 дней в среде CTL в присутствии одного из следующих видов обработки: (a) микрогранул со Strep-Tactin® № 1, (b) микрогранул со Strep-Tactin № 2, (c) наногранул со Strep-Tactin № 3, (d) гранул с G-белком, конъюгированным с антителом к Strep-метке, (e) гранул с G-белком, дважды конъюгированным с антителом к Strep-метке /антителом к CD28, или (f) гранул с двойным антителом к CD3/CD28 (положительный контроль). После культивирования в течение 5 дней клетки фиксировали, пермеабилизовали, окрашивали антителом к Ki-67, конъюгированным с FITC, и анализировали с помощью проточной цитометрии.
Из этих данных видно, что гранулы со Strep-Tactin или гранулы с антителом к Strep-метке могут стимулировать селективную клеточную пролиферацию, и пролиферация, измеряемая с помощью окрашивания Ki-67, была лучше, чем наблюдавшаяся с антителом к CD3/CD28 положительного контроля (фигура 14).
Дополнительный уровень белка Ki-67 проводили на Т-клетках, трансдуцированных T-ChARM1, T-ChARM2 или T-ChARM3 к CD19 и культивировавшихся в течение 7 дней в среде CTL при: (a) отсутствии обработки; (b) присутствии микрогранул со Strep-Tactin® № 1 в дозе 15 мкг, 50 мкг или 150 мкг на 1 x 106 клеток или (c) совместном культивировании с облученными клетками ТM-LCL с 50 ед./мл IL2 (положительный контроль). После культивирования в течение 7 дней клетки фиксировали, пермеабилизовали, окрашивали антителом к Ki-67, конъюгированным с FITC, и анализировали с помощью проточной цитометрии. Из этих результатов также видно, что гранулы со Strep-Tactin могут стимулировать пролиферацию Т-клеток, экспрессирующих T-ChARM, независимо от количества использованных гранул, в частности, для клеток с T-ChARM2 и T-ChARM3 (фигура 15). Кроме того, Т-клетки, экспрессирующие каждый из T-ChARM, пролиферировали в присутствии гранул со Strep-Tactin на том же ил более высоком уровне, нежели при положительной контрольной стимуляции с помощью TM-LCL.
Пример 14
Селективное размножение Т-клеток, экспрессирующих молекулы T-ChARM
В общей сложности приблизительно 5 x 105 CD8+ T-клеток человека стимулировали с помощью гранул с антителом к CD3/CD28. На 2 день обработанные клетки трансдуцировали лентивирусом, содержащим молекулу нуклеиновой кислоты, кодирующую T-ChARM1/huEGFRt к CD19. На 5 день гранулы с антителом к CD3/CD28 удаляли. В этот момент обработанные клетки разделяли на две группы, одну группу дополнительно не обрабатывали, а другую группу обрабатывали микрогранулами со Strep-Tactin® (от приблизительно 0,5 мкм до приблизительно 1,5 мкм). На 10 день клетки из каждой группы собирали, окрашивали иммунофлуоресцентным антителом к Strep-метке и анализировали с помощью проточной цитометрии. По кривой роста видно, что после удаления гранул с антителом к CD3/CD28 добавление микрогранул со Strep-Tactin продолжает стимулировать значительную пролиферацию Т-клеток (фигура 17 A). Из анализа проточной цитометрии видно, что клетки, которые были пролиферирующими, фактически представляли собой Т-клетки, экспрессирующие T-ChARM, поскольку присутствовал значительно более высокий процент Т-клеток, экспрессирующих T-ChARM (как измерено посредством окрашивания huEGFRt) в группе, обработанной гранулами со Strep-Tactin (нижняя секция), по сравнению с контрольной группой (верхняя секция) (фигура 17 B). Клетки из каждой группы затем дополнительно отсортировывали с помощью маркера для huEGFRt, после чего 5,0 x 105 клеток размножали путем стимуляции с помощью CD19+ TM-LCL. Клетки, предварительно обработанные микрогранулами со StrepTactin, подвергались значительной и быстрой пролиферации до уровня приблизительно 8,0 x 107 клеток через 7 дней по сравнению только лишь с 4,0 x 106 клеток в контрольной группе. Это показывает, что после стимуляции микрогранулами со Strep-Tactin через последовательность метки T-ChARM последующая повторная стимуляция через scFv-компонент к CD19 T-ChARM является высокоэффективной.
Для определения того, нужна ли вообще стимуляция гранулами с антителом к CD3/CD28 для размножения Т-клеток, экспрессирующих T-ChARM, авторы данной заявки исследовали, могут ли быть Т-клетки трансдуцированы для экспрессии T-ChARM только с помощью стимуляции цитокинами и затем селективно размножены посредством обработки только гранулами с антителом к Strep-метке. В общей сложности приблизительно 5 x 105 CD8+ T-клеток человека культивировали с 5 нг/мл IL-7 и 10 нг/мл IL-15 в течение 24 ч. и затем трансдуцировали с тем же титром вирусов, кодирующих два типа T-ChARM3 к CD19 (с эффекторным доменом 41BB или CD28). Трансдуцированные клетки на 2 день обрабатывали гранулами с G-белком, конъюгированным с антителом к Strep-метке, и затем на 7 день собирали, окрашивали с помощью иммунофлуоресцентного антитела к Strep-метке II и анализировали с помощью проточной цитометрии.
По данным видно, что гранулы с G-белком, конъюгированным с антителом к Strep-метке, стимулировали пролиферацию Т-клеток, экспрессирующих T-ChARM, до более чем 60% клеток в культуре (фигуры 18 B и 18 D) в отсутствие стимуляции гранулами с антителом к CD3/CD28. Если трансдуцированные клетки не подвергали воздействию гранул с антителом к Strep-метке, то пролиферировало менее 1% трансдуцированных клеток (фигуры 18 A и 18 C).
Функциональность Т-клеток с ChARM после размножения на гранулах, покрытых только моноклональным антителом к Strep-метке или моноклональными антителами к Strep-метке/CD28, проверяли, чтобы убедиться, что стимуляция через ChARM не будет оказывать неблагоприятного воздействия на распознавание опухоли in vitro или in vivo. Независимо от костимулирующего домена в модели, Т-клетки с ChARM, размноженные на микрогранулах с антителом к Strep-метке, показывали мощную цитолитическую активность, эффективное высвобождение цитокинов и сохраненную экстенсивную пролиферативную способность в комплексе с антигенной стимуляцией по сравнению с клетками до размножения или после вызванного антигеном размножения (TM-LCL) (фигуры 30 A - 30 C). После селективного размножения Т-клетки с ChARM характеризовались высокой жизнеспособностью (>90%), большой долей сохраненной экспрессии костимулирующих рецепторов (CD27/CD28) и маркеров Т-клеток центральной памяти CD45RO и CD62L (фигура 30 D), были способны устранять клетки опухоли Raji у мышей NSG (фигура 30 E) и были способны сохраняться так же, как Т-клетки с CAR, размноженные посредством стимуляции CD19+ B-клетками (фигура 30 L).
Пример 15
Влияние вовлечения реагентов, связывающих метку, на высвобождение цитокинов Т-клетками, экспрессирующими T-ChARM
Т-клетки, экспрессирующие CAR (с коротким) (размноженные при стимуляции TM-LCL) или T-ChARM1 (размноженные при стимуляции TM-LCL или микрогранулами со StrepTactin) к CD19, совместно культивировали в течение 24 часов с клетками Raji (фигура 19 C) или клетками K562, экспрессирующими либо CD19 (фигура 19 A), либо ROR1 (отрицательный контроль) (фигура 19 B). PMA/иономицин использовали в качестве положительного контроля (фигура 19 D). Супернатанты собирали и анализировали с помощью мультиплексного анализа цитокинов (Luminex®). Уровень высвобождения цитокинов Т-клетками, экспрессирующими T-ChARM1 к CD19, культивированными на микрогранулах со Strep-Tactin, был выше (за исключением IFN-γ), чем наблюдавшийся для Т-клеток, экспрессирующих T-ChARM1, стимулированных клетками TM-LCL (фигура 19 A, C и D). Вне зависимости от условий группа совместного культивирования с клетками K562/ROR1 (отрицательный контроль) не продуцировала каких-либо обнаруживаемых цитокинов (фигура 19 B). Интересно отметить, что наблюдался значительно более высокий уровень продуцирования IL2 в культурах, индуцированных гранулами со Strep-Tactin (более чем 10-кратное повышение), по сравнению с группой, стимулированной TM-LCL.
Пример 16
Пролиферация, усиленная с помощью антитела к Strep-метке в комбинации с антителами к CD27 или к CD28
Очищенные Т-клетки, экспрессирующие T-ChARM3 к CD19 (5 x 105), помещали в среду CTL с 50 ед./мл IL2 на 0 день, и затем в культуру клеток добавляли 2 мкг магнитных гранул с G-белком (NEB), гранулы с G-белком, конъюгированным с антителом к Strep-метке II (0,5 мкг)/ антителом к CD27 (0,5 мкг), или гранулы с G-белком, конъюгированным с антителом к Strep-метке II (0,5 мкг)/ антителом к CD28 (0,5 мкг). Клетки только в культуральной среде использовали в качестве отрицательного контроля. На 5 день клетки изучали под микроскопом.
На фигуре 20 показано, что гранулы с G-белком, конъюгированным с антителом к Strep-метке II, стимулировали размножение Т-клеток, экспрессирующих T-ChARM, и что комбинирование антитела к Strep-метке II либо с антителом к CD28, либо с антителом к CD27 будет стимулировать размножение Т-клеток, экспрессирующих T-ChARM, еще более эффективно.
Различные варианты осуществления, описанные выше, можно объединять с получением дополнительных вариантов осуществления. Все патенты США, публикации заявок на выдачу патентов США, заявки на выдачу патентов США, иностранные патенты, заявки на иностранный патент и непатентные публикации, упомянутые в данном описании и/или перечисленные в информационном листке заявки, включены в данный документ посредством ссылки в полном объеме. Аспекты вариантов осуществления могут быть модифицированы, если необходимо использовать концепции различных патентов, заявок и публикаций, для получения дополнительных вариантов осуществления.
Эти и другие изменения могут быть сделаны в вариантах осуществления с учетом приведенного выше подробного описания. В целом, в нижеследующей формуле изобретения используемые термины не должны толковаться как ограничивающие формулу изобретения конкретными вариантами осуществления, раскрытыми в настоящем описании и формуле изобретения, но должны быть истолкованы с включением всех возможных вариантов наряду с полным объемом эквивалентов, на которые эта формула изобретения имеет право. Соответственно, формула изобретения не ограничивается настоящим раскрытием.