Результат интеллектуальной деятельности: ЛЕЧЕНИЕ СЕРДЕЧНОГО ПРИСТУПА И ИШЕМИЧЕСКОГО ПОВРЕЖДЕНИЯ СОЕДИНЕНИЯМИ ГАЛОГЕНА
Вид РИД
Изобретение
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет по предварительной заявке на патент США № 61/937943, поданной 10 февраля 2014 г., предварительной заявке на патент США № 62/007015, поданной 3 июня 2014 г., предварительной заявке на патент США № 62/060338, поданной 6 октября 2014 г. и предварительной заявке на патент США №62/082957, поданной 21 ноября 2014 г., каждая из которых полностью включена в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям, содержащим соединения галогена и/или халькогенида, в том числе содержащим соединение галогена и/или халькогена в восстановленной форме, например, галиды и/или халькогениды, и способам лечения или предотвращения повреждений и заболеваний, в том числе заболеваний и повреждений, связанных с гипоксией, ишемией или реперфузионным повреждением и/или образованием активных форм кислорода, например, сердечного приступа, хронической сердечной недостаточности, заболеваний и повреждений, связанных с повышенной скоростью обмена веществ, например, эпилепсии, и заболеваний и повреждений, связанных с нежелательным иммунным или воспалительным ответом, например, реакцией «трансплантат против хозяина» (РТПХ), или трансплантацией органов. Настоящее изобретение также относится к способам уменьшения или ингибирования иммунного ответа с применением композиции, содержащей соединение галида и/или халькогенида.
УРОВЕНЬ ТЕХНИКИ
Соединения, содержащие галоген, т.е. элемент 17 группы периодической таблицы элементов, обычно называют «галогенами» или «соединениями галогенов». Указанные элементы представлены йодом (I), фтором (F), хлором (Cl), бромом (Br) и астатом (At). Искусственно созданный элемент 117 (унунсептий) может также считаться галогеном. Термин «галоген» означает «солеобразующий», и соединения, содержащие галогены, обычно называют «солями». Все галогены содержат 7 электронов в своих внешних оболочках, что обеспечивает степень окисления, равную -1. Все галогены образуют бинарные соединения с водородом, известные как галиды водорода: фторид водорода (HF), хлорид водорода (HCl), бромид водорода (HBr), йодид водорода (HI), и астатид водорода (HAt). Водные растворы галидов водорода известны как галогенводородные кислоты. Указанные кислоты имеют следующие названия: фтористоводородная кислота, соляная кислота, бромистоводородная кислота и йодистоводородная кислота. Хлор играет у высших животных биологическую роль, обеспечивая водные хлоридные анионы, входящие в электролитный состав межклеточной и внутриклеточной жидкости. Известно, что йод необходим нашему организму в следовых количествах, в частности, для щитовидной железы, и дефицит железа может вызывать разрастание щитовидной железы. О биологической роли остальных трех галогенов ничего не известно.
В медицине ишемически-реперфузионные повреждения обычно связаны с кровопотерей или снижением притока крови к ткани или органу. Ишемическое-реперфузионное повреждение представляет собой сложное явление, часто встречающееся при ограничении притока крови к органу или ткани вследствие повреждения или кровопотери, а также в хирургической практике. Ишемия обычно относится к ограничению притока крови в ткани, вызывающему нехватку кислорода и глюкозы, необходимых для клеточного метаболизма. Ишемия, как правило, бывает вызвана проблемами с кровеносными сосудами, приводящими к повреждению или дисфункции ткани. Ишемия также относится к локальной анемии в ткани или органе, которая может возникать в результате травмы или застоя (например, вазоконстрикции, тромбоза или эмболии). Последствиями такого повреждения является местное или отдаленное разрушение тканей, и иногда смерть. Реперфузия обычно относится к восстановлению притока крови к ишемической ткани или органу. Первичная реперфузионная терапия, в том числе первичная чрескожная коронарная ангиопластика (ПЧКА) и тромболизис, являются стандартом лечения острых коронарных синдромов. Быстрое восстановление кровотока в ишемическом миокарде ограничивает размеры инфаркта и снижает смертность. Однако, к сожалению, восстановление кровотока может проводить также к повреждению ткани, например, сердечной, и к осложнениям, называемым реперфузионным повреждением. Реперфузионное повреждение представляет собой повреждение ткани, происходящее при восстановлении кровотока в ткани после периода ишемии или кислородной недостаточности. Отсутствие поступающих из крови кислорода и питательных веществ в течение ишемического периода обуславливает состояние, при котором восстановление циркуляции приводит к воспалению и окислительному повреждению за счет индуцирования окислительного стресса вместо восстановления нормальной функции. Например, имеются убедительные данные, свидетельствующие о синтезе при ишемии миокарда собственно миокардом или инфильтрующими его воспалительными клетками активных форм кислорода (АФК) в качестве раннего события при указанном процессе. Синтезированные АФК могут обуславливать повреждение клеток, опосредованное несколькими путями, в том числе непосредственное повреждение мембран и белков, или непрямое повреждение за счет активации про-апоптотических путей.
Эффективная терапия для уменьшения или предотвращения ишемического и реперфузионного повреждения оказалась труднодостижимой. Несмотря на более глубокое понимание патофизиологии указанных процессов и обнадеживающие доклинические испытания нескольких агентов, результаты большинства клинических испытаний, направленных для предотвращение ишемически-реперфузионного повреждения, были разочаровывающими. Соответственно, способы терапии для лечения или ограничения повреждений и нарушений, обусловленных гипоксией, ишемией и/или реперфузией, остаются активной областью исследований.
Очевидно, что в данной области техники существует потребность в новых фармацевтических композициях и способах лечения или предотвращения ишемических и/или реперфузионных повреждений, в том числе, например, удобных для введения пациентам, как в контролируемой медицинской среде, например, при лечении заболевания, в качестве лечения в полевых условиях при чрезвычайной ситуации, так и в качестве неотложной помощи при катастрофической травме или угрожающем жизни медицинском явлении. Настоящее изобретение удовлетворяет указанную потребность путем обеспечения фармацевтических композиций, содержащих активные агенты, которые, как показано в настоящем документе, защищают животных от повреждений, обусловленных гипоксическими и/или ишемическими состояниями, а также других повреждений и болезненных состояний.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением предложены композиции и способы, подходящие для лечения или предотвращения различных заболеваний, состояний и расстройств.
Согласно одному варианту реализации в настоящем изобретении предложен способ лечения или предотвращения повреждения или заболевания у субъекта, включающий введение указанному субъекту композиции, содержащей соединение галогена и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Согласно определенным вариантам реализации указанное соединение галогена находится в химически восстановленной форме. Согласно определенным вариантам реализации указанное соединение галогена содержит йод, бром, хлор, фтор или астат. Согласно конкретным вариантам реализации в том случае, если соединение галогена содержит йод, указанное соединение галогена представляет собой йодид. Согласно различным вариантам реализации указанный йодид представляет собой йодид натрия, йодид калия, йодид водорода, йодид кальция или йодид серебра. Согласно конкретным вариантам реализации указанное соединение галогена представляет собой йодат. Согласно различным вариантам реализации указанный йодат представляет собой йодат натрия, йодат калия, йодат кальция или йодат серебра. Согласно определенным вариантам реализации указанное соединение галогена содержит бром. Согласно конкретным вариантам реализации в том случае, если соединение галогена содержит бром, указанное соединение галогена представляет собой бромид. Согласно определенным вариантам реализации указанный галоген присутствует в соединении галогена в восстановленной форме.
Согласно определенным вариантам реализации согласно настоящему изобретению указанная композиция содержит один или большее количество восстанавливающих агентов или антиоксидантов. Согласно конкретным вариантам реализации указанная композиция входит в состав, обеспечивающий поддержание галогена или соединения галогена, присутствующего в указанной композиции, в восстановленном состоянии, например, обеспечивающий поддержание степени окисления йодида -1. Согласно одному варианту реализации указанная композиция представляет собой фармацевтическую композицию, содержащую восстановленную форму соединения галогена, например, восстановленную форму йода, такую как йодид, глутатион и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Согласно определенным вариантам реализации указанный глутатион присутствует в количестве, достаточном для поддержания указанного галогена или соединения галогена в восстановленном состоянии. Согласно определенным вариантам реализации способов и композиции согласно настоящему изобретению по меньшей мере 90% указанной восстановленной формы галогена или соединения галогена в указанной композиции остается в восстановленной форме в течение по меньшей мере одного часа, по меньшей мере одной недели, по меньшей мере одного месяца или по меньшей мере шести месяцев при хранении при комнатной температуре. Согласно определенным вариантам реализации по меньшей мере 90% указанной восстановленной формы галогена или соединения галогена в указанной композиции находится в восстановленной форме в течение по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере четырех месяцев, по меньшей мере шести месяцев, или по меньшей мере один год при хранении при температуре, составляющей приблизительно 4ºC. Согласно конкретным вариантам реализации по меньшей мере 50%, по меньшей мере 75%, или по меньшей мере 90% глутатиона, исходно присутствовавшего в указанной композиции, находится в восстановленной форме.
Согласно различным вариантам реализации способов согласно настоящему изобретению указанную композицию вводят субъекту парентерально или перорально. Согласно определенным вариантам реализации указанную композицию вводят субъекту внутривенно или путем инфузии.
Согласно определенным вариантам реализации указанная композиция представляет собой состав для перорального введения и содержит стабильную восстановленную форму соединения галогена.
Согласно конкретным вариантам реализации указанная композиция входит в состав для внутривенного введения или введения путем инфузии, и содержит стабильную восстановленную форму соединения галогена.
Согласно различным вариантам реализации указанную композицию вводят указанному субъекту в количестве, достаточном для увеличения концентрации галогена в крови по меньшей мере на 100%, по меньшей мере на 200%, по меньшей мере на 300%, по меньшей мере на 400%, или по меньшей мере на 500% по меньшей мере на некоторое время.
Согласно различным вариантам реализации указанное заболевание или повреждение выбрано из любого из перечисленных, или вызвано или обусловлено чем-либо из перечисленного: абляционная терапия, адреналектомия, аневризма аорты, хирургия корня аорты, аортальный стеноз, порок клапана аорты, аритмия, атеросклероз, трепетание предсердий, фибрилляция предсердий, дефект межпредсердной перегородки, артериовенозная мальформация, хирургия головного мозга в сознании, бариатрическая хирургия, трансплантация костного мозга, повреждения плечевого сплетения, брадикардия, аневризма головного мозга, хирургическое увеличение молочной железы, хирургическое уменьшение молочной железы, ожоговая травма, операция коронарного шунтирования, коронарная болезнь сердца, абляционная терапия сердца, катетеризация сердца, ресинхронизирующая сердечная терапия, хирургия сердца, кардиомиопатия, хирургия сердца, заболевания сердечно-сосудистой системы, каротидная ангиопластика и стентирование, коарктация аорты, врожденный порок сердца, операция коронарного шунтирования, коронарная болезнь сердца, медицина критических состояний, хроническая обструктивная болезнь легких, протезирование локтевого сустава, неотложная медицинская помощь, терапия внутренних болезней, общая хирургия, желудочно-кишечное кровотечение, сердечный приступ, трансплантация сердца, хирургия клапанов сердца, протезирование тазобедренного сустава, гипертрофическая кардиомиопатия, гипоксическая ишемическая энцефалопатия, гистерэктомия, хирургическое формирование илеоанального анастомоза (J-образного резервуара), воспалительное заболевание кишечника, ишемическая болезнь сердца, ишемически-реперфузионное повреждение, синдром раздраженного кишечника, челюстная хирургия, трансплантация почки, гортанно-трахеальная хирургическая реконструкция, трансплантация печени, операция по уменьшению объема легких, трансплантация легкого, минимально инвазивная хирургия сердца, нейрохирургия, челюстно-лицевая и оральная хирургия, ортопедическая хирургия, трансплантация поджелудочной железы, панкреатит, частичная нефрэктомия, хирургия шейного отдела позвоночника в педиатрии, педиатрическая хирургия, опущение тазовых органов, пластическая и реконструктивная хирургия, пульмонология и медицина критических состояний, атрезия легочной артерии, изоляция легочной вены, выпадение прямой кишки, рестриктивная кардиомиопатия, отслоение сетчатки, ретинопатия недоношенных, роботизированная хирургия, повреждение спинного мозга, спонтанное расслоение коронарной артерии, спонтанная окклюзия виллизиева круга, инсульт, применение телемедицины при инсульте (телеинсульт), внезапная остановка сердца, стереотаксическая радиохирургия, хирургия, систолическая сердечная недостаточность, хроническая сердечная недостаточность, тахикардия, гипертрофическая кардиомиопатия, аневризма грудного отдела аорты, торакальная хирургия, полная артропластика локтевого сустава, болезнь трикуспидального клапана, язвенный колит, клапансохраняющая реконструкция корня аорты, сосудистая и эндоваскулярная хирургия, сосудистая медицина или желудочковая тахикардия. Согласно определенным вариантам реализации указанное повреждение или заболевание выбрано из следующих, обусловлено или вызвано чем-либо из следующего: воспаление, сердечный приступ, операция коронарного шунтирования, ишемия, ишемия ЖКТ, ишемия печени, ишемия почек, гипоксически-ишемическая энцефалопатия, инсульт, травматическое повреждение головного мозга, ишемия конечностей, ишемия глаза, сепсис, воздействие дыма, ожог, реперфузия или острое повреждение легких. Согласно определенным вариантам реализации указанное повреждение представляет собой инфаркт, обусловленный сердечным приступом или инсультом. Согласно определенным вариантам реализации указанное заболевание представляет собой гипоксически-ишемическую энцефалопатию. Согласно конкретным вариантам реализации указанное повреждение представляет собой медицинскую процедуру, такую как, например, трансплантация клеток, тканей или органов, или обусловлено медицинской процедурой, например, отторжение трансплантата. Согласно определенным вариантам реализации указанное повреждение представляет собой аутологичную или гетерологичную трансплантацию, например, клеток, ткани или органа. Согласно определенным вариантам реализации указанное повреждение представляет собой операцию коронарного шунтирования, необязательно – шунтирование коронарных артерий (ШКА).
Определенные варианты реализации способов согласно настоящему изобретению предусматривают введение субъекту композиции, содержащей соединение галогена и композиции, содержащей один или большее количество дополнительных активных агентов. Согласно определенным вариантам реализации одна композиция содержит и соединение галогена, и один или большее количество дополнительных активных агентов, тогда как согласно другим вариантам реализации указанный галоген и указанные один или большее количество дополнительных активных агентов присутствуют в отдельных композициях. Согласно конкретным вариантам реализации композиции согласно настоящему изобретению содержат соединение галогена и/или один или большее количество дополнительных активных агентов, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Согласно конкретным вариантам реализации композиции согласно настоящему изобретению представляют собой фармацевтические композиции. Согласно конкретным вариантам реализации настоящее изобретение включает композицию, содержащую соединение галогена, необязательно в восстановленной форме, один или большее количество дополнительных активных агентов и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Согласно конкретным вариантам реализации указанные один или большее количество дополнительных активных агентов содержат халькогенид, необязательно в восстановленной форме. Согласно конкретным вариантам реализации указанный халькогенид включает сульфид или селенид. Согласно конкретным вариантам реализации указанный сульфид или селенид представляет собой восстановленную форму сульфида или селенида. Согласно некоторым вариантам реализации указанная восстановленная форма сульфида присутствует в стабильной жидкой фармацевтической композиции, содержащей фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Согласно определенным вариантам реализации указанная композиция содержит и соединение галогена, и халькогенид, при этом указанная композиция входит в состав для внутривенного или перорального введения.
Согласно конкретным вариантам реализации способов согласно настоящему изобретению указанная композиция содержит носитель. Согласно определенным вариантам реализации указанное соединение галогена связано с указанным носителем. Согласно определенным вариантам реализации с тех случаях, когда композиция содержит соединение галогена и один или большее количество дополнительных активных агентов, указанное соединение галогена и указанные один или большее количество дополнительных активных агентов связаны с указанным носителем. Согласно определенным вариантам реализации указанное соединение галогена и указанные один или большее количество дополнительных активных агентов, присутствующие в указанной композиции, связаны с указанным носителем ковалентным или нековалентным образом. Согласно конкретным вариантам реализации указанный носитель представляет собой альбумин, плазму, сыворотку, альфа-2-макроглобулин или иммуноглобулин, или полипептид, родственный любому из указанных полипептидов.
Согласно близкому варианту реализации в настоящем изобретении предложена композиция, содержащая соединение галогена и носитель, причем указанное соединение галогена связано с носителем. Согласно определенным вариантам реализации указанная композиция дополнительно содержит один или большее количество дополнительных активных агентов. Согласно конкретным вариантам реализации указанные один или большее количество дополнительных активных агентов связаны с указанным носителем. Согласно определенным вариантам реализации указанное соединение галогена и/или указанные один или большее количество дополнительных активных агентов связаны с указанным носителем ковалентным или нековалентным образом. Согласно определенным вариантам реализации указанные один или большее количество дополнительных активных агентов содержат халькогенид. Согласно конкретным вариантам реализации указанный халькогенид включает сульфид или селенид. Согласно дополнительным вариантам реализации указанный сульфид или селенид представляет собой восстановленную форму сульфида или селенида.
Согласно дополнительным близким вариантам реализации настоящим изобретением охвачена композиция, содержащая стабильную восстановленную форму соединения галогена, при этом указанная фармацевтическая композиция входит в состав для внутривенного введения, введения путем инфузии или перорального введения. Согласно конкретным вариантам реализации указанное соединение галогена содержит йод, бром, хлор, фтор или астат. Согласно определенным вариантам реализации указанное соединение галогена содержит йод. Согласно конкретным вариантам реализации указанное соединение галогена представляет собой йодид, йодат, органический йодид, периодат или периодинан. Согласно определенным вариантам реализации указанный йодид представляет собой йодид натрия, йодид калия, йодид водорода, йодид кальция, йодид цинка или йодид серебра. Согласно определенным вариантам реализации указанный йодат представляет собой йодат натрия, йодат калия, йодат кальция или йодат серебра. Согласно конкретным вариантам реализации указанное соединение галогена содержит бром. Согласно определенным вариантам реализации указанное соединение галогена представляет собой бромид. Согласно конкретным вариантам реализации указанная композиция содержит глутатион.
Согласно определенным вариантам реализации способов и композиции согласно настоящему изобретению по меньшей мере 90% соединения галогена в указанной композиции присутствует в восстановленной форме в течение по меньшей мере одного часа, по меньшей мере одной недели, по меньшей мере одного месяца или по меньшей мере шести месяцев при хранении при комнатной температуре. Согласно определенным вариантам реализации по меньшей мере 90% соединения галогена в указанной композиции присутствует в восстановленной форме в течение по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере четырех месяцев, по меньшей мере шести месяцев или по меньшей мере одного года при хранении при температуре, составляющей приблизительно 4ºC.
Согласно определенным вариантам реализации способов и композиций согласно настоящему изобретению указанная композиция, содержащая соединение галогена и/или композиция, содержащая дополнительный активный агент, содержит один или большее количество восстанавливающих агентов, регулирующих тоничность агентов, стабилизаторов, поверхностно-активных веществ, лиопротекторов, полиолов, антиоксидантов или консервантов.
Согласно родственным вариантам реализации, настоящим изобретением охвачена единичная дозированная форма композиции согласно настоящему изобретению, отличающаяся тем, что указанная единичная дозированная форма представляет собой состав для перорального введения. Согласно конкретным вариантам реализации единичная дозированная форма представляет собой пилюлю, таблетку, каплет или капсулу. Согласно определенным вариантам реализации единичная дозированная форма содержит 150 мг или менее, 125 мг или менее, 100 мг или менее, 75 мг или менее, 50 мг или менее, 25 мг или менее, или 10 мг или менее соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит от приблизительно 1 мг до приблизительно 150 мг (включая любой интервал в указанном диапазоне), от приблизительно 1 мг до приблизительно 125 мг, от приблизительно 1 мг до приблизительно 100 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 50 мг, от приблизительно 1 мг до приблизительно 25 мг или от приблизительно 1 мг до приблизительно 10 мг соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит приблизительно 150 мг, приблизительно 125 мг, приблизительно 100 мг, приблизительно 75 мг, приблизительно 50 мг, приблизительно 25 мг или приблизительно 10 мг соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит 1000 мг или менее, 800 мг или менее, 700 мг или менее, 500 мг или менее, 250 мг или менее, 200 мг или менее, или 150 мг или менее соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит от приблизительно 100 мг до приблизительно 1000 мг (включая любой интервал в указанном диапазоне), от приблизительно 150 мг до приблизительно 800 мг, от приблизительно 200 мг до приблизительно 700 мг, от приблизительно 250 мг до приблизительно 600 мг, от приблизительно 300 мг до приблизительно 500 мг, от приблизительно 350 мг до приблизительно 450 мг или от приблизительно 300 мг до приблизительно 700 мг соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит приблизительно 200 мг, приблизительно 300 мг, приблизительно 400 мг, приблизительно 500 мг, приблизительно 600 мг, приблизительно 700 мг, приблизительно 800 мг, приблизительно 900 мг или приблизительно 1000 мг соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит или включает количество соединения галогена и/или халькогена. Обеспечивающее эффективную дозу при введении одной или большего числа единичных дозированных форм субъекту, например, млекопитающему, такому как человек. Например, одна или большее количество, две или большее количество, или четыре или большее количество единичных дозированных форм можно вводить субъекту в течение одного дня для достижения эффективного количества. Согласно конкретным вариантам реализации указанное соединение галогена содержит йод, бром, хлор, фтор или астат. Согласно определенным вариантам реализации указанное соединение галогена содержит йод. Согласно определенным вариантам реализации указанное соединение галогена представляет собой йодид, йодат, органический йодид, периодат или периодинан. Согласно определенным вариантам реализации указанное соединение галогена представляет собой йодид. Согласно определенным вариантам реализации указанный йодид представляет собой йодид натрия, йодид калия, йодид водорода, йодид кальция или йодид серебра. Согласно определенным вариантам реализации указанное соединение галогена представляет собой йодат. Согласно определенным вариантам реализации указанный йодат представляет собой йодат натрия, йодат калия, йодат кальция или йодат серебра. Согласно определенным вариантам реализации указанное соединение галогена содержит бром. Согласно определенным вариантам реализации указанное соединение галогена представляет собой бромид.
Согласно конкретным вариантам реализации единичная дозированная форма дополнительно содержит один или большее количество дополнительных активных агентов. Согласно определенным вариантам реализации указанные один или большее количество дополнительных активных агентов содержат халькогенид. Согласно определенным вариантам реализации указанный халькогенид включает сульфид или селенид. Согласно определенным вариантам реализации указанный сульфид или селенид представляет собой восстановленную форму сульфида или селенида.
Настоящее изобретение также включает способ лечения или предотвращения повреждения или заболевания у субъекта, включающий введение указанному субъекту любой из единичных дозированных форм согласно настоящему изобретению. Согласно конкретным вариантам реализации указанное заболевание или повреждение представляет собой любое из описанных в настоящем документе. Согласно определенным вариантам реализации указанное повреждение представляет собой инфаркт, вызванный сердечным приступом или инсультом. Согласно определенным вариантам реализации указанное заболевание представляет собой хроническую сердечную недостаточность, например, систолическую сердечную недостаточность. Согласно определенным вариантам реализации указанное повреждение вызвано операцией коронарного шунтирования, необязательно – шунтирования коронарных артерий (ШКА).
Согласно определенным вариантам реализации любого из способов, предложенных в настоящем изобретении, указанный способ дополнительно включает введение субъекту композиции, содержащей струмогенный агент, соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы, или глутатион. Согласно конкретному варианту реализации указанные один или большее количество дополнительных активных агентов содержит глутатион. Согласно определенным вариантам реализации по меньшей мере 50%, по меньшей мере 75%, или по меньшей мере 90% вводимого глутатиона находится в восстановленном состоянии.
Согласно определенным вариантам реализации любая из композиций согласно настоящему изобретению дополнительно содержит один или большее количество дополнительных активных агентов. Согласно определенным вариантам реализации указанные один или большее количество дополнительных активных агентов содержат струмогенный агент, соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы, или глутатион. Согласно конкретному варианту реализации указанные один или большее количество дополнительных активных агентов содержит глутатион. Согласно определенным вариантам реализации по меньшей мере 50%, по меньшей мере 75%, или по меньшей мере 90% вводимого глутатиона находится в восстановленном состоянии.
Согласно конкретным вариантам реализации способов и композиций согласно настоящему изобретению струмогенный агент, соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы, или глутатион связан(о) с указанным носителем.
Согласно определенным вариантам реализации настоящим изобретением охвачен способ лечения или предотвращения повреждения или заболевания у субъекта, включающий введение указанному субъекту композиции, содержащей халькогенид и глутатион, или содержащей соединение галогена и глутатион, отличающийся тем, что указанная композиция дополнительно содержит фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Согласно определенным вариантам реализации указанная композиция дополнительно содержит соединение галогена или халькогенид, соответственно. Согласно определенным вариантам реализации указанная композиция содержит соединение галогена, халькогенид и глутатион. Согласно определенным вариантам реализации указанное соединение галогена содержит йод, например, йодид или йодат. Согласно определенным вариантам реализации указанный халькогенид включает селенид или сульфид, в том числе например, восстановленные формы сульфида или селенида, или обоих. Согласно определенным вариантам реализации указанное заболевание или повреждение представляет собой любое из описанных в настоящем документе. Согласно конкретным вариантам реализации указанное повреждение или заболевание выбрано из перечисленных ниже, обусловлено или вызвано чем-либо из перечисленных ниже: воспаление, сердечный приступ, хроническая сердечная недостаточность, операция коронарного шунтирования, ишемия, ишемия ЖКТ, ишемия печени, ишемия почек, гипоксически-ишемическая энцефалопатия, инсульт, травматическое повреждение головного мозга, ишемия конечностей, ишемия глаза, сепсис, воздействие дыма, ожог, реперфузия или острое повреждение легких. Согласно одному варианту реализации указанное повреждение представляет собой инфаркт, вызванный сердечным приступом или инсультом. Согласно одному варианту реализации указанное повреждение вызвано операцией коронарного шунтирования, необязательно – шунтированием коронарных артерий (ШКА).
Согласно различным вариантам реализации любого из способов, предложенных в настоящем изобретении, указанному субъекту вводят от приблизительно 1 пг/кг до приблизительно 1 г/кг халькогенида, сульфида и/или селенида. Согласно определенным вариантам реализации указанному субъекту вводят от приблизительно 10 мкг/кг до приблизительно 10 мг/кг халькогенида, например, сульфида или селенида. Согласно определенным вариантам реализации любого из способов, предложенных в настоящем изобретении, указанное соединение галогена представляет собой йодид, йодат или йод, и указанному субъекту вводят от приблизительно 10 пг/кг до приблизительно 1г/кг йодида, йодата или йода. Согласно конкретным вариантам реализации указанному субъекту вводят от приблизительно 10 мкг/кг до приблизительно 10 мг/кг, от приблизительно 100 мкг/кг до приблизительно 10 мг/кг, от приблизительно 1 мг/кг до приблизительно 10 мг/кг, от приблизительно 1 мг/кг до приблизительно 5 мг/кг, приблизительно 1 мг/кг, приблизительно 2 мг/кг, приблизительно 3 мг/кг, приблизительно 4 мг/кг, приблизительно 5 мг/кг, приблизительно 6 мг/кг, приблизительно 7 мг/кг, приблизительно 8 мг/кг, приблизительно 9 мг/кг или приблизительно 10 мг/кг йодида, йодата или йода. Согласно определенным вариантам реализации любое количество из указанных вводят указанному субъекту в течение приблизительно 24 часов или в течение приблизительно 48 часов, например, ежедневно или через день, на протяжении периода времени, например, на протяжении одного дня, двух дней, трех дней, четырех дней, пяти дней, шести дней, одной недели, двух недель, одного месяца, двух месяцев, шести месяцев, одного года или дольше.
Согласно определенным вариантам реализации количество соединения галогена, например, йодида, йодата или йода, вводимое указанному субъекту, например, млекопитающему или человеку, составляет 150 мг или менее, 125 мг или менее, 100 мг или менее, 75 мг или менее, 50 мг или менее, 25 мг или менее, или 10 мг или менее соединения галогена. Согласно определенным вариантам реализации вводимое указанному субъекту количество соединения галогена составляет от приблизительно 1 мг до приблизительно 150 мг (включая любой интервал в указанном диапазоне), от приблизительно 1 мг до приблизительно 125 мг, от приблизительно 1 мг до приблизительно 100 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 50 мг, от приблизительно 1 мг до приблизительно 25 мг или от приблизительно 1 мг до приблизительно 10 мг соединения галогена. Согласно определенным вариантам реализации вводимое указанному субъекту количество соединения галогена составляет приблизительно 150 мг, приблизительно 125 мг, приблизительно 100 мг, приблизительно 75 мг, приблизительно 50 мг, приблизительно 25 мг или приблизительно 10 мг соединения галогена. Согласно определенным вариантам реализации вводимое указанному субъекту количество соединения галогена составляет 1000 мг или менее, 800 мг или менее, 700 мг или менее, 500 мг или менее, 250 мг или менее, 200 мг или менее, или 150 мг или менее соединения галогена. Согласно определенным вариантам реализации вводимое указанному субъекту количество соединения галогена составляет от приблизительно 100 мг до приблизительно 1000 мг (включая любой интервал в указанном диапазоне), от приблизительно 150 мг до приблизительно 800 мг, от приблизительно 200 мг до приблизительно 700 мг, от приблизительно 250 мг до приблизительно 600 мг, от приблизительно 300 мг до приблизительно 500 мг, от приблизительно 350 мг до приблизительно 450 мг или от приблизительно 300 мг до приблизительно 700 мг соединения галогена. Согласно определенным вариантам реализации вводимое указанному субъекту количество соединения галогена составляет приблизительно 200 мг, приблизительно 300 мг, приблизительно 400 мг, приблизительно 500 мг, приблизительно 600 мг, приблизительно 700 мг, приблизительно 800 мг, приблизительно 900 мг или приблизительно 1000 мг соединения галогена. Согласно определенным вариантам реализации любое количество из указанных вводят указанному субъекту в течение приблизительно 24 часов или приблизительно 48 часов, например, ежедневно или через день, на протяжении периода времени, например, на протяжении одного дня, двух дней, трех дней, четырех дней, пяти дней, шести дней, одной недели, двух недель, одного месяца, двух месяцев, шести месяцев, одного года или дольше.
Согласно различным вариантам реализации любого из способов и композиций согласно настоящему изобретению указанная композиция содержит глутатион в концентрации от приблизительно 1,5 мкМ до приблизительно 500 мМ. Согласно конкретным вариантам реализации указанная композиция содержит глутатион в концентрации от приблизительно 15 мМ до приблизительно 500 мМ.
Согласно дополнительному варианту реализации настоящим изобретением предусмотрена композиция, содержащая халькогенид и глутатион, или соединение галогена и глутатион, отличающаяся тем, что указанная композиция дополнительно содержит фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Согласно конкретным вариантам реализации указанная композиция дополнительно содержит соединение галогена или халькогенид, соответственно. Согласно определенным вариантам реализации указанная композиция содержит соединение галогена, халькогенид и глутатион. Согласно конкретным вариантам реализации указанное соединение галогена содержит йод, например, йодид. Согласно конкретным вариантам реализации указанный халькогенид включает селенид или сульфид, например, восстановленную форму селенида, сульфида или обоих. Согласно определенным вариантам реализации глутатион присутствует в указанной композиции в концентрации, составляющей от приблизительно 1 мМ до приблизительно 500 мМ. Согласно определенным вариантам реализации указанную композицию хранят в условиях пониженного содержания кислорода или в бескислородной среде до и/или во время введения указанному субъекту. Согласно определенным вариантам реализации указанную композицию хранят в указанных условиях в атмосфере аргона или азота до введения указанному субъекту. Согласно определенным вариантам реализации указанная композиция входит в состав для парентерального или перорального введения. Согласно определенным вариантам реализации указанная композиция входит в состав для внутривенного введения или введения путем инфузии.
Согласно другому близкому варианту реализации настоящим изобретением охвачен способ лечения или предотвращения заболевания или повреждения у субъекта, включающий ингибирование или предотвращение уменьшения отношения количества восстановленного глутатиона и количества окисленного глутатиона в кровотоке субъекта или на участке заболевания или повреждения. Согласно определенным вариантам реализации указанный способ включает увеличение отношения количества восстановленного глутатиона и количества окисленного глутатиона в кровотоке субъекта или на участке заболевания или повреждения. Согласно конкретным вариантам реализации указанный способ включает системное введение соединения галогена и/или халькогенида указанному субъекту до, во время или после начала указанного заболевания или повреждения. Согласно определенным вариантам реализации указанное соединение галогена содержит йод. Согласно конкретным вариантам реализации указанное соединение галогена представляет собой йодид или йодат. Согласно определенным вариантам реализации указанный халькогенид включает серу или селен. Согласно конкретным вариантам реализации указанный халькогенид включает селенид. Согласно определенным вариантам реализации указанное соединение галогена и/или указанный халькогенид вводят субъекту перорально или внутривенно, или путем инфузии. Согласно определенным вариантам реализации указанное соединение галогена и/или указанный халькогенид вводят субъекту на участке, удаленном от указанного заболевания или повреждения. Согласно определенным вариантам реализации указанное заболевание или повреждение локализовано в определенной ткани или органе. Согласно определенным вариантам реализации указанное заболевание или повреждение локализовано в определенном типе клеток, ткани или органе. Согласно определенным вариантам реализации указанный способ используют для лечения или предотвращения кризиса серповидных клеток или серповидноклеточной анемия. Согласно определенным вариантам реализации указанный способ используют для лечения или предотвращения острого нарушения кровообращения. Согласно определенным вариантам реализации указанный способ используют для лечения или предотвращения инфаркта миокарда или кардиогенный шок. Согласно определенным вариантам реализации указанный способ используют для лечения или предотвращения сердечного приступа или хронической сердечной недостаточности. Согласно определенным вариантам реализации указанный способ используют для лечения или предотвращения контраст-индуцированной нефропатии.
Согласно дополнительному варианту реализации в настоящем изобретении предложен способ предотвращения, ингибирования или уменьшения иммунного ответа у субъекта, включающий введение соединения галогена и/или халькогенида указанному субъекту. Согласно конкретным вариантам реализации указанное соединение галогена содержит йод. Согласно определенным вариантам реализации указанное соединение галогена представляет собой йодид. Согласно определенным вариантам реализации указанный халькогенид включает серу или селен. Согласно определенным вариантам реализации халькогенид включает селенид. Согласно конкретным вариантам реализации указанное соединение галогена и/или указанный халькогенид вводят субъекту перорально или внутривенно, или путем инфузии. Согласно определенным вариантам реализации указанное соединение галогена и/или указанный халькогенид вводят субъекту в область воспаления или иммунной реакции. Согласно определенным вариантам реализации указанный способ используют для лечения или предотвращения реакции «трансплантат против хозяина». Согласно определенным вариантам реализации указанный способ используют для ингибирования или уменьшения иммунного ответа во время или после трансплантации клеток, тканей и органов. Согласно конкретным вариантам реализации любых способов, связанных с трансплантацией клеток, тканей и органов, указанная клетка, ткань или орган является аллогенным(ой) или аутологичным(ой) для реципиента трансплантата. Согласно определенным вариантам реализации указанный способ используют для лечения или предотвращения ишемического или реперфузионного повреждения. Согласно определенным вариантам реализации указанный способ уменьшает количество одного или большего числа активные формы кислорода в кровотоке субъекта или в область воспаления или иммунной реакции в организме указанного субъекта.
Согласно определенным вариантам реализации в композициях и способах согласно настоящему изобретению вместо халькогенида или соединения галогена, или в дополнение к ним используют струмогенный агент.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
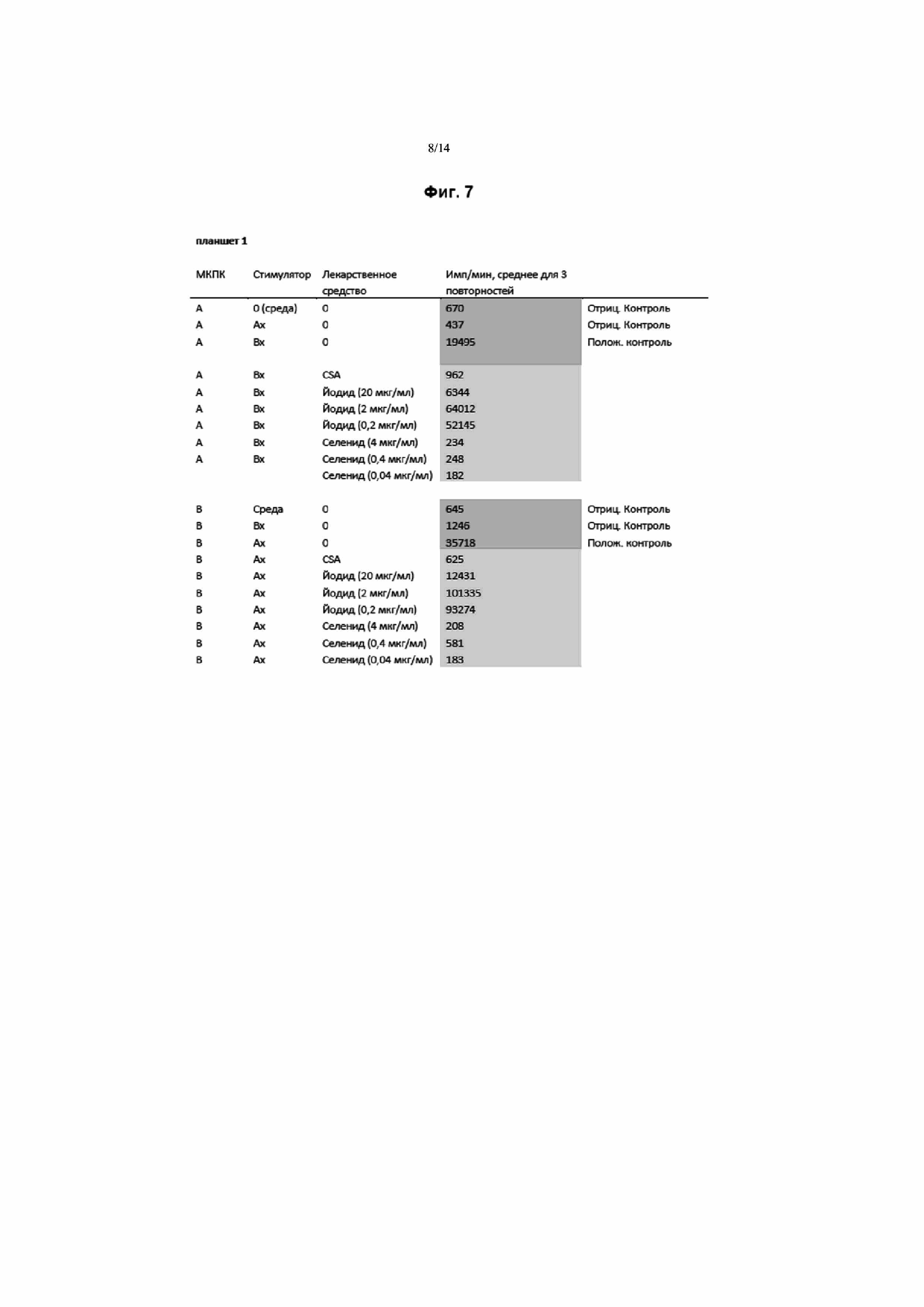
На Фиг. 1 приведен график и таблица, демонстрирующие защиту от инфаркта с применением NaI после индуцированной лигированием ишемии. Ишемическое состояние индуцировали у мышей путем лигирования со вскрытием грудной клетки левой нисходящей коронарной артерии. На указанном графике столбцы Inf/AAR и Inf/LV отражают морфометрический анализ размера зоны инфаркта (Inf) относительно общего размера области риска (AAR) или левого желудочка (LV), соответственно, в присутствии контрольного солевого раствора или возрастающих количеств NaI (согласно указанному). Столбец AAR/LV соответствует отношению размера области риска и размера левого желудочка в присутствии контрольного солевого раствора или возрастающих количеств NaI (согласно указанному), и показывает, что аналогичный отбор образцов выполняли для всех экспериментальных объектов. В каждой группе столбцов Inf/AAR, Inf/LV и AAR/LV в направлении слева направо соответствуют столбцам, расположенным в направлении сверху вниз на условных обозначениях. В таблице под графиком приведены средний объем (%) и стандартная ошибка для каждой точки данных.
На Фиг. 2 приведен график и таблица, демонстрирующие защиту от инфаркта с применением NaI после индуцированной лигированием ишемии. Ишемическое состояние индуцировали у мышей путем лигирования со вскрытием грудной клетки левой нисходящей коронарной артерии. На указанном графике столбцы Inf/AAR и Inf/LV отражают морфометрический анализ размера зоны инфаркта (Inf) относительно общего размера области риска (AAR) или левого желудочка (LV), соответственно, в присутствии контрольного солевого раствора или возрастающих количеств NaI (согласно указанному). Столбцы AAR/LV соответствуют отношению размера области риска и размера левого желудочка в присутствии контрольного солевого раствора или возрастающих количеств NaI (мг/кг), и показывают, что аналогичный отбор образцов выполняли для всех экспериментальных объектов. В каждой группе столбцов Inf/AAR Inf/LV и AAR/LV столбцы в направлении слева направо соответствуют столбцам, расположенным в направлении сверху вниз на условных обозначениях. В таблице под графиком приведены средний объем (%) и стандартная ошибка для каждой точки данных.
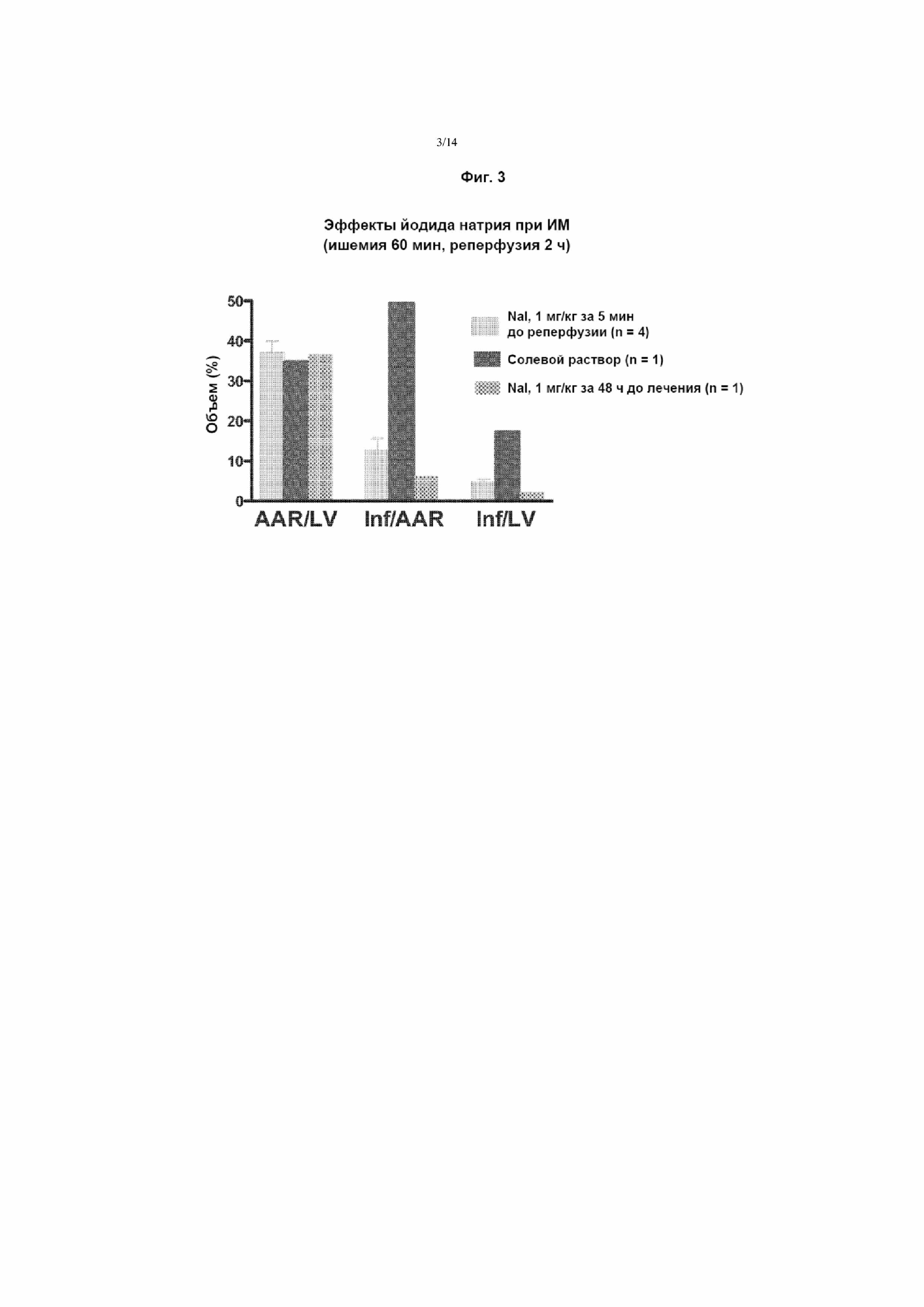
На Фиг. 3 приведен график, демонстрирующий защиту от инфаркта за счет профилактического лечения NaI за 5 минут или 48 часов до индуцированной лигированием ишемии. Субъектам вводили либо физиологический раствор, либо NaI (1 мг/кг) за 5 минут или за 48 часов до индуцирования ишемии путем лигирования со вскрытием грудной клетки левой нисходящей коронарной артерии. Через 60 минут ишемического состояния лигатуры снимали для индуцирования реперфузии, измеряли размер зоны инфаркта и регистрировали относительно общего размера области риска (AAR) и левого желудочка (LV). В каждой группе столбцов Inf/AAR, Inf/LV и AAR/LV столбцы в направлении слева направо соответствуют столбцам, расположенным в направлении сверху вниз на условных обозначениях. В таблице под графиком приведены средний объем (%) и стандартная ошибка для каждой точки данных.
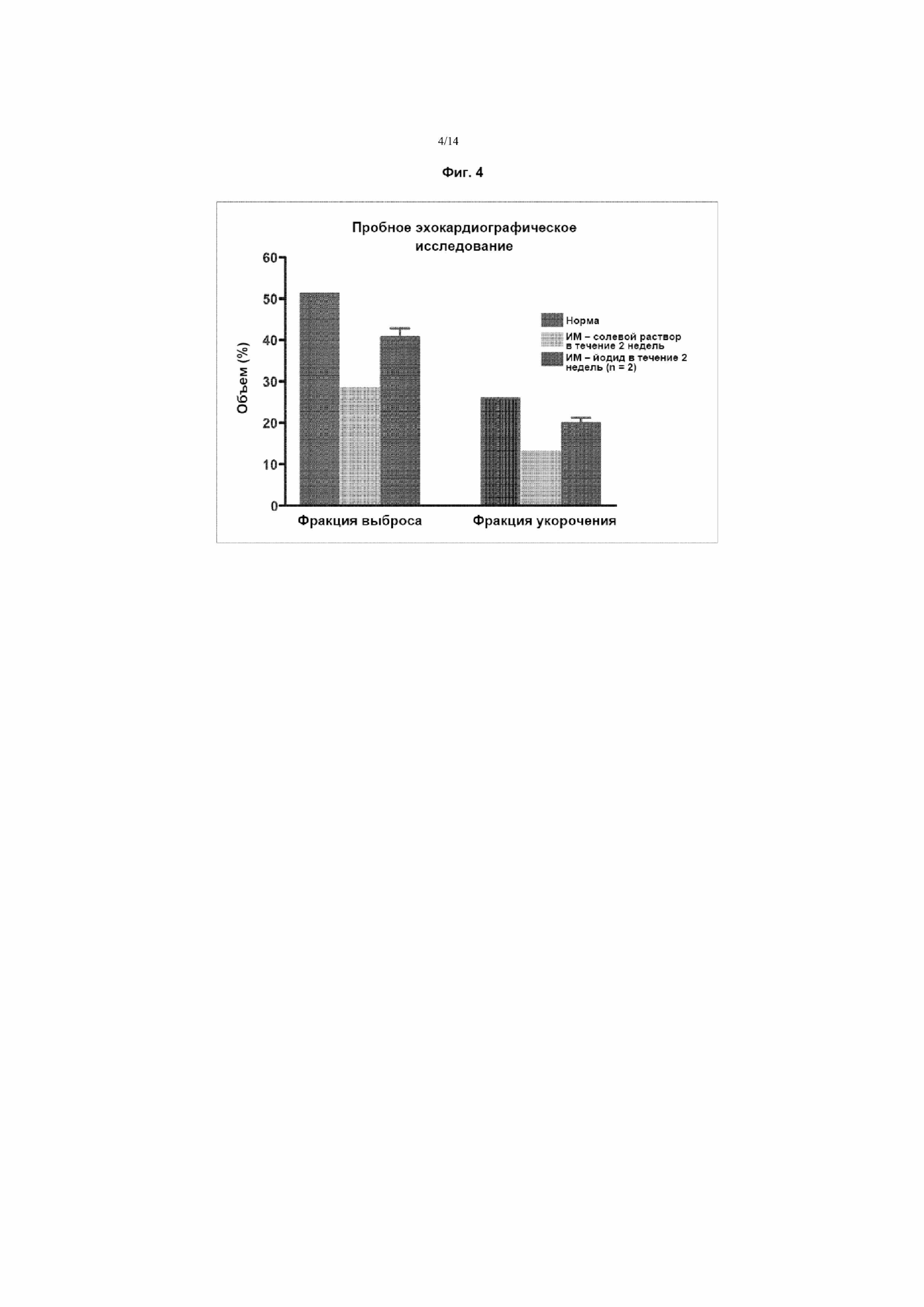
На Фиг. 4 приведен график, демонстрирующий защиту от инфаркта за счет профилактического лечения NaI путем однократного внутривенного введения за два дня до индуцированной лигированием ишемии согласно оценке с применением эхокардиограммы. На графике приведен средний объем (%) фракции выброса и фракции укорочения у здоровых животных (без индуцирования инфаркта), и животных, получавших лечение солевым раствором в качестве контроля или NaI. В каждой группе столбцов столбцы фракции выброса и фракции укорочения в направлении слева направо соответствуют столбцам, расположенным в направлении сверху вниз на условных обозначениях.
На Фиг. 5 приведены снимки, демонстрирующие, что глутатион предотвращает окисление селенида. На фотографиях представлены образцы с 50 мМ селенидом в воде (Фиг. 5A) или 150 мМ GSH (Фиг. 5B) на протяжении 8 минут непосредственно после получения. Окисленные формы селенида в растворах остаются темными, при этом наблюдается очевидное уменьшение уровней окисления образцов в глутатионе в каждый момент времени.
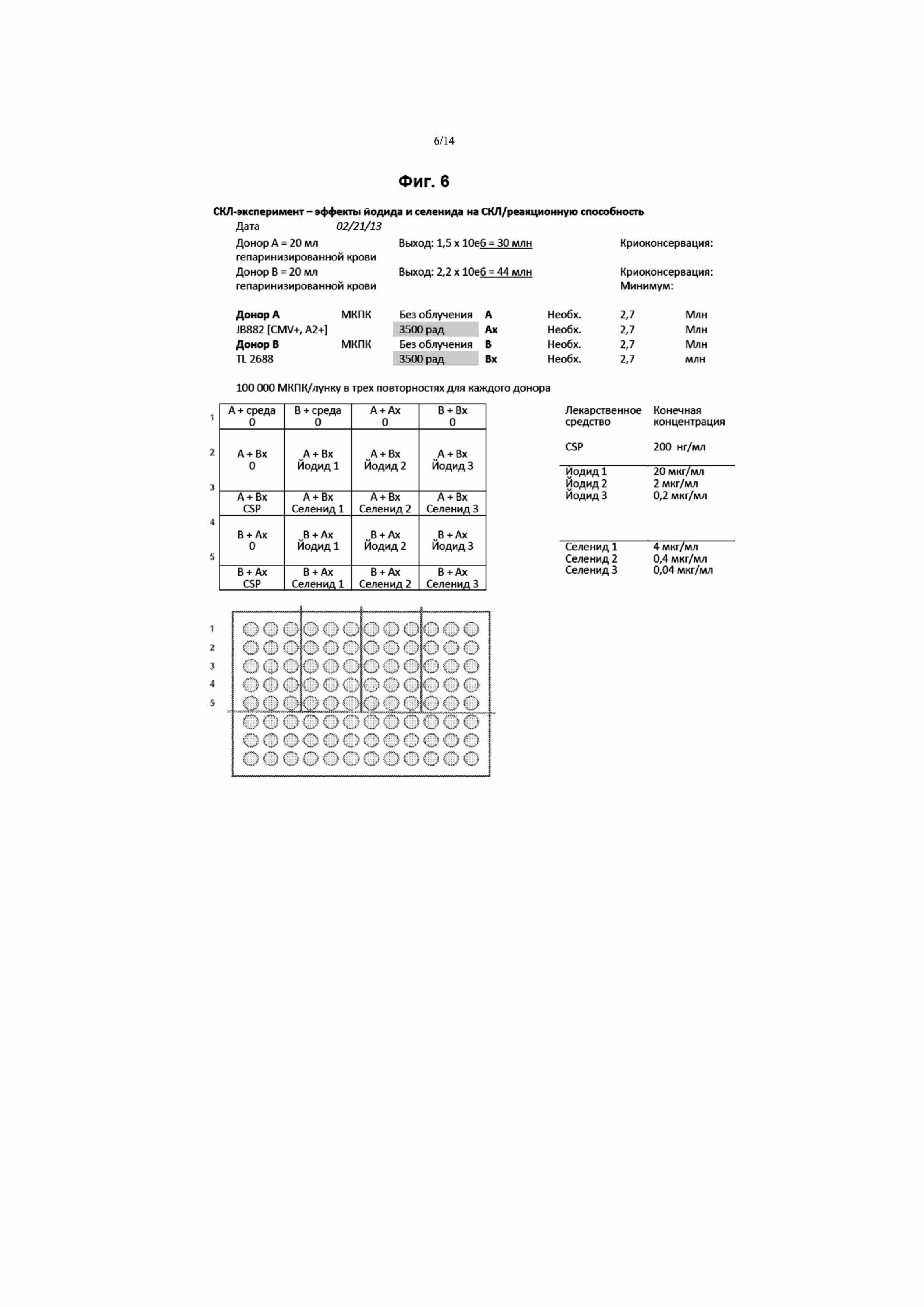
На Фиг. 6 приведено описание экспериментального протокола для демонстрации иммуносупрессивных эффектов селенида и йодида.
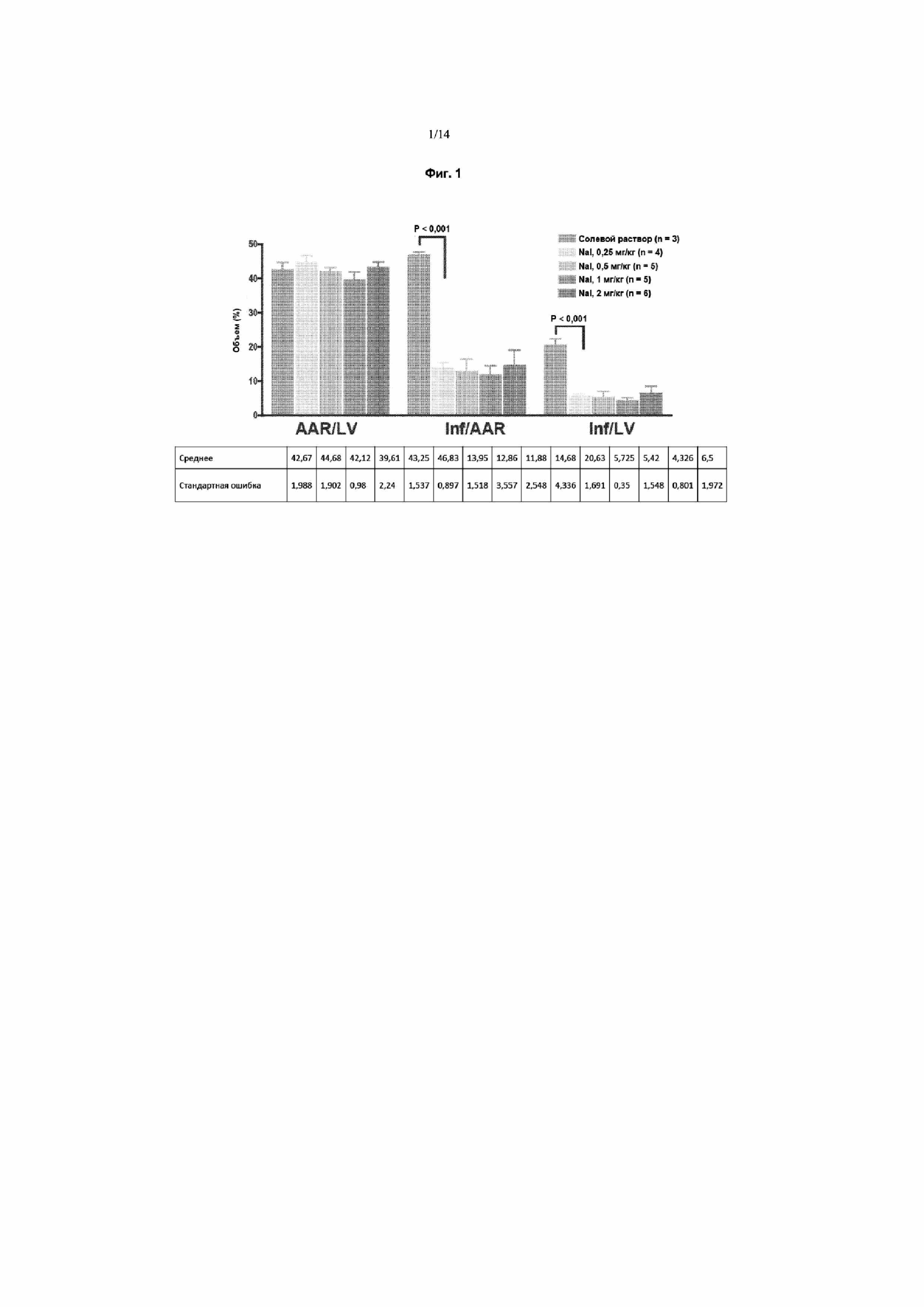
На Фиг. 7 приведена таблица, отражающая иммуносупрессивные эффекты йодида и селенида.
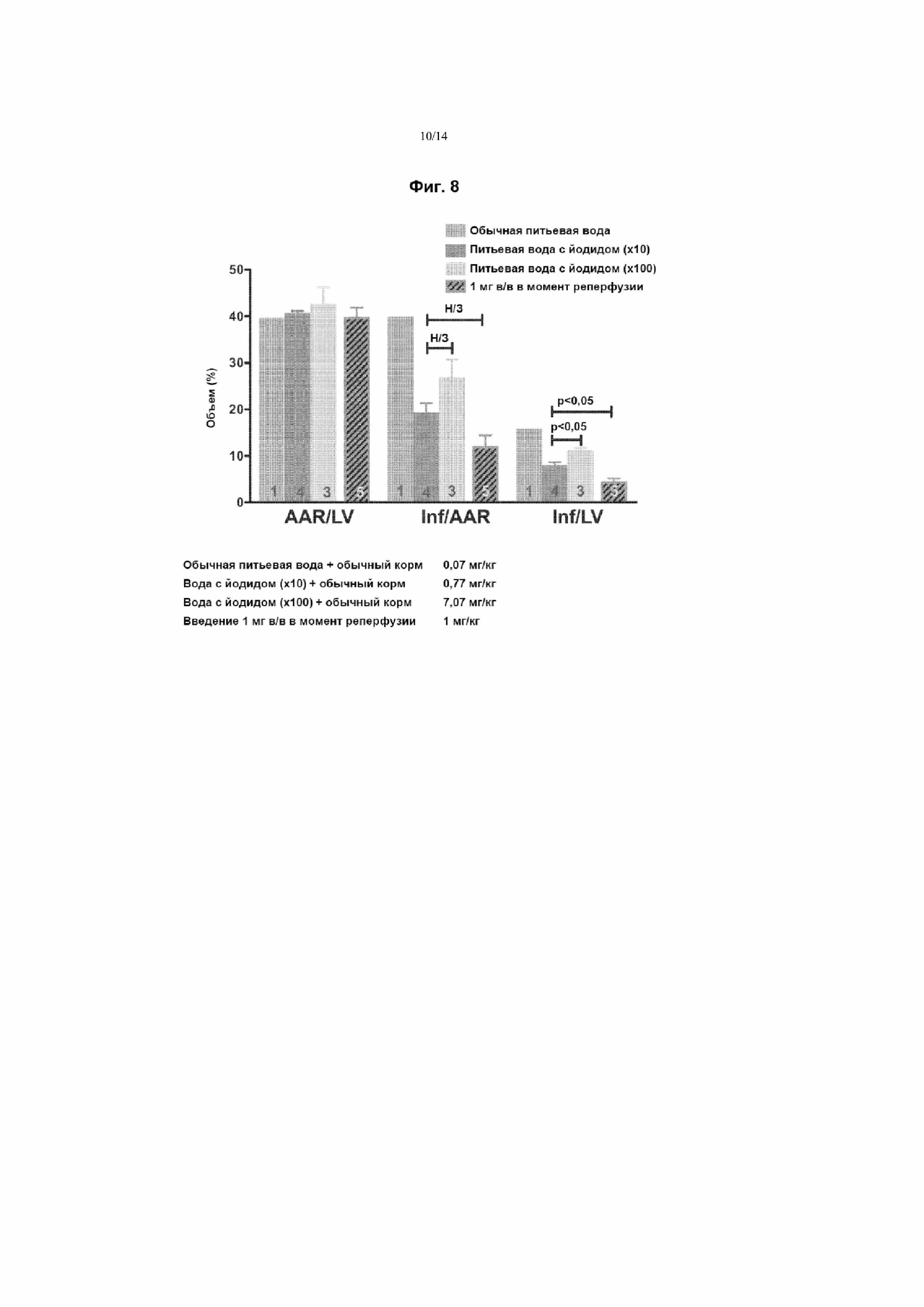
На Фиг. 8 приведен график и таблица, демонстрирующие защиту от инфаркта с применением NaI после индуцированной лигированием ишемии. На указанном графике столбцы Inf/AAR и Inf/LV отражают морфометрический анализ размера зоны инфаркта (Inf) относительно общего размера области риска (AAR) или левого желудочка (LV), соответственно, после индуцированной лигированием ишемии с началом через 2 дня диеты, включающей питьевую воду, содержащую заданные количества NaI. Столбцы AAR/LV соответствуют отношению размера области риска и размера левого желудочка после употребления обычной воды или воды, содержащей повышенные количества NaI (согласно указанным), и показывает, что аналогичный отбор образцов выполняли для всех экспериментальных объектов. В каждой группе столбцов столбцы Inf/AAR, Inf/LV и AAR/LV в направлении слева направо соответствуют расположенным в направлении сверху вниз столбцам на условных обозначениях. Присутствующее в разных образцах питьевой воды количество йодида указано под графиком.
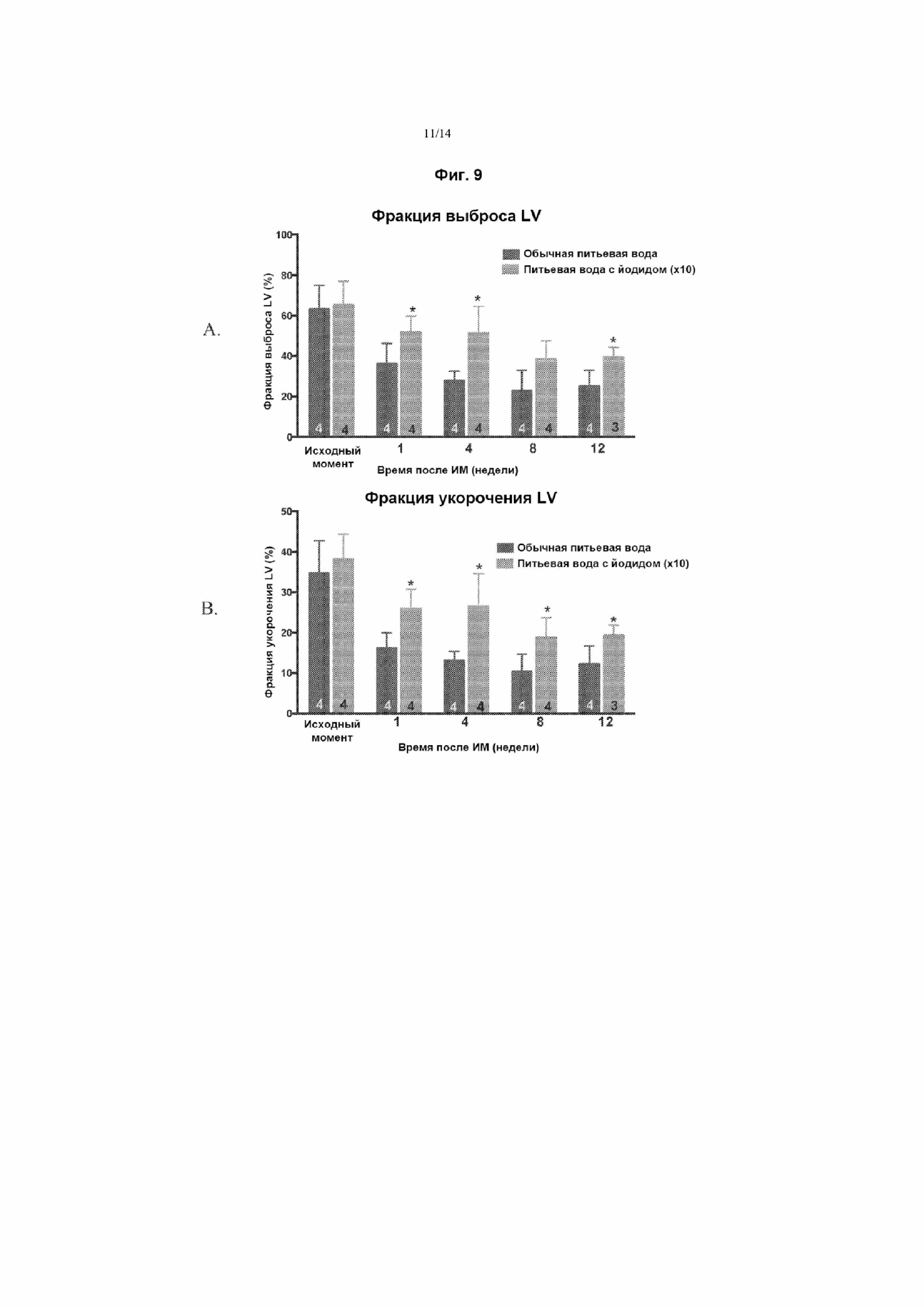
На Фиг. 9 приведены графики, демонстрирующие защиту от хронической сердечной недостаточности при применении NaI после индуцированного лигированием ишемического инфаркта миокарда. Фиг. 9A представляет собой график, отражающий фракцию выброса (%) левого желудочка (LV) в исходный момент времени и в заданные моменты времени после индуцированного инфаркта миокарда. Диету, включающую питьевую воду, содержащую 0,77 мг/кг NaI, начинали сразу после завершения процедуры лигирования. Фиг. 9B представляет собой график, отражающий фракцию укорочения (%) LV в исходный момент времени и в заданные моменты времени после индуцированного инфаркта миокарда. Диету, включающую питьевую воду, содержащую 0,77 мг/кг NaI, начинали сразу после завершения процедуры лигирования. Для каждой пары столбцов звездочками отмечено статистически значимое различие между мышами, получавшими содержащую йодид воду (светлые столбцы) и обычную питьевую воду (темные столбцы) (p<0,05).
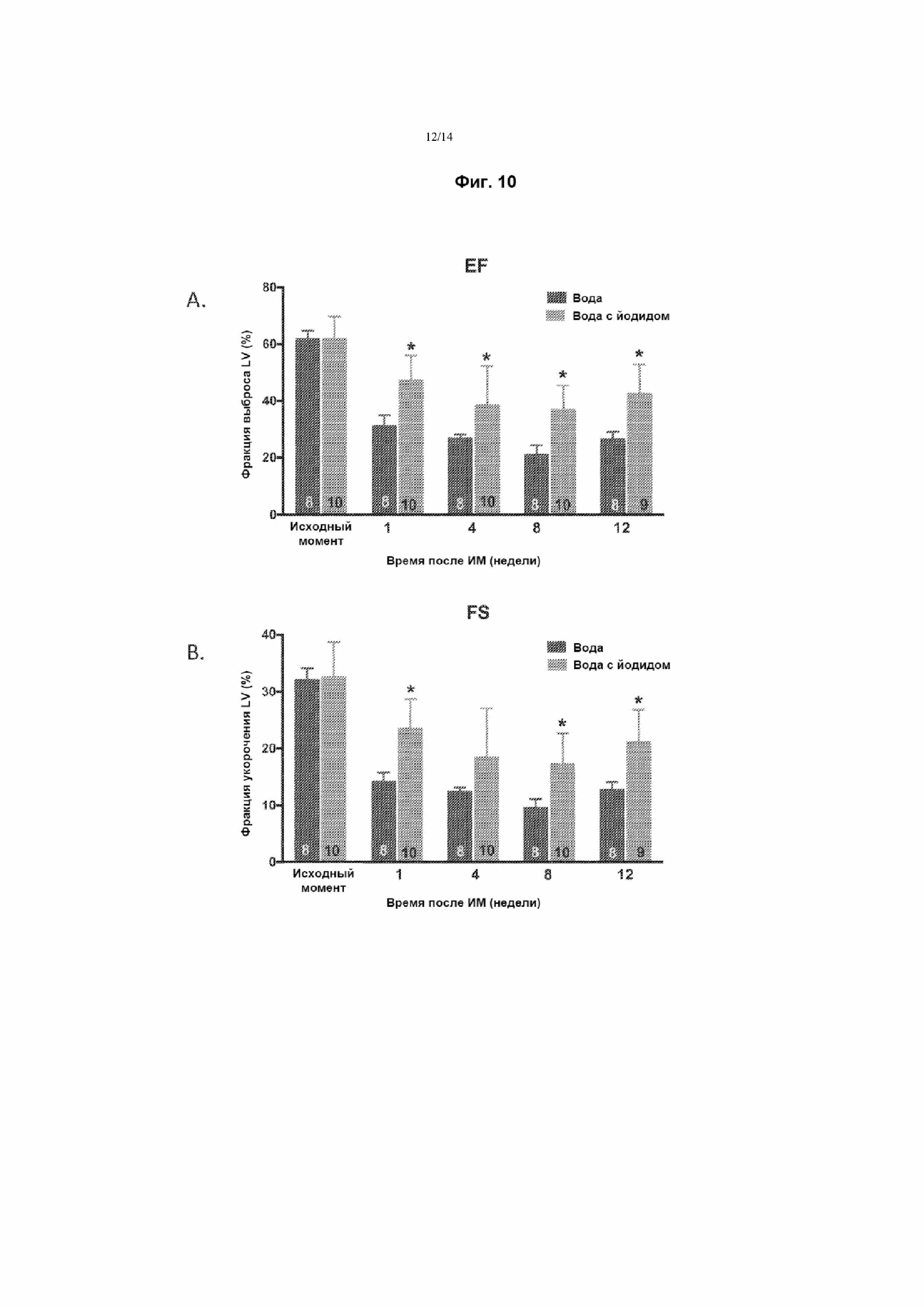
На Фиг. 10 приведены графики, демонстрирующие защиту от хронической сердечной недостаточности с применением NaI после индуцированной лигированием ишемии при инфаркте миокарда. Фиг. 10A представляет собой график, отражающий фракцию выброса (EF) (%) левого желудочка (LV) в исходный момент времени и в заданные моменты времени после индуцированного инфаркта миокарда. Диету, включающую питьевую воду, содержащую 0,77 мг/кг NaI, начинали сразу после завершения процедуры лигирования. Фиг. 10B представляет собой график, отражающий фракцию укорочения (FS) (%) LV в исходный момент времени и в заданные моменты времени после индуцированного инфаркта миокарда. Диету, включающую питьевую воду, содержащую 0,77 мг/кг NaI, начинали сразу после завершения процедуры лигирования. Для каждой пары столбцов звездочками отмечено статистически значимое различие между мышами, получавшими содержащую йодид воду (светлые столбцы) и обычную питьевую воду (темные столбцы) (p<0,05).
На Фиг. 11 приведены графики, отражающие уровни сердечного тропонина I (cTpnI) в плазме крови животных, получавших лечение плацебо, ишемическое прекондиционирование или 1 мг/кг NaI в модели острого инфаркта миокарда на крысах. Фиг. 11A представляет собой график, отражающий уровни cTpnI через 4 часа; Фиг. 11B представляет собой график, отражающий уровни cTpnI через 24 часа; и Фиг. 11C представляет собой график, отражающий уровни cTPNI через 4 часа и 24 часа. * p<0,05 относительно плацебо при однофакторном дисперсионном анализе ANOVA.
На Фиг. 12 приведены графики, демонстрирующие успешное лечение NaI острого инфаркта миокарда. На указанных графиках столбцы Inf/AAR и Inf/LV отражают морфометрический анализ размера зоны инфаркта (Inf) относительно общего размера области риска (AAR) или левого желудочка (LV), соответственно. На Фиг. 12A показан размер AAR у животных, получавших лечение плацебо, ишемическое прекондиционирование или 1 мг/кг NaI; на Фиг. 12B показан % Inf/AAR у животных, получавших лечение плацебо, ишемическое прекондиционирование или 1 мг/кг NaI; и на Фиг. 12C показан % Inf/LV у животных, получавших лечение плацебо, ишемическое прекондиционирование или 1 мг/кг NaI. *p<0,05 относительно плацебо при однофакторном дисперсионном анализе ANOVA; и #p<0,05 относительно ишемического прекондиционирования при однофакторном дисперсионном анализе ANOVA.
ПОДРОБНОЕ ОПИСАНИЕ изобретениЯ
Настоящее изобретение частично основано на неожиданных данных, свидетельствующих о том, что соединения галогенов, такие как йодиды, могут применяться для лечения или предотвращения заболеваний или повреждений, в том числе, например, связанных с гипоксией, ишемией или реперфузией, образованием активных форм кислорода, иммунным или воспалительным ответом или повышенной скоростью метаболизма, включая, например, хроническую сердечную недостаточность. Согласно описанию в прилагаемых примерах лечение соединением галогена до, во время или после ишемического приступа, например, сердечного приступа, обеспечивает защиту тканей от повреждения. Кроме того, в прилагаемых примерах показано, что лечение галогенами уменьшает симптомы хронической сердечной недостаточности, например, после сердечного приступа. Соответственно, в настоящем изобретении предложены новые способы лечения и предотвращения различные заболеваний, состояний и повреждений, в том числе связанных с гипоксией, ишемией и/или реперфузией, или обусловленные гипоксией, ишемией и/или реперфузией, включающие введение субъекту, у которого имеется риск развития такого заболевания, состояния или повреждения, композиции, содержащей соединение галогена, такое как йодид. Согласно определенным вариантам реализации указанная композиция можно вводить указанному субъекту до, в течение или после заболевания, состояния или повреждения. Кроме того, в настоящем изобретении предложены новые композиции (например, фармацевтические композиции), содержащие соединение галогена. Согласно определенным вариантам реализации указанная композиция содержит соединение галогена в стабильной восстановленной форме, например, в виде йодида. Согласно конкретным вариантам реализации указанная композиция входит в состав для внутривенного введения, введения путем инфузии или перорального введения. В частности, применение способов согласно настоящему изобретению целесообразно, поскольку известны многие соединения галогенов, безопасные для применения у млекопитающих; таким образом, в настоящем изобретении предложены новые безопасные способы лечения и предотвращения ряда заболеваний, состояний и повреждений.
Кроме того, настоящим изобретением охвачены композиции, например, фармацевтические композиции, содержащие стабильную восстановленную форму соединения галогена, например, йодид. Указанные композиции могут входить в состав, обеспечивающий поддержание соединения галогена в восстановленной форме, подходящей для введения субъекту и, соответственно, представляют собой новые усовершенствованные фармацевтические продукты для лечения и предотвращения множества заболеваний, состояний и повреждений, с сроком годности, подходящим для распространения и хранения перед использованием. Помимо соединения галогена композиции согласно настоящему изобретению могут также содержать один или большее количество дополнительных активных агентов, таких как, например, халькогенид, который также может быть представлен стабильной восстановленной формой. Фармацевтические композиции согласно настоящему изобретению могут входить в состав для внутривенного введения, инфузии или перорального введения, согласно конкретным вариантам реализации.
Настоящее изобретение также включает единичные дозированные формы композиции, содержащей эффективное количество соединения галогена, которые подходят, в том числе, при лечении различных заболеваний, состояний и повреждений. Согласно различным вариантам реализации указанная композиция может входить в состав для внутривенного введения, введения путем инфузии, перорального введения и/или в состав, обеспечивающий поддержание соединения галогена в восстановленной форме при хранении. Согласно конкретным вариантам реализации единичные дозированные формы содержат или включают заранее дозированные эффективные количества соединения галогена, применение которых целесообразно для доставки подходящего эффективного количества соединения галогена указанному субъекту, в частности, при экстренном вмешательстве на участке повреждения или при транспортировке субъекта. Согласно определенным вариантам реализации указанная композиция представляет собой жидкую композицию, тогда как согласно другим вариантам реализации указанная композиция представляет собой твердую или полутвердую композицию. Например, указанная композиция может представлять собой жидкую композицию, подходящую для внутривенного введения или введения путем инфузии, или указанная композиция может представлять собой твердую или полутвердую композицию, такую как пилюля, таблетка или капсула, подходящую для перорального введения.
Кроме того, настоящим изобретением охвачены способы и композиции, связанные с применением соединения галогена в комбинации с одним или большее количество дополнительных активных агентов для лечения или предотвращения любых заболеваний, состояний или повреждений согласно описанию в настоящем документе, в том числе связанных с ишемией, гипоксией, и реперфузией, или обусловленных ишемией, гипоксией или реперфузией. Указанные способы включают введение субъекту композиции, содержащей соединение галогена в комбинации с дополнительной композицией, содержащей указанные один или большее количество дополнительных активных агентов, а также включают введение указанному субъекту одной композиции, содержащей как соединение галогена, так и указанные один или большее количество дополнительных активных агентов. Настоящим изобретением охвачено применение широкого спектра дополнительных активных агентов, включая, например, халькогениды, такие как сульфиды и селениды, а также другие агенты. Согласно конкретным вариантам реализации указанная композиция содержит соединение галогена и другой активный агент, применяемый для лечения или предотвращения хронической сердечной недостаточности. Композиции могут входить в составы, подходящие для введения с помощью множества различных способов, в том числе но не ограничиваясь перечисленными, внутривенного введения, введения путем инфузии или перорального введения.
Согласно определенным вариантам реализации настоящим изобретением охвачены композиции, которые содержат носитель, при этом соединение галогена связано с указанным носителем. Дополнительные активные агенты, такие как халькогениды, могут также быть связаны с указанным носителем. Согласно одному варианту реализации указанный носитель представляет собой альбумин или родственный полипептид, плазму, сыворотку, альфа-2-макроглобулин или иммуноглобулин.
Настоящее изобретение также отчасти основано на неожиданно обнаруженных данных, свидетельствующих о том, что глутатион стабилизирует или предотвращает окисление халькогенидов, в том числе селенида. Соответственно, настоящим изобретением охвачены композиции (например, фармацевтические композиции), содержащие глутатион и халькогенид (такой как селенид), необязательно в комбинации с соединением галогена (таким как йодид), которые могут применяться для лечения или предотвращения заболеваний или повреждений, включая, например, связанные с гипоксией, ишемией или реперфузией. Согласно конкретным вариантам реализации указанная композиция входит в состав для внутривенного введения, введения путем инфузии или перорального введения. В частности, композиции согласно настоящему изобретению обеспечивают преимущество, поскольку глутатион ингибирует окисление халькогенида, что делает указанную композицию более стабильной и увеличивая срок хранения.
Настоящее изобретение также включает единичные дозированные формы с композицией, содержащей эффективное количество халькогенида и глутатион, которые подходят, в том числе, при лечении различных заболеваний, состояний и повреждений. Указанная композиция может также содержать эффективное количество соединения галогена. Согласно конкретным вариантам реализации единичные дозированные формы содержат или включают заранее отмеренное эффективное количество халькогенида, например, селенид или сульфид, что обеспечивает преимущество для доставки подходящего эффективного количества халькогенида указанному субъекту, в частности при экстренном вмешательстве на участке повреждения или при транспортировке субъекта. Согласно определенным вариантам реализации указанная композиция представляет собой жидкую композицию, тогда как согласно другим вариантам реализации указанная композиция представляет собой твердую или полутвердую композицию. Например, указанная композиция может представлять собой жидкую композицию, подходящую для внутривенного введения или введения путем инфузии, или указанная композиция может представлять собой твердую или полутвердую композицию, такую как пилюля, таблетка или капсула, подходящие для перорального введения. Настоящее изобретение также отчасти основано на данных, свидетельствующих о том, что глутатион стабилизирует или предотвращает окисление галогенов, в том числе соединений йода, например, йодида и йодата. Соответственно, настоящим изобретением охвачены композиции (например, фармацевтические композиции), содержащие глутатион и соединение галогена (такое как соединение йода, например, йодид или йодат), необязательно в комбинации с другим активным агентом, например, соединением халькогенида (таким как сульфид или селенид), которые могут применяться для лечения или предотвращения заболеваний или повреждений, включая, например, связанные с гипоксией, ишемией или реперфузией. Согласно конкретным вариантам реализации указанный другой активный агент представляет собой агент, применяемый для лечения или предотвращения хронической сердечной недостаточности. Согласно определенным вариантам реализации указанная композиция содержит соединение галогена, глутатион и другой активный агент, применяемый для лечения или предотвращения сердечной недостаточности. Согласно конкретным вариантам реализации указанная композиция входит в состав для внутривенного введения, введения путем инфузии или перорального введения. В частности, композиции согласно настоящему изобретению обеспечивают преимущество, поскольку глутатион ингибирует окисление соединений галогенов (и также халькогенида, в случае его присутствия), что повышает стабильность указанной композиции и увеличивая срок хранения.
Настоящее изобретение также включает единичные дозированные формы с композицией, содержащей эффективное количество соединения галогена и глутатиона, которые подходят в том числе для лечения различных заболеваний, состояний и повреждений. Указанная композиция может также содержать эффективное количество халькогенида и/или другого активного агента, применяемого для лечения хронической сердечной недостаточности. Согласно конкретным вариантам реализации единичные дозированные формы содержат или включают заранее отмеренное эффективное количество соединения галогена, например, соединения йода, такого как йодид или йодат, что обеспечивает преимущество для доставки подходящего эффективного количества соединения галогена указанному субъекту, в частности при экстренном вмешательстве на участке повреждения или при транспортировке субъекта. Согласно определенным вариантам реализации указанная композиция представляет собой жидкую композицию, тогда как согласно другим вариантам реализации указанная композиция представляет собой твердую или полутвердую композицию. Например, указанная композиция может представлять собой жидкую композицию, подходящую для внутривенного введения или введения путем инфузии, или указанная композиция может представлять собой твердую или полутвердую композицию, такую как пилюля, таблетка или капсула, подходящую для перорального введения.
Настоящее изобретение также включает единичные дозированные формы с композицией, содержащей эффективное количество соединения галогена и другого активного агента, применяемого для лечения или предотвращения хронической сердечной недостаточности, которые подходят, в том числе, для лечения или предотвращения хронической сердечной недостаточности, например, после сердечного приступа. Указанная композиция может также содержать эффективное количество халькогенида и/или глутатиона. Согласно конкретным вариантам реализации единичные дозированные формы содержат или включают заранее отмеренное эффективное количество соединения галогена, например, йодида, и другого активного агента, обеспечивающего преимущество при доставке подходящего эффективного количества соединения галогена и другого активного агента субъекту, например, субъекту, страдающему хронической сердечной недостаточностью, или субъекту после сердечного приступа. Согласно определенным вариантам реализации указанная композиция представляет собой жидкую композицию, тогда как согласно другим вариантам реализации указанная композиция представляет собой твердую или полутвердую композицию. Например, указанная композиция может представлять собой жидкую композицию, подходящую для внутривенного введения или введения путем инфузии, или указанная композиция может представлять собой твердую или полутвердую композицию, такую как пилюля, таблетка или капсула, подходящую для перорального введения.
Настоящее изобретение также отчасти основано на открытии, заключающемся в том, что селенид, йодид и другие соединения, которые ингибируют выработку, активность или поглощение гормонов щитовидной железы, включая, например, струмогенные агенты, нарушают или ингибируют образование пероксида на участке повреждения или заболевания, таким образом предотвращая пагубные эффекты пероксида и, соответственно, предотвращая, ингибируя или уменьшая указанное повреждение или заболевание. Соответственно, настоящим изобретением охвачены способы лечения или предотвращения любых повреждений и заболеваний согласно описанию в настоящем документе у субъекта, путем введения субъекту струмогенного агента, или активного агента, который ингибирует или нарушает образование пероксида на участке повреждения или заболевания. Согласно конкретным вариантам реализации такой активный агент представляет собой йодид или селенид.
Без связи с какой-либо конкретной теорией считается, что ингибирование выработки гормонов щитовидной железы йодом обусловлена, по меньшей мере отчасти, эффектом Вольфа-Чайкова. Эффект Вольфа-Чайкова представляет собой снижение уровней гормонов щитовидной железы, вызванный поглощением большого количества йода. Он считается ауторегуляторным явлением, которое ингибирует органификацию (окисление йодида) в щитовидной железе, образование гормонов щитовидной железы внутри фолликулов щитовидной железы и высвобождение гормонов щитовидной железы в кровоток. Это становится очевидным на фоне повышенных уровней циркулирующего йодида. Эффект Вольфа-Чайкова длится несколько дней (около 10 дней), после чего происходит восстановление нормальной органификации йода и нормальной функции тиропероксидазы, предположительно за счет пониженной концентрации органического йода на фоне понижающей регуляции натрий-йодидного симпортера (NIS) на базолатеральной мембране фолликулярной клетки щитовидной железы. Считается, что при сдерживании выработки, активности или уровней гормонов щитовидной железы на участке повреждения или заболевания восстанавливается метаболическая активность или ингибируется гиперметаболическая активность, что приводит к уменьшению повреждения в поврежденной или пораженной заболеванием ткани. хотя и неизвестно, каким образом высокие уровни йодида препятствуют синтезу H2O2 тиропероксидазой, существует несвязанная с конкретной теорией гипотеза, заключающаяся в том, что йодид выступает донором электронов для пероксида водорода с образованием воды, что неправильно интерпретировали как ингибирование тиропероксидазы.
Настоящее изобретение также предусматривает применение йодида или других элементных восстанавливающих агентов (ЭВА), таких как сульфид или селенид, для лечения или предотвращения любых заболеваний, расстройств, состояний или повреждений согласно описанию в настоящем документе. Кроме того, настоящее изобретение также отчасти включает способы применения соединений галогенов и/или халькогенидов для ингибирования, предотвращения или уменьшения иммунного ответа у субъекта. Согласно описанию в настоящем документе соединения галогенов, например, йодид, и халькогенидов, например, селенид, могут ингибировать или уменьшать активные формы кислорода. Соответственно, они могут применяться для уменьшения метаболической активности и стресса, а также воспаления и нежелательного иммунного ответа, включая, например, вызываемые активными формами кислорода.
Композиции согласно настоящему изобретению, в том числе стабильные композиции, содержащие восстановленную форму соединения галогена и/или восстановленную форму халькогенида, могут применяться в любых из множества способов согласно настоящему изобретению.
Определения и сокращения
В том случае, если в настоящем документе явным образом не указано иное, научные и технические термины, используемые в настоящей заявке, имеют значения, общеизвестные специалистам в данной области техники. Как правило, номенклатура, используемая в отношении химии, молекулярной биологии, клеточной биологии, биологии раковых заболеваний, иммунологии, микробиологии, фармакологии, химии белков и нуклеиновых кислот, а также связанных с ними техник согласно описанию в настоящем документе, хороша известна и часто используется в данной области техники.
Используемые в настоящем документе термины имеют приведенные ниже значения, если не указано иное.
Термин «включая» означает «включая, но не ограничиваясь перечисленными». «Включая» и «включая но не ограничиваясь перечисленными» используются взаимозаменяемо.
Термины, приведенные в единственном числе, подразумевают «один или большее количество», если не указано иное.
Термин «приблизительно» означает количество, уровень, значение, число, частоту, процент, измерение, размер, величину, массу или длину, варьирующие на 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1% относительно референсных количества, уровня, значения, числа, частоты, процента, измерения, размера, величины, массы или длины. Согласно любому варианту реализации в контексте численных значений в сочетании с термином «приблизительно», конкретным образом предусмотрена возможность опущения термина «приблизительно».
Если иное не продиктовано контекстом, во всех разделах настоящего описания и в формуле изобретения термин «содержать» и его варианты, например, «содержит» и «включая» должны толковаться в открытом, всеобъемлющем смысле, то есть как «включая, но не ограничиваясь перечисленным».
«Состоит из» означает «включает» и ограничивается перечисленным после выражения «состоящий из». Соответственно, выражение « состоящий из» указывает на то, что перечисленные элементы являются необходимыми или обязательными, и что другие элементы присутствовать не могут.
«Состоящий по существу из» означает включение любых элементов, перечисленных после указанного выражения, и ограничение других элементов, не влияющих или не вносящих вклад в активность или действие, раскрытое в настоящем документе для перечисленных элементов. Соответственно, выражение «состоящий по существу из» указывает на то, что перечисленные элементы являются необходимыми или обязательными, однако другие элементы являются необязательными и могут присутствовать или не присутствовать в зависимости от того, оказывают ли они влияние на активность или действие перечисленных элементов.
В настоящем документе упоминание «одного варианта реализации» или «варианта реализации» означает, что конкретный признак, структура или характеристика, описанный(ая) в связи с указанным вариантом реализации, включен(а) по меньшей мере в один вариант реализации настоящего изобретения. Соответственно, использование выражений «согласно одному варианту реализации» или «согласно варианту реализации» в различных разделах настоящего описания не обязательно подразумевает один и тот же вариант реализации. Кроме того, конкретные признаки, структуры или характеристики могут быть скомбинированы любым подходящим образом в одном или большем числе вариантов реализации.
«Увеличение» или «повышение» количества, как правило, относится к «статистически значимому» количеству, и может включать увеличение в 1,1; 1,2; 1,3; 1,4; 1,5; 1,6; 1,7; 1,8; 1,9; 2; 2,5; 3; 3,5; 4; 4,5; 5; 6; 7; 8; 9; 10; 15; 20; 30; 40; 50 или более раз (например, в 100, 500, 1000 раз) (включая все целочисленные варианты и десятые доли значений до 1 и выше, например, 2,1; 2,2; 2,3; 2,4 и т.п.) количества или уровня согласно описанию в настоящем документе.
«Уменьшение» количества, «снижение» количества или «меньшее» количество, как правило, относится к «статистически значимому» количеству, и может включать уменьшение приблизительно в 1,1; 1,2; 1,3; 1,4; 1,5; 1,6 1,7; 1,8; 1,9; 2; 2,5; 3; 3,5; 4; 4,5; 5; 6; 7; 8; 9; 10; 15; 20; 30; 40; или 50 раз или более (например, в 100, 500, 1000 раз) (включая все целочисленные варианты и десятые доли значений до 1 и выше, например, 1,5; 1,6; 1,7; 1,8 и т.п.) количества или уровня согласно описанию в настоящем документе.
«Композиция» может содержать активный агент, например, соединение галогена и/или халькогенида, и носитель, инертный или активный, например, фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Композиция может представлять собой фармацевтическую композицию. Согласно конкретным вариантам реализации указанные композиции являются стерильными, по существу не содержат эндотоксинов или нетоксичны для реципиентов в используемой дозировке или концентрации.
«Фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество» включает без ограничения любой адъювант, носитель, вспомогательное вещество, скользящее вещество, подслащивающий агент, разбавитель, консервант, пигмент/краситель, усилитель вкуса и аромата, поверхностно-активное вещество, смачивающие агент, диспергирующий агент, суспендирующий агент, стабилизатор, изотонический агент, растворитель или эмульгатор, одобренный Управлением по контролю за продуктами питания и лекарствами США в качестве приемлемых для применения у человека или домашних животных.
Термин «биологическая материя» относится к любому живому биологическому материалу, в том числе клеткам, тканям, органам и/или организмам, и любой их комбинации. Предполагается, что способы, предложенные в настоящем изобретении могут быть реализованы в отношении части организма (например, в клетках, в ткани и/или в одном или большем числе органов), при этом указанная часть остается внутри организма либо извлекается из организма, или в отношении целого организма. Кроме того, в контексте клеток и тканей предполагается, что варианты реализации согласно настоящему изобретению могут быть направлены на гомогенные и гетерогенные популяции клеток. Термин «биологическая материя in vivo» относится к биологической материи в состоянии in vivo, т.е. остающейся внутри организма или соединенной с организмом. Кроме того, термин «биологическая материя» синонимичен термину «биологический материал». Согласно определенным вариантам реализации предполагается, что одна или большее количество клеток, тканей или органов отделены от организма. Термин «выделенный» может применяться для описания такой биологической материи. Предполагается, что способы, предложенные в настоящем изобретении, можно реализовать в отношении биологической материи in vivo и/или выделенной биологической материи.
Термины «млекопитающее» и «субъект» включает человека и не являющихся человеком млекопитающих, таких как, например, человек, мышь, крыса, кролик, обезьяна, корова, свинья, овца, лошадь, собака и кошка.
«Фармацевтически приемлемые соли» включают следующие соли: сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формат, бензоат, глутамат, метансульфонат, этансульфонат, бензенсульфонат, п-толуолсульфонат, камфоросульфонат, памоат, фенилацетат, трифторацетат, акрилат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, o-ацетоксибензоат, нафталин-2-бензоат, изобутират, фенилбутират, альфа-гидроксибутират, бутин-l,4-дикарбоксилат, гексин-l,4-дикарбоксилат, капрат, каприлат, циннамат, гликолят, гептаноат, гиппурат, малат, гидроксимаоеат, малонат, манделат, мезилат, никотинат, фталат, терафталат, пропиолат, пропионат, фенилпропионат, себацат, суберат, p-бромбензенсульфонат, хлорбензенсульфонат, этилсульфонат, 2-гидроксиэтилсульфонат, метилсульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, нафталин-l,5-сульфонат, ксиленсульфонат и тартрат. Термин «фармацевтически приемлемая соль» также относится к соли антагониста согласно настоящему изобретению, содержащего кислую функциональную группу, такую как функциональная группа карбоновой кислоты, и основание. Подходящие основания включают, не ограничиваясь перечисленными, гидроксиды щелочных металлов, таких как натрий, калий и литий, гидроксиды щелочно-земельных металлов, таких как кальций и магний, гидроксиды других металлов, такие как алюминий и цинк, аммония и органических аминов, таких как незамещенные или гидрокси-замещенные моно-, ди-, или триалкиламины, дициклогексиламин, трибутиламин, пиридин, N-метил, N-этиламин, диэтиламин, триэтиламин, моно-, бис-, или трис-(2-OH-низшие алкиламины), такие как моно-, бис-, или трис-(2-гидроксиэтил)амин, 2-гидрокси-трет-бутиламин, или трис-(гидроксиметил)метиламин, N,N-ди-(низший алкил)-N-(гидроксил-(низший алкил))-амины, такие как N,N-диметил-N-(2-гидроксиэтил)амин или три-(2-гидроксиэтил)амин, N-метил-D-глюкамин, и аминокислот такие как аргинин, лизин, и т.п. Термин «фармацевтически приемлемая соль» также включает гидрат соединения согласно настоящему изобретению.
Термины «ткань» и «орган» используют в соответствии со их обычными распространенными значениями. Несмотря на то, что ткань состоит из клеток, следует понимать, что термин «ткань» относится к агрегату аналогичных клеток, образующий структурный материал определенного типа. Далее, орган представлен тканью конкретного типа. Согласно определенным вариантам реализации указанная(ый) ткань или орган «выделен», что означает, что он находится вне организма.
Термины «гипоксия» и «гипоксический» относятся к среде, уровни кислорода в которой ниже нормальных. Гипоксия возникает в том случае, когда нормальные физиологические уровни кислорода не поступают в клетку, ткань или орган. «Нормоксия» относится к нормальным для конкретного представляющего интерес типа клеток, статуса клеток или ткани физиологическим уровням кислорода. «Аноксия» означает отсутствие кислорода. «Гипоксические условия» представляют собой условия, обуславливающие гипоксию клеток, органов или организма. Указанные условия зависят от типа клетки и от специфического пространственного положения клетки или положения в ткани или органе, а также от метаболического статуса клетки. Для целей настоящего изобретения гипоксические условия включают условия, при которых концентрация кислорода соответствует нормальному содержанию в атмосфере или ниже, то есть менее 20,8; 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1; 0,5; 0%. Как вариант, указанные значения могут соответствовать проценту от содержания в атмосфере при давлении в 1 атмосферу (101,3 кПа). «Аноксия» представляет собой отсутствие кислорода. Концентрация кислорода, составляющая 0%, соответствует бескислородным условиям. Соответственно, гипоксические условия включают бескислородные условия, хотя согласно некоторым вариантам реализации применяют гипоксические условия, соответствующие не менее чем 0,5% кислорода. В настоящем документе «условия с нормальным содержанием кислорода» соответствуют концентрациям кислорода, составляющим около 20,8% или более.
Термин «буфер» в настоящем документе означает фармацевтически приемлемое вспомогательное вещество, которое стабилизирует pH фармацевтического состава. Подходящие буферы хорошо известны в данной области техники. Подходящие фармацевтически приемлемые буферы включают, не ограничиваясь перечисленными, ацетатные буферы, гистидиновые буферы, цитратные буферы, сукцинатные буферы, Tris-буферы и фосфатные буферы. Согласно определенным вариантам реализации концентрация буфера составляет от приблизительно 0,01 мМ до приблизительно 1000 мМ, от приблизительно 0,1 мМ до приблизительно 1000 мМ, от приблизительно 0,1 мМ до приблизительно 500 мМ, от приблизительно 0,1 до приблизительно 200 мМ, от приблизительно 0,1 до приблизительно 100 мМ, от приблизительно 1 мМ до приблизительно 1000 мМ, от приблизительно 1 мМ до приблизительно 500 мМ, от приблизительно 1 мМ до приблизительно 200 мМ, от приблизительно 1 мМ до приблизительно 100 мМ, от приблизительно 1 мМ до приблизительно 50 мМ, от приблизительно 2 мМ до приблизительно 60 мМ, от приблизительно 4 мМ до приблизительно 60 мМ, или приблизительно 4 мМ до приблизительно 40 мМ, от приблизительно 5 мМ до приблизительно 20 мМ, или от приблизительно 5 мМ до приблизительно 25 мМ.
Фармацевтически приемлемые «криопротекторы» известны в данной области техники и включают без ограничения, например, сахарозу, трегалозу и глицерин. Фармацевтически приемлемые криопротекторы обеспечивают стабильную защиту композиций, или одного или большего числа их активных ингредиентов от эффектов, обусловленных замораживанием и/или лиофилизацией.
Термином «регулирующий тоничность агент» или «модификатор тоничности» в настоящем документе обозначаются фармацевтически приемлемые агенты, используемые для модуляции тоничности композиции. Подходящие регулирующие тоничность агенты включают, не ограничиваясь перечисленными, хлорид натрия, сорбит, трегалозу, хлорид калия, глицерин и любой компонент из группы аминокислот, сахара, согласно определению в настоящем документе а также их комбинации. Согласно определенным вариантам реализации регулирующие тоничность агенты могут применяться в количестве от приблизительно 1 мМ до приблизительно 1000 мМ, от приблизительно 1 мМ до приблизительно 500 мМ, приблизительно 5 мМ до от приблизительно 500 мМ, от приблизительно 10 мМ до приблизительно 450 мМ, от приблизительно 20 мМ до приблизительно 400 мМ, от приблизительно 50 мМ до от приблизительно 300 мМ, от приблизительно 100 мМ до приблизительно 200 мМ или от приблизительно 125 мМ до приблизительно 175 мМ. Согласно определенным вариантам реализации регулирующий тоничность агент содержит аминокислоту, присутствующую в композиции в концентрации от приблизительно 5 мМ до приблизительно 500 мМ.
Термин «стабилизатор» означает фармацевтически приемлемое вспомогательное вещество, защищающее активные фармацевтический(ие) ингредиент(ы) или агент(ы) и/или указанную композицию от химического и/или механического разрушения при производстве, хранении и применении. Стабилизаторы включают, не ограничиваясь перечисленными, сахара, аминокислоты, полиолы, поверхностно-активные вещества, антиоксиданты, консерванты, циклодекстрины, например, гидроксипропил-β-циклодекстрин, сульфобутилэтил-β-циклодекстрин, β-циклодекстрин, полиэтиленгликоли, например, ПЭГ 3000, ПЭГ 3350, ПЭГ 4000, ПЭГ 6000, альбумин, например альбумин сыворотки человека (HSA), бычий сывороточный альбумин (BSA), соли, например, хлорид натрия, хлорид магния, хлорид кальция, и хелаторы, например, ЭДТК. Стабилизаторы могут присутствовать в указанной композиции в количестве от приблизительно 0,1 мМ до приблизительно 1000 мМ, приблизительно 1 мМ до приблизительно 500 мМ, приблизительно 10 до приблизительно 300 мМ, или от приблизительно 100 мМ до приблизительно 300 мМ.
В настоящем документе, термин «поверхностно-активное вещество» относится к фармацевтически приемлемому органическому веществу, содержащему амфипатические структуры; а именно, оно состоит из групп, отличающихся противоположными тенденциями в отношении растворимости, как правило, жирорастворимой углеводородной цепи и водорастворимой ионной группы. Поверхностно-активные вещества могут быть классифицированы в зависимости от заряда поверхностно-активного фрагмента, на анионные, катионные и неионогенные поверхностно-активные вещества. Поверхностно-активные вещества могут применяться в качестве смачивающих, эмульгирующих, солюбилизирующих и диспергирующих агентов для фармацевтических композиций и составов с биологическими материалами. Согласно некоторым вариантам реализации композиций согласно описанию в настоящем документе количество поверхностно-активного вещества описано в виде процента, отражающего отношение массы к объему (массо-объемный процент). Подходящие фармацевтически приемлемые поверхностно-активные вещества включают, не ограничиваясь перечисленными, группу сложных эфиров жирных кислот и полиоксиэтиленсорбитана (Tween), простые полиоксиэтиленалкилэфиры (Brij), простые алкилфенилполиоксиэтиленэфиры (Triton-X), сополимер полиоксиэтилена-полиоксипропилена (Полоксамер, Плюроник), или додецилсульфат натрия (ДСН). Сложные эфиры полиоксиэтиленсорбитана и жирных кислот включают полисорбат 20 (продаваемый под торговым наименованием Tween 20™) и полисорбат 80 (продаваемый под торговым наименованием Tween 80™). Сополимеры полиэтилена-полипропилена включают продаваемые под наименованиями Плюроник® F68 или Полоксамер 188™. Простые полиоксиэтиленовые эфиры алкилов включают продаваемые под торговым наименованием Brij™. Простые полиоксиэтиленовые эфиры алкилфенолов включают продаваемые под торговым наименованием Triton-X. Полисорбат 20 (Tween 20™) и полисорбат 80 (Tween 80™) обычно используют в концентрациях, варьирующих от приблизительно 0,001% (масса/объем) до приблизительно 1% (масса/объем) или от приблизительно 0,002% (масса/объем) до приблизительно 0,1% (масса/объем) общего объема указанной композиции, или, как вариант, от приблизительно 0,003% (масса/объем) до приблизительно 0,007% (масса/объем). Согласно некоторым вариантам реализации Tween 80™ используют в концентрации, составляющей приблизительно 0,003% (масса/объем), приблизительно 0,004% (масса/объем), приблизительно 0,0045% (масса/объем), приблизительно 0,005% (масса/объем), приблизительно 0,0055% (масса/объем), приблизительно 0,006% (масса/объем) или приблизительно 0,007% (масса/объем). Согласно некоторым вариантам реализации Tween 80™ используют в концентрации, составляющей приблизительно 0,005% (масса/объем). В указанном аспекте «масса/объем» соответствует отношению массы поверхностно-активного вещества к общему объему указанной композиции.
«Лиопротектор» относится к фармацевтически приемлемому веществу, которое стабилизирует белок, нуклеиновую кислоту или другой(ие) активные фармацевтический(ие) ингредиент(ы) или агент(ы) при лиофилизации. Примеры лиопротекторов включают, без ограничения, сахарозу, трегалозу или маннит.
«Полиол» относится к спирту, содержащему несколько гидроксильных групп, или сахарный спирт. Сахарный спирт представляет собой гидрогенизированную форму углевода, карбонильная группа которого (альдегид или кетон, восстанавливающий сахар) была восстановлена до первичной или вторичной гидроксильной группы (таким образом, образуется спирт). Сахарные спирты имеют общую формулу H(HCHO)n+1H, а сахара имеют формулу H(HCHO)nHCO.
«Антиоксидант» относится к молекуле, способной замедлять или предотвращать окисление других молекул. Антиоксиданты часто представлены восстанавливающими агентами, хелатирующими агентами и акцепторами кислорода, такими как тиолы, аскорбиновая кислота или полифенолы. Неограничивающие примеры антиоксидантов включают аскорбиновую кислоту (AA, E300), тиосульфат, метионин, токоферолы (E306), пропилгаллат (PG, E310), третичный бутилгидрохинон (TBHQ), бутилированный гидроксианизол (BHA, E320) и бутилированный гидрокситолуол (BHT, E321).
«Консервант» представляет собой природное или синтетическое химическое вещество, добавляемое в продукты, например, в пищевые продукты, фармацевтические композиции, краски, биологические образцы, древесину и т.п., для предотвращения разложения, обусловленного микробным ростом или нежелательными химическими изменениями. Добавление консервантов может производиться отдельно или в сочетании с другими способами предохранения. Консерванты могут представлять собой антимикробные консерванты, ингибирующие рост бактерий и грибов, или антиоксидантов такие как абсорбенты кислорода, ингибирующие окисление компонентов. Примеры антимикробных консервантов включают хлорид бензалкония, бензойную кислоту, хлоргексидин, глицерин, фенол, сорбат калия, тимеросал, сульфиты (диоксид серы, бисульфит натрия, кислый сульфит калия и т.п.) и двунатриевую ЭДТК. Другие консерванты включают обычно используемые в композициях с белками для парентерального ведения, например, бензиловый спирт, фенол, м-крезол, хлорбутанол или метилпарабен.
Если не указано иное, используемые в описании и прилагаемой формуле изобретения приведенные ниже термины имеют следующие значения:
«Млекопитающее» включает человека, а также как одомашненных животных, например, лабораторных и домашних животных (таких как кошки, собаки, свиньи, крупный рогатый скот, овцы, козы, лошади и кролики), так и не являющихся домашними животных, таких как обитающие в дикой природе, и т.п.
«Необязательный» или «необязательно» означает, что описанное после указанного термина явление или условия могут возникать или могут не возникать, и что указанное описание предусматривает варианты, в которых указанное явление или условие возникает, и варианты, в которых указанное явление или условие не возникает.
«Фармацевтическая композиция» относится к составу, содержащему соединение и среду, обычно используемую в данной области техники для доставки биологически активного соединения млекопитающим, например, человеку. Такая среда, соответственно, может включать любые фармацевтически приемлемые носители, разбавители или вспомогательные вещества.
«Сульфид» относится к сере с валентностью -2, например, H2S или его соли (например, NaHS, Na2S и т.п.).
«Селенид» относится к селену с валентностью -2, например, H2Se или его соли (например, NaHSe, Na2Se и т.п.).
Как «йодид», так и «восстановленная форма йодида» относятся к йодиду с валентностью -1 (например, NaI). «Восстановленная форма йода» включает йодид.
«Халькогенид» или «халькогенидные соединения» относится к соединениям, содержащим элементный халькоген, т.е. элемент группы 6 периодической таблицы элементов, исключая оксиды. Указанные элементы представлены серой (S), селеном (Se), теллуром (Te) и полонием (Po). Конкретные халькогениды и их соли включают, не ограничиваясь перечисленными: H2S, Na2S, NaHS, K2S, KHS, Rb2S, CS2S, (NH4)2S, (NH4)HS, BeS, MgS, CaS, SrS, BaS, H2Se, Na2Se, NaHSe, K2Se, KHSe, Rb2Se, CS2Se, (NH4)2Se, (NH4)HSe, BeSe, MgSe, CaSe, SrSe, PoSe и BaSe.
В настоящем документе «продукт окисления» относится к продуктам, образующимся при окислении соединения, например, халькогенид или галид соединение, включая, например, сульфит, сульфат, тиосульфат, полисульфиды, дитионат, политионат, элементную серу, селенит, селенат, тиоселенат, полиселениды, и элементный селен. Такие продукты окисления могут образовываться в результате обработки, производства или хранения (например, путем окисления).
В настоящем документе «струмогенный агент» относится к веществу, которое ингибирует синтез гормона щитовидной железы организмом. Хотя указанный механизм не полностью понят, считается, что некоторые струмогенные агенты подавляют функцию щитовидной железы, влияя на поглощение или органификацию йода (синтез гормона щитовидной железы), что может в результате вызывать увеличение, т.е. разрастание щитовидной железы, тогда как эффект других струмогенных агентов может обеспечиваться за счет других механизмов. Химические вещества, которые, как было показано, оказывают струмогенные эффекты, включают:
сульфадиметоксин, пропилтиоурацил, перхлорат калия и йопаноевая кислота;
некоторые оксазолидины, такие как гоитрин;
тиоцианат, например, избыток тиоцианата в Центральной Африке, в частности, при сочетании с дефицитом селена. Использование маниока как источника углеводов является источником тиоцианата в некоторых областях.
ионы, такие как тиоцианат и перхлорат, которые снижают поглощение йодида за счет конкурентного ингибирования и, как последствие пониженной секреции железой тироксина и трийодтиронина, вызывают, в низких дозах, увеличение высвобождение тиротропина (за счет восстановления отрицательной обратной связи), который затем стимулирует железу;
амиодарон, который ингибирует периферическое превращение тироксина в трийодтиронин; а также влияет на действие гормона щитовидной железы;
литий ингибирует высвобождение гормонов щитовидной железы;
метимазол; и
фенобарбитал, фенитоин, карбамазепин, рифампицин индуцируют метаболическую деградацию трийодтиронина (T3) и тироксина (T4).
«Терапевтически эффективное количество» относится к количеству соединения или композиции согласно настоящему изобретению, которое, при введении в биологический материал, например, при введении млекопитающему, предпочтительно человеку, является достаточным для обеспечения лечения, согласно описанию ниже, заболевания, повреждения или состояния биологического материала, например, у млекопитающего, предпочтительно, у человека. Количество соединения или композиции согласно настоящему изобретению, составляющее «терапевтически эффективное количество» варьирует в зависимости от соединения или композиции, заболевания, повреждения или состояния и его тяжести, способа введения, и возраста биологического материала, например, у млекопитающего, лечение которого проводится, однако может быть определено с помощью рутинных методов специалистом в данной области техники на основе его собственных знаний и указанного описания.
«Лечить/обрабатывать» или «лечение/обработка» в настоящем документе предусматривает лечение представляющего интерес заболевания, повреждения или состояния, например, повреждения ткани, в биологическом материале, например, у млекопитающего, предпочтительно человека, у которого имеется представляющее интерес заболевание или состояние, и включает: (i) предотвращение или ингибирование возникновения указанного заболевания, повреждения или состояния в биологическом материале, например, у млекопитающего, в частности, если такое млекопитающее предрасположено к развитию указанного состояния, однако оно еще не было у него диагностировано; (ii) ингибирование указанного заболевания, повреждения или состояния, т.е. остановка его развития; (iii) облегчение указанного заболевания, повреждения или состояния, т.е. обеспечение регресса указанного заболевания или состояния; или (iv) облегчение симптомов, обусловленных указанным заболеванием, повреждением или состоянием. В настоящем документе термины «заболевание», «расстройство» и «состояние» могут применяться взаимозаменяемо. В настоящем документе термин «повреждение» включает непреднамеренные повреждения и намеренные повреждения, в том числе повреждения «от руки человека», в том числе повреждения, связанные с медицинскими процедурами, такими как хирургические вмешательства и трансплантации.
«Хроническая сердечная недостаточность» (ХСН), также называемая застойной сердечной недостаточностью (ЗСН) наблюдается в том случае, когда сердце неспособно достаточно эффективно перекачивать кровь, чтобы удовлетворить потребности организма. Распространенные причины ХСН включают коронарную болезнь сердца, в том числе ранее перенесенный инфаркт миокарда (сердечный приступ), высокое давление крови, фибрилляция предсердий, порок клапана сердца и кардиомиопатия. Это приводит к сердечной недостаточности в результате изменения структуры или функционирования сердца. Два основных типа сердечной недостаточности представлены следующими: (1) сердечная недостаточность, обусловленная дисфункцией левого желудочка, отличающаяся нарушением способности левого желудочка к сокращению, также называемая систолической сердечной недостаточностью; и (2) сердечная недостаточность с нормальной фракцией выброса, отличающаяся нарушением способности сердца к расслаблению, также называемая диастолической сердечной недостаточностью.
Соединения галогенов
Настоящее изобретение относится к соединениям галогенов, содержащим любой элемент, входящий в 17 группу периодической таблицы элементов. В соответствии с настоящим изобретением может применяться любая форма соединения галогена, включая, например, галиды водорода, галиды металлов, интергалогенные соединения, органо-галогенные соединения и многогалогенные соединения. Согласно некоторым вариантам реализации соединение галогена относится к любому соединению, содержащему фтор, хлор, бром, йод, астат или унунсептий. Согласно конкретным вариантам реализации настоящее изобретение относится к соединениям галогенов в восстановленной форме, например, к йодидам.
Фтор (F), самый легкий галоген, представляет собой неметаллический элемент с атомным числом 9. При стандартных давлении и температуре он находится в форме двухатомного газа F2. Фтор представляет наиболее химически реакционноспособный элемент, вступающий в реакции со всеми другими элементами за исключением кислорода, гелия, неона и криптона. Он также является наиболее электроотрицательным элементом, соответственно, притягивающим электроны с большей силой, чем все другие элементы. Существует 11 изотопов фтора с известными периодами полураспада, при этом указанные изотопы имеют массовые числа, варьирующие от 15 до 25. При этом природный фтор состоит из одного стабильного изотопа, 19F.
Хлор (Cl), второй по массе галоген, представляет собой неметаллический элемент с атомным числом 17. При стандартных давлении и температуре он находится в форме диатомного газа Cl2. Хлор представляет собой элемент с максимальным электронным сродством, и третий по электроотрицательности. Существует 16 изотопов хлора с известными периодами полураспада; указанные изотопы имеют массовые числа, варьирующие от 31 до 46. Встречающийся в природе хлор представляет собой смесь двух стабильных изотопов 35Cl и 37Cl, с природным соотношением изотопов, составляющим приблизительно 3:1.
Бром (Br), третий по массе галоген, представляет собой неметаллический элемент с атомным числом 35. При стандартных давлении и температуре он находится в виде диатомной жидкости Br2. Существует 26 изотопов брома с известными периодами полураспада; указанные изотопы имеют массовые числа, варьирующие от 68 до 94. Встречающийся в природе бром представляет собой смесь двух стабильных изотопов 79Cl и 81Cl с природным соотношением изотопов, составляющим приблизительно 1:1.
Йод (I), второй по массе природный галоген, представляет собой неметаллический элемент с атомным числом 53. При стандартных давлении и температуре он находится в виде твердого вещества, диатомной молекулы I2. Существует 34 изотопов йода с известными периодами полураспада; указанные изотопы имеют массовые числа, варьирующие от 108 до 144. При этом природный йод состоит из одного стабильного изотопа, 127I.
Астат, самый тяжелый природный галоген, представляет собой высокорадиоактивный неметаллический элемент с атомным числом 85. Он разлагается настолько быстро (максимальный период полураспада составляет менее чем 12 часов) что его свойства не очень хорошо известны. Спорным вопросом является то, существует ли астат в виде двухатомной молекулы At2, поскольку указанная форма фактически никогда не наблюдалась. Астат способен вступать в реакцию с водородом с образованием астатида водорода, и предположительно вступает в реакцию с металлами, такими как натрий, с образованием солей. Существует 37 известных изотопов астата, все они являются радиоактивными и имеют очень короткие периоды полураспада. Массовые числа указанных изотопов варьируют от 207 до 221. Стабильных изотопов астата не существует.
Согласно различным вариантам реализации композиции и способы, предложенные в настоящем изобретении, включают одно или большее количество соединений галогенов, таких как различные формы йода или брома.
Согласно одному варианту реализации настоящее изобретение относится к соединению галогена, содержащему йод. Согласно конкретным вариантам реализации указанное соединение галогена представляет собой восстановленную форму йода, такую как йодид. Некоторые варианты реализации могут включать йод-содержащее соединение галогена, которое представляет собой йодид, йодат, органический йодид, периодат или периодинан.
Согласно некоторым вариантам реализации указанное соединение галогена представляет собой йодид, содержащий одно или большее количество соединений из неограничивающего перечня, включающего йодид алюминия, монойодид алюминия, йодид аммония, трийодид сурьмы, дийодид мышьяка, трийодид мышьяка, йодид бария, бериллия йодид, йодид висмута (III), трийодид бора, йодид кадмия, йодид цезия, йодид кальция, йодид кандокурония, тетрайодид углерода, йодид кобальта (II), кокцинит, йодид меди (I), DiOC6, тетрайодид дифосфора, дитиазанина йодид, эхотиофат, йодид эйнштейния (iii), соль эшенмозера, дигидройодид этилендиамина, йодид галлия (III), GelGreen, GelRed, йодид германия, монойодид золота, трийодид золота, йодид водорода, оксид йод, йодметилйодид цинка, йодсилан, йодид железа (II), йодид свинца (II), йодид лития, йодид магния, йодид марганца (II), йодид ртути (I), йодид ртути (II), йодид никеля (II), трийодид азота, йодид палладия (II), трийодид фосфора, полийодид, йодид калия, калия тетрайодмеркурат (II), йодид пропидия, йодид рубидия, йодид рубидия/серебра, йодид самария (II), тетрайодид кремния, йодид серебра, йодид натрия, йодид стронция, йодид теллура, тетрайодид теллура, йодид тербия (III), йодид тетраэтиламмония, трийодид таллия, йодид таллия (I), йодид тория (IV), йодид тибезония, йодид тимония, йодид олова (II), йодид олова (IV), тетрайодид титана, трийодид, триметилсилилйодид, триметилсульфоксония йодид, пентайодид урана, тетрайодид урана, трийодид урана, йодид ванадия(III), йодид цинка и йодид циркония (IV).
Согласно конкретным вариантам реализации указанное соединение галогена представляет собой йодид, включая йодид натрия, йодид калия, йодид водорода, йодид кальция или йодид серебра.
Согласно некоторым вариантам реализации указанное соединение галогена представляет собой йодат, содержащие одно или большее количество соединений из неограничивающего перечня, включающего йодат кальция, йодноватую кислоту, йодат калия, зеелигерит, йодат серебра и йодат натрия.
Согласно конкретным вариантам реализации указанное соединение галогена представляет собой йодат, включая йодат натрия, йодат калия, йодат кальция или йодат серебра.
Согласно некоторым вариантам реализации указанное соединение галогена представляет собой органический йодид, содержащий одно или большее количество соединений из неограничивающего перечня, включающего 25I-NBF, 25I-NBMD, 25I-NBOH, 25I-NBOMe, 2C-I, 5, 5-I-R91150, ацетризовую кислоту, адипийодон, адостерол, альтропан, AM-1241, AM-2233, AM-630, AM-679 (каннабиоид), AM-694, AM251, амиодарон, бензиодарон, бромйодметан, будиодарон, бутилйодид, тетрайодид углерода, хиниофон, хлорйодметан, клиохинол, диатризоевую кислоту, дийодгидроксипропан, дийодгидроксихинолин, дийодметан, 2,5-диметокси-4-йодамфетамин, домиодол, эритрозин, этилйодид, этилйодацетат, фиалуридин, фторйодметан, галопрогин, герапатит, IAEDANS, ибацитабин, IDNNA, идоксифен, идоксуридин, инипариб, йобенгуан, йодбензойную кислоту, йобитридол, йокармиковую кислоту, йоцетамовую кислоту, йодамид, йодиксанол, йодацетамид, йодуксусную кислоту, пара-йодамфетамин, йодбензамид, йодбензен, 2-йодбензойную кислоту, 19-йодхолестерин, йодцианопиндолол, йодоформ, 1-йодморфин, йодфенол, йодфенпропит, 4-йодпропофол, йодпропинил бутилкарбамат, йодтрифторэтилен, йодоксамовую кислоту, 2-йодоксибензойную кислоту, йофетамин (123I), йофлупан (123I), йоглициевую кислоту, иогликамовую кислоту, йомазенил, йомепрод, йопамидол, иопаноевую кислоту, йопентол, йопромид, йопидол, йотролан, йотроксовую кислоту, йоверсол, йоксагловую кислоту, йоксилан, иподат натрия, изопропилйодид, метиодал, метилйодид, метризамид, метризоевую кислоту, пентафторэтил йодид, плакогипафорин, N-пропилйодид, пропилйодон, рафоксанид, бенгалроз, RTI-121, RTI-229, RTI-353, RTI-55, SB-258,585, ацетризоат натрия, тиратрикол, трифторйодметан и тиропаноевую кислоту.
Согласно конкретным вариантам реализации указанное соединение галогена представляет собой органический йодид. Органические соединения йода представляют собой органические соединения, содержащие один или большее количество связей углерод–йод. Практически все органические соединения йода содержат йодид, связанный с одним углеродным центром. Обычно их классифицируют как производные I-. Некоторые йодорганические соединения отличает наличие йода с более высокой степенью окисления. Йодорганические соединения, часто применяемые в качестве дезинфицирующих средств или пестицидов, включают, например, йодоформ (CHI3), метиленйодид (CH2I2) и метилйодид (CH3I). Согласно конкретному варианту реализации органический йодид представляет собой полийодорганическое соединение. Полийодорганические соединения иногда используются в качестве рентгеноконтрастных агентов при флюороскопиии, представляющей собой тип медицинской визуализации. Различные подобные полийодорганические соединения коммерчески доступны; многие из них представляют собой производные 1,3,5-трийодбензена и содержат приблизительно 50% йода по массе. Согласно определенным вариантам реализации указанный агент растворим в воде, нетоксичен и/или легко экскретируется. Репрезентативным реагентом является Йоверсол, содержащий водорастворимые диольные заместители. Другие йодорганические соединения включают, не ограничиваясь перечисленными, два гормона щитовидной железы, тироксин («T4») и трийодтиронин («T3»). Природные морепродукты являются богатыми источниками йодорганических соединений, в том числе недавно открытых плакогипафоринов губки Plakortis simplex.
Настоящее изобретение также включает применение соединений, например, лекарственных соединений, в состав которых включен йод. Например, йод может быть включен в существующие лекарственные средства, такие как N-ацетилцистеин, стандартные обезболивающие и нестероидные противовоспалительные лекарственные средства, такие как, например, аспирин, ибупрофен и напроксен. Большинство НПВП функционируют в качестве неселективных ингибиторов фермента циклооксигеназы (COX), ингибируя как изофермент циклооксигеназу-1 (COX-1), так и изофермент циклооксигеназу-2 (COX-2).
Согласно определенным вариантам реализации указанное соединение галогена представляет собой полийодид. Полийодиды представляют собой класс многогалогенных анионов, полностью состоящих из атомов йода. Наиболее распространенным и простейшим представителем является ион трийодида, I3−. Другие известные полийодиды большего размера включают [I4]2-, [I5]-, [I7]-, [I8]2-, [I9]-, [I10]2-, [I10]4-, [I11]-, [I12]2-, [I13]3-, [I16]2-, [I22]4-, [I26]3-, [I26]4-, [I28]4- и [I29]3-. Одним из примеров полийодида является йод Люголя, также называемый раствором Люголя. Коммерчески доступен раствор Люголя с разной активностью, содержащий 1%, 2%, или 5% йода. 5% раствор состоит из смеси 5% (масса/объем) йода (I2) и 10% (масса/объем) йодида калия (KI) в дистиллированной воде, и общее содержание йода в нем составляет 130 мг/мл. Йодид калия обеспечивает водорастворимость элементного йода за счет образования иона трийодида (I−3). Раствор Люголя называют также: I2KI (йод/йодид калия); маркодин, крепкий йодный раствор (системный); и водный раствор йода BCP. Примеры полийодидов, в том числе их ионов и соответствующих катионов, приведены в таблице 1.
Таблица 1. Полийодиды
|
Согласно одному варианту реализации указанное соединение галогена представляет собой йодсодержащий раствор, которая содержит или состоит из элементной йода и йодидов, растворенных в воде и спирте.
Согласно некоторым вариантам реализации указанное соединение галогена представляет собой периодат, включающий одно или большее количество соединений из неограничивающего перечня, включающего периодинан Десса-Мартина, I, 2-йодоксибензойную кислоту, периодную кислоту, периодат калия и периодат натрия.
Согласно конкретным вариантам реализации указанное соединение галогена представляет собой периодат, в том числе периодат натрия, периодат калия, периодат кальция или периодат серебра.
Согласно конкретным вариантам реализации указанное соединение галогена представляет собой периодинан. Периодинаны представляют собой химические соединения, содержащие гипервалентный йод. Согласно некоторым вариантам реализации указанное соединение галогена представляет собой периодинан, включая одно или большее количество соединений из неограничивающего перечня, включающего (бис(трифторацетокси)йод)бензен, периодинан Десса-Мартина, йодобензилдихлорид, йодозобензол и 2-йодоксибензойную кислоту.
Согласно одному варианту реализации указанное соединение галогена представляет собой настойку йодида на масле или масляную настойку йода.
Согласно одному варианту реализации настоящее изобретение относится к соединению галогена, содержащему бром. Определенные варианты реализации могут предусматривать бром-содержащее соединение галогена, которое представляет собой бромид, бромат, органобромид или пербромат.
Согласно некоторым вариантам реализации указанное соединение галогена представляет собой бромид, содержащий одно или большее количество соединений из неограничивающего перечня, включающего бромид аклидиния, бромид алюминия, бромид аммония, АННИН-6-плюс, бромид сурьмы, бромид мышьяка, бромид бария, бромид бензододециния, бромид бериллия, бромид бибензония, трибромид висмута, трибромид бора, бромаргирит, бром(тетрагидротиофен)золото (I), бромид бромпентаамминкобальта (III), бромпентакарбонилрений (I), бромид кадмия, бромид цезия, бромид цезия-кадмия, бромид кальция, бромид церия (III), бромид цетримония, бромид хрома (III), бромид циметропия, клидиний бромид, бромид кобальта (II), бромид меди (I), бромид меди (II), бромциан, демекарий бромид, бромид дителлура, DODAB, домифен бромид, этидий бромид, фазадиний бромид, фентоний, бромид галлия (III), бромид золота (I), бромид золота (III), гексафлуроний бромид, бромистоводородную кислоту, бромид водорода, бромид индия (I), бромид индия (III), монобромид йода, бромид железа (II), бромид железа (III), бромид лантания (III), бромид олова (II), бромид лития, бромид магния, бромид марганца (II), бромид ртути (I), бромид ртути (II), метилбромид морфина, бромид никеля (II), бромид ниобия, бромид ниобия (V), трибромид азота, нитрозилбромид, отилоний бромид, окситропий бромид, оксифеноний бромид, бромид палладия (II), панкуроний бромид, гептабромид фосфора, пентабромид фосфора, трибромид фосфора, пифитрин, бромид пипекурония, бромид платины (II), бромид платины (IV), дибромид полония, бромид калия, бромид пропантелина, бромид радия, бромид рубидия, тетрабромид кремния, бромид серебра, бромид натрия, бромид стронция, бромид тантала (V), тетрабромид теллура, бромид тербия (III), тетрабромзолотую кислоту, тетрабромметан, бромид таллия (I), тимепидиум бромид, бромид олова (II), бромид олова (IV), тетрабромид титана, трибромсилан, бромид трифенилциклопропения, бромид вольфрама (V), окситетрабромид вольфрама (VI), пентабромид урана, тетрабромид урана, бромид ванадия (III), бромид иттербия (III), бромид иттрия (III), бромид цинка и бромид циркония (IV).
Согласно конкретным вариантам реализации указанное соединение галогена представляет собой бромид, включающий бромид натрия, бромид калия, бромид водорода, бромид кальция или бромид серебра.
Согласно некоторым вариантам реализации указанное соединение галогена представляет собой бромат, включающий одно или большее количество соединений из неограничивающего перечня, включающего бромноватую кислоту, бромат кальция, бромат калия, бромат серебра, бромат натрия и бромат стронция.
Согласно некоторым вариантам реализации указанное соединение галогена представляет собой органобромид, включающий одно или большее количество соединений из неограничивающего перечня, включающего 2-броммасляную кислоту, 25B-NBOMe, 2C-B, 2C-B-BZP, 2C-B-FLY, 2CB-Ind, 2CBCB-NBOMe, 2CBFly-NBOMe, 66-Br-APB, ацекарбромал, агелиферин, аллилбромид, AM-087, амброксол, арбидол, AS-8112, BCDMH, бензбромарон, бензилбромид, биброкатол, браллобарбитал, бретазенил, бретилиум, бретилиум для лечения вентрикулярной фибрилляции, бримонидин, бривудин, бродифакум, бродимоприм, брофаромин, бромацил, бромадиолон, бромадолин, бромантан, бромазепам, бромазин, брометалин, бромфенак, бромгексин, бромированные огнестойкие добавки, бромизовал, 2-бром-1-хлорпропан, 4-бром-3,5-диметоксиамфетамин, 2-бром-4,5-метилендиоксиамфетамин, бром-DragonFLY, бромуксусную кислоту, бромацетон, бромацетилалпренололментан, 8-бромаденозин 3',5'-циклический монофосфат, пара-бромамфетамин, 4-броманилин, броманизол, бромбензен, бромбиман, 1-бромбутан, 2-бромбутан, бромхлордифторметан, бромхлорметан, бромхлорсалициланилид, бромкрезоловый зеленый, бромкрезоловый фиолетовый, бромкриптин, бромциклогексан, бромдезоксиуридин, бромдихлорметан, бромдифторацетилхлорид, бромдифторметан, бромдифенилметан, бромэтан, бромфторметан, бромоформ, 3-бромфуран, 8-бромгуанозин-3',5'-циклический монофосфат, 1-бромгексан, 2-бромгексан, Бром-йодметан, бромметан, 4-бром-N-метилкатинон, бромпентан, бромфеноловый синий, бромадол, 2-бромпропан, бромпировиноградная кислота, N-бромсукцинимид, бромтрифторметан, 5-бромурацил, 5-бромуридин, бромксинил, бромперидол, бромфенирамин, бромсульфталеин, бронидокс, бронопол, брофебарбитал, бропиримин, бротизолам, броксатерол, броксихинолин, буталлилонал, трет-бутилбромид, C-8813, карбромал, хлорфенапир, циклотизолам, конволютиндол A, DBDMH, DBNPA, декабромдифенилэфир, дельтаметрин, десформилфлюстрабромин, дексбромфенирамин, диарилпиримидины, 1,2-дибром-3-хлорпропан, 1,4-дибромбензен, дибромхлорметан, дибромдифторметан, 1,1-дибромметан, 1,2-дибромметан, дибромфторметан, дибромметан, 1,2-дибромпропан, 1,3-дибромпропан, дибромтетрафторэтан, дибромтирозин, дибромпропамидин, дифетиалон, 2,5-диметокси-4-бромамфетамин, DS-1 (лекарственное средство), эбротидин, эмбрамин, эозин, эозин B, эозин Y, этилбромацетат, этравирин, FL3 (флаваглин), флибромазолам, гидазепам, H-89, галофугинон, галомон, галотан, галоксазолам, гексабромциклододекан, ибролипим, имидазенил, изоброминдион, JWH-249, JWH-424, KF-26777, лонафарниб, меброквалон, мербромин, мета-DOB, метаклазепам, митобронитол, мукобромную кислоту, наркобарбитал, нелотансерин, нелтенексин, NGD-4715, ницерголин, O-806, октабромдифенилэфир, броморганическое соединение, P7C3, памабром, PEAQX, пентабромдифенилэфир, фенацилбромид, феназепам, 2-фенилэтилбромид, флоксин, пинаверин, пиндобинд, пипоброман, PNU-282,987, многобромистый бифенил, многобромистые простые эфиры дифенила, пропаллилонал, пропаргилбромид, N-пропилбромид, ремоксиприд, ромифидин, RTI-51, SB-357,134, сигмодал, SSR-180,711, стампидин, суринабант, суругатоксин, TCB-2, тетрабромбисфенол A, тетраброметан, тетрабромэтилен, тетрабромметан, TH-302, тилброхинол, тралометрин, 2,4,6-триброманизол и трибромфторметан.
Согласно некоторым вариантам реализации указанное соединение галогена представляет собой пербромат, включающий пербромат натрия, пербромат калия, пербромат водород или пербромат серебра.
Конкретные варианты реализации настоящего изобретения относятся к восстановленной форме соединения галогена. Существуют многие приемлемые способы восстановления соединений галогенов, известные специалисту в данной области техники. Примеры восстановленных форм галидных соединений включают, например, йодид и бромид, при этом указанный галоген имеет валентность, равную -1. Неограничивающие примеры способов восстановления включают химическое восстановление электроположительными элементными металлами (например, такими как литий, натрий, магний, железо, цинк и алюминий), реагентами для гидридного переноса (такими как NaBH4 и LiAIH4, например) или применение газообразного водорода с палладиевым, платиновым или никелевым катализатором.
Конкретный вариант реализации настоящего изобретения относится к введению соединения галогена, принадлежащего к описанному в настоящем документе типу, субъекту-млекопитающему, при этом указанные соединения вводят в виде композиции, в концентрации или в составе, не обладающей(ем) значимой токсичностью для указанных млекопитающих, например, в виде фармацевтической композиции. Согласно конкретным вариантам реализации соединение галогена с установленной токсичностью для субъекта-млекопитающего исключено из предусмотренных настоящим изобретением. Соответственно, согласно конкретным вариантам реализации йодид калия исключен из предусмотренных настоящим изобретением. Кроме того, предполагается, что некоторые варианты реализации могут включать введение более чем одного из указанных соединений галогенов указанному млекопитающему, одновременно либо по отдельности, таким образом, что комбинация указанных соединений, не отличающихся значимой токсичностью при индивидуальном применении, также не отличаются значимой токсичностью при применении в комбинации.
Другие соединения, содержащие соединение галогена или элементный галоген, могут также применяться в соответствии со способами согласно настоящему изобретению и/или быть включены в композиции согласно настоящему изобретению. Согласно некоторым вариантам реализации указанное соединение галогена представляет собой коммерчески доступное вещество. Согласно определенным вариантам реализации указанный коммерчески доступные вещества могут включать радиологические контрастирующие агенты, составы, растворы или лекарственные средства с йодом для местного применения. Согласно определенным вариантам реализации указанное коммерчески доступное вещество содержит йод, и может быть выбрано из неограничивающего перечня, включающего диатризоат, иопаноевую кислоту, йоподат, йоталамат, метризамид, диатрозид, дийодгидроксихинолон, настойку йода, йодповидон, йодхлоргидроксихинолон, иодоформную марлю, насыщенный йодид калия (SSKI), раствор Люголя, йодированный глицерин, эхотиофатйодид, сироп йодистоводородной кислоты, йодид кальция, амиодарон, отхаркивающие средства, витамины, содержащие йод, йодхлоргидроксихинолон, дийодгидроксихинолон, йодид калия, бензиодарон, йодид изопропамида, левотироксин и эритрозин. Согласно определенным вариантам реализации указанное коммерчески доступное вещество содержит бром, и может быть выбрано из неограничивающего перечня, включающего Альфаган (бримонидин), Атровент (ипратропиум), Целекса (циталопрам), Комбивент (ипратропия бромид), Энаблекс (дарифенацин), Гвайфенекс DM (декстрометорфан), Разадин (галантамин) и Спирива (тиотропий).
Определенные композиции и способы, предложенные в настоящем изобретении содержат соединение галогена в комбинации с глутатионом и/или струмогенным агентом. Согласно описанию в настоящем документе глутатион может стабилизировать соединения галогенов в восстановленной форме, а струмогенные агенты могут ингибировать синтез гормона щитовидной железы.
Другие активные агенты
Настоящее изобретение также предусматривает применение других активных агентов, отдельно или в комбинации с соединением галогена для лечения или предотвращения любых заболеваний, состояний или повреждений согласно описанию в настоящем документе. Различные агенты, эффективные для лечения или предотвращения любых из указанных заболеваний, состояний или повреждений, описаны или известны в данной области техники; могут применяться любые из указанных агентов или другие агенты. Кроме того, другие агенты могут применяться в комбинации с соединением галогена в соответствии со способами согласно настоящему изобретению.
Согласно определенным вариантам реализации активный агент представляет собой халькогенид или его соль. Было показано, что обработка халькогенидом индуцирует стазис биологической материи и защищает биологическую материю от гипоксического и ишемического повреждения. В указанных исследованиях было показано, что сульфид может снижать метаболизм и защищать мышей и крыс от гипоксических повреждений (PCT-публикация WO2005/041655). Соединения, содержащий элементный халькоген, т.е. элемент 6 группы периодической таблицы элементов, исключая оксиды, часто называют «халькогенидами» или «соединениями халькогенидов». Указанные элементы представлены серой (S), селеном (Se), теллуром (Te) и полонием (Po). Распространенные халькогениды содержат один или большее число элементов, выбранных из S, Se, и Te, помимо других элементов. Конкретные халькогениды и их соли включают, не ограничиваясь перечисленными: H2S, Na2S, NaHS, K2S, KHS, Rb2S, CS2S, (NH4)2S, (NH4)HS, BeS, MgS, CaS, SrS, BaS, H2Se, Na2Se, NaHSe, K2Se, KHSe, Rb2Se, CS2Se, (NH4)2Se, (NH4)HSe, BeSe, MgSe, CaSe, SrSe, PoSe и BaSe. Различные халькогениды описаны в WO2005/041656, WO2005/041655 и WO2006/113914.
Согласно определенным вариантам реализации активный агент представляет собой антагонист кислорода. Термин «антагонист кислорода» относится к веществу, конкурирующему с кислородом в отношении использования биологической материей, которой для жизнеобеспечения требуется кислород («утилизирующая кислород биологическая материя»). Кислород, как правило, используется или является необходимым для различных клеточных процессов, создающих первичный источник легко утилизируемой энергии для биологической материи. Антагонист кислорода эффективно уменьшает или устраняет количество кислорода, доступное для утилизирующей кислород биологической материи, и/или количество кислорода, который может быть использовано утилизирующей кислород биологической материей. Соответственно, согласно некоторым вариантам реализации антагонист кислорода ингибирует или уменьшает уровень клеточного дыхания в клетках, например, за счет участков связывания цитохром-c-оксидазы, которые в ином случае связываются с кислородом. Одним из примеров антагонистов кислорода является монооксид углерода. Различные антагонисты кислорода описаны в WO2005/041656, WO2005/041655 и WO2006/113914.
Согласно дополнительным вариантам реализации активный агент представляет собой стазис-индуцирующее соединение, такое как ротенон. Дополнительные стазис-индуцирующие соединения описаны, например, в US2010/0021387.
Согласно определенным вариантам реализации активный агент представляет собой элементный восстанавливающий агент (ЭВА), такой как йодид, сульфид или селенид.
Согласно другим вариантам реализации активный агент представляет собой модулирующее HIF соединение, различные варианты которого описаны в US2009/0011051. Система транскрипционного фактора HIF (индуцируемый гипоксией фактор) представляет собой ключевой регулятор ответов на гипоксию, занимая центральное положение в гомеостазе кислорода в самых различных организмах. Было идентифицировано значительное число транскрипционных мишеней, играющих критически важные роли в ангиогенезе, эритропоэзе, энергетическом обмене, воспалении, вазомоторной функции и апоптотическом/пролиферативном ответе. Указанная система имеет важное значение для нормального развития, и играет ключевую роль в патофизиологических ответах на ишемию/гипоксию. HIF также имеет важное значение при раковых заболеваниях, при которых, как правило, происходит его повышающая регуляция, оказывает значительное действие на рост опухолей и ангиогенез. ДНК-связывающий комплекс HIF состоит из гетеродимера, включающего субъединицы α и β. Регуляция кислородом происходит посредством гидроксилирования α-субъединиц, как правило, одного или большего числа остатков пролина, которые затем быстро уничтожаются протеасомой в оксигенированных клетках. Это включает связывание α-субъединиц HIF белком-супрессором опухолевого роста фон Хиппеля-Линдау (pVHL или VHL), при этом pVHL действует как элемент распознавания или часть элемента распознавания убиквитинлигазы, что способствует убиквитин-зависимому протеолизу за счет взаимодействия со специфической последовательностью или последовательностями α-субъединицы HIF. При гипоксии указанный процесс подавлен, соответственно, происходит стабилизация HIFα и транскрипционная активация за счет гетеродимера HIF α/β. Некоторые соединения, которые, как было показано, влияют на метаболическую активность, также стабилизируют HIF; таким образом, такие соединения задействованы в схемах профилактики и лечения гипоксии, ишемии, стазиса и/или любого другого состояния или статуса, связанного со стабилизацией HIF, такого как геморрагический шок. Любые из указанные соединений могут применяться в соответствии с настоящим изобретением.
Согласно другим вариантам реализации активный агент представляет собой полихалькогенид. Типовые полихалькогениды описаны в WO2009/003061.
Согласно дополнительным вариантам реализации активный агент представляет собой полисульфидное соединение, примеры которого описаны в WO2010/045582.
Другой активный агент, который может применяться, например, в комбинации с соединением галогена, представлен оксидом азота.
Некоторые композиции и способы, предложенные в настоящем изобретении содержат халькогенид в комбинации с глутатионом и/или струмогенным агентом. Согласно описанию в настоящем документе, глутатион может стабилизировать халькогениды в восстановленной форме, а струмогенные агенты могут ингибировать синтез гормона щитовидной железы.
Согласно определенным вариантам реализации способы, предложенные в настоящем изобретении включают введение нуждающемуся в этом субъекту любого из следующих агентов или соединений, отдельно или в комбинации, в том числе, но не ограничиваясь перечисленными, любые комбинации перечисленного ниже:
соединение галогена;
халькогенид;
струмогенный агент или другое соединение, которое уменьшает или ингибирует выработку, активность или поглощение гормонов щитовидной железы;
соединение галогена и халькогенид;
халькогенид и глутатион;
соединение галогена и глутатион; и
соединение галогена, халькогенид и глутатион.
Согласно определенным вариантам реализации соединение галогена вводят или вводят в состав вместе с активным агентом, применяемым для лечения ХСН, например, ХСН, обусловленной дисфункцией левого желудочка, таким как ингибитор ангиотензин-превращающего фермента (ACE), бета-блокатор, антагонист альдостерона, блокаторы рецепторов ангиотензина или гидралазин с нитратом. Согласно дополнительным вариантам реализации другой активный агент представляет собой антикоагулянт, антитромбоцитарную терапию, блокатор рецепторов ангиотензина II, блокатор кальциевых каналов, диуретик, сосудорасширяющее средство или статин.
Неограничивающие примеры ингибиторов ангиотензин-превращающего фермента, которые могут применяться в соответствии с настоящим изобретением, включают: каптоприл (Капотен®), эналаприл (Васотек®), лизиноприл (Принивил®, Зестрил®), гидрохлорид беназеприла (Лотензин®), фозиноприл натрия (Моноприл®), рамиприл (Алтаце®), гидрохлорид квинаприла (Аккуприл®), периндоприлэрбумин (Ацеон®), трандолаприл (Мавик®) и гидрохлорид моэксиприла (Униваск®).
Неограничивающие примеры неселективных бета-блокаторов, которые могут применяться в соответствии с настоящим изобретением включают: аллопуринол, буциндолол, картеолол, карведилол (обладает дополнительной α-блокирующей активностью), лабеталол (обладает дополнительной α-блокирующей активностью), надолол, окспренолол (обладает собственной симпатомиметической активностью), пенбутолол (обладает собственной симпатомиметической активностью), пиндолол (обладает собственной симпатомиметической активностью), пропранолол, соталол, тимолол и кору эвкоммии (растительное средство).
Неограничивающие примеры β1-селективных бета-блокаторов, которые могут применяться в соответствии с настоящим изобретением (также известных как кардиоселективные) включают: ацебутолол (обладает собственной симпатомиметической активностью), атенолол, бетаксолол, бисопролол, бисопролол, эсмолол, метопролол и небиволол (также увеличивает высвобождение оксида азота для вазодилатации).
Неограничивающие примеры β2-селективных агентов, которые могут применяться в соответствии с настоящим изобретением, включают: бутаксамин (незначительная α-адренергическая агонистическая активность).
Неограничивающие примеры специфических бета-блокаторов, назначаемых при хронической сердечной недостаточности включают: карведилол, метопролол с замедленным высвобождением, бисопролол и небиволол.
Неограничивающие примеры блокаторов ангиотензина II включают: кандесартан (Атаканд®), эпросартан (Теветен®), ирбесартан (Авапро®), лозартан (Козаар®), телмисартан (Микардис®) и валсартан (Диован®).
Согласно определенным вариантам реализации способы, предложенные в настоящем изобретении включают введение нуждающемуся в этом субъекту, например, субъекту, у которого диагностирована ХСН или имеется риск развития хронической сердечной недостаточности, любого из следующих агентов или соединений, отдельно или в комбинации, в том числе, но не ограничиваясь перечисленными, любых комбинаций перечисленного ниже:
соединение галогена;
соединение галогена и глутатион;
соединение галогена и другой активный агент, применяемый для лечения хронической сердечной недостаточности; и
соединение галогена, другой активный агент, применяемый для лечения хронической сердечной недостаточности, и глутатион.
При применении в комбинации два или большее число агентов можно вводить указанному субъекту в составе одной или разных композиций. Кроме того, при введении указанному субъекту трех или большего числа агентов два агента могут входить в состав одной композиции, а третий агент – в состав отдельной композиции. Указанные композиции можно вводить одновременно, в течение перекрывающихся периодов времени или в разные периоды времени.
Композиции и единичные дозированные формы
Настоящее изобретение также включает композиции, содержащие соединение галогена, такое как, например, йодид или бромид. Согласно конкретным вариантам реализации указанная композиция дополнительно содержит один или большее количество дополнительных активных агентов, в том числе любых из описанных в настоящем документе. Согласно определенным вариантам реализации композиции согласно настоящему изобретению представляют собой фармацевтические композиции. Согласно конкретным вариантам реализации композиции согласно настоящему изобретению дополнительно содержат фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество, такое как, например, буфер. Согласно определенным вариантам реализации композиции согласно настоящему изобретению представляют собой фармацевтические композиции, содержащие соединение галогена и глутатион. Конкретные композиции содержат соединение галогена, например, йодид, и другое соединение, применяемое для лечения или предотвращения хронической сердечной недостаточности. Дополнительные композиции согласно настоящему изобретению содержат глутатион в комбинации с халькогенидом и/или соединением галогена. Согласно определенным вариантам реализации композиция содержит глутатион, халькогенид и соединение галогена. Согласно конкретным вариантам реализации композиция согласно настоящему изобретению включает глутатион и селенид. Согласно конкретным вариантам реализации композиция согласно настоящему изобретению включает глутатион и сульфид. Согласно определенным вариантам реализации композиция согласно настоящему изобретению содержит йодид (или йодат), селенид и глутатион. Согласно определенным вариантам реализации композиция согласно настоящему изобретению содержит йодид (или йодат), сульфид и глутатион. Согласно конкретным вариантам реализации по меньшей мере часть селенида или сульфида находится в восстановленной форме, и глутатион ингибирует окисление халькогенида в указанной композиции. Указанная восстановленная форма халькогенида может представлять собой любую форму из описанных в настоящем документе. Согласно конкретным вариантам реализации по меньшей мере часть йодида или йодата находится в восстановленной форме, и глутатион ингибирует окисление соединения галогена в указанной композиции. Указанная восстановленная форма соединения может представлять собой любую форму из описанных в настоящем документе.
Согласно определенным вариантам реализации настоящим изобретением охвачены композиции, содержащие соединение галогена, например, восстановленную форму соединения галогена. Согласно родственным вариантам реализации настоящее изобретение включает композиции, содержащие соединение галогена, например, восстановленную форму соединения галогена, и один или большее количество дополнительных активных агентов, например, халькогенид, например, восстановленную форму халькогенида, или активный агент, применяемый для лечения хронической сердечной недостаточности. Согласно определенным вариантам реализации указанная композиция дополнительно содержит глутатион. Настоящее изобретение также включает способы, которые включают введение указанному субъекту композиции, содержащей восстановленную форму соединения галогена, отдельно или в комбинации с введением указанному субъекту композиции, содержащей один или большее количество дополнительных активных агентов, таких как, например, восстановленная форма халькогенида. Согласно конкретным вариантам реализации восстановленная форма халькогенида содержит халькоген, например, серу или селен, с валентностью -2. Согласно конкретным вариантам реализации одна композиция содержит и соединение галогена, и один или большее количество дополнительных активных агентов или активный агент, применяемый для лечения хронической сердечной недостаточности. Согласно определенным вариантам реализации любых из композиций согласно настоящему изобретению соединение галогена представляет собой восстановленную форму соединения галогена, которая содержит галоген с валентностью -1, например, йодид или бромид, такой как йодид натрия. Согласно определенным вариантам реализации любых из композиций согласно описанию в настоящем документе указанная композиция дополнительно содержит глутатион или другой восстанавливающий агент.
Согласно конкретным вариантам реализации указанные композиции входит в состав, обеспечивающий поддержание галогена и/или халькогенида в восстановленной форме при хранении в течение периода времени. Соответственно, указанные композиции могут представлять собой стабильные композиции с восстановленными формами соединений галогенов и/или восстановленными формами халькогенидов, или их солями или предшественниками, эффективность которых в качестве терапевтического средства, как правило, может снижаться при производстве и хранении в результате реакций окисления, дающих продукты окисления. Композиции согласно настоящему изобретению отличаются большим сроком хранения, легкость и воспроизводимость получения, предназначены для введения стандартными способами, и, соответственно, обеспечивают преимущества при лечении и предотвращении ряда заболеваний, состояний и повреждений. Настоящим изобретением предусмотрено их применение в способах защиты биологических тканей от заболевания или повреждения, в частности, ишемического, гипоксического или реперфузионного повреждения, а также способы лечения или предотвращения повреждения или заболевания у субъекта.
Согласно определенным вариантам реализации стабильная композиция, содержащая халькогенид и/или соединение галогена, содержит глутатион.
Согласно дополнительным вариантам реализации композиция содержит струмогенный агент или активный агент, который ингибирует или уменьшает выработку, активность или поглощение гормонов щитовидной железы, отдельно или в комбинации с другим активным агентом, таким как халькогенид и/или соединение галогена.
Согласно определенным вариантам реализации указанных композиций, композицию считают стабильной, т.е. она представляет собой стабильную композицию, в том случае, если по меньшей мере 90% соединения галогена или халькогенида (в случае его присутствия в указанной композиции), или как соединения галогена, так и халькогенида (если они присутствуют в указанной композиции), находятся в указанной композиции в восстановленной форме в течение по меньшей мере одного часа при хранении при комнатной температуре, либо при температуре 4ºC, 25ºC, 40ºC или 50ºC. Согласно родственным вариантам реализации композицию считают стабильной в том случае, если по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% соединения галогена, халькогенида или как соединения галогена, так и халькогенида в указанной композиции находится в восстановленной форме в течение по меньшей мере одного часа при хранении при комнатной температуре или при хранении при температуре 4ºC. Согласно определенным вариантам реализации стабильных композиций по меньшей мере 90% соединения галогена, халькогенида или как соединения галогена, так и халькогенида в указанной композиции находится в восстановленной форме в течение по меньшей мере одного дня, по меньшей мере одной недели, по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере четырех месяцев, по меньшей мере шести месяцев или по меньшей мере одного года, при хранении либо при комнатной температуре, либо при температуре 4ºC, 25ºC, 40ºC или 50ºC. Согласно родственным вариантам реализации по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% соединения галогена, халькогенида или как соединения галогена, так и халькогенида в стабильной композиции находится в восстановленной форме в течение по меньшей мере одного дня, по меньшей мере одной недели, по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере четырех месяцев, по меньшей мере шести месяцев или по меньшей мере одного года, при хранении либо при комнатной температуре, либо при температуре 4ºC. Согласно конкретным вариантам реализации по меньшей мере 98% соединения галогена, халькогенида или как соединения галогена, так и халькогенида в стабильной композиции находится в восстановленной форме в течение по меньшей мере одного месяца или по меньшей мере шести месяцев при хранении при температуре 4ºC. Согласно родственным вариантам реализации по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% соединения галогена, халькогенида или как соединения галогена, так и халькогенида в стабильной композиции находится в восстановленной форме в течение по меньшей мере одного дня, по меньшей мере одной недели, по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере четырех месяцев, по меньшей мере шести месяцев или по меньшей мере одного года, при хранении при комнатной температуре либо при температуре 25 ºC. Согласно конкретным вариантам реализации по меньшей мере 98% соединения галогена, халькогенида или как соединения галогена, так и халькогенида в стабильной композиции находится в восстановленной форме в течение по меньшей мере одного месяца или по меньшей мере шести месяцев при хранении при комнатной температуре или 25ºC. Согласно родственным вариантам реализации по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% соединения галогена, халькогенида или как соединения галогена, так и халькогенида в стабильной композиции находится в восстановленной форме в течение по меньшей мере одного дня, по меньшей мере одной недели, по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере четырех месяцев, по меньшей мере шести месяцев или по меньшей мере одного года, при хранении либо при комнатной температуре, либо при температуре 40ºC или 50ºC. Согласно конкретным вариантам реализации по меньшей мере 98% соединения галогена, халькогенида или как соединения галогена, так и халькогенида в стабильной композиции находится в восстановленной форме в течение по меньшей мере одного месяца или по меньшей мере шести месяцев при хранении при температуре 40ºC или 50ºC. Согласно различным вариантам реализации указанная композиция представляет собой жидкую фармацевтическую композицию, тогда как согласно другим вариантам реализации указанная композиция представляет собой твердое вещество или порошок, или указанная композиция высушена, лиофилизирована или сублимирована.
Согласно конкретным вариантам реализации настоящее изобретение относится к стабильной жидкой композиции, содержащей йодид, отличающейся тем, что указанная стабильная жидкая композиция содержит менее чем 1% любого из следующих продуктов окисления йодида (степень окисления: -1): гипойодит (степень окисления: +1), йодит (степень окисления: +3), йодат (степень окисления: +5), или периодат (степень окисления: +7). Согласно конкретным вариантам реализации указанный стабильная жидкая композиция, содержащая йодид, содержит менее чем 1% йода (I2).
Согласно определенным вариантам реализации восстановленная форма соединения галогена содержит галоген с валентностью -1. Согласно конкретным вариантам реализации восстановленная форма халькогенида содержит халькоген, например, серу или селен с валентностью -2. Согласно конкретным вариантам реализации указанная восстановленная форма галогена представляет собой восстановленную форму галогена йода, например, йодид. Согласно конкретным вариантам реализации указанный восстановленная форма соединения галогена представлена NaI, KI, HI, CaI или AgI. Согласно конкретным вариантам реализации указанная восстановленная форма халькогенида представлена H2Se, Na2Se, NaHSe, HSe-, H2S, NaHS, Na2S или HS-.
Согласно конкретным вариантам реализации любые из композиций согласно описанию в настоящем документе содержат фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Кроме того, любые из указанных композиций могут содержать один или большее количество буферных агентов, восстанавливающих агентов, регулирующих тоничность агентов, стабилизаторов, поверхностно-активных веществ, лиопротекторов, полиолов, антиоксидантов или консервантов. Согласно конкретным вариантам реализации любые из указанных композиций согласно описанию в настоящем документе содержат глутатион.
Согласно конкретным вариантам реализации указанные композиции могут содержать один или большее количество растворителей. Согласно конкретным вариантам реализации указанный растворитель представляет собой воду. Согласно конкретным вариантам реализации указанный растворитель представляет собой забуференный фосфатом солевой раствор.
Композиции согласно настоящему изобретению и способы, предложенные в настоящем изобретении могут включать соединение галогена и/или халькогенида, или его соль или предшественник, в любой требуемой концентрации. Указанная концентрация легко может быть оптимизирована, например, в зависимости от типа повреждения или заболевания, лечение которого проводят, и способа введения, таким образом, чтобы обеспечить доставку эффективного количества удобным образом и в течение подходящего периода времени.
Согласно некоторым вариантам реализации концентрация соединения галогена, или его соли или предшественника, присутствующего(ей) в композиции согласно настоящему изобретению, составляет от приблизительно 0,0001 мМ до приблизительно 100 M, от приблизительно 0,0005 мМ до приблизительно 50 M, от приблизительно 0,001 мМ до приблизительно 10 M, от приблизительно 0,001 мМ до приблизительно 5 M, от приблизительно 0,001 мМ до приблизительно 1 M, от приблизительно 0,005 мМ до приблизительно 10 M, от приблизительно 0,005 мМ до приблизительно 5 M, от приблизительно 0,005 мМ до приблизительно 1 M, от приблизительно 0,005 мМ до приблизительно 0,5 M, от приблизительно 0,01 мМ до приблизительно 10 M, от приблизительно 0,01 мМ до приблизительно 5 M, от приблизительно 0,01 мМ до приблизительно 2 M, от приблизительно 0,1 мМ до приблизительно 1 M, от приблизительно 0,1 мМ до приблизительно 0,5 M, от приблизительно 0,5 мМ до приблизительно 5 M, от приблизительно 0,5 мМ до приблизительно 2 M, от приблизительно 0,5 мМ до приблизительно 1 M, от приблизительно 0,5 мМ до приблизительно 0,5 M, от приблизительно 1 мМ до приблизительно 5 M, от приблизительно 1 мМ до приблизительно 2 M, от приблизительно 1 мМ до приблизительно 1 M, от приблизительно 1 мМ до приблизительно 0,5 M, от приблизительно 5 мМ до приблизительно 5 M, от приблизительно 5 мМ до приблизительно 2 M, от приблизительно 5 мМ до приблизительно 1 M, от приблизительно 5 мМ до приблизительно 0,5 M, от приблизительно 5 мМ до приблизительно 0,25 M, от приблизительно 10 мМ до приблизительно 1 M, от приблизительно 10 мМ до приблизительно 0,5 M, от приблизительно 10 мМ до приблизительно 0,25 M, или приблизительно 10 мМ, приблизительно 50 мМ приблизительно 100 мМ, или приблизительно 200 мМ.
Согласно некоторым вариантам реализации концентрация соединения халькогенида или халькогенида, или его соли или предшественника составляет от приблизительно 0,001 мМ до приблизительно 5,000 мМ, от приблизительно 1 мМ до приблизительно 1000 мМ, от приблизительно 10 мМ до приблизительно 500 мМ, от приблизительно 50 мМ до приблизительно 500 мМ, от приблизительно 75 мМ до приблизительно 250 мМ, или от приблизительно 95 мМ до 150 мМ.
Согласно конкретным вариантам реализации композиция содержит селенид в концентрации, составляющей от приблизительно 0,1 мМ до приблизительно 1000 мМ, от приблизительно 1 мМ до приблизительно 1000 мМ, от приблизительно 5 мМ до приблизительно 1000 мМ, от приблизительно 10 мМ до приблизительно 1000 мМ, от приблизительно 10 мМ до приблизительно 750 мМ, от приблизительно 50 мМ до приблизительно 500 мМ, от приблизительно 100 мМ до приблизительно 500 мМ, от приблизительно 10 мМ до приблизительно 500 мМ, от 1 мМ до приблизительно 500 мМ, или от приблизительно 10 мМ до приблизительно 250 мМ.
Согласно конкретным вариантам реализации композиция содержит сульфид в концентрации, составляющей от приблизительно 0,1 мМ до приблизительно 1000 мМ, приблизительно 1 мМ до приблизительно 1000 мМ, приблизительно 5 мМ до приблизительно 1000 мМ, от приблизительно 10 мМ до приблизительно 1000 мМ, от приблизительно 10 мМ до приблизительно 750 мМ, от приблизительно 50 мМ до приблизительно 500 мМ, от приблизительно 100 мМ до приблизительно 500 мМ, от приблизительно 10 мМ до приблизительно 500 мМ, от 1 мМ до приблизительно 500 мМ, или от приблизительно 10 мМ до приблизительно 250 мМ.
Согласно определенным вариантам реализации концентрация указанной восстановленной формы соединения галогена и/или халькогенида, например, селенида или сульфида, в композиции согласно настоящему изобретению составляет приблизительно, по меньшей мере приблизительно или максимум приблизительно 0,001; 0,01; 0,02; 0,03; 0,04; 0,05; 0,06; 0,07; 0,08; 0,09; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0; 1,1; 1,2; 1,3; 1,4; 1,5; 1,6; 1,7; 1,8; 1,9; 2,0; 2,1; 2,2; 2,3; 2,4; 2,5; 2,6; 2,7; 2,8; 2,9; 3,0; 3,1; 3,2; 3,3; 3,4; 3,5; 3,6; 3,7; 3,8; 3,9; 4,0; 4,1; 4,2; 4,3; 4,4; 4,5; 4,6; 4,7; 4,8; 4,9; 5,0 мМ или M, или большее количество, или соответствует значениям в пределах любого основанного на указанных значениях диапазона (при стандартных температуре и давлении (STP)).
В настоящем документе термин «%» при применении без уточнения (такого как масса/объем, объем/объем или масса/масса) означает процентное соотношение веса и объема для растворов твердых веществ в s (масса/объем), процентное соотношение веса и объема для растворов газов в s (масса/объем), процентное соотношение объемов для растворов s в s (объем/объем) и процентное соотношение масс для смесей твердых веществ и полутвердых веществ (масса/масса) (Remington's Pharmaceutical Sciences (2005); 21st Edition, Troy, David B. Ed. Lippincott, Williams and Wilkins).
Согласно одному варианту реализации композиция содержит селенид или сульфид в расчетном количестве 80% – 100% (масса/объем). Согласно одному варианту реализации композиция содержит селенид или сульфид в расчетном количестве 90% – 100% (масса/объем). Согласно одному варианту реализации композиция содержит селенид или сульфид в расчетном количестве 95% – 100% (масса/объем). Согласно одному варианту реализации композиция содержит сульфид в расчетном количестве 98% – 100% (масса/объем).
Согласно определенным вариантам реализации композиция содержит глутатион в концентрации, составляющей от приблизительно 1,5 мкМ до приблизительно 10 M, от приблизительно 15 мкМ до приблизительно 1 M, от приблизительно 150 мкМ до приблизительно 1 M, от приблизительно 1,5 мМ до приблизительно 1 M, от приблизительно 10 мМ до приблизительно 500 мМ, от приблизительно 10 мМ до приблизительно 250 мМ, или приблизительно 100 мМ, приблизительно 120 мМ, приблизительно 150 мМ, приблизительно 170 мМ или приблизительно 200 мМ.
Согласно определенным вариантам реализации композиция содержит струмогенный агент или соединение, которое ингибирует или нарушает выработку гормонов щитовидной железы, активность или поглощение в концентрации, составляющей от приблизительно 0,1 мкМ до приблизительно 100 M, от приблизительно 1,5 мкМ до приблизительно 10 M, от приблизительно 15 мкМ до приблизительно 1 M, от приблизительно 150 мкМ до приблизительно 1 M, от приблизительно 1 мМ до приблизительно 1 M, от приблизительно 10 мМ до приблизительно 500 мМ, от приблизительно 10 мМ до приблизительно 250 мМ, или приблизительно 100 мМ, приблизительно 120 мМ, приблизительно 150 мМ, приблизительно 170 мМ или приблизительно 200 мМ.
Согласно определенным вариантам реализации композиция согласно настоящему изобретению включает халькогенид и глутатион, и, необязательно, соединение галогена или его соль или предшественник, при этом концентрация халькогенида составляет от приблизительно 1 мМ до приблизительно 1 M, от приблизительно 10 мМ до приблизительно 500 мМ, или от приблизительно 10 мМ до приблизительно 100 мМ, концентрация глутатиона составляет от приблизительно 100 мкМ до приблизительно 1 M, от приблизительно 1 мМ до приблизительно 1 M, или от приблизительно 10 мМ до приблизительно 500 мМ, а концентрация соединения галогена, в случае его присутствия, составляет от приблизительно 0,01 мМ до приблизительно 5 M, от приблизительно 1 мМ до приблизительно 0,5 M, или от приблизительно 10 мМ до приблизительно 250 мМ. Согласно определенным вариантам реализации в указанной композиции присутствует соединение галогена. Согласно конкретным вариантам реализации указанное соединение галогена представляет собой йодид или йодат, и указанный халькогенид включает селен или серу. Согласно определенным вариантам реализации композиция согласно настоящему изобретению включает соединение галогена, или его соль или предшественник, глутатион и, необязательно, халькогенид, при этом концентрация соединения галогена составляет от приблизительно 0,01 мМ до приблизительно 5 M, от приблизительно 1 мМ до приблизительно 0,5 M, или от приблизительно 10 мМ до приблизительно 250 мМ, концентрация глутатиона составляет от приблизительно 100 мкМ до приблизительно 1 M, от приблизительно 1 мМ до приблизительно 1 M, или от приблизительно 10 мМ до приблизительно 500 мМ, и концентрация соединения галогена, в случае его присутствия, составляет от приблизительно 1 мМ до приблизительно 1 M, от приблизительно 10 мМ до приблизительно 500 мМ, или от приблизительно 10 мМ до приблизительно 100 мМ. Согласно определенным вариантам реализации в указанной композиции присутствует халькогенид. Согласно конкретным вариантам реализации указанное соединение галогена представляет собой йодид или йодат, и указанный халькогенид включает селен или серу. Согласно конкретным вариантам реализации любых из указанных композиций указанная композиция входит в состав для пероральной доставки, или представляет собой дозированную форму для перорального применения, соединение галогена (в случае присутствия) содержит йод (например, йодид или йодат), а халькогенид (в случае присутствия) содержит селен. Согласно определенным вариантам реализации указанный халькогенид представляет собой селенид или селенид. Согласно конкретным вариантам реализации указанная композиция входит в состав для внутривенного введения, указанное соединение галогена (в случае присутствия) представляет собой йодид или йодат, и указанный халькогенид (в случае присутствия) находится в восстановленной форме, например, представляет собой селенид или сульфид. Согласно одному варианту реализации указанная композиция содержит селенид, йодид и глутатион, концентрация каждого из которых находится в пределах любого из диапазонов концентраций или в концентрации согласно описанию в настоящем документе.
Согласно конкретным вариантам реализации значение pH композиции согласно настоящему изобретению находится в диапазоне (3,0–12,0), тогда как согласно другим вариантам реализации значение pH находится в диапазоне (5,0–9,0). Значения pH указанной фармацевтической композиции могут быть доведены до физиологически приемлемого диапазона. Например, согласно одному варианту реализации значение pH стабильной композиции находится в диапазоне 6,5–8,5. Согласно другим вариантам реализации значение рН композиций согласно настоящему изобретению находится в диапазоне 7,5–8,5 или 7,4–9,0.
Согласно конкретным вариантам реализации кислород присутствует в композиции согласно настоящему изобретению в концентрации в диапазоне 0 мкМ-5 мкМ или 0 мкМ-1 мкМ или 0 мкМ-0,1 мкМ или 0 мкМ – 0,01 мкМ. Согласно конкретным вариантам реализации кислород присутствует в указанной композиции в концентрации, составляющей менее чем 3 мкМ, менее чем 1 мкМ, менее чем 0,1 мкМ, менее чем 0,01 мкМ или менее чем 0,001 мкМ.
Согласно определенным вариантам реализации композиции согласно настоящему изобретению могут также содержать ограниченное количество продуктов окисления. Продукты окисления, которые могут присутствовать согласно различным вариантам реализации настоящего изобретения, включают, не ограничиваясь перечисленными, йод, йодат, бром, бромат, селенит, тиоселенат, полиселениды, элементный селен, селенат, сульфит, сульфат, тиосульфат, полисульфиды, дитионат, политионат и элементную серу. Согласно различным вариантам реализации один или большее количество указанных продуктов окисления присутствует в композиции в количестве менее чем 10%, менее чем 5,0%, менее чем 2,0%, менее чем 1,0%, менее чем 0,5%, менее чем 0,2%, менее чем 0,1%, менее чем 0,05%, или менее чем 0,01% (масса/объем) от общего количества соединения галогена и/или халькогенид в указанной композиции.
Согласно одному варианту реализации значения осмолярности композиции находятся в диапазоне 200–400 мОсм/л. NaCl может применяться в качестве вспомогательного вещества для коррекции осмолярности.
Согласно определенным вариантам реализации желательно обеспечение изотоничности композиций, поскольку это уменьшению болезненности при введении и минимизирует потенциальные гемолитические эффекты, связанные с гипертоничностью или гипотоничностью композиций. Соответственно, композиции согласно настоящему изобретению не только отличаются повышенной стабильностью при хранении, но также обладают дополнительным преимуществом, заключающимся в уменьшении по существу боли при введении по сравнению с составами, где используются другие более традиционные буферные системы, содержащие кислоту и соль кислоты.
Стабильные жидкие композиции, содержащие восстановленные формы халькогенидов, в том числе сульфид или селенид, и способы их получения были описаны, например, в публикации РСТ № WO2008/043081, в предварительной заявке на патент США № 61/659311 и в опубликованной заявке РСТ № WO2013/188528. Любая из указанных композиций может применяться для лечения или предотвращения любого из заболеваний, расстройств или повреждений согласно описанию в настоящем документе.
Композиции согласно настоящему изобретению, содержащие восстановленную форму халькогенида и дополнительно содержащие глутатион, могут быть получены специалистом в данной области техники аналогичным образом, например, путем получения композиции, содержащей указанную восстановленную форму халькогенида, и добавления глутатиона. Аналогичным образом, композиции, содержащие восстановленную форму халькогенида и восстановленную форму соединения галогена, могут быть получены специалистом в данной области техники аналогичным образом, например, путем получения композиции, содержащей восстановленную форму халькогенида, и комбинирования с восстановленной формой соединения галогена или с композицией, содержащей восстановленную форму соединения галогена.
В WO2008/043081 описаны композиции, содержащие стабильную жидкую фармацевтическую форму соединения халькогенида или халькогенида или его соли или предшественника в фармацевтически приемлемом носителе, при этом концентрация, значение pH и продукты окисления указанного соединения халькогенида или халькогенида или соли остаются в пределах диапазона критериев приемлемости после хранения указанной жидкой фармацевтической композиции. Согласно различным вариантам реализации указанное соединение халькогенида или соль халькогенида выбрано(а) из группы, состоящей из: H2S, Na2S, NaHS, K2S, KHS, Rb2S, CS2S, (NH4)2S, (NH4)HS, BeS, MgS, CaS, SrS и BaS. Согласно другим вариантам реализации указанное соединение халькогенида или соль халькогенида выбрано(а) из группы, состоящей из: H2Se, Na2Se, NaHSe, K2Se, KHSe, Rb2Se, CS2Se, (NH4)2Se, (NH4)HSe, BeSe, MgSe, CaSe, SrSe, PoSe и BaSe. В соответствии с настоящим изобретением указанные композиции могут также содержать соединение галогена, например, йодид, глутатион или струмогенный агент.
Согласно конкретным вариантам реализации стабильных жидких или водных композиций соединение халькогенида или соль халькогенида представляет собой сульфид и его концентрация находится в диапазоне от 95 мМ до 150 мМ.
Согласно конкретным вариантам реализации в тех случаях, когда указанный халькогенид соединение или соль халькогенида представляет собой сульфид, указанный сульфид присутствует в количествах, варьирующих от приблизительно 80% до приблизительно 100%, от приблизительно 90% до 100%, или от приблизительно 95% до 100% (масса/объем).
Согласно конкретным вариантам реализации указанная жидкость представляет собой гидроксид натрия.
Согласно определенным вариантам реализации значение рН указанной композиции находится в диапазоне от 6,5 до 8,5. Согласно одному варианту реализации содержание кислорода в указанной композиции составляет 5 мкМ или менее.
Согласно одному варианту реализации указанная композиция дополнительно содержит один или большее количество продуктов окисления, выбранных из полисульфида, сульфита, сульфата и тиосульфата. Указанные продукты окисления могут быть представлены сульфатом в количестве (0% – 1,0%), или сульфитом в количестве (0% – 1,0%), или полисульфидом в количестве (0% – 1%), или тиосульфатом в количестве (0% – 1,0%).
Период хранения может составлять приблизительно 3 месяца при температурах в диапазоне (23° – 27°) или 6 месяцев при температурах в диапазоне (23°– 27°). Согласно одному варианту реализации осмолярность указанной композиции находится в диапазоне 250–330 мОсм/л. Она может быть изотонической или почти изотонической.
Согласно определенным вариантам реализации композиция представляет собой стерильную стабильную водную фармацевтическую композицию, содержащую раствор деоксигенированной воды и нонагидрата сульфида натрия, при этом нонагидрат сульфида натрия дает Na2S, H2S и HS−, и концентрация H2S находится в диапазоне от 1,0 мг/мл до 4,0 мг/мл; при этом значение pH указанного раствора доводят до значений в диапазоне от 7,5 до 8,5 путем добавления к раствору HCl; при этом осмолярность указанного раствора находится в диапазоне 250–330 мОсм/л; при этом указанный раствор дополнительно содержит продукты окисления сульфидов, выбранные из группы, состоящей из полисульфида, сульфита, сульфата и тиосульфата; при этом указанные продукты окисления содержат сульфат в количестве (0% – 1,0%), сульфит в количестве (0% – 1,0%), полисульфид в количестве (0% – 1%) или тиосульфат в количестве (0% – 1,0%); при этом указанный раствор является изотоническим или почти изотоническим; и при этом указанный раствор стабилен в течение по меньшей мере четырех месяцев. Согласно конкретным вариантам реализации содержание кислорода в указанной композиции находится в диапазоне от 0 мкМ до 5 мкМ, от 0 мкМ до 3 мкМ, от 0,01 мкМ до 1 мкМ, или от 0,001 мкМ до 1 мкМ. Согласно определенным вариантам реализации указанная композиция дополнительно содержит соединение галогена, например, такое как йодид или бромид, например, йодид натрия. Такая композиция может также содержать глутатион или струмогенный агент или другой агент, который нарушает или ингибирует выработку, активность или поглощение гормонов щитовидной железы.
Согласно определенным вариантам реализации указанная композиция представляет собой стерильную стабильную фармацевтическую композицию, содержащую раствор деоксигенированной воды и Na2S, при этом указанный Na2S дает HS−, и значение pH указанного раствора находится в диапазоне от 7,8 до 8,2; при этом осмолярность указанного раствора находится в диапазоне 250–330 мОсм/л; при этом указанный раствор дополнительно содержит продукты окисления сульфидов, выбранные из группы, состоящей из полисульфида, сульфита, сульфата и тиосульфата; при этом указанные продукты окисления содержат сульфат в количестве (0% – 1,0%), сульфит в количестве (0% – 1,0%), полисульфид в количестве (0% – 1%) или тиосульфат в количестве (0% – 1,0%); при этом указанный раствор стабилен в течение по меньшей мере четырех месяцев; при этом указанный раствор является изотоническим или почти изотоническим. Согласно определенным вариантам реализации указанная композиция дополнительно содержит соединение галогена, такое как, например, йодид или бромид, например, йодид натрия. Такая композиция может также содержать глутатион (или другое соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы, или струмогенный агент).
Согласно определенным вариантам реализации указанная композиция представляет собой стерильную стабильную жидкую фармацевтическую композицию, полученную путем проведения следующих этапов в любой подходящей последовательности: получение раствора Na2S путем промывки кристаллов Na2S.9H2O деоксигенированной, дистиллированной и деионизированной водой; барботирование N2, смеси N2/CO2, или смеси N2/H2S через указанный раствор с получением Na2S, дающего HS−, и доведение значения pH указанного раствора до значений в диапазоне от 7,5 до 8,5 путем добавления в указанный раствор HCl; при этом осмолярность указанного раствора находится в диапазоне 250–330 мОсм/л; при этом указанный раствор дополнительно содержит продукты окисления сульфидов, выбранные из группы, состоящей из полисульфида, сульфита, сульфата и тиосульфата; при этом указанные продукты окисления содержат сульфат в количестве (0% – 1,0%), сульфит в количестве (0% – 1,0%), полисульфид в количестве (0% – 1%) или тиосульфат в количестве (0% – 1,0%); причем указанная композиция является изотонической или почти изотонической. Согласно определенным вариантам реализации указанная композиция дополнительно содержит соединение галогена, такое как, например, йодид или бромид, например, йодид натрия. Такая композиция может также содержать глутатион или струмогенный агент, или другой агент, который нарушает или ингибирует выработку, активность или поглощение гормонов щитовидной железы.
Согласно различным вариантам реализации описанных выше композиций, содержащих халькогенид, концентрация HS− находится в диапазоне от 1 мМ до 250 мМ, от 10 мМ до 200 мМ или от 95 мМ до 150 мМ. Согласно одному варианту реализации описанных выше композиций, содержащих халькогенид, концентрация HS− находится в диапазоне от 1 мМ до 250 мМ, от 10 мМ до 200 мМ или от 95 мМ до 150 мМ. Согласно одному варианту реализации описанных выше композиций, содержащих халькогенид, концентрация HS− находится в диапазоне от 1 мМ до 250 мМ, от 10 мМ до 200 мМ или от 95 мМ до 150 мМ.
Настоящее изобретение также включает наборы, содержащие композицию(и) согласно настоящему изобретению. Согласно определенным вариантам реализации такие наборы содержат один или большее количество контейнеров для хранения композиции(ий) согласно настоящему изобретению. Согласно одному варианту реализации композицию хранят в контейнере в атмосфере инертного или благородного газа, указанный контейнер герметично закрыт и заключен в непроницаемую для кислорода светозащитную оболочку (например, флакон из янтарного стекла). Согласно определенным вариантам реализации набор содержит композицию, содержащую соединение галогена, например, восстановленную форму йода, например, йодид, и композиция, содержащая активный агент, применяемый для лечения хронической сердечной недостаточности.
Согласно определенным вариантам реализации композиция упакована в непроницаемый контейнер. «Непроницаемый контейнер» относится к контейнерам, обеспечивающим барьер для прохождения молекул газа. Непроницаемые контейнеры известны специалистам в данной области техники и включают, не ограничиваясь перечисленными, «внутривенные пакеты» или шприцы, содержащие газонепроницаемый конструкционный материал, или герметично закрытый стеклянный сосуд. Согласно конкретным вариантам реализации указанная композиция может быть упакована в непроницаемый контейнер с инертной атмосферой, инертным газом или благородным газом. «Благородный газ» относится к гелию (He), неону (Ne), аргону (Ar), криптону (Kr), ксенону (Xe) и радону (Rn). «Инертный газ» относится к азоту (N2). Термин «инертная атмосфера» относится к атмосфере азота или аргона в контейнере. Согласно конкретным вариантам реализации указанный контейнер содержит среду с пониженным содержанием кислорода или бескислородную среду. «Среда с пониженным содержанием кислорода» представляет собой среду с концентрацией кислорода, составляющей менее чем 100 частей на миллион. Указанная композиция может быть упакована в светозащитный сосуд или контейнер, например, флаконы из янтарного стекла. Согласно одному варианту реализации указанную композицию герметично запечатывают и хранят в стеклянной ампуле.
Согласно некоторым вариантам реализации композиции согласно настоящему изобретению содержат одно или большее количество вспомогательных веществ, включаемых для предотвращения окисления соединения галогена и/или халькогенида при хранении в течение периода от одного до 12 месяцев или дольше. Согласно некоторым вариантам реализации хранение продолжается в течение периода от одного до шести месяцев. Согласно некоторым вариантам реализации хранение продолжается в течение периода от трех до шести месяцев. Согласно некоторым вариантам реализации хранение продолжается в течение периода от 4 до 5 месяцев. Во вариантах реализации настоящего изобретения может применяться одно вспомогательное вещество или комбинация вспомогательных веществ. Существует множество подходящих вспомогательных веществ. Примеры включают хелаторы, модифицирующие pH агенты, восстанавливающие агенты, антиоксиданты, спиновые ловушки и консерванты.
Согласно одному варианту реализации композиции согласно настоящему изобретению могут необязательно содержать хелаторы или хелатирующие агенты. Хелатирующие агенты, дающие растворимые комплексы с металлами, называют также комплексообразующими агентами. Хелатирующий агент, как правило, содержит по меньшей мере две функциональные группы в качестве доноров пары электронов для металла, например, —O, —NH2 или —COO−. Примеры встречающихся в природе хелаторов включают углеводы, в том числе полисахариды, органические кислоты, содержащие более одной координационной группы, липиды, стероиды, аминокислоты и родственные соединения, пептиды, фосфаты, нуклеотиды, тетрапирролы, ферриоксамины, ионофоры, такие как грамицидин, монензин, валиномицин и фенольные смолы. Примеры синтетических хелаторов включают, не ограничиваясь перечисленными, диэтилентриаминпентауксусную кислоту (DTPA), пентанатриевую соль диэтилентриаминпентауксусной кислоты (DTPA5), CaDTPAH, димеркапрол (BAL), дефероксамин, десферал, 2,2′-бипиридил-димеркаптопропанолэтилендиаминтетрауксусную кислоту, этилендиокси-диэтилен-динитрилотетрауксусную кислоту (ЭДТК), CaNa2-этилендиаминтетрауксусную кислоту, этиленгликоль-бис-(2-аминоэтил)-N,N,N′,N′-тетрауксусную кислоту (EGTA), ионофоры, нитрилотриуксусную кислоту (NTA), ортофенантролин, салициловую кислоту, сукцимер (мезо-2,3-димеркаптоянтарную кислоту (DMSA), триэтаноламин (TEA), тринатриевая соль N-(2-гидроксиэтил)этилендиамин-N,N′,N′-триуксусной кислоты (HEDTA), нитрилотриуксусную кислоту (NTA). Согласно одному варианту реализации указанный синтетический хелатор представляет собой DTPA. Согласно определенным вариантам реализации концентрация DTPA составляет приблизительно, по меньшей мере приблизительно или максимум приблизительно 0; 0,001; 0,01; 0,02; 0,03; 0,04; 0,05; 0,06; 0,07; 0,08; 0,09; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0 мМ или M или соответствует значениям в пределах любого основанного на указанных значениях диапазона. Согласно одному варианту реализации концентрация DTPA находится в диапазоне от 0,1 мМ до 50 мМ. Согласно одному варианту реализации указанный синтетический хелатор состоит из DTPA5. Согласно определенным вариантам реализации концентрация DTPA5 находится в диапазоне (0,0001% – 0,1%) (масса/объем). Согласно другому варианту реализации концентрация DTPA5 находится в диапазоне (0% – 1,0%) (масса/объем). Согласно одному варианту реализации концентрация DTPA5 находится в диапазоне (0% – 0,01%) (масса/объем). Согласно одному варианту реализации указанный синтетический хелатор представляет собой CaDTPA. Согласно определенным вариантам реализации концентрация CaDTPA находится в диапазоне (0,0001% – 0,1%) (масса/объем). Согласно одному варианту реализации концентрация CaDTPA находится в диапазоне (0% – 0,01%) (масса/объем). Согласно другому варианту реализации концентрация CaDTPA находится в диапазоне (0% – 1,0%) (масса/объем). Согласно одному варианту реализации указанный синтетический хелатор представляет собой дефероксамин. Согласно определенным вариантам реализации концентрация дефероксамина составляет приблизительно, по меньшей мере приблизительно или максимум приблизительно 0; 0,001; 0,01; 0,02; 0,03; 0,04; 0,05; 0,06; 0,07; 0,08; 0,09; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0 мМ или M, или соответствует значениям в пределах любого основанного на указанных значениях диапазона. Согласно одному варианту реализации указанный дефероксамин находится в диапазоне от 0,1 мМ до 10 мМ. Согласно одному варианту реализации указанный синтетический хелатор представляет собой ЭДТК. Согласно определенным вариантам реализации концентрация ЭДТК составляет приблизительно, по меньшей мере приблизительно или максимум приблизительно 0; 0,001; 0,01; 0,02; 0,03; 0,04; 0,05; 0,06; 0,07; 0,08; 0,09; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0 мМ или M, или соответствует значениям в пределах любого основанного на указанных значениях диапазона. Согласно определенному варианту реализации концентрация ЭДТК находится в диапазоне 0% – 1% (масса/объем). Согласно другому варианту реализации ЭДТК находится в диапазоне 0,0001% – 0,1% (масса/объем). Согласно другому варианту реализации концентрация ЭДТК находится в диапазоне 0% – 1,0% (масса/объем). Согласно одному варианту реализации концентрация ЭДТК находится в диапазоне 0% до 0,01% (масса/объем).
Композиции согласно настоящему изобретению могут также содержать один или большее количество модифицирующих pH агентов. Модифицирующие pH агенты включают, не ограничиваясь перечисленными, неорганические соли, такие как карбонат цинка, карбонат магния, карбонат кальция, гидроксид магния, вторичный кислый фосфат кальция, ацетат кальция, гидроксид кальция, лактат кальция, малеат кальция, олеат кальция, оксалат кальция, фосфат кальция, ацетат магния, вторичный кислый фосфат магния, фосфат магния, лактат магния, малеат магния, олеат магния, оксалат магния, хлорид натрия, карбонат натрия, бикарбонат натрия, гидроксид калия, фосфат калия, бикарбонат натрия, тиогликолевая кислота, цинка ацетат, вторичный кислый фосфат цинка, фосфат цинка, лактат цинка, малеат цинка, олеат цинка, оксалат цинка и их комбинации. Другие модифицирующие pH агенты включают, например, уксусную кислоту, фумаровую кислоту, яблочную кислоту, азотную кислоту, фосфорную кислоту, пропионовую кислоту, серную кислоту, винную кислоту, углекислый газ, угольную кислоту, N-метил-D-глюкамин, 4-(2-гидроксиэтил)-морфолин, трометамин, оротовую кислоту и соляную кислоту. Согласно одному варианту реализации указанный модифицирующий pH агент представляет собой гидроксид натрия.
Модифицирующий pH агент может служить в качестве буферного агента при добавлении в уже кислый или основной раствор, значение рН которого он модифицирует и затем поддерживает на новом уровне (см. Национальный фармакологический справочник США, 29 издание, (2006), Rockville, Md.; Stahl, P. Wermuth, C. ed. Handbook of Pharmaceutical Salts Properties, Selection and Use. Wiley (2002)).
Согласно определенным вариантам реализации композиции согласно настоящему изобретению включают одно или большее число вспомогательных веществ, представляющих собой восстанавливающие агенты, такие как, например, глутатион (см.: патент США № 6586404), трис(2-карбоксиэтил)-фосфин гидрохлорид (TSEP), I-цистеин, цистеин или метионин. Согласно одному варианту реализации указанный восстанавливающий агент представляет собой глутатион (см. Vincent et al., Endocrine Reviews (2004) 25:612-628), дитиотреитол (DTT) (Weir et al., Respir and Physiol Biol; (2002) 132:121-30) или дитиоэритрит (DTE). Согласно определенным вариантам реализации концентрация глутатиона составляет приблизительно, по меньшей мере приблизительно или максимум приблизительно 0; 0,001; 0,01; 0,02; 0,03; 0,04; 0,05; 0,06; 0,07; 0,08; 0,09; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0 мМ или M или большее количество или соответствует значениям в пределах любого основанного на указанных значениях диапазона. Согласно определенным вариантам реализации концентрация дитиотреитола (DTT) составляет приблизительно, по меньшей мере приблизительно или максимум приблизительно 0; 0,001; 0,01; 0,02; 0,03; 0,04; 0,05; 0,06; 0,07; 0,08; 0,09; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0 мМ или 1 M, или соответствует значениям в пределах любого основанного на указанных значениях диапазона. Согласно определенным вариантам реализации указанный восстанавливающий агент представляет собой дитиоэритрит (DTE), и его концентрация составляет приблизительно, по меньшей мере приблизительно или максимум приблизительно 0; 0,001; 0,01; 0,02; 0,03; 0,04; 0,05; 0,06; 0,07; 0,08; 0,09; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0 мМ или M, или соответствует значениям в пределах любого основанного на указанных значениях диапазона.
Композиций согласно настоящему изобретению могут необязательно содержать акцептор свободных радикалов или антиоксидант. Примеры акцепторов свободных радикалов или антиоксидантов включают, не ограничиваясь перечисленными, аскорбиновую кислоту (витамин C), D-альфа токоферол-ацетат, DL-альфа-токоферол (витамин E), мелатонин, бисульфит натрия, сульфит натрия, метабисульфит натрия, тролокс (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота), трис-(2-карбоксиэтил)-фосфин гидрохлорид (TCEP), мелатонин, дитионит, пиросульфит, цистеин, бисульфит калия, тиогликолят натрия, тиоэтиленгликоль, L-треоаскорбиновую кислоту, ацетилсалициловую кислоту, салициловую кислоту, лецитин, аскорбилпальмитат, бутилированный гидроксианидол, аскорбиновую кислоту, бутилированный гидроксианизол, бутилированный гидроксихинон, бутилгидроксианизол, гидроксикумарин, бутилированный гидрокситолуол, цефальм, этилгаллат, пропилгаллат, октилгаллат, лаурилгаллат, пропилгидроксибензоат, тригидроксибутилрофенон, диметилфенол, лецитин, этаноламин, меглумин и их комбинации (см. US 2005/0106214). Согласно одному варианту реализации указанный антиоксидант представляет собой агент – спиновую ловушку. Примеры спиновых ловушек включают, не ограничиваясь перечисленными, N-трет-бутил-фенилнитрон (PBN) (см. Kotake, Y., Antioxid Redox Signal (1999) 481), 4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксил (TEMPOL) (Gariboldi, M. B., et al. (2000), Free Radic. Biol. Med. 29:633; Miura, Y., et al. J. Radiat. Res. (Tokyo) (2000) 41:103; Mota-Filipe, H., et al. (1999), Shock 12:255R: 22-41; S: 39-26) 2,2,6,6-тетраметилпиперидин-N-оксил (TEMPO) (см. Lapchak, et al., Stroke (2001) 32:147-53); (динатрия-[(трет-бутилимино) метил]бензен-1,3-дисульфонат N-оксид (NXY-059) (см. Lapchak et al., CNS Drug Rev (2003) 9:253-62). Согласно некоторым вариантам реализации указанный агент – спиновая ловушка представляет собой TEMPO, который присутствует в диапазоне концентраций от 0 мг/кг до 1000 мг/кг. Согласно некоторым вариантам реализации указанный агент – спиновая ловушка представляет собой TEMPO и присутствует в диапазоне концентраций от 100 мг/кг до 1000 мг/кг. Согласно другому варианту реализации указанный агент – спиновая ловушка представляет собой TEMPO и присутствует в диапазоне концентраций от 0 мг/кг до 100 мг/кг.
Композиция согласно настоящему изобретению может необязательно содержать консервант. В настоящем документе термин «консервант» означает соединение, применяемое для предотвращения роста микроорганизмов. Такие соединения, например, включают без ограничения хлорид бензалкония, хлорид бензетония, бензойную кислоту, бензиловый спирт, бутилированный гидроксианизол (BHA), бромид цетримония, хлорид цетилпиридиния, хлорбутанол, хлоркрезол, крезол, метилпарабен натрия, фенол, феноксиэтанол, фенилэтиловый спирт, фенилмеркурацетат, фенилмеркурнитрат, фенилмеркурацетат, тимеросал, метакрезол, хлорид миристил-гамма-пиколиния, бензоат калия, сорбат калия, бензоат натрия, пропионат натрия, сорбиновая кислота, тиоглицерин, тимеросал, тимол, метил-, этил-, пропил- или бутилпарабены и другие соединения, известные специалистам в данной области техники. Такие консерванты используют в стабильных композициях в стандартных концентрациях в соответствии с приемлемой фармацевтической практикой, согласно описанию. (см.: Фармакопея США, Национальный формуляр, 29 издание, (2006) Rockville, Md.; Remington's Pharmaceutical Sciences (2005) 21st Edition, Troy, D B, Ed. Lippincott, Williams and Wilkins). Согласно определенному варианту реализации консервант представляет собой бензиловый спирт и присутствует в диапазоне концентраций от 0% до 1,0% (масса/объем). Согласно одному варианту реализации указанный консервант представляет собой бензиловый спирт и присутствует в диапазоне концентраций от 0% до 0,5% (масса/объем). Согласно одному варианту реализации указанный консервант представляет собой фенол в диапазоне концентраций от 0% – 0,5% (масса/объем). Согласно определенному варианту реализации консервант представляет собой метилпарабен в концентрации (0,0% – 0,25% (масса/объем). Согласно определенному варианту реализации консервант представляет собой этилпарабен в диапазоне концентраций от 0% – 0,25% (масса/объем). Согласно определенному варианту реализации консервант представляет собой пропилпарабен в диапазоне концентраций от 0% до 0,25% (масса/объем). Согласно определенному варианту реализации консервант представляет собой бутилпарабен в диапазоне концентраций от 0% до 0,4% (масса/объем). Согласно определенному варианту реализации консервант представляет собой бензалкония хлорид в диапазоне концентраций от 0% до 0,02% (масса/объем).
Согласно конкретным вариантам реализации любые из композиций согласно настоящему изобретению могут содержать как восстановленную форму соединения галогена, так и восстановленную форму халькогенида. Кроме того, композиция может содержать два или большее число соединений галогенов и/или два или большее число халькогенидов.
Настоящее изобретение также включает единичные дозированные формы композиций согласно настоящему изобретению. Согласно определенным вариантам реализации единичная дозированная форма содержит или состоит из эффективного количества соединения галогена для лечения или предотвращения заболевания, состояния или повреждения, в том числе любых из описанных в настоящем документе, у нуждающегося в этом субъекта. Согласно определенным вариантам реализации единичная дозированная форма содержит или состоит из эффективного количества халькогенида для лечения или предотвращения заболевания, состояния или повреждения, в том числе любых из описанных в настоящем документе, у нуждающегося в этом субъекта. Согласно определенным вариантам реализации единичная дозированная форма дополнительно содержит глутатион в количестве, эффективном для поддержания халькогенида и/или соединения галогена в восстановленной форме при любых условиях согласно описанию в настоящем документе. Согласно конкретным вариантам реализации единичная дозированная форма входит в состав для внутривенного введения, введения путем инфузии или перорального введения. Согласно определенным вариантам реализации в настоящем документе термин «предотвращение» включает ингибирование или сдерживание дебюта или прогрессирования заболевания или повреждения, или снижение степени нарушения или повреждения, вызванного заболевания или повреждения.
Согласно конкретным вариантам реализации единичная дозированная форма, содержащая соединение галогена, такое как йодид или NaI, содержит или состоит из приблизительно 0,005 мг – приблизительно 5000 мг, приблизительно 0,05 – приблизительно 1000 мг, приблизительно 0,5 мг – приблизительно 100 мг, приблизительно 1 мг – приблизительно 100 мг, приблизительно 2,5 мг – приблизительно 100 мг, приблизительно 0,5 мг – приблизительно 50 мг, приблизительно 1 мг – приблизительно 50 мг, приблизительно 2,5 мг – приблизительно 50 мг, приблизительно 5 мг – приблизительно 50 мг, приблизительно 10 мг – приблизительно 50 мг, или приблизительно 1 мг, приблизительно 2 мг, приблизительно 5 мг, приблизительно 10 мг или приблизительно 15 мг. Согласно родственным вариантам реализации единичная дозированная форма содержит 150 мг или менее, 125 мг или менее, 100 мг или менее, 75 мг или менее, 50 мг или менее, 25 мг или менее, или 10 мг или менее соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит от приблизительно 1 мг до приблизительно 150 мг (включая любой интервал в указанном диапазоне), от приблизительно 1 мг до приблизительно 125 мг, от приблизительно 1 мг до приблизительно 100 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 50 мг, от приблизительно 1 мг до приблизительно 25 мг или от приблизительно 1 мг до приблизительно 10 мг соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит приблизительно 150 мг, приблизительно 125 мг, приблизительно 100 мг, приблизительно 75 мг, приблизительно 50 мг, приблизительно 25 мг или приблизительно 10 мг соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит 1000 мг или менее, 800 мг или менее, 700 мг или менее, 500 мг или менее, 250 мг или менее, 200 мг или менее, или 150 мг или менее соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит от приблизительно 100 мг до приблизительно 1000 мг (включая любой интервал в указанном диапазоне), от приблизительно 150 мг до приблизительно 800 мг, от приблизительно 200 мг до приблизительно 700 мг, от приблизительно 250 мг до приблизительно 600 мг, от приблизительно 300 мг до приблизительно 500 мг, от приблизительно 350 мг до приблизительно 450 мг или от приблизительно 300 мг до приблизительно 700 мг соединения галогена. Согласно определенным вариантам реализации единичная дозированная форма содержит приблизительно 200 мг, приблизительно 300 мг, приблизительно 400 мг, приблизительно 500 мг, приблизительно 600 мг, приблизительно 700 мг, приблизительно 800 мг, приблизительно 900 мг или приблизительно 1000 мг соединения галогена.
Согласно некоторым вариантам реализации включая, например, варианты реализации, согласно которым единичная дозированная форма входит в жидкий состав, например, для внутривенного введения или введения путем инфузии, концентрация соединения галогена или его соли или предшественника, присутствующего в единичной дозированной форме согласно настоящему изобретению, составляет от приблизительно 0,0001 мМ до приблизительно 100 M, от приблизительно 0,0005 мМ до приблизительно 50 M, от приблизительно 0,001 мМ до приблизительно 10 M, от приблизительно 0,001 мМ до приблизительно 5 M, от приблизительно 0,001 мМ до приблизительно 1 M, от приблизительно 0,005 мМ до приблизительно 10 M, от приблизительно 0,005 мМ до приблизительно 5 M, от приблизительно 0,005 мМ до приблизительно 1 M приблизительно 0,005 мМ до приблизительно 0,5 M, от приблизительно 0,01 мМ до приблизительно 10 M, от приблизительно 0,01 мМ до приблизительно 5 M, от приблизительно 0,01 мМ до приблизительно 2 M, от приблизительно 0,1 мМ до приблизительно 1 M, от приблизительно 0,1 мМ до приблизительно 0,5 M, от приблизительно 0,5 мМ до приблизительно 5 M, от приблизительно 0,5 мМ до приблизительно 2 M, от приблизительно 0,5 мМ до приблизительно 1 M, от приблизительно 0,5 мМ до приблизительно 0,5 M, от приблизительно 1 мМ до приблизительно 5 M, от приблизительно 1 мМ до приблизительно 2 M, от приблизительно 1 мМ до приблизительно 1 M, от приблизительно 1 мМ до приблизительно 0,5 M, от приблизительно 5 мМ до приблизительно 5 M, от приблизительно 5 мМ до приблизительно 2 M приблизительно 5 мМ до приблизительно 1 M, от приблизительно 5 мМ до приблизительно 0,5 M, от приблизительно 5 мМ до приблизительно 0,25 M, от приблизительно 10 мМ до приблизительно 1 M, от приблизительно 10 мМ до приблизительно 0,5 M, от приблизительно 10 мМ до приблизительно 0,25 M, или приблизительно 10 мМ, приблизительно 50 мМ, приблизительно 100 мМ или приблизительно 200 мМ. Указанная единичная дозированная форма может также содержать один или большее количество фармацевтически приемлемых разбавителей, вспомогательных веществ или носителей.
Согласно определенному варианту реализации единичная дозированная форма содержит йод, например, NaI, и эффективное количество составляет от приблизительно 150 мкг или более, приблизительно 300 мкг или более, приблизительно 500 мкг или более, приблизительно 1 мг или более, приблизительно 2 мг или более, приблизительно 5 мг или более, приблизительно 10 мг или более, приблизительно 15 мг или более или приблизительно 20 мг или более. Согласно определенным вариантам реализации эффективное количество составляет от 150 мкг до 1000 мг, от 300 мкг до 1000 мг, от 500 мкг до 1000 мг, от 1 мг до 1000 мг, от 2 мг до 1000 мг, от 5 мг до 1000 мг, от 10 мг до 1000 мг, от 150 мкг до 100 мг, от 300 мкг до 100 мг, от 500 мкг до 100 мг, от 1 мг до 100 мг, от 2 мг до 100 мг, от 5 мг до 100 мг или от 10 мг до 100 мг. Согласно определенным вариантам реализации эффективное количество составляет от 150 мкг до 50 мг, от 300 мкг до 20 мг, от 500 мкг до 10 мг, от 1 мг до 20 мг, от 1 мг до 10 мг или приблизительно 5 мг, приблизительно 10 мг, приблизительно 15 мг или приблизительно 20 мг. Согласно другим вариантам реализации эффективное количество составляет от приблизительно 1 мг до приблизительно 150 мг (включая любой интервал в указанном диапазоне), от приблизительно 1 мг до приблизительно 125 мг, от приблизительно 1 мг до приблизительно 100 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 50 мг, от приблизительно 1 мг до приблизительно 25 мг или от приблизительно 1 мг до приблизительно 10 мг соединения галогена. Согласно определенным вариантам реализации эффективное количество составляет от приблизительно 150 мг, приблизительно 125 мг, приблизительно 100 мг, приблизительно 75 мг, приблизительно 50 мг, приблизительно 25 мг или приблизительно 10 мг соединения галогена. Согласно определенным вариантам реализации эффективное количество содержит 1000 мг или менее, 800 мг или менее, 700 мг или менее, 500 мг или менее, 250 мг или менее, 200 мг или менее, или 150 мг или менее соединения галогена. Согласно определенным вариантам реализации эффективное количество составляет от приблизительно 100 мг до приблизительно 1000 мг (включая любой интервал в указанном диапазоне), от приблизительно 150 мг до приблизительно 800 мг, от приблизительно 200 мг до приблизительно 700 мг, от приблизительно 250 мг до приблизительно 600 мг, от приблизительно 300 мг до приблизительно 500 мг, от приблизительно 350 мг до приблизительно 450 мг или от приблизительно 300 мг до приблизительно 700 мг соединения галогена. Согласно определенным вариантам реализации указанный эффективное количество составляет приблизительно 200 мг, приблизительно 300 мг, приблизительно 400 мг, приблизительно 500 мг, приблизительно 600 мг, приблизительно 700 мг, приблизительно 800 мг, приблизительно 900 мг или приблизительно 1000 мг соединения галогена. Согласно конкретным вариантам реализации эффективное количество соответствует количеству в день.
Согласно определенным вариантам реализации единичная дозированная форма содержит или состоит из эффективного количества халькогенида для лечения или предотвращения заболевания, состояния или повреждения, в том числе любых из описанных в настоящем документе, у нуждающегося в этом субъекта. Согласно конкретным вариантам реализации единичная дозированная форма халькогенида содержит от приблизительно 0,005 мг до приблизительно 5000 мг, от приблизительно 0,05 мг до приблизительно 5000 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 0,005 мг до приблизительно 2000 мг, от приблизительно 0,05 мг до приблизительно 2000 мг, от приблизительно 0,1 мг до приблизительно 2000 мг, от приблизительно 0,5 мг до приблизительно 2000 мг, от приблизительно 1 мг до приблизительно 1000 мг, от приблизительно 2 мг до приблизительно 500 мг, от приблизительно 5 мг до приблизительно 500 мг, от приблизительно 10 мг до приблизительно 100 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 100 мг или приблизительно 150 мг.
Согласно определенным вариантам реализации единичная дозированная форма содержит или состоит из эффективного количества соединения галогена и халькогенида, при этом указанное соединение галогена и халькогенида присутствует в единичной дозированной форме в количестве, подходящем для лечения или предотвращения заболевания, состояния или повреждения, в том числе любого из описанных в настоящем документе, у нуждающегося в этом субъекта. Следует понимать, что эффективное количество каждого соединения галогена и халькогенида может отличаться от количества при использовании в комбинации по сравнению с количеством при индивидуальном использовании.
Согласно определенным вариантам реализации единичная дозированная форма содержит или состоит из эффективного количества соединения галогена и активного агента, применяемого для лечения хронической сердечной недостаточности, при этом указанное соединение галогена и указанный активный агент присутствуют в единичной дозированной форме в количестве, подходящем для лечения или предотвращения заболевания, состояния или повреждения, такого как хроническая сердечная недостаточность, у нуждающегося в этом субъекта. Следует понимать, что эффективное количество каждого соединения галогена и халькогенида может отличаться от количества при использовании в комбинации по сравнению с количеством при индивидуальном использовании.
Согласно определенным вариантам реализации единичная дозированная форма содержит или состоит из эффективного количества композиции, содержащей и халькогенид, и глутатион, композиции, содержащей и соединение галогена, и глутатиона, или композиции, содержащей все соединения галогена, халькогенида и глутатиона, отличающийся тем, что указанное соединение галогена (в случае присутствия) и халькогенида (в случае присутствия) присутствуют в указанной композиции в количестве, подходящем для лечения или предотвращения заболевания, состояния или повреждения, в том числе любого из описанных в настоящем документе, у нуждающегося в этом субъекта. Глутатион может присутствовать в количестве, достаточном для ингибирования окисления халькогенида и/или соединения галогена. Следует понимать, что эффективное количество каждого соединения галогена и халькогенида может отличаться от количества при использовании в комбинации по сравнению с количеством при индивидуальном использовании. Согласно определенным вариантам реализации указанная композиция содержит от приблизительно 15 мМ до приблизительно 500 мМ глутатиона или от приблизительно 10 мМ до приблизительно 500 мМ глутатиона.
Согласно определенным вариантам реализации композиция согласно настоящему изобретению могут входить в состав дозированной формы, подходящей для перорального или парентерального введения. Кроме того, согласно конкретным вариантам реализации композиция согласно настоящему изобретению может быть представлена в форме состава для немедленного или модифицированного высвобождения. Например, составы с соединениями галогена и/или халькогенида могут применяться для обеспечения контролируемого высвобождения, при котором высвобождение соединения(ий) контролируется и регулируется для обеспечения меньшей частоты дозирования или для улучшения фармакокинетического профиля или профиля токсичности определенного активного агента.
В целом, количество активного соединения, присутствующего в композиции или единичной дозированной форме, зависит в том числе от конкретного соединения и состава, возраста и состояния субъекта, и повреждения, состояния или заболевания, лечение или предотвращение которого проводят, способа введения и частоты дозирования.
Частота дозирования также зависит от повреждения, состояния или заболевания, лечение или предотвращение которого проводят, количества или концентрации указанного соединения, конкретной используемой композиции, способа введения и могут включать специфические для конкретного субъекта вариации, в том числе, но не ограничиваясь перечисленными, в зависимости от возраста, массы тела, пола или общего состояния здоровья. Например, композиция для перорального применения может вводиться до хирургического вмешательства для предотвращения ишемического/реперфузионного повреждения во время или после хирургического вмешательства; в этом случае она может вводиться один или большее количество раз до хирургического вмешательства, необязательно в форме состава для немедленного, модифицированного или контролируемого высвобождения. В других ситуациях, например, композиция для перорального или внутривенного применения может вводиться после повреждения или возникновения медицинского состояния (например, инсульта или сердечного приступа); в таком случае целесообразным может быть применение состава для немедленного высвобождения для достижения относительно быстрого эффекта лечения или предотвращения ишемического/реперфузионного повреждения на участке повреждения или медицинского состояния.
Согласно определенным вариантам реализации единичная дозированная форма, подходящая для перорального введения, представлена в форме пилюли, жидкой лекарственной формы для перорального введения (водные или неводные растворы или суспензии), болюсов, порошков, гранул, полимерных составов для контролируемого высвобождения, пасты для нанесения на язык, таблетки, каплета или капсулы. Пилюля представляет собой небольшую округлую твердую фармацевтическую лекарственную форму для перорального применения, которую применяли до появления таблеток и капсул. В разговорной лексике таблетки, капсулы и каплеты до сих пор часто называют общим термином «пилюли». Согласно определенным вариантам реализации пилюли получают путем смешивания активных ингредиентов со вспомогательным веществом, таким как глюкозный сироп, при помощи ступки и пестика с получением пасты, затем разделяют на части подходящего размера и часто покрывают сахаром для придания более приятного вкуса.
Таблетка представляет собой фармацевтическую дозированную форму, которая содержит смесь активных веществ и вспомогательных веществ, обычно в виде порошка, спрессованного или уплотненного с получением из порошка твердой единицы дозы. Указанные вспомогательные вещества могут включать разбавители, связывающие или гранулирующие агенты, скользящие вещества (агенты для повышения текучести) и смазывающие вещества для обеспечения эффективного таблетирования; разрыхлители для содействия распаду таблетки в желудочно-кишечном тракте; подсластители или вкусоароматические вещества для усиления вкуса; пигменты для придания таблеткам визуальной привлекательности и т.п. Полимерное покрытие часто наносят для придания таблетке гладкости и повышения легкости проглатывания, для контроля скорости высвобождения активного ингредиента или для придания больше стабильности. Размер таблеток для проглатывания, как правило, варьирует от нескольких миллиметров до приблизительно сантиметра. Некоторые таблетки имеют форму капсул и называются «каплетами».
Капсулы могут быть представлены в форме капсул с твердой оболочкой, обычно используемых для сухих порошковых ингредиентов, или минигранул, или капсул с мягкой оболочкой, в основном используемых для масел и активных ингредиентов, растворенных или суспендированных в масле. Согласно определенным вариантам реализации капсулы получают на основе водных растворов гелеобразующих агентов, таких как желатин или растительные полисахариды. В раствор гелеобразующего агента могут быть добавлены другие ингредиенты, такие как пластификаторы, например, глицерин и/или сорбит для уменьшения твердости капсулы, подкрашивающие агенты, консерванты, разрыхлители, смазывающие вещества, вещества для обработки поверхности.
Уровни доз соединения галогена и/или халькогенида, присутствующего в композиции согласно описанию в настоящем документе, могут варьировать для получения количества соединения галогена и/или халькогенида, эффективного для достижения требуемого терапевтического эффекта у конкретного субъекта, соединения галогена, халькогенида и способа введения, в отсутствие токсичности для указанного субъекта.
Согласно определенным вариантам реализации единичная дозированная форма композиции согласно настоящему изобретению входит в состав для пероральной доставки, например, пилюля, таблетка, каплет или капсула, содержит или состоит из приблизительно 0,005 – приблизительно 5000 мг, приблизительно 0,05 – приблизительно 1000 мг, приблизительно 0,5 – приблизительно 500 мг, приблизительно 0,5 – приблизительно 250 мг, приблизительно 0,5 мг – приблизительно 100 мг, приблизительно 1 мг – приблизительно 500 мг, приблизительно 1 – приблизительно 250 мг, приблизительно 1 мг до приблизительно 125 мг, приблизительно 1 мг до приблизительно 120 мг, приблизительно 1 до приблизительно 100 мг, приблизительно 2,5 мг – приблизительно 250 мг, приблизительно 2,5 – приблизительно 100 мг, приблизительно 0,5 мг – приблизительно 50 мг, приблизительно 1 мг – приблизительно 50 мг, приблизительно 2,5 мг – приблизительно 50 мг, приблизительно 5 мг – приблизительно 50 мг, приблизительно 10 мг – приблизительно 50 мг, приблизительно 1 – приблизительно 15 мг, приблизительно 1 – приблизительно 10 мг или приблизительно 1 мг, приблизительно 2 мг, приблизительно 5 мг, приблизительно 10 мг, или приблизительно 15 мг соединения галогена, такого как йодид или NaI. Единичная дозированная форма может также содержать фармацевтически приемлемый носитель, вспомогательное вещество или разбавитель.
Согласно конкретным вариантам реализации единичная дозированная форма композиции согласно настоящему изобретению, входящая в состав для пероральной доставки, например, пилюля, таблетка, каплет, или капсула, содержит или состоит из менее чем 150 мг, менее чем 140 мг, менее чем 130 мг, менее чем 120 мг, менее чем 110 мг, менее чем 100 мг, менее чем 90 мг, менее чем 80 мг, менее чем 70 мг, менее чем 60 мг, менее чем 50 мг, менее чем 40 мг, менее чем 30 мг, менее чем 20 мг, менее чем 10 мг, или менее чем 5 мг соединения галогена, такого как йодид или NaI. Единичная дозированная форма может также содержать фармацевтически приемлемый носитель, вспомогательное вещество или разбавитель.
Согласно определенным вариантам реализации единичная дозированная форма может содержать халькогенид, отдельно или в комбинации с другим активным агентом, таким как соединение галогена. Согласно конкретным вариантами реализации халькогенид, например, сульфид или селенид, присутствует в единичной дозированной форме в количестве. составляющем от приблизительно 0,005 мг до приблизительно 5000 мг, от приблизительно 0,05 мг до приблизительно 5000 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, приблизительно 0,005 мг до от приблизительно 2000 мг, приблизительно 0,05 мг до приблизительно 2000 мг, от приблизительно 0,1 мг до приблизительно 2000 мг, приблизительно 0,5 мг до от приблизительно 2000 мг, приблизительно 1 мг до приблизительно 1000 мг, от приблизительно 2 мг до приблизительно 500 мг, приблизительно 5 мг до приблизительно 500 мг, от приблизительно 10 мг до приблизительно 100 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 100 мг или приблизительно 150 мг.
Согласно конкретным вариантам реализации подходящих для перорального введения единичных дозированных форм указанная единичная дозированная форма содержит и соединение галогена, и халькогенид. Согласно определенным вариантам реализации и соединение галогена, и халькогенид, например, сульфид или селенид, находятся в восстановленной форме. Согласно одному варианту реализации единичная дозированная форма содержит твердый внешний слой, содержащий соединение галогена, например, йод, окружающий или инкапсулирующий внутреннюю часть, содержащую жидкий раствор с халькогенидом. Согласно конкретным вариантам реализации единичная дозированная форма содержит твердый внешний слой, инкапсулирующий внутреннюю жидкую часть, содержащую соединение галогена и халькогенид. Согласно определенным вариантам реализации указанный инкапсулированный халькогенид защищен от окисления указанным твердым внешним слоем. Согласно определенным вариантам реализации указанные активные агенты смешаны на молекулярном уровне.
Согласно конкретным вариантам реализации единичных дозированных форм, подходящих для перорального введения, единичная дозированная форма содержит и глутатион, и халькогенид. Согласно определенным вариантам реализации указанный халькогенид, например, сульфид или селенид, находится в восстановленной форме. Согласно определенным вариантам реализации единичная дозированная форма дополнительно содержит соединение галогена. Согласно определенным вариантам реализации указанный агентов смешаны на молекулярном уровне.
Согласно конкретным вариантам реализации единичных дозированных форм, подходящих для перорального введения, единичная дозированная форма содержит и глутатион, и соединение галогена. Согласно определенным вариантам реализации указанное соединение галогена, например, йод, находится в восстановленной форме, например, в виде йодида или йодата. Согласно определенным вариантам реализации единичная дозированная форма дополнительно содержит соединение халькогенида. Согласно определенным вариантам реализации указанные агенты смешаны на молекулярном уровне.
Согласно различным вариантам реализации композиции и единичные дозированные формы согласно настоящему изобретению могут быть получены в виде любого другой формы, подходящей для требуемого способа введения. Как правило, составы включают все физиологически приемлемые композиции. Такие составы могут включать соединение галогена, отдельно или в комбинации с другим активным агентом, таким как халькогенид, в комбинации с любым физиологически приемлемым носителей, разбавителем или вспомогательным веществом. Такие составы могут включать халькогенид, отдельно или в комбинации с другим активным агентом, таким как соединение галогена, в комбинации с любым физиологически приемлемым носителем, разбавителем или вспомогательным веществом. Соединения галогенов и/или халькогенидов могут входить в состав для введения с любой биологически приемлемой средой, в том числе, но не ограничиваясь перечисленными, с водой, забуференным солевым раствором, полиолов или их смесями. «Биологически приемлемая среда» включает все растворители, дисперсионные среды и т.п., которые могут подходить для требуемого способа введения указанной фармацевтической композиции. Подходящие биологически приемлемые среды и их составы описаны, например, в последнем выпуске руководства «Remington's Pharmaceutical Sciences» (Remington's Pharmaceutical Sciences. Mack Publishing Company, Easton, Pa., USA 1985).
Составы и содержащие их единичные дозированные формы могут содержать подходящие физиологически приемлемые носители, содержащие вспомогательные вещества, облегчающие введение соединения галогена и/или другого активного агента в составы, подходящие для фармацевтического применения. Составы и содержащие их единичные дозированные формы могут также включают агенты, увеличивающие или иным образом влияющие на биодоступность соединения галогена и/или другого активного агента. В настоящем документе «биодоступность» относится к эффекту, доступности и стабильности активного(ых) агента(ов) после введения субъекту.
Фармацевтически приемлемый носители могут представлять собой фармацевтически приемлемый материал, композицию или основу, в том числе, но не ограничиваясь перечисленными, жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или инкапсулирующий материал, вовлеченный в перенос или транспорт нужных агонистов в орган или часть организма. Каждый носитель должен быть совместим с другими ингредиентами указанного состава и не вредить указанному субъекту. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают, не ограничиваясь перечисленными, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; трагакант; солод; желатин; тальк; масло какао, воски, растительные и животные жиры, парафины, силиконы, бентониты, кремниевую кислоту, оксид цинка; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар-агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт; растворы фосфатного буфера; и любые другие совместимые вещества, используемые в фармацевтических составах.
Составы могут также включать смачивающие агенты; эмульгаторы и смазывающие вещества, такие как лаурил сульфат натрия и стеарат магния; подкрашивающие агенты; модифицирующие высвобождение агенты; агенты для покрытия; подслащивающие, вкусоароматические и/или отдушивающие агенты; консерванты; и антиоксиданты. Составы могут также включать буферные агенты и/или соли, способствующие абсорбции или стабилизирующие соединение галогена и/или халькогенид. Другие добавки, такие как хелатирующие агенты, ингибиторы ферментов и т.п., которые способствуют биологической активности указанной фармацевтической композиции, могут также быть включены в указанный состав.
Указанные составы могут входить в единичную дозированную форму и могут быть получены любыми известными в данной области техники способами. Количество соединения галогена, которые может быть скомбинировано с носителем с получением единичной дозированной формы, обычно соответствует количеству соединения галогена, обеспечивающему терапевтический эффект.
Составы, подходящие для перорального введения, могут быть представлены в твердой форме (капсулы, саше, пилюли, таблетки, таблетки для рассасывания, порошки, драже, гранулы); или в виде раствора или суспензии в водной или неводной жидкости; или в виде жидкой эмульсии типа «масло в воде» или «вода в масле»; или в виде эликсира или сиропа; или в виде пастилок (с применением инертной основы, такой как желатин и глицерин, или сахароза и камедь); и/или в виде ополаскивателей или растворов для орошения полости рта и т.п.; или в виде болюса, электуария или пасты.
Твердые составы могут содержать фармацевтически приемлемые носители и наполнители, включая, но не ограничиваясь перечисленными, цитрат натрия или дикальций фосфат; крахмалы; лактозу; сахарозу; глюкозу; маннит; и/или кремниевую кислоту. Твердые составы могут включать дополнительные компоненты, включая, но не ограничиваясь перечисленными, связующие вещества, такие как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахарозу и/или камедь; увлажнители, такие как глицерин; разрыхляющие агенты, такие как агар-агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия; замедляющие растворение агенты, такие как парафин; ускорители абсорбции, такие как соединения четвертичного аммония; смачивающие агенты, такие как цетиловый спирт и глицерилмоностеарат; абсорбенты, такие как каолин и бентонитовая глина; смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурил сульфат натрия и их смеси; и подкрашивающие агенты. Указанный состав может также включать буферные агенты, в частности, в тех случаях, когда соединение галогена и/или халькогенид представлен в форме капсулы, таблетки или пилюли.
Твердые составы могут также включать наполнители для мягких и твердых желатиновых капсул со вспомогательными веществами, такими как лактоза или молочные сахара, а также высокомолекулярные полиэтиленгликоли и т.п.
На твердые составы с композициями согласно описанию в настоящем документе, такие как драже, капсулы, пилюли и гранулы, могут необязательно наноситься риски, или они могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные и другие покрытия. Твердые дозированные формы могут также быть представлены формами, обеспечивающими медленное или контролируемое высвобождение агента(агентов). Соответственно, твердые составы могут включать любой материал, способный обеспечивать требуемый профиль высвобождения активного(ых) агента(ов), в том числе, но не ограничиваясь перечисленными, варьирующие количества гидроксипропилметилцеллюлозы или другие полимерные матрицы, липосомы и/или микросферы. В составы может также вводиться заливочный агент. Примеры подходящих для применения заливочных агентов включают, не ограничиваясь перечисленными, полимерные вещества и воски. Соединение галогена и/или халькогенида может также быть представлено микрокапсулированной формой, с включением, при необходимости, одного или большего числа описанных выше вспомогательных веществ.
Жидкие дозированные формы для перорального введения соединения галогена и/или халькогенида могут включать фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо соединения галогена и/или халькогенида жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в данной области техники, в том числе, но не ограничиваясь перечисленными, воду или другие растворители; солюбилизирующие агентов и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль; масла (в частности, хлопковое, арахисовое, кукурузное, масло зародышей пшеницы, оливковое, касторовое и кунжутное масла); глицерин; тетрагидрофуриловый спирт; полиэтиленгликоли; сложные эфиры сорбитана и жирных кислот, и их смеси.
Настоящее изобретение также включает стабильные жидкие фармацевтические композиции в составах для парентерального введения, например, внутривенного введения или введения путем инфузии. Согласно определенным вариантам реализации указанные стабильные жидкие фармацевтические композиции содержат восстановленную форму халькогенида и/или восстановленную форму соединения галогена. Согласно конкретным вариантам реализации указанная композиция дополнительно содержит глутатион. Согласно другим вариантам реализации стабильные жидкие фармацевтические композиции в составах для парентерального введения содержат струмогенный агент или соединение, которое ингибирует или нарушает синтез, активность или поглощение гормона щитовидной железы. Согласно конкретным вариантам реализации стабильные жидкие фармацевтические композиции в составах для парентерального введения содержат халькогенид, например, селенид, и глутатион. Согласно конкретным вариантам реализации стабильные жидкие фармацевтические композиции в составах для парентерального введения содержат соединение галогена, например, йодид, и глутатион. Согласно конкретным вариантам реализации стабильные жидкие фармацевтические композиции в составах для парентерального введения содержат селенид, йодид и глутатион. Селенид, йодид и глутатион могут присутствовать в концентрации согласно описанию в настоящем документе, или в количестве, достаточном или подходящем для доставки субъекту количества согласно описанию в настоящем документе. Концентрация каждого активного агента в указанной композиции может легко быть определена на основании нужного количества каждого активного агента, который требуется ввести нуждающемуся в этом субъекту.
Согласно конкретным вариантам реализации композиция согласно настоящему изобретению включает халькогенид, соединение галогена и глутатион. Согласно определенным вариантам реализации указанный халькогенид представляет собой сульфид или селенид (или его восстановленную форму), а указанное соединение галогена представляет собой йодид или йодат. Согласно конкретным вариантам реализации указанный халькогенид представляет собой селенид. Согласно конкретным вариантам реализации указанное соединение галогена представляет собой йодид. Соответственно, согласно одному варианту реализации композиция согласно настоящему изобретению содержит селенид, йодид и глутатион. Указанная композиция может представлять собой состав для внутривенного введения или введения путем инфузии. Указанная композиция может представлять собой стабильную композицию для внутривенного введения или введения путем инфузии. Согласно конкретным вариантам реализации указанная композиция содержит селенид в концентрации, составляющей от приблизительно 1 мМ до приблизительно 1 M или от приблизительно 10 мМ до приблизительно 500 мМ, йодид в концентрации, составляющей от приблизительно 1 мМ до приблизительно 1M или от приблизительно 10 мМ до приблизительно 500 мМ, и глутатион в концентрации, составляющей от приблизительно 1 мМ до приблизительно 500 мМ или от приблизительно 10 мМ до приблизительно 500 мМ. Согласно конкретным вариантам реализации указанная композиция помещена в непроницаемый для кислорода контейнер, и может находиться в атмосфере газообразного азота или аргона. Согласно конкретным вариантам реализации помещенное в контейнер количество композиции представляет собой соответствующее единице дозы количество, содержащее или представляющее собой подходящую дозу для введения нуждающемуся в этом субъекту.
Составы с соединениями галогенов и/или халькогенидами для парентерального введения могут содержать соединение галогена и/или халькогенида в комбинации с одним или большим числом фармацевтически приемлемых изотонических водных или неводных растворов, дисперсий, суспензий или эмульсий, или порошков, которые могут быть восстановлены с получением стерильных растворов или дисперсий для инъекций непосредственно перед применением. Составы для парентерального введения могут содержать антиоксиданты; буферы или растворяемые вещества, обеспечивающие раствору изотоничность относительно крови получающего указанный раствор субъекта; бактериостатические средства; суспендирующие или загущающие агенты.
Инъецируемые депо-составы, содержащие соединение галогена и/или халькогенид, могут быть получены путем формирования микроинкапсулированных матриц с соединениями галогенов и/или халькогенидов в биоразлагаемых полимерах. Примеры биоразлагаемых полимеров включают, не ограничиваясь перечисленными полилактид-полигликолид, сложные поли(ортоэфиры) и поли(ангидриды). Соотношение активного агента и полимера, и природа конкретного используемого полимера могут оказывать влияние на высвобождение активного агента. Инъецируемые депо-составы могут также быть получены путем включения лекарственного средства в липосомы или микроэмульсии.
Настоящее изобретение также включает наборы, содержащие композиции или единичные дозированные формы согласно настоящему изобретению. Согласно определенным вариантам реализации такие наборы содержат один или большее количество контейнеров для хранения композиций согласно настоящему изобретению. Согласно одному варианту реализации указанную композицию хранят в контейнере в атмосфере инертного или благородного газа, и указанный контейнер герметично закрыт и заключен в непроницаемую для кислорода светозащитную оболочку (например, флакон из янтарного стекла).
Согласно конкретным вариантам реализации композиция согласно настоящему изобретению содержит носитель. Согласно определенным вариантам реализации указанное соединение галогена связано с указанным носителем, и согласно другим вариантам реализации и соединение галогена, и один или большее количество дополнительных активных агентов, присутствующих в указанной композиции, также связаны с указанным носителем. Указанное соединение галогена и один или большее количество дополнительных активных агентов могут быть связаны ковалентным или нековалентным образом. Согласно определенным вариантам реализации указанный носитель представляет собой биологически совместимый носитель, который может быть, например, биоразлагаемым или инертным. Согласно определенным вариантам реализации указанный носитель представляет собой полипептид, такой как, например, альбумин, например, альбумин человека. Примеры других носителей, которые могут применяться в соответствии с настоящим изобретением, включают, не ограничиваясь перечисленными, плазму, сыворотку, альфа-2-макроглобулин и иммуноглобулин.
Способы получения композиций
Композиции, содержащие соединения галогенов, в том числе восстановленные формы соединений галогенов, такие как йодид и бромид, могут быть получены любым известным доступным способом. Согласно определенным вариантам реализации соединение галогена растворяют в воде или подходящем буфере, таком как буфер с NaCl.
Некоторые халькогенидные соединения (например, сульфид водорода, селенид водорода) нестабильны в присутствии кислорода, что обусловлено их способностью вступать в химические реакции с кислородом, приводящие к их окислению и химическому преобразованию. Соответственно, кислород может быть удален из растворов, используемых в указанных способах, с применением способов, известных в данной области техники, включая, но не ограничиваясь перечисленными, применение отрицательного давления (вакуумная дегазация раствора) или приведение раствора в контакт с реагентом, обеспечивающим связывание или «хелатирование» кислорода, что эффективно удаляет его из раствора. В целом, способы получения композиций для применения в соответствии с настоящим изобретением могут включать ограничение содержания кислорода на любом этапе получения и хранения.
В WO2008/043081 описаны способы получения стабильных жидких композиций, содержащих халькогениды или их соли, в том числе содержащих восстановленные формы халькогенидов.
В предварительной заявке на патент США № 61/159311 также описаны способы получения композиции, содержащей восстановленную форму халькогенида, например, халькогенида, содержащего селен или серу с валентностью -2, например, селенид или сульфид.
Согласно конкретным вариантам реализации любого из способов получения стабильной композиции согласно описанию в настоящем документе степень окисления или валентность восстановленной формы халькогенида равна -2. Согласно определенным вариантам реализации указанный восстановленная форма халькогенида представляет собой анион H2Se, Na2Se, NaHSe или HSe-.
Согласно одному варианту реализации композицию, содержащую восстановленную форму халькогенида, получают следующим образом: смешивают халькоген или кислоту халькогена с восстанавливающим агентом в среде с пониженным содержанием кислорода, в условиях и на протяжении периода времени, достаточных для обеспечения окисления большей части восстанавливающего агента и восстановления большей части халькогена. Согласно определенным вариантам реализации указанные условия включают температуру, приблизительно соответствующую комнатной температуре. Согласно конкретным вариантам реализации указанный период времени составляет приблизительно один час, приблизительно два часа, приблизительно три часа, или продолжается в течение ночи, например, составляет приблизительно 12 часов. Согласно конкретным вариантам реализации указанный период времени заканчивается или истекает тогда, когда раствор указанной смеси становится визуально прозрачным, или когда уменьшается либо прекращается барботирование (обусловленное образованием водорода из бороводорода при реакции с водой).
Согласно конкретным вариантам реализации указанный халькоген представляет собой серу или селен, и восстановленная форма халькогенида содержит серу или селен со степенью окисления -2. Согласно определенным вариантам реализации указанная кислота халькогена представляет собой селенистую кислоту или селенит натрия, или элементный селен, и восстановленная форма халькогенида содержит серу или селен со степенью окисления -2.
Согласно конкретным вариантам реализации указанный восстанавливающий агент имеет восстановительный потенциал (Eo), составляющий приблизительно 0,4 В или менее. Согласно одному варианту реализации указанный восстанавливающий агент представляет собой боргидрид натрия (NaBH4). Согласно определенным вариантам реализации молярное отношение восстанавливающего агента и халькогена, или кислоты халькогена, составляет от приблизительно 5:1 до приблизительно 0,5:1, или от приблизительно 3:1 до приблизительно 1:1. Согласно одному варианту реализации молярное отношение восстанавливающего агента и халькогена, или кислоты халькогена, составляет приблизительно 2:1.
Согласно конкретным вариантам реализации указанный восстанавливающий агент представляет собой боргидрид натрия, указанный халькоген представляет собой сера или селен, и указанный кислота халькогена представляет собой селенистую кислоту. Согласно одному конкретному варианту реализации восстанавливающий агент представляет собой боргидрид натрия, халькоген представляет собой селен, и молярное отношение боргидрида натрия и селена составляет приблизительно 2:1. Согласно конкретным вариантам реализации селен присутствует в количестве от приблизительно 1 мМ до приблизительно 10 M, или от приблизительно 1 мМ до 1M (от 79 мг/л до 79 г/л). Согласно конкретным вариантам реализации боргидрид натрия представлен в виде 1M раствора в воде.
Согласно определенному варианту реализации указанный способ реализуют в условиях пониженного содержания кислорода или в бескислородной среде. Согласно определенным вариантам реализации указанный способ реализуют в атмосфере инертного или благородного газа. Согласно определенным вариантам реализации указанный способ реализуют в атмосфере азота. Например, через указанную среду с пониженным содержанием кислорода может пропускаться азот. Согласно определенным вариантам реализации азот пропускают со скоростью приблизительно 100 см3/мин. Согласно конкретным вариантам реализации среда с пониженным содержанием кислорода представляет собой контейнер с бескислородной средой. Согласно конкретным вариантам реализации указанный контейнер представляет собой шприц, внутривенный пакет, пробирку или сосуд. Согласно определенным вариантам реализации указанный контейнер содержит закрываемый входной порт или герметизируемый порт. Согласно одному варианту реализации указанный контейнер представляет собой герметизируемую пробирку с резиновой пробкой, например, пробирку Хангейта.
Согласно конкретным вариантам реализации указанного способа пропускание азота через указанный контейнер, например, пробирку, реализуют с применением двух игл, проходящих через пробку указанного контейнера, при этом одну из двух игл используют в качестве порта для входа азота в пробирку, а вторую иглу используют для выхода азота из пробирки.
Согласно конкретным вариантам реализации указанный способ дополнительно включает нагревание смеси через указанный период времени. Согласно конкретным вариантам реализации указанное нагревание продолжают до тех пор, пока не прекращается какое-либо наблюдаемое барботирование. Указанные способы могут также включать охлаждение смеси после нагревания. Охлаждение может быть осуществлено, например, путем помещения смеси на лед. Согласно определенным вариантам реализации охлаждение продолжают до тех пор, пока из раствора смеси не выпадет осадок бората.
Указанные способы могут также дополнительно включать центрифугирование раствора смеси для отделения супернатанта от осажденного бората натрия и удаления указанного супернатанта, при этом указанный супернатант содержит стабильную композицию, содержащую указанный восстановленный халькогенид.
Согласно конкретным вариантам реализации указанные способы включают подкисление смеси кислотой, при этом указанная кислота восстанавливается и не является летучей, и барботирование раствора газообразным селенидом водорода или сульфидом водорода, при этом значение pH указанного раствора составляет более 3,9. Без связи с конкретной теорией считается, что при добавлении нелетучей кислоты (например, фосфорной кислоты) к раствору восстановленного халькогенида, который может содержать нежелательные нелетучие соединения, pH понижается до значения менее чем pK халькогенида, с получением таким образом газа (например, H2S или H2Se). Газообразную форму можно извлечь из раствора путем пропускания азота через смесь и переноса во второй раствор со значением pH, превышающим значение pK, что обеспечивает переход халькогенида в ионную форму, уже не являющуюся газом (т.е. захват халькогенида).
Согласно определенному варианту реализации указанная кислота представляет собой фосфористую кислоту и указанный раствор забуферивают фосфатно-солевым раствором (ФСБ). Это позволяет захватить газообразный селенид водорода или сульфид водорода в емкости.
Согласно другим вариантам реализации настоящим изобретением охвачен другой способ получения композиции, содержащей восстановленную форму халькогенида, включающий смешивание элементного селена (Se) или серы (S) и гидрида натрия в растворе, содержащем минеральное масло или тетрагидрофуран (ТГФ), с получением таким образом стабильной композиции, содержащей гидроселенид натрия или сульфид натрия. Согласно определенным вариантам реализации указанный способ также включает добавление воды в раствор смеси, с удалением таким образом гидрида натрия. Согласно конкретным вариантам реализации, если указанный раствор содержит минеральное масло, указанный способ дополнительно включает извлечение из раствора смеси водной фазы, причем в указанной водный фазе присутствует восстановленный халькогенид. Согласно конкретным вариантам реализации в том случае, если раствор содержит ТГФ, указанный способ дополнительно включает удаление указанного ТГФ кипячением указанного раствора смеси при температуре, составляющей приблизительно 70° C.
Согласно различным вариантам реализации способы получения композиций согласно настоящему изобретению дополнительно включают коррекцию значения pH указанной композиции. Согласно определенным вариантам реализации значение pH корректируют путем добавления чего-либо одного или более из хлорида водорода, диоксида углерода, азота или сульфида водорода. Согласно другому варианту реализации значение pH корректируют путем растворения в указанной композиции азота, диоксида углерода, селенида водорода или сульфида водорода или любой их комбинации.
Согласно определенным вариантам реализации после получения согласно различным вариантам реализации композицию хранят в непроницаемом контейнере, например, непроницаемом для кислорода контейнере. В частности, это целесообразно для предотвращения окисления указанной восстановленной формы соединения галогена или халькогенида. Непроницаемые контейнеры известны специалистам в данной области техники и включают, не ограничиваясь перечисленными, «внутривенные пакеты», содержащие газонепроницаемый конструкционный материал, или герметично закрытый стеклянный сосуд. Согласно конкретным вариантам реализации указанный непроницаемый контейнер содержит непроницаемый для кислорода материал с коэффициентом пропускания кислорода, составляющим менее 10-10 [см3(STP)/см/(см2+с+Па)], где STP = стандартные температура и давление (25 °C и давление = 1 атм.); Па = паскали, и с = секунда. Например, стенки указанного контейнер могут содержать слой непроницаемого для кислорода полимера. Примеры непроницаемых для кислорода полимеров включают, не ограничиваясь перечисленными: силиконовый каучук, природный каучук, полиэтилен низкой плотности (ПЭНП), полистирол (ПС), полиэтилен (ПЭ), поликарбонат (ПК), поливинилацетат (ПВА), аморфный полиэтилентерефталат (АПЭТ), поливинилхлорид (ПВХ), нейлон 6 (Ny6), поливинилфторид (ПВФ), поливинилиденхлорид (ПВДХ), полиацетонитрил (ПАН), этиленвиниловый спирт (ЭВС) и поливиниловый спирт (ПВС). Согласно определенным вариантам реализации коэффициент пропускания кислорода указанного полимера составляет менее 10-10 [см3(STP)/см/(см2+с+Па)].Согласно конкретным вариантам реализации стенки указанного контейнера содержат несколько слоев одного или большего числа непроницаемых для кислорода полимеров.
Согласно дополнительным вариантам реализации указанный контейнер содержит один или большее количество повторно герметизируемых или закрываемых входных портов. Согласно определенным вариантам реализации указанный контейнер содержит два или большее число повторно герметизируемых или закрываемых входных портов. Как было отмечено, согласно конкретным вариантам реализации указанный контейнер представляет собой бутыль, пакет, пробирку, флакон или шприц. Согласно определенным вариантам реализации указанный контейнер представляет собой внутривенный пакет или шприц. Согласно конкретным вариантам реализации указанный контейнер представляет собой герметизируемую пробирку с резиновой пробкой, например, пробирку Хангейта.
Согласно родственным вариантам реализации указанное устройство дополнительно содержит средства доставки, связанные с указанным контейнером через повторно герметизируемый или закрываемый входной порт. Согласно конкретным вариантам реализации указанное средство доставки выполнено с возможностью внутривенной доставки раствора из указанного контейнера субъекту нуждающегося в этом. Например, указанное средство доставки может представлять собой иглу или канюлю. Согласно определенным вариантам реализации указанное средство доставки содержит восстановленный кислород или бескислородную среду, или находится в среде с пониженным содержанием кислорода или бескислородной среде.
Согласно конкретным вариантам реализации хранения или устройств для доставки согласно настоящему изобретению указанное соединение представляет собой соединение галогена или халькогенид. Согласно определенным вариантам реализации указанное соединение представляет собой восстановленную форму соединения галогена или халькогенида, например, йодид, бромид, антион NaI, KI, HI, CaI, AGI, H2Se, Na2Se, NaHSe или HSe- или другие соединения согласно описанию в настоящем документе. Согласно определенным вариантам реализации указанное устройство содержит композицию согласно настоящему изобретению.
Для предотвращения воздействия воздуха в газонепроницаемый контейнер для хранения, содержащий композицию согласно настоящему изобретению, перед закрытием может быть введен инертный или благородный газ, такой как азот или аргон.
Согласно другим родственным вариантам реализации композиции хранят в светоустойчивом или светозащитном контейнере или флаконе, таком как флакон из янтарного стекла. Указанная композиция может быть упакована в стеклянный флакон. Он может быть заполнен с небольшим избыточным давлением в инертной атмосфере, например, атмосфере азота, для предотвращения/замедления окислительного разложения указанной композиции, которая может размещаться так, чтобы препятствовать проникновению света, с предотвращением таким образом фотохимического разложения указанной композиции. Это может обеспечиваться применением флакона из янтарного стекла. Известны дополнительные контейнерные системы, позволяющие обеспечить хранение раствора в бескислородной среде, поскольку многие растворы для внутривенного применение чувствительны к воздействию кислорода. Например, может использоваться стеклянный контейнер, из которого в процессе наполнения и герметизации удаляют кислород. Согласно другому варианту реализации используются доступные гибкие пластиковые контейнеры, которые могут заключаться во внешнюю герметизирующую оболочку для защиты от воздействия кислорода. В общем, может использоваться любой контейнер, который предотвращает взаимодействие кислорода со стабильной композицией (см., например, патент США № 6458758). Согласно одному варианту реализации указанный контейнер включает одну или большее количество акцепторов кислорода. Например, акцептирующая кислород композиция может наноситься в качестве покрытия или слоя на внутренней поверхности продукта, поддерживающего или сохраняющего барьерную функцию для защиты от проникновения кислорода (см., например, патент США № 5492742).
Согласно конкретным вариантам реализации контейнер или флакон может содержать единицу дозы композиции согласно настоящему изобретению. Согласно определенным вариантам реализации единичная дозированная форма содержит или состоит из эффективного количества указанной композиции для лечения или предотвращения у субъекта заболевания, состояния или повреждения, в том числе любого из описанных в настоящем документе.
Согласно конкретным вариантам реализации настоящим изобретением охвачен контейнер, такие как пакет для солевого раствора, который содержит заранее смешанную жидкую композицию соединения галогена, например, йодида или бромида, при этом количество заранее смешанной жидкой композиции соответствует дозе, подходящей для лечения или предотвращения заболевания, состояния или повреждения, в том числе любого из описанных в настоящем документе, у нуждающегося в этом субъекта, и один или большее количество фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. Согласно конкретным вариантам реализации указанная жидкая композиция является стерильной.
Согласно конкретным вариантам реализации настоящим изобретением охвачен контейнер, такой как флакон, который включает сухую композицию с соединением галогена, например, йодидом или бромидом, отличающийся тем, что указанное количество сухой композиции соответствует дозе, подходящей для лечения или предотвращения заболевания, состояния или повреждения, в том числе любого из описанных в настоящем документе, у нуждающегося в этом субъекта. Указанная сухая композиция может быть восстановлена, например, с применением фармацевтически приемлемого носителя, разбавителя или вспомогательного вещества, например, стерильной воды, до доставки нуждающемуся в этом субъекту.
Согласно определенным вариантам реализации композиции, содержащие соединение галогена и активный агент, применяемый для лечения хронической сердечной недостаточности, могут быть получены путем смешивания восстановленной формы соединения галогена, например, йодида, и активного агента, применяемого для лечения хронической сердечной недостаточности. Согласно определенным вариантам реализации в смесь вводят также один или большее количество фармацевтически приемлемых вспомогательных веществ, разбавителей или носителей.
Способы применения соединений галогенов и других композиций
Согласно определенным вариантам реализации композицию согласно настоящему изобретению используют для лечения или предотвращения повреждения или заболевания в биологическом материале, например, у субъекта, например, млекопитающего, такого как человек. Согласно конкретным вариантам реализации композицию согласно настоящему изобретению используют для лечения субъекта (или обработки биологического материала) до, во время или после ишемического или гипоксического состояния или реперфузии. Обработка биологического материала может проводиться in vivo, ex vivo или in vitro. Согласно конкретным вариантам реализации композицию согласно настоящему изобретению используют для лечения или предотвращения повреждения, вызванного сердечным приступом или инфарктом, обусловленным сердечным приступом или инсультом. Согласно конкретным вариантам реализации композицию согласно настоящему изобретению используют для лечения или предотвращения повреждения, вызванного трансплантацией клеток, тканей или органов. В настоящем документе описаны различные заболевания, повреждения и состояния, лечение каждого из которых может проводиться с применением композиции согласно настоящему изобретению, например, композиции, содержащей соединение галогена, такое как йодид, или композиции, содержащей халькогенид, такой как сульфид или селенид. Согласно конкретным вариантам реализации указанная композиция представляет собой стабильный состав, обеспечивающий поддержание соединения галогена или халькогенида в восстановленном состоянии.
Согласно определенным вариантам реализации настоящим изобретением охвачены способы лечения или предотвращения заболевания или повреждения в нуждающемся в этом биологическом материале, включающие введение в указанный биологический материал эффективного количества композиции согласно настоящему изобретению. Согласно конкретным вариантам реализации указанная композиция содержит эффективное количество одного или большего числа галидов и/или одного или большего числа халькогенидов, и, необязательно, одного или большего числа дополнительных активных агентов, в том числе любых из описанных в настоящем документе. Согласно конкретным вариантам реализации указанный галид или соединение галогена содержит йод, например, йодид или йодат. Согласно конкретным вариантам реализации указанный халькогенид включает серу или селен, например, сульфид или селенид. Согласно конкретным вариантам реализации указанная композиция также содержит глутатион или другой восстанавливающий агент.
Согласно одному варианту реализации композиции согласно настоящему изобретению используют для лечения субъектов, которые перенесли заболевание, повреждение, травму или интенсивную терапию, испытывают заболевание, повреждение, травму или проходят интенсивную терапию, или предрасположенные к заболеванию, повреждению, травме или интенсивной терапии. Соответственно, настоящим изобретением охвачен способ лечения или предотвращения заболевания, повреждения или травмы, в том числе повреждения, связанного с интенсивной терапией, у нуждающегося в этом субъекта, включающий введение субъекту эффективного количества композиции согласно настоящему изобретению. Согласно конкретным вариантам реализации указанная композиция содержит эффективное количество одного или большего числа галидов и/или одного или большего числа халькогенидов, и, необязательно, одного или большего числа дополнительных активных агентов, в том числе любых из описанных в настоящем документе. Согласно конкретным вариантам реализации указанное повреждение может быть вызвано внешними повреждающими факторами, такими как ожоги, раны, ампутации, пулевые ранения или хирургическая травма, хирургия брюшной полости, хирургия предстательной железы; внутренними повреждающими факторами, такими как септический шок, инсульт или остановка сердца, сердечный приступ, хроническая сердечная недостаточность, например, приводящая к резкому ослаблению кровообращения; или снижением кровообращения, обусловленным неинвазивным стрессом, таким как воздействие холода или радиации. На клеточном уровне повреждение часто приводит к гипоксии клеток, тканей и/или органов, приводя таким образом к индуцированию запрограммированной гибели клеток, или «апоптозу». Согласно конкретным вариантам реализации повреждение обусловлено реперфузией кислорода в клетке, ткани, органе, или у млекопитающего после гипоксического или ишемического явления. Согласно конкретным вариантам реализации композиции и способы, предложенные в настоящем изобретении, в том числе связанные с галидом и/или халькогенидами, используют для лечения или предотвращения послеоперационных спаек, например, послеоперационных спаек брюшной полости, малого таза и сердца. Согласно определенным вариантам реализации спайка представляет собой полосу рубцовой ткани, связывающей два участка ткани или органы. Спайка может развиваться в случае ответа механизмов восстановления организма на повреждение ткани, например, хирургическое вмешательство, инфекцию, травму или радиацию. Хотя спайки могут возникать где угодно, самыми распространенными локализациями являются брюшная полость, таз и сердце. Согласно определенным вариантам реализации композиции и способы, предложенные в настоящем изобретении, в том числе связанные с галидом и/или халькогенидами, используют для лечения или предотвращения повреждения, связанного с приживлением стволовых клеток, и/или для содействия приживлению стволовых клеток или уменьшения отторжения стволовых клеток, например, аллогенных или аутологичных стволовых клеток, введенных субъекту.
Согласно одному варианту реализации настоящим изобретением охвачено приведение в контакт клеток, тканей, органов, конечностей и даже целых организмов с эффективным количеством композиции согласно настоящему изобретению в качестве способов защиты от пагубного эффекта повреждения или заболевания. Настоящее изобретение также охватывает способы индуцирования регенерации тканей и заживления ран путем ингибирования/предотвращения/задержки биологических процессов, которые могут приводить к замедлению заживления ран и регенерации тканей. Согласно определенным вариантам реализации настоящим изобретением охвачены способы защиты биологического материала, или предотвращения или ингибирования повреждения нуждающегося в этом биологического материала, включающий введение в указанный биологический материал эффективного количества композиции согласно настоящему изобретению. Согласно конкретным вариантам реализации указанная композиция содержит эффективное количество одного или большего числа галидов и/или одного или большего числа халькогенидов, и, необязательно, одного или большего числа дополнительных активных агентов, в том числе любых из описанных в настоящем документе. В указанном контексте в ситуации, когда имеется существенное ранение конечности или организма, приведение биологической материи в контакт с композицией согласно настоящему изобретению способствует процессу заживления ран и регенерации тканей путем регуляции биологических процессов, которые ингибируют выздоровление и регенерацию. Помимо заживления ран, способы, предложенные в настоящем изобретении могут применяться для предотвращения или лечения травмы, такой как остановка сердца или инсульт, или геморрагический шок. Настоящее изобретение имеет важное значение, например, в связи с риском травмы в результате неотложных хирургических процедур, таких как торакотомия, лапаротомия и рассечение селезенки, или хирургия сердца, аневризма, хирургия, хирургия головного мозга и т.п.
Согласно определенным вариантам реализации способы, предложенные в настоящем изобретении могут применяться для повышения выживаемости или ингибирования/предотвращения ишемического повреждения или ингибирования/предотвращения реперфузионного повреждения, например, обусловленного остановкой сердца или инсультом. Соответственно, согласно одному варианту реализации настоящим изобретением охвачены способы повышения выживаемости или уменьшения ишемического или реперфузионного повреждения путем введения в биологический материал, для которого диагностировано ишемическое повреждение или риск ишемического повреждения, или для ингибирования/предотвращения реперфузионного повреждения, например, обусловленного остановка сердца или инсульт, композиции согласно настоящему изобретению, например, композиции, содержащей соединение галогена, необязательно в комбинации с одним или большим числом дополнительных активных агентов, таких как халькогенид. Они могут применяться, например, у субъекта, страдающего или имеющего риск остановки сердца или инсульта, включающий введение эффективного количества композиции согласно настоящему изобретению субъекту до, после или и до, и после инфаркта миокарда, остановки сердца или инсульта.
«Ишемия» относится к ограничению притока крови к тканям, вызывающему нехватку кислорода и глюкозы, необходимых для клеточного метаболизма. Она может быть вызвана проблемами с кровеносными сосудами, приводящими к повреждению пораженной ткани. Согласно определенным вариантам реализации она обусловлена вазоконстрикцией, тромбозом, инфарктом миокарда, инсультом или эмболией. В настоящем документе «реперфузионное повреждение» относится к повреждению ткани, обусловленному восстановлением кровотока в ткани после периода ишемии или кислородной недостаточности. Считается, что отсутствие поступающих из крови кислорода и питательных веществ во время периода ишемии приводит к состоянию, при котором восстановление кровотока приводит к воспалению и окислительному повреждению за счет индуцирования окислительного стресса. Согласно определенным вариантам реализации указанный способ приводит к уменьшению размера зоны инфаркта по сравнению с указанным размером в отсутствие лечения указанной стабильной композицией.
Согласно определенным вариантам реализации способы, предложенные в настоящем изобретении включают предварительную обработку биологического материала, например, лечение субъекта, композицией согласно настоящему изобретению до ишемического, гипоксического или реперфузионного повреждения или явления, или обусловленного заболеванием повреждающего фактора. Указанные способы могут применяться в случаях, когда повреждение или заболевание, потенциально способное привести к ишемии или гипоксии, планируется или выбирается заранее, или заранее предсказана возможность его возникновения. Примеры включают, не ограничиваясь перечисленными, обширное оперативное вмешательство, при котором может происходить самопроизвольная кровопотеря, или результат процедуры сердечно-легочного шунтирования, при которой может быть нарушено насыщение крови кислородом, или при котором доставка крови по сосудам может восстанавливаться (как в случае хирургической операции шунтирования коронарных артерий (ШКА)), или при лечении доноров клеток, тканей или органов (или обработке донорских клеток, тканей или органов) до извлечения донорских клеток, тканей или органов для транспортировки и трансплантации реципиенту, нуждающемуся в трансплантации клеток, ткани или органов. Согласно различным вариантам реализации указанные донорские клетки, ткани или орган аутологичны или гетерологичны для реципиента трансплантата. Примеры включают, не ограничиваясь перечисленными, медицинские состояния, при которых имеется риск повреждения или прогрессирования заболевания (например, в условиях нестабильной стенокардии, после ангиопластики, аневризмы с кровотечениями, геморрагического инсульта, после серьезной травмы или кровопотери), или при которых риск может быть диагностирован с применением медицинского диагностического теста.
Согласно определенным вариантам реализации соединений, композиции и способы, предложенные в настоящем изобретении используют для лечения, ингибирования, уменьшения или предотвращения любого из следующих заболеваний или состояний, или повреждений, связанных или обусловленных любым из следующих вариантов лечения: трансплантация (например, трансплантация почки, трансплантация трупной почки, трансплантация печени, трансплантация кишечника, трансплантация легкого или лоскутная трансплантация); кишечная непроходимость (например, недостаточность перистальтики и послеоперационная кишечная непроходимость); болезнь «трансплантат против хозяина»; индуцированное радиацией повреждение легких; индуцированное искусственной вентиляцией повреждение легких; катаракта (например, начальная катаракта, сенильная катаракта или начальная катаракта сенильная катаракта); хантавирусный легочный синдром (ХЛС); вирус Эбола; сальмонеллезная инфекция, бактериальная инфекция; ишемическая родовая травма (например, гипоксическая ишемическая энцефалопатия (ГИЭ) или асфиксия при рождении); болезнь периферических сосудов; постоянная ишемия; инфаркт миокарда с подъемом сегмента ST (STEMI); снижение слуха (например, снижение слуха при воздействии шума или острое нарушение слуха); эпилептический статус (эпилепсия), ишемия/реперфузионное повреждение верхней брыжеечной артерии (например, ишемически-реперфузионное повреждение после окклюзии верхней брыжеечной артерии); серповидноклеточная анемия или кризис серповидных клеток; или контраст-индуцированная нефропатия. Согласно определенным вариантам реализации любые из указанные заболеваний, расстройств или повреждений лечат композицией, содержащей халькогенид, или композицией, содержащей галид. Согласно конкретным вариантам реализации указанная содержащая халькогенид композиция содержит сульфид или селенид, например, в восстановленной форме, в том числе любые из композиций согласно описанию в настоящем документе, например, обеспечивающие поддержание сульфида или селенида в восстановленной форме.
Согласно определенным вариантам реализации настоящее изобретение включает лечение или предотвращение индуцированного радиоконтрастным агентом повреждение почек у нуждающегося в этом субъекта, включающий введение субъекту эффективного количества композиции, содержащей галоген (например, йодид) или халькогенид (например, сульфид или селенид). Индуцированное радиоконтрастным агентом повреждение почек (контраст-индуцированная нефропатия) представляет собой значимую клиническую проблему и было связано с повышенной смертностью среди пациентов и более продолжительной госпитализацией. Введение радиоконтрастного агента в сочетании с визуализацией коронарных артерий, периферических артерий или почек представляет собой распространенное медицинское вмешательство. Однако введение радиоконтрастного агента часто приводит к значимому повреждению почек в подгруппе пациентов с наличием определенных факторов риска. Например, пациенты старшего возраста, пациенты, имеющие фоновое заболевание (например, диабет или атеросклероз) и/или имеющие пограничное нарушение функции почек, в частности, предрасположены к повреждению почек. Согласно одному варианту реализации указанный радиоконтрастный агент вводят до или во время диагностической визуализации почек. Согласно другому примеру варианта реализации радиоконтрастный агент вводят до или во время диагностической визуализации кровеносных сосудов сердца. Согласно другому примеру варианта реализации указанного способа радиоконтрастный агент представляет собой йодированный радиоконтрастный агент. Согласно другому примеру варианта реализации указанного способа у субъекта (например, пациента-человека, нуждающегося в таком лечении) имеется существующее нарушение функции почек до введения указанного радиоконтрастного агента. Согласно другому примеру варианта реализации указанного способа исходный уровень креатинина у указанного человека составляет 120 мкмоль/л или более, скорость клубочковой фильтрации менее чем 60 мл/мин на 1,73 м2 и/или клиренс креатинина менее чем 60 мл/мин. Согласно другому примеру варианта реализации указанного способа, у указанного человека наблюдается одно или большее число состояний, выбранных из сахарного диабета типа 1 или 2, атеросклероза, застойной сердечной недостаточности, внутриартериального баллонного насоса, анемии, систолического давления крови менее чем 80 мм рт.ст., возраста более 50 лет, скорости клубочковой фильтрации менее чем 60 мл/мин на 1,73 м2 и пониженного интраваскулярного объема. Согласно другому примеру варианта реализации указанного способа указанное индуцированное радиоконтрастным агентом повреждение почек представляет собой индуцированную радиоконтрастным агентом нефропатию или острую почечную дисфункцию.
Соответственно, согласно определенным вариантам реализации настоящим изобретением охвачен способ лечения, предотвращения, снижения, ингибирования (или связанный со снижением или ингибированием повреждения) любых расстройств или процедур согласно описанию в настоящем документе в биологическом материале (например, у субъекта), включающий введение эффективного количества соединения или композиции согласно описанию в настоящем документе в биологический материал (например, субъекту).
Согласно определенным вариантам реализации настоящим изобретением охвачен способ лечения, предотвращения, снижения, ингибирования хронической сердечной недостаточности у нуждающегося в этом субъекта, включающий введение эффективного количества соединения или композиции согласно описанию в настоящем документе субъекту (например, указанному субъекту). Согласно конкретным вариантам реализации у указанного субъекта была диагностирована хроническая сердечная недостаточность, например, систолическая сердечная недостаточность, или предрасположенность к ней. ХСН может быть диагностирована на основании истории симптомов и физикального осмотра с эхокардиографическим подтверждением. Кроме того, может быть целесообразно проведение анализов крови, электрокардиографии и рентгенографии грудной клетки для определения первопричины. Согласно конкретным вариантам реализации у указанного субъекта была диагностирована хроническая сердечная недостаточность, обусловленная дисфункцией левого желудочка, или систолическая сердечная недостаточность. Согласно конкретным вариантам реализации у указанного субъекта произошел сердечный приступ, например, в пределах одного дня, одной недели, одного месяца, 6 месяцев, одного года или 5 лет до начала лечения. Согласно определенным вариантам реализации указанному субъекту вводят галоген, например йодсодержащий галоген, например, йодид. Согласно конкретным вариантам реализации указанному субъекту вводят фармацевтическую композицию, содержащую восстановленную форму соединения галогена, например, восстановленную форму йода, такую как йодид или йодат, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Согласно определенным вариантам реализации указанный фармацевтическая композиция дополнительно содержит глутатион. Согласно определенным вариантам реализации указанный глутатион присутствует в количестве, достаточном для поддержания указанного галогена или соединения галогена в восстановленном состоянии. Согласно конкретным вариантам реализации указанному субъекту вводят любые из композиций, например, фармацевтические композиции, или единичные дозированные формы согласно описанию в настоящем документе с применением любых способов введения согласно описанию в настоящем документе. Согласно конкретным вариантам реализации указанному субъекту вводят соединение галогена перорально или внутривенно.
Согласно конкретным вариантам реализации способов лечения или предотвращения ХСН, например, систолической сердечной недостаточности, соединение галогена вводят субъекту в комбинации с одним или большим числом других активных агентов, применяемых для лечения ХСН. Согласно определенным вариантам реализации указанному субъекту вводят эффективное количество первой фармацевтической композиции, содержащей восстановленную форму соединения галогена, например, восстановленную форму йода, такую как йодид или йодат, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество, и эффективное количество второй фармацевтической композиции, содержащей другой активный агент, применяемый для лечения ХСН. Следует понимать, что эффективное количество каждой фармацевтической композиции при применении в комбинации может быть меньше эффективного количества одной или обеих композиций при раздельном применении. Согласно определенным вариантам реализации указанные две фармацевтические композиции функционируют синергистически при лечении или предотвращении ХСН.
Согласно определенным вариантам реализации указанный другой активный агент, применяемый для лечения ХСН, например, ХСН, обусловленной дисфункцией левого желудочка, представляет собой ингибитор ангиотензин-превращающего фермента (ACE) или бета-блокатор. Согласно другим вариантам реализации указанный другой активный агент представляет собой антагонист альдостерона, блокаторы рецепторов ангиотензина или гидралазин с нитратом. Согласно дополнительным вариантам реализации другой активный агент представляет собой антикоагулянт, антитромбоцитарную терапию, блокаторы рецепторов ангиотензина II, блокатор кальциевых каналов, диуретик, сосудорасширяющее средство или статин. Согласно конкретным вариантам реализации биологический материал, например, клетка млекопитающего, ткань, орган или млекопитающее, получает предварительное лечение композицией согласно настоящему изобретению, например, композицией, содержащей соединение галогена, до ишемического, гипоксического или реперфузионного явления или повреждения. Согласно конкретным вариантам реализации указанный биологический материал контактирует с указанной композицией в течение по меньшей мере или приблизительно одного часа, по меньшей мере или приблизительно двух часов, по меньшей мере или приблизительно четырех часов, по меньшей мере или приблизительно шести часов, по меньшей мере или приблизительно восьми часов, по меньшей мере или приблизительно 10 часов, по меньшей мере или приблизительно 12 часов, по меньшей мере или приблизительно 16 часов, по меньшей мере или приблизительно 20 часов, по меньшей мере или приблизительно 24 часов, по меньшей мере или приблизительно 36 часов, по меньшей мере или приблизительно 48 часов, по меньшей мере или приблизительно трех дней, по меньшей мере или приблизительно 4 дней, по меньшей мере или приблизительно 5 дней, по меньшей мере или приблизительно одной недели, по меньшей мере или приблизительно двух недель, по меньшей мере или приблизительно одного месяца, от одного часа до одной недели, от одного часа до 48 часов, от одного часа до 24 часов, от 2 часов до одной недели, от 2 часов до 48 часов, от 2 часов до 24 часов, от 4 часов до одной недели, от 4 часов до 48 часов, от 4 часов до 24 часов, от 12 часов до одной недели, от 12 часов до 48 часов, от 12 часов до 24 часов, от 24 часов до одной недели, или от 24 часов до 48 часов до или непосредственно перед ишемическим, гипоксическим или реперфузионным явлением или повреждением. Согласно определенным вариантам реализации имеется период времени после лечения и непосредственно до ишемического, гипоксического или реперфузионного явления или повреждения, в течение которого биологическая материя не контактирует с композицией согласно настоящему изобретению, например, период времени, составляющий приблизительно 5 минут, приблизительно 10 минут, приблизительно 20 минут, приблизительно 30 минут, приблизительно один час, приблизительно два часа, приблизительно четыре часа, приблизительно восемь часов, приблизительно 12 часов или приблизительно 24 часа. Согласно конкретным вариантам реализации указанный биологический материал, например, клетку, ткань или орган, пересаживают или трансплантируют реципиенту во время или после лечения композицией согласно настоящему изобретению. Согласно конкретным вариантам реализации указанный пересаженный или трансплантированный биологический материал является аутологичным или чужеродным для указанного реципиента.
Вместе с тем, дополнительные варианты реализации согласно настоящему изобретению относятся к повышению выживаемости и предотвращению необратимого повреждения ткани в результате кровопотери или обусловленной иными причинами недостаточности поступления кислорода в клетки или ткань, например, в результате отсутствия адекватного поступления крови. Согласно определенным вариантам реализации настоящим изобретением охвачены способы повышения выживаемости или предотвращения повреждения ткани в результате кровопотери или обусловленной иными причинами недостаточности поступления кислорода в клетки или ткань в нуждающемуся в этом биологическом материале, включающий введение в указанный биологический материал эффективного количества композиции согласно настоящему изобретению. Согласно конкретным вариантам реализации указанная композиция содержит эффективное количество одного или большего числа галидов и/или одного или большего числа халькогенидов, и, необязательно, одного или большего числа дополнительных активных агентов, в том числе любых из описанных в настоящем документе. Отсутствие адекватного поступления крови может представлять собой результат, например, фактической кровопотери, или может быть обусловлено состояниями или заболеваниями, приводящими к блокаде притока крови к клеткам и тканям, понижающими давление крови локально или во всем организме, снижающими количество переносимого с кровью кислорода или уменьшающими количество переносящих кислород клеток крови. Состояния и заболевания, которые могут быть вовлечены в указанные процессы, включают, не ограничиваясь перечисленными, тромбы и эмболии, цисты, разрастания, опухоли, анемию (включая серповидноклеточную анемию), гемофилию, другие заболевания, связанные со свертываемостью крови (например, болезнь фон Виллебранда или идиопатическая тромбоцитопеническая пурпура (ИТП)) и атеросклероз. Такие состояния и заболевания также включают создающие по существу гипоксические или бескислородные условия в клетках или ткани организма в результате повреждения, заболевания или состояния.
Согласно одному варианту реализации в настоящем изобретении предложены способы и композиции для повышения выживаемости или уменьшения или предотвращения нарушения или повреждения биологического материала (например, организма млекопитающего, или ткани или органа млекопитающего), испытывающего геморрагический шок или реперфузию, которые включают приведение в контакт указанного биологического материала, подверженного риску геморрагического шока или находящегося в состоянии геморрагического шока, с эффективным количеством композиции согласно настоящему изобретению, в целесообразных временных рамках, например, в пределах одного часа после повреждения. Указанный способ позволяет транспортировать субъекта в контролируемую среду (например, среду для хирургического вмешательства) для устранения первопричины повреждения, и после чего пациент может быть возвращен к нормальному функционированию контролируемым образом. При указанных показаниях первый час после повреждения, называемый«золотым часом», является критически важным для благополучного исхода.
Согласно различным другим вариантам реализации способы и композиции согласно настоящему изобретению могут применяться при лечении или предотвращении нейродегенеративных заболеваний, связанных с ишемией, гипоксией или реперфузией при лечении гипотермии, при лечении гиперпролиферативных расстройств и при лечении иммунных расстройств. Согласно различным другим вариантам реализации биологическое состояние представляет собой любое состояние или комбинацию следующих состояний: неврологическое заболевание, заболевание сердечно-сосудистой системы, болезнь обмена веществ, инфекционное заболевание, заболевание легких, генетическое заболевание, аутоиммунное заболевание и связанное с иммунной системой заболевание. Согласно определенным вариантам реализации способы и композиции согласно настоящему изобретению используют для повышения выживаемости биологической материи ex vivo в гипоксическом или ишемическом состоянии, включая, например, выделенные клетки, ткани и органы. Конкретные примеры такого биологического материала ex vivo включают тромбоциты и другие продукты крови, а также клетки, ткани и органы для трансплантации, например, для аутологичной или гетерологичной трансплантации. Согласно различным вариантам реализации биологический материал для трансплантации обрабатывают композицией согласно описанию в настоящем документе в организме донора, после извлечения из организма донора или после трансплантации реципиенту, или любой их комбинацией. Согласно конкретным вариантам реализации реципиент трансплантации получает лечение композицией согласно описанию в настоящем документе до, во время или после трансплантации биологического материала, например, клеток, ткани или органа.
Способы, предложенные в настоящем изобретении могут применяться для регуляции восстановительной среды крови, ткани или клеток, включая, например, присутствующей на участке повреждения или заболевания, такого как, например, инфаркт миокарда. Согласно определенным вариантам реализации настоящим изобретением охвачены способы для регуляции восстановительной среды в биологическом материале, включающий введение в указанный биологический материал эффективного количества композиции согласно настоящему изобретению. Согласно конкретным вариантам реализации указанная композиция содержит эффективное количество одного или большего числа галидов и/или одного или большего числа халькогенидов, и, необязательно, одного или большего числа дополнительных активных агентов, в том числе любых из описанных в настоящем документе. Без связи с конкретной теорией следует понимать, что в нормальных условиях в эритроцитах наблюдается постоянное отношение восстановленного глутатиона к окисленному глутатиону, составляющее приблизительно 99:1. В указанных условиях антионы, такие как селенит и йодат, попадают в эритроциты через переносчик анионов/белок полосы 3 на плазматической мембране, и при воздействии высоковосстановительного глутатиона преобразуются/восстанавливаются до селенида и йодида. Дополнительным побочным продуктом указанной реакции является синтез незначительного количества окисленного глутатиона. Указанный окисленный глутатион восстанавливается с использованием энергии, образующейся при окислении глюкозы в пентозофосфатном пути. Селенид и йодид выходят из клеток через переносчик анионов/белок полосы 3 и способны переносить восстановительный потенциал эритроцитов в другие части организма. При перегрузке указанного пути, например, при повреждении или заболевании, отношение восстановленного глутатиона к окисленному снижается, например, до менее чем 90:10, 80:10, 70:10, 60:10 или даже до 50:50 после сердечного приступа. Кроме того, считается, что количество восстановленных анионов, таких как селенид и йодид, синтезируемых эритроцитами и высвобождаемых в кровоток и ткани, также уменьшается, что приводит к уменьшению количества восстанавливающих агентов в кровотоке и тканях, в том числе, например, поврежденных или пораженных заболеванием тканях. Уменьшение количества восстанавливающих агентов (йодида и селенида) приводит к снижению способности к нейтрализации свободных радикалов, что обуславливает окислительный стресс и вызывает повреждение ткани, например, повреждение, обусловленное гипоксией, ишемией или реперфузией. Указанное явление называется «острым нарушением кровообращения». Указанные и связанные с ними механизмы обсуждаются, например, в источниках: D’Alessandro, A. et al. Blood Transf, 2013: 11: 75-87; Salmi, H. et al., Pediatric Endocrinology, Diabetes, and Metabolism 2011, 17, 1, 14-19; Snethil, S. et al., Clinica Chimica Acta 348 (2004) 131-137; и Tolan, N. et al., Anal. Chem. 2009, 81, 31202-3108. Кроме того, добавление экзогенного йодида и селенида в кровоток освобождает эритроциты от необходимости синтезировать селенид и йодид, и позволяет эритроцитам использовать оставшийся восстановительный потенциал для поддержания уровней гемоглобина.
Глутатион (GSH) представляет собой трипептид, содержащий гамма-пептидную связь между аминогруппой цистеина (присоединенного обычной пептидной связью к глицину) и карбоксильной группой боковой цепи глутамата. Он представляет собой антиоксидант, предотвращает повреждение важных клеточных компонентов, вызванное активными формами кислорода, такими как свободные радикалы и пероксиды. Тиольные группы представляют собой восстановительные агенты, присутствующие в клетках животных в концентрации приблизительно 5 мМ. Глутатион ослабляет дисульфидные связи цистеинов, образующиеся в цитоплазматических белках, функционируя в качестве донора электронов. В ходе указанного процесса глутатион преобразуется в окисленную форму дисульфида глутатиона (GSSG), также называемую L-(–)-глутатионом. Окисленный глутатион может быть восстановлен глутатионредуктазой, с использованием НАДФH в качестве донора электронов. Отношение восстановленного глутатиона к окисленному глутатиону в клетках часто используют в качестве меры токсичности для клеток.
Соответственно, в настоящем изобретении предложен способ лечения или предотвращения повреждения или заболевания, в том числе любого из описанных в настоящем документе, в том числе, но не ограничиваясь перечисленным, ишемического или реперфузионного повреждения, у нуждающегося в этом субъекта, путем ингибирования или предотвращения уменьшения отношения количества или молярной концентрации восстановленных форм глутатиона и количества или молярной концентрации окисленных форм глутатиона в кровотоке субъекта или на участке заболевания или повреждения, например, в пораженной заболеванием или поврежденной ткани. Согласно определенным вариантам реализации указанный способ включает введение субъекту эффективного количества композиции согласно настоящему изобретению. Согласно конкретным вариантам реализации указанная композиция содержит эффективное количество одного или большего числа галидов и/или одного или большего числа халькогенидов, и, необязательно, одного или большего числа дополнительных активных агентов, в том числе любых из описанных в настоящем документе. Указанный способ может также применяться для увеличения отношения количества или молярной концентрации восстановленных форм глутатиона и количества или молярной концентрации окисленных форм глутатиона в кровотоке субъекта или на участке заболевания или повреждения. Согласно конкретным вариантам реализации указанные способы включают системное введение соединения галогена и/или халькогенида субъекту до, во время или после начала указанного заболевания или повреждения. Согласно определенным вариантам реализации соединение галогена, например, йодид, вводится субъекту до дебюта указанного заболевания или повреждения. Согласно конкретным вариантам реализации халькогенид, например, селенид, вводится субъекту до дебюта указанного заболевания или повреждения, во время дебюта или возникновения заболевания или повреждения, или после дебюта указанного заболевания или повреждения. Также следует понимать, что могут применяться другие соединения, нарушающие выработку, активность или функцию гормонов щитовидной железы, в том числе струмогенные агенты, вместо соединения галогена или халькогенида или в комбинации с соединением галогена или халькогенида, при реализации указанных или других способов согласно настоящему изобретению. Халькогениды и соединения галогенов могут применяться в любых количествах, описанных в настоящем документе. Согласно определенным вариантам реализации субъекту вводят от приблизительно 1 пг/кг до приблизительно 1 г/кг халькогенида, сульфида или селенида, от приблизительно 10 мкг/кг до приблизительно 10 мг/кг халькогенида, сульфида или селенида. Согласно определенным вариантам реализации указанное соединение галогена представляет собой йодид, и субъекту вводят от приблизительно 10 пг/кг до приблизительно 1 г/кг йодида. Согласно определенным вариантам реализации субъекту вводят от приблизительно 10 мкг/кг до приблизительно 10 мг/кг йодида.
Согласно определенным вариантам реализации способы, предложенные в настоящем изобретении, обеспечивают поддержание отношения количества или молярной концентрации восстановленных форм глутатиона и количества или молярной концентрации окисленных форм глутатиона в кровотоке субъекта или на участке заболевания или повреждения или ингибирование падения указанного количества или молярной концентрации ниже 99%, ниже 98%, ниже 97%, ниже 96%, ниже 95%, ниже 94%, ниже 93%, ниже 92%, ниже 91%, ниже 90%, ниже 80%, ниже 70%, ниже 60%, ниже 50%, ниже 40%, ниже 30%, ниже 20% или ниже 10% после дебюта указанного заболевания или повреждения. Согласно определенным вариантам реализации способы, предложенные в настоящем изобретении, обеспечивают увеличение отношения количества восстановленных форм глутатиона и количества окисленных форм глутатиона в кровотоке субъекта или на участке заболевания или повреждения до или более чем до 99%, до или более чем до 98%, до или более чем до 97%, до или более чем до 96%, до или более чем до 95%, до или более чем до 94%, до или более чем до 93%, до или более чем до 92%, до или более чем до 91%, до или более чем до 90%, до или более чем до 80%, до или более чем до 70%, до или более чем до 60%, до или более чем до 50%, до или более чем до 40%, до или более чем до 30%, до или более чем до 20%, или до или более чем до 10% после дебюта указанного заболевания или повреждения. Согласно конкретным вариантам реализации перечисленные отношения достигаются за период времени или поддерживаются в течение периода времени в пределах 1 минуты, 5 минут, 30 минут, 1 часа, 2 часов, 4 часов, 8 часов, 12 часов, 24 часов, 48 часов или 48 часов с момента введения указанной композиции субъекту.
В настоящем изобретении также предложены способы определения или мониторинга терапевтического эффекта композиции или лечения, в том числе любых композиций или способов согласно описанию в настоящем документе, которые могут быть реализованы отдельно или в комбинации с любым способом согласно описанию в настоящем документе. Указанные способы включают определение отношения количества или концентрации восстановленного глутатиона и количества или молярной концентрации окисленного глутатиона. Отношения количества или молярной концентрации восстановленного глутатиона и количества или молярной концентрации окисленного глутатиона могут быть определены, например, в образце крови, например, согласно описанию в любых из ранее упомянутых источников. Увеличение или ингибирование дальнейшего уменьшения указанного отношения после лечения указывает на эффективность, а уменьшение указанного отношения предполагает, что лечение имеет ограниченную терапевтическую ценность или не имеет терапевтической ценности.
Согласно некоторым вариантам реализации настоящее изобретение относится к способу предотвращения, ингибирования или уменьшения иммунного ответа в биологическом материале или у нуждающегося в этом субъекта, включающий введение в указанный биологический материал или указанному субъекту эффективного количества композиции согласно настоящему изобретению. Согласно конкретным вариантам реализации указанная композиция содержит эффективное количество одного или большего числа галидов и/или одного или большего числа халькогенидов, и, необязательно, одного или большего числа дополнительных активных агентов, в том числе любых из описанных в настоящем документе. Согласно некоторым вариантам реализации иммунный ответ обычно относится к любому ответу, вызываемому врожденной или приобретенной иммунной системой. Согласно некоторым вариантам реализации указанный иммунный ответ инициируется активацией T-клеток. Согласно некоторым вариантам реализации указанный иммунный ответ инициируется активацией B-клеток. Предусмотренный настоящим изобретением иммунный ответ может быть стимулирован любым способом. Согласно некоторым вариантам реализации иммунный ответ индуцирован патогеном. Согласно некоторым вариантам реализации иммунный ответ представляет собой аутоиммунный ответ. Согласно некоторым вариантам реализации иммунный ответ относится к воспалению. Согласно определенным вариантам реализации аутоиммунный ответ индуцируется после трансплантации клеток, ткани или органа. Согласно определенным вариантам реализации аутоиммунный ответ представляет собой результат аутоиммунного расстройства.
Согласно некоторым вариантам реализации воспаление относится к неспецифической первой реакции, обеспечиваемой иммунной системой в ответ на обнаруженное повреждение или угрозу. Она представляет собой врожденную защитную реакцию, отличающуюся от более точной адаптивной реакции иммунной системы. Воспаление может действовать совместно с адаптивными реакциями иммунной системы, которые развиваются медленнее, однако более точно нацелены на вредоносный агент, например, химический или патогенный, который может вызывать локальное повреждение.
Воспаление может быть связано с инфекциями, но оно возникает в ответ на повреждение или угрозу практически любого типа, включая физическую травму, холод, радиационные ожоги, воздействие температур или коррозионно-активных материал, химических раздражителей, бактериальных или вирусных патогенов, локализованную кислородную депривацию (ишемию) или реперфузию (резкое возобновление поступления кислорода в ишемическую ткань) и др. Оно включает классические симптомы: покраснение, жар, припухлость и боль, и может сопровождаться снижением функции воспаленного органа или ткани. Оно может представлять собой генерализованную реакцию, включающую ряд эффектов, которые могут демонстрировать тенденцию к противодействию повреждающему агенту, который может присутствовать на участке, где было детектировано повреждение или угроза, или демонстрировать тенденцию к ограничению распространения повреждения или угрозы исходной локализацией, предотвращая его быстрое распространение.
Согласно некоторым вариантам реализации аутоиммунный ответ определяют в общем как любой ответ организма, приводящий к атаке иммунной системы на собственные клетки и ткани. Этиология аутоиммунного ответа очень широка и включает генетические факторы и факторы окружающей среды, а также иммунологические механизмы, в том числе, например, но никоим образом не ограничиваясь перечисленными: T-клеточный обходной путь; рассогласование T-клеток и B-клеток; аномалии опосредованной B-клеточным рецептором обратной связи; молекулярная мимикрия; перекрестная идиотипическая реакция; нарушение цитокиновой регуляции; апоптоз дендритных клеток; распространение эпитопа, дрейф эпитопов; модификация эпитопов или экспонирование маскированных эпитопов.
Согласно некоторым вариантам реализации аутоиммунный ответ относится к системным аутоиммунным заболеваниям, определенным как аутоиммунные заболевания, повреждающие многие органы; такие как, например, красная волчанка, синдром Шегрена, склеродермия, ревматоидный артрит и аутоиммунный миозит, такой как дерматомиозит, полимиозит, васкулит (например, синдром Черджа-Стросс), саркоидоз, общие аллергии и т.п.
Согласно некоторым вариантам реализации аутоиммунный ответ относится к местным аутоиммунным синдромам, определяемых как аутоиммунное заболевание, поражают один орган или ткань; такие как, например, сахарный диабет 1 типа; тиреоидит Хашимото; болезнь Эддисона; целиакия; болезнь Крона; болезнь Грейвса, злокачественная анемия; псориаз; обыкновенная пузырчатка; витилиго; аутоиммунная гемолитическая анемия; идиопатическая тромбоцитопеническая пурпура; миастения гравис; и т.п.
Некоторые варианты реализации настоящего изобретения относятся к лечению, предотвращению или ослаблению отторжения органов или болезни «трансплантат против хозяина» (РТПХ) и/или связанных состояний. Согласно определенным вариантам реализации настоящим изобретением охвачены способы лечения или предотвращения отторжения органов или болезни «трансплантат против хозяина» (РТПХ) и/или связанных состояний у нуждающегося в этом субъекта, включающий введение субъекту эффективного количества композиции согласно настоящему изобретению. Согласно определенным вариантам реализации настоящим изобретением охвачены способы лечения или предотвращения отторжения органов или болезни «трансплантат против хозяина» (РТПХ) и/или связанных состояний у нуждающегося в этом субъекта, включающие приведение в контакт трансплантированных клеток, ткани или органа с эффективным количеством композиции согласно настоящему изобретению. Согласно конкретным вариантам реализации указанная композиция содержит эффективное количество одного или большего числа галидов и/или одного или большего числа халькогенидов, и, необязательно, одного или большего числа дополнительных активных агентов, в том числе любых из описанных в настоящем документе. Отторжение органов происходит при разрушении иммунными клетками хозяина трансплантированной ткани посредством иммунного ответа. Аналогичным образом, иммунный ответ вовлечен и в РТПХ, однако в указанном случае чужеродные трансплантированные иммунные клетки уничтожают ткани хозяина. Введение соединений галогенов или халькогенидов согласно настоящему изобретению, ингибирующих иммунный ответ, может представлять собой эффективную терапию при предотвращении отторжения органов или РТПХ.
Некоторые варианты реализации относятся к лечению, предотвращению или облегчению воспаления, обусловленного ишемическими или реперфузионными повреждениями. Согласно определенным вариантам реализации настоящим изобретением охвачены способы лечения или предотвращения воспаления, например, воспаления, обусловленного ишемическими или реперфузионными повреждениями у нуждающегося в этом субъекта, включающий введение субъекту эффективного количества композиции согласно настоящему изобретению. Согласно определенному варианту реализации указанная композиция содержит эффективное количество галида и/или эффективное количество халькогенида, и, необязательно, одного или большего числа дополнительных активных агентов, включая любые из описанных в настоящем документе. Согласно определенным вариантам реализации реперфузионные повреждения возникают при прекращении притока крови к органу на некоторый период времени, например, после инфаркта миокарда, инсульта и других тромботических явлений. При ишемии ткани испытывают стресс, обусловленный недостатком кислорода, и в конечном итоге, если ишемия продолжается, ткань становится некротической, что приводит к накоплению различных промежуточных продуктов метаболизма. Восстановление кровотока приводит к быстрому увеличению количества кислородных радикалов, приводящему к воспалению. Соответственно, варианты реализации настоящего изобретения относятся к применению соединений галогенов, таких как йодид, или соединений халькогенидов, таких как селенид или сульфид, для уменьшения образования активных форм кислорода.
В данной области техники известно множество разных методов анализа, подходящих для детекции активации иммунологического ответа. Некоторые типичные неограничивающие примеры включают, однако никоим образом не ограничиваются: способы детекции лимфоцитов (т.е. T-клетки, B-клетки и NK-клетки), моноциты и дендритные клетки. Примеры таких анализов включают, например, ELISPOT; анализ экспрессирования цитокинов на основе проточной цитометрии; окрашивание мультимеров HLA/пептид; анализ тетрамеров MHC; анализ карбоксифлуоресцеин-сукцинимидилового эфира; антигенспецифический иммунный ответ: гиперчувствительность замедленного типа, детекция использования гена T-клеточного рецептора или синтеза цитокинов на основе ПЦР, реакции смешанных лимфоцитов для измерения пролиферации Т-клеток, и т.п.
Согласно вариантам реализации любой анализ, обеспечивающий возможность детекции иммунного ответа, генерируемого каким-либо стимулом, подходит для измерения эффекта соединения галогена или халькогенида на подавление иммунного ответа.
Согласно конкретным вариантам реализации иммуносупрессию, индуцируемую соединениями галогенов или халькогенидов, оценивают путем измерения пролиферации T-клеток, например, в ответ на активацию антигенпрезентирующих клеток. Представляя собой по существу реакцию смешанных лимфоцитов, указанный анализ используется факт, заключающийся в том, что воздействие на T-клетки презентированными антигенами приводит к активации Т-клеток и их пролиферации, а также способствует увеличению синтеза ДНК. МКПК выделяли от двух доноров, и затем образцы разделяли на две группы; одну группу облучали, а вторую нет. Облучение приводит к презентации многочисленных антигенов антигенпрезентирующим клеткам, соответственно, облученные клетки служить в качестве мощных активаторов T-клеток. при смешивании облученных клеток с необлученными наблюдается выраженная пролиферация Т-клеток. Указанная пролиферация может быть измерена с применением любого анализа пролиферации, как хорошо известно специалистам в данной области техники. Согласно одному варианту реализации пролиферацию оценивают путем измерения синтеза ДНК. Смешанные МКПК культивировали в присутствии или в отсутствие соединений галогена или халькогенида в течение 5 дней, и затем активировали меченым тритием тимидином в течение 18 часов для мечения вновь синтезированной ДНК. Уровень мечения непосредственно коррелирует с уровнем активации Т-клеток, соответственно, низкие уровни мечения коррелируют с иммуносупрессией.
Согласно некоторым вариантам реализации иммуносупрессию за счет соединения галогена или халькогенида оценивают с применением указанного анализа; обнаружено, что соединение галогена приводит к уменьшению включения меченого тритием тимидина на 10%, указывая, соответственно, на 10% иммуносупрессию. Согласно некоторым вариантам реализации лечение соединением галогена описанным способом приводит к 20% иммуносупрессии, или 30%, 40%, 50%, 60%, 70%, 80%, 90%, или 100% иммуносупрессии. Согласно конкретным вариантам реализации соединение галогена содержит йодид. Согласно конкретным вариантам реализации соединение халькогенида, которое индуцирует иммуносупрессию, содержит селенид или сульфид.
Согласно определенным вариантам реализации способов, предложенных в настоящем изобретении, количество или эффективное количество соединения галогена, введенное в биологический материал, например, введенное млекопитающему или в ткань млекопитающего, составляет приблизительно, по меньшей мере, по меньшей мере приблизительно или максимум приблизительно 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1; 2; 3; 4; 5; 6; 7; 8; 9; 10; 11; 12; 13; 14; 15; 16; 17; 18; 19; 20; 21; 22; 23; 24; 25; 26; 27; 28; 29; 30; 31; 32; 33; 34; 35; 36; 37; 38; 39; 40; 41; 42; 43; 44; 45; 46; 47; 48; 49; 50; 51; 52; 53; 54; 55; 56; 57; 58; 59; 60; 61; 62; 63; 64; 65; 66; 67; 68; 69; 70; 71; 72; 73; 74; 75; 76; 77; 78; 79; 80; 81; 82; 83; 84; 85; 86; 87; 88; 89; 90; 91; 92; 93; 94; 95; 96; 97; 98; 99; 100; 110; 120; 130; 140; 150; 160; 170; 180; 190; 200; 210; 220; 230; 240; 250; 260; 270; 280; 290; 300; 310; 320; 330; 340; 350; 360; 370; 380; 390; 400; 410; 420; 430; 440; 441; 450; 460; 470; 480; 490; 500; 510; 520; 530; 540; 550; 560; 570; 580; 590; 600; 610; 620; 630; 640; 650; 660; 670; 680; 690; 700; 710; 720; 730; 740; 750; 760; 770; 780; 790; 800; 810; 820; 830; 840; 850; 860; 870; 880; 890; 900; 910; 920; 930; 940; 950; 960; 970; 980; 990; 1000 мг, мг/кг, или мг/м2, или соответствует значениям в пределах любого основанного на указанных значениях диапазона. Как вариант, указанное количество может быть выражено как 0,1; 0,5; 1; 2; 3; 4; 5; 6; 7; 8; 9; 10; 11; 12; 13; 14; 15; 16; 17; 18; 19; 20; 21; 22; 23; 24; 25; 26; 27; 28; 29; 30; 31; 32; 33; 34; 35; 36; 37; 38; 39; 40; 41; 42; 43; 44; 45; 46; 47; 48; 49; 50; 51; 52; 53; 54; 55; 56; 57; 58; 59; 60; 61; 62; 63; 64; 65; 66; 67; 68; 69; 70; 71; 72; 73; 74; 75; 76; 77; 78; 79; 80; 81; 82; 83; 84; 85; 86; 87; 88; 89; 90; 91; 92; 93; 94; 95; 96; 97; 98; 99; 100; 110; 120; 130; 140; 150; 160; 170; 180; 190; 200; 210; 220; 230; 240; 250; 260; 270; 280; 290; 300; 310; 320; 330; 340; 350; 360; 370; 380; 390; 400; 410; 420; 430; 440; 441; 450; 460; 470; 480; 490; 500; 510; 520; 530; 540; 550; 560; 570; 580; 590; 600; 610; 620; 630; 640; 650; 660; 670; 680; 690; 700; 710; 720; 730; 740; 750; 760; 770; 780; 790; 800; 810; 820; 830; 840; 850; 860; 870; 880; 890; 900; 910; 920; 930; 940; 950; 960; 970; 980; 990; 1000 мМ или M, или соответствует значениям в пределах любого основанного на указанных значениях диапазона.
Согласно определенным вариантам реализации способов согласно настоящему изобретению указанное соединение галогена содержит йод или йодид, например, NaI, и указанное эффективное количество составляет от приблизительно или более 150 мкг, приблизительно или более 300 мкг, приблизительно или более 500 мкг, приблизительно или более 1 мг, приблизительно или более 2 мг, приблизительно или более 5 мг, приблизительно или более 10 мг, приблизительно или более 15 мг, или приблизительно или более 20 мг. Согласно определенным вариантам реализации эффективное количество составляет от 150 мкг до 1000 мг, от 300 мкг до 1000 мг, от 500 мкг до 1000 мг, от 1 мг до 1000 мг, от 2 мг до 1000 мг, от 5 мг до 1000 мг, от 10 мг до 1000 мг, от 150 мкг до 100 мг, от 300 мкг до 100 мг, от 500 мкг до 100 мг, от 1 мг до 100 мг, от 2 мг до 100 мг, от 5 мг до 100 мг или от 10 мг до 100 мг. Согласно определенным вариантам реализации эффективное количество составляет от 150 мкг до 50 мг, от 300 мкг до 20 мг, от 500 мкг до 10 мг, от 1 мг до 20 мг, от 1 мг до 10 мг, или приблизительно 5 мг, приблизительно 10 мг, приблизительно 15 мг или приблизительно 20 мг.
Согласно конкретным вариантам реализации любого из способов согласно настоящему изобретению, биологический материал, например, субъект, получает лечение или контактирует с эффективным количеством композиции или соединения согласно настоящему изобретению, при этом указанное эффективное количество составляет от приблизительно 0,01 мг/кг до приблизительно 20 мг/кг, от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 2 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 1 мг/кг, приблизительно 0,5 мг/кг, приблизительно 0,6 мг/кг, приблизительно 0,7 мг/кг, приблизительно 0,8 мг/кг, приблизительно 0,9 мг/кг, приблизительно 1,0 мг/кг, приблизительно 1,1 мг/кг или приблизительно 1,2 мг/кг.
Согласно конкретным вариантам реализации эффективное количество йода или йодид представляет собой количество по меньшей мере или приблизительно в два раза, в три раза, в четыре раза, в пять раз, в шесть раз, в семь раз, в восемь раз, в девять раз, в 10 раз, в 12 раз, в 15 раз, или в 20 раз превышающее приведенные ниже рекомендуемые среднесуточные количества. Согласно конкретным вариантам реализации эффективное количество йода или йодида представляет собой количество, превышающее приведенные ниже рекомендуемые среднесуточные количества йода в 2–20 раз, 5–15 раз или в 5–10 раз.
|
1Информационный бюллетень по йоду отдела пищевых добавок НИЗ для потребителей, редакция 24 июня 2011 г., в силе с 2013 г.
Согласно конкретным вариантам реализации любого из способов, предложенных в настоящем изобретении, указанные способы дополнительно включают измерение или определение количества или концентрации соединения галогена, присутствующего в биологическом материале или у субъекта, лечение которого проводится (например, концентрация в кровотоке субъекта), с последующим введением в указанный биологический материал или субъекту количества композиции, содержащей соединение галогена, для обеспечения требуемого общего количества или концентрации соединения галогена в указанном биологическом материале или у субъекта, при этом указанное общее количество или концентрация включает как количество или концентрацию, измеренную или определенную в указанном биологическом материале или у субъекта, так и количество, введенное в указанный биологический материал или субъекту. Согласно конкретным вариантам реализации указанное требуемое общее количество представляет собой эффективное количество для лечения или предотвращения заболевания или повреждения, которым страдает субъект, или эффективное количество для предотвращения воспаления или отторжения трансплантированного органа. Согласно определенным вариантам реализации способов, предложенных в настоящем изобретении, соединение галогена содержит йод, например, NaI, и эффективное количество составляет от приблизительно 0,01 мг/кг до приблизительно 20 мг/кг, от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 2 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 1 мг/кг, приблизительно 0,5 мг/кг, приблизительно 0,6 мг/кг, приблизительно 0,7 мг/кг, приблизительно 0,8 мг/кг, приблизительно 0,9 мг/кг, приблизительно 1,0 мг/кг, приблизительно 1,1 мг/кг или приблизительно 1,2 мг/кг. Согласно определенным вариантам реализации указанное соединение галогена содержит йод, и эффективное количество представляет собой количество, приблизительно равное концентрации или количеству, достигаемому за счет эффективного количества йода, по меньшей мере или приблизительно в два раза, в три раза, в четыре раза, в пять раз, в шесть раз, в семь раз, в восемь раз, в девять раз, в 10 раз, в 12 раз, в 15 раз или в 20 раз превышающего приведенные ниже рекомендуемые среднесуточные количества. Согласно конкретным вариантам реализации эффективное количество йода или йодида представляет собой количество, в 2–20 раз, 5–15 раз или 5–10 раз превышающее приведенные ниже рекомендуемые среднесуточные количества йода.
|
1Информационный бюллетень по йоду для потребителей отдела пищевых добавок НИЗ, редакция 24 июня 2011 г., в силе с 2013 г.
Согласно дополнительным вариантам реализации при введении композиции, содержащей соединение галогена, в комбинации с одним или большим числом дополнительных активных агентов (или содержащей их композицией), количество или эффективное количество дополнительного активного агента соответствует любой из концентраций или дозировок, описанных в настоящем документе в отношении соединения галогена. Кроме того, указанный дополнительный активный агент может вводиться любым из способов, описанных в настоящем документе для содержащей соединение галогена указанной композиции. Кроме того, указанная композиция, содержащая соединение галогена, и указанная композиция, содержащая дополнительный активный агент, например, халькоген, такой как сульфид или селенид, можно вводить субъекту в одно и то же время, в разное время или на протяжении перекрывающихся периодов времени.
Согласно конкретным вариантам реализации с тех случаях, когда композиция содержит глутатион и соединения галогена и/или халькогенида, указанные соединения галогена и халькогенида (в случае присутствия) вводят в любых описанных в настоящем документе количествах для каждого активного агента. Согласно определенным вариантам реализации глутатион присутствует в количестве, достаточном для ингибирования окисления халькогенида и/или соединения галогена, в том числе в количестве, попадающем в любые диапазоны, описанные в настоящем документе. Согласно конкретным вариантам реализации указанное соединение галогена представляет собой йодид, например, NaI, и указанный халькогенид представляет собой сульфид или селенид.
Согласно конкретным вариантам реализации согласно настоящему изобретению, эффективное количество композиции вводят в биологический материал, например, в ткань или в организм субъекта, до реперфузии, например, в течение по меньшей мере одной, двух, трех, четырех, пяти или 10 минут из 10 минут или 30 минут, непосредственно предшествующих ишемии или реперфузии. Согласно конкретным вариантам реализации введение указанной композиции приводит к уменьшению ишемического или реперфузионного повреждения. Согласно определенным вариантам реализации указанное реперфузионное повреждение соответствует менее чем 80%, менее чем 70%, менее чем 60%, менее чем 50%, менее чем 40%, или менее чем 30% реперфузионного повреждения в отсутствие лечения указанной композицией.
Согласно конкретным вариантам реализации обработки биологического материала, т.е. лечения субъекта, композицией согласно настоящему изобретению после повреждения, например, сердечного приступа или инсульта, приводит к уменьшению повреждения, например, размера зоны инфаркта. Согласно определенным вариантам реализации указанное повреждение или размер зоны инфаркта соответствует менее чем 80%, менее чем 70%, менее чем 60%, менее чем 50%, менее чем 40%, или менее чем 30% тяжести или размера зоны инфаркта в отсутствие лечения указанной стабильной композицией.
Согласно конкретным вариантам реализации обработка биологической материи, например, лечение субъекта в пределах 10 минут, в пределах 30 минут, в пределах одного часа, или в пределах двух часов от сердечного приступа композицией согласно настоящему изобретению приводит к уменьшению повреждения сердца или увеличению фракции укорочения или улучшению функции левого желудочка по сравнению с отсутствием лечения указанной композицией. Согласно конкретным вариантам реализации указанное уменьшение повреждения сердца составляет по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, или по меньшей мере 50% по сравнению с отсутствием лечения указанной композицией. Уменьшение повреждения сердца может быть детектировано с помощью оценки уровней специфического сердечного белка, сердечного тропонина I, в крови субъекта после лечения. Согласно конкретным вариантам реализации увеличение фракции укорочения или улучшение функции левого желудочка составляет по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, или по меньшей мере 50% по сравнению с отсутствием лечения указанной композицией.
Согласно определенным вариантам реализации настоящим изобретением охвачен способ уменьшения воспаления в сердце субъекта, например, млекопитающего, после сердечного приступа, путем введения субъекту композиции согласно настоящему изобретению. Согласно определенным вариантам реализации указанное уменьшение воспаления сердца составляет по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, или по меньшей мере 50% по сравнению с воспалением в отсутствие лечения указанной композицией.
Согласно различным вариантам реализации способов, предложенных в настоящем изобретении, на биологический материал, например, на орган, на субъекта или его ткань воздействуют композицией согласно настоящему изобретению на протяжении приблизительно, по меньшей мере, по меньшей мере приблизительно или максимум приблизительно 30 секунд, 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 минут, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 часов, 1, 2, 3, 4, 5, 6, 7 дней или более, или в течение времени, попадающего в любой диапазон в пределах указанных значений или соответствующего комбинации указанных значений.
Далее, при введении композиции в соответствии с настоящим изобретением внутривенно или путем инфузии, предполагается, что могут быть использованы следующие параметры: скорость введения, составляющая приблизительно, по меньшей мере приблизительно или максимум приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100 капель в минуту или микрокапель/минуту, или соответствующая значениям в пределах любого основанного на указанных значениях диапазона. Согласно некоторым вариантам реализации количество указанной композиции представлено объемом, зависящим от концентрации соединения галогена, присутствующего в указанной композиции. Продолжительность времени может составлять приблизительно, по меньшей мере приблизительно или максимум приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60 минут, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 часов, 1, 2, 3, 4, 5, 6, 7 дней, 1, 2, 3, 4, 5 недель, и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев, или соответствует значениям в пределах любого основанного на указанных значениях диапазона.
В целом или за один сеанс можно вводить объемы, составляющие 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 441, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, 1000 мл или л, или попадающие в любой диапазон в пределах указанных значений.
В соответствии с различными вариантами реализации способов согласно настоящему изобретению в биологический материал вводят композицию согласно настоящему изобретению, например, внутривенно, внутрикожно, внутриартериально, внутрибрюшинно, внутрь очага поражения, интракраниально, внутрисуставно, внутрь предстательной железы, внутриплеврально, внутритрахеально, интраназально, интравитреально, интравагинально, внутриректально, местно, внутрь опухоли, внутримышечно, внутрибрюшинно, интраокулярно, подкожно, подконъюнктивально, интраваскулярно, через слизистую оболочку, интраперикардиально, интраумбиликально, интраокулярно, перорально, местно, локально, путем инъекции, путем инфузии, путем непрерывной инфузии, путем абсорбции, путем адсорбции, путем погружения, путем локализованной перфузии, через катетер или путем лаважа. Согласно конкретным вариантам реализации ее вводят парентерально, например, внутривенно, или путем вдыхания. «Парентеральный» относится к любому способу введения вещества не через пищеварительный тракт. Согласно конкретным вариантам реализации соединение галогена вводят субъекту путем внутривенного введения или инфузии.
Согласно определенным вариантам реализации способ или композицию согласно настоящему изобретению используют для лечения или предотвращения заболевания или повреждения, выбранного из любого из следующих, или вызванного или обусловленного чем-либо из перечисленного: абляционная терапия, адреналектомия, аневризма аорты, хирургия корня аорты, аортальный стеноз, порок клапана аорты, аритмия, атеросклероз, трепетание предсердий, фибрилляция предсердий, дефект межпредсердной перегородки, артериовенозная мальформация, хирургия головного мозга в сознании, бариатрическая хирургия, трансплантация костного мозга, повреждения плечевого сплетения, брадикардия, аневризма головного мозга, хирургическое увеличение молочной железы, хирургическое уменьшение молочной железы, ожоговая травма, операция коронарного шунтирования, коронарная болезнь сердца, абляционная терапия сердца, катетеризация сердца, ресинхронизирующая сердечная терапия, хирургия сердца, кардиомиопатия, хирургия сердца, заболевания сердечно-сосудистой системы, каротидная ангиопластика и стентирование, коарктация аорты, врожденный порок сердца, операция коронарного шунтирования, коронарная болезнь сердца, медицина критических состояний, хроническая обструктивная болезнь легких, протезирование локтевого сустава, неотложная медицинская помощь, терапия внутренних болезней, общая хирургия, желудочно-кишечное кровотечение, сердечный приступ, трансплантация сердца, хирургия клапанов сердца, протезирование тазобедренного сустава, гипертрофическая кардиомиопатия, гипоксическая ишемическая энцефалопатия, гистерэктомия, хирургическое формирование илеоанального анастомоза (J-образного резервуара), воспалительное заболевание кишечника, ишемическая болезнь сердца, ишемически-реперфузионное повреждение, синдром раздраженного кишечника, челюстная хирургия, трансплантация почки, гортанно-трахеальная хирургическая реконструкция, трансплантация печени, операция по уменьшению объема легких, трансплантация легкого, минимально инвазивная хирургия сердца, нейрохирургия, челюстно-лицевая и оральная хирургия, ортопедическая хирургия, трансплантация поджелудочной железы, панкреатит, частичная нефрэктомия, хирургия шейного отдела позвоночника в педиатрии, педиатрическая хирургия, опущение тазовых органов, пластическая и реконструктивная хирургия, пульмонология и медицина критических состояний, атрезия легочной артерии, изоляция легочной вены, выпадение прямой кишки, рестриктивная кардиомиопатия, отслоение сетчатки, ретинопатия недоношенных, роботизированная хирургия, повреждение спинного мозга, спонтанное расслоение коронарной артерии, спонтанная окклюзия виллизиева круга, инсульт, применение телемедицины при инсульте (телеинсульт), внезапная остановка сердца, стереотаксическая радиохирургия, хирургическое вмешательство, хроническая сердечная недостаточность, систолическая сердечная недостаточность, тахикардия, гипертрофическая кардиомиопатия, аневризма грудного отдела аорты, торакальная хирургия, полная артропластика локтевого сустава, болезнь трикуспидального клапана, язвенный колит, клапансохраняющая реконструкция корня аорты, сосудистая и эндоваскулярная хирургия, сосудистая медицина или желудочковая тахикардия.
Согласно определенным вариантам реализации указанное повреждение или заболевание выбрано, обусловлено или вызвано чем-либо из перечисленного: воспаление, сердечный приступ, операция коронарного шунтирования, ишемия, ишемия ЖКТ, ишемия печени, ишемия почек, гипоксически-ишемическая энцефалопатия, инсульт, травматическое повреждение головного мозга, ишемия конечностей, ишемия глаза, сепсис, воздействие дыма, ожог, реперфузия или острое повреждение легких. Согласно определенным вариантам реализации указанное повреждение представляет собой инфаркт, вызванный сердечным приступом или инсультом. Согласно конкретным вариантам реализации указанное повреждение вызвано операцией коронарного шунтирования, необязательно – шунтированием коронарных артерий (ШКА). Согласно одному варианту реализации указанное заболевание представляет собой гипоксически-ишемическую энцефалопатию.
Устройства для доставки
Согласно дополнительным вариантам реализации настоящим изобретением охвачено устройство для доставки лекарственного средства, разработанное для ограничения, предотвращения или ингибирования окисления восстановленной формы активного агента, такого как, например, восстановленная форма соединения галогена или восстановленная форма халькогенида. Согласно конкретным вариантам реализации указанное устройство поддерживает в восстановленной форме активный агент. Согласно конкретным вариантам реализации указанное устройство содержит восстановленную форму активного агента, например, восстановленную форму соединения галогена или халькогенида. Согласно конкретным вариантам реализации указанное устройство для лекарственного средства содержит композицию согласно настоящему изобретению.
Применение подготовленных производителем заранее смешанных готовых к употреблению продуктов целесообразно с точки зрения безопасности лекарственных средств для внутривенного введения, поскольку это устраняет возможность ошибок, связанных с измерением и разведением внутривенных или инфузируемых лекарственных средств. Соответственно, согласно определенным вариантам реализации настоящим изобретением охвачено устройство для доставки лекарственного средства для введения готового к употреблению продукта, содержащего восстановленную форму активного агента. Согласно конкретным вариантам реализации восстановленная форма активного агента представляет собой восстановленную форму соединения галогена и/или халькогенида, например, селенид или сульфид.
Согласно родственным вариантам реализации настоящее изобретение включает контейнер, содержащий эффективное количество композиции согласно настоящему изобретению или эффективное количество соединения галогена. Указанное эффективное количество может быть представлено в жидкой форме, например, активный агент может быть растворен в растворе, или может быть представлен сухой формой (например, высушен, лиофилизирован или сублимирован), позволяющей растворять указанный активный агент в растворе перед введением субъекту.
Следует понимать, что во всех вариантах реализации композиций согласно описанию в настоящем документе указанная композиция может представлять собой фармацевтическую композицию.
Кроме того, следует понимать, что традиционные способы доставки активных агентов, которые могут включать закачку воздуха во флакон, содержащий активный агент, в процессе набирания активного агента в шприц или пакет, могут приводить к нежелательному окислению активного агента, который находится в восстановленной форме. Соответственно, настоящее изобретение включает устройства для доставки, минимизирующие или предотвращающие контакт активного агента с кислородом во время введения субъекту.
Согласно одному варианту реализации настоящим изобретением охвачено устройство для доставки лекарственного средства, содержащее:
резервуар для композиции согласно настоящему изобретению, т.е. содержащей соединение галогена или восстановленную форму соединения галогена, отдельно или в комбинации с одним или большим числом дополнительных активных агентов, таких как, например, халькогенид или восстановленная форма халькогенида, например, сульфид или селенид; и
гидравлический передающий механизм, выполненный с возможностью сохранения по меньшей мере 90% указанной восстановленной формы активного агента в указанной композиции в восстановленной форме во время введения субъекту. Согласно конкретным вариантам реализации он выполнен с возможностью сохранения по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% указанной восстановленной формы активного агента в восстановленной форме во время введения субъекту. Согласно определенным вариантам реализации указанный гидравлический передающий механизм гидравлически соединен с указанным резервуаром. Согласно другим вариантам реализации он может быть гидравлически соединен с указанным резервуаром.
Согласно определенным вариантам реализации указанный резервуар непроницаем для кислорода и/или образован непроницаемым для кислорода полимером. Согласно определенным вариантам реализации указанный резервуар содержит непроницаемый для кислорода слой, например, на внутренней поверхности, который может содержать: полиэтилен (LDPE), полистирол (PS), полиэтилен (PE), поликарбонат (PC), поливинил ацетат (ПВА), АПЭТ, поливинилхлорид (PVC), нейлон 6 (Ny6), поливинилфторид (ПВФ), поливинилиденхлорид (ПВДХ), полиацетонитрил (ПАН), этиленвиниловый спирт (ЭВС) или поливиниловый спирт (ПВС). Согласно определенным вариантам реализации коэффициент пропускания кислорода указанного полимера составляет менее 10-10 [см3(STP)/см/(см2+с+Па)]. Согласно родственным вариантам реализации он составляет менее 10-9, менее 10-8 или менее 10-7 [см3(STP)/см/( см 2+с+Па)]. Согласно родственным вариантам реализации указанный резервуар включает несколько слоев непроницаемых для кислорода полимеров.
Согласно конкретным вариантам реализации указанный резервуар содержит повторно герметизируемый порт. Повторно герметизируемый порт может использоваться для введения раствора, содержащего терапевтический агент, такой как восстановленная форма соединения галогена и/или восстановленная форма халькогенида, в указанный резервуар. Повторно герметизируемый порт может применяться для соединения с гидравлическим передающим механизмом. Согласно конкретным вариантам реализации указанный резервуар включает совокупность повторно герметизируемых портов. Согласно определенным вариантам реализации указанный резервуар представляет собой бутыль, пакет, пробирку, флакон или шприц. Согласно конкретным вариантам реализации он представляет собой внутривенный пакет или шприц. Согласно конкретным вариантам реализации он представляет собой трубчатый элемент, включающий пробку, выполненную с возможностью герметичного закрытия указанного трубчатого элемента. Согласно одному варианту реализации указанный трубчатый элемент представляет собой пробирку Хангейта.
Согласно конкретным вариантам реализации указанный гидравлический передающий механизм выполнен с возможностью гидравлического соединения с резервуаром через повторно герметизируемый порт. Согласно родственным вариантам реализации указанный гидравлический передающий механизм выполнен с возможностью внутривенной доставки активного агента, например, восстановленной формы соединения галогена и/или восстановленной формы халькогенида из резервуара нуждающемуся в этом субъекту. Согласно определенному варианту реализации указанный гидравлический передающий механизм включает по меньшей мере что-либо одно из иглы и канюли.
Согласно определенным вариантам реализации указанное устройство, в том числе гидравлический передающий механизм, используют в условиях пониженного содержания кислорода или в бескислородной среде. Согласно конкретным вариантам реализации указанная среда с пониженным содержанием кислорода или бескислородная среда обеспечивается в пределах контейнера, при этом указанный контейнер необязательно представляет собой пакет или эластичный контейнер, например, позволяющий производить манипуляции с компонентами устройства через пакет, например, подсоединение гидравлического передающего механизма к резервуару согласно вариантам реализации, при которых они изначально не были соединены. Согласно конкретному варианту реализации указанный контейнер содержит один или большее количество непроницаемых для кислорода полимеров, в том числе любые из описанных выше. Согласно конкретным вариантам реализации стенки указанного контейнера содержат несколько слоев из одного или нескольких непроницаемых для кислорода полимеров.
Согласно конкретным вариантам реализации указанное устройство содержит в резервуаре композицию, содержащую восстановленную форму соединения галогена и/или халькогенида. Согласно определенным вариантам реализации указанная восстановленная форма соединения галогена представляет собой йодид, например, йодид натрия, йодид калия или йодид водорода, и/или указанная восстановленная форма халькогенида представляет собой H2Se, Na2Se или NaHSe, или сульфидное соединение.
Согласно конкретным вариантам реализации указанное устройство обеспечивает доставку восстановленной формы активного агента, например, восстановленной формы соединения галогена, такого как йодид, и/или восстановленной формы халькогенида, такого как селенид или сульфид, отличающуюся тем, что по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% указанного активного агента вводят субъекту в восстановленной форме.
Настоящее изобретение также включает способ уменьшения повреждения или лечения заболевания у субъекта путем введения указанному субъекту композиции согласно настоящему изобретению, причем указанную композицию вводят указанному субъекту с применением устройства согласно настоящему изобретению. Согласно конкретным вариантам реализации указанное повреждение или заболевание представлено любым из описанных в настоящем документе, в том числе, но не ограничиваясь перечисленными, повреждение, обусловленное ишемией или реперфузией. Согласно конкретным вариантам реализации указанное повреждение представляет собой инфаркт, вызванный сердечным приступом или инсультом, или хронической сердечной недостаточностью. Согласно другим вариантам реализации указанное повреждение вызвано воспалением. Согласно определенным вариантам реализации указанную композицию, содержащую соединение галогена, вводят субъекту с применением устройства согласно описанию в настоящем документе. Согласно определенным вариантам реализации в том случае, если указанная композиция, содержащая соединение галогена, также содержит дополнительный терапевтический агент или в том случае, если указанную композицию, содержащую соединение галогена, вводят в комбинации с композицией, содержащей дополнительный активный агент, такой как восстановленная форма халькогенида, при этом указанная композиция, содержащая соединение галогена, и/или указанная другая композиция вводятся с применением устройства согласно описанию в настоящем документе.
Кроме того, настоящее изобретение также включает способ доставки нуждающемуся в этом пациенту композиции, содержащей восстановленную форму активного агента, отличающийся тем, что указанная композиция содержит соединение галогена, и включающий:
размещение указанной композиции, содержащей восстановленную форму активного агента, в резервуар, выполненный с возможностью поддержания активного агента в восстановленной форме;
установление гидравлического соединения между резервуаром и субъектом;
доставку заданного объема указанной композиции из резервуара субъекту в среде, по существу не содержащей кислорода.
Согласно конкретным вариантам реализации устройство согласно настоящему изобретению содержит: (1) внутривенный пакет, содержащий композицию согласно настоящему изобретению, отличающийся тем, что указанный внутривенный пакет непроницаем для кислорода; и (2) трубчатый элемент, отличающийся тем, что один конец указанного трубчатого элемента соединен с внутривенным пакетом через порт во внутривенном пакете, или тем, что один конец указанного трубчатого элемента может быть соединен с внутривенным пакетом через порт во внутривенном пакете, отличающийся тем, что второй конец указанного трубчатого элемента соединен с иглой или канюлей, или тем, что второй конец указанного трубчатого элемента может быть соединен с иглой или канюлей, при этом указанное устройство размещено в пакете, содержащем восстановленный кислород или бескислородную среду. Согласно конкретным вариантам реализации указанный внутривенный пакет и/или указанный пакет содержит(ат) один или большее количество непроницаемых для кислорода полимеров согласно описанию в настоящем документе. Согласно конкретным вариантам реализации указанный пакет отличается гибкостью, например, обеспечивающей пользователю возможность соединения трубчатого элемента с внутривенным пакетом и/или иглой, причем указанное устройство остается герметично закрытым в пакете.
Согласно конкретным вариантам реализации устройство согласно настоящему изобретению содержит: (1) внутривенный пакет, содержащий композицию согласно настоящему изобретению, отличающийся тем, что указанный внутривенный пакет непроницаем для кислорода; и (2) трубчатый элемент, отличающийся тем, что один конец указанного трубчатого элемента соединен с внутривенным пакетом через порт во внутривенном пакете, или один конец указанного трубчатого элемента может быть соединен с внутривенным пакетом через порт во внутривенном пакете, и тем, что второй конец указанного трубчатого элемента соединен с иглой или канюлей, или второй конец указанного трубчатого элемента может быть соединен с иглой или канюлей, причем указанное устройство находится в пакете, содержащем восстановленный кислород или бескислородную среду. Согласно конкретным вариантам реализации указанный внутривенный пакет и/или указанный пакет содержит(ат) один или большее количество непроницаемых для кислорода полимеров согласно описанию в настоящем документе. Согласно конкретным вариантам реализации указанный пакет отличается гибкостью, обеспечивая пользователю возможность соединения указанного трубчатого элемента с внутривенным пакетом и/или иглой, причем указанное устройство остается герметично закрытым в пакете, и применения давления для инициации течения указанной композиции из внутривенного пакета через указанный трубчатый элемент в направлении иглы или канюли, или внутрь иглы или канюли.
Согласно конкретным вариантам реализации устройство согласно настоящему изобретению содержит: (1) шприц, содержащий композицию согласно настоящему изобретению, отличающийся тем, что указанный шприц непроницаем для кислорода; и (2) иглу или канюлю, отличающуюся тем, что указанная игла или канюля соединена с указанным шприцом через порт в шприце, или тем, что указанную иглу или канюлю можно присоединить к указанному шприцу через порт в шприце, причем указанное устройство находится в пакете, содержащем среду с пониженным содержанием кислорода или бескислородную среду. Согласно конкретным вариантам реализации указанный шприц и/или указанный пакет содержит(ат) один или большее количество непроницаемых для кислорода полимеров согласно описанию в настоящем документе. Согласно конкретным вариантам реализации указанный пакет отличается гибкостью, обеспечивая пользователю возможность соединения указанной иглы или канюли со шприцом, причем указанное устройство остается герметично закрытым в пакете, и воздействия на шприц давлением для инициации течения стабильной композиции внутрь иглы или канюли.
Согласно конкретным вариантам реализации указанное устройство содержит терапевтически эффективное количество агента или композиции согласно настоящему изобретению.
примеры
Пример 1
йодид натрия улучшает исход при инфаркте миокарда
Указанный пример демонстрирует, что йодид натрия (NaI) улучшает исход в модели сердечного приступа на мышах за счет уменьшения размера зоны инфаркта.
Для изучения эффекта NaI на размер зоны инфаркта при инфаркте миокарда в модели сердечного приступа на мышах проводили лигирование левой нисходящей коронарной артерии мышей со вскрытием грудной клетки (LAD-лигирование). Через 55 минут после инициации ишемии в бедренную вену каждой мыши инъецировали либо основу (физиологический раствор), либо экспериментальный агент (NaI). Сердечную мышцу реперфузировали, снимая лигатуру через 60 минут после инициации ишемии. Через 2 часа реперфузии размер зоны инфаркта измеряли с применением морфометрии (фиг. 1). В указанном исследовании использовали пять групп мышей, в том числе получающая основу – физиологический раствор группа (n=3) и пять экспериментальных групп, которые получали 0,25 мг/кг (n=4), 0,5 мг/кг (n=5), 1 мг/кг (n=5) или 2 мг/кг (n=6) NaI. Для подтверждения того, что все животные в указанном исследовании получали аналогичное лечение, определяли зону риска (AAR) в виде доли от левого желудочка (фиг. 1). Зону риска (AAR) и размер зоны инфаркта (Inf) измеряли с применением специфических красителей ТТХ и эванс голубой. Получали несмещенным образом обработанные изображения путем задания постоянных пороговых значений, генерировали изображения в ПО Photoshop® и проводили их количественную оценку для получения данных, представленных на фиг. 1.
Результаты указывают на значимое уменьшение размеров зоны инфаркта при сравнении получавшей физиологический раствор группы со всеми 4 экспериментальными группами, которые получали NaI (фиг. 1). Лечение NaI в каждой из протестированных дозировок приводило приблизительно к 70% уменьшению размера зоны инфаркта по сравнению с отдельным применением основы.
Дополнительный тест проводили в тех же условиях, но с применением расширенного диапазона концентраций NaI. Результаты указанного теста также демонстрировали значимое уменьшение размеров зоны инфаркта при сравнении получавшей физиологический раствор группы со всеми 4 экспериментальными группами, которые получали NaI (фиг. 2).
Для определения того, улучшает ли предварительная обработка NaI до сердечного приступа исход сердечного приступа, проводили эксперименты на мышах, осуществляя лигирование со вскрытием грудной клетки, инъецируя либо основу (физиологический раствор), либо экспериментальный агент (NaI) в бедренную вену каждой мыши либо за 5 минут, либо за 48 часов до инициации ишемии. Затем проводили лигирование со вскрытием грудной клетки левой нисходящей коронарной артерии (LAD-лигирование), и сердечную мышцу реперфузировали, снимая лигатуру через 60 минут после инициации ишемии. Через 2 часа реперфузии размер зоны инфаркта измеряли с применением морфометрии согласно описанию выше (фиг. 3). В указанном исследовании использовали 3 группы мышей, в том числе получающую основу – физиологический раствор группу (n=1) и две экспериментальных группы, которые получали 1 мг/кг NaI за 5 минут до LAD-лигирования (n=4) или 1 мг/кг NaI за 48 часов до LAD-лигирования (n=1).
Результаты указывают на значимое уменьшение размеров зоны инфаркта при сравнении получавшей физиологический раствор группы с обеими экспериментальными группами, которые получали NaI (фиг. 3). Для каждой из протестированных дозировок предварительное лечение NaI приводило приблизительно к 70% уменьшению размера зоны инфаркта по сравнению с отдельным применением основы.
Кроме того, защитный эффект NAI подтверждали с помощью эхокардиографии, что показано на фиг. 4. Выполняли трансторакальную эхокардиографию левого желудочка (LV) in vivo с применением сканирующей головки RMV Scanhead 30 МГц в сочетании с системой Vevo 770 (Visualsonics) и получали двухмерные эхокардиографические изображения. Конечно-диастолический диаметр LV (EDD) и LV конечно-систолический диаметр (ESD) вычисляли за сутки до исходного момента, и через 1 и 4 недели после ишемии и реперфузии миокарда. Вычисляли процент фракции укорочения LV (FS) и фракции выброса LV (EF).
Пример 2
глутатион стабилизирует селенид
Чтобы продемонстрировать, что глутатион предотвращает окисление селенида, получали 50 мМ растворы селенида в воде или 150 мМ GSH, и наблюдали в течение 8 минут непосредственно после получения. На фиг. 5 окисленные формы селенида в растворах остаются темными, при этом наблюдается очевидное уменьшение уровней окисления образцов в глутатионе в каждый момент времени.
Пример 3
иммуносупрессорные свойства соединений галогенов и халькогенидов
Чтобы продемонстрировать иммуносупрессорные свойства йодида и селенида, брали кровь у двух доноров (A и B) и выделяли из крови мононуклеарные клетки периферической крови (МКПК). МКПК либо облучали 3500 рад (Ax и Bx), либо не облучали (A и B). Облученные и необлученные МКПК от каждого пациента смешивали (по 100 000 от каждого пациента) и помещали в культуральную среду, содержащие различные количества циклоспорина A (CSA, положительный контроль), йодида (Iod), селенида (Sel) или только среды в течение 5 дней. Конкретные количества каждого соединения показаны на фиг. 6. После указанного инкубирования клетки активировали меченным тритием тимидином в течение 18 часов для определения уровня синтеза ДНК. Клетки лизировали, лизат фильтровали для захвата ДНК на фильтре; фильтры анализировали в сцинцилляционном счетчике. Регистрировали представленные на фиг. 7 количества включенного трития. МКПК от донора A, не смешанные с другими клетками или смешанные с облученными МКПК от донора A, служили в качестве отрицательного контроля; аналогичным образом получали отрицательный контроль для донора B. В качестве положительного контроля служили МКПК от A, смешанные с Bx, или наоборот. Все концентрации селенида уменьшали уровень мечения до контрольных уровней. Йодид в максимальной концентрации уменьшал уровень мечения. Другие показали, что уровень мечения прямо коррелировал со степенью активации Т-клеток. Низкие уровни мечения коррелируют с иммуносупрессией. Указанные эксперименты демонстрируют, что селенид и йодид отказывают иммуносупрессивные эффекты.
Пример 4
йодид натрия улучшает исход при инфаркте миокарда
Указанный пример демонстрирует, что лечение йодидом натрия (NaI) в питьевой воде за два дня до индуцирования инфаркта улучшает исход в модели сердечного приступа на мышах.
Для изучения эффекта предварительного лечения содержащей NaI питьевой водой на размер зоны инфаркта при инфаркте миокарда в модели сердечного приступа на мышах, мышам в трех группах предоставляли питьевую воду, содержащую различные концентрации йодида для обеспечения дозировок, составляющих 0,07 мг/кг/день (обычная питьевая вода) для первой группы; 0,77 мг/кг/день для второй группы; или 7,07 мг/кг/день для третьей группы, на протяжении двух дней непосредственно до лигирования левой нисходящей коронарной артерии (LAD-лигирование) со вскрытием грудной клетки для инициации ишемии. Мыши в четвертой группе получали обычную питьевую воду в течение двух дней до инициации ишемии, однако через 55 минут после инициации ишемии в бедренную вену каждой из указанные мышей инъецировали либо основу (физиологический раствор), либо экспериментальный агент (NaI). Затем реперфузировали сердечные мышцы мышей, снимая лигатуры через 60 минут после инициации ишемии. Через два часа реперфузии измеряли размер зоны инфаркта с применением морфометрии (фиг. 1). Для подтверждения того, что все животные в указанном исследовании получали аналогичное лечение, определяли зону риска (AAR) в виде доли от левого желудочка (фиг. 8). Зону риска (AAR) и размер зоны инфаркта (Inf) измеряли с применением специфических красителей TTC и эванс голубой. Получали несмещенным образом обработанные изображения путем задания постоянных пороговых значений, генерировали изображения в ПО Photoshop® и проводили их количественную оценку для получения данных, представленных на фиг. 8.
Результаты указывают на значимое уменьшение размеров зоны инфаркта при сравнении с группой, предварительно получавшей обычную воду, с группами, получавшими предварительное лечение водой, содержащей более высокие концентрации йодида (фиг. 8). Указанное уменьшение были несколько ниже или сопоставимы с наблюдаемыми у мышей, которым внутривенно вводили йодид в момент реперфузии.
Пример 5
йодид натрия облегчает хроническую сердечную недостаточность
Указанный пример демонстрирует, что лечение йодидом натрия (NaI) улучшает исход в модели хронической сердечной недостаточности на мышах.
Для изучения эффекта питьевой воды, содержащей NaI, на хроническую сердечную недостаточность после сердечного приступа в модели на мышах, мышам в двух группах предоставляли питьевую воду без йодида, или питьевую воду, содержащую 0,77 мг/кг/день йодида, начиная непосредственно после лигирования левой нисходящей коронарной артерии со вскрытием грудной клетки (LAD-лигирование) для инициации ишемии, и продолжали до окончания исследования, которое продолжалось 12 недель. До LAD-лигирования и через 1 неделю, 2 недели, 4 недели, 8 недель и 12 недель после LAD-лигирования мышей исследовали с помощью эхокардиографии для определения фракции выброса левого желудочка и фракции укорочения левого желудочка. Результаты представлены на фиг. 9. Указанное исследование повторяли согласно описанию выше с большим количеством мышей, и комбинированные результаты обоих исследований показаны на фиг. 10.
Указанные результаты показывают статистически значимое возрастание уменьшения фракции выброса левого желудочка и фракции укорочения левого желудочка в группе, получавшей лечение водой, содержащей 0,77 мг/кг/день йодида по сравнению с группой, получавшей лечение обычной питьевой водой (фиг. 9). Эти результаты демонстрируют, что указанное лечение может применяться для лечения или предотвращения хронической сердечной недостаточности, в том числе хронической сердечной недостаточности после инфаркта миокарда.
Пример 6
йодид натрия эффективен при лечении острого инфаркта миокарда
Указанное исследование демонстрирует эффективность йодида натрия при введении в концентрации 1 мг/кг в виде в/в болюса в модели острого инфаркта миокарда на крысах (ОИМ) путем сравнения значений сердечного тропонина I в плазме (cTpnI) через 4 и 24 ч и размеров зоны инфаркта при инфаркте миокарда через 24 ч при сравнении когорты, получавшей плацебо – только физиологический раствор, и подвергавшейся 30-минутной ишемии, когортой ишемического прекондиционирования (5 мин ишемии/5 мин реперфузии, 3x), подвергавшейся 30-минутной ишемии, и получавшей экспериментальное лечение когортой, получавшей 1 мг/кг NaI в виде в/в болюса и подвергавшейся 30-минутной ишемии.
Методы
Самцы крыс CD® IGS (масса тела 300–450 г) подвергались 30-минутной окклюзии левой нисходящей коронарной артерии (LAD) с последующей реперфузией в течение 24–30 ч. Через 4 ч и через 24–30 ч после реперфузии брали 200–400 мкл крови для измерения уровней cTpnI в плазме посредством ИФА. После взятия пробы крови в момент времени 24–30 ч LAD повторно перекрывали; после в/в введение эванса голубого извлекали сердца. Сердца замораживали в течение ночи, готовили срезы и окрашивали хлоридом трифенилтетразолия для последующего проведения слепого исследования инфаркта.
Подготовка животных и хирургия
Крыс анестезировали смесью кетамина/ ксилазина (100 мг/кг и 10 мг/кг, соответственно) и поддерживали анестезию 2–3% изофлурана в 100% медицинском кислороде после интубирования направляющим ангиокатетером 16 калибра (в/в катетер Terumo® Surflo, 16Gx2”, VWR кат.№ TESR-OX1651CA). Животным проводилась вентиляция легких с применением аппарата ИВЛ для небольших животных Harvard Apparatus, модель 683, оснащенного цилиндром объемом 5 см3 с дыхательным объемом 1,5–2,0 мл/удар и скоростью дыхания 105 ударов в минуту. При расположении крысы на правом боку с операционного поля удаляли шерсть с помощью ножниц и затем очищали с помощью пропитанных спиртом подушечек. Биение сердца визуализировали через стенки грудной клетки и производили дорсовентральный разрез в левой стенке грудной клетки непосредственно над бьющимся сердцем. Подлежащие фасции отсекали, открывая ребра и межреберные мышцы. Затем проводили левую торакотомию в области 4-го межреберного промежутка и ребра разделяли с применением ретракторов Alm (Fine Science Tools, кат. №17008-07). Затем осторожно вскрывают перикард и используют для поддержания легких и вилочковой железы вне операционного поля. Визуализируют левую переднюю нисходящую коронарную артерию и накладывают шов проленовой нитью 5-0, используя коническую иглу RB-2 (Ethicon, кат. №8710H), дважды пропуская нить под артерией на границе ушка левого предсердия, чтобы полностью окружить артерию. Концы нити проводят через трубчатый элемент PU-50 длиной 1 см, и индуцируют ишемию, затягивая нить вокруг трубчатого элемента и фиксируя кровоостанавливающими зажимами. Ишемию подтверждали посредством визуального наблюдения цианоза и акинеза в стенке левого желудочка. Реперфузию обеспечивали, устраняя кровоостанавливающие зажимы и вынимая трубчатый элемент из стенки желудочка, ослабляя таким образом шов вокруг LAD. Реперфузию подтверждали посредством визуализации устранения цианоза стенки желудочка. Шов вокруг LAD оставляли и затем закрывали грудную клетку, стягивая края ребер и зашивая мышцы одним швом шелковой нитью 5-0. После наложения последнего шва в легких временно создавали избыточное давление, закрывая патрубок выдоха аппарата на 3-4 цикла для удаления воздуха из полости грудной клетки. Затем шов затягивали, чтобы закрыть грудную полости, фасции над ребрами и межреберные мышцы зашивали шелковой нитью 5-0; затем зашивали кожу шелковой нитью 5-0. Анестезию прекращали, и отключали животное от аппарата ИВЛ после восстановления самостоятельного дыхания. Эндотрахеальную трубку удаляли после того, как животное приходило в сознание. В течение всей хирургической процедуры животные находились на подогреваемой площадке с циркулирующей водой под нагревательной лампой тепло для поддержания центральной температуры тела. После периода восстановления все животные оставались в клетках под нагревающими лампами вплоть до взятия крови через 4 ч, после чего их переводили обратно в помещение для содержания животных.
Получение образцов плазмы и ИФА-анализ cTpnI
Под изофлурановой анестезией (3% для индукции, 2% для поддержания) брали кровь через 4 ч (из хвоста у ранее не подвергавшихся процедурам животных и из катетеризованной сонной артерии у катетеризованных ранее животных) в гепаринизированные пробирки Microtainer для отделения плазмы (VWR, кат. №VT365985), а пробы через 24–30 ч собирали либо через катетер в сонной артерии (прекатетеризация Charles River) или катетер в яремной вене (имплантированный ранее не подвергавшимся процедурам животным до вскрытия грудной клетки и повторной окклюзии LAD). Кровь центрифугировали при 10,000+ об/мин в течение 5 минут, плазму переносили в микроцентрифужную пробирку объемом 0,5 мл и хранили при -20⁰C.
Уровень сердечного тропонина I измеряли всего в 51 образце плазмы (26 взятых через 4 ч образцах и 25 взятых через 24–30 ч образцах), которые проводили в разведениях 1:50 через набор для высокочувствительного анализа ELISA сердечного тропонина крыс ELISA (Kamiya Biomedical Company, кат. №KT-639) в соответствии со инструкциями производителя.
Морфометрический анализ
После взятия крови через 24 ч грудную клетку повторно вскрывали, используя произведенный накануне разрез, и повторно перекрывали LAD с помощью проленовой нити, накануне оставленной вокруг LAD. После визуального подтверждения ишемии вводили в/в 10% раствор эванса синего (в сонную артерию или яремную вену через канюлю) до тех пор, пока перфузируемая область сердца не синела, а затем вырезали сердце из грудной полости. Атриумы, клапаны, крупные сосуды, и правый желудочек отделяли после тщательной промывки водой, затем левый желудочек повторно быстро промывали водой, заворачивали в целлофан и замораживали в течение ночи при -20°C. Затем левый желудочек препарировали с получением 6 срезов толщиной 2 мм и инкубировали в 1,5 мл 1% ТТХ в ФСБ в течение 20 мин при 37°C. Затем получали изображения апикальных и базальных поверхностей для каждого среза с применением Nikon DSL 3200, оснащенного макрообъективом. Анализ инфарктов был заслеплен относительно лечения.
Результаты
Уровни тропонина в плазме были стабильно ниже у животных, получавших лечение йодидом натрия, чем у животных, получавших лечение плацебо (фиг. 10). Кроме того, размер зоны инфаркта был меньше у животных, получавших лечение йодидом натрия по сравнению с получавшими лечение плацебо (фиг. 11), тогда как для размеров зоны инфаркта в когорте ишемического прекондиционирования наблюдались исключительно незначимые тенденции к уменьшению размеров по сравнению с плацебо. Указанные данные демонстрируют, что введение йодида эффективно при лечении ОИМ.
Пример 7
лечение заболеваний человека элементными восстанавливающими агентами
Многие заболевания человека связаны с образованием активных форм кислорода, обуславливающих перекисное окисление липидов и карбонилирование белков, включая заболевания, описанные в приведенных выше примерах, лечение которых целесообразно проводить с применением йодида (или сульфида, или селенида). Указанные химические модификации биополимеров являются причиной потери клеток, приводящей к возникновению заболевания и смерти. Соответственно, лечение других заболеваний, связанных с образованием активных форм кислорода, также может проводиться с применением йодида или другого элементного восстанавливающего агента (ЭВА), в том числе любых из описанных в настоящем документе, например, сульфида или селенида. Следующие заболевания тестируют в моделях заболеваний человека на животных или ex vivo для демонстрации ожидаемых результатов при получении животными лечения или обработке тканей йодидом или другим ЭВА, таким как сульфид или селенид. Все исследования включают внутривенное лечение ЭВА.
Трансплантация почек
Извлекают почки у собак и свиней, хранят в течение 24 часов и затем трансплантировали животному, у которого отсутствовала вторая почка и, соответственно, зависимого от функции трансплантированной почки. Ожидается, что ЭВА, например, йодид, сульфид и селенид, увеличивают функциональность сохраненной почки, подтверждая, что ЭВА могут применяться для улучшения трансплантации почек у человека.
Болезнь «трансплантат против хозяина»
Мышей и собак облучают для уничтожения стволовых клеток костного мозга (СККМ) и неподходящие донорские СККМ трансплантируют облученным животным в отсутствие лечения циклоспорином A. Ожидается, что ЭВА, например, йодид, сульфид и селенид, будут функционировать вместо циклоспорина и обеспечивать приживление неродственного костного мозга без отторжения трансплантата и наступления смерти.
Болезнь периферических сосудов
Мышей оперируют для прекращения бедренного кровотока к задней конечности. Ожидается, что лечение ЭВА, например, йодид, сульфид или селенид, дважды в сутки в течение 2 недель после хирургического вмешательства, для стойкого улучшения кровотока.
Потеря слуха в результате воздействия шума
Мышей подвергают воздействию громких звуков и затем проводят лечение путем внутривенного введения ЭВА, такого как йодид, селенид или сульфид. Ожидается, что лечение ЭВА будет улучшать результат по сравнению с не получавшими лечения контрольными животными, т.е. приводить к уменьшению снижения слуха.
Острый ишемический инсульт
Крысы, испытывавшие временное прекращение кровотока в головном мозге, повергались реперфузии одновременно с лечением ЭВА, таким как йодид, сульфид или селенид. Ожидается, что лечение ЭВА будет уменьшать повреждение ткани, вызванное прекращением кровотока, и уменьшать ишемически-реперфузионное повреждение.
Острый инфаркт миокарда
Левую переднюю нисходящую коронарную артерию животных (мышей, крыс и кроликов) временно лигируют для имитации сердечного приступа. В момент реперфузии инфузируют ЭВА, такой как йодид, сульфид или селенид. Указанное лечение уменьшает повреждение сердца и улучшает сердечную функцию.
Контраст-индуцированная нефропатия
Мышам вводят контрастирующий агент в условиях, индуцирующих повреждение почек, для моделирования типа повреждения, которым часто страдают пациенты, получающие внутривенно контрастирующий агент при визуализации сосудов. Ожидается, что лечение ЭВА, например, йодидом, сульфидом или селенидом, будет уменьшать повреждение и улучшать функцию почек.
Серповидноклеточная анемия
Мыши-носители специфического мутантного гемоглобина страдают гемолизом эритроцитов и повреждениями сосудов, аналогичными наблюдаемым у пациентов с серповидноклеточной анемией. Повреждение у указанных мышей усугубляется воздействием острой гипоксии. Указанные мыши будут получать лечение ЭВА, таким как сульфид, селенид или йодид, при наличии или в отсутствие острой гипоксии, и ожидается, что лечение ЭВА будет защищать их от указанного повреждения.
Послеоперационная кишечная непроходимость
Перитонеальная хирургия связана с продолжительным восстановлением, связанным с периодом, в течение которого существует риск прекращения перистальтики кишечника. Такое прекращение перильстатики индуцируют у мышей, а затем проводят лечение мышей ЭВА, например, йодидом, сульфидом или селенидом. Ожидается, что ЭВА будет укорачивать/устранять указанное прекращение перильстатики после хирургического вмешательства.
Индуцированное радиацией повреждение легких
Облучение радиацией в ходе противораковой терапии иногда приводит к непреднамеренному повреждению легких. Мышей облучают для стимуляции повреждения легких. ЭВА, например, йодид, сульфид или селенид, вводят мышам до и после облучения. Ожидается, что лечение ЭВА будет уменьшать повреждение легких.
Индуцированное искусственной вентиляцией повреждение легких
Вентиляция легких имеет большое значение для некоторых пациентов; однако вентиляция может приводить к повреждению легкого. У мышей вызывают индуцированное вентиляцией повреждение и проводят лечение ЭВА, таким как йодид, сульфид или селенид, или не проводят лечения. Ожидается, что лечение ЭВА будет уменьшать повреждение легких.
Сальмонеллезная инфекция
Бактериальная инфекция, вызванная Salmonella, может быть летальной. Мышей инфицируют сальмонеллой и проводили лечение ЭВА, например, йодидом, сульфидом или селенидом. Ожидается, что ЭВА будет подавлять иммунный и воспалительный ответ, повышая таким образом выживание.
Ретинопатия
Потеря клеток сетчатки предположительно обусловлена действием активных форм кислорода. ЭВА являются антиоксидантами. Крыс помещают в условия, вызывающие ретинопатию, для моделирования дегенерации сетчатки у человека, и проводят их лечение ЭВА, таким как йодид, сульфид или селенид. Ожидается, что лечение ЭВА будет повышать жизнеспособность клеток сетчатки.
Сохранение органов
Трансплантация органов предусматривает временное прекращение кровотока. Эксплантированные органы от свиней-доноров перфузируют ex vivo ЭВА, например, йодидом, сульфидом или селенидом, в предохраняющем растворе перед трансплантацией свинье-реципиенту. Ожидается, что лечение ЭВА будет улучшать функционирование органа после трансплантации реципиенту.
Гипоксически-ишемическая энцефалопатия
Временное прекращение кровотока с последующей реперфузией может приводить к стойкому повреждению головного мозга. Новорожденные хорьки получают лечение ЭВА, например, йодидом, сульфидом или селенидом, в условиях, имитирующих указанное повреждение головного мозга. Ожидается, что лечение ЭВА при рождении будет уменьшать повреждение головного мозга.
Эпилепсия
Эпилепсия связана с судорожными приступами, обуславливающими избыточную метаболическую активность в головном мозге и его повреждение. Лечение ЭВА уменьшает скорость метаболизма. Крысы получают лечение ЭВА, например, йодидом, сульфидом или селенидом, в условиях, моделирующих эпилептический припадок и повреждение головного мозга. Ожидается, что лечение крыс, страдающих судорожными приступами, ЭВА будет уменьшать повреждение головного мозга.
Приживление стволовых клеток
Трансплантация стволовых клеток приводит к окислительному повреждению и утрате многих из указанных клеток. Кардиомиоциты трансплантируют в поврежденные сердца крыс, и в указанные клетки и животным вводят либо ЭВА, например, йодид, сульфид или сульфид, или не проводят лечения. Ожидается, что обработка стволовых клеток и лечение животных-реципиентов ЭВА будет улучшать приживление стволовых клеток.
Все указанные выше патенты США, опубликованные заявки на патент США, заявки на патент США, зарубежные патенты, зарубежные патентные заявки и непатентные публикации, упоминаемые в настоящем описании и/или перечисленные в информационном листе, полностью включены в настоящий документ посредством ссылки.
Ниже приведены варианты осуществления настоящего изобретения.
1. Способ лечения или предотвращения повреждения или заболевания у субъекта, включающий введение указанному субъекту композиции, содержащей соединение галогена и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
2. Способ согласно варианту осуществления 1, в котором указанное соединение галогена содержит йод, бром, хлор, фтор или астат.
3. Способ согласно варианту осуществления 2, в котором указанное соединение галогена содержит йод.
4. Способ согласно варианту осуществления 3, в котором указанное соединение галогена представляет собой йодид, йодат, органический йодид, периодат или периодинан.
5. Способ согласно варианту осуществления 4, в котором указанное соединение галогена представляет собой йодид.
6. Способ согласно варианту осуществления 5, в котором указанный йодид представляет собой йодид натрия, йодид калия, йодид водорода, йодид кальция или йодид серебра.
7. Способ согласно варианту осуществления 4, в котором указанное соединение галогена представляет собой йодат.
8. Способ согласно варианту осуществления 7, в котором указанный йодат представляет собой йодат натрия, йодат калия, йодат кальция или йодат серебра.
9. Способ согласно варианту осуществления 2, в котором указанное соединение галогена содержит бром.
10. Способ согласно варианту осуществления 9, в котором указанное соединение галогена представляет собой бромид.
11. Способ согласно варианту осуществления 1, в котором указанный галоген присутствует в соединении галогена в восстановленной форме.
12. Способ согласно любому из вариантов осуществления 1–11, в котором указанную композицию вводят указанному субъекту парентерально или перорально.
13. Способ согласно варианту осуществления 12, в котором указанную композицию вводят указанному субъекту внутривенно или путем инфузии.
14. Способ согласно варианту осуществления 13, в котором указанная композиция приготовлена для внутривенного введения, введения путем инфузии или перорального введения, и при этом указанная композиция содержит стабильную восстановленную форму соединения галогена.
15. Способ согласно любому из вариантов осуществления 1–14, в котором указанную композицию вводят указанному субъекту в количестве, достаточном для увеличения концентрации галогена в крови по меньшей мере на 100%, по меньшей мере на 200%, по меньшей мере на 300%, по меньшей мере на 400% или по меньшей мере на 500% в течение по меньшей мере некоторого времени.
16. Способ согласно любому из вариантов осуществления 1–15, в котором указанное заболевание или повреждение выбрано из любого из перечисленного, или вызвано или обусловлено чем-либо из перечисленного: абляционная терапия, адреналектомия, аневризма аорты, хирургия корня аорты, аортальный стеноз, порок клапана аорты, аритмия, атеросклероз, трепетание предсердий, фибрилляция предсердий, дефект межпредсердной перегородки, артериовенозная мальформация, хирургия головного мозга в сознании, бариатрическая хирургия, трансплантация костного мозга, повреждения плечевого сплетения, брадикардия, аневризма головного мозга, хирургическое увеличение молочной железы, хирургическое уменьшение молочной железы, ожоговая травма, операция коронарного шунтирования, катаракта, коронарная болезнь сердца, абляционная терапия сердца, катетеризация сердца, ресинхронизирующая сердечная терапия, хирургия сердца, кардиомиопатия, хирургия сердца, заболевания сердечно-сосудистой системы, каротидная ангиопластика и стентирование, коарктация аорты, врожденный порок сердца, операция коронарного шунтирования, коронарная болезнь сердца, медицина критических состояний, хроническая обструктивная болезнь легких, вирус Эбола, протезирование локтевого сустава, неотложная медицинская помощь, эпилепсия, терапия внутренних болезней, общая хирургия, желудочно-кишечное кровотечение, реакция «трансплантат против хозяина», хантавирусный легочный синдром (ХЛС), сердечный приступ, трансплантация сердца, хирургия клапанов сердца, протезирование тазобедренного сустава, гипертрофическая кардиомиопатия, гипоксическая ишемическая энцефалопатия, гистерэктомия, хирургическое формирование илеоанального анастомоза (J-образного резервуара), кишечная непроходимость, послеоперационная кишечная непроходимость, воспалительное заболевание кишечника, ишемическая болезнь сердца, ишемически-реперфузионное повреждение, синдром раздраженного кишечника, челюстная хирургия, трансплантация почки, гортанно-трахеальная хирургическая реконструкция, трансплантация печени, операция по уменьшению объема легких, трансплантация легкого, минимально инвазивная хирургия сердца, потеря слуха в результате воздействия шума, нейрохирургия, челюстно-лицевая и оральная хирургия, ортопедическая хирургия, трансплантация поджелудочной железы, панкреатит, частичная нефрэктомия, хирургия шейного отдела позвоночника в педиатрии, педиатрическая хирургия, опущение тазовых органов, болезнь периферических сосудов, пластическая и реконструктивная хирургия, пульмонология и медицина критических состояний, атрезия легочной артерии, изоляция легочной вены, индуцированное радиацией повреждение легких, выпадение прямой кишки, рестриктивная кардиомиопатия, отслоение сетчатки, ретинопатия недоношенных, роботизированная хирургия, сальмонеллезная инфекция, послеоперационная спайка, серповидно клеточная анемия, кризис серповидных клеток, инфаркт миокарда с подъёмом сегмента ST (STEMI), приживление стволовых клеток, повреждение спинного мозга, спонтанное расслоение коронарной артерии, спонтанная окклюзия виллизиева круга, инсульт, применение телемедицины при инсульте (телеинсульт), внезапная остановка сердца, стереотаксическая радиохирургия, хирургическое вмешательство, хроническая сердечная недостаточность, систолическая сердечная недостаточность, тахикардия, гипертрофическая кардиомиопатия, аневризма грудного отдела аорты, торакальная хирургия, полная артропластика локтевого сустава, болезнь трикуспидального клапана, язвенный колит, клапансохраняющая реконструкция корня аорты, сосудистая и эндоваскулярная хирургия, сосудистая медицина, спровоцированное ИВЛ повреждение легких или желудочковая тахикардия.
17. Способ согласно любому из вариантов осуществления 1–16, в котором указанное повреждение или заболевание выбрано из следующих, обусловлено или вызвано чем-либо из следующего: воспаление, иммунный ответ, сердечный приступ, операция коронарного шунтирования, ишемия, ишемия ЖКТ, ишемия печени, ишемия почек, гипоксически-ишемическая энцефалопатия, инсульт, травматическое повреждение головного мозга, ишемия конечностей, ишемия глаза, сепсис, воздействие дыма, ожог, реперфузия или острое повреждение легких.
18. Способ согласно варианту осуществления 17, в котором указанное повреждение представляет собой инфаркт, вызванный сердечным приступом или инсультом.
19. Способ согласно варианту осуществления 16, в котором указанное повреждение вызвано операцией коронарного шунтирования, необязательно – шунтированием коронарных артерий (ШКА).
20. Способ согласно варианту осуществления 17, в котором указанное заболевание представляет собой гипоксически-ишемическую энцефалопатию.
21. Способ согласно любому из вариантов осуществления 1–20, в котором указанный способ дополнительно включает введение указанному субъекту композиции, содержащей один или большее количество дополнительных активных агентов.
22. Способ согласно варианту осуществления 21, в котором указанные один или большее количество дополнительных активных агентов содержат халькогенид.
23. Способ согласно варианту осуществления 22, в котором указанный халькогенид включает сульфид или селенид.
24. Способ согласно варианту осуществления 23, в котором указанный сульфид или селенид представляет собой восстановленную форму сульфида или селенида.
25. Способ согласно варианту осуществления 24, в котором указанный халькогенид представляет собой восстановленную форму сульфида.
26. Способ согласно варианту осуществления 25, в котором указанная восстановленная форма сульфида входит в состав стабильной жидкой фармацевтической композиции, содержащей фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
27. Способ согласно любому из вариантов осуществления 1–20, в котором указанная композиция дополнительно содержит один или большее количество дополнительных активных агентов.
28. Способ согласно варианту осуществления 26, в котором указанные один или большее количество дополнительных активных агентов содержат халькогенид.
29. Способ согласно варианту осуществления 28, в котором указанный халькогенид включает сульфид или селенид.
30. Способ согласно варианту осуществления 29, в котором указанный сульфид или селенид представляет собой восстановленную форму сульфида или селенида.
31. Способ согласно варианту осуществления 30, в котором указанный халькогенид представляет собой восстановленную форму сульфида.
32. Способ согласно любому из вариантов осуществления 1–31, в котором указанная композиция содержит носитель.
33. Способ согласно варианту осуществления 32, в котором указанное соединение галогена связано с указанным носителем.
34. Способ согласно любому из вариантов осуществления 27–31, в котором указанная композиция содержит носитель, и тем, что указанное соединение галогена и указанные один или большее количество дополнительных активных агентов связаны с указанным носителем.
35. Способ согласно варианту осуществления 34, в котором указанное соединение галогена и указанные один или большее количество дополнительных активных агентов, присутствующие в указанной композиции, связаны с указанным носителем ковалентным или нековалентным образом.
36. Способ согласно любому из вариантов осуществления 32–35, в котором указанный носитель представляет собой альбумин, плазму, сыворотку, альфа-2-макроглобулин или иммуноглобулин.
37. Композиция, содержащая соединение галогена и носитель, в которой указанное соединение галогена связано с указанным носителем.
38. Композиция согласно варианту осуществления 37, в которой указанная композиция дополнительно содержит один или большее количество дополнительных активных агентов, при этом указанные один или большее количество дополнительных активных агентов связаны с указанным носителем.
39. Композиция согласно варианту осуществления 37 или варианту осуществления 38, в которой указанное соединение галогена и/или указанные один или большее количество дополнительных активных агентов связаны с указанным носителем ковалентными или нековалентным образом.
40. Композиция согласно варианту осуществления 37, в которой указанные один или большее количество дополнительных активных агентов содержат халькогенид.
41. Композиция согласно варианту осуществления 40, в которой указанный халькогенид включает сульфид или селенид.
42. Композиция согласно варианту осуществления 41, в которой указанный сульфид или селенид представляет собой восстановленную форму сульфида или селенида.
43. Композиция согласно варианту осуществления 41, в которой указанный халькогенид представляет собой восстановленную форму сульфида.
44. Фармацевтическая композиция, содержащая стабильную восстановленную форму соединения галогена, в которой указанная фармацевтическая композиция входит в состав для внутривенного введения, введения путем инфузии или перорального введения.
45. Композиция согласно варианту осуществления 44, в которой указанное соединение галогена содержит йод, бром, хлор, фтор или астат.
46. Композиция согласно варианту осуществления 45, в которой указанное соединение галогена содержит йод.
47. Композиция согласно варианту осуществления 46, в которой указанное соединение галогена представляет собой йодид, йодат, органический йодид, периодат или периодинан.
48. Композиция согласно варианту осуществления 47, в которой указанное соединение галогена представляет собой йодид.
49. Композиция согласно варианту осуществления 48, в которой указанный йодид представляет собой йодид натрия, йодид калия, йодид водорода, йодид кальция или йодид серебра.
50. Композиция согласно варианту осуществления 47, в которой указанное соединение галогена представляет собой йодат.
51. Композиция согласно варианту осуществления 50, в которой указанный йодат представляет собой йодат натрия, йодат калия, йодат кальция или йодат серебра.
52. Композиция согласно варианту осуществления 45, в которой указанное соединение галогена содержит бром.
53. Композиция согласно варианту осуществления 52, в которой указанное соединение галогена представляет собой бромид.
54. Способ согласно любому из вариантов осуществления 1–36 или композиция согласно любому из вариантов осуществления 37–53, в котором(ой) по меньшей мере 90% указанного соединения галогена в указанной композиции находится в восстановленной форме в течение по меньшей мере одного часа, по меньшей мере одной недели, по меньшей мере одного месяца или по меньшей мере шести месяцев при хранении при комнатной температуре.
55. Способ согласно любому из вариантов осуществления 1–36 или композиция согласно любому из вариантов осуществления 37–53, в котором(ой) по меньшей мере 90% указанного соединения галогена в указанной композиции находится в восстановленной форме в течение по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере четырех месяцев, по меньшей мере шести месяцев или по меньшей мере одного года при хранении при температуре, составляющей приблизительно 4ºC.
56. Способ согласно любому из вариантов осуществления 1–36 или композиция согласно любому из вариантов осуществления 37–55, в котором(ой) указанная композиция, содержащая соединение галогена, и/или указанная композиция, содержащая указанный дополнительный активный агент, содержит один или большее количество восстанавливающих агентов, регулирующих тоничность агентов, стабилизаторов, поверхностно-активных веществ, лиопротекторов, полиолов, антиоксидантов или консервантов.
57. Способ согласно любому из вариантов осуществления 1–36 или 54–56, включающий обеспечение композиции согласно любому из вариантов осуществления 37–53 указанному субъекту.
58. Единичная дозированная форма композиции согласно любому из вариантов осуществления 37–53, в которой указанная единичная дозированная форма представляет собой состав для перорального введения.
59. Единичная дозированная форма согласно варианту осуществления 58, в которой указанная единичная дозированная форма представляет собой пилюлю, таблетку, каплет или капсулу.
60. Единичная дозированная форма согласно варианту осуществления 58 или варианту осуществления 59, в которой указанная единичная дозированная форма содержит 150 мг или менее, 125 мг или менее, 100 мг или менее, 50 мг или менее, 25 мг или менее, или 10 мг или менее соединения галогена.
61. Единичная дозированная форма согласно варианту осуществления 60, в которой указанная единичная дозированная форма содержит от приблизительно 1 мг до приблизительно 150 мг, от приблизительно 1 мг до приблизительно 150 мг, от приблизительно 1 мг до приблизительно 125 мг, от приблизительно 1 мг до приблизительно 100 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 50 мг, от приблизительно 1 мг до приблизительно 25 мг или приблизительно 1 мг до приблизительно 10 мг соединения галогена.
62. Единичная дозированная форма согласно любому из вариантов осуществления 58–61, в которой указанное соединение галогена содержит йод, бром, хлор, фтор или астат.
63. Единичная дозированная форма согласно варианту осуществления 62, в которой указанное соединение галогена содержит йод.
64. Единичная дозированная форма согласно варианту осуществления 63, в которой указанное соединение галогена представляет собой йодид, йодат, органический йодид, периодат или периодинан.
65. Единичная дозированная форма согласно варианту осуществления 64, в которой указанное соединение галогена представляет собой йодид.
66. Единичная дозированная форма согласно варианту осуществления 65, в которой указанный йодид представляет собой йодид натрия, йодид калия, йодид водорода, йодид кальция или йодид серебра.
67. Единичная дозированная форма согласно варианту осуществления 64, в которой указанное соединение галогена представляет собой йодат.
68. Единичная дозированная форма согласно варианту осуществления 67, в которой указанный йодат представляет собой йодат натрия, йодат калия, йодат кальция или йодат серебра.
69. Единичная дозированная форма согласно варианту осуществления 62, в которой указанное соединение галогена содержит бром.
70. Единичная дозированная форма согласно варианту осуществления 69, в которой указанное соединение галогена представляет собой бромид.
71. Единичная дозированная форма согласно любому из вариантов осуществления 58-70, в которой указанная единичная дозированная форма дополнительно содержит один или большее количество дополнительных активных агентов.
72. Единичная дозированная форма согласно варианту осуществления 71, в которой указанные один или большее количество дополнительных активных агентов содержат халькогенид.
73. Единичная дозированная форма согласно варианту осуществления 72, в которой указанный халькогенид включает сульфид или селенид.
74. Единичная дозированная форма согласно варианту осуществления 73, в которой указанный сульфид или селенид представляет собой восстановленную форму сульфида или селенида.
75. Способ лечения или предотвращения повреждения или заболевания у субъекта, включающий введение указанному субъекту единичной дозированной форма согласно любому из вариантов осуществления 58–74.
76. Способ согласно варианту осуществления 75, в котором указанное заболевание или повреждение выбрано из любого из перечисленных, или вызвано или обусловлено любым из перечисленного: абляционная терапия, адреналектомия, аневризма аорты, хирургия корня аорты, аортальный стеноз, порок клапана аорты, аритмия, атеросклероз, трепетание предсердий, фибрилляция предсердий, дефект межпредсердной перегородки, артериовенозная мальформация, хирургия головного мозга в сознании, бариатрическая хирургия, трансплантация костного мозга, повреждения плечевого сплетения, брадикардия, аневризма головного мозга, хирургическое увеличение молочной железы, хирургическое уменьшение молочной железы, ожоговая травма, катаракта, операция коронарного шунтирования, коронарная болезнь сердца, абляционная терапия сердца, катетеризация сердца, ресинхронизирующая сердечная терапия, хирургия сердца, кардиомиопатия, хирургия сердца, заболевания сердечно-сосудистой системы, каротидная ангиопластика и стентирование, коарктация аорты, врожденный порок сердца, операция коронарного шунтирования, коронарная болезнь сердца, медицина критических состояний, хроническая обструктивная болезнь легких, вирус Эбола, протезирование локтевого сустава, неотложная медицинская помощь, эпилепсия, терапия внутренних болезней, общая хирургия, желудочно-кишечное кровотечение, реакция «трансплантат против хозяина», хантавирусный легочный синдром (ХЛС), сердечный приступ, трансплантация сердца, хирургия клапанов сердца, протезирование тазобедренного сустава, гипертрофическая кардиомиопатия, гипоксическая ишемическая энцефалопатия, гистерэктомия, хирургическое формирование илеоанального анастомоза (J-образного резервуара), кишечная непроходимость, послеоперационная кишечная непроходимость, воспалительное заболевание кишечника, ишемическая болезнь сердца, ишемически-реперфузионное повреждение, синдром раздраженного кишечника, челюстная хирургия, трансплантация почки, гортанно-трахеальная хирургическая реконструкция, трансплантация печени, операция по уменьшению объема легких, трансплантация легкого, минимально инвазивная хирургия сердца, нейрохирургия, потеря слуха в результате воздействия шума, челюстно-лицевая и оральная хирургия, ортопедическая хирургия, трансплантация поджелудочной железы, панкреатит, частичная нефрэктомия, хирургия шейного отдела позвоночника в педиатрии, педиатрическая хирургия, опущение тазовых органов, болезнь периферических сосудов, пластическая и реконструктивная хирургия, пульмонология и медицина критических состояний, атрезия легочной артерии, изоляция легочной вены, индуцированное радиацией повреждение легких, выпадение прямой кишки, рестриктивная кардиомиопатия, отслоение сетчатки, ретинопатия недоношенных, роботизированная хирургия, сальмонеллезная инфекция, послеоперационная спайка, серповидноклеточная анемия, кризис серповидных клеток, инфаркт миокарда с подъемом сегмента ST (STEMI), приживление стволовых клеток, повреждение спинного мозга, спонтанное расслоение коронарной артерии, спонтанная окклюзия виллизиева круга, инсульт, применение телемедицины при инсульте (телеинсульт), внезапная остановка сердца, стереотаксическая радиохирургия, хирургическое вмешательство, хроническая сердечная недостаточность, систолическая сердечная недостаточность, тахикардия, гипертрофическая кардиомиопатия, аневризма грудного отдела аорты, торакальная хирургия, полная артропластика локтевого сустава, болезнь трикуспидального клапана, язвенный колит, клапансохраняющая реконструкция корня аорты, сосудистая и эндоваскулярная хирургия, сосудистая медицина, спровоцированное ИВЛ повреждение легких или желудочковая тахикардия.
77. Способ согласно варианту осуществления 75, в котором указанное повреждение или заболевание выбрано из следующих, обусловлено или вызвано чем-либо из следующего: воспаление, сердечный приступ, операция коронарного шунтирования, ишемия, ишемия ЖКТ, ишемия печени, ишемия почек, гипоксически-ишемическая энцефалопатия, инсульт, травматическое повреждение головного мозга, ишемия конечностей, ишемия глаза, сепсис, воздействие дыма, ожог, реперфузия или острое повреждение легких.
78. Способ согласно варианту осуществления 77, в котором указанное повреждение представляет собой инфаркт, вызванный сердечным приступом или инсультом.
79. Способ согласно варианту осуществления 77, в котором указанное повреждение вызвано операцией коронарного шунтирования, необязательно – шунтированием коронарных артерий (ШКА).
80. Способ согласно варианту осуществления 76, в котором указанное заболевание представляет собой гипоксически-ишемическую энцефалопатию.
81. Способ согласно любому из вариантов осуществления 1–36, в котором указанный способ дополнительно включает введение указанному субъекту композиции, содержащей один или большее количество дополнительных активных агентов.
82. Способ согласно варианту осуществления 81, в котором указанные один или большее количество дополнительных активных агентов содержат струмогенный агент или соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы.
83. Способ согласно любому из вариантов осуществления 81, в котором указанные один или большее количество дополнительных активных агентов содержат глутатион.
84. Способ согласно варианту осуществления 83, в котором по меньшей мере 50% вводимого глутатиона находится в восстановленном состоянии.
85. Способ согласно варианту осуществления 83, в котором по меньшей мере 75% или по меньшей мере 90% вводимого глутатиона находится в восстановленном состоянии.
86. Способ согласно любому из вариантов осуществления 1–20 или 27-31, в котором указанная композиция дополнительно содержит один или большее количество дополнительных активных агентов.
87. Способ согласно варианту осуществления 86, в котором указанные один или большее количество дополнительных активных агентов содержат струмогенный агент или соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы.
88. Способ согласно любому из вариантов осуществления 86, в котором указанные один или большее количество дополнительных активных агентов содержит глутатион.
89. Способ согласно варианту осуществления 88, в котором по меньшей мере 50% вводимого глутатиона находится в восстановленном состоянии.
90. Способ согласно варианту осуществления 89, в котором по меньшей мере 75% или по меньшей мере 90% вводимого глутатиона находится в восстановленном состоянии.
91. Способ согласно любому из вариантов осуществления 32–36, в котором указанная композиция дополнительно содержит один или большее количество дополнительных активных агентов.
92. Способ согласно варианту осуществления 91, в котором указанные один или большее количество дополнительных активных агентов содержат струмогенный агент или соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы.
93. Способ согласно любому из вариантов осуществления 91–92, в котором указанные один или большее количество дополнительных активных агентов содержит глутатион.
94. Способ согласно варианту осуществления 93, в котором по меньшей мере 50% вводимого глутатиона находится в восстановленном состоянии.
95. Способ согласно любому из вариантов осуществления 92–94, в котором указанный струмогенный агент, соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы, или глутатион связан(о) с указанным носителем.
96. Композиция согласно любому из вариантов осуществления 37–43, в которой указанная композиция дополнительно содержит один или большее количество дополнительных активных агентов.
97. Композиция согласно варианту осуществления 96, в которой указанные один или большее количество дополнительных активных агентов содержат струмогенный агент или соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы.
98. Композиция согласно варианту осуществления 96, в которой указанные один или большее количество дополнительных активных агентов содержат глутатион.
99. Композиция согласно варианту осуществления 98, в которой по меньшей мере 50% глутатиона находится в восстановленном состоянии.
100. Композиция согласно варианту осуществления 99, в которой по меньшей мере 75% или по меньшей мере 90% глутатиона находится в восстановленном состоянии.
101. Композиция согласно любому из вариантов осуществления 96–100, в которой указанный глутатион, струмогенный агент или соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы, связан(о) с указанным носителем.
102. Композиция согласно любому из вариантов осуществления 37–53, в которой указанная композиция дополнительно содержит один или большее количество дополнительных активных агентов.
103. Композиция согласно варианту осуществления 102, в которой указанная композиция дополнительно содержит халькогенид.
104. Композиция согласно любому из вариантов осуществления 102 или 103, в которой указанная композиция дополнительно содержит струмогенный агент или соединение, которое ингибирует или нарушает выработку или активность гормонов щитовидной железы.
105. Композиция согласно любому из вариантов осуществления 102 или 103, в которой указанная композиция дополнительно содержит глутатион.
106. Композиция согласно любому из вариантов осуществления 103–105, в которой указанный халькогенид включает селенид или сульфид.
107. Композиция согласно варианту осуществления 106, в которой указанный селенид или сульфид представляет собой восстановленную форму селенида или сульфида.
108. Композиция согласно любому из вариантов осуществления 105–107, в которой по меньшей мере 50% указанного глутатиона находится в восстановленной форме.
109. Способ лечения или предотвращения повреждения или заболевания у субъекта, включающий введение указанному субъекту композиции, содержащей глутатион, халькогенид и/или струмогенный агент, в котором указанная композиция дополнительно содержит фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
110. Способ согласно варианту осуществления 109, в котором указанная композиция дополнительно содержит соединение галогена.
111. Способ согласно варианту осуществления 109 или варианту осуществления 110, в котором указанная композиция содержит халькогенид и глутатион.
112. Способ согласно варианту осуществления 111, в котором указанная композиция содержит соединение галогена, халькогенид и глутатион.
113. Способ согласно варианту осуществления 112, в котором указанное соединение галогена содержит йод.
114. Способ согласно любому из вариантов осуществления 109–113, в котором указанный халькогенид включает селенид или сульфид.
115. Способ согласно варианту осуществления 114, в котором указанный халькогенид включает селенид.
116. Способ согласно варианту осуществления 115, в котором указанный халькогенид включает восстановленную форму селенида.
117. Способ согласно любому из вариантов осуществления 109–116, в котором указанное заболевание или повреждение выбрано из любого из перечисленных, или вызвано или обусловлено чем-либо из перечисленного: абляционная терапия, адреналектомия, аневризма аорты, хирургия корня аорты, аортальный стеноз, порок клапана аорты, аритмия, атеросклероз, трепетание предсердий, фибрилляция предсердий, дефект межпредсердной перегородки, артериовенозная мальформация, хирургия головного мозга в сознании, бариатрическая хирургия, трансплантация костного мозга, повреждения плечевого сплетения, брадикардия, аневризма головного мозга, хирургическое увеличение молочной железы, хирургическое уменьшение молочной железы, ожоговая травма, катаракта, операция коронарного шунтирования, коронарная болезнь сердца, абляционная терапия сердца, катетеризация сердца, ресинхронизирующая сердечная терапия, хирургия сердца, кардиомиопатия, хирургия сердца, заболевания сердечно-сосудистой системы, каротидная ангиопластика и стентирование, коарктация аорты, врожденный порок сердца, контраст-индуцированная нефропатия, операция коронарного шунтирования, коронарная болезнь сердца, медицина критических состояний, хроническая обструктивная болезнь легких, вирус Эбола, протезирование локтевого сустава, неотложная медицинская помощь, эпилепсия, терапия внутренних болезней, общая хирургия, желудочно-кишечное кровотечение, реакция «трансплантат против хозяина», хантавирусный легочный синдром (ХЛС), сердечный приступ, трансплантация сердца, хирургия клапанов сердца, протезирование тазобедренного сустава, гипертрофическая кардиомиопатия, гипоксическая ишемическая энцефалопатия, гистерэктомия, хирургическое формирование илеоанального анастомоза (J-образного резервуара), кишечная непроходимость, послеоперационная кишечная непроходимость, воспалительное заболевание кишечника, ишемическая болезнь сердца, ишемически-реперфузионное повреждение, синдром раздраженного кишечника, челюстная хирургия, трансплантация почки, гортанно-трахеальная хирургическая реконструкция, трансплантация печени, операция по уменьшению объема легких, трансплантация легкого, минимально инвазивная хирургия сердца, нейрохирургия, потеря слуха в результате воздействия шума, челюстно-лицевая и оральная хирургия, ортопедическая хирургия, трансплантация поджелудочной железы, панкреатит, частичная нефрэктомия, хирургия шейного отдела позвоночника в педиатрии, педиатрическая хирургия, опущение тазовых органов, болезнь периферических сосудов, пластическая и реконструктивная хирургия, пульмонология и медицина критических состояний, атрезия легочной артерии, изоляция легочной вены, индуцированное радиацией повреждение легких, выпадение прямой кишки, рестриктивная кардиомиопатия, отслоение сетчатки, ретинопатия недоношенных, роботизированная хирургия, сальмонеллезная инфекция, послеоперационная спайка, серповидноклеточная анемия, кризис серповидных клеток, инфаркт миокарда с подъёмом сегмента ST (STEMI), приживление стволовых клеток, повреждение спинного мозга, спонтанное расслоение коронарной артерии, спонтанная окклюзия виллизиева круга, инсульт, применение телемедицины при инсульте (телеинсульт), внезапная остановка сердца, стереотаксическая радиохирургия, хирургическое вмешательство, хроническая сердечная недостаточность, систолическая сердечная недостаточность, тахикардия, гипертрофическая кардиомиопатия, аневризма грудного отдела аорты, торакальная хирургия, полная артропластика локтевого сустава, болезнь трикуспидального клапана, язвенный колит, клапансохраняющая реконструкция корня аорты, сосудистая и эндоваскулярная хирургия, сосудистая медицина, спровоцированное ИВЛ повреждение легких или желудочковая тахикардия.
118. Способ согласно варианту осуществления 117, в котором указанное повреждение или заболевание выбрано из любого из перечисленного, обусловлено или вызвано чем-либо из перечисленного: воспаление, сердечный приступ, операция коронарного шунтирования, ишемия, ишемия ЖКТ, ишемия печени, ишемия почек, гипоксически-ишемическая энцефалопатия, инсульт, травматическое повреждение головного мозга, ишемия конечностей, ишемия глаза, сепсис, воздействие дыма, ожог, реперфузия или острое повреждение легких.
119. Способ согласно варианту осуществления 117, в котором указанное повреждение представляет собой инфаркт, вызванный сердечным приступом или инсультом.
120. Способ согласно варианту осуществления 117, в котором указанное повреждение вызвано операцией коронарного шунтирования, необязательно – шунтированием коронарных артерий (ШКА).
121. Способ согласно любому из вариантов осуществления 109–120, в котором указанному субъекту вводят от приблизительно 1 пг/кг до приблизительно 1 г/кг халькогенида, сульфида или селенида.
122. Способ согласно варианту осуществления 121, в котором указанному субъекту вводят от приблизительно 10 мкг/кг до приблизительно 10 мг/кг халькогенида, сульфида или селенида.
123. Способ согласно любому из вариантов осуществления 109–122, в котором указанное соединение галогена представляет собой йодид, и указанному субъекту вводят от приблизительно 10 пг/кг до приблизительно 1 г/кг йодида.
124. Способ согласно варианту осуществления 123, в котором указанному субъекту вводят от приблизительно 10 мкг/кг до приблизительно 10 мг/кг.
125. Способ согласно любому из вариантов осуществления 109–124, в котором указанная композиция содержит от приблизительно 1,5 мкМ до приблизительно 500 мМ глутатиона.
126. Способ согласно варианту осуществления 125, в котором указанная композиция содержит глутатион в концентрации от приблизительно 15 мМ до приблизительно 500 мМ.
127. Композиция, содержащая глутатион, а также халькогенид либо струмогенный агент, либо и халькогенид, и струмогенный агент, и в которой указанная композиция дополнительно содержит фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
128. Композиция согласно варианту осуществления 127, в которой указанная композиция дополнительно содержит соединение галогена.
129. Композиция согласно варианту осуществления 127 или варианту осуществления 128, в которой указанная композиция содержит халькогенид и глутатион.
130. Композиция согласно варианту осуществления 129, в которой указанная композиция содержит соединение галогена, халькогенид и глутатион.
131. Композиция согласно варианту осуществления 130, в которой указанное соединение галогена содержит йод.
132. Композиция согласно любому из вариантов осуществления 127–131, в которой указанный халькогенид включает селенид или сульфид.
133. Композиция согласно варианту осуществления 132, в которой указанный халькогенид включает селенид.
134. Композиция согласно варианту осуществления 133, в которой указанный халькогенид включает восстановленную форму селенида.
135. Композиция согласно любому из вариантов осуществления 132–134, в которой указанный халькогенид включает стабильную восстановленную форму селенида или сульфида.
136. Композиция согласно любому из вариантов осуществления 127–135, в которой указанный глутатион присутствует в указанной композиции в концентрации, составляющей от приблизительно 1 мМ до приблизительно 500 мМ.
137. Композиция согласно любому из вариантов осуществления 127–136, в которой указанную композицию хранят в условиях пониженного содержания кислорода или в бескислородной среде до и/или во время введения указанному субъекту.
138. Композиция согласно варианту осуществления 137, в которой указанную композицию хранят в указанных условиях в атмосфере аргона или азота до введения указанному субъекту.
139. Композиция согласно любому из вариантов осуществления 127–138, в которой указанная композиция входит в состав для парентерального или перорального введения.
140. Композиция согласно варианту осуществления 139, в которой указанная композиция входит в состав для внутривенного введения или введения путем инфузии.
141. Способ лечения или предотвращения заболевания или повреждения у субъекта, включающий ингибирование или предотвращение уменьшения отношения количества восстановленных форм глутатиона и количества окисленных форм глутатиона в кровотоке субъекта или на участке заболевания или повреждения.
142. Способ согласно варианту осуществления 141, включающий увеличение отношения количества восстановленных форм глутатиона и количества окисленных форм глутатиона в кровотоке субъекта или на участке заболевания или повреждения.
143. Способ согласно варианту осуществления 141 или варианту осуществления 142, в котором указанный способ включает системное введение соединения галогена и/или халькогенида указанному субъекту до, во время или после начала указанного заболевания или повреждения.
144. Способ согласно варианту осуществления 143, в котором указанное соединение галогена содержит йод.
145. Способ согласно варианту осуществления 144, в котором указанное соединение галогена представляет собой йодид.
146. Способ согласно варианту осуществления 143, в котором указанный халькогенид включает серу или селен.
147. Способ согласно варианту осуществления 146, в котором указанный халькогенид включает селенид.
148. Способ согласно любому из вариантов осуществления 141–147, в котором указанное соединение галогена и/или халькогенид вводят указанному субъекту перорально или внутривенно, или путем инфузии.
149. Способ согласно любому из вариантов осуществления 141–148, в котором указанное соединение галогена и/или указанный халькогенид вводят указанному субъекту на участке, удаленном от указанного заболевания или повреждения.
150. Способ согласно варианту осуществления 149, в котором указанное заболевание или повреждение локализовано в определенном типе клеток, ткани или органе.
151. Способ согласно любому из вариантов осуществления 141–150, в котором указанный способ используют для лечения или предотвращения кризиса серповидных клеток, инфаркта миокарда или миогенного шока.
152. Способ согласно любому из вариантов осуществления 141–150, в котором указанный способ используют для лечения или предотвращения острого нарушения кровообращения.
153. Способ предотвращения, ингибирования или уменьшения иммунного ответа у субъекта, включающий введение соединения галогена и/или халькогенида указанному субъекту.
154. Способ согласно варианту осуществления 153, в котором указанное соединение галогена содержит йод.
155. Способ согласно варианту осуществления 154, в котором указанное соединение галогена представляет собой йодид.
156. Способ согласно варианту осуществления 153, в котором указанный халькогенид включает серу или селен.
157. Способ согласно варианту осуществления 156, в котором указанный халькогенид включает селенид.
158. Способ согласно любому из вариантов осуществления 153–157, в котором указанное соединение галогена и/или халькогенид вводят указанному субъекту перорально или внутривенно, или путем инфузии.
159. Способ согласно любому из вариантов осуществления 153–158, в котором указанное соединение галогена и/или указанный халькогенид вводят указанному субъекту в область воспаления или иммунной реакции.
160. Способ согласно любому из вариантов осуществления 153–159, в котором указанный способ используют для лечения или предотвращения реакции «трансплантат против хозяина».
161. Способ согласно любому из вариантов осуществления 153–159, в котором указанный способ используют для ингибирования или уменьшения иммунного ответа во время или после трансплантации органов.
162. Способ согласно любому из вариантов осуществления 153–159, в котором указанный способ используют для лечения или предотвращения аутоиммунного заболевания.
163. Способ согласно варианту осуществления 162, в котором указанное аутоиммунное заболевание представляет собой ревматоидный артрит или болезнь Крона.
164. Способ согласно любому из вариантов осуществления 153–159, в котором указанный способ используют для лечения или предотвращения ишемического или реперфузионного повреждения.
165. Способ согласно любому из вариантов осуществления 153–159, в котором указанный способ уменьшает количество одного или большего числа активных форм кислорода в кровотоке субъекта или на участке воспаления или иммунной реакции в организме субъекта.
166. Способ согласно варианту осуществления 165, в котором указанная иммунная реакция представляет собой T-клеточный или В-клеточный ответ.
167. Способ согласно варианту осуществления 166, в котором указанный иммунный ответ представляет собой активацию Т-клеток.
168. Способ согласно варианту осуществления 1, в котором указанное заболевание представляет собой хроническую сердечную недостаточность.
169. Способ согласно варианту осуществления 168, в котором хроническая сердечная недостаточность представляет собой систолическую сердечную недостаточность.
170. Способ согласно варианту осуществления 1, в котором указанное соединение галогена представляет собой йодид.
171. Способ согласно варианту осуществления 168, в котором указанное соединение галогена вводят в комбинации с другим активным агентом, применяемым для лечения хронической сердечной недостаточности.
172. Способ согласно варианту осуществления 168, в котором указанный другой активный агент присутствует в той же композиции в виде соединения галогена.