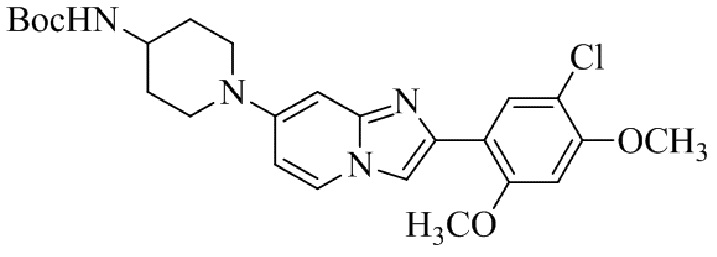
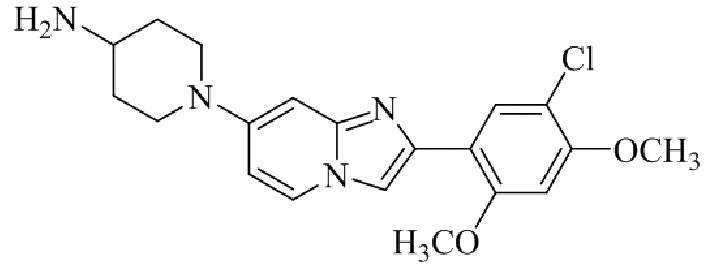
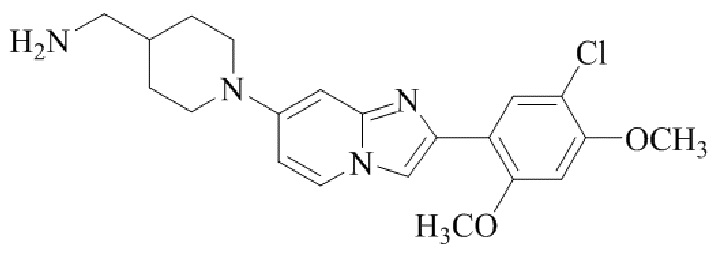
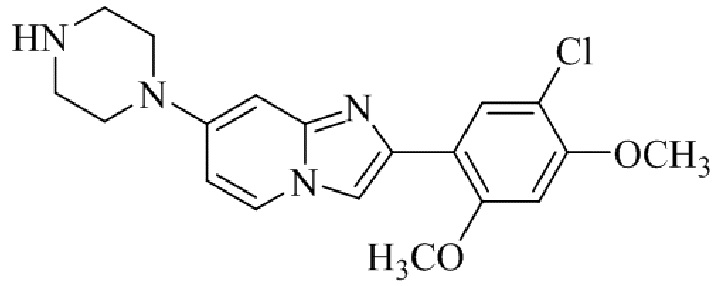
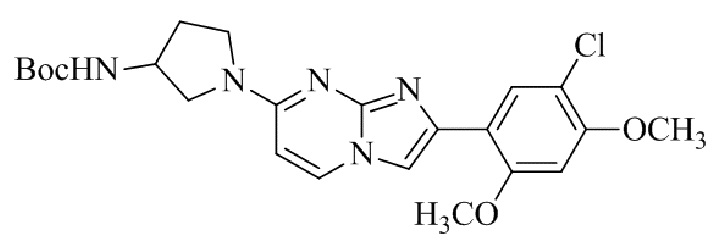
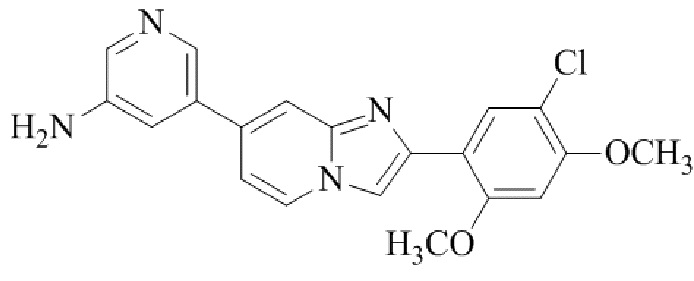
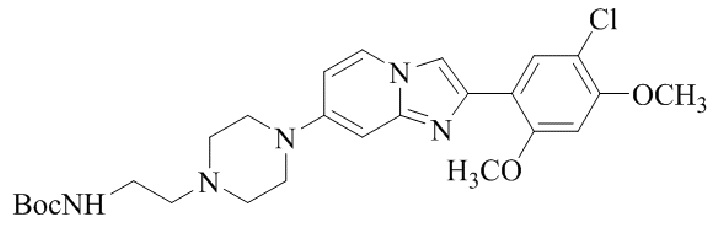
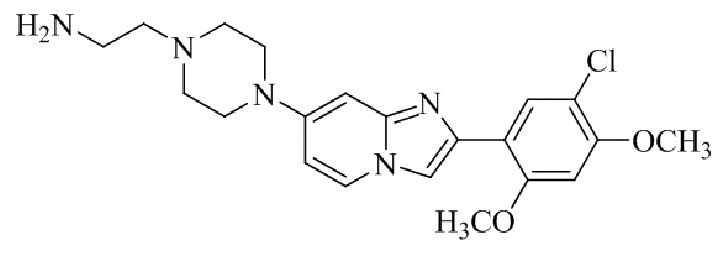
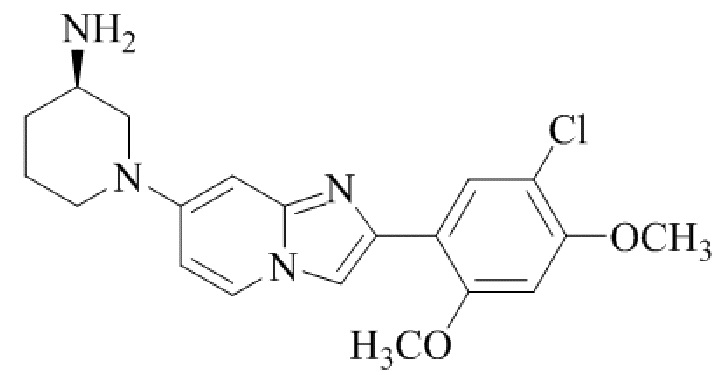
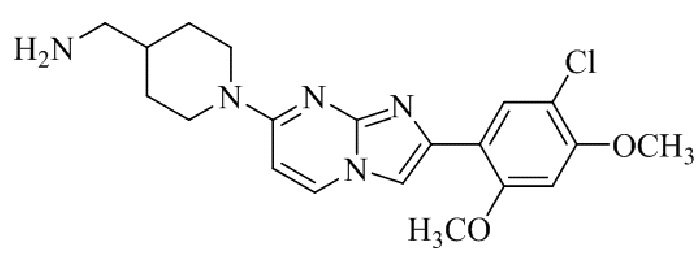
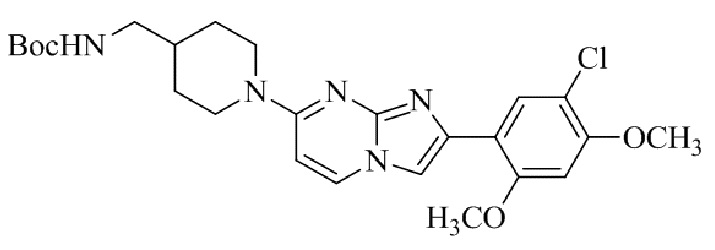
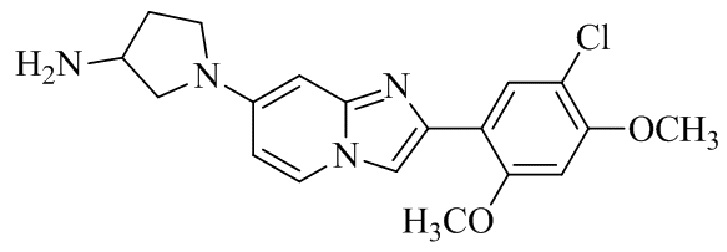
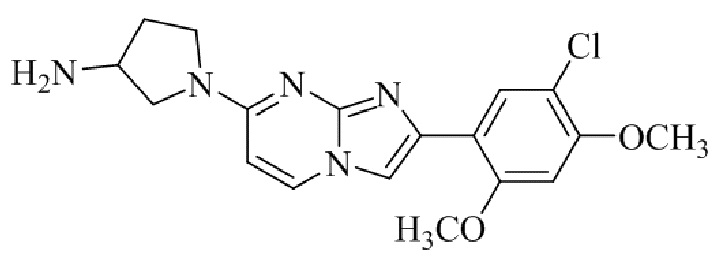
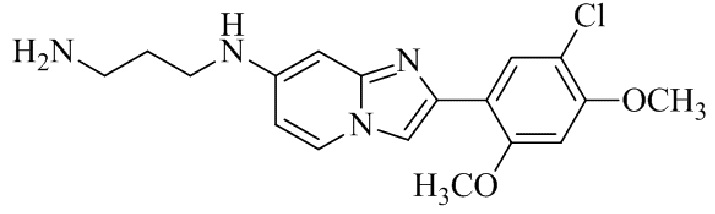
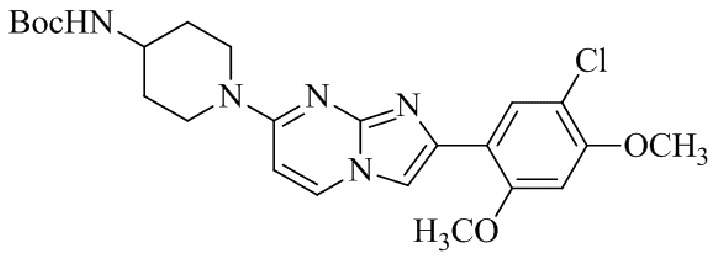
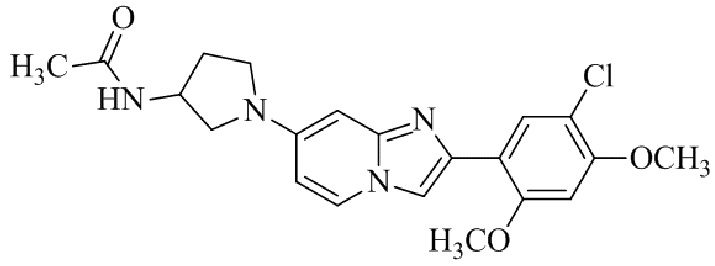
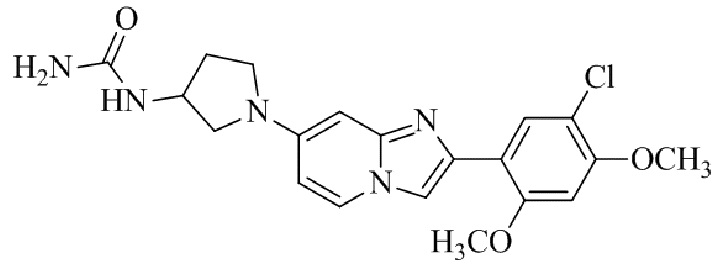
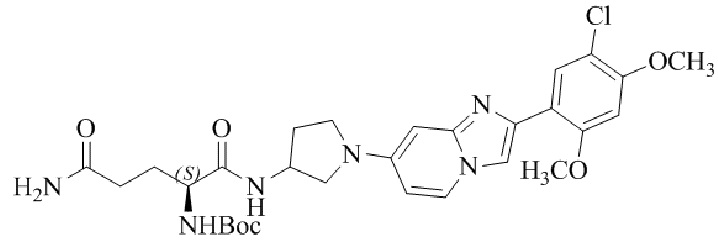
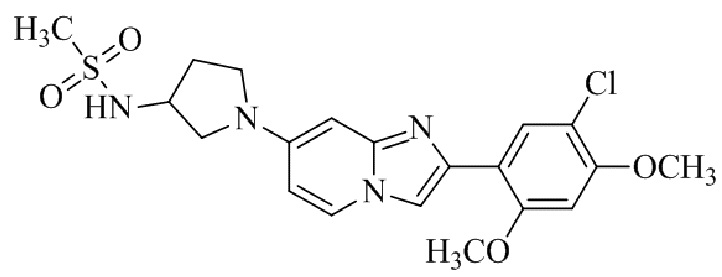
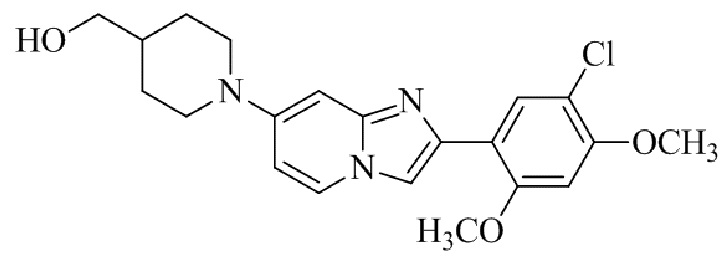
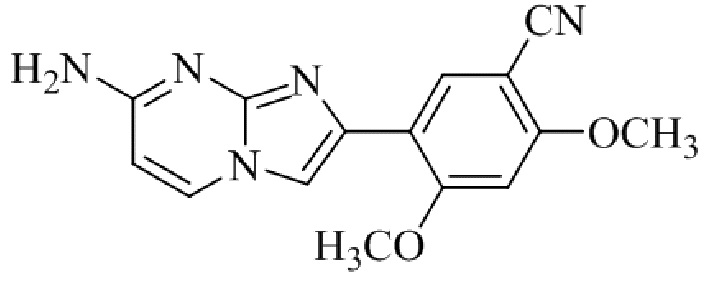
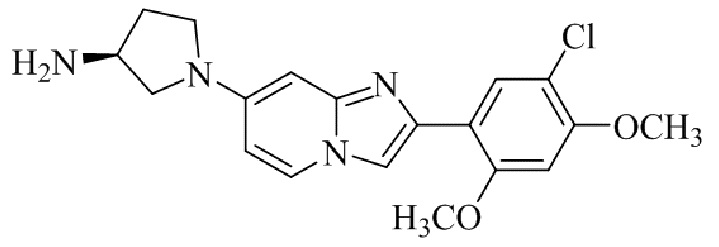
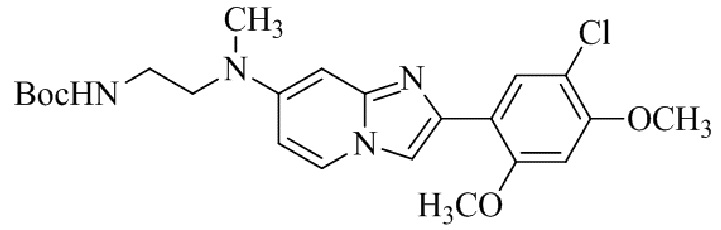
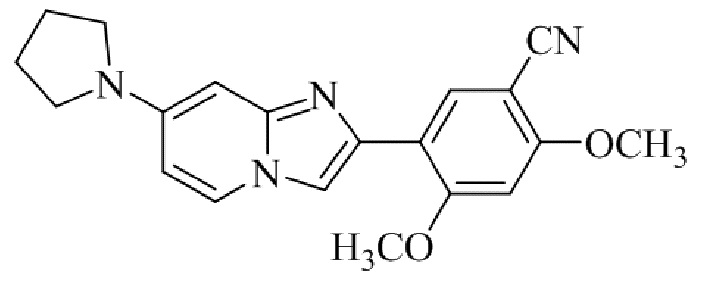
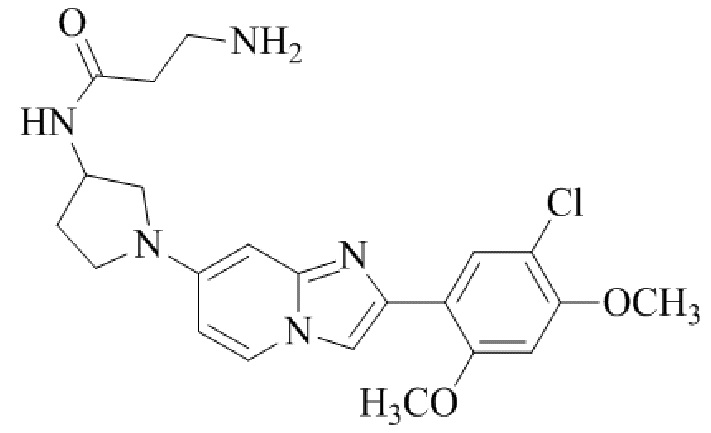
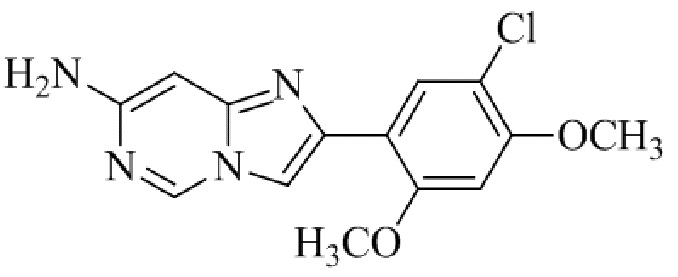
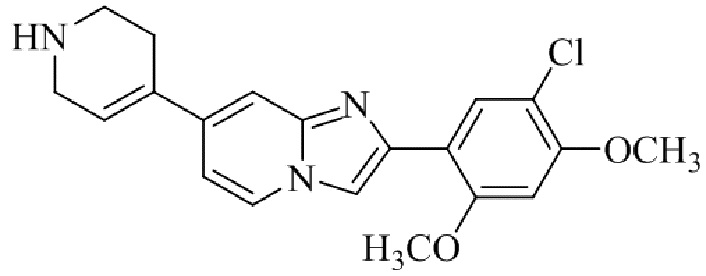
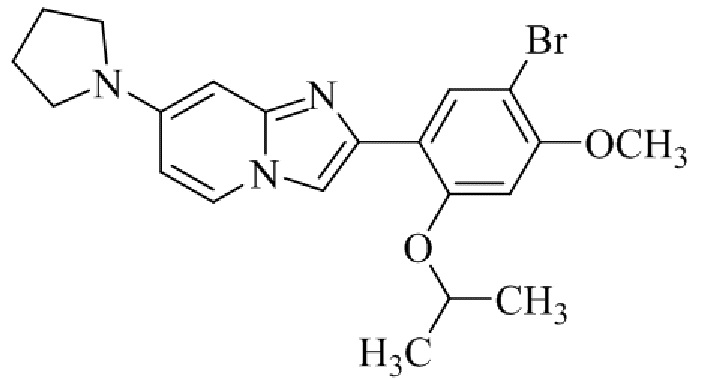
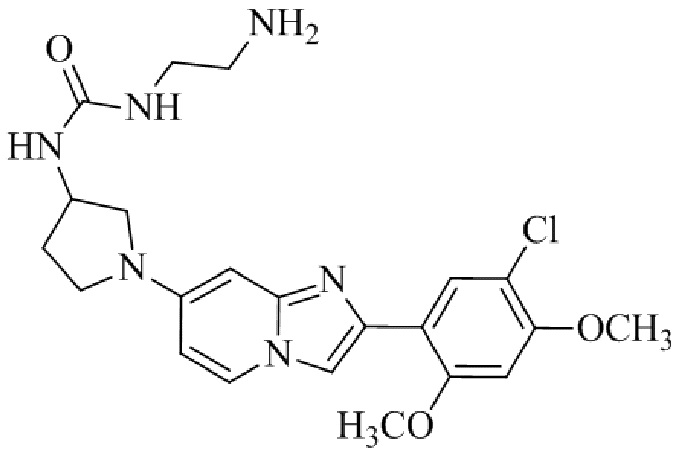
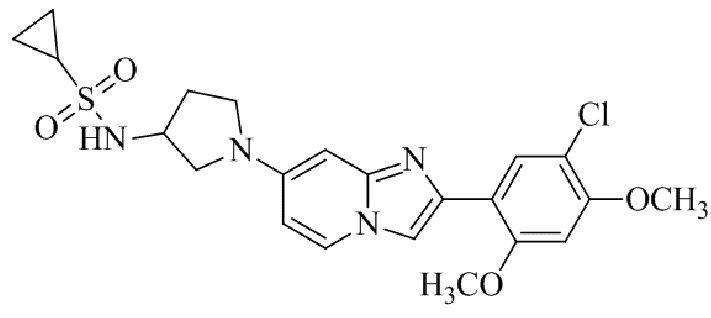
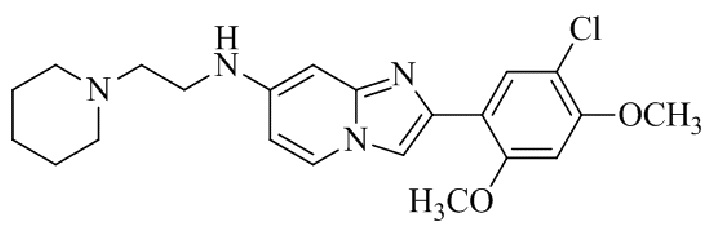
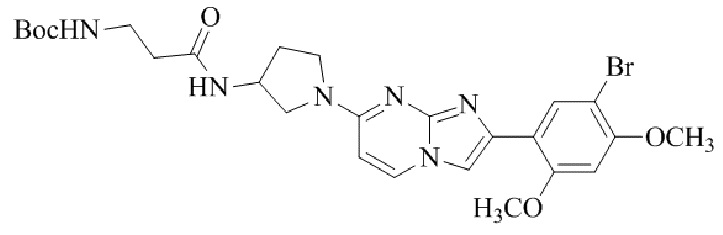
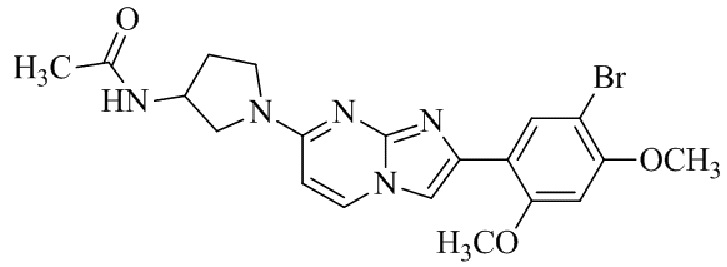
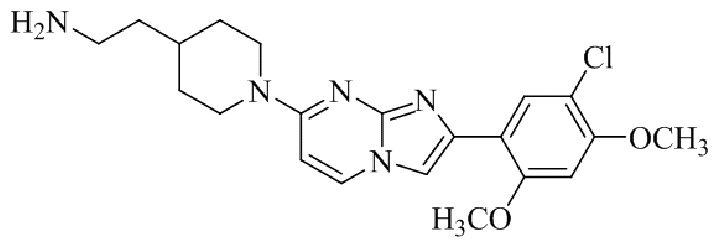
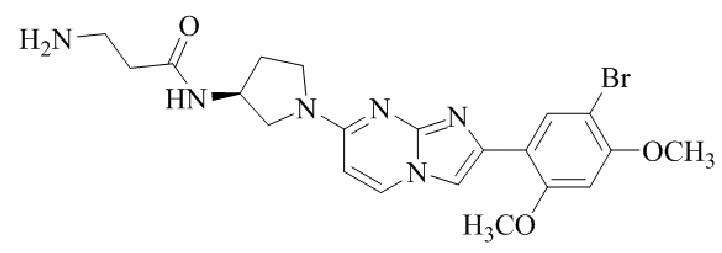
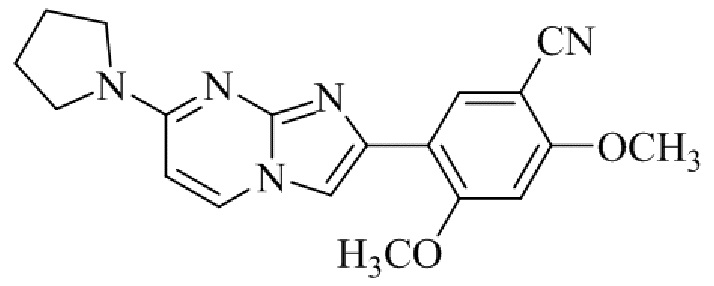
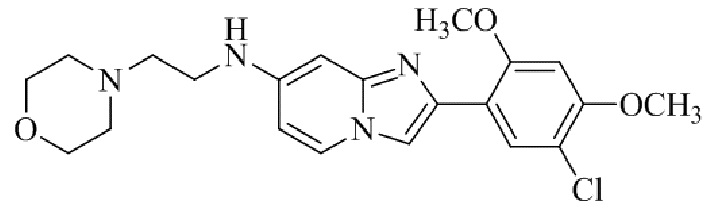
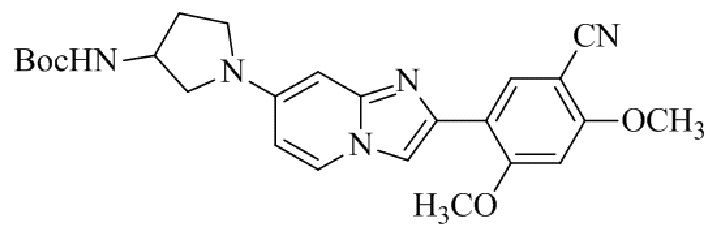
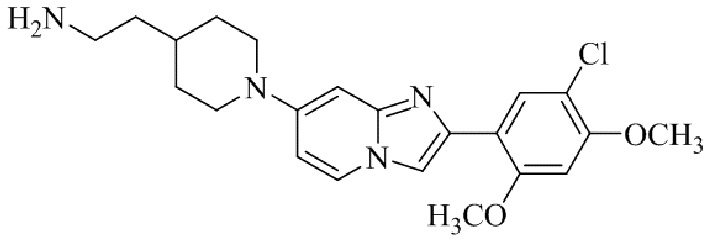
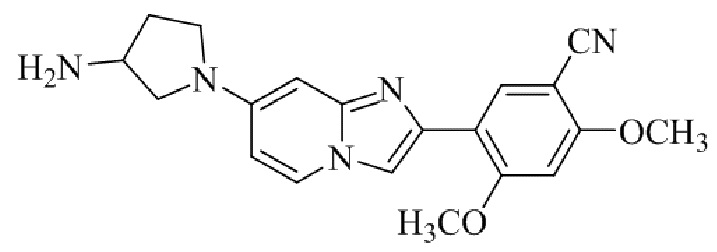
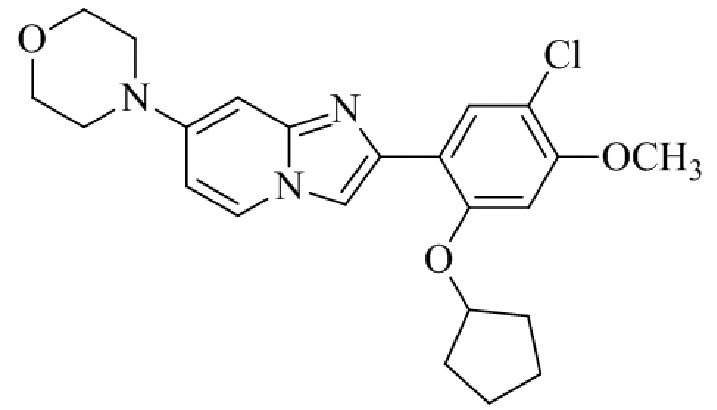
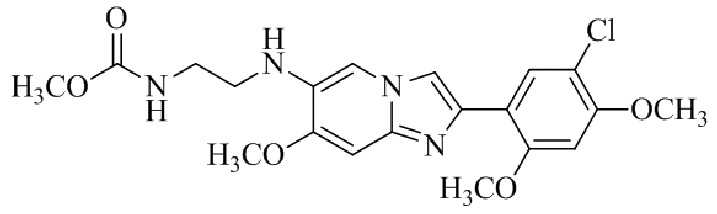
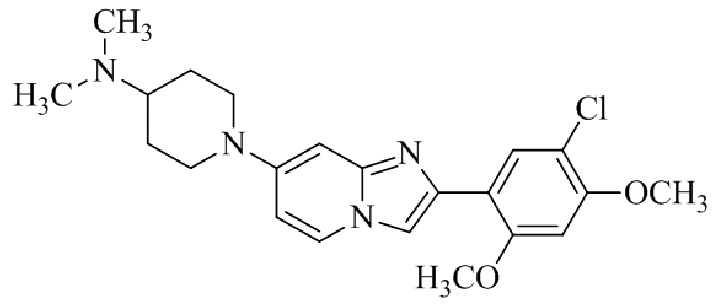
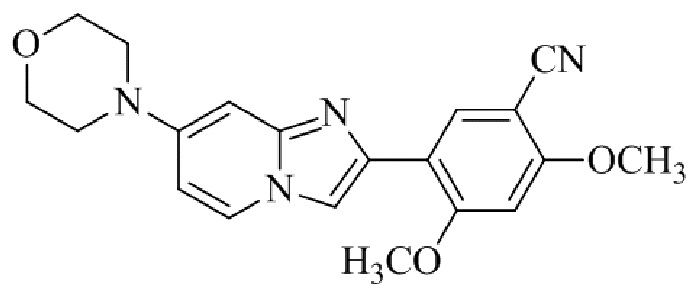
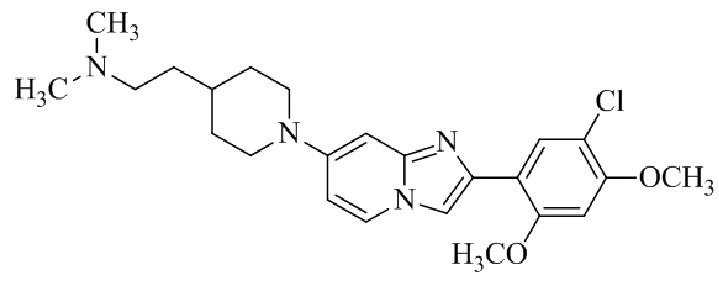
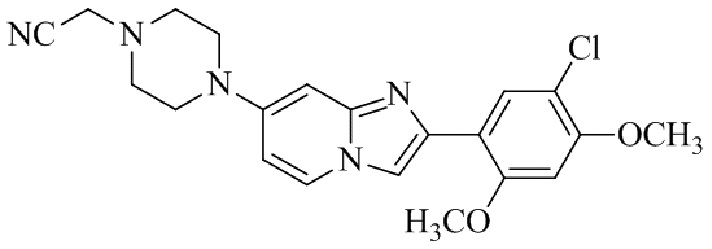
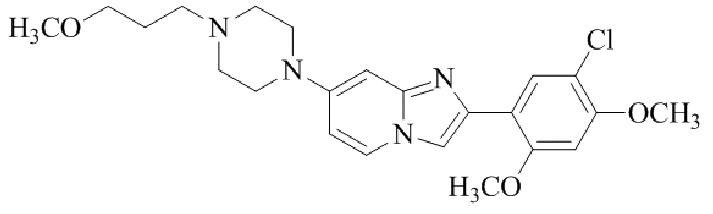
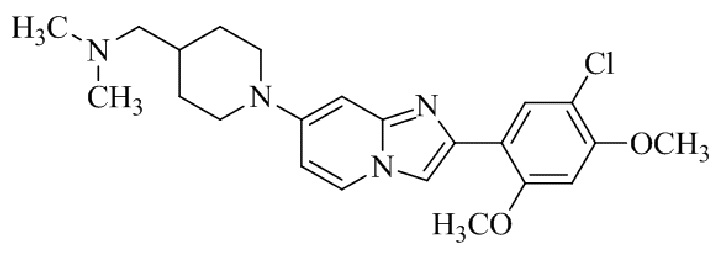
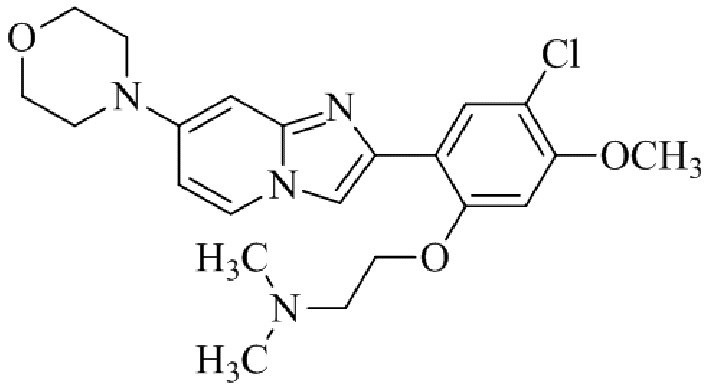
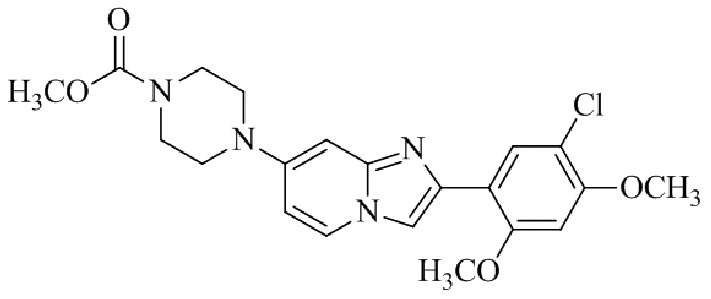
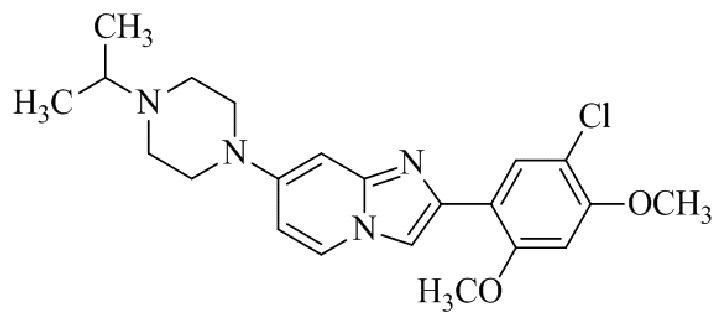
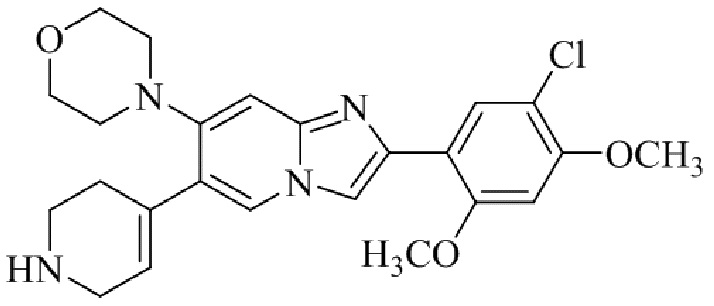
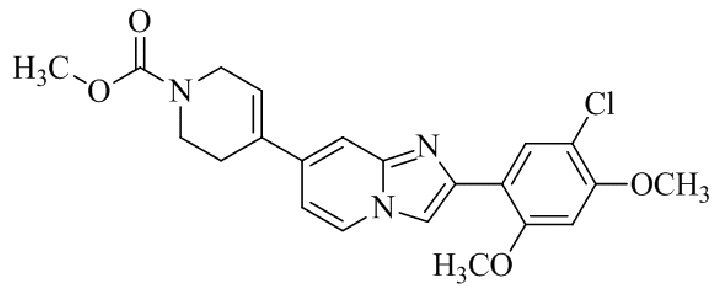
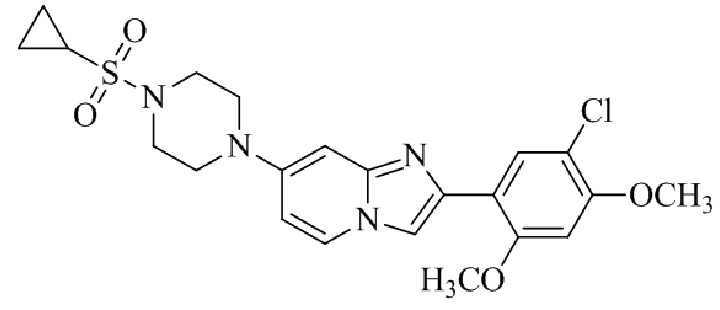
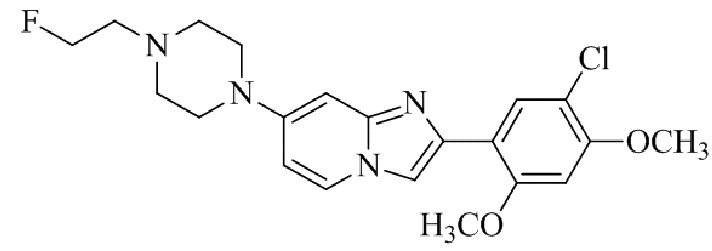
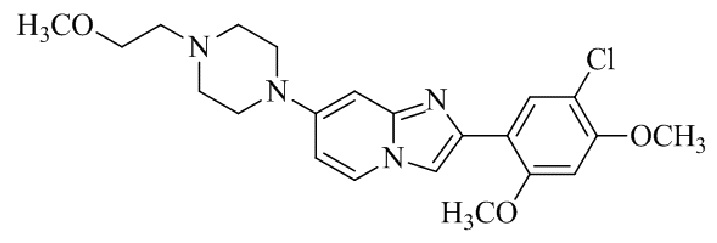
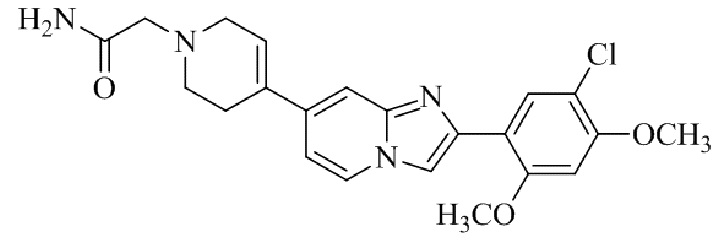
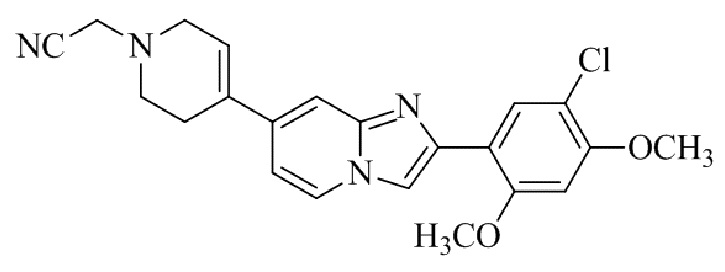
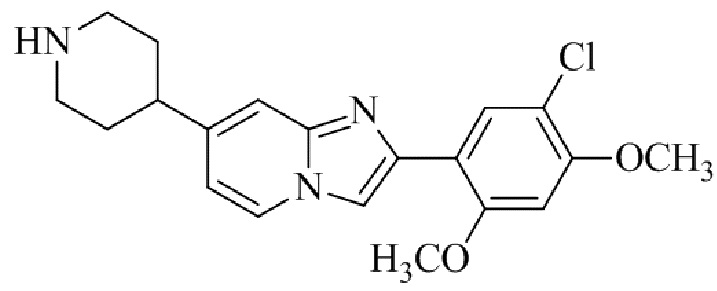
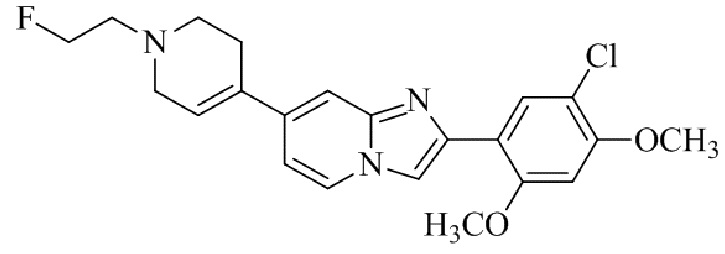
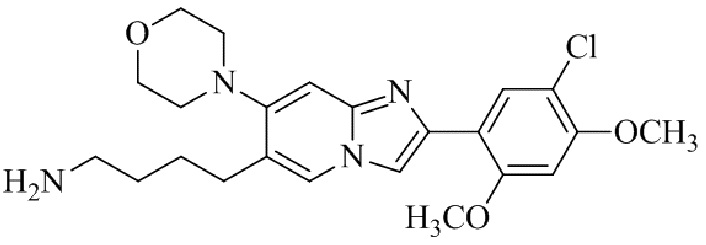
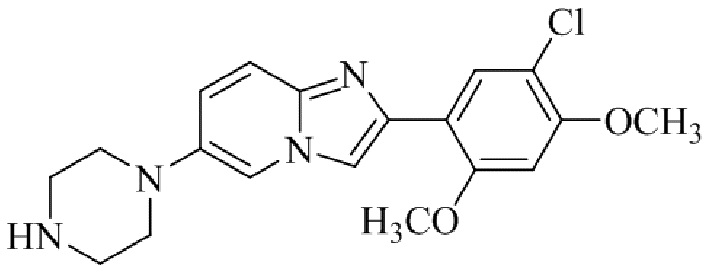
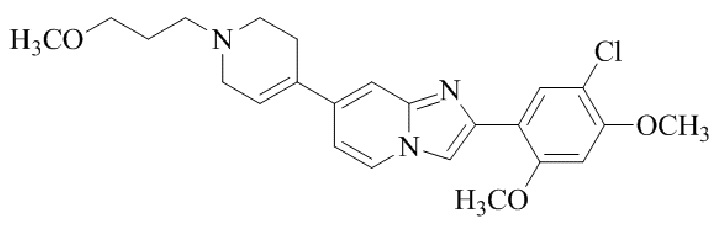
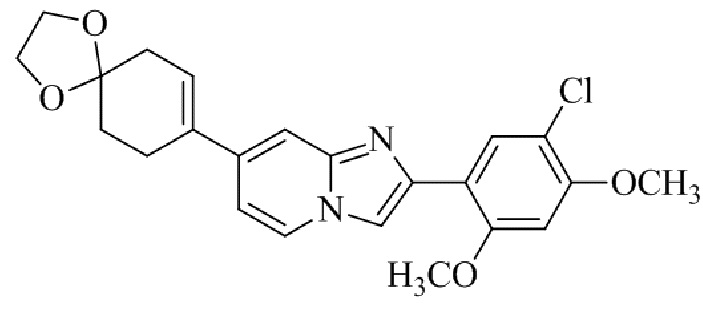
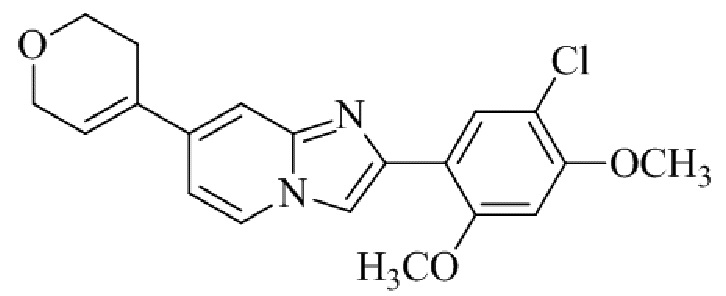
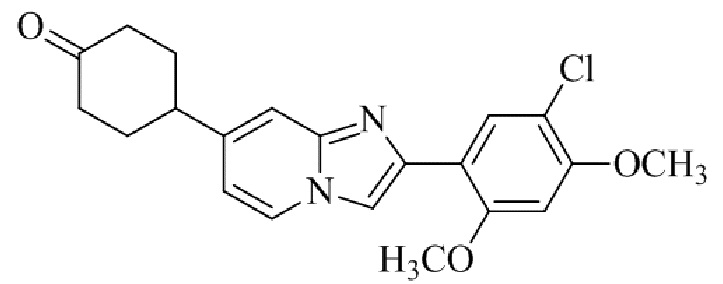
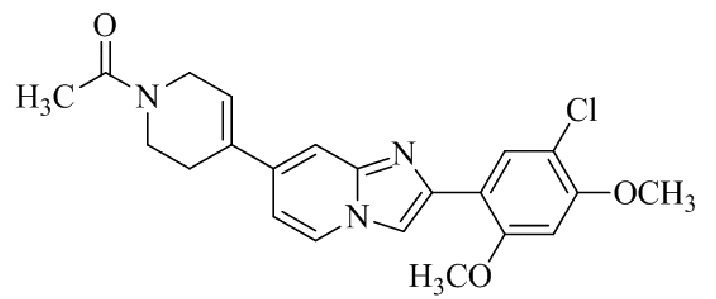
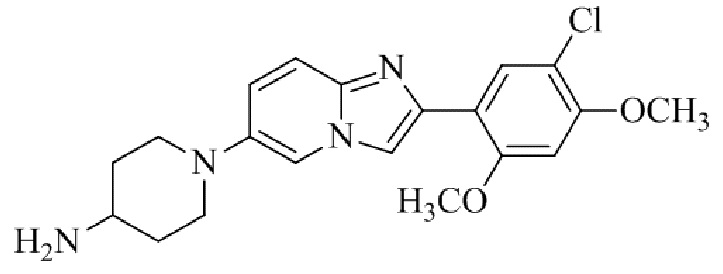
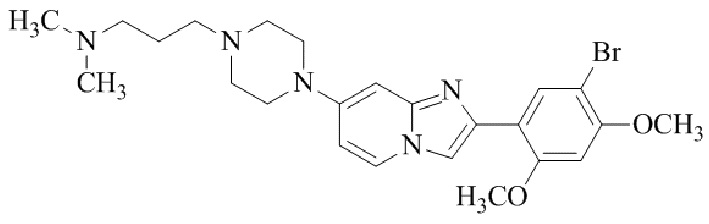
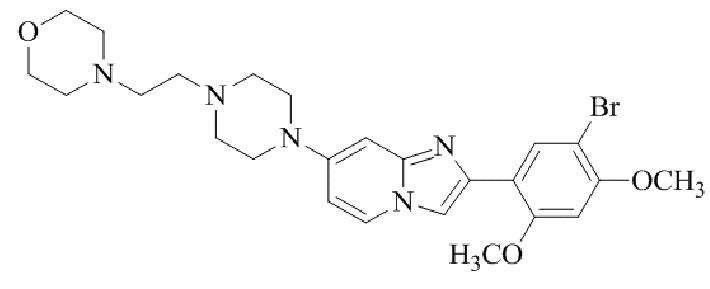
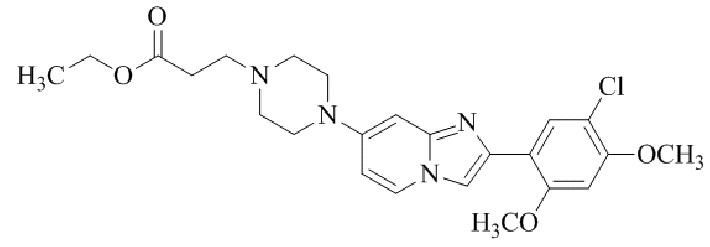
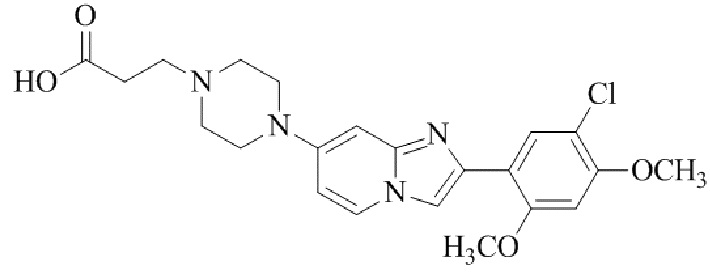
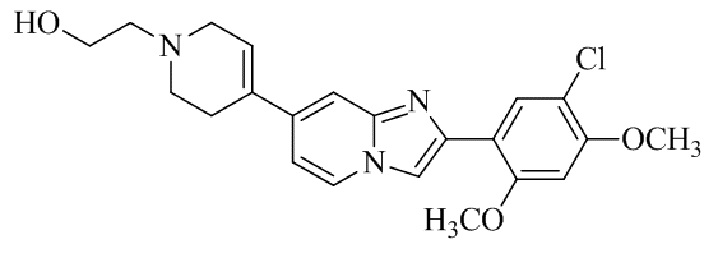
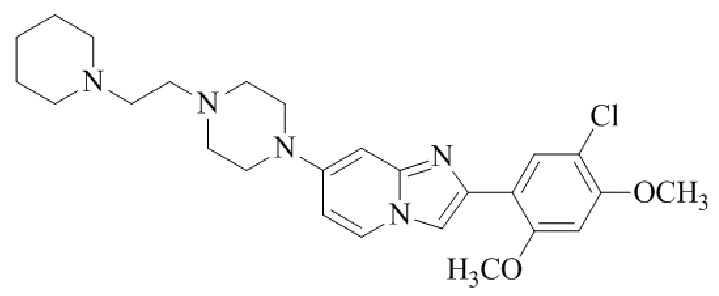
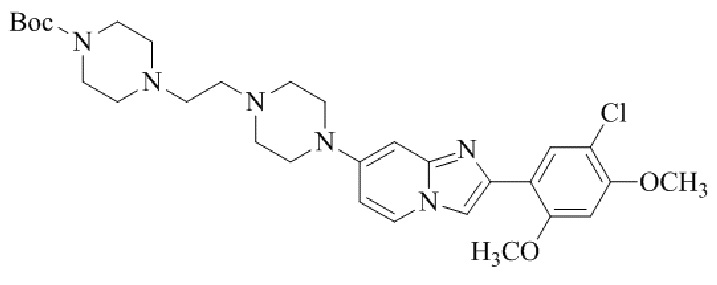
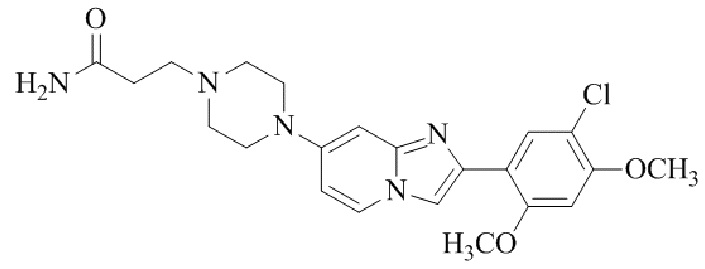
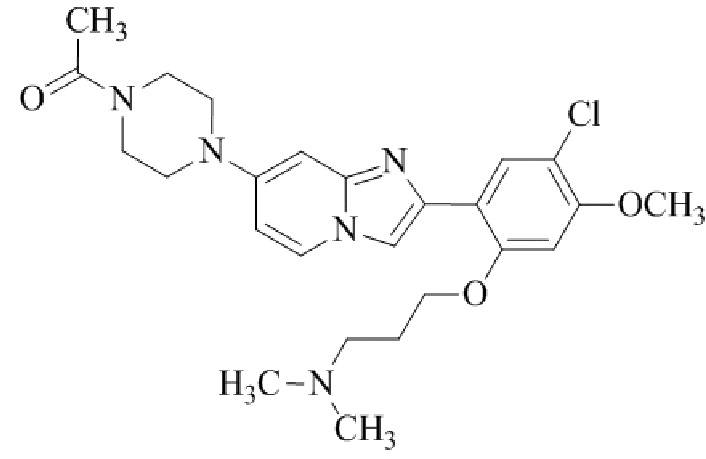
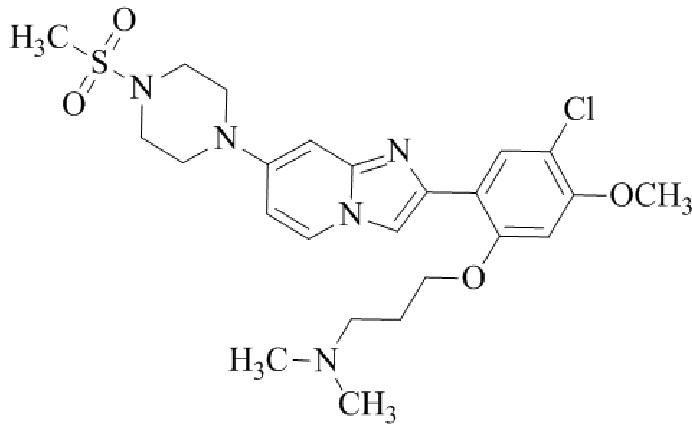
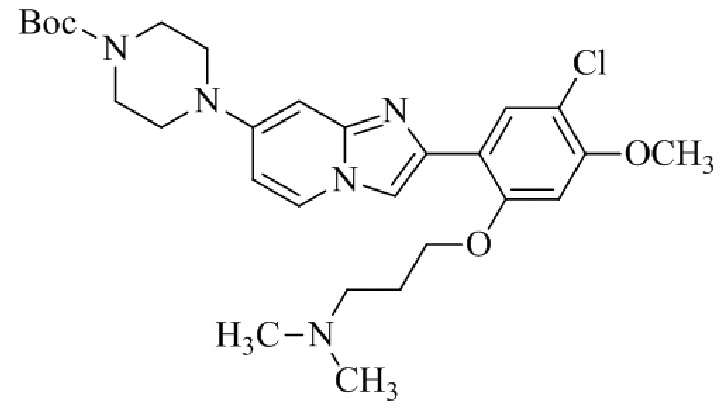
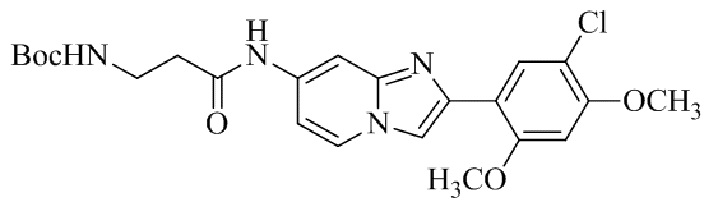
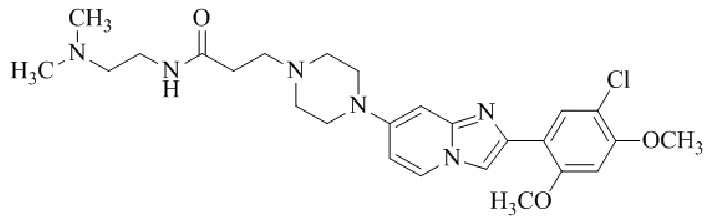
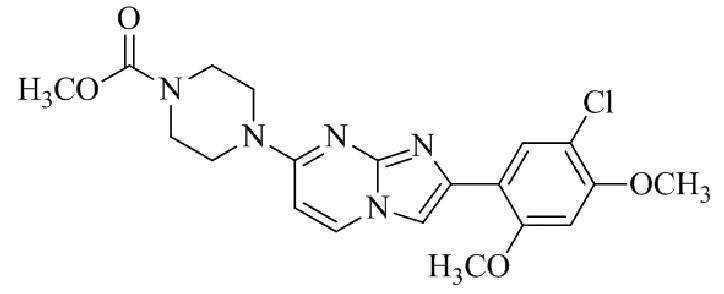
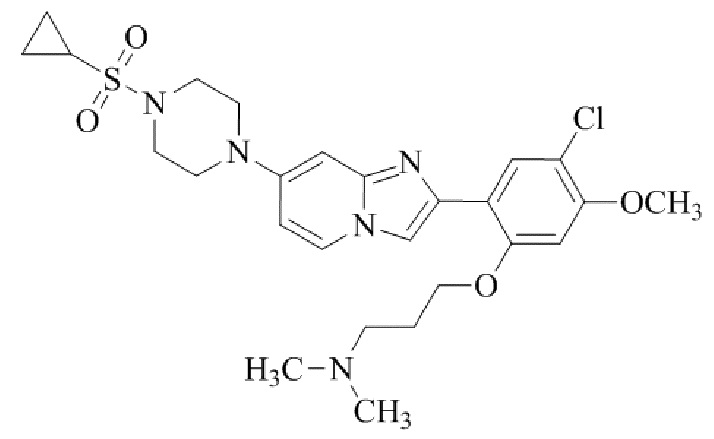
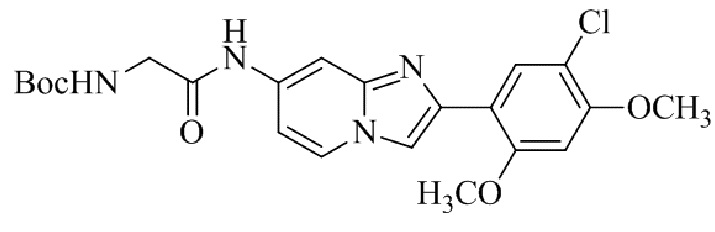
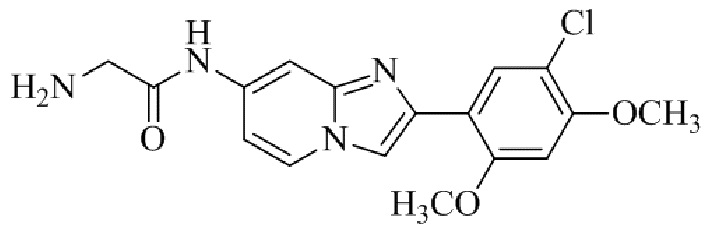
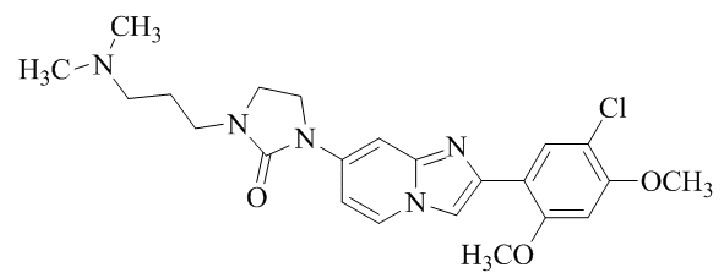
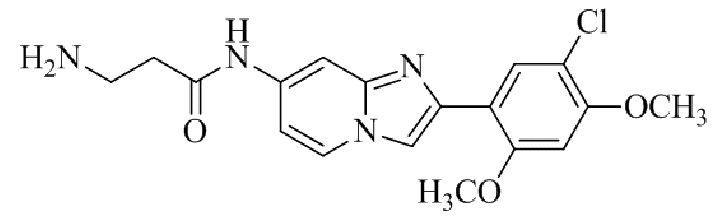
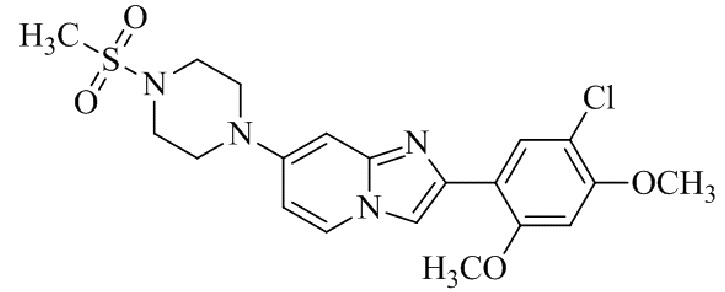
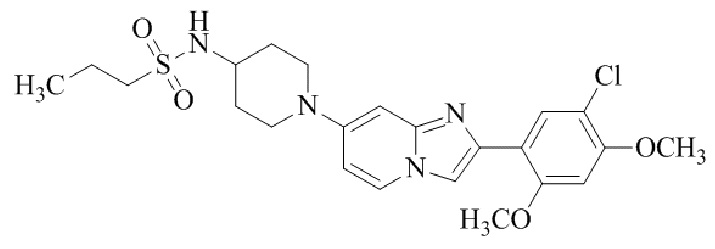
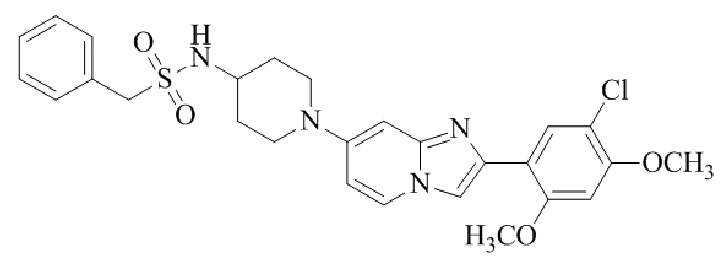
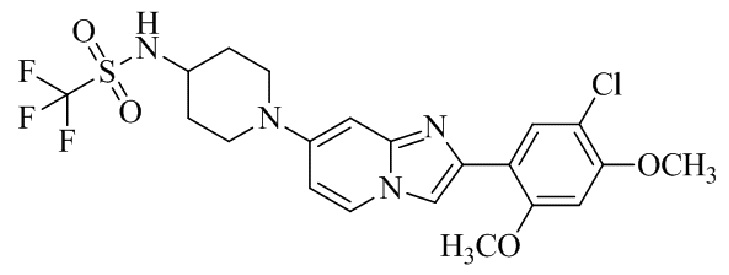
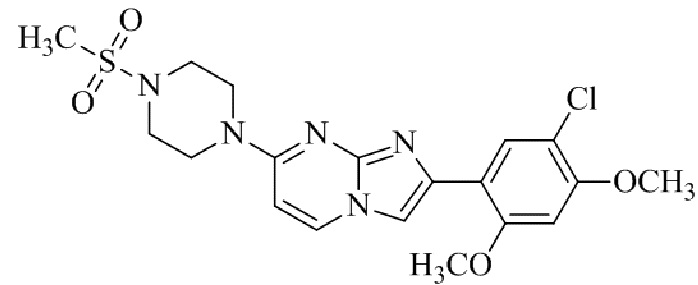
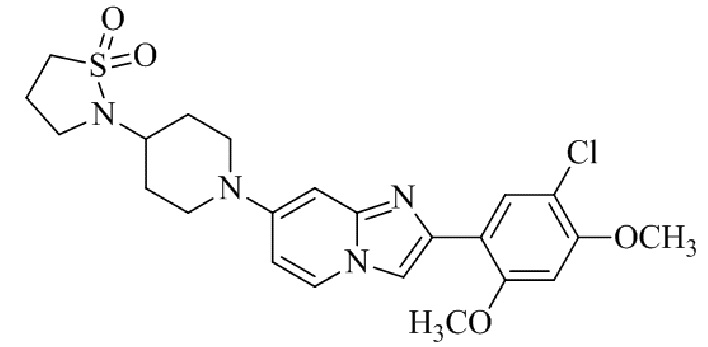
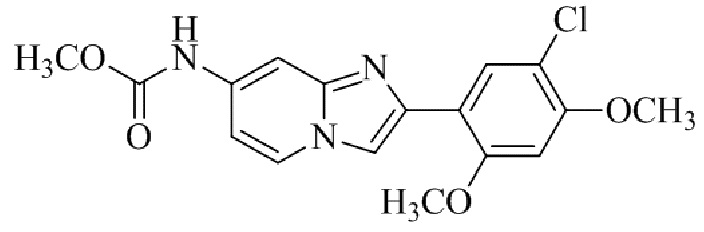
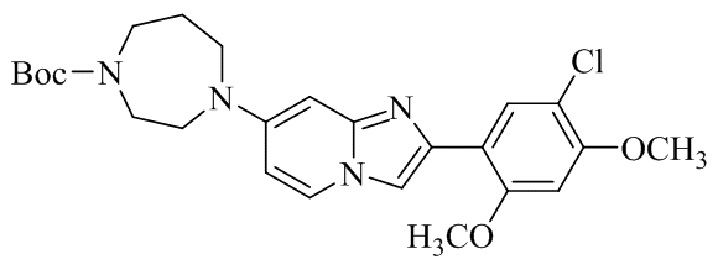
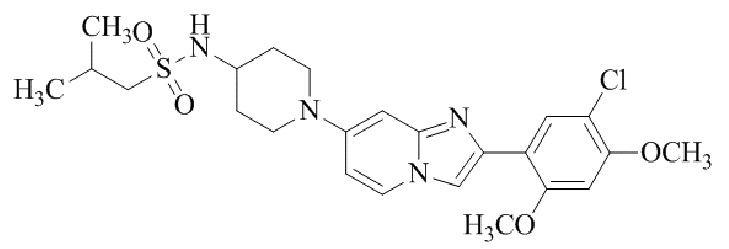
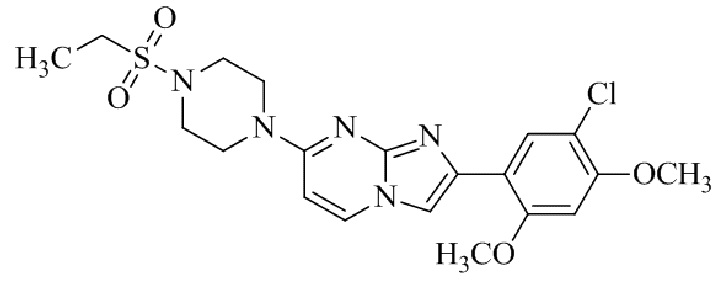
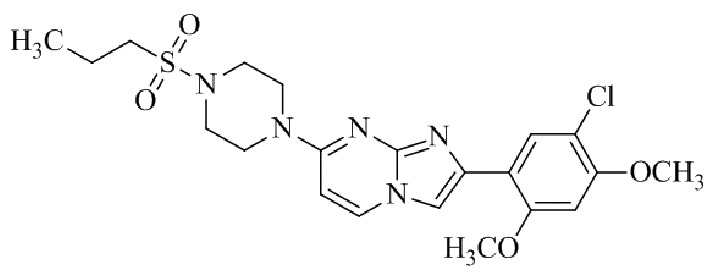
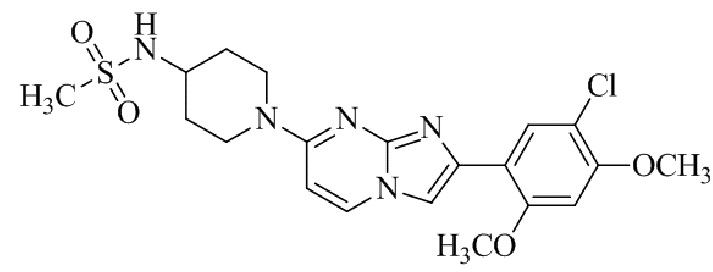
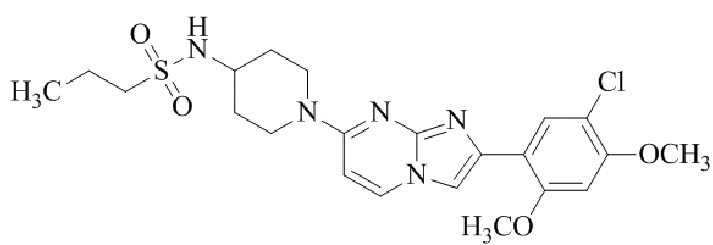
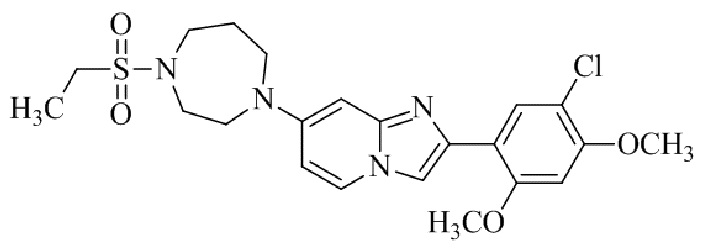
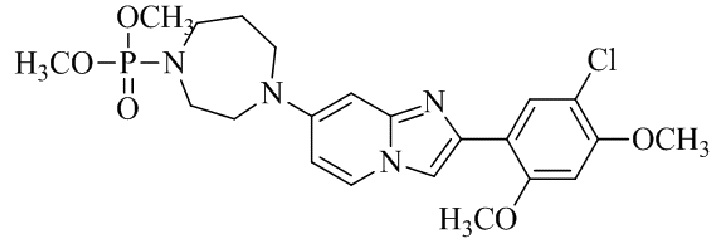
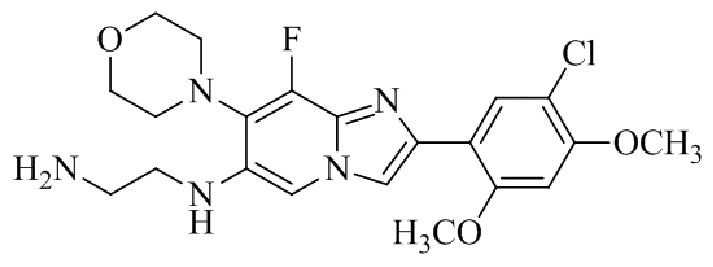
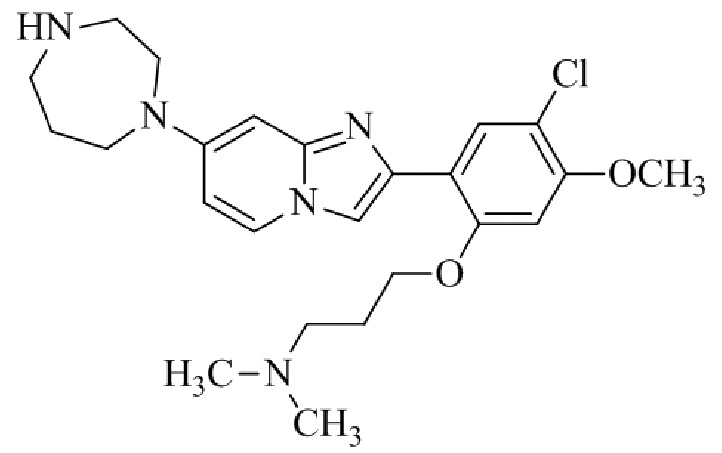
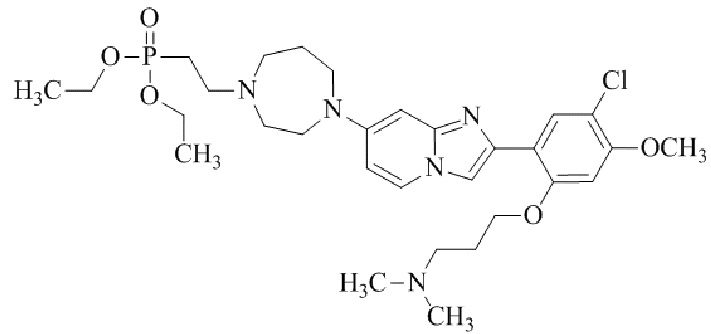
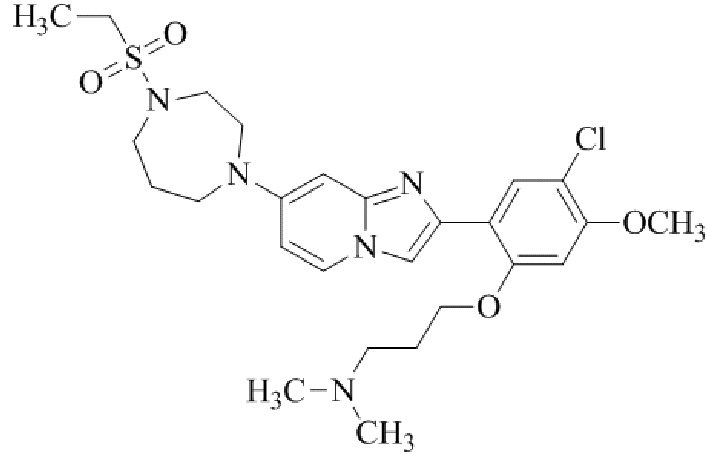
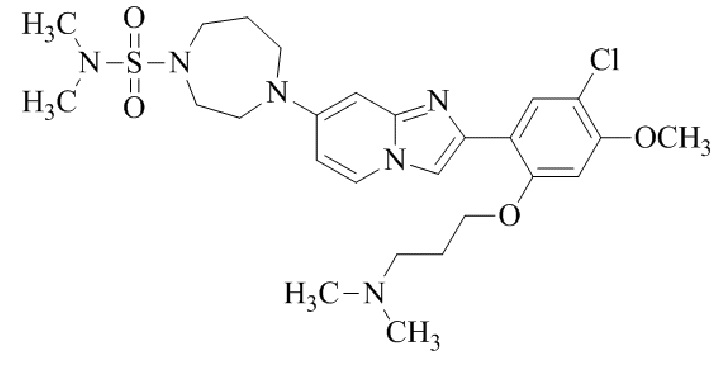
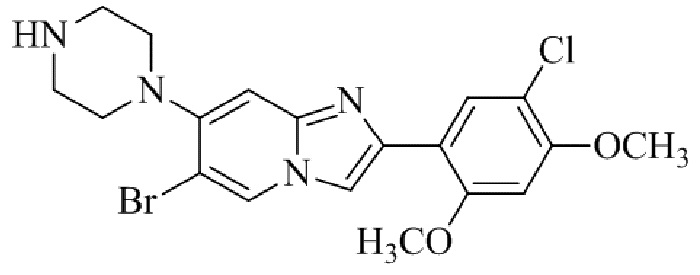
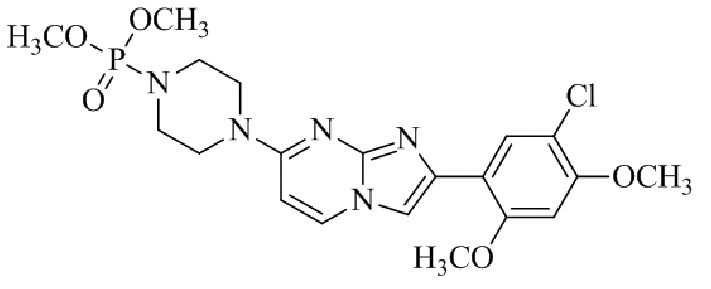
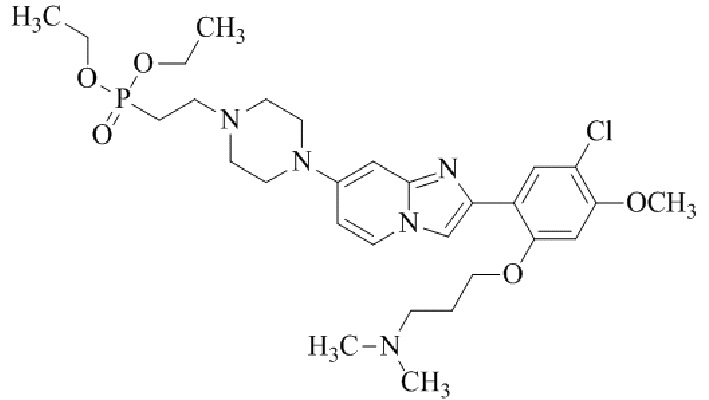
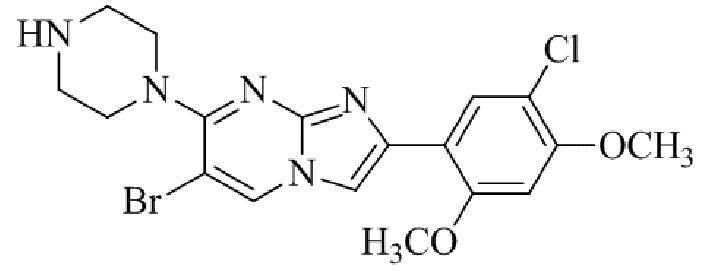
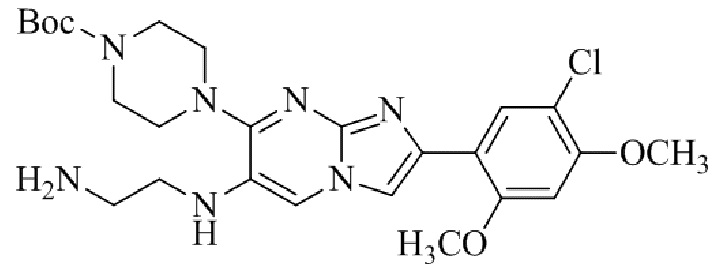
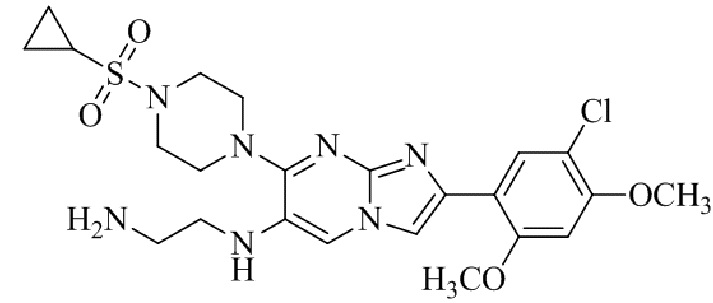
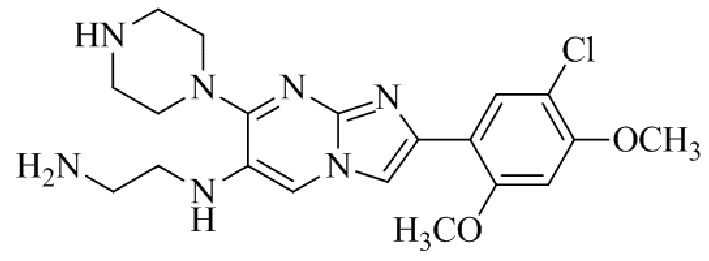
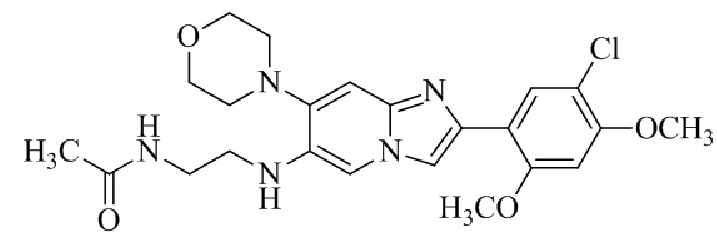
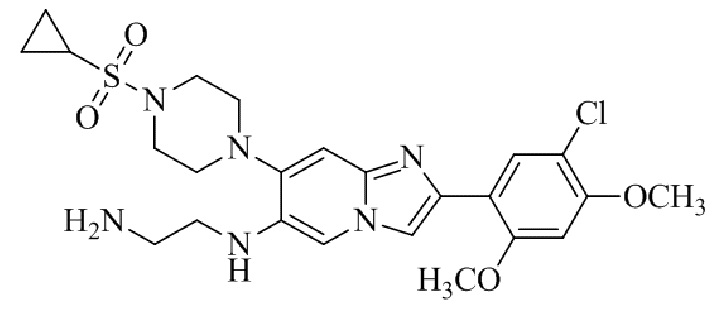
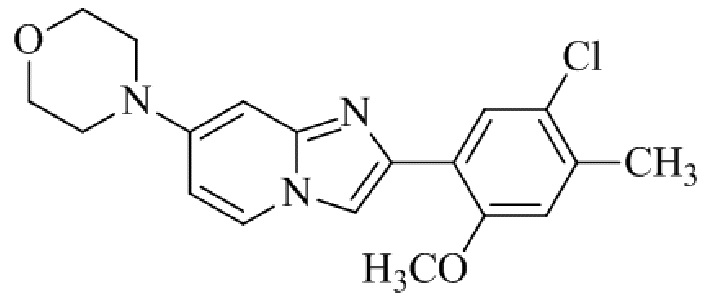
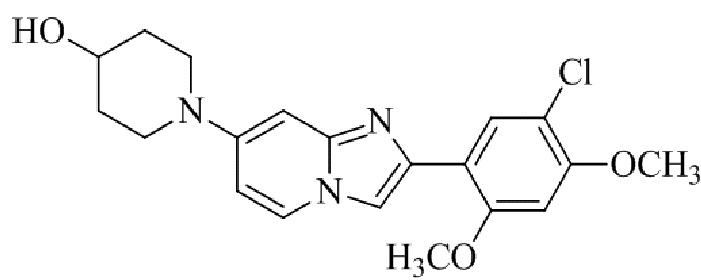
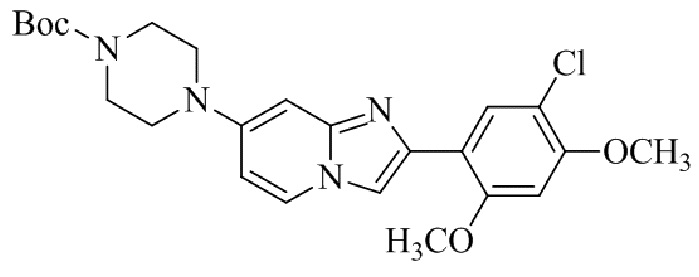
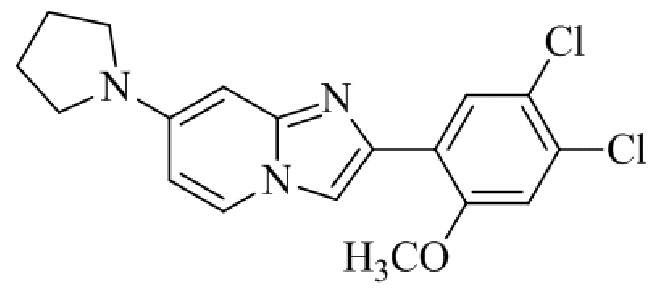
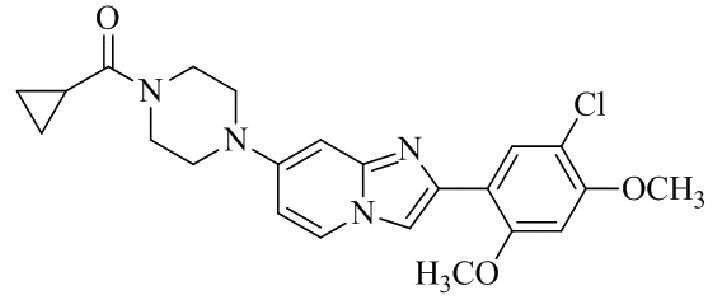
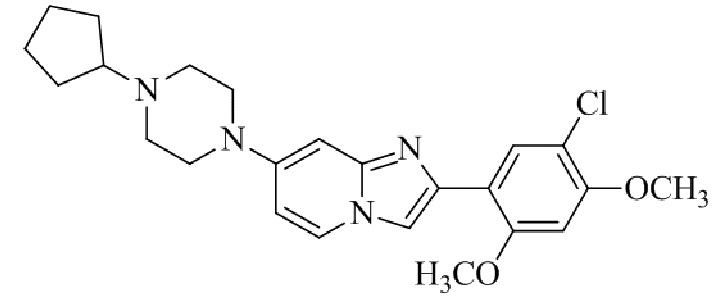
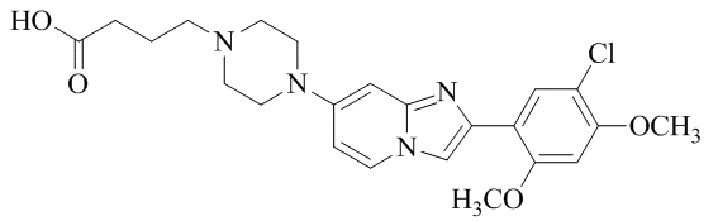
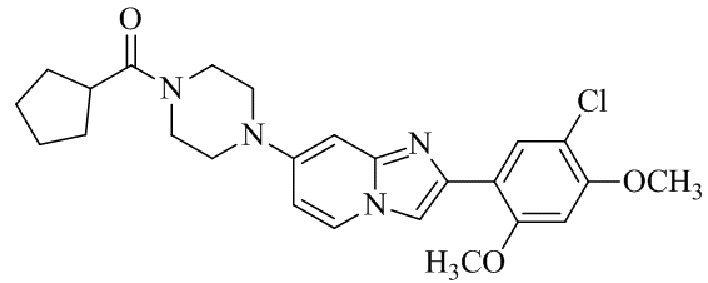
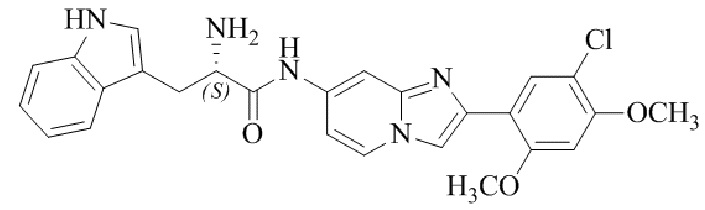
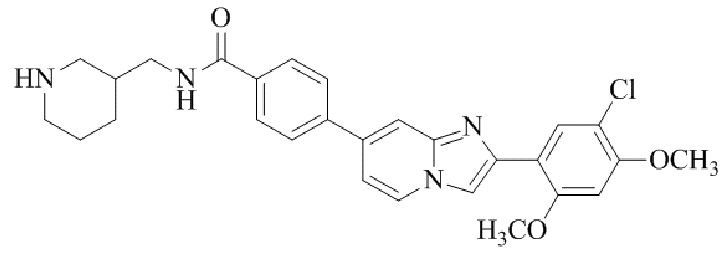
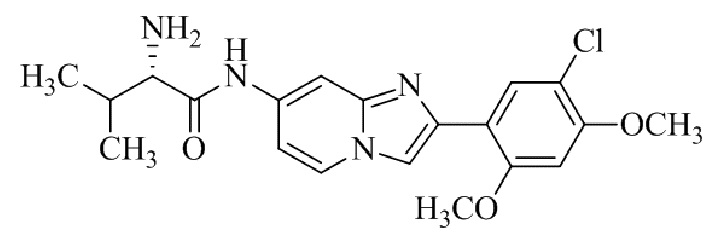
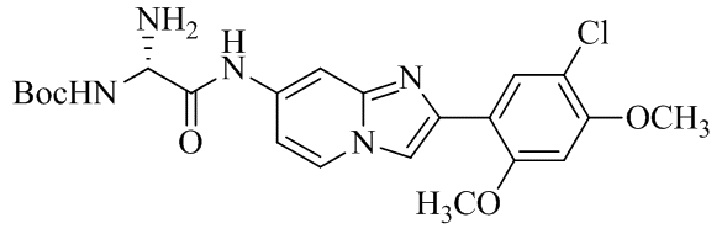
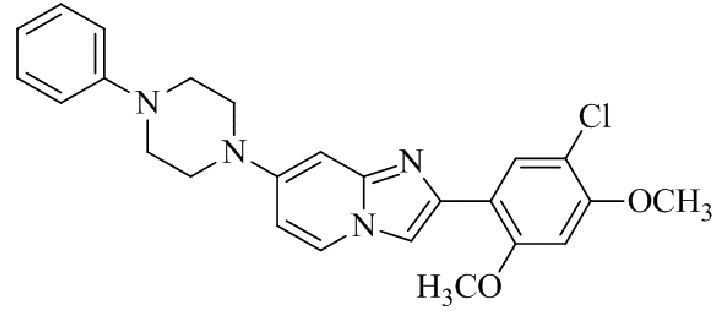
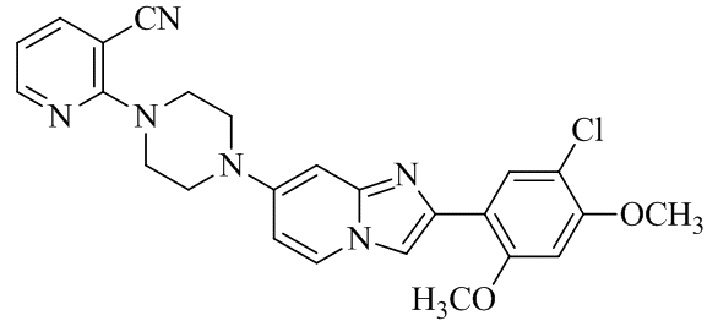
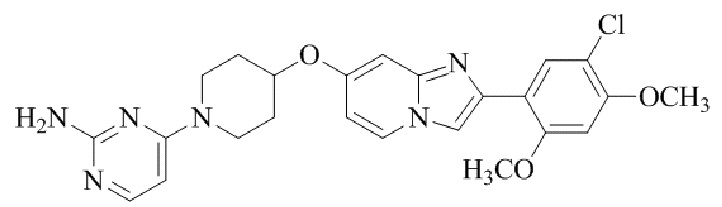
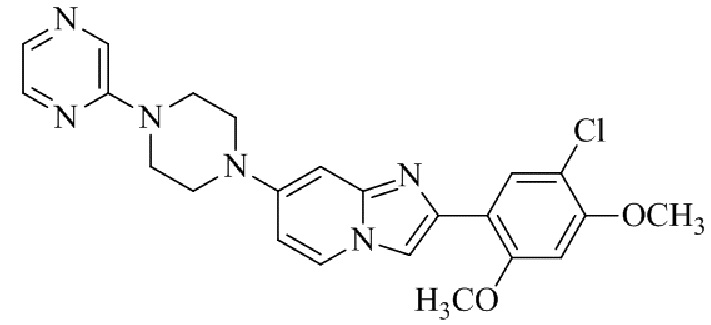
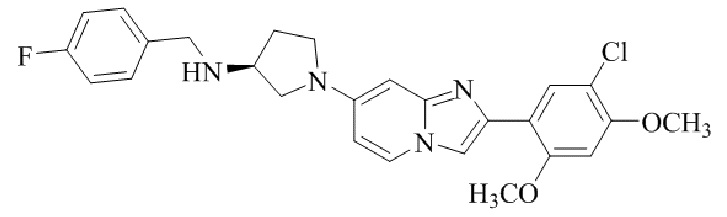
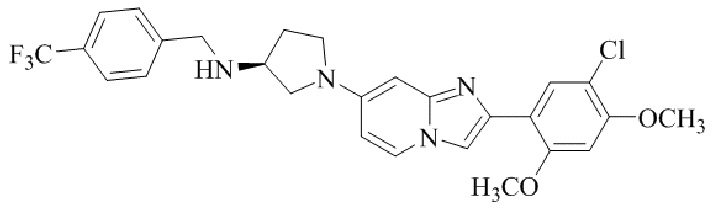
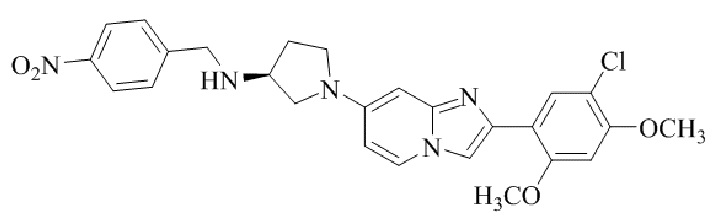
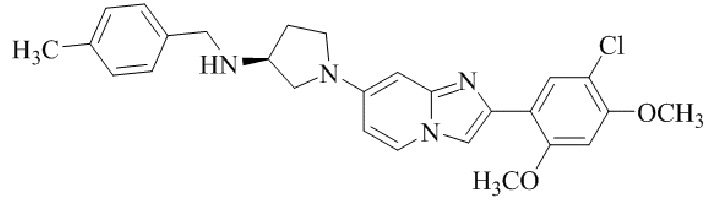
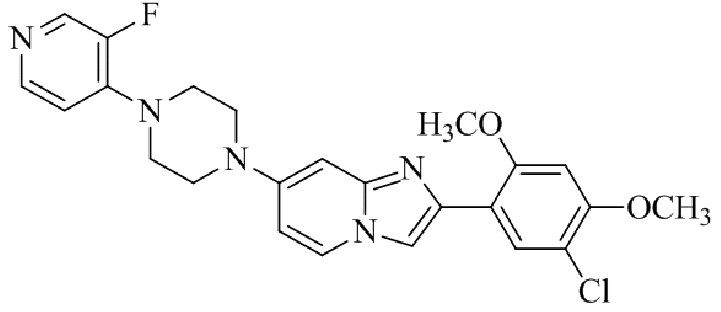
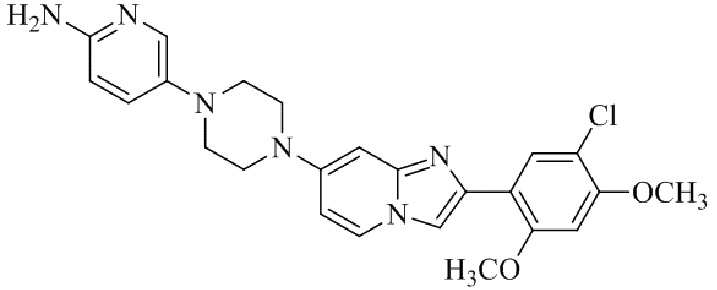
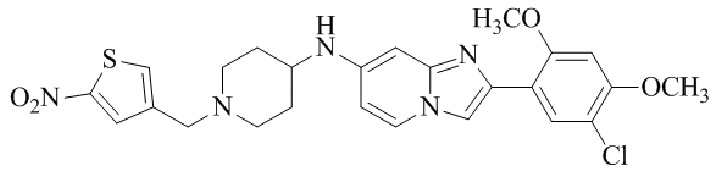
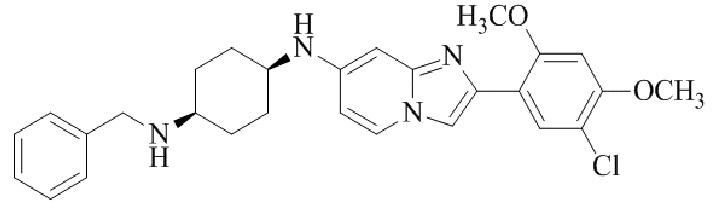
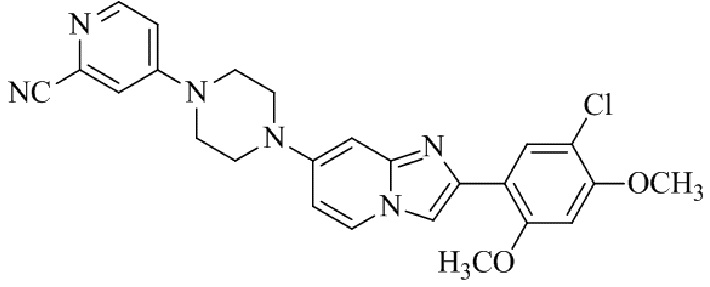
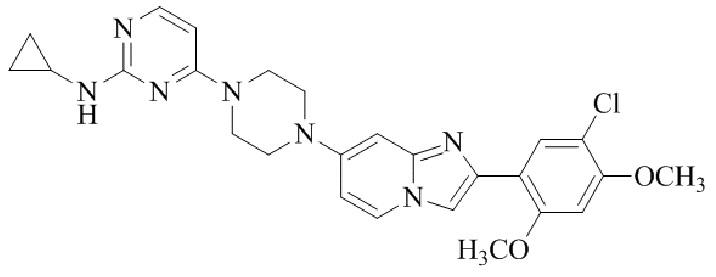
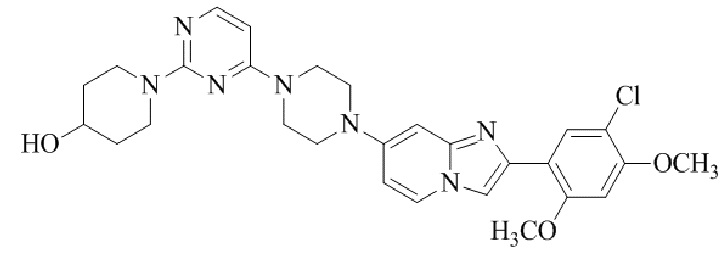
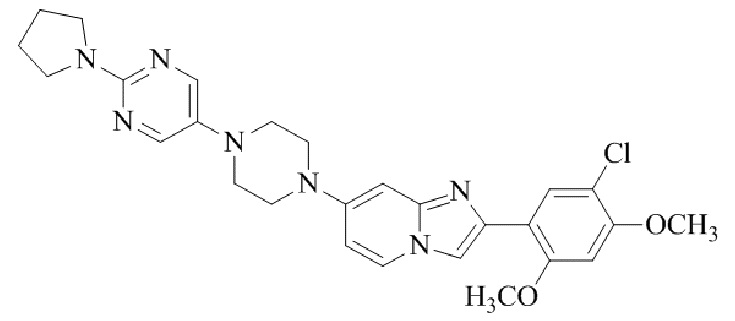
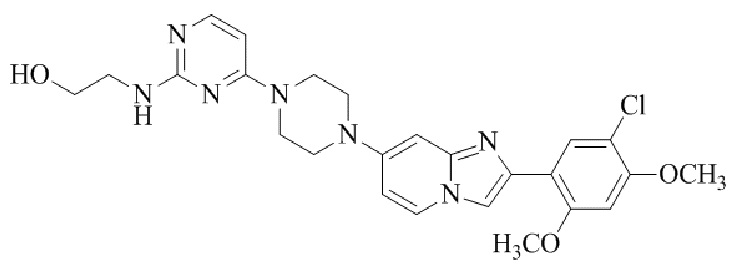
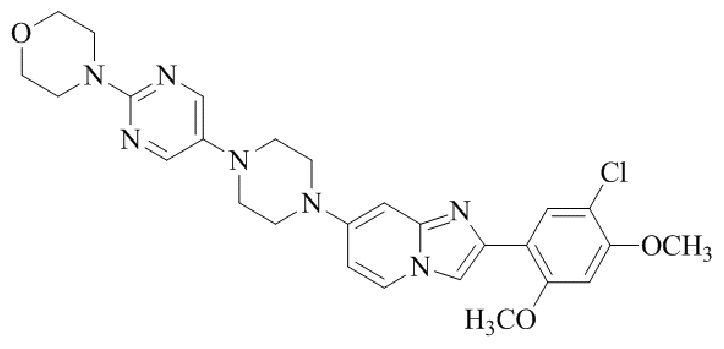
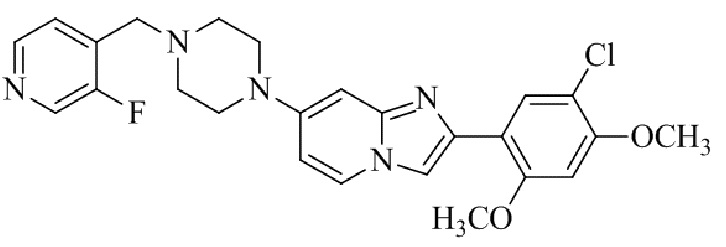
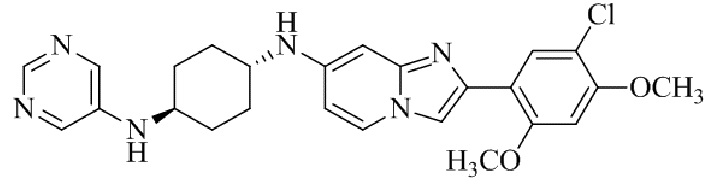
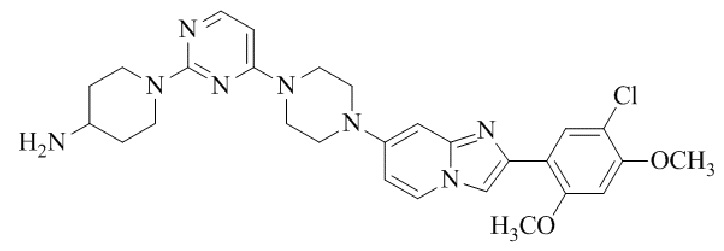
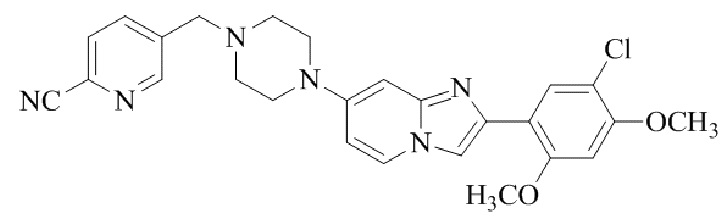
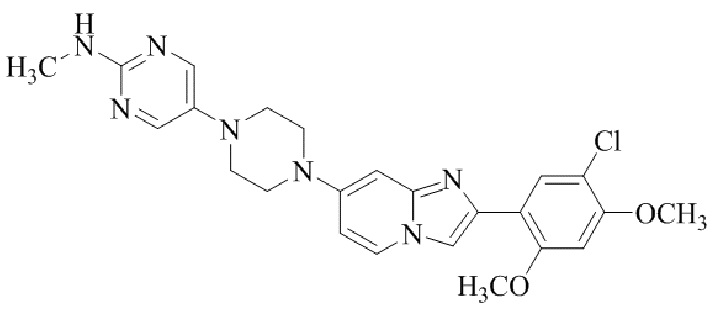
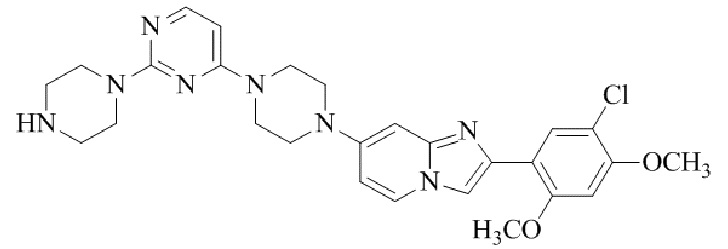
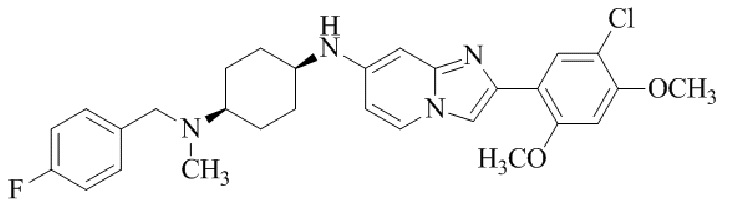
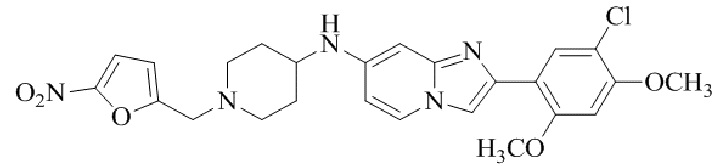
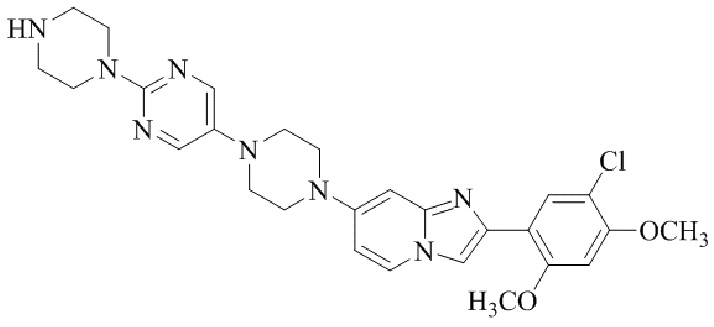
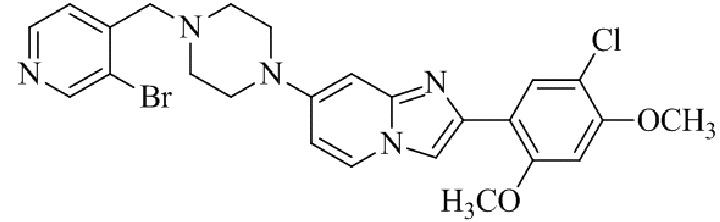
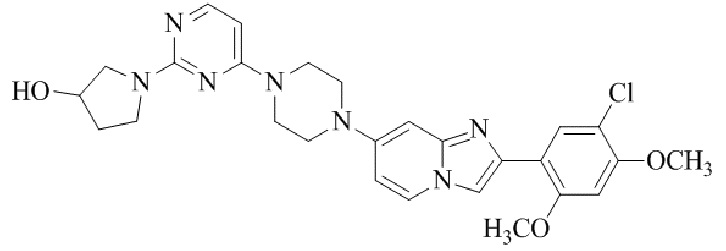
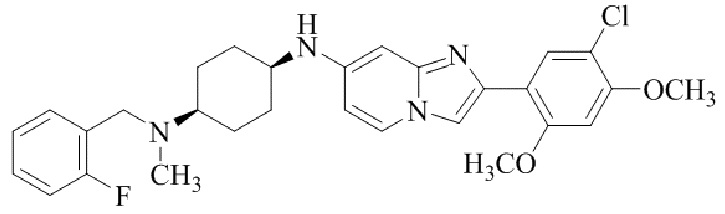
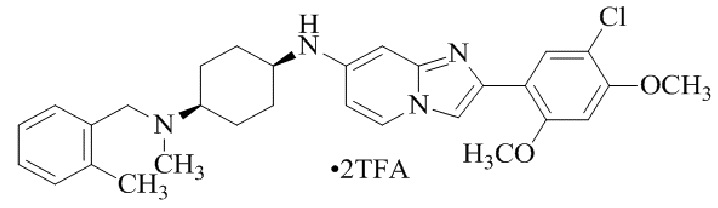
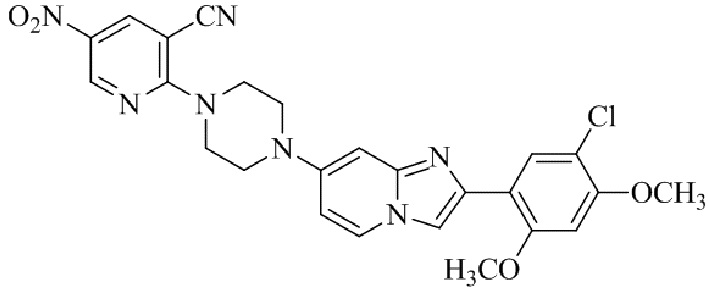
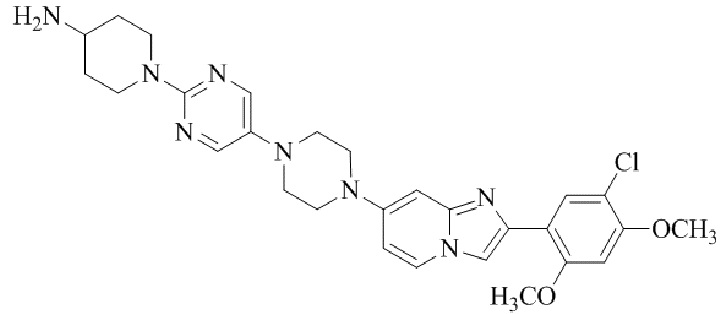
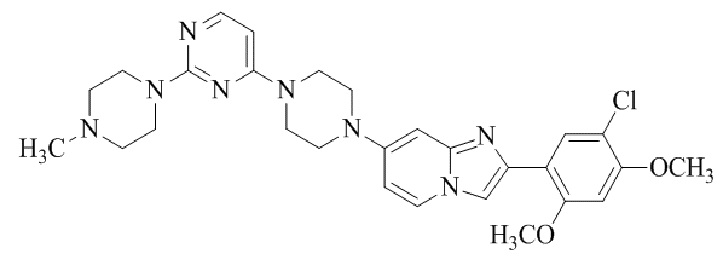
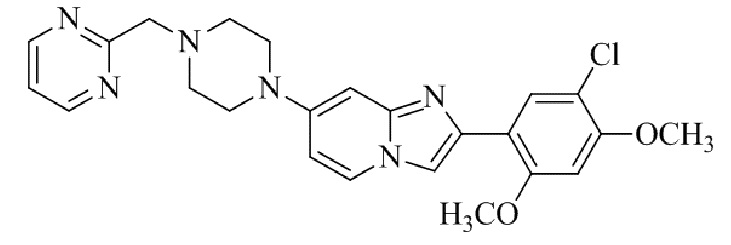
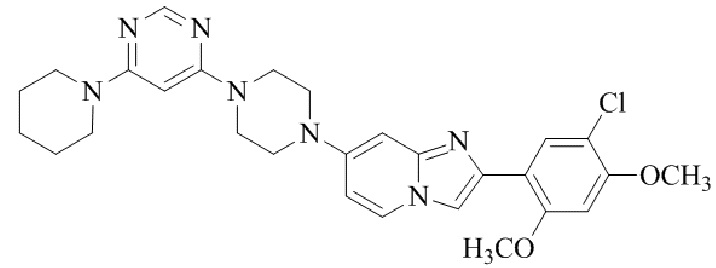
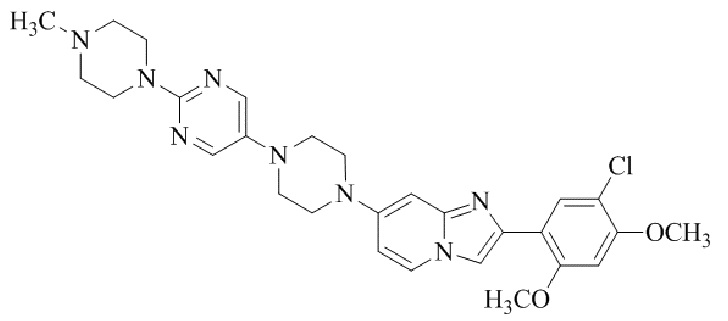
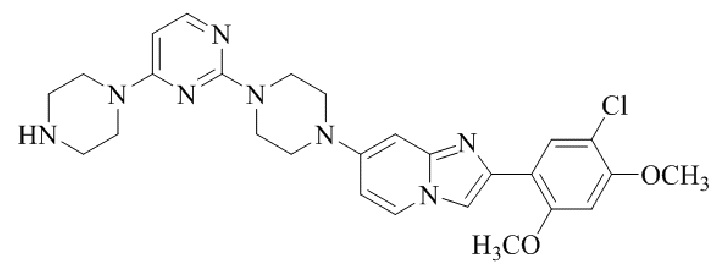
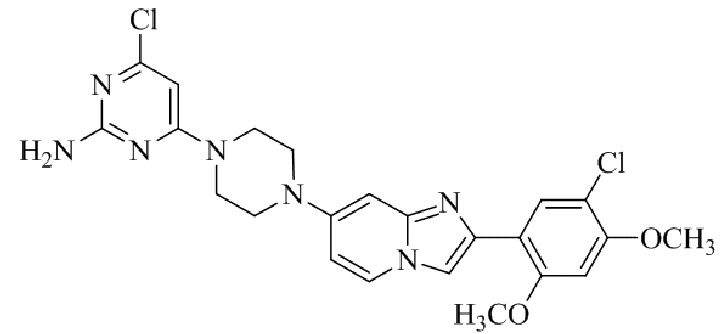
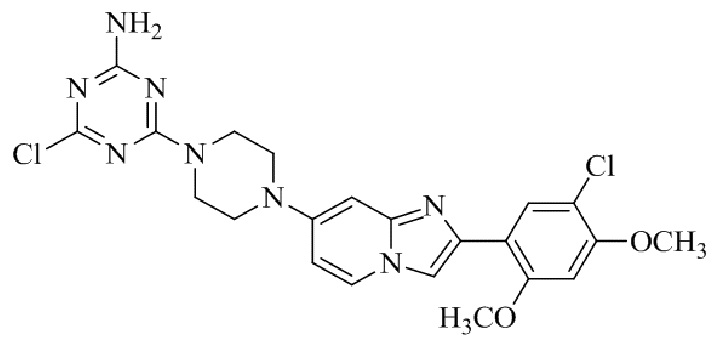
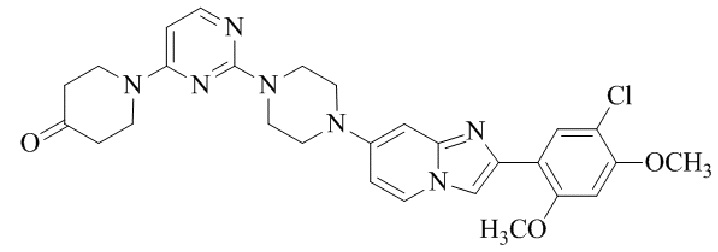
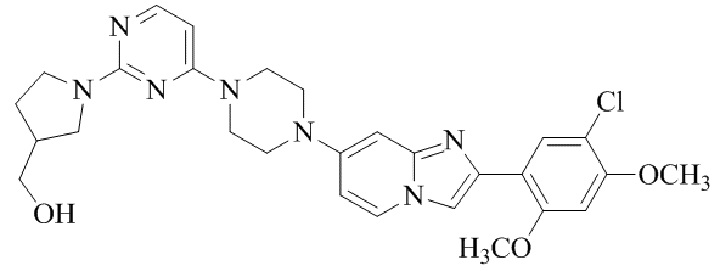
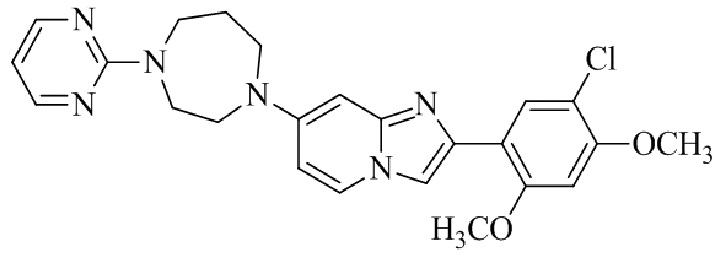
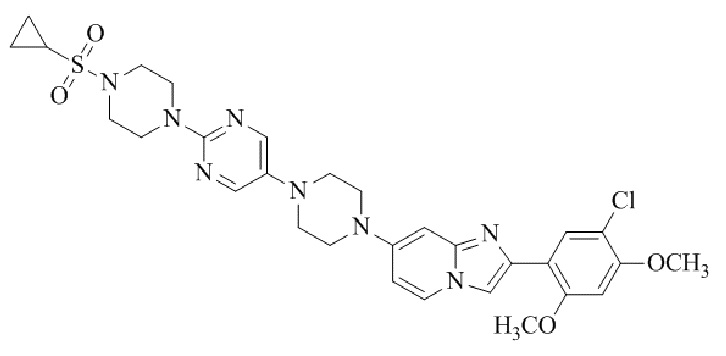
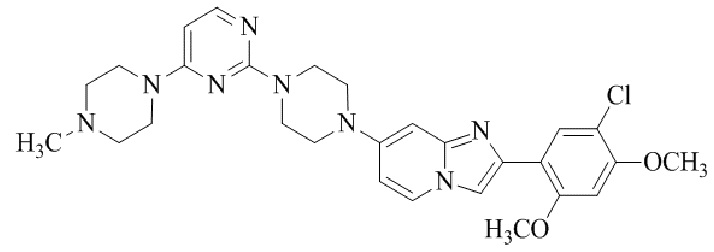
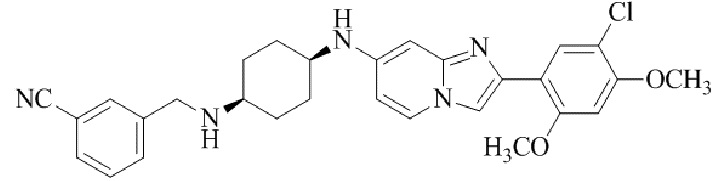
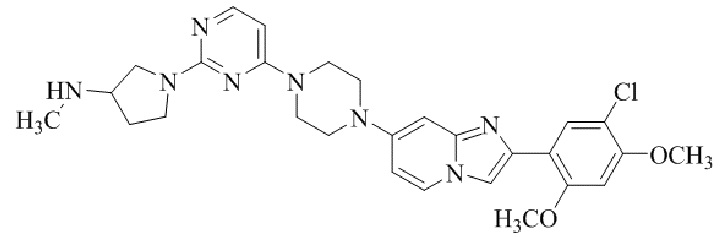
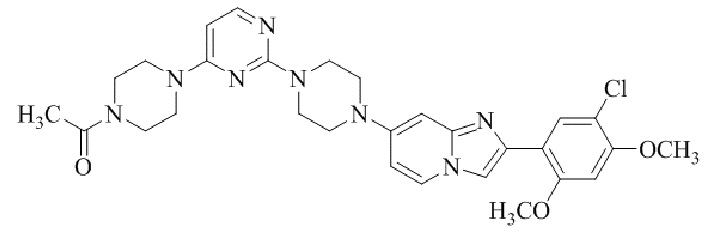
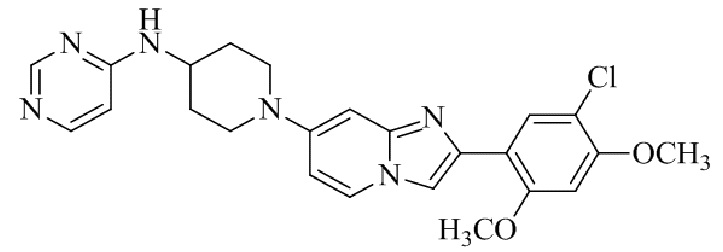
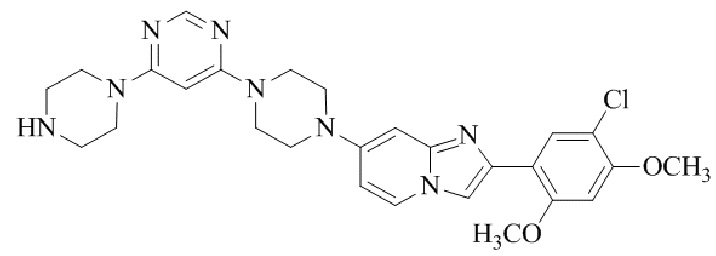
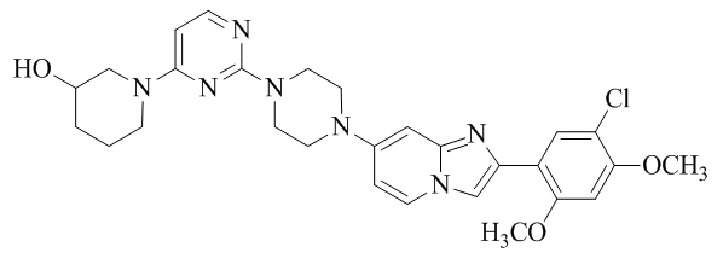
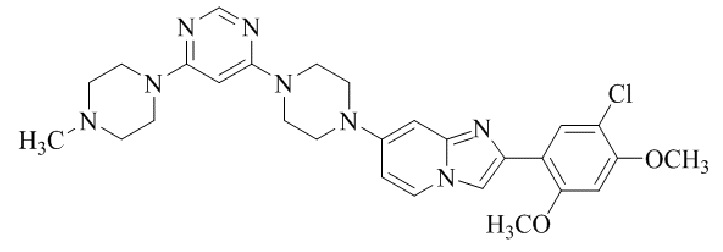
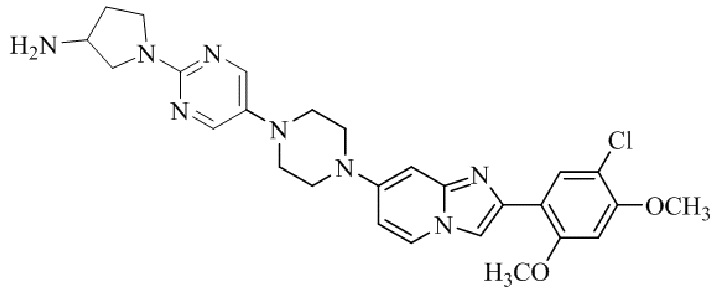
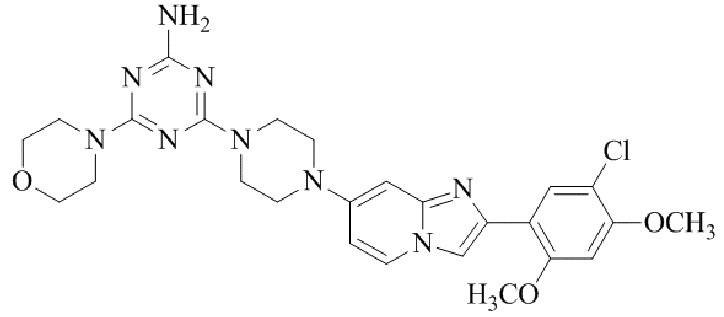
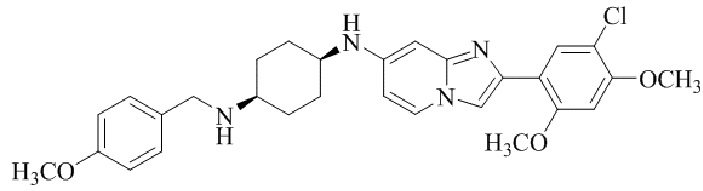
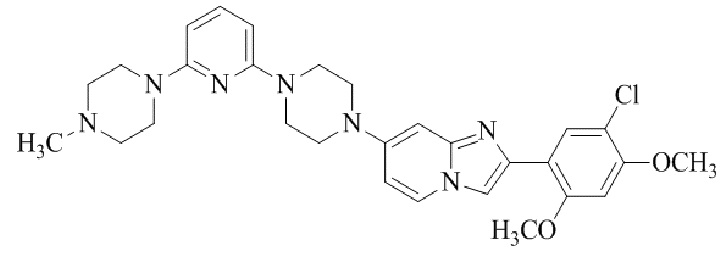
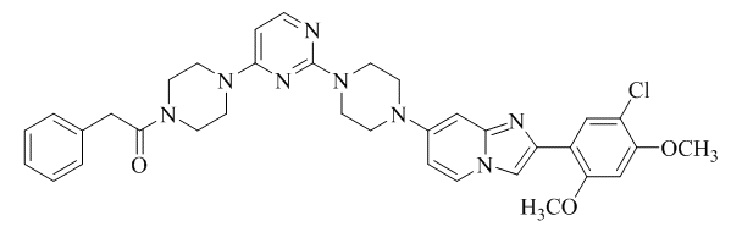
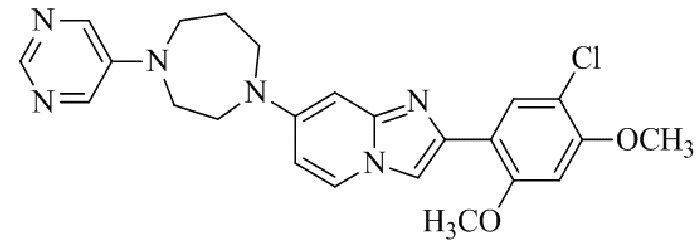
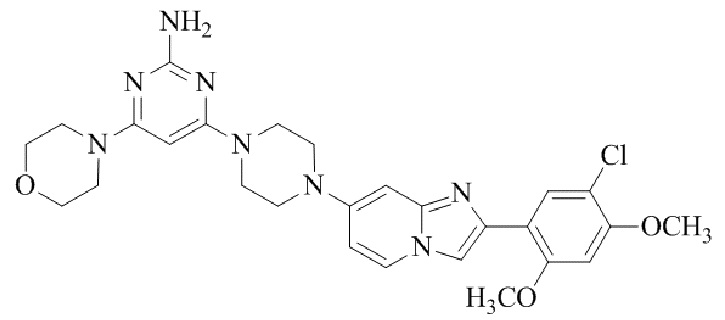
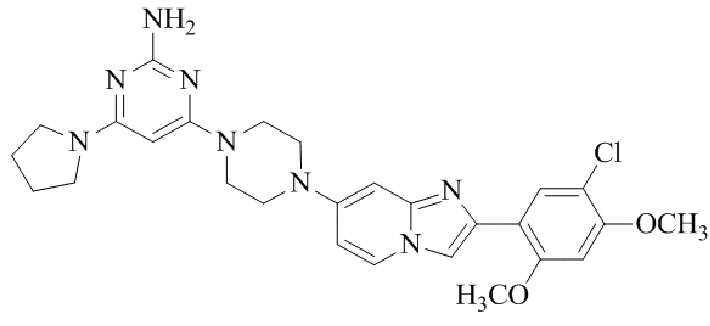
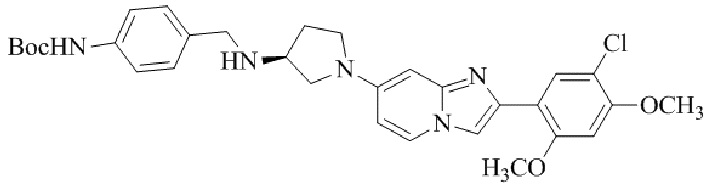
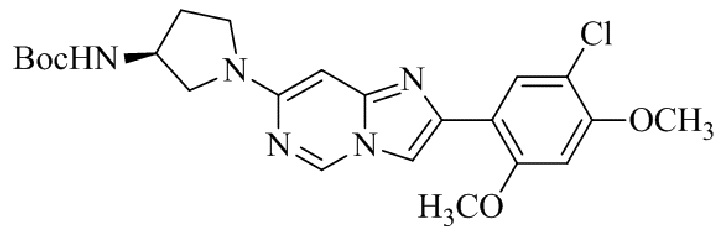
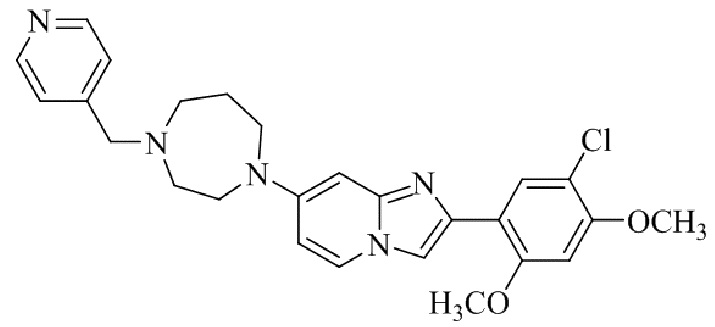
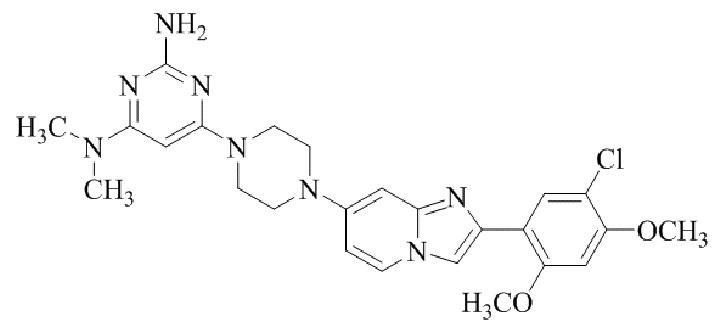
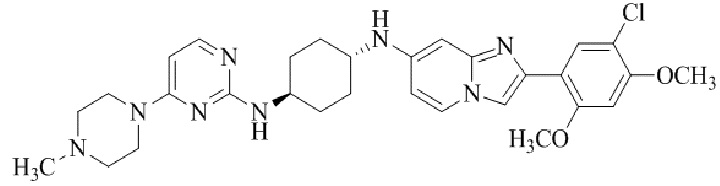
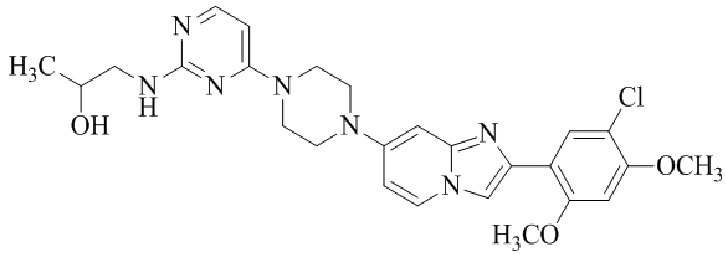
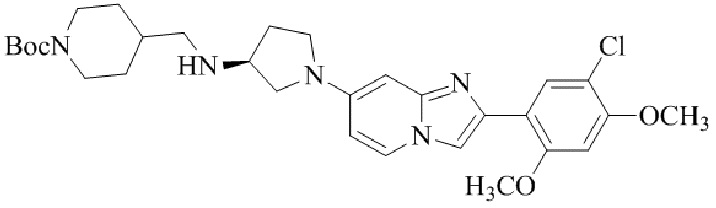
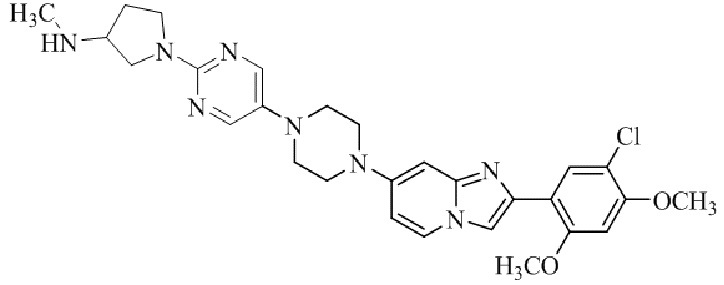
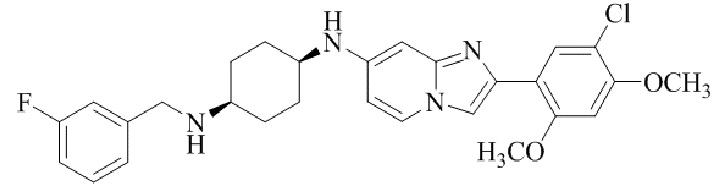
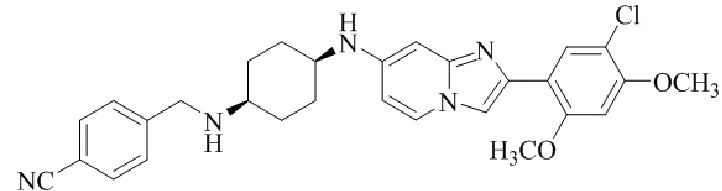
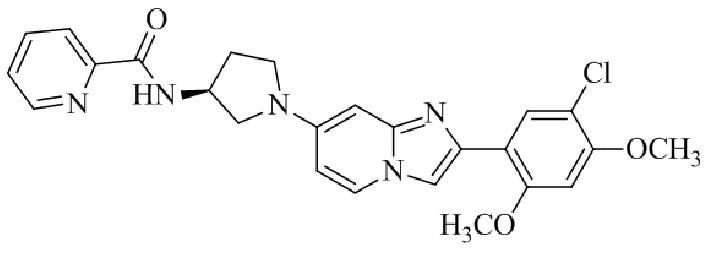
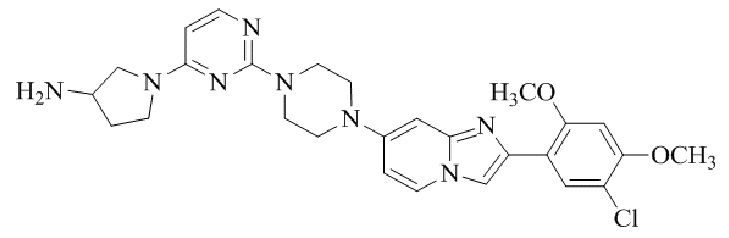
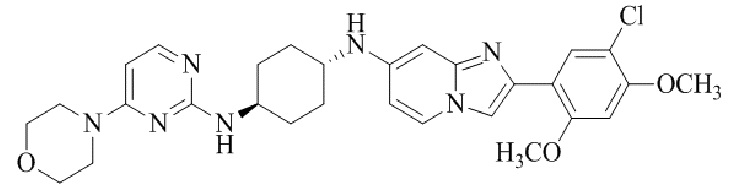
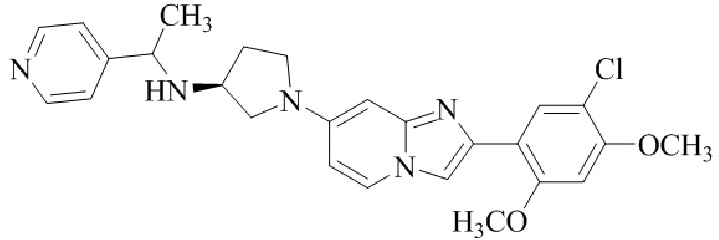
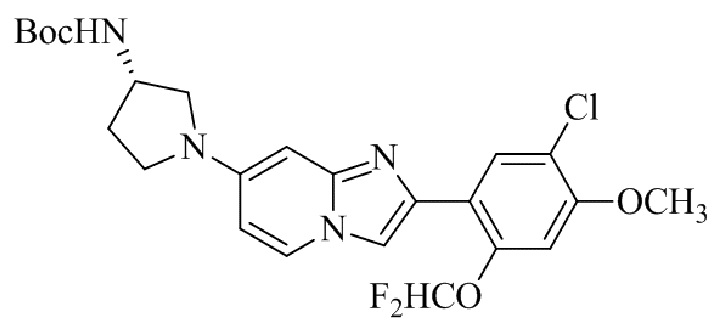
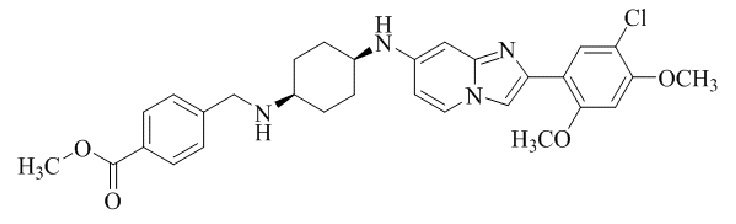
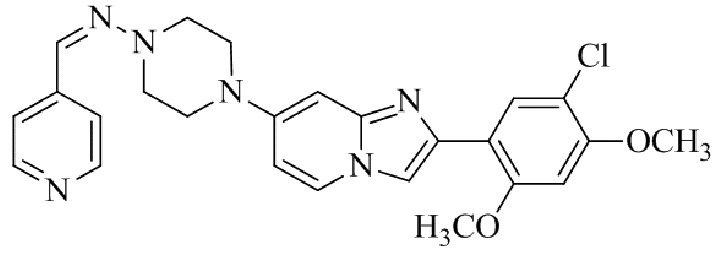
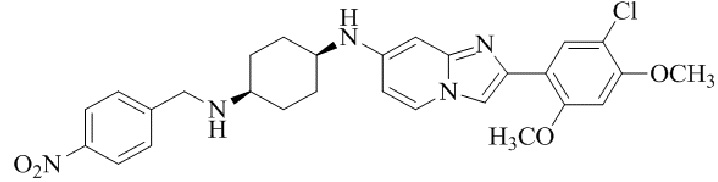
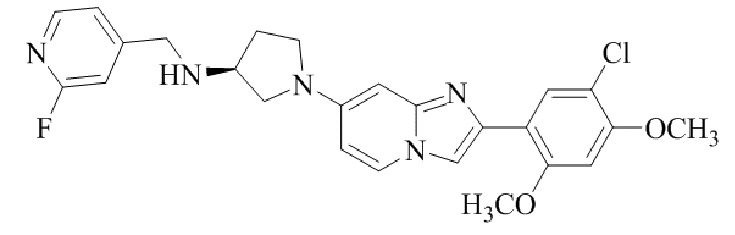
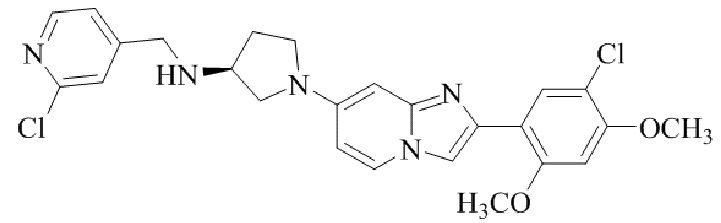
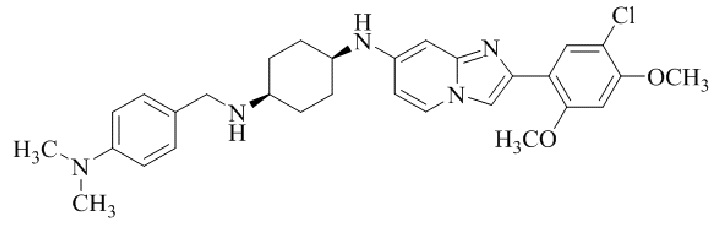
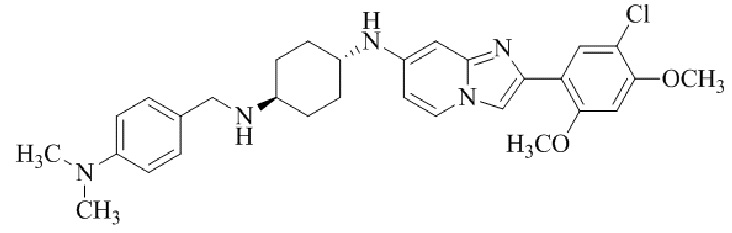
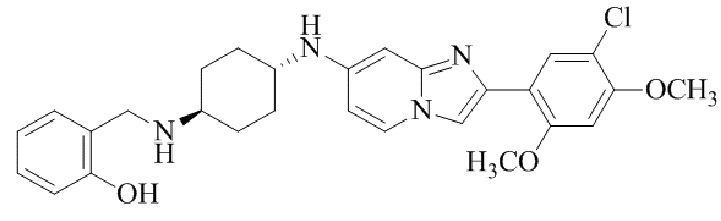
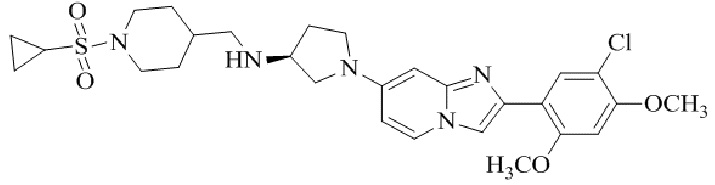
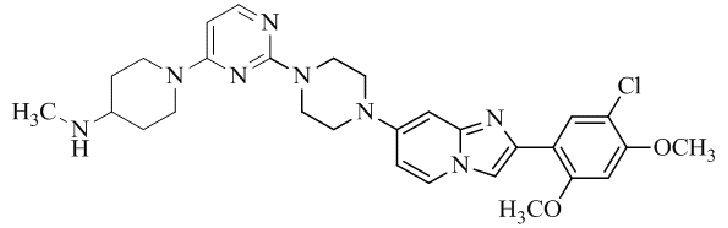
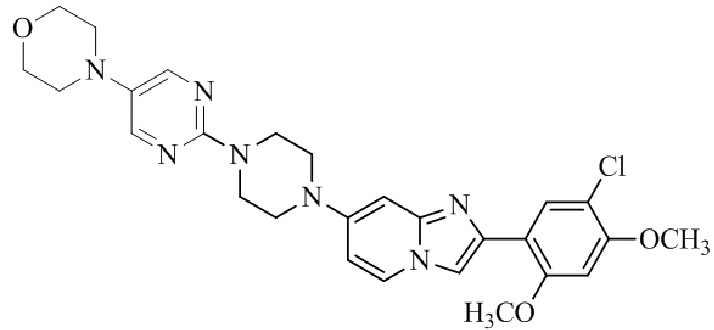
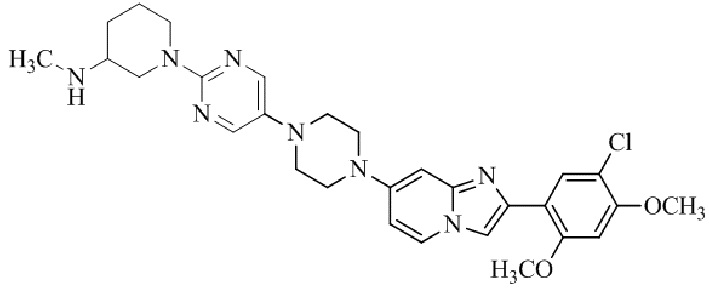
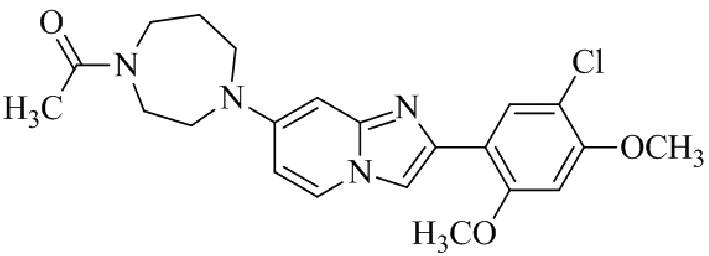
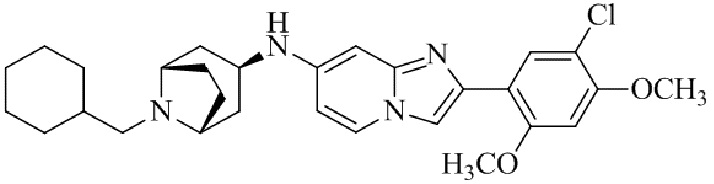
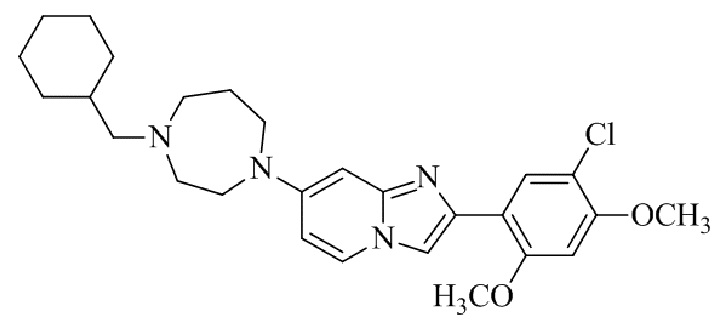
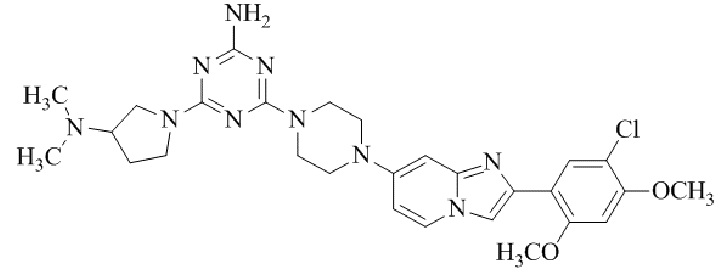
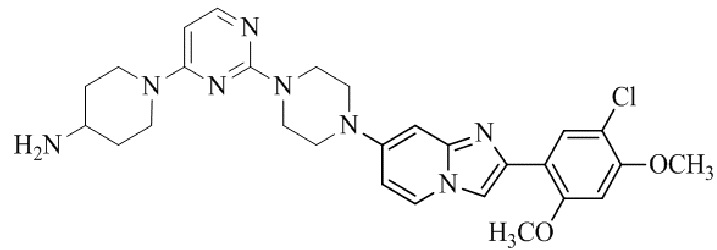
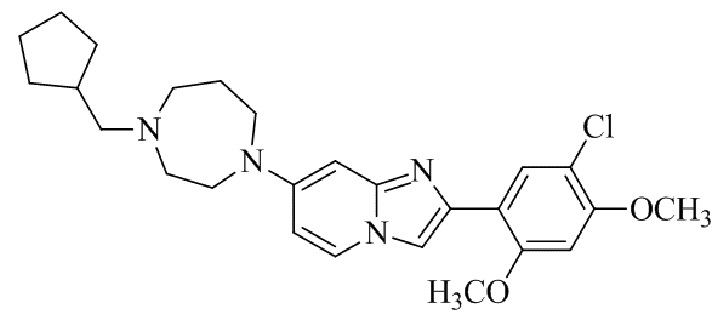
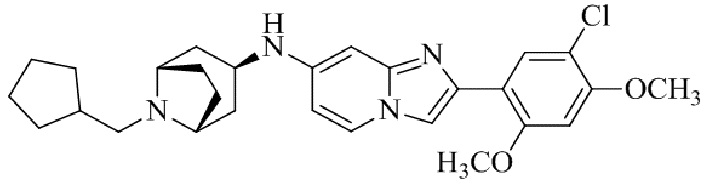
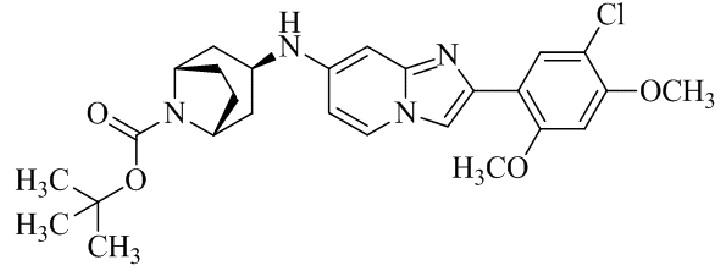
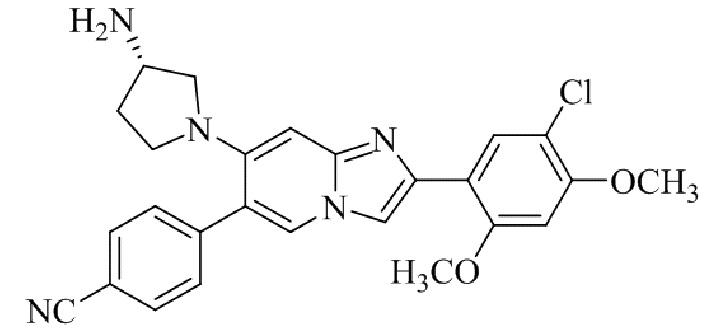
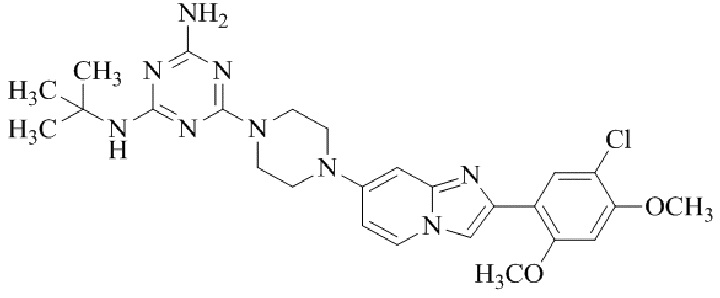
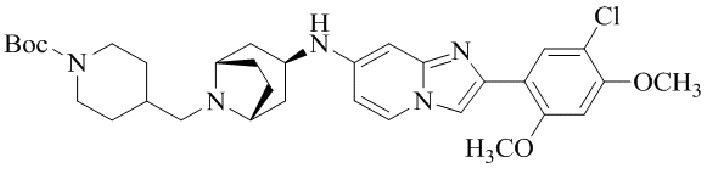
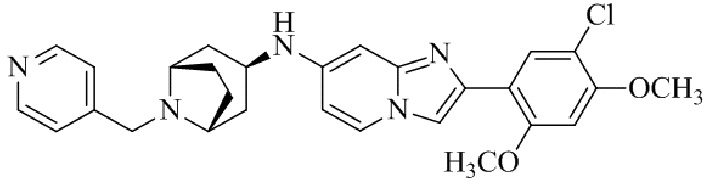
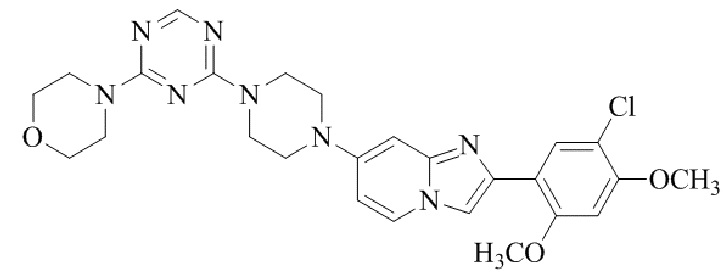
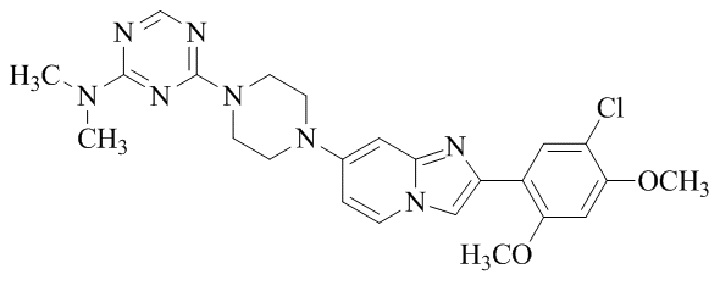
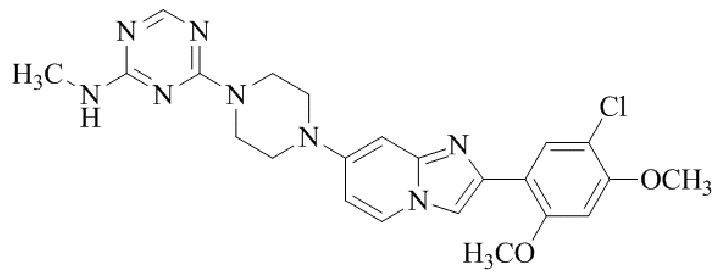
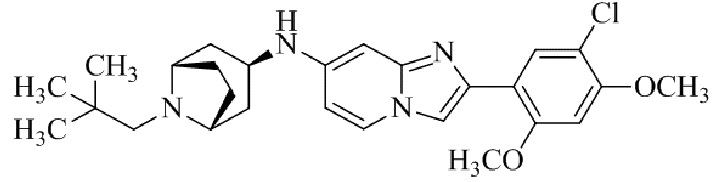
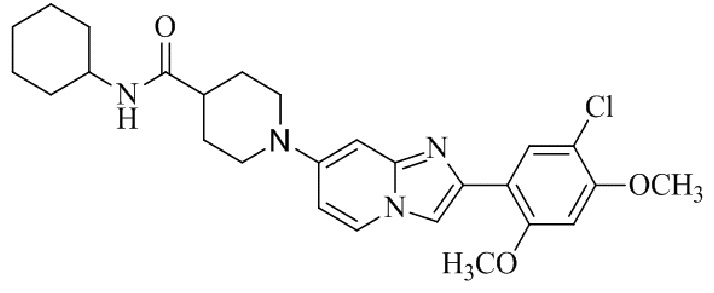
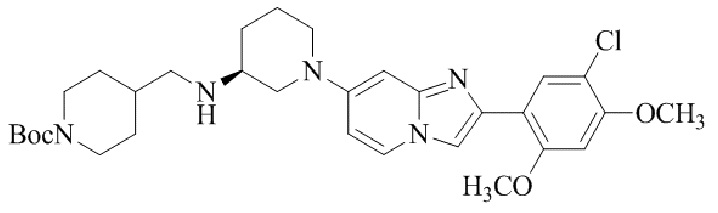
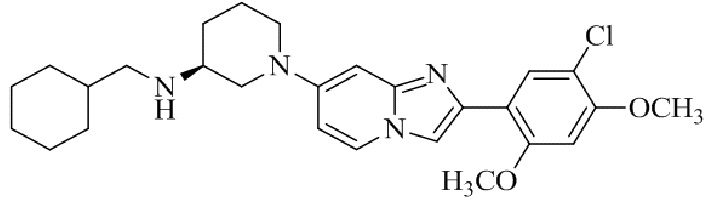
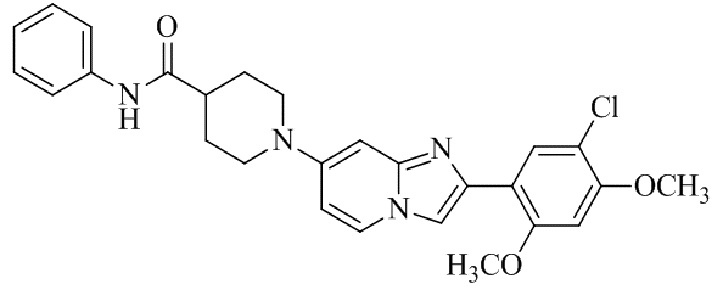
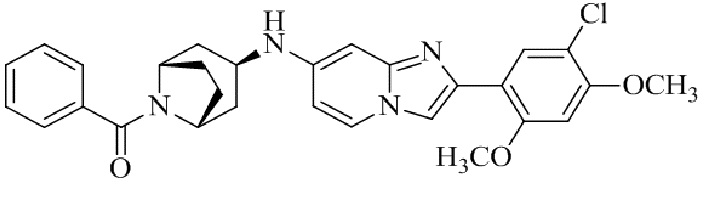
Результат интеллектуальной деятельности: БИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ИНГИБИРОВАНИЯ SUV39H2
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ПАТЕНТНУЮ ЗАЯВКУ
Настоящая патентная заявка испрашивает преимущество приоритета предварительной заявки США № 62/234,183, поданной 29 сентября 2015 года, раскрытие которой включено в настоящее описание в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к соединению, обладающему ингибирующей активностью в отношении SUV39H2, способу его получения и фармацевтической композиции, содержащей соединение в качестве активного ингредиента. Настоящее изобретение относится к способу лечения или предотвращения заболевания, в которое вовлечена сверхэкспрессия SUV39H2.
УРОВЕНЬ ТЕХНИКИ
Нуклеосома, основная единица упаковки ДНК у эукариот, которая состоит из 147 п. о. ДНК, навитой последовательно вокруг гистоновой белковой сердцевины, представляет собой фундаментальную единицу хроматиновых структур [непатентный документ 1]. Все четыре гистона сердцевины (H3, H4, H2A и H2B) обладают неструктурированными N-концевыми хвостами, и эти N-концы гистонов, в частности, подвержены ряду разнообразных посттрансляционных модификаций: ацетилирование, метилирование, фосфорилирование, убиквитинилирование, сумоилирование и АДФ-рибозилирование [непатентный документ 2]. Эти модификации гистонов вызывают динамические изменения в структуре хроматина и, тем самым, влияют на регуляцию транскрипции, репликацию ДНК, репарацию ДНК и альтернативный сплайсинг [непатентные документы 3 и 4]. Среди этих эпигенетических отметок на гистонах процесс метилирования является особенно важным для регуляции транскрипции [непатентный документ 5]. В N-концевых хвостах расположены пять остатков лизина (H3K4, H3K9, H3K27, H3K36 и H4K20), являющихся репрезентативными лизинами, которые могут становиться моно-, ди- или триметилированными. Тогда как метилирование H3K9, H3K27 и H4K20 преимущественно представляет транскрипцию, отметки метилирования на H3K4 и H3K36 связаны с индукцией активной транскрипции [непатентный документ 6]. Например, метилирование на гистоне H3 по лизину 9 (H3K9) представляет собой одну из наиболее обильных и стабильных модификаций гистонов, которая вовлечена как в репрессию генов, так и в формирование гетерохроматина. H3K9 может быть моно-, ди- или триметилированным по H3K9, тогда как молчащие участки эухроматина богаты моно- и диметилированным H3K9 [непатентный документ 17]. У млекопитающих гетерохроматиновые участки сильно триметилированы по H3K9, тогда как молчащие эухроматиновые участки богаты моно- и диметилированным H3K9 [непатентный документ 17]. Метилирование H3K9 связано с de novo сайленсингом генов и метилированием ДНК и наследуется после митоза сопряженно с метилированием ДНК.
Ранее сообщалось о том, что некоторые гистоновые метилтрансферазы и деметилазы тесно вовлечены в канцерогенез у человека [непатентные документы 7, 8, 9, 10 и 11]. Например, показано, что SMYD3, PRMT1, PRMT6, SUV420H1 и SUV420H2 стимулируют пролиферацию клеток через их ферментативную активность [патентные документы 1, 8, 9, 12, 13, 14 и 18].
SUV39H2, также известный как KMT1B [непатентный документ 15], представляет собой содержащую SET-домен гистоновую метилтрансферазу, и известно, что он метилирует остаток лизина H3K9. Suv39h2, мышиный гомолог SUV39H2 человека, выделен и охарактеризован в качестве второго мышиного гена Suv39h, для которого показана идентичность 59% с Suv39h1 [непатентный документ 16]. Экспрессия Suv39h2 ограничена семенниками взрослых особей, и иммунная локализация эндогенного белка Suv39h2 обнаруживает обильное распространение в гетерохроматине во время первой профазы мейоза и на ранних этапах спермиогенеза. Во время средней пахитены Suv39h2, в частности, накапливается в хроматине молчащих половых хромосом, присутствующих в XY тельце. Кроме того, активность гистоновой метилтрансферазы Suv39h2, по-видимому, играет важную роль в регуляции динамики хроматина более высокого порядка во время мужского мейоза [непатентный документ 16].
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
ПАТЕНТНЫЙ ДОКУМЕНТ
1. WO2005/071102.
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
1. Strahl BD et al. Nature 2000; 403: 41-45;
2. Kouzarides T et al. Cell 2007; 128: 693-705;
3. Huertas D et al. Epigenetics 2009; 4: 31-42;
4. Luco RF et al. Science 2010; 327: 996-1000;
5. Kouzarides T et al. Curr Opin Genet Dev 2002; 12: 198-209;
6. Peterson CL et al. Curr Biol 2004; 14: R546-551;
7. Cho HS et al. Cancer Res 2010;
8. Hamamoto R et al. Nat Cell Biol 2004;6:731-40;
9. Hamamoto R et al. Cancer Sci 2006;97:113-8;
10. Yoshimatsu M et al. Int J Cancer 2011; 128: 562-573;
11. Hayami S et al. Int J Cancer 2011; 128: 574-586;
12. Kunizaki M et al. Cancer Res 2007;67:10759-65;
13. Silva FP et al. Oncogene 2008;27:2686-92;
14. Tsuge M et al. Nat Genet 2005;37:1104-7;
15. Allis CD et al. Cell 2007; 131: 633-636;
16. O'Carroll D et al. Mol Cell Biol 2000; 20: 9423-9433;
17. Martin C et al. Nat Rev Mol Cell Biol 2005;6:838-49; и
18. Schneider R et al. Trends Biochem Sci 2002;27:396-402.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения прилагали усилия к разработке эффективного ингибитора SUV39H2 и обнаружили, что определенное соединение может избирательно ингибировать активность SUV39H2.
Настоящее изобретение относится к следующему с (1) до (17).
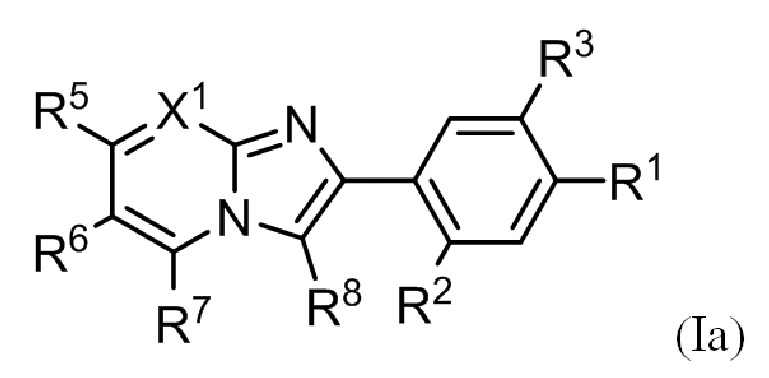
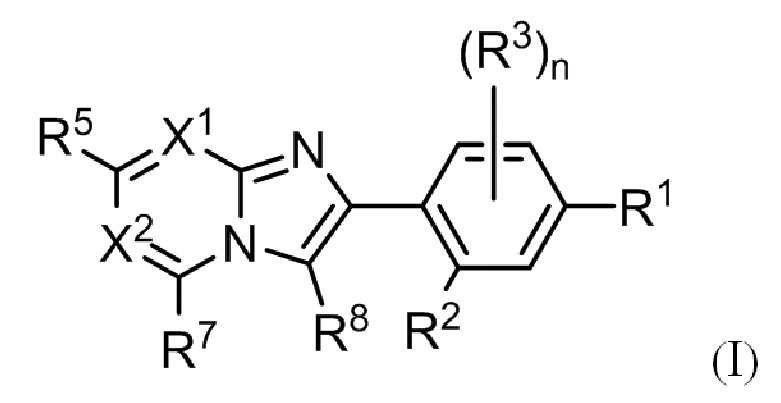
(1) Соединение, представленное формулой (I), или его фармацевтически приемлемая соль:
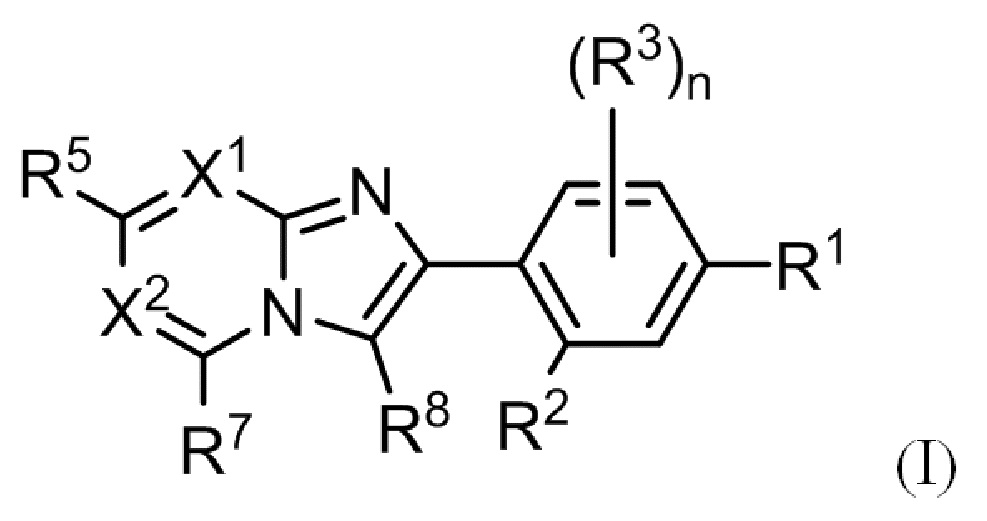
где
R1 выбирают из группы, состоящей из атома галогена, гидрокси, C1-C6 алкила и C1-C6 алкокси, где алкил и алкокси могут быть замещены одним или более заместителями, выбранными из A1;
R2 выбирают из группы, состоящей из атома водорода, атома галогена, гидрокси, C1-C6 алкила, C1-C6 алкокси и C3-C10 циклоалкокси, где алкил и алкокси могут быть замещены одним или более заместителями, выбранными из A2;
R3 независимо выбирают из группы, состоящей из атома галогена, циано, нитро, гидрокси, карбокси, C1-C6 алкила, C1-C6 алкокси, (C1-C6 алкокси)карбонила, C1-C6 алкилтио, C1-C6 алкилсульфинила и C1-C6 алкилсульфонила;
n представляет собой целое, выбранное из от 0 до 3;
X1 представляет собой N или CR4;
X2 представляет собой N или CR6;
R4 выбирают из группы, состоящей из атома водорода, атома галогена, C1-C6 алкила и C1-C6 алкокси;
R5 и R6 независимо выбирают из группы, состоящей из атома водорода, атома галогена и Y, где по меньшей мере один из R5 и R6 представляет собой Y;
Y независимо выбирают из группы, состоящей из гидрокси, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из A3, C1-C6 алкокси, необязательно замещенного одним или более заместителями, выбранными из A3, -NR11R12, -CONR13R14, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rc, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rd, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Re, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rf, и -OR15;
R11 выбирают из группы, состоящей из атома водорода, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rb, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rb, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rb, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rb, (C1-C6 алкокси)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C3-C10 циклоалкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (C6-C10 арил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rh, (3-12-членного неароматического гетероциклил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (5-10-членного гетероарил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминокарбонила, (C1-C6 алкил)аминокарбонила и ди(C1-C6 алкил)аминокарбонила;
R12 выбирают из группы, состоящей из атома водорода и C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra;
R13 выбирают из группы, состоящей из атома водорода, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rh, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, и 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg;
R14 выбирают из группы, состоящей из атома водорода и C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra;
R15 выбирают из группы, состоящей из C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rc, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rd, 4-12-членного гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Re, и 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rf;
A1 независимо выбирают из группы, состоящей из атома галогена и циано;
A2 независимо выбирают из группы, состоящей из атома галогена, циано, амино, C1-C6 алкиламино, ди(C1-C6 алкил)амино, C1-C6 алкилтио, C1-C6 алкилсульфинила, C1-C6 алкилсульфонила C3-C10 циклоалкила и C1-C6 алкокси;
A3 независимо выбирают из группы, состоящей из атома галогена, циано, амино, C1-C6 алкиламино, ди(C1-C6 алкил)амино, C1-C6 алкилтио, C1-C6 алкилсульфинила, C1-C6 алкилсульфонила, C3-C10 циклоалкилсульфонила, C3-C10 циклоалкила и C1-C6 алкокси;
Ra независимо выбирают из группы, состоящей из атома галогена, гидрокси, C1-C6 алкокси, циано, (C1-C6 алкокси)карбонила, карбокси, (C1-C6 алкокси)карбониламино, (C1-C6 алкил)карбониламино, амино, C1-C6 алкиламино, ди(C1-C6 алкил)амино, аминокарбонила, (C1-C6 алкил)аминокарбонила, ди(C1-C6 алкил)аминокарбонила, C1-C6 алкилсульфониламино, C3-C10 циклоалкилсульфониламино, ди(C1-C6 алкил)фосфоно, C7-C14 аралкила, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rh, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, и 4-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg;
Rb независимо выбирают из группы, состоящей из атома галогена, гидрокси, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C1-C6 алкокси, необязательно замещенного одним или более заместителями, выбранными из Ra, циано, (C1-C6 алкокси)карбонила, карбокси, -NR21R22, -CONR23R24, ди(C1-C6 алкил)фосфоно, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rh, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, и 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg;
Rc, Re и Rf независимо выбирают из группы, состоящей из атома галогена, гидрокси, циано, карбокси, -NR21R22, -CONR23R24, -N=CH-R25, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкокси)C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкокси)карбонила, (C6-C10 арил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rh, (C3-C10 циклоалкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (3-12-членного неароматического гетероциклил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминокарбонила, (C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, ди(C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, [(C1-C6 алкил)аминокарбонил]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, [ди(C1-C6 алкил)аминокарбонил]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, C1-C6 алкилсульфонила, необязательно замещенного одним или более атомами галогенов, C3-C10 циклоалкилсульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (C6-C10 арил)сульфонила, необязательно замещенного одним или более заместителями, выбранными из Rh, C7-C14 аралкилсульфонила, (3-12-членного неароматического гетероциклил)сульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, 5-10-членного гетероарилкарбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, 5-10-членного гетероарилсульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминосульфонила, C1-C6 алкиламиносульфонила, ди(C1-C6 алкил)аминосульфонила, ди(C1-C6 алкил)фосфоно и оксо;
Rd независимо выбирают из группы, состоящей из атома галогена, гидрокси, циано, карбокси, -NR21R22, -CONR23R24, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкокси)C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкокси)карбонила, (C6-C10 арил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rh, (C3-C10 циклоалкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (3-12-членного неароматического гетероциклил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминокарбонила, (C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, ди(C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, [(C1-C6 алкил)аминокарбонил]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, [ди(C1-C6 алкил)аминокарбонил]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, C1-C6 алкилсульфонила, необязательно замещенного одним или более атомами галогенов, C3-C10 циклоалкилсульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (C6-C10 арил)сульфонила, необязательно замещенного одним или более заместителями, выбранными из Rh, C7-C14 аралкилсульфонила, (3-12-членного неароматического гетероциклил)сульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, 5-10-членного гетероарилсульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминосульфонила, C1-C6 алкиламиносульфонила, ди(C1-C6 алкил)аминосульфонила и ди(C1-C6 алкил)фосфоно;
Rg независимо выбирают из группы, состоящей из нитро, гидрокси, C1-C6 алкила, необязательно замещенного одним или более атомами галогенов, C1-C6 алкокси, необязательно замещенного одним или более атомами галогенов, атома галогена, амино, циано, C1-C6 алкиламино, необязательно замещенного одной или более гидроксигруппами, ди(C1-C6 алкил)амино, необязательно замещенного одной или более гидроксигруппами, C3-C10 циклоалкиламино, (C1-C6 алкил)карбонила, (C1-C6 алкокси)карбонила, C1-C6 алкилсульфонила, C3-C10 циклоалкилсульфонила, C7-C14 аралкила, необязательно замещенного одним или более заместителями, выбранными из Ri, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Ri, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Ri, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Ri, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Ri, и оксо;
Rh независимо выбирают из группы, состоящей из нитро, гидрокси, C1-C6 алкила, необязательно замещенного одним или более атомами галогенов, C1-C6 алкокси, необязательно замещенного одним или более атомами галогенов, атома галогена, амино, циано, C1-C6 алкиламино, ди(C1-C6 алкил)амино, C1-C6 алкилкарбонила, (C1-C6 алкокси)карбонила, (C1-C6 алкокси)карбониламино, N-(C1-C6 алкокси)карбонил-N-(C1-C6 алкил)амино, C1-C6 алкилсульфонила, C3-C8 циклоалкилсульфонила, C7-C14 аралкила, необязательно замещенного одним или более заместителями, выбранными из Ri, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Ri, C3-C8 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Ri, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Ri, и 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Ri;
Ri независимо выбирают из группы, состоящей из нитро, гидрокси, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из атома галогена и гидрокси, атома галогена, амино, циано, C1-C6 алкиламино, ди(C1-C6 алкил)амино, C1-C6 алкилкарбонила, необязательно замещенного одним или более заместителями, выбранными из фенила и гидрокси, (C1-C6 алкокси)карбонила, необязательно замещенного одним или более заместителями, выбранными из фенила и гидрокси, C1-C6 алкилсульфонила, C3-C8 циклоалкилсульфонила, C1-C6 алкилсульфониламино, C3-C8 циклоалкилсульфониламино и оксо;
R21 выбирают из группы, состоящей из атома водорода, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rh, 4-12-членного гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, (C1-C6 алкокси)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C3-C10 циклоалкил)карбонила, (C6-C10 арил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rh, (3-12-членного неароматического гетероциклил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (5-10-членного гетероарил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминокарбонила, (C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, ди(C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, C1-C6 алкилсульфонила, необязательно замещенного одним или более атомами галогенов, C7-C14 аралкилсульфонила, C3-C10 циклоалкилсульфонила, аминосульфонила, C1-C6 алкиламиносульфонила, ди(C1-C6 алкил)аминосульфонила и ди(C1-C6 алкил)фосфоно;
R22 выбирают из группы, состоящей из атома водорода и C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra;
R23 выбирают из группы, состоящей из атома водорода, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, [(C1-C6 алкил)амино]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, [ди(C1-C6 алкил)амино]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rh, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, и 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg;
R24 выбирают из группы, состоящей из атома водорода и C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra;
R25 выбирают из группы, состоящей из C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rc, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rd, 4-12-членного гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Re, и 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rf;
R7 выбирают из группы, состоящей из атома водорода, атома галогена, C1-C6 алкила и C1-C6 алкокси;
R8 выбирают из группы, состоящей из атома водорода, атома галогена, C1-C6 алкила и C1-C6 алкокси; и
где атом серы, включенный в гетероциклил или гетероарил, может быть окислен до SO или SO2.
(2) Соединение или его фармацевтически приемлемая соль в соответствии с (1):
где
R1 выбирают из группы, состоящей из атома галогена, гидрокси, C1-C6 алкила и C1-C6 алкокси, где алкил и алкокси могут быть замещены одним или более заместителями, выбранными из A1;
R2 выбирают из группы, состоящей из атома водорода, атома галогена, гидрокси, C1-C6 алкила, C1-C6 алкокси и C3-C10 циклоалкокси, где алкил и алкокси могут быть замещены одним или более заместителями, выбранными из A2;
R3 независимо выбирают из группы, состоящей из атома галогена, циано, нитро, гидрокси, карбокси, C1-C6 алкила, C1-C6 алкокси, (C1-C6 алкокси)карбонила, C1-C6 алкилтио, C1-C6 алкилсульфинила и C1-C6 алкилсульфонила;
n представляет собой целое, выбранное из от 0 до 3;
X1 представляет собой N или CR4;
X2 представляет собой N или CR6;
R4 выбирают из группы, состоящей из атома водорода, атома галогена, C1-C6 алкила и C1-C6 алкокси;
R5 и R6 независимо выбирают из группы, состоящей из атома водорода, атома галогена и Y, где по меньшей мере один из R5 и R6 представляет собой Y;
Y независимо выбирают из группы, состоящей из гидрокси, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из A3, C1-C6 алкокси, необязательно замещенного одним или более заместителями, выбранными из A3, -NR11R12, -CONR13R14, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rc, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rd, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Re, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rf, и -OR15;
R11 выбирают из группы, состоящей из атома водорода, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rb, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rb, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rb, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rb, (C1-C6 алкокси)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C3-C10 циклоалкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (C6-C10 арил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rh, (3-12-членного неароматического гетероциклил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (5-10-членного гетероарил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминокарбонила, (C1-C6 алкил)аминокарбонила и ди(C1-C6 алкил)аминокарбонила;
R12 выбирают из группы, состоящей из атома водорода и C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra;
R13 выбирают из группы, состоящей из атома водорода, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rh, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, и 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg;
R14 выбирают из группы, состоящей из атома водорода и C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra;
R15 выбирают из группы, состоящей из C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rc, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rd, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Re, и 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rf;
A1 независимо выбирают из группы, состоящей из атома галогена и циано;
A2 независимо выбирают из группы, состоящей из атома галогена, циано, амино, C1-C6 алкиламино, ди(C1-C6 алкил)амино, C1-C6 алкилтио, C1-C6 алкилсульфинила, C1-C6 алкилсульфонила C3-C10 циклоалкила и C1-C6 алкокси;
A3 независимо выбирают из группы, состоящей из атома галогена, циано, амино, C1-C6 алкиламино, ди(C1-C6 алкил)амино, C1-C6 алкилтио, C1-C6 алкилсульфинила, C1-C6 алкилсульфонила, C3-C10 циклоалкилсульфонила, C3-C10 циклоалкила и C1-C6 алкокси;
Ra независимо выбирают из группы, состоящей из атома галогена, гидрокси, C1-C6 алкокси, циано, (C1-C6 алкокси)карбонила, карбокси, (C1-C6 алкокси)карбониламино, (C1-C6 алкил)карбониламино, амино, C1-C6 алкиламино, ди(C1-C6 алкил)амино, аминокарбонила, (C1-C6 алкил)аминокарбонила, ди(C1-C6 алкил)аминокарбонила, C1-C6 алкилсульфониламино, C3-C10 циклоалкилсульфониламино, ди(C1-C6 алкил)фосфоно, C7-C14 аралкила, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rh, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, и 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg;
Rb независимо выбирают из группы, состоящей из атома галогена, гидрокси, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C1-C6 алкокси, необязательно замещенного одним или более заместителями, выбранными из Ra, циано, (C1-C6 алкокси)карбонила, карбокси, -NR21R22, -CONR23R24, ди(C1-C6 алкил)фосфоно, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rh, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, и 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg;
Rc, Re и Rf независимо выбирают из группы, состоящей из атома галогена, гидрокси, циано, карбокси, -NR21R22, -CONR23R24, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкокси)C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкокси)карбонила, (C6-C10 арил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rh, (C3-C10 циклоалкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (3-12-членного неароматического гетероциклил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминокарбонила, (C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, ди(C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, [(C1-C6 алкил)аминокарбонил]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, [ди(C1-C6 алкил)аминокарбонил]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, C1-C6 алкилсульфонила, необязательно замещенного одним или более атомами галогенов, C3-C10 циклоалкилсульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (C6-C10 арил)сульфонила, необязательно замещенного одним или более заместителями, выбранными из Rh, C7-C14 аралкилсульфонила, (3-12-членного неароматического гетероциклил)сульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, 5-10-членного гетероарилсульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминосульфонила, C1-C6 алкиламиносульфонила, ди(C1-C6 алкил)аминосульфонила, ди(C1-C6 алкил)фосфоно и оксо;
Rd независимо выбирают из группы, состоящей из атома галогена, гидрокси, циано, карбокси, -NR21R22, -CONR23R24, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкокси)C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкокси)карбонила, (C6-C10 арил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rh, (C3-C10 циклоалкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (3-12-членного неароматического гетероциклил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминокарбонила, (C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, ди(C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, [(C1-C6 алкил)аминокарбонил]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, [ди(C1-C6 алкил)аминокарбонил]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, C1-C6 алкилсульфонила, необязательно замещенного одним или более атомами галогенов, C3-C10 циклоалкилсульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (C6-C10 арил)сульфонила, необязательно замещенного одним или более заместителями, выбранными из Rh, C7-C14 аралкилсульфонила, (3-12-членного неароматического гетероциклил)сульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, 5-10-членного гетероарилсульфонила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминосульфонила, C1-C6 алкиламиносульфонила, ди(C1-C6 алкил)аминосульфонила и ди(C1-C6 алкил)фосфоно;
Rg независимо выбирают из группы, состоящей из нитро, гидрокси, C1-C6 алкила, необязательно замещенного одним или более атомами галогенов, атома галогена, амино, циано, C1-C6 алкиламино, ди(C1-C6 алкил)амино, (C1-C6 алкил)карбонила, (C1-C6 алкокси)карбонила, C1-C6 алкилсульфонила, C3-C10 циклоалкилсульфонила, C7-C14 аралкила, необязательно замещенного одним или более заместителями, выбранными из Ri, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Ri, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Ri, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Ri, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Ri, и оксо;
Rh независимо выбирают из группы, состоящей из нитро, гидрокси, C1-C6 алкила, необязательно замещенного одним или более атомами галогенов, атома галогена, амино, циано, C1-C6 алкиламино, ди(C1-C6 алкил)амино, C1-C6 алкилкарбонила, (C1-C6 алкокси)карбонила, C1-C6 алкилсульфонила, C3-C8 циклоалкилсульфонила, C7-C14 аралкила, необязательно замещенного одним или более заместителями, выбранными из Ri, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Ri, C3-C8 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Ri, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Ri, и 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Ri;
Ri независимо выбирают из группы, состоящей из нитро, гидрокси, C1-C6 алкила, необязательно замещенного одним или более атомами галогенов, атома галогена, амино, циано, C1-C6 алкиламино, ди(C1-C6 алкил)амино, C1-C6 алкилкарбонила, (C1-C6 алкокси)карбонила, C1-C6 алкилсульфонила и C3-C8 циклоалкилсульфонила;
R21 выбирают из группы, состоящей из атома водорода, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rh, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, (C1-C6 алкокси)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C1-C6 алкил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, (C3-C10 циклоалкил)карбонила, (C6-C10 арил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rh, (3-12-членного неароматического гетероциклил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, (5-10-членного гетероарил)карбонила, необязательно замещенного одним или более заместителями, выбранными из Rg, аминокарбонила, (C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, ди(C1-C6 алкил)аминокарбонила, необязательно замещенного одним или более заместителями, выбранными из Ra, C1-C6 алкилсульфонила, необязательно замещенного одним или более атомами галогенов, C7-C14 аралкилсульфонила, C3-C10 циклоалкилсульфонила, аминосульфонила, C1-C6 алкиламиносульфонила, ди(C1-C6 алкил)аминосульфонила и ди(C1-C6 алкил)фосфоно;
R22 выбирают из группы, состоящей из атома водорода и C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra;
R23 выбирают из группы, состоящей из атома водорода, C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, [(C1-C6 алкил)амино]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, [ди(C1-C6 алкил)амино]C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rg, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rh, 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rg, и 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Rg;
R24 выбирают из группы, состоящей из атома водорода и C1-C6 алкила, необязательно замещенного одним или более заместителями, выбранными из Ra;
R7 выбирают из группы, состоящей из атома водорода, атома галогена, C1-C6 алкила и C1-C6 алкокси;
R8 выбирают из группы, состоящей из атома водорода, атома галогена, C1-C6 алкила и C1-C6 алкокси; и
где атом серы, включенный в гетероциклил или гетероарил, может быть окислен до SO или SO2.
(3) Соединение или его фармацевтически приемлемая соль в соответствии с (1) или (2), где соединение представлено формулой (Ia):
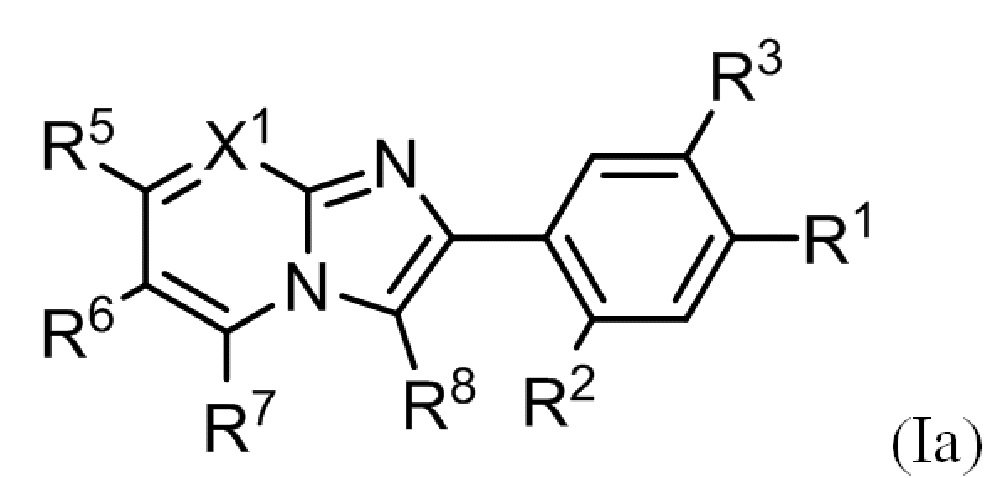
где R1, R2, R3, R5, R6, R7, R8 и X1 такие, как определено в (1) или (2).
(4) Соединение или его фармацевтически приемлемая соль в соответствии с (1) или (2), где соединение представлено формулой (Ia):
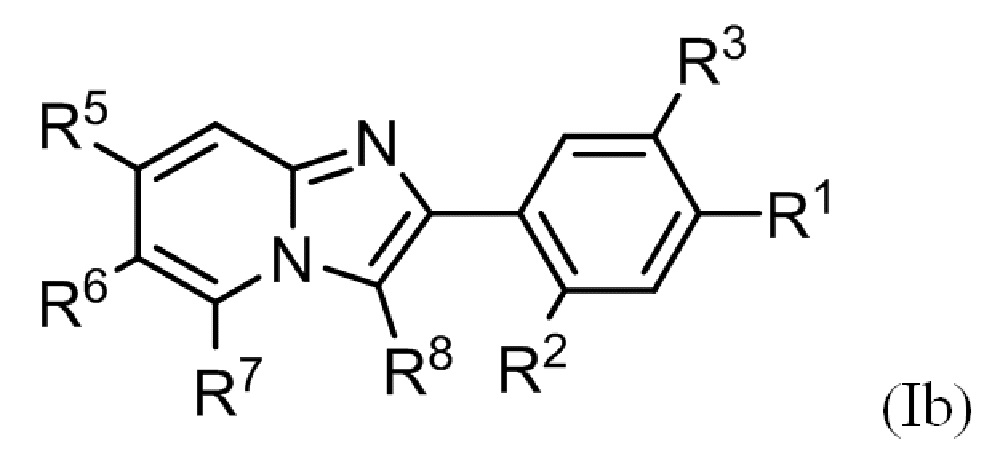
где R1, R2, R3, R5, R6, R7 и R8 такие, как определено в (1) или (2).
(5) Соединение или его фармацевтически приемлемая соль в соответствии с любым одним из (1)-(4), где R1 представляет собой метокси.
(6) Соединение или его фармацевтически приемлемая соль в соответствии с любым одним из (1)-(5), где R7 и R8 представляют собой атомы водорода.
(7) Соединение или его фармацевтически приемлемая соль в соответствии с любым одним из (1)-(6), где R3 представляет собой атом галогена.
(8) Соединение или его фармацевтически приемлемая соль в соответствии с любым одним из (1)-(7), где R2 представляет собой метокси.
(9) Соединение или его фармацевтически приемлемая соль в соответствии с любым одним из (1)-(8), где R5 представляет собой Y и R6 представляет собой атом водорода.
(10) Соединение или его фармацевтически приемлемая соль в соответствии с любым одним из (1)-(9), где Y независимо выбирают из группы, состоящей из -NR11R12, C3-C10 циклоалкила, необязательно замещенного одним или более заместителями, выбранными из Rc, C6-C10 арила, необязательно замещенного одним или более заместителями, выбранными из Rd, 3-12-членного неароматического гетероциклила, необязательно замещенного одним или более заместителями, выбранными из Re, и 5-10-членного гетероарила, необязательно замещенного одним или более заместителями, выбранными из Rf
(11) Соединение или его фармацевтически приемлемая соль в соответствии с любым одним из (1)-(10), где Y выбирают из группы, состоящей из:
пиперазин-1-ила, замещенного одним или более заместителями, выбранными из Re;
пирролидин-1-ила, замещенного одним или более заместителями, выбранными из Re;
1,4-диазепан-1-ила, замещенного одним или более заместителями, выбранными из Re;
8-азабицикло[3.2.1]октан-3-иламино, в котором фрагмент 8-азабицикло[3.2.1]октан-3-ила замещен одним или более заместителями, выбранными из Rb;
пиперидин-4-иламино, в котором фрагмент пиперидин-4-ила замещен одним или более заместителями, выбранными из Rb; и
циклогексиламино, в котором фрагмент циклогексила замещен одним или более заместителями, выбранными из Rb.
(12) Соединение или его фармацевтически приемлемая соль в соответствии с любым одним из (1)-(11), где Y выбирают из группы, состоящей из:
пиперазин-1-ила, замещенного в 4 положении 5-10-членным гетероарилом, необязательно замещенным одним или более заместителями, выбранными из Rg;
1,4-диазепан-1-ила, замещенного в 4 положении метилом, замещенным заместителем, выбранным из Ra;
пирролидин-1-ила, замещенного в 3 положении группой -NHR21, в которой R21 представляет собой метил, замещенный заместителем, выбранным из Ra;
8-азабицикло[3.2.1]октан-3-иламино, в котором фрагмент 8-азабицикло[3.2.1]октан-3-ила замещен в 8 положении метилом, замещенным заместителем, выбранным из Ra,
пиперидин-4-иламино, в котором фрагмент пиперидин-4-ила замещен в 1 положении метилом, замещенным заместителем, выбранным из Ra, и
циклогексиламино, в котором фрагмент циклогексила замещен в 4 положении группой -NHR21, в которой R21 представляет собой метил, замещенный заместителем, выбранным из Ra.
(13) Соединение или его фармацевтически приемлемая соль в соответствии с любым одним из (1)-(12), где Y выбирают из группы, состоящей из:
пиперазин-1-ила, замещенного одним или более заместителями, выбранными из Re,
пирролидин-1-ила, замещенного одним или более заместителями, выбранными из Re, и
циклогексиламино, в котором фрагмент циклогексила замещен одним или более заместителями, выбранными из Rb.
(14) Соединение или его фармацевтически приемлемая соль в соответствии с любым одним из (1)-(13), где Y выбирают из группы, состоящей из:
пиперазин-1-ила, замещенного в 4 положении 5-10-членным гетероарилом, необязательно замещенным одним или более заместителями, выбранными из Rg;
пирролидин-1-ила, замещенного в 3 положении группой -NHR21, в которой R21 представляет собой метил, замещенный заместителем, выбранным из Ra; и
циклогексиламино, в котором фрагмент циклогексила замещен в 4 положении 5-10-членным гетероариламино, в котором фрагмент гетероарил может быть замещен одним или более заместителями, выбранными из Rg.
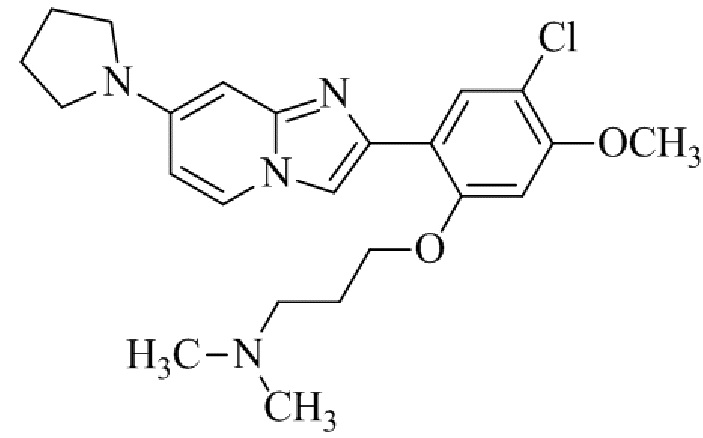
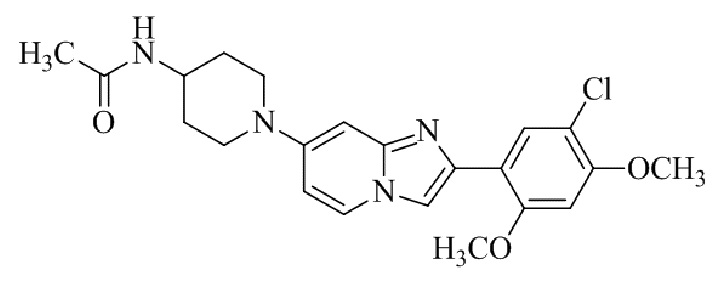
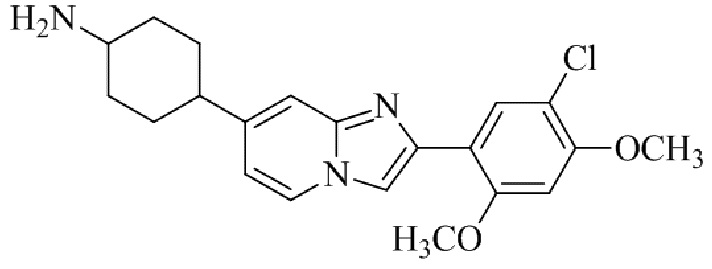
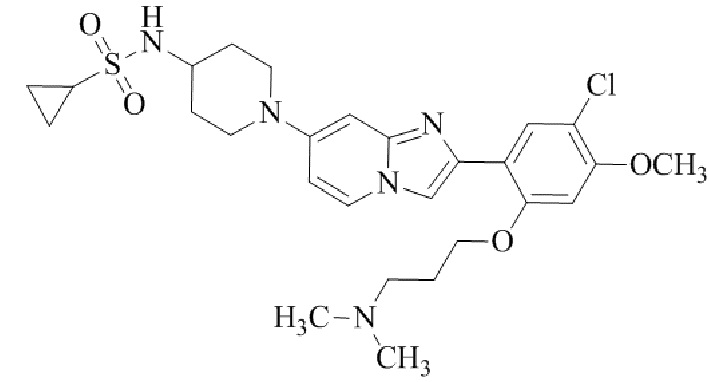
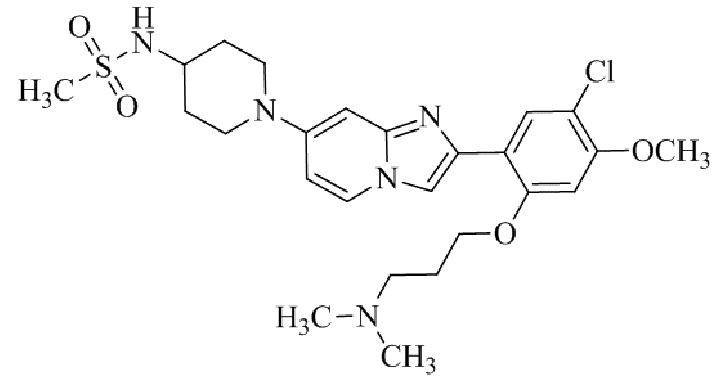
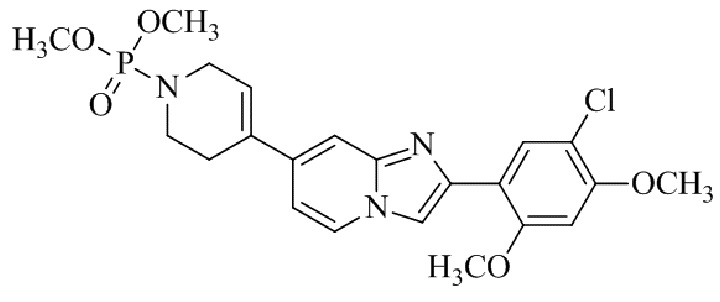
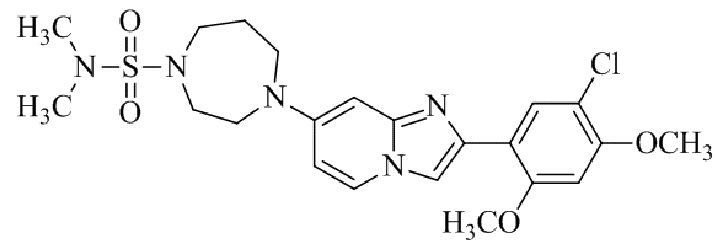
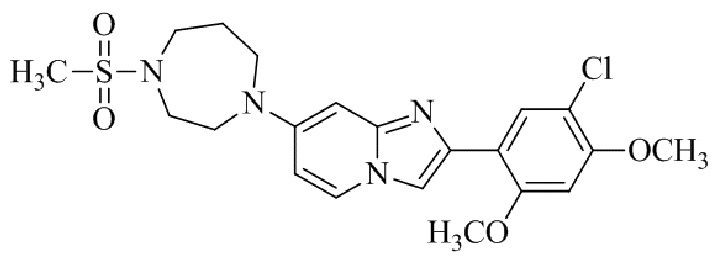
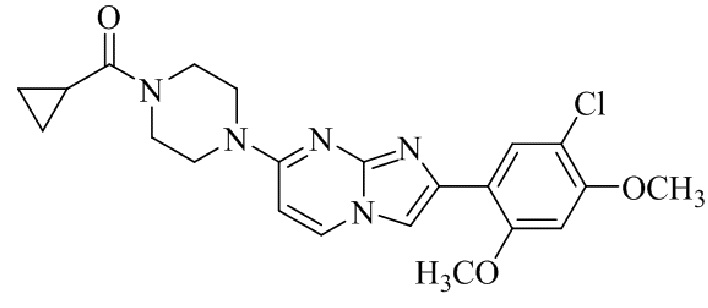
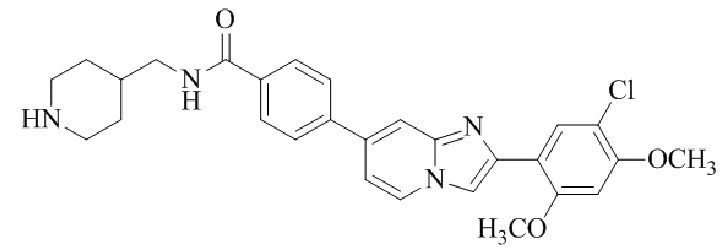
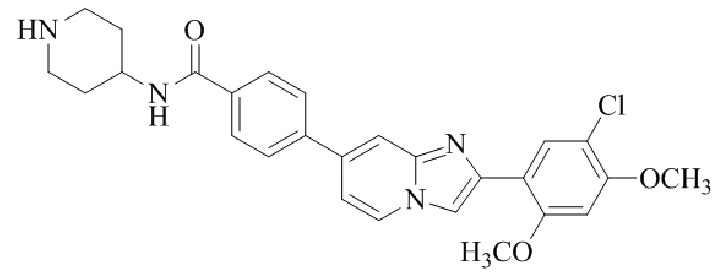
(15) Соединение или его фармацевтически приемлемая соль в соответствии с (1), которое выбирают из группы, состоящей из:
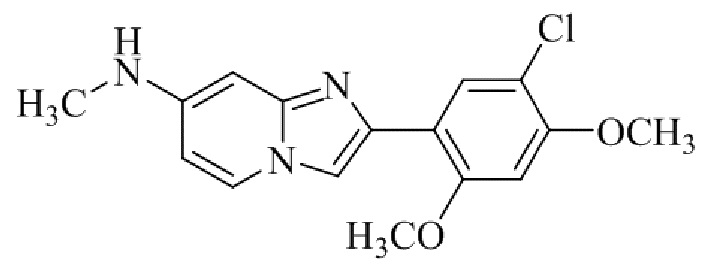
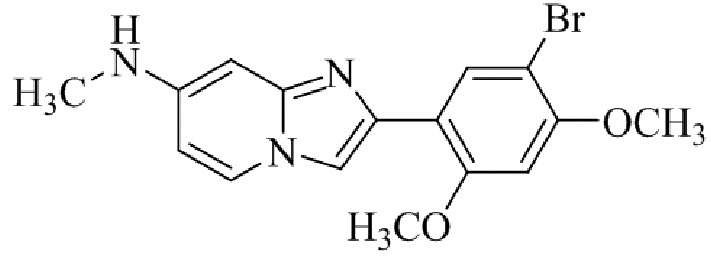
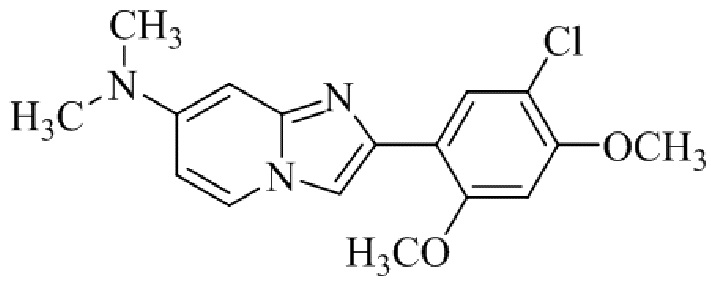
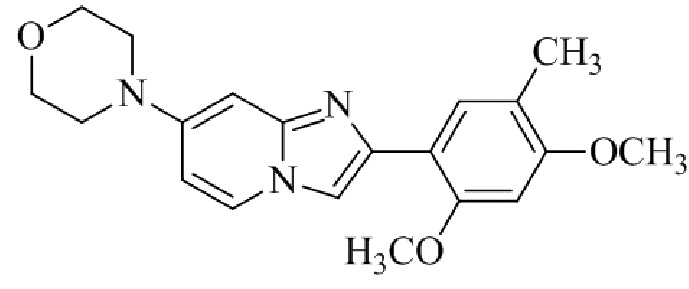
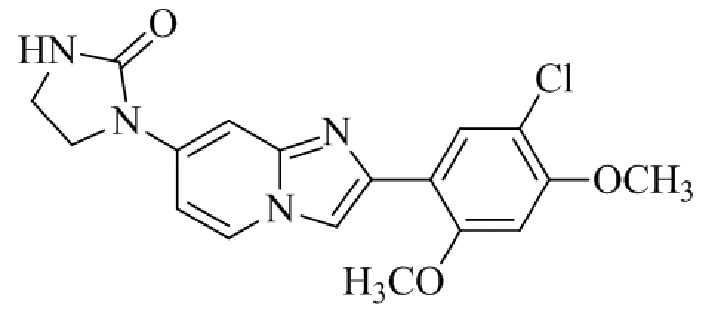
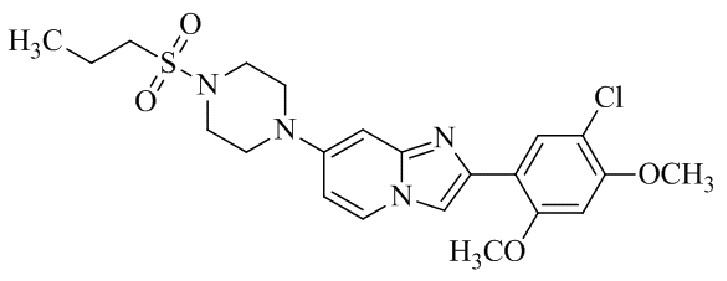
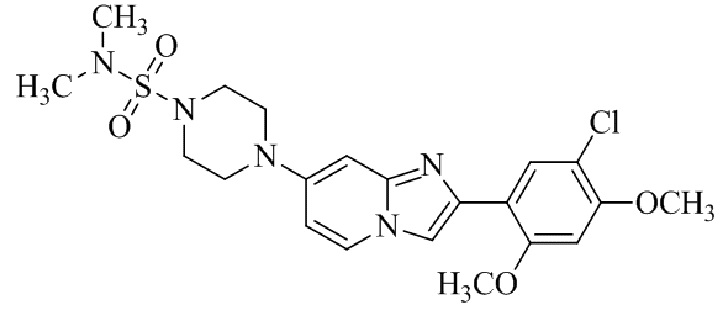
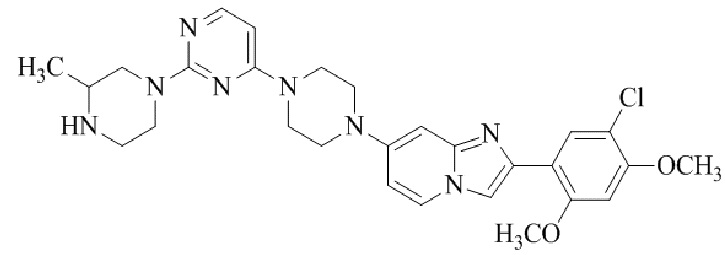
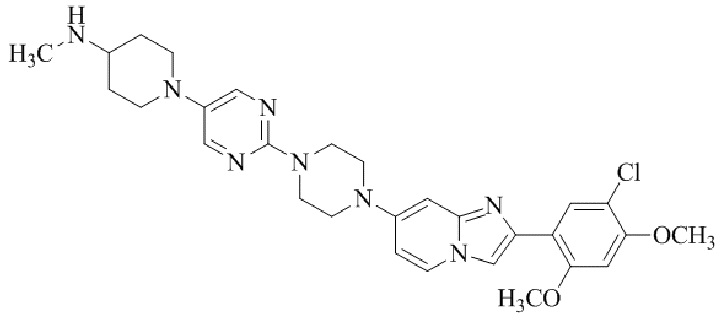
2-(5-бром-2,4-диметоксифенил)-N-метилимидазо[1,2-a]пиридин-7-амина;
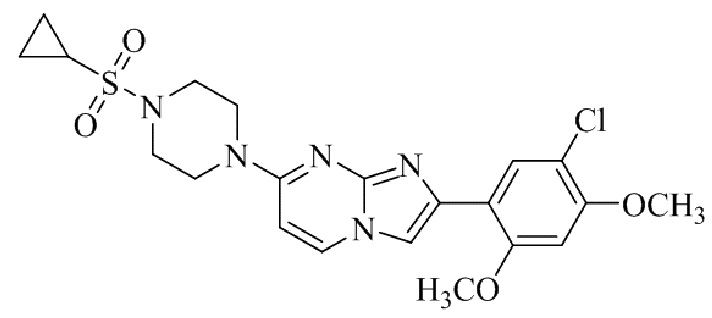
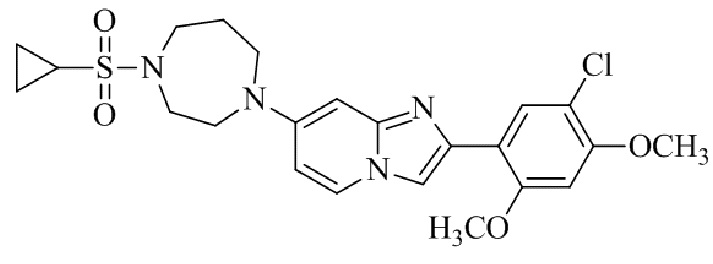
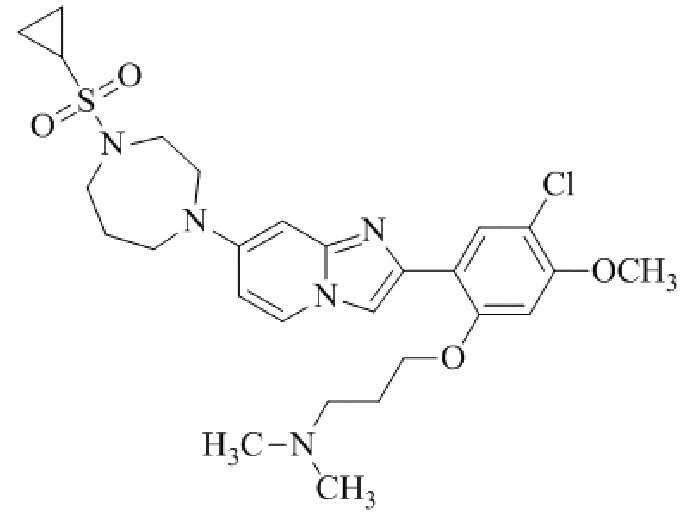
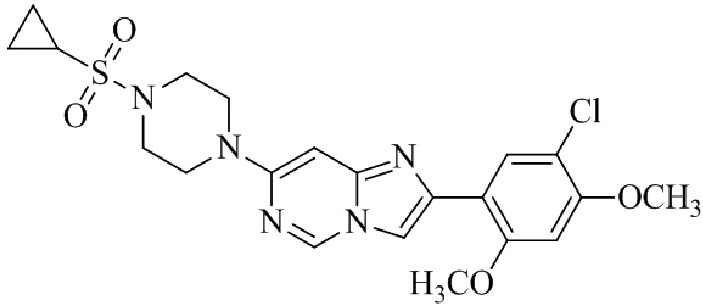
2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридина;
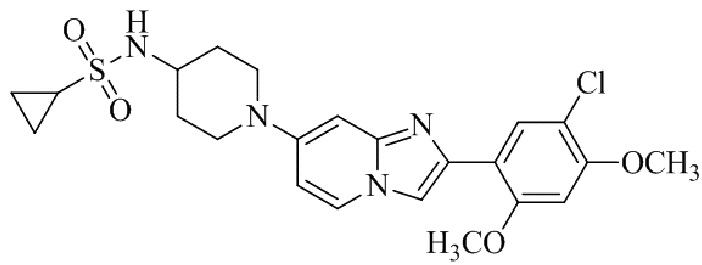
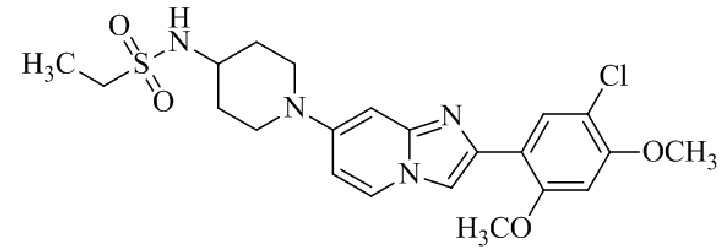
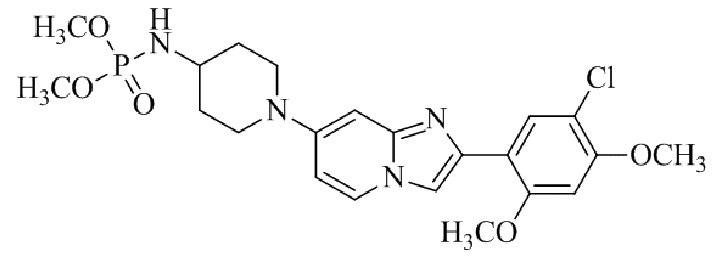
N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)метансульфонамида;
2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиримидина;
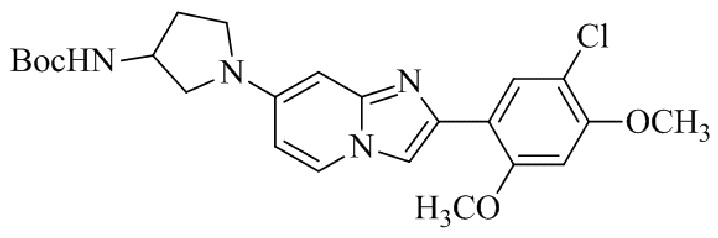
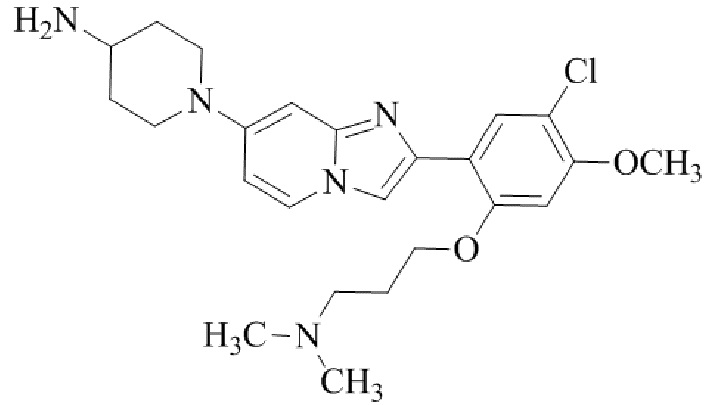
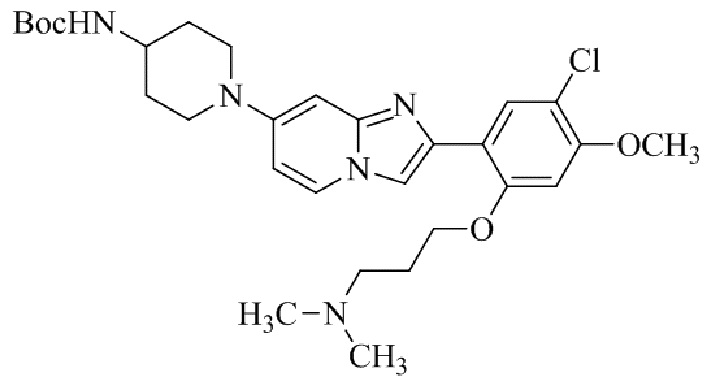
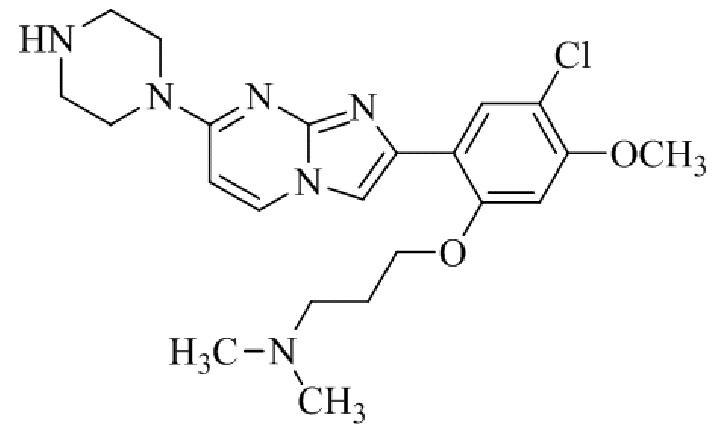
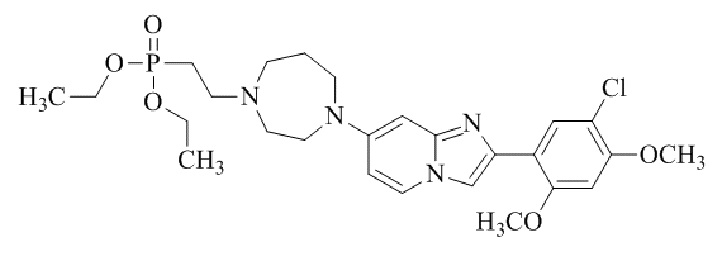
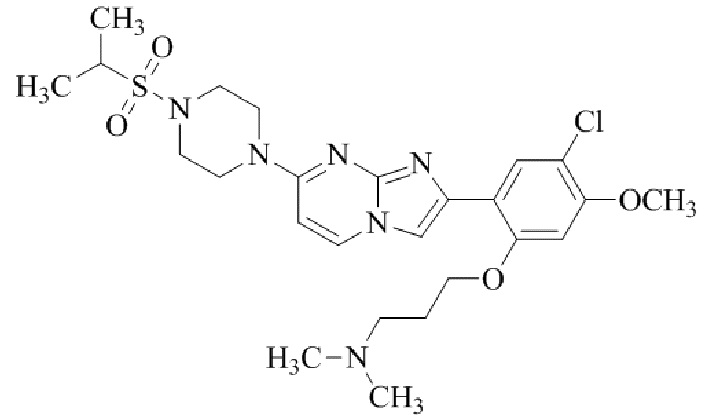
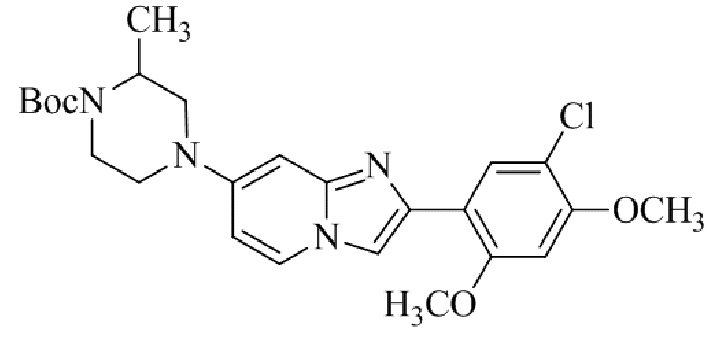
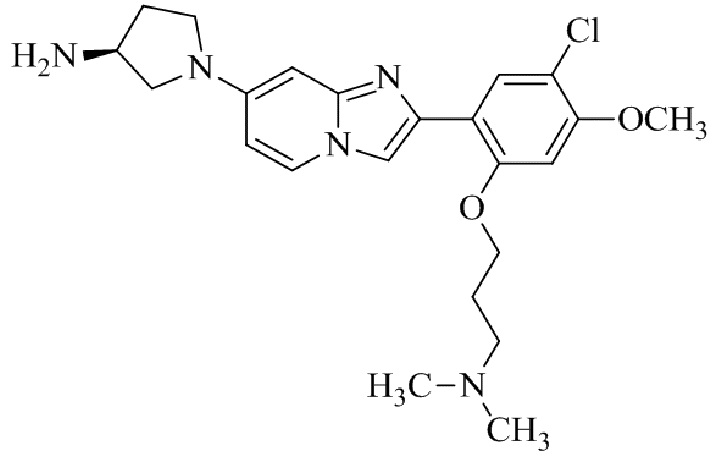
трет-бутил(1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)карбамата;
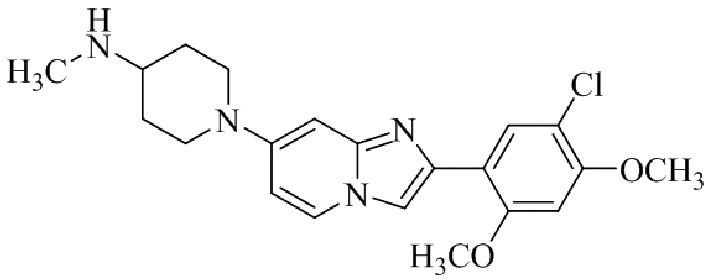
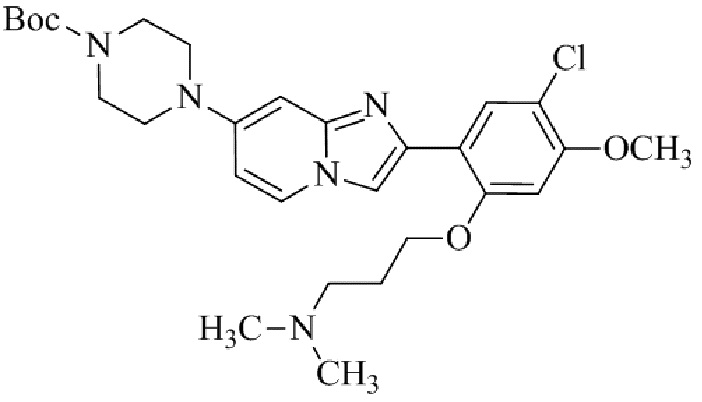
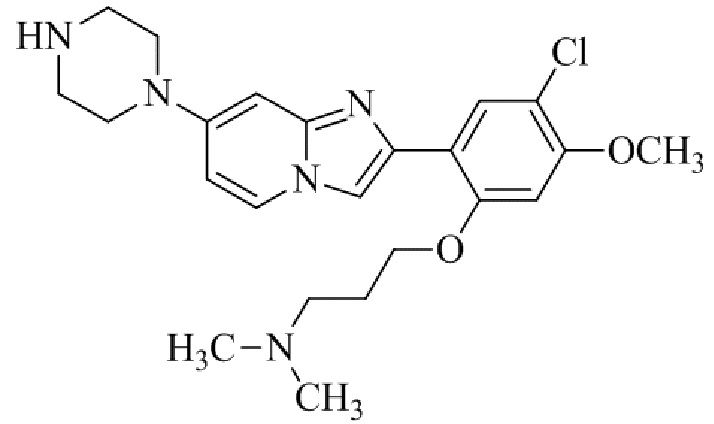
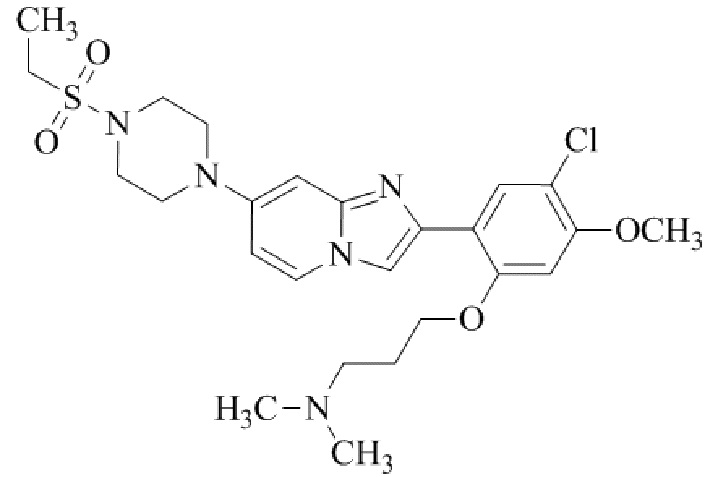
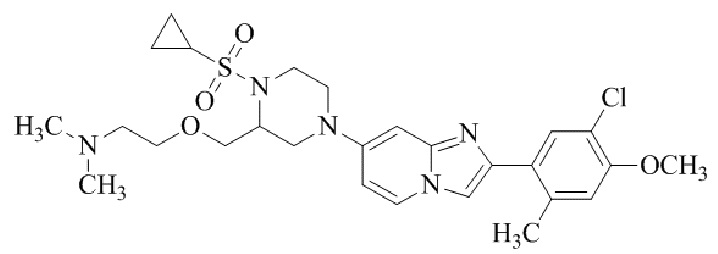
1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]-пиридин-7-ил)пиперидин-4-амина;
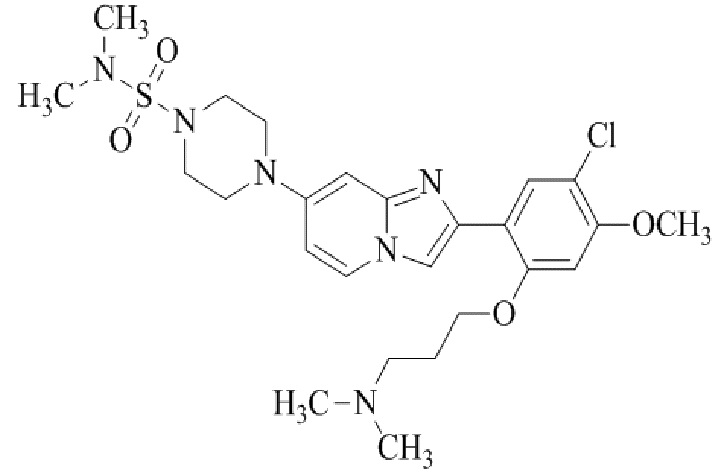
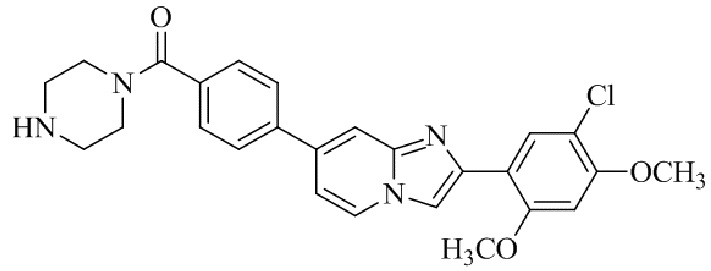
4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N,N-диметил-пиперазин-1-сульфонамида;
N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этансульфонамида;
N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)-1,1,1-трифторметансульфонамида;
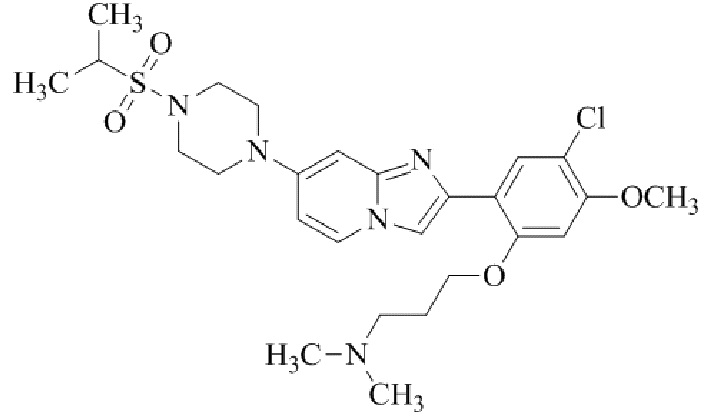
2-(5-хлор-2,4-диметоксифенил)-7-(4-(изопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридина;
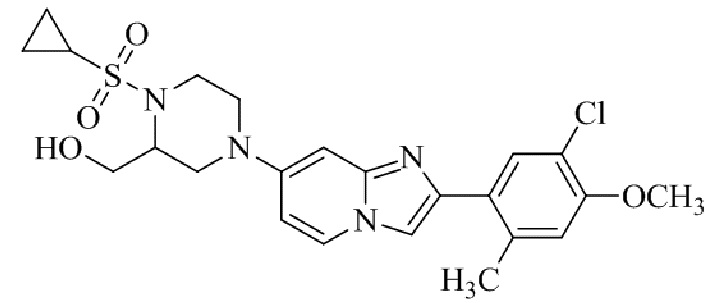
7-(4-(N,N-диметиламиносульфониламино)пиперидин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина;
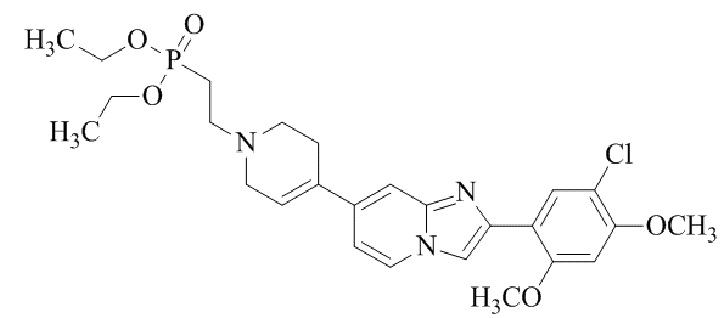
диметил (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)фосфоната;
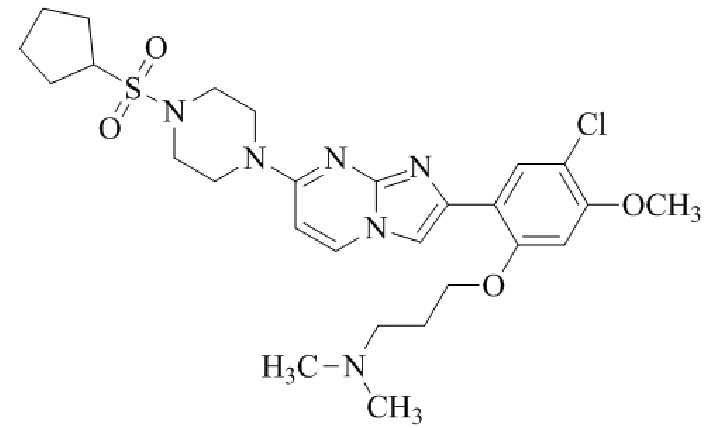
2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопентилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиримидина;
2-(5-хлор-2,4-диметоксифенил)-7-(4-(изопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиримидина;
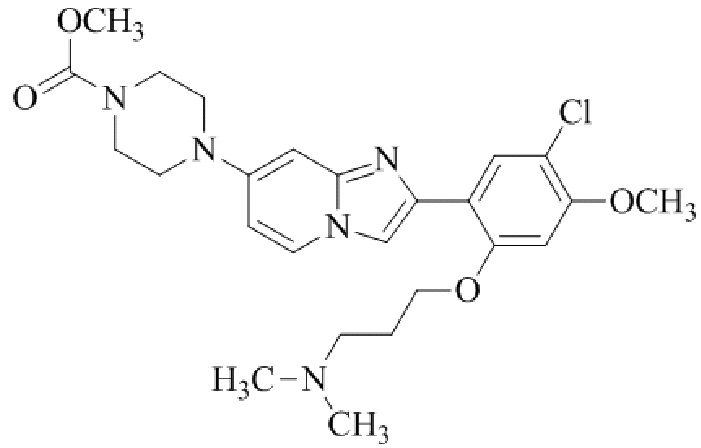
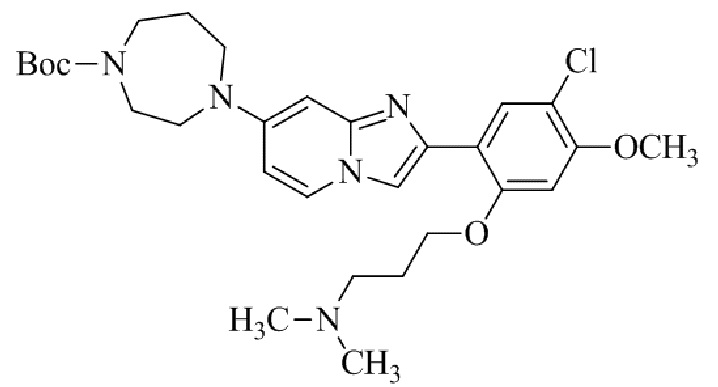
трет-бутил-4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)-1,4-диазепан-1-карбоксилата;
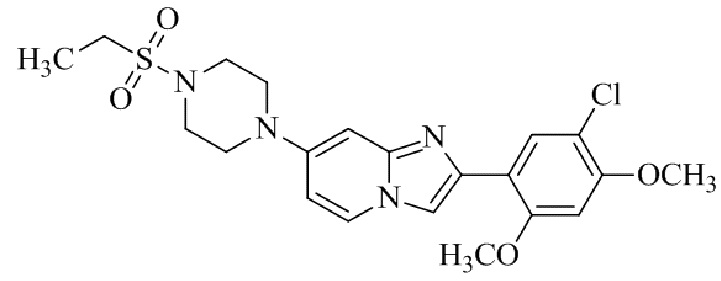
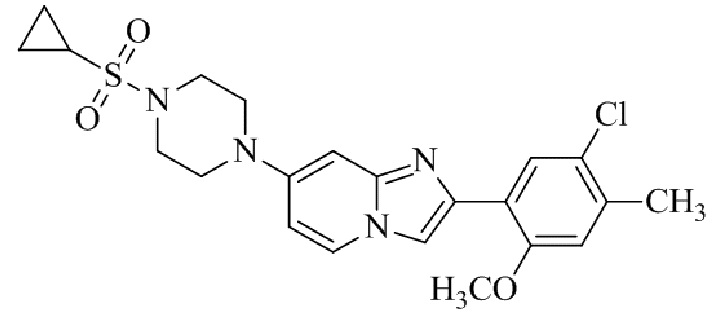
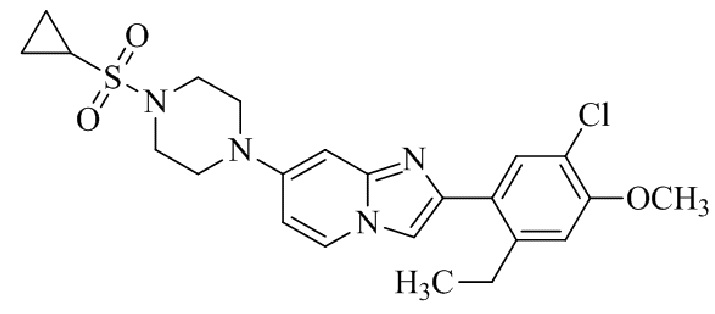
2-(5-хлор-2-метокси-4-метилфенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридина;
трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилата;
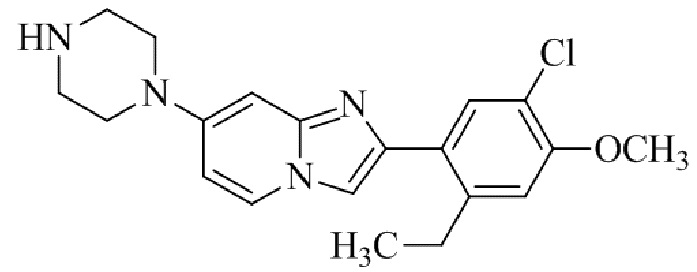
2-(5-хлор-2-этил-4-метоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридина
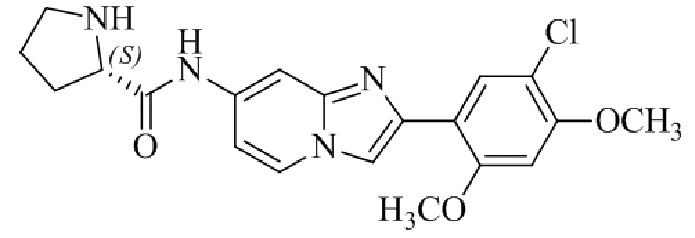
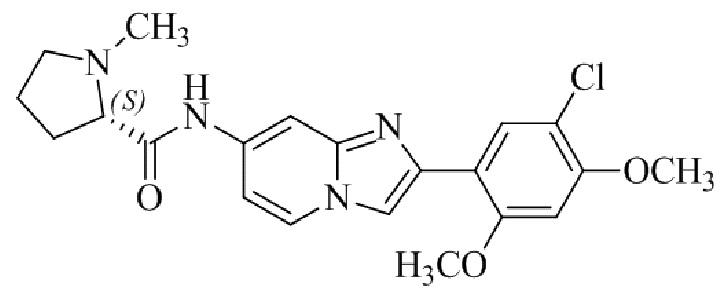
(S)-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1-метилпирролидин-2-карбоксамида
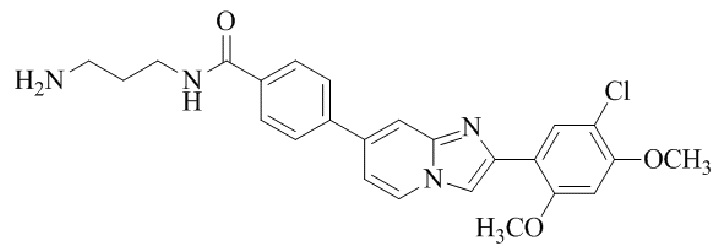
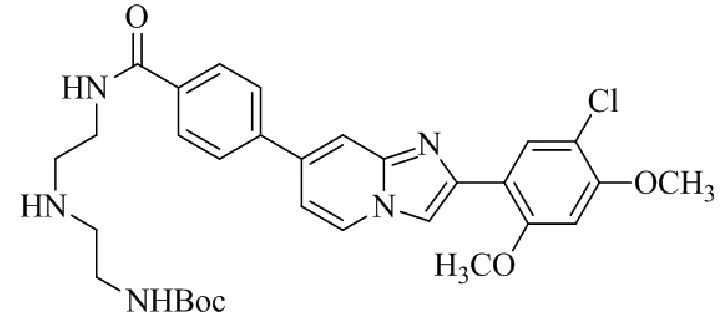
трет-бутил(2-((2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)бензамидо)этил)амино)этил)карбамата;
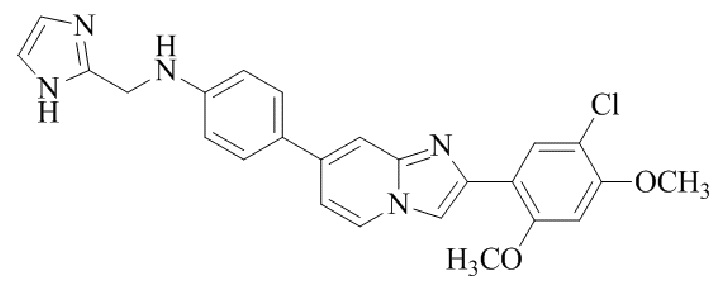
N-((1H-имидазол-2-ил)метил)-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)анилина;
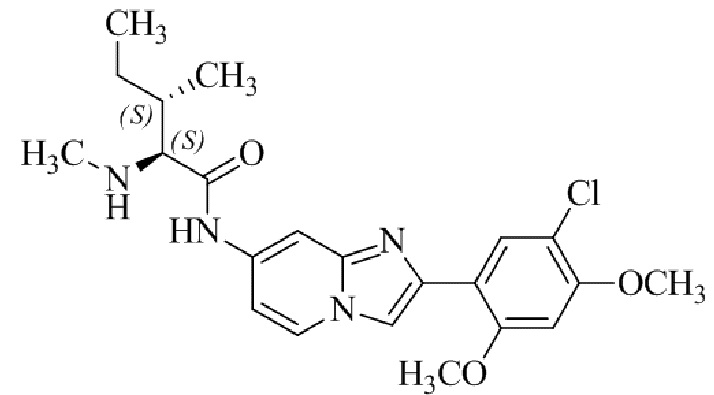
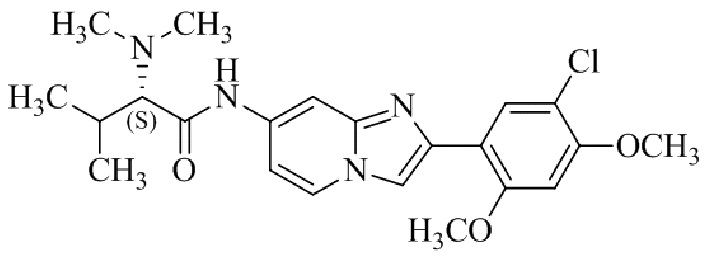
(S)-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-2-(диметиламино)-3-метилбутанамида;
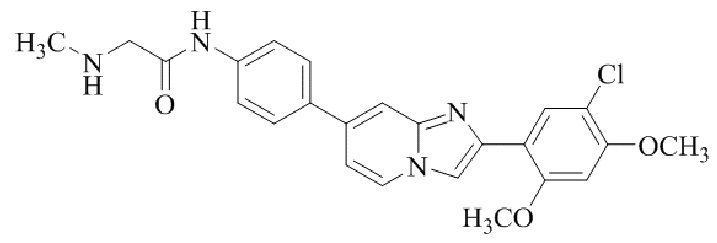
N-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)фенил)-2-(метиламино)ацетамида;
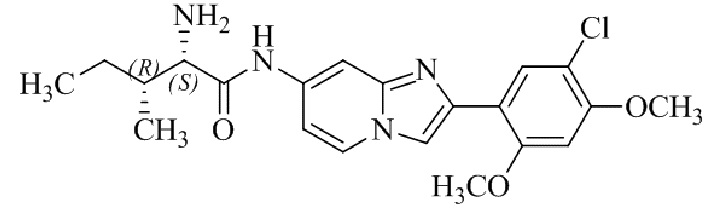
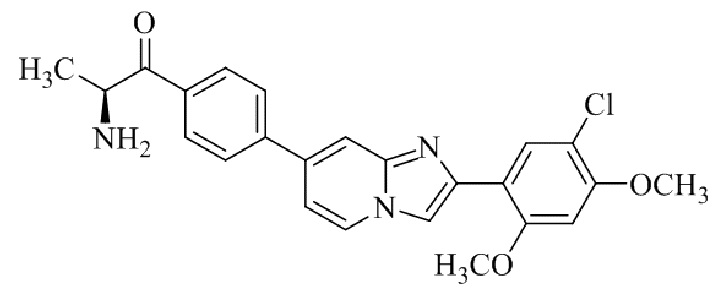
(S)-2-амино-1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)фенил)пропан-1-она;
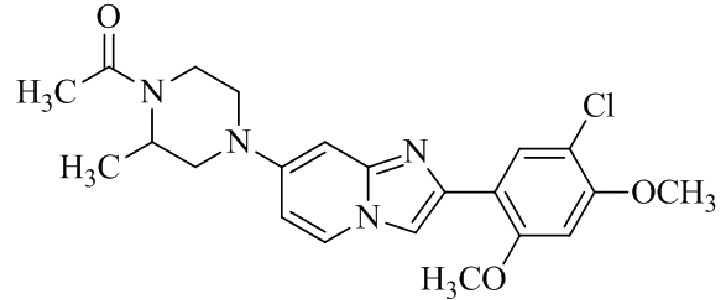
трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-2-метилпиперазин-1-карбоксилата;
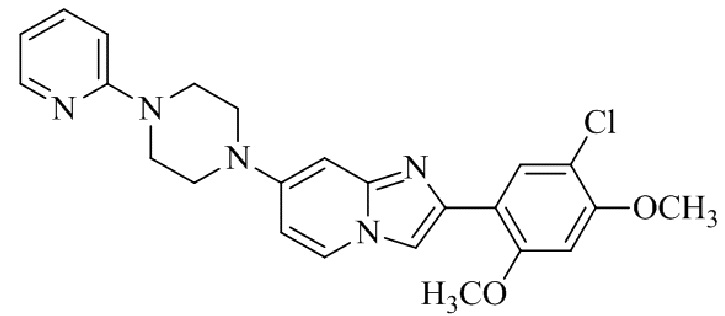
2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина;
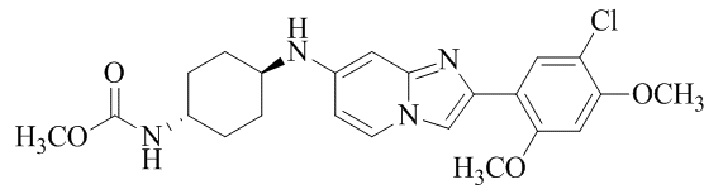
метил(4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-транс-амино)циклогексил)карбамата;
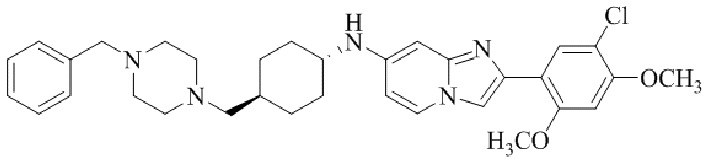
транс-N-(4-((4-бензилпиперазин-1-ил)метил)циклогексил)-2-(5-хлор-2,4-диметокси-фенил)имидазо[1,2-a]пиридин-7-амина трифторацетата;
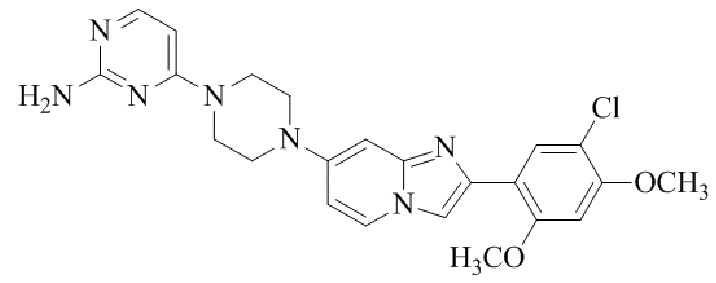
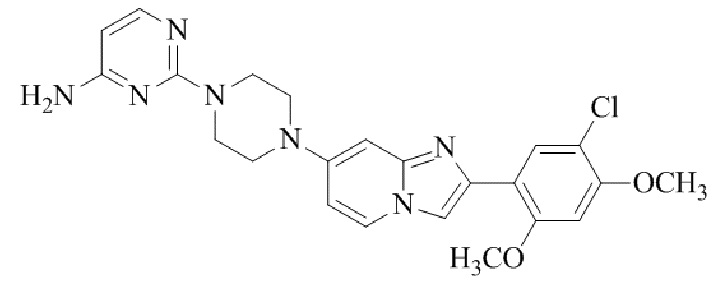
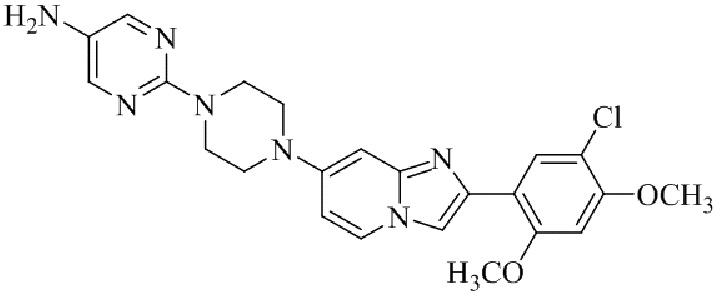
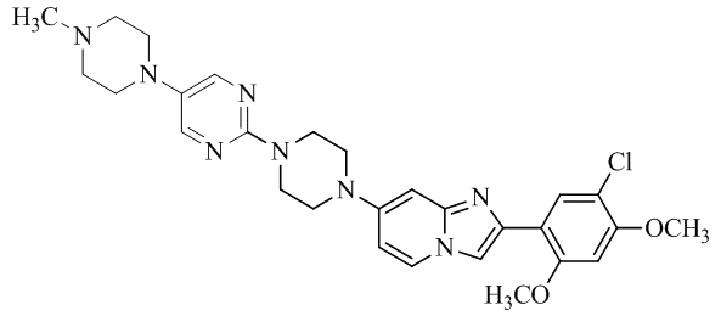
4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-амина;
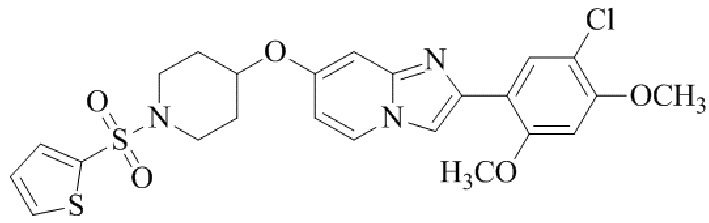
2-(5-хлор-2,4-диметоксифенил)-7-((1-(тиофен-2-илсульфонил)пиперидин-4-ил)окси)имидазо[1,2-a]пиридина;
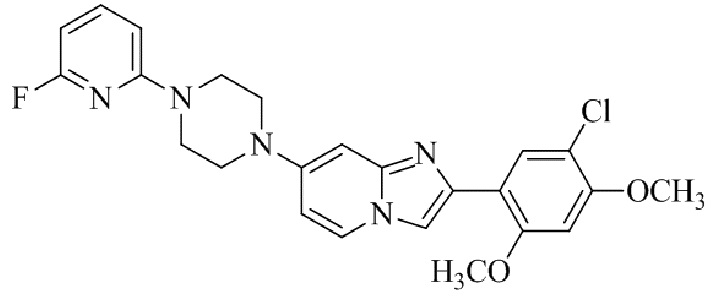
2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-фторпиридин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина;
2-(5-хлор-2,4-диметоксифенил)-7-(4-фенилпиперазин-1-ил)имидазо[1,2-a]пиридина;
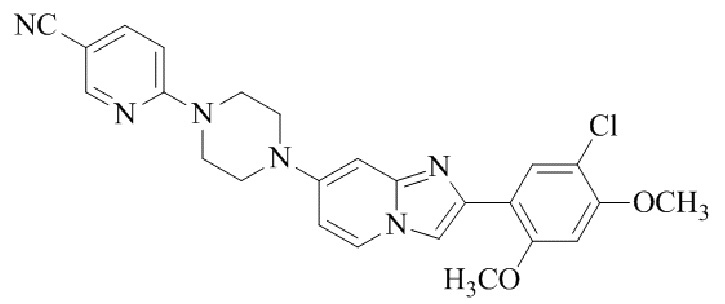
2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)никотинонитрила;
4-(4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)окси)пиперидин-1-ил)пиримидин-2-амина;
2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиразин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина;
2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-амина;
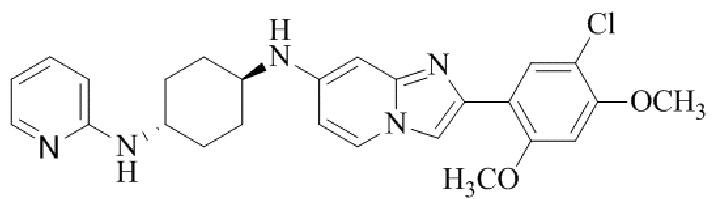
N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(пиридин-2-ил)-транс-циклогексан-1,4-диамина;
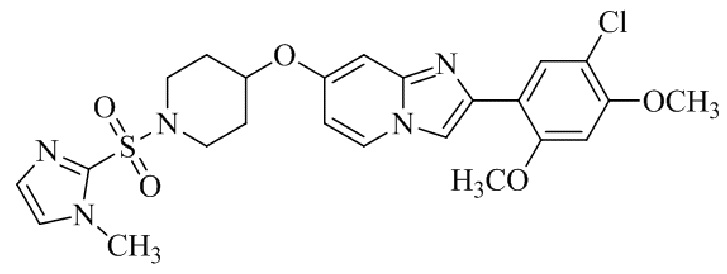
2-(5-хлор-2,4-диметоксифенил)-7-((1-((1-метил-1H-имидазол-2-ил)сульфонил)пиперидин-4-ил)окси)имидазо[1,2-a]пиридина;
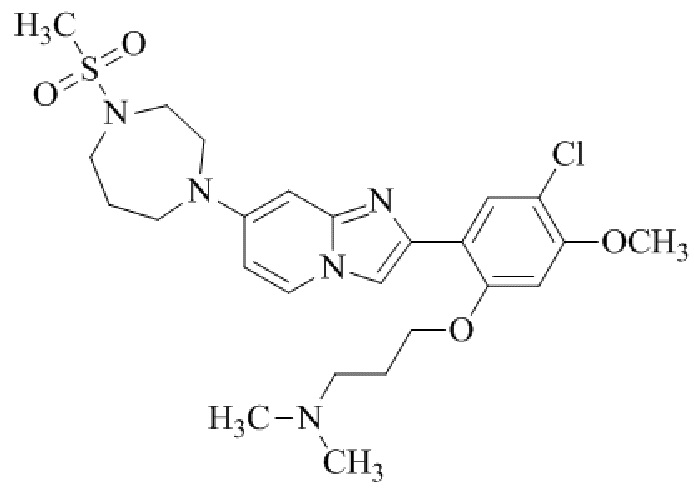
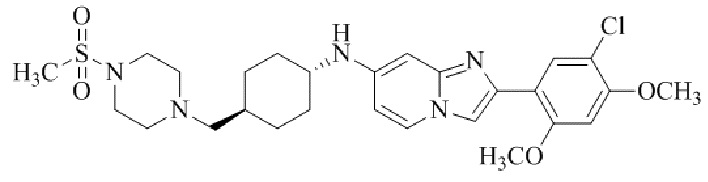
2-(5-хлор-2,4-диметоксифенил)-транс-N-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)циклогексил)имидазо[1,2-a]пиридин-7-амина;
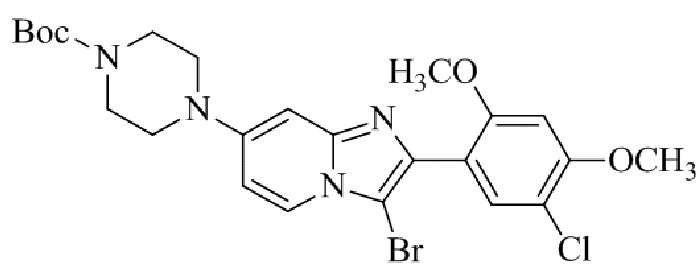
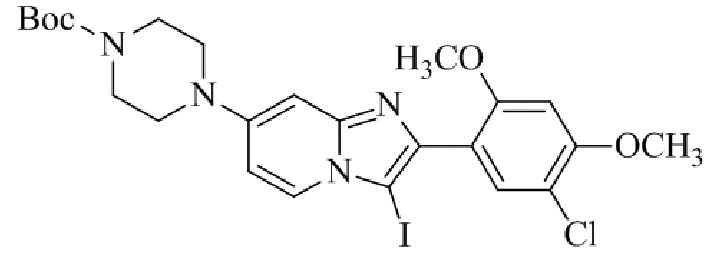
трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)-3-йодимидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилата;
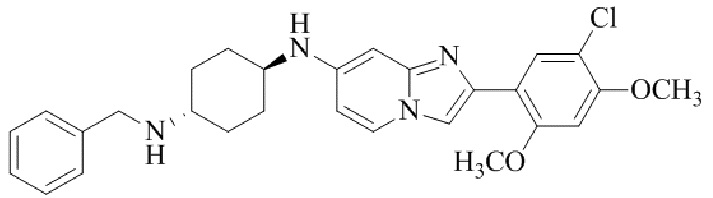
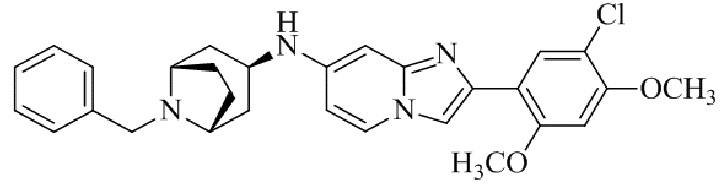
N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-транс-циклогексан-1,4-диамина;
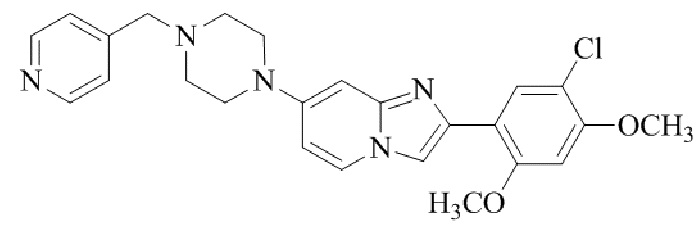
2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-4-илметил)пиперазин-1-ил)имидазо[1,2-a]пиридина;
6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)никотинонитрила;
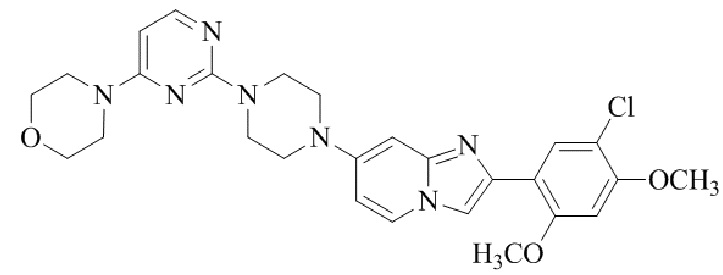
4-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)морфолина;
2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперидин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина;
2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-3-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина;
4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N,N-диметилпиримидин-2-амина;
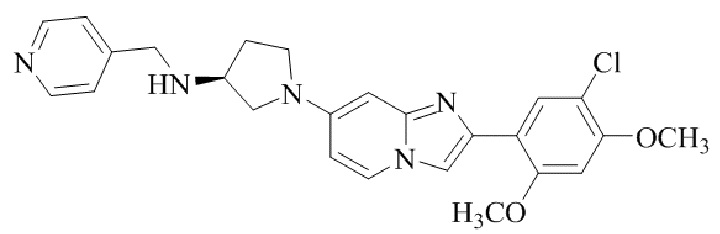
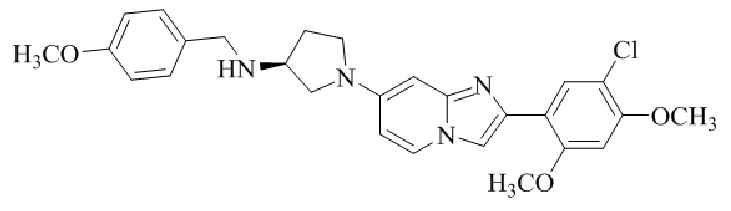
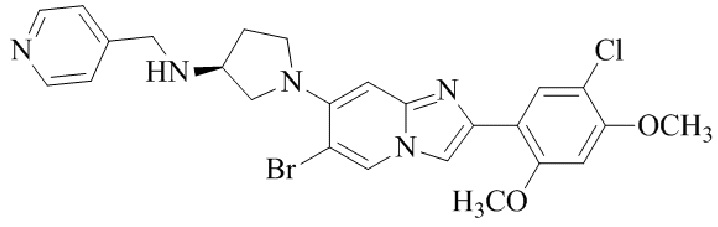
(S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина;
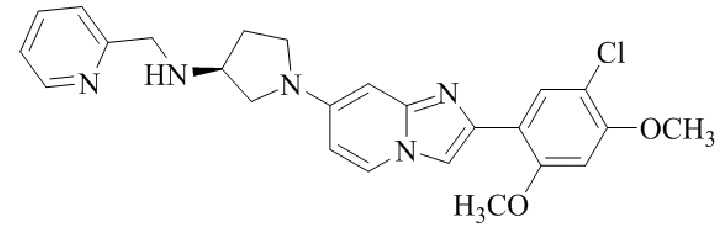
(S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-2-илметил)пирролидин-3-амина;
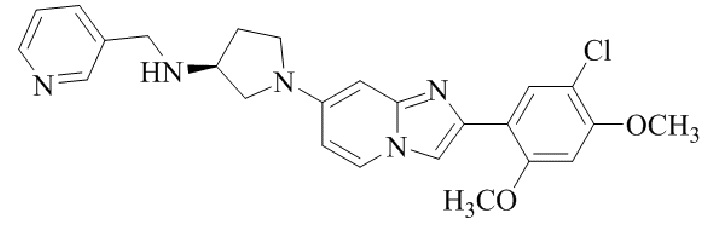
(S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-3-илметил)пирролидин-3-амина;
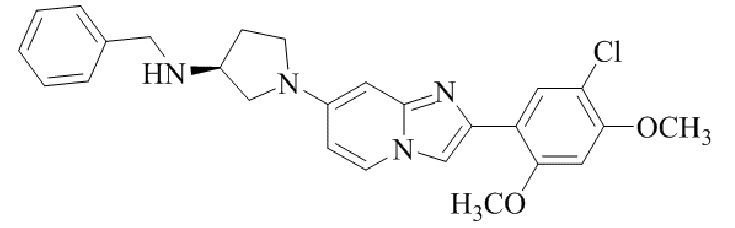
(S)-N-бензил-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-амина;
(S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(4-фторбензил)пирролидин-3-амина;
(S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(4-(трифторметил)бензил)пирролидин-3-амина;
(S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(4-нитробензил)пирролидин-3-амина;
(S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(4-метилбензил)пирролидин-3-амина; и
их фармацевтически приемлемых солей.
(16) Соединение или его фармацевтически приемлемая соль в соответствии с (1), которое выбирают из группы, состоящей из:
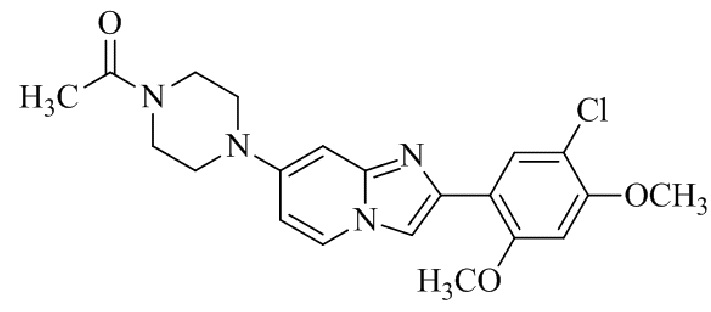
2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)никотинонитрила;
(S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина;
2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-4-илметил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридина;
2-(5-хлор-2,4-диметоксифенил)-7-(4-(4-(пиперазин-1-ил)пиримидин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина;
1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)пиперидин-4-амина;
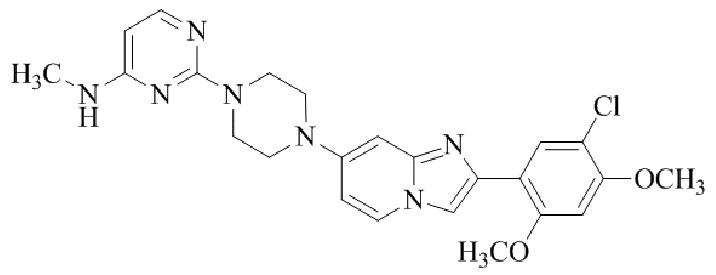
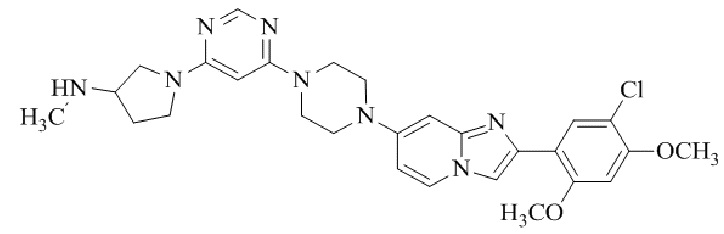
1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-N-метилпирролидин-3-амина;
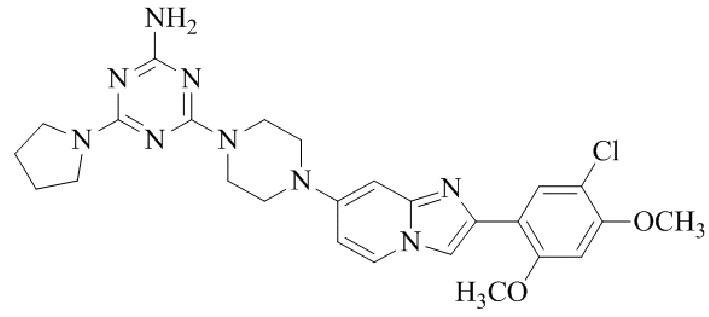
4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-6-морфолино-1,3,5-триазин-2-амина;
2-(5-хлор-2,4-диметоксифенил)-N-(1-((5-нитротиофен-3-ил)метил)пиперидин-4-ил)имидазо[1,2-a]пиридин-7-амина;
2-(5-хлор-2,4-диметоксифенил)-N-((1R,3r,5S)-8-(пиридин-4-илметил)-8-азабицикло[3.2.1]октан-3-ил)имидазо[1,2-a]пиридин-7-амина;
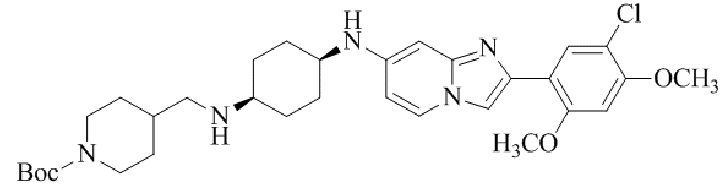
трет-бутил-4-((((1s,4s)-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)пиперидин-1-карбоксилата; и
их фармацевтически приемлемых солей.
(17) Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение или его фармацевтически приемлемую соль в соответствии с каким-либо одним из (1)-(16).
(18) Фармацевтическая композиция в соответствии с (17) для применения при лечении или предотвращении злокачественной опухоли.
(19) Фармацевтическая композиция в соответствии с (18), в которой злокачественную опухоль выбирают из группы, состоящей из злокачественной опухоли легких, злокачественной опухоли шейки матки, злокачественной опухоли мочевого пузыря, злокачественной опухоли пищевода, остеосаркомы, злокачественной опухоли предстательной железы и опухоли мягких тканей.
(20) Способ лечения или предотвращения заболевания, в которое вовлечена сверхэкспрессия SUV39H2, который включает введение эффективного количества соединения или его фармацевтически приемлемой соли в соответствии с каким-либо одним из (1)-(16) нуждающемуся в этом субъекту.
(21) Способ в соответствии с (20), в котором заболевание представляет собой злокачественную опухоль.
(22) Применение соединения или его фармацевтически приемлемой соли в соответствии с каким-либо одним из (1)-(16) для изготовления лекарственного средства для применения при лечении или предотвращении заболевания, которое включает сверхэкспрессию SUV39H2.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Цель настоящего изобретения состоит в том, чтобы предоставить соединение, обладающее ингибирующей активностью против MELK, которое можно использовать для лечения пролиферативных заболеваний, таких как злокачественная опухоль, и фармацевтическую композицию, содержащую соединение. Другая цель настоящего изобретения состоит в том, чтобы предоставить способ лечения и/или предотвращения пролиферативного заболевания. Дополнительная цель состоит в том, чтобы предоставить процесс получения соединения.
Далее в настоящем описании соединение, представленное формулой (I), обозначают как соединение (I). То же применимо к соединениям, представленным формулами под другими номерами. Следует отметить, что, как используют в настоящем описании и в приложенной формуле изобретения, формы единственного числа включают множественное число до тех пор, пока контекст явно не диктует иное. Таким образом, например, упоминание «группы» представляет собой упоминание одной или нескольких групп, если не указано иное.
В определениях каждой из групп в формулах, которые указаны выше, «C1-C6 алкил» и C1-C6 алкильная часть в «C1-C6 алкокси», «C1-C6 алкиламино», «ди(C1-C6 алкил)амино», «(C1-C6 алкил)карбониле», «C1-C6 алкилтио», «C1-C6 алкилсульфиниле», «C1-C6 алкилсульфониле» и т. п. обозначает алкильную группу с неразветвленной цепью или разветвленной цепью, которая имеет от одного до шести атомов углерода. В частности, примеры «C1-C6 алкила» и «C1-C6 алкильной части» включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, 1-метилбутил, 1-этилпропил, 2-метилбутил, изопентил, трет-пентил, 1,2-диметилпропил, неопентил, гексил, 1-метилпентил, 1-этилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, изогексил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 1-изопропилпропил, 1-этил-1-метилпропил, 2,3-диметилбутил, 3,3-диметилбутил, 2,2-диметилбутил, 2-этилбутил и 3-этилбутил, но без ограничения этим.
В этом описании C1-C6 алкильная часть в каждой группе имеет то же определение, что и указанная выше «C1-C6 алкильная часть», если не указано иное. В том случае, если группа содержит несколько C1-C6 алкильных частей, C1-C6 алкильные части могут быть одинаковыми или различающимися.
Конкретные примеры «C1-C6 алкокси» включают метокси, этокси, пропокси, изопропокси, изобутилокси, трет-бутилокси, бутокси, пентилокси и гексилокси, но без ограничения этим.
«C1-C6 алкоксикарбонил» относится к одновалентной группе, представленной C(=O)O-(C1-C6 алкилом). Конкретные примеры «(C1-C6 алкокси)карбонила» включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, изобутилоксикарбонил, трет-бутоксикарбонил, бутоксикарбонил, пентилоксикарбонил и гексилоксикарбонил, но без ограничения этим.
«(C1-C6 алкил)карбонил» относится к одновалентной группе, представленной -C(=O)-(C1-C6 алкилом). Конкретные примеры «(C1-C6 алкил)карбонила» включают метилкарбонил (т. е. ацетил), этилкарбонил, пропилкарбонил, изопропилкарбонил, изобутилкарбонил, трет-бутилкарбонил, бутилкарбонил, пентилкарбонил и гексилкарбонил, но без ограничения этим.
Конкретные примеры «C1-C6 алкиламино» включают метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, втор-бутиламино и трет-бутиламино, пентиламино, но без ограничения этим.
Алкильные части в «ди(C1-C6 алкил)амино» могут быть одинаковыми или различными. Конкретные примеры «ди(C1-C6 алкил)амино» включают диметиламино, диэтиламино, дипропиламино, диизопропиламино, дибутиламино, диизобутиламино, ди(втор-бутил)амино, ди(трет-бутил)амино, дипентиламино, этил(метил)амино, пропил(метил)амино, изопропил(метил)амино, бутил(метил)амино, изобутил(метил)амино, втор-бутил(метил)амино, трет-бутил(метил)амино и пентил(метил)амино, но без ограничения этим.
Конкретные примеры «атома галогена» включают атомы фтора, хлора, брома и йода.
Термин «C3-C10 циклоалкил» относится к насыщенной моноциклической углеводородной группе, имеющей от трех до десяти атомов углерода, и мостиковой циклической углеводородной группе, имеющей от четырех до десяти атомов углерода, которую формируют, когда два или больше насыщенных моноциклическыихи углеводорода имеют два или больше общих атомов углерода. Термин «C3-C10 циклоалкил» также охватывает циклоалкильную группу, конденсированную с ароматическим или неароматическими карбоциклическим кольцом, чтобы формировать бициклическую группу. В частности, примеры «C3-C10 циклоалкила» включают насыщенные моноциклические углеводородные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил, и мостиковые циклические углеводородные группы, такие как адамантил, но без ограничения этим.
В определениях каждой из групп в формулах, приведенных выше, C3-C10 циклоалкильная часть в «C3-C10 циклоалкокси», «(C3-C10 циклоалкил)карбониле», «(C3-C10 циклоалкил)сульфониле», «(C3-C10 циклоалкил)сульфониламино» и т. п. обозначает то же, что описано выше. В частности, примеры «C3-C10 циклоалкокси» включают циклопропокси, циклобутокси, циклопентокси, циклогексилокси, циклогептилокси и циклооктилокси, и мостиковые циклические углеводородные группы, такие как адамантилокси, но без ограничения этим.
Термин «C6-C10 арил» относится к ароматической карбоциклической группе, имеющей от шести до десяти атомов углерода, и охватывает ароматическую карбоциклическую группу, конденсированную с ароматическим или неароматическим карбоциклическим кольцом, чтобы формировать бициклическую группу. Конкретные примеры включают фенил, 1-нафтил, 2-нафтил и 2,3-дигидро-1H-инденил, но без ограничения этим.
Термин «C7-C14 аралкил» относится к алкильной группе, замещенной арильной группой, которая имеет от 7 до 14 атомов углерода. Конкретные примеры включают бензил, 2-фенилэтил, 1-фенилэтил, лигроин-1-илметил, лигроин-2-илметил и 2,3-дигидро-1H-инден-4-илметил, но без ограничения этим.
В определениях каждой из групп в формулах, приведенных выше, C7-C14 аралкильная часть в «C7-C14 аралкилсульфонил» и т. п. обозначает то же, что описано выше. В частности, примеры «C7-C14 аралкилсульфонила» включают бензилсульфонил, но без ограничения этим.
Термин «5-10-членный гетероарил» относится к ароматической гетероциклической группе, имеющей один или несколько гетероатомов, предпочтительно от одного до трех гетероатомов, которые выбраны из группы, состоящей из атома азота, атома кислорода и атома серы. Термин «5-10-членный гетероарил» охватывает ароматическую гетероциклическую группу, конденсированную с ароматическим или неароматическим карбоциклическим кольцом или ароматическим или неароматическим гетероциклическим кольцом для того, чтобы формировать бициклическую группу, а также охватывает ароматическую карбоциклическую группу, конденсированную с ароматическим или неароматическим гетероциклическим кольцом для того, чтобы формировать бициклическую группу. Конкретные примеры включают фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, бензофуранил, бензотиофенил, бензоксазолил, бензотиазолил, изоиндолил, индолил, 1H-индазолил, бензимидазолил, бензотриазолил, оксазолопиримидинил, тиазолопиримидинил, пирролопиридинил, пирролопиримидинил, имидазопиридинил, пуринил, хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, хиноксалинил, нафтиридинил, пиридопиримидинил, [1,2,4] триазоло[1,5-a]пиридил и пирроло[2,3-b]пиридил, но без ограничения этим. В частности, предпочтительны тиенил, пирролил, имидазолил, изоксазолил, пиридил, пиримидинил, пиразолил, 1H-индазолил, бензимидазолил, [1,2,4]триазоло[1,5-a]пиридил или пирроло[2,3-b]пиридил. Термин «5-10-членный гетероарилкарбонил» относится к группе, содержащей 5-10-членную гетероарильную группу, которая представляет собой то, что определено выше.
Термин «3-12-членный неароматический гетероциклил» относится к неароматической гетероциклической группе, имеющей один или несколько гетероатомов, предпочтительно от одного до трех гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы. Термин «3-12-членный неароматический гетероциклил» охватывает неароматическую гетероциклическую группу, конденсированную с ароматическим или неароматическим карбоциклическим кольцом или ароматическим или неароматическим гетероциклическим кольцом, чтобы формировать бициклическую группу, и также охватывает неароматическую карбоциклическую группу, конденсированную с ароматическим или неароматическим гетероциклическим кольцом для того, чтобы формировать бициклическую группу. Конкретные примеры включают азиридинил, азетидинил, пирролидинил, пиперидил (включая пиперидино), азепанил, 1,2,5,6-тетрагидропиридил, 1,2,3,6-тетрагидропиридил, имидазолидинил, пиразолидинил, пиперазинил, гомопиперазинил, 1,4-диазепанил, пиразолинил, оксиранил, тетрагидрофуранил, тетрагидро-2H-пиранил, 5,6-дигидро-2H-пиранил, оксазолидинил, морфолинил (включая морфолино), тетрагидротиофенил, тетрагидро-2H-тиопиранил, тиоксазолидинил, тиоморфолинил, 2H-оксазолил, 2H-тиоксазолил, дигидроиндолил, дигидроизоиндолил, дигидробензофуранил, бензоимидазолидинил, 2,3-дигидробензимидазолил, 2,3-дигидробензоксазолил, дигидробензотиоксазолил, бензодиоксолинил, тетрагидрохинолил, тетрагидроизохинолил, дигидро-2H-хроманил, дигидро-1H-хроманил, дигидро-2H-тиохроманил, дигидро-1H-тиохроманил, тетрагидрохиноксалинил, тетрагидрохиназолинил, дигидробензодиоксанил, оксетанил, 1,2-дигидропиридил, 1-азабицикло[2.2.2]октан-3-ил, 2,5-азабицикло[2.2.1]гептил, 8-азабицикло[3.2.1]октил, пиперидин-4-спиро-3'-пирролидин-1-ил и изоиндолил, но без ограничения этим. В частности, предпочтительны азетидинил, пирролидинил, пиперидино, пиперидил, пиперазинил, морфолино, морфолинил, 1,2-дигидропиридил, 1,2,5,6-тетрагидропиридил, 1-азабицикло[2.2.2]октан-3-ил, 2,5-азабицикло[2.2.1]гептил, 8-азабицикло[3.2.1]октил, 2,3-дигидробензимидазолил или пиперидин-4-спиро-3'-пирролидин-1-ил.
Термин «3-12-членный азотосодержащий гетероциклил» относится к ароматической или неароматической гетероциклической группе, имеющей один атом азота и один или несколько дополнительных гетероатомов, предпочтительно от одного до трех гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы. Термин «3-12-членный азотосодержащий гетероциклил» охватывает гетероциклическую группу, конденсированную с ароматическим или неароматическим карбоциклическим кольцом или ароматическим или неароматическим гетероциклическим кольцом для того, чтобы формировать бициклическую группу. Конкретные примеры включают азиридинил, азетидинил, пирролил, пирролидинил, пиперидил (включая пиперидино), азепанил, имидазолил, пиразолил, триазолил, тетразолил, пиперазинил и морфолинил.
Фармацевтически приемлемые соли соединения (I) обозначают, например, фармацевтически приемлемые кислотно-аддитивные, аминокислотно-аддитивные соли или т. п. Конкретные примеры фармацевтически приемлемых кислотно-аддитивных солей соединения (I) включают соли неорганических кислот, такие как гидрохлорид, сульфат и фосфат, соли органических кислот, такие как ацетат, малеат, фумарат, цитрат и т. п., и примеры фармацевтически приемлемых аминокислотно-аддитивных солей включают аддитивные соли, например, лизина, глицина, фенилаланина, аспарагиновой кислоты или глутаминовой кислоты. В частности, фармацевтически приемлемые соли соединения (I) включают соль гидрохлорид, соль дигидрохлорид и соль тригидрохлорид.
Примеры заболеваний, в которые вовлечена сверхэкспрессия SUV39H2 и которые можно лечить и/или предотвращать с помощью фармацевтических композиций, содержащих в качестве активного ингредиента соединение или его фармацевтически приемлемую соль по настоящему изобретению, включают злокачественную опухоль, злокачественную опухоль молочной железы, злокачественную опухоль мочевого пузыря, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, хронический миелолейкоз (CML), злокачественную опухоль толстой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль желудка, злокачественную опухоль печени, немелкоклеточную злокачественную опухоль легких (NSCLC), лимфому, остеосаркому, злокачественную опухоль яичников, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки и мелкоклеточную злокачественную опухоль легких (SCC), но без ограничения этим. Примеры злокачественной опухоли, которую можно лечить и/или предотвращать, включают злокачественную опухоль молочной железы, злокачественную опухоль мочевого пузыря, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, CML, злокачественную опухоль толстой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль желудка, злокачественную опухоль печени, NSCLC, лимфому, остеосаркому, злокачественную опухоль яичников, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки и SCC, но без ограничения этим. В одном из вариантов осуществления примеры злокачественной опухоли включают злокачественную опухоль легких, злокачественную опухоль шейки матки, злокачественную опухоль мочевого пузыря, злокачественную опухоль пищевода, остеосаркому, злокачественную опухоль предстательной железы и опухоль мягких тканей.
Соединение (I) включает соединения, которые могут иметь стереоизомеры, такие как региоизомеры, геометрические изомеры, оптические изомеры и таутомеры, и все возможные изомеры, в том числе в настоящее изобретение включены они и их смеси.
Соединение (I) также включает соединения, имеющие один или несколько минорных стабильных изотопов или радиоизотопов, таких как 2H, 3H, 13C, 14C, 15N, 18O и т. п., которые можно получать в соответствии со стандартными процедурами для получения соединения с одним или более изотопами, указанными выше.
Кроме того, соединение (I) и его фармацевтически приемлемые соли могут существовать в форме сольвата с водой (гидрата) или различными другими растворителями, и эти сольваты также включены в настоящее изобретение.
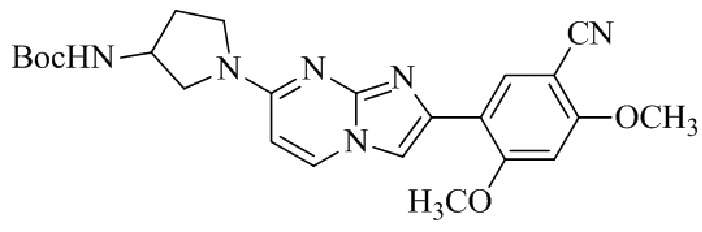
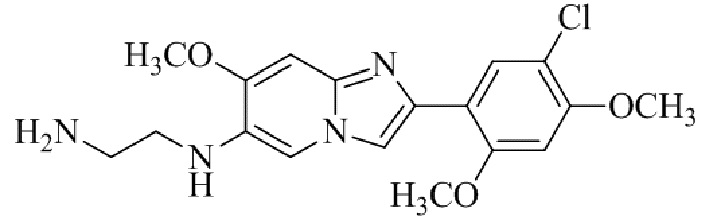
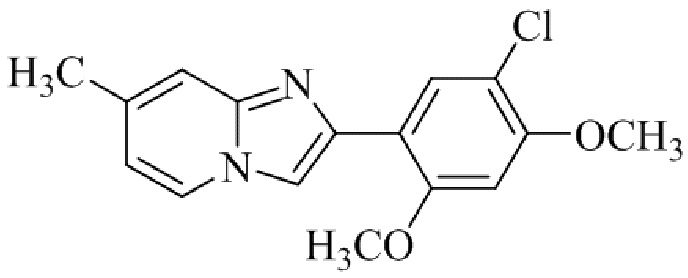
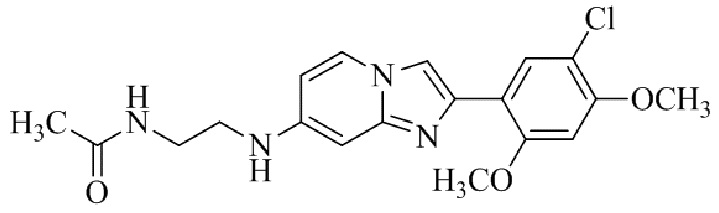
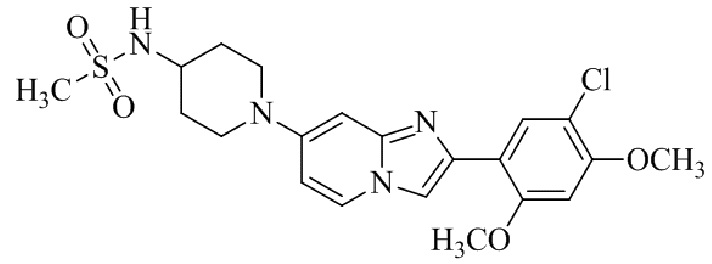
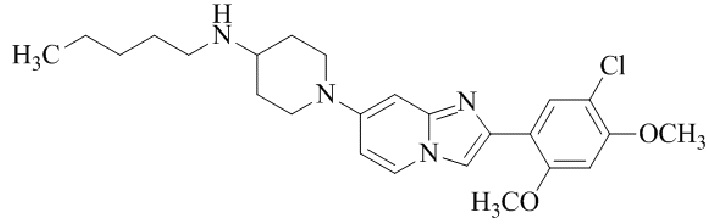
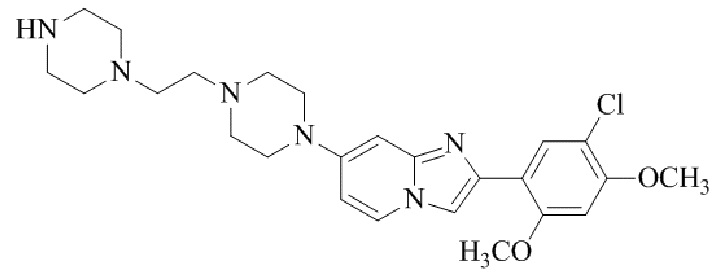
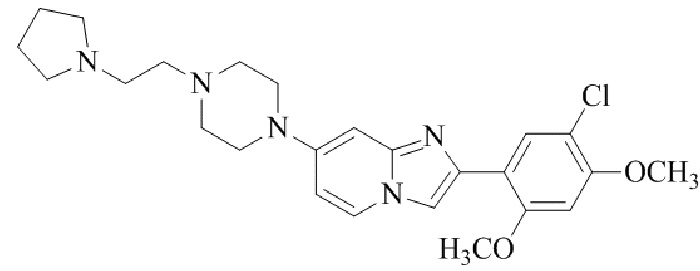
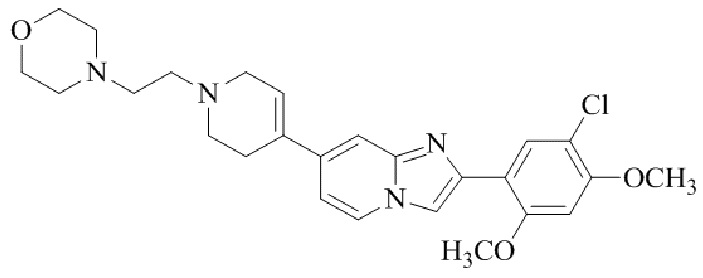
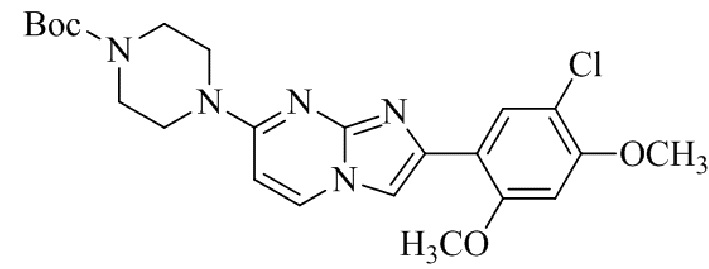
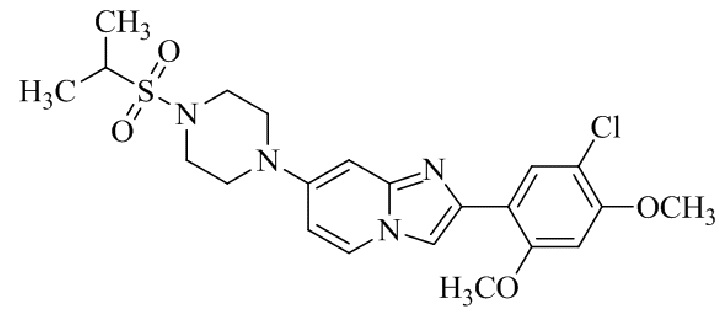
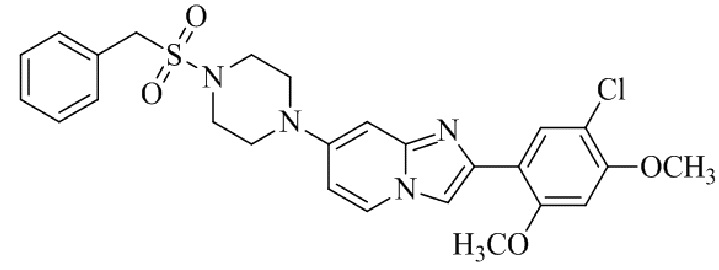
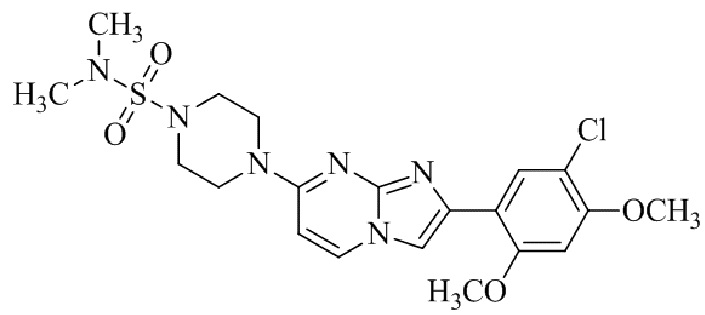
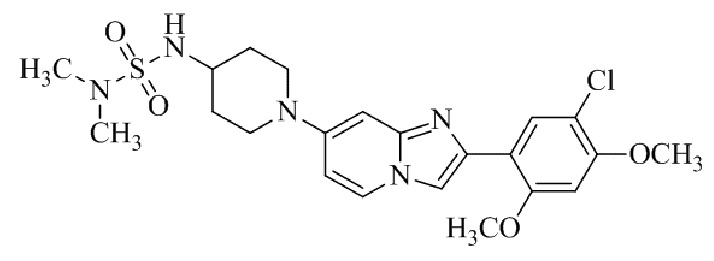
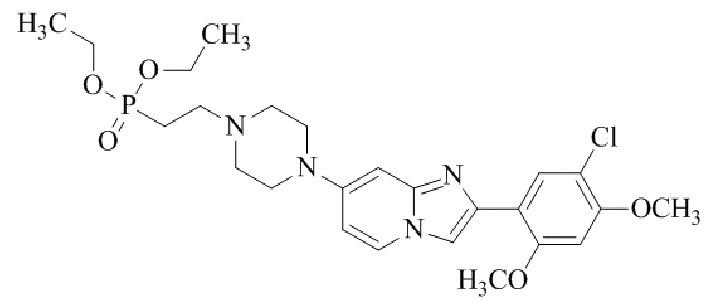
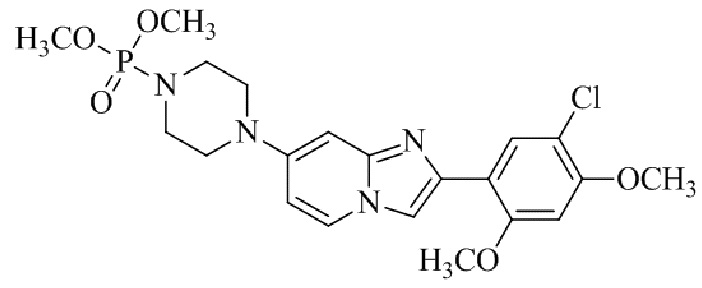
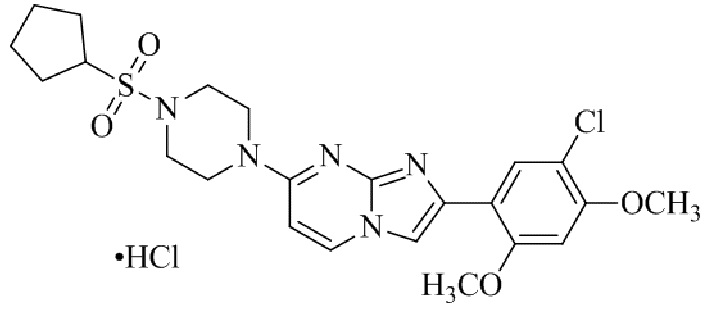
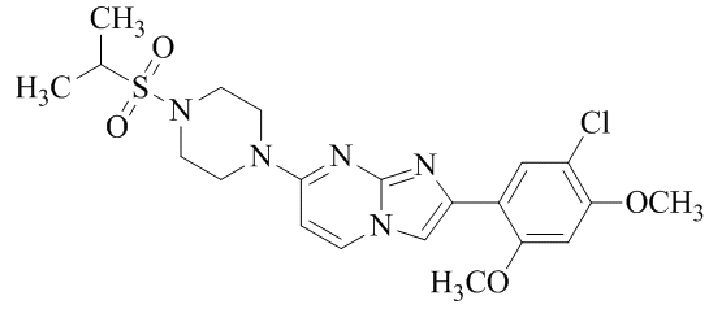
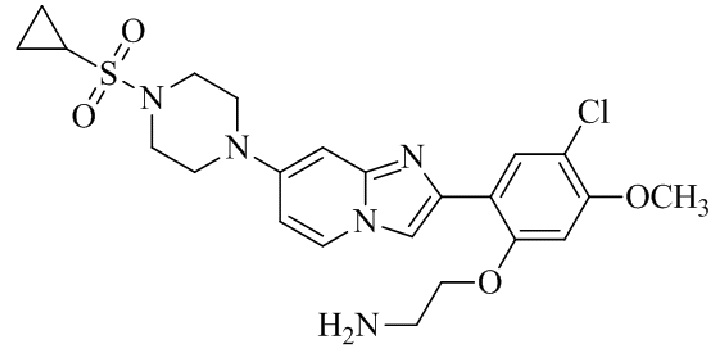
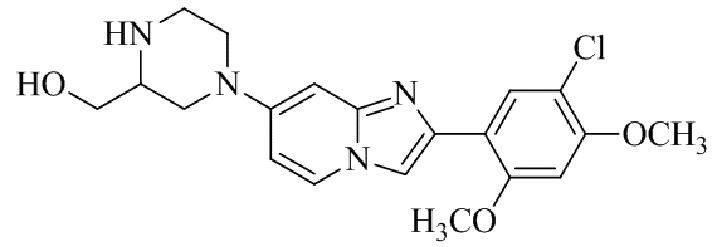
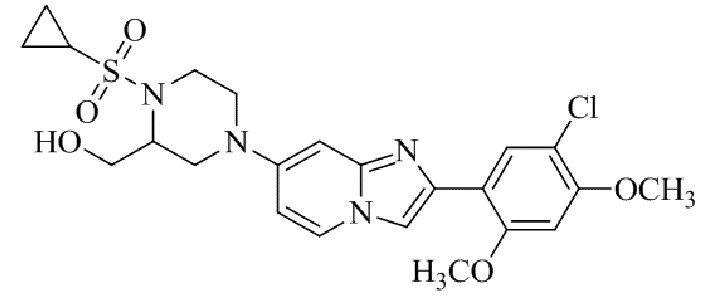
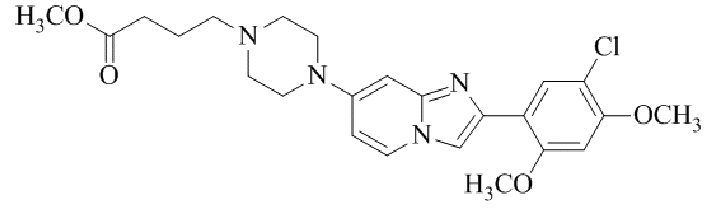
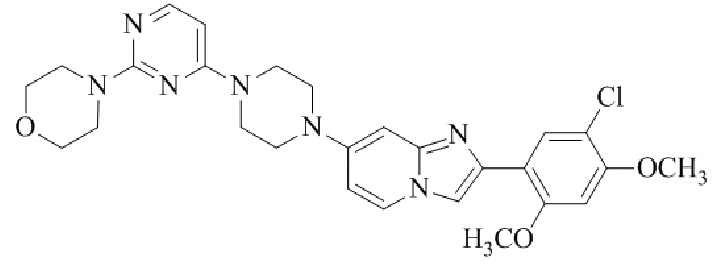
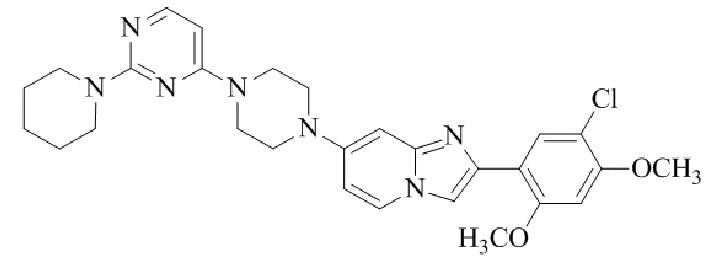
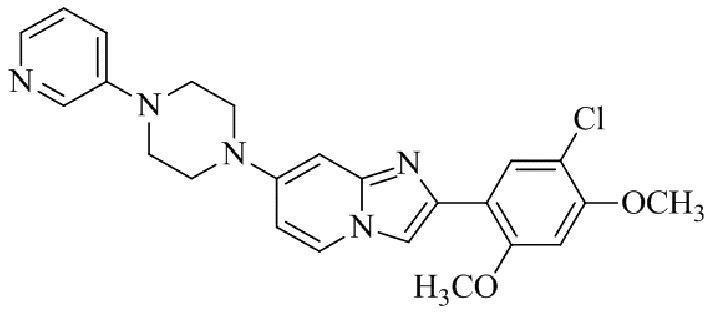
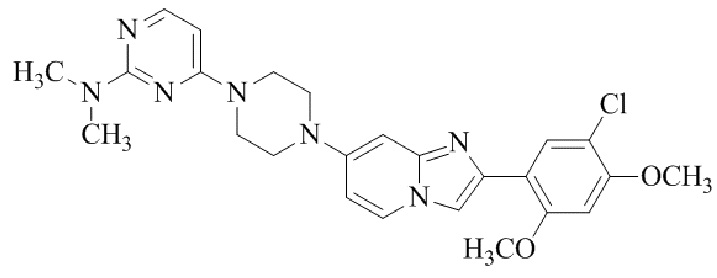
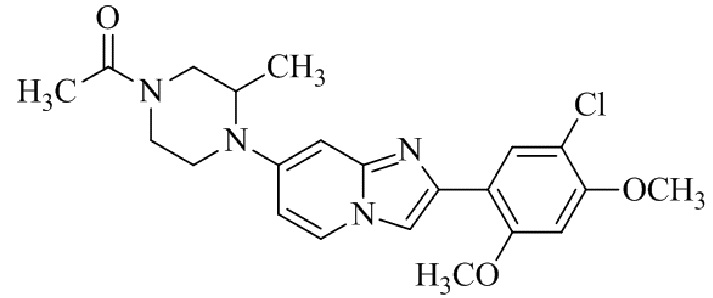
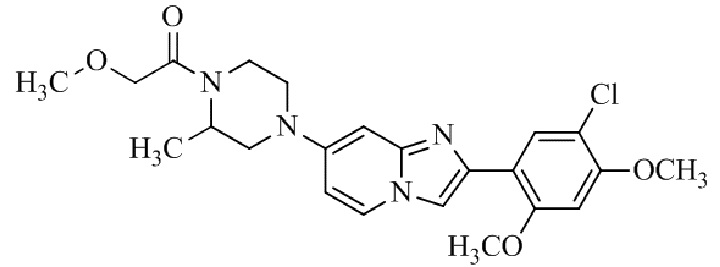
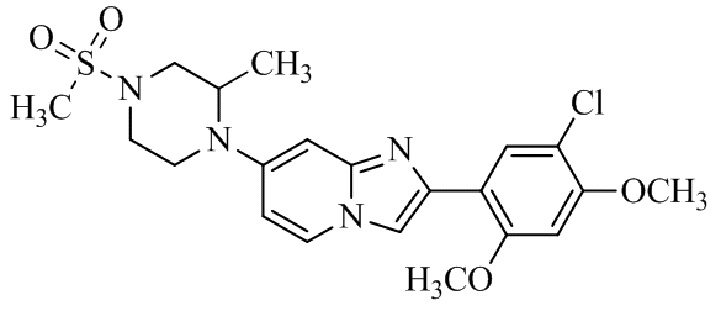
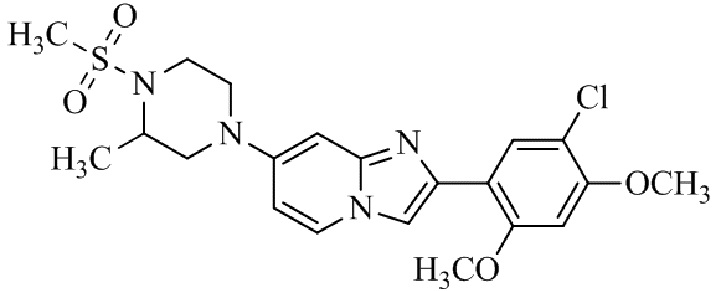
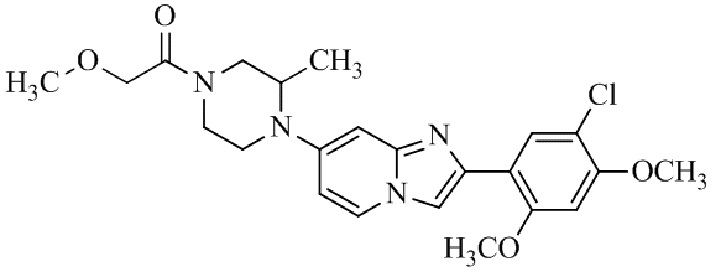
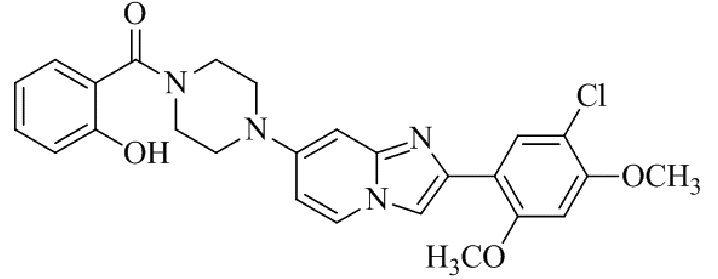
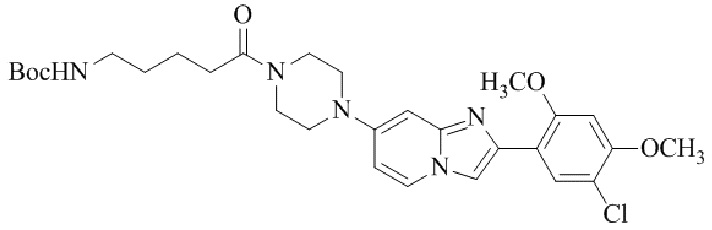
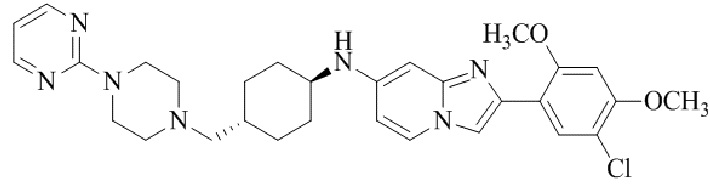
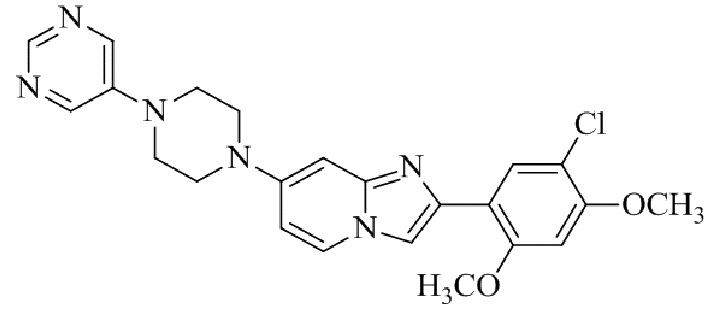
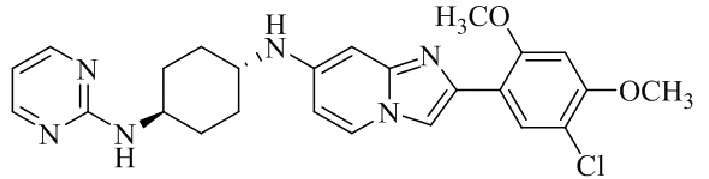
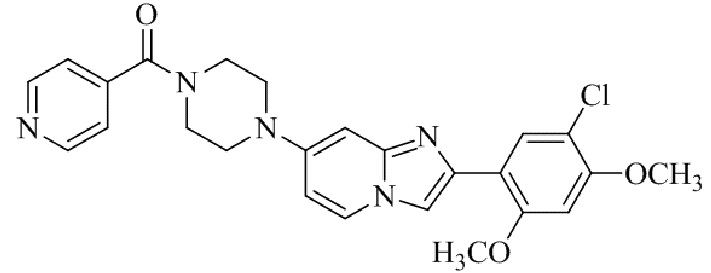
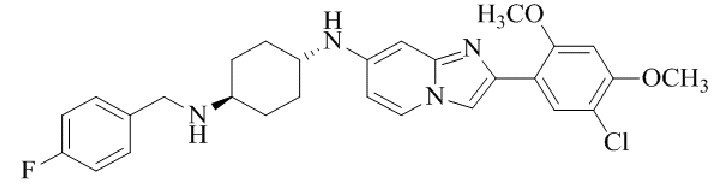
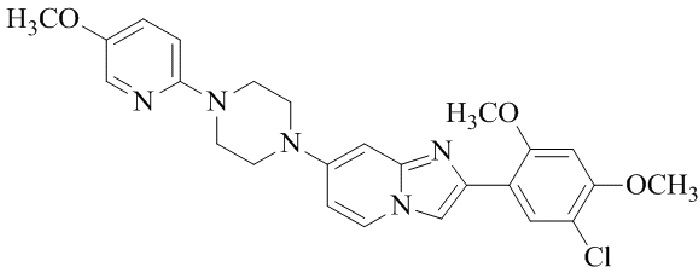
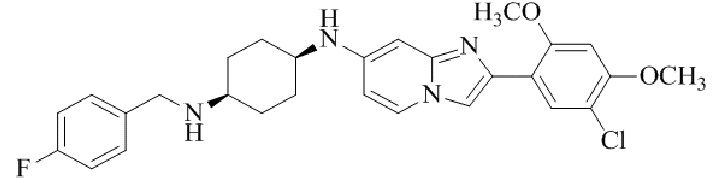
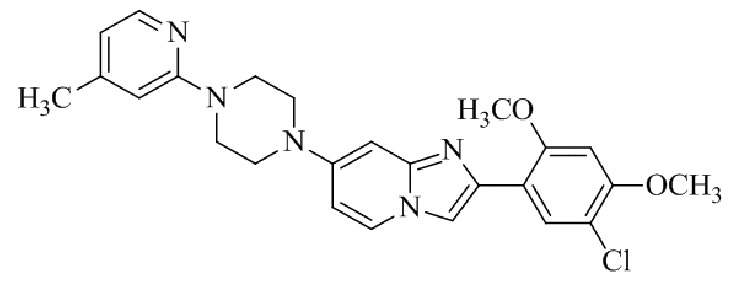
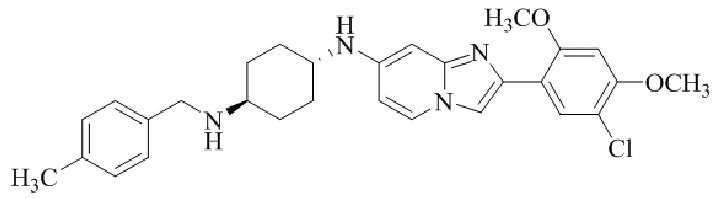
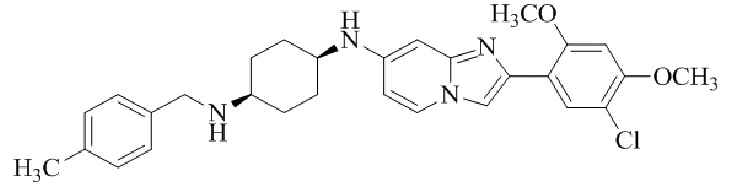
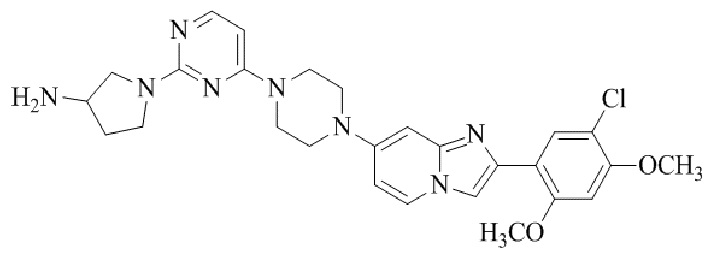
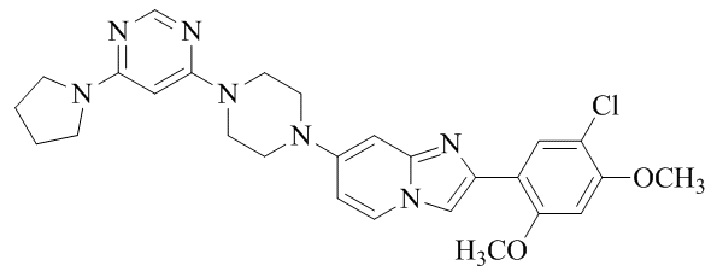
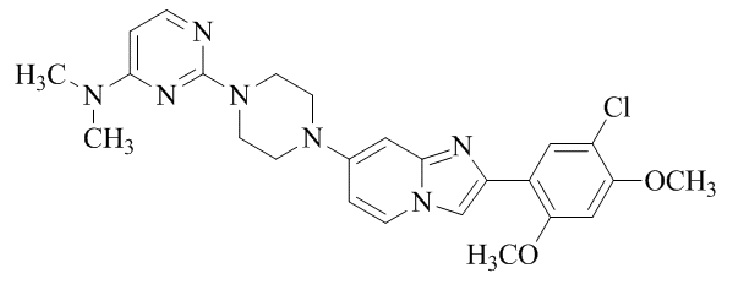
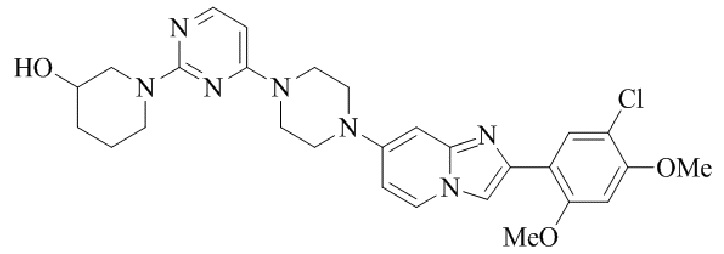
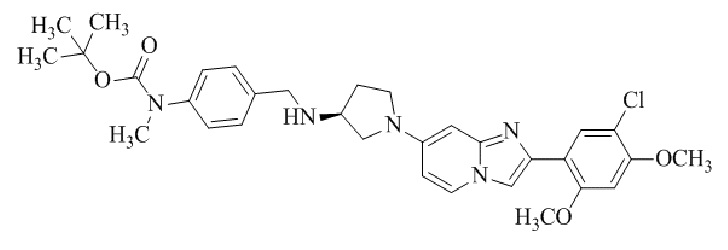
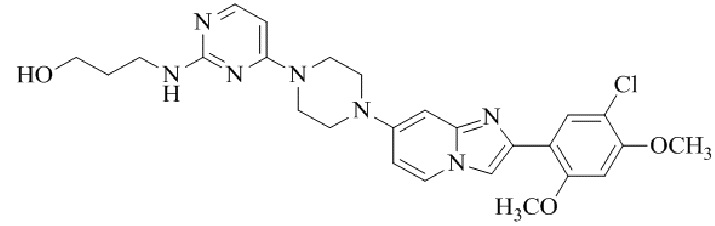
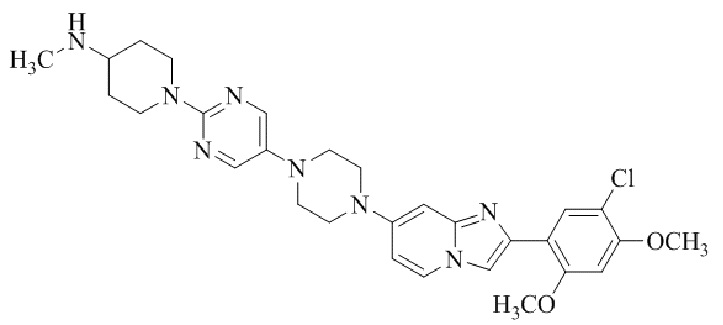
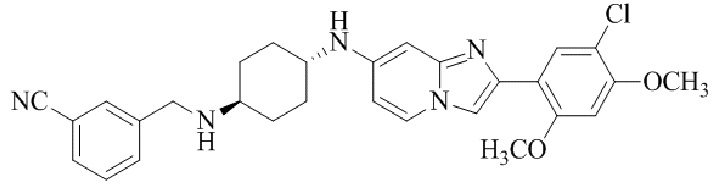
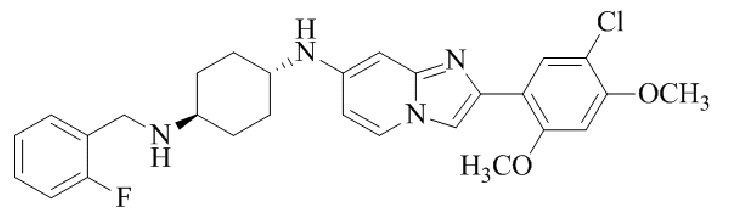
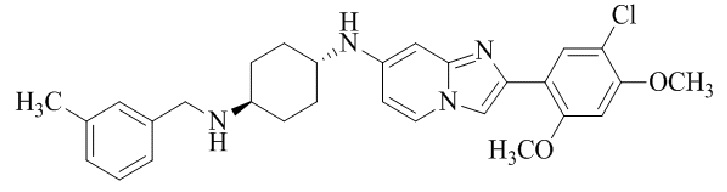
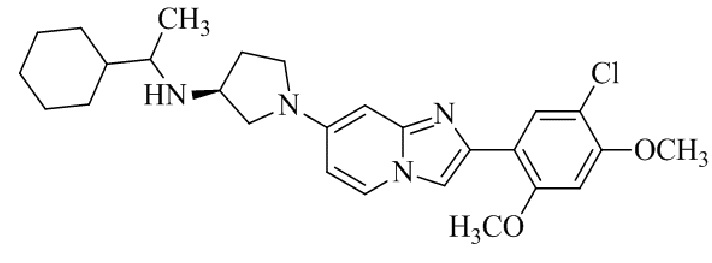
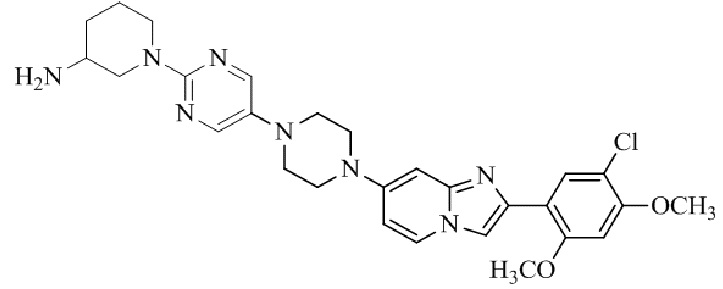
Конкретные примеры соединения (I) по настоящему изобретению представлены в таблицах 1 и 2 (примеры с 1 до 460). Однако соединения по настоящему изобретению не ограничены этим.
Таблица 1
Таблица соединений:
|
Таблица 2
Таблица соединений:
|
Соединение (I) и его фармацевтически приемлемые соли можно вводить по отдельности как они есть; однако, как правило, желательно предоставлять их в виде фармацевтических составов различных типов. Такие фармацевтические составы используют для животных или человека.
Фармацевтические составы по настоящему изобретению могут содержать в качестве активного ингредиента отдельно соединение (I) или его фармацевтически приемлемую соль или смесь с какими-либо другими активными ингредиентами для лечения. Кроме того, эти фармацевтические составы получают любыми способами, хорошо известными в области получения составов лекарственных средств посредством смешивания активного ингредиента с фармацевтически приемлемыми носителями одного или нескольких типов (например, разбавителями, растворителями и эксципиентами).
Желательно, для лечения используют наиболее эффективный путь введения, и примеры включают оральный путь или парентеральный путь, такой как внутривенный путь.
Форма введения представляет собой, например, таблетки и инъекции.
Таблетки подходят для перорального введения, и их можно получать с использованием эксципиентов, таких как лактоза, разрыхлителей, таких как крахмал, смазывающих средств, таких как стеарат магния, и связывающих средств, таких как гидроксипропилцеллюлоза.
Инъекции подходят для парентерального введения, и их можно получать с использованием, например, растворителей или разбавителей, таких как растворы солей, растворы глюкозы или смесь соленой воды и раствора глюкозы.
Доза соединения (I) или его фармацевтически приемлемой соли, а также число доз различаются в зависимости от формы введения, возраста и массы тела пациента, природы симптома, подлежащего лечению, или тяжести и т. п., но, как правило, для перорального введения она составляет от 0,01 мг до 1000 мг, предпочтительно в диапазоне от 0,05 мг до 100 мг для взрослого, и ее вводят от одного до нескольких раз в сутки. В случае парентерального введения, такого как внутривенное введение, от 0,001 мг до 1000 мг или предпочтительно от 0,01 мг до 100 мг вводят взрослому от одного до нескольких раз в сутки. Однако эти дозы и число доз варьируют в зависимости от различных условий, которые указаны выше.
Промежуточные соединения и соединения, представляющие интерес, в следующих примерах можно выделять и очищать, подвергая их способам разделения и очистки, широко используемым в синтетической органической химии, если не указано иное, и примеры включают фильтрование, экстрагированию, промывание, сушку, концентрирование, перекристаллизацию и хроматографию различных типов. Альтернативно, промежуточные соединения можно подвергать последующей реакции без очистки.
Ниже в настоящем описании, настоящее изобретение, в частности, описано со ссылкой на примеры, но объем настоящего изобретения не следует толковать как ограниченный ими.
Кроме того, в примерах, представленных далее, если не указано иное, если определенная группа становится измененной в условиях способа получения или является неподходящей для осуществления способа, соединение, представляющее интерес, можно получать с использованием способов введения и удаления защитных групп, широко используемых в синтетической органической химии (например, «Protective Groups in Organic Synthesis», T. W. Greene, John Wiley & Sons Inc., 1999). Кроме того, порядок реакционных процессов, таких как введение заместителя, можно менять по мере необходимости.
ПРИМЕРЫ
Сокращения
|
Эксперименты
Если не указано иное, реактивы и растворители использовали как получали от коммерческих поставщиков. Спектры протонного ядерно-магнитного резонанса получали на спектрометре Bruker AVANCE 300 на 300 МГц и спектрометре Bruker AVANCE 400 на 400 МГц. Тетраметилсилан использовали в качестве внутреннего стандарта для протонных спектров. Тонкослойную хроматографию осуществляли с использованием пластин Merck TLC silica-gel 60F254. Визуализацию TLC пластин осуществляли с использованием УФ света (254 нм). Масс-спектры получали на спектрометре Shimadzu LCMS-2010EV с использованием ионизации электрораспылением и химической ионизации при атмосферном давлении. ВЭЖХ анализы осуществляли с использованием способов с 1 до 9.
ВЭЖХ способ 1
Колонка: SunFire C18 (4,6×150 мм, 5,0 мкм)
Температура колонки: окружающая
Обнаружение: УФ на 254 нм
Разбавитель образца: ацетонитрил
Подвижная фаза A: вода (с 0,05% TFA)
Подвижная фаза B: ацетонитрил (с 0,05% TFA)
Таблица A. Градиент в способе 1
|
ВЭЖХ способ 2
Колонка: XTerra MS (4,6×150 мм, 5,0 мкм)
Температура колонки: окружающая
Обнаружение: УФ на 254 нм
Разбавитель образца: ацетонитрил
Подвижная фаза A: вода (с 0,05% TFA)
Подвижная фаза B: ацетонитрил (с 0,05% TFA)
Таблица B. Градиент в способе 2
|
ВЭЖХ способ 3
Колонка: Luna C18(2) (4,6×250 мм, 5,0 мкм)
Температура колонки: окружающая
Обнаружение: УФ на 254 нм
Разбавитель образца: ацетонитрил
Подвижная фаза A: вода (с 0,05% TFA)
Подвижная фаза B: ацетонитрил (с 0,05% TFA)
Таблица C. Градиент в способе 3
|
ВЭЖХ способ 4
Колонка: Alltima C18 (4,6×250 мм, 5,0 мкм)
Температура колонки: окружающая
Обнаружение: УФ на 254 нм
Разбавитель образца: ацетонитрил
Подвижная фаза A: вода (с 0,05% TFA)
Подвижная фаза B: ацетонитрил (с 0,05% TFA)
Таблица D. Градиент в способе 4
|
ВЭЖХ способ 5
Колонка: XTerra RP (4,6×150 мм, 5,0 мкм)
Температура колонки: окружающая
Обнаружение: УФ на 254 нм
Разбавитель образца: ацетонитрил
Подвижная фаза A: вода (с 0,05% TFA)
Подвижная фаза B: ацетонитрил (с 0,05% TFA)
Таблица E. Градиент в способе 5
|
ВЭЖХ способ 6
Колонка: Eclipse XDB C18 (4,6×150 мм, 5,0 мкм)
Температура колонки: окружающая
Обнаружение: УФ на 220 нм
Разбавитель образца: ацетонитрил:H2O (50:50)
Подвижная фаза A: вода (с 0,05% TFA)
Подвижная фаза B: ацетонитрил (с 0,05% TFA)
Таблица F. Градиент в способе 6
|
ВЭЖХ способ 7
Колонка: Eclipse XDB C18 (4,6×150 мм, 5,0 мкм)
Температура колонки: окружающая
Обнаружение: УФ на 230 нм
Разбавитель образца: ацетонитрил:H2O (50:50)
Подвижная фаза A: вода (с 0,05% TFA)
Подвижная фаза B: ацетонитрил (с 0,05% TFA)
Таблица G. Градиент в способе 7
|
ВЭЖХ способ 8
Колонка: Symmetry C18(2) (4,6×250 мм, 5,0 мкм)
Температура колонки: окружающая
Обнаружение: УФ на 254 нм
Разбавитель образца: ацетонитрил
Подвижная фаза A: вода (с 0,05% TFA)
Подвижная фаза B: ацетонитрил (с 0,05% TFA)
Таблица H. Градиент в способе 8
|
ВЭЖХ способ 9
Колонка: Eclipse XDB C18 (4,6×150 мм, 5,0 мкм)
Температура колонки: окружающая
Обнаружение: УФ на 254 нм
Разбавитель образца: ацетонитрил: H2O (50:50)
Подвижная фаза A: вода (с 0,05% TFA)
Подвижная фаза B: ацетонитрил (с 0,05% TFA)
Таблица I. Градиент в способе 9
|
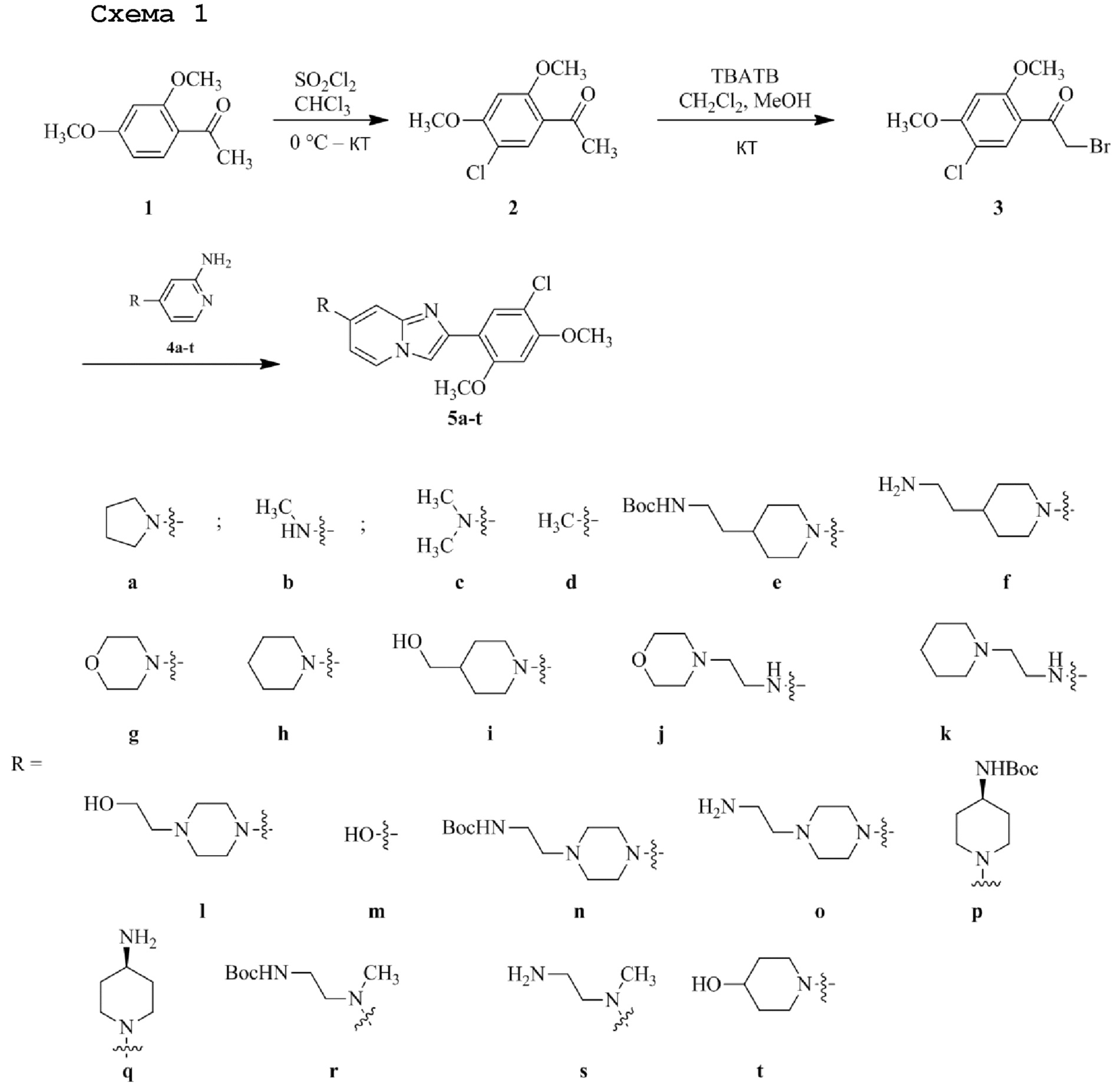
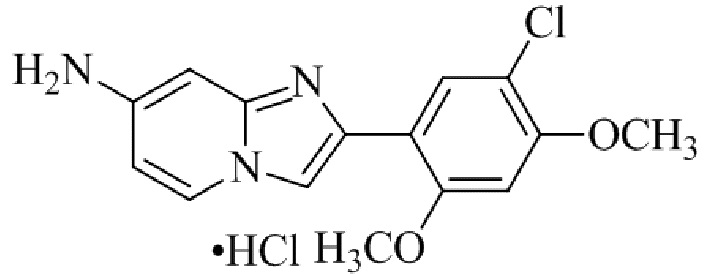
Получение 1-(5-хлор-2,4-диметоксифенил)этанона 2;
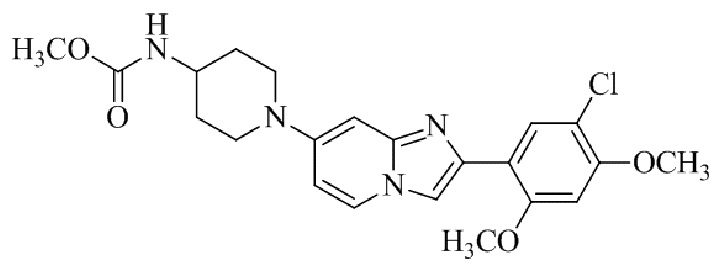
Раствор 1-(2,4-диметоксифенил)этанона 1 (2,00 г, 0,11 ммоль) в хлороформе (30 мл) охлаждали до 0°C и добавляли SO2Cl2 (1,50 г, 0,11 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин и при комнатной температуре в течение 1 ч. Реакционную смесь разводили хлороформом (100 мл) и промывали раствором бикарбоната натрия (2×30 мл). Органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении, и продукт очищали посредством колоночной хроматографии (силикагель, 10% EtOAc/гексаны) для того, чтобы получить 1-(5-хлор-2,4-диметоксифенил)этанон 2 (1,33 г, 56%) в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 7,65 (с, 1H), 6,85 (с, 1H), 3,97 (с, 3H), 3,96 (с, 3H), 2,49 (с, 3H).
Получение 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3;
В раствор 1-(5-хлор-2,4-диметоксифенил)этанона 2 (1,33 г, 6,2 ммоль) в CH2Cl2/MeOH (20 мл/15 мл) добавляли трибромид тетрабутиламмония (TBATB, 3,0 г, 6,2 ммоль). Реакционную смесь разводили метанолом, охлаждали до 0°C и перемешивали при 0°C в течение 30 мин. Осадок собирали посредством фильтрования и промывали холодным метанолом для того, чтобы получить (836 мг, 46%) желаемого 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 7,94 (с, 1H), 6,84 (с, 1H), 4,52 (с, 2H), 3,98 (с, 3H), 3,98 (с, 3H).
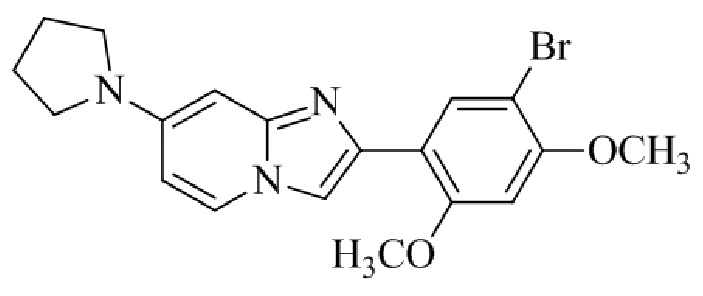
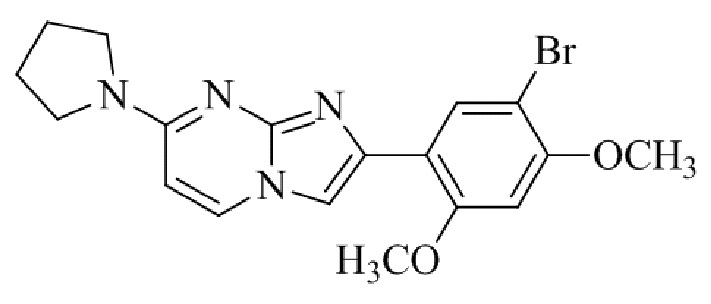
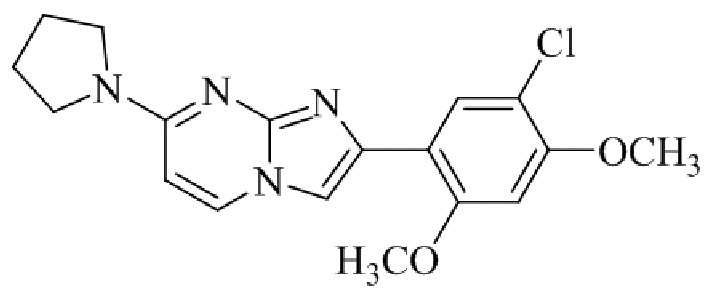
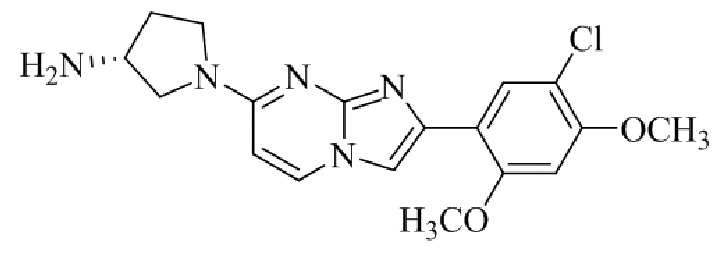
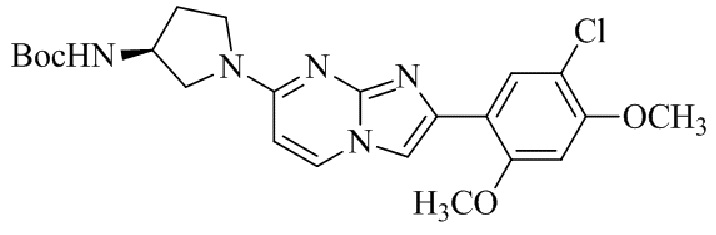
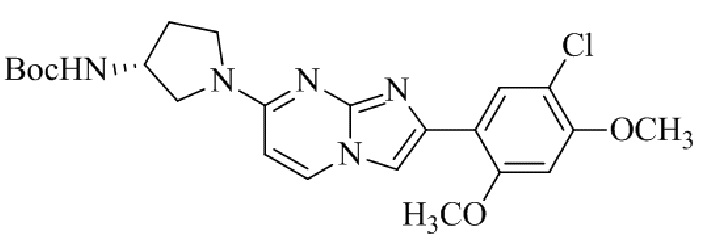
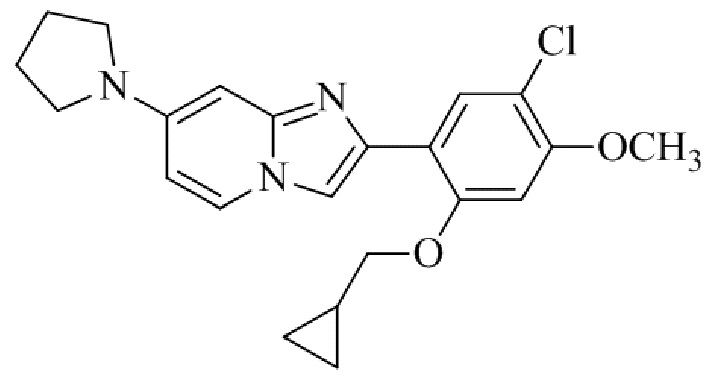
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2- a ]пиридина гидробромида 5a (пример 4);
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (70 мг, 0,24 ммоль) и 4-(пирролидин-1-ил)пиридин-2-амина 4a (39 мг, 0,24 ммоль) в ацетоне (3 мл) нагревали при 75°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета собирали посредством фильтрования, промывали ацетоном и сушили при пониженном давлении для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридина гидробромид 5a (45 мг, 43%) в виде твердого вещества розового цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 13,03 (с, 1H), 8,50 (д, J=7,6 Гц, 1H), 8,20 (с, 1H), 7,89 (с, 1H), 6,97 (с, 1H), 6,95 (дд, J=2,2, 7,6 Гц, 1H), 6,30 (д, J=2,0 Гц, 1H), 4,05 (с, 3H), 3,99 (с, 3H), 3,48-3,38 (м, 4H), 2,08-1,98 (м, 4H); ВЭЖХ (способ 4) 98,7% (AUC), tR=19,02 мин. APCI MS m/z 358 [M+H]+.
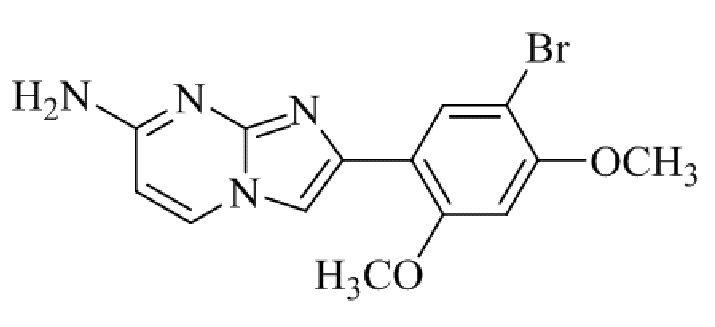
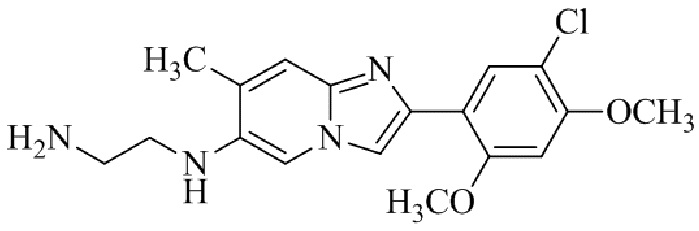
Получение 2-(5-хлор-2,4-диметоксифенил) -N- метилимидазо[1,2- a ]пиридин-7-амина гидробромида 5b (пример 6);
Соединение 2-(5-хлор-2,4-диметоксифенил)-N-метилимидазо[1,2-a]пиридин-7-амина гидробромида 5b получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридина гидробромид 5a, и получали в виде твердого вещества грязно-белого цвета (40 мг, 41%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,40 (ушир. с, 1H), 8,37 (д, J=7,4 Гц, 1H), 8,20 (с, 1H), 7,98 (с, 1H), 7,79-7,68 (м, 1H), 6,96 (с, 1H), 6,80 (дд, J=2,2, 7,4 Гц, 1H), 6,35 (с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 2,83 (д, J=4,8 Гц, 3H); ВЭЖХ (способ 2) >99% (AUC), tR=17,57 мин.; ESI MS m/z 318 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)- N,N- диметилимидазо[1,2- a ]пиридин-7-амина гидробромида 5c (пример 22);
Соединение 2-(5-хлор-2,4-диметоксифенил)-N,N-диметилимидазо[1,2-a]пиридин-7-амина гидробромида 5c получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридина гидробромид 5a, и получали в виде твердого вещества белого цвета (выход 64%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,07 (ушир. с, 1H), 8,50 (д, J=7,8 Гц, 1H), 8,22 (с, 1H), 7,90 (с, 1H), 7,09 (ушир. с, 1H), 6,97 (с, 1H), 6,43 (с, 1H), 4,05 (с, 3H), 3,98 (с, 3H), 3,14 (с, 6H); ВЭЖХ (способ 4) >99% (AUC), tR=18,29 мин.; ESI MS m/z 332 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-метилимидазо[1,2- a ]пиридина гидробромида 5d (пример 76);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-метилимидазо[1,2-a]пиридина гидробромида 5d получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридина гидробромид 5a, и получали в виде твердого вещества белого цвета (выход 10%).
1H ЯМР (400 МГц, DMSO-d6): δ 14,19 (с, 1H), 8,76 (д, 1H, J=6,9 Гц), 8,61 (с, 1H), 8,02 (с, 1H), 7,69 (с, 1H), 7,35 (дд, J=1,3, 6,8 Гц, 1H), 7,00 (с, 1H), 4,08 (с, 3H), 4,00 (с, 3H), 2,55 (с, 3H); ESI MS m/z 303 [M+H]+.
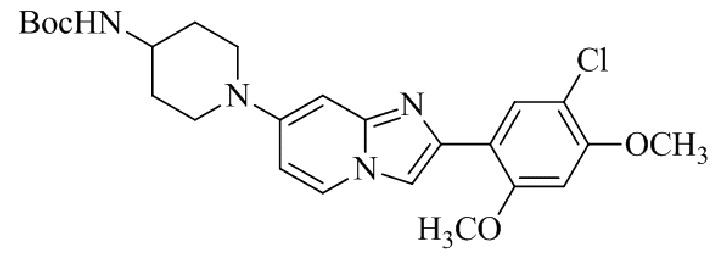
Получение трет -бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)этил)карбамата 5e;
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (221 мг, 0,754 ммоль), бикарбоната натрия (90,4 мг, 1,07 ммоль), трет-бутил(2-(1-(2-аминопиридин-4-ил)пиперидин-4-ил)этил)карбамата 4e (230 мг, 0,718 ммоль) в DMF (5 мл) нагревали при 90°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета собирали посредством фильтрования, промывали водой и сушили при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 95:5 CHCl3/метанол) для того, чтобы получить трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e (100 мг, 33%) в виде твердого вещества зеленого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,86 (д, J=7,5 Гц, 1H), 7,84 (с, 1H), 6,82 (с, 1H), 6,58-6,53 (м, 2H), 4,48 (ушир. с, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,71 (д, J=12,6 Гц, 2H), 3,23-3,15 (м, 2H), 2,81-2,72 (м, 2H), 1,86-1,79 (м, 2H), 1,50-1,46 (м, 2H), 1,45 (с, 9H), 1,42-1,30 (м, 3H).
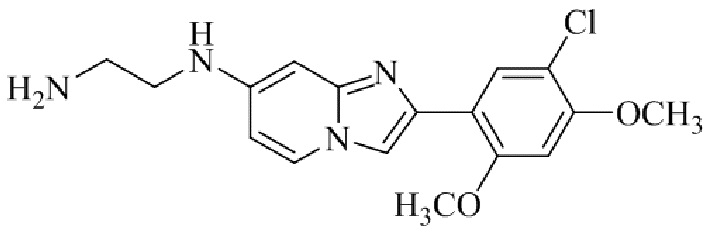
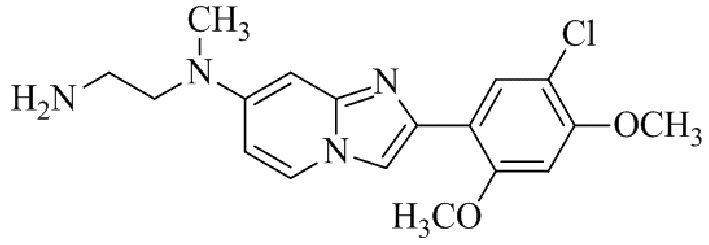
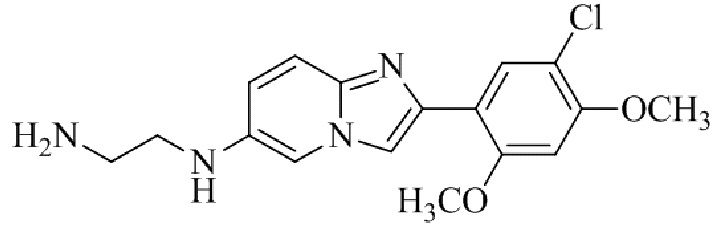
Получение 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)этанамина гидрохлорида 5f (пример 72);
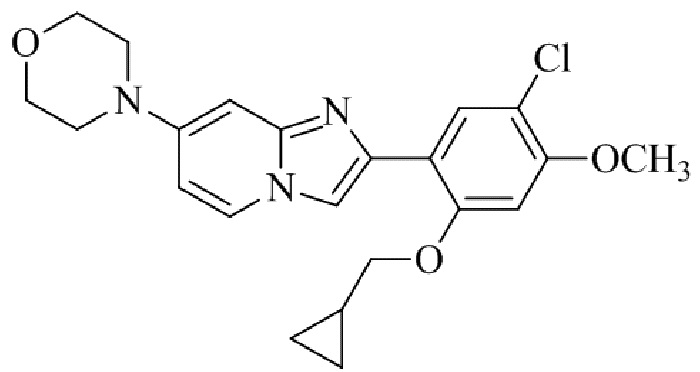
Раствор трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамата 5e (70 мг) в 4M HCl в диоксане (3 мл) перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли; остаток желтого цвета собирали посредством фильтрования; твердое вещество промывали простым эфиром и сушили при пониженном давлении для того, чтобы получить 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этанамина гидрохлорид 5f (50 мг, 61%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,81 (с, 1H), 8,51 (д, J=7,7 Гц, 1H), 8,24 (с, 1H), 8,07 (с, 1H), 7,97 (ушир. с, 3H), 7,29 (дд, J=2,3, 7,8 Гц, 1H), 6,97 (с, 1H), 6,70 (с, 1H), 4,09-3,96 (м, 8 H), 3,08-2,98 (м, 2H), 2,88-2,79 (м, 2H), 1,85-1,76 (м, 2H), 1,75-1,65 (м, 1H), 1,58-1,49 (м, 2H), 1,26-1,14 (м, 2H); ВЭЖХ (способ 2) 94,9% (AUC), tR=16,01 мин.; APCI MS m/z 415 [M+H]+.
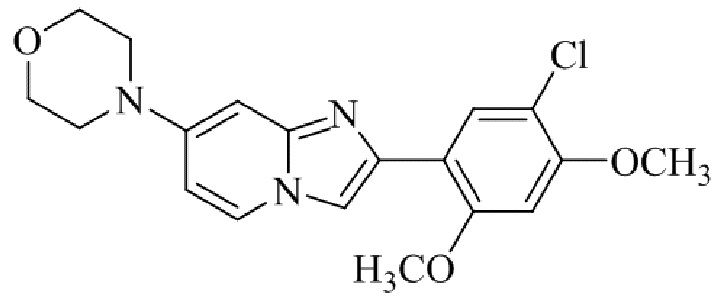
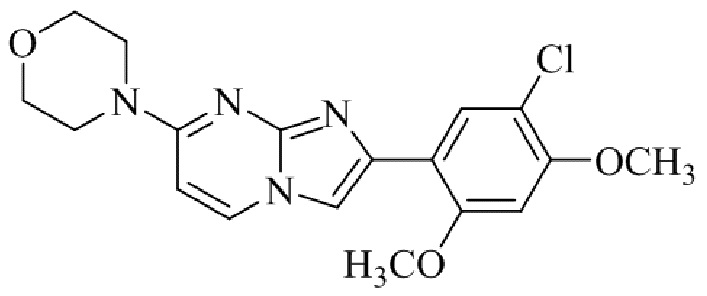
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)морфолина гидробромида 5g (пример 12);
Соединение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)морфолина гидрабромид 5g получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a, и получали в виде твердого вещества белого цвета (58 мг, 44%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,58(д, J=7,6 Гц, 1H), 8,29 (с, 1H), 7,93 (с, 1H), 7,33 (д, J=7,6 Гц, 1H), 6,98 (с, 1H), 6,72 (с, 1H), 4,05 (с, 3H), 3,99 (с, 3H), 3,79-3,76(м, 4H), 3,49-3,47 (м, 4H); ВЭЖХ (способ 4) 99,6% (AUC), tR=17,83 мин.; APCI MS m/z 374 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(пиперидин-1-ил)имидазо[1,2- a ]пиридина гидробромида 5h (пример 25);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(пиперидин-1-ил)имидазо[1,2-a]пиридина гидробромид 5h получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a, и получали в виде твердого вещества белого цвета (35 мг, 41%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,1 (ушир. с, 1H), 8,49 (д, J=7,76 Гц, 1H), 8,23 (с, 1H), 7,91 (с, 1H), 7,29 (д, J=7,7 Гц, 1H), 6,97 (с, 1H), 6,66 (с, 1H), 4,05 (с, 3H), 3,98 (с, 3H), 3,56-3,50 (м, 4H), 1,72-1,56 (м, 6H); ВЭЖХ (способ 5) 98,9% (AUC), tR=17,75 мин; APCI MS m/z 372 [M+H]+.
Получение (1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)метанола 5i (пример 41);
Соединение (1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)метанол 5i получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a. Полученную соль ощелачивали водным аммиаком, промывали водой, фильтровали и сушили. Продукт получали в виде твердого вещества белого цвета (58 мг, 8%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,87 (д, J=7,50 Гц, 1H), 7,84 (с, 1H), 6,81 (с, 1H), 6,57 (с, 1H), 6,56 (с, 1H) 3,99 (с, 3H), 3,95 (с, 3H), 3,80-3,72 (м, 2H), 3,55 (д, J=6,4 Гц, 2H), 2,84-2,75 (м, 2H), 1,91-1,83 (м, 2H), 1,78-1,67 (м, 2H), 1,47-1,34 (м, 2H). ВЭЖХ (способ 5) >99% (AUC), tR=15,65 мин; ESI MS m/z 402 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил) -N- (2-морфолиноэтил)имидазо[1,2- a ]-пиридин-7-амина 5j (пример 70);
Соединение 2-(5-хлор-2,4-диметоксифенил)-N-(2-морфолиноэтил)имидазо[1,2-a]пиридин-7-амин 5j получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества белого цвета (9 мг, 7%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,81 (д, J=7,5 Гц, 1H), 7,84 (с, 1H), 6,57 (с, 1H), 6,49 (с, 1H), 6,4 (с, 1H) 4,55 (с, 1H), 3,95 (с, 3H), 3,95 (с, 3H), 3,74-3,72 (м, 4H), 3,22-3,19 (м, 2H), 2,62 (д, J=6,4 Гц, 2H), 2,50-2,48 (м, 2H. ВЭЖХ (способ 2) 97,9% (AUC), tR=15,23 мин; APCI MS m/z 417 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил) -N- (2-(пиперидин-1-ил)этил)имидазо[1,2- a ]пиридин-7-амина 5k (пример 64);
Соединение 2-(5-хлор-2,4-диметоксифенил)-N-(2-(пиперидин-1-ил)этил)имидазо[1,2-a]пиридин-7-амин 5k получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a. Полученную соль ощелачивали водным аммиаком, промывали водой, фильтровали и сушили. Продукт получали в виде твердого вещества белого цвета (60 мг, 42%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,80 (с, 1H), 7,70 (д, J=7,0 Гц, 1H), 6,57 (с, 1H), 6,47 (д, J=2,0 Гц, 1H), 6,22 (дд, J=2,2, 7,2 Гц, 1H), 4,66-4,60 (м, 1H), 3,98 (с, 3H), 3,94 (с, 3H), 3,16 (дд, J=5,2, 11,6 Гц, 2H), 2,61 (т, J=6,1 Гц, 2H), 2,40 (ушир. с, 4H), 1,58-1,54 (м, 2H), 1,49-1,42 (м, 2H); ВЭЖХ (способ 3) 94,7% (AUC), tR=15,62 мин.; ESI MS 417 [(M+2)+H]+
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)этанола гидрохлорида 5l (пример 43);
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (138 мг, 0,45 ммоль) и 4-(пирролидин-1-ил)пиридин-2-амина 4l (100 мг, 0,45 ммоль) в ацетоне (5 мл) нагревали при 75°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета собирали посредством фильтрования, обрабатывали с использованием HCl в диоксане и сушили при пониженном давлении для того, чтобы получить 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этанола гидрохлорид 5l (55 мг, 48%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,99 (ушир. с, 1H), 10,80 (с, 1H), 8,64 (д, J=7,71 Гц, 1H), 8,33 (с, 1H), 8,08 (с, 1H), 7,35 (дд, J=7,76 Гц, 1H), 6,98 (с, 1H), 6,89 (с, 1H), 5,38 (ушир. с, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,88-3,79 (м, 2H), 3,74-3,43 (м, 4H), 3,29-3,15 (м, 4H); ВЭЖХ (способ 2) 98,3% (AUC), tR=14,95 мин; ESI MS m/z 417 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ола 5m (пример 20);
Соединение 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ол 5m получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-N-(2-(пиперидин-1-ил)этил)имидазо[1,2-a]пиридин-7-амин 5k; и получали в виде твердого вещества желтого цвета (выход 11%).
1H ЯМР (400 МГц, CD3OD): δ 8,11 (д, J=7,5 Гц, 1H), 7,92 (с, 1H), 7,86 (с, 1H), 6,82 (с, 1H), 6,56-6,48 (м, 2H), 4,03 (с, 3H), 3,96 (с, 3H); ВЭЖХ (способ 4) 96,77% (AUC), tR=17,12 мин.; ESI MS m/z 305 [M+H]+.
Получение трет -бутил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)этил)карбамата 5n (пример 28);
Соединение трет-бутил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этил)карбамат 5n получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a, и получали в виде твердого вещества белого цвета (80 мг, 49%).
Раствор 5n (100 мг) в MeOH добавляли HCl в MeOH (1,2 Н, 2,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Образованный осадок собирали посредством фильтрования и полученное твердое вещество промывали холодным MeOH, сушили в вакуумной печи при 50°C в течение 24 часов для того, чтобы получить трет-бутил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этил)карбамата дигидрохлорид (пример 28) в виде аморфного твердого вещества белого цвета (80 мг, 71%).
1H ЯМР (400 МГц, DMSO-d6): δ 14,15 (с, 1H), 11,36 (с, 1H), 8,63 (д, J=7,7 Гц, 1H), 8,32 (с, 1H), 8,12 (с, 1H), 7,36 (дд, J=2,3, 7,7 Гц, 1H), 7,16 (ушир. с, 1H), 6,98 (с, 1H), 6,90 (с, 1H), 4,26-4,12 (м, 2H), 4,06 (с, 3H), 3,99 (с, 3H), 3,73-3,60 (м, 2H), 3,59-3,47 (м, 2H), 3,45-3,37 (м, 2H), 3,26 (ушир. с, 4H), 1,40 (с, 9H); ВЭЖХ (способ 5) >99% (AUC), tR=15,30 мин.; APCI MS m/z 516 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)этанамина гидрохлорида 5o (пример 29);
Соединение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этанамина гидрохлорид 5o получали аналогичным образом, как 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этанамина гидрохлорид 5f, и получали в виде твердого вещества белого цвета (22 мг, 50%).
1H ЯМР (400 МГц, CD3OD): δ 8,48 (д, J=7,7 Гц, 1H), 8,18 (с, 1H), 7,29 (дд, J=7,7 Гц, 1H), 6,98 (с, 1H), 6,90 (с, 1H), 4,08 (с, 3H), 4,00 (с, 3H), 3,97-3,75 (м, 2H), 3,56-3,37 (м, 8H); ВЭЖХ (способ 4) >99% (AUC), tR=15,36 мин; ESI MS m/z 416 [M+H]+.
Получение трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)карбамата 5p;
Соединение трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)карбамат 5p получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a, и получали в виде твердого вещества белого цвета (35 мг, 14%).
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-амина гидрохлорида 5q (пример 30);
Соединение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-амина гидрохлорид 5q получали аналогичным образом, как 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этанамина гидрохлорид 5f, и получали в виде твердого вещества белого цвета(10 мг, 52%).
1H ЯМР (400 МГц, CD3OD): δ 8,49 (д, J=7,8 Гц, 1H), 8,14 (с, 1H), 7,79 (с, 1H), 7,19 (с, 1H), 6,93 (с, 1H), 6,90 (с, 1H), 4,08 (с, 3H), 4,06-4,01 (ушир. с, 1H), 4,00 (с, 3H), 3,84-3,75 (м, 1H), 3,53-3,43 (м, 1H), 3,41-3,22 (м, 2H), 2,24-2,13 (м, 1H), 2,05-1,93 (м, 1H), 1,85-1,72 (м, 1H); ВЭЖХ (способ 4) 96,3% (AUC), tR=15,84 мин; ESI MS m/z 387 [M+H]+.
Получение трет -бутил(2-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)(метил)амино)этил) карбамата 5r (пример 48);
Соединение трет-бутил(2-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)(метил)амино)этил)карбамат 5r получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a, и получали в виде твердого вещества белого цвета (35 мг, 14%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,86 (д, J=7,3 Гц, 1H), 7,82 (с, 1H), 6,59- 6,58 (м, 2H), 6,52-6,51 (м, 1H), 4,13 (с, 3H), 3,96 (с, 3H), 3,52-3,50 (м, 2H), 3,34-3,32 (м, 2H), 3,01 (с, 3H), 1,47 (с, 9H); ВЭЖХ (способ 3) 98,8% (AUC), tR=18,28 мин; ESI MS m/z 461 [M+H]+.
Получение N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N1-метилэтан-1,2-диамина гидрохлорида 5s (пример 54);
Соединение N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N1-метилэтан-1,2-диамина гидрохлорид 5s получали аналогичным образом, как 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этанамина гидрохлорид 5f, и получали в виде твердого вещества белого цвета (20 мг, 51%).
1H ЯМР (400 МГц, CD3OD): δ 8,44 (д, J=7,8 Гц, 1H), 8,11 (с, 1H), 7,76 (с, 1H), 7,12 (д, J=7,8 Гц 1H), 6,89 (с, 1H), 6,80 (с, 1H), 4,08 (с, 3H), 4,00 (с, 3H), 4,00 (с, 3H), 3,91-3,87(м, 2H), 3,27-3,24 (м, 5H); ВЭЖХ (способ 3) 97,5% (AUC), tR=14,62 мин; ESI MS m/z 361 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ола 5t (пример 231);
Соединение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ол 5t получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества белого цвета (206 мг, 71%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,27 (д, J=7,4 Гц, 1H), 8,27 (с, 1H), 8,17 (с, 1H), 7,99 (с, 1H), 6,86 (д, J=7,4 Гц, 1H), 6,64 (с, 1H), 4,70 (ушир. с, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,78-3,76 (м, 1H), 3,65-3,64 (м, 2H), 2,94-2,92 (м, 2H), 1,88-1,86 (м, 2H), 1,59-1,57 (м, 2H); ВЭЖХ (способ 1) 96,9% (AUC), tR=10,14 мин; ESI MS m/z 388 [M+H]+.
Схема 2
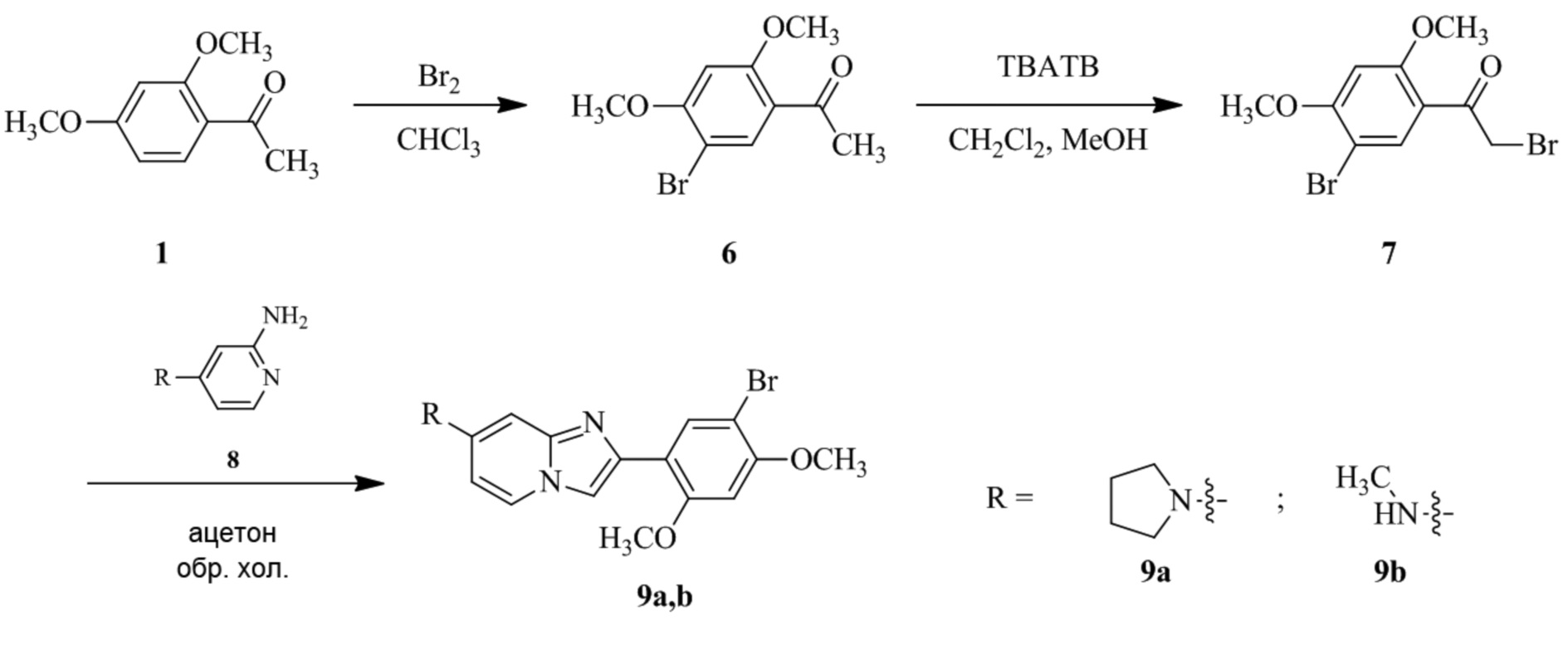
Получение 1-(5-бром-2,4-диметоксифенил)этанона 6;
Раствор 1-(2,4-диметоксифенил)этанона 1 (2,00 г, 11,0 ммоль) и брома (543 мкл, 10,5 ммоль) в хлороформе (30 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разводили водой и экстрагировали с использованием DCM. Органическую фазу сушили и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить желаемое соединение 1-(5-бром-2,4-диметоксифенил)этанон 6 (2,07 г, 72%) в виде твердого вещества грязно-белого цвета.
Получение 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2- a ]пиридина 9a (пример 1);
Раствор 2-бром-1-(5-бром-2,4-диметоксифенил)этанона 7 (124 мг, 0,367 ммоль) и 4-(пирролидин-1-ил)пиридин-2-амина 8 (60 мг, 0,367 ммоль) в ацетоне (4 мл) нагревали при 75°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета собирали посредством фильтрования и твердое вещество промывали ацетоном. Твердое вещество суспендировали в водном растворе аммиака (10 мл) и перемешивали в течение 2 ч. Свободное основание собирали посредством фильтрования и твердое вещество промывали водой, сушили при пониженном давлении для того, чтобы получить 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 9a (51 мг, 35%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,55 (с, 1H), 7,83 (д, J=7,4 Гц, 1H), 7,80 (с, 1H), 6,55 (с, 1H), 6,43 (д, J=2,2 Гц, 1H), 6,33 (дд, J=2,2, 7,4 Гц, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,40-3,30 (м, 4H), 2,10-2,00 (м, 4H); ВЭЖХ (способ 2) >99% (AUC), tR=19,12 мин; APCI MS m/z 404 [M+H]+.
Получение 2-(5-бром-2,4-диметоксифенил) -N- метилимидазо[1,2- a ]пиридин-7-амина гидробромида 9b (пример 11);
Соединение 2-(5-бром-2,4-диметоксифенил)-N-метилимидазо[1,2-a]пиридин-7-амина гидробромид 9b получали аналогичным образом, как 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 9a, и получали в виде твердого вещества грязно-белого цвета (выход 44%).
1H ЯМР (300 МГц, DMSO-d6): δ 13,02 (ушир. с, 1H), 8,36 (д, J=7,4 Гц, 1H), 8,20 (с, 1H), 8,00 (с, 1H), 7,68-7,62 (м, 1H), 6,94 (с, 1H), 6,82 (дд, J=2,1, 7,4 Гц, 1H), 6,30 (ушир. с, 1H), 4,04 (с, 3H), 3,97 (с, 3H), 2,84 (д, J=4,8 Гц, 3H); ВЭЖХ (способ 4) >99% (AUC), tR=17,98 мин; ESI MS m/z 362 [M+H]+.
Получение 1-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2-а]пиридин-7-ил)пирролидин-3-ола 9с (пример 7);
Соединение 1-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ол 9c получали аналогичным образом, как 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 9a, и получали в виде аморфного твердого вещества грязно-белого цвета (выход 89%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,32 (с, 1H), 8,25 (д, J=7,4 Гц, 1H), 7,93 (с, 1H), 6,82 (с, 1H), 6,44 (дд, J=2,0, 7,4 Гц, 1H), 6,19 (с, 1H), 4,99 (д, J=3,7 Гц, 1H), 4,41 (ушир. с, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,51-3,31 (м, 3H), 3,15 (д, J=10,6 Гц, 1H), 2,12-1,99 (м, 1H), 1,96-1,86 (м, 1H); ВЭЖХ (способ 2) >99% (AUC), tR=17,29 мин.; ESI MS m/z 420 [(M+2)+H]+.
Схема 3
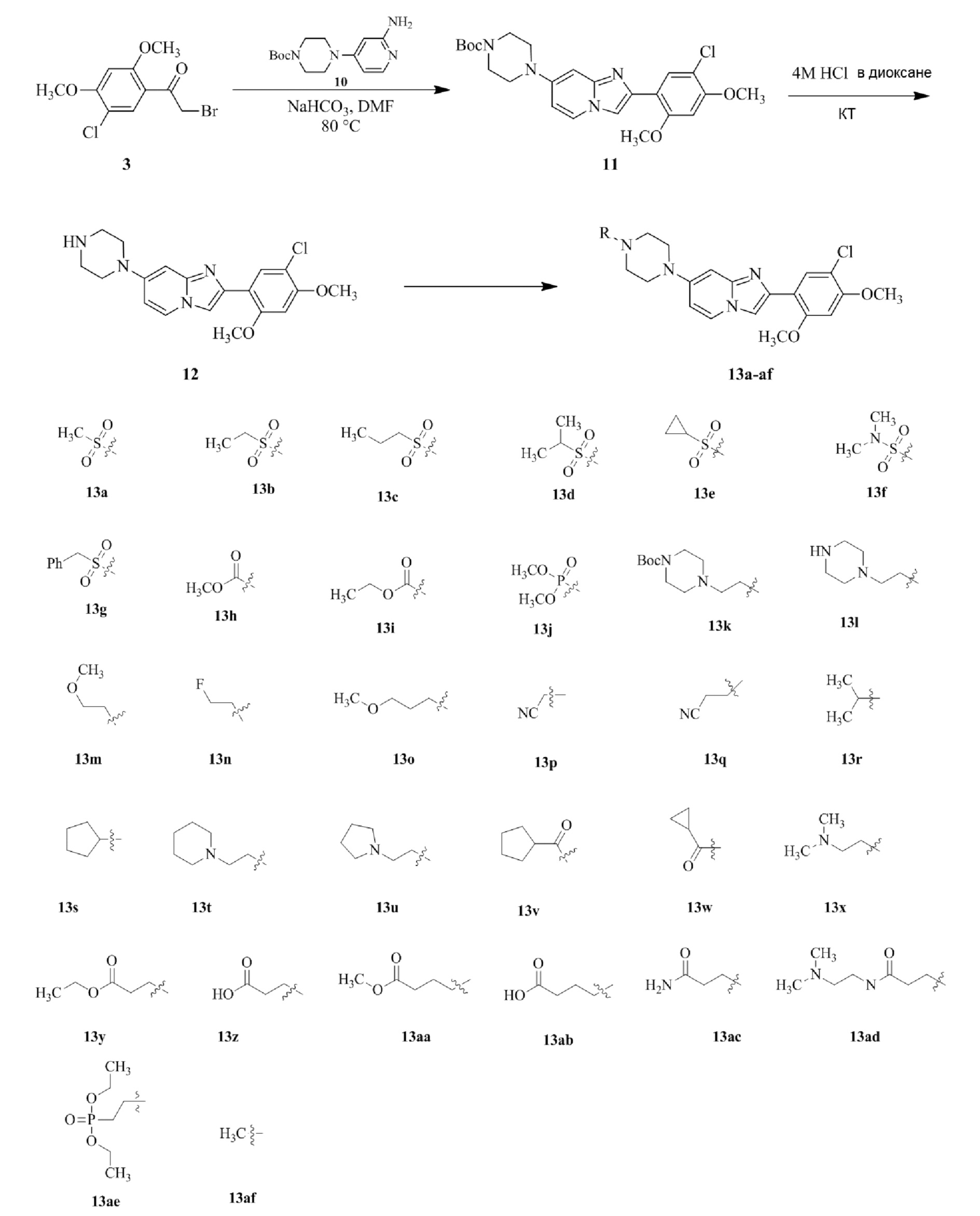
Получение трет -бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперазин-1-карбоксилата 11 (пример 232);
Cмесь 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (2,50 г, 8,49 ммоль), трет-бутил-4-(2-аминопиридин-4-ил)пиперазин-1-карбоксилата 10 (2,26 г, 8,09 ммоль) и NaHCO3 (1,36 г, 16,18 ммоль) в DMF (5 мл) нагревали при 90°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в воду. Полученный осадок собирали посредством фильтрования и промывали водой и сушили при пониженном давлении. Неочищенный материал очищали посредством колоночной хроматографии (силикагель, 4% MeOH/DCM) для того, чтобы получить трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 11 (2,3 г, 60%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,36 (с, 1H), 7,90 (д, J=7,5 Гц, 1H), 7,88 (с, 1H), 6,81 (д, J=1,8 Гц, 1H), 6,58 (с, 1H), 6,54 (дд, J=2,3, 7,5 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,60 (т, J=4,9 Гц, 4H), 3,18 (т, J=5,2 Гц, 4H), 1,49 (с, 9H); ВЭЖХ (способ 1) 96,6% (AUC), tR=11,55 мин.; ESI MS m/z 473 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2- a ]пиридина 12 (пример 17);
Раствор трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилата 11 (50 мг, 0,12 ммоль) в 4,0 M HCl в диоксане (3 мл) перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь фильтровали и твердое вещество промывали диоксаном и сушили при пониженном давлении для того, чтобы получить соль HCl и соединение 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12 (38 мг, 48%) в виде твердого вещества коричневого цвета. Соль нейтрализовали для синтеза 13. Соединение суспендировали в 10 мл водного аммиака, разбавляли водой и экстрагировали с использованием хлороформа (2×20 мл). Органический слой сушили и концентрировали для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12 (38 мг, 48%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 14,00 (ушир. с, 1H), 9,48 (с, 1H), 8,62 (д, J=7,7 Гц, 1H), 8,31 (с, 1H), 8,09 (с, 1H), 7,33 (дд, J=2,4, 7,7 Гц, 1H), 6,98 (с, 1H), 6,87 (д, J=2,2 Гц, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,78-3,72 (м, 4H), 3,26 (ушир. с, 4H); ВЭЖХ (способ 2) 95,3% (AUC), tR=14,95 мин.; ESI MS m/z 373 [M+H]+.
Получение сульфонамид 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]пиридина 13a (пример 169);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (60 мг, 0,16 ммоль) и DIPEA (42 мкл, 0,32 ммоль) в дихлорметане (1 мл) добавляли метансульфонилхлорид (28 мкл, 0,242 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали, суспендировали в водном растворе аммиака и перемешивали в течение 2 ч. Осадок собирали посредством фильтрования. Твердое вещество промывали водой, сушили при пониженном давлении и очищали посредством колоночной хроматографии (силикагель, 9:1 MeOH/DCM) для того, чтобы получить желаемый сульфонамид 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a (43%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,93 (д, J=7,4 Гц, 1H), 7,90 (с, 1H), 6,85 (д, J=2,4 Гц, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,4, 7,4 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,50-3,25 (м, 8H), 2,83 (с, 3H). ВЭЖХ (способ 1) 97,7% (AUC), tR=10,45 мин. ESI MS m/z 451 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(этилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]пиридина 13b (пример 172);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(этилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13b получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 37%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,93 (д, J=7,4 Гц, 1H), 7,90 (с, 1H), 6,84 (д, J=2,2 Гц, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,2, 7,4 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,53-3,43 (м, 4H), 3,35-3,27 (м, 4H), 3,01 (к, J=7,4 Гц, 2H), 1,41 (д, J=7,4 Гц, 3H); ВЭЖХ (способ 1) 98,7% (AUC), tR=10,68 мин.; ESI MS m/z 465 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(пропилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]пиридина 13c (пример 170);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(пропилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13c получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 28%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,93 (д, J=7,4 Гц, 1H), 7,90 (с, 1H), 6,84 (д, J=2,2 Гц, 1H), 6,59 (с, 1H), 6,53 (дд, J=2,2, 7,4 Гц, 1H), 4,00 (с, 3H), 3,96 (с, 3H), 3,49-3,43 (м, 4H), 3,35-3,29 (м, 4H), 2,97-2,89 (м, 2H), 1,95-1,83 (м, 2H), 1,08 (т, J=7,8 Гц, 3H); ВЭЖХ (способ 1) 98,1% (AUC), tR=11,02 мин.; ESI MS m/z 479 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(изопропилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]пиридина 13d (пример 178);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(изопропилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13d получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 39%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,92 (д, J=7,4 Гц, 1H), 7,89 (с, 1H), 6,83 (д, J=2,2 Гц, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,2, 7,4 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,58-3,48 (м, 4H), 3,32-3,26 (м, 4H), 3,25-3,18 (м, 1H), 1,38 (д, J=6,8 Гц, 6H); ВЭЖХ (способ 1) >99% (AUC), tR=10,93 мин; ESI MS m/z 479 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопропилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]пиридина 13e (пример 103);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]-пиридина 12 (75 мг, 0,20 ммоль) в пиридине (1,5 мл) добавляли циклопропансульфонилхлорид (61 мкл, 0,60 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, концентрировали при пониженном давлении и очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить желаемый сульфонамид 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопропилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13e (60 мг, 63%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,42 (д, J=7,6 Гц, 1H), 8,11 (с, 1H), 8,10 (с, 1H), 6,98 (д, J=6,2 Гц, 1H), 6,90 (с, 1H), 6,76-6,73 (м, 1H), 4,02 (с, 3H), 3,95 (с, 3H), 3,46-3,39 (м, 4H), 3,38-3,33 (м, 4H), 2,69-2,63 (м, 1H), 1,05-0,92 (м, 4H); ВЭЖХ (способ 2) 97,6% (AUC), tR=18,47 мин; ESI MS m/z 477 [M+H]+.
Получение 4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]- N,N- диметилпиперазин-1-сульфонамида 13f (пример 171);
Соединение 4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-N,N-диметилпиперазин-1-сульфонамид 13f получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a и получали в виде твердого вещества грязно-белого цвета (выход 30%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,93 (д, J=7,4 Гц, 1H), 7,89 (с, 1H), 6,83 (д, J=2,2 Гц, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,2, 7,4 Гц, 1H), 4,00 (с, 3H), 3,96 (с, 3H), 3,45-3,47 (м, 4H), 3,33-3,25 (м, 4H), 2,88 (с, 6H); ВЭЖХ (способ 1) >99% (AUC), tR=10,90 мин; ESI MS m/z 480 [M+H]+.
Получение соединения 7-[4-(бензилсульфонил)пиперазин-1-ил]-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин 13g (пример 179);
Соединение 7-[4-(бензилсульфонил)пиперазин-1-ил]-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин 13g получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 44%).
1H ЯМР (300 МГц, CDCl3): δ 8,36 (с, 1H), 7,90 (д, J=7,4 Гц, 1H), 7,89 (с, 1H), 7,47- 7,35 (м, 5H), 6,77 (д, J=2,2 Гц, 1H), 6,58 (с, 1H), 6,47 (дд, J=2,2, 7,4 Гц, 1H), 4,28 (с, 2H), 3,99 (с, 3H), 3,96 (с, 3H), 3,31-3,23 (м, 4H), 3,19-3,11 (м, 4H); ВЭЖХ (способ 1) 95,8% (AUC), tR=11,54 мин.; ESI MS m/z 527 [M+H]+.
Получение метил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперазин-1-карбоксилата 13h (пример 99);
Соединение метил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 13h получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (70 мг, 81%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,91 (д, J=7,4 Гц, 1H), 7,88 (с, 1H), 6,83 (ушир. с, 1H), 6,58 (с, 1H), 6,54 (дд, J=2,4, 7,5 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,74 (с, 3H), 3,65 (т, J=4,8 Гц, 4H), 3,23-3,18 (м, 4H); ВЭЖХ (способ 3) 97,5% (AUC), tR=17,22 мин.; ESI MS m/z 431 [M+H]+.
Получение этил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]-пиперазин-1-карбоксилата 13i (пример 107);
Соединение этил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-пиперазин-1-карбоксилат 13i получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желто-зеленого цвета (выход 73%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,91 (д, J=7,5 Гц, 1H), 7,87 (с, 1H), 6,86 (с, 1H), 6,59-6,53 (м, 2H), 4,18 (дд, J=7,0, 14,0 Гц, 2H), 3,99 (с, 3H), 3,95 (с, 3H), 3,65 (т, J=5,0 Гц, 4H), 3,26-3,17 (м, 4H), 1,29 (т, J=7,0 Гц, 3H); ВЭЖХ (способ 2) 97,2% (AUC), tR=18,63 мин.; ESI MS m/z 445 [M+H]+.
Получение диметил{4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперазин-1-ил}фосфоната 13j (пример 203);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (100 мг, 0,30 ммоль), триэтиламина (130 мкл, 0,90 ммоль) и диметилхлорфосфата (42 мкл, 0,33 ммоль) в DCM (2 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разводили в DCM (50 мл), промывали раствором NH4OH (10 мл) и солевым раствором (10 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить диметил{4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-ил}фосфонат 13j (40 мг, 31%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,35 (с, 1H), 7,91 (д, J=7,8 Гц, 1H), 7,86 (с, 1H), 6,86 (с, 1H), 6,58 (с, 1H), 6,55 (дд, J=2,4 Гц, 7,6 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,75 (с, 3H), 3,71 (с, 3H), 3,37-3,28 (м, 4H), 3,24-3,17 (м, 4H). ВЭЖХ (способ 1) 98,0% (AUC), tR=10,35 мин.; ESI MS m/z 481 [M+H]+.
Получение трет -бутил-4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)этил)пиперазин-1-карбоксилата 13k (пример 136);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]-пиридина 12 (200 мг, 0,50 ммоль), трет-бутил-4-(2-бромэтил)пиперазин-1-карбоксилата (160 мг, 0,53 ммоль) и карбоната калия (140 мг, 1,00 ммоль) в ацетонитриле (4 мл) нагревали с обратным холодильником в течение 3 ч. Реакционную смесь фильтровали и фильтрат дистиллировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить трет-бутил-4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)пиперазин-1-ил)этил)пиперазин-1-карбоксилат 13k (130 мг, 42%) в виде твердого вещества бледно-желтого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,88 (д, J=7,6 Гц, 1H), 7,86 (с, 1H), 6,80 (д, J=7,5 Гц, 1H), 6,57 (с, 1H), 6,55 (дд, J=2,3, 7,6 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,44 (т, J=5,1 Гц, 4H), 3,24 (т, J=5,1 Гц, 4H), 2,66 (т, J=5,0 Гц, 4H), 2,61-2,54 (м, 4H), 2,44 (т, J=5,0 Гц, 4H), 1,46 (с, 9H); ВЭЖХ (способ 1) 99,0% (AUC), tR=9,55 мин.; ESI MS m/z 585 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперазин-1-ил)этил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 13l (пример 142);
Раствор трет-бутил-4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)пиперазин-1-ил)этил)пиперазин-1-карбоксилата 13k (120 мг) в 4M HCl в диоксане (5 мл) перемешивали при комнатной температуре в течение 4 ч. Растворитель удаляли и остаток желтого цвета нейтрализовали водным раствором аммиака. Осадок собирали посредством фильтрования и твердое вещество промывали водой и сушили при пониженном давлении для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперазин-1-ил)этил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13l (90 мг, 91%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,14 (д, J=7,58 Гц, 1H), 8,06 (с, 1H), 7,96 (с, 1H), 6,78 (с, 1H), 6,76 (д, J=7,6 Гц, 1H), 6,66 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,30-3,27 (м, 4H), 3,01-2,92 (м, 4H), 2,72-2,65 (м, 4H), 2,64-2,55 (м, 8H); ВЭЖХ (способ 3) 98,0% (AUC), tR=14,88 мин; ESI MS m/z 485 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-метоксиэтил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 13m (пример 105);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]-пиридина 12 (75 мг, 0,20 ммоль), 1-бром-2-метоксиэтана (21 мкл, 0,53 ммоль) и трет-бутоксида натрия (48 мг, 0,50 ммоль) в т-бутаноле (3 мл) нагревали с обратным холодильником в течение 4 ч. Реакционную смесь гасили водой и экстрагировали хлороформом. Органическую фазу сушили над сульфатом натрия и концентрировали. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-метоксиэтил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13m (46 мг, 51%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,88 (д, J=7,6 Гц, 1H), 7,85 (с, 1H), 6,82 (с, 1H), 6,58-6,50 (м, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,56 (т, J=5,5 Гц, 2H), 3,38 (с, 3H), 3,30-3,25 (м, 4H), 2,70-2,62 (м, 6 H); ВЭЖХ (способ 3) 96,7% (AUC), tR=15,36 мин.; APCI MS m/z 431 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-фторэтил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 13n (пример 104);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-фторэтил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13n получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-метоксиэтил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13m, и получали в виде твердого вещества грязно-белого цвета (47 мг, 56%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,89 (д, J=7,5 Гц, 1H), 7,86 (с, 1H), 6,84-6,81 (м, 1H), 6,57 (с, 1H), 6,55 (дд, J=2,4, 7,6 Гц, 1H), 4,67 (т, J=4,8 Гц, 1H), 4,55 (т, J=4,8 Гц, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,30-3,25 (м, 4H), 2,80 (т, J=4,8 Гц, 1H), 2,75-2,69 (м, 5H); ВЭЖХ (способ 3) 97,37% (AUC), tR=15,36 мин; APCI MS m/z 419 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(3-метоксипропил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 13o (пример 96);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(3-метоксипропил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13n получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-метоксиэтил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13m, и получали в виде твердого вещества светло-желтого цвета (60 мг, 66%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,88 (д, J=7,4 Гц, 1H), 7,82 (с, 1H), 6,83 (с, 1H), 6,59-6,54 (м, 2H), 3,99 (с, 3H), 3,95 (с, 3H), 3,45 (т, J=6,4 Гц, 2H), 3,34 (с, 3H), 3,26 (т, J=4,9 Гц, 4H), 2,62 (т, J=5,0 Гц, 4H), 2,49 (т, J=7,3 Гц, 2H), 1,85-1,76 (м, 2H); ВЭЖХ (способ 3) 96,6% (AUC), tR=15,47 мин.; APCI MS m/z 445 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)ацетонитрила 13p (пример 95);
Соединение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)ацетонитрил 13p получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-метоксиэтил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13m, и получали в виде твердого вещества светло-желтого цвета (30 мг, 37%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,91 (д, J=7,7 Гц, 1H), 7,88 (с, 1H), 6,83 (д, J=1,9 Гц, 1H), 6,58 (с, 1H), 6,55 (дд, J=2,4, 7,5 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,59 (с, 2H), 3,29 (т, J=5,0 Гц, 4H), 2,78 (т, J=5,2 Гц, 4H); ESI MS m/z 412 [M+H]+.
Получение 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пропаннитрила 13q (пример 108);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]-пиридина 12 (75 мг, 0,50 ммоль) и акрилонитрила (21 мкл, 0,40 ммоль) в метаноле (5 мл) перемешивали при комнатной температуре в течение 8 ч. Растворитель удаляли при пониженном давлении. Остаток промывали разбавленным водным раствором аммиака для того, чтобы получить 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пропаннитрил 13q (65 мг, 76%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,89 (д, J=7,6 Гц, 1H), 7,87 (с, 1H), 6,81 (с, 1H), 6,59-6,51 (м, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,30-3,23 (м, 4H), 2,76 (т, J=6,9 Гц, 2H), 2,71-2,65 (м, 4H), 2,55 (т, J=6,8 Гц, 2H); ВЭЖХ (способ 3) 97,6% (AUC), tR=15,44 мин.; APCI MS m/z 426 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-изопропилпиперазин-1-ил)имидазо[1,2- a ]пиридина 13r (пример 100);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-изопропилпиперазин-1-ил)имидазо[1,2-a]пиридин 13r получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-метоксиэтил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13m, и получали в виде твердого вещества грязно-белого цвета (45 мг, 52%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,88 (д, J=7,5 Гц, 1H), 7,86 (с, 1H), 6,82 (д, J=2,2 Гц, 1H), 6,58-6,54 (м, 2H), 3,99 (с, 3H), 3,95 (с, 3H), 3,26 (т, J=5,0 Гц, 4H), 2,78-2,67 (м, 5H), 1,10 (с, 3H), 1,09 (с, 3H); ВЭЖХ (способ 2) 99,10% (AUC), tR=15,30 мин; APCI MS m/z 415 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-циклопентилпиперазин-1-ил)имидазо[1,2- a ]пиридина 13s (пример 239);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (100 мг, 0,30 ммоль), трет-бутил-4-(2-бромэтил)пиперазин-1-карбоксилата (59 мг, 0,40 ммоль) и карбоната цезия (200 мг, 0,60 ммоль) в ацетонитриле (2 мл) нагревали с обратным холодильником в течение 16 ч. Реакцию гасили водой и экстрагировали дихлорметаном. Органическую фазу сушили и концентрировали. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-циклопентилпиперазин-1-ил)имидазо[1,2-a]пиридин 13s (50 мг, 42%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,37 (с, 1H), 7,88 (д, J=7,50 Гц, 1H), 7,86 (с, 1H), 6,81 (ушир. с, 1H), 6,57 (с, 1H), 6,56 (д, J=7,5 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,30-3,23 (м, 4H), 2,71-2,63 (м, 4H), 2,60-2,49 (м, 1H), 1,96-1,83 (м, 2H), 1,79-1,66 (м, 2H), 1,52-1,38 (м, 2H); ВЭЖХ (способ 1) 97,7% (AUC), tR=9,32 мин; ESI MS m/z 441 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперидин-1-ил)этил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 13t (пример 135);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]-пиридина 12 (100 мг, 0,30 ммоль), 1-(2-хлорэтил)пиперидина гидрохлорида (92 мг, 0,50 ммоль) и карбоната калия (120 мг, 0,9 ммоль) в ацетонитриле (4 мл) нагревали с обратным холодильником в течение 3 ч. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперидин-1-ил)этил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13t (80 мг, 62%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,88 (д, J=7,5 Гц, 1H), 7,86 (с, 1H), 6,79 (с, 1H), 6,57 (с, 1H), 6,55 (д, J=7,5 Гц, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,27-3,22 (м, 4H), 2,68-2,64 (м, 4H), 2,63-2,59 (м, 2H), 2,58-2,52 (м, 2H), 2,51-2,43 (м, 4H), 1,66-1,57 (м, 4H), 1,49-1,41 (м, 2H); ВЭЖХ (способ 3) 99,0% (AUC), tR=15,13 мин; ESI MS m/z 484 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пирролидин-1-ил)этил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 13u (пример 143);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пирролидин-1-ил)этил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13u получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперидин-1-ил)этил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13t, и получали в виде твердого вещества грязно-белого цвета (80 мг, 63%).
1H ЯМР (300 МГц, CDCl3): δ 8,36 (с, 1H), 7,92 (д, J=7,4 Гц, 1H), 7,89 (с, 1H), 6,81 (с, 1H), 6,58 (с, 1H), 6,54 (д, J=7,4 Гц, 1H), 4,30-4,27 (м, 2H), 4,00 (с, 3H), 3,95 (с, 3H), 3,69-3,63 (м, 4H), 3,24-3,16 (м, 4H), 2,80-2,78 (м, 2H), 2,64-2,55 (м, 2H), 1,83-1,77 (м, 4H); ВЭЖХ (способ 1) 96,7% (AUC), tR=9,41 мин; ESI MS m/z 470 [M+H]+.
Получение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)(циклопентил)метанона 13v (пример 241);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]-пиридина 12 (75 мг, 0,20 ммоль), циклопентанкарбонилхлорида (32 мг, 0,24 ммоль) и триэтиламина (60 мг, 0,6 ммоль) в DCM (1,5 мл) перемешивали при 0°C в течение 1 ч, за чем следовало 2 ч при комнатной температуре. Реакционную смесь гасили водным раствором бикарбоната натрия, который экстрагировали дихлорметаном. Органическую фазу концентрировали. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)(циклопентил)метанон 13v (50 мг, 53%) в виде твердого вещества желтого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,35 (с, 1H), 7,92 (д, J=7,4 Гц, 1H), 7,88 (с, 1H), 6,83 (с, 1H), 6,58 (с, 1H), 6,55 (д, J=7,4 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,85-3,67 (м, 4H), 3,28-3,18 (м, 4H), 3,01-2,88 (м, 1H), 1,79-1,51 (м, 5H); ВЭЖХ (способ 1) 98,0% (AUC), tR=11,06 мин; ESI MS m/z 469 [M+H]+.
Получение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)(циклопропил)метанона 13w (пример 238);
Соединение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)(циклопропил)метанон 13w получали аналогичным образом, как (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)(циклопентил)метанон 13v, и получали в виде твердого вещества грязно-белого цвета (46 мг, 39%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 6,86 (с, 1H), 6,82 (д, J=7,5 Гц, 1H), 6,70 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,83 (м, 2H), 3,63 (м, 4H), 3,31(м, 2H), 3,21(м, 2H), 2,01-1,98 (м, 1H), 0,75-0,72 (м, 4H); ВЭЖХ (способ 1) 97,9% (AUC), tR=10,49 мин; ESI MS m/z 441 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)- N,N- диметилэтанамина 13x (пример 88);
Cмесь 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этанамина гидрохлорида 5o (100 мг, 0,24 ммоль), цианоборогидрида натрия (121 мг, 1,92 ммоль), формальдегида (37%) (0,1 мл) и уксусной кислоты (110 мкл, 1,92 ммоль) в метаноле (1,5 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь фильтровали и получали твердое вещество. Твердое вещество промывали хлороформом и суспендировали в водном растворе аммиака. Осадок собирали посредством фильтрования и промывали водой для того, чтобы получить 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N,N-диметилэтанамин 13x (51 мг, 53%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3) δ 8,33 (с, 1H), 7,88 (д, J=7,5 Гц, 1H), 7,85 (с, 1H), 6,81 (д, J=2,3 Гц, 1H), 6,60-6,54 (м, 2H), 3,99 (с, 3H), 3,95 (с, 3H), 3,31-3,24 (м, 4H), 2,69-2,63 (м, 4H), 2,58-2,48 (м, 4H), 2,30 (с, 6H); ВЭЖХ (способ 2) 94,0% (AUC), tR=14,89 мин; APCI MS m/z 444 [M+H]+.
Получение этил-3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пропаноата 13y (пример 132);
Соединение этил-3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пропаноат 13y получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперидин-1-ил)этил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13t, и получали в виде твердого вещества грязно-белого цвета (150 мг, 40%).
1H ЯМР (300 МГц, CDCl3); δ 8,37 (с, 1H), 7,89 (с, 1H), 7,86 (с, 1H), 6,80 (с, 1H), 6,57 (с, 1H), 6,56-6,52 (м, 1H),4,19-4,12 (м, 2H), 3,99 (с, 3H), 3,95 (с, 3H), 3,26-3,23 (м, 4H), 2,78-2,76 (м, 2H),2,67-2,60 (м, 4H), 2,5-2,50 (м, 2H), 1,30-1,27 (м, 3H); ВЭЖХ (способ 1) 97,6% (AUC), tR=9,27 мин; ESI MS m/z 473 [M+H]+.
Получение 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пропановой кислоты 13z (пример 133);
Cмесь этил-3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пропаноата 13y (80 мг, 0,17 ммоль), гидроксида лития (14 мг, 0,34 ммоль) и воды (1,6 мл) в THF(1,6 мл) перемешивали при комнатной температуре в течение 3 ч. Растворитель удаляли и остаток нейтрализовали разбавленной HCl до (pH 6,0). Полученный осадок фильтровали и твердое вещество промывали водой. Твердое вещество сушили для того, чтобы получить 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пропановую кислоту 13z (60 мг, 80%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,45 (д, J=7,5 Гц, 1H), 8,16 (с, 1H), 8,09 (с, 1H), 7,09 (д, J=7,5 Гц, 1H), 6,93 (с, 1H), 6,76 (с, 1H), 4,03 (с, 3H), 3,96 (с, 3H), 3,56-3,41 (м, 4H), 2,93-2,77 (м, 6H), 2,64-2,54 (м, 2H); ВЭЖХ (способ 1) 98,8% (AUC), tR=9,03 мин; ESI MS m/z 445 [M+H]+.
Получение метил-4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)бутаноата 13aa (пример 237);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (50 мг, 0,13 ммоль), метил-4-бромбутаноата (29 мг, 0,16 ммоль) и карбоната цезия (87 мг, 0,26 ммоль) в DMF (3 мл) нагревали до 80°C в течение 3 ч. Реакционную смесь гасили раствором аммиака, затем экстрагировали этилацетатом. Органическую фазу концентрировали. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить метил-4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)бутаноат 13aa (14 мг, 40%) в виде твердого вещества бледно-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,30 (д, J=7,5 Гц, 1H), 8,15 (с, 1H), 8,03 (с, 1H), 6,87 (с, 1H), 6,79 (д, J=7,5 Гц, 1H), 6,69 (с, 1H), 4,00 (с, 3H), 3,98 (с, 3H), 3,59 (с, 3H), 3,28-3,26 (м, 3H), 3,24 -3,22 (м, 3H), 2,48-2,46 (м, 2H), 2,36-2,34 (м, 4H); ВЭЖХ (способ 1) 96,5% (AUC), tR=9,30 мин; ESI MS m/z 473 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)бутановой кислоты 13ab (пример 240);
Соединение этил-4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)бутановая кислота 13ab получали аналогичным образом, как 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пропановую кислоту 13z, и получали в виде твердого вещества грязно-белого цвета (29 мг, 55%).
1H ЯМР (300 МГц, DMSO-d6 с D2O): δ 8,56 (д, J=7,5 Гц, 1H), 8,28 (с, 1H), 7,92 (с, 1H), 7,26 (д, J=7,5 Гц, 1H), 6,92 (с, 1H), 4,00 (с, 3H), 3,97 (с, 3H), 3,92-3,91 (м, 2H), 3,67 (м, 2H), 3,52-3,48 (м, 4H), 3,21-3,18 (м, 2H), 2,42-2,38 (м, 2H), 2,00-1,97 (м, 2H). ВЭЖХ (способ 1) 99,4% (AUC), tR=9,11 мин; ESI MS m/z 459 [M+H]+.
Получение 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пропанамида 13ac (пример 137);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (100 мг, 0,30 ммоль) в ацетонитриле (2 мл) добавляли K2CO3 (80 мг, 0,60 ммоль) и 3-бромпропионамид (60 мг, 0,40 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Растворитель удаляли при пониженном давлении и остаток экстрагировали с использованием CH2Cl2 (2×25 мл) и промывали водой. Объединенные органические соединения промывали солевым раствором (50 мл), сушили над Na2SO4 и концентрировали при пониженном давлении для того, чтобы получить 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пропанамид 13ac (50 мг, 42%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,15 (д, J=7,6 Гц, 1H), 8,06 (с, 1H), 7,97 (с, 1H), 6,79 (с, 1H), 6,77 (д, J=7,6 Гц, 1H), 6,68 (с, 1H), 4,01 (с, 3H), 3,95 (с, 3H), 2,77-2,71 (м, 2H), 2,70-2,65 (м, 4H), 2,49-2,43 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=8,95 мин; ESI MS m/z 444 [M+H]+.
Получение метил-3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил) -N- (2-(диметиламино)этил)пропанамида 13ad (пример 158);
Cмесь 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пропановой кислоты 13z (60 мг, 0,13 ммоль), N1,N1-диметилэтан-1,2-диамина (12 мг, 0,14 ммоль), TBTU (50 мг, 0,16 ммоль) и N,N-диизопропилэтиламина (50 мкл, 0,40 ммоль) в DMF (1 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили водой и экстрагировали этилацетатом. Органическую фазу сушили над Na2SO4 и концентрировали. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N-(2-(диметиламино)этил)пропанамид 13ad (15 мг, 22%) в виде твердого вещества бледно-желтого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,15 (д, J=7,6 Гц, 1H), 8,06 (с, 1H), 7,97 (с, 1H), 6,78 (с, 1H), 6,77 (д, J=7,6 Гц, 1H), 6,67 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,35-3,30 (м, 6H), 2,73 (т, J=7,2 Гц, 2H), 2,70-2,65 (м, 4H), 2,49-2,41 (м, 4H), 2,26 (м, 6H); ВЭЖХ (способ 1) 96,7% (AUC), tR=8,69 мин; ESI MS m/z 515 [M+H]+.
Получение диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)этил)фосфоната 13ae (пример 202);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (100 мг, 0,30 ммоль), карбоната цезия (300 мг, 0,90 ммоль) и диэтил(2-хлорэтил)фосфоната (88 мкл, 0,33 ммоль) в DCM (2 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разводили в DCM (50 мл), промывали раствором NH4OH (10 мл) и солевым раствором (10 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)пиперазин-1-ил)этил)фосфонат 13ae (30 мг, 21%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,35 (с, 1H), 7,89 (д, J=7,5 Гц, 1H), 7,83 (с, 1H), 6,92 (ушир. с, 1H), 6,59 (ушир. с, 1H), 6,58 (с, 1H), 4,18-4,07 (м, 4H), 4,00 (с, 3H), 3,95 (с, 3H), 3,32-3,25 (м, 4H), 2,77-2,69 (м, 2H), 2,65-2,63 (м, 4H), 2,06-1,96 (м, 2H), 1,37-1,34 (м, 6H); ВЭЖХ (способ 1) >99% (AUC), tR=9,34 мин; ESI MS m/z 537 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-метилпиперазин-1-ил)имидазо[1,2- a ]-пиридина 13af (пример 106);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (75 мг, 0,20 ммоль), цианоборогидрида натрия (12,5 мг, 0,20 ммоль) и параформальдегида (9 мг) в метаноле (3 мл) перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-метилпиперазин-1-ил)имидазо[1,2-a]пиридин 13af (22 мг, 28%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3); δ 8,36 (с, 1H), 7,89 (д, J=7,6 Гц, 1H), 7,84 (с, 1H), 6,87 (с, 1H), 6,60-6,55 (м, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,31-3,25 (м, 4H), 2,62-2,55 (м, 4H), 2,36 (с, 3H); ESI MS m/z 387 [M+H]+.
Схема 4
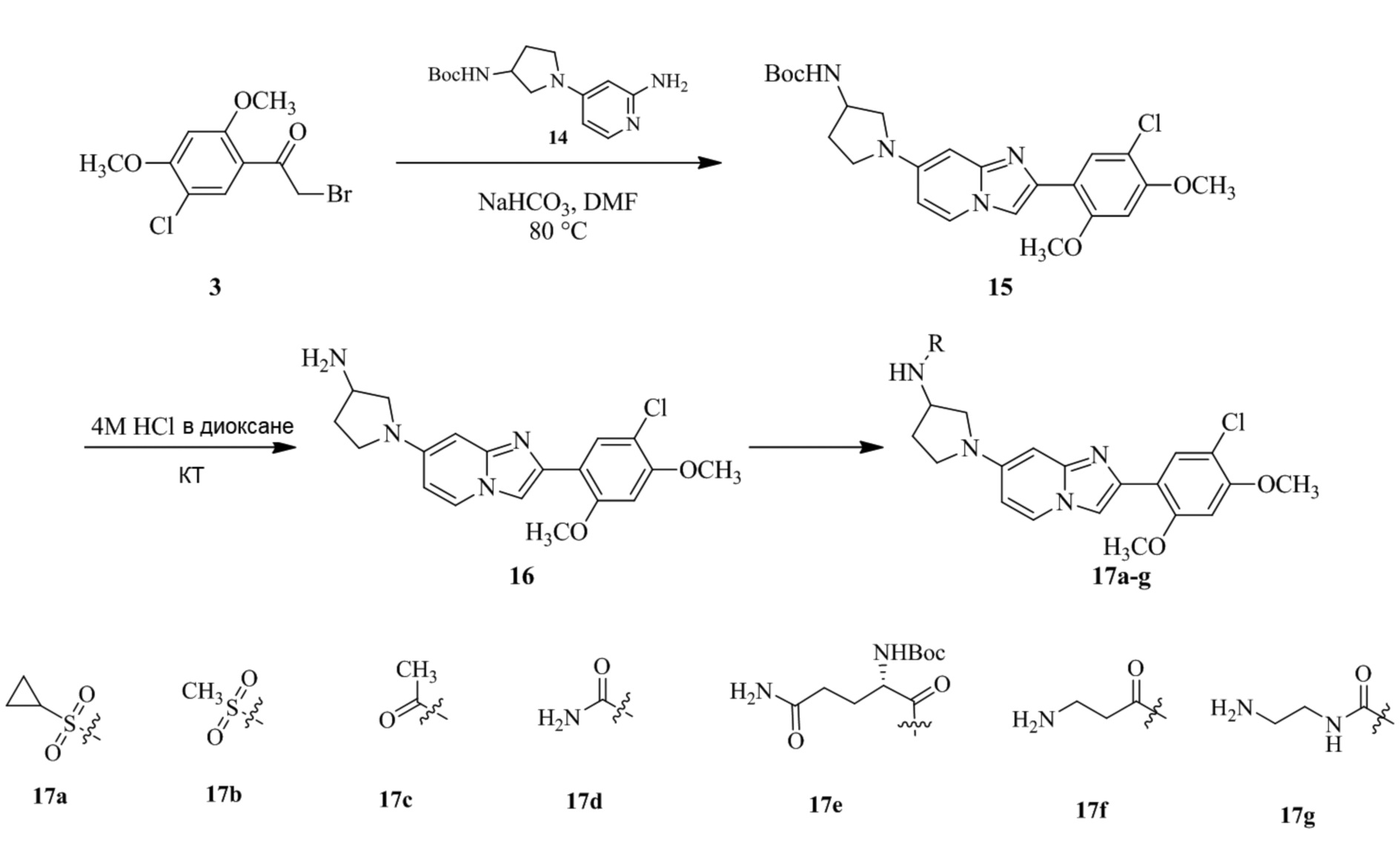
Получение трет -бутил{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пирролидин-3-ил}карбамата 15 (пример 23);
Соединение трет-бутил{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пирролидин-3-ил)карбамат} 15 получали аналогичным образом, как трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 11, и получали в виде твердого вещества белого цвета (выход 27%).
1H ЯМР (400 МГц, CDCl3): δ 8,17 (с, 1H), 7,96 (д, J=7,4 Гц, 1H), 7,72 (с, 1H), 6,93 (ушир. с, 1H), 6,55 (с, 1H), 6,46-6,42 (м, 1H), 4,78 (ушир. с, 1H), 4,37 (ушир. с, 1H), 4,05 (с, 3H), 3,95 (с, 3H), 3,71-3,67 (м, 1H), 3,57-3,50 (м, 1H), 3,49-3,42 (м, 1H), 3,31-3,24 (м, 1H), 2,23-2,22 (м, 1H), 2,03-1,99 (м, 1H), 1,46 (с, 9H); ВЭЖХ (способ 2) 98,9% (AUC), tR=17,04 мин; ESI MS m/z 473 [M+H]+.
Получение 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пирролидин-3-амина 16 (пример 33);
Соединение 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пирролидин-3-амин 16 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12, и получали в виде твердого вещества зеленого цвета (выход 85%).
1H ЯМР (400 МГц, CD3OD): δ 8,11 (д, J=7,4 Гц, 1H), 8,02 (с, 1H), 7,90 (с, 1H), 6,78 (с, 1H), 6,53 (дд, J=2,3, 7,5 Гц, 1H), 6,29 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,75-3,69 (м, 1H), 3,62-3,55 (м, 2H), 3,45-3,39 (м, 1H), 3,18-3,15 (м, 1H), 2,33-2,24 (м, 1H), 1,96-1,88 (м, 1H); ВЭЖХ (способ 4) 96,4% (AUC), tR=15,74 мин; ESI MS m/z 373 [M+H]+.
Получение N -{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пирролидин-3-ил}циклопропансульфонамида 17a (пример 63);
Соединение N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пирролидин-3-ил}циклопропансульфонамид 17 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 18%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,28 (д, J=7,4 Гц, 1H), 8,16 (с, H), 7,95 (с, H), 7,49 (д, J=7,6 Гц, 1H), 6,85 (с, 1H), 6,49 (дд, J=2,3, 7,4 Гц, 1H), 6,24 (д, J=2,0 Гц, 1H), 4,12-4,05 (м, 1H), 4,00 (с, 3H), 3,92 (с, 3H), 3,67-3,61 (м, 1H), 3,49-3,43 (м, 1H), 3,37-3,32 (м, 1H), 3,25-3,21 (м, 1H), 2,67-2,61 (м, 1H), 2,33-2,24 (м, 1H), 2,01-1,93 (м, 2H), 1,02-0,93 (м, 4H); ВЭЖХ (способ 2) 96,7% (AUC), tR=18,28 мин.; ESI MS m/z 477 [M+H]+.
Получение N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)метансульфонамида 17b (пример 40);
Соединение N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)метансульфонамид 17b получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества светло-зеленого цвета (выход 20%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,32 (д, J=7,4 Гц, 1H), 8,11 (с, 1H), 8,01 (с, 1H), 7,45 (д, J=6,8 Гц, 1H), 6,88 (с, 1H), 6,62-6,56 (м, 1H), 6,26 (с, 1H), 4,15-4,05 (м, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,86-3,79 (м, 1H), 3,71-3,61 (м, 1H), 3,53-3,42 (м, 2H), 3,00 (с, 3H), 2,36-2,20 (м, 1H), 2,05-1,94 (м, 1H); ESI MS m/z 451 [M+H]+.
Получение N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)ацетамида 17c (пример 37);
Cмесь 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пирролидин-3-амина 16 (50 мг, 0,13 ммоль), ацетилхлорида (8,6 мкл, 0,12 ммоль) и триэтиламина (37 мкл, 0,6 ммоль) в DCM (1,5 мл) перемешивали при 0°C в течение 1 ч, затем при комнатной температуре в течение 2 ч при комнатной температуре. Реакционную смесь гасили раствором бикарбоната натрия, который экстрагировали дихлорметаном. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить N-(1-(2-(5-хлор-2,4-диметокси-фенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)ацетамид 17c (28 мг, 59%) в виде твердого вещества зеленого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,12 (д, J=7,4 Гц, 1H), 8,03 (с, 1H), 7,91 (с, 1H), 6,78 (с, 1H), 6,56-6,50 (м, 1H), 6,30 (с, 1H), 4,55-4,46 (м, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,71-3,62 (м, 1H), 3,59-3,49 (м, 1H), 3,49-3,41 (м, 1H), 3,27-3,24 (м, 1H), 2,37-2,26 (м, 1H), 2,09-2,00 (м, 1H), 1,95 (с, 3H); ВЭЖХ (способ 2) 94,9% (AUC), tR=16,98 мин.; ESI MS m/z 415 [M+H]+.
Получение 1-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)мочевины 17d (пример 38);
Cмесь фенил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамата (65 мг, 0,17 ммоль) и аммиака в этаноле (10 мл, 2,0 M) в этаноле (1,5 мл) нагревали при 80°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток очищали посредством препаративной TLC (9:1 DCM/MeOH) для того, чтобы получить 1-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)мочевину 17d (20 мг, 40%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,28 (д, J=7,4 Гц, 1H), 8,15 (с, 1H), 7,96 (с, 1H), 6,86 (с, 1H), 6,52-6,48 (м, 1H), 6,32 (д, J=7,1 Гц, 1H), 6,23 (с, 1H), 5,43 (с, 2H), 4,28-4,18 (м, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,57-3,49 (м, 1H), 3,45-3,32 (м, 2H), 3,19-3,08 (м, 2H), 2,21-2,11 (м, 1H), 1,90-1,81 (м, 1H); ВЭЖХ (способ 2) 94,0% (AUC), tR=16,67 мин.; ESI MS m/z 416 [M+H]+.
Получение трет -бутил((2 S )-5-амино-1-((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил)пирролидин-3-ил)амино)-1,5-диоксопентан-2-ил)карбамата 17e (пример 39);
Cмесь 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-пирролидин-3-амина 16 (100 мг, 0,27 ммоль), (S)-5-амино-2-((трет-бутоксикарбонил)амино)-5-оксовалериановой кислоты (132 мг, 0,54 ммоль), HATU (305 мг, 0,80 ммоль) и DIPEA (280 мкл, 1,60 ммоль) в DCM (10 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили водой и экстрагировали дихлорметаном. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить трет-бутил((2S)-5-амино-1-((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)амино)-1,5-диоксопентан-2-ил)карбамат 17e (80 мг, 50%) в виде твердого вещества светло-зеленого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,17 (д, J=7,5 Гц, 1H), 7,95-7,91 (м, 2H), 6,80 (с, 1H), 6,65-6,60 (м, 1H), 6,33 (с, 1H), 4,56-4,49 (м, 1H), 4,05-3,98 (м, 4H), 3,95 (с, 3H), 3,73-3,66 (м, 1H), 3,62-3,54 (м, 1H), 3,52-3,45 (м, 1H), 3,37-3,31 (м, 1H), 2,38-2,25 (м, 3H), 2,15-2,06 (м, 1H), 2,04-1,93 (м, 1H), 1,90-1,80 (м, 1H), 1,42 (с, 9H); ВЭЖХ (способ 2) 96,0% (AUC), tR=17,69 мин.; ESI MS m/z 601 [M+H]+.
Получение 3-амино -N- (1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)пропанамида 17f (пример 50);
Раствор трет-бутил(3-((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)пирролидин-3-ил)амино)-3-оксопропил)карбамата (75 мг, 0,16 ммоль) в 4,0 M HCl в диоксане (3 мл) перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь фильтровали, промывали диоксаном и сушили при пониженном давлении для того, чтобы получить 3-амино-N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)пропанамид. Гидрохлоридную соль суспендировали в 10 мл водного аммиака, перемешивали в течение 1 ч при комнатной температуре и экстрагировали хлороформом (2×20 мл). Органический слой сушили над сульфатом натрия и концентрировали для того, чтобы получить 3-амино-N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)пропанамид 17f (50 мг, 82%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,36 (д, J=7,5 Гц, 1H), 8,06 (с, 1H), 7,75 (с, 1H), 6,92-6,88 (м, 2H), 6,48 (с, 1H), 4,62-4,55 (м, 1H), 4,07 (с, 3H), 3,99 (с, 3H), 3,83-3,76 (м, 1H), 3,71-3,55 (м, 2H), 3,45-3,38 (м, 2H), 3,32 (т, J=6,4 Гц, 2H), 2,64 (т, J=6,8 Гц, 2H), 2,44-2,33 (м, 1H), 2,19-2,10 (м, 1H); ESI MS m/z 444 [M+H]+.
Получение 1-(2-аминоэтил)-3-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил)пирролидин-3-ил)мочевины 17g (пример 62);
Соединение 1-(2-аминоэтил)-3-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)мочевина 17g получали аналогичным образом, как 3-амино-N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)пропанамид 17f, и получали в виде твердого вещества коричневого цвета (10 мг, 24%);
1H ЯМР (400 МГц, DMSO-d6): δ 8,26 (д, J=6,8, 1H), 8,16 (с, 1H), 7,94 (с, 1H), 6,85 (с, 1H), 6,48 (д, J=6,8, 1H), 6,35-6,18 (м, 2H), 5,84 (ушир. с, 1H), 4,26 (ушир. с, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,56-3,50 (м, 2H), 3,12-2,94 (м, 4H), 2,22-2,11 (м, 1H), 1,90-1,79 (м, 1H); ESI MS m/z 459 [M+H]+.
Схема 5
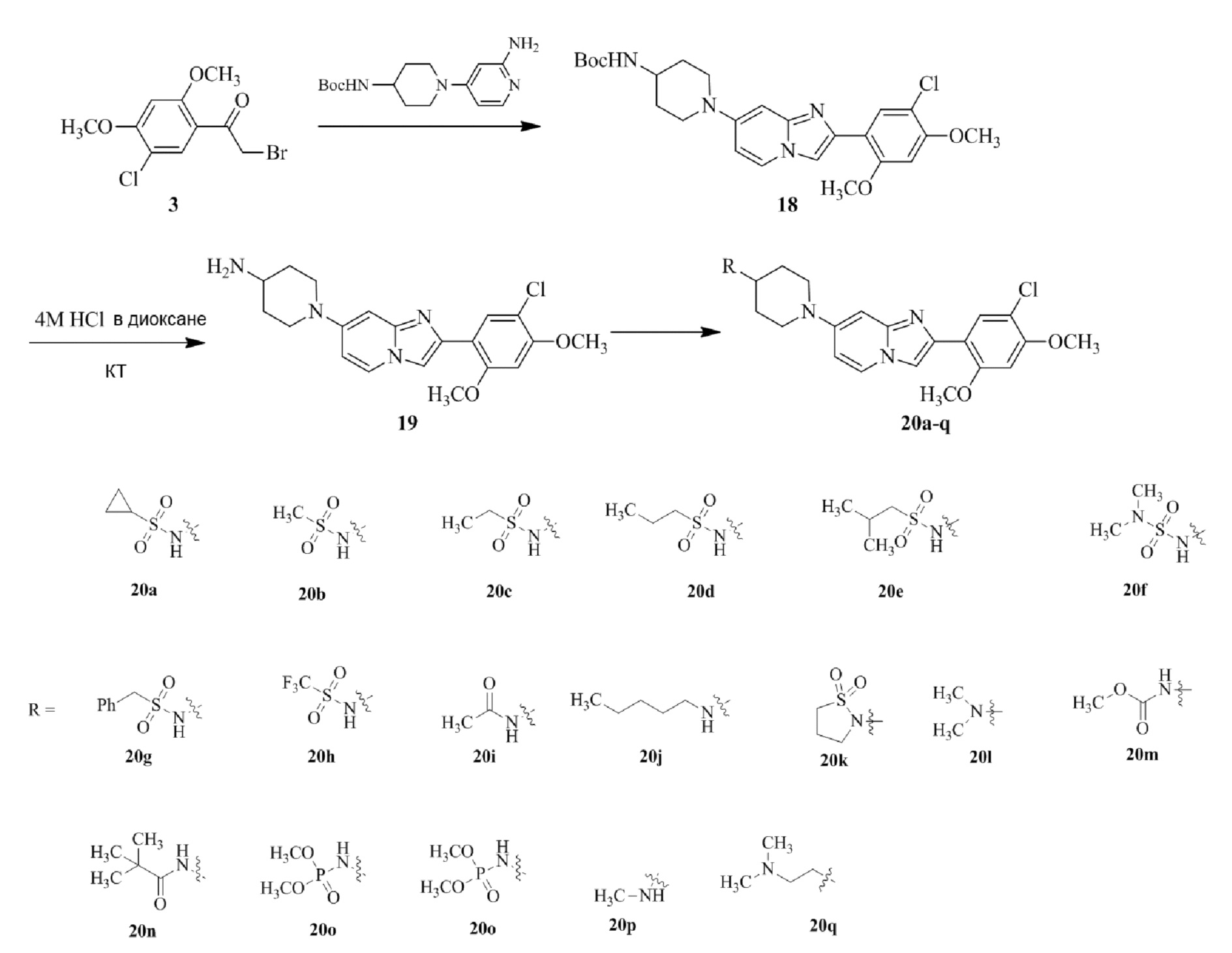
Получение трет -бутил{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]-пиперидин-4-ил}карбамата 18 (пример 14);
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (200 мг, 0,681 ммоль) и трет-бутил(1-(2-аминопиридин-4-ил)пиперидин-4-ил)карбамата (198 мг, 0,681 ммоль) в ацетоне (5 мл) нагревали при 75°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета собирали посредством фильтрования и промывали ацетоном. Осадок суспендировали в водном аммиаке (10 мл) и перемешивали в течение 2 ч. Твердое вещество фильтровали, повторно суспендировали в минимальном количестве метанола, концентрировали и сушили при пониженном давлении для того, чтобы получить трет-бутил{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}карбамат 18 (155 мг, 47%) в виде твердого вещества сине-зеленого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,37 (с, 1H), 7,89-7,85 (м, 2H), 6,82-6,79 (м, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,4, 7,7 Гц, 1H), 4,56-4,35 (м, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,70-3,60 (м, 3H), 2,98-2,86 (м, 2H), 2,11-2,01 (м, 2H), 1,63-1,49 (м, 2H), 1,45 (с, 9H); ВЭЖХ (способ 4) 98,3% (AUC), tR=19,17 мин.; APCI MS m/z 487 [M+H]+.
Получение 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-амина 19 (пример 15);
Раствор трет-бутил{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}карбамата 18 (50 мг, 0,103 ммоль) в 1 M HCl в метаноле (3 мл) нагревали при 55°C в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Остаток растирали в порошок с этилацетатом (2×2 мл) и сушили при пониженном давлении для того, чтобы получить 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-амина гидрохлорид 19 (35 мг, 74%) в виде твердого вещества грязно-белого цвета. Соль суспендировали в 10 мл водного аммиака, перемешивали в течение 1 ч при комнатной температуре и экстрагировали реакционную смесь хлороформом (2×20 мл). Органический слой сушили и концентрировали для того, чтобы получить 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-амин 19 с 65% общим выходом.
1H ЯМР (300 МГц, CD3OD): δ 8,40 (д, J=7,7 Гц, 1H), 8,12 (с, 1H), 7,76 (с, 1H), 7,24 (дд, J=2,5, 7,7 Гц, 1H), 6,90-6,86 (м, 2H), 4,26-4,16 (м, 2H), 4,08 (с, 3H), 4,00 (с, 3H), 3,58-3,42 (м, 1H), 3,26-3,14 (м, 2H), 2,24-2,13 (м, 2H), 1,79-1,64 (м, 2H); APCI MS m/z 387 [M+H]+.
Получение N -{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-ил}циклопропансульфонамида 20a (пример 126);
В раствор 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-амина 19 (50 мг, 0,13 ммоль) и триэтиламина (72 мкл, 0,52 ммоль) в дихлорметане (3 мл) загружали циклопропилсульфонилхлорид (36 мг, 0,26 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После 16 ч реакционную смесь концентрировали, суспендировали в водном растворе аммиака и перемешивали в течение 2 ч. Осадок собирали посредством фильтрования, промывали водой, сушили при пониженном давлении и очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}циклопропансульфонамид 20a (20 мг, 31%) в виде твердого вещества зеленого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,35 (с, 1H), 7,89 (д, J=7,5 Гц, 1H), 7,85 (с, 1H), 6,87 (с, 1H), 6,57 (с, 1H), 6,55 (дд, J=2,4, 7,5 Гц, 1H), 4,29 (д, J=4,8 Гц, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 3,72-3,65 (м, 2H), 3,59-3,50 (м, 1H), 2,99-2,90 (м, 2H), 2,50-2,42 (м, 1H), 2,19-2,11 (м, 2H), 1,75-1,63 (м, 2H), 1,23-1,18 (м, 2H), 1,06-1,00 (м, 2H). ВЭЖХ (способ 1) 94,0% (AUC), tR=10,75 мин. APCI MS m/z 491 [M+H]+.
Получение N -{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-ил}метансульфонамида 20b (пример 128);
N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}метансульфонамид 20b получали аналогичным образом, как N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}циклопропансульфонамид 20a, и получали в виде твердого вещества грязно-белого цвета (выход 58%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,89 (д, J=7,5 Гц, 1H), 7,87 (с, 1H), 6,81 (д, J=1,9 Гц, 1H), 6,58 (с, 1H), 6,52 (дд, J=2,3, 7,5 Гц, 1H), 4,32 (д, J=7,2 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,67 (д, J=13,1 Гц, 2H), 3,59-3,48 (м, 1H), 3,02 (с, 3H), 2,97-2,88 (м, 2H), 2,13 (д, J=11,1 Гц, 2H), 1,74-1,62 (м, 2H); ВЭЖХ (способ 2) 98,1% (AUC), tR=17,73 мин; APCI MS m/z 465 [M+H]+.
Получение N -{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-ил}этансульфонамида 20c (пример 173);
N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}этансульфонамид 20c получали аналогичным образом, как N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}циклопропансульфонамид 20a, и получали в виде твердого вещества зеленого цвета (выход 45%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,89 (д, J=7,6 Гц, 1H), 7,86 (с, 1H), 6,85 (с, 1H), 6,58 (с, 1H), 6,54 (дд, J=2,3, 7,5 Гц, 1H), 4,09 (д, J=7,7 Гц, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 3,68 (д, J=12,7 Гц, 2H), 3,55-3,47 (м, 1H), 3,08 (дд, J=7,3, 14,7 Гц, 2H), 2,96-2,89 (м, 2H), 2,16-2,11 (м, 2H), 1,72-1,62 (м, 2H), 1,40 (т, J=7,3 Гц, 3H); ВЭЖХ (способ 1) 95,2% (AUC), tR=10,61 мин; ESI MS m/z 479 [M+H]+.
Получение N -{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-ил}пропан-1-сульфонамида 20d (пример 174);
N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}пропан-1-сульфонамид 20d получали аналогичным образом, как N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}циклопропансульфонамид 20a, и получали в виде твердого вещества зеленого цвета (выход 22%).
1H ЯМР (400 МГц, CDCl3): δ 8,33 (с, 1H), 7,89 (д, J=7,4 Гц, 1H), 7,84 (с, 1H), 6,86- 6,83 (м, 1H), 6,57 (с, 1H), 6,53 (дд, J=2,2, 7,5 Гц, 1H), 4,44 (ушир. с, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,68 (д, J=12,9 Гц, 2H), 3,55-3,44 (м, 1H), 3,07-2,99 (м, 2H), 2,98-2,88 (м, 2H), 2,15-2,07 (м, 2H), 1,91-1,82 (м, 2H), 1,71-1,61 (м, 2H), 1,07 (т, J=7,4 Гц, 3H); ESI MS m/z 493 [M+H]+.
Получение N -[1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-ил}-2-метилпропан-1-сульфонамида 20e (пример 185);
N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}-2-метилпропан-1-сульфонамид 20e получали аналогичным образом, как N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}циклопропансульфонамид 20a и получали в виде твердого вещества желто-зеленого цвета (выход 61%).
1H ЯМР (400 МГц, CDCl3): δ 8,35 (с, 1H), 7,89 (д, J=7,5 Гц, 1H), 7,85 (с, 1H), 6,84 (ушир. с, 1H), 6,57 (с, 1H), 6,53 (дд, J=2,4, 7,5 Гц, 1H), 4,22 (д, J=7,1 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,68 (д, J=13 Гц, 2H), 3,52-3,49 (м, 1H), 2,96-2,89 (м, 4H), 2,33-2,23 (м, 1H), 2,13-2,06 (м, 2H), 1,71-1,61 (м, 2H), 1,12 (д, 6H, J=6,7 Гц); ВЭЖХ (способ 1) 98,6% (AUC), tR=11,09 мин.; ESI MS m/z 507 [M+H]+.
Получение N -{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-ил} N,N- диметилсульфонамида 20f (пример 181);
N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}N,N-диметилсульфонамид 20f получали аналогичным образом, как N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}циклопропансульфонамид 20a, и получали в виде твердого вещества зеленого цвета (выход 44%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,88 (д, J=7,5 Гц, 1H), 7,86 (с, 1H), 6,83- 6,81 (м, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,4, 7,5 Гц, 1H), 4,05 (д, J=7,6 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,66 (д, J=13,2 Гц, 2H), 3,46-3,37 (м, 1H), 2,95-2,88 (м, 2H), 2,82 (с, 6H), 2,18-2,11 (м, 2H), 1,69-1,59 (м, 2H); ВЭЖХ (способ 1) 97,4% (AUC), tR=10,83 мин; ESI MS m/z 494 [M+H]+.
Получение N -{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-ил}-1-фенилметансульфонамида 20g (пример 175);
N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}-1-фенилметансульфонамид 20g получали аналогичным образом, как N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}циклопропансульфонамид 20a, и получали в виде твердого вещества зеленого цвета (выход 11%).
1H ЯМР (400 МГц, CDCl3): δ 8,34 (с, 1H), 7,88 (д, J=7,5 Гц, 1H), 7,83 (с, 1H), 7,45-7,38 (м, 5H), 6,85 (с, 1H), 6,57 (с, 1H), 6,52 (дд, J=2,2, 7,5 Гц, 1H), 4,29 (с, 2H), 4,20-4,12 (м, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,61 (д, J=13,0 Гц, 2H), 3,27-3,19 (м, 1H), 2,86-2,76 (м, 2H), 2,02-1,94 (м, 2H), 1,59-1,49 (м, 2H); ESI MS m/z 541 [M+H]+.
Получение N -{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-ил}-1,1,1-трифторметансульфонамида 20h (пример 176);
N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}-1,1,1-трифторметансульфонамид 20h получали аналогичным образом, как N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}циклопропансульфонамид 20a, и получали в виде твердого вещества зеленого цвета (выход 25%).
1H ЯМР (400 МГц, CDCl3): δ 8,34 (с, 1H), 7,89 (д, J=7,5 Гц, 1H), 7,86 (с, 1H), 6,84- 6,82 (м, 1H), 6,58 (с, 1H), 6,52 (дд, J=2,4, 7,5 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,73-3,66 (м, 3H), 2,98-2,89 (м, 2H), 2,19-2,12 (м, 2H), 1,80-1,68 (м, 2H); ВЭЖХ (способ 1) 96,9% (AUC), tR=11,66 мин.; ESI MS m/z 519 [M+H]+.
Получение N -{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-ил}ацетамида 20i (пример 124);
N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}ацетамид 20i получали аналогичным образом, как N-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}циклопропансульфонамид 20a, и получали в виде твердого вещества грязно-белого цвета (выход 72%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,88 (д, J=7,5 Гц, 1H), 7,86 (с, 1H), 6,81 (д, J=2,2 Гц, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,4, 7,5 Гц, 1H), 5,37 (д, J=7,7 Гц, 1H), 4,04-3,97 (м, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,68 (д, J=13,1 Гц, 2H), 3,00-2,90 (м, 2H), 2,10-2,02 (м, 2H), 1,99 (с, 3H), 1,57-1,49 (м, 2H); ВЭЖХ (способ 1) 97,2% (AUC), tR=10,09 мин.; ESI MS m/z 429 [M+H]+.
Получение 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил] -N- пентилпиперидин-4-амина 20j (пример 129);
В раствор 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-амина 19 (50 мг, 0,129 ммоль) и валеральдегид (11 мг, 0,129 ммоль) в метаноле (3 мл) загружали цианоборогидрид натрия (16 мг, 0,258 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель удаляли при пониженном давлении и остаток разводили гидроксидом аммония (10 мл) и экстрагировали хлороформом (2×10 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-N-пентилпиперидин-4-амин 20j (23 мг, 39%) в виде твердого вещества желто-коричневого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,86 (д, J=7,5 Гц, 1H), 7,84 (с, 1H), 6,80 (д, J=2,2 Гц, 1H), 6,57 (с, 1H), 6,55 (дд, J=2,4, 7,6 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,75-3,67 (м, 2H), 2,88-2,78 (м, 2H), 2,77-2,65 (м, 3H), 2,04 (д, J=10,9 Гц, 2H), 1,64-1,50 (м, 4H), 1,39-1,27 (м, 4H), 0,90 (т, J=6,8 Гц, 3H); ВЭЖХ (способ 1) 97,4% (AUC), tR=9,74 мин; APCI MS m/z 457 [M+H]+.
Получение 2-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиперидин-4-ил}изотиазолидин 1,1-диоксида 20k (пример 182);
В раствор 1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-пиперидин-4-амина 19 (50 мг, 0,13 ммоль) и триэтиламина (54 мкл, 0,39 ммоль) в дихлорметане (3 мл) добавляли 3-хлорпропан-1-сульфонилхлорид (23 мг, 0,13 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем концентрировали. Остаток суспендировали в водном аммиаке и перемешивали в течение 2 ч. Осадок собирали посредством фильтрования, промывали водой и сушили при пониженном давлении для того, чтобы получить 55 мг неочищенного остатка. В раствор неочищенного остатка в DMF (3 мл) загружали NaH (7,5 мг, 0,31 ммоль) в атмосфере азота. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию гасили холодной водой (10 мл) и экстрагировали хлороформом (2×25 мл). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и остаток очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить желаемый 2-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил]пиперидин-4-ил}изотиазолидин 1,1-диоксид 20k (28 мг, 55%) в виде твердого вещества желтого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,37 (с, 1H), 7,89 (д, J=7,5 Гц, 1H), 7,87 (с, 1H), 6,85- 6,82 (м, 1H), 6,57 (с, 1H), 6,54 (дд, J=2,3, 7,5 Гц, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 3,78 (д, J=13,0 Гц, 2H), 3,67-3,60 (м, 1H), 3,29 (т, J=7,2 Гц, 2H), 3,17 (т, J=7,6 Гц, 2H), 2,95-2,88 (м, 2H), 2,40-2,31 (м, 2H), 2,07-1,98 (м, 2H), 1,95-1,82 (м, 2H); ВЭЖХ (способ 1) 97,1% (AUC), tR=10,69 мин.; ESI MS m/z 491 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N,N- диметилпиперидин-4-амина 20l (пример 92);
Соединение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N,N-диметилпиперидин-4-амин 20l получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-метилпиперазин-1-ил)имидазо[1,2-a]пиридин 13af, и получали в виде твердого вещества белого цвета (выход 12%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,89-7,84 (м, 2H), 6,81 (д, J=2,3 Гц, 1H), 6,58-6,54 (м, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,76 (д, J=12,7 Гц, 2H), 2,83-2,74 (м, 2H), 2,36-2,26 (м, 7H), 1,95 (д, J=12,8 Гц, 2H), 1,71-1,59 (м, 2H); ВЭЖХ (способ 2) 96,5% (AUC), tR=15,45 мин; APCI MS m/z 415 [M+H]+.
Получение метил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)карбамата 20m (пример 122);
Соединение метил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)карбамат 20m получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 59%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (ушир. с, 1H), 7,88 (д, J=7,6 Гц, 1H), 7,86 (с, 1H), 6,81 (с, 1H), 6,57 (с, 1H), 6,54 (д, J=7,6 Гц, 1H), 4,60 (ушир. с, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,71-3,62 (м, 6H), 2,13-2,01 (м, 2H), 1,57-1,48 (м, 2H); ВЭЖХ (способ 1) 97,5% (AUC), tR=10,61 мин; ESI MS m/z 445 [M+H]+.
Получение N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)пиваламида 20n (пример 123);
Соединение N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)пиваламид 20n получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 45%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,88 (д, J=7,6 Гц, 1H), 7,86 (с, 1H), 6,81 (с, 1H), 6,58 (с, 1H), 6,54 (д, J=7,6 Гц, 1H), 5,47 (ушир. с, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,72-3,64 (м, 2H), 3,02-2,93 (м, 2H), 2,08-2,00 (м, 2H), 1,58-1,48 (м, 2H), 1,19 (с, 9H); ВЭЖХ (способ 1) 97,9% (AUC), tR=10,98 мин; ESI MS m/z 471 [M+H]+.
Получение диметил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)фосфорамидата 20o (пример 198);
Диметил (1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)фосфорамидат 20o получали аналогичным образом, как диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этил)фосфонат 13ae, и получали в виде гигроскопического твердого вещества коричневого цвета (выход 23%).
1H ЯМР (400 МГц, CDCl3): δ 8,13 (д, J=7,5 Гц, 1H), 8,05 (с, 1H), 7,95 (с, 1H), 6,78 (с, 1H), 6,77 (д, J=7,5 Гц, 1H), 6,67 (с, 1H), 4,01 (с, 3H), 3,95 (с, 3H), 3,94-3,92 (м, 2H), 3,82 (с, 3H), 3,79 (с, 3H), 3,29-3,27 (м, 1H), 2,94-2,91 (м, 2H), 2,02-2,00 (м, 2H), 1,63-1,61 (м, 2H); ВЭЖХ (способ 1) 97,1% (AUC), tR=10,37 мин; APCI MS m/z 495 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил) -N- метилпиперидин-4-амина гидрохлорида 20p (пример 24);
Соединение трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)карбамат (145 мг, 2,31 ммоль) растворяли в 1 мл 1,2 M HCl в метаноле и перемешивали в течение 3 ч. Растворитель удаляли для того, чтобы получить 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-метилпиперидин-4-амина гидрохлорид 20p в виде твердого вещества белого цвета (выход 76%).
1H ЯМР (300 МГц, CD3OD): δ 8,41 (д, J=7,7 Гц, 1H), 8,11 (с, 1H), 7,77 (с, 1H), 6,89 (д, J=7,7 Гц, 1H), 6,82 (м, 2H), 4,26-4,20 (м, 2H), 4,08 (с, 3H), 4,00 (с, 3H), 3,42-3,41 (м, 1H), 3,29-3,21 (м, 2H), 2,80 (с, 3H), 2,36-2,30 (м, 2H), 1,73-1,69 (м, 2H); ВЭЖХ (способ 4)=99,4% (AUC), tR=14,37 мин; APCI MS m/z 401 [M+H]+.
Получение 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)- N,N- диметилэтанамина 20q (пример 94);
Cмесь 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этанамина (120 мг, 0,28 ммоль), цианоборогидрида натрия (145,2 мг, 2,31 ммоль), формальдегида (37%) (117 мкл) и уксусной кислоты (132 мкл, 0,23 ммоль) в метаноле (1,5 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь фильтровали и остаток распределялся между водой и хлороформом. Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и остаток очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)-N,N-диметилэтанамин 20q (15 мг, 9%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,86 (д, J=7,5 Гц, 1H), 7,84 (с, 1H), 6,82-6,79 (м, 1H), 6,57 (с, 1H), 6,55 (дд, J=2,4, 7,6 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,71 (д, J=12,6 Гц, 2H), 2,82-2,73 (м, 2H), 2,48-2,41 (м, 2H), 2,33 (с, 6H), 1,85-1,77 (м, 2H), 1,57-1,48 (м, 3H), 1,45-1,32 (м, 3H); ВЭЖХ (способ 2) 95,9% (AUC), tR=16,21 мин.; ESI MS m/z 443 [M+H]+.
Схема 6
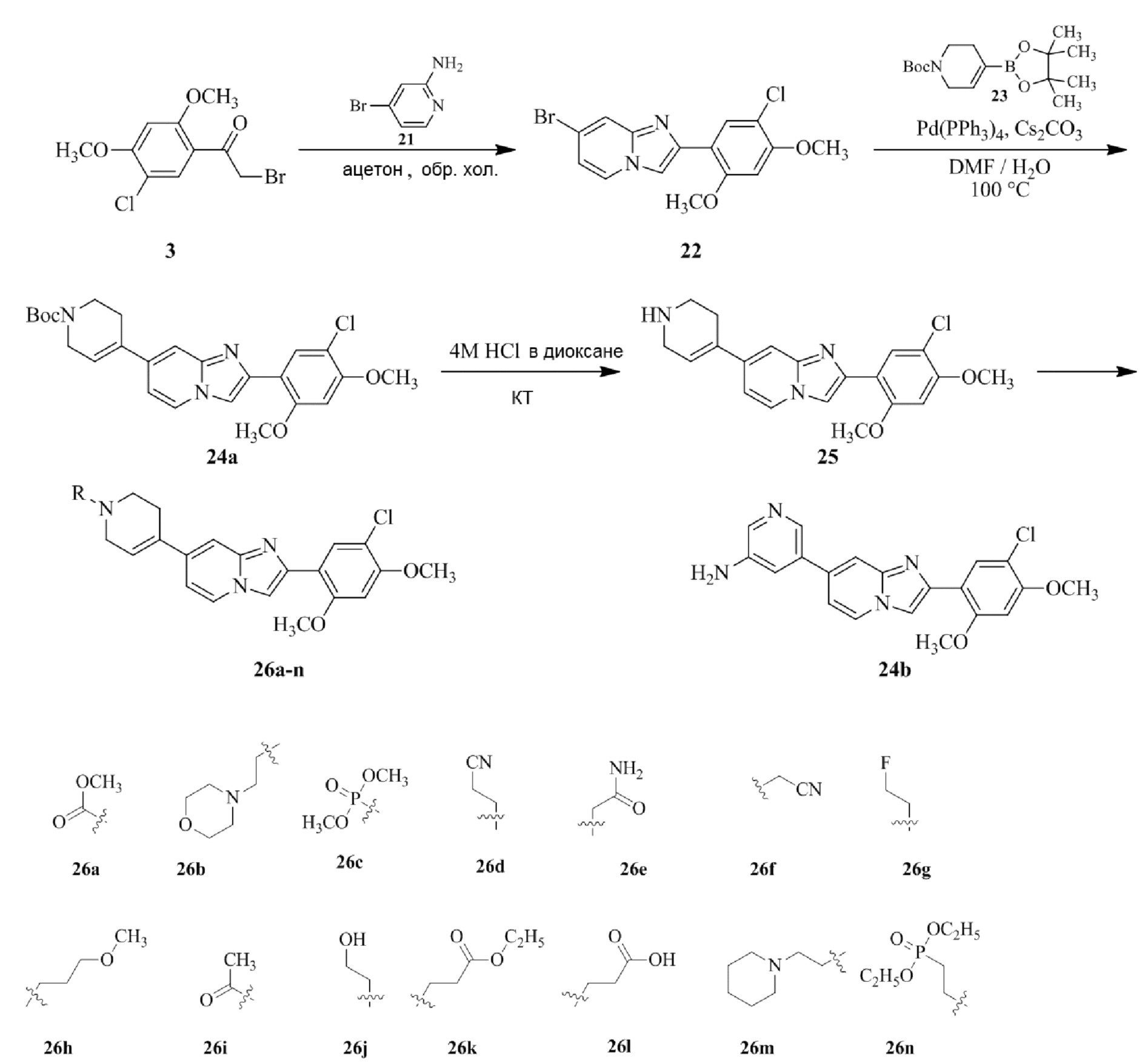
Получение 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридина 22;
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (678 мг, 2,31 ммоль) и 4-бромпиридин-2-амина 21 (400 мг, 2,31 ммоль) в ацетоне (10 мл) нагревали при 75°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета фильтровали, промывали ацетоном и сушили при пониженном давлении. Соединение 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина гидробромид 22 (500 мг, 48%) получали в виде твердого вещества грязно-белого цвета. HBr соль (450 мг, 1,0 ммоль) суспендировали в водном аммиаке (10 мл) и перемешивали в течение 2 ч. Твердое вещество собирали посредством фильтрования и сушили при пониженном давлении для того, чтобы получить 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин 22 (310 мг, 86%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,77 (дд, J=0,6, 7,2 Гц, 1H), 8,65 (д, J=0,6 Гц, 1H), 8,17-8,11 (м, 1H), 8,06 (с, 1H), 7,6 (дд, J=2,0, 7,2 Гц, 1H), 4,08 (с, 3H), 4,00 (с, 3H); ВЭЖХ (способ 2) >99% (AUC), tR=17,43 мин.; APCI MS m/z 369 [M+H]+.
Получение трет -бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]-5,6-дигидропиридин-1(2H)-карбоксилата 24a;
Cмесь 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 22 (100 мг, 0,272 ммоль), трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2H)-карбоксилата 23 (101 мг, 0,326 ммоль) и Cs2CO3 (221 мг, 0,680 ммоль) в DMF/H2O (2 мл/0,4 мл) дегазировали азотом, затем добавляли Pd(PPh3)4 (16 мг, 0,136 ммоль). Реакционную смесь нагревали при 90°C микроволнами в течение 30 мин и выливали в воду (20 мл). Полученный таким образом осадок собирали посредством фильтрования, промывали водой и сушили при пониженном давлении. Твердое вещество очищали посредством колоночной хроматографии (силикагель, 2:10 EtOAc/гексаны) для того, чтобы получить трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидропиридин-1(2H)-карбоксилат 24a (80 мг, 62%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 8,03 (с, 1H), 8,02-7,98 (м, 1H), 7,51 (с, 1H), 6,88 (дд, J=1,6, 7,1 Гц, 1H), 6,58 (с, 1H), 6,21 (ушир. с, 1H), 4,16-4,09 (м, 2H), 4,00 (с, 3H), 3,95 (с, 3H), 3,66 (т, J=5,6 Гц, 2H), 2,56 (ушир. с, 2H), 1,50 (с, 9H); ВЭЖХ (способ 2) 97,6% (AUC), tR=22,16 мин.; ESI MS m/z 470 [M+H]+.
Получение 5-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пиридин-3-амина 24b (пример 27);
5-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиридин-3-амин 24b получали аналогичным образом, как трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидропиридин-1(2H)-карбоксилат 24a, с использованием (5-аминопиридин-3-ил)бороновой кислоты взамен трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2H)-карбоксилата 23 и получали в виде твердого вещества грязно-белого цвета (выход 24%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,62 (д, J=7,1 Гц, 1H), 8,34 (с, H), 8,25 (с, H), 8,17 (д, J=1,7 Гц, 1H) 7,97 (д, J=2,3 Гц, 1H), 7,76 (с, 1H), 7,25 (т, J=2,2 Гц, 1H), 7,16 (дд, J=1,5, 7,1 Гц, 1H), 6,91 (с, 1H), 5,48 (с, 2H), 4,04 (с, 3H), 3,95 (с, 3H); ВЭЖХ (способ 4) 96,3% (AUC), tR=15,74 мин.; ESI MS m/z 381 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(3,6-дигидро-2 H -пиран-4-ил)имидазо[1,2- a ]пиридина 24c (пример 118);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(3,6-дигидро-2H-пиран-4-ил)имидазо[1,2-a]пиридин 24c получали аналогичным образом, как 24a, с использованием 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана вместо трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2H)-карбоксилата 23 и получали в виде твердого вещества грязно-белого цвета (выход 33%).
1H ЯМР (400 МГц, CDCl3): δ 8,45 (с, 1H), 8,04 (с, 1H), 8,02 (дд, J=0,7, 7,2 Гц, 1H), 7,52 (с, 1H), 6,91 (дд, J=1,8, 7,2 Гц, 1H), 6,59 (с, 1H), 6,31-6,27 (м, 1H), 4,39-4,35 (м, 2H), 4,01 (с, 3H), 3,99-3,94 (м, 5H), 2,59-2,53 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=10,43 мин.; ESI MS m/z 371 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(пиперидин-4-ил)имидазо[1,2-a]пиридина 24d (пример 112);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2-a]пиридина 25 (100 мг) в THF (8,0 мл, с несколькими каплями MeOH) добавляли Pd/C (10%, 10 мг). Получаемую суспензию дегазировали водородом в течение 15 минут и оставляли перемешиваться в течение ночи. Реакционную смесь фильтровали через слой целита; и целит промывали в MeOH. Затем объединенный фильтрат концентрировали для того, чтобы получить неочищенный материал, который далее растирали в порошок с 20% CHCl3/гексанами для того, чтобы получить желаемый продукт 2-(5-хлор-2,4-диметоксифенил)-7-(пиперидин-4-ил)имидазо[1,2-a]пиридин 24d в виде твердого вещества белого цвета (80 мг, 80%).
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 8,03-7,99 (м, 2H), 7,39 (с, 1H), 6,65 (д, J=7,4 Гц, 1H), 6,59 (с, 1H), 4,00 (с, 3H), 3,96 (с, 3H), 3,24 (д, J=12,3 Гц, 2H), 2,83-2,74 (м, 2H), 2,70-2,60 (м, 2H), 1,91 (д, J=13,1 Гц, 2H), 1,72 -1,65 (м, 2H); ВЭЖХ (способ 2) 98,5% (AUC), tR=14,96 мин.; ESI MS m/z 372 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2- a ]пиридина 25 (пример 52);
Раствор трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидропиридин-1(2H)-карбоксилата 24a (55 мг, 0,117 ммоль) в 4,0 M HCl в диоксане (2 мл) перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь фильтровали, и твердое вещество промывали диоксаном и сушили при пониженном давлении для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2-a]пиридина гидрохлорид 25 (25 мг, 48%) в виде твердого вещества грязно-белого цвета. Соль суспендировали в 10 мл водного аммиака, перемешивали в течение 1 ч при комнатной температуре и экстрагировали хлороформом (2×20 мл). Органический слой сушили и концентрировали для того, чтобы получить свободное основание 2-(5-хлор-2,4-диметоксифенил)-7-(1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2-a]пиридин 25 в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,40 (с, 1H), 8,04 (д, J=0,6 Гц, 1H), 8,02 (дд, J=0,6, 7,2 Гц, 1H), 7,52 (с, 1H), 6,80 (дд, J=1,4, 7,2 Гц, 1H), 6,59 (с, 1H), 6,22 (с, 1H), 4,18 (с, 2H), 3,96 (с, 3H), 3,76 (с, 3H), 3,75-3,65 (м, 2H), 2,58 (с, 2H); ВЭЖХ (способ 3) 98,9% (AUC), tR=17,32 мин.; ESI MS m/z 428 [M+H]+.
Получение метил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]-5,6-дигидропиридин-1(2 H )-карбоксилата 26a (пример 102);
Метил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидро-пиридин-1(2H)-карбоксилат 26a получали аналогичным образом, как метил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 13h, и получали в виде твердого вещества желто-зеленого цвета (выход 52%).
1H ЯМР (400 МГц, CDCl3): δ 8,40 (с, 1H), 8,04 (д, J=0,6 Гц, 1H), 8,02 (дд, J=0,6, 7,2 Гц, 1H), 7,52 (с, 1H), 6,80 (дд, J=1,4, 7,2 Гц, 1H), 6,59 (с, 1H), 6,22 (с, 1H), 4,18 (с, 2H), 4,01 (с, 3H), 3,96 (с, 3H), 3,76 (с, 3H), 3,75-3,65 (м, 2H), 2,58 (с, 2H); ВЭЖХ (способ 3) 98,9% (AUC), tR=17,32 мин.; ESI MS m/z 428 [M+H]+.
Получение 4-(2-{4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]-5,6-дигидропиридин-1(2 H )-ил}этил)морфолина 26b (пример 144);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2-a]пиридина 25 (100 мг, 0,27 ммоль), карбоната калия (74 мг, 0,54 ммоль) и 4-(2-хлорэтил)морфолина (45 мкл, 0,29 ммоль) в ацетонитриле (5 мл) нагревали с обратным холодильником в течение 3 ч. Реакционную смесь фильтровали через фильтровальную подушку и споласкивали в DCM (10 мл). Объединенные фильтраты концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить 4-(2-{4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидропиридин-1(2H)-ил}этил)морфолин 26b (62 мг, 47%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, CH3OD): δ 8,22 (д, J=7,6 Гц, 1H), 8,08 (с, 1H), 7,97 (с, 1H), 7,31 (с, 1H), 7,04 (д, J=7,6 Гц, 1H), 6,71 (с, 1H), 6,34 (ушир. с, 1H), 4,32 (т, J=5,2 Гц, 2H), 4,17-4,14 (м, 2H), 4,00 (с, 3H), 3,92 (с, 3H), 3,74-3,71 (м, 6H), 2,83 (т, J=5,2 Гц, 2H), 2,72-2,69 (м, 4H), 2,56-2,52 (м, 2H); ВЭЖХ (способ 2) 98,54% (AUC), tR=15,69 мин.; LCMS-ESI m/z 481 [M-H]-.
Получение диметил{4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]-5,6-дигидропиридин-1(2 H )-ил}фосфоната 26c (пример 195);
Диметил{4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидропиридин-1(2H)-ил}фосфонат 26c получали аналогичным образом, как трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидропиридин-1(2H)-карбоксилат 24a, и получали в виде твердого вещества грязно-белого цвета (выход 31%).
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 8,05 (с, 1H), 8,03 (дд, J=0,6 Гц, 7,1 Гц, 1H), 7,53 (ушир. с, 1H), 6,90 (дд, J=1,8 Гц, 7,3 Гц, 1H), 6,59 (с, 1H), 6,27 (т, J=1,5 Гц, 1H), 4,01 (с, 3H), 3,96 (с, 3H), 3,89 (дд, J=3,0 Гц, 5,6 Гц, 2H), 3,73 (с, 3H), 3,70 (с, 3H), 3,46-3,39 (м, 2H), 2,58-2,51 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=10,30 мин. ESI MS m/z 478 [M+H]+.
Получение 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)пропаннитрила 26d (пример 109);
3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)пропаннитрил 26d получали аналогичным образом, как 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пропаннитрил 13q, и получали в виде твердого вещества грязно-белого цвета (выход 65%).
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 8,03 (с, 1H), 8,00 (дд, J=0,7, 7,2 Гц, 1H), 7,52 (с, 1H), 6,90 (дд, J=1,8, 7,2 Гц, 1H), 6,59 (с, 1H), 6,22 (ушир. с, 1H), 4,00 (с, 3H), 3,96 (с, 3H), 3,32-3,27 (м, 2H), 2,89-2,78 (м, 4H), 2,66-2,56 (м, 4H); ВЭЖХ (способ 3) >99% (AUC), tR=15,31 мин; ESI MS m/z 423 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)ацетамида 26e (пример 110);
2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)ацетамид 26e получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-метоксиэтил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13m, и получали в виде твердого вещества грязно-белого цвета (выход 42%).
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 8,05 (с, 1H), 8,02 (дд, J=0,8, 7,2 Гц, 1H), 7,52 (ушир. с, 1H), 6,91 (дд, J=2,1, 7,2 Гц, 1H), 6,59 (с, 1H), 6,25 (ушир. с, 1H), 5,42 (ушир. с, 1H), 4,01 (с, 3H), 3,96 (с, 3H), 3,34-3,30 (м, 2H), 3,17 (с, 2H), 2,86 (т, J=5,6 Гц, 2H), 2,66-2,60 (м, 2H); ВЭЖХ (способ 3) 99,1% (AUC), tR=15,10 мин; ESI MS m/z 427 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)ацетонитрила 26f (пример 111);
2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)ацетонитрил 26f получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-метоксиэтил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13m, и получали в виде твердого вещества грязно-белого цвета (выход 43%).
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 8,04 (с, 1H), 8,02 (дд, J=0,7, 7,2 Гц, 1H), 7,52 (ушир. с, 1H), 6,90 (дд, J=2,0, 7,2 Гц, 1H), 6,59 (с, 1H), 6,25 (ушир. с, 1H), 4,01 (с, 3H), 3,96 (с, 3H), 3,69 (с, 2H), 3,40-3,35 (м, 2H), 2,89 (т, J=5,6 Гц, 2H), 2,72-2,65 (м, 2H); ВЭЖХ (способ 3) >99% (AUC), tR=16,79 мин; ESI MS m/z 409 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(1-(2-фторэтил)-1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2- a ]пиридина 26g (пример 113);
2-(5-хлор-2,4-диметоксифенил)-7-(1-(2-фторэтил)-1,2,3,6- тетрагидропиридин-4-ил)имидазо[1,2-a]пиридин 26g получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(3-метоксипропил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13n, и получали в виде твердого вещества грязно-белого цвета (выход 38%).
1H ЯМР (400 МГц, CDCl3): δ 8,40 (с, 1H), 8,03 (с, 1H), 7,99 (дд, J=7,2 Гц, 1H), 7,52 (ушир. с, 1H), 6,91 (дд, J=7,2 Гц, 1H), 6,59 (с, 1H), 6,25 (ушир. с, 1H), 4,71 (т, J=4,9 Гц, 1H), 4,59 (т, J=4,9 Гц, 1H), 4,00 (с, 3H), 3,96 (с, 3H), 3,34-3,30 (м, 2H), 2,91-2,80 (м, 4H), 2,67-2,61 (м, 4H); ВЭЖХ (способ 3) >99% (AUC), tR=15,32 мин; ESI MS m/z 416 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(1-(3-метоксипропил)-1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2- a ]пиридина 26h (пример 116);
2-(5-хлор-2,4-диметоксифенил)-7-(1-(3-метоксипропил)-1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2-a]пиридин 26h получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-метоксиэтил)пиперазин-1-ил)имидазо[1,2-a]пиридин 13m, и получали в виде твердого вещества грязно-белого цвета (выход 35%).
1H ЯМР (400 МГц, CDCl3): δ 8,40 (с, 1H), 8,02 (с, 1H), 7,99 (дд, J=0,8, 7,2 Гц, 1H), 7,52 (ушир. с, 1H), 6,91 (дд, J=2,1, 7,2 Гц, 1H), 6,59 (с, 1H), 6,26 (ушир. с, 1H), 4,00 (с, 3H), 3,96 (с, 3H), 3,47 (т, J=6,4 Гц, 2H), 3,35 (с, 3H), 3,23-3,20 (м, 2H), 2,76-2,72 (м, 2H), 2,65-2,54 (м, 4H), 1,91-1,81 (м, 2H); ВЭЖХ (способ 3)97,4% (AUC), tR=15,43 мин; ESI MS m/z 442 [M+H]+.
Получение 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-5,6-дигидропиридин-1(2 H )-ил)этанона 26i (пример 120);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2-a]пиридина 25 (70 мг, 0,18 ммоль), уксусного ангидрида (73 мкл, 0,36 ммоль) и DIPEA (73 мкл, 0,56 ммоль) в DCM (1 мл) перемешивали при КТ в течение 3 ч. Реакционную смесь разводили водой и экстрагировали с использованием DCM (10 мл). Органическую фазу концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)этанон 26i (53 мг, 65%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 8,05 (с, 1H), 8,03 (дд, J=0,9, 7,3 Гц, 1H), 7,54 (ушир. с, 1H), 7,49 (с, 1H), 6,92-6,85 (м, 1H), 6,59 (с, 1H), 6,29-6,16 (м, 1H), 4,32-4,28 (м, 1H), 4,20-4,17 (м, 1H), 4,01 (с, 3H), 3,96 (с, 3H), 3,88-3,82 (м, 1H), 3,73-3,68 (м, 1H), 2,66-2,55 (м, 2H), 2,17 (с, 3H); ВЭЖХ (способ 1) >99% (AUC), tR=10,06 мин; ESI MS m/z 412 [M+H]+
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-5,6-дигидропиридин-1(2 H )-ил)этанола 26j (пример 134);
Соединение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)этанол 26j получали аналогичным образом, как 4-(2-{4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидропиридин-1(2H)-ил}этил)морфолин 26b, и получали в виде твердого вещества грязно-белого цвета (выход 61%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,45 (д, J=7,2 Гц, 1H), 8,24 (м, 2H), 7,42 (с, 1H), 7,10-7,08 (м, 1H), 6,89 (м, 1H), 6,40 (м, 1H), 4,41 (м, 1H), 4,02 (с, 3H), 3,94 (с, 3H), 3,57-3,55 (м, 2H), 3,17 (м, 2H) 2,69-2,67 (м, 2H), 2,53-2,51 (м, 4H); ВЭЖХ (способ 2) >99% (AUC), tR=14,78 мин.; ESI MS m/z 414 [M+H]+.
Получение этил-3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-5,6-дигидропиридин-1(2 H )-ил)пропаноата 26k (пример 140);
Соединение этил-3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)пропаноат 26k получали аналогичным образом, как 4-(2-{4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидро-пиридин-1(2H)-ил}этил)морфолин 26b, и получали в виде твердого вещества грязно-белого цвета (выход 56%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,46- 8,48(д, J=7,2 Гц, 1H), 8,26-8,21 (м, 2H), 7,48 (м, 1H), 7,12-7,10 (м, 1H), 6,89 (м, 1H), 6,41 (м, 1H), 4,13-4,11 (м, 2H), 4,08-4,06 (м, 3H), 4,03-3,95 (м, 3H), 3,44-3,31 (м, 3H), 2,97 (с, 3H) 2,69-2,65 (м, 4H), 1,23-1,18 (м, 3H); ВЭЖХ (способ 1) 95,6% (AUC), tR=9,28 мин. ESI MS m/z 470 [M+H]+.
Получение 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)пропановой кислоты 26l (пример 141);
Cмесь этил-3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)пропаноата 26k (70 мг, 0,14 ммоль), гидроксида лития (7 мг, 0,28 ммоль) и воды (0,5 мл) в метаноле (5 мл) перемешивали при КТ в течение 8 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток закисляли разбавленной HCl, и осадок собирали посредством фильтрования; промывали водой и сушили для того, чтобы получить 3-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)пропановую кислоту 26l (29 мг, 45%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 11,80 (ушир. с, 1H), 8,52-8,49 (д, J=7,2 Гц, 1H), 8,29 (с, 1H), 8,21 (с, 1H), 7,75 (м, 1H), 7,15-7,13 (м, 1H), 6,90 (с, 1H), 6,43 (м, 1H), 4,03 (с, 3H), 3,95 (с, 3H), 3,74 (м, 2H), 3,22 (м, 4H), 2,78 (м, 4H); ВЭЖХ (способ 1) >99% (AUC), tR=14,96 мин.; ESI MS m/z 442 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(1-(2-(пиперидин-1-ил)этил)-1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2- a ]пиридина 26m (пример 147);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2-a]пиридина 25 (100 мг, 0,27 ммоль), карбоната цезия (74 мг, 0,54 ммоль) и 4-(2-хлорэтил)пиперидина гидрохлорида (50 мг, 0,29 ммоль) в DMF (5 мл) нагревали с обратным холодильником в течение 16 ч. Реакцию гасили водой и ощелачивали раствором аммиака (2 мл). Реакционную смесь экстрагировали этилацетатом и промывали водой. Органическую фазу концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(1-(2-(пиперидин-1-ил)этил)-1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2-a]пиридин 26m (66 мг, 51%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): 8,56 (д, J=7,2 Гц, 1H), 8,45 (с, 1H), 8,26 (с, 1H), 7,45 (м, 1H), 7,13-6,93 (м, 1H), 6,89 (с, 1H), 6,42 (м, 1H), 4,03 (с, 3H), 3,95 (с, 3H), 3,21 (м, 2H), 2,80-2,78 (м, 3H), 2,72-2,68 (м, 5H), 2,66-2,64 (м, 2H) 1,62-1,60 (м, 5H), 1,48-1,44 (м, 3H); ВЭЖХ (способ 1) >99% (AUC), tR=8,83 мин, ESI MS m/z 481 [M+H]+.
Получение диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)этил)фосфоната 26n (пример 194);
Диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)этил)фосфонат 26n получали аналогичным образом, как диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этил)фосфонат 13ae, и получали в виде гигроскопического твердого вещества желто-коричневого цвета (выход 35%).
1H ЯМР (300 МГц, CDCl3): δ 8,39 (с, 1H), 8,03 (с, 1H), 7,99 (д, J=7,3 Гц, 1H), 6,59 (с, 1H), 6,25 (ушир. с, 1H), 4,19-4,06 (м, 4H), 4,00 (с, 3H), 3,95 (с, 3H), 3,26-3,20 (м, 2H), 2,86-2,72 (м, 4H), 2,62 (ушир. с, 2H), 2,13-1,99 (м, 2H), 1,37-1,34 (м, 6H); ВЭЖХ (способ 1) 98,5% (AUC), tR=9,27 мин; ESI MS m/z 534 [M+H]+.
Схема 7
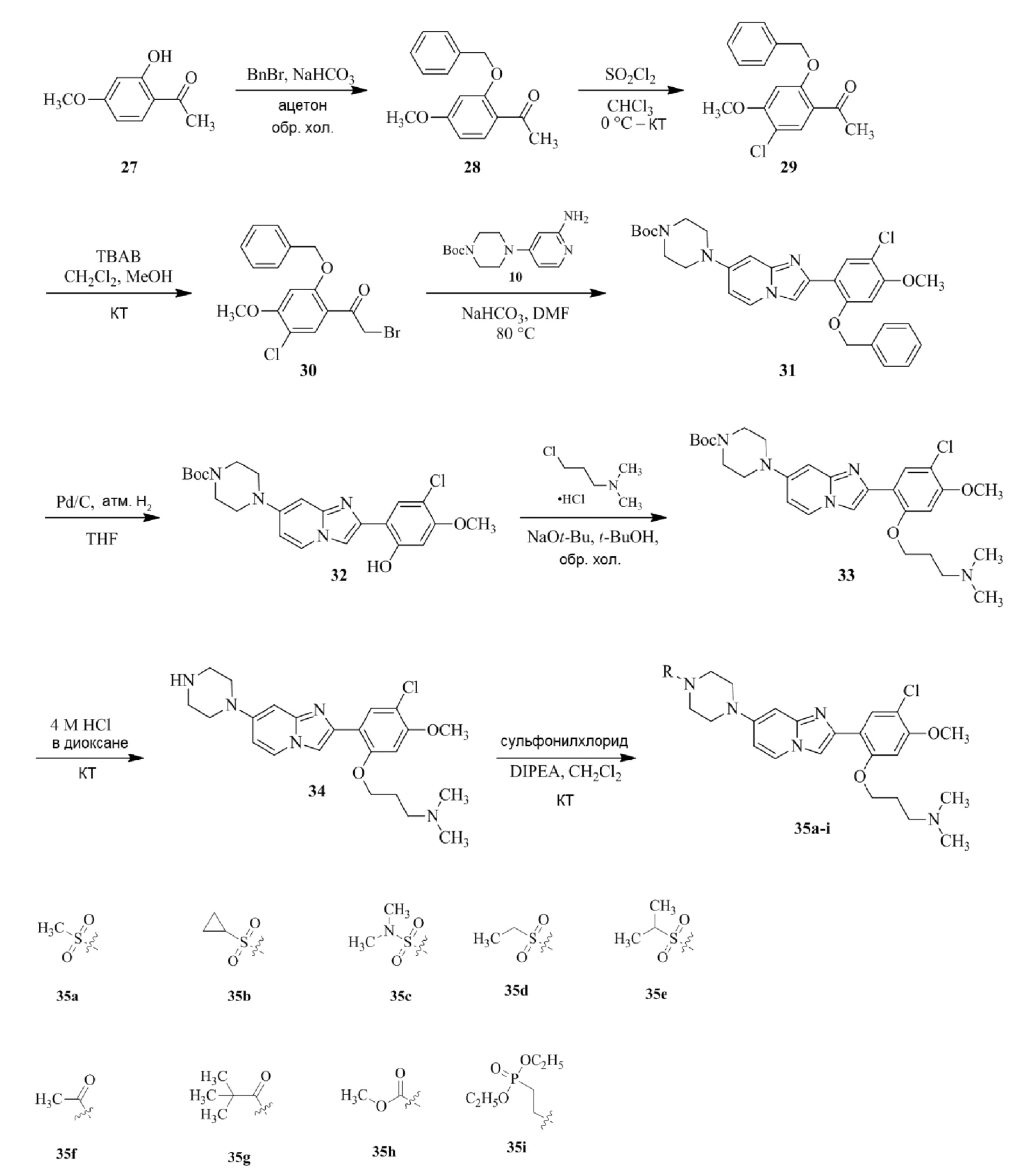
Получение трет -бутил-4-{2-[2-(бензилокси)-5-хлор-4-метоксифенил]имидазо[1,2- a ]-пиридин-7-ил}пиперазин-1-карбоксилата 31;
Раствор 1-[2-(бензилокси)-5-хлор-4-метоксифенил]-2-бромэтанона 30 (132 мг, 0,359 ммоль) и трет-бутил-4-(2-аминопиридин-4-ил)пиперазин-1-карбоксилата 10 (100 мг, 0,359 ммоль) в ацетоне (2 мл) нагревали при 75°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета собирали посредством фильтрования и промывали ацетоном. Твердое вещество суспендировали в водном аммиаке (10 мл) и перемешивали в течение 2 ч. Реакционную смесь фильтровали и сушили при пониженном давлении для того, чтобы получить желаемое соединение трет-бутил-4-{2-[2-(бензилокси)-5-хлор-4-метоксифенил]имидазо[1,2-a]пиридин-7-ил}пиперазин-1-карбоксилат 31 (140 мг, 71%) в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, CD3OD): δ 8,30 (д, J=7,7 Гц, 1H), 7,99 (с, 1H), 7,77 (с, 1H), 7,52-7,46 (м, 2H), 7,45-7,31 (м, 3H), 7,15 (м, 1H), 6,69 (с, 1H), 6,79-6,74 (м, 1H), 5,40 (с, 2H), 3,90 (с, 3H), 3,67-3,51 (м, 8H), 1,49 (с, 9H); ВЭЖХ (способ 3) >99% (AUC), tR=19,63 мин.; ESI MS m/z 549 [M+H]+.
Получение трет -бутил-4-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2- a ]-пиридин-7-ил]пиперазин-1-карбоксилата 32;
В раствор 31 (400 мг, 0,73 ммоль) в THF загружали Pd/C (100 мг). Реакционную смесь перемешивали при комнатной температуре в атмосфере H2 (1 атм.) в течение 6 ч. Реакционную смесь фильтровали через небольшую подушку целита и промывали подушку хлороформом. Объединенный органический фильтрат концентрировали при пониженном давлении и остаток очищали посредством колоночной хроматографии (силикагель, 10:1 DCM/MeOH) для того, чтобы получить трет-бутил-4-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 32 (200 мг, 60%) в виде твердого вещества сине-зеленого цвета.
1H ЯМР (400 МГц, CDCl3): δ 7,79 (д, J=7,5 Гц, 1H), 7,52 (с, 1H), 7,49 (с, 1H), 6,74 (д, J=2,2 Гц, 1H), 6,63 (дд, J=2,4, 7,5 Гц, 1H), 6,60 (с, 1H), 3,90 (с, 3H), 3,61 (т, J=5,0 Гц, 4H), 3,23 (т, J=5,1 Гц, 4H), 1,49 (с, 9H); ВЭЖХ (способ 1) >99% (AUC), tR=11,20 мин.; ESI MS m/z 459 [M+H]+.
Получение трет -бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-карбоксилата 33 (пример 127);
В смесь трет-бутил-4-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилата 32 (200 мг, 0,44 ммоль) и диметиламинпропилхлорида (93 мг, 0,52 ммоль) в tBuOH добавляли NaOtBu (126 мг, 1,39 ммоль). После перемешивария при 90°C в течение 4 ч реакционную смесь разводили в CH2Cl2/MeOH (20 мл/2 мл). Органический слой промывали солевым раствором (10 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии (силикагель, 1:10:0,1 метанол/DCM/гидроксид аммония) для того, чтобы получить трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 33 (130 мг, 55%) в виде твердого вещества сине-зеленого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,92 (д, J=7,4 Гц, 1H), 7,91 (с, 1H), 6,81 (д, J=2,4 Гц, 1H), 6,59 (с, 1H), 6,55 (дд, J=2,4, 7,4 Гц, 1H), 4,19 (т, J=6,6 Гц, 2H), 3,93 (с, 3H), 3,64-3,56 (м, 4H), 3,23-3,15 (м, 4H), 2,54 (т, J=6,6 Гц, 2H), 2,29 (с, 6H), 2,20-2,08 (м, 2H), 1,49 (с, 9H); ВЭЖХ (способ 3) 97,6% (AUC), tR=10,00 мин.; ESI MS m/z 544 [M+H]+
Получение 3-{4-хлор-5-метокси-2-[7-(пиперазин-1-ил)имидазо[1,2- a ]пиридин-2-ил]фенокси}- N,N- диметилпропан-1-амина 34 (пример 139);
Раствор трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метокси-фенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилата 33 (35 мг, 0,064 ммоль) в 4,0 M HCl в диоксане (1 мл) нагревали при 50°C в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении и остаток суспендировали в водном аммиаке (10 мл). Суспензию перемешивали при комнатной температуре в течение 2 ч и экстрагировали хлороформом (2×10 мл). Объединенный органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали посредством колоночной хроматографии (силикагель, 1:10:0,1 метанол/DCM/гидроксид аммония) для того, чтобы получить 3-{4-хлор-5-метокси-2-[7-(пиперазин-1-ил)имидазо[1,2-a]пиридин-2-ил]фенокси}-N,N-диметилпропан-1-амин 34 (20 мг, 71%) в виде твердого вещества сине-зеленого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 7,90 (д, J=7,4 Гц, 1H), 7,89 (с, 1H), 6,80 (д, J=2,4 Гц, 1H), 6,58 (с, 1H), 6,55 (дд, J=2,4, 7,4 Гц, 1H), 4,18 (т, J=6,6 Гц, 2H), 3,90 (с, 3H), 3,22-3,17 (м, 4H), 3,07-3,02 (м, 4H), 2,54 (т, J=6,6 Гц, 2H), 2,29 (с, 6H), 2,19-2,08 (м, 2H); ВЭЖХ (способ 3) 96,4% (AUC), tR=14,35 мин; ESI MS m/z 444 [M+H]+.
Получение 3-(4-хлор-5-метокси-2-{7-[4-(метилсульфонил)пиперазин-1-ил]-имидазо[1,2- a ]пиридин-2-ил}фенокси)- N,N- диметилпропан-1-амина 35a (пример 155);
3-(4-хлор-5-метокси-2-{7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин-2-ил}фенокси)-N,N-диметилпропан-1-амин 35a получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 47%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 8,00 (д, J=7,4 Гц, 1H), 7,95 (с, 1H), 6,85 (д, J=2,4 Гц, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,4, 7,4 Гц, 1H), 4,19 (т, J=6,6 Гц, 2H), 3,94 (с, 3H), 3,45-3,30 (м, 8H), 2,84 (с, 3H), 2,58 (т, J=6,6 Гц, 2H), 2,32 (с, 6H), 2,22-2,10 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=9,21 мин.; APCI MS m/z 522 [M+H]+.
Получение 3-(4-хлор-2-{7-[4-(циклопропилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]-пиридин-2-ил}-5-метоксифенокси) N,N- диметилпропан-1-амина 35b (пример 160);
3-(4-хлор-2-{7-[4-(циклопропилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин-2-ил}-5-метоксифенокси)-N,N-диметилпропан-1-амин 35b получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]-пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 57%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,94 (д, J=7,4 Гц, 1H), 7,93 (с, 1H), 6,84 (д, J=2,4 Гц, 1H), 6,59 (с, 1H), 6,53 (дд, J=2,4, 7,4 Гц, 1H), 4,19 (т, J=6,6 Гц, 2H), 3,94 (с, 3H), 3,52-3,46 (м, 4H), 3,38-3,30 (м, 4H), 2,53 (т, J=6,6 Гц, 2H), 2,34-3,29 (м, 1H), 2,29 (с, 6H), 2,18-2,08 (м, 2H), 1,26-1,18 (м, 2H), 1,06-0,98 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=9,46 мин; ESI MS m/z 548 [M+H]+.
Получение 4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}-имидазо[1,2- a ]пиридин-7-ил) N,N- диметилпиперазин-1-сульфонамида 35c (пример 196);
4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)-N,N-диметилпиперазин-1-сульфонамид 35c получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желтого цвета (выход 37%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,96 (д, J=7,4 Гц, 1H), 7,93 (с, 1H), 6,82 (д, J=2,2 Гц, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,3, 7,5 Гц, 1H), 4,19 (т, J=6,3 Гц, 2H), 3,93 (с, 3H), 3,43-3,40 (м, 4H), 3,29-3,27(м, 4H), 2,87 (с, 6H), 2,56 (т, J=7,0 Гц, 2H), 2,30 (с, 6H), 2,18-2,13 (м, 2H); ВЭЖХ (способ 1) 98,4% (AUC), tR=9,55 мин.; ESI MS m/z 551 [M+H]+.
Получение 3-(4-хлор-2-(7-(4-(этилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиридин-2-ил)-5-метоксифенокси)- N,N- диметилпропан-1-амина 35d (пример 199);
3-(4-хлор-2-(7-(4-(этилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин-2-ил)-5-метоксифенокси)-N,N-диметилпропан-1-амин 35d получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 58%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,95 (д, J=7,6, 1H), 7,93 (с, 1H), 6,83 (д, J=2,4, 1H), 6,58 (с, 1H), 6,52 (дд, J=2,4, 7,6, 1H), 4,19 (т, J=6,4, 2H), 3,93 (с, 3H), 3,50-3,45 (м, 4H), 3,34-3,29 (м, 4H), 3,01 (дд, J=7,6, 15,2, 2H), 2,35 (т, J=6,9, 2H), 2,30 (с, 6H), 2,18-2,11 (м, 2H), 1,40 (т, J=7,6, 3H,); ВЭЖХ (способ 1) 94,42% (AUC), tR=9,38 мин.; APCI MS m/z 536 [M+H]+.
Получение 3-(4-хлор-2-(7-(4-(изопропилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]-пиридин-2-ил)-5-метоксифенокси)- N,N- диметилпропан-1-амина 35e (пример 197);
3-(4-хлор-2-(7-(4-(изопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин-2-ил)-5-метоксифенокси)-N,N-диметилпропан-1-амин 35e получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 22%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 8,00 (д, J=7,3, 1H), 7,95 (с, 1H), 6,82 (д, J=2,2, 1H), 6,57 (с, 1H), 6,53 (дд, J=2,2, 7,3, 1H), 4,19 (т, J=6,4, 2H), 3,93 (с, 3H), 3,55-3,50 (м, 4H), 3,31-3,20 (м, 5H), 2,60 (т, J=7,0, 2H), 2,33 (с, 6H), 2,22-2,13 (м, 2H), 1,39 (с, 3H), 1,37 (с, 3H); ВЭЖХ (способ 1) 96,93% (AUC), tR=9,57 мин.; ESI MS m/z 550 [M+H]+.
Получение 1-(4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)этанона 35f (пример 154);
Соединение 1-(4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этанон 35f получали аналогичным образом, как 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)этанон 26i, и получали в виде твердого вещества грязно-белого цвета (выход 66%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,94 (дд, J=0,9, 7,5 Гц, 1H), 7,92 (с, 1H), 6,81 (с, 1H), 6,59 (с, 1H), 6,55 (м, 1H), 4,19 (т, J=6,5 Гц, 2H), 3,93 (с, 3H), 3,81-3,77 (м, 2H), 3,68-3,63 (м, 2H), 3,26-3,19 (м, 4H), 2,53 (т, J=7,0 Гц, 2H), 2,28 (с, 6H), 2,16 (с, 3H), 2,15-2,09 (м, 2H). ВЭЖХ (способ 1) >99% (AUC), tR=8,93 мин; ESI MS m/z 486 [M+H]+.
Получение 1-(4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-2,2-диметилпропан-1-она 35g (пример 156);
Соединение 1-(4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-2,2-диметилпропан-1-он 35g получали аналогичным образом, как 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)этанон 26i, и получали в виде твердого вещества грязно-белого цвета (выход 52%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,99 (дд, J=7,4 Гц, 1H), 7,94 (с, 1H), 6,80 (ушир. с, 1H), 6,58 (с, 1H), 6,55 (м, 1H), 4,19 (т, J=6,3 Гц, 2H), 3,93 (с, 3H), 3,84-3,80 (м, 4H), 3,24-3,19 (м, 4H), 2,59 (т, J=7,1 Гц, 2H), 2,32 (с, 6H), 2,21-2,13 (м, 2H), 1,32 (с, 9H); ВЭЖХ (способ 1) 99,0% (AUC), tR=9,58 мин; ESI MS m/z 528 [M+H]+.
Получение метил-4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-карбоксилата 35h (пример 152);
Соединение метил-4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 35h получали аналогичным образом, как 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-5,6-дигидропиридин-1(2H)-ил)этанон 26i, и получали в виде твердого вещества грязно-белого цвета (выход 72%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,99 (дд, J=0,9, 7,5 Гц, 1H), 7,94 (с, 1H), 6,81 (с, 1H), 6,57 (с, 1H), 6,55 (дд, J=2,1, 7,52 Гц, 1H), 4,19 (т, J=6,3 Гц, 2H), 3,93 (с, 3H), 3,74 (с, 3H), 3,68-3,63 (м, 4H), 3,23-3,17 (м, 4H), 2,60 (т, J=7,2 Гц, 2H), 2,33 (с, 6H), 2,21-2,13 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=9,29 мин; ESI MS m/z 502 [M+H]+.
Получение диэтил(2-(4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)этил)фосфоната 35i (пример 219);
Диэтил(2-(4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этил)фосфонат 35i получали аналогичным образом, как диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этил)фосфонат 13ae, и получали в виде гигроскопического твердого вещества коричневого цвета (12 мг, 8%).
1H ЯМР (400 МГц, CDCl3); δ 8,38 (с, 1H), 7,93 (д, J=7,6, 1H), 7,91 (с, 1H), 6,80 (д, J=2,2, 1H), 6,58 (с, 1H), 6,55 (дд, J=2,4,7,6, 1H), 4,22-4,06 (м, 6H), 3,93 (с, 3H), 3,25 (т, J=4,9, 4H), 2,77-2,69 (м, 2H), 2,64 (т, J=4,9, 4H), 2,57 (т, J=7,0, 2H), 2,31 (с, 6H), 2,19-2,11 (м, 2H), 2,06-1,95 (м, 2H), 1,34 (т, J=7,0, 6H); ESI MS m/z 608 [M+H]+.
Схема 8
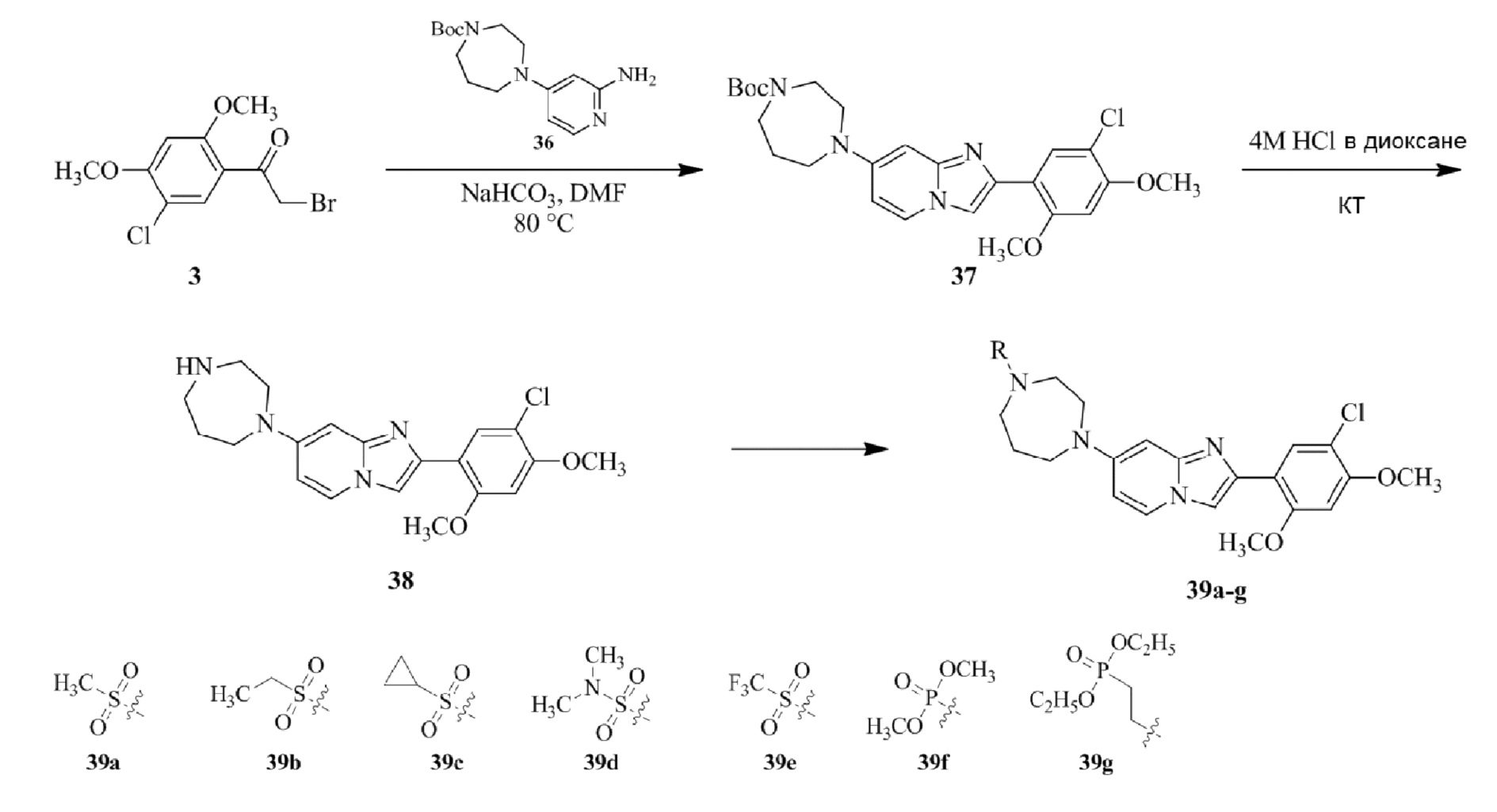
Получение трет -бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил]-1,4-диазепан-1-карбоксилата 37 (пример 184);
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (200 мг, 0,681 ммоль) и трет-бутил-4-(2-аминопиридин-4-ил)-1,4-диазепан-1-карбоксилата 36 (198 мг, 0,681 ммоль) в ацетоне (5 мл) нагревали при 75°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета собирали посредством фильтрования и промывали ацетоном. Осадок суспендировали в водном аммиаке (10 мл) и перемешивали в течение 2 ч. Твердое вещество фильтровали. Полученное твердое вещество азеотропно дистиллировали с метанолом и сушили при пониженном давлении для того, чтобы получить трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-1,4-диазепан-1-карбоксилат 37 (155 мг, 47%) в виде твердого вещества сине-зеленого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,37 (с, 1H), 7,89-7,85 (м, 2H), 6,82-6,79 (м, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,4, 7,7 Гц, 1H), 4,56-4,35 (м, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,70-3,60 (м, 3H), 2,98-2,86 (м, 2H), 2,11-2,01 (м, 2H), 1,63-1,49 (м, 2H), 1,45 (с, 9H); ESI MS m/z 487 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диазепан-1-ил)имидазо[1,2- a ]-пиридина 38 (пример 189);
2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диазепан-1-ил)имидазо[1,2-a]пиридин 38 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2-a]пиридин 25, и получали в виде твердого вещества грязно-белого цвета (выход 82%).
1H ЯМР (300 МГц, CD3OD): δ 8,37 (с, 1H), 7,85 (д, J=7,7 Гц, 1H). 7,81 (с, 1H), 6,61 (д, J=2,1 Гц, 1H), 6,58 (с, 1H), 6,44 (дд, J=2,1, 7,7 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,63 (т, J=6,4 Гц, 2H), 3,59 (т, J=6,4 Гц, 2H), 3,06 (т, J=6,4 Гц, 2H), 2,84 (т, J=6,4 Гц, 2H), 2,00-1,90 (2H, м); ESI MS m/z 387 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)-1,4-диазепан-1-ил]имидазо[1,2- a ]пиридина 39a (пример 201);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)-1,4-диазепан-1-ил]имидазо[1,2-a]пиридин 39a получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желто-зеленого цвета (выход 46%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,89 (д, J=7,4 Гц, 1H), 7,82 (с, 1H), 6,67 (ушир. с, 1H), 6,58 (с, 1H), 6,44 (дд, J=2,5, 7,5 Гц, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 3,76-3,71 (м, 4H), 3,54 (т, J=5,4 Гц, 2H), 3,26 (т, J=6,0 Гц, 2H), 2,79 (с, 3H), 2,13-2,08 (м, 2H); ВЭЖХ (способ 1) 95,4% (AUC), tR=10,52 мин. ESI MS m/z 465 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(этилсульфонил)-1,4-диазепан-1-ил]имидазо[1,2- a ]пиридина 39b (пример 206);
2-(5-хлор-2,4-диметоксифенил)-7-[4-(этилсульфонил)-1,4-диазепан-1-ил]имидазо[1,2-a]пиридин 39b получали аналогичным образом, как сульфонамид 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желто-зеленого цвета (выход 29%).
1H ЯМР (400 МГц, CDCl3): δ 8,33 (с, 1H), 7,89 (д, J=7,5 Гц, 1H), 7,81 (с, 1H), 6,72 (ушир. с, 1H), 6,57 (с, 1H), 6,46 (дд, J=2,3, 7,5 Гц, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 3,77-3,71 (м, 4H), 3,56 (т, J=5,2 Гц, 2H), 3,27 (т, J=5,9 Гц, 2H), 2,98 (дд, J=7,4, 14,8 Гц, 2H), 2,14-2,08 (м, 2H), 1,30 (т, J=7,3 Гц, 3H); ВЭЖХ (способ 1) 96,5% (AUC), tR=10,73 мин. ESI MS m/z 479 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопропилсульфонил)-1,4-диазепан-1-ил]имидазо[1,2- a ]пиридина 39c (пример 187);
2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопропилсульфонил)-1,4-диазепан-1-ил]имидазо[1,2-a]пиридин 39c получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 33%).
1H ЯМР (300 МГц, CDCl3): δ 8,30 (с, 1H), 7,91 (д, J=7,4 Гц, 1H), 7,78 (с, 1H), 6,85 (с, 1H), 6,56 (с, 1H), 6,51 (дд, J=2,4, 7,4 Гц, 1H), 4,40 (с, 3H), 3,95 (с, 3H), 3,79-3,67 (м, 4H), 3,65-3,55 (м, 2H), 3,33 (т, J=5,9 Гц, 2H), 2,38-2,00 (м, 3H), 1,21-1,05 (м, 2H), 0,99-0,83 (м, 2H); ВЭЖХ (способ 1) 98,0% (AUC), tR=10,88 мин; ESI MS m/z 491 [M+H]+.
Получение 4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]- N,N- диметил-1,4-диазепан-1-сульфонамида 39d (пример 200);
4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-N,N-диметил-1,4-диазепан-1-сульфонамид 39d получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желто-зеленого цвета (выход 51%).
1H ЯМР (400 МГц, CDCl3): δ 8,35 (с, 1H), 7,88 (д, J=7,5 Гц, 1H), 7,82 (с, 1H), 6,64 (ушир. с, 1H), 6,57 (с, 1H), 6,44 (дд, J=2,4, 7,6 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,75-3,69 (м, 4H), 3,54 (т, J=5,4 Гц, 2H), 3,29 (т, J=6,0 Гц, 2H), 2,73 (с, 6H), 2,13-2,07 (м, 2H). ВЭЖХ (способ 2) 97,7% (AUC), tR=18,52 мин. ESI MS m/z 494 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-{4-[(трифторметил)сульфонил]-1,4-диазепан-1-ил}имидазо[1,2- a ]пиридина 39e (пример 188);
2-(5-хлор-2,4-диметоксифенил)-7-{4-[(трифторметил)сульфонил]-1,4-диазепан-1-ил}имидазо[1,2-a]пиридин 39e получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желто-зеленого цвета (выход 61%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,48 (д, J=7,8 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,08 (д, J=7,8 Гц, 1H), 6,95 (с, 1H), 6,62 (д, J=2,2 Гц, 1H), 4,04 (с, 3H), 3,97 (с, 3H), 3,54-3,92 (м, 8H), 1,82-2,04 (м, 2H); ВЭЖХ (способ 1) 99,0% (AUC), tR=11,69 мин; ESI MS m/z 519 [M+H]+.
Получение диметил(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-1,4-диазепан-1-ил)фосфоната 39f (пример 207);
Диметил(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1,4-диазепан-1-ил)фосфонат 39f получали аналогичным образом, как диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этил)фосфонат 13ae, и получали в виде гигроскопического твердого вещества коричневого цвета (выход 32%).
1H ЯМР (400 МГц, CDCl3): δ 8,33 (с, 1H), 7,89 (д, J=7,8 Гц, 1H), 7,77 (с, 1H), 6,83 (ушир. с, 1H), 6,57 (с, 1H), 6,50 (дд, J=2,3, 7,6 Гц, 1H), 4,01 (с, 3H), 3,95 (с, 3H), 3,72-3,60 (м, 10H), 3,43-3,36 (м, 2H), 3,18-3,10 (м, 2H), 2,04-1,97 (м, 2H); ВЭЖХ (способ 1) 94,08% (AUC), tR=10,37 мин.; ESI MS m/z 495 [M+H]+.
Получение диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-1,4-диазепан-1-ил)этил)фосфоната 39g (пример 210);
Диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1,4-диазепан-1-ил)этил)фосфонат 39g получали аналогичным образом, как диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этил)фосфонат 13ae, и получали в виде гигроскопического твердого вещества коричневого цвета (выход 18%).
1H ЯМР (400 МГц, CDCl3): δ 8,34 (с, 1H), 7,86 (д, J=7,5 Гц, 1H), 7,75 (с, 1H), 6,79 (ушир. с, 1H), 6,57 (с, 1H), 6,49 (д, J=6,4 Гц, 1H), 4,13-4,03 (м, 4H), 4,01 (с, 3H), 3,95 (с, 3H), 3,63-3,53 (м, 4H), 2,88-2,78 (м, 4H), 2,62 (т, J=5,4 Гц, 2H), 2,03-1,89 (м, 4H), 1,30 (т, J=7,1 Гц, 6H); ВЭЖХ (способ 1) 96,35% (AUC), tR=9,47 мин.; ESI MS m/z 551 [M+H]+.
Схема 9
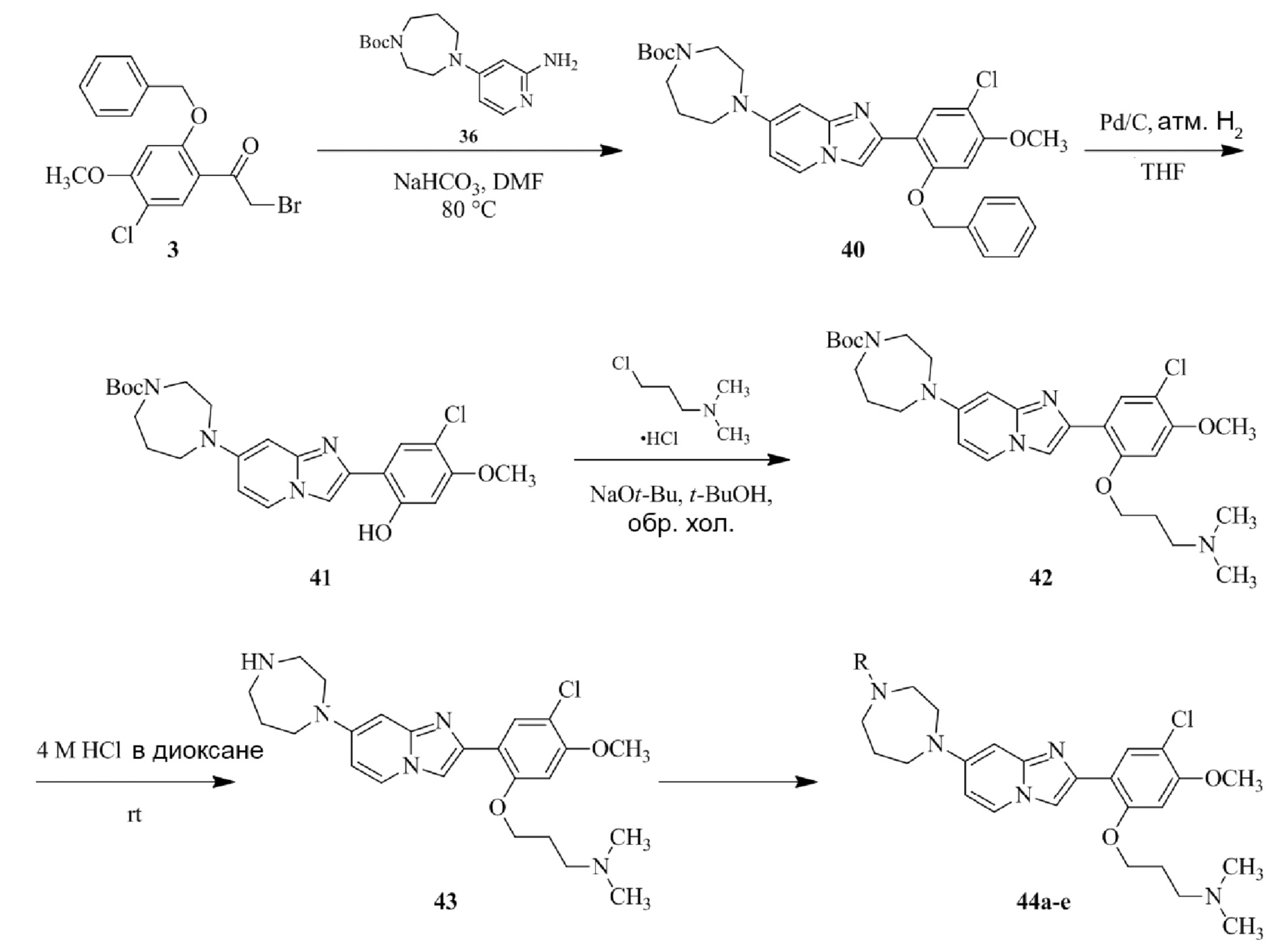
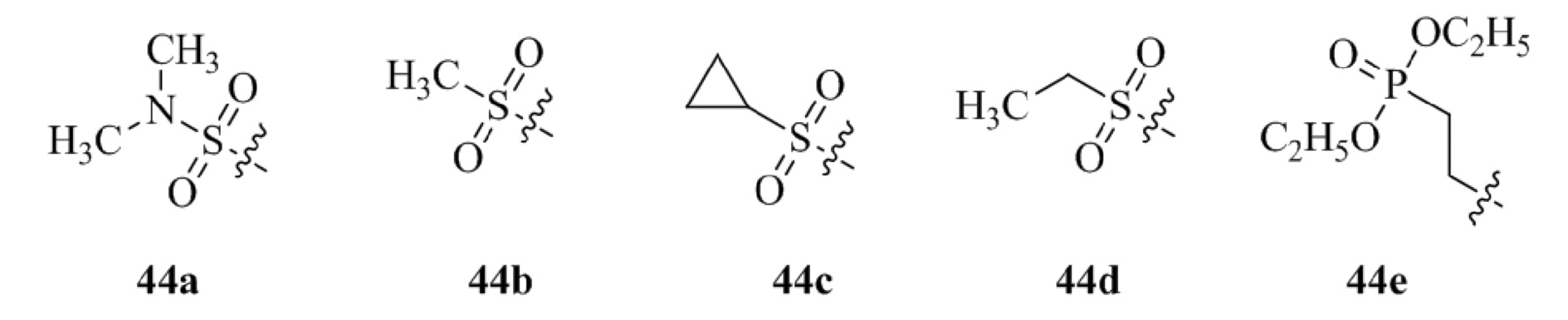
Получение трет -бутил-4-{2-[2-(бензилокси)-5-хлор-4-метоксифенил]имидазо[1,2- a ]-пиридин-7-ил}-1,4-диазепан-1-карбоксилата 40;
трет-бутил-4-{2-[2-(бензилокси)-5-хлор-4-метоксифенил]имидазо[1,2-a]пиридин-7-ил}-1,4-диазепан-1-карбоксилат 40 получали аналогичным образом, как 4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 11, и получали в виде твердого вещества коричневого цвета (выход 99%).
1H ЯМР (400 МГц, CDCl3): δ 8,41 (с, 1H), 7,76-7,71 (м, 2H), 7,51-7,46 (м, 2H), 7,45-7,34 (м, 3H), 6,68 (ушир. с, 1H), 6,61 (с, 1H), 6,41 (дд, J=2,2, 5,8 Гц, 1H), 5,23 (с, 2H), 3,87 (с, 3H), 3,64-3,54 (м, 6H), 3,36-3,21 (м, 2H), 2,05-1,96 (м, 2H), 1,42 (с, 9H). ESI MS m/z 563 [M+H]+.
Получение трет -бутил-4-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2- a ]-пиридин-7-ил]-1,4-диазепан-1-карбоксилата 41;
трет-бутил-4-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил]-1,4-диазепан-1-карбоксилат 41 получали аналогичным образом, как 4-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 32, и получали в виде твердого вещества коричневого цвета (выход 81%).
1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=7,4 Гц, 1H), 7,47 (с, 1H), 7,44 (с, 1H), 6,60 (с, 1H), 6,56-6,46 (м, 2H), 3,89 (с, 3H), 3,67-3,56 (м, 6H), 3,39-3,24 (м, 2H), 2,05-1,96 (м, 2H), 1,42 (с, 9H). ESI MS m/z 473 [M+H]+.
Получение трет -бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метокси-фенил}имидазо[1,2- a ]пиридин-7-ил)-1,4-диазепан-1-карбоксилат 42 (пример 211);
трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)-1,4-диазепан-1-карбоксилат 42 получали аналогичным образом, как трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 33, и получали в виде твердого вещества светло-желтого цвета (выход 70%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,89 (д, J=7,4 Гц, 1H), 7,85 (с, 1H), 6,61 (ушир. с, 1H), 6,58 (с, 1H), 6,43 (дд, J=2,4, 7,6 Гц, 1H), 4,18 (т, J=6,6 Гц, 2H), 3,93 (с, 3H), 3,65-3,56 (м, 6H), 3,33-3,23 (м, 2H), 2,56 (т, J=6,6 Гц, 2H), 2,30 (с, 6H), 2,14 (к, J=6,4 Гц, 2H), 2,01 (т, J=5,9 Гц, 2H), 1,44-1,37 (м, 9H); ВЭЖХ (способ 1) >99% (AUC), tR=9,93 мин.; ESI MS m/z 558 [M+H]+.
Получение 3-{2-[7-(1,4-диазепан-1-ил)имидазо[1,2- a ]пиридин-2-ил]-4-хлор-5-метоксифенокси}- N,N- диметилпропан-1-амина 43 (пример 209);
3-{2-[7-(1,4-диазепан-1-ил)имидазо[1,2-a]пиридин-2-ил]-4-хлор-5-метоксифенокси}-N,N-диметилпропан-1-амин 43 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12, и получали в виде твердого вещества светло-желтого цвета (выход 71%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,86 (д, J=7,5 Гц, 1H), 7,84 (с, 1H), 6,62-6,55 (м, 2H), 6,47-6,41 (м, 1H), 4,18 (т, J=6,4 Гц, 2H), 3,92 (с, 3H), 3,66-3,55 (м, 4H), 3,05 (т, J=5,3 Гц, 2H), 2,84 (т, J=5,6 Гц, 2H), 2,55 (т, J=7,0 Гц, 2H), 2,30 (с, 6H), 2,18-2,09 (м, 2H), 1,97-1,89 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=9,93 мин.; ESI MS m/z 558 [M+H]+.
Получение 4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}-имидазо[1,2- a ]пиридин-7-ил)- N,N- диметил-1,4-диазепан-1-сульфонамида 44a (пример 216);
4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]-пиридин-7-ил)-N,N-диметил-1,4-диазепан-1-сульфонамид 44 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a и получали в виде твердого вещества желто-зеленого цвета (выход 35%).
1H ЯМР (400 МГц, CDCl3): δ 8,35 (с, 1H), 8,08 (д, J=7,4 Гц, 1H), 7,92 (с, 1H), 6,65 (д, J=2,1 Гц, 1H), 6,56 (с, 1H), 6,45 (дд, J=2,1, 7,4 Гц, 1H), 4,19 (т, J=6,1 Гц, 2H), 3,92 (с, 3H), 3,75-3,70 (м, 4H), 3,54 (т, J=5,6 Гц, 2H), 3,29 (т, J=5,7 Гц, 2H), 2,70 (с, 8H), 2,41 (с, 6H), 2,28-2,20 (м, 2H), 2,13-2,05(м, 2H); ВЭЖХ (способ 1) 96,6% (AUC), tR=9,52 мин; ESI MS m/z 565 [M+H]+.
Получение 3-(4-хлор-2-(7-(4-(метилсульфонил)-1,4-диазепан-1-ил)имидазо[1,2- a ]пиридин-2-ил)-5-метоксифенокси)- N,N- диметилпропан-1-амина 44b (пример 213);
Соединение 3-(4-хлор-2-(7-(4-(метилсульфонил)-1,4-диазепан-1-ил)имидазо[1,2-a]-пиридин-2-ил)-5-метоксифенокси)-N,N-диметилпропан-1-амин 44b получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желто-зеленого цвета (выход 70%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,91 (д, J=7,8, 1H), 7,87 (с, 1H), 6,61 (д, J=2,3, 1H), 6,58 (с, 1H), 6,43 (дд, J=2,6, 7,5, 1H), 4,19 (т, J=6,3, 2H), 3,93 (с, 3H), 3,76-3,70 (м, 4H), 3,56-3,52 (м, 2H), 3,27 (т, J=6,0, 2H), 2,79 (с, 3H), 2,55 (т, J=7,2, 2H), 2,30 (с, 6H), 2,16-2,09 (м, 4H); ВЭЖХ (способ 1) 93,74% (AUC), tR=9,23 мин.; ESI MS m/z 536 [M+H]+.
Получение 3-(4-хлор-2-(7-(4-(циклопропилсульфонил)-1,4-диазепан-1-ил)имидазо[1,2- a ]-пиридин-2-ил)-5-метоксифенокси)- N,N- диметилпропан-1-амина 44c (пример 212);
Соединение 3-(4-хлор-2-(7-(4-(циклопропилсульфонил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридин-2-ил)-5-метоксифенокси)-N,N-диметилпропан-1-амин 44c получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желто-зеленого цвета (выход 32%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,94 (д, J=7,4, 1H), 7,88 (с, 1H), 6,62 (д, J=2,4, 1H), 6,57 (с, 1H), 6,43 (дд, J=2,7, 7,8, 1H), 4,19 (т, J=6,7, 2H), 3,93 (с, 3H), 3,75-3,68 (м, 4H), 3,62-3,57 (м, 2H), 3,32 (т, J=5,9, 2H), 2,58 (т, J=7,0, 2H), 2,32 (с, 6H), 2,27-2,19 (м, 1H), 2,19-2,07 (м, 4H), 1,17-1,12 (м, 2H), 094-0,88 (м, 2H); ВЭЖХ (способ 1) 93,82% (AUC), tR=9,49 мин.; ESI MS m/z 562 [M+H]+.
Получение 3-(4-хлор-2-(7-(4-(этилсульфонил)-1,4-диазепан-1-ил)имидазо[1,2- a ]пиридин-2-ил)-5-метоксифенокси)- N,N- диметилпропан-1-амина 44d (пример 215);
Соединение 3-(4-хлор-2-(7-(4-(этилсульфонил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридин-2-ил)-5-метоксифенокси)-N,N-диметилпропан-1-амин 44d получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желто-зеленого цвета (выход 30%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 8,03 (д, J=7,5 Гц, 1H), 7,91 (с, 1H), 6,63 (д, J=2,3 Гц, 1H), 6,57 (с, 1H), 6,44 (дд, J=2,5, 7,6 Гц, 1H), 4,19 (т, J=6,3 Гц, 1H), 3,93 (с, 3H), 3,77-3,68 (м, 4H), 3,55 (т, J=5,4 Гц, 2H), 3,26 (т, J=6,0 Гц, 1H), 2,98 (к, 2H, J=7,5, 14,9 Гц), 2,67 (т, 2H, J=7,3 Гц), 2,38 (с, 6H), 2,25-2,17 (м, 2H), 2,15-2,08 (м, 2H), 1,30 (т, 3H, J=7,5 Гц); ESI MS m/z 550 [M+H]+.
Получение диэтил(2-(4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)-1,4-диазепан-1-ил)этил)фосфоната 44e (пример 214);
Соединение диэтил(2-(4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)-1,4-диазепан-1-ил)этил)фосфонат получали аналогичным образом, как диэтил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этил)фосфонат 13ae, и получали в виде гигроскопического твердого вещества коричневого цвета (выход 15%).
1H ЯМР (400 МГц, CDCl3); δ 8,38 (с, 1H), 7,92 (д, J=7,4 Гц, 1H), 7,85 (с, 1H), 6,60 (д, J=2,2 Гц, 1H), 6,57 (с, 1H), 6,43 (дд, J=2,5, 7,6 Гц, 1H), 4,19 (т, J=6,3 Гц, 2H), 4,13-4,02 (м, 4H), 3,93 (с, 3H), 3,62-3,52 (м, 4H), 2,88-2,77 (м, 4H), 2,64-2,57 (м, 4H), 2,34 (с, 6H), 2,22-2,13 (м, 2H), 2,02-1,88 (м, 4H), 1,30 (т, J=7,1 Гц, 6H); ВЭЖХ (способ 1) 95,23% (AUC), tR=8,76 мин.; ESI MS m/z 622 [M+H]+.
Схема 10
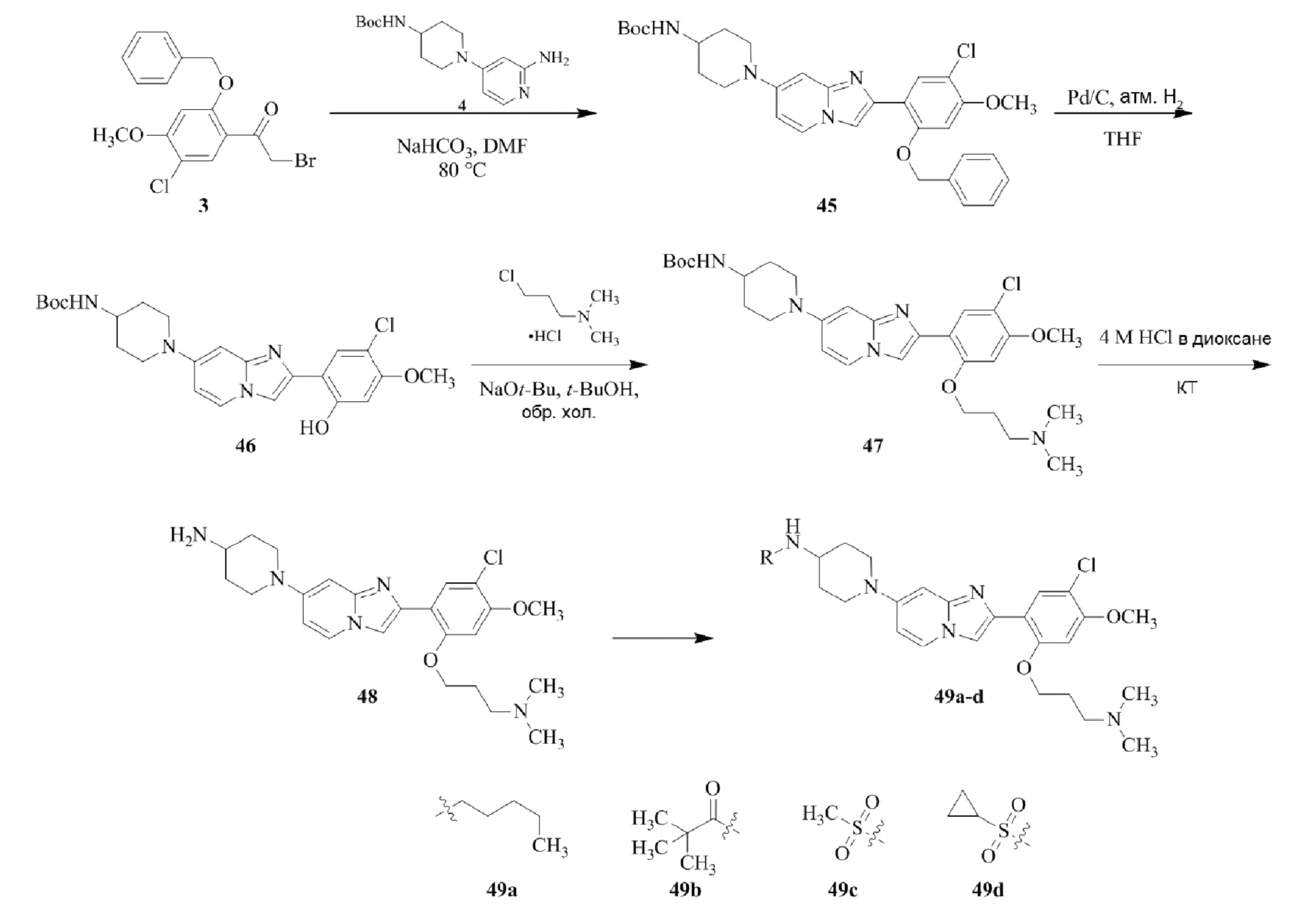
Получение трет -бутил(1-{2-[2-(бензилокси)-5-хлор-4-метоксифенил]имидазо[1,2- a ]-пиридин-7-ил}пиперидин-4-ил)карбамата 45;
трет-бутил(1-{2-[2-(бензилокси)-5-хлор-4-метоксифенил]имидазо[1,2-a]-пиридин-7-ил}пиперидин-4-ил)карбамат 45 получали аналогичным образом, как 4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 11, и получали в виде твердого вещества желтого цвета (выход 73%).
1H ЯМР (400 МГц, CDCl3): δ 8,41 (с, 1H), 7,78 (с, 1H), 7,74 (д, J=7,5 Гц, 1H), 7,51-7,46 (м, 2H), 7,45-7,35 (м, 3H), 6,80 (д, J=2,2 Гц, 1H), 6,61 (с, 1H), 6,49 (дд, J=2,4, 7,5 Гц, 1H), 5,22 (с, 2H), 4,47 (ушир. с, 1H), 3,87 (с, 3H), 3,67-3,60 (м, 3H), 2,96 (м, 2H), 2,05 (д, J=9,7 Гц, 2H), 1,57-1,47 (с, 2H), 1,45 (с, 9H). ESI MS m/z 563 [M+H]+.
Получение трет -бутил{1-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2- a ]-пиридин-7-ил]пиперидин-4-ил}карбамата 46;
трет-бутил{1-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперидин-4-ил}карбамат 46 получали аналогичным образом, как 4-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 32, и получали в виде твердого вещества желто-коричневого цвета (выход 77%).
1H ЯМР (400 МГц, CDCl3): δ 7,90 (д, J=7,5 Гц, 1H), 7,49 (с, 1H), 7,48 (с, 1H), 6,74 (д, J=1,8 Гц, 1H), 6,65-6,59 (м, 2H), 4,48 (ушир. с, 1H), 3,89 (с, 3H), 3,75-3,63 (м, 3H), 3,01-2,91 (м, 2H), 2,13-2,04 (м, 2H), 1,59-1,51 (м, 2H), 1,46 (с, 9H).
Получение трет -бутил(1-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метокси-фенил}имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)карбамата 47 (пример 148);
трет-бутил(1-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}-имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)карбамат 47 получали аналогичным образом, как трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]-пиридин-7-ил)пиперазин-1-карбоксилат 33, и получали в виде твердого вещества желтого цвета (выход 68%).
1H ЯМР (300 МГц, CDCl3): δ 8,38 (с, 1H), 7,91 (д, J=7,6 Гц, 1H), 7,89 (с, 1H), 6,80 (д, J=2,2 Гц, 1H), 6,57 (с, 1H), 6,53 (дд, J=2,3, 7,5 Гц, 1H), 4,46 (ушир. с, 1H), 4,18 (т, J=6,4 Гц, 2H), 3,93 (с, 3H), 3,70-3,60 (м, 3H), 2,95-2,87 (м, 2H), 2,56 (т, J=14,4 Гц, 2H), 2,30 (с, 6H), 2,19-2,05 (м, 4H), 1,60-1,48 (м, 2H), 1,46 (с, 9H). ВЭЖХ (способ 1) >99% (AUC), tR=10,03 мин. APCI MS m/z 558 [M+H]+.
Получение 1-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}-имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-амина 48 (пример 150);
1-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперидин-4-амин 48 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12, и получали в виде твердого вещества желтого цвета (выход 66%).
1H ЯМР (300 МГц, CDCl3): δ 8,38 (с, 1H), 7,88 (т, J=3,9 Гц, 2H), 6,80 (д, J=2,2 Гц, 1H), 6,58 (с, 1H), 6,55 (д, J=2,4 Гц, 1H), 4,18 (т, J=12,8 Гц, 2H), 3,93 (с, 3H), 3,74-3,65 (м, 2H), 2,92-2,79 (м, 3H), 2,54 (т, J=14,4 Гц, 2H), 2,29 (с, 6H), 2,18-2,09 (м, 2H), 1,99-1,89 (м, 2H), 1,56-1,41 (м, 2H). APCI MS m/z 458 [M+H]+.
Получение 1-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2- a ]пиридин-7-ил) -N- пентилпиперидин-4-амина 49a (пример 165);
1-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)-N-пентилпиперидин-4-амин 49 получали аналогичным образом, как трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 33, и получали в виде густого сиропа желтого цвета (выход 20%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,89-7,87 (м, 2H), 6,80 (д, J=2,3 Гц, 1H), 6,58 (с, 1H), 6,56 (дд, J=2,4, 7,6 Гц, 1H), 4,18 (т, J=6,4 Гц, 2H), 3,93 (с, 3H), 3,70 (д, J=12,9 Гц, 2H), 2,87-2,81 (м, 2H), 2,66 (т, J=7,3 Гц, 3H), 2,55 (т, J=7,0 Гц, 3H), 2,30 (с, 6H), 2,19-2,11 (м, 2H), 2,04-1,98 (м, 2H), 1,53-1,48 (м, 3H), 1,36-1,28 (м, 4H), 0,92-0,88 (м, 4H); ВЭЖХ (способ 1) 97,1% (AUC), tR=8,99 мин.; APCI MS m/z 528 [M+H]+.
Получение N-(1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)пиваламида 49b (пример 162);
N-(1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)пиваламид 49b получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 33%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,91-7,87 (м, 2H), 6,81 (д, J=2,1, 1H), 6,58 (с, 1H), 6,54 (дд, J=2,4, 7,6 Гц, 1H), 5,47 (д, J=7,6 Гц, 1H), 4,18 (т, J=6,4 Гц, 2H), 4,02-3,95 (м, 1H), 3,93 (с, 3H), 3,68 (д, J=12,7 Гц, 2H), 3,01-2,92 (м, 2H), 2,54 (т, J=7,0, 2 Гц, 2H), 2,29 (с, 6H), 2,17-2,10 (м, 2H), 2,08-2,00 (м, 2H), 1,59-1,48 (м, 2H), 1,19 (с, 9H); APCI MS m/z 542 [M+H]+.
Получение N-(1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)метансульфонамида 49c (пример 164);
N-(1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)метансульфонамид 49c получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (выход 61%).
1H ЯМР (400 МГц, CDCl3); δ 8,37 (с, 1H), 7,92-7,89 (м, 2H), 6,81 (д, J=2,3 Гц, 1H), 6,51 (с, 1H), 6,52 (дд, J=2,4, 7,5 Гц, 1H), 4,40 (д, J=6,3 Гц, 1H), 4,18 (т, J=6,4 Гц, 2H), 3,93 (с, 3H), 3,70-3,63 (м, 2H), 3,58-3,48 (м, 1H), 3,02 (с, 3H), 2,97-2,88 (м, 2H), 2,54 (т, J=7,0 Гц, 1H), 2,29 (с, 6H), 2,17-2,09 (м, 4H), 1,74-1,69 (м, 2H); APCI MS m/z 536 [M+H]+.
Получение N-(1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)циклопропансульфонамида 49d (пример 163);
N-(1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)циклопропансульфонамид 49d получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желтого цвета (выход 51%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,93 (д, J=7,5 Гц, 1H), 7,91 (с, 1H), 6,81 (д, J=2,2 Гц, 1H), 6,58 (с, 1H), 6,53 (дд, J=2,4, 7,6 Гц, 1H), 4,24 (д, J=7,7 Гц, 1H), 4,19 (т, J=6,4 Гц, 2H), 3,93 (с, 3H), 3,70-3,63 (м, 2H), 3,59-3,50 (м, 1H), 2,97-2,88 (м, 2H), 2,57 (т, J=7,0 Гц, 2H), 2,49-2,42 (м, 1H), 2,31 (с, 6H), 2,19-2,11 (м, 4H), 1,75-1,66 (м, 2H), 1,23-1,18 (м, 2H), 1,06-1,00 (м, 2H); ВЭЖХ (способ 1) 97,23% (AUC), tR=9,42 мин.; ESI MS m/z 562 [M+H]+.
Схема 11
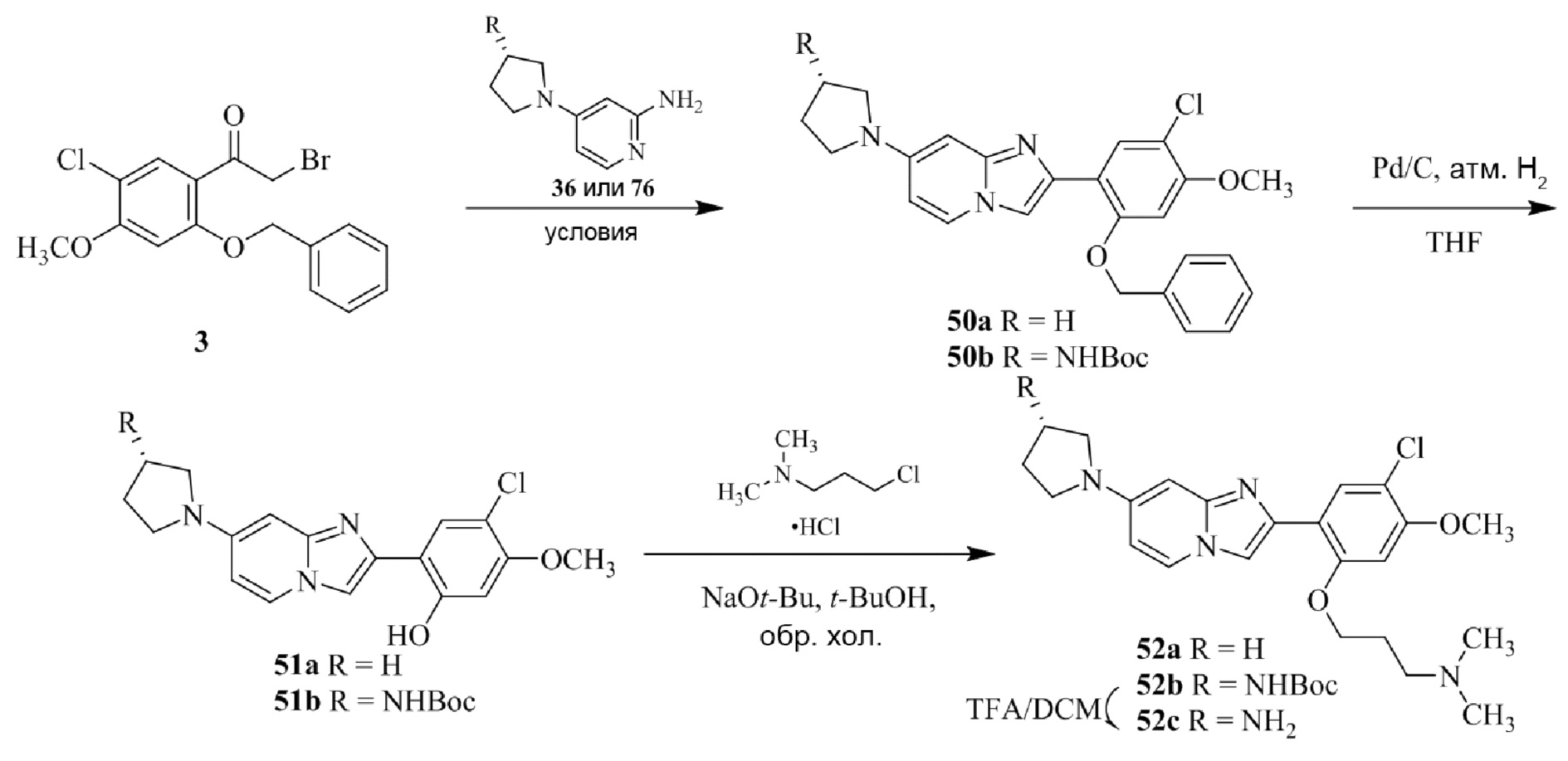
Получение 2-[2-(бензилокси)-5-хлор-4-метоксифенил]-7-(пирролидин-1-ил)имидазо[1,2- a ]пиридина 50a;
Соединение 2-[2-(бензилокси)-5-хлор-4-метоксифенил]-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 50a получали аналогичным образом, как трет-бутил-4-{2-[2-(бензилокси)-5-хлор-4-метоксифенил]имидазо[1,2-a]пиридин-7-ил}пиперазин-1-карбоксилат 31, и получали в виде твердого вещества грязно-белого цвета (выход 80%).
1H ЯМР (400 МГц, CDCl3): δ 8,43 (с, 1H), 7,78 (с, 1H), 7,71 (д, J=7,4 Гц, 1H), 7,52-7,48 (м, 2H), 7,45-7,34 (м, 3H), 6,60 (с, 1H), 6,42 (д, J=2,0 Гц, 1H), 6,29 (дд, J=2,3, 7,4 Гц, 1H), 5,23 (с, 2H), 3,87 (с, 3H), 3,37-3,31 (м, 4H), 2,06-2,01 (м, 4H); ESI MS m/z 434 [M+H]+.
Получение ( S )- трет -бутил(1-(2-(2-(бензилокси)-5-хлор-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)карбамата 50b;
Соединение (S)-трет-бутил(1-(2-(2-(бензилокси)-5-хлор-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат 50b получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества грязно-белого цвета (выход 74%).
1H ЯМР (400 МГц, CDCl3): δ8,42 (с, 1H), 7,76 (с, 1H), 7,73 (д, J=7,5 Гц, 1H), 7,53-7,47 (м, 2H), 7,46-7,37 (м, 3H), 6,61 (с, 1H), 6,43 (с, 1H), 6,26 (дд, J=2,2,7,4 Гц, 1H), 5,23 (с, 2H), 4,70 (ушир. с, 1H), 4,36 (ушир. с, 1H), 3,87 (с, 3H), 3,68-3,58 (м, 1H), 3,52-3,33 (м, 3H), 3,26-3,16 (м, 1H), 2,38-2,24 (м, 1H), 2,04-1,92 (м, 1H), 1,46 (с, 9H); ВЭЖХ (способ 1) 95,2% (AUC), tR=12,46 мин.; ESI MS m/z 549 [M+H]+.
Получение 4-хлор-5-метокси-2-[7-(пирролидин-1-ил)имидазо[1,2- a ]пиридин-2-ил]фенола 51a;
4-хлор-5-метокси-2-[7-(пирролидин-1-ил)имидазо[1,2-a]пиридин-2-ил]фенол 51a получали аналогичным образом, как 4-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 32, и получали в виде твердого вещества коричневого цвета (выход 76%).
1H ЯМР (400 МГц, CDCl3): δ 7,85 (д, J=7,4 Гц, 1H), 7,47 (с, 1H), 7,42 (с, 1H), 6,61 (с, 1H), 6,39 (дд, J=2,4, 7,4 Гц, 1H), 6,34 (с, 1H), 3,89 (с, 3H), 3,39-3,33 (м, 4H), 2,09-2,03 (м, 4H); ВЭЖХ (способ 3) 97,56% (AUC), tR=17,45 мин.; ESI MS m/z 344 [M+H]+.
Получение ( S )- трет -бутил(1-(2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)карбамата 51b;
Соединение (S)-трет-бутил(1-(2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат 51b получали аналогичным образом, как трет-бутил-4-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 32 и получали в виде твердого вещества коричневого цвета (выход 93%).
1H ЯМР (400 МГц, CDCl3): δ 7,87 (д, J=6,5 Гц, 1H), 7,47 (с, 1H), 7,44 (с, 1H), 6,60 (с, 1H), 6,39-6,33 (м, 2H), 4,72 (ушир. с, 1H), 4,38 (ушир. с, 1H), 3,89 (с, 3H), 3,69-3,62 (м, 1H), 3,53-3,38 (м, 2H), 3,26-3,20 (м, 1H), 2,38-2,28 (м, 1H), 2,05-1,95 (м, 1H), 1,46 (с, 9H); ВЭЖХ (то же, что способ 1, УФ 220 нМ) 97,7% (AUC), tR=11,37 мин.; ESI MS m/z 459 [M+H]+.
Получение 3-{4-хлор-5-метокси-2-[7-(пирролидин-1-ил)имидазо[1,2- a ]пиридин-2-ил]фенокси}- N,N- диметилпропан-1-амина 52a (пример 80);
3-{4-хлор-5-метокси-2-[7-(пирролидин-1-ил)имидазо[1,2-a]пиридин-2-ил]фенокси}-N,N-диметилпропан-1-амин 52 получали аналогичным образом, как трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 33, и получали в виде твердого вещества коричневого цвета (выход 56%).
1H ЯМР (400 МГц, CDCl3): δ 8,41 (с, 1H), 7,86 (д, J=7,4 Гц, 1H), 7,83 (с, 1H), 6,57 (с, 1H), 6,44 (с, 1H), 6,33 (дд, J=2,2, 7,4 Гц, 1H), 4,18 (т, J=6,4 Гц, 2H), 3,92 (с, 3H), 3,38-3,32 (м, 4H), 2,56 (т, J=7,0 Гц, 2H), 2,30 (с, 6H), 2,19-2,10 (м, 2H), 2,06-2,02 (м, 4H); ВЭЖХ (способ 3) 95,6% (AUC), tR=15,89 мин; APCI MS m/z 429 [M+H]+.
Получение ( S )- трет -бутил(1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)карбамата 52b;
Соединение (S)-трет-бутил(1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат 52b получали аналогичным образом, как трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 33, и получали в виде твердого вещества светло-пурпурного цвета (выход 52%).
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 7,89-7,84 (м, 2H), 6,57 (с, 1H), 6,43 (д, J=2,1 Гц, 1H), 6,31 (дд, J=2,5, 7,6 Гц, 1H), 4,72 (ушир. с, 1H), 4,38 (ушир. с, 1H), 4,18 (т, J=6,5, 13 Гц, 2H), 3,93 (с, 3H), 3,68-3,61 (м, 1H), 3,52-3,44 (м, 1H), 3,44-3,36 (м, 1H), 3,26-3,19 (м, 1H), 2,54 (т, J=7,2, 14,4 Гц, 2H), 2,38-2,26 (м, 7H), 2,18-2,09 (м, 2H), 2,03-1,94 (м, 1H), 1,46 (с, 9H); ВЭЖХ (способ 1) 98,2% (AUC), tR=10,04 мин; ESI MS m/z 544 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-амина 52c (пример 432);
Соединение (S)-трет-бутил(1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат 52b обрабатывали с использованием TFA/CH2Cl2 в течение 2 ч при комнатной температуре, концентрировали и ощелачивали гидроксидом аммония для того, чтобы получить (S)-1-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-амин 52c в виде аморфного твердого вещества пурпурного цвета (выход 95%).
1H ЯМР (400 МГц, CDCl3): δ 8,40 (с, 1H), 7,88-7,82 (м, 2H), 6,57 (с, 1H), 6,42 (д, J=2,3 Гц, 1H), 6,31 (дд, J=2,3, 7,4 Гц, 1H), 4,18 (т, J=6,5, 13,0 Гц, 2H), 3,92 (с, 3H), 3,80-3,73 (м, 1H), 3,61-3,50 (м, 2H), 3,42-3,36 (м, 1H), 3,11-3,05 (м, 1H), 2,54 (т, J=6,8, 14,3 Гц, 2H), 2,29 (с, 6H), 2,28-2,21 (м, 1H), 2,18-2,09 (м, 2H), 1,89-1,79 (м, 1H). ВЭЖХ (способ 1) >99% (AUC), tR=15,23 мин; ESI MS m/z 444 [M+H]+.
Схема 12
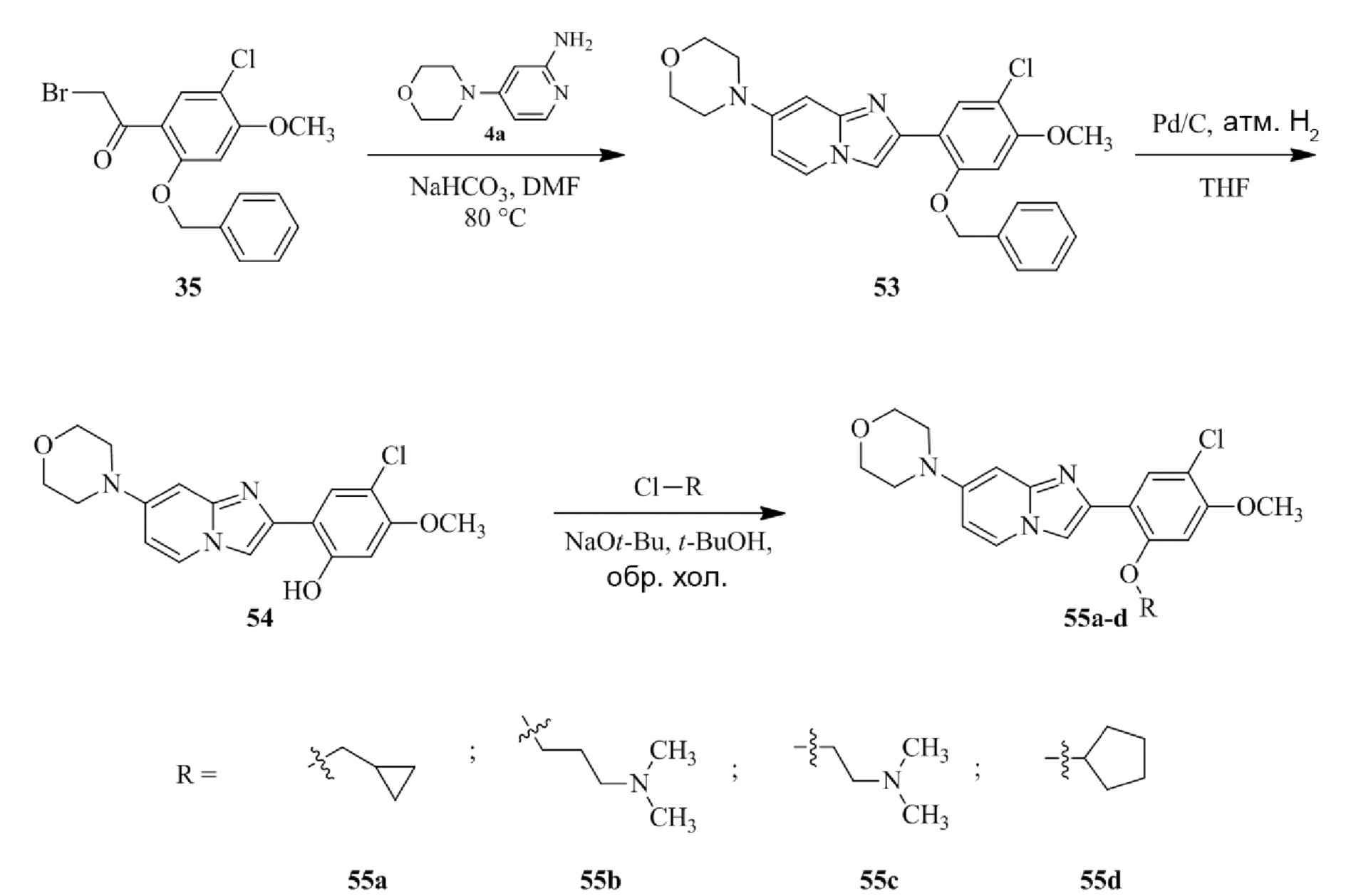
Получение 4-(2-(2-(бензилокси)-5-хлор-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)морфолина 53;
Соединение 2-[2-(бензилокси)-5-хлор-4-метоксифенил]-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 50 получали аналогичным образом, как трет-бутил-4-{2-[2-(бензилокси)-5-хлор-4-метоксифенил]имидазо[1,2-a]пиридин-7-ил}пиперазин-1-карбоксилат 31, и получали в виде твердого вещества грязно-белого цвета (выход 94%).
Получение 4-хлор-5-метокси-2-(7-морфолиноимидазо[1,2- a ]пиридин-2-ил)фенола 54;
Соединение 4-хлор-5-метокси-2-(7-морфолиноимидазо[1,2-a]пиридин-2-ил)фенол 54 получали аналогичным образом, как 4-[2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 32, и получали в виде твердого вещества грязно-белого цвета (выход 62%).
Получение 4-(2-(5-хлор-2-(циклопропилметокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)морфолина 55a (пример 84);
Соединение 4-(2-(5-хлор-2-(циклопропилметокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)морфолин 55a получали аналогичным образом, как трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 33, и получали в виде твердого вещества коричневого цвета (выход 56%).
1H ЯМР (400 МГц, CDCl3): δ 8,40 (с, 1H), 8,03 (с, 1H), 7,92 (д, J=7,5 Гц, 1H), 6,83 (с, 1H), 6,54 (дд, J=2,4, 7,5 Гц, 1H), 6,52 (с, 1H), 3,96 (д, J=7,0 Гц, 1H), 3,92 (с, 3H), 3,90-3,85 (м, 4H), 3,23-3,18 (м, 4H), 0,76-0,70 (м, 2H), 0,47-0,42 (м, 2H); ВЭЖХ (способ 3) 98,50% (AUC), tR=18,03 мин; APCI MS m/z 414 [M+H]+.
Получение 3-(4-хлор-5-метокси-2-(7-морфолиноимидазо[1,2- a ]пиридин-2-ил)фенокси)- N,N- диметилпропан-1-амина 55b (пример 85);
Соединение 3-(4-хлор-5-метокси-2-(7-морфолиноимидазо[1,2-a]пиридин-2-ил)фенокси)-N,N-диметилпропан-1-амин 55b получали аналогичным образом, как трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 33, и получали в виде твердого вещества коричневого цвета (выход 52%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,96 (д, J=7,5 Гц, 1H), 7,92 (с, 1H), 6,81 (д, J=2,3 Гц, 1H), 6,57 (с, 1H), 6,54 (дд, J=2,4, 7,5 Гц, 1H), 4,19 (т, J=6,4 Гц, 2H), 3,93 (с, 3H), 3,90-3,85 (м, 4H), 3,23-3,27 (м, 4H), 2,57 (т, J=7,0 Гц, 2H), 2,32 (с, 6H), 2,20-2,11 (м, 2H); ВЭЖХ (способ 3) 98,13% (AUC), tR=15,36 мин; APCI MS m/z 445 [M+H]+.
Получение 2-(4-хлор-5-метокси-2-(7-морфолиноимидазо[1,2- a ]пиридин-2-ил)фенокси)- N,N- диметилэтанамина 55c (пример 98);
Соединение 2-(4-хлор-5-метокси-2-(7-морфолиноимидазо[1,2-a]пиридин-2-ил)фенокси)-N,N-диметилэтанамин 55c получали аналогичным образом, как трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 33, и получали в виде твердого вещества коричневого цвета (выход 63%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 8,09 (с, 1H), 7,91 (д, J=7,30 Гц, 1H), 6,81 (ушир. с, 1H), 6,59 (с, 1H), 6,52 (д, J=7,30 Гц, 1H), 4,23-4,21 (м, 2H), 3,93 (с, 3H), 3,89-3,87 (м, 4H), 3,22-3,20 (м, 4H), 2,88-2,86 (м, 2H), 2,39 (с, 6H); ВЭЖХ (способ 3) 99,0% (AUC), tR=15,19 мин; ESI MS m/z 431 [M+H]+.
Получение 4-(2-(5-хлор-2-(циклопентилокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)морфолина 55d (пример 90);
Соединение 4-(2-(5-хлор-2-(циклопентилокси)-4-метоксифенил)имидазо[1,2-a]-пиридин-7-ил)морфолин 55d получали аналогичным образом, как трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 33, и получали в виде твердого вещества коричневого цвета (выход 30%).
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 7,92 (д, J=7,5 Гц, 1H), 7,85 (с, 1H), 6,86 (с, 1H), 6,59-6,51 (м, 2H), 4,97-4,91 (м, 1H), 3,93 (с, 3H), 3,90-3,83 (м, 4H), 3,25-3,17 (м, 4H), 2,07-1,96 (м, 4H), 1,92-1,81 (м, 2H), 1,77-1,68 (м, 2H); ВЭЖХ (способ 2) 97,69% (AUC), tR=19,79 мин; APCI MS m/z 428 [M+H]+.
Схема 13
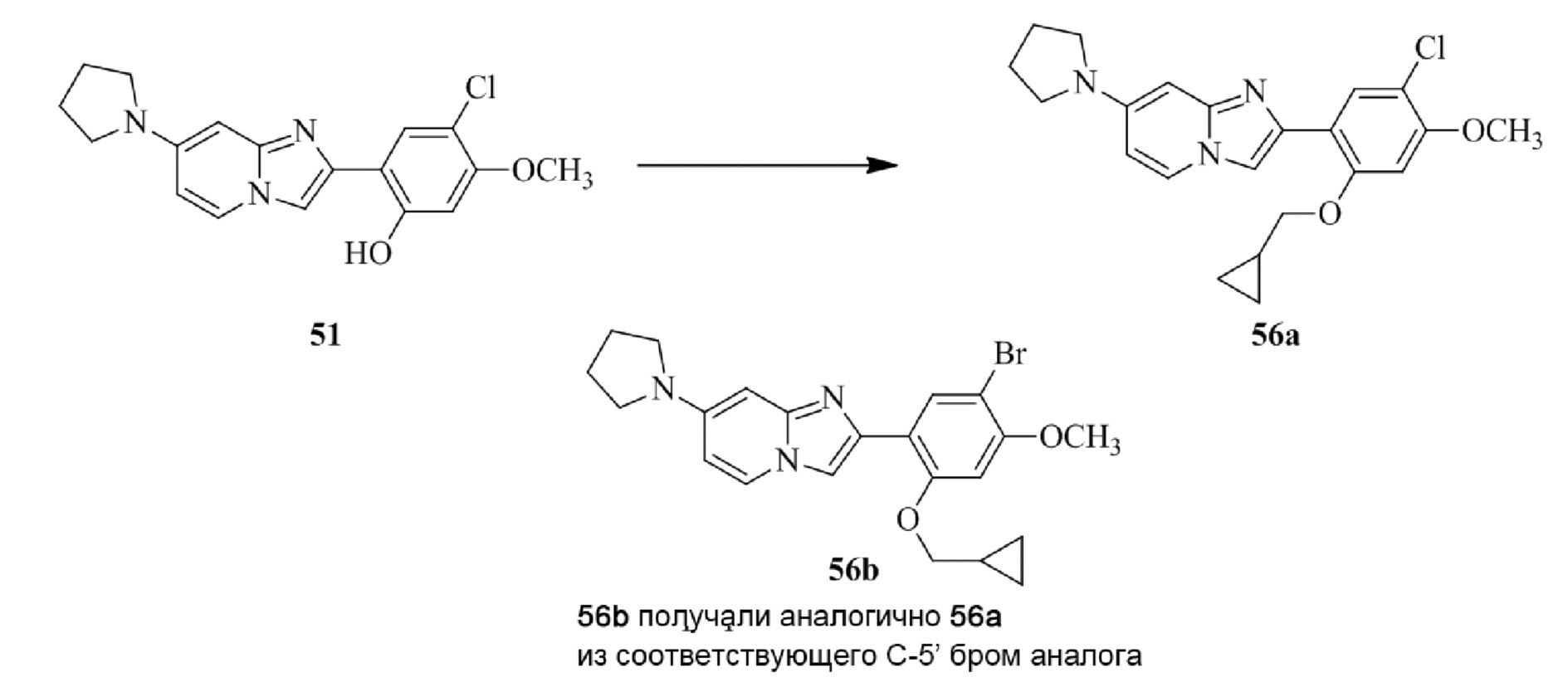
Получение 2-(5-хлор-2-(циклопропилметокси)-4-метоксифенил)-7-(пирролидин-1-ил)имидазо[1,2- a ]пиридина 56a (пример 82);
2-(5-хлор-2-(циклопропилметокси)-4-метоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 56c получали аналогичным образом, как трет-бутил-4-(2-{5-хлор-2-[3-(диметиламино)пропокси]-4-метоксифенил}имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 33, и получали в виде твердого вещества коричневого цвета (выход 31%).
1H ЯМР (400 МГц, CDCl3): δ 8,43 (с, 1H), 7,94 (с, 1H), 7,85 (д, J=7,4 Гц, 1H), 6,51 (с, 2H), 6,37-6,33 (м, 1H), 3,96 (д, J=7,0 Гц, 2H), 3,91 (с, 3H), 3,40-3,33 (м, 4H), 2,09-2,01 (м, 4H), 0,76-0,70 (м, 2H), 0,47-0,42 (м, 2H); ESI MS m/z 398 [M+H]+.
Получение 2-(5-бром-2-(циклопропилметокси)-4-метоксифенил)-7-(пирролидин-1-ил)имидазо[1,2- a ]пиридина гидробромида 56b (пример 53);
2-(5-бром-2-(циклопропилметокси)-4-метоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридина гидробромид 56b получали аналогичным образом, как 2-(5-хлор-2-(циклопропилметокси)-4-метоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 56a, с использованием 2-бром-1-(5-бром-2,4-диметоксифенил)этанона 7 и получали в виде твердого вещества белого цвета (выход 39%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,04 (с, 1H), 8,61 (д, J=7,5 Гц, 1H), 8,11 (с, 1H), 8,02 (с, 1H), 6,95 (с, 1H), 6,93 (с, 1H), 6,27 (с, 1H), 5,06-4,97 (м, 1H), 3,94 (с, 3H), 3,48-3,40 (м, 4H), 2,06-1,99 (м, 4H), 1,44 (с, 3H), 1,42 (с, 3H). ВЭЖХ (способ 3) >99% (AUC), tR=18,93 мин; ESI MS m/z 430 [M+H]+.
Схема 14
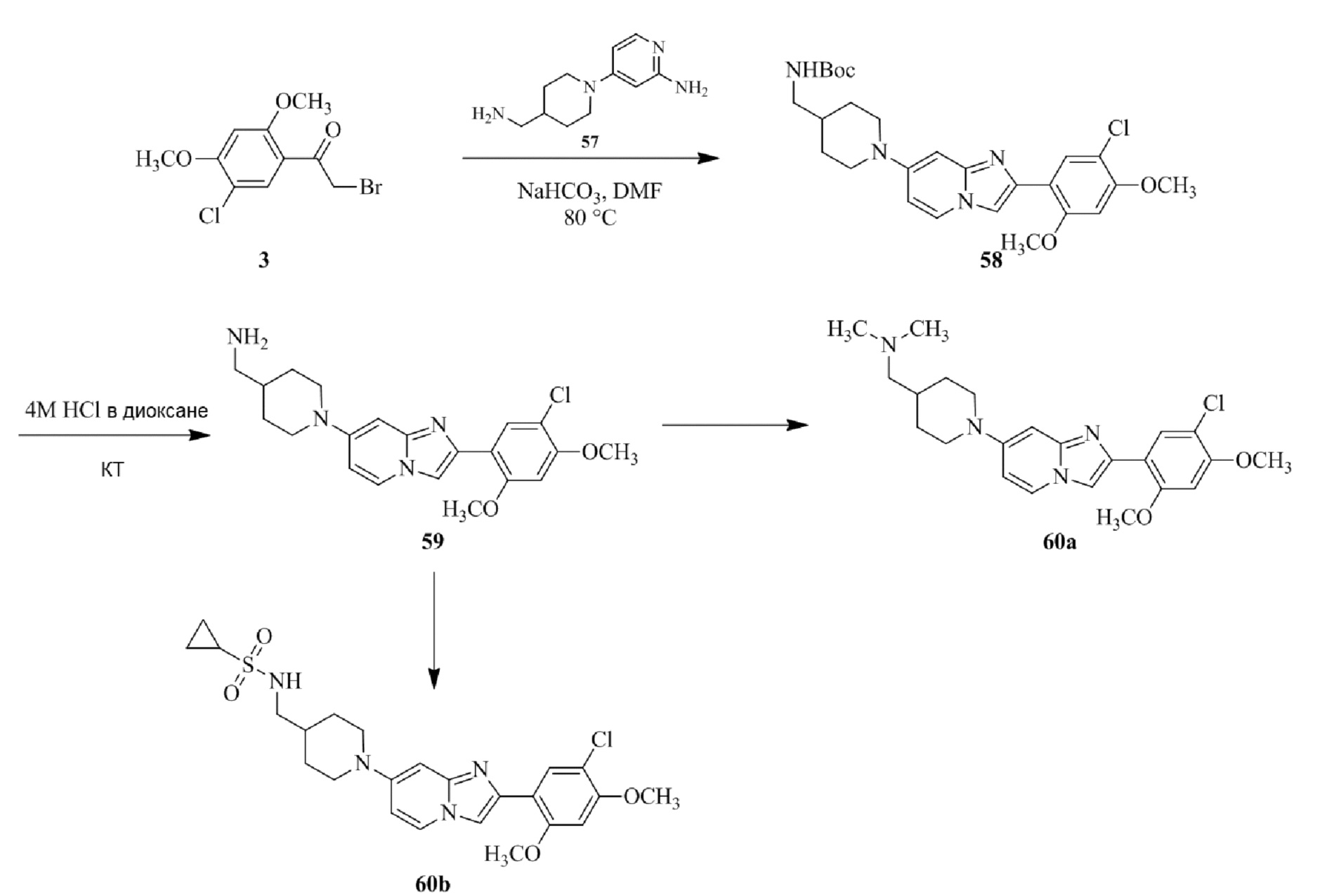
трет -бутил((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)метил)карбамат 58;
трет-бутил((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)метил)карбамат 58 получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества грязно-белого цвета (выход 74%).
(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)метанамина гидрохлорид 59 (пример 16);
(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)метанамина гидрохлорид 59 получали аналогичным образом, как 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этанамин 5f, и получали в виде твердого вещества белого цвета (выход 68%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,69 (ушир. с, 1H), 8,52 (д, J=7,8 Гц, 1H), 8,25 (с, 1H), 8,04 (с, 1H), 8,01 (ушир. с, 3H), 7,33 (дд, J=7,8 Гц, 1H), 6,98 (с, 1H), 6,76 (с, 1H), 4,08 (ушир. с, 2H), 4,05 (с, 3H), 3,98 (с, 3H), 3,11-3,02 (м, 2H), 2,78-2,70 (м, 2H), 2,00-1,84 (м, 3H), 1,33-1,21 (м, 2H); ВЭЖХ (способ 4) 96,3% (AUC), tR=15,72 мин; ESI MS m/z 401 [M+H]+.
1-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)- N,N- диметилметанамин 60a (пример 97);
1-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)-N,N-диметилметанамин 60 получали аналогичным образом, как 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N,N-диметилэтанамин 13x, и получали в виде твердого вещества коричневого цвета (7 мг, 6%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,86 (д, J=7,6 Гц, 1H), 7,84 (с, 1H), 6,83 (с, 1H), 6,61-6,55 (м, 2H), 3,99 (с, 3H), 3,95 (с, 3H), 3,74 (д, J=12,4 Гц, 2H), 2,79 (т, J=10,7 Гц, 2H), 2,32-2,17 (м, 8H), 1,90 (д, J=12,0 Гц, 2H), 1,41-1,23 (м, 4H); ESI MS m/z 429 [M+H]+.
N -((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)метил)циклопропансульфонамид 60b (пример 149);
Соединение N-((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)метил)циклопропансульфонамид 60b получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (15 мг, 27%).
1H ЯМР (400 МГц, CDCl3); δ 8,36 (с, 1H), 7,87 (д, J=7,7 Гц, 1H), 7,85 (с, 1H), 6,81 (д, J=2,2 Гц, 1H), 6,58 (с, 1H), 6,55 (дд, J=2,4, 7,5 Гц, 1H), 4,33 (ушир. с, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,75 (д, J=12,5 Гц, 2H), 3,10 (т, J=5,9 Гц, 2H), 2,83-2,74 (м, 2H), 2,46-2,39 (м, 1H), 1,89 (д, J=12,5 Гц, 2H), 1,77-1,68 (м, 1H), 1,45-1,34 (м, 2H), 1,21-1,15 (м, 2H), 1,04-0,97 (м, 2H); ВЭЖХ (способ 1) 94,0% (AUC), tR=11,01 мин APCI MS m/z 505 [M+H]+
Схема 15
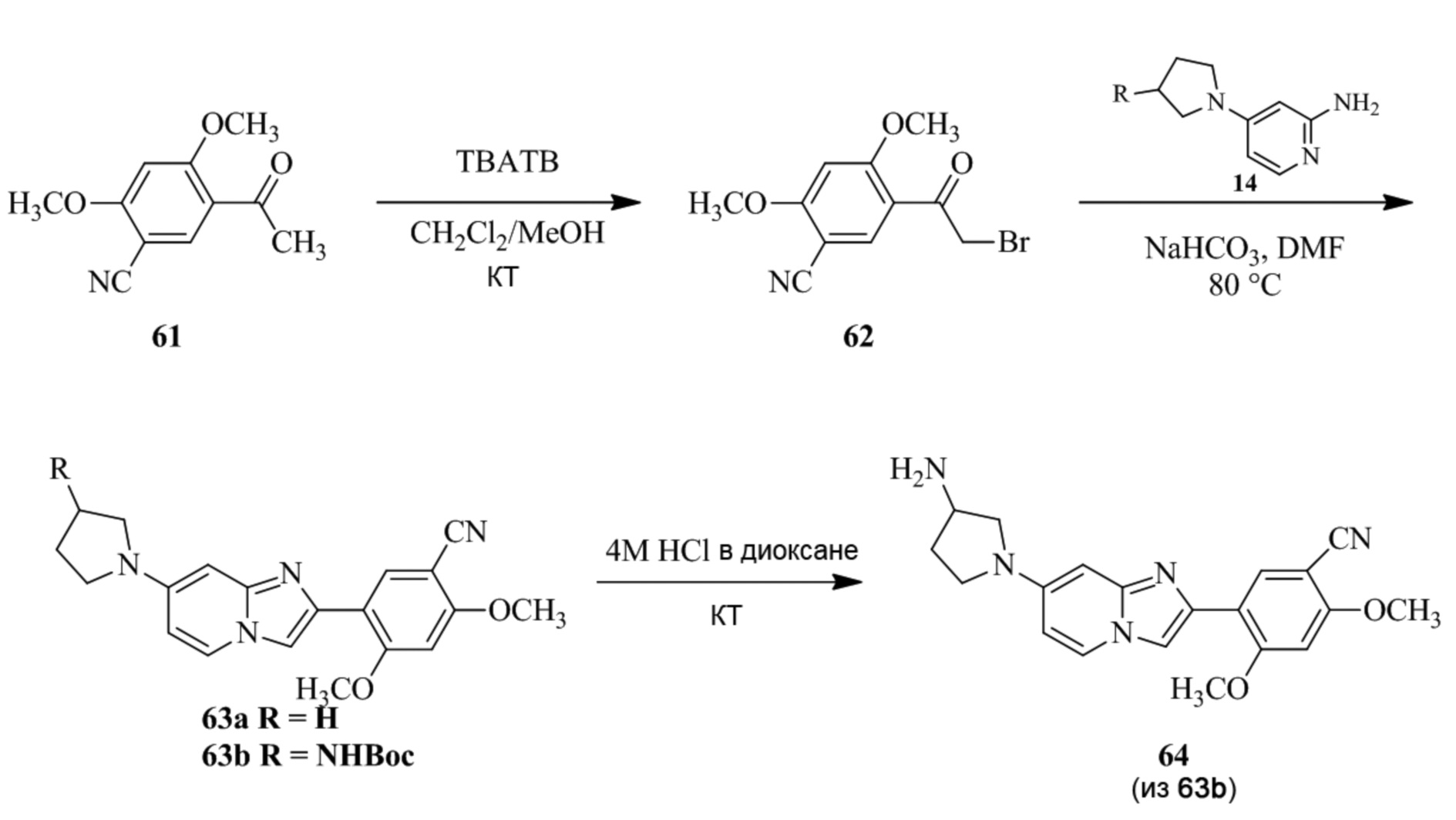
Получение 2,4-диметокси-5-[7-(пирролидин-1-ил)имидазо[1,2- a ]пиридин-2-ил]бензонитрила 63a гидробромида (пример 49);
2,4-диметокси-5-[7-(пирролидин-1-ил)имидазо[1,2-a]пиридин-2-ил]бензонитрил 63a получали аналогичным образом, как 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 9a, и получали в виде твердого вещества грязно-белого цвета (выход 62%). Получаемое соединение обрабатывали с использованием HBr для того, чтобы получить желаемую гидробромидную соль.
1H ЯМР (400 МГц, DMSO-d6): δ 8,49 (д, J=7,4 Гц, 1H), 8,23 (с, 1H), 8,14 (с, 1H), 7,00 (с, 1H), 6,97-6,91 (м, 1H), 6,31 (с, 1H), 4,12 (с, 3H), 4,04 (с, 3H), 3,44 (с, 4H), 2,03 (с, 4H). ВЭЖХ (способ 2) 97,12% (AUC), tR=18,09 мин. ESI MS m/z 349 [M+H]+.
Получение трет -бутил{1-[2-(5-циано-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пирролидин-3-ил}карбамата 63b (пример 71);
трет-бутил{1-[2-(5-циано-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пирролидин-3-ил}карбамат 63b получали аналогичным образом, как трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 11, и получали в виде твердого вещества зеленого цвета (выход 32%).
1H ЯМР (400 МГц, CDCl3): δ 8,57 (с, 1H), 7,86 (д, J=7,3 Гц, 1H), 7,78 (с, 1H), 6,52 (с, 1H), 6,44 (с, 1H), 6,33 (дд, J=2,3, 7,4 Гц, 1H), 4,72 (ушир. с, 1H), 4,38 (ушир. с, 1H), 4,05 (с, 3H), 3,97 (с, 3H), 3,69-3,63 (м, 1H), 3,52-3,38 (м, 2H), 3,23 (дд, J=4,1, 9,9 Гц, 1H), 2,37-2,28 (м, 1H), 2,05-1,95 (м, 1H), 1,46 (с, 9H); ESI MS m/z 464 [M+H]+.
Получение 2-метокси-5-(7-(пирролидин-1-ил)имидазо[1,2-а]пиридин-2-ил)бензонитрила гидробромида 63с (пример 21);
Соединение 2-метокси-5-(7-(пирролидин-1-ил)имидазо[1,2-a]пиридин-2-ил)бензонитрила гидробромид 63c получали аналогичным образом, как 63a, из 5-ацетил-2-метоксибензонитрила вместо 5-ацетил-2,4-диметоксибензонитрила 61 через бромирование и замыкание кольца. Желаемый продукт получали в виде аморфного твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,50 (д, J=7,5 Гц, 1H), 8,29 (с, 1H), 8,24 (с, 1H), 8,11(д, J=7,8 Гц, 1H), 7,47 (д, J=8,7 Гц, 1H), 6,94 (д, J=6,1 Гц, 1H), 6,32 (с, 1H), 4,00 (с, 3H), 3,45 (ушир. с, 4H), 2,03 (ушир. с, 4H); ВЭЖХ (способ 4) >99% (AUC), tR=17,73 мин.; ESI MS m/z 319 [M+H]+.
Получение 5-[7-(3-аминопирролидин-1-ил)имидазо[1,2- a ]пиридин-2-ил]-2,4-диметоксибензонитрила 64 (пример 73);
5-[7-(3-аминопирролидин-1-ил)имидазо[1,2-a]пиридин-2-ил]-2,4-диметоксибензонитрил 64 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12, и получали в виде твердого вещества грязно-белого цвета (выход 49%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,54 (д, J=7,5 Гц, 1H), 8,35 (ушир. с, 3H), 8,25 (с, 2H), 7,01 (с, 1H), 6,98 (д, J=6,7 Гц, 1H), 6,42 (с, 1H), 4,13 (с, 3H), 4,04 (с, 3H), 4,03-4,00 (м, 1H), 3,79-3,73 (м, 1H), 3,72-3,64 (м, 1H), 3,59-3,50 (м, 2H), 2,41-2,34 (м, 1H), 2,21-2,18 (м, 1H); ВЭЖХ (способ 2) 95,4% (AUC), tR=14,48 мин; APCI MS m/z 364 [M+H]+.
Схема 16
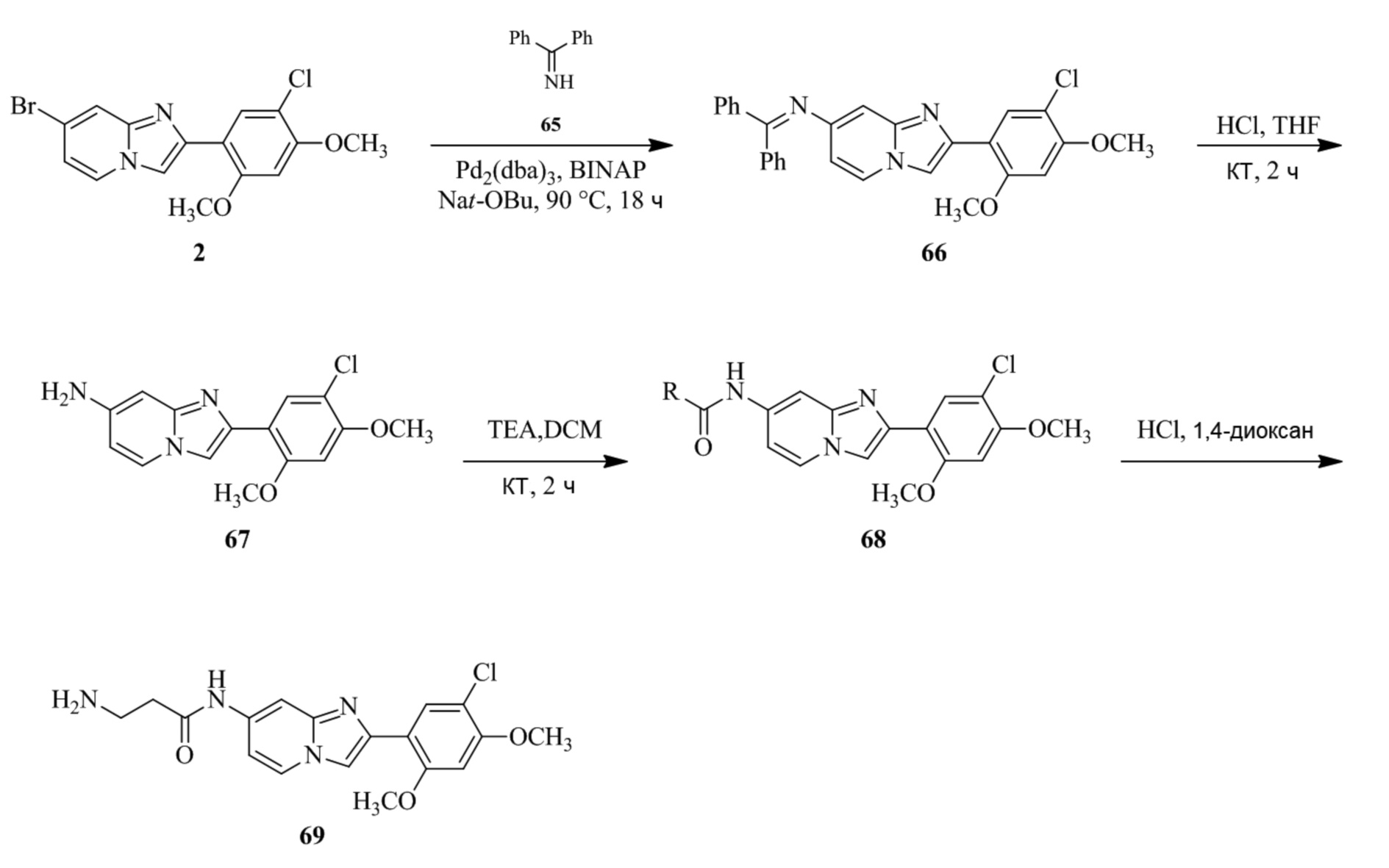
Получение 2-(5-хлор-2,4-диметоксифенил) -N- (дифенилметилен)имидазо[1,2- a ]-пиридин-7-амина 66;
Брали смесь 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 22 (2,5 г, 6,80 ммоль), бензофенонимина (1,8 г, 10,20 ммоль), дибензилиденацетондипалладия (270 мг, 0,30 ммоль), BINAP (500 мг, 0,80 ммоль) и трет-бутоксида натрия (1,6 г, 17,0 ммоль) в толуоле (37,5 мл) и дегазировали аргоном. Реакционную смесь нагревали до 90°C в течение 18 ч. Реакционную массу охлаждали до комнатной температуры, разбавляли этилацетатом (100 мл) и фильтровали через слой целита. Фильтрат дистиллировали при пониженном давлении и остаток очищали посредством хроматографии CombiFlash (силикагель, 7:3 гексан/EtOAc) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-N-(дифенилметилен)имидазо[1,2-a]пиридин-7-амин 66 (2 г, 79%) в виде твердого вещества коричневого цвета.
Получение 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-амина 67 (пример 151);
В раствор 2-(5-хлор-2,4-диметоксифенил)-N-(дифенилметилен)имидазо[1,2-a]пиридин-7-амина 66 (1,5 г, 3,20 ммоль) в THF (20 мл) загружали концентрированную HCl (6 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель дистиллировали при пониженном давлении. Остаток растирали в порошок с MTBE, фильтровали и сушили при пониженном давлении для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амин 67 в виде HCl соли (960 мг, 98%) в виде твердого вещества коричневого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,37 (д, J=7,3 Гц, 1H), 8,18 (с, 1H), 7,93 (с, 1H), 7,08 (ушир. с, 2H), 6,96 (с, 1H), 6,78 (дд, J=2,2 Гц, 7,3 Гц, 1H) 6,61 (д, J=2,1 Гц, 1H), 4,04 (с, 3H), 3,98 (с, 3H); ВЭЖХ (способ 1) 95,8% (AUC), tR=10,08 мин; ESI MS m/z 304 [M+H]+.
Получение метил[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]карбамата 68a (пример 183);
Cмесь 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 67 (100 мг, 0,30 ммоль), триэтиламина (130 мкл, 0,90 ммоль) и метилхлорформиата (25 мкл, 0,33 ммоль) в DCM (2 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь сушили при пониженном давлении и остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить метил[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]карбамат 68a (40 мг, 33,3%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,37 (с, 1H), 8,02 (с, 1H), 8,00 (с, 1H), 7,47 (д, J=2,1 Гц, 1H), 7,07 (ушир. с, 1H), 6,78 (ушир. с, 1H), 6,58 (с, 1H), 4,00 (с, 3H), 3,96 (с, 3H), 3,81 (с, 3H); ВЭЖХ (способ 3) 97,4% (AUC), tR=16,98 мин.; ESI MS m/z 362 [M+H]+.
Получение трет -бутил(3-{[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]амино}-3-оксопропил)карбамата 68b (пример 157);
В смесь 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 63 (120 мг, 0,40 ммоль) и N-Boc-β-аланина (83 мг, 0,44 ммоль) в N,N-диметилформамиде (1,2 мл) загружали N,N-диизопропилэтиламин (230 мкл, 1,20 ммоль), после чего следовало добавление ангидрида 1-пропанфосфоновой кислоты (50% в DMF) (190 мкл, 0,60 ммоль) по каплям. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили водой (10 мл), осадок собирали посредством фильтрования и сушили при пониженном давлении. Твердое вещество очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить трет-бутил(3-{[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]амино}-3-оксопропил)карбамат 68b (90 мг, 48%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 10,81 (с, 1H), 8,69 (д, J=7,4 Гц, 1H), 8,51 (с, 1H), 8,37 (с, 1H), 7,95 (с, 1H), 7,32 (д, J=6,6 Гц, 1H), 6,99 (с, 1H), 6,94 (т, J=5,3 Гц, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,29-3,23 (м, 2H), 2,60 (т, J=6,9 Гц, 2H), 1,37 (с, 9H); ВЭЖХ (способ 1) 95,4% (AUC), tR=10,96 мин.; ESI MS m/z 475 [M+H]+.
Получение 3-амино -N- [2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил]пропанамида 69 (пример 168);
Cмесь трет-бутил(3-{[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]амино}-3-оксопропил)карбамата 68b (50 мг, 0,10 ммоль) и 4 M HCl в 1,4-диоксане (2 мл) перемешивали при комнатной температуре в течение 3 ч. Растворитель дистиллировали при пониженном давлении и остаток ощелачивали водным раствором аммиака (30%) для того, чтобы получить 3-амино-N-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пропанамид 69 (25 мг, 64%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, CH3OD): δ 8,30 (д, J=7,5 Гц, 1H), 8,14 (с, 1H), 8,10 (с, 1H), 8,01 (ушир. с, 1H), 7,01-6,99 (м, 1H), 6,79 (с, 3H), 4,03 (с, 3H), 3,95 (с, 3H), 3,11 (т, J=6,3 Гц, 2H), 2,69 (т, J=6,3 Гц, 2H); ВЭЖХ (способ 1) 96,2% (AUC), tR=8,95 мин. ESI MS m/z 375 [M+H]+.
Схема 17
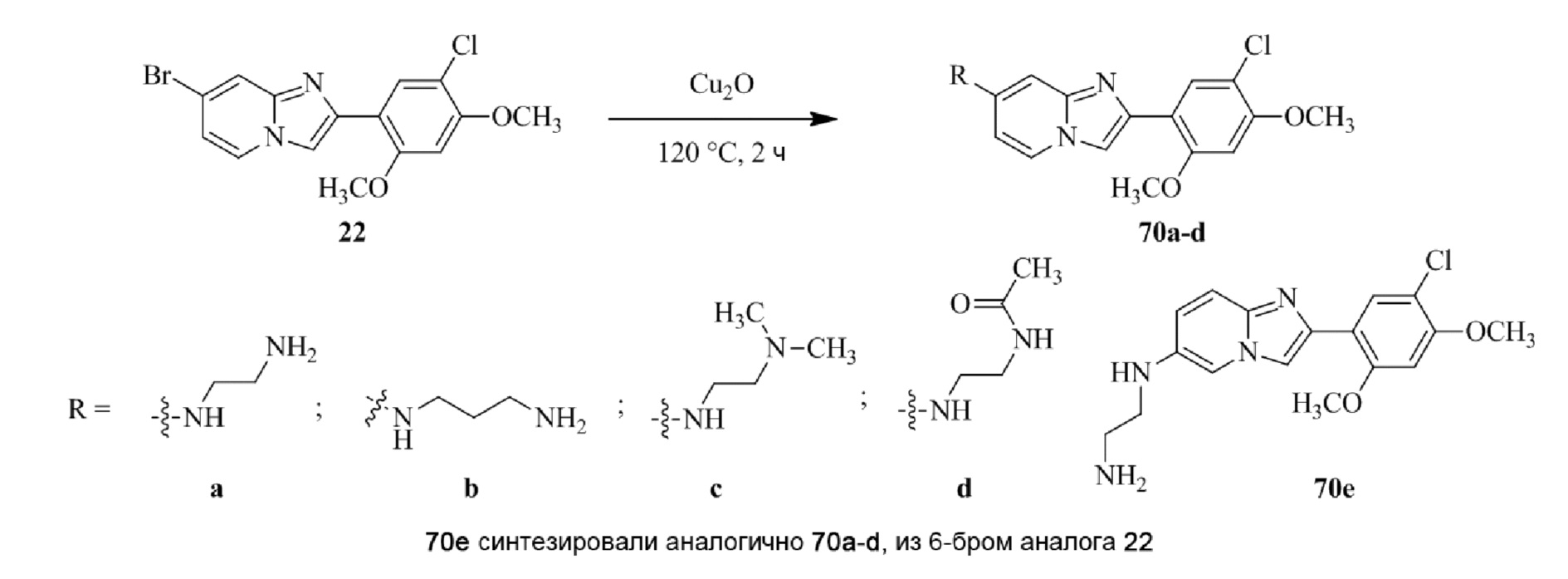
Получение N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)этан-1,2-диамина дигидрохлорида 70a (пример 10);
Cмесь 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 22 (200 мг, 0,54 ммоль) и Cu2O (25 мг) в этилендиамине (3,0 мл) нагревали при 120°C в течение 2 часов. Растворитель удаляли. Твердое вещество очищали посредством хроматографии CombiFlash (силикагель, 9:0,8:0,2 DCM/метанол/аммиак) для того, чтобы получить свободное основание, которое превращали в дигидрохлоридную соль N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)этан-1,2-диамина дигидрохлорид 70a в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,8 (с, 1H), 8,44 (д, J=7,4 Гц, 1H), 8,32 (ушир. с, 3H), 8,12-8,04 (м, 1H), 8,09 (с, 1H), 6,96 (с, 1H), 6,91 (дд, J=1,8, 7,3 Гц, 1H), 6,54 (с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 3,52-3,46 (м, 2H), 3,08 (ушир. с, 2H); ВЭЖХ (способ 4) 97,6% (AUC), tR=15,65 мин.; ESI MS m/z 347 [M+H]+.
Получение N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пропан-1,3-диамина 70b (пример 35);
Соединение N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пропан-1,3-диамин 70b получали аналогичным образом, как N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)этан-1,2-диамин 70a, и получали в виде твердого вещества белого цвета (16%).
1H ЯМР (400 МГц, CD3OD): δ 8,95 (с, 1H), 8,92 (д, J=7,4 Гц, 1H), 8,68 (с, 1H), 7,66 (с, 1H), 7,17 (д, J=7,4 Гц, 1H), 6,99 (с, 1H), 6,97 (с, 1H), 4,80 (с, 3H), 4,74 (с, 3H), 3,93-3,87 (м, 2H), 3,47 (т, J=6,7 Гц, 2H), 2,50-2,43 (м, 2H); ВЭЖХ (способ 4) >99% (AUC), tR=15,79 мин; ESI MS m/z 361 [M+H]+.
Получение N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 2, N 2-диметилэтан-1,2-диамин 70c (пример 83);
Соединение N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N2,N2-диметилэтан-1,2-диамин 70c получали аналогичным образом, как 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N,N-диметилэтанамин 13x, и получали в виде твердого вещества белого цвета (51%).
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,80 (с, 1H), 7,77 (д, J=7,3 Гц, 1H), 6,57 (с, 1H), 6,47 (с, 1H), 6,24- 6,20 (м, 1H), 4,56 (с, 3H), 3,98 (с, 3H), 3,94 (с, 3H), 3,19-3,14 (м, 2H), 2,61-2,57 (м, 2H), 2,26 (с, 6H); ВЭЖХ (способ 3) 97,3% (AUC), tR=15,37 мин; ESI MS m/z 375 [M+H]+.
Получение N -(2-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)этил)ацетамида 70d (пример 77);
Cмесь N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)этан-1,2-диамина 70a (100 мг, 0,28 ммоль) и Ac2O (28 мкл) в пиридине (2,0 мл) перемешивали при комнатной температуре в течение 4 часов. Растворитель удаляли. Твердое вещество очищали посредством хроматографии CombiFlash (силикагель, 9:0,8:0,2 DCM/метанол/аммиак) для того, чтобы получить N-(2-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)этил)ацетамид 70d в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,14 (д, J=7,3 Гц, 1H), 7,96 (с, 1H), 7,85 (с, 1H), 6,87 (с, 1H), 6,63 (дд, J=2,2, 7,4 Гц, 1H), 6,50 (с, 1H), 4,40 (с, 3H), 3,97 (с, 3H), 3,49-3,41 (м, 2H), 3,37-3,32 (м, 2H), 1,96 (с, 3H); ВЭЖХ (способ 3) 94,7% (AUC), tR=16,42 мин.; ESI MS m/z 389 [M+H]+.
Получение N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-6-ил)этан-1,2-диамина 70e (пример 81);
Соединение N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-6-ил)этан-1,2-диамин 70e получали аналогичным образом, как N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)этан-1,2-диамин 70a, с использованием 6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина и получали в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,35 (с, 1H), 7,76 (с, 1H), 7,51 (д, J=7,3 Гц, 1H), 7,43 (с, 1H), 6,76 (с, 1H), 6,22 (д, J=7,3 Гц, 1H), 6,58 (с, 1H) 4,02 (с, 3H), 3,90 (с, 3H), 3,11-3,08 (м, 4H); ВЭЖХ (способ 3) 98,2% (AUC), tR=15,17 мин; ESI MS m/z 347 [M+H]+.
Схема 18
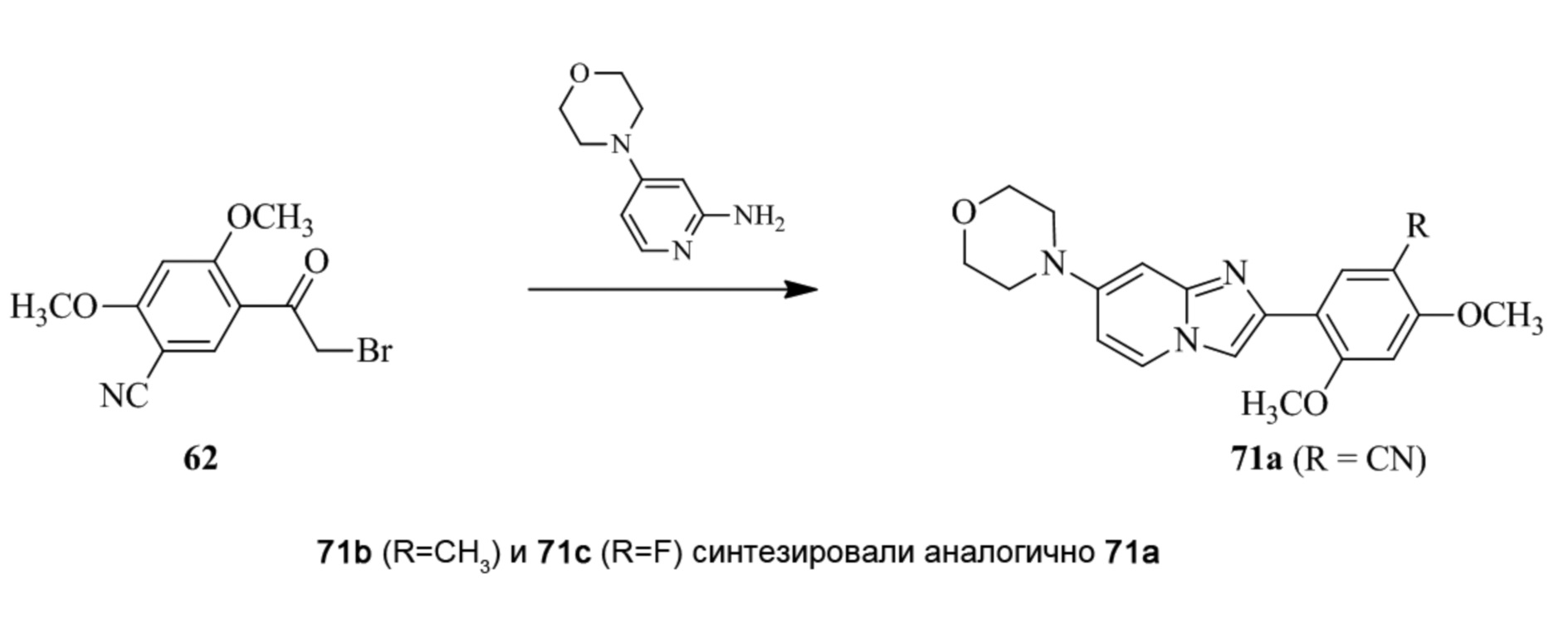
Получение 2,4-диметокси-5-(7-морфолиноимидазо[1,2- a ]пиридин-2-ил)бензонитрила 71a(пример 93);
2,4-диметокси-5-(7-морфолиноимидазо[1,2-a]пиридин-2-ил)бензонитрил 71a получали аналогичным образом, как 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 9a, и получали в виде твердого вещества грязно-белого цвета (выход 50%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,35 (с, 1H), 8,34 (д, J=7,5 Гц, 1H), 8,06 (с, 1H), 6,91 (с, 1H), 6,85 (д, 7,6 Гц, 1H), 6,67 (с, 1H), 4,09 (с, 3H), 4,00 (с, 3H), 3,78-3,72 (м, 4H), 3,24-3,18 (м, 4H); ВЭЖХ (способ 3) 98,5% (AUC), tR=16,48 мин; ESI MS m/z 365 [M+H]+.
Получение 4-(2-(2,4-диметокси-5-метилфенил)имидазо[1,2- a ]пиридин-7-ил)морфолина 71b (пример 86);
4-(2-(2,4-диметокси-5-метилфенил)имидазо[1,2-a]пиридин-7-ил)морфолин 71b получали аналогичным образом, как 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 9a, и получали в виде твердого вещества грязно-белого цвета (выход 38%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,32 (д, J=7,5 Гц, 1H), 7,98 (с, 1H), 7,97 (с, 1H), 6,81- 6,76 (м, 1H), 6,68 (с, 1H), 6,67 (с, 1H), 3,95 (с, 3H), 3,85 (с, 3H), 3,79-3,71 (м, 4H), 3,23-3,14 (м, 4H), 2,14 (с, 3H); ВЭЖХ (способ 5) 97,5% (AUC), tR=17,7 мин; ESI MS m/z 465 [M+H]+.
Получение 4-(2-(5-фтор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)морфолина гидробромида 71c (пример 87)
4-(2-(5-фтор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)морфолин 71c получали аналогичным образом, как 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 9a, и получали в виде твердого вещества грязно-белого цвета (выход 70%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,25 (ушир. с, 1H), 8,57 (д, J=7,7 Гц, 1H), 8,28 (с, 1H), 7,75 (д, J=7,7 Гц, 1H), 7,33-7,30 (м, 1H), 7,02 (с, 1H), 7,01 (с, 1H), 6,74 (с, 1H), 4,02 (с, 3H), 3,97 (с, 3H), 3,80-3,75 (м, 4H), 3,50-3,45 (м, 4H); ВЭЖХ (способ 5) >99% (AUC), tR=18,15 мин; APCI MS m/z 358 [M+H]+.
Схема 19
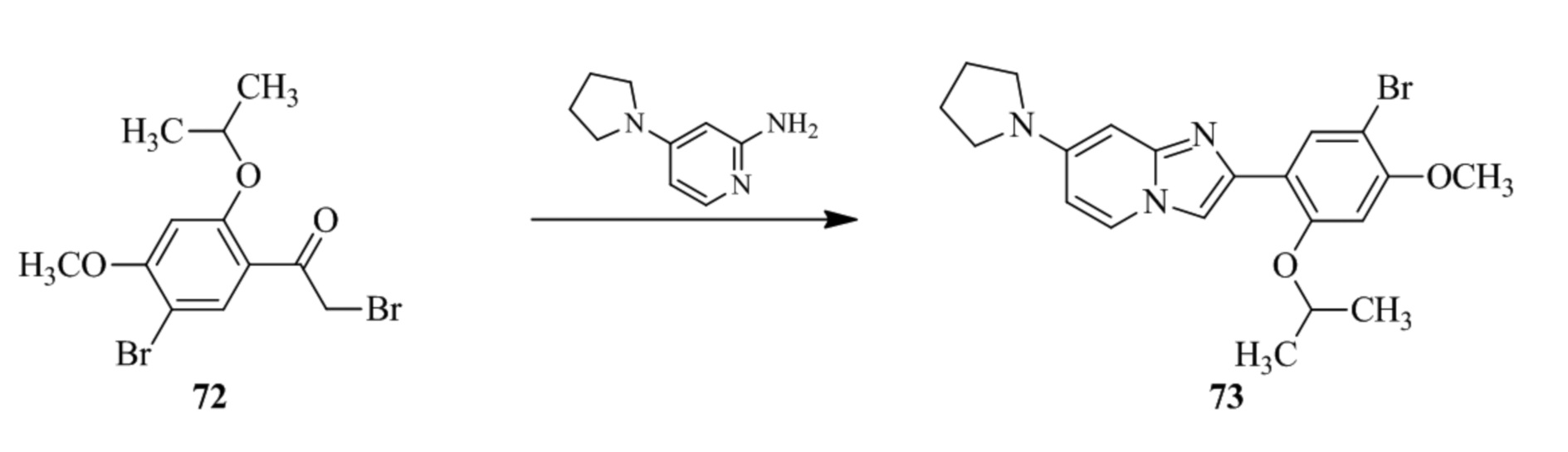
Получение 2-(5-бром-2-изопропокси-4-метоксифенил)-7-(пирролидин-1-ил)имидазо[1,2- a ]пиридина гидробромида 73;
2-(5-бром-2-изопропокси-4-метоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридина гидробромид 73 получали аналогичным образом, как 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 9a, и получали в виде твердого вещества грязно-белого цвета (выход 26%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,04 (с, 1H), 8,61 (д, J=7,6 Гц, 1H), 8,11 (с, 1H), 8,02 (с, 1H), 6,95 (с, 1H), 6,93 (с, 1H), 6,27 (с, 1H), 5,06-4,97 (м, 1H), 3,94 (с, 3H), 3,48-3,40 (м, 4H), 2,06-1,99 (м, 4H), 1,44 (с, 3H), 1,42 (с, 3H); ВЭЖХ (способ 3) >99% (AUC), tR=18,93 мин; ESI MS m/z 430 [M+H]+
Схема 20
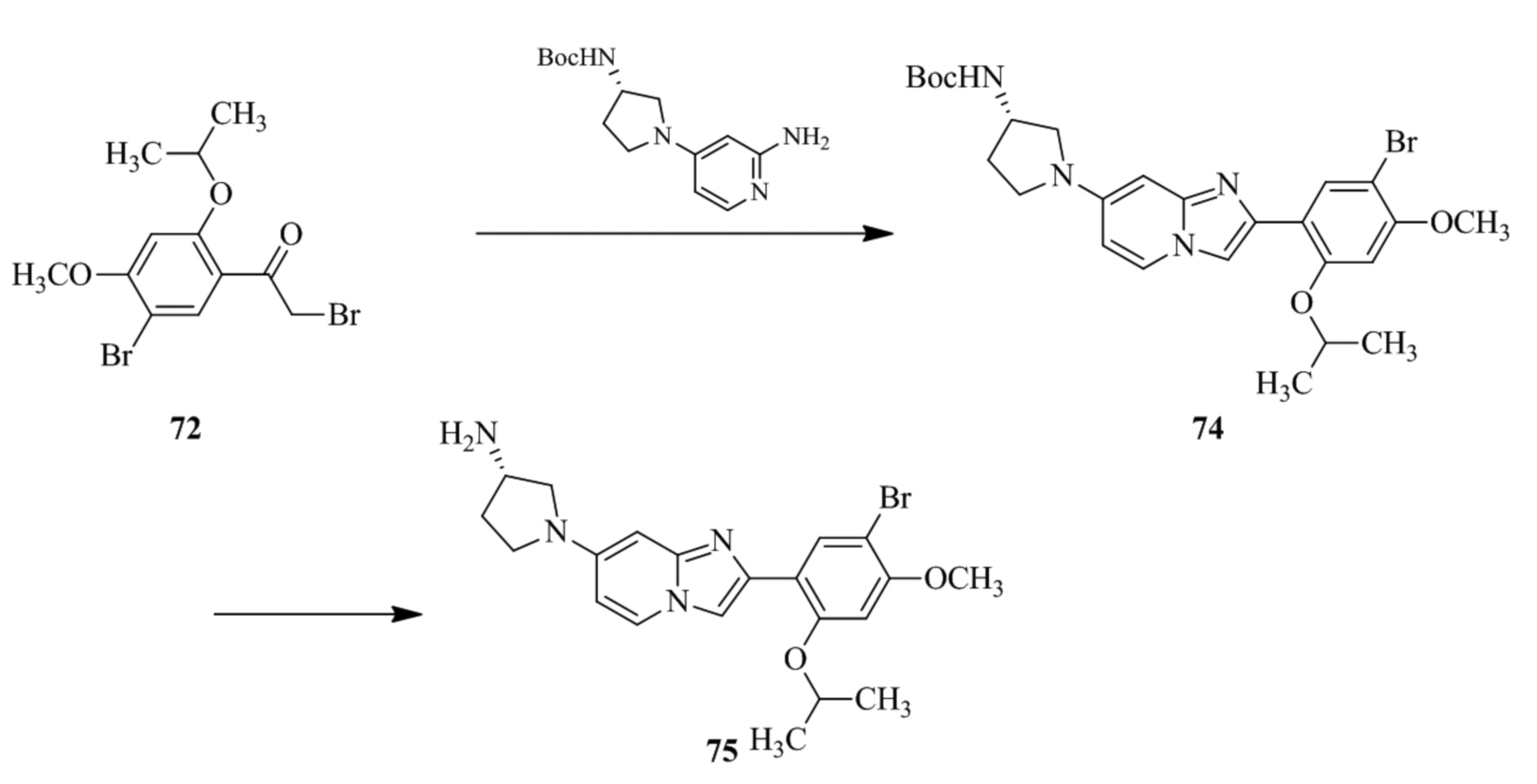
Получение ( S )- трет -бутил(1-(2-(5-бром-2-изопропокси-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)карбамата 74;
Соединение (S)-трет-бутил(1-(2-(5-бром-2-изопропокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат 74 получали аналогичным образом, как 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 9a, и получали в виде твердого вещества грязно-белого цвета.
Получение ( S )-1-(2-(5-бром-2-изопропокси-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-амина гидрохлорида 75 (пример 59);
(S)-1-(2-(5-бром-2-изопропокси-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-амина гидрохлорид 75 получали аналогичным образом, как 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этанамин 5f, и получали в виде твердого вещества грязно-белого цвета (выход 62%).
1H ЯМР (400 МГц, CD3OD): δ 8,52 (д, J=7,2 Гц, 1H), 8,07 (с, 1H), 7,90 (с, 1H), 6,97 (д, J=7,2 Гц, 1H), 6,95 (с, 1H), 6,56-6,54 (м, 1H), 4,95-4,54 (м, 1H), 4,16-4,14 (м, 1H), 4,02 (с, 3H), 3,95-3,93 (м, 1H), 3,79-3,78 (м, 1H), 3,57-3,56 (м, 2H), 2,62-2,60 (м, 2H), 2,30-2,28 (м, 2H), 1,49 (с, 6H); ВЭЖХ (способ 3) 98,1% (AUC), tR=16,02 мин; ESI MS m/z 445 [M+H]+.
Схема 21
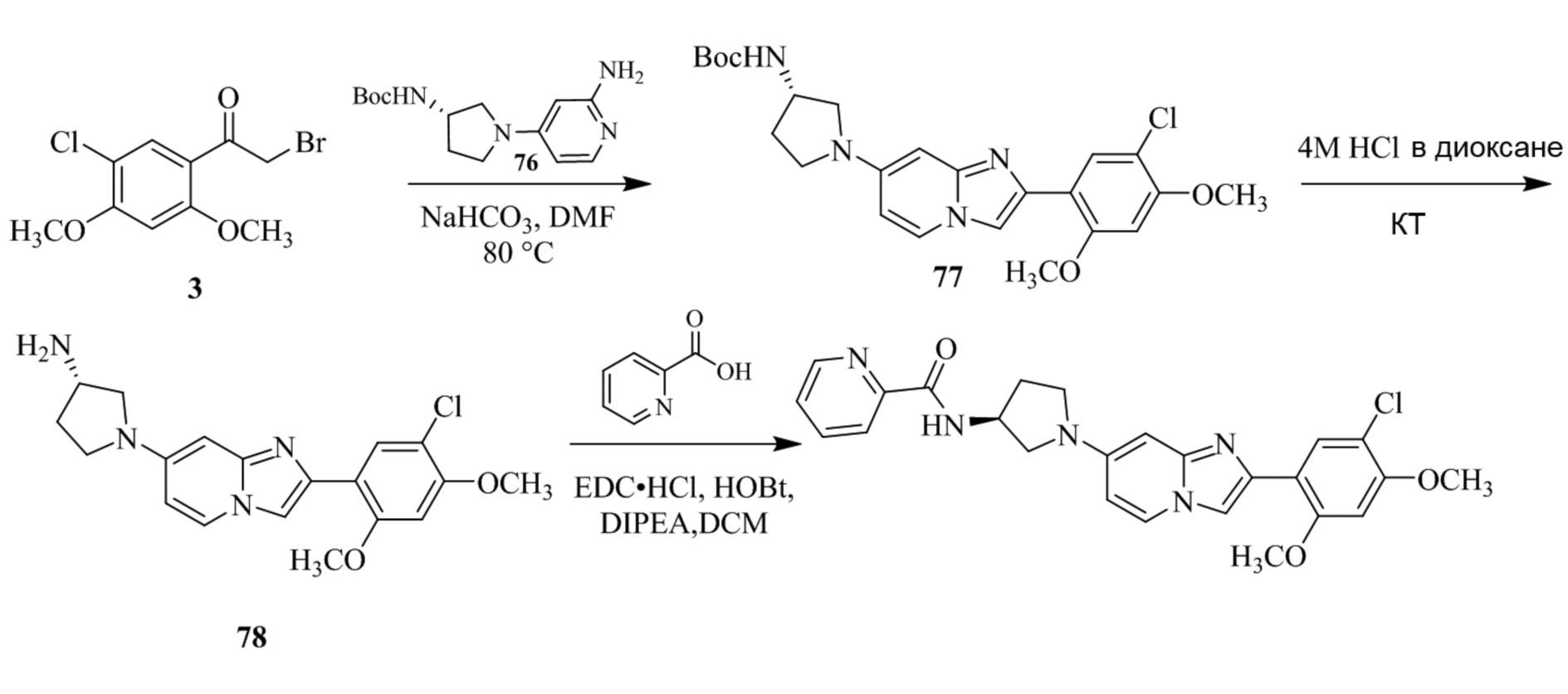
( S ) -трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)карбамат 77 (пример 44);
(S)-трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат 77 получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества белого цвета (75 мг, 44%).
1H ЯМР (400 МГц, CD3OD): δ 8,35 (с, 1H), 7,87 (д, J=7,2 Гц, 1H), 7,81 (с, 1H), 6,57 (с, 1H), 6,50-6,48 (м, 1H), 6,33 (д, J=7,2 Гц, 1H), 4,79 (ушир. с, 1H), 4,45 (ушир. с, 1H), 3,99 (с, 3H), 3,98 (с, 3H), 3,71-3,69 (м, 1H), 3,53-3,48 (м, 2H), 3,29-3,27 (м, 1H), 2,33-2,31 (м, 1H), 2,08-1,99 (м, 1H), 1,46 (с, 9H); ВЭЖХ (способ 2) 94,1% (AUC), tR=19,68 мин; ESI MS m/z 473 [M+H]+.
( S ) - 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-амина гидрохлорид 78 (пример 47);
(S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-амина гидрохлорид 78 получали аналогичным образом, как 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этанамин 5f, и получали в виде твердого вещества белого цвета (35 мг, 72%).
1H ЯМР (400 МГц, DMSO-d6); δ 13,70 (с, 1H), 8,58-8,44 (м, 4H), 8,27 (с, 1H), 8,05 (с, 1H), 7,03-6,94 (м, 2H), 6,44 (с, 1H), 4,09-3,95 (м, 7H), 3,80-3,64 (м, 2H), 3,61-3,50 (м, 2H), 2,42-2,33 (м, 1H), 2,26-2,17 (м, 1H); ESI MS m/z 373 [M+H]+.
Получение ( S )-N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)пиколинамида (пример 404);
Соединение (S)-N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)пиколинамид получали аналогичным образом, как трет-бутил(2-((2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)бензамидо)этил)амино)этил)карбамат 236 (пример 248), и получали в виде твердого вещества светло-коричневого цвета (62%).
1H ЯМР (400 МГц, DMSO-d6): 8,93 (д, J=7,7 Гц, 1H), 8,66-8,63 (м, 1H), 8,28 (д, J=7,5 Гц, 1H), 8,16 (с, 1H), 8,08-7,93 (м, 2H), 7,95 (с, 1H), 7,63-7,58 (м, 1H), 6,85 (с, 1H), 6,51 (дд, J=2,3, 7,5 Гц, 1H), 6,25 (с, 1H), 4,73-4,64 (м, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,69-3,62 (м, 1H), 3,56-3,49 (м, 1H), 3,43-3,34 (м, 2H), 2,34-2,25 (м, 1H), 2,24-2,14 (м, 1H). ВЭЖХ (то же, что способ 1, за исключением обнаружения при 220 нм) 95,5% (AUC), tR=10,99 мин; ESI MS m/z 478 [M+H]+.
Схема 22
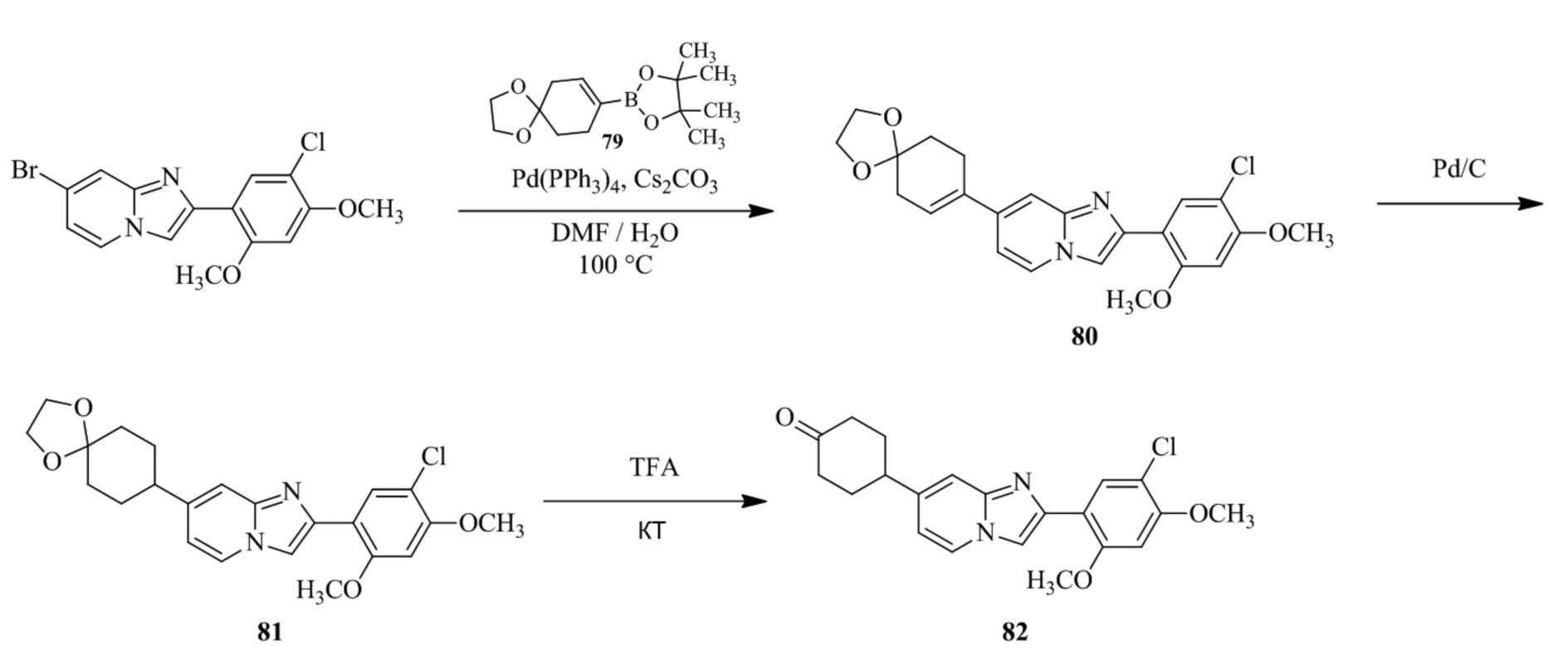
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диоксаспиро[4,5]дец-7-ен-8-ил)имидазо[1,2- a ]пиридина 80 (пример 117);
2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диоксаспиро[4,5]дец-7-ен-8-ил)имидазо[1,2-a]пиридин 80 получали аналогичным образом, как трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидропиридин-1(2H)-карбоксилат 24a, и получали в виде твердого вещества грязно-белого цвета (120 мг, 40%).
1H ЯМР (400 МГц, CDCl3): δ 8,40 (с, 1H), 8,02 (с, 1H), 7,99 (д, J=7,30 Гц, 1H), 7,54 (с, 1H), 6,92 (д, J=7,30 Гц, 1H), 6,58 (с, 1H), 6,21-6,19 (м, 1H), 4,00-3,96 (м, 10H), 2,72-2,70 (м, 2H), 2,52-2,50 (м, 2H), 1,96-1,94 (м, 2H); ВЭЖХ (способ 1) 98,6% (AUC), tR=10,78 мин; ESI MS m/z 427 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диоксаспиро[4,5]декан-8-ил)имидазо[1,2- a ]пиридина 81;
Раствор 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диоксаспиро[4,5]дец-7-ен-8-ил)имидазо[1,2-a]пиридина 80 (50 мг, 0,117 ммоль) и Pd/C (50 мг) в THF (10 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь фильтровали, промывали с использованием THF и сушили при пониженном давлении для того, чтобы получить желаемое соединение 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диоксаспиро[4,5]декан-8-ил)имидазо[1,2-a]пиридин (25 мг) в виде твердого вещества грязно-белого цвета.
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-циклогексанона 82 (пример 119);
Раствор 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диоксаспиро[4,5]декан-8-ил)имидазо[1,2-a]пиридина 80 (10 мг, 0,02 ммоль) и TFA (2 мл) в воде (0,5 мл) перемешивали при комнатной температуре в течение 72 ч. Растворитель удаляли при пониженном давлении для того, чтобы получить желаемое соединение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексанон 82 (9 мг, 88%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 8,06-8,03 (м, 2H), 7,44 (с, 1H), 6,65 (дд, J=1,7, 7,0 Гц, 1H), 6,59 (с, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 3,10-3,01 (м, 1H), 2,57-2,51 (м, 4H), 2,33-2,35 (м, 2H), 2,02-1,90 (м, 2H); ВЭЖХ (способ 2) 94,06% (AUC), tR=17,36 мин; ESI MS m/z 385 [M+H]+.
Схема 23
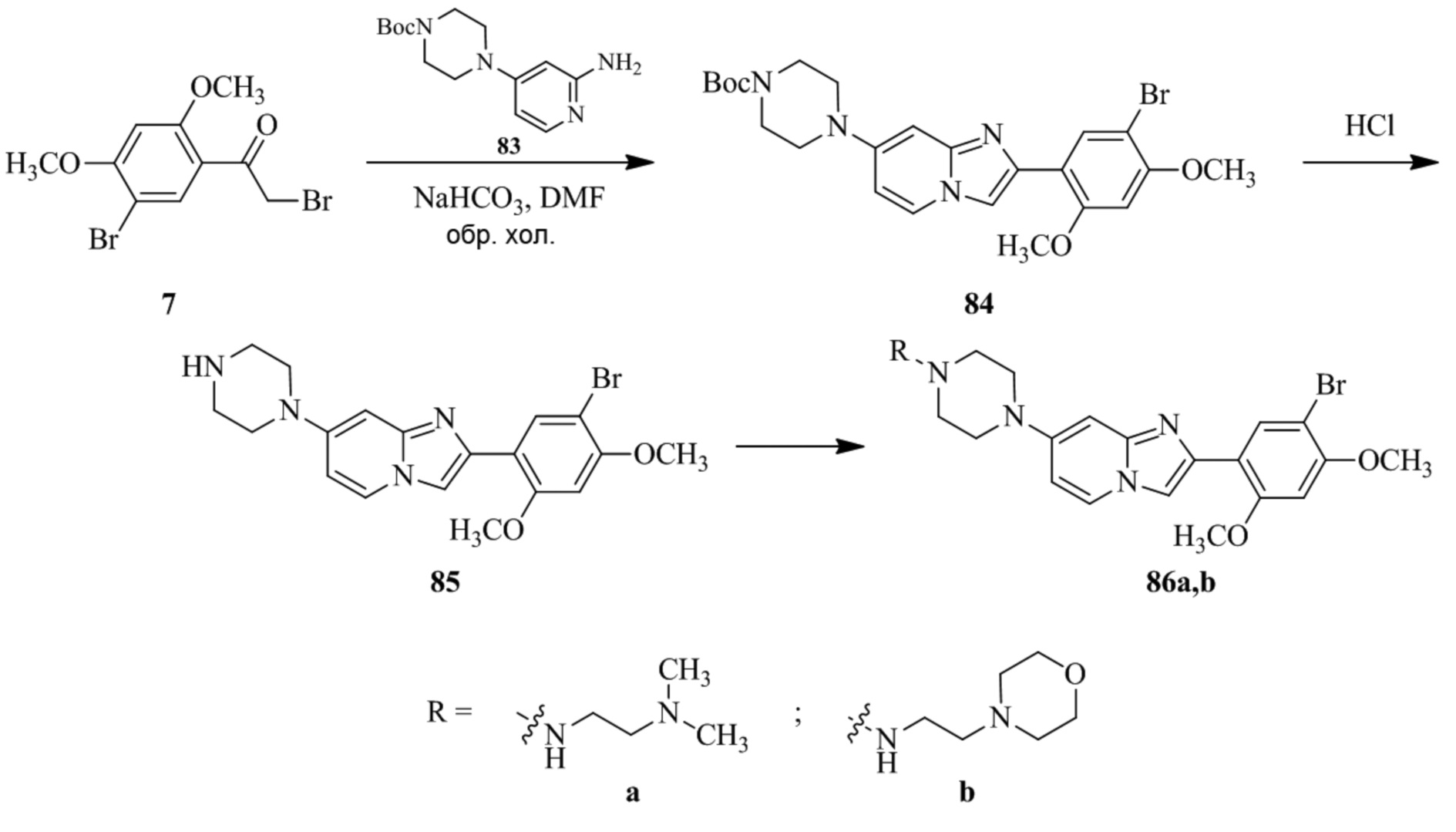
Получение трет -бутил-4-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-карбоксилата 84;
трет-бутил-4-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 77 получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества белого цвета.
Получение 2-(5-бром-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2- a ]пиридина 85;
2-(5-бром-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 85 получали аналогичным образом, как 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)пиперидин-4-ил)этанамин 5f, и получали в виде твердого вещества желтого цвета.
Получение 3-(4-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)- N,N- диметилпропан-1-амина 86a (пример 130);
Cмесь 2-(5-бром-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]-пиридина 12 (100 мг, 0,30 ммоль), N,N-диметилпропан-1-амина гидрохлорида (63 мг, 0,40 ммоль) и карбоната цезия (290 мг, 0,9 ммоль) в DMF (2 мл) нагревали с обратным холодильником в течение 3 ч. Реакционную смесь гасили водой и экстрагировали этилацетатом. Растворитель удаляли при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить 3-(4-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)пиперазин-1-ил)-N,N-диметилпропан-1-амин 86a (48 мг, 38%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,36 (с, 1H), 8,92-7,90 (м, 2H), 6,82 (с, 1H), 6,55 (с, 1H), 6,53 (м, 1H), 4,19 (м, 2H), 4,15 (с, 3H), 3,99 (с, 3H), 3,76-3,72 (м, 4H), 3,23-3,20 (м, 4H), 2,37-2,34 (м, 2H), 2,22 (с, 6H), 1,80-1,82 (м, 2H); ВЭЖХ (способ 1) 97,63% (AUC), tR=9,42 мин.; ESI MS m/z 502 [M+H]+.
Получение 4-(2-(4-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)этил)морфолина 86b (пример 131);
4-(2-(4-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)этил)морфолин 86b получали аналогичным образом, как 3-(4-(2-(5-бром-2,4-диметокси-фенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N,N-диметилпропан-1-амин 86a, и получали в виде твердого вещества белого цвета (40 мг, 33%).
1H ЯМР (300 МГц, CDCl3): δ 8,36 (с, 1H), 7,93 (д, J=7,2 Гц, 1H), 7,88 (с, 1H), 6,82 (м, 1H), 6,58 (с, 1H), 6,54 (д, J=7,2 Гц, 1H), 4,28(м, 2H), 4,00 (с, 3H), 3,95 (с, 3H), 3,73-3,71 (м, 4H), 3,69-3,67 (м, 4H), 3,22-3,19 (м, 4H), 2,68-2,66 (м, 2H), 2,54-2,52 (м, 4H); ВЭЖХ (способ 1)=98,0% (AUC), tR=9,40 мин; ESI MS m/z 530 [M+H]+.
Схема 24
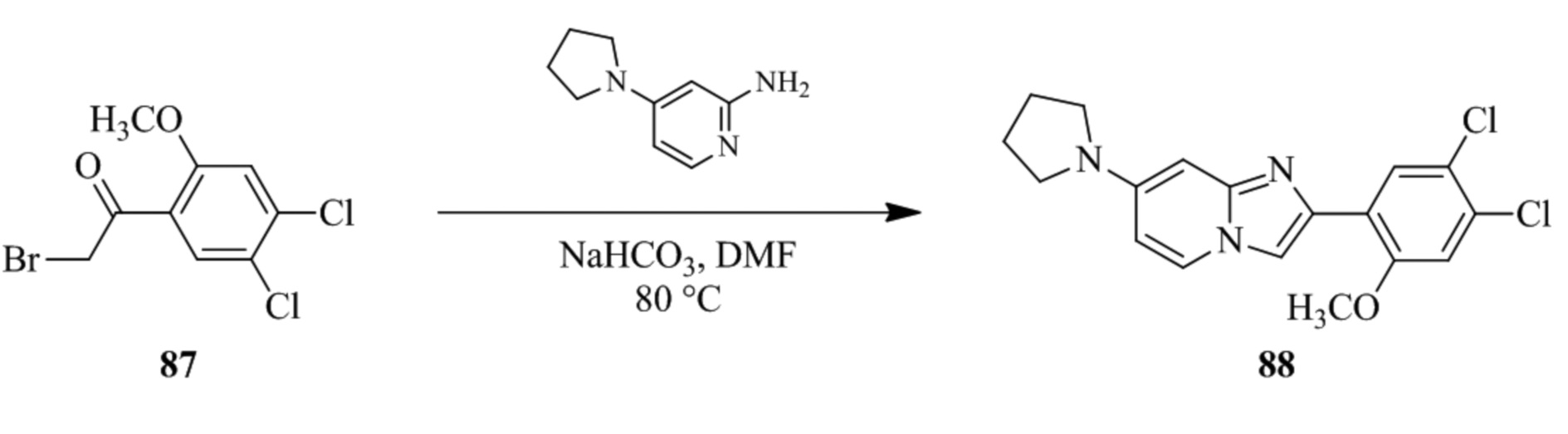
Получение 2-(4,5-дихлор-2-метоксифенил)-7-(пирролидин-1-ил)имидазо[1,2- a ]пиридина 88 (пример 233);
Соединение 2-(4,5-дихлор-2-метоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]-пиридин 88 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a. Получаемую соль бромистоводородной кислоты нейтрализовали разбавленным водным аммиаком для того, чтобы получить свободное основание и в виде твердого вещества грязно-белого цвета (48 мг, 72%).
1H ЯМР (400 МГц, CDCl3): δ 8,48 (с, 1H), 7,87 (с, 1H), 7,85 (д, J=7,6 Гц, 1H), 7,02 (с, 1H), 6,42 (ушир. с, 1H), 6,36 (дд, 1H, J=2,4 Гц, 7,5), 3,97 (с, 3H), 3,38-3,33 (м, 4H), 2,07-2,03 (м, 4H); ВЭЖХ (способ 1) 99,73% (AUC), tR=11,76 мин.; APCI MS m/z 362 [M+H]+.
Схема 25
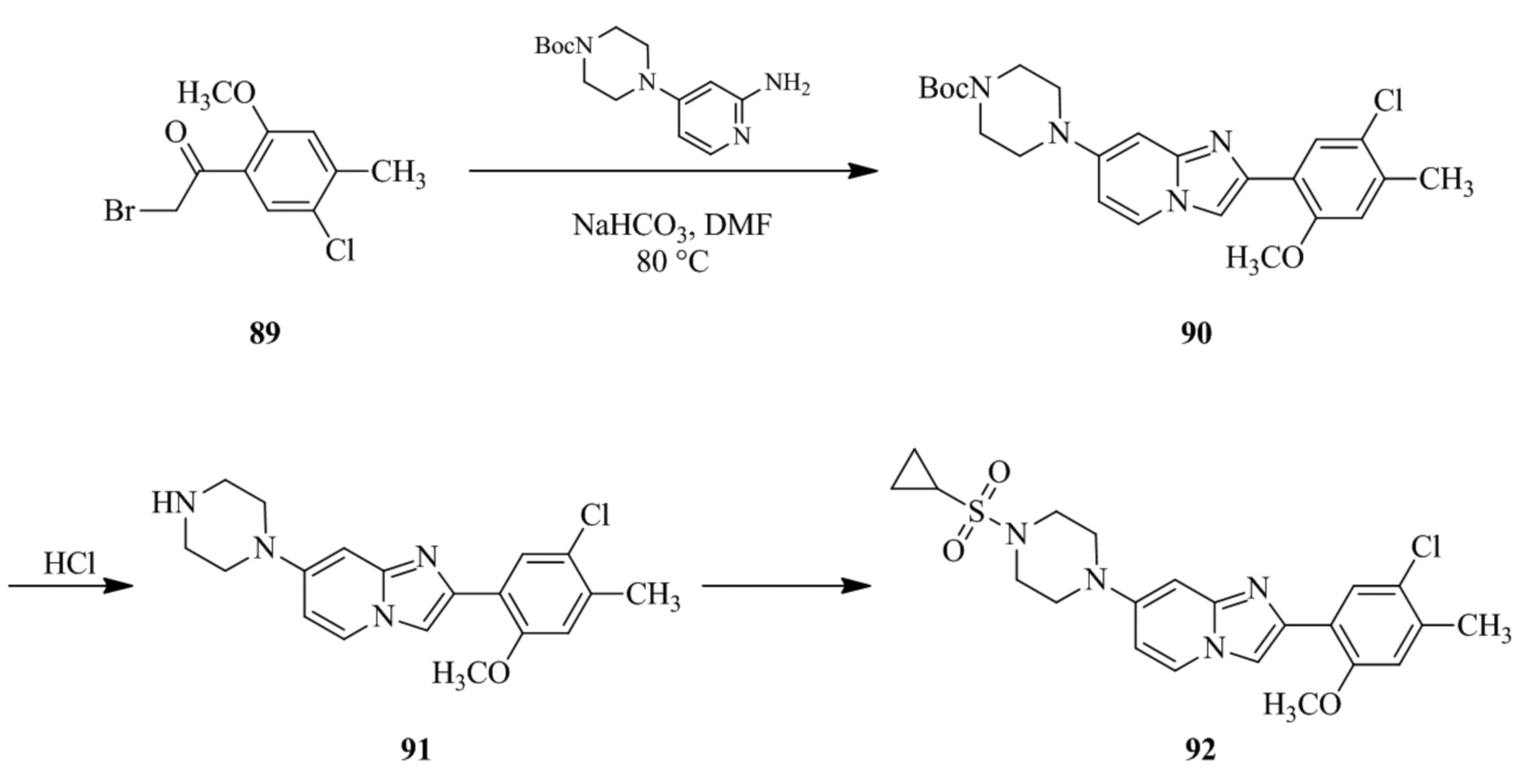
Получение трет -бутил-4-(2-(5-хлор-2-метокси-4-метилфенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-карбоксилата 90;
Соединение трет-бутил-4-(2-(5-хлор-2-метокси-4-метилфенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 90 получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества белого цвета (150 мг, 45%).
2-(5-хлор-2-метокси-4-метилфенил)-7-(пиперазин-1-ил)имидазо[1,2- a ]пиридина гидрохлорид 91 (пример 228);
Раствор трет-бутил-4-(2-(5-хлор-2-метокси-4-метилфенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилата 90 (40 мг, 0,08 ммоль) в 4M HCl в диоксане (1,5 мл) перемешивали при 55°C в течение 1,5 ч. Растворитель удаляли; осадок желтого цвета промывали простым эфиром и сушили при пониженном давлении для того, чтобы получить 2-(5-хлор-2-метокси-4-метилфенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина гидрохлорид 91 (30 мг, 96%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,50 (д, J=7,64 Гц, 1H), 8,27 (с, 1H), 7,78 (с, 1H), 7,30 (дд, J=7,64 Гц, 1H), 7,19 (с, 1H), 6,99 (с, 1H), 4,03 (с, 3H), 3,86-3,82 (м, 4H), 3,46-3,41 (м, 4H), 2,45 (с, 3H). ВЭЖХ (способ 1) 98,4% (AUC), tR=15,65 мин; ESI MS m/z 357 [M+H]+.
Получение 2-(5-хлор-2-метокси-4-метилфенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 92 (пример 229);
Соединение 2-(5-хлор-2-метокси-4-метилфенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин 92 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопропилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13e, и получали в виде твердого вещества белого цвета (19 мг, 37%).
1H ЯМР (400 МГц, CDCl3): δ 8,33 (с, 1H), 7,95 (с, 1H), 7,94 (д, J=7,59 Гц, 1H), 6,86 (с, 1H), 6,82 (с, 1H), 6,54 (дд, J=7,59 Гц, 1H), 3,96 (с, 3H), 3,50-3,46 (м, 4H), 3,36-3,32 (м, 4H), 2,40 (с, 3H), 2,3-2,26 (м, 1H), 1,31-1,20 (м, 2H), 1,15-1,01 (м, 2H). ВЭЖХ (способ 1) 98,9% (AUC), tR=11,16 мин; ESI MS m/z 461 [M+H]+.
Схема 26
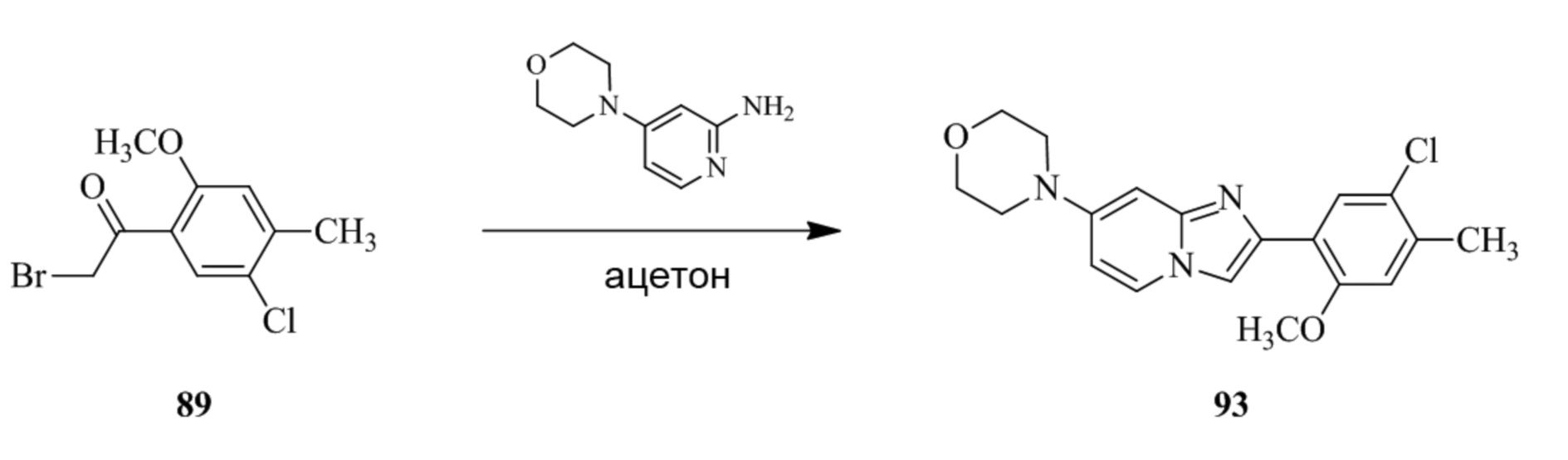
4-(2-(5-хлор-2-метокси-4-метилфенил)имидазо[1,2- a ]пиридин-7-ил)морфолин 93 (пример 230);
Соединение 4-(2-(5-хлор-2-метокси-4-метилфенил)имидазо[1,2-a]пиридин-7-ил)морфолин 93 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a, и получали в виде твердого вещества белого цвета (89 мг, 59%).
1H ЯМР (400 МГц, CDCl3): δ 8,33 (с, 1H), 7,94 (с, 1H), 7,92 (д, J=7,55 Гц, 1H), 6,82 (с, 1H), 6,81 (с, 1H), 6,55 (м, 1H), 3,96 (с, 3H), 3,89-3,85 (м, 4H), 3,23-3,18 (м, 4H), 2,40 (с, 3H); ВЭЖХ (способ 2) >99% (AUC), tR=18,15 мин; ESI MS m/z 358 [M+H]+.
Схема 27
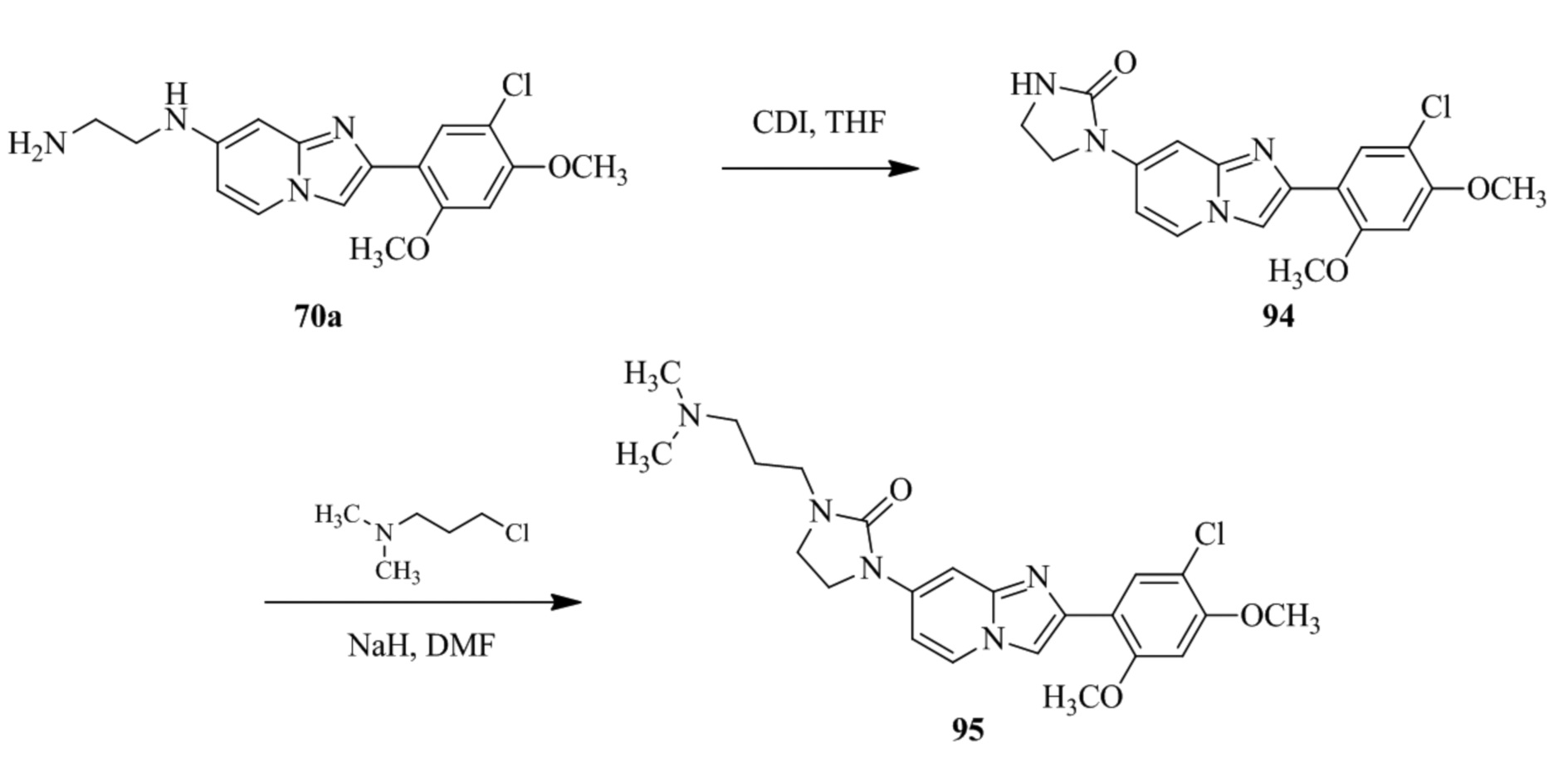
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)имидазолидин-2-она 94 (пример 138);
В раствор N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-этан-1,2-диамина 70a (75 мг, 0,20 ммоль) в тетрагидрофуране (3 мл) добавляли 1,1-карбонилдиимидазол (48 мг, 0,3 ммоль) и осуществляли перемешивание при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали и остаток растирали в порошок с ацетонитрилом для того, чтобы получить желаемое соединение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)имидазолидин-2-он 94 (50 мг, 62%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,41 (д, J=7,5 Гц, 1H), 8,18 (с, 1H), 8,14 (с, 1H), 7,73 (д, J=7,5 Гц, 1H), 7,19 (с, 1H), 7,15 (с, 1H), 6,88 (с, 1H), 4,02 (с, 3H), 3,94 (с, 3H), 3,93-3,85 (м, 2H), 3,50-3,40 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=9,96 мин; ESI MS m/z 373 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-3-(3-(диметиламино)пропил)имидазолидин-2-она 95 (пример 167);
В раствор 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)имидазолидин-2-она 94 (100 мг, 0,30 ммоль) в N,N-диметилформамиде (3 мл) добавляли 60% NaH (40 мг, 1,50 ммоль), после чего следовал N,N-диметиламинопропилхлорид (60 мг, 0,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь гасили 10% раствором хлорида аммония (20 мл) и экстрагировали хлороформом (100 мл). Органический слой концентрировали при пониженном давлении и остаток очищали посредством хроматографии CombiFlash (силикагель, DCM/метанол) для того, чтобы получить 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-(3-(диметиламино)пропил)имидазолидин-2-он 6 (25 мг, 20%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, CD3OD): δ 8,26 (д, J=7,6 Гц, 1H), 8,09 (с, 2H), 7,77 (д, J=7,6 Гц, 1H), 7,12 (с, 1H), 6,79 (с, 1H), 4,02 (с, 3H), 3,95 (с, 3H), 3,94-3,89 (м, 2H), 3,64-3,56 (м, 2H), 2,48-2,39 (м, 2H), 2,31 (м, 6H), 1,87-1,74 (м, 2H). ВЭЖХ (способ 1) 98,4% (AUC), tR=9,16 мин; ESI MS m/z 458 [M+H]+.
Схема 28
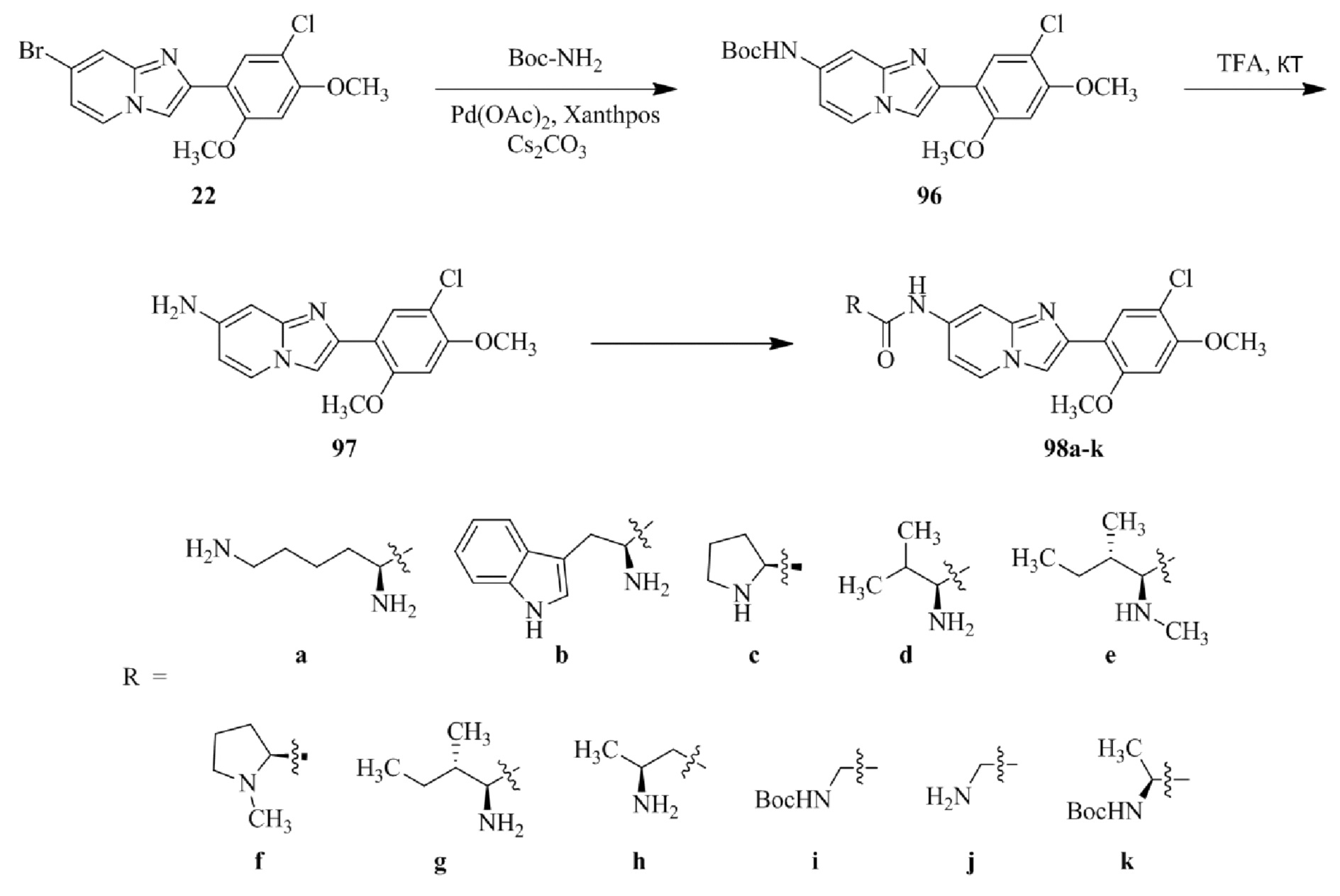
Получение трет -бутил(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-карбамата 96;
Брали смесь 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 22 (1,00 г, 2,70 ммоль), трет-бутилкарбамата (470 мг, 4,00 ммоль), ацетата палладия (220 мг, 0,10 ммоль), Xanthpos (170 мг, 0,30 ммоль) и карбоната цезия (2,2 г, 6,8 ммоль) в 1,4-диоксане (20 мл) и дегазировали аргоном. Реакционную смесь нагревали до 100°C в течение 3 ч. Реакционную массу охлаждали до комнатной температуры, разбавляли этилацетатом (100 мл) и фильтровали через слой целита. Фильтрат дистиллировали при пониженном давлении и остаток очищали посредством хроматографии CombiFlash (силикагель, 7:3 Гексан/EtOAc) для того, чтобы получить трет-бутил(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)карбамат (800 мг, 87%) в виде твердого вещества желтого цвета.
Получение 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-амина 97;
Cмесь трет-бутил(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-карбамата 96 (4,0 г, 9,90 ммоль) и трифторуксусной кислоты (20 мл) в дихлорметане (40 мл) перемешивали при комнатной температуре в течение 4 ч. Растворитель дистиллировали при пониженном давлении и остаток ощелачивали водным раствором аммиака (30%) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амин 4 (2,95 г, 89%) в виде твердого вещества бледно-желтого цвета. Затем соединение 4 обрабатывали с использованием 4M HCl в 1,4-диоксане (10 мл) и концентрировали при пониженном давлении для того, чтобы получить указанное в заголовке соединение 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амин в виде HCl соли.
Получение ( S )-2,6-диамино -N- (2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил)гексанамида 98a (пример 247);
В смесь HCl соли 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 4 (120 мг, 0,40 ммоль) и кислоты (140 мг, 0,40 ммоль) в DMF (2 мл) добавляли HATU (150 мг, 0,40 ммоль), после чего следовал диизопропилэтиламин (160 мг, 1,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь выливали в воду и осадок собирали посредством фильтрования. Неочищенное вещество очищали посредством хроматографии CombiFlash (силикагель, MeOH/DCM) для того, чтобы получить форму (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамида с бис-Boc защитой в виде твердого вещества грязно-белого цвета. Соединение обрабатывали с использованием 4M HCl в 1,4-диоксане (2 мл) и концентрировали при пониженном давлении для того, чтобы получить (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамид 98a (30 мг, 16%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,32 (д, J=7,4 Гц, 1H), 8,15 (с, 1H), 8,11 (с, 1H), 8,05 (с, 1H), 7,08 (д, J=7,4 Гц, 1H), 6,80 (с, 1H), 4,03 (с, 3H) 3,95 (с, 3H), 3,57 (т, J=6,4 Гц, 1H), 2,94 (т, J=7,4 Гц, 2H), 1,91-1,81 (м, 1H), 1,71-1,66 (м, 3H), 1,58-1,47 (м, 2H); ВЭЖХ (способ 1) 98,9% (AUC), tR=8,52 мин; ESI MS m/z 432 [M+H]+.
Получение ( S )-2-амино -N- (2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-3-(1H-индол-3-ил)пропанамида 98b (пример 250);
Соединение (S)-2-амино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-(1H-индол-3-ил)пропанамида 98b получали аналогичным образом, как (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамид 98a, и получали в виде твердого вещества грязно-белого цвета (30 мг, 20%).
1H ЯМР (300 МГц, DMSO-d6): δ 10,82 (с, 1H), 8,42 (д, J=7,3 Гц, 1H), 8,20 (с, 1H), 8,17 (с, 1H), 7,97 (с, 1H), 7,59 (д, J=7,3 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 7,17 (с, 1H), 7,08-7,00 (м, 2H), 6,95 (т, J=7,1 Гц, 1H), 6,88 (с, 1H), 4,02 (с, 3H), 3,94 (с, 3H), 3,69-3,62 (м, 1H), 3,20-3,12 (м, 1H), 2,97-2,88 (м, 1H). ВЭЖХ (способ 1) 94,1% (AUC), tR=9,81 мин; ESI MS m/z 490 [M+H]+.
Получение ( S ) -N- (2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-2-карбоксамида 98c (пример 244);
Соединение (S)-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-2-карбоксамид 98c получали аналогичным образом, как (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамид 98a, и получали в виде твердого вещества грязно-белого цвета (60 мг, 39%).
1H ЯМР (400 МГц, DMSO-d6): δ 10,23 (ушир. с, 1H), 8,44 (д, J=7,3 Гц, 1H), 8,19 (с, 1H), 8,17 (с, 1H), 7,98 (с, 1H), 7,09 (д, J=7,3 Гц, 1H), 6,87 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,84-3,79 (м, 1H), 2,96 (т, J=6,9 Гц, 2H), 2,16-2,05 (м, 1H), 1,89-1,78 (м, 1H), 1,76-1,65 (м, 2H); ВЭЖХ (способ 1) 96,1% (AUC), tR=8,50 мин; ESI MS m/z 401 [M+H]+.
Получение ( S )-2-амино -N- (2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-3-метилбутанамида 98d (пример 252);
Соединение (S)-2-амино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-метилбутанамид 98d получали аналогичным образом, как (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамид 98a, и получали в виде твердого вещества желтого цвета (25 мг, 22%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,43 (д, J=7,43 Гц, 1H), 8,19 (с, 1H), 8,17 (с, 1H), 7,97 (с, 1H), 7,04 (м, 1H), 6,88 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,16-3,11 (м, 1H), 2,00-1,91 (м, 1H), 0,94 (д, J=6,80 Гц, 3H), 0,87 (д, J=6,80 Гц, 3H); ВЭЖХ (способ 1) 98,1% (AUC), tR=9,31 мин; ESI MS m/z 403 [M+H]+.
Получение (2 S ,3 S ) -N- (2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-3-метил-2-(метиламино)пентанамида 98e (пример 266);
Соединение (2S,3S)-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-метил-2-(метиламино)пентанамид 98e получали аналогичным образом, как (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамид 98a, и получали в виде твердого вещества желто-коричневого цвета (40 мг, 21%).
1H ЯМР (400 МГц, CD3OD): δ 8,31 (д, J=7,2 Гц, 1H), 8,14 (с, 1H), 8,11 (с, 1H), 8,01 (с, 1H), 7,11 (д, J=7,2 Гц, 1H), 6,79 (с, 1H), 4,02 (с, 3H), 3,95 (с, 3H), 3,01 (ушир. с, 1H), 2,38 (с, 3H), 1,82-1,58 (м, 2H), 1,44-1,17 (м, 1H), 1,08-0,82 (м, 6H); ВЭЖХ (способ 1) 96,7% (AUC), tR=9,54 мин; ESI MS m/z 431 [M+H]+.
Получение ( S ) -N- (2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-1-метилпирролидин-2-карбоксамида 98f (пример 263);
В смесь HCl соли 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 97 (120 мг, 0,40 ммоль) и кислоты (65 мг, 0,50 ммоль) в DMF (2 мл) добавляли HATU (190 мг, 0,50 ммоль), после чего следовал DIPEA (150 мг, 1,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь выливали в воду и осадок собирали посредством фильтрования. Неочищенное вещество очищали посредством хроматографии CombiFlash (силикагель, MeOH/DCM) и получали в виде твердого вещества желтого цвета (50 мг, 34%).
1H ЯМР (300 МГц, CDCl3): δ 9,49 (с, 1H), 8,34 (с, 1H), 8,02 (д, J=7,3 Гц, 1H), 7,99 (с, 1H), 7,70 (ушир. с, 1H), 7,32 (д, J=7,3 Гц, 1H), 6,58 (с, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 3,27-3,20 (м, 1H), 3,08-3,02 (м, 1H), 2,48 (с, 3H), 2,46-2,41 (м, 1H), 2,36-2,24 (м, 1H), 2,04-1,93 (м, 1H), 1,89-1,79 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=9,08 мин; ESI MS m/z 415 [M+H]+.
Получение трет -бутил((2S,3R)-1-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил)амино)-3-метил-1-оксопентан-2-ил)карбамата 98h (пример 257);
трет-бутил((2S,3R)-1-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-3-метил-1-оксопентан-2-ил)карбамат 98h получали аналогичным образом, как форму (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо-[1,2-a]пиридин-7-ил)гексанамида с бис-Boc защитой во время синтеза (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамида 98a, и получали в виде твердого вещества грязно-белого цвета (50 мг, 33%).
1H ЯМР (300 МГц, CDCl3): δ 8,84 (ушир. с, 1H), 8,13 (с, 1H), 8,95 (д, J=7,3 Гц, 1H), 7,88 (с, 1H), 7,78 (с, 1H), 6,86 (ушир. с, 1H), 6,42 (с, 1H), 5,24 (ушир. с, 1H), 4,11 (т, J=7,8 Гц, 1H), 3,92 (с, 3H), 3,91 (с, 3H), 1,96 (ушир. с, 1H), 1,48 (с, 9H), 1,31-1,20 (м, 2H), 1,02 (д, J=6,8 Гц, 3H), 0,93 (т, J=7,3 Гц, 3H); ВЭЖХ (способ 1) 98,8% (AUC), tR=11,85 мин; ESI MS m/z 517 [M+H]+.
Получение (2 S ,3 R )-2-амино -N- (2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил)-3-метилпентанамида 98h (пример 258);
Соединение (2S,3R)-2-амино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)-3-метилпентанамида 98h получали аналогичным образом, как (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамид 98a, и получали в виде твердого вещества грязно-белого цвета (25 мг, 20%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,43 (с, 1H), 8,18 (с, 1H), 7,98 (с, 1H), 7,05 (с, 1H), 6,88 (с, 1H), 4,02 (с, 3H), 3,94 (с, 3H), 3,17 (с, 1H), 1,69 (с, 1H), 1,52 (с, 1H), 1,28-1,09 (м, 1H), 0,90 (с, 3H), 0,93 (с, 3H); ВЭЖХ (способ 1) 98,8% (AUC), tR=9,5 мин; ESI MS m/z 417 [M+H]+.
Получение трет -бутил(2-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-амино)-2-оксоэтил)карбамата 98i (пример 161);
Соединение трет-бутил(2-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-2-оксоэтил)карбамат 98i получали аналогичным образом, как форму (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамида с бис-Boc защитой, и получали в виде твердого вещества желтого цвета (60 мг, 43%).
1H ЯМР (300 МГц, CDCl3): δ 8,50 (ушир. с, 1H), 8,35 (с, 1H), 8,00 (с, 1H), 7,98 (с, 1H), 7,68 (с, 1H), 7,11 (д, J=6,2 Гц, 1H), 6,56 (с, 1H), 5,28 (ушир. с, 1H), 3,98 (с, 3H), 3,95 (с, 3H), 3,93-3,90 (м, 2H), 1,49 (с, 9H); ВЭЖХ (способ 3) 96,9% (AUC), tR=17,5 мин; ESI MS m/z 461 [M+H]+.
Получение 2-амино -N- (2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-ацетамида 98j (пример 166);
Соединение (2-амино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-ацетамид 98j получали аналогичным образом, как (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамид 98a, и получали в виде твердого вещества грязно-белого цвета (30 мг, 77%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,44 (д, J=7,3 Гц, 1H), 8,19 (с, 1H), 8,17 (с, 1H), 7,97 (с, 1H), 7,04 (д, J=7,3 Гц, 1H), 6,88 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,34 (м, 2H); ВЭЖХ (способ 1) 97,6% (AUC), tR=8,8 мин; ESI MS m/z 361 [M+H]+.
Получение ( S )- трет -бутил(1-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил)амино)-1-оксопропан-2-ил)карбамата 98k (пример 253);
Соединение (S)-трет-бутил(1-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-1-оксопропан-2-ил)карбамат 98k получали аналогичным образом, как форму (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамида с бис-Boc защитой во время синтеза (S)-2,6-диамино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)гексанамида 98a, и получали в виде твердого вещества грязно-белого цвета (70 мг, 50%).
1H ЯМР (400 МГц, CDCl3): δ 8,87 (ушир. с, 1H), 8,37 (с, 1H), 7,96 (д, J=7,2 Гц, 1H), 7,94 (с, 1H), 7,71 (с, 1H), 7,00 (с, 1H), 6,52 (с, 1H), 5,00 (ушир. с, 1H), 4,34 (ушир. с, 1H), 3,96 (с, 3H), 3,94 (с, 3H), 1,48 (с, 9H), 1,45 (д, J=7,0 Гц, 3H); ВЭЖХ (способ 1) >99% (AUC), tR=11,05 мин; ESI MS m/z 475 [M+H]+.
Схема 29
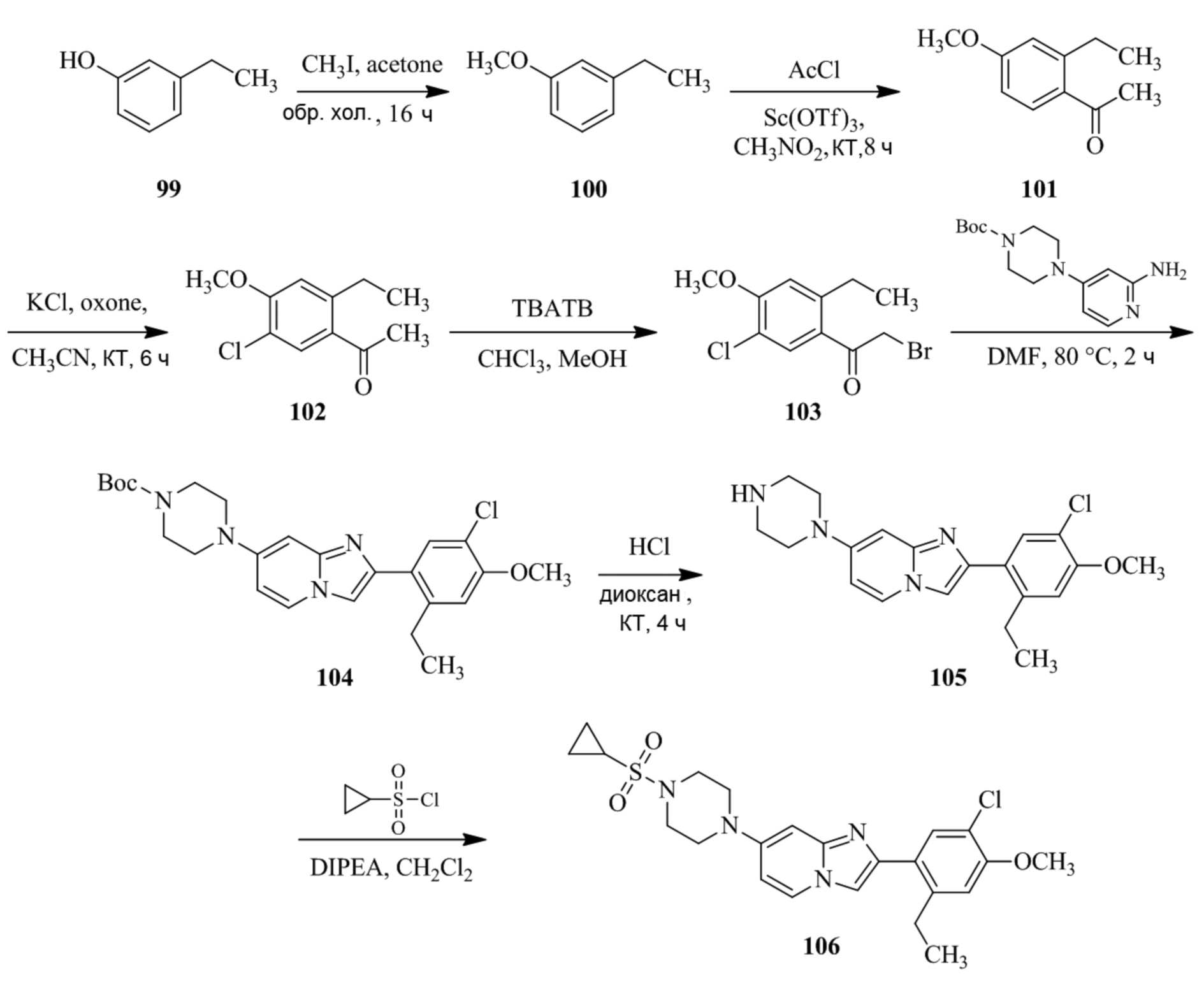
Получение 1-этил-3-метоксибензола 100;
В раствор 3-этилфенола 99(5,00 г, 40,9 ммоль) в ацетоне (50 мл) добавляли карбонат калия (11,30 г, 81,80 ммоль), после чего следовал йодметан (7,53 г, 53,10 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 16 ч. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Брали остаток в этилацетате (200 мл) и промывали 10% раствором гидроксида натрия (100 мл). Органический слой концентрировали при пониженном давлении для того, чтобы получить желаемое соединение 1-этил-3-метоксибензол 100 (5,00 г, 90%) в виде жидкости бледно-желтого цвета.
Получение 1-(2-этил-4-метоксифенил)этаноне 101;
В раствор 1-этил-3-метоксибензола 100 (3,25 г, 23,7 ммоль) в нитрометане (30 мл) добавляли ацетилхлорид (2,78 г, 35,5 ммоль), после чего следовал трифлат скандия (1,2 г, 2,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 8 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии (силикагель, EtOAc/гексан) для того, чтобы получить 1-(2-этил-4-метоксифенил)этанон 101 (550 мг, 23%) в виде жидкости бледно-желтого цвета.
Получение 1-(5-хлор-2-этил-4-метоксифенил)этанона 102;
В раствор 1-(2-этил-4-метоксифенил)этанона 101 (550 мг, 3,10 ммоль) в смеси вода/ацетонитрил 1:1 (11 мл) добавляли хлорид калия (250 мг, 3,40 ммоль), после чего следовал оксон (2,1 г, 3,40 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь экстрагировали этилацетатом (100 мл) и органический слой концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии (силикагель, EtOAc/гексан) для того, чтобы получить 1-(5-хлор-2-этил-4-метоксифенил)этанон 102 (250 мг, 38%) в виде бесцветной жидкости.
Получение 2-бром-1-(5-хлор-2-этил-4-метоксифенил)этанона 103;
Cмесь 1-(5-хлор-2-этил-4-метоксифенил)этанона 102 (250 мг, 1,20 ммоль) и тетрабутиламмонийтрибромида (580 мг, 1,20 ммоль) в DCM/MeOH 3:1 (8 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и очищали посредством колоночной хроматографии (силикагель, DCM/гексан) для того, чтобы получить 2-бром-1-(5-хлор-2-этил-4-метоксифенил)этанон 103 (270 мг, 79%) в виде полутвердого вещества оранжевого цвета.
Получение трет -бутил-4-(2-(5-хлор-2-этил-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-карбоксилата 104;
Cмесь 2-бром-1-(5-хлор-2-этил-4-метоксифенил)аэтанон 103 (260 мг, 0,90 ммоль), трет-бутил-4-(2-аминопиридин-4-ил)пиперазин-1-карбоксилата (250 г, 0,90 ммоль) и NaHCO3 (230 мг, 2,70 ммоль) в DMF (5 мл) нагревали при 90°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в воду. Полученный таким образом осадок фильтровали, промывали водой и сушили при пониженном давлении. Осадок очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить трет-бутил-4-(2-(5-хлор-2-этил-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 104 (300 мг, 71,4%) в виде твердого вещества бледно-желтого цвета.
Получение 2-(5-хлор-2-этил-4-метоксифенил)-7-(пиперазин-1-ил)имидазо[1,2- a ]пиридина 105 (пример 260);
Раствор трет-бутил-4-(2-(5-хлор-2-этил-4-метоксифенил)имидазо[1,2-a]-пиридин-7-ил)пиперазин-1-карбоксилата 104 (200 мг, 0,40 ммоль) в 4,0 M HCl в диоксане (5 мл) перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали, промывали диоксаном и сушили при пониженном давлении для того, чтобы получить HCl соль желаемого соединения 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 105 (120 мг, 71%) в виде твердого вещества желтого цвета. Соединение суспендировали в 10 мл водного аммиака, перемешивали в течение 1 ч при комнатной температуре и осажденное твердое вещество фильтровали для того, чтобы получить свободное основание 2-(5-хлор-2-этил-4-метоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 105 в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 7,91 (д, J=7,3 Гц, 1H), 7,79 (с, 1H), 7,39 (с, 1H), 6,84 (с, 1H), 6,81 (с, 1H), 6,59 (д, J=7,3 Гц, 1H), 3,94 (с, 3H), 3,23-3,17 (м, 4H), 3,07-3,02 (м, 4H), 2,94-2,86 (м, 2H), 1,23 (т, J=7,6 Гц, 3H); ВЭЖХ (способ 1) 97,3% (AUC), tR=9,24 мин; ESI MS m/z 371 [M+H]+.
Получение 2-(5-хлор-2-этил-4-метоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 106 (пример 261);
В раствор 2-(5-хлор-2-этил-4-метоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 105(120 мг, 0,30 ммоль) и DIPEA (120 мг, 0,90 ммоль) в дихлорметане (2 мл) загружали циклопропилсульфонилхлорид (60 мг, 0,40 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. После 3 ч реакционную смесь концентрировали, суспендировали в водном аммиаке и перемешивали в течение 2 ч. Осадок фильтровали, промывали водой, сушили при пониженном давлении и очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить желаемый сульфонамид 2-(5-хлор-2-этил-4-метоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин 106(70 мг, 46%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 7,96 (д, J=7,38 Гц, 1H), 7,76 (с, 1H), 7,41 (с, 1H), 6,92 (ушир. с, 1H), 6,85 (с, 1H), 6,60 (д, J=7,4 Гц, 1H), 3,94 (с, 3H), 3,51-3,46 (м, 4H), 3,39-3,34 (м, 4H), 2,94-2,86 (м, 2H), 2,34-2,26 (м, 1H), 1,26-1,19 (м, 5H), 1,06-1,00 (м, 2H); ВЭЖХ (способ 1) 97,9% (AUC), tR=11,06 мин; ESI MS m/z 475 [M+H]+.
Схема 30
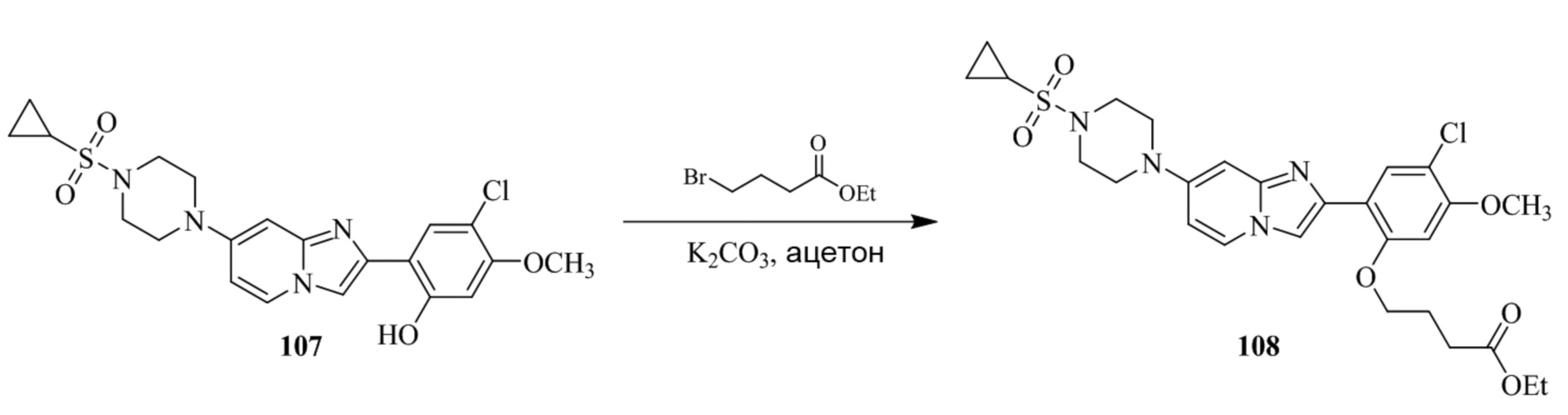
Получение этил-4-(4-хлор-2-(7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиридин-2-ил)-5-метоксифенокси)бутаноата 108;
В раствор 4-хлор-2-(7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин-2-ил)-5-метоксифенола 107 (1,0 г, 2,16 ммоль) в ацетоне (15 мл) добавляли K2CO3 (0,9 г, 4,66 ммоль) и этил-4-бромбутаноат (0,4 мл, 2,59 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 24 ч. Растворитель удаляли при пониженном давлении и остаток экстрагировали с использованием CH2Cl2 (2×25 мл) и промывали водой. Объединенные органические соединения промывали солевым раствором (50 мл), сушили над Na2SO4 и концентрировали при пониженном давлении для того, чтобы получить этил-4-(4-хлор-2-(7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин-2-ил)-5-метоксифенокси)бутаноат 108 (80%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,96 (д, J=8,0 Гц, 1H), 7,88 (с, 1H), 6,85 (д, J=1,9 Гц, 1H), 6,59 (с, 1H), 6,56 (дд, J=2,2, 7,8 Гц, 1H), 4,20-4,12 (м, 4H), 3,93 (с, 3H), 3,49-4,47 (м, 4H), 3,35-3,32 (м, 4H), 2,58 (т, J=6,7 Гц, 2H), 2,30-2,26 (м, 3H), 1,25 (т, J=6,9 Гц, 3H), 1,16-1,12 (м, 2H), 1,03-0,96 (м, 2H); ВЭЖХ (способ 1) 95,3%; APCI MS m/z 577 [M+H]+.
Получение 2-(4-хлор-2-(7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиридин-2-ил)-5-метоксифенокси)этанамина 108b (пример 234);
Соединение трет-бутил(2-(4-хлор-2-(7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин-2-ил)-5-метоксифенокси)этил)карбамат 108a получали сходно с этил-4-(4-хлор-2-(7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин-2-ил)-5-метоксифенокси)бутаноатом 108, с использованием трет-бутил(2-бромэтил)карбамата в качестве алкилирующего реактива, с 80% выходом. трет-Бутил(2-(4-хлор-2-(7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин-2-ил)-5-метоксифенокси)этил)карбамат 108a обрабатывали с использованием TFA/CH2Cl2 для того, чтобы получить свободное основание 2-(4-хлор-2-(7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин-2-ил)-5-метоксифенокси)этанамин 108b, после нейтрализации с использованием NaOH, в виде твердого вещества грязно-белого цвета (выход 60%).
1H ЯМР (400 МГц, CDCl3): δ 8,22 (с, 1H), 7,99 (д, J=7,4 Гц, 1H), 7,83 (с, 1H), 6,90 (д, J=2,2 Гц, 1H), 6,58 (с, 1H), 6,56 (дд, J=2,2, 7,6 Гц, 1H), 4,22 (т, J=5,1 Гц, 2H), 3,93 (с, 3H), 3,49-4,47 (м, 4H), 3,39-3,35 (м, 4H), 3,27 (т, J=5,3 Гц, 2H), 2,32-2,30 (м, 1H), 1,24-1,18 (м, 2H), 1,05-0,96 (м, 2H); ВЭЖХ (способ 2) 95,4% (AUC), tR=15,93 мин; ESI MS m/z 506 [M+H]+.
Схема 31
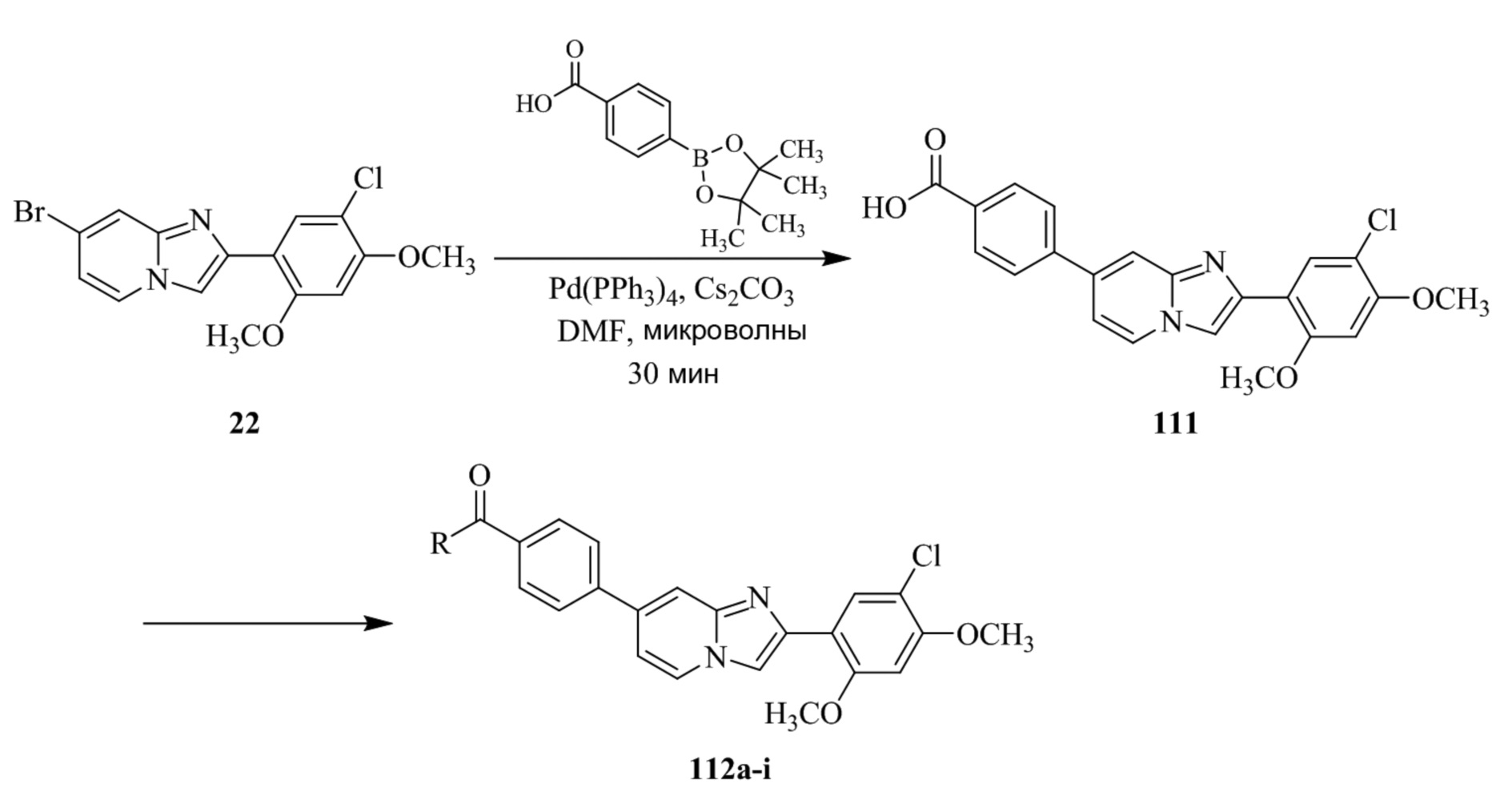
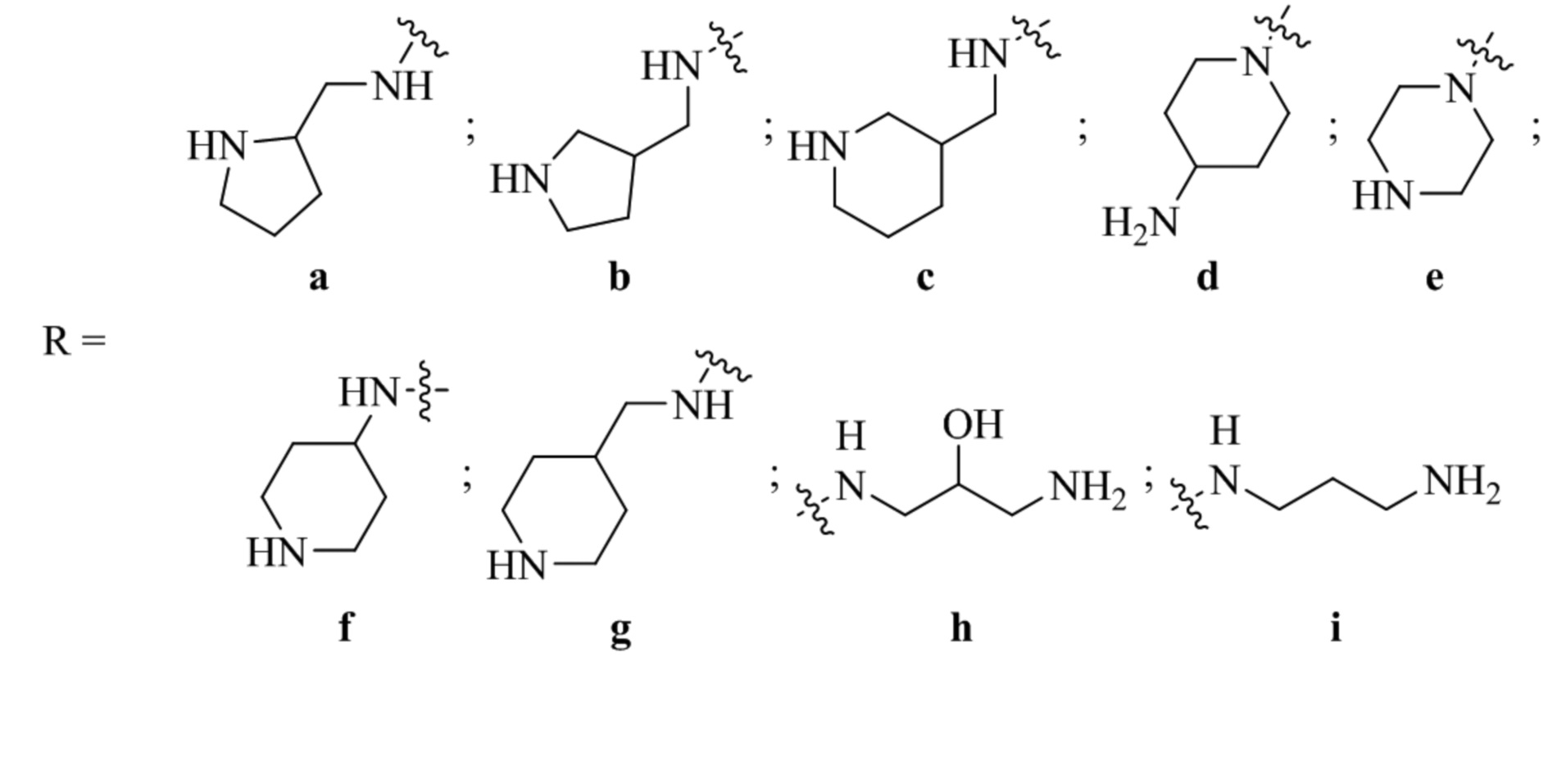
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)бензойной кислоты 111 (пример 246);
В раствор 22 (300 мг, 0,81 ммоль) в 1,4-диоксане (30 мл) добавляли сложный бороновый эфир (403 мг, 1,62 ммоль), Cs2O3 (660 мг, 4,0 ммоль) и Pd катализатор (40 мг, 0,057 ммоль). Реакционную смесь нагревали микроволнами в течение 30 мин при 90°C. Реакционную смесь разводили водой и экстрагировали в 10% MeOH/CH2Cl2 (2×25 мл) и воде. Объединенные органические соединения промывали солевым раствором (50 мл), сушили над Na2SO4 и концентрировали при пониженном давлении для того, чтобы получить 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-бензойную кислоту 111 (выход 70%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,47 (д, J=7,2 Гц, 1H), 8,28 (с, 1H), 8,17 (с, 1H), 8,07 (д, J=8,4 Гц, 2H), 7,76-7,79 (м, 3H), 7,26 (дд, J=1,9, 7,3 Гц, 1H), 6,82 (с, 1H), 4,06 (с, 3H), 3,98 (с, 3H); ВЭЖХ (способ 1) 98,8%;.ESI MS m/z 409 [M+H]+.
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил) -N- (пирролидин-2-илметил)бензамида 112a (пример 248);
В раствор 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)бензойной кислоты 111 (40 мг, 0,1 ммоль) в DCM (5 мл) при комнатной температуре добавляли EDC (28 мг, 0,15 ммоль), HOBt (26 мг, 0,2 ммоль), DIPEA (0,05 мл, 0,3 ммоль) и трет-бутил-2-(аминометил)пирролидин-1-карбоксилат (24 мг, 0,12 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении и остаток экстрагировали в 10% MeOH/CH2Cl2 (2×25 мл) и промывали водой. Объединенные органические соединения промывали солевым раствором (50 мл), сушили над Na2SO4 и концентрировали при пониженном давлении для того, чтобы получить защищеннй Boc 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид в виде твердого вещества желтого цвета.
Кроме того, твердое соединение: защищенный Boc 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид (50 мг, 0,08 ммоль) добавляли в 4,0 M HCl в диоксане (1 мл) и MeOH (1 мл). Реакцию перемешивали при 50°C в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении и остаток суспендировали в водном аммиаке (10 мл). Суспензию перемешивали при комнатной температуре в течение 2 ч и экстрагировали хлороформом (2×10 мл). Объединенный органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении и остаток очищали посредством колоночной хроматографии (силикагель, 1:0,1:10 метанол/гидроксид аммония/DCM) для того, чтобы получить 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид 112a в виде твердого вещества желтого цвета (выход 60%).
1H ЯМР (400 МГц, CDCl3): δ 8,45 (д, J=6,9 Гц, 1H), 8,25 (с, 1H), 8,14 (с, 1H), 7,97 (д, J=8,0 Гц, 2H), 7,83 (д, J=8,0 Гц, 2H), 7,78 (с, 1H), 7,24 (д, J=6,9 Гц, 1H), 6,79 (с, 1H), 4,04 (с, 3H), 3,96 (с, 3H), 3,58-3,41 (м, 2H), 3,40-3,32 (м, 1H), 3,09-2,97 (м, 1H), 2,92-2,84 (м, 1H), 2,02-1,92 (м, 1H), 1,91-1,73 (м, 2H), 1,62-1,50 (м, 1H); APCI m/z 491 [M+H]+; ВЭЖХ (способ 1) >99%.
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил) -N- (пирролидин-2-илметил)бензамида 112b (пример 249);
4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид 112b получали аналогичным образом, как 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид 112a, и получали в виде твердого вещества коричневого цвета (выход 36%).
1H ЯМР (400 МГц, CD3OD): δ 8,42 (д, J=7,1 Гц, 1H), 8,22 (с, 1H), 8,13 (с, 1H), 7,93 (д, J=8,0 Гц, 2H), 7,81 (д, J=8,0 Гц, 2H), 7,75 (с, 1H), 7,21 (д, J=6,8 Гц, 1H), 6,77 (с, 1H), 4,84-4,81 (м, 1H), 4,03 (с, 3H), 3,95 (с, 3H), 3,28-319 (м, 1H), 3,18-3,07 (м, 1H), 3,02-2,92 (м, 1H), 2,91-2,85 (м, 1H), 2,30-2,18 (м, 1H), 1,95-1,80 (м, 1H); ВЭЖХ (способ 1) 98,4%. APCI MS m/z 477 [M+H]+.
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил) -N- (пиперидин-3-илметил)бензамида 112c (пример 251);
Соединение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиперидин-3-илметил)бензамид 112c получали аналогичным образом, как 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид 112a, и получали в виде твердого вещества коричневого цвета (выход 32%).
1H ЯМР (400 МГц, CD3OD): δ 8,47 (д, J=7,4 Гц, 1H), 8,28 (с, 1H), 8,16 (с, 1H), 7,94 (д, J=8,3 Гц, 2H), 7,85 (д, J=8,3 Гц, 2H), 7,80 (с, 1H), 7,27 (д, J=6,8 Гц, 1H), 6,82 (с, 1H), 4,03 (с, 3H), 3,97 (с, 3H), 3,18-3,09 (м, 1H), 3,08-2,95 (м, 1H), 2,67-2,53 (м, 1H), 2,47-2,36 (м, 1H), 1,99-1,83 (м, 2H), 1,82-1,69 (м, 1H), 1,63-1,47 (м, 1H), 1,22-1,18 (м, 1H); ВЭЖХ (способ 1) 98,1%; APCI MS m/z 505 [M+H]+.
Получение (4-аминопиперидин-1-ил)(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)фенил)метанона 112d (пример 259);
Соединение (4-аминопиперидин-1-ил)(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)фенил)метанон 112d получали аналогичным образом, как 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид 112a, и получали в виде твердого вещества коричневого цвета (общий выход 32%).
1H ЯМР (400 МГц, CD3OD): δ 8,48 (д, J=7,4 Гц, 1H), 8,28 (с, 1H), 8,16 (с, 1H), 7,95 (д, J=8,0 Гц, 2H), 7,85 (д, J=8,1 Гц, 2H), 7,79 (с, 1H), 7,27-7,24 (м, 1H), 6,82 (с, 1H), 4,06 (с, 3H), 3,97 (с, 3H), 3,26-3,17 (м, 2H), 2,88-2,78 (м, 2H), 2,29-2,00 (м, 2H), 1,72-1,60 (м, 2H); ВЭЖХ (способ 1) 94,1%; APCI MS m/z 491 [M+H]+.
Получение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)фенил)(пиперазин-1-ил)метанона 112e (пример 254);
Соединение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)фенил)(пиперазин-1-ил)метанон 112e получали аналогичным образом, как 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид 112a и получали в виде твердого вещества коричневого цвета (общий выход 28%).
1H ЯМР (400 МГц, CDCl3): δ 8,43 (с, 1H), 8,17 (д, J=7,0 Гц, 1H), 8,12 (с, 1H), 7,83 (с, 1H), 7,69 (д, J=8,1 Гц, 2H), 7,53 (д, J=7,6 Гц, 2H), 7,03 (д, J=7,6 Гц, 1H), 6,61 (с, 1H), 4,03 (с, 3H), 3,97 (м, 3H), 3,79-3,49 (м, 4H), 3,00-2,79 (м, 1H); ВЭЖХ (способ 1) 94,22%, tR=9,31 мин.; APCI-MS m/z 477 [M+H]+.
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил) -N- (пиперидин-4-ил)бензамида 112f (пример 268);
Соединение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиперидин-4-ил)бензамид 112f получали аналогичным образом, как 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид 112a, и получали в виде твердого вещества коричневого цвета (выход 31%).
1H ЯМР (400 МГц, CDCl3): δ 8,43 (с, 1H), 8,17 (д, J=7,0 Гц, 1H), 8,12 (с, 1H), 7,88-7,85 (м, 3H), 7,72 (д, J=8,0 Гц, 2H), 7,06 (д, J=7,1 Гц, 1H), 6,61 (с, 1H), 6,02 (д, J=7,6 Гц, 1H), 4,12-4,10 (м, 1H), 4,03 (с, 3H), 3,97 (м, 3H), 3,14-3,11 (м, 2H), 2,81-2,74 (м, 2H), 2,15-2,05 (м, 2H), 1,49-1,46 (м, 2H); ВЭЖХ (способ 1) 97,68%, tR=9,47 мин.; APCI-MS m/z 491 [M+H]+.
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил) -N- (пиперидин-4-илметил)бензамида 112g (пример 267);
Соединение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиперидин-4-илметил)бензамид 112g получали аналогичным образом, как 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид 112a, и получали в виде твердого вещества коричневого цвета (17 мг, общий выход 32%).
1H ЯМР (400 МГц, CDCl3): δ 8,43 (с, 1H), 8,17 (д, J=7,0 Гц, 1H), 8,12 (с, 1H), 7,88-7,85 (м, 3H), 7,72 (д, J=8,0 Гц, 2H), 7,06 (д, J=7,1 Гц, 1H), 6,61 (с, 1H), 6,25 (м, 1H) 4,12-4,10 (м, 1H), 4,03 (с, 3H), 3,97 (с, 3H), 3,40-3,37 (м, 2H), 3,12-3,09 (м, 2H), 2,65-2,59 (м, 2H), 1,78-1,75 (м, 3H), 1,27-1,19 (м, 3H); ВЭЖХ (способ 1) 97,36%, tR=9,5 мин.; ESI-MS m/z 505 [M+H]+.
Получение N -(3-амино-2-гидроксипропил)-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)бензамида 112h (пример 256);
Соединение N-(3-амино-2-гидроксипропил)-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)бензамид 112h получали аналогичным образом, как 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид 112a, и получали в виде твердого вещества коричневого цвета (общий выход 28%).
1H ЯМР (400 МГц, CD3OD): δ 8,51 (с, 1H), 8,31 (с, 1H), 8,16 (с, 1H), 8,0 (д, J=8,2 Гц, 2H), 7,89 (д, J=8,2 Гц, 2H), 7,82 (с, 1H), 7,28 (д, J=6 Гц, 1H), 6,84 (с, 1H), 4,06 (с, 4H), 4,04 (с, 3H), 3,55-3,47 (м, 2H), 3,13-3,09 (м, 1H), 2,92-2,87 (м, 1H); ВЭЖХ (способ 1) 99,03%, tR=9,34 мин.; APCI-MS m/z 481 [M+H]+.
Получение N-(3-аминопропил)-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)бензамида 112i (пример 265);
Соединение N-(3-аминопропил)-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)бензамид 112i получали аналогичным образом, как 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пирролидин-2-илметил)бензамид 112a, и получали в виде твердого вещества коричневого цвета (30 мг, 46%).
1H ЯМР (400 МГц, CD3OD): δ 8,46 (д, J=7,0 Гц, 1H), 8,26 (с, 1H), 8,15 (с, 1H), 7,95-7,93 (м, 2H), 7,86-7,84 (м, 2H), 7,78 (с, 1H), 7,24 (д, J=7,1 Гц, 1H), 6,80 (с, 1H), 4,05 (с, 3H), 3,96 (с, 3H), 3,50 (т, J=12,4 Гц, 2H), 2,80 (т, J=6,9 Гц, 2H), 1,88-1,84 (м, 2H); ВЭЖХ (способ 1) 95,26%, tR=9,39 мин.; ESI-MS m/z 465 [M+H]+.
Схема 32
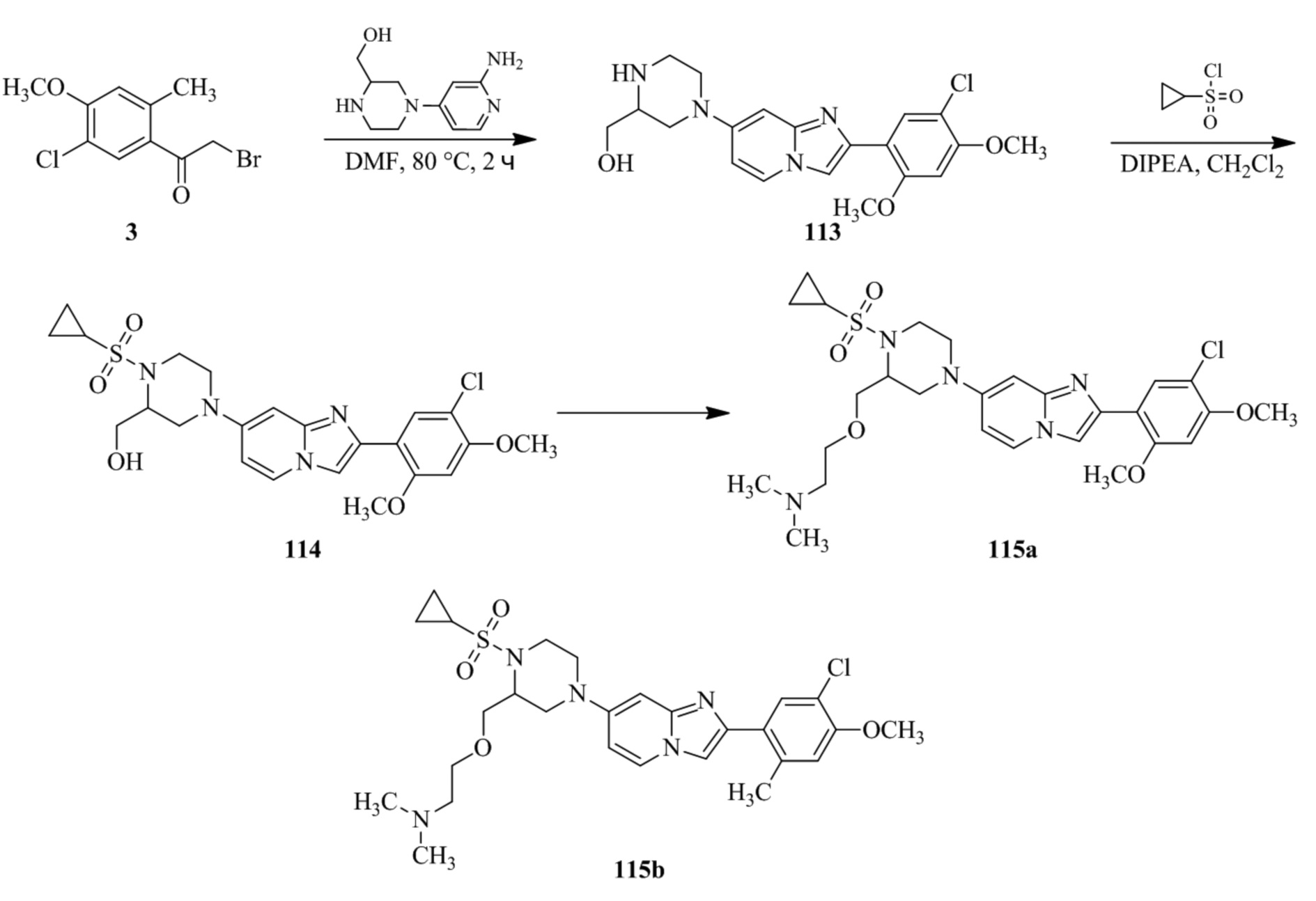
Получение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-2-ил)метанола 113 (пример 235);
Cмесь 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (197 мг, 0,67 ммоль), (4-(2-аминопиридин-4-ил)пиперазин-2-ил)метанола (200 мг, 0,96 ммоль) и NaHCO3 (161 г, 1,92 ммоль) в этаноле (15 мл) нагревали при 80°C в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и удаляли растворитель. Остаток очищали посредством колоночной хроматографии (силикагель, 15% MeOH/CHCl3) для того, чтобы получить (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-2-ил)метанол (90 мг, 23%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,28 (д, J=7,4, 1H), 8,16 (с, 1H), 8,00 (с, 1H), 6,86 (с, 1H), 6,76 (дд, 1H, J=2,3, 7,6), 6,60 (д, J=2,1, 1H), 4,66 (т, 1H, J=5,3), 4,00 (с, 3H), 3,95 (с, 3H), 3,69-3,63 (м, 1H), 3,62-3,56 (м, 1H), 3,42-3,35 (м, 2H), 3,02-2,96 (м, 1H), 2,81-2,72 (м, 2H), 2,70-2,62 (м, 1H), 2,40-2,32 (м, 2H); ВЭЖХ (способ 2) 98,25% (AUC), tR=11,35 мин.; APCI MS m/z 403 [M+H]+.
Получение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-1-(циклопропилсульфонил)пиперазин-2-ил)метанола 114 (пример 236);
Соединение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1-(циклопропилсульфонил)пиперазин-2-ил)метанол 114 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества грязно-белого цвета (8 мг, 10%).
1H ЯМР (400 МГц, DMSO-d6) δ 8,33 (с, 1H), 7,93 (с, 1H), 7,91 (с, 1H), 6,90 (с, 1H), 6,50 (с, 1H), 6,49 (с, 1H), 4,10 (ушир. с, 1H), 4,05-3,85 (м, 9H), 3,85-3,80 (м, 2H), 3,65-3,55 (м, 1H), 3,55-3,45 (м, 1H), 3,25-3,10 (м, 1H), 3,05-2,95 (м, 1H), 2,55-2,45 (м, 1H), 1,28-1,25 (м, 2H), 1,15-1,03 (м, 2H); ВЭЖХ (способ 2) 96,04% (AUC), tR=14,06 мин.; APCI MS m/z 507 [M+H]+.
Получение (4-(2-(5-хлор-4-метокси-2-метилфенил)имидазо[1,2- a ]пиридин-7-ил)-1-(циклопропилсульфонил)пиперазин-2-ил)метанола 114b (пример 262);
Соединение (4-(2-(5-хлор-4-метокси-2-метилфенил)имидазо[1,2-a]пиридин-7-ил)-1-(циклопропилсульфонил)пиперазин-2-ил)метанол 114b получали аналогичным образом, как (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1 (циклопропилсульфонил)пиперазин-2-ил)метанол 114, с использованием 2-бром-1-(5-хлор-4-метокси-2-метилфенил)этанона вместо 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3. Продукт получали в виде аморфного твердого вещества грязно-белого цвета (выход 30%).
1H ЯМР (400 МГц, CDCl3): δ 7,95 (д, J=6,7 Гц, 1H), 7,94 (с, 1H), 7,45 (с, 1H), 6,84 (д, J=2,2 Гц, 1H), 6,81 (с, 1H), 6,55 (дд, J=2,4, 7,5 Гц, 1H), 4,13-4,06 (м, 1H), 4,04-3,98 (м, 1H), 3,95-3,89 (м, 4H), 3,93-3,77 (м, 2H), 3,59-3,45 (м, 2H), 3,08 (дд, J=3,8, 12,7 Гц, 1H), 3,04 (тд, J=4,1, 11,8 Гц, 1H), 2,52 (с, 3H), 2,51-2,45 (м, 1H), 1,24-1,20 (м, 2H), 1,06-1,01 (м, 2H); ВЭЖХ (способ 1) 96,5% (AUC), tR=10,36 мин.; ESI MS m/z 491 [M+H]+.
Получение 2-((4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-1-(циклопропилсульфонил)пиперазин-2-ил)метокси)- N,N- диметилэтанамина 115a (пример 245);
Cмесь (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1-(циклопропилсульфонил)пиперазин-2-ил)метанола 114 (80 мг, 0,15 ммоль), N,N-диметилэтанамина (72 мг, 0,47 ммоль) и NaH (5,7 г, 0,23 ммоль) в THF (5 мл) перемешивали при комнатной температуре в течение 48 ч. Реакцию гасили водой и экстрагировали этилацетатом. Растворитель удаляли и остаток очищали посредством колоночной хроматографии (силикагель, 15% MeOH/CHCl3) для того, чтобы получить 2-((4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1-(циклопропилсульфонил)пиперазин-2-ил)метокси)-N,N-диметилэтанамин (11 мг, 12%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,36 (с, 1H), 7,91 (д, J=7,1 Гц, 1H), 7,88 (с, 1H), 6,82 (д, J=2,4 Гц, 1H), 6,58 (с, 1H), 6,55 (дд, J=2,4, 7,5 Гц, 1H), 4,20 (с, 1H), 4,01 (с, 3H) 3,96 (с, 3H), 3,90-3,84 (м, 1H), 3,81-3,75 (м, 3H), 3,65 (т, J=5,7 Гц, 2H), 3,56 (д, J=12,3 Гц, 1H), 3,45-3,35 (м, 1H), 3,04-2,92 (м, 2H), 2,67-2,56 (м, 2H), 2,55-2,48 (м, 1H), 2,34 (с, 6H), 1,22-1,17 (м, 2H), 1,03-0,98 (м, 2H); ВЭЖХ (способ 1) 93,78% (AUC), tR=9,55 мин.; APCI MS m/z 578 [M+H]+.
Получение 2-((4-(2-(5-хлор-4-метокси-2-метилфенил)имидазо[1,2- a ]пиридин-7-ил)-1-(циклопропилсульфонил)пиперазин-2-ил)метокси)- N,N- диметилэтанамина 115b (пример 264);
Соединение 2-((4-(2-(5-хлор-4-метокси-2-метилфенил)имидазо[1,2-a]пиридин-7-ил)-1-(циклопропилсульфонил)пиперазин-2-ил)метокси)-N,N-диметилэтанамин 115b получали аналогичным образом, как 2-((4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1-(циклопропилсульфонил)пиперазин-2-ил)метокси)-N,N-диметилэтанамин 115a, с использованием 2-бром-1-(5-хлор-4-метокси-2-метилфенил)этанона вместо 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3. Продукт получали в виде твердого вещества желто-зеленого цвета (25 мг, 33%).
1H ЯМР (400 МГц, CDCl3): δ 7,94 (д, J=6,8 Гц, 2H), 7,46 (с, 1H), 6,82 (с, 1H), 6,81 (с, 1H), 6,59 (д, J=6,9 Гц, 1H), 4,23 (м, 1H), 3,93 (с, 3H), 3,86-3,82 (м, 1H), 3,80-3,78 (м, 3H), 3,64 (т, J=11,16 Гц, 2H), 3,55-3,53 (м, 1H), 3,41-3,38 (м, 1H), 3,04-2,96 (м, 2H), 2,61-2,51 (м, 2H), 2,50 (с, 4H), 2,33 (с, 6H), 1,25-1,19 (м, 2H), 1,02-1,00 (м, 2H); ВЭЖХ (способ 1) 96,48%, tR=9,55 мин.; APCI-MS m/z 562 [M+H]+.
Схема 33
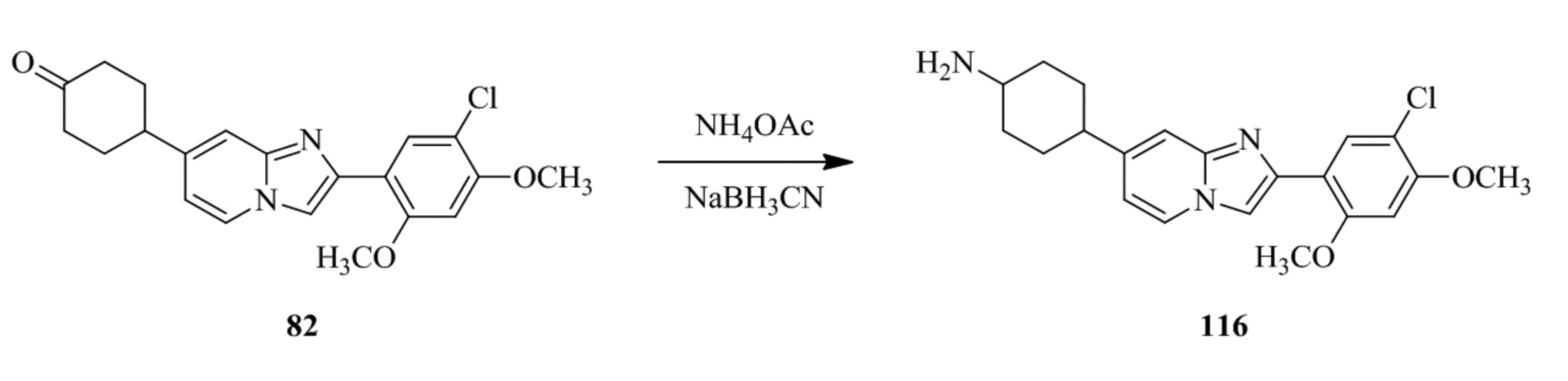
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-циклогексанамина 116 (пример 125) ;
Cмесь 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексанона 82 (200 мг, 0,53 ммоль), ацетата аммония (123 мг, 1,60 ммоль) и цианоборогидрида натрия (99 мг, 1,60 ммоль) в метаноле (10 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь концентрировали и промывали разведенным раствором аммиака. Остаток очищали посредством колоночной хроматографии (силикагель, 10:1 DCM/MeOH) для того, чтобы получить 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексанамин 116 (200 мг, 86%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 8,02-7,96 (м, 2H), 7,38 (с, 1H), 6,62 (дд, J=1,6, 7,0 Гц, 1H), 6,58 (с, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 2,80 (ушир. с, 1H), 2,55-2,46 (м, 1H), 2,08-1,95 (м, 4H), 1,59-1,46 (м, 2H), 1,38-1,26 (м, 2H); APCI MS m/z 386 [M+H]+.
Схема 34
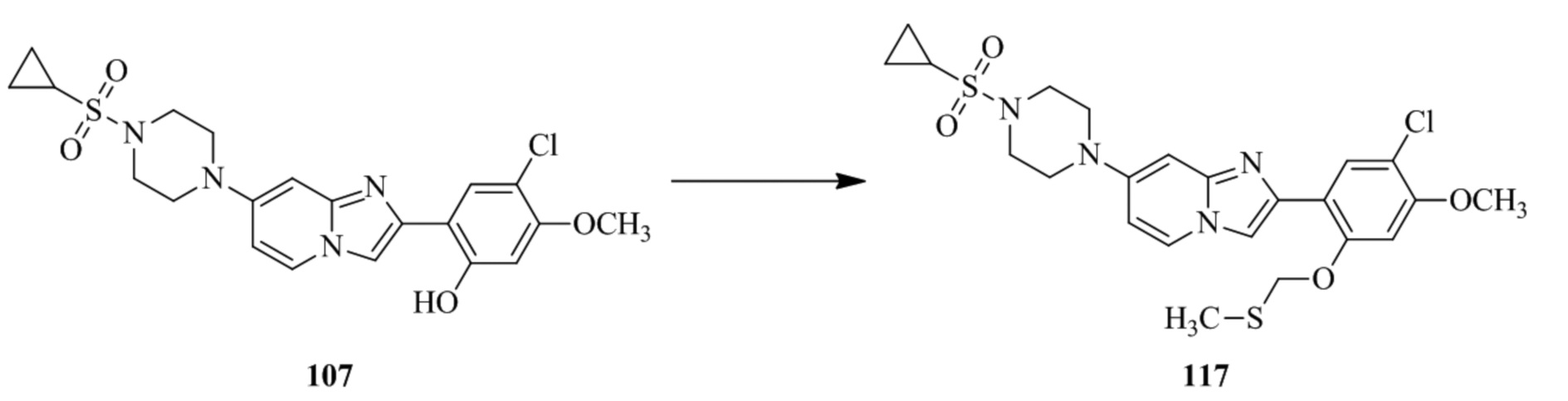
Получение 2-(5-хлор-4-метокси-2-((метилтио)метокси)фенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 117 (пример 255);
Соединение 2-(5-хлор-4-метокси-2-((метилтио)метокси)фенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин 117 получали аналогичным образом, как этил-4-(4-хлор-2-(7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]-пиридин-2-ил)-5-метоксифенокси)бутаноат 108, и получали в виде твердого вещества грязно-белого цвета (выход 59%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,40-8,38 (м, 1H), 8,20 (с, 1H), 8,06 (с, 1H), 6,97 (с, 1H), 6,84-6,82 (м, 1H), 6,75 (с, 1H), 5,54 (с, 2H), 3,92-3,90 (м, 3H), 3,36-3,32 (м, 8H), 2,69-2,66 (м, 1H), 2,22 (с, 3H), 1,00-0,96 (м, 4H); ESI MS m/z 523 [M+H]+.
Схема 35
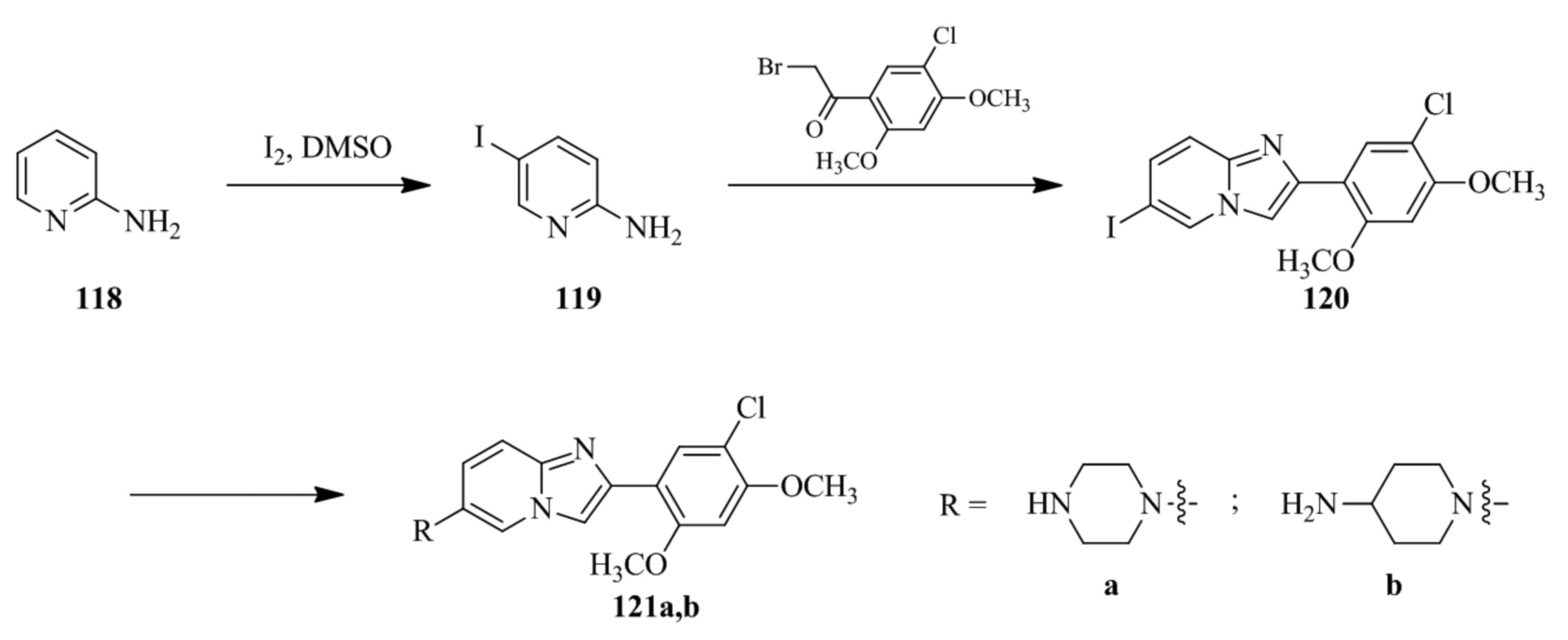
Получение 5-йодпиридин-2-амина 119;
В раствор 2-аминопиридина 118 (5,00 г, 53,0 ммоль) в диметилсульфоксиде (100 мл) добавляли гранулы йода (8,09 г, 31,8 ммоль). Реакционную смесь нагревали при 100°C в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры и гасили 10% раствором тиосульфата натрия (100 мл) и экстрагировали этилацетатом (250 мл). Органический слой концентрировали при пониженном давлении и очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить 5-йодпиридин-2-амин 119 (2,8 г, 24%) в виде твердого вещества темно-желтого цвета.
Получение 2-(5-хлор-2,4-диметоксифенил)-6-йодимидазо[1,2- a ]пиридина 120;
Раствор 2-бром-1-(5-бром-2,4-диметоксифенил)этанона (3,50 г, 12,0 ммоль) и 5-йодпиридин-2-амина 119 (2,50 г, 11,4 ммоль) в ацетоне (25 мл) нагревали при 75°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета фильтровали и промывали ацетоном. Осадок суспендировали в водном аммиаке (10 мл) и перемешивали в течение 2 ч. Осадок фильтровали, промывали водой и сушили при пониженном давлении для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-6-йодимидазо[1,2-a]пиридин 120 (4,00 г, 85%) в виде твердого вещества грязно-белого цвета.
Получение 2-(5-хлор-2,4-диметоксифенил)-6-(пиперазин-1-ил)имидазо[1,2- a ]-пиридина гидрохлорида 121a (пример 115);
Брали смесь 2-(5-хлор-2,4-диметоксифенил)-6-йодимидазо[1,2-a]пиридина 120 (200 мг, 0,50 ммоль), N-Boc пиперазина (110 мг, 0,60 ммоль), йодида меди (I) (14 мг, 0,075 ммоль), этиленгликоля (60 мг, 1,00 ммоль) и фосфата калия (320 мг, 1,50 ммоль) в 2-пропаноле (2 мл) и дегазировали аргоном. Реакционную смесь нагревали до 85°C в течение 30 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли с использованием DCM (20 мл) и фильтровали через слой целита. Фильтрат дистиллировали при пониженном давлении и остаток очищали посредством хроматографии CombiFlash (силикагель, MeOH/DCM) и соединение обрабатывали с использованием 4M HCl в 1,4-диоксане. Реакционную смесь концентрировали при пониженном давлении для того, чтобы получить гидрохлоридную соль 2-(5-хлор-2,4-диметоксифенил)-6-(пиперазин-1-ил)имидазо[1,2-a]пиридина 121a (30 мг, 17%) в виде твердого вещества желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 9,34 (с, 1H), 8,48 (с, 1H), 8,46 (с, 1H), 8,14 (с, 1H), 7,83 (ушир. с, 2H), 6,99 (с, 1H), 4,07 (с, 3H), 4,00 (с, 3H), 3,48-3,32 (м, 8H); ВЭЖХ (способ 1) >99% (AUC), tR=8,89 мин; APCI MS m/z 373 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-6-ил)пиперидин-4-амина 121b (пример 121);
1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-6-ил)пиперидин-4-амин 121b получали аналогичным образом, как HCl соль 2-(5-хлор-2,4-диметоксифенил)-6-(пиперазин-1-ил)имидазо[1,2-a]пиридина 121a. Полученную HCl соль 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-6-ил)пиперидин-4-амина 121b суспендировали в водном аммиаке (2 мл) и перемешивали в течение 2 ч. Осадок фильтровали, промывали водой, сушили при пониженном давлении для того, чтобы получить 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-6-ил)пиперидин-4-амин 121b (30 мг, 16%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,13 (с, 1H), 8,08 (с, 1H), 7,90 (с, 1H), 7,39 (д, J=7,2, 1H), 7,22 (д, J=7,4, 1H), 6,79 (с, 1H), 4,02 (с, 3H), 3,95 (с, 3H), 3,60-3,50 (м, 2H), 2,91-2,80 (м, 1H), 2,77-2,65 (м, 2H), 2,04-1,94 (м, 2H), 1,67-1,53 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=8,96 мин; ESI MS m/z 387 [M+H]+.
Схема 36
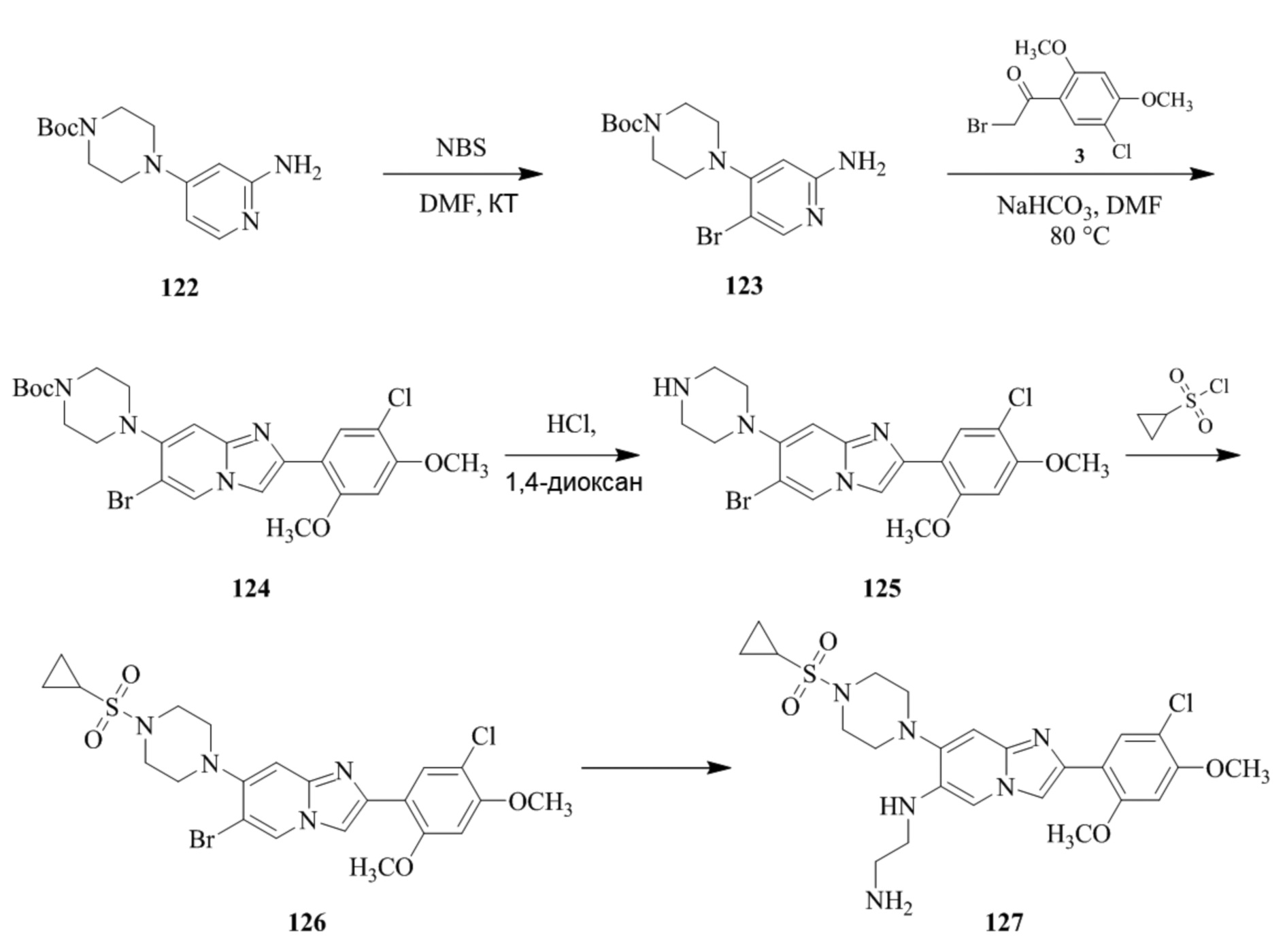
Получение трет -бутил-4-(2-амино-5-бромпиридин-4-ил)пиперазин-1-карбоксилата 123;
В раствор трет-бутил-4-(2-аминопиридин-4-ил)пиперазин-1-карбоксилата 122 (250 мг, 0,90 ммоль) в DMF (5 мл) добавляли N-бромсукцинимид (160 мг, 0,90 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь гасили 10% раствором тиосульфата натрия (100 мл) и экстрагировали хлороформом (100 мл). Органический слой концентрировали при пониженном давлении и очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить желаемое соединение трет-бутил-4-(2-амино-5-бромпиридин-4-ил)пиперазин-1-карбоксилат 123 (150 мг, 47%) в виде твердого вещества бледно-желтого цвета.
Получение трет -бутил-4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил)пиперазин-1-карбоксилата 124;
В раствор трет-бутил-4-(2-амино-5-бромпиридин-4-ил)пиперазин-1-карбоксилата 123 (750 мг, 2,10 ммоль) в N,N-диметилформамиде (15 мл) добавляли 2-бром-1-(5-хлор-2,4-диметоксифенил)этанон (620 мг, 2,10 ммоль), после чего следовал бикарбонат натрия (520 мг, 6,20 ммоль). Реакционную смесь нагревали до 80°C в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и гасили водой (25 мл), а осадок фильтровали и сушили при пониженном давлении. Твердое вещество очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить трет-бутил-4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 124 (800 мг, 69%) в виде твердого вещества грязно-белого цвета.
Получение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2- a ]пиридина 125 (пример 217);
Раствор трет-бутил-4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)пиперазин-1-карбоксилата 124 (800 мг, 1,50 ммоль) в 4,0 M HCl в диоксане (5 мл) перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь фильтровали, промывали диоксаном и сушили при пониженном давлении для того, чтобы получить 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина гидрохлорид (600 мг, 92%) в виде твердого вещества желтого цвета. Твердое вещество суспендировали в 10 мл водного аммиака, перемешивали в течение 1 ч при комнатной температуре и экстрагировали с использованием хлороформа (2×20 мл). Органический слой сушили и концентрировали для того, чтобы получить 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 125 в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,86 (с, 1H), 8,18 (с, 1H), 8,13 (с, 1H), 7,06 (с, 1H), 6,88 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,00-2,86 (м, 8H). ВЭЖХ (способ 1) 96,7% (AUC), tR=9,17 мин; ESI MS m/z 453 [M+H]+.
Получение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропил-сульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 126;
Соединение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин 126 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества желтого цвета (600 мг, 75%).
Получение N 1-(2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиридин-6-ил)этан-1,2-диамина 127 (пример 225);
Соединение N1-(2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин-6-ил)этан-1,2-диамин 127 получали аналогичным образом, как N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)этан-1,2-диамин 70a, и получали в виде твердого вещества желтого цвета (30 мг, 9%).
1H ЯМР (300 МГц, CDCl3): δ 8,33 (с, 1H), 7,90 (с, 1H), 7,30 (с, 1H), 7,10 (с, 1H), 6,57 (с, 1H), 4,56 (ушир. с, 1H), 3,98 (с, 3H), 3,94 (с, 3H), 3,52-3,46 (м, 4H), 3,10-3,06 (м, 8H), 2,36-2,32 (м, 1H), 1,23-1,21(м, 2H), 1,19-1,07(м, 2H); ВЭЖХ (способ 1) 92,02% (AUC), tR=9,60 мин.; ESI MS m/z 535 [M+H]+.
Схема 37
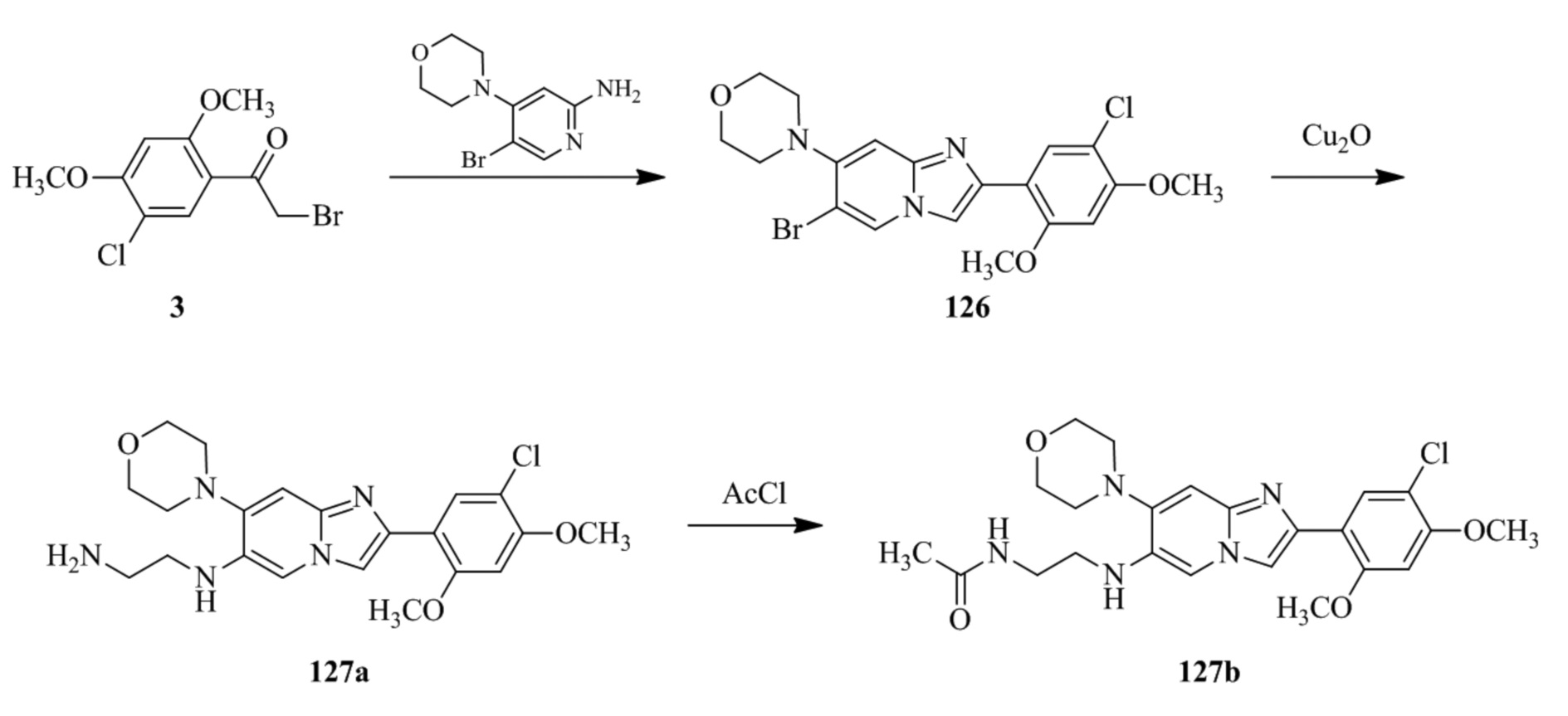
Получение 4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)морфолина 126;
Соединение 4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)морфолин 126 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a, и получали в виде твердого вещества белого цвета (430 мг, 61%).
Получение N 1-(2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2- a ]-пиридин-6-ил)этан-1,2-диамина 127a (пример 89);
Соединение N1-(2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2-a]-пиридин-6-ил)этан-1,2-диамин 127a получали аналогичным образом, как N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)этан-1,2-диамин 70a, и получали в виде твердого вещества оранжевого цвета (170 мг, 32%).
1H ЯМР (400 МГц, CDCl3): δ 8,34 (с, 1H), 7,90 (д, 1H, J=7,6 Гц), 7,26 (с, 1H), 7,10 (с, 1H), 6,58 (с, 1H), 4,85 (ушир. с, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,88-3,81 (м, 4H), 3,07-3,03 (м, 4H), 3,01-2,98 (м, 4H); ВЭЖХ (способ 2) 92,6% (AUC), tR=21,68 мин.; ESI MS m/z 342 [M+H]+.
Получение N-(2-((2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2- a ]-пиридин-6-ил)амино)этил)ацетамида 127b (пример 224);
Соединение N-(2-((2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2-a]-пиридин-6-ил)амино)этил)ацетамид 127b получали аналогичным образом, как получали N-(2-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)этил)ацетамид 70d. Продукт получали в виде твердого вещества белого цвета (28 мг, 51%).
1H ЯМР (400 МГц, CDCl3): δ 8,34 (с, 1H), 7,90 (д, J=7,6 Гц, 1H), 7,31 (с, 1H), 7,11 (с, 1H), 6,57 (с, 1H), 5,73 (ушир. с, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,91-3,88 (м, 4H), 3,64-3,62 (м, 2H), 3,18-3,16 (м, 2H), 2,98-2,97 (м, 4H), 2,03 (с, 3H); ВЭЖХ (способ 1) 97,46% (AUC), tR=11,44 мин.; ESI MS m/z 474 [M+H]+.
Получение N 1-(2-(5-хлор-2,4-диметоксифенил)-8-фтор-7-морфолиноимидазо[1,2- a ]пиридин-6-ил)этан-1,2-диамина 127c (пример 208);
Соединение N1-(2-(5-хлор-2,4-диметоксифенил)-8-фтор-7-морфолиноимидазо[1,2-a]пиридин-6-ил)этан-1,2-диамин 127c получали аналогичным образом, как 127a, придерживаясь последовательности от 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3, используя 5-бром-3-фтор-4-морфолинопиридин-2-амин. Желаемый продукт получали в виде твердого вещества грязно-белого цвета (17% на 2 стадии).
1H ЯМР (300 МГц, CD3OD): δ 8,15 (д, J=3,0 Гц, 1H), 8,06 (с, 1H), 7,7 (с, 1H), 6,82 (с, 1H), 4,03 (с, 3H), 3,96 (с, 3H), 3,87 (т, J=5,4 Гц, 4H), 3,48 (т, J=6,2 Гц, 2H), 3,28-3,17 (м, 6H); ВЭЖХ (способ 1) 98,7% (AUC), tR=9,18 мин.; ESI MS m/z 450 [M+H]+.
Схема 38
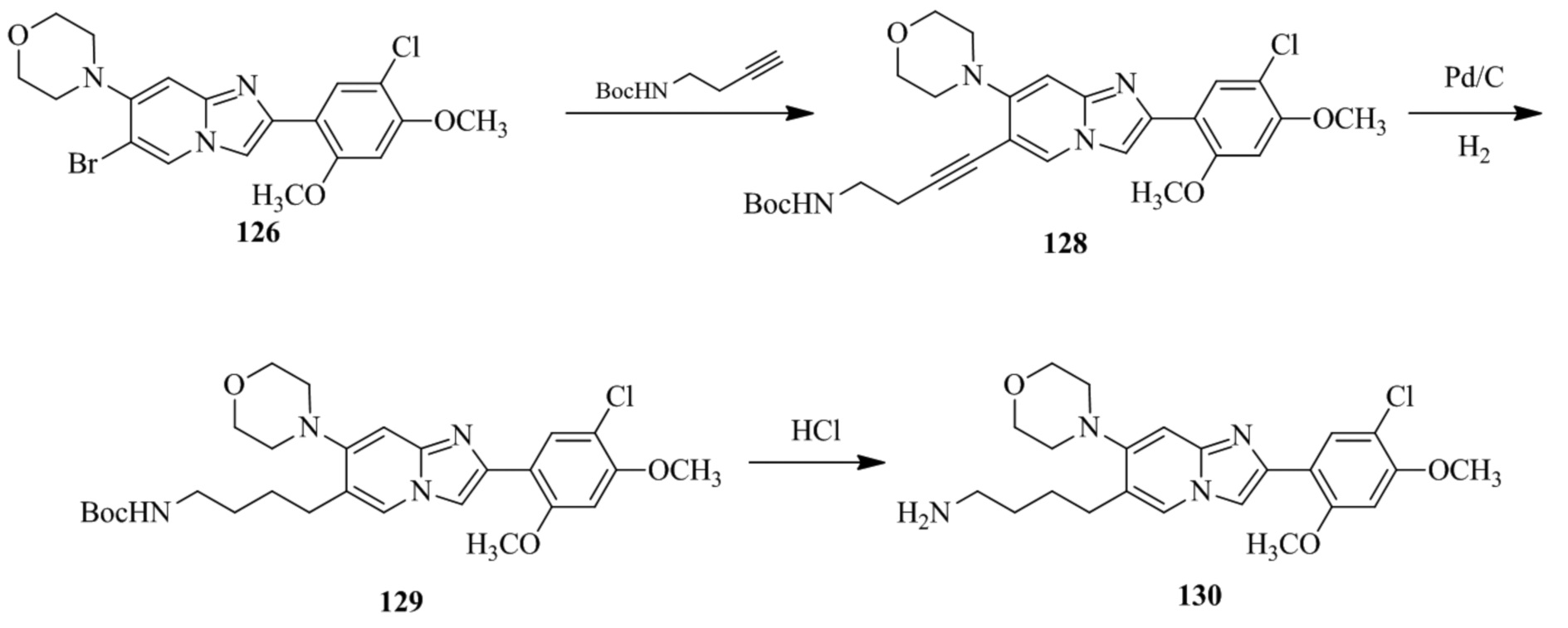
Получение трет -бутил(4-(2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2- a ]пиридин-6-ил)бут-3-ин-1-ил)карбамата 128;
Брали смесь 4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)морфолина 126 (275 мг, 0,60 ммоль), трет-бутилбут-3-ин-1-илкарбамата (154 мг, 0,91 ммоль), йодида меди (I) (5,7 мг, 0,03 ммоль), три-трет-бутилфосфина (24,5 мг, 0,12 ммоль) и триэтиламина (323 мкл, 2,42 ммоль) в ацетонитриле (10 мл) и дегазировали аргоном. Добавляли Pd(PPh3)4 (70 мг, 0,06 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 16 ч. Реакционную массу охлаждали до комнатной температуры, разбавляли с использованием DCM (20 мл) и фильтровали через слой целита. Фильтрат дистиллировали при пониженном давлении и остаток очищали посредством хроматографии CombiFlash (силикагель, MeOH/DCM) для того, чтобы получить трет-бутил(4-(2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2-a]пиридин-6-ил)бут-3-ин-1-ил)карбамат 126 (150 мг, 45%) в виде твердого вещества грязно-белого цвета.
Получение трет -бутил(4-(2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2- a ]пиридин-6-ил)бутил)карбамата 129;
В раствор трет-бутил(4-(2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2-a]пиридин-6-ил)бут-3-ин-1-ил)карбамата 128 (140 мг, 0,25 ммоль) в THF(10 мл) и метаноле (1 мл) загружали Pd/C (10 мг). Реакционную смесь перемешивали при комнатной температуре в атмосфере H2 (1 атм.) в течение 16 ч. Реакционную смесь фильтровали через небольшую подушку целита и промывали хлороформом. Объединенный органический фильтрат концентрировали при пониженном давлении и остаток очищали посредством колоночной хроматографии (силикагель, 10:1 DCM/MeOH) для того, чтобы получить трет-бутил(4-(2-(5-хлор-2,4-диметоксифенил)-7- морфолиноимидазо[1,2-a]пиридин-6-ил)бутил)карбамат 128(88 мг, 78%) в виде твердого вещества светло-желтого цвета.
4-(2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2- a ]пиридин-6-ил)бутан-1-амин 130 (пример 114);
Соединение 4-(2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2-a]пиридин-6-ил)бутан-1-амин 130 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a. Полученную соль ощелачивали водным аммиаком, промывали водой, фильтровали и сушили. Продукт получали в виде твердого вещества белого цвета (62 мг, 87%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,92 (с, 1H), 7,86 (с, 1H), 7,14 (с, 1H), 6,58 (с, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,88-3,83 (м, 4H), 2,97-2,92 (м, 4H), 2,76 (т, J=6,8 Гц, 2H), 2,63 (т, J=7,6 Гц, 2H), 1,77-1,67 (м, 2H), 1,58-1,51 (м, 2H); ВЭЖХ (способ 1) 95,10% (AUC), tR=9,25 мин.; APCI MS m/z 445 [M+H]+.
Схема 39
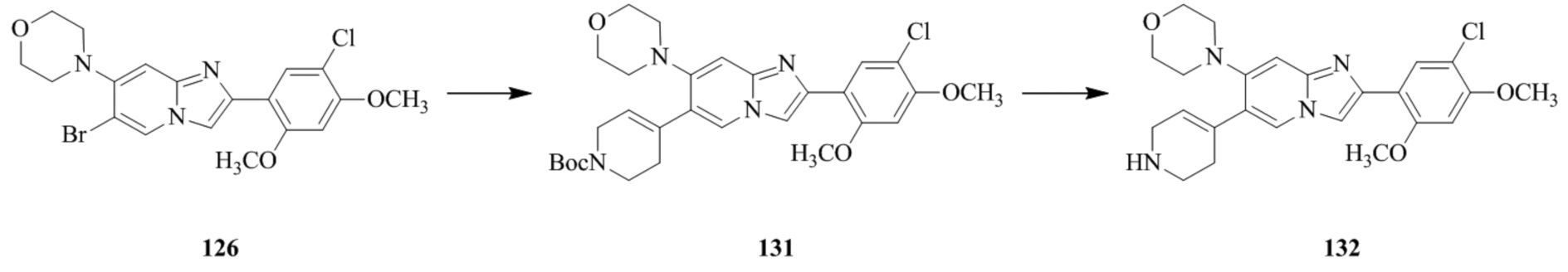
Получение трет -бутил-4-(2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2- a ]пиридин-6-ил)-5,6-дигидропиридин-1(2H)-карбоксилата 131;
Соединение трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)-7-морфолиноимидазо[1,2-a]пиридин-6-ил)-5,6-дигидропиридин-1(2H)-карбоксилат 131 получали аналогичным образом, как трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]-5,6-дигидропиридин-1(2H)-карбоксилат 24a. Продукт получали в виде твердого вещества белого цвета (100 мг, 54%).
Получение 4-(2-(5-хлор-2,4-диметоксифенил)-6-(1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2- a ]пиридин-7-ил)морфолина 132 (пример 101);
Соединение 4-(2-(5-хлор-2,4-диметоксифенил)-6-(1,2,3,6-тетрагидропиридин-4-ил)имидазо[1,2-a]пиридин-7-ил)морфолин 132 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a. Продукт получали в виде твердого вещества грязно-белого цвета (25 мг, 64%).
1H ЯМР (400 МГц, DMSO-d6): δ 14,9 (ушир. с, 1H), 9,50 (ушир. с, 2H), 8,52 (с, 1H), 8,45 (с, 1H), 8,08 (с, 1H), 7,03 (с, 1H), 6,99 (с, 1H),6,09 (с, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,80-3,73 (м, 6H), 3,32-3,26 (м, 2H), 3,20-3,15 (м, 4H), 2,73-2,67 (м, 2H); ESI MS m/z 455 [M+H]+.
Схема 40
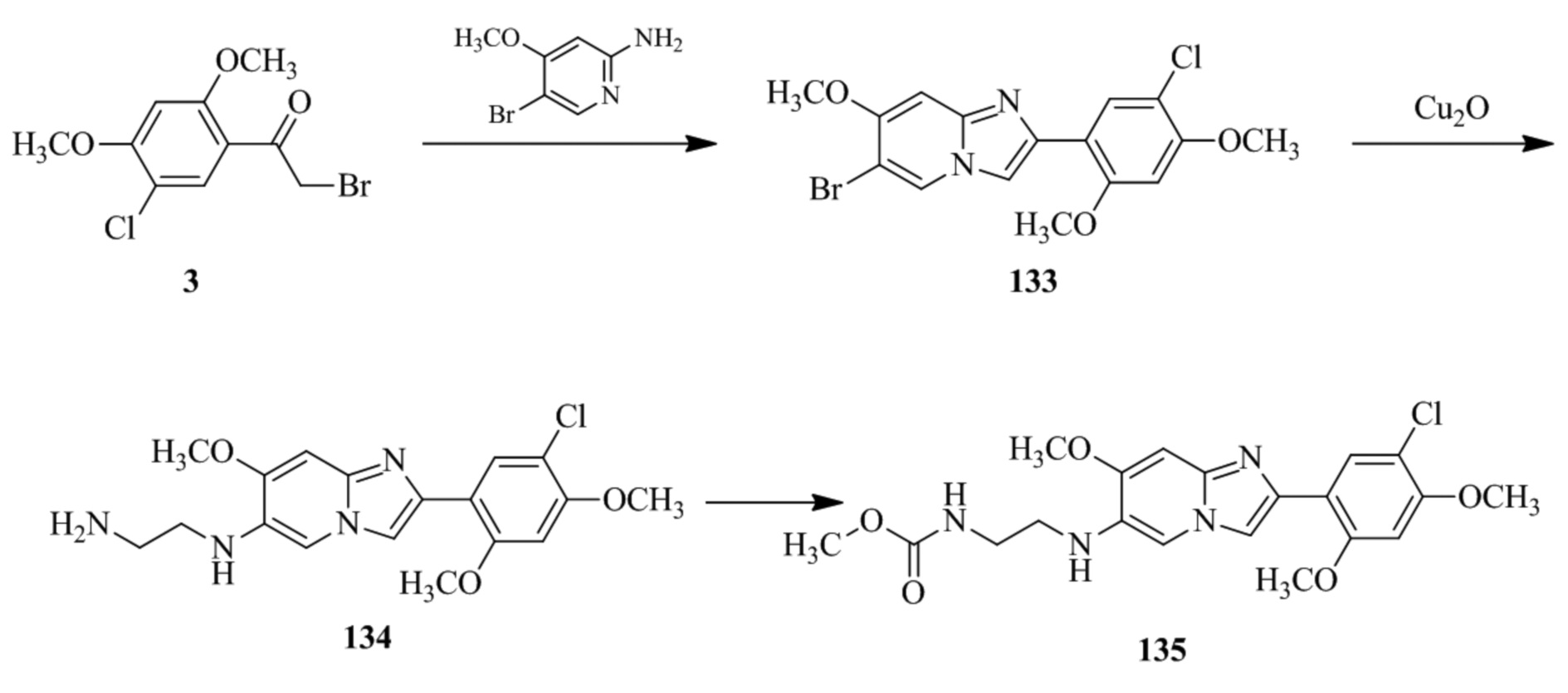
Получение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-метоксиимидазо[1,2- a ]пиридина 133;
Соединение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-метоксиимидазо[1,2-a]пиридин 133 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a. Продукт получали в виде твердого вещества белого цвета (310 мг, 52%).
Получение N1-(2-(5-хлор-2,4-диметоксифенил)-7-метоксиимидазо[1,2- a ]пиридин-6-ил)этан-1,2-диамина 134 (пример 75);
Соединение N1-(2-(5-хлор-2,4-диметоксифенил)-7-метоксиимидазо[1,2-a]пиридин-6-ил)этан-1,2-диамин 134 получали аналогичным образом, как получали N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)этан-1,2-диамин 70a. Продукт получали в виде твердого вещества белого цвета (39 мг, 27%).
1H ЯМР (400 МГц, CDCl3): δ 8,33 (с, 1H), 7,84 (с, 1H), 7,23 (с, 1H), 6,84 (м, 1H), 6,57 (м, 1H), 3,98 (с, 3H), 3,94 (м, 6H), 3,11-3,06 (м, 4H); ВЭЖХ (способ 2) 98,70%, tR=15,37 мин.; ESI-MS m/z 377 [M+H]+.
Получение метил(2-((2-(5-хлор-2,4-диметоксифенил)-7-метоксиимидазо[1,2- a ]-пиридин-6-ил)амино)этил)карбамата 135 (пример 91);
Соединение метил(2-((2-(5-хлор-2,4-диметоксифенил)-7-метоксиимидазо[1,2-a]пиридин-6-ил)амино)этил)карбамата 135 получали аналогичным образом, как получали N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)этан-1,2-диамин 70a. Продукт получали в виде твердого вещества оранжевого цвета (25 мг, 28%).
1H ЯМР (300 МГц, CDCl3): δ 8,33 (с, 1H), 7,85 (с, 1H), 6,84 (с, 1H), 6,57 (м, 3H), 4,99 (ушир. с, 1H), 4,14-4,10 (м, 1H), 3,99 (с, 3H), 3,94 (м, 3H), 3,92 (м, 3H), 3,71 (м, 3H), 3,46-3,44 (м, 2H), 3,23-3,21 (м, 2H); ВЭЖХ (способ 3) 98,91%, tR=17,16 мин.; ESI-MS m/z 435 [M+H]+.
Схема 41
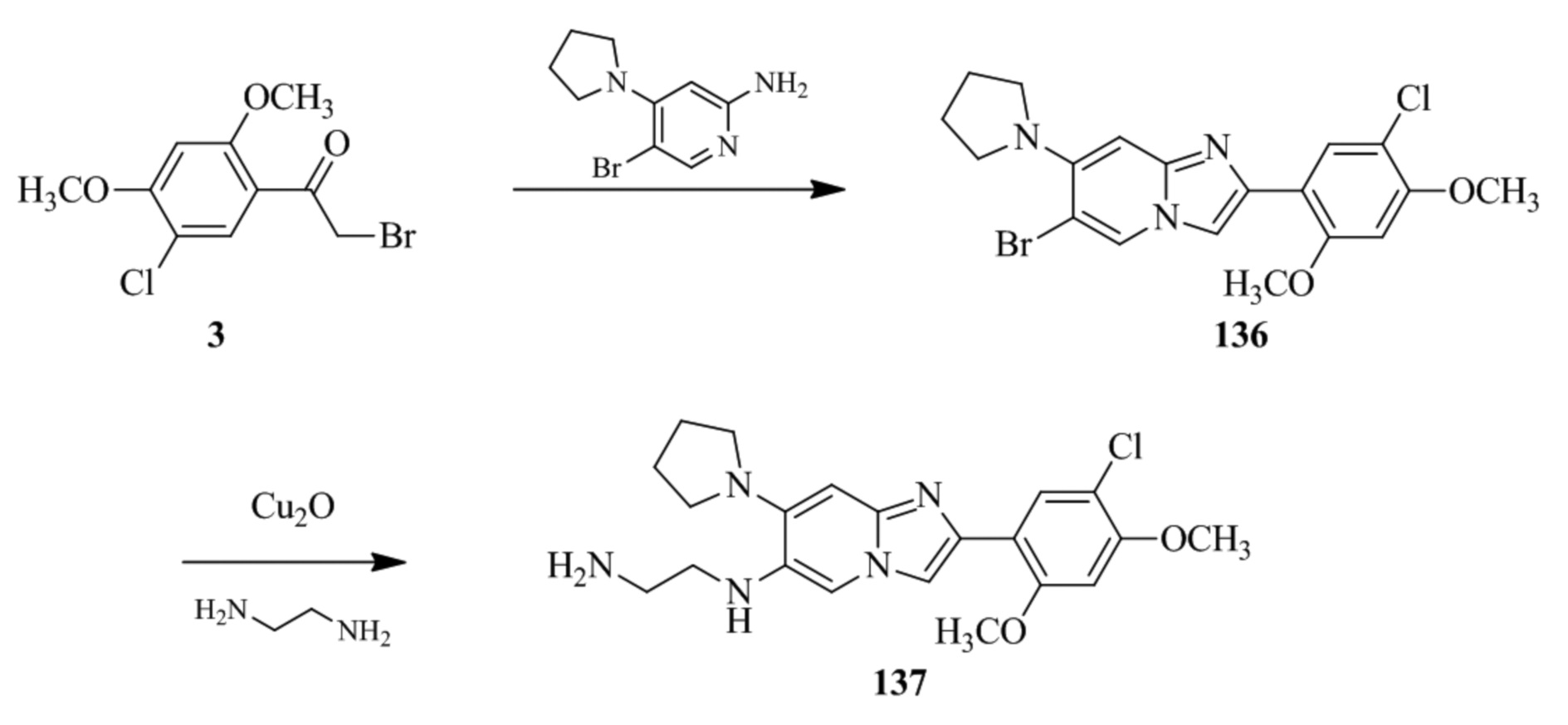
Получение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2- a ]пиридина 136;
Соединение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 136 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a, и получали в виде твердого вещества белого цвета (490 мг, 57%).
Получение N 1-(2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2- a ]пиридин-6-ил)этан-1,2-диамина 137 (пример 60);
Соединение N1-(2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин-6-ил)этан-1,2-диамин 137 получали аналогичным образом, как N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)этан-1,2-диамин 70a, и получали в виде твердого вещества оранжевого цвета (45 мг, 15%).
1H ЯМР (400 МГц, CD3OD): δ 8,04 (с, 1H), 7,94 (с, 1H), 7,58 (с, 1H), 6,85 (с, 1H), 6,78 (с, 1H), 3,96 (с, 3H), 3,94 (с, 3H), 3,29-3,23 (м, 6H), 3,21-3,19 (м, 2H), 2,01-1,98 (м, 4H). ВЭЖХ (способ 3) 96,12% (AUC), tR=15,79 мин; ESI MS m/z 416 [M+H]+.
Схема 42
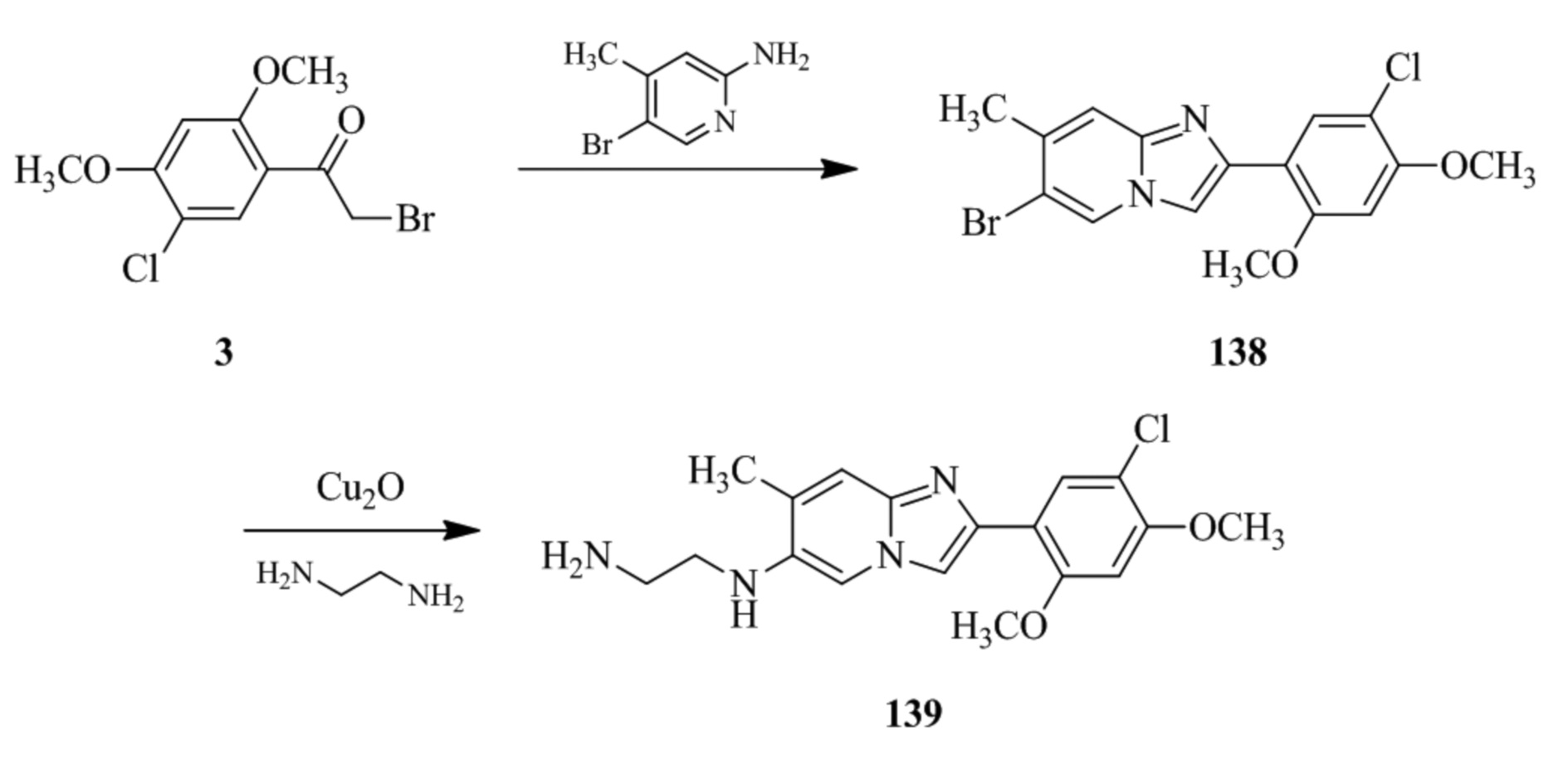
Получение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-метилимидазо[1,2- a ]пиридина 138;
Соединение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-метилимидазо[1,2-a]-пиридин 138 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a, и получали в виде твердого вещества белого цвета (198 мг, 49%).
Получение N 1-(2-(5-хлор-2,4-диметоксифенил)-7-метилимидазо[1,2- a ]пиридин-6-ил)этан-1,2-диамина 139 (пример 78);
Соединение N1-(2-(5-хлор-2,4-диметоксифенил)-7-метилимидазо[1,2-a]пиридин-6-ил)этан-1,2-диамин 139 получали аналогичным образом, как N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)этан-1,2-диамин 70a, и получали в виде твердого вещества оранжевого цвета (58 мг, 30%).
1H ЯМР (400 МГц, CDCl3): δ 8,35 (с, 1H), 7,93 (с, 1H), 7,26-7,24 (с, 2H), 6,57 (м, 1H), 3,98 (с, 3H), 3,94 (м, 6H), 3,81-3,80 (ушир. с, 1H), 3,08-3,06 (м, 4H), 2,27 (с, 3H); ВЭЖХ (способ 3) 97,21%, tR=15,28 мин.; APCI-MS m/z 361 [M+H]+.
Схема 43
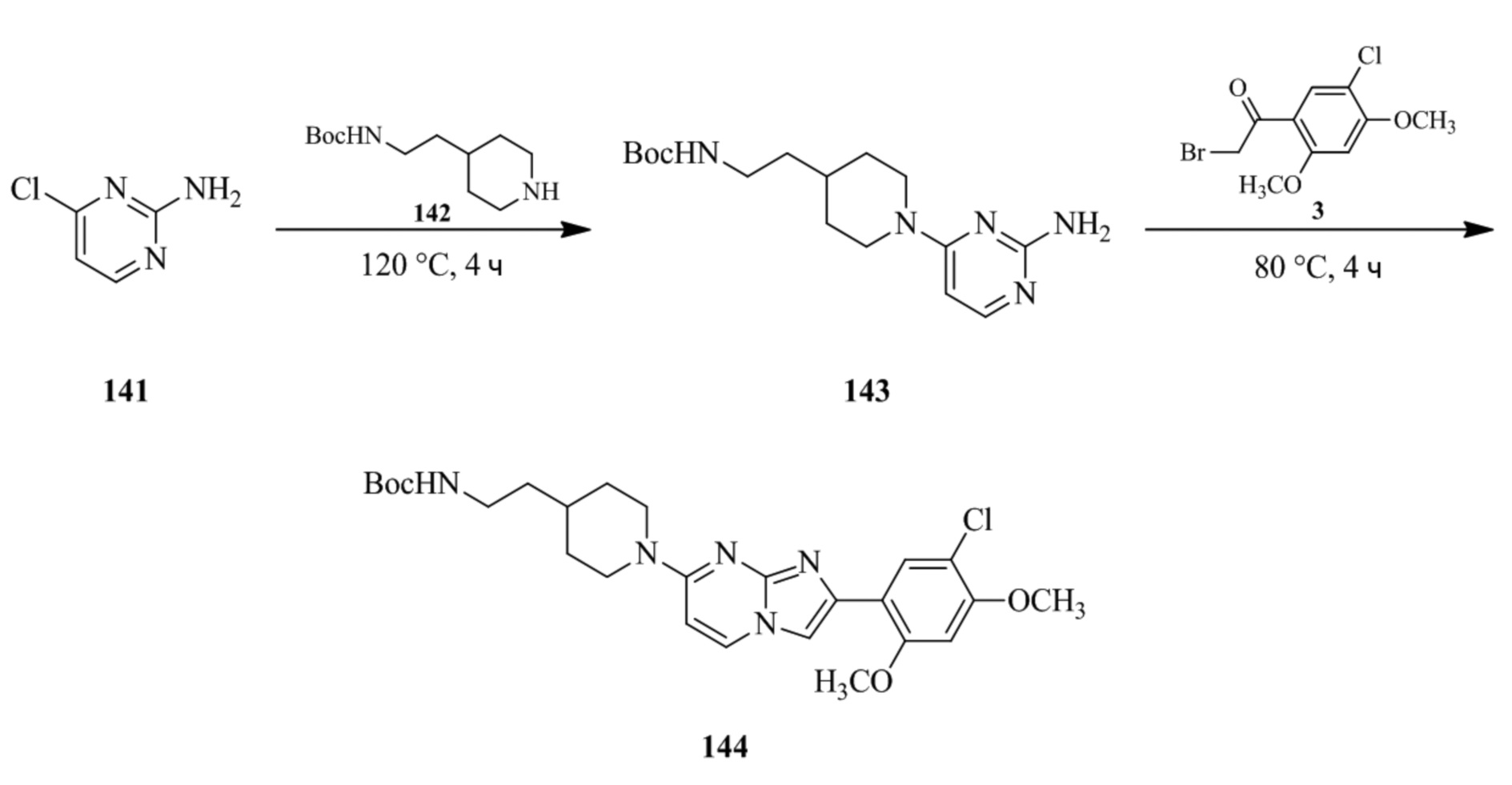
Получение трет -бутил{2-[1-(2-аминопиримидин-4-ил)пиперидин-4-ил]этил}карбамата 143;
Запаянную пробирку загружали 2-амино-4-хлорпиримидином (200 мг, 1,60 ммоль) и трет-бутил[2-(пиперидин-4-ил)этил]карбаматом 141 (430 мг, 1,90 ммоль) в 1-бутаноле (2 мл). Реакционную смесь нагревали до 120°C в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Остаток суспендировали в водном аммиаке (10 мл) и перемешивали в течение 2 ч. Осадок собирали посредством фильтрования и сушили при пониженном давлении для того, чтобы получить трет-бутил{2-[1-(2-аминопиримидин-4-ил)пиперидин-4-ил]этил}карбамат 143 (230 мг, 46%) в виде твердого вещества бледно-желтого цвета.
Получение трет -бутил(2-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил]пиперидин-4-ил}-этил)карбамата 144 (пример 61);
В раствор трет-бутил{2-[1-(2-аминопиримидин-4-ил)пиперидин-4-ил]этил}карбамата 143 (200 мг, 0,60 ммоль) в N,N-диметилформамиде (2 мл) загружали 2-бром-1-(5-хлор-2,4-диметоксифенил)этанон (200 мг, 0,70 ммоль), после чего следовал бикарбонат натрия (150 мг, 1,80 ммоль). Реакционную смесь нагревали до 80°C в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и гасили водой (25 мл) и осадок собирали посредством фильтрования и сушили при пониженном давлении. Твердое вещество очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить трет-бутил(2-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил]пиперидин-4-ил}этил)карбамат 144 (220 мг, 69%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,49 (д, J=7,7 Гц, 1H), 8,10 (с, 1H), 7,83 (с, 1H), 6,87 (с, 1H), 6,82 (д, J=7,7 Гц, 1H), 6,77 (т, J=5,3 Гц, 1H), 4,42 (д, J=12,9 Гц, 2H), 4,00 (с, 3H), 3,93 (с, 3H), 3,02-2,88 (м, 4H), 1,81-1,72 (м, 2H), 1,66-1,54 (м, 1H), 1,37 (с, 9H), 1,35-1,30 (м, 2H), 1,15-1,02 (м, 2H). ВЭЖХ (способ 3) 94,8% (AUC), tR=18,72 мин; ESI MS m/z 516 [M+H]+.
Схема 44
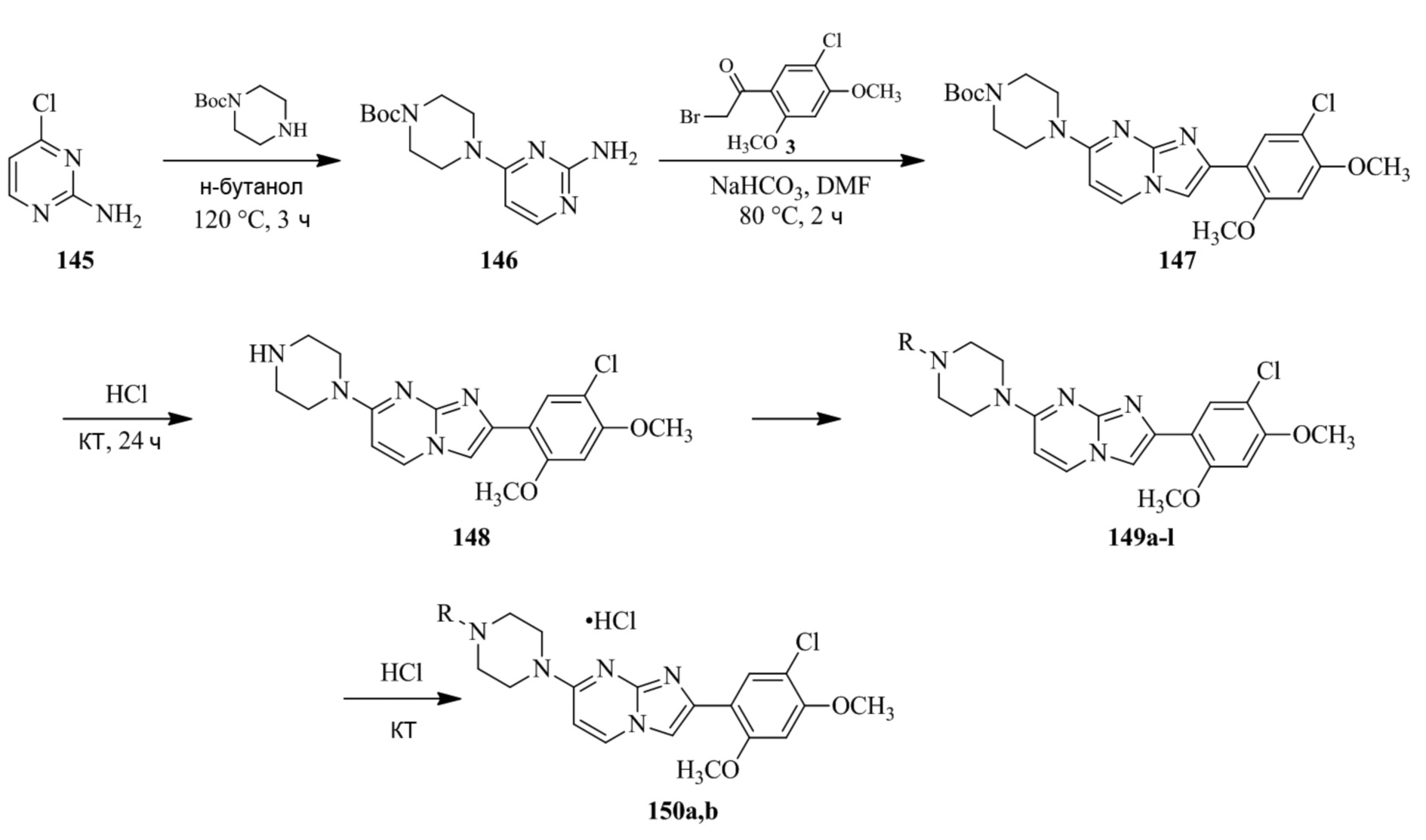
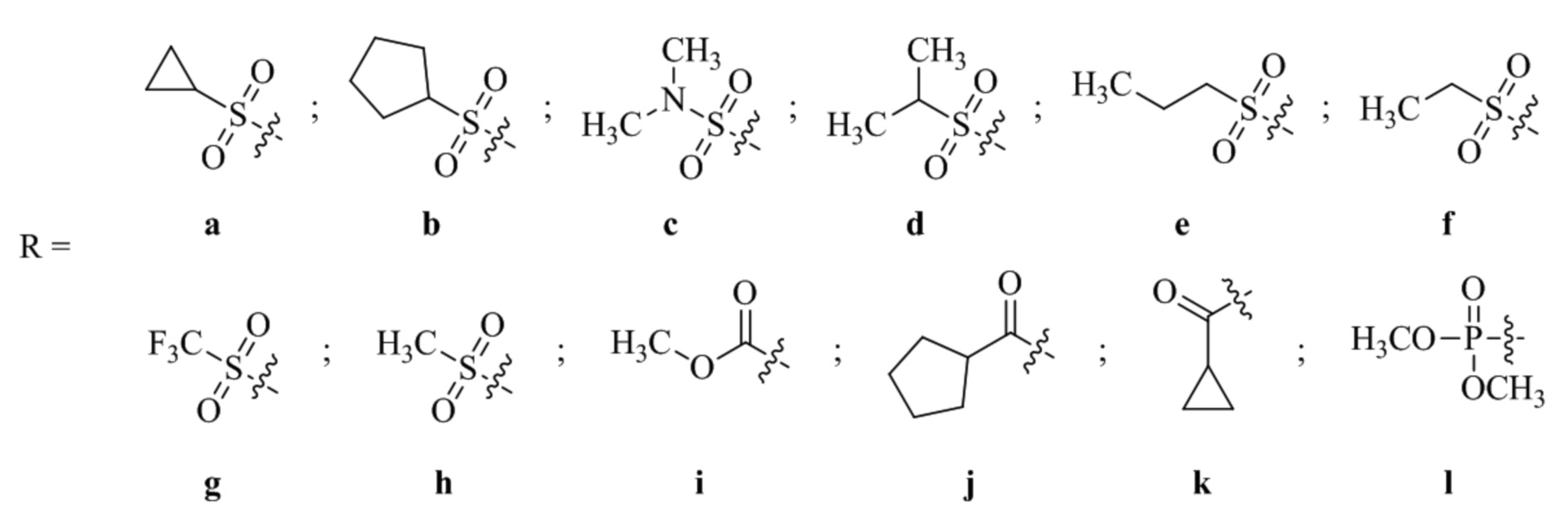
Получение трет -бутил-4-(2-аминопиримидин-4-ил)пиперазин-1-карбоксилата 146;
Cмесь 4-хлорпиримидин-2-амина 145 (3,0 г, 23,0 ммоль) и т-бутилпиперазин-1-карбоксилата (5,2 г, 27,8 ммоль) в н-бутаноле (30 мл) нагревали при 120°C в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении. Твердое вещество промывали раствором NH4OH и фильтровали для того, чтобы получить 146 (5,00 г, 78,1%) в виде твердого вещества желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 7,78 (д, J=7,6 Гц, 1H), 6,00-5,98 (м, 3H), 3,51-3,47 (м, 4H), 3,36-3,33 (м, 4H), 1,41 (с, 9H).
Получение трет -бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил]пиперазин-1-карбоксилата 147 (пример 145);
Cмесь трет-бутил-4-(2-аминопиримидин-4-ил)пиперазин-1-карбоксилата 146 (500 мг, 1,79 ммоль), бикарбоната натрия (300 мг, 3,58 ммоль) и 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона (525 мг, 1,96 ммоль) в DMF (10 мл) нагревали при 80°C в течение 2 ч. Реакционную смесь выливали в воду со льдом и фильтровали на фильтровальной подушке. Остаток очищали посредством хроматографии CombiFlash (силикагель, 7:3 этилацетат/гексан) для того, чтобы получить 147 (517 мг, 61%) в виде твердого вещества белого цвета:
1H ЯМР (300 МГц, DMSO-d6): δ 8,55 (д, J=7,6 Гц, 1H), 8,13 (с, 1H), 7,84 (с, 1H), 6,86 (с, 1H), 6,77 (д, J=7,6 Гц, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,69-3,63 (м, 4H), 3,46-3,41 (м, 4H), 1,43 (с, 9H). ВЭЖХ 94,04% (AUC), tR=11,32 мин. ESI MS m/z 474 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2- a ]-пиримидина 148 (пример 153);
Cмесь трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиримидин-7-ил]пиперазин-1-карбоксилата 147 (510 мг, 1,36 ммоль) и соляной кислоты в метаноле (5,00 мл, раствор 1,25 М) в метаноле (10 мл) перемешивали при комнатной температуре в течение 18 ч. Реакцию концентрировали при пониженном давлении. Твердое вещество промывали раствором NH4OH и фильтровали, и остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиримидин 148 (365 мг, 91%) в виде твердого вещества желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,16 (д, J=7,6 Гц, 1H), 7,46 (с, 1H), 7,09 (с, 1H), 6,85 (д, J=7,6 Гц, 1H), 6,34 (с, 1H), 4,00 (с, 3H), 3,97 (с, 3H), 3,82-3,69 (м, 4H), 3,37-3,29 (м, 4H), m/z 374 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопропилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]пиримидина 149a (пример 146);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиримидина 148 (100 мг, 0,26 ммоль), пиридина (65 мкл, 0,78 ммоль) и циклопропансульфонилхлорида (41 мкл, 0,29 ммоль) в DCM (8 мл) перемешивали при комнатной температуре в течение 18 ч. Реакцию концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопропилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидин 149a (29 мг, 22%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, CH3OD): δ 8,69 (д, J=7,6 Гц, 1H), 8,05 (с, 1H), 8,03 (с, 1H), 7,13 (д, J=7,6 Гц, 1H), 6,93 (с, 1H), 4,03 (с, 3H), 3,96 (с, 3H), 3,93-3,87 (м, 4H), 3,37-3,33 (м, 4H), 2,68-2,65 (м, 1H), 1,04-0,93 (м, 4H); ВЭЖХ (способ 1) 98,51% (AUC), tR=10,59 мин.; ESI MS m/z 478 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопентилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]пиримидина 149b;
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]-пиримидина 148 (100 мг, 0,26 ммоль), триэтиламина (100 мкл, 0,80 ммоль) и циклопентансульфонилхлорида (50 мкл, 0,29 ммоль) в DCM (10 мл) перемешивали при комнатной температуре в течение 2 ч. Реакцию разводили метиленхлоридом (50 мл), промывали раствором NH4OH (10 мл) и солевым раствором (10 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопентил-сульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидин 149b (88 мг, 71%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,58 (д, J=7,6 Гц, 1H), 8,11 (с, 1H), 7,88 (с, 1H), 6,87 (с, 1H), 6,86-6,81 (д, J=7,6 Гц, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,82-3,74 (м, 4H), 3,70-3,64 (м, 1H), 3,35-3,64 (м, 3H), 3,22-3,18 (м, 1H), 2,01-1,91 (м, 2H), 1,86-1,76 (м, 2H), 1,69-1,61 (м, 2H), 1,59-1,50 (м, 2H). ВЭЖХ (способ 1) 92,04% (AUC), tR=11,09 мин; ESI MS m/z 506 [M+H]+.
Получение 4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил]- N,N- диметилпиперазин-1-сульфонамида 149(c) (пример 180);
Соединение 4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил]-N,N-диметилпиперазин-1-сульфонамид 149c получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопентилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидин 149b и получали в виде твердого вещества грязно-белого цвета (39 мг, 31%).
1H ЯМР (400 МГц, CDCl3): δ 8,52 (с, 1H), 8,07 (д, J=7,6 Гц, 1H), 7,72 (с, 1H), 6,56 (с, 1H), 6,37 (д, J=7,6 Гц, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,82 (т, J=4,9 Гц, 4H), 3,34 (т, J=4,9 Гц, 4H), 2,86 (с, 6H). ВЭЖХ (способ 3) 98,13% (AUC), tR=17,39 мин; ESI MS m/z 481 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(изопропилсульфонил)пиперазин-1-ил]-имидазо[1,2- a ]пиримидина 149(d) (пример 205);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(изопропилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидин 149d получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопентилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидин 149b, и получали в виде твердого вещества грязно-белого цвета (52 мг, 41%).
1H ЯМР (400 МГц, CH3OD): δ 8,37 (д, J=7,6 Гц, 1H), 8,06 (с, 1H), 7,82 (с, 1H), 6,77 (с, 1H), 6,70 (д, J=7,6 Гц, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,85-3,81 (м, 4H), 3,47-3,43 (м, 4H), 3,38-3,34 (м, 1H), 1,34 (с, 3H), 1,32 (с, 3H). ESI MS m/z 480 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(пропилсульфонил)пиперазин-1-ил]-имидазо[1,2- a ]пиримидина 149e (пример 191);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(пропилсульфонил)пиперазин-1-ил]-имидазо[1,2-a]пиримидин 149e получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопентилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидин 149b, и получали в виде твердого вещества грязно-белого цвета (48 мг, 38%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,57 (д, J=7,6 Гц, 1H), 8,13 (с, 1H), 7,85 (с, 1H), 6,86 (с, 1H), 7,79 (д, J=7,6 Гц, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,79-3,75 (м, 4H), 3,30-3,26 (м, 4H), 3,09-3,02 (м, 2H), 1,73-1,68 (м, 2H), 1,80-1,60 (м, 3H). ВЭЖХ (способ 1) 99,08% (AUC), tR=10,82 мин. ESI MS m/z 480 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(этилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]пиримидина 149f (пример 190);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-[4-(этилсульфонил)пиперазин-1-ил]-имидазо[1,2-a]пиримидин 149f получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопентилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидин 149b, и получали в виде твердого вещества грязно-белого цвета (42 мг, 34%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,57 (д, J=7,6 Гц, 1H), 8,13 (с, 1H), 7,85 (с, 1H), 6,86 (с, 1H), 6,80 (д, J=7,6 Гц, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,79-3,75 (м, 4H), 3,32-3,26 (м, 4H), 3,12-3,08 (м, 2H), 1,23-1,19 (м, 3H). ВЭЖХ (способ 1) 98,69% (AUC), tR=10,48 мин. ESI MS m/z 466 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-{4-[(трифторметил)сульфонил]-пиперазин-1-ил}имидазо[1,2- a ]пиримидина 149g;
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]-пиримидина 148 (55 мг, 0,14 ммоль), триэтиламина (63 мкл, 0,44 ммоль) и трифторметансульфонового ангидрида (66 мкл, 0,22 ммоль) в DCM (3 мл) перемешивали при комнатной температуре в течение 0,5 ч. Реакцию концентрировали при пониженном давлении. Неочищенное соединение разводили метиленхлоридом (8 мл), промывали раствором NaHCO3 (3 мл) и солевым раствором (10 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-{4[(трифторметил)сульфонил]пиперазин-1-ил}имидазо[1,2-a]пиримидин 149g (20 мг, 31%) в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,49 (с, 1H), 8,08 (д, J=7,6 Гц, 1H), 7,73 (с, 1H), 6,54 (с, 1H), 6,36 (д, J=7,6 Гц, 1H), 3,98 (с, 3H), 3,93 (с, 3H), 3,87-3,83 (м, 4H), 3,59-3,84 (м, 4H). ВЭЖХ (способ 1) 97,23% (AUC), tR=11,43 мин. ESI MS m/z 506 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(метилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиримидина 149h (пример 177);
Соединение диметил (2-(5-хлор-2,4-диметоксифенил)-7-(4-(метилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиримидин 149h получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопентилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидин 149b, и получали в виде твердого вещества грязно-белого цвета (42 мг, 31%).
1H ЯМР (400 МГц, CDCl3): δ 8,49 (с, 1H), 8,09 (д, J=7,6 Гц, 1H), 7,72 (с, 1H), 6,55 (с, 1H), 6,39 (д, J=7,7, 1H), 3,98 (с, 3H), 3,94 (с, 3H), 3,88-3,85 (м, 4H), 3,32-3,30 (м, 4H), 2,79 (с, 3H); ВЭЖХ (способ 1) 96,8%, tR=10,23 мин.; ESI-MS m/z 452 [M+H]+.
Получение метил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперазин-1-карбоксилата 149i (пример 159);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиримидина 148 (100 мг, 0,26 ммоль), метилхлорформиата (25 мкл, 0,26 ммоль) и карбоната цезия (173 мг, 0,52 ммоль) в DMF (5 мл) нагревали с обратным холодильником в течение 16 ч. Реакционную смесь гасили раствором аммиака и экстрагировали этилацетатом. Органическую фазу уменьшали досуха. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/MeOH) для того, чтобы получить метил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилата 149i (72 мг, 68%) в виде твердого вещества бледно-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,56-8,54 (д, J=7,6 Гц, 1H), 8,13 (с, 1H), 7,84 (с, 1H), 6,86 (с, 1H), 6,77-6,75 (м, 1H), 3,99 (с, 3H), 3,93 (с, 3H), 3,70-3,67 (м, 4H), 3,64 (с, 3H), 3,50-3,48 (м, 4H). ВЭЖХ (способ 1) 97,38% (AUC), tR=10,33 мин. ESI MS m/z 432 [M+H]+.
Получение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперазин-1-ил)(циклопентил)метанона 149j (пример 243);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]-пиримидина 148 (100 мг, 0,26 ммоль), DIPEA (93 мкл, 0,53 ммоль) и циклопентанкарбонилхлорида (49 мкл, 0,29 ммоль) в DCM (5 мл) перемешивали при комнатной температуре в течение 1,5 ч. Реакцию гасили водой. Получали твердое вещество. Твердое вещество белого цвета очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-ил)(циклопентил)метанон (58 мг, 51%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO): δ 13,78 (ушир. с, 1H), 8,71 (д, J=8,0 Гц, 1H), 8,10 (с, 1H), 8,00 (с, 1H), 7,24 (д, J=8,0 Гц, 1H), 6,97 (с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 3,89-3,85 (м, 4H), 3,71-3,64 (м, 4H), 3,05-2,98 (м, 1H), 1,81-1,72 (м, 2H), 1,70-1,54 (м, 6H); ВЭЖХ (способ 1) 94,73%, tR=10,82 мин.; ESI-MS m/z 470 [M+H]+.
Получение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперазин-1-ил)(циклопропил)метанона 149k (пример 242);
(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-ил)(циклопропил)метанон 149k получали аналогичным образом, как (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-ил)(циклопентил)метанон 149i, и получали в виде твердого вещества грязно-белого цвета (28 мг, 25%).
Получение диметил(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперазин-1-ил)фосфоната 149l (пример 218);
Соединение диметил(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-ил)фосфонат 149l получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопентилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидин 149b, и получали в виде твердого вещества грязно-белого цвета (42 мг, 31%).
1H ЯМР (400 МГц, DMSO): δ 8,60 (д, J=8,0 Гц, 1H), 8,12 (с, 1H), 7,85 (с, 1H), 6,95 (с, 1H), 6,79 (д, J=8,0 Гц, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,63-3,61 (м, 4H), 3,60 (с, 3H), 3,30 (с, 3H), 2,50-2,49 (м, 4H); ВЭЖХ (способ 1) 94,8%, tR=10,12 мин.; ESI-MS m/z 482 [M+H]+.
Получение HCl соли 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопропилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]пиримидина 150a;
Cмесь 149a (120 мг, 0,25 ммоль) и соляной кислоты в метаноле (2 мл) в метаноле (5 мл) перемешивали при комнатной температуре в течение 15 минут. Реакцию концентрировали при пониженном давлении для того, чтобы получить HCl соль 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопропилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидина 150(a) (111 мг, 86%) в виде твердого вещества белого цвета:
1H ЯМР (300 МГц, DMSO-d6): δ 13,99 (ушир. с, 1H), 8,83-8,75 (м, 1H), 8,15 (с, 1H), 8,11-8,04 (м, 1H), 7,32-7,30 (д, J=7,6 Гц, 1H), 6,95 (с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 3,96-3,91 (м, 4H), 3,40-3,35 (м, 4H), 2,72-2,64 (м, 1H), 1,03-0,95 (м, 4H); ВЭЖХ (способ 1) 95,8% (AUC), tR=10,64 мин. ESI MS m/z 478 [M+H]+.
Получение HCl соли 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопентилсульфонил)пиперазин-1-ил]имидазо[1,2- a ]пиримидина 150(b) (пример 204);
Cмесь 149a (70 мг, 0,25 ммоль) и соляной кислоты в метаноле (1 мл) в метаноле (4 мл) перемешивали при комнатной температуре в течение 15 минут. Реакцию концентрировали при пониженном давлении для того, чтобы получить HCl соль 2-(5-хлор-2,4-диметоксифенил)-7-[4-(циклопентилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиримидина 150(b) (69 мг, 93%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,85 (ушир. с, 1H), 8,74 (д, J=7,6 Гц, 1H), 8,12 (с, 1H), 8,02 (с, 1H), 7,28 (д, J=7,6 Гц, 1H), 6,97 (с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 3,96-3,87 (м, 4H), 3,73-3,67 (м, 1H), 3,42- 3,35 (м, 4H), 2,02-1,92 (м, 2H), 1,86-1,76 (м, 2H), 1,71-1,62 (м, 2H), 1,61-1,51(м, 2H). ВЭЖХ (способ 1) 96,0% (AUC), tR=10,61 мин. ESI MS m/z 506 [M+H]+.
Схема 45
Получение трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперидин-4-ил)карбамата 152 (пример 36);
Cмесь трет-бутил(1-(2-аминопиримидин-4-ил)пиперидин-4-ил)карбамата 151 (1,00 г, 3,40 ммоль), бикарбоната натрия (859 мг, 10,2 ммоль) и 2-бром-1-(5-хлор-2,4-диметокси-фенил)этанона 3 (1,00 г, 3,40 ммоль) в DMF (10 мл) нагревали при 80°C в течение 3 ч. Реакцию выливали в воду со льдом и собирали твердое вещество посредством фильтрования. Остаток очищали посредством хроматографии CombiFlash (силикагель, 8:2 этилацетат/гексан) для того, чтобы получить 152 (769 мг, 48%) в виде твердого вещества белого цвета:
1H ЯМР (300 МГц, DMSO-d6): δ 8,51 (д, J=7,6 Гц, 1H), 8,13 (с, 1H), 7,81 (с, 1H), 6,91 (д, J=7,6 Гц, 1H), 6,86 (с, 1H), 6,77 (д, J=7,6 Гц, 1H), 4,35-4,31 (м, 2H), 3,99 (с, 3H), 3,93 (с, 3H), 3,60-3,55 (м, 1H), 3,09-3,01(м, 2H), 1,82-1,78(м, 2H),1,39 (с, 9H), 1,38-1,20 (м, 2H); ВЭЖХ 95,62% (AUC), tR=11,31 мин. ESI MS m/z 488 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперидин-4-амина гидрохлорида 153 (пример 42);
Cмесь трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперидин-4-ил)карбамата 152 (50 мг, 0,10 ммоль) и соляной кислоты в метаноле (5,00 мл, раствор 1,25 М) в метаноле (5 мл) перемешивали при комнатной температуре в течение 18 ч. Реакцию концентрировали при пониженном давлении. Твердое вещество промывали водой и фильтровали и остаток очищали посредством хроматографии CombiFlash (силикагель, 8:2 DCM/метанол) для того, чтобы получить 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперидин-4-амина гидрохлорид 153 (35 мг, 89%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,70 (д, J=7,8 Гц, 1H), 8,39 (ушир. с, 3H), 8,09 (с, 1H), 8,02 (с, 1H), 7,27 (д, J=7,8 Гц, 1H), 6,97 (с, 1H), 4,03 (с, 3H), 3,98 (с, 3H), 3,50-3,27 (м, 5H), 2,12-2,10 (м, 2H), 1,64-1,57(м, 2H), m/z 388 [M+H]+.
Получение N -(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперидин-4-ил)метансульфонамида 154(a) (пример 192);
Cмесь 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперидин-4-амина гидрохлорида 153 (100 мг, 0,21 ммоль), триэтиламина (121 мкл, 0,84 ммоль) и метилсульфонилхлорида (36 мкл, 0,32 ммоль) в DCM (6 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперидин-4-ил)метансульфонамида 154(a) (42 мг, 41%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,51 (д, J=7,6 Гц, 1H), 8,13 (с, 1H), 7,81 (с, 1H), 7,14 (д, J=7,6 Гц, 1H), 6,85 (с, 1H), 6,77 (д, J=7,6 Гц, 1H), 4,30(д, J=9,0 Гц, 2H), 4,00 (с, 3H), 3,93 (с, 3H), 3,52-3,45 (м, 1H), 3,15-3,12 (м, 2H), 2,95 (с, 3H), 1,94-1,90 (м, 2H), 1,50-1,36 (м, 2H); ВЭЖХ (способ 1) 95,02% (AUC), tR=10,24 мин.; ESI MS m/z 466 [M+H]+.
Получение N -(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперидин-4-ил)пропан-1-сульфонамида 154(b) (пример 193);
Соединение N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперидин-4-ил)пропан-1-сульфонамид 154(b) получали аналогичным образом, как N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперидин-4-ил)метансульфонамид 154a, и получали в виде твердого вещества грязно-белого цвета (41 мг, 38%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,53 (д, J=7,6 Гц, 1H), 8,11 (с, 1H), 7,84 (с, 1H), 7,16 (д, J=7,6 Гц, 1H), 6,87 (с, 1H), 6,82 (м, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,82 (т, J=4,9 Гц, 4H), 3,34 (т, J=4,9 Гц, 4H), 2,86 (с, 6H), 1,95-1,85(м, 2H), 0,99 (т, J=7,4 Гц, 3H); ВЭЖХ (способ 3) 94,08% (AUC), tR=10,70 мин; ESI MS m/z 494 [M+H]+.
Схема 46
Получение трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пирролидин-3-ил)карбамата 156 (пример 26);
Cмесь трет-бутил(1-(2-аминопиримидин-4-ил)пирролидин-3-ил)карбамата 155 (600 мг, 2,14 ммоль), бикарбоната натрия (216 мг, 2,57 ммоль) и 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (751 мг, 2,57 ммоль) в DMF (8 мл) нагревали при 80°C в течение 16 ч. Реакционную смесь выливали в воду со льдом и фильтровали. Остаток очищали посредством хроматографии CombiFlash (силикагель, 8:2 этилацетат/гексан) для того, чтобы получить 156 (570 мг, 57%) в виде твердого вещества белого цвета:
1H ЯМР (300 МГц, DMSO-d6): δ 8,48 (д, J=7,6 Гц, 1H), 8,13 (с, 1H), 7,80 (с, 1H), 7,24- 7,22 (м, 1H), 6,85 (с, 1H), 6,40(д, J=7,6 Гц, 1H), 4,14 (ушир. с, 1H), 3,99 (с, 3H), 3,71 (с, 3H), 3,69-3,34 (м, 4H), 2,19-2,09 (м, 1H), 1,96-1,86 (м, 1H), 1,40 (с, 9H). ВЭЖХ (способ 3) 97,0% (AUC), tR=18,66 мин. ESI MS m/z 474 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пирролидин-3-амина гидрохлорида 157 (пример 34);
Cмесь трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиримидин-7-ил)пирролидин-3-ил)карбамата 156 (550 мг, 1,16 ммоль) и HCl в метаноле (5,00 мл, раствор 1,25 М) в метаноле (15 мл) перемешивали при комнатной температуре в течение 16 ч. Реакцию концентрировали при пониженном давлении. Твердое вещество промывали водой и фильтровали и остаток очищали посредством хроматографии CombiFlash (силикагель, 8:2 DCM/метанол) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиримидин 157(380 мг, 60%) в виде твердого вещества желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 13,80-13,71 (ушир. с, 1H), 8,74-8,71 (м, 4H), 8,14 (с, 1H), 8,02 (с, 1H), 6,96-6,94 (м, 2H),4,04 (с, 3H), 3,98 (с, 3H), 3,91-3,64 (м, 5H), 2,49-2,20 (м, 2H). ВЭЖХ (способ 3) 95,0% (AUC), tR=15,83 мин. ESI MS m/z 374 [M+H]+.
Схема 47
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)морфолина гидробромида 158a (пример 79);
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (96 мг, 0,33 ммоль) и 4-морфолинопиримидин-2-амина (50 мг, 0,3 ммоль) в ацетоне (5 мл) нагревали с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры, осадок белого цвета фильтровали, промывали ацетоном, обрабатывали водой, фильтровали и сушили при пониженном давлении для того, чтобы получить 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)морфолина гидробромид 158a (30 мг, 27%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, DMSO-d6) 13,64 (ушир. с, 1H), 8,69 (д, J=7,76 Гц, 1H), 8,08 (с, 1H), 7,97 (с, 1H), 7,22 (д, J=7,76 Гц, 1H), 6,97 (с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 3,87-3,78 (м, 4H), 3,77-3,71 (м, 4H). ВЭЖХ (способ 3) >99% (AUC), tR=16,76 мин; ESI MS m/z 375 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-амина 158b (пример 8);
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (140 мг, 0,47 ммоль) и пиримидин-2,4-диамина (50 мг, 0,45 ммоль) в ацетоне (5 мл) нагревали с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры. Осадок фильтровали и обрабатывали разбавленным аммиаком. Осадок фильтровали, промывали водой и сушили при пониженном давлении для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-амин 158b (95 мг, 36%) в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, DMSO-d6) δ 8,36 (д, 1H, J=7,2 Гц), 8,09 (с, 1H), 7,76 (с, 1H), 6,84 (с, 1H), 6,76 (с, 2H), 6,22 (д, 1H, J=7,2 Гц), 3,98 (с, 3H), 3,92 (с, 3H); ESI MS m/z 305 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперазин-1-ил)этанола 158c (пример 45);
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (146 мг, 0,49 ммоль) и 2-(4-(2-аминопиримидин-4-ил)пиперазин-1-ил)этанола (100 мг, 0,48 ммоль) в ацетоне (5 мл) нагревали с обратным холодильником в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры. Осадок фильтровали и обрабатывали разбавленной HCl, промывали водой и сушили при пониженном давлении для того, чтобы получить 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиримидин-7-ил)пиперазин-1-ил)этанол 158c (92 мг, 42%) в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 14,00 (ушир. с, 1H), 11,50 (ушир. с, 1H), 8,82-8,80 (м, 1H), 8,16 (с, 1H), 8,05 (м, 1H), 7,32-7,30 (м, 1H), 6,97 (с, 1H), 4,60-4,56 (ушир. с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 3,84-3,70 (м, 3H), 3,39-3,20(м, 8H); ESI MS m/z 418 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2- a ]пиримидина гидробромида 158d (пример 9);
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (47 мг, 0,16 ммоль) и 4-пирролидинопиримидин-2-амина гидробромида (25 мг, 0,15 ммоль) в ацетоне (5 мл) нагревали с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета фильтровали, промывали ацетоном, фильтровали и сушили при пониженном давлении для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиримидина гидробромид 158d (55 мг, 71%) в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 13,63 (с, 1H), 8,63 (д, 1H, J=7,6 Гц), 8,07 (с, 1H), 7,98 (с, 1H), 6,96 (с, 1H), 6,89 (д, 1H, J=7,6 Гц), 4,03 (с, 3H), 3,97 (с, 3H), 3,65-3,54 (м, 4H), 2,08-1,93 (м, 4H); ESI MS m/z 359 [M+H]+.
Схема 48
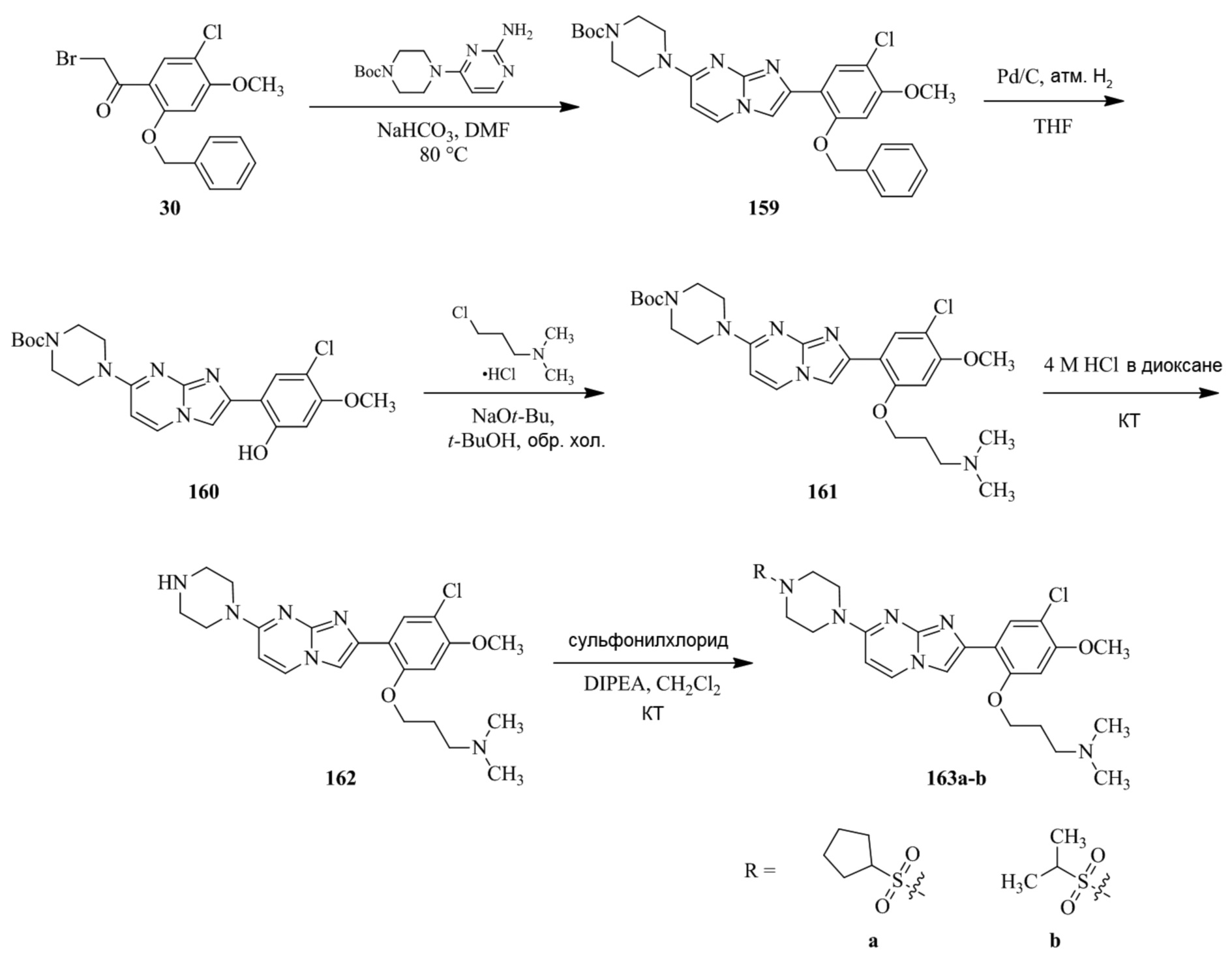
Получение трет -бутил-4-(2-(2-(бензилокси)-5-хлор-4-метоксифенил)имидазо[1,2- a ]-пиримидин-7-ил)пиперазин-1-карбоксилата 159;
Раствор 1-[2-(бензилокси)-5-хлор-4-метоксифенил]-2-бромэтанона 30 (728 мг, 1,96 ммоль), NaHCO3 (300 мг, 3,58 ммоль) и трет-бутил-4-(2-аминопиримидин-4-ил)пиперазин-1-карбоксилата (500 мг, 1,79 ммоль) в DMF (10 мл) нагревали при 80°C в течение 2 ч. Реакционную смесь гасили водой; осадок желтого цвета фильтровали и промывали водой. Твердое вещество фильтровали и сушили при пониженном давлении для того, чтобы получить желаемое соединение трет-бутил-4-(2-(2-(бензилокси)-5-хлор-4-метоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилат 159 (738 мг, 75%) в виде твердого вещества желтого цвета.
1H ЯМР (300 МГц, DMSO): δ 8,50 (д, J=7,5 Гц, 1H), 8,15 (с, 1H), 7,78 (с, 1H), 7,55 (м, 2H), 7,40 (м, 3H), 6,96 (с, 1H), 6,72 (д, J=7,5 Гц, 1H), 5,39 (с, 2H), 3,87 (с, 3H), 3,66 (м, 4H), 3,44 (м, 4H), 1,43 (с, 9H); ВЭЖХ (способ 1) 99,35%, tR=12,08 мин.; ESI-MS m/z 550 [M+H]+.
Получение трет -бутил-4-(2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2- a ]-пиримидин-7-ил)пиперазин-1-карбоксилата 160;
В раствор 159 (1,00 г, 1,80 ммоль) в THF загружали Pd/C (300 мг). Реакционную смесь перемешивали при комнатной температуре в атмосфере H2 (1 атм.) в течение 3 ч. Реакционную смесь фильтровали через небольшую подушку целита и промывали хлороформом. Объединенный органический фильтрат концентрировали при пониженном давлении и остаток очищали посредством колоночной хроматографии (силикагель, 10:1 DCM/MeOH) для того, чтобы получить трет-бутил-4-(2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилат 160 (600 мг, 71%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,06 (д, J=7,4 Гц, 1H), 7,45 (с, 1H), 7,32 (с, 1H), 6,60 (с, 1H), 6,45 (д, J=7,4 Гц, 1H), 3,89 (с, 3H), 3,74-3,72 (м, 4H), 3,58-3,56 (м, 4H), 1,49 (с, 9H); ВЭЖХ (способ 1)=99,2% (AUC), tR=10,95 мин; ESI MS m/z 460 [M+H]+.
Получение трет -бутил-4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперазин-1-карбоксилата 161;
В смесь трет-бутил-4-(2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилата 160 (100 мг, 0,20 ммоль) и диметиламинпропилхлорида (63 мг, 0,40 ммоль) в tBuOH загружали NaOtBu (76 мг, 0,80 ммоль). После перемешивания при 80°C в течение 24 ч, реакционную смесь разводили в CH2Cl2/MeOH (20 мл/2 мл). Органический слой промывали солевым раствором (10 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии (силикагель, 1:0,1:10 метанол/гидроксид аммония/DCM) для того, чтобы получить трет-бутил-4-(2-(5-хлор-2-гидрокси-4-метоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилат 161 (30 мг, 25%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,82 (д, J=7,4 Гц, 1H), 8,39 (с, 1H), 8,01 (с, 1H), 6,47 (с, 1H), 6,37 (д, J=7,4 Гц, 1H), 4,18 (т, J=5,3 Гц, 2H), 3,91 (с, 3H), 3,75-3,69 (м, 4H), 3,56-3,51 (м, 4H), 3,31- 3,25 (м, 2H), 2,83 (с, 6H), 2,56-2,47 (м, 2H), 1,49 (с, 9H); ВЭЖХ (способ 1) 98,9% (AUC), tR=9,81 мин; ESI MS m/z 545 [M+H]+.
Получение 3-(4-хлор-5-метокси-2-(7-(пиперазин-1-ил)имидазо[1,2- a ]пиримидин-2-ил)фенокси)- N,N- диметилпропан-1-амина 162 (пример 186);
Раствор трет-бутил-4-(2-(5-хлор-2-(3-(диметиламино)пропокси)-4-метоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилата 161 (250 мг, 0,50 ммоль) в 4,0 M HCl в диоксане (1 мл) перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь концентрировали при пониженном давлении и остаток суспендировали в водном аммиаке (10 мл). Суспензию перемешивали при комнатной температуре в течение 2 ч и экстрагировали хлороформом (2×10 мл). Объединенный органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении и остаток очищали посредством колоночной хроматографии (силикагель, 1:0,1:10 метанол/гидроксид аммония/DCM) для того, чтобы получить 3-(4-хлор-5-метокси-2-(7-(пиперазин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенокси)-N,N-диметилпропан-1-амин 162 (130 мг, 65%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,55 (д, J=7,2 Гц, 1H), 8,12 (с, 1H), 7,80 (с, 1H), 6,83 (с, 1H), 6,74 (д, J=7,2 Гц, 1H), 4,28-4,16 (м, 2H), 3,91 (с, 3H), 3,67-3,55 (м, 4H), 2,90-2,71 (м, 4H), 2,21 (с, 6H), 2,10-1,99 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=8,20 мин; ESI MS m/z 445 [M+H]+.
Получение 3-(4-хлор-2-(7-(4-(циклопентилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]-пиримидин-2-ил)-5-метоксифенокси)- N,N- диметилпропан-1-амина 163a (пример 227);
3-(4-хлор-2-(7-(4-(циклопентилсульфонил)пиперазин-1-ил)имидазо[1,2-a]-пиримидин-2-ил)-5-метоксифенокси)-N,N-диметилпропан-1-амин 163a получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]пиридин 13a, и получали в виде твердого вещества белого цвета (выход 38%).
1H ЯМР (400 МГц, CDCl3): δ 8,52 (с, 1H), 8,17 (д, J=7,4 Гц, 1H), 7,78 (с, 1H), 6,55 (с, 1H), 6,37 (д, J=7,4 Гц, 1H), 4,18 (т, J=6,3 Гц, 2H), 3,92 (с, 3H), 3,87-3,82 (м, 4H), 3,52-3,48 (м, 5H), 2,61 (т, J=7,1 Гц, 2H), 2,34 (с, 6H), 2,21-2,13 (м, 2H), 2,05-1,96 (м, 4H), 1,85-1,75 (м, 2H), 1,64-1,55 (м, 2H); ВЭЖХ (способ 1) 97,9% (AUC), tR=9,79 мин; ESI MS m/z 577 [M+H]+.
Получение 3-(4-хлор-2-(7-(4-(изопропилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]-пиримидин-2-ил)-5-метоксифенокси)- N,N- диметилпропан-1-амина 163b (пример 226);
3-(4-хлор-2-(7-(4-(изопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиримидин-2-ил)-5-метоксифенокси)-N,N-диметилпропан-1-амин 163b получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-[4-(метилсульфонил)пиперазин-1-ил]имидазо[1,2-a]-пиридин 13a, и получали в виде твердого вещества белого цвета (2,20 г, 44%).
1H ЯМР (300 МГц, CD3OD): δ 8,43 (д, J=7,6 Гц, 1H), 7,85 (с, 1H), 7,75 (с, 1H), 6,78-6,75 (м, 2H), 4,27 (т, J=5,8 Гц, 2H), 3,94 (с, 3H), 3,87-3,76 (м, 4H), 3,53-3,42 (м, 4H), 3,12-3,02 (м, 2H), 2,78 (с, 6H), 2,31-2,19 (м, 2H), 1,35 (с, 3H), 1,33 (с, 3H). ВЭЖХ (способ 1) 95,1% (AUC), tR=9,45 мин; ESI MS m/z 551 [M+H]+.
Схема 49
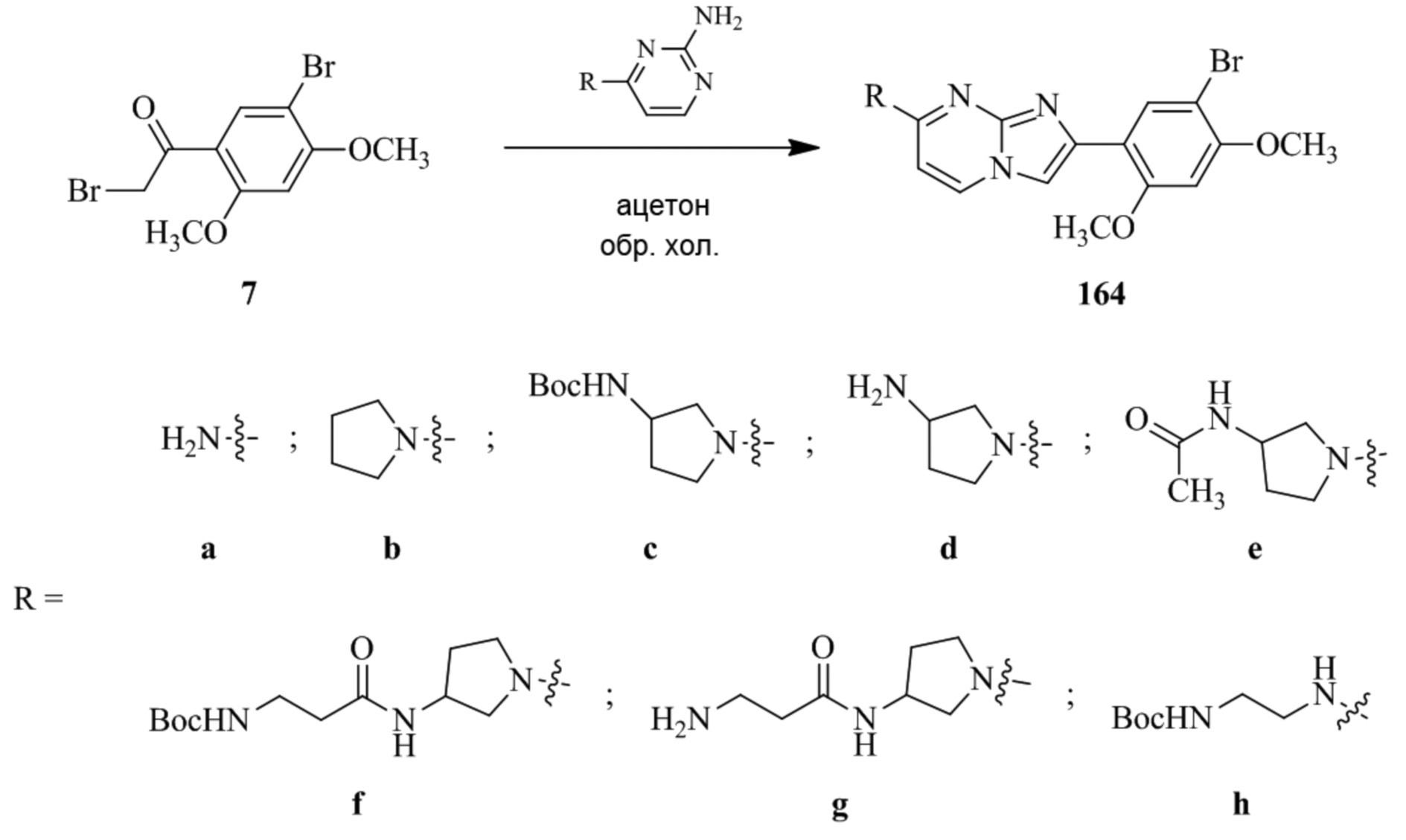
Получение 2-(5-бром-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-амина гидрохлорида 164a (пример 2);
Раствор 2-бром-1-(5-бром-2,4-диметоксифенил)этанона 7 (62 мг, 0,0.21 ммоль) и пиримидин-2,4-диамина 164a (20 мг, 0,18 ммоль) в ацетоне (5 мл) нагревали с обратным холодильником в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры; осадок белого цвета фильтровали и промывали ацетоном. Осадок суспендировали в водном аммиаке (10 мл) и перемешивали в течение 30 мин. Осадок фильтровали, промывали водой. Твердое вещество превращали в HCl соль посредством обработки его разбавленной HCl. Полученный осадок сушили при пониженном давлении для того, чтобы получить 2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-амина гидрохлорид 164a (18 мг, 44%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,54- 8,52 (д, J=7,6 Гц, 1H), 8,22 (ушир. с, 2H), 8,11 (с, 1H), 8,07 (с, 1H), 6,92 (с, 3H), 6,71-6,68 (д, J=7,6 Гц, 1H), 4,03 (с, 3H), 3,97 (с, 3H). ВЭЖХ (способ 3) 97,8% (AUC), tR=16,84 мин; APCI MS m/z 351 [M+2+H]+.
Получение 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2- a ]пиримидина 164b (пример 3);
Соединение 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]-пиримидин 164b получали аналогичным образом, как 2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-амин 164a, и получали в виде свободного основания (выход 51%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,48 (д, J=7,4 Гц, 1H), 8,37 (с, 1H), 7,79 (с, 1H), 6,83 (с, 1H), 6,41 (д, J=7,4 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,48-3,46 (м, 4H), 1,88-1,84 (м, 4H). ВЭЖХ (способ 4)=96,3% (AUC), tR=18,48 мин. ESI MS m/z 405 [M+2+H]+.
Получение трет -бутил(3-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)циклопентил)карбамата 164c (пример 13);
Соединение трет-бутил(3-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)циклопентил)карбамат 164c получали аналогичным образом, как 2-(5-бром-2,4-диметокси-фенил)имидазо[1,2-a]пиримидин-7-амин 164a, и получали в виде свободного основания (200 мг, 77%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,48 (д, J=7,4 Гц, 1H), 8,28 (с, 1H), 7,79 (с, 1H), 7,23 (с, 1H), 6,82 (с, 1H), 6,41 (д, J=7,4 Гц, 1H), 4,13 (ушир. с, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,73-3,64 (м, 1H), 3,61-3,53 (м, 1H), 3,52-3,45 (м, 1H), 3,39-3,32 (м, 1H), 2,22-2,08 (м, 1H), 1,96-1,83 (м, 1H). ВЭЖХ (способ 4) 97,8% (AUC), tR=18,76 мин; APCI MS m/z 520 [M+H]+.
Получение 3-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)-циклопентанамина гидрохлорида 164d (пример 19);
Соединение 3-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)циклопентанамина гидрохлорид 164d получали аналогично 3-амино-N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)пропанамиду 17f, и получали в виде гидрохлоридной соли (70 мг, 76%).
1H ЯМР (300 МГц, DMSO-d6): δ 13,86 (ушир. с, 1H), 8,72 (д, J=7,3 Гц, 4H), 8,13 (с, 2H), 6,96 (с, 1H), 6,93 (с, 1H), 4,04 (с, 3H), 3,97 (с, 3H), 3,93-3,81 (м, 3H), 3,80-3,64 (м, 2H), 2,45-2,17 (м, 2H). ВЭЖХ (способ 5) 98,3% (AUC), tR=14,38 мин; APCI MS m/z 420 [M+H]+.
Получение N -(3-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)-циклопентил)ацетамида 164e (пример 66);
Соединение N-(3-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)-циклопентил)ацетамид 164d получали аналогично (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)(циклопентил)метанону 13t, и получали в виде свободного основания в виде твердого вещества желтого цвета (50 мг, 61%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,49 (д, J=7,5 Гц, 1H), 8,28 (с, 1H), 8,16 (д, J=6,4 Гц, 1H), 7,80 (с, 1H), 6,83 (с, 1H), 6,43 (д, J=7,5 Гц, 1H), 4,36 (ушир. с, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,71-3,67 (м, 1H), 3,59-3,57 (м, 2H), 3,45 (ушир. с, 1H), 2,20-2,12 (м, 1H), 1,95-1,85 (м, 1H), 1,82 (с, 3H). ВЭЖХ (способ 3) 98,1% (AUC), tR=16,34 мин; ESI MS m/z 460 [M+H]+.
Получение трет -бутил(3-((3-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)циклопентил)амино)-3-оксопропил)карбамата 164f (пример 65);
Соединение трет-бутил(3-((3-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]-пиримидин-7-ил)циклопентил)амино)-3-оксопропил)карбамат 164f получали аналогично трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамату 5e и получали в виде твердого вещества коричневого цвета (70 мг, 50%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,51 (д, J=7,3 Гц, 1H), 8,26 (с, 1H), 8,19 (д, J=6,4 Гц, 1H), 7,83 (с, 1H), 6,84 (с, 1H), 6,74 (ушир. с, 1H), 6,48 (д, J=7,3 Гц, 1H), 4,37 (ушир. с, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,76-3,66 (м, 1H), 3,65-3,52 (м, 2H), 3,44-3,33 (м, 1H), 3,13-3,10 (м, 2H), 2,26-2,24 (м, 3H), 1,96-1,86 (м, 1H), 1,36 (с, 9H); ВЭЖХ (способ 3) 95,7% (AUC), tR=17,34 мин; ESI MS m/z 589 [M+H]+.
Получение 3-амино -N- (3-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)циклопентил)пропанамида гидрохлорида 164g (пример 68);
Соединение 3-амино-N-(3-(2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]-пиримидин-7-ил)циклопентил)пропанамида гидрохлорид 164g получали аналогично 3-амино-N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)пропанамиду 17f, и получали в виде гидрохлоридной соли в виде твердого вещества бледно-желтого цвета (30 мг, 64%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,74 (с, 1H), 8,70-8,59 (м, 2H), 8,17 (с, 1H), 8,08 (с, 1H), 8,00-7,85 (м, 3H), 6,93 (с, 1H), 6,92-6,83 (ушир. с, 1H), 4,52-4,37 (м, 1H), 4,04 (с, 3H), 3,97 (с, 3H), 3,86-3,78 (м, 2H), 3,77-3,66 (м, 2H), 3,62-3,42 (м, 2H), 3,05-2,94 (м, 2H), 2,35-2,14 (м, 1H), 2,14-1,95 (м, 1H). ВЭЖХ (способ 5) 96,1% (AUC), tR=15,42 мин; ESI MS m/z 489 [M+H]+.
Получение трет -бутил(2-((2-(5-бром-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)амино)этил)карбамата 164h (пример 18);
Соединение трет-бутил(2-((2-(5-бром-2,4-диметоксифенил)имидазо[1,2-a]-пиримидин-7-ил)амино)этил)карбамат 164h получали аналогично трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)-карбамату 5e, и получали в виде твердого вещества коричневого цвета (100 мг, 25%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,35 (д, J=7,3 Гц, 1H), 8,24 (с, 1H), 7,80 (с, 1H), 7,66 (ушир. с, 1H), 6,91 (ушир. с, 1H), 6,83 (с, 1H), 6,32 (д, J=7,3 Гц, 1H) 3,99 (с, 3H), 3,92 (с, 3H), 3,42-3,33 (м, 2H), 3,21-3,11 (м, 2H), 1,38 (с, 9H); ВЭЖХ (способ 4) 96,4% (AUC), tR=18,45 мин.; APCI MS m/z 494 [M+H]+.
Схема 50
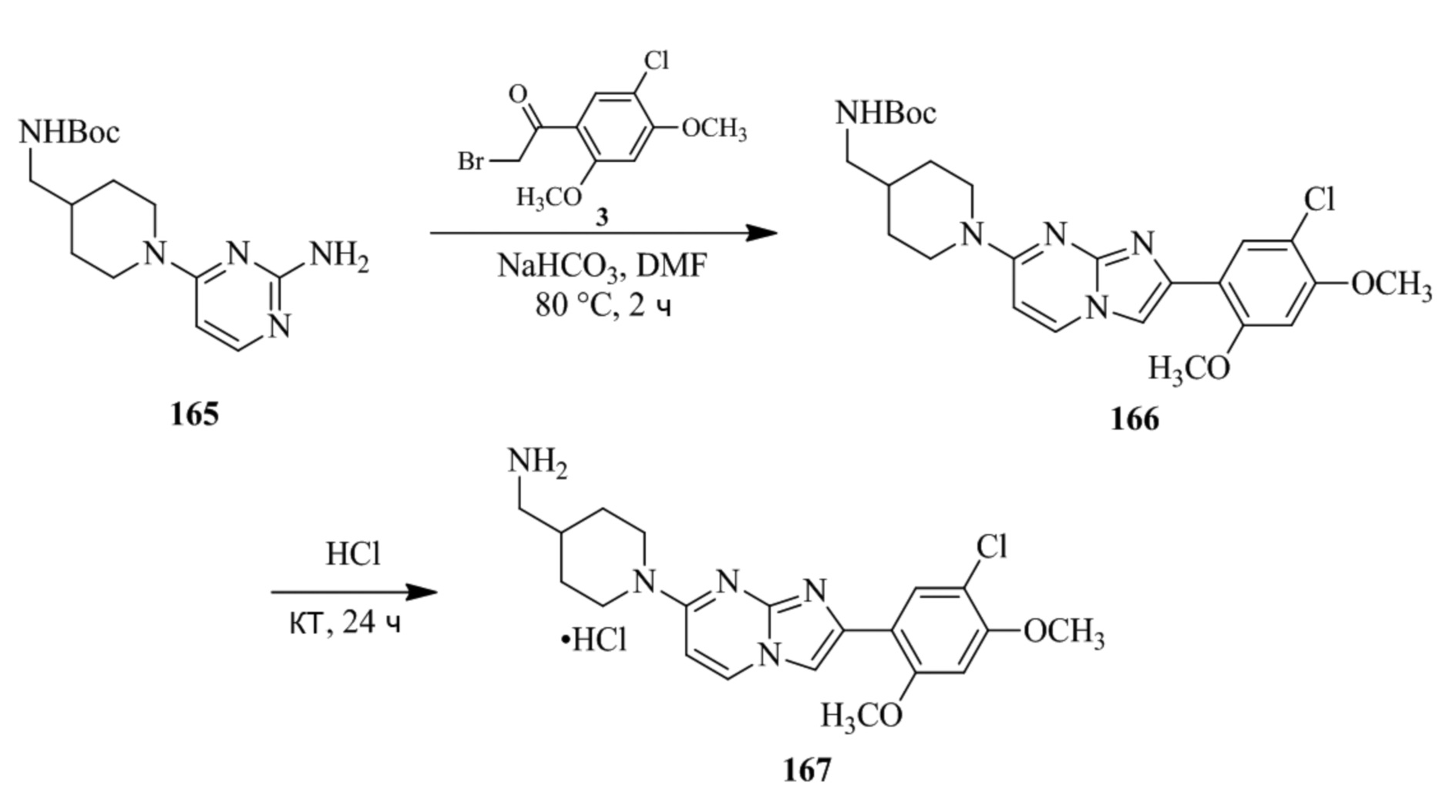
Получение трет -бутил((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперидин-4-ил)метил)карбамата 166 (пример 32);
В раствор трет-бутил((1-(2-аминопиримидин-4-ил)пиперидин-4-ил)метил)карбамата 165 (120 мг, 0,39 ммоль) в DMF (5 мл) загружали 2-бром-1-(5-хлор-2,4-диметокси-фенил)этанон (107 мг, 0,42 ммоль), после чего следовал бикарбонат натрия (39 мг, 0,46 ммоль). Реакционную смесь нагревали до 90°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры, гасили водой (25 мл), осадок собирали посредством фильтрования и сушили при пониженном давлении. Твердое вещество очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить трет-бутил((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиримидин-7-ил)пиперидин-4-ил)метил)карбамат 166 (135 мг, 69%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,48 (д, J=7,6 Гц, 1H), 8,12 (с, 1H), 7,79 (с, 1H), 6,88-6,85 (м, 2H), 6,75 (д, J=7,6 Гц, 1H), 4,43-4,39 (м, 2H), 3,95 (с, 3H), 3,93 (с, 3H), 2,95-2,86 (м, 4H), 1,71-1,68 (м, 3H), 1,38 (с, 9H), 1,10-1,06 (м, 2H); ВЭЖХ (способ 3) 99,12% (AUC), tR=19,01 мин.; ESI MS m/z 502 [M+H]+.
Получение (1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперидин-4-ил)метанамина гидрохлорида 167 (пример 31);
Cмесь трет-бутил((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперидин-4-ил)метил)карбамата 166 (90 мг, 1,79 ммоль) и соляной кислоты в метаноле (2,00 мл, раствор 1,25 М) в метаноле (5 мл) перемешивали при комнатной температуре в течение 16 ч. Реакцию концентрировали при пониженном давлении для того, чтобы получить 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперидин-4-ил)метанамина гидрохлорид 167 (78 мг, 92%) в виде твердого вещества желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,89-8,67 (д, J=7,6 Гц, 1H), 8,27 (ушир. с, 3H), 8,08 (с, 1H), 8,03 (с, 1H), 7,29-7,27 (д, J=7,6 Гц, 1H), 6,96 (с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 3,39(м, 3H), 3,17-3,15 (м, 2H), 2,75-2,71 (м, 2H), 2,06 (м, 1H), 1,96-1,91 (м, 2H), 1,30-1,19 (м, 2H). ВЭЖХ (способ 3) 97,5% (AUC), tR=15,83 мин. ESI MS m/z 402 [M+H]+.
Схема 51
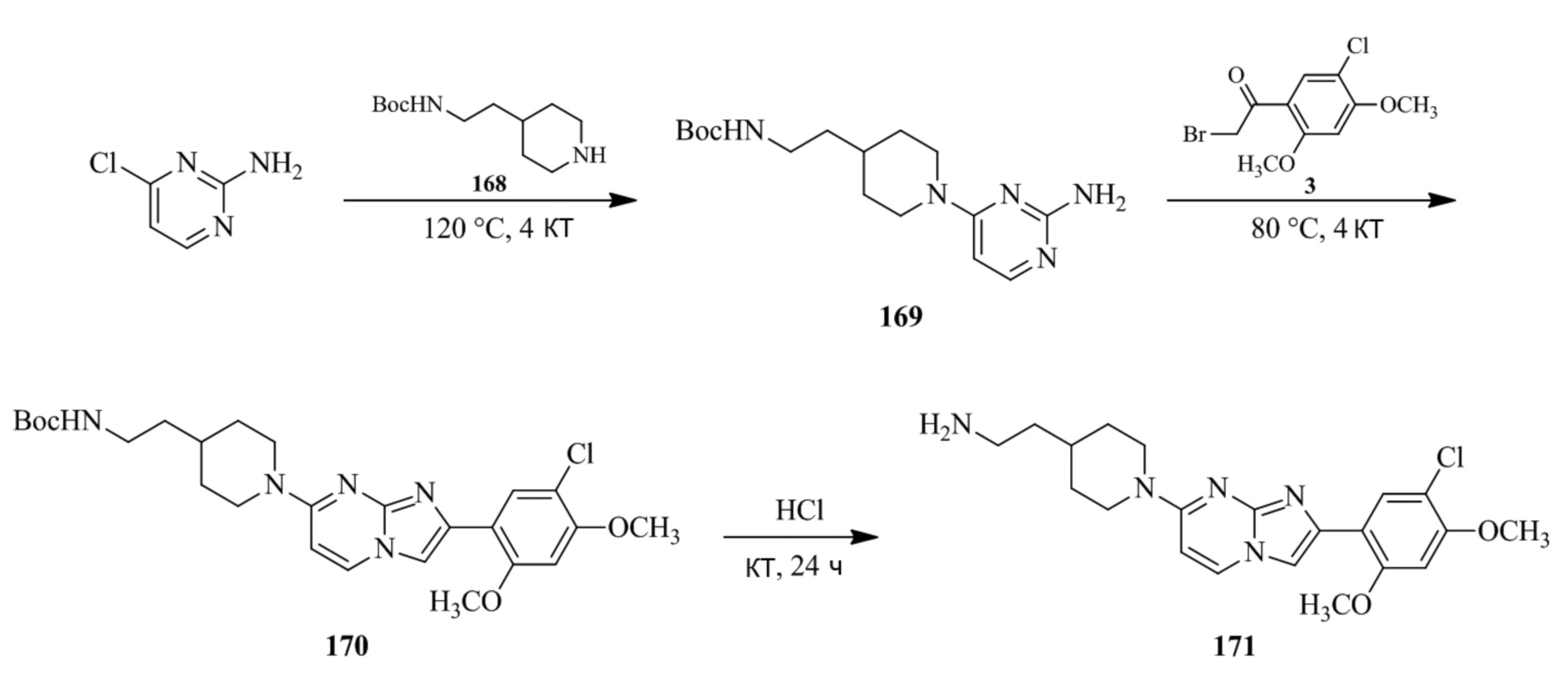
Получение трет -бутил{2-[1-(2-аминопиримидин-4-ил)пиперидин-4-ил]этил}карбамата 169;
В раствор 2-амино-4-хлорпиримидина (200 мг, 1,60 ммоль) в 1-бутаноле (2 мл) загружали трет-бутил[2-(пиперидин-4-ил)этил]карбамат 168 (430 мг, 1,90 ммоль) и реакционный сосуд надежно запаивали. Реакционную смесь нагревали до 120°C в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Остаток суспендировали в водном аммиаке (10 мл) и перемешивали в течение 2 ч. Осадок фильтровали и сушили при пониженном давлении для того, чтобы получить трет-бутил{2-[1-(2-аминопиримидин-4-ил)пиперидин-4-ил]этил}карбамат 169 (230 мг, 46%) в виде твердого вещества бледно-желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 7,71 (д, J=6,1 Гц, 1H), 6,75 (ушир. с, 1H), 5,99 (д, J=6,0 Гц, 1H), 5,88 (с, 2H), 4,27 (д, J=13,1 Гц, 2H), 2,95 (дд, J=6,7 Гц, 13,3 Гц, 2H), 2,71 (т, J=11,3 Гц, 2H), 1,67 (д, J=12,8 Гц, 2H), 1,60-1,43 (м, 1H), 1,37 (с, 9H), 1,34-1,25 (м, 2H), 1,07-0,90 (м, 2H). ESI MS m/z 321 [M+H]+.
Получение трет -бутил(2-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил]пиперидин-4-ил}этил)карбамата 170 (пример 61);
В раствор трет-бутил{2-[1-(2-аминопиримидин-4-ил)пиперидин-4-ил]этил}карбамата 169 (200 мг, 0,60 ммоль) в N,N-диметилформамиде (2 мл) загружали 2-бром-1-(5-хлор-2,4-диметоксифенил)этанон (200 мг, 0,70 ммоль), после чего следовал бикарбонат натрия (150 мг, 1,80 ммоль). Реакционную смесь нагревали до 80°C в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и гасили водой (25 мл), и осадок фильтровали и сушили при пониженном давлении. Твердое вещество очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить трет-бутил(2-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил]пиперидин-4-ил}этил)карбамат 170 (220 мг, 69%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,49 (д, J=7,7 Гц, 1H), 8,10 (с, 1H), 7,83 (с, 1H), 6,87 (с, 1H), 6,82 (д, J=7,7 Гц, 1H), 6,77 (т, J=5,3 Гц, 1H), 4,42 (д, J=12,9 Гц, 2H), 4,00 (с, 3H), 3,93 (с, 3H), 3,02-2,88 (м, 4H), 1,81-1,72 (м, 2H), 1,66-1,54 (м, 1H), 1,37 (с, 9H), 1,35-1,30 (м, 2H), 1,15-1,02 (м, 2H). ВЭЖХ (способ 3) 94,8% (AUC), tR=18,72 мин; ESI MS m/z 516 [M+H]+.
Получение 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пиперидин-4-ил)этанамина 171 (пример 67);
Cмесь трет-бутил(2-{1-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиримидин-7-ил]пиперидин-4-ил}этил)карбамата (70 мг, 0,13 ммоль) и соляной кислоты в диоксане (5,00 мл, 4,00 М раствор) перемешивали при комнатной температуре в течение 4 ч. Реакцию концентрировали при пониженном давлении для того, чтобы получить 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперидин-4-ил)метанамина гидрохлорид 171 (30 мг, 53%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,68 (ушир. с, 1H), 8,66 (д, J=7,61 Гц, 1H), 8,14-8,05 (м, 4H), 8,03 (с, 1H), 7,26 (д, J=7,6 Гц, 1H), 6,96 (с, 1H), 4,85 (ушир. с, 1H), 4,38 (ушир. с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 3,16-3,13 (м, 2H), 2,82 (ушир. с, 2H), 1,9-1,70 (м, 3H), 1,60-1,50 (м, 2H), 1,20-1,07 (м, 2H). ESI MS m/z 416 [M+H]+.
Схема 52
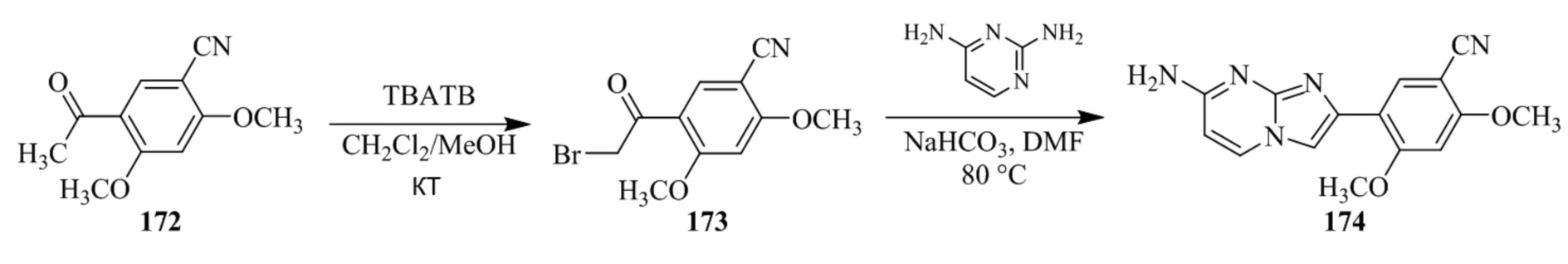
Получение 5-(7-аминоимидазо[1,2- a ]пиримидин-2-ил)-2,4-диметоксибензонитрила 174 (пример 46);
5-(7-аминоимидазо[1,2-a]пиримидин-2-ил)-2,4-диметоксибензонитрил 174 получали аналогичным образом, как 2-(5-бром-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 9a, и получали в виде твердого вещества грязно-белого цвета (выход 58%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,37 (д, J=7,2 Гц, 1H), 7,79 (с, 1H), 6,91-6,81 (м, 3H), 6,26 (д, J=7,2 Гц, 1H) 4,07 (с, 3H), 3,99 (с, 3H); ВЭЖХ (способ 3) 95,6% (AUC), tR=15,14 мин; ESI MS m/z 304 [M+H]+.
Получение 5-(7-аминоимидазо[1,2- a ]пиримидин-2-ил)-2,4-диметоксибензонитрила гидрохлорида (пример 46);
5-(7-аминоимидазо[1,2-a]пиримидин-2-ил)-2,4-диметоксибензонитрила гидрохлорид получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12, и получали в виде твердого вещества грязно-белого цвета (выход 92%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,57 (ушир. с, 1H), 8,53 (д, J=7,4 Гц, 1H), 8,37-8,24(м, 2H), 8,22 (с, 3H), 6,99 (с, 1H), 6,70 (д, J=7,4 Гц, 1H), 4,10 (с, 3H), 4,04 (с, 3H). ВЭЖХ (способ 3) 97,3% (AUC), tR=15,59 мин; ESI MS m/z 296 [M+H]+.
Схема 53
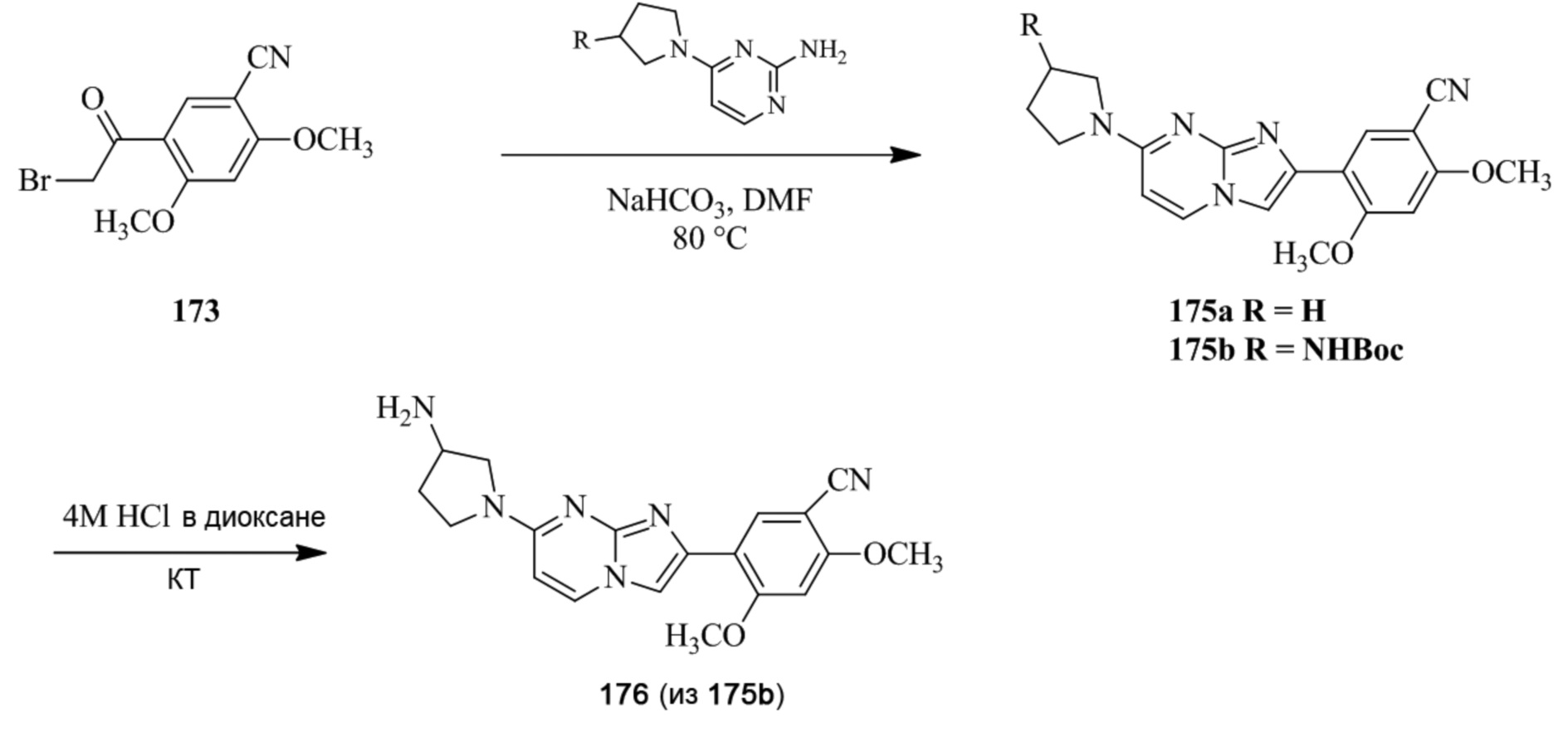
Получение трет -бутил(1-(2-(5-циано-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пирролидин-3-ил) карбамата 175b (пример 74);
Соединение трет-бутил(1-(2-(5-циано-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пирролидин-3-ил)карбамата 175b получали аналогичным образом, как трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 11, и получали в виде твердого вещества желтого цвета (15 мг, 66%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,48 (д, J=7,53 Гц, 1H), 8,32 (с, 1H), 7,82 (с, 1H), 7,23 (ушир. с, 1H), 6,89 (с, 1H), 6,42 (д, J=7,53 Гц, 1H) 4,13 (ушир. с, 1H), 4,07 (с, 3H), 3,99 (с, 3H), 3,72-3,66 (м, 1H), 3,6-3,57 (м, 1H), 3,55-3,47 (м, 1H), 3,41-3,32 (м, 1H), 2,20-2,10 (м, 1H), 1,97-1,85 (м, 1H), 1,40 (с, 9H). ВЭЖХ (способ 5) 97,5% (AUC), tR=17,7 мин; ESI MS m/z 465 [M+H]+.
Получение 2,4-диметокси-5-(7-(пирролидин-1-ил)имидазо[1,2- a ]пиримидин-2-ил)-бензонитрила гидрохлорида 175a (пример 69);
Соединение 2,4-диметокси-5-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)-бензонитрил 175a получали аналогичным образом, как трет-бутил-4-[2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил]пиперазин-1-карбоксилат 11, и получали в виде твердого вещества грязно-белого цвета (20 мг, 29%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,66 (ушир. с, 1H), 8,63 (д, J=7,6 Гц, 1H), 8,18 (с, 1H), 8,09 (с, 1H), 6,99 (с, 1H), 6,90 (д, J=7,6 Гц, 1H), 4,11 (с, 3H), 4,04 (с, 3H), 3,65-3,56 (м, 4H), 2,08-1,96 (м, 4H). ВЭЖХ (способ 5) >99% (AUC), tR=17,1 мин; ESI MS m/z 350 [M+H]+.
Получение 5-(7-(3-аминопирролидин-1-ил)имидазо[1,2- a ]пиримидин-2-ил)-2,4-диметоксибензонитрила 176;
5-(7-(3-аминопирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)-2,4-диметоксибензонитрил 176 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12, и получали в виде твердого вещества грязно-белого цвета (выход 76%).
Схема 54
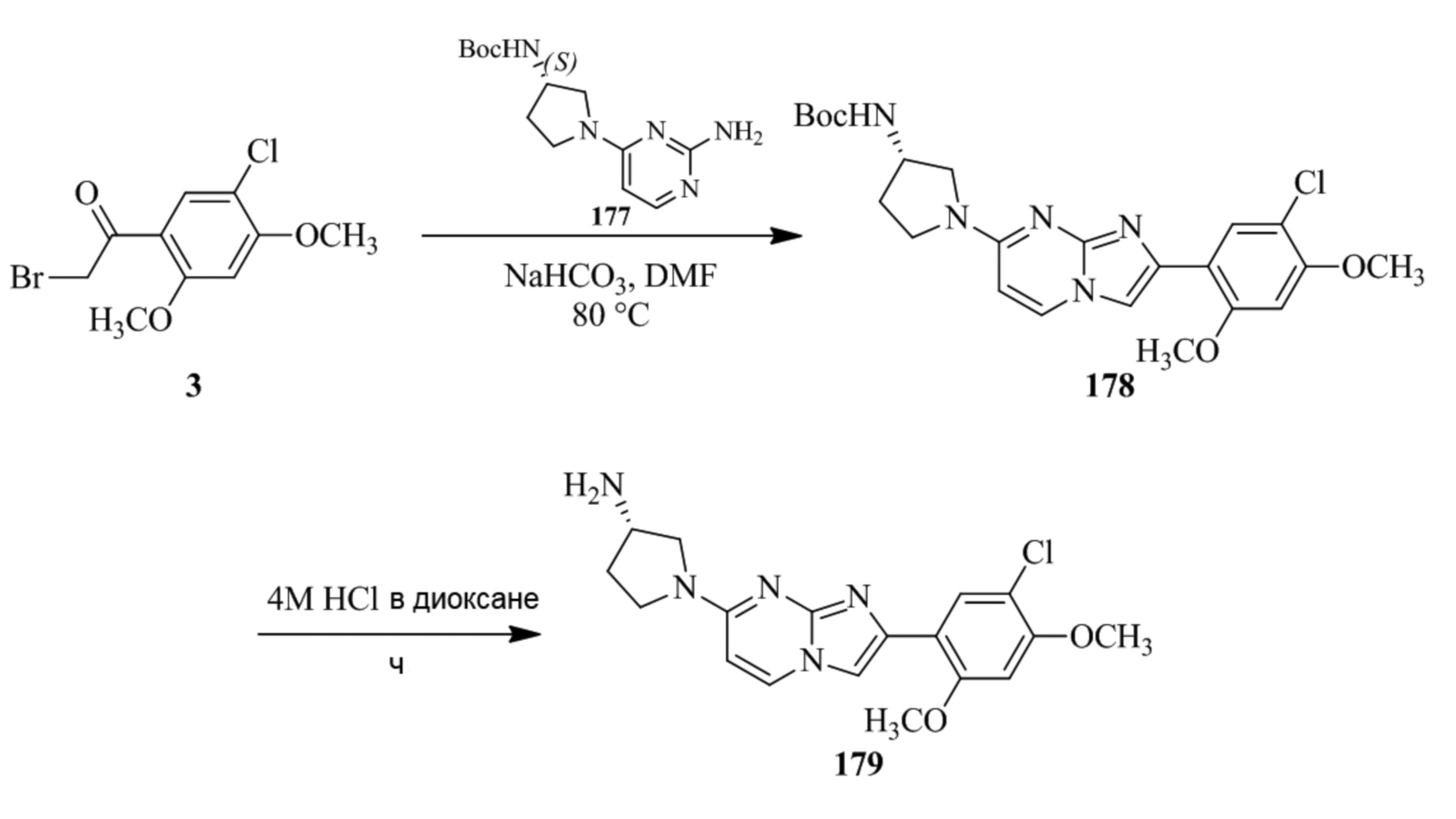
Получение ( S ) -трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиримидин-7-ил)пирролидин-3-ил)карбамата 178 (пример 56);
(S)-трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пирролидин-3-ил)карбамат 178 получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества желтого цвета (30 мг, 72%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,48 (д, J=7,6 Гц, 1H), 8,12 (с, 1H), 7,80 (с, 1H), 7,23 (ушир. с, 1H), 6,85 (с, 1H), 6,40 (д, J=7,6 Гц, 1H), 4,13 (ушир. с, 1H), 3,99 (с, 3H), 3,93 (с, 3H), 3,73-3,64 (м, 1H), 3,63-3,56 (м, 1H), 3,55-3,45 (м, 1H), 3,40-3,32 (м, 1H) 2,22-2,08 (м, 1H), 1,95-1,84 (м, 1H), 1,40 (с, 9H). ВЭЖХ (способ 3) 94,5% (AUC), tR=17,99 мин; ESI MS m/z 474 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пирролидин-3-амина гидрохлорида 179 (пример 58);
(S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пирролидин-3-амина гидрохлорид 179 получали аналогичным образом, как 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этанамин 5f, и получали в виде твердого вещества грязно-белого цвета (50 мг, 54%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,83 (ушир. с, 1H), 8,71 (д, J=7,56 Гц, 1H), 8,69-8,55 (м, 3H), 8,13 (с, 1H), 8,01 (с, 1H), 6,98-6,92 (м, 2H), 4,04 (с, 3H), 4,01 (с, 3H), 3,92-3,81 (м, 3H), 3,79-3,66 (м, 2H), 2,46-2,31 (м, 1H), 2,29-2,16 (м, 1H) ВЭЖХ (способ 3) 96,2% (AUC), tR=15,13 мин; ESI MS m/z 374 [M+H]+.
Схема 55
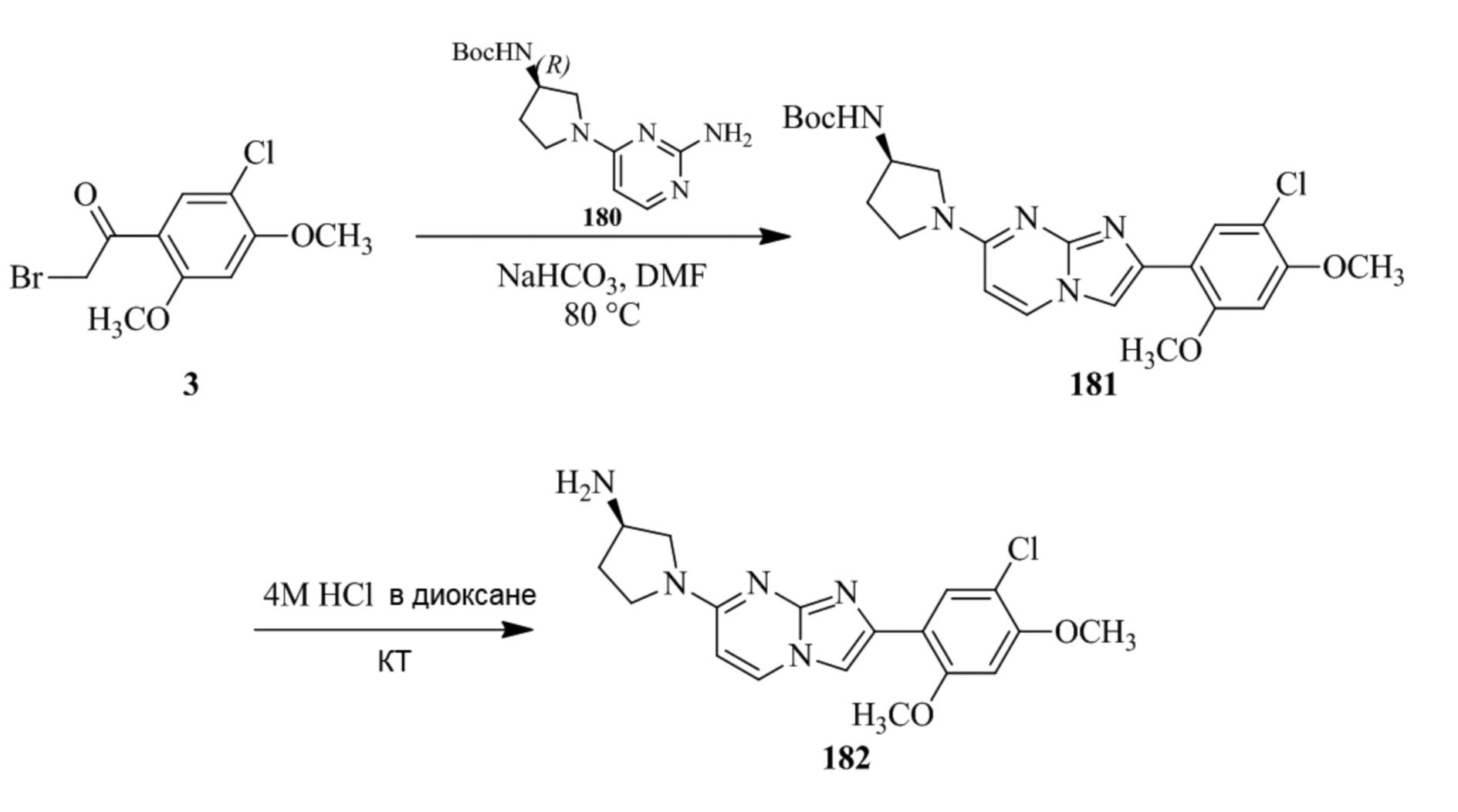
Получение (( R ) -трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиримидин-7-ил)пирролидин-3-ил)карбамата 181 (пример 57);
(R)-трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пирролидин-3-ил)карбамат 181 получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества желтого цвета (20 мг, 80%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,48 (д, J=7,4 Гц, 1H), 8,12 (с, 1H), 7,80 (с, 1H), 7,23 (ушир. с, 1H), 6,85 (с, 1H), 6,40 (д, J=7,4 Гц, 1H), 4,13 (ушир. с, 1H), 3,99 (с, 3H), 3,93 (с, 3H), 3,73-3,56 (м, 2H), 3,55-3,32 (м, 2H), 2,22-2,08 (м, 1H), 1,95-1,84 (м, 1H), 1,40 (с, 9H); ESI MS m/z 474 [M+H]+.
( R )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиримидин-7-ил)пирролидин-3-амина гидрохлорид 182 (пример 55);
(R)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пирролидин-3-амина гидрохлорид 182 получали аналогичным образом, как 2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этанамин 5f, и получали в виде твердого вещества желтого цвета (50 мг, 90%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,85 (ушир. с, 1H), 8,83-8,64 (м, 4H), 8,13 (с, 1H), 8,01 (с, 1H), 6,96 (с, 1H), 6,94 (с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 3,80-3,66 (м, 2H), 2,46-2,18 (м, 2H); ВЭЖХ (способ 3) 98,8% (AUC), tR=15,13 мин; ESI MS m/z 374 [M+H]+.
Схема 56
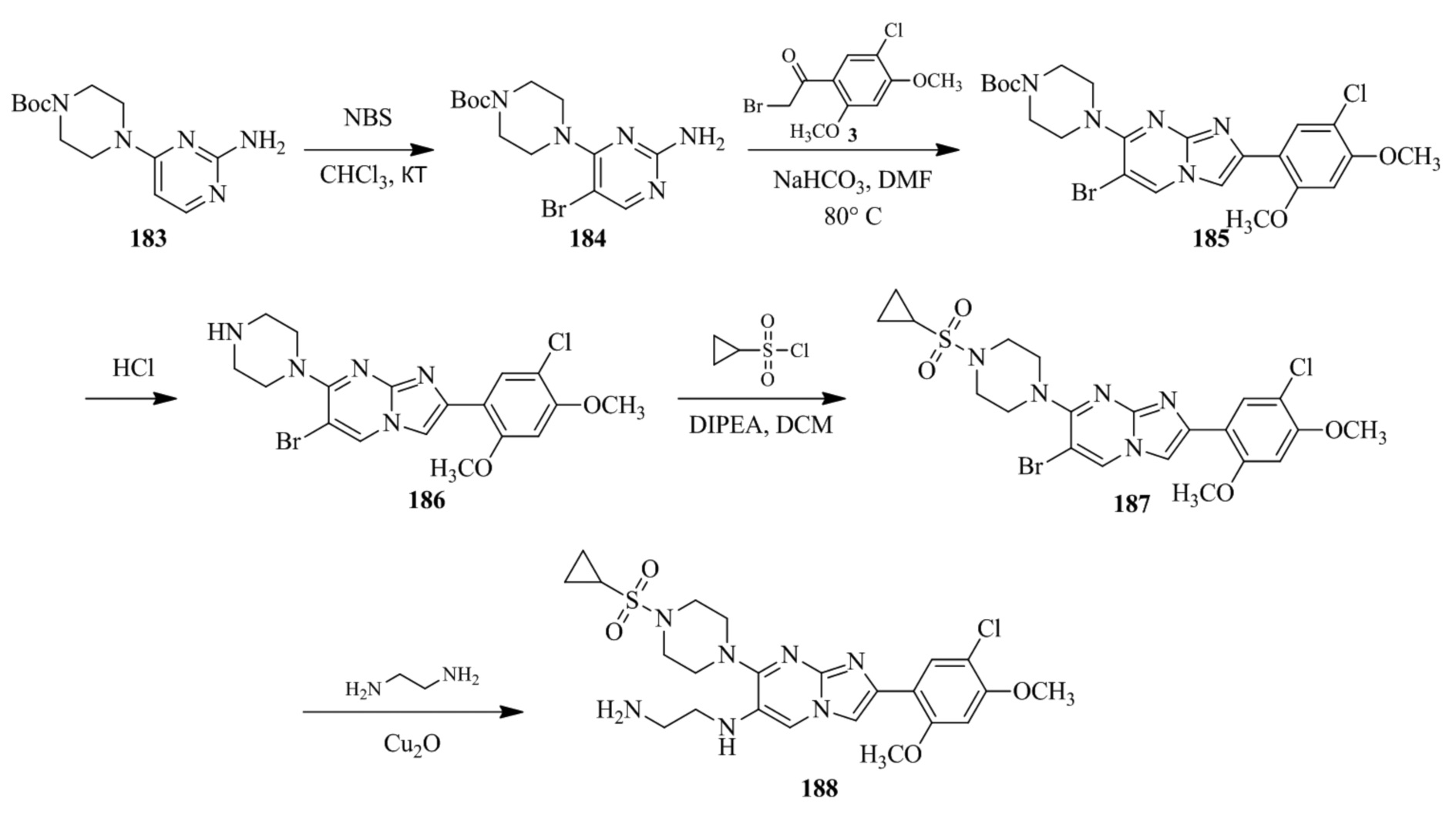
Получение трет -бутил-4-(2-амино-5-бромпиримидин-4-ил)пиперазин-1-карбоксилата 184;
В раствор трет-бутил-4-(2-аминопиримидин-4-ил)пиперазин-1-карбоксилата 3 (2,00 г, 7,20 ммоль) в хлороформе (60 мл) добавляли N-бромсукцинимид (1,28 г, 7,20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь гасили 10% раствором тиосульфата натрия (100 мл) и экстрагировали хлороформом (100 мл). Органический слой концентрировали при пониженном давлении и очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить желаемое соединение трет-бутил-4-(2-амино-5-бром-пиримидин-4-ил)пиперазин-1-карбоксилат 184 (1,60 г, 62%) в виде твердого вещества бледно-желтого цвета.
Получение трет -бутил-4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиримидин-7-ил)пиперазин-1-карбоксилата 185;
В раствор трет-бутил-4-(2-амино-5-бромпиримидин-4-ил)пиперазин-1-карбоксилата 184 (1,50 г, 4,20 ммоль) в DMF (30 мл) добавляли 2-бром-1-(5-хлор-2,4-диметоксифенил)этанон 3 (1,23 г, 4,20 ммоль), после чего следовал бикарбонат натрия (1,06 г, 12,60 ммоль). Реакционную смесь нагревали до 80°C в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры, гасили водой (25 мл) и осадок собирали посредством фильтрования, сушили при пониженном давлении. Твердое вещество очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить трет-бутил-4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилат 185 (1,60 г, 69%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,51 (с, 1H), 8,37 (с, 1H), 7,79 (с, 1H), 6,56 (с, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,63-3,57 (м, 4H), 3,55-3,49 (м, 4H), 1,49 (с, 9H). ВЭЖХ (способ 1) 98,1% (AUC), tR=11,75 мин; ESI MS m/z 537 [M+H]+.
Получение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2- a ]пиримидина 186 (пример 220);
Раствор трет-бутил-4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиримидин-7-ил)пиперазин-1-карбоксилата 185 (100 мг, 0,18 ммоль) в 4,0 M HCl в диоксане (2 мл) перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь фильтровали, промывали диоксаном и сушили при пониженном давлении для того, чтобы получить HCl соль трет-бутил-4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилата 7 (60 мг, 73%) в виде твердого вещества желтого цвета. Соединение суспендировали в 10 мл водного аммиака, перемешивали в течение 1 ч при комнатной температуре и экстрагировали хлороформом (2×20 мл). Органический слой сушили и концентрировали для того, чтобы получить 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиримидин 186 в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 9,08 (с, 1H), 8,20 (с, 1H), 7,95 (с, 1H), 6,88 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,37-3,33 (м, 4H), 2,91-2,86 (м, 4H). ВЭЖХ (способ 1) 98,9% (AUC), tR=9,01 мин; ESI MS m/z 454 [M+H]+.
Получение 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиримидина 187;
В раствор 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиримидина 7 (700 мг, 1,50 ммоль) и диизопропилэтиламина (450 мг, 4,50 ммоль) в дихлорметане (15 мл) загружали циклопропансульфонилхлорид (240 мг, 1,70 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали, суспендировали в водном аммиаке и перемешивали в течение 2 ч. Осадок собирали посредством фильтрования, промывали водой, сушили и очищали посредством колоночной хроматографии (силикагель, MeOH/DCM) для того, чтобы получить 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиримидин 187 (500 мг, 58%) в виде твердого вещества бледно-желтого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,50 (с, 1H), 8,40 (с, 1H), 7,81 (с, 1H), 6,56 (с, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,72-3,66 (м, 4H), 3,52-3,46 (м, 4H), 2,33-2,25 (м, 1H), 1,24-1,15 (м, 2H), 1,05-0,98 (м, 2H). ВЭЖХ (способ 1) 98,1% (AUC), tR=10,98 мин; ESI MS m/z 556 [M+H]+.
Получение N1-(2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиримидин-6-ил)этан-1,2-диамина 188 (пример 222);
В раствор 6-бром-2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиримидина 187 (100 мг, 0,20 ммоль) в этилендиамине (1 мл) добвляли оксид меди (I) (10 мг), и нагревали его при 100°C в течение 2 ч. После 2 ч реакционную смесь концентрировали и очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить N1-(2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиримидин-6-ил)этан-1,2-диамин 188 (10 мг, 10%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,54 (с, 1H), 7,60 (с, 1H), 6,58 (с, 1H), 5,51 (ушир. с, 1H), 5,33 (с, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,86-3,80 (м, 4H), 3,40-3,30 (м, 6H), 3,17-3,14 (м, 2H), 2,28-2,19 (м, 1H), 1,21-1,14 (м, 2H), 1,01-0,94 (м, 2H). ВЭЖХ (способ 1) 97,4% (AUC), tR=9,66 мин; ESI MS m/z 536 [M+H]+.
Схема 57
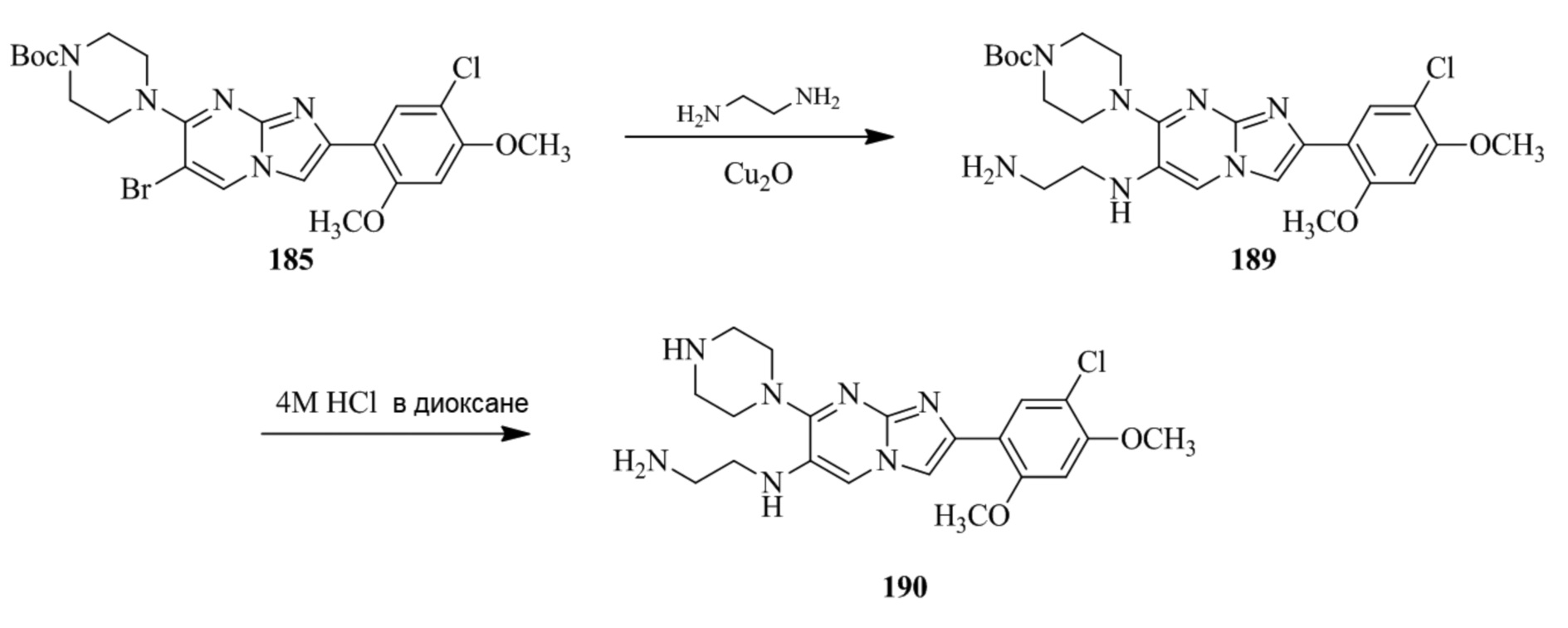
Получение трет -бутил-4-(6-((2-аминоэтил)амино)-2-(5-хлор-2,4-диметокси-фенил)имидазо[1,2- a ]пиримидин-7-ил)пиперазин-1-карбоксилата 189 (пример 221);
В раствор трет-бутил-4-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилата 6 (400 мг, 0,70 ммоль) в этилендиамине (4 мл) добавляли оксид меди (40 мг), и нагревали его при 100°C в течение 2 ч. После 2 ч реакционную смесь концентрировали и очищали посредством хроматографии CombiFlash (силикагель, 9:1 DCM/метанол) для того, чтобы получить трет-бутил-4-(6-((2-аминоэтил)амино)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилат 189 (40 мг, 10%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,53 (с, 1H), 7,61 (с, 1H), 6,55 (с, 1H), 5,31 (с, 1H), 4,00 (с, 3H), 3,94 (с, 3H), 3,78-3,61 (м, 4H), 3,56-3,47 (м, 4H), 3,37-3,29 (м, 2H), 3,17-3,11 (м, 2H), 1,49 (с, 9H); ВЭЖХ (способ 1) 95,2% (AUC), tR=10,11 мин; ESI MS m/z 532 [M+H]+.
Получение N1-(2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2- a ]пиримидин-6-ил)этан-1,2-диамина 190 (пример 223);
Cмесь трет-бутил-4-(6-((2-аминоэтил)амино)-2-(5-хлор-2,4-диметокси-фенил)имидазо[1,2-a]пиримидин-7-ил)пиперазин-1-карбоксилата 189 (20 мг, 0,03 ммоль) и 4,0 M HCl в диоксане (2 мл) перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь фильтровали, промывали диоксаном и сушили при пониженном давлении для того, чтобы получить HCl соль желаемого соединения 190 (15 мг, 93%) в виде твердого вещества желтого цвета. Твердое вещество суспендировали в 10 мл водного аммиака, перемешивали в течение 1 ч при комнатной температуре и экстрагировали хлороформом (2×20 мл). Органический слой сушили и концентрировали для того, чтобы получить N1-(2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиримидин-6-ил)этан-1,2-диамин 190 в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,16 (с, 1H), 7,99 (с, 1H), 6,84 (с, 1H), 5,54 (с, 1H), 4,01 (с, 3H), 3,92 (с, 3H), 3,53-3,50 (м, 4H), 2,83-2,72 (м, 6H); ВЭЖХ (способ 1) 95,0% (AUC), tR=8,47 мин; ESI MS m/z 432 [M+H]+.
Схема 58
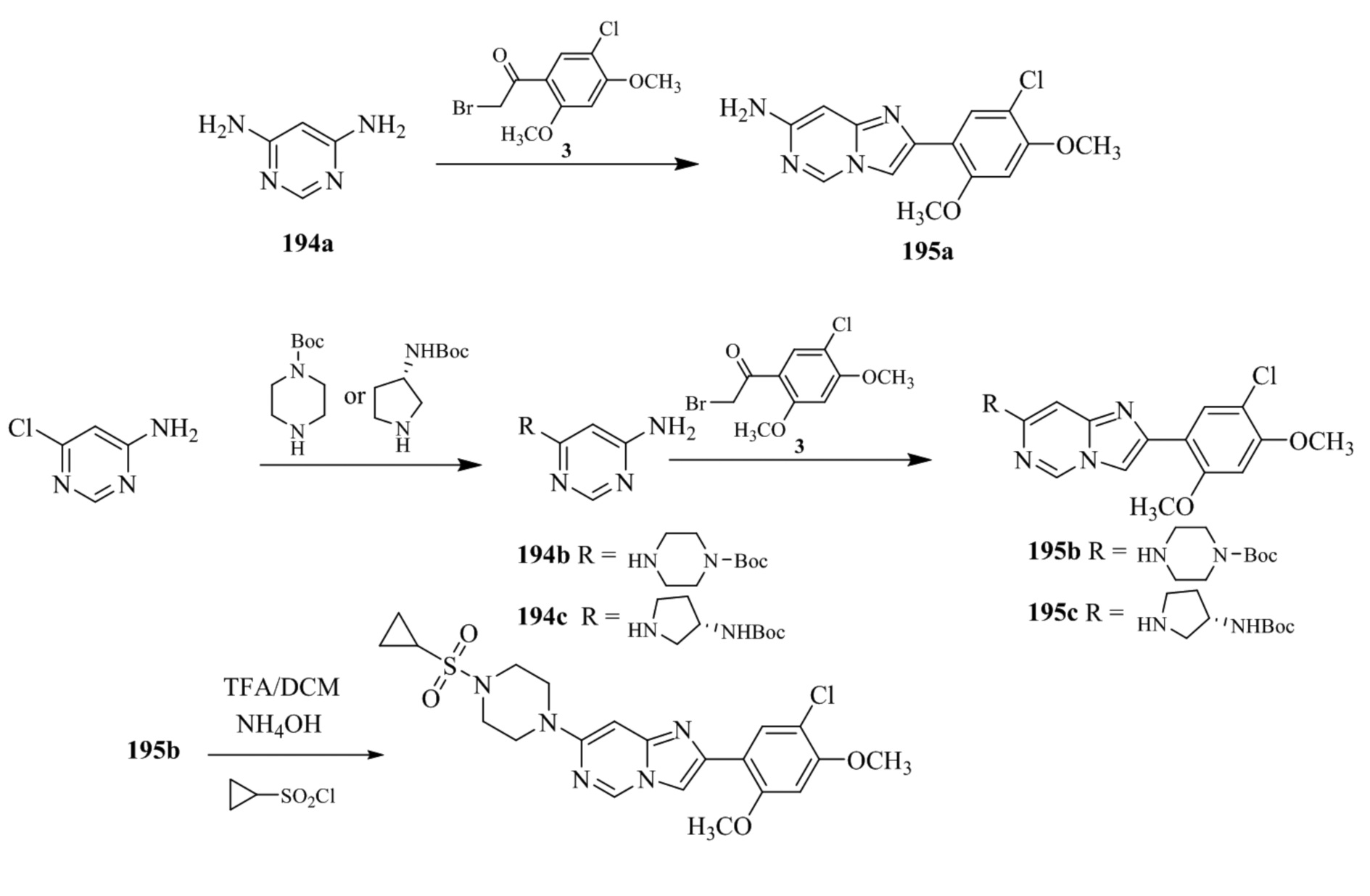
Получение 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- c ]пиримидин-7-амина 195a (пример 51);
Соединение 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-c]пиримидин-7-амина 195 получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(пирролидин-1-ил)имидазо[1,2-a]пиридин 5a. Твердое вещество ощелачивали водным аммиаком, промывали водой, собирали посредством фильтрования и сушили. Продукт получали в виде твердого вещества белого цвета (52 мг, 18%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,96 (с, 1H), 8,14 (с, 1H), 7,99 (с, 1H), 6,87 (с, 1H), 6,15 (м, 2H), 4,01 (с, 3H), 3,94 (с, 3H); ВЭЖХ (способ 3) 95,12% (AUC), tR=16,24 мин; ESI MS m/z 305 [M+H]+.
Получение трет -бутил-4-(6-аминопиримидин-4-ил)пиперазин-1-карбоксилата 194b;
Cмесь 6-хлорпиримидин-4-амина (680 мг, 5,25 ммоль), трет-бутилпиперазин-1-карбоксилата (1,17 г, 6,30 ммоль) и DIPEA (2,6 мл, 16 ммоль) в н-бутаноле (5 мл) нагревали при 140°C в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и очищали посредством колоночной хроматографии (силикагель, 10:1:0,1 DCM/метанол/гидроксид аммония) для того, чтобы получить трет-бутил-4-(6-аминопиримидин-4-ил)пиперазин-1-карбоксилат 194b (0,81 г, 55%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,00 (с, 1H), 5,73 (с, 1H), 3,60-3,53 (м, 4H), 3,53-3,46 (м, 4H), 1,47 (с, 9H); ESI MS m/z 280 [M+H]+.
Получение ( S )- трет -бутил(1-(6-аминопиримидин-4-ил)пирролидин-3-ил)карбамата 194c;
Соединение (S)-трет-бутил(1-(6-аминопиримидин-4-ил)пирролидин-3-ил) карбамат 194c получали аналогичным образом, как трет-бутил-4-(6-аминопиримидин-4-ил)пиперазин-1-карбоксилат 194b, и получали в виде твердого вещества светло-коричневого цвета (выход 78%).
1H ЯМР (400 МГц, CD3OD): δ 7,92 (с, 1H), 5,45 (с, 1H), 4,23-4,13 (м, 1H), 3,71-3,59 (м, 1H), 3,57-3,39 (м, 2H), 3,28-3,19 (м, 1H), 2,27-2,16 (м, 1H), 1,99-1,88 (м, 1H),1,44 (с, 9H); ESI MS m/z 280 [M+H]+.
Получение трет -бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- c ]пиримидин-7-ил)пиперазин-1-карбоксилата 195b;
Соединение трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-c]пиримидин-7-ил)пиперазин-1-карбоксилат 195b получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества грязно-белого цвета (51%).
1H ЯМР (400 МГц, CDCl3): δ8,68 (с, 1H), 8,36 (с, 1H), 7,90 (с, 1H), 6,58 (с, 1H), 6,49 (с, 1H), 4,01 (с, 3H), 3,96 (с, 3H), 3,60-3,55 (м, 4H), 3,52-3,45 (м, 4H), 1,49 (с, 9H); ВЭЖХ (способ 1) 96,80% (AUC), tR=11,66 мин; ESI MS m/z 474 [M+H]+.
Получение ( S )- трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- c ]пиримидин-7-ил)пирролидин-3-ил)карбамата 195c (пример 387);
Соединение (S)-трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-c]пиримидин-7-ил)пирролидин-3-ил)карбамат 195c получали аналогичным образом, как трет-бутил(2-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)этил)карбамат 5e, и получали в виде твердого вещества желто-зеленого цвета (72%).
1H ЯМР (400 МГц, CDCl3): δ 8,64 (с, 1H), 8,37 (с, 1H), 7,86 (с, 1H), 6,57 (с, 1H), 6,21 (с, 1H), 4,71 (ушир. с, 1H), 4,37 (ушир. с, 1H), 4,01 (с, 3H), 3,95 (с, 3H), 3,78-3,72 (м, 1H), 3,60-3,47 (м, 2H), 3,40-3,33 (м, 2H), 2,36-2,26 (м, 1H), 2,03-1,94 (м, 1H), 1,46 (с, 9H). ВЭЖХ (способ 1) 94,3% (AUC), tR=11,43 мин; ESI MS m/z 474 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2- c ]пиримидина (пример 390);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопропилсульфонил)пиперазин-1-ил)имидазо[1,2-c]пиримидин получали аналогичным образом, как (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-((1-(циклопропилсульфонил)пиперидин-4-ил)метил)пирролидин-3-амин 240r, из трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-c]пиримидин-7-ил)пиперазин-1-карбоксилата 195b и получали в виде твердого вещества желто-зеленого цвета (выход 70% на 2 стадии).
1H ЯМР (400 МГц, CDCl3): δ 8,69 (с, 1H), 8,36 (с, 1H), 7,93 (с, 1H), 6,58 (с, 1H), 6,52 (с, 1H), 4,01 (с, 3H), 3,96 (с, 3H), 3,63 (т, J=4,8, 10,2 Гц, 4H), 3,45 (т, J=5,2, 10 Гц, 4H), 2,32-2,24 (м, 1H), 1,24-1,18 (м, 2H), 1,04-0,97 (м, 2H). ВЭЖХ (способ 1) 98,9% (AUC), tR=10,99 мин; ESI MS m/z 478 [M+H]+.
Схема 59
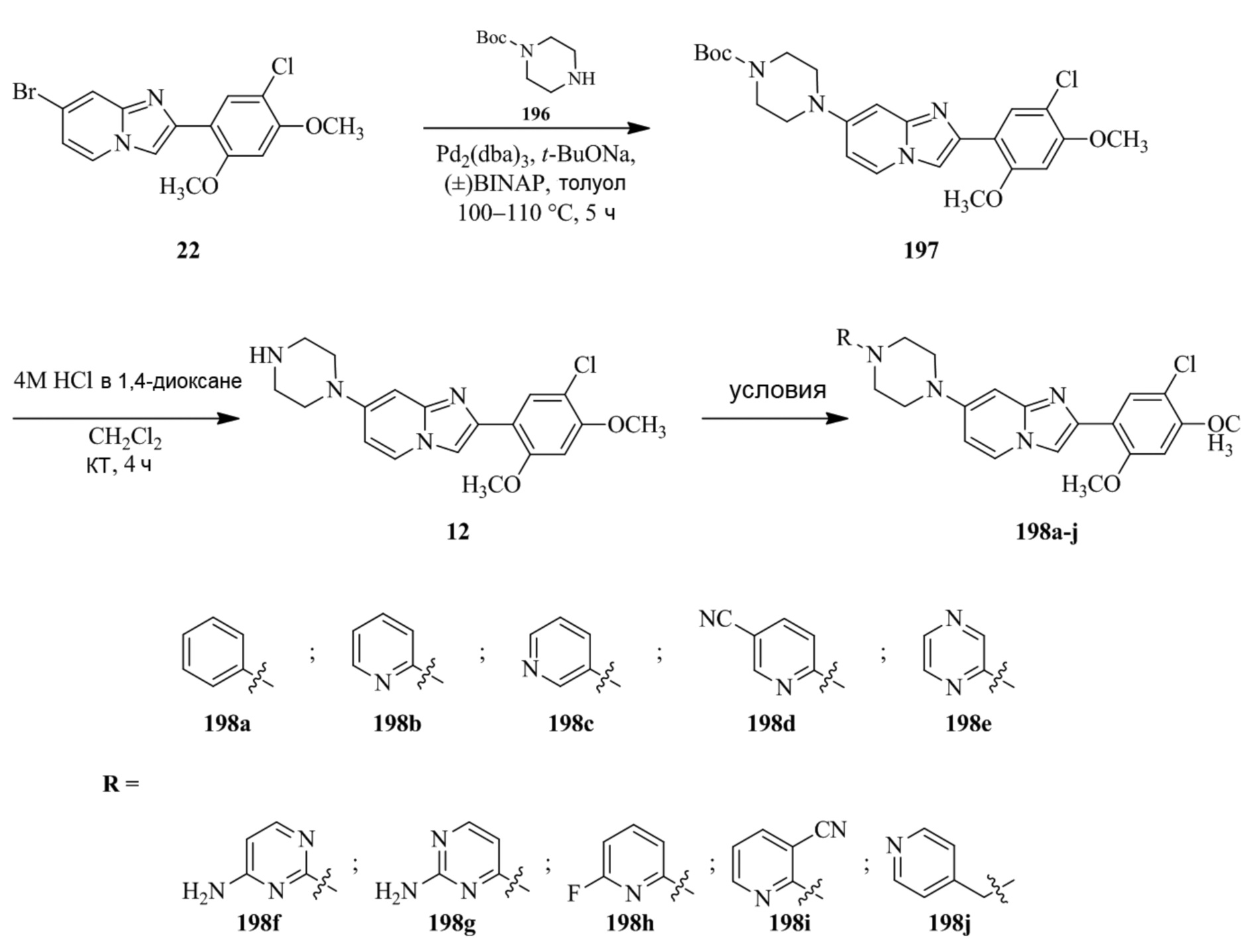
Получение трет -бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-карбоксилата 197;
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 22 (5,00 г, 13,6 ммоль), трет-бутилпиперазин-1-акарбоксилат 196 (3,80 г, 20,4 ммоль), (±) BINAP (850 мг, 1,37 ммоль) и t-BuONa (4,00 г, 41,6 ммоль) в толуоле (100 мл) дегазировали аргоном в течение 15 мин. Затем в эту смесь загружали Pd2(dba)3 (650 мг, 0,71 ммоль) и снова дегазировали аргоном в течение еще 5 мин. Получаемую реакционную смесь перемешивали при 100-110°C в течение 5 ч в запаянной пробирке. Реакционную смесь охлаждали, фильтровали через подушку целита и выпаривали досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 197 (5,40 г, 84%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 7,91 (д, J=7,5 Гц, 1H), 7,87 (с, 1H), 6,85 (с, 1H), 6,58 (с, 1H), 6,56 (дд, J=2,2, 7,5 Гц, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 3,61-3,58 (м, 4H), 3,22-3,20 (м, 4H), 1,49 (с, 9H); ESI+APCI MS m/z 473 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2- a ]пиридина 12;
В раствор трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилата 7 (5,40 г, 11,4 ммоль) в CH2Cl2 (125 мл) загружали 4,0 M HCl в 1,4-диоксане (25 мл) и перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали и полученное твердое вещество промывали в CH2Cl2. Затем твердое вещество суспендировали в воде (55 мл), ощелачивали насыщенным раствором бикарбоната натрия (55 мл), перемешивали в течение 1 ч при комнатной температуре и фильтровали для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12 (4,0 г, 93%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,28 (д, J=7,2 Гц, 1H), 8,17 (с, 1H), 8,00 (с, 1H), 6,86 (с, 1H), 6,78 (д, J=7,0 Гц, 1H), 6,62 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,12 (ушир. с, 4H), 2,83 (ушир. с, 4H); ESI+APCI MS m/z 373 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-фенилпиперазин-1-ил)имидазо[1,2- a ]пиридина 198a (пример 282);
Раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (200 мг, 0,54 ммоль), фенилбороновой кислоты (132 мг, 1,08 ммоль) и пиридина (0,10 мл, 1,2 ммоль) в CH2Cl2 (10 мл) дегазировали кислородом в течение 15 мин. Затем в эту смесь загружали Cu(OAc)2 (98 мг, 0,54 ммоль) и снова дегазировали кислородом в течение еще 5 мин. Получаемую реакционную смесь перемешивали при комнатной температуре в течение 24 ч и выпаривали досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-фенилпиперазин-1-ил)имидазо[1,2-a]пиридин 198a (25 мг, 10%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,29 (с, 1H), 7,95 (д, J=7,3 Гц, 1H), 7,82 (с, 1H), 7,31 (т, J=7,5 Гц, 2H), 7,04 (с, 1H), 6,98 (д, J=8,0 Гц, 2H), 6,92 (т, J=7,2 Гц, 1H), 6,67 (д, J=6,6 Гц, 1H), 6,56 (с, 1H), 4,01 (с, 3H), 3,95 (с, 3H), 3,45-3,41 (м, 4H), 3,36-3,33 (м, 4H); ВЭЖХ (способ 6) 92,0% (AUC), tR=13,88 мин.; ESI+APCI MS m/z 449 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-2-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 198b (пример 276);
В суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (200 мг, 0,54 ммоль) и карбоната цезия (350 мг, 1,07 ммоль) в DMF (5 мл) загружали 2-фторпиридин (80 мг, 0,82 ммоль) и получаемую реакционную смесь перемешивали при 150-160°C в течение 24 ч в запаянной пробирке. Затем реакционную смесь охлаждали и выпаривали досуха. Остаток распределялся между этилацетатом и водой, и слои разделяли. Органический слой промывали водой и солевым раствором; сушили над сульфатом натрия, фильтровали и концентрировали. Полученное неочищенное вещество очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 198b (12 мг, 5%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,5 Гц, 1H), 8,18 (с, 1H), 8,15 (дд, J=1,4, 4,8 Гц, 1H), 8,03 (с, 1H), 7,59-7,54 (м, 1H), 6,91 (д, J=8,6 Гц, 1H), 6,88-6,85 (м, 2H), 6,72 (д, J=2,0 Гц, 1H), 6,69-6,65 (м, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,67-3,63 (м, 4H), 3,36-3,32 (м, 4H); ESI+APCI MS m/z 450 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-3-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 198c (пример 296);
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (100 мг, 0,27 ммоль), 3-бромпиридина (64 мг, 0,41 ммоль), (±)BINAP (17 мг, 0,027 ммоль) и t-BuONa (78 мг, 0,81 ммоль) в DME (2 мл) дегазировали аргоном в течение 15 мин. Впоследствии в смесь загружали Pd2(dba)3 (13 мг, 0,014 ммоль), и снова дегазировали ее аргоном в течение еще 5 мин. Получаемую реакционную смесь перемешивали при 100-110°C в течение 5 ч в запаянной пробирке. Реакционную смесь охлаждали, фильтровали через подушку целита и выпаривали досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-3-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 198c (60 мг, 50%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,38 (д, J=2,8 Гц, 1H), 8,35 (д, J=7,5 Гц, 1H), 8,18 (с, 1H), 8,04-8,03 (м, 2H), 7,41 (дд, J=1,7, 8,4 Гц, 1H), 7,26-7,23 (м, 1H), 6,89 (д, J=2,2 Гц, 1H), 6,87 (с, 1H), 6,74 (д, J=1,8 Гц, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,40-3,36 (м, 8H); ВЭЖХ (способ 6) 95,2% (AUC), tR=11,65 мин.; ESI+APCI MS m/z 450 [M+H]+.
Получение 6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)никотинонитрила 198d (пример 293);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (150 мг, 0,40 ммоль) и N,N-диизопропилэтиламина (0,2 мл, 1,2 ммоль) в DMF (3 мл) загружали 6-хлорникотинонитрил (111 мг, 0,80 ммоль). Реакционную смесь перемешивали при 110-120°C в течение 16 ч в запаянной пробирке. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)никотинонитрил 198d (35 мг, 18%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,52 (д, J=2,0 Гц, 1H), 8,34 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,88 (дд, J=2,4, 9,2 Гц, 1H), 7,01 (д, J=9,2 Гц, 1H), 6,87 (с, 1H), 6,85 (д, J=2,4 Гц, 1H), 6,71 (д, J=1,6 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,84 (т, J=5,0 Гц, 4H), 3,35 (т, J=5,2 Гц, 4H); ВЭЖХ (способ 6) 96,3% (AUC), tR=13,70 мин.; ESI+APCI MS m/z 475 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиразин-2-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 198e (пример 285);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиразин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 198e получали аналогичным образом, как 6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)никотинонитрил 198d, и получали в виде твердого вещества грязно-белого цвета (выход 21%) с использованием 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (100 мг, 0,27 ммоль), 2-хлорпиразина (62 мг, 0,54 ммоль) и N,N-диизопропилэтиламина (0,2 мл, 1,2 ммоль) в DMF (2 мл).
1H ЯМР (400 МГц, DMSO-d6): δ 8,40 (д, J=1,2 Гц, 1H), 8,34 (д, J=7,5 Гц, 1H), 8,18 (с, 1H), 8,13-8,11 (м, 1H), 8,04 (с, 1H), 7,87 (д, J=2,6 Гц, 1H), 6,89-6,86 (м, 2H), 6,73 (д, J=1,9 Гц, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,76-3,73 (м, 4H), 3,39-3,35 (м, 4H); ВЭЖХ (способ 6) 95,9% (AUC), tR=13,00 мин.; ESI+APCI MS m/z 451 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-амина 198f (пример 286);
Соединение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-амин 198f получали аналогичным образом, как 6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)никотинонитрил 198d, и получали в виде твердого вещества грязно-белого цвета (выход 24%) с использованием 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (100 мг, 0,27 ммоль), 2-хлорпиримидин-4-амина (70 мг, 0,54 ммоль) и N,N-диизопропилэтиламина (0,2 мл, 1,2 ммоль) в DMF (2 мл).
1H ЯМР (400 МГц, DMSO-d6): δ 8,39 (д, J=7,6 Гц, 1H), 8,11 (с, 1H), 8,09 (с, 1H), 7,78 (д, J=5,6 Гц, 1H), 6,98 (д, J=7,3 Гц, 1H), 6,90 (с, 1H), 6,71 (с, 1H), 6,55 (ушир. с, 2H), 5,79 (д, J=5,7 Гц, 1H), 4,02 (с, 3H), 3,95 (с, 3H), 3,82-3,79 (м, 4H), 3,36-3,32 (м, 4H); ВЭЖХ (способ 6) 96,5% (AUC), tR=11,82 мин.; ESI+APCI MS m/z 466 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-амина 198g (пример 279);
Соединение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-амин 198g получали аналогичным образом, как 6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)никотинонитрил 198d, и получали в виде твердого вещества грязно-белого цвета (выход 20%), используя 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12 (100 мг, 0,27 ммоль), 4-хлорпиримидин-2-амин (70 мг, 0,54 ммоль) и N,N-диизопропилэтиламин (0,2 мл, 1,2 ммоль) в DMF (2 мл).
1H ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=10,0 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,80 (д, J=8,0 Гц, 1H), 6,87-6,83 (м, 2H), 6,72 (с, 1H), 6,12-6,07 (м, 3H), 4,01 (с, 3H), 3,94 (с, 3H), 3,70 (ушир. с, 4H), 3,31 (ушир. с, 4H); ВЭЖХ (способ 6) 96,9% (AUC), tR=11,75 мин.; ESI+APCI MS m/z 466 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-фторпиридин-2-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 198h (пример 281);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-фторпиридин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 198h получали аналогичным образом, как 6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)никотинонитрил 198d, и получали в виде твердого вещества грязно-белого цвета (выход 51%), используя 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12 (100 мг, 0,27 ммоль), 2,6-дифторпиридин (62 мг, 0,54 ммоль) и N,N-диизопропилэтиламин (0,2 мл, 1,2 ммоль) в DMF (2 мл).
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,5 Гц, 1H), 8,18 (с, 1H), 8,04 (с, 1H), 7,70 (к, J=8,2 Гц, 1H), 6,87 (с, 1H), 6,85 (д, J=2,3 Гц, 1H), 6,77 (дд, J=2,5, 8,2 Гц, 1H), 6,72 (д, 1,8 Гц, 1H), 6,31 (дд, J=2,7, 7,7 Гц, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,68-3,64 (м, 4H), 3,36-3,33 (м, 4H); ВЭЖХ (способ 1) 95,7% (AUC), tR=14,19 мин.; ESI+APCI MS m/z 468 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)никотинонитрила 198i (пример 283);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (100 мг, 0,27 ммоль) и N-метилморфолина (0,2 мл, 1,8 ммоль) в DMSO (2 мл) загружали 2-хлорникотинонитрил (75 мг, 0,54 ммоль). Реакционную смесь перемешивали при 110-120°C в течение 16 ч в запаянной пробирке. Реакционную смесь охлаждали и суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)никотинонитрил 9i (45 мг, 35%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,45 (дд, J=1,8, 4,7 Гц, 1H), 8,34 (д, J=7,5 Гц, 1H), 8,18 (с, 1H), 8,11 (дд, J=5,7, 7,6 Гц, 1H), 8,03 (с, 1H), 6,99-6,94 (м, 1H), 6,87 (с, 1H), 6,85 (д, J=2,3 Гц, 1H), 6,72 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,82-3,78 (м, 4H), 3,43-3,39 (м, 4H); ВЭЖХ (способ 6) 94,0% (AUC), tR=13,78 мин.; ESI+APCI MS m/z 475 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-4-илметил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 198j (пример 292);
В раствор соединения 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 12 (100 мг, 0,27 ммоль) и 4-пиридинкарбоксальдегида (86 мг, 0,80 ммоль) в CH2Cl2 добавляли уксусную кислоту (0,1 мл) и получаемую смесь перемешивали в течение 1 ч. Добавляли цианоборогидрид натрия (84 мг, 1,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении, остаток ощелачивали водным раствором бикарбоната натрия и неочищенный материал очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-4-илметил)пиперазин-1-ил)имидазо[1,2-a]пиридин 198j (25 мг, 20%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,53 (д, J=1,2 Гц, 2H), 8,31 (д, J=7,2 Гц, 1H), 8,16 (с, 1H), 8,01 (с, 1H), 7,34 (дд, J=6,0, 19,6 Гц, 2H), 6,86 (с, 1H), 6,80 (дд, J=2,4, 7,6 Гц, 1H), 6,65 (д, J=2,0 Гц, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,58 (с, 2H), 3,25 (т, J=4,8 Гц, 4H), 2,54 (т, J=4,4 Гц, 4H); ВЭЖХ (способ 6) 96,2% (AUC), tR=11,05 мин.; ESI+APCI MS m/z 464 [M+H]+.
Схема 60
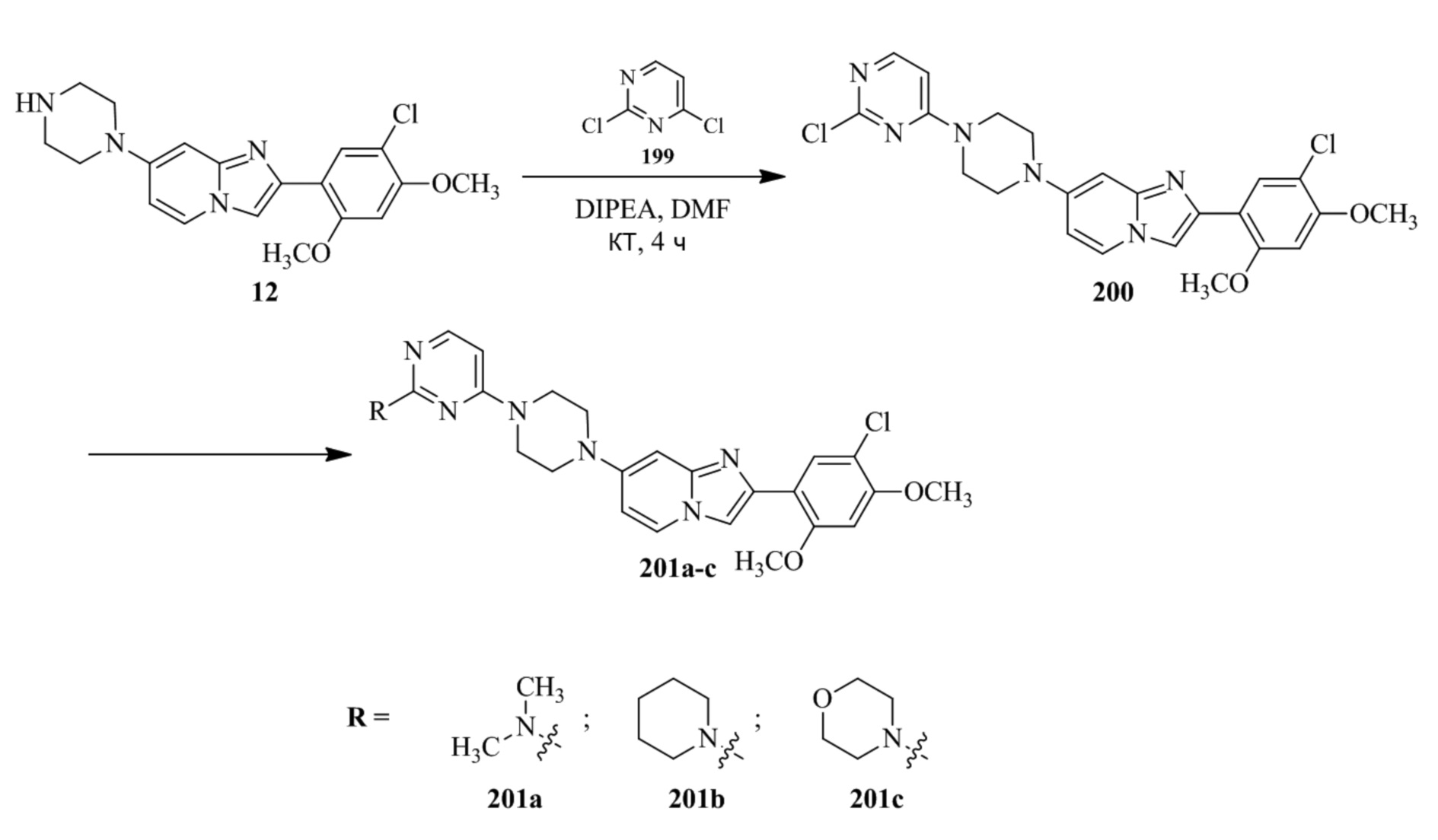
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 200;
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 12 (1,00 г, 2,68 ммоль) и N,N-диизопропилэтиламина (0,7 мл, 4,02 ммоль) в DMF (10 мл) загружали 2,4-дихлорпиримидин 199 (400 мг, 2,69 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч в атмосфере азота. Реакционную смесь разводили в MTBE и перемешивали в течение 1 ч. Осадок фильтровали, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 200 (600 мг, 46%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,5 Гц, 1H), 8,20 (с, 1H), 8,10 (д, J=6,1 Гц, 1H), 8,04 (с, 1H), 6,89 (д, J=6,2 Гц, 1H), 6,87 (с, 1H), 6,83 (дд, J=2,2, 7,6 Гц, 1H), 6,72 (д, J=1,6 Гц, 1H), 4,02 (с, 3H), 3,94 (с, 3H), 3,79 (ушир. с, 4H), 3,36-3,33 (м, 4H); ESI+APCI MS m/z 485 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)- N,N- диметилпиримидин-2-амина 201a (пример 297);
Раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 200 (50 мг, 0,10 ммоль) в 2,0 M N,N-диметиламине в THF (2,0 мл) перемешивали при 60-70°C в запаянной пробирке в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли водой. Смесь перемешивали при комнатной температуре в течение 30 мин и осадок собирали посредством фильтрования. Твердое вещество дополнительно очищали посредством разрушения из DMF с водой для того, чтобы получить 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N,N-диметилпиримидин-2-амин 201a (13 мг, 25%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=10,0 Гц, 1H), 8,18 (с, 1H), 8,03 (с, 1H), 7,90 (д, J=7,7 Гц, 1H), 6,88-6,84 (м, 2H), 6,71 (с, 1H), 6,12 (д, J=7,8 Гц, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,72 (ушир. с, 4H), 3,31 (ушир. с, 4H), 3,06 (с, 6H); ВЭЖХ (способ 6) >99% (AUC), tR=12,05 мин.; ESI+APCI MS m/z 494 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперидин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 201b (пример 295);
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 200 (50 мг, 0,10 ммоль) в пиперидине (0,5 мл) подвергали обработке микроволнами при 100°C в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и перемешивали в течение 30 мин. Осадок собирали посредством фильтрования для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперидин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 201b (30 мг, 54%) в виде твердого вещества грязно-белого цвета после сушки при пониженном давлении.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,90 (д, J=5,9 Гц, 1H), 6,87 (с, 1H), 6,85 (дд, J=2,2, 7,6 Гц, 1H), 6,71 (с, 1H), 6,10 (д, J=5,9 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,70-3,66 (м, 8H), 3,31 (ушир. с, 4H), 1,61-1,55 (м, 2H), 1,49-1,46 (м, 4H); ВЭЖХ (способ 7) 91,4% (AUC), tR=12,54 мин.; ESI+APCI MS m/z 534 [M+H]+.
Получение 4-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)морфолина 201c (пример 294);
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 200 (50 мг, 0,10 ммоль) в морфолине (0,5 мл) подвергали обработке микроволнами при 100°C в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и перемешивали в течение 30 мин. Осадок собирали посредством фильтрования, промывали водой и сушили при пониженном давлении для того, чтобы получить 4-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)морфолин 201c (45 мг, 81%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,18 (с, 1H), 8,03 (с, 1H), 7,93 (д, J=5,9 Гц, 1H), 6,87 (с, 1H), 6,84 (дд, J=2,2, 7,6 Гц, 1H), 6,71 (д, J=1,8 Гц, 1H), 6,20 (д, J=6,0 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,72 (ушир. с, 4H), 3,63 (с, 8H), 3,31 (ушир. с, 4H); ВЭЖХ (способ 7) 93,5% (AUC), tR=11,93 мин.; ESI+APCI MS m/z 536 [M+H]+.
Схема 61
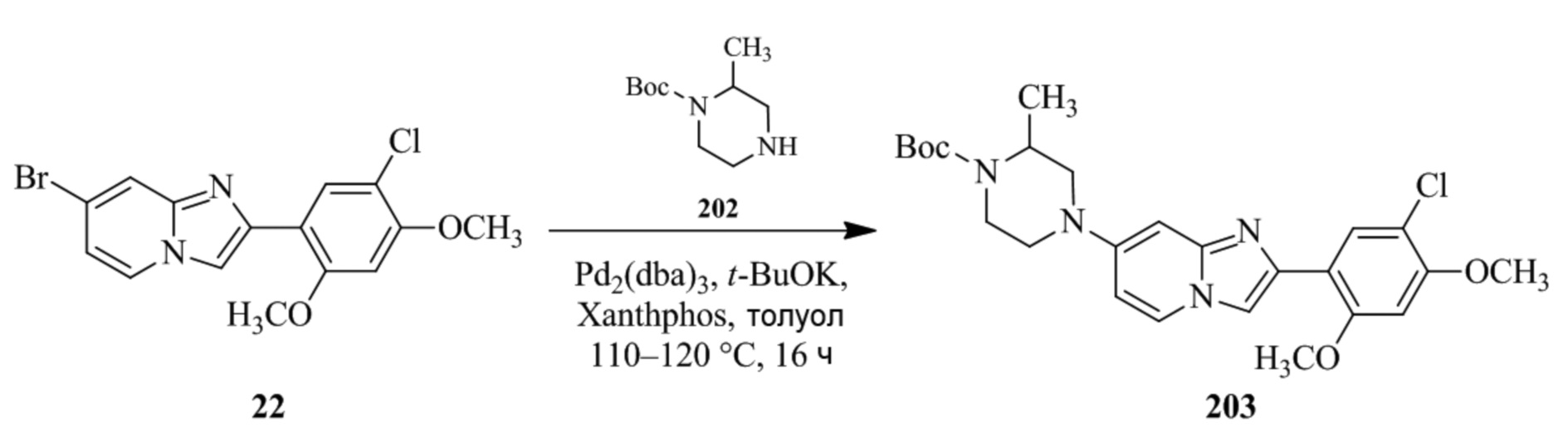
Получение трет -бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-2-метилпиперазин-1-карбоксилата 203 (пример 275);
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 22 (200 мг, 0,544 ммоль), трет-бутил-2-метилпиперазин-1-карбоксилата 202 (218 мг, 1,09 ммоль), Xanthphos (34 мг, 0,059 ммоль) и t-BuOK (181 мг, 1,62 ммоль) в толуоле (10 мл) дегазировали аргоном в течение 15 мин. Впоследствии в смесь загружали Pd2(dba)3 (24 мг, 0,026 ммоль) и снова дегазировали аргоном в течение еще 5 мин. Получаемую реакционную смесь нагревали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали, фильтровали через подушку целита и выпаривали досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-2-метилпиперазин-1-карбоксилат 203 (90 мг, 34%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,32 (д, J=7,6 Гц, 1H), 8,16 (с, 1H), 8,02 (с, 1H), 6,86 (с, 1H), 6,78 (дд, J=2,4, 7,6 Гц, 1H), 6,66 (д, J=1,6 Гц, 1H), 4. 22-4,20 (м, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3. 83-3,79 (м, 1H), 3,70-3. 60 (м, 2H), 3,22-3,16 (м, 1H), 2,97-2,91 (м, 1H), 2,76-2,70 (м, 1H), 1,42 (с, 9H), 1,18 (д, J=6,4 Гц, 3H); ВЭЖХ (способ 6) 97,0% (AUC), tR=14,23 мин.; ESI+APCI MS m/z 487 [M+H]+.
Схема 62
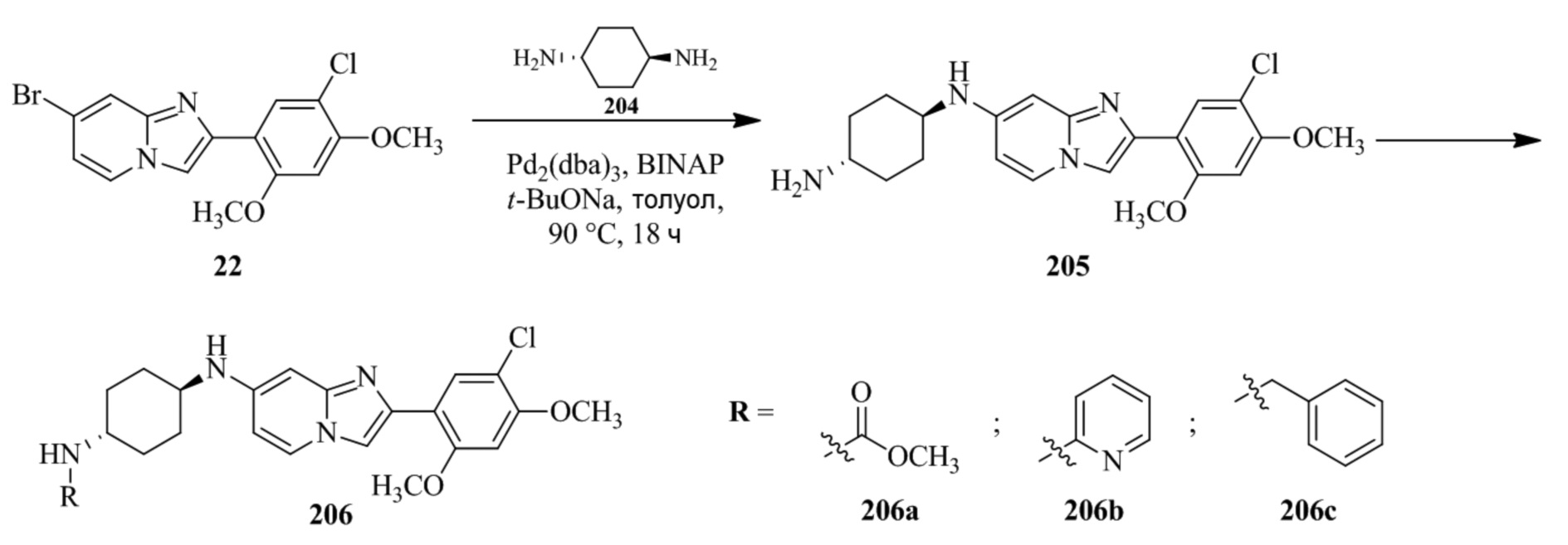
Получение транс - N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-циклогексан-1,4-диамина 205;
Поднимали смесь 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 22 (1,00 г, 2,73 ммоль), транс-циклогексан-1,4-диамина 204 (311 мг, 2,73 ммоль), Pd2(dba)3 (125 мг, 0,13 ммоль), BINAP (170 мг, 0,27 ммоль) и трет-бутоксида натрия (786 мг, 8,19 ммоль) в толуоле (20 мл) и дегазировали ее аргоном. Реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли с использованием CH2Cl2 (30 мл) и фильтровали через подушку целита. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью хроматографии на силикагеле (CH3OH/CH2Cl2) для того, чтобы получить транс-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 205 (500 мг, 46%) в виде твердого вещества зеленого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,14 (с, 1H), 8,10 (д, J=7,6 Гц, 1H), 7,86 (с, 1H), 6,84 (с, 1H), 6,33 (дд, J=2,0, 7,2 Гц, 1H), 6,19 (с, 1H), 5,97 (д, J=7,6 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,15-3,12 (м, 1H), 2,58-2,55 (м, 1H), 2,01-1,99 (м, 2H), 1,81-1,79 (м, 2H), 1,23-1,16 (м, 4H); ESI+APCI MS m/z 401 [M+H]+.
Получение (метил-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)- транс- циклогексил)карбамата 206a (пример 277);
Cмесь N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(пиридин-2-ил)-транс-циклогексан-1,4-диамина 205 (250 мг, 0,62 ммоль), триэтиламина (260 мкл, 1,86 ммоль) и метилхлорформиата (71 мкл, 0,93 ммоль) в CH2Cl2 (20 мл) перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь гасили водой и экстрагировали с использованием CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении; остаток очищали с помощью CombiFlash Companion (силикагель, 10:1 CH3OH/CH2Cl2) для того, чтобы получить (метил(4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-транс-амино)циклогексил)карбамат 206a (100 мг, 35%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,11 (д, J=7,2 Гц, 1H), 7,87 (с, 1H), 7,10 (д, J=6,8 Гц, 1H), 6,84 (с, 1H), 6,35 (дд, J=2,4, 7,6 Гц, 1H), 6,21 (с, 1H), 6,02 (д, J=7,2 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,51 (с, 3H), 3,18-3,16 (м, 1H), 2,04 (д, J=11,2 Гц, 2H), 1,85 (д, J=10,0 Гц, 2H), 1,39-1,30 (м, 2H), 1,25-1,16 (м, 2H); ВЭЖХ (способ 8) >99% (AUC), tR=13,19 мин.; ESI+APCI MS m/z 459 [M+H]+.
Получение N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(пиридин-2-ил)- транс -циклогексан-1,4-диамина 206b (пример 287);
Cмесь N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(пиридин-2-ил)-транс-циклогексан-1,4-диамина 205 (100 мг, 0,25 ммоль), 2-бромпиридина (44 мг, 0,28 ммоль), Pd2(dba)3 (11 мг, 0,013 ммоль), BINAP (15 мг, 0,025 ммоль) и трет-бутоксида натрия (72 мг, 0,75 ммоль) поднимали в толуоле (5,0 мл) и дегазировали аргоном. Реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли с использованием CH2Cl2 (10 мл) и фильтровали через подушку целита. Фильтрат концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)-N4-(пиридин-2-ил)-транс-циклогексан-1,4-диамин 206b (13 мг, 9%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,20 (д, J=6,0 Гц, 1H), 8,04 (с, 1H), 7,98 (с, 1H), 7,94 (д, J=5,2 Гц, 1H), 7,34-7,30 (м, 1H), 6,89 (с, 1H), 6,53 (ушир. с, 1H), 6,46-6,40 (м, 2H), 6,37 (д, J=7,6 Гц, 1H), 6,30 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,77-3. 63 (м, 1H), 2,05 (т, J=10,8 Гц, 4H),1,38-1,26 (м, 4H); ВЭЖХ (способ 6) 93,4% (AUC), tR=11,91 мин.; ESI+APCI MS m/z 478 [M+H]+.
Получение N 1-бензил- N 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- транс -циклогексан-1,4-диамина 206c (пример 291);
Cмесь N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(пиридин-2-ил)-транс-циклогексан-1,4-диамина 205 (200 мг, 0,50 ммоль), триэтиламина (228 мкл, 1,63 ммоль), DMAP (10 мг, 0,081 ммоль) и бензилбромида (8 мкл, 0,7 ммоль) в CH2Cl2 (10 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разводили водой и экстрагировали с использованием CH2Cl2 (2×10 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-транс-циклогексан-1,4-диамин 206c (25 мг, 10%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,11 (д, J=7,6 Гц, 1H), 7,87 (с, 1H), 7,40-7,32 (м, 4H), 7,27 (д, J=7,2 Гц, 1H), 6,84 (с, 1H), 6,29 (дд, J=2,0, 7,2 Гц, 1H), 6,23 (с, 1H), 6,00 (д, J=7,6 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,86 (ушир. с, 1H), 3,22-3,20 (м, 1H), 2,04 (т, J=13,6 Гц, 4H), 1,37-1,29 (м, 2H), 1,20-1,11 (м, 2H); ВЭЖХ (способ 6) 93,1% (AUC), tR=12,18 мин.; ESI+APCI MS m/z 491 [M+H]+.
Схема 63
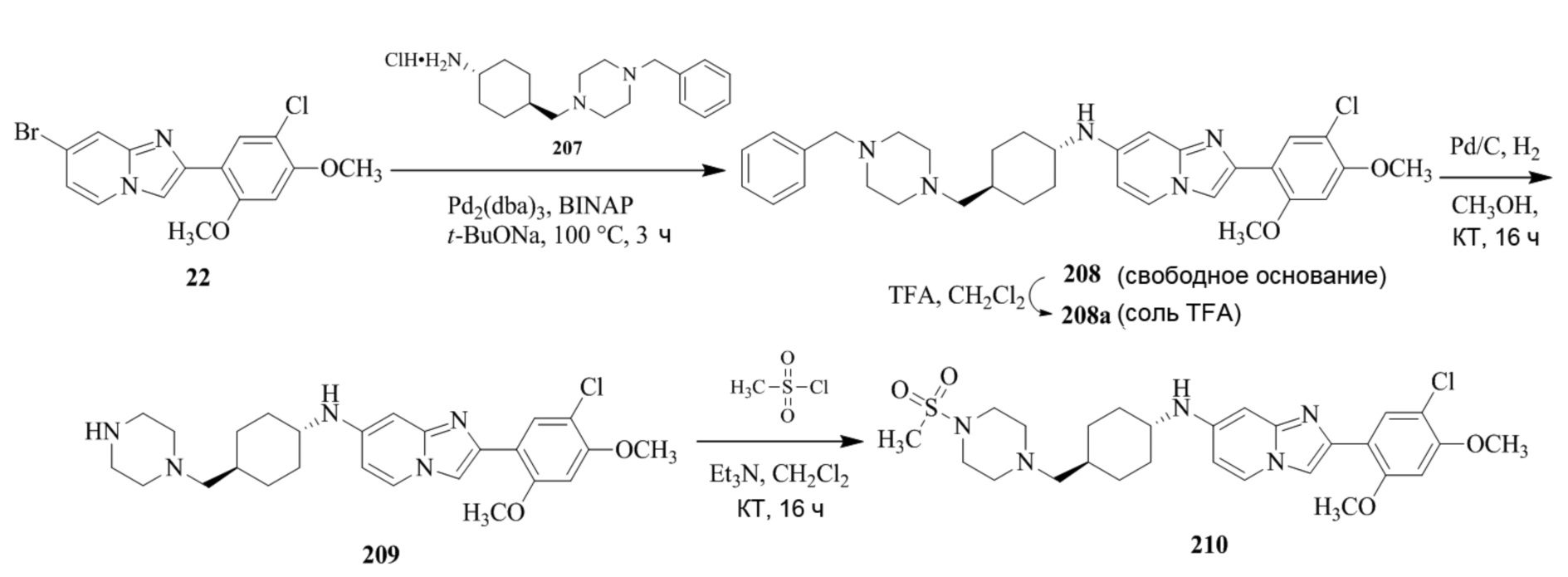
Получение ( транс-N- (4-((4-бензилпиперазин-1-ил)метил)циклогексил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-амина 208;
Cмесь 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 22 (100 мг, 0,27 ммоль), транс-4-((4-бензилпиперазин-1-ил)метил)циклогексанамина гидрохлорида 207 (94 мг, 0,29 ммоль), Pd2(dba)3 (12 мг, 0,013 ммоль), BINAP (15 мг, 0,024 ммоль) и трет-бутоксида натрия (100 мг, 1,04 ммоль) поднимали в толуоле (5 мл) и дегазировали аргоном. Реакционную смесь нагревали при 100°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли с использованием CH2Cl2 (20 мл) и фильтровали через подушку целита. Фильтрат концентрировали при пониженном давлении и остаток очищали с помощью хроматографии на силикагеле (CH3OH/CH2Cl2) для того, чтобы получить транс-N-(4-((4-бензилпиперазин-1-ил)метил)-циклогексил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амин 208 (50 мг, 32%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,10 (д, J=7,6 Гц, 1H), 7,86 (с, 1H), 7,33-7,21 (м, 5H), 6,84 (с, 1H), 6,34 (дд, J=2,0, 7,2 Гц, 1H), 6,18 (с, 1H), 5,99 (д, J=7,6 Гц, 1H), 3,98 (с, 3H), 3,92 (с, 3H), 3,44 (с, 2H), 3,17-3,14 (м, 1H), 2,35 (ушир. с, 7H), 2,09 (д, J=7,2 Гц, 2H), 2,04 (д, J=10,4 Гц, 2H), 1,80 (д, J=12,0 Гц, 2H), 1,52-1,45 (м, 1H), 1,18 -1,09 (м, 2H), 1,04-0,93 (м, 2H); ESI+APCI MS m/z 574 [M+H]+.
Получение транс-N- (4-((4-бензилпиперазин-1-ил)метил)циклогексил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-амин 2,2,2-трифторацетата 208a (пример 278);
Cмесь транс-N-(4-((4-бензилпиперазин-1-ил)метил)циклогексил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 208 (100 мг, 0,17 ммоль) и трифторуксусной кислоты (1,0 мл) в CH2Cl2 (20 мл) перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении, остаток растирали в порошок с пентаном для того, чтобы получить транс-N-(4-((4-бензилпиперазин-1-ил)метил)циклогексил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амин в виде TFA соли 208a (40 мг, 33%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, D2O): δ 7,84 (д, J=7,2 Гц, 1H), 7,58 (с, 1H), 7,52-7,47 (м, 5H), 7,33 (с, 1H), 6,55 (д, J=7,6 Гц, 1H), 6,44 (с, 1H), 6,20 (с, 1H), 4,33 (с, 2H), 3,91 (с, 3H), 3,79 (с, 3H), 3,52 (ушир. с, 8H), 3,29 (ушир. с, 1H), 3,11 (д, J=6,4 Гц, 2H), 2,12 (д, J=12,4 Гц, 2H), 1,87 (д, J=8,8 Гц, 2H), 1,31-1,20 (м, 4H); ВЭЖХ (способ 8) 97,5% (AUC), tR=10,08 мин.; ESI+APCI MS m/z 574 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)- транс-N- (4-(пиперазин-1-илметил)циклогексил)имидазо[1,2- a ]пиридин-7-амина 209;
Cмесь транс-N-(4-((4-бензилпиперазин-1-ил)метил)циклогексил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 208 (200 мг, 0,34 ммоль) и 10% Pd/C (50 мг) в CH3OH (25 мл) перемешивали при комнатной температуре в течение 16 ч в атмосфере водорода (1 атм.). Реакционную смесь фильтровали через подушку целита, катализатор промывали в CH3OH (2×20 мл) и фильтрат концентрировали при пониженном давлении для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-транс-N-(4-(пиперазин-1-илметил)циклогексил)имидазо[1,2-a]пиридин-7-амин 209 (100 мг, 60%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,10 (д, J=7,6 Гц, 1H), 7,86 (с, 1H), 6,84 (с, 1H), 6,34 (д, J=6,8 Гц, 1H), 6,18 (с, 1H), 6,01 (д, J=7,6 Гц, 1H), 3,98 (с, 3H), 3,92 (с, 3H), 3,22 (ушир. с, 1H), 3,16 (с, 2H), 2,67 (ушир. с, 3H), 2,23-2,16 (м, 4H), 2,07-2,03 (м, 4H), 1,81 (д, J=10,8 Гц, 2H), 1,49 (ушир. с, 1H), 1,31-1,09 (м, 2H), 1,04-0,96 (м, 2H); ESI+APCI MS m/z 483 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)- транс-N- (4-((4-(метилсульфонил)пиперазин-1-ил)метил)циклогексил)имидазо[1,2- a ]пиридин-7-амина 210 (пример 289);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-транс-N-(4-(пиперазин-1-илметил)циклогексил)имидазо[1,2-a]пиридин-7-амина 209 (200 мг, 0,41 ммоль), триэтиламина (125 мкл, 1,24 ммоль) и метансульфонилхлорида (38 мкл, 0,49 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь гасили водой и экстрагировали в CH2Cl2 (2×20 мл), и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-транс-N-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)циклогексил)имидазо[1,2-a]пиридин-7-амин 210 (45 мг, 20%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,12-8,10 (м, 2H), 7,87 (с, 1H), 6,84 (с, 1H), 6,35 (д, J=6,4 Гц, 1H), 6,19 (с, 1H), 6,01 (д, J=7,6 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,17 (ушир. с, 1H), 3,10 (ушир. с, 4H), 2,86 (с, 3H), 2,43 (ушир. с, 4H),2,16 (д, J=6,0 Гц, 2H), 2,05 (д, J=10,8 Гц, 2H), 1,82 (д, J=11,6 Гц, 2H), 1,51 (ушир. с, 1H), 1,23-1,11 (м, 2H), 1,07-0,98 (м, 2H); ВЭЖХ (способ 6) >99% (AUC), tR=11,73 мин.; ESI+APCI MS m/z 562 [M+H]+.
Схема 64
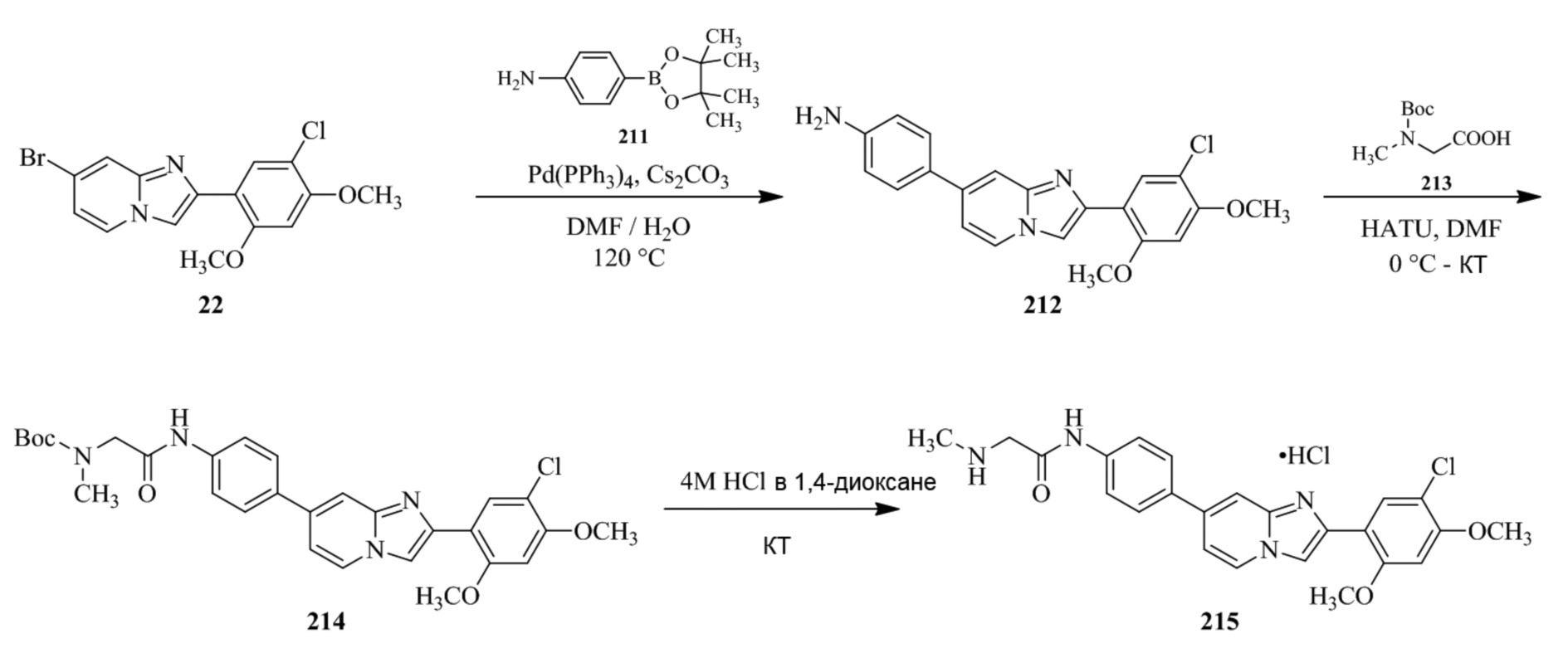
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)анилина 212;
Cмесь 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 22 (3,00 г, 8,16 ммоль), 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина 211 (2,12 г, 9,67 ммоль) и Cs2CO3 (6,60 г, 20,5 ммоль) в DMF/H2O (30 мл/3 мл) дегазировали аргоном и загружали в нее Pd(PPh3)4 (470 мг, 0,41 ммоль). Реакционную смесь нагревали при 120°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом и фильтровали через подушку целита. Фильтрат выливали в воду (20 мл), полученный таким образом осадок фильтровали, промывали водой и сушили при пониженном давлении для того, чтобы получить 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)анилин 212 (2,1 г, 67%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,42 (с, 1H), 8,08 (дд, J=0,4, 6,8 Гц, 1H), 8,03 (с, 1H), 7,77 (с, 1H), 7,48 (дд, J=1,2, 6,4 Гц, 2H), 7,01 (дд, J=1,6, 6,8 Гц, 1H), 6,77 (дд, J=2,0, 6,8 Гц, 2H), 6,58 (с, 1H), 4,01 (с, 3H), 3,95 (с, 3H).
Получение трет -бутил(2-((4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)фенил)амино)-2-оксоэтил)(метил)карбамата 214;
Cмесь 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)анилина 212 (500 мг, 1,31 ммоль), 2-((трет-бутоксикарбонил)(метил)амино)уксусной кислоты 213 (250 мг, 1,31 ммоль), HATU (800 мг, 2,10 ммоль) и DIPEA (0,75 мл, 4,31 ммоль) в DMF (5 мл) перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь гасили водой и полученное твердое вещество фильтровали, промывали водой и MTBE, сушили в вакууме для того, чтобы получить трет-бутил(2-((4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)фенил)амино)-2-оксоэтил)(метил)карбамат 214 (450 мг, 62%) в виде твердого вещества бледно-желтого цвета.
1H ЯМР (300 МГц, CDCl3): δ. 9,29-9,24 (м, 1H), 7,80-7,78 (м, 2H), 7,65 (с, 1H), 7,21-7,17 (м, 3H), 7,09 (д, J=8,1 Гц, 2H), 6,57 (д, J=7,2 Гц, 1H), 6,15 (с, 1H), 3,51 (ушир. с, 5H), 3,43 (с, 3H), 2,43 (с, 3H), 0,90 (ушир. с, 9H).
Получение N -(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)фенил)-2-(метиламино)ацетамида гидрохлорида 215 (пример 273);
В раствор трет-бутил(2-((4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)фенил)амино)-2-оксоэтил)(метил)карбамата 214 (100 мг, 0,18 ммоль) в диоксане (2 мл) добавляли 4,0 M HCl в диоксане (2 мл), реакционную смесь перемешивали при комнатной температуре в течение ночи. Осадок фильтровали, промывали в MTBE и сушили при пониженном давлении для того, чтобы получить N-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)фенил)-2-(метиламино)ацетамида гидрохлорид 215 (60 мг, 68%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 11,11 (с, 1H), 9,05 (д, J=4,8 Гц, 2H), 8,90 (д, J=7,2 Гц, 1H), 8,65 (с, 1H), 8,23 (с, 1H), 8,04 (с, 1H)), 7,85 (д, J=8,8 Гц, 2H), 7,82 (д, J=6,8 Гц, 2H), 7,01 (с, 1H), 4,10 (с, 3H), 4,01 (ушир. с, 5H), 2,65 (т, J=5,2 Гц); ВЭЖХ (способ 9) 95,8% (AUC), tR=11,44 мин.; ESI+APCI MS m/z 450 [M+H]+.
Схема 65
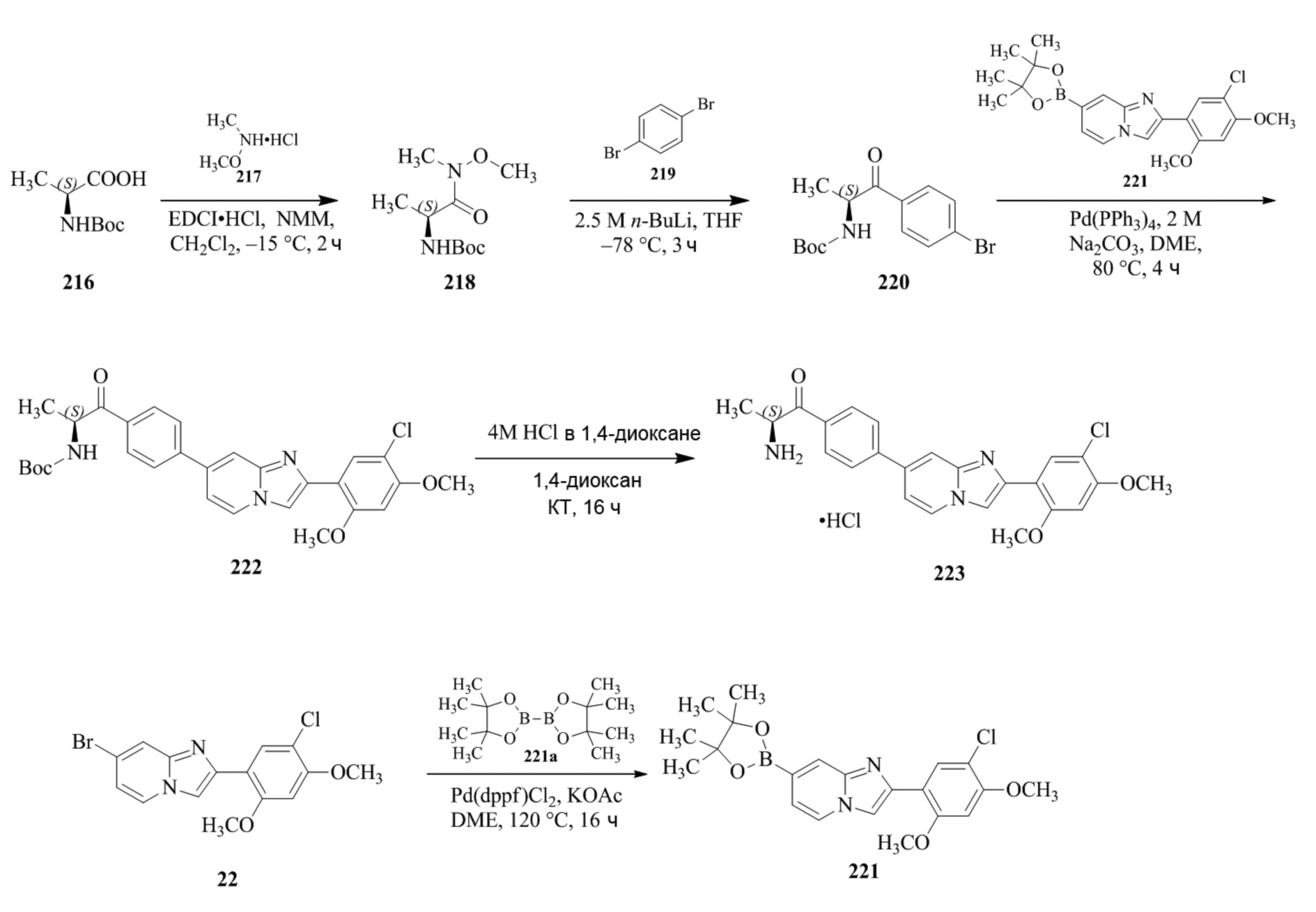
Получение ( S )- трет -бутил(1-(метокси(метил)амино)-1-оксопропан-2-ил)карбамата 218;
Раствор (S)-2-((трет-бутоксикарбонил)амино)пропановой кислоты 216 (5,00 г, 26,4 ммоль) в CH2Cl2 (50 мл) охлаждали до -15°C и добавляли в него N,O-диметилгидроксиламина гидрохлорид 217 (2,81 г, 28,8 ммоль), после чего следовал NMM (2,90 г, 28,6 ммоль) в атмосфере азота. Затем EDCI•HCl (5,56 г, 29,0 ммоль) добавляли в реакционную смесь частями, при этом поддерживая температуру на -15°C, и реакционную смесь перемешивали при той же температуре в течение 1 ч. Реакционную смесь разводили в CH2Cl2 (50 мл) и промывали водой (60 мл), и органический слой отделяли и промывали солевым раствором (50 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении для того, чтобы получить (S)-трет-бутил(1-(метокси(метил)амино)-1-оксопропан-2-ил)карбамат 218 (4,0 г, неочищенн.).
1H ЯМР (400 МГц, DMSO-d6): δ 7,01 (д, J=7,6 Гц, 1H), 4,41-4,36 (м, 1H), 3,71 (с, 3H), 3,09 (с, 3H), 1,36 (с, 9H), 1,14 (д, J=7,2 Гц, 3H).
Получение ( S )- трет -бутил(1-(4-бромфенил)-1-оксопропан-2-ил)карбамата 220;
Раствор 1,4-дибромбензола 219 (6,00 г, 25,4 ммоль) в сухом THF (40 мл) охлаждали до -78°C в атмосфере азота. В раствор медленно добавляли n-BuLi (2,5 М, 10,3 мл, 25,8 ммоль) и реакционную смесь перемешивали при той же температуре в течение 45 мин., причем в течение этого периода формировался осадок. В реакционную смесь медленно добавляли раствор (S)-трет-бутил(1-(метокси(метил)амино)-1-оксопропан-2-ил)карбамата 218 (1,50 г, 6,46 ммоль) в THF (20 мл), реакционную смесь перемешивали при той же температуре в течение еще 2 ч прежде, чем ее гасили насыщенным раствором NH4Cl (50 мл). Водный слой экстрагировали в EtOAc (100 мл), органический слой концентрировали и неочищенное вещество очищали с помощью CombiFlash Companion (силикагель, 10% EtOAc/гексаны) для того, чтобы получить (S)-трет-бутил(1-(4-бромфенил)-1-оксопропан-2-ил)карбамат 220 (320 мг, 15%).
1H ЯМР (400 МГц, DMSO-d6): δ 7,88 (д, J=8,4 Гц, 2H), 7,73 (д, J=8,4 Гц, 2H), 7,37 (д, J=7,2 Гц, 1H), 4,99-4,96 (м, 1H), 1,33 (с, 9H), 1,21 (д, J=6,8 Гц, 3H).
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2- a ]пиридина 221;
В раствор 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 5 (5,00 г, 13,6 ммоль) в DME (100 мл) добавляли 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) 221a (3,82 г, 15,0 ммоль), после чего следовал KOAc (4,01 г, 41,0 ммоль). Реакционную смесь дегазировали аргоном в течение 10 мин и затем добавляли Pd(dppf)Cl2 (516 мг, 0,70 ммоль) и реакционную смесь дегазировали в течение еще 10 минут. Реакционную колбу запаивали и перемешивали при 120°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли в CH2Cl2 (100 мл) и фильтровали через подушку целита. Фильтрат концентрировали при пониженном давлении для того, чтобы получить неочищенный продукт, который дополнительно растирали в порошок с гексаном (100 мл) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-a]пиридин 221 (4,0 г, 71%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,53 (д, J=6,6 Гц, 1H), 8,39 (с, 1H), 7,94 (с, 1H), 7,77 (с, 1H), 6,97 (д, J=6,9 Гц, 1H), 6,90 (с, 1H), 4,03 (с, 3H), 3,95 (с, 3H), 1,32 (с, 12H).
Получение ( S )- трет -бутил(1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил)фенил)-1-оксопропан-2-ил)карбамата 222;
В раствор (S)-трет-бутил(1-(4-бромфенил)-1-оксопропан-2-ил)карбамата 220 (237 мг, 0,72 ммоль) и 2-(5-хлор-2,4-диметоксифенил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-a]пиридина 221 (300 мг, 0,72 ммоль) в DME (10 мл) добавляли раствор Na2CO3 (2 М, 1,08 мл, 2,16 ммоль). Реакционную смесь дегазировали аргоном в течение 10 минут и затем добавляли Pd(PPh3)4 (42 мг, 0,036 ммоль). Реакционную смесь перемешивали при 80°C в течение 4 ч в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры и испаряли при пониженном давлении. Неочищенный материал очищали с помощью CombiFlash Companion (силикагель, 60% EtOAc/гексаны) для того, чтобы получить (S)-трет-бутил(1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)фенил)-1-оксопропан-2-ил)карбамат 222 (100 мг, 26%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,67 (д, J=7,2 Гц, 1H), 8,39 (с, 1H), 8,27 (с, 1H), 8,09-7,99 (м, 5H), 7,38-7,34 (м, 2H), 6,92 (с, 1H), 5,13-5,05 (м, 1H), 4,06 (с, 3H), 3,97 (с, 3H), 1,37 (с, 9H), 1,27 (д, J=6,8 Гц, 3H).
Получение ( S )-2-амино-1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил)фенил)пропан-1-она гидрохлорида 223 (пример 274);
Раствор (S)-трет-бутил(1-(4-(2-(5-хлор-2,4 диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)фенил)-1-оксопропан-2-ил)карбамата 222 (70 мг, 0,13 ммоль) в 1,4-диоксане (2 мл) медленно добавляли 4 M HCl в 1,4-диоксане (2 мл) при комнатной температуре в атмосфере азота. Реакционную смесь перемешивали в течение 16 ч и выпаривали. Получаемое твердое вещество растирали в порошок с MTBE (3 мл) для того, чтобы получить (S)-2-амино-1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)фенил)пропан-1-она гидрохлорид 223 (20 мг, 35%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,76 (д, J=7,2 Гц, 1H), 8,50 (с, 1H), 8,16 (д, J=8,4 Гц, 2H), 8,07 (с, 1H), 8,01 (д, J=8,4 Гц, 2H), 7,84 (с, 1H), 7,75 (дд, J=1,6, 7,2 Гц, 1H), 6,86 (с, 1H), 5,12-5,07 (м, 1H), 4,04 (с, 3H), 3,93 (с, 3H), 1,52 (д, J=7,6 Гц, 3H); ВЭЖХ (способ 6) 96,1% (AUC), tR=11,55 мин.; ESI+APCI MS m/z 435 [M+H]+.
Схема 66
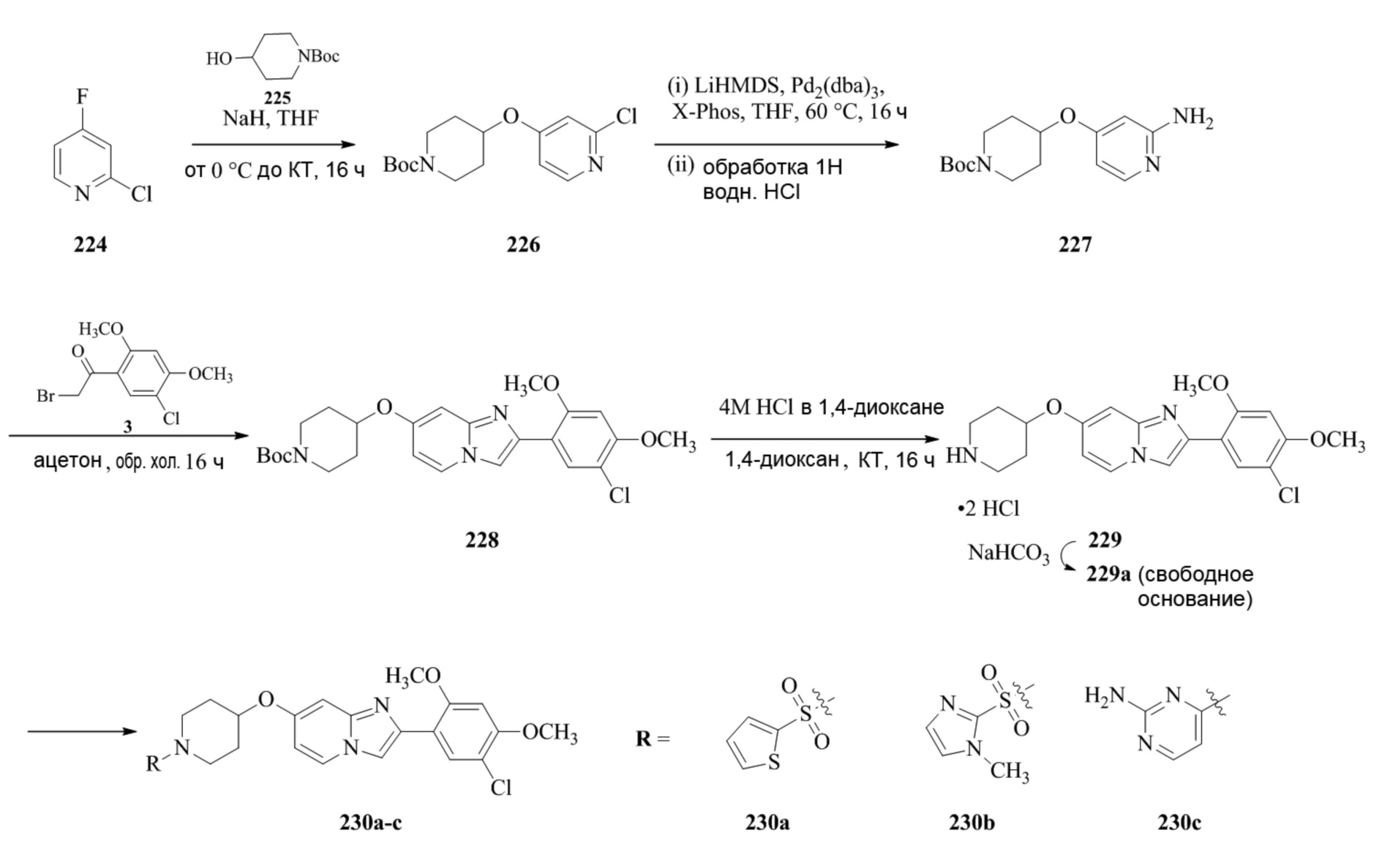
Получение трет -бутил-4-((2-хлорпиридин-4-ил)окси)пиперидин-1-карбоксилата 226;
В раствор трет-бутил-4-гидроксипиперидин-1-карбоксилата 225 (7,65 г, 38,0 ммоль) в THF (60 мл) загружали NaH (2,00 г, 50,0 ммоль) в атмосфере азота при 0°C и перемешивали в течение 1 ч. В вышеуказанную реакционную смесь по каплям добавляли раствор 2-хлор-4-фторпиридина 224 (5,50 г, 41,8 ммоль) в THF (20 мл) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. В реакционную смесь добавляли воду (70 мл) при 0°C и водный слой экстрагировали в EtOAc (2×70 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении для того, чтобы получить трет-бутил-4-((2-хлорпиридин-4-ил)окси)пиперидин-1-карбоксилат 226 (8,5 г, 72%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,18 (с, 1H), 6,82 (д, J=2,0 Гц, 1H), 6,74 (дд, J=2,0, 5,6 Гц, 1H), 4,58-4,53 (м, 1H), 3,71-3,65 (м, 2H), 3,40-3,34 (м, 2H), 1,98-1,91 (м, 2H), 1,80-1,75 (м, 2H), 1,47 (с, 9H); ESI+APCI MS m/z 313 [M+H]+.
Получение трет -бутил-4-((2-аминопиридин-4-ил)окси)пиперидин-1-карбоксилата 227;
Устойчивый поток аргона пропускали через смесь трет-бутил-4-((2-хлорпиридин-4-ил)окси)пиперидин-1-карбоксилата 226 (8,00 г, 25,6 ммоль), Pd2(dba)3 (470 мг, 0,51 ммоль) и XPhos (490 мг, 1,03 ммоль) в THF (100 мл). В получаемую дегазированную смесь медленно добавляли LiHMDS (1,0 М, 54 мл, 54 ммоль) при комнатной температуре. Реакционную смесь нагревали до 60°C в течение 16 ч. Реакционную смесь охлаждали до 0°C, разбавляли в 1 Н HCl (100 мл) и экстрагировали в EtOAc (2×90 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток растирали в порошок с н-пентаном для того, чтобы получить трет-бутил-4-((2-аминопиридин-4-ил)окси)-пиперидин-1-карбоксилат 227 (6,0 г, 80%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=5,6 Гц, 1H), 6,24 (дд, J=2,0, 6,0 Гц, 1H), 5,97 (д, J=2,0 Гц, 1H), 4,50-4,46 (м, 1H), 4,39 (ушир. с, 2H), 3,69-3,63 (м, 2H), 3,38-3,31 (м, 2H), 1,93-1,88 (м, 2H), 1,77-1,70 (м, 2H), 1,46 (с, 9H); ESI+APCI MS m/z 294 [M+H]+.
Получение трет -бутил-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)окси)пиперидин-1-карбоксилата 228;
Раствор 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 3 (6,00 г, 20,4 ммоль) и трет-бутил-4-((2-аминопиридин-4-ил)окси)пиперидин-1-карбоксилата 227 (6,20 г, 21,1 ммоль) в ацетоне (80 мл) нагревали с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры. Образованное твердое вещество фильтровали и промывали ацетоном и гексаном. Твердое вещество суспендировали в смеси насыщенного раствора NaHCO3 и CH2Cl2 и перемешивали в течение 1 ч. Органический слой отделяли, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении для того, чтобы получить трет-бутил-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)окси)пиперидин-1-карбоксилат 228 (8,5 г, 85%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,39 (д, J=7,6 Гц, 1H), 8,18 (с, 1H), 8,11 (с, 1H), 7,03 (д, J=2,0 Гц, 1H), 6,87 (с, 1H), 6,57 (дд, J=2,0, 7,2 Гц, 1H), 4,69-4,65 (м, 1H), 4,06 (с, 3H), 3,94 (с, 3H), 3,73-3,67 (м, 2H), 3,22-3,17 (м, 2H), 2,00-1,97 (м, 2H), 1,59-1,51 (м, 2H), 1,41 (с, 9H); ESI+APCI MS m/z 488 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(пиперидин-4-илокси)имидазо[1,2- a ]пиридина дигидрохлорида 229;
В раствор трет-бутил-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)окси)пиперидин-1-карбоксилата 228 (8,50 г, 17,4 ммоль) в диоксане (50 мл) загружали 4,0 M HCl в диоксане (20 мл), получаемую смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли при пониженном давлении, образованное твердое вещество фильтровали и промывали в CH2Cl2 и н-гексане и сушили при пониженном давлении для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(пиперидин-4-илокси)имидазо[1,2-a]пиридина дигидрохлорид 229 (7,6 г, 95%) в виде твердого вещества белого цвета. Соль нейтрализовали для синтеза 230c (соединение 229 суспендировали в насыщенном растворе NaHCO3 и CH2Cl2 и перемешивали в течение 1 ч при комнатной температуре. Органический слой отделяли и концентрировали при пониженном давлении для того, чтобы получить свободное основание 2-(5-хлор-2,4-диметоксифенил)-7-(пиперидин-4-илокси)имидазо[1,2-a]пиридин 229a в виде твердого вещества грязно-белого цвета).
1H ЯМР (400 МГц, CD3OD): δ 8,53 (д, J=7,2 Гц, 1H), 8,23 (с, 1H), 7,72 (с, 1H), 7,31 (д, J=2,4 Гц, 1H), 7,09 (дд, J=2,4, 7,6 Гц, 1H), 6,81 (с, 1H), 5,00-4,97 (м, 1H), 4,0 (с, 3H), 3,91 (с, 3H), 3,39-3,33 (м, 2H), 3,28-3,20 (м, 2H), 2,27-2,22 (м, 2H), 2,08-2,02 (м, 2H); ESI+APCI MS m/z 388 [M+H]+.
Получение 2 -(5-хлор-2,4-диметоксифенил)-7-((1-(тиофен-2-илсульфонил)пиперидин-4 -ил )окси)имидазо[1,2- a ]пиридина 230a (пример 280);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперидин-4-илокси)имидазо[1,2-a]пиридина дигидрохлорида 229 (200 мг, 0,434 ммоль) и триэтиламина (0,31 мл, 2,2 ммоль) в CH2Cl2 (10 мл) добавляли тиофен-2-сульфонилхлорид (159 мг, 0,871 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь суспендировали в насыщенном растворе NaHCO3 и избытке CH2Cl2 и перемешивали в течение 1 ч. Органический слой отделяли, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-((1-(тиофен-2-илсульфонил)пиперидин-4-ил)окси)имидазо[1,2-a]пиридин 230a (50 мг, 21%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,36 (д, J=7,2 Гц, 1H), 8,28 (д, J=1,2 Гц, 1H), 8,16 (с, 1H), 8,10 (с, 1H), 7,86 (дд, J=2,8, 5,2 Гц, 1H), 7,37 (дд, J=1,2, 4,8 Гц, 1H), 6,99 (д, J=2,0 Гц, 1H), 6,87 (с, 1H), 6,50 (дд, J=2,0, 7,2 Гц, 1H), 4,60-4,56 (м, 1H), 4,0 (с, 3H), 3,93 (с, 3H), 3,35-3,30 (м, 2H), 2,93-2,87 (м, 2H), 2,09-2,06 (м, 2H), 1,76-1,67 (м, 2H); ВЭЖХ (способ 6) 98,8% (AUC), tR=12,88 мин.; ESI+APCI MS m/z 534 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-((1-((1-метил-1 H -имидазол-2-ил)сульфонил)пиперидин-4-ил)окси)имидазо[1,2- a ]пиридина 230b (пример 288);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-((1-((1-метил-1H-имидазол-2-ил)-сульфонил)пиперидин-4-ил)окси)имидазо[1,2-a]пиридин 230b получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-((1-(тиофен-2-илсульфонил)пиперидин-4-ил)окси)имидазо[1,2-a]пиридин 230a, и получали в виде твердого вещества белого цвета (выход 20%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,39 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,11 (с, 1H), 7,48 (с, 1H), 7,13 (с, 1H), 7,04 (д, J=2,0 Гц, 1H), 6,87 (с, 1H), 6,57 (дд, J=2,4, 7,6 Гц, 1H), 4,70-4,66 (м, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,87 (с, 3H), 3,61-3,57 (м, 2H), 3,34-3,33 (м, 2H), 2,12-2,08 (м, 2H), 1,79-1,71 (м, 2H); ВЭЖХ (способ 6) >99% (AUC), tR=13,11 мин.; ESI+APCI MS m/z 532 [M+H]+.
Получение 4-(4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)окси)-пиперидин-1-ил)пиримидин-2-амина 230c (пример 284);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперидин-4-илокси)имидазо[1,2-a]пиридина 229a (100 мг, 0,258 ммоль) и N,N-диизопропилэтиламина (0,22 мл, 1,3 ммоль) в DMF (3 мл) добавляли 4-хлорпиримидин-2-амин (67 мг, 0,52 ммоль). Реакционную смесь перемешивали при 110-120°C в течение 16 ч в запаянной пробирке, затем ее охлаждали до комнатной температуры. В реакционную смесь добавляли воду, и водный слой экстрагировали в CH2Cl2. Органический слой промывали два раза ледяной холодной водой, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 4-(4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)окси)пиперидин-1-ил)пиримидин-2-амин 230c (30 мг, 24%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,40 (д, J=7,2 Гц, 1H), 8,19 (с, 1H), 8,12 (с, 1H), 7,76 (д, J=6,4 Гц, 1H), 7,06 (д, J=2,0 Гц, 1H), 6,88 (с, 1H), 6,58 (дд, J=2,4, 7,2 Гц, 1H), 6,08 (д, J=6,0 Гц, 1H), 6,01 (с, 2H), 4,78-4,74 (м, 1H), 4,06-3,97 (м, 2H), 4,01 (с, 3H), 3,94 (с, 3H), 3,38-3,31 (м, 2H), 2,05-2,03 (м, 2H), 1,63-1,56 (м, 2H); ВЭЖХ (способ 6) 97,0% (AUC), tR=11,75 мин.; ESI+APCI MS m/z 481 [M+H]+.
Схема 67
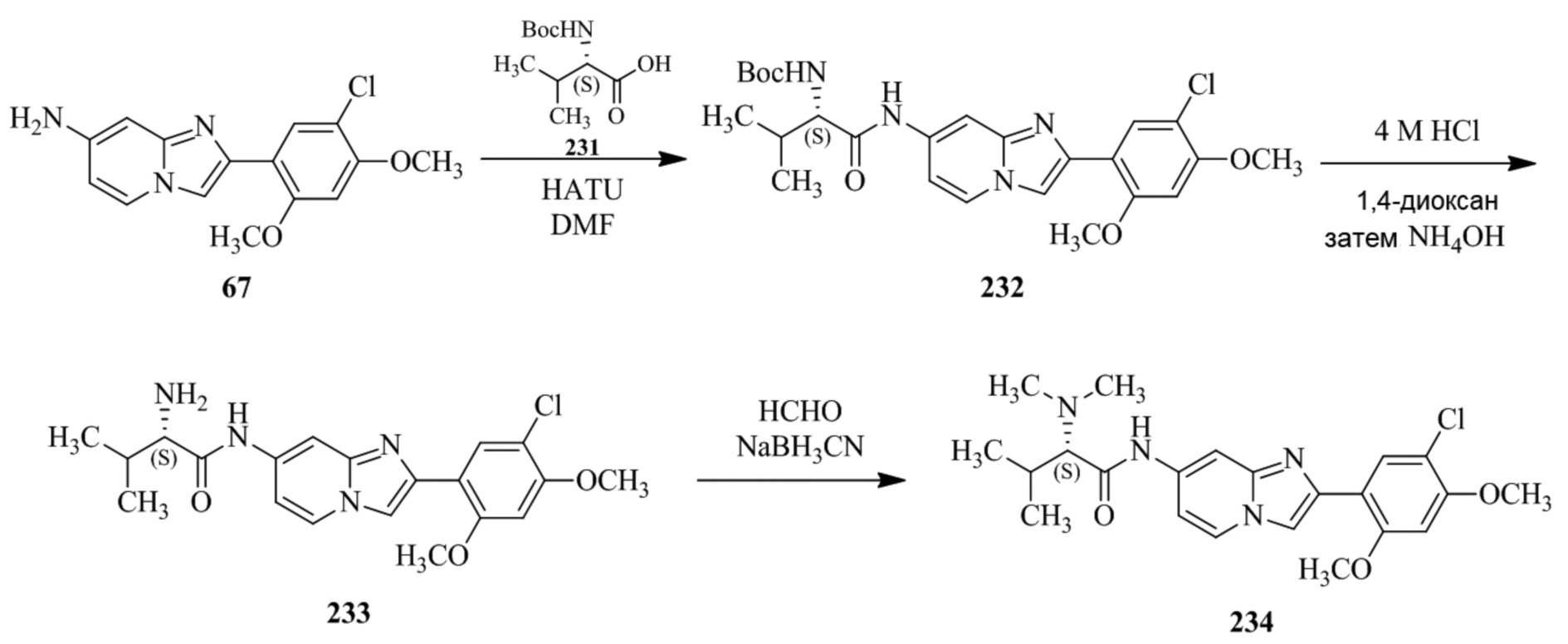
Получение ( S )- трет -бутил(1-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)-3-метил-1-оксобутан-2-ил)карбамата 232;
В смесь 2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 67 (300 мг, 0,99 ммоль) и (S)-2-((трет-бутоксикарбонил)амино)-3-метилбутановой кислоты 231 (652 мг, 3,00 ммоль) в N,N-диметилформамиде (5,0 мл) загружали N,N-диизопропилэтиламин (1,1 мл, 6,3 ммоль), после чего следовало добавление HATU (1,70 г, 4,47 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили водой (10 мл) и осадок собирали посредством фильтрования, полученное твердое вещество промывали водой и сушили при пониженном давлении. Твердое вещество очищали посредством колоночной хроматографии (силикагель, 9,5:0,5 CHCl3/метанол) для того, чтобы получить (S)-трет-бутил(1-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат 232 (350 мг, 70%) в виде твердого вещества коричневого цвета.
ESI MS m/z 503 [M+H]+.
Получение ( S )-2-амино -N- (2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-3-метилбутанамида 233;
Cмесь (S)-трет-бутил(1-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]-пиридин-7-ил)амино)-3-метил-1-оксобутан-2-ил)карбамата 232 (350 мг, 0,696 ммоль) и 4 M HCl в 1,4-диоксане (5 мл) перемешивали при комнатной температуре в течение 3 ч. Растворитель удаляли при пониженном давлении и остаток ощелачивали водным раствором аммиака (30%) для того, чтобы получить (S)-2-амино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-метилбутанамид 233 (175 мг, 62%) в виде твердого вещества коричневого цвета.
ESI MS m/z 403 [M+H]+.
Получение ( S ) -N- (2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-2-(диметиламино)-3-метилбутанамида 234 (пример 272);
В раствор (S)-2-амино-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-метилбутанамида 233 (100 мг, 0,248 ммоль) и формальдегида (37% в MeOH) (200 мкл, 2,48 ммоль) в метаноле (5 мл) загружали каталитическую AcOH и цианоборогидрид натрия (47 мг, 0,75 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли при пониженном давлении и остаток разводили водным раствором аммиака (30%) (10 мл) и экстрагировали хлороформом (2×10 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали посредством колоночной хроматографии (силикагель, 9:1 CHCl3/MeOH) для того, чтобы получить (S)-N-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-2-(диметиламино)-3-метилбутанамид 234 (40 мг, 37%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,60 (ушир. с, 1H), 8,38 (с, 1H), 8,03 (д, J=0,64 Гц, 1H), 8,01 (с, 1H), 7,60 (д, J=2,0 Гц, 1H), 7,29 (дд, J=2,6, 7,2 Гц, 1H), 6,58 (с, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 2,61 (д, J=4,6 Гц, 1H), 2,34 (с, 6H), 2,25-2,16 (м, 2H), 1,08 (д, J=6,8 Гц, 3H), 0,97 (д, J=6,8 Гц, 3H); ВЭЖХ (способ 1) 95,3% (AUC), tR=9,44 мин.; ESI MS m/z 431 [M+H]+.
Схема 68
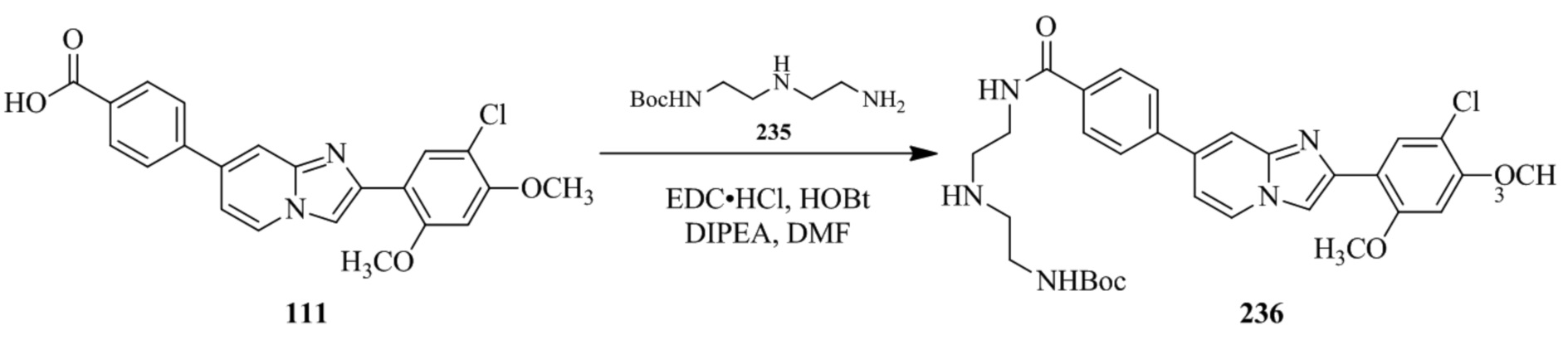
Получение трет -бутил(2-((2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)бензамидо)этил)амино)этил)карбамата 236 (пример 269);
В смесь 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)бензойной кислоты 111 (200 мг, 0,489 ммоль) и трет-бутил(2-((2-аминоэтил)амино)этил)карбамата 235 (145 мкл, 0,73 ммоль) в N,N-диметилформамиде (5,0 мл) загружали N,N-диизопропилэтиламин (250 мкл, 1,44 ммоль), после чего следовало добавление EDC•HCl (140 мг, 0,73 ммоль) и HOBt (131 мг, 0,98 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили водой (10 мл) и осадок собирали посредством фильтрования; полученное твердое вещество промывали водой и сушили при пониженном давлении. Твердое вещество очищали посредством колоночной хроматографии (силикагель, 9:1 CHCl3/метанол с 0,5 мл водного раствора аммиака (30%) на 100 мл) для того, чтобы получить трет-бутил(2-((2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)бензамидо)этил)амино)этил)карбамат 236 (130 мг, 45%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,42 (с, 1H), 8,09 (д, J=7,0 Гц, 1H), 8,04 (ушир. с, 1H), 7,98 (д, J=8,4 Гц, 2H), 7,77 (ушир. с, 1H), 7,66 (д, J=8,3 Гц, 2H), 7,34 (ушир. с, 1H), 6,97 (д, J=6,8 Гц, 1H), 6,65 (с, 1H), 5,25 (ушир. с, 1H), 4,00 (с, 3H), 3,96 (с, 3H), 3,75-3,68 (м, 2H), 3,42-3,35 (м, 2H), 3,39 (тд, J=5,5, 10,8 Гц, 2H), 2,98 (тд, J=5,5, 10,8 Гц, 2H), 1,39 (с, 9H); ВЭЖХ (способ 1) 96,3% (AUC), tR=10,00 мин.; ESI MS m/z 594 [M+H]+.
Схема 69
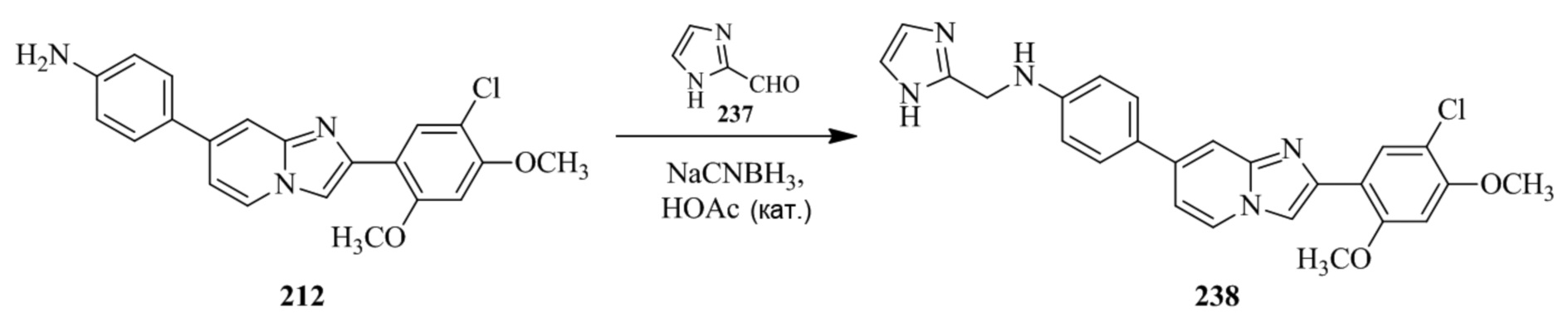
Получение N -((1 H -имидазол-2-ил)метил)-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)анилина 238 (пример 270);
В раствор 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)анилина 212 (75 мг, 0,20 ммоль) и 1H-имидазол-2-карбальдегиде 237 (22 мг, 0,23 ммоль) в метаноле (5 мл) загружали каталитическую AcOH и цианоборогидрид натрия (47 мг, 0,75 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли при пониженном давлении и остаток разводили водным раствором аммиака (30%, 10 мл) и экстрагировали хлороформом (2×10 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии (силикагель, 9:1 CHCl3/MeOH) для того, чтобы получить N-((1H-имидазол-2-ил)метил)-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)анилин 238 (60 мг, 65%) в виде твердого вещества желто-зеленого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,33 (д, J=7,1 Гц, 1H), 8,16 (с, 1H), 8,11 (с, 1H), 7,58 (ушир. с, 1H), 7,53 (д, J=8,7 Гц, 2H), 7,14 (дд, J=1,8, 7,1 Гц, 1H), 6,99 (ушир. с, 2H), 6,79 (с, 1H), 6,74 (д, J=8,7 Гц, 2H), 4,45 (ушир. с, 2H), 4,00 (с, 3H), 3,95 (с, 3H); ВЭЖХ (способ 1) 97,5% (AUC), tR=9,67 мин.; ESI MS m/z 460 [M+H]+.
Схема 70
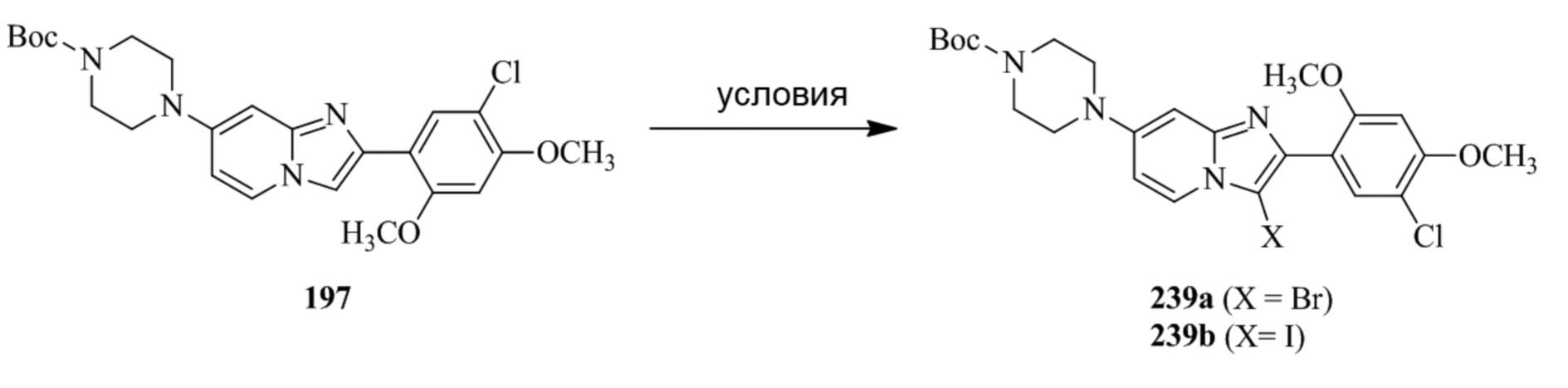
Получение трет -бутил-4-(3-бром-2-(2-хлор-4,5-диметоксифенил)имидазо[1,2- a ]-пиридин-7-ил)пиперазин-1-карбоксилата 239a (пример 271);
В раствор трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилата 197 (400 мг, 0,846 ммоль) в CH2Cl2/MeOH (3 мл/1 мл) медленно добавляли TBATB (488 мг, 1,01 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разводили в CH2Cl2 (30 мл), промывали водой (2×10 мл) и затем солевым раствором (10 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью CombiFlash Companion (силикагель, 20% EtOAc/гексаны) для того, чтобы получить трет-бутил-4-(3-бром-2-(5-хлор-2,4-диметокси-фенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилат 239a в виде твердого вещества белого цвета (350 мг, 75%).
1H ЯМР (400 МГц, CDCl3): δ 7,95 (д, J=7,6 Гц, 1H), 7,56 (с, 1H), 6,83 (д, J=2 Гц, 1H), 6,71 (дд, J=2,4, 7,6 Гц, 1H), 6,59 (с, 1H), 3,97 (с, 3H), 3,87 (с, 3H), 3,61(м, 4H), 3,21 (м, 4H), 1,49 (с, 9H); ВЭЖХ (способ 1) >99% (AUC), tR=11,77 мин.; ESI MS m/z 553 [(M+2)+H]+.
Получение трет -бутил-4-(2-(5-хлор-2,4-диметоксифенил)-3-йодимидазо[1,2- a ]пиридин-7-ил)пиперазин-1-карбоксилата 239b (пример 290);
В суспензию трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-карбоксилата 7 (142 мг, 0,300 ммоль) в ацетонитриле (8 мл) загружали N-йодсукцинимид (95 мг, 0,42 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере азота. Суспензию фильтровали и полученное твердое вещество промывали небольшим количеством ацетонитрила для того, чтобы получить твердое вещество желтого цвета, которое перекристаллизовывали из метанола для того, чтобы получить трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)-3-йодимидазо[1,2-a]-пиридин-7-ил)пиперазин-1-карбоксилат 239b (120 мг, 67%) в виде твердого вещества желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,10 (д, J=7,5 Гц, 1H), 7,32 (с, 1H), 6,98 (дд, J=2,4, 7,8 Гц, 1H), 6,87 (с, 1H), 6,76 (д, J=2,1 Гц, 1H), 3,96 (с, 3H), 3,82 (с, 3H), 3,49-3,47 (м, 4H), 3,25-3,23 (м, 4H), 1,43 (с, 9H); ВЭЖХ (способ 1) 94,2% (AUC), tR=11,86 мин.; ESI MS m/z 599 [M+H]+.
Схема 71
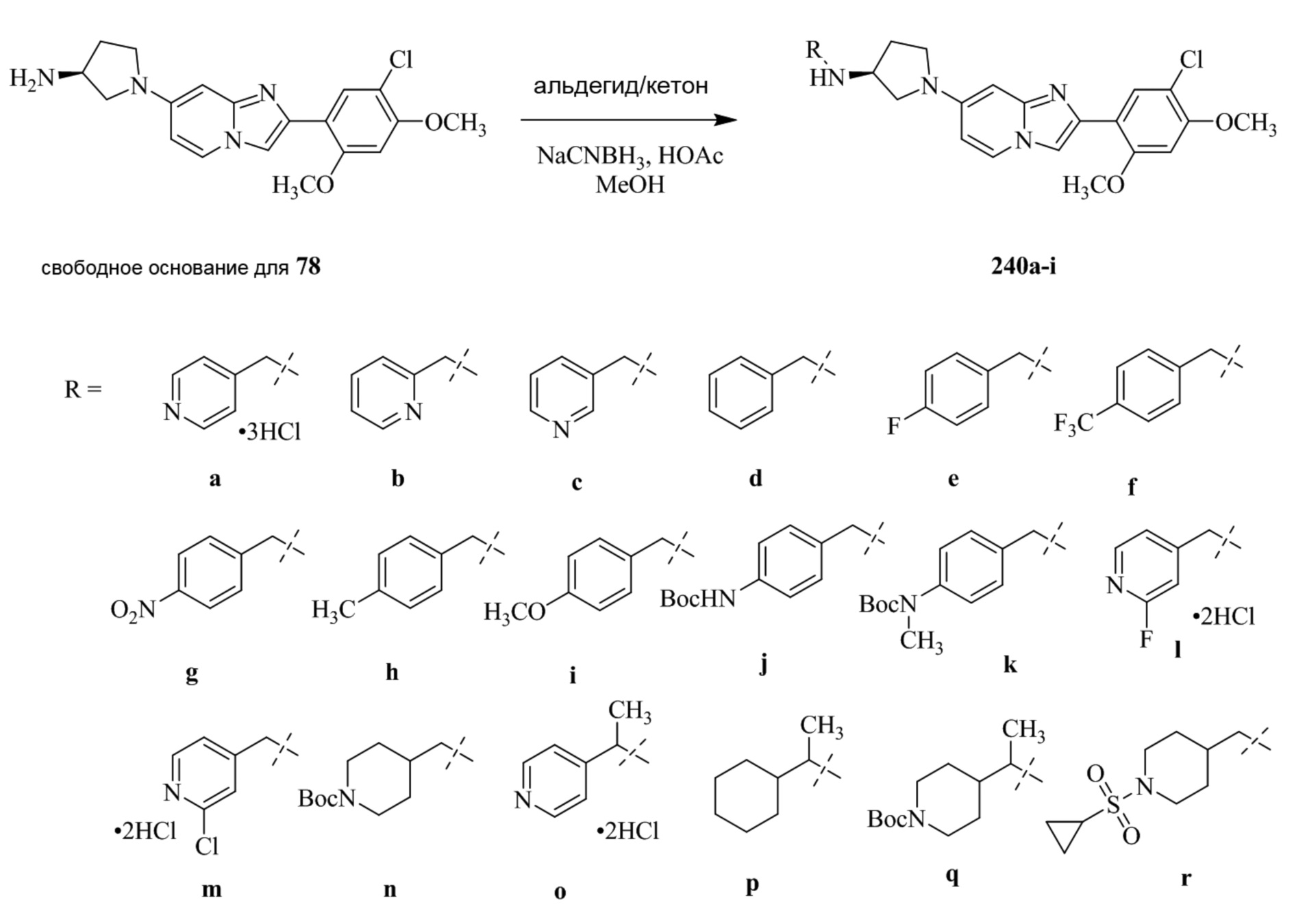
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида 240a (пример 298);
В 250 мл круглодонную колбу загружали (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-амин (1,0 г, 2,69 ммоль), изоникотинальдегид (316 мг, 2,95 ммоль), 60 мл метанола и HOAc (154 мкл, 2,69 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут перед добавлением NaCNBH3 (186 мг, 2,96 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и затем разбавляли дихлорметаном (500 мл). Органический слой промывали раствором NaHCO3, после чего следовала вода и затем солевой раствор; сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали посредством колоночной хроматографии (силикагель, 90:9:1 дихлорметан/MeOH/гидроксид аммония) для того, чтобы получить (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амин (1,0 г, 80%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,56 (дд, J=1,6, 4,5 Гц, 2H), 8,35 (с, 1H), 7,86 (д, J=7,5 Гц, 1H), 7,79 (с, 1H), 7,29 (дд, J=1,6, 4,5 Гц, 2H), 6,57 (с, 1H), 6,51 (ушир. с, 1H), 6,32 (дд, J=2,4, 7,5 Гц, 1H), 4,00 (с, 3H), 3,96 (с, 3H), 3,88 (с, 2H), 3,61-3,50 (м, 3H), 3,44-3,36 (м, 1H), 3,23-3,18 (м, 1H), 2,31-2,21 (м, 1H), 2,00-1,91 (м, 1H); ESI MS m/z 464 [M+H]+.
Затем свободное основание превращали в его тригидрохлоридную соль с использованием следующей процедуры: (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амин (1,0 г) поднимали в 10 мл воды с HCl (4 Н водный раствор, 2 мл). Раствор обрабатывали звуком в течение 5 минут и затем лиофилизировали в течение ночи. Желаемый (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорид 240a получали в виде твердого вещества желтого цвета (1,15 г, 93%).
1H ЯМР (300 МГц, DMSO-d6): δ 13,74 (ушир. с, 1H), 10,57 (ушир. с, 1H), 10,41 (ушир. с, 1H), 8,87-8,79 (м, 2H), 8,57 (д, J=7,6 Гц, 1H), 8,27 (с, 1H), 8,06 (с, 1H), 8,02 (д, J=6,1 Гц, 2H), 7,00-6,95(м, 2H), 6,45 (д, J=2,2 Гц, 1H), 4,48 (с, 2H), 4,05 (с, 3H), 3,98 (с, 3H), 3,92-3,75 (м, 5H), 3,58-3,49 (м, 2H); ВЭЖХ (способ 4) 98,8% (AUC), tR=16,07 мин.; ESI MS m/z 464 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(пиридин-2-илметил)пирролидин-3-амина 240b (пример 299);
Соединение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-2-илметил)пирролидин-3-амин 240b получали аналогичным образом, как свободное основание (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида 240a, и получали в виде аморфного твердого вещества коричневого цвета (выход 25%*).
1H ЯМР (400 МГц, CDCl3): δ 8,56 (д, J=4,3 Гц, 1H), 8,38 (с, 1H), 7,89-7,76 (м, 2H), 7,70-7,59 (м, 1H), 7,31 (д, J=7,7 Гц, 1H), 7,21-7,14 (м, 1H), 6,57 (с, 1H), 6,44 (с, 1H), 6,36-6,27 (м, 1H), 4,06-3,87 (м, 8H), 3,62-3,48 (м, 3H), 3,44-3,34 (м, 1H), 3,28-3,18 (м, 1H), 2,32-2,20 (м, 1H), 2,04-1,93 (м, 1H); ВЭЖХ (то же, что способ 1, за исключением обнаружения при 220 нм) 94,2% (AUC), tR=9,49 мин.; ESI MS m/z 464 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(пиридин-3-илметил)пирролидин-3-амина 240c (пример 300);
Соединение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-3-илметил)пирролидин-3-амин 240c получали аналогичным образом, как свободное основание (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида 240a, и получали в виде аморфного твердого вещества грязно-белого цвета (выход 16%*).
1H ЯМР (400 МГц, CDCl3): δ 8,59 (д, J=1,8 Гц, 1H), 8,52 (дд, J=1,6, 4,8 Гц, 1H), 8,36 (с, 1H), 7,86 (д, J=7,5 Гц, 1H), 7,78 (с, 1H), 7,72-7,68 (м, 1H), 7,30-7,26 (м, 1H), 6,57 (с, 1H), 6,54 (ушир. с, 1H), 6,34 (дд, J=2,2, 7,4 Гц, 1H), 4,00 (с, 3H), 3,95 (с, 3H), 3,88 (с, 2H), 3,62-3,50 (м, 3H), 3,44-3,36 (м, 1H), 3,23-3,18 (м, 1H), 2,31-2,22 (м, 1H), 2,00-1,91 (м, 1H); ВЭЖХ (способ 1) 94,3% (AUC), tR=9,12 мин.; ESI MS m/z 464 [M+H]+.
Получение ( S )-N-бензил-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-амина 240d (пример 301);
Соединение (S)-N-бензил-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-амин 240d получали аналогичным образом, как свободное основание (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида 240a, и получали в виде аморфного твердого вещества грязно-белого цвета (выход 40%).
1H ЯМР (300 МГц, CDCl3): δ 8,39 (с, 1H), 7,84 (д, J=7,4 Гц, 1H), 7,81 (с, 1H), 7,38-7,30 (м, 4H), 7,30-7,26 (м, 1H), 6,57 (с, 1H), 6,42 (с, 1H), 6,30 (дд, J=2,4, 7,4 Гц, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,86 (с, 2H), 3,60-3,46 (м, 3H), 3,42-3,32 (м, 1H), 3,22-3,13 (м, 1H), 2,32-2,19 (м, 1H), 1,99-1,87 (м, 1H); ВЭЖХ (способ 1) 92,0% (AUC), tR=9,85 мин.; ESI MS m/z 463 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(4-фторбензил)пирролидин-3-амина 240e (пример 302);
Соединение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(4-фторбензил)пирролидин-3-амин 240e получали аналогичным образом, как свободное основание (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида 240a, и получали в виде аморфного твердого вещества грязно-белого цвета (выход 15%*).
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 7,84 (д, J=7,6 Гц, 1H), 7,82 (с, 1H), 7,34-7,28 (м, 2H), 7,05-6,98 (м, 2H), 6,57 (с, 1H), 6,42 (с, 1H), 6,30 (дд, J=2,4, 7,5 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,82 (с, 2H), 3,59-3,47 (м, 3H), 3,41-3,33 (м, 1H), 3,20-3,15 (м, 1H), 2,30-2,21 (м, 1H), 1,98-1,89 (м, 1H); ВЭЖХ (способ 1) 95,0% (AUC), tR=9,99 мин.; ESI MS m/z 481 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(4-(трифторметил)бензил)пирролидин-3-амина 240f (пример 303);
Соединение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(4-(трифторметил)бензил)пирролидин-3-амин 240f получали аналогичным образом, как свободное основание (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида 240a, и получали в виде аморфного твердого вещества грязно-белого цвета (выход 52%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,85 (д, J=7,4 Гц, 1H), 7,81 (с, 1H), 7,59 (д, J=8,1 Гц, 2H), 7,47 (д, J=8,0 Гц, 2H), 6,57 (с, 1H), 6,46 (ушир. с, 1H), 6,31 (дд, J=2,3, 7,5 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,92 (с, 2H), 3,61-3,49 (м, 3H), 3,42-3,35 (м, 1H), 3,22-3,17 (м, 1H), 2,30-2,21 (м, 1H), 1,99-1,90 (м, 1H); ВЭЖХ (способ 1) >99% (AUC), tR=10,43 мин.; ESI MS m/z 531 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(4-нитробензил)пирролидин-3-амина 240g (пример 304);
Соединение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(4-нитробензил)пирролидин-3-амин 240g получали аналогичным образом, как свободное основание (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида 240a, и получали в виде аморфного твердого вещества желто-коричневого цвета (выход 44%).
1H ЯМР (400 МГц, CDCl3): δ 8,37 (с, 1H), 8,19 (д, J=8,7 Гц, 2H), 7,85 (д, J=7,5 Гц, 1H), 7,80 (с, 1H), 7,54 (д, J=8,6 Гц, 2H), 6,57 (с, 1H), 6,50 (ушир. с, 1H), 6,32 (дд, J=2,3, 7,4 Гц, 1H), 4,00 (с, 3H), 3,97 (с, 2H), 3,95 (с, 3H), 3,62-3,50 (м, 3H), 3,44-3,36 (м, 1H), 3,24-3,17 (м, 1H), 2,30-2,22 (м, 1H), 2,00-1,92 (м, 1H); ВЭЖХ (то же, что способ 1, за исключением обнаружения при 220 нм) 93,4% (AUC), tR=10,06 мин.; ESI MS m/z 508 [M+H]+.
Получение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(4-метилбензил)пирролидин-3-амина 240h (пример 305);
Соединение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(4-метилбензил)пирролидин-3-амин 240h получали аналогичным образом, как свободное основание (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида 240a, и получали в виде аморфного твердого вещества грязно-белого цвета (выход 50%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,84 (д, J=7,4 Гц, 1H), 7,80 (с, 1H), 7,22 (д, J=8,0 Гц, 2H), 7,47 (д, J=7,9 Гц, 2H), 6,57 (с, 1H), 6,43 (с, 1H), 6,30 (дд, J=2,3, 7,4 Гц, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,81 (с, 2H), 3,59-3,47 (м, 3H), 3,40-3,33 (м, 1H), 3,20-3,15 (м, 1H), 2,34 (с, 3H), 2,29-2,20 (м, 1H), 1,97-1,88 (м, 1H); ВЭЖХ (способ 1) >99% (AUC), tR=10,09 мин.; ESI MS m/z 477 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(4-метоксибензил)пирролидин-3-амина 240i (пример 306);
Соединение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(4-метоксибензил)пирролидин-3-амин 240i получали аналогичным образом, как свободное основание (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида 240a, и получали в виде аморфного твердого вещества грязно-белого цвета (выход 53%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,84 (д, J=7,5 Гц, 1H), 7,80 (с, 1H), 7,27-7,23 (м, 2H), 6,89-6,85 (м, 2H), 6,57 (с, 1H), 6,45 (с, 1H), 6,31 (дд, J=2,3, 7,4 Гц, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,80 (с, 3H), 3,79 (с, 2H), 3,59-3,47 (м, 3H), 3,40-3,33 (м, 1H), 3,21-3,14 (м, 1H), 2,29-2,19 (м, 1H), 1,98-1,89 (м, 1H); ВЭЖХ (способ 1) >99% (AUC), tR=9,95 мин.; ESI MS m/z 493 [M+H]+.
Получение ( S )- трет -бутил(4-(((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)амино)метил)фенил)карбамата 240j (пример 386);
Соединение (S)-трет-бутил(4-(((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)амино)метил)фенил)карбамат 240j получали аналогичным образом, как (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амин (свободное основание для 240a), и получали в виде аморфного твердого вещества грязно-белого цвета (выход 60%).
1H ЯМР (400 МГц, CDCl3): δ 8,39 (с, 1H), 7,84 (д, J=7,5 Гц, 1H), 7,80 (с, 1H), 7,32 (д, J=8,5 Гц, 2H), 7,28-7,23 (м, 2H), 6,57 (с, 1H), 6,45 (ушир. с, 2H), 6,31 (дд, J=2,3, 7,5 Гц, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,80 (с, 2H), 3,58-3,46 (м, 3H), 3,40-3,32 (м, 1H), 3,20-3,11 (м, 1H), 2,28-2,18 (м, 1H), 1,96-1,86 (м, 1H), 1,51 (с, 9H). ВЭЖХ (способ 1) 97,8% (AUC), tR=10,54 мин; ESI MS m/z 578 [M+H]+.
Получение ( S )- трет -бутил(4-(((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)амино)метил)фенил)(метил)карбамата 240k (пример 394);
Соединение (S)-трет-бутил(4-(((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)амино)метил)фенил)(метил)карбамат 240k получали аналогичным образом, как (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амин (свободное основание для 240a), и получали в виде аморфного твердого вещества грязно-белого цвета (выход 40%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,84 (д, J=7,4 Гц, 1H), 7,80 (с, 1H), 7,29 (д, J=8,5 Гц, 2H), 7,19 (д, J=8,4 Гц, 2H), 6,57 (с, 1H), 6,46 (ушир. с, 1H), 6,31 (дд, J=2,3, 7,5 Гц, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,83 (с, 2H), 3,60-3,48 (м, 3H), 3,41-3,34 (м, 1H), 3,24 (с, 3H), 3,21-3,16 (м, 1H), 2,29-2,20 (м, 1H), 1,98-1,89 (м, 1H), 1,44 (с, 9H). ВЭЖХ (способ 1) 94,9% (AUC), tR=10,59 мин; ESI MS m/z 592 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-((2-фторпиридин-4-ил)метил)пирролидин-3-амина дигидрохлорида 240l (пример 412);
Соединение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-((2-фторпиридин-4-ил)метил)пирролидин-3-амина дигидрохлорид 240l получали аналогичным образом, как (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорид 240a, и получали в виде аморфного твердого вещества грязно-белого цвета (выход 60%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,52 (с, 1H), 10,30 (ушир. с, 1H), 10,09 (ушир. с, 1H), 8,56 (д, J=7,2 Гц, 1H), 8,33 (д, J=4,4 Гц, 1H), 8,26 (с, 1H), 8,00 (с, 1H), 7,61 (ушир. с, 1H), 7,50 (ушир. с, 1H), 7,01-6,95 (м, 2H), 6,42 (с, 1H), 4,37 (ушир. с, 2H), 4,05 (с, 3H), 3,98 (с, 3H), 3,82 (ушир. с, 2H), 3,74 (ушир. с, 1H), 3,58-3,48 (м, 1H), 2,44 (ушир. с, 1H). ВЭЖХ (то же, что способ 1, за исключением обнаружения при 220 нм) 94,5% (AUC), tR=9,60 мин; ESI MS m/z 482 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-((2-хлорпиридин-4-ил)метил)пирролидин-3-амина дигидрохлорида 240m (пример 413);
Соединение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-((2-хлорпиридин-4-ил)метил)пирролидин-3-амина дигидрохлорид 240m получали аналогичным образом, как (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорид 240a, и получали в виде аморфного твердого вещества грязно-белого цвета (выход 65%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,58 (с, 1H), 10,26 (ушир. с, 1H), 10,08 (ушир. с, 1H), 8,56 (д, J=7,9 Гц, 1H), 8,50 (д, J=4,7 Гц, 1H), 8,27 (с, 1H), 8,02 (с, 1H), 7,85 (ушир. с, 1H), 7,69 (д, J=4,2 Гц, 1H), 7,01-6,94 (м, 2H), 6,43 (с, 1H), 4,34 (ушир. с, 2H), 4,09-3,95 (м, 7H), 3,84 (ушир. с, 2H), 3,78-3,69 (м, 1H), 3,58-3,49 (м, 1H), 2,45 (ушир. с, 1H). ВЭЖХ (способ 1) >99% (AUC), tR=9,71 мин; ESI MS m/z 498 [M+H]+.
Получение ( S )- трет -бутил-4-(((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)амино)метил)пиперидин-1-карбоксилата 240n (пример 400);
Соединение (S)-трет-бутил-4-(((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)амино)метил)пиперидин-1-карбоксилат 240n получали аналогичным образом, как (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амин (свободное основание для 240a), и получали в виде аморфного твердого вещества грязно-белого цвета (выход 40%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,85 (д, J=7,5 Гц, 1H), 7,79 (с, 1H), 6,57 (с, 1H), 6,48 (ушир. с, 1H), 6,33 (дд, J=2,2, 7,4 Гц, 1H), 4,11 (ушир. с, 2H), 3,99 (с, 3H), 3,95 (с, 3H), 3,61-3,54 (м, 1H), 3,54-3,45 (м, 2H), 3,42-3,34 (м, 1H), 3,15-3,10 (м, 1H), 2,751-2,62 (м, 2H), 2,60-2,50 (м, 2H), 2,29-2,19 (м, 1H), 1,93-1,83 (м, 1H), 1,70 (ушир. с, 3H), 1,45 (с, 9H), 1,19-1,06 (м, 2H),. ВЭЖХ (способ 1) >99% (AUC), tR=10,28 мин; ESI MS m/z 570 [M+H]+.
Получение (3 S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(1-(пиридин-4-ил)этил)пирролидин-3-амина дигидрохлорида 240o (пример 407);
В 50 мл круглодонную колбу загружали (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-амин (50 мг, 0,134 ммоль), 1-(пиридин-4-ил)этанон (18 мг, 0,147 ммоль), 4 мл метанола/THF (1:1) и HOAc (15,4 мкл, 0,147 ммоль). Реакционную смесь перемешивали при 50°C в течение 3 часов перед добавлением NaCNBH3 (10 мг, 0,147 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и затем разбавляли дихлорметаном (500 мл). Органический слой промывали раствором NaHCO3, после чего следовала вода и затем солевой раствор; сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали посредством колоночной хроматографии (силикагель, 90:9:1 дихлорметан/MeOH/гидроксид аммония) для того, чтобы получить (3S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(1-(пиридин-4-ил)этил)пирролидин-3-амин, который превращали в дигидрохлоридную соль 240o (18 мг, 28%), в виде твердого вещества светло-коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,54 (с, 1H), 10,97-10,11 (м, 2H), 8,76 (с, 2H), 8,56 (т, J=6,6, 13,8 Гц, 1H), 8,27 (с, 1H), 8,00 (д, J=6,3 Гц, 1H), 7,89 (с, 2H), 6,98 (с, 1H), 6,97-6,90 (м, 1H), 6,39 (дд, J=2,2, 16,2 Гц, 1H), 4,67 (ушир. с, 1H), 4,05 (с, 3H), 3,98 (с, 3H), 3,83-3,64 (м, 6H), 2,34 (ушир. с, 2H), 1,68 (д, J=6,7 Гц, 3H). ВЭЖХ (способ 1) 95,2% (AUC), tR=9,12 мин; ESI MS m/z 478 [M+H]+.
Получение (3 S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(1-циклогексилэтил)пирролидин-3-амина 240p (пример 416);
Соединение (3S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(1-циклогексилэтил)пирролидин-3-амин 240p получали аналогичным образом, как (3S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(1-(пиридин-4-ил)этил)пирролидин-3-амин (свободное основание дигидрохлоридной соли 240o), и получали в виде аморфного твердого вещества грязно-белого цвета (выход 20%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (д, J=1,2 Гц, 1H), 7,84 (д, J=7,4 Гц, 1H), 7,79 (с, 1H), 6,57 (с, 1H), 6,47 (ушир. с, 1H), 6,33 (д, J=7,2 Гц, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 3,64-3,53 (м, 2H), 3,53-3,45 (м, 1H), 3,41-3,32 (м, 1H), 3,12-3,04 (м, 1H), 2,58-2,48 (м, 1H), 2,30-2,16 (м, 1H), 1,89-1,80 (м, 1H), 1,79-1,71 (м, 3H), 1,71-1,63 (м, 3H), 1,35-1,09 (м, 5H), 1,08-0,94 (м, 5H). ВЭЖХ (способ 1) >99% (AUC), tR=10,21 мин; ESI MS m/z 483 [M+H]+.
Получение трет -бутил-4-(1-((( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)амино)этил)пиперидин-1-карбоксилата 240q (пример 425);
Соединение трет-бутил-4-(1-(((S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)амино)этил)пиперидин-1-карбоксилат 240q получали аналогичным образом, как (3S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(1-(пиридин-4-ил)этил)пирролидин-3-амин (свободное основание дигидрохлоридной соли 240o), и получали в виде твердого вещества светло-желтого цвета (выход 65%).
1H ЯМР (300 МГц, CDCl3): δ 8,38 (с, 1H), 7,85 (д, J=7,6 Гц, 1H), 7,81 (с, 1H), 6,57 (с, 1H), 6,43 (ушир. с, 1H), 6,31 (дд, J=2,2, 7,5 Гц, 1H), 4,15 (ушир. с, 2H), 3,99 (с, 3H), 3,94 (с, 3H), 3,63-3,52 (м, 2H), 3,52-3,44 (м, 1H), 3,41-3,31 (м, 1H), 3,10-3,02 (м, 1H), 2,71-2,49 (м, 3H), 2,29-2,13 (м, 1H), 1,90-1,68 (м, 2H), 1,45 (с, 9H), 1,26-1,13 (м, 2H), 1,09-1,02 (м, 3H). ВЭЖХ (то же, что способ 1, за исключением обнаружения при 220 нм) 94,7% (AUC), tR=10,34 мин; ESI MS m/z 584 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-((1-(циклопропилсульфонил)пиперидин-4-ил)метил)пирролидин-3-амина 240r (пример 421)
Соединение (S)-трет-бутил-4-(((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)амино)метил)пиперидин-1-карбоксилат 240n обрабатывали с использованием TFA/CH2Cl2 в течение 2 ч при комнатной температуре; концентрировали и ощелачивали гидроксидом аммония для того, чтобы получить (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиперидин-4-илметил)пирролидин-3-амин, который превращали в (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-((1-(циклопропилсульфонил)пиперидин-4-ил)метил)пирролидин-3-амин 240r аналогичным образом, как N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)циклопропансульфонамид (17a, пример 63).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,85 (д, J=7,3 Гц, 1H), 7,81 (с, 1H), 6,57 (с, 1H), 6,46 (ушир. с, 1H), 6,32 (дд, J=2,3, 7,4 Гц, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,86-3,78 (м, 2H), 3,61-3,54 (м, 1H), 3,54-3,45 (м, 2H), 3,42-3,34 (м, 1H), 3,16-3,10 (м, 1H), 2,84-2,72 (м, 2H), 2,63-2,53 (м, 2H), 2,29-2,19 (м, 2H), 1,93-1,79 (м, 3H), 1,39-1,24 (м, 3H), 1,19-1,12 (м, 2H), 1,00-0,93 (м, 2H). ВЭЖХ (то же, что способ 1, за исключением обнаружения при 220 нм) 94,2% (AUC), tR=9,79 мин; ESI MS m/z 574 [M+H]+.
Схема 2-1
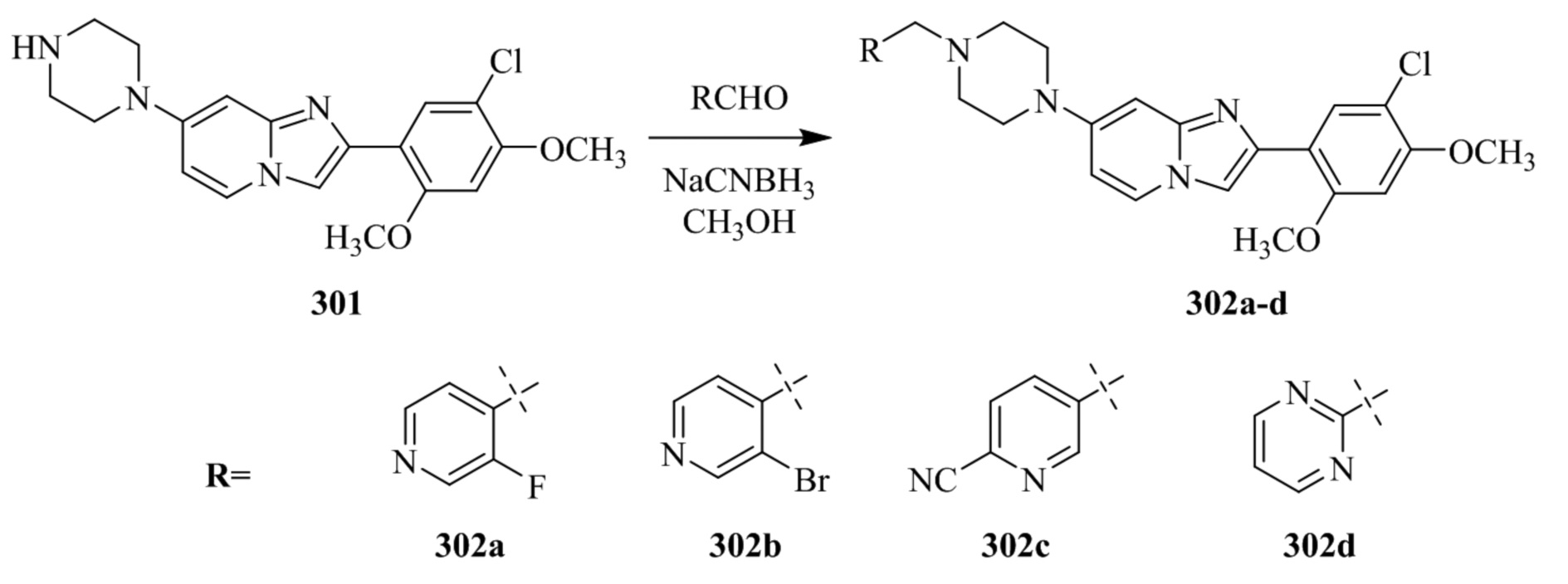
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-((3-фторпиридин-4-ил)метил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 302a (пример 336);
В суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (150 мг, 0,40 ммоль), 3-фторизоникотинальдегида (75 мг, 0,60 ммоль) в CH3OH (10 мл) добавляли уксусную кислоту (0,2 мл) и получаемую смесь перемешивали в течение 1 ч. Добавляли цианоборогидрид натрия (126 мг, 2,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разводили водным раствором бикарбоната натрия и экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-((3-фторпиридин-4-ил)метил)пиперазин-1-ил)имидазо[1,2-a]пиридин 302a (25 мг, 13%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,56 (с, 1H), 8,43 (д, J=4,0 Гц, 1H), 8,30 (д, 7,6 Гц, 1H), 8,16 (с, 1H), 8,01 (с, 1H), 7,54 (т, J=5,6 Гц, 1H), 6,86 (с, 1H), 6,80 (дд, J=2,0, 7,6 Гц, 1H), 6,65 (с, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,67 (с, 2H), 3,24 (ушир. с, 4H), 2,57 (ушир. с, 4H), ВЭЖХ (способ 1) 98,2% (AUC), tR=11,34 мин; ESI+APCI MS m/z 482 [M+H]+.
Получение 7-(4-((3-бромпиридин-4-ил)метил)пиперазин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридина 302b (пример 345);
7-(4-((3-бромпиридин-4-ил)метил)пиперазин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин 302b получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-((3-фторпиридин-4-ил)метил)пиперазин-1-ил)имидазо[1,2-a]пиридин 302a, и получали в виде твердого вещества грязно-белого цвета (выход 34%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,71 (с, 1H), 8,54 (д, J=5,2 Гц, 1H), 8,31 (д, J=7,6 Гц, 1H), 8,16 (с, 1H), 8,02 (с, 1H), 7,58 (д, J=4,6 Гц, 1H), 6,87 (с, 1H), 6,82 (д, J=7,6 Гц, 1H), 6,67 (с, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,65 (с, 2H), 3,27 (ушир. с, 4H), 2,62 (ушир. с, 4H); ВЭЖХ (способ 1) 91,7% (AUC), tR=11,74 мин; ESI+APCI MS m/z 542 [M+H]+.
Получение 5-((4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)метил)пиколинонитрила 302c (пример 339);
Соединение 5-((4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)метил)пиколинонитрил 302c получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-((3-фторпиридин-4-ил)метил)пиперазин-1-ил)имидазо[1,2-a]пиридин 302a, и получали в виде твердого вещества грязно-белого цвета (выход 16%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,73 (с, 1H), 8,30 (д, J=7,5 Гц, 1H), 8,16 (с, 1H), 8,02 (д, J=2,7 Гц, 3H), 6,86 (с, 1H), 6,79 (дд, J=2,1, 7,5 Гц, 1H), 6,66 (с, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,69 (с, 2H), 3,24 (ушир. с, 4H), 2,54 (ушир. с, 4H); ВЭЖХ (способ 1) 96,4% (AUC), tR=11,47 мин; ESI+APCI MS m/z 489 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиримидин-2-илметил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 2d (пример 352)
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиримидин-2-илметил)пиперазин-1-ил)имидазо[1,2-a]пиридин 302d получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-((3-фторпиридин-4-ил)метил)пиперазин-1-ил)имидазо[1,2-a]пиридин 302a, и получали в виде твердого вещества грязно-белого цвета (выход 18%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,80 (д, J=5,2 Гц, 2H), 8,30 (д, J=7,6 Гц, 1H), 8,16 (с, 1H), 8,01 (с, 1H), 7,42 (т, J=4,8 Гц, 1H), 6,86 (с, 1H), 6,79 (дд, J=2,0, 7,6 Гц, 1H), 6,64 (с, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,78 (с, 2H), 3,22 (ушир. с, 4H), 2,67 (ушир. с, 4H); ВЭЖХ (способ 1) 97,6% (AUC), tR=11,11 мин; ESI+APCI MS m/z 465 [M+H]+.
Схема 2-2
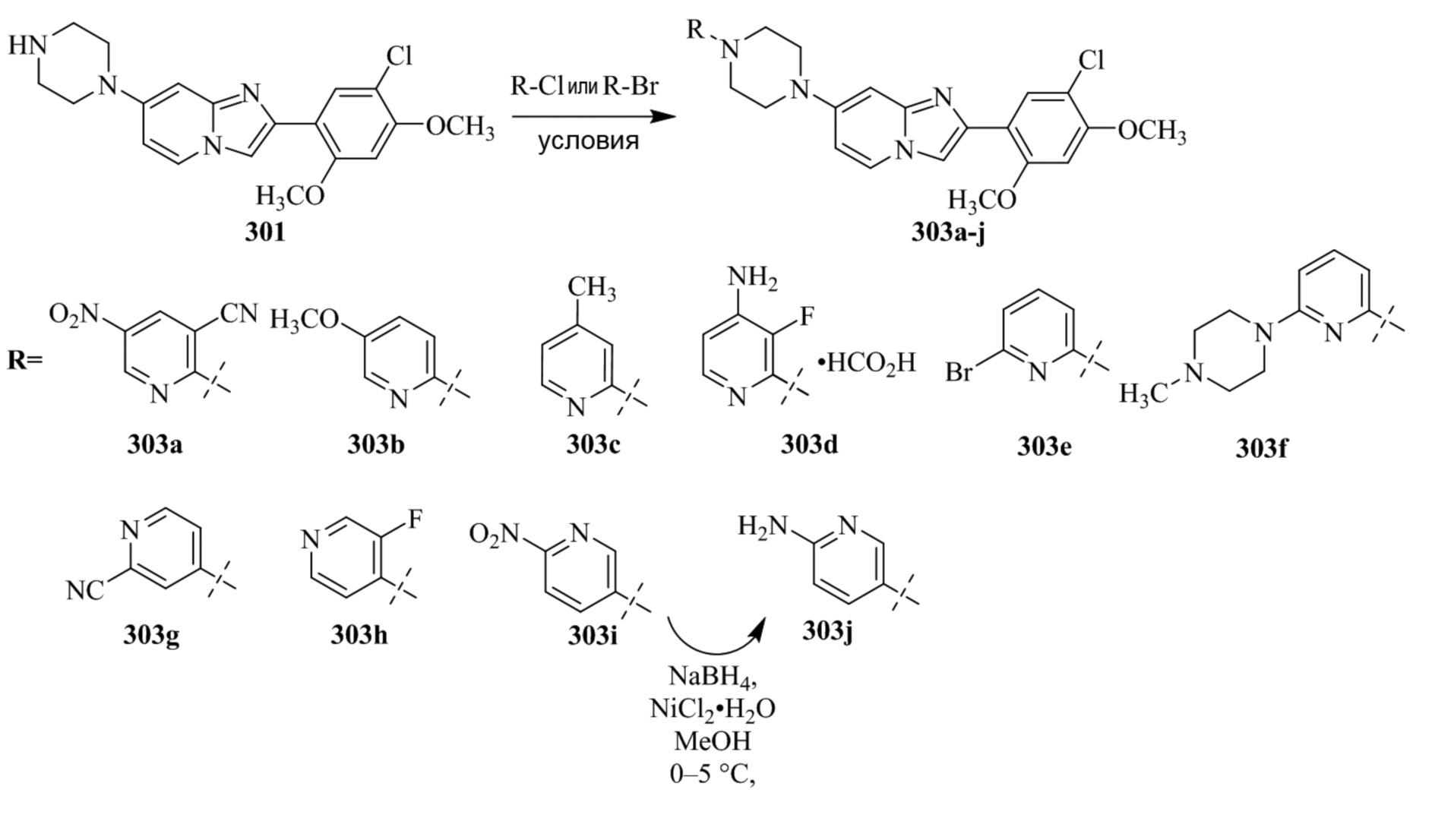
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-5-нитроникотинонитрила 303a (пример 349);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (100 мг, 0,26 ммоль) и N,N-диизопропилэтиламина (0,13 мл, 0,80 ммоль) в DMF (3 мл) загружали 2-хлор-5-нитроникотинонитрил (58 мг, 0,31 ммоль). Реакционную смесь перемешивали при 80-90°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-5-нитроникотинонитрил 303a (25 мг, 18%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 9,15 (д, J=2,8 Гц, 1H), 8,87 (д, J=2,8 Гц, 1H), 8,36 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 6,87 (с, 1H), 6,84 (дд, J=7,6, 2,4 Гц, 1H), 6,71 (с, 1H), 4,15 (ушир. с, 4H), 4,01 (с, 3H), 3,93 (с, 3H), 3,47 (ушир. с, 4H); ВЭЖХ (способ 1) 99,0% (AUC), tR=14,11 мин.; ESI+APCI MS m/z 520 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(5-метоксипиридин-2-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 303b (пример 321);
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 1 (100 мг, 0,27 ммоль), 2-хлор-5-метоксипиридина (42 мг, 0,29 ммоль), (±)BINAP (17 мг, 0,027 ммоль) и t-BuOK (90 мг, 0,80 ммоль) в 1,4-диоксане (20 мл) дегазировали аргоном в течение 15 мин. Затем в смесь загружали Pd(OAc)2 (9,0 мг, 0,013 ммоль), и дегазировали ее аргоном в течение еще 5 мин. Получаемую реакционную смесь перемешивали при 100-110°C в течение 16 ч в запаянной пробирке. Реакционную смесь охлаждали, фильтровали через подушку целита и выпаривали досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-3-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 303b (25 мг, 19%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=2,8 Гц, 1H), 8,35 (д, J=7,6 Гц, 1H), 8,18 (с, 1H), 8,03 (м, 1H), 7,91 (д, J=2,8 Гц, 1H), 7,30 (дд, J=9,2, 3,2 Гц, 1H), 6,91 (д, J=9,2 Гц, 1H), 6,87 (с, 1H), 6,85 (д, J=2,4 Гц, 1H), 6,27 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,74 (с, 3H), 3,54-3,52 (м, 4H), 3,51-3,32 (м, 4H); ВЭЖХ (способ 1) 92,8% (AUC), tR=11,80 мин.; ESI+APCI MS m/z 480 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(4-метилпиридин-2-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 303c (пример 327);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(4-метилпиридин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 303c получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(5-метоксипиридин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 303b, и получали в виде твердого вещества грязно-белого цвета (выход 20%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 8,00 (д, J=1,2 Гц, 1H), 6,87 (с, 2H), 6,73 (д, J=9,6 Гц, 2H), 6,52 (д, J=9,8 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,66-3,63 (м, 4H), 3,39-3,35 (м, 4H), 2,24 (с, 3H); ВЭЖХ (способ 1) 90,2% (AUC), tR=11,77 мин.; ESI+APCI MS m/z 464 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-3-фторпиридин-4-аминформиата 303d (пример 365);
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (500 мг, 1,3 ммоль), 2-хлор-3-фторпиридин-4-амина (286 мг, 2,0 ммоль), (±)BINAP (84 мг, 0,1 ммоль) и t-BuOK (376 мг, 3,3 ммоль) в 1,4-диоксане (20 мл) дегазировали аргоном в течение 15 мин. В смесь загружали Pd2(dba)3 (122 мг, 0,13 ммоль), и дегазировали ее аргоном в течение еще 5 мин. Получаемую реакционную смесь перемешивали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали, фильтровали через подушку целита и выпаривали досуха. Полученный остаток очищали посредством препаративной ВЭЖХ для того, чтобы получить 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-3-фторпиридин-4-аминформиат 303d (18 мг) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,33 (д, J=7,5 Гц, 1H), 8,20 (д, J=16,8 Гц, 2H), 8,03 (с, 1H), 7,53 (д, J=5,1 Гц 1H), 6,85 (д, J=9,9, 2H), 6,71 (с, 1H), 5,90 (с, 2H), 4,01 (с, 3H), 3,93 (с, 3H), 3,42 (с, 4H), 3,34 (с, 4H), ВЭЖХ (способ 1) 94,9% (AUC), tR=11,75 мин. ESI+APCI MS m/z 483 [M+H]+.
Получение 7-(4-(6-бромпиридин-2-ил)пиперазин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридина 303e;
Соединение 7-(4-(6-бромпиридин-2-ил)пиперазин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин 303e получали аналогичным образом, как 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-5-нитроникотинонитрил 303a, и получали в виде твердого вещества грязно-белого цвета (выход 46%). ESI+APCI MS m/z 528 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-(4-метилпиперазин-1-ил)пиридин-2-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 303f (пример 381);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-(4-метилпиперазин-1-ил)пиридин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 303f получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(5-метоксипиридин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 303b, и получали в виде твердого вещества грязно-белого цвета (выход 29%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,35 (т, J=8,1 Гц, 1H), 6,87-6,84 (м, 2H), 6,71 (с, 1H), 6,18-6,10 (м, 2H), 4,01 (с, 3H), 3,93 (с, 3H), 3,58 (ушир. с, 4H), 3,43 (ушир. с, 4H), 3,35 (ушир. с, 4H), 2,43 (ушир. с, 4H), 2,24 (с, 3H); ВЭЖХ (способ 1) 90,2% (AUC), tR=12,21 мин.; ESI+APCI MS m/z 548 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиколинонитрила 303g (пример 330);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (150 мг, 0,40 ммоль) и N,N-диизопропилэтиламина (0,2 мл, 1,2 ммоль) в DMF (3 мл) загружали 4-хлорпиколинонитрил (67 мг, 0,48 ммоль). Реакционную смесь перемешивали при 100-110°C в течение 16 ч в запаянной пробирке. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиколинонитрил 303g (40 мг, 21%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,26 (д, J=6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,56 (д, J=2,4 Гц, 1H), 7,13 (дд, J=2,4, 6 Гц, 1H), 6,87 (м, 2H), 6,72 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,61 (ушир. с, 4H), 3,37 (ушир. с, 4H); ВЭЖХ (способ 1) 91,4% (AUC), tR=12,34 мин.; ESI+APCI MS m/z 475 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(3-фторпиридин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 303h (пример 322);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(3-фторпиридин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 303h получали аналогичным образом, как 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиколинонитрил 303g, и получали в виде твердого вещества грязно-белого цвета (выход 16%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,2 Гц, 1H), 8,29 (д, J=5,6 Гц, 1H), 8,18 (с, 1H), 8,03 (с, 1H), 7,04 (т, J=7,6 Гц, 1H), 6,87 (с, 1H), 6,84 (с, 1H), 6,73 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,42 (ушир. с, 4H), 3,40 (ушир. с, 4H); ВЭЖХ (способ 1) 93,2% (AUC), tR=11,96 мин.; ESI+APCI MS m/z 468 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-нитропиридин-3-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 303i;
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (200 мг, 0,53 ммоль) и N,N-диизопропилэтиламина (0,26 мл, 1,59 ммоль) в DMF (4 мл) загружали 5-бром-2-нитропиридин (130 мг, 0,64 ммоль). Реакционную смесь перемешивали при 65°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-нитропиридин-3-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 303i (110 мг, 41%) в виде твердого вещества бледно-желтого цвета. ESI+APCI MS m/z 495 [M+H]+.
Получение 5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиридин-2-амина 303j (пример 323);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-нитропиридин-3-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 303i (110 мг, 0,22 ммоль) в CH3OH (10 мл), который охлаждали до 0-5°C, добавляли NiCl2•H2O (212 мг, 0,89 ммоль). Получаемую смесь перемешивали в течение 10 мин и затем загружали в нее NaBH4 (66 мг, 1,7 ммоль). Реакционную смесь перемешивали в течение еще 20 мин при той же температуре. Реакционную смесь разводили водой, фильтровали через подушку целита и фильтрат экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиридин-2-амин 303j (10 мг, 10%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,67 (д, J=2,8 Гц, 1H), 7,25 (дд, J=3,2, 9,2 Гц, 1H), 6,86 (м, 2H), 6,71 (с, 1H), 6,44 (д, J=8,8 Гц, 1H), 5,46 (ушир. с, 2H), 4,01 (с, 3H), 3,93 (с, 3H), 3,36 (ушир. с, 4H), 3,09 (ушир. с, 4H); ESI+APCI MS m/z 465 [M+H]+.
Схема 2-3
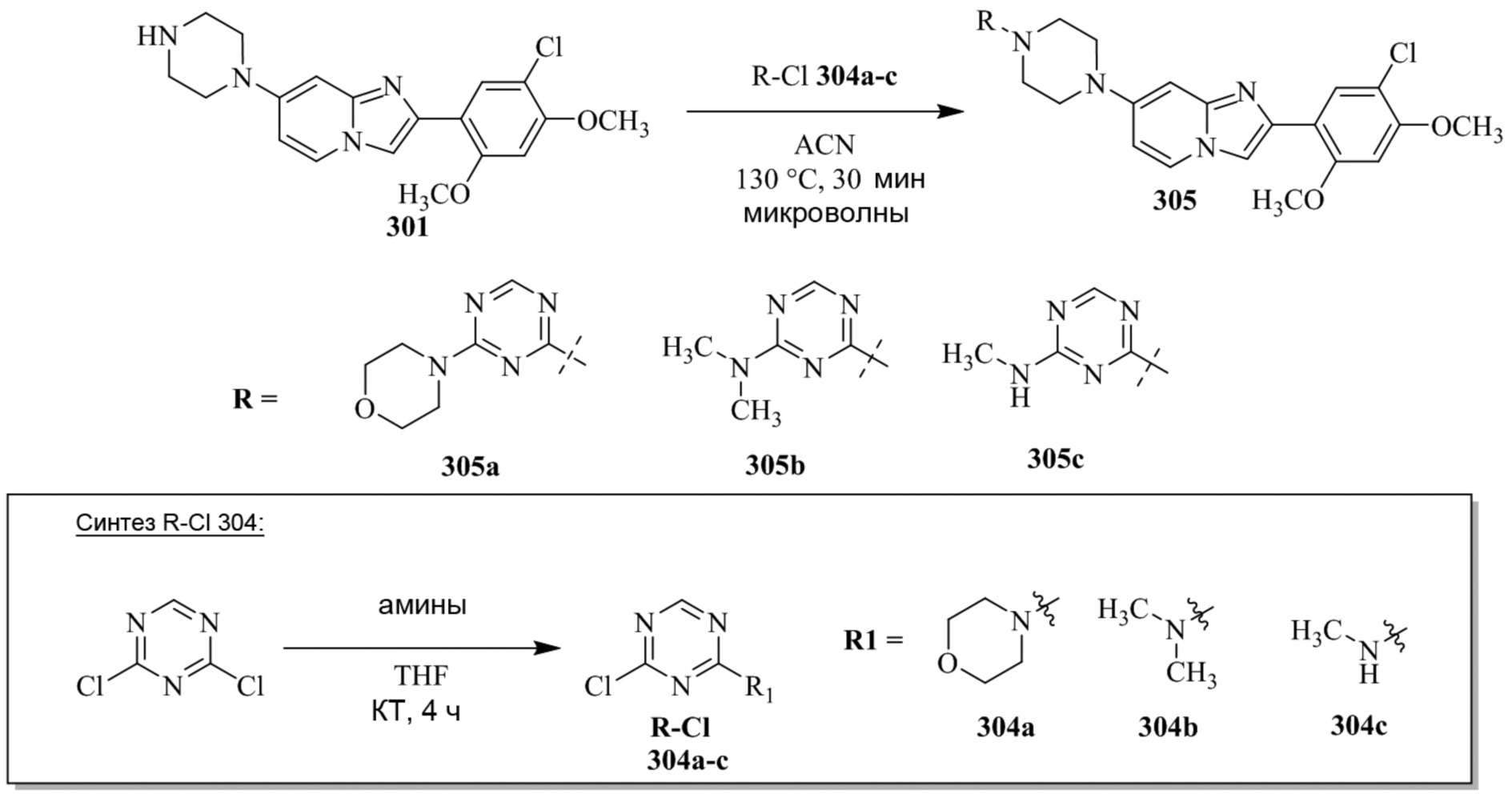
Получение 4-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-ил)морфолина 305a; (пример 449);
В раствор 2,4-дихлор-1,3,5-триазина (200 мг, 1,34 ммоль) в THF (5,0 мл) добавляли морфолин (151,0 мг, 1,74 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч и затем гасили водой. Осадок собирали посредством фильтрования, промывали водой и сушили для того, чтобы получить соединение 4-(4-хлор-1,3,5-триазин-2-ил)морфолин 304a (150 мг, неочищенн.), которое использовали на следующей стадии без дополнительной очистки. ESI+APCI MS m/z 201 [M+H]+.
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (100 мг, 0,26 ммоль) в CH3CN (1,0 мл) добавляли 4-(4-хлор-1,3,5-триазин-2-ил)морфолин 304a (81 мг, 1,40 ммоль). Реакционную смесь нагревали при 130°C в микроволновом реакторе в течение 30 мин прежде, чем ее гасили водой. Образованный осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенный материал очищали с помощью CombiFlash Companion (силикагель, 90:9:1 CH2Cl2/MeOH/гидроксид аммония) для того, чтобы получить 4-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-ил)морфолин 305a в виде твердого вещества грязно-белого цвета (7,0 мг, 5%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,38 (д, J=7,5 Гц, 1H), 8,19 (с, 1H), 8,14 (с, 1H), 8,06 (с, 1H), 6,90 (д, J=7,8, 1H), 6,88 (с, 1H), 6,71 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,89 (с, 4H), 3,72 (д, J=4,2 Гц, 4H), 3,62 (с, 4H), 3,33 (с, 4H). ВЭЖХ (способ 4) 97,5% (AUC), tR=12,41 мин. ESI+APCI MS m/z 537 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)- N , N -диметил-1,3,5-триазин-2-амина 305b (пример 450);
В раствор 2,4-дихлор-1,3,5-триазина (200 мг, 1,34 ммоль) в THF (5,0 мл) добавляли N,N-диметиламина гидрохлорид (119 мг, 1,47 ммоль) и DIPEA (518 мг, 4,0 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч и затем гасили водой. Образованный осадок собирали посредством фильтрования, промывали водой и сушили для того, чтобы получить соединение 4-хлор-N,N-диметил-1,3,5-триазин-2-амин 304b (120 мг). Неочищенный материал использовали на следующей стадии без дополнительной очистки. ESI+APCI MS m/z 159 [M+H]+.
Соединение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N,N-диметил-1,3,5-триазин-2-амин 305b получали аналогичным образом, как 4-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-ил)морфолин 305a, и получали в виде твердого вещества грязно-белого цвета (выход 22%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,36 (д, J=7,5 Гц, 1H), 8,15 (с, 1H), 8,14 (с, 1H), 8,04 (с, 1H), 6,87 (ушир. с, 2H), 6,71 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,89 (с, 4H), 3,33 (с, 4H), 3,09 (с, 6H). ВЭЖХ (способ 4) 98,5% (AUC), tR=12,00 мин. ESI+APCI MS m/z 495 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-N-метил-1,3,5-триазин-2-амина 305c (пример 451);
Соединение 4-хлор-N-метил-1,3,5-триазин-2-амин 304c получали аналогичным образом, как 4-хлор-N,N-диметил-1,3,5-триазин-2-амин 304b, и неочищенный материал использовали на следующей стадии без дополнительной очистки. ESI+APCI MS m/z 145 [M+H]+.
Соединение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N-метил-1,3,5-триазин-2-амин 305c получали аналогичным образом, как 4-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-ил)морфолин 305a, и получали в виде твердого вещества грязно-белого цвета (выход 23%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,35 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,03 (ушир. с, 2H), 7,35-7,23 (м, 1H), 6,87 (с, 1H), 6,87 (д, J=10,5 Гц, 1H), 6,72 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,89 (ушир. с, 4H), 3,33 (ушир. с, 4H), 2,78 (д, J=4,5 Гц, 3H). ВЭЖХ (способ 4) 95,1% (AUC), tR=11,91 мин. ESI+APCI MS m/z 481 [M+H]+.
Схема 2-4
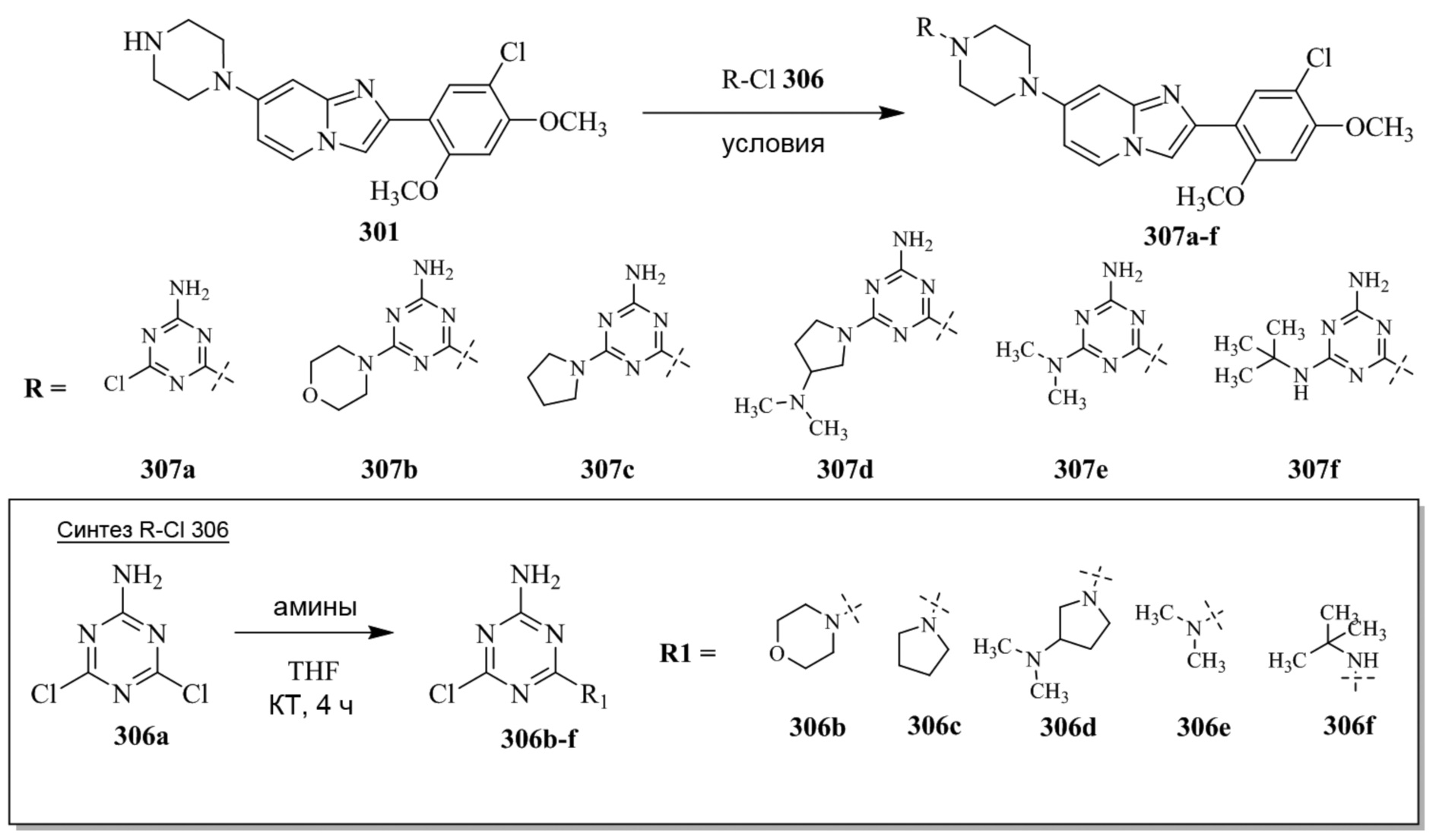
Получение 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-амина 307a (пример 361);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (300 мг, 0,80 ммоль) в CH3CN (1,0 мл) добавляли 4,6-дихлор-1,3,5-триазин-2-амин 306a (266 мг, 1,61 ммоль). Реакционную смесь нагревали при 130°C в микроволновом реакторе в течение 30 мин. Затем реакционную смесь гасили водой и образованный осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенный материал очищали с помощью CombiFlash Companion (силикагель, 90:9:1 CH2Cl2/MeOH/гидроксид аммония) для того, чтобы получить 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-амин 307a (120 мг, 29%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,38 (д, J=7,5 Гц, 1H), 8,14 (с, 1H), 8,06 (с, 1H), 7,43 (д, J=15,3 Гц, 2H), 6,91-6,85 (м, 2H), 6,73 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,90-3,80 (м, 4H), 3,40-3,30 (м, 4H). ВЭЖХ (способ 1) 91,4% (AUC), tR=13,0 мин. ESI+APCI MS m/z 501 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-6-морфолино-1,3,5-триазин-2-амина 307b (пример 379);
В раствор 4,6-дихлор-1,3,5-триазин-2-амина 306a (150 мг, 0,90 ммоль) в THF (5,0 мл) добавляли морфолин (87 мг, 1,00 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. Реакционную смесь гасили водой и образованный осадок собирали посредством фильтрования, промывали водой и сушили для того, чтобы получить соединение 4-хлор-6-морфолино-1,3,5-триазин-2-амин 306b (150 мг). Неочищенное соединение использовали на следующей стадии без дополнительной очистки. ESI+APCI MS m/z 216 [M+H]+.
Соединение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-6-морфолино-1,3,5-триазин-2-амин 307b получали аналогичным образом, как соединение 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-амин 307a, и получали в виде твердого вещества грязно-белого цвета (выход 7%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,35 (д, J=7,5 Гц, 1H), 8,16 (с, 1H), 8,03 (с, 1H), 6,87 (с, 1H), 6,87 (д, J=12,9 Гц, 1H), 6,72 (с, 1H), 6,36 (ушир. с, 2H), 4,01 (с, 3H), 3,93 (с, 3H), 3,87- 3,75 (м, 4H), 3,69-3,54 (м, 8H), 3,28-3,20 (м, 4H). ВЭЖХ (способ 1) 98,1% (AUC), tR=11,86 мин. ESI+APCI MS m/z 552 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-6-(пирролидин-1-ил)-1,3,5-триазин-2-амина 307c (пример 431);
Соединение 4-хлор-6-(пирролидин-1-ил)-1,3,5-триазин-2-амин 306c получали аналогичным образом, как 4-хлор-6-морфолино-1,3,5-триазин-2-амин 306b, и неочищенный материал использовали на следующей стадии без дополнительной очистки. ESI+APCI MS m/z 200 [M+H]+.
Соединение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-6-(пирролидин-1-ил)-1,3,5-триазин-2-амин 307c получали аналогичным образом, как 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-амин 307a, и получали в виде твердого вещества грязно-белого цвета (выход 10%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,35 (д, J=7,2 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 6,87-6,83 (м, 2H), 6,72 (с, 1H), 6,26 (ушир. с, 2H), 4,01 (с, 3H), 3,93 (с, 3H), 3,87-3,79, 3,49-3,35 (м, 4H), 3,38-3,21 (м, 4H), 1,86 (т, J=6,4 Гц, 4H). ВЭЖХ (способ 5) 98,7% (AUC), tR=12,74 мин. ESI+APCI MS m/z 536 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-6-(3-(диметиламино)пирролидин-1-ил)-1,3,5-триазин-2-амина 307d (пример 436);
Соединение 4-хлор-6-(3-(диметиламино)пирролидин-1-ил)-1,3,5-триазин-2-амин 306d получали аналогичным образом, как 4-хлор-6-морфолино-1,3,5-триазин-2-амин 306b, неочищенный материал использовали на следующей стадии без дополнительной очистки. ESI+APCI MS m/z 243 [M+H]+.
Соединение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-6-(3-(диметиламино)пирролидин-1-ил)-1,3,5-триазин-2-амин 307d получали аналогичным образом, как 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-амин 307a, и получали в виде твердого вещества грязно-белого цвета (6,4%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,35 (д, J=7,6 Гц, 1H), 8,18 (с, 1H), 8,03 (с, 1H), 6,87 (с, 1H), 8,85 (дд, J=2,4 Гц, 7,6 Гц, 1H), 6,72 (д, J=2,0 Гц, 1H), 6,30 (ушир. с, 2H), 4,01 (с, 3H), 3,94 (с, 3H), 3,87-3,79 (м, 4H), 3,76-3,58 (м, 2H), 3,28-3,21 (м, 4H), 3,13-2,92 (м, 1H), 2,69-2,62 (м, 2H), 2,21-2,15 (м, 6H), 2,12-2,03 (м, 1H), 1,75-1,71 (м, 1H). ВЭЖХ (способ 1) 97,0% (AUC), tR=11,1 мин. ESI+APCI MS m/z 579 [M+H]+.
Получение 6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)- N 2, N 2-диметил-1,3,5-триазин-2,4-диамина 307e (пример 440);
В раствор 4,6-дихлор-1,3,5-триазин-2-амина 306a (300 мг, 2,72 ммоль) в THF (5,0 мл) добавляли диметиламина гидрохлорид (220 мг, 1,00 ммоль) и DIPEA (703 мг, 5,45 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч и затем гасили водой. Образованный осадок собирали посредством фильтрования, промывали водой и сушили для того, чтобы получить 6-хлор-N2,N2-диметил-1,3,5-триазин-2,4-диамин 306e (150 мг). Неочищенный материал использовали на следующей стадии без дополнительной очистки.
ESI+APCI MS m/z 174 [M+H]+.
Соединение 6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N2,N2-диметил-1,3,5-триазин-2,4-диамин 307e получали аналогичным образом, как 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-амин 307a, и получали в виде твердого вещества грязно-белого цвета (выход 22%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,36 (д, J=7,5 Гц, 1H), 8,14 (с, 1H), 8,05 (с, 1H), 6,90-6,88 (м, 2H), 6,72 (с, 1H),6,25 (ушир. с, 2H), 4,01 (с, 3H), 3,94 (с, 3H), 3,88-3,80 (м, 4H), 3,28-3,21 (м, 4H), 3,02 (с, 6H). ВЭЖХ (способ 5) 99,69% (AUC), tR=12,39 мин. ESI+APCI MS m/z 510 [M+H]+.
Получение N 2-(трет-бутил)-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2,4-диамина 307f (пример 446);
Соединение N2-(трет-бутил)-6-хлор-1,3,5-триазин-2,4-диамин 306f получали аналогичным образом, как 4-хлор-6-морфолино-1,3,5-триазин-2-амин 306b, неочищенный материал использовали на следующей стадии без дополнительной очистки. ESI+APCI MS m/z 202 [M+H]+.
Соединение N2-(трет-бутил)-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2,4-диамин 307f получали аналогичным образом, как 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-1,3,5-триазин-2-амин 307a, и получали в виде твердого вещества грязно-белого цвета (выход 14%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,02 (с, 1H), 6,86 (с, 1H), 6,85 (дд, J=2,4 Гц, 7,6 Гц, 1H), 6,72 (д, J=1,6 Гц 1H), 6,06 (ушир. с, 3H), 4,00 (с, 3H), 3,93 (с, 3H), 3,85-3,78 (м, 4H), 3,30-3,23 (м, 4H), 1,36 (с, 9H). ВЭЖХ (способ 1) 99,2% (AUC), tR=12,69 мин. ESI+APCI MS m/z 538 [M+H]+.
Схема 2-5
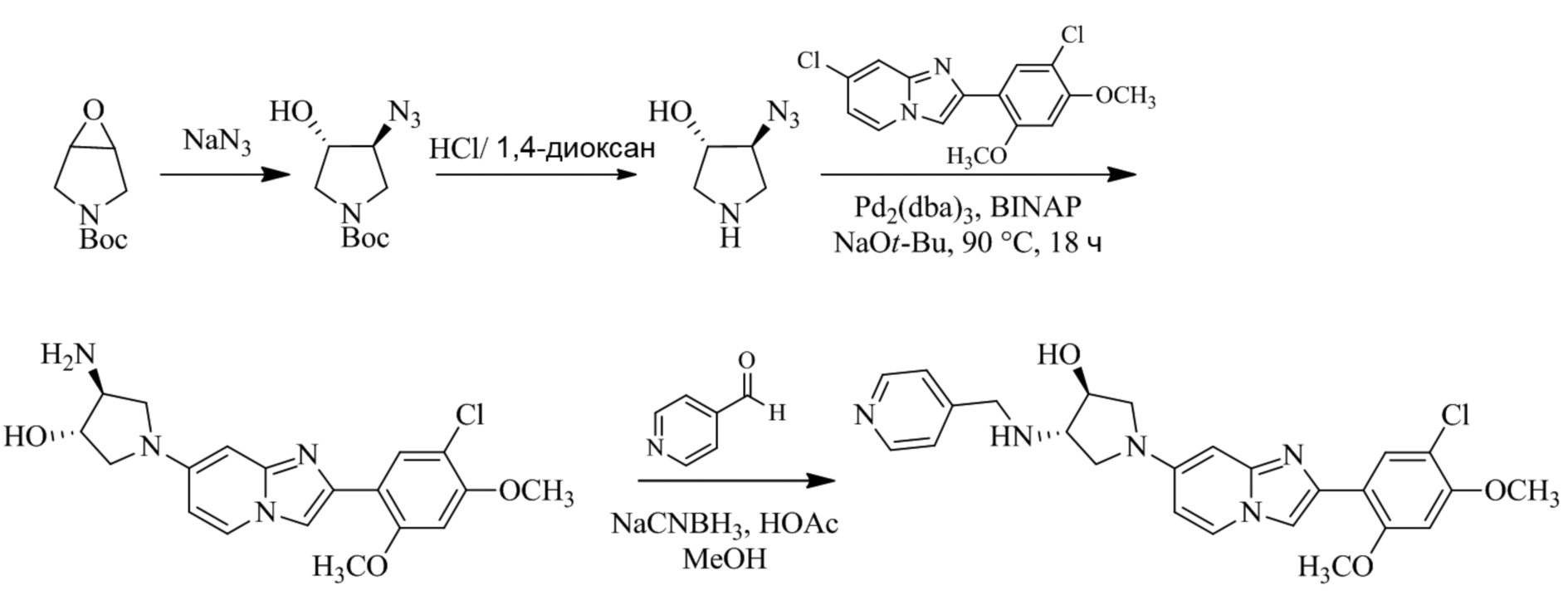
Получение транс - трет -бутил-3-азидо-4-гидроксипирролидин-1-карбоксилата;
В 50 мл круглодонную колбу загружали трет-бутил-6-окса-3-азабицикло[3.1.0]гексан-3-карбоксилат (500 мг, 2,69 ммоль), 16 мл метанола и 2 мл воды. В этот раствор добавляли NaN3 (877 мг, 13,5 ммоль) и NH4Cl (647 мг, 12,1 ммоль) и реакционную смесь нагревали при 60°C в течение 16 ч. Реакционную смесь разводили водой и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали раствором NaHCO3, после чего следовала вода и затем солевой раствор; сушили над Na2SO4, фильтровали и концентрировали для того, чтобы получить транс-трет-бутил-3-азидо-4-гидроксипирролидин-1-карбоксилат (575 мг, 93%) в виде бесцветного сиропа.
1H ЯМР (400 МГц, CDCl3): δ 4,27-4,21 (м, 1H), 3,92 (ушир. с, 1H), 3,76-3,55 (м, 2H), 3,49-3,27 (м, 2H), 2,65-2,37 (м, 1H), 1,46 (с, 9H).
Получение транс -4-азидопирролидин-3-ола гидрохлорида;
В 50 мл круглодонную колбу загружали транс-трет-бутил-3-азидо-4-гидроксипирролидин-1-карбоксилат (570 мг, 2,49 ммоль) и 5 мл дихлорметана. В этот раствор добавляли HCl/1,4-диоксан (4 М, 2 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Избыток растворителей удаляли при пониженном давлении для того, чтобы получить продукт транс-4-азидопирролидин-3-ола гидрохлорид (400 мг, 95%) в виде твердого вещества коричневого цвета, которое переносили на следующую стадию без дополнительной очистки.
Получение транс -4-амино-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ола;
Суспензию 7-хлор-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина (50 мг, 0,15 ммоль), транс-4-азидопирролидин-3-ола гидрохлорида (28 мг, 0,17 ммоль), (±) BINAP (12 мг, 0,01 ммоль) и NaOt-Bu (45 мг, 0,46 ммоль) в диоксане (5 мл) дегазировали аргоном в течение 15 мин. Быстро добавляли Pd2(dba)3 (5,6 мг, 0,006 ммоль). Получаемую реакционную смесь перемешивали при 90°C в течение 16 ч. Реакционную смесь охлаждали, фильтровали через подушку целита и выпаривали досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить транс-4-амино-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ол (14 мг, 23%) в виде твердого вещества светло-коричневого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,25 (д, J=7,7 Гц, 1H), 8,16 (с, 1H), 7,93 (с, 1H), 6,85 (с, 1H), 6,45 (дд, J=2,3, 7,5 Гц, 1H), 6,17 (с, 1H), 5,15 (д, J=3,2 Гц, 1H), 3,99 (с, 3H), 3,97 (ушир. с, 2H), 3,92 (с, 3H), 3,66-3,58 (м, 1H), 3,58-3,51 (м, 1H), 3,16-3,10 (м, 1H), 3,08-3,01 (м, 1H). ВЭЖХ (то же, что способ 1, за исключением обнаружения на 220 нМ) 96,0% (AUC), tR=9,21 мин; ESI MS m/z 389 [M+H]+.
Получение транс -1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-4-((пиридин-4-илметил)амино)пирролидин-3-ола (пример 439);
Соединение транс-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-4-((пиридин-4-илметил)амино)пирролидин-3-ол получали аналогичным образом, как свободное основание (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида (пример 298), и получали в виде твердого вещества коричневого цвета (50%).
1H ЯМР (400 МГц, DMSO-d6): 8,48 (дд, J=1,6, 4,5 Гц, 2H), 8,25 (д, J=7,4 Гц, 1H), 8,16 (с, 1H), 7,93 (с, 1H), 7,37 (д, J=6,0 Гц, 2H), 6,85 (с, 1H), 6,45 (дд, J=2,2, 7,4 Гц, 1H). 6,17 (д, J=1,8 Гц, 1H), 5,13 (д, J=4,0 Гц, 1H), 4,16 (с, H), 3,99 (с, 3H), 3,92 (с, 3H), 3,82 (с, 2H), 3,64-3,58 (м, 1H), 3,57-3,49 (м, 1H), 3,22-3,08 (м, 1H). ESI MS m/z 480 [M+H]+.
Схема 2-6
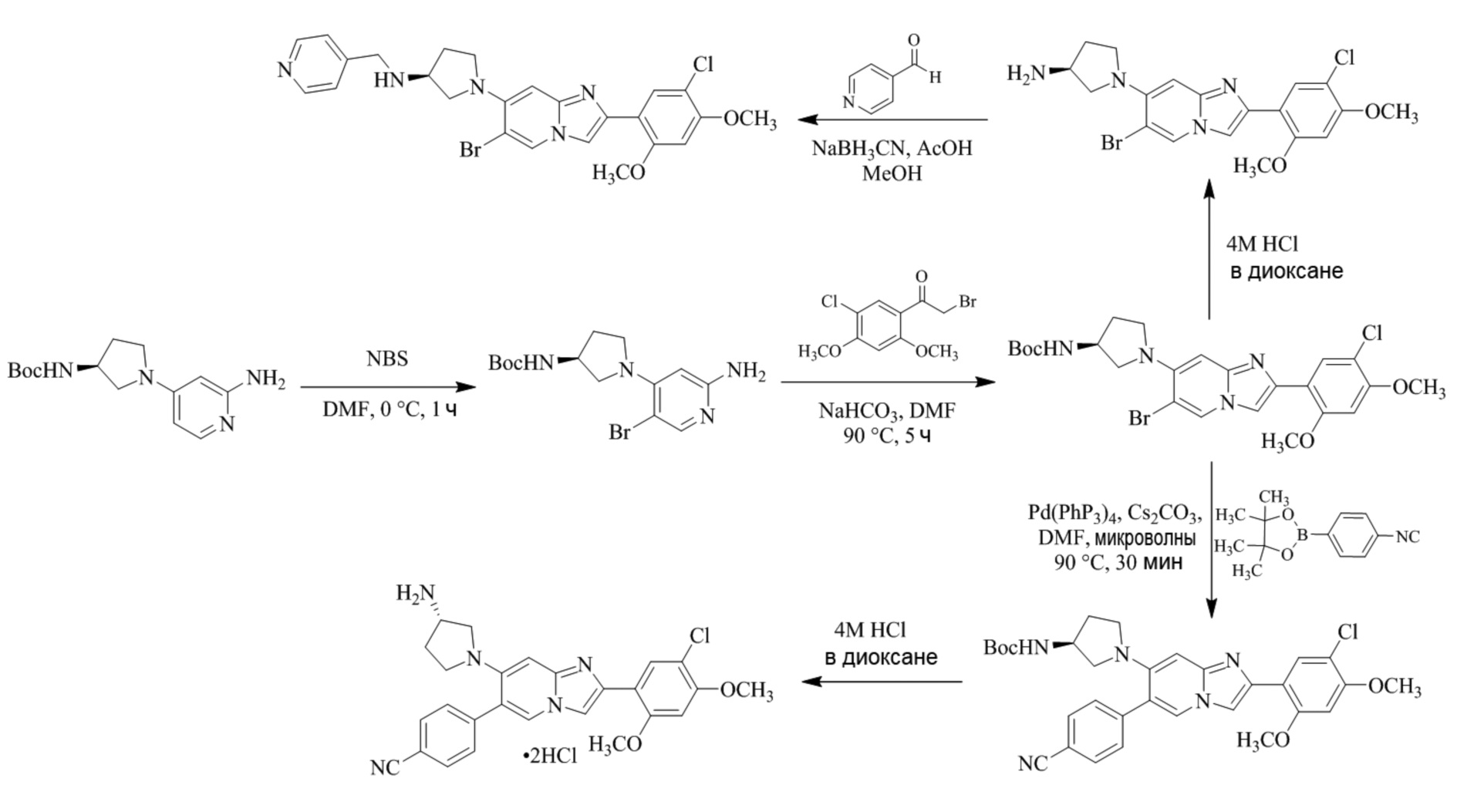
Получение трет -бутил(1-(2-амино-5-бромпиридин-4-ил)пирролидин-3-ил)карбамата;
В раствор трет-бутил(1-(2-аминопиридин-4-ил)пирролидин-3-ил)карбамата (1,80 г, 6,47 ммоль) в 20 мл DMF добавляли NBS (1,15 г, 6,47 ммоль) по частям при 0°C и реакционную смесь перемешивали при той же температуре в течение 1 ч. Реакционную смесь разводили водой и экстрагировали в CHCl3 (4×100 мл). Органический слой промывали раствором NaHCO3, после чего следовала вода и затем солевой раствор; сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии (силикагель, 9:1 CHCl3/MeOH) для того, чтобы получить трет-бутил(1-(2-амино-5-бромпиридин-4-ил)пирролидин-3-ил)карбамат (700 мг, 30%) в виде твердого вещества светло-коричневого цвета.
1H ЯМР (400 МГц, CDCl3): δ 7,93 (с, 1H), 5,73 (с, 1H), 4,27 (ушир. с, 1H), 4,23 (с, 2H), 3,78-3,68 (м, 2H), 3,54-3,46 (м, 1H), 3,44-3,37 (м, 1H), 2,25-2,14 (м, 1H), 1,95-1,85 (м, 1H).
Получение ( S )- трет -бутил(1-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)карбамата;
Соединение (S)-трет-бутил(1-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат получали аналогичным образом, как (S)-трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат 77 (пример 44), и получали в виде твердого вещества светло-коричневого цвета (765 мг, 47%).
1H ЯМР (400 МГц, CDCl3): δ 8,33 (с, 1H), 8,21 (с, 1H), 7,85 (с, 1H), 6,95 (с, 1H), 6,57 (с, 1H), 4,83 (ушир. с, 1H), 4,35 (ушир. с, 1H), 4,00 (с, 3H), 3,96 (с, 3H), 3,68-3,60 (м, 1H), 3,60-3,52 (м, 1H), 3,42-3,35 (м, 1H), 3,34-3,25 (м, 1H), 2,38-2,27 (м, 1H), 1,95-1,86 (м, 1H), 1,46 (с, 9H).
Получение ( S )-1-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-амина;
Соединение (S)-трет-бутил(1-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат обрабатывали с использованием 4M HCl в 1,4-диоксане в течение 2 ч, концентрировали при пониженном давлении и затем ощелачивали водным аммиаком для того, чтобы получить (S)-1-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-амин в виде твердого вещества желтого цвета (выход 78%).
1H ЯМР (400 МГц, CDCl3): δ 8,35 (с, 1H), 8,19 (с, 1H), 7,85 (с, 1H), 6,87 (с, 1H), 6,58 (с, 1H), 3,99 (с, 3H), 3,95 (с, 3H), 3,72-3,65 (м, 1H), 3,65-3,60 (м, 1H), 3,60-3,54 (м, 1H), 3,44-3,36 (м, 1H), 3,27-3,22 (м, 1H), 2,31-2,21 (м, 1H), 1,82-1,72 (м, 1H).
Получение ( S )-1-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина (пример 438);
Соединение (S)-1-(6-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амин получали аналогичным образом, как свободное основание (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметил)пирролидин-3-амина тригидрохлорида (пример 298), и получали в виде твердого вещества желтого цвета (48%).
1H ЯМР (400 МГц, CDCl3): δ 8,58-8,51 (м, 2H), 8,35 (с, 1H), 8,20 (с, 1H), 7,86 (с, 1H), 7,31-7,28 (м, 2H), 6,91 (с, 1H), 6,58 (с, 1H), 3,99 (с, 3H), 3,96 (с, 3H), 3,87 (с, 2H), 3,61-3,45 (м, 3H), 3,45-3,33 (м, 2H), 2,31-2,21 (м, 1H), 1,93-1,82 (м, 1H). ВЭЖХ (способ 2) 97,1% (AUC), tR=11,69 мин; ESI MS m/z 544[(M+2)+H]+.
Получение ( S )- трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)-6-(4-цианофенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)карбамата;
Соединение (S)-трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)-6-(4-цианофенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат получали аналогичным образом, как 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-бензойную кислоту, и получали в виде твердого вещества желтого цвета (42%).
1H ЯМР (400 МГц, CDCl3): δ 8,38 (с, 1H), 7,91 (с, 1H), 7,82 (с, 1H), 7,73 (д, J=8,4 Гц, 2H), 7,62 (д, J=8,4 Гц, 2H), 6,93 (с, 1H), 6,59 (с, 1H), 4,52 (ушир. с, 1H), 4,14 (ушир. с, 1H), 3,99 (с, 3H), 3,96 (с, 3H), 3,12-3,02 (м, 2H), 2,99-2,90 (м, 1H), 2,77-2,69 (м, 1H), 2,23-2,12 (м, 1H), 1,77-1,70 (м, 1H), 1,43 (с, 9H).
Получение ( S )-4-(7-(3-аминопирролидин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-6-ил)бензонитрила дигидрохлорида (пример 445);
Соединение (S)-4-(7-(3-аминопирролидин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-6-ил)бензонитрила дигидрохлорид получали посредством обработки (S)-трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)-6-(4-цианофенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамата с использованием 4M HCl в 1,4-диоксане в течение 2 ч, концентрирования при пониженном давлении и наконец лиофилизирования, и получали в виде твердого вещества белого цвета (69%).
1H ЯМР (400 МГц, DMSO): δ 13,95 (с, 1H), 8,57 (с, 1H), 8,25 (с, 1H), 8,17 (с, 3H), 8,07 (с, 1H), 8,01 (д, J=8,2 Гц, 2H), 7,72 (д, J=8,2 Гц, 2H), 6,99 (с, 1H), 6,78 (с, 1H), 4,05 (с, 3H), 3,99 (с, 3H), 3,77 (с, 1H), 3,28-3,22 (м, 1H), 3,21-3,12 (м, 1H), 3,06-2,97 (м, 1H), 2,23-2,12 (м, 1H), 2,04-1,93 (м, 1H). ВЭЖХ (способ 1) 97,3% (AUC), tR=9,62 мин; APCI MS m/z 474 [M+H]+.
Схема 2-7
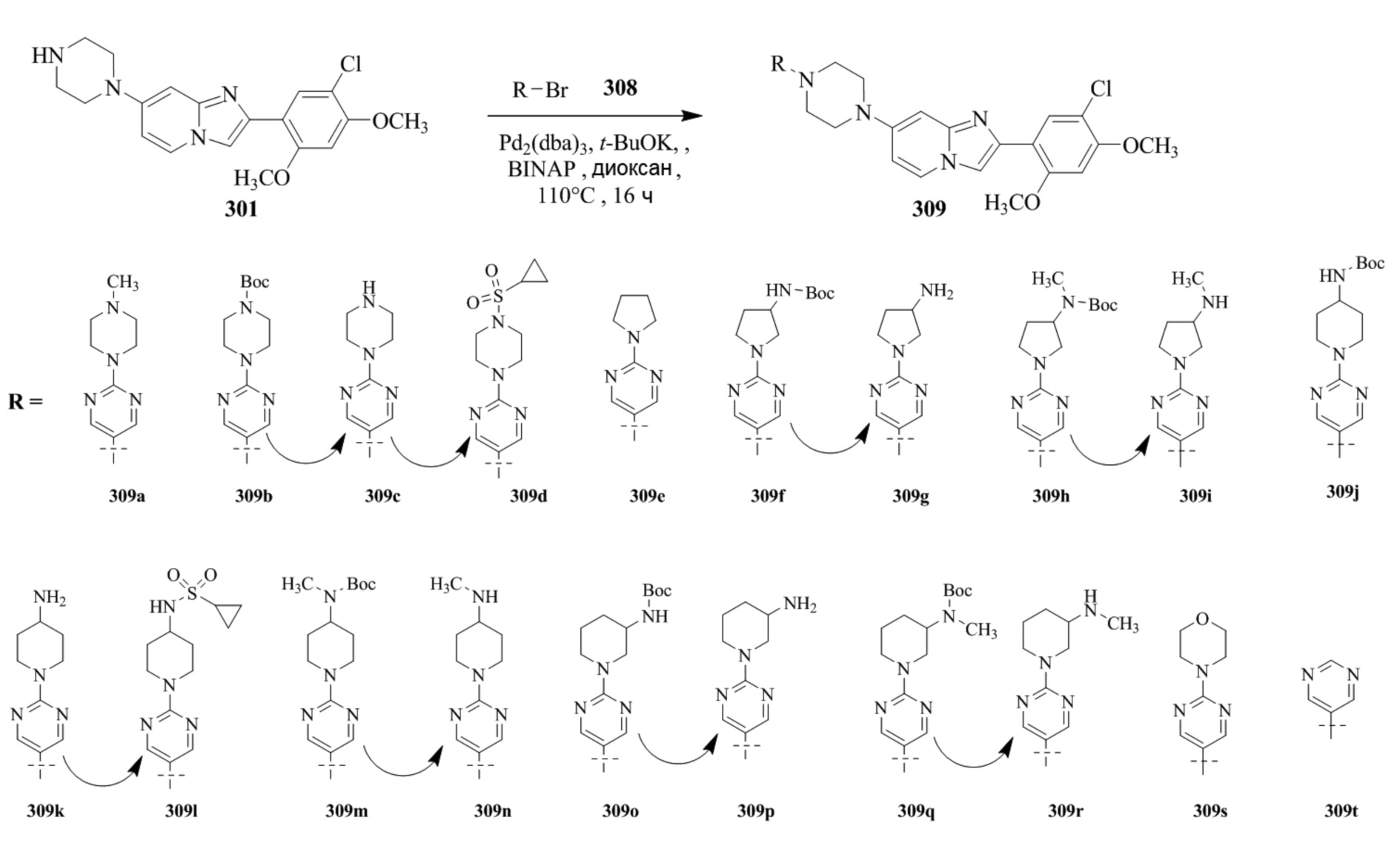
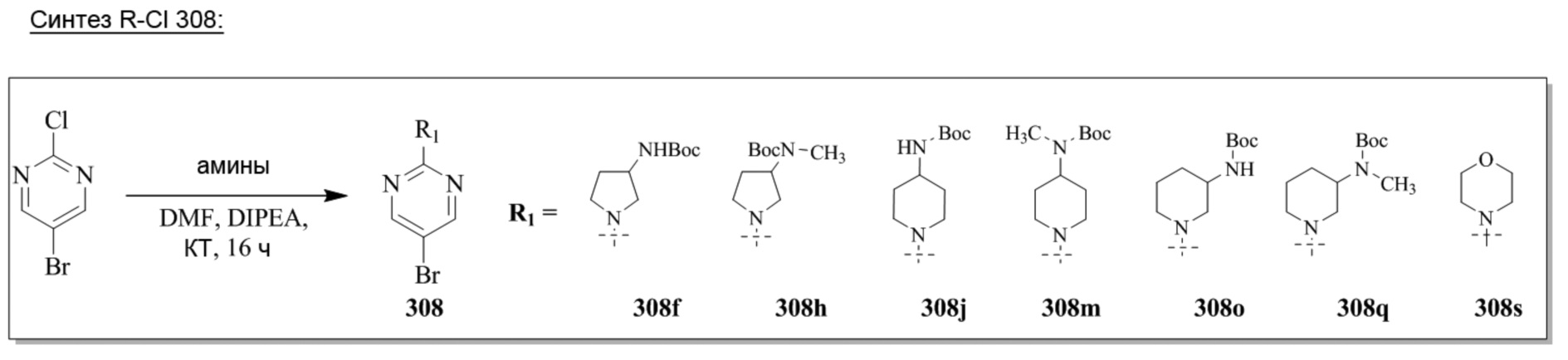
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(4-метилпиперазин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 309a (пример 358);
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (200 мг, 0,53 ммоль), 5-бром-2-(4-метилпиперазин-1-ил)пиримидина (165 мг, 0,64 ммоль), BINAP (33 мг, 0,05 ммоль) и KOt-Bu (150 мг, 1,3 ммоль) в 1,4-диоксане (8,0 мл) дегазировали аргоном в течение 15 мин. В суспензию добавляли Pd2(dba)3 (49 мг, 0,05 ммоль) и реакционную смесь дополнительно дегазировали аргоном в течение 5 мин. Реакционную смесь перемешивали при 100-110°C в течение 16 ч прежде, чем ее охлаждали до комнатной температуры. Реакционную смесь фильтровали через подушку целита и фильтрат концентрировали досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(4-метилпиперазин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 309a (пример 358) (20 мг, 6,8%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,27 (с, 2H), 8,18 (с, 1H), 8,04 (с, 1H), 6,87 (с, 1H), 6,85 (с, 1H), 6,74 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,63 (с, 4H), 3,37 (с, 4H), 3,16 (с, 4H), 2,38 (с, 4H), 2,22 (с, 3H). ВЭЖХ (способ 1) 92,31% (AUC), tR=12,03 мин. ESI+APCI MS m/z 549 [M+H]+.
Получение трет -бутил-4-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперазин-1-карбоксилата 309b;
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (2,0 г, 5,3 ммоль), трет-бутил-4-(5-бромпиримидин-2-ил)пиперазин-1-карбоксилата (3,68 г, 10,8 ммоль), BINAP (334 мг, 0,536 ммоль) и NaOt-Bu (1,29 г, 13,4 ммоль) в 1,4-диоксане (30 мл) дегазировали аргоном в течение 15 мин. В суспензию добавляли Pd2(dba)3 (344 мг, 0,37 ммоль) и реакционную смесь дополнительно дегазировали аргоном в течение 5 мин. Затем реакционную смесь перемешивали при 100-110°C в течение 16 ч прежде, чем ее охлаждали до комнатной температуры. Реакционную смесь фильтровали через подушку целита и фильтрат концентрировали досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперазин-1-карбоксилат 309b (670 мг, 20%) в виде твердого вещества светло-коричневого цвета. ESI+APCI MS m/z 635 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперазин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 309c (пример 344);
В перемешиваемый раствор трет-бутил-4-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперазин-1-карбоксилата 309b (30 мг, 0,047 ммоль) в 2,2,2-трифторэтаноле (2,0 мл) добавляли триметилсилилхлорид (0,04 мл) при 0°C и реакционную смесь перемешивали при той же температуре до исчерпания исходного материала, как показывал TLC анализ. Вышеуказанную реакционную смесь концентрировали и лиофилизировали для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперазин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина бис(2,2,2-трифторацетат) 309c (пример 344) (18 мг, 60%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,73 (с, 1H), 9,10 (с, 2H), 8,57 (д, J=7,6 Гц, 1H), 8,34 (с, 2H), 8,29 (с, 1H), 8,03 (с, 1H), 7,39 (д, J=6,4 Гц, 1H), 6,99 (с, 1H), 6,83 (с, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,85-3,84 (м, 4H), 3,67 (с, 4H), 3,22 (с, 4H), 3,14 (с, 4H).
ВЭЖХ (способ 1) 94,80% (AUC), tR=11,83 мин. ESI+APCI MS m/z 534 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(4-(циклопропилсульфонил)пиперазин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 309d (пример 369);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперазин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 309c (100 мг, 0,18 ммоль), N,N-диизопропилэтиламина (80 мкл, 0,47 ммоль) и циклопропансульфонилхлорида (20 мкл, 0,49 ммоль) в дихлорметане (4,0 мл) перемешивали при комнатной температуре в течение 2 ч в атмосфере N2. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×20 мл), объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством препаративной ВЭЖХ для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(4-(циклопропилсульфонил)пиперазин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 2,2,2-трифторацетат 309d (пример 369) (10 мг, 7,3%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,58 (д, J=8,0 Гц, 1H), 8,32 (с, 1H), 8,29 (с, 1H), 7,93 (с, 1H), 7,41 (дд, J=2,4, 7,6 Гц, 1H), 6,96 (с, 1H), 6,79 (д, J=2 Гц, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,75 (т, J=4,4 Гц, 4H), 3,67 (т, J=5,6 Гц, 4H), 3,25 (т, J=4,8 Гц, 4H), 3,22 (т, J=4,8 Гц, 4H), 2,63-2,59 (м, 1H), 1,01-0,91 (м, 4H), ВЭЖХ (способ 1) 95,71% (AUC), tR=13,37 мин. ESI+APCI MS m/z 638,8 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пирролидин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 309e (пример 333);
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (200 мг, 0,53 ммоль), 5-бром-2-(пирролидин-1-ил)пиримидина (236 мг, 1,00 ммоль), BINAP (33 мг, 0,053 ммоль) и KOt-Bu (180 мг, 1,6 ммоль) в 1,4-диоксане (4,0 мл) дегазировали аргоном в течение 15 мин. В суспензию добавляли Pd(OAc)2 (18 мг, 0,026 ммоль) и реакционную смесь дополнительно дегазировали аргоном в течение 5 мин. Реакционную смесь перемешивали при 100-110°C в течение 16 ч прежде, чем ее охлаждали до комнатной температуры. Реакционную смесь фильтровали через подушку целита и фильтрат концентрировали досуха. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пирролидин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 309e (пример 333) (12 мг, 4%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=7,5 Гц, 1H), 8,24 (с, 2H), 8,17 (с, 1H), 8,04 (с, 1H), 6,88 (д, J=5,4 Гц, 2H), 6,73 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,46-3,37(м, 8H), 3,12 (с, 4H), 1,93-1,89 (м, 4H). ВЭЖХ (способ 1) 98,4% (AUC), tR=12,25 мин. ESI+APCI MS m/z 520,0 [M+H]+.
Получение трет -бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)карбамата 308f;
В раствор 5-бром-2-хлорпиримидина (600 мг, 3,1 ммоль) и N,N-диизопропилэтиламина (1,35 мл, 7,7 ммоль) в DMF (5 мл) добавляли трет-бутилпирролидин-3-илкарбамат (634 мг, 3,4 ммоль), реакционную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере N2. Реакционную смесь разводили водой и экстрагировали d EtOAc (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток растирали в порошок c н-гексаном и сушили для того, чтобы получить трет-бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)карбамат 308f (700 мг, 66%) в виде твердого вещества грязно-белого цвета. E SI+APCI MS m/z 344 [M+H]+.
Получение трет -бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)карбамата 309f;
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (300 мг, 0,81 ммоль), трет-бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)карбамата 308f (550 мг, 1,6 ммоль), [(t-Bu)3PH]BF4 (11 мг, 0,04 ммоль) и NaOt-Bu (232 мг, 2,4 ммоль) в 1,4-диоксане (8 мл) дегазировали аргоном в течение 15 мин. В суспензию добавляли Pd(OAc)2 (9 мг, 0,04 ммоль) и реакционную смесь дополнительно дегазировали аргоном в течение 5 мин. Реакционную смесь перемешивали при 100-110°C в течение 16 ч прежде, чем ее охлаждали до комнатной температуры. Реакционную смесь фильтровали через подушку целита и фильтрат концентрировали досуха. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)карбамат 309f (38 мг, 7%) в виде твердого вещества светло-желтого цвета. ESI+APCI MS m/z 633 [M+H]+.
Получение 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-амина дигидрохлорида 309g (пример 378);
В раствор трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)карбамата 309f (75 мг, 0,11 ммоль) в 2,2,2-трифторэтаноле (1 мл) добавляли TMS-Cl (0,1 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь испаряли досуха и остаток растирали в порошок с н-пентаном для того, чтобы получить 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-амина дигидрохлорид 309g (пример 378) (40 мг, 63%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 13,84 (ушир. с, 1H), 8,62 (д, J=6,0 Гц, 1H), 8,4-8,29 (м, 6H), 8,06 (т, J=7,2 Гц, 1H), 7,38 (д, J=7,8 Гц, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,75-3,56 (м, 9H), 3,52-3,48 (м, 1H), 3,17 (м, 3H), 2,14-2,06 (м, 1H); ВЭЖХ (способ 1) 90,23% (AUC), tR=11,49 мин. ESI+APCI MS m/z 533 [M+H]+.
Получение трет -бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)(метил)карбамата 308h;
Соединение трет-бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)(метил)карбамат 308h получали аналогичным образом, как соединение трет-бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)карбамат 308f, и получали с выходом 76%. ESI+APCI MS m/z 357 [M+H]+.
Получение трет -бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)(метил)карбамата 309h;
Соединение трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)(метил)карбамат 309h получали аналогичным образом, как трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)карбамат 309f, и получали с выходом 20%. ESI+APCI MS m/z 649 [M+H]+.
Получение 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-N-метилпирролидин-3-амина дигидрохлорида 309i (пример 401);
Соединение 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-N-метилпирролидин-3-амина дигидрохлорид 309i получали аналогичным образом, как соединение 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-амина дигидрохлорид 309g, и получали в виде аморфного твердого вещества желтого цвета (выход 78%).
1H ЯМР (300 МГц, DMSO-d6): δ 13,84 (ушир. с, 1H), 9,44 (т, J=4,8 Гц, 1H), 9,3 (т, J=5,6 Гц, 1H), 8,58 (д, J=7,6 Гц, 1H), 8,31 (д, J=8,8 Гц, 3H), 8,09 (с, 1H), 7,4 (дд, J1=2,4 Гц, J2=7,6 Гц, 1H), 6,98 (с, 1H), 6,86 (с, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,71-3,68 (м, 3H), 3,65-3,60 (м, 6H), 3,26-3,19 (м, 4H), 2,61 (с, 1H), 2,40-2,28 (м, 1H), 2,25-2,15 (м, 1H), ВЭЖХ (способ 6) 92,4% (AUC), tR=12,97 мин. ESI+APCI MS m/z 549 [M+H]+.
Получение трет -бутил(1-(5-бромпиримидин-2-ил)пиперидин-4-ил)карбамата 308j;
Соединение трет-бутил(1-(5-бромпиримидин-2-ил)пиперидин-4-ил)карбамат 308j получали аналогичным образом, как трет-бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)карбамат 308f, и получали в виде твердого вещества грязно-белого цвета (выход 81%). ESI+APCI MS m/z 357 [M+H]+.
Получение трет -бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ил)карбамата 309j;
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (500 мг, 1,3 ммоль), трет-бутил(1-(5-бромпиримидин-2-ил)пиперидин-4-ил)карбамата 308j (717 мг, 2,0 ммоль), [(t-Bu)3PH]BF4 (19 мг, 0,06 ммоль) и KOt-Bu (450 мг, 4,0 ммоль) в ксилоле (25 мл) дегазировали аргоном в течение 15 мин. Впоследствии в смесь загружали Pd(OAc)2 (15 мг, 0,06 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Получаемую реакционную смесь перемешивали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали через подушку целита. Фильтрат концентрировали и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ил)карбамат 309j (300 мг, 34%) в виде твердого вещества светло-желтого цвета. ESI+APCI MS m/z 649 [M+H]+.
Получение 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-амина 309k (пример 350);
В суспензию трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ил)карбамата 309j (250 мг, 0,38 ммоль) в 2,2,2-трифторэтаноле (5 мл) добавляли TMS-Cl (0,1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь испаряли досуха и разбавляли водным раствором NaHCO3. Водный слой экстрагировали в EtOAc (2×50 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-амин 309k (пример 350) (25 мг, 11%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,33 (д, J=7,8 Гц, 1H), 8,24 (с, 2H), 8,19 (с, 1H), 8,04 (с, 1H), 6,87 (ушир. с, 2H), 6,73 (с, 1H), 4,47-4,38 (м, 2H), 4,0 (с, 3H), 3,93 (с, 3H), 3,37-3,35 (м, 4H) 3,20-3,18 (м, 4H), 3,03-2,82 (м, 2H) 2,80-2,77 (м, 1H); ВЭЖХ (способ 1) 98,7% (AUC), tR=11,74 мин. ESI+APCI MS m/z 549 [M+H]+.
Получение N -(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ил)циклопропансульфонамида 309l (пример 393);
В суспензию трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ил)карбамата 309j (250 мг, 0,38 ммоль) в 2,2,2-трифторэтаноле (5 мл) добавляли TMS-Cl (0,1 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали, и остаток поднимали в дихлорметане (4 мл), N,N-диизопропилэтиламин (80 мкл, 0,45 ммоль). В суспензию добавляли циклопропансульфонилхлорид (20 мкл, 0,23 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере N2 и затем разбавляли водой. Водный слой экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2 для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(4-(циклопропилсульфонил)пиперазин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 309l (пример 393) (30 мг, 25%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,32 (д, J=7,5 Гц, 1H), 8,26 (с, 2H), 8,18 (с, 1H), 8,04 (с, 1H), 7,15 (д, J=7,8 Гц, 1H), 6,74 (с, 1H),4,42 (д, J=12,6 Гц, 2H), 4,02 (с, 3H), 3,94 (с, 3H), 3,62-3,57 (м, 4H), 3,18-3,16 (м, 4H), 3,0 (т, J=12,0 Гц, 2H), 2,62-2,56 (м, 1H), 1,90-1,86 (м, 2H), 1,44-1,40 (м, 2H), 0,96-0,93 (м, 4H); ВЭЖХ (способ 1) 90,58% (AUC), tR=12,56 мин.; ESI+APCI MS m/z 653 [M+H]+.
Получение трет -бутил(1-(5-бромпиримидин-2-ил)пиперидин-4-ил)(метил)карбамата 308m;
Соединение трет-бутил(1-(5-бромпиримидин-2-ил)пиперидин-4-ил)(метил)карбамат 8m получали аналогичным образом, как соединение трет-бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)карбамат 308f, и получали в виде твердого вещества грязно-белого цвета (выход 80%). ESI+APCI MS m/z 371 [M+H]+.
Получение трет -бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ил)(метил)карбамата 309m;
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (500 мг, 1,3 ммоль), трет-бутил(1-(5-бромпиримидин-2-ил)пиперидин-4-ил)(метил)карбамата (745 мг, 2,0 ммоль), BINAP (83 мг, 0,1 ммоль) и NaOt-Bu (387 мг, 4,0 ммоль) в толуоле (20 мл) дегазировали аргоном в течение 15 мин. Впоследствии в смесь загружали Pd2(dba)3 (123 мг, 0,13 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Реакционную смесь перемешивали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали через подушку целита. Фильтрат концентрировали и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ил)(метил)карбамат 309m (150 мг, 17%) в виде твердого вещества светло-желтого цвета. ESI+APCI MS m/z 663 [M+H]+.
Получение 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-N-метилпиперидин-4-амина дигидрохлорида 309n (пример 396);
Соединение 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-N-метилпиперидин-4-амина дигидрохлорид 309n получали аналогичным образом, как 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-амина дигидрохлорид 309g, и получали в виде твердого вещества желтого цвета (выход 70%).
1H ЯМР (300 МГц, DMSO-d6): δ 14,07 (с, 1H), 9,19 (ушир. с, 2H), 8,32 (с, 2H), 8,29 (с, 2H), 8,11 (с, 1H), 7,38 (д, J=8,4 Гц, 1H), 6,97 (с, 1H), 6,88 (с, 1H), 4,62 (д, J=13,8 Гц, 2H), 4,06 (с, 3H), 3,98 (с, 3H), 3,78-3,65 (м, 8H), 2,90 (т, J=12,0 Гц, 2H), 2,07 (д, J=12,0 Гц, 2H), 1,5 (к, J=2,7 Гц, 2H); ВЭЖХ (способ 1) 92,14% (AUC), tR=10,55 мин.; ESI+APCI MS m/z 563 [M+H]+.
Получение трет -бутил(1-(5-бромпиримидин-2-ил)пиперидин-3-ил)карбамата 308o;
Соединение трет-бутил(1-(5-бромпиримидин-2-ил)пиперидин-3-ил)карбамат 308o получали аналогичным образом, как трет-бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)карбамат 308f, и получали в виде твердого вещества грязно-белого цвета (выход 67%). ESI+APCI MS m/z 357 [M+H]+.
Получение трет -бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-3-ил)карбамата 309o;
Соединение трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-3-ил)карбамат 309o получали аналогичным образом, как трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)карбамат 309f, и получали в виде твердого вещества коричневого цвета (выход 27%). ESI+APCI MS m/z 649 [M+H]+
Получение 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-3-амина 309p (пример 417);
В суспензию трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-3-ил)карбамата 309o (150 мг, 0,23 ммоль) в 2,2,2-трифторэтаноле (5 мл) добавляли TMS-Cl (0,2 мл), реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали досуха. Остаток поднимали в водном растворе NaHCO3 (10 мл) и экстрагировали с использованием DCM (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-3-амин 309p (пример 417) (25 мг, 20%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,45 (д, J=7,6 Гц, 1H), 8,26 (с, 2H), 8,04 (с, 1H), 6,87 (ушир. с, 2H), 6,74 (с, 1H), (ушир. с, 2H), 4,4 (д, J=8,8 Гц, 1H), 4,24 (д, J=12,8 Гц, 1H) 4,01 (с, 3H), 3,94 (с, 3H), 3,42-3,36 (м, 4H), 3,2 (ушир. с, 4H), 2,93 (т, J=10,4 Гц, 1H), 2,82-2,77 (м, 2H), 1,92-1,89 (м, 1H), 1,72-1,69 (м, 2H); ВЭЖХ (способ 5) 95,8% (AUC), tR=18,45 мин; ESI+APCI MS m/z 549 [M+H]+.
Получение трет -бутил(1-(5-бромпиримидин-2-ил)пиперидин-3-ил)(метил)карбамата 308q;
Соединение трет-бутил(1-(5-бромпиримидин-2-ил)пиперидин-3-ил)(метил)карбамат 308q получали аналогичным образом, как соединение трет-бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)карбамат 308f, и получали в виде твердого вещества грязно-белого цвета (выход 71%). ESI+APCI MS m/z 371 [M+H]+.
Получение трет -бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-3-ил)(метил)карбамата 309q;
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (500 мг, 1,3 ммоль), трет-бутил(1-(5-бромпиримидин-2-ил)пиперидин-3-ил)(метил)карбамата 308q (743 мг, 2,0 ммоль), [(t-Bu)3PH]BF4 (40 мг, 0,13 ммоль) и NaOt-Bu (380 мг, 4,0 ммоль) в ксилоле (15 мл) дегазировали аргоном в течение 15 мин. Впоследствии в смесь загружали Pd(OAc)2 (30 мг, 0,13 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Получаемую реакционную смесь перемешивали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали через подушку целита, фильтрат концентрировали досуха. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-3-ил)(метил)карбамат 309q (200 мг, 22%) в виде твердого вещества коричневого цвета. ESI+APCI MS m/z 663 [M+H]+
Получение 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-N-метилпиперидин-3-амина 309r (пример 428);
Соединение 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-N-метилпиперидин-3-амин 309r получали аналогичным образом, как 1-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-3-амин 309p, и получали в виде твердого вещества грязно-белого цвета (выход 32%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,25 (с, 2H), 8,18 (с, 1H), 8,04 (с, 1H), 6,87 (ушир. с, 2H), 6,74 (с, 1H), 4,4 (д, J=30,4 Гц, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,34 (ушир. с, 4H), 3,11 (ушир. с, 4H), 2,93 (т, J=8,4 Гц, 1H), 2,83 (т, J=8,8 Гц, 1H), 2,3 (с, 3H), 1,99 -1,92 (м, 1H), 1,48-1,28 (м, 2H). ВЭЖХ (способ 5) 97,02% (AUC), tR=12,24 мин; ESI+APCI MS m/z 563 [M+H]+.
Получение 4-(5-бромпиримидин-2-ил)морфолина 308s;
Соединение 4-(5-бромпиримидин-2-ил)морфолин 308s получали аналогичным образом, как трет-бутил(1-(5-бромпиримидин-2-ил)пирролидин-3-ил)карбамат 308f, и получали в виде твердого вещества белого цвета (выход 87%).
1H ЯМР (400 МГц, CDCl3): δ 8,3 (с, 2H), 3,74 (ушир. с, 8H); ESI+APCI MS m/z 244 [M+H]+.
Получение 4-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)морфолина 309s (пример 335);
Соединение 4-(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)морфолин 309s получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пирролидин-1-ил)пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 309e, и получали в виде твердого вещества грязно-белого цвета (выход 9%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,6 Гц, 1H), 8,29 (с, 2H), 8,18 (с, 1H), 8,03 (с, 1H), 6,87 (с, 1H), 6,85 (с, 1H), 6,73 (с, 1H), 4,01 (с, 3H), 3,67-3,64 (м, 3H), 3,59-3,57 (с, 3H), 3,37 (ушир. с, 3H), 3,17 (ушир. с, 3H); ВЭЖХ (способ 1) 93,9% (AUC), tR=13,01 мин.; ESI+APCI MS m/z 536 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 309t (пример 317);
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (500 мг, 1,34 ммоль), 5-бромпиримидина (330 мг, 2,07 ммоль), (±) BINAP (90 мг, 0,14 ммоль) и NaOt-Bu (390 мг, 4,05 ммоль) в толуоле (15 мл) дегазировали аргоном в течение 15 мин. Впоследствии в смесь загружали Pd2(dba)3 (70 мг, 0,076 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Получаемую реакционную смесь перемешивали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали через подушку целита и фильтрат испаряли досуха. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиримидин-5-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 309t (пример 317) (275 мг, 45%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,63 (с, 1H), 8,58 (с, 2H), 8,35 (д, J=7,5 Гц, 1H), 8,18 (с, 1H), 8,04 (с, 1H), 6,90 (с, 1H), 6,87 (с, 1H), 6,76 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,43 (ушир. с, 4H), 3,41 (ушир. с, 4H); ВЭЖХ (способ 1) 98,0% (AUC), tR=12,61 мин.; ESI+APCI MS m/z 451 [M+H]+.
Схема 2-8
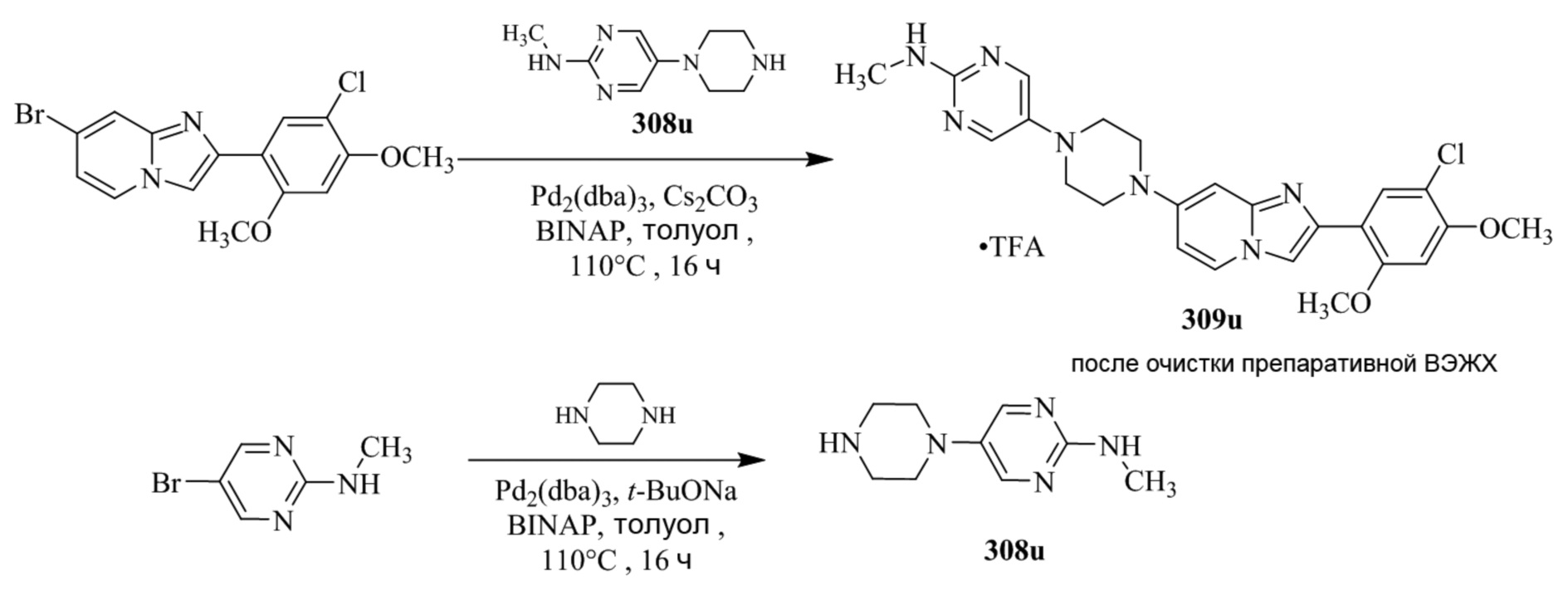
Получение N -метил-5-(пиперазин-1-ил)пиримидин-2-амина 308u;
Суспензию 5-бром-N-метилпиримидин-2-амина (300 мг, 1,6 ммоль), пиперазина (692 мг, 8,0 ммоль), BINAP (47 мг, 0,16 ммоль) и NaOt-Bu (308 мг, (3,2 ммоль) в толуоле (8,0 мл) дегазировали аргоном в течение 5 мин. Впоследствии в смесь загружали Pd2(dba)3 (76 мг, 0,080 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Реакционную смесь перемешивали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и фильтровали через подушку целита. Фильтрат испаряли досуха. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить N-метил-5-(пиперазин-1-ил)пиримидин-2-амин 308u (220 мг, неочищенн.) в виде твердого вещества желтого цвета. ESI+APCI MS m/z 193 [M+H]+.
Получение 5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-N-метилпиримидин-2-амина трифторацетата 309u (пример 340);
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина (200 мг, 0,54 ммоль), N-метил-5-(пиперазин-1-ил)пиримидин-2-амина 308u (211 мг, 1,0 ммоль), BINAP (34 мг, 0,054 ммоль) и Cs2CO3 (532 мг, 1,63 ммоль) в толуоле (8,0 мл) дегазировали аргоном в течение 5 мин. Впоследствии в смесь загружали Pd2(dba)3 (51 мг, 0,054 ммоль) и дополнительно дегазировали ее аргоном в течение еще 5 мин. Реакционную смесь перемешивали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали через подушку целита. Фильтрат испаряли досуха. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2), после чего следовала препаративная ВЭЖХ для того, чтобы получить 5-(4-(2-(5-хлор-2,4диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N-метилпиримидин-2-амина трифторацетат 309u (пример 340) (10 мг, 3%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,40 (с, 1H), 8,57 (д, J=8,0 Гц, 1H), 8,28 (с, 1H), 8,21 (с, 2H), 7,93 (с, 1H), 7,4 (дд, J=4,0, 8,0 Гц, 1H), 6,99 (с, 1H), 6,80 (с, 1H), 4,05 (с, 3H), 3,99 (с, 3H), 3,66 (с, 4H), 3,16-3,14 (м, 4H), 2,78 (с, 3H). ВЭЖХ (способ 1) 94,70% (AUC), tR=11,94 мин. ESI+APCI MS m/z 480 [M+H]+.
Схема 2-9
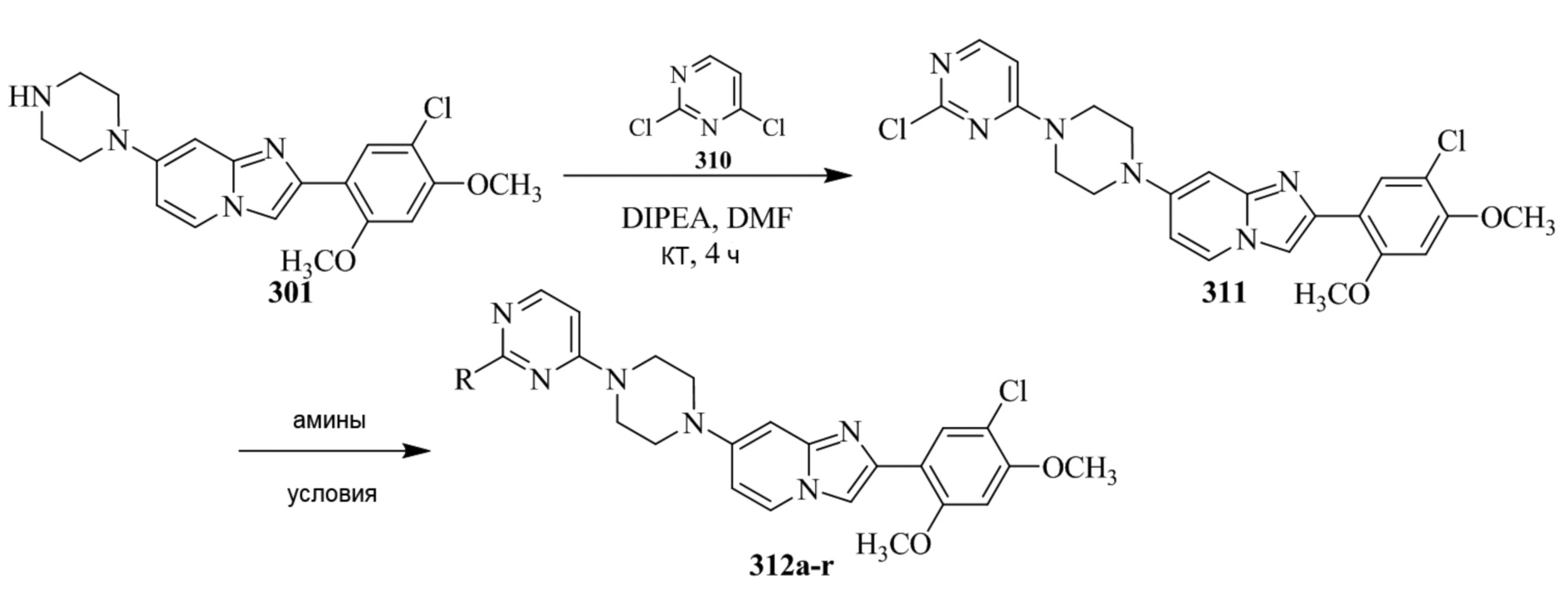
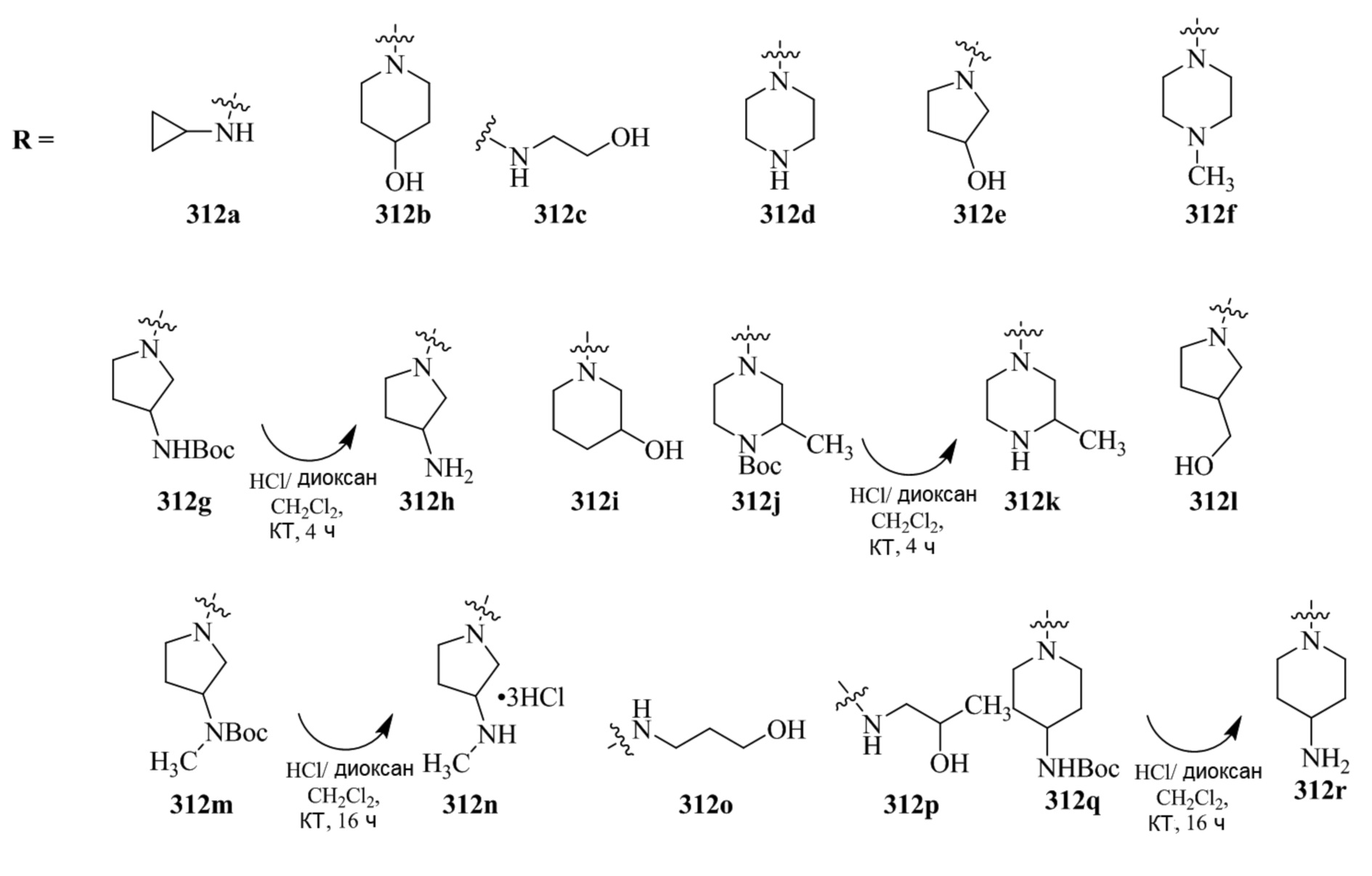
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 311;
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (1,00 г, 2,68 ммоль) и N,N-диизопропилэтиламина (0,70 мл, 4,0 ммоль) в DMF (10 мл) загружали 2,4-дихлорпиримидин 310 (400 мг, 2,69 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч в атмосфере N2. Реакционную смесь разводили в MTBE (100 мл) и перемешивали энергично в течение 1 ч. Осадок собирали посредством фильтрования, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 311 (600 мг, 46%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,5 Гц, 1H), 8,20 (с, 1H), 8,10 (д, J=6,1 Гц, 1H), 8,04 (с, 1H), 6,89 (д, J=6,2 Гц, 1H), 6,87 (с, 1H), 6,83 (дд, J=2,2, 7,6 Гц, 1H), 6,72 (д, J=1,6 Гц, 1H), 4,02 (с, 3H), 3,94 (с, 3H), 3,79 (ушир. с, 4H), 3,33-3,36 (м, 4H). ESI+APCI MS m/z 485 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-N-циклопропилпиримидин-2-амина 312a (пример 331);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 311 (100 мг, 0,206 ммоль) добавляли в циклопропиламин (1 мл), реакционную смесь нагревали при 130°C в микроволновом реакторе в течение 30 мин. Реакционную смесь разводили водой и образованный осадок собирали посредством фильтрования, промывали и сушили. Неочищенный материал очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N-циклопропилпиримидин-2-амин 312a (15 мг, 14%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,2 Гц, 1H), 8,17 (с, 1H), 8,02 (с, 1H), 7,86 (д, J=6,0 Гц, 1H), 6,86-6,84 (м, 2H), 6,71 (с, 1H), 6,14 (д, J=6 Гц, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,71 (с, 4H), 3,33 (с, 4H), 2,50 (м, 1H), 0,63 (дд, J=6,8,11,6 Гц, 2H), 0,44 (дд, J=4,4, 8 Гц, 2H); ВЭЖХ (способ 1) 94,1% (AUC), tR=12,0 мин. ESI+APCI MS m/z 506 [M+H]+.
Получение 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ола 312b (пример 332);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (100 мг, 0,206 ммоль) и DIPEA (79 мг, 0,61 ммоль) в ацетонитриле (1,0 мл), добавляли пиперидин-4-ол (31 мг, 0,30 ммоль). Реакционную смесь нагревали при 100°C в микроволновом реакторе в течение 40 мин. Реакционную смесь гасили водой и образованный осадок собирали посредством фильтрования, промывали и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ол 312b (10 мг, 8,8%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,35 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,91 (д, J=6 Гц, 1H), 6,87-6,83 (м, 2H), 6,71 (с, 1H), 6,13 (д, J=6 Гц, 1H), 4,68 (д, J=4,5 Гц, 1H), 4,30-4,24 (м, 2H), 4,01 (с, 3H), 3,93 (с, 3H), 3,75-3,54 (м, 5H), 3,49-3,35 (м, 4H), 3,17-3,09 (м, 2H), 1,17-1,73 (м, 2H), 1,34-1,14 (м, 2H); ВЭЖХ (способ 1) 96,3% (AUC), tR=11,75 мин.; ESI+APCI MS m/z 550 [M+H]+.
Получение 2-((4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)амино)этанола 312c (пример 334);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 311 (20 мг, 0,041 ммоль) добавляли в 2-аминоэтанол (0,5 мл) и реакционную смесь нагревали при 130°C в микроволновом реакторе в течение 30 мин. Реакционную смесь разводили водой и образованный осадок собирали посредством фильтрования, промывали и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить 2-((4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)амино)этанол 312c (10 мг, 47%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,83 (д, J=6 Гц, 1H), 6,86-6,83 (м, 2H), 6,71 (с, 1H), 6,38 (ушир. с, 2H), 6,10 (д, J=5,6 Гц, 1H), 4,65 (ушир. с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,75-3,67 (м, 4H), 3,49 (ушир. с, 2H), 3,33 (ушир. с, 4H), 2,5 (ушир. с, 2H); ВЭЖХ (способ 1) 98,4% (AUC), tR=11,65 мин.; ESI+APCI MS m/z 536 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 312d (пример 341);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (200 мг, 0,412 ммоль) и DIPEA (159 мг, 1,23 ммоль) в ацетонитриле (1,0 мл) добавляли пиперизина гидрохлорид (70 мг, 0,82 ммоль) и реакционную смесь нагревали при 130°C в микроволновом реакторе в течение 30 мин. Реакционную смесь разводили водой. Образованный осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/H3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 312d (20 мг, 9%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,35 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,91 (д, J=6 Гц, 1H), 6,87-6,84 (м, 2H), 6,71 (с, 1H), 6,15 (д, J=5,6 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,70 (ушир. с, 4H), 3,59 (ушир. с, 4H), 3,33-3,25 (м, 4H), 2,69 (ушир. с, 4H); ВЭЖХ (способ 1) 99,6% (AUC), tR=11,03 мин.; ESI+APCI MS m/z 535 [M+H]+.
Получение 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ола 312e (пример 346);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (150 мг, 0,30 ммоль) и пирролидин-3-ола (40 мг, 0,46 ммоль) нагревали при 130°C в микроволновом реакторе в течение 30 мин. Реакционную смесь разводили водой; образованный осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ол 312e (20 мг, 12%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,35 (д, J=7,2 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,89 (д, J=6 Гц, 1H), 6,87-6,84 (м, 2H), 6,71 (с, 1H), 6,12 (д, J=6 Гц, 1H), 4,88 (д, J=3,2 Гц, 1H), 4,32 (ушир. с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,71 (ушир. с, 4H), 3,57-3,43 (м, 3H), 3,40 (д, J=12 Гц, 1H), 3,33-3,12 (м, 4H), 2,09-1,93 (м, 1H), 1,89-1,80 (м, 1H); ВЭЖХ (способ 1) 91,3% (AUC), tR=11,73 мин.; ESI+APCI MS m/z 536 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(4-метилпиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 312f (пример 351);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(4-метилпиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 312f получали аналогичным образом, как соединение 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ол 312e, и получали в виде твердого вещества грязно-белого цвета (выход 13%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,35 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,92 (д, J=6 Гц, 1H), 6,87-6,83 (м, 2H), 6,71 (с, 1H), 6,17 (д, J=6 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,71-3,64 (м, 8H), 3,33-3,12 (м, 4H), 2,33-2,30 (м, 4H), 2,20 (с, 3H); ВЭЖХ (способ 1) 99,1% (AUC), tR=11,43 мин.; ESI+APCI MS m/z 549 [M+H]+.
Получение трет -бутил(1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)карбамата 312g;
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (150 мг, 0,309 ммоль), трет-бутилпирролидин-3-илкарбамата (85 мг, 0,46 ммоль) и DIPEA (119 мг, 0,92 ммоль) нагревали при 130°C в микроволновом реакторе в течение 30 мин. Реакционную смесь разводили водой; образованный осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)карбамат 312g (180 мг, 92%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,35 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,89 (д, J=6 Гц, 1H), 7,17 (д, J=6 Гц, 1H), 6,87-6,83 (м, 2H), 6,71 (с, 1H), 6,14 (д, J=6,3 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,75-3,64 (м, 5H), 3,62-3,40 (м, 2H), 3,33-3,12 (м, 4H), 3,00-2,91 (м, 1H), 2,45-2,38 (м, 1H), 2,10-2,04 (м, 1H), 1,84-1,78 (м, 1H), 1,39 (с, 9H).
Получение 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-амина 312h (пример 354);
В раствор трет-бутил(1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)карбамата 312g (150 мг, 0,236 ммоль) в CH2Cl2 (2 мл) добавляли раствор HCl в 1,4-диоксане (4,0 М, 0,5 мл) и получаемую смесь перемешивали при комнатной температуре в течение 4 ч. Белый осадок собирали посредством фильтрования, промывали дихлорметаном. Твердое вещество суспендировали в воде (5,0 мл) и ощелачивали насыщенным раствором бикарбоната натрия (5,0 мл, перемешивали в течение 1 ч при комнатной температуре). Суспензию фильтровали для того, чтобы получить 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-амин 312h (15 мг, 12%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,35 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,88 (д, J=6 Гц, 1H), 6,86-6,84 (м, 2H), 6,71 (с, 1H), 6,11 (д, J=6,0 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,75-3,64 (м, 4H), 3,58-3,41 (м, 4H), 3,33-3,12 (м, 4H), 3,12 (дд, J=4,8, 10,8 Гц, 1H), 2,02-1,95 (м, 1H), 1,67-1,60 (м, 1H); ВЭЖХ (способ 1) 99,7% (AUC), tR=11,1 мин.; ESI+APCI MS m/z 535 [M+H]+.
Получение 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-3-ола 312i (пример 357);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (300 мг, 0,206 ммоль) в ацетонитриле (1,0 мл) добавляли пиперидин-3-ол (92 мг, 0,927 ммоль), после чего следовал DIPEA (239 мг, 1,85 ммоль). Реакционную смесь нагревали при 130°C в микроволновом реакторе в течение 30 мин. Реакционную смесь разводили водой; образованный осадок собирали посредством фильтрования, промывали и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-3-ол 312i (15 мг) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,35 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,90 (д, J=6 Гц, 1H), 6,87-6,83 (м, 2H), 6,71 (с, 1H), 6,12 (д, J=5,6 Гц, 1H), 4,83 (д, J=4,4 Гц, 1H), 4,49 (д, J=8 Гц, 1H), 4,35 (д, J=13,2 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,80-3,66 (м, 4H), 3,45-3,38 (м, 1H), 3,33-3,12 (м, 4H), 2,88-2,82 (м, 1H), 2,72-2,67 (м, 1), 1,89 (ушир. с, 1H), 1,67 (ушир. с, 1H), 1,34 (ушир. с, 2H); ВЭЖХ (способ 1) 94,3% (AUC), tR=11,8 мин. ESI+APCI MS m/z 550 [M+H]+.
Получение трет -бутил-4-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-2-метилпиперазин-1-карбоксилата 312j;
Смесь 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (200 мг, 0,41 ммоль) и трет-бутил-2-метилпиперазин-1-карбоксилата (164 мг, 0,824 ммоль) нагревали при 125°C в микроволновом реакторе в течение 3 ч. Реакционную смесь разводили водой; осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-2-метилпиперазин-1-карбоксилат 312j (125 мг, 47%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,36 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,92 (д, J=6 Гц, 1H), 6,87-6,84 (м, 2H), 6,71 (с, 1H), 6,18 (д, J=6 Гц, 1H), 4,51 (дд, J=13,2, 20,7 Гц, 2H), 4,18 (ушир. с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,78-3,68 (м, 4H), 3,33-3,12 (м, 4H), 3,07-2,99 (м, 2H), 2,90-2,81 (м, 1H), 1,42 (с, 9H), 1,05 (д, J=6,6 Гц, 3H); ВЭЖХ (способ 1) 96,1% (AUC), tR=13,0 мин.; ESI+APCI MS m/z 649 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(3-метилпиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 312k (пример 362);
В раствор трет-бутил-4-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-2-метилпиперазин-1-карбоксилата 312j (250 мг, 0,386 ммоль) в CH2Cl2 (2 мл) добавляли раствор HCl в 1,4-диоксане (4,0 М, 1,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали и полученное твердое вещество промывали дихлорметаном. Твердое вещество суспендировали в воде (5,0 мл), ощелачивали насыщенным бикарбонатом натрия (5,0 мл, перемешивали в течение 1 ч при комнатной температуре) и фильтровали суспензию для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-(3-метилпиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 312k (60 мг, 28%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,35 (д, J=7,5 Гц, 1H), 8,18 (с, 1H), 8,03 (с, 1H), 7,90 (д, J=5,7 Гц, 1H), 6,87-6,83 (м, 2H), 6,71 (с, 1H), 6,14 (д, J=6 Гц, 1H), 4,45 (д, J=11,7 Гц, 2H), 4,01 (с, 3H), 3,93 (с, 3H), 3,81-3,70 (м, 4H), 3,33-3,12 (м, 4H), 2,91(д, J=10,8 Гц, 1H), 2,73-2,58 (м, 2H), 2,37-2,27 (м, 2H), 1,00 (д, J=6,3 Гц, 3H); ВЭЖХ (способ 1) 98,3% (AUC), tR=11,0 мин.; ESI+APCI MS m/z 549 [M+H]+.
Получение (1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)метанола 312l (пример 367);
Раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (250 мг, 0,515 ммоль), пирролидин-3-илметанола (104 мг, 1,03 ммоль) и DIPEA (198 мг, 1,54 ммоль) в ацетонитриле (1,0 мл) нагревали при 130°C в микроволновом реакторе в течение 1 ч. Реакционную смесь разводили водой; осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить (1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)метанол 312l (25 мг, 8,8%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,35 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,88 (д, J=6,0 Гц, 1H), 6,87-6,84 (м, 2H), 6,71 (д, J=2 Гц, 1H), 6,11 (д, J=6 Гц, 1H), 4,69 (ушир. с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,82-3,71 (м, 4H), 3,59-3,50 (м, 2H), 3,45-3,38 (м, 3H), 3,31-3,28 (м, 4H), 3,22-3,16 (м, 1H), 2,40-2,29 (м, 1H), 1,99-1,91 (м, 1H), 1,71-1,62 (м, 1H); ВЭЖХ (способ 1) 98,5% (AUC), tR=11,8 мин.; ESI+APCI MS m/z 550 [M+H]+.
Получение трет -бутил(1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)(метил)карбамата 312m;
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (300 мг, 0,618 ммоль) и трет-бутилметил(пирролидин-3-ил)карбамата (247 мг, 1,23 ммоль) нагревали при 115°C в микроволновом реакторе в течение 1 ч. Реакционную смесь разводили водой; осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)(метил)карбамат 312m (300 мг, 75%) в виде твердого вещества грязно-белого цвета. ESI+APCI MS m/z 649 [M+H]+.
Получение 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-N-метилпирролидин-3-амина тригидрохлорида 312n (пример 372);
В раствор трет-бутил(1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пирролидин-3-ил)(метил)карбамата 312m (150 мг, 0,23 ммоль) в CH2Cl2 (3 мл) добавляли раствор HCl в 1,4-диоксане (4,0 М, 1,0 мл) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь фильтровали и полученное твердое вещество промывали дихлорметаном для того, чтобы получить 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)-N-метилпирролидин-3-амина тригидрохлорид 312n (6 мг, 4,7%) в виде твердого вещества бледно-желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 9,74 (с, 1H), 9,54 (с, 1H), 8,62 (д, J=7,8 Гц, 1H), 8,30 (с, 1H), 8,11 (с, 1H), 7,96 (д, J=7,5 Гц, 2H), 7,35 (дд, J=2,1, 7,8 Гц, 1H), 6,98 (с, 1H), 6,80 (с, 1H), 6,64 (д, J=7,2 Гц, 1H), 4,06-3,73 (м, 18H),2,59 (с, 3H), 2,37 (с, 1H); ВЭЖХ (способ 1) 96,7% (AUC), tR=11,0 мин.; ESI+APCI MS m/z 549 [M+H]+.
Получение 3-((4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)амино)пропан-1-ола 312o (пример 395);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (100 мг, 0,20 ммоль) в ацетонитриле (2,0 мл) добавляли 3-аминопропан-1-ол (23 мг, 0,309 ммоль), после чего следовал DIPEA (80 мг, 0,619 ммоль). Реакционную смесь нагревали при 130°C в микроволновом реакторе в течение 1 ч. Реакционную смесь разводили водой; осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить 3-((4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)амино)пропан-1-ол 312o (15,0 мг, 14%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,83 (д, J=6,0 Гц, 1H), 6,86-6,83 (м, 2H), 6,71 (д, J=2 Гц, 1H), 6,48 (ушир. с, 1H), 6,09 (д, J=6 Гц, 1H), 4,46 (ушир. с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,74-3,69 (м, 4H), 3,47 (т, J=6,4 Гц, 2H), 3,37-3,25 (м, 6H), 1,69 (м, 2H); ВЭЖХ (способ 1) 98,2% (AUC), tR=10,3 мин.; ESI+APCI MS m/z 524 [M+H]+.
Получение 1-((4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)амино)пропан-2-ола 312p (пример 399);
Раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (100 мг, 0,20 ммоль), 1-аминопропан-2-ола (23 мг, 0,309 ммоль) и DIPEA (80 мг, 0,619 ммоль) в ацетонитриле (2,0 мл) нагревали при 130°C в микроволновом реакторе в течение 2 ч. Реакционную смесь разводили водой; осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить 1-((4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)амино)пропан-2-ол 312p (25 мг, 23%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,35 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,83 (д, J=6,0 Гц, 1H), 6,87-6,84 (м, 2H), 6,71 (д, J=2 Гц, 1H), 6,39 (ушир. с, 1H), 6,11 (д, J=6 Гц, 1H), 4,72 (ушир. с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,80-3,69 (м, 5H), 3,30-3,12 (м, 6H), 1,06 (д, J=6,4 Гц, 3H); ВЭЖХ (способ 2) 99,5% (AUC), tR=11,7 мин.; ESI+APCI MS m/z 524 [M+H]+.
Получение трет -бутил(1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ил)карбамата 312q;
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(4-(2-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 311 (200 мг, 0,412 ммоль), трет-бутилпиперидин-4-илкарбамата (113 мг, 0,618 ммоль) и DIPEA (159 мг, 1,23 ммоль) нагревали при 100°C в микроволновом реакторе в течение 40 мин. Реакционную смесь разводили водой; осадок собирали посредством фильтрования, промывали водой и сушили. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ил)карбамат 312q (150 мг, 56%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,35 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,91 (д, J=6 Гц, 1H), 6,87-6,80 (м, 3H), 6,71 (с, 1H), 6,14 (д, J=8 Гц, 1H), 4,56 (д, J=13,2 Гц, 2H), 4,01 (с, 3H), 3,93 (с, 3H), 3,80-3,75 (м, 4H), 3,54-3,47 (м, 1H), 3,45-3,30 (м, 4H), 2,91 (т, J=12,3 Гц, 2H), 1,75 (д, J=9,3 Гц, 2H), 1,38 (с, 9H), 1,35-1,23 (м, 2H); ВЭЖХ (способ 1) 95,1% (AUC), tR=12,7 мин.; ESI+APCI MS m/z 649 [M+H]+.
Получение 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-амина 312r (пример 338);
В раствор трет-бутил(1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-ил)карбамата 312q (130 мг, 0,20 ммоль) в CH2Cl2 (1,0 мл) добавляли раствор HCl в 1,4-диоксане (4,0 М, 1,0 мл). Суспензию перемешивали при комнатной температуре в течение 4 ч и затем фильтровали. Полученное твердое вещество промывали дихлорметаном и затем ресуспендировали в воде (5,0 мл), ощелачивали насыщенным бикарбонатом натрия (5,0 мл, перемешивали в течение 1 ч при комнатной температуре). Суспензию фильтровали для того, чтобы получить 1-(4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-ил)пиперидин-4-амин 312r (30 мг, 27%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,90 (д, J=6 Гц, 1H), 6,86 (с, 1H), 6,85 (дд, J=2,4, 7,6 Гц, 1H), 6,70 (с, 1H), 6,11 (д, J=6 Гц, 1H), 4,49 (д, J=12,8 Гц, 2H), 4,01 (с, 3H), 3,93 (с, 3H), 3,75-3,67 (м, 4H), 3,45-3,30 (м, 4H), 2,91-2,75 (м, 3H), 1,73 (д, J=10,8 Гц, 2H), 1,15 (м, 2H); ВЭЖХ (способ 1) 93,2% (AUC), tR=11,1 мин.; ESI+APCI MS m/z 549 [M+H]+.
Схема 2-10
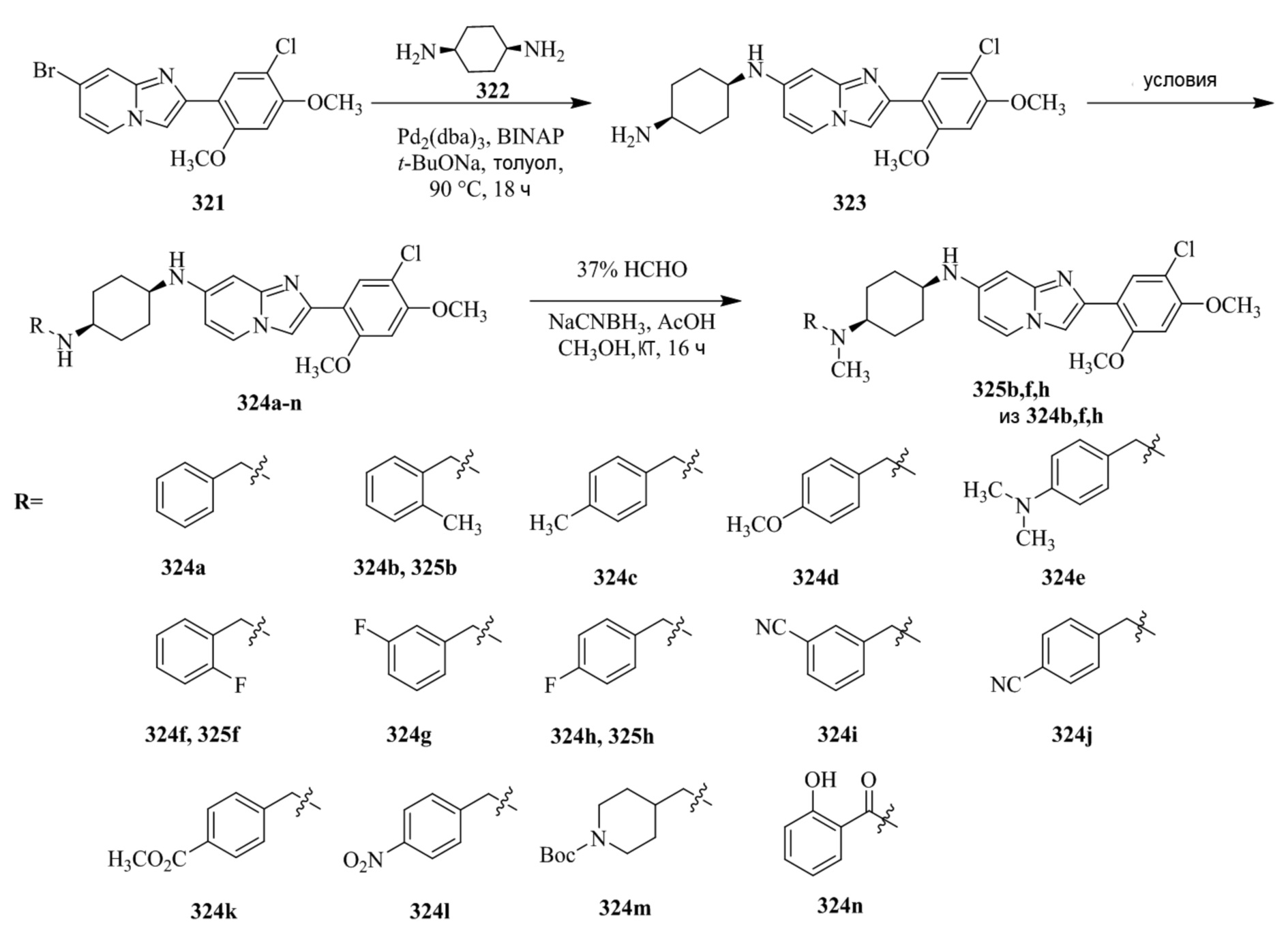
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)циклогексан-1,4-диамина 323;
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 321 (5,00 г, 13,7 ммоль), цис-циклогексан-1,4-диамина (1,55 г, 13,7 ммоль), BINAP (849 мг, 1,36 ммоль) и NaOt-Bu (3,93 г, 40,9 ммоль) в толуоле (150 мл) дегазировали аргоном в течение 15 мин. В суспензию добавляли Pd2(dba)3 (625 мг, 0,68 ммоль) и получаемую смесь дополнительно дегазировали аргоном в течение 5 мин. Реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли с использованием CH2Cl2 (500 мл) и фильтровали через подушку целита. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью хроматографии на силикагеле (CH3OH/CH2Cl2) для того, чтобы получить цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 323 (1,50 г, 27%) в виде твердого вещества зеленого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,10 (д, J=3,8 Гц, 1H), 7,86 (с, 1H), 6,84 (с, 1H), 6,44 (дд, J=2,0, 7,2 Гц, 1H), 6,18 (с, 1H), 5,98 (д, J=8,0 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,38-3,35 (м, 1H), 2,83-2,80 (м, 1H), 1,72-1,70 (м, 2H), 1,63-1,54 (м, 2H), 1,49-1,44 (м, 4H); ESI+APCI MS m/z 401 [M+H]+.
Получение цис-N 1-бензил- N 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)циклогексан-1,4-диамина 324a (пример 325);
Раствор цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамина 323 (100 мг, 0,25 ммоль), бензальдегида (26 мг, 0,25 ммоль) и AcOH (0,1 мл) в CH3OH (5 мл) перемешивали при комнатной температуре в течение 1 ч; в реакционную смесь загружали NaCNBH3 (85 мг, 1,24 ммоль) при 0°C и затем перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×10 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a (пример 325) (20 мг, 16%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,10 (д, J=7,2 Гц, 1H), 7,86 (с, 1H), 7,36-7,29 (м, 4H), 7,23-7,20 (м, 1H), 6,84 (с, 1H), 6,43 (д, J=8,0 Гц, 1H), 6,19 (с, 1H), 6,02 (д, J=7,2 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,73 (с, 2H), 3,39-3,35 (м, 1H), 2,68-2,64 (м, 1H), 1,73-1,70 (м, 2H), 1,60-1,62 (м, 6H); ВЭЖХ (способ 3) 96,5% (AUC), tR=12,21 мин.; ESI+APCI MS m/z 491 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(2-метилбензил)циклогексан-1,4-диамина;
Соединение цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(2-метилбензил)циклогексан-1,4-диамин 324b получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a, и получали в виде твердого вещества грязно-белого цвета (20 мг, 16%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,14 (с, 1H), 8,10 (д, J=7,2 Гц, 1H), 7,86 (с, 1H), 7,33-7,32 (м, 2H), 7,14-7,13 (м, 3H), 6,84 (с, 1H), 6,43 (дд, J=2,0, 7,2 Гц, 1H), 6,20 (с, 1H), 6,03 (д, J=7,2 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,73 (с, 2H), 3,43-3,38 (м, 1H), 2,71-2,69 (м, 1H), 2,32 (с, 3H), 1,72-1,65 (м, 8H); ВЭЖХ (способ 3) 92,2% (AUC), tR=12,45 мин.; ESI+APCI MS m/z 505 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N4-(4-метилбензил)циклогексан-1,4-диамина 324c (пример 329);
Соединение цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-метилбензил)циклогексан-1,4-диамин 324c получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a, и получали в виде твердого вещества грязно-белого цвета (20 мг, 19%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,10 (д, J=7,6 Гц, 1H), 7,22 (д, J=7,6 Гц, 2H), 7,10 (д, J=7,6 Гц, 2H), 6,84 (с, 1H), 6,42 (д, J=5,6 Гц, 1H), 6,19 (с, 1H), 6,01 (д, J=7,2 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,65 (с, 2H), 3,39-3,35 (м, 1H), 2,64-2,60 (м, 1H), 2,60 (с, 3H), 1,72-1,68 (м, 2H), 1,50-1,59 (м, 6H); ВЭЖХ (способ 1) 97,4% (AUC), tR=12,58 мин.; ESI+APCI MS m/z 505 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(4-метоксибензил)циклогексан-1,4-диамина бис(2,2,2-трифторацетат) 324d (пример 380);
Соединение цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-метоксибензил)циклогексан-1,4-диамин получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a, и свободное основание очищали посредством препаративной ВЭЖХ для того, чтобы получить TFA соль цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-метоксибензил)циклогексан-1,4-диамина бис(2,2,2-трифторацетат) 324d (пример 380) в виде твердого вещества грязно-белого цвета (выход 7%).
1H ЯМР (400 МГц, DMSO-d6) δ: 13,20 (ушир. с, 1H), 8,76 (ушир. с, 1H), 8,40 (д, J=7,2 Гц, 1H), 8,23 (с, 1H),7,88 (с, 1H), 7,6 (д, J=7,8 Гц, 1H), 7,40-7,38 (м, 2H), 7,02-6,93 (м, 4H), 6,44 (ушир. с, 1H), 4,13 (д, J=5,2 Гц, 2H), 4,05 (с, 3H), 3,99 (с, 3H), 3,8 (с, 3H),3,7 (ушир. с, 1H), 3,1 (ушир. с, 1H), 1,95-1,93 (м, 4H), 1,85-1,70 (м, 4H); ВЭЖХ (способ 1) 98,21% (AUC), tR=12,1 мин.; ESI+APCI MS m/z 521 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(4-(диметиламино)бензил)циклогексан-1,4-диамина бис(2,2,2-трифторацетат)а 324e (пример 418);
Соединение цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-(диметиламино)бензил)циклогексан-1,4-диамин получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a. Свободное основание очищали посредством препаративной ВЭЖХ для того, чтобы получить цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-(диметиламино)бензил)циклогексан-1,4-диамина бис(2,2,2-трифторацетат) 324e (пример 418) в виде твердого вещества грязно-белого цвета (выход 4%).
1H ЯМР (300 МГц, DMSO-d6) δ: 13,27 (с, 1H), 8,68 (ушир. с, 2H), 8,41 (д, J=7,5 Гц, 1H), 8,20 (с, 1H),7,89 (с, 1H), 7,56 (д, J=5,4 Гц, 1H), 7,31 (д, J=8,7 Гц, 2H), 6,98-6,75 (м, 2H), 6,78-6,75 (м, 2H), 6,45 (ушир. с, 1H), 4,05 (с, 5H), 3,99 (с, 3H), 3,68 (ушир. с, 1H), 3,14-3,11 (м, 1H), 3,09 (с, 6H), 2,08-1,92 (м, 4H), 1,81-1,76 (м, 4H); ВЭЖХ (способ 5) >99% (AUC), tR=11,96 мин.; ESI+APCI MS m/z 534 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(2-фторбензил)циклогексан-1,4-диамина 324f;
Соединение цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(2-фторбензил)циклогексан-1,4-диамин 324f получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a, и получали в виде твердого вещества грязно-белого цвета (выход 16%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,10 (д, J=7,6 Гц, 1H), 7,86 (с, 1H), 7,50 (т, J=6,8 Гц, 2H), 7,28-7,26 (м, 1H), 7,18-7,11 (м, 2H), 6,84 (с, 1H), 6,43 (д, J=6,4 Гц, 1H), 6,19 (с, 1H), 6,02 (д, J=7,6 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,76 (с, 2H), 3,37 (ушир. с, 1H), 2,64 (ушир. с, 1H), 1,71-1,69 (м, 2H), 1,68-1,62(м, 6H); ВЭЖХ (способ 3) 90,5% (AUC), tR=12,23 мин.; ESI+APCI MS m/z 509 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(3-фторбензил)циклогексан-1,4-диамина бис(2,2,2-трифторацетата) 324g (пример 402);
Соединение цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(3-фторбензил)циклогексан-1,4-диамин получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a. Свободное основание очищали посредством препаративной ВЭЖХ для того, чтобы получить цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(3-фторбензил)циклогексан-1,4-диамина бис(2,2,2-трифторацетат) 324g в виде твердого вещества грязно-белого цвета (выход 4%).
1H ЯМР (400 МГц, DMSO-d6) δ: 13,17 (с, 1H), 8,97 (ушир. с, 2H), 8,40 (д, J=7,6 Гц, 1H), 8,23 (с, 1H),7,89 (с, 1H), 7,55-7,49 (м, 2H), 7,42-7,36 (м, 2H), 7,31-7,26 (м, 1H), 6,98 (с, 1H), 6,96 (д, J=12,4 Гц, 1H), 6,44 (ушир. с, 1H), 4,24-4,16 (м, 2H), 4,05 (с, 3H), 3,99 (с, 3H), 3,69-3,64 (м, 1H), 3,25-3,15 (м, 1H), 1,94-1,85 (м, 4H), 1,75-1,85 (м, 4H); ВЭЖХ (способ 4) 98,65% (AUC), tR=13,57 мин.; ESI+APCI MS m/z 509 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(4-фторбензил)циклогексан-1,4-диамина 324h (пример 326);
Соединение цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-фторбензил)циклогексан-1,4-диамин 324h получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a, и получали в виде твердого вещества грязно-белого цвета (выход 19%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,10 (д, J=7,2 Гц, 1H), 7,86 (с, 1H), 7,40-7,37 (м, 2H), 7,12 (т, J=8,8 Гц, 2H), 6,84 (с, 1H), 6,43 (д, J=7,2 Гц, 1H), 6,19 (с, 1H), 6,04 (д, J=7,2 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,70 (с, 2H), 3,39-3,35 (м, 1H), 2,66-2,63 (м, 1H), 1,73-1,61 (м, 8H); ВЭЖХ (способ 3) 96,2% (AUC), tR=12,31 мин.; ESI+APCI MS m/z 509 [M+H]+.
Получение 3-((( цис- 4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрила 324i (пример 371);
Соединение 3-(((цис-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрил 324i получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a, и получали в виде твердого вещества грязно-белого цвета (выход 26%).
1H ЯМР (300 МГц, DMSO-d6) δ: 8,17 (д, J=7,5 Гц, 1H),8,09 (с, 1H), 7,93 (с, 1H), 7,90 (с, 1H),7,78-7,76 (м, 2H), 7,59 (т, J=8,4 Гц, 1H), 6,87 (с, 1H), 6,52 (д, J=6,9 Гц, 1H),6,3 (ушир. с, 1H), 6,24 (ушир. с, 1H), 4,0 (с, 4H), 3,93 (с, 4H), 3,46 (ушир. с, 2H),1,98-1,50 (м, 2H); ВЭЖХ (способ 1) 97,6% (AUC), tR=12,02 мин.; ESI+APCI MS m/z 516 [M+H]+.
Получение 4-((( цис- 4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрила бис(2,2,2-трифторацетата) 324j (пример 403);
Соединение 4-(((цис-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрил получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a. Свободное основание очищали посредством препаративной ВЭЖХ для того, чтобы получить 4-(((цис-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрила бис(2,2,2-трифторацетат) 324j в виде твердого вещества грязно-белого цвета (выход 4%).
1H ЯМР (400 МГц, DMSO-d6) δ: 13,38 (с, 1H), 9,0 (ушир. с, 2H), 8,45 (д, J=7,6 Гц, 1H), 8,23 (с, 1H),7,96 (д, J=8,4 Гц, 2H), 7,88 (с, 1H), 7,73-7,71 (м, 2H), 7,5 (д, J=4,4 Гц, 1H), 6,98 (с, 1H), 6,95 (д, J=4,4 Гц, J=7,2 Гц, 1H), 6,44 (ушир. с, 1H), 4,32 (ушир. с, 2H), 4,05 (с, 3H), 3,99 (с, 3H), 3,7 (ушир. с, 1H), 3,20 (ушир. с, 1H), 1,96-1,94 (м, 4H), 1,81-1,72 (м, 4H); ВЭЖХ (способ 1) 96,22% (AUC), tR=12,74 мин.; ESI+APCI MS m/z 516 [M+H]+.
Получение метил-4-((( цис- 4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)циклогексил)амино)метил)бензоата бис(2,2,2-трифторацетата) 324k (пример 409);
Соединение метил-4-(((цис-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензоат получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a. Свободное основание очищали посредством препаративной ВЭЖХ для того, чтобы получить метил-4-(((цис-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензоата бис(2,2,2-трифторацетат) 324k в виде твердого вещества грязно-белого цвета (выход 12%).
1H ЯМР (400 МГц, DMSO-d6) δ: 13,23 (с, 1H), 9,0 (ушир. с, 2H), 8,40 (д, J=7,5 Гц, 1H), 8,23 (с, 1H), 8,04 (д, J=8,1 Гц, 2H), 7,88 (с, 1H), 7,67 (д, J=8,4 Гц, 2H), 7,57 (д, J=5,7 Гц, 1H), 6,98-6,93(м, 2H), 6,46 (ушир. с, 1H), 4,31 (ушир. с, 2H), 4,05 (с, 3H), 3,98 (с, 3H), 3,87 (с, 3H), 3,7 (ушир. с, 1H), 3,30-3,22 (м, 1H), 1,96-1,88 (м, 4H), 1,84-1,73 (м, 4H); ВЭЖХ (способ 1) 96,22% (AUC), tR=12,74 мин.; ESI+APCI MS m/z 516 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(4-нитробензил)циклогексан-1,4-диамина 324l (пример 411);
Соединение цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-нитробензил)циклогексан-1,4-диамин 324l получали аналогично цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамину 324a и получали в виде твердого вещества грязно-белого цвета (выход 13%).
1H ЯМР (300 МГц, DMSO-d6) δ: 8,19 (д, J=5,7 Гц, 2H), 8,12 (д, J=7,8 Гц, 2H), 7,87 (с, 1H), 7,65 (д, J=5,7 Гц, 2H), 6,84 (с, 1H), 6,45 (дд, J=1,8, 9,0 Гц, 1H),6,19 (с, 1H), 6,06 (д, J=6,6 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,86 (ушир. с, 2H), 2,65-2,55 (м, 2H), 1,85-1,51 (м, 8H); ВЭЖХ (способ 5) 93,57% (AUC), tR=12,19 мин.; ESI+APCI MS m/z 536 [M+H]+.
Получение трет -бутил-4-((( цис- 4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)циклогексил)амино)метил)пиперидин-1-карбоксилата 324m (пример 423);
Соединение трет-бутил-4-(((цис-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)пиперидин-1-карбоксилат 324m получали аналогичным образом, как цис-N1-бензил-N4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 324a, и получали в виде твердого вещества грязно-белого цвета (выход 4%).
1H ЯМР (400 МГц, DMSO-d6) δ: 8,26 (д, J=7,6 Гц, 2H), 7,87 (с, 1H), 6,85 (с, 1H), 6,50 (д, J=7,6 Гц, 1H), 6,20 (с, 1H), 6,06 (д, J=5,6 Гц, 1H), 3,99 (с, 3H), 3,93 (с, 5H), 3,45 (ушир. с, 1H), 2,65-2,55 (м, 4H), 1,72-1,54 (м, 11H), 1,54 (с, 9H), 1,01 (ушир. с, 2H), 0,99-0,85 (м, 2H).; ВЭЖХ (способ 5) 98,29% (AUC), tR=12,93 мин.; ESI+APCI MS m/z 598 [M+H]+.
Получение N -( цис- 4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)циклогексил)-2-гидроксибензамида трифторацетата 324n (пример 392);
Cмесь цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамина 323 (200 мг, 0,5 ммоль), 2-гидроксибензойной кислоты (83 мг, 0,6 ммоль), HATU (285 мг, 0,75 ммоль) и N,N-диизопропилэтиламина (0,17 мл, 1,0 ммоль) в DMF (3 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили водой и экстрагировали в EtOAc (2×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали посредством препаративной ВЭЖХ для того, чтобы получить N-(цис-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)-2-гидроксибензамида трифторацетат 324n (пример 392) (40 мг, 20%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6) δ: 12,98 (ушир. с, 1H), 12,36 (с, 1H), 8,57 (ушир. с, 1H), 8,44-8,38 (м, 1H), 8,20 (с, 1H), 7,94 (д, J=7,4 Гц, 1H), 7,88 (с, 1H),7,51-7,40 (м, 2H), 6,97-6,91 (м, 4H), 6,4 (ушир. с, 1H), 4,05 (с, 3H), 3,99 (с, 4H), 3,65 (ушир. с, 1H), 1,8 (ушир. с, 8H); ВЭЖХ (способ 1) 97,61% (AUC), tR=13,89 мин.; ESI+APCI MS m/z 521 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-метил- N 4-(2-метилбензил)циклогексан-1,4-диамина бис(2,2,2-трифторацетата) 325b (пример 348);
Раствор цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(2-метилбензил)циклогексан-1,4-диамина 324b (200 мг, 0,39 ммоль), 37% формальдегида (11 мг, 0,43 ммоль), AcOH (50 мкл) в CH3OH (5,0 мл) перемешивали при комнатной температуре в течение 1 ч; в реакционную смесь загружали NaCNBH3 (27 мг, 0,43 ммоль) при 0°C и затем перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×10 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) после чего следовала препаративная ВЭЖХ для того, чтобы получить цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-метил-N4-(2-метилбензил)циклогексан-1,4-диамина бис(2,2,2-трифторацетат) 325b (20 мг, 16%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,20 (с, 1H), 9,13 (с, 1H), 8,42 (д, J=8,0 Гц, 1H), 8,23 (с, 1H), 7,89 (с, 1H), 7,58 (д, J=6,8 Гц, 1H), 7,49 (д, J=7,6 Гц, 1H), 7,41-7,30 (м, 3H), 6,98 (с, 2H), 6,47 (с, 1H), 4,54 (д, J=12,0 Гц, 1H), 4,16-4,10 (м, 1H), 4,05 (с, 3H), 3,98 (с, 3H), 3,83 (с, 1H), 3,47 (с, 1H), 2,69 (с, 3H), 2,42 (с, 3H), 2,1-1,90 (м, 6H), 1,75-1,73 (м, 2H); ВЭЖХ (способ 3) 98,4% (AUC), tR=12,45 мин.; ESI+APCI MS m/z 520 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(2-фторбензил)- N 1-метилциклогексан-1,4-диамина бис(2,2,2-трифторацетата) 325f (пример 347);
Соединение цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(2-фторбензил)-N1-метилциклогексан-1,4-диамина бис(2,2,2-трифторацетат) 325f получали аналогично цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-метил-N4-(2-метилбензил)циклогексан-1,4-диамина бис(2,2,2-трифторацетату) 325b и получали в виде твердого вещества грязно-белого цвета (выход 5%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,24 (с, 1H), 9,62 (с, 1H), 8,42 (д, J=8,0 Гц, 1H), 8,23 (с, 1H), 7,89 (с, 1H), 7,66-7,56 (м, 3H), 7,40-7,33 (м, 2H), 6,98-6,96 (м, 2H), 6,47 (с, 1H), 4,56 (д, J=12,8 Гц, 1H), 4,25-4,20 (м, 1H), 4,05 (с, 3H), 3,98 (с, 3H), 3,81 (с, 1H), 3,42 (с, 1H), 2,71 (с, 3H), 2,10-1,77 (м, 6H), 1,75-1,73 (м, 2H); ВЭЖХ (способ 3) >99% (AUC), tR=12,32 мин.; ESI+APCI MS m/z 523 [M+H]+.
Получение цис-N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(4-фторбензил)- N 1-метилциклогексан-1,4-диамина 325h (пример 342);
Cмесь цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-фторбензил)циклогексан-1,4-диамина 324h (250 мг, 0,49 ммоль), 37% формальдегида (16 мг, 0,54 ммоль) и AcOH (100 мкл) в CH3OH (5 мл) перемешивали при комнатной температуре в течение 1 ч. В реакционную смесь загружали NaCNBH3 (34 мг, 0,54 ммоль) при 0°C и перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить цис-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-фторбензил)-N1-метилциклогексан-1,4-диамин 325h (пример 342) (50 мг, 19%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,14 (д, J=7,2 Гц, 1H), 8,12 (с, 1H), 7,89 (с, 1H), 7,35 (м, 2H), 7,13 (т, J=8,8 Гц, 2H), 6,85 (с, 1H), 6,53-6,51 (м, 1H), 6,22-6,19 (м, 2H), 3,99 (с, 3H), 3,92 (с, 3H), 3,55 (с, 3H), 2,11 (с, 3H), 1,84-1,73 (м, 4H), 1,62-1,59 (м, 4H); ВЭЖХ (способ 3) 98,10% (AUC), tR=12,34 мин.; ESI+APCI MS m/z 523 [M+H]+.
Схема 2-11
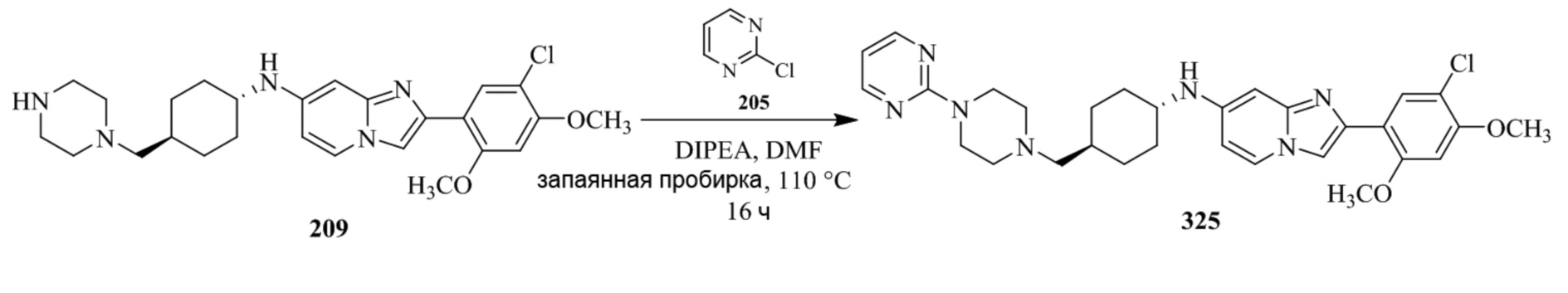
Получение 2-(5-хлор-2,4-диметоксифенил)-N-(( транс )-4-((4-(пиримидин-2-ил)пиперазин-1-ил)метил)циклогексил)имидазо[1,2- a ]пиридин-7-амина 325 (пример 316);
В раствор 2-(5-хлор-2,4-диметоксифенил)-транс-N-(4-(пиперазин-1-илметил)циклогексил)имидазо[1,2-a]пиридин-7-амина 324 (100 мг, 0,24 ммоль) в DMF (2 мл) добавляли 2-хлорпиримидин (39 мг, 0,24 ммоль) и реакционную смесь перемешивали при 110-120°C в течение 16 ч в запаянной пробирке. Реакционную смесь гасили водой и экстрагировали в EtOAc (2×10 мл) и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-N-((транс)-4-((4-(пиримидин-2-ил)пиперазин-1-ил)метил)циклогексил)имидазо[1,2-a]пиридин-7-амин 325 (пример 316) (20 мг, 17%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=4,8 Гц, 2H), 8,14 (д, J=7,2 Гц, 1H), 8,09 (с, 1H), 7,91 (с, 1H), 6,86 (с, 1H), 6,60 (т, д, J=4,8 Гц, 1H), 6,42 (д, J=6,4 Гц, 1H), 6,22 (с, 1H), 3,99 (с, 3H), 3,93 (с, 3H), 3,72 (ушир. с, 4H), 3,22-3,16 (м, 1H), 2,39 (ушир. с, 4H), 2,16 (д, J=7,2 Гц, 2H), 2,06 (д, J=10 Гц, 2H), 1,86 (д, J=11,6 Гц, 2H), 1,58-1,54 (м, 1H), 1,23-1,14 (м, 2H), 1,09-1,03 (м, 2H); ВЭЖХ (способ 3) 92,2% (AUC), tR=11,97 мин.; ESI+APCI MS m/z 562 [M+H]+.
Схема 2-12
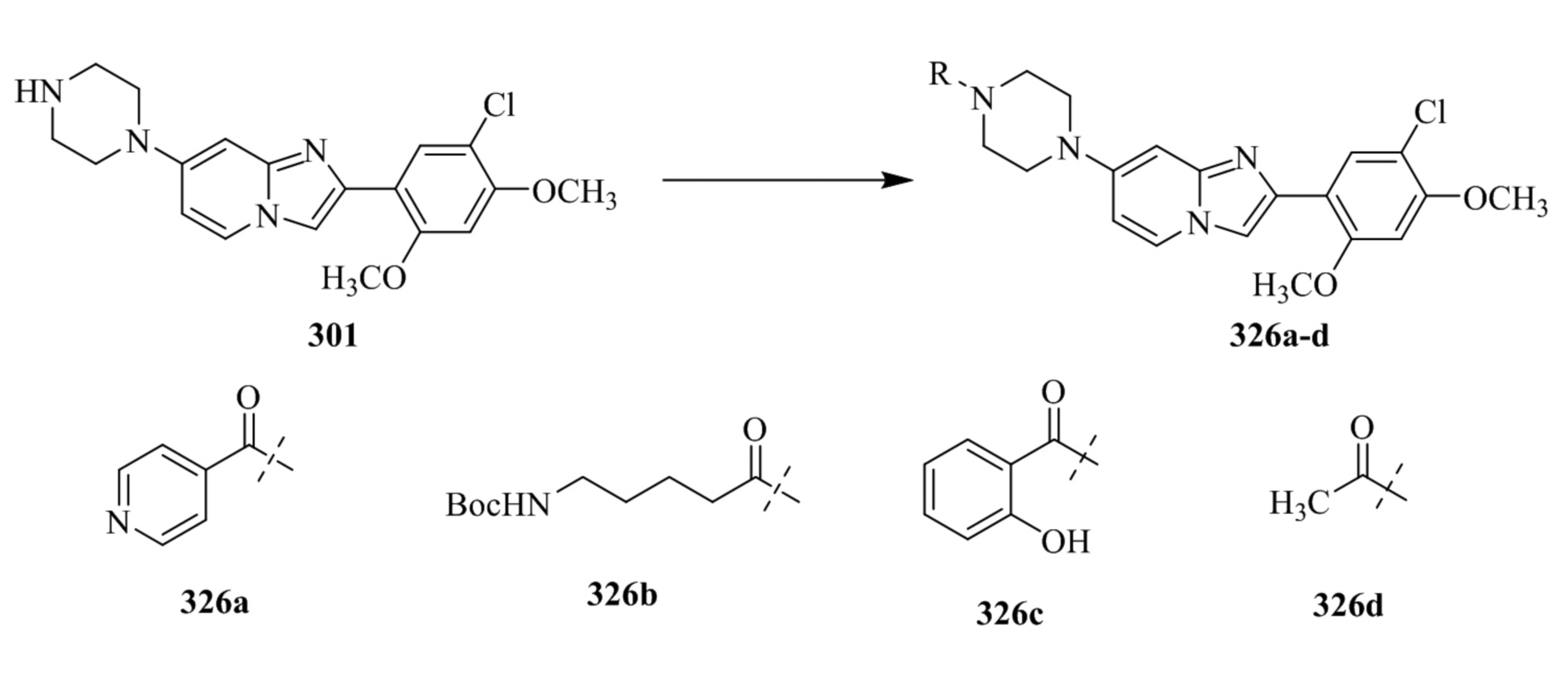
Получение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)(пиридин-4-ил)метанона 326a (пример 319);
В раствор изоникотиновой кислоты (75 мг, 0,60 ммоль) в сухом DMF (5,0 мл) загружали HATU (232 мг, 0,60 ммоль) и DIPEA (0,22 мл, 1,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. В эту реакционную смесь добавляли 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридин 301 (150 мг, 0,40 ммоль) и получаемую реакционную смесь перемешивали в течение дополнительных 4 ч. Реакционную смесь разводили с использованием EtOAc (10 мл) и промывали водой (2×10 мл), после чего следовал солевой раствор. Органический экстракт сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)(пиридин-4-ил)метанон 326a (пример 319) (30 мг, 15%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,70 (дд, J=1,6 4,4 Гц, 2H), 8,37 (д, J=7,6 Гц, 1H), 8,13 (с, 1H), 8,06 (с, 1H), 7,45 (дд, J=1,6, 4,4 Гц, 2H), 6,88 (ушир. с, 2H), 6,70 (д, J=2,0 Гц, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,79 (с, 2H), 3,42 (с, 4H).
ВЭЖХ (способ 1) 98,43% (AUC), tR=11,61 мин.; ESI+APCI MS m/z 478,1 [M+H]+.
Получение трет -бутил(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-5-оксопентил)карбамата 326b (пример 315);
Соединение трет-бутил(5-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-5-оксопентил)карбамат 326b получали аналогичным образом, как 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)(пиридин-4-ил)метанон 326a, и получали в виде твердого вещества грязно-белого цвета (выход 32%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,55 (д, J=7,6 Гц, 1H), 8,26 (с, 1H), 7,91 (с, 1H), 7,28 (дд, J=2,0, 8,0 Гц, 1H), 6,98 (с, 1H), 6,77 (с, 1H), 6,66 (д, J=2,0 Гц, 1H), 4,05 (с, 3H), 3,99 (с, 3H), 3,65 (с, 4H), 3,58 (с, 2H), 3,53 (с, 2H), 2,92 (к, J=6,8 Гц, 2H), 2,36 (т, J=7,2 Гц, 2H), 1,50 (к, J=7,6 Гц, 2H), 1,41 (д, J=6,8 Гц, 2H), 1,36 (с, 9H); ВЭЖХ (способ 1) 98,28% (AUC), tR=13,41 мин.; ESI+APCI MS m/z 572,3 [M+H]+.
Получение (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)(2-гидроксифенил)метанона 326c (пример 314);
В перемешанный раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (100 мг, 0,26 ммоль) и 2-(трифторметил)фенола (53 мг, 0,32 ммоль) в 1,4-диоксане (2,5 мл) добавляли водный раствор NaOH (1 Н, 0,81 мл, 0,81 ммоль). Получаемый раствор нагревали при 80°C в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой. Образованный осадок собирали посредством фильтрования, промывали гексанами для того, чтобы получить (4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)(2-гидроксифенил)метанон 326c (пример 314) в виде твердого вещества грязно-белого цвета (120 мг,90%).
1H ЯМР (400 МГц, DMSO-d6): δ 9,86 (с, 1H), 8,46 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,01 (с, 1H), 7,28-7,23 (м, 1H), 7,17 (дд, J=1,6, 7,6 Гц, 1H), 7,08 (д, J=7,6 Гц, 1H), 6,93-6,85 (м, 3H), 6,70 (д, J=2,0 Гц, 1H), 4,03 (с, 3H), 3,96 (с, 3H), 3,78-3,70 (м, 2H), 3,43 (с, 6H); ВЭЖХ (способ 1) 92,21% (AUC), tR=12,76 мин.; ESI+APCI MS m/z 493 [M+H]+.
Получение 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)этанона 326d (пример 307);
В перемешанный раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (100 мг, 0,26 ммоль) и триэтиламина (0,1 мл, 0,67 ммоль) в CH2Cl2 (10 мл) добавляли ацетилхлорид (0,1 мл, 0,24 ммоль) при 0°C и получаемую смесь перемешивали при комнатной температуре в течение 6 ч. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои промывали водой, за которой следовал солевой раствор, сушили над Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 326d (пример 307) в виде твердого вещества грязно-белого цвета (10 мг, 9%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,02 (с, 1H), 6,86 (с, 1H), 6,82 (дд, J=2,0, 7,6 Гц, 1H), 6,69 (с, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,59 (с, 4H), 3,19 (с, 4H), 2,05 (с, 3H); ВЭЖХ (способ 1) 97,4% (AUC), tR=12,46 мин.; ESI+APIC MS m/z 415 [M+H]+.
Схема 2-13
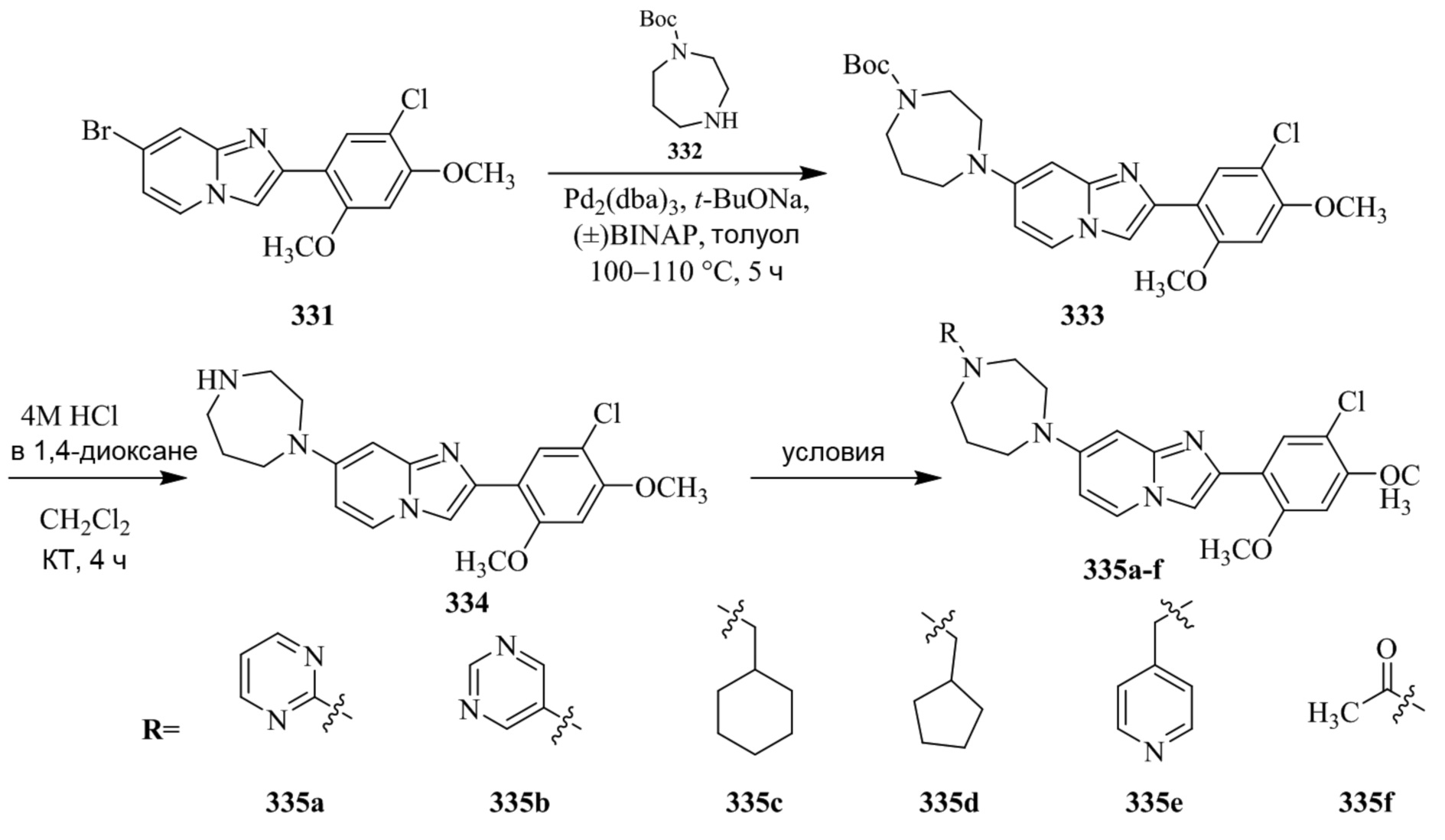
Получение трет -бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-1,4-диазепан-1-карбоксилата 333;
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 331 (8,00 г, 21,8 ммоль), трет-бутил-1,4-диазепан-1-карбоксилата 332 (5,24 г, 26,2 ммоль), (±) BINAP (1,49 г, 2,39 ммоль) и NaOt-Bu (6,28 г, 65,4 ммоль) в толуоле (100 мл) дегазировали аргоном в течение 15 мин. В получаемую смесь загружали Pd2(dba)3 (998 мг, 1,09 ммоль) и дегазировали аргоном в течение еще 5 мин. Реакционную смесь перемешивали при 100-110°C в течение 5 ч. Реакционную смесь охлаждали, фильтровали через подушку целита (целит промывали в 10% MeOH/CH2Cl2) и объединенный фильтрат испаряли досуха. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1,4-диазепан-1-карбоксилат 333 (4,50 г, 42%) в виде твердого вещества коричневого цвета. ESI+APCI MS m/z 487 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диазепан-1-ил)имидазо[1,2- a ]пиридина 334;
В раствор трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1,4-диазепан-1-карбоксилата 333 (4,30 г, 8,84 ммоль) в CH2Cl2 (100 мл) загружали раствор HCl в 1,4-диоксане (4,0 М, 20 мл) и перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали и полученное твердое вещество промывали в CH2Cl2. Затем твердое вещество суспендировали в воде (55 мл), ощелачивали насыщенным раствором бикарбоната натрия (55 мл), перемешивали в течение 1 ч при комнатной температуре и фильтровали для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диазепан-1-ил)имидазо[1,2-a]пиридин 334 (3,60 г, 94%) в виде твердого вещества коричневого цвета. ESI+APCI MS m/z 387 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиримидин-2-ил)-1,4-диазепан-1-ил)имидазо[1,2- a ]пиридина 335a (пример 368);
В суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диазепан-1-ил)имидазо[1,2-a]пиридина 334 (150 мг, 0,38 ммоль) и N,N-диизопропилэтиламина (0,19 мл, 1,14 ммоль) в DMF (3 мл) загружали 2-хлорпиримидин (87 мг, 0,76 ммоль). Получаемую смесь подвергали обработке микроволнами при 100°C в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиримидин-2-ил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридин 335a (пример 368) (25 мг, 14%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,31 (д, J=4,8 Гц, 2H), 8,25 (д, J=7,6 Гц, 1H), 8,14 (с, 1H), 7,94 (с, 1H), 6,85 (с, 1H), 6,70 (дд, J=2,4, 7,6 Гц, 1H), 6,55 (т, J=4,8 Гц, 1H), 3,99 (с, 3H), 3,95 (м, 5H), 3,70 (т, J=5,2 Гц, 2H), 3,64 (т, J=5,6 Гц, 2H), 3,53 (т, J=5,6 Гц, 2H), 1,96 (т, J=5,6 Гц, 2H); ВЭЖХ (способ 1) 99,4% (AUC), tR=12,74 мин.; ESI+APCI MS m/z 465 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиримидин-5-ил)-1,4-диазепан-1-ил)имидазо[1,2- a ]пиридина 335b (пример 383);
Суспензию 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диазепан-1-ил)имидазо[1,2-a]пиридина 334 (100 мг, 0,25 ммоль), 5-бромпиримидина (62 мг, 0,38 ммоль), (±) BINAP (17 мг, 0,02 ммоль) и NaOt-Bu (72 мг, 0,75 ммоль) в толуоле (10 мл) дегазировали аргоном в течение 15 мин. Затем в эту смесь загружали Pd2(dba)3 (11 мг, 0,01 ммоль), и дегазировали ее аргоном в течение еще 5 мин. Получаемую реакционную смесь перемешивали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали через подушку целита (целит промывали в 10% MeOH/CH2Cl2) и объединенный фильтрат испаряли досуха. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиримидин-5-ил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридин 335b (пример 383) (25 мг, 20%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,39 (с, 1H), 8,34 (с, 2H), 8,24 (д, J=7,5 Гц, 1H), 8,15 (с, 1H), 7,93 (с, 1H), 6,85 (с, 1H), 6,68 (д, J=6 Гц, 1H), 6,50 (с, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,72 (с, 4H), 3,50 (ушир. с, 4H), 1,98 (ушир. с, 2H); ВЭЖХ (способ 1) 93,0% (AUC), tR=12,42 мин.; ESI+APCI MS m/z 465 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклогексилметил)-1,4-диазепан-1-ил)имидазо[1,2- a ]пиридина 335c (пример 435);
Раствор 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диазепан-1-ил)имидазо[1,2-a]пиридина 334 (150 мг, 0,38 ммоль), циклогексанкарбальдегида (65 мг, 0,58 ммоль) и уксусной кислоты (0,2 мл) в CH3OH (10 мл) перемешивали в течение 1 ч. Добавляли цианоборогидрид натрия (122 мг, 1,94 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разводили водным раствором бикарбоната натрия и экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклогексилметил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридин 335c (пример 435) (18 мг, 10%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,25 (д, J=7,6 Гц, 1H), 8,15 (с, 1H), 7,94 (с, 1H), 6,86 (с, 1H), 6,65 (дд, J=2,4, 7,6 Гц, 1H), 6,39 (д, J=2,0 Гц, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,55-3,49 (м, 4H), 2,70 (ушир. с, 2H), 2,45 (ушир. с, 2H), 2,23 (д, J=6,0 Гц, 2H), 1,87 (ушир. с, 2H), 1,71-1,61 (м, 5H), 1,40 (ушир. с, 1H), 1,19-1,08 (м, 3H), 0,86-0,72 (м, 2H); ВЭЖХ (способ 1) 99,5% (AUC), tR=11,89 мин.; ESI+APCI MS m/z 483 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопентилметил)-1,4-диазепан-1-ил)имидазо[1,2- a ]пиридина 335d (пример 442);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклопентилметил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридин 335d получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклогексилметил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридин 335c, и получали в виде твердого вещества грязно-белого цвета (выход 11%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,36 (д, J=7,5 Гц, 1H), 8,08 (с, 1H), 8,05 (с, 1H), 6,90 (с, 1H), 6,84 (д, J=6,0 Гц 1H), 6,49 (с, 1H), 4,02 (с, 3H), 3,95 (с, 3H), 3,71 (ушир. с, 2H), 3,55 (ушир. с, 2H), 3,49-3,34 (м, 6H), 2,21-1,93 (м, 3H), 1,81-1,65 (м, 2H), 1,61-1,42 (м, 4H), 1,25-1,11 (м, 2H); ВЭЖХ (способ 1) 92,6% (AUC), tR=11,75 мин.; ESI+APCI MS m/z 469 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-4-илметил)-1,4-диазепан-1-ил)имидазо[1,2- a ]пиридина дигидрохлорида 335e (пример 388);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-4-илметил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридин получали аналогичным образом, как 2-(5-хлор-2,4-диметоксифенил)-7-(4-(циклогексилметил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридин 335c, и получали в виде твердого вещества грязно-белого цвета (выход 45%). ESI+APCI MS m/z 478 [M+H]+.
Свободное основание обрабатывали водным раствором HCl (1 Н, 2,0 экв.) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(пиридин-4-илметил)-1,4-диазепан-1-ил)имидазо[1,2-a]пиридина дигидрохлорид 335e (пример 388) в виде твердого вещества светло-желтого цвета (количественно) после лиофилизации.
Получение 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-1,4-диазепан-1-ил)этанона 335f (пример 429);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(1,4-диазепан-1-ил)имидазо[1,2-a]пиридина 334 (150 мг, 0,38 ммоль) и Et3N (0,16 мл, 1,14 ммоль) в CH2Cl2 (15 мл) загружали ацетилхлорид (44 мг, 0,57 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-1,4-диазепан-1-ил)этанон 335f (пример 429) (25 мг, 15%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,25 (д, J=7,2 Гц, 1H), 8,13 (с, 1H), 7,96 (с, 1H), 6,89 (с, 1H), 6,72 (д, J=5,6 Гц, 1H), 6,53 (с, 1H), 4,01 (с, 3H), 3,95 (с, 3H), 3,69-3,63 (м, 6H),3,46 (ушир. с, 2H), 1,97-1,91 (м, 5H); ВЭЖХ (способ 5) 97,6% (AUC), tR=12,70 мин.; ESI+APCI MS m/z 429 [M+H]+.
Схема 2-14
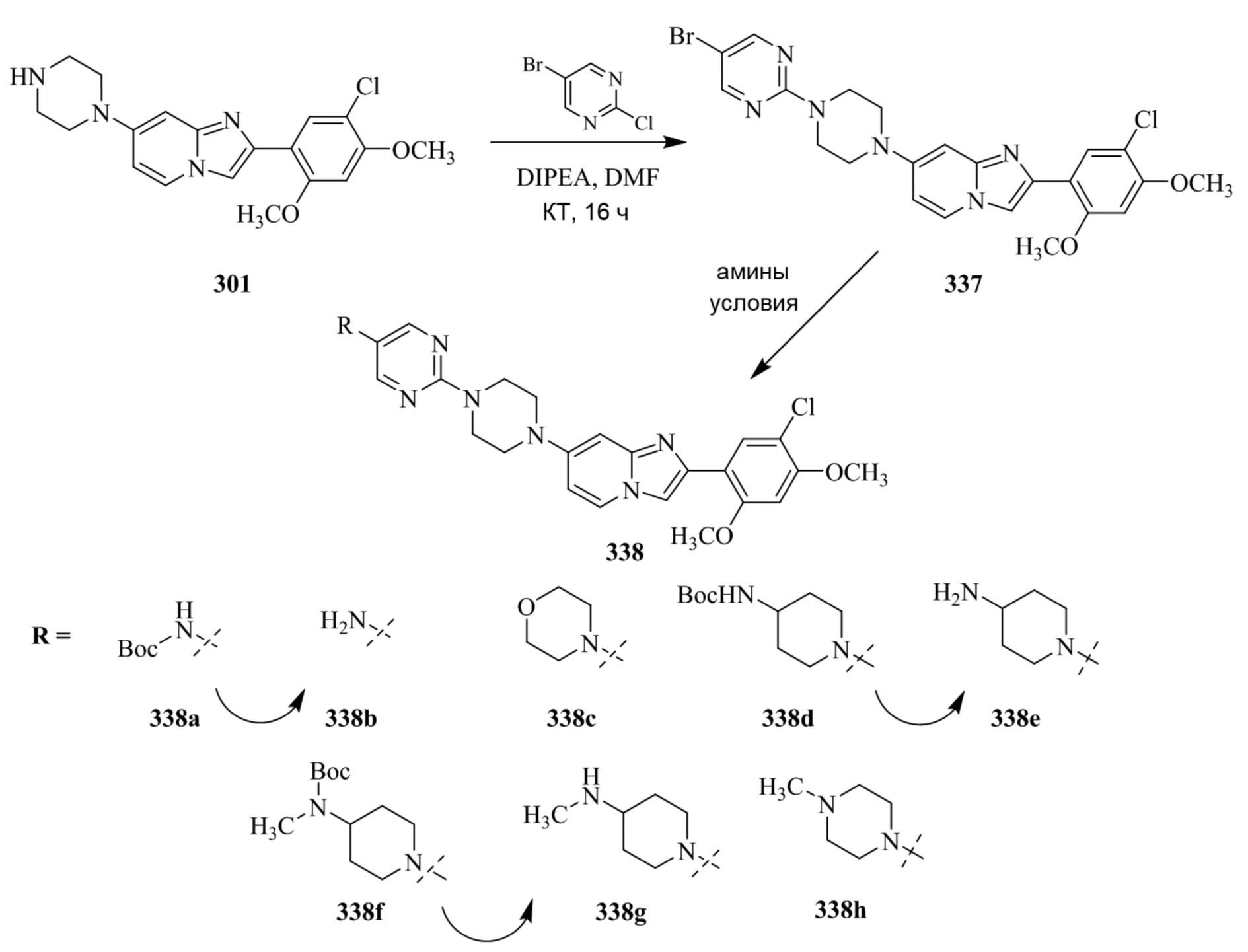
Получение 7-(4-(5-бромпиримидин-2-ил)пиперазин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридина 337;
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (5,00 г, 13,4 ммоль) и N,N-диизопропилэтиламина (10,0 мл, 57,4 ммоль) в DMF (10 мл) загружали 5-бром-2-хлорпиримидин (5,20 г, 26,9 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования; полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 7-(4-(5-бромпиримидин-2-ил)пиперазин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин 337 (5,5 г, 77%) в виде твердого вещества коричневого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,50 (с, 2H), 8,34 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 6,86 (с, 1H), 6,83 (с, 1H), 6,72 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,88 (ушир. с, 4H), 3,33 (ушир. с, 4H); ESI+APCI MS m/z 529 [M+H]+.
Получение трет -бутил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)карбамата 338a;
Суспензию 7-(5-бромпиримидин-2-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 337 (200 мг, 0,37 ммоль), трет-бутилкарбамата (100 мг, 0,84 ммоль), X-phos (36 мг, 0,075 ммоль) и NaOt-Bu (112 мг, 1,13 ммоль) в толуоле (8 мл) дегазировали аргоном в течение 15 мин. В получаемую смесь загружали Pd2(dba)3 (36 мг, 0,037 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Реакционную смесь перемешивали при 110°C в течение 30 мин под микроволнами. Реакционную смесь охлаждали, фильтровали через подушку целита (целит промывали в 10% MeOH/CH2Cl2) и объединенный фильтрат испаряли досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)карбамат 338a (140 мг, неочищенн.) в виде твердого вещества светло-желтого цвета. ESI+APCI MS m/z 566 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-амина гидрохлорида 338b (пример 422);
В раствор трет-бутил(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)карбамата 338a (15 мг, 0,032 ммоль) в 2,2,2-трифторэтаноле (2 мл) загружали триметилсилилхлорид (0,05 мл) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. Реакционную смесь испаряли досуха. Остаток растирали в порошок с CH2Cl2 и н-пентаном для того, чтобы получить 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-амина гидрохлорид 338b (пример 422) (15 мг, 92%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,58 (ушир. с, 1H), 9,32 (ушир. с, 2H), 8,58 (д, J=7,6 Гц, 1H), 8,34 (с, 2H), 8,29 (с, 1H), 8,04 (с, 1H), 7,33 (с, 1H), 6,98 (с, 1H), 6,76 (с, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,89 (ушир. с, 4H), 3,55 (ушир. с, 4H); ВЭЖХ (способ 6) 96,7% (AUC), tR=12,10 мин.; ESI+APCI MS m/z 466 [M+H]+.
Получение 4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)морфолина 338c (пример 427);
Суспензию 7-(4-(5-бромпиримидин-2-ил)пиперазин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 337 (250 мг, 0,47 ммоль), морфолина (0,6 мл, 6,93 ммоль), (±) BINAP (60 мг, 0,096 ммоль) и NaOt-Bu (140 мг, 1,45 ммоль) в толуоле (12,5 мл) дегазировали аргоном в течение 15 мин. В получаемую смесь загружали Pd2(dba)3 (45 мг, 0,049 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Реакционную смесь перемешивали при 90-100°C в течение 12 ч в запаянной пробирке. Реакционную смесь охлаждали, фильтровали через подушку целита (целит промывали в 10% MeOH/CH2Cl2) и объединенный фильтрат испаряли досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)морфолин 338c (пример 427) (120 мг, 23%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,6 Гц, 1H), 8,24 (с, 2H), 8,18 (с, 1H), 8,03 (с, 1H), 6,87 (с, 1H), 6,85 (с, 1H), 6,72 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,79 (ушир. с, 4H), 3,73 (ушир. с, 4H), 3,31 (ушир. с, 4H), 3,01 (ушир. с, 4H); ВЭЖХ (способ 6) >99% (AUC), tR=13,23 мин.; ESI+APCI MS m/z 536 [M+H]+.
Получение трет -бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)пиперидин-4-ил)карбамата 338d;
Суспензию 7-(4-(5-бромпиримидин-2-ил)пиперазин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 337 (400 мг, 0,75 ммоль), трет-бутилпиперидин-4-илкарбамата (304 мг, 1,51 ммоль), (±) BINAP (96 мг, 0,15 ммоль) и NaOt-Bu (220 мг, 2,28 ммоль) в толуоле (20 мл) дегазировали аргоном в течение 15 мин. В получаемую смесь загружали Pd2(dba)3 (72 мг, 0,078 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Получаемую реакционную смесь перемешивали при 90-100°C в течение 12 ч в запаянной пробирке. Реакционную смесь охлаждали, фильтровали через слой целита (целит промывали в 10% MeOH/CH2Cl2) и объединенный фильтрат испаряли досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)пиперидин-4-ил)карбамат 338d (210 мг, неочищенн.). ESI+APCI MS m/z 649 [M+H]+.
Получение 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)пиперидин-4-амина 338e (пример 441);
В раствор трет-бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)пиперидин-4-ил)карбамата 338d (60 мг) в CH2Cl2 (2,5 мл) загружали 4,0 M HCl в 1,4-диоксане (0,5 мл) и перемешивали его при комнатной температуре в течение 16 ч. Фильтровали реакционную смесь, и полученное твердое вещество распределяли между насыщенным бикарбонатным раствором и CH2Cl2, и разделяли слои. Органический слой промывали солевым раствором; сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растирали в порошок с CH2Cl2 и н-пентаном и фильтровали для того, чтобы получить 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)пиперидин-4-амин 338e (пример 441) (6 мг, 12%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,33 (д, J=7,5 Гц, 1H), 8,22 (с, 2H), 8,11 (с, 1H), 8,03 (с, 1H), 6,86 (с, 1H), 6,83 (с, 1H), 6,72 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,78 (ушир. с, 4H), 3,43-3,39 (м, 2H), 3,31 (ушир. с, 4H), 2,72-2,59 (м, 3H), 1,80-1,76 (м, 2H), 1,39-1,35 (м, 2H); ESI+APCI MS m/z 549 [M+H]+.
Получение трет -бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)пиперидин-4-ил)(метил)карбамата 338f;
Соединение трет-бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)пиперидин-4-ил)(метил)карбамат 338f получали аналогичным образом, как трет-бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)пиперидин-4-ил)карбамат 338d, и получали в виде твердого вещества грязно-белого цвета (выход 14%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,24 (с, 2H), 8,17 (с, 1H), 8,03 (с, 1H), 6,86-6,84 (м, 2H), 6,72 (д, J=2,0 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,80-3,77 (м, 4H), 3,55 (д, J=12,0 Гц, 2H), 3,31-3,28 (м, 4H), 2,69 (с, 3H), 2,67-2,55 (м, 3H), 1,83-1,75 (м, 2H), 1,61-1,56 (м, 2H), 1,40 (с, 9H); ВЭЖХ (способ 1) 96,6% (AUC), tR=14,2 мин.; ESI+APCI MS m/z 663 [M+H]+.
Получение 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)-N-метилпиперидин-4-амина 338g (пример 458);
Соединение 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)-N-метилпиперидин-4-амин 338g получали аналогичным образом, как 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-5-ил)пиперидин-4-амин 338e, и получали в виде твердого вещества грязно-белого цвета (выход 32%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=6,3 Гц, 1H), 8,22 (с, 2H), 8,17 (с, 1H), 8,03 (с, 1H), 6,86-6,84 (м, 2H), 6,72 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,78 (ушир. с, 4H), 3,45-3,33 (м, 6H), 2,72-2,60 (м, 2H), 2,27 (с, 3H), 1,88-1,84 (м, 2H), 1,54-1,51 (м, 1H), 1,40-1,35 (м, 2H); ВЭЖХ (способ 1) >99% (AUC), tR=11,8 мин.; ESI+APCI MS m/z 563 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(5-(4-метилпиперазин-1-ил)пиримидин-2-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 338h (пример 430);
Суспензию 7-(4-(5-бромпиримидин-2-ил)пиперазин-1-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 337 (250 мг, 0,47 ммоль), 1-метилпиперазина (0,5 мл, 4,50 ммоль), X-phos (46 мг, 0,096 ммоль) и NaOt-Bu (140 мг, 1,45 ммоль) в толуоле (12,5 мл) дегазировали аргоном в течение 15 мин. В получаемую смесь загружали Pd2(dba)3 (45 мг, 0,049 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Реакционную смесь перемешивали при 90-100°C в течение 12 ч в запаянной пробирке. Реакционную смесь охлаждали, фильтровали через подушку целита (целит промывали в 10% MeOH/CH2Cl2) и объединенный фильтрат испаряли досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(5-(4-метилпиперазин-1-ил)пиримидин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 338h (пример 430) (20 мг, 4%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,36 (д, J=7,6 Гц, 1H), 8,26 (с, 2H), 8,15 (с, 1H), 8,06 (с, 1H), 6,91 (д, J=7,2 Гц, 1H), 6,88 (с, 1H), 6,73 (с, 1H), 4,01 (с, 3H), 3,94 (с, 3H), 3,79 (ушир. с, 4H), 3,73 (ушир. с, 4H), 3,31 (ушир. с, 4H), 3,12 (ушир. с, 4H), 2,79 (ушир. с, 4H), 2,47 (с, 3H); ВЭЖХ (способ 6) 91,8% (AUC), tR=12,17 мин.; ESI+APCI MS m/z 549 [M+H]+.
Схема 2-15
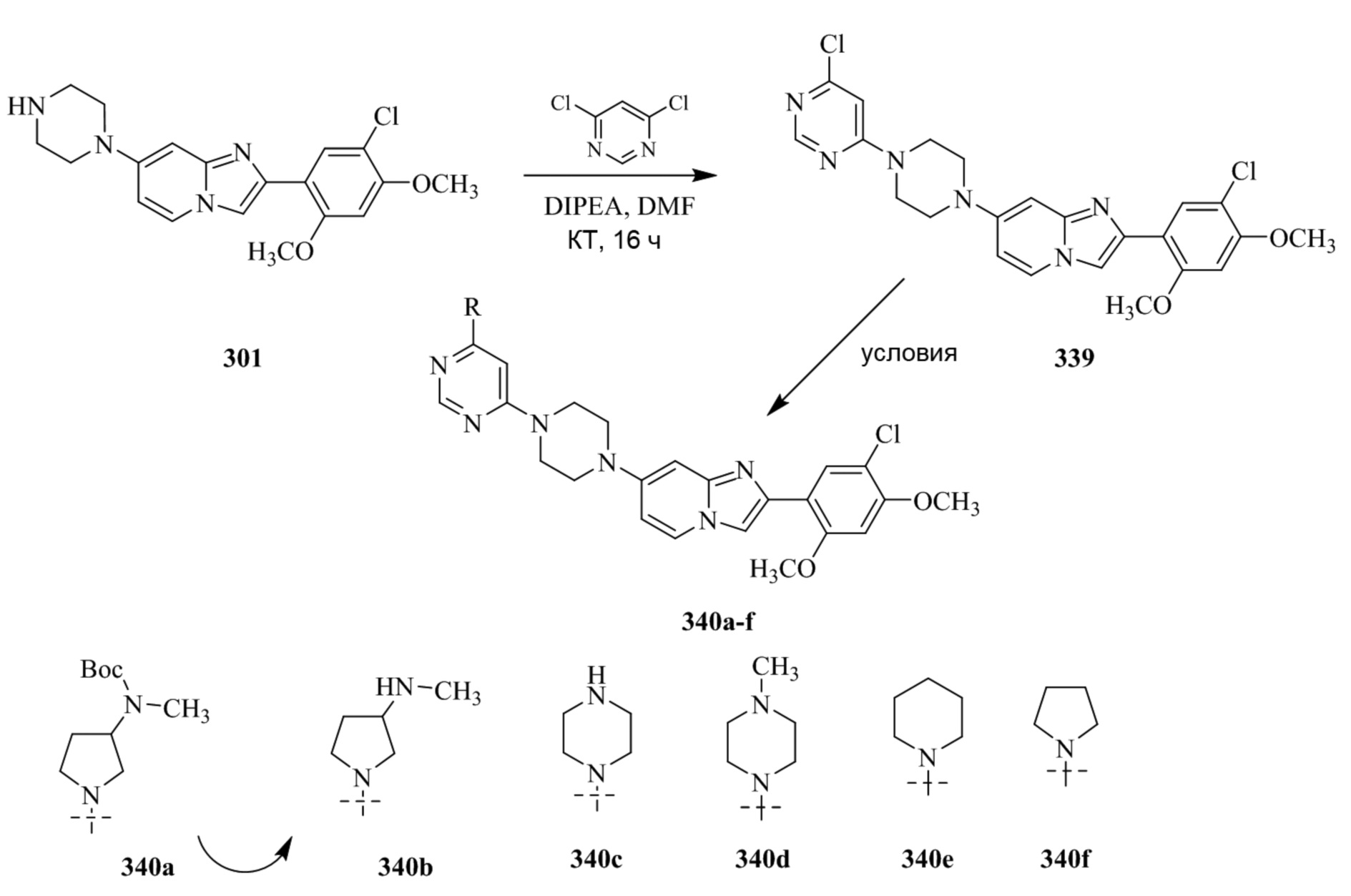
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 339;
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (1,00 г, 2,68 ммоль) и N,N-диизопропилэтиламина (2,0 мл, 11,5 ммоль) в DMF (20 мл) загружали 4,6-дихлорпиримидин (800 мг, 5,37 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, промывали водой, сушили и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 339 (1,1 г, 85%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,38 (с, 1H), 8,35 (д, J=7,2 Гц, 1H), 8,17 (с, 1H), 8,04 (с, 1H), 7,07 (с, 1H), 6,88 (с, 1H), 6,87 (с, 1H), 6,72 (д, J=2,0 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,82 (ушир. с, 4H), 3,35 (ушир. с, 4H); ESI+APCI MS m/z 485 [M+H]+.
Получение трет -бутил(1-(6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пирролидин-3-ил)(метил)карбамата 340a;
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 339 (200 мг, 0,41 ммоль) и триэтиламина (0,6 мл, 4,30 ммоль) в DMSO (4 мл) загружали трет-бутил метил(пирролидин-3-ил)карбамат (416 мг, 2,07 ммоль). Реакционную смесь перемешивали при 90-100°C в течение 1 ч. Реакционную смесь охлаждали до температуры окружающей среды и разбавляли водой. Образованные твердые вещества собирали посредством фильтрования, промывали водой, сушили и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пирролидин-3-ил)(метил)карбамат 340a (130 мг, 48%). ESI+APCI MS m/z 649 [M+H]+.
Получение 1-(6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)-N-метилпирролидин-3-амина 340b (пример 424);
В раствор трет-бутил(1-(6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пирролидин-3-ил)(метил)карбамата 340a (155,0 мг) в 2,2,2-трифторэтаноле (2,5 мл) загружали триметилсилилхлорид (0,2 мл) при 0°C. Реакционную смесь перемешивали при 0°C в течение 30 мин. Реакционную смесь испаряли досуха и остаток поднимали в воде. Получаемую смесь ощелачивали насыщенным раствором бикарбоната натрия и экстрагировали в CH2Cl2. Объединенные органические слои промывали солевым раствором; сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) и выделенное соединение растирали в порошок с CH2Cl2 и гексанами для того, чтобы получить 1-(6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)-N-метилпирролидин-3-амин 340b (45 мг, 34%) в виде твердого вещества светло-коричневого цвета.
1H ЯМР (400 МГц, CD3OD): δ 8,08 (д, J=7,2 Гц, 1H), 7,97 (с, 1H), 7,96 (с, 1H), 7,88 (с, 1H), 6,71 (д, J=7,2 Гц, 1H), 6,68 (с, 1H), 6,59 (с, 1H), 5,5 (с, 1H), 3,92 (с, 3H), 3,85 (с, 3H), 3,64 (ушир. с, 4H), 3,60-3,35 (м, 4H), 3,28 (ушир. с, 4H), 2,38 (с, 3H), 2,18-2,13 (м, 1H), 1,84-1,80 (м, 1H); ВЭЖХ (способ 6) 95,4% (AUC), tR=11,35 мин.; ESI+APCI MS m/z 549 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-(пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 340c (пример 375);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 339 (200 мг, 0,41 ммоль) в DMF (5 мл) загружали пиперазин (142 мг, 1,65 ммоль). Реакционную смесь перемешивали при 90-100°C в течение 16 ч в запаянной пробирке. Реакционную смесь суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, промывали водой, сушили и очищали с помощью запускаемой по массе препаративной ВЭЖХ для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-(пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 340c (55 мг, 25%) в виде твердого вещества желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,2 Гц, 1H), 8,17 (с, 1H), 8,09 (с, 1H), 8,03 (с, 1H), 6,86 (с, 1H), 6,84 (д, J=3,2 Гц, 1H), 6,72 (с, 1H), 5,95 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,71 (ушир. с, 4H), 3,47 (ушир. с, 4H), 3,32 (ушир. с, 4H), 2,71 (ушир. с, 4H); ВЭЖХ (способ 1) 98,1% (AUC), tR=11,02 мин.; ESI+APCI MS m/z 535 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-(4-метилпиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина дигидрохлорида 340d (пример 377);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 339 (170 мг, 0,35 ммоль) и 1-метилпиперазина (1,7 мл) перемешивали при 90-100°C в течение 16 ч в запаянной пробирке. Реакционную смесь суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, промывали водой, сушили и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Свободное основание превращали в его гидрохлоридную соль, и соль растирали в порошок с н-пентаном для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-(4-метилпиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина дигидрохлорид 340d (115 мг, 53%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,90 (ушир. с, 1H), 11,3 (ушир. с, 1H), 8,60 (д, J=8,0 Гц, 1H), 8,30 (д, J=2,0 Гц, 2H), 8,12 (с, 1H), 7,07 (дд, J=2,4 Гц, J=7,6 Гц, 1H), 6,98 (с, 1H), 6,79 (д, J=2,0 Гц, 1H), 6,21 (с, 1H), 4,54 (д, J=13,5 Гц, 2H), 4,06 (с, 3H), 3,99 (с, 3H), 3,89 (ушир. с, 4H), 3,68 (ушир. с, 4H), 3,49 (д, J=11,6 Гц, 2H), 3,43-3,37 (м, 2H), 3,08-3,02 (м, 2H), 3,78 (д, J=4,4 Гц, 3H); ВЭЖХ (способ 1) 93,7% (AUC), tR=11,05 мин.; ESI+APCI MS m/z 549 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-(пиперидин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 340e (пример 353);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 339 (100 мг, 0,1 ммоль) и пиперидина (1,0 мл) перемешивали при 100°C в течение 2 ч в запаянной пробирке. Реакционную смесь суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, промывали водой, сушили и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Выделенное соединение растирали в порошок с CH2Cl2 и гексанами для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-(пиперидин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 340e (30 мг, 54%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=7,8 Гц, 1H), 8,17 (с, 1H), 8,08 (с, 1H), 8,03 (с, 1H), 6,88 (с, 1H), 6,86 (д, J=2,7 Гц, 1H), 6,72 (с, 1H), 5,96 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,71 (ушир. с, 4H), 3,55 (ушир. с, 4H), 3,31 (ушир. с, 4H), 1,61 (ушир. с, 2H), 1,49 (ушир. с, 4H); ВЭЖХ (способ 1) 92,2% (AUC), tR=12,48 мин.; ESI+APCI MS m/z 534 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-(пирролидин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 340f (пример 355);
Cмесь 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-хлорпиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина 339 (100 мг, 0,1 ммоль) и пирролидина (1,0 мл) перемешивали при 100°C в течение 2 ч в запаянной пробирке. Реакционную смесь суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, промывали водой, сушили и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Выделенное соединение растирали в порошок с CH2Cl2 и гексанами для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(6-(пирролидин-1-ил)пиримидин-4-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 340f (55 мг, 51%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,35 (д, J=7,6 Гц, 1H), 8,16 (с, 1H), 8,06 (с, 1H), 8,04 (с, 1H), 6,89 (с, 1H), 6,87 (с, 1H), 6,71 (с, 1H), 5,62 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,69 (ушир. с, 4H), 3,37 (ушир. с, 4H), 3,31 (ушир. с, 4H), 1,90 (ушир. с, 4H); ВЭЖХ (способ 1) 91,4% (AUC), tR=12,25 мин.; ESI+APCI MS m/z 520 [M+H]+.
Схема 2-16
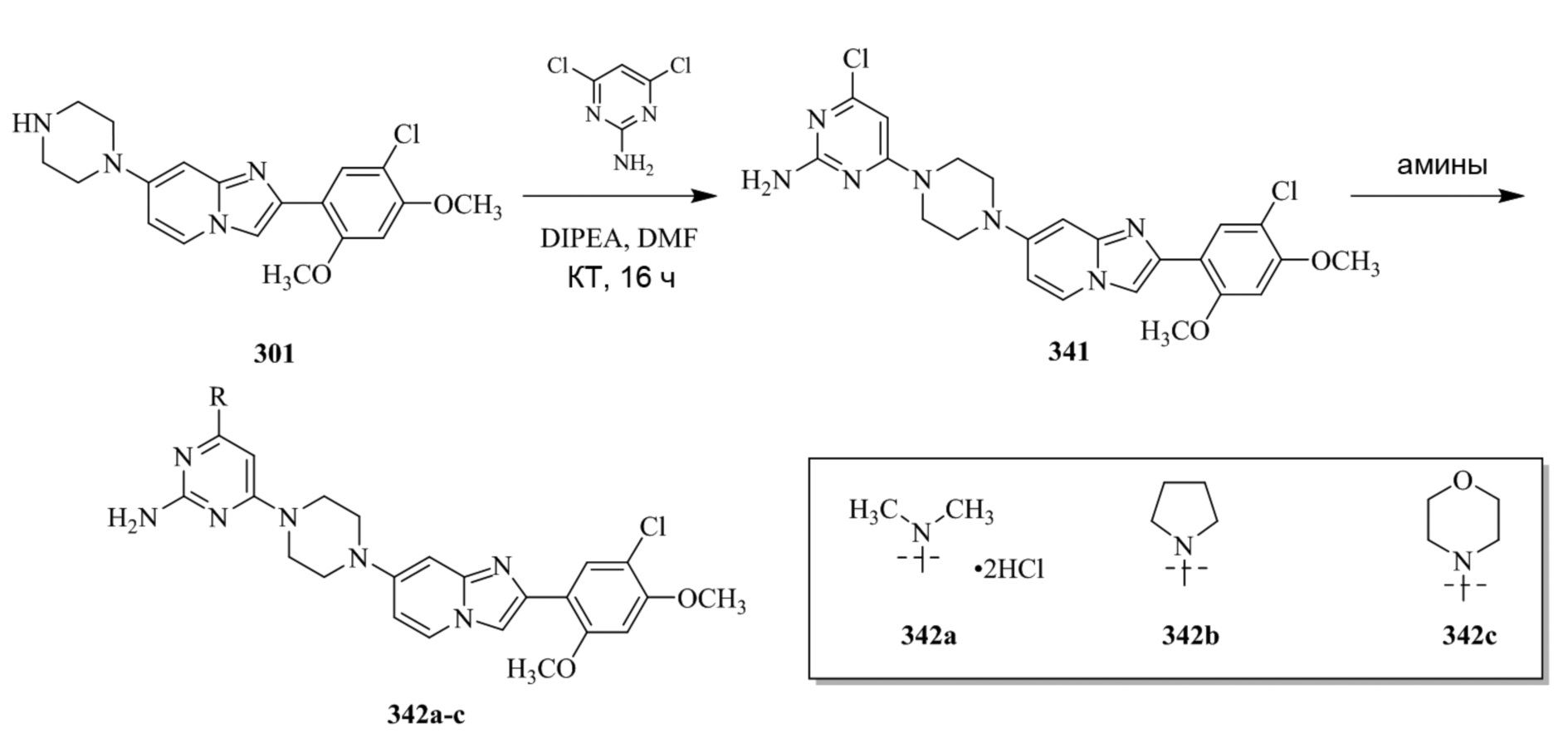
Получение 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-амина 341 (пример 360);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (500 мг, 1,34 ммоль) и N,N-диизопропилэтиламина (1,0 мл, 5,74 ммоль) в DMF (10 мл) загружали 4,6-дихлорпиримидин-2-амин (440 мг, 2,68 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, промывали водой, сушили и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Выделенное соединение растирали в порошок с метанолом и гексанами для того, чтобы получить 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-амин 341 (пример 360) (450 мг, 62%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=7,8 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 6,87 (с, 1H), 6,84 (д, J=2,4 Гц, 1H), 6,72 (с, 1H), 6,55 (ушир. с, 2H), 6,18 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,72 (ушир. с, 4H), 3,29 (ушир. с, 4H); ВЭЖХ (способ 1) 96,5% (AUC), tR=12,33 мин.; ESI+APCI MS m/z 500 [M+H]+.
Получение 6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)- N 4, N 4-диметилпиримидин-2,4-диамина дигидрохлорида 342a (пример 389);
В раствор 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-амина 341 (200 мг, 0,40 ммоль) и диметиламина гидрохлорида (330 мг, 4,04 ммоль) в DMSO (5 мл) загружали триэтиламин (0,6 мл, 4,30 ммоль). Реакционную смесь перемешивали при 90-100°C в течение 16 ч в запаянной пробирке. Реакционную смесь суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, промывали водой, сушили и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Выделенное соединение дополнительно очищали с помощью запускаемой по массе препаративной ВЭЖХ. Продукт превращали в его гидрохлоридную соль и растирали в порошок с н-пентаном для того, чтобы получить 6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N4,N4-диметилпиримидин-2,4-диамина дигидрохлорид 342a (21 мг, 11%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,6 (ушир. с, 1H), 11,5 (ушир. с, 1H), 8,58 (д, J=7,6 Гц, 1H), 8,29 (с, 1H), 8,01 (с, 1H), 7,56 (ушир. с, 2H), 7,33 (д, J=6,0 Гц, 1H), 6,99 (с, 1H), 6,72 (с, 1H), 5,34 (с, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,87 (ушир. с, 4H), 3,68 (ушир. с, 4H), 3,10 (с, 6H); ВЭЖХ (способ 1) >99% (AUC), tR=11,51 мин.; ESI+APCI MS m/z 509 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-6-(пирролидин-1-ил)пиримидин-2-амина 342b (пример 385);
В раствор 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-амина 341 (150 мг, 0,3 ммоль) в DMSO (3 мл) загружали пирролидин (0,3 мл, 3,59 ммоль). Реакционную смесь перемешивали при 90-100°C в течение 16 ч в запаянной пробирке. Реакционную смесь суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, промывали водой, сушили и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Выделенное соединение растирали в порошок с CH2Cl2 и гексанами для того, чтобы получить 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-6-(пирролидин-1-ил)пиримидин-2-амин 342b (45 мг, 21%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=7,5 Гц, 1H), 8,16 (с, 1H), 8,04 (с, 1H), 6,87 (с, 1H), 6,85 (с, 1H), 6,71 (с, 1H), 5,68 (ушир. с, 2H), 5,07 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,62 (ушир. с, 4H), 3,32 (ушир. с, 4H), 3,28 (ушир. с, 4H), 1,87 (ушир. с, 4H); ВЭЖХ (способ 1) 96,3% (AUC), tR=12,27 мин.; ESI+APCI MS m/z 535 [M+H]+.
Получение 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-6-морфолинопиримидин-2-амина 342c (пример 384);
В раствор 4-хлор-6-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-2-амина 341 (150 мг, 0,3 ммоль) в DMSO (3 мл) загружали морфолин (0,3 мл, 3,46 ммоль). Реакционную смесь перемешивали при 90-100°C в течение 16 ч в запаянной пробирке. Реакционную смесь суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, промывали водой, сушили и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Полученный продукт дополнительно очищали с помощью запускаемой по массе препаративной ВЭЖХ. Полученный продукт растирали в порошок с насыщенным раствором бикарбоната натрия; образованное твердое вещество фильтровали, промывали водой и сушили для того, чтобы получить 4-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-6-морфолинопиримидин-2-амин 342c (25 мг, 13%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 6,88-6,86 (м, 2H), 6,72 (д, J=2,0 Гц, 1H), 5,71 (ушир. с, 2H), 5,40 (с, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,62 (ушир. с, 8H), 3,43 (ушир. с, 4H), 3,26 (ушир. с, 4H); ВЭЖХ (способ 1) 99,0% (AUC), tR=11,94 мин.; ESI+APCI MS m/z 551 [M+H]+.
Схема 2-17
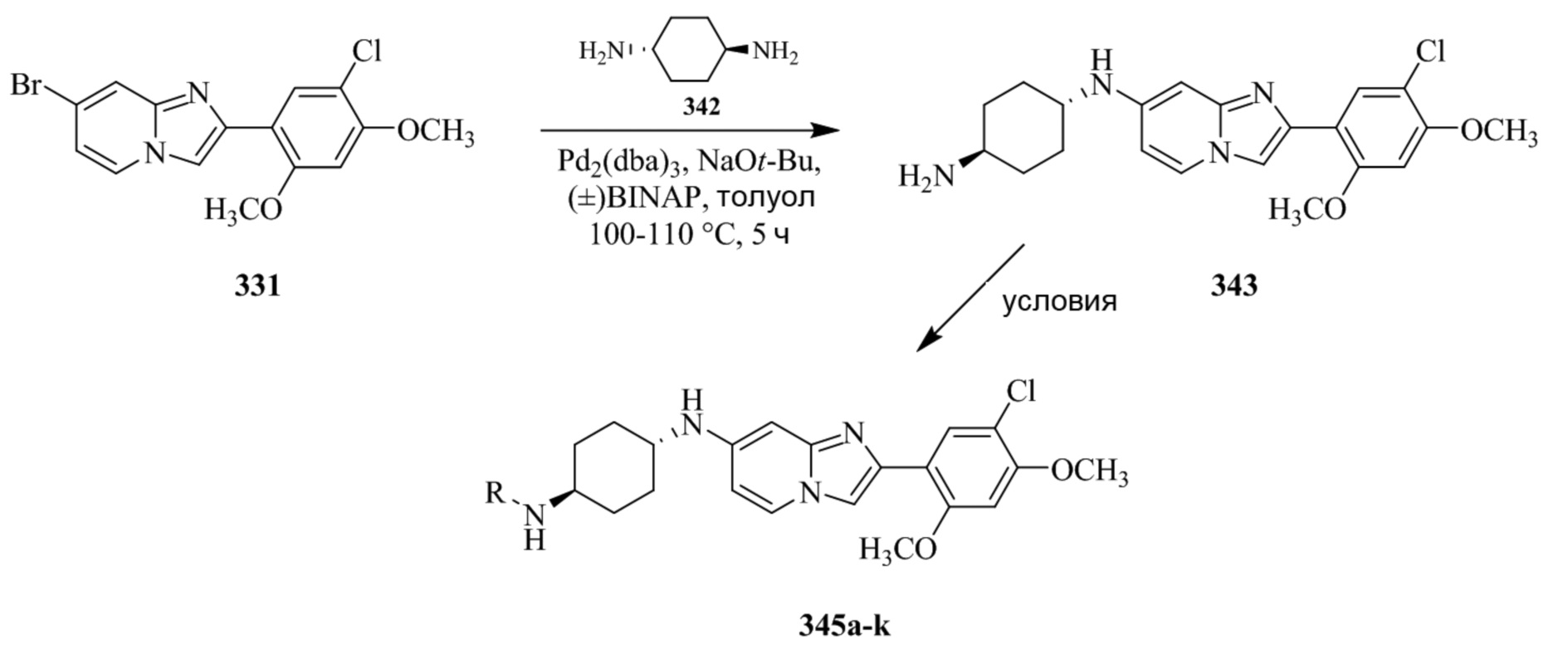
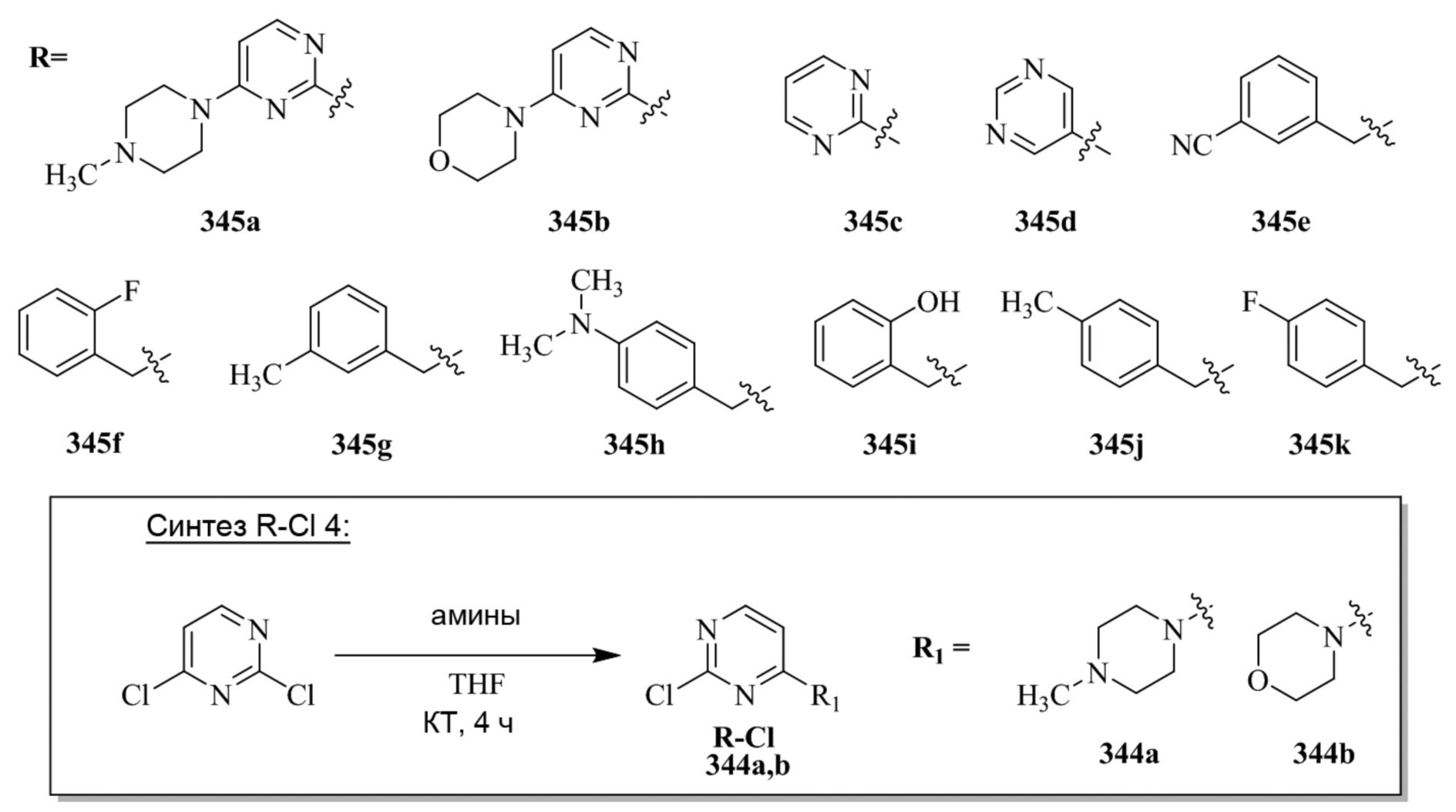
Получение (1 r ,4 r )- N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)циклогексан-1,4-диамина 343;
Cмесь 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 331 (1,00 г, 2,73 ммоль), транс-циклогексан-1,4-диамина 342 (311 мг, 2,73 ммоль), Pd2(dba)3 (125 мг, 0,13 ммоль), (±) BINAP (170 мг, 0,27 ммоль) и NaOt-Bu (786 мг, 8,19 ммоль) в толуоле (20 мл) дегазировали аргоном в течение 15 мин и затем нагревали при 100°C в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли с использованием CH2Cl2 (30 мл) и фильтровали через подушку целита. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали посредством колоночной хроматографии (силикагель, CH3OH/CH2Cl2) для того, чтобы получить (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамин 343 (500 мг, 46%) в виде твердого вещества зеленого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,14 (с, 1H), 8,10 (д, J=7,6 Гц, 1H), 7,86 (с, 1H), 6,84 (с, 1H), 6,33 (дд, J=2,0, 7,2 Гц, 1H), 6,19 (с, 1H), 5,97 (д, J=7,6 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,15-3,12 (м, 1H), 2,58-2,55 (м, 1H), 2,01-1,99 (м, 2H), 1,81-1,79 (м, 2H), 1,23-1,16 (м, 4H); ESI+APCI MS m/z 401 [M+H]+.
Получение (1 r ,4 r )- N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(4-(4-метилпиперазин-1-ил)пиримидин-2-ил)циклогексан-1,4-диамина 345a (пример 398);
В раствор 2,4-дихлорпиримидина (1,00 г, 6,71 ммоль) и 1-метилпиперазина (671 мг, 6,71 ммоль) в THF (25 мл) загружали триэтиламин (1,41 мл, 10,1 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь распределяли между раствором NH4Cl и этилацетатом и разделяли слои. Органический слой промывали солевым раствором; сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-хлор-4-(4-метилпиперазин-1-ил)пиримидин 344a (830 мг, 53%). ESI+APCI MS m/z 213 [M+H]+.
Суспензию (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамина 343 (150 мг, 0,37 ммоль), 2-хлор-4-(4-метилпиперазин-1-ил)пиримидина 344a (119 мг, 0,56 ммоль), (±) BINAP (25 мг, 0,04 ммоль) и NaOt-Bu (106 мг, 1,11 ммоль) в толуоле (10 мл) дегазировали аргоном в течение 15 мин. Затем в получаемую смесь загружали Pd2(dba)3 (16 мг, 0,01 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Реакционную смесь перемешивали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали, фильтровали через подушку целита (целит промывали в 10% MeOH/CH2Cl2) и объединенный фильтрат испаряли досуха. Остаток очищали посредством препаративной ВЭЖХ для того, чтобы получить (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-(4-метилпиперазин-1-ил)пиримидин-2-ил)циклогексан-1,4-диамин 345a (10 мг, 5%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,11(д, J=7,6 Гц, 1H), 7,87 (с, 1H),7,79 (д, J=6,0 Гц, 1H), 6,84 (с, 1H), 6,35 (дд, J=2,0, 7,6 Гц, 2H), 6,22 (с, 1H), 6,03 (д, J=7,2 Гц, 1H), 5,99 (д, J=6,0 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,68-3,66 (м, 1H), 3,51 (ушир. с, 4H), 3,24-3,16 (м, 1H), 2,32 (ушир. с, 4H), 2,19 (с, 3H), 2,08-2,06 (м, 2H), 1,97-1,94 (м, 2H), 1,44-1,35 (м, 2H), 1,29-1,20 (м, 2H); ВЭЖХ (способ 3) 93,2% (AUC), tR=13,06 мин. ESI+APCI MS m/z 577 [M+H]+.
Получение (1 r ,4 r )- N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(4-морфолинопиримидин-2-ил)циклогексан-1,4-диамина 345b (пример 406);
Соединение 4-(2-хлорпиримидин-4-ил)морфолин 344b получали аналогичным образом, как 2-хлор-4-(4-метилпиперазин-1-ил)пиримидин 344a; ESI+APCI MS m/z 200 [M+H]+.
Соединение (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-морфолинопиримидин-2-ил)циклогексан-1,4-диамин 345b получали аналогичным образом, как (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-(4-метилпиперазин-1-ил)пиримидин-2-ил)циклогексан-1,4-диамин 345a, и получали в виде твердого вещества грязно-белого цвета (выход 10%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,12(д, J=4,8 Гц, 1H), 7,88 (с, 1H),7,82 (д, J=6,0 Гц, 1H), 6,85 (с, 1H), 6,36 (д, J=5,6 Гц, 2H), 6,22 (с, 1H), 6,01 (д, J=7,2 Гц, 1H), 6,00 (д, J=5,6 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,68-3,66 (м, 1H), 3,63 (ушир. с, 4H), 3,48 (ушир. с, 4H), 3,28-3,20 (м, 1H), 2,08-2,05 (м, 2H), 1,97-1,94 (м, 2H), 1,44-1,35 (м, 2H), 1,29-1,20 (м, 2H); ВЭЖХ (способ 5) 97,4% (AUC), tR=12,93 мин.; ESI+APCI MS m/z 564 [M+H]+.
Получение (1 r ,4 r )- N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(пиримидин-2-ил)циклогексан-1,4-диамина гидрохлорида 345c (пример 318);
Соединение (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(пиримидин-2-ил)циклогексан-1,4-диамин получали аналогичным образом, как (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-(4-метилпиперазин-1-ил)пиримидин-2-ил)циклогексан-1,4-диамин 345a, и превращали в гидрохлоридную соль (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(пиримидин-2-ил)циклогексан-1,4-диамина гидрохлорид 345c в виде аморфного твердого вещества желто-зеленого цвета (выход 10% на 2 стадии).
1H ЯМР (400 МГц, DMSO-d6): δ 13,32 (с, 1H), 8,84-8,32 (м, 3H), 8,20 (с, 1H), 7,97 (с, 1H), 7,89 (ушир. с, 1H), 7,66 (д, J=5,8 Гц, 1H), 6,97 (с, 1H), 6,88 (ушир. с, 1H), 6,70 (т, J=4,9, 9,9 Гц, 1H), 6,49 (ушир. с, 1H), 4,04 (с, 3H), 3,98 (с, 3H), 3,40 (ушир. с, 1H), 2,04 (т, J=11,7, 22,5 Гц, 4H), 1,56-1,32 (м, 4H); ВЭЖХ (способ 4) 98,2% (AUC), tR=17,46 мин; ESI MS m/z 479 [M+H]+.
Получение (1 r ,4 r )- N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(пиримидин-5-ил)циклогексан-1,4-диамина 345d (пример 337);
Соединение (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(пиримидин-5-ил)циклогексан-1,4-диамин 345d получали аналогичным образом, как (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-(4-метилпиперазин-1-ил)пиримидин-2-ил)циклогексан-1,4-диамин 345a, и получали в виде твердого вещества грязно-белого цвета (выход 11%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (с, 1H), 8,14-8,11 (м, 4H), 7,87 (с, 1H), 6,84 (с, 1H), 6,38 (дд, J=2,0, 7,2 Гц, 1H), 6,06 (с, 1H), 6,08 (д, J=7,6 Гц, 1H), 6,01 (д, J=8,0 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 1H), 2,07-2,02 (м, 4H), 1,40-1,39 (м, 4H); ВЭЖХ (способ 1) 97,9% (AUC), tR=12,65 мин.; ESI+APCI MS m/z 479 [M+H]+.
Получение 3-((((1 r ,4 r )-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрила 345e (пример 397);
В суспензию (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)циклогексан-1,4-диамина 343 (200 мг, 0,50 ммоль), 3-формилбензонитрила (98 мг, 0,75 ммоль) в CH3OH (10 мл) добавляли уксусную кислоту (0,2 мл) и получаемую смесь перемешивали в течение 1 ч. Затем в реакционную смесь загружали NaCNBH3 (157 мг, 2,5 ммоль) и затем перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разводили водным раствором бикарбоната натрия и экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить 3-((((1r,4r)-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрил 345e (20 мг, 8%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,13-8,10 (м, 2H), 7,87 (с, 1H), 7,81 (с, 1H), 7,70 (с, 2H), 7,55-7,53 (м, 1H), 6,84 (с, 1H), 6,34 (д, J=5,6 Гц, 1H), 6,21 (с, 1H), 6,01 (д, J=6,4 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,81 (с, 2H), 3,32-3,21 (м, 2H), 2,05-1,95 (м, 4H), 1,23-1,13 (м, 4H); ВЭЖХ (способ 3) 94,2% (AUC), tR=13,38 мин.; ESI+APCI MS m/z 516 [M+H]+.
Получение (1 r ,4 r )- N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(2-фторбензил)циклогексан-1,4-диамина 345f (пример 414);
Соединение (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(2-фторбензил)циклогексан-1,4-диамин 345f получали аналогичным образом, как 3-((((1r,4r)-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрил 345e, и получали в виде твердого вещества грязно-белого цвета (выход 15%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,11 (д, J=7,2 Гц, 1H), 7,87 (с, 1H), 7,50 (т, J=7,5 Гц, 1H), 7,28 (т, J=7,5 Гц, 1H), 7,20-7,11 (м, 2H), 6,84 (с, 1H), 6,33 (дд, J=1,8, 7,5 Гц, 1H), 6,20 (с, 1H), 6,01 (д, J=7,8 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,80 (с, 2H), 3,35-3,19 (м, 2H), 2,06-1,95 (м, 4H), 1,31-1,09 (м, 4H); ВЭЖХ (способ 5) 90,2% (AUC), tR=12,71 мин.; ESI+APCI MS m/z 509 [M+H]+.
Получение (1 r ,4 r )- N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(3-метилбензил)циклогексан-1,4-диамина 345g (пример 415);
Соединение (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(3-метилбензил)циклогексан-1,4-диамин 345g получали аналогичным образом, как 3-((((1r,4r)-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрил 345e, и получали в виде твердого вещества грязно-белого цвета (выход 13%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,14 (с, 1H), 8,11 (д, J=7,2 Гц, 1H), 7,87 (с, 1H), 7,20-7,12 (м, 2H), 7,02 (д, J=6,8 Гц, 1H), 6,84 (с, 1H), 6,33 (д, J=7,6 Гц, 1H), 6,20 (с, 1H), 6,00 (д, J=7,6 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,70 (с, 2H), 3,35-3,19 (м, 2H), 2,29 (с, 3H), 2,04-1,94 (м, 4H), 1,27-1,12 (м, 4H); ВЭЖХ (способ 5) 91,5% (AUC), tR=12,88 мин. ESI+APCI MS m/z 505 [M+H]+.
Получение (1 r ,4 r )- N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(4-(диметиламино)бензил)циклогексан-1,4-диамина 345h (пример 419);
Соединение (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-(диметиламино)бензил)циклогексан-1,4-диамин 345h получали аналогичным образом, как 3-((((1r,4r)-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрил 345e, и получали в виде твердого вещества грязно-белого цвета (выход 12%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,14 (с, 1H), 8,11 (д, J=7,2 Гц, 1H), 7,87 (с, 1H), 7,15 (д, J=8,4 Гц, 2H), 6,84 (с, 1H), 6,68 (д, J=8,4 Гц, 2H), 6,33 (д, J=7,2 Гц, 1H), 6,20 (с, 1H), 6,00 (д, J=7,6 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,65 (с, 2H), 3,35-3,29 (м, 1H), 3,19-3,18 (м, 1H), 2,86 (с, 6H), 2,05-1,95 (м, 4H), 1,28-1,12 (м, 4H); ВЭЖХ (способ 5) 91,6% (AUC), tR=12,45 мин.; ESI+APCI MS m/z 534 [M+H]+.
Получение 2-((((1 r ,4 r )-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)циклогексил)амино)метил)фенола 345i (пример 420);
Соединение 2-((((1r,4r)-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)фенол 345i получали аналогичным образом, как 3-((((1r,4r)-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрил 345e, и получали в виде твердого вещества грязно-белого цвета (выход 10%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,14 (с, 1H), 8,11 (д, J=7,6 Гц, 1H), 7,87 (с, 1H), 7,08-7,05 (м, 2H), 6,84 (с, 1H), 6,72-6,67 (м, 2H), 6,33 (д, J=7,2 Гц, 1H), 6,21 (с, 1H), 6,02 (д, J=7,6 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,90 (с, 2H), 3,35-3,22 (м, 2H), 2,06-1,98 (м, 4H), 1,32-1,10 (м, 4H); ВЭЖХ (способ 5) 93,9% (AUC), tR=12,58 мин. ESI+APCI MS m/z 507 [M+H]+.
Получение (1 r ,4 r )- N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(4-метилбензил)циклогексан-1,4-диамина (2,2,2-трифторацетата) 345j (пример 328);
Соединение (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-метилбензил)циклогексан-1,4-диамин получали аналогичным образом, как 3-((((1r,4r)-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрил 345e. Неочищенный материал очищали посредством препаративной ВЭЖХ для того, чтобы получить (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-метилбензил)циклогексан-1,4-диамина (2,2,2-трифторацетат) в виде твердого вещества грязно-белого цвета (выход 10%).
1H ЯМР (400 МГц, DMSO-d6): δ 13,28 (ушир. с, 1H), 8,91 (ушир. с, 2H), 8,37 (д, J=6,0 Гц, 1H), 8,19 (с, 1H), 7,90 (с, 1H), 7,49 (ушир. с, 1H), 7,40 (д, J=7,2 Гц, 2H), 7,27 (д, J=7,6 Гц, 2H), 6,96 (с, 1H), 6,83 (с, 1H), 6,52 (с, 1H), 4,15 (с, 2H), 4,04 (с, 3H), 3,98 (с, 3H), 3,17-3,10 (м, 2H), 2,33 (с, 3H), 2,22-2,09 (м, 4H), 1,57-1,55 (м, 2H), 1,31-1,28 (м, 2H); ВЭЖХ (способ 5) 99,1% (AUC), tR=12,43 мин.; ESI+APCI MS m/z 505 [M+H]+.
Получение (1 r ,4 r )- N 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)- N 4-(4-фторбензил)циклогексан-1,4-диамина 345k (пример 320);
Соединение (1r,4r)-N1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N4-(4-фторбензил)циклогексан-1,4-диамин 345k получали аналогичным образом, как 3-((((1r,4r)-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)циклогексил)амино)метил)бензонитрил 345e, и получали в виде твердого вещества грязно-белого цвета (выход 19%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,13 (с, 1H), 8,10 (д, J=7,6 Гц, 1H), 7,86 (с, 1H), 7,40-7,37 (м, 2H), 7,12 (д, J=8,8 Гц, 2H), 6,84 (с, 1H), 6,33 (дд, J=2,4, 7,6 Гц, 1H), 6,20 (с, 1H), 5,97 (д, J=7,6 Гц, 1H), 3,98 (с, 3H), 3,92 (с, 3H), 3,74 (с, 2H), 3,20-3,19 (м, 2H), 2,05-1,95 (м, 4H), 1,25-1,12 (м, 4H); ВЭЖХ (способ 2) 91,8% (AUC), tR=12,15 мин.; ESI+APCI MS m/z 509 [M+H]+.
Схема 2-18
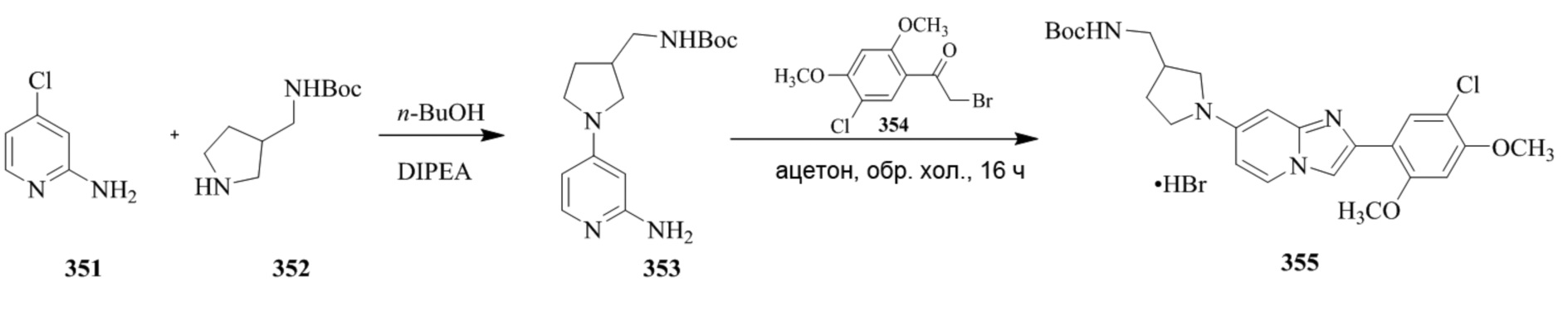
Получение трет -бутил((1-(2-аминопиридин-4-ил)пирролидин-3-ил)метил)карбамата 353;
В раствор 4-хлорпиридин-2-амина 351 (500 мг, 3,90 ммоль) в n-BuOH/N,N-диизопропилэтиламине (10 мл/5 мл) загружали трет-бутил(пирролидин-3-илметил)карбамат 352 (937 мг, 4,68 ммоль). Реакционную смесь перемешивали при 110-120°C в течение 16 ч в запаянной пробирке. Реакционную смесь концентрировали при пониженном давлении и остаток распределялся между CH2Cl2 (50 мл) и насыщенным раствором бикарбоната натрия (30 мл). Слои разделяли и органический слой сушили над Na2SO4, фильтровали и концентрировали. Полученное твердое вещество растирали в порошок с гексанами для того, чтобы получить трет-бутил((1-(2-аминопиридин-4-ил)пирролидин-3-ил)метил)карбамат 353 (900 мг, 79%) в виде твердого вещества грязно-белого цвета. Соединение использовали для следующей стадии без дополнительной очистки. ESI+APCI MS m/z 293 [M+H]+.
Получение трет -бутил((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)метил)карбамата 355 (пример 459);
Раствор трет-бутил((1-(2-аминопиридин-4-ил)пирролидин-3-ил)метил)карбамата 353 (800 мг, 2,73 ммоль) и 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 354 (880 мг, 3,01 ммоль) в ацетоне (15 мл) нагревали при 75°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и образованный осадок белого цвета собирали посредством фильтрования и промывали гексанами для того, чтобы получить трет-бутил((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)метил)карбамата гидробромид 355 (600 мг, 45%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 12,99 (с, 1H), 8,49 (д, J=7,6 Гц, 1H), 8,22 (с, 1H), 7,88 (с, 1H), 7,06 (т, J=5,2 Гц, 1H), 6,98 (с, 1H), 6,92 (д, J=8,0 Гц, 1H), 6,28 (с, 1H), 4,05 (с, 3H), 3,98 (с, 3H), 3,52-3,44 (м, 3H), 3,18-3,16 (м, 1H), 3,03 (т, J=6,8 Гц, 2H), 2,51-2,49 (м, 1H), 2,12-2,08 (м, 1H), 1,87-1,72 (м, 1H), 1,39 (с, 9H); ВЭЖХ (способ 1) 95,82% (AUC), tR=14,25 мин.; ESI+APCI MS m/z 487 [M+H]+.
Схема 2-19
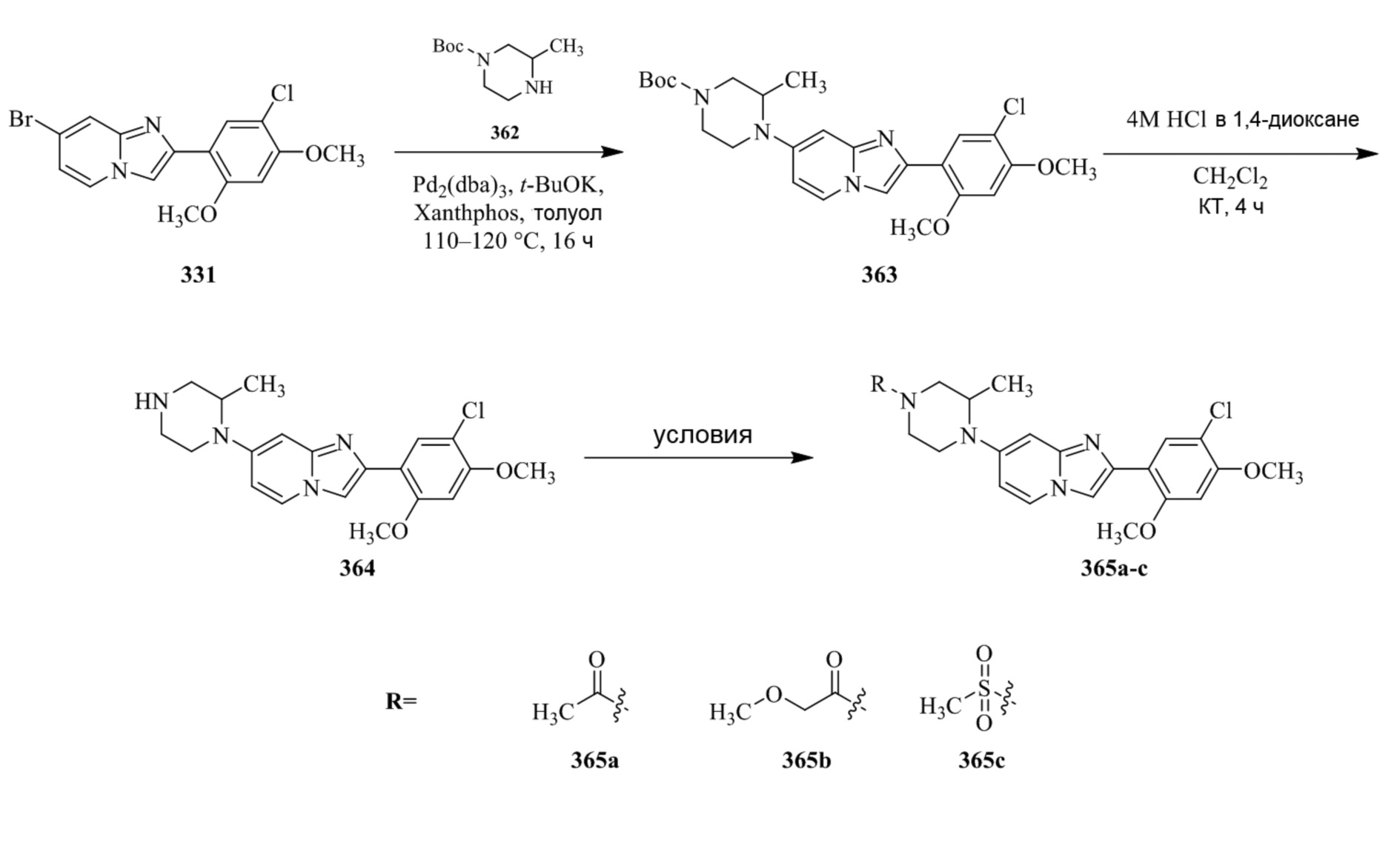
Получение трет -бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-3-метилпиперазин-1-карбоксилата 363;
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 331 (1,00 г, 2,73 ммоль), трет-бутил-3-метилпиперазин-1-карбоксилата 362 (819 мг, 4,09 ммоль), Xanthphos (173 мг, 0,30 ммоль) и t-BuOK (917 мг, 8,19 ммоль) в толуоле (30 мл) дегазировали аргоном в течение 15 мин. Впоследствии в смесь загружали Pd2(dba)3 (125 мг, 0,13 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Реакционную смесь нагревали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали, фильтровали через подушку целита (целит промывали в 10% MeOH/CH2Cl2) и объединенный фильтрат испаряли досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-метилпиперазин-1-карбоксилат 363 (800 мг, 60%) в виде твердого вещества грязно-белого цвета. ESI+APCI MS m/z 487 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(2-метилпиперазин-1-ил)имидазо[1,2- a ]пиридина 364;
В раствор трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-метилпиперазин-1-карбоксилата 363 (800 мг, 1,64 ммоль) в CH2Cl2 (10 мл) загружали раствор HCl в 1,4-диоксане (4,0 М, 5 мл) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали и полученное твердое вещество промывали с использованием CH2Cl2. Затем твердое вещество суспендировали в воде (15 мл), ощелачивали насыщенным раствором бикарбоната натрия (15 мл) посредством перемешивания в течение 1 ч при комнатной температуре и фильтровали для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(2-метилпиперазин-1-ил)имидазо[1,2-a]пиридин 364 (600 мг, 94%) в виде твердого вещества грязно-белого цвета. ESI+APCI MS m/z 387 [M+H]+.
Получение 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-3-метилпиперазин-1-ил)этанона 365a (пример 308);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(2-метилпиперазин-1-ил)имидазо[1,2-a]пиридина 364 (150 мг, 0,38 ммоль) и Et3N (0,16 мл, 1,16 ммоль) в CH2Cl2 (15 мл) загружали ацетилхлорид (44 мг, 0,57 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-метилпиперазин-1-ил)этанон 365a (20 мг, 12%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, 353K DMSO-d6): δ 8,27 (д, J=7,2 Гц, 1H), 8,19 (с, 1H), 7,98 (с, 1H), 6,88 (с, 1H), 6,73 (д, J=6,0 Гц, 1H), 6,63 (с, 1H), 4,11 (ушир. с, 1H), 4,01 (с, 3H), 3,95 (с, 3H), 3,94-3,92 (м, 1H), 3,49-3,41 (м, 1H), 3,21-3,13 (м, 2H), 2,98-2,91 (м, 2H), 2,07 (с, 3H), 1,05 (д, J=6,0 Гц, 3H); ВЭЖХ (способ 1) 97,6% (AUC), tR=12,55 мин.; ESI+APCI MS m/z 429 [M+H]+.
Получение 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-3-метилпиперазин-1-ил)-2-метоксиэтанона 365b (пример 313);
Соединение 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-метилпиперазин-1-ил)-2-метоксиэтанон 365b получали аналогичным образом, как 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-метилпиперазин-1-ил)этанон 365a, и получали в виде твердого вещества грязно-белого цвета (выход 12%).
1H ЯМР (400 МГц, 353K DMSO-d6): δ 8,28 (д, J=7,6 Гц, 1H), 8,19 (с, 1H), 7,99 (с, 1H), 6,88 (с, 1H), 6,75 (дд, J=2,0, 7,6 Гц, 1H), 6,64 (с, 1H), 4,19-4,10 (м, 4H), 4,01 (ушир. с, 4H), 3,95 (с, 3H), 3,48-3,45 (м, 1H), 3,36 (ушир. с, 4H), 3,16-3,14 (м, 2H), 1,05 (д, J=6,4 Гц, 3H); ВЭЖХ (способ 1) 97,9% (AUC), tR=12,36 мин.; ESI+APCI MS m/z 459 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(2-метил-4-(метилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 365c (пример 311);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(2-метил-4-(метилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин 365c получали аналогичным образом, как 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-3-метилпиперазин-1-ил)этанон 365a (с использованием метансульфонилхлорида вместо ацетилхлорида), и получали в виде твердого вещества грязно-белого цвета (выход 20%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,35 (д, J=7,6 Гц, 1H), 8,15 (с, 1H), 8,04 (с, 1H), 6,87 (с, 1H), 6,85 (д, J=6,4 Гц, 1H), 6,67 (с, 1H), 4,35-4,25 (м, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,61-3,54 (м, 2H), 3,42-3,35 (м, 1H), 3,11-3,08 (м, 2H), 2,93 (ушир. с, 4H),1,07 (д, J=6,4 Гц, 3H); ВЭЖХ (способ 1) 95,3% (AUC), tR=12,85 мин.; ESI+APCI MS m/z 465 [M+H]+.
Схема 2-20
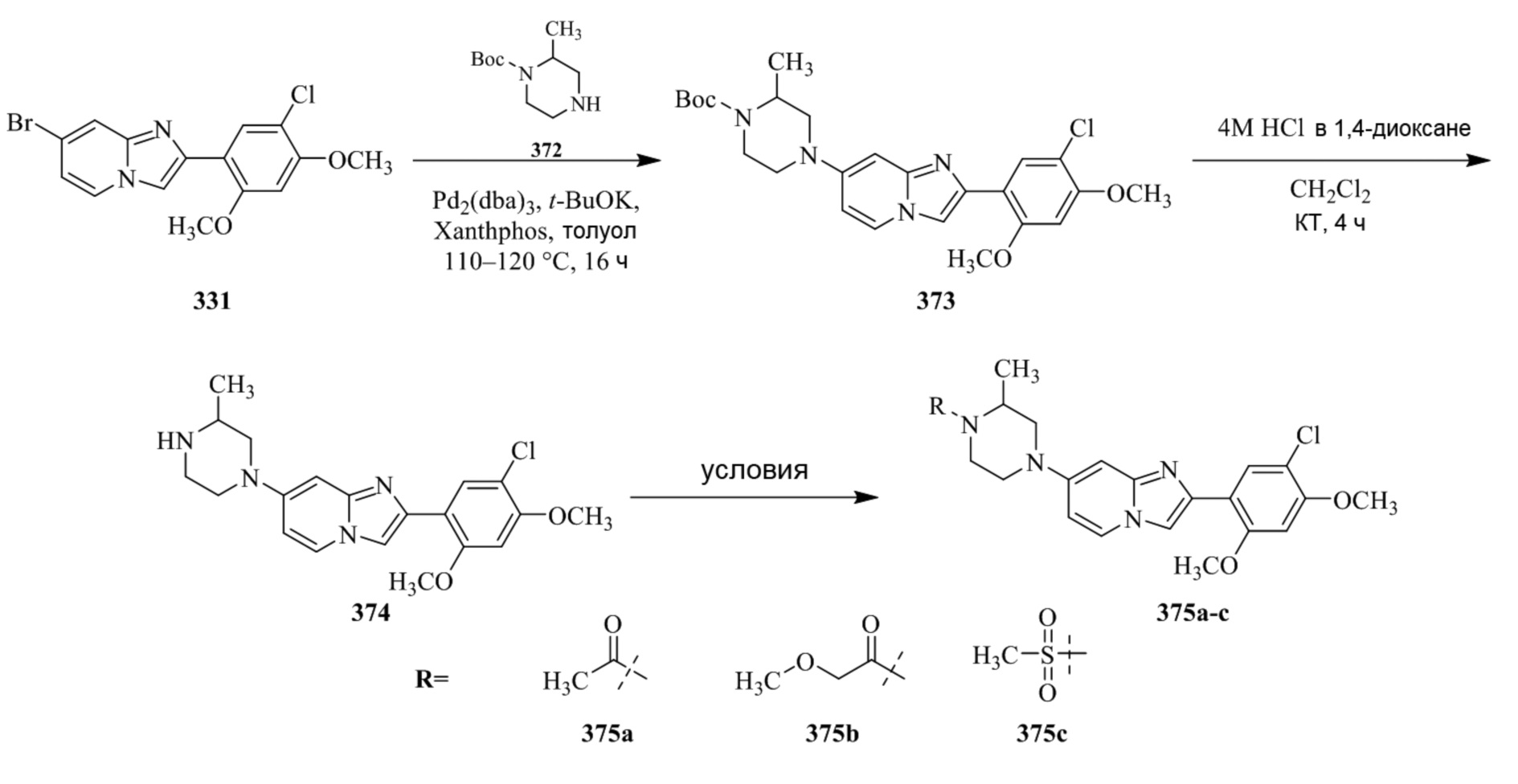
Получение трет -бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-2-метилпиперазин-1-карбоксилата 373;
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 1 (200 мг, 0,544 ммоль), трет-бутил-2-метилпиперазин-1-карбоксилата 372 (218 мг, 1,09 ммоль), Xanthphos (34 мг, 0,059 ммоль) и t-BuOK (181 мг, 1,62 ммоль) в толуоле (10 мл) дегазировали аргоном в течение 15 мин. Впоследствии в смесь загружали Pd2(dba)3 (24 мг, 0,026 ммоль) и дополнительно дегазировали ее аргоном в течение еще 5 мин. Реакционную смесь нагревали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали, фильтровали через подушку целита (целит промывали в 10% MeOH/CH2Cl2) и объединенный фильтрат испаряли досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-2-метилпиперазин-1-карбоксилат 373 (90 мг, 34%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,32 (д, J=7,6 Гц, 1H), 8,16 (с, 1H), 8,02 (с, 1H), 6,86 (с, 1H), 6,78 (дд, J=2,4, 7,6 Гц, 1H), 6,66 (д, J=1,6 Гц, 1H), 4. 22-4,20 (м, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3. 83-3,79 (м, 1H), 3,70-3,60 (м, 2H), 3,22-3,16 (м, 1H), 2,97-2,91 (м, 1H), 2,76-2,70 (м, 1H), 1,42 (с, 9H), 1,18 (д, J=6,4 Гц, 3H); ВЭЖХ (способ 1) 97,0% (AUC), tR=14,23 мин.; ESI+APCI MS m/z 487 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(3-метилпиперазин-1-ил)имидазо[1,2- a ]пиридина 374;
В раствор трет-бутил-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-2-метилпиперазин-1-карбоксилата 373 (1,50 г, 3,08 ммоль) в CH2Cl2 (20 мл) загружали раствор HCl в 1,4-диоксане (4,0 М, 15 мл) и перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали и полученное твердое вещество промывали в CH2Cl2. Затем твердое вещество суспендировали в воде (35 мл), ощелачивали насыщенным раствором бикарбоната натрия (35 мл) посредством перемешивания в течение 1 ч при комнатной температуре. Твердое вещество фильтровали, промывали водой и сушили для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(3-метилпиперазин-1-ил)имидазо[1,2-a]пиридин 374 (1,10 г, 91%) в виде твердого вещества грязно-белого цвета. ESI+APCI MS m/z 387 [M+H]+.
Получение 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-2-метилпиперазин-1-ил)этанона 375a (пример 309);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(3-метилпиперазин-1-ил)имидазо[1,2-a]пиридина 374 (150 мг, 0,38 ммоль) и Et3N (0,16 мл, 1,16 ммоль) в CH2Cl2 (15 мл) загружали ацетилхлорид (44 мг, 0,57 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-2-метилпиперазин-1-ил)этанон 375a (15 мг, 9%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, 353K DMSO-d6): δ 8,28 (д, J=7,6 Гц, 1H), 8,19 (с, 1H), 7,99 (с, 1H), 6,88 (с, 1H), 6,73 (дд, J=2,8, 7,6 Гц, 1H), 6,66 (д, J=2,0 Гц, 1H), 4,46 (ушир. с, 1H), 4,01 (с, 3H), 3,95 (с, 3H), 3,73-3,69 (м, 1H), 3,63-3,60 (м, 1H), 3,31 (ушир. с, 1H), 3,04 (дд, J=4,0, 12,8 Гц, 1H), 2,88-2,83 (м, 2H), 2,06 (с, 3H), 1,25 (д, J=6,8 Гц, 3H); ВЭЖХ (способ 1) 99,2% (AUC), tR=12,54 мин.; ESI+APCI MS m/z 429 [M+H]+.
Получение 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-2-метилпиперазин-1-ил)-2-метоксиэтанона 375b (пример 310);
Соединение 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-2-метилпиперазин-1-ил)-2-метоксиэтанон 375b получали аналогичным образом, как 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-2-метилпиперазин-1-ил)этанон 375a, и получали в виде твердого вещества грязно-белого цвета (выход 8%).
1H ЯМР (400 МГц, 353K DMSO-d6): δ 8,28 (д, J=7,6 Гц, 1H), 8,19 (с, 1H), 7,99 (с, 1H), 6,88 (с, 1H), 6,74-6,72 (м, 1H), 6,67 (с, 1H), 4,45-4,42 (м, 1H), 4,12 (с, 2H), 4,01 (ушир. с, 4H), 3,95 (с, 3H), 3,74-3,71 (м, 1H), 3,64-3,61 (м, 1H), 3,34 (ушир. с, 4H), 3,05 (дд, J=4,0, 12,8 Гц, 1H), 2,93-2,85 (м, 1H), 1,28 (д, J=6,4 Гц, 3H); ВЭЖХ (способ 1) 98,2% (AUC), tR=12,33 мин.; ESI+APCI MS m/z 459 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(3-метил-4-(метилсульфонил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 375c (пример 312);
Соединение 2-(5-хлор-2,4-диметоксифенил)-7-(3-метил-4-(метилсульфонил)пиперазин-1-ил)имидазо[1,2-a]пиридин 375c получали аналогичным образом, как 1-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-2-метилпиперазин-1-ил)этанон 375a (с использованием метансульфонового хлорида вместо ацетилхлорида) и получали в виде твердого вещества грязно-белого цвета (выход 25%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,6 Гц, 1H), 8,16 (с, 1H), 8,03 (с, 1H), 6,87 (с, 1H), 6,79 (дд, J=2,4, 7,6 Гц, 1H), 6,68 (д, J=2,0 Гц, 1H), 4,05-4,02 (м, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,70-3,53 (м, 3H), 3,38-3,37 (м, 1H), 3,03 (дд, J=3,6, 12,8 Гц, 1H), 2,99 (с, 3H), 2,91-2,84 (м, 1H), 1,29 (д, J=6,8 Гц, 3H); ВЭЖХ (способ 1) 99,2% (AUC), tR=12,81 мин.; ESI+APCI MS m/z 465 [M+H]+.
Схема 2-21
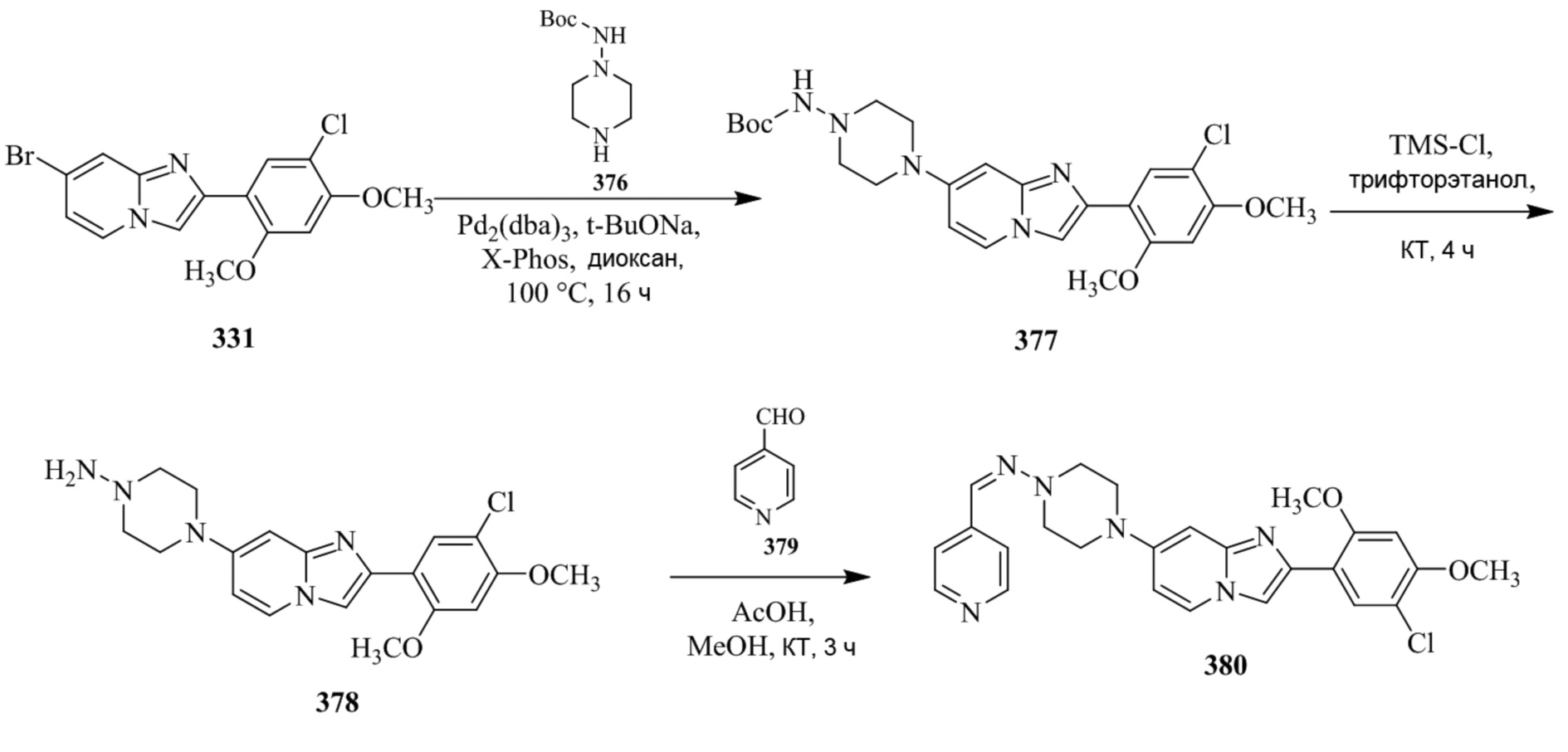
Получение трет -бутил(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)карбамата 377;
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 331 (1,00 г, 2,73 ммоль), трет-бутилпиперазин-1-илкарбамата 376 (823 мг, 4,08 ммоль), X-Phos (130 мг, 0,27 ммоль) и NaOt-Bu (787 мг, 8,2 ммоль) в 1,4-диоксане (20 мл) дегазировали аргоном в течение 15 мин. Впоследствии в смесь загружали Pd2(dba)3 (250 мг, 0,27 ммоль) и дополнительно дегазировали ее аргоном в течение 5 мин. Реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали, фильтровали через подушку целита и фильтрат испаряли досуха. Полученный остаток очищали с помощью CombiFlash (силикагель, MeOH/CH2Cl2) для того, чтобы получить трет-бутил(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)карбамат 377 (500 мг, 37%) в виде твердого вещества светло-желтого цвета. ESI+APCI MS m/z 488 [M+H]+.
Получение 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-амина гидрохлорида 378;
В суспензию трет-бутил(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)карбамата 377 (120 мг, 0,24 ммоль) в 2,2,2-трифторэтаноле (3 мл) загружали TMS-Cl (0,1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь испаряли досуха для того, чтобы получить 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-амина гидрохлорид 378 (60 мг, 57%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 9,62 (ушир. с, 3H), 8,58 (д, J=7,8 Гц, 1H), 8,30 (с, 1H), 7,95 (с, 1H), 7,24 (д, J=8,1 Гц, 1H), 6,99 (с, 1H), 6,80 (с, 1H), 4,05 (с, 3H),3,99 (с, 3H), 3,63 (ушир. с, 4H), 3,03 (ушир. с, 4H),; ВЭЖХ (способ) 99,2% (AUC), tR=11,22 мин.; ESI+APCI MS m/z 388 [M+H]+.
Получение ( Z )-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(пиридин-4-илметилен)пиперазин-1-амина 380 (пример 410);
Cмесь 4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-амина гидрохлорида 378 (50 мг, 0,11 ммоль), триметиламина (0,045 мл, 0,33 ммоль) изоникотинальдегида 379 (0,011 мл, 0,13 ммоль) и AcOH (0,05 мл) в CH3OH (2 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×10 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить (Z)-4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(пиридин-4-илметилен)пиперазин-1-амин 380 (10 мг, 16%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, DMSO-d6) δ: 8,54 (ушир. с, 2H), 8,36 (д, J=6,9 Гц, 1H), 8,18 (с, 1H), 8,05 (с, 1H),7,69 (ушир. с, 1H), 7,52 (ушир. с, 2H), 6,88 (ушир. с, 1H), 6,78 (с, 1H), 4,0 (с, 3H), 3,94 (с, 3H), 3,45 (ушир. с, 4H), 3,35 (ушир. с, 4H).; ВЭЖХ (способ 5) 96,6% (AUC), tR=12,65 мин.; ESI+APCI MS m/z 477 [M+H]+.
Схема 2-22
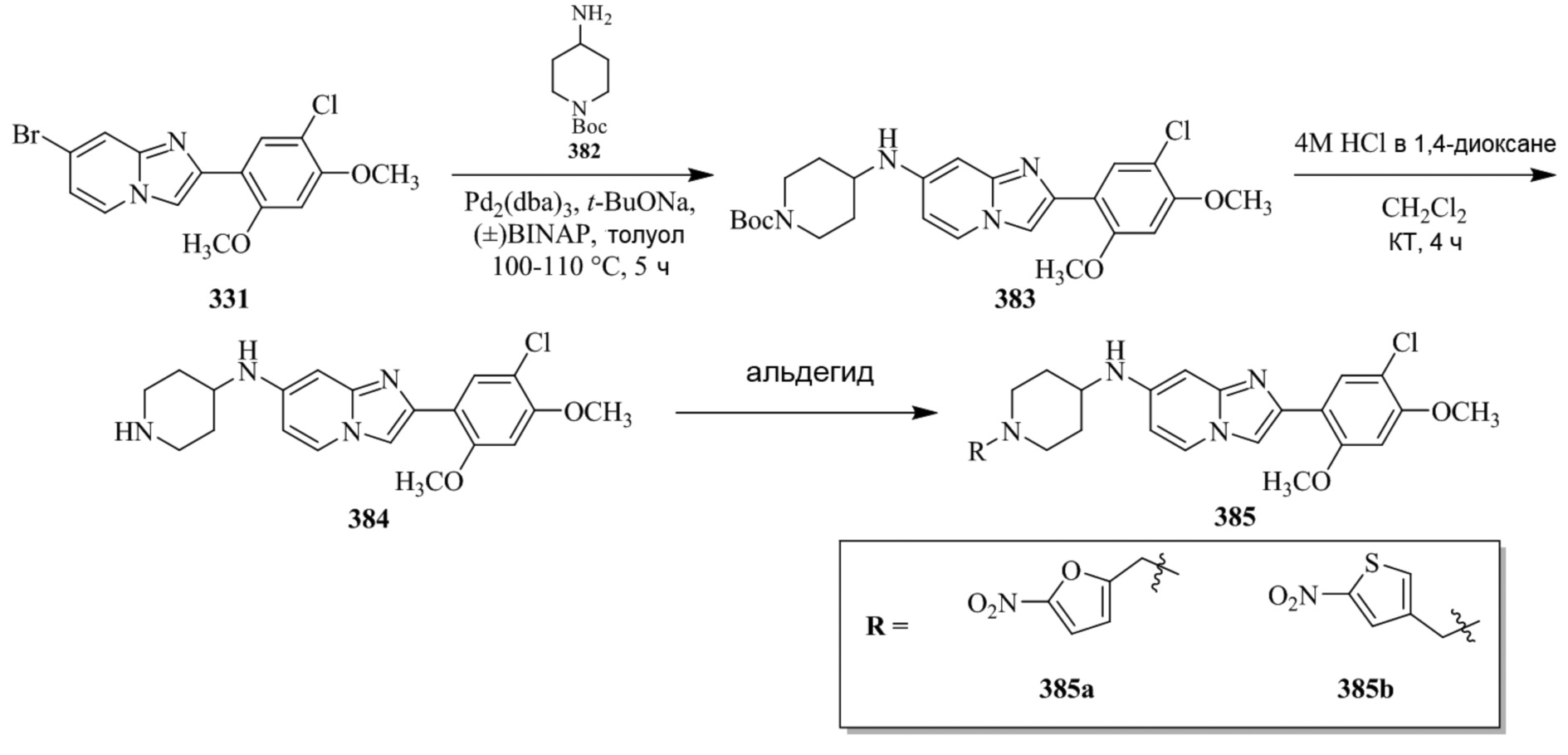
Получение трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-и трет -бутил-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)пиперидин-1-карбоксилата 383;
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 331 (5,00 г, 13,7 ммоль), трет-бутил-4-аминопиперидин-1-карбоксилата 382 (2,7 г, 13,7 ммоль), (±) BINAP (849 мг, 1,36 ммоль) и NaOt-Bu (3,9 г, 40,98 ммоль) в толуоле (50 мл) дегазировали аргоном в течение 15 мин. Затем в эту смесь загружали Pd2(dba)3 (625 мг, 0,683 ммоль) и дополнительно дегазировали ее аргоном в течение еще 5 мин. Реакционную смесь перемешивали при 100-110°C в течение 16 ч. Реакционную смесь охлаждали, фильтровали через подушку целита (подушку целита промывали в 10% MeOH/CH2Cl2) и объединенный фильтрат испаряли досуха. Полученный остаток растирали в порошок с 10% MTBE в гексанах для того, чтобы получить трет-бутил-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)пиперидин-1-карбоксилат 383 (2,50 г, 31%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,13-8,12 (м, 2H), 7,88 (с, 1H), 6,84 (с, 1H), 6,36 (дд, J=2,0, 7,2 Гц, 1H), 6,31 (с, 1H), 6,09 (с, 1H), 3,99 (с, 3H), 3,92-3,86 (м, 5H), 3,48-3,40 (м, 1H), 3,02-2,92 (м, 2H), 1,95 (д, J=9,2 Гц, 2H), 1,41 (с, 9H), 1,33-1,23 (м, 2H).
Получение 2-(5-хлор-2,4-диметоксифенил)-N-(пиперидин-4-ил)имидазо[1,2- a ]пиридин-7-амина 384;
В раствор трет-бутил-4-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)пиперидин-1-карбоксилата 383 (1,50 г, 3,08 ммоль) в CH2Cl2 (25 мл) загружали раствор HCl в 1,4-диоксане (4,0 М, 15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали и полученное твердое вещество промывали в CH2Cl2. Затем твердое вещество суспендировали в воде (55 мл), ощелачивали насыщенным раствором бикарбоната натрия (55 мл) посредством перемешивания в течение 1 ч при комнатной температуре. Твердое вещество собирали посредством фильтрования, промывали водой и сушили для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-N-(пиперидин-4-ил)имидазо[1,2-a]пиридин-7-амин 384 (500 мг, 42%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,14-8,11 (м, 2H), 7,87 (с, 1H), 6,84 (с, 1H), 6,36 (дд, J=1,6, 7,2 Гц, 1H), 6,25 (с, 1H), 6,08 (д, J=7,2 Гц, 1H), 3,99 (с, 3H), 3,92 (с, 3H), 3,36-2,67 (м, 5H), 1,92 (д, J=10,8 Гц, 2H), 1,29-1,22 (м, 2H).
Получение 2-(5-хлор-2,4-диметоксифенил)-N-(1-((5-нитрофуран-2-ил)метил)пиперидин-4-ил)имидазо[1,2- a ]пиридин-7-амина 385a (пример 343);
В раствор 2-(5-хлор-2,4-диметоксифенил)-N-(пиперидин-4-ил)имидазо[1,2-a]пиридин-7-амина 384 (200 мг, 0,518 ммоль) в CH3OH (2 мл) загружали 5-нитрофуран-2-карбальдегид (109 мг, 0,777 ммоль) и уксусную кислоту (0,2 мл). Получаемую смесь перемешивали при температуре окружающей среды в течение 1 ч. В реакционную смесь добавляли NaCNBH3 (96 мг, 1,55 ммоль) и реакционную смесь перемешивали в течение 16 ч. Реакционную смесь концентрировали, остаток поднимали в водном растворе NaHCO3 (5,0 мл) и водной слой экстрагировали этилацетатом (2×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-N-(1-((5-нитрофуран-2-ил)метил)пиперидин-4-ил)имидазо[1,2-a]пиридин-7-амин 385a (15 мг, 5,6%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,14-8,11 (м, 2H), 7,89 (с, 1H), 7,67 (д, J=3,6 Гц, 1H), 6,85 (с, 1H), 6,78 (д, J=3,6 Гц, 1H), 6,39 (д, J=5,7 Гц, 1H), 6,24 (с, 1H), 6,15 (д, J=6 Гц, 1H), 3,99 (с, 4H), 3,92 (с, 3H), 3,67 (с, 2H), 3,33-3,22 (м, 1H), 2,86 (д, J=11,7 Гц, 2H), 2,29-2,22 (м, 2H),1,98 (д, J=10,5 Гц, 2H), 1,48-1,38 (м, 2H); ВЭЖХ (способ 1) 97,6% (AUC), tR=11,9 мин.; ESI+APCI MS m/z 512 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-N-(1-((5-нитротиофен-3-ил)метил)пиперидин-4-ил)имидазо[1,2- a ]пиридин-7-амина 385b (пример 324);
В раствор 2-(5-хлор-2,4-диметоксифенил)-N-(пиперидин-4-ил)имидазо[1,2-a]пиридин-7-амина 384 (200 мг, 0,518 ммоль) в метаноле (2 мл) загружали 5-нитротиофен-3-карбальдегид (163 мг, 1,03 ммоль) и уксусную кислоту (0,1 мл). Получаемую смесь перемешивали при комнатной температуре в течение 1 ч. В реакционную смесь загружали NaCNBH3 (163 мг, 2,58 ммоль) и перемешивали ее при комнатной температуре в течение 16 ч. Реакционную смесь концентрировали. Остаток поднимали в водном растворе NaHCO3 (5,0 мл) и экстрагировали в 10% CH3OH/CH2Cl2 (20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Неочищенное соединение очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-N-(1-((5-нитротиофен-2-ил)метил)пиперидин-4-ил)имидазо[1,2-a]пиридин-7-амин 385b (40 мг, 12%); в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,15 (д, J=7,2 Гц, 1H), 8,09 (с, 1H), 8,01 (д, J=2,0 Гц, 1H), 7,92 (с, 1H), 7,85 (с, 1H), 6,86 (с, 1H), 6,43 (д, J=6,0 Гц, 1H), 6,28 (с, 1H), 6,26 (с, 1H), 3,99 (с, 3H), 3,93 (с, 3H), 3,53 (с, 2H), 3,17 (с, 1H), 2,82 (д, J=11,6 Гц, 2H), 2,19 (т, J=10,8 Гц, 2H), 1,96 (д, J=10,8 Гц, 2H), 1,48-1,40 (м, 2H); ВЭЖХ (способ 1) 92,1% (AUC), tR=12,05 мин.; ESI+APCI MS m/z 528 [M+H]+.
Схема 2-23
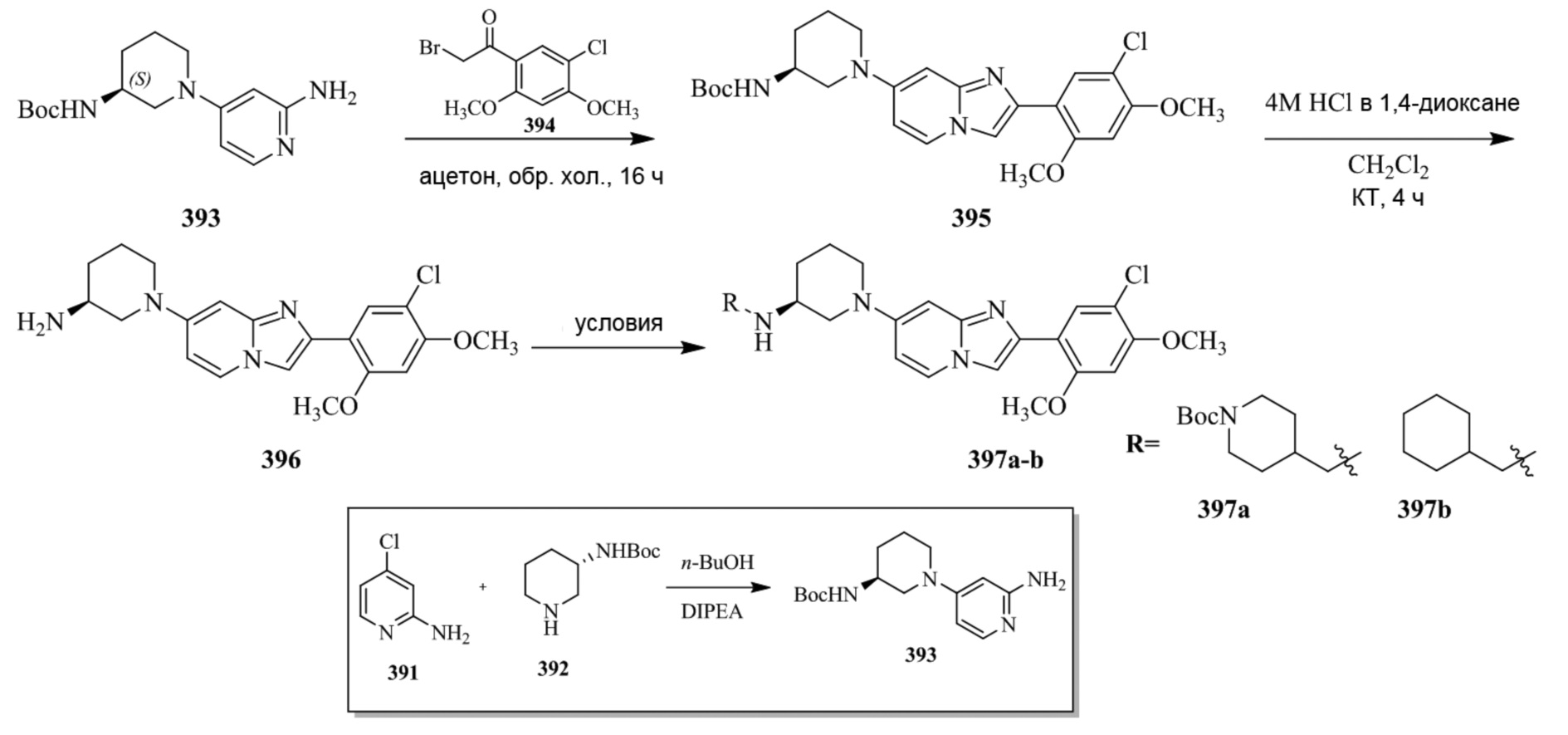
Получение ( S )- трет -бутил(1-(2-аминопиридин-4-ил)пиперидин-3-ил)карбамата 393;
В раствор 4-хлорпиридин-2-амина 391 (5,00 г, 39,1 ммоль) в n-BuOH/N,N-диизопропилэтиламине (100 мл/20 мл) загружали (S)-трет-бутилпиперидин-3-илкарбамат 392 (15,6 г, 78,1 ммоль). Реакционную смесь перемешивали при 110-120°C в течение 16 ч в запаянной пробирке. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении; неочищенный материал поднимали в насыщенном растворе бикарбоната натрия (100 мл) и экстрагировали в CH2Cl2 (150 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток растирали в порошок с гексанами для того, чтобы получить (S)-трет-бутил(1-(2-аминопиридин-4-ил)пиперидин-3-ил)карбамат 393 (5,80 г, 50%) в виде твердого вещества грязно-белого цвета. Соединение использовали на следующей стадии без дополнительной очистки. ESI+APCI MS m/z 293 [M+H]+.
Получение ( S )- трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-3-ил)карбамата 395;
Раствор (S)-трет-бутил(1-(2-аминопиридин-4-ил)пиперидин-3-ил)карбамата 3 (5,00 г, 17,1 ммоль) и 2-бром-1-(5-хлор-2,4-диметоксифенил)этанона 394 (5,49 г, 18,8 ммоль) в ацетоне (100 мл) нагревали при 75°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, образованный осадок белого цвета собирали посредством фильтрования и промывали гексанами. Твердое вещество суспендировали в водном гидроксиде аммония и перемешивали при комнатной температуре в течение 4 ч. Суспензию фильтровали и полученное твердое вещество промывали гексаном и сушили при пониженном давлении для того, чтобы получить (S)-трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-3-ил)карбамат 395 (6,50 г, 78%) в виде твердого вещества белого цвета. ESI+APCI MS m/z 487 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-3-амина 396;
В раствор (S)-трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-3-ил)карбамата 395 (5,50 г, 11,3 ммоль) в CH2Cl2 (50 мл) загружали 4,0 M HCl в 1,4-диоксане (25 мл) и перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали и полученное твердое вещество промывали с использованием CH2Cl2. Затем твердое вещество суспендировали в воде (55 мл), ощелачивали насыщенным раствором бикарбоната натрия (55 мл) посредством перемешивания при комнатной температуре в течение 1 ч. Суспензию фильтровали и полученное твердое вещество промывали водой и сушили для того, чтобы получить (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-3-амин 396 (4,30 г, 95%) в виде твердого вещества грязно-белого цвета. ESI+APCI MS m/z 387 [M+H]+.
Получение ( S )- трет -бутил-4-(((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-3-ил)амино)метил)пиперидин-1-карбоксилата 397a (пример 454);
Раствор (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-3-амина 396 (250 мг, 0,64 ммоль), трет-бутил-4-формилпиперидин-1-карбоксилата (194 мг, 0,97 ммоль) и уксусной кислоты (0,2 мл) в CH3OH (10 мл) перемешивали при комнатной температуре в течение 1 ч. Добавляли цианоборогидрид натрия (201 мг, 3,2 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разводили водным раствором бикарбоната натрия и экстрагировали в CH2Cl2 (2×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, NH4OH/CH3OH/CH2Cl2) для того, чтобы получить (S)-трет-бутил-4-(((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-3-ил)амино)метил)пиперидин-1-карбоксилат 397a (130 мг, 34%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, метанол-d4): δ 8,04 (д, J=7,5 Гц, 1H), 7,97 (с, 1H), 7,86 (с, 1H), 6,69-6,65 (м, 2H), 6,58 (с, 1H), 4,00-3,96 (м, 2H), 3,92 (с, 3H), 3,85 (с, 3H), 3,73-3,70 (м, 1H), 3,57-3,53 (м, 1H), 2,84-2,76 (м, 1H), 2,66-2,63 (м, 4H), 2,50 (д, J=6,6 Гц, 2H), 1,97-1,93 (м, 1H), 1,78-1,56 (м, 5H), 1,35 (с, 9H), 1,10-0,95 (м, 2H), 0,81-0,75 (м, 1H); ВЭЖХ (способ 1) >99% (AUC), tR=12,65 мин.; ESI+APCI MS m/z 584 [M+H]+.
Получение ( S )-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-(циклогексилметил)пиперидин-3-амина 397b (пример 455);
Соединение (S)-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-(циклогексилметил)пиперидин-3-амин 397b получали аналогичным образом, как (S)-трет-бутил-4-(((1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-3-ил)амино)метил)пиперидин-1-карбоксилат 397a, и получали в виде твердого вещества грязно-белого цвета (выход 16%).
1H ЯМР (300 МГц, метанол-d4): δ 8,27 (д, J=7,5 Гц, 1H), 8,16 (с, 1H), 7,98 (с, 1H), 6,86 (с, 1H), 6,75 (д, J=7,5 Гц, 1H), 6,61 (с, 1H), 4,00 (с, 3H), 3,93 (с, 3H), 3,77-3,74 (м, 1H), 3,64-3,60 (м, 1H), 2,81-2,72 (м, 1H), 2,50 (д, J=6,6 Гц, 2H), 1,93-1,90 (м, 1H), 1,77-1,52 (м, 8H), 1,35-1,23 (м, 6H), 0,63-0,83 (м, 2H); ВЭЖХ (способ 1) 96,9% (AUC), tR=12,67 мин.; ESI+APCI MS m/z 483 [M+H]+.
Схема 2-24
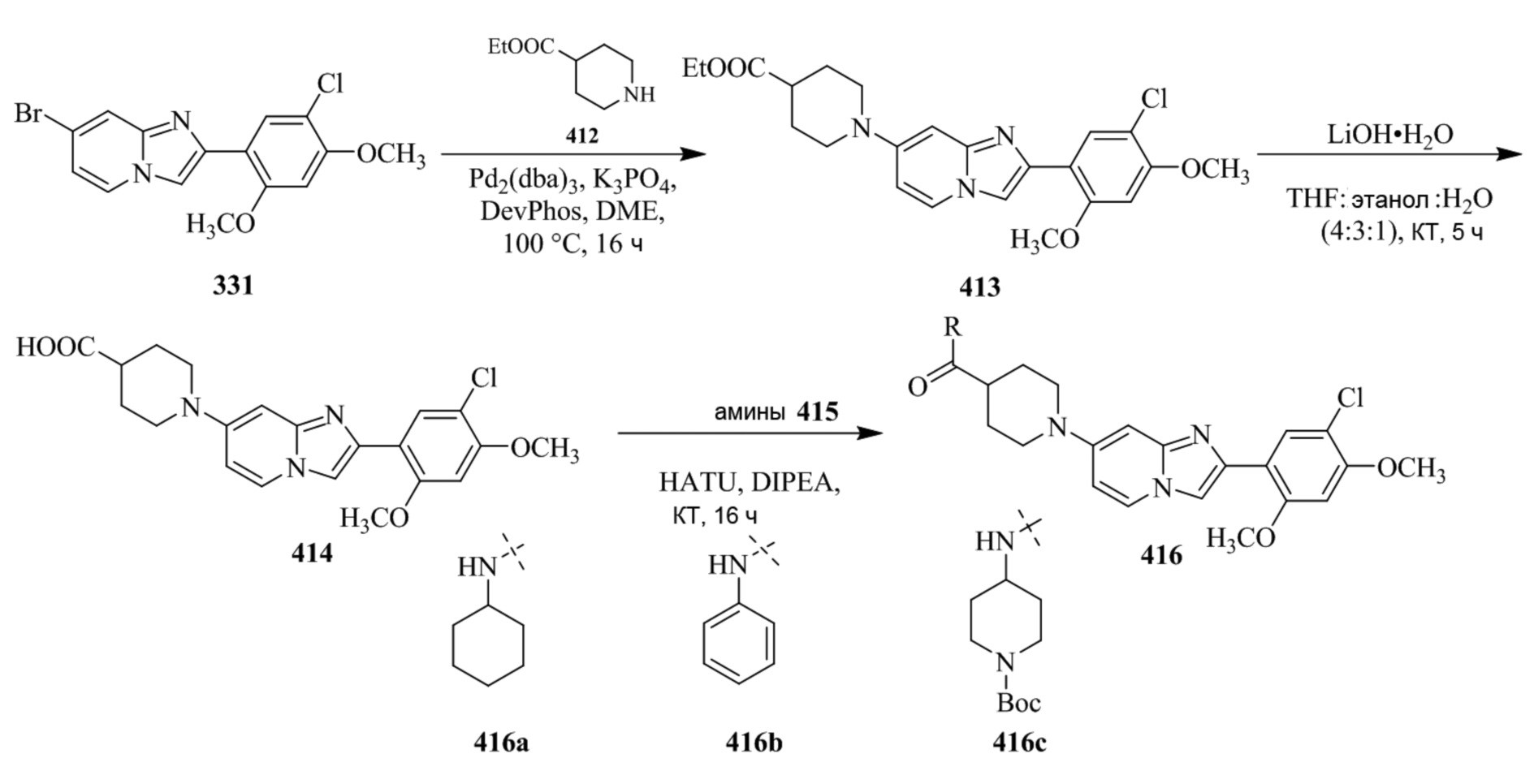
Получение этил-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-карбоксилата 413;
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 331 (4,00 г, 10,9 ммоль), этилпиперидин-4-карбоксилата 412 (1,50 г, 16,5 ммоль), DavePhos (643 мг, 1,63 ммоль) и K3PO4 (4,70 г, 22,4 ммоль) в диметоксиэтане (80 мл) дегазировали аргоном в течение 15 мин. Впоследствии в смесь загружали Pd2(dba)3 (503 мг, 0,55 ммоль) и дополнительно дегазировали ее аргоном в течение еще 5 мин. Реакционную смесь перемешивали при 90-100°C в течение 16 ч. Реакционную смесь охлаждали, фильтровали через подушку целита и фильтрат испаряли досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить этил-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-карбоксилат 413 (3,0 г, 63%) в виде твердого вещества грязно-белого цвета. ESI+APCI m/z 444 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-карбоновой кислоты 414;
В раствор этил-1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-карбоксилата 413 (3,00 г, 6,77 ммоль) в смеси растворителей THF (12 мл), этанола (6 мл) и воды (3 мл) загружали LiOH•H2O (2,05 г, 27,1 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Основную часть органических растворителей испаряли, а остаток разводили водой и экстрагировали в EtOAc (2×25 мл). Водный слой подкисляли до pH 3,0 с использованием 10% раствора KHSO4 и образованное твердое вещество собирали посредством фильтрования и сушили для того, чтобы получить 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-карбоновую кислоту 414 (1,8 г, 64%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 11,59 (ушир. с, 1H), 8,37 (д, J=8,0 Гц, 1H), 8,05 (с, 1H), 7,84 (с, 1H), 7,0 (дд, J=2,4, 8,0 Гц, 1H) 6,98 (с, 1H), 6,67 (д, J=2,0 Гц, 1H), 4,02 (с, 3H), 3,95 (с, 3H), 3,88-3,84 (м, 2H), 2,99 (т, J=6,8 Гц, 2H), 2,58-2,55 (м, 1H), 1,98-1,92 (м, 2H), 1,69-1,59 (м, 2H); ESI+APCI m/z 416 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-циклогексилпиперидин-4-карбоксамидкислоты 416a (пример 453);
Cмесь 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-карбоновой кислоты 414 (150 мг, 0,36 ммоль), циклогексанамина 415a (0,05 мл, 0,47 ммоль), HATU (205 мг, 0,54 ммоль) и N,N-диизопропилэтиламина (0,09 мл, 0,54 ммоль) в DMF (3 мл) перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь гасили дробленым льдом и экстрагировали в EtOAc (2×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-циклогексилпиперидин-4-карбоксамид 416a (20 мг, 11%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6) δ: 8,28 (д, J=5,7 Гц, 1H), 8,16 (с, 1H), 8,0 (с, 1H),7,64 (д, J=6,0 Гц, 1H), 6,86 (с, 1H), 6,78 (дд, J=1,8, 5,7 Гц, 1H), 6,65 (с, 1H), 4,0 (с, 3H), 3,93 (с, 3H), 3,83-3,79 (м, 2H), 3,51-3,47 (м, 1H), 2,77-2,74 (м, 2H), 2,30-2,26 (м, 1H), 1,82-1,56 (м, 10H), 1,26-1,23 (м, 2H), 1,15-1,1 (м, 2H); ВЭЖХ (способ 5) 97,2% (AUC), tR=13,72 мин.; ESI+APCI MS m/z 497 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)-N-фенилпиперидин-4-карбоксамида 416b (пример 456);
Cмесь 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-карбоновой кислоты 414 (150 мг, 0,36 ммоль), анилина 415b (43 мг, 0,47 ммоль), HATU (205 мг, 0,54 ммоль) и N,N-диизопропилэтиламина (0,09 мл, 0,54 ммоль) в DMF (3 мл) перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь гасили водой и экстрагировали в EtOAc (2×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)-N-фенилпиперидин-4-карбоксамидкарбоксамид 416b (25 мг, 14%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6) δ: 9,94 (с, 1H), 8,36 (д, J=7,6 Гц, 1H), 8,11 (с, 1H), 8,07 (с, 1H),7,61 (д, J=7,6 Гц, 2H), 7,28 (т, J=7,2 Гц, 2H), 7,03 (т, J=7,2 Гц, 1H), 6,95 (д, J=5,6 Гц, 1H), 6,90 (с, 1H), 6,70 (д, J=2,0 Гц, 1H), 4,02 (с, 3H), 3,95 (с, 3H), 3,93 (ушир. с, 2H), 2,90 (т, J=12,0 Гц, 2H), 2,68-2,55 (м, 1H), 1,99-1,90 (м, 2H), 1,80-1,70 (м, 2H), 1,15-1,1 (м, 2H); ВЭЖХ (способ 5) 98,3% (AUC), tR=13,81 мин.; ESI+APCI MS m/z 491 [M+H]+.
Получение трет -бутил-4-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-карбоксамидо)пиперидин-1-карбоксилата 416c (пример 460);
Cмесь 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-карбоновой кислоты 414 (150 мг, 0,36 ммоль), трет-бутил-4-аминопиперидин-1-карбоксилата 415c (94 мг, 0,47 ммоль), HATU (205 мг, 0,54 ммоль) и N,N-диизопропилэтиламина (0,09 мл, 0,54 ммоль) в DMF (3 мл) перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь гасили водой и экстрагировали в EtOAc (2×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-карбоксамидо)пиперидин-1-карбоксилат 416c (60 мг, 28%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6) δ: 8,28 (д, J=7,6 Гц, 1H), 8,16 (с, 1H), 8,0 (с, 1H),7,76 (д, J=7,6 Гц, 1H), 6,86 (с, 1H), 6,79 (дд, J=2,4, 7,6 Гц, 1H), 6,65 (д, J=1,6 Гц, 1H), 4,0 (с, 3H), 3,93 (с, 3H), 3,70-3,73 (м, 4H), 3,72-3,68 (м, 1H), 2,84-2,72 (м, 4H), 2,30-2,24 (м, 1H), 1,76-7,60 (м, 6H), 1,39 (с, 9H), 1,28-1,18 (м, 2H); ВЭЖХ (способ 5) 98,1% (AUC), tR=13,79 мин.; ESI+APCI MS m/z 598 [M+H]+.
Схема 2-25
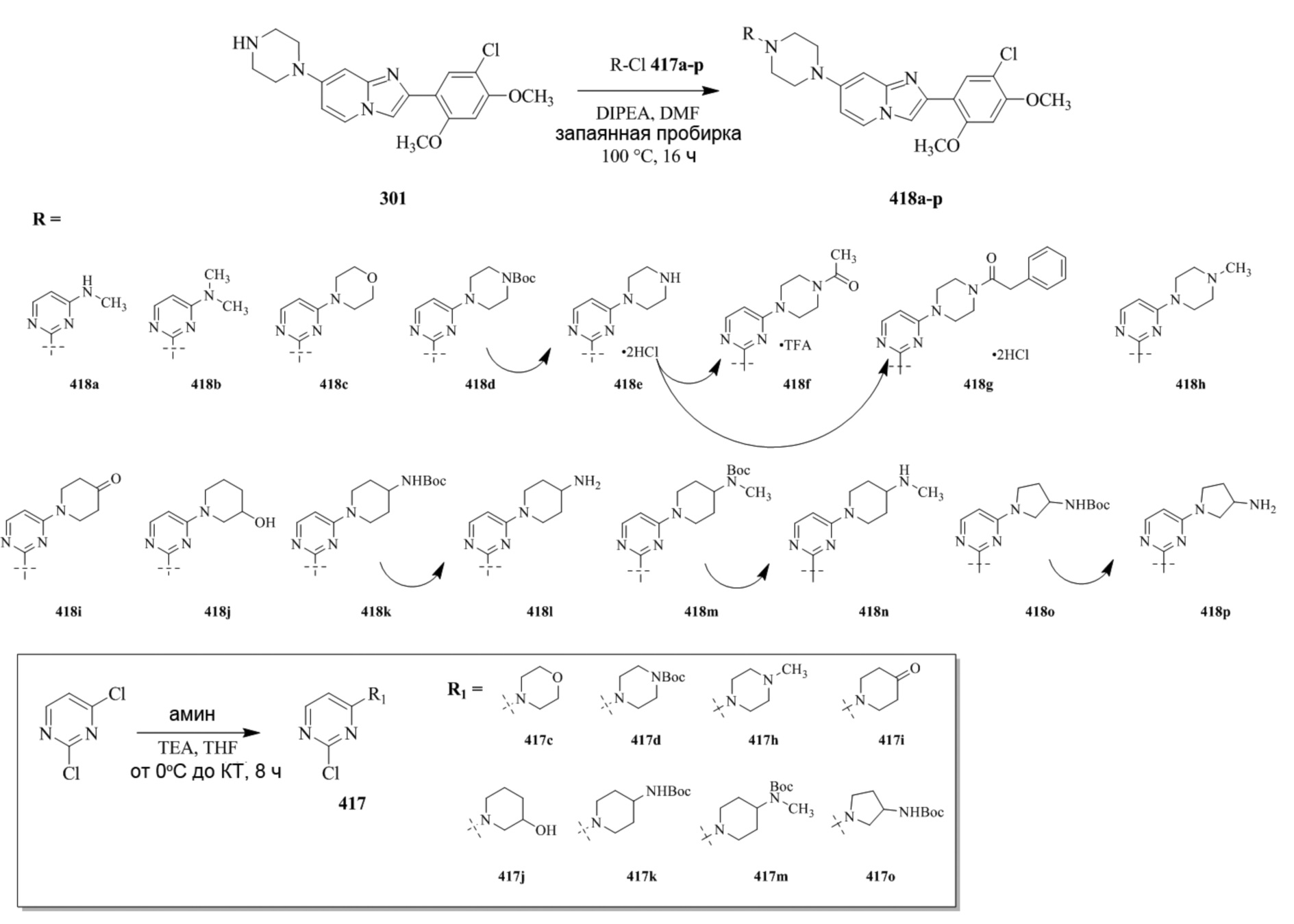
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)-N-метилпиримидин-4-амина 413a (пример 364);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (200 мг, 0,53 ммоль) и N,N-диизопропилэтиламина (0,4 мл, 2,29 ммоль) в DMF (5 мл) загружали 2-хлор-N-метилпиримидин-4-амин (155 мг, 1,07 ммоль). Реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования; полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Затем продукт растирали в порошок с метанолом и фильтровали. Твердые вещества промывали гексанами и сушили для того, чтобы получить 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N-метилпиримидин-4-амин 418a (20 мг, 8%) в виде твердого вещества светло-коричневого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=7,5 Гц, 1H), 8,15 (с, 1H), 8,04 (с, 1H), 7,75 (ушир. с, 1H), 6,97 (ушир. с, 1H), 6,89 (с, 1H), 6,87 (с, 1H), 6,71 (с, 1H), 5,78 (д, J=5,7 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,83 (ушир. с, 4H), 3,33 (ушир. с, 4H), 2,78 (д, J=4,2 Гц, 3H); ВЭЖХ (способ 1) 92,8% (AUC), tR=11,85 мин.; ESI+APCI MS m/z 480 [M+H]+.
Получение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)- N , N -диметилпиримидин-4-амина 418b (пример 356);
Соединение 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N,N-диметилпиримидин-4-амин 418b получали аналогичным образом, как 2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)-N-метилпиримидин-4-амин 418a, и получали в виде твердого вещества коричневого цвета (выход 18%).
1H ЯМР (300 МГц, DMSO-d6): δ 8,33 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,04 (с, 1H), 7,87 (д, J=6,0 Гц, 1H), 6,86 (с, 1H), 6,83 (с, 1H), 6,71 (с, 1H), 5,98 (д, J=6,0 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,83 (ушир. с, 4H), 3,26 (ушир. с, 4H), 3,01 (с, 6H); ВЭЖХ (способ 1) 97,8% (AUC), tR=12,10 мин.; ESI+APCI MS m/z 494 [M+H]+.
Получение 4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)морфолина 418c (пример 363);
В раствор 2,4-дихлорпиримидина (1,00 г, 6,71 ммоль) и морфолина (0,59 мл, 6,81 ммоль) в THF (25 мл) загружали триэтиламин (1,4 мл, 10,0 ммоль) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч. Реакционную смесь испаряли досуха, остаток поднимали в CH2Cl2 и органический слой промывали водой, после которой следовал солевой раствор; сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 4-(2-хлорпиримидин-4-ил)морфолин 417c (1,0 г, 70%) в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,17 (д, J=5,1 Гц, 1H), 6,53 (д, J=5,1 Гц, 1H), 3,81 (т, J=4,5 Гц, 4H), 3,75 (т, J=4,5 Гц, 4H); ESI+APCI MS m/z 200 [M+H]+.
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (250 мг, 0,67 ммоль) и N,N-диизопропилэтиламина (0,5 мл, 2,87 ммоль) в DMF (7,5 мл) загружали 4-(2-хлорпиримидин-4-ил)морфолин 417c (238 мг, 1,34 ммоль). Реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования; полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Затем полученный продукт растирали в порошок с метанолом и фильтровали. Твердые вещества промывали гексанами и сушили для того, чтобы получить 4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)морфолин 418c (20 мг, 5%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=10,0 Гц, 1H), 8,16 (с, 1H), 8,03 (с, 1H), 7,94 (д, J=8,0 Гц, 1H), 6,87 (с, 1H), 6,85 (с, 1H), 6,71 (с, 1H), 6,12 (д, J=7,6 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,82 (ушир. с, 4H), 3,65 (ушир. с, 4H), 3,53 (ушир. с, 4H), 3,28 (ушир. с, 4H); ВЭЖХ (способ 6) 97,4% (AUC), tR=11,89 мин.; ESI+APCI MS m/z 536 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(4-(пиперазин-1-ил)пиримидин-2-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина дигидрохлорида 418e (пример 359);
В раствор 2,4-дихлорпиримидина (500 мг, 3,35 ммоль) и трет-бутилпиперазин-1-карбоксилата (685 мг, 3,67 ммоль) в DMF (5 мл) загружали триэтиламин (0,7 мл, 5,02 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакцию суспендировали в воде, образованные твердые вещества собирали посредством фильтрования, промывали водой, сушили при пониженном давлении. Неочищенный материал очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(2-хлорпиримидин-4-ил)пиперазин-1-карбоксилат 417d (510 мг, 51%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,06 (д, J=6,0 Гц, 1H), 6,40 (д, J=6,0 Гц, 1H), 3,65 (ушир. с, 4H), 3,52 (ушир. с, 4H), 1,49 (с, 9H); ESI+APCI MS m/z 299 [M+H]+.
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (150 мг, 0,40 ммоль) и N,N-диизопропилэтиламина (0,3 мл, 1,72 ммоль) в DMF (3 мл) загружали трет-бутил-4-(2-хлорпиримидин-4-ил)пиперазин-1-карбоксилат 417d (243 мг, 0,81 ммоль). Реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, промывали водой, сушили при пониженном давлении. Полученное твердое вещество очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-карбоксилат 418d (70 мг, 39%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,34 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,93 (д, J=6,0 Гц, 1H), 6,87 (с, 1H), 6,85 (с, 1H), 6,71 (с, 1H), 6,12 (д, J=6,0 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,82 (ушир. с, 4H), 3,56 (ушир. с, 4H), 3,40 (ушир. с, 4H), 3,27 (ушир. с, 4H), 1,42 (с, 9H); ESI+APCI MS m/z 635 [M+H]+.
В раствор трет-бутил-4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-карбоксилата 418d (90 мг, 0,14 ммоль) в 2,2,2-трифторэтаноле (3 мл) загружали триметилсилилхлорид (0,2 мл) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч. Реакционную смесь испаряли досуха для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(4-(пиперазин-1-ил)пиримидин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина дигидрохлорид 418e (80 мг, 93%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,97 (ушир. с, 1H), 9,55 (ушир. с, 2H), 8,60 (д, J=10,0 Гц, 1H), 8,30 (с, 1H), 8,10 (с, 1H), 8,01 (д, J=9,2 Гц, 1H), 7,35 (дд, J=2,8 Гц, J=10,4 Гц, 1H), 6,98 (с, 1H), 6,80 (д, J=2,0 Гц, 1H), 6,59 (с, 1H), 4,06 (с, 3H), 3,99 (ушир. с, 11H), 3,71 (ушир. с, 4H), 3,21 (ушир. с, 4H); ВЭЖХ (способ 1) 91,7% (AUC), tR=10,95 мин.; ESI+APCI MS m/z 535 [M+H]+.
Получение 1-(4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)этанона 2,2,2-трифторацетата 418f (пример 373);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(4-(пиперазин-1-ил)пиримидин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина дигидрохлорида 418e (65 мг, 0,10 ммоль) и триэтиламина (0,1 мл, 0,71 ммоль) в CH2Cl2 (2 мл) загружали уксусный ангидрид (0,02 мл, 0,21 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь разводили водой и водный слой экстрагировали в CH2Cl2. Органические слои объединяли, промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Продукт дополнительно очищали с помощью запускаемой по массе препаративной ВЭЖХ для того, чтобы получить 1-(4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)этанона 2,2,2-трифторацетат 418f (15 мг, 20%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,58 (д, J=7,6 Гц, 1H), 8,28 (с, 1H), 7,97 (д, J=6,8 Гц, 1H), 7,93 (с, 1H), 7,33 (дд, J=2,4, 7,6 Гц, 1H), 6,99 (с, 1H), 6,73 (д, J=2,4 Гц, 1H), 6,47 (ушир. с, 1H), 4,05 (с, 3H), 3,99 (с, 3H), 3,90 (ушир. с, 4H), 3,70 (ушир. с, 4H), 3,54 (ушир. с, 8H), 2,06 (с, 3H); ВЭЖХ (способ 1) >99% (AUC), tR=11,71 мин.; ESI+APCI MS m/z 577 [M+H]+.
Получение 1-(4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)-2-фенилэтанона дигидрохлорида 418g (пример 382);
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(4-(4-(пиперазин-1-ил)пиримидин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридина дигидрохлорида 418e (100 мг, 0,16 ммоль) и триэтиламина (0,16 мл, 1,14 ммоль) в CH2Cl2 (2 мл) загружали 2-фенилацетилхлорид (0,05 мл, 0,37 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь разводили с использованием CH2Cl2 и промывали насыщенным раствором бикарбоната натрия. Органические слои объединяли, промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Затем полученный продукт растирали в порошок с метанолом и промывали гексанами для того, чтобы получить 1-(4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)-2-фенилэтанон, который растворяли в 2,2,2-трифторэтаноле (3 мл), загружали в него триметилсилилхлорид (0,2 мл) при 0°C и перемешивали его в течение 10 мин. Реакционную смесь испаряли досуха для того, чтобы получить 1-(4-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперазин-1-ил)-2-фенилэтанона дигидрохлорид 418g (28 мг, 80%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 13,8 (ушир. с, 1H), 12,9 (ушир. с, 1H), 8,59 (д, J=7,6 Гц, 1H), 8,29 (с, 1H), 8,06 (с, 1H), 7,93 (д, J=7,2 Гц, 1H), 7,34-7,30 (м, 3H), 7,25-7,22 (м, 3H), 7,33 (дд, J=2,4 Гц, J=7,6 Гц, 1H), 6,99 (с, 1H), 6,76 (д, J=1,6 Гц, 1H), 6,56 (ушир. с, 1H), 4,06 (с, 3H), 3,99 (с, 3H), 3,95 (ушир. с, 4H), 3,79 (с, 2H), 3,72 (ушир. с, 8H), 3,63 (ушир. с, 4H); ВЭЖХ (способ 6) 95,0% (AUC), tR=11,43 мин.; ESI+APCI MS m/z 653 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-7-(4-(4-(4-метилпиперазин-1-ил)пиримидин-2-ил)пиперазин-1-ил)имидазо[1,2- a ]пиридина 418h (пример 370);
В раствор 2,4-дихлорпиримидина (1,0 г, 6,71 ммоль) и 1-метилпиперазина (0,75 мл, 6,76 ммоль) в THF (25 мл) загружали триэтиламин (1,4 мл, 10,2 ммоль) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь испаряли досуха, остаток поднимали в CH2Cl2; органический слой промывали водой, после которой следовал солевой раствор; сушили над сульфатом натрия, фильтровали и концентрировали. Полученный неочищенный материал очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-хлор-4-(4-метилпиперазин-1-ил)пиримидин 417h (830 мг, 53%) в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 8,02 (д, J=6,3 Гц, 1H), 6,40 (д, J=6,0 Гц, 1H), 3,67 (ушир. с, 4H), 2,47 (ушир. с, 4H), 2,34 (с, 3H); ESI+APCI MS m/z 213 [M+H]+.
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (150 мг, 0,40 ммоль) и N,N-диизопропилэтиламина (0,3 мл, 1,72 ммоль) в DMF (5 мл) загружали 2-хлор-4-(4-метилпиперазин-1-ил)пиримидин 417h (171 мг, 0,80 ммоль). Реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования; полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Затем продукт растирали в порошок с CH2Cl2/гексанами и сушили для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-7-(4-(4-(4-метилпиперазин-1-ил)пиримидин-2-ил)пиперазин-1-ил)имидазо[1,2-a]пиридин 418h (30 мг, 12%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,91 (д, J=6,0 Гц, 1H), 6,87 (с, 1H), 6,85 (дд, J=2,4, 7,6 Гц, 1H), 6,70 (д, J=2,0 Гц, 1H), 6,12 (д, J=6,0 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,81 (ушир. с, 4H), 3,55 (ушир. с, 4H), 3,27 (ушир. с, 4H), 2,38 (ушир. с, 4H), 2,23 (с, 3H); ВЭЖХ (способ 1) 97,0% (AUC), tR=10,91 мин.; ESI+APCI MS m/z 549 [M+H]+.
Получение 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперидин-4-она 418i (пример 366);
В раствор 2,4-дихлорпиримидина (1,0 г, 6,71 ммоль) и пиперидин-4-она гидрохлорида (910 мг, 6,71 ммоль) в THF (25 мл) загружали триэтиламин (2,8 мл, 10,2 ммоль) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь испаряли досуха. Остаток поднимали в CH2Cl2; органический слой промывали водой, после которой следовал солевой раствор; сушили над сульфатом натрия, фильтровали и концентрировали. Полученное неочищенное вещество очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 1-(2-хлорпиримидин-4-ил)пиперидин-4-он 2i (890 мг, 62%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,13 (д, J=6,0 Гц, 1H), 6,49 (д, J=6,4 Гц, 1H), 3,98 (т, J=6,0 Гц, 4H), 2,59 (т, J=6,4 Гц, 4H); ESI+APCI MS m/z 212 [M+H]+.
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (100 мг, 0,26 ммоль) и N,N-диизопропилэтиламина (0,2 мл, 1,14 ммоль) в DMF (5 мл) загружали 1-(2-хлорпиримидин-4-ил)пиперидин-4-он 417i (115 мг, 0,54 ммоль). Реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования; полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Затем полученный продукт растирали в порошок с метанолом, промывали гексанами и сушили для того, чтобы получить 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперидин-4-он 418i (20 мг, 9%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,97 (д, J=6,0 Гц, 1H), 6,87-6,84 (м, 2H), 6,71 (с, 1H), 6,24 (д, J=6,0 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,89 (д, J=6,0 Гц, 4H), 3,84 (д, J=4,8 Гц, 4H), 3,28 (д, J=5,2 Гц, 4H), 2,43 (д, J=6,0 Гц, 4H); ВЭЖХ (способ 6) 90,2% (AUC), tR=11,71 мин.; ESI+APCI MS m/z 548 [M+H]+.
Получение 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперидин-3-ола 418j (пример 376);
В раствор 2,4-дихлорпиримидина (1,00 г, 6,71 ммоль) и пиперидин-3-ола (680 мг, 6,72 ммоль) в THF (25 мл) загружали триэтиламин (1,4 мл, 10,0 ммоль) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь испаряли досуха, поднимали в CH2Cl2 и органический слой промывали водой, после которой следовал солевой раствор; сушили над сульфатом натрия, фильтровали и концентрировали. Полученное неочищенное вещество очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 1-(2-хлорпиримидин-4-ил)пиперидин-3-ол 417j (1,1 г, 69%) в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 7,99 (д, J=6,3 Гц, 1H), 6,43 (д, J=6,3 Гц, 1H), 3,96-3,73 (м, 3H), 3,45-3,38 (м, 2H), 2,92 (д, J=4,8 Гц, 2H), 2,04-1,84 (м, 2H), 1,73-1,59 (м, 2H); ESI+APCI MS m/z 213 [M+H]+.
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (200 мг, 0,53 ммоль) и N,N-диизопропилэтиламина (0,4 мл, 2,29 ммоль) в DMF (5 мл) загружали 1-(2-хлорпиримидин-4-ил)пиперидин-3-ол 417j (232 мг, 1,08 ммоль). Реакционную смесь перемешивали при 90-100°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования; полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Затем полученный продукт растирали в порошок с CH2Cl2/гексанами и сушили для того, чтобы получить 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперидин-3-ол 418j (40 мг, 11%) в виде твердого вещества светло-коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,87 (д, J=6,0 Гц, 1H), 6,87-6,84 (м, 2H), 6,71 (д, J=2,0 Гц, 1H), 6,09 (д, J=6,0 Гц, 1H), 4,88 (д, J=4,4 Гц, 1H), 4,01 (с, 3H), 3,95-3,93 (м, 4H), 3,81 (т, J=4,8 Гц, 4H), 3,47-3,44 (м, 1H), 3,27 (т, J=4,8 Гц, 4H), 3,04-2,99 (м, 1H), 2,84-2,79 (м, 1H), 1,90-1,88 (м, 1H), 1,72-1,69 (м, 1H), 1,41-1,33 (м, 2H); ВЭЖХ (способ 1) 94,1% (AUC), tR=11,71 мин.; ESI+APCI MS m/z 550 [M+H]+.
Получение 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперидин-4-амина 418l (пример 437);
В раствор 2,4-дихлорпиримидина (2,0 г, 13,4 ммоль) и трет-бутилпиперидин-4-илкарбамата (2,7 г, 13,9 ммоль) в THF (50 мл) загружали триэтиламин (2,8 мл, 20,1 ммоль) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь концентрировали и остаток поднимали в этилацетате; органический слой промывали раствором NH4Cl, после которого следовал солевой раствор; сушили над сульфатом натрия, фильтровали и концентрировали. Полученное неочищенное вещество очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(2-хлорпиримидин-4-ил)пиперидин-4-ил)карбамат 417k (2,4 г, 73%).
1H ЯМР (400 МГц, CDCl3): δ 8,01 (д, J=6,0 Гц, 1H), 6,41 (д, J=6,0 Гц, 1H), 4,63 (д, J=6,4 Гц, 1H), 4,29 (ушир. с, 2H), 3,74 (ушир. с, 1H), 3,06 (т, J=12,0 Гц, 2H), 2,05 (ушир. с, 2H), 1,51 (с, 9H), 1,40-1,33 (м, 2H); ESI+APCI MS m/z 313 [M+H]+.
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (250 мг, 0,67 ммоль) и N,N-диизопропилэтиламина (0,5 мл, 2,87 ммоль) в DMF (7,5 мл) загружали трет-бутил(1-(2-хлорпиримидин-4-ил)пиперидин-4-ил)карбамат 417k (315 мг, 1,01 ммоль). Реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперидин-4-ил)карбамат 418k (260 мг, неочищенн.). ESI+APCI MS m/z 649 [M+H]+.
В раствор трет-бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперидин-4-ил)карбамата 418k (110 мг) в CH2Cl2 (2,5 мл) загружали 4M HCl в 1,4-диоксане (0,5 мл) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь испаряли досуха и поднимали в воде. Раствор ощелачивали насыщенным раствором бикарбоната натрия, образованное твердое вещество фильтровали, промывали водой и сушили для того, чтобы получить 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперидин-4-амин 418l (60 мг, 64%) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,39 (дд, J=3,6, 7,6 Гц, 1H), 8,24 (с, 1H), 8,09 (д, J=2,4 Гц, 1H), 7,93 (дд, J=4,0, 8,0 Гц, 1H), 6,93-6,90 (м, 2H), 6,77 (с, 1H), 6,19-6,17 (м, 1H), 4,25 (ушир. с, 2H), 4,07 (с, 3H), 3,99 (с, 3H), 3,87 (ушир. с, 4H), 3,33 (ушир. с, 4H), 3,03-2,98 (м, 2H), 2,87 (ушир. с, 1H), 1,81 (ушир. с, 2H), 1,29-1,18 (м, 2H); ВЭЖХ (способ 1) 93,7% (AUC), tR=10,57 мин.; ESI+APCI MS m/z 549 [M+H]+.
Получение 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)-N-метилпиперидин-4-амина 418n (пример 426);
В раствор 2,4-дихлорпиримидина (2,0 г, 13,4 ммоль) и трет-бутил метил(пиперидин-4-ил)карбамата (2,7 г, 13,5 ммоль) в THF (50 мл) загружали триэтиламин (2,8 мл, 20,1 ммоль) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь концентрировали, остаток поднимали в этилацетате и органический слой промывали раствором NH4Cl, после которого следовал солевой раствор; сушили над сульфатом натрия, фильтровали и концентрировали. Полученный неочищенный материал очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(2-хлорпиримидин-4-ил)пиперидин-4-ил)(метил)карбамат 417m (2,4 г, 73%).
1H ЯМР (400 МГц, CDCl3): δ 7,93 (д, J=5,6 Гц, 1H), 6,34 (д, J=6,0 Гц, 1H), 4,41 (ушир. с, 1H), 4,24 (ушир. с, 1H), 2,87 (т, J=11,2 Гц, 2H), 2,64 (с, 3H), 1,71 (ушир. с, 2H), 1,58 (ушир. с, 3H), 1,41 (с, 9H); ESI+APCI MS m/z 327 [M+H]+.
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (250 мг, 0,67 ммоль) и N,N-диизопропилэтиламина (0,5 мл, 2,87 ммоль) в DMF (10 мл) загружали трет-бутил(1-(2-хлорпиримидин-4-ил)пиперидин-4-ил)(метил)карбамат 417m (330 мг, 1,01 ммоль). Реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперидин-4-ил)(метил)карбамат 418m (155 мг, 17%).
ESI+APCI MS m/z 663 [M+H]+.
В раствор трет-бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пиперидин-4-ил)(метил)карбамата 418m (155 мг) в 2,2,2-трифторэтаноле (2,5 мл) загружали триметилсилилхлорид (0,2 мл) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. Реакционную смесь испаряли досуха и поднимали в воде. Полученный раствор ощелачивали насыщенным раствором бикарбоната натрия и экстрагировали в CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Полученный продукт растирали в порошок с CH2Cl2 и н-пентаном для того, чтобы получить 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)-N-метилпиперидин-4-амин 418n (80 мг, 60%) в виде твердого вещества светло-коричневого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,2 Гц, 1H), 8,18 (с, 1H), 8,03 (с, 1H), 7,88 (д, J=6,0 Гц, 1H), 6,87 (с, 1H), 6,84 (д, J=8,4 Гц, 1H), 6,71 (с, 1H), 6,12 (д, J=6,0 Гц, 1H), 4,17 (ушир. с, 2H), 4,01 (с, 3H), 3,93 (с, 3H), 3,81 (ушир. с, 4H), 3,27 (ушир. с, 4H), 2,98 (т, J=11,6 Гц, 2H), 2,54-2,58 (м, 2H), 2,29 (с, 3H), 1,83 (ушир. с, 2H), 1,19-1,14 (м, 2H); ВЭЖХ (способ 6) 95,0% (AUC), tR=11,43 мин.; ESI+APCI MS m/z 563 [M+H]+.
Получение 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пирролидин-3-амина 418p (пример 405);
В раствор 2,4-дихлорпиримидина (1,0 г, 6,71 ммоль) и трет-бутилпирролидин-3-илкарбамата (1,35 г, 6,74 ммоль) в THF (25 мл) загружали триэтиламин (1,4 мл, 10,0 ммоль) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь испаряли досуха и остаток поднимали в CH2Cl2; органический слой промывали водой, после которой следовал солевой раствор; сушили над сульфатом натрия, фильтровали и концентрировали. Полученный неочищенный материал очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(2-хлорпиримидин-4-ил)пирролидин-3-ил)карбамат 417o (550 мг, 69%).
1H ЯМР (300 МГц, CDCl3): δ 8,01 (д, J=6,0 Гц, 1H), 6,20 (д, J=6,0 Гц, 1H), 4,86 (ушир. с, 1H), 3,85 (ушир. с, 1H), 3,66-3,12 (м, 3H), 2,18 (ушир. с, 2H), 1,58-1,35 (м, 10H); ESI+APCI MS m/z 313 [M+H]+.
В раствор 2-(5-хлор-2,4-диметоксифенил)-7-(пиперазин-1-ил)имидазо[1,2-a]пиридина 301 (200 мг, 0,53 ммоль) и N,N-диизопропилэтиламина (0,4 мл, 2,29 ммоль) в DMF (10 мл) загружали трет-бутил(1-(2-хлорпиримидин-4-ил)пирролидин-3-ил)карбамат 417o (240 мг, 0,8 ммоль). Реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2). Затем продукт растирали в порошок с CH2Cl2/гексанами и сушили для того, чтобы получить трет-бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пирролидин-3-ил)карбамат 418o (140 мг, неочищенн.). ESI+APCI MS m/z 635 [M+H]+.
В раствор трет-бутил(1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пирролидин-3-ил)карбамата 418o (140,0 мг) в 2,2,2-трифторэтаноле (5 мл) загружали триметилсилилхлорид (0,2 мл) при 0°C. Реакционную смесь перемешивали при 0°C в течение 30 мин. Реакционную смесь испаряли досуха и очищали с помощью запускаемой по массе препаративной ВЭЖХ. Выделенный продукт поднимали в воде, ощелачивали насыщенным раствором бикарбоната натрия и экстрагировали в CH2Cl2. Объединенные органические слои промывали солевым раствором; сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растирали в порошок с CH2Cl2/гексанами и сушили для того, чтобы получить 1-(2-(4-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперазин-1-ил)пиримидин-4-ил)пирролидин-3-амин 418p (15 мг, 13%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,33 (д, J=7,6 Гц, 1H), 8,17 (с, 1H), 8,03 (с, 1H), 7,87 (д, J=6,0 Гц, 1H), 6,86 (с, 1H), 6,84 (с, 1H), 6,71 (с, 1H), 5,79 (д, J=5,2 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,83 (ушир. с, 4H), 3,65-3,44 (м, 5H), 3,26 (ушир. с, 4H), 2,07 (с, 1H), 1,74 (с, 1H); ВЭЖХ (способ 6) 96,1% (AUC), tR=11,45 мин.; ESI+APCI MS m/z 535 [M+H]+.
Схема 2-26
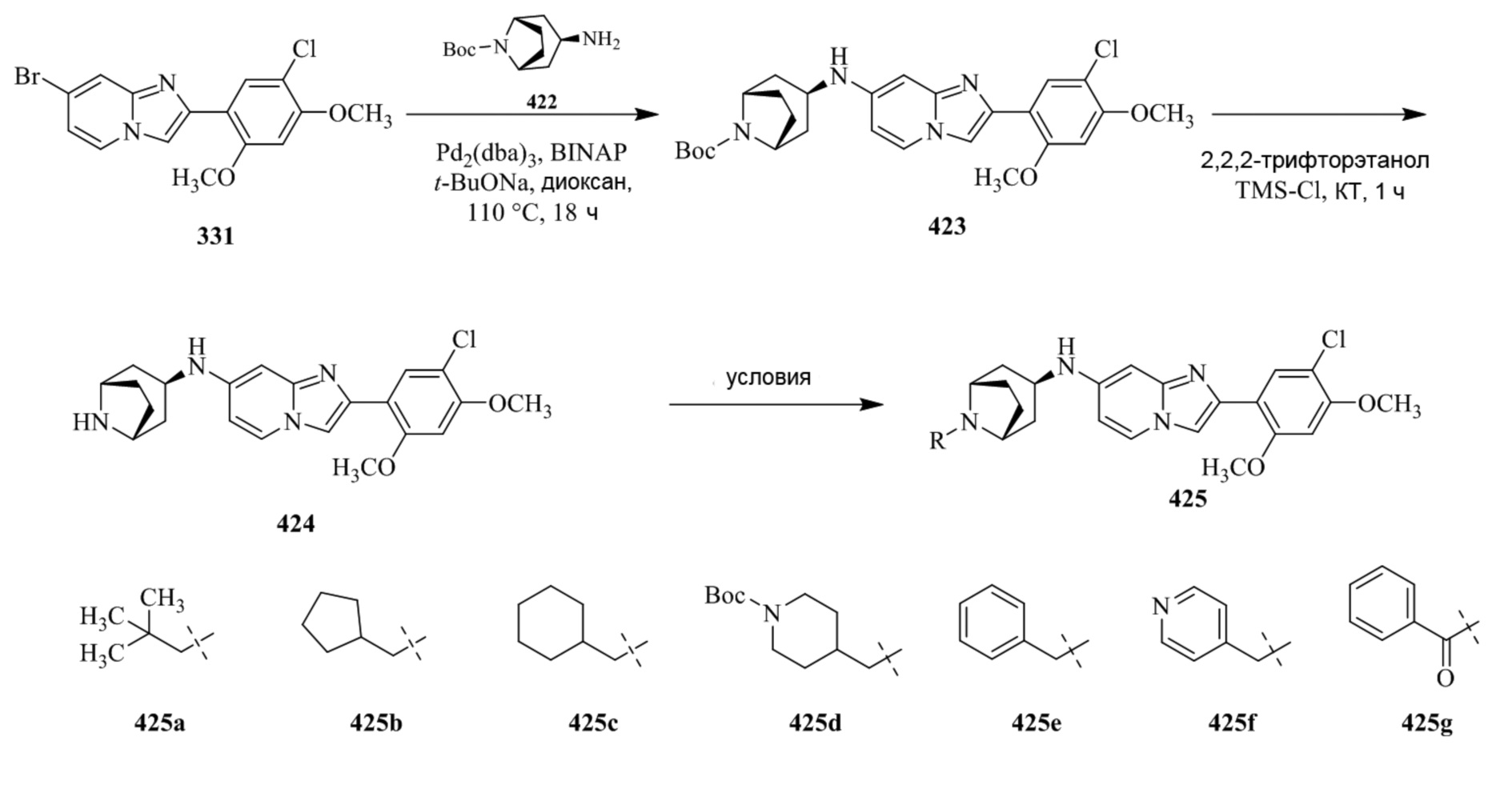
Получение (1 R ,3 r ,5 S )- трет -бутил-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-карбоксилатдиамина 423 (пример 444);
Cмесь 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 331 (1,50 г, 4,08 ммоль), (1R,3r,5S)-трет-бутил-3-амино-8-азабицикло[3.2.1]октан-8-карбоксилата 422 (1,39 г, 6,14 ммоль), BINAP (255 мг, 0,41 ммоль) и трет-бутоксида натрия (1,18 г, 12,3 ммоль) в диоксане (20 мл) дегазировали аргоном в течение 15 мин. Добавляли трис(дибензилиденацетон)дипалладий(0) (375 мг, 0,41 ммоль) и получаемую смесь дополнительно дегазировали аргоном в течение еще 5 мин. Реакционную смесь нагревали при 100°C в течение 18 ч при перемешивании. Реакционную смесь охлаждали до комнатной температуры, разбавляли с использованием CH2Cl2 (500 мл) и фильтровали через подушку целита. Фильтрат концентрировали и полученный остаток очищали с помощью хроматографии на силикагеле (CH3OH/CH2Cl2) для того, чтобы получить (1R,3r,5S)-трет-бутил-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-карбоксилат 423 (1,40 г, 67%) в виде твердого вещества зеленого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,14 (д, J=7,6 Гц, 2H), 7,89 (с, 1H), 6,85 (с, 1H), 6,18 (д, J=7,2 Гц, 1H), 6,07 (с, 1H), 4,06 (ушир. с, 2H),3,99 (с, 3H), 3,92 (с, 3H), 3,58 (ушир. с, 1H), 2,18-2,07 (м, 4H), 1,86-1,75 (м, 4H), 1,43 (с, 9H); ВЭЖХ (способ 1) >99% (AUC), tR=14,75 мин.; ESI+APCI MS m/z 513 [M+H]+.
Получение N -((1 R ,3 r ,5 S )-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-амина 424;
В суспензию (1R,3r,5S)-трет-бутил-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-карбоксилата 423 (2,8 г, 5,4 ммоль) в 2,2,2-трифторэтаноле (10 мл) загружали TMS-Cl (3 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь испаряли досуха и остаток поднимали в растворе NaHCO3. Получаемую суспензию перемешивали в течение 30 мин при комнатной температуре и затем фильтровали. Выделенное твердое вещество промывали водой и затем сушили для того, чтобы получить N-((1R,3r,5S)-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амин 424 (2,0 г, 59%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,14 (т, J=3,6 Гц, 2H), 7,89 (с, 1H), 6,85 (с, 1H), 6,48 (дд, J=5,4 Гц, J=16,5 Гц, 1H), 6,18 (д, J=3,0 Гц, 1H), 6,08 (с, 1H), 4,06 (с, 3H),3,99 (с, 3H), 3,61-3,55 (м, 3H), 2,27-2,1 (м, 4H), 1,84-1,79 (м, 4H); ESI+APCI MS m/z 413 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-N-((1 R ,3 r ,5 S )-8-неопентил-8-азабицикло[3.2.1]октан-3-ил)имидазо[1,2- a ]пиридин-7-амина 425a (пример 452);
Cмесь N-((1R,3r,5S)-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 424 (100 мг, 0,24 ммоль), пивалальдегида (31 мг, 0,36 ммоль) и AcOH (0,1 мл) в CH3OH (4 мл) перемешивали при комнатной температуре в течение 1 ч. Затем добавляли цианоборогидрид натрия (23 мг, 0,36 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×10 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-N-((1R,3r,5S)-8-неопентил-8-азабицикло[3.2.1]октан-3-ил)имидазо[1,2-a]пиридин-7-амин 425a (6 мг, 5%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, MeOD-d6): δ 7,97 (д, J=7,2 Гц, 1H), 7,85 (с, 1H), 7,81 (с, 1H),6,71 (с, 1H), 6,47 (д, J=7,2 Гц, 1H), 6,14 (с, 1H), 3,93 (с, 3H), 3,86 (с, 3H), 3,51 (т, J=6,9 Гц, 1H), 3,25 (ушир. с, 2H), 2,21-1,73 (м, 10H), 0,88 (с, 9H); ВЭЖХ (способ 1) 92,99% (AUC), tR=12,22 мин.; ESI+APCI MS m/z 483 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-N-((1 R ,3 r ,5 S )-8-(циклопентилметил)-8-азабицикло[3.2.1]октан-3-ил)имидазо[1,2- a ]пиридин-7-амина 425b (пример 443);
Cмесь N-((1R,3r,5S)-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 424 (150 мг, 0,36 ммоль), циклопентанкарбальдегида (43 мг, 0,4 ммоль) и AcOH (0,1 мл) в CH3OH (4 мл) перемешивали при комнатной температуре в течение 1 ч. Затем добавляли цианоборогидрид натрия (34 мг, 0,54 ммоль) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре в атмосфере азота. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×10 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-N-((1R,3r,5S)-8-(циклопентилметил)-8-азабицикло[3.2.1]октан-3-ил)имидазо[1,2-a]пиридин-7-амин 425b (60 мг, 33%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,12 (д, J=9,2 Гц, 2H), 7,87 (с, 1H), 6,85 (с, 1H), 6,45 (дд, J=2,0 Гц, J=7,2 Гц, 1H), 6,01 (ушир. с, 2H), 3,99 (с, 3H), 3,92 (с, 3H), 3,48 (ушир. с, 1H), 3,17 (ушир. с, 2H), 2,22-1,87 (м, 9H), 1,83-1,69 (м, 4H), 1,58-1,49 (м, 4H), 1,26-1,14 (2H),; ВЭЖХ (способ 1) 98,33% (AUC), tR=12,41 мин.; ESI+APCI MS m/z 495 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-N-((1 R ,3 r ,5 S )-8-(циклогексилметил)-8-азабицикло[3.2.1]октан-3-ил)имидазо[1,2- a ]пиридин-7-амина 425c (пример 434);
Cмесь N-((1R,3r,5S)-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 424 (150 мг, 0,36 ммоль), циклогексанкарбальдегида (60 мг, 0,54 ммоль) и AcOH (0,1 мл) в CH3OH (4 мл) перемешивали при комнатной температуре в течение 1 ч. Затем добавляли цианоборогидрид натрия (34 мг, 0,54 ммоль) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре в атмосфере азота. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×10 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-N-((1R,3r,5S)-8-(циклогексилметил)-8-азабицикло[3.2.1]октан-3-ил)имидазо[1,2-a]пиридин-7-амин 425c (20 мг, 11%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,12 (д, J=7,8 Гц, 2H), 7,87 (с, 1H), 6,85 (с, 1H), 6,45 (дд, J=12, 17,4 Гц, 1H), 6,07-6,01 (м, 2H), 3,99 (с, 3H), 3,92 (с, 3H), 3,48 (ушир. с, 1H), 3,10 (ушир. с, 2H), 2,10-1,99 (м, 4H), 1,91-1,57 (м, 11H), 1,44-1,37 (м, 1H), 1,27-1,11 (3H), 0,92-0,83 (м, 2H); ВЭЖХ (способ 1) 96,77% (AUC), tR=12,49 мин.; ESI+APCI MS m/z 509 [M+H]+.
Получение трет -бутил-4-(((1 R ,3 r ,5 S )-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-ил)метил)пиперидин-1-карбоксилата 425d (пример 447);
Cмесь N-((1R,3r,5S)-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 424 (200 мг, 0,48 ммоль), трет-бутил-4-формилпиперидин-1-карбоксилата (155 мг, 0,73 ммоль) и AcOH (0,1 мл) в CH3OH (5 мл) перемешивали при комнатной температуре в течение 1 ч. Затем добавляли цианоборогидрид натрия (45 мг, 0,73 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×10 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил-4-(((1R,3r,5S)-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-ил)метил)пиперидин-1-карбоксилат 425d (110 мг, 37,3%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, MeOD-d6): δ 7,95 (д, J=7,2 Гц, 1H), 7,90 (с, 1H), 7,80 (с, 1H),6,69 (с, 1H), 6,41 (дд, J=2,0 Гц, J=7,2 Гц, 1H), 6,11 (д, J=1,6 Гц, 1H), 4,01-3,96 (м, 2H), 3,98 (с, 3H), 3,85 (с, 3H), 3,54 (т, J=6,4 Гц, 1H), 3,38 (т, J=1,6 Гц, 2H), 2,69-2,58 (м, 2H), 2,43-2,42 (м, 2H), 2,25 -2,20 (м, 2H), 2,06-1,98 (м, м, 4H), 1,85-1,81 (м, 2H), 1,73-1,70 (м, 3H), 1,36 (с, 9H), 1,09-1,0 (м, 2H); ВЭЖХ (способ 1) 97,50% (AUC), tR=12,73 мин.; ESI+APCI MS m/z 610 [M+H]+.
Получение N -((1 R ,3 r ,5 S )-8-бензил-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-амина 425e (пример 433);
Cмесь N-((1R,3r,5S)-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 424 (150 мг, 0,36 ммоль), бензальдегида (42 мг, 0,4 ммоль) и AcOH (0,1 мл) в CH3OH (4 мл) перемешивали при комнатной температуре в течение 1 ч. В реакционную смесь добавляли NaCNBH3 (23 мг, 0,43 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Реакционную смесь разводили водой и экстрагировали в CH2Cl2 (2×10 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить N-((1R,3r,5S)-8-бензил-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амин 425e (18 мг, 10%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (300 МГц, DMSO-d6): δ 8,13 (т, J=4,4 Гц, 2H), 7,88 (с, 1H),7,46-7,25 (м, 5H), 6,85 (с, 1H), 6,48 (дд, J=1,6 Гц, J=7,2 Гц, 1H), 6,09-6,04 (м, 2H), 3,99 (с, 3H), 3,92 (с, 3H), 3,52 (ушир. с, 3H), 3,11 (ушир. с, 2H), 2,23-2,12 (м, 2H),2,10-1,90 (м, 4H), 1,74-1,70 (м, 2H),; ВЭЖХ (способ 1) 94,87% (AUC), tR=11,75 мин.; ESI+APCI MS m/z 503 [M+H]+.
Получение 2-(5-хлор-2,4-диметоксифенил)-N-((1 R ,3 r ,5 S )-8-(пиридин-4-илметил)-8-азабицикло[3.2.1]октан-3-ил)имидазо[1,2- a ]пиридин-7-амина 425f (пример 448);
Cмесь N-((1R,3r,5S)-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 424 (200 мг, 0,36 ммоль), 4-(хлорметил)пиридина гидрохлорида (118 мг, 0,73 ммоль) и N,N-диизопропилэтиламина (0,42 мл, 0,9 ммоль) в DMF (3 мл) перемешивали при 100°C в течение 16 ч в атмосфере азота. Реакционную смесь гасили водой и экстрагировали в EtOAc (2×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали при пониженном давлении. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить 2-(5-хлор-2,4-диметоксифенил)-N-((1R,3r,5S)-8-(пиридин-4-илметил)-8-азабицикло[3.2.1]октан-3-ил)имидазо[1,2-a]пиридин-7-амин 425f (15 мг, 6%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, DMSO-d6) δ: 8,50 (д, J=5,7 Гц, 2H), 8,12 (д, J=6,9 Гц, 2H), 7,87 (с, 1H), 7,40 (д, J=5,1 Гц, 2H), 6,84 (с, 1H), 6,46 (д, J=6,0 Гц, 1H), 6,04 (с, 2H), 3,99 (с, 3H), 3,92 (с, 3H), 3,55 (ушир. с, 3H), 3,17 (ушир. с, 2H), 2,27-2,13 (м, 2H), 2,02-1,99 (м, 4H), 1,73 (д, J=14,1 Гц, 2H); ВЭЖХ (способ 1) 93,99% (AUC), tR=11,09 мин.; ESI+APCI MS m/z 504 [M+H]+.
Получение ((1 R ,3 r ,5 S )-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-ил)(фенил)метанона 425g (пример 457);
Cмесь N-((1R,3r,5S)-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 424 (150 мг, 0,36 ммоль), бензойной кислоты (67 мг, 0,54 ммоль), HATU (207 мг, 0,54 ммоль) и N,N-диизопропилэтиламина (0,16 мл, 0,9 ммоль) в DMF (3 мл) перемешивали при комнатной температуре в течение 16 ч при комнатной температуре в атмосфере азота. Реакционную смесь гасили водой и экстрагировали в EtOAc (2×25 мл). Объединенные органические слои промывали водой, за которой следовал солевой раствор; сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить ((1R,3r,5S)-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-ил)(фенил)метанон 425g (25 мг, 13%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6) δ: 8,14 (т, J=3,6 Гц, 2H), 7,88 (с, 1H),7,5-7,43 (м, 5H), 6,84 (с, 1H), 6,46 (дд, J=2,0 Гц, J=7,2 Гц, 1H), 6,18 (д, J=3,6 Гц, 1H), 6,09 (с, 1H), 4,06 (ушир. с, 1H), 3,99 (с, 4H), 3,92 (с, 3H), 3,67-3,56 (м, 1H), 2,28-2,05 (м, 4H), 1,93-1,82 (м, 4H); ВЭЖХ (способ 5) >99% (AUC), tR=13,76 мин.; ESI+APCI MS m/z 517 [M+H]+.
Схема 2-27
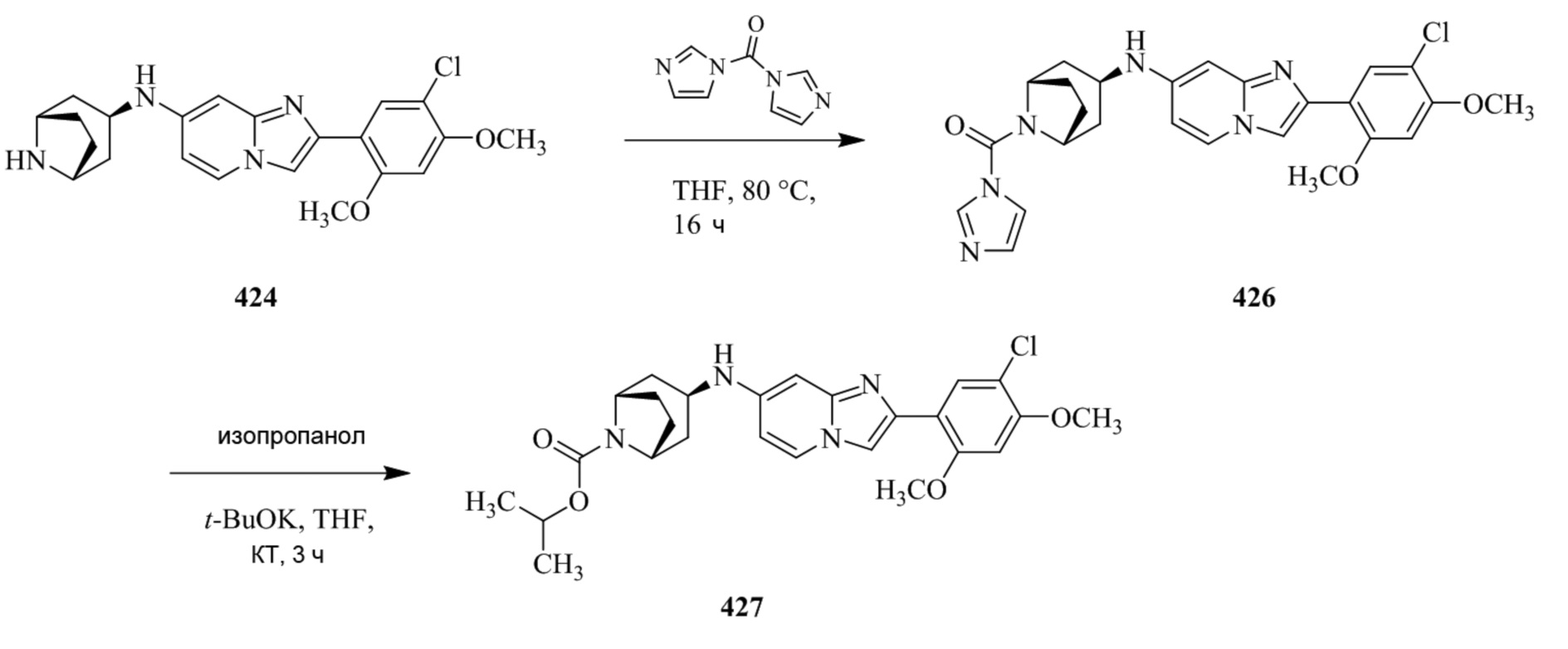
Получение (( 1R ,3 r ,5 S )-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-ил)( 1H -имидазол-1-ил)метанона 426;
Cмесь N-((1R,3r,5S)-8-азабицикло[3.2.1]октан-3-ил)-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-амина 424 (1,0 г, 2,4 ммоль), ди(1H-имидазол-1-ил)метанона (507 мг, 3,1 ммоль) в THF (30 мл) перемешивали при 80°C в течение 16 ч. Реакционную смесь разводили водой и экстрагировали в EtOAc (2×25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении и остаток растирали в порошок с н-гексаном для того, чтобы получить ((1R,3r,5S)-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-ил)(1H-имидазол-1-ил)метанон 426 (1,0 г, 83%) в виде твердого вещества светло-желтого цвета. ESI+APCI MS m/z 507 [M+H]+.
Получение (1 R ,3 r ,5 S )-изопропил 3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-карбоксилата 427 (пример 391);
В смесь ((1R,3r,5S)-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-ил)(1H-имидазол-1-ил)метанона 426 (125 мг, 0,24 ммоль), пропан-2-ола 7(17 мг, 0,3 ммоль) в THF (4 мл) добавляли раствор KOt-Bu (80 мг, 0,72 ммоль) в THF (4 мл) при 10°C и реакционную смесь перемешивали при комнатной температуре в течение 3 ч в атмосфере азота. Реакционную смесь разводили солевым раствором и экстрагировали в EtOAc (2×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить (1R,3r,5S)-изопропил-3-((2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)амино)-8-азабицикло[3.2.1]октан-8-карбоксилат 427 (пример 391) (20 мг, 16%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (400 МГц, DMSO-d6) δ: 8,15 (с, 1H), 8,13 (д, J=2,4 Гц, 1H), 7,89 (с, 1H), 6,47 (дд, J=2,0 Гц, J=7,2 Гц, 1H), 6,21 (ушир. с, 1H), 4,86-4,77 (м, 1H), 4,12 (ушир. с, 2H), 3,99 (с, 3H), 3,92 (с, 3H), 3,62-3,59 (м, 1H), 2,20-2,09 (м, 4H), 1,90-1,87 (м, 4H), 1,2 (ушир. с, 6H); ВЭЖХ (способ 5) 97,76% (AUC), tR=14,01 мин.; ESI+APCI MS m/z 499 [M+H]+.
Схема 2-28
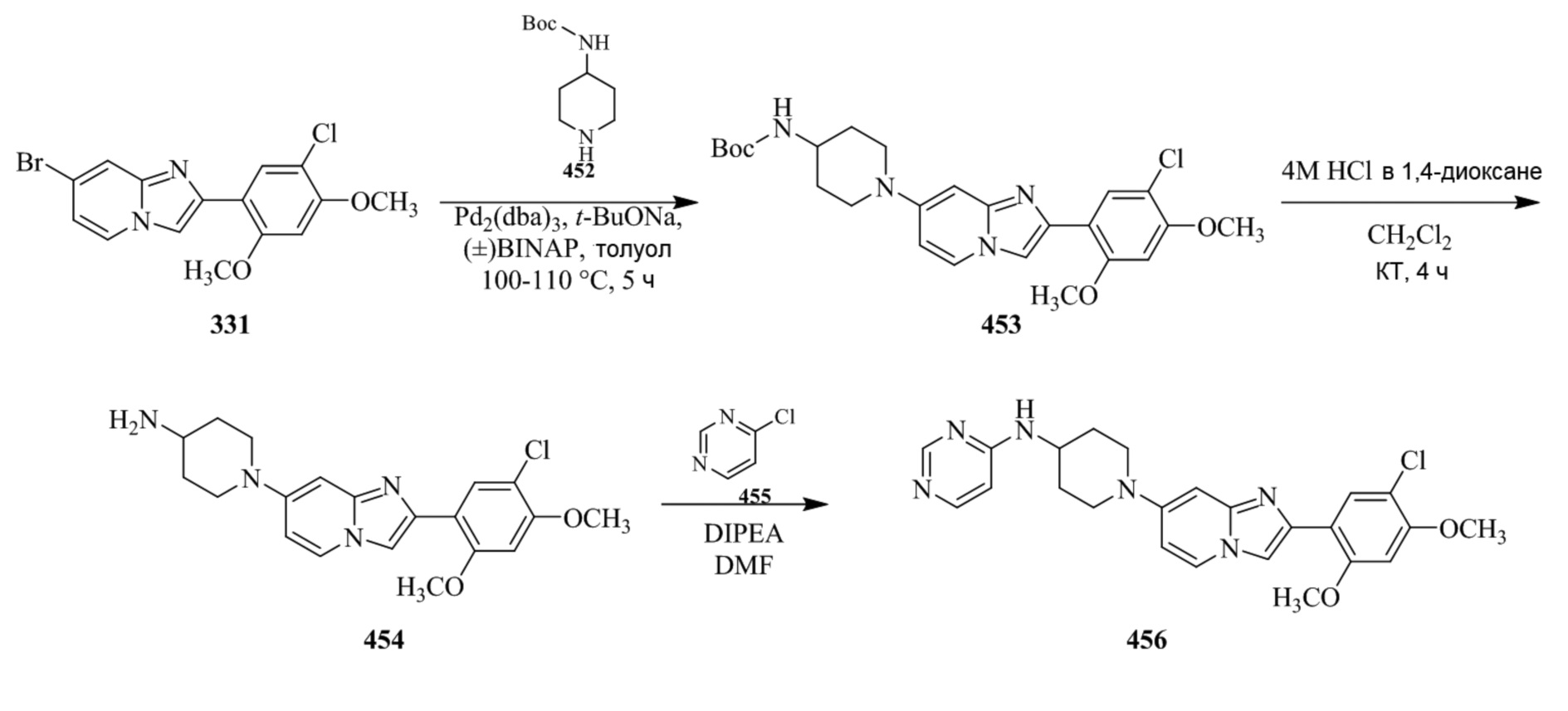
Получение трет -бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)карбамата 453;
Суспензию 7-бром-2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридина 331 (6,00 г, 16,4 ммоль), трет-бутилпиперидин-4-илкарбамата 452 (4,91 г, 24,6 ммоль), (±) BINAP (1,12 г, 1,80 ммоль) и NaOt-Bu (4,72 г, 49,2 ммоль) в толуоле (100 мл) дегазировали аргоном в течение 15 мин. В смесь загружали Pd2(dba)3 (750 мг, 0,81 ммоль) и дополнительно дегазировали ее аргоном в течение еще 5 мин. Получаемую реакционную смесь перемешивали при 100-110°C в течение 5 ч. Реакционную смесь охлаждали, фильтровали через подушку целита (подушку целита промывали в 10% MeOH/CH2Cl2) и объединенные фильтраты испаряли досуха. Полученный остаток очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)карбамат 3 (2,50 г, 31%) в виде твердого вещества коричневого цвета. ESI+APCI MS m/z 487 [M+H]+.
Получение 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-амина 454;
В раствор трет-бутил(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)карбамата 453 (2,50 г, 5,14 ммоль) в CH2Cl2 (50 мл) загружали 4,0 M HCl в 1,4-диоксане (10 мл) и перемешивали его при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали и полученное твердое вещество промывали в CH2Cl2. Затем твердое вещество суспендировали в воде (55 мл), ощелачивали насыщенным раствором бикарбоната натрия (55 мл) посредством перемешивания при комнатной температуре в течение 1 ч. Твердое вещество собирали посредством фильтрования, промывали водой и сушили для того, чтобы получить 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-амин 454 (1,80 г, 91%) в виде твердого вещества коричневого цвета. ESI+APCI MS m/z 387 [M+H]+.
Получение N -(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2- a ]пиридин-7-ил)пиперидин-4-ил)пиримидин-4-амина 456 (пример 374);
В суспензию 1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-амина 454 (100 мг, 0,25 ммоль) и N,N-диизопропилэтиламина (0,13 мл, 0,77 ммоль) в DMF (2 мл) загружали 4-хлорпиримидин 455 (57 мг, 0,50 ммоль). Получаемую смесь подвергали обработке микроволнами при 100°C в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры, суспендировали в воде и перемешивали в течение 1 ч. Осадок собирали посредством фильтрования, полученное твердое вещество промывали водой, сушили при пониженном давлении и очищали с помощью CombiFlash Companion (силикагель, CH3OH/CH2Cl2) для того, чтобы получить N-(1-(2-(5-хлор-2,4-диметоксифенил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ил)пиримидин-4-амин 456 (30 мг, 25%) в виде твердого вещества грязно-белого цвета.
1H ЯМР (400 МГц, DMSO-d6): δ 8,40 (с, 1H), 8,29 (д, J=7,5 Гц, 1H), 8,17 (с, 1H), 8,02 (с, 1H), 8,00 (с, 1H), 7,37 (д, J=7,5 Гц, 1H), 6,86 (с, 1H), 6,81 (дд, J=2,1, 9,6 Гц, 1H), 6,69 (с, 1H), 6,45 (д, J=5,7 Гц, 1H), 4,00 (с, 4H), 3,93 (с, 3H), 3,79-3,75 (м, 2H), 2,98-2,90 (м, 2H), 1,99-1,96 (м, 2H), 1,60-1,49 (м, 2H); ВЭЖХ (способ 1) 96,1% (AUC), tR=11,55 мин.; ESI+APCI MS m/z 465 [M+H]+.
Схема 2-29
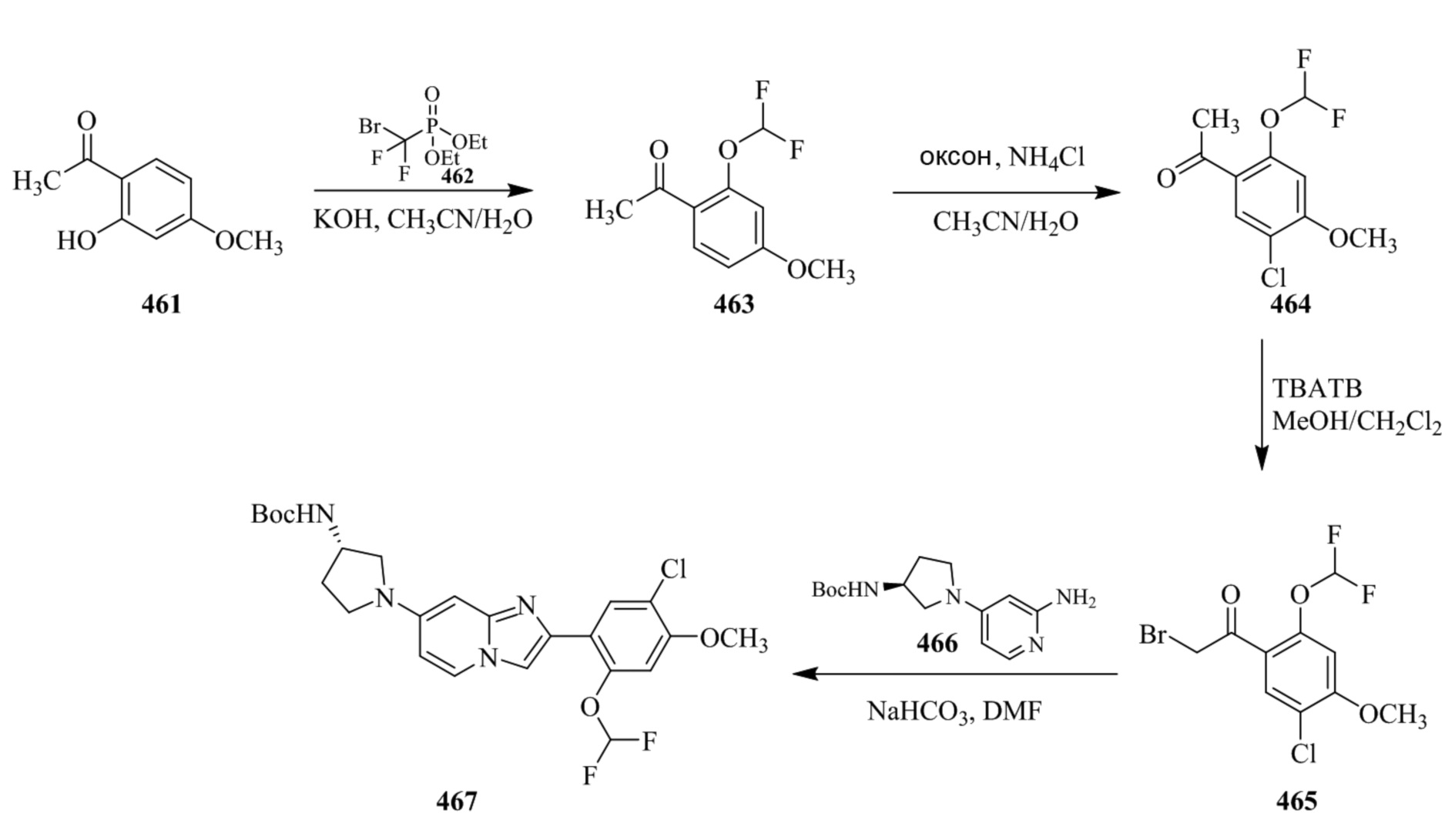
Получение 1-(2-(дифторметокси)-4-метоксифенил)этанона 463;
В смесь 1-(2-гидрокси-4-метоксифенил)этанона 461 (3,3 г, 20 ммоль), KOH (22,4 г, 40 ммоль) в CH3CN/воде (20 мл/20 мл), охлажденную в ацетоновой ванне с сухим льдом, быстро добавляли диэтил(бромдифторметил)фосфонат 462 (7,1 мл, 40 ммоль). После добавления удаляли холодную ванну и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь распределяли между этилацетатом и водой, слои разделяли и водный слой экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, за которой следовал солевой раствор; сушили над Na2SO4, фильтровали и концентрировали для того, чтобы получить 1-(2-(дифторметокси)-4-метоксифенил)этанон 463 в виде масла желтоватого цвета, которое затвердевало, когда стояло (4,4 г, неочищенн.). Неочищенный материал использовали на следующей стадии непосредственно без дополнительной очистки.
1H ЯМР (300 МГц, CDCl3): δ 7,84 (д, J=8,8 Гц, 1H), 6,79 (дд, J=2,3, 8,8 Гц, 1H), 6,66 (д, J=2,3 Гц, 1H), 6,59 (т, J=74 Гц, 1H), 3,86 (с, 3H), 2,59 (с, 3H). 19F ЯМР (282 МГц, CDCl3): δ -81,19.
Получение 1-(5-хлор-2-(дифторметокси)-4-метоксифенил)этанона 464;
В суспензию 1-(2-(дифторметокси)-4-метоксифенил)этанона 463 (4,3 г, 20 ммоль), NH4Cl (1,39 г, 26 ммоль) в смеси CH3CN/воды (100 мл/10 мл) добавляли оксон® (7,38 г, 24 ммоль) по частям при комнатной температуре. Получаемую суспензию энергично перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток разводили водой (100 мл) и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, после которой следовал солевой раствор, сушили над Na2SO4 и концентрировали. Остаток очищали посредством хроматографии на силикагеле (1:9, этилацетат/гексаны) для того, чтобы получить 1-(5-хлор-2-(дифторметокси)-4-метоксифенил)этанон 464 (3,2 г, 64%) в виде воскообразного твердого вещества белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 7,89 (с, 1H), 6,71 (с, 1H), 6,59 (т, J=73 Гц, 1H), 3,96 (с, 3H), 2,58 (с, 3H). 19F ЯМР (282 МГц, CDCl3): δ -81,24.
Получение 2-бром-1-(5-хлор-2-(дифторметокси)-4-метоксифенил)этанона 465;
В раствор 1-(5-хлор-2-(дифторметокси)-4-метоксифенил)этанона 464 (3,2 г, 12,8 ммоль) в смеси MeOH/CH2Cl2 (10 мл/20 мл), который охлаждали в ледяной водяной бане, по частям добавляли трибромид тетрабутиламмония (6,8 г, 14,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворители удаляли при пониженном давлении и остаток поднимали в этилацетате (150 мл). Органический слой промывали водой (3×20 мл), после чего следовал солевой раствор, сушили над Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали посредством хроматографии на силикагеле (1:3, CH2Cl2/гексаны) для того, чтобы получить 2-бром-1-(5-хлор-2-(дифторметокси)-4-метоксифенил)этанон 465 (2,7 г, 63%) в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, CDCl3): δ 7,94 (с, 1H), 6,72 (с, 1H), 6,64 (т, J=72 Гц, 1H), 4,45 (с, 2H), 3,98 (с, 3H).
Получение ( S )- трет -бутил(1-(2-(5-хлор-2-(дифторметокси)-4-метоксифенил)имидазо[1,2- a ]пиридин-7-ил)пирролидин-3-ил)карбамата 467 (пример 408);
Cмесь (S)-трет-бутил(1-(2-аминопиридин-4-ил)пирролидин-3-ил)карбамата 6 (170 мг, 0,607 ммоль), 2-бром-1-(5-хлор-2-(дифторметокси)-4-метоксифенил)этанона 465 (200 мг, 0,607 ммоль) и NaHCO3 (102 мг, 1,21 ммоль) в безводном DMF (3 мл) подвергали обработке микроволнами при 90°C в течение 1 ч. Реакционную смесь разводили водой (30 мл) и экстрагировали этилацетатом (2×30 мл). Объединенные органические слои промывали водой (3×30 мл), после которой следовал солевой раствор, сушили над Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали посредством хроматографии на силикагеле (5:95; MeOH/CH2Cl2) для того, чтобы получить (S)-трет-бутил(1-(2-(5-хлор-2-(дифторметокси)-4-метоксифенил)имидазо[1,2-a]пиридин-7-ил)пирролидин-3-ил)карбамат 467 (200 мг, 65%) в виде твердого вещества зеленоватого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,42 (с, 1H), 7,89 (д, J=7,3 Гц, 1H), 7,77 (с, 1H), 6,75 (с, 1H), 6,50 (т, J=74 Гц, 1H), 6,44 (ушир. с, 1H), 6,36 (дд, J=2,4, 7,5 Гц, 1H), 4,72 (ушир. с, 1H), 4,40 (ушир. с, 1H), 3,93 (с, 3H), 3,66 (дд, J=6,1, 10,2 Гц, 1H), 3,51-3,38 (м, 2H), 3,24 (дд, J=4,3, 9,9 Гц, 1H), 2,36-2,31 (м, 1H), 2,07-1,96 (м, 1H), 1,47 (с, 9H); ВЭЖХ (способ 1) 97,0% (AUC), tR=11,81 мин.; ESI MS m/z 509 [M+H]+.
Соединения по изобретению в этой заявке, конкретно не описанные в вышеприведенных примерах, также синтезировали посредством схожих или аналогичных способов, обращаясь к вышеприведенным примерам и т. п.
Далее фармакологические активности соединения (I) описаны в следующих тестовых примерах.
[Тестовые примеры]
Получение планшетов разведений соединения (96-луночные планшеты)
В тестируемое соединение добавляли 100% DMSO для получения стокового раствора с конечной концентрацией 10 мМ, и раствор инкубировали в течение ночи на встряхивателе при 150 об./мин. В 96-луночный планшет дозировали 75 мкл 50% DMSO (в воде) во все лунки от столбца 3 до столбца 11, 76 мкл 50% DMSO добавляли в столбец 2 (от ряда A до ряда H). 24 мкл 10 мМ стокового соединения добавляли в колонку 2 (от ряда A до ряда H), чтобы получить конечную концентрацию 2,4 мМ. Смесь (25 мкл) в каждой лунке в столбце 2 смешивали и переносили в соответствующую лунку столбца 3. Схожую процедуру повторяли до столбца 11, чтобы получить 10 серийных разведений (1:4) каждого соединения.
Получение стандартного планшета с соединением (96-луночный планшет)
Аналитический буфер (18 мкл) добавляли в ряд A, колонки 3-11, и синефунгин (24 мкл, 12,5 мМ) добавляли в колонку 2. Смесь (6 мкл) в ряду A столбце 2 переносили в соответствующие лунки столбца 3. Смесь (24 мкл) в лунках столбца 3 смешивали и переносили в столбец 4 и схожую процедуру продолжали до столбца 11, чтобы получить 10-точечное серийное разведение синефунгина.
Получение 384-луночного тестового планшета
Воду (0,25 мкл) добавляли в столбец 1 и столбец 23 (лунки с минимальным и максимальным сигналом, соответственно) и 50% DMSO (0,25 мкл) добавляли в столбец 2 и столбец 24 (лунки с минимальным и максимальным сигналом, соответственно). Тестируемые соединения (0,25 мкл) добавляли в соответствующие лунки в рядах с A до N. Ряд O содержал соединение внутреннего стандарта. Синефунгин (4 мкл) добавляли в ряд P. Каждую концентрацию соединения тестировали в двух повторениях.
Анализ Suv39H2
Аналитический буфер (4 мкл) добавляли во все лунки, включая лунки тестируемого соединения и контрольные лунки (за исключением контрольных лунок с синефунгином), используя Multidrop Combi. Планшет центрифугировали на 1000 об./мин в течение 1 мин. Субстратную смесь (8 мкл), содержащую радиоактивно меченный 3H-SAM (конечная конц.: 100 нМ) и пептид гистона H3 (конечная конц.: 350 нМ), добавляли во все лунки с использованием Multidrop Combi и центрифугировали на 1000 об./мин в течение 1 мин. SUV39H2 (8 мкл, конечная конц.: оптимизировали для каждой партии фермента на основании удельной активности) добавляли с использованием Multidrop Combi. Аналитический планшет центрифугировали на 1000 об./мин в течение 1 мин. Аналитический буфер использовали в качестве фонового контроля и инкубировали при комнатной температуре в течение 3 часов. Реакцию останавливали с использованием 20 мкл 2,5 мг/мл бус Streptavidin SPA (конечная конц. 50 мкг/лунка) в буфере с использованием Multidrop Combi и центрифугировали в течение 1 мин. Планшет загружали в счетчик Trilux-Microbeta и выполняли отсроченное считывание через 10 часов. Радиоактивный сигнал измеряли по 1 мин/лунка. Синефунгин и соединение внутреннего стандарта использовали в качестве вспомогательных соединений для того, чтобы определять эффективность анализа.
Анализ данных
- Следующие вычисления выполняли с использованием полученных исходных CPM данных:
- Использованное программное обеспечение: XLFit из IDBS. Использовали модель Dose Response One Site - Model 205
- Отрицательный контроль 1% DMSO/вода (минимальный сигнал - столбцы 1 и 2) = усредненное значение для всех фоновых контрольных лунок
- Положительный контроль 1% DMSO/вода (максимальный сигнал - столбцы 23 и 24) = усредненное значение для всех контрольных лунок
- Соотношение сигналов=(положительный контроль)/(отрицательный контроль)
- Z'=1-(((3×стандартн. откл. отрицательного контроля)+(3×стандартн. откл. положительного контроля))/(усреднен. значение положительного контроля - усредненн. значение отрицательного контроля))
% Ингибирования тестируемого соединения = (100-((усредн. CPM тестируемое соединение - усредненн. CPM отрицательн. контр.)/(усредненн. CPM положительн. контр. - усредненн. CPM отрицательн. контр.))×100)
Для каждого тестового планшета вычисляли следующие результаты:
- усредненное, стандартное отклонение и %CV фоновых контролей
- усредненное, стандартное отклонение и %CV положительных контролей
- Z' значение планшета
- значения IC50 стандартных и тестируемых соединений (в нМ)
- значение R2 аппроксимированной кривой концентрация-ответ
- коэффициент наклона Хилла аппроксимированной кривой концентрация-ответ
- отношение сигнала к шуму
Для каждого выборочного соединения представляли следующие результаты:
- кривая зависимости ответа от концентрации для каждого соединения
- концентрация соединения, вызывающая 50% ингибирование активности фермента (значения IC50 (в нМ))
- % ингибирования при максимальной тестированной концентрации.
- максимальная тестированная концентрация
- значение R2 аппроксимированной кривой концентрация-ответ
- коэффициент наклона Хилла для аппроксимированной кривой концентрация-ответ
Значения IC50 типичных соединений по настоящему изобретению представлены в следующих таблицах 3 и 4:
Анализ вестерн-блоттинга
Для того чтобы оценить статус экспрессии SUV39H2 в нескольких клеточных линиях, осуществляли анализ вестерн-блоттинга с использованием неочищенного клеточного лизата, собранного от этих клеток. Антитело к SUV39H2 использовали для визуализации экспрессии. Клеточные линии злокачественных опухолей A549, HCT-116, HFL1, CCD-18Co и PC14 значительно экспрессировали SUV39H2.
Клеточный анализ
Активные перспективные ингибиторы против SUV39H2 оценивали по их мишенеспецифической цитотоксичности с использованием A549, HCT-116, HFL1, CCD-18Co и PC14. 100 мкл клеточной суспензии высевали на 96-луночный микротитровальный планшет (ViewPlate-96FTC, PerkinElmer). Начальная концентрация клеток для A549, HCT-116, HFL1, CCD-18Co и PC14 составляла 3000 клеток/лунка, 2000 клеток/лунка и 2500 клеток/лунка, соответственно. Рост клеток определяли с использованием Cell Counting Kit-8 (DOJINDO) через 72 часа после экспозиции перспективных ингибиторов. IC50 использовали в качестве индикатора антипролиферативной активности ингибиторов, и ее вычисляли способом серийных разведений (0, 1,5625, 3,125, 6,25, 12,5, 25, 50, и 100 мкМ). Точные значения IC50 вычисляли как описано ранее.
Значения IC50 типичных соединений (примеры с 1 до 460) по настоящему изобретению представлены в следующих таблицах 3 и 4:
Таблица 3
|
Таблица 4
|
|
|