Результат интеллектуальной деятельности: ВАКЦИНОТЕРАПИЯ НЕОВАСКУЛЯРИЗАЦИИ СОСУДИСТОЙ ОБОЛОЧКИ ГЛАЗА
Вид РИД
Изобретение
Область техники
Группа изобретений относится к фармацевтическим средствам для лечения и/или профилактики заболеваний, вызываемых образованием новых кровеносных сосудов (неоваскуляризацией) сосудистой оболочки глаза (неоваскулярная макулопатия). Данное изобретение также относится к средствам, ингибирующим неоваскуляризацию в сосудистой оболочке глаза.
Уровень техники
Экссудативная возрастная дистрофия желтого пятна (AMD), вызванная неоваскуляризацией сосудистой оболочки глаза (CNV), - это одна из главных причин тяжелого нарушения зрения в развивающихся странах. Данные, существующие к настоящему времени, предполагают, что фактор роста сосудистого эндотелия (VEGF) играет центральную роль в развитии CNV. Например, сообщалось о том, что CNV подавляется соединениями, которые ингибируют продукцию VEGF, или соединениями, которые ингибируют путь передачи сигнала VEGF. Кроме того, сообщалось, что антитела к VEGF проявляют высокую терапевтическую эффективность по сравнению с общепринятыми терапевтическими способами, включая фотодинамическую терапию. Поэтому в последние годы средства против VEGF стали основным вариантом лекарственной терапии против CNV.
Передача сигнала VEGF опосредована двумя типами рецепторных тирозин-киназ, т.е. VEGFR-1 и VEGFR-2. Два рецептора экспрессируются на мембранах CNV человека и мембранах CNV лабораторной мыши. Однако роль пути передачи сигнала от VEGFR-1 при CNV еще остается неясной. Например, в одном из исследований сообщается, что ингибирование передачи сигнала VEGFR-1 путем перорального введения антител, генного нокдауна или малой интерферирующей РНК (siRNA) ингибирует CNV. В другом исследовании сообщается, что в глазу активация VEGFR-1 с помощью VEGF или плацентарного фактора роста 1 (PIGF1), который является лигандом VEGFR-2, приводит к активации CNV через активацию VEGFR-2 посредством SPARC.
С другой стороны, для VEGFR-2 открытие того факта, что активация передачи сигнала через VEGFR-2 стимулирует рост CNV, в целом общепризнано. Таким образом, ожидается, что антиангиогенные подходы, направленные на VEGFR-2, такие как системное или местное введение средств против VEGFR-2 или антител к VEGFR-2, и введение siRNA в стекловидное тело, будут ингибировать передачу сигнала VEGFR-2 и рост CNV.
Однако проблема с доступными в настоящее время средствами против VEGF состоит в том, что они требуют повторных инъекций с интервалами от 4 до 6 недель. Кроме того, существует значительный риск тяжелых осложнений, таких как эндофтальмит и отслойка сетчатки. Поэтому желательно разработать новый терапевтический способ, который заменит используемые в настоящее время средства против VEGF.
Известно, что вакцина на основе пептида, происходящего из VEGF-2 рецептора человека, индуцирует цитотоксические T-лимфоциты (CTL), которые обладают мощной цитотоксичностью против эндотелиальных клеток, экспрессирующих VEGFR-2, в опухолевых тканях (патентный документ 1). Однако не известны вакцины, которые индуцируют цитотоксические T-лимфоциты (CTL) в сосудистой оболочке глаза. Кроме того, существует множество неясных аспектов в механизме неоваскуляризации в сосудистой оболочке глаза и в других тканях.
Документ по предшествующему уровню техники по данному изобретению представлен ниже.
Патентный документ 1 WO/2004/024766.
Описание изобретения
Проблемы, решаемые данным изобретением
Данное изобретение выполнено в свете изложенных выше обстоятельств. Цель, которая должна быть достигнута данным изобретением, состоит в получении фармацевтических средств, мишенью которых является VEGFR-2, который, как известно, является одним из белков, вовлеченных в неоваскуляризацию сосудистой оболочки глаза, для лечения и/или профилактики заболеваний, вызываемых неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия). Еще одной целью данного изобретения является получение средств для ингибирования неоваскуляризации сосудистой оболочки глаза.
Средства для решения проблем
Чтобы достичь указанных выше целей, авторы данного изобретения сфокусировали свое внимание на VEGFR-2, который, как известно, является одним из белков, вовлеченных в неоваскуляризацию сосудистой оболочки глаза. Конкретно, авторы данного изобретения вводили вакцину, содержащую пептид, происходящий из VEGFR-2, в качестве антигена модельным мышам (трансгенные мыши A2/Kb), экспрессирующим HLA-A*0201 человека, и тестировали эффект вакцины. В результате авторы данного изобретения обнаружили, что вакцина, содержащая пептид в качестве антигена, ингибирует неоваскуляризацию сосудистой оболочки глаза.
Существует множество сообщений о связи между VEGF и неоваскуляризацией сосудистой оболочки глаза. Однако существует и множество неясных аспектов в механизме неоваскуляризации сосудистой оболочки глаза и других тканей, и роль VEGFR-1 и VEGFR-2 в неоваскуляризации до сих пор остается неизвестной. Конкретно, хотя существуют сообщения о применении VEGFR-1 и VEGFR-2 в вакцинотерапии против злокачественных опухолей, отсутствуют сообщения, которые демонстрируют их применение для вакцинотерапии против неоваскуляризации сосудистой оболочки глаза. Это показывает, что специалисты в данной области техники признают, что, хотя вакцины на основе пептидов, происходящих из VEGFR-1- и VEGFR-2, известны как ингибирующие неоваскуляризацию, не связанную с сосудистой оболочкой глаза, они необязательно демонстрируют сходные эффекты на сосудистой оболочке глаза. При таких обстоятельствах авторы данного изобретения выбрали VEGFR-2 из множества кандидатов в качестве мишени и провели эксперименты. В результате авторы данного изобретения обнаружили, что вакцина, содержащая пептид, происходящий из VEGFR-2, в качестве антигена может ингибировать неоваскуляризацию сосудистой оболочки глаза. Авторы данного изобретения также обнаружили, что вакцина, содержащая пептид, происходящий из VEGFR-2 в качестве антигена, эффективна не только для пациентов с тяжелыми симптомами, но также для пациентов на ранних стадиях заболевания при сравнительно хорошем зрении. Конкретно, данное изобретение предоставляет изложенное ниже в пп. [1]-[36]:
[1] фармацевтическое средство для лечения и/или профилактики заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), которое содержит, по меньшей мере, один из пептидов (a)-(c), перечисленных ниже, в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-12;
(b) пептид с одним или несколькими аминокислотными замещениями, делециями, дополнениями и/или вставками в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, где пептид обладает активностью, индуцирующей цитотоксические Т-клетки; и
(c) пептид с одним или несколькими аминокислотными замещениями, делециями, добавлениями и/или вставками в какой-либо аминокислотной последовательности из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[2] фармацевтическое средство по п.[1], в котором заболевание, вызванное неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), выбрано из экссудативной возрастной дистрофии желтого пятна, миопической дегенерации желтого пятна, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных эпителиопатий, связанных с пигментом сетчатки, атрофии сосудистой оболочки глаза, хороидеремии и остеомы сосудистой оболочки глаза;
[3] вакцина для лечения и/или профилактики заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), которая содержит, по меньшей мере, один из представленных ниже пептидов (a) и (b) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-6; и
(b) пептид с одним или несколькими аминокислотными замещениями, делециями, добавлениями и/или вставками в какой-либо аминокислотной последовательности из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки.
[4] вакцина для лечения и/или профилактики заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), которая содержит, по меньшей мере, один из представленных ниже пептидов (a) и (b) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 7-12; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какой-либо аминокислотной последовательности из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[5] вакцина по п.[3], которая вводится субъекту, у которого антиген HLA представляет собой HLA-A02;
[6] вакцина по п.[4], которая вводится субъекту, у которого антиген HLA представляет собой HLA-A24;
[7] вакцина по пп.[5] или [6], где заболевание, вызванное неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), выбрано из экссудативной возрастной дистрофии желтого пятна, миопической дегенерации желтого пятна, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных эпителиопатий, связанных с пигментом сетчатки, атрофии сосудистой оболочки глаза, хороидеремии и остеомы сосудистой оболочки глаза;
[8] фармацевтическое средство для ингибирования неоваскуляризации сосудистой оболочки глаза, которое содержит, по меньшей мере, один из представленных ниже пептидов (a)-(c) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-12;
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки; и
(c) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[9] вакцина для ингибирования неоваскуляризации сосудистой оболочки глаза, которая содержит, по меньшей мере, один из представленных ниже пептидов (a) и (b) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-6; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[10] вакцина для ингибирования неоваскуляризации сосудистой оболочки глаза, которая содержит, по меньшей мере, один из представленных ниже пептидов (a) и (b) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 7-12; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[11] вакцина по п.[9], которую вводят субъекту, у которого антиген HLA представляет собой HLA-A02;
[12] вакцина по п.[10], которую вводят субъекту, у которого антиген HLA представляет собой HLA-A24;
[13] способ лечения и/или профилактики заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), который включает стадию введения субъекту фармацевтического средства, содержащего, по меньшей мере, один из представленных ниже пептидов (a)-(c) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-12;
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки; и
(c) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или С-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[14] способ по п.[13], в котором заболевание, вызванное неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), выбрано из экссудативной возрастной дистрофии желтого пятна, миопической дегенерации желтого пятна, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных эпителиопатий, связанных с пигментом сетчатки, атрофии сосудистой оболочки глаза, хороидеремии и остеомы сосудистой оболочки глаза;
[15] способ лечения и/или профилактики заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), который включает стадию введения субъекту вакцины, содержащей, по меньшей мере, один из представленных ниже пептидов (a) и (b) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-6; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[16] способ лечения и/или профилактики заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), который включает стадию введения субъекту вакцины, содержащей, по меньшей мере, один из представленных ниже пептидов (a) и (b) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 7-12; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[17] способ по п.[15], в котором введение выполняют субъекту, у которого антиген HLA представляет собой HLA-A02;
[18] способ по п.[16], в котором введение выполняют субъекту, у которого антиген HLA представляет собой HLA-A24;
[19] способ по пп.[17] или [18], в котором заболевание, вызванное неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), выбрано из экссудативной возрастной дистрофии желтого пятна, миопической дегенерации желтого пятна, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных эпителиопатий, связанных с пигментом сетчатки, атрофии сосудистой оболочки глаза, хороидеремии и остеомы сосудистой оболочки глаза;
[20] способ ингибирования неоваскуляризации сосудистой оболочки глаза, который включает стадию введения субъекту фармацевтического средства, содержащего, по меньшей мере, один из представленных ниже пептидов (a)-(c) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-12;
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки; и
(c) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[21] способ ингибирования неоваскуляризации сосудистой оболочки глаза, который включает стадию введения субъекту вакцины, содержащей, по меньшей мере, один из представленных ниже пептидов (a) и (b) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-6; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[22] способ ингибирования неоваскуляризации сосудистой оболочки глаза, который включает стадию введения субъекту вакцины, содержащей, по меньшей мере, один из представленных ниже пептидов (a) и (b) в качестве активного ингредиента:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 7-12; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[23] способ по п.[21], в котором введение выполняют субъекту, у которого антиген HLA представляет собой HLA-A02;
[24] способ по п.[22], в котором введение выполняют субъекту, у которого антиген HLA представляет собой HLA-A24;
[25] применение какого-либо из представленных ниже пептидов (a)-(c) в получении фармацевтического средства для лечения и/или профилактики заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия):
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-12;
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки; и
(c) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[26] применение по п.[25], в котором заболевание, вызванное неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), выбрано из экссудативной возрастной дистрофии желтого пятна, миопической дегенерации желтого пятна, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных эпителиопатий, связанных с пигментом сетчатки, атрофии сосудистой оболочки глаза, хороидеремии и остеомы сосудистой оболочки глаза;
[27] применение представленных ниже пептидов (a) или (b) в получении вакцины для лечения и/или профилактики заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия):
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-6; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какой-либо аминокислотной последовательности из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[28] применение представленных ниже пептидов (a) или (b) в получении вакцины для лечения и/или профилактики заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия):
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 7-12; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[29] применение по п.[27], в котором вакцина предназначена для введения субъекту, у которого антиген HLA представляет собой HLA-A02;
[30] применение по п.[28], в котором вакцина предназначена для введения субъекту, у которого антиген HLA представляет собой HLA-A24;
[31] применение по п.[29] или п.[30], где заболевание, вызванное неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), выбрано из экссудативной возрастной дистрофии желтого пятна, миопической дегенерации желтого пятна, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных эпителиопатий, связанных с пигментом сетчатки, атрофии сосудистой оболочки глаза, хороидеремии и остеомы сосудистой оболочки глаза;
[32] применение какого-либо из представленных ниже пептидов (a)-(c) в получении фармацевтического средства для ингибирования неоваскуляризации сосудистой оболочки глаза:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-12;
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки; и
(c) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[33] применение представленных ниже пептидов (a) или (b) в получении вакцины для ингибирования неоваскуляризации сосудистой оболочки глаза:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-6; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[34] применение приведенных ниже пептидов (a) или (b) в получении вакцины для ингибирования неоваскуляризации сосудистой оболочки глаза:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 7-12; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[35] применение по п.[33], в котором вакцина предназначена для введения субъекту, у которого антиген HLA представляет собой HLA-A02;
[36] применение по п.[34], в котором вакцина предназначена для введения субъекту, у которого антиген HLA представляет собой HLA-A24;
[37] какой-либо из приведенных ниже пептидов (a)-(c) для применения в лечении и/или профилактике заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия):
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-12;
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки; и
(c) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[38] пептид по п.[37], где заболевание, вызванное неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), выбрано из экссудативной возрастной дистрофии желтого пятна, миопической дегенерации желтого пятна, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных эпителиопатий, связанных с пигментом сетчатки, атрофии сосудистой оболочки глаза, хороидеремии и остеомы сосудистой оболочки глаза;
[39] представленные ниже пептиды (a) или (b) для применения в лечении и/или профилактике заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия):
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-6; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[40] представленные ниже пептиды (a) или (b) для применения в лечении и/или профилактике заболевания, вызванного неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия):
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 7-12; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[41] пептид по п.[39], где вакцина предназначена для введения субъекту, у которого антиген HLA представляет собой HLA-A02;
[42] пептид по п.[40], где вакцина предназначена для введения субъекту, у которого антиген HLA представляет собой HLA-A24;
[43] пептид по пп.[41] или [42], где заболевание, вызванное неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), выбирают из экссудативной возрастной дистрофии желтого пятна, миопической дегенерации желтого пятна, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных эпителиопатий, связанных с пигментом сетчатки, атрофии сосудистой оболочки глаза, хороидеремии и остеомы сосудистой оболочки глаза;
[44] какой-либо из представленных ниже пептидов (a)-(c) для применения в ингибировании неоваскуляризации сосудистой оболочки глаза:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-12;
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки; и
(c) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[45] представленные ниже пептиды (a) или (b) для применения в ингибировании неоваскуляризации сосудистой оболочки глаза:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-6; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в которой вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[46] представленные ниже пептиды (a) или (b) для применения в ингибировании неоваскуляризации сосудистой оболочки глаза:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 7-12; и
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки;
[47] пептид по п.[45], где вакцина предназначена для введения субъекту, у которого антиген HLA представляет собой HLA-A02; и
[48] пептид по п.[46], где вакцина предназначена для введения субъекту, у которого антиген HLA представляет собой HLA-A24.
Краткое описание чертежей
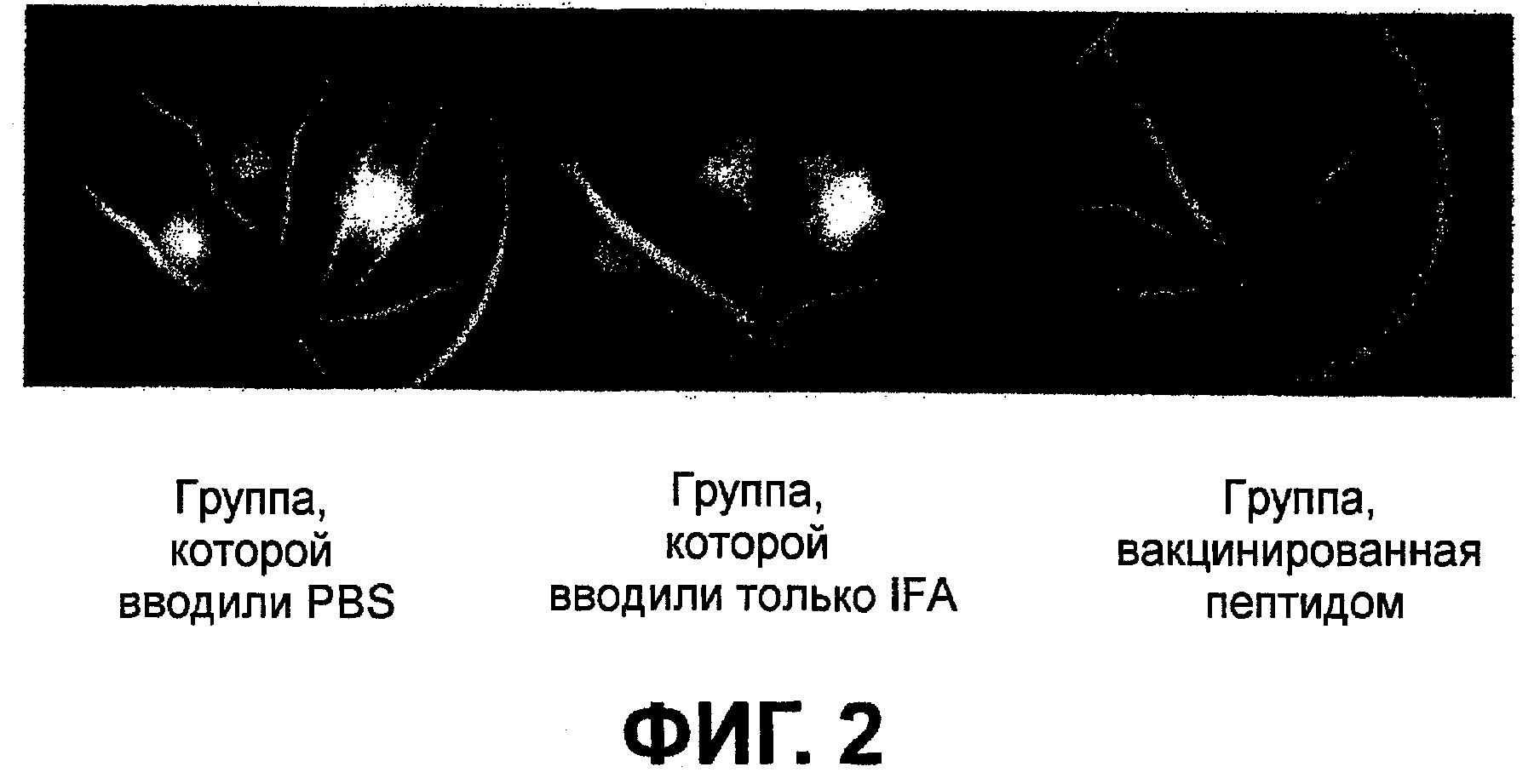
Фиг.1 представляет диаграмму, демонстрирующую показатель утечки флуоресценции в новообразованных сосудах сосудистой оболочки глаза, полученный с помощью флуоресцентной ангиографии глазного дна на седьмой день у группы, получавшей физиологический раствор с фосфатным буфером (PBS), группы, которой вводили только IFA, и группы, вакцинированной пептидом.
Фиг.2 представляет фотографии, показывающие пример флуоресцентной ангиографии глазного дна на седьмой день у группы, которой вводили PBS, группы, которой вводили только IFA, и группы, вакцинированной пептидом.
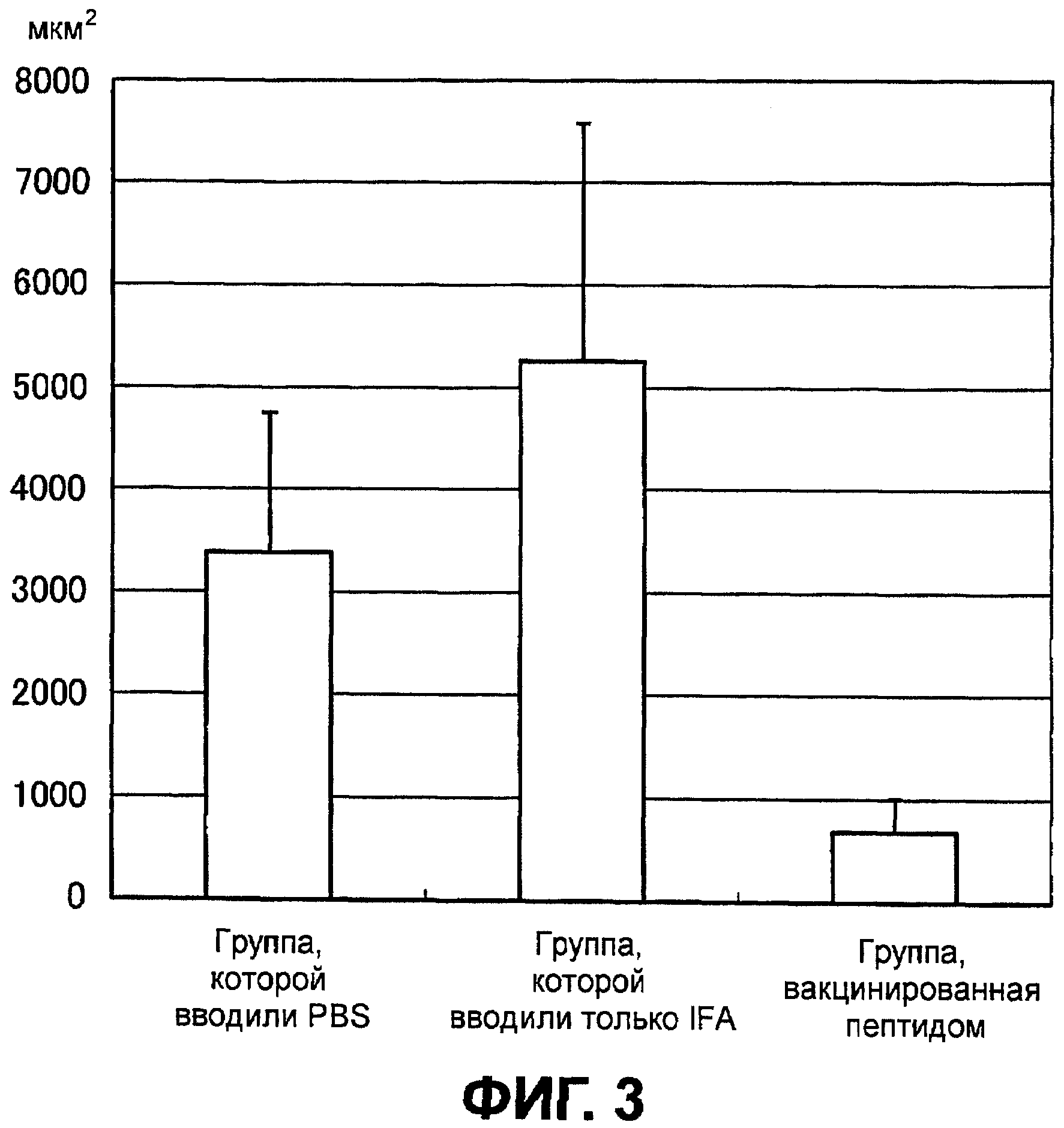
Фиг.3 представляет диаграмму, показывающую поперечное сечение новообразованных сосудов сосудистой оболочки глаза, полученное с помощью флуоресцентной ангиографии глазного дна на седьмой день у группы, которой вводили PBS, группы, которой вводили только IFA, и группы, вакцинированной пептидом.
Фиг.4 представляет фотографии, показывающие пример увеличенного препарата сосудистой оболочки на седьмой день у группы, которой вводили PBS, группы, которой вводили только IFA, и группы, вакцинированной пептидом.
Способ осуществления изобретения
Данное изобретение относится к фармацевтическим средствам для лечения и/или профилактики заболеваний, вызванных неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), которые содержат пептид, происходящий из VEGFR-2 в качестве активного ингредиента. Далее в данном документе эти фармацевтические средства могут быть названы как «фармацевтические средства по данному изобретению». Как описано выше, данное изобретение основывается на открытии авторов данного изобретения, что вакцины, содержащие в качестве антигена пептид, происходящий из VEGFR-2, эффективны для ингибирования неоваскуляризации сосудистой оболочки глаза.
Аминокислотная последовательность VEGFR-2 человека известна и описана, например, в патенте США № 5861301. Специалисты в данной области техники, имеющие доступ к информации, описанной в этом патентном документе, могут легко получить VEGFR-2 человека.
Пептид, происходящий из VEGFR-2, содержащийся в фармацевтических средствах по данному изобретению, предпочтительно представляет собой нонамерный или декамерный частичный пептид. Более конкретно, такие пептиды включают:
(a) пептид, содержащий какую-либо аминокислотную последовательность из SEQ ID NO: 1-12.
Ограничений пептидов по данному изобретению не существует, при условии, что пептиды обладают активностью, индуцирующей CTL против клеток, экспрессирующих VEGFR-2. Более конкретно, пептиды по данному изобретению также включают:
(b) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 1-6, в котором вторая аминокислота с N-конца представляет собой лейцин или метионин, и/или C-концевая аминокислота представляет собой валин или лейцин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки. Кроме того, одна или две аминокислоты могут быть добавлены на N-конце и/или C-конце пептидов.
Кроме того, пептиды по данному изобретению также включают:
(c) пептид, имеющий одно или несколько аминокислотных замещений, делеций, добавлений и/или вставок в какую-либо аминокислотную последовательность из SEQ ID NO: 7-12, в котором вторая аминокислота с N-конца представляет собой фенилаланин, тирозин, метионин или триптофан, и/или C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин, и где пептид обладает активностью, индуцирующей цитотоксические Т-клетки.
Замещаемые аминокислотные остатки предпочтительно замещаются на другие аминокислоты, у которых свойства боковых цепей аминокислоты сохраняются. Примеры свойств боковой цепи аминокислоты включают гидрофобные аминокислоты (A, I, L, M, F, P, W, Y и V); гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S и T); аминокислоты, имеющие алифатические боковые цепи (G, A, V, L, I и P); аминокислоты, имеющие боковые цепи, содержащие гидроксильную группу (S, T и Y); аминокислоты, имеющие боковые цепи, содержащие атом серы (C и M); аминокислоты, имеющие боковые цепи, содержащие карбоновую кислоту и амиды (D, N, E и Q); аминокислоты, имеющие боковые цепи, содержащие основание (R, K и H); и аминокислоты, имеющие боковые цепи, содержащие ароматическое кольцо (H, F, Y и W) (все аминокислоты представлены однобуквенными кодами в скобках). Аминокислотное замещение внутри каждой группы называется консервативным замещением. Полипептид, обладающий модифицированной аминокислотной последовательностью, в которой один или несколько аминокислотных остатков делетированы, добавлены и/или замещены другими аминокислотами в определенной аминокислотной последовательности, как известно, сохраняет свою исходную биологическую активность (Mark, D.F. et al., Proc. Natl. Acad. Sci. USA (1984) 81, 5662-6; Zoller, M.J. and Smith, M., Nucleic Acids Res. (1982) 10, 6487-500; Wang, A. et al., Science (1984) 224: 1431-3; Dalbadie-McFarland, G. et al., Proc. Natl. Acad. Sci. USA (1982) 79: 6409-13).
Число мутировавших аминокислот конкретно не ограничено. В целом, это число составляет семь или менее, предпочтительно - пять или менее, а более предпочтительно - три или менее (например, две или менее). Идентичность аминокислотной последовательности может быть определена, например, с использованием алгоритма BLAST по Karlin and Altschul (Proc. Natl. Acad. Sci. USA (1993) 90: 5873-7).
В данном изобретении пептид, содержащий аминокислотную последовательность SEQ ID NO: 2 особенно предпочтителен.
Кроме того, пептид по данному изобретению может быть получен путем синтеза пептида с какого-либо положения аминокислотной последовательности. Синтез пептида может быть выполнен в соответствии со способами, общепринятыми в химии пептидов. Общепринятые способы синтеза описаны в таких документах, как “Peptide Synthesis”, Interscience, New York, 1966; “The Proteins”, Vol. 2, Academic Press Inc., New York, 1976; “Peptide Synthesis (Peptide Gosei)”, Maruzen, 1975; “Fundamentals and Experiments of Peptide Synthesis (Peptide Gosei no Kiso to Jikken)”, Maruzen, 1985; и “The sequel of Development of Pharmaceuticals (Zoku Iyakuhin no Kaihatsu)”, Vol. 14, Peptide Synthesis (Peptide Gosei), Hirokawa Shoten, 1991, и в таких публикациях, как международная публикация № WO99/67288.
Пептиды по данному изобретению могут также быть синтезированы известными способами генной инженерии. Пример генно-инженерных способов синтеза представлен в нижеследующем способе. Вектор, в который встраивали ДНК, которая кодирует представляющий интерес пептид, вводили в подходящие клетки-хозяева для получения трансформированных клеток. Пептиды по данному изобретению могут быть получены путем сбора пептидов, продуцированных в этих трансформированных клетках.
Кроме того, пептид по данному изобретению может продуцироваться исходно как слитый белок, который затем расщепляют с использованием соответствующей протеазы с получением пептида. В способе получения слитого белка полинуклеотид, кодирующий пептид по данному изобретению, может быть лигирован внутри рамки считывания с полинуклеотидом, кодирующим другой пептид, и в таком виде может быть вставлен в вектор экспрессии для экспрессии в хозяине. Для этой цели могут быть использованы технологии, известные специалистам в данной области техники. В качестве пептидов, слитых с пептидами по данному изобретению, могут быть использованы известные пептиды, такие как FLAG (Hopp, T.P. et al., BioTechnology (1988) 6, 1204-1210), 6x His, состоящий из шести остатков гистидина (His), 10x His, гемагглютинин вируса гриппа (HA), фрагменты c-myc человека, фрагменты VSV-GP, фрагменты p18HIV, T7-tag, HSV-tag, E-tag, фрагменты антигена SV40T, lck tag, фрагменты α-тубулина, B-tag и фрагменты белка C. Также возможно лигирование пептидов по данному изобретению с глютатион-S-трансферазой (GST), гемагглютинином вируса гриппа (HA), С-доменами иммуноглобулина, β-галактозидазой, белком, связывающим мальтозу (MBP) или подобными для получения слитых белков. Пептиды по данному изобретению могут быть получены путем обработки продуцированных таким образом слитых белков подходящими протеазами, а затем выделения пептидов, представляющих интерес. Пептиды могут быть выделены способами, известными специалистам в данной области техники, такими как аффинная хроматография.
Кроме того, пептиды по данному изобретению обладают активностью, индуцирующей цитотоксические Т-клетки (опосредованная клетками активность, индуцирующая T-клетки), когда пептиды контактируют in vitro или in vivo с клетками, обладающими антигенной активностью. В частности, пептиды по данному изобретению предпочтительно обладают высокой аффинностью к антигенам HLA, таким как антигены типов A-02 и A-24, о которых сообщали, что они экспрессируются в популяции японцев с высокой частотой. Антигены HLA, такие как антигены типов A-02 и A-24, включают подтипы, такие как A-0201 и A-2402, соответственно. Примеры пептидов, обладающих высокой аффинностью связывания с HLA-A*0201, включают пептиды SEQ ID NO: 1-6 (WO/2004/024766).
Пептиды по данному изобретению включают не только пептиды, обладающие высокой аффинностью связывания с HLA-A*0201, но также пептиды, обладающие высокой аффинностью связывания с другими типами антигенов HLA (например, HLA-A*2402). Среди таких пептидов, примеры пептидов, обладающих высокой аффинностью связывания HLA-A*2402, включают пептиды SEQ ID NO: 7-12.
Если вакцинная эффективность пептида, происходящего из определенного белка, подтверждена, специалисты в данной области техники могут легко найти другие пептиды, которые обладают высокой аффинностью связывания с антигеном HLA из того же белка, и протестировать вакцинные эффекты этих пептидов. Кроме того, специалисты в данной области техники могут легко найти пептиды, которые обладают высокой аффинностью связывания с антигенами HLA, иными, чем HLA-A*0201, из того же белка, и получить вакцины, которые могут быть применены для различных расовых групп. Специалистам в данной области техники хорошо известно, что, когда пептид, происходящий из определенного белка, активирует иммунную реакцию против белка, пептид, происходящий из того же белка, который демонстрирует высокую аффинность к другому антигену HLA, также активирует иммунную реакцию против белка, постольку поскольку пептид обладает активностью, индуцирующей CTL против белка. Более конкретно, специалистам в данной области техники хорошо известно, что, когда пептид, происходящий из VEGFR-2 (например, SEQ ID NO: 2) ингибирует неоваскуляризацию путем активации иммунной реакции против VEGFR-2, пептид, происходящий из VEGFR-2, который демонстрирует высокую аффинность к другому антигену HLA (например, пептид, который демонстрирует высокую аффинность к HLA-A24) также ингибирует неоваскуляризацию путем активации иммунной реакции против VEGFR-2, постольку поскольку пептид обладает активностью, индуцирующей CTL против VEGFR-2.
Связывание пептида по данному изобретению и антигена HLA может быть измерено путем выделения клеток, обладающих антигеном HLA на поверхности клетки, таких как дендритные клетки, и оценки связывания пептида с клетками с помощью общепринятых способов.
В качестве альтернативы, существует программное обеспечение, доступное в Интернете, такое как описано Parker K.C., J. Immunol. 152, 163-75 (1994), которое может быть применено для расчета аффинности связывания различных пептидов с антигеном HLA in silico. Аффинность связывания с антигеном HLA может быть измерена в соответствии со способом, описанным, например, Parker, K.C., J. Immunol., 152, 163-75 (1994), Nukaya, I., Int. J. Cancer, 80, 92-7 (1999), и т.д.
В клинике путем предварительного определения типа антигена HLA, которым обладает нуждающийся в лечении пациент, пептиды, которые обладают высокой аффинностью связывания с этим антигеном, или пептиды, которые обладают высокой активностью, индуцирующей цитотоксические Т-клетки (CTL) через представление антигена, могут быть отобраны подходящим образом. Пептиды, отобранные такими способами, также включены в пептиды по данному изобретению.
В данном изобретении «лечение» означает ослабление характерных симптомов заболеваний, вызванных неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), у пациентов, у которых эти симптомы реально развились. В данном изобретении отсутствуют конкретные ограничения степени ослабления симптомов. Даже если степень очень низка, это включается в понятие «лечения» по данному изобретению, постольку поскольку симптомы могут быть ослаблены.
В данном изобретении «профилактика» означает заблаговременное подавление развития характерных симптомов заболеваний, вызванных неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия). В данном изобретении отсутствует ограничение степени подавления развития. Даже если степень очень низка, это включается в понятие «профилактика» по данному изобретению, постольку поскольку развитие может быть подавлено.
Ухудшение зрения представляет собой симптом заболеваний, вызванных неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия). Определение того, ослаблен этот симптом или нет, может быть достигнуто с помощью исследования зрения. Кроме того, активность новообразованных сосудов сосудистой оболочки глаза может быть определена путем исследования с помощью флуоресцентной ангиографии глазного дна или с помощью приборов для когерентной томографии.
Пептиды по данному изобретению могут быть использованы в лечении и/или профилактике сами по себе. В качестве альтернативы, пептиды могут быть приготовлены общепринятыми способами изготовления форм. В этих случаях носители, наполнители и подобные общепринятые компоненты, используемые в фармацевтике, могут быть соответствующим образом включены в дополнение к пептидам по данному изобретению. Например, они могут быть использованы парентерально в форме инъецируемых стерильных растворов или суспензий, приготовленных на воде или других фармацевтически приемлемых жидкостях. Например, они могут быть приготовлены в виде формы путем соответствующего комбинирования их с фармацевтически приемлемыми носителями или средами, более конкретно, стерилизованной водой или физиологическими солевыми растворами, растительными маслами, эмульгаторами, суспендирующими средствами, поверхностно-активными веществами, стабилизаторами, вкусовыми агентами, наполнителями, средами, консервантами, связующими агентами и подобным, и смешивания их в форму разовой дозы, требующейся в общепринятой фармацевтической практике. Количество активного ингредиента в формах устанавливается так, чтобы была достигнута соответствующая доза в пределах определенного диапазона.
Пептиды по данному изобретению могут быть использованы в качестве вакцин для индуцирования CTL in vivo, либо по отдельности, либо в виде комбинации двух или более типов. Более конкретно, данное изобретение относится к вакцинам для лечения и/или профилактики заболеваний, вызванных неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия), которые включают в качестве активного ингредиента пептид, происходящий из VEGFR-2. Путем введения пептида по данному изобретению, пептид при высокой плотности взаимодействует с антигеном HLA клетки, представляющей антиген, и это индуцирует CTL, которые специфически реагируют на провзаимодействовавший комплекс, образовавшийся между пептидом и антигеном HLA, и интенсивность атаки на сосудистые эндотелиальные клетки в сосудистой оболочке глаза возрастает. В качестве альтернативы, у пациента берут дендритные клетки и стимулируют пептидом по данному изобретению, чтобы получить клетки, представляющие антиген, у которых пептид по данному изобретению связан с поверхностью клетки. Путем введения клеток пациенту у него индуцируют CTL, и, таким образом, интенсивность атаки на клетки-мишени может быть усилена.
При использовании пептидов по данному изобретению в качестве вакцин, они могут быть введены вместе с адъювантом, так что эффективно устанавливается клеточный иммунитет, могут быть введены вместе с другими активными ингредиентами, такими как противораковые средства, или могут быть введены в форме частиц. Могут быть применены адъюванты, такие как описанные в документе Johnson AG., Clin. Microbiol. Rev., 7:277-289, 1994. Также могут быть использованы липосомные препараты, препараты в форме частиц, полученные путем связывания с шариками диаметром в несколько микрометров, препараты, связанные с липидами и подобные.
Специалисты в данной области техники могут подходящим образом спланировать способ, дозировку и период введения вакцины по данному изобретению в зависимости от симптомов, наблюдающихся у пациента (субъекта), нуждающегося во введении вакцины по данному изобретению. Вакцины по данному изобретению могут быть введены и системно, и местно. Примеры системного введения включают пероральное введение, внутрикожное введение, подкожное введение и внутривенную инъекцию. Примеры местного введения включают введение вблизи от сосудистой оболочки глаза.
Дозировка может составить, например, 0,001 мг - 1000 мг, предпочтительно 0,001 мг - 1000 мг, а более предпочтительно - 0,1 мг - 10 мг, но не ограничена этим. Вакцины предпочтительно вводят один раз в несколько дней или месяцев, но частота этим не ограничена.
Фармацевтические средства по данному изобретению эффективны против заболеваний, вызванных неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия). Ограничения заболеваний, являющихся мишенями фармацевтических средств по данному изобретению, отсутствуют, постольку поскольку это заболевания, вызванные неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия). Предпочтительно, заболевания включают неоваскулярную макулопатию, которая сопровождает такие заболевания, как экссудативная возрастная дистрофия желтого пятна, миопическая дегенерация желтого пятна, ангиоидные полосы сетчатки, центральная экссудативная хориоретинопатия, различные эпителиопатии, связанные с пигментом сетчатки, атрофия сосудистой оболочки глаза, хороидеремия и остеома сосудистой оболочки глаза. Особенно предпочтительным примером является экссудативная возрастная дистрофия желтого пятна.
Фармацевтические средства по данному изобретению имеют малый риск быстрого ухудшения зрения и развития жестоких осложнений после лечения, которые представляют собой проблемы при общепринятых терапевтических способах. Следовательно, фармацевтические средства по данному изобретению могут быть применены не только на пациентах с выраженными симптомами, но также на пациентах, находящихся на ранней стадии заболевания при наличии сравнительно хорошего зрения. Поскольку поражение сетчатки в случаях ранней стадии заболевания невелико при относительно хорошем зрении, прогноз по зрению после лечения запущенных случаев ожидается намного более благоприятным, чем при общепринятом лечении.
Данное изобретение основывается на открытии, что вакцины, содержащие в качестве антигена пептид, происходящий из VEGFR-2, повреждают эндотелиальные клетки кровеносных сосудов путем индуцирования цитотоксической активности T-лимфоцитов (CTL). Следовательно, данное изобретение предоставляет средства для ингибирования неоваскуляризации сосудистой оболочки глаза, которые включают в качестве активного ингредиента пептид, происходящий из VEGFR-2. Конкретные описания пептида, происходящего из VEGFR-2, изложены выше. В данном изобретении отсутствуют ограничения степени ингибирования. Даже если степень ингибирования очень низка, это включается в понятие «ингибирование», постольку поскольку неоваскуляризация может быть ингибирована.
Ингибирующие средства по данному изобретению могут быть использованы в форме вакцин. Более конкретно, данное изобретение предоставляет вакцины для ингибирования неоваскуляризации сосудистой оболочки глаза, которые содержат в качестве активного ингредиента пептид, происходящий из VEGFR-2. Конкретные описания вакцин, например, сайтов, способов и дозировок введения вакцин, описаны выше.
Все ссылки предшествующего состояния техники, процитированные в данном описании, включены в данный документ по ссылке.
ПРИМЕРЫ
Ниже в данном документе данное изобретение будет конкретно описано со ссылками на примеры, но они не должны быть истолкованы как ограничивающие его.
СПОСОБЫ
Животные
Мышей C57bl/6 с весом тела 20 г - 25 г получали на фирме CLEA Japan (Токио, Япония). Все эксперименты проводили в соответствии с требованиями Комитета по использованию и уходу за животными и Положением по использованию животных в исследовании глаза и зрения Ассоциации по исследованию зрения и офтальмологии. Мыши, использованные в экспериментах, экспрессировали HLA-A*0201 человека.
Антигенные пептиды
Мышей разделили на три группы. PBS, адъювант иммунитета (неполный адъювант Фрейнда (IFA)) или суспензию антигенного пептида, происходящего из VEGF-рецептора 2 человека, с IFA инъецировали подкожно в подмышечную ямку дважды (день 0 и день 10). Пептид состоит из девяти аминокислот, начиная с положения 773 VEGFR-2 человека, VIAMFFWLL (SEQ ID NO: 2), для которого подтверждено наличие антиангиогенного эффекта на опухолевой модели. Затем, на 20-й день, индуцировали CNV в трех местах в обоих глазах с помощью полупроводникового лазера с характеристиками ϕ 200 мкм, 200 мВт и 0,02 секунды.
Экспериментальная CNV
Экспериментальную CNV индуцировали, как описано в других источниках, с небольшими модификациями. Вкратце, общей анестезии добивались интраперитонеальной инъекцией (1 мл/кг) смеси (1:1) гидрохлорида кетамина (Ketalar®, фирма Sankyo, Токио, Япония) и гидрохлорида ксилазина (Celactal®, фирма Bayer, Токио, Япония). Зрачок расширяли с помощью одной капли 0,5% тропикамида (Mydrin® M, фирма Santen Pharmaceutical, Осака, Япония) для фотокоагуляции. Шесть лазерных фотокоагуляций наносили в каждый глаз между главными сосудами сетчатки вокруг оптического диска с помощью диодного лазерного фотокоагулятора (DC-3000®, фирма NIDEK, Осака, Япония) и передающей системы щелевой лампы (SL150, фирма Topcon, Токио, Япония) с размером пятна 200 мм, длительностью 0,02 секунды и интенсивностью 200 мВт.
Оценка степени CNV по флуоресцеиновой ангиографии
На третий и седьмой дни после индукции CNV (дни 23 и 27) животные, общим числом - 169, были использованы для изучения эффекта на утечку из повреждений CNV (на третий день число животных в контрольной группе, группе с малой дозой и группе с высокой дозой составляло 41, 34 и 18, соответственно; на седьмой день число животных в контрольной группе, группе с малой дозой и группе с высокой дозой составляло 51, 15 и 10, соответственно). Исследователи, не информированные о воздействии, изучали повреждения на третий и седьмой дни с помощью способа флуоресцеиновой флуоресцентной ангиографии глазного дна, описанного в других источниках.
Измерение величины CNV по плоскому препарату сосудистой оболочки глаза
Мыши, общим числом 36, были использованы для анализа плоских препаратов сосудистой оболочки глаза (число мышей в каждой группе на третий и седьмой дни составило 4 и 8, соответственно). Через три дня и семь дней после лазерной обработки величину повреждения CNV оценивали, используя плоские препараты сосудистой оболочки глаза, как описано ранее. Мышь анестезировали и перфузировали 1 мл физиологического раствора, содержащего фосфатный буфер (PBS), содержащего 50 мг/мл декстрана, конъюгированного с флуоресцеин-изотиоцианатом (FITC) (4,4 кДа, 50 мг/кг веса тела; фирма Sigma). Затем выделяли глаза и удаляли роговицу и хрусталик, а всю сетчатку осторожно отсекали от глазного бокала. Выполняли радиальные разрезы от краев экватора, и глазной бокал распластывали на покровном стекле склерой вниз. Плоские препараты рассматривали во флуоресцентном микроскопе (Olympus DPSO), а изображения фиксировали с помощью видеокамеры с зарядовой связью (CCD). Данные вводили в компьютер с помощью системы программного обеспечения (Studio lite). Контур области CNV обозначали с помощью компьютерной мыши, а измерения выполняли с помощью общедоступной программы обработки изображений Национальных институтов здравоохранения США. Для статистического анализа размер повреждений усредняли с получением одного значения для каждого животного. Данные представлены как среднее ± стандартная ошибка.
Статистический анализ
Значения, полученные с помощью флуоресцеиновой флуоресцентной ангиографии глазного дна, оценивали с помощью U-теста Манна-Уитни. Величину повреждений CNV оценивали с помощью дисперсионного анализа (ANOVA), после чего выполняли апостериорный тест Даннета. Значения [вероятности] P<0,05 рассматривали как статистически достоверные для всех форм произведенных статистических исследований.
Этические соображения
Несмотря на то, что авторы данного изобретения прикладывали усилия для уменьшения дискомфорта, испытываемого мышами, в соответствии с Руководством по экспериментальным операциям на животных Университета Токио, так как адъювант Фрейнда применяли для усиления иммунной реакции, уровень страданий относился к категории C по классификации Центра научных работников по охране животных.
Результаты
Эффект на утечку из CNV
На третий день различий в утечке флуоресцеина между контрольной группой, группой, получившей малую дозу, и группой, получившей большую дозу, не наблюдалось. Утечка флуоресцеина из повреждений CNV у группы, которой не вводили вакцину, увеличивалась на седьмой день по сравнению с третьим днем. Утечка флуоресцеина из повреждений CNV была меньше у группы, получившей большую дозу, чем в контроле (фиг.1 и 2). Хотя это и не было статистически достоверно, но утечка из повреждений CNV была ниже у животных из группы, получившей малую дозу, чем у животных из контрольной группы.
Эффект на величину повреждения CNV
Никаких различий в величине повреждения CNV на третий день между контрольной группой, группой, получившей малую дозу, и группой, получившей большую дозу, не наблюдалось. Средняя величина повреждения CNV в группе, которой не вводили вакцину, была выше на седьмой день, чем на третий день. Величина повреждений CNV существенно снижена в группе, получившей малую дозу, и в группе, получившей большую дозу, по сравнению с контрольной группой (фиг.3 и 4).
Авторы данного изобретения показали, что пептид VIAMFFWLL(9) (SEQ ID NO: 2) подавляет активацию VEGF и ингибирует рост CNV. Известно, что VIAMFFWLL (SEQ ID NO: 2) регулирует иммунные ответы. Поскольку активация CNV опосредована через процесс воспаления, а ингибиторный эффект VIAMFFWLL (SEQ ID NO: 2) на рост CNV in vivo наблюдался только на седьмой день, а не на третий день, вероятно, что VIAMFFWLL (SEQ ID NO: 2) воздействует на иммунные ответы, такие как инфильтрация лейкоцитов, регулируя, таким образом, процесс неоваскуляризации, а не ингибирование CNV через ингибирование самой неоваскуляризации.
Промышленная применимость
Данное изобретение предоставляет фармацевтические средства (вакцины) для лечения и/или профилактики заболеваний, вызванных неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия).
Общепринятые лазерная терапия, фотодинамическая терапия, оперативное лечение, лекарственная терапия и им подобное были разработаны как способы лечения заболеваний, вызванных неоваскуляризацией сосудистой оболочки глаза (неоваскулярная макулопатия). Однако лазерная терапия может вызывать снижение зрения в центральном звене. Существуют примеры быстрого ухудшения зрения после фотодинамической терапии в случаях исходно хорошего зрения. При оперативном лечении существует риск послеоперационных осложнений, связанных с хирургическим вмешательством. При лекарственной терапии существует риск серьезных осложнений, таких как эндофтальмит и отслойка сетчатки вследствие внутриглазной инъекции. То есть, общепринятые терапии обладают высоким риском снижения зрения вследствие побочных эффектов и осложнений, связанных с лечением. Поэтому было трудно лечить случаи ранних стадий развития заболевания при сравнительно хорошем зрении.
С другой стороны, как минимум, фармацевтические средства (вакцины) по данному изобретению не вызывают локальных осложнений в глазу, таким образом, вышеупомянутые риски, вероятно, будут отсутствовать. Поэтому возможно лечение случаев ранних стадий развития заболевания при сравнительно хорошем зрении. Кроме того, поскольку поражение сетчатки невелико в случаях ранних стадий развития заболевания при сравнительно хорошем зрении, прогноз по зрению после лечения в запущенных случаях ожидается значительно более благоприятным, чем при общепринятом лечении.
Известно, что при заболеваниях по данному изобретению существует высокая встречаемость развития сходных новообразованных сосудов в контрлатеральном глазу. Однако устоявшегося способа профилактики формирования новообразованных сосудов в контрлатеральном глазу не существует. Можно ожидать, что вакцинная терапия по данному изобретению будет эффективна в превентивном лечении контрлатерального глаза.