Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ FGF21 И ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к производным аналогов FGF21, более конкретно к аналогам FGF21, имеющим боковую цепь в положении 167, 169, 170, 171, 172, 173, 174, 175, 180 или 181, и их фармацевтическому применению.
Включение перечня последовательностей путем ссылки
Перечень последовательностей, озаглавленный «Перечень последовательностей» занимающий 33 кб, был создан 21 декабря 2015 и включен в данное описание путем ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
FGF21 является представителем подсемейства FGF19 атипичных факторов роста фибробластов (FGF), обладающих скорее метаболическим, чем миогенным эффектом. FGF21 связывается и активирует рецепторы FGF (FGFR1c, FGFR2c и FGFR3c), но только в присутствии не являющихся сигнальными корецепторов бета-клото (BKL). Тканеспецифическая экспрессия BKL определяет метаболическую активность FGF21. Мыши, трансгенные по FGF21, являются резистентными к ожирению, индуцируемому диетой, и имеют большую продолжительность жизни. FGF21 является метаболическим регулятором энергетических затрат, метаболизма глюкозы и липидов и обладает большим потенциалом для устранения избыточной массы тела, гипергликемии и дислипидемии у пациентов с ожирением, страдающих диабетом и дислипидемией.
FGF21 нестабилен in vivo вследствие протеолиза, и практически половина эндогенного циркулирующего FGF21 человека является неактивной. Потеря активности происходит вследствие деградации С-конца, у большинства таких метаболитов терминальным является Р171, а не S181. Таким образом, требуется защита используемых в терапевтических целях молекул FGF21 от расщепления С-концевой области в ходе метаболизма. Инженерия С-концевой области может защищать от деградации, однако до настоящего времени в результате таких генно-инженерных манипуляций происходило снижение или потеря активности соединения FGF21, полученного при помощи генной инженерии. N-концевая область FGF21 связывается с FGFR, тогда как С-концевая область FGF21 связывается с BKL. Отсечение С-концевых аминокислот приводит к существенной потере активности.
Пегилирование в положении 180 [180C]FGF21 приводит к значительному снижению активности in vitro (J. Xu et al., Bioconjugate Chemistry (2013), 24, 915-925). Слитый с Fc белок, полученный в результате присоединения Fc к С-концу FGF21, обладает гораздо более низкой активностью по сравнению с нативным FGF21 и с FGF21, слитым N-концом с Fc (Hecht et al., PLoS One 2012, 7(11), e49345).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к производным FGF21, имеющим боковую цепь в положении, соответствующем одному из положений 167, 169, 170, 171, 172, 173, 174, 175, 180 или 181, если сравнивать со зрелым FGF21 человека (SEQ ID NO: 1). Данное изобретение относится к производным FGF21, имеющим боковую цепь в положении, соответствующем одному из положений 180 или 181, если сравнивать со зрелым FGF21 человека (SEQ ID NO: 1). Более конкретно, боковая цепь ковалентно присоединена в положении аналога FGF21, которое соответствует положению 180 зрелого FGF21 человека (SEQ ID NO: 1) или ковалентно присоединена к положению аналога FGF21, которое соответствует положению 181 зрелого FGF21 человека (SEQ ID NO: 1).
Более конкретно, боковая цепь ковалентно присоединена в положении аналога FGF21, которое соответствует положению 170, 174 или 175 зрелого FGF21 человека (SEQ ID NO: 1), или ковалентно присоединена в положении аналога FGF21, которое соответствует положению 167, 171, 172 или 173 зрелого FGF21 человека (SEQ ID NO: 1).
В положении аналога FGF21, к которому присоединена боковая цепь, находится цистеин. Боковая цепь ковалентно присоединена к атому серы остатка цистеина, к которому присоединена боковая цепь. Боковая цепь содержит линкер и протрактор. Протрактор может представлять собой двухосновную жирную кислоту.
Линкер может содержать несколько линкерных элементов, таких как один или несколько остатков gGlu и/или один или несколько остатков Ado (Ado представляет собой 8-амино-3,6-диоксаоктановую кислоту), и/или один или несколько других бирадикалов, включающих *-NH группу и *-СО группу. Протрактор и линкер связаны посредством амидной связи. Линкер присоединен к атому серы 180Cys или 181Cys белка FGF21 посредством тиоэфирной связи.
Линкер может содержать несколько линкерных элементов, таких как один или несколько остатков gGlu и/или один или несколько остатков Ado (Ado представляет собой 8-амино-3,6-диоксаоктановую кислоту), и/или один или несколько элементов Trx (Trx представляет собой транексамовую кислоту) и/или один или несколько *-NH-S(=O)2-(CH2)3-CO-* и/или один или несколько других бирадикалов, включающих *-NH группу и *-СО группу. Протрактор и линкер соединены посредством амидной связи, тогда как линкер присоединен к белку FGF21 посредством тиоэфирной связи с атомом серы цистеина в положении 167, 169, 170, 171, 172, 173, 174, 175, 180 или 181.
Белок FGF21 в составе производного FGF21 по изобретению представляет собой аналог зрелого FGF21 человека (SEQ ID NO: 1), аналог, который содержит остаток цистеина в одном из положений, соответствующих положению 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1).
Аналог FGF21 производного по изобретению может иметь в сумме до 30 аминокислотных замен по сравнению со зрелым FGF21 человека (SEQ ID NO: 1), из которых остаток цистеина в одном из положений 180 или 181 считают одной аминокислотной заменой. Самое большее 29 дополнительных замен могут независимо представлять собой одно или несколько достраиваний аминокислот, одну или несколько вставок, одну или несколько делеций и/или одну или несколько замен.
В частности, в первом аспекте изобретение относится к производному белка FGF21, где указанный белок содержит остаток Cys в положении, соответствующем положению 167, 169, 170, 171, 172, 173, 174, 175, 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1), где указанное производное содержит протрактор, присоединенный к указанному остатку Cys посредством линкера; где протрактор выбран из группы
Соед. 1А: НООС-(СН2)х-СО-*,
Соед. 1В: НООС-бензол-O-(СН2)х-СО-*
Соед. 1С: HO-S(=O)2-(CH2)x-CO-*
где х является целым числом в диапазоне от 8 до 18, и где линкер содержит по меньшей мере одно из каждого из Соед. 2, Соед. 3 и Соед. 4;
где Соед. 2 выбрано из:
Соед. 2А: *-NH-CH(COOH)-(CH2)2-CO-*,
Соед. 2В: *-NH-S(=O)2-(CH2)3-CO-* и
Соед. 2С: *-NH-СН2-циклогексан-СО-*,
где Соед. 3 представляет собой *-NH-(CH2)2-[O-(CH2)2]k-O-[CH2]n-CO-*, где k является целым числом в диапазоне от 1 до 5, n является целым числом в диапазоне от 1 до 5, и
где Соед. 4 выбрано из:
*-NH-(CH2)m-NH-CO-CH2-* и
*-NH-CH(COOH)-(CH2)m-NH-CO-CH2-*
где m является целым числом в диапазоне от 1 до 5 и
где Соед. 2, Соед. 3 и Соед. 4 связаны между собой амидными связями в указанной последовательности, присоединены *-NH концом к СО-* концу протрактора, и своим СН2-* концом к атому серы остатка Cys в положении, соответствующем положению 167, 169, 170, 171, 172, 173, 174, 175, 180 или 181 зрелого FGF21 человека (SEQ ID NO: 1), или его фармацевтически приемлемым соли, амиду или эфиру.
Более конкретно, в первом аспекте изобретение относится к производному белка FGF21, где указанный белок содержит остаток Cys в положении, соответствующем положению 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1), и, самое большее, 30 аминокислотных модификаций при сравнении со зрелым FGF21 человека (SEQ ID NO: 1); где указанное производное содержит протрактор, присоединенный к указанному остатку Cys посредством линкера; где протрактор представляет собой Соед. 1: НООС-(СН2)х-СО-*, где х является целым числом в диапазоне от 10 до 18, и где линкер содержит по меньшей мере одно из каждого из Соед. 2, Соед. 3 и Соед. 4:
Соед. 2: *-NH-CH(COOH)-(CH2)2-CO-*,
Соед. 3: *-NH-(CH2)2-[O-(CH2)2]k-O-[CH2]n-CO-*, и
Соед. 4: *-NH-(CH2)m-NH-CO-CH2-*,
где k является целым числом в диапазоне от 1 до 5, n является целым числом в диапазоне от 1 до 5, и m является целым числом в диапазоне от 1 до 5. Соед. 2, Соед. 3 и Соед. 4 связаны между собой амидными связями в указанной последовательности, присоединены *-NH концом к СО-* концу протрактора, и своим СН2-* концом к атому серы остатка Cys в положении, соответствующем положению 180 или 181 зрелого FGF21 человека (SEQ ID NO: 1).
Предпочтительные производные FGF21 по изобретению, обозначенные Соединениями 13-24, изложены в Экспериментальной части.
Другие предпочтительные производные FGF21 по изобретению, обозначенные Соединениями 13-18, изложены в Экспериментальной части.
Другие предпочтительные производные FGF21 по изобретению, обозначенные Соединениями 35-41, изложены в Экспериментальной части.
Другие предпочтительные производные FGF21 по изобретению, обозначенные Соединениями 43-56, изложены в Экспериментальной части.
В следующем аспекте изобретение относится к аналогу FGF21, содержащему остаток Cys в положении, соответствующем положению 167, 169, 170, 171, 172, 173, 174, 175, 180 или 181 зрелого FGF21 человека (SEQ ID NO: 1). Аналоги предпочтительно имеют высокую степень идентичности с FGF21 человека (SEQ ID NO: 1). Степень идентичности можно описать количеством аминокислотных замен или модификаций в сравнении с FGF21 человека (SEQ ID NO: 1).
В следующем аспекте изобретение относится к аналогу FGF21, содержащему остаток Cys в положении, соответствующем положению 180 или 181 зрелого FGF21 человека (SEQ ID NO: 1), и, самое большее, 30 аминокислотных модификаций в сравнении со зрелым FGF21 человека (SEQ ID NO: 1).
В третьем аспекте изобретение относится к фармацевтическому применению производных и аналогов FGF21 по изобретению, например, к применению в лечении и/или профилактике всех форм диабета и связанных с ним заболеваний, таких как нарушения пищевого поведения, сердечно-сосудистые заболевания, осложнения диабета; и/или для улучшения показателей липидного обмена, улучшения функции β-клеток; и/или для отсрочивания или предупреждения прогрессирования заболевания диабета; и/или для лечения и/или профилактики стеатоза печени и неалкогольной жировой болезни печени (НАЖБП).
Производные FGF21 по изобретению являются биологически активными. Например, они обладают высокой активностью и, дополнительно или альтернативно, могут хорошо связываться с рецепторами FGF. Дополнительно или альтернативно, они обладают пролонгированным фармакокинетическим профилем. Например, они обладают очень большим периодом полувыведения в конечной фазе при внутривенном введении мышам и/или карликовым свинкам. Данное сочетание высокой активности с большим периодом полувыведения может быть очень востребованным.
Любопытно, что все производные FGF21, содержащие боковую цепь в положении, соответствующем одному из положений 167, 169, 170, 171, 172, 173, 174, 175, 180 или 181, если сравнивать со зрелым FGF21 человека, сохраняют активность.
Дополнительно или альтернативно, замечено, что производные FGF21, содержащие боковую цепь в положении, соответствующем одному из положений 180 или 181, и особенно в положении 180 зрелого FGF21, сохраняют высокую активность.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В дальнейшем буквы греческого алфавита могут быть представлены своим символом или соответствующим написанием, например: α=альфа; β=бета; ε=эпсилон; γ=гамма; ω=омега и т.д. Кроме того, греческая буква μ может обозначаться "u", например, к μI=uI, или в μМ=uM.
Звездочка (*) в химической формуле обозначает место присоединения.
Изобретение относится в первом аспекте к производному белка FGF21, где указанный белок содержит остаток Cys в положении, соответствующем положению 167, 169, 170, 171, 172, 173, 174, 175, 180 или положению 181 зрелого FGF21 (SEQ ID NO: 1), где указанное производное содержит протрактор, присоединенный к указанному остатку Cys посредством линкера; где протрактор выбран из группы
Соед. 1А: НООС-(СН2)х-СО-*,
Соед. 1В: НООС-бензол-O-(СН2)х-СО-*
Соед. 1С: HO-S(=O)2-(CH2)x-CO-*
где х является целым числом в диапазоне от 8 до 18, и где линкер содержит по меньшей мере одно из каждого из Соед. 2, Соед. 3 и Соед. 4;
где Соед. 2 выбрано из:
*-NH-CH(COOH)-(CH2)m-CO-*,
*-NH-S(=O)2-(CH2)m-CO-* и
*-NH-(СН2)m-циклогексан-СО-*,
где m отдельно выбрано в виде целого числа в диапазоне от 1 до 5,
где Соед. 3 представляет собой *-NH-(CH2)2-[O-(CH2)2]k-O-[CH2]n-CO-*, где k является целым числом в диапазоне от 1 до 5, n является целым числом в диапазоне от 1 до 5, и
где Соед. 4 выбрано из:
*-NH-(CH2)m-NH-CO-CH2-* и
*-NH-CH(COOH)-(CH2)m-NH-CO-CH2-*
где m является целым числом в диапазоне от 1 до 5.
В следующих воплощениях Соед. 2 выбрано из:
*-NH-CH(COOH)-(CH2)2-CO-*,
*-NH-S(=O)2-(CH2)3-CO-* и
*-NH-СН2-циклогексан-СО-*.
В следующем воплощении Соед. 2 представляет собой *-NH-CH(COOH)-(СН2)2-СО-*.
В следующем воплощении Соед. 2 представляет собой *-NH-S(=O)2-(CH2)3-СО-*.
В следующем воплощении Соед. 2 представляет собой *-NH-CH2-циклогексан-СО-*.
Как упоминалось выше, производное включает по меньшей мере одно из каждого из Соед. 2, Соед. 3 и Соед. 4, связанных между собой амидными связями. Кроме того, элементы линкера связаны в указанной последовательности. Соед. 2 присоединено своим *-NH концом к СО-* концу протрактора, а Соед. 4 своим СН2-* концом присоединено к атому серы остатка Cys в положении, соответствующем положению 167, 169, 170, 171, 172, 173, 174, 175, 180 или 181 зрелого FGF21 человека (SEQ ID NO: 1) или его фармацевтически приемлемой соли, амида или эфира.
В следующем аспекте изобретение относится к производному белка FGF21, где указанный белок содержит остаток Cys в положении, соответствующем положению 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1), и, самое большее, 30 аминокислотных модификаций по сравнению со зрелым FGF21 человека (SEQ ID NO: 1); где указанное производное содержит протрактор, присоединенный к указанному остатку Cys посредством линкера; где протрактор представляет собой Соед. 1: НООС-(СН2)х-СО-*, где х является целым числом в диапазоне от 10 до 18 и где линкер содержит по меньшей мере одно из каждого из Соед. 2, Соед. 3 и Соед. 4:
Соед. 2: *-NH-CH(COOH)-(CH2)2-CO-*,
Соед. 3: *-NH-(CH2)2-[O-(CH2)2]k-O-[CH2]n-CO-*, и
Соед. 4: *-NH-(CH2)m-NH-CO-CH2-*,
где k является целым числом в диапазоне от 1 до 5, n является целым числом в диапазоне от 1 до 5, и m является целым числом в диапазоне от 1 до 5. Соед. 2, Соед. 3 и Соед. 4 связаны между собой амидными связями в указанной последовательности, присоединены своим *-NH концом к СО-* концу протрактора, и своим СН2-* концом к тиоловой группе остатка Cys в положении, соответствующем положению 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1).
Белки и аналоги FGF21
В природе нативный белок FGF21 синтезируется с сигнальным пептидом из 28 аминокислот, обеспечивающим секрецию. Зрелый полипептид FGF21, состоящий из оставшейся 181 аминокислоты, включен в перечень последовательностей как SEQ ID NO: 1.
Белок FGF21 производного по изобретению может здесь и далее обозначаться «остовом» или «белковым остовом» производного или «аналогом FGF21».
Термин «белок FGF21» в данном описании относится к аналогу или варианту человеческого FGF21 (FGF21(1-181)), последовательность которого включена в перечень последовательностей как SEQ ID NO: 1. Белок, имеющий последовательность SEQ ID NO: 1, может также обозначаться «нативным» FGF21, «зрелым» FGF21 и/или «зрелым человеческим FGF21».
В перечне последовательностей первой аминокислоте зрелого FGF21 человека с последовательностью SEQ ID NO: 1 (гистидин) присваивается номер 1.
Примером аналога FGF21 является белок с последовательностью SEQ ID NO: 1, имеющий N-концевой метионин, также обозначаемый MetFGF21 (SEQ ID NO: 2). N-концевой Met добавляется, когда зрелый FGF21 экспрессируют в Е. coli, см., например, WO 2006/050247, Таблица 6. Дополнительному N-концевому аминокислотному остатку, предшествующему гистидину, находящемуся в положении 1 зрелого FGF21 человека (SEQ ID NO: 1), присваивают положение -1. Неисчерпывающими примерами подходящих обозначений MetFGF21 с последовательностью SEQ ID NO: 2 являются MetFGF21, [Met]FGF21 или [-1M]FGF21.
MetFGF21 демонстрирует биологическую активность, сопоставимую со зрелым FGF21 человека с последовательностью SEQ ID NO: 1, и в практических целях часто используется в качестве референтного соединения вместо зрелого FGF21 человека с последовательностью SEQ ID NO: 1. Аминокислотная последовательность MetFGF21 включена в перечень последовательностей как SEQ ID NO: 2.
В данном описании белки FGF21 по изобретению можно охарактеризовать путем указания i) номера аминокислотного остатка зрелого FGF21(1-181) человека, соответствующего замененному аминокислотному остатку (т.е. соответствующего положения в зрелом FGF21) и ii) фактической замены.
Один аспект изобретения относится к белку FGF21 (аналогу FGF21), содержащему аминокислотную замену, где аминокислотный остаток дикого типа замещен остатком цистеина. В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 167, 169, 170, 171, 172, 173, 174, 175, 180 и 181 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 167, 169, 170, 171, 172, 173, 174 и 175 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 167, 170, 171, 172, 173, 174, 175 и 180 FGF21 (1-181) (SEQ ID NO: 1).
В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 169, 170, 173, 174, 175, 180 и 181 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 170, 173, 174, 175 и 180 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 170, 173, 174, 175, 180 и 181 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 170, 173, 174, 175 и 180 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 170, 173, 174 и 175 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 170, 173, 174, 180 и 181 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 170, 173, 174 и 180 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 170, 173 и 174 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 180 и 181 FGF21 (1-181) (SEQ ID NO: 1).
Например, белок FGF21 по изобретению характеризуется тем, что содержит остаток Cys либо в положении, соответствующем положению 180 FGF21(1-181) (SEQ ID NO: 1), либо в положении, соответствующем положению 181 FGF21(1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем положению 180 или 181 FGF21 (1-181) (SEQ ID NO: 1). В одном воплощении белок FGF21 содержит остаток Cys в положении, соответствующем положению 180 FGF21 (1-181) (SEQ ID NO: 1).
Указанные остатки Cys белка FGF21 по изобретению могут обозначаться Cys180 и Cys181, соответственно. Например, белок FGF21 по изобретению, имеющий остаток Cys в положении, соответствующем положению 181 зрелого FGF21 человека (SEQ ID NO: 1), может обозначаться Cys181 FGF21 и/или 181С FGF21, в альтернативном варианте [Cys181]FGF21 и/или [181C]FGF21.
Ниже приведен не являющийся исчерпывающим пример подходящего обозначения аналога.
Ala[Gln121,Leu168,Cys180]FGF21 обозначает аналог зрелого FGF21 человека, где к N-концу добавлен аланин (т.е. Ala находится в положении, соответствующем положению -1 зрелого FGF21 человека (SEQ ID NO: 1)), естественный аспарагин в положении 121 замещен на глутамин, естественный метионин в положении 168 замещен на лейцин и естественный аланин в положении 180 замещен на цистеин.
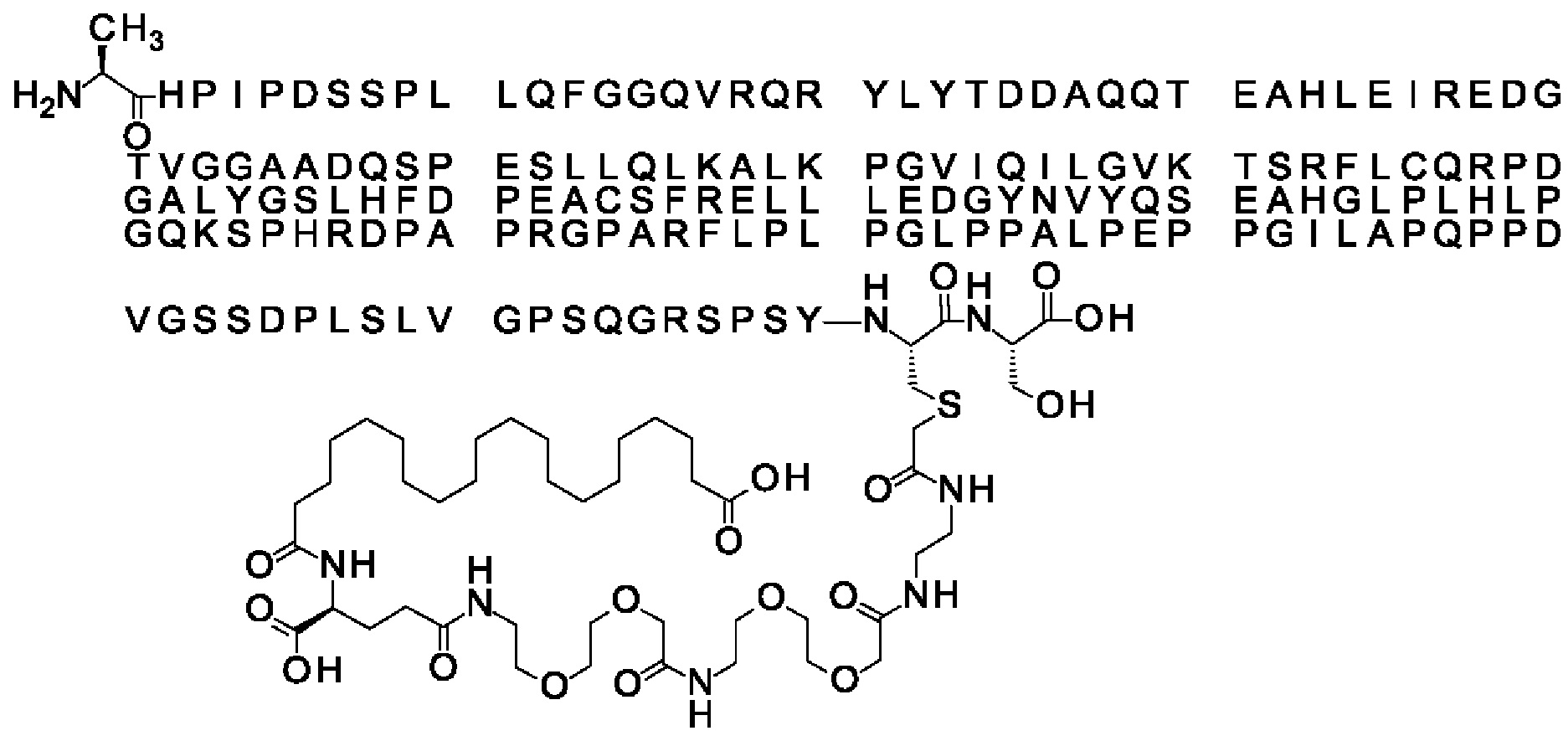
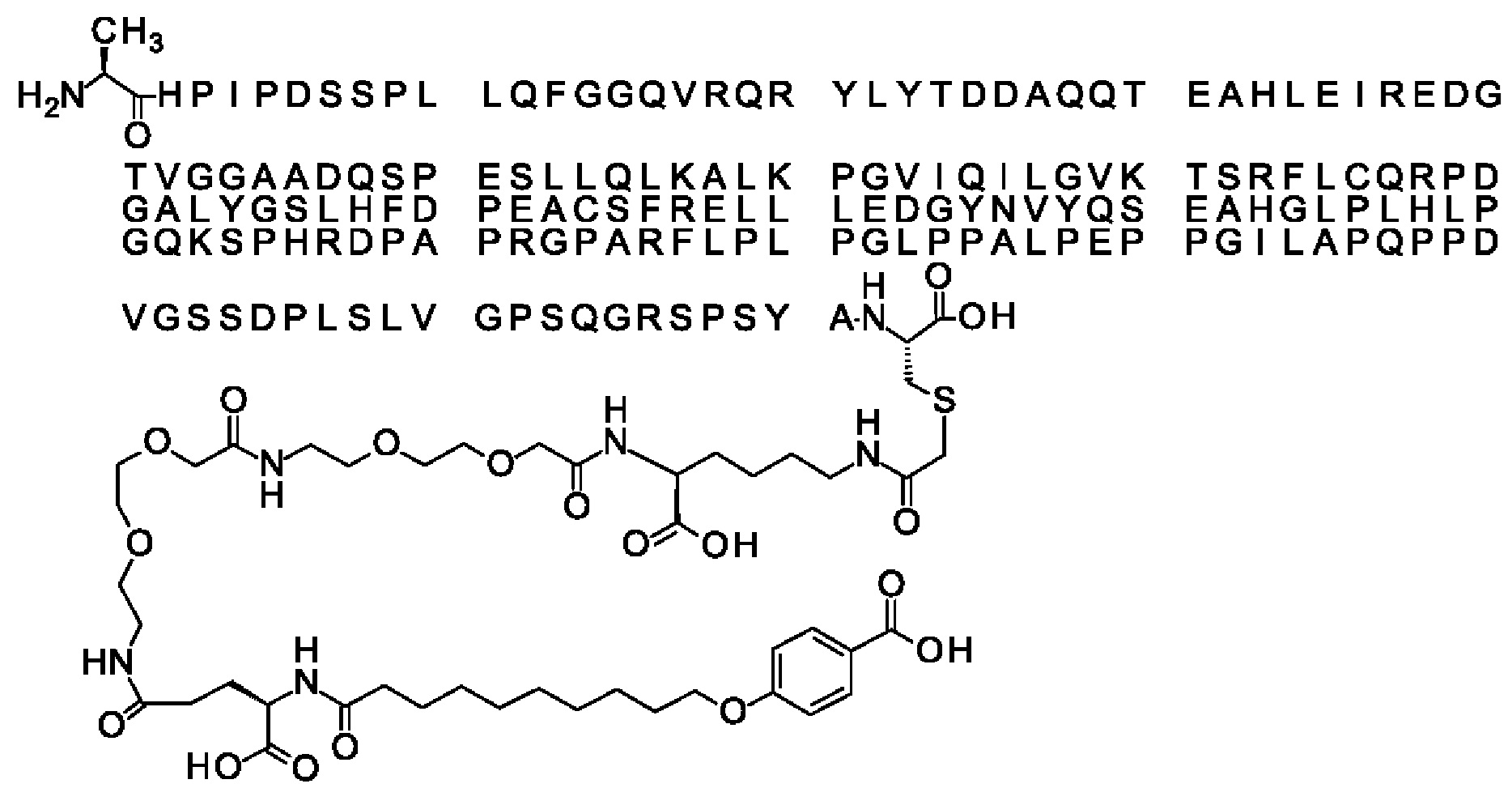
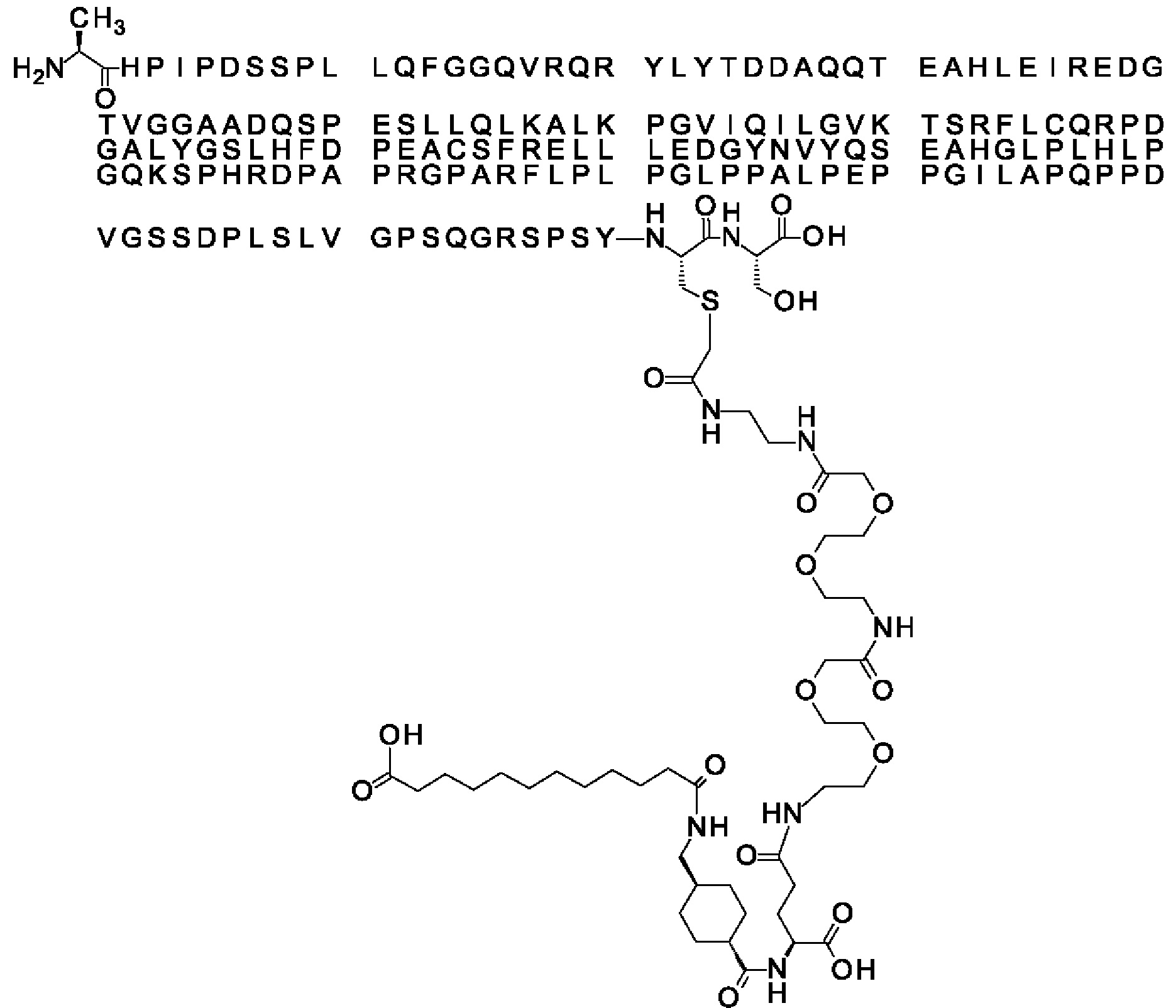
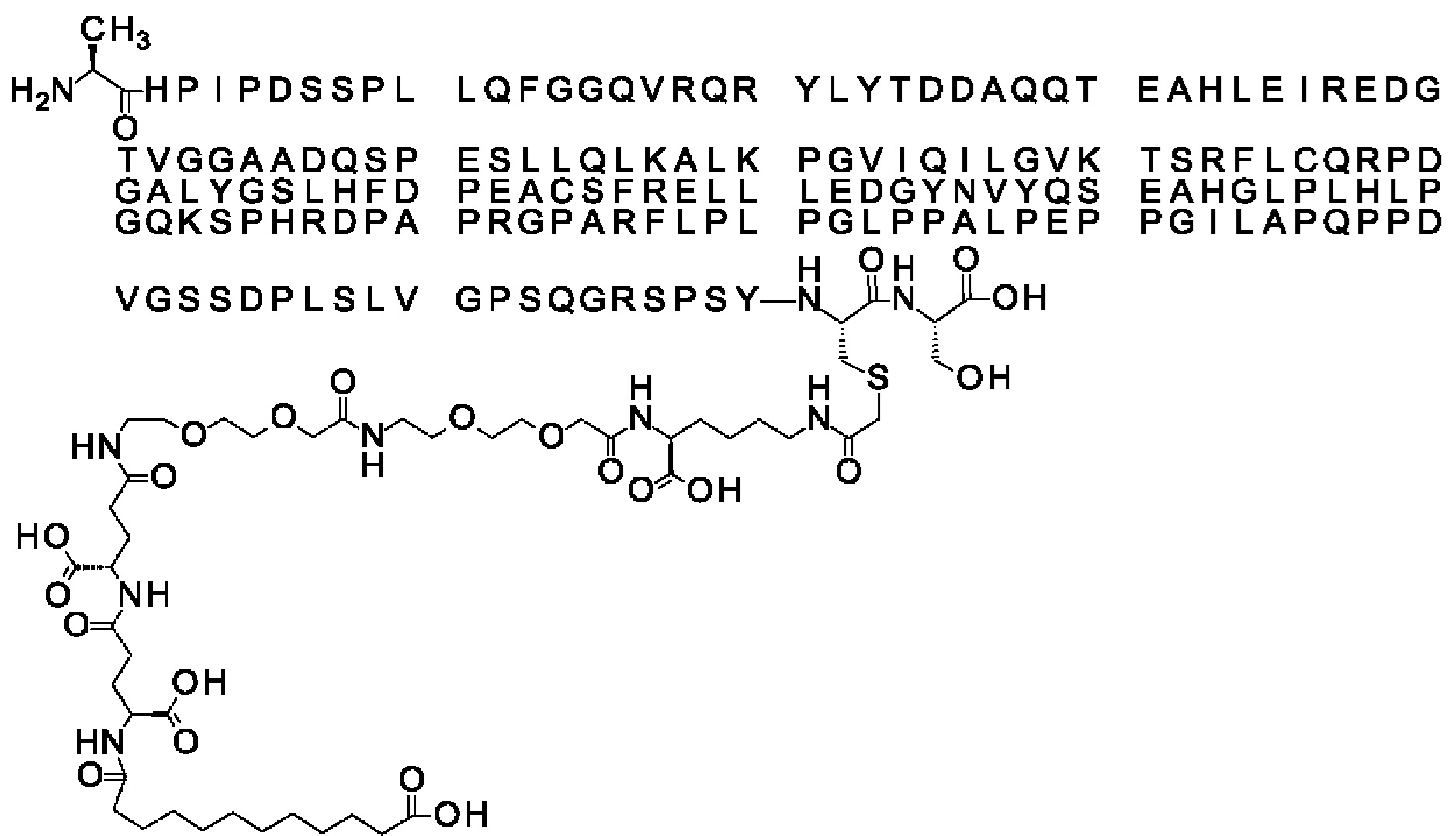
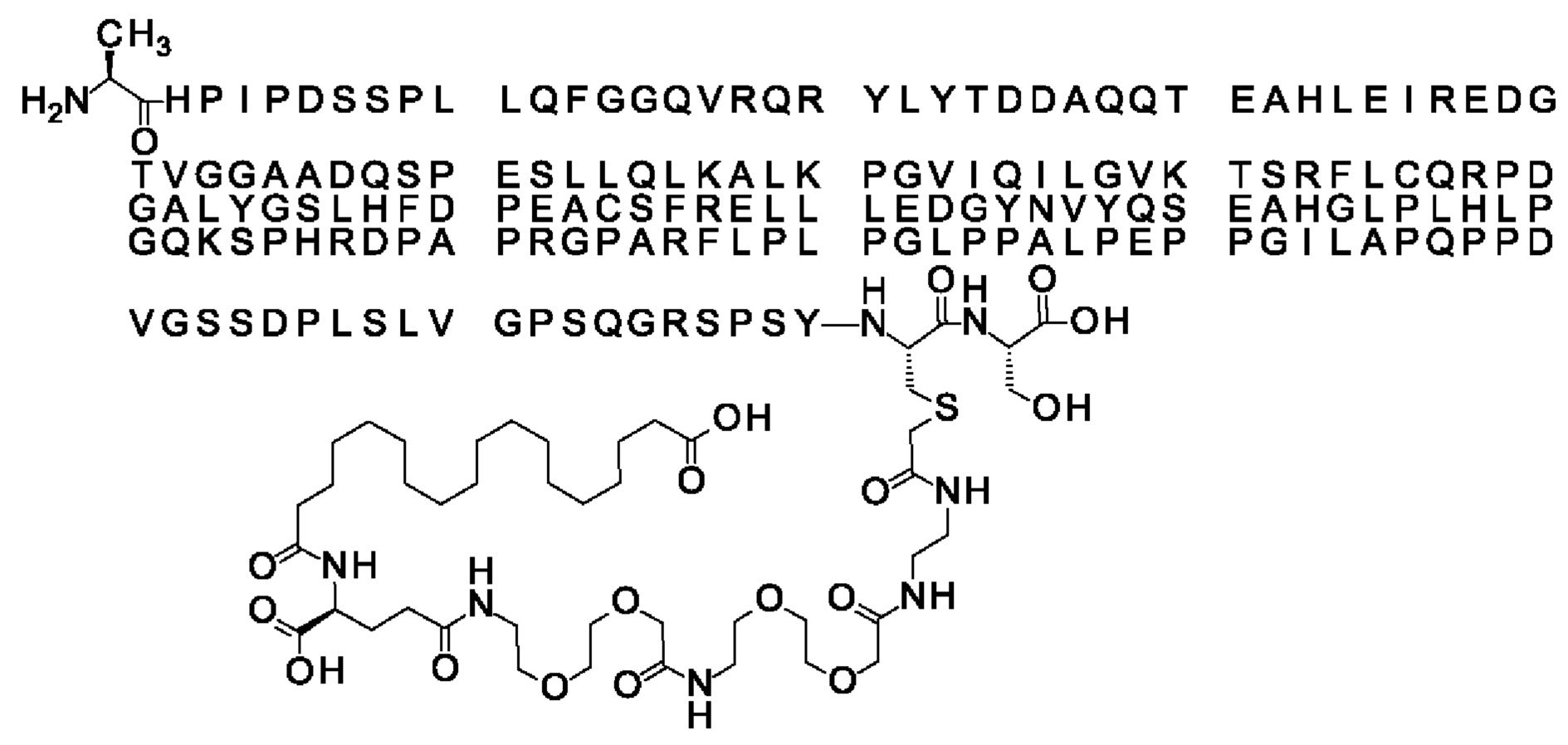
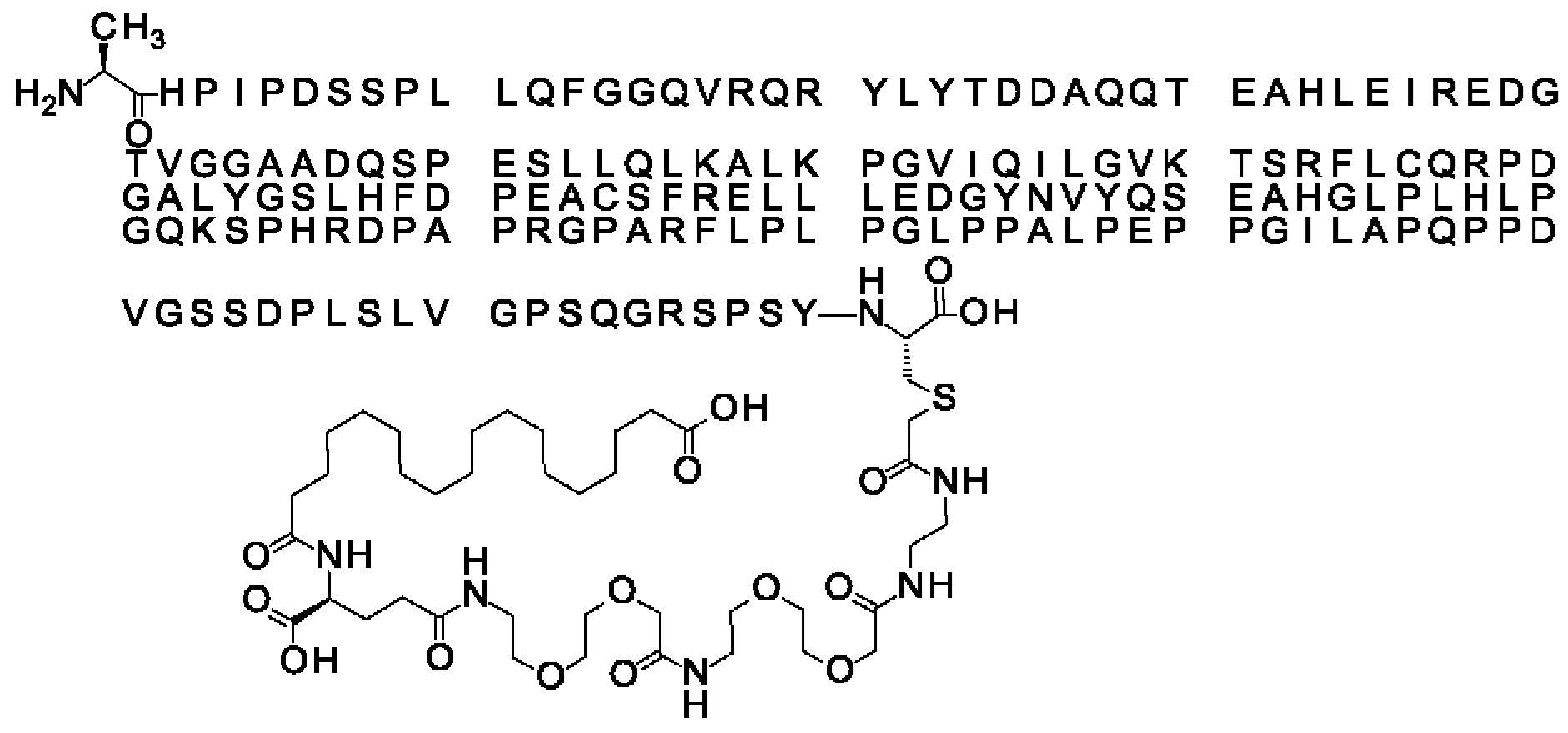
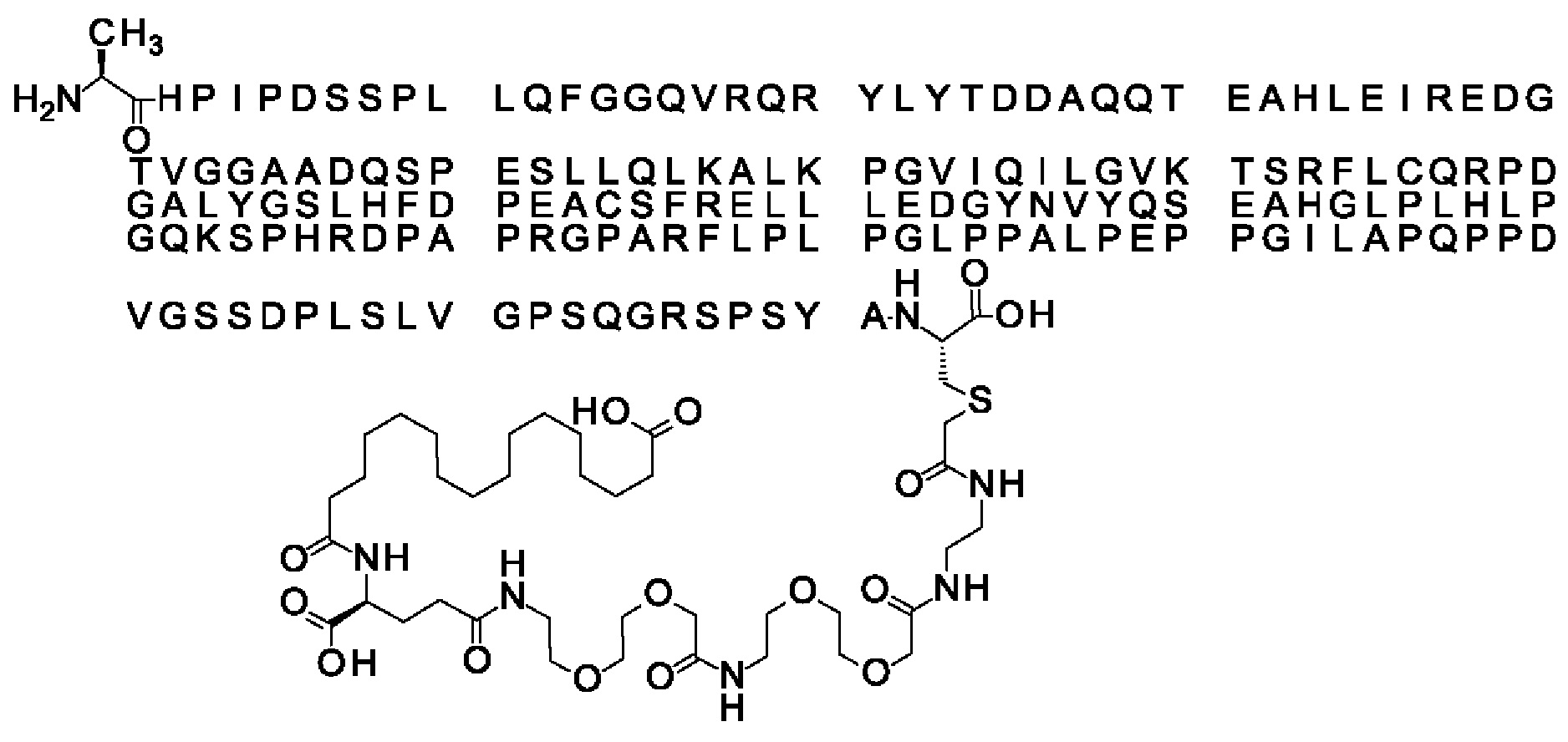
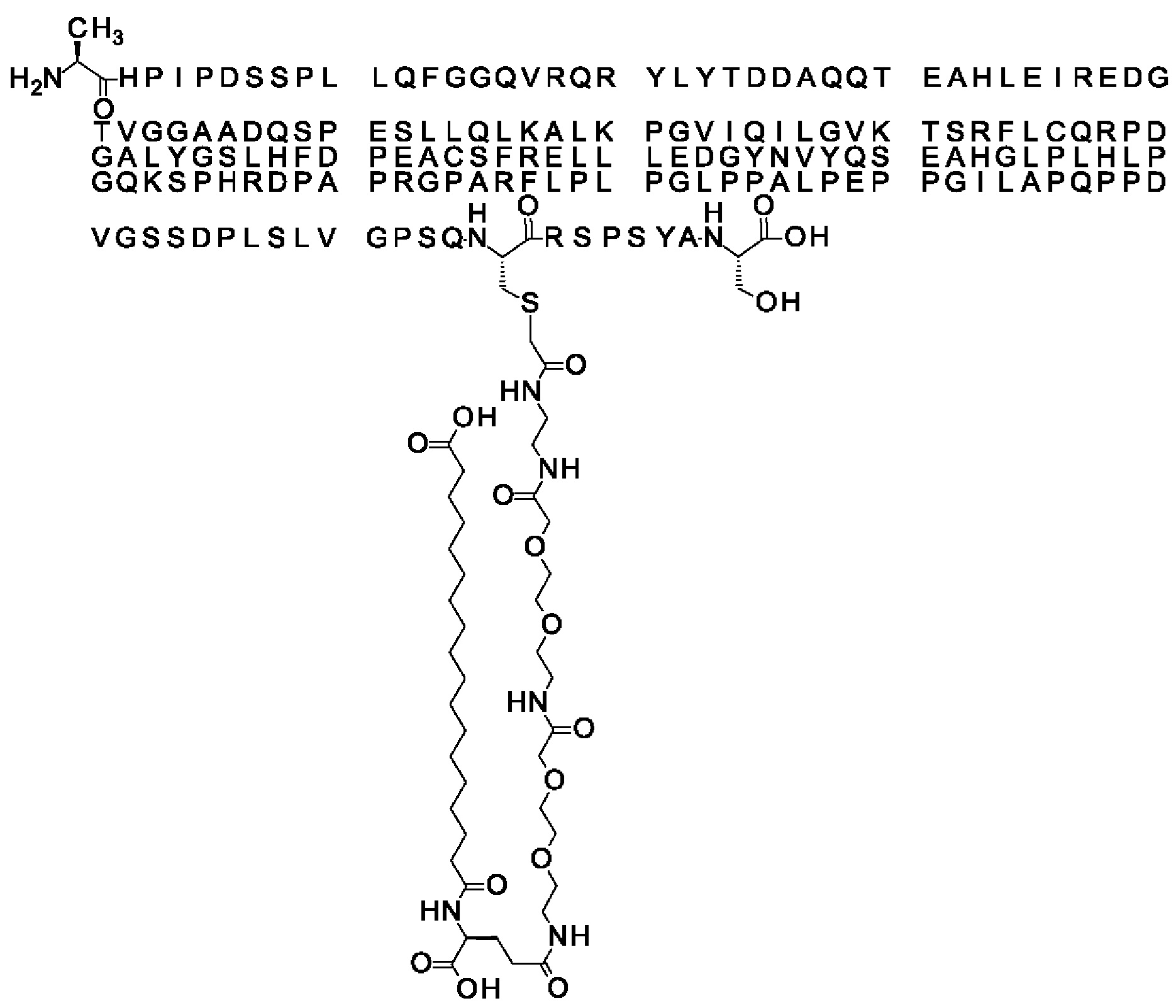
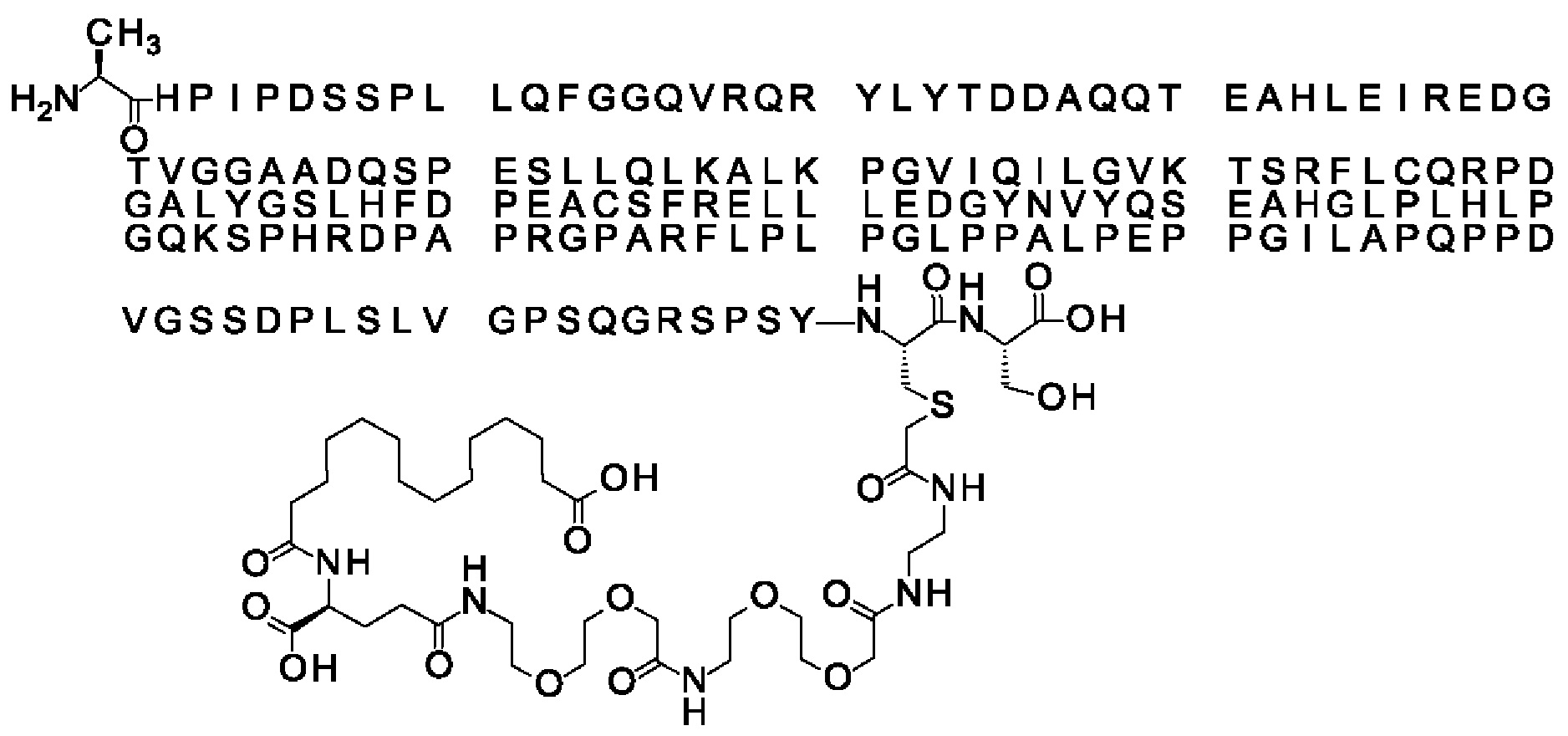
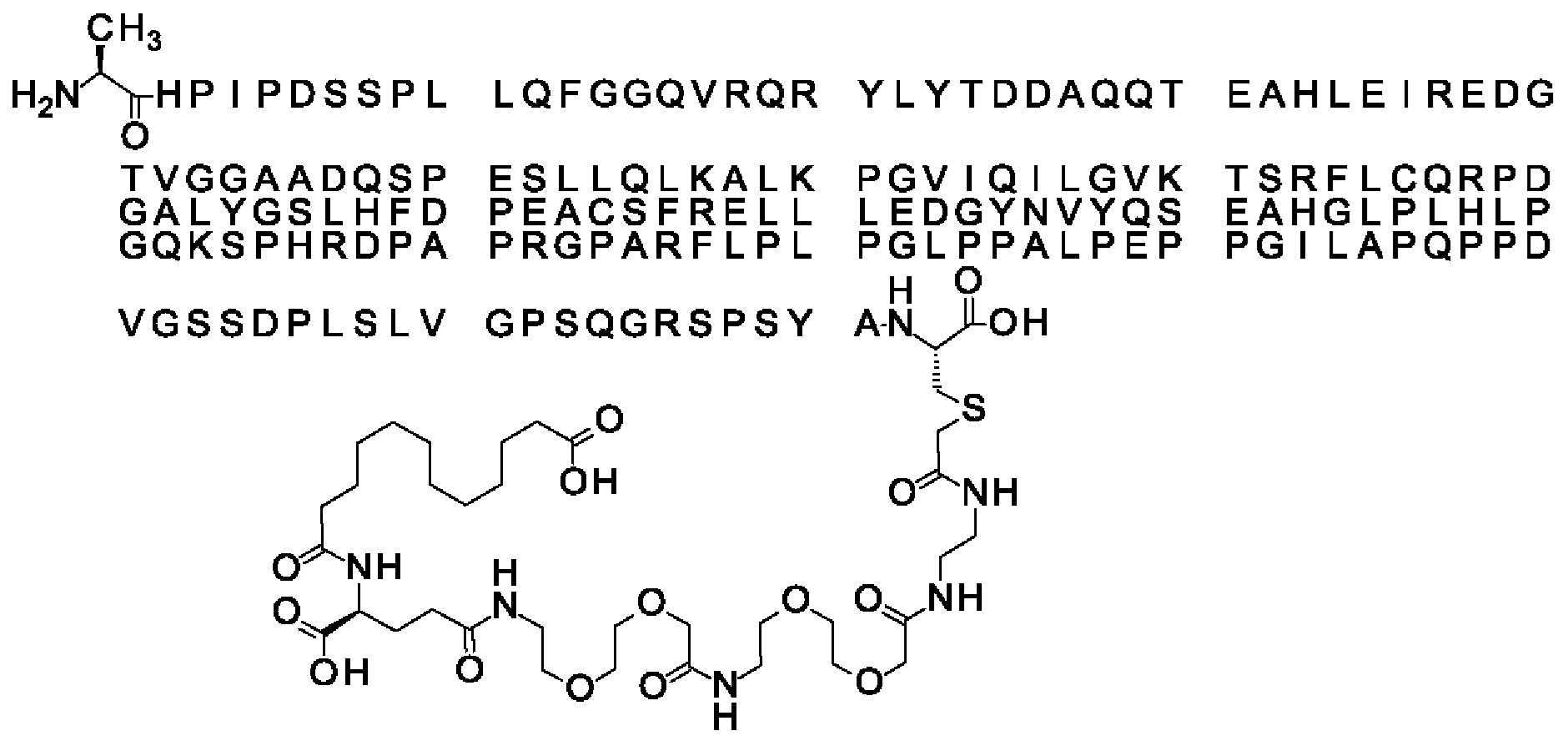
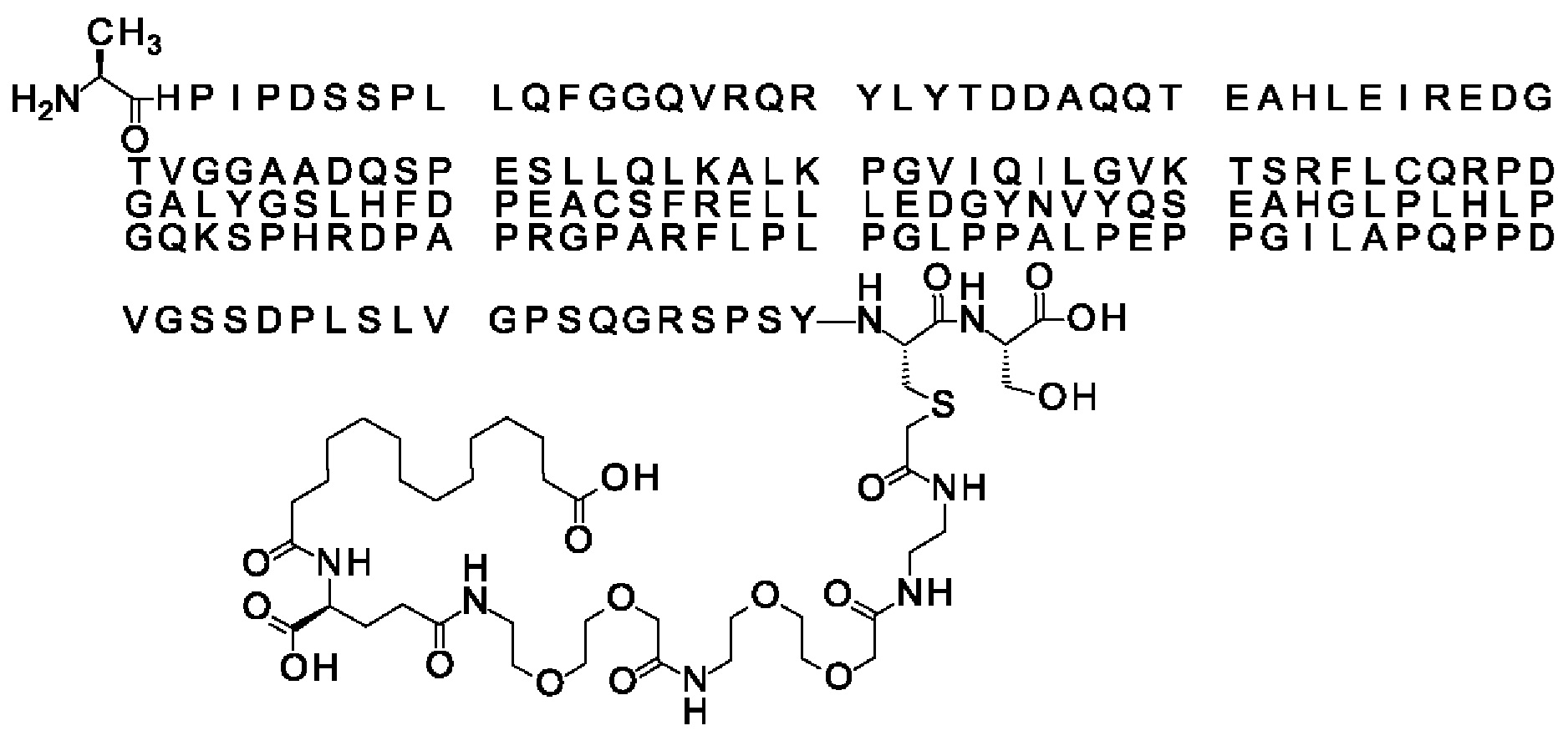
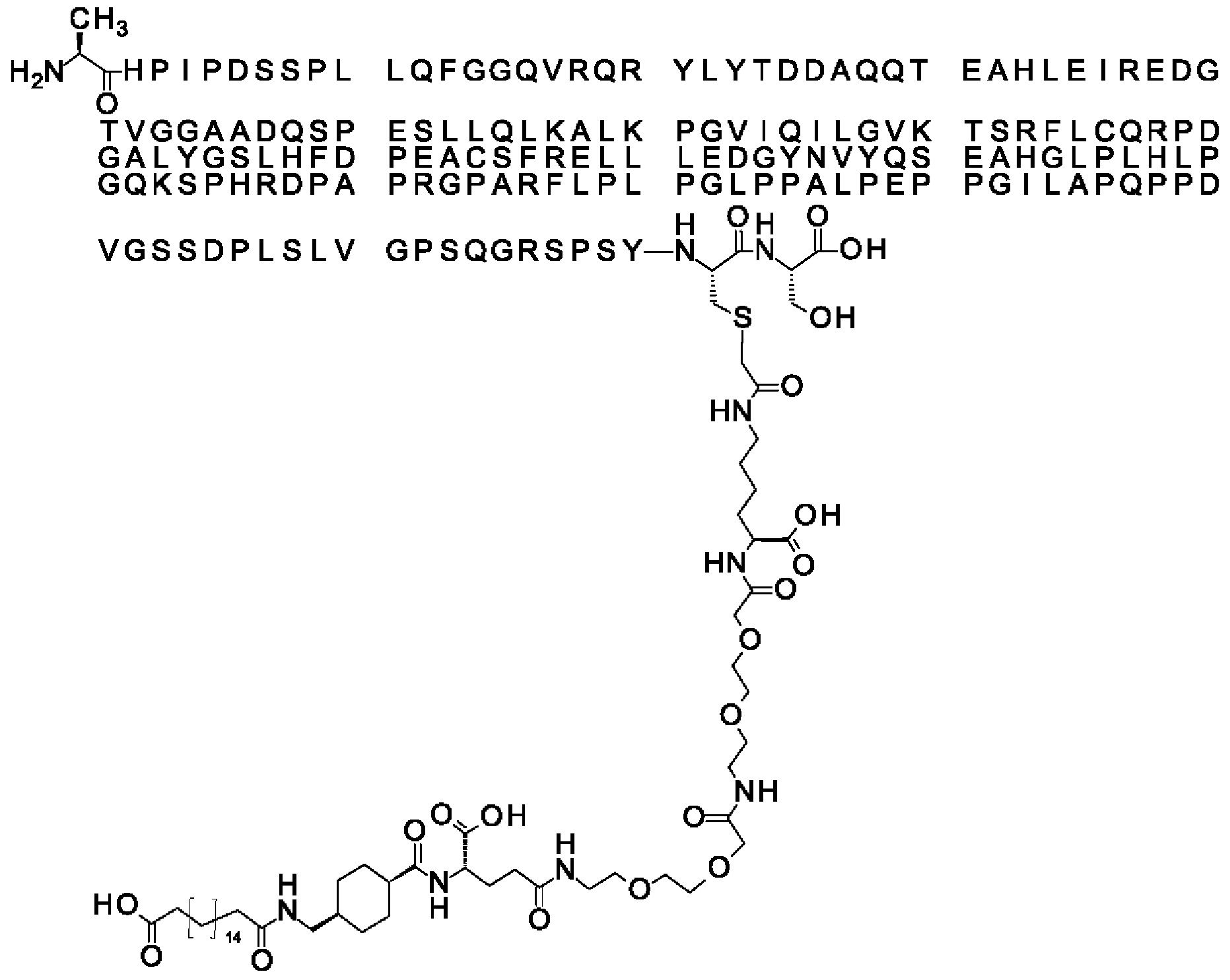
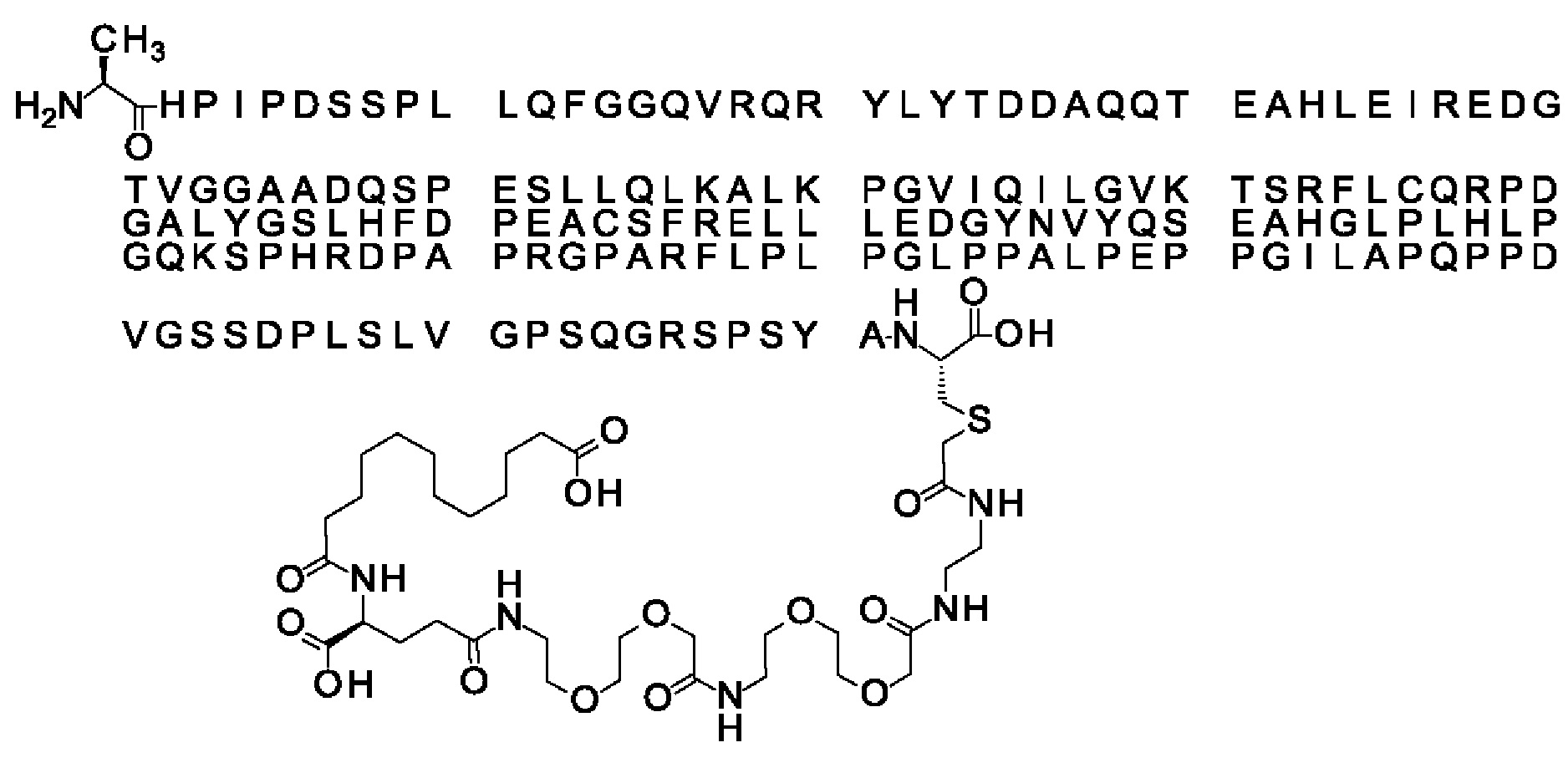
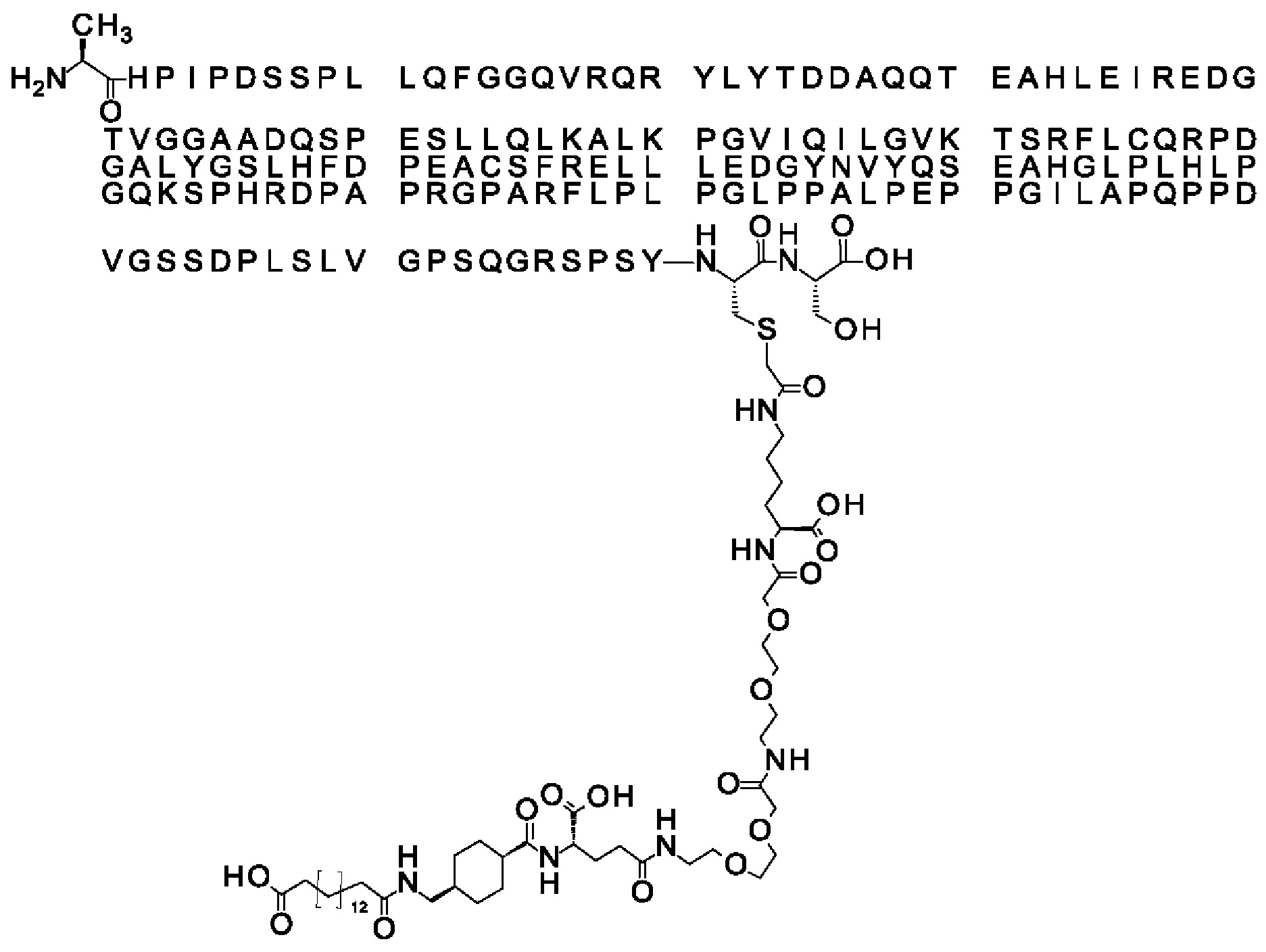
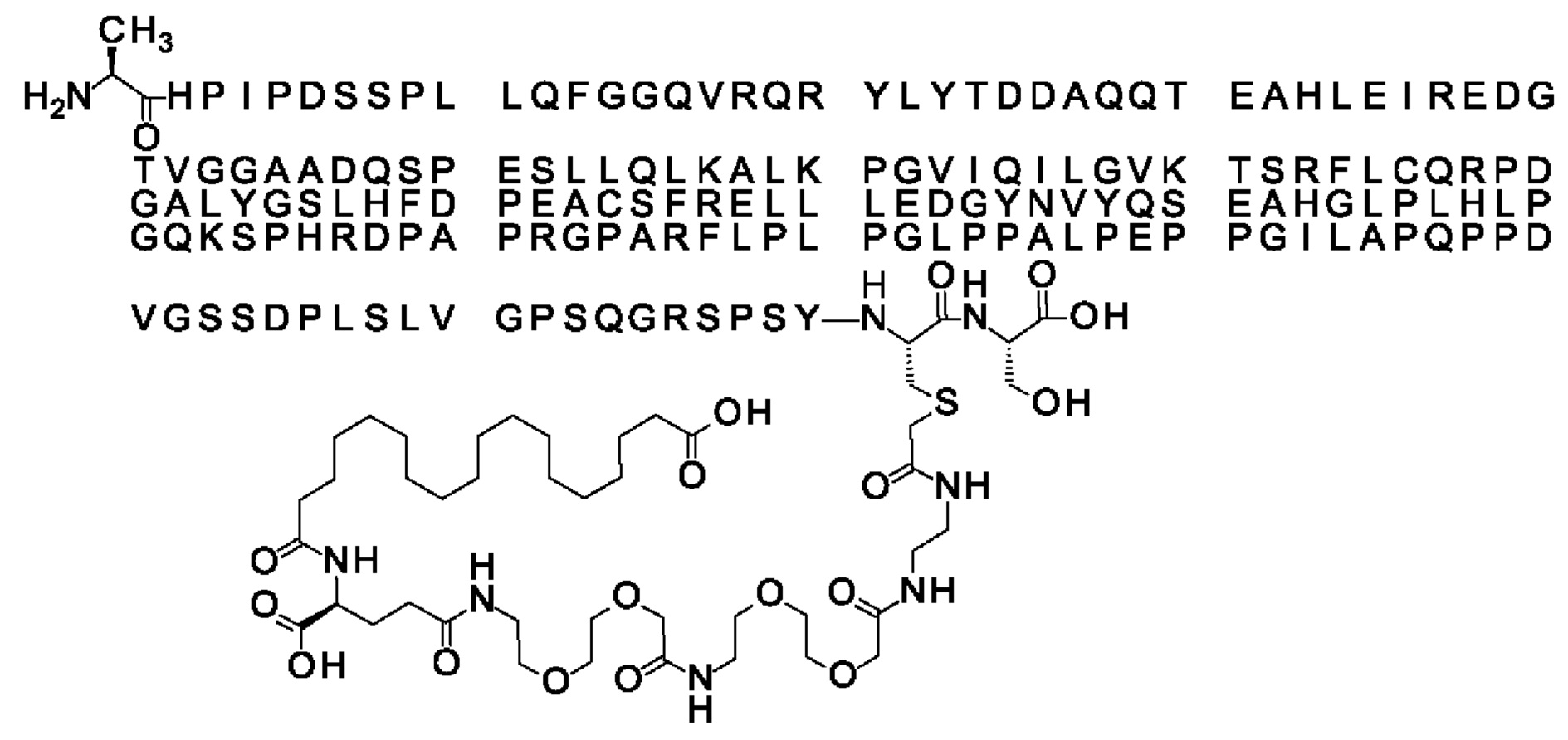
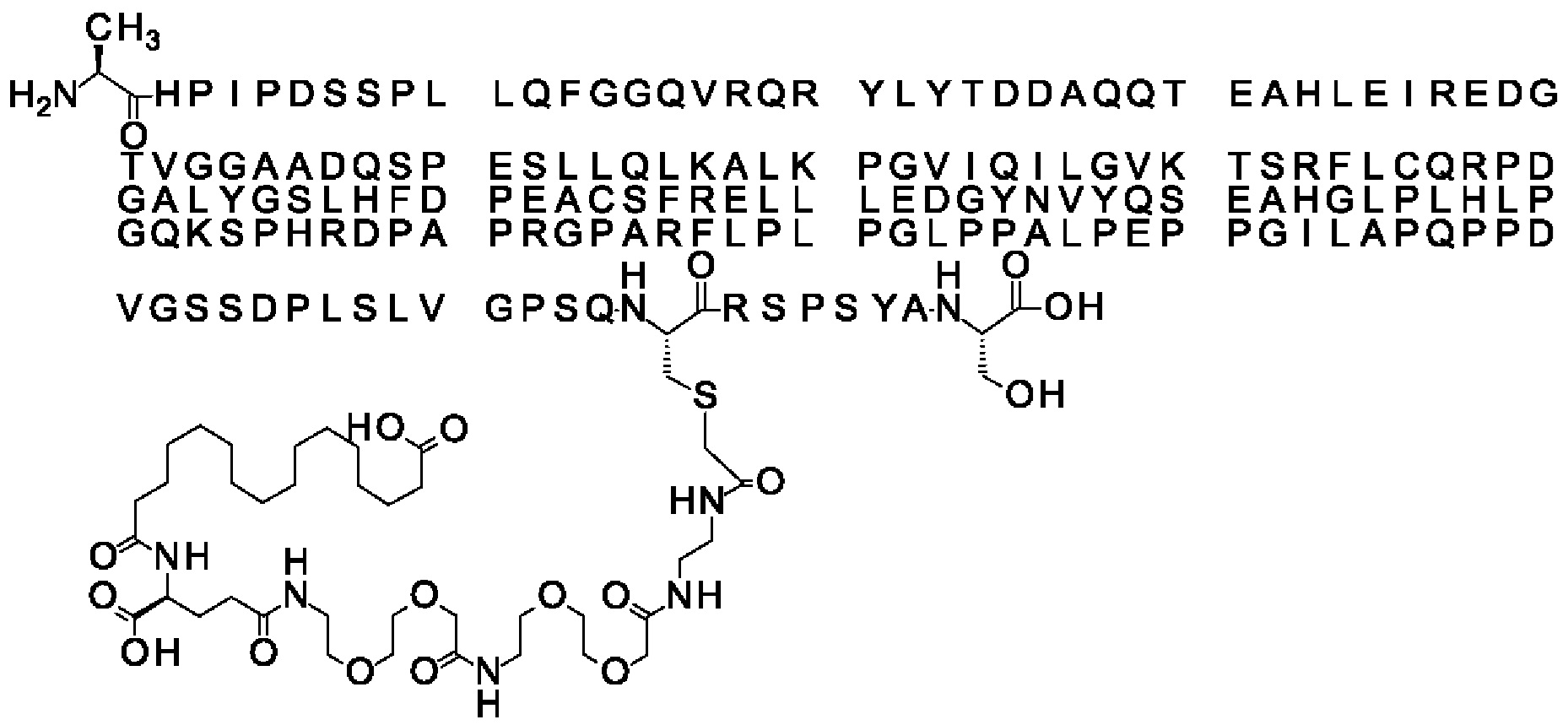
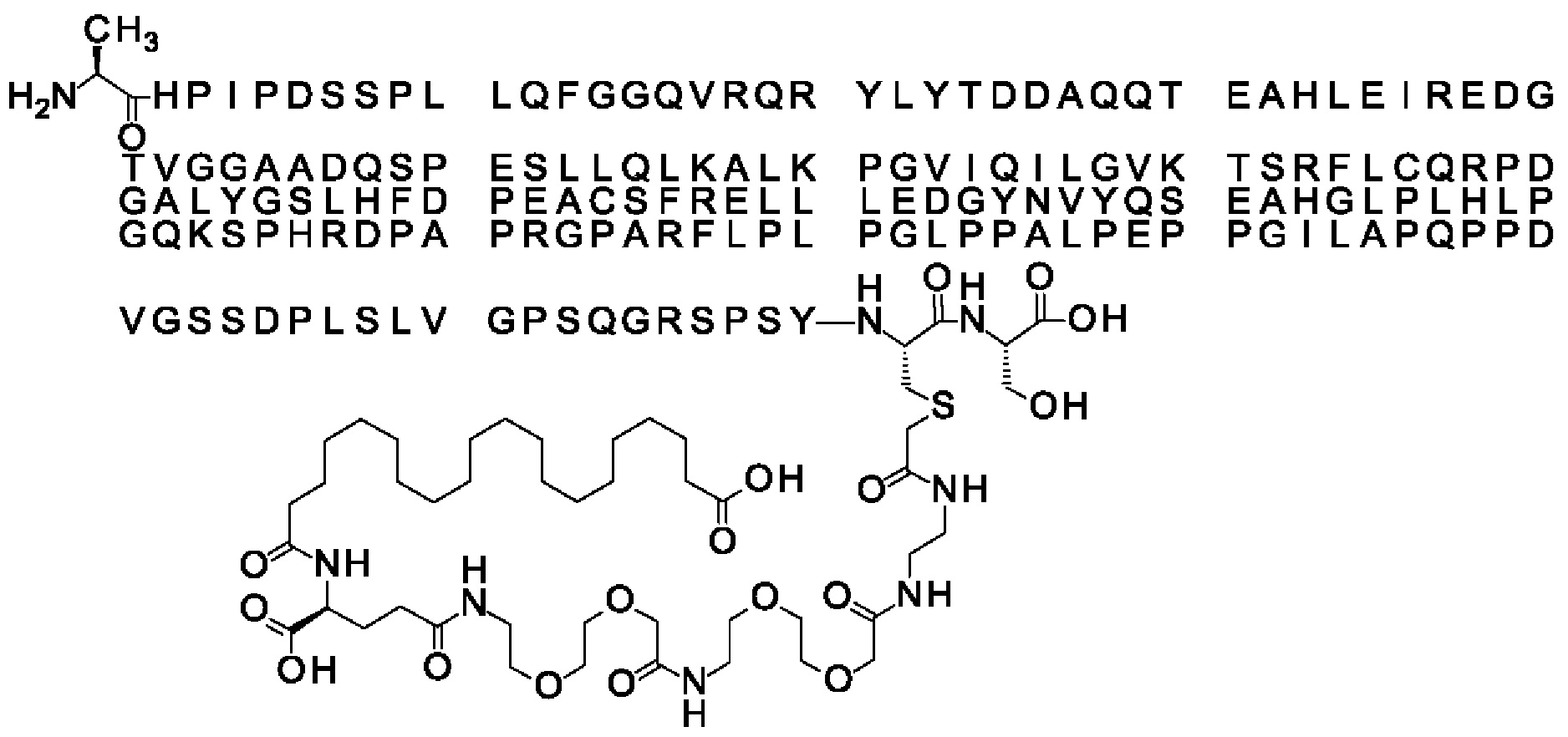
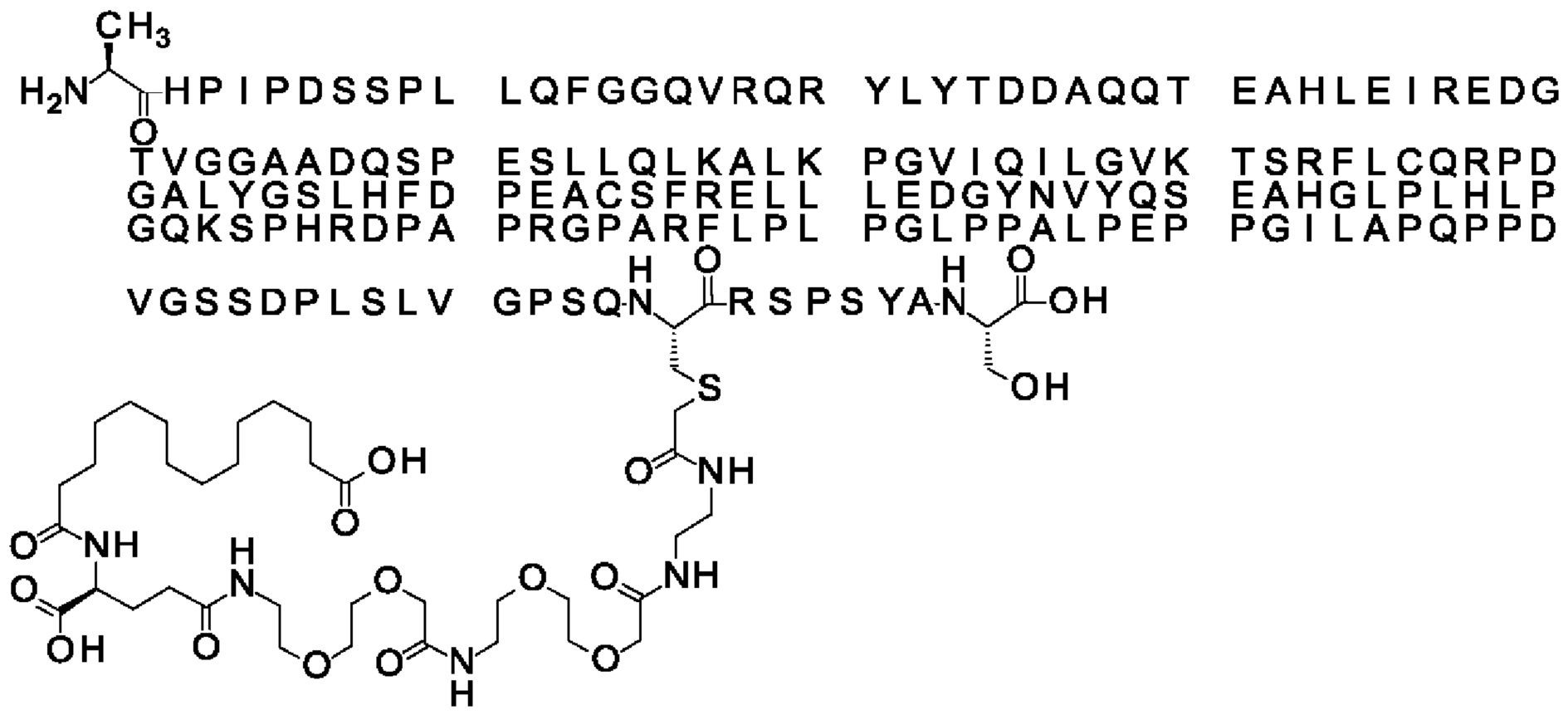
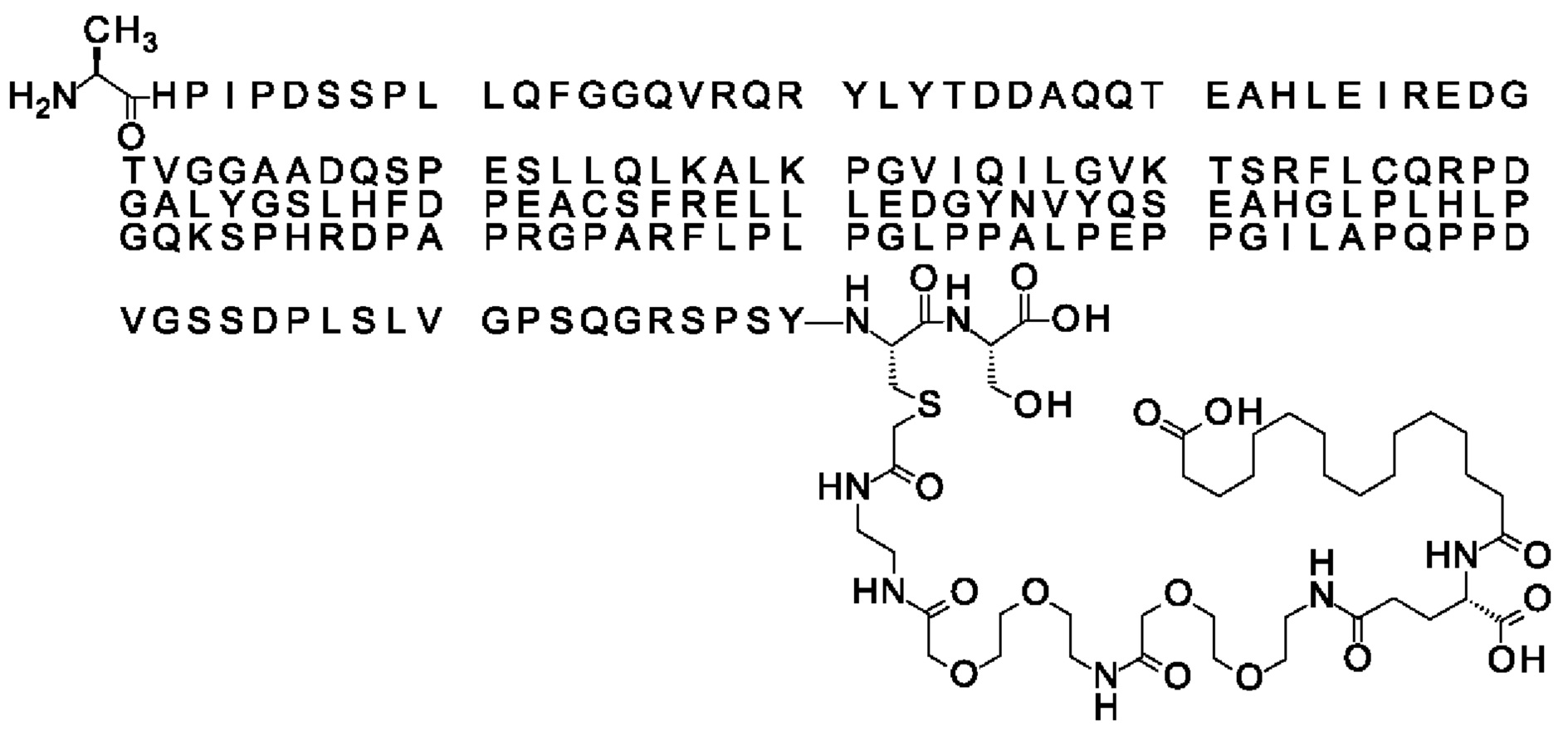
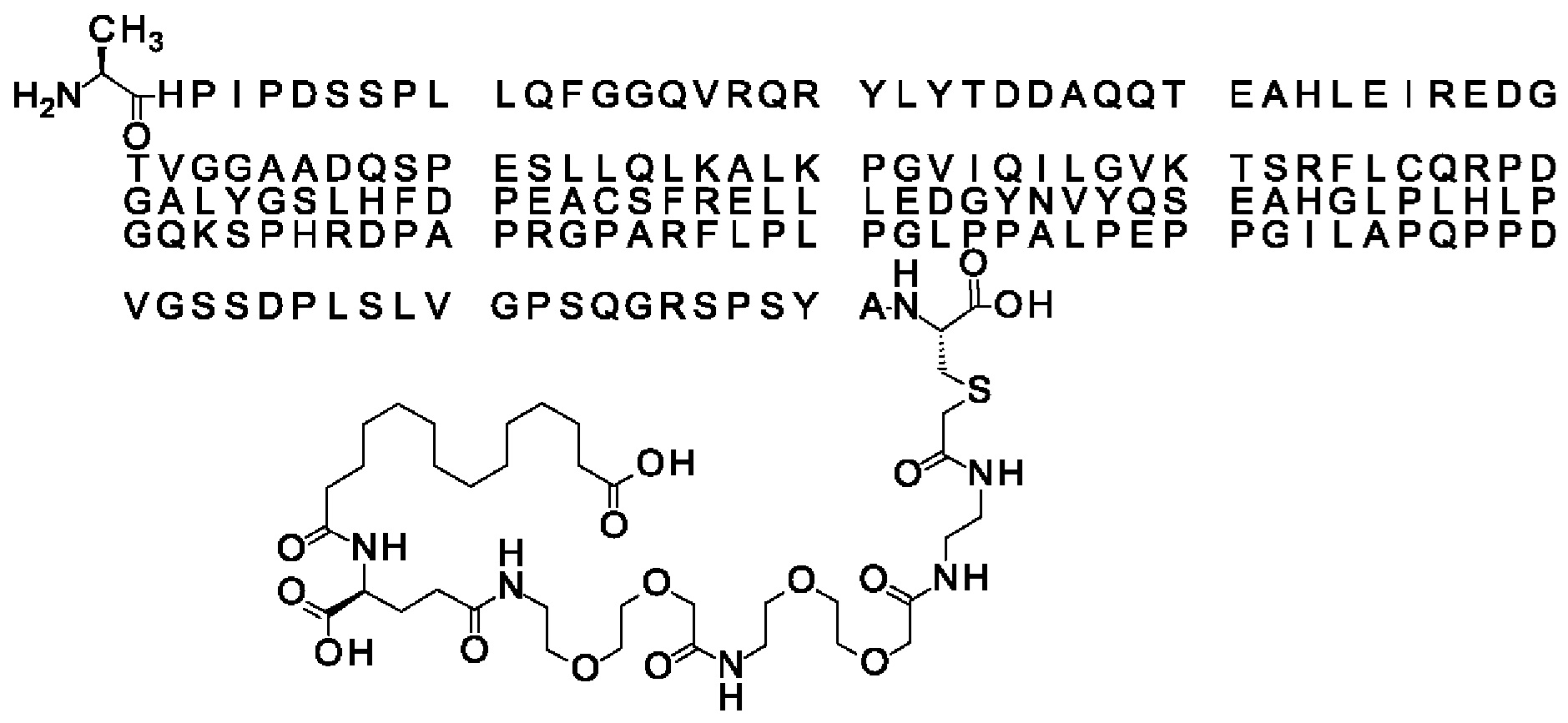
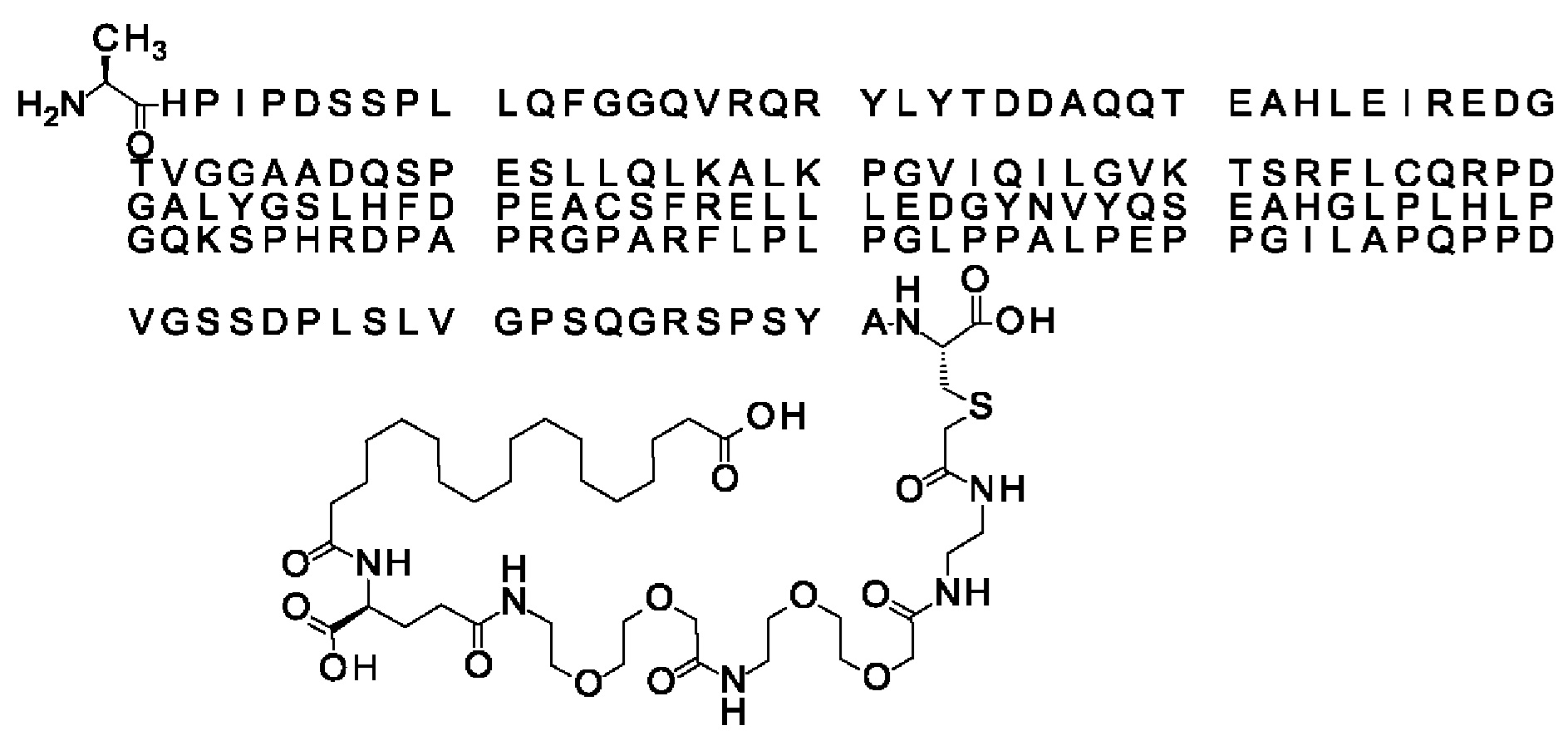
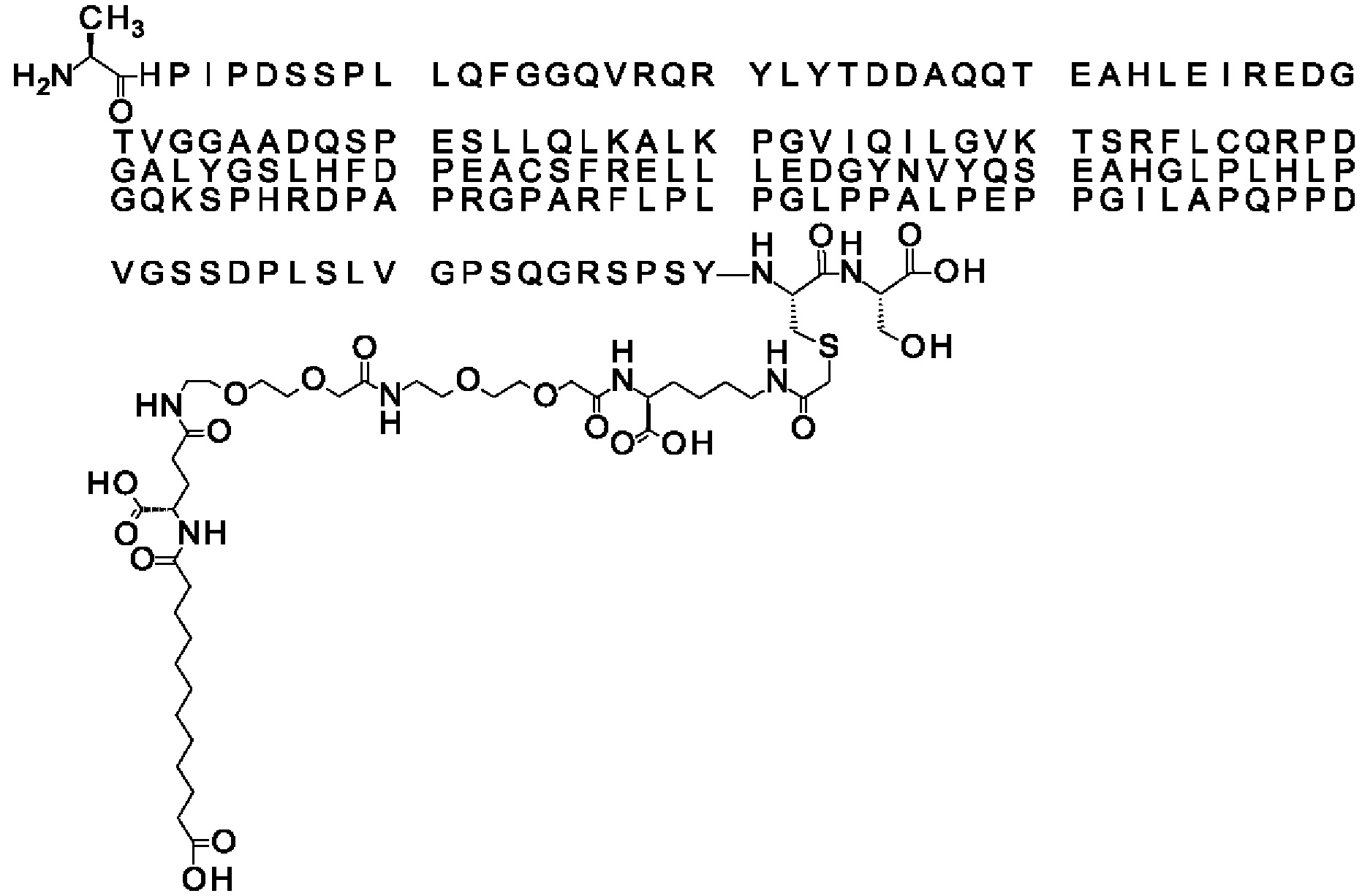
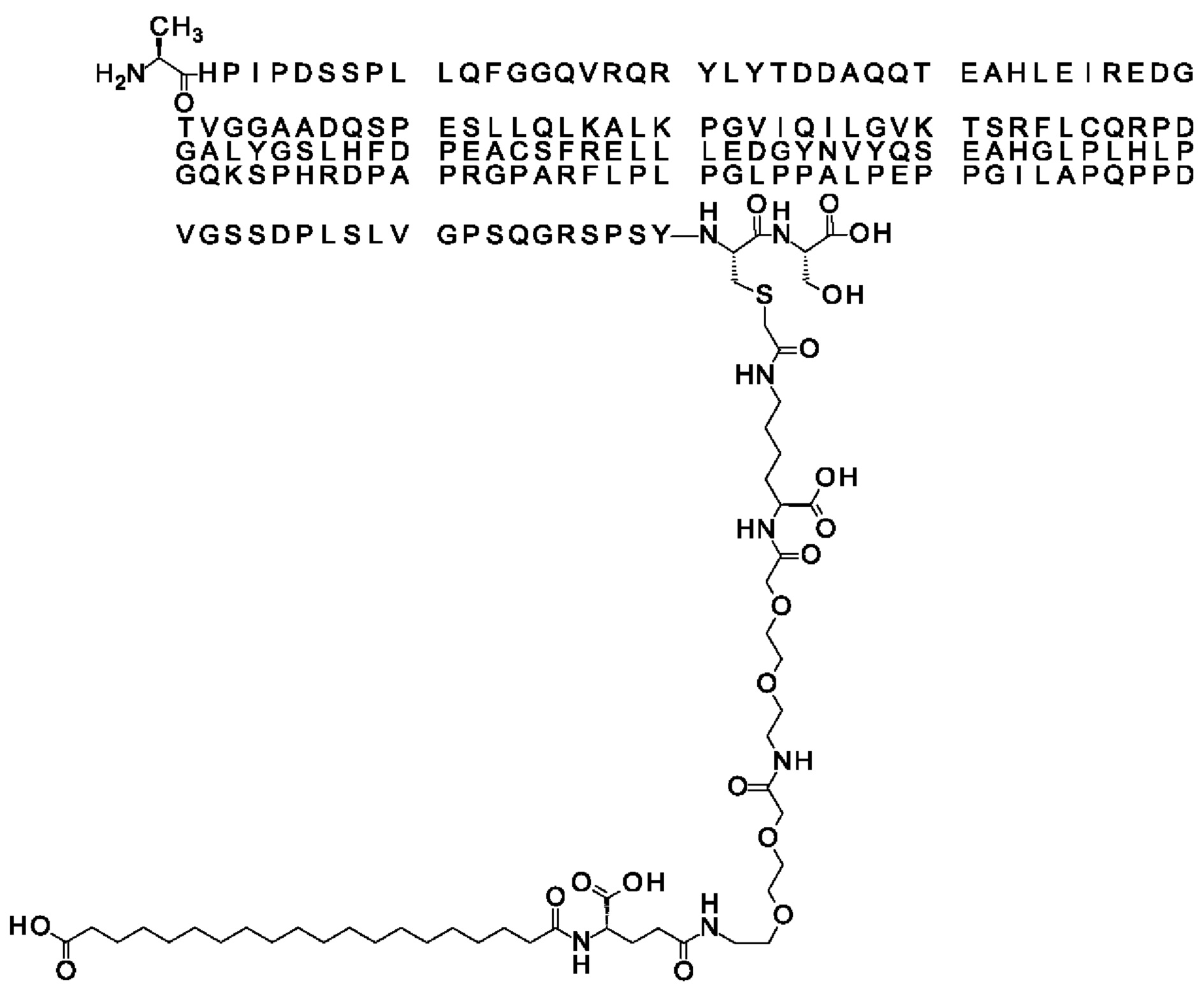
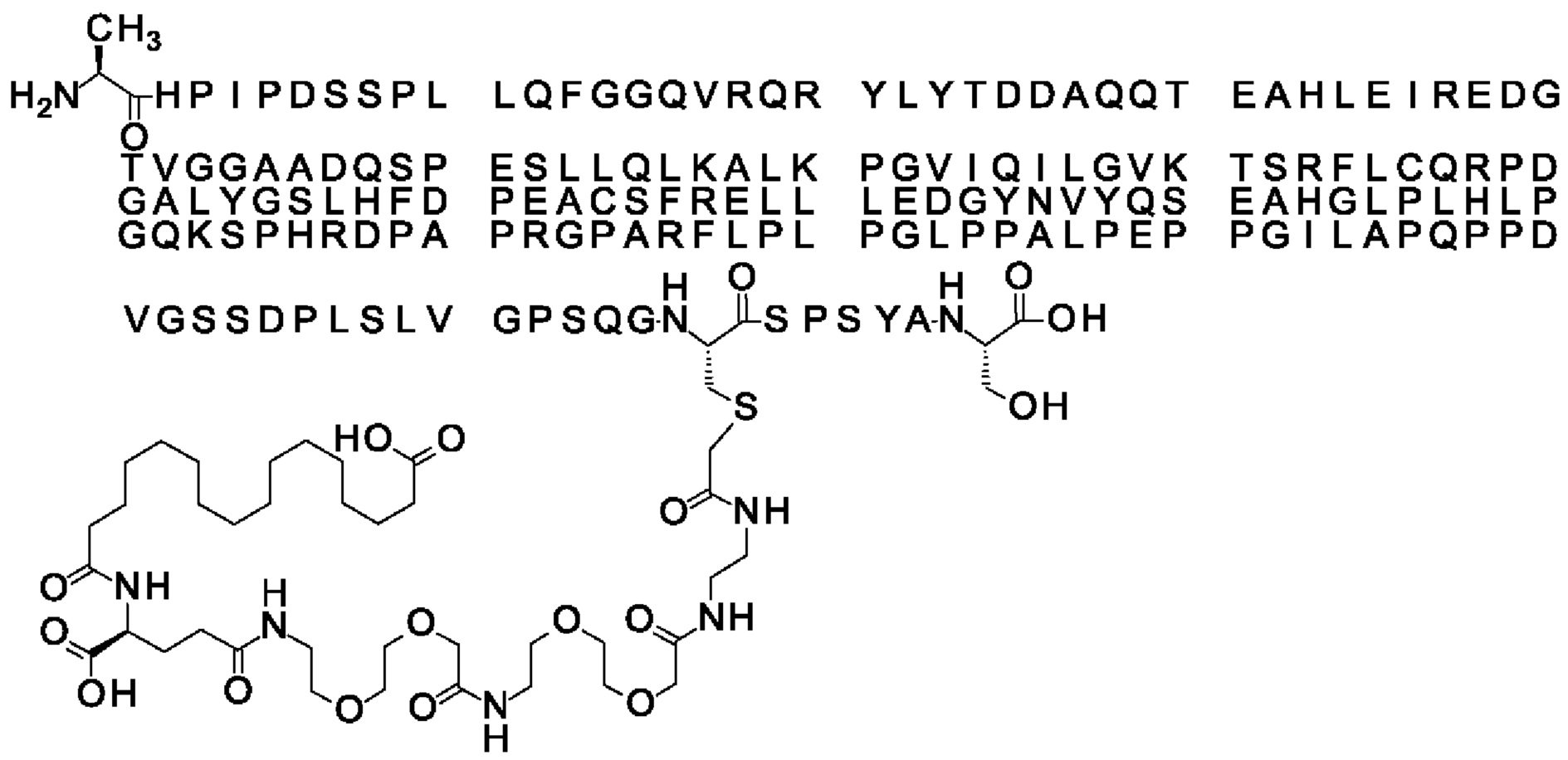
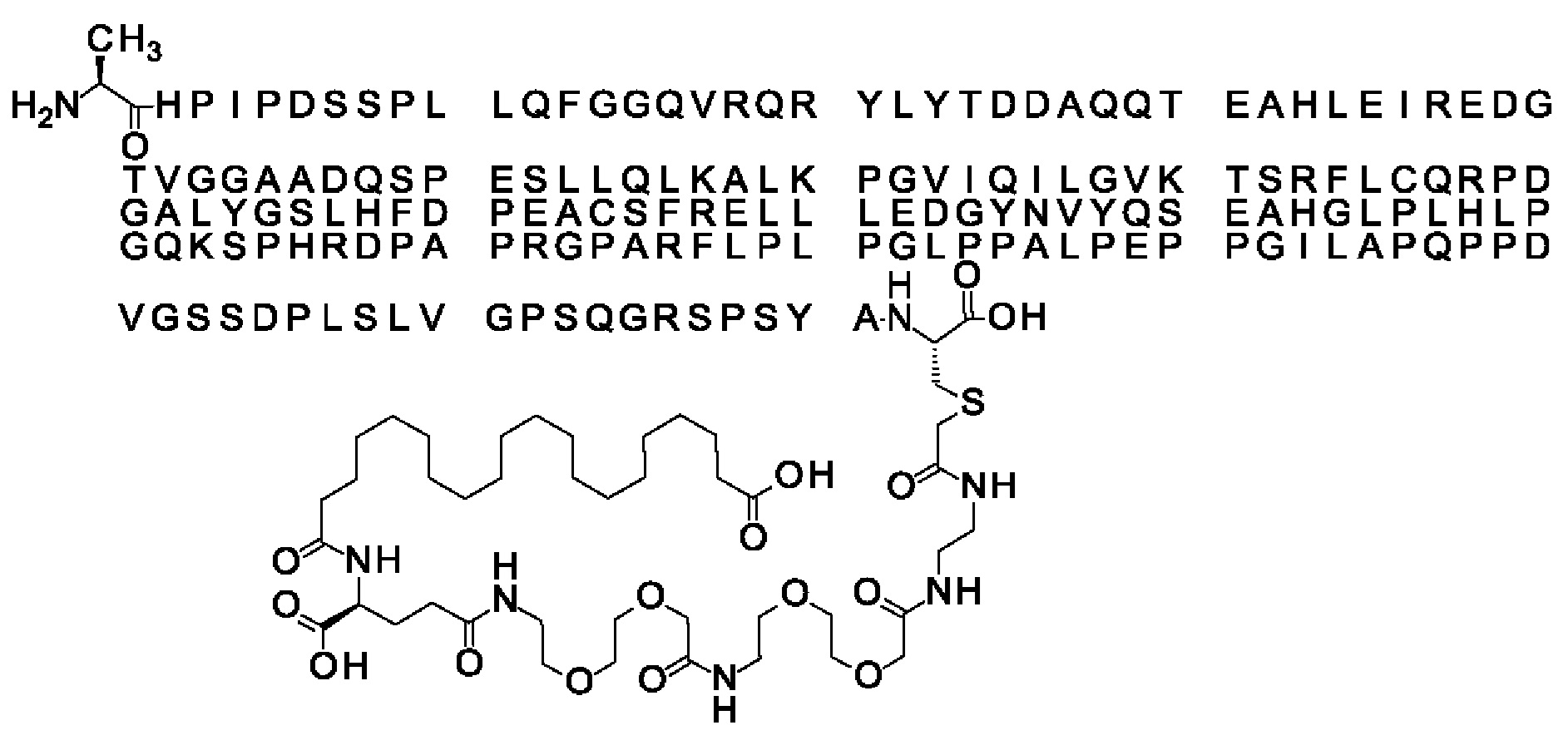
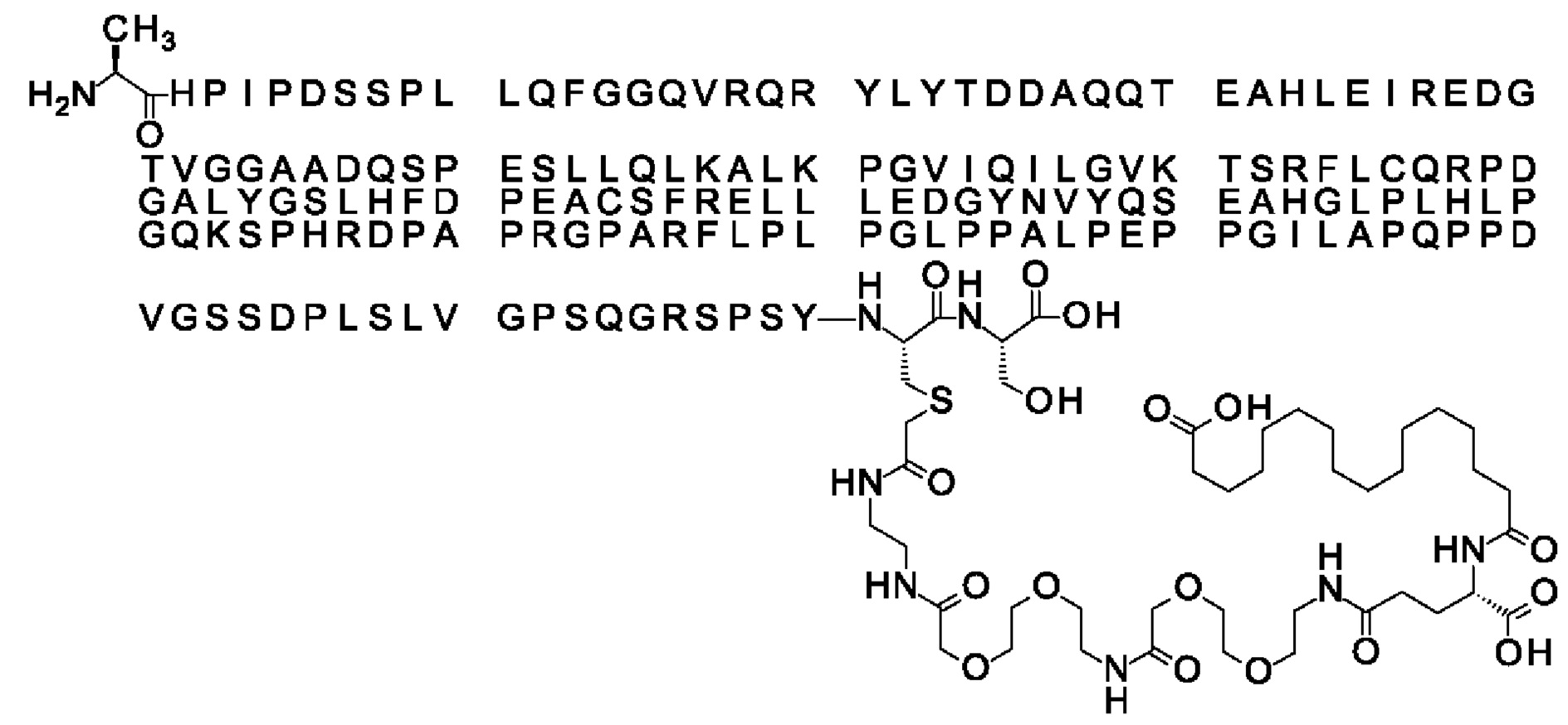
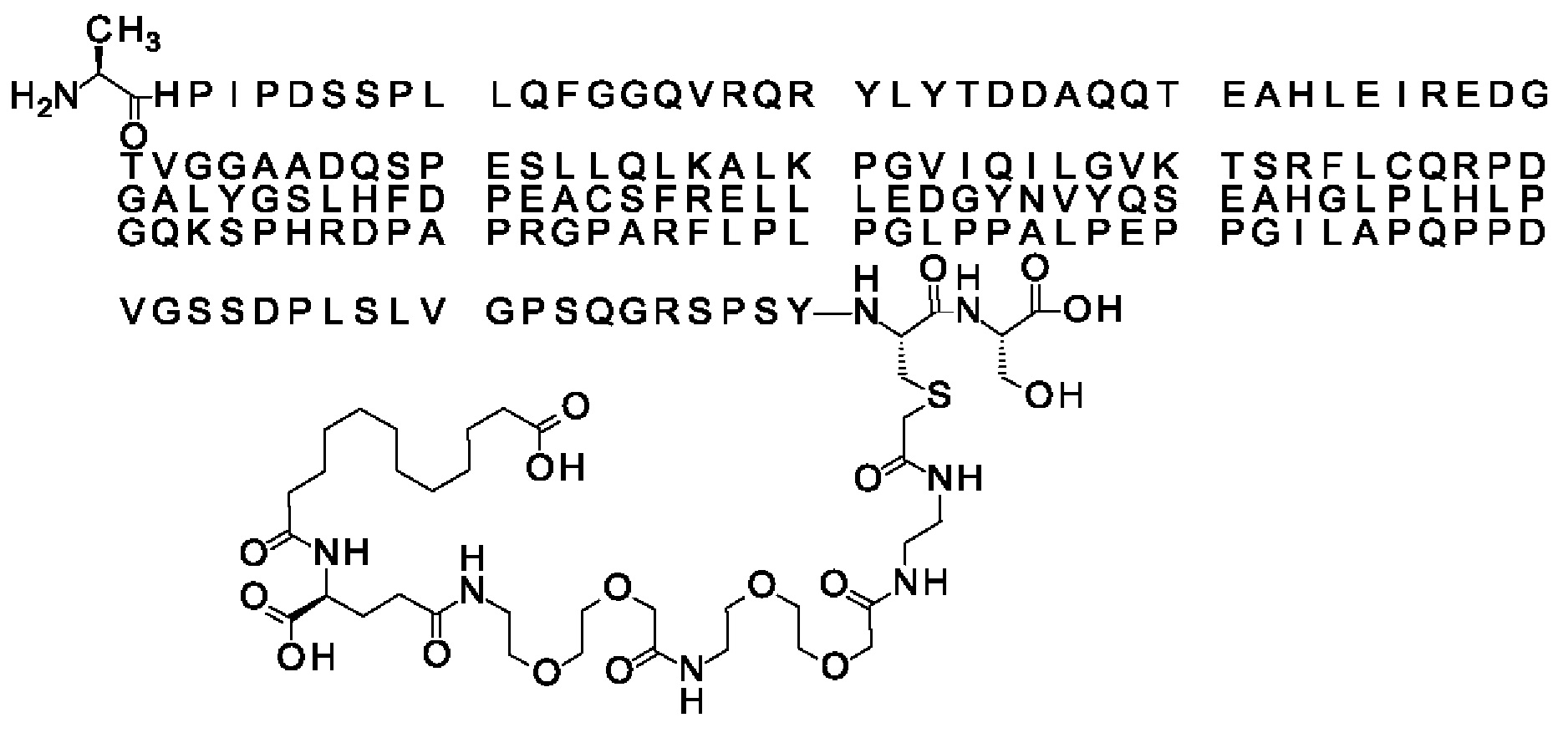
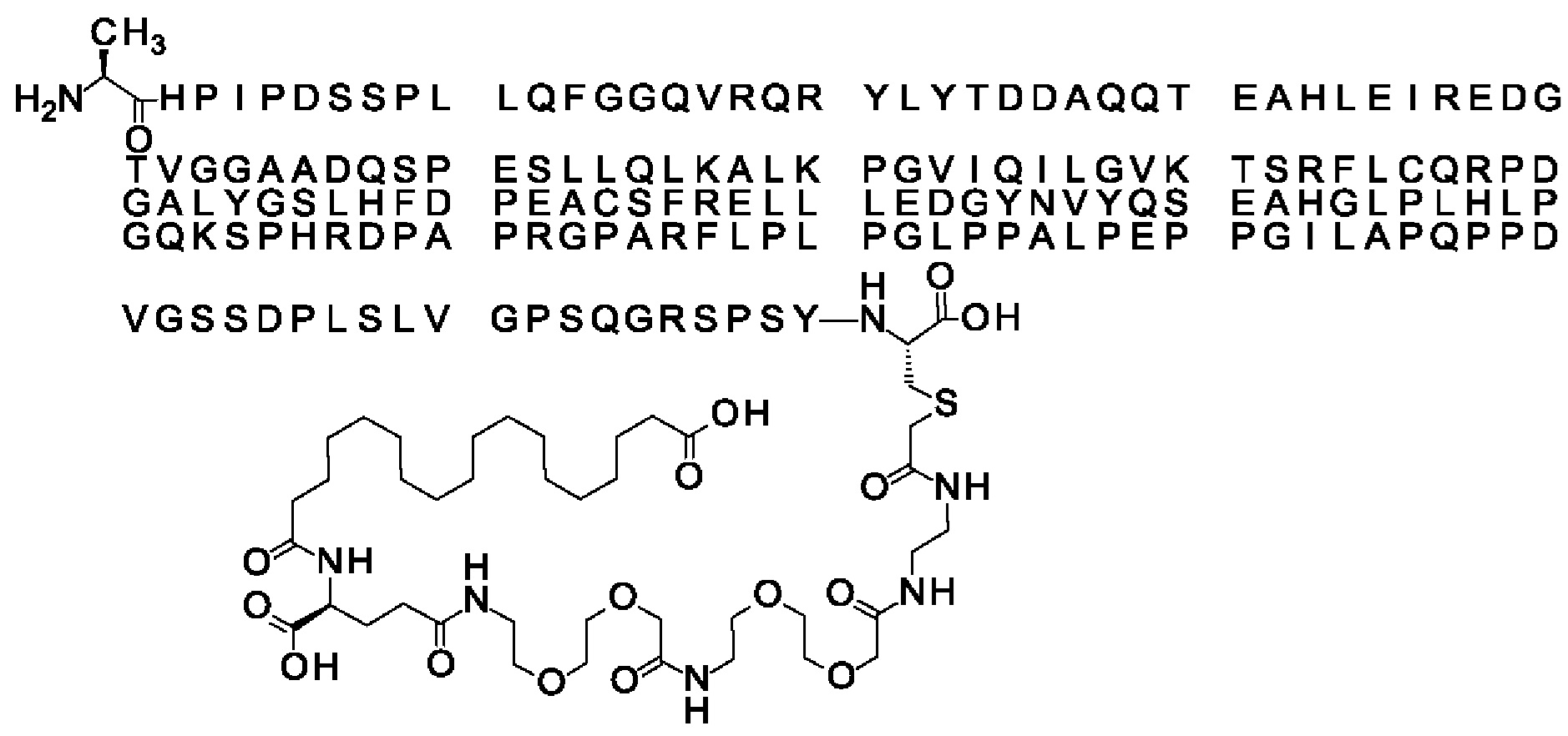
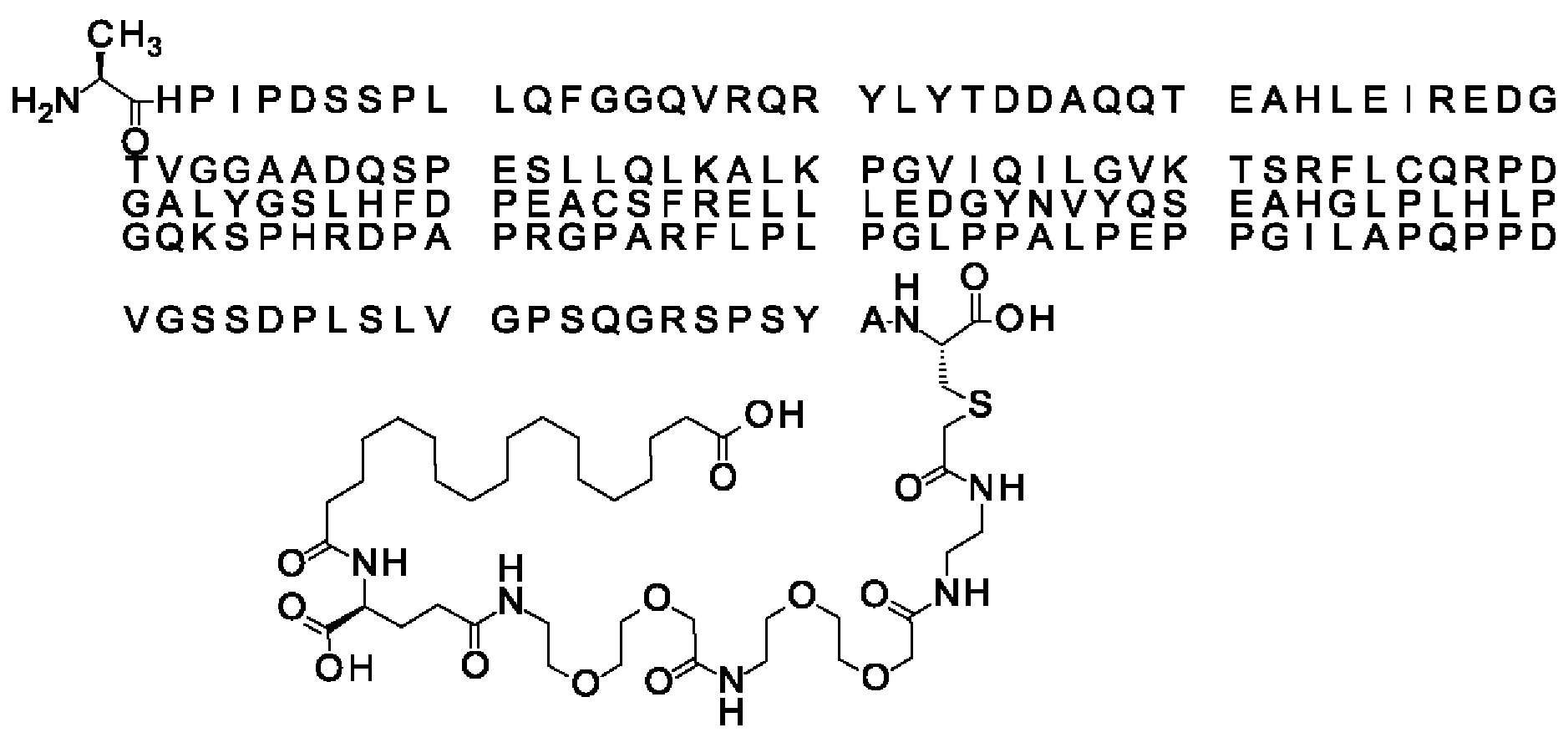
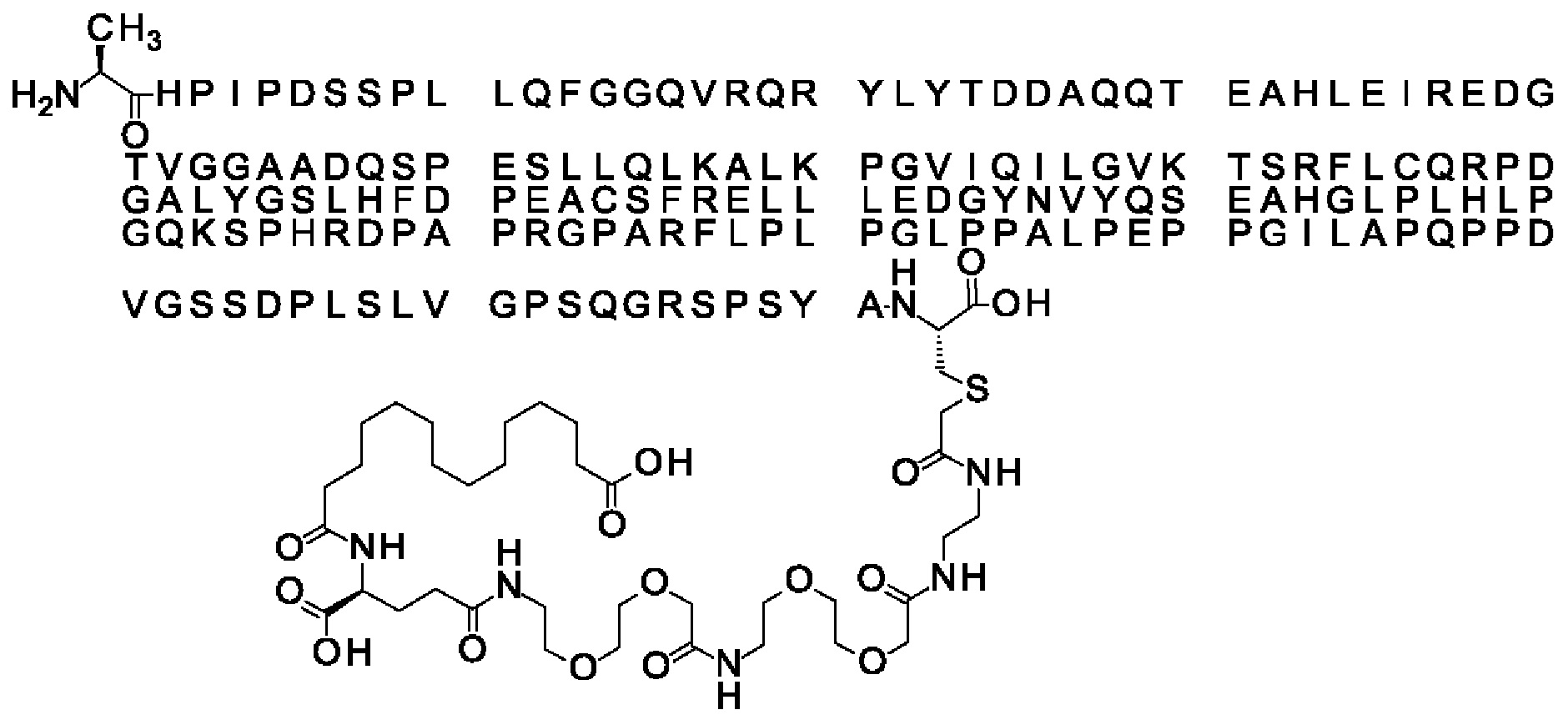
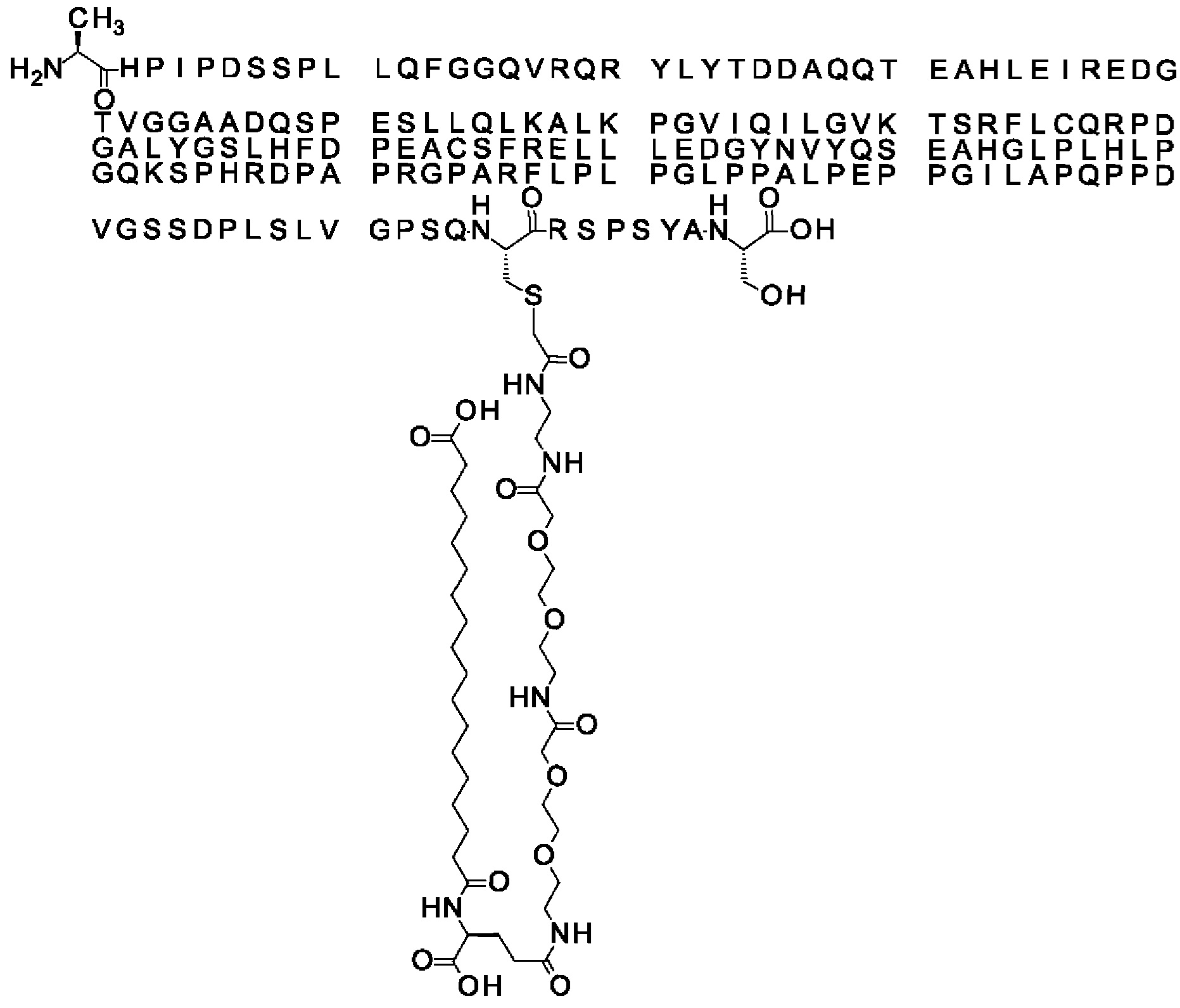
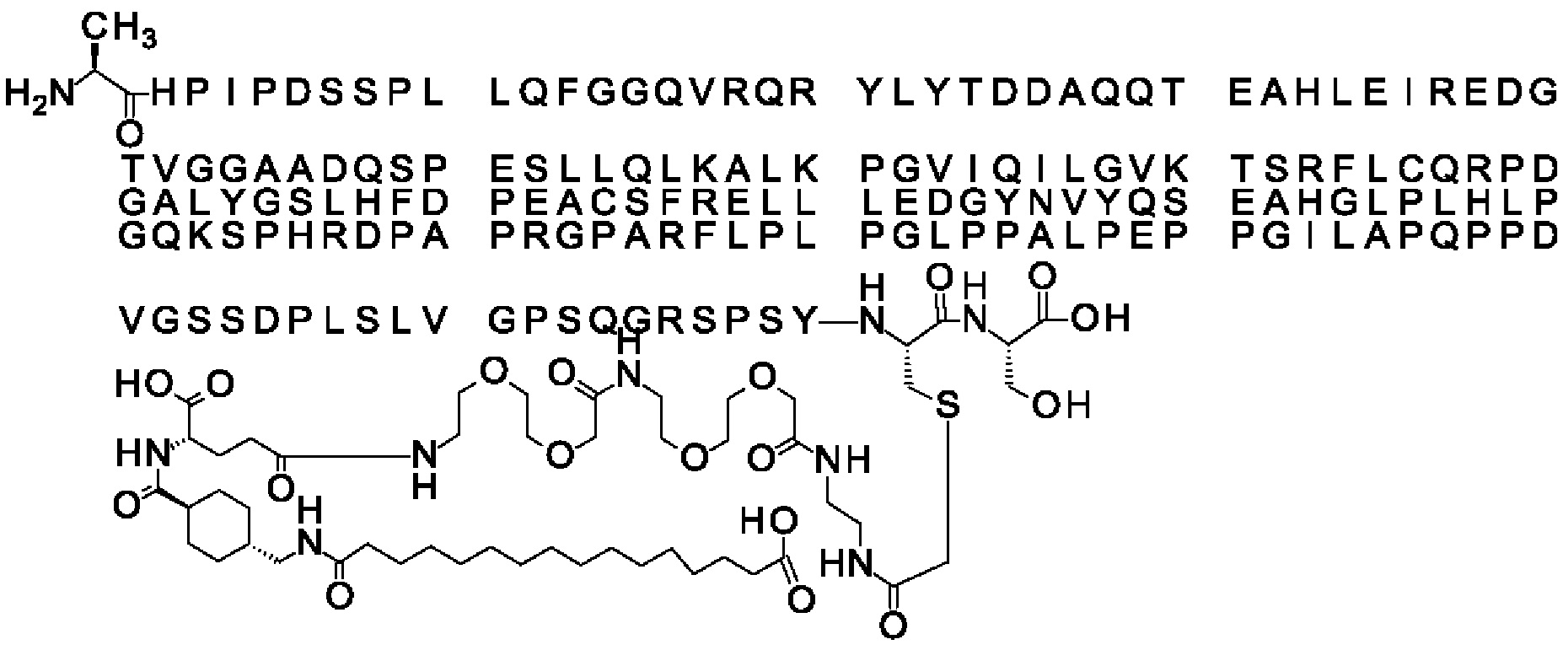
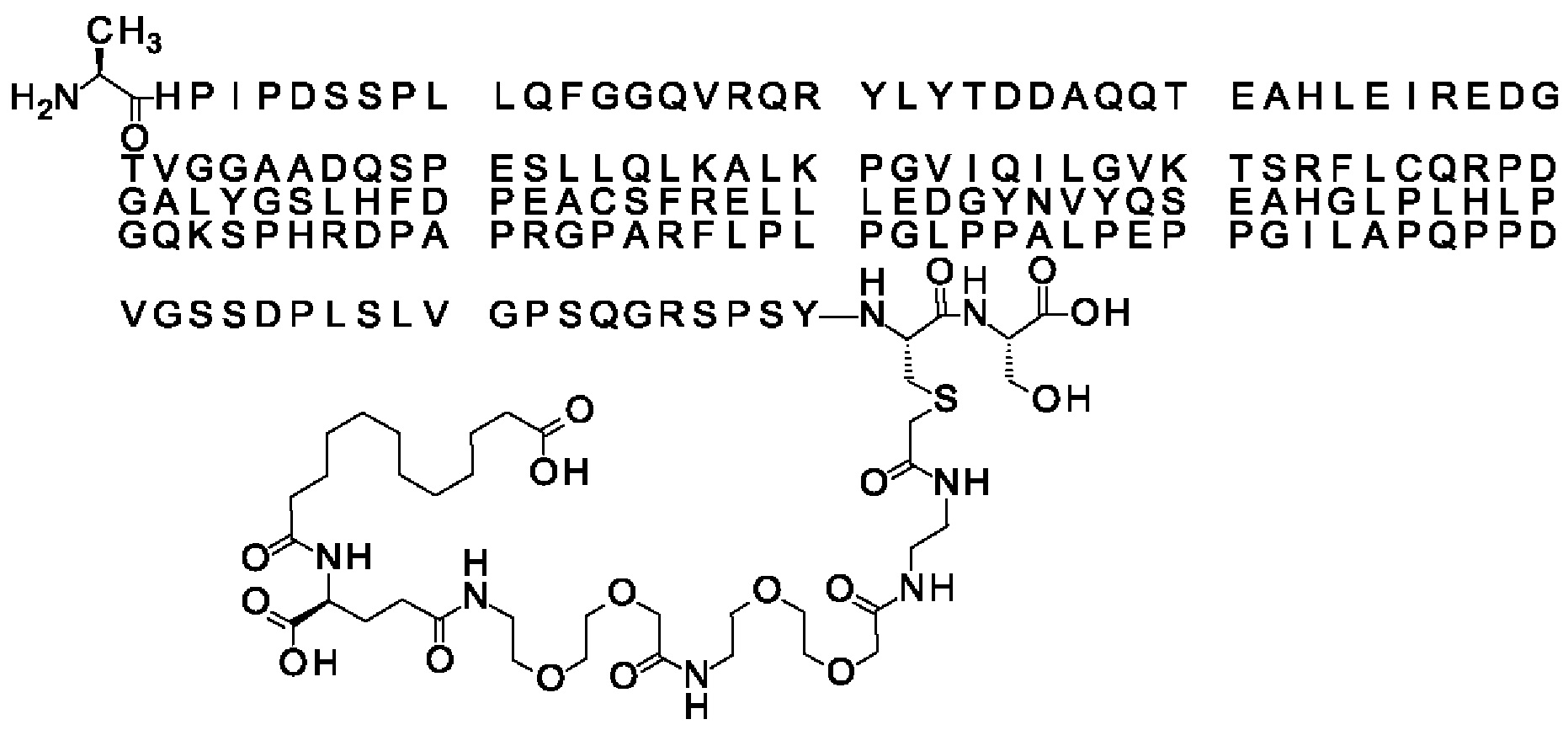
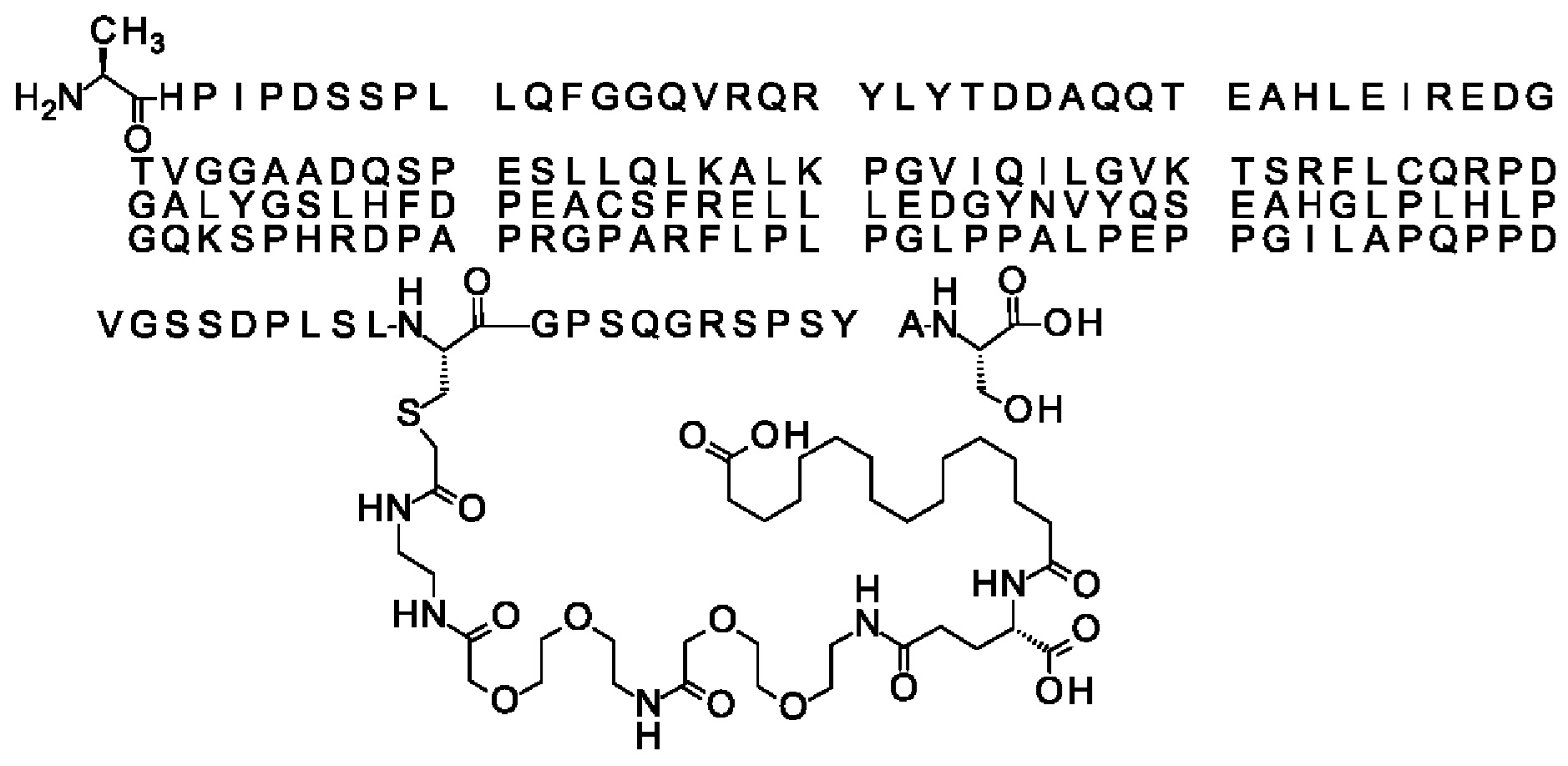
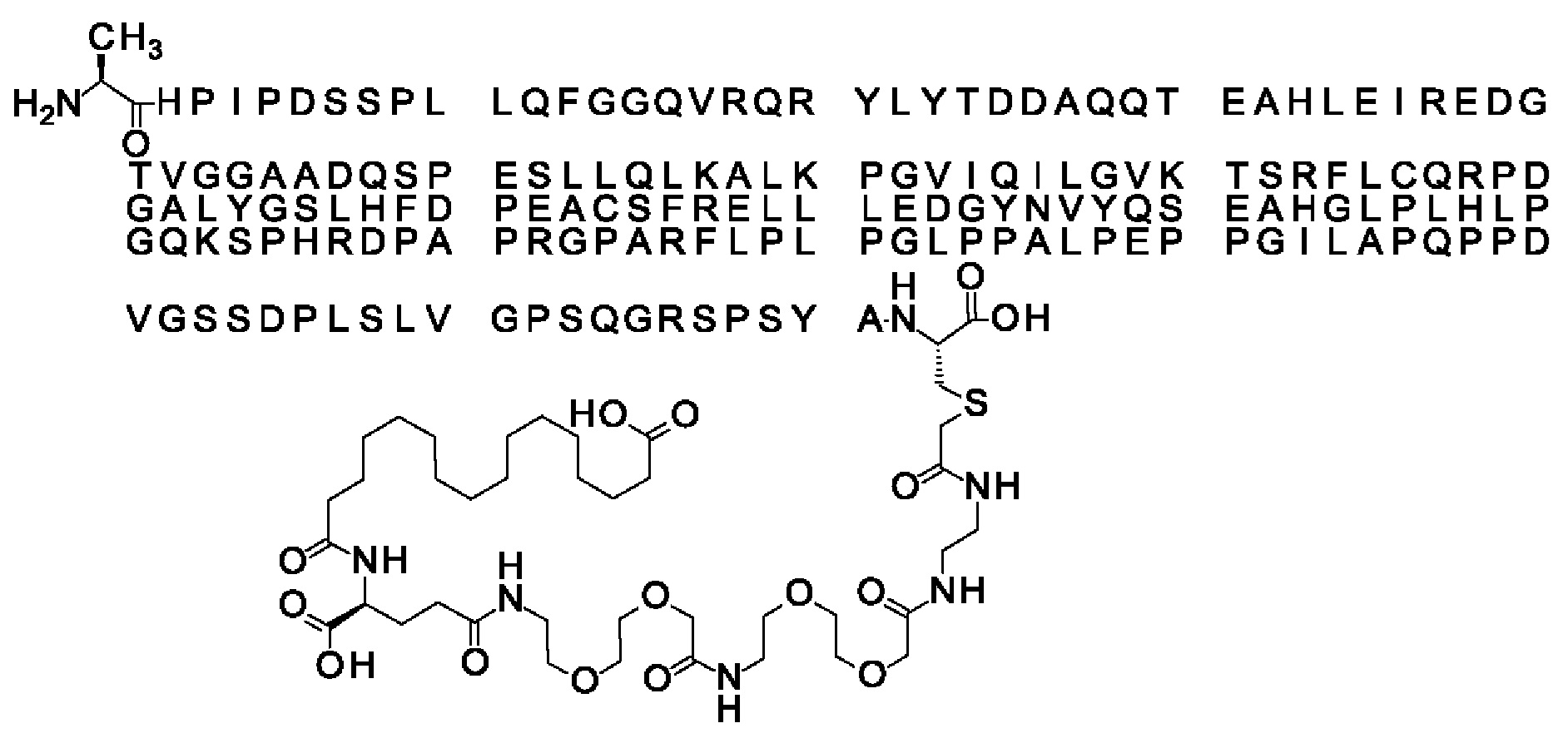
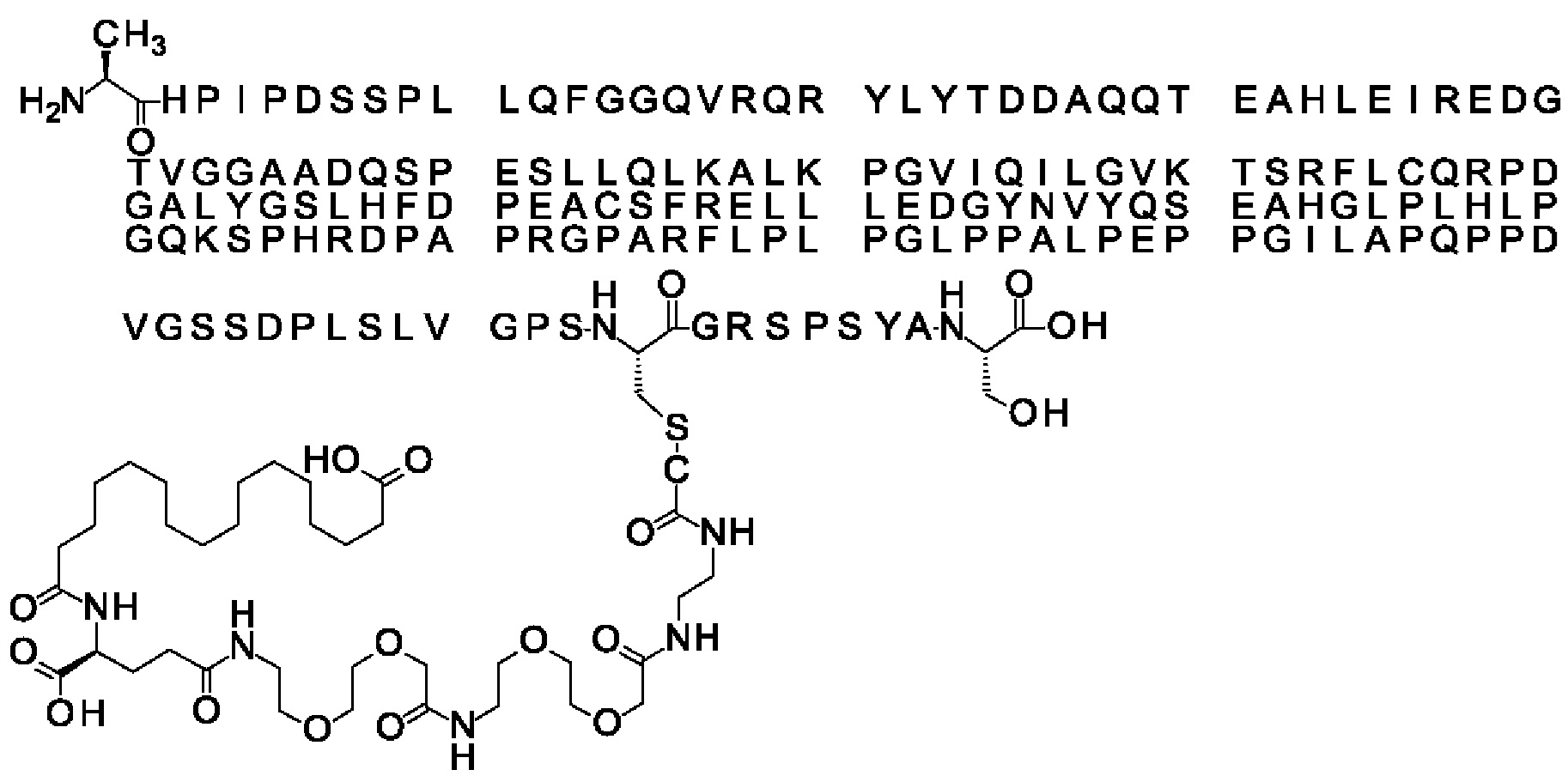
Ниже приведен не являющийся исчерпывающим пример подходящего обозначения производного аналога FGF21. S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этиламино]-2-оксоэтил]-Ala[Cln121,Leu168,Cys180]FGF21 обозначает производное аналога зрелого FGF21 человека (SEQ ID NO: 1), где Ala[Gln121,Leu168,Cys180] обозначает аминокислотные замены при сравнении со зрелым FGF21 человека (SEQ ID NO: 1) где нумерация обозначает соответствующие положения зрелого FGF21, и где заместитель [2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]-амино]этокси]этокси]ацетил]амино]этиламино]-2-оксоэтил]- ковалентно присоединен к атому серы цистеина в положении, соответствующем положению 180 в зрелом FGF21 человека (SEQ ID NO: 1).
Белок FGF21 по изобретению может дополнительно иметь аминокислотные замены при сравнении с FGF21 (SEQ ID NO: 1), однако их число ограничено, самое большее, 30 аминокислотными заменами. Данные замены также имеют место при сравнении со зрелым FGF21(1-181) человека (SEQ ID NO: 1) и могут представлять, независимо друг от друга, одну или несколько аминокислотных замен, вставок, достроек и/или делеций.
В частном воплощении аминокислотные замены в одном или нескольких положениях соответствуют одному или нескольким положениям -1, 121 и 168 FGF21 (SEQ ID NO: 1).
В одном воплощении белок FGF21 по изобретению помимо аминокислотной замены на цистеин содержит - 1Ala, 121Gln и 168Leu.
В воплощении белок FGF21 по изобретению содержит - 1Ala, 121Gln и 168Leu дополнительно к любому из перечисленного: 167Cys, 170Cys, 171Cys, 172Cys, 173Cys, 174Cys, 175Cys, 180Cys и 181Cys. Конкретными белками FGF21 по изобретению, которые также включены в конкретные производные по изобретению, изложенные в Экспериментальной части, являются SEQ ID NO: 8, 10, 12, 14, 15, 16, 17, 18, 19 и 20 в перечне последовательностей.
В другом конкретном воплощении белок FGF21 по изобретению дополнительно к 180Cys или к 181Cys содержит - 1Ala, 121Gln и 168Leu.
Конкретными белками FGF21 по изобретению, которые также входят в конкретные производные по изобретению, изложенные в Экспериментальной части, являются SEQ ID NO: 8 и SEQ ID NO: 10 перечня последовательностей.
Белок «содержащий» определенные указанные замены может содержать дополнительные замены при сравнении со зрелым FGF21 человека (SEQ ID NO: 1).
Как следует из приведенных выше примеров, аминокислотные остатки можно идентифицировать по их полному названию, их однобуквенному коду и/или их трехбуквенному коду. Эти три способа являются полностью эквивалентными.
Выражения «положение, эквивалентное» или «положение, соответствующее» могут использоваться, чтобы охарактеризовать сайт замены в варианте последовательности FGF21 путем ссылки на зрелый FGF21 человека (SEQ ID NO: 1). Эквивалентные или соответствующие положения, а также количество замен легко вычислить, например, записав вручную и оценив визуально; и/или можно использовать стандартную программу для выравнивания белков или пептидов, такую как «align» на основе алгоритма Нидлмана - Вунша. Данный алгоритм описан Needleman, S.B. and Wunsch, CD., (1970), Journal of Molecular Biology, 48: 443-453, а программа для выравнивания предложена Myers and W. Miller в "Optimal Alignments in Linear Space" CABIOS (computer applications in the biosciences) (1988) 4:11-17. Для выравнивания можно использовать выбранную по умолчанию матрицу весов выравнивания BLOSUM62 и выбранную по умолчанию матрицу сходства и устанавливать штраф за введение разрыва (gap penalty) -12, или, предпочтительно, -10, а штрафы за продолжение разрыва (extension penalty) -2, или, предпочтительно, -0,5.
Ниже приведен пример такого выравнивания, в котором последовательность номер 1 представляет собой зрелый FGF21 (SEQ ID NO: 1), а последовательность номер 2 является аналогом Ala[121Q, 168L, 181C]FGF21 (SEQ ID NO: 10). Таким образом, рассчитанная идентичность составляет 97,8%.


В других воплощениях белок FGF21 или аналог, или FGF21-остов производных FGF обладает по меньшей мере 80% идентичностью с FGF21 человека (SEQ ID NO: 1), такой как идентичностью по меньшей мере 85%, такой как идентичностью по меньшей мере 90%, такой как идентичностью по меньшей мере 92, 93, 94, 95, 96, 97, 98 или 99% с FGF21 человека (SEQ ID NO: 1).
Термин «белок» относится к соединению, которое содержит ряд аминокислот, связанных между собой амидной (или пептидной) связями.
Белки по изобретению содержат по меньшей мере 151 аминокислоту, которые соединены пептидными связями. В частных воплощениях белок содержит по меньшей мере 160, предпочтительно, по меньшей мере 170, более предпочтительно, по меньшей мере 180, еще более предпочтительно, по меньшей мере 181 или, наиболее предпочтительно, по меньшей мере 182. В дополнительных конкретных воплощениях белок: а) построен или б) состоит из 181 или 182 аминокислот.
В другом предпочтительном воплощении белок состоит из аминокислот, соединенных между собой пептидными связями.
Аминокислоту можно охарактеризовать как соединение, которое содержит аминогруппу и карбоксильную группу и, необязательно, одну или несколько дополнительных групп, которые часто обозначают боковой цепью. Аминогруппа может, например, быть первичной или вторичной аминогруппой.
Аминокислотный остаток представляет собой радикал аминокислоты, входящий в состав пептида или белка.
В частном воплощении аминокислоты белка по изобретению представляют собой альфа-аминокислоты, где атом азота первичной или вторичной аминогруппы связан с альфа-углеродным атомом.
В другом частном воплощении аминокислоты белка по изобретению выбраны из кодируемых аминокислот и некодируемых аминокислот.
В одном воплощении аминокислоты белка по изобретению представляют собой кодируемые аминокислоты.
Кодируемые аминокислоты можно охарактеризовать, как в Таблице 1 раздела 3АА-1 рекомендаций Международного союза теоретической и прикладной химии (см. http://www.chem.qmul.ac.uk/iupac/), где приведены структура, тривиальное название, систематическое название, одно- и трехбуквенные символы для 20 кодируемых аминокислот.
Термин «некодируемые аминокислоты» относится ко всем другим аминокислотам. Неисчерпывающими примерами некодируемых аминокислот являются D-изомеры кодируемых аминокислот, такие как D-аланин и D-лейцин.
В дальнейшем описании все конкретные аминокислоты, для которых не указан оптический изомер, означают L-изомер (если не указано иное), например, когда упоминается конкретная аминокислота глутамин, это означает L-глутамин, если не указано иное. С другой стороны, когда аминокислоты описаны более общими формулами, такими как брутто формулы или структурные формулы и когда не показана стереохимия, указанные формулы охватывают все стереоизомеры.
Согласно общепринятой в области техники практике, N-конец белков FGF21 по изобретению указан слева, а С-конец справа.
Производные FGF21
Термин «производное», который в данном описании употребляют, когда речь идет о белке FGF21 или аналоге FGF21, означает химически модифицированный белок или аналог, в котором точно указанное количество заместителей ковалентно присоединено к одному или более конкретным аминокислотным остаткам белка. Заместители могут обозначаться как боковые цепи.
В конкретном воплощении боковая цепь способна образовывать нековалентные связи с альбумином, таким образом способствуя циркуляции производного в кровотоке, а также оказывая эффект, пролонгирующий время действия производного, поскольку комплекс производного FGF21 и альбумина распадается медленно с высвобождением активного фармацевтического ингредиента.
Боковая цепь содержит часть, которая в данном описании обозначается протрактор.
Протрактор может располагаться на дистальном конце боковой цепи или вблизи него, если рассматривать относительно точки ее присоединения к белку.
В следующем конкретном воплощении боковая цепь содержит часть между протрактором и точкой присоединения к белку, эта часть может обозначаться линкером. Линкер может состоять из одного или нескольких линкерных элементов.
В конкретных воплощениях боковая цепь и/или протрактор являются липофильными и/или отрицательно заряжены при физиологических значениях рН (7,4).
Боковая цепь может быть ковалентно присоединена к остатку цистеина белка FGF21 посредством алкилирования.
В предпочтительном воплощении боковую цепь синтезируют и активируют галоацетамидной группой, которая вступает в реакцию с тиоловой группой остатка цистеина, с образованием ковалентной тиол-углеродной связи (данный процесс обозначают алкилированием Cys), которую также обозначают тиоэфирной связью. Таким образом, тиоловая группа у производных отсутствует, а боковая цепь присоединяется через атом серы. В случаях, когда тиоловая группа упоминается в отношении производного, следует понимать, что имеется в виду атом серы, который является частью тиоловой группы цистеина до алкилирования Cys.
В другом воплощении боковую цепь активируют малеимидной группой, которая вступает в реакцию с тиоловой группой остатка цистеина, с образованием ковалентной тиол-углеродной связи.
В данном изобретении термины протрактор и линкер могут охватывать непрореагировавшие, а также прореагировавшие формы данных молекул. Из контекста, в котором используют термин, становится понятно, какую из форм имеют в виду.
В одном аспекте каждый протрактор содержит или состоит из протрактора формулы Соед. 1:
Соед. 1: НООС-(СН2)х-СО-*,
где х является целым числом в диапазоне от 10 до 18.
В альтернативных воплощениях протрактор Соед. 1 выбрано из группы протракторов, определяемой Соед. 1А, Соед. 1В и Соед. 1С
Соед. 1А: НООС-(СН2)х-СО-*,
где х является целым числом в диапазоне от 8 до 18,
Соед. 1В: НООС-бензол-O-(СН2)х-СО-*
где х является целым числом в диапазоне от 8 до 18, и
Соед. 1С; HO-S(=O)2-(CH2)x-CO-*
где х является целым числом в диапазоне от 8 до 18.
Длина углеродной цепи, определяемая х, может варьировать от 8 до 18 для каждой из различных структур Соед. 1, при этом, как описано ниже, для различных типов протракционных элементов могут быть предпочтительны более короткие или более длинные версии.
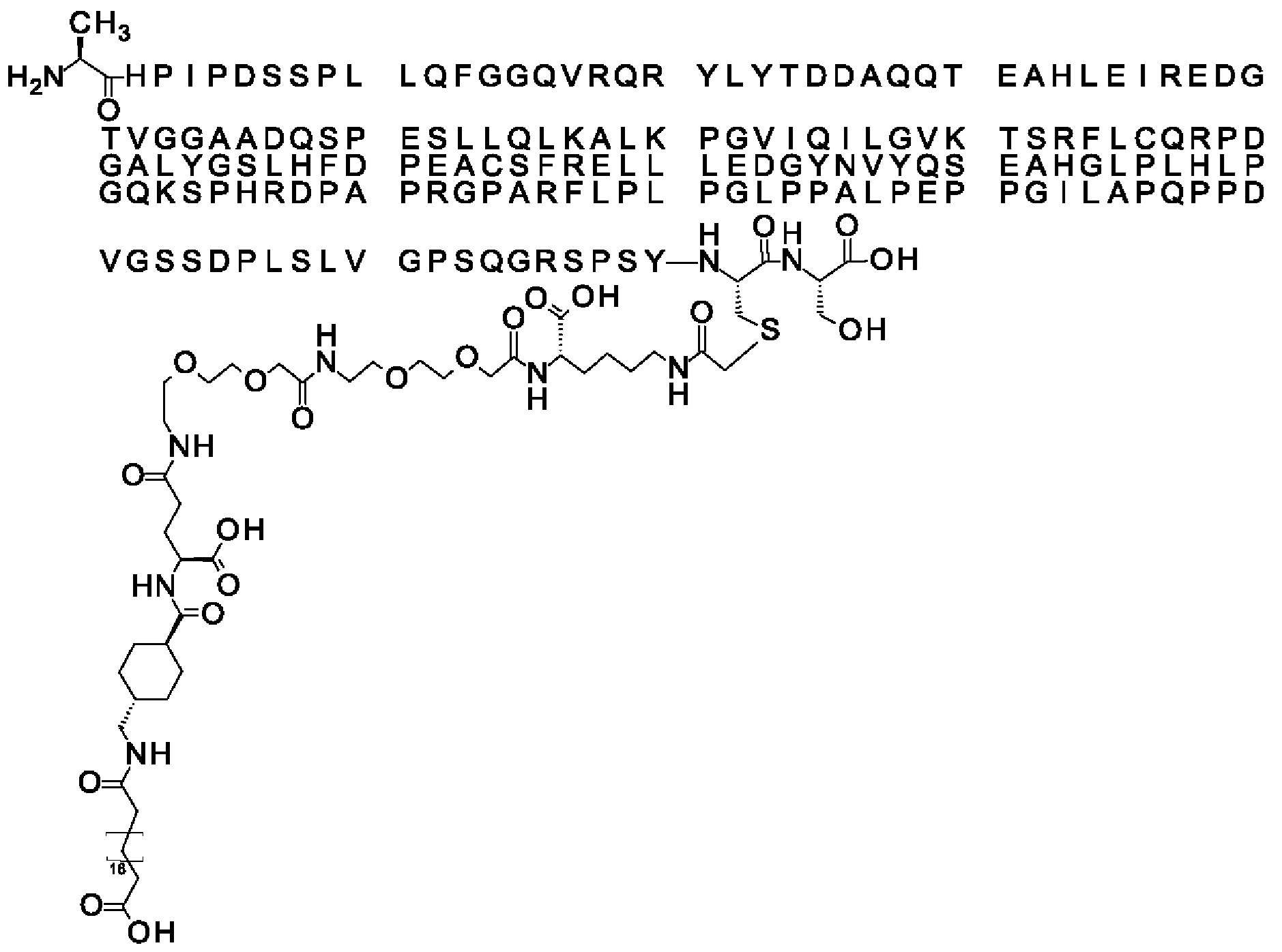
В конкретном воплощении 1А, *-(СН2)х-* относится к линейному алкилену, в котором х является целым числом в диапазоне от 10 до 18, таким как от 14 до 18 или таким как от 14 до 16.
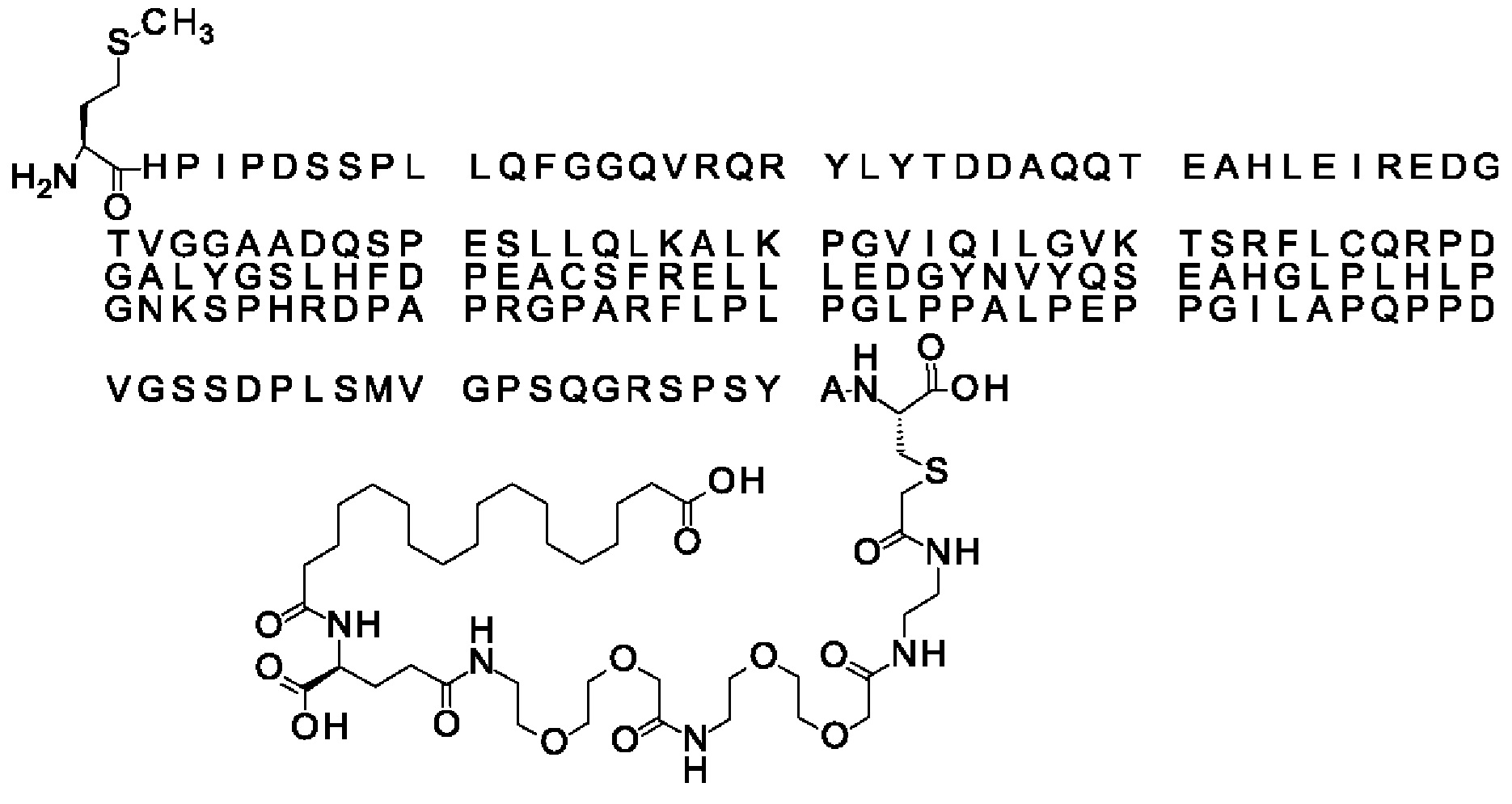
В другом конкретном воплощении 1А, *-(СН2)х-* относится к линейному алкилену, в котором х составляет 16. Данный протрактор может кратко обозначаться С18 двухосновной кислотой, т.е. дикарбоновой жирной кислотой с 18 атомами углерода. Когда х=16, структура данного линкерного элемента соответствует Соед. 1а:
Соед. 1а: HOOC-(CH2)16-CO-*.
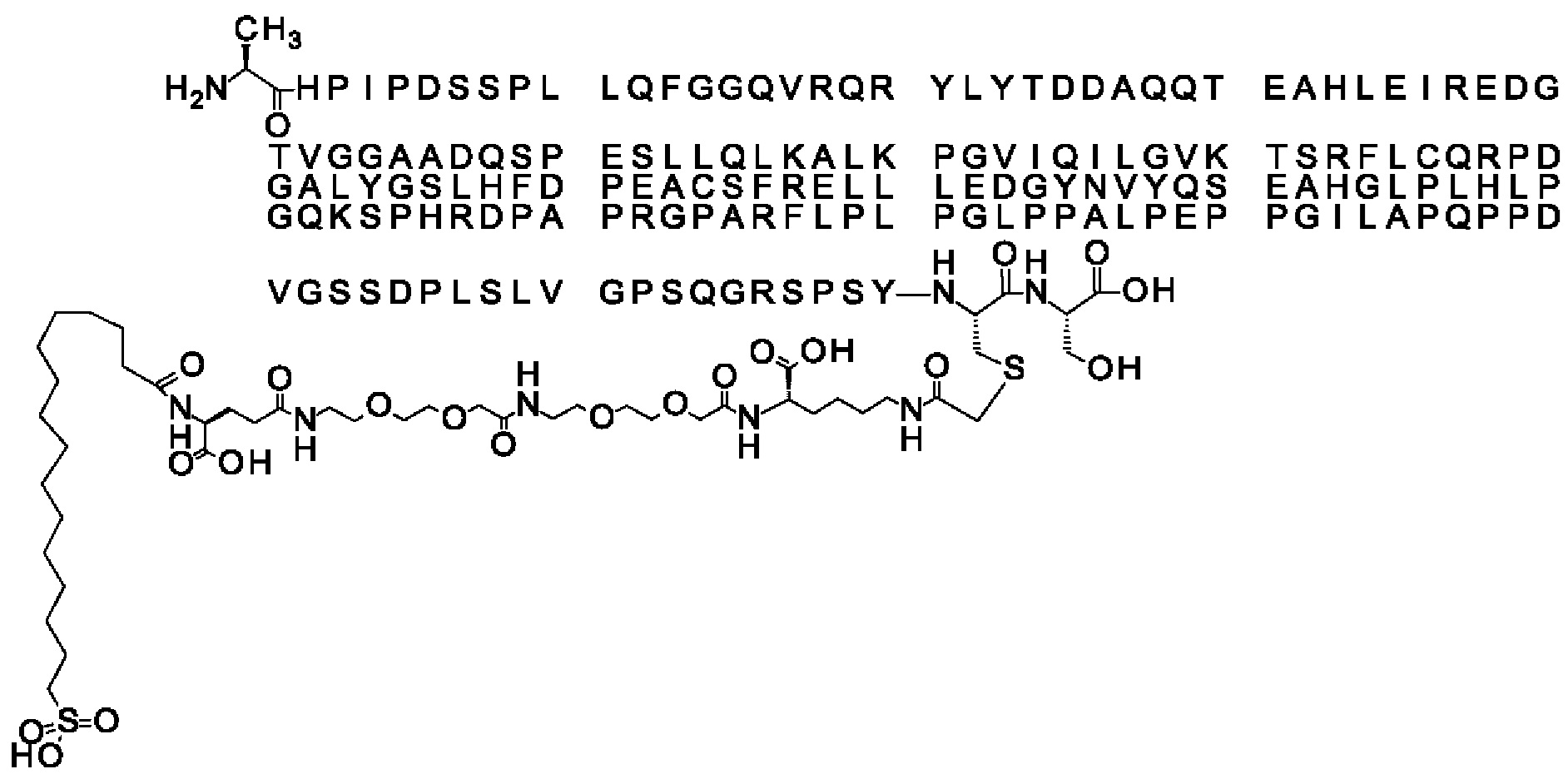
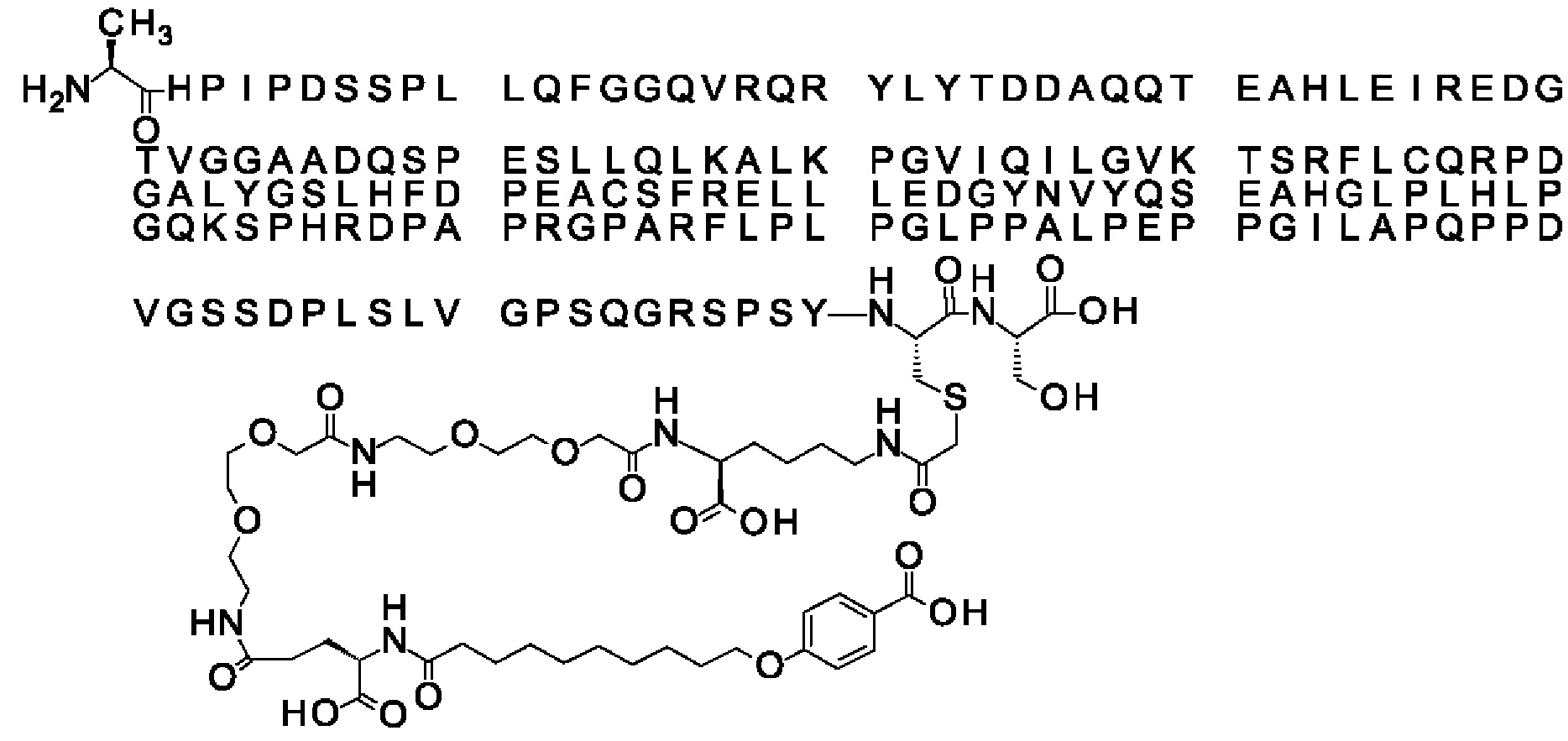
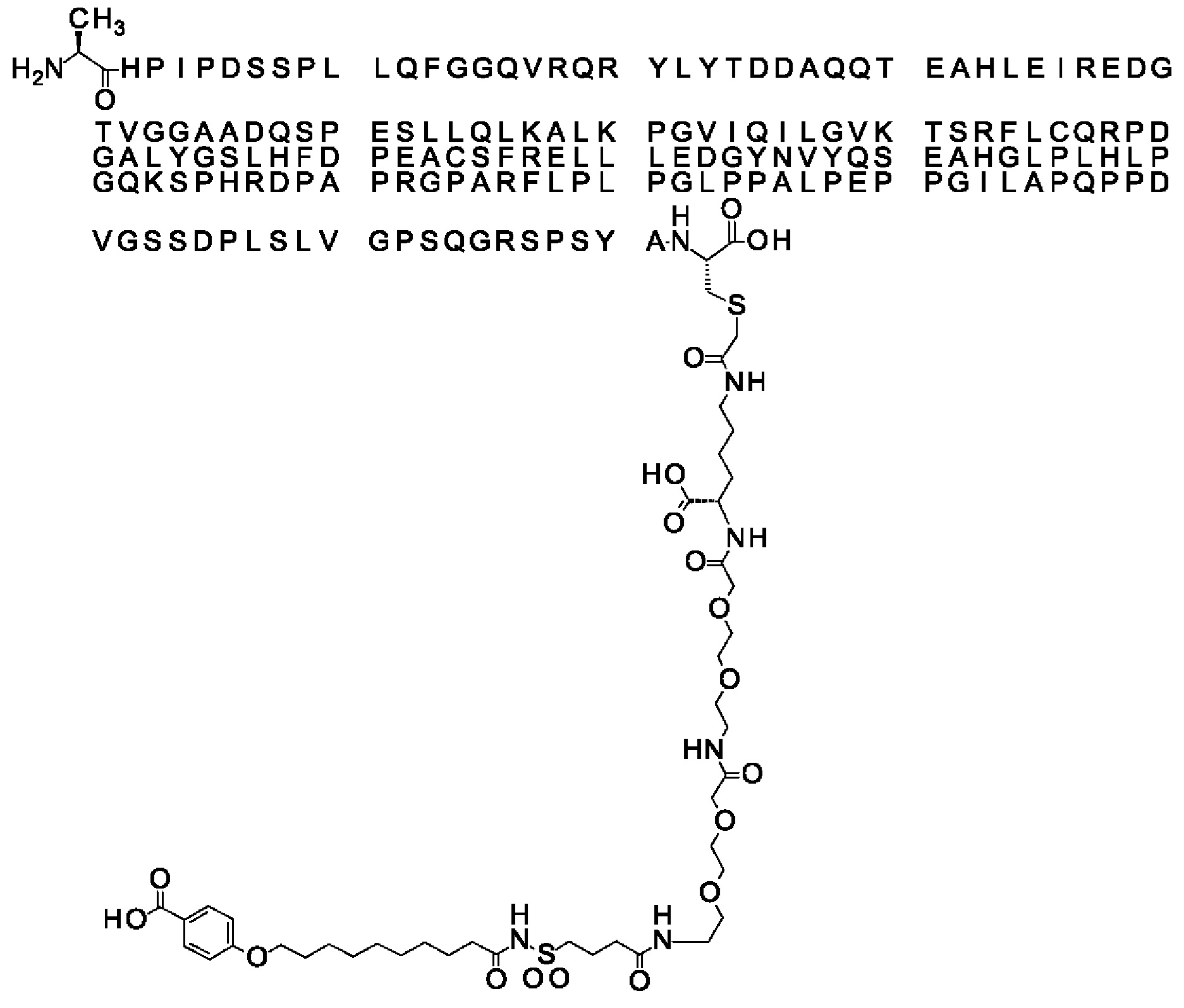
В одном воплощении протрактор представляет собой Соед. 1В. В воплощении 1В *-(СН2)х-* относится к линейному алкилену, в котором х является целым числом в диапазоне от 8 до 14. В конкретном воплощении, когда х=9, структура данного линкерного элемента соответствует Соед. 1b.
Соед. 1b: НООС-бензол-O-(СН2)9-СО*
В одном воплощении протрактор представляет собой Соед. 1С. В воплощении 1С *-(СН2)х-* относится к линейному алкилену, в котором х является целым числом в диапазоне от 10 до 18, таким как от 12 до 18 или от 14 до 18. В конкретном воплощении 1С, когда х=15, структура данного линкерного элемента соответствует Соед. 1с
Соед. 1с: HO-S(=O)2-(CH2)15-CO-*
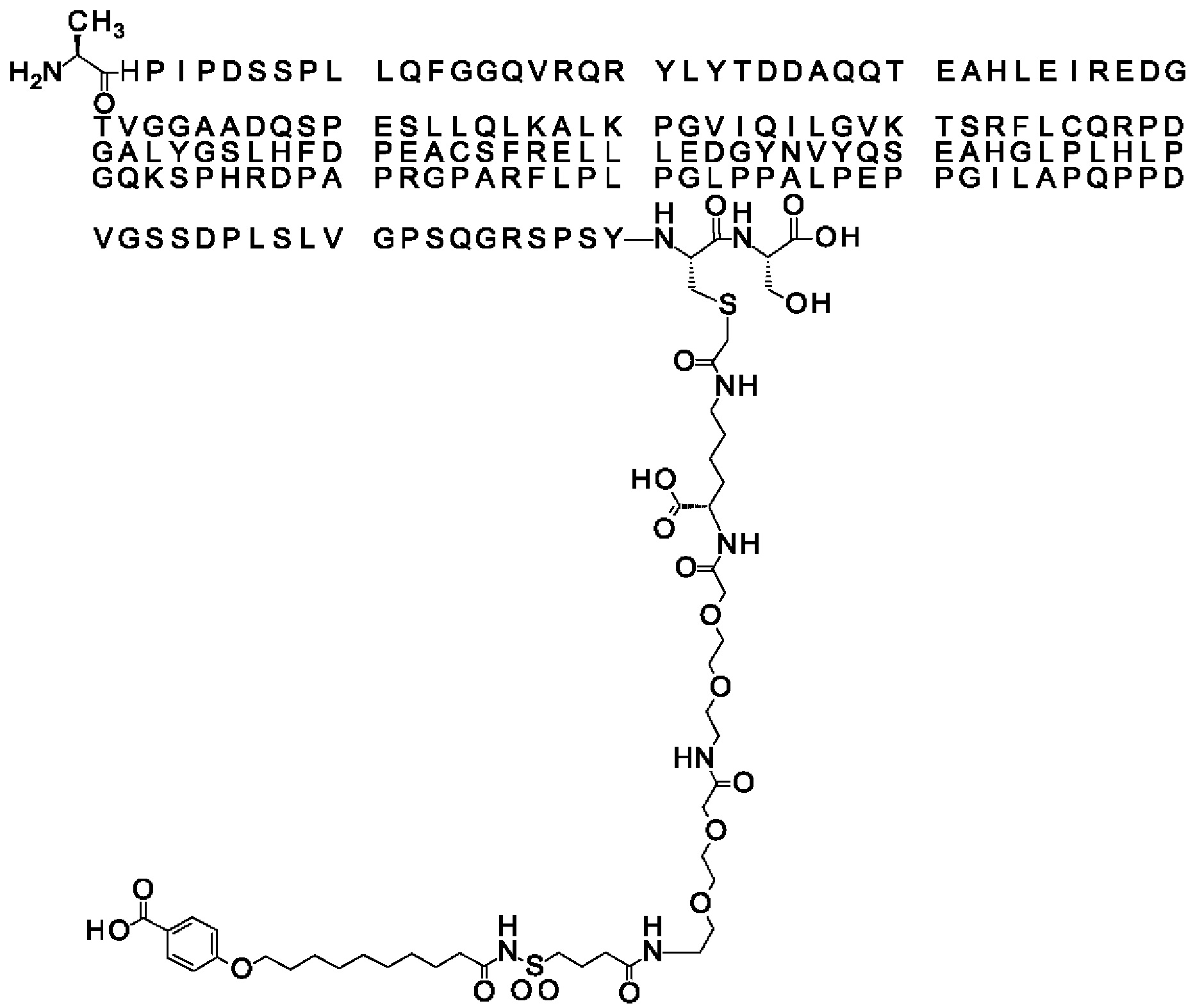
Обозначения являются стандартными в области техники, например, в приведенных выше формулах *-СО-* относится к карбонилу (*-С(=O)-*). Например, в любой формуле (R-CO-*) в данном описании (где R является таким, как определено в каждой формуле), R-CO-* обозначает R-C(=O)-*. Бензол относится к кольцевой структуре, в которой Соед. 1В замещено O-(СН2)х-* и -СООН по С1 и С4, соответственно. HO-S(=O)2 означает сульфоновую кислоту.
Линкер производного по изобретению содержит по меньшей мере один из следующих линкерных элементов: Соед. 2, Соед. 3 и Соед. 4. Элементы Соед. 2 и Соед. 3 оба имеют -NH- и СО- конец, что позволяет им присоединяться посредством амидной связи друг к другу и либо к -СО-, либо к -NH- протрактора или Соед. 4.
Соед. 4 имеет -NH- конец (способный образовывать амидную связь с Соед. 2 или Соед. 3, и -NH-CO-CH2- конец, который в непрореагировавшей форме представляет собой галоацетамид, способный вступать в реакцию с тиоловой группой цистеина аналога FGF21.
Линкер производного по изобретению содержит по меньшей мере один из следующих линкерных элементов: Соед. 2, Соед. 3 и Соед. 4,
где Соед. 2 выбрано из:
*-NH-CH(COOH)-(CH2)m-CO-*,
*-NH-S(=O)2-(CH2)m-CO-*,
*-NH-(СН2)m-циклогексан-СО-*, и
где m отдельно выбрано в виде целого числа в диапазоне от 1 до 5,
где Соед. 3 представляет собой *-NH-(CH2)2-[O-(CH2)2]k-O-[CH2]n-CO-*, где k является целым числом в диапазоне от 1 до 5, n является целым числом в диапазоне от 1 до 5, и
где Соед. 4 выбрано из:
*-NH-(CH2)m-NH-CO-CH2-* и
*-NH-CH(COOH)-(CH2)m-NH-CO-CH2-*
где m отдельно выбрано в виде целого числа в диапазоне от 1 до 5.
В одном воплощении Соед. 2 представляет собой *-NH-CH(COOH)-(CH2)m-СО-*, где m принимает значения 1, 2 или 3. В одном воплощении m принимает значения 2 или 3.
В воплощении, где m равно 2, линкерный элемент Соед. 2 может обозначаться как Соед. 2а, что означает *-NH-CH(COOH)-(CH2)2-CO-*. Линкерный элемент *-NH-CH(COOH)-(CH2)2-CO-* может кратко обозначаться gGlu, гамма Glu или γ-Glu. В gGlu для присоединения к другому линкерному элементу используется гамма-карбоксильная группа глутаминовой кислоты. В одном конкретном воплощении (каждый) линкерный элемент gGlu находится в L-форме.
В одном воплощении Соед. 2 представляет собой *-NH-S(=O)2-(CH2)m-СО-*, где m принимает значения 1, 2 или 3. В одном воплощении m принимает значения 2 или 3. Линкерный элемент *-NH-S(=O)2-(CH2)m-CO-* представляет собой производное сульфоновой кислоты, где карбокси-группа используется для присоединения к другому линкерному элементу. В одном воплощении m принимает значения 3, и линкерный элемент Соед. 2 может обозначаться как Соед. 2b: *-NH-S(=O)2-(CH2)3-CO-*.
В одном воплощении Соед. 2 представляет собой *-NH-(СН2)m-циклогексан-СО-*, где m принимает значения 1, 2 или 3. В одном воплощении m принимает значения 2 или 3. В структуре Соед. 2 циклогексановое кольцо, таким образом, замещено NH-CH2 и СО по С1 и С4, соответственно.
В одном воплощении m принимает значение 1 и линкерный элемент Соед. 2 может обозначаться Соед. 2с: *-NH-СН2-циклогексан-СО-*. Данный линкерный элемент может также обозначаться Trx.
В линкерном элементе Соед. 3, «k» и «n» оба могут варьировать от 1 до 5. Когда k=n=1, структура данного линкерного элемента соответствует Соед. 3а:
В одном воплощении Соед. 3 представляет собой Соед. 3а: *-NH-(CH2)2-O-(СН2)2-O-СН2-СО-*. Линкерный элемент Соед. 3а может кратко обозначаться Ado (8-амино-3,6-диоксаоктановая кислота), поскольку является ее бирадикалом.
В линкерном элементе Соед. 4, «m» может варьировать от 1 до 5. В одном воплощении Соед. 4 представляет собой *-NH-(CH2)m-NH-CO-CH2-*, где m принимает значения 1, 2, 3 или 4. В одном воплощении m принимает значения 2 или 3.
В одном воплощении, когда Соед. 4 представляет собой *-NH-(CH2)m-NH-CO-СН2-* и m=2, структура данного линкерного элемента соответствует Соед. 4а: *-NH-(CH2)2-NH-CO-CH2-*.
В одном воплощении Соед. 4 представляет собой *-NH-CH(COOH)-(CH2)m-NH-CO-CH2-*, где m принимает значения 1, 2, 3 или 4. В одном воплощении m принимает значения 2 или 3. В одном воплощении m принимает значения 4 или 5.
Когда Соед. 4 представляет собой *-NH-CH(COOH)-(CH2)m-NH-CO-CH2-* и m=4, структура данного линкерного элемента соответствует Соед. 4b: *-NH-CH(COOH)-(CH2)4-NH-CO-CH2-*.
Линкер производного по изобретению может содержать один или несколько указанных различных типов линкерных элементов и может также содержать один или несколько из любых отдельных элементов линкера. В одном воплощении линкер содержит только один элемент Соед. 4. В одном воплощении линкер содержит один или несколько из каждого из элементов Соед. 2 и Соед. 3 и только один элемент Соед. 4.
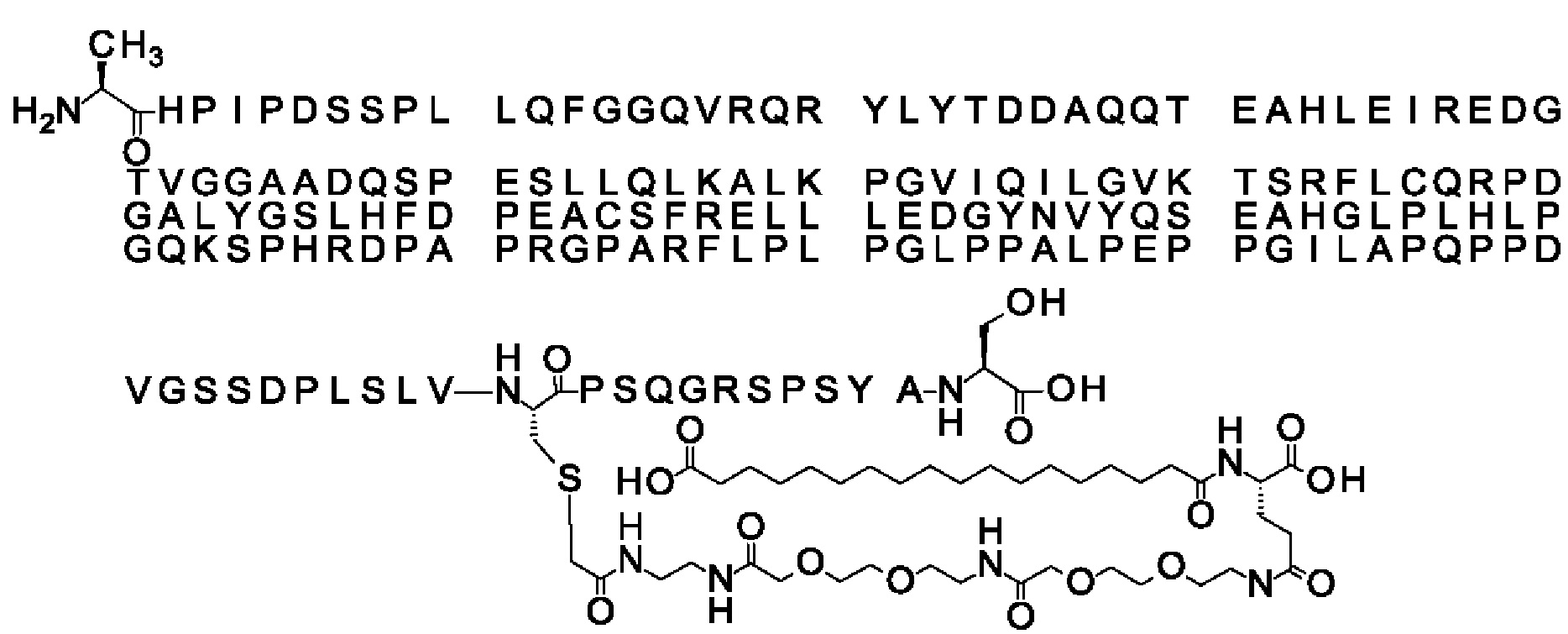
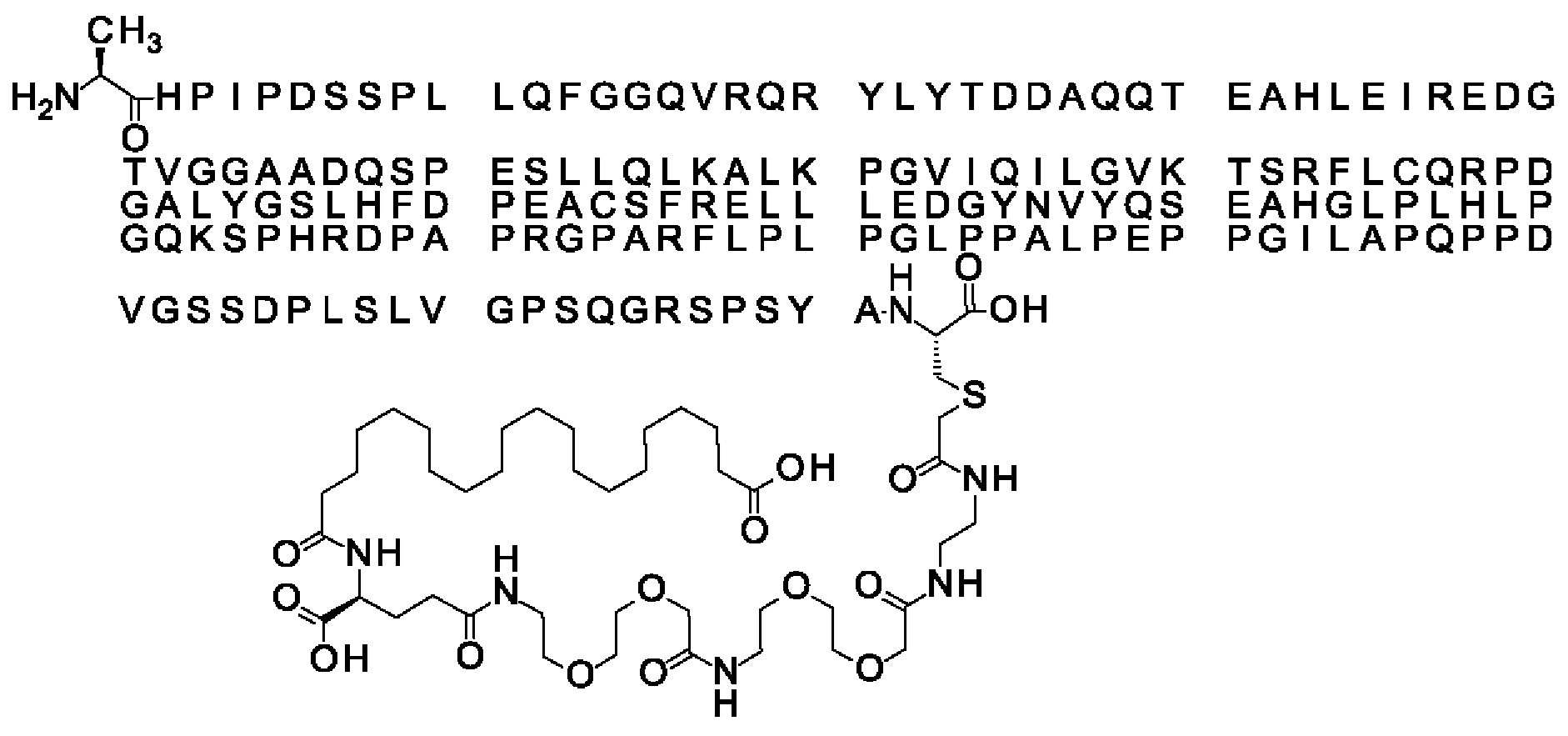
В качестве примера, не являющегося исчерпывающим, линкер может состоять из одного элемента Соед. 2, двух элементов Соед. 3а и одного элемента Соед. 4, связанных между собой амидными связями и расположенных в указанной последовательности, присоединенных своим *-NH концом к СО-* концу протрактора и своим СО-* концом к атому серы остатка Cys в положении 180 или 181 белка FGF21. Элементы Соед. 4, таким образом, связывают -СО-* конец элементов Соед. 2/Соед. 3 с атомом серы цистеина аналога FGF21.
В следующем примере линкер может состоять из двух элементов Соед. 2, таких как двух элементов Соед. 2а, двух элементов Соед. 3а и одного элемента Соед. 4, связанных между собой амидными связями и расположенными в указанной последовательности. Элементы Соед. 2 связаны своим *-NH концом с СО-* концом протрактора, а Соед. 4 связано своим СН2-* концом с атомом серы остатка Cys белка FGF21.
В одном воплощении линкер соединен с тиоловой группой Cys в положении 169, 170, 171, 172, 173, 173, 174, 175, 180 или 181 белка FGF21. В других воплощениях линкер соединен с атомом серы Cys в положении 180 или 181.
Нет необходимости упоминать, исключительно для соблюдения формальностей: Фраза «в указанной последовательности» означает, что *-NH конец упомянутого первым линкерного элемента (в данном случае, Соед. 2) присоединен к СО-* концу протрактора, а СО-* конец упомянутого последним линкерного элемента (в данном случае, Соед. 4) соединен с тиоловой группой остатка Cys белка FGF21, о котором идет речь.
В одном воплощении производное по изобретению выбрано из группы, состоящей из:
a. Соединений 13-24
b. Соединений 35-41 и/или
c. Соединений 43-56.
В следующем воплощении производное выбрано из Соединений 13-24.
В одном воплощении производное выбрано из Соединений 13-18. В одном воплощении производное выбрано из Соединений 20-24.
В одном воплощении производное выбрано из Соединений 35-41.
В одном воплощении производное выбрано из Соединений 43-56. В одном воплощении производное выбрано из Соединений 43-44 и 46-54. В одном воплощении производное выбрано из Соединений 44, 47 и 50-54.
Вместо Соед. 4 можно использовать линкерный элемент, производное малеимида, где р и q могут варьировать от 1 до 5:

Когда p=q=2, структура данного линкерного элемента соответствует N-(2-аминоэтил)-3-(-2,5-диоксо-пирролидин-1-ил)пропанамиду:
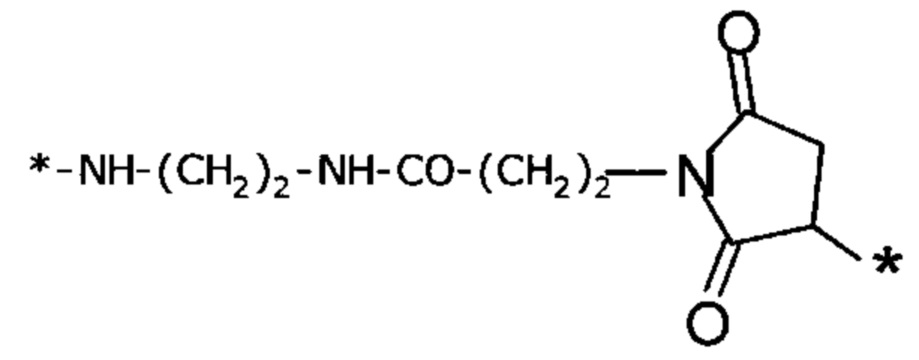
Производные по изобретению могут находиться в различных стереоизомерных формах, имеющих одинаковую молекулярную формулу и последовательность связанных атомов, но различающихся только трехмерной ориентацией атомов в пространстве. Стереоизомерия приведенных в качестве примера производных по изобретению указана в Экспериментальной части в названиях, а также в структурах, с использованием стандартной номенклатуры. Если не указано иное, изобретение относится ко всем стереоизомерным формам заявленных производных.
Функциональные свойства
Производные FGF21 по изобретению являются биологически активными. Например, они обладают высокой активностью и, дополнительно или альтернативно, могут хорошо связываться с рецепторами FGF. Дополнительно или альтернативно, они обладают пролонгированным фармакокинетическим профилем. Например, они обладают очень большим периодом полувыведения в конечной фазе при внутривенном введении мышам и/или карликовым свинкам. Данное сочетание высокой активности с большим периодом полувыведения может быть очень востребованным.
Дополнительно или альтернативно, любопытно, что производные FGF21, содержащие боковую цепь в положении, соответствующем одному из положений 167, 169, 170, 171, 172, 173, 173, 174, 175, 180 или 181 зрелого FGF21 человека, обладают высокой активностью.
Согласно первому аспекту, производные FGF21 обладают активностью FGF21. Например, производные FGF21 по изобретению обладают удивительно высокой активностью в отношении человеческих рецепторов FGF.
В первом конкретном воплощении активность, или потентность, относится к активности in vitro, т.е. эффективности в функциональных исследованиях рецепторов FGF, более конкретно, к способности активировать человеческие рецепторы FGF.
Активность in vitro можно, например, определять в тестах с цельными клетками, экспрессирующими человеческие рецепторы FGF (FGFR1c, FGFR2c или FGFR3c) и BKL. Например, ответ человеческих рецепторов FGF можно измерить, используя HEK (эмбриональные клетки почки человека), сверхэкспрессирующие бета-клото (BKL) человека. Клеткам HEK293 свойственна эндогенная экспрессия нескольких рецепторов FGF, включая FGFR1c и FGFR3c. Данные клетки не отвечают на FGF21, если их не трансфицировать корецептором BKL. Активация комплекса рецептор FGF/BKL приводит к активации сигнального пути MAPK/ERK и фосфорилированию ERK. Уровень фосфорилированной ERK (pERK) в заданный момент времени повышается с увеличением концентраций FGF21. Один не являющийся исчерпывающим пример такого анализа описан в Примере 6.
Активность in vitro можно также определять в тестах с мышиными адипоцитами 3T3-L1. Например, можно исследовать аналоги и производные FGF21 на предмет их способности усиливать захват глюкозы адипоцитами. Дифференцированным адипоцитам 3T3-L1 присуща эндогенная экспрессия FGFRIc и BKL. Клетки 3T3-L1 не отвечают на FGF21 до тех пор, пока они не дифференцируются, поскольку дифференцировка приводит к экспрессии корецептора BKL. Активация комплекса рецептор FGFR1c/BKL повышает экспрессию глюкозного транспортера 1 (GLUT1) и, таким образом, аналоги FGF21 будут приводить к дозозависимому увеличению количества глюкозы, захватываемой адипоцитами.
В качестве показателя активности лекарственного средства обычно используют значение ЕС50. Оно обозначает концентрацию соединения, о котором идет речь, индуцирующую ответ, который на кривой доза-ответ находится посередине между нулевой линией и максимумом. Проще говоря, ЕС50 представляет концентрацию, при которой наблюдается эффект, равный 50% от максимально возможного. Активность производных по изобретению in vitro можно определять, как описано выше, и определять ЕС50 производных, о которых идет речь. Чем ниже значение ЕС50, тем лучше активность.
В качестве примера, не являющегося исчерпывающим, производное FGF21 обладает активностью, которую определяли с использованием клеток HEK293, сверхэкспрессирующих бета-клото человека, которая соответствует ЕС50 менее 60 нМ при 0% HSA, предпочтительно, менее 20 нМ, или, более предпочтительно, менее 10 нМ (например, определенной, как описано в Примере 6).
В качестве примера, не являющегося исчерпывающим, производное FGF21 по изобретению обладает активностью, которую определяли по захвату глюкозы адипоцитами 3T3-L1, соответствующей ЕС50 менее 60 нМ, предпочтительно, менее 20 нМ, или, более предпочтительно, менее 10 нМ (например, определенной, как описано в Примере 7).
В качестве примера, не являющегося исчерпывающим, производное FGF21 по изобретению обладает эффективностью Emax, которую определяли по захвату глюкозы адипоцитами 3T3-L1, составляющей по меньшей мере 50%, предпочтительно, по меньшей мере 80%, или, более предпочтительно, по меньшей мере 90% (например, определенной, как описано в Примере 7).
В качестве примера, не являющегося исчерпывающим, производное FGF21 по изобретению обладает активностью, которую определяли по захвату глюкозы адипоцитами 3T3-L1, которая соответствует ЕС50 менее 60 нМ, предпочтительно, менее 20 нМ, или, более предпочтительно, менее 10 нМ (например, определенной, как описано в Примере 7), и эффективностью Emax, которую определяли по захвату глюкозы адипоцитами 3T3-L1, составляющей по меньшей мере 80%, или, более предпочтительно, по меньшей мере 90% (например, определенной, как описано в Примере 7).
Во втором конкретном воплощении активность, или потентность, относится к активности in vitro. Белки и производные по изобретению активны in vivo, что можно определить известным в области техники способом в любой подходящей модели на животных, а также в клинических исследованиях.
Ранее было показано, что уменьшение массы тела, индуцированное FGF21 у мышей без ожирения, предсказывает эффект у мышей с ожирением и, следовательно, мышей без ожирения считают хорошей скрининговой моделью. Мыши C57BL без ожирения представляют собой один пример подходящей модели на животных, а эффект снижения массы тела можно определить у таких мышей in vivo (определить, например, как описано в Примере 9).
Согласно второму аспекту, производные по изобретению несут протрактор.
Протракцию можно оценить in vitro и/или определить in vivo в фармакокинетических
исследованиях. Увеличение активности in vitro в присутствии сывороточного альбумина, значение ЕС50, указывает на аффинность к альбумину сыворотки и представляет способ предсказания пролонгированного фармакокинетического профиля исследуемого соединения в моделях на животных. Протракцию можно определить, например, как период полувыведения в конечной фазе 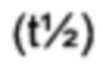 после внутривенного введения, например, мышам или карликовым свинкам.
после внутривенного введения, например, мышам или карликовым свинкам.
В качестве примера, не являющегося исчерпывающим, производное по изобретению имеет период полувыведения в конечной фазе после внутривенного введения мышам по меньшей мере 1 час, более предпочтительно, по меньшей мере 3 часа или, наиболее предпочтительно, по меньшей мере 10 часов (определенное, например, как описано в Примере 8).
В качестве другого не являющимся исчерпывающим примера, производное по изобретению имеет период полувыведения в конечной фазе после внутривенного введения карликовым свинкам по меньшей мере 2 часа, более предпочтительно, по меньшей мере 10 часов, еще более предпочтительно, по меньшей мере 20 часов или, наиболее предпочтительно, по меньшей мере 50 часов (определенное, например, как описано в Примере 8).
Согласно третьему аспекту, производные по изобретению несут протрактор и в то же время обладают очень хорошей активностью. Данное сочетание хорошей активности/связывания и большого периода полувыведения, может быть очень востребованным.
Согласно четвертому аспекту, производные по изобретению обладают хорошими биофизическими свойствами. Данные свойства включают физическую стабильность и/или растворимость, но не ограничиваются ими. Эти и другие биофизические свойства можно измерить стандартными способами, известными в области химии белков. В конкретном воплощении данные свойства улучшены по сравнению со зрелым FGF21 человека.
Другие конкретные воплощения производных по изобретению описаны в разделе, озаглавленном «Частные воплощения», предшествующем Экспериментальной части.
Получение и очистка соединения FGF21
Получение белков, например, FGF21, хорошо известно в области техники. Аналоги FGF21 могут быть получены способом, который включает культивирование клетки-хозяина, содержащей последовательность ДНК, кодирующую молекулу, и способной экспрессировать аналоги FGF21 в подходящей питательной среде в условиях, обеспечивающих экспрессию аналога FGF21. Для получения FGF21 и его аналогов можно применять несколько рекомбинантных способов. Примеры способов, которые можно применять для получения FGF21 в микроорганизмах, например, таких как Escherichia coli и Saccharomyces cerevisiae, изложены, например, в WO 12010553.
Конкретные примеры способов получения ряда производных по изобретению включены в Экспериментальный раздел. Вкратце, аналоги FGF21 дериватизируют по остатку цистеина путем алкилирования. Таким образом, с аналогом FGF21 могут реагировать боковые цепи, способные вступать в реакцию с тиолом, такие как боковые цепи, полученные с галоацетамидом. Аналог FGF21 можно получить с цистамином, защищающим тиоловую группу цистеина. В таком случае перед реакцией с аналогом, имеющим боковую цепь, способную вступать в реакцию с тиолом, такой аналог восстанавливают, например, восстанавливающим агентом, таким как фосфин.
Аналоги FGF21 и производные по данному изобретению можно очищать различными способами, известными в области техники, включая, хроматографию (например, ионообменную, аффинную, гидрофобную, хроматографическое фокусирование и эксклюзионную хроматографию), электрофоретические способы (например, препаративное изоэлектрическое фокусирование (ИЭФ), различную растворимость (например, преципитацию сульфатом аммония) или экстрагирование (см., например, Protein Purification, J.-C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989), но не ограничиваясь ими.
Пути (способы) введения
Термин «лечение» охватывает как профилактику, так и минимизацию указанных заболеваний, нарушений или состояний (т.е. «лечение» относится к профилактическому и терапевтическому введению производных FGF21 по изобретению или композиций, содержащих производные FGF21 по изобретению), если не указано иное или если это не противоречит явным образом контексту.
Способ введения может представлять собой любой способ, который эффективно доставляет соединение по данному изобретению в желаемый или соответствующий участок организма, такой как парентеральный способ, например, подкожное, внутримышечное или внутривенное введение. В альтернативном варианте, соединение по данному изобретению можно вводить пероральным, легочным, ректальным, чрескожным, трансбуккальным, подъязычным или интраназальным способом.
Фармацевтические композиции
Фармацевтические композиции, содержащие производное по изобретению или его фармацевтически приемлемую соль, амид или эфир, и фармацевтически приемлемый эксципиент, можно получать известным в области техники способом.
Термин «эксципиент» в широком смысле относится к любому компоненту, отличному от активного(ых) терапевтического(их) ингредиента(ов). Эксципиент может представлять собой инертное вещество, неактивное вещество и/или вещество, неактивное с медицинской точки зрения.
Эксципиент может служить для разных целей, например, служить носителем, наполнителем, разбавителем, вспомогательным веществом, используемым в производстве таблеток, и/или улучшать введение и/или абсорбцию активного вещества.
Композиции фармацевтически активных ингредиентов с различными эксципиентами хорошо известны в области техники, см., например, Remington: The Science and Practice of Pharmacy (например, 19th издание (1995) и любое более позднее издание).
Инъекционные композиции, содержащие соединения FGF21 по данному изобретению, можно получать стандартными способами, используемыми в фармацевтическом производстве, которые включают растворение и смешивание ингредиентов надлежащим образом для получения желаемых конечных продуктов. Так, согласно одной процедуре, соединение FGF21 по данному изобретению растворяют в подходящем буфере при подходящем значении рН, чтобы минимизировать или избежать преципитации. Инъекционную композицию готовят стерильной, например, стерилизуют фильтрованием. Также в композицию можно добавлять антимикробные агенты.
Композиция может представлять собой стабилизированную композицию. Термин «стабилизированная композиция» относится к композиции с повышенной физической и/или химической стабильностью, предпочтительно, с той и другой. Как правило, композиция должна быть стабильной в ходе применения и хранения (в соответствии с рекомендованными условиями применения и хранения) до истечения срока годности.
Термин «физическая стабильность» относится к физическому состоянию и его изменениям без нарушения ковалентных связей и, следовательно, тенденции белка образовывать биологически неактивные и/или нерастворимые агрегаты и/или фибрилляты в результате воздействия температурно-механического стресса и/или взаимодействия с нарушающими стабильность границами раздела и поверхностями (такими как гидрофобные поверхности). Физическую стабильность водной композиции белка можно оценивать визуально и/или путем измерения мутности и/или измерения концентрации после воздействия механического/физического стресса (например, встряхивания) при различных температурах в течение различного времени. В альтернативном варианте физическую стабильность можно оценить с помощью спектроскопического агента или зонда, позволяющего зарегистрировать изменение конформационного статуса белка, например, такого как тиофлавин Т или зондов, связывающихся с «гидрофобными участками».
Термин «химическая стабильность» относится к химическим (в частности, ковалентным) изменениям ковалентных связей в структуре белка, приводящим к образованию продуктов химической деградации, возможно обладающих сниженной биологической активностью и/или повышенной иммуногенностью по сравнению с интактным белком. Химическую стабильность можно оценить путем измерения количества продуктов химической деградации в различные моменты времени после воздействия различных внешних условий, например, при помощи эксклюзионной ВЭЖХ, обращенно-фазовой ВЭЖХ, жидкостной хроматомасс-спектрометрии и/или пептидного картирования.
В одном аспекте изобретения предложены производные FGF21 с улучшенной физической стабильностью. В одном аспекте изобретения предложены производные FGF21 с улучшенной химической стабильностью.
Комбинированная терапия
Терапию производным FGF21 по данному изобретению можно также осуществлять в сочетании с одним или несколькими дополнительными фармацевтически активными веществами, например, выбранными из антидиабетических агентов, агентов против ожирения, агентов, регулирующих аппетит, анти-гипертензивных агентов, агентов для лечения и/или предупреждения осложнений, являющихся следствием диабета или ассоциированных с диабетом, и агентов для лечения и/или предупреждения осложнений и расстройств, являющихся следствием ожирения или ассоциированных с ожирением.
Примерами таких фармакологически активных веществ являются: агонисты рецептора GLP-1, инсулин, ингибиторы DPP-IV (дипептидилпептидазы-IV), агонисты амилина и агонисты рецептора лептина.
Медицинские показания
Данное изобретение также относится к производным по изобретению, для применения в качестве лекарственных средств.
В частных воплощениях производное по изобретению можно применять в следующих терапевтических способах лечения:
(i) профилактика и/или лечение всех форм диабета, таких как гипергликемия, диабет 2 типа, нарушение толерантности к глюкозе, диабет 1 типа, инсулиннезависимый диабет, MODY-диабет (от англ. maturity onset diabetes of the young, диабет взрослого типа у молодых лиц), гестационный диабет и/или для снижения HbA1C;
(ii) отсрочивание или предупреждение прогрессирования диабетического заболевания, такого как прогрессирование диабета 2 типа, отсрочивание прогрессирования нарушенной толерантности к глюкозе (НТГ) в инсулинозависимый диабет 2 типа, отсрочивание или предупреждение инсулинорезистентности и/или отсрочивание прогрессирования инсулин-независимого диабета 2 типа в инсулинозависимый диабет 2 типа;
(iii) улучшение функции β-клеток, такое как уменьшение апоптоза β-клеток, усиление функции β-клеток и/или увеличение массы β-клеток, и/или для восстановления чувствительности β-клеток к глюкозе;
(iv) профилактика и/или лечение нарушений пищевого поведения, таких как ожирение, например, за счет уменьшения потребления пищи, увеличения расхода энергии, уменьшения массы тела, подавления аппетита, индуцирования насыщения; лечение или предупреждение компульсивного переедания, нервной булимии и/или ожирения, вызванного введением нейролептических или стероидных препаратов; и/или профилактика и/или лечение сопутствующих ожирению заболеваний, таких как остеоартрит и/или недержание мочи;
(v) профилактика и/или лечение осложнений диабета, таких как нефропатия;
(vi) улучшение параметров липидного обмена, такое как профилактика и/или лечение дислипидемии, снижение общих липидов сыворотки; увеличение ЛПВП; снижение мелких компактных ЛПНП; снижение ЛПОНП; снижение триглицеридов; снижение холестерина; снижение уровней липопротеина a (Lp(a)) в плазме человека; ингибирование образования аполипопротеина а (аро(а)) in vitro и/или in vivo;
(vii) профилактика и/или лечение сердечно-сосудистых заболеваний, таких как синдром X, атеросклероз, инфаркт миокарда, ишемическая болезнь сердца, повреждение, вызванное реперфузией, инсульт, церебральная ишемия, кардиологическое заболевание или сердечно-сосудистое заболевание, гипертрофия левого желудочка, атеросклеротическая болезнь сердца, гипертензия, эссенциальная гипертензия, острый гипертонический криз, кардиомиопатия, сердечная недостаточность, непереносимость физической нагрузки, острая и/или хроническая сердечная недостаточность, аритмия, дизритмия сердца, потеря сознания, стенокардия, реокклюзия сердечно-легочного шунта и/или стента, перемежающаяся хромота (облитерирующий атеросклероз), диастолическая дисфункция и/или систолическая дисфункция; и/или снижение кровяного давления, такое как снижение систолического кровяного давления;
(viii) профилактика и/или лечение стеатоза печени и/или неалкогольной жировой болезни печени (НАЖБП) и/или
(ix) профилактика и/или лечение критических заболеваний, такое как лечение критически больных пациентов, пациентов, страдающих критической полинефропатией (CIPNP) и/или пациентов с возможной CIPNP, профилактика развития критических заболеваний или CIPNP; профилактика, лечение и/или устранение у пациентов синдрома системной воспалительной реакции (SIRS); профилактика или уменьшение вероятности развития у пациента бактериемии, септицемии и/или септического шока в ходе госпитализации.
В частном воплощении показания выбраны из группы, состоящей из (i)-(vii). В другом частном воплощении показания выбраны из группы, состоящей из i), (iv), (vi) и/или (vii). Наиболее предпочтительны следующие показания: Диабет 2 типа и/или ожирение. В одном воплощении соединения по изобретению предназначены для лечения диабета 2 типа. В одном воплощении соединения по изобретению предназначены для лечения ожирения.
Частные воплощения
Ниже приведены частные воплощения изобретения:
1. Производное белка FGF21,
где указанный белок содержит остаток Cys в положении, соответствующем положению 167, 169, 170, 171, 172, 173, 174, 175, 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1),
где указанное производное содержит протрактор, присоединенный к указанному остатку Cys посредством линкера;
где протрактор выбран из группы
Соед. 1А: НООС-(СН2)х-СО-*,
Соед. 1В: НООС-бензол-O-(СН2)х-СО-* и
Соед. 1С: HO-S(=O)2-(CH2)x-CO-*
где х является целым числом в диапазоне от 8 до 18, и
где линкер содержит по меньшей мере одно из каждого из Соед. 2, Соед. 3 и Соед. 4:
где Соед. 2 выбрано из:
*-NH-CH(COOH)-(CH2)m-CO-*,
*-NH-S(=O)2-(CH2)m-CO-* и
*-NH-(СН2)m-циклогексан-СО-*,
где m является целым числом в диапазоне от 1 до 5,
где Соед. 3 представляет собой *-NH-(CH2)2-[O-(CH2)2]k-O-[CH2]n-CO-*, где k является целым числом в диапазоне от 1 до 5, n является целым числом в диапазоне от 1 до 5, и
где Соед. 4 выбрано из:
*-NH-(CH2)m-NH-CO-CH2-* и
*-NH-CH(COOH)-(CH2)m-NH-CO-CH2-*
где m является целым числом в диапазоне от 1 до 5, и
где Соед. 2, Соед. 3 и Соед. 4 связаны друг с другом посредством амидной связи в указанной последовательности, присоединены своим *-NH концом к СО-* концу протрактор, а своим СН2-* концом к атому серы остатка Cys в положении, соответствующем положению 167, 169, 170, 171, 172, 173, 174, 175, 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1), или его фармацевтически приемлемые соль, амид или эфир.
2. Производное по воплощению 1, где указанный белок содержит остаток Cys в положении 170, 171, 172, 173, 174, 175, 180 или положении 181.
3. Производное по воплощению 1, где указанный белок содержит остаток Cys в положении 170, 173, 174, 175, 180 или положении 181.
4. Производное по любому из предшествующих воплощений, где Соед. 2 выбрано из группы:
Соед. 2а: *-NH-CH(COOH)-(CH2)2-CO-*,
Соед. 2b: *-NH-S(=O)2-(CH2)3-CO-* и
Соед. 2с: *-NH-СН2-циклогексан-СО-*.
5. Производное по воплощению 1, где Соед. 4 выбрано из:
Соед. 4а: *-NH-(CH2)2-NH-CO-CH2-*.
Соед. 4b: *-NH-CH(COOH)-(CH2)4-NH-CO-CH2-*.
6. Производное белка FGF21, где указанный белок содержит остаток Cys в положении, соответствующем положению 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1), и, самое большее, 30 аминокислотных модификаций при сравнении со зрелым FGF21 человека (SEQ ID NO: 1);
где указанное производное содержит протрактор, присоединенный к указанному остатку Cys посредством линкера;
где протрактор выбран из группы
Соед. 1А: НООС-(СН2)х-СО-*,
где х является целым числом в диапазоне от 10 до 18,
Соед. 1В: НООС-бензол-O-(СН2)х
где х является целым числом в диапазоне от 8 до 18,
и
Соед. 1С: HO-S(=O)2-(CH2)x
где х является целым числом в диапазоне от 10 до 18,
где линкер содержит по меньшей мере одно из каждого из Соед. 2, Соед. 3 и Соед. 4:
Соед. 2: *-NH-CH(COOH)-(CH2)2-CO-*,
Соед. 3: *-NH-(CH2)2-[O-(CH2)2]k-O-[CH2]n-CO-*, и
Соед. 4: *-NH-(CH2)m-NH-CO-CH2-*,
где k является целым числом в диапазоне от 1 до 5, n является целым числом в диапазоне от 1 до 5, и m является целым числом в диапазоне от 1 до 5;
и
где Соед. 2, Соед. 3 и Соед. 4 связаны друг с другом посредством амидной связи в указанной последовательности, присоединены своим *-NH концом к СО-* концу протрактора, а своим -СН2-* концом к атому серы остатка Cys в положении, соответствующем положению 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1), или его фармацевтически приемлемые соль, амид или эфир.
7. Производное по любому из предшествующих воплощений, где Соед. 1 выбрано из группы:
Соед. 1а: НООС-(СН2)16-СО-*,
Соед. 1b: НООС-бензол-O-(СН2)9-СО-* и
Соед. 1с: HO-S(=O)2-(CH2)15-CO-*
8. Производное белка FGF21,
где указанный белок содержит остаток Cys в положении, соответствующем положению 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1), где указанное производное содержит протрактор, присоединенный к указанному остатку Cys посредством линкера;
где протрактор представляет собой
Соед. 1: НООС-(СН2)х-СО-*,
где х является целым числом в диапазоне от 10 до 18, и
где линкер содержит по меньшей мере одно из каждого из Соед. 2, Соед. 3 и Соед. 4:
Соед. 2: *-NH-CH(COOH)-(CH2)2-CO-*,
Соед. 3: *-NH-(CH2)2-[O-(CH2)2]k-O-[CH2]n-CO-*, и
Соед. 4: *-NH-(CH2)m-NH-CO-CH2-*,
где k является целым числом в диапазоне от 1 до 5, n является целым числом в диапазоне от 1 до 5, и m является целым числом в диапазоне от 1 до 5;
где Соед. 2, Соед. 3 и Соед. 4 связаны друг с другом посредством амидной связи в указанной последовательности, присоединены своим *-NH концом к СО-* концу протрактора, а своим -СН2-* концом к атому серы остатка Cys в положении, соответствующем положению 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1), или его фармацевтически приемлемые соль, амид или эфир.
9. Производное белка FGF21,
где указанный белок содержит остаток Cys в положении, соответствующем положению 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1), и, самое большее, 30 аминокислотных модификаций при сравнении со зрелым FGF21 человека (SEQ ID NO: 1);
где указанное производное содержит протрактор, присоединенный к указанному остатку Cys посредством линкера;
где протрактор представляет собой
Соед. 1: НООС-(СН2)х-СО-*,
где х является целым числом в диапазоне от 10 до 18, и
где линкер содержит по меньшей мере одно из каждого из Соед. 2, Соед. 3 и Соед. 4:
Соед. 2: *-NH-CH(COOH)-(CH2)2-CO-*,
Соед. 3: *-NH-(CH2)2-[O-(CH2)2]k-O-[CH2]n-CO-*, и
Соед. 4: *-NH-(CH2)m-NH-CO-CH2-*,
где k является целым числом в диапазоне от 1 до 5, n является целым числом в диапазоне от 1 до 5, и m является целым числом в диапазоне от 1 до 5;
где Соед. 2, Соед. 3 и Соед. 4 связаны друг с другом посредством амидной связи в указанной последовательности, присоединены своим *-NH концом к СО-* концу протрактора, а своим -СН2-* концом к тиоловой группе остатка Cys в положении, соответствующем положению 180 или положению 181 зрелого FGF21 человека (SEQ ID NO: 1), или его фармацевтически приемлемые соль, амид или эфир.
10. Производное по любому из предшествующих воплощений, где указанный белок содержит остаток Cys в положении, соответствующем положению 180 зрелого FGF21 человека (SEQ ID NO: 1).
11. Производное по любому из предшествующих воплощений, где указанный белок имеет, самое большее, 30, например, 25, например, 20, например, 15, например, 10, например, 8, например, самое большее, 5 аминокислотных модификаций при сравнении со зрелым FGF21 человека (SEQ ID NO: 1).
12. Производное по любому из предшествующих воплощений, где указанный белок имеет 4 или 5 аминокислотных модификаций при сравнении со зрелым FGF21 человека (SEQ ID NO: 1).
13. Производное по любому из предшествующих воплощений, где указанный белок имеет 4 аминокислотные модификации при сравнении со зрелым FGF21 человека (SEQ ID NO: 1).
14. Производное по любому из предшествующих воплощений, где указанный белок FGF идентичен по меньшей мере на 80%, например, на 85%, например, на 90%, например, на 95% зрелому FGF21 человека (SEQ ID NO: 1).
15. Производное по любому из предшествующих воплощений, где указанный белок FGF идентичен по меньшей мере на 96%, например, на 97%, например, на 98%, например, на 99% зрелому FGF21 человека (SEQ ID NO: 1).
16. Производное по любому из предшествующих воплощений, где аминокислотные замены находятся в одном или более положений, соответствующих одному или более из положений 121, 168, 180 или 181 зрелого FGF21 человека (SEQ ID NO: 1).
17. Производное по любому из предшествующих воплощений, где одна из аминокислотных замен представляет собой добавление остатка Ala в положении, соответствующем N-концу зрелого FGF21 человека (SEQ ID NO: 1).
18. Производное по любому из предшествующих воплощений, где белок содержит Ala на N-конце указанного белка.
19. Производное по любому из предшествующих воплощений, где белок содержит 121Q.
20. Производное по любому из предшествующих воплощений, где белок содержит 168L.
21. Производное по любому из предшествующих воплощений, где белок содержит аминокислотную последовательность SEQ ID NO: 8 или 10.
22. Производное по любому из предшествующих воплощений, где белок содержит аминокислотную последовательность SEQ ID NO: 8, 10, 12, 15, 16, 17, 18, 19 или 20.
23. Производное по любому из предшествующих воплощений, где Соед. 1 представляет собой 1А или 1С и х является целым числом в диапазоне от 12 до 18.
24. Производное по любому из предшествующих воплощений, где Соед. 1 представляет собой 1А или 1С и х является целым числом в диапазоне от 14 до 16.
25. Производное по любому из предшествующих воплощений, где Соед. 1 представляет собой 1В и х является целым числом в диапазоне от 8 до 12.
26. Производное по любому из предшествующих воплощений, где х представляет собой 16.
27. Производное по любому из предшествующих воплощений, где k является целым числом в диапазоне от 1 до 2.
28. Производное по любому из предшествующих воплощений, где k принимает значение 1.
29. Производное по любому из предшествующих воплощений, где n является целым числом в диапазоне от 1 до 2.
30. Производное по любому из предшествующих воплощений, где n принимает значение 1.
31. Производное по любому из предшествующих воплощений, где m в Соед. 4 является целым числом в диапазоне от 1 до 5.
32. Производное по любому из предшествующих воплощений, где m в Соед. 4 принимает значение 2.
33. Производное по любому из предшествующих воплощений, где протрактор содержит Соед. 1а: HOOC-(CH2)16-CO-*.
34. Производное по любому из предшествующих воплощений, где протрактор состоит из Соед. 1а: HOOC-(CH2)14-CO-*.
35. Производное по любому из предшествующих воплощений, где линкер содержит Соед. 3а: *-NH-(CH2)2-O-(CH2)2-O-CH2-CO-*.
36. Производное по любому из предшествующих воплощений, где линкер содержит Соед. 4а: *-NH-(CH2)2-NH-CO-CH2-*.
37. Производное по любому из предшествующих воплощений, где линкер состоит по меньшей мере из одного элемента, представляющего собой Соед. 2, двух элементов, представляющих собой Соед. 3, и одного элемента, представляющего собой Соед. 4.
38. Производное по любому из предшествующих воплощений, где линкер состоит из одного элемента, представляющего собой Соед. 2, двух элементов, представляющих собой Соед. 3, и одного элемента, представляющего собой Соед. 4.
39. Производное по любому из предшествующих воплощений, где линкер состоит из двух элементов, представляющих собой Соед. 2, двух элементов, представляющих собой Соед. 3, и одного элемента, представляющего собой Соед. 4.
40. Производное по любому из предшествующих воплощений, где линкер состоит из одного элемента, представляющего собой Соед. 2, двух элементов, представляющих собой Соед. 3а, и одного элемента, представляющего собой Соед. 4а.
41. Производное по любому из предшествующих воплощений, где производное представляет собой одно из следующего:
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(11-карбоксиундеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21 (Соединение 13)
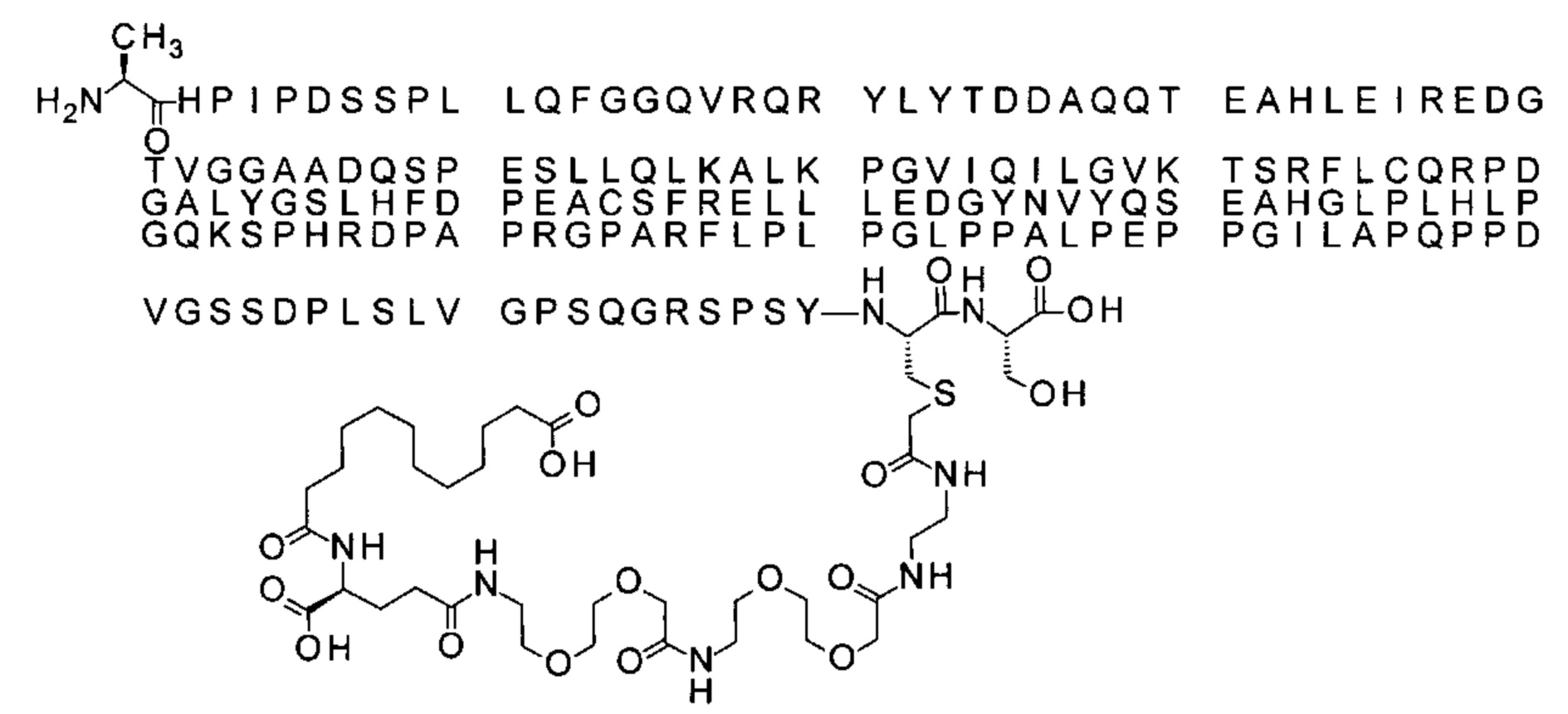
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21 (Соединение 14)
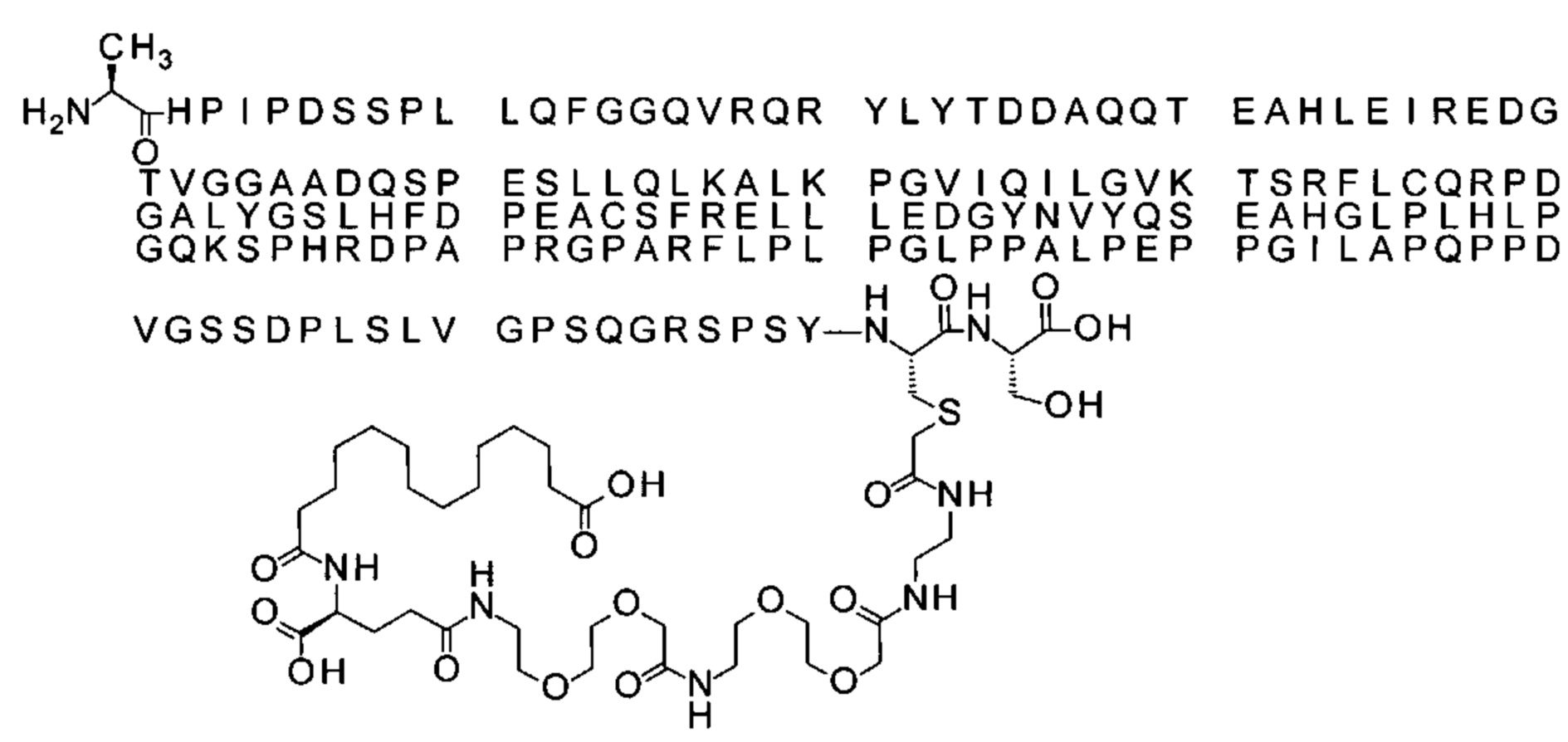
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21 (Соединение 15)
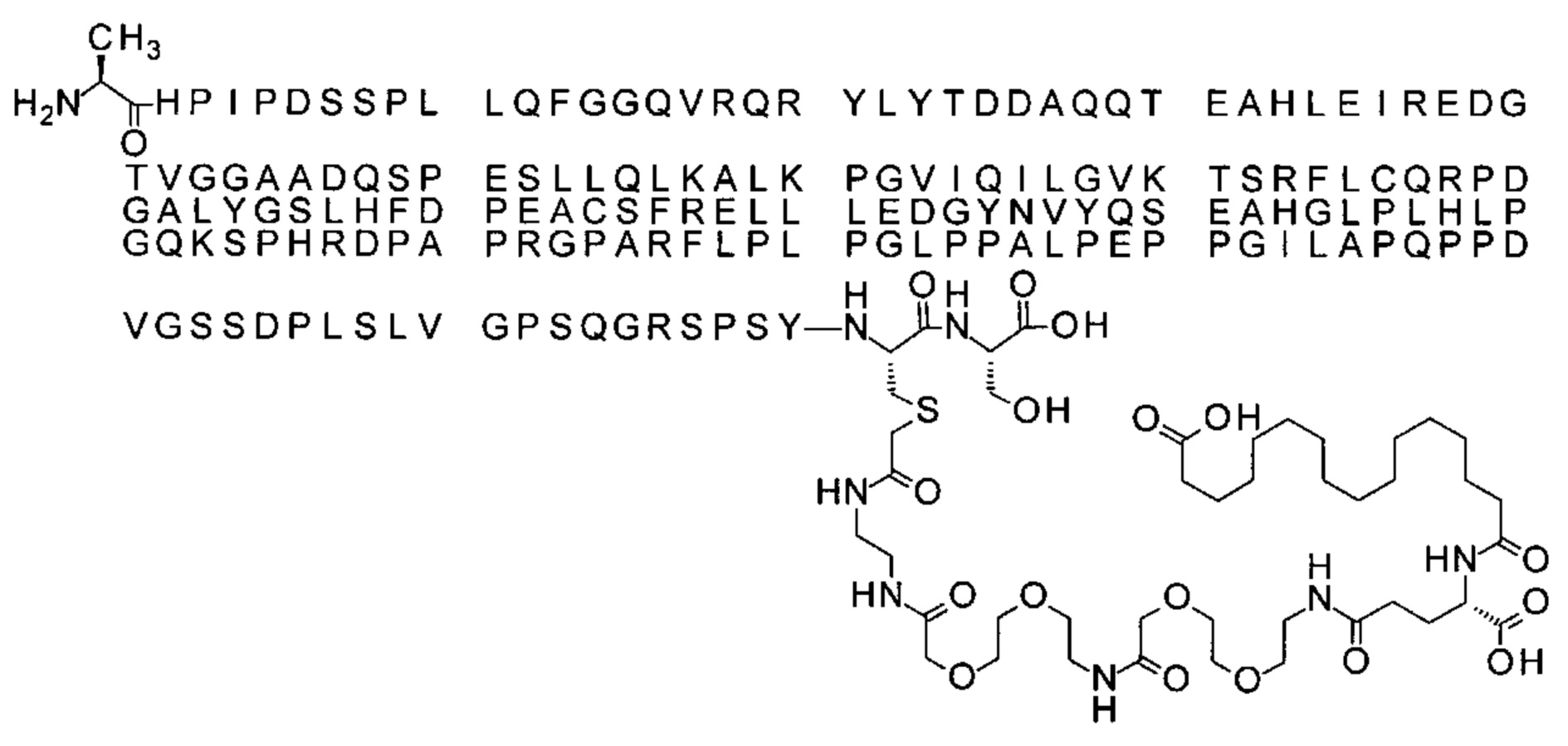
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21 (Соединение 16)
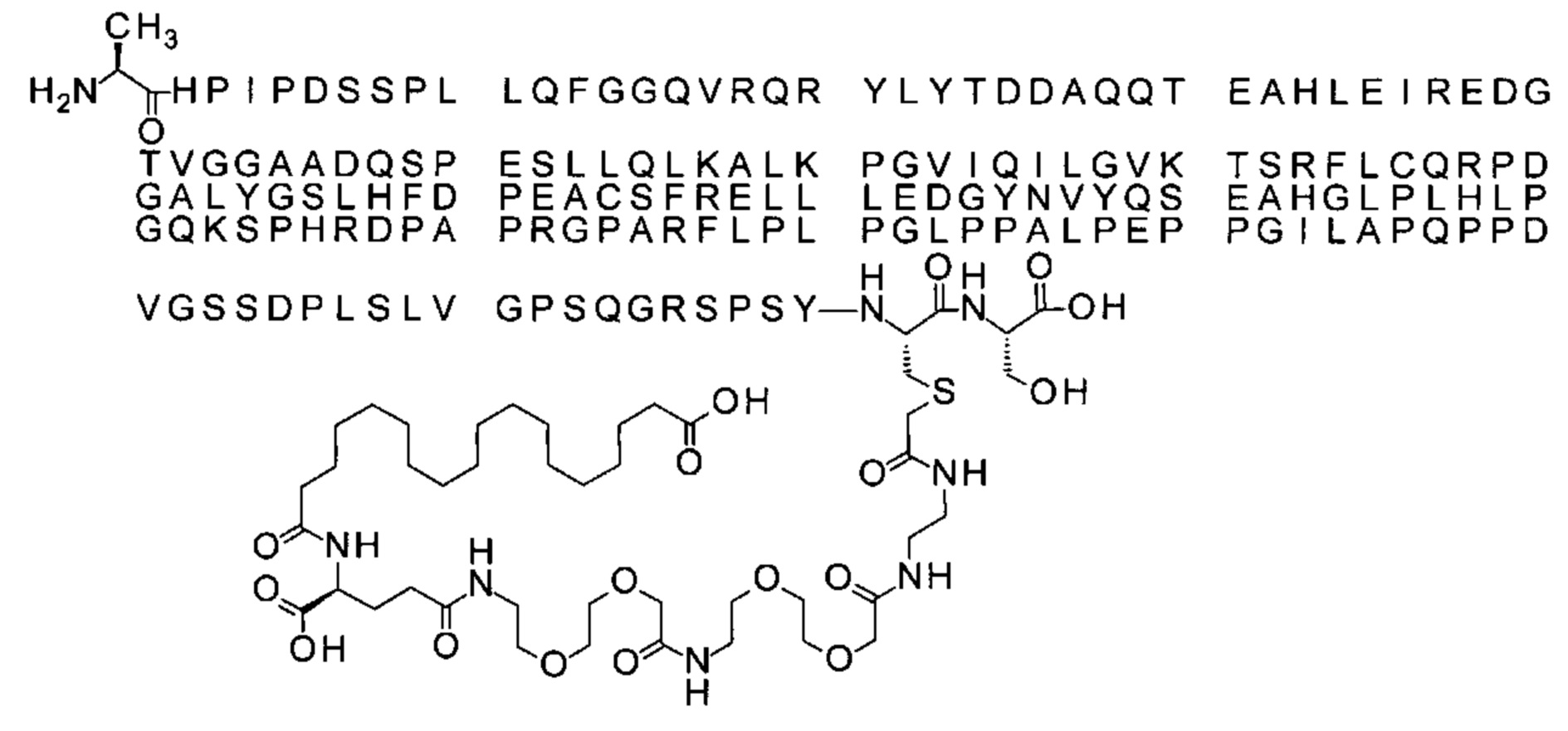
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(19-карбоксинонадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21 (Соединение 17)
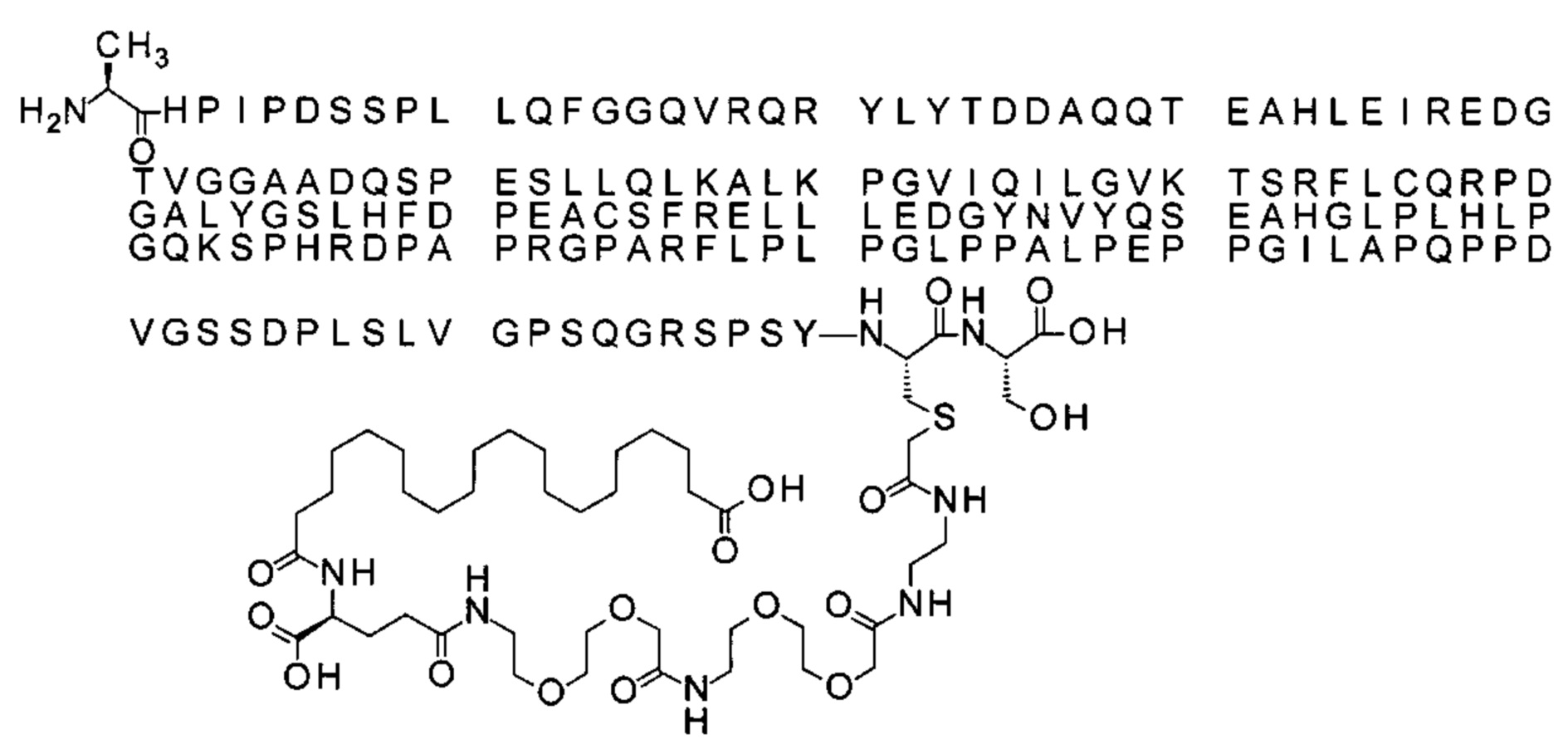
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180,des181]FGF21 (Соединение 18)
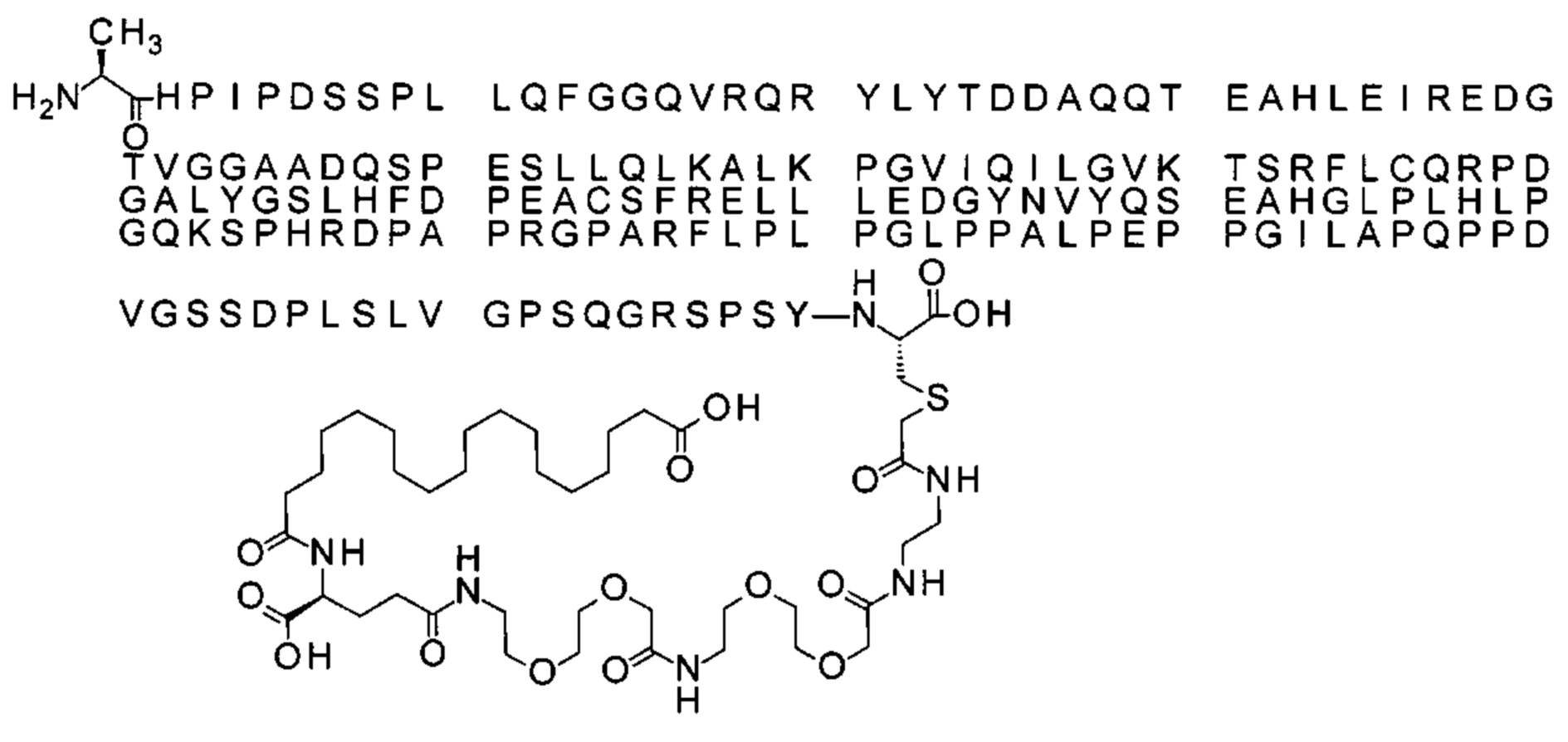
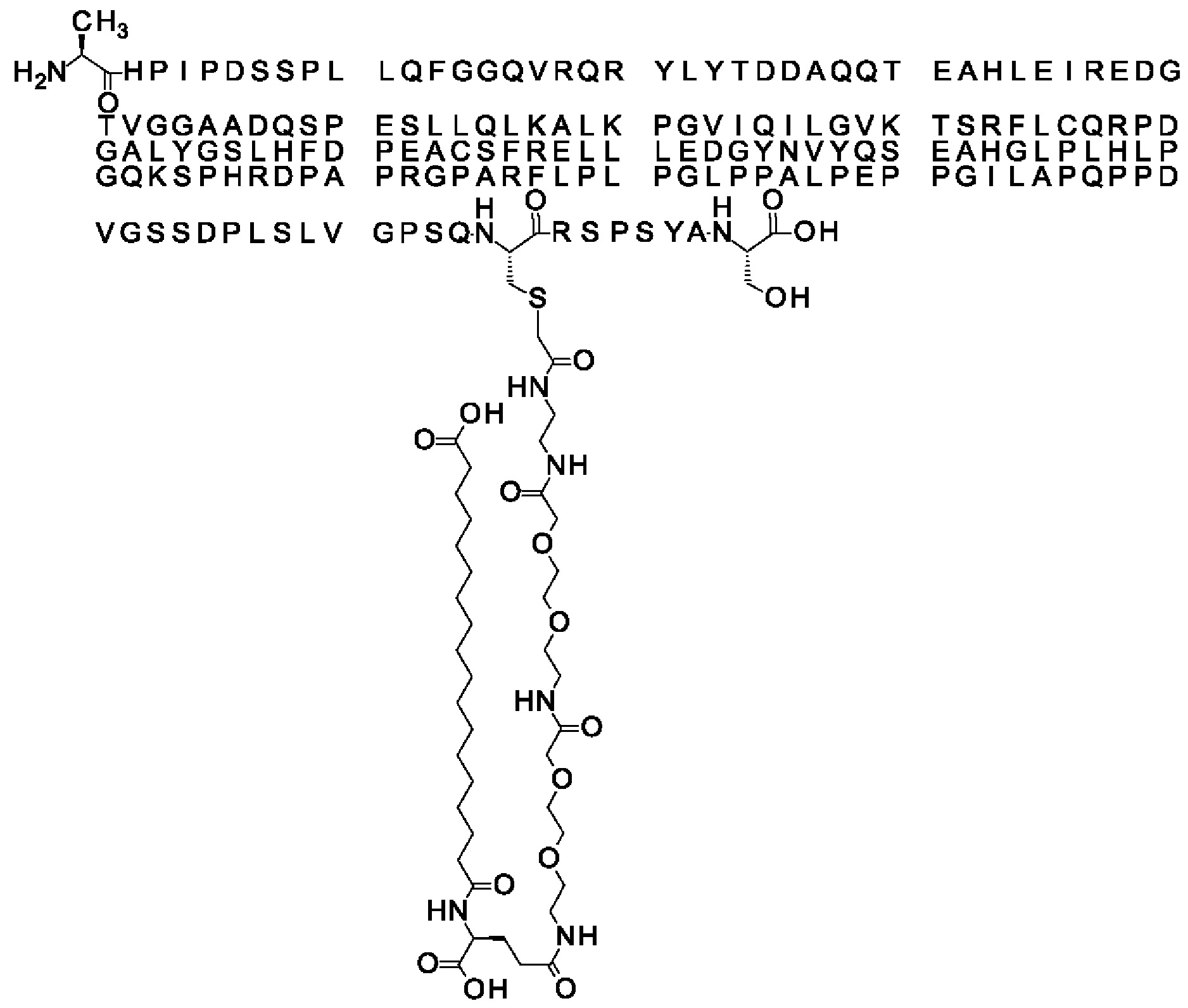
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(11-карбоксиундеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys181]FGF21 (Соединение 19)
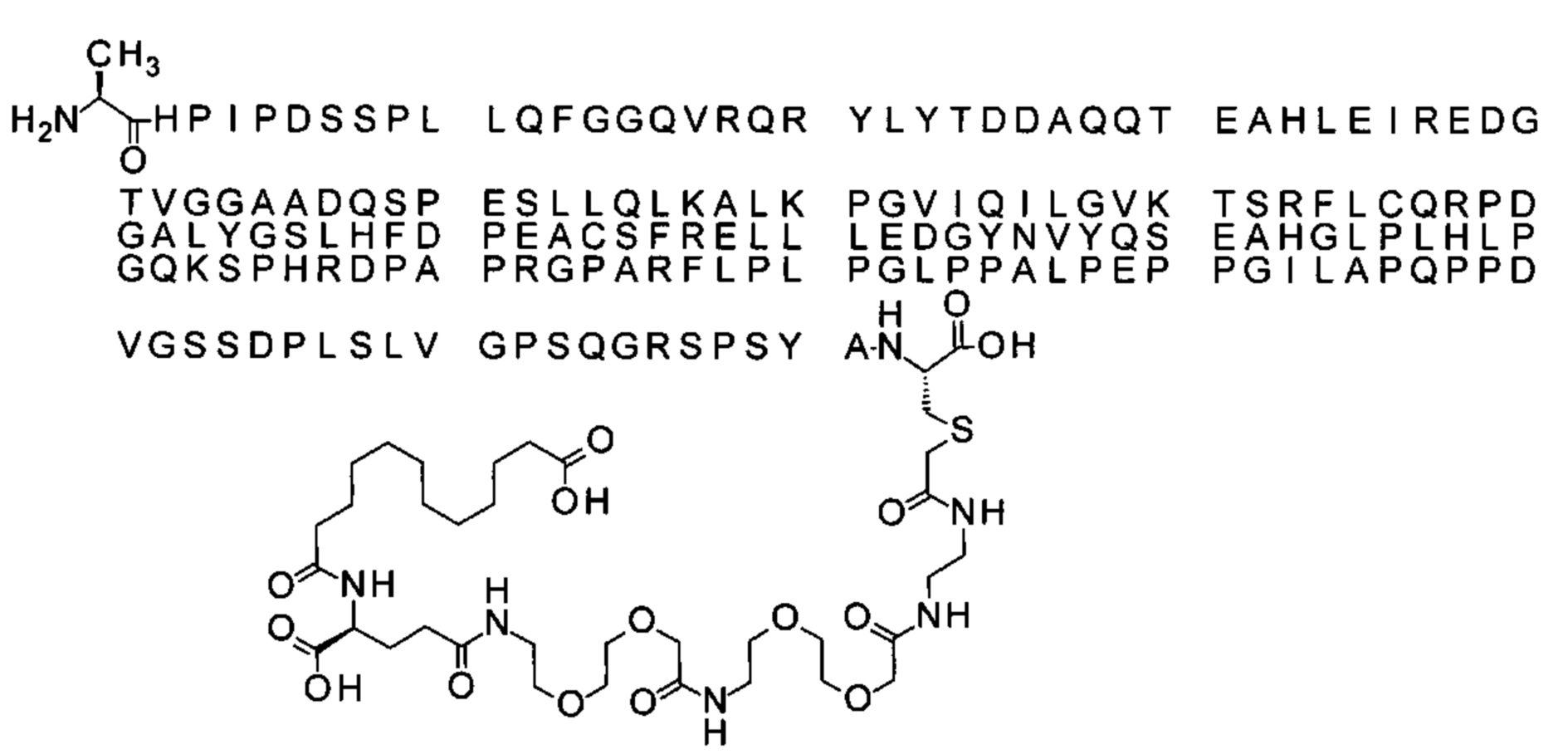
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys181]FGF21 (Соединение 20)
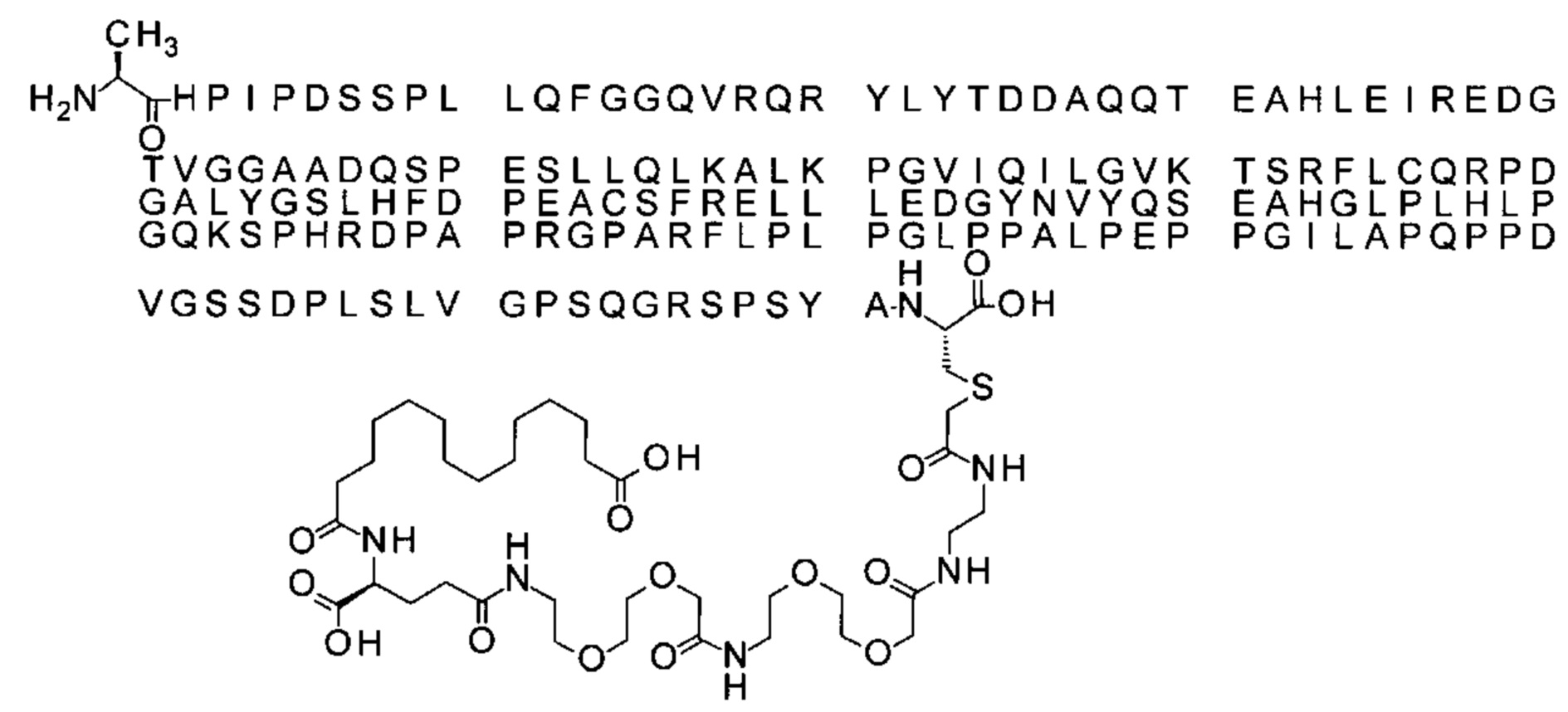
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Gys181]FGF21 (Соединение 21)
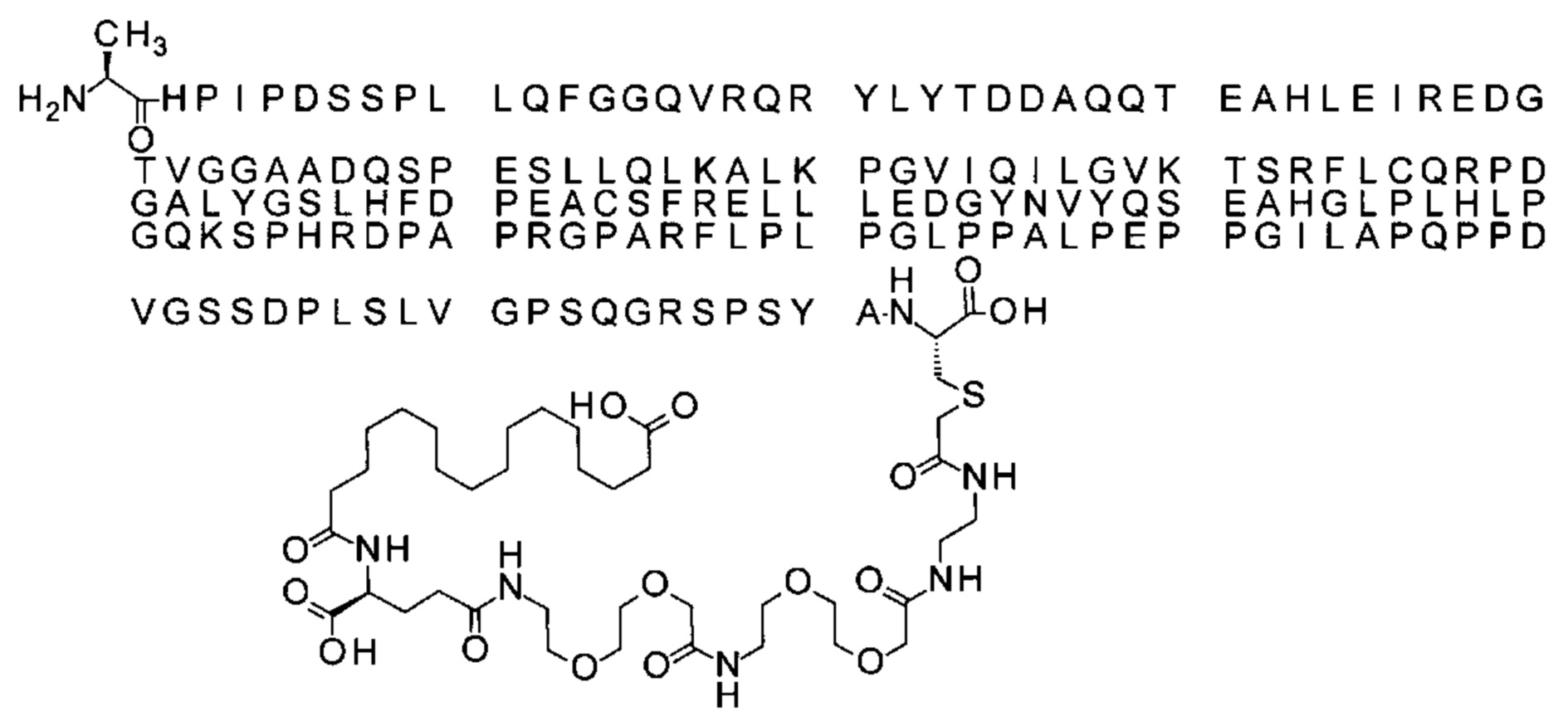
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys181]FGF21 (Соединение 22)
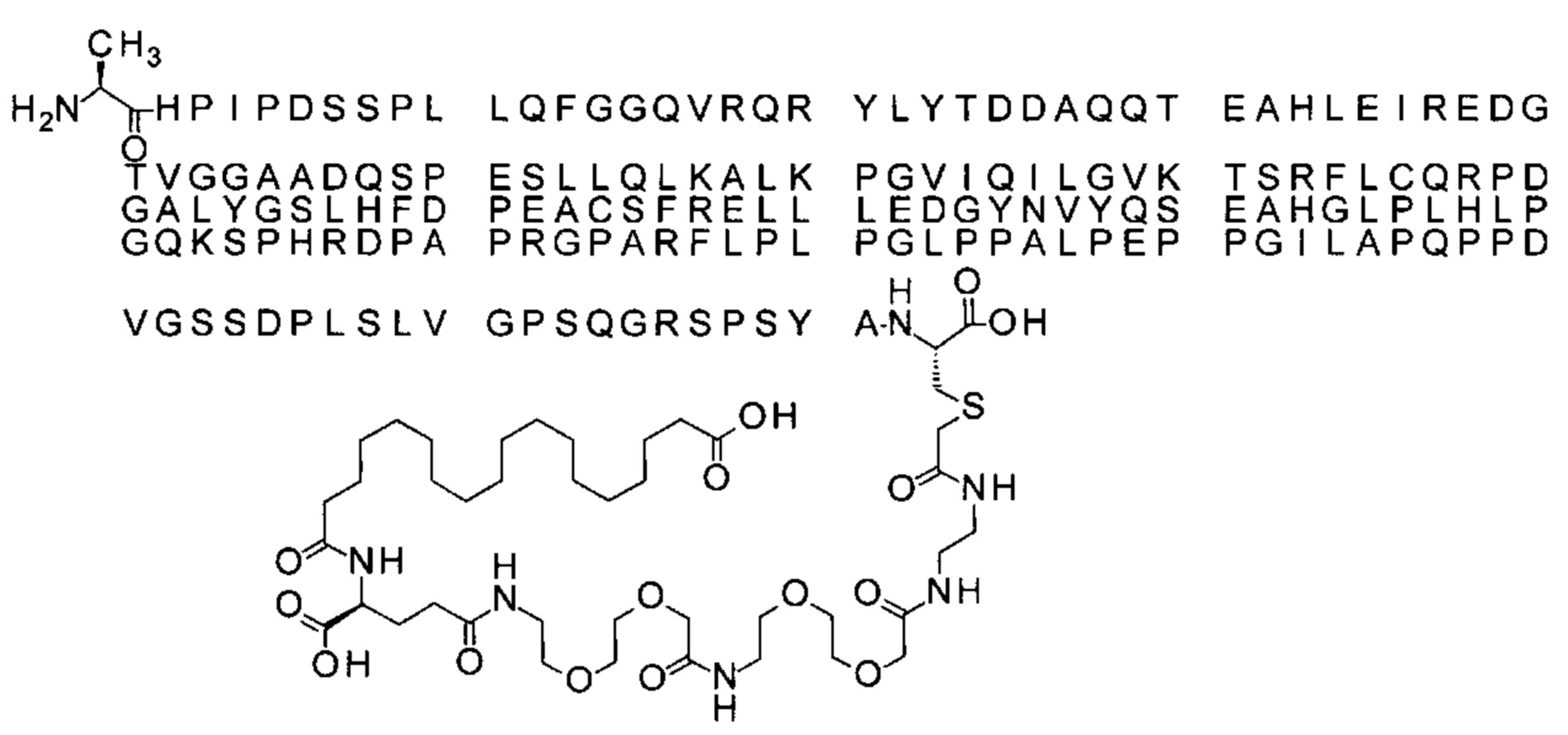
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(19-карбоксинонадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Gys181]FCF21 (Соединение 23)
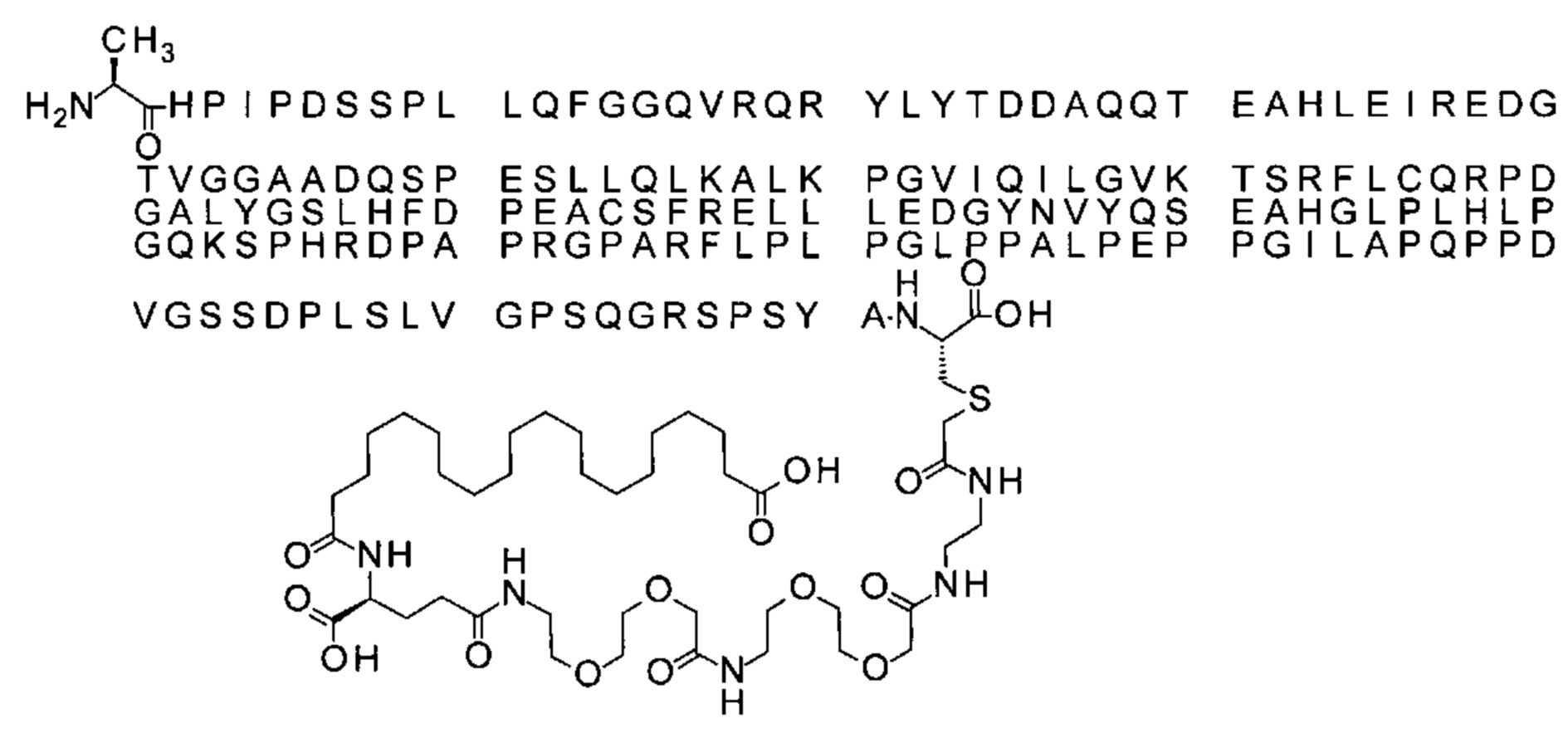
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Met[Gys181]FCF21 (Соединение 24)

42. Производное по любому из предшествующих воплощений, где производное представляет собой одно из следующего:
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(11-карбоксиундеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21 (Соединение 13)
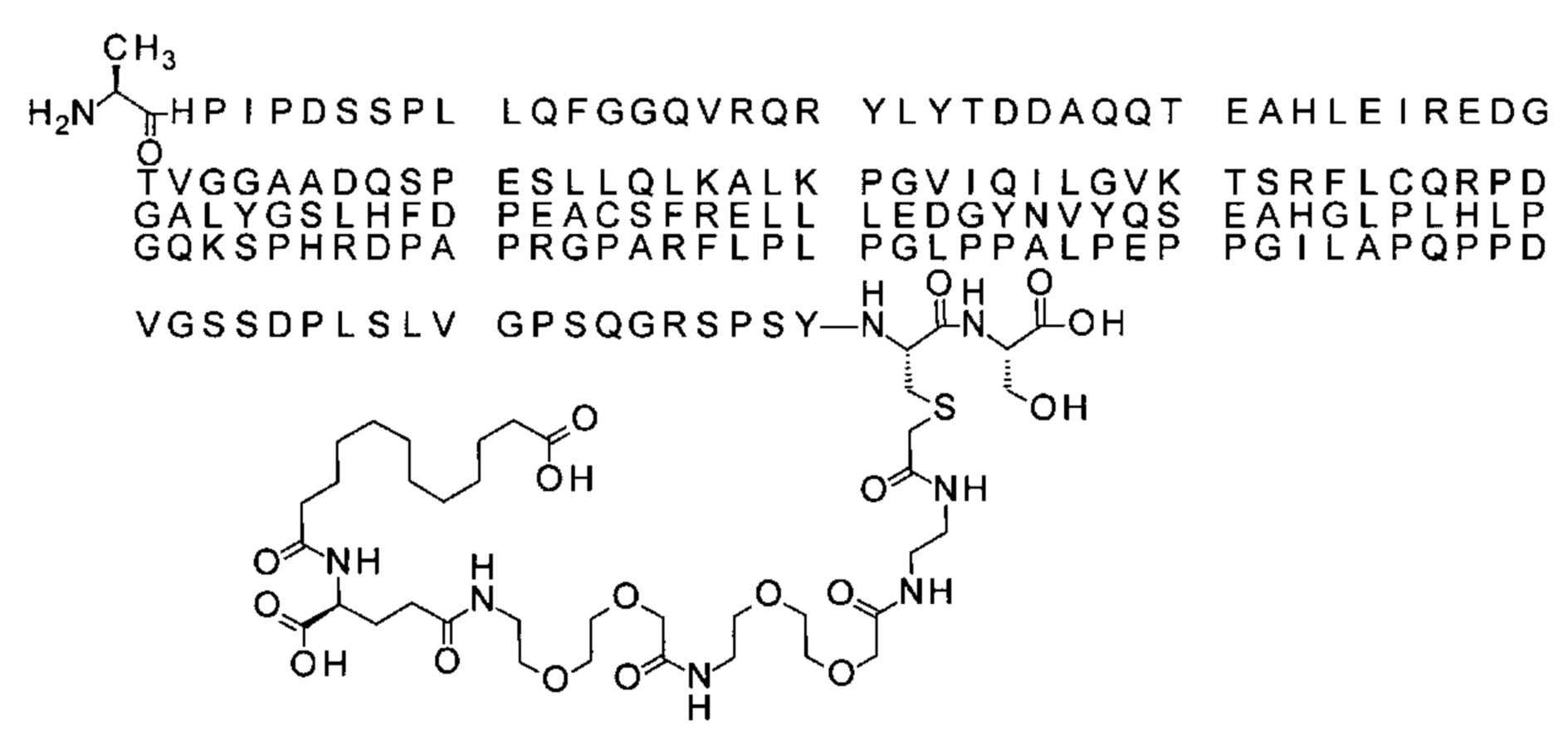
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21 (Соединение 14)
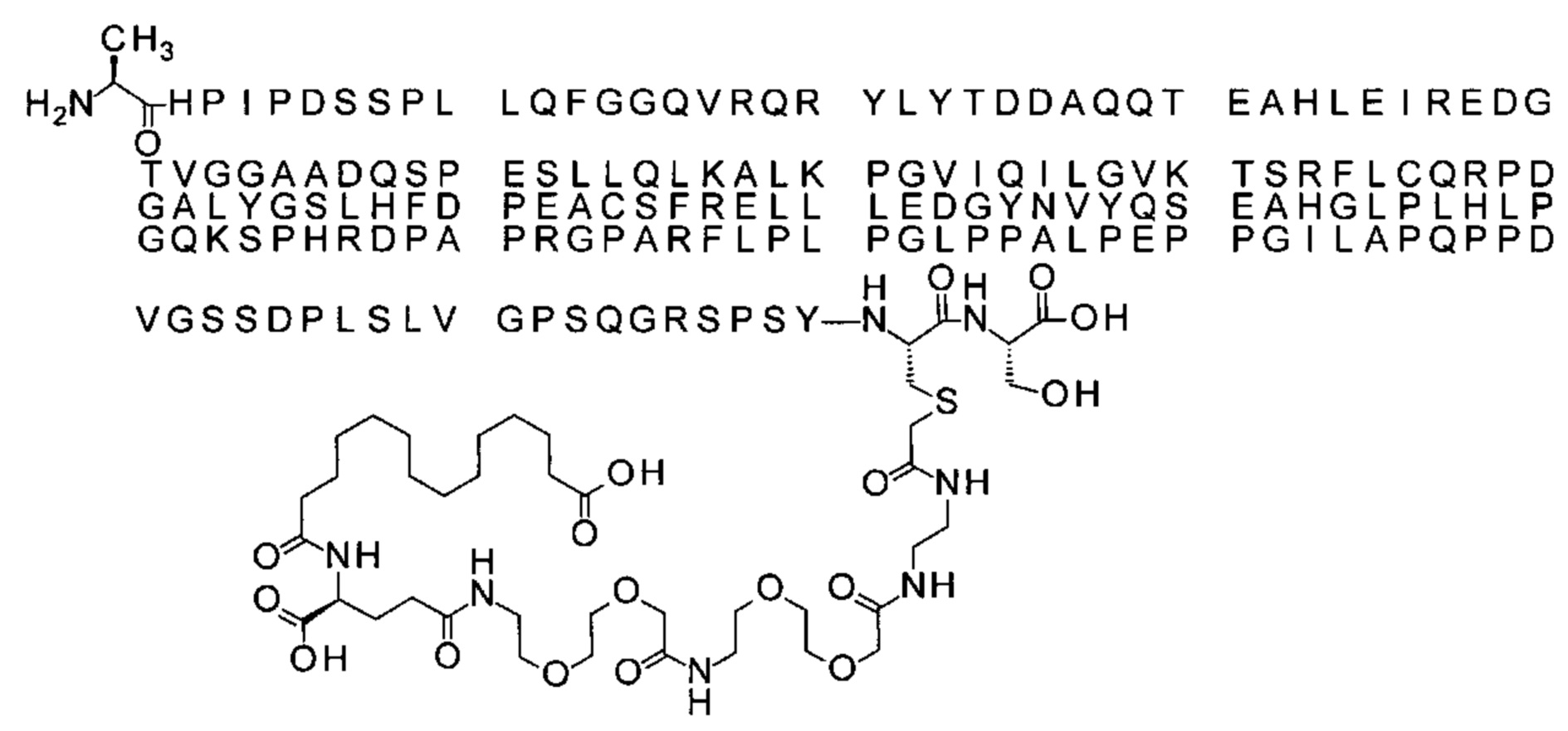
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21 (Соединение 15)
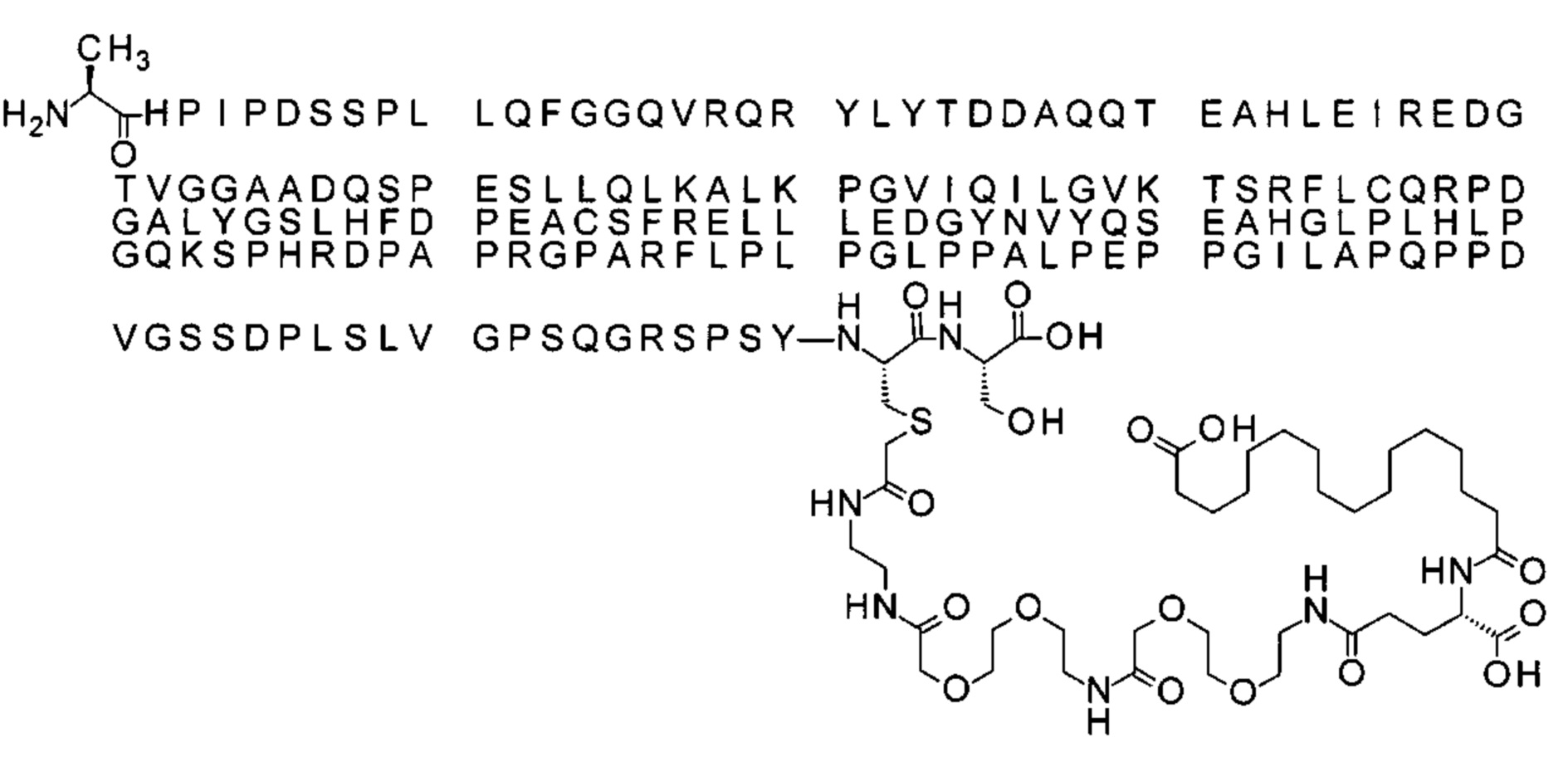
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FCF21 (Соединение 16)
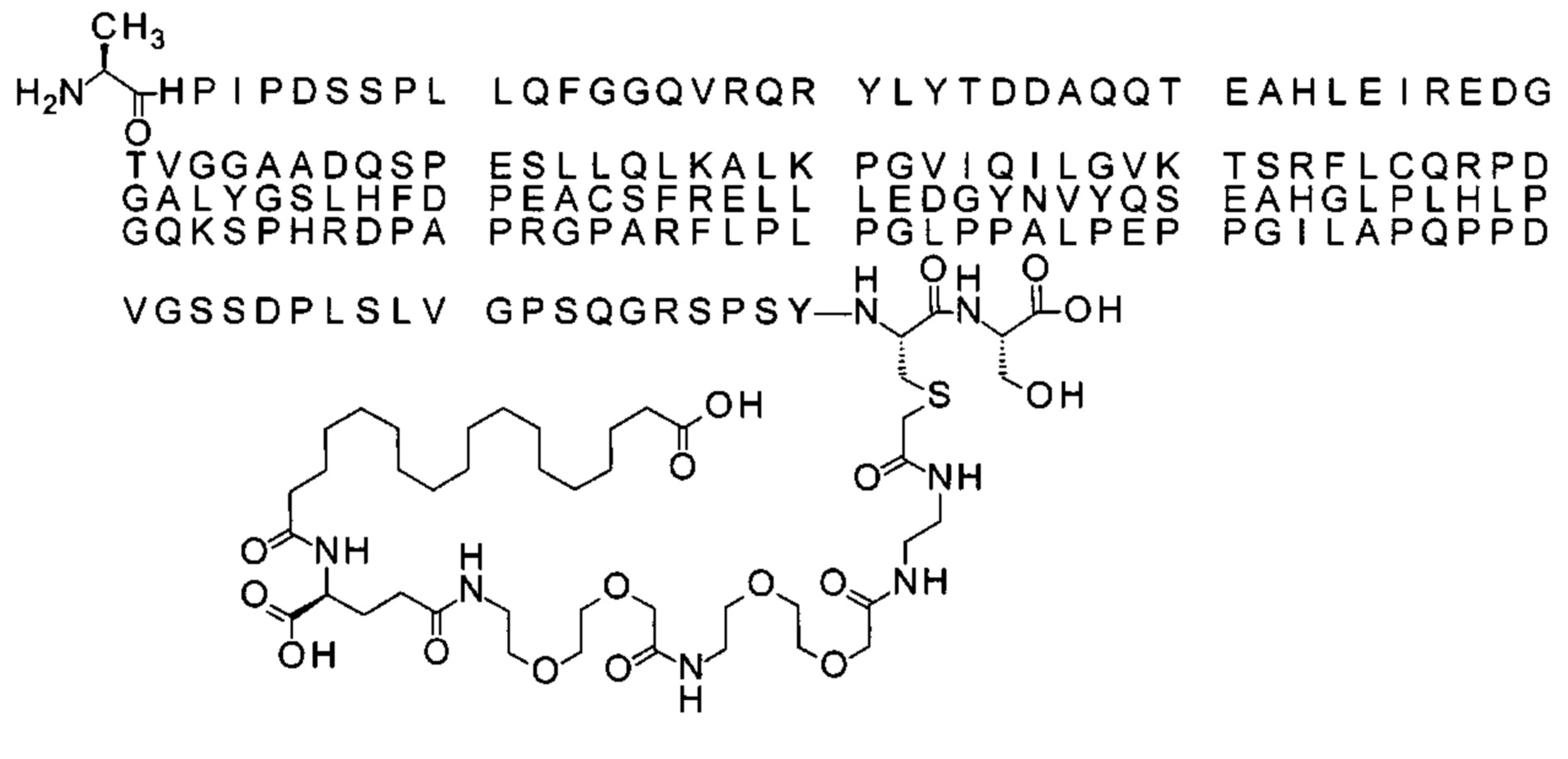
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(19-карбоксинонадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FCF21 (Соединение 17)
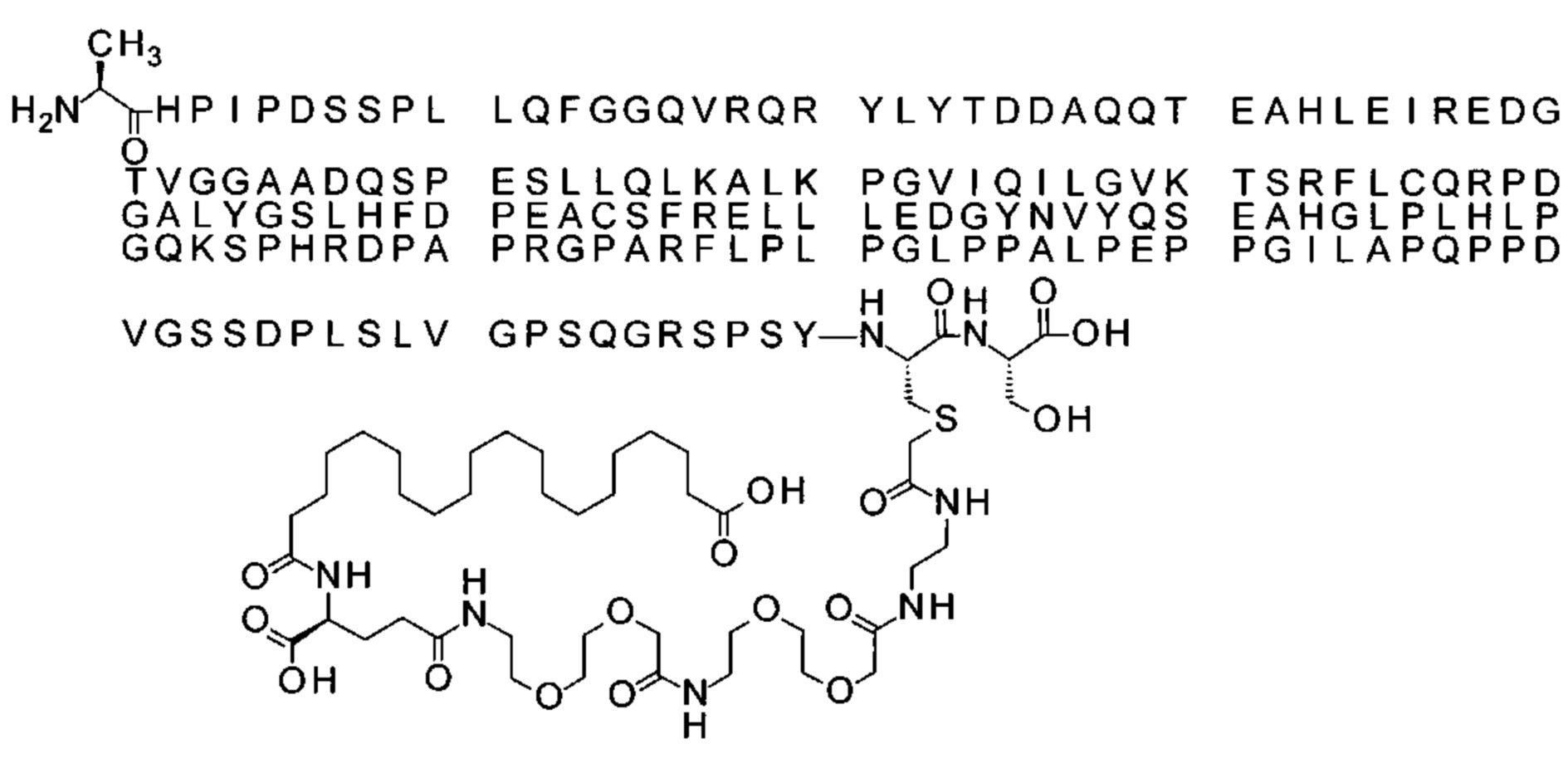
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180,des181]FCF21 (Соединение 18)
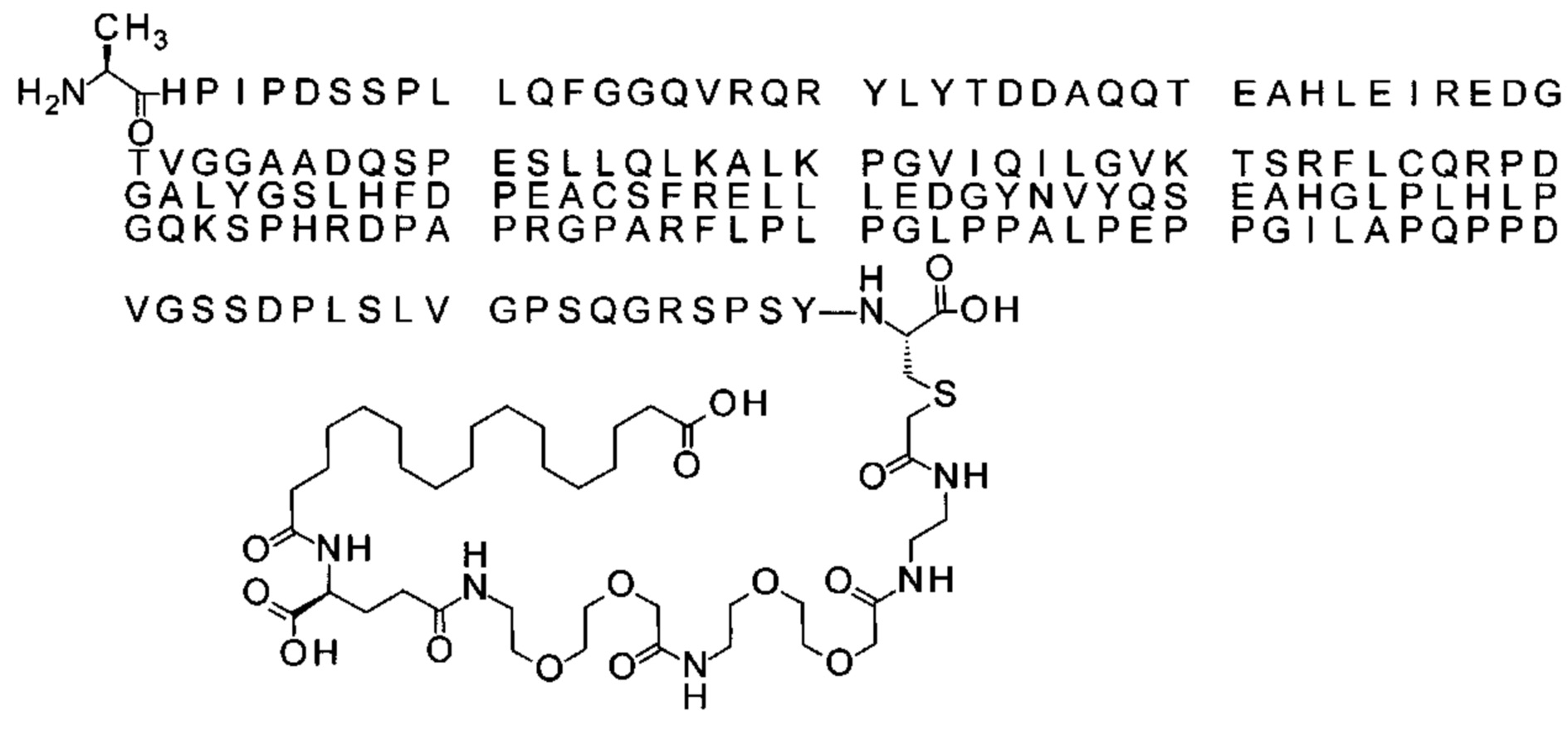
43. Производное по любому из предшествующих воплощений, где производное выбрано из группы соединений 13-24 и 43-56.
44. Производное по любому из предшествующих воплощений, где производное выбрано из группы соединений 35-41.
45. Производное по любому из предшествующих воплощений, где производное выбрано из группы соединений 13-24, 35-41 и 43-56.
46. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 13.
47. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 14.
48. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 15. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 16.
49. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 17.
50. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 18.
51. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 19.
52. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 20.
53. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 21.
54. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 22.
55. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 23.
56. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 24.
57. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 35.
58. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 36.
59. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 37.
60. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 38.
61. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 39.
62. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 40.
63. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 41.
64. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 43.
65. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 44.
66. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 45.
67. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 46.
68. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 47.
69. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 48.
70. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 49.
71. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 50.
72. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 51.
73. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 53.
74. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 54.
75. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 55.
76. Производное по любому из предшествующих воплощений, где производное представляет собой Соед. 56.
77. Производное по любому из предшествующих воплощений, где производное обладает активностью FGF21.
78. Производное по любому из предшествующих воплощений, где производное способно активировать рецепторы FGF.
79. Производное по любому из предшествующих воплощений, где период полувыведения в конечной фазе (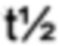 ) после внутривенного введения карликовым свинкам по меньшей мере в 20 раз превышает период полувыведения в конечной фазе (
) после внутривенного введения карликовым свинкам по меньшей мере в 20 раз превышает период полувыведения в конечной фазе (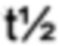 ) зрелого FGF21 человека.
) зрелого FGF21 человека.
80. Производное по любому из воплощений 1-79 для применения в качестве лекарственного средства.
81. Производное по любому из воплощений 1-79 для применения в способе лечения и/или профилактики любой из форм диабета и связанных с ним заболеваний, таких как ожирение, нарушения пищевого поведения, сердечно-сосудистые заболевания, осложнения диабета; и/или для улучшения показателей липидного обмена, улучшения функции β-клеток; и/или для отсрочивания или предупреждения прогрессирования заболевания диабета; и/или для лечения и/или профилактики стеатоза печени и неалкогольной жировой болезни печени (НАЖБП).
82. Применение производного по любому из воплощений 1-79 в изготовлении лекарственного средства для лечения и/или профилактики всех форм диабета и связанных с ним заболеваний, таких как ожирение, нарушения пищевого поведения, сердечно-сосудистые заболевания, осложнения диабета; и/или для улучшения показателей липидного обмена, улучшения функции β-клеток; и/или для отсрочивания или предупреждения прогрессирования заболевания диабета; и/или для лечения и/или профилактики стеатоза печени и неалкогольной жировой болезни печени (НАЖБП).
83. Способ лечения и/или профилактики всех форм диабета и связанных с ним заболеваний, таких как ожирение, нарушения пищевого поведения, сердечно-сосудистые заболевания, осложнения диабета; и/или для улучшения показателей липидного обмена, улучшения функции β-клеток; и/или для отсрочивания или предупреждения прогрессирования заболевания диабета; и/или для лечения и/или профилактики стеатоза печени и неалкогольной жировой болезни печени (НАЖБП) посредством введения фармацевтически активного количества производного по любому из воплощений 1-79.
84. Белок FGF21, который содержит аминокислотную замену аминокислоты дикого типа на остаток цистеина в положении, соответствующем одному из положений 167, 169, 170, 171, 172, 173, 174, 175, 180 и 181 FGF21 (1-181) (SEQ ID NO: 1).
85. Белок FGF21 по воплощению 83, где белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 170, 173, 174, 180 и 181 FGF21 (1-181) (SEQ ID NO: 1).
86. Белок FGF21 по воплощению 83, где белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 170, 173 и 174 FGF21 (1-181) (SEQ ID NO: 1).
87. Белок FGF21 по воплощению 83, где белок FGF21 содержит остаток Cys в положении, соответствующем одному из положений 180 и 181 FGF21 (1-181) (SEQ ID NO: 1).
88. Белок FGF21 по воплощению 83, где помимо варианта остатка Cys белок FGF21 содержит - 1Ala, 121Gln и/или 168Leu.
89. Белок FGF21 по воплощению 83, где помимо цистеина в одном из положений 167, 169, 170, 171, 172, 173, 174, 175, 180 и 181 FGF21 (1-181) (SEQ ID NO: 1) белок FGF21 содержит - 1Ala, 121Gln и/или 168Leu.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Список сокращений
AcOD: дейтерированный ацетон
Ado: 8-амино-3,6-диоксаоктановая кислота
BSPP: бис(п-сульфонатофенил)фенилфосфина дикалиевая соль дигидрат
DCM: дихлорметан
DMSO: диметилсульфоксид
DPBS: фосфатно-солевой буфер в модификации Дюльбекко
EDAC: (3-диметиламинопропил) этилкарбодиимид
ELSD: Испарительный детектор светорассеяния
Fmoc: 9Н-флуорен-9-илметоксикарбонил
Fc: кристаллизуемый фрагмент
GLP-1: глюкагон-подобный пептид-1
gGlu: гамма-глутаминовая кислота
GLUT1: глюкозный транспортер 1
HATU: 2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат
HEPES: 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота
HPLC: высокоэффективная жидкостная хроматография
IgG4: иммуноглобулин G4
IBMX: 3-изобутил-1-метилксантин
IPTG: изопропил β-D-1-тиогалактопиранозид
LCMS: жидкостная хроматография с масс-спектрометрией
Mtt: 4-метилтритил
NMR: ядерно-магнитный резонанс
OtBu: трет-бутиловый эфир
PBS: фосфатно-солевой буфер
RF: коэффициент удерживания (коэффициент замедления)
Rt: время удерживания
RT: комнатная температура
tBu: т-бутил
TCTU: O-6-хлоро-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат
TFA: трифторуксусная кислота
Tris: трис(гидроксиметил)аминометан или 2-амино-2-гидроксиметилпропан-1,3-диол
Trx: транексамовая кислота
UPLC: Сверхпроизводительная жидкостная хроматография
ZOSu: N-(бензилоксикарбонилокси)сукцинимид.
Материалы и методы
Общие способы детекции и характеризации
LCMS способ 1
Образец разводили приблизительно в 0,2 мг/мл и инжектировали в системе LCMS, например, 3-5 мкл. Оборудование LCMS состоит из системы UPLC и масс-спектрометра. Аналоги обессоливают, разделяют на колонке с обращенной фазой (например, на колонке С4, С8, С18 или предколонке) и анализируют, используя линейный градиент ацетонитрила в 0,02-0,05% TFA (трифторуксусной кислоте). Прибор должен быть калиброван, при возможности, с использованием отдельного распылителя для введения референтного соединения с известной массой, т.н. системы lock mass spray. Строят масс-спектр по основным хроматографическим пикам и определяют массу исходного соединения с помощью алгоритма деконволюции.
Пример настроек прибора LCMS (Synapt):
режим регистрации положительно заряженных ионов
напряжение на капилляре 3000 В
напряжение на конусе 30 В
температура источника 100°С,
температура испарения растворителя 250°С
скорость потока газа в конусе (N2) 25 л/ч
диапазон измеряемых масс m/z 200-3000.
Приведены значения масс после деконволюции
LCMS способ 2
Система: Agilent 1290 infinity колонка UPLC: Aeris WIDEPORE 3,6μ XB-C18 2,1×50 мм Детектор: Agilent Technologies LC/MSD TOF 6230 (G6230A)
Настройки детектора. Способ ионизации: Источник Agilent Jet Stream Диапазон сканирования: m/z мин 100, m/z макс. 3200. Режим работы линейного отражателя - положительный режим.
Условия: Линейный градиент: 5%-95% B в течение 10 минут 0-8 мин 5-95% В, 8-9 мин 95% В, 9-9,5 мин 95-5% В 9,5-10 мин 5% В. Скорость потока: фиксированная 0,40 мл/мин. Температура колонки: 40°C
Подвижная фаза: Растворитель А: 99,90% H2O, 0,02% TFA. Растворитель В: 99,90% CH3CN, 0,02% TFA. Растворитель С: не применимо.
Описание и валидация результатов. Установленная масса представляет собой либо m/z ((m+z)/z) соединения для соединений с m<4000 или массу (среднюю), установленную в результате деконволюции с использованием программного обеспечения Masshunter Workstation версии В.05.00 Build 5.0.519.13 SP1 (Agilent). Рассчитанная масса представляет собой среднюю молекулярную массу нужного соединения Рассчитанное отношение m/z представляет собой молекулярную массу (m+z)/z нужного соединения
LCMS способ 3
Система: Agilent 1290 infinity. Колонка UPLC: Phenomenex Aeris widepore 3,6μ C4 50×2,1 мм. Детектор: Agilent Technologies LC/MSD TOF 6230 (G6230A).
Настройки детектора. Способ ионизации: Источник Agilent Jet Stream Диапазон сканирования: m/z мин. 100, m/z макс. 3200. Режим работы линейного отражателя - положительный режим.
Условия: Ступенчатый градиент: 5%-90% B в течение 10 минут: 0-1 мин 5-20% В, 1-7 мин 20-90% В, 7-8 мин 90% В 8-8,5 мин 90-5% В 8,5-10 мин 5% В скорость потока: фиксированная 0,40 мл/мин. Температура колонки: 40°C
Подвижная фаза: Растворитель А: 99,90% H2O, 0,02% TFA. Растворитель В: 99,90% CH3CN, 0,02% TFA. Растворитель С: Не применимо.
Описание и валидация результатов. Установленная масса представляет собой либо m/z ((m+z)/z) соединения для соединений с m<4000, либо массу (среднюю), установленную в результате деконволюции с использованием программного обеспечения Masshunter Workstation версии В.05.00 Build 5.0.519.13 SP1 (Agilent). Рассчитанная масса представляет собой среднюю молекулярную массу нужного соединения. Рассчитанное отношение m/z представляет собой молекулярную массу (m+z)/z нужного соединения.
LCMS способ 4
Система: Система Waters с самоочисткой
Колонка: Kinetex С18 4,6 мм × 50 мм
Детектор: УФ: PDA, ELSD, MS Micromass Quatro micro
Настройки детектора: Способ ионизации: ES+, Диапазон сканирования 100-1000, напряжение на конусе 30 В, напряжение на капилляре 300 кВ, время сканирования 1,3 с; PDA: 210-400 нм; ELSD: нагреватель-охладитель распылителя 70%, дрейфовая трубка 57,0°C
Условия: Линейный градиент ацетонитрил/вода 20:80 - 100:0 + 0,1% FA, градиент: 4,0 мин, общее время: 6,0 мин, скорость потока: 1,1 мл/мин. Температура колонки: 23°C.
Получение соединений по изобретению
Пример 1: Клонирование и экспрессия зрелого FGF21 человека
Последовательности ДНК и аминокислотные последовательности FGF21 человека были изложены, например, Nishimura et al. in Biochim. Biophys. Acta 1492(1):203-206 (2000). Последовательности также представлены в общедоступных базах данных под номерами доступа: EMBL:AB021975 и UNIPROT:Q9NSA1, соответственно.
Белок зрелого FGF21 клонировали и экспрессировали как внутриклеточный белок в Е. coli, без сигнального пептида, но с добавлением метионина на N-конце. Более конкретно, последовательность гена, кодирующего зрелый FGF21 человека (с добавленным Met на N-конце), имевшую кодоны, оптимизированные для экспрессии в Е. coli, клонировали между сайтами NdeI и BamHI вектора рЕТ11 с. Ген FGF21 находился под контролем промотора фага Т7. Экспрессируемой конструкцией трансформировали Е. coli BL21(DE3). Выбирали одиночную колонию и культивировали в LB + Amp 100 мкг/мл до достижения OD450 0,5. Экспрессию индуцировали 0,3 мМ IPTG в течение 4 часов при 37°C. Неочищенные экстракты клеток для анализа экспрессии FGF21 получали путем разрушения ультразвуком. Окрашивание Кумасси полиакриламидного геля после электрофореза в присутствии ДСН подтвердило успешную экспрессию FGF21, который идентифицировали преимущественно во фракции осадка. Несмотря на то, что рассчитанная молекулярная масса экспрессированного таким образом MetFGF21 составляет 19,5 кДа, он мигрировал в геле как белок с массой 25 кДа, что по-видимому, является следствием высокого содержания пролинов, замедляющих перемещение белка.
В данном описании MetFGF21 использовали в качестве референтного соединения. Когда FGF21 продуцировали с использованием экспрессирующей системы Е. Coli, на N-конце FGF21 добавлялся метионин. Полагают, что это не влияет на биологическую активность, и поэтому в качестве референтных соединений обычно используют как FGF21, так и MetFGF21.
Пример 2. Клонирование и экспрессия аналогов FGF21
Конструкции для экспрессии аналогов, приведенных в Таблице 1 (Пример 3), получили в результате мутагенеза конструкции для экспрессии зрелого FGF21, описанной в Примере 1. Использовали набор для внедрения множества мутаций компании Stratagene. Использовали те же условия экспрессии, которые описаны в Примере 1. Окрашивание Кумасси полиакриламидного геля после электрофореза в присутствии ДСН подтвердило успешную экспрессию аналогов. Экспрессировали аналоги, включавшие дипептид Met-Ala, расположенный в направлении N-конца относительно последовательностей FGF21, что обеспечивало экспрессию аналогов FGF21, у которых N-концевым аминокислотным остатком был Ala в результате отщепления Met ферментами Е. coli.
Пример 3. Выделение зрелого FGF21 и аналогов FGF21
Для выделения зрелого FGF21 и аналогов FGF21, описанных в Примерах 1-2, использовали следующий способ или аналогичные ему способы.
Клеточный осадок Е. coli ресуспендировали в 10 мМ фосфате калия с рН 6,0 и дважды измельчали в гомогенизаторе при 800 бар. Тельца включения осаждали путем центрифугирования (10000×g, в течение 30 минут), ресолюбилизировали в 50 мМ Трис, рН 8,0 и, необязательно, добавляли 2М мочевину и/или 5 мМ цистеамин и суспензию перемешивали в течение ночи при 4°C. Перед нанесением на колонку суспензию снова центрифугировали при 10000×g, в течение 30 минут. Надосадочную жидкость наносили на колонку для анионообменной хроматографии (Q Sepharose Fast Flow resin, GE Healthcare) и элюировали 50-250 мМ NaCl. К пулу элюата добавляли 0,4 М сульфат аммония и наносили его на колонку Phenyl FF (GE Healthcare), уравновешенную 20 мМ Трис, рН 8,0, 0,4 М сульфатом аммония. Колонку промывали 20 мМ Трис, рН 8,0, с 1,5 М хлоридом натрия перед элюированием 10% Трис-хлоридным буфером (20 мМ Tris рН 8,0, 1,5 М хлорид натрия). Для финальной очистки можно использовать колонку 30Q. Итоговый продукт анализировали ДСН-ПААГ или другими соответствующими способами. Для соединений 3 и 5-10 при проведении фармакологических тестов сохранялась защита введенных цистеинов цистеамином.
Аналоги FGF21 получали, как описано выше. Для соединений указана масса исходного вещества, которую определяли с помощью LCMS (используя LCMS способ 1).
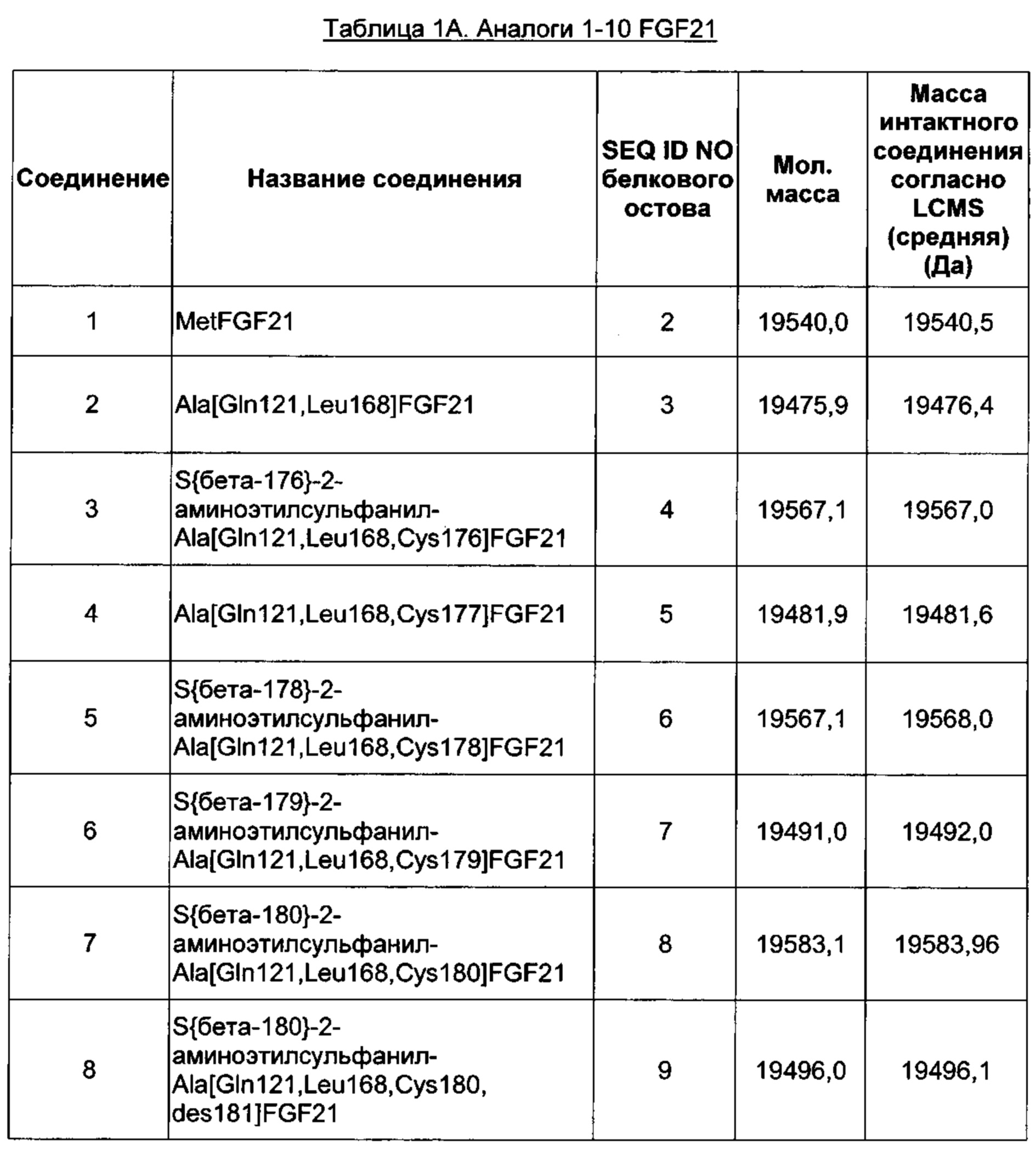

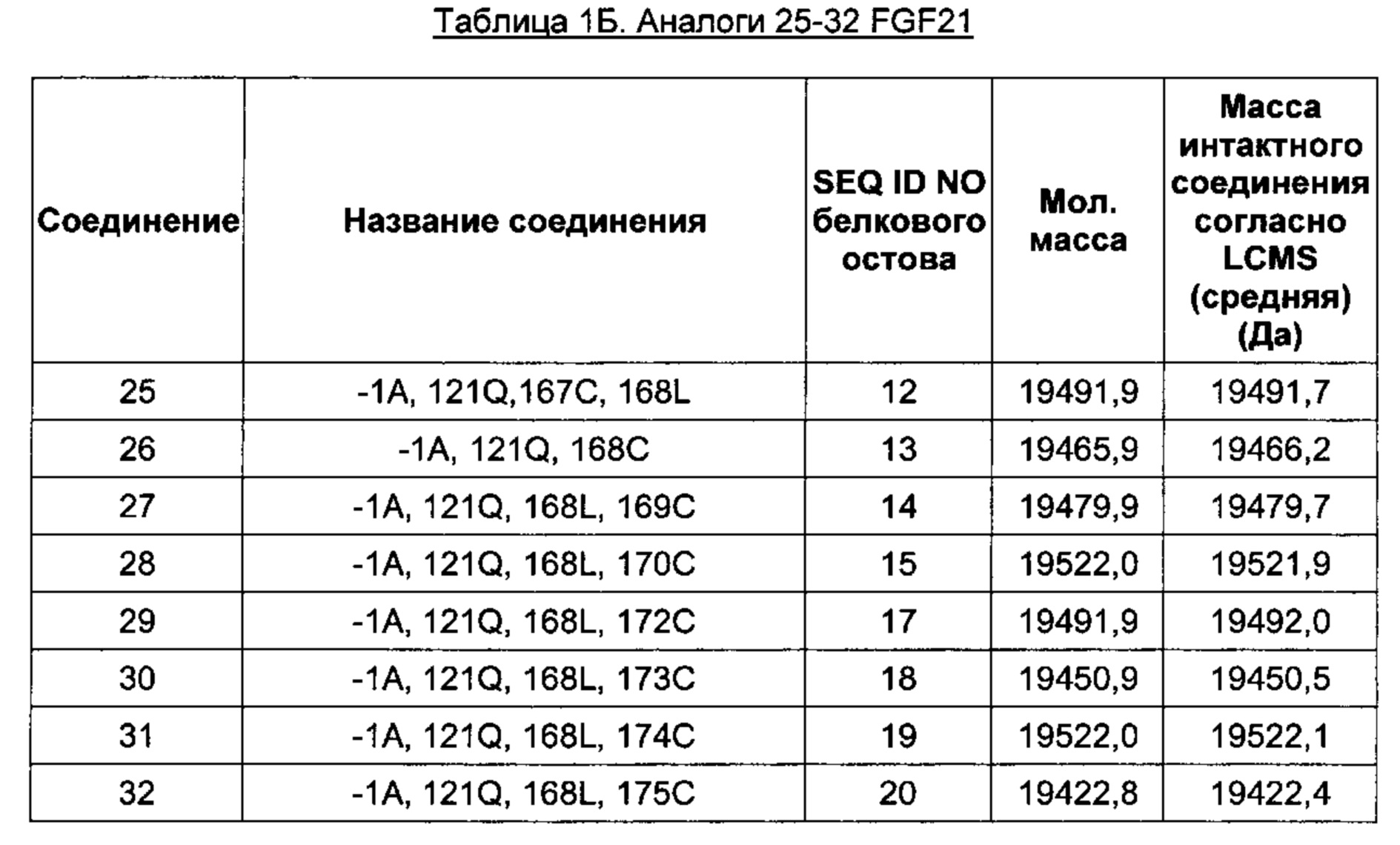
Пример 4. Подготовка реагентов для дериватизации аналогов FGF21
Приготовление репрезентативного реагента для дериватизации приведено в Примере 4.1. Реагенты из Примеров 4.2-4.4 получали способом, описанным в Примере 4.1. Реагенты из примеров 4.5-4.17 получали аналогичными способами, как описано ниже.
Пример 4.1. Получение 15-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}пентадекановой кислоты
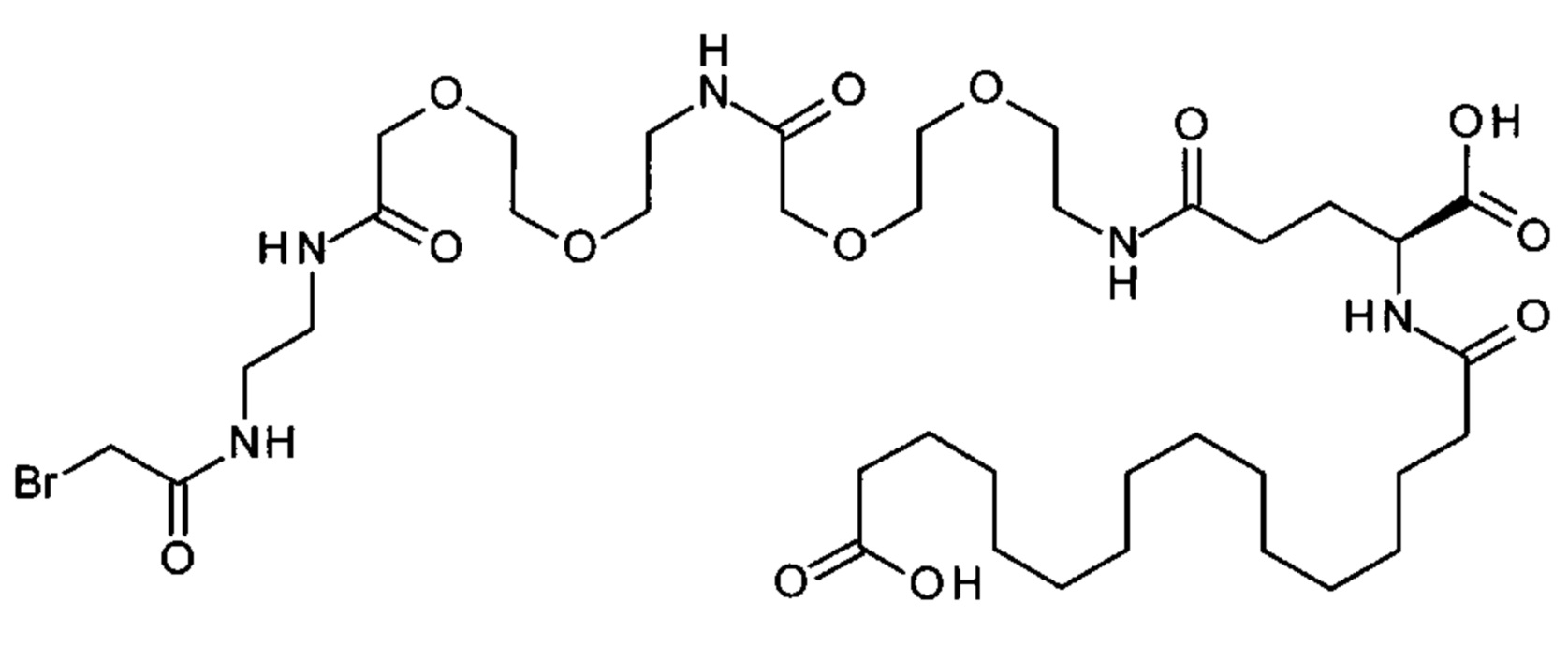
Протокол твердофазного синтеза:
Раствор N-(бензилоксикарбонилокси)сукцинимида (ZOSu, 100 г, 401 ммоль) в дихлорметане (500 мл) добавляли по каплям в течение 2 часов к раствору этилендиамина (1, 189 мл, 2,81 моль) в дихлорметане (750 мл). Через 30 мин суспензию фильтровали и твердую фазу промывали дихлорметаном. Фильтрат выпаривали досуха и остаток разбавляли толуолом (1,00 л) и водой (0,5 л). Полученную смесь отфильтровывали и фильтрат разделяли с получением двух фаз. Водная фаза содержала продукт; поэтому его экстрагировали дихлорметаном (2×250 мл). Все органические фазы объединяли, высушивали над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Осадок разводили толуолом (750 мл) и экстрагировали 2М водным раствором соляной кислоты (500 мл) и 1М водным раствором соляной кислоты (100 мл). Кислые водные фазы объединяли и подщелачивали раствором гидроксида натрия (60,0 г, 1,50 моль) в воде (90 мл). Полученную смесь экстрагировали дихлорметаном (4×200 мл), высушивали над безводным сульфатом натрия, фильтровали, концентрировали в вакууме и разводили смесью гексанов (200 мл). 4 М раствор хлороводорода в эфире (100 мл, 400 ммоль) добавляли к раствору, полученную суспензию концентрировали в вакууме и разводили смесью гексанов (1,0 л). Преципитированную твердую фазу отфильтровывали, промывали смесью гексанов и высушивали в вакууме с получением гидрохлорида бензилового эфира (2-амино-этил)-карбаминовой кислоты в виде белого порошка.
Выход: 62,62 г (68%).
RF (SiO2, дихлорметан/метанол 4:1): 0,25 (свободное основание).
1Н NMR спектр (300 MHz, AcOD-d4, 80°C, dH): 7.42-7.26 (m, 5Н); 5.16 (s, 2Н); 3.60 (t, J=5.7 Hz, 2H); 3.32 (t, J=5.7 Hz, 2H).
2-хлортритильную смолу, 100-200 меш, 1,7 ммоль/г (3, 40,1 г, 68,1 ммоль) оставляли набухать в осушенном дихлорметане (250 мл) на 20 минут. К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-Ado-OH, 17,5 г, 45,4 ммоль) и N,N-диизопропилэтиламин (30,1 мл, 173 ммоль) в осушенном дихлорметане (50 мл) и смесь встряхивали в течение 5 часов. Смолу отфильтровывали и обрабатывали раствором N,N-диизопропилэтиламина (15,8 мл, 90,8 ммоль) в смеси метанол/дихлорметан (4:1, 250 мл, 2×5 мин). Смолу промывали N,N-диметилформамидом (2×250 мл), дихлорметаном (2×250 мл) и N,N-диметилформамидом (3×250 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×250 мл). Смолу промывали N,N-диметилформамидом (3×250 мл), 2-пропанолом (2×250 мл) и дихлорметаном (300 мл, 2×250 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-Ado-OH, 26,3 г, 68,1 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 24,2 г, 68,1 ммоль) и N,N-диизопропилэтиламин (21,4 мл, 123 ммоль) в N,N-диметилформамиде (140 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×250 мл), дихлорметаном (2×250 мл) и N,N-диметилформамидом (250 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×250 мл). Смолу промывали N,N-диметилформамидом (3×250 мл), 2-пропанолом (2×250 мл) и дихлорметаном (300 мл, 2×250 мл). К смоле добавляли раствор 1-трет-бутилового эфира (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-Glu-OtBu, 29,0 г, 68,1 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 24,2 г, 68,1 ммоль) и N,N-диизопропилэтиламин (21,4 мл, 123 ммоль) в N,N-диметилформамиде (140 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×250 мл), дихлорметаном (2×250 мл) и N,N-диметилформамидом (250 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×250 мл). Смолу промывали N,N-диметилформамидом (3×250 мл), 2-пропанолом (2×250 мл) и дихлорметаном (300 мл, 2×250 мл). К смоле добавляли раствор 16-(трет-бутокси)-16-оксогексадекановой кислоты (23,3 г, 68,1 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 24,2 г, 68,1 ммоль) и N,N-диизопропилэтиламин (21,4 мл, 123 ммоль) в смеси N,N-диметилформамид/дихлорметан (4:1, 200 мл). Смолу встряхивали в течение 1 часа, отфильтровывали и промывали N,N-диметилформамидом (3×250 мл), дихлорметаном (2×250 мл), метанолом (2×250 мл) и дихлорметаном (350,6×250 мл). Отщепление продукта от смолы проводили с помощью обработки 2,2,2-трифторэтанолом (250 мл) в течение 18 часов. Смолу отделяли фильтрованием и промывали дихлорметаном (2×250 мл), смесью 2-пропанол/дихлорметан (1:1, 2×250 мл), 2-пропанолом (250 мл) и дихлорметаном (3×250 мл). Растворы объединяли; растворитель выпаривали и неочищенный продукт очищали путем колоночной флэш-хроматографии (Silicagel 60, 0,040-0,060 мм; элюент: дихлорметан/метанол 1:0-9:1). Очищенную (S)-22-(трет-бутоксикарбонил)-41,41-диметил-10,19,24,39-тетраоксо-3,6,12,15,40-пентаокса-9,18,23-триазадотетраконтановую кислоту высушивали в вакууме и получали в виде бледно-желтого вязкого масла.
Выход: 30,88 г (83%).
RF (SiO2, дихлорметан/метанол 4:1): 0,30.
1Н NMR спектр (300 MHz, CDCl3, dH): 7.36 (t, J=5.7 Hz, 1H); 7.02 (t, J=5.4 Hz, 1H); 6.55 (d, J=7.7 Hz, 1H); 4.46 (m, 1H); 4.18 (s, 2H); 4.02 (s, 2H); 3.83-3.36 (m, 16H); 2.44-2.12 (m, 7H); 2.02-1.86 (m, 1H); 1.60 (m, 4H); 1.47 (s, 9H); 1.45 (s, 9H); 1.36-1.21 (m, 20H).
LCMS способ 4
Чистота: 100%
Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 50:50 до 100:0 + 0,1% FA): 3,60 мин.
Измеренное m/z, z=1: 818,7 (M+H)+
Затем к раствору (S)-22-(трет-бутоксикарбонил)-41,41-диметил-10,19,24,39-тетраоксо-3,6,12,15,40-пентаокса-9,18,23-триазадотетраконтановой кислоты (22,4 г, 27,4 ммоль) в осушенном дихлорметане (110 мл) добавляли 2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат (HATU, 11,4 г, 30,1 ммоль) и триэтиламин (8,77 мл, 62,9 ммоль). К суспензии гидрохлорида бензилового эфира (2-амино-этил)-карбаминовой кислоты (6,94 г, 30,1 ммоль) в осушенном дихлорметане (165 мл) добавляли триэтиламин (5,72 мл, 41,0 ммоль) и полученную смесь добавляли к указанному выше раствору. Смесь перемешивали при комнатной температуре в течение ночи, а затем выпаривали досуха. Осадок повторно растворяли в этилацетате (500 мл); промывали 1М водным раствором соляной кислоты (2×200 мл), 5% водным раствором карбоната натрия (2×200 мл, очень медленное разделение фаз), 1 М водным раствором соляной кислоты (8×200 мл) и рассолом; высушивали над безводным сульфатом натрия и выпаривали досуха в вакууме. Осадок очищали при помощи флэш-хроматографии (Silicagel 60, 0,040-0,060 мм; элюент: дихлорметан/метанол 95:5) с получением трет-бутилового эфира 15-[(S)-3-(2-{2-[(2-{2-[(2-бензилоксикарбониламино-этилкарбамоил)-метокси]-этокси}-этилкарбамоил)-метокси]-этокси}-этилкарбамоил)-1-трет-бутоксикарбонил-пропилкарбамоил]-пентадекановой кислоты в виде светло-желтого вязкого масла.
Выход: 23,84 г (88%)
RF (SiO2, дихлорметан/метанол 9:1): 0,35
1Н NMR спектр (300 MHz, CDCl3, dH): 7.39-7.26 (m, 6Н); 7.19 (t, J=6.3 Hz, 1H); 6.91 (t, J=5.7 Hz, 1H); 6.52 (d, J=7.5 Hz, 1H); 5.83 (t, J=5.5 Hz, 1H); 5.09 (s, 2H); 4.41 (ddd, J=12.3, 4.6 и 4.3 Hz, 1H); 3.99 (s, 2H); 3.97 (s, 2H); 3.71-3.30 (m, 20H); 2.33-2.08 (m, 7H); 1.97-1.83 (m, 1H); 1.67-1.51 (m, 4H); 1.45 (s, 9H); 1.44 (s, 9 H); 1.35-1.20 (m, 20H).
LCMS способ 4
Чистота: 100%
Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 50:50 до 100:0 + 0,1% FA): 4,18
мин
Измеренное m/z, z=1: 994,9 (M+H)+
К раствору указанного выше соединения (23,8 г, 24,0 ммоль) в метаноле (350 мл) добавляли палладий на угле (10%, 1,27 г, 1,20 ммоль) и полученную смесь гидрогенизировали при нормальном атмосферном давлении в течение 4 часов. Катализатор отделяли фильтрованием и фильтрат выпаривали досуха. Осадок несколько раз выпаривали из дихлорметана для удаления остатков метанола и высушивали в вакууме для получения трет-бутил (S)-1-амино-25-(трет-бутоксикарбонил)-4,13,22,27-тетраоксо-6,9,15,18-тетраокса-3,12,21,26-тетраазадотетраконтан-42-оата в виде вязкого бесцветного масла.
Выход: 20,50 г (99%).
RF (SiO2, дихлорметан/метанол 9:1): 0,05.
1Н NMR спектр (300 MHz, CDCl3, dH): 7.54 (t, J=5.7 Hz, 1H); 7.41 (t, J=5.6 Hz, 1H); 7.14 (t, J=5.5 Hz, 1H); 6.68 (d, J=7.5 Hz, 1H); 5.25 (bs, 2H); 4.39 (td, J=8.3 и 4.2 Hz, 1H); 4.01 (s, 4H); 3.74-3.39 (m, 18H); 2.96 (t, J=5.7 Hz, 2H); 2.34-2.06 (m, 7H); 1.97-1.83 (m, 1H); 1.68-1.50 (m, 4H); 1.45 (s, 9H); 1.43 (s, 9H); 1.37-1.19 (m, 20H).
LCMS способ 4
Чистота: 100%
Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 50:50 до 100:0 + 0,1% FA): 1,43 мин
Измеренное m/z, z=1: 860,8 (M+H)+
К раствору указанного выше амина (6, 20,5 г, 23,8 ммоль) в осушенном дихлорметане (290 мл) добавляли N,N-диизопропилэтиламин (4,98 мл, 28,6 ммоль) при -30°C в атмосфере аргона. Добавляли по каплям бромацетилбромид (2,48 мл, 28,6 ммоль) и полученный раствор дополнительно перемешивали при -30°C в течение 3 часов. Охлаждающую баню убирали и смесь перемешивали при комнатной температуре в течение 1 часа, а затем растворитель удаляли в вакууме. Осадок повторно растворяли в этилацетате (450 мл) и промывали 5% водным раствором лимонной кислоты (300 мл). Фазы разделяли в течение 1 часа. Органический слой промывали водой (300 мл) и полученную эмульсию оставляли для разделения в течение ночи для получения 3 фаз. Прозрачный водный слой удаляли и оставшиеся 2 фазы встряхивали, добавляя насыщенный водный раствор бромида калия (100 мл). Фазы оставляли разделяться в течение ночи, затем водную фазу удаляли, а органическую фазу высушивали над безводным сульфатом натрия. Растворитель удаляли под вакуумом и осадок очищали при помощи флэш-хроматографии (Silicagel 60, 0,040-0,060 мм; элюент: дихлорметан/метанол 95:5) с получением трет-бутил (S)-1-бромо-28-(трет-бутоксикарбонил)-2,7,16,25,30-пентаоксо-9,12,18,21-тетраокса-3,6,15,24,29-пентаазапентатетраконтан-45-оата в виде бесцветного твердого вещества.
Выход: 19,46 г (83%).
RF (SiO2, дихлорметан/метанол 9:1): 0,25
1Н NMR спектр (300 MHz, CDCl3, dH): 7.46 (m, 1Н); 7.33 (t, J=5.9 Hz, 1H); 7.21 (t, J=5.1 Hz, 1H); 6.92 (t, J=5.2 Hz, 1H); 6.50 (d, J=7.5 Hz, 1H); 4.41 (ddd, J=12.2, 4.5 и 4.2 Hz, 1H); 4.01 (s, 4H), 3.85 (s, 2H); 3.75-3.40 (m, 20H), 2.36-2.08 (m, 7H); 1.99-1.84 (m, 1H); 1.68-1.51 (m, 4H), 1.46 (s, 9H); 1.44 (s, 9H); 1.38-1.19 (m, 20H)
LCMS способ 4
Чистота: 100%
Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 50:50 до 100:0+0,1% FA): 3,51 мин.
Измеренное m/z, z=1: 980,9, 982,9 (М+Н)+
Указанное выше соединение (19,5 г, 19,8 ммоль) растворяли в трифторуксусной кислоте (120 мл) и полученный раствор перемешивали при комнатной температуре в течение 1,5 часов. Трифторуксусную кислоту удаляли под вакуумом и осадок выпаривали из дихлорметана (6×200 мл). К маслянистому осадку добавляли диэтиловый эфир (20 мл) и перемешивали смесь в течение ночи для образования суспензии. Твердый продукт отфильтровывали, промывали диэтиловым эфиром и смесью гексанов и высушивали в вакууме для получения указанного в заголовке продукта 15-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}пентадекановой кислоты в виде белого порошка.
Выход: 16,74 г (97%).
1Н NMR спектр (300 MHz, AcOD-d4, dH): 4.61 (dd, J=8.8 и 4.8 Hz, 1H); 4.12 (s, 2H), 4.10 (s, 2H); 3.96 (s, 2H); 3.77-3.39 (m, 20H), 2.49-2.18 (m, 7H); 2.16-1.04 (m, 1H); 1.71-1.56 (m, 4H), 1.30 (bs, 20H)
LCMS способ 4
Чистота: 100%
Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 50:50 до 100:0 + 0,1% FA): 3,51 мин
Теоретическое m/z, z=1: Измеренное m/z, z=1: 868,7, 870,7
Пример 4.2. Получение 11-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}ундекановой кислоты
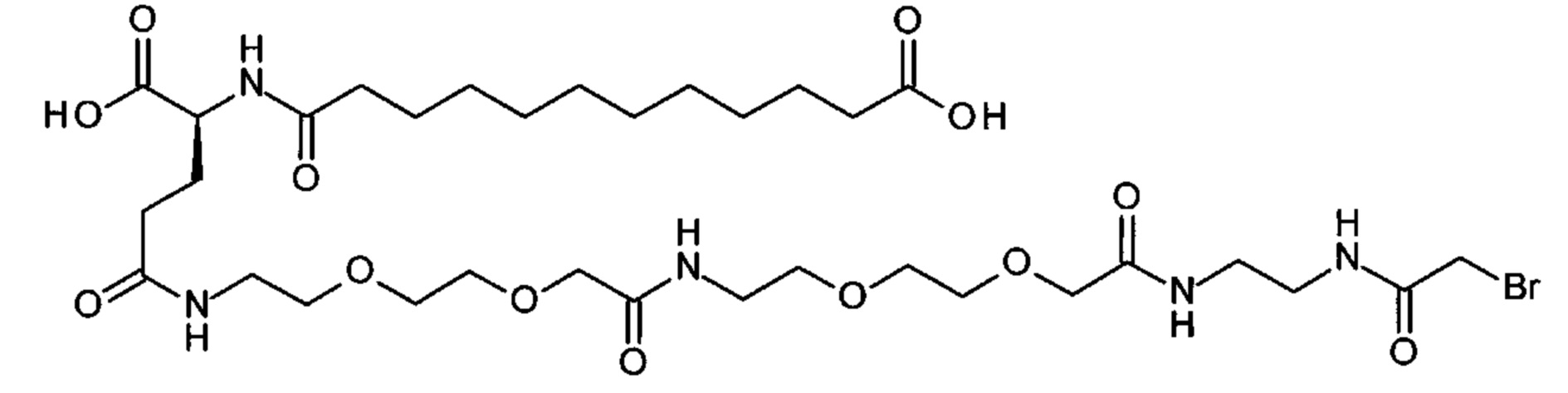
11-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}ундекановую кислоту получали тем же способом, который описан в Примере 4.1, с получением вязкого оранжевого масла.
1Н NMR спектр (300 MHz, AcOD-d4, dH): 4.61 (dd, J=8.9 и 4.9 Hz, 1H); 4.13 (s, 2H); 4.10 (s, 2H); 3.96 (s, 2H); 3.79-3.38 (m, 20H); 2.50-2.16 (m, 7H); 2.16-2.00 (m, 1H); 1.72-1.56 (m, 4H); 1.42-1.24 (m, 12H)
LCMS способ 4:
Чистота: 100% (ELSD)
Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 20:80 до 100:0 + 0,1% FA): 2,74 мин
Теоретическое m/z, z=1: 813,8, Измеренное m/z, z=1: 812,0, 814,0
Пример 4.3. Получение 13-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}тридекановой кислоты

13-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}тридекановую кислоту получали тем же способом, который описан в Примере 4.1, с получением вязкого желтого масла.
1Н NMR спектр (300 MHz, AcOD-d4, dH): 4.61 (dd, J=8.9 и 4.9 Hz, 1H); 4.13 (s, 2H); 4.11 (s, 2H); 3.96 (s, 2 H); 3.77-3.40 (m, 20H); 2.49-2.18 (m, 7H); 2.16-2.07 (m, 1H); 1.70-1.56 (m, 4H); 1.31 (bs, 16H).
LCMS способ 4:
Чистота: 100% (ELSD)
Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 20:80 до 100:0 + 0,1% FA): 2,94 мин
Теоретическое m/z, z=1: 841,9, Измеренное: m/z, z=1: 841,7, 843,7
Пример 4.4. Получение 19-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетил-амино)этилкарбамоил]метокси}этокси)этилкарбамоил]метокси}этокси)-этилкарбамоил]пропилкарбамоил}нонадекановой кислоты
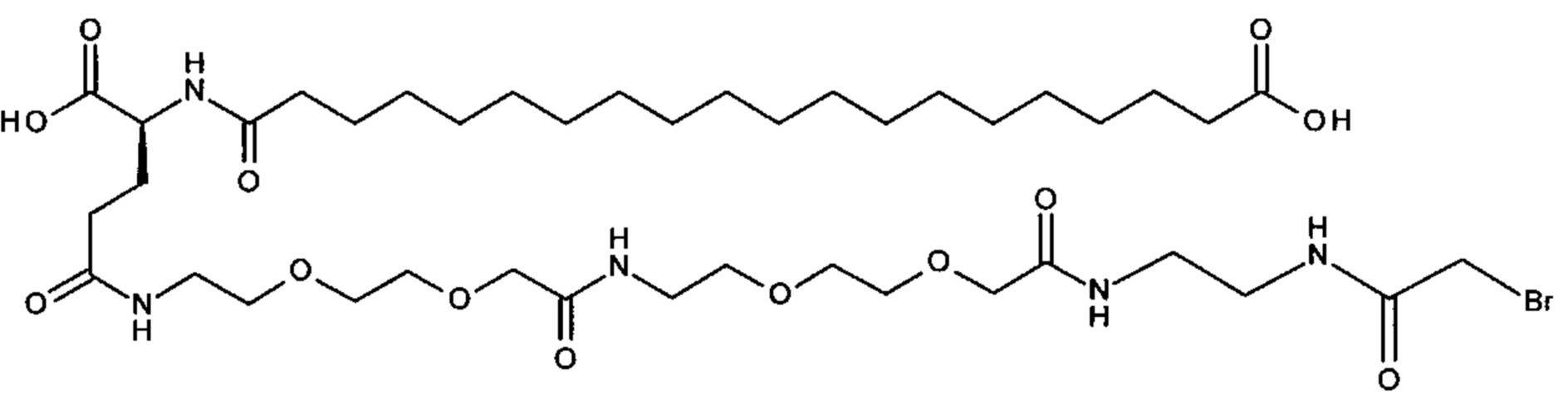
19-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетил-амино)этилкарбамоил]метокси}этокси)этилкарбамоил]метокси}этокси)-этилкарбамоил]пропилкарбамоил}нонадекановую кислоту получали тем же способом, который описан в Примере 4.1, с получением бежевого порошка.
1Н NMR спектр (300 MHz, AcOD-d4, dH): 4.65-4.57 (m, 1H); 4.13 (s, 2H); 4.10 (s, 2H); 3.96 (s, 2H); 3.77-3.43 (m, 20H); 2.49-2.40 (t, J=7.3 Hz, 2H); 2.39-2.23 (m, 5H); 2.17-2.07 (m, 1H); 1.68-1.57 (m, 4H); 1.30 (bs, 28H)
LCMS способ 4:
Чистота: 100% (ELSD)
Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 50:50 до 100:0 + 0,1% FA): 2,17 мин
Теоретическая масса: 926,0, Измеренное m/z: 926 (М+Н)+
Пример 4.5. Получение 18-[[(1S)-4-[2-[2-[2-[2-[2-[2-[2-[(2-бромацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-18-оксо-октадекановой кислоты
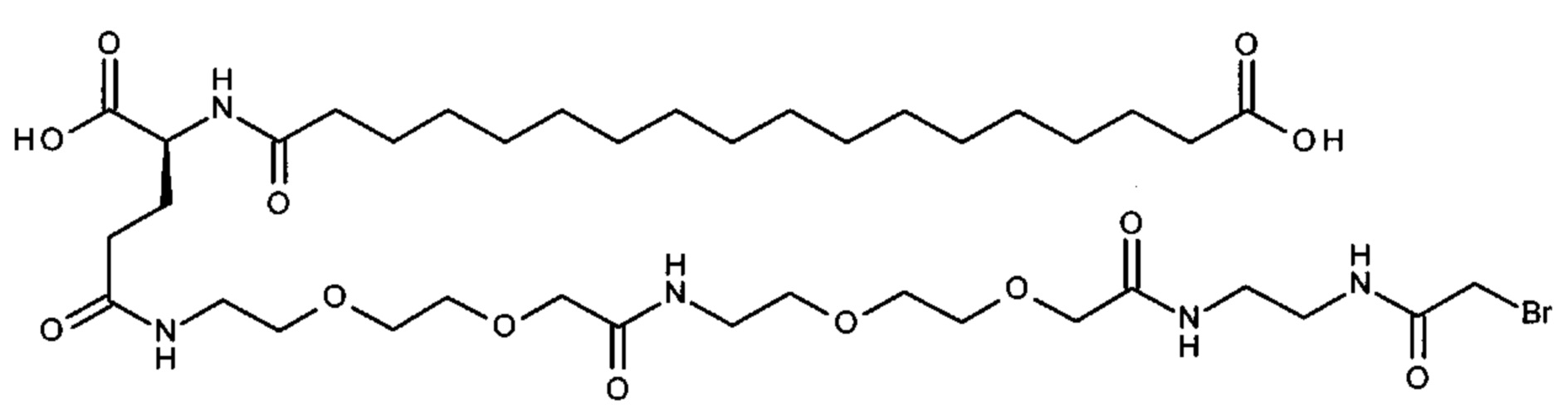
Протокол твердофазного синтеза:
Стадия 1: бензил 18-[[(1S)-4-[2-[2-[2-[2-[2-[2-(2-аминоэтиламино)-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-бензилоксикарбонил-4-оксо-бутил]амино]-18-оксо-октадеканоат К раствору этилендиамина (8,5 мл) в DCM (80 мл) и триэтиламина (5,2 мл) при 0°C добавляли раствор бензил 18-[[(1S)-1-бензилоксикарбонил-4-[2-[2-[2-[2-[2-[2-(2,5-диоксопирролидин-1-ил)окси-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-4-оксо-бутил]амино]-18-оксо-октадеканоат (26 г), полученный, как описано в WO 10029159, в DCM (320 мл) по каплям в течение 75 мин. После перемешивания в течение 2 ч преципитат отделяли фильтрованием. К фильтрату добавляли воду (200 мл) и изопропанол (50 мл). Смесь экстрагировали. Органический слой высушивали с использованием MgSO4. MgSO4 удаляли фильтрованием и фильтрат высушивали в вакууме с образованием указанного в заголовке соединения 20,07 г (81%) LCMS: Теоретическая масса: 956,2; Измеренное m/z, z=1: 957,0
Стадия 2: бензил 18-[[(1S)-1-бензилоксикарбонил-4-[2-[2-[2-[2-[2-[2-[2-[(2-хлорацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-4-оксо-бутил]амино]-18-оксо-октадеканоат
Хлоруксусную кислоту (0,19 г) растворяли в DCM (15 мл). Добавляли N-гидроксисукцинимид (0,22 г) и EDAC HCl (0,42 г). После перемешивания в течение 2,5 ч добавляли бензил 18-[[(1S)-4-[2-[2-[2-[2-[2-[2-(2-аминоэтиламино)-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-бензилоксикарбонил-4-оксо-бутил]амино]-18-оксо-октадеканоат (1,5 г) в DCM (5 мл). После перемешивания в течение ночи при комнатной температуре смесь экстрагировали 1М HCl (2×20 мл) и смесью вода/рассол 2:1 (30 мл). Органический слой высушивали (MgSO4), фильтровали и концентрировали в вакууме с получением прозрачного масла, 1,37 г (84%)
LCMS: Теоретическая масса: 1032,7; Измеренное m/z, z=1: 1033,1
Стадия 3: 18-[[(1S)-1-карбокси-4-[2-[2-[2-[2-[2-[2-[2-[(2-хлорацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-4-оксо-бутил]амино]-18-оксо-октадекановая кислота
К раствору бензил 18-[[(1S)-1-бензилоксикарбонил-4-[2-[2-[2-[2-[2-[2-[2-[(2-хлорацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-4-оксо-бутил]амино]-18-оксо-октадеканоата (10,5 г) в ацетоне (140 мл) добавляли 10% PD/C (1,0 г) после продувки азотом. После гидрогенизации в течение 6 ч смесь нагревали до 40-50°C перед фильтрованием. Из холодного фильтрата выделяли преципитат, промывали ацетоном и высушивали с получением указанного в заголовке соединения, 7,42 г (85%).
Стадия 4: 8-[[(1S)-4-[2-[2-[2-[2-[2-[2-[2-[(2-бромацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-18-оксо-октадекановая кислота.
К суспензии 18-[[(1S)-1-карбокси-4-[2-[2-[2-[2-[2-[2-[2-[(2-хлорацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-4-оксо-бутил]амино]-18-оксо-октадекановой кислоты в ацетоне (60 мл) добавляли бромид натрия (5 экв., 1,21 г). Смесь перемешивали при комнатной температуре в темноте. Еще через 2 ч добавляли бромид натрия (10 экв., 2,41 г). Еще через 2 суток добавляли бромид натрия (5 экв., 1,21 г). Через 5 суток смесь концентрировали. Чтобы уменьшить остаток вдвое, добавляли DCM (30 мл), 10% аскорбиновую кислоту (20 мл) и воду 30 мл. К эмульсии добавляли изопропанол (50 мл) и воду (30 мл). Органическую фазу отделяли и дважды промывали смесью 10% аскорбиновой кислоты (20 мл) и изопропанола (10 мл). Органический слой высушивали (MgSO4), фильтровали и концентрировали с получением твердого масла, которое кристаллизовали в ацетоне и выделяли путем фильтрации с получением указанного в заголовке соединения, контаминированного исходным материалом, 0,80 г (72%).
LCMS: Теоретическая масса: 896,9. Измеренное m/z, z=1: 898,9 (М+1)
Пример 4.6. Получение 12-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[2-[(2-бромацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-12-оксо-додекановой кислоты
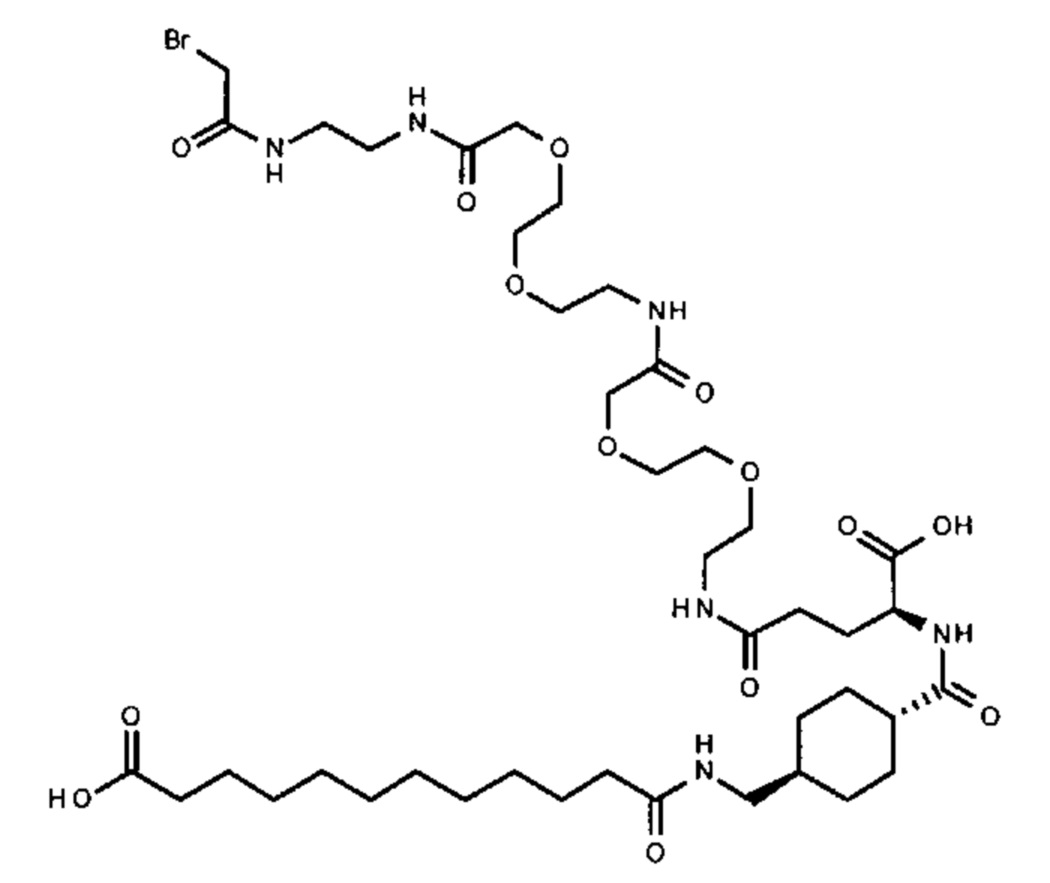
Протокол твердофазного синтеза:
2-хлортритильную смолу, 100-200 меш, 1,8 ммоль/г (1, 11,9 г, 21,4 ммоль) оставляли набухать в осушенном дихлорметане (80 мл) на 20 минут. К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 5,50 г, 14,3 ммоль) и N,N-диизопропилэтиламин (9,44 мл, 54,2 ммоль) в осушенном дихлорметане (70 мл) и смесь встряхивали в течение 4 часов. Смолу отфильтровывали и обрабатывали раствором N,N-диизопропилэтиламина (4,97 мл, 28,5 ммоль) в смеси метанол/дихлорметан (4:1, 2×5 мин, 2×57 мл). Затем смолу промывали N,N-диметилформамидом (2×80 мл), дихлорметаном (2×80 мл) и N,N-диметилформамидом (3×80 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×80 мл). Смолу промывали N,N-диметилформамидом (3×80 мл), 2-пропанолом (2×80 мл) и дихлорметаном (100 мл 2×80 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 11,0 г, 28,5 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 10,1 г, 28,5 ммоль) и N,N-диизопропилэтиламин (9,93 мл, 57,0 ммоль) в N,N-диметилформамиде (80 мл) и смесь встряхивали в течение 2 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×80 мл), дихлорметаном (2×80 мл) и N,N-N,N-диметилформамидом (3×80 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×80 мл). Смолу промывали N,N-диметилформамидом (3×80 мл), 2-пропанолом (2×80 мл) и дихлорметаном (100 мл 2×80 мл). К смоле добавляли раствор 1-трет-бутилового эфира (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu, 9,11 г, 21,4 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 7,60 г, 21,4 ммоль) и N,N-диизопропилэтиламин (6,71 мл, 38,5 ммоль) в N,N-диметилформамиде (80 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×80 мл), дихлорметаном (2×80 мл) и N,N-N,N-диметилформамидом (2×80 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×80 мл). Смолу промывали N,N-диметилформамидом (3×80 мл), 2-пропанолом (2×80 мл) и дихлорметаном (100 мл 2×80 мл). К смоле добавляли раствор 4-[(9Н-флуорен-9-илметоксикарбониламино)метил]циклогексанкарбоновой кислоты (Fmoc-Trx-OH, 9,11 г, 21,4 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 7,60 г, 21,4 ммоль) и N,N-диизопропилэтиламин (6,71 мл, 38,5 ммоль) в N,N-диметилформамиде (80 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×80 мл), дихлорметаном (2×80 мл) и N,N,N,N-диметилформамидом (2×80 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×80 мл). Смолу промывали N,N-диметилформамидом (3×80 мл), 2-пропанолом (2×80 мл) и дихлорметаном (100 мл 2×80 мл). К смоле добавляли раствор моно-трет-бутилового эфира додекандиовой кислоты (C12(OtBu)-OH, 6,13 г, 21,4 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 7,61 г, 21,4 ммоль) и N,N-диизопропилэтиламин (6,71 мл, 38,5 ммоль) в смеси дихлорметан/N,N-диметилформамид (4:1, 80 мл) и смесь встряхивали в течение 1,5 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (6×80 мл), дихлорметаном (4×80 мл), метанолом (4×80 мл) и дихлорметаном (7×80 мл). Продукт отщепляли от смолы путем обработки 2,2,2-трифторэтанолом (80 мл) в течение 18 часов. Смолу отделяли фильтрованием и промывали дихлорметаном (4×80 мл), смесью дихлорметан/2-пропанол (1:1, 4×80 мл), 2-пропанолом (2×80 мл) и дихлорметаном (6×80 мл). Растворы объединяли; растворитель выпаривали и неочищенный продукт очищали путем колоночной хроматографии (Silicagel 60, 0,040-0-063 мм; элюент: дихлорметан/метанол 1:0-9:1). Очищенный продукт (2) высушивали в вакууме и получали в виде масла.
Выход: 5,40 г (42%).
RF (SiO2, дихлорметан/метанол 9:1): 0,30.
1Н NMR спектр (300 MHz, CDCl3, dH): 7.45-7.31 (m, 1Н); 7.10-6.97 (m, 1Н); 6.71-6.60 (m, 1Н); 5.70-5.58 (m, 1Н); 4.43-4.31 (m, 1Н); 4.15 (s, 2Н); 4.01 (s, 2Н); 3.79-3.31 (m, 16Н); 3.13-3.08 (m, 2Н); 2.28-1.79 (m, 11Н); 1.71-1.51 (m, 4Н); 1.46 (s, 9Н); 1.44 (s, 9Н); 1.25 (bs, 12Н); 1.05-0.88 (m, 2Н).
Чистота согласно LC-MS: 100%
LC-MS Rt (Sunfire 4,6 мм × 100 мм, ацетонитрил/вода 50:50 до 100:0 + 0,1% FA): 2,16 мин.
LC-MS m/z: 903,0 (М+Н)+
Затем к указанному выше раствору масла (2, 5,31 г, 5,89 ммоль) в осушенном дихлорметане (23 мл) добавляли 2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат (HATU, 2,46 г, 6,48 ммоль) и триэтиламин (1,89 мл, 13,6 ммоль). К суспензии гидрохлорида бензилового эфира (2-амино-этил)-карбаминовой кислоты (3, 1,49 г, 6,48 ммоль) в осушенном дихлорметане (35 мл) добавляли триэтиламин (1,36 мл, 9,72 ммоль) и полученную смесь добавляли к указанному выше раствору. Смесь перемешивали при комнатной температуре в течение ночи, а затем выпаривали досуха. Осадок повторно растворяли в этилацетате (70 мл); промывали 1М водным раствором соляной кислоты (1×70 мл), 5% водным раствором карбоната натрия (2×70 мл), 1 М водным раствором соляной кислоты (4×70 мл) и рассолом (70 мл); высушивали над безводным сульфатом натрия и выпаривали. Осадок очищали при помощи колоночной флэш-хроматографии (Silicagel 60, 0,040-0-063 мм; элюент: дихлорметан/метанол 95:5 до 92:8) с получением вязкого желтого масла.
Выход: 2,81 г (44%).
RF (SiO2, дихлорметан/метанол 9:1): 0,25.
1Н NMR спектр (300 MHz, CDCl3, dH): 7.41-7.29 (m, 6Н); 7.22-7.13 (m, 1Н); 6.93-6.81 (m, 1Н); 6.62-6.58 (m, 1Н); 5.90-5.81 (m, 1Н); 5.68-5.55 (m, 1Н); 5.09 (s, 2Н); 4.42-4.33 (m, 1Н); 4.01-3.95 (m, 4Н); 3.75-3.30 (m, 20Н); 3.14-3.06 (m, 2Н); 2.31-2.01 (m, 11H); 1.97-1.76 (m, 1H); 1.65-1.52 (m, 4H); 1.46 (s, 9H); 1.44 (s, 9H); 1.27 (bs, 12H); 1.04-0.87 (m, 2H).
К раствору указанного выше соединения (2,81 г, 2,60 ммоль) в метаноле (43 мл) добавляли палладий на угле (10%, 0,15 г, 0,13 ммоль) и полученную смесь гидрогенизировали при нормальном атмосферном давлении в течение 2,5 часов. Катализатор отделяли фильтрованием и фильтрат выпаривали досуха. Осадок совместно испаряли с толуолом четыре раза и высушивали в вакууме с получением соединения 5.
Выход: 2,01 г (81%).
1Н NMR спектр (300 MHz, CDCl3, dH): 7.51-7.36 (m, 2Н); 7.04-6.96 (m, 1Н); 6.76-6.66 (m, 1Н); 5.93-5.85 (m, 1Н); 4.41-4.29 (m, 1Н); 4.03-3.99 (m, 4Н); 3.73-3.25 (m, 18Н); 3.13-2.97 (m, 4Н); 2.34-1.78 (m, 11Н); 1.67-1.51 (m, 4Н); 1.46 (s, 9Н); 1.44 (s, 9Н); 1.30 (m, 12Н); 1.04-0.88 (m, 2Н).
Чистота согласно LC-MS: 100% (ELSD)
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 70:30 до 100:0 + 0,1% TFA): 0,67 мин.
LC-MS m/z: 945,0 (М+Н)+
К раствору указанного выше амина (5, 1,79 г, 1,90 ммоль) в осушенном дихлорметане (30 мл) добавляли N,N-диизопропилэтиламин (0,40 мл, 2,28 ммоль) при -30°C в атмосфере аргона. Добавляли по каплям бромацетилбромид (0,20 мл, 2,28 ммоль) и полученный раствор перемешивали при -30°C в течение 3 часов. Охлаждающую баню убирали, смесь перемешивали при комнатной температуре дополнительно в течение 1 часа, а затем выпаривали досуха. Осадок повторно растворяли в этилацетате (50 мл), промывали 5% водным раствором лимонной кислоты (3×50 мл, очень медленное разделение фаз), 1 М водным раствором соляной кислоты (4×50 мл) и рассолом (50 мл). Органический слой высушивали над безводным сульфатом натрия, фильтровали и выпаривали. Осадок очищали при помощи колоночной флэш-хроматографии (Silicagel 60, 0,040-0-063 мм; элюент: дихлорметан/метанол 95:5 до 93:7) с образованием желтого масла.
Выход: 1,63 г (80%).
RF (SiO2, дихлорметан/метанол 95:5): 0,25.
1Н NMR спектр (300 MHz, CDCl3, dH): 7.56-7.48 (m, 1Н); 7.43-7.34 (m, 1Н); 7.04-6.95 (m, 1Н); 6.62 (d, J=7.9 Hz, 1H); 5.74-5.63 (m, 1H); 4.43-4.33 (m, 1H); 4.02 (s, 4H); 3.85 (s, 2H); 3.73-3.40 (m, 20H); 3.14-3.09 (m, 2H); 2.34-2.04 (m, 9H); 1.97-1.76 (m, 4H); 1.68-1.51 (m, 7H); 1.46 (s, 9H); 1.44 (s, 9H); 1.27 (m, 12H); 1.07-0.90 (m, 2H).
Чистота согласно LC-MS: 100% (ELSD)
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 50:50 до 100:0 + 0,1% FA): 2,16 мин.
LC-MS m/z: 1066,0 (М+Н)+
Указанное выше соединение (1,53 г, 1,44 ммоль) растворяли в трифторуксусной кислоте (25 мл) и оставляли на 1,5 часа. Трифторуксусную кислоту удаляли под вакуумом и осадок выпаривали совместно с толуолом три раза и с дихлорметаном десять раз с получением желтого маслянистого твердого вещества.
Выход: 810 мг (59%).
1Н NMR спектр (300 MHz, AcOD-d4, dH): 4.64-4.54 (m, 1H); 4.13 (s, 2H); 4.11 (s, 2H); 3.96 (s, 2H); 3.78-3.40 (m, 20H); 3.13-3.10 (d, J=6.6 Hz, 2H); 2.51-2.19 (m, 9H); 1.94-1.77 (m, 4H); 1.68-1.41 (m, 7H); 1.31 (bs, 12H); 1.10-0.92 (m, 2H).
Чистота согласно LC-MS: 100% (ELSD)
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 20:80 до 100:0 + 0,1% FA): 2,82 мин.
LC-MS m/z: 952,0 (M+H)+
Пример 4.7. Получение 16-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[2-[(2-бромацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-16-оксо-гексадекановой кислоты
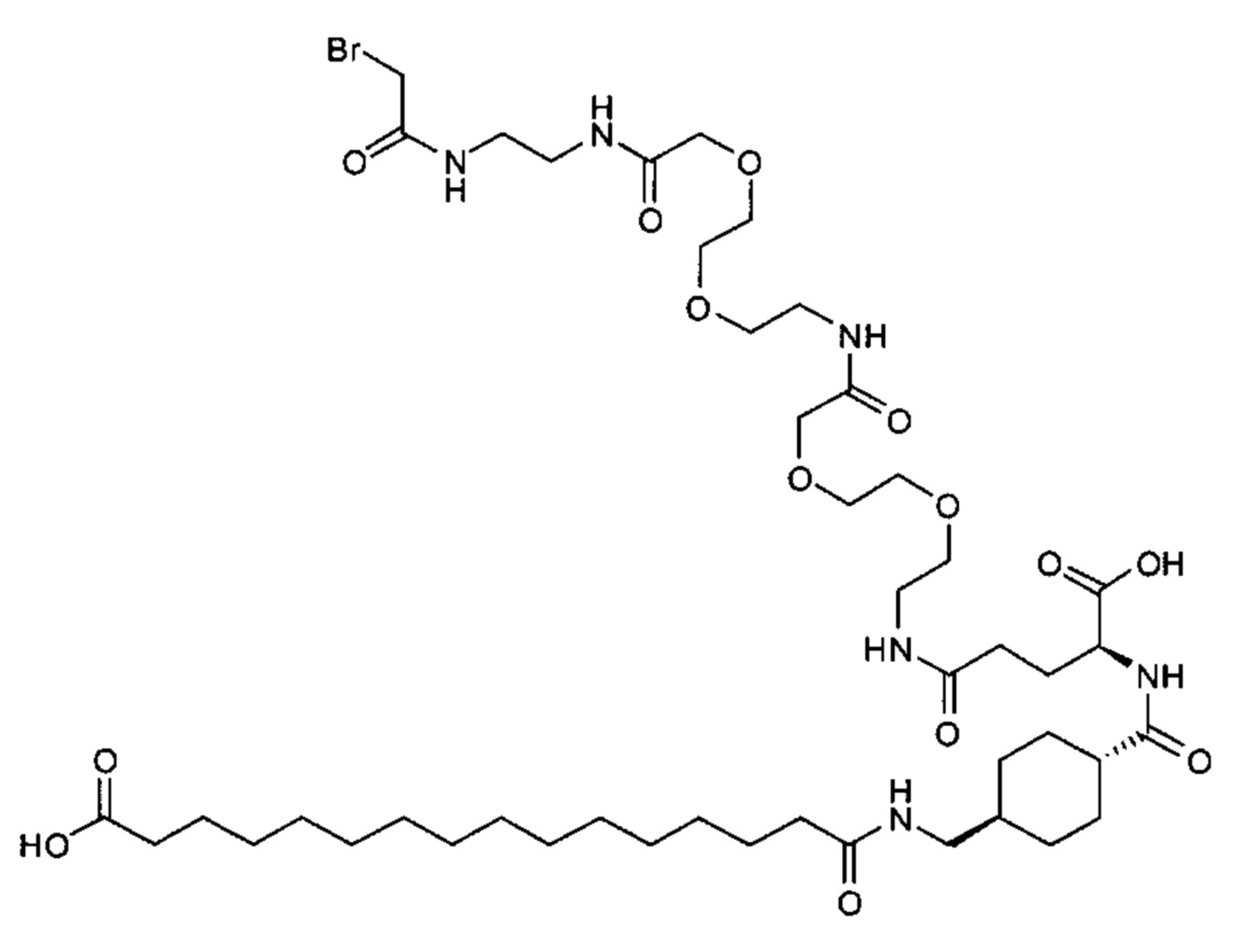
Протокол твердофазного синтеза:
2-хлортритильную смолу, 100-200 меш, 1,8 ммоль/г (1, 11,9 г, 21,4 ммоль) оставляли набухать в осушенном дихлорметане (80 мл) на 20 минут. К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 5,50 г, 14,3 ммоль) и N,N-диизопропилэтиламин (9,44 мл, 54,2 ммоль) в осушенном дихлорметане (70 мл) и смесь встряхивали в течение 4 часов. Смолу отфильтровывали и обрабатывали раствором N,N-диизопропилэтиламина (4,97 мл, 28,5 ммоль) в смеси метанол/дихлорметан (4:1, 2×5 мин, 2×57 мл). Затем смолу промывали N,N-диметилформамидом (2×80 мл), дихлорметаном (2×80 мл) и N,N-диметилформамидом (3×80 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×80 мл). Смолу промывали N,N-диметилформамидом (3×80 мл), 2-пропанолом (2×80 мл) и дихлорметаном (100 мл, 2×80 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 11,0 г, 28,5 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 10,1 г, 28,5 ммоль) и N,N-диизопропилэтиламин (9,93 мл, 57,0 ммоль) в N,N-диметилформамиде (80 мл) и смесь встряхивали в течение 2 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×80 мл), дихлорметаном (2×80 мл) и N,N-N,N-диметилформамидом (3×80 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×80 мл). Смолу промывали N,N-диметилформамидом (3×80 мл), 2-пропанолом (2×80 мл) и дихлорметаном (100 мл, 2×80 мл). К смоле добавляли раствор 1-трет-бутилового эфира (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu, 9,11 г, 21,4 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 7,60 г, 21,4 ммоль) и N,N-диизопропилэтиламин (6,71 мл, 38,5 ммоль) в N,N-диметилформамиде (80 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×80 мл), дихлорметаном (2×80 мл) и N,N-N,N-диметилформамидом (2×80 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×80 мл). Смолу промывали N,N-диметилформамидом (3×80 мл), 2-пропанолом (2×80 мл) и дихлорметаном (100 мл, 2×80 мл). К смоле добавляли раствор Fmoc-транексамовой кислоты (Fmoc-Trx-OH, 9,11 г, 21,4 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 7,60 г, 21,4 ммоль) и N,N-диизопропилэтиламин (6,71 мл, 38,5 ммоль) в N,N-диметилформамиде (80 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×80 мл), дихлорметаном (2×80 мл) и N,N-N,N-диметилформамидом (2×80 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×80 мл). Смолу промывали N,N-диметилформамидом (3×80 мл), 2-пропанолом (2×80 мл) и дихлорметаном (100 мл, 2×80 мл). К смоле добавляли раствор моно-трет-бутилового эфира гексадекандиовой кислоты (C16(OtBu)-OH, 7,33 г, 21,4 ммоль), О-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 7,61 г, 21,4 ммоль) и N,N-диизопропилэтиламин (6,71 мл, 38,5 ммоль) в смеси дихлорметан/N,N-диметилформамид (4:1, 80 мл) и смесь встряхивали в течение 1,5 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (6×80 мл), дихлорметаном (4×80 мл), метанолом (4×80 мл) и дихлорметаном (7×80 мл). Продукт отщепляли от смолы путем обработки 2,2,2-трифторэтанолом (80 мл) в течение 18 часов. Смолу отделяли фильтрованием и промывали дихлорметаном (4×80 мл), смесью дихлорметан/2-пропанол (1:1, 4×80 мл), 2-пропанолом (2×80 мл) и дихлорметаном (6×80 мл). Растворы объединяли; растворитель выпаривали и неочищенный продукт очищали при помощи колоночной хроматографии (Silicagel 60, 0,040-0-063 мм; элюент: дихлорметан/метанол 1:0-9:1). Промежуточное соединение (2) высушивали в вакууме и получали в виде масла.
Выход: 8,20 г (80%).
RF (SiO2, дихлорметан/метанол 9:1): 0,20.
1Н NMR спектр (300 MHz, CDCl3, dH): 7.44-7.33 (m, 1H); 7.07-6.97 (m, 1H); 6.72-6.63 (m, 1H); 5.70-5.59 (m, 1H); 4.44-4.33 (m, 1H); 4.15 (s, 2H); 4.01 (s, 2H); 3.76-3.32 (m, 16H); 3.14-3.07 (m, 2H); 2.38-1.77 (m, 11H); 1.71-1.50 (m, 4H); 1.46 (s, 9H); 1.44 (s, 9H); 1.25 (bs, 20H); 1.05-0.87 (m, 2H).
Чистота согласно LC-MS: 100%
LC-MS Rt (Sunfire 4,6 мм × 100 мм, ацетонитрил/вода 50:50 до 100:0+0,1% FA): 3,56 мин.
LC-MS m/z: 959,0 (M+H)+
Затем к раствору промежуточного соединения 2 (8,13 г, 8,49 ммоль) в осушенном дихлорметане (34 мл) добавляли 2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат (HATU, 3,55 г, 9,34 ммоль) и триэтиламин (2,72 мл, 19,5 ммоль). К суспензии гидрохлорида бензилового эфира (2-амино-этил)-карбаминовой кислоты (2,15 г, 9,34 ммоль) в осушенном дихлорметане (51 мл) добавляли триэтиламин (1,78 мл, 12,7 ммоль) и полученную смесь добавляли к указанному выше раствору. Смесь перемешивали при комнатной температуре в течение ночи, а затем выпаривали досуха. Осадок повторно растворяли в этилацетате (150 мл); промывали 1М водным раствором соляной кислоты (1×100 мл), 5% водным раствором карбоната натрия (2×100 мл), 1 М водным раствором соляной кислоты (4×100 мл) и рассолом; высушивали над безводным сульфатом натрия и выпаривали. Осадок очищали при помощи колоночной флэш-хроматографии (Silicagel 60, 0,040-0-063 мм; элюент: дихлорметан/метанол 95:5 до 92:8) с получением соединения 4 в виде вязкого желтого масла.
Выход: 5,59 г (58%).
RF (SiO2, дихлорметан/метанол 9:1): 0,20.
1Н NMR спектр (300 MHz, CDCl3, dH): 7.41-7.31 (m, 6Н); 7.21-7.12 (m, 1Н); 6.92-6.83 (m, 1Н); 6.58-6.52 (m, 1Н); 5.89-5.79 (m, 1Н); 5.62-5.51 (m, 1Н); 5.10 (s, 2Н); 4.43-4.32 (m, 1Н); 4.05-3.92 (m, 4Н); 3.75-3.30 (m, 20Н); 3.15-3.07 (m, 2Н); 2.33-2.03 (m, 11Н); 1.97-1.68 (m, 1Н); 1.67-1.51 (m, 4Н); 1.45 (s, 9Н); 1.44 (s, 9Н); 1.26 (bs, 20Н); 1.05-0.87 (m, 2Н).
Чистота согласно LC-MS: 100% (ELSD)
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 70:30 до 100:0+0,1% TFA): 1,41 мин.
LC-MS m/z: 1136,0(М+Н)+
К раствору указанного выше соединения (4, 5,59 г, 4,93 ммоль) в метаноле (85 мл) добавляли палладий на угле (10%, 0,27 г, 0,24 ммоль) и полученную смесь гидрогенизировали при нормальном атмосферном давлении в течение 2,5 часов. Катализатор отделяли фильтрованием и фильтрат выпаривали досуха. Осадок совместно испаряли с толуолом четыре раза и высушивали в вакууме с получением соединения 5.
Выход: 3,45 г (70%).
1Н NMR спектр (300 MHz, CDCl3, dH): 7.43-7.33 (m, 2Н); 7.05-6.94 (m, 1Н); 6.72-6.65 (m, 1Н); 5.69-5.59 (m, 1Н); 4.44-4.33 (m, 1Н); 4.03-3.98 (m, 4Н); 3.72-3.39 (m, 18Н); 3.15-3.07 (m, 2Н); 2.96-2.90 (m, 2Н); 2.34-1.78 (m, 13Н); 1.71-1.51 (m, 7Н); 1.46 (s, 9Н); 1.44 (s, 9Н); 1.25 (m, 20Н); 1.07-0.93 (m, 1Н).
Чистота согласно LC-MS: 100% (ELSD)
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 70:30 до 100:0+0,1% TFA): 0,76 мин.
LC-MS m/z: 1001,0 (М+Н)+
К раствору указанного выше амина (5, 3,45 г, 3,45 ммоль) в осушенном дихлорметане (55 мл) добавляли N,N-диизопропилэтиламин (0,73 мл, 4,14 ммоль) при -30°С в атмосфере аргона. Добавляли по каплям бромацетилбромид (0,36 мл, 4,14 ммоль) и полученный раствор перемешивали при -30°С в течение 3 часов. Охлаждающую баню убирали, смесь перемешивали при комнатной температуре дополнительно в течение 1 часа, а затем выпаривали досуха. Осадок повторно растворяли в этилацетате (100 мл), промывали 5% водным раствором лимонной кислоты (3×100 мл, очень медленное разделение фаз), 1 М водным раствором соляной кислоты (4×100 мл) и рассолом. Органический слой высушивали над безводным сульфатом натрия, фильтровали и выпаривали. Осадок очищали при помощи колоночной флэш-хроматографии (Silicagel 60, 0,040-0-063 мм; элюент:дихлорметан/метанол 95:5 до 93:7) с образованием соединения 6 в виде желтого масла.
Выход: 1,63 г (44%).
RF (SiO2, дихлорметан/метанол 95:5): 0,15.
1Н NMR спектр (300 MHz, CDCl3, dH): 7.55-7.46 (m, 1Н); 7.43-7.33 (m, 1Н); 6.99-6.89 (m, 1Н); 6.58 (d, J=7.5 Hz, 1H); 5.72-5.59 (m, 1H); 4.44-4.32 (m, 1H); 4.02 (s, 4H); 3.85 (s, 2H); 3.74-3.40 (m, 20H); 3.14-3.09 (m, 2H); 2.33-2.05 (m, 9H); 2.01-1.76 (m, 4H); 1.67-1.53 (m, 7H); 1.46 (s, 9H); 1.44 (s, 9H); 1.25 (m, 20H); 1.07-0.89 (m, 2H).
Чистота согласно LC-MS: 100% (ELSD)
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 50:50 до 100:0+0,1% FA): 3,47 мин.
LC-MS m/z: 1122,0 (М+Н)+
Указанное выше соединение (6, 1,63 г, 1,53 ммоль) растворяли в трифторуксусной кислоте (25 мл) и оставляли на 1,5 часа. Трифторуксусную кислоту удаляли под вакуумом и осадок выпаривали совместно с толуолом три раза. К маслянистому осадку добавляли диэтиловый эфир (120 мл) и перемешивали в течение 1 часа. Затем преципитат отделяли фильтрованием и осадок высушивали в вакууме с образованием белого порошка.
Выход: 1,55 г (90%).
1Н NMR спектр (300 MHz, AcOD-d4, dH): 4.65-4.56 (m, 1H); 4.14 (s, 2H); 4.12 (s, 2H); 3.98 (s, 2H); 3.78-3.44 (m, 20H); 3.14-3.10 (d, J=6.8 Hz, 2H); 2.48-2.21 (m, 8H); 2.18-2.10 (m, 1H); 1.97-1.79 (m, 4H); 1.70-1.46 (m, 7H); 1.32 (bs, 20H); 1.11-0.93 (m, 2H).
Чистота согласно LC-MS: 100% (ELSD)
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 20:80 до 100:0+0,1% FA): 3,32 мин.
LC-MS m/z: 1008,0 (M+H)+
Пример 4.8. Получение 18-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-18-оксо-октадекановой кислоты
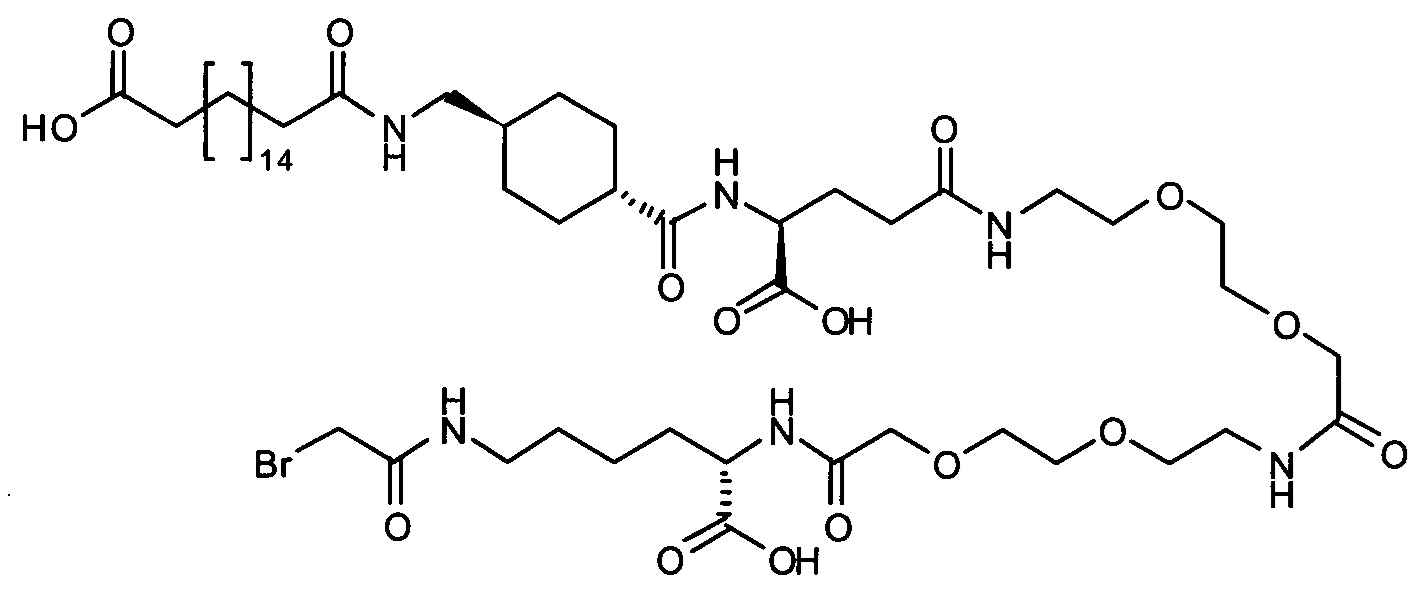
Протокол синтеза:
Модифицированную группами Fmoc-Lys(Mtt) смолу Ванга, 0,26 ммоль/г (1, 11,7 г, 3,05 ммоль) оставляли набухать в дихлорметане (100 мл) в течение 45 минут. Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мл, 3×90 мл). Смолу промывали N,N-диметилформамидом (3×90 мл), 2-пропанолом (3×90 мл) и дихлорметаном (3×90 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 2,35 г, 6,09 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 2,17 г, 6,09 ммоль) и N,N-диизопропилэтиламин (2,12 мл, 12.2 ммоль) в N,N-диметилформамиде (100 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×90 мл), дихлорметаном (3×90 мл) и N,N-N,N-диметилформамидом (3×90 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мл, 3×90 мл). Смолу промывали N,N-диметилформамидом (3×90 мл), 2-пропанолом (3×90 мл) и дихлорметаном (3×90 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 2,35 г, 6,09 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 2,17 г, 6,09 ммоль) и N,N-диизопропилэтиламин (2,12 мл, 12,2 ммоль) в N,N-диметилформамиде (100 мл) и смесь встряхивали в течение 1,5 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×90 мл), дихлорметаном (3×90 мл) и N,N-N,N-диметилформамидом (3×90 мл) для получения промежуточного соединения 1. Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мл, 3×90 мл). Смолу промывали N,N-диметилформамидом (3×90 мл), 2-пропанолом (3×90 мл) и дихлорметаном (3×90 мл). К смоле добавляли раствор 1-трет-бутилового эфира (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu, 1,94 г, 4,57 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 1,62 г, 4,57 ммоль) и N,N-диизопропилэтиламин (1,43 мл, 8,23 ммоль) в N,N-диметилформамиде (100 мл) и смесь встряхивали в течение 1,5 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×90 мл), дихлорметаном (3×90 мл) и N,N-N,N-диметилформамидом (3×90 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мл, 3×90 мл). Смолу промывали N,N-диметилформамидом (3×90 мл), 2-пропанолом (3×90 мл) и дихлорметаном (3×90 мл). К смоле добавляли раствор 4-[(9Н-флуорен-9-илметоксикарбониламино)метил]циклогексанкарбоновой кислоты (Fmoc-Trx-OH, 1,73 г, 4,57 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 1,62 г, 4,57 ммоль) и N,N-диизопропилэтиламин (1,43 мл, 8,23 ммоль) в N,N-диметилформамиде (100 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×90 мл), дихлорметаном (3×90 мл) и N,N-N,N-диметилформамидом (3×90 мл) для получения промежуточного соединения 2. Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×50 мл). Смолу промывали N,N-диметилформамидом (3×50 мл), 2-пропанолом (3×50 мл) и дихлорметаном (3×30 мл). К смоле добавляли раствор моно-трет-бутилового эфира октадекандиовой кислоты (C18(OtBu)-OH, 0,85 г, 2,28 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 0,81 г, 2,28 ммоль) и N,N-диизопропилэтиламин (0,72 мл, 4,11 ммоль) в N,N-диметилформамиде (50 мл) и смесь встряхивали в течение 1,5 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×50 мл), дихлорметаном (3×50 мл) и N,N-диметилформамидом (3×50 мл). Группу Mtt удаляли путем обработки 80% 1,1,1,3,3,3-гексафтор-2-пропанолом в дихлорметане (2×10 мин, 2×30 мин, 4×50 мл). Смолу промывали дихлорметаном (6×50 мл). К смоле добавляли раствор бромуксусной кислоты (4,24 г, 30,5 ммоль) и N,N'-диизопропилкарбодиимид (DIC, 4,01 мл, 25,9 ммоль) в N,N-диметилформамиде (50 мл) и смесь встряхивали в течение 45 минут. Смолу отфильтровывали и промывали N,N-диметилформамидом (5×50 мл) и дихлорметаном (10×50 мл). Продукт отщепляли от смолы путем обработки трифторуксусной кислотой (50 мл) в течение 1 часа. Смолу отделяли фильтрованием и промывали трифторуксусной кислотой (1×25 мл) и дихлорметаном (2×30 мл). Растворы объединяли и растворители выпаривали досуха, с получением соединения в виде вязкого коричневатого масла.
Выход: 2,18 мг(64%).
1Н NMR спектр (300 MHz, AcOD-d4, 80°С, dH): 4.72-4.55 (m, 2Н); 4.16 (s, 2Н); 4.12 (s, 2Н); 3.80-3.62 (m, 12Н); 3.58-3.44 (m, 4Н); 3.32 (t, J=6.8 Hz, 2H); 3.15 (d, J=6.8 Hz, 2H); 2.51-2.07 (m, 8H); 2.01-1.77 (m, 6H); 1.72-1.44 (m, 11H); 1.33 (bs, 24H); 1.13-0.95 (m, 2H).
Чистота согласно LC-MS: 96%
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 20:80 до 100:0+0,1% FA): 3,68 мин.
LC-MS m/z: 1124,1 (M+H)+
Пример 4.9. Получение 16-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-16-оксо-гексадекановой кислоты.
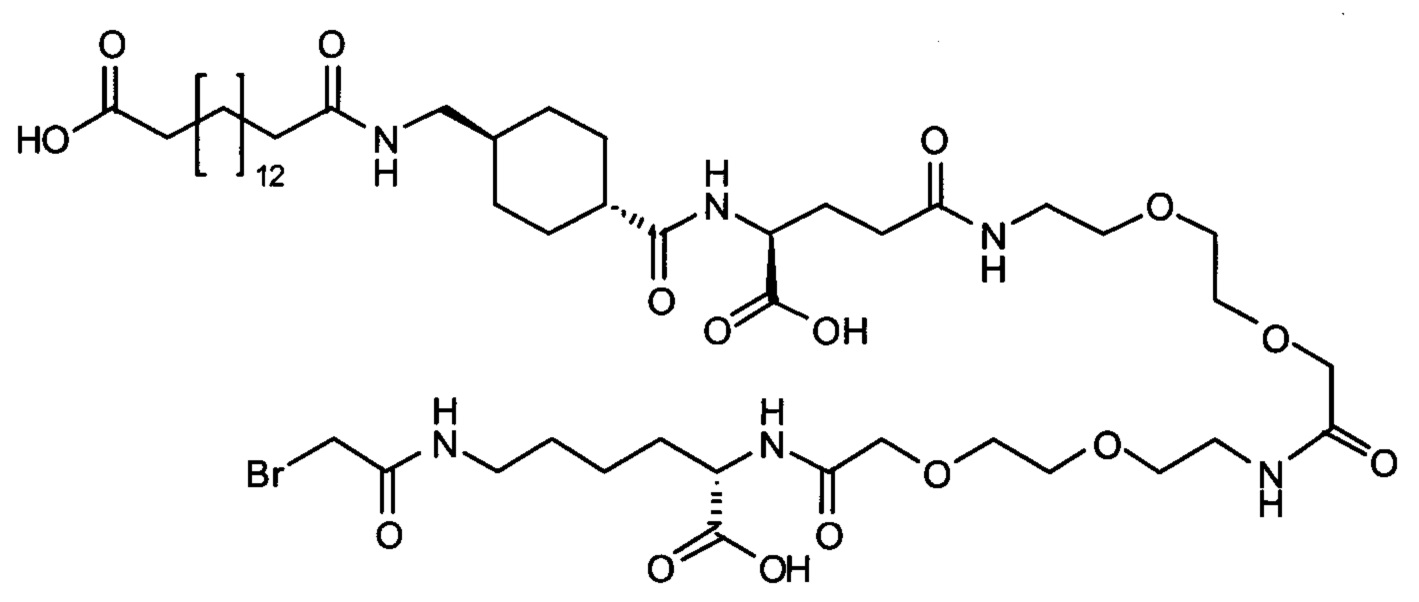
Процедура синтеза была аналогична Примеру 4.8, за исключением того, что на стадии синтеза, следующей за промежуточным соединением 2, вместо моно-трет-бутилового эфира октадекандиовой кислоты (C18(OtBu)-OH) применяли моно-трет-бутиловый эфир гексадекандиовой кислоты (C16(OtBu)-OH). Продукт получали в виде вязкого коричневатого масла.
Выход: 2,05 мг (62%).
1Н NMR спектр (300 MHz, AcOD-d4, 80°С, dH): 4.71-4.55 (m, 2Н); 4.16 (s, 2Н); 4.12 (s, 2Н); 3.79-3.62 (m, 12Н); 3.58-3.44 (m, 4Н); 3.32 (t, J=6.7 Hz, 2H); 3.15 (d, J=6.6 Hz, 2H); 2.49-2.07 (m, 8H); 2.01-1.77 (m, 6H); 1.72-1.44 (m, 11H); 1.33 (bs, 20H); 1.13-0.97 (m, 2H).
Чистота согласно LC-MS: 92%
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 20:80 до 100:0+0,1% FA): 3,38 мин.
LC-MS m/z: 1096,0 (M+H)+
Пример 4.10. Получение 4-[10-[[4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-4-оксо-бутил]сульфониламино]-10-оксо-декокси]бензойной кислоты
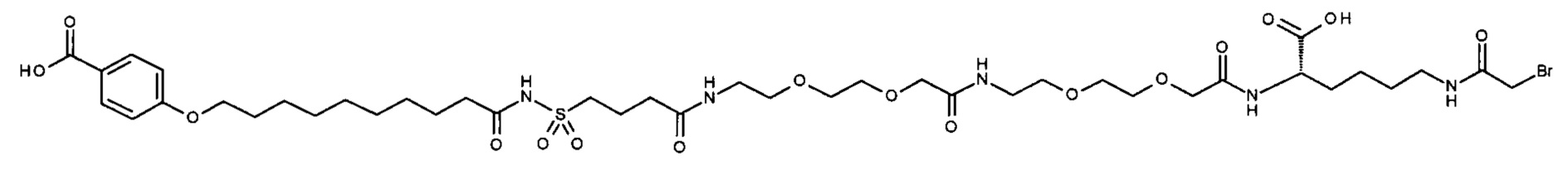
Процедура синтеза была аналогична Примеру 4.8, за исключением того, что на стадиях синтеза, следующих за промежуточным соединением 1, вначале к смоле присоединяли 3-карбокипропансульфонамид и затем 10-(4-трет-бутоксикарбонилфенокси)декановую кислоту с использованием стандартных процедур синтеза с введением/снятием защитных групп Fmoc. Последующие стадии синтеза, отщепления и выделения продукта, приведенные в Примере 4.8, позволили получить белое твердое вещество.
LC-MS m/z: 998,54 (М1+).
UPLC5: способ 09_В4_1, Rt=8,3004 мин (рН 2,3); чистота 98%.
Пример 4.11. Получение 4-[10-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-10-оксо-декокси]бензойной кислоты
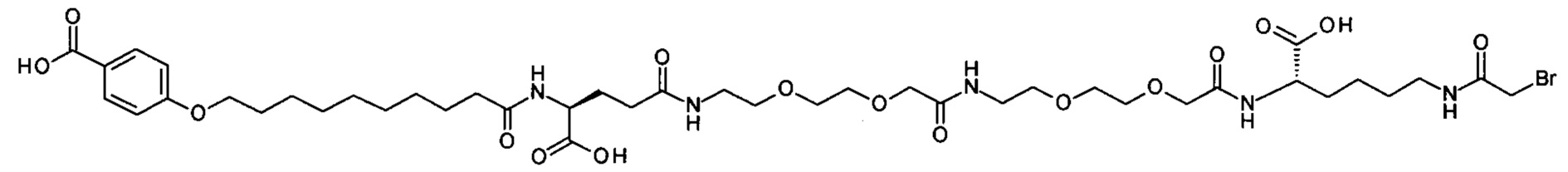
Процедура синтеза была аналогична Примеру 4.8, за исключением того, что на стадиях синтеза, следующих за промежуточным соединением 1, вначале к смоле присоединяли 1-трет-бутиловый эфир (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu) и затем 10-(4-трет-бутоксикарбонилфенокси)декановую кислоту с использованием стандартных процедур синтеза с введением/снятием защитных групп Fmoc. Последующие стадии синтеза, отщепления и выделения продукта, приведенные в Примере 4.8, позволили получить белое твердое вещество.
LC-MS m/z: 978,55 (М1+).
UPLC5: способ 09_В4_1, Rt=7,573 мин (рН 2,3); чистота 99%.
Пример 4.12. Получение 20-[[(1S)-4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-1-карбокси-4-оксо-бутил]амино]-20-оксо-эйкозановой кислоты

Процедура синтеза была аналогична Примеру 4.8, за исключением того, что на стадиях синтеза, следующих за промежуточным соединением 1, вначале к смоле дважды присоединяли 1-трет-бутиловый эфир (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu), после чего к смоле присоединяли 20-трет-бутокси-20-оксо-эйкозановую кислоту (C20(OtBu)-OH) с использованием стандартных процедур синтеза с введением/снятием защитных групп Fmoc. Последующие стадии синтеза, отщепления и выделения продукта, приведенные в Примере 4.8, позволили получить белое твердое вещество.
LC-MS m/z: 1141,2(М+Н)+
Пример 4.13. Получение 20-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-20-оксо-эйкозановой кислоты

Процедура синтеза была аналогична Примеру 4.8, за исключением того, что на стадиях синтеза, следующих за промежуточным соединением 1, вначале к смоле присоединяли 1-трет-бутиловый эфир (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu), после чего к смоле присоединяли 20-трет-бутокси-20-оксо-эйкозановую кислоту (C20(OtBu)-OH) с использованием стандартных процедур синтеза с введением/снятием защитных групп Fmoc. Последующие стадии синтеза, отщепления и выделения продукта, приведенные в Примере 4.8, позволили получить белое твердое вещество.
LC-MS m/z: 1012,0 (М+Н)+
Пример 4.14. Получение (2S,25S)-2-(4-(2-бромацетамидо)бутил)-4,13,22-триоксо-25-(15-сульфопентадеканамидо)-6,9,15,18-тетраокса-3,12,21-триазагексакозандиовой кислоты
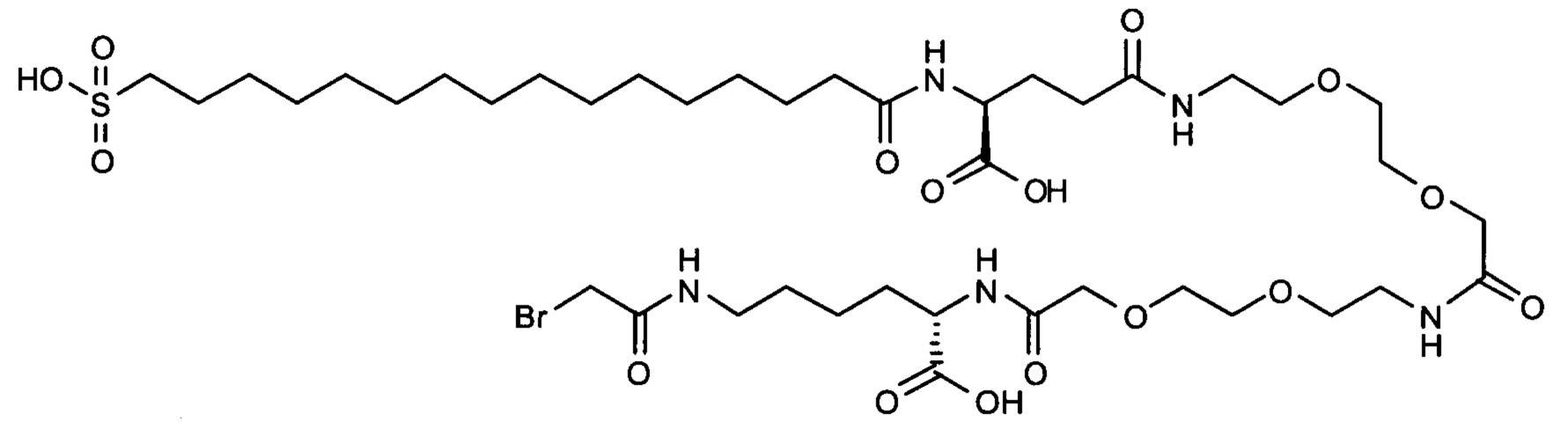
Протокол синтеза:
Модифицированную группами Fmoc-Lys(Mtt) смолу Ванга, 0,26 ммоль/г (1, 36,7 г, 9,55 ммоль) оставляли набухать в дихлорметане (200 мл) в течение 45 минут. Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×150 мл). Смолу промывали N,N-диметилформамидом (3×150 мл), 2-пропанолом (2×150 мл) и дихлорметаном (2×150 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 7,36 г, 19,1 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N''-тетраметилурония тетрафторборат (TCTU, 6,79 г, 19,1 ммоль) и N,N-диизопропилэтиламин (6,66 мл, 38,2 ммоль) в N,N-диметилформамиде (150 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×150 мл), дихлорметаном (2×150 мл) и N,N-диметилформамидом (2×150 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×150 мл). Смолу промывали N,N-диметилформамидом (2×150 мл), 2-пропанолом (2×150 мл) и дихлорметаном (2×150 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 7,36 г, 19,1 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 6,79 г, 19,1 ммоль) и N,N-диизопропилэтиламин (6,66 мл, 38,2 ммоль) в N,N-диметилформамиде (150 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×150 мл), дихлорметаном (2×150 мл) и N,N-диметилформамидом (150 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×150 мл). Смолу промывали N,N-диметилформамидом (3×150 мл), 2-пропанолом (2×150 мл) и дихлорметаном (2×150 мл). К смоле добавляли раствор 1-трет-бутилового эфира (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu, 6,10 г, 14,3 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 5,09 г, 14,3 ммоль) и N,N-диизопропилэтиламин (4,49 мл, 25,8 ммоль) в N,N-диметилформамиде (150 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×150 мл), дихлорметаном (2×150 мл) и N,N-диметилформамидом (150 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×150 мл). Смолу промывали N,N-диметилформамидом (3×150 мл), 2-пропанолом (2×150 мл) и дихлорметаном (2×150 мл). Смолу разделяли на три порции, к одной из указанных порций смолы добавляли раствор натриевой соли 16-сульфо-гексадекановой кислоты (3, 2,28 г, 6,37 ммоль), (бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (РуВОР, 3,31 г, 6,37 ммоль) и N,N-диизопропилэтиламин (2,22 мл, 12,8 ммоль) в диметилсульфоксиде (80 мл) и смесь встряхивали в течение 2 часов. Смолу отфильтровывали и промывали смесью N,N-диметилформамид:вода (3:1, 3×80 мл), N,N-диметилформамидом (3×80 мл), дихлорметаном (3×80 мл) и N,N-диметилформамидом (2×80 мл). Группу Mtt удаляли путем обработки 80% 1,1,1,3,3,3-гексафтор-2-пропанолом в дихлорметане (3×10 мин, 2×30 мин, 5×80 мл). Смолу промывали дихлорметаном (6×80 мл). К смоле добавляли раствор бромуксусной кислоты (6,64 г, 47,8 ммоль) и N,N'-диизопропилкарбодиимид (DIC, 5,26 мл, 34,0 ммоль) в N,N-диметилформамиде (80 мл) и смесь встряхивали в течение 45 минут. Смолу отфильтровывали и промывали N,N-диметилформамидом (4×80 мл) и дихлорметаном (10×80 мл). Продукт отщепляли от смолы путем обработки трифторуксусной кислотой (100 мл) в течение 1 часа. Смолу отделяли фильтрованием и промывали трифторуксусной кислотой (1×40 мл) и дихлорметаном (3×50 мл). Растворы объединяли и растворители выпаривали досуха, с получением вязкого коричневатого масла. Масло растворяли в смеси вода:ацетонитрил (4:1, 25 мл) и раствор пропускали через колонку (7×10 см) Dowex 50WX4 в Н+ форме (50-100 меш; элюент: вода). Фракции с кислыми значениями рН объединяли и подвергали сублимационной сушке с получением белого порошка.
Выход: 2,17 г (68%).
1Н NMR спектр (300 MHz, AcOD-d4, 80°С, dH): 4.74-4.56 (m, 2Н); 4.16 (d, J=5.3 Hz, 4H); 3.95 (s, 2H); 3.82-3.64 (m, 12H); 3.61-3.47 (m, 4H); 3.33 (t, J=6.9 Hz, 2H); 3.17-3.07 (m, 2H); 2.54 (t, J=7.3 Hz, 2H); 2.38 (t, J=7.5 Hz, 2H); 2.34-2.09 (m, 2H); 2.01-1.93 (m, 1H); 1.93-1.78 (m, 3H); 1.74-1.57 (m, 4H); 1.57-1.29 (m, 24H).
Чистота согласно LC-MS: 100%
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 20:80 до 100:0+0,1% FA): 2,86 мин.
LC-MS m/z: 1003,9 (M+H)+
Пример 4.15. Получение 12-[[(1S)-4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-1-карбокси-4-оксо-бутил]амино]-12-оксо-додекановой кислоты
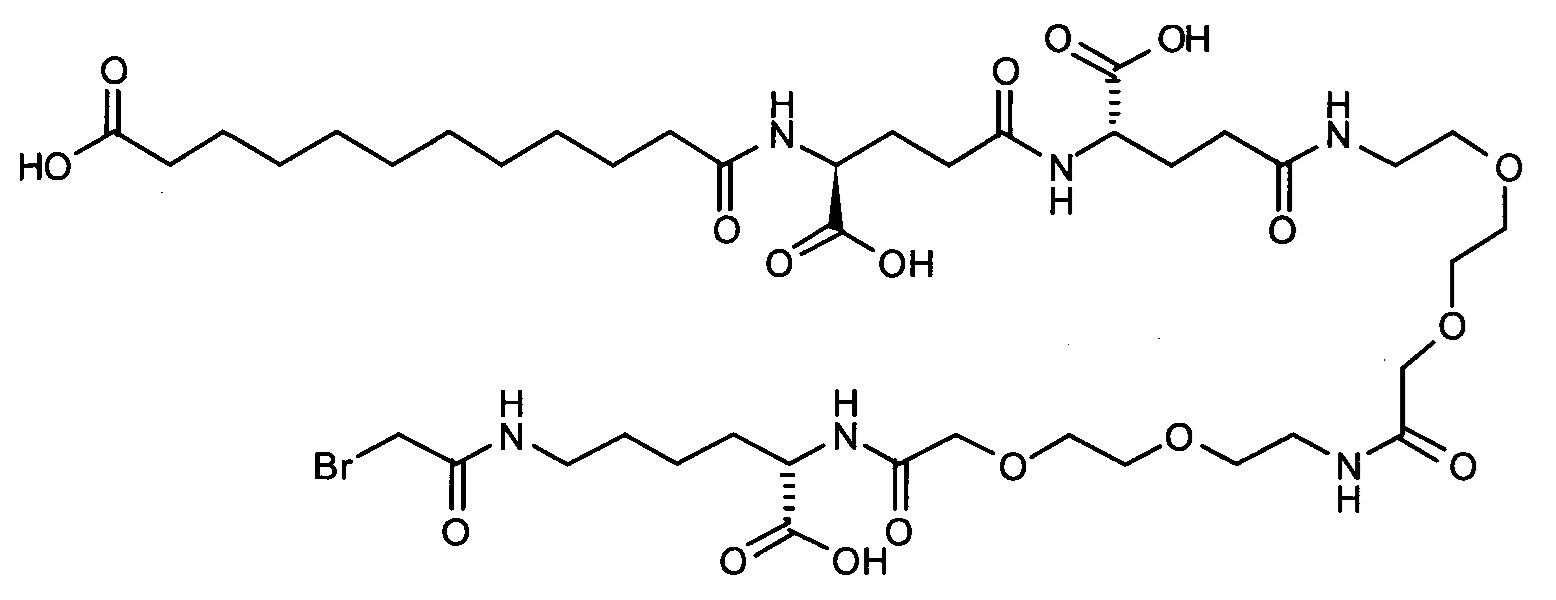
Протокол синтеза:
Модифицированную группами Fmoc-Lys(Mtt) смолу Ванга, 0,26 ммоль/г (1, 36,7 г, 9,55 ммоль) оставляли набухать в дихлорметане (200 мл) в течение 45 минут. Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×150 мл). Смолу промывали N,N-диметилформамидом (3×150 мл), 2-пропанолом (2×150 мл) и дихлорметаном (2×150 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 7,36 г, 19,1 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 6,79 г, 19,1 ммоль) и N,N-диизопропилэтиламин (6,66 мл, 38,2 ммоль) в N,N-диметилформамиде (150 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×150 мл), дихлорметаном (2×150 мл) и N,N-диметилформамидом (2×150 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×150 мл). Смолу промывали N,N-диметилформамидом (2×150 мл), 2-пропанолом (2×150 мл) и дихлорметаном (2×150 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 7,36 г, 19,1 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 6,79 г, 19,1 ммоль) и N,N-диизопропилэтиламин (6,66 мл, 38,2 ммоль) в N,N-диметилформамиде (150 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×150 мл), дихлорметаном (2×150 мл) и N,N-диметилформамидом (150 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×150 мл). Смолу промывали N,N-диметилформамидом (3×150 мл), 2-пропанолом (2×150 мл) и дихлорметаном (2×150 мл). К смоле добавляли раствор 1-трет-бутилового эфира (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu, 6,10 г, 14,3 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 5,09 г, 14,3 ммоль) и N,N-диизопропилэтиламин (4,49 мл, 25,8 ммоль) в N,N-диметилформамиде (150 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×150 мл), дихлорметаном (2×150 мл) и N,N-диметилформамидом (150 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×150 мл). Смолу промывали N,N-диметилформамидом (3×150 мл), 2-пропанолом (2×150 мл) и дихлорметаном (2×150 мл). Смолу делили на три порции, к одной из указанных порций смолы (2) добавляли раствор 1-трет-бутилового эфира (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu, 2,03 г, 4,78 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 1,70 г, 4,78 ммоль) и N,N-диизопропилэтиламин (1,50 мл, 8,60 ммоль) в N,N-диметилформамиде (70 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (2×70 мл), дихлорметаном (2×70 мл) и N,N-N,N-диметилформамидом (70 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×30 мин, 2×70 мл). Смолу промывали N,N-диметилформамидом (3×70 мл), 2-пропанолом (2×70 мл) и дихлорметаном (2×70 мл). К смоле добавляли раствор моно-трет-бутилового эфира додекандиовой кислоты (C12(OtBu)-OH, 1,37 г, 4,78 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 1,70 г, 4,78 ммоль) и N,N-диизопропилэтиламин (1,50 мл, 8,60 ммоль) в смеси дихлорметан/N,N-диметилформамид (4:1, 70 мл) и смесь встряхивали в течение 1,5 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×150 мл), дихлорметаном (3×150 мл) и N,N-диметилформамидом (3×150 мл). Группу Mtt удаляли путем обработки 80% 1,1,1,3,3,3-гексафтор-2-пропанолом в дихлорметане (3×10 мин, 2×30 мин, 4×70 мл). Смолу промывали дихлорметаном (6×70 мл). К смоле добавляли раствор бромуксусной кислоты (6,60 г, 47,8 ммоль) и N,N'-диизопропилкарбодиимид (DIC, 5,30 мл, 34,0 ммоль) в N,N-диметилформамиде (90 мл) и смесь встряхивали в течение 30 минут. Смолу отфильтровывали и промывали N,N-диметилформамидом (4×70 мл) и дихлорметаном (10×70 мл). Продукт отщепляли от смолы путем обработки трифторуксусной кислотой (100 мл) в течение 1 часа. Смолу отделяли фильтрованием и промывали трифторуксусной кислотой (1×40 мл) и дихлорметаном (2×40 мл). Растворы объединяли и растворители выпаривали досуха, с получением вязкого коричневатого масла.
Выход: 2,94 мг (90%).
1Н NMR спектр (300 MHz, AcOD-d4, dH): 4.74-4.53 (m, 3H); 4.17 (s, 2H); 4.12 (s, 2H); 3.96 (s, 2H); 3.81-3.40 (m, 16H); 3.31 (t, J=6.8 Hz, 2H); 2.57-2.20 (m, 10H); 2.16-2.04 (m, 3H); 1.89-1.75 (m, 1H); 1.72-1.54 (m, 6H); 1.52-1.41 (m, 2H); 1.32 (bs, 12H).
Чистота согласно LC-MS: 100%
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 20:80 до 100:0+0,1% FA): 2,64 мин.
LC-MS m/z: 1028,0 (M+H)+
Пример 4.16. Получение 12-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-12-оксо-додекановой кислоты
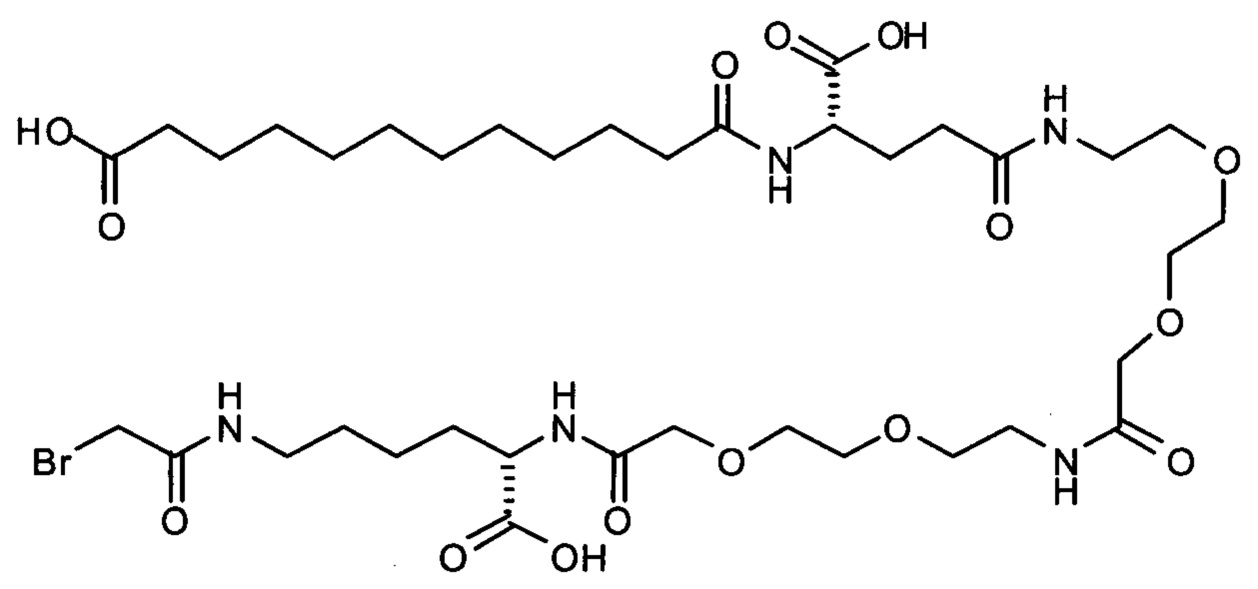
Процедура синтеза была аналогична Примеру 4.8, за исключением того, что на стадиях синтеза, следующих за промежуточным соединением 1, вначале к смоле присоединяли 1-трет-бутиловый эфир (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu), а затем 12-трет-бутокси-12-оксо-додекановую кислоту, используя стандартную процедуру синтеза с введением/снятием защитных групп Fmoc. Последующие стадии синтеза, отщепления и выделения продукта, приведенные в Примере 4.8, позволили получить соединение в виде густого коричневатого масла.
Выход: 97%
1Н NMR спектр (300 MHz, AcOD-d4, dH): 4.73-4.55 (m, 2H); 4.17 (s, 2H); 4.12 (s, 2H); 3.96 (s, 2H); 3.80-3.42 (m, 16H); 3.31 (t, J=6.78 Hz, 2H); 2.49-2.17 (m, 7H); 2.01-1.92 (m, 2H); 1.87-1.76 (m, 1H); 1.70-1.54 (m, 6H); 1.52-1.41 (m, 2H); 1.32 (bs, 12H).
Чистота согласно LC-MS: 100%
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 20:80 до 100:0+0,1% FA): 2,72 мин.
LC-MS m/z: 900,0 (M+H)+
Пример 4.17. Получение 20-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-20-оксо-эйкозановой кислоты
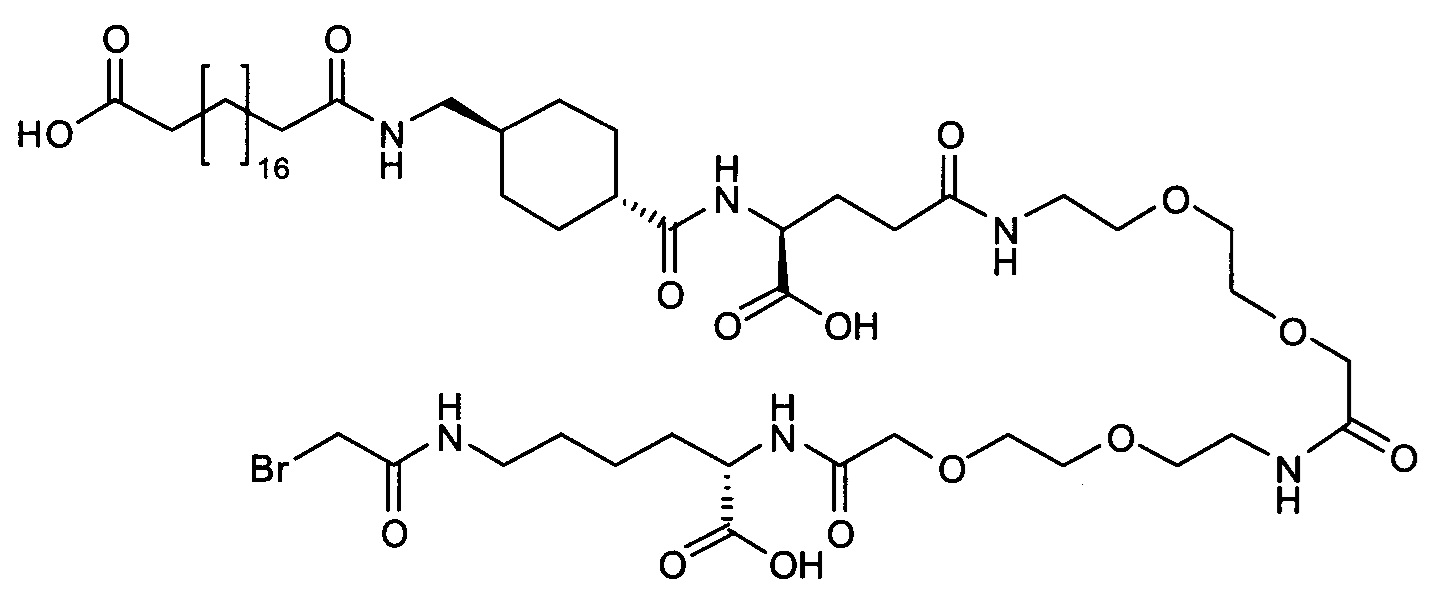
Протокол синтеза:
Модифицированную группами Fmoc-Lys(Mtt) смолу Ванга, 0,26 ммоль/г (1, 11,2 г, 2,90 ммоль) оставляли набухать в дихлорметане (100 мл) в течение 45 минут. Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×100 мл). Смолу промывали N,N-диметилформамидом (3×90 мл), 2-пропанолом (3×90 мл) и дихлорметаном (3×90 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 2,23 г, 5,80 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 2,06 г, 5,80 ммоль) и N,N-диизопропилэтиламин (2,02 мл, 11,6 ммоль) в N,N-диметилформамиде (100 мл) и смесь встряхивали в течение 1 часа. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×90 мл), дихлорметаном (3×90 мл) и N,N-N,N-диметилформамидом (3×90 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×100 мл). Смолу промывали N,N-диметилформамидом (3×90 мл), 2-пропанолом (3×90 мл) и дихлорметаном (3×90 мл). К смоле добавляли раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 2,23 г, 5,80 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 2,06 г, 5,80 ммоль) и N,N-диизопропилэтиламин (2,02 мл, 11,6 ммоль) в N,N-диметилформамиде (100 мл) и смесь встряхивали в течение 1,5 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×90 мл), дихлорметаном (3×90 мл) и N,N-N,N-диметилформамидом (3×90 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×100 мл). Смолу промывали N,N-диметилформамидом (3×90 мл), 2-пропанолом (3×90 мл) и дихлорметаном (3×90 мл). К смоле добавляли раствор 1-трет-бутилового эфира (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты (Fmoc-LGlu-OtBu, 1,85 г, 4,35 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 1,55 г, 4,35 ммоль) и N,N-диизопропилэтиламин (1,36 мл, 7,82 ммоль) в N,N-диметилформамиде (100 мл) и смесь встряхивали в течение 1,5 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×90 мл), дихлорметаном (3×90 мл) и N,N-N,N-диметилформамидом (3×90 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×100 мл). Смолу промывали N,N-диметилформамидом (3×90 мл), 2-пропанолом (3×90 мл) и дихлорметаном (3×90 мл). Раствор 4-[(9Н-флуорен-9-илметоксикарбониламино)метил]циклогексанкарбоновой кислоты (Fmoc-Trx-OH, 1,65 г, 4,35 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 1,55 г, 4,35 ммоль) и N,N-диизопропилэтиламин (1,36 мл, 7,82 ммоль) в N,N-диметилформамиде (100 мл) добавляли к смоле и смесь встряхивали в течение 2 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×90 мл), дихлорметаном (3×90 мл) и N,N-N,N-диметилформамидом (3×90 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (1×5 мин, 1×10 мин, 1×30 мин, 3×100 мл). Смолу промывали N,N-диметилформамидом (3×90 мл), 2-пропанолом (3×90 мл) и дихлорметаном (3×90 мл). К смоле добавляли раствор моно-трет-бутилового эфира эйкозандиовой кислоты (C20(OtBu)-OH, 1,73 г, 4,35 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 1,55 г, 4,35 ммоль) и N,N-диизопропилэтиламин (1,36 мл, 7,82 ммоль) в N,N-диметилформамиде (100 мл) и смесь встряхивали в течение 2 часов. Смолу отфильтровывали и промывали N,N-диметилформамидом (3×90 мл), дихлорметаном (3×90 мл), N,N-диметилформамидом (3×90 мл) и дихлорметаном (3×90 мл). Группу Mtt удаляли путем обработки 80% 1,1,1,3,3,3-гексафтор-2-пропанолом в дихлорметане (2×10 мин, 2×30 мин, 4×100 мл). Смолу промывали дихлорметаном (6×90 мл) и N,N-диметилформамидом (3×90 мл). К смоле добавляли раствор бромуксусной кислоты (8,06 г, 58,0 ммоль) и N,N'-диизопропилкарбодиимид (DIC, 7,60 мл, 49,3 ммоль) в N,N-диметилформамиде (100 мл) и смесь встряхивали в течение 40 минут. Смолу отфильтровывали и промывали N,N-диметилформамидом (5×90 мл) и дихлорметаном (12×90 мл). Продукт отщепляли от смолы путем обработки трифторуксусной кислотой (100 мл) в течение 1 часа. Смолу отделяли фильтрованием и промывали трифторуксусной кислотой (1×50 мл) и дихлорметаном (7×70 мл). Растворы объединяли и растворители выпаривали досуха, с получением вязкого коричневатого масла.
Выход: 3,28 г (98%).
1Н NMR спектр (300 MHz, AcOD-d4, 80°С, dH): 4.68 (dd, J=8.0 и 5.4Hz, 1H); 4.60 (dd, J=7.9 и 5.3 Hz, 1H); 4.16 (s, 2H); 4.12 (s, 2H); 3.94 (s, 2H); 3.81-3.61 (m, 12H); 3.59-3.44 (m, 4H); 3.32 (t, J=6.8 Hz, 2H); 3.14 (d, J=6.8 Hz, 2H); 2.49-1.79 (m, 15H); 1.73-1.43 (m, 11H); 1.33 (s, 28H); 1.11-0.96 (m, 2H).
Чистота согласно LC-MS: 100% (ELSD)
LC-MS Rt (Kinetex 4,6 мм × 50 мм, ацетонитрил/вода 20:80 до 100:0+0,1% FA): 4,04 мин.
LC-MS m/z: 1151,3 (M+H)+
Пример 5. Получение производных FGF21
Получение репрезентативного производного FGF21 приведено в Примере 5.1 (Соединение 21). Производные FGF21 из Примеров 5.2-5.14 (Соединения 11-20 и 22-24) получали способом, описанным в Примере 5.1. Производные FGF21 из Примеров 5.15-5.37 получали способом, описанным в Примере 5.1, или как описано ниже.
Пример 5.1. Соединение 21.
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys181]FGF21
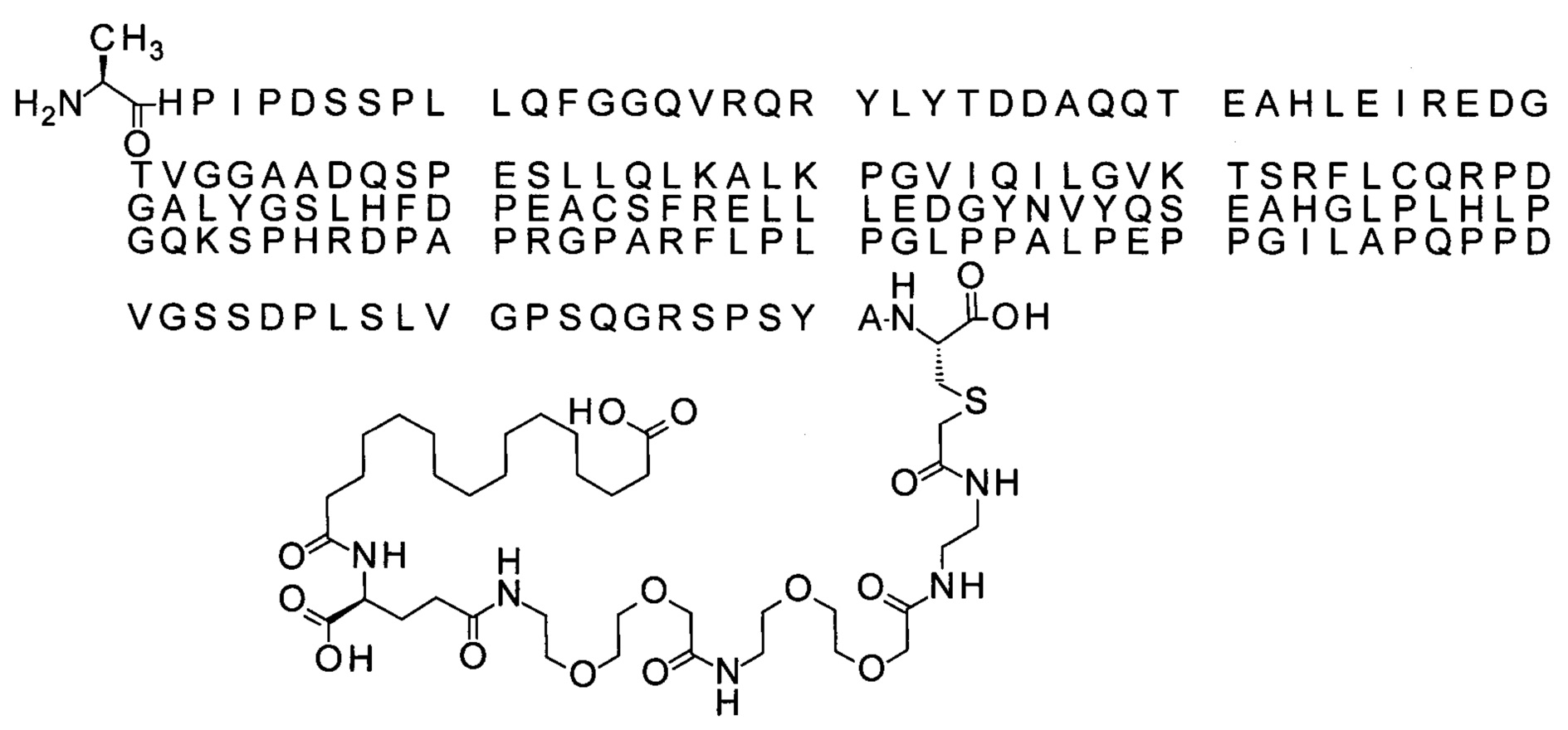
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 10 (см. Пример 3).
Соединение 21 получали следующим образом:
Остаток Cys в положении 181 аналога S{бета-181}-2-аминоэтилсульфанил-Ala[Gln121,Leu168,Cys181]FGF21 последовательности SEQ NO: 10, полученного, как описано в Примерах 1-3, модифицировали по тиоловой группе остатка Cys, находящегося в положении 181С, реагентом, полученным в Примере 4.1:
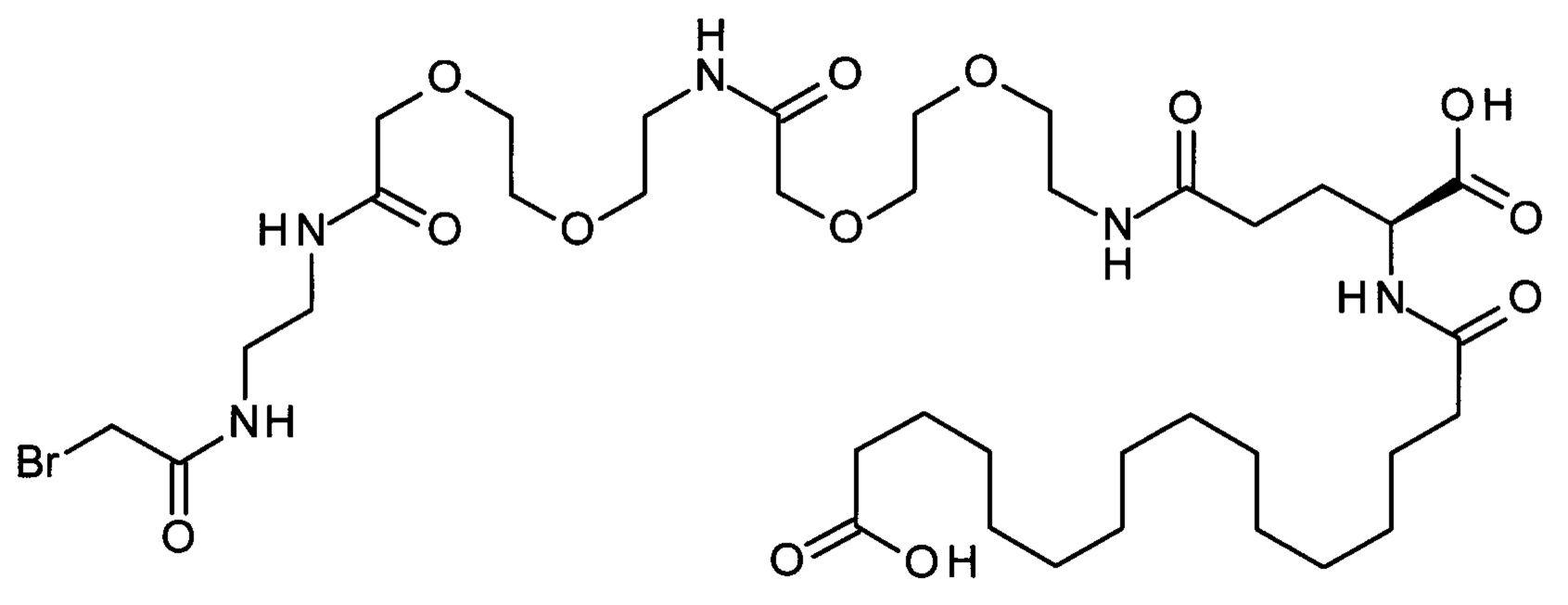
К защищенному цистеамином Ala[Gln121,Leu168,Cys181]FGF21 (70 мг, 0,0036 ммоль), в Трис и NaCl-буфере (1,35 мг/мл) добавляли Трис в воде для доведения рН до 8,0. BSPP (бис(п-сульфонатофенил)фенилфосфина дикалиевую соль дигидрат, 12 мг) растворяли в воде и осторожно перемешивали в течение 4 часов при комнатной температуре. Добавляли 15-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}этокси)этилкарбамоил]-метокси}этокси)этилкарбамоил]пропилкарбамоил}пентадекановую кислоту (19 мг, 0,022 ммоль) в этаноле (0,5 мл). После осторожного перемешивания в течение ночи добавляли воду MiliQ (150 мл) для снижения электропроводности до 2,5 мСм/см. Смесь очищали на анионообменной колонке MonoQ 10/100 GL с использованием буфера А: 20 мМ Трис, рН 8,0; буфера Б: 20 мМ Трис, 500 мМ NaCl, рН 8,0, скорости потока 6 мл/мин, градиента 0-80% В в объеме, превышающем 60 объемов колонки. Выход: 37 мг (51%).
LCMS способ 2
Теоретическая масса: 20279,9. Измеренная: 20280,4
Пример 5.2. Соединение 11.
S{бета-178}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys178]FGF21
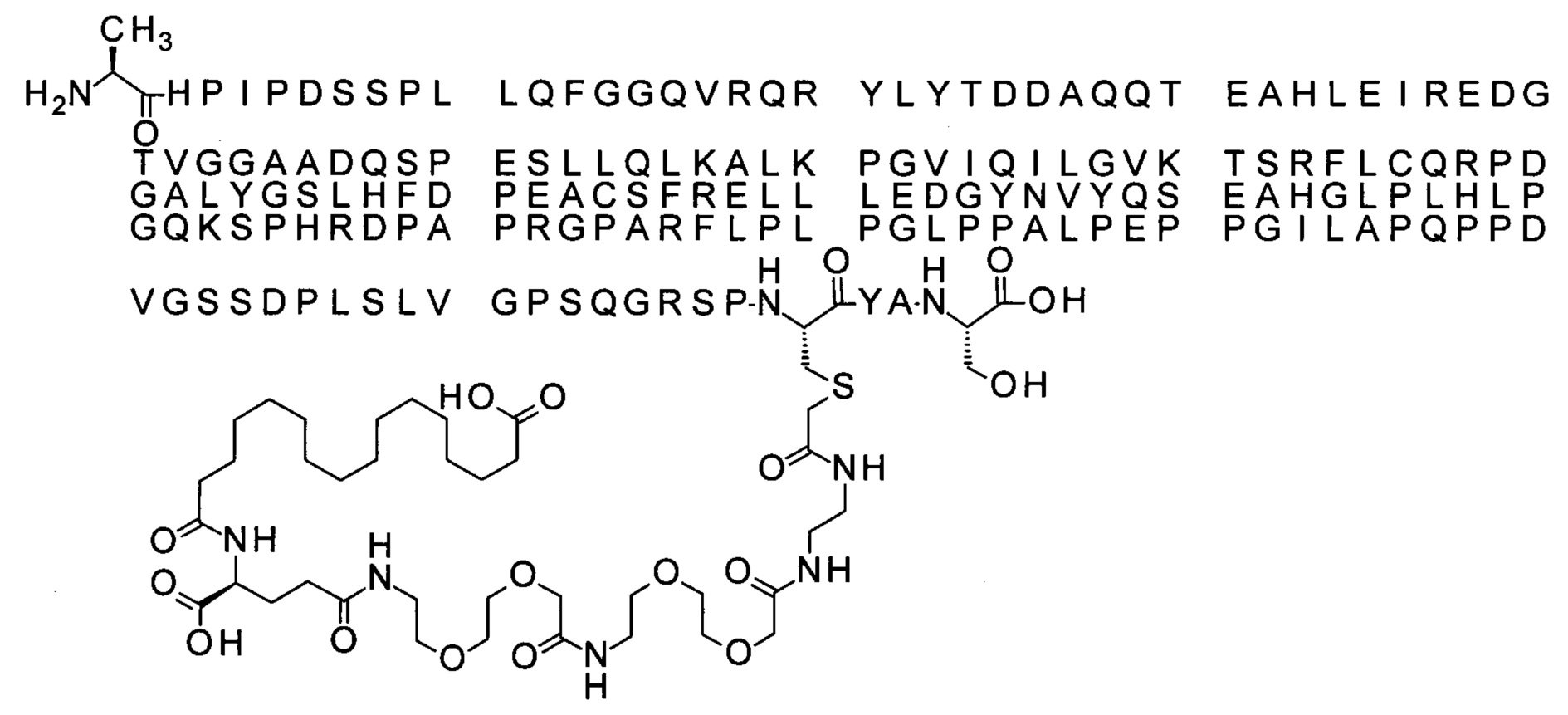
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 6 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 15-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}пентадекановой кислоты из Примера 4.1.
LCMS способ 2
Теоретическая масса: 20279,9; Измеренная 20280,2
Пример 5.3. Соединение 12.
S{бета-179}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys179]FGF21
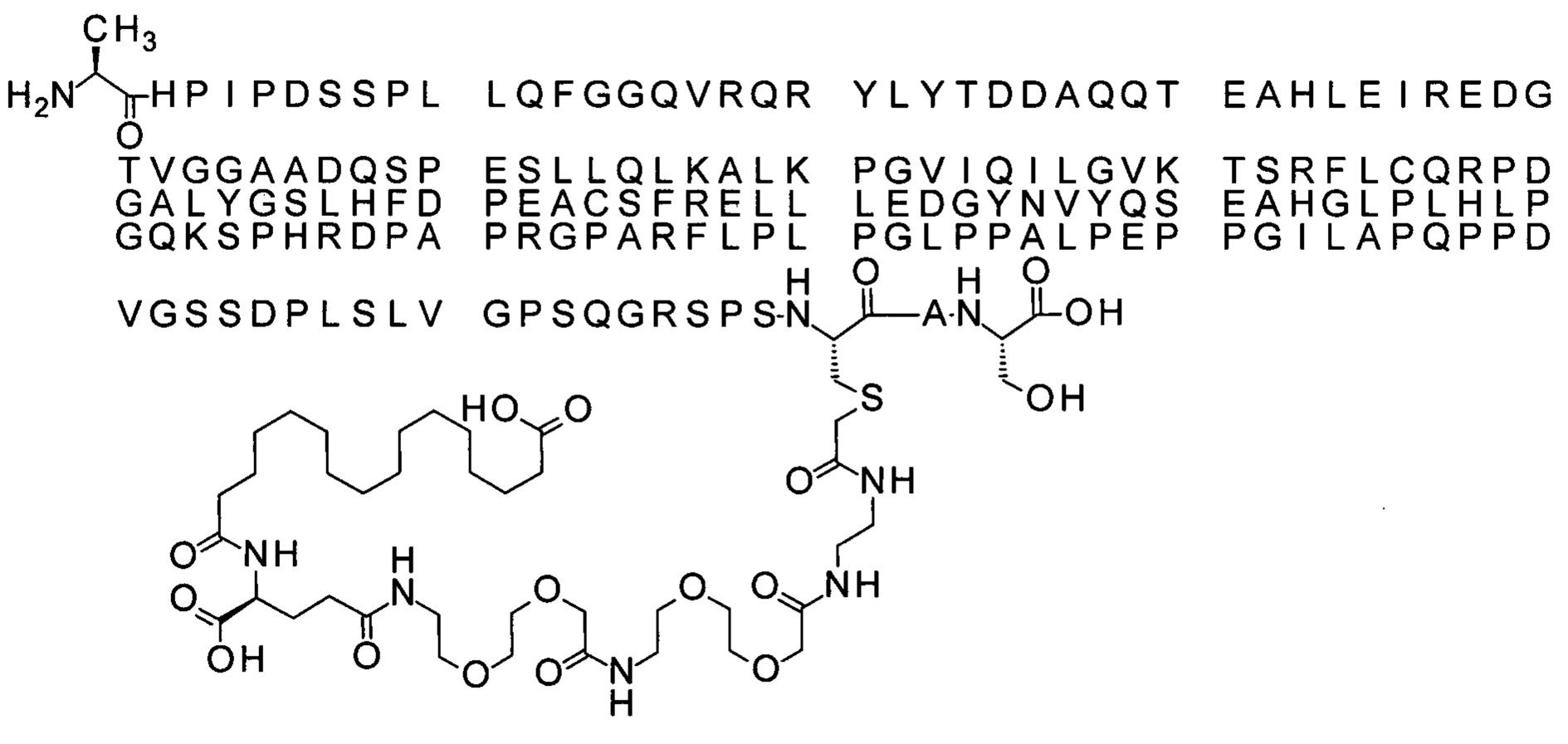
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 7 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 15-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)-этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}пентадекановой кислоты из Примера 4.1.
LCMS способ 3
Теоретическая масса: 20203,8; Измеренная 20204,2
Пример 5.4. Соединение 13.
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(11-карбоксиундеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Аlа[Gln121, Leu168,Cys180]FGF21
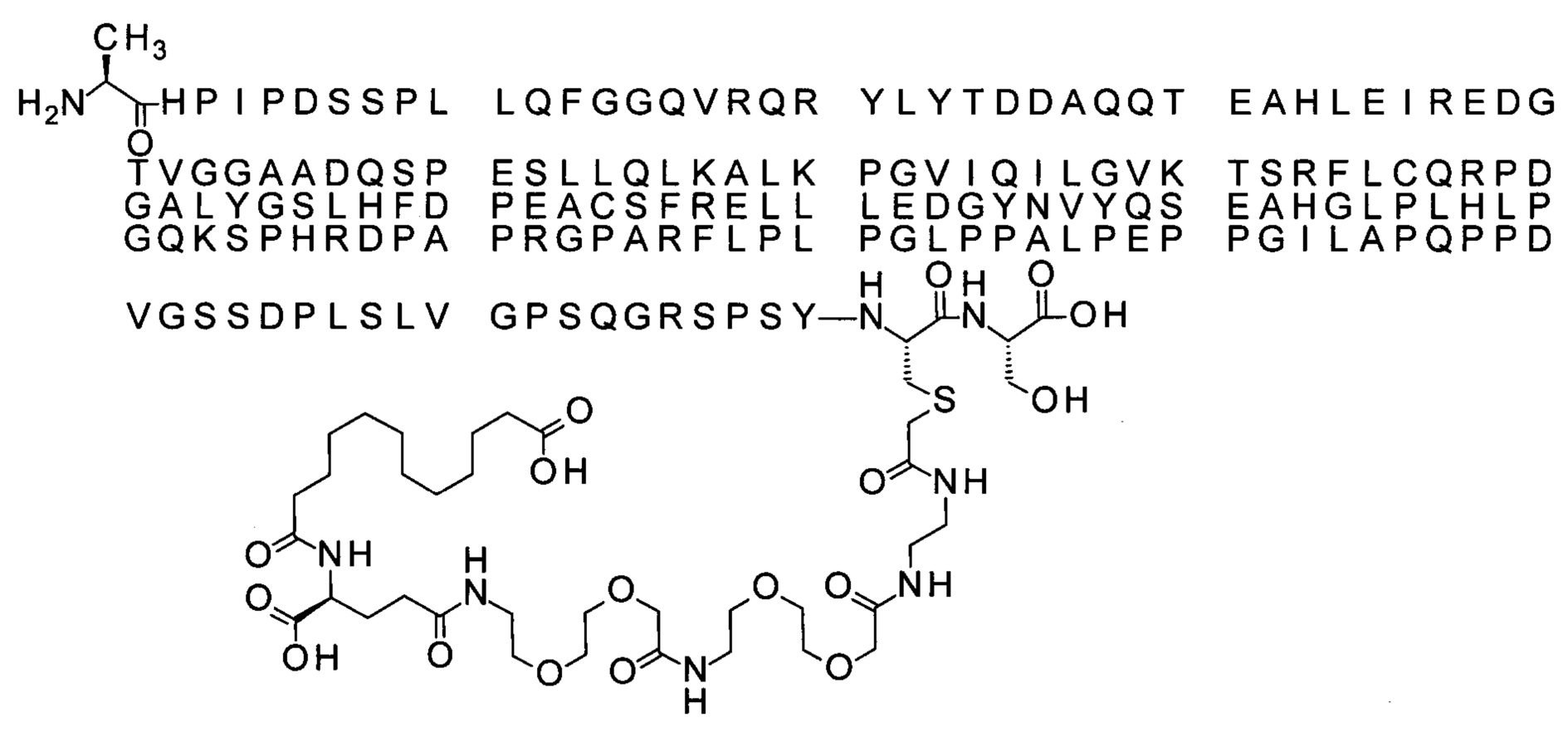
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 11-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)-этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}ундекановой кислоты из Примера 4.2.
LCMS способ 2
Теоретическая масса: 20239,8; Измеренная 20240,1
Пример 5.5. Соединение 14.
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Аlа[Gln121,Leu168,Суs180]FGF21
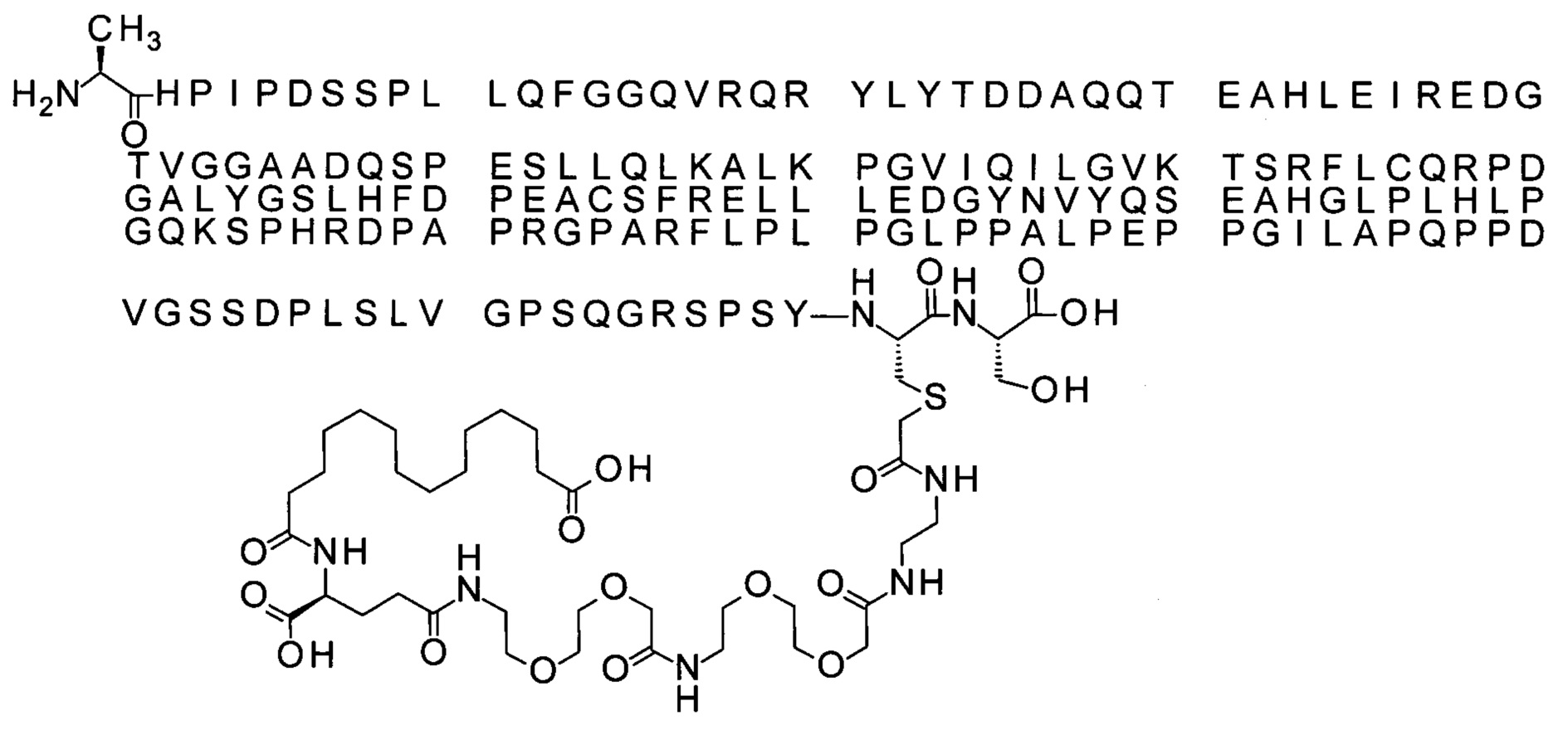
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 13-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}тридеканов ой кислоты из Примера 4.3.
LCMS способ 3
Теоретическая масса: 20267,8; Измеренная 20268,1
Пример 5.6. Соединение 15.
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21
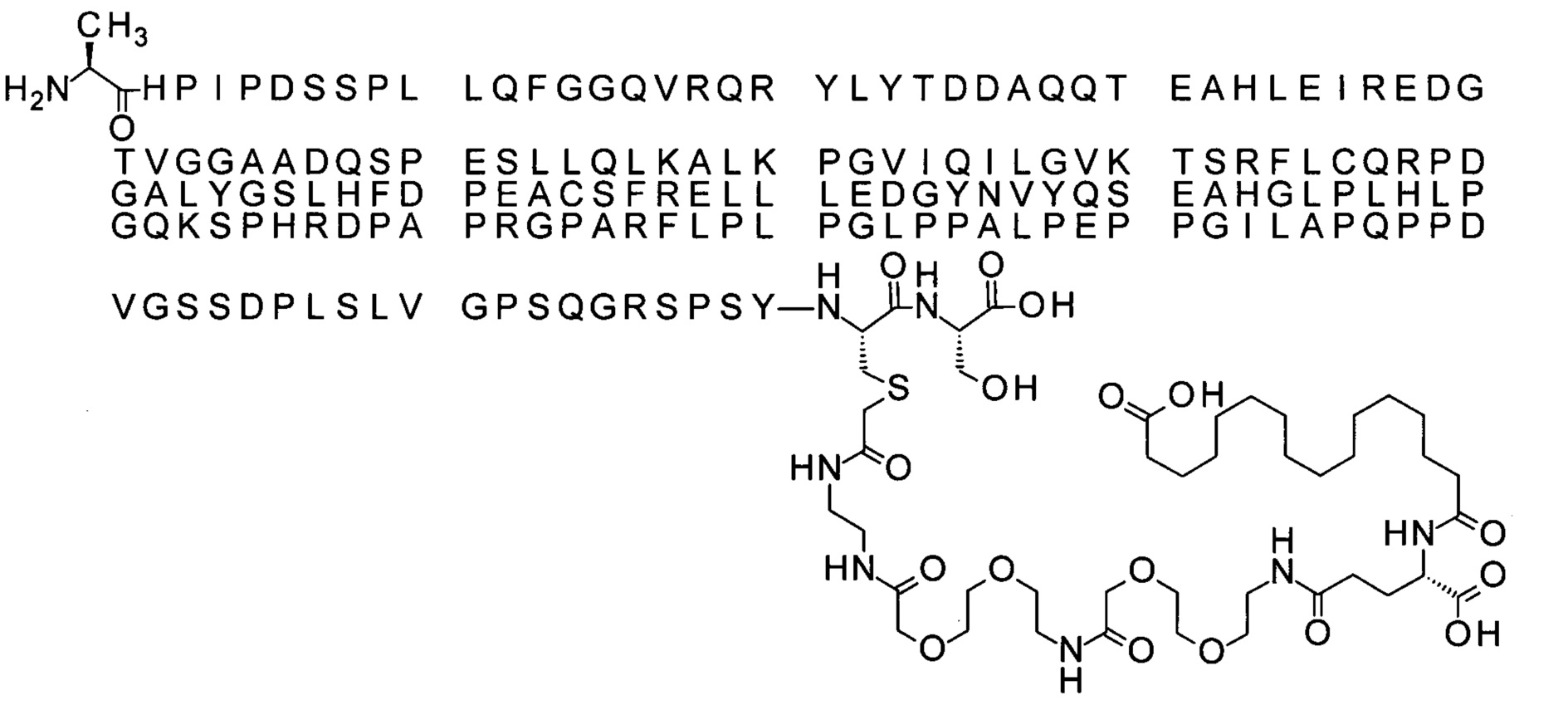
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 15-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}пентадекановой кислоты из Примера 4.1.
LCMS способ 2
Теоретическая масса: 20295,9; Измеренная 20296,2
Пример 5.7. Соединение 16.
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21
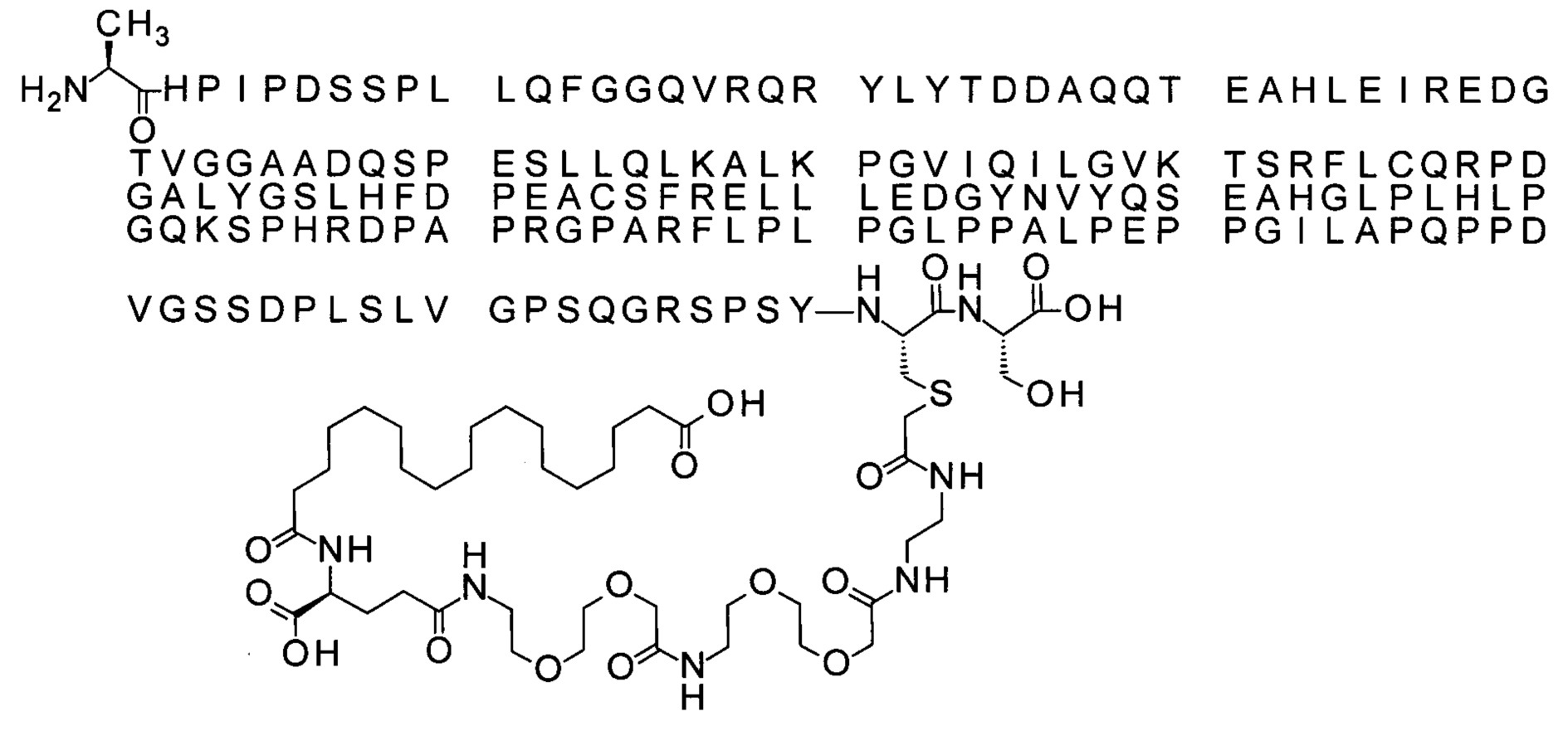
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 17-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}гептадекановой кислоты из Примера 4.5.
LCMS способ 3
Теоретическая масса: 20323,9; Измеренная 20324,5
Пример 5.8. Соединение 17.
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(19-карбоксинонадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180]FGF21
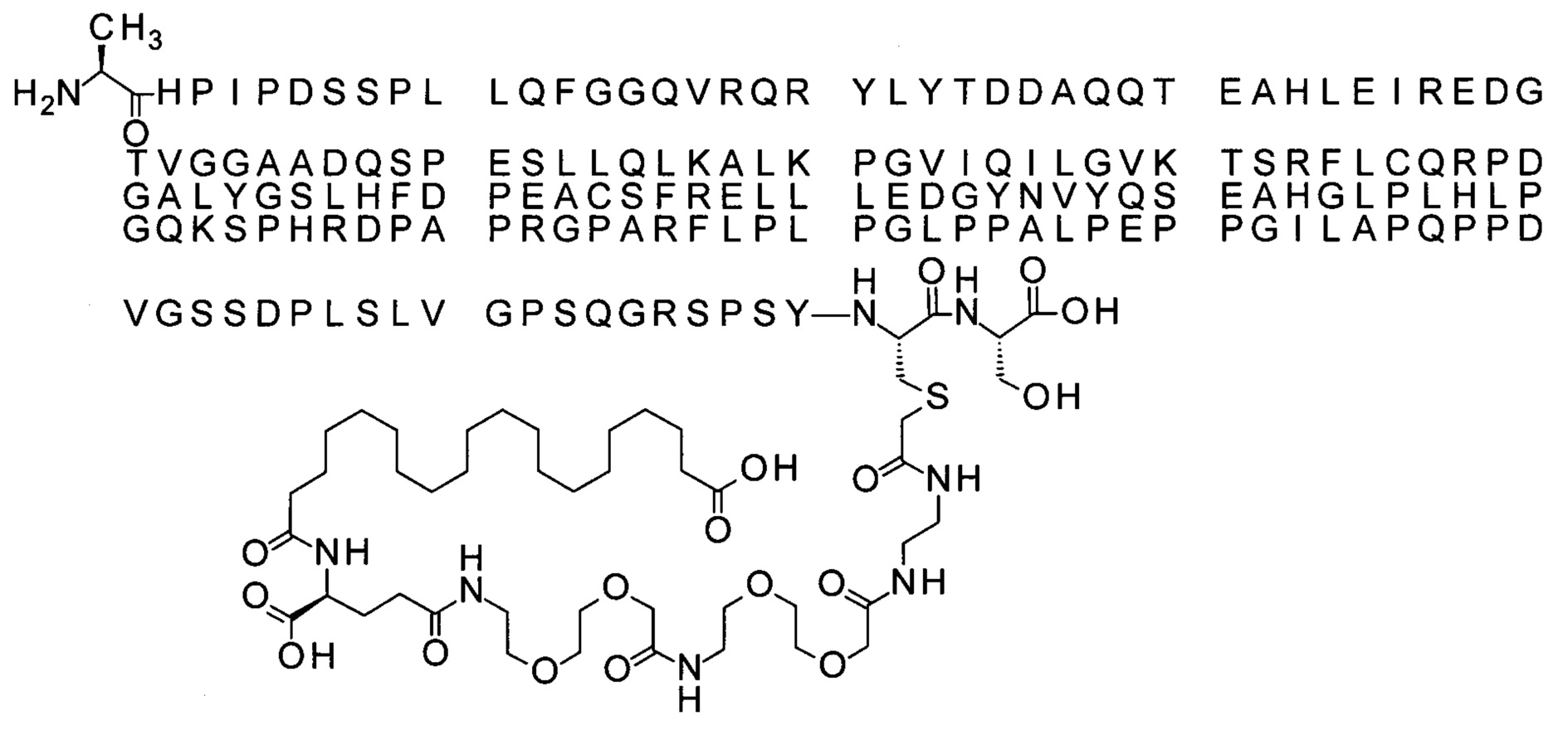
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 19-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)-этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}нонадекановой кислоты из Примера 4.4.
LCMS способ 3
Теоретическая масса: 20352,0; Измеренная: 20352,0
Пример 5.9. Соединение 18.
S{бета-180}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys180,des181]FGF21
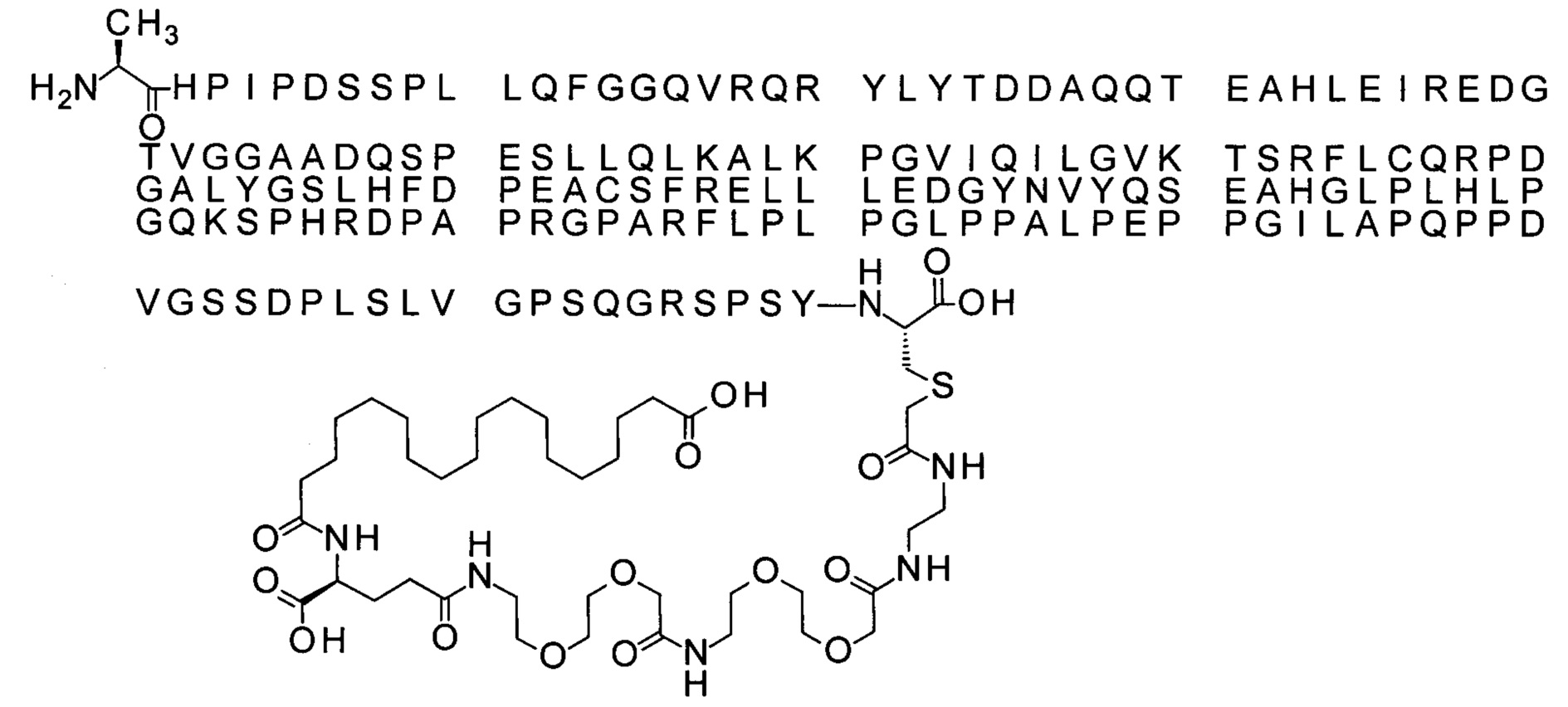
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 9 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 17-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)-этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}гептадекановой кислоты из Примера 4.5.
LCMS способ 2
Теоретическая масса: 20236,8; Измеренная: 20237,0
Пример 5.10. Соединение 19.
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(11-карбоксиундеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys181]FGF
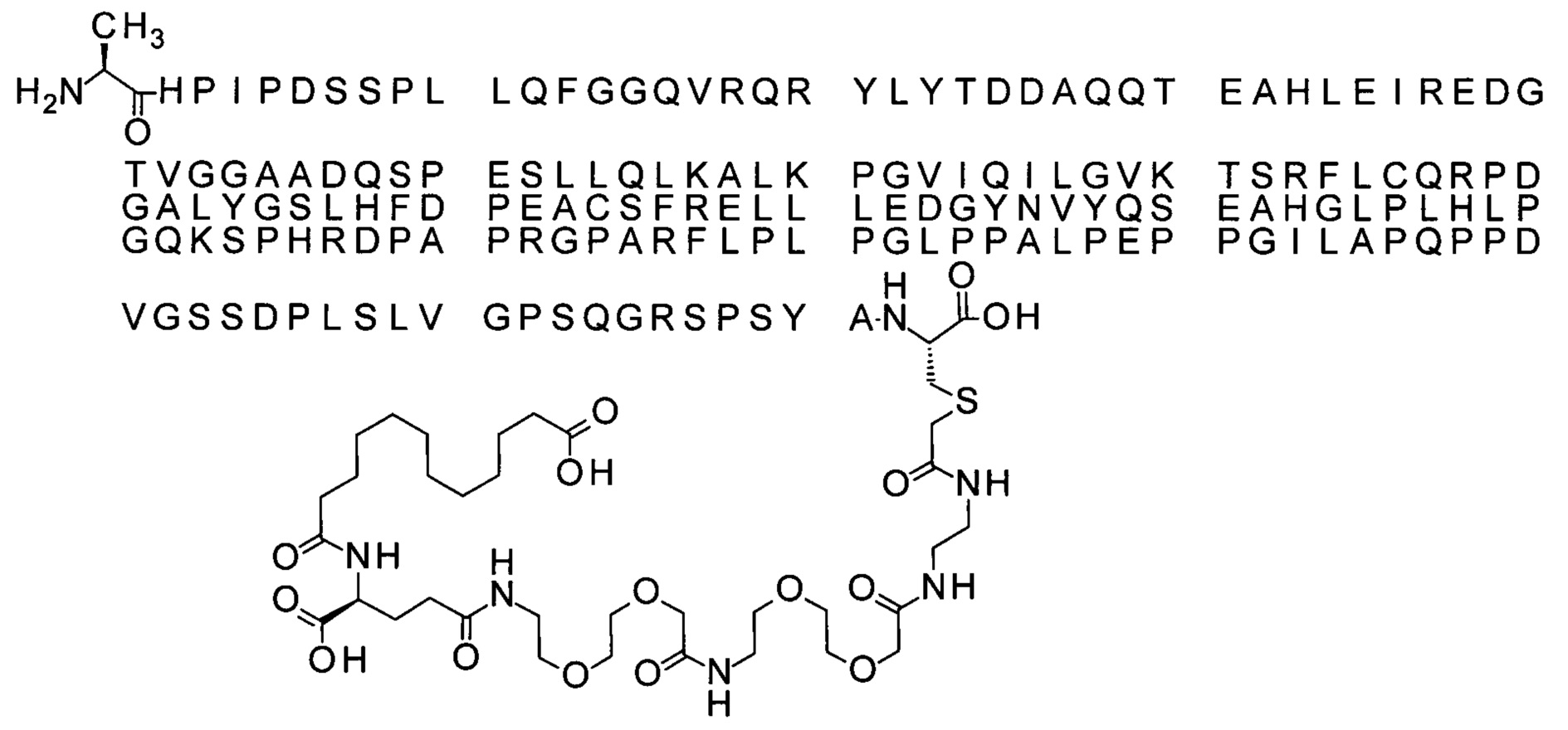
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 1 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 11-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}ундекановой кислоты из Примера 4.2.
LCMS способ 2
Теоретическая масса: 20223,8; Измеренная: 20224,4.
Пример 5.11. Соединение 20.
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Аlа[Gln121,Leu168,Суs181]FGF21
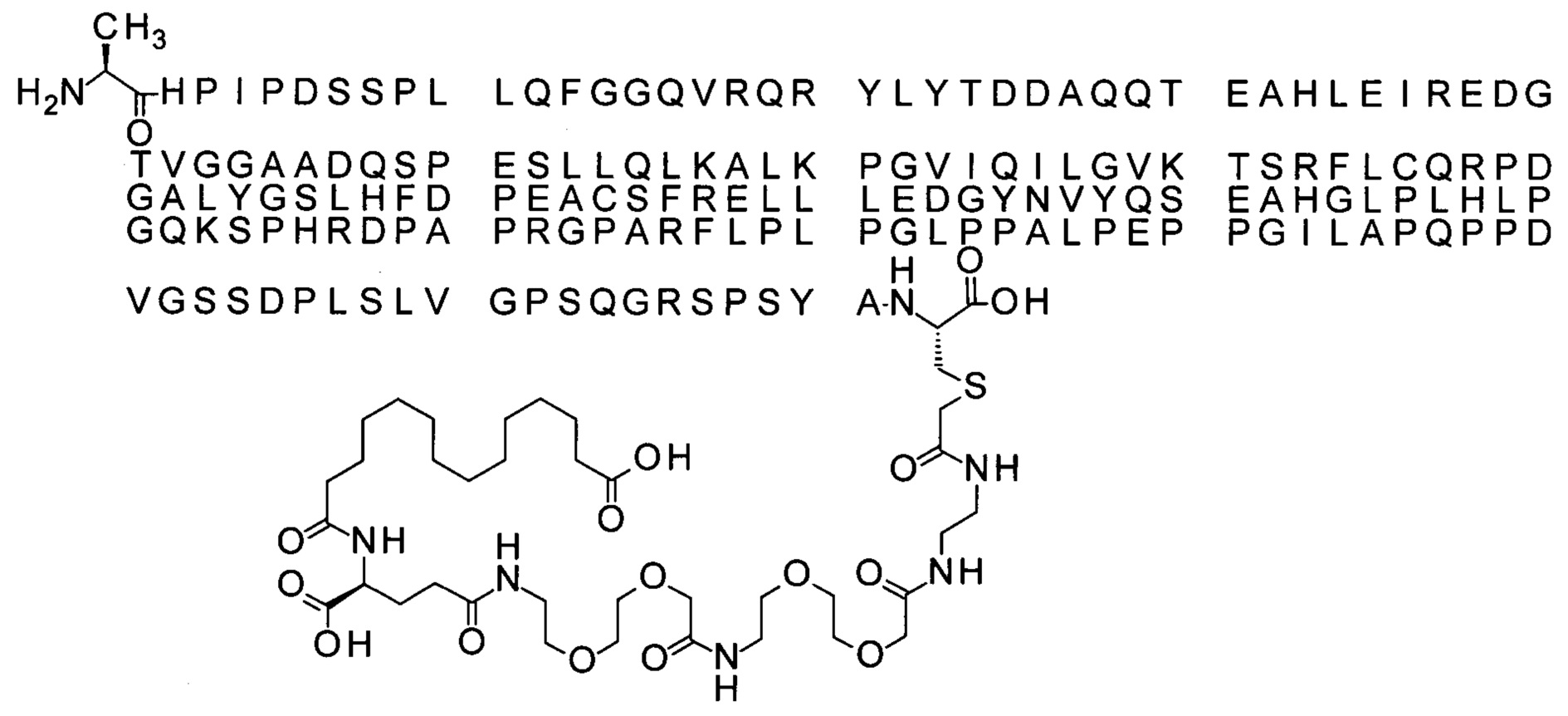
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 10 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 13-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этил-карбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}тридекановой кислоты из Примера 4.3.
LCMS способ 2
Теоретическая масса: 20251,8; Измеренная: 20252,2
Пример 5.12. Соединение 22.
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Аlа[Gln121,Leu168,Суs181]FGF21
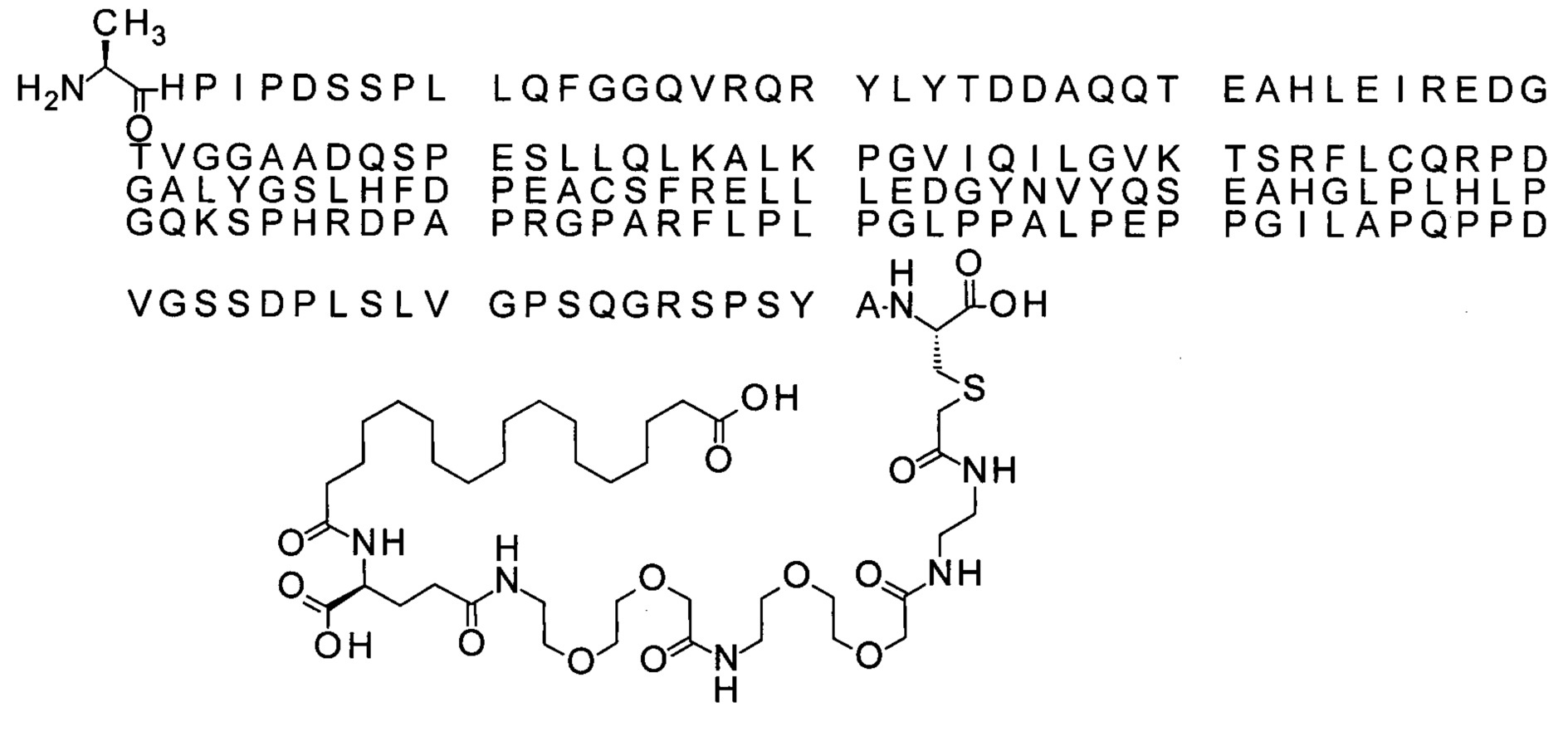
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 10 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 17-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}-этокси)этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}гептадекановой кислоты из Примера 4.5.
LCMS способ 2
Теоретическая масса: 20307,9; Измеренная: 20308,6.
Пример 5.13. Соединение 23.
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(19-карбоксинонадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Аlа[Gln121,Leu168,Cys181]FGF21
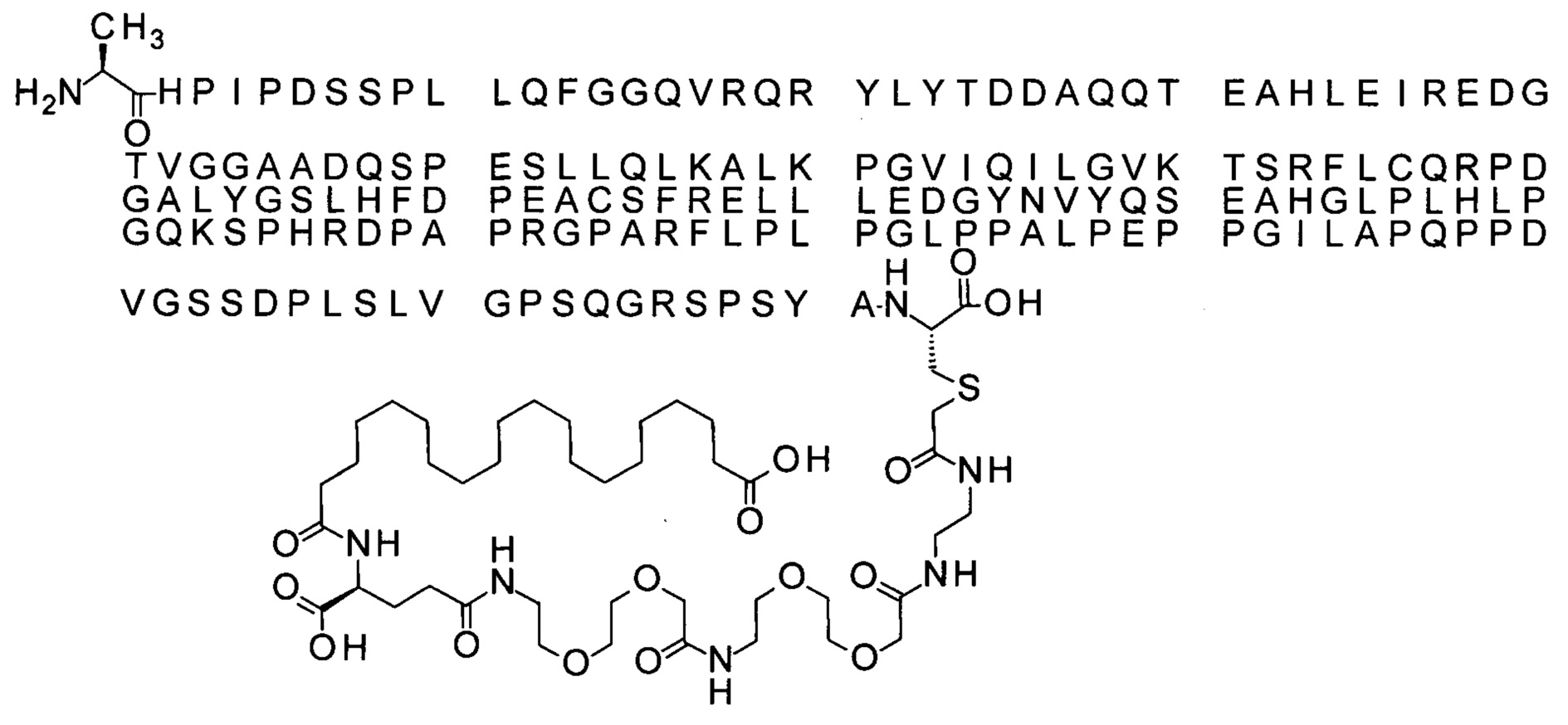
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 10 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 19-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этил-карбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}нонадекановой кислоты из Примера 4.4.
LCMS способ 2
Теоретическая масса: 20336,0; Измеренная: 20336,2
Пример 5.14. Соединение 24.
S{бета-181}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Met[Cys181] FGF21
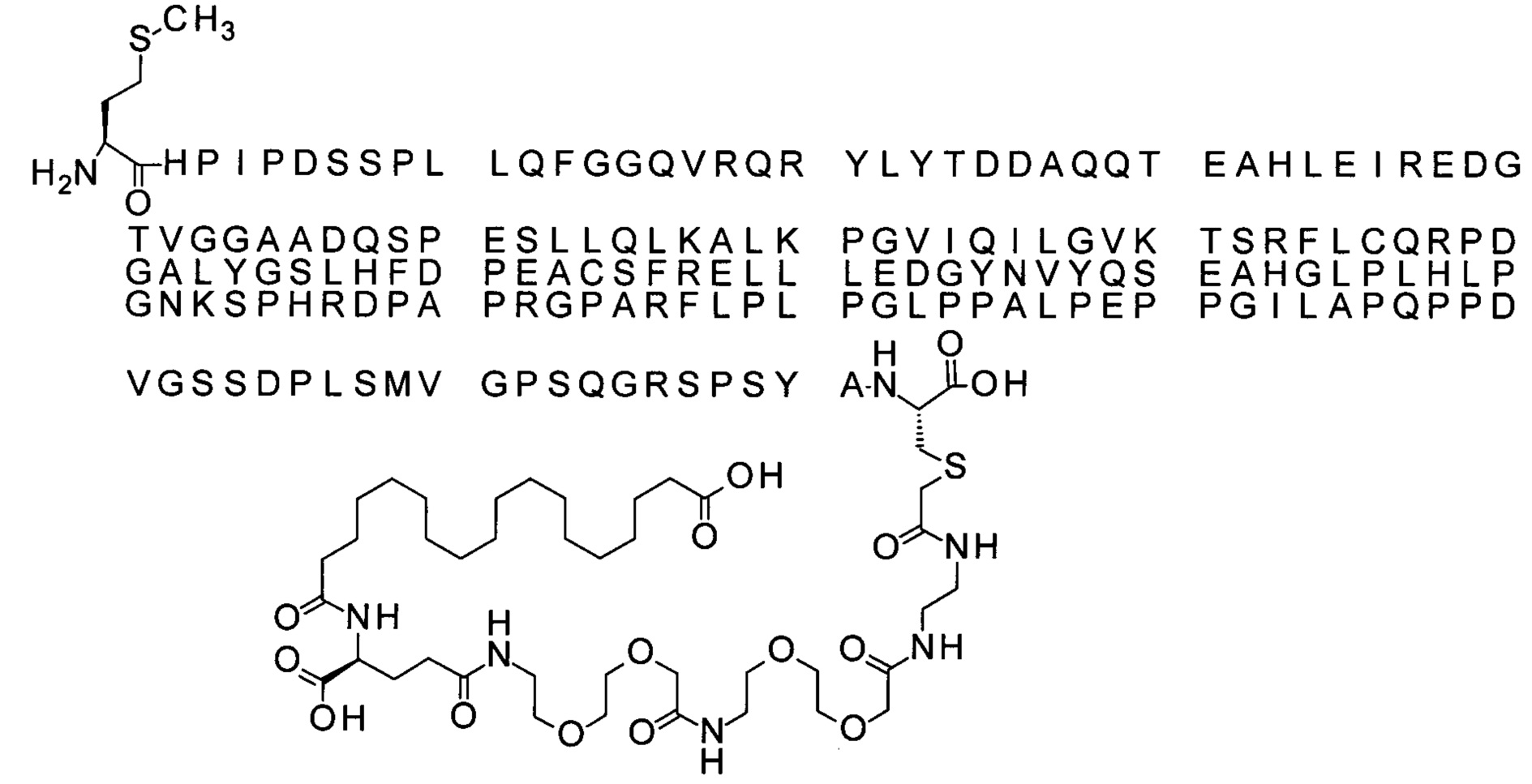
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 11 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 17-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)-этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}гептадекановой кислоты из Примера 4.5.
LCMS способ 3
Теоретическая масса: 20372,2; Измеренная: 20372,2.
Пример 5.15. Соединение 34.
S{бета-168}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Аlа[Gln121,Cys168]FGF21
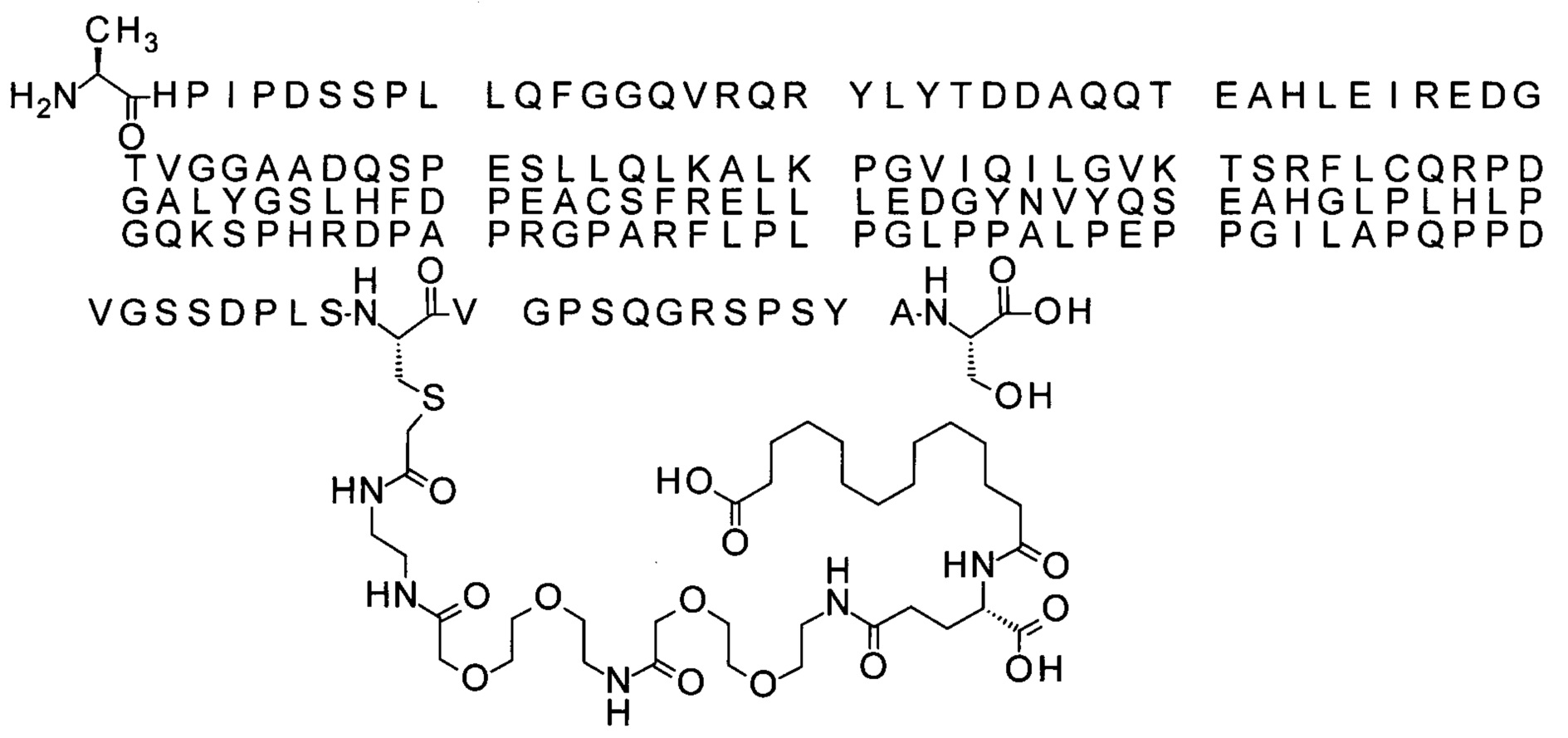
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 13 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 13-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}тридекановой кислоты из Примера 4.3.
LCMS способ 1
Теоретическая масса: 20225.; Измеренная: 20226,7
Пример 5.16. Соединение 35.
S{бета-169}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Аlа[Cln121,Leu168,Cys169]FGF21
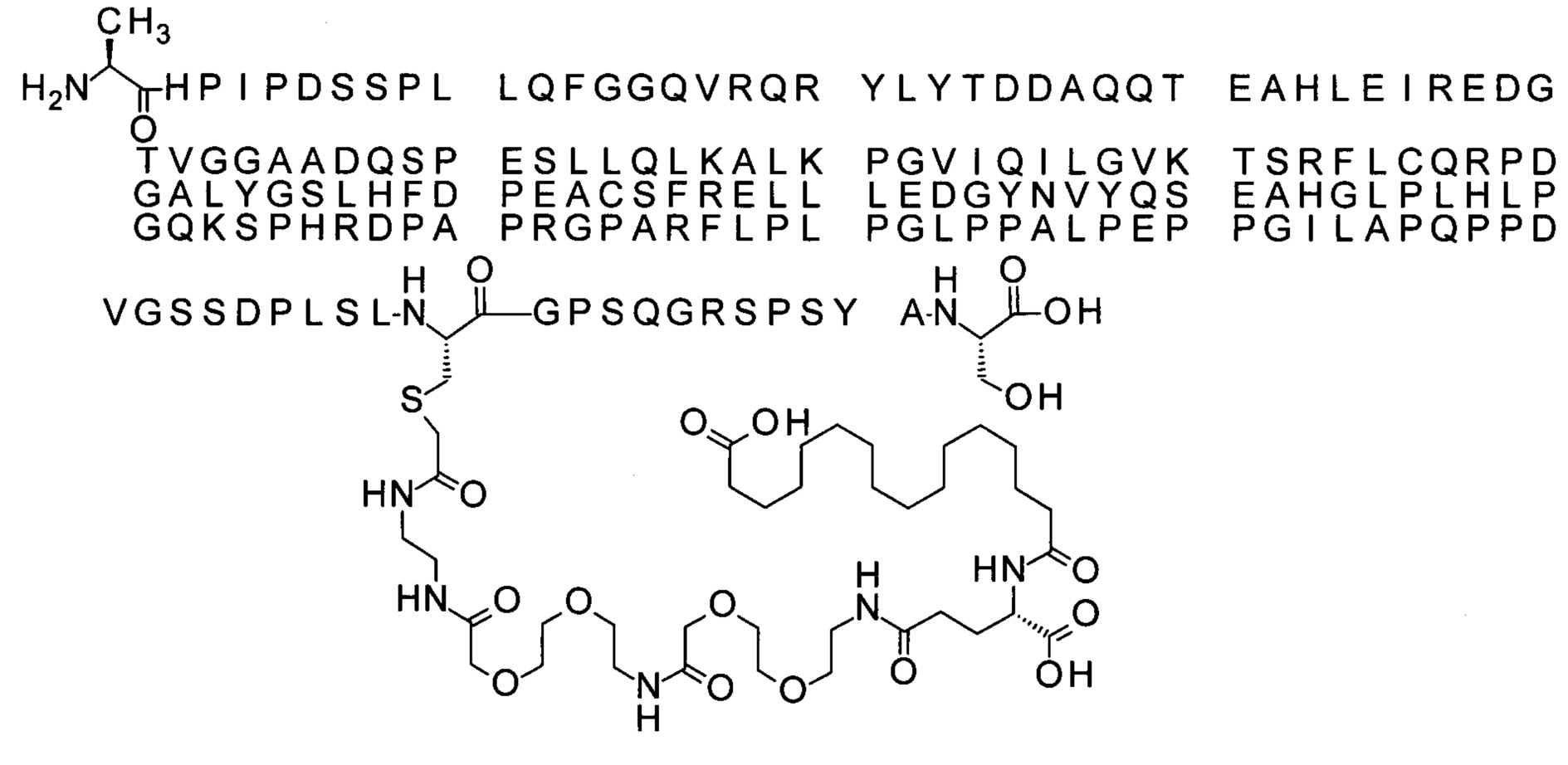
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 14 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 15-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}пентадекановой кислоты из Примера 4.1.
LCMS способ 3
Теоретическая масса: 20267,8; Измеренная 20268,2
Пример 5.17. Соединение 36.
18-[[(1S)-4-[2-[2-[2-[2-[2-[2-(2-ацетамидоэтиламино)-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-18-оксо-октадекановой кислоты-Ala[Gln121,Leu168,Cys170]FGF21
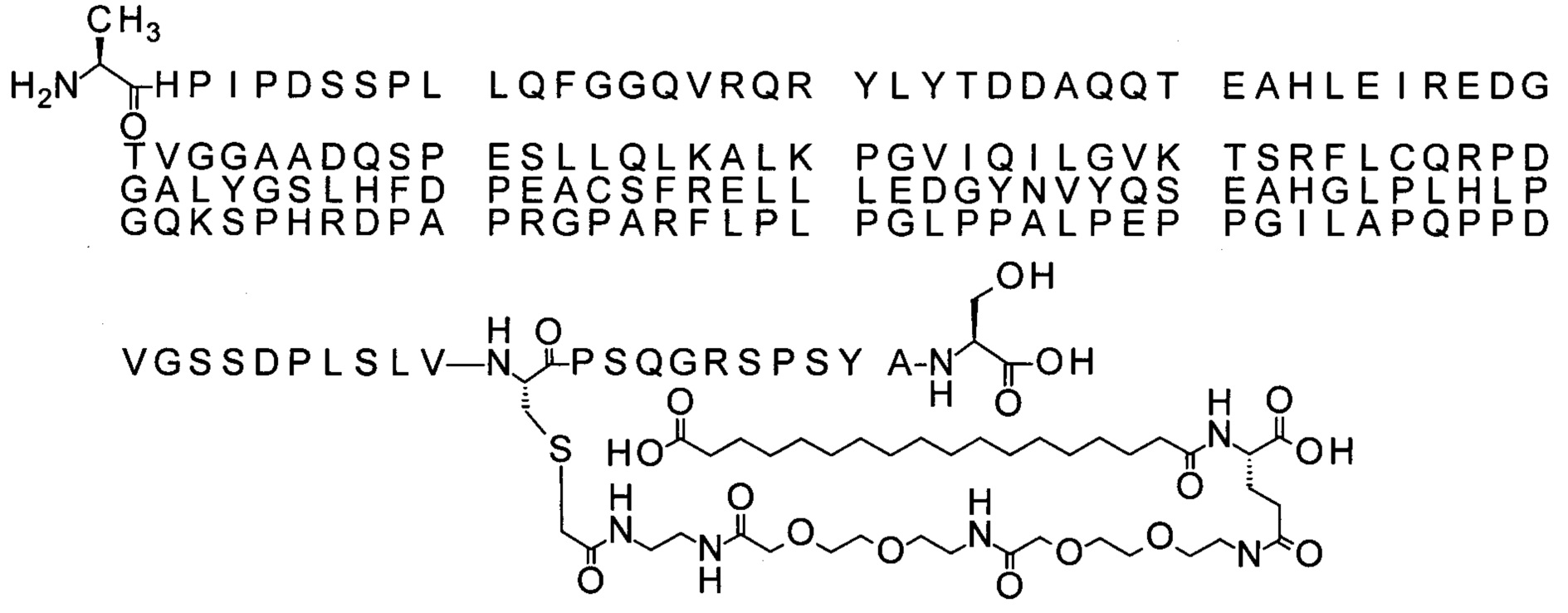
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 15 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
18-[[(1S)-4-[2-[2-[2-[2-[2-[2-[2-[(2-бромацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-18-оксо-октадекановой кислоты из Примера 4.5.
Пример 5.18. Соединение 37.
S{бета-173}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Аlа[Gln121,Leu168,Cys173]FGF21 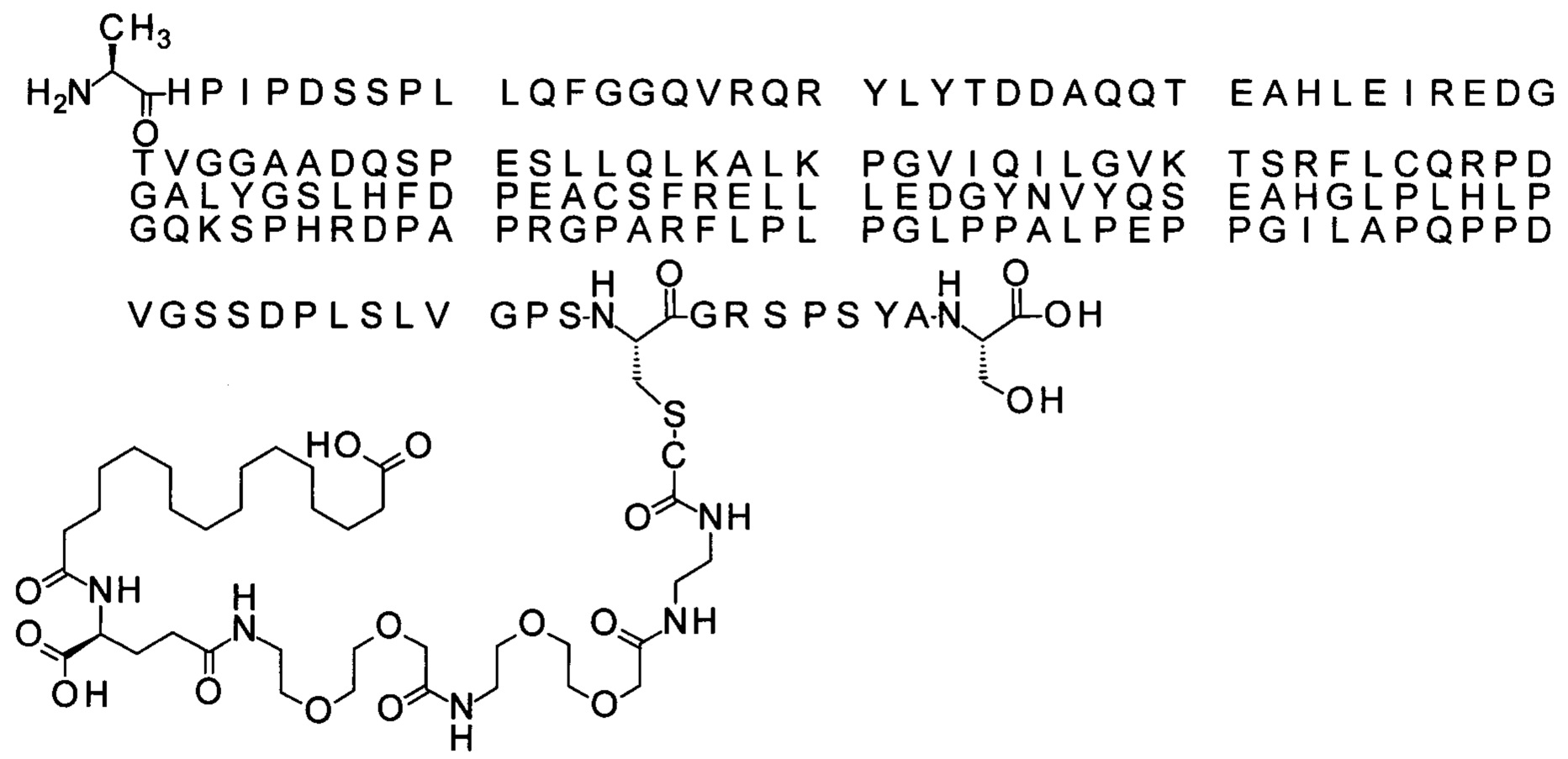
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 18 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 15-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}пентадекановой кислоты из Примера 4.1.
LCMS способ 3
Теоретическая масса: 20238,8; Измеренная: 20239,3
Пример 5.19. Соединение 38.
S{бета-174}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys174]FGF21
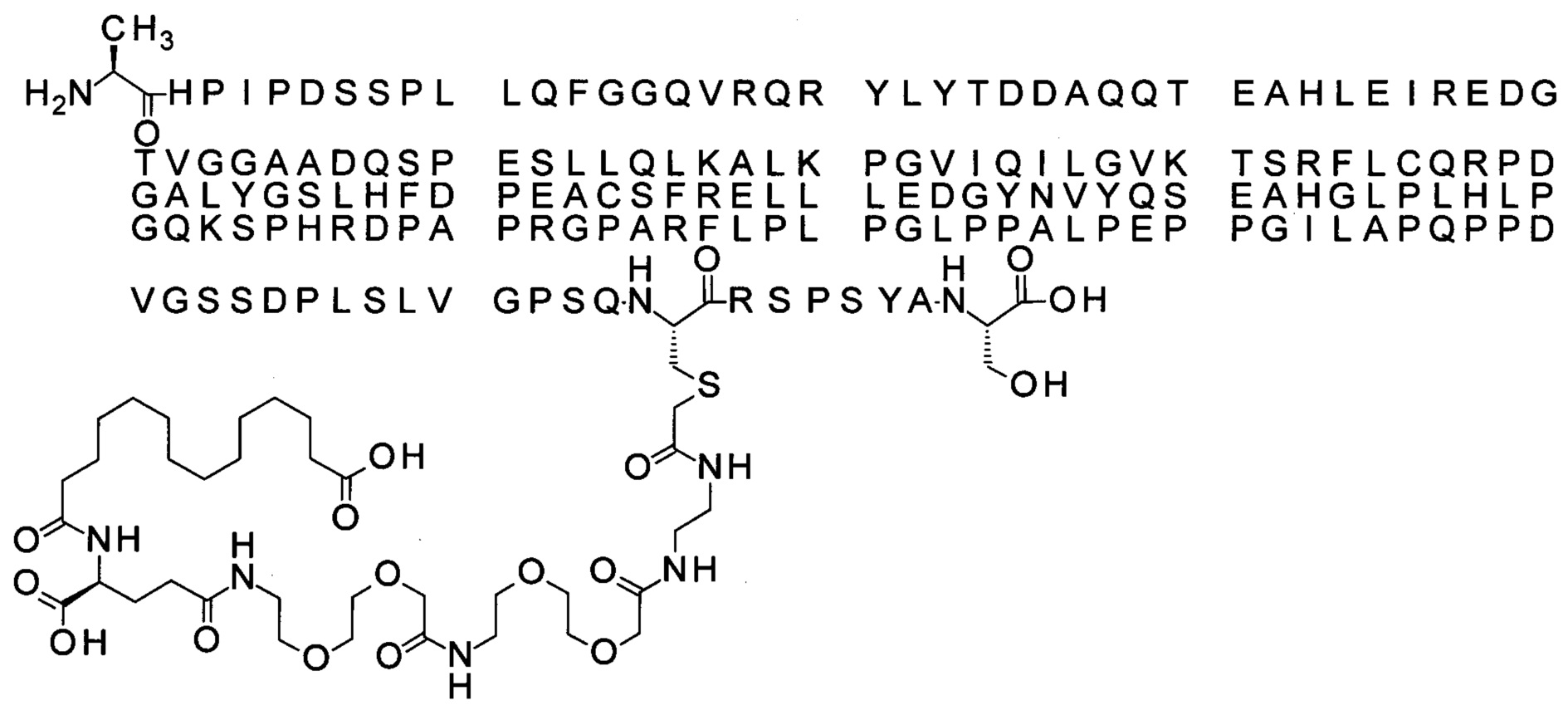
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 19 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 13-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}тридекановой кислоты из Примера 4.3.
LCMS способ 1
Теоретическая масса: 20281,9; Измеренная: 20281,9
Пример 5.20. Соединение 39.
18-[[(1S)-4-[2-[2-[2-[2-[2-[2-(2-ацетамидоэтиламино)-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-18-оксо-октадекановая кислота-Ala[Gln121,Leu168,Cys174]FGF21
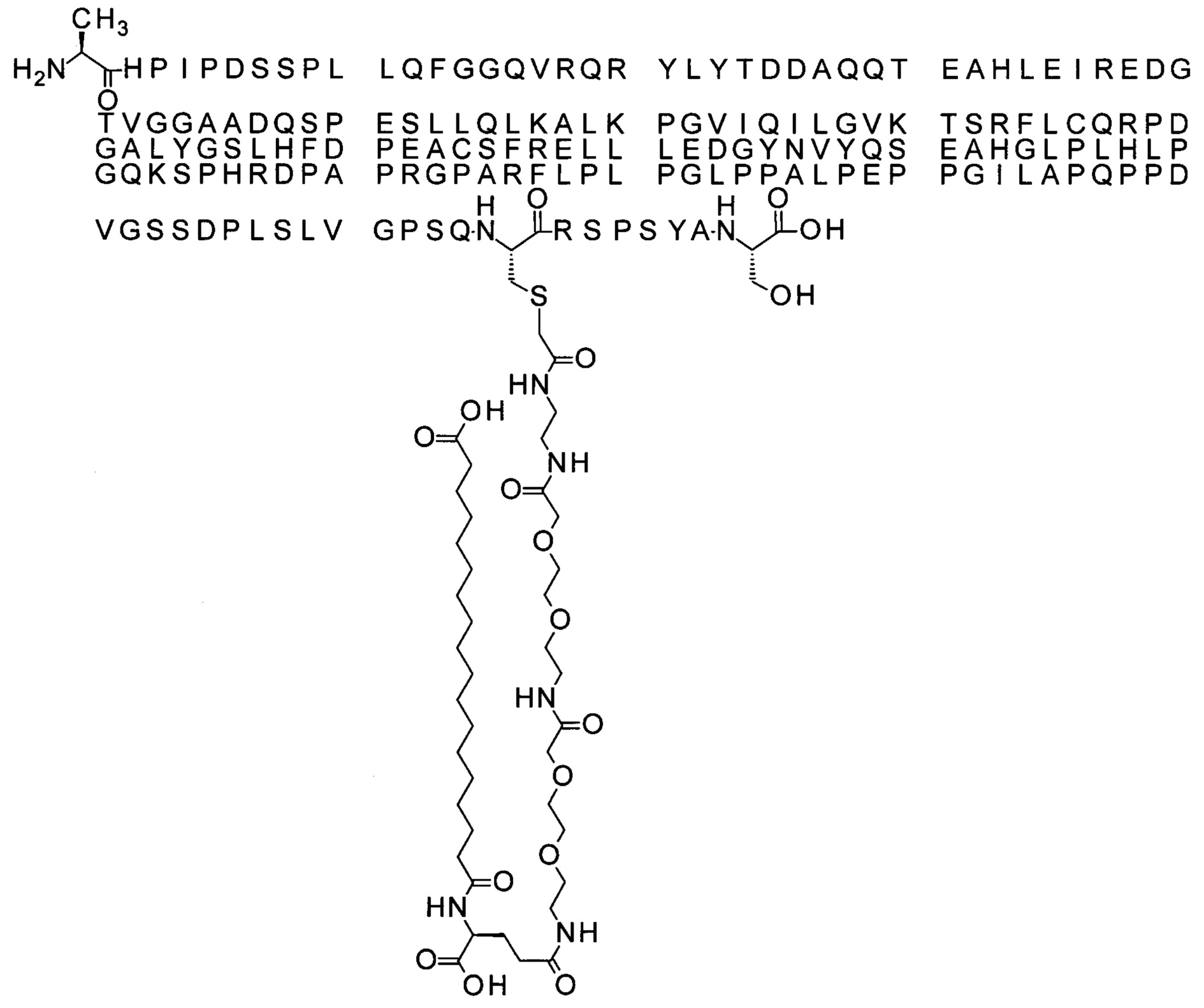
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 19 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
18-[[(1S)-4-[2-[2-[2-[2-[2-[2-[2-[(2-бромацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-18-оксо-октадекановой кислоты из Примера 4.5.
Пример 5.21. Соединение 40.
16-[[(1S)-4-[2-[2-[2-[2-[2-[2-(2-ацетамидоэтиламино)-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-16-оксо-гексадекановая кислота-Ala[Gln121,Leu168,Cys174]FGF21
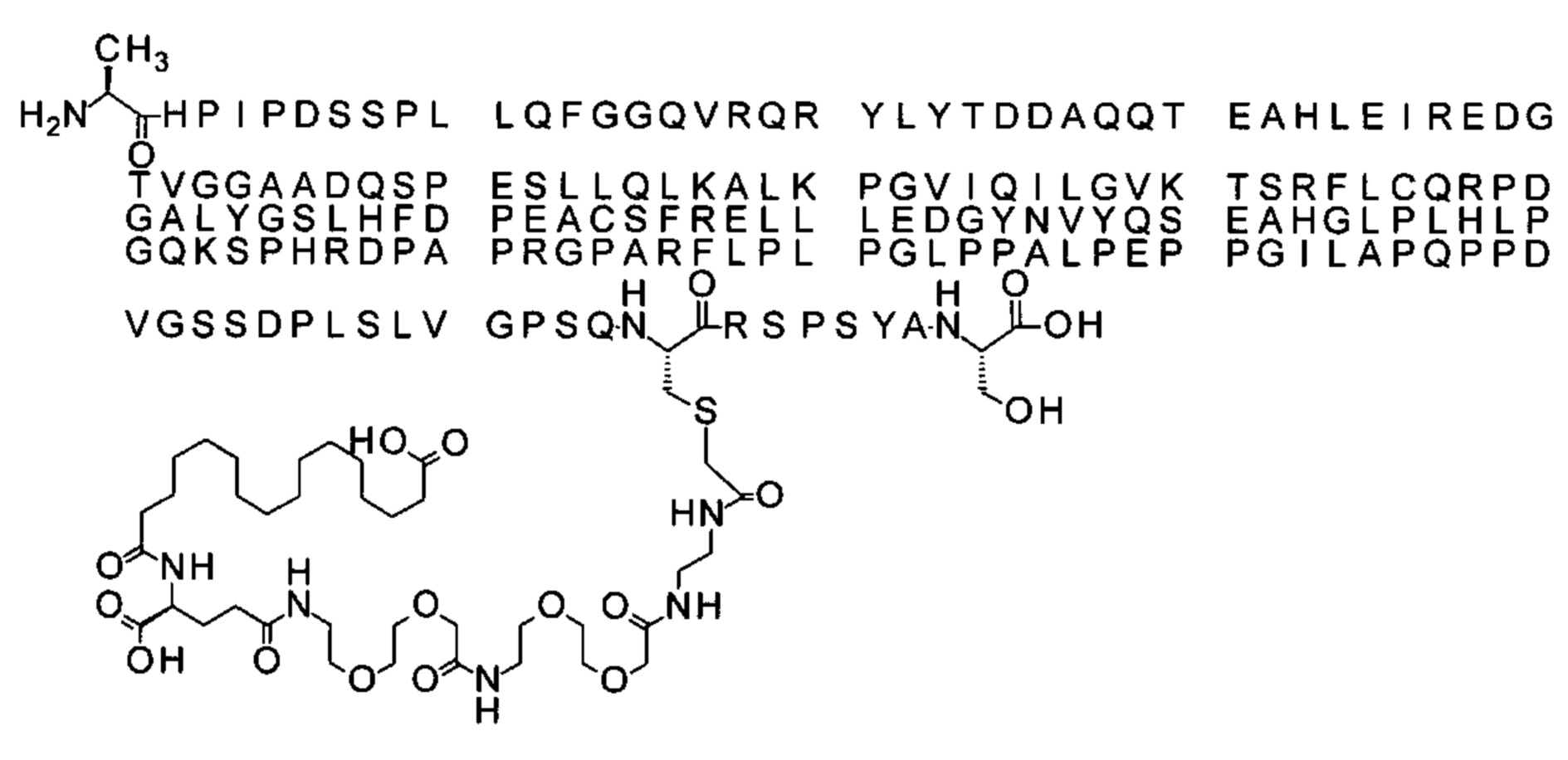
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 19 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
16-[[(1S)-4-[2-[2-[2-[2-[2-[2-[2-[(2-бромацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-16-оксо-гексадекановой кислоты из Примера 4.1.
Пример 5.22. Соединение 41.
S{бета-175}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys175]FGF21
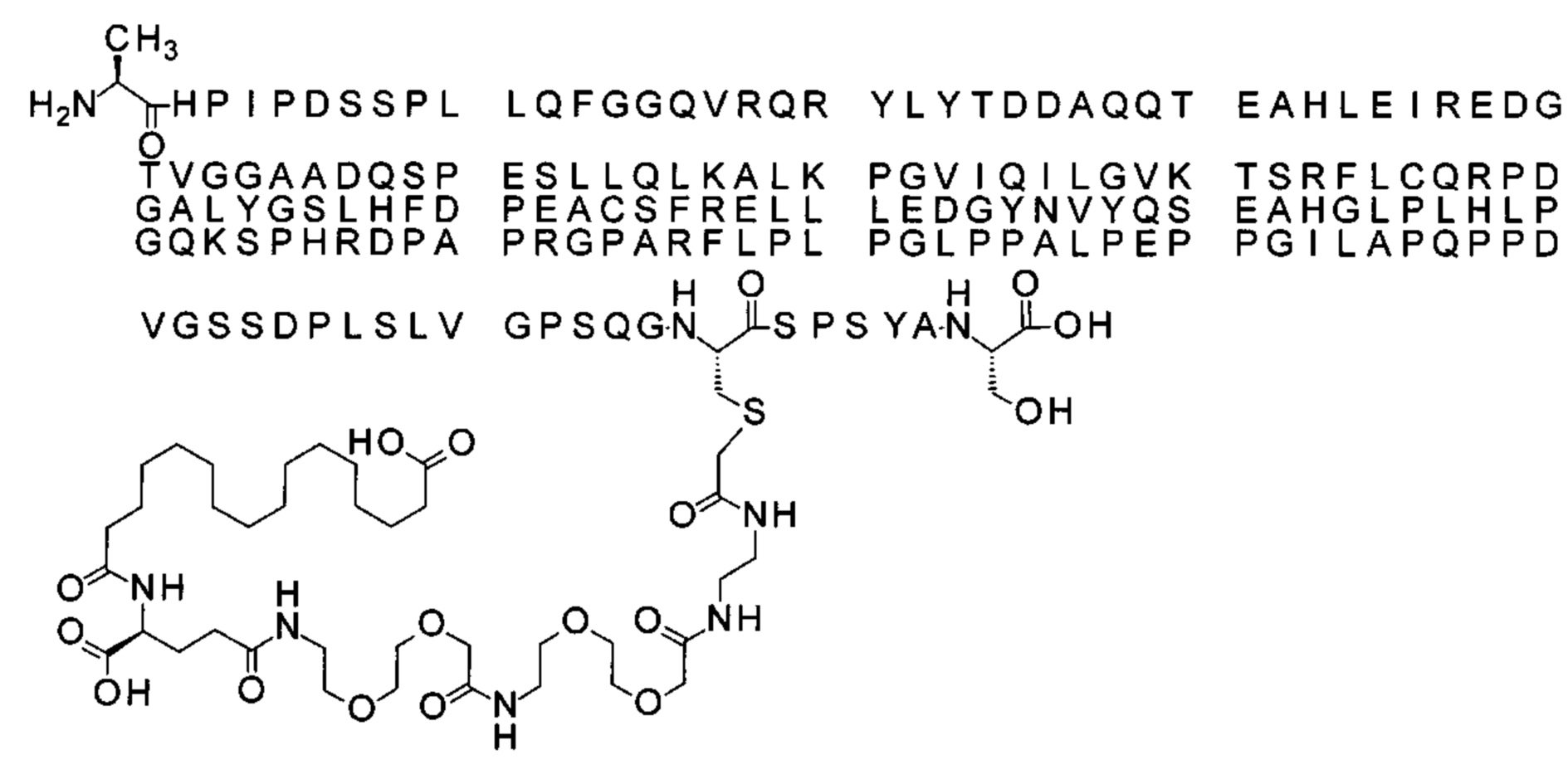
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 20 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 15-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}пентадекановой кислоты из Примера 4.1.
LCMS способ 3
Теоретическая масса: 20210,8; Измеренная: 20211,4
Пример 5.23. Соединение 42.
S{бета-176}-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этиламино]-2-оксоэтил]-Ala[Gln121,Leu168,Cys176]FGF21
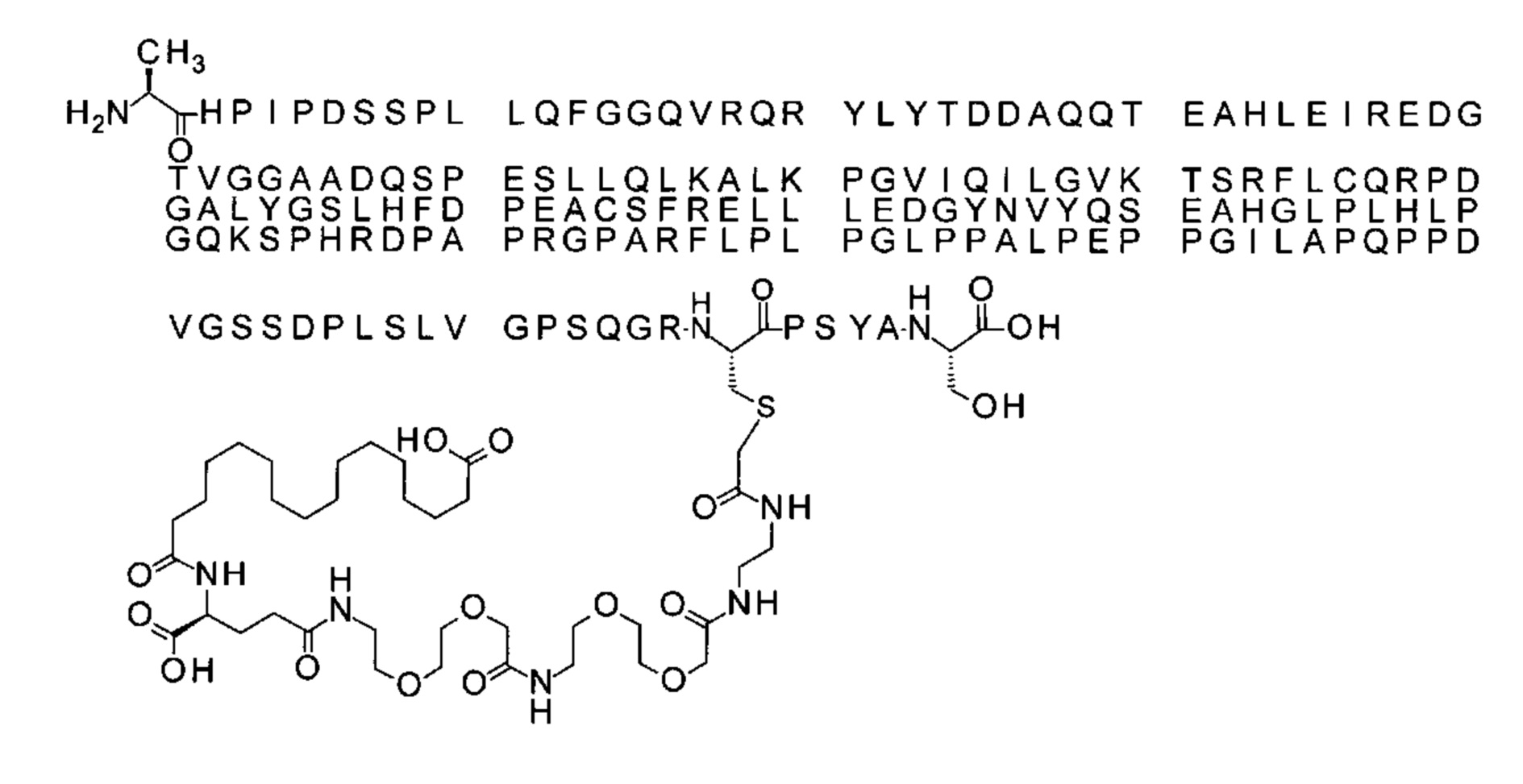
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 4 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 15-{(S)-1-карбокси-3-[2-(2-{[2-(2-{[2-(2-бромацетиламино)этилкарбамоил]метокси}этокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]-пропилкарбамоил}пентадекановой кислоты из Примера 4.1.
LCMS способ 3
Теоретическая масса: 20279,9; Измеренная 20280,4
Пример 5.24. Соединение 43.
4-[10-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-ацетамидо-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-10-оксо-декокси]бензойная кислота]-Ala[Gln121,Leu168,Cys180]FGF21
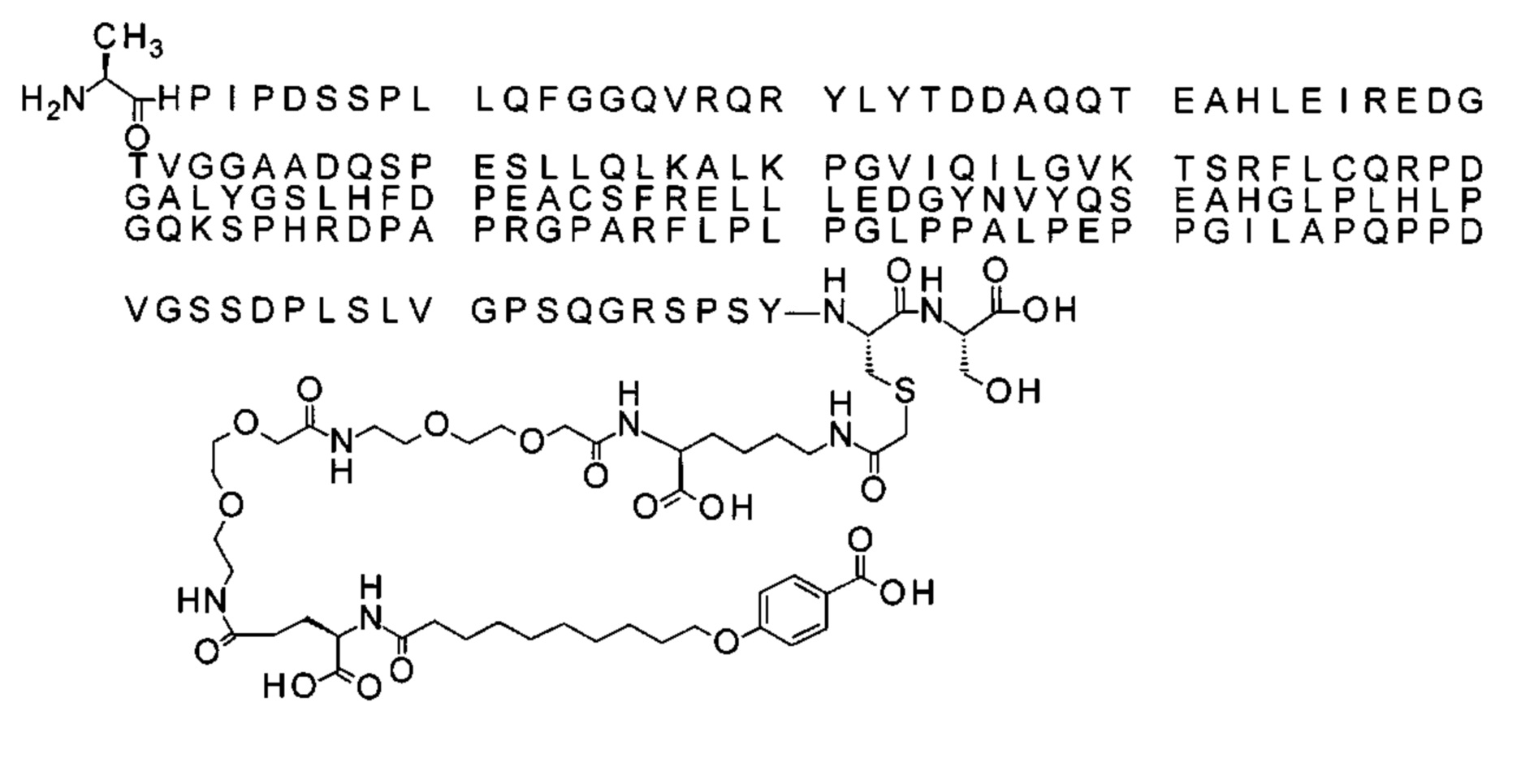
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 4-[10-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-10-оксо-декокси]бензойной кислоты из Примера 4.11.
Пример 5.25. Соединение 44.
4-[10-[[4-[2-[2-[2-[2-[2-[2-[[(1S)-5-ацетамидо-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-4-оксо-бутил]сульфониламино]-10-оксо-декокси]бензойная кислота]-Ala[Gln121,Leu168,Cys180]FGF21
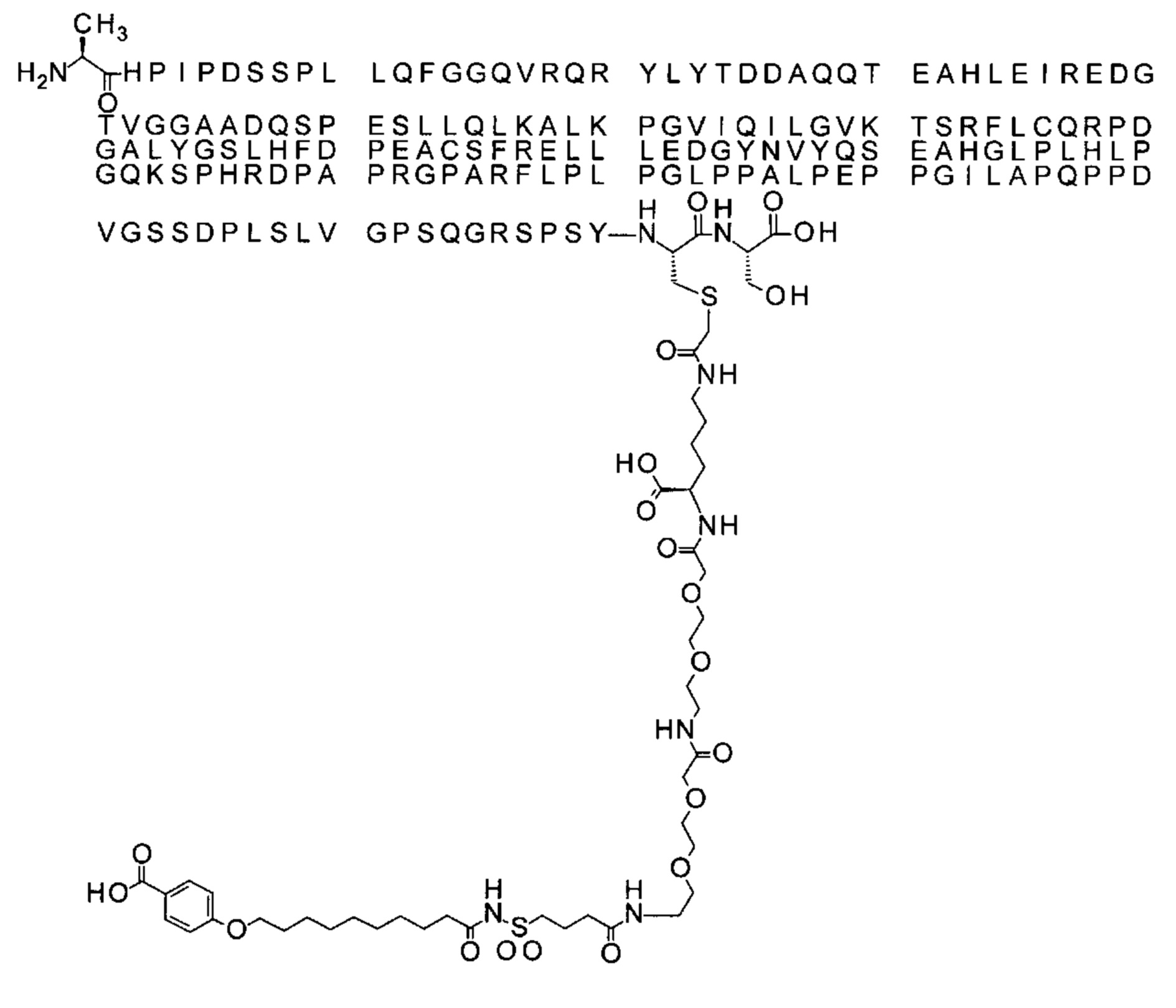
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
4-[10-[[4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-4-оксо-бутил]сульфониламино]-10-оксо-декокси]бензойной кислоты из Примера 4.10.
Пример 5.26. Соединение 45.
20-[[(1S)-4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-ацетамидо-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-1-карбокси-4-оксо-бутил]амино]-20-оксо-эйкозановая кислота-Ala[Gln121,Leu168,Cys180]FGF21
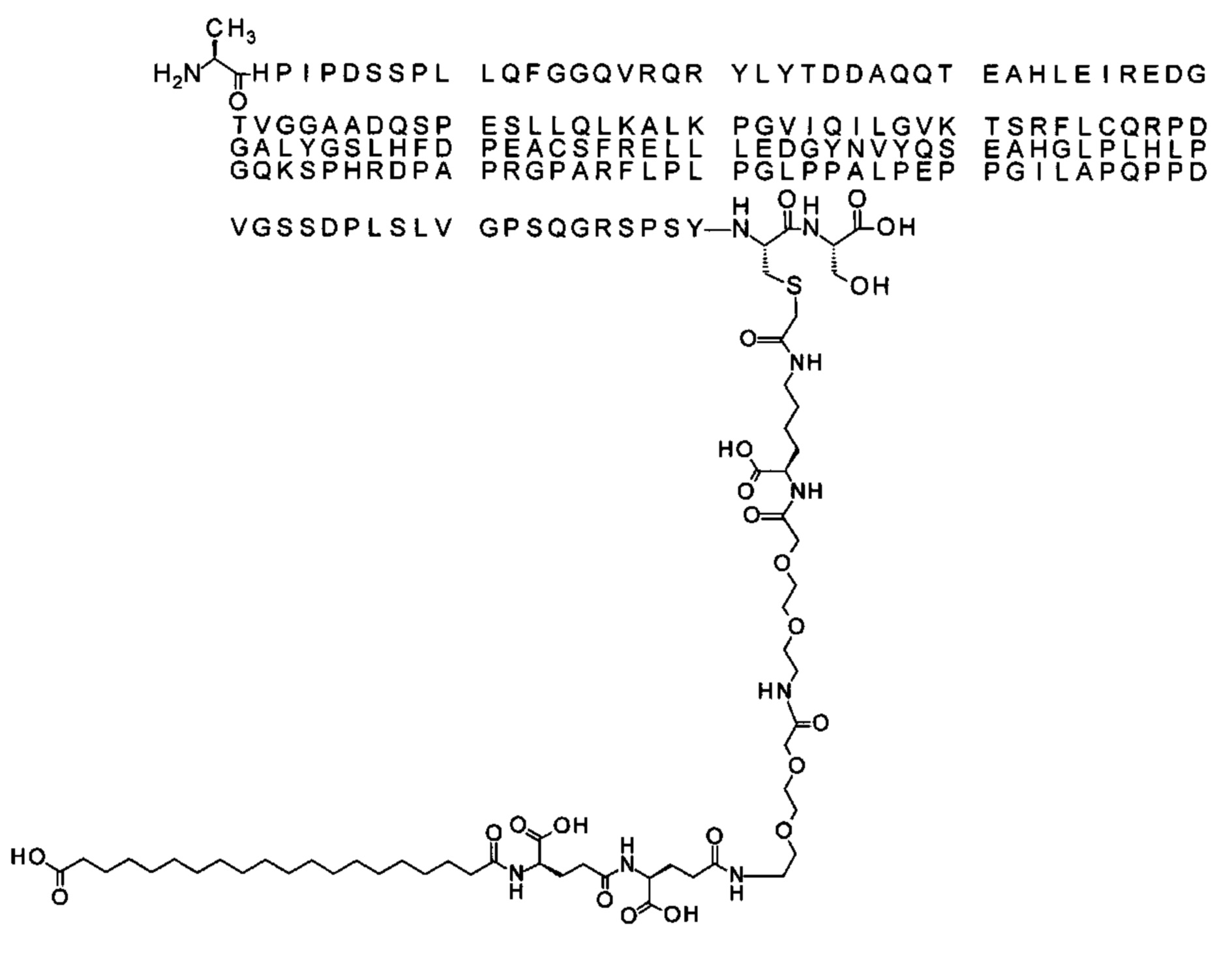
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
20-[[(1S)-4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-1-карбокси-4-оксо-бутил]амино]-20-оксо-эйкозановой кислоты из Примера 4.12.
Пример 5.27. Соединение 46.
20-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-ацетамидо-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-20-оксо-эйкозановая кислота-Ala[Gln121,Leu168,Cys180]FGF21
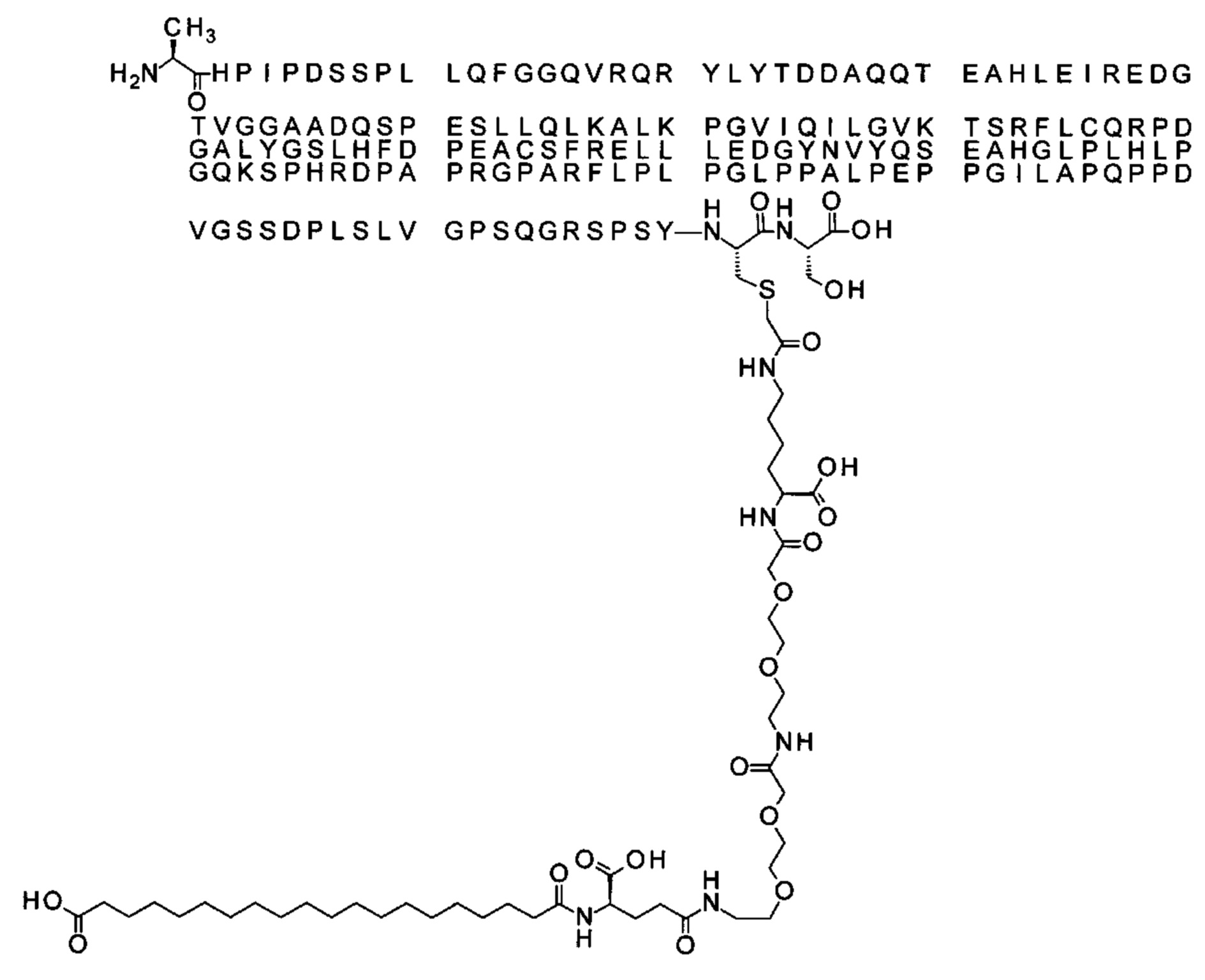
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
20-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-20-оксо-эйкозановой кислоты из Примера 4.13.
Пример 5.28. Соединение 47.
(2S)-6-ацетамидо-2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]гексадекановая кислота-Ala[Gln121,Leu168,Cys180]FGF21
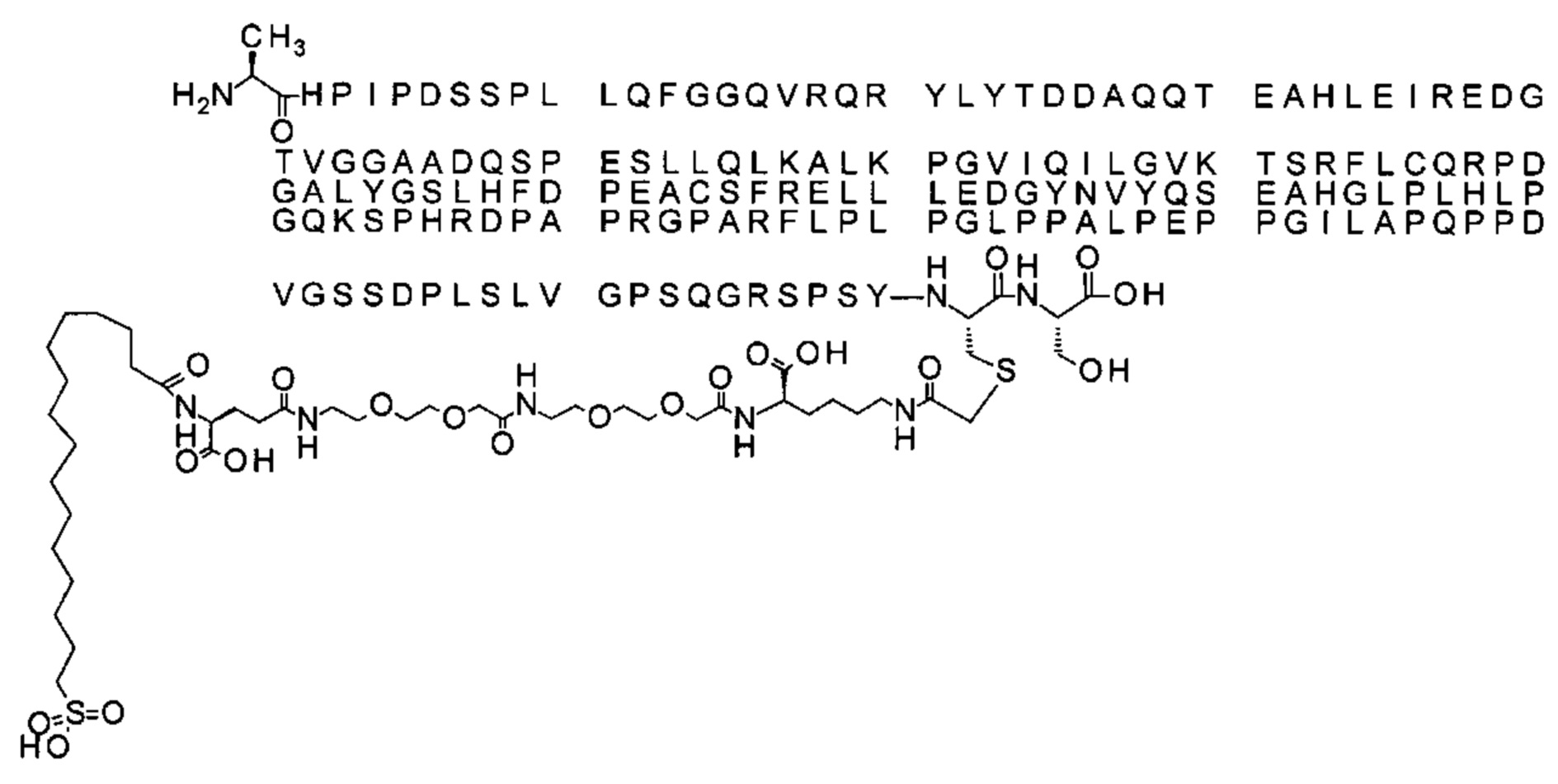
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
(2S)-6-[(2-бромацетил)амино]-2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]гексановой кислоты из Примера 4.14.
Пример 5.29. Соединение 48.
12-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-ацетамидо-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-12-оксо-додекановая кислота-Ala[Gln121,Leu168,Cys180]FGF21
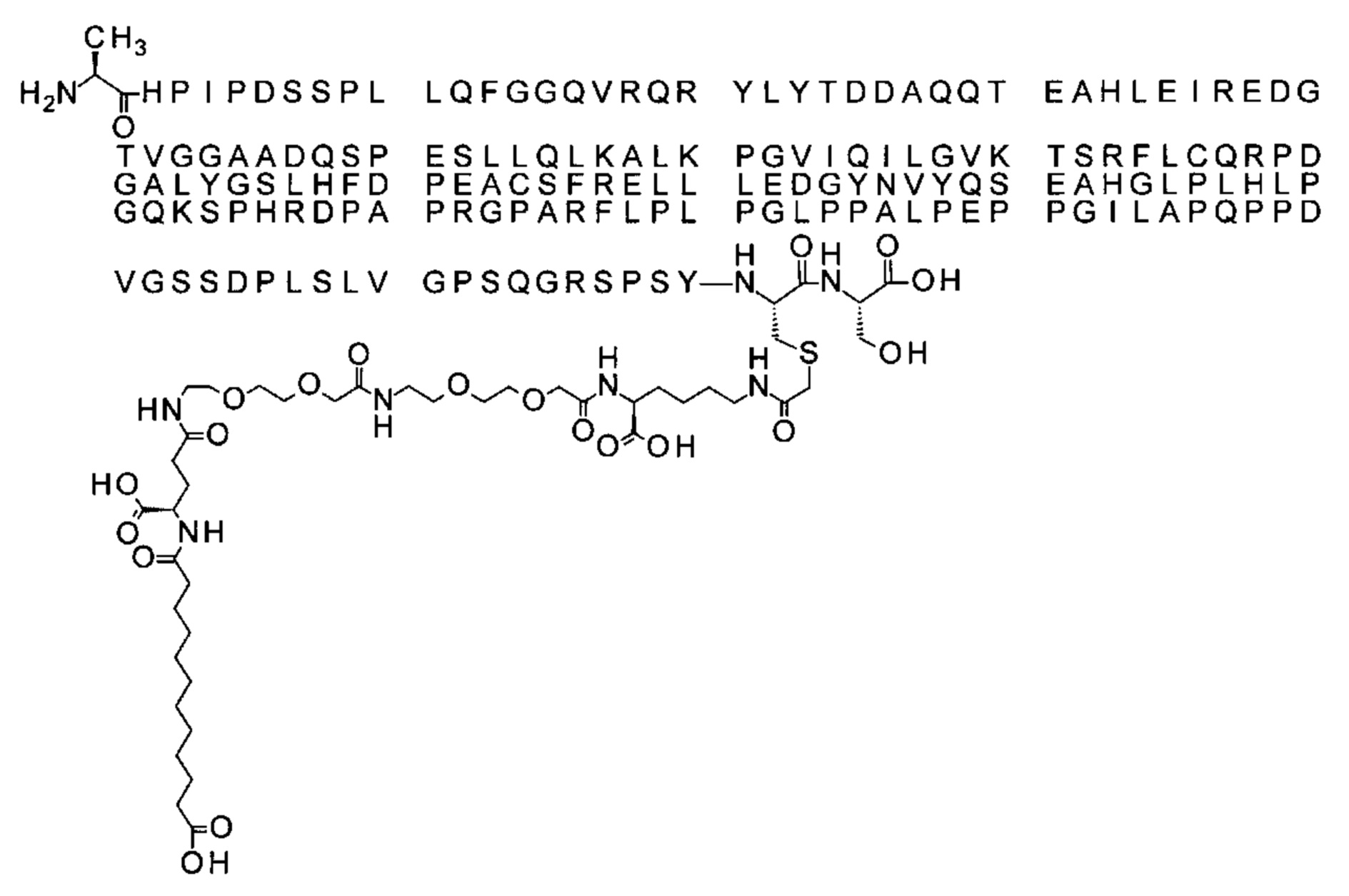
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
12-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-12-оксо-додекановой кислоты из Примера 4.16.
Пример 5.30. Соединение 49.
12-[[(1S)-4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-ацетамидо-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-1-карбокси-4-оксо-бутил]амино]-12-оксо-додекановая кислота-Ala[Gln121,Leu168,Cys180]FGF21
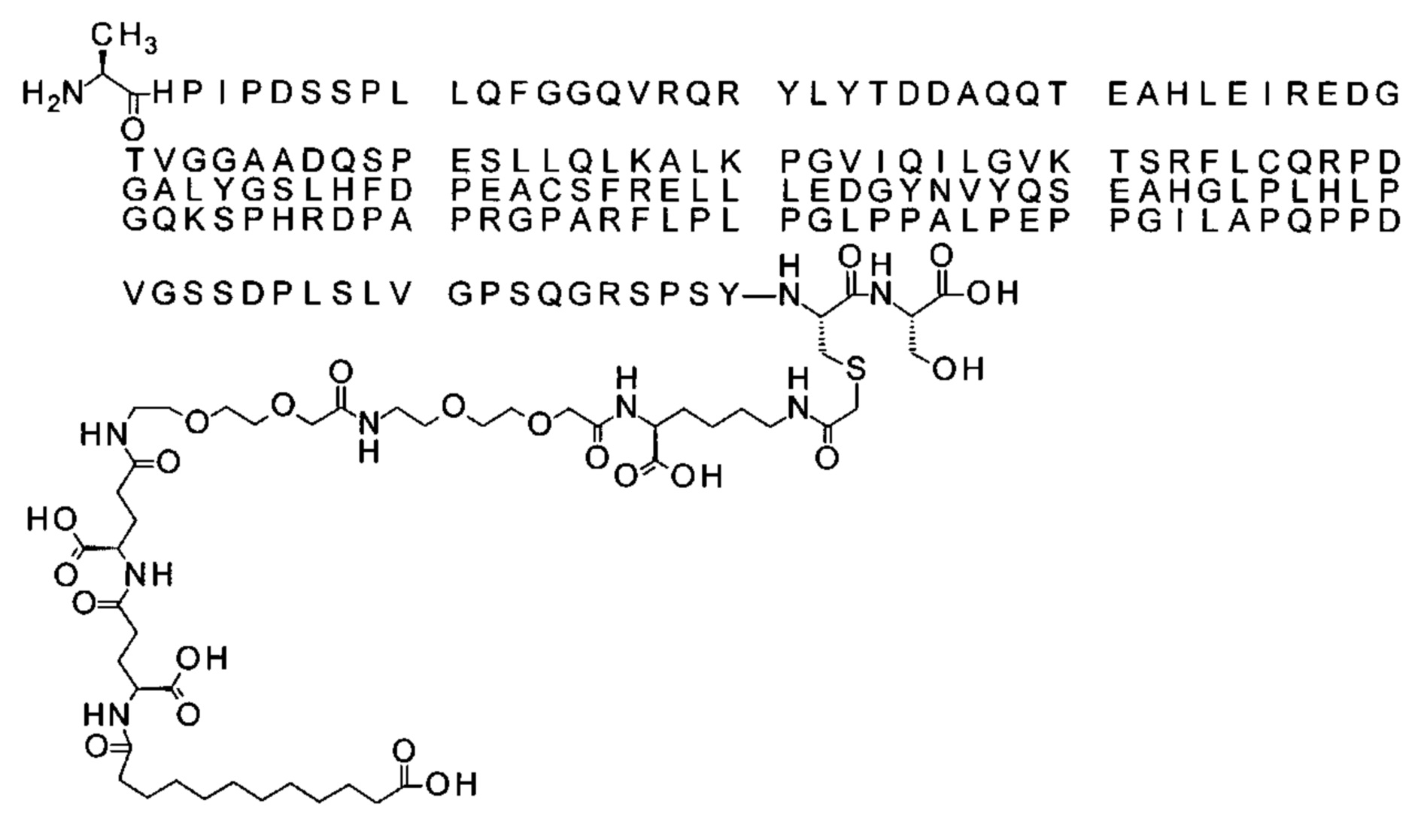
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
12-[[(1S)-4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-1-карбокси-4-оксо-бутил]амино]-12-оксо-додекановой кислоты из Примера 4.15.
Пример 5.31. Соединение 50.
20-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-ацетамидо]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-20-оксо-эйкозановая кислота-Ala[Gln121,Leu168,Cys180]FGF21
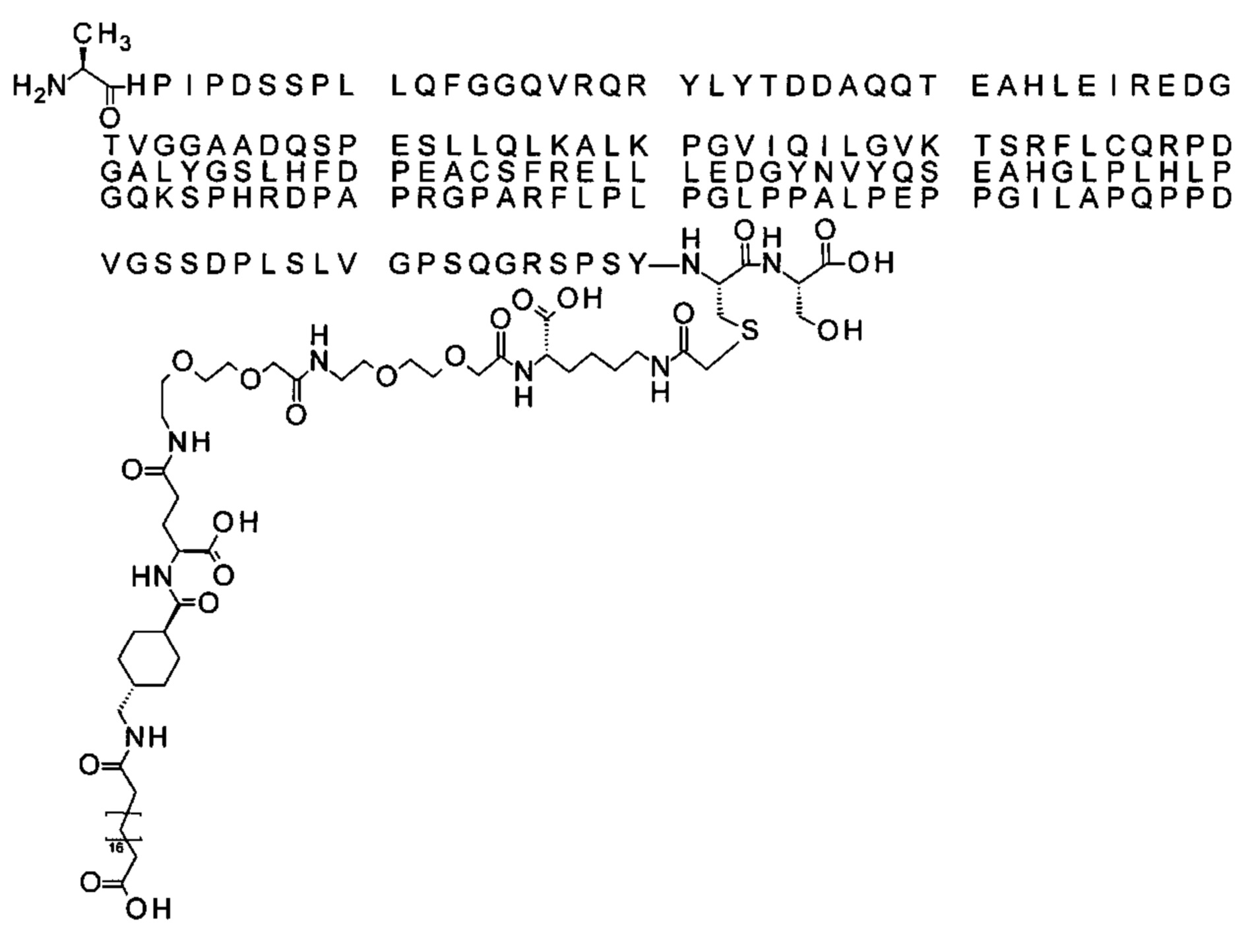
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
20-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-20-оксо-эйкозановой кислоты из Примера 4.17.
Пример 5.32. Соединение 51.
16-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-(2-ацетамидоэтиламино)-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-16-оксо-гексадекановая кислота-Ala[Gln121,Leu168,Cys180]FGF21
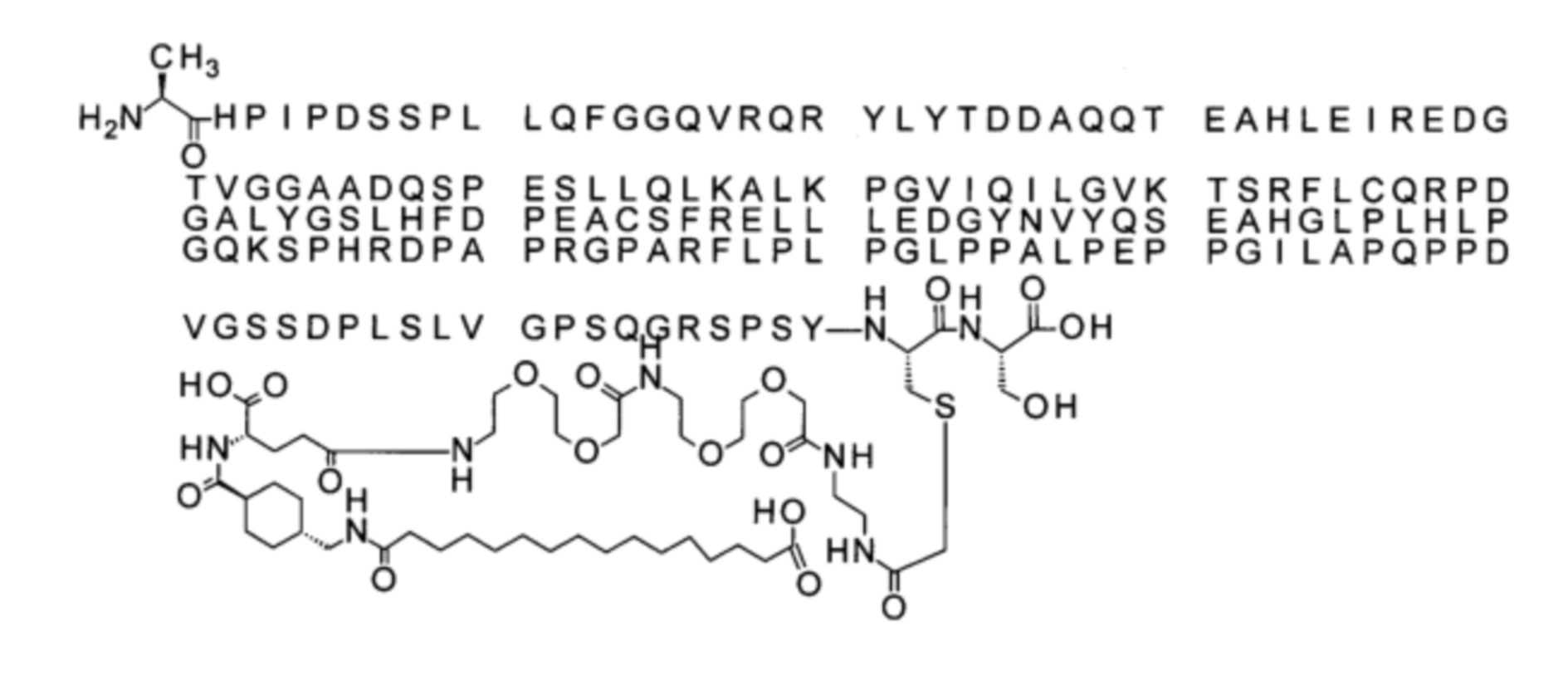
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
16-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[2-[(2-бромацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-16-оксо-гексадекановой кислоты из Примера 4.7.
Пример 5.33. Соединение 52.
16-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-ацетамидо]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-16-оксо-гексадекановая кислота-Ala[Gln121,Leu168,Cys180]FGF21
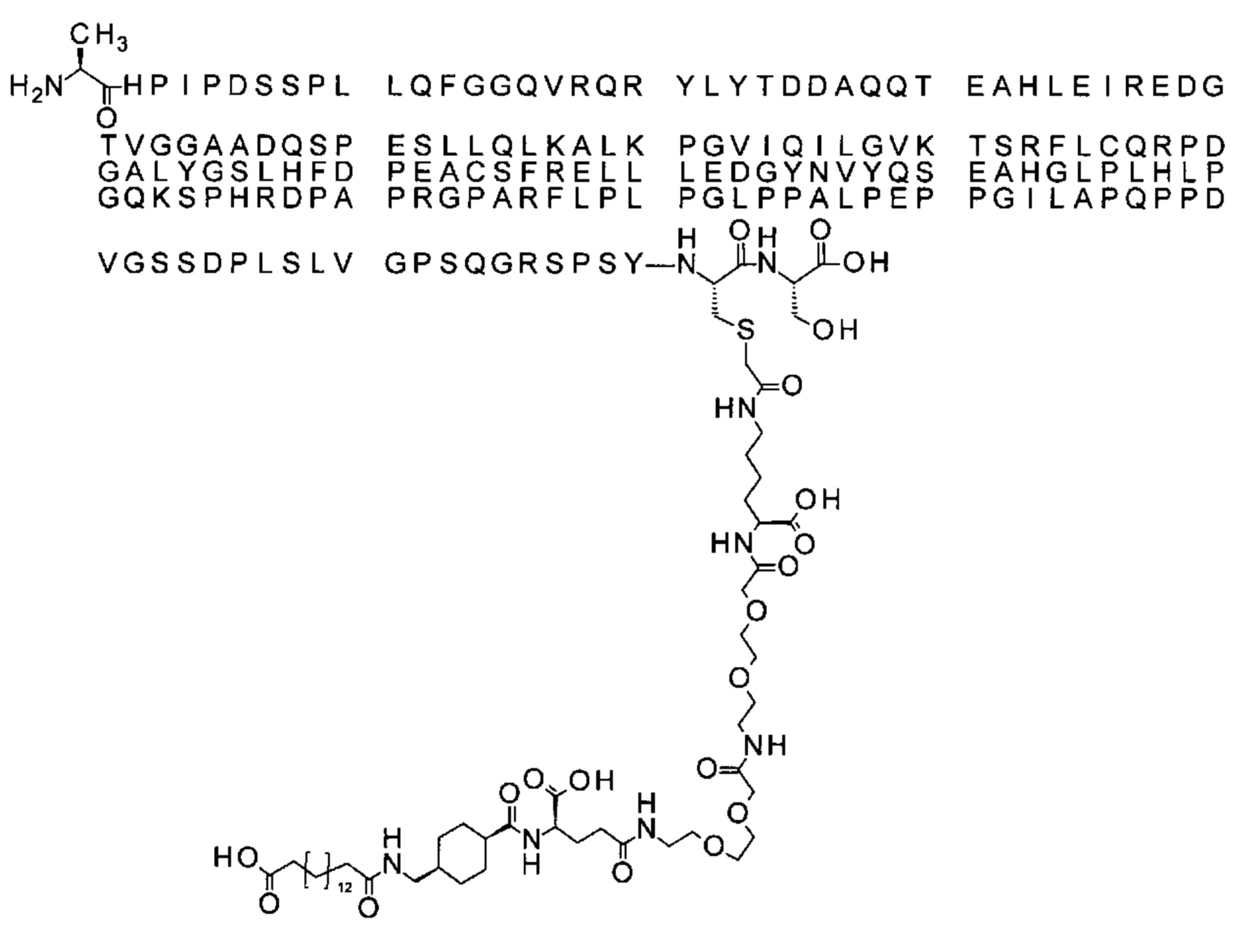
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
16-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-16-оксо-гексадекановой кислоты из Примера 4.9.
Пример 5.34. Соединение 53.
18-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-ацетамидо]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-18-оксо-октадекановая кислота-Ala[Gln121,Leu168,Cys180]FGF21
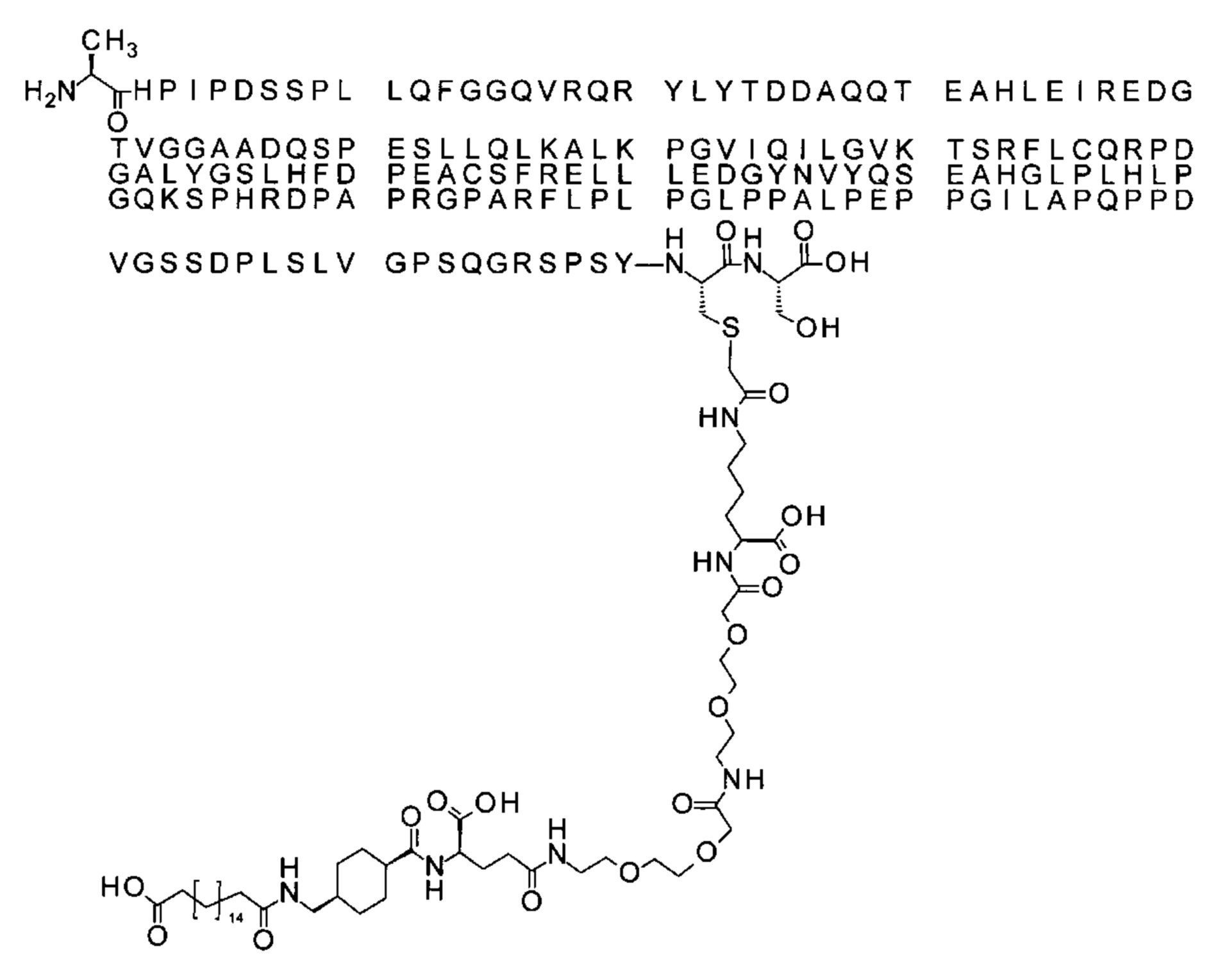
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
18-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-18-оксо-октадекановой кислоты из Примера 4.8.
Пример 5.35. Соединение 54.
12-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-(2-ацетамидоэтиламино)-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-12-оксо-додекановая кислота-Ala[Gln121,Leu168,Cys180]FGF21
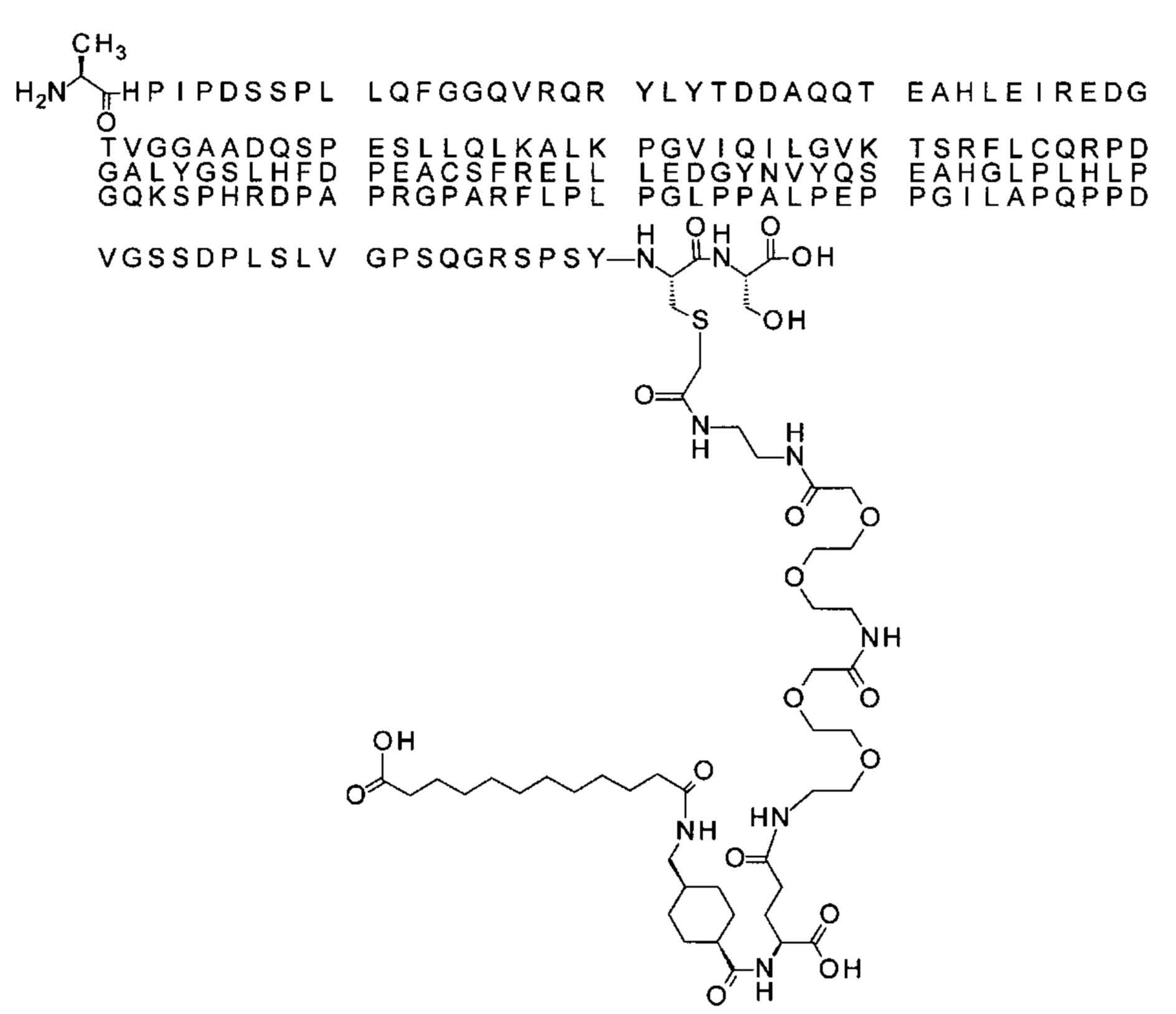
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 8 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
12-[[4-[[(1S)-4-[2-[2-[2-[2-[2-[2-[2-[(2-бромацетил)амино]этиламино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]карбамоил]циклогексил]метиламино]-12-оксо-додекановой кислоты из Примера 4.6.
Пример 5.36. Соединение 55.
4-[10-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-ацетамидо-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-10-оксо-декокси]бензойная кислота]-Ala[Gln121,Leu168,Cys181]FGF21
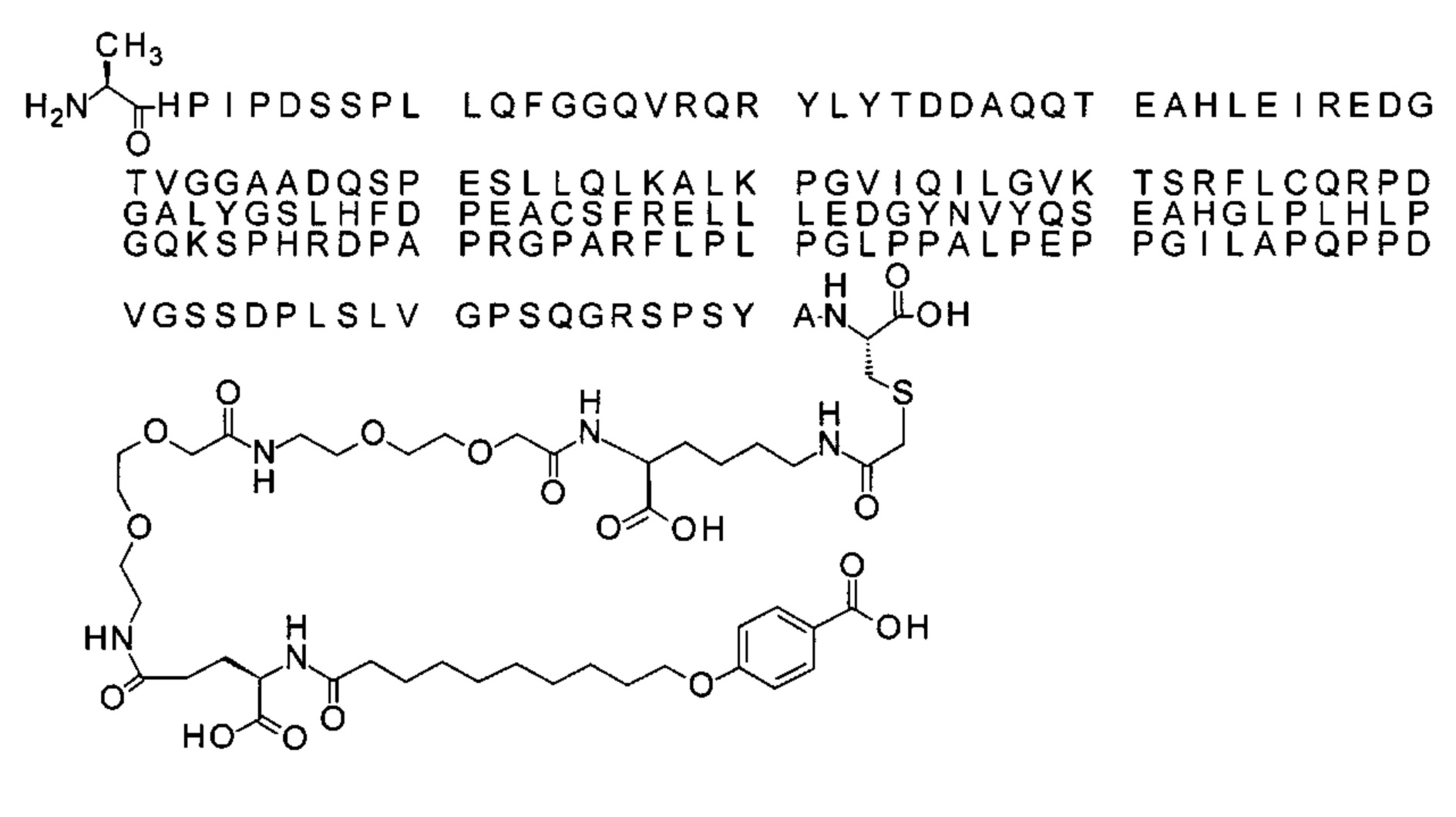
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 10 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента 4-[10-[[(1S)-4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-1-карбокси-4-оксо-бутил]амино]-10-оксо-декокси]бензойной кислоты из Примера 4.11.
Пример 5.37. Соединение 56.
4-[10-[[4-[2-[2-[2-[2-[2-[2-[[(1S)-5-ацетамидо-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-4-оксо-бутил]сульфониламино]-10-оксо-декокси]бензойная кислота-Ala[Gln121,Leu168,Cys181]FGF21
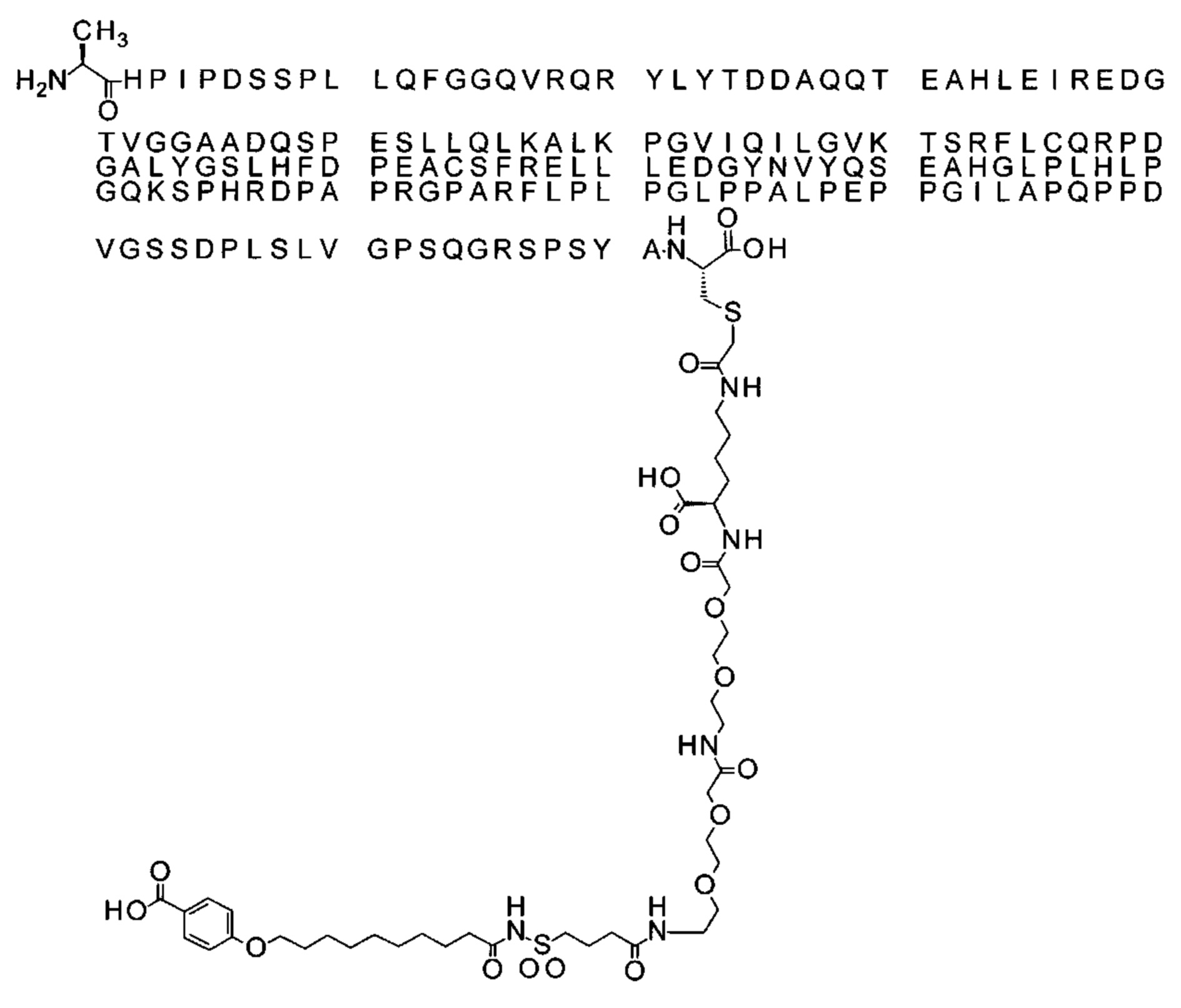
Данное соединение представляет собой производное аналога FGF21 последовательности SEQ ID NO: 10 (см. Пример 3), полученное способом, описанным в Примере 5.1, с использованием реагента
4-[10-[[4-[2-[2-[2-[2-[2-[2-[[(1S)-5-[(2-бромацетил)амино]-1-карбокси-пентил]амино]-2-оксо-этокси]этокси]этиламино]-2-оксо-этокси]этокси]этиламино]-4-оксо-бутил]сульфониламино]-10-оксо-декокси]бензойной кислоты из Примера 4.10.
Фармакологические способы
Полезность аналогов FGF21 по данному изобретению в качестве фармацевтически активных агентов для уменьшения набора веса и лечения ожирения и диабета у млекопитающих (таких, как человек) можно продемонстрировать по активности агонистов FGF21 в стандартных тестах и в исследованиях in vitro и in vivo, описанных в данном документе.
В указанных исследованиях также представлены средства, при помощи которых активность соединений FGF21 по данному изобретению можно сравнить с активностью известных соединений.
Пример 6. Активность рецептора FGF при исследовании фосфорилирования Erk в клетках HEK293, сверхэкспрессирующих BKL человека
Задачей данного примера является тестирование активности, или потентности, производных FGF21 in vitro. Активность in vitro является мерой активации рецептора FGF21 в исследованиях на цельных клетках.
Активность производных FGF21 из Примера 5 определяли с использованием клеток HEK (от англ. Human Embryonic Kidney, эмбриональных клеток почки человека), сверхэкспрессирующих бета-клото (BKL) человека, как описано ниже.
Для исследования связывания производных FGF21 с альбумином проводили анализ в отсутствие альбумина сыворотки, а также в присутствии альбумина сыворотки человека (HSA, от англ. human serum albumin) (конечная концентрация в анализе 0,1%). Увеличение значения ЕС50 (снижение активности) производных FGF21 в присутствии альбумина сыворотки будет указывать на связывание с альбумином сыворотки и представляет собой способ предсказания пролонгированного фармакокинетического профиля исследуемого соединения в моделях на животных.
Результаты для аналогов FGF21 приведены в Таблице 2, а результаты для производных FGF21 приведены в Таблице 3. MetFGF21 (SEQ ID NO: 2) включен в качестве референтного образца.
Принцип исследования
Клеткам НЕК293 свойственна эндогенная экспрессия нескольких рецепторов FGF, включая FGFR1c, FGFR3c и FGFR4. Данные клетки не отвечают на FGF21, если их не трансфицировать корецептором бета-клото (BKL). Активация комплекса рецептор FGF/BKL приводит к активации сигнального пути MAPK/ERK и фосфорилированию ERK. Уровень фосфорилированной ERK (pERK) в заданный момент времени повышается с увеличением концентраций FGF21. Как изложено ниже, уровень pERK определяли после 12-минутной активации аналогами FGF21 в нескольких концентрациях.
Ход исследования
Клетки HEK293/бета-клото высаживали по 30000 клеток/лунку в 96-луночные планшеты в DMEM (BioWhittaker #BE12-604F/U1), с добавлением 10% эмбриональной телячьей сыворотки (Gibco #16140-071), 1% пенициллина/стрептомицина (Gibco #15140), 100 мкг/мл гигромицина В, (Calbiochem, # 400052). Через 2 суток и за 2 часа до добавления соединения среду для культивирования клеток заменяли 100 мкл базовой среды (DMEM (BioWhittaker #ВЕ12-604F/U1)). Аналоги FGF21 разводили в среде для проведения анализа (DMEM (BioWhittaker #BE12-604F/U1) с добавлением 0,02% Tween20), подогретой до 37°С, добавляли к клеткам (100 мкл) и инкубировали при 37°С в течение 12 минут. Производные FGF21 также исследовали в присутствии 0,1% HSA (Sigma - А1887). Всю среду быстро удаляли и добавляли по 50 мкл лизирующего буфера на лунку. Планшет встряхивали в течение 5 минут и лизат был готов для определения pERK. pERK определяли в 384-луночных планшетах с использованием набора AlphaScreen SureFire (PerkinElmer #TGRES10K). Набор основан на использовании специфических к ERK и pERK антител, связанных с гранулами-донорами и гранулами-акцепторами. В присутствии pERK гранулы-акцепторы и гранулы-доноры оказываются в непосредственной близости, и генерируется сигнал, который считывают при помощи устройства EnVision. Данные анализируют с использованием GraphPad Prism и выражают активность белков FGF21 в абсолютных значениях ЕС50.

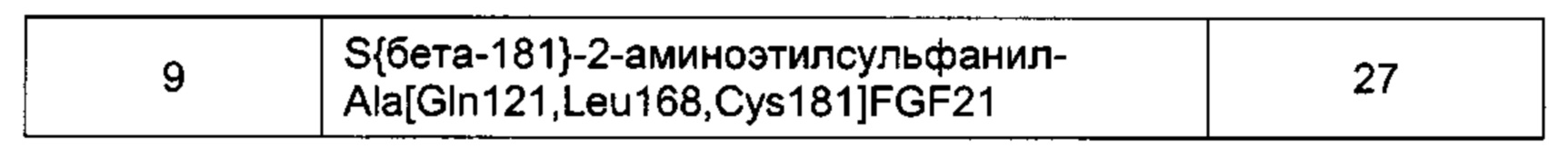
Как следует из результатов, приведенных в Таблице 2, внедрение цистеина в положения 176, 177, 178 или 179 значительно снижает активность по сравнению с MetFGF21. При этом, неожиданно обнаружили, что внедрение цистеина в положение 180 или в положение 181 не приводит к снижению (180С) или приводит к умеренному снижению (181С) активности по сравнению с MetFGF21. Соединение 7, имеющее цистеин в положении 180, демонстрирует активность, сопоставимую с MetFGF21 и Соединением 2, имеющими такие же аминокислотные замены, как и Соединение 8, за исключением цистеина в положении 180.
Активность Соединения 9, имеющего цистеин в положении 181, только незначительно снижена по сравнению с MetFGF21 и с Соединением 2, имеющими такие же аминокислотные замены, как и Соединение 9, за исключением цистеина в положении 181.
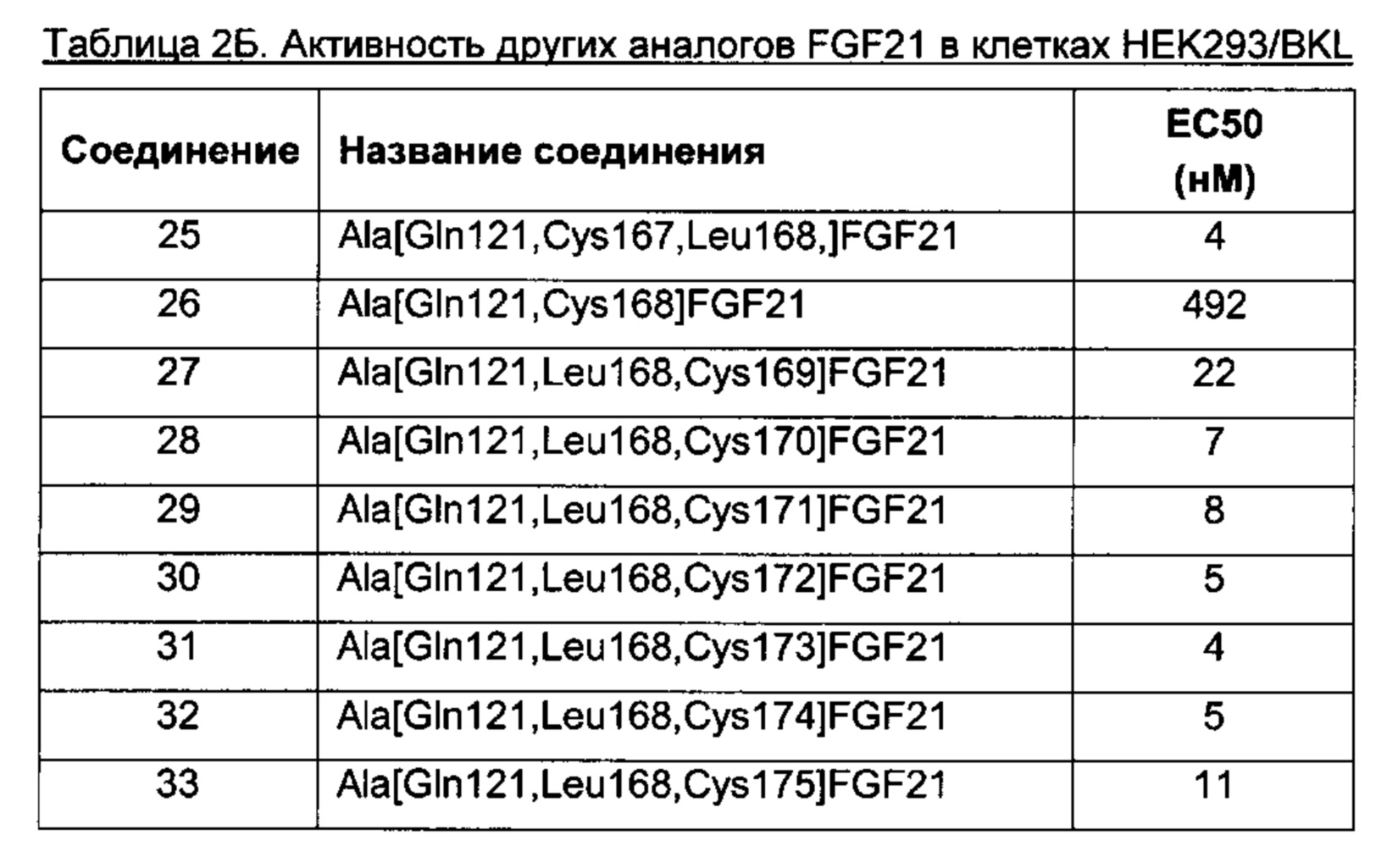
Неожиданно обнаружили, что соединение #26, имеющее аминокислотную замену С168, обладает сниженной активностью, тогда как аналоги, имеющие цистеин в положении 167, 169, 170, 171, 172, 173, 174 и 175, обладают сопоставимой с MetFGF21 активностью.
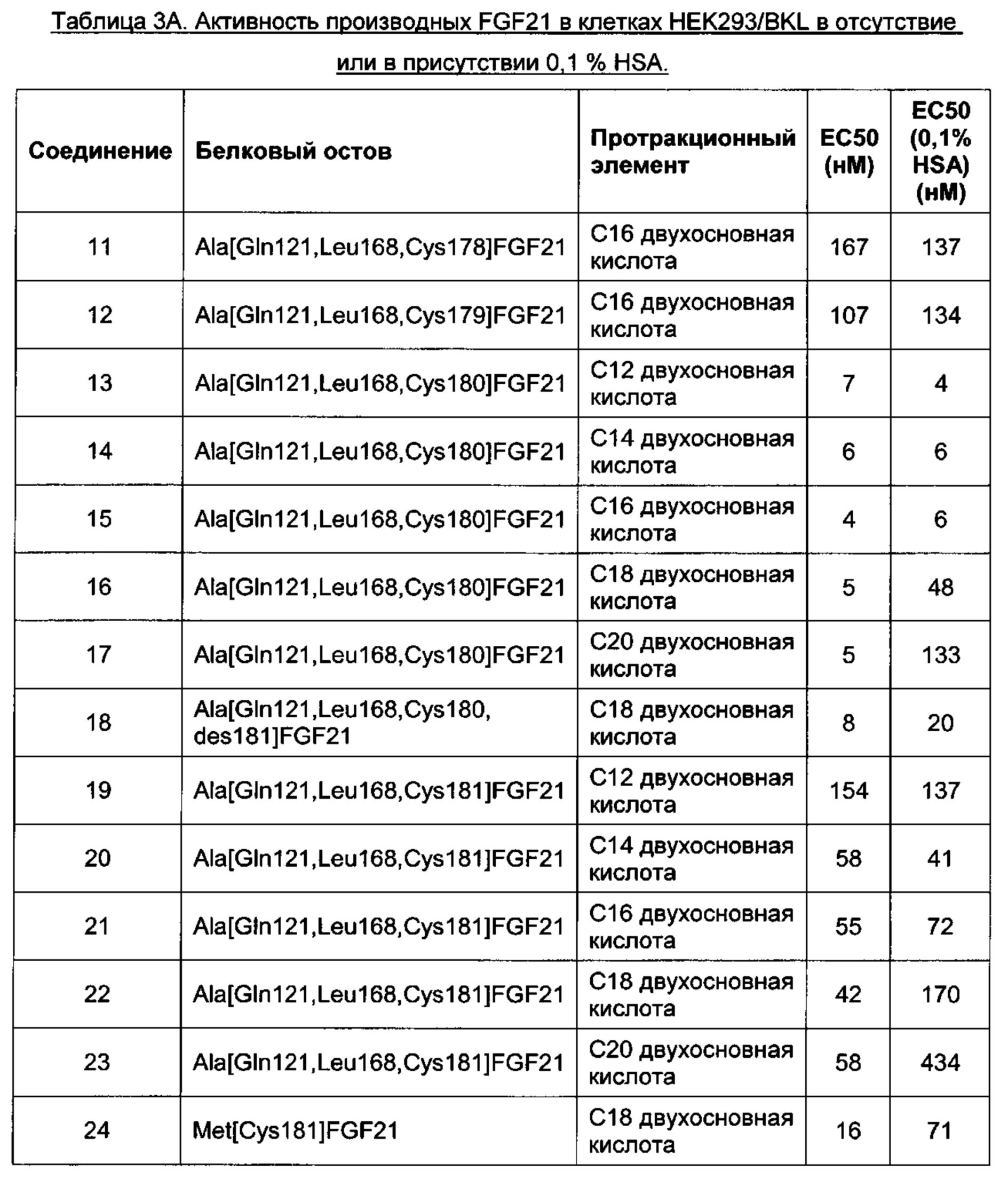
Как следует из результатов, приведенных в Таблице 3А, неожиданно оказалось, что присоединение боковой цепи по данному изобретению к цистеину в любом из положений 178-181 не приводит к уменьшению активности по сравнению с соединениями, не имеющими боковой цепи (см. Таблицу 2). Все соединения 11, 12, 15 и 21 содержат идентичную боковую цепь, где протракционный элемент представляет собой двухосновную кислоту (Соед. 1а) (линкерные элементы представляют собой один элемент, представляющий собой Соед. 2, два элемента, представляющие собой Соед. 3а, и один элемент, представляющий собой Соед. 4а). При сравнении с активностью соответствующих аналогов FGF21 (Соединения 5, 6, 7 и 9, см. Таблицу 2), можно заметить, что активности указанных производных FGF21 и соответствующих аналогов FGF21 (т.е. не имеющих боковой цепи) одинаковы.
Также исследовали влияние на активность соединений, имеющих протракционные элементы с жирными кислотами с цепями различной длины. В отсутствие HSA активность производных FGF с цистеином в положении 180 и производных FGF21, имеющих в качестве протракционного элемента С12 двухосновную кислоту, С14 двухосновную кислоту, С16 двухосновную кислоту или С18 двухосновную кислоту, была одинаковой. В отсутствие HSA активность производных FGF с цистеином в положении 181 и производных FGF21, имеющих в качестве пролонгирующего элемента С14 двухосновную кислоту, С16 двухосновную кислоту или С18 двухосновную кислоту или С20 двухосновную кислоту, была одинаковой.
Увеличение концентрации HSA не оказывало влияния или оказывало незначительное влияние на активность производных, содержащих С12, С14 или С16 боковую цепь, тогда как активность соединений с С18 или С20 боковой цепью была снижена в присутствии 0,1% HSA.
Как следует из Таблицы 3А, увеличение значения ЕС50 в присутствии 0,1% сывороточного альбумина по сравнению со значением ЕС50 в отсутствие сывороточного альбумина у производных FGF21 коррелирует с увеличением длины протрактора. Это хорошо согласуется с увеличением периода полужизни указанных производных FGF21 (см. Пример 8).

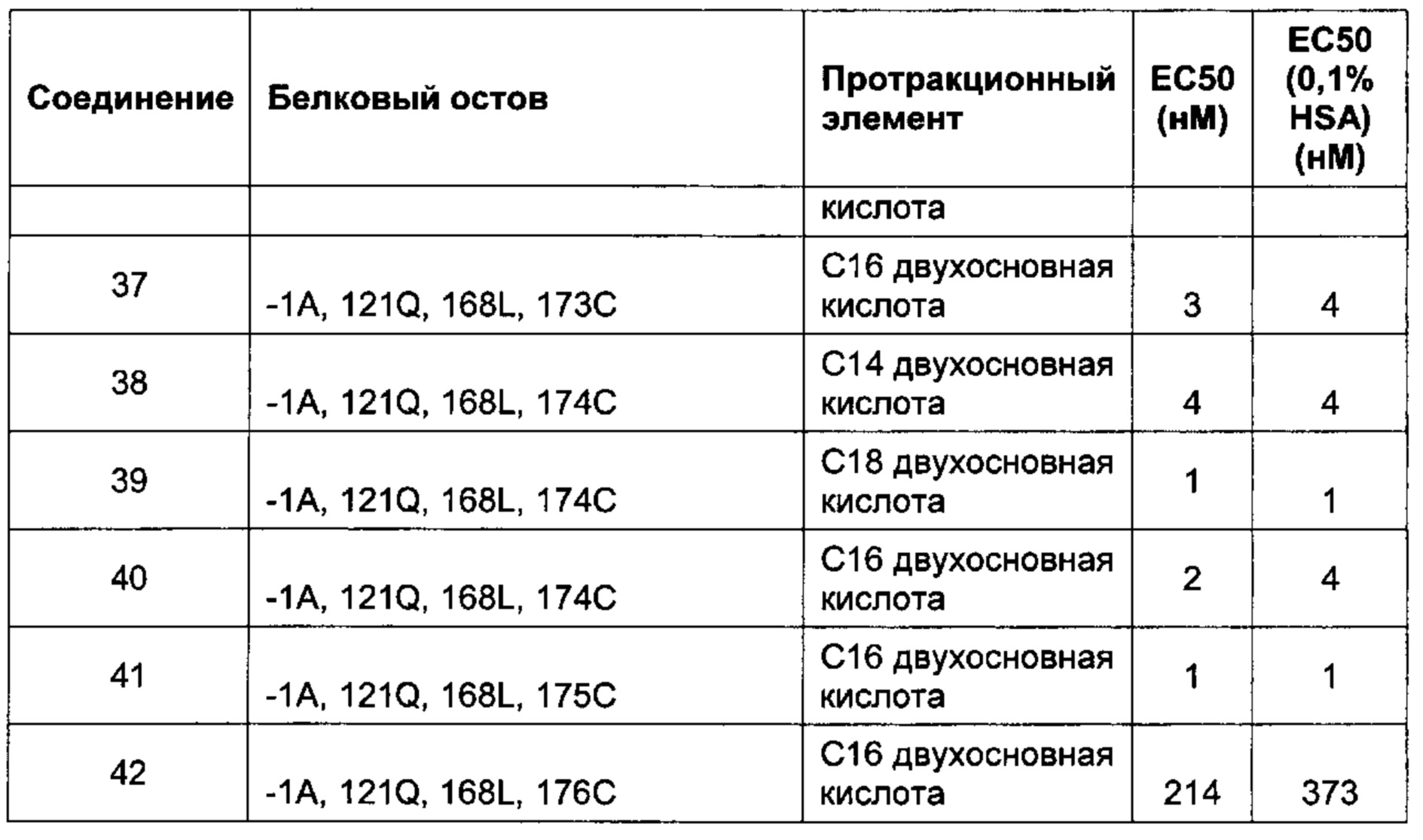
Также исследовали активность производных FGF21 с различным остовом, описанных выше, и обнаружили, что все производные с цистеином в положении 169, 170, 171, 172, 173, 174 и 175 сохраняют активность при дериватизации жирнокислотным протрактором. Отметили, что при дериватизации по Cys 169 активность незначительно уменьшается.
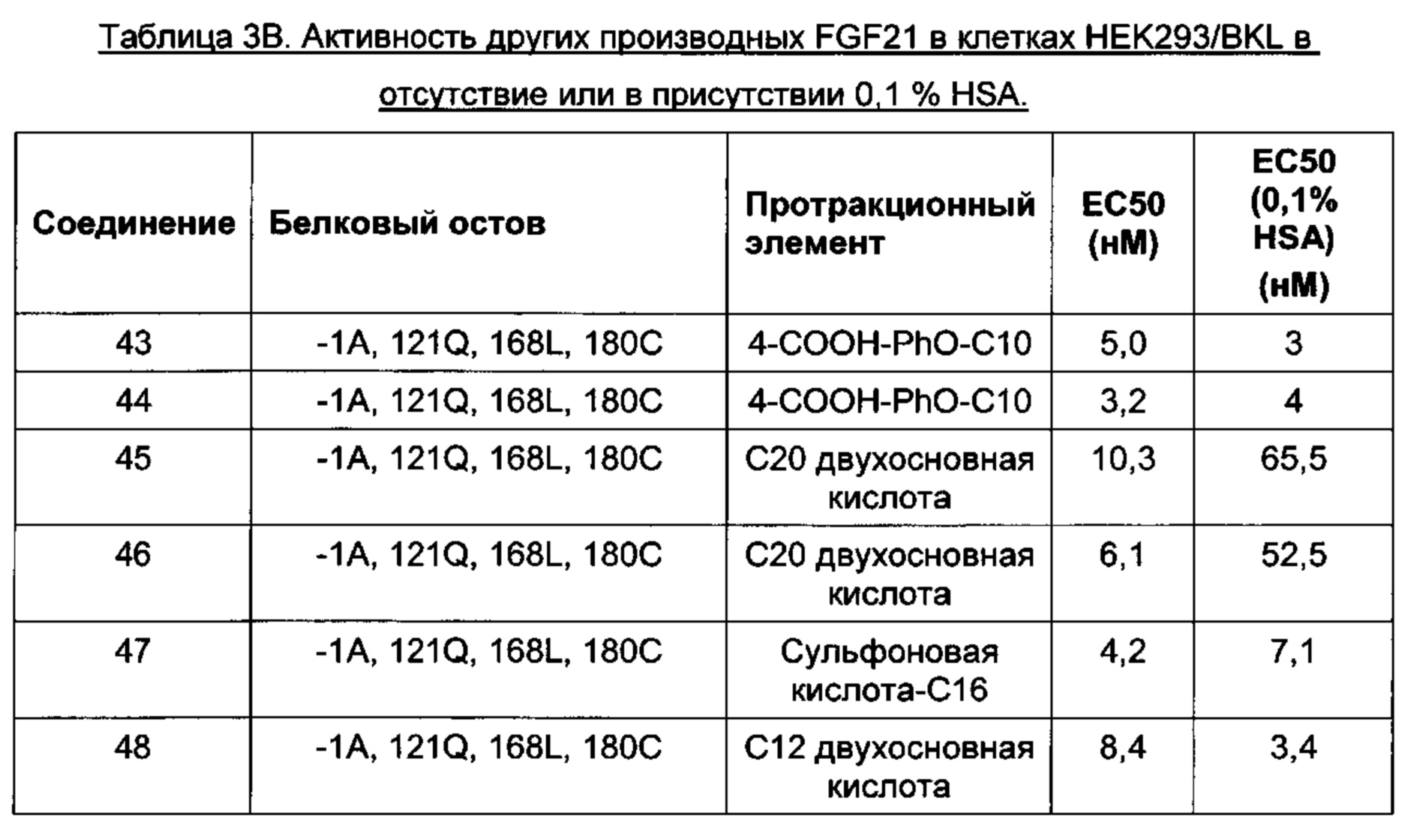
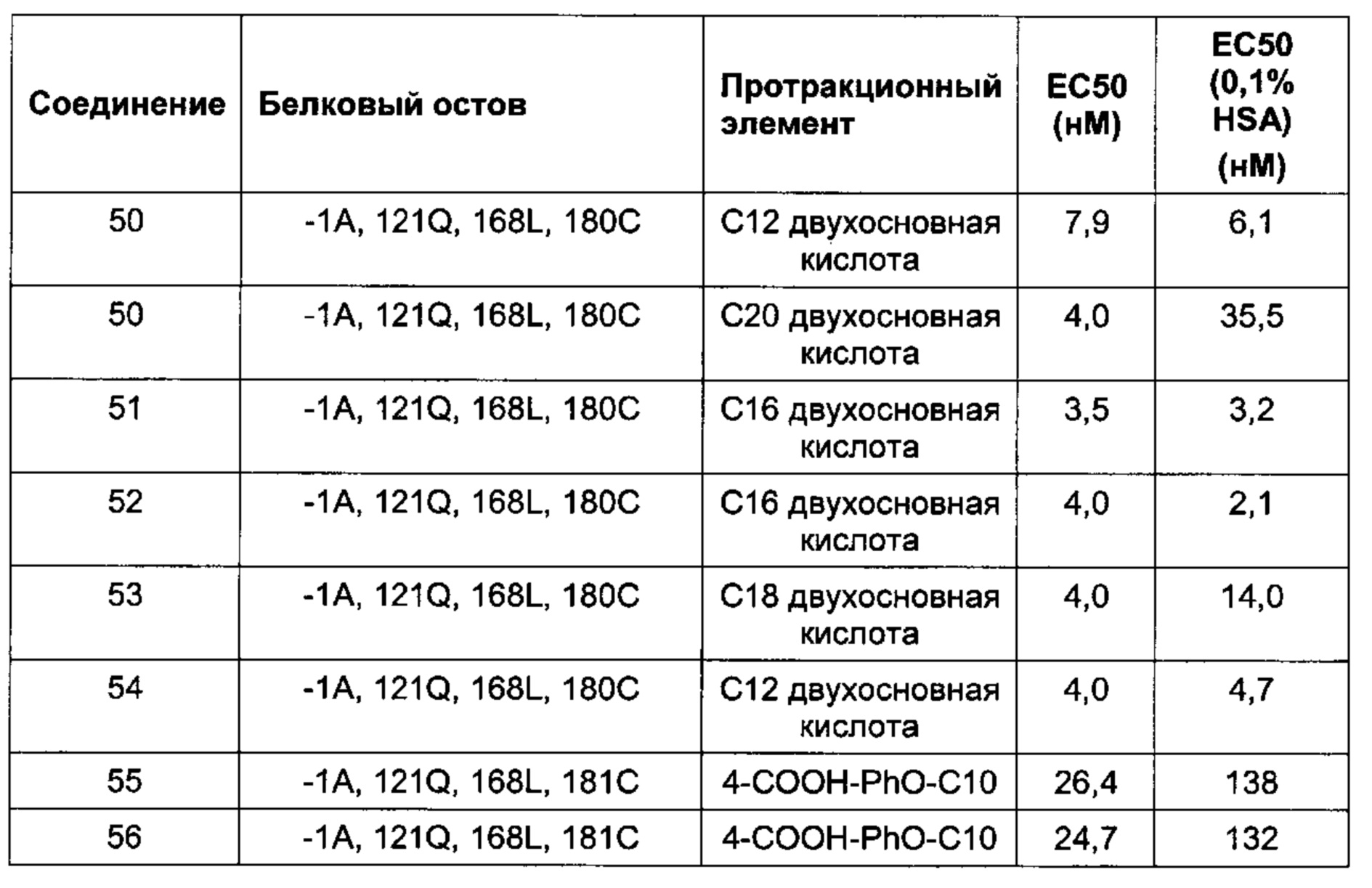
Для сравнения других протракционных элементов исследовали различные комбинации протракторов и линкеров. Все они были конъюгированы с Cys 180 или Cys 181, и функциональные возможности полученных производных FGF21 были почти одинаковыми, что свидетельствовало, что при конъюгировании с Cys FGF21, таким как Cys 180 или Cys 181, можно использовать различные протракционные элементы.
Пример 7. Захват глюкозы адипоцитами 3T3-L1
Исследовали способность модифицированных по С-концу аналогов усиливать захват глюкозы мышиными адипоцитами 3T3-L1. Следующее исследование использовали для определения биологической активности аналогов и производных FGF21 по изобретению.
Принцип исследования
Активность in vitro можно также определять в тестах с мышиными адипоцитами 3T3-L1 путем исследования способности аналогов и производных FGF21 усиливать захват глюкозы адипоцитами. Дифференцированным адипоцитам 3T3-L1 присуща эндогенная экспрессия FGFR1c и BKL. Клетки 3T3-L1 не отвечают на FGF21 до тех пор, пока они не дифференцируются, поскольку дифференцировка вызывает экспрессию корецептора BKL. Активация комплекса рецептор FGFR1c/BKL повышает экспрессию глюкозного транспортера 1 (GLUT1) и, таким образом, агонисты FGF21 будут приводить к дозозависимому увеличению количества глюкозы, захватываемой адипоцитами.
Ход исследования
Мышиные фибробласты 3T3-L1 (например, доступные для приобретения в АТСС, кат. номер CL-173) поддерживали в базовой питательной среде (DMEM (4500 мг/л глюкозы) с добавлением 10% эмбриональной телячьей сыворотки (FBS) и 1% пенициллина/стрептомицина). Клеткам не давали достичь конфлюентности и делали пассажи (переносили в новые флаконы) до достижения приблизительно 60% конфлюентности (при визуальной оценке).
Для исследования захвата глюкозы клетки находились в 96-луночном планшете по 15000 клеток/лунку (BIOCOAT) и при достижении конфлюентности (высокая плотность, в целях образования дифференцированных адипоцитов) базовую среду базовой заменяли средой, содержащей троглитазон, IBMX, дексаметазон (доступные для приобретения, например, в компании Sigma) и инсулин человека (доступный для приобретения, например, в компании Novo Nordisk A/S).
Клетки использовали через 7-9 суток после инициации дифференцировки. Клетки стимулировали аналогами или производными FGF21 по изобретению в возрастающих концентрациях (0-300 нМ) в течение 20 часов в базальной среде. Перед добавлением 3Н-дезокси-глюкозы (в дальнейшем описании: метка) клетки промывали теплым (приблизительно 37°С) буфером для проведения анализа (PBS с добавлением 1 мМ MgCl2 и 2 мМ CaCl2), HEPES и 0,1% альбумина сыворотки человека) и инкубировали клетки с меткой в течение 1 часа. Инкубацию останавливали путем двукратной промывки ледяным буфером для проведения анализа. Клетки лизировали в Triton Х-100 и переносили лизат в 96-луночный планшет, добавляли microscint-40 (доступный для приобретения, например, в компании Perkin Elmer) и определяли количество метки с использованием счетчика TOP-counter (например, счетчик Packard top-counter от компании Perkin Elmer). Рассчитывали ЕС50 и Emax исследуемого соединения FGF21. Результаты, которые приведены в Таблицах 4-5 ниже, демонстрируют ЕС50 (активность) и Emax (эффективность) аналогов и производных FGF21, соответственно.
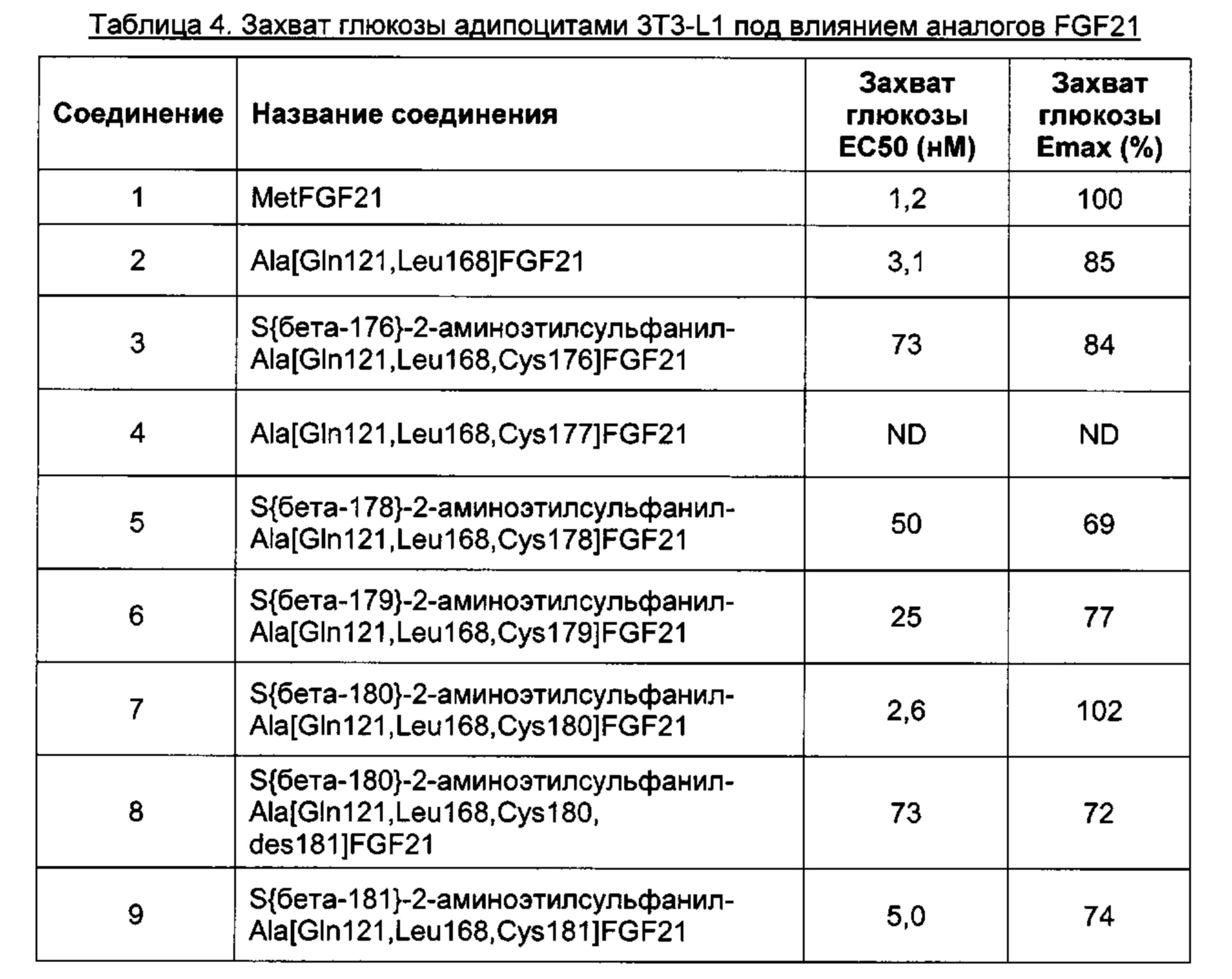
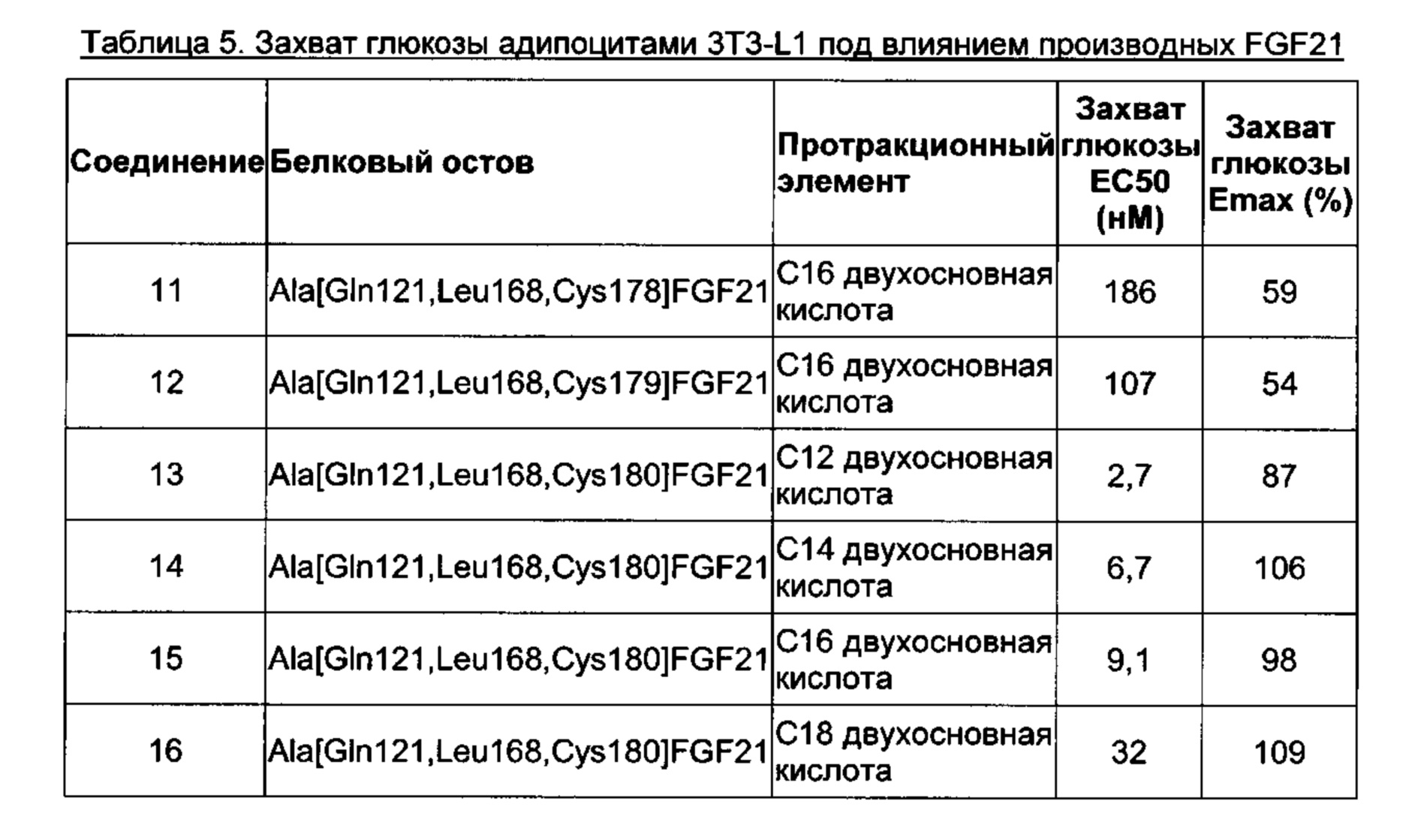

Вследствие связывания боковых цепей производных FGF21 с альбумином производные FGF21 (Таблица 5) обладают более низкой активностью, чем соответствующие аналоги FGF21 (Таблица 4) из-за присутствия сыворотки и, следовательно, альбумина в базальной среде для проведения анализа. Снижение активности коррелирует с длиной протракционного элемента.
Пример 8. Фармакокинетическое исследование на карликовых свинках и мышах
Целью данного исследования было определение протракции производных FGF21 in vivo после внутривенного введения карликовым свинкам и мышам, т.е. пролонгирования времени их нахождения в организме и, следовательно, их времени действия. Для этого проводили фармакокинетическое (ФК) исследование, в котором определяли период полувыведения в конечной фазе исследуемого аналога. Под периодом полувыведения в конечной фазе понимают время, которое требуется для снижения определенной концентрации в плазме в два раза в конечной фазе (фазе элиминации).
Исследование на карликовых свинках
В исследованиях использовали самок карликовых свинок  ottingen, полученных из компании Ellegaard
ottingen, полученных из компании Ellegaard  Gottingen Minipigs (Dalmose, Дания), в возрасте приблизительно 7-14 месяцев, массой приблизительно 16-35 кг. Карликовых свинок содержали либо по-отдельности (животные с постоянными катетерами), либо в группах, и один или два раза в сутки давали ограниченное количество корма SDS (Special Diets Services, Essex, UK) для карликовых свинок.
Gottingen Minipigs (Dalmose, Дания), в возрасте приблизительно 7-14 месяцев, массой приблизительно 16-35 кг. Карликовых свинок содержали либо по-отдельности (животные с постоянными катетерами), либо в группах, и один или два раза в сутки давали ограниченное количество корма SDS (Special Diets Services, Essex, UK) для карликовых свинок.
По меньшей мере через 2 недели акклиматизации каждому животному имплантировали два постоянных центральных венозных катетера в каудальную полую вену или черепную вену. Животным давали 1 неделю восстановиться после хирургического вмешательства и затем использовали для повторных фармакокинетических исследований с соответствующим периодом отмывки между последовательными введениями.
Внутривенные инъекции соединений (в объеме, соответствующем, например, 0,050-0,125 мл/кг) выполняли через один катетер или через внутривенную канюлю venflon, и брали кровь в определенные моменты времени вплоть до 11 суток после введения (предпочтительно, через другой катетер или посредством пункции вены).
Образцы крови (например, 0,8 мл) собирали в пробирки, покрытые EDTA (8 мМ) и затем центрифугировали при 4°С и 1942G в течение 10 минут. Образцы крови брали, чтобы обеспечить достаточный охват всей кривой «концентрация АФИ в плазме - время». В примере образцы крови брали в момент времени t = перед введением, через 0,0833, 0,25, 0,5, 0,75, 1, 1,5, 2, 3, 4, 6, 8, 10, 24, 30, 48, 72, 96, 120, 144, 168, 192, 216, 240, 264 часа после введения.
Плазму раскапывали по пробиркам Micronic на сухом льду и хранили при - 20°С до анализа плазменной концентрации соответствующего аналога FGF-1 с использованием ELISA. Отдельные профили концентрация в плазме - время анализировали с использованием фармакокинетического метода без компартментализации в программе Phoenix v. 6.3 (Pharsight Inc., Mountain View, CA, USA) или другого соответствующего программного обеспечения для анализа ФК, и определяли итоговый период полувыведения в конечной фазе (гармоническое среднее). Период полувыведения в конечной фазе производных FGF21 представляет собой среднее арифметическое из двух определений с различными дозами, как описано выше.
Исследование на мышах
Фармакокинетические профили аналогов FGF21 исследовали у нормальных мышей без ожирения C57bl, n=2-3 (приблизительно 30 граммов). Соединения FGF21 вводили в виде однократной внутривенной дозы 20 мг/кг (приблизительно 5 мл/кг).
Уровни соединений FGF21 в плазме определяли с использованием набора Fibroblast Growth Factor-21 Human ELISA (поставляемого компанией BioVendor, кат. номер RD191108200R). Для фармакокинетических расчетов использовали программное обеспечение на базе ПК, WinNonLin версии 6.3 от Pharsight Corporation, Cary N.C. Результаты приведены в Таблице 6.
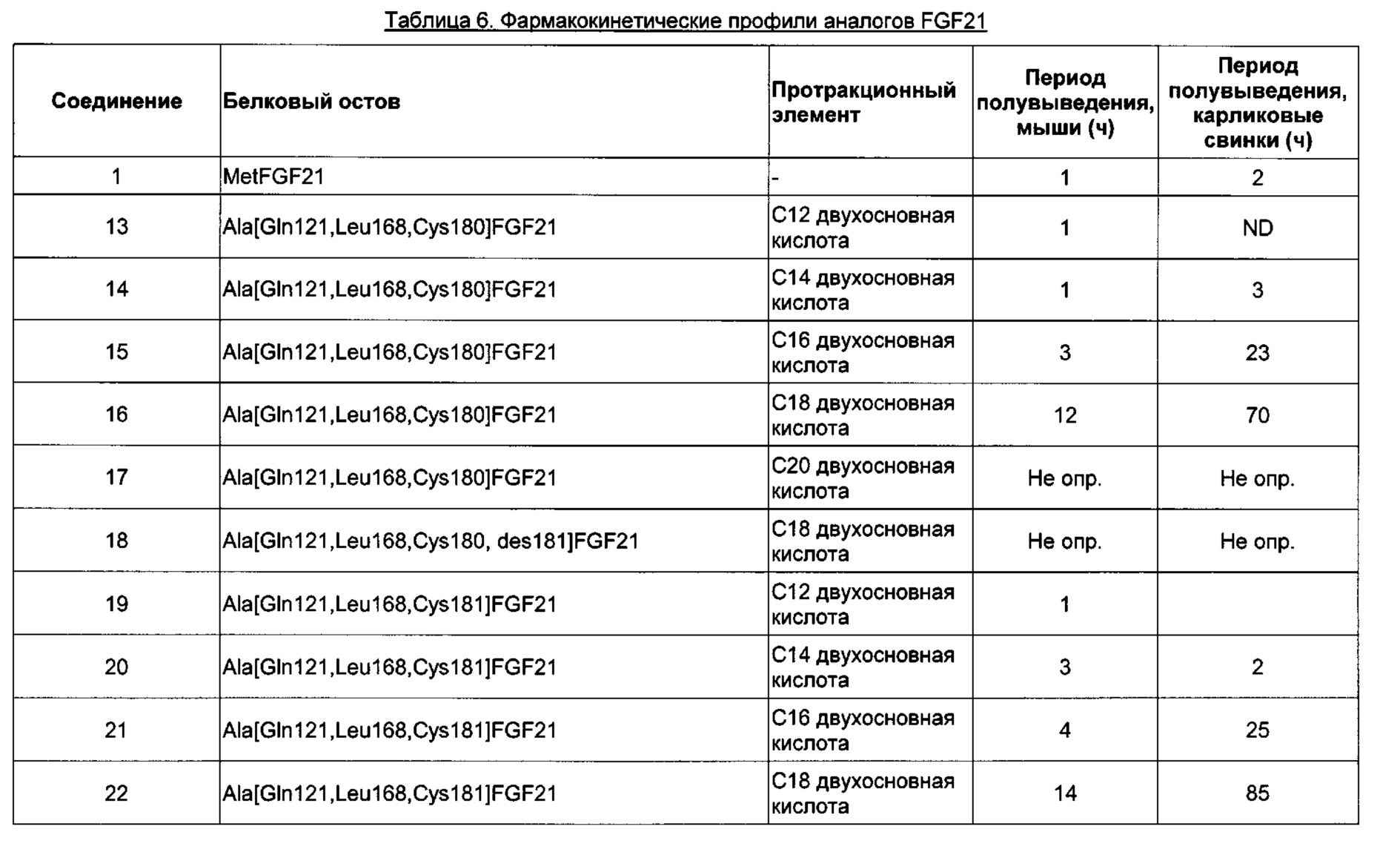
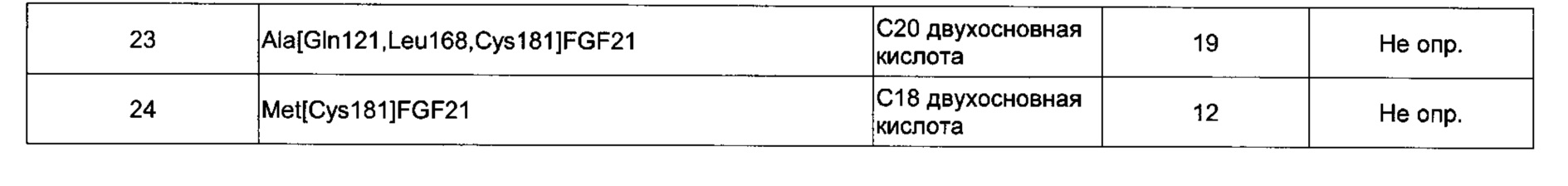
Как следует из Таблицы 6, время полужизни в плазме увеличивается с длиной цепи жирной кислоты протракционного элемента, как у карликовых свинок, так и у мышей.
Пример 9. Снижение массы тела у мышей без ожирения
Для определения активности производных FGF21 in vivo исследовали влияние на массу тела мышей C57BL без ожирения после подкожного (п.к.) введения. Ранее было показано, что уменьшение массы тела, индуцированное FGF21 у мышей без ожирения, предсказывает эффект у мышей с ожирением и, следовательно, мышей без ожирения считают хорошей скрининговой моделью.
Соединения вводили п. к. 1 мг/кг один раз в сутки (QD) или два раза в сутки (BID) в 10 мМ фосфате, 2% (мас./об.) глицерин, 500 ppm (=0,05%) полисорбат 80, рН=8,15, (2 мл/кг) в течение 7 дней (n=7-8). Группы, получавшие соответствующее плацебо (контроль), получали 10 мМ фосфат, 2% (мас./об.) глицерин, 500 ppm (=0,05%) полисорбат 80, рН=8,15, (2 мл/кг) п.к. дважды в сутки в течение 7 дней (n=6-8). Массу тела измеряли перед введением и повторно раз через 7 дней воздействия. Результаты приведены в Таблице 7.
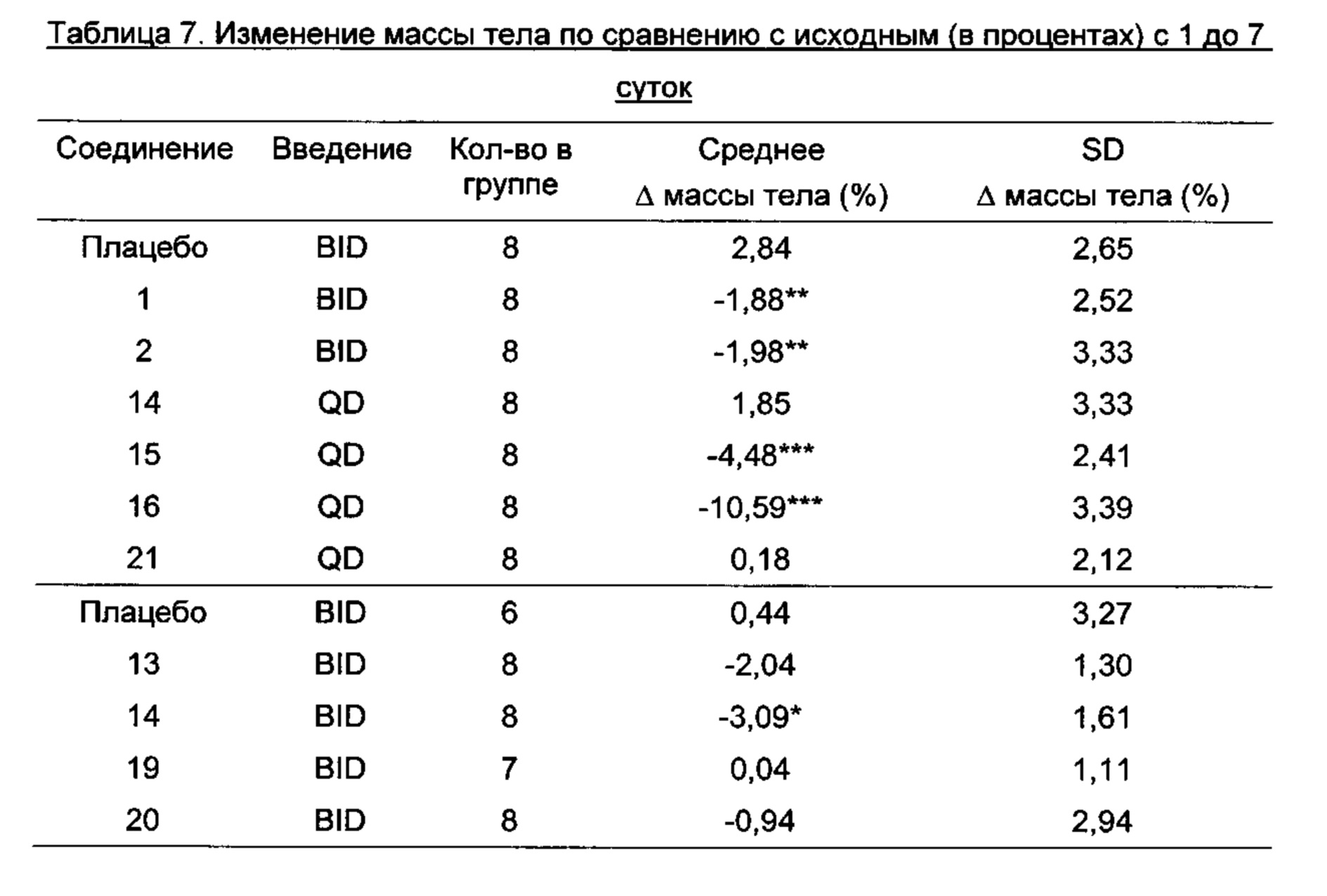
*р<0,05, **р<0,01, ***р<0,001 Однофакторный дисперсионный анализ, апостериорный критерий Даннетта, сравнение соединения с соответствующим плацебо, n=6-8
Активность in vivo, которую определяли, как потерю массы тела, была выше у производных FGF21, имеющих боковую цепь в положении 180, чем у производных, имеющих ту же боковую цепь в положении 181. Таким образом, активность in vivo коррелирует с активностью in vitro. Влияние на снижение массы тела зависит от времени полужизни в плазме. Если время полужизни в плазме является коротким, введение дважды в сутки увеличивает эффективность.
Несмотря на то, что в данном документе проиллюстрированы и описаны некоторые признаки изобретения, специалисту в области техники будут очевидны многие модификации, замены, изменения и эквиваленты. Таким образом, следует понимать, что приведенная ниже формула изобретения охватывает все подобные модификации и изменения, как входящие в объем изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110>Ново Нордиск A/С
<120>Производные FGF21 и их применения
<130>140109WO01
<160>20
<170>PatentIn version 3.5
<210>1
<211>181
<212>ПРТ
<213>HOMO SAPIENS
<400>1
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Ala Ser
180
<210>2
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>2
Met His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210>3
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>3
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210>4
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>4
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Gln Gly Arg
165 170 175
Cys Pro Ser Tyr Ala Ser
180
<210>5
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>5
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Cys Ser Tyr Ala Ser
180
<210>6
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>6
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Cys Tyr Ala Ser
180
<210>7
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>7
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Cys Ala Ser
180
<210>8
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>8
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Cys Ser
180
<210>9
<211>181
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>9
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Cys
180
<210>10
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>10
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Cys
180
<210>11
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>11
Met His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Cys
180
<210>12
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>12
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Cys Leu Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210>13
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>13
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Cys Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210>14
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>14
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Cys Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210>15
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>15
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Cys Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210>16
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>16
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Cys Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210>17
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>17
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Cys Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210>18
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>18
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Cys Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210>19
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>19
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Gln Cys Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210>20
<211>182
<212>ПРТ
<213>ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223>Искусственный белок на основе зрелого FGF21 человека
<400>20
Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala
20 25 30
His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln
35 40 45
Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile
50 55 60
Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp
65 70 75 80
Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe
85 90 95
Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala
100 105 110
His Gly Leu Pro Leu His Leu Pro Gly Gln Lys Ser Pro His Arg Asp
115 120 125
Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro
130 135 140
Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Leu Val Gly Pro Ser Gln Gly Cys
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<---