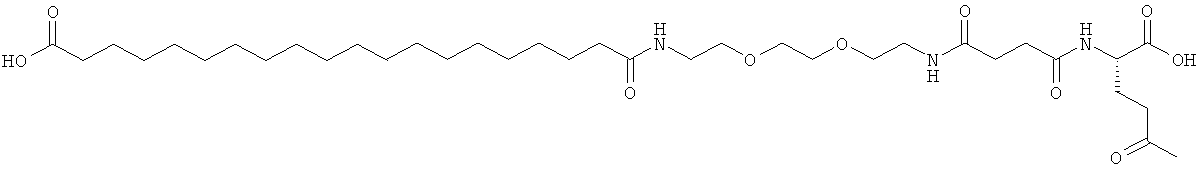
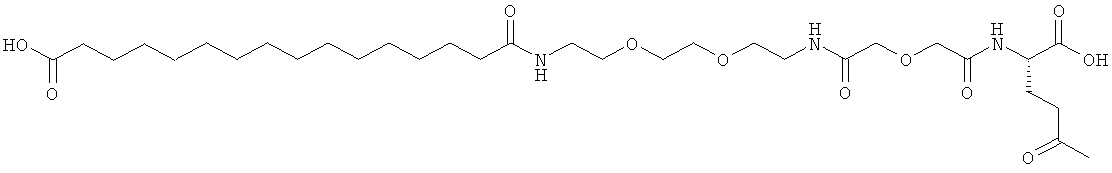
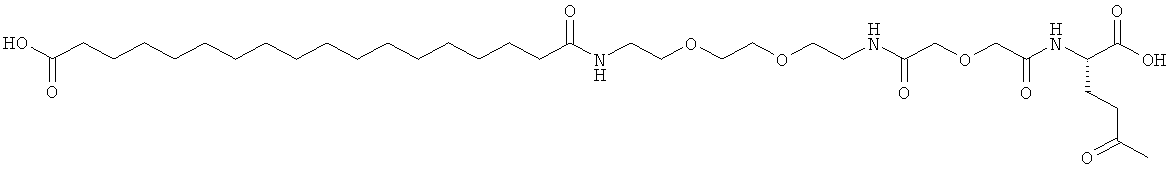
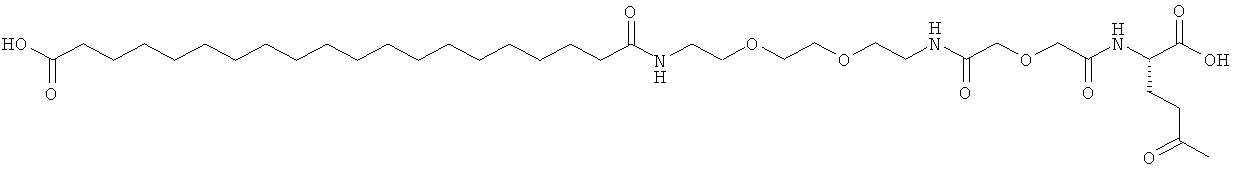
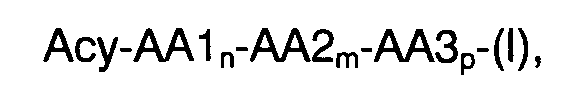Результат интеллектуальной деятельности: АНАЛОГИ ИНСУЛИНА С АЦИЛЬНОЙ И АЛКИЛЕНГЛИКОЛЕВОЙ ГРУППИРОВКОЙ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым ацилированным аналогам инсулина и их родственным аспектам.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ДАННОГО ИЗОБРЕТЕНИЯ
Инсулин представляет собой полипептидный гормон, секретируемый β-клетками поджелудочной железы. Инсулин состоит из двух полипептидных цепей, обозначенных как цепи А и В, которые связаны вместе двумя межцепьевыми дисульфидными связями. В человеческом, свином и бычьем инсулине цепи А и В содержат 21 и 30 аминокислотных остатков соответственно. Однако от вида к виду существуют вариации среди аминокислотных остатков, присутствующих в различных положениях в двух цепях. Широко распространенное применение генной инженерии дало возможность получения аналогов природных инсулинов путем замены одного или более чем одного аминокислотного остатка.
Инсулин применяют для лечения диабета и связанных с ним заболеваний или являющихся его результатом. Инсулин является незаменимым при поддержании нормальной метаболической регуляции. Обычно инсулин вводят путем инъекций. К сожалению, многие диабетики неохотно принимают интенсивную терапию вследствие дискомфорта, связанного с многочисленными инъекциями, необходимыми для поддержания строгого контроля уровней глюкозы. При пероральном введении инсулин быстро разлагается в желудочно-кишечном тракте и не всасывается в кровоток. Поэтому исследованы альтернативные пути введения инсулина, такие как пероральный, ректальный, чрескожный и назальный пути. До сих пор, однако, эти пути введения не привели в результате к достаточно эффективному всасыванию инсулина.
За десятилетия стали доступны как препараты инсулина длительного действия, так и препараты инсулина быстрого действия, и многие пациенты принимают 2-4 инъекции в сутки. В последние десятилетия оказалось, что для пациента-диабетика крайне важно поддерживать строгий контроль уровня глюкозы в крови.
В Международной патентной заявке под номером публикации WO 2007/096431, которая была опубликована 30 августа 2007 (Novo Nordisk A/S), описаны инсулины, имеющие сложную боковую цепь без алкиленгликолевых группировок. В Международной патентной заявке под номером публикации WO 2006/082205 (Novo Nordisk A/S) описаны инсулины, имеющие сложную боковую цепь, соединенную с аминокислотой в B цепи. Согласно п.1, US 6444641 В1 относится к аналогу инсулина, ацилированному жирной кислотой, включающему аналог инсулина, к которому жирная ацильная цепь присоединена амидной связью, где изоэлектрическая точка этого жирного аналога инсулина выше, чем изоэлектрическая точка инсулина. Согласно п.1, WO 2006/082205 (Novo Nordisk A/S) относится к производным инсулина, имеющим боковую цепь, присоединенную либо к α-аминогруппе N-концевого аминокислотного остатка В цепи, либо к ε-аминогруппе остатка Lys, присутствующего в B цепи исходной молекулы инсулина. Pharm. Res. 21. (2004), 1498-1504, относится к продлению действия инсулина детермир.
ОПРЕДЕЛЕНИЯ
В данной заявке термин инсулин охватывает как природные инсулины, например человеческий инсулин, так и аналоги инсулина.
В данной заявке термин аминокислотный остаток охватывает аминокислоту, в которой удален атом водорода из аминогруппы, и/или гидроксигруппа удалена из карбоксигруппы, и/или атом водорода удален из меркаптогруппы. Неточно аминокислотный остаток может быть обозначен как аминокислота.
В данной заявке термин пептидный остаток охватывает пептид, в котором удален атом водорода из аминогруппы, и/или гидроксигруппа удалена из карбоксигруппы, и/или атом водорода удален из меркаптогруппы. Неточно пептидный остаток может быть обозначен как пептид.
В данной заявке термин аналог инсулина охватывает полипептид, который имеет молекулярную структуру, которая формально может быть выведена из структуры природного инсулина, например человеческого инсулина, путем делетирования и/или замены (замещения) одного или более чем одного аминокислотного остатка, встречающегося в природном инсулине, и путем добавления одного или более чем одного аминокислотного остатка к аминокислотному остатку А21. Предпочтительно добавленные и/или замененные аминокислотные остатки представляют собой кодируемые аминокислотные остатки. Например, цепь А может быть удлинена с ее С-конца, например, на 1, 2, 3 или 4 аминокислотных остатка (по сравнению с человеческим инсулином), положения которых обозначены А22, А23, А24 и А25 соответственно. Даже, несмотря на то что аналог инсулина имеет удлинение в положении А21/А22, в этом аналоге инсулина могут находиться делеции в других положениях. Так же, как и в человеческом инсулине, в аналоге инсулина по данному изобретению аминокислотный остаток А21 соединен с остатком Cys в положении 20, где этот остаток Cys участвует в образовании межцепьевой дисульфидной связи. В данной заявке также термин исходный инсулин или исходный аналог инсулина используют для аналога инсулина. В основном термин "исходный" используют при дифференциации от аналога инсулина, несущего боковую цепь, которая, например, может быть введена химическим путем в результате ацилирования.
В данной заявке термины, такие как А1, А2, A3 и т.д., указывают на положение 1, 2 и 3, соответственно, в А цепи инсулина (отсчитываемое от N-конца). Подобным образом, термины, такие как В1, В2, В3 и т.д., указывают на положение 1, 2 и 3, соответственно, в B цепи инсулина (отсчитываемое от N-конца). Используя однобуквенные коды аминокислот, термины, такие как А21А, A21G и A21Q, означают, что аминокислота в положении А21 представляет собой А, G и Q, соответственно. Используя трехбуквенные коды для аминокислот, соответствующие выражения представляют собой AlaA21, GlyA21 и GlnA21, соответственно.
В данной заявке термины, такие как desB29 и desB30, указывают на аналог инсулина, в котором отсутствует аминокислотный остаток В29 или В30, соответственно.
Нумерация положений в аналогах инсулина в А и В цепях проведена таким образом, что исходное соединение представляет собой человеческий инсулин с нумерацией, используемой для него.
В данной заявке выражение "кодируемый" в связи с терминами, такими как аминокислота, аминокислотный остаток, пептид или пептидный остаток, используют для указания аминокислоты, аминокислотного остатка, пептида или пептидного остатка, который может кодироваться триплетом ("кодоном") нуклеотидов, как принято генной инженерией.
В данной заявке термин мутация охватывает любое изменение в аминокислотной последовательности (замены и инсерции кодируемыми аминокислотами, а также делеции).
Под инсулином быстрого действия или болюсным инсулином подразумевают инсулин, обладающий быстрым началом действия, подобным или более быстрым, чем у нормального человеческого инсулина, и/или продолжительностью действия, которая подобна или является только немного более длительной, чем у нормального человеческого инсулина.
Под инсулином пролонгированного действия или базальным инсулином подразумевают инсулин, обладающий более длительной продолжительностью действия, чем обычный или нормальный человеческий инсулин.
Под высокой физической стабильностью подразумевают тенденцию к фибрилляции, составляющей менее 50% от таковой человеческого инсулина. Фибрилляция может быть описана лаг-периодом перед тем, как инициировано образование фибрилл при данных условиях.
Полипептид со сродством к рецептору инсулина и к рецептору IGF-1 представляет собой полипептид, который способен к взаимодействию с рецептором инсулина и с рецептором человеческого IGF-1 в соответствующем анализе связывания. Такие анализы рецепторов хорошо известны в данной области техники и дополнительно описаны в примерах. Ацилированные аналоги инсулина по данному изобретению не должны связываться с рецептором IGF-1 или должны обладать достаточно низким сродством к указанному рецептору. Точнее, ацилированные аналоги инсулина по данному изобретению должны обладать сродством по отношению к рецептору IGF-1 по существу такой же или меньшей величины, чем человеческий инсулин.
Для удобства далее следуют названия аминокислот обычными трехбуквенными кодами или однобуквенными кодами в скобках: Глицин (Gly или G), пролин (Pro или Р), аланин (Ala или А), валин (Val или V), лейцин (Leu или L), изолейцин (Ile или I), метионин (Met или М), цистеин (Cys или С), фенилаланин (Phe или F), тирозин (Tyr или Y), триптофан (Trp или W), гистидин (His или Н), лизин (Lys или K), аргинин (Arg или R), глутамин (Gln или Q), аспарагин (Asn или N), глутаминовая кислота (Glu или Е), аспарагиновая кислота (Asp или D), серин (Ser или S) и треонин (Thr или Т). Если вследствие опечаток существуют отклонения от общепринято используемых кодов, применяют общепринято используемые коды. Аминокислоты, присутствующие в инсулинах по данному изобретению, предпочтительно представляют собой аминокислоты, которые могут кодироваться нуклеиновой кислотой. Аминокислоты, такие как Glu и Asp, могут находиться в α, γ, L или D форме.
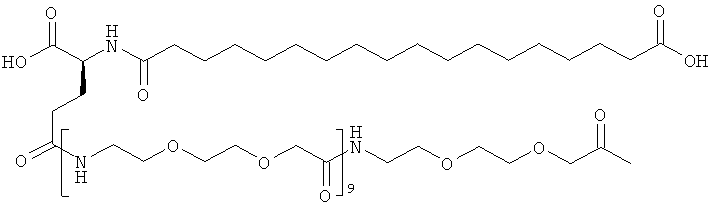
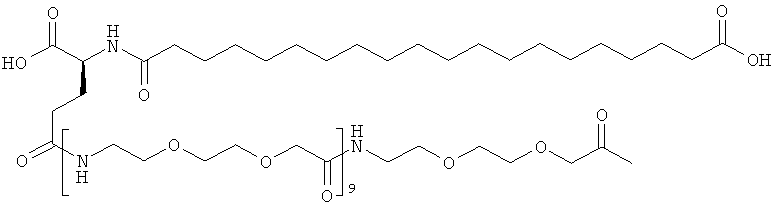
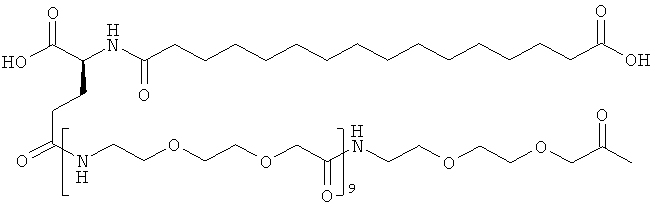
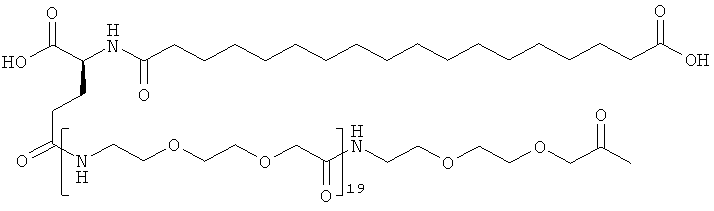
Приведенные ниже сокращения использованы в описании и в примерах: Да представляет собой дальтон (молекулярная масса), кДа представляет собой килодальтон (=1000 Да), Mw представляет собой молекулярную массу, OSu представляет собой 1-сукцинимидилокси = 2,5-диоксопирролидин-1-илокси, КТ представляет собой комнатную температуру, SA представляет собой синапиновую кислоту, и Su представляет собой 1-сукцинимидил = 2,5-диоксопирролидин-1-ил, ДХМ представляет собой дихлорметан, ДИЭА (и ДИПЭА) представляет собой N,N-диизопропилэтиламин, TSTU представляет собой N,N,N',N'-тетраметил-O-(N-сукцинимидил)урония тетрафторборат, Трис представляет собой трис-(гидроксиметил)аминометан, ОК представляет собой объем колонки, NMP представляет собой N-метилпирролидин-2-он, OTBU представляет собой трет-бутокси, OEG представляет собой аминокислоту 8-амино-3,6-диоксаоктановую кислоту, ЧСА представляет собой человеческий сывороточный альбумин, TNBS представляет собой 2,4,6-тринитробензолсульфоновую кислоту, НОВТ (или HOBt) представляет собой 1-гидроксибензотриазол, HOAt представляет собой 1-гидрокси-7-азабензотриазол, NaOH представляет собой гидроксид натрия, ДМФ представляет собой N,N-диметилформамид, ТГФ представляет собой тетрагидрофуран, ТФУ представляет собой трифторуксусную кислоту, ммоль представляет собой миллимоль, Fmoc представляет собой флуорен-9-илметоксикарбонил, OEG представляет собой 8-амино-3,6-диоксаоктановую кислоту (или ее остаток), gGlu (здесь также обозначен γGlu) представляет собой гамма-глутаминовую кислоту, и в примере 48 для удобства приведенные ниже примечания использованы для обозначения последовательности ацильных группировок инсулинов по изобретению и по предшествующему уровню техники:
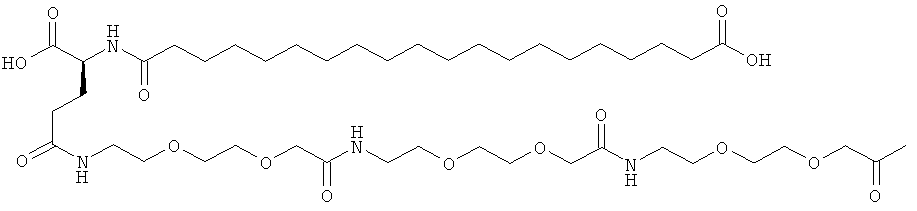
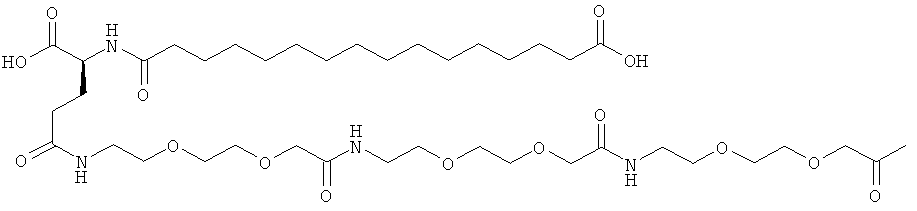
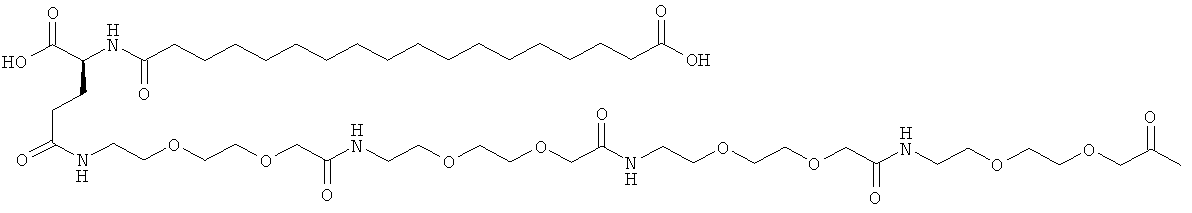
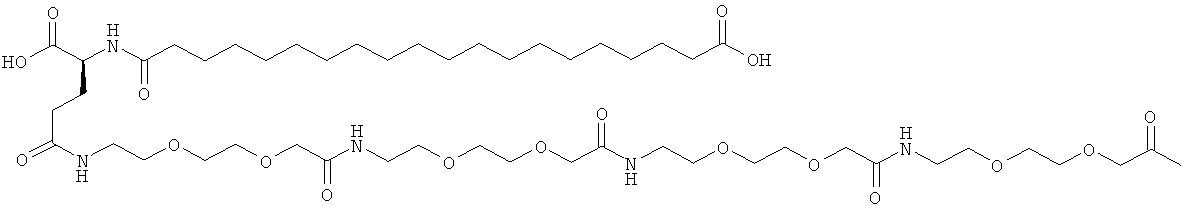
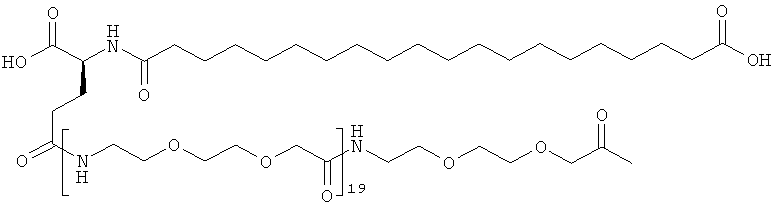
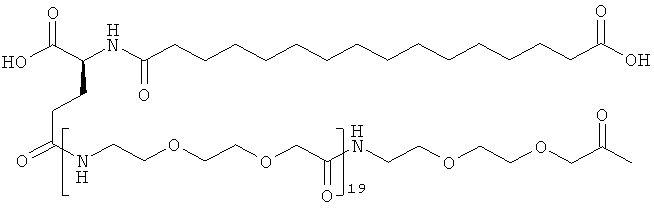
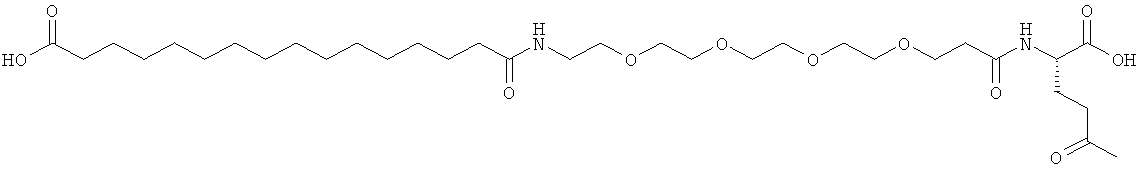
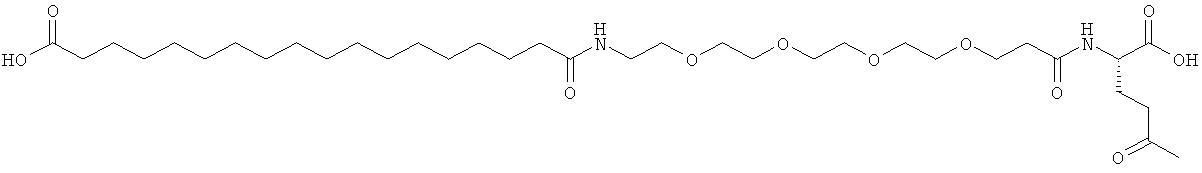
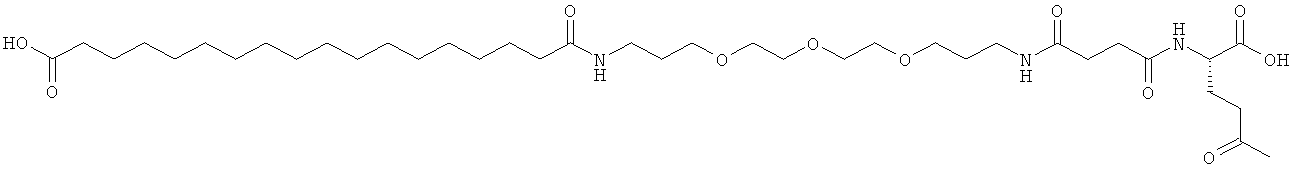
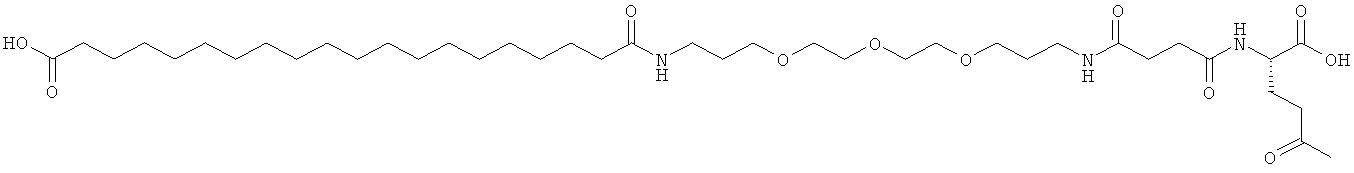
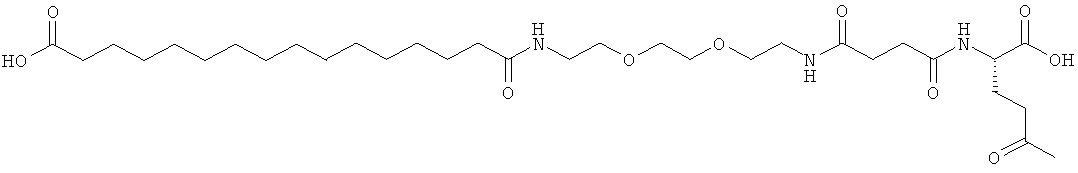
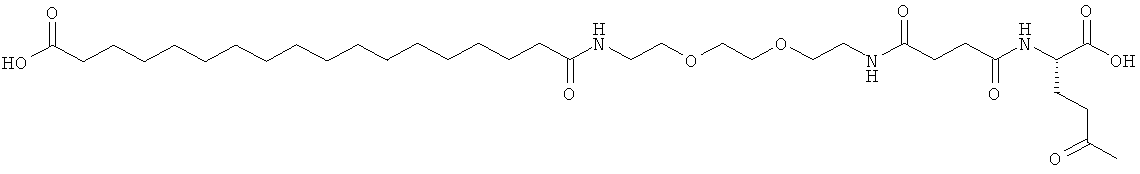
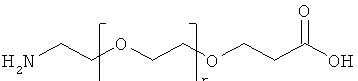
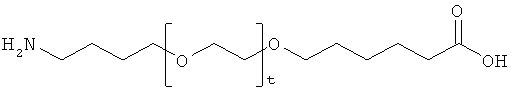
С18 представляет собой октадекандиоил, С20 представляет собой эйкозандиоил, gGlu представляет собой гамма-глутаминовую кислоту, PEG3 представляет собой 3-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)пропионовую кислоту, PEG5 представляет собой 3-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)этокси]-этокси}пропионовую кислоту и PEG7 представляет собой 3-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)этокси]этокси}этокси)этокси]пропионовую кислоту (полные структуры/последовательности можно найти в примерах).
ЗАДАЧИ ДАННОГО ИЗОБРЕТЕНИЯ
Задача данного изобретения состоит в преодолении или уменьшении по меньшей мере одного из недостатков предшествующего уровня техники или в разработке полезной альтернативы.
Одна из задач данного изобретения состоит в предоставлении производных инсулина, которые обладают хорошей биодоступностью.
Другая задача данного изобретения состоит в предоставлении производных инсулина, которые полезны в качестве инсулинов быстрого действия.
Другая задача данного изобретения состоит в предоставлении производных инсулина, которые можно вводить легочным путем.
Другая задача данного изобретения состоит в предоставлении производных инсулина, которые обладают пролонгированным профилем действия.
Другая задача данного изобретения состоит в предоставлении производных инсулина, которые полезны в качестве базальных инсулинов.
Другая задача данного изобретения состоит в предоставлении производных инсулина, которые обладают высоким связывающим сродством с рецепторами инсулина.
Другая задача данного изобретения состоит в улучшении времени полужизни in vivo инсулинов.
Другая задача данного изобретения состоит в предоставлении производных инсулина, обладающих более низкой склонностью вызывать гипогликемические состояния, чем человеческий инсулин.
Другая задача данного изобретения состоит в нахождении инсулинов, обладающих удовлетворительной физической стабильностью, в частности, после хранения в течение 2 лет.
Другой аспект данного изобретения состоит в нахождении инсулинов, обладающих удовлетворительной химической стабильностью, в частности, после хранения в течение 2 лет.
Другой аспект данного изобретения состоит в нахождении инсулинов, обладающих удовлетворительной протеолитической стабильностью, в частности, после хранения в течение 2 лет.
Другой аспект данного изобретения состоит в нахождении инсулинов, обладающих удовлетворительной растворимостью.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ДАННОГО ИЗОБРЕТЕНИЯ
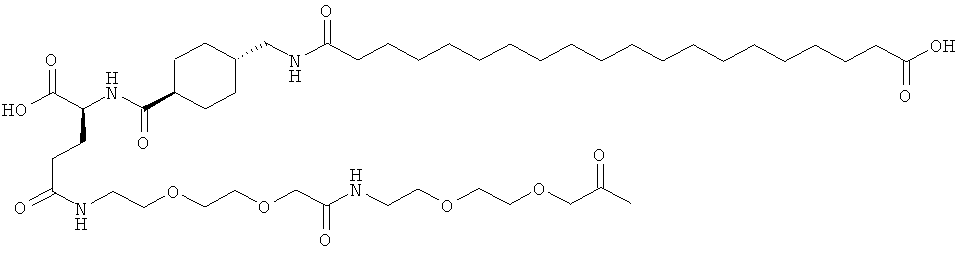
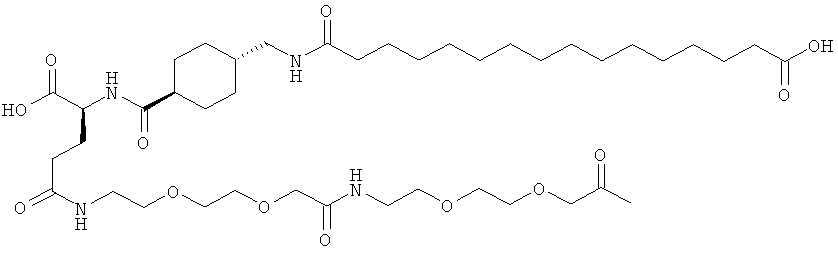
Кратко, данное изобретение относится к ацилированному аналогу инсулина, где этот аналог инсулина содержит остаток лизина, соединенный с С-концом аминокислотного остатка А21, или пептидный остаток из аминокислотных остатков в количестве вплоть до 4, содержащий остаток лизина, где этот пептидный остаток соединен с С-концом аминокислотного остатка А21, характеризующемуся тем, что ацильная группировка, включающая алкиленгликолевую группировку, присоединена к остатку лизина в положении А22 или присоединена к остатку лизина, присутствующему в пептидном остатке, присоединенном к С-концу аминокислотного остатка А21. Следовательно, аналог инсулина содержит аминокислоту в положении А22.
Неожиданно обнаружили, что инсулины по изобретению (ацилированные аналоги инсулина, содержащие одну или более чем одну алкиленгликолевую группировку) обладают более высоким связывающим сродством к рецепторам инсулина, чем подобные ацилированные аналоги инсулина без алкиленгликолевых группировок, при измерении в анализах связывания рецептора инсулина, проводимых в присутствии высоких концентраций ЧСА (человеческого сывороточного альбумина), например 4,5% ЧСА.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ФОРМ ОСУЩЕСТВЛЕНИЯ
Удивительно, что ацилированные аналоги инсулина по данному изобретению проявляют хорошую биодоступность и высокое связывающее сродство с рецептором инсулина в присутствии высоких концентраций ЧСА.
Аналог инсулина, присутствующий в ацилированном аналоге инсулина согласно данному изобретению, может быть формально проиллюстрирован как человеческий инсулин, который имеет один аминокислотный остаток, соединенный с С-концом аминокислотного остатка в положении А21, или как человеческий инсулин, который имеет пептидный остаток из аминокислотных остатков в количестве вплоть до 4, соединенный с С-концом аминокислотного остатка в положении А21 и, может быть, где один или более чем один из аминокислотных остатков в положениях А1-А21 и В1-В30 делегирован или заменен другим аминокислотным остатком. Что касается номенклатуры, аминокислотный остаток, соединенный с аминокислотным остатком в положении А21, находится в положении А22. Подобным образом, аминокислотные остатки, присутствующие в пептидном остатке, соединенном с аминокислотным остатком в положении А21, находятся в положениях А22, А23, А24 или А25.
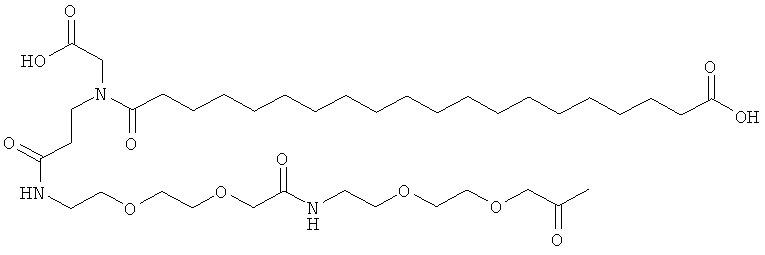
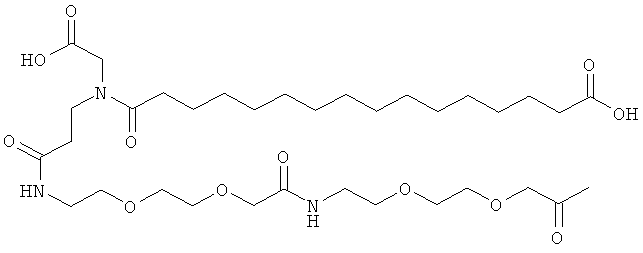
Ацилированные аналоги инсулина по данному изобретению можно формально сконструировать из аналога инсулина и ацильной группировки, содержащей алкиленгликоль, имеющей общую формулу (I): Acy-AA1n-AA2m-AA3p-, где Acy, АА1, АА2, АА3, n, m и p являются такими, как определено здесь, например, путем формального удаления атома водорода из аминогруппы в аналоге инсулина и присоединения к нему боковой цепи формулы (I).
В ацилированных аналогах инсулина по данному изобретению ацильная группировка, содержащая алкиленгликоль, формулы (I) соединена с остатком лизина в положении, которое находится на С-концевой стороне или на С-конце аминокислотного остатка А21. Например, ацильная группировка, содержащая алкиленгликоль, формулы (I) может быть соединена с остатком лизина в положении А22. Если ацильная группировка, содержащая алкиленгликоль, формулы (I) соединена с пептидным остатком, который соединен с аминокислотным остатком в положении А21, ацильная группировка, содержащая алкиленгликоль, формулы (I) соединена с остатком лизина в любом из положений А22, А23, А24 или А25.
Как упомянуто здесь, ацильная группировка, присутствующая в формуле Acy-AA1n-AA2m-AA3p-, образована от жирной кислоты или жирной дикислоты.
В данной заявке термин "жирная кислота" охватывает нормальные или разветвленные алифатические карбоновые кислоты, имеющие по меньшей мере два атома углерода и являющиеся насыщенными или ненасыщенными. Не ограничивающими примерами жирных кислот являются миристиновая кислота, пальмитиновая кислота и стеариновая кислота.
В данной заявке термин "жирная дикислота" охватывает нормальные или разветвленные алифатические дикарбоновые кислоты, имеющие по меньшей мере два атома углерода и являющиеся насыщенными или ненасыщенными. Не ограничивающими примерами жирных дикислот являются янтарная кислота, гександикислота, октандикислота, декандикислота, додекандикислота, тетрадекандикислота, гексадекандикислота, гептадекандикислота, октадекандикислота и эйкозандикислота.
Нейтральный циклический аминокислотный остаток, обозначенный АА1, представляет собой аминокислоту, содержащую насыщенное 6-членное карбоциклическое кольцо, необязательно содержащее гетероатом азота, и предпочтительно это кольцо представляет собой циклогексановое кольцо или пиперидиновое кольцо. Предпочтительно молекулярная масса этой нейтральной циклической аминокислоты находится в интервале от примерно 100 до примерно 200 Да.
Кислый аминокислотный остаток, обозначенный АА2, представляет собой аминокислоту с молекулярной массой вплоть до примерно 200 Да, содержащую две группировки карбоновой кислоты и одну первичную или вторичную аминогруппу.
Нейтральный алкиленгликольсодержащий аминокислотный остаток, обозначенный АА3, представляет собой алкиленгликолевую группировку, может быть, олиго- или полиалкиленгликолевую группировку, содержащую функциональную группу карбоновой кислоты на одном конце и функциональную аминогруппу на другом конце.
В данной заявке термин алкиленгликолевая группировка охватывает олиго- и полиалкиленгликолевые группировки, а также моноалкиленгликолевые группировки. Полиалкиленгликоли включают цепи на основе полиэтиленгликоля на основе полипропиленгликоля и на основе полибутиленгликоля, то есть цепи, которые основаны на повторяющемся звене -CH2CH2O-, -CH2CH2CH2O- или CH2CH2CH2CH2O-. Алкиленгликолевая группировка может быть как монодисперсной (с хорошо определенной длиной/молекулярной массой), так и полидисперсной (с менее хорошо определенной длиной/средней молекулярной массой). Моноалкиленгликолевые группировки включают -OCH2CH2O-, -OCH2CH2CH2O- или -OCH2CH2CH2CH2O-содержащие различные группы на каждом конце.
Как упомянуто здесь, порядок, в котором АА1, АА2 и АА3 встречаются в ацильной группировке формулы (I) (Acy-AA1n-AA2m-AA3p-), может быть независимо взаимозаменяемым. Следовательно, формула Acy-AA1n-AA2m-AA3p- также охватывает группировки, такие как, например, формулы Acy-AA2m-AA1n-AA3p- и формулы Acy-AA3p-AA2m-AA1n-, где Acy, АА1, АА2, АА3, n, m и p являются такими, как определено здесь.
Как упомянуто здесь, связи между группировками Acy, АА1, АА2 и/или АА3 представляют собой амидные связи (-CONH-, где -СО- имеет происхождение от одной из группировок Acy, АА1, АА2 и АА3, a -NH- имеет происхождение от одной из группировок АА1, АА2 и АА3).
ПРЕДПОЧТИТЕЛЬНЫЕ ФОРМЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В форме осуществления исходный инсулин по изобретению может, кроме лизина в положении А22 и кроме любого пептидного остатка из аминокислот в количестве вплоть до 4, соединенного с С-концом аминокислотного остатка А21, и кроме мутаций B29R и/или desB30, включать одну или более чем одну из приведенных ниже мутаций. Здесь сначала указано положение в А или В цепи, а затем возможный аминокислотный остаток(остатки) приведен в виде однобуквенного кода. В одной форме осуществления присутствует 5 мутаций, в другой форме осуществления присутствует 4 мутации, в другой форме осуществления присутствует 3 мутации, в другой форме осуществления присутствует 2 мутации, в другой форме осуществления присутствует 1 мутация и в другой форме осуществления мутации отсутствуют, кроме лизина в положении А22 и кроме любого пептидного остатка из аминокислот в количестве вплоть до 4, соединенного с С-концом аминокислотного остатка А21, и кроме мутаций B29R и/или desB30:
А4: А или Q.
А5: L.
А8: R, N, Q, Е, Н, L или W.
А9: R или L.
А14: Е или О.
А15: А или Т.
А16: М.
А17: D или F.
А18: R, L, I, D или V.
А21: G или А.
В3: A, R, H, I, L, M, F, W, Y, S или Т.
В10: D или Е.
В25: Y, Н или desB25.
В26: Q, Е, S или desB26.
В27: Н, L, M, W или Y.
В28: D или Е.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А4А или A4Q.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A5L.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации A8L, A8N, A8Q, А8Е, А8Н, A8L или A8W. В Другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А8Н.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A9R или A9L. В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A9L.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А14Е или A14D.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А15А или А15Т.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А16М.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A17D или A17F.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации A18R, A18L, А181, A18D или A18V. В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A18L или A18V. В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А181.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A21G или А21А.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации В3А, B3R, В3Н, B3I, B3L, В3М, B3F, B3W, B3Y, B3S или В3Т.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию B10D или В10Е.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации B25Y, В25Н или desB25.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации B26Q, В26Е, B26S или desB26.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации В27Н, B27L, В27М, B27W или B27Y. В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию B27W или B27Y.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию B28D или В28Е.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации A21Q, B1Q, desB1, B3Q, B3S, В3Т, B13Q или desB27.
Не ограничивающие конкретные примеры исходных аналогов инсулина, которые могут присутствовать в ацилированных аналогах инсулина по данному изобретению, включают приведенные ниже, где указаны отклонения от человеческого инсулина:
|
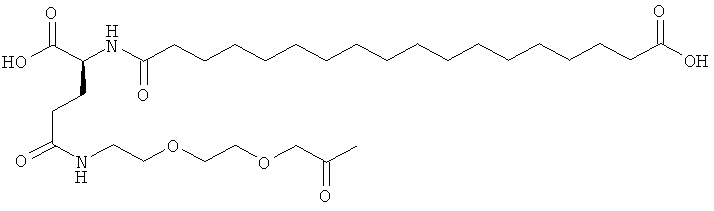
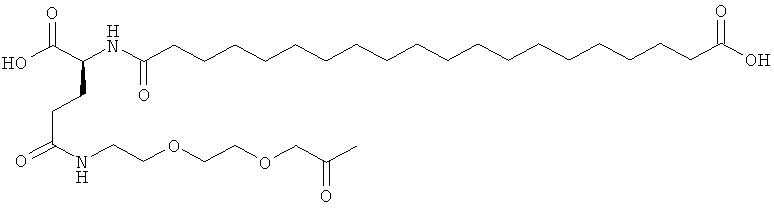
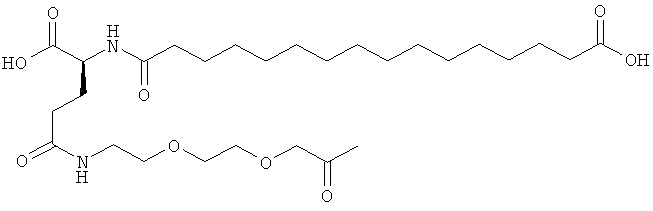
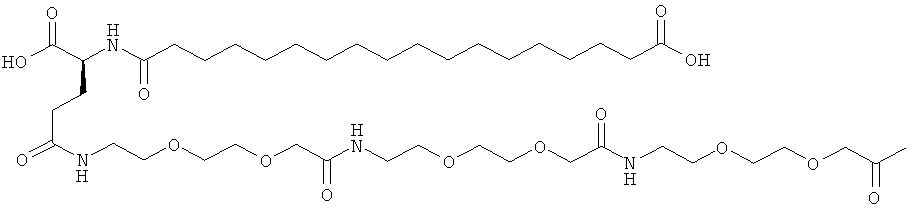
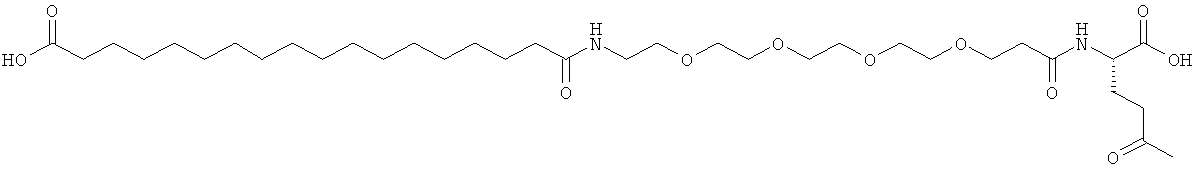
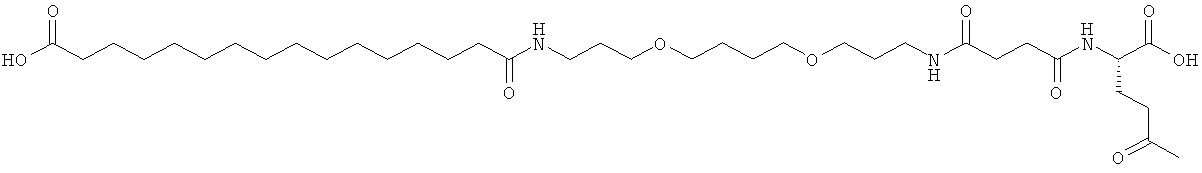
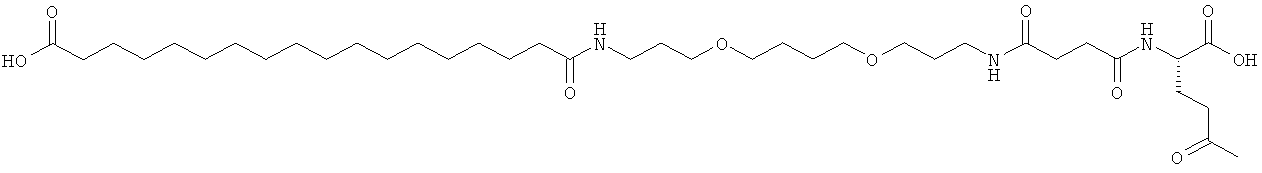
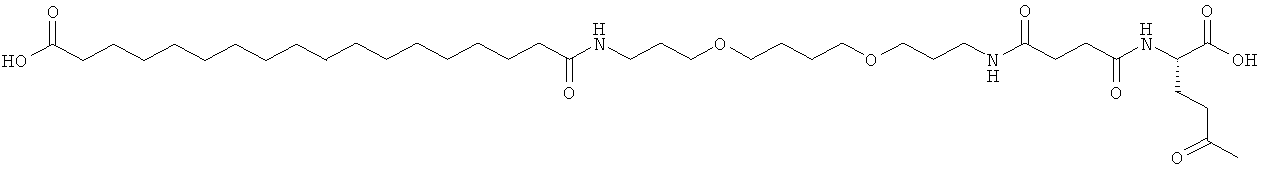
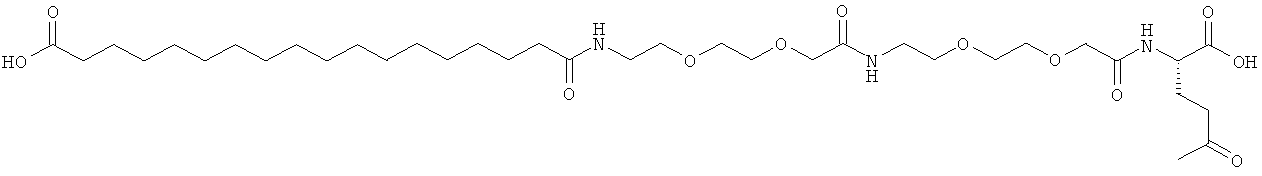
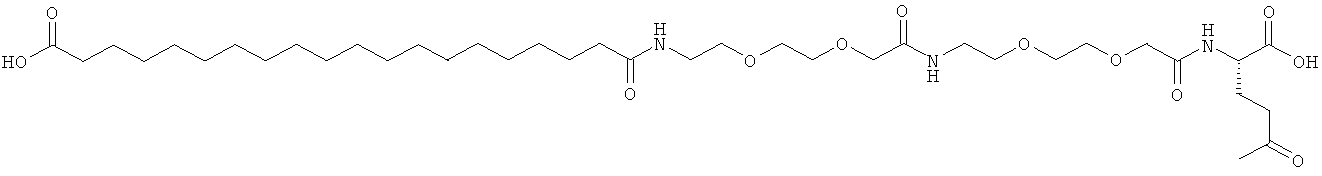
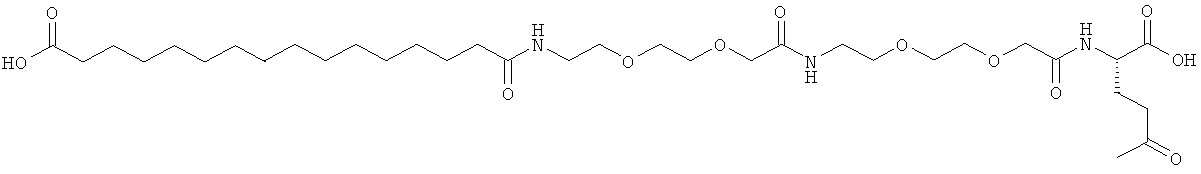
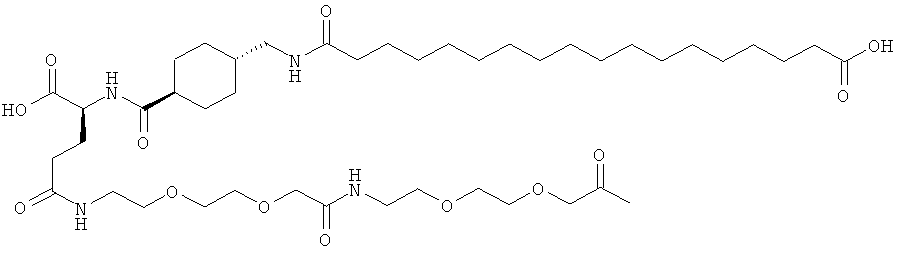
He ограничивающие конкретные примеры ацильных группировок формулы Acy-AA1n-AA2m-AA3p-, которые могут присутствовать в ацилированных аналогах инсулина по данному изобретению, приведены ниже:
|
|
|
|
В одной форме осуществления группировка, обозначенная АА3, выбрана среди приведенных ниже соединений, в которых атом азота удален из аминогруппы и гидроксигруппа удалена из карбоксигруппы:
|
Любой из вышеуказанных не ограничивающих конкретных примеров ацильных группировок формулы Acy-AA1n-AA2m-AA3p- может быть присоединен к эпсилон-аминогруппе остатка лизина, присутствующего в любом из вышеуказанных не ограничивающих конкретных примеров аналогов инсулина с получением посредством этого дополнительных конкретных примеров ацилированных аналогов инсулина по данному изобретению.
Исходные инсулины могут быть получены способом, который сам по себе известен. Например, их можно продуцировать путем экспрессии последовательности ДНК, кодирующей интересующий одноцепочечный инсулин, в подходящей клетке-хозяине с помощью хорошо известной методики, которая раскрыта, например, в ЕР 1246845. Инсулин экспрессируется в трансформированной клетке-хозяине в виде молекулы-предшественника, которую преобразуют в желаемую молекулу инсулина ферментативными и химическими способами in vitro, как раскрыто, например, в ЕР 163529 и ЕР 214826. Молекула-предшественник может экспрессироваться с N-концевым удлинением, которое позже отщепляется, как раскрыто, например, в ЕР 1246,845. Примеры N-концевых удлинений типа, пригодного в настоящем изобретении, например, раскрыты в патенте США №5395922 и в патенте ЕР №765395. Более конкретно можно сделать ссылку на WO 2006/082205, от с.37, строка 31, до с.39, строка 29.
Исходный аналог инсулина может быть преобразован в ацилированный аналог инсулина по данному изобретению путем введения желаемой группы формулы Acy-AA1n-AA2m-AA3p- в остаток лизина в аналоге инсулина. Желаемая группа формулы Acy-AA1n-AA2m-AA3p- может быть введена любым удобным способом, и многие способы таких реакций раскрыты на предшествующем уровне техники. Большие подробности видны из приведенных ниже примеров.
Ацилированные аналоги инсулина по данному изобретению могут быть представлены в форме соединений, по существу свободных от цинка, или в форме комплексов с цинком. Когда предложены цинковые комплексы ацилированных аналогов инсулина по данному изобретению, с каждым гексамером инсулина могут быть связаны два иона Zn2+, три иона Zn2+ или четыре иона Zn2+. Растворы цинковых комплексов ацилированных аналогов инсулина по данному изобретению содержат смеси таких типов.
В следующем аспекте данное изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество ацилированного аналога инсулина по данному изобретению вместе с фармацевтически приемлемым носителем, которую можно применять для лечения диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию, у пациентов, нуждающихся в таком лечении. Ацилированный аналог инсулина по данному изобретению можно применять для получения фармацевтической композиции для применения при лечении диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию. Такие композиции получают способом, который сам по себе известен.
В следующем аспекте данного изобретения предложена фармацевтическая композиция для лечения диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию, у пациента, нуждающегося в таком лечении, содержащая терапевтически эффективное количество ацилированных аналогов инсулина по данному изобретению в смеси с инсулином или аналогом инсулина, который обладает быстрым началом действия, вместе с фармацевтически приемлемыми носителями и добавками.
В следующем аспекте данное изобретение относится к легочному применению для лечения диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию, у пациента, нуждающегося в таком лечении, включающему терапевтически эффективное количество ацилированных аналогов инсулина по данному изобретению, может быть, в смеси с инсулином или аналогом инсулина, который обладает быстрым началом действия, вместе с фармацевтически приемлемыми носителями и добавками.
В одном аспекте в данном изобретении предложена фармацевтическая композиция, представляющая собой смесь ацилированного аналога инсулина по данному изобретению и аналога инсулина быстрого действия, выбранного из группы, состоящей из AspB28 человеческого инсулина; LysB28 ProB29 человеческого инсулина и LysB3 GluB29 человеческого инсулина.
Ацилированные аналоги инсулина по данному изобретению и аналог инсулина быстрого действия могут быть смешаны в соотношении примерно 90/10%; примерно 70/30% или примерно 50/50%.
В следующем аспекте изобретения предложен способ лечения диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию, у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества ацилированных аналогов инсулина по данному изобретению вместе с фармацевтически приемлемым носителем и фармацевтически приемлемыми добавками.
В следующем аспекте изобретения предложен способ лечения диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию, у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества ацилированных аналогов инсулина по данному изобретению в смеси с инсулином или аналогом инсулина, который обладает быстрым началом действия, вместе с фармацевтически приемлемым носителем и фармацевтически приемлемыми добавками.
В следующем аспекте изобретения предложена фармацевтическая композиция для лечения диабета у пациента, нуждающегося в таком лечении, содержащая терапевтически эффективное количество ацилированных аналогов инсулина по данному изобретению, может быть, в смеси с инсулином или аналогом инсулина, который обладает быстрым началом действия, вместе с фармацевтически приемлемым носителем.
В следующем аспекте изобретения предложена фармацевтическая композиция согласно изобретению, предназначенная для легочного введения.
В следующем аспекте изобретения предложен способ лечения диабета у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества ацилированных аналогов инсулина по п.1 вместе с фармацевтически приемлемым носителем.
В следующем аспекте изобретения предложен способ лечения диабета у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества ацилированных аналогов инсулина по п.1 в смеси с инсулином или аналогом инсулина, который обладает быстрым началом действия, вместе с фармацевтически приемлемым носителем.
В следующем аспекте настоящее изобретение относится к ацилированным инсулинам по данному изобретению, которые обладают связывающим сродством к рецептору инсулина, как описано здесь, измеренным в присутствии ЧСА (например, в присутствии 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4% или 4,5% ЧСА), которое составляет >3%, более предпочтительно >5%, более предпочтительно >10%, более предпочтительно >15%, более предпочтительно >20%, более предпочтительно >30%, более предпочтительно >40%, более предпочтительно >50%, более предпочтительно >60% при измерении относительно человеческого инсулина.
В следующем аспекте настоящее изобретение относится к ацилированным аналогам инсулина по данному изобретению, которые обладают общей гидрофобностью, которая по существу подобна таковой человеческого инсулина.
В следующем аспекте ацилированные аналоги инсулина по данному изобретению имеют индекс гидрофобности, k'rel, который находится в интервале от примерно 0,02 до примерно 10, от примерно 0,1 до примерно 5; от примерно 0,5 до примерно 5; от примерно 0,2 до примерно 2; от примерно 0,2 до примерно 1; от примерно 0,1 до примерно 2 или от примерно 0,5 до примерно 2. Гидрофобность (индекс гидрофобности) ацилированных аналогов инсулина по данному изобретению относительно человеческого инсулина, k'rel, измеряли на колонке ВЭЖХ LiChrosorb RP18 (5 мкм, 250×4 мм) путем изократического элюирования при 40°C, используя смеси А) 0,1 М натрийфосфатного буфера, рН 7,3, содержащего 10% ацетонитрил, и Б) 50% ацетонитрила в воде в качестве элюентов. Мониторинг элюирования проводили путем слежения за поглощением УФ элюата при 214 нм. Время свободного объема, t0, находили путем впрыскивания 0,1 мМ нитрата натрия. Время удерживания для человеческого инсулина, thuman, доводили примерно до 2t0 путем варьирования соотношения между растворами А И Б. k'rel=(tderivative-t0)/(thuman-t0).
В другом аспекте изобретение относится к фармацевтической композиции, содержащей ацилированный аналог инсулина по данному изобретению, который растворим при физиологических значениях рН.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей ацилированный аналог инсулина по данному изобретению, который растворим при значениях рН в интервале от примерно 6,5 до примерно 8,5.
В другом аспекте изобретение относится к фармацевтической композиции с пролонгированным профилем действия, которая содержит ацилированный аналог инсулина по данному изобретению.
В другом аспекте изобретение относится к инсулинам с действием, избирательным или предпочтительным для печени.
В другом аспекте изобретение относится к фармацевтической композиции, которая представляет собой раствор, содержащий от примерно 120 нмоль/мл до примерно 2400 нмоль/мл, от примерно 400 нмоль/мл до примерно 2400 нмоль/мл, от примерно 400 нмоль/мл до примерно 1200 нмоль/мл, от примерно 600 нмоль/мл до примерно 2400 нмоль/мл или от примерно 600 нмоль/мл до примерно 1200 нмоль/мл ацилированных аналогов инсулина по данному изобретению или смеси ацилированных аналогов инсулина по данному изобретению вместе с аналогом инсулина быстрого действия.
ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ПО ДАННОМУ ИЗОБРЕТЕНИЮ
Путь введения может представлять собой любой путь, который эффективно транспортирует соединение по данному изобретению в желаемое или подходящее место в организме, такой как парентеральный, например подкожный, внутримышечный или внутривенный. Альтернативно соединение по данному изобретению можно вводить пероральным, легочным или назальным путем.
Для парентерального введения препарат соединения по данному изобретению готовят аналогично препаратам известных инсулинов. Кроме того, для парентерального введения соединение по данному изобретению вводят аналогично с введением известных инсулинов, и врачи знакомы с этой процедурой.
Парентеральное введение можно осуществлять с помощью шприца, может быть, шприца карандашного типа. Альтернативно парентеральное введение можно осуществлять с помощью инфузионного насоса.
Инъекционные композиции соединения по данному изобретению можно готовить, используя общепринятые методики фармацевтической промышленности, которые включают соответствующее растворение и смешивание ингредиентов для получения желаемого конечного продукта. Таким образом, согласно одной методике, соединения по данному изобретению растворяют в количестве воды, которое является несколько меньшим, чем конечный объем композиции, которую нужно получить. По необходимости добавляют изотонический агент, консервант и буфер, и при необходимости доводят значение рН раствора, используя кислоту, например соляную кислоту, или основание, например водный раствор гидроксида натрия, по необходимости. Наконец, объем раствора доводят водой до получения желаемой концентрации ингредиентов.
Точнее, препарат инсулина по данному изобретению, например раствор или суспензию, можно готовить путем растворения соединения по данному изобретению в водной среде в слабокислых условиях, например, при концентрации в диапазоне от примерно 240 до примерно 1200 нмоль/мл. Водную среду делают изотонической, например хлоридом натрия или глицерином. Кроме того, водная среда может содержать ионы цинка при концентрациях вплоть до примерно 20 мкг Zn++ на единицу активности инсулина, буферы, такие как ацетат и цитрат, и консерванты, такие как мета-крезол или фенол. Значение рН раствора доводят в сторону нейтральности, не приближая его слишком близко к изоэлектрической точке соединения по данному изобретению, чтобы избежать осаждения. Значение рН конечного препарата инсулина зависит от числа зарядов, которое может быть, изменено в соединении по данному изобретению от концентрации ионов цинка, от концентрации соединения по данному изобретению и от выбранного соединения по данному изобретению. Препарат инсулина стерилизуют, например, путем стерильного фильтрования.
Препараты инсулина по данному изобретению применяют подобно применению известных препаратов инсулина.
Решение по поводу количества соединения по данному изобретению, которое нужно вводить, определения частоты введения соединения по данному изобретению и выбора соединения или соединений по данному изобретению, которые нужно вводить, может быть, вместе с другим противодиабетическим соединением, принимают при консультации с практикующим врачом, который знаком с лечением диабета.
Следовательно, данное изобретение также относится к способу лечения диабета, включающему введение эффективного количества соединения по данному изобретению пациенту, нуждающемуся в таком лечении.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Ацилированные аналоги инсулина по данному изобретению можно вводить подкожным, пероральным или легочным путем.
Для подкожного введения препараты ацилированных аналогов инсулина по данному изобретению готовят аналогично препаратам известных инсулинов. Кроме того, для подкожного введения ацилированные аналоги инсулина по данному изобретению вводят аналогично введению известных инсулинов, и, как правило, врачи знакомы с этой процедурой.
Ацилированные аналоги инсулина по данному изобретению можно вводить путем ингаляции в дозе, эффективной для повышения уровней инсулина в кровообращении и/или для снижения уровней глюкозы в кровообращении. Такое введение может быть эффективным для лечения расстройств, таких как диабет или гипергликемия. Достижение эффективных доз инсулина требует введения ингаляционной дозы в диапазоне от примерно 0,5 мкг/кг до примерно 50 мкг/кг ацилированного аналога инсулина по данному изобретению. Терапевтически эффективное количество может быть определено компетентным практикующим врачом, который должен принять во внимание такие факторы, как уровень инсулина, уровни глюкозы в крови, физическое состояние пациента, состояние легких пациента или тому подобное.
Ацилированные аналоги инсулина по данному изобретению можно доставлять путем ингаляции для достижения его медленного всасывания и/или сниженного системного клиренса. Различные ингаляционные устройства обычно обеспечивают сходную фармакокинетику при сравнении сходных размеров частиц и сходных уровней депонирования в легких.
Ацилированные аналоги инсулина по данному изобретению можно доставлять с помощью любого из разнообразных ингаляционных устройств, известных в данной области техники для введения терапевтического агента путем ингаляции. Эти устройства включают дозирующие ингаляторы, небулайзеры, генераторы сухого порошка, пульверизаторы и тому подобное. Предпочтительно ацилированные аналоги инсулина по данному изобретению доставляют с помощью ингалятора сухого порошка или пульверизатора. Существует несколько желательных признаков ингаляционного устройства для введения ацилированных аналогов инсулина по данному изобретению. Например, доставка с помощью ингаляционного устройства предпочтительно является надежной, воспроизводимой и точной. Ингаляционное устройство должно доставлять мелкие частицы аэрозолей, например менее чем примерно 10 мкм, например примерно 1-5 мкм, для хорошей пригодности для вдыхания. Некоторыми конкретными примерами имеющихся в продаже ингаляционных устройств, подходящих для практики данного изобретения, являются Циклохалер, Турбохалер™ (Astra), Ротахалер® (Glaxo), Дискус® (Glaxo), ингалятор Спирос™ (Dura), устройства, продаваемые Inhale Therapeutics, AERx™ (Aradigm), небулайзер Ультравент® (Mallinckrodt), небулайзер Аком II® (Marquest Medical Products), дозирующий ингалятор Вентолин® (Glaxo), ингалятор порошка Спинхалер® (Fisons) или тому подобное.
Как понятно специалистам в данной области техники, препарат ацилированных аналогов инсулина по данному изобретению, доставляемое количество препарата и продолжительность введения однократной дозы зависит от типа используемого ингаляционного устройства. Для некоторых аэрозольных систем доставки, таких как небулайзеры, частота введения и продолжительность времени, в течение которого активируют систему, зависит, в основном, от концентрации ацилированных аналогов инсулина в аэрозоле. Например, более короткие периоды введения можно применять при более высоких концентрациях ацилированных аналогов инсулина в растворе небулайзера. Устройства, такие как дозирующие ингаляторы, могут обеспечивать более высокие концентрации аэрозоля и могут работать в течение более коротких периодов времени для доставки желаемого количества ацилированного аналога инсулина по данному изобретению. Устройства, такие как ингаляторы порошка, доставляют активный агент до тех пор, пока данная заправка агента не будет распылена из устройства. При данном типе ингалятора количество инсулина ацилированных аналогов инсулина по данному изобретению в данном количестве порошка определяет дозу, доставляемую при однократном введении.
Размер частиц ацилированных аналогов инсулина по данному изобретению в препарате, доставляемом с помощью ингаляционного устройства, является критическим в отношении способности инсулина к попаданию в легкие, и предпочтительно в нижние дыхательные пути или альвеолы. Предпочтительно препараты ацилированных аналогов инсулина по данному изобретению готовят таким образом, чтобы по меньшей мере примерно 10% доставляемых ацилированных аналогов инсулина было депонировано в легких, предпочтительно от примерно 10 до примерно 20% или более. Частицы ацилированного аналога инсулина, доставляемого путем ингаляции, имеют размер частиц предпочтительно менее чем примерно 10 мкм, более предпочтительно в интервале от примерно 1 мкм до примерно 5 мкм. Препарат ацилированного аналога инсулина выбран таким образом, чтобы получить желаемый размер частиц в выбранном ингаляционном устройстве.
Предпочтительно для введения в виде сухого порошка ацилированный аналог инсулина по данному изобретению готовят в форме частиц с размером частиц менее чем примерно 10 мкм, предпочтительно от примерно 1 до примерно 5 мкм. Предпочтительный размер частиц эффективен для доставки в альвеолы легких пациента. Предпочтительно сухой порошок, в основном, состоит из частиц, полученных таким образом, что большинство частиц имеет размер в желаемом интервале. Предпочтительно по меньшей мере примерно 50% сухого порошка состоит из частиц, имеющих диаметр менее чем примерно 10 мкм. Такие препараты могут быть получены с помощью распылительной сушки, измельчения, микронизации или конденсации при точке превращения раствора, содержащего ацилированный аналог инсулина по данному изобретению и другие желаемые ингредиенты. Другие способы, также пригодные для образования частиц, полезных в настоящем изобретении, известны в данной области техники.
Частицы обычно отделяются от препарата сухого порошка в контейнере, а затем переносятся в легкие пациента посредством потока транспортирующего воздуха. Типично в современных ингаляторах сухого порошка сила для разрушения твердого вещества обеспечивается исключительно вдохом пациента. В другом типе ингалятора воздушный поток, создаваемый вдохом пациента, активирует лопастной двигатель, который разрушает агломераты частиц.
Препараты ацилированных аналогов инсулина по данному изобретению для введения из ингалятора сухого порошка типично включают тонкоизмельченный сухой порошок, содержащий производное, но этот порошок может также включать наполнитель, носитель, эксципиент, другую добавку или тому подобное. Добавки можно включать в препарат сухого порошка ацилированного аналога инсулина, например, для разбавления порошка, которое необходимо для доставки из ингалятора конкретного порошка, для облегчения обработки препарата, для получения предпочтительных свойств порошка для препарата, для облегчения распыления порошка из ингаляционного устройства, для стабилизации препарата (например, антиоксиданты или буферы), для обеспечения вкуса препарата или тому подобного. Предпочтительно добавка не оказывает вредного влияния на дыхательные пути пациента. Ацилированный аналог инсулина можно смешивать с добавкой на молекулярном уровне, либо твердый препарат может включать частицы ацилированного аналога инсулина, смешанные с частицами добавки или нанесенные на них в виде покрытия. Типичные добавки включают моно-, ди- и полисахариды; сахарные спирты и другие полиолы, такие как, например, лактоза, глюкоза, раффиноза, мелезитоза, лактит, мальтит, трегалоза, сахароза, маннит, крахмал или их комбинации; сурфактанты, такие как сорбиты, дифосфатидилхолин или лецитин или тому подобное. Типично добавка, такая как наполнитель, присутствует в количестве, эффективном для вышеописанной цели, часто от примерно 50% до примерно 90% масс./масс. препарата. Дополнительные агенты, известные в данной области техники для включения в препарат белка, такого как аналог белка инсулина, могут быть также включены в препарат.
Распыляемый раствор, включающий ацилированные аналоги инсулина по данному изобретению, может быть получен путем проталкивания суспензии или раствора ацилированного аналога инсулина через сопло под давлением. Размер и конфигурация сопла, прилагаемое давление и скорость подачи жидкости могут быть выбраны для достижения желаемого выхода и размера частиц. Электрораспыление может быть получено, например, с помощью электрического поля в сочетании с подачей через капилляр или сопло. Предпочтительно частицы конъюгата инсулина, доставляемые с помощью пульверизатора, имеют размер частиц менее чем примерно 10 мкм, предпочтительно в интервале от примерно 1 мкм до примерно 5 мкм.
Препараты ацилированных аналогов инсулина по данному изобретению, пригодные для применения с пульверизатором, типично включают ацилированные аналоги инсулина в водном растворе при концентрации от примерно 1 мг до примерно 500 мг ацилированного аналога инсулина на мл раствора. В зависимости от выбранного ацилированного аналога инсулина и от других факторов, известных врачу, верхний предел может быть ниже, например, 450, 400, 350, 300, 250, 200, 150, 120, 100 или 50 мг ацилированного аналога инсулина на мл раствора. Препарат может включать агенты, такие как эксципиент, буфер, изотонический агент, консервант, сурфактант и предпочтительно цинк. Препарат может также включать эксципиент или агент для стабилизации ацилированного аналога инсулина, такой как буфер, восстанавливающий агент, белок-наполнитель или углевод. Белки-наполнители, полезные при включении в препараты конъюгатов инсулина, включают альбумин, протамин или тому подобное. Типичные углеводы, полезные при включении в препараты ацилированного аналога инсулина, включают сахарозу, маннит, лактозу, трегалозу, глюкозу или тому подобное. Препарат ацилированных аналогов инсулина может также включать сурфактант, который может уменьшить или предотвратить агрегацию конъюгата инсулина, вызванную поверхностным натяжением, которое вызвано пульверизацией раствора при образовании аэрозоля. Можно использовать различные общепринятые сурфактанты, такие как эфиры полиоксиэтилена и жирных кислот и спиртов, а также эфиры полиоксиэтиленсорбита и жирных кислот. Количества, как правило, находятся в интервале между примерно 0,001 и примерно 4% масс./масс. препарата.
Фармацевтические композиции, содержащие ацилированный аналог инсулина по данному изобретению, можно также вводить парентерально пациентам, нуждающимся в таком лечении. Парентеральное введение можно осуществлять путем подкожной, внутримышечной или внутривенной инъекции с помощью шприца, может быть шприца карандашного типа. Альтернативно парентеральное введение можно осуществлять с помощью инфузионного насоса.
Инъекционные композиции ацилированных аналогов инсулина по данному изобретению можно готовить, используя общепринятые методики фармацевтической промышленности, которые включают соответствующее растворение и смешивание ингредиентов для получения желаемого конечного продукта. Таким образом, согласно одной методике, ацилированный аналог инсулина растворяют в количестве воды, которое является несколько меньшим, чем конечный объем композиции, которую нужно готовить. Цинк, изотонический агент, консервант и/или буфер добавляют по необходимости, и значение рН раствора доводят при необходимости, используя кислоту, например соляную кислоту, или основание, например водный гидроксид натрия, по необходимости. Наконец, объем раствора доводят водой для получения желаемой концентрации ингредиентов.
В следующей форме осуществления данного изобретения буфер выбран из группы, состоящей из ацетата натрия, карбоната натрия, цитрата, глицилглицина, гистидина, глицина, лизина, аргинина, дигидрофосфата натрия, динатрия гидрофосфата, фосфата натрия и трис(гидроксиметил)аминометана, бицина, трицина, яблочной кислоты, сукцината, малеиновой кислоты, фумаровой кислоты, винной кислоты, аспарагиновой кислоты и их смесей. Каждый из этих конкретных буферов составляет альтернативную форму осуществления данного изобретения.
В следующей форме осуществления данного изобретения препарат дополнительно содержит фармацевтически приемлемый консервант, который может быть выбран из группы, состоящей из фенола, орто-крезола, мета-крезола, пара-крезола, метил-пара-гидроксибензоата, пропил-пара-гидроксибензоата, 2-феноксиэтанола, бутил-пара-гидроксибензоата, 2-фенилэтанола, бензилового спирта, хлорбутанола и тиомеросала, бронопола, бензойной кислоты, имидмочевины, хлоргексидина, натрия дегидроацетата, хлоркрезола, этил-пара-гидроксибензоата, бензетония хлорида, хлорфенезина (3-(4-хлорфенокси)-1,2-пропандиола) или их смесей. В следующей форме осуществления данного изобретения консервант присутствует в концентрации от примерно 0,1 мг/мл до 20 мг/мл. В следующей форме осуществления данного изобретения консервант присутствует в концентрации от примерно 0,1 мг/мл дo 5 мг/мл. В следующей форме осуществления данного изобретения консервант присутствует в концентрации от примерно 5 мг/мл до 10 мг/мл. В следующей форме осуществления данного изобретения консервант присутствует в концентрации от примерно 10 мг/мл до 20 мг/мл. Каждый из этих конкретных консервантов составляет альтернативную форму осуществления данного изобретения. Применение консерванта в фармацевтических композициях хорошо известно специалистам в данной области техники. Для удобства сделана ссылка на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
В следующей форме осуществления данного изобретения препарат дополнительно содержит изотонический агент, который может быть выбран из группы, состоящей из соли (например, хлорида натрия), сахара или сахарного спирта, аминокислоты (например, L-глицина, L-гистидина, аргинина, лизина, изолейцина, аспарагиновой кислоты, триптофана или треонина), альдита (например, глицерина, 1,2-пропандиола (пропиленгликоля), 1,3-пропандиола или 1,3-бутандиола), полиэтиленгликоля (например, ПЭГ400) или их смесей. Можно использовать любой сахар, такой как моно-, ди- или полисахариды, или водорастворимые глюканы, включая, например, фруктозу, глюкозу, маннозу, сорбозу, ксилозу, мальтозу, лактозу, сахарозу, трегалозу, декстран, пуллулан, декстрин, циклодекстрин, растворимый крахмал, гидроксиэтилкрахмал и карбоксиметилцеллюлозу-Na. В одной форме осуществления сахарная добавка представляет собой сахарозу. Сахарный спирт определяют как С4-С8 углеводород, имеющий по меньшей мере одну -ОН группу, и он включает, например, маннит, сорбит, инозит, галактит, дульцит, ксилит и арабит. В одной форме осуществления добавка сахарного спирта представляет собой маннит. Вышеупомянутые сахара или сахарные спирты можно использовать индивидуально или в комбинации. Фиксированный предел используемого количества отсутствует, насколько сахар или сахарный спирт растворим в жидком препарате и не оказывает вредного воздействия на стабилизирующие эффекты, достигнутые при использовании способов по данному изобретению. В одной форме осуществления концентрация сахара или сахарного спирта составляет между примерно 1 мг/мл и примерно 150 мг/мл. В следующей форме осуществления данного изобретения изотонический агент присутствует в концентрации от примерно 1 мг/мл до 50 мг/мл. В следующей форме осуществления данного изобретения изотонический агент присутствует в концентрации от примерно 1 мг/мл до 7 мг/мл. В следующей форме осуществления данного изобретения изотонический агент присутствует в концентрации от примерно 8 мг/мл до 24 мг/мл. В следующей форме осуществления данного изобретения изотонический агент присутствует в концентрации от примерно 25 мг/мл до 50 мг/мл. Каждый из этих конкретных изотонических агентов составляет альтернативную форму осуществления данного изобретения. Применение изотонического агента в фармацевтических композициях хорошо известно специалистам в данной области техники. Для удобства сделана ссылка на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
Типичными изотоническими агентами являются хлорид натрия, маннит, диметилсульфон и глицерин, и типичными консервантами являются фенол, мета-крезол, метил-пара-гидроксибензоат и бензиловый спирт.
Примерами пригодных буферов являются ацетат натрия, глицилглицин, ГЭПЭС (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) и фосфат натрия.
Композицию для назального введения ацилированных аналогов инсулина по данному изобретению можно, например, готовить, как описано в Европейском патенте №272097.
Композиции, содержащие ацилированные аналоги инсулина по данному изобретению, можно применять при лечении состояний, которые чувствительны к инсулину. Таким образом, их можно применять при лечении диабета типа 1, диабета типа 2 и гипергликемии, например, которую иногда наблюдают у людей с серьезными повреждениями и у людей, которые перенесли обширную операцию. Оптимальный уровень дозы для любого пациента зависит от ряда факторов, включая эффективность конкретного применяемого производного инсулина, возраст, массу тела, физическую активность и режим питания пациента, от возможного комбинирования с другими лекарствами и от тяжести состояния, подлежащего лечению. Рекомендовано, чтобы суточная дозировка ацилированного аналога инсулина по данному изобретению была определена специалистами в данной области техники для каждого индивидуального пациента простым путем, как для известных композиций инсулина.
ВАЖНЫЕ ПРИЗНАКИ ДАННОГО ИЗОБРЕТЕНИЯ
Подводя итог, некоторые признаки данного изобретению являются такими, как описано ниже:
1. Ацилированный аналог инсулина, где аналог инсулина содержит остаток лизина, соединенный с С-концом аминокислотного остатка А21, или пептидный остаток из аминокислотных остатков в количестве вплоть до 4, содержащий остаток лизина, где этот пептидный остаток соединен с С-концом аминокислотного остатка А21, характеризующийся тем, что ацильная группировка, включающая алкиленгликолевую группировку, присоединена к остатку лизина в положении А22 или присоединена к остатку лизина, присутствующему в пептидном остатке, который присоединен к С-концу аминокислотного остатка А21, и где в аналоге инсулина присутствует только один лизин (K, Lys).
2. Ацилированный аналог инсулина по п.1, где ацильная группировка имеет общую формулу I:
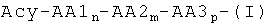 ,
,
где
n равно 0 или представляет собой целое число в интервале 1-3,
m равно 0 или представляет собой целое число в интервале 1-6,
p равно 1, 2 или 3,
Acy представляет собой жирную кислоту или жирную дикислоту, содержащую примерно 8-24 атома углерода, в которой формально гидроксигруппа удалена из карбоксигруппы жирной кислоты или из одной из карбоксигрупп жирной дикислоты,
АА1 представляет собой нейтральную циклическую аминокислоту, в которой формально атом водорода удален из аминогруппы, и гидроксигруппа удалена из карбоксигруппы,
АА2 представляет собой кислую аминокислоту, в которой формально атом водорода удален из аминогруппы, и гидроксигруппа удалена из карбоксигруппы,
АА3 представляет собой нейтральную, алкиленгликольсодержащую аминокислоту, в которой формально атом водорода удален из аминогруппы, и гидроксигруппа удалена из карбоксигруппы,
порядок, в котором АА1, АА2 и АА3 встречаются в формуле, может быть независимо взаимозаменяемым,
соединения между Acy, АА1, АА2 и/или АА3 представляют собой амидные (пептидные) связи, и
присоединение к исходному инсулину может осуществляться с С-конца остатка АА1, АА2 или АА3 в ацильной группировке формулы (I) или с одной из боковых цепей остатка АА2, присутствующего в группировке формулы (I).
3. Ацилированный аналог инсулина, где аналог инсулина содержит остаток лизина, соединенный с С-концом аминокислотного остатка А21, или пептидный остаток из аминокислотных остатков в количестве вплоть до 4, содержащий остаток лизина, где этот пептидный остаток соединен с С-концом аминокислотного остатка А21, характеризующийся тем, что ацильная группировка, включающая алкиленгликолевую группировку, присоединена к остатку лизина в положении А22 или присоединена к остатку лизина, присутствующему в пептидном остатке, который присоединен к С-концу аминокислотного остатка А21, и где в аналоге инсулина присутствует только один лизин (K, Lys), и где ацильная группировка, включающая алкиленгликолевую группировку, имеет общую формулу I: 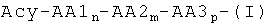 , где n равно 0 или представляет собой целое число в интервале 1-3, m равно 0 или представляет собой целое число в интервале 1-6, p равно 1, 2 или 3, Асу представляет собой жирную кислоту или жирную дикислоту, содержащую примерно 8-24 атома углерода, в которой формально гидроксигруппа удалена из карбоксигруппы жирной кислоты или из одной из карбоксигрупп жирной дикислоты, АА1 представляет собой нейтральную циклическую аминокислоту, в которой формально атом водорода удален из аминогруппы, и гидроксигруппа удалена из карбоксигруппы, АА2 представляет собой кислую аминокислоту, в которой формально атом водорода удален из аминогруппы, и гидроксигруппа удалена из карбоксигруппы, АА3 представляет собой нейтральную, алкиленгликольсодержащую аминокислоту, в которой формально атом водорода удален из аминогруппы, и гидроксигруппа удалена из карбоксигруппы, порядок, в котором АА1, АА2 и АА3 встречаются в формуле, может быть независимо взаимозаменяемым, соединения между Асу, АА1, АА2 и/или АА3 представляют собой амидные (пептидные) связи, и присоединение к исходному инсулину может осуществляться с С-конца остатка АА1, АА2 или АА3 в ацильной группировке формулы (I) или с одной из боковых цепей остатка АА2, присутствующего в группировке формулы (I).
, где n равно 0 или представляет собой целое число в интервале 1-3, m равно 0 или представляет собой целое число в интервале 1-6, p равно 1, 2 или 3, Асу представляет собой жирную кислоту или жирную дикислоту, содержащую примерно 8-24 атома углерода, в которой формально гидроксигруппа удалена из карбоксигруппы жирной кислоты или из одной из карбоксигрупп жирной дикислоты, АА1 представляет собой нейтральную циклическую аминокислоту, в которой формально атом водорода удален из аминогруппы, и гидроксигруппа удалена из карбоксигруппы, АА2 представляет собой кислую аминокислоту, в которой формально атом водорода удален из аминогруппы, и гидроксигруппа удалена из карбоксигруппы, АА3 представляет собой нейтральную, алкиленгликольсодержащую аминокислоту, в которой формально атом водорода удален из аминогруппы, и гидроксигруппа удалена из карбоксигруппы, порядок, в котором АА1, АА2 и АА3 встречаются в формуле, может быть независимо взаимозаменяемым, соединения между Асу, АА1, АА2 и/или АА3 представляют собой амидные (пептидные) связи, и присоединение к исходному инсулину может осуществляться с С-конца остатка АА1, АА2 или АА3 в ацильной группировке формулы (I) или с одной из боковых цепей остатка АА2, присутствующего в группировке формулы (I).
4. Ацилированный аналог инсулина по любому из возможных пп.1-3, где Асу имеет происхождение от жирной кислоты или жирной дикислоты с числом атомов углерода от 14 до 20, предпочтительно от 16 до 20 атомов углерода, более предпочтительно от 16 до 18 атомов углерода, альтернативно от 18 до 20 атомов углерода, и конкретно 8, 10, 12, 14, 16, 17, 18, 20, 22 или 24 атома углерода.
5. Ацилированный аналог инсулина по любому из возможных пп.1-4, где Acy имеет происхождение от дикарбоновой кислоты.
6. Ацилированный аналог инсулина по любому из возможных пп.1-5, где Acy представляет собой тетрадекандикислоту, пентадекандикислоту, гексадекандикислоту, гептадекандикислоту, октадекандикислоту или эйкозандикислоту, из которой удалена гидроксигруппа.
7. Ацилированный аналог инсулина по любому из возможных пп.1-5, где Acy представляет собой гексадекандикислоту, октадекандикислоту или эйкозандикислоту, из которой удалена гидроксигруппа.
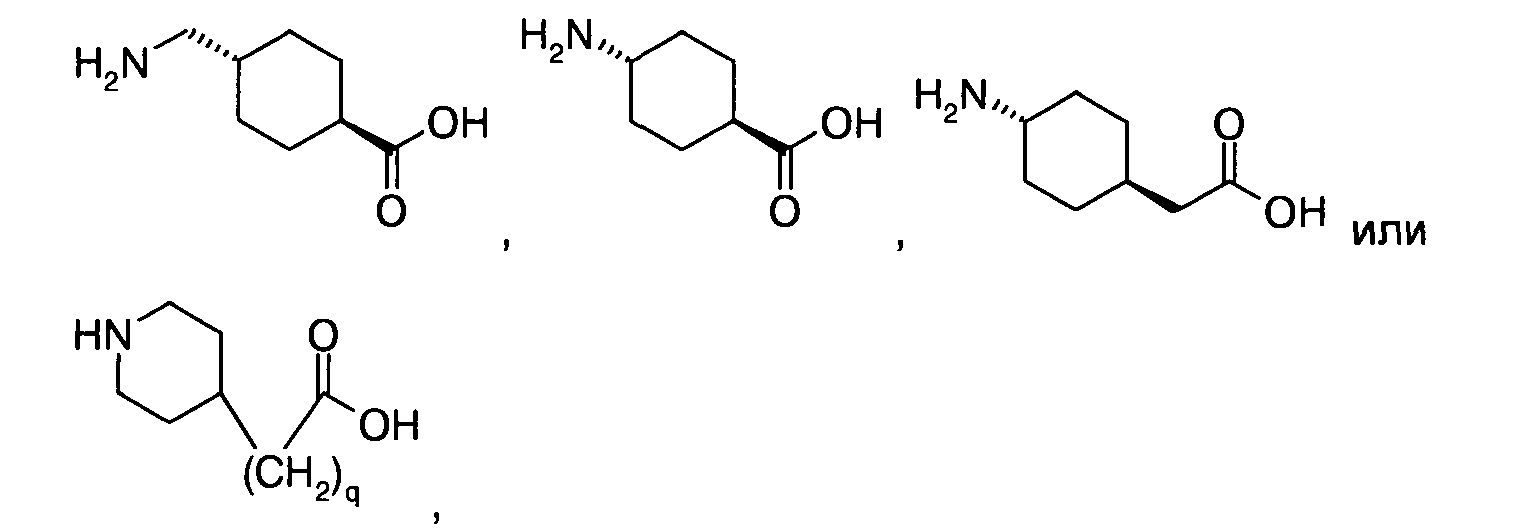
8. Ацилированный аналог инсулина, по любому из возможных пп.1-5, где АА1 выбрана из:
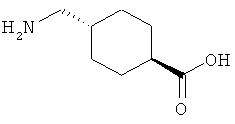
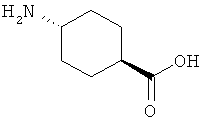
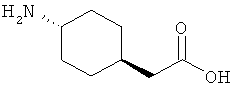 или
или 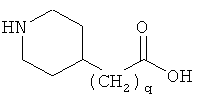
где q равно 0, 1, 2, 3 или 4, и в которой формально атом водорода удален из аминогруппы и гидроксигруппа удалена из карбоксигруппы.
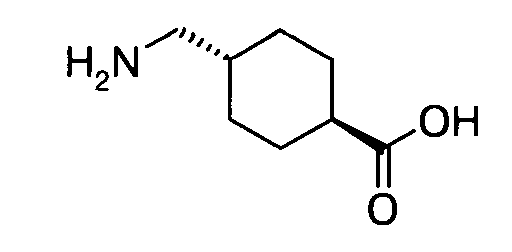
9. Ацилированный аналог инсулина по п.8, где АА1 представляет собой

в которой формально атом водорода удален из аминогруппы и гидроксигруппа удалена из карбоксигруппы.
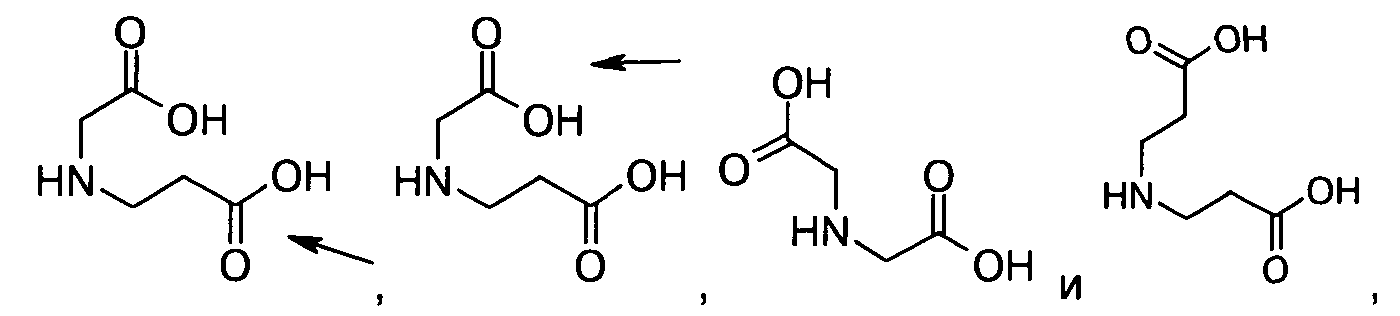
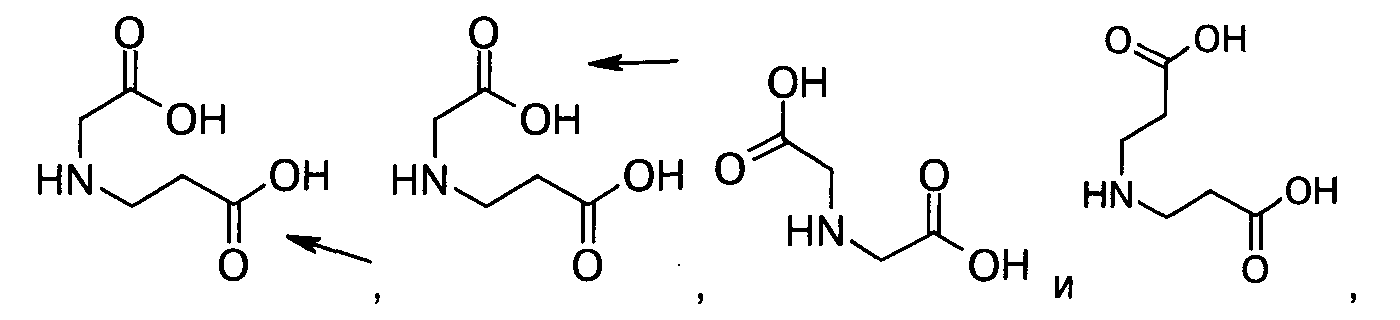
10. Ацилированный аналог инсулина по любому из возможных пп.1-9, где АА2 выбрана из Glu, Asp, D-Glu, D-Asp, γGlu, γAsp, γ-D-Glu, γ-D-Asp или любого из приведенных ниже соединений:
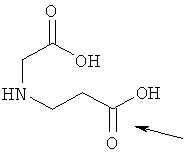
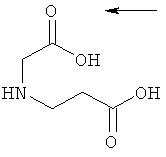
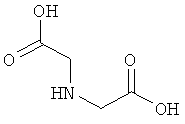 и
и 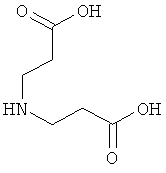
где стрелками указана точка присоединения к аминогруппе АА1, АА2 или АА3, и в которой формально атом водорода удален из аминогруппы и гидроксигруппа удалена из карбоксигруппы.
11. Ацилированный аналог инсулина по любому из пп.1-10, где АА2 представляет собой γGlu.
12. Ацилированный аналог инсулина по любому из возможных пп.1-11, где АА3 выбрана из любого из приведенных ниже соединений:
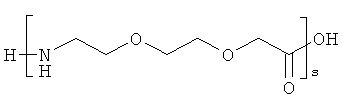
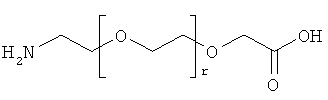
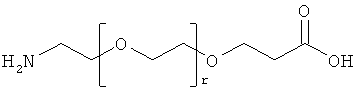
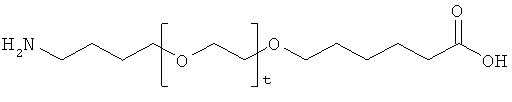
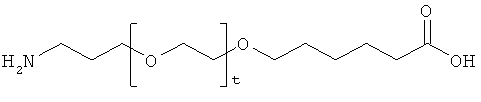
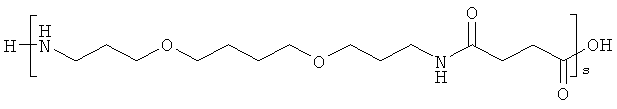
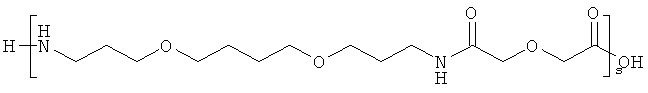
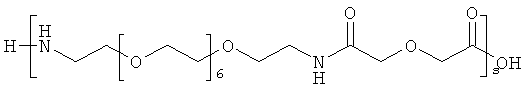
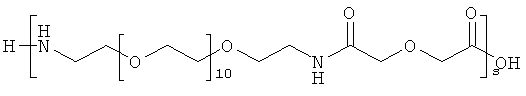
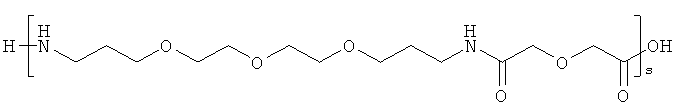
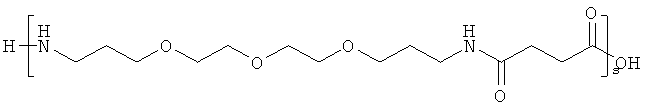
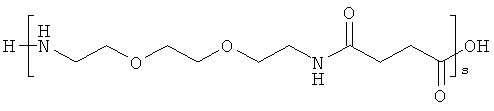 и
и
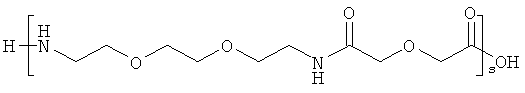
r представляет собой целое число в интервале 1-100, предпочтительно 1-10,
s представляет собой целое число в интервале 1-30, предпочтительно 1-10,
t представляет собой целое число в интервале 1-150, предпочтительно 20-70,
и в которой формально атом водорода удален из аминогруппы и гидроксигруппа удалена из карбоксигруппы.
13. Ацилированный аналог инсулина по п.12, где r равно 1, 2, 3, 4, 5, 7, 11, 23 или 27.
14. Ацилированный аналог инсулина по любому из возможных пп.1-13, где s равно 1, 2, 3, 4, 10, 20 или 30.
15. Ацилированный аналог инсулина по любому из возможных пп.1-14, где целое число t выбрано так, что средняя молекулярная масса приведенной выше формулы, где встречается целое число t, составляет 2000 Да, 3400 Да или 5000 Да.
16. Ацилированный аналог инсулина по любому из возможных пп.1-15, где ацильная группировка формулы Acy-AA1n-AA2m-AA3p-, где Acy, АА1, АА2, АА3, n, m и p являются такими, как определено выше, соединена с остатком лизина в положении А22.
17. Ацилированный аналог инсулина по любому из возможных пп.1-16, где ацильная группировка формулы Acy-AA1n-AA2m-AA3p-, где Acy, АА1, АА2, АА3, n, m и p являются такими, как определено выше, соединена с остатком лизина в положении А23.
18. Ацилированный аналог инсулина по любому из возможных пп.1-17, где ацильная группировка формулы Acy-AA1n-AA2m-AA3p-, где Acy, АА1, АА2, АА3, n, m и p являются такими, как определено выше, соединена с остатком лизина в положении А24.
19. Ацилированный аналог инсулина по любому из возможных пп.1-18, где ацильная группировка формулы Acy-AA1n-AA2m-AA3p-, где Acy, АА1, АА2, АА3, n, m и p являются такими, как определено выше, соединена с остатком лизина в положении А25.
20. Ацилированный аналог инсулина по любому из возможных пп.1-19, где аналог инсулина содержит 52 аминокислотных остатка.
21. Ацилированный аналог инсулина по любому из возможных пп.1-20, где аналог инсулина содержит 51 аминокислотный остаток.
22. Ацилированный аналог инсулина по любому из возможных пп.1-21, где аналог инсулина содержит 53 аминокислотных остатка.
23. Ацилированный аналог инсулина по любому из возможных пп.1-22, где аналог инсулина содержит 54 аминокислотных остатка.
24. Ацилированный аналог инсулина по любому из возможных пп.1-23, где аналог инсулина содержит 50 аминокислотных остатков.
25. Ацилированный аналог инсулина по любому из возможных пп.1-24, где аналог инсулина содержит 49 аминокислотных остатков.
26. Ацилированный аналог инсулина по любому из возможных пп.1-25, где только один из аминокислотных остатков в положениях А1-А21 и В1-В30 аналога инсулина имеет отклонение от аминокислотных остатков, присутствующих в человеческом инсулине.
27. Ацилированный аналог инсулина по любому из возможных пп.1-26, где только два из аминокислотных остатков в положениях А1-А21 и В1-В30 аналога инсулина имеют отклонения от аминокислотных остатков, присутствующих в человеческом инсулине.
28. Ацилированный аналог инсулина по любому из возможных пп.1-27, где только три из аминокислотных остатков в положениях А1-А21 и В1-В30 аналога инсулина имеют отклонения от аминокислотных остатков, присутствующих в человеческом инсулине.
29. Ацилированный аналог инсулина по любому из возможных пп.1-28, где только четыре из аминокислотных остатков в положениях А1-А21 и В1-В30 аналога инсулина имеют отклонения от аминокислотных остатков, присутствующих в человеческом инсулине.
30. Ацилированный аналог инсулина по любому из возможных пп.1-29, где отсутствует аминокислотный остаток, соединенный с N-концом аминокислотных остатков, присутствующих в положении А1 или В1, и отсутствует аминокислотный остаток, соединенный с C-концом аминокислотных остатков, присутствующих в положении В30.
31. Ацилированный аналог инсулина по любому из возможных пп.1-30, где аминокислотный остаток в положении А14 аналога инсулина представляет собой Е.
32. Ацилированный аналог инсулина по любому из возможных пп.1-31, где аминокислотный остаток в положении А18 аналога инсулина представляет собой Q.
33. Ацилированный аналог инсулина по любому из возможных пп.1-32, где аминокислотный остаток в положении А21 аналога инсулина представляет собой А, G или Q.
34. Ацилированный аналог инсулина по любому из возможных пп.1-33, где аминокислотный остаток в положении А22 аналога инсулина представляет собой K или G.
35. Ацилированный аналог инсулина по п.34, где аминокислотный остаток в положении А22 аналога инсулина представляет собой K.
36. Ацилированный аналог инсулина по п.35, где аминокислотный остаток в положении А22 аналога инсулина представляет собой K, и где отсутствует аминокислотный остаток, соединенный с С-концом указанного аминокислотного остатка A22K.
37. Ацилированный аналог инсулина по любому из возможных пп.1-36, где аминокислотный остаток в положении А23 аналога инсулина представляет собой K или G.
38. Ацилированный аналог инсулина по любому из возможных пп.1-37, где аминокислотный остаток в положении А24 аналога инсулина представляет собой K или G.
39. Ацилированный аналог инсулина по любому из возможных пп.1-38, где аминокислотный остаток в положении А25 аналога инсулина представляет собой K.
40. Ацилированный аналог инсулина по любому из возможных пп.1-39, где аминокислотный остаток в положении В1 аналога инсулина представляет собой Q или отсутствует.
41. Ацилированный аналог инсулина по любому из возможных пп.1-40, где аминокислотный остаток в положении В3 аналога инсулина представляет собой Q или Т.
42. Ацилированный аналог инсулина по любому из возможных пп.1-41, где аминокислотный остаток в положении В13 аналога инсулина представляет собой Q.
43. Ацилированный аналог инсулина по любому из возможных пп.1-42, где аминокислотный остаток в положении В25 аналога инсулина представляет собой Н.
44. Ацилированный аналог инсулина по любому из возможных пп.1-43, где аминокислотный остаток в положении В27 аналога инсулина отсутствует.
45. Ацилированный аналог инсулина по любому из возможных пп.1-44, где аминокислотный остаток в положении В28 аналога инсулина представляет собой D, Е или R.
46. Ацилированный аналог инсулина по любому из возможных пп.1-45, где аминокислотный остаток в положении В28 аналога инсулина представляет собой R и аминокислотный остаток в положении В29 представляет собой Р.
47. Ацилированный аналог инсулина по любому из возможных пп.1-46, где аминокислотный остаток в положении В29 аналога инсулина представляет собой R.
48. Ацилированный аналог инсулина по любому из возможных пп.1-47, где аминокислотный остаток в положении В30 аналога инсулина отсутствует.
49. Ацилированный аналог инсулина по любому из возможных пп.1-48, где аминокислотный остаток в положении А14 аналога инсулина представляет собой Y или Е, аминокислотный остаток в положении А18 аналога инсулина представляет собой N или Q, аминокислотный остаток в положении А21 аналога инсулина представляет собой N, A, G или Q, аминокислотный остаток в положении А22 аналога инсулина представляет собой K или G, аминокислотный остаток в положении А23 аналога инсулина отсутствует или представляет собой K или G, аминокислотный остаток в положении А24 аналога инсулина отсутствует или представляет собой K или G, аминокислотный остаток в положении А25 аналога инсулина отсутствует или представляет собой K, аминокислотный остаток в положении В1 аналога инсулина представляет собой F, Q или отсутствует, аминокислотный остаток в положении В3 аналога инсулина представляет собой N, Q или Т, аминокислотный остаток в положении В13 аналога инсулина представляет собой Е или Q, аминокислотный остаток в положении В25 аналога инсулина представляет собой F или Н, аминокислотный остаток в положении В27 аналога инсулина представляет собой Т или отсутствует, аминокислотный остаток в положении В28 аналога инсулина представляет собой Р, D, Е или R, аминокислотный остаток в положении В29 аналога инсулина представляет собой K или R, и аминокислотный остаток в положении В30 аналога инсулина представляет собой Т или отсутствует.
50. Ацилированный аналог инсулина по любому из возможных пп.1-49, где все аминокислотные остатки в аналоге инсулина представляют собой остатки кодируемых аминокислот.
51. Ацилированный аналог инсулина по любому из возможных пп.1-50, где АА2 представляет собой gGlu.
52. Ацилированный аналог инсулина по любому из возможных пп.1-52, где ацильная группировка общей формулы Acy-AA1n-AA2m-AA3p- имеет одну из общих формул Acy-АА3-, Acy-АА2-АА3-, Acy-АА2-АА3-АА2-, Acy-АА2-(АА3)2-, Acy-АА2-(АА3)2-АА2 или Acy-АА3-АА2-, где каждый из Acy, АА2 и АА3 является таким, как определено выше.
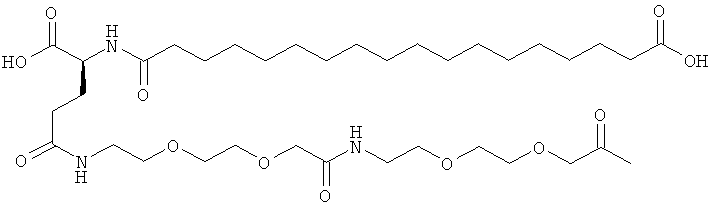
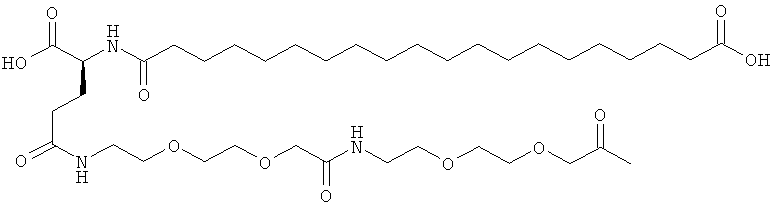
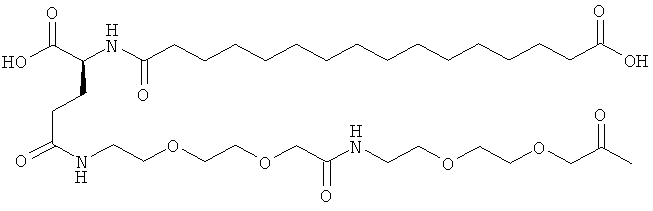
53. Ацилированный аналог инсулина по любому из возможных пп.1-52, который представляет собой любое из соединений, конкретно упомянутое в данной заявке, например соединения, описанные здесь в конкретных примерах.
54. Соединение по любому из возможных пунктов на продукт 1-53 для применения в качестве лекарства или для применения в лекарстве.
55. Соединение по любому из возможных пунктов на продукт 1-54 для лечения диабета или применение соединения по любому из возможных пунктов на продукт 1-54 для получения лекарства для лечения диабета.
56. Способ лечения диабета, где этот способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из возможных пунктов на продукт 1-55.
57. Любой новый признак или комбинация признаков, описанных в данной заявке.
Результатом комбинирования одной или более чем одной из форм осуществления, описанных в данной заявке, может быть, также с одним или более чем одним пунктом приведенной ниже формулы изобретения и одним или более чем одним из пунктов, упомянутых в данной заявке, являются дополнительные формы осуществления, и настоящее изобретение относится ко всем возможным комбинациям форм осуществления, пунктов и пунктов формулы изобретения.
Все ссылки, включая публикации, патентные заявки и патенты, цитируемые здесь, включены в данную заявку посредством ссылки в их полном объеме, и до некоторой степени, как если бы каждая ссылка была индивидуально и конкретно указана как включенная посредством ссылки и изложена здесь в полном объеме (до максимальной степени, допустимой законом).
Все заголовки и подзаголовки использованы в данной заявке только для удобства, и их не следует рассматривать как ограничивающие изобретение каким-либо путем.
Применение любых и всех примеров или выражений, предполагающих приведение примера (например, "такой как"), предложенное здесь, предназначено исключительно для лучшего освещения изобретения и не налагает ограничений на объем изобретения, если не заявлено иное. Ни одну из формулировок в описании не следует рассматривать как указывающую на какой-либо не заявленный элемент как существенный для практики изобретения.
Цитирование и включение патентных документов в данную заявку сделано только для удобства и не отражает какую-либо точку зрения на действительность, патентоспособность и/или исполнимость таких патентных документов. Упоминание в данной заявке ссылок не является признанием того, что они составляют предшествующий уровень техники.
Здесь слово "содержать" следует интерпретировать в широком смысле как означающее "включать", "содержать" или "содержать в себе" (руководство ЕРО С 4.13).
Данное изобретение включает все модификации и эквиваленты сущности, изложенной в прилагаемой формуле изобретения, как разрешено применимым законодательством.
Приведенные ниже примеры предложены для иллюстрации, но не для ограничения.
ПРИМЕРЫ
Общие методики:
Конструирование экспрессионных векторов, трансформация дрожжевых клеток и экспрессия предшественников инсулина по изобретению
Все экспрессионные плазмиды представляют собой плазмиды типа С-РОТ, подобные описанным в ЕР 171142, которые характеризуются содержанием гена триозофосфатизомеразы Schizosaccharomyces pombe (POT) в целях селекции плазмид и стабилизации в S. cerevisiae. Плазмиды также содержат промотор и терминатор триозофосфатизомеразы S. cerevisiae. Эти последовательности подобны соответствующим последовательностям в плазмиде pKFN1003 (описанной в WO 90/10075), которые представляют собой все последовательности за исключением последовательности фрагмента EcoRI-XbaI, кодирующий гибридный белок лидерного пептида и продукта инсулина. С целью экспрессии различных гибридных белков фрагмент EcoRI-XbaI pKFN1003 просто заменен фрагментом EcoRI-XbaI, кодирующим интересующий гибридный белок лидер-инсулин. Такие фрагменты EcoRI-XbaI можно синтезировать, используя синтетические олигонуклеотиды и ПЦР, в соответствии со стандартными методиками.
Трансформанты дрожжей получали путем трансформации штамма-хозяина S. cerevisiae MT663 (МАТа/МАТα рер4-3/рер4-3 HIS4/his4 tpi::LEU2/tpi::LEU2 Cir+). Штамм дрожжей MT663 был депонирован в Deutsche Sammlung von Mikroorganismen und Zeilkulturen в связи с подачей заявки WO 92/11378, и ему был дан депозитный номер DSM 6278.
МТ663 выращивали на среде YPGaL (1% дрожжевой экстракт Bacto, 2% пептон Bacto, 2% галактоза, 1% лактат) до O.D. 0,6 при 600 нм. 100 мл культуры собирали центрифугированием, промывали 10 мл воды, повторно центрифугировали и ресуспендировали в 10 мл раствора, содержащего 1,2 М сорбит, 25 мМ Na2ЭДТА pH=8,0 и 6,7 мг/мл дитиотрейтола. Суспензию инкубировали при 30°C в течение 15 минут, центрифугировали, и клетки ресуспендировали в 10 мл раствора, содержащего 1,2 М сорбит, 10 мМ Nа2ЭДТА, 0,1 М цитрат натрия, pH 5,8 и 2 мг Novozym®234. Суспензию инкубировали при 30°C в течение 30 минут, клетки собирали центрифугированием, промывали в 10 мл 1,2 М сорбита и 10 мл CAS (1,2 М сорбит, 10 мМ CaCl2, 10 мМ Трис HCl (pH=7,5)) и ресуспендировали в 2 мл CAS. Для трансформации 1 мл клеток, суспендированных в CAS, смешивали примерно с 0,1 мг плазмидной ДНК и оставляли при комнатной температуре на 15 минут. Добавляли 1 мл (20% полиэтиленгликоль 4000, 10 мМ CaCl2, 10 мМ Трис HCl, pH=7,5), и смесь оставляли еще на 30 минут при комнатной температуре. Смесь центрифугировали, и осадок ресуспендировали в 0,1 мл SOS (1,2 М сорбит, 33% об/об YPD, 6,7 мМ CaCl2) и инкубировали при 30°С в течение 2 часов. Затем суспензию центрифугировали, и осадок ресуспендировали в 0,5 мл 1,2 М сорбита. Затем добавляли 6 мл верхнего агара (среда SC Sherman et al. (1982) Methods in Yeast Genetics, Cold Spring Harbor Laboratory), содержащего 1,2 М сорбит и 2,5% агар, при 52°С, и суспензию заливали на поверхность чашек, содержащих такую же отвердевшую среду с агаром, содержащую сорбит. Штамм S. cerevisiae MT663, трансформированный экспрессионными плазмидами, выращивали на YPD в течение 72 ч при 30°С.
Получение, очистка и характеристика ацилированных аналогов инсулина по данному изобретению
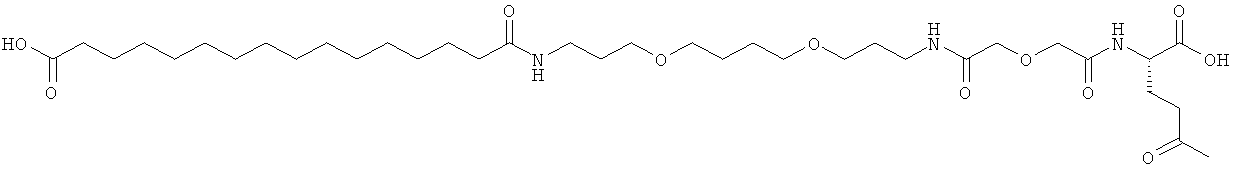
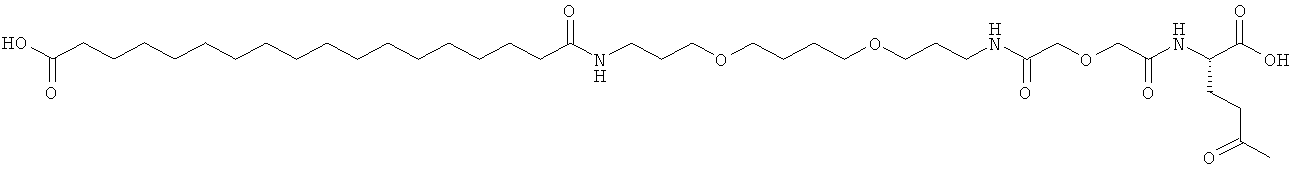
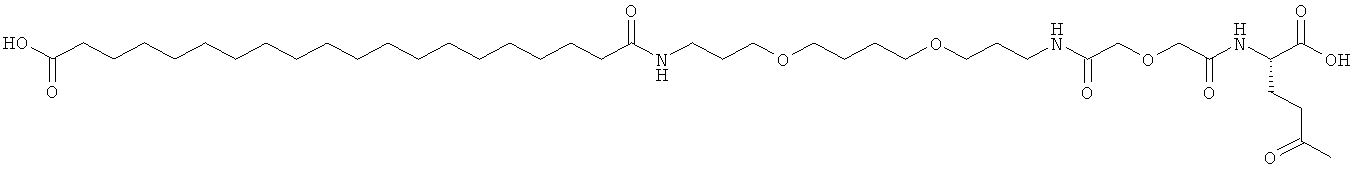
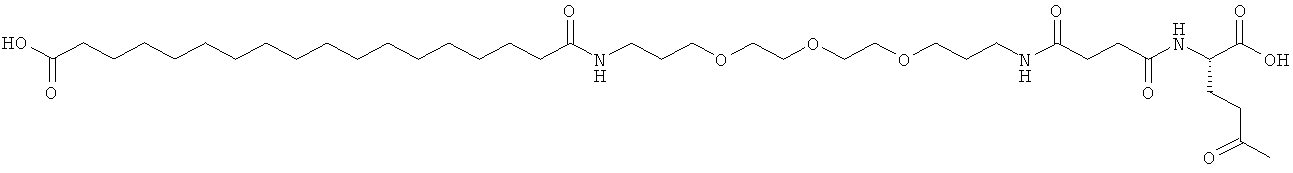
Приведенные ниже примеры относятся к промежуточным соединениям и конечным продуктам, идентифицированным в описании и в примерах. Получение ацилированных аналогов инсулина по данному изобретению подробно описано с использованием приведенных ниже примеров, но описанные химические реакции и схемы очистки раскрыты в отношении их общей применимости к получению производных инсулина по изобретению. Иногда реакция может быть неприменима, как описано для каждого соединения, включенного в раскрытый объем изобретения. Соединения, для которых это происходит, должны быть легко распознаны специалистами в данной области техники. В этих случаях реакции могут быть успешно проведены путем общепринятых модификаций, известных специалистам в данной области техники, то есть путем соответствующей защиты взаимодействующих групп, путем замены на другие общепринятые реагенты или путем рутинной модификации условий реакции. Альтернативно другие реакции, раскрытые в данной заявке или, иначе, общепринятые, применимы к соответствующим соединениям по изобретению. При всех способах получения все исходные вещества известны или могут быть легко получены из известных исходных веществ, используя способы, которые сами по себе известны. Все температуры приведены в градусах Цельсия и, если не указано иное, все доли и проценты даны по массе при ссылке на выходы, и все доли даны по объему при ссылке на растворители и элюенты.
Ацилированные аналоги инсулина по данному изобретению могут быть очищены путем применения одной или более чем одной из приведенных ниже методик, которые типичны в данной области техники. Эти методики могут быть при необходимости модифицированы в отношении градиентов, рН, солей, концентраций, скорости тока, колонок и т.д. В зависимости от факторов, таких как состав примесей, растворимость обсуждаемых инсулинов и т.д., эти модификации могут быть легко распознаны и осуществлены специалистами в данной области техники.
Общая методика твердофазного синтеза реагентов ацилирования общей формулы (II):
(II): Acy-AA1n-AA2m-AA3p-Act,
где Acy, АА1, АА2, АА3, n, m и p являются такими, как определено выше, и Act представляет собой уходящую группу активного эфира, такого как эфиры N-гидроксисукцинимид (OSu) или 1-гидроксибензотриазол, и
где карбоновые кислоты в пределах ацильной группировки защищены в виде трет-бутиловых эфиров.
Соединения общей формулы (II) согласно изобретению можно синтезировать на твердом носителе, используя методики, хорошо известные специалистам в области твердофазного пептидного синтеза. Эта методика включает присоединение Fmoc-защищенной аминокислоты к полистироловой 2-хлортритилхлоридной смоле. Это присоединение можно, например, осуществить, используя свободную N-защищенную аминокислоту в присутствии третичного амина, такого как триэтиламин или N,N-диизопропилэтиламин (см. ссылки ниже). С-конец (который присоединен к смоле) этой аминокислоты находится в конце последовательности синтеза, связанной с исходными инсулинами по изобретению. После присоединения Fmoc-аминокислоты к смоле защитную группу Fmoc удаляют, используя, например, вторичные амины, такие как пиперидин или диэтиламин, с последующим сочетанием другой (или такой же) Fmoc-защищенной аминокислоты и удалением защиты. Последовательность синтеза заканчивается сочетанием моно-трет-бутил-защищенных жирных (α,ω)дикислот, таких как моно-трет-бутиловые эфиры гександикислоты, гептандикислоты, октандикислоты или эйкозандикислоты. Отщепление соединений от смолы осуществляют, используя разбавленную кислоту, такую как 0,5-5% ТФУ/ДХМ (трифторуксусная кислота в дихлорметане), уксусная кислота (например, 10% в ДХМ, или НОАс/трифторэтанол/ДХМ 1:1:8) или гексафторизопропанол в ДХМ (см., например, "Organic Synthesis on Solid Phase", F.Z. Dorwald, Wiley-VCH, 2000. ISBN 3-527-29950-5, "Peptides: Chemistry and Biology", N. Sewald & H.-D. Jakubke, Wiley-VCH, 2002, ISBN 3-527-30405-3 или "The Combinatorial Chemistry Catalog" 1999, Novabiochem AG, и ссылки, цитируемые в этих документах). Это гарантирует, что удаление защиты трет-бутиловых эфиров, присутствующих в соединениях в качестве защитных групп карбоновой кислоты, не происходит. Наконец, C-концевую карбоксигруппу (освобожденную от смолы) активируют, например, в виде эфира N-гидроксисукцинимида (OSu), и используют либо непосредственно, либо после очистки, в качестве реагента сочетания при присоединении к исходным инсулинам по изобретению. Эта методика проиллюстрирована в примере 4.
Альтернативно реагенты ацилирования вышеприведенной общей формулы (II) могут быть получены путем синтеза в жидкой фазе, как описано ниже.
Моно-трет-бутил-защищенные жирные дикислоты, такие как трет-бутиловые эфиры гександикислоты, гептандикислоты, октандикислоты или эйкозандикислоты, активируют, например, в виде OSu-эфиров, как описано ниже, или в виде любого другого активированного эфира, известного специалистам в данной области техники, такого как HOBt- или HOAt-эфиры. Этот активный эфир подвергают сочетанию с одной из аминокислот АА1, моно-трет-бутил-защищенной АА2 или АА3 в подходящем растворителе, таком как ТГФ, ДМФ, NMP (или смесь растворителей), в присутствии подходящего основания, такого как DIPEA или триэтиламин. Промежуточное соединение выделяют, например, с помощью методик экстракции или с помощью хроматографических методик. Полученное в результате промежуточное соединение снова подвергают активации (как описано выше) и сочетанию с одной из аминокислот АА1, моно-трет-бутил-защищенной АА2 или АА3, как описано выше. Данную процедуру повторяют до получения желаемого защищенного промежуточного соединения Acy-AA1n-AA2m-АА3р-ОН. Это соединение, в свою очередь, активируют с получением реагентов ацилирования общей формулы (II) Acy-AA1n-AA2m-AA3p-Act. Данная методика проиллюстрирована в примере 9.
Общая методика (А) получения ацилированных аналогов инсулина по данному изобретению
Общая методика (А) изложена ниже и проиллюстрирована в первых примерах:
Пример 1, Общая методика (А):
A22K(Nε-Гексадекандиоил-(3-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)-пропионил-γGlu), B29R, desB30 человеческий инсулин
Данный инсулин был получен по аналогии с инсулином, описанным в WO 2006/082205, пример 3, используя A22K, B29R desB30 человеческий инсулин вместо desB30 человеческого инсулина.
ЖХ-МС (электрораспыление); m/z: 1627 (М+4)+/4; 1302 (М+5)+/5.
Пример 2, Общая методика (А):
A22K(Nε-Гексадекандиоил-(2-аминоэтил-ПЭГ2000-илацетил)), B29R desB30 человеческий инсулин
Стадия 1:
Гексадекандикислоты трет-бутиловый эфир 2,5-диоксопирролидин-1-иловый эфир (218 мг, 0,497 ммоль) растворяли в ДХМ (10 мл), добавляли пропиламин-ПЭГ-карбоновую кислоту MW 2000 (SUNBRIGHT® PA-20HC от фирмы NOF Coporation, 1000 мг, примерно 0,497 ммоль), и смесь перемешивали в атмосфере азота в течение ночи. Реакционную смесь переносили на колонку силикагеля и элюировали ДХМ с градиентом этанола (0-10%) с получением промежуточного соединения трет-бутилгексадекандиоилпропиламин-ПЭГ-карбоновой кислоты (MW 2000).
Стадия 2: Синтез A22K(Nε-Гексадекандиоил-(2-аминоэтил-ПЭГ2000-илацетил)), B29R, desB30 человеческий инсулин.
трет-Бутилгексадекандиоилпропиламин-ПЭГ-карбоновую кислоту (MW 2000) (72 мг, 0,031 ммоль) растворяли в ТГФ (4 мл), добавляли DIPEA (6,3 мкл, 0,037 ммоль) и TSTU (11,1 мг, 0,037 ммоль), и смесь перемешивали в течение ночи в атмосфере азота, добавляли ДМСО (1 мл), и смесь добавляли к раствору A22K, B29R desB30 человеческого инсулина (180 мг, 0,031 ммоль), растворенного вместе с триэтиламином (43 мкл, 0,31 ммоль) в ДМСО (2 мл). Смесь охлаждали на льду и добавляли воду (15 мл), рН сначала доводили до 5,2 1 н. HCl, а затем снова доводили до рН 7-8 1% аммиаком в воде. Смесь очищали на препаративной ВЭЖХ, используя 35-75% градиент ацетонитрила в воде, содержащей 0,1% ТФУ. Фракции анализировали на ЖХ-МС, и фракции, содержащие желаемый продукт, объединяли, растворитель удаляли в вакууме с последующей лиофилизацией. Лиофилизированный материал обрабатывали ТФУ/водой 95:5 в течение 30 минут, и растворитель удаляли в вакууме, сырой продукт очищали, используя анионообменную хроматографию (колонка Ressource Q, 1 мл (Amersham Biosciences) и элюирование градиентом ацетата аммония (от 0,25% до 1,25% за 25 объемов колонки)) в 42,5% ЕtOН, 0,25% Трис, рН 7,5, с последующей препаративной ВЭЖХ, используя колонку Jupiter C4 5 мкм, элюируя 30-70% градиентом ацетонитрил/вода, содержащую 0,1% ТФУ, за 90 минут с получением соединения, указанного в заголовке.
ВЭЖХ-МС: m/z около 1360 (М+/6).
Пример 3, Общая методика (А):
A22K(Nε-3-(3-{4-[3-(5-Карбоксипентаноиламино)пропокси]бутокси}-пропилкарбамоил)пропионил-γGlu), B29R, desB30 человеческий инсулин
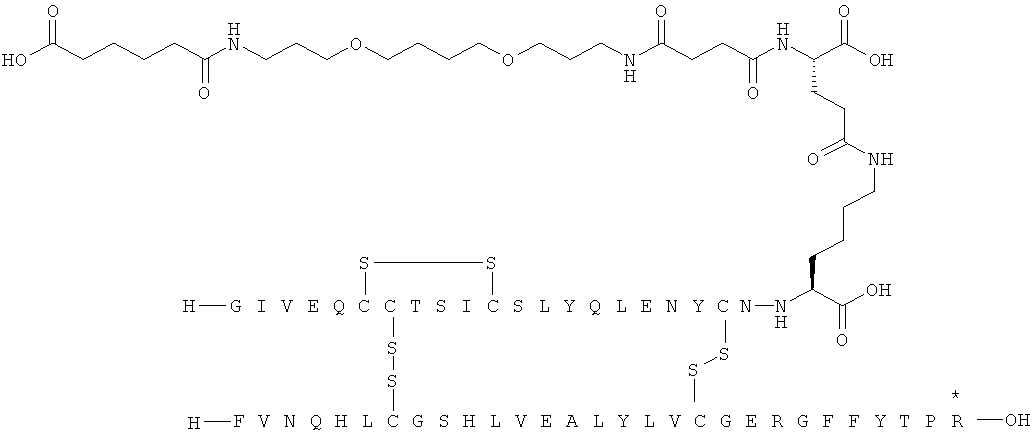
Данный инсулин был получен по аналогии с инсулином, описанным в WO 2006/082205, пример 8, используя A22K, B29R desB30 человеческий инсулин вместо desB30 человеческого инсулина, и используя гексадекандикислоты моно-трет-бутиловый эфир вместо октандикислоты моно-трет-бутилового эфира.
MALDI-TOF (времяпролетная ионизация лазерной десорбцией с использованием матрицы) МС (матрица: синапиновая кислота); m/z: 6411.
Пример 4, Общая методика (А): A22K(Nε-[2-(2-[2-(2-[2-(Октадекандиоил-γGlu)амино]этокси)этокси]ацетиламино)этокси]этокси)ацетил]), B29R, desB30 человеческий инсулин
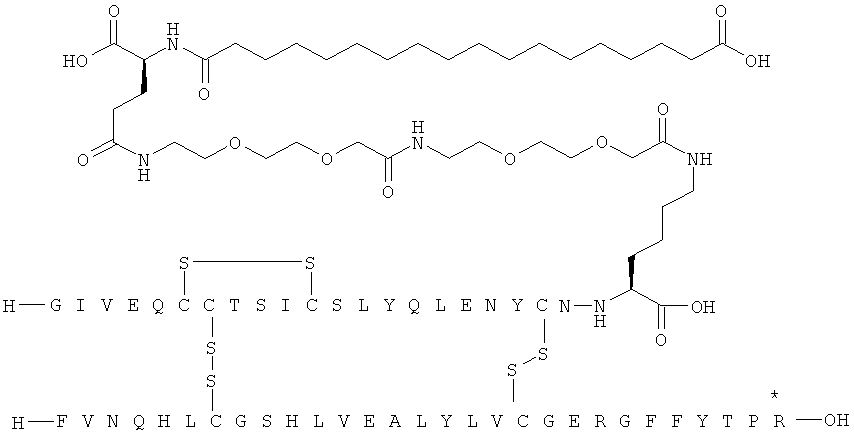
MALDI-TOF МС (матрица: синапиновая кислота); m/z: 6581.
Реагент ацилирования для получения данного инсулина был получен, как описано ниже:
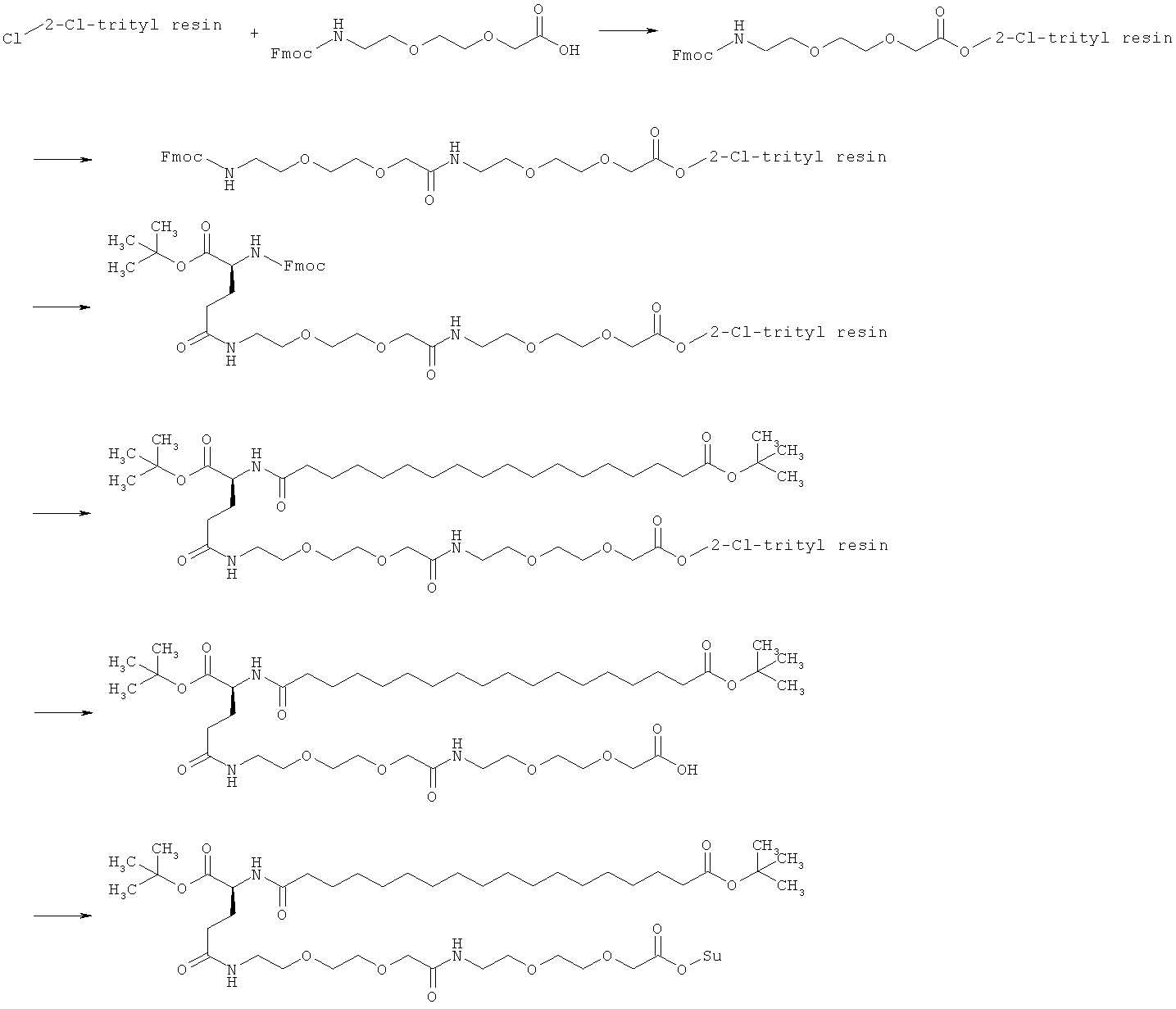
Исходная смола: 2-хлортритиловая смола (2-Cl-trityl resin), 1,60 ммоль/г
1,0 г смолы набухало в течение 30 мин в ДХМ (10 мл).
1. Ацилирование Fmoc-8-амино-3,6-диоксаоктановой кислотой:
0,39 г (0,63 экв., 1,0 ммоль) Ртос-8-амино-3,6-диоксаоктановой кислоты (Fmoc-OEG-OH) растворяли в ДХМ (15 мл) и добавляли к смоле. Добавляли по каплям N,N-диизопропилэтиламин (DIEA) (0,44 мл, 2.5 ммоль). Реакционную смесь перемешивали на вортексе в течение 30 мин, а затем добавляли метанол (2 мл), и смесь перемешивали на вортексе в течение 15 мин дополнительно. Смолу фильтровали и промывали NMP (2×8 мл) и ДХМ (8×8 мл).
Добавляли 20% пиперидин/NMP (8 мл), давали стоять в течение 10 мин, повторяли еще раз. Фильтровали и промывали NMP (2×8 мл), ДХМ (3×8 мл) и NMP (5×8 мл).
Положительный тест TNBS дал смолу красного цвета.
2. Ацилирование Fmoc-8-амино-3,6-диоксаоктановой кислотой:
0,78 г (2 экв., 2,0 ммоль) Fmoc-8-амино-3,6-диоксаоктановой кислоты растворяли в NMP/ДХМ 1:1 (10 мл). Добавляли 0,28 г (2,2 экв., 2,4 ммоль) HOSu с последующим добавлением 0,37 мл (2,2 экв., 2,4 ммоль) DIC. Реакционной смеси давали стоять в течение 1 часа и, наконец, добавляли ее к смоле, и добавляли 0,407 мл (2,2 экв.) DIEA. Смесь перемешивали на вортексе в течение 16 часов, фильтровали и промывали NMP (2×8 мл), ДХМ (3×8 мл) и NMP (5×8 мл).
Положительный тест TNBS дал бесцветную смолу.
Добавляли 20% пиперидин/NMP (8 мл), давали стоять в течение 10 мин, повторяли еще раз. Фильтровали и промывали NMP (2×8 мл), ДХМ (3×8 мл) и NMP (5×8 мл).
Положительный тест TNBS дал смолу красного цвета.
Ацилирование Fmoc-Glu-OtBu:
0,86 г (2 экв., 2,0 ммоль) Fmoc-Glu-OtBu растворяли в NMP/ДХМ 1:1 (10 мл). Добавляли 0,32 г (2,2 экв., 2,4 ммоль) НОВТ с последующим добавлением 0,37 мл (2,2 экв., 2,4 ммоль) DIC. Реакционной смеси давали стоять в течение 20 мин, а затем переносили ее на смолу и, наконец, добавляли 0,407 мл (2,2 экв.) DIEA. Смесь перемешивали на вортексе в течение 16 часов, фильтровали и промывали NMP (2×8 мл), ДХМ (3×8 мл) и NMP (5×8 мл).
Положительный тест TNBS дал бесцветную смолу.
Добавляли 20% пиперидин/NMP (8 мл), давали стоять в течение 10 мин, повторяли еще раз. Фильтровали и промывали NMP (2×8 мл), ДХМ (3×8 мл) и NMP (5×8 мл).
Положительный тест TNBS дал смолу красного цвета.
Ацилирование октадекандикислоты моно-трет-бутиловым эфиром:
0,75 г (2 экв., 2,0 ммоль) Октадекандикислоты моно-трет-бутилового эфира растворяли в NMP/ДХМ 1:1 (10 мл). Добавляли 0,32 г (2,2 экв., 2,4 ммоль) НОВТ с последующим добавлением 0,37 мл (2,2 экв., 2,4 ммоль) DIC. Реакционной смеси давали стоять в течение 20 мин, а затем переносили ее на смолу и, наконец, добавляли 0,41 мл (2,2 экв.) DIEA. Смесь перемешивали на вортексе в течение 16 часов, фильтровали и промывали NMP (2×8 мл), ДХМ (3×8 мл) и NMP (5×8 мл).
Отщепление ТФУ:
8 мл 5% ТФУ/ДХМ добавляли к смоле, и реакционную смесь перемешивали на вортексе в течение 2 часов, фильтровали, и фильтрат собирали. К смоле добавляли дополнительное количество 5% ТФУ/ДХМ (8 мл), и смесь перемешивали на вортексе в течение 10 мин, фильтровали и промывали смолу ДХМ (2×10 мл). рН объединенных фильтратов и промывок доводили до основного, используя примерно 800 мкл DIEA. Смесь выпаривали в вакууме с получением масла (3,5 г). Добавляли диэтиловый эфир (30 мл), и не растворившееся масло отделяли декантацией и выпаривали в вакууме. Таким образом, получили 1,1 г 17-{(S)-1-трет-бутоксикарбонил-3-[2-(2-{[2-(2-карбоксиметоксиэтокси)-этилкарбамоил]метокси}этокси)этилкарбамоил]пропилкарбамоил}гептадекановой кислоты трет-бутилового эфира (альтернативное название: трет-бутилоктадекандиоил-Glu(ОЕС-ОЕС-ОН)-OTBU) в виде масла.
ЖХ-МС (Sciex100 API): m/z=846,6 (M+1)+.
OSu-активация:
Вышеописанный трет-бутилоктадекандиоил-Glu(OEG-OEG-ОН)-OTBU (0,63 г) растворяли в ТГФ (35 мл). Добавляли DIEA (0,255 мл, 2 экв.) с последующим добавлением TSTU (0,45 г, 2 экв.), и смесь перемешивали при комнатной температуре в течение 16 часов. Смесь распределяли между этилацетатом (250 мл) и водным NaHSO4 (3×100 мл). Органическую фазу высушивали (MgSO4) и концентрировали в вакууме с получением 0,65 г 17-((S)-1-трет-бутоксикарбонил-3-{2-[2-({2-[2-(2,5-диоксопирролидин-1-илоксикарбонилметокси)этокси]этилкарбамоил}метокси)этокси]этилкарбамоил}-пропилкарбамоил)гептадекановой кислоты трет-бутилового эфира (альтернативное название: трет-бутилоктадекандиоил-Glu(OEG-OEG-OSu)-OTBU) в виде масла.
ЖХ-МС: m/z=943,4 (М+1)+.
Пример 5, Общая методика (А):
A22K(Nε-3-(3-{4-[3-(13-
Карбокситридеканоиламино)пропокси]бутокси}пропилкарбамоил)пропионил-γGlu), B29R, desB30 человеческий инсулин
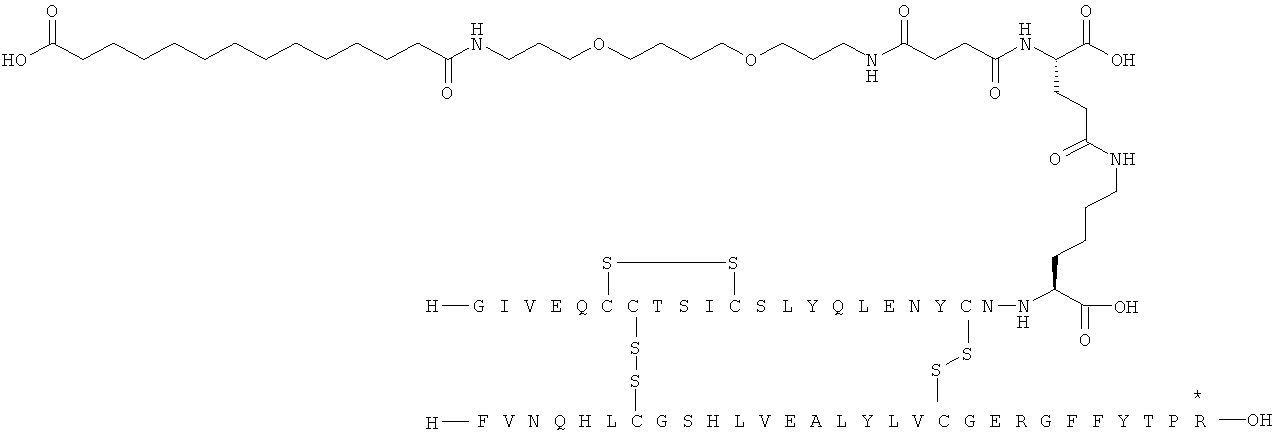
ЖХ-МС (электрораспыление): m/z=1630, (M+4)+/4
Пример 6, Общая методика (А):
A22K(Nε-[2-(2-[2-(2-[2-(Эйкозандиоил-γGlu)амино]этокси)этокси]ацетиламино)этокси]этокси)ацетил]), B29R, desB30 человеческий инсулин
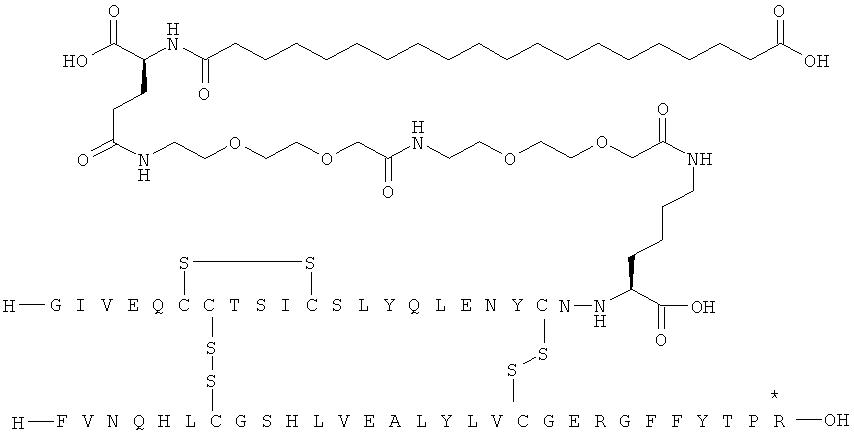
MALDI-MC (матрица: синапиновая кислота); m/z: 6606
Пример 7, Общая методика (А):
А14Е, A22K(Nε-[2-(2-[2-(2-[2-(Октадекандиоил-γGlu)амино]этокси)этокси]-ацетиламино)этокси]этокси)ацетил]), В25Н, B29R, desB30 человеческий инсулин
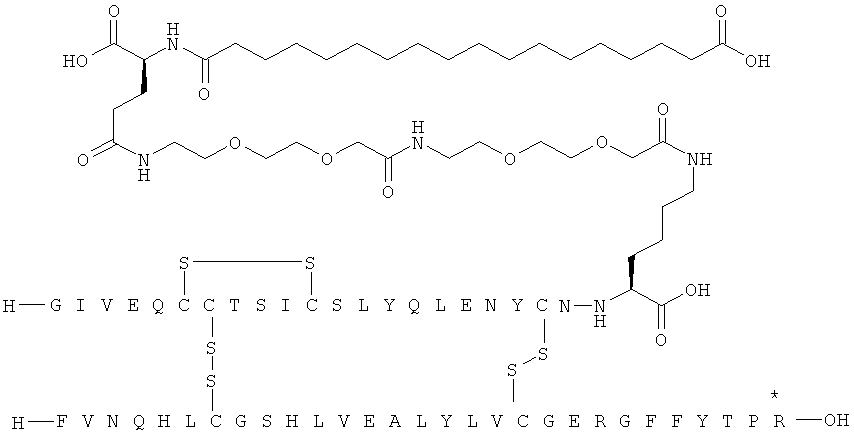
ЖХ-МС (электрораспыление): m/z=1634, (N+4)+/4
Пример 8, Общая методика (А):
A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-аминоэтокси)этокси]-ацетиламино}этокси)этокси]ацетил), desB29, desB30 человеческий инсулин
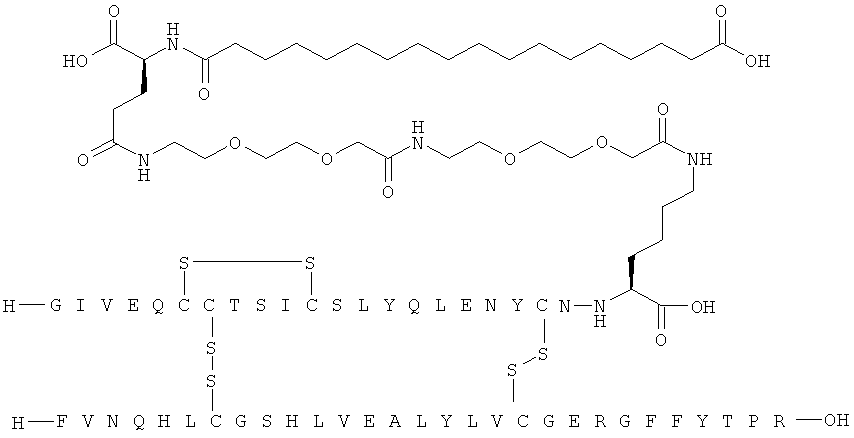
63 мг A22K(Nε-октадекандиоил-γGlu-[2-(2-{2-[2-(2-аминоэтокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин (пример 4) растворяли в Трис-буфере, рН 8 (50 мМ, 10 мл), и добавляли карбоксипептидазу В, иммобилизованную на сефарозном геле в Трис-буфере, рН 8 (50 мМ, 0,2 мл), содержащем 20% этанол, и смесь осторожно встряхивали в течение 16 часов при комнатной температуре. Добавляли дополнительное количество карбоксипептидазы В, иммобилизованной на сефарозном геле в Трис-буфере, рН 8 (50 мМ, 0,8 мл), содержащем 20% этанол, и смесь осторожно встряхивали в течение 24 часов. Смесь фильтровали, и фильтр промывали Трис-буфером, рН 8 (50 мМ, 0,8 мл), содержащим 20% этанол. Объединенные фильтраты и промывки лиофилизировали. Остаток очищали ВЭЖХ с получением инсулина, указанного в заголовке.
MALDI-TOF MC: m/z=6424
Пример 9, Общая методика (А):
А14Е, A22K(Nε-Эйкозандиоил-γGlu-(3-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)пропионил)), В25Н, B29R, desB30 человеческий инсулин
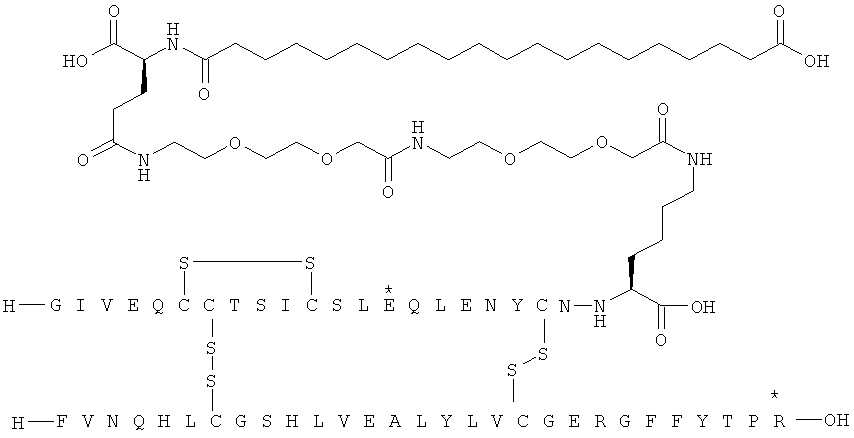
Получение реагента ацилирования 19-{1-трет-Бутоксикарбонил-3-[2-(2-{2-[2-(2-карбоксиэтокси)этокси]этокси}-этокси)этилкарбамоил]пропилкарбамоил}нонадекановой кислоты трет-бутилового эфира N-гидроксисукцинимида эфира и сочетание с исходным инсулином:
Икозандикислоты трет-бутиловый эфир N-гидроксисукцинимид эфир:
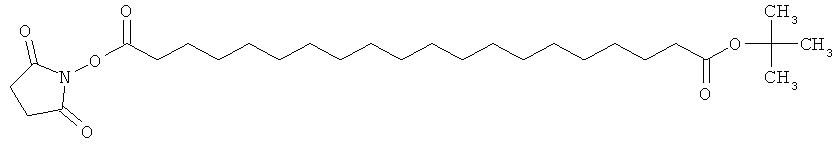
Эйкозандикислоты моно-трет-бутиловый эфир (5 г, 12,54 ммоль) и TSTU (4,53 г, 15,05 ммоль) смешивали в ТГФ (50 мл), добавляли DIPEA (2,62 мл), и полученную в результате мутную смесь перемешивали при КТ в течение 2 ч, затем добавляли ДМФ (30 мл) с получением в результате прозрачного раствора, который далее перемешивали в течение ночи. Полученную в результате смесь выпаривали почти до сухости, и остаток смешивали с холодным ацетонитрилом, что приводило в результате к выпадению осадка. Этот осадок отфильтровывали и высушивали в вакууме в течение ночи с получением 6,01 г (97%) икозандикислоты трет-бутилового эфира N-гидроксисукцинимида эфира.
МС (электрораспыление): m/z: 440 (М-56 (tBu)).
2-(19-трет-Бутоксикарбонилнонадеканоиламино)пентандикислоты 1-трет-бутиловый эфир
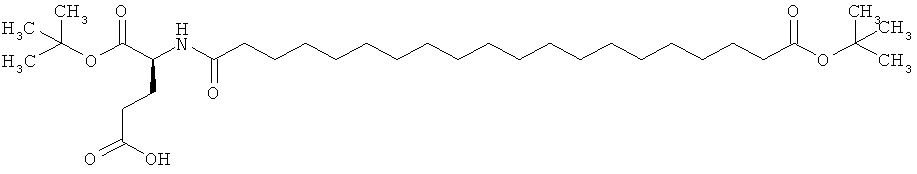
Икозандикислоты трет-бутиловый эфир 2,5-диоксопирролидин-1-иловый эфир (6,01 г, 12,124 ммоль) растворяли в ТГФ (150 мл) и смешивали с суспензией H-Glu-OtBu (2,71 г, 13,33 ммоль) в ДМФ/воде (1/1, 40 мл).
В результате получили гелеобразный раствор, который нагревали до получения прозрачного раствора, который перемешивали при КТ в течение 3 ч. Затем раствор выпаривали, добавляли 100 мл воды, и смесь нагревали до 60°С, в результате чего получили раствор, который кристаллизовался при охлаждении. Осадок перекристаллизовали из ацетонитрила, и кристаллы высушивали в вакууме. Выход 6,82 г (96%).
МС (электрораспыление): m/z 584 (М+1).
2-(19-трет-Бутоксикарбонилнонадеканоиламино)пентандикислоты 1-трет-бутиловый эфир 5-(2,5-диоксопирролидин-1-ил)эфир
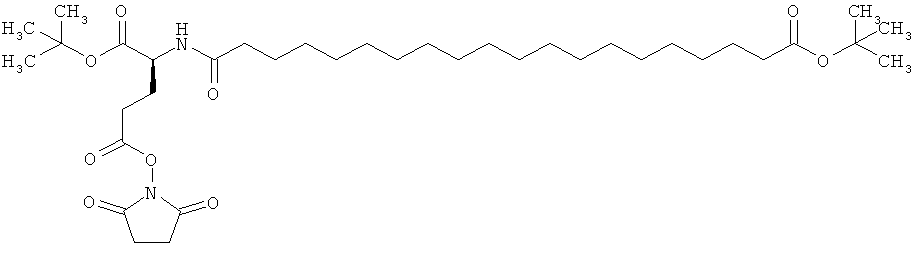
2-(19-трет-Бутоксикарбонилнонадеканоиламино)пентандикислоты 1-трет-бутиловый эфир (6,52 г, 11,17 ммоль) растворяли в ТГФ (100 мл), добавляли DIPEA (2,14 мл), а затем раствор TSTU (3,70 г, 12,29 ммоль) в ацетонитриле (25 мл). Смесь перемешивали в течение ночи при КТ, затем ее выпаривали с получением в результате коричневатого остатка, который перекристаллизовали из ацетонитрила. После охлаждения в течение ночи при 5°С образовался порошок. Этот порошок растворяли в ТГФ и высушивали MgSO4, фильтровали и выпаривали до сухости с получением 6,17 г (81%) соединения, указанного в заголовке.
МС (электрораспыление): m/z: 681 (М+1).
19-{1-трет-Бутоксикарбонил-3-[2-(2-{2-[2-(2-карбоксиэтокси)этокси}этокси]этокси)этилкарбамоил]пропилкарбамоил}-нонадекановой кислоты трет-бутиловый эфир
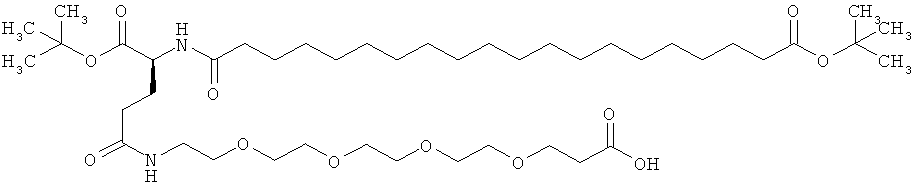
2-(19-трет-Бутоксикарбонилнонадеканоиламино)пентандикислоты 1-трет-бутиловый эфир 5-(2,5-диоксопирролидин-1-ил)эфир (0,56 г, 0,822 ммоль) растворяли в ТГФ (20 мл), добавляли 3-(2-{2-[2-(2-аминоэтокси)-этокси]этокси}этокси)пропионовую кислоту (0,22 г, 0,82 ммоль) в ТГФ (20 мл), и смесь перемешивали при КТ в течение 3 ч. ЖХМС показала, что реакция завершена (МС: m/z 831 (М+1)), и реакционную смесь использовали непосредственно для следующей реакции с TSTU.
19-(1-трет-Бутоксикарбонил-3-{2-[2-(2-{2-[2-(2,5-диоксопирролидин-1-илоксикарбонил)этокси]этокси}этокси)этокси]этилкарбамоил}-пропилкарбамоил)нонадекановой кислоты трет-бутиловый эфир
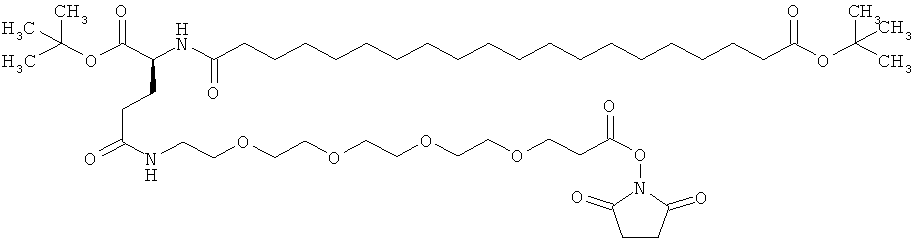
19-{1-трет-Бутоксикарбонил-3-[2-(2-{2-[2-(2-карбоксиэтокси)этокси]этокси}этокси)этилкарбамоил]пропилкарбамоил}-нонадекановой кислоты трет-бутиловый эфир (0,68 г сырого раствора в ТГФ 40 мл, 0,82 ммоль) и TSTU (0,296 г, 0,982 ммоль) смешивали, рН доводили добавлением DIPEA (0,171 мл), и полученную в результате смесь перемешивали при КТ в течение ночи. В результате этого получили прозрачный раствор, который выпаривали до сухости и обрабатывали диэтиловым эфиром с получением 1,2 г соединения, указанного в заголовке, в виде восковой массы, которую использовали без дальнейшей очистки.
МС (электрораспыление): m/z 816 (М-2 tBu) (вычислено 816).
Сочетание 19-(1-трет-бутоксикарбонил-3-{2-[2-(2-{2-[2-(2,5-диоксопирролидин-1-илоксикарбонил)этокси]этокси}этокси)этокси]этилкарбамоил}-пропилкарбамоил)нонадекановой кислоты трет-бутилового эфира с А14Е, A22K, В25Н, B29R, desB30 человеческим инсулином:
А14Е, A22K, В25Н, B29R, desB30 человеческий инсулин (0,3 г, 0,052 ммоль) растворяли в смеси ацетонитрила (4 мл) и Na2CO3 (0,1 М, 10 мл), рН доводили до 10,6 NaOH (1 М). К раствору добавляли 19-(1-трет-бутоксикарбонил-3-{2-[2-(2-{2-[2-(2,5-диоксопирролидин-1-илоксикарбонил)этокси]этокси}этокси)этокси]-этилкарбамоил}пропилкарбамоил)нонадекановой кислоты трет-бутиловый эфир (0,048 г, 0,052 ммоль) в ацетонитриле (4 мл), и смесь мягко перемешивали при КТ в течение 1 ч. Добавляли 5 капель раствора метиламина (40% в МеОН), и смесь перемешивали в течение следующих 5 мин. Затем добавляли уксусную кислоту (ледяную, 5 мл) одной порцией, и полученную в результате смесь очищали препаративной ВЭЖХ (колонка С18, 3 см, градиент 0-7 мин 20% ацетонитрил, 7-32 мин 20-100% ацетонитрил, 32-37 мин 100% ацетонитрил).
Чистые фракции объединяли и лиофилизировали.
Полученное в результате соединение растворяли в ТФУ (30 мл) и перемешивали при КТ в течение 2 ч, затем добавляли ацетонитрил (20 мл) и воду (20 мл), и смесь очищали препаративной ВЭЖХ (колонка С18, 3 см, градиент 0-7 мин 20% ацетонитрил, 7-32 мин 20-60% ацетонитрил, 32-37 мин 60% ацетонитрил).
Чистые фракции объединяли и лиофилизировали.
После повторной очистки ВЭЖХ (колонка С18, 3 см, градиент 0-7 мин 25% ацетонитрил, 7-47 мин 25-60% ацетонитрил, 47-52 мин 60% ацетонитрил) чистые фракции объединяли и лиофилизировали.
В результате этого получили 13 мг конечного продукта.
МС (электрораспыление): m/z 6520 (вычислено 6520).
Пример 10, Общая методика (А):
A18L, A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-аминоэтокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
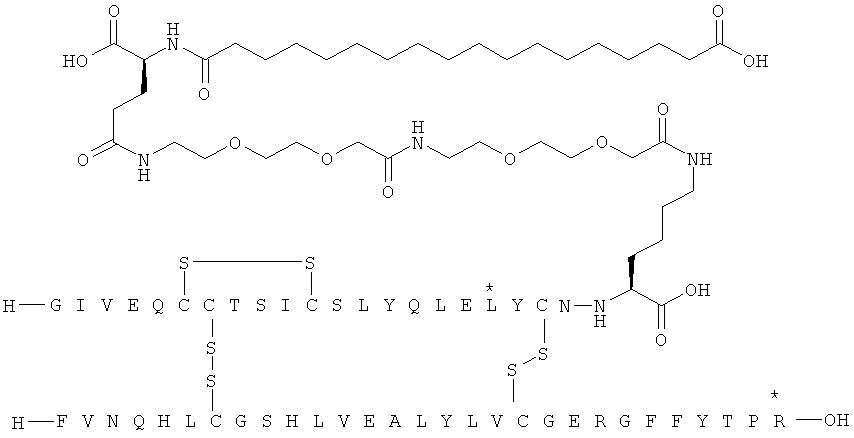
МС (электрораспыление): m/z: 6578 (Вычислено: 6578).
Пример 11, Общая методика (А):
А8Н, A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
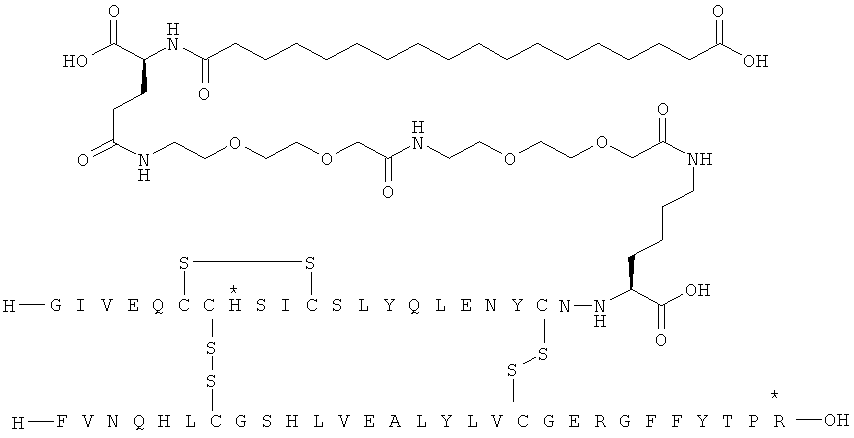
MALDI-TOF МС: m/z=6615 (Вычислено: 6615).
Пример 12, Общая методика (А):
A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]ацетил-γGlu), B29R, desB30 человеческий инсулин
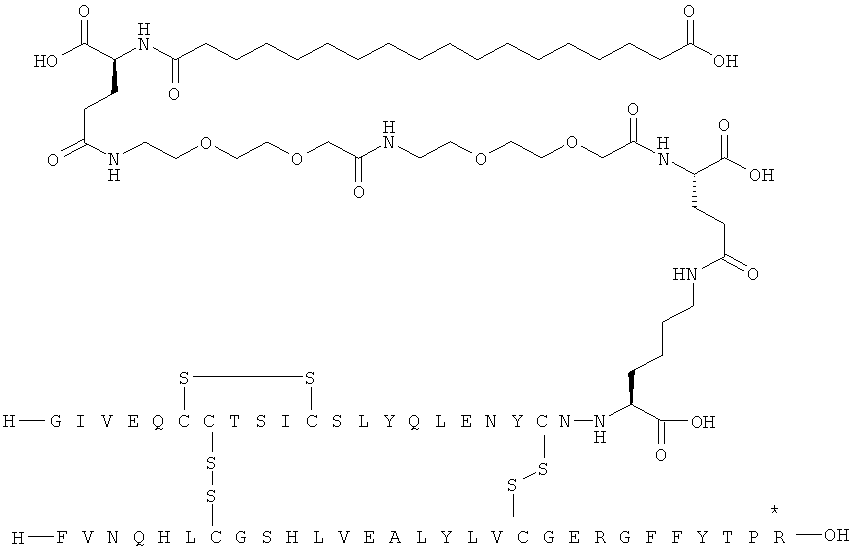
МС (электрораспыление): m/z=1677 (m+4)/4.
Пример 13, Общая методика (А):
A22K(Nε-Эйкозандиоил-γGlu-(3-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)этокси]этокси}пропионил)), B29R, desB30 человеческий инсулин
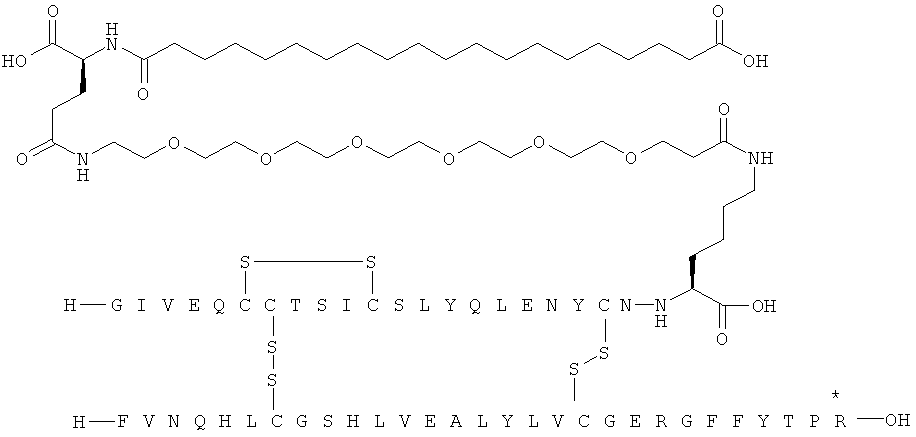
МС (электрораспыление): m/z=6653 (Вычислено: 6653).
Пример 14, Общая методика (А):
A22K(Nε-Октадекандиоил-γGlu-(3-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)пропионил)), B29R, desB30 человеческий инсулин
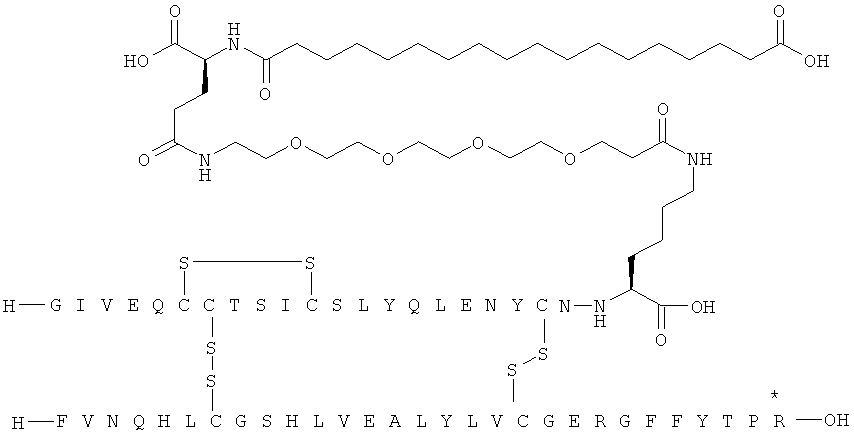
MALDI-TOF MC: m/z=6535 (Вычислено: 6535)
Пример 15, Общая методика (А):
А14Е, A22K(Nε-Октадекандиоил-γGlu-(3-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)этокси]этокси}этокси)этокси]пропионил)), В25Н, B29R, desB30 человеческий инсулин
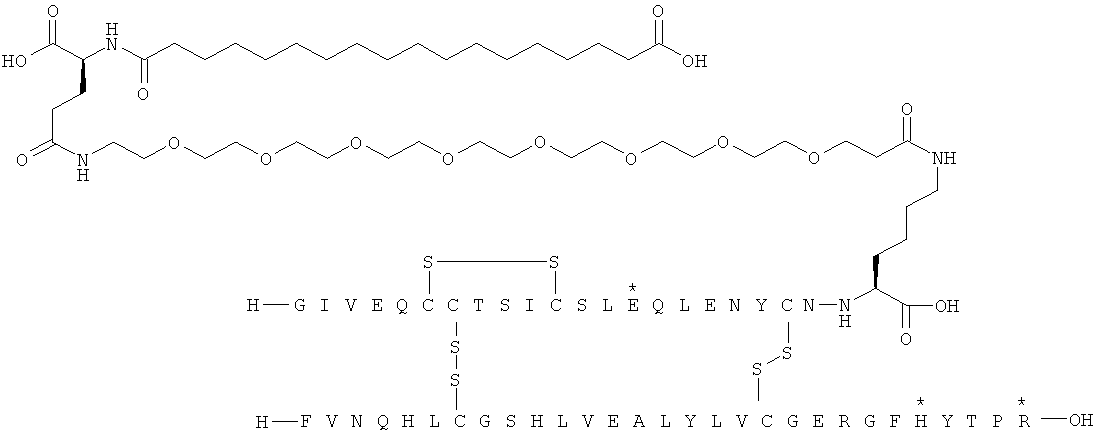
MC (электрораспыление): m/z=1667,9 (m+4)/4.
Пример 16, Общая методика (А):
А14Е, A22K(Nε-Эйкозандиоил-γGlu-γGlu-(3-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)этокси]этокси}этокси)этокси]пропионил)), В25Н, B29R, desB30 человеческий инсулин
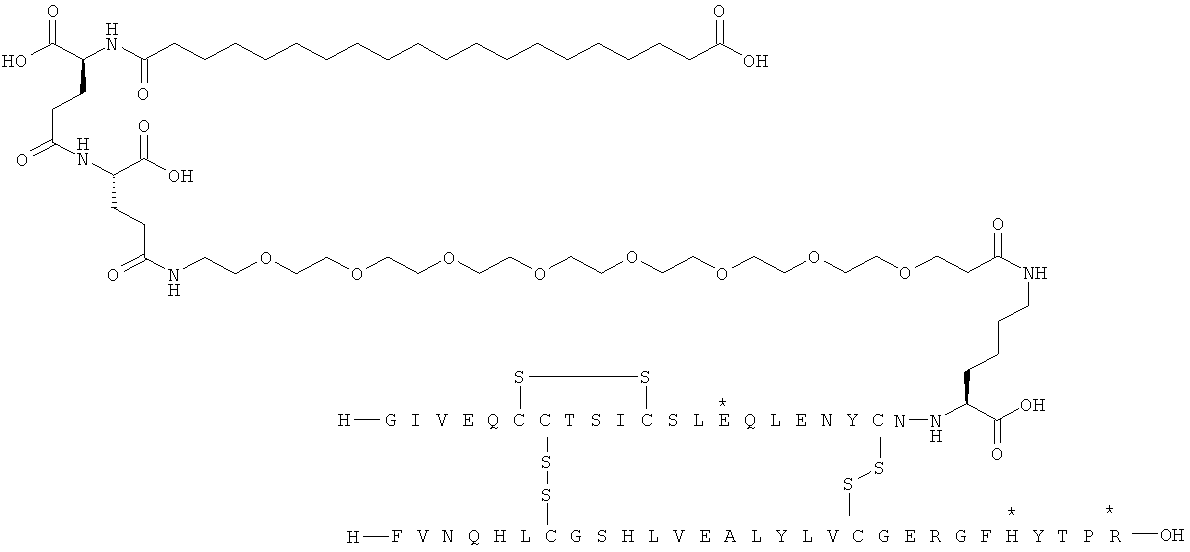
MALDI-TOF MC: m/z=6824 (Вычислено: 6825)
Пример 17, Общая методика (А):
А14Е, A22K(Nε-Октадекандиоил-γGlu-(3-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)пропионил)-γGlu), В25Н, B29R, desB30 человеческий инсулин
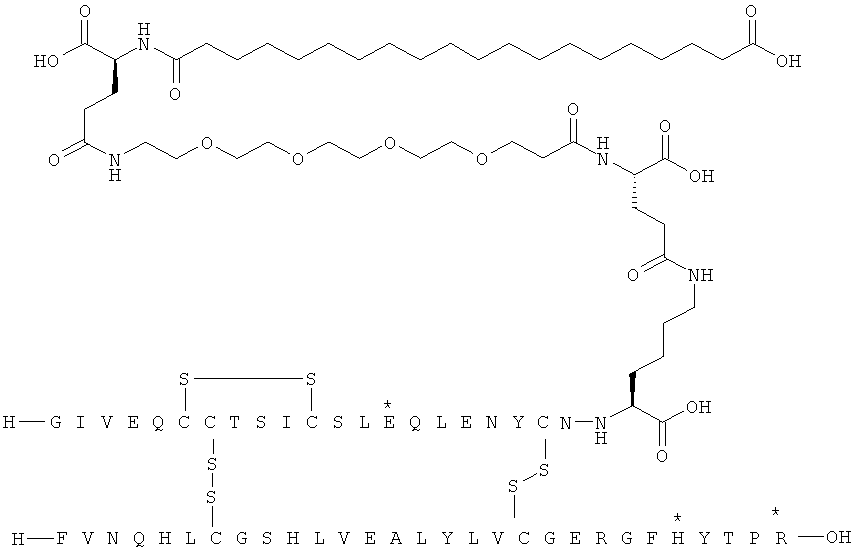
MALDI-TOF MC: m/z=6620 (Вычислено: 6621)
Пример 18, Общая методика (А):
A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]ацетил), В28Е, B29R, desB30 человеческий инсулин
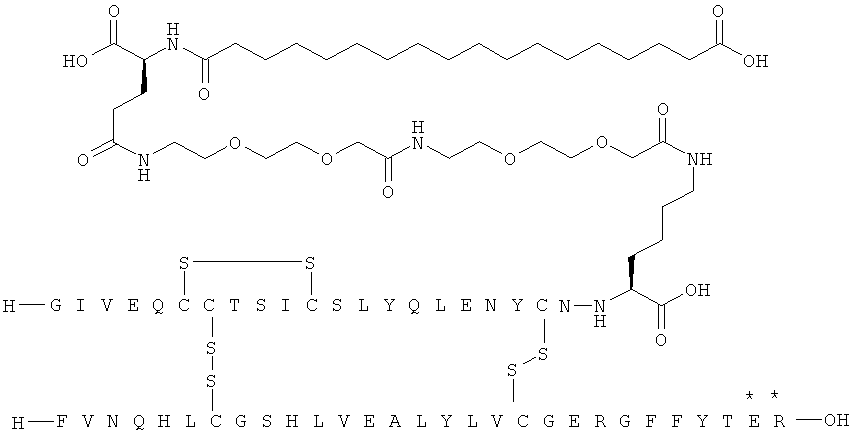
MALDI-TOF MC: m/z=6610 (Вычислено: 6610)
Пример 19, Общая методика (А):
A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
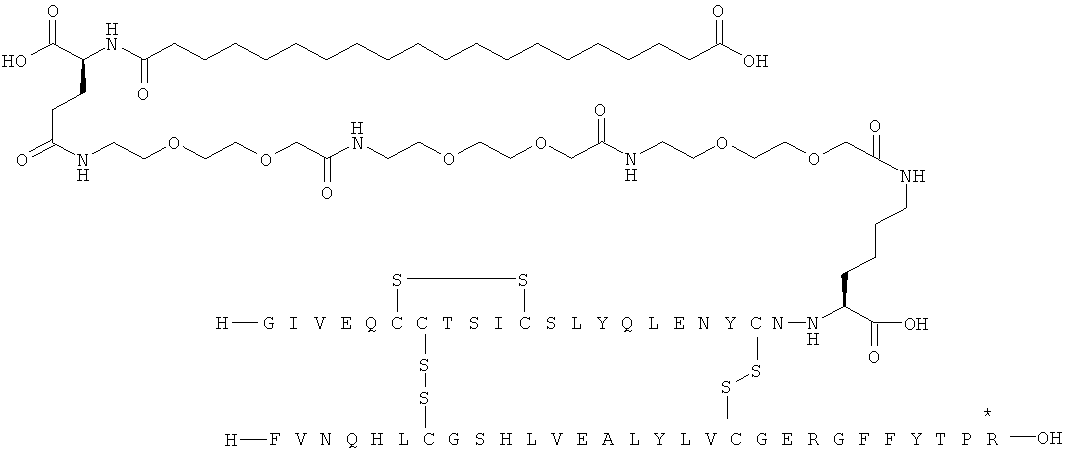
MALDI-TOF MC: m/z=6724 (Вычислено: 6724)
Инсулины в приведенных ниже примерах могут быть получены с использованием подобных методик:
Пример 20:
А14Е, A22K(Nε-[2-(2-[2-(2-[2-(Эйкозандиоил-γGlu)амино]этокси)этокси]-ацетиламино)этокси]этокси)ацетил]), В25Н, B29R, desB30 человеческий инсулин
Пример 21:
A22K(Nε-Октадекандиоил-(3-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)-пропионил-γGlu), B29R, desB30 человеческий инсулин
Пример 22:
A22K(Nε-Эйкозандиоил-(3-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)-пропионил-γGlu), B29R, desB30 человеческий инсулин
Пример 23:
A22K(Nε-Октадекандиоил-(2-аминоэтил-ПЭГ2000-илацетил)), B29R desB30 человеческий инсулин
Пример 24:
A22K(Nε-Эйкозандиоил-(2-аминоэтил-ПЭГ2000-илацетил)), B29R desB30 человеческий инсулин
Пример 25:
A22K(Nε-3-(3-{4-[3-(15-Карбоксипентадеканоиламино)пропокси]бутокси}-пропилкарбамоил)пропионил-γGlu), B29R desB30 человеческий инсулин
Пример 26:
A22K(Nε-3-(3-{4-[3-(17-Карбоксигептадеканоиламино)пропокси]бутокси}-пропилкарбамоил)пропионил-γGlu), B29R desB30 человеческий инсулин
Пример 27:
A22K(Nε-Тетрадекандиоил-(3-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)-пропионил-γGlu), B29R, desB30 человеческий инсулин
Пример 28:
А8Н, A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 29:
A18L, A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 30:
A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)- этокси]ацетиламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 31:
А8Н, A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)-этокси]ацетиламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 32:
A18L, A22K(Nε-Октадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)-этокси]ацетиламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 33:
А8Н, A22K(Nε-Эйкозандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 34:
А8Н, A22K(Nε-Эйкозандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 35:
A18L, A22K(Nε-Эйкозандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 36:
A22K(Nε-Эйкозандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)-этокси]ацетиламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 37:
А8Н, A22K(Nε-Эйкозандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)-этокси]ацетиламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 38:
A18L, A22K(Nε-Эйкозандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)-этокси]ацетиламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 39:
А8Н, A22K(Nε-Гексадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 40:
А8Н, A22K(Nε-Гексадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 41:
A18L, A22K(Nε-Гексадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]-ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 42:
A22K(Nε-Гексадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)-этокси]ацетиламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 43:
А8Н, A22K(Nε-Гексадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)-этокси]ацетиламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 44:
A18L, A22K(Nε-Гексадекандиоил-γGlu-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)-этокси]ацетиламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 45:
A22K(Nε-Гексадекандиоил-γGlu-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 46:
А8Н, A22K(Nε-Гексадекандиоил-γGlu-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 47:
A18L, A22K(Nε-Гексадекандиоил-γGlu-[2-(2-{2-[2-(2-аминоэтокси)этокси]ацетиламино}этокси)этокси]ацетил), B29R, desB30 человеческий инсулин
Пример 48:
Связывание производных инсулина по данному изобретению с рецептором инсулина
Сродство ацилированных аналогов инсулина по данному изобретению к рецептору человеческого инсулина определяли с помощью анализа САС (сцинтилляционного анализа сближения) в анализе иммобилизации антитела на микротитрационных планшетах. Гранулы, связывающие антитело, SPA-PVT, реагент против мыши (Amersham Biosciences, № по каталогу PRNQ0017) смешивают с 25 мл связывающего буфера (100 мМ ГЭПЭС рН 7,8; 100 мМ хлорид натрия, 10 мМ MgSO4, 0,025% Твин-20). Смесь реагентов для одного Packard Optiplate (Packard No. 6005190) состоит из 2,4 мкл разведенного 1:5000 очищенного рекомбинантного рецептора человеческого инсулина (с экзоном 11 или без экзона 11), количества исходного раствора A14Tyr[125I]-человеческого инсулина, соответствующего 5000 имп/мин на 100 мкл смеси реагентов, 12 мкл разведения 1:1000 антитела F12, 3 мл SPA-гранул и связывающего буфера до суммарного объема 12 мл. Затем всего 100 мкл смеси реагентов добавляют в каждую лунку в Packard Optiplate и готовят серию разведений производного инсулина в Optiplate для соответствующих образцов. Затем образцы инкубируют в течение 16 часов при мягком встряхивании. Затем фазы разделяют центрифугированием в течение 1 мин, и планшеты помещают в счетчик Topcounter. Данные по связыванию аппроксимировали, используя алгоритм нелинейной регрессии в GraphPad Prism 2.01 (GraphPad Software, San Diego, CA).
Значения сродства к рецептору инсулина избранных инсулинов по изобретению:
|
Пример 49:
Эффект снижения глюкозы в крови у крысы после i.v. болюсной инъекции производных инсулина по данному изобретению
Самцов крыс линии Вистар, 200-300 г, голодавших в течение 18 ч, анестезируют, используя любой из препаратов Hypnorm-Dormicum s.c. (1,25 мг/мл Dormicum, 2,5 мг/мл флуанизон, 0,079 мг/мл фентанила цитрат) 2 мл/кг в качестве возбуждающей дозы (к моменту времени - 30 мин перед дозированием испытуемого вещества) и дополнительно 1 мл/кг каждые 20 минут.
Животных дозируют внутривенной инъекцией (хвостовая вена), 1 мл/кг, контрольных и испытуемых соединений (обычный диапазон дозы 0,125-20 нмоль/кг). Образцы крови для определения концентрации глюкозы в цельной крови собирают в гепаринизированные 10 мкл стеклянные пробирки с помощью пункции капиллярных сосудов в кончике хвоста в момент времени - 20 мин и 0 мин (перед дозированием) и в моменты времени через 10, 20, 30, 40, 60, 80, 120 и 180 мин после дозирования. Концентрации глюкозы в крови измеряют после разведения в аналитическом буфере методом иммобилизованной глюкозооксидазы, используя автоматический анализатор EBIO Plus (Eppendorf, Germany). Вычисления средних значений концентрации глюкозы в плазме (среднее ± СОС) получают для каждой дозы и каждого соединения.
Пример 50:
Эффективность ацилированных аналогов инсулина по данному изобретению относительно человеческого инсулина
Для эксперимента локальной фиксации использовали самцов крыс линии Спрэг-Доули массой 238-383 г на сутки эксперимента. Крысы получают свободный доступ к корму при контролируемых условиях окружающей среды и голодают в течение ночи (с 3 pm) перед экспериментом локальной фиксации.
Экспериментальный протокол:
Крыс акклиматизируют в виварии в течение по меньшей мере 1 недели перед операцией. Примерно за 1 неделю до эксперимента локальной фиксации вводят катетеры Tygon под анестезией галотаном в яремную вену (для инфузии) и сонную артерию (для забора крови) и выводят и фиксируют на задней стороне шеи. Крысы получают ветеринарный стрептоциллин (Boehringer Ingelheim; 0,15 мл/крыса, i.m.) после операции и помещают в отделение по уходу за животными (25°С) на период выздоровления. Для получения обезболивания Anorphin (0,06 мг/крыса, s.c.) вводят во время анестезии, и римадил (1,5 мг/кг, s.c.) вводят после полного восстановления после анестезии (2-3 ч) и снова один раз в сутки в течение 2 суток.
В 7 часов утра на сутки эксперимента крыс после ночного голодания (с 3 часов ночи предшествующих суток) взвешивают и соединяют со шприцами для дозирования и инфузионной системой (насосы Harvard 22 Basic, Harvard, и стеклянный шприц Perfectum Hypodermic, Aldrich) а затем помещают в индивидуальные фиксирующие клетки, где они остаются в течение примерно 45 мин до начала эксперимента. Крысы способны свободно передвигаться на своей обычной подстилке в течение всего эксперимента и имеют свободный доступ к питьевой воде. После 30 мин базального периода, в течение которого измеряют уровни глюкозы в плазме, через 10 мин интервалы инфузируют (i.v.) испытуемое производное инсулина и человеческий инсулин (один уровень дозы на крысу, n=6-7 на уровень дозы) при постоянной скорости в течение 300 мин. Уровни глюкозы в плазме измеряют через 10 мин интервалы на протяжении всего эксперимента и доводят инфузию 20% водной глюкозой соответственно в целях поддержания эугликемии. Образцы ресуспендированных эритроцитов объединяют от каждой крысы и возвращают в объемах примерно 0,5 мл через каротидный катетер.
На сутки эксперимента берут пробы растворов индивидуальных испытуемых производных инсулина и раствор человеческого инсулина перед экспериментами и по окончании экспериментов локальной фиксации, и концентрации пептидов подтверждают с помощью ВЭЖХ. Концентрации в плазме инсулина крысы и С-пептида, а также испытуемого производного инсулина и человеческого инсулина измеряют в соответствующие моменты времени перед исследованиями и по окончании исследований. Крыс умерщвляют по окончании эксперимента, используя передозировку пентобарбитала.
Пример 51:
Легочная доставка производных инсулина крысам
Испытуемое вещество дозируют легочным путем способом инстилляции каплями. Кратко, самцов крыс линии Вистар (примерно 250 г) анестезируют 60 мл фентанила/дигидробензперидола/-Dormicum, даваемого в виде возбуждающей дозы 6,6 мл/кг s.c. с последующими 3 поддерживающими дозами 3,3 мл/кг s.c. с интервалом 30 мин. Через десять минут после индукции анестезии получают базальные образцы из хвостовой вены (t=-20 мин) с последующим взятием базального образца сразу после дозирования испытуемого вещества (t=0). При t=0 испытуемое вещество дозируют внутритрахеально в одно легкое. Специальную канюлю с закругленным концом закрепляют на шприце, содержащем 200 мкл воздуха и испытуемое вещество (1 мл/кг). Через ротовое отверстие канюлю вводят в трахею и продвигают в один из главных бронхов - сразу после прохождения бифуркации. В процессе введения шею пальпируют снаружи для гарантии внутритрахеального положения. Содержимое шприца впрыскивают с последующей 2-секундной паузой. Затем канюлю медленно вытягивают. Крыс держат под анестезией во время испытания (образцы крови в течение вплоть до 4 или 8 ч) и подвергают эвтаназии после эксперимента.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 представляет собой цепь А1-А21 примеров 1-6, 8, 12-14, 18 и 19. SEQ ID NO:2 представляет собой цепь В1-В29 примеров 1-6, 10-14 и 19. SEQ ID NO:3 представляет собой цепь А1-А21 примеров 7, 9 и 15-17. SEQ ID NO:4 представляет собой цепь В1-В29 примеров 7, 9 и 15-17. SEQ ID NO:5 представляет собой цепь А1-А21 примера 10. SEQ ID NO:6 представляет собой цепь А1-А21 примера 11. SEQ ID NO:7 представляет собой цепь В1-В29 примера 18. SEQ ID NO:8 представляет собой цепь В1-В28 примера 8.