Результат интеллектуальной деятельности: ПЕРОРАЛЬНЫЕ ОСНОВА И ПРЕПАРАТ В ФОРМЕ ПЛЕНКИ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к основе в форме пленки и препарату (лекарственному препарату) в форме пленки, которые быстро растворяются во рту. Более конкретно, настоящее изобретение относится к основе в форме пленки для перорального применения и к препарату в форме пленки для перорального применения, которые быстро растворяются во рту, в результате чего лекарственное средство всасывается через желудочно-кишечный тракт или слизистую оболочку полости рта.
Уровень техники
Препараты в форме пленки, ленты или листа пригодные для перорального применения, которые распадаются или растворяются слюной без пережевывания, уже доступны в виде десяти или более препаратов выпускаемых без рецепта (OTC препараты) за рубежом. В Японии эти препараты доступны в виде нескольких рецептурных лекарственных препаратов.
Такой препарат в форме пленки содержит лекарственное средство, диспергированное или растворенное в основе в форме пленки. В примерном способе его получения водорастворимый полимер растворяют в растворителе, и там же растворяют или диспергируют лекарственное средство, и полученную дисперсию или раствор формуют в пленку, и затем высушивают.
В следующей патентной литературе раскрыты такие препараты в форме пленки. В патентном источнике литературы 1 раскрыт препарат, включающий в себя основание в форме пленки, образованное из танина и гидроксипропилцеллюлозы или смеси гидроксипропилцеллюлозы и поливинилпирролидона, а также лекарственного средства, добавленного к основе в форме пленки. В патентном источнике литературы 2 раскрыт препарат в форме пленки, содержащий лекарственное средство, агент, образующий съедобную водорастворимую пленку и гидроксипропилцеллюлозу с низкой степенью замещения. В патентном источнике литературы 3 раскрыт быстрорастворимый препарат в форме пленки, содержащий лекарственное средство и съедобное полимерное вещество, обладающий прочностью на разрыв и сопротивлением растяжению в пределах заданных диапазонов и растворяющийся во рту за 60 секунд. В патентном источнике литературы 4 раскрыта растворимая пленка, которая содержит активный ингредиент, обладающий растворимостью в воде менее, чем около 1 г/4 мл при комнатной температуре и имеет содержание воды менее, чем около 15 масс. %.
В патентном источнике литературы 5 раскрыт быстрорастворимый препарат хотя и не в форме пленки, который может быть получен путем растворения/диспергирования лекарственного средства, сахарида и поливинилпирролидона в органическом растворителе для приготовления суспензии, заполнения формы для препаратов суспензией и удаления органического растворителя.
Тем не менее, многие из препаратов в форме пленки, которые были раскрыты до сих пор, содержат сахар или сахарный спирт в качестве наполнителя для обеспечения прочности пленки. Сахар или сахарный спирт находится в форме, когда они растворены или рекристаллизованы в растворителе. По этой причине эти традиционные препараты в форме пленки дают ощущение липкости во рту, связанное с водорастворимым полимером. Кроме того, проблемой также является ощущение липкости, возникающее при обращении с препаратами пальцами.
Для решения таких проблем в патентном источнике литературы 6 раскрыт способ улучшения свойства распадаемости пероральной основы в форме пленки и перорального препарата в форме пленки во рту, при одновременном предотвращении растворения или рекристаллизации сахара или сахарного спирта путем диспергирования частиц сахара или сахарного спирта в пленке, содержащей съедобный полимер. Кроме того, были осуществлены различные исследования размера частиц, добавленных в препараты в форме пленки (см. патентные источники литературы с 7 по 9).
Список ссылок
Патентная литература
Патентный источник литературы 1: Патент Японии №3496727
Патентный источник литературы 2: JP-A 2008-169138
Патентный источник литературы 3: JP-A 2004-43450
Патентный источник литературы 4: JP-T 2007-528876
Патентный источник литературы 5: JP-A H11-116465
Патентный источник литературы 6: WO 2010/087032
Патентный источник литературы 7: WO 2004/066986
Патентный источник литературы 8: WO 2004/045537
Патентный источник литературы 9: WO 2010/103539
Сущность изобретения
Техническая проблема
Когда сахар или сахарный спирт используется в качестве наполнителя, однако, ощущение липкости, сопутствующее поглощению влаги сахаридом отрицательно влияет на тактильное впечатление. Другой проблемой является то, что следует избегать применения таких препаратов для людей с ограничением потребления углеводов (например, тем, для кого необходим контроль уровня сахара в крови). Кроме того, несмотря на то, что были проведены различные исследования размера частиц, добавляемых в препараты в форме пленки (см. например, патентные источники литературы с 7 по 9), не был достаточно изучен способ контроля размера частиц или формы частиц.
Учитывая существующий уровень техники, настоящее изобретение направлено на создание пероральной основы в форме пленки и перорального препарата в форме пленки, которые имеют быстрый профиль растворения во рту и достаточную прочность пленки, дают хорошее тактильное впечатление при обращении с ними пальцами, приятную текстуру и вкус во рту, и являются применимыми для людей с ограничением потребления углеводов.
Решение проблемы
Авторы настоящего изобретения провели различные исследования для решения вышеупомянутых проблем и обнаружили, что пероральная основа в форме пленки и пероральный препарат в форме пленки, если основа в форме пленки содержит дополнительные компоненты, имеют быстрый профиль растворения во рту и достаточную прочность пленки, дают хорошее тактильное впечатление при обращении с ними пальцами, приятную текстуру и вкус во рту, и являются применимыми для людей с ограничением потребления углеводов. Более конкретно основа в форме пленки включает в себя съедобный полимер, растворимый в воде и органическом растворителе с параметром растворимости 9,7 или выше, и по меньшей мере одно соединение, выбранное из группы, состоящей из аминокислоты, дипептида и нуклеотида, диспергированное в форме частиц. Таким образом, было завершено настоящее изобретение.
Настоящее изобретение относится к пероральной основе в форме пленки, включающей в себя съедобный полимер, растворимый в воде и органическом растворителе с параметром растворимости 9,7 или выше, и частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, диспергированного в форме частиц в пероральной основе в форме пленки.
Частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, предпочтительно имеют средний размер частиц от 0,1 до 60 мкм.
Съедобный полимер, растворимый в воде и органическом растворителе с параметром растворимости 9,7 или выше, предпочтительно является твердым при температуре окружающей среды.
Съедобный полимер, растворимый в воде и органическом растворителе с параметром растворимости 9,7 или выше, предпочтительно является по меньшей мере одним из поливинилпирролидона и гидроксипропилцеллюлозы.
Поливинилпирролидон предпочтительно имеет средневесовую молекулярную массу от 2500 до 3000000.
Гидроксипропилцеллюлоза предпочтительно имеет средневесовую молекулярную массу от 10000 до 1150000.
Гидроксипропилцеллюлоза предпочтительно имеет степень гидроксипропоксил-замещения от 50 до 100 %.
Пероральную основу в форме пленки по настоящему изобретению предпочтительно получают с использованием органического растворителя с параметром растворимости 9,7 или выше.
Настоящее изобретение также относится к пероральному препарату в форме пленки, включающему пероральную основу в форме пленки по настоящему изобретению и лекарственное средство, диспергированное или растворенное в пероральной основе в форме пленки.
Настоящее изобретение подробно описано далее.
Пероральная основа в форме пленки по настоящему изобретению содержит съедобный полимер, растворимый в воде и органическом растворителе с параметром растворимости 9,7 или выше, и частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида. Частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, диспергируют в пероральной основе в форме пленки по настоящему изобретению в форме частиц.
Пероральная основа в форме пленки по настоящему изобретению, обладающая такой структурой, имеет быстрый профиль растворения во рту и достаточную прочность пленки, и дает хорошее тактильное впечатление при обращении с основой пальцами и приятную текстуру, и вкус во рту. Кроме того, по сравнению с основами, содержащими сахар или сахарный спирт, пероральная основа в форме пленки по настоящему изобретению, содержащая частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, предотвращает ухудшение тактильного впечатления (придающее ощущение липкости), сопутствующего поглощению влаги сахаридом, и является применимой для людей с ограничением употребления углеводородов.
Фраза "диспергируют в форме частиц", используемая в контексте настоящего документа, относится к форме, в которой частицы не растворены или рекристаллизованы, а диспергированы с сохранением формы частиц. Специалист в данной области техники сможет легко и четко различить аминокислоту и т.п., находящихся в рекристаллизованной форме в основе в форме пленки, от аминокислоты и т.п., находящихся в форме частиц в основе в форме пленки, с помощью микроскопического наблюдения или т.п.
Другими словами, аминокислота и т.п., в пероральной основе в форме пленки спонтанно рекристаллизуются и находятся в рекристаллизованной форме, и, следовательно, имеют непостоянные и негомогенные формы и размеры, которые иногда называют аморфным состоянием. В случае, когда аминокислота и т.п. диспергированы в форме частиц в пероральной основе в форме пленки, производитель контролирует размер частиц при производстве основы в форме пленки так, что аминокислота и т.п. имеют искусственные формы и размеры.
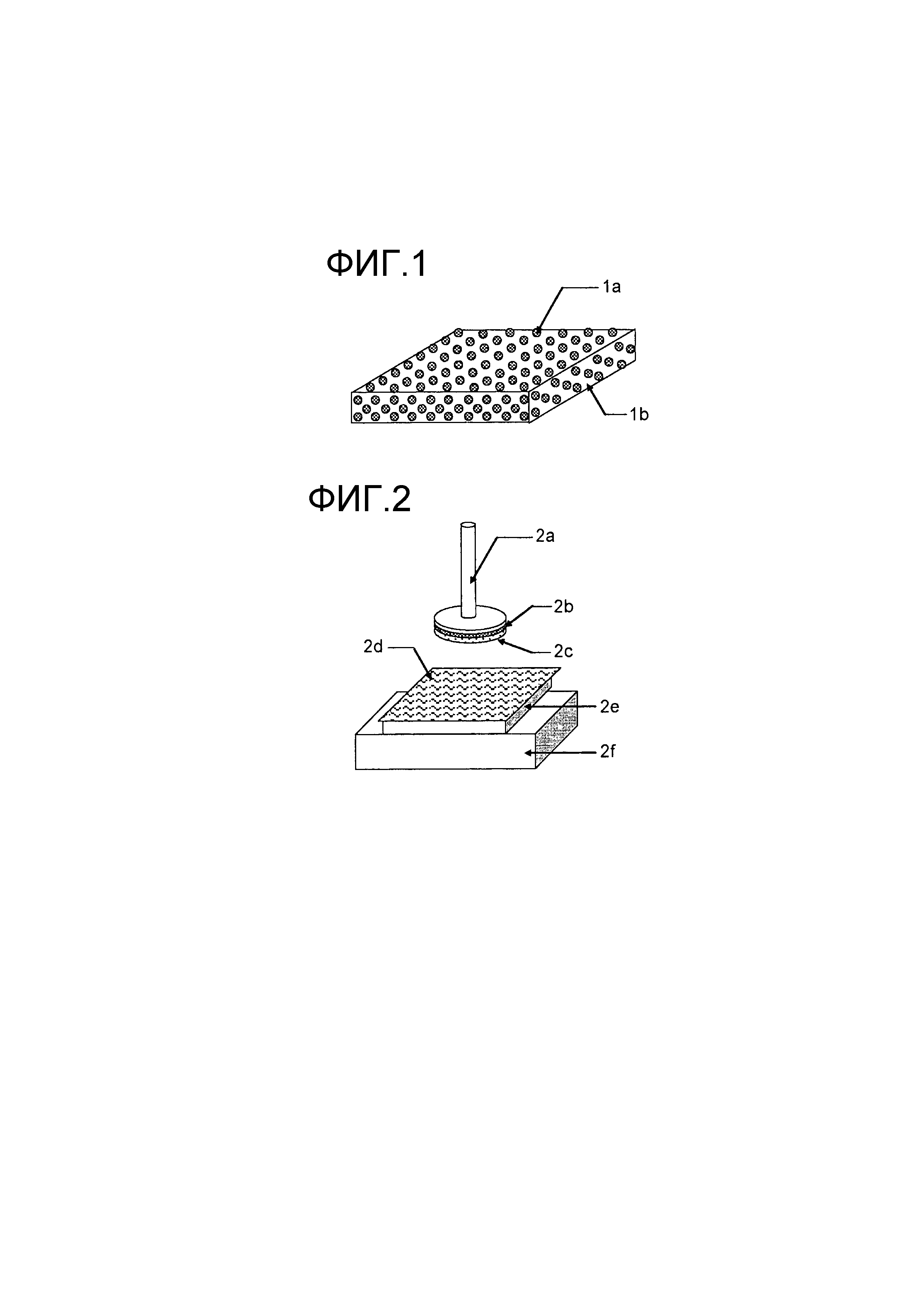
На Фиг. 1 представлено схематическое изображение, иллюстрирующее примерный вариант осуществления пероральной основы в форме пленки по настоящему изобретению. Как показано на Фиг. 1, в пероральной основе в форме пленки по настоящему изобретению частицы 1a по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, диспергированы в форме частиц в съедобной пленке 1b из съедобного полимера.
Частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, добавляют в качестве наполнителя с целью обеспечения прочности пленки.
Частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, предпочтительно являются нерастворимыми в органическом растворителе с параметром растворимости 9,7 или выше.
По меньшей мере одно соединение, выбранное из группы, состоящей из аминокислоты, дипептида и нуклеотида, может быть диспергировано в форме частиц, и размер частиц и форма частиц может контролироваться, при условиях, что используемые частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, имеют указанные выше свойства растворимости, что используется описанный ниже съедобный полимер, растворимый в воде и органическом растворителе с параметром растворимости 9,7 или выше, и что в качестве растворителя при производстве используется органический растворитель с параметром растворимости 9,7 или выше.
Термин "параметр растворимости" (также называемый SP значение), используемый в контексте настоящего документа, относится к квадратному корню ((кал/см3)1/2) от теплоты испарения (кал/см3), необходимой для испарения одного молярного объема жидкости. Когда говорят, что вещество "нерастворимо" в растворителе, количество растворителя, необходимое для растворения 1 г вещества (растворяемого вещества) при температуре 20°С составляет 100 мл или больше. Когда говорят, что вещество "растворимо" в растворителе, количество растворителя, необходимое для растворения 1 г вещества (растворяемого вещества) при температуре 20°C составляет менее 5 мл. Когда говорят, что вещество "легко растворимо" в растворителе, количество растворителя, необходимое для растворения 1 г вещества (растворяемого вещества) при температуре 20°C составляет менее 3 мл.
Для легкого образования частиц, частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, предпочтительно являются твердыми при температуре окружающей среды.
Фраза "твердые при температуре окружающей среды", используемая в контексте настоящего документа, означает отсутствие текучести при 20°C.
Частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, предпочтительно диспергированы в форме частиц сами по себе в пероральной основе в форме пленки по настоящему изобретению, без покрытия, например, микроинкапсулированием или т.п. Такие частицы без покрытия проявляют свое действие немедленно после применения, а их производство не требует сложной процедуры.
Частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, могут иметь любой размер частиц, при условии, что они находятся в форме частиц. Предпочтительно их средний размер частиц составляет от 0,1 до 60 мкм. Если размер частиц составляет менее 0,1 мкм, частицы могут быть агрегированы. В таком случае гибкость пероральной основы в форме пленки может варьироваться от партии к партии. Если размер частиц составляет более 60 мкм, когда пероральная основа в форме пленки, имеющая достаточную толщину, содержит такие частицы, гибкость ее может варьироваться от партии к партии. Более предпочтительно средний размер частиц составляет от 0,5 до 40 мкм.
Средний размер частиц по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, используемый в контексте настоящего документа, обозначает средней размер 50% по объему частиц, измеренный с помощью анализатора распределения частиц по размерам по рассеянию лазерного излучения.
Если частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, имеют средний размер частиц вне диапазона упомянутого выше, частицы могут быть подвергнуты разделению по размерам с тем, чтобы иметь средний размер частиц в пределах вышеуказанного диапазона. Средний размер частиц можно регулировать путем гранулирования, такого как измельчение, сухое измельчение, или влажная грануляция, или путем классификации с помощью сита или классифицирующего устройства.
Выбор аминокислоты не имеет конкретных ограничений, и предпочтительные примеры аминокислот включают в себя глицин, аланин, валин, лейцин, изолейцин, пролин, серин, треонин, цистеин, метионин, аспарагиновую кислоту, глутаминовую кислоту, аспарагин, глутамин, лизин, аргинин, гистидин, фенилаланин, тирозин, триптофан, гидроксипролин и их фармацевтически приемлемые соли. Каждая из этих аминокислот может быть использована по отдельности или две или более из них могут быть использованы в комбинации.
Выбор дипептида не имеет конкретных ограничений, при условии, что дипептид представляет собой молекулу, содержащую две аминокислоты, соединенные пептидной связью. Их предпочтительные примеры включают в себя молекулы, содержащие один вид или разные виды аминокислот, выбранных из вышеуказанных аминокислот, соединенных пептидными связями, и их фармацевтически приемлемые соли. Каждый из этих дипептидов может быть использован по отдельности или два, или более из них могут быть использованы в комбинации.
Выбор нуклеотида не имеет конкретных ограничений, и их предпочтительные примеры включают в себя адениловую кислоту, тимидиловую кислоту, гуаниловую кислоту, цитидиловую кислоту, инозиновую кислоту и их фармацевтически приемлемые соли. Каждый из этих нуклеотидов может быть использован по отдельности или два, или более из них могут быть использованы в комбинации.
Количество частиц по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, предпочтительно составляет от 5 до 80 масс. % от общей массы твердого вещества пероральной основы в форме пленки или перорального препарата в форме пленки по настоящему изобретению. Если количество составляет меньше 5 масс. %, быстрый профиль растворения во рту или достаточная прочность пленки могут быть не достигнуты. В противоположность этому, если количество составляет более 80 масс. %, сохранение формы продукта может быть невыгодно снижено, если размер частиц по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, значительно не снизится. Более предпочтительно количество составляет от 10 до 60 масс. %.
Выбор съедобного полимера, растворимого в воде и органическом растворителе с параметром растворимости 9,7 или выше, не имеет конкретных ограничений при условии, что он является съедобным и растворимым в воде и органическом растворителе с параметром растворимости 9,7 или выше, и имеет относительно большую молекулярную массу для того, чтобы обладать пленкообразующей способностью. Съедобный полимер предпочтительно является твердым при температуре окружающей среды.
Такой съедобный полимер имеет средневесовую молекулярную массу предпочтительно от 2000 до 4000000. Если средневесовая молекулярная масса составляет менее 2000, пленкообразующая способность может быть слабой, так что форма пероральной основы в форме пленки может быть трудно поддерживаемой. Если средневесовая молекулярная масса составляет более 4000000, растворимость пероральной основы в форме пленки может быть слабой, что приводит к проблеме при практическом использовании. Более предпочтительно средневесовая молекулярная масса составляет от 2500 до 3000000.
Более конкретно, съедобным полимером, растворимым в воде и органическом растворителе с параметром растворимости 9,7 или выше, предпочтительно является поливинилпирролидон (далее сокращенно "ПВП") и/или гидроксипропилцеллюлоза (далее сокращенно "ГПЦ").
Эти съедобные полимеры показывают достаточную растворимость в воде и органическом растворителе с параметром растворимости 9,7 или выше, и удовлетворяют обоим следующим условиям: они быстро растворяются во рту, и их использование дает возможность использовать растворитель, в котором частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида не растворимы при производстве пероральной основы в форме пленки. Их использование, следовательно, позволяет по меньшей мере одно соединение, выбранное из группы, состоящей из аминокислоты, дипептида и нуклеотида, равномерно диспергировать и наносить в форме частиц.
Более предпочтительным среди съедобных полимеров, растворимых в воде и органическом растворителе с параметром растворимости 9,7 или выше, является ГПЦ. Причина этого заключается в том, что ГПЦ, обладающая более низкой гигроскопичностью к относительной влажности, чем ПВП, является предпочтительным с точки зрения практического использования. Каждый из этих пищевых полимеров, растворимых в воде и органическом растворителе с параметром растворимости 9,7 или выше, могут быть использованы по отдельности или два, или более из них могут быть использованы в комбинации.
ПВП имеет средневесовую молекулярную массу предпочтительно от 2500 до 3000000. Если средневесовая молекулярная масса составляет менее 2500, стабильность и гигроскопичность может быть снижена. Если средневесовая молекулярная масса составляет более 3000000, растворимость может быть снижена. Средневесовая молекулярная масса более предпочтительно составляет от 2500 до 1200000.
ГПЦ имеет средневесовую молекулярную массу предпочтительно от 10000 до 1150000. Если средневесовая молекулярная масса составляет менее 10000, гигроскопичность и стабильность может быть снижена. Если средневесовая молекулярная масса составляет более 1150000, растворимость может быть снижена. Средневесовая молекулярная масса более предпочтительно составляет 10000 до 370000.
Молекулярная масса, использованная в контексте настоящего документа, означает средневесовую молекулярную массу. Средневесовая молекулярная масса определяется методом гель-проникающей хроматографии.
ГПЦ предпочтительно имеет степень гидроксипропоксил-замещения от 50 до 100%. Если степень гидроксипропоксил-замещения составляет менее 50%, растворимость в органическом растворителе может быть снижена. Степень гидроксипропоксил-замещения более предпочтительно составляет 53,4% или более.
Степень гидроксипропоксил-замещения определяется в соответствии с Japanese Pharmacopoeia, fifteenth edition, Official monographs, Hydroxypropyl cellulose, Assay.
Пероральная основа в форме пленки по настоящему изобретению может содержать соответствующее количество других съедобных полимеров вдобавок к съедобному полимеру, растворимому в воде и органическом растворителе с параметром растворимости 9,7 или выше.
Примеры других съедобных полимеров включают в себя съедобные полимеры, растворимые только в воде, и съедобные полимеры, нерастворимые в воде и органическом растворителе с параметром растворимости 9,7 или выше. Их конкретные примеры включают в себя синтетические полимеры, такие как поливиниловый спирт, карбоксивиниловый полимер, гидроксипропилметилцеллюлоза (далее сокращенно "ГПМЦ"), гидроксиэтилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксипропилцеллюлоза с низкой степенью замещения, кристаллическая целлюлоза, натрий карбоксиметилцеллюлоза, кальций карбоксиметилцеллюлоза, карбоксиметилцеллюлоза и карбоксиэтилкрахмал натрия; и полимеры, получаемые из натуральных продуктов, такие как альгинат натрия, декстран, казеин, пуллулан, пектин, гуаровая камедь, ксантановая камедь, трагакантовая камедь, аравийская камедь, арабская камедь и крахмал.
Общее количество съедобного полимера, растворимого в воде и органическом растворителе с параметром растворимости 9,7 или выше, и других съедобных полимеров предпочтительно составляет от 1 до 80 масс. % от общей массы твердого вещества пероральной основы в форме пленки или препарата по настоящему изобретению. Если общее количество составляет менее 1 масс. %, количество частиц по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, может быть слишком большим. В таком случае сохранение формы продукта может быть невыгодно снижено, если размер частиц по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, значительно не уменьшится. Если общее количество составляет более 80 масс. %, быстрый профиль растворения во рту или достаточная прочность пленки могут быть не достигнуты. Общее количество более предпочтительно составляет от 10 до 70 масс. %.
Пероральная основа в форме пленки по настоящему изобретению при необходимости может опционально содержать, в дополнение к указанным выше веществам, ароматизаторы, агенты, маскирующие вкус, подсластители, красители, консерванты, антиоксиданты, стабилизаторы, поверхностно-активные вещества, пластификаторы (например, полиэтиленгликоль (ПЭГ)). Поскольку пероральная основа в форме пленки по настоящему изобретению содержит в качестве наполнителя частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, пероральная основа в форме пленки предпочтительно не содержит сахара или сахарного спирта, обычно используемых в качестве наполнителя. Пероральная основа в форме пленки по настоящему изобретению, однако, может содержать сахар или сахарный спирт при условии, что они не ухудшают действие настоящего изобретения.
Пероральный препарат в форме пленки по настоящему изобретению включает в себя пероральную основу в форме пленки по настоящему изобретению и лекарственное средство, диспергированное или растворенное в пероральной основе в форме пленки.
Лекарственное средство может быть диспергировано или растворено в пероральной основе в форме пленки по настоящему изобретению. Если лекарственное средство диспергировано, лекарственное средство предпочтительно нерастворимо в органическом растворителе с параметром растворимости 9,7 или выше. Для легкого образования частиц лекарственного средства лекарственное средство более предпочтительно является твердым при температуре окружающей среды.
Выбор лекарственного средства не имеет конкретных ограничений при условии, что оно является пригодным для перорального применения. Его примеры включают в себя седативные средства, отхаркивающие, слабительные и противораковые лекарственные средства, противодиабетические лекарственные средства, лекарственные средства против болезни Паркинсона, антидепрессанты, транквилизаторы, лекарственные средства против деменции, гипотензивные лекарственные средства, лекарственные средства против гиперлипемии, лекарственные средства против мигрени, лекарственные средства для лечения остеопороза, лекарственные средства для лечения гипотензии, противокашлевые средства, лекарственные средства против язвенной болезни, лекарственные средства против полакиурии/дизурии, лекарственные средства против непроизвольного мочеиспускания, противоязвенные лекарственные средства, противоаллергические лекарственные средства и антагонисты рецепторов 5-HT3 (противорвотные лекарственные средства). Лекарственные средства предпочтительно не являются горькими. Тем не менее, даже горькое лекарственное средство может быть соответствующим образом использовано при помощи способов маскировки горечи (например, микроинкапсулирование, добавление агентов, маскирующих горечь, подсластителей, вкусовых добавок или ароматических веществ).
Количество лекарственные средства зависит от его характеристик и предпочтительно составляет от 0,1 до 60 масс. % от общей массы твердого вещества перорального препарата в форме пленки по настоящему изобретению. Если количество составляет более 60 масс. %, сохранение формы продукта может быть невыгодно снижено, если размер частиц препарата значительно не уменьшится.
Выбор толщины пероральной основы в форме пленки и перорального препарата в форме пленки по настоящему изобретению не имеет конкретных ограничений и предпочтительно составляет от 30 до 300 мкм. Если толщина составляет менее 30 мкм, прочность пленки и удобность в обращении продукта может быть невыгодно снижена. Если толщина составляет более 300 мкм, растворение в ротовой полости занимает много времени, так что пероральная основа в форме пленки и пероральный препарат в форме пленки могут не быть легко растворены.
Выбор плоских форм пероральной основы в форме пленки и перорального препарата в форме пленки по настоящему изобретению не имеет конкретных ограничений, и они могут быть любыми формами, такими как прямоугольная, квадратная формы и форма круга.
Пероральная основа в форме пленки и пероральный препарат в форме пленки по настоящему изобретению могут быть получены, например, следующим способом.
Сперва заданное количество съедобного полимера растворяют в растворителе (например, этаноле, пропаноле, ацетоне). В полученном растворе в случае получения препарата диспергируют или растворяют лекарственное средство, и заданное количество частиц по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, гомогенно диспергируют с образованием дисперсии. Здесь частицы предварительно подвергают измельчению, гранулированию или обработке классификатором так, что корректируется их размер частиц. Соответствующее количество полученной дисперсии распределяют по антиадгезионной пленке и сушат для получения пленки. Таким образом получается пероральная основа в форме пленки и пероральный препарат в форме пленки. Кроме того, высушенные пероральную основу в форме пленки и пероральный препарат в форме пленки обрезают до желаемого размера и, опционально, герметично упаковывают как продукт.
Если в процессе изготовления дисперсии образуются пузырьки, дисперсию предпочтительно оставляют на ночь или подвергают вакуумной деаэрации.
Выбор растворителя, используемого в производстве пероральной основы в форме пленки и перорального препарата в форме пленки по настоящему изобретению, не имеет конкретных ограничений при условии, что частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, в нем не растворяются, но съедобный полимер, растворимый в воде и органическом растворителе с параметром растворимости 9,7 или выше, растворяется в нем. Предпочтительно используется органический растворитель с параметром растворимости 9,7 или выше.
Другими словами, пероральную основу в форме пленки и пероральный препарат в форме пленки по настоящему изобретению предпочтительно получают с использованием органического растворителя с параметром растворимости 9,7 или выше.
Органический растворитель с параметром растворимости 9,7 или выше предпочтительно имеет параметр растворимости от 9,7 до 20 и более предпочтительно от 9,7 до 15. Если параметр растворимости выше 20, частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, могут быть непреднамеренно растворены в растворителе в зависимости от вида частиц.
Более конкретно, органическим растворителем с параметром растворимости 9,7 или выше, предпочтительно являются этанол, пропанол и ацетон. Более предпочтительным является этанол. Каждый из этих органических растворителей с параметром растворимости 9,7 или выше может быть использован по отдельности или два, или более из них могут использованы в комбинации. К этим органическим растворителям с параметром растворимости 9,7 или выше может быть добавлено небольшое количество воды (очищенной воды).
В Таблице 1 приведены параметры растворимости (SP значения) воды и органических растворителей с параметром растворимости 9,7 или выше.
|
Полезные эффекты изобретения
Пероральная основа в форме пленки и пероральный препарат в форме пленки по настоящему изобретению имеют быстрый профиль растворения во рту и достаточную прочность пленки, и дают хорошее тактильное впечатление при обращении с ними пальцами и приятную текстуру, и вкус во рту. В сравнении с содержащими сахар или сахарный спирт пероральная основа в форме пленки и пероральный препарат в форме пленки по настоящему изобретению, которые содержат частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, предотвращают ухудшение тактильного впечатление (дающего ощущение липкости), сопутствующее поглощению влаги, и являются применимыми для людей с ограничением в потреблении углеводов.
При производстве пероральной основы в форме пленки и перорального препарата в форме пленки по настоящему изобретению частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, не нуждаются в предварительном растворении в растворе, но могут быть диспергированы или нанесены в форме частиц. Соответственно, пероральная основа в форме пленки и пероральный препарат в форме пленки по настоящему изобретению могут быть эффективно получены, и размер частиц и форма частиц могут регулироваться.
Краткое описание чертежей
На Фиг. 1 представлено схематическое изображение, иллюстрирующее примерный вариант осуществления пероральной основы в форме пленки по настоящему изобретению.
На Фиг. 2 представлено схематическое изображение, иллюстрирующее установку испытания на продолжительность липкости.
Описание вариантов осуществления
Настоящее изобретение подробно описано со ссылкой на, но не ограничиваясь ими, следующие далее примеры.
Частицы аминокислоты, дипептида или нуклеотида, используемые в примерах и сравнительных примерах, предварительно измельчают и пропускают через сито с размерами ячейки 32 мкм, 50 мкм или 90 мкм. Средний размер 50 % по объему частиц этих частиц измеряют с помощью анализатора распределения частиц по размерам по рассеянию лазерного излучения и полученный размер частиц используют в качестве среднего размера частиц. В Таблице 2 приведены размер частиц 50 % по объему частиц аминокислоты, дипептида или нуклеотида, используемых в примерах и сравнительных примерах.
|
Примеры 1 и 2
К 60,0 частям по массе этанола (параметр растворимости 12,7) добавляют 40,0 частей по массе ГПЦ (растворима в воде и органическом растворителе с параметром растворимости 9,7 или выше, молекулярная масса около 30000, степень гидроксипропоксил-замещения от 53,4 до 77,5%) или ПВП (растворим в воде и органическом растворителе с параметром растворимости 9,7 или выше, молекулярная масса от 1050000 до 1200000, ПВП К-30) и растворяют при перемешивании для образования раствора ГПЦ или ПВП в этаноле.
Отдельно к соответствующему количеству этанола добавляют 9,0 частей по массе золмитриптана и растворяют при перемешивании. К полученному раствору добавляют 40,0 частей по массе частиц L-глутамата натрия, предварительно пропущенных через сито (размер ячейки 32 мкм), и перемешивают с помощью ультразвука. К полученному раствору добавляют 117,5 частей по массе раствора ГПЦ или ПВП в этаноле и 4,0 частей по массе полиэтиленгликоля (ПЭГ400) и смешивают при перемешивании. Полученную жидкость подвергают деаэрации, достаточной для образования дисперсии.
Дисперсию распределяют по полиэфирной антиадгезионной пленке и сушат с получением пленки, имеющей толщину около 100 мкм. Полученную пленку обрезают до прямоугольника (размер 3 см2), изготавливая таким образом пероральный препарат в форме пленки, в котором были диспергированы частицы L-глутамата натрия.
Сравнительные примеры 1, 2
Золмитриптан в количестве 9,0 частей по массе добавляют к небольшому количеству этанола и затем растворяют в нем при нагревании. К 47,0 частям по массе пуллулана (растворимого только в воде) или ГПМЦ (растворимой только в воде) добавляют 183,3 частей по массе или 200,0 частей по массе дистиллированной воды, 4,0 части по массе полиэтиленгликоля (ПЭГ 400) и 40,0 частей по массе частиц L-глутамата натрия, предварительно пропущенных через сито (размер ячейки 32 мкм), и растворяют при перемешивании. К полученному раствору добавляют подготовленный заранее раствор золмитриптана в этаноле и растворяют в нем с перемешиванием при нагревании при 45°С. Полученную жидкость подвергают деаэрации, достаточной для получения раствора.
Раствор распределяют по полиэфирной антиадгезионной пленке и сушат с получением пленки, имеющей толщину около 100 мкм. Полученную пленку обрезают до прямоугольника (размер 3 см2), изготавливая таким образом пероральный препарат в форме пленки, в котором растворены частицы L-глутамата натрия.
|
Примеры с 3 по 10
Пероральные препараты в форме пленки, содержащие частицы аминокислоты, дипептида или нуклеотида, диспергированные в нем, получают таким же способом, как в Примере 1, за исключением того, что изменяют вид частиц аминокислоты, дипептида или нуклеотида и изменяют состав, как показано в Таблице 4.
|
Примеры с 11 по 16
Пероральные препараты в форме пленки, содержащие частицы L-глутамата натрия, диспергированные в них, получают таким же способом, как в Примере 1, за исключением того, что изменяют вид частиц аминокислоты, дипептида или нуклеотида и изменяют состав, как показано в Таблице 5.
|
|
Сравнительный пример 3
Пероральный препарат в форме пленки, не содержащий какой-либо аминокислоты, дипептида и нуклеотида, приготавливают таким же образом, как в Примере 1, за исключением того, что не используют частицы L-глутамата натрия и изменяют состав, как показано в Таблице 6.
Сравнительные примеры с 4 по 13
К 65,0 частям по массе очищенной воды добавляют 35,0 частей по массе ГПЦ (растворима в воде и органическом растворителе с параметром растворимости 9,7 или выше, молекулярная масса около 30000, степень гидроксипропоксил-замещения от 53,4 до 77,5%) и растворяют при перемешивании. Таким образом, изготавливают раствор ГПЦ в очищенной воде.
Отдельно к следовым количествам этанола добавляют 9,0 частей по массе золмитриптана и растворяют при перемешивании. К полученному раствору добавляли 40,0 частей по массе частиц аминокислоты, дипептида или нуклеотида, предварительно пропущенных через сито (размер ячейки 32 мкм), и перемешивают с помощью ультразвука. К полученному раствору добавляют 134,3 частей по массе раствора ГПЦ в очищенной воде и 4,0 части по массе полиэтиленгликоля (ПЭГ 400) и смешивают при перемешивании. Полученную жидкость подвергают деаэрации, достаточной для получения раствора.
Раствор распределяют по полиэфирной антиадгезионной пленке и сушат с получением пленки, имеющей толщину примерно 100 мкм. Полученную пленку пытаются удалить с полиэфирной антиадгезионной пленки для приготовления перорального препарата в форме пленки. В сравнительных примерах 4, 6 и с 8 по 13, однако, пероральные препараты в форме пленки являются хрупкими и слишком мягкими, так что невозможно получить пероральные препараты в форме пленки, пригодные к использованию. В сравнительных примерах 5 и 7 полученные пленки, имеющие толщину около 100 мкм, обрезают до прямоугольника (размер 3 см2), изготавливая таким образом пероральные препараты в форме пленки, содержащие аминокислоту, дипептид или нуклеотид, растворенные в нем.
|
Сравнительные примеры с 14 по 22
Пероральные препараты в форме пленки, содержащие частицы сахара или сахарного спирта, диспергированные в них, получают таким же образом, как в Примере 1, за исключением того, что вместо частиц L-глутамата натрия используют частицы сахара и изменяют составы, как показано в Таблице 7.
Здесь средний размер 50% по объему частиц сахара или сахарного спирта измеряют с помощью анализатора распределения частиц по размерам по рассеянию лазерного излучения. Частицы D-маннита A имеют средний размер 50% по объему частиц 17 мкм. Частицы D-маннита B имеют средний размер 50% по объему частиц 15 мкм. Частицы D-маннита C имеют средний размер 50% по объему частиц 16 мкм. Частицы D-маннита D имеют средний размер 50% по объему частиц 14 мкм. Частицы мальтозы имеют средний размер 50% по объему частиц 20 мкм. Частицы глюкозы имеют средний размер 50% по объему частиц 19 мкм.
|
Способ испытания
Следующие способы используют для оценки высвобождаемости при производстве, профиля растворения во рту, прочности пленки, тактильных впечатлений при обращении пальцами, текстуры во рту, вкуса и удобства использования при ограничении потребления углеводов пероральных препаратов в форме пленки из примеров и сравнительных примеров.
(1) Испытание высвобождаемости
Оценивают высвобождаемость каждого перорального препарата в форме пленки от полиэфирной антиадгезионной пленки при его производстве. Оценку проводят в соответствии со следующими критериями.
4: Легкоудаляемый
3: Удаляемый
2: Каким-то образом удаляемый
1: Каким-то образом удаляемый, но рвущийся
0: Не удаляемый
(2) Испытание распадаемости в ротовой полости
Профиль растворения во рту оценивают с помощью следующего испытания распадаемости во рту.
В 1000 мл стеклянную чашку Петри загружают 900 мл раствора фосфатного буфера (рН 6,8) и сито из нержавеющей стали (Ф мм) погружают в раствор. Раствор перемешивают (300 оборотов в минуту) с помощью мешалки. Температуру раствора поддерживают при 37±2°С с использованием циркулятора воды постоянной температуры. Испытуемый образец (3 см2) помещают в раствор и сеть из нержавеющей стали (размер ячейки 5 мм), имеющую размер 3 см2×3 см2 помещают на него в качестве груза. Распадаемость испытуемого образца наблюдают визуально и с помощью секундомера измеряют необходимое для ее достижения время после помещения испытуемого образца в раствор.
Описанную выше процедуру проводят три раза для образцов каждого перорального препарата в форме пленки и среднее время определяют, как время распада во рту. Время распада во рту преобразовывают в счет в соответствии со следующими критериями. Тестовый образец, который не может быть удален в тесте высвобождаемости (1) оценивают счетом 0.
4: от 0 до 10 секунд
3: от 10 до 15 секунд
2: от 15 до 20 секунд
1: 20 секунд или больше
(3) Испытание на сопротивление растяжению и испытание на сопротивление сгибанию
Прочность пленки оценивали с помощью следующего испытания на сопротивление растяжению и испытания на сопротивление сгибанию.
(3-1) Испытание на сопротивление растяжению
Испытуемый образец, обрезанный до размера 12 мм × 50 мм, сушат до достаточной степени в эксикаторе и подвергают испытанию на сопротивление растяжению, используя небольшой настольный динамометр (Shimadzu Corporation, EZ TEST-100M) в соответствии с JIS K7127 " Plastics-Test conditions for films and sheets". Используемая скорость испытания составляет 60 мм в минуту. Поскольку тестовый образец является слабоудлинняемым, предел прочности на разрыв, определяемый измерением, используют как сопротивление растяжению.
Испытание проводят три раза для каждого испытуемого образца и среднее значение определяют, как сопротивление растяжению.
Значения сопротивления растяжению преобразуют в счет в соответствии со следующими критериями. Тестовый образец, который не может быть удален в тесте высвобождаемости (1) оценивают счетом 0.
4: от 10 до 20 Н
3: от 5 до 10 Н
2: от 2 до 5 Н
1: от 0 до 2 Н
(3-2) Испытание на сопротивление сгибанию
Испытание проводили в соответствии с "JIS L1096 general fabric test method 8.19 rigid flexible, 8.19.1 A method (45° cantilever method)".
Приготавливают пять партий испытуемых образцов, имеющих размер 20 мм × 150 мм. Испытуемый образец помещают на горизонтальный стол, имеющий с одной стороны наклон 45° и гладкую поверхность, таким образом, что короткую сторону испытуемого образца совмещают с базовой линией шкалы. Затем испытуемый образец медленно сдвигают в сторону наклона подходящим способом и, когда центральная точка одного конца испытуемого образца приходит в контакт с наклоном, с использованием шкалы, считывают расположение другого конца.
Сопротивление изгибу обозначается расстоянием перемещения (мм) испытуемого образца. Каждый тестовый образец переворачивают вверх дном и обратно и измеряют сопротивление сгибанию, а среднее значение измеренных значений определяют как сопротивление сгибанию. Критерии оценки были установлены на основе сопротивления сгибанию (около 60 мм) перорального препарата в форме пленки, не содержащего какой-либо аминокислоты, дипептида и нуклеотида (Сравнительный пример 3), в качестве стандарта. Испытуемый образец, который не может быть удален в тесте высвобождаемости (1) оценивают счетом 0.
4: Стандартный ± 10 мм
3: Стандартный ± 20 мм
2: Стандартный ± 30 мм
1: Стандартный ± 40 мм или более
(4) Испытание на продолжительность липкости и сенсорное испытание (тактильные впечатления)
Тактильное впечатление при обращении пальцами и текстуру во рту оценивают с помощью следующего испытания на продолжительность липкости и сенсорного испытания (тактильное впечатление).
(4-1) Испытание на продолжительность липкости
Испытание проводят с использованием реометра (SUN SCIENTIFIC, CR-2000) в среде, показанной на Фиг. 2.
К зонду 2а (Ф 12 мм) испытуемый образец 2c (Ф 12 мм) крепят с помощью двусторонней липкой ленты 2b. Отдельно резиновую прокладку 2e помещают на испытательном стенде 2f и на нее помещают коллагеновую пленку 2d, пропитанную водой. Очищенную воду в количестве 200 мкл добавляют к испытуемому образцу 2с. Зонд 2а с испытуемым образцом 2с перемещают вниз до соприкосновения с коллагеновой пленкой 2d, а затем перемещают вверх. В это время продолжительность липкости после начальной липкости, наблюдаемой, когда проба 2а был удалена от коллагеновой пленки 2d, измеряют с использованием толщиномера на записывающей бумаге. Оценку проводили на основании следующих критериев. Испытуемый образец, который не может быть удален в испытании высвобождаемости (1), разрезают вместе с антиадгезионной пленкой и прикрепляют к зонду с помощью двусторонней липкой ленты со стороны антиадгезионной пленки. Измерение выполняют аналогично.
4: от 0 до 2 мм
3: от 2 до 3 мм
2: от 3 до 4 мм
1: от 4 мм или более
(4-2) Сенсорное испытание (тактильные впечатления)
К пероральной основе в форме пленки прикасаются круговыми движениями пальцами в течение 5 секунд и наблюдают тактильные впечатления (липкая или нет). Оценку проводят в соответствии со следующими критериями.
4: Не липкая
3: Липкая, но не раздражающая
2: Некомфортно липкая
1: Довольно липкая и куски пленки остаются на пальцах
(5) Сенсорное испытание (вкус)
Пероральный препарат в форме пленки держат во рту до тех пор, пока препарат растворится для оценки влияния на вкус. Оценку проводят в соответствии со следующими критериями.
4: Приятный вкус
3: Нет/только незначительно горький или неприятный вкус
2: Сильный горький или неприятный вкус
1: Настолько горький или неприятный вкус, что не позволяет удерживать препарат во рту
(6) Пригодность для использования при ограничении потребления углеводов
Пригодность для использования перорального препарата в форме пленки при ограничении потребления углеводов оценивают на основании содержащихся углеводов. Оценку проводят в соответствии со следующими критериями.
4: Не содержит углеводов
3: Содержит три или более сахарида
2: Содержит дисахарид
1: Содержит моносахарид
|
|
|
В Сравнительных примерах 1, 2 и с 4 по 13 при производстве пероральных препаратов в форме пленок в качестве растворителя в основном используют очищенную воду и, следовательно, частицы аминокислоты, дипептида или нуклеотида непреднамеренно растворяют в ней. В результате пероральные препараты в форме пленки, содержащие частицы аминокислоты, дипептида или нуклеотида, диспергированные в них, не могут быть получены. Такие пероральные препараты в форме пленки не могут иметь быстрый профиль растворения во рту или достаточную прочность пленки, а тактильное впечатление при обращении с препаратами пальцами и текстура во рту являются неблагоприятными (Таблица 8, 9).
Для того, чтобы избежать этих проблем даже в том случае, когда частицы аминокислоты, дипептида или нуклеотида растворяют, можно предложить снизить количество частиц аминокислоты, дипептида или нуклеотида. При таком способе, однако, количество съедобного полимера относительно увеличивается, что возможно вызовет схожие проблемы.
Промышленная применимость
Пероральная основа в форме пленки и пероральный препарат в форме пленки по настоящему изобретению имеют быстрый профиль растворения во рту и достаточную прочность пленки, дают хорошее тактильное впечатление при обращении с ними пальцами и благоприятного текстуру, и вкус во рту. Кроме того, по сравнению с содержащими сахар или сахарный спирт пероральная основа в форме пленки и пероральный препарат в форме пленки по настоящему изобретению, содержащие частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, предотвращают ухудшение тактильного впечатления (ощущения липкости), сопутствующее поглощению влаги сахаридом, и являются применимыми для людей с ограничением потребления углеводов.
В производстве пероральной основы в форме пленки и перорального препарата в форме пленки по настоящему изобретению частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида, не нуждаются в предварительном растворении в растворе, но могут быть диспергированы или нанесены в форме частиц. Соответственно, пероральная основа в форме пленки и пероральный препарат в форме пленки по настоящему изобретению могут быть эффективно получены и размер частиц, и форма частиц могут регулироваться.
Список соответствия обозначений
1a. Частицы по меньшей мере одного соединения, выбранного из группы, состоящей из аминокислоты, дипептида и нуклеотида
1b. Съедобная пленка
2a. Зонд
2b. Двусторонняя липкая лента
2с. Испытуемый образец
2d. Коллагеновая пленка
2e. Резиновая прокладка
2f. Испытательный стенд