Результат интеллектуальной деятельности: ПЕРОРАЛЬНАЯ ОСНОВА В ВИДЕ ПЛЕНКИ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к пероральной основе в виде пленки, которая легко растворяется во рту; и к препарату, содержащему лекарственное средство в данной основе. Более конкретно, настоящее изобретение относится к пероральной основе в виде пленки и препарату, который будет быстро растворяться во рту, так что лекарственное средство будет хорошо абсорбироваться через желудочно-кишечный тракт или слизистую оболочку рта.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В настоящее время лекарственные средства, вводимые перорально, продаются в виде твердых препаратов, таких как безоболочечные таблетки, таблетки, покрытые оболочкой, капсулы, порошки и гранулы; жидких препаратов, таких как жидкости и эмульсии и т.п. Таблетки, распадающиеся перорально, и быстрорастворимые пероральные пленки уже существуют на рынке в виде препаратов, которые распадаются во рту и всасываются желудочно-кишечным трактом.
Перорально вводимые препараты в виде пленки, ленты или листа, которые должны разлагаться или растворяться слюной без жевания, уже доступны за границей в виде десяти или более безрецептурных лекарственных средств (ОБР лекарства). В Японии эти препараты доступны в виде одного препарата, отпускаемого по рецепту, а также безрецептурных лекарственных средств.
Следующие патентные документы описывают технологии, относящиеся к таким препаратам в виде пленки. Патентный документ 1 описывает основу для препарата, которую получают путем растворения в растворителе гидроксипропилцеллюлозы или смеси гидроксипропилцеллюлозы с поливинилпирролидоном, и таниновой субстанции с последующим удалением растворителя. Патентный документ 2 описывает пастилки в виде пленки, которые получают путем ламинирования покрывающим слоем (a) содержащим водорастворимый, негигроскопический полисахарид и смягчитель, слоем лекарственного средства (b) содержащим лекарственное средство и съедобный водорастворимый полимер, и слоем лекарственного средства (c) содержащим лекарственное средство, съедобный водорастворимый полимер и таниновую субстанцию, в порядке (a), (b), (c), (b), и (a). Патентный документ 3 описывает быстрорастворимый препарат в виде пленки, который содержит лекарственное средство и съедобное полимерное вещество, обладает прочностью пленки на разрыв от 200 до 3000 г/7 мм и прочностью пленки на растяжение от 200 до 3000 г/15 мм, и плавится во рту в течение 60 секунд. Патентный документ 4 описывает пленочный препарат для орального применения, который содержит один из пептизированных крахмалов и пуллулан; ферментно-модифицированный крахмал; и пластификатор. Патентный документ 5 описывает растворимый пленочный препарат, который содержит активный ингредиент с водорастворимостью приблизительно менее чем 1 г/4 мл при комнатной температуре и содержанием влаги приблизительно менее чем 15 масс.%. Патентный документ 6 описывает препарат в виде пленки, который содержит лекарственное средство, съедобное водорастворимое пленкообразующее вещество и низкозамещенную гидроксипропилцеллюлозу со степенью молярного замещения от 0,05 до 1,0. Также патентный документ 7 описывает технологию приготовления быстрорастворимого препарата, который быстро разрушается или растворяется во рту или т.п., путем растворения или диспергирования лекарственного средства, сахаридов и поливинилпирролидона в органическом растворителе с последующим удалением растворителя.
Однако основы в виде пленки и препараты, описанные до настоящего времени, производят путем диспергирования или растворения лекарственного средства в водорастворимом полимере, и для некоторых из таких основ и препаратов применяют сахара или сахарные спирты (патентный документ 3 и патентный документ 4). В производстве таких основ или препаратов, используемые сахара или сахарные спирты растворены в растворителе или перекристаллизованы. По этой причине, эти стандартные пероральные основы в виде пленки или препараты дают ощущение липкости, связанное с водорастворимым полимером, когда находятся во рту или при держании в пальцах. Патентный документ 7, который относится к быстрорастворимому препарату, не описывает ни технологию диспергирования мелких частиц сахаридов, ни производство препарата в виде пленки.
Патентный документ 1 JP 7-187993 A
Патентный документ 2 JP 2001-288074 A
Патентный документ 3 JP 2004-43450 A
Патентный документ 4 JP 2005-21124 A
Патентный документ 5 JP 2007-528876 T
Патентный документ 6 JP 2008-169138 A
Патентный документ 7 JP 11-116465 A.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, ПОДЛЕЖАЩИЕ РЕШЕНИЮ ПОСРЕДСТВОМ ИЗОБРЕТЕНИЯ
Для решения таких проблем, целью настоящего изобретения является создание пероральной основы в виде пленки и препарата, которые имеют быстрый профиль растворения во рту и достаточную прочность пленки, и обеспечивают сниженное чувство липкости во рту, связанное с водорастворимым полимером, и улучшенное ощущение при держании в пальцах.
СРЕДСТВА РЕШЕНИЯ ЗАДАЧ
Авторы настоящего изобретения провели различные исследования для решения вышеописанной проблемы, и обнаружили, что препарат, если производится с использованием следующей основы в виде пленки, имеет быстрый профиль растворения во рту и достаточную прочность пленки, и обеспечивает сниженное чувство липкости во рту, связанное с водорастворимым полимером, и улучшенное ощущение при держании в пальцах. Основу в виде пленки производят путем диспергирования в органическом растворителе с параметром растворимости от 9,7 или выше съедобного полимера, растворимого в воде и органическом растворителе, и частиц одного или нескольких соединений сахаров и их сахарных спиртов в виде мелких частиц, которые нерастворимы в органическом растворителе.
То есть настоящее изобретение относится к следующим пунктам с 1 по 11.
1. Пероральная основа в виде пленки, которая содержит один или два или более съедобных полимеров, растворимых в воде и органическом растворителе с параметром растворимости от 9,7 или выше, и частицы одного или двух или более соединений, выбранных из группы, состоящей из сахаров, от моно- до гексасахаридов, и их сахарных спиртов со средним размером частиц от 0,1 мкм до 60 мкм.
2. Пероральная основа в виде пленки по п.1, где частицы одного или двух или более соединений выбраны из группы, состоящей из сахаров и их сахарных спиртов, имеют средний размер частиц от 0,1 мкм до 30 мкм.
3. Пероральная основа в виде пленки по пп.1 или 2, где съедобные полимеры, растворимые в воде и органическом растворителе с параметром растворимости от 9,7 или выше, представляют собой одно или два или более соединений, выбранных из группы, состоящей из поливинилпирролидона и гидроксипропилцеллюлозы.
4. Пероральная основа в виде пленки по п.3, где поливинилпирролидон имеет средневзвешенную молекулярную массу от 2500 до 3000000.
5. Пероральная основа в виде пленки по п.3, где гидроксипропилцеллюлоза имеет средневзвешенную молекулярную массу от 10000 до 1200000.
6. Пероральная основа в виде пленки по п.3 или 5, где гидроксипропилцеллюлоза имеет степень замещения гидроксипропокси-группами от 50% до 100%.
7. Пероральный препарат в виде пленки, содержащий лекарственное средство в пероральной основе в виде пленки по любому из пп.1-6.
8. Способ производства пероральной основы в виде пленки, включающий растворение или диспергирование в органическом растворителе с параметром растворимости 9,7 или выше, одного или двух или более съедобных полимеров, растворимых в воде и органическом растворителе, сахаров и их сахарных спиртов со средним размером частиц от 0,1 мкм до 60 мкм, и формирование тонкого слоя дисперсии с последующим высушиванием слоя.
9. Способ производства перорального препарата в виде пленки, включающий растворение или диспергирование в органическом растворителе с параметром растворимости 9,7 или выше, лекарственного средства, одного или двух или более съедобных полимеров, растворимых в воде и органическом растворителе, и частиц одного или двух или более соединений, выбраны из группы, состоящей из сахаров, от моно- до гексасахаридов, и их сахарных спиртов со средним размером частиц от 0,1 мкм до 60 мкм, и создание тонкого слоя полученной дисперсии с последующим высушиванием слоя.
10. Способ производства пероральной основы в виде пленки, включающий: растворение в части органического растворителя с параметром растворимости 9,7 или выше, одного или двух или более съедобных полимеров, растворимых в воде и органическом растворителе, для приготовления раствора; смешивание раствора с дисперсией, приготовленной путем диспергирования в остатке органического растворителя с параметром растворимости 9,7 или выше частиц одного или двух или более соединений, выбраны из группы, состоящей из сахаров, от моно- до гексасахаридов, и их сахарных спиртов со средним размером частиц от 0,1 мкм до 60 мкм для приготовления смешанной дисперсии; и формирование тонкого слоя дисперсии с последующим высушиванием слоя.
11. Способ производства перорального препарата в виде пленки, включающий растворение в части органического растворителя с параметром растворимости 9,7 или выше, одного или двух или более съедобных полимеров, растворимых в воде и органическом растворителе, для приготовления раствора; смешивание полученного раствора с дисперсией, приготовленной путем растворения или диспергирования в остатке органического растворителя с параметром растворимости 9,7 или выше, лекарственного средства и частиц одного или двух или более соединений, выбраны из группы, состоящей из сахаров, от моно- до гексасахаридов, и их сахарных спиртов со средним размером частиц от 0,1 мкм до 60 мкм для приготовления смешанной дисперсии; и формирование тонкого слоя дисперсии с последующим высушиванием слоя.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Пероральная основа в виде пленки и препарат по настоящему изобретению, каждый содержит один или два или более соединений, выбранных из сахаров и сахарных спиртов, диспергированных в них в виде частиц, и обладают быстрым профилем растворения и достаточной прочностью пленки. Дополнительно, основа и препарат обеспечивают безусловно улучшенные свойства, такие как сниженное чувство липкости, относящееся к водорастворимому полимеру, когда находятся во рту, и улучшенное чувство при держании в пальцах, по сравнению с традиционными продуктами. То есть в случае, когда основу и препарат производят путем однородного диспергирования одного или двух или более соединений, выбранных из сахаров и сахарных спиртов, в виде частиц в пленке, данные основа и препарат могут несомненно улучшить только свойства, относящиеся к приему основы и препарата, такие как растворение во рту, ощущение пленки во рту и ощущение при держании в пальцах, без ухудшения свойств пленки, которые требуются для основы и препарата, таких как прочность при растяжении и жесткость.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
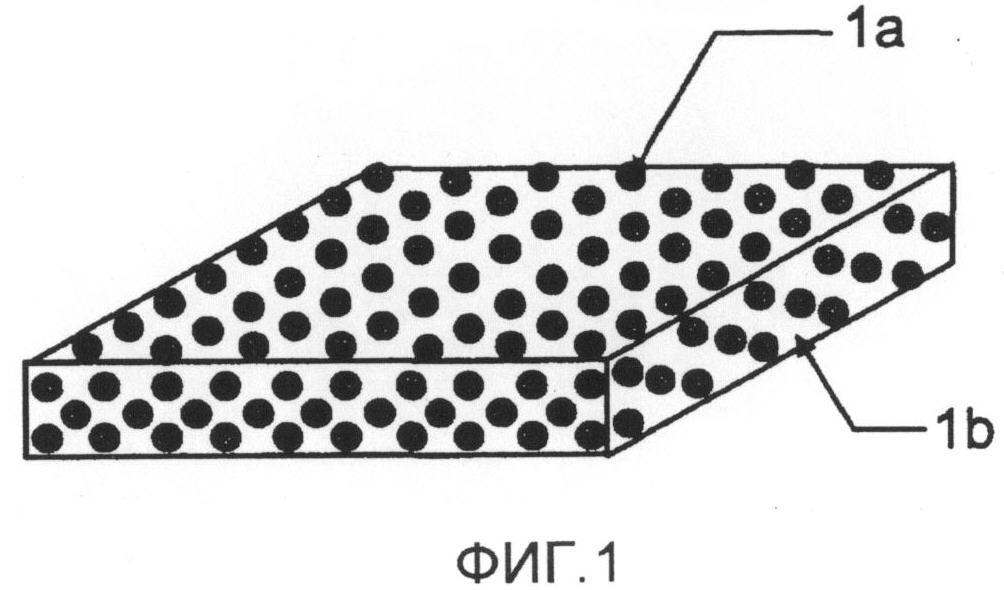
Фиг.1 представляет собой схему, иллюстрирующую особенность пероральной основы в виде пленки и препарата согласно настоящему изобретению;
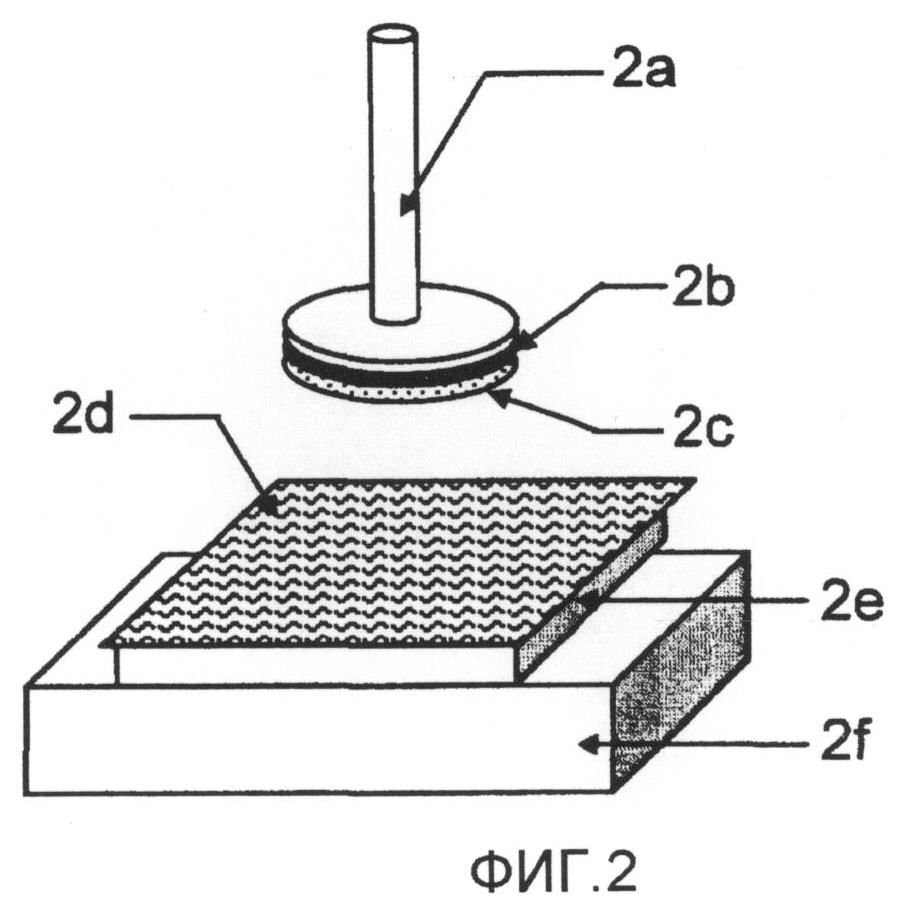
фиг.2 представляет собой схему, иллюстрирующую измерение длительности липкости;
фиг.3 представляет собой вид (увеличение в 1000 раз), показывающий поверхность пероральной основы в виде пленки в примере 21 по настоящему изобретению;
фиг.4 представляет собой вид (увеличение в 1000 раз), показывающий поверхность пероральной основы в виде пленки в примере 22 по настоящему изобретению; и
фиг.5 представляет собой вид (увеличение в 500 раз), показывающий поверхность пероральной основы в виде пленки в примере 23 по настоящему изобретению.
Разъяснение символов
|
СПОСОБ(Ы) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пероральная основа в виде пленки по настоящему изобретению содержит один или два или более съедобных полимеров, растворимых в воде и органическом растворителе с параметром растворимости от 9,7 или выше, и частицы одного или двух или более соединений, выбранных из группы, состоящей из сахаров, от моно- до гексасахаридов, и их сахарных спиртов со средним размером частиц от 0,1 мкм до 60 мкм. Фиг.1 представляет собой изображение, схематически иллюстрирующее особенность такой основы, в которой частицы (1a) одного или двух или более соединений сахаров и сахарных спиртов однородно диспергированы в пленке (1b), которая содержит съедобный полимер(ы). В случае перорального препарата в виде пленки по настоящему изобретению, частицы (1a) одного или двух или более соединений сахаров и сахарных спиртов однородно диспергированы в пленке (1b), которая содержит съедобный полимер(ы) и лекарственное средство.
Съедобный полимер, растворимый как в воде, так и в органическом растворителе с параметром растворимости 9,7 или выше, в настоящем изобретении конкретно не ограничен при условии, что полимер способен образовывать пленку, съедобен и растворим в органическом растворителе, в котором нерастворимы сахара и сахарные спирты. В настоящем изобретении, термин "съедобный" относится к фармацевтически приемлемому полимеру, который можно вводить перорально.
Более конкретно, съедобный полимер предпочтительно является поливинилпирролидоном (далее, PVP) и гидроксипропилцеллюлозой (далее, HPC), поскольку они демонстрируют достаточную растворимость в воде и органическом растворителе с параметром растворимости от 9,7 или выше, быстро растворяются во рту и позволяют использовать вышеописанный органический растворитель в производстве. Из них более предпочтительной является HPC, поскольку она имеет меньшую гигроскопичность по отношению к относительной влажности, чем PVP, и считается предпочтительной с практической точки зрения.
Предпочтительно средневзвешенная молекулярная масса вышеуказанного PVP, применяемого в качестве съедобного полимера по настоящему изобретению, составляет от 2500 до 3000000, и более предпочтительно от 2500 до 1200000. Если средневзвешенная молекулярная масса составляет менее чем 2500, это может отрицательно сказаться на стабильности и гигроскопичности получаемых основы и препарата. Напротив, если молекулярная масса превышает 3000000, растворимость в органическом растворителе с параметром растворимости 9,7 или выше может быть плохой.
Предпочтительно средневзвешенная молекулярная масса вышеуказанной HPC, применяемой в качестве съедобного полимера по настоящему изобретению, составляет от 10000 до 1200000, и более предпочтительно от 10000 до 370000. Если средневзвешенная молекулярная масса составляет менее чем 10000, это может отрицательно сказаться на стабильности и гигроскопичности получаемых основы и препарата. Напротив, если молекулярная масса превышает 1200000, растворимость в органическом растворителе с параметром растворимости 9,7 или выше может быть плохой.
Средневзвешенные молекулярные массы PVP и HPC получают методом гель-проникающей хроматографии.
Предпочтительно степень замещения гидроксипропокси-группами в вышеуказанной HPC, применяемой в качестве съедобного полимера по настоящему изобретению, составляет от 50% до 100%. Здесь степень замещения гидроксипропокси-группами представляет собой значение, определенное в соответствии с количественным способом, который описан в Официальных Фармакопейных статьях Пятнадцатого издания Фармакопеи Японии в разделе, озаглавленном "Гидроксипропилцеллюлоза". Более предпочтительно, степень замещения гидроксипропокси-группами в вышеуказанной HPC составляет, по меньшей мере, 53,4%. Если степень замещения гидроксипропокси-группами меньше, чем 53,4%, растворимость HPC в воде и в органическом растворителе с параметром растворимости 9,7 или выше может быть плохой. Максимальная степень замещения гидроксипропокси-группами в HPC, применяемой в настоящем изобретении, составляет предпочтительно приблизительно 77,5%, как определено в Официальных Фармакопейных статьях Пятнадцатого издания Фармакопеи Японии.
Каждый из этих съедобных полимеров можно использовать по отдельности, или два или более съедобных полимеров можно использовать в комбинации. Коммерчески доступные съедобные полимеры, которые предлагаются в качестве фармацевтических, можно использовать в качестве съедобного полимера, для удобства. Доля одного или двух или более съедобных полимеров в общем количестве пероральной основы в виде пленки или препарата по настоящему изобретению является подходящей от 10 масс.% до 80 масс.% и предпочтительно от 20 масс.% до 70 масс.%. Если доля съедобного полимера меньше чем 10 масс.% пленка может быть хрупкой и демонстрировать недостаточную прочность; напротив, если доля превышает 80 масс.%, полимер, как правило, вызывает ощущение липкости во рту.
Съедобный полимер, растворимый как в воде, так и в органическом растворителе с параметром растворимости 9,7 или выше, может быть скомбинирован с соответствующим количеством съедобного полимера, растворимого только в воде или съедобного полимера, нерастворимого в воде и органическом растворителе. Примеры таких съедобных полимеров включают полимеры, полученные из природных веществ, такие как камедь акации, аравийская камедь, альгинат натрия, казеин, ксантановая камедь, гуаровая камедь, декстран, трагакантовая камедь, крахмал, пуллулан и пектин; полусинтетические полимеры, такие как кристаллическая целлюлоза, метилцеллюлоза, этилцеллюлоза, карбоксиметилцеллюлоза, натриевая карбоксиметилцеллюлоза, кальциевая карбоксиметилцеллюлоза, натриевый карбоксиметилкрахмал, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза и низкозамещенная гидроксипропилцеллюлоза; и синтетические полимеры, такие как поливиниловый спирт и карбоксивинилполимер. Эти полимеры могут быть коммерчески доступны в виде фармацевтических препаратов.
В настоящем изобретении следующие сахара, от моно- до гексасахаридов, и их сахарные спирты используют в дополнение к съедобному полимеру, растворимому как в воде, так и в органическом растворителе с параметром растворимости 9,7 или выше.
Примеры моносахаридов включают: альдотетрозы, такие как эритроза и треоза; альдопентозы, такие как рибоза ликсоза, ксилоза и арабиноза; альдогексозы, такие как аллоза, талоза, гулоза, глюкоза, альтроза, манноза, галактоза и идоза; кетотетрозы, такие как эритрулоза; кетопентозы, такие как ксилюлоза и рибулоза; и кетогексозы, такие как псикоза, фруктоза, сорбоза и тагатоза. Примеры дисахаридов включают: α-диглюкозиды, такие как трегалоза, койибиоза, нигероза, мальтоза и изомальтоза; β-диглюкозиды, такие как изотрегалоза, софороза, ламинарибиоза, целлобиоза и гентибиоза; α,β-диглюкозиды, такие как неотрегалоза; лактоза; сахароза; и изомальтулоза (палатиноза). Примером трисахаридов является раффиноза. Примеры олигосахаридов, содержащих от 3 до 6 сахаридных остатков, включают циклические олигосахариды, такие как фруктоолигосахариды, галактоолигосахариды, ксилоолигосахариды, изомальтоолигосахариды, хитиновые олигосахариды, хитозановые олигосахариды, олигоглюкозамин и циклодекстрины.
Примеры моносахаридных спиртов включают: тетритолы, такие как эритритол, D-треитол, и L-треитол; пентитолы, такие как D-арабинитол и ксилит; гекситолы, такие как D-идитол, галактитол (дульцитол), D-глюкоцитол (сорбит) и маннит; и циклитолы, такие как инозитол. Примеры дисахаридных спиртов включают мальтитол, лактитол и восстановленную палатинозу (изомальт); и примеры олигосахаридов включают пентаэритритол и восстановленную мальтозную крахмальную патоку.
Среди них, сахара от моно- до трисахаридов и их сахарные спирты являются предпочтительными с точки зрения легкости растворения во рту основы в виде пленки и препарата. Более конкретно, лактоза, эритритол, ксилит, маннит и восстановленная палатиноза (изомальт), которые имеют низкую гигроскопичность, являются более предпочтительными. В настоящем изобретении применяют одно или два или более соединений, выбранных из вышеуказанных сахаров, от моно- до гексасахаридов, и их сахарных спиртов.
В настоящем изобретении одно или два или более соединений, выбранных из вышеуказанных сахаров, от моно- до гексасахаридов, и их сахарных спиртов, должно включать частицы со средним размером от 0,1 мкм до 60 мкм. Предпочтительно от 30 масс.% до 80 масс.% вышеуказанных сахаров и сахарных спиртов по отношению к общему количеству сахаров и сахарных спиртов в основе или препарате содержат частицы со средним размером в вышеуказанном диапазоне. Если средний размер частиц одного или двух или более соединений, выбранных из сахаров и сахарных спиртов, меньше чем 0,1 мкм, соответствующие частицы могут агрегировать и гибкость основы в виде пленки или препарата может быть в некоторых участках различной. Сходно, если частицы со средним размером, превышающим 60 мкм, содержатся в основе в виде пленки или препарате практической толщины, гибкость препарата может быть различной в некоторых участках. Одно или два или более соединений, выбранных из сахаров и сахарных спиртов, более предпочтительно представляют собой такие, которые включают частицы со средним размером от 0,1 мкм до 30 мкм.
Здесь средний размер частиц одного или более соединений, выбранных из сахаров и сахарных спиртов, относится к 50 об.% среднего размера частиц, определенного при помощи лазерного рассеивающего анализатора размера частиц.
А именно, 10 мг частиц сахаров или сахарных спиртов добавляют к 3 мл хлороформного раствора 0,2 масс.% полиоксиэтиленового сложного эфира монолауриновой кислоты, и частицы в достаточной степени диспергируют ультразвуком. Полученную дисперсию добавляют к хлороформу с тем, чтобы степень пропускания стала от 75% до 85% в лазерном рассеивающем анализаторе размера частиц (LA-950, продукт Horiba Ltd.). Затем 50 об.% среднего размера частиц измеряют мокрым способом.
Частицы одного или двух или более соединений, выбранных из сахаров, от моно- до гексасахаридов, и их сахарных спиртов, предпочтительно составляют от 1 масс.% до 80 масс.%, более предпочтительно от 10 масс.% до 60 масс.%, от общего веса основы или препарата. В основе или препарате практической толщины, если количество частиц одного или двух или более соединений, выбранных из сахаров и сахарных спиртов, составляет менее чем 1 масс.%, не наблюдается достаточного улучшения в свойствах профиля растворения во рту, прочности пленки, ощущении липкости во рту, связанной с водорастворимыми полимерами, и ощущении при держании в пальцах. Количество, превышающее 80 масс.%, может ухудшить свойства сохранения формы и т.п. основы или препарата, кроме тех случаев, когда средний размер частиц сахара и сахарного спирта значительно снижен. В качестве вышеуказанных сахаров и сахарных спиртов удобно использовать коммерчески доступный продукт, предусмотренный для фармацевтического применения. Также, коммерчески доступный продукт можно использовать после сортировки по размерам, с тем, чтобы средний размер частиц лежал внутри вышеупомянутого диапазона. Корректировку по вышеупомянутому среднему размеру частиц можно проводить при помощи таких способов, как измельчение до порошка, грануляция посредством сухой грануляции, влажной грануляции и т.п., и классификация с использованием сита, механического классификатора или т.п.
Растворимость съедобного полимера, сахаров и сахарных спиртов, применяемых в настоящем изобретении, в воде или органическом растворителе с параметром растворимости 9,7 или выше описывается следующими терминами. А именно, если для растворения 1 г растворяемого вещества при 20°C необходимо количество в 100 мл или более органического растворителя или воды, то растворяемое вещество является "нерастворимым". Напротив, если для растворения 1 г растворяемого вещества при 20°C необходимо количество менее чем 5 мл органического растворителя или воды, то растворяемое вещество является "растворимым". Когда необходимо количество воды или органического растворителя менее чем 3 мл, то растворяемое вещество является "легкорастворимым". Известно, что сахара и сахарные спирты, применяемые в настоящем изобретении, имеют низкую растворимость в органическом растворителе, которая снижается при повышении температуры органического растворителя. Таким образом, путем повышения температуры органического растворителя возможно снизить растворимость сахаров и сахарных спиртов, чтобы стабилизировать их в состоянии частиц.
Пероральная основа в виде пленки и препарат в соответствии с настоящим изобретением могут необязательно содержать подходящее количество дополнительного вещества (веществ), такого как пластификатор (например, полиэтиленгликоль), поверхностно-активное вещество, стабилизатор, консервант, антиоксидант, ароматизатор, корректор вкуса, подсластитель и краситель, а также съедобный полимер и одно или два или более соединений, выбранных из группы, состоящей из сахаров и сахарных спиртов.
Лекарственное средство, которое должно содержаться в пероральном препарате в виде пленки по настоящему изобретению конкретно не ограничено, при условии, что его можно вводить перорально. Его примеры включают противоопухолевые препараты, противовоспалительные лекарственные средства, противоаллергические лекарственные средства, противодиабетические лекарственные средства, антигиперлипидемические лекарственные средства, лекарственные средства для улучшения метаболизма кости/кальция, противогипертонические лекарственные средства, антиангинальные лекарственные средства, антиаритмические лекарственные средства, сосудорасширяющие лекарственные средства, диуретики, бронхолитики, противоастматические лекарственные средства, средства от кашля, отхаркивающие лекарственные средства, средства, способствующие пищеварению, регуляторы желудочно-кишечной функции, лекарственные средства против пептической язвы, лекарственные средства для заболеваний тонкой кишки, слабительные средства, антипсихотические средства, антидепрессанты, стабилизаторы настроения, психостимуляторы, снотворные, противотревожные лекарственные средства, противоэпилептические препараты, лекарственные средства для лечения мигрени, противорвотные препараты, средства от головокружения, лекарственные средства для лечения болезни Паркинсона, средства для улучшения мозгового кровообращения, лекарственные средства против деменции, антибактериальные лекарственные средства, противовирусные лекарственные средства, противогрибковые лекарственные средства, средства для лечения частого мочеиспускания и нарушений мочеиспускания и средства для лечения недержания мочи. Количество лекарственного средства, которое должно содержаться в препарате, будет варьировать в зависимости от типа и титра лекарственного средства, симптомов пациента, принимающего препарат и т.п. Тем не менее, с учетом требуемой дозы, количество обычно составляет от 0,1 масс.% до 60 масс.% от общего количества препарата.
Конкретные примеры лекарственных средств включают золмитриптан, дифенгидрамин, тамуслозин, гранисетрон, тортерозин, скополамин, фамотидин, кандезартана цилексетил, пиоглитазон, амлодипин, донепезил и их соли.
Лекарственное средство, применяемое в настоящем изобретении, предпочтительно не имеет горького вкуса, поскольку препарат в виде пленки по настоящему изобретению предназначен для введения перорально, однако лекарственные средства с горьким вкусом также могут быть использованы соответствующим образом за счет применения способа, маскирующего горечь, например, микрокапсулирования, или за счет добавления вещества, блокирующего горечь, подсластителя, корректора вкуса или ароматизатора. Многие сахара и сахарные спирты, применяемые в настоящем изобретении, дают сладость, и можно ожидать, что они обеспечат эффект маскировки горечи лекарственного средства.
Толщина основы в виде пленки и препарата по настоящему изобретению конкретно не ограничена в настоящем документе, но составляет предпочтительно от 30 мкм до 300 мкм. Если толщина меньше, чем 30 мкм, прочность пленки может снижаться и, таким образом, физические свойства препарата могут ухудшаться. Если толщина превышает 300 мкм, препарату может потребоваться больше времени для растворения во рту, таким образом, он не будет легко растворяться. Двухмерная форма основы в виде пленки и препарата по настоящему изобретению может быть обычной, такой как прямоугольник, квадрат, круг и эллипс.
Пероральную основу в виде пленки по настоящему изобретению можно производить путем растворения или диспергирования в органическом растворителе с параметром растворимости от 9,7 или выше, одного или двух или более съедобных полимеров, растворимых в воде и органическом растворителе, и частиц одного или двух или более соединений, выбраны из группы, состоящей из сахаров, от моно- до гексасахаридов, и их сахарных спиртов со средним размером частиц от 0,1 мкм до 60 мкм, и создание тонкого слоя полученной дисперсии с последующим высушиванием слоя. Сходно с основой, препарат в виде пленки можно производить путем растворения или диспергирования в органическом растворителе с параметром растворимости 9,7 или выше, лекарственного средства, одного или двух или более съедобных полимеров, растворимых в воде и органическом растворителе, и частиц одного или двух или более соединений, выбраны из группы, состоящей из сахаров, от моно- до гексасахаридов, и их сахарных спиртов со средним размером частиц от 0,1 мкм до 60 мкм, и создание тонкого слоя полученной дисперсии с последующим высушиванием слоя.
Более предпочтительно, пероральную основу в виде пленки получают при помощи следующих процессов. Сперва растворяют заранее определенное количество съедобного полимера в части органического растворителя, который имеет параметр растворимости 9,7 или выше и в котором может растворяться полимер. Раздельно, частицы одного или двух или более соединений, выбранных из группы, состоящей из сахаров и сахарных спиртов, подвергают процессам, таким как измельчение до порошка, грануляция и классификация для корреляции среднего размера их частиц, и затем частицы однородно диспергируют в остатке органического растворителя. Дисперсию и остальные добавки по мере необходимости, такие как пластификатор, смешивают с раствором съедобного полимера в органическом растворителе. Надлежащее количество смеси наносят на антиадгезионную пленку, сделанную из полистирола или полиэтилентерефталата, и затем высушивают. Таким образом производят основу в виде пленки. Количество вышеуказанного органического растворителя для растворения съедобного полимера составляет предпочтительно 1-2-кратное количество веса съедобного полимера. В случае производства перорального препарата в виде пленки, раствор готовят путем растворения съедобного полимера в части органического растворителя с параметром растворимости 9,7 или выше. Лекарственное средство растворяют или диспергируют в остатке органического растворителя и затем диспергируют в растворителе частицы одного или двух или более соединений, выбранных из сахаров и сахарных спиртов. К дисперсии добавляют раствор съедобного полимера и по необходимости остальные добавки, такие как пластификатор. Сходным образом, как описано выше, надлежащее количество смеси наносят на антиадгезионную пленку и затем высушивают. Высушенный продукт нарезают на желаемые формы желаемого размера и герметично упаковывают по мере необходимости. Таким образом производят пероральный препарат в виде пленки.
Органический растворитель с параметром растворимости от 9,7 или выше, который применяется в производстве перорального препарата в виде пленки по настоящему изобретению, может быть таким, в котором нерастворимы сахара или сахарные спирты, но растворим съедобный полимер. Примеры таковых включают метанол, этанол, изопропанол, пропиленгликоль, метиленхлорид и ацетон. Любое выбранное из них соединение можно использовать по отдельности, или два или более соединений можно использовать в комбинации. Из них являются предпочтительными низшие спирты, такие как метанол, этанол и изопропанол, метиленхлорид и ацетон, и можно также добавлять очищенную воду, если их количество будет невелико. Если раствор пузырится в процессе приготовления, раствор следует деаэрировать, оставляя раствор стоять в течение ночи или посредством вакуумной деаэрации.
В настоящем описании, термин "параметр растворимости" (величина SP) относится к квадратному корню из теплоты испарения (кал/см3), которая требуется для одного моля по объему жидкости, чтобы испариться. Таблица 1 показывает параметр растворимости органических растворителей и воды, которые можно использовать в настоящем изобретении. Параметр растворимости органического растворителя, который можно использовать в настоящем изобретении составляет предпочтительно от 9,7 до 20 и более предпочтительно от 9,7 до 15. Растворитель с параметром растворимости, превышающим 20, не является предпочтительным для цели по настоящему изобретению, поскольку он, возможно, растворяет сахара или сахарные спирты.
|
ПРИМЕРЫ
Настоящее изобретение будет более конкретно описано при помощи следующих примеров, которые, однако, не предназначены для ограничения объема настоящего изобретения.
Частицы сахаров и сахарных спиртов, используемых в примерах и сравнительных примерах, были измельчены до состояния порошка, подвергнуты просеиванию через сито (32 мкм, 50 мкм или 90 мкм) и измерены для определения 50 об.% среднего размера частиц при помощи лазерного рассеивающего анализатора размера частиц. Полученную величину использовали в качестве показателя размера частиц для соответствующих частиц. Таблица 2 показывает 50 об.% средних размеров частиц для используемых сахаров и сахарных спиртов.
|
Примеры 1, 2
Таблица 3 показывает составы перорального препарата в виде пленки в примерах 1 и 2 по настоящему изобретению, и составы в сравнительных примерах 1 и 2.
|
Пероральный препарат в виде пленки в примерах 1 и 2 готовили посредством следующих процессов. В соответствии с таблицей 3, 47,0 массовых частей HPC (средневзвешенная молекулярная масса равна приблизительно 30000, степень замещения гидроксипропокси-группами равна от 53,4% до 77,5%) или PVP K-30 (средневзвешенная молекулярная масса равна приблизительно 40000) растворяли в 70,5 массовых частях этанола путем перемешивания для приготовления раствора HPC или PVP K-30 в этаноле. В оставшемся этаноле растворяли путем перемешивания 9,0 массовых частей золмитриптана; и затем 40,0 массовых частей тонкодисперсных частиц D-маннита, заранее просеянных через сито 32 мкм, диспергировали при помощи ультразвукового перемешивания. Дисперсию смешивали с раствором HPC или PVP K-30 в этаноле и 4,0 массовыми частями полиэтиленгликоля путем перемешивания, и смесь деаэрировали в достаточной степени. Смесь наносили на антиадгезионную пленку, сделанную из полиэтилентерефталата, и затем высушивали. Таким образом изготавливали пленку с толщиной приблизительно 100 мкм. Полученную пленку разрезали на прямоугольники размером 3 см2, посредством чего изготавливали препарат в виде пленки.
Пероральные препараты в виде пленки в сравнительных примерах 1 и 2 готовили посредством следующих процессов. В соответствии с таблицей 3, 9,0 массовых частей золмитриптана растворяли при нагревании в 33,3 массовых частях этанола. 47,0 массовых частей пуллулана или гидроксипропилметилцеллюлозы, 4,0 массовых частей полиэтиленгликоля и 40,0 массовых частей тонкодисперсных частиц D-маннита, заранее просеянных через сито 32 мкм, растворяли в очищенной воде путем перемешивания. Раствор золмитриптана в этаноле растворяли в дисперсии при помешивании при 45°C. Полученный раствор достаточно деаэрировали, наносили на антиадгезионную пленку, сделанную из полиэтилентерефталата, и затем высушивали, посредством чего изготавливали пленку с толщиной приблизительно 100 мкм. Полученную пленку разрезали на прямоугольники размером 3 см2, и таким образом изготавливали препарат в виде пленки.
Примеры 3-10
Таблица 4 показывает составы пероральных препаратов в виде пленки в примерах с 3 по 10 по настоящему изобретению. Препараты готовили посредством той же процедуры, что и пероральные препараты в виде пленки в примерах 1 и 2. А именно, золмитриптан растворяли в этаноле и в нем диспергировали тонкодисперсные частицы сахаров или сахарных спиртов, заранее просеянных через сито 32 мкм. Затем раствор, приготовленный путем добавления HPC к 70,5 массовых частей этанола, и полиэтиленгликоль смешивали с дисперсией. Смесь достаточно деаэрировали, наносили на антиадгезионную пленку, сделанную из полиэтилентерефталата, и затем высушивали. Таким образом изготавливали пленку с толщиной приблизительно 100 мкм. Пленку разрезали на прямоугольники размером 3 см2, посредством чего изготавливали пероральный препарат в виде пленки.
|
Сравнительные примеры 3-13
Таблица 5 показывает составы в сравнительных примерах с 3 по 13.
|
Пероральный препарат в виде пленки в сравнительном примере 3 готовили посредством той же процедуры, что и пероральные препараты в виде пленки в примере 1, за исключением того, что в соответствии с таблицей 5, золмитриптан и полиэтиленгликоль растворяли в этаноле, чтобы приготовить дисперсию, и к дисперсии добавляли раствор HPC в этаноле.
Пероральные препараты в виде пленки в сравнительных примерах с 4 по 13 готовили посредством следующих процессов. Сперва, золмитриптан растворяли при нагревании в этаноле. HPC (средневзвешенная молекулярная масса равна приблизительно 30000, степень замещения гидроксипропокси-группами равна от 53,4% до 77,5%), полиэтиленгликоль и тонкодисперсные частицы сахаров или сахарных спиртов, заранее просеянных через сито 32 мкм, растворяли в очищенной воде путем перемешивания. Раствор золмитриптана в этаноле растворяли в дисперсии при помешивании при 45°C. Полученную смесь достаточно деаэрировали, наносили на антиадгезионную пленку, сделанную из полиэтилентерефталата, и затем высушивали.
Полученные таким образом пленки в сравнительных примерах 3-13, за исключением сравнительных примеров 3, 5, 7, 12 и 13, были очень хрупкими и мягкими, и, таким образом, эти пленки было невозможно снять с антиадгезионной пленки, сделанной из полиэтилентерефталата. По этой причине, в этих сравнительных примерах препарата в виде пленки не получали. Каждую из пленок, полученных в сравнительных примерах 3, 5, 7, 12 и 13, разрезали на прямоугольники размером 3 см2, с тем, чтобы получить препарат в виде пленки.
Примеры 11-20
Таблица 6 показывает составы перорального препарата в виде пленки в примерах с 11 по 20 по настоящему изобретению.
|
Пероральный препарат в виде пленки в примерах с 11 по 16 готовили посредством следующих процессов. А именно, как показано в таблице 6, HPC (средневзвешенная молекулярная масса равна приблизительно 30000, степень замещения гидроксипропокси-группами равна от 53,4% до 77,5%) растворяли путем перемешивания в этаноле, в 1,5-кратном количестве от веса HPC, с тем, чтобы получить раствор HPC в этаноле. Лекарственное средство растворяли в остатке этанола путем перемешивания, и этот раствор смешивали, путем перемешивания, с тонкодисперсными частицами D-маннита, раствором HPC в этаноле и полиэтиленгликолем. Смесь наносили на антиадгезионную пленку, сделанную из полиэтилентерефталата, и затем высушивали. Таким образом изготавливали пленку с толщиной приблизительно 100 мкм. Полученную пленку разрезали на прямоугольники размером 3 см2, посредством чего изготавливали препарат в виде пленки.
Пероральные препараты в виде пленки в примерах с 17 по 20 готовили посредством следующих процессов. А именно, как показано, в таблице 6, лекарственное средство, тонкодисперсные частицы D-маннита и полиэтиленгликоль диспергировали в этаноле в течение 10 минут при помощи ультразвука. В дисперсии растворяли HPC (средневзвешенная молекулярная масса равна приблизительно 30000, степень замещения гидроксипропокси-группами равна 53,4 до 77,5%). Полученный раствор наносили на антиадгезионную пленку, сделанную из полиэтилентерефталата, и затем высушивали. Таким образом изготавливали пленку с толщиной приблизительно 70 мкм. Полученную пленку разрезали на прямоугольники размером 3 см2, посредством чего изготавливали препарат в виде пленки.
Примеры 21-26
Таблица 7 показывает составы пероральных основ в виде пленки в примерах с 21 по 26 по настоящему изобретению.
|
Эти основы были приготовлены, как описано ниже. А именно, как показано в таблице 7, HPC (средневзвешенная молекулярная масса равна приблизительно 30000, степень замещения гидроксипропокси-группами равна от 53,4% до 77,5%) растворяли путем перемешивания в этаноле, в 1,5-кратном количестве от веса HPC (примеры с 21 по 23 и 26) или в количестве, равном весу HPC (примеры 24 и 25), для того, чтобы получить раствор HPC в этаноле. Тонкодисперсные частицы D-маннита диспергировали в остатке этанола при помощи ультразвука. Дисперсию затем смешивали с раствором HPC в этаноле и полиэтиленгликолем. Смесь наносили на антиадгезионную пленку, сделанную из полиэтилентерефталата, и затем высушивали. Таким образом изготавливали пленку с толщиной приблизительно 100 мкм. Полученную пленку разрезали на прямоугольники размером 3 см2, посредством чего изготавливали основу в виде пленки.
Пероральные препараты в виде пленки и основы, приготовленные в примерах и сравнительных примерах в соответствии с настоящим изобретением, оценивали на прочность пленки, ощущение липкости во рту, профиль растворения во рту, и ощущение при касании пальцами, путем измерений в тесте на высвобождение, тесте на жесткость, тесте на прочность при растяжении, тесте на продолжительность липкости, оральном тесте на растворимость и сенсорном тесте (ощущение). Средний размер частиц для тонкодисперсных частиц сахаров и сахарных спиртов, диспергированных в каждой основе в виде пленки, определяли с использованием микроскопа. Каждый способ тестирования описан ниже.
(1) Тест на расслаивание
Каждый образец препаратов в виде пленки или основ во время их изготовления снимали с полиэтилентерефталатной пленки и оценивали с использованием следующих критериев.
Критерии оценки
4: Снимается легко
3: Можно снять
2: Можно снять с некоторым усилием
1: Можно снять с усилием, но пленка рвется
0: Вообще нельзя снять
(2) Тест на жесткость
Тест проводили с использованием следующего способа "JIS L1096 Способы тестирования для ткацких фабрик, 8.19 Жесткость, 8.19.1 Способ A (способ с 45° консолью)". В этом тесте, пять образцов для испытания размером 20×150 мм были выбраны из образцов каждого из примеров и сравнительных примеров, и короткий край образцов для испытания совместили с нулем на шкале, расположенной на гладкой, плоской платформе, у которой один конец наклонен на 45° вниз. Затем образцу осторожно придавали скольжение в направлении наклона любым подходящим способом, и когда центральная точка ребра образца вступила в контакт с наклоном A, положение задней кромки отметили на шкале. Жесткость выражали как длину (в мм), которую прошел образец. Жесткость определяли посредством измерений расстояний, на которые переместились пять образцов лицевой стороной как вверх, так и вниз, как вперед, так и назад, с последующим расчетом среднего значения. Оценочные критерии перечислены ниже и основаны на жесткости (приблизительно 60 мм) препарата в виде пленки, не содержащего в своем составе сахара (сравнительный пример 3). Если приготовленный образец было физически невозможно снять с антиадгезионной пленки и, таким образом, получить препарат в виде пленки, образец получал оценку 0.
Критерии оценки
4: 60±10 мм или больше, менее чем 60±20 мм
3: 60±20 мм или больше, менее чем 60±30 мм
2: 60±30 мм или больше, менее чем 60±40 мм
1: 60±40 мм или больше
(3) Тест на прочность при растяжении
Этот тест проводили, следуя "JIS K7127 Способ исследования свойств растяжения пластиковых пленок и листов". Каждую из основ в виде пленки и препараты нарезали на образцы размером 12×50 мм, и на них проводили тест после высушивания в сушильном аппарате. Использовали небольшой настольный аппарат для теста на растяжение в вертикальном положении (произведен Shimadzu Corporation, EZ TEST-100M) для проведения теста при скорости растяжения 60 мм/мин. Поскольку для тестовых образцов растяжения практически не наблюдалось, в качестве величины прочности при растяжении использовали прочность при растяжении в измеренной точке начала разрушения. Тест повторили три раза для каждого образца, и среднее значение записали как прочность при растяжении. Прочность при растяжении затем перевели в оценку с использованием следующих критериев. Если приготовленный образец было физически невозможно снять с антиадгезионной пленки и таким образом получить препарат в виде пленки, образец получал оценку 0.
Критерии оценки
4: Прочность при растяжении = 10 Н или больше, менее чем 20 Н
3: Прочность при растяжении = 5 Н или больше, менее чем 10 Н
2: Прочность при растяжении = 2 Н или больше, менее чем 5 Н
1: Прочность при растяжении = менее чем 2 Н
(4) Тест на длительность липкости
Тест проводили с использованием реометра (SUN SCIENTIFIC, 35 CR-2000) на тестовых образцах диаметром 12 мм, нарезанных из каждого препарата в виде пленки и основ. Здесь "липкость" относится к прочности прилипания образца к адгеренту за время приведения образца, посредством небольшого усилия, в контакт с адгерентом на короткое время. Условия теста показаны на фиг.2. Сперва образец 2c приклеивали к штанге 2a диаметром 12 мм при помощи двухсторонней ленты 2b. Раздельно, кусок резины 2e установили на тестовой платформе 2f, и поместили на него коллагеновую пленку 2d, пропитанную водой. Затем нанесли на образец 200 мкл очищенной воды, штангу 2a с образцом 2c, приклеенным к ней, опускали, приводя в контакт с поверхностью коллагеновой пленки 2d, и затем поднимали. В этот момент длительность липкости после начального прилипания, которое получили, когда штанга 2a высвободилась от коллагеновой пленки 2d, измеряли на бумаге для регистрации при помощи штангенциркуля. Результаты измерений были преобразованы в оценки по следующим критериям. Образцы, которые вообще невозможно было снять с антиадгезионной пленки, вырезали вместе с антиадгезионной пленкой, и приклеивали к штанге стороной с антиадгезионной пленкой при помощи двухсторонней ленты. Затем длительность липкости измеряли тем же образом.
Критерии оценки
4: Значение измерения продолжительности липкости = менее чем 2 мм
3: Значение измерения продолжительности липкости = 2 или более, менее чем 3 мм
2: Значение измерения продолжительности липкости = 3 или более, менее чем 4 мм
1: Значение измерения продолжительности липкости = 4 мм или более
(5) Пероральный тест на растворимость
Сперва 900 мл фосфатного буфера с pH 6,8 помещали в 1000-мл низкую стеклянную чашку Петри, в него погружали перевернутую сетчатую корзину из нержавеющей стали (диаметром 4 мм) и перемешивали буфер с помощью мешалки (300 об./мин.). Температуру жидкости поддерживали на уровне 37±2°C с использованием водного циркулятора с постоянной температурой. Образец для испытаний (3 см2) погрузили в жидкость, и одновременно поместили на его поверхность сито из нержавеющей стали 3×3 см (сетка 5 мм) в качестве грузила. Распад образца для испытаний контролировали визуально, и длительность от времени погружения образца до конца его распада измеряли с помощью секундомера. Измерение каждого образца повторяли троекратно и среднее значение измерений использовали в качестве времени растворения во рту. Время растворения во рту превращали в оценку с использованием следующих критериев. Если приготовленный образец было физически невозможно снять с антиадгезионной пленки и, таким образом, получить препарат в виде пленки, образец получал оценку 0.
Критерии оценки
4: Время растворения во рту = менее 10 сек.
3: Время растворения во рту = 10 сек. или дольше, меньше, чем 15 сек.
2: Время растворения во рту = 15 сек. или дольше, меньше, чем 20 сек.
1: Время растворения во рту = 20 сек. или дольше
(6) Сенсорный тест (ощущение)
Соответственно нарезанные препараты в виде пленки или основы оценивали на неприятное ощущение липкости на основании следующих критериев с помощью исследователя, посредством рисования круга пальцами на поверхности в течение 5 сек. Если приготовленный образец было физически невозможно снять с антиадгезионной пленки и таким образом получить препарат в виде пленки, образец получал оценку 0.
Критерии оценки
4: Нет ощущения липкости
3: Слегка липкая, но не неприятная
2: Неприятное ощущение липкости
1: Очень липкая, и пленка остается на пальцах
(7) Средний размер тонкодисперсных частиц сахарных спиртов в основе в виде пленки
Размер мелкодисперсных частиц D-маннита от A до C в пероральной основе в виде пленки в каждом из примеров с 21 по 23 по настоящему изобретению измеряли при помощи микроскопа (продукт Keyence Corp., модель VHX-600). Сперва измеряли 200 частиц, и из этих измерений рассчитывали 50 об.% среднего размера частиц.
Таблица 8 показывает оценочные результаты тестов с (1) по (6), проведенные на препаратах в виде пленки в примерах с 1 по 10.
|
Все пероральные препараты в виде пленки, перечисленные в таблице 8, получили хороший оценочный балл в соответствующих тестах, за исключением того, что пероральный препарат в виде пленки в примере 4 получил немного плохой оценочный балл в сенсорном тесте. А именно, таблица 8 показывает, что пероральный препарат в виде пленки в каждом из примеров с 1 по 10 по настоящему изобретению показал хорошие антиадгезионные свойства, обладал достаточной прочностью, хорошо растворялся во рту и создавал хорошие ощущения и только легкое ощущение липкости.
Таблица 9 показывает оценочные результаты тестов с (1) по (6), проведенные на препаратах в виде пленки в сравнительных примерах с 1 по 13.
|
Пероральный препарат в виде пленки сравнительного примера 1 в таблице 9, произведенный путем растворения в очищенной воде пуллулана, который представляет собой съедобный полимер, растворимый в воде, но почти нерастворимый в этаноле, не получил хороших оценочных баллов ни в одном из тестов. Пероральный препарат в виде пленки сравнительного примера 2, произведенный с использованием гидроксипропилметилцеллюлозы, которая представляет собой съедобный полимер, растворимый в воде, но почти нерастворимый в этаноле, имел низкую прочность на прогиб и создавал ощущение липкости. Пероральный препарат в виде пленки сравнительного примера 3, не содержащий ни сахара, ни сахарных спиртов, плохо растворялся во рту и создавал сильное ощущение липкости. Каждый из пероральных препаратов в виде пленки сравнительных примеров с 4 по 12, произведенный путем растворения HPC в очищенной воде, не обладал достаточной прочностью как пленка. Пероральный препарат в виде пленки сравнительного примера 13, произведенный путем растворения HPC в очищенной воде без использования тонкодисперсных частиц сахаров и сахарных спиртов, плохо растворялся во рту и создавал сильное ощущение липкости.
Таблица 10 показывает оценочные результаты тестов с (1) по (6) проведенные на препаратах в виде пленки в примерах с 11 по 20.
|
Каждый из пероральных препаратов в виде пленки в примерах от 11 до 20 по настоящему изобретению, перечисленных в таблице 10, получил хороший оценочный балл в соответствующих тестах, и обладал достаточной прочностью пленки, хорошим растворением во рту и хорошим вкусом, даже когда содержал любое из различных лекарственных средств.
Таблица 11 показывает оценочные результаты тестов от (1) до (6), проведенные на основах в виде пленки в примерах с 21 по 26.
|
Каждая из пероральных основ в виде пленки в примерах с 21 по 26 по настоящему изобретению, перечисленных в таблице 11, получила хорошие оценочные баллы в соответствующих тестах, за исключением теста на продолжительность липкости основы в виде пленки в примере 24 и прочности при растяжении основы в виде пленки в примере 26.
Таблица 12 показывает результаты определения среднего размера частиц для пероральных основ в виде пленки в примерах 21-23. Фиг.3-5, каждая, показывают изображение, полученное при помощи микроскопа.
|
Таблица 12 показывает, что 50 об.% среднего размера тонкодисперсных частиц D-маннита не претерпели существенных изменений в каждой из пероральных основ в виде пленки в примерах с 21 по 23 по настоящему изобретению, по сравнению с тем, что было до добавления, что означает, что D-маннит диспергировал в основе в виде тонкодисперсных частиц без растворения. Хорошую дисперсию тонкодисперсных частиц D-маннита также отмечали при наблюдении за пероральными основами в виде пленки в примерах с 21 по 23 при помощи микроскопа, как показано на фиг.3-5.
Промышленная применимость
Настоящее изобретение относится к пероральной основе в виде пленки и препарату, которые обладают достаточной прочностью пленки и быстрым профилем растворения во рту и обеспечивают сниженное чувство липкости во рту и улучшенное ощущение при держании в пальцах.
Настоящая заявка утверждает приоритет международной заявки PCT/JP2009/051511, зарегистрированной согласно Договору о патентной кооперации, полное содержание которой включено, таким образом, в настоящий документ в качестве ссылки.