Результат интеллектуальной деятельности: Полипептиды для лечения онкологических заболеваний
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии и медицины, в частности, к новым последовательностям полипептида, способного ингибировать активность RAS-ГТФазы, включающего функциональный фрагмент и транспортную последовательность, при этом функциональный фрагмент включает аминокислотную последовательность SEQ ID NO: 1 и/или любой другой фрагмент длиной не менее 6 из последовательности аминокислот SEQ ID NO: 1 или, по меньшей мере, на 60% идентичной ей последовательности.
Изобретение также относится к применению вышеуказанного полипептида для ингибирования сигнального пути MAPK/ERK, который гиперактивирован при многих онкологических заболеваниях, а также приготовления лекарственного средства для лечения злокачественной или доброкачественной опухоли.
Уровень техники
Ras самый распространенный онкоген опухолей человека, на который не действует ни один из зарегистрированных препаратов. Мутации генов Ras-GTP, приводящие к гиперактивации сигнального пути MAPK/ERK, встречаются в 25% всех опухолей человека. Мутации приводят к тому, что Ras-киназа постоянно находится в комплексе с GTP. Двойной комплекс Ras-GTP с высокой афинностью связывает Raf-киназу, в результате чего образуется активный тройной комплекс Ras-Raf-GTP, который фосфорилирует МЕК киназу и, тем самым, передает сигнал дальше по каскаду киназ, активируя пролиферативную активность. Сигналы, передаваемые по сигнальному пути RAS/MAPK/ERK, определяют активность опухолевой клетки, способность к росту, метастазированию, а также определяют сроки жизни раковых клеток. Выделенный полипептид связывается с активным комплексов Ras-GTP по сайту связывания Raf-киназы и препятствует образованию активного тройного комплекса Ras-Raf-GTP, тем самым, ингибируя сигнальный путь MAPK/ERK, вызывает остановку пролиферации и/или элиминацию клетки путем апоптоза.
Ключевая реакция активации Ras и дальнейшей передачи им сигнала заключается в связывании GTP. Поэтому активно исследовались подходы для воздействия именно на G-домен Ras. Эти подходы были основаны на попытках увеличении скорости гидролиза мутантной формы Ras (1,2) ингибировании обмена GDP-GTP (3, 4).
Большая частота мутаций Ras при злокачественных заболеваниях делает его привлекательной мишенью для противоопухолевой терапии. Способы достижения этой цели могут быть основаны на ингибировании ферментов посттрансляционной модификации Ras-белка. Наиболее частой мишенью для достижения этой цели являются фарнезилтрансфераза и геранил-геранилтрансфераза 1 (geranyl geranyl transferase I), которые участвуют в присоединении прениловой группы к аминокислотным остаткам ras белка. (Prenylation - процесс переноса прениловой группы (15-carbon farnesylor 20-carbon geranyl-geranyl) на цистеиновый остаток Ras на егоС-конце.) Описан ингибитор FTI - показавший себя как потенциальный кандидат в качестве противоопухолевого агента при Ras-активированных вариантах опухолей (5, 6, 7). Несмотря на то, что FTI проявил активность в отношении вариантов рака с мутациями H-RAS и N-RAS он оказался не активным в отношении опухолей с мутантными вариантами K-RAS. Поэтому, несмотря на то, что ряд ингибиторов фарнезилтрансферазы показали обнадеживающую противоопухолевую активность, необходимы поиски средств ингибирования мутантных форм K-RAS.
В работе, появившейся в 2015 году (8), описывается использование пептидов для ингибирования Ras-GTP. Авторы провели компьютерный анализ пептидной библиотеки и выявили несколько циклических пептидов, обладающих свойствами ингибирования Ras и интернализации. Действие этих пептидов на клетки приводило к активации апотоза. Исследования in vivo авторами не проводилось.
Дополнительным мотивом к поиску технологий применения естественных белковых ингибиторов пролиферации стало открытие коротких последовательностей аминокислот (n=15-30), способных выполнять векторные (транспортные) функции в отношении пептидных последовательностей и соединений другой химической природы (РНК, ДНК) (9).
До настоящего времени проблему восстановления нарушенной функции внутриклеточных белков пытались решать на основе методов доставки гена (генная терапия) (10). Однако эта технология до настоящего времени не получила широкого выхода в клиническую практику из-за ряда принципиальных проблем.
Альтернативный способ решения этой задачи, основанный на технологии пептидных векторов, обладающих способностью проникать в клетки, не повреждая плазматическую мембрану, является весьма перспективным ввиду слабой иммуногенности таких соединений и способности переносить достаточно крупные молекулы.
Соединение возможности целевой доставки пептидов в клетку и обнаружение коротких функциональных доменов в белках регуляторах различных клеточных функций создали предпосылки для конструирования молекул имеющих патогенетическую направленность (11). Относительная простота синтеза таких молекул позволяет говорить о принципиальной возможности создания индивидуальных химиопрепаратов на их основе, т.е. влияющих на патологические изменения свойственных данной конкретной опухоли (Perea S.E. и др., 2004).
Открытие пептидов, способных проникать в клетку без участия мембранных белков и способных осуществлять внутриклеточный транспорт связанных с ними белковых фрагментов и олигонуклеотидов открывает новый этап в развитии биологии и медицины. Одним из эффективных переносчиков крупных молекул внутрь клеток является пептид pAntp. Его свойства известны, в частности, из публикаций Derossi D. et al.. The third helix of the Antennapedia homeodamain translocates through membranes. // J. Biol. Chem. 269 (1994) 10444-10450 и Morris MC. et al. A peptides carrier for the delivery of biologically active proteins in mammalian cells. // Nat. Biotechnology. 19 (2001) 1173-1176.
Раскрытие изобретения
Задачей изобретения является создание нового химерного пептида, обладающего повышенным терапевтическим действием и не требующего сложной и трудоемкой схемы его получения.
Техническим результатом настоящего изобретения является медико-биологический эффект, объективно проявляющийся в выраженном цитотоксическом действии указанного полипептида на опухолевые клетки таких заболеваний, как колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка рак яичника, миеломы, злокачественной лимфомы, а также фиброаденомы молочной железы, кроме того упрощение схемы получения химерного пептида за счет уменьшения общего количества стадий. Дополнительными техническими результатами являются возможность ингибировать белок-белковое взаимодействие, а также ингибировать мутантные формы K-RAS.
Технический результат достигается благодаря получению полипептида с антипролиферативной активностью, а именно, способного ингибировать активность RAS-ГТФазы, содержащего функциональный фрагмент и транспортную последовательность, при этом функциональный фрагмент включает аминокислотную последовательность SEQ ID NO: 1 и/или любой другой фрагмент длиной не менее 6 из последовательности аминокислот SEQ ID NO: 1 или, по меньшей мере, на 60% идентичной ей последовательности.
В одном из вариантов осуществления настоящее изобретение относится к полипептиду с антипролиферативной активностью, а именно, способного ингибировать активность RAS-ГТФазы, включающий аминокислотную последовательность SEQ ID NO: 1 или ее фрагмент, длиной не менее 6 аминокислот, или по меньшей мере на 60% идентичную ей последовательность.
В одном из вариантов осуществления настоящее изобретение относится к полипептиду с антипролиферативной активностью, а именно, способного ингибировать активность RAS-ГТФазы, содержащему функциональный фрагмент и транспортную последовательность, при этом функциональный фрагмент включает аминокислотную последовательность, по меньшей мере, на 60% идентичную последовательности аминокислот SEQ ID NO: 1.
В одном из вариантов осуществления настоящее изобретение относится к полипептиду с антипролиферативной активностью, при этом между функциональным фрагментом и транспортной последовательностью могут быть вставки различной химической природы.
В одном из предпочтительных вариантов осуществления настоящее изобретение относится к химерному пептиду с антипролиферативной активностью, содержащему функциональный фрагмент, включающий аминокислотную последовательность SEQ ID NO: 1.
В одном из вариантов осуществления настоящее изобретение относится к функциональному пептиду с антипролиферативной активностью, включающему аминокислотную последовательность SEQ ID NO: 1 и/или любой другой фрагмент длиной не менее 6 из последовательности аминокислот SEQ ID NO: 1 или, по меньшей мере, на 60% идентичной ей последовательности.
В одном из вариантов осуществления настоящее изобретение относится к функциональному пептиду, включающему аминокислотную последовательность по меньшей мере на 60% идентичную последовательности аминокислот SEQ ID NO: 1.
В одном из предпочтительных вариантов осуществления настоящее изобретение относится к функциональному пептиду, включающему аминокислотную последовательность SEQ ID NO: 1.
В другом варианте осуществления настоящее изобретение относится к применению указанного химерного пептида или функционального фрагмента для ингибирования активности RAS-ГТФазы.
В другом варианте осуществления настоящее изобретение относится к применению указанного химерного пептида или функционального фрагмента для получения лекарственного средства, предназначенного для лечения онкологических заболеваний.
В одном из предпочтительных вариантов осуществления настоящее изобретение относится к химерному пептиду или функциональному фрагменту, который может быть использован для лечения злокачественной опухоли, выбранной из группы, включающей, колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка, рак яичника, миелома и злокачественная лимфома.
В другом варианте осуществления настоящее изобретение относится к способу ингибирования сигнального пути MAPK/ERK с использованием химерного пептида или функционального фрагмента.
Используемый в настоящем документе термин «химерный пептид» включает в себя пептид, имеющий определенную последовательность связывания функционального и транспортного фрагментов в химерной пептидной молекуле, дополнительно для связывания может использоваться любая последовательность любой длины, в том числе посредством дополнительных аминокислотных остатков (от 1 до 50), связывающих между собой два вышеуказанных фрагмента, при этом транспортная аминокислотная последовательность, как вариант, может быть присоединена к С-концу указанной функциональной последовательности посредством группы X, где X представляет собой аминокислотную последовательность, содержащую от 1 до 50 аминокислотных остатков, а также могут использоваться вставки различной химической природы. Методы получения химерного пептида включают в себя как твердофазный метод, представлен в документах RU 2297241, 22.11.2004 и RU 2435783, 29.09.2010, так и генно-инженерный метод, представлен в документах RU 2297241, 22.11.2004 и RU 2435783, 29.09.2010. Исследование свойств данных химерных пептидов приведены в документе RU 2435783.
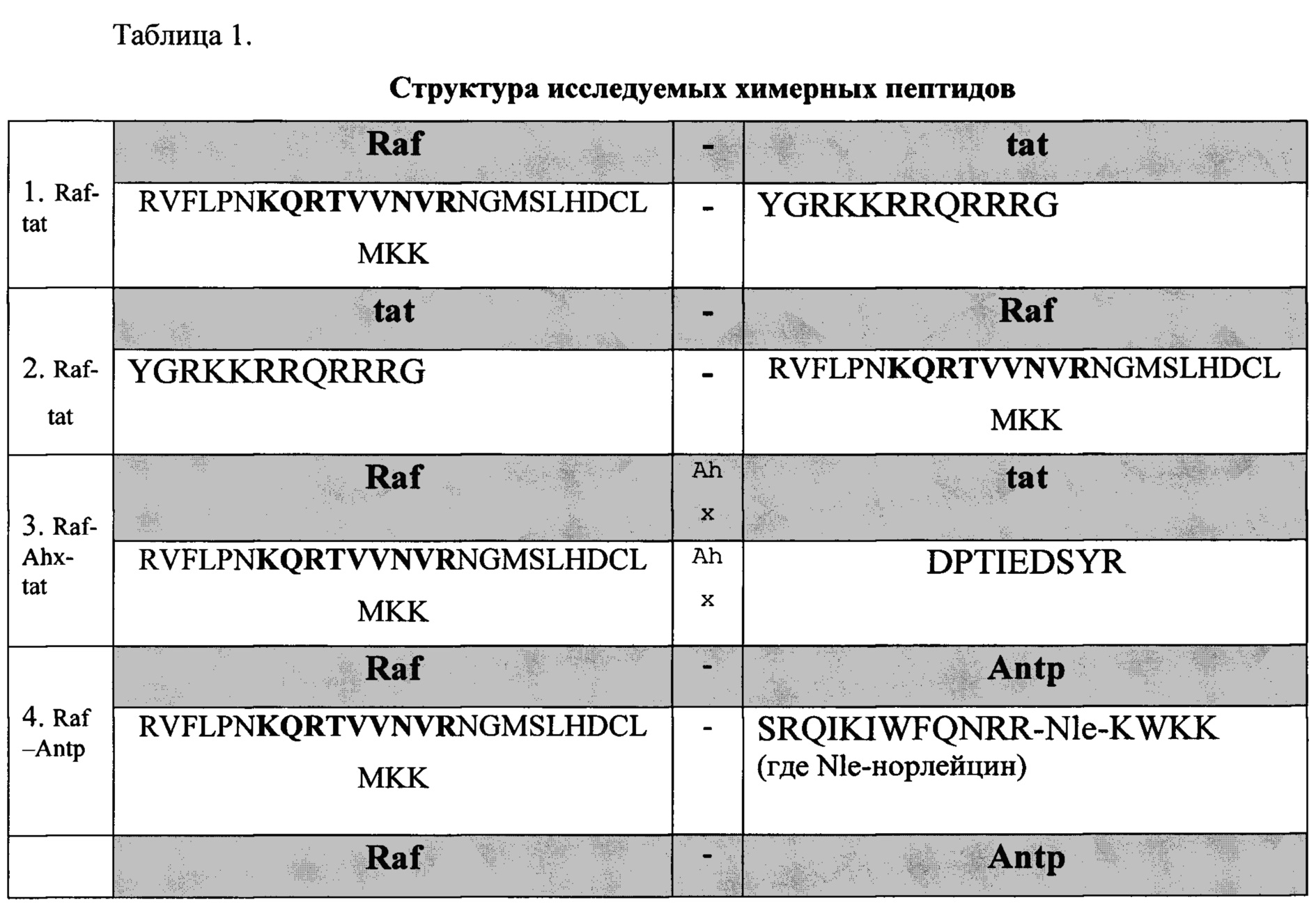
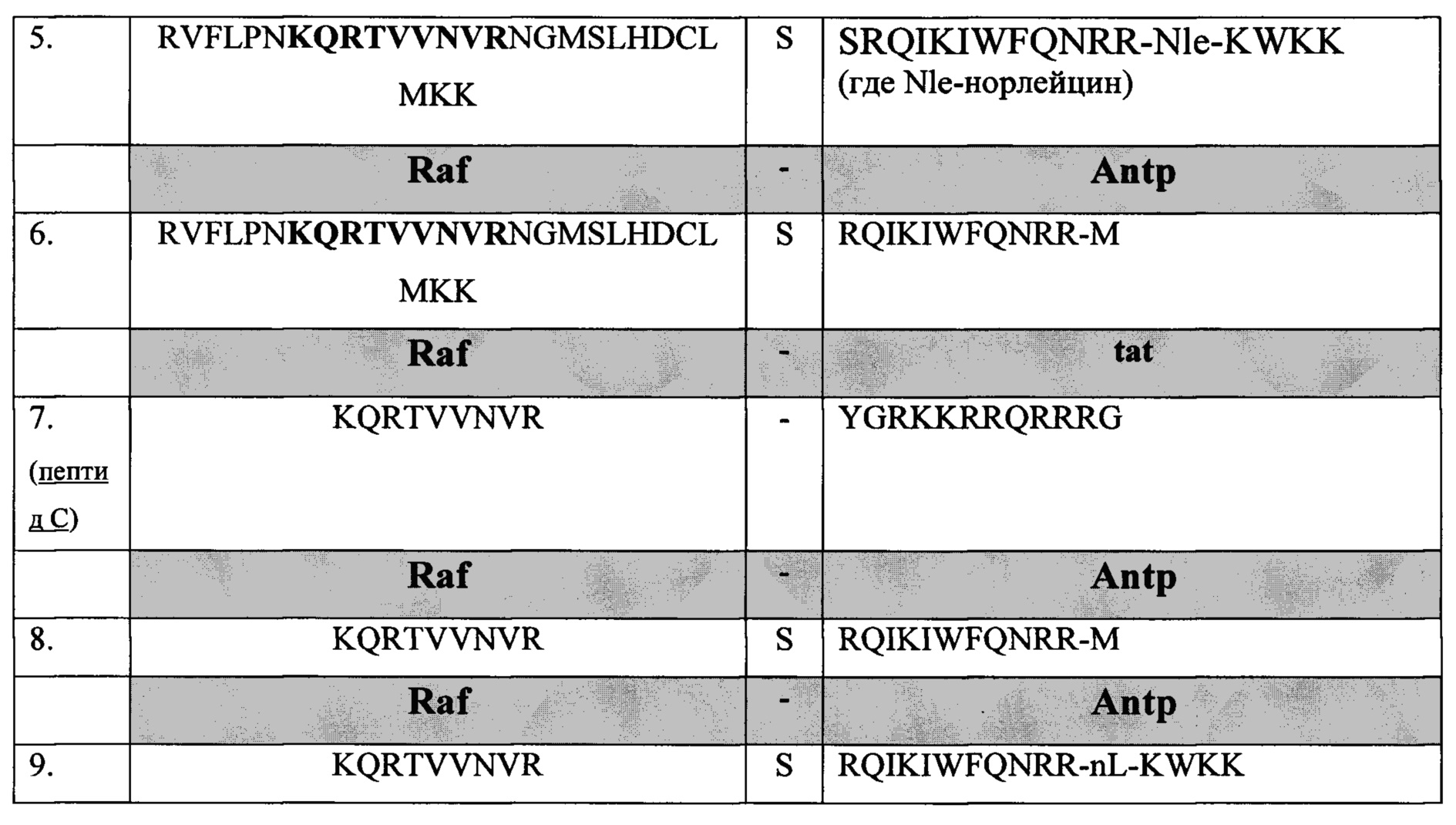
Пептиды 1-9 состоят из функциональной части Raf и интернализуемой последовательности pAntp или tat и отличаются по местоположению функциональной группы относительно N-, С- концов молекулы и по наличию вставки для пептида. Пептиды 4-9 имеют варианты по месторасположению функциональной группы относительно N-, С- концов, так функциональный фрагмент может располагаться у NH2- конца, так и у -СООН конца. Соответственно транспортная последовательность может располагаться у NH2- конца, так и у -СООН конца.
Используемый в настоящем документе термин «функциональный фрагмент» или полипептид может представлять любую полипептидную последовательность размера не менее 6 из SEQ ID NO: 1, а также гомологичной ей на 60% и более последовательности. SEQ ID NO: 1 представляет фрагмент с 59 по 87 аминокислоту из белка RAF (UniProtKB - Р04049 (RAF 1 HUMAN)
(59)RVFLPNKQRTVVNVRNGMSLHDCLMKK(87)
SEQ ID NO: 2 KQRTVVNVR представляет фрагмент аминокислотной последовательности SEQ ID NO: 1.
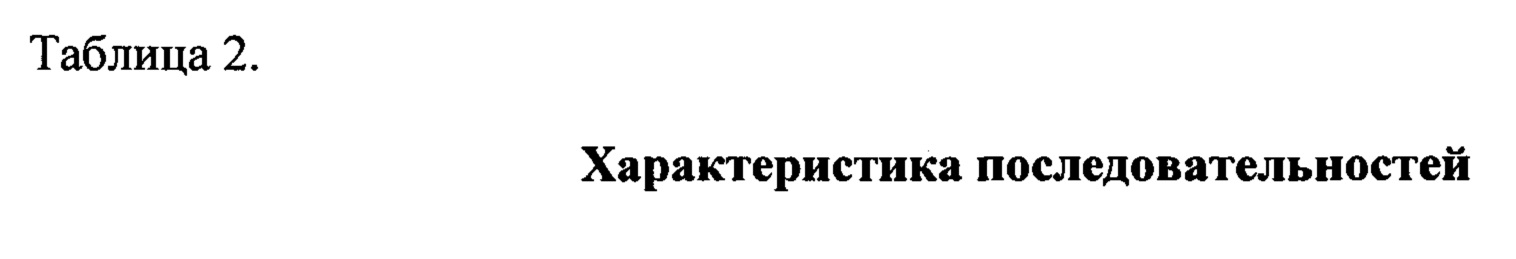
Настоящее изобретение охватывает также последовательности гомологичные (идентичные) на 60% и более SEQ ID NO: 1 или SEQ ID NO: 2. Гомология рассчитывается с помощью программ, известных для специалиста данной области.
Настоящее изобретение охватывает также варианты аминокислотных последовательностей SEQ ID NO: 1 или SEQ ID NO: 2. Варианты аминокислотных последовательностей могут являться замещающими либо инсерционными вариантами.
Настоящее изобретение охватывает также варианты аминокислотных последовательностей SEQ ID NO: 1 или SEQ ID NO: 2, а также любые вставки и делеции 1-2 аминокислот или их аналогов.
Как правило, инсерционные мутанты подразумевают добавление материала на неконечной точке пептида. Сюда может относиться включение нескольких остатков, иммунореактивного эпитопа или просто одного остатка. Добавляемый материал может подвергаться изменениям, например, метилирование, ацетилирование и т.п. Либо к N- или С-терминальному концу пептида могут добавляться дополнительные остатки.
Что касается замещающих вариантов, то, как правило, они подразумевают замещение одной аминокислоты другой аминокислотой на одном или нескольких участках пептида. Замещение может использоваться для модулирования одного или нескольких свойств пептида, например, устойчивости к протеолизу, без потери других функций или свойств. Предпочтительно, чтобы подобные замещения были консервативными, иными словами, одна аминокислота замещается другой аминокислотой схожей формы и заряда. Консервативные замещения хорошо известны, к ним относятся, например, замены следующего типа: аланин на серии, аргинин на лизин, аспарагин на глутамин или гистидин, аспартат на глутамат, цистеин на серии, глутамин на аспарагин, глутамат на аспартат; глицин на пролин, гистидин на аспарагин или глутамин, изолейцин на лейцин или валин, лейцин на валин или изолейцин, лизин на арганин, метионин на лейцин или изолейцин, фенилаланин на тирозин, лейцин или метионин, серии на треонин, треонин на серии, триптофан на тирозин, тирозин на триптофан или фенилаланин, валин на изолейцин или лейцин.
Ниже представлено обсуждение замены аминокислот пептида для получения эквивалента либо улучшенной молекулы второго поколения. Например, некоторые аминокислоты могут замещаться другими аминокислотами в структуре пептида/ белка без существенной потери в связывающей способности взаимодействия с такими структурами, как, например, участки связывания на молекулах носителя или участки антител, отвечающие за связывание антигена. Поскольку связывание является связыванием взаимодействия и в силу природы пептида/ белка, которая определяет биологическую функциональную активность такого пептида/ белка, замещение некоторых аминокислот может осуществляться в ряде пептида/ белка и в ряде кодирования ДНК; в результате будет получен белок со схожими свойствами. Таким образом, выдвигается предположение, что различные изменения могут вноситься в ряд ДНК генов без существенной потери их биологических свойств или активности (см. обсуждение ниже). Далее, аминокислоты, рассматриваемые в рамках настоящего изобретения, могут содержать изменения, например, метилирование, ацетилирование, миристилирование и т.п.
При внесении таких изменений можно учесть индекс гидропатичности аминокислот. Важность индекса гидропатичности аминокислот для переноса биологической функции на пептид/ белок хорошо известна (Kyte and Doolittle, 1982). Допускается, что относительные свойства гидропатичности аминокислоты влияет на вторичную структуру получаемого пептида/ белка, что, в свою очередь, определяет взаимодействие пептида/ белка с другими молекулами, например, с ферментами, субстратами, рецепторами, ДНК, антителами, антигенами и т.п.
Каждая аминокислота имеет индекс гидропатичности, зависящий от ее гидропатичности и заряда (Kyte and Doolittle, 1982): изолейцин (+4,5), валин (+4,2), лейцин (+3,8), фенилаланин (+2,8), цистеин/ цистин (+2,5), метионин (+1,9), аланин (+1,8), глицин (-0,4), треонин (-0,7), серии (-0,8), триптофан (-0,9), тирозин (-1,3), пролин (-1,6), гистидин (-3,2), глутамат (-3,5), глутамин (-3,5), аспартат (-3,5), аспарагин (-3,5), лизин (-3,9) и аргинин (-4,5).
Известно, что некоторые аминокислоты могут замещаться другими аминокислотами с аналогичным индексом или показателем гидропатичности с получением аналогичного пептида/ белка со схожей биологической активностью, т.е. получается эквивалентный по биологическим функциям пептид/ белок. При внесении таких изменений предпочтительными являются аминокислоты с индексом гидропатичности в пределах +-2, особенно приемлемым является показатель +-1, но самыми оптимальными являются индексы +-0,5.
Признанным является тот факт, что замещение схожих аминокислот может быть оптимальным с учетом гидропатичности. В Патенте США №4,554,101, ссылка на который приводится в настоящем документе, указывается, что максимальная локальная средняя гидропатичность белка (в зависимости от гидропатичности соседних аминокислот) совпадает с биологическим свойством белка. Как описано в Патенте США №4,554,101, аминокислотные остатки имеют следующие значения гидропатичности: аргинин (+3,0), лизин (+3,0), аспартат (+3,0+- 1), глутамат (+3,0+- 1), серии (+0,3), аспарагин (+0,2), глутамин (+0,2), глицин (0), треонин (-0,4), пролин (-0,5+- 1), аланин (-0,5), гистидин (-0,5), цистеин (-1,0), метионин (-1,3), валин (-1,5), лейцин (-1,8), изолейцин (-1,8), тирозин (-2,3), фениланин (-2,5), триптофан (-3,4).
Признанным является тот факт, что аминокислоту можно заместить другой аминокислотой со схожим значением гидропатичности, в результате все равно будет получен белок с эквивалентными биологическими и иммунологическими свойствами. При внесении таких изменений предпочтительными являются аминокислоты с показателем гидропатичности в пределах +-2, особенно приемлемым является показатель +-1, но самыми оптимальными являются индексы +-0,5.
Как указано выше, замещение аминокислот основано преимущественно на относительной схожести заместителей боковых цепей аминокислоты, например, на их гидропатичности, заряде, размере и т.п.Примерами замещений, где учитываются упомянутые выше характеристики, хорошо известны, к ним относятся следующие: арганин и лизин, глутамат и аспартат, серии и треонин, глутамин и аспарагин, валин, лейцин и изолейцин. Тем не менее, изменения аминокислот в рамках настоящего изобретения могут быть и не консервативными, но все же входить в сферу применения настоящего изобретения до тех пор, пока пептиды сохраняют функцию связывания с клетками опухоли.
Еще одним примером приготовления пептидов в соответствии с изобретением является использование миметиков пептида. Миметики - это молекулы, в состав которых входят пептиды, копирующие элементы вторичной структуры белка. См., например, Johnson et al., 1993. Обоснованием использования миметиков пептида является то, что каркас пептидов белка существует преимущественно для построения боковых цепей аминокислоты таким образом, чтобы способствовать взаимодействию молекул, например, антитело и антиген. Ожидается, что миметик пептида обеспечит взаимодействия в молекулах, схожие с естественной молекулой. Такие принципы могут использоваться вместе с описанными выше принципами для получения молекул второго поколения, обладающих рядом естественных свойств Ras, но с измененными или даже улучшенными характеристиками. Например, замещение аминокислот для получения мотивов, обладающих лучшим связыванием с клетками опухоли, либо мотивов, которые можно изменять для связывания различных типов клеток опухоли с получением пептидов, более близких к Ras, разных для различных типов опухоли.
Воплощение настоящего изобретения подразумевает дополнительные меры, связанные с аминокислотной последовательностью, входящей в состав SEQ ID NO:l, либо с его фрагментом или производным элементом, который способствует трансдукции или интернализации противоракового пептида в клетку опухоли.
Используемый в настоящем документе термин «антипролиферативная активность» включает в себя способность ингибиторов циклиновых киназ или композиций, включающих ингибиторы циклиновых киназ, оказывать цитостатический и цитотоксический эффект на клетки злокачественной и доброкачественной опухоли.
Используемый в настоящем документе термин «транспортная последовательность» включает в себя любую транспортную последовательность. Любая транспортная последовательность может быть использована при условии, что заявленная функциональная последовательность, включенная в любую другую полипептидную последовательность любого размера или любую другую структуру или молекулу, выполняет функции, указанные в настоящем документе. Может быть использована, в том числе, и последовательности пептида VP22 (pAntp) вируса простого герпеса в качестве транспортного агента для переноса ингибитора циклиновых киназ внутрь целевых клеток, например, ROIKIWFQNRRMKWKK. В конкретном случае область трансдукции белка также связывается либо соединяется иным образом с конъюгатом Ras-киназ / противоракового компонента. В другом случае область трансдукции белка - это белок ТАТ ВИЧ (Schwarze et al., 1999), добавление области трансдукции белка ускоряет доставку в клетку опухоли, включая клетки опухоли мозга, поскольку эта область позволяет преодолевать гематоэнцефалический барьер. Таким образом, в этом воплощении настоящего изобретения, несмотря на то, что область трансдукции белка ускоряет доставку к любой ткани, пептид Ras-киназу настоящего изобретения направляет весь комплекс исключительно в клетку опухоли, например, при раке головы или шеи, раке молочных желез либо раке мозга, и область трансдукции белка является преимущественно вспомогательным средством ускорения такой доставки и трансдукции комплекса противоракового препарата. Другие области трансдукции белка входят в предмет настоящего изобретения и хорошо известны.
Опытный специалист знает, что можно легко провести скрининг или тест варианта, чтобы определить, сохранил ли вариант противоопухолевые свойства. Иными словами, в соответствии с методикой, представленной в настоящем документе (см. Примеры), вариант аминокислотной последовательности SEQ ID NO:2 или другой вариант интернализирующего пептида может сопрягаться с определимым маркером, введенным в клетку, и анализироваться на предмет интернализации клеткой. Предпочтительный метод анализа заключается в флуоресцентной микроскопии, хотя опытный специалист знает, что метод анализа следует подбирать в зависимости от используемого маркера. В дополнение или вместо этого метода in vitro можно использовать исследование in vivo. Например, вариант, сопряженный с определяемым маркером, вводится животному, к примеру, голой мыши с опухолью или раковой тканью, затем опухолевую ткань животного анализируют для определения маркера. Опытный специалист может использовать другие методы или варианты таких методов для выявления интернализирующего пептида, такого как SEQ ID NO:2, в клетке.
Используемый в настоящем документе термин «онкологическое заболевание» включает в себя как злокачественные, так и доброкачественные опухоли, включая колоректальный рак, рак почек, рак легкого, в том числе немелкоклеточный рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка, рак яичника, миелома, злокачественная лимфома.
Краткое описание чертежей
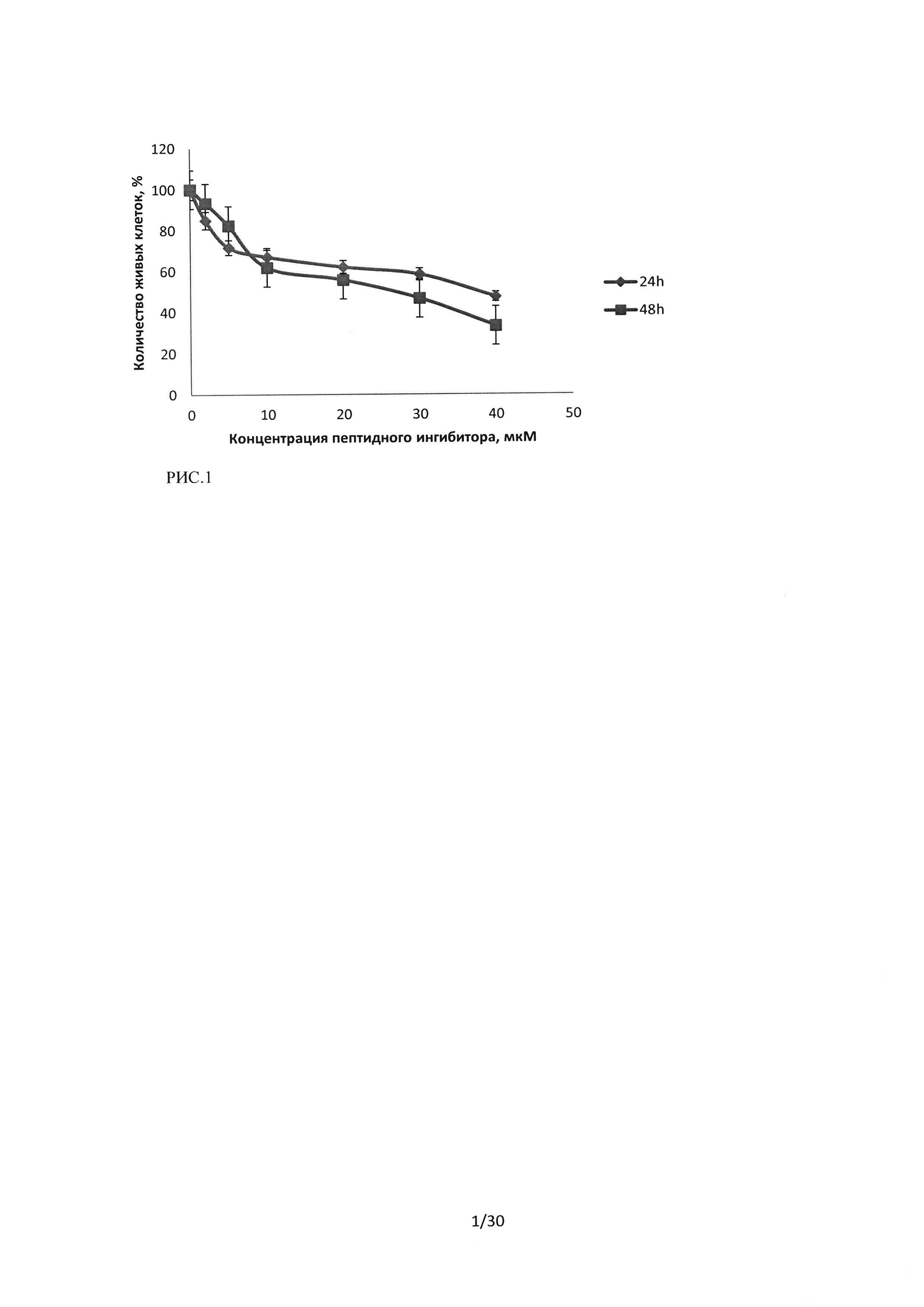
Рисунок 1. Сравнение изменений количества живых клеток при воздействии на культуру А549 последовательности пептидного ингибитора Ras-ГТФазы (пептид С из Таблицы 1, здесь и во всех последующих экспериментах).
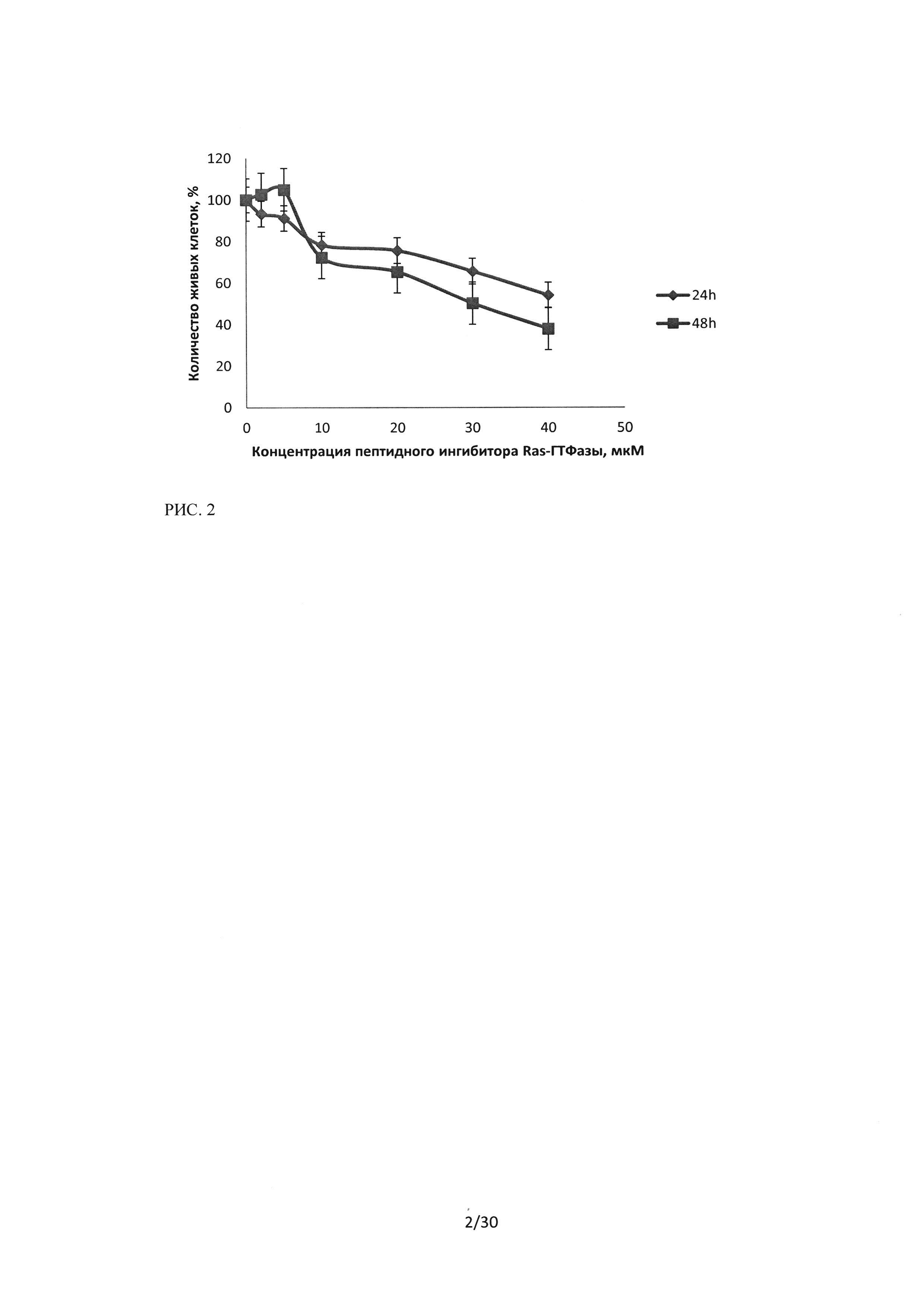
Рисунок 2. Сравнение изменений количества живых клеток при воздействии на культуру Н460 последовательности пептидного ингибитора Ras-ГТФазы.
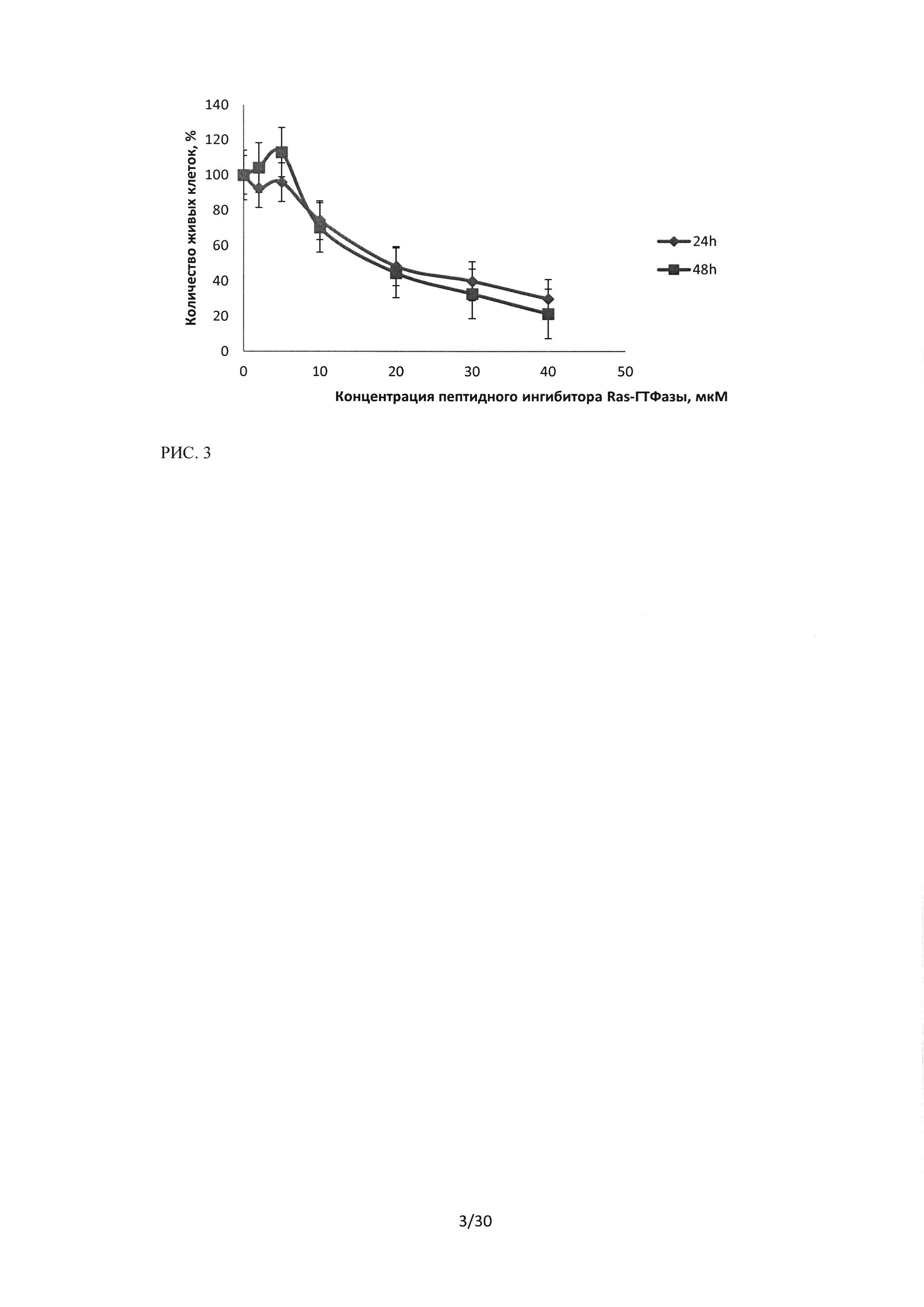
Рисунок 3. Сравнение изменений количества живых клеток при воздействии на культуру HI299 последовательности пептидного ингибитора Ras-ГТФазы.
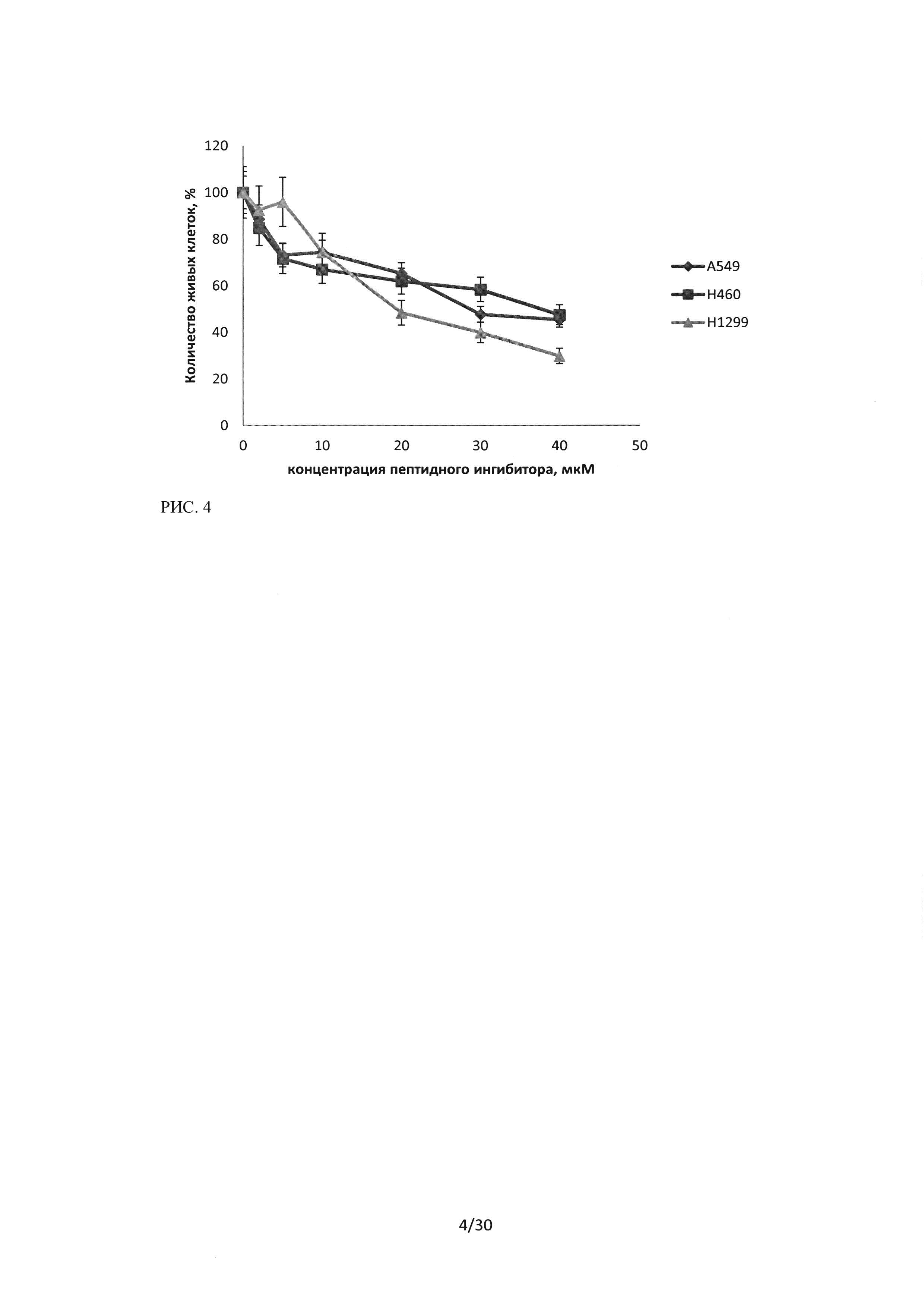
Рисунок 4. Воздействие последовательности пептидного ингибитора Ras-ГТФазы на культуры клеток А549, Н460 и HI299, время инкубации 24 часа.
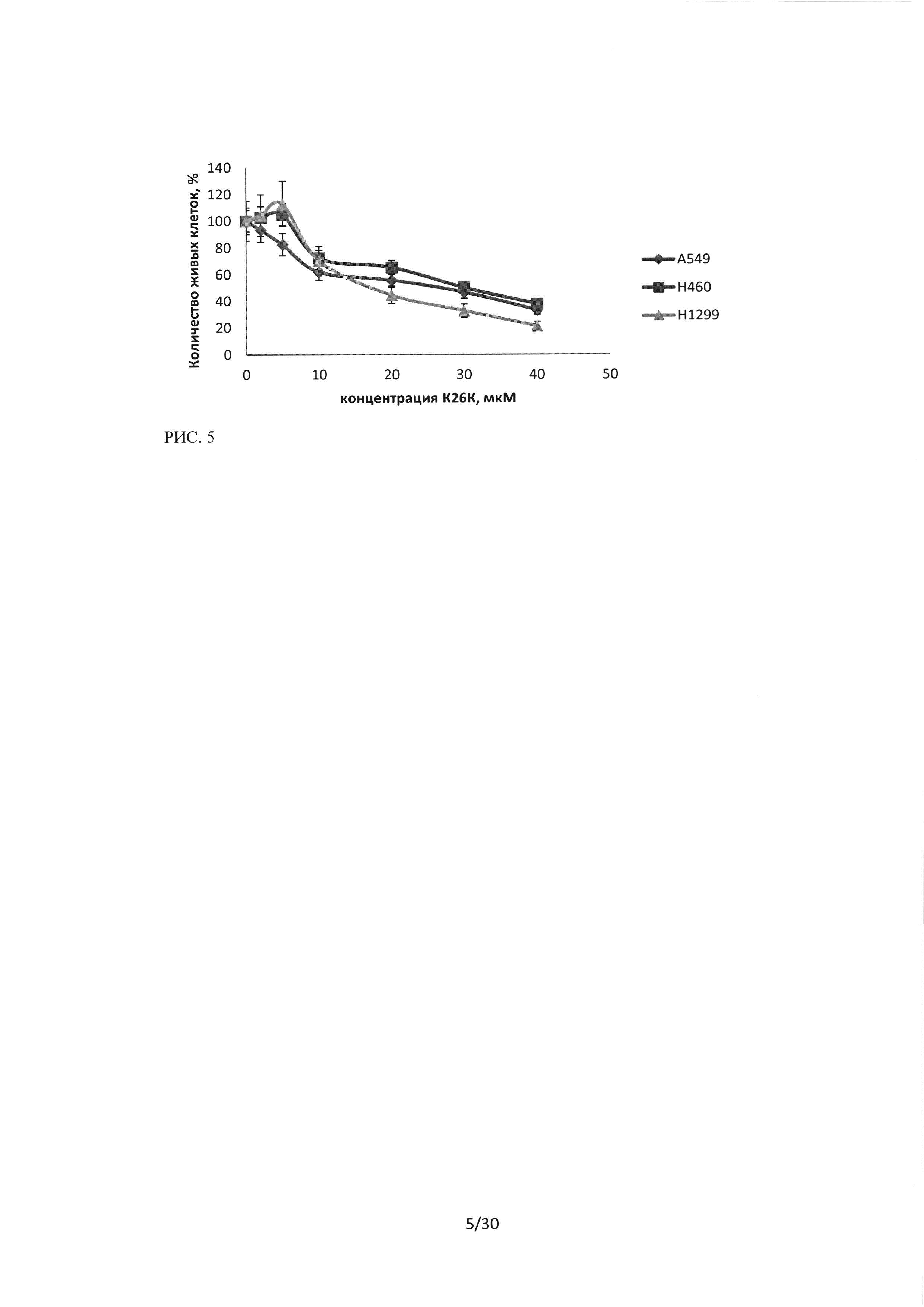
Рисунок 5. Воздействие последовательности пептидного ингибитора Ras-ГТФазы на культуры клеток А549, Н460 и HI299, время инкубации 48 часов.
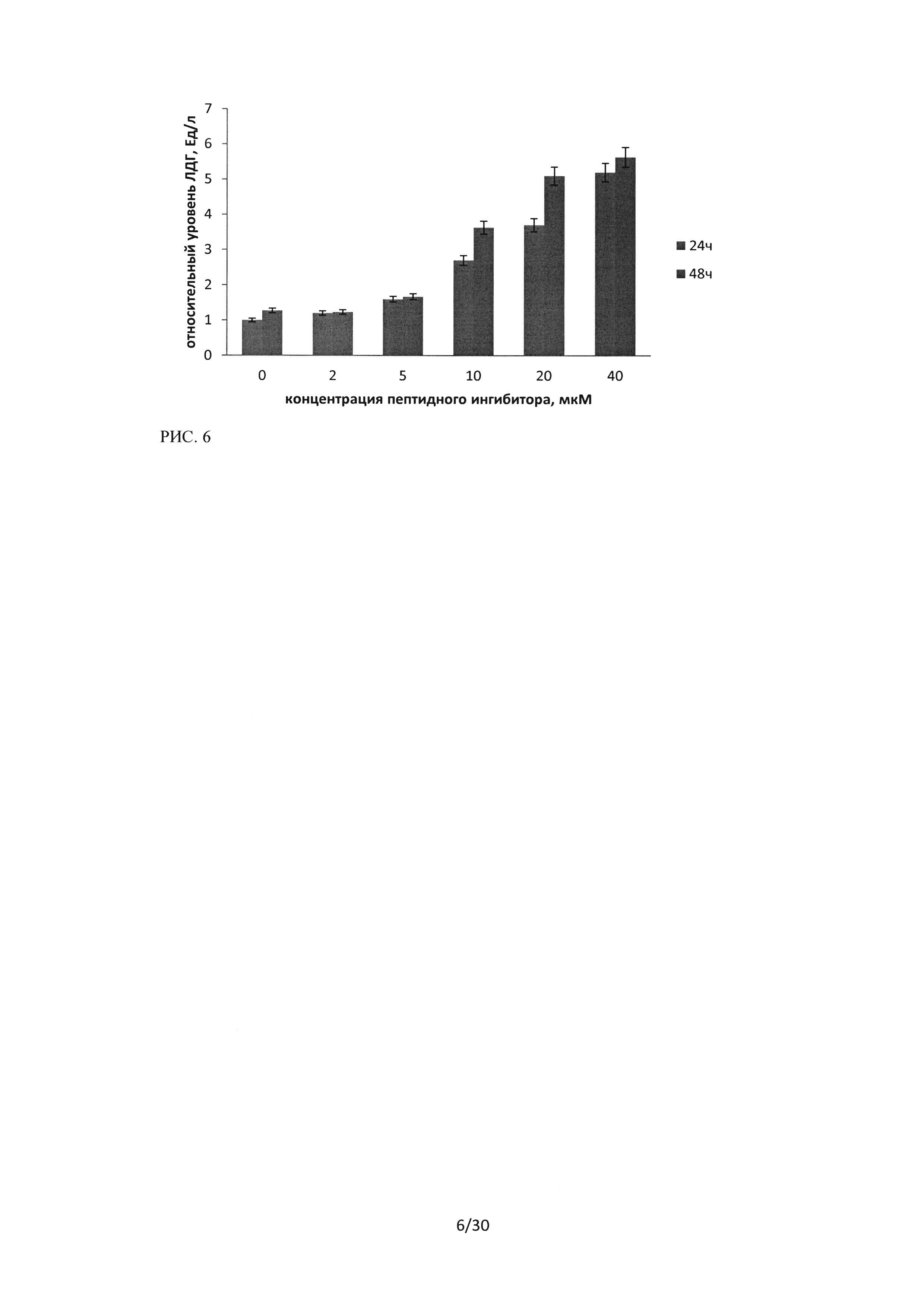
Рисунок 6. Результаты ЛДГ-теста клеток культуры А549 после 24 и 48 часов инкубации с пептидной последовательностью ингибитором Ras-ГТФазы, в концентрациях от 2 до 40 мкМ. Результаты контроля - клетки А549, инкубированные со средой, в течение 24 часов, приняты за 1.
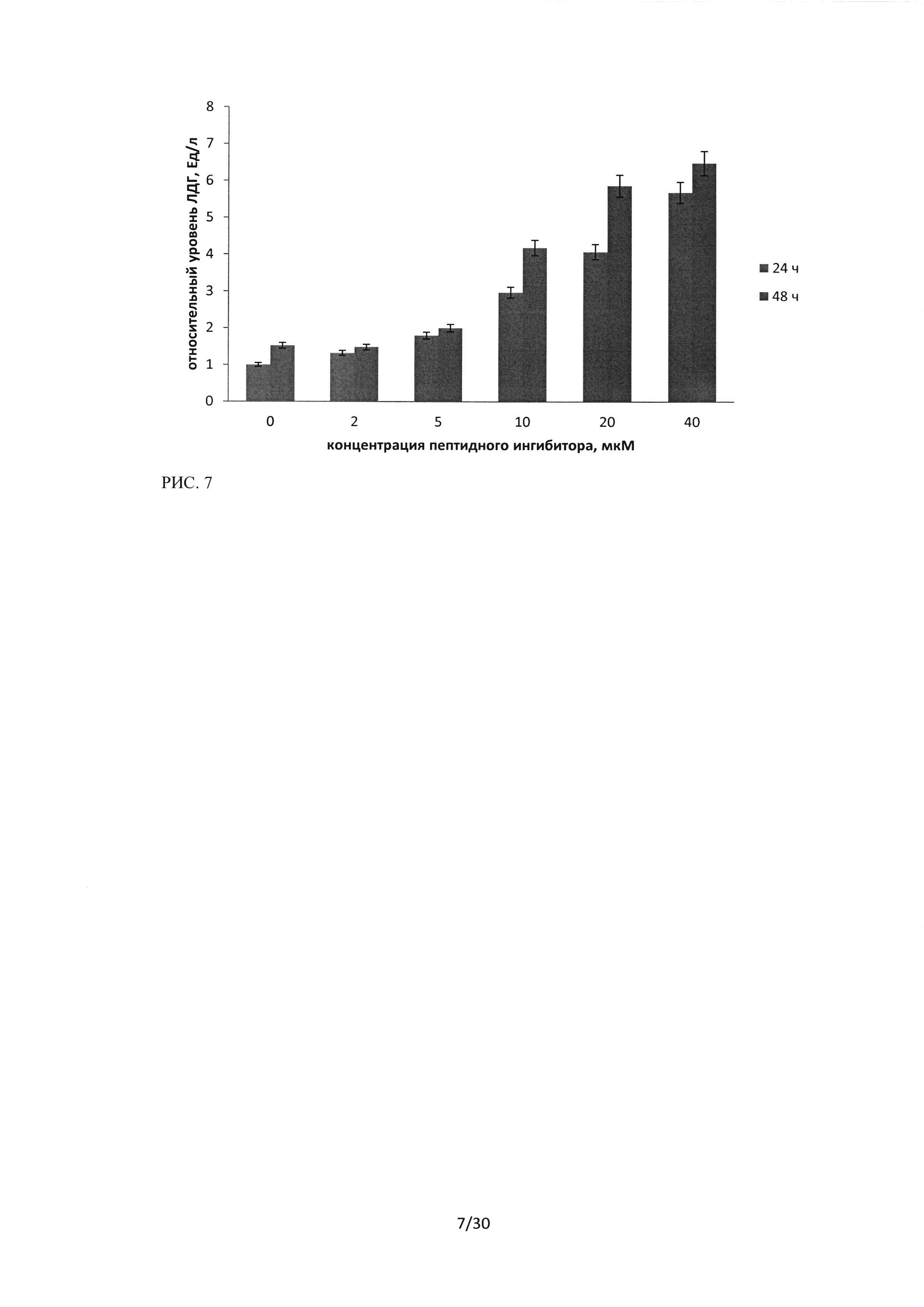
Рисунок 7. Результаты ЛДГ-теста клеток культуры Н460 после 24 и 48 часов инкубации с пептидной последовательностью ингибитором Ras-ГТФазы, в концентрациях от 2 до 40 мкМ. Результаты контроля - клетки Н460, инкубированные со средой, в течение 24 часов, приняты за 1.
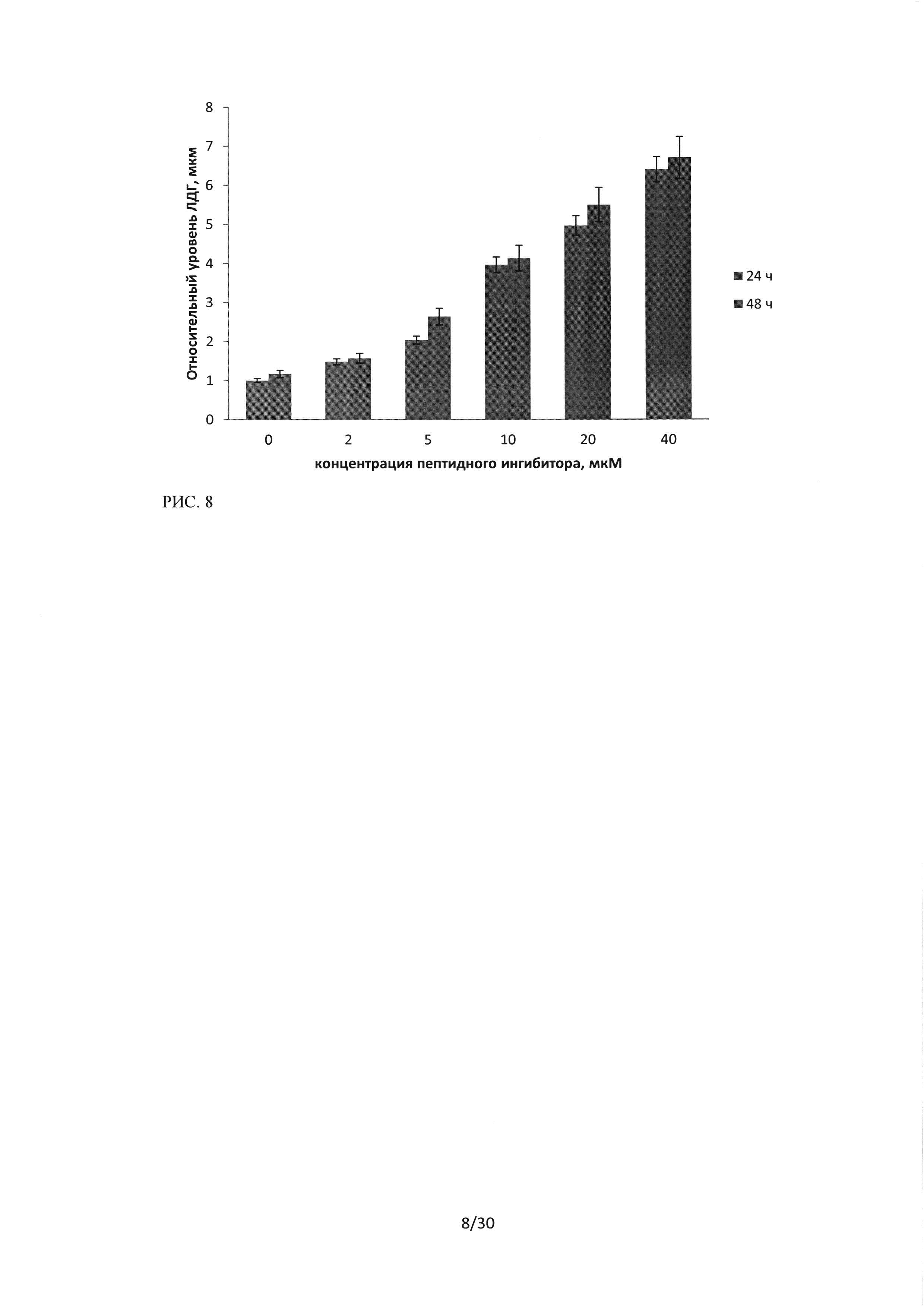
Рисунок 8. Результаты ЛДГ-теста клеток культуры HI299 после 24 и 48 часов инкубации с пептидной последовательностью ингибитором Ras-ГТФазы, в концентрациях от 2 до 40 мкМ. Результаты контроля - клетки HI299, инкубированные со средой, в течение 24 часов, приняты за 1 Результаты ЛДГ-теста клеток культуры HI299 после 24 и 48 часов инкубации с пептидной последовательностью ингибитором Ras-ГТФазы, в концентрациях от 2 до 40 мкМ. Результаты контроля - клетки HI299, инкубированные со средой, в течение 24 часов, приняты за 1.
Рисунок 9. Сравнение результатов ЛДГ-теста для культур А549, Н460 и HI299 при времени инкубации 24 часа и концентрации пептидного ингибитора Ras-ГТФазы от 2 до 40 мкМ.
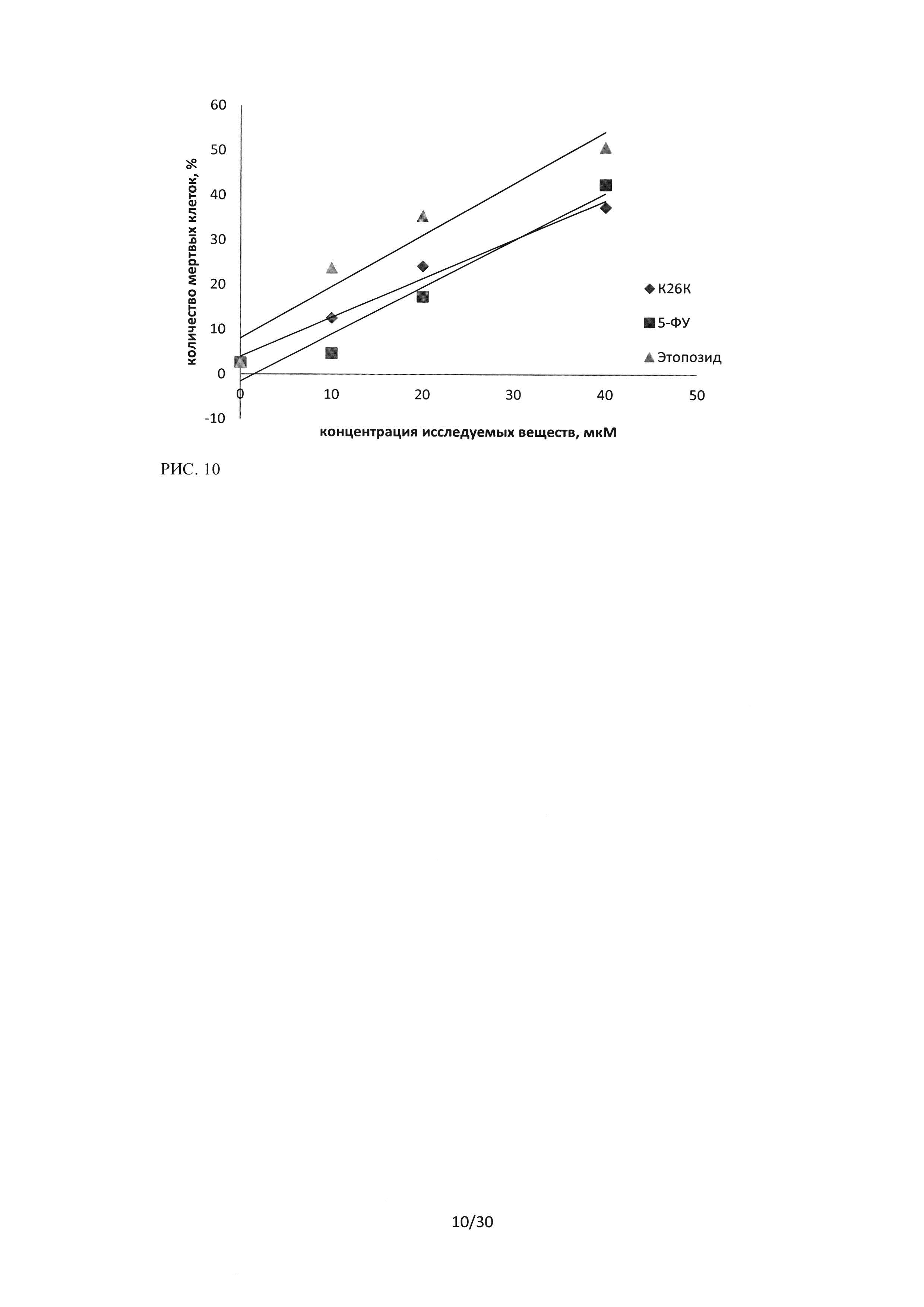
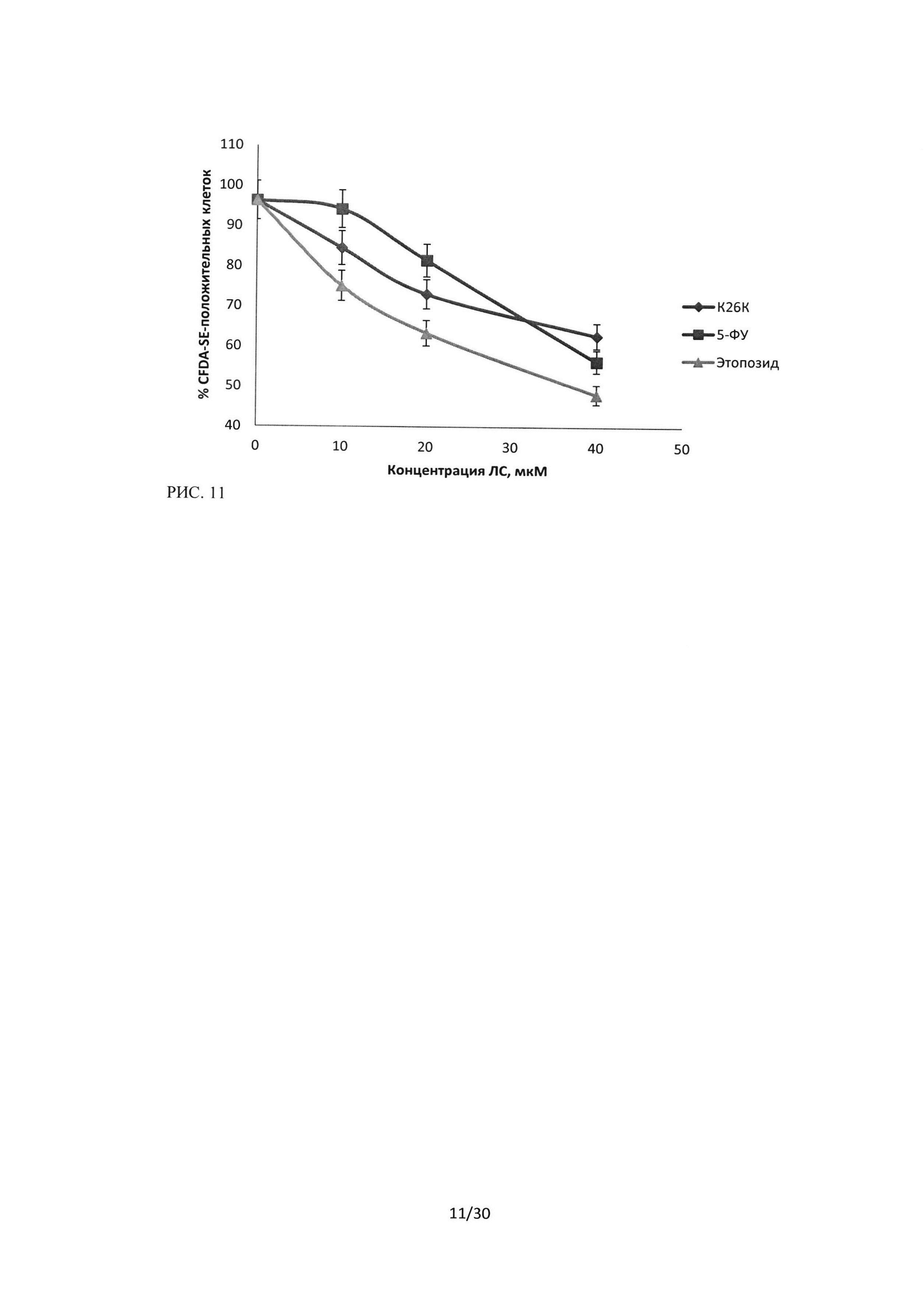
Рисунок 10. Сравнение цитотоксического эффекта пептидного ингибитора Ras-ГТФазы, 5-фторурацила и этопозида на культуру клеток А549. Окраска CFDA-SE/PI, зависимость изменения количества PI-положительных частиц от концентрации ЛС, время инкубации 24 часа.
Рисунок 11. Сравнение цитотоксического эффекта пептидного ингибитора Ras-ГТФазы, 5-фторурацила и этопозида на культуру клеток А549. Окраска CFDA-SE/PI, зависимость изменения количества CFDA-SE - положительных клеток (живых) от концентрации ЛС, время инкубации 24 часа.
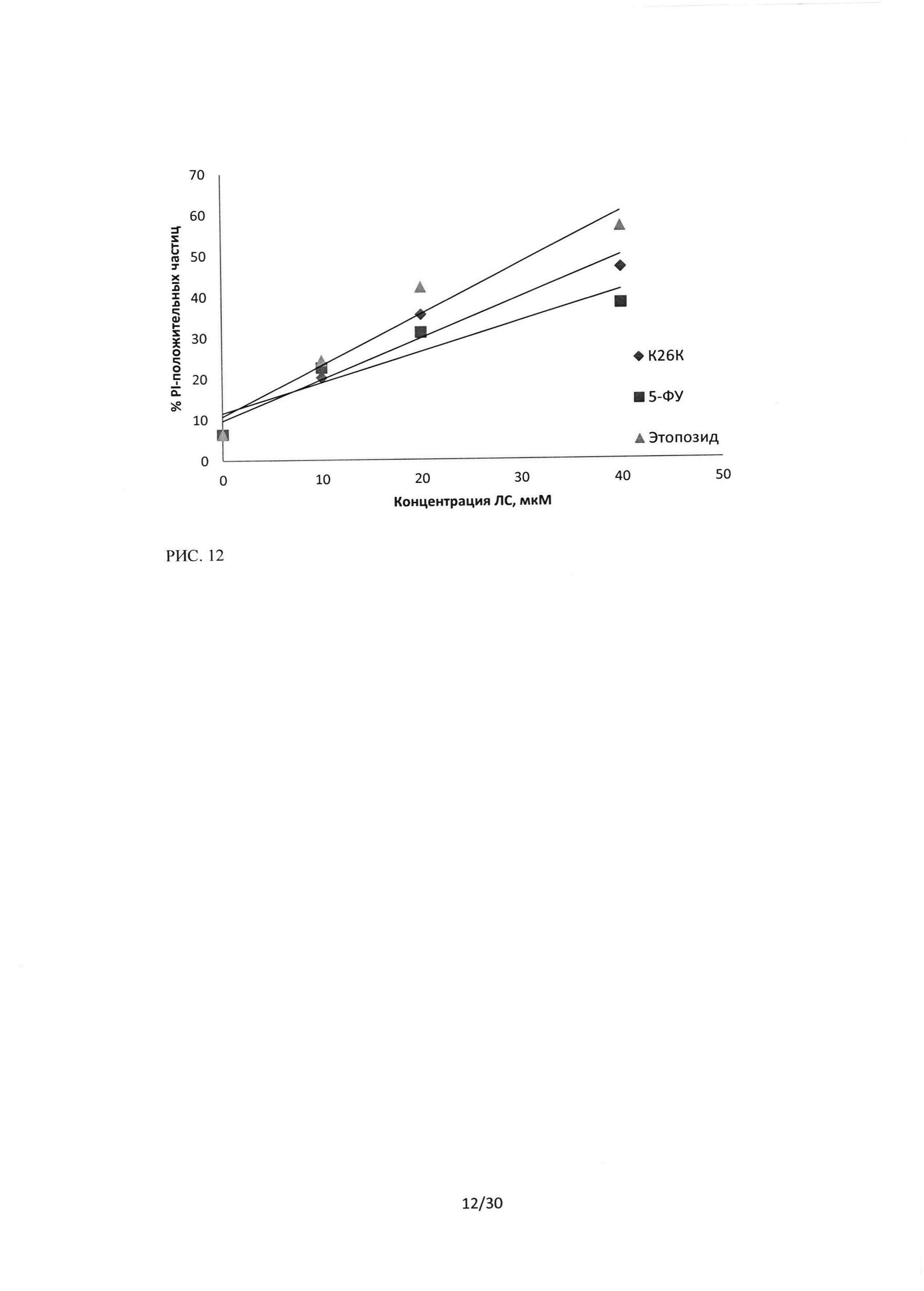
Рисунок 12. Сравнение цитотоксического эффекта пептидного ингибитора Ras-ГТФазы, 5-фторурацила и этопозида на культуру клеток Н460. Окраска CFDA-SE/PI, зависимость изменения количества PI-положительных частиц от концентрации ЛС, время инкубации 24 часа.
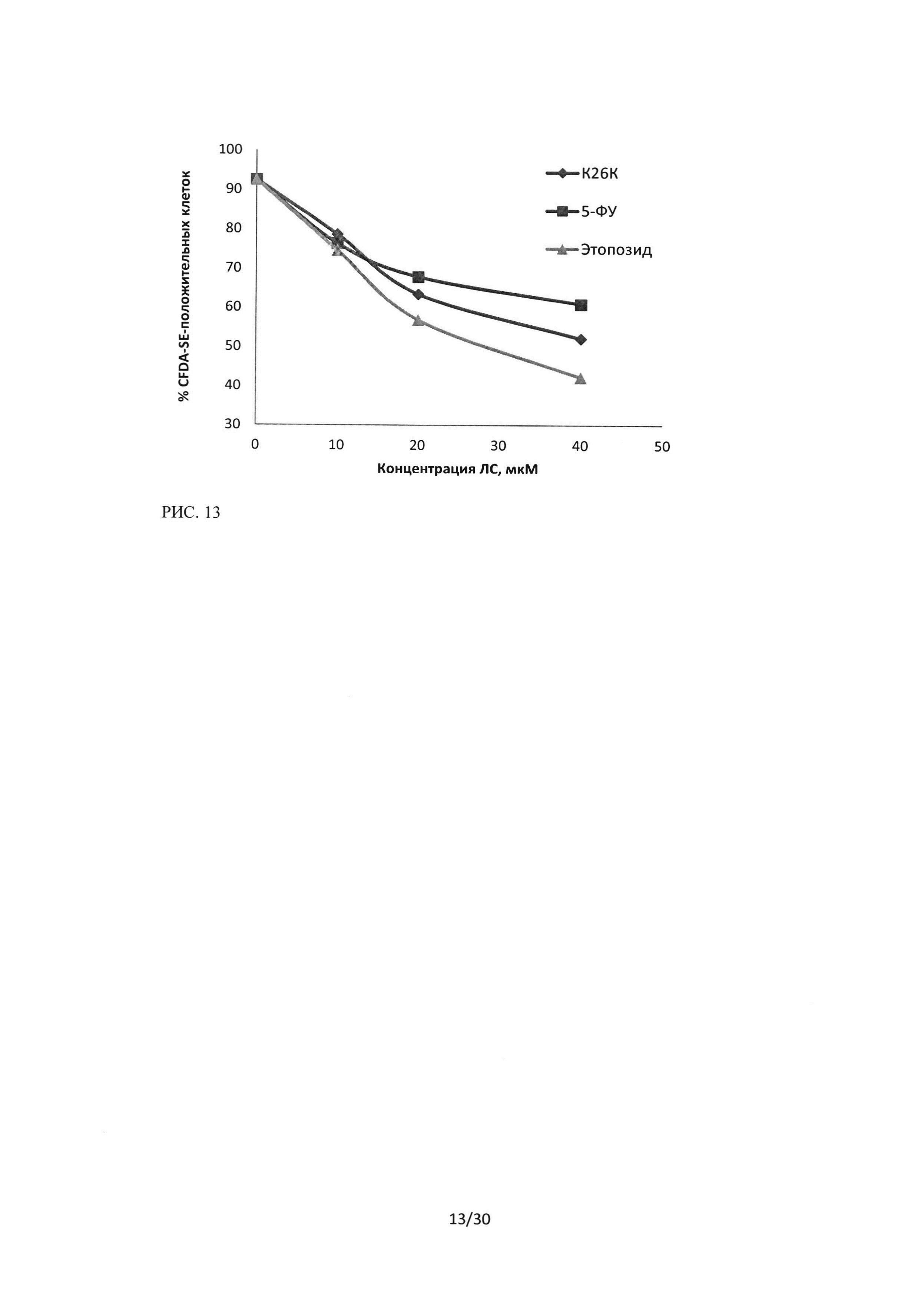
Рисунок 13. Сравнение цитотоксического эффекта пептидного ингибитора Ras-ГТФазы, 5-фторурацила и этопозида на культуру клеток Н460. Окраска CFDA-SE/PI, зависимость изменения количества CFDA-SE - положительных клеток (живых) от концентрации ЛС, время инкубации 24 часа.
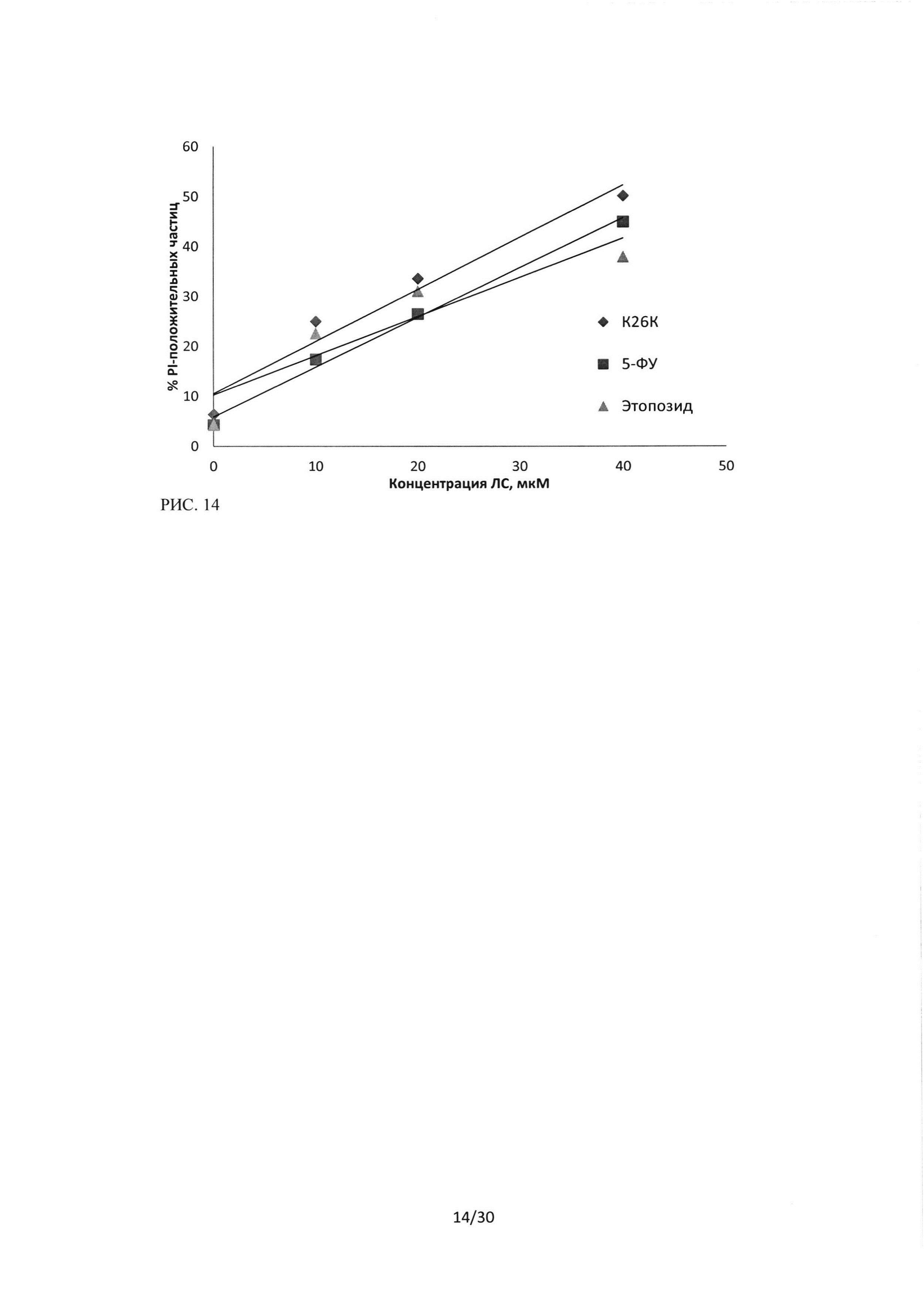
Рисунок 14. Сравнение цитотоксического эффекта пептидного ингибитора Ras-ГТФазы, 5-фторурацила и этопозида на культуру клеток Н1299. Окраска CFDA-SE/PI, зависимость изменения количества PI-положительных частиц от концентрации ЛС, время инкубации 24 часа.
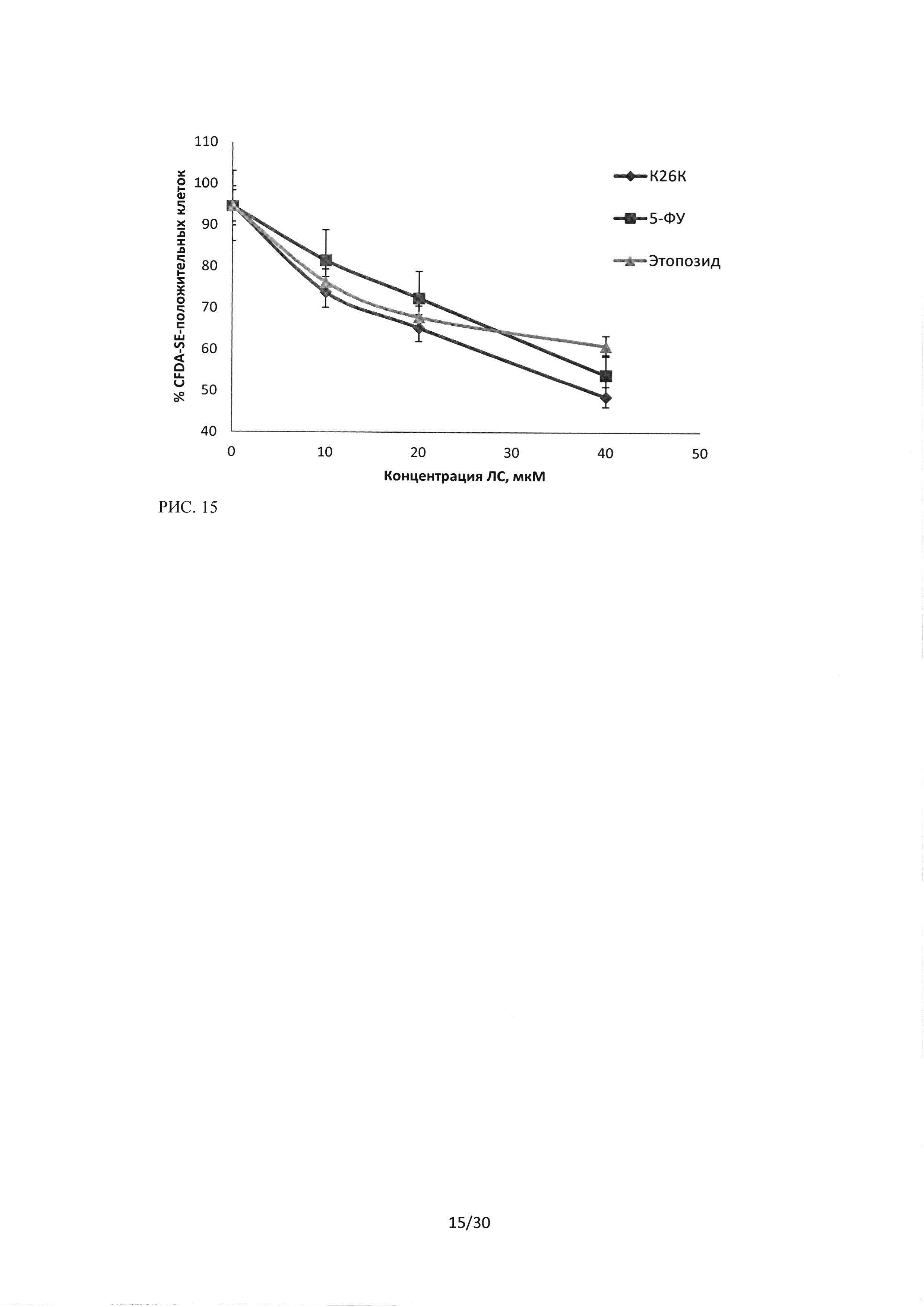
Рисунок 15. Сравнение цитотоксического эффекта пептидного ингибитора Ras-ГТФазы, 5-фторурацила и этопозида на культуру клеток Н1299. Окраска CFDA-SE/PI, зависимость изменения количества CFDA-SE - положительных клеток (живых) от концентрации ЛС, время инкубации 24 часа.
Рисунок 15. Сравнение цитотоксического эффекта пептидного ингибитора Ras-ГТФазы, 5-фторурацила и этопозида на культуру клеток Н1299. Окраска CFDA-SE/PI, зависимость изменения количества CFDA-SE - положительных клеток (живых) от концентрации ЛС, время инкубации 24 часа.
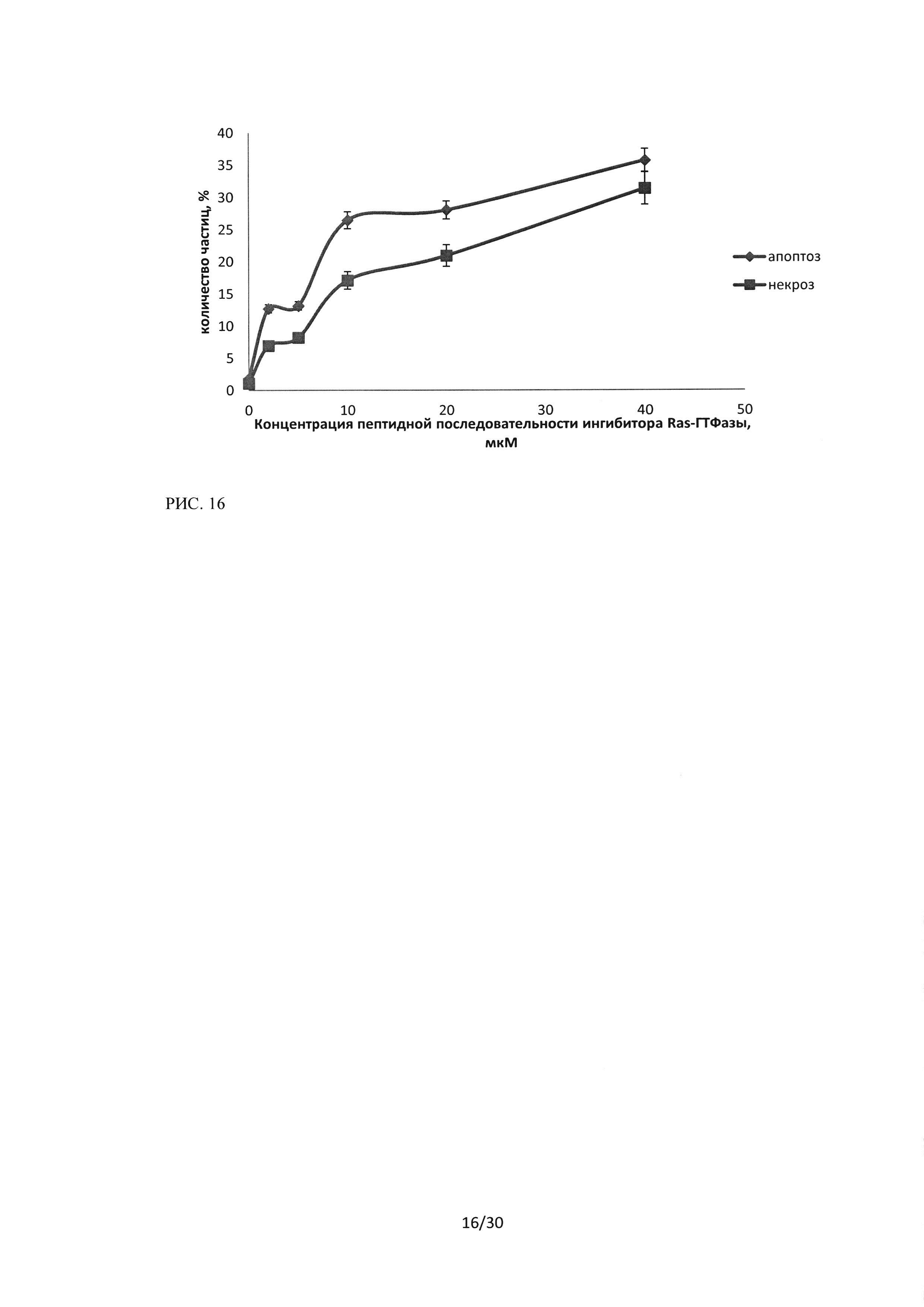
Рисунок 16. Изменение уровня апоптоза и некроза в культуре клеток линии А549 при воздействии пептидной последовательности ингибитора Ras-ГТФазыв концентрациях 2-40 мкМ. Метод проточной цитофлуориметрии, окраска Annexin V-FITC (FL1) / PI (FL3).
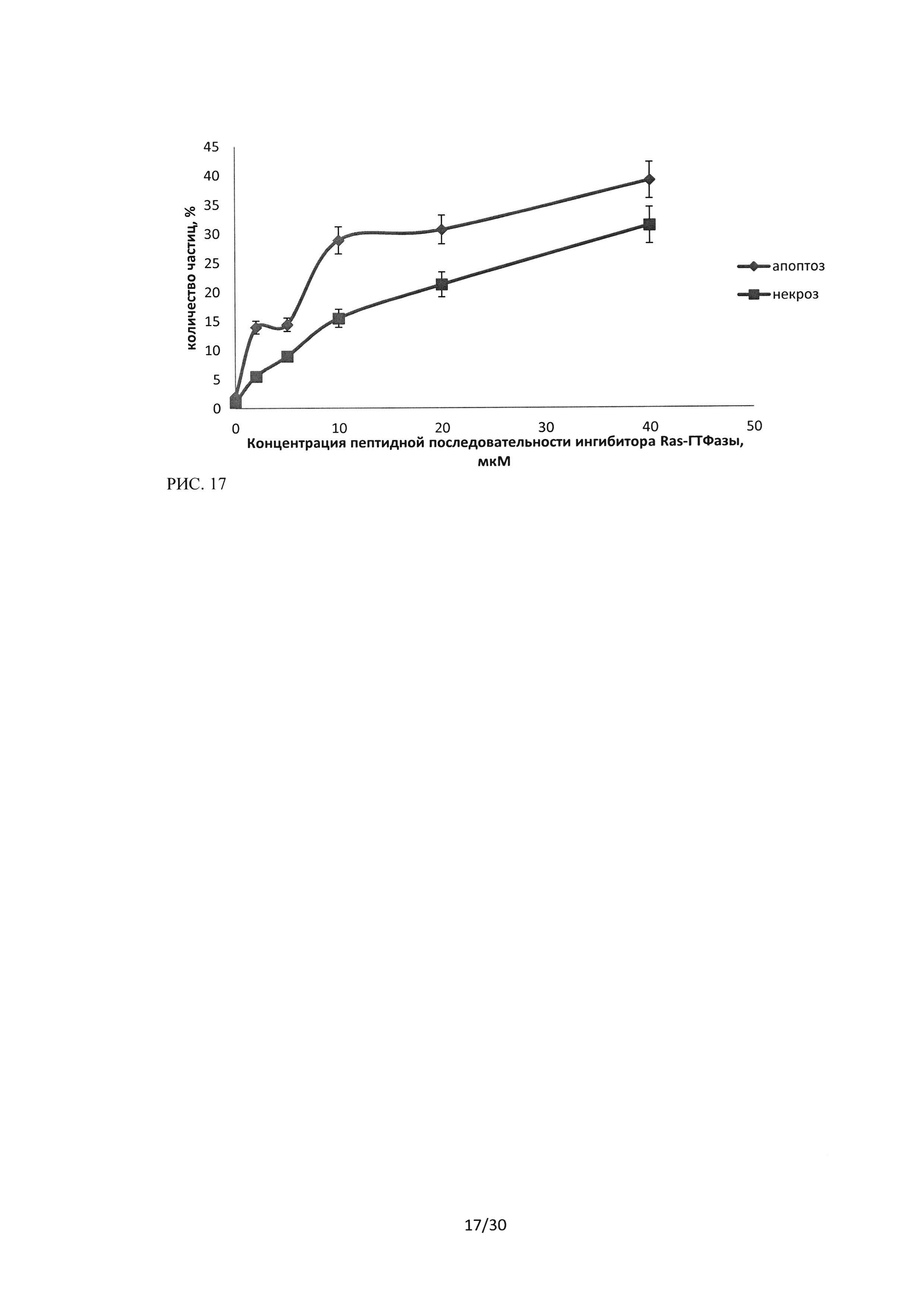
Рисунок 17. Изменение уровня апоптоза и некроза в культуре клеток линии Н460 при воздействии пептидной последовательности ингибитора Ras-ГТФазыв концентрациях 2-40 мкМ. Метод проточной цитофлуориметрии, окраска Annexin V-FITC (FL1) / PI (FL3).
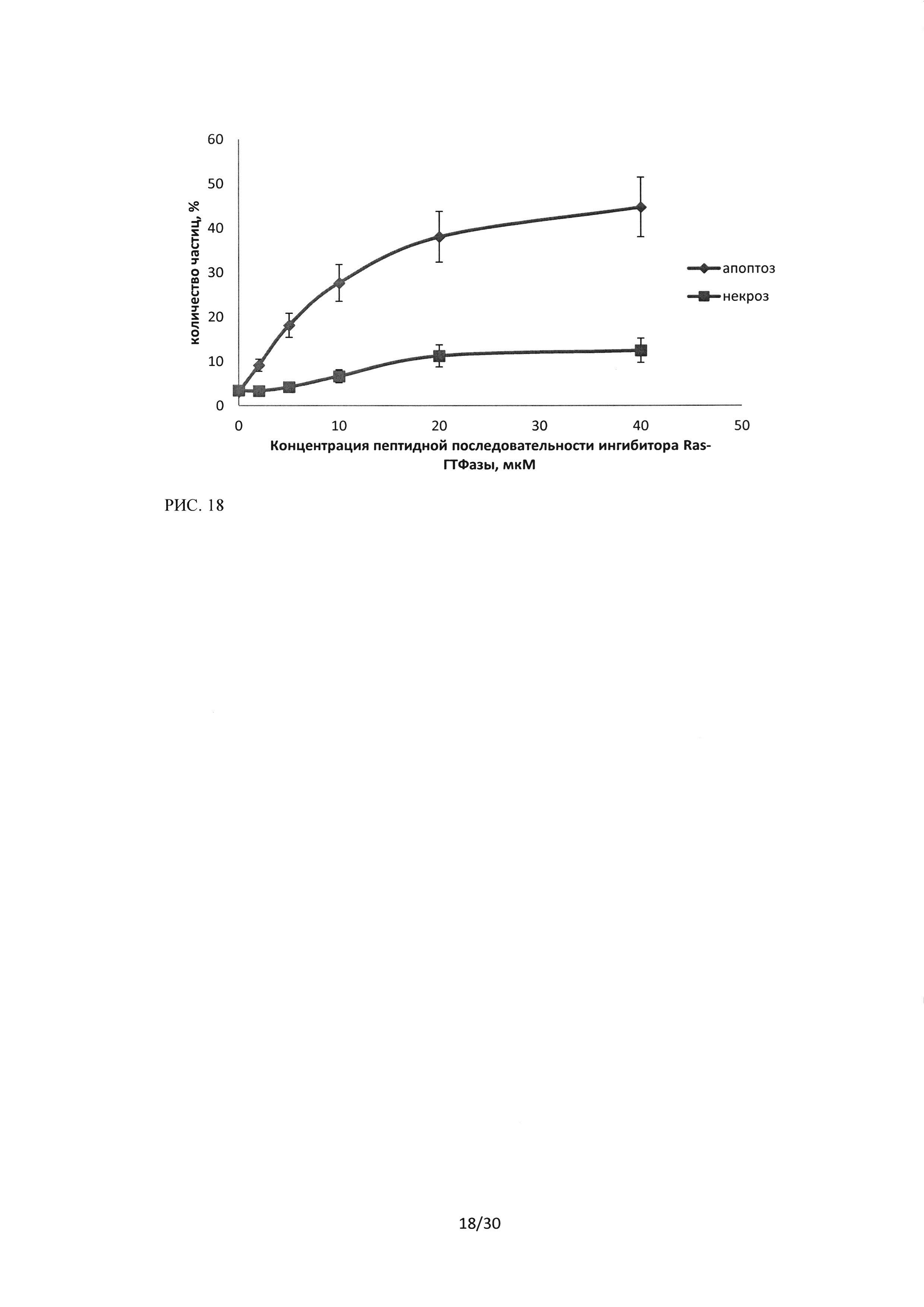
Рисунок 18. Изменение уровня апоптоза и некроза в культуре клеток линии HI299 при воздействии пептидного ингибитора Ras-ГТФазыв концентрациях 2-40 мкМ. Метод проточной цитофлуориметрии, окраска Annexin V-FITC (FL1) / PI (FL3).
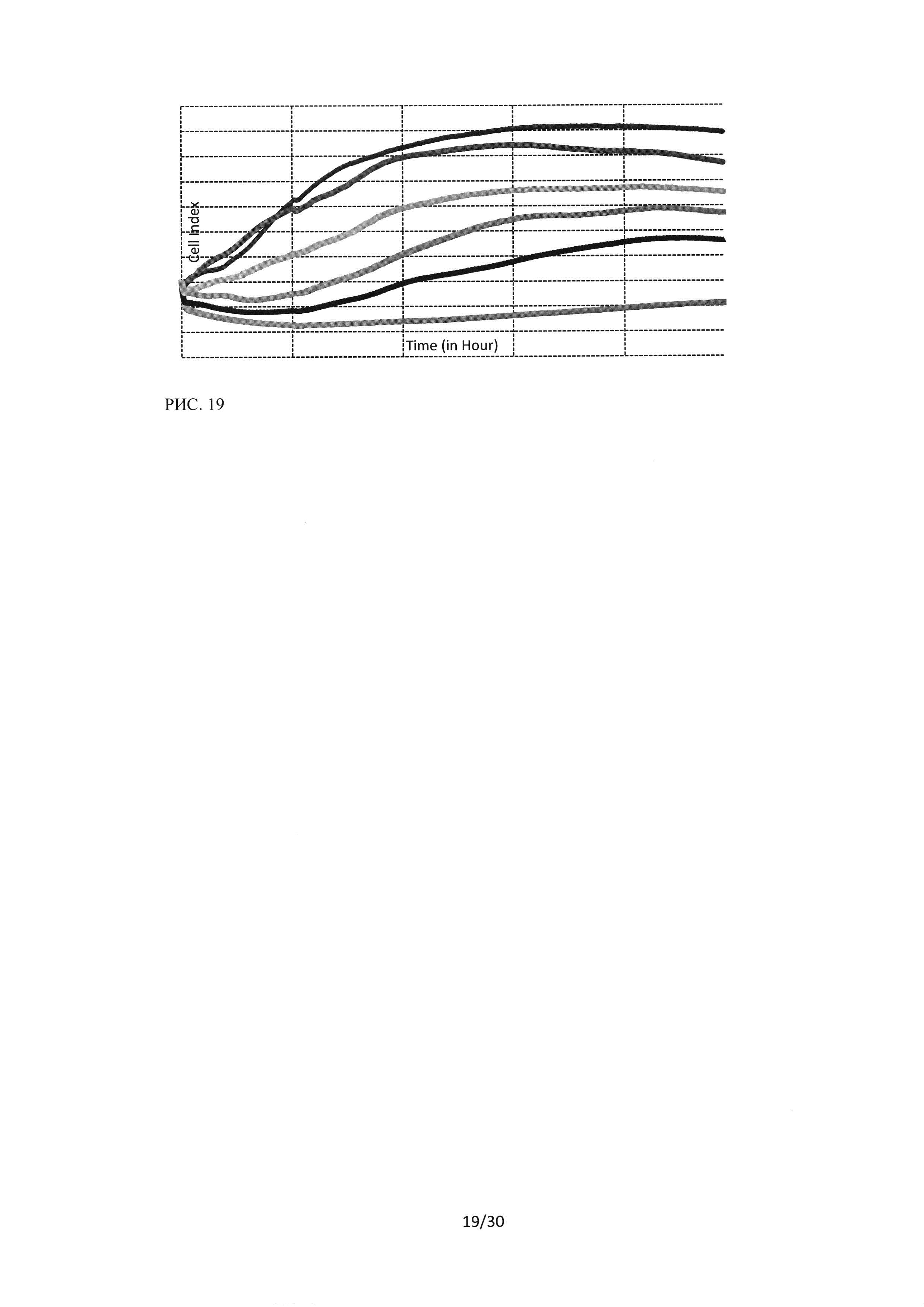
Рисунок 19. Исследование воздействия лекарственного средства ингибитора Ras-ГТФазы в концентрациях 2-40 мкМ на культуру А549 методом клеточного анализа iCELLIgence.
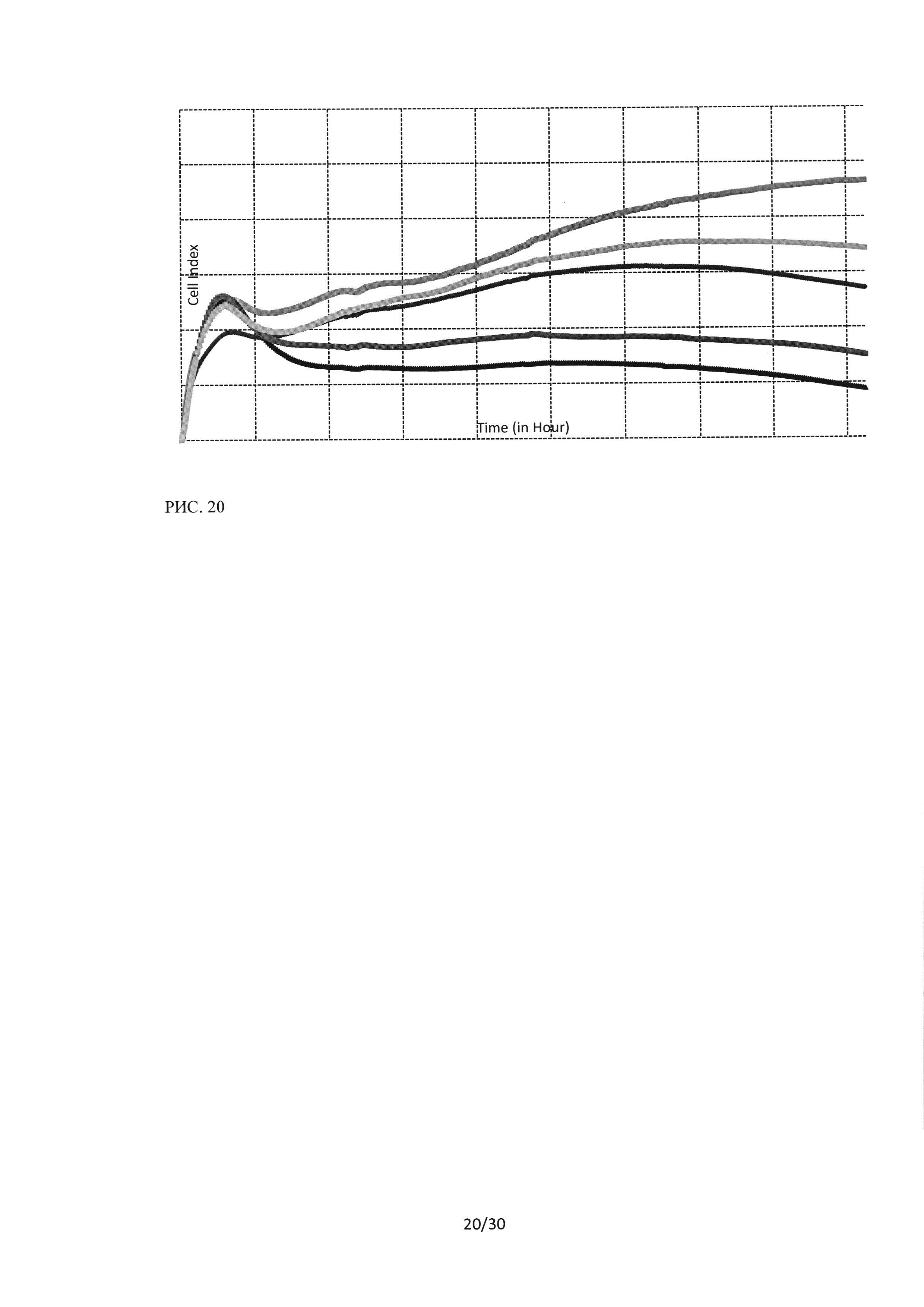
Рисунок 20. Исследование воздействия лекарственного средства ингибитора Ras-ГТФазыв концентрациях 5-40 мкМ на культуру Н460 методом клеточного анализа iCELLIgence Исследование воздействия лекарственного средства ингибитора Ras-ГТФазыв концентрациях 5-40 мкМ на культуру Н460 методом клеточного анализа iCELLIgence.
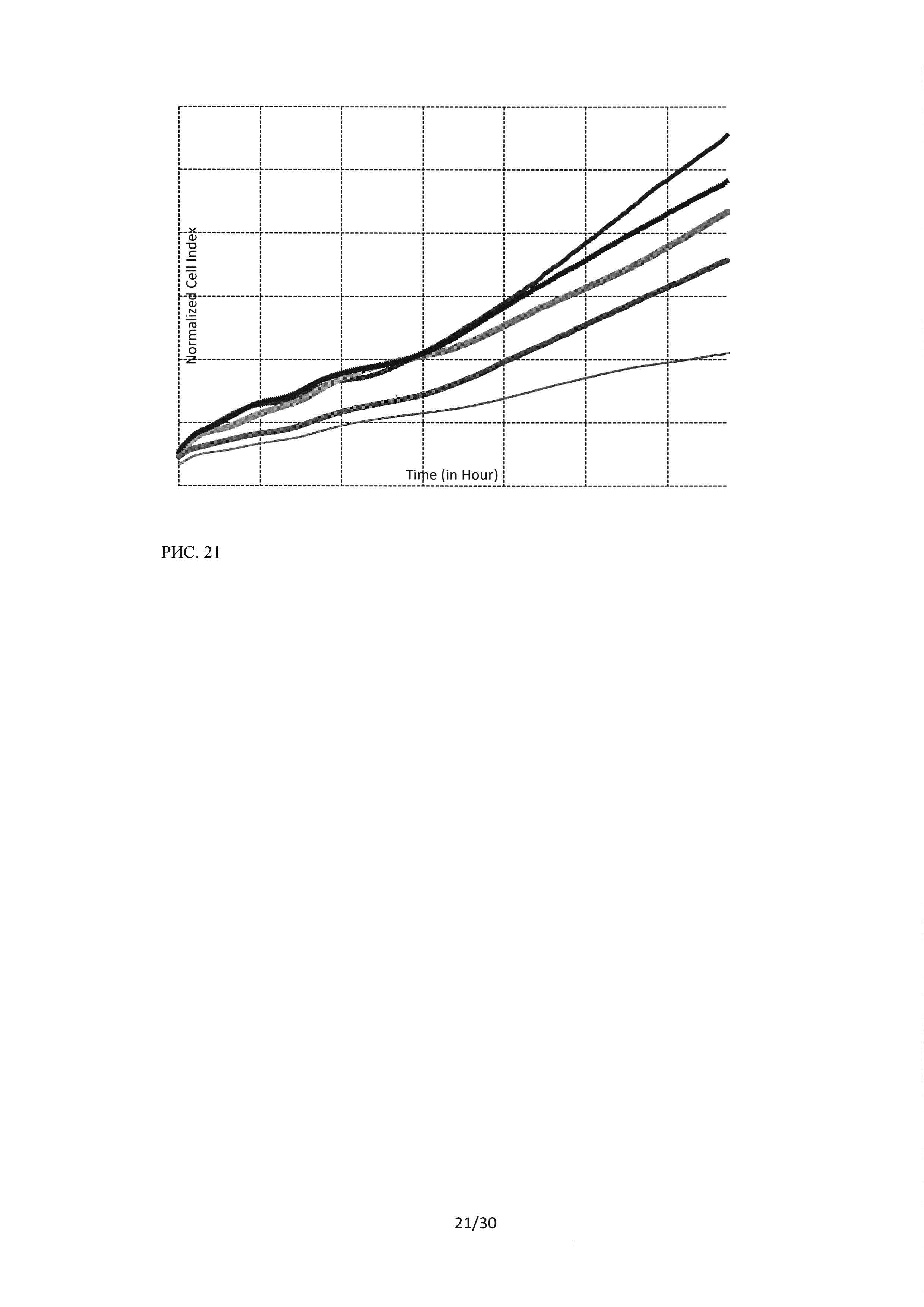
Рисунок 21. Исследование воздействия лекарственного средства ингибитора Ras-ГТФазы в концентрациях 5-40 мкМ на культуру HI299 методомклеточного анализа iCELLIgence.
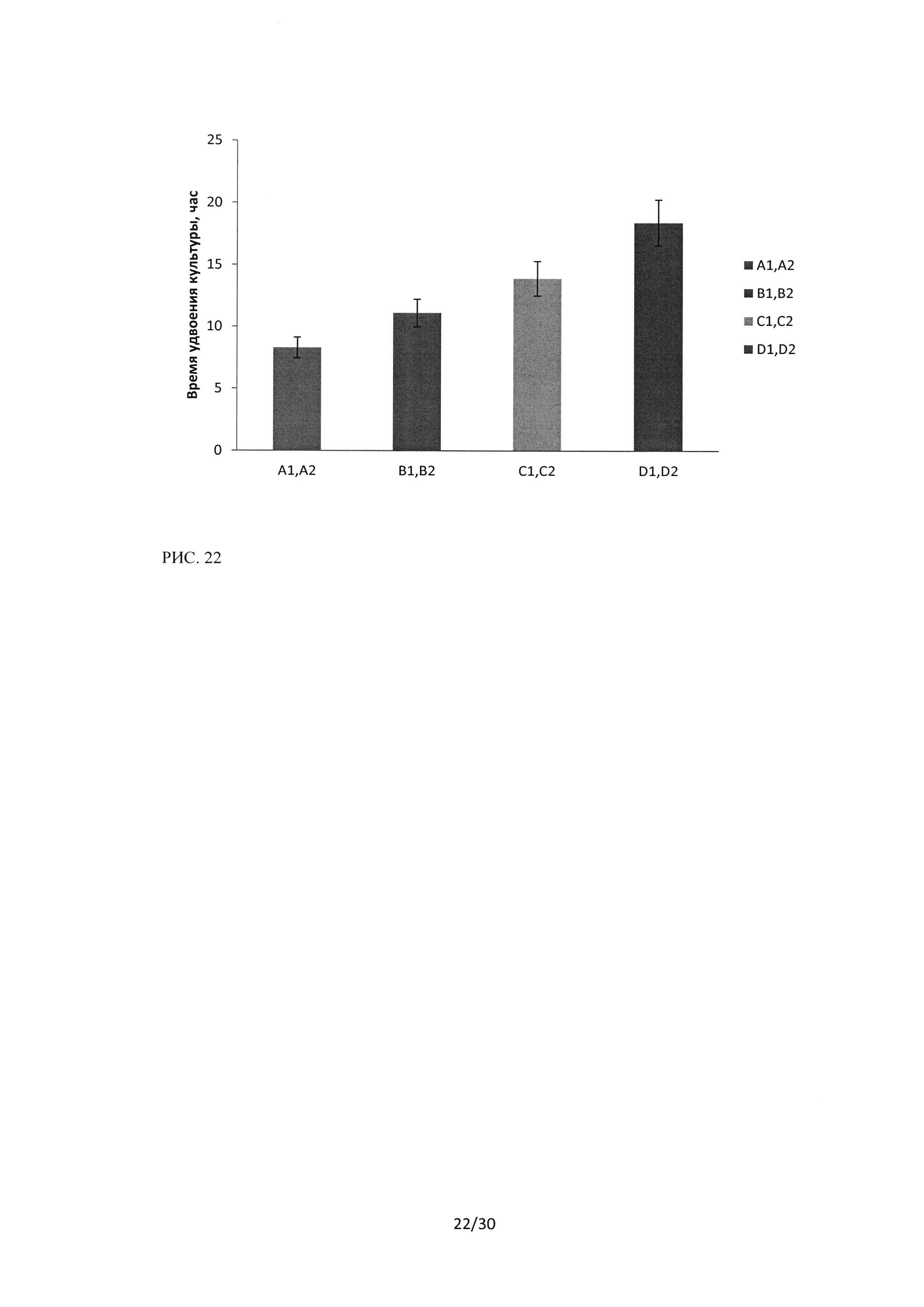
Рисунок 22. Время удвоения клеточной популяции культуры клеток А549 при воздействии пептидного ингибитора Ras-ГТФазыв концентрациях В1 В2 - 10 мкМ, С1С2 - 20 мкМ, D1D2 - 40 мкМ, Al А2 - контрольный образец.
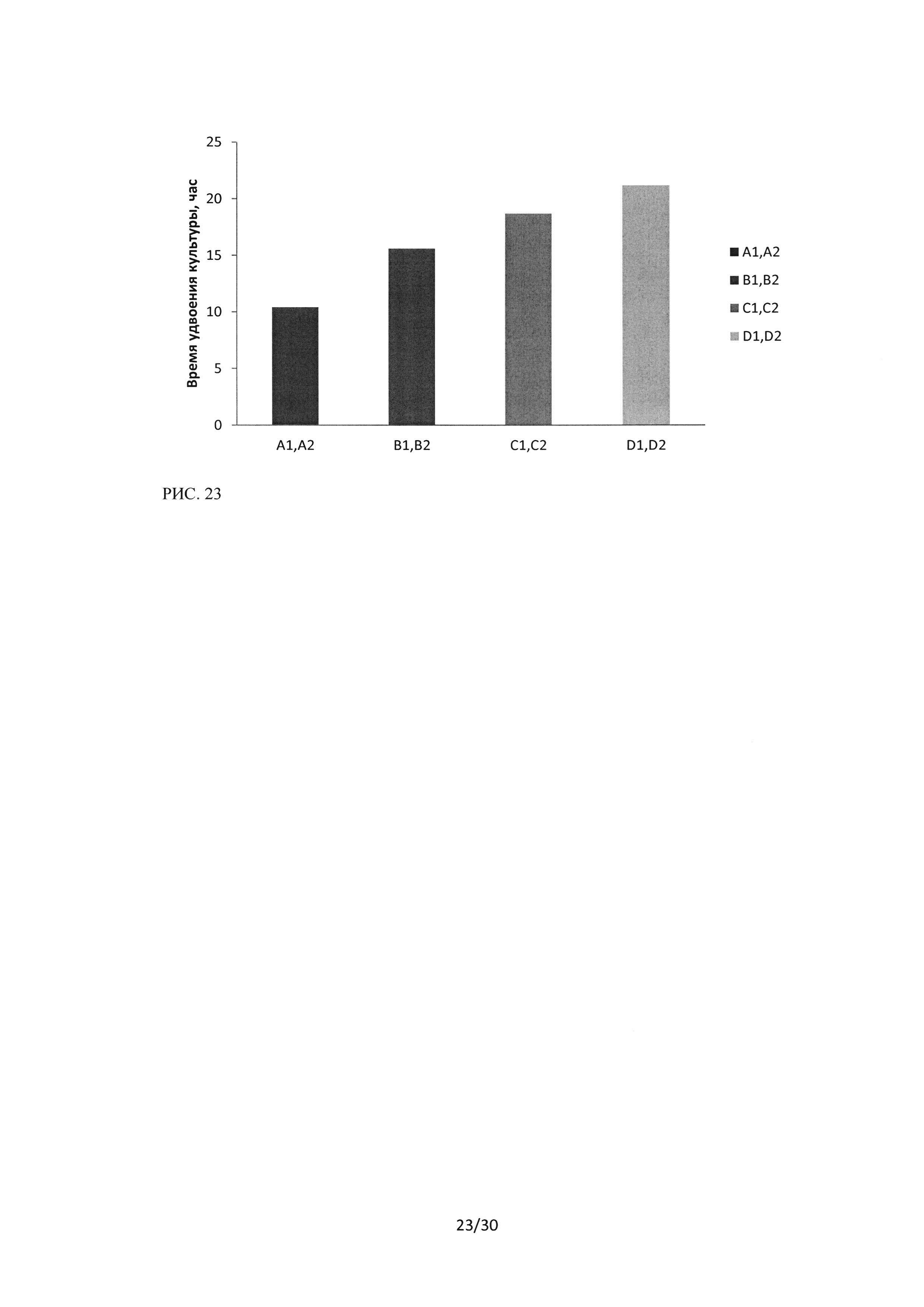
Рисунок 23. Время удвоения клеточной популяции культуры клеток Н460 при воздействии пептидного ингибитора Ras-ГТФазыв концентрациях В1 В2 - 10 мкМ, С1С2 - 20 мкМ, D1D2 - 40 мкМ, A1 А2 - контрольный образец.
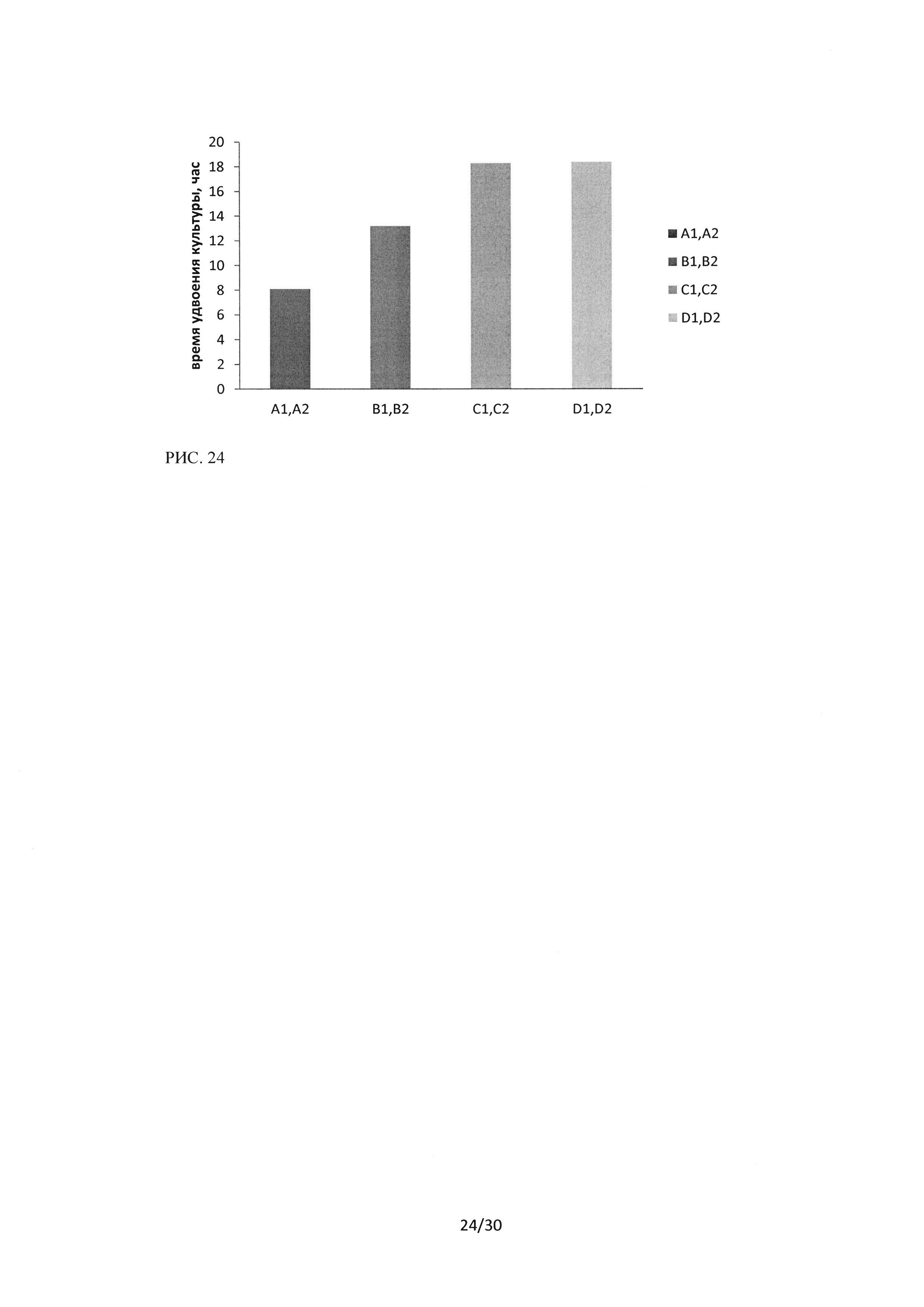
Рисунок 24. Время удвоения клеточной популяции культуры клеток HI299 при воздействиипептидного ингибитора Ras-ГТФазыв концентрациях В1 В2 - 10 мкМ, С1С2 - 20 мкМ, D1D2 - 40 мкМ, A1 А2 - контрольный образец.
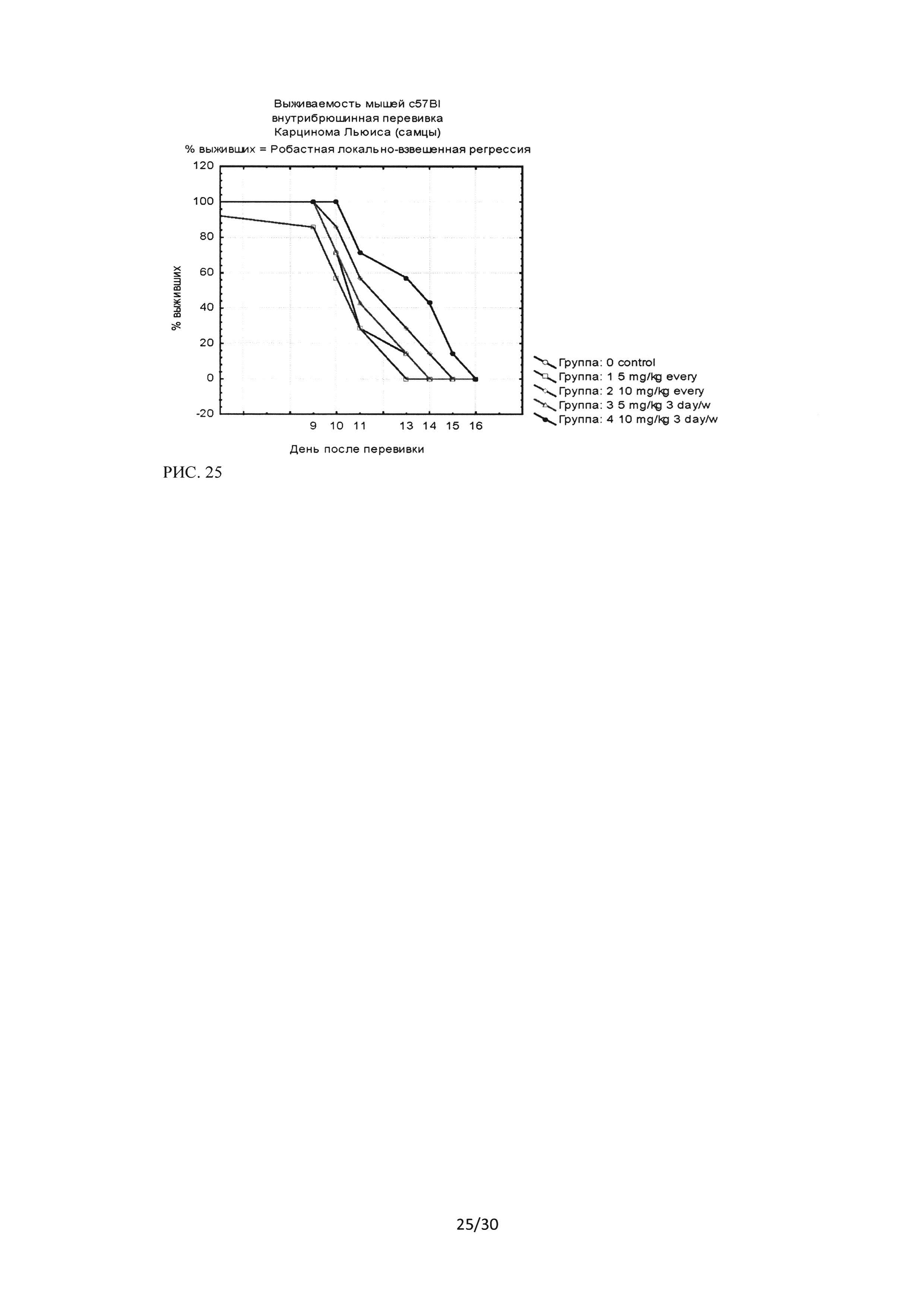
Рисунок 25. Кривые выживаемости мышей линии С57 В1/6 (самцы) с внутрибрюшиннотрансплантированными клетками линии аденокарциномы легкого Lewis (LLC) при введении ингибитора Ras-ГТФазы.
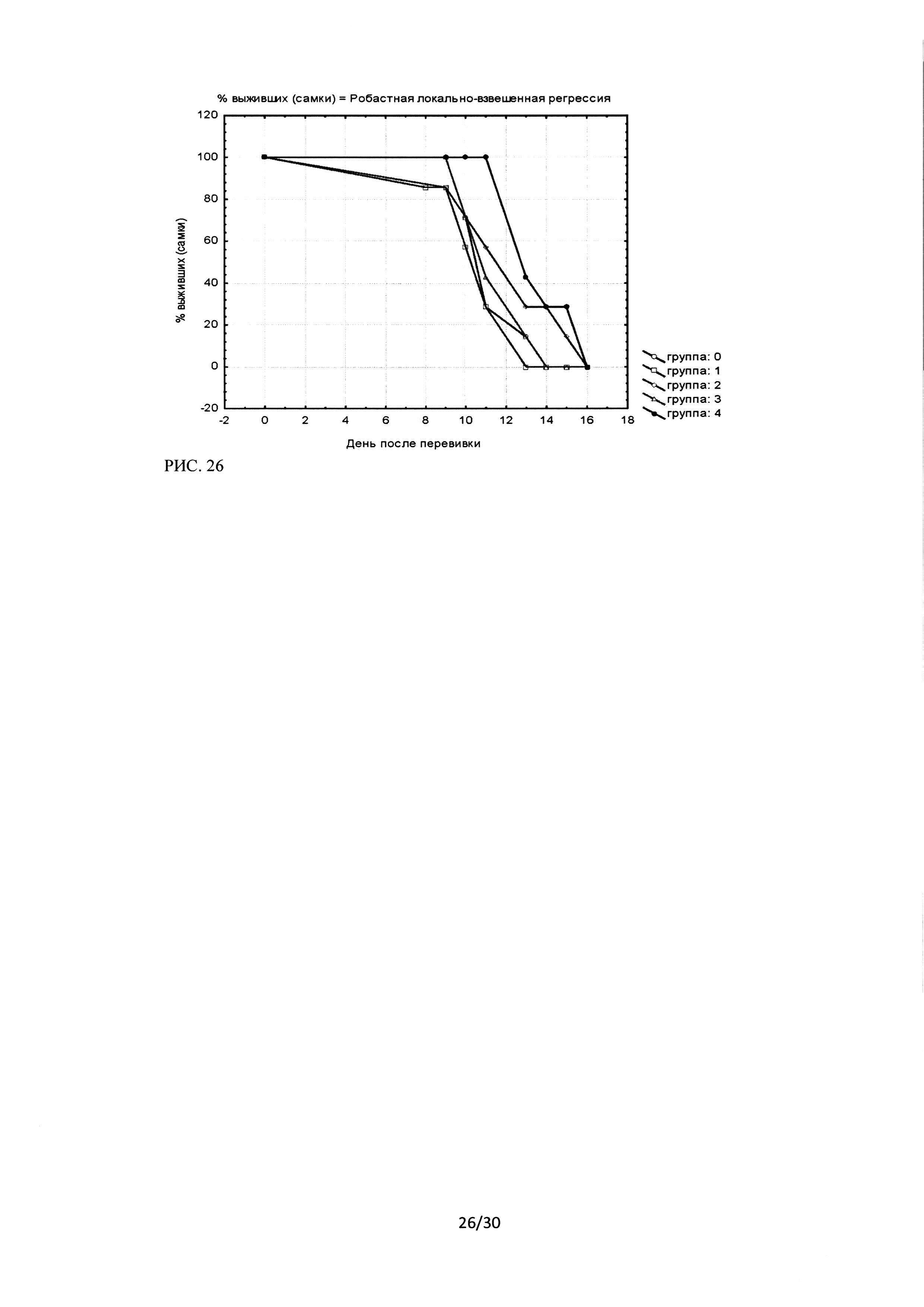
Рисунок 26. Кривые выживаемости мышей линии С57 В1/6 (самки) с внутрибрюшиннотрансплантированными клетками линии аденокарциномы легкого Lewis (LLC) при введении ингибитора Ras-ГТФазы Кривые выживаемости мышей линии С57 В1/6 (самки) с внутрибрюшиннотрансплантированными клетками линии аденокарциномы легкого Lewis (LLC) при введении ингибитора Ras-ГТФазы.
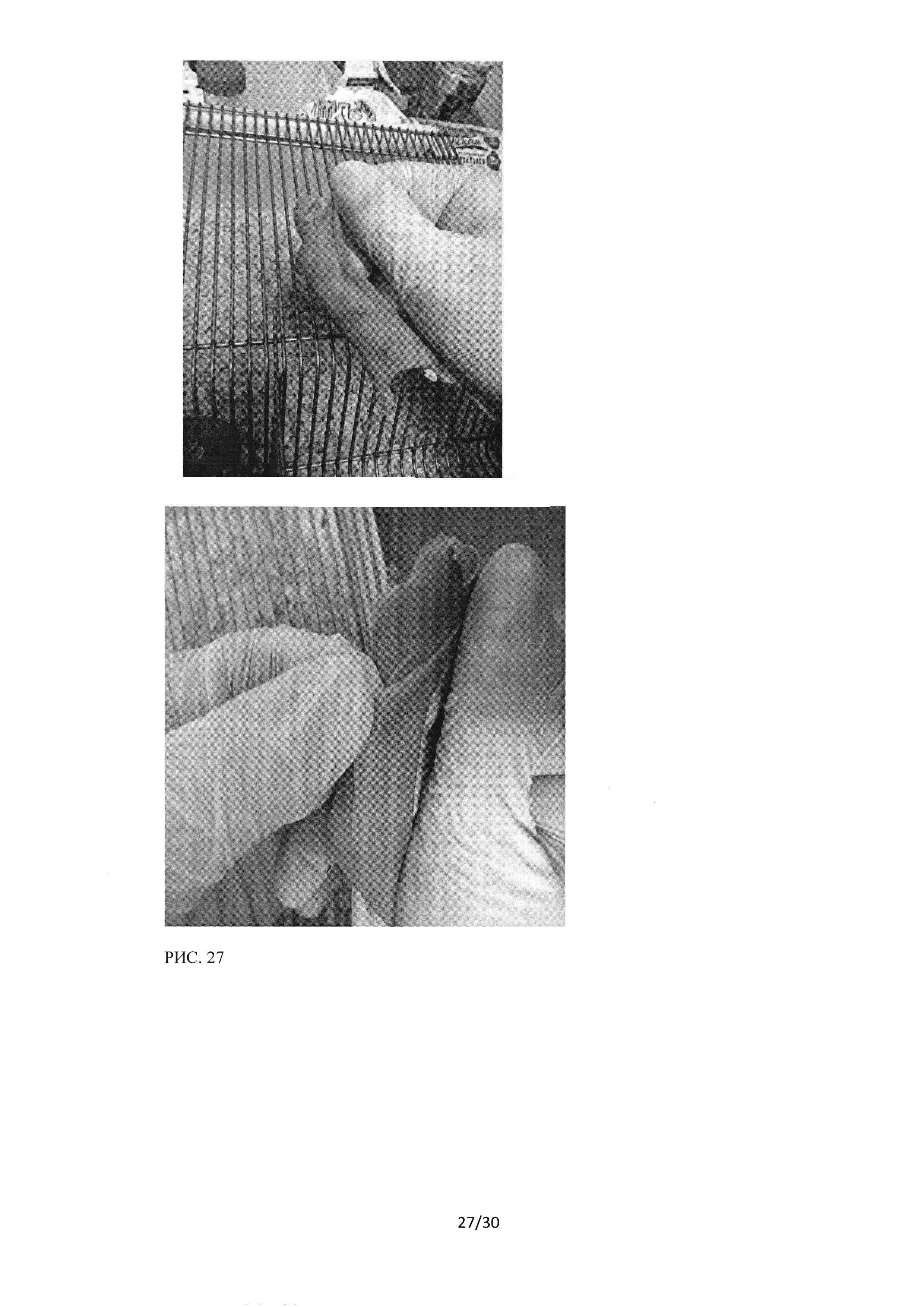
Рисунок 27. Вид опухолей в контрольной (А) и опытной (В) группах на 14 день после перевивки опухолей Вид опухолей в контрольной (А) и опытной (В) группах на 14 день после перевивки опухолей.
Рисунок 28. Изменение объема подкожно трансплантированных опухолей аденокарциномы легкого человека (А549) в группах мышей линии BALBc (NUDE) (самки+самки) при внутривенном введении ингибитора Ras-ГТФазы в дозах 0,1 мг/мышь (5 мг/кг) и 0,2 мг/мышь (10 мг/кг).
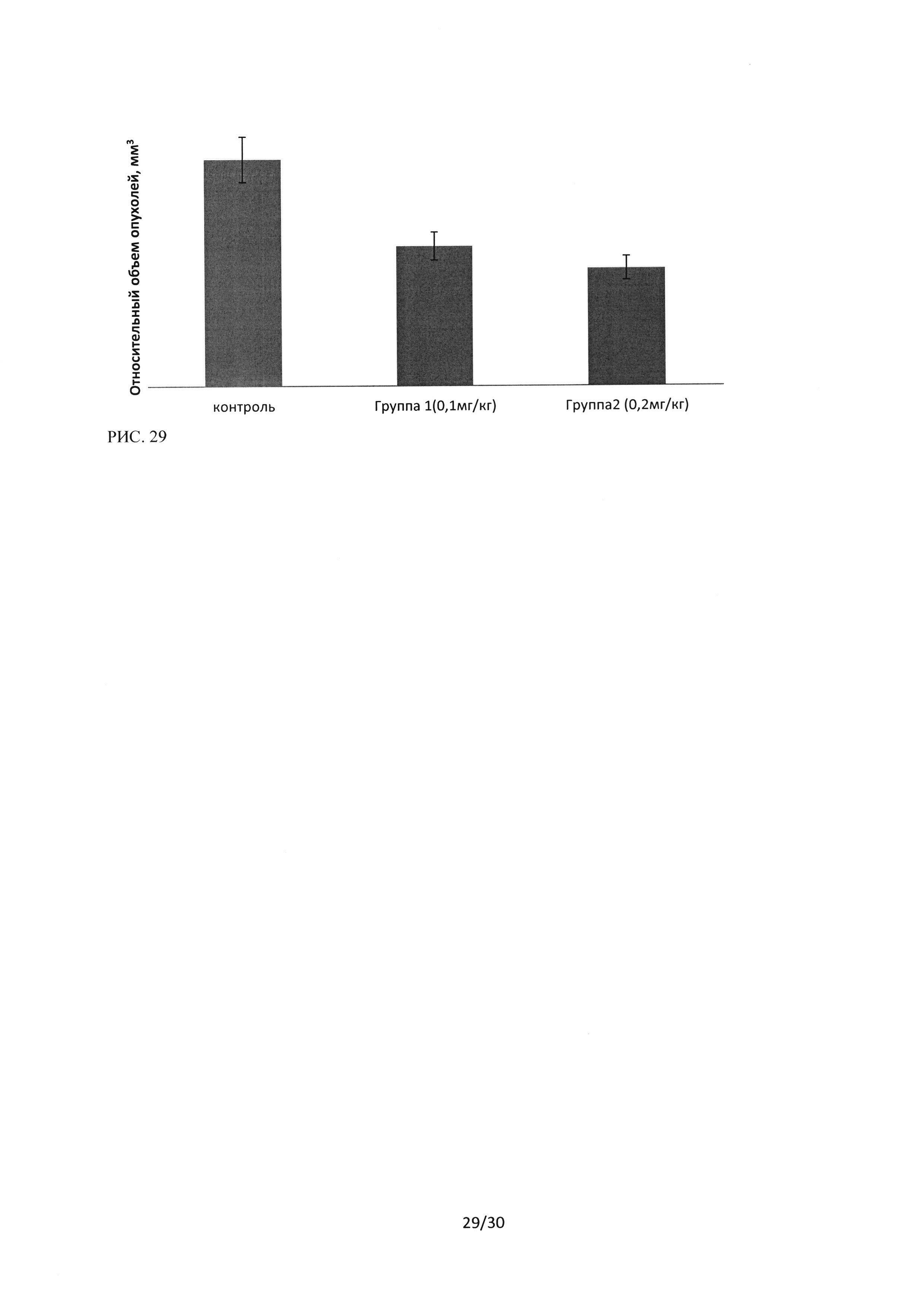
Рисунок 29. Гистограмма изменения относительного объема опухолей для двух исследуемых групп мышей линии BALBc (NUDE) (самки + самки) при внутривенном введении ингибитора Ras-ГТФазы в дозах 0,1 мг/мышь (5 мг/кг) и 0,2 мг/мышь (10 мг/кг).
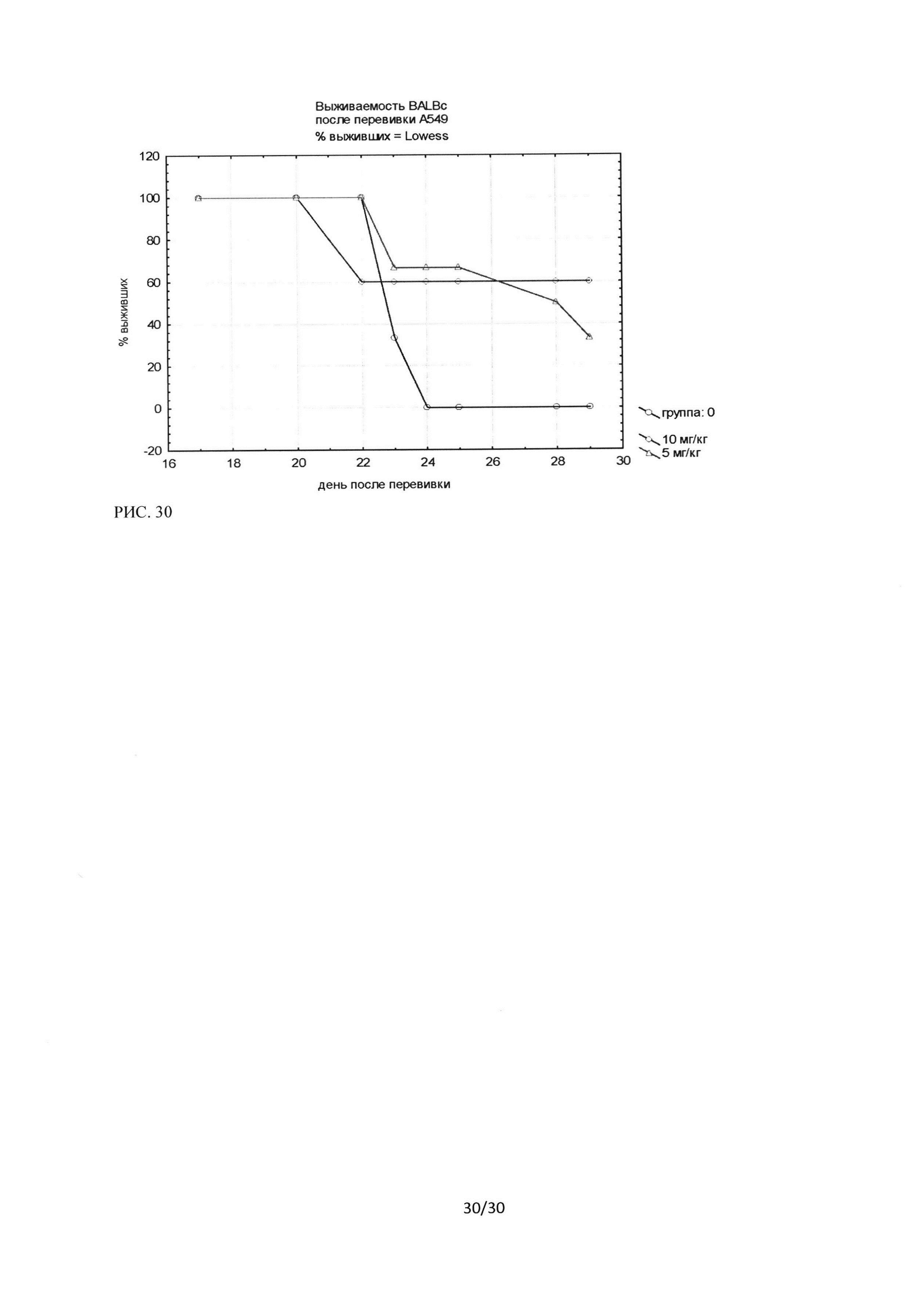
Рисунок 30. Кривые выживаемости мышей линии BALBc (NUDE) (самки + самки) с подкожно трансплантированной опухолью аденокарциномы легкого человека (А549) при внутривенном введении ингибитора Ras-ГТФазы в дозах 0,1 мг/мышь (5 мг/кг) и 0,2 мг/мышь (10 мг/кг). Кривые выживаемости мышей линии BALBc (NUDE) (самки+самки) с подкожно трансплантированной опухолью аденокарциномы легкого человека (А549) при внутривенном введении ингибитора Ras-ГТФазы в дозах 0,1 мг/мышь (5 мг/кг) и 0,2 мг/мышь (10 мг/кг).
Осуществление изобретения
Возможность осуществления изобретения с реализацией указанного назначения и достижением технического результата подтверждают следующие результаты исследований, однако приведенные результаты не ограничивают варианты использования заявленного технического решения.
Для исследования эффектов на опухолях человека использовали методы in vitro - перевивных культур опухолевых клеток и in vivo - ксенографные модели опухолей человека.
Исследование влияния пептида С (Таблица 1) было проведено на клеточных линиях человека НСТ116, НТ29 (аденокарциномы толстого кишечника) и А549 (аденокарцинома легких). Показано, что для этих моделей, внесение пептида С в культуральную среду вызывает индукцию апоптоза и остановку пролиферации. Наибольший цитотоксический эффект был получен для клеток линии А549. Результаты исследований
Пример 1. Исследование специфической активности последовательности пептидного ингибитора Ras-ГТФазы с использованием МТТ
На культурах клеток А549, HI299 и Н460 была поставлена серия экспериментов по изучению цитотоксического воздействия последовательности пептидного ингибитора Ras-ГТФазы. Цитотоксический эффект был оценен несколькими методами. В первую очередь были поставлены эксперименты, в которых с помощью МТТ-теста оценивали количество живых клеток, оставшихся в культуре после воздействия последовательности пептидного ингибитора Ras-ГТФазы в разных концентрациях. Время инкубации исследуемых клеточных культур с пептидным ингибитором Ras-ГТФазы, составляло 24 и 48 часов. Было проведено исследование воздействия на культуры лекарственного средства пептидного ингибитора Ras-ГТФазы в различных концентрациях от 2 до 40 мкМ. Данный метод (МТТ-тест) основан на способности митохондриальных и цитоплазматических дегидрогеназ живых метаболически-активных клеток восстанавливать неокрашенные формы 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола (МТТ-реагента) до голубого кристаллического фармазана, растворимого в диметилсульфоксиде (ДМСО).
При исследовании влияния пептидного ингибитора Ras-ГТФазына культуру клеток А549, было показано, что количество живых клеток уменьшается при увеличении концентрации в диапазоне от 2 до 40 мкМ, через 24 часа инкубации при концентрации 40 мкМпептидного ингибитора Ras-ГТФазы количество живых клеток снижается до 47%.
При увеличении времени инкубации до 48 часов было показано, что в диапазоне концентраций от 10 до 40 мкМ наблюдается снижение количества живых клеток, относительно 24 часов инкубации, а при воздействии низких доз пептидного ингибитора Ras-ГТФазы (2 мкМ, 5 мкМ) наблюдается увеличение количества живых клеток, относительно 24 часовой инкубации при тех же концентрациях.
На рисунке 1 показано изменение количества живых клеток в культуре А549 (средние значения по трем экспериментам, в каждом эксперименте было поставлено три дубля) при 24 часовой и 48 часовой инкубации. Видно, что увеличение времени инкубации незначительно снижает количество живых клеток.
При концентрации 40 мкМ количество живых клеток составляло в среднем 37%. При исследовании цитотоксического влияния лекарственного средства последовательности пептидного ингибитора Ras-ГТФазы на клетки линии Н460 также было показано, что снижение количества живых клеток происходит пропорционально увеличению концентрации К26К в диапазоне от 2 до 40 мкМ, достоверное снижение количества живых клеток относительно контрольных образцов наблюдается при увеличении концентрации более 10 мкМ. При концентрации 40 мкМ происходит снижение количества живых клеток на 46%.
При увеличении времени инкубации до 48 часов наблюдается рост клеток в образцах 2 и 5 мкМ, в образцах с концентрацией пептидного ингибитора Ras-ГТФазы 10 мкМ и более происходит снижение количества живых.
На рисунке 2 представлено сравнение изменения количества живых клеток в культуре Н460 при воздействии последовательности пептидного ингибитора Ras-ГТФазы в течение 24 и 48 часов.
Также, как и для линии А549, показано увеличение количества живых клеток при воздействии пептидного ингибитора в низких концентрациях 2 и 5 мкМ и инкубации 48 часов, что может свидетельствовать об обратимости воздействия. При увеличении времени инкубации до 48 часов происходит увеличение количества мертвых клеток, при концентрации пептидного ингибитора Ras-ГTФaзы20 мкМ и инкубации 24 часа количество живых клеток в культуре составляло 75,5%, при инкубации 48 часов - 65%.
При исследовании методом МТТ цитотоксического эффекта последовательности пептидного ингибитора на клетки линии H1299 также была обнаружена прямая концентрационная зависимость. Эффект, оказываемый на клетки культуры HI299 был выше, чем для А549 и Н460, так при концентрации 20 мкМ количество живых клеток через 24 часа инкубации составляло 48%, при увеличении концентрации до 40 мкМ количество живых клеток снижалось до 29%.
При увеличении времени инкубации до 48 часов было обнаружено увеличение количества живых клеток при воздействии пептидного ингибитора в концентрациях 2 и 5 мкМ, и дальнейшее снижение количества живых клеток при воздействии пептидного ингибитора в концентрациях более 10 мкМ.
При сравнении полученных результатов МТТ-теста для линии HI299 было показано, что увеличение времени инкуации до 48 часов не приводит к достоверному увеличению цитотоксического эффекта (рисунок 3).
На основании проведенных исследований противоопухолевого эффекта лекарственного средства пептидного ингибитора Ras-ГТФазы методом МТТ было показано, что последовательность обладает выраженым цитотоксическим действием относительно исследуемых линий рака легкого человека (А549, Н460 и H1299). Эффект пропорционален концентрации лекарственного средства, однако низкие концентрации 2 и 5 мкМ вызывают обратимый эффект, в то время как, концентрации более 10 мкМ оказывают стойкий цитотоксический эффект. На рисунках 4 и 5 показано сравнение цитотоксического эффекта последовательности пептидного ингибитора относительно трех исследуемых линий.
Показано, что наибольший эффект наблюдался при инкубации пептидного ингибитора с клетками HI299, данная культура оказалась наиболее чувствительной к воздействию.
Пример 2. Исследование цитотоксичностипептидной последовательности ингибитора Ras-ГТФазы с помощью ЛДГ-теста
ЛДГ-тест, в отличие от МТТ-теста, показывающего количество живых, метаболически активных клеток, отражает количество погибших клеток за все время инкубации (отношение активности ЛДГ в среде инкубации в опытной лунке и в контрольной пропорционально количеству погибших клеток). ЛДГ-тест ставился через 24 и 48 часов инкубации клеток культур А549, H1299 и Н460 с пептидной последовательностью ингибитором Ras-ГТФазы. Анализ уровня ЛДГ проводился на автоматическом биохимическом анализаторе Olympus AU-400.
Проводилась оценка уровня ЛДГ после 24 часовой и 48 часовой инкубации культур клеток с пептидным ингибитopoмRas-ГTФaзы в концентрациях 2, 5, 10, 20 и 40 мкМ.
Для культуры А549 было показано, что уровень ЛДГ в надосадочной жидкости возрастает пропорционально увеличению концентрации ингибитора и увеличивается при 48 часовой концентрации (Рисунок 6). Высота пика на рисунках соответствует относительному уровню ЛДГ и пропорциональна количеству погибших клеток.
При исследовании цитотоксического эффекта пептидного ингибитора Ras-ГТФазына клетках Н460 также было обнаружено увеличение количества ЛДГ пропорциональное концентрации вносимого пептидного ингибитора.
Рисунок 7. Результаты ЛДГ-теста клеток культуры Н460 после 24 и 48 часов инкубации с пептидной последовательностью ингибитором Ras-ГТФазы, в концентрациях от 2 до 40 мкМ. Результаты контроля - клетки Н460, инкубированные со средой, в течение 24 часов, приняты за 1.
На рисунке 8 представлены результаты исследования цитотоксического эффекта последовательности пептидного ингибитора Ras-ГТФазыотносительно культуры HI299.
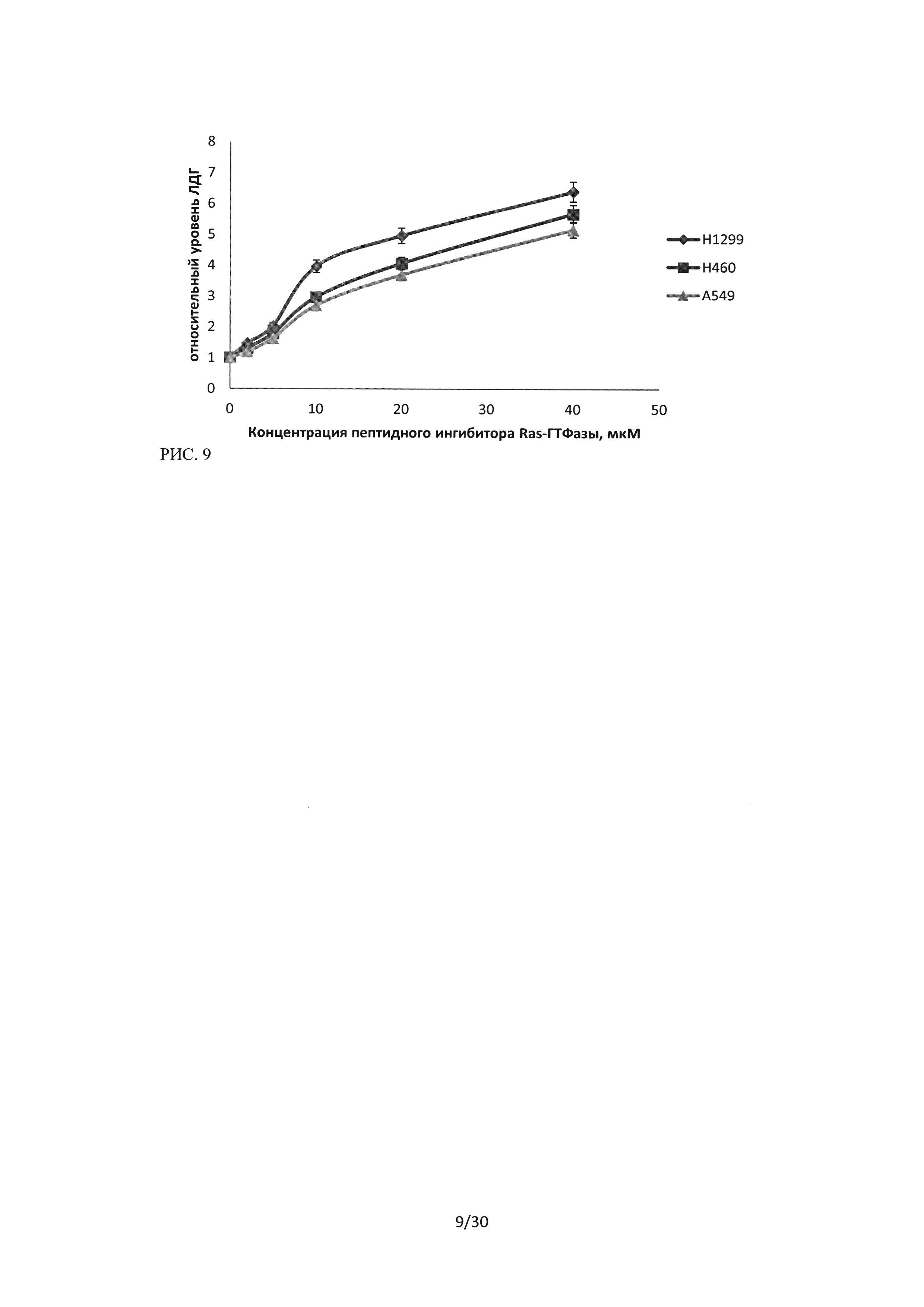
Результаты ЛДГ-теста для культуры H1299 также показали наличие концентрационной зависимости цитотоксического эффекта ЛС К26К и незначительное увеличение ЛДГ в надосадочной жидкости (количество мертвых/разрушенных клеток) при увеличении времени инкубации до 48 часов. При сравнении цитотоксического эффекта пептидного ингибитора Ras-ГТФазы, анализируемого методом ЛДГ-теста, на исследуемых культурах рака легкого человека, было установлено, что наибольший эффект наблюдается в культуре H1299 (Рисунок 9).
Т.о. с помощью метода ЛДГ-теста было показано, что исследуемое лекарственное средство на основе пептидной последовательности ингибитора Ras-ГТФазы, обладает выраженным цитотоксическим эффектом относительно клеток рака легкого человека. Цитотоксический эффект линейно зависит от концентрации внесенного в культуральную среду пептидного ингибитора Ras-ГТФазы и, в меньшей степени, зависит от времени инкубации.
Пример 3. Исследование цитотоксичностипептидной последовательности ингибитора Ras-ГТФазыс помощью метода проточной цитофлуориметрии окраской CFDA-SE/PI
Регистрируемая методом проточной цитофлюориметрии двойная окраска CFDA-SE/PI позволяет различать живые клетки, окрашивающиеся витальным красителем CFDA-SE, и мертвые, окрашивающиеся пропидий иодидом (PI). При исследовании противоопухолевого эффекта последовательности пептидного ингибитора Ras-ГТФазы методом окраски CFDA-SE/PI было проведено сравнение эффектов исследуемой последовательности и лекарственных препаратов (ЛП), применяемых в медицинской практике: 5-фторурацил и этопозид. Данные по оценке цитотоксичностипептидной последовательности ингибитора Ras-ГТФазы и ЛП 5-ФУ и этопозид, в отношении культуры А549 по связыванию PI, регистрируемые по 3 каналу флюоресценции, представлены на рисунке 10. Данные по оценке цитотоксичности для культуры А549 по связыванию CFDA-SE, регистрируемые по 1 каналу флюоресценции, представлены на рисунке 11. Время инкубации составляло 24 часа.
Из приведенных результатов видно, что исследуемая последовательность пептидного ингибитора Ras-ГТФазы, оказывает сопоставимый с 5-ФУ и этопозидом цитотоксический эффект на клетки линии А549. Данный эффект при концентрациях 10 и 20 мкМ выше, чем у 5-ФУ, но несколько ниже, чем эффект этопозида.
Результаты исследования цитотоксического эффекта пептидной последовательности ингибитора Ras-ГТФазы и сравнение данного эффекта с эффектами ЛП 5-ФУ и этопозид представлены на рисунках 12-13. Показано, что цитотоксический исследуемых лекарственных препаратов имеет линейную зависимость от концентрации.
Эффект пептидного ингибитора Ras-ГТФазы для культуры Н460 превосходит цитотоксический эффект 5-фторурацила, но ниже, чем эффект этопозида.
При исследовании эффективности пептидной последовательности ингибитора Ras-ГТФазы в отношении клеток линии HI299 и сравнение эффектов с цитотоксическими эффектами 5-фторурацила и этопозида в равных концентрациях, методом проточной цитофлуориметрии с двойной окраской CFDA-SE/PI, было показано, что на данную клеточную культуру последовательность пептидного ингибитораоказывает стойкий цитотоксический эффект. Данный эффект выражается в увеличении количества PI-положительных частиц (мертвые клетки) и снижении клеток, положительных по CFDA-SE. На рисунке 14 представлен эффект трех исследуемых лекарственных средств, показано, что уровень PI-положительных частиц возрастает в зависимости от увеличения концентрации ЛС, и для линии HI299 цитотоксический эффект пептидного ингибитора Ras-ГТФазы превосходит эффекты 5-фторурацила и этопозида. Рисунок 15 отражает изменение количества живых клеток, положительных по CFDA-SE.
Исследование эффективности пептидной последовательности ингибитора Ras-ГТФазы в отношении клеток линий А549, Н460 и H1299 методом двойной окраской CFDA-SE/PI показало, что противоопухолевый эффект пептидного ингибитора Ras-ГТФазы сопоставим с цитотоксическим эффектом стандартных противоопухолевых препаратов 5-фторурацил и этопозид.
Пример 4. Исследование цитотоксичностипептидной последовательности ингибитора Ras-ГТФазыс помощью метода проточной цитофлуориметрии окраской AnnexinV/PI
Цитометрический анализ культур А549, HI 299 и Н460 проводили на проточномцитофлуориметреСуюпихРС 500 (BeckmanCoulter, США). Накопление производили до 10000 событий. Для настройки режимов компенсации и установки границ квадрантов использовали следующие контроли: неокрашенные клетки; клетки, окрашенные только Annexin V-FITC (без PI); клетки, окрашенные только PI (без Annexin V-FITC). В образце оценивали показатели прямого (FSC) и бокового (SSC) светорассеяния клеток, интенсивность флуоресценции Annexin V-FITC (FL1) и PI (FL3). После исключения дебриса (по показателям прямого и бокового светорассеяния) определяли количество Annexin+- и PI+-клеток в режиме DotPlot (двумерная гистограмма). Количество апоптотических Annexin+-клеток определяли в верхнем левом квадранте, клетки в позднем апоптозе (Annexin+PI+-клетки) оценивали в верхнем правом квадранте гистограммы. Сбор данных и компьютерную обработку осуществляли с использованием программного обеспечения прибора.
С помощью метода проточной цитофлуориметрии можно выявить самые ранние события процесса апоптоза, уловив стадию, когда «принимается решение» о переходе границы жизнеспособности и самом пути клеточной смерти. Известно, что пропидиум иодид является маркером клеток, находящихся в позднем апоптозе или некрозе (при некрозе происходит нарушение целостности клеточной мембраны, что позволяет PI войти в клетку и связаться с ДНК). Существуют также флуоресцентные красители, способные пометить клетки, «решившие» идти по пути апоптоза. Наиболее ранним событием, предваряющим такое решение, является окисление липидов клеточных мембран, происходящее под влиянием избыточной продукции активных форм кислорода. При этом особенно уязвимы ненасыщенные жирно-кислотные хвосты кислых фосфолипидов, представленные в мембранах в основном фосфатидилсерином. Образование гидроперекисей фосфатидилсерина нарушает его взаимодействие с белками цитоскелетааннексинами и облегчает миграцию окисленного фосфатидилсерина с внутренней стороны мембранного бислояна наружную. По этой причине фосфатидилсерин, который в нормальной клетке практически полностью локализован с внутренней стороны бислоя, при индукции апоптоза начинает появляться и с внешней стороны мембраны. Экспрессия фосфатидилсерина на наружной поверхности мембраны наблюдается, начиная с ранней стадии апоптоза до полной деградации клетки. Этим обстоятельством и пользуются исследователи для того, чтобы отличить нормальные жизнеспособные клетки от тех, у которых выявляется готовность к апоптозу. В качестве соединения, маркирующего апоптозные клетки, используют рекомбинантный белок аннексии V (Annexin V), конъюгированный с флуоресцентным красителем. Обычно с этой целью применяют флуоресцеинизотиоционат, FITC. Таким образом, внесение в клеточную суспензию двух меток - PI (для выявления некроза) и аннексина V-FITC (для выявления апоптоза) - позволяет одновременно оценить количество интактных, апоптотических и некротических клеток в данной суспензии (жизнеспособные клетки - отрицательные и по аннексину V, и по PI; клетки, находящиеся на ранней стадии апоптоза,- положительные по аннексину V и отрицательные по PI; клетки на поздней стадии апоптоза или уже погибшие - положительные и по аннексину V, и по PI; погибшие клетки - отрицательные по аннексину V и положительные по PI.
Было проведено исследование эффективности последовательности пептидногоингибитора Ras-ГТФазыс помощью метода проточной цитофлуориметрии и окраски AnnexinV/PI. Оценка цитотоксического и проапоптотического эффектов проводилась для концентраций пептидной последовательности ингибитора Ras-ГТФазы - 2, 5, 10, 20 и 40 мкМ; время инкубации составило 24 часа.
Показано, что для исследуемых клеточных культур внесение пептидной последовательности ингибитора Ras-ГТФазывызывает индукцию апоптоза. Уровень апоптоза зависит от концентрации, как и уровень клеток, погибших по пути некроза. Для противоопухолевой терапии наиболее предпочтителен вариант гибели опухолевых клеток по пути апоптоза, т.к. не вызывает обширного воспаления и выхода в интерстициальное пространство продуктов клеточного распада и индукторов воспалительных реакций. Также наличие высокого уровня апоптоза косвенно свидетельствует о специфичности воздействия исследуемой последовательности, представляющей собой ингибитор Ras-ГТФазы. В исследуемых культурах опухолевых клеток уровень апоптоза при воздействии на клетки пептидной последовательности ингибитора Ras-ГТФазыотличался, на рисунках 16-18 представлены результаты сравнения уровней апоптоза и некроза, индуцированные внесением Л С пептидного ингибитора в культуральную среду исследуемых линий.
Как видно из представленных результатов (рисунки 16-18), зависимости уровней апоптоза и некроза для клеточных линий А549 и Н460 при воздействии на них последовательности пептидного ингибитора Ras-ГТФазы, имеют схожий вид. Уровень апоптоза при воздействии исследуемой пептидной последовательности в концентрации 40 мкМ и времени инкубации 24 часа возрастает до 35% в культуре А549 и до 40% в культуре Н460, а уровни некроза до 32% и 31% соответственно, а также кривые имеют схожий вид. В то же время эффект воздействия последовательности пептидного ингибитора Ras-ГТФазы на клетки линии HI299 имел принципиальные особенности (рисунок 18), уровень индуцированного апоптоза в данной культуре был достоверно выше, чем уровень некроза. Количество клеток, вступивших в апоптоз (ранний + поздний апоптоз) при воздействии пептидного ингибитора Ras-ГТФазыв концентрации 10 мкМ в среднем составило 27,7%, при увеличении концентрации до 20 мкМ -38% и при концентрации 40 мкМ составило 45%.
Проведенное исследование видов клеточной гибели (апоптоз и некроз) при воздействии на клетки линий рака легкого человека методом проточной цитофлуориметрии с использованием двойной окраски Annexin V-FITC / PI, показало: исследуемаяпептидная последовательность ингибитора Ras-ГТФазы, обладает выраженным специфическим противоопухолевым действием в отношении культур клеток рака легкого человека. Данный эффект характеризуется индукцией клеточной гибели преимущественно по пути апоптоза. Уровень апоптоза,индуцированного внесением в культуральную среду пептидного ингибитора, зависит от типа клеток и обусловлен, по-видимому, молекулярно-генетическими особенностями клеточной линии.
Пример 5. Исследование влияния последовательностей фрагментов ингибитора Ras-ГТФазына клеточный рост.
Для динамического исследования влияния лимфоцитов, трансфецированныхплазмидами, содержащими гены различных вариантов рецепторов использовали прибор RTCA iCELLIgence, фирмы ACEA Biosciences (США). Принцип метода основан на измерении импеданса приповерхностного слоя на дне культуральной лунки. Величина импеданса пропорциональна количеству клеток в лунке (или если точнее, площади, занимаемой клетками). Значения сопротивления, измеренные для электродов в индивидуальных лунках, зависят от геометрии электрода, концентрации ионов в лунке и от наличия клеток, фиксированных на электродах. В отсутствие клеток, электрическое сопротивление в первую очередь определяется ионным составом среды на границе раствора/электрода и в растворе. В присутствии клеток, они присоединяются к сенсорной поверхности электрода и действуют как изолятор, что приводит к изменению локального ионного окружения на границе раствора/электрода, и увеличению сопротивления. Таким образом, чем больше клеток располагается на электроде, тем сильнее меняется сопротивление этого электрода. Уникальность системы для клеточного анализа iCELLIgence в том, что она основана на микроэлектронных биосенсорах, которые позволяют динамически и в реальном времени анализировать клеточный ответ без использования дополнительных маркеров или меток. Таким образом, добавление ингибиторов роста или цитотоксических агентов к культуре растущих клеток приводит к угнетению роста и/или гибели клеток, что сопровождается снижением регистрируемого импеданса, как абсолютного, так и по сравнению с контрольными лунками, где рост клеток продолжается. Измерение производится периодически в течение всего времени эксперимента, что позволяет регистрировать динамику роста в каждой лунке с заданной периодичностью. С применением метода клеточного анализа iCELLIgence было проведено исследование цитостатического воздействия последовательности фрагмента ингибитора Ras-ГТФазына клетки культур А549, Н1299 и Н460.
Для каждой клеточной линии было поставлено по пять экспериментов по исследованию влияния пептидного ингибитора Ras-ГТФазына рост клеток при его концентрациях в диапазоне 2-40 мкМ. При проведении экспериментов клетки вносились на планшет в количестве 20000 на лунку, инкубировались 3 часа для начального закрепления на дне планшета, а затем к культуральной среде добавлялось исследуемое вещество в различных концентрациях. На рисунках 19-21 представлены примеры графиков клеточного роста для культур А549, Н460 и Н1299.

При исследовании цитостатического эффекта пептидного ингибитора Ras-ГТФазы в отношении клеток линии А549, было показано, что эффект имеет четкую концентрационную зависимость. При воздействии на клетки пептидного ингибитора Ras-ГТФазы в концентрации 2 мкМ показатель клеточного индекса (отражает количество прикрепленных, живых клеток) снижается относительно контрольного образца в 1,2 раза, при воздействии пептидного ингибитора в концентрации 5 мкМ в 1,6 раза, при 10 мкМ в 2,14 раза, при 20 мкМ в 4 раза, а при воздействии на клетки А549 пептидного ингибитора Ras-ГТФазы в концентрации 40 мкМ мы наблюдали полную остановку пролиферации со снижением клеточного индекса до отрицательных значений, т.е. клеток становилось меньше, чем было внесено изначально.

При исследовании воздействия пептидного ингибитора Ras-ГТФазы на клетки линии Н460 также был обнаружен цитостатический эффект, определяющийся по снижению пролиферативной активности в культуре при внесении в среду пептидного ингибитора. Эффект имел концентрационную зависимость: при воздействии на клетки Н460 пептидного ингибитора в концентрации 5 мкМ клеточный индекс снижался в 1,3 раза, при воздействии концентрации 10 мкМ - в 1,5 раза, при воздействии 20 мкМ в 2,4 раза, при воздействии 40 мкМ в 4 раза по сравнению с контрольными образцами.

При исследовании цитостатического эффекта пептидного ингибитора Ras-ГТФазы «методом пролиферации в реальном времени» с помощью клеточного анализа iCELLIgence на клетках культуры Н1299 был получен более слабый эффект, чем для культур А549 и Н460. Так значение клеточного индекса при воздействии на клетки HI299 пептидного ингибитора Ras-ГТФазы в концентрации 5 мкМ снижалось в среднем в 1,1 раза, при воздействии 10 мкМ в 1,5 раза, при воздействии 20 мкМ в 1,6 раза, при воздействии 40 мкМ в 2,5 раза. Полученный низкий цитостатический эффект для клеток HI299 вполне согласуется с результатами о высоком цитотоксическом эффекте пептидного ингибитора Ras-ГТФазы в отношении данной клеточной линии. Клетки, обладающие высокой пролиферативной активностью, по-видимому, более подвержены проапоптотическому воздействию ингибитopaRas-ГTФaзы, в то же время клетки, уходящие из под его воздействия продолжают вступать в деление и размножаться.
С помощью программного обеспечения клеточного анализатора iCELLIgence были получены результаты времени удвоения культуры при воздействии на клетки пептидного ингибитора Ras-ГТФазы. Для линии клеток А549 было показано, что при концентрации пептидного ингибитора 40 мкМ время удвоения клеточной популяции возрастает до 18,4 часа, в контроле время удвоения культуры составляло - 8,3 часа (рисунок 22).
Анализ времени удвоения клеточной популяции в культуре клеток Н460 было несколько больше, чем для А549, даже в контроле, что свидетельствует о более медленной пролиферации данной линии клеток. Воздействие пептидного ингибитора Ras-ГТФазы характеризовалось увеличением времени удвоения популяции, имело концентрационную зависимость (Рисунок 23).
При воздействии лекарственного средства пептидного ингибитора Ras-ГТФазы на культуру клеток Н460 в концентрации 20 мкМ задержка времени удвоения пролиферации составила - 1,8 раза, при увеличении концентрации пептидного ингибитора до 40 мкМ - 2,1 раза.
На рисунке 24 представлено рассчитанное время удвоения популяции клеток культуры Н1299. Показано, что данная клеточная линия отличается более высокой пролиферативной активностью, так время удвоения популяции в контрольном образце составляло 8,1 часа (для линии А549 - 8,3, для Н460 - 10,4). При увеличении концентрации пептидного ингибитора Ras-ГТФазыдо 20 мкМ наблюдалось линейное увеличение времени удвоения (18,3 часа при 20 мкМ), однако, увеличение концентрации до 40 мкМ не привело к дальнейшей задержке пролиферации и составило 18,4 часа.
Таким образом, при исследовании противоопухолевого эффекта последовательности пептидного ингибитора Ras-ГТФазы в отношении культур рака легкого человекаА549, HI299 и Н460 было показано, что исследуемое лекарственное средство является потенциальным противоопухолевым препаратом. Обладает выраженной цитотоксической активностью, определяющейся в увеличении количества мертвых клеток и снижении количества живых клеток в культурах исследуемых линий. Исследуемое лекарственное средство индуцирует апоптоз в клетках рака легкого человека, причем, данный эффект зависит от типа клеточной линии. Цитотоксический и проапоптотический эффекты имеют прямую концентрационную зависимость. Цитостатический эффект последовательности пептидного ингибитора Ras-ГТФазы, определяющейся в снижении пролиферативной активности клеток при внесении его в культуральную среду, также имеет концентрационную зависимость и различен для разного типа клеток.
Заключение.
Анализ эффективности лекарственного средства in vitro последовательности пептидного ингибитора Ras-ГТФазывключал исследование оценки цитотоксического и цитостатического эффектов на клеточные культуры А549, HI299 и Н460. Методами МТТ-теста, ЛДГ-теста и методом проточной цитометрии с CFDA-SE/PI окраской был оценен цитотоксический эффект исследуемой последовательности. Методом проточнойцитометрии (окраска AnnexinV/PI) проведено исследование уровня апоптоза. Использование метода «пролиферации в реальном времени» RTCA iCELLIgence позволило оценить цитостатический эффект.
На основании проведенных исследований было показано, что исследуемое лекарственное средство пептидный ингибитор Ras-ГТФазы обладает выраженными противоопухолевыми свойствами в отношении культур клеток рака легкого человека.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ ЭФФЕКТИВНОСТИ IN VIVO
Пример 6. Эффективность ингибитора Ras-ГТФазы в отношении опухолевых клеток Карцинома Льюиса (LCC)
Было проведено изучение выживаемости мышей с внутрибрюшинно трансплантированными клетками аденокарциномы легкого Lewisnpn лечении лекарственным средством ингибитором Ras-ГТФазы. Животные были разделены на 4 основные группы:
Внутрибрюшинное введение 0,1 мг/мышь (5 мг/кг) ингибитора Ras-ГТФазы каждый день;
Внутрибрюшинное введение 0,2 мг/мышь (10 мг/кг) ингибитора Ras-ГТФазы, в 0,2 мл раствора 0,9% NaCl каждый день;
Внутрибрюшинное введение 0,1 мг/мышь (5 мг/кг) ингибитора Ras-ГТФазы через день;
Внутрибрюшинное введение 0,2 мг/мышь (10 мг/кг) ингибитора Ras-ГТФазы, в 0,2 мл раствора 0,9% NaCl через день;
Контрольные группы - животные с внутрибрюшинно трансплантированной аденокарциномой легкого Lewis, каждый/через день введение 0,2 мл раствора 0,9% NaCl.
В каждую группу входило 12 животных: 6 самцов + 6 самок.
Выживаемость оценивалась до гибели 100% животных с успешно трансплантированными опухолями. Количество введений составило 12 инъекций для групп 1 и 2; и 6 инъекций для групп 3 и 4.
Результаты проведенного исследования показали достоверные отличия в выживаемости для группы 4 -введение препарата в дозе 10 мг/кг через день от группы контроля. Достоверных отличий между группами самцы и самки получено не было.
Сравнение полученных кривых выживаемости для режимов «каждый день» и «через день» показывают тенденцию улучшения выживаемости при режимах введения ингибитором Ras-ГТФазы через день (оба режима через день при равных разовых дозах показывают тенденцию к лучшей выживаемости в группах несмотря на более низкую суммарную дозу (рис. 25, рис. 26).
Как показано на рисунках 25 и 26, наилучшая выживаемость была зафиксирована в группе №4 (доза 10 мг/кг, режим введения - через день) как для самцов, так и для самок. Сравнение режимов также демонстрирует тенденцию большей эффективности при введении препарата через день, хотя отличия для групп не достоверны. Таким образом, независимо от пола животных, показано, что при режиме введения препарата через день и разовой дозе 10 мг/кг достоверно увеличивается продолжительность жизни экспериментальных животных. Процент увеличения продолжительности жизни животных вычислялся по формуле:
УПЖ=(СПЖопыт-СПЖконтроль)СПЖконтроль×100%
Было показано, что достоверные отличия, выявленные для групп 4 (самцы и самки), составляют 21% для самцов и 25% для самок. Для групп 1-3 увеличение продолжительности жизни животных достоверно от контрольной группы не отличалось.
Динамики роста внутрибрюшинно трансплантированной опухоли - аденокарциномы легкого мышей линии С57 В1/6 на фоне введения ингибитора Ras-ГТФазыпри 2 схемах и 2 дозах применения оценивалась по увеличению веса животных - нарастанию асцита. Однако в проведенном исследовании наблюдалась ранняя гибель животных, первые погибшие на 8 день после перевивки опухолей, а изменения веса животных (нарастание асцита) достоверно не отличалось в исследованных группах.
При исследовании эффективности ингибитора Ras-ГТФазы в отношении опухолевых клеток Карцинома Льюиса (LCC), было показано что наилучший противоопухолевый эффект достигается привведение препарата в дозе 10 мг/кг с интервалом через день. Для данной группы (4) получены достоверные отличия выживаемости относительно группы контроля.
Пример 7. Эффективность ингибитора Ras-ГТФазына модели опухолевых клеток рака легоко человека (А549).
Было проведено изучение динамики роста опухоли и выживаемости мышей с подкожнотрансплантированной опухолью - аденокарциномой легкого человека (А549) у мышей линии BALBc (NUDE) на фоне введения ингибитора Ras-ГТФазыпри 2 дозах применения. Животные были разделены на 2 основные группы:
Внутривенное введение (5 мг/кг) ингибитора Ras-ГТФазы в 0,2 мл раствора 0,9% через день;
Внутривенное введение (10 мг/кг) ингибитора Ras-ГТФазы, в 0,2 мл раствора 0,9% NaCl через день;
Контрольную группу составили животные с подкожнотрансплантированной опухолью аденокарциномы легкого человека (А549), введение через день 0,2 мл раствора 0,9% NaCl. В каждую группу входило 12 животных: 6 самцов + 6 самок.
При исследовании динамики роста опухоли и выживаемости мышей линии BALBc (NUDE) с подкожно трансплантированной опухолью культуры А549 достоверных отличий между самцами и самками внутри каждой группы получено не было, поэтому данные самцы-самки были объединены. На рисунке 27 (фото) представлен типичный вид опухолей в контрольной (рисунок 27 А) и опытной группе 2 (рисунок 27 В) на 16 день после перевивки опухолей.
Изучение динамики роста подкожно трансплантированной опухоли - аденокарциномы легкого человека у мышей NUDE на фоне введения ингибитора Ras-ГТФазыпри 2 дозах применения показало достоверное торможение роста опухоли.
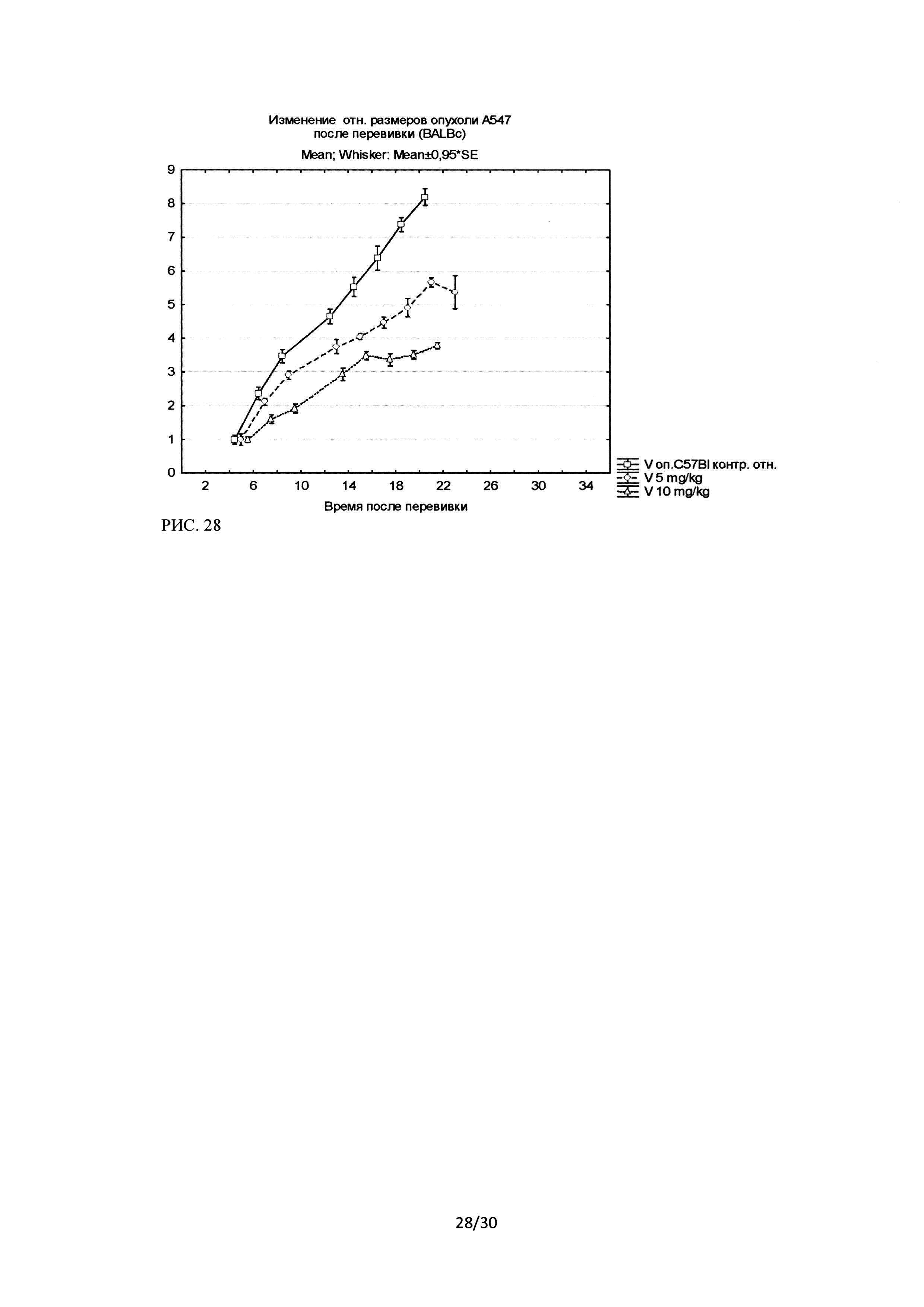
Торможение роста составило (на момент 100% гибели группы контроля) для группы с режимом введения через день и дозой 10 мг/кг - 57,3%, а для группы с дозой 5 мг/кг -30,5% (рисунок 28).
Как показано на рисунке 28, минимальные различия в объемах опухолей наблюдались с 8 дня после перевивки опухолей, после 1 инъекции ингибитора Ras-ГТФазы. На 22 день после перевивки (после 8 инъекций исследуемого лекарственного средства, в режиме введения через день) отличия между группами были максимальны (Таблица 3, рисунок 29).

На рисунке 29 представлены изменения относительного объема (относительно объема опухоли на момент начала введения ЛС) опухолей в исследуемых группах на 22 день после перевивки.
Изучение динамики роста подкожно трансплантированной опухоли - аденокарциномы легкого человека у мышей NUDE на фоне введения ингибитора Ras-ГТФазыпри 2 дозах применения показало достоверное торможение роста опухоли в обеих группах, однако наилучший эффект был достигнут при внутривенном введении ЛС в дозе 0,2 мг/мышь (10 мг/кг).
Анализ выживаемости показал, что применение обеих доз лечения (0,1 мг/мышь (5 мг/кг) и 0,2 мг/мышь (10 мг/кг)) при режиме введения через день существенно увеличивают время жизни экспериментальных животных. На момент 100% гибели животных в контрольной группе, получавшей инъекции NaCl, в группе с вводимой дозой 5 мг/кг было живо 66%, а в группе с дозой 10 мг/кг - 60% животных. При этом дальнейшее наблюдение показало, что в группе с дозой 10 мг/кг гибели животных не наблюдается при наблюдении более 10 дней после гибели всех животных в контрольной группе. В группе с дозой 5 мг/кг за этот период наблюдения осталось живо 33% животных (рисунок 30).
Процент увеличения продолжительности жизни животных вычислялся по формуле:
УПЖ=(СПЖопыт- СПЖконтроль)/СПЖконтроль×100%
Получены достоверные отличия с контролем для групп 1 и 2, в группе 1 (0,1 мг/мышь (5 мг/кг)) увеличение продолжительности жизни животных составило 16% относительно контрольной группы; в группе 2 (0,2 мг/мышь (10 мг/кг)) увеличение продолжительности жизни животных составило 36,3% относительно контрольной группы. Т.о. для подкожно трансплантированной опухоли культуры А549 (рак легкого, человек), также как и в случае с клетками аденокарциномы легкого Lewis, было доказано увеличение выживаемости при введении ингибитора Ras-ГТФазы по схеме введения препарата через день.
Заключение
Исследование эффективности ингибитора Ras-ГТФазы в отношении опухолевых клеток карцинома Льюиса (LCC) при двух дозах и двух интервалах ведения выявило достоверное увеличение продолжительности жизни животных в группе с введением лекарственного средства в дозе 0,2 мг/мышь (10 мг/кг) с интервалом через день. Различия между самцами и самками были незначительны и увеличение продолжительности жизни относительно контрольной группы составляло 21% для самцов и 25% для самок. Для опытных групп с введением лекарственного средства каждый день увеличение продолжительности жизни животных достоверно от контрольной группы не отличалось. Изменение увеличения объема опухоли из клеток карциномы Льюиса (LCC) имели большой разброс данных и различия между группами были недостоверны.
Исследования динамики роста опухоли и выживаемости мышей с подкожно трансплантированной опухолью - аденокарциномой легкого человека (А549) у мышей линии BALBc (NUDE) на фоне введения ингибитора Ras-ГТФазы были проведены при 2 дозах применения (0,1 мг/мышь (5 мг/кг) и 0,2 мг/мышь (10 мг/кг)) и схеме введения ЛС через день. Показано, что введение ЛС - ингибитора Ras-ГТФазы в исследуемых группах увеличивает продолжительность жизни и тормозит развитие опухоли. Было получено, что наибольший эффект оказывает доза 0,2 мг/мышь (10 мг/кг), на 36,3% увеличилась продолжительность жизни животных относительно контрольной группы, а торможение роста опухоли составило (на момент 100% гибели группы контроля) - 57,3%.
Т.о. было показано, что лекарственное средство на основе пептидного ингибитора Ras-ГТФазы, обладает противоопухолевым эффектом в отношении клеток немелкоклеточного рака легкого человека (А549).
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Ahmadian MR, Stege Р, Scheffzek К, Wittinghofer A. Confirmation of the arginine-finger hypothesis for the GAP-stimulated GTP-hydrolysis reaction of Ras. Nat Struct Biol. 1997 Sep; 4(9): 686-9.
2. 2. Scheffzek K, Ahmadian MR, Kabsch W, Wiesmuller L, Lautwein A, Schmitz F, Wittinghofer A. The Ras-RasGAP complex: structural basis for GTPase activation and its loss in oncogenic Ras mutants.Science. 1997 Jul 18; 277(5324): 333-8.
3. Colombo S, Peri F, Tisi R, Nicotra F, Martegani E. Design and characterization of a new class of inhibitors of ras activation. Ann N Y AcadSci 2004; 1030: 52-61.
4. Hocker HJ, Cho KJ, Chen CY, Rambahal N, Sagineedu SR, Shaari K, et al. Andrographolide derivatives inhibit guanine nucleotide exchange and abrogate oncogenic Ras function. ProcNatlAcadSci USA 2013; 110: 10201-6
5. Cortes J., Albitar M., Thomas D., Giles F., Kurzrock R., Thibault A., et al., Efficacy of the farnesyltransferase inhibitor R1 15777 in chronic myeloid leukemia and other hematologic malignancies, Blood, 2003, 101, 1692-1697
6. Alsina M., Fonseca R., Wilson E.F., Belle A.N., Gerbino E., Price-Troska Т., et al., Farnesyltransferase inhibitor tipifarnib is well tolerated, induces stabilization of disease, and inhibits farnesylation and oncogenic/tumor survival pathways in patients with advanced multiple myeloma, Blood, 2004, 103, 3271-3277
7. Kim E.S., Kies M.S., Fossella F.V., Glisson B.S., Zaknoen S., Statkevich P., et al., Phase II study of the farnesyltransferase inhibitor lonafarnib with paclitaxel in patients with taxane-refractory/ resistant nonsmall cell lung carcinoma, Cancer, 2005, 104, 561-569
8. Upadhyaya P, Qian Z, Seiner NG, Clippinger SR1, Wu Z, Briesewitz R, Pei D. - Inhibition of Ras signaling by blocking Ras-effector interactions with cyclic peptides. - AngewChemlnt Ed Engl. 2015 Jun 22; 54(26): 7602-6. doi: 10.1002/anie.201502763. Epub 2015 May 7
9. Fawell S., Seery J. et al., 1994; Vives E., Brodin P., Lebleu B. 1997; Kaplan I.M. et al., 2005; Gupta B. et al., 2005; Fernandez-Carneado J. et al., 2005
10. Георгиев Г.П. 2000; Wender P.A. et al., 2000; Барышников А.Ю. 2004
11. Schutze-Redelmeier M.P. и др., 2004; Trehin R., Merkle H.P., 2004; Cong-Mei Wu и др., 2004