Результат интеллектуальной деятельности: Рекомбинантная плазмидная ДНК pET19b-SAV, обеспечивающая синтез полноразмерного белка стрептавидина Streptomyces avidinii, штамм бактерий Escherichia coli - продуцент растворимого полноразмерного белка стрептавидина Streptomyces avidinii
Вид РИД
Изобретение
Группа изобретений относится к микробиологической промышленности, биотехнологии, генной и белковой инженерии. Сконструирована плазмида рЕТ19b-SAV, обеспечивающая в клетках Escherichia coli синтез полноразмерного рекомбинантного белка стрептавидина Streptomyces avidinii, одна молекула которого способна связывать 3,9 молекулы биотина. Создан штамм бактерий Escherichia coli - продуцент полноразмерного стрептавидина в цитоплазматическом растворе, накапливающий за 4 часа индуцированной ферментации 35-40 мг стрептавидина на 1 литр культуральной жидкости.
Стрептавидин Streptomyces avidinii - это гомотетрамерный белок, каждая субъединица которого связывает биотин (витамин Н). Образующийся при этом комплекс обладает уникальной для нековалентных соединений стабильностью (Kd=10-15 M). Благодаря этому на основе стрептавидин-биотинового взаимодействия разработаны и широко используются различные виды высокочувствительного микроанализа, направленной доставки препарата, нерадиоактивного мечения молекул и т.д.
Получение стрептавидина культивированием природного бактериального источника S. avidinii обладает рядом существенных недостатков: длительное инкубирование (в течение 6-14 суток), многостадийная очистка, включающая сульфат - аммонийное осаждение, диализ, хроматографию, загрязнение препарата биотином и высокомолекулярными производными стрептавидина [1]. Для преодоления этих недостатков были произведены попытки получения стрептавидина гетерологичной экспрессией в клетках-хозяевах, обедненных биотином.
Ген, кодирующий стрептавидин, был отклонирован в 1986 году [2], и предложен ряд способов получения стрептавидина в рекомбинантых клетках Е. coil.
Известны рекомбинантные плазмидные ДНК и штаммы-продуценты стрептавидина на основе рекомбинантных клеток E. coli [например, 3, 4].
Недостатком этих систем является то, что синтезируемый в клетках стрептавидин находится в виде нерастворимых телец-включений и для его получения необходимы дополнительные стадии: растворение белка в присутствии высоких концентраций детергента, диализ, фолдинг белка. Получаемый препарат часто содержит высокомолекулярные агрегаты стрептавидина.
Известна плазмида и рекомбинантный штамм-продуцент Е. coli BL21(DE3), обеспечивающий синтез стрептавидина в растворе цитоплазмы [5, 6]. Созданная при этом плазмида pUC8SZ содержит ген, кодирующий полноразмерный белок стрептавидин (15-159), удлиненный по N-концу 12-членным пептидом, так называемым, Tag7 пептидом.
Недостатком указанного изобретения является необходимость кратковременного прогревания цитоплазматической фракции (75°С, 10 мин) для очистки белка, что, наряду с гибридной формой белка, возможно, и обусловило падение его специфической активности.
Описано применение этой же генетической конструкции для трансформации другого штамма - Е. coli BL21(DE3)pLysS [7].
Синтезируемый при этом стрептавидин находится в нерастворимой фракции и его выделение осложнено проблемой растворения с помощью детергентов и последующим фолдингом.
Прототипом к заявляемой группе изобретений является рекомбинантная плазмидная ДНК PSAV27, кодирующая синтез растворимого стрептавидина из Streptomyces avidinii, и бактериальный штамм Escherichia coli - продуцент растворимого стрептавидина из Streptomyces avidinii [8, 9]. При этом, клонированный ген стрептавидина содержит последовательность, кодирующую лидерный пептид, состоящий из 24 аминокислот, который обеспечивает транслокацию белка в раствор периплазматического пространства.
Недостатком этого продуцента является необходимость дополнительного фракционирования биомассы клеток-продуцентов с целью получения периплазматической фракции, в которой сосредоточен стрептавидин. При этом проводят дополнительные стадии инкубирования клеток в растворе, содержащем 20% сахарозы, и обработки клеток лизоцимом.
Задачей заявляемой группы изобретений является создание эффективного продуцента стрептавидина на основе штаммов E. coli, обеспечивающего накопления белка в растворе цитоплазмы в биологически активном состоянии, что позволяет одностадийно получать высокоочищенный препарат стрептавидина методом аффинной хроматографии.
Техническим результатом группы изобретений является получение рекомбинантного штамма E. coli, обладающего способностью синтезировать стрептавидин с полноценной биологической активностью в раствор цитоплазмы, что упрощает процедуру получения высокоочищенного белка (одностадийная аффинная хроматография) по сравнению с получением стрептавидина из периплазматической, а также из нерастворимой фракций, требующего нескольких стадий очистки.
Указанный результат достигается путем конструирования рекомбинантной плазмидной ДНК pET19b-SAV, обеспечивающей синтез полноразмерного белка стрептавидина, имеющей молекулярную массу 4 МДа и размер 6126 п.о. и содержащей, в соответствии с физической и генетической картой плазмиды, сайты рестрикции NcoI, XhoI, NcoI-XhoI фрагмент ДНК плазмиды рЕТ19b длиной 5643 п.о., включающий промотор T7lac, ген ампициллин- резистентности (ген β-лактамазы), определяющий резистентность к ампициллину при трансформации Е. coli, участок ori инициации репликации и фрагмент ДНК NcoI-XhoI размером 483 п.о., представляющий собой последовательность, кодирующую полноразмерный стрептавидин без лидерного пептида; а также штамма бактерий Escherichia coli - продуцента полноразмерного стрептавидина, полученного трансформацией культуры клеток Escherichia coli BL21-Codon Plus(DE3) плазмидной ДНК pET19b-SAV, имеющей нуклеотидную последовательность SEQ ID No. 1 белка полноразмерного стрептавидина.
Сущность группы изобретений заключается в следующем.
Методами генной инженерии получают плазмидную ДНК pET19b-SAV, несущую фрагмент хромосомной ДНК Streptomyces avidinii, содержащий ген полноразмерного стрептавидина без лидерного пептида. Клетки Е. coli, трансформированные сконструированной плазмидой, способны синтезировать в растворенной форме белок стрептавидин, обладающий способностью связывать на одну молекулу 3,9 молекул биотина.
Исходным генетическим материалом для конструирования рекомбинантной плазмиды pET19b-SAV являются:
- плазмидный вектор pET-19b (Novagen), обеспечивающий встраивание гена, кодирующего полноразмерый стрептавидин;
- клетки штамм Streptomyces avidinii (АС865, Российская национальная коллекция промышленных микроорганизмов) - источник гена, кодирующего полноразмерный стрептавидин.
Полученная в результате плазмидная ДНК pET19b-SAV характеризуется следующими признаками:
- имеет молекулярную массу 4 МДа и размер 6126 п.о.;
- кодирует полноразмерный белок стрептавидин;
- состоит из следующих элементов:
а) NcoI-XhoI фрагмент ДНК плазмиды рЕТ19b (5643 п.о.), содержащий промотор T7lac, ген lacI белка-репрессора lac-оперона, участок ori инициации репликации, генетический маркер amp (ген β-лактамазы), определяющий резистентность к ампициллину при трансформации Е. coli.
б) фрагмент ДНК NcoI-XhoI размером 483 п.о., представляющий собой последовательность, кодирующую полноразмерный стрептавидин без лидерного пептида.
Для получения продуцента полноразмерного стрептавидина компетентные клетки Е. coli BL21-Codon Plus(DE3) - RIPL (Novagen) трансформируют сконструированной плазмидой pET19b-SAV.
Полученный таким образом штамм Е. coli BL21-Codon Plus(DE3)/pET19b-SAV характеризуется следующими признаками.
Морфологические признаки. Клетки мелкие утолщенной палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаре - колонии круглые, гладкие, прижатые, мутные, блестящие, серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или LB бульоне) образуют интенсивную ровную муть. Клетки растут при температуре 37°С при оптимуме рН от 6,8 до 7,0.
Устойчивость к антибиотику. Клетки проявляют устойчивость к ампициллину (200 мкг/мл), обусловленную наличием плазмиды.
Штамм Е. coli BL21-Codon Plus(DE3)/pET19b-SAV обеспечивает индуцируемый изопропилтиогалактозидом (ИПТГ) синтез белка полноразмерного стрептавидина. Индикацию экспрессии определяют с помощью гель-электрофореза в денатурирующих условиях (SDS-PAGE). Уровень экспрессии определяют с помощью денситометрии полиакриламидного геля, окрашенного Кумасси R-250, с помощью системы гель-документации AlphaImager с соответствующим программным обеспечением (AlphaInnotech, США). Уровень экспрессии составляет 10-13% от суммарного клеточного белка.
Весь целевой белок локализован в цитоплазматической фракции. Его препарат высокой степени очистки (98%) получают с помощью аффинной хроматографии. Степень очистки определяют сканированием геля прибором AlphaImager (AlphaInnotech, США). Концентрацию белка определяют спектрофотометрически, пользуясь значением Е0,1%280 нм = 3,4 [3], либо с помощью набора DC Protein Assay (Bio-Rad, США) по протоколу производителя.
Полученный белок обладает способностью связывать 3,9 молекул биотина на 1 молекулу белка, что было установлено колориметрическим методом с использованием красителя 4-гидроксиазобензол-2-карбоновая кислота (НАВА) [10].
Таким образом, впервые получена плазмида pET19b-SAV и штамм - продуцент, обеспечивающие продуцирование в бактериальных клетках Е. coli полноразмерного функционально - активного белка стрептавидина в цитоплазматическом растворе
Изобретение иллюстрируется следующими фигурами.
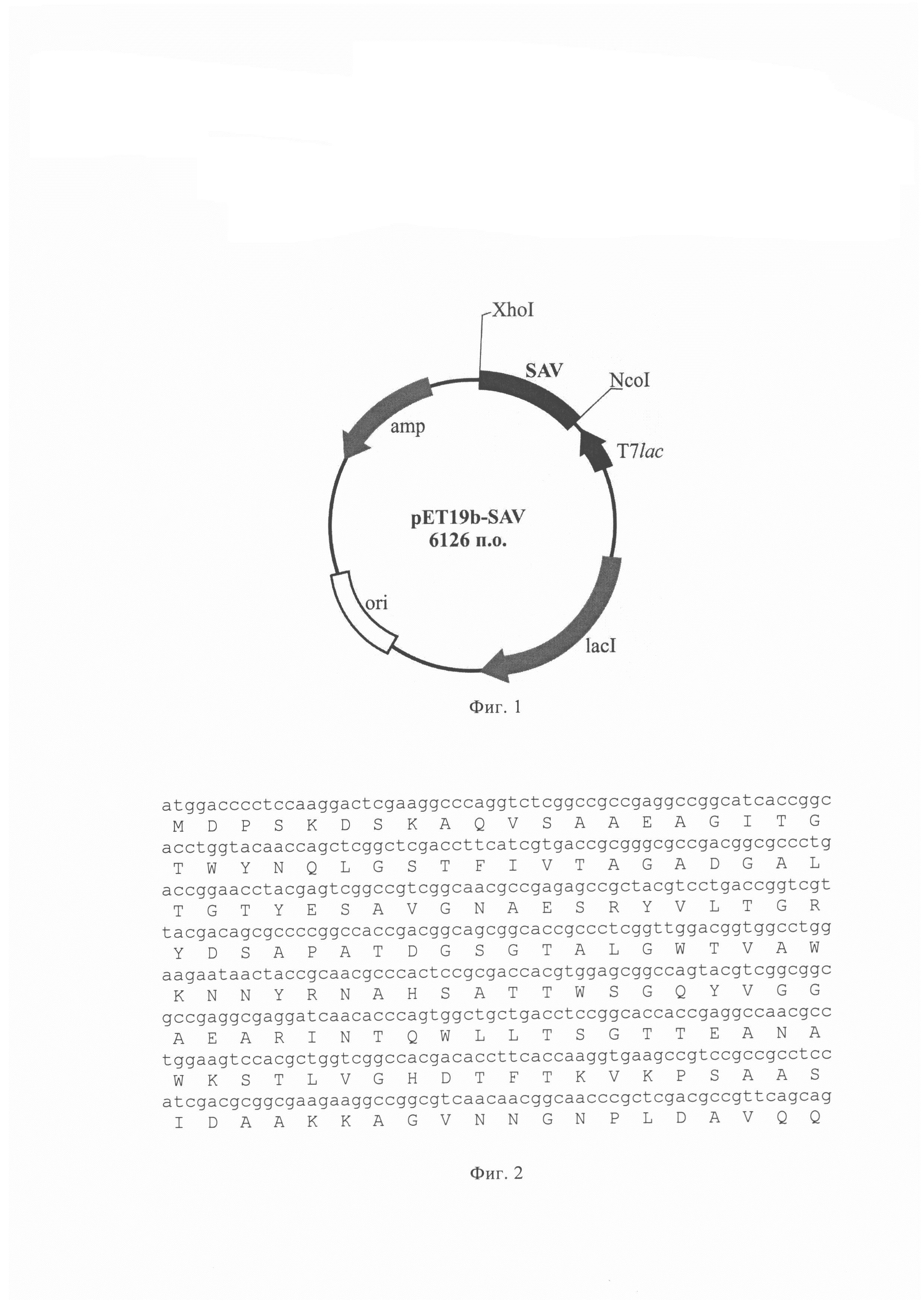
Фиг 1 Общая схема структурной организации плазмиды pET19b-SAV. Обозначения: SAV - ген, кодирующий полноразмерный стрептавидин; T7lac - область промотора; amp - ген устойчивости к ампициллину; lacI - ген белка-репрессора lac-оперона, ori - участок инициации репликации, указаны некоторые сайты рестрикции.
Фиг. 2 Нуклеотидная последовательность, кодирующая полноразмерный белок стрептавидина SEQ ID No. 1
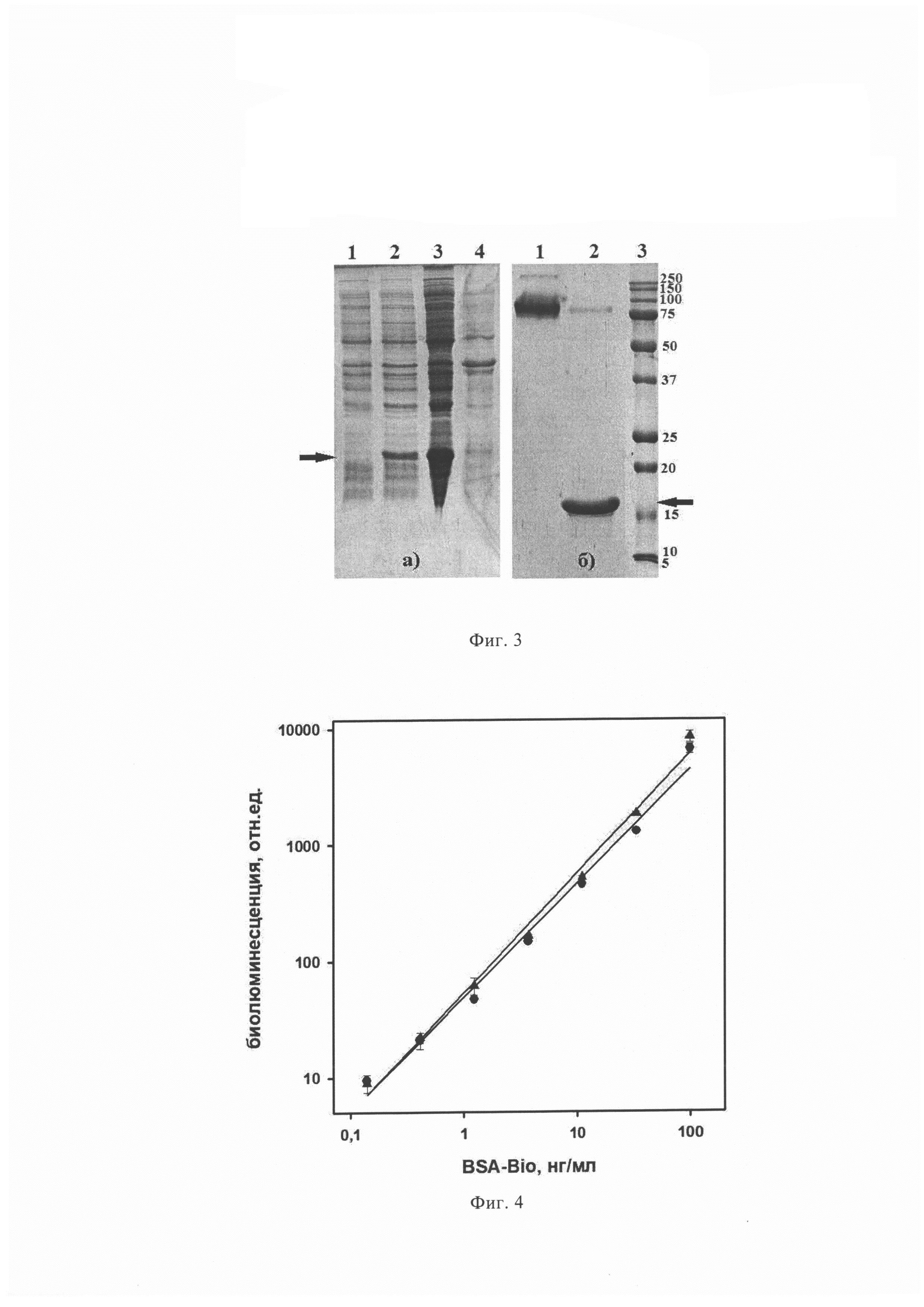
Фиг. 3 (а) Электрофоретический анализ фракций при получении полноразмерного стрептавидина в 15% SDS-PAGE, где дорожки 1,2 - лизат рекомбинантных клеток до и после индукции ИПТГ; 3 - цитоплазматическая фракция; 4 - фракция осадка клеточного дебриса, раствор в 6 М мочевине, (б) Электрофоретический анализ полученного препарата полноразмерного стрептавидина, где дорожка 1 - образец стрептавидина без температурной денатурации; 2 - образец стрептавидина после температурной денатурации; 3 - стандартные белки. Молекулярная масса стандартов показана цифрами. Стрелки показывают полосу мономерного стрептавидина.
Фиг. 4 Анализ взаимодействия стрептавидина с биотинилированными молекулами бычьего сывороточного альбумина (BSA-Bio), сорбированного на поверхности иммунологического микропланшета, с помощью биолюминесцентного сигнала биотинилированного производного Са2+-регулируемого фотопротеина обелина (Bio-Obe). Обозначения: полноразмерный стрептавидин, полученный экспрессией в патентуемом штамме клеток Е. coli BL21-Codon Plus(DE3)/pET19b-SAV, - (- • -); коммерческий стрептавидин (Sigma) - 
Для понимания сущности группы изобретений они иллюстрируются следующими примерами.
Пример 1. Конструирование плазмидной ДНК pET19b-SAV
Штамм Streptomyces avidinii (АС865, Российская национальная коллекция промышленных микроорганизмов) высевают в жидкую среду следующего состава: 10 г/л пептона, 5 г/л NaCl, рН 7,2, - не содержащую антибиотика, и культивируют 3 суток при 28°С.
Хромосомную ДНК Streptomyces avidinii выделяют с помощью набора GeneJET Plasmid Miniprep Kit (Thermo Fisher Scientific) и используют в качестве источника гена стрептавидина.
Фрагмент ДНК, кодирующий полноразмерный стрептавидин без лидерного пептида (483 п.о.) с сайтами рестрикции на 5'- (NcoI) и 3'- (XhoI) концах, получают методом полимеразной цепной реакции (ПЦР) с использованием Pfu-ДНК-полимеразы (SibEnzyme, Россия) и следующих праймеров:
Up 5'-CGCTCCATGGGACCCCTCCAAGGACTC-3';
Dn 5'-CGGGCTCGAGCTACTGCTGAACGGCG-3'.
Условия ПЦР: 95°С в течение 30 секунд; 25 циклов (95°С - 30 с, 59°С - 30 с, 72°С - 1 мин); 72°С в течение 7 минут.
Продукт амплификации расщепляют ферментами рестрикции NcoI и XhoI в реакционной смеси, содержащей 10 мМ Трис-HCl, рН 8,6, 10 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT, 0,1 мг/мл BSA и по 20 ед. активности соответствующих ферментов. Реакцию проводят в течение 2 часов при 37°С, заключительная стадия - 20 минут при 65°С.
Обработку ДНК векторной плазмиды pET-19b (Novagen) проводят рестриктазами NcoI и XhoI в аналогичных условиях, после чего дефосфорилируют щелочной фосфатазой CIP (NEB, США) в течение 1 часа при 37°С.
Далее ПЦР-фрагмент и линеаризованный вектор очищают электрофоретически в 1% агарозном геле с последующим выделением ДНК набором QIAquick™ Gel Extraction Kit (Quiagen, США) в соответствии с рекомендациями производителя.
Лигирование проводят в стандартном буфере. Полученной лигазной смесью трансформируют клетки Escherichia coli XL1Blue. С помощью полимеразной цепной реакции отбирают клоны, содержащие вставку нужного размера. Полученную таким образом целевую плазмиду обозначают как pET19b-SAV. Схема плазмидной ДНК pET19b-SAV представлена на Фиг. 1.
Последовательность клонированных фрагментов подтверждена секвенированием Фиг. 2.
Пример 2 Получение штамма Е. coli BL21-Codon Plus(DE3)/pET19b-SAV и экспрессия полноразмерного стрептавидина.
Клетки Е. coli BL21-Codon Plus(DE3) трансформируют плазмидой pET19b-SAV, инкубируют в колбах при активном перемешивании в LB среде с добавлением 200 мМ ампициллина при температуре 37°С до оптической плотности Е600 нм = 1,9-2,0 и добавляют индуктор изопропил-β-D-тио-галактопиранозид (ИПТГ) до концентрации 1 мМ. Через 4 ч клетки осаждают центрифугированием. Осадок ресуспендируют в PBS буфере (0,15 М NaCl, 0,05 М K-Na- фосфатный буфер, рН 7,0) и разрушают клетки с помощью ультразвукового дезинтегратора (5 раз по 20 с) на ледяной бане. Полученную суспензию центрифугируют при 10000 g, супернатант представляет собой фракцию цитоплазматических белков. Концентрацию стрептавидина определяют колориметрически, где в качестве красителя используют 4-гидроксиазобензол-2-карбоновую кислоту (НАВА) [10].
Очистку стрептавидина из цитоплазматической фракции проводят с использованием 2-иминобиотинагарозы ("Sigma"). В колонку с гелем 2-иминобиотинагарозы, уравновешенную буфером для хроматографии (1 М NaCl, 0,1 М K-Na- фосфатный буфер, рН 7,0), вносят цитоплазматическую фракцию, промывают тем же буфером, удаляя все цитоплазматические белки. Элюцию стрептавидина ведут буфером, содержащим 50 мМ СН3СООН, рН 4,0. Элюированный стрептавидин быстро переводят в буфер 5 мМ Tris-HCl, рН 7,5, содержащий 0,01% NaN3 в ячейке для ультрафильтрации на мембране Amicon® Ultra 10K. Состав белков во фракциях при получении стрептавидина и чистоту препарата анализировали с помощью гель-электрофореза (Фиг. 3а и 3б соответственно). Данные гель-электрофореза подтверждают, что белок получен в высокоочищенном состоянии.
Пример 3 Демонстрация применения полученного стрептавидина в качестве биоспецифического мостика между биотинилированными молекулами бычьего сывороточного альбумина (BSA-Bio), сорбированного на поверхности иммунологического микропланшета, и Са2+-регулируемого фотопротеина обелина (Bio-Obe).
В лунки планшета вносили по 0,1 мл раствора биотинилированного BSA с концентрацией 100, 33,3; 11,1; 3,7; 1,2; 0,41; 0,14; 0 нг/мл (в PBS) и инкубировали 12 ч при 4°С. После промывки (трижды, PBS, 0,1% Tween20, 5 мМ ЭДТА) блокировали не занятые места на поверхности 1% раствором BSA в PBS буфере (1 час при 37°С). После промывки в лунки вносили по 0,1 мл раствора стрептавидина (в PBS, 5 мкг/мл), инкубировали в течение часа при 37°С и встряхивании (350 об/мин). После очередной промывки в лунки вносили по 0,1 мл раствора биотинилированного обелина (0,2 мкг/мл) в 20 мМ Трис-HCl, рН 7,0, 0,15 М NaCl, 5 мМ ЭДТА. Инкубировали планшет в течение часа при 23°С, 350 об/мин, затем тщательно промывали. Биолюминесцентный сигнал связавшегося биотинилированного обелина измеряли с помощью планшетного люминометра Mithras LB 940 (Berthold, Германия) сразу после впрыска 0,1 мл раствора СаСl2 (0,1 М СаСl2, 0,1 М Трис-HCl, рН 8,8) в течение 2,5 с. Функциональная активность полученного препарата стрептавидина подтверждается значением величины биолюминесцентного сигнала в зависимости от концентрации BSA-Bio (фигура 4).
Таким образом, впервые получены плазмидная ДНК pET19b-SAV, содержащая ген полноразмерного белка стрептавидина, и штамм бактерий E. coli - продуцент функционально активного полноразмерного белка стрептавидина в цитоплазматическом растворе.
ЛИТЕРАТУРА
1. Suter, М. Isolation and characterization of highly purified streptavidin obtained in a two-step purification procedure from Streptomyces avidinii grown in a synthetic medium J. lmmunol / Suter, J. Cazin, Jr. J.E. Butler, D.M. Mock // Methods. 1988. V. 113. P. 83-91
2.  C.E. Molecular cloning and nucleotide sequence of the streptavidin gene / C.E.
C.E. Molecular cloning and nucleotide sequence of the streptavidin gene / C.E.  I.D. Kuntz, S. Birken, R. Axel, C.R. Cantor // Nucleic Acids Res. - 1986 - Vol. 14(4). - P. 1871-1882
I.D. Kuntz, S. Birken, R. Axel, C.R. Cantor // Nucleic Acids Res. - 1986 - Vol. 14(4). - P. 1871-1882
3. Sano, T. Molecular cloning and nucleotide sequence of the streptavidin gene / T. Sano, C. Cantor // Proc. Natl. Acad. Sci. - 1990 - Vol. 87. - P. 142-146
4 Jouybari, R.M. / Production of recombinant streptavidin and optimization of refolding conditions for recovery of biological activity // R.M. Jouybari, A. Sadeghi, B. Khansarinejad, S.S. Abbasian, H. Abtahi.. Reports of Biochemistry & Molecular Biology. - 2018 - Vol. 6, No. 2, - P. 178-185
5 Gallizia, A. Production of a soluble and functional recombinant streptavidin in Escherichia coli / A. Gallizia, C. Lalla, E. Nardone, P. Santambrogio, A. Brandazza, A. Sidoli, P. Arosio // Protein expression and purification. - 1998 - Vol. 14, - P. - 192-196.
6. Le Trong, I. Crystallographic analysis of a full-length streptavidin with its C-terminal polypeptide bound in the biotin binding site / I. Le Trong, N. Humbert, T.R. Ward, R.E. Stenkamp // J. Mol. Biol. - 2006 - Vol. 356, No. 3. - P. - 738-745.
7. Humbert, N. Electrophoretic behavior of streptavidin complexed to a biotinylated probe: a functional screening assay for biotin-binding proteins / N. Humbert, A. Zocchi, T.R. Ward // Electrophoresis. - 2005 - Vol. 26, - P. - 47-52.
8 Патент РФ №2153535, опубликовано 27.07.2000, бюл. №21
9 Вейко, И.П. Клонирование гена стрептавидина из Streptomyces avidinii и его экспрессия в Escherichia coli. Секреция стрептавидина клетками Е. Coli // И.П. Вейко, Л.Б. Гулько, Л.В. Окорокова, Н.А. Дьяков, В.Г. Дебабов // Биоорган, химия. - 1999 - Т. 25(3). С. 184-188.
10 Green, N.M. Avidin and streptavidin / N.M. Green // Methods Enzymol. - 1990 - Vol. 184. - P. 51-67.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Federal Research Center “Krasnoyarsk Science Center” of the Siberian Branch of the Russian Academy of Sciences
<120>
<140>
<141> Рекомбинантная плазмидная ДНК pET19b-SAV, обеспечивающая синтез полноразмерного белка стрептавидина Streptomyces avidinii, штамм бактерий Escherichia coli - продуцент растворимого полноразмерного белка стрептавидина Streptomyces avidinii
RU 2019124913
2019-08-05
<160> Номер SEQ ID NO 1
<210> 1
<211> 483
<212> DNA
<213> Streptomyces avidinii
<400> 1
atg gac ccc tcc aag gac tcg aag gcc cag gtc tcg gcc gcc gag 45
Met Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu
1 5 10 15
gcc ggc atc acc ggc acc tgg tac aac cag ctc ggc tcg acc ttc 90
Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
20 25 30
atc gtg acc gcg ggc gcc gac ggc gcc ctg acc gga acc tac gag 135
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Glu
35 40 45
tcg gcc gtc ggc aac gcc gag agc cgc tac gtc ctg acc ggt cgt 180
Ser Ala Val Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg
50 55 60
tac gac agc ggc ccg gcc acc gac ggc agc ggc acc gcc ctc ggt 225
Tyr Asp Ser Gly Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly
65 70 75
tgg acg gtg gcc tgg aag aat aac tac cgc aac gcc cac tcc gcg 270
Trp Thr Val Ala Trp Arg Asn Asn Tyr Arg Asn Ala His Ser Ala
80 85 90
acc acg tgg agc ggc cag tac gtc ggc ggc gcc gag gcg agg atc 315
Thr Thr Trp Ser Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile
95 100 105
aac acc cag tgg ctg ctg acc tcc ggc acc acc gag gcc aac gcc 360
Asn Thr Gln Trp Leu Leu Thr Ser Gly Thr Thr Glu Ala Asn Ala
110 115 120
tgg aag tcc acg ctg gtc ggc cac gac acc ttc acc aag gtg aag 405
Trp Lys Ser Thr Leu Val Gly His Asp Thr Phe Thr Lys Val Lys
125 130 135
ccg tcc gcc gcc tcc atc gac gcg gcg aag aag gcc ggc gtc aac 450
Pro Ser Ala Ala Ser Ile Asp Ala Ala Lys Lys Ala Gly Val Asn
140 145 150
aac ggc aac ccg ctc gac gcc gtt cag cag tag 483
Asn Gly Asn Pro Leu Asp Ala Val Gln Gln Am*
155 160
<---