Результат интеллектуальной деятельности: КОМПОЗИЦИЯ ТАБЛЕТКИ ЛЕНАЛИДОМИДА ДЛЯ ПЕРОРАЛЬНОГО ПРИЕМА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее раскрытие относится к композиции таблетки для перорального приема, включающей леналидомид, и способу ее получения. Более конкретно, настоящее раскрытие относится к композиции таблеточного типа и способу ее получения, где композиция демонстрирует физико-химическую эквивалентность с препаратами леналидомида в виде твердых капсул, обладает таким же фармакологическим, терапевтическим эффектом в доклинических исследованиях и исследованиях биоэквивалентности, а также более удобна для приема, имеет улучшенные свойства обрабатываемости, безопасности и т.п.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Множественная миелома представляет собой гематологическое злокачественное образование, характеризующееся аномальной дифференциацией и пролиферацией плазматических клеток. Эти аномальные плазматические клетки называются клетками миеломы. Клетки миеломы образуют опухоли, расплавляют кость, вызывая боль и переломы, и поражают костный мозг, снижая уровень лейкоцитов, эритроцитов и тромбоцитов, и тем самым увеличивают риск анемии, инфекции и кровотечения. Кроме того, клетки миеломы продуцируют белок М, аномальный иммунный белок, который вызывает сгущение крови и приводит к синдрому гипервязкости или повреждению почек. В основном это вызывается у мужчин (особенно у чернокожих), у людей старше 65 лет, и в последнее время заболеваемость постепенно увеличивается в Корее. Основными лекарственными средствами при множественной миеломы являются бортезомиб, талидомид и леналидомид. На рынке постоянно увеличивается доля бортезомиба, который является препаратом для инъекций. В случае пероральных лекарственных средств, леналидомид используют значительно чаще, чем талидомид, и его доля на рынке быстро увеличивается.
Леналидомид является препаратом талидомида следующего поколения, и он обладает лучшим терапевтическим эффектом благодаря более сильным противораковым свойствам и иммуномодулирующей способности. Были сообщения о том, что комбинация леналидомида и дексаметазона у пациентов с рецидивами или рефрактерным заболеванием значительно улучшила время безрецидивной выживаемости 13,4 месяца и общую выживаемость 38 месяцев. Побочные эффекты талидомида, такие как периферическая невропатия, практически устранены. Хотя стал более серьезным такой побочный эффект, как подавление костного мозга, известно, что при введении фактора, стимулирующего лейкоциты, больших проблем не возникает. Благодаря этим преимуществам доля леналидомида на рынке стремительно растет.
Леналидомид был разработан компанией Celgene в форме капсулы для перорального приема и доступен в свободной продаже в дозах 25, 20, 15, 10, 7,5, 5 и 2,5 мг. Торговое название препарата в Корее - капсулы Revlimid®, и он содержит леналидомид гемигидрат. Капсулы Revlimid®, которые представляют собой твердые капсульные препараты, упакованы в виде капсул размера 0 во всех случаях композиций 25, 20, 15 и 10 мг. Большая ось составляет около 2,17 см, которая является значительно длинной и объемной. Поэтому пациентам может показаться несколько неудобным их прием, особенно пожилым пациентам. Кроме того, даже при приеме с водой капсула может прилипать к горлу или пищеводу во время глотания. В этом случае капсулу нельзя оттуда отделить, даже если пациент пьет большое количество воды. Если лекарственное средство случайно высвобождается из капсулы, это может вызвать боль, а в некоторых случаях может вызвать воспаление. Если разработать форму таблетки, имеющей небольшую длину и небольшой объем, проблемы, вызываемые неудобными и объемными капсулами, могут быть решены, и, таким образом, пациенту легче будет принимать лекарственное средство. То есть недостатки капсул можно преодолеть.
В конце 1950-х и 1960-х талидомид использовали в качестве антиноцицептивного средства для беременных женщин, но были трагические события, когда рождались десятки тысяч уродливых детей по всему миру из-за побочных эффектов неожиданной тератогенности. Леналидомид, как и талидомид, имеет побочные эффекты тератогенности, поэтому он запрещен для введения или лечения беременной женщины, женщины детородного возраста или женщины, которая может забеременеть. Для предотвращения такого побочного эффекта, толстая желатиновая капсула окружает лекарственное средство, когда его получают в виде капсулы, поэтому можно считать, что безопасное покрытие обеспечено. Однако в случае таблеток (особенно таблеток без покрытия) лекарственное средство непосредственно присутствует на поверхности таблеток, и существует вероятность того, что таблетки могут действовать на тех, кто занимается их обработкой, не имеющих отношения к использованию. Если пациент принимает дробную дозу, отделяемую вдоль разделительной линии на таблетке, или если таблетка ломается во время вынимания ее из упаковки PTP из-за ломкости, или если она рассыпается из-за рыхлости, существует риск воздействия лекарственного средства на лицо, осуществляющее манипуляции с таблеткой, и окружающих людей. Если таблетки покрыты оболочкой, существует также риск воздействия на лицо, осуществляющее манипуляции с таблеткой, и окружающих людей, поскольку покрытие не нанесено в достаточном количестве из-за низкой доли покрытия, так что лекарственное средство остается незащищенным на некоторых или многих частях таблетки, или лекарственное средство присутствует на поверхности слоя покрытия, потому что лекарственное средство непрерывно выделялось в процессе нанесения покрытия.
Следовательно, в отличие от обычного случая, необходима таблетка с покрытием, в которой нанесено достаточное количество покрывающих агентов, чтобы полностью покрыть таблетку, чтобы не только целая таблетка была защищена покрытием сверх определенной толщины или более, но также покрытие могло полностью защитить лекарственное средство от оператора или т.п.
В то же время, может потребоваться разработать и изготовить лекарственное средство таким образом, чтобы оно имело такую же скорость высвобождения лекарственного средства и паттерн высвобождения, как у коммерчески доступных капсул, которые прошли клинические испытания. Для этой цели важно выбрать оптимальное давление покрытия, чтобы установить подходящий диапазон твердости, выбрать подходящие покрывающие агенты и разработать систему покрытия так, чтобы обеспечить подходящую долю покрытия и подобный паттерн растворения. Может возникнуть необходимость не только обеспечить in vitro физико-химическую эквивалентность в средах для растворения с широким диапазоном pH, но также представить эквивалентность in vivo в фармакокинетических испытаниях биологической эквивалентности на людях, а также в доклинических исследованиях на лабораторных животных.
СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, КОТОРЫЕ ДОЛЖНЫ БЫТЬ РЕШЕНЫ
Целью настоящего раскрытия является обеспечение композиции таблетки и способа ее получения путем изменения лекарственной формы коммерчески доступных препаратов леналидомида в виде твердых капсул на таблетку, которую легко принимать из-за малой длины и небольшого объема, при этом лекарственное средство защищено от непосредственного контакта с лицом, осуществляющим манипуляции с таблеткой, посредством полной упаковки всей таблетки на определенную толщину путем подходящего выбора агента покрытия и толщины покрытия, и можно предотвратить вытекание лекарственного средства во время процесса нанесения покрытия. Настоящее раскрытие также обеспечивает композицию таблетки и способ ее получения, где паттерн растворения эквивалентен паттерну растворения в капсулах, и, таким образом, композиция таблетки демонстрирует эквивалентность в испытаниях in vivo на лабораторных животных и испытаниях на биоэквивалентность, а также на физико-химическую эквивалентность в сравнительных испытаниях на растворение. Таким образом, настоящее раскрытие обеспечивает композицию таблетки и способ ее получения, где композиция таблетки обладает такой же фармакологической эффективностью и эффектом, как у коммерчески доступных препаратов в форме капсул, и является даже еще более совершенной и улучшенной, что касается ее внешнего вида, удобства приема и обработки, простоты изготовления, безопасности и т.п.
ТЕХНИЧЕСКИЕ СРЕДСТВА ДЛЯ РЕШЕНИЯ ЗАДАЧ
Определение терминов
Если прямо не указано иное, некоторые термины, используемые в настоящем описании, можно определить следующим образом.
Если контекст явно не указывает на обратое, в настоящем описании термин ʺвключающийʺ или ʺсодержащийʺ означает, что любой элемент (или компонент) включен без специальных ограничений, и не должен рассматриваться как исключение какого-либо другого элемента (или компонента). Также, ʺленалидомидʺ может представлять собой леналидомид в форме основания (лекарственное вещество в форме основания, без соли) или его фармацевтически приемлемую соль или изомер или их смеси. В каждом случае он также может быть в форме различных гидратов, и в каждом случае он может быть в различных кристаллических формах. Например, это могут быть различные гидраты, такие как леналидомид ангидрид, полугидрат, моногидрат, дигидрат и тригидрат и т.д., различные сольваты или их смеси.
Кроме того, термин ʺмикронизированныйʺ означает, что он измельчен в порошок до очень малого размера, например, средний диаметр измеряется в микрометрах или нанометрах.
Для решения вышеуказанных задач, настоящее раскрытие обеспечивает композицию таблетки для перорального приема, включающую леналидомид в качестве активного ингредиента, и по меньшей мере один фармацевтически приемлемый носитель. Более конкретно, настоящее раскрытие обеспечивает композицию таблетки для перорального приема, где на поверхность непокрытой таблетки нанесен покрывающий агент.
В одном варианте осуществления настоящего раскрытия композиция таблетки для перорального приема может включать леналидомид в качестве активного ингредиента; разбавитель, выбранный из группы, включающей сахара, сахарные спирты, целлюлозы, крахмалы, неорганические соли и их смеси; разрыхлитель, выбранный из группы, включающей набухающий разрыхлитель, смачиваемый разрыхлитель и их смеси; и смазывающее вещество, выбранное из группы, включающей растворимое смазывающее вещество, нерастворимое смазывающее вещество и их смеси; где AUC (площадь под кривой) составляет от 140 до 7100 нг⋅час/мл и Cmax составляет от 42 до 2100 нг/мл, но может не ограничиваться этим.
В одном варианте осуществления настоящего раскрытия скорость растворения композиции таблетки для перорального приема может составлять от 1 до 50% при измерении через 2,5 минут в 900 мл среды для растворения с pH 1,2 способом с использованием лопастной мешалки при скорости 50 об/мин., но может не ограничиваться этим.
В одном варианте осуществления настоящего раскрытия скорость растворения композиции таблетки для перорального приема может составлять от 10 до 95% при измерении через 5 минут в 900 мл среды для растворения с pH 1,2 способом с использованием лопастной мешалки при скорости 50 об/мин., но может не ограничиваться этим.
В одном варианте осуществления настоящего раскрытия время разложения композиции таблетки для перорального приема в буферном растворе с рН 1,2 может составлять от 1 до 20 минут, но может не ограничиваться этим.
В одном варианте осуществления настоящего раскрытия твердость композиции таблетки для перорального приема может составлять от 10 N до 300 N, и истираемость может составлять менее чем 2%, но может не ограничиваться этим.
В одном варианте осуществления настоящего раскрытия слой покрытия композиции таблетки для перорального приема может представлять собой больше, чем один слой, и/или общая толщина слоя покрытия может составлять по меньшей мере 1 мкм, но может не ограничиваться этим.
В одном варианте осуществления настоящего раскрытия композиция таблетки для перорального приема может включать от 0,5 до 200 массовых частей разбавителя, 0,02-10 массовых частей разрыхлителя и/или 0,005-3,5 массовых частей смазывающего вещества на 1 массовую часть леналидомида, но может не ограничиваться этим.
В одном варианте осуществления настоящего раскрытия объем таблетки может быть меньше объема капсулы размера 0, но может не ограничиваться этим.
Настоящее раскрытие также обеспечивает способ получения композиции таблетки для перорального приема, включающий смешивание леналидомида в качестве активного ингредиента и по меньшей мере одного фармацевтически приемлемого носителя; прессование смеси для получения таблетки перед нанесением покрытия (таблетки без покрытия); и покрытие поверхности таблетки без покрытия покрывающим агентом.
В настоящем раскрытии леналидомид можно использовать в микронизированной форме. Средний размер частиц (×50) микронизированного леналидомида может быть, например, меньше чем 100 мкм, предпочтительно меньше чем 50 мкм, более предпочтительно меньше чем 30 мкм, и еще более предпочтительно меньше чем 15 мкм. Кроме того, средний размер частиц (×50) микронизированного леналидомида может составлять, например, по меньшей мере 0,1 мкм, предпочтительно по меньшей мере 0,2 мкм, более предпочтительно по меньшей мере 0,5 мкм, еще более предпочтительно по меньшей мере 1 мкм. Если средний размер частиц леналидомида не входит в вышеуказанный диапазон, скорость растворения может быть снижена или процесс может быть затруднен. Средний размер частиц (×50) означает размер частиц, соответствующий 50% по массе в кривой распределения частиц по размерам, который может быть измерен с использованием, например, анализатора размера частиц методом дифракции света.
В композиции таблетки по настоящему изобретению фармацевтически приемлемый носитель, включенный в таблетку без покрытия, может быть, например, по меньшей мере одним, выбранным из разбавителя, разрыхлителя и смазывающего вещества.
В одном варианте осуществления настоящего изобретения разбавитель может быть выбран из группы, включающей сахара, сахарные спирты, целлюлозы, крахмалы, неорганические соли и их смеси.
В одном варианте осуществления настоящего изобретения разрыхлитель может быть выбран из группы, включающей набухающий разрыхлитель, смачиваемый разрыхлитель и их смеси.
Указанный сахар является понятием, охватывающим моносахариды, полисахариды и их фармацевтически приемлемые производные; крахмал является понятием, охватывающим крахмалы и их фармацевтически приемлемые производные; и целлюлоза является понятием, охватывающим целлюлозы и их фармацевтически приемлемые производные, которые должны быть известны и доступны специалистам в данной области, но конкретно не ограничиваются конкретным компонентом.
Указанный разбавитель может представлять собой, например, по меньшей мере один, выбранный из группы, включающей лактозу (либо ангидрид, либо гидрат, например, моногидрат), порошкобразную целлюлозу, микрокристаллическую целлюлозу, силикатизированную микрокристаллическую целлюлозу, крахмал, желатинизированный крахмал, карбонат кальция, циклодекстрин, сульфат кальция, силикат кальция, карбонат магния, дикальцийфосфат, трикальцийфосфат, трисиликат магния, хлорид калия, хлорид натрия, двухосновный фосфат кальция дигидрат, трехосновный фосфат кальция, каолин, карбонат магния, оксид магния, маннит, мальтит, сорбит, ксилит, лактозу, декстрозу, мальтозу, сахарозу, глюкозу, фруктозу, мальтодекстрин, декстраты, декстрин и их смеси. Однако он может не ограничиваться этим. Предпочтительно, могут быть выбраны лактоза, микрокристаллическая целлюлоза, маннит, крахмал или их смеси. Наиболее предпочтительно, могут быть выбраны смесь лактозы и микрокристаллической целлюлозы. Разбавитель также может действовать как связующее вещество.
В одном варианте осуществления настоящего изобретения можно использовать 0,5-200 массовых частей, предпочтительно 1-100 массовых частей, более предпочтительно 2-50 массовых частей, еще более предпочтительно 3-30 массовых частей, еще более предпочтительно 4-20 массовых частей разбавителя на 1 массовую часть леналидомида. Если количество используемого разбавителя намного меньше указанного диапазона, получить таблетки будет сложно. С другой стороны, если разбавитель используют в количестве, превышающем вышеуказанный диапазон, концентрация лекарственного вещества может быть снижена, поэтому может возникнуть проблема с обеспечением однородности содержимого при получении таблеток.
Указанный разрыхлитель, например, можно выбрать из группы, включающей крахмал, целлюлозу, сшитый полимер, смолы, полисахариды и их смеси. Например, он может представлять собой по меньшей мере одно вещество, выбранное из группы, включающей натрийкроскармеллозу (CrosCMC-Na), карбоксиметилцеллюлозу, кросповидон (сшитый поливинилпирролидон), гидроксипропилцеллюлозу с низкой степенью замещения (L-HPC), крахмал (пшеничный, рисовый, кукурузаный или картофельный крахмал), натрий карбоксиметилкрахмал, натрий крахмалгликонат, альгиновую кислоту, натрий карбоксиметилцеллюлозу, агар, ксилан, геллановую камедь, ксантановую камедь, частично гидролизованный крахмал и их смеси. Однако он может не ограничиваться этим. Предпочтительно, разрыхлитель может представлять собой натрий кроскармеллозу, кросповидон, гидроксипропилцеллюлозу с низкой степенью замещения (L-HPC) или натрий крахмалгликонат. Более предпочтительно, разрыхлитель может представлять собой натрий кроскармеллозу.
В одном варианте осуществления настоящего изобретения можно использовать 0,02-10 массовых частей, предпочтительно 0,05-5 массовых частей, более предпочтительно 0,1-2,5 массовых частей, еще более предпочтительно 0,15-1,5 массовых частей, даже более предпочтительно 0,2-1 массовую часть разрыхлителя на 1 массовую часть леналидомида. Если количество используемого разрыхлителя намного меньше указанного диапазона, может быть проблема замедления скорости растворения из-за замедления скорости дезинтеграции. С другой стороны, если разрыхлитель используют в количестве, превышающем вышеуказанный диапазон, может быть проблема с производительностью, такая как невозможность прессования или нанесения покрытия.
В одном варианте осуществления настоящего изобретения смазывающее вещество может быть выбрано из группы, включающей растворимое смазывающее вещество, нерастворимое смазывающее вещество и их смеси.
Указанное смазывающее вещество является понятием, охватывающим смазывающее вещество, антиадгезив и вещество, способствующее скольжению. Например, смазывающее вещество может представлять собой по меньшей мере одно вещество, выбранное из группы, включающей стеарат магния, фумаровую кислоту, стеариновую кислоту, стеарат кальция, стеарилфумарат натрия, сложный эфир сахарозы и жирных кислот, крахмал (пшеничный, рисовый, кукурузаный или картофельный крахмал), тальк, высокодисперсный (коллоидный) диоксид кремния, оксид магния, карбонат магния, глицерилбегенат, глицерилмоностеарат, диоксид кремния, силикат кальция, силикат магния, отвержденное растительное масло, отвержденное парафиновое масло, полиэтиленгликоль, лаурилсульфат натрия, лаурилсульфат магния, бензоат натрия, полиоксиэтиленмоностеарат, глицерилтриацетат, монолаурат сахарозы и их смеси, но может не ограничиваться этим. Предпочтительно, смазывающее вещество может представлять собой стеарат магния, стеариновую кислоту или высокодисперсный (коллоидный) диоксид кремния. Более предпочтительно, смазывающее вещество может представлять собой стеарат магния.
В одном варианте осуществления настоящего изобретения можно использовать 0,005-3,5 массовых частей, предпочтительно 0,015-2,0 массовых частей, более предпочтительно 0,03-0,75 массовая часть, еще более предпочтительно 0,05-0,5 массовых частей, даже более предпочтительно 0,1-0,35 массовых частей смазывающего вещества на 1 массовую часть леналидомида. Если количество используемого смазывающего вещества намного меньше указанного диапазона, может быть проблема с производительностью, такая как невозможность прессования. С другой стороны, если смазывающее вещество используют в количестве, превышающем вышеуказанный диапазон, может быть проблема замедления растворения или проблема с производительностью.
Покрывающий агент может представлять собой гидрофильный полимер, например, по меньшей мере один, выбранный из группы, включающей гидроксипропилметилцеллюлозу (HPMC), поливиниловый спирт (PVA), привитый сополимер поливинилового спирта Macrogol, полимер акриловой кислоты и ее соли, полиметакрилат, сополимер поли(бутилметакрилата, 2-диметиламиноэтилметакрилата, метилметакрилата) (например, Eudragit® E, Evonik), карбоксиметилцеллюлозу (натриевые соли и кальциевые соли), этилцеллюлозу, метилцеллюлозу, гидроксиэтилцеллюлозу, этилгидроксиэтилцеллюлозу, гидроксипропилцеллюлозу (HPC), L-HPC (HPC с низкой степенью замещения), поливинилпирролидон (PVP), винилпирролидон-винилацетатный сополимер (например, Kollidon® VA64, BASF), желатин, гуаровую камедь, частично гидролизованный крахмал, альгинат, ксантан и их смеси. Однако он может не ограничиваться этим.
Предпочтительно, покрывающий агент может представлять собой гидроксипропилметилцеллюлозу (HPMC), поливиниловый спирт (PVA), привитый сополимер поливинилового спирта Macrogol, сополимер поли(бутилметакрилата, 2-диметиламиноэтилметакрилата, метилметакрилата) (например, Eudragit® E, Evonik).
В одном варианте осуществления настоящего изобретения можно использовать 1-30 массовых частей, предпочтительно 2-25 массовых частей, более предпочтительно 3-20 массовых частей, еще более предпочтительно 4-15 массовых частей, даже более предпочтительно 5-15 массовых частей и наиболее предпочтительно 6-15 массовых частей смазывающего вещества на 100 массовых частей таблетки без покрытия. Если количество используемого гидрофильного полимера намного меньше указанного диапазона, может быть проблема с тем, что таблетка без покрытия не покрывается полностью покрывающим агентом. С другой стороны, если гидрофильный полимер используют в количестве, превышающем вышеуказанный диапазон, может чрезмерно замедляться скорость растворения.
После разрезания таблетки пополам толщину слоя покрытия можно измерить при помощи сканирующего электронного микроскопа (SEM) или т.п. В этот момент предпочтительно, чтобы вся поверхность таблетки была равномерно покрыта определенной толщиной, и среднюю толщину можно определить путем измерения 5 или более таблеток и нахождения среднего значения. При наблюдении поперечного разреза, средняя толщина слоя покрытия может составлять по меньшей мере 1 мкм и не больше чем 300 мкм. Более предпочтительно, она может составлять по меньшей мере 3 мкм и не больше чем 275 мкм. Еще более предпочтительно, она может составлять по меньшей мере 5 мкм и не больше чем 250 мкм. Еще более предпочтительно, она может составлять по меньшей мере 7 мкм и не больше чем 225 мкм. Еще более предпочтительно, она может составлять по меньшей мере 10 мкм и не больше чем 200 мкм. Еще более предпочтительно, она может составлять по меньшей мере 15 мкм и не больше чем 180 мкм. Наиболее предпочтительно, она может составлять по меньшей мере 20 мкм и не больше чем 150 мкм. Если средняя толщина слоя покрытия меньше указанного диапазона, затруднительно равномерно покрыть таблетку полностью, и во время обработки может образоваться пыль. Если средняя толщина слоя покрытия толще, чем вышеуказанный диапазон, достижение желаемой цели может стать невозможным по причине замедления растворения, чрезмерного времени процесса и т.п.
Когда слой покрытия образован в виде одного слоя, можно смешать и использовать один или несколько покрывающих агентов, и всю таблетку покрыть достаточным количеством покрывающего агента, чтобы образовать слой покрытия. Слой покрытия предпочтительно может быть двойным слоем или содержать больше слоев. Например, в случае покрытия более чем двумя слоями, каждый слой может быть изготовлен из другого покрывающего агента для защиты таблетки от воздействия лекарственного средства, влаги, окисления и тому подобного. В одном варианте осуществления, первичное покрытие гидроксипропилметилцеллюлозой (HPMC) предпочтительно осуществляют для формирования барьера для лекарственного средства, и затем наносят вторичное покрытие привитым сополимером поливинилового спирта Macrogol для окончательного формирования двухслойного покрытия. В одном варианте осуществления первичное покрытие гидроксипропилметилцеллюлозой (HPMC) предпочтительно наносят для формирования барьера для лекарственного средства, и затем наносят вторичное покрытие поливиниловым спиртом (PVA) для формирования влагозащитного барьера с целью окончательного формирования двухслойного покрытия улучшенной функции. Однако покрытие может не ограничиваться этим.
Может быть необходимо тщательно выбрать тип и состав растворителя, используемого для получения покрывающей жидкости, чтобы предотвратить мгновенное растворение лекарственного вещества жидкостью для нанесения покрытия во время нанесения покрытия и его удерживание в слое покрытия. Кроме того, может потребоваться установить такие условия нанесения покрытия, которые позволяют покрывающему раствору быстро высохнуть после нанесения покрытия на таблетку без покрытия. Растворителем для покрытия может быть, но не ограничиваясь этим, этанол, метанол, ацетон, ацетонитрил, тетрагидрофуран, гексан, метиленхлорид, изопропиловый спирт, вода или т.п., или их смеси. Предпочтительно, можно использовать этанол, воду или их смеси. Более предпочтительно, смесь этанола и воды, смесь метиленхлорида и этанола или смесь изопропилового спирта и этанола используют в качестве растворителя для покрытия для формирования первичного покрытия, и затем воду используют в качестве растворителя покрытия для формирования вторичного покрытия.
В процессе получения таблетки с покрытием, как описано выше, могут использоваться различные дополнительные биологически инертные ингредиенты для дополнительной цели повышения эффективности покрытия, стабильности лекарственного средства, улучшения внешнего вида, цвета, защиты, сохранения, связывания, эксплуатационных характеристик и процесса изготовления и т.д.
В одном варианте осуществления настоящего изобретения биологически инертный ингредиент, который может быть дополнительно включен в слой покрытия, может представлять собой по меньшей мере один ингредиент, выбранный из группы, включающей пластификаторы, смазывающие вещества, красители, ароматизаторы, поверхностно-активные вещества, стабилизаторы, антиоксиданты, пенообразователи, пеногасители, парафин и воск и т.д.
Пластификаторы, которые могут быть также включены в слой покрытия, представляют собой, например, по меньшей мере один, выбранный из группы, включающей триэтилцитрат, дибутилфталат, диэтилфталат, дибутилсебацинат, диэтилсебацинат, трибутилцитрат, ацетилтриэтилцитрат, пропиленгликоль, триацетин, полиэтиленгликоль, цетиловый спирт, стеариловый спирт и цетостеариловый спирт, но могут не ограничиваться этим. Пластификатор можно использовать в количестве по меньшей мере 100% масс. (например, 0-100% масс. или 0,1-100% масс.), конкретнее, по меньшей мере 50% масс. (например, 0-50% масс. или 0,1-50% масс.) и более конкретно по меньшей мере 30% масс. (например, 0-30% масс. или 0,1-30% масс.) в расчете на общую сухую массу полимера, используемого для каждого слоя покрытия, но могут не ограничиваться этим.
Смазывающее вещество, которое может быть дополнительно включено в слой покрытия, может представлять собой, например, по меньшей мере одно, выбранное из группы, включающей стеарат магния, фумаровую кислоту, стеариновую кислоту, стеарат кальция, стеарилфумарат натрия, полиэтиленгликоль, крахмал (пшеничный, рисовый, кукурузаный или картофельный крахмал), тальк, высокодисперсный (коллоидный) диоксид кремния, оксид магния, карбонат магния, глицерилбегенат, глицерилмоностеарат, диоксид кремния, силикат кальция, силикат магния и их смеси, но может не ограничиваться этим. Смазывающее вещество можно использовать в количестве по меньшей мере 100% масс. (например, 0-100% масс. или 0,1-100% масс.) в расчете на общую сухую массу полимера, используемого для каждого слоя покрытия, но может не ограничиваться этим.
В одном варианте осуществления настоящего изобретения после отвешивания исходных ингредиентов таблетку можно получить в следующей (необязательном) порядке: гранулирование, смешивание, прессование (таблетирование) и нанесение покрытия. Гранулирование можно осуществить с использованием способа, такого как сухое гранулирование, мокрое гранулирование и т.п.
В одном варианте осуществления настоящего изобретения, в случае способа мокрого гранулирования, гранулы получают путем приготовления раствора связующего, формирования гранул из смеси лекарственного средства и разбавителя и т.д. вместе с раствором связующего, просеивания и сушки. После этого оставшиеся ингредиенты смешивают и затем прессуют. Раствор связующего можно получить путем растворения водорастворимого полимера, такого как гидроксипропилметилцеллюлоза (HPMC), поливиниловый спирт (PVA), гидроксипропилцеллюлоза (HPC), L-HPC (HPC с низкой степенью замещения), поливинилпирролидон (PVP), винилпирролидон-винилацетатный сополимер (например, Kollidon® VA64, BASF), или сахаров или сахарных спиртов, таких как белый сахар, сорбит, мальтит, ксилит и эритрит и т.д., в воде, этаноле или их смеси.
В одном варианте осуществления настоящего изобретения при гранулировании с использованием способа сухой грануляции смесь лекарственного вещества, разбавителя и связующего прессуют при помощи роликового пресса и затем просеивают через сито. После этого оставшиеся ингредиенты смешивают, а затем прессуют.
Прямое прессование вместо грануляции является предпочтительным в упрощенном способе, потому что ингредиенты смешивают и прессуют сразу после отвешивания сырых ингредиентов. Поскольку лекарственное средство как таковое обладает тератогенными побочными эффектами, может возникнуть необходимость в защитном снаряжении в процессе изготовления. Возможно будет целесообразно исключить беременных женщин или женщин, которые могут быть беременными, если это возможно. Кроме того, может быть предпочтительным использовать прямое прессование, при котором воздействие препарата на оператора сводится к минимуму. Однако настоящее раскрытие может не ограничиваться этим.
Когда содержание лекарственного средства в таблетке низкое, важно обеспечить однородность смешивания. Поэтому требуется тщательное внимание для обеспечения однородности смешивания с этапа смешивания. Равномерность смешивания смеси можно улучшить, если лекарственное средство, разбавитель, разрыхлитель и смазывающее вещество и т.д. смешивают последовательно, а не смешивают вместе.
Например, в одном варианте осуществления часть разбавителя смешивают с лекарственным средством, и затем еще добавляют часть разбавителя и смешивают. Затем к этому добавляют оставшуюся часть разбавителя и смешивают, а разрыхлитель и смазывающее вещество добавляют ступенчато, чтобы получить смесь для конечного прессования.
Например, в другом варианте осуществления разрыхлитель сначала смешивают с лекарственным веществом, а затем к этой смеси можно добавить часть разбавителя и снова смешать. Затем добавляют часть разбавителя и снова смешивают, и в завершение добавляют смазывающее вещество, чтобы подготовить смесь для конечного прессования.
Поскольку доза лекарственного средства может варьироваться, может потребоваться установить форму, массу и размер для каждой таблетки и получать ее с использованием соответствующих пуансонов. Для каждой дозы можно использовать один и тот же тип эксципиента. Кроме того, пропорция используемого эксципиента может быть разной или одинаковой относительно каждой дозы. Предпочтительно, при расчете всех доз таблеток, чтобы они имели одинаковые эксципиенты и одинаковые пропорции, количество леналидомида, количество каждого эксципиента и общую массу таблетки можно сделать пропорциональными.
Форма таблетки может варьироваться, как, например, прямоугольник, эллипс, ромб, круг и многоугольник (например, треугольник, четырехугольник, пятиугольник и шестиугольник и т.д.). Форму таблеток можно определить с учетом простоты использования, простоты изготовления пуансона и работы с ним, простоты процесса изготовления, такого как таблетирование, нанесение покрытий, упаковка и обращение, контролируемости паттерна растворения и простоты контроля факторов, связанных с такими свойствами, как твердость, истираемость и разложение таблетки. Кроме того, можно выбрать подходящую форму для каждой дозы.
Общая масса таблетки без покрытия предпочтительно является такой, чтобы средняя масса таблетки не превышала 1100 мг. Более предпочтительно она не может превышать 880 мг, еще более предпочтительно она не может превышать 660 мг, даже более предпочтительно она не может превышать 550 мг, и наиболее предпочтительно она не может превышать 440 мг.
Нижний предел среднего значения общей массы таблетки без покрытия предпочтительно составляет по меньшей мере 5 мг. Более предпочтительно он может быть по меньшей мере 10 мг, еще более предпочтительно он может быть по меньшей мере 20 мг, даже более предпочтительно он может быть по меньшей мере 30 мг, и наиболее предпочтительно он может быть по меньшей мере 40 мг.
Длина самой длинной оси (в случае круглой формы, диаметр) таблетки без покрытия предпочтительно короче, чем длина капсулы № 0, которая составляет 2,17 см. Более предпочтительно она может быть не больше чем 2 см, еще более предпочтительно она может быть не больше чем 1,8 см, и даже более предпочтительно она может быть не больше чем 1,6 см.
Длина самой короткой оси (в случае круглой формы, диаметр) таблетки без покрытия предпочтительно составляет по меньшей мере 1 мм. Более предпочтительно она может быть по меньшей мере 2 мм, еще более предпочтительно она может быть по меньшей мере 3 мм, и даже более предпочтительно она может быть по меньшей мере 4 мм.
Твердость таблетки без покрытия может варьироваться в зависимости от формы, массы и размера таблетки, но максимальная средняя твердость 300N и минимальная средняя твердость 10N являются предпочтительными. Более предпочтительно, максимальная средняя твердость составляет 250N, а минимальная средняя твердость составляет 20N. Более предпочтительно, максимальная средняя твердость составляет 230N, а минимальная средняя твердость составляет 30N. Наиболее предпочтительно, максимальная средняя твердость составляет 210N, а минимальная средняя твердость составляет 40N. Если твердость таблетки без покрытия намного выше указанного диапазона, может возникнуть задержка высвобождения лекарственного средства из-за задержки разложения. С другой стороны, если твердость таблетки без покрытия ниже указанного диапазона, таблетки могут ломаться во время нанесения покрытия, транспортировки, хранения и приема из-за хрупкости.
Вышеуказанная твердость относится к значению, измеренному на большой оси в случае прямоугольной таблетки и т.д., а также относится к средней твердости 6 случайно выбранных таблеток.
В настоящем изобретении истираемость таблетки без покрытия может составлять меньше чем 2%. Более предпочтительно, истираемость может составлять меньше чем 1%. Даже более предпочтительно, истираемость может составлять меньше чем 0,5%.
В настоящем изобретении время разложения таблетки без покрытия может быть одним из важных факторов, которые могут определить время высвобождения лекарственного средства. Следовательно, необходимо иметь надлежащую твердость путем сжатия при соответствующем давлении в процессе таблетирования, чтобы таблетка могла иметь желаемое время разложения, которое может быть фактором, определяющим паттерн растворения таблеток в дополнение к количеству покрывающего агента в процессе нанесения покрытия. Паттерн растворения влияет на абсорбцию в организме. Поэтому важно установить подходящее время разложения, обеспечив соответствующую твердость путем соответствующего давления при таблетировании. Кроме того, паттерн растворения лекарственного средства должен быть одинаковым, даже если доза изменяется. То есть время разложения может быть одинаковым для всех таблеток, имеющих разные дозы.
Время разложения можно измерить в соответствии с испытанием на разложение № 17 из общих методов испытаний Корейской Фармакопеи, десятое издание (KP X), в буферном растворе с pH 1,2, который является первым испытываемым раствором. Время разложения определяют путем измерения 6 таблеток и получением среднего значения. В одном варианте осуществления среднее время разложения таблеток без покрытия составляет 1-20 минут, предпочтительно 1 минуту и 30 секунд - 15 минут, более предпочтительно 2 минуты - 10 минут, еще более предпочтительно 2 минуты 30 секунд - 8 минут, даже более предпочтительно 3 минуты - 6 минут, и наиболее предпочтительно 3 минуты 30 секунд - 5 минут 30 секунд. В настоящем изобретении слой покрытия, образованный на таблетке без покрытия, может представлять собой один слой, двойной слой или включающий больше слоев, более предпочтительно двойной слой или включающий больше слоев.
Растворитель для покрытия может варьироваться. Например, для HPMC покрытия, растворитель может содержать безводный этанол и воду в соотношении от 2:8 до 8:2, или может содержать только воду. Кроме того, например, можно использовать только воду в качестве растворителя для PVA покрытия. Все эти растворители улетучиваются в процессе нанесения покрытия и практически не остаются в конечном продукте.
Таблетки также могут содержать различные добавки для улучшения физических свойств таблеток, производительности, прессуемости, внешнего вида, вкуса и/или стабильности лекарственного средства, и т.п. Такие добавки включают, например, стабилизаторы, солюбилизаторы, подсластители, усилители вкуса, пигменты, смачивающие агенты, наполнители, стабилизаторы, поверхностно-активные вещества, смазывающие вещества, солюбилизаторы, буферы, адсорбенты, усилители вкуса, связующие вещества, суспендирующие агенты, отвердители, антиоксиданты, полирующие вещества, вкусовые агенты, отдушки, покрывающие агенты, смачивающие агенты, регуляторы влажности, наполнители, пеногасители, освежающие агенты, облегчающие жевание агенты, антистатики, красители, сахара, изотонические агенты, мягчители, эмульгаторы, сшивающие агенты, повышающие вязкость агенты, формирующие агенты, регуляторы pH, эксципиенты, диспергирующие агенты, разрыхлители; вещества, придающие водонепроницаемость; антимикробные агенты, консерванты, солюбилизирующие агенты, солюбилизаторы, растворители и флюидизирующие вещества и т.д. Однако они этим не ограничиваются, и можно использовать любые добавки, если они являются фармацевтически приемлемыми. Таблетки с покрытием по настоящему изобретению могут демонстрировать скорость растворения в испытании на растворимость, которая эквивалентна скорости растворения сравнительного препарата в форме капсул. В частности, начальная скорость растворения через 2,5 минут, 5 минут, 10 минут и 15 минут и т.д. является важной в кислых условиях, таких как буферный раствор с pH 1,2.
Испытание на растворимость можно осуществить в соответствии с испытанием на растворимость No. 35 из общих методов испытаний Корейской Фармакопеи, десятое издание (KP X), способом с использованием лопастной мешалки, который является вторым методом, при 50 об./мин при 37°C. Средняя скорость растворения в определенные моменты времени может быть получена путем испытания каждой из шести (6) таблеток и измерения их скорости растворения в каждый момент времени при помощи ВЭЖХ.
Средняя скорость растворения леналидомида из таблетки с покрытием в каждый момент времени может составлять, например, 1-50% через 2,5 минут, 10-95% (или 20-90%) через 5 минут, 40% - 105% через 10 минут или 70% - 105% через 15 минут.
В одном варианте осуществления таблетка с покрытием может иметь среднюю скорость растворения предпочтительно 2-48%, более предпочтительно 5-45% и даже более предпочтительно 10-40% при измерении через 2,5 минуты в 900 мл среды для растворения при pH 1,2 способом с использованием лопастной мешалки при 50 об./мин.
В одном варианте осуществления таблетка с покрытием может иметь скорость растворения предпочтительно 20-90%, более предпочтительно 30-87,5%, еще более предпочтительно 40-85%, и даже более предпочтительно 50-80% при измерении через 5 минут в 900 мл среды для растворения при pH 1,2 способом с использованием лопастной мешалки при 50 об./мин. В одном варианте осуществления таблетка с покрытием может иметь скорость растворения предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 70%, и даже более предпочтительно по меньшей мере 80% при измерении через 10 минут в 900 мл среды для растворения при pH 1,2 способом с использованием лопастной мешалки при 50 об./мин.
В одном варианте осуществления таблетка с покрытием может иметь скорость растворения предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 77,5%, еще более предпочтительно по меньшей мере 80% и даже более предпочтительно по меньшей мере 85% при измерении через 15 минут в 900 мл среды для растворения при pH 1,2 способом с использованием лопастной мешалки при 50 об./мин.
Таблетка с покрытием может иметь значения AUC (площадь под кривой) и Cmax (максимальная концентрация в крови), которые составляют 80-125%, предпочтительно 90-110%, и наиболее предпочтительно 95-105% при сравнении с препаратами в форме капсул в испытании на биоэквивалентность (in vivo PK испытание).
В испытании на биоэквивалентность, проведенном на здоровых взрослых добровольцах (мужчины), AUC (площадь под кривой) в качестве фармакокинетического фактора может составлять 140-7100 нг·час/мл. Она может быть предпочтительно 280-5700 нг·час/мл, более предпочтительно 425-4250 нг·час/мл, еще более предпочтительно 570-2800 нг·час/мл, даже более предпочтительно 700-2100 нг·час/мл, и наиболее предпочтительно 1000-1800 нг·час/мл.
В испытании на биоэквивалентность, проведенном на здоровых взрослых добровольцах (мужчины), Cmax в качестве фармакокинетического фактора может составлять 42-2100 нг/мл. Она может быть предпочтительно 84-1680 нг/мл, более предпочтительно 120-1260 нг/мл, еще более предпочтительно 160-840 нг/мл, даже более предпочтительно 210-630 нг/мл и наиболее предпочтительно 310-525 нг/мл.
Композиция таблетки по настоящему изобретению, описанную выше, можно использовать для тех же целей, что и предыдущие препараты леналидомида, например, для лечения и/или профилактики множественной миеломы, миелодиспластического синдрома и т.п.
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Композиция таблетки, включающая леналидомид, раскрытая в настоящем раскрытии, представляет физико-химическую эквивалентность с препаратами леналидомида в форме твердых капсул, обладает таким же фармакологическим терапевтическим эффектом в доклинических исследованиях и исследованиях биоэквивалентности, а также является улучшенной в том, что касается простоты приема, обращения, безопасности и т.п., и, таким образом, ожидают, что она будет полезной в виде композиции в форме таблетки.
КРАТКОЕ ОБЪЯСНЕНИЕ ЧЕРТЕЖЕЙ
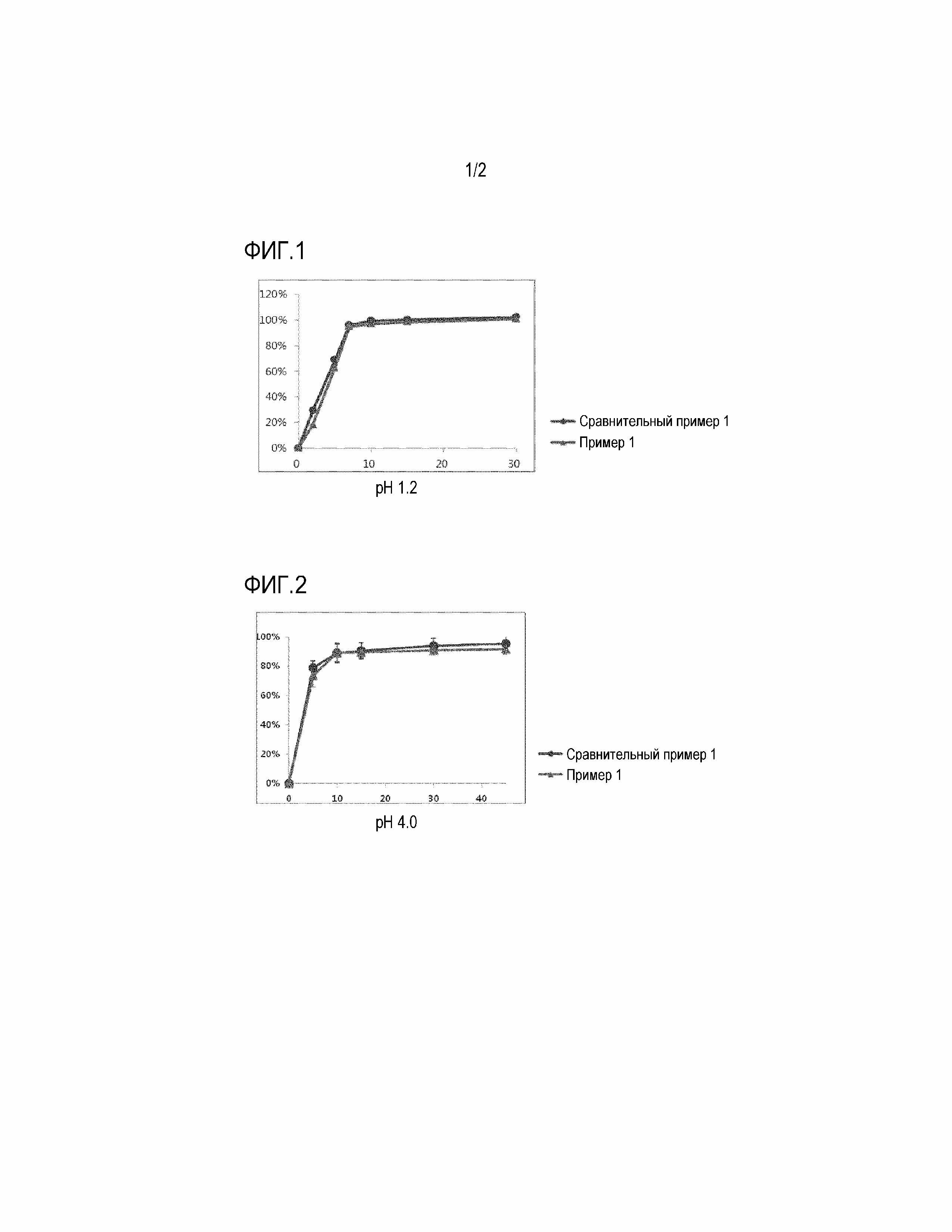
Фиг. 1 представляет график, показывающий результат сравнительного испытания на растворимость с использованием таблетки Примера 1 и препарата Сравнительного Примера 1 в форме капсулы (Revlimid® капсулы) в среде для растворения с pH 1,2.
Фиг. 2 представляет график, показывающий результат сравнительного испытания на растворимость с использованием таблетки Примера 1 и препарата Сравнительного Примера 1 в форме капсулы в среде для растворения с pH 4,0.
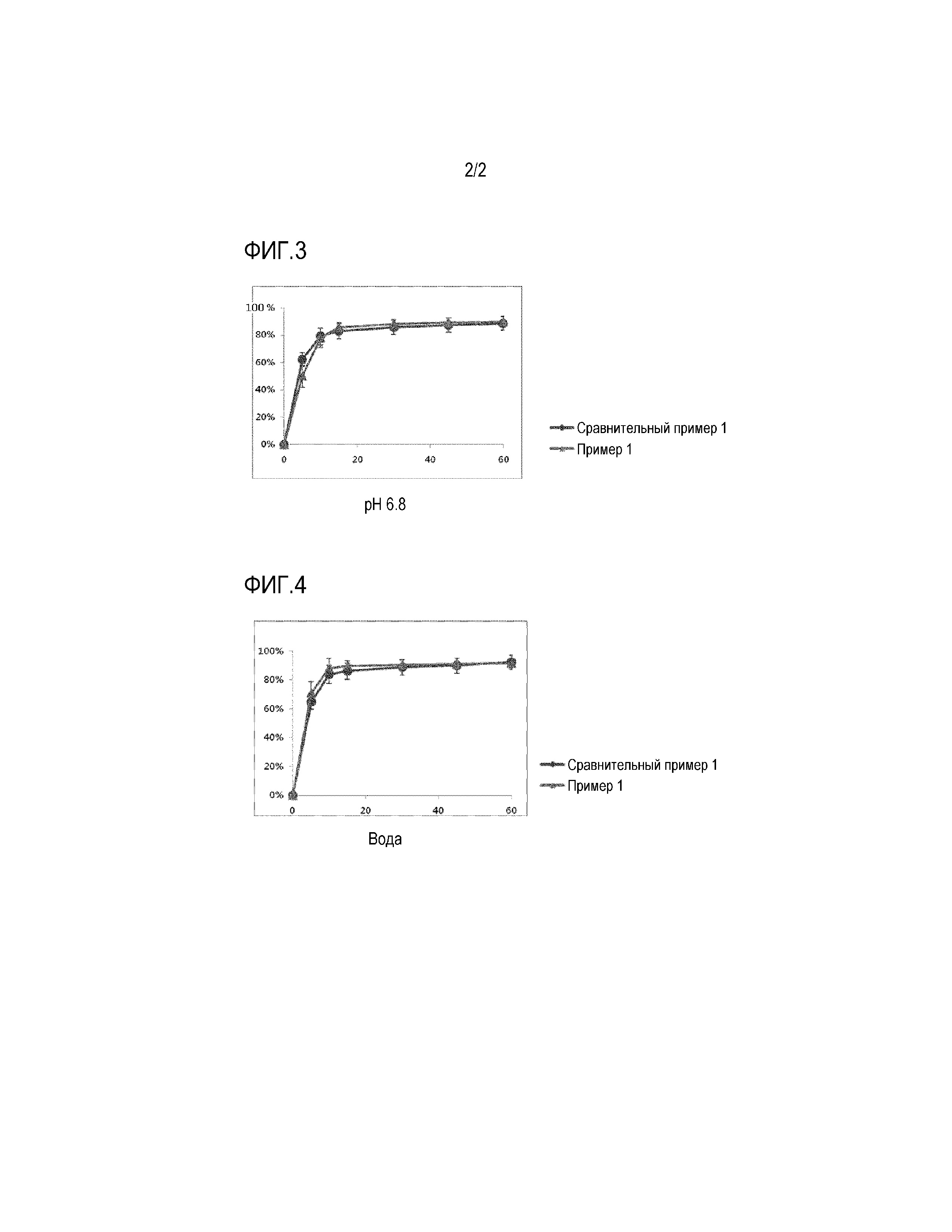
Фиг. 3 представляет график, показывающий результат сравнительного испытания на растворимость с использованием таблетки Примера 1 и препарата Сравнительного Примера 1 в форме капсулы в среде для растворения с pH 6,8.
Фиг. 4 представляет график, показывающий результат сравнительного испытания на растворимость с использованием таблетки Примера 1 и препарата Сравнительного Примера 1 в форме капсулы в воде.
ПОДРОБНОЕ ОПИСАНИЕ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение более подробно объясняется следующими примерами. Однако эти примеры предназначены только для иллюстрации настоящего изобретения, и объем настоящего изобретения никоим образом не ограничивается этими примерами.
Пример 1
<Получение таблеток без покрытия>
5,0 г леналидомида и 40,0 г безводной лактозы просеивали через сито и смешивали. После этого 31,8 г микрокристаллической целлюлозы, 2,4 г натрийкроскармеллозы и 0,8 г стеарата магния просеивали через сито и затем смешивали. Смесь прессовали с использованием продолговатого пуансона, из расчета 400 мг массы на таблетку. Твердость таблетки без покрытия составляла около 155 N.
<Нанесение покрытия на не имеющие покрытия таблетки>
Полученную выше таблетку без покрытия дважды покрывали двумя типами покрывающих агентов в суммарном количестве 7,5% (масс/масс) в расчете на 100% (масс/масс) общей массы таблетки без покрытия. После первичного покрытия (2,5% (масс/масс)) с использованием Opadry®, содержащего HPMC в качестве основного компонента, вторичное покрытие (5% (масс/масс)) осуществляли с Opadry®, содержащим PVA в качестве основного компонента. Рабочие условия для первичного покрытия показаны в Таблице 1 ниже, а рабочие условия для вторичного покрытия показаны в Таблице 2 ниже.
|
Пример 2
<Получение таблеток без покрытия>
5,0 г леналидомида и 40,0 г безводной лактозы просеивали через сито и смешивали. После этого 31,8 г микрокристаллической целлюлозы, 2,4 г натрий кроскармеллозы, 0,4 г стеарата магния, 0,2 г Aerosil и 0,2 г стеариновой кислоты просеивали через сито и затем смешивали. Смесь прессовали с использованием продолговатого пуансона, из расчета 400 мг массы на таблетку. Твердость таблетки без покрытия составляла 150 N.
<Нанесение покрытия на не имеющие покрытия таблетки>
Полученную выше таблетку без покрытия дважды покрывали двумя типами покрывающих агентов в суммарном количестве 6% (масс/масс) в расчете на 100% (масс/масс) общей массы таблетки без покрытия. После первичного покрытия (2% (масс/масс)) с использованием Opadry®, содержащего HPMC в качестве основного компонента, вторичное покрытие (4% (масс/масс)) осуществляли с Opadry®, содержащим привитый сополимер поливинилового спирта Macrogol в качестве основного компонента.
Пример 3
<Получение таблеток без покрытия>
5,0 г леналидомида и 40,0 г высушенного распылением маннита просеивали через сито и смешивали. После этого 31,8 г микрокристаллической целлюлозы, 2,4 г натрийкрахмалгликолята и 0,8 г стеарата кальция просеивали через сито и затем смешивали. Смесь прессовали с использованием продолговатого пуансона, из расчета 400 мг массы на таблетку. Твердость таблетки без покрытия составляла 165 N.
<Нанесение покрытия на не имеющие покрытия таблетки>
Полученную выше не имеющую покрытия таблетку покрывали Opadry®, содержащим HPMC в качестве основного компонента, в суммарном количестве 5% (масс/масс) в расчете на 100% (масс/масс) общей массы таблетки без покрытия.
Экспериментальный Пример 1: Измерение свойств таблеток
Испытание на истираемость
Истираемость измеряли для 10 таблеток методом, описанным в Фармакопее США, пункт 1216 Истираемость Таблетки, с использованием тестера истираемости Pharmatest, и результаты показаны в Таблице 3 ниже (время измерения=4 минуты).
|
Испытание на разложение
В соответствии с методом испытания на разложение Корейской Фармакопеи, десятое издание, испытание на разложение осуществляли для Примера 1 в растворе с pH 1,2, с n=3, и результаты показаны в Таблице 4 ниже.
|
Экспериментальный Пример 2: Испытание на растворимость
Испытание на растворимость осуществляли для Примера 1 в следующих условиях, с n=6, и результаты показаны в Таблице 5 ниже.
|
Метод испытания: метод испытания на растворимость с использованием лопастной мешалки в Корейской Фармакопее
Среда для растворения: 0,01 N раствор HCl
Скорость вращения: 50 об/мин
Температура: 37°С
Критерий времени для растворения: 15 минут
Метод анализа: метод ВЭЖХ
Условия ВЭЖХ анализа
Детектор: ультрафиолетовый абсорбциометр (длина волны 210 нм)
Колонка: длина 250 мм, диаметр 4,6 мм, колонка C18 5 мкм или эквивалентная колонка
Скорость потока: 1,0 мл/мин
Объем вводимой пробы: 10 мкл
Подвижная фаза: показана в Таблице 6 ниже
|
Растворитель A: Раствор, в котором 1,36 г дигидрофосфата калия растворяют в 1000 мл воды, его рН доводят до 3,5±0,05 с использованием ортофосфата и затем фильтруют.
Растворитель B: Раствор, в котором метанол и ацетонитрил смешивали в соотношении 90:10 (об/об) и затем фильтровали.
Экспериментальный Пример 3: Сравнительное растворение
Скорость растворения в зависимости от времени измеряли в при pH 1,2, pH 4,0, pH 6,8 и в воде, в соответствии с методом испытания на растворимость из общих методов испытаний Корейской фармакопеи, восьмое издание, с использованием Примера 1 и Сравнительного Примера 1 (препарат Revlimid® в форме капсул).
Скорость растворения измеряли жидкостным хроматографом с использованием испытываемого раствора, взятого в каждой точке времени определения растворения, и профиль растворения показан на Фиг. 1-4.
<Условия растворения>
Устройство для испытания на растворимость: метод испытания на растворимость с использованием лопастной мешалки в Корейской Фармакопее
Испытываемый раствор: pH 1,2, pH 4,0, pH 6,8 и вода
Скорость вращения: 50 об/мин
Температура: 37°С
Критерии времени для растворения:
2,5, 5, 10, 15 и 30 мин (pH 1,2)
5, 10, 15, 30 и 45 мин (pH 4,0)
5, 10, 15, 30, 45 и 60 мин (pH 6,8 и вода)
Метод анализа: метод ВЭЖХ
Пример 4: Толщина слоя покрытия в зависимости от доли покрытия
Таблетки прессовали в продолговатую форму, чтобы они имели большую ось 15 мм и малую ось 5,8 мм, таким же образом, как в Примере 1, и покрывали при помощи Opadry® (содержащий PVA) с получением таблеток, каждая из которых имела определенную твердость. Долю покрытия можно было определить по увеличению массы после нанесения покрытия по сравнению с массой таблетки.
Среднюю толщину слоя покрытия наблюдали при помощи сканирующей электронной микроскопии (СЭМ) после разрезания таблеток пополам, и среднее значение было получено из пяти значений толщины и показано в таблице 7 ниже.
|
Пример 5: Получение таблеток, каждая из которых содержит определенную дозу леналидомида
Таблетки с каждой дозой получали по существу таким же образом, как в Примере 1.
Результаты оценки для каждой таблетки показаны в Таблице 8 ниже.
|
Экспериментальный Пример 4: Испытание на биологическую эквивалентность леналидомида
Испытание на биологическую эквивалентность осуществляли на сорока одном (41) здоровом добровольце мужского пола для сравнения таблеток леналидомида в качестве испытываемого вещества (доза 25 мг), полученных в Примере 1, и вещества сравнения Revlimid® (Celgene, 25 мг доза).
Субъектов разделяли на две группы, испытываемое вещество и вещество сравнения принимали с водой натощак, и кровь собирали с заданными интервалами времени до 24 часов. Через 2 недели испытывали те же лекарственные средства, но группу меняли. Кровь собирали, плазму отделяли от собранных образцов крови и хранили в замороженном виде. Образцы анализировали с использованием устройства ЖХ/МС/МС для определения концентрации в крови. Значения AUC и Cmax получали из данных, и результаты обобщенно представлены в Таблице 9 ниже.
|