Результат интеллектуальной деятельности: СПОСОБ КОНЪЮГАЦИИ КОНСТАНТНОГО ФРАГМЕНТА ТЯЖЕЛОЙ ЦЕПИ АНТИТЕЛА ЧЕЛОВЕКА И ПЕПТОИДНОГО АНАЛОГА АУТОАНТИГЕНА MOG35-55 ДЛЯ ТЕРАПИИ РАССЕЯННОГО СКЛЕРОЗА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к биотехнологии, а именно: к способу конъюгации константного фрагмента тяжелой цепи антитела человека и пептоидного аналога аутоантигена MOG35-55 для терапии социально-значимого заболевания - рассеянного склероза (PC).
Объектом исследования является химический конъюгат, состоящий из модуля доставки - пептоидого аналога аутоантигена MOG35-55, химически конъюгированного с цитотоксическим модулем - константным доменом тяжелой цепи иммуноглобулина человека. Аутоантиген - пептид MOG35-55 является одним из основных биомаркеров патологических лимфоцитов, ассоциированных с PC [Reindl М., N Engl J Med, 2003; Reindl M., Nat. Rev. Neurol. 2013; Zocher et al. Int Immunol. 2003]. Пептоидный аналог MOG35-55 обладает сходными с пептидом MOG35-55 характеристиками специфичности и эффективности связывания с патологическими лимфоцитами при PC, при этом имеет значительно более высокую стабильность к протеолитической деградации [Reddy М., Cell, 2011]. Константный домен тяжелой цепи иммуноглобулина человека является естественным сигналом иммунной системы для деградации клетки-мишени по механизму комплимент-зависимой цитотоксичности. Объединение перечисленных модулей в единую молекулу позволяет получать бифункциональный цитотоксический агент, направленно элиминирующий специфические патологические лимфоциты при PC.
Известен способ получения бифункционального агента для терапии рака молочной железы, где к фрагменту антитела, связывающегося со специфическим рецептором (HER2/neu) на поверхности раковых клеток, присоединен токсин [Deyev SM et al. Design of multivalent complexes using the barnase-barstar module. Nat Biotechnol. 2003 Dec; 21(12):1486-92.]. Показано что такие молекулы связываются с раковыми, но не с обычными клетками (KD не менее 10-7 М), и убивают их с помощью токсина.
УРОВЕНЬ ТЕХНИКИ
Объектом изобретения является способ химической конъюгации модуля доставки - пептоидого аналога аутоантигена MOG35-55, с цитотоксическим модулем - константным доменом тяжелой цепи иммуноглобулина человека. Аутоантиген - пептид MOG35-55 является одним из основных биомаркеров патологических лимфоцитов, ассоциированных с PC [Reindl M, N Engl J Med, 2003; Reindl M., Nat. Rev. Neurol. 2013; Zocher et al. Int Immunol. 2003]. Пептоидный аналог MOG35-55 обладает сходными с пептидом MOG35-55 характеристиками специфичности и эффективности связывания с патологическими лимфоцитами при PC, при этом имеет значительно более высокую стабильность к протеолитической деградации [Reddy М., Cell, 2011]. Константный домен тяжелой цепи иммуноглобулина человека является естественным сигналом иммунной системы для деградации клетки-мишени по механизму комплимент-зависимой цитотоксичности. Объединение перечисленных модулей в единую молекулу позволяет получать бифункциональный цитотоксический агент, направленно элиминирующий специфические патологические лимфоциты при PC.
Известен бифункциональный агент для терапии рака молочной железы, который представляет собой фрагмент антитела, связывающегося со специфическим рецептором (HER2/neu) на поверхности раковых клеток, к которому присоединен токсин [Deyev SM et al. Design of multivalent complexes using the barnase*barstar module. Nat Biotechnol. 2003 Dec; 21(12):1486-92.]. Показано что такие молекулы связываются с раковыми, но не с обычными клетками (KD не менее 10-7 М), и убивают их с помощью токсина. Аналогом описываемого противоракового соединения является зарубежный противораковый препарат Herceptin®, который представляет собой полноразмерное анти-HER-2/neu-антитело.
Известны способы получения аналогов бифункциональных цитотоксических агентов для элиминации патологических В-клеток, состоящие из специфического таргетирующего пептида и токсических агентов на основе барназы, псевдомонадного токсина и константного Fc-домена антитела человека [Stepanov AV et al. Design of targeted В cell killing agents. Plos One. 2011 Jun; 6]. Аналоги препаратов таргетированных иммунотоксинов высокоспецифично (с избирательностью до 5000 раз более высокой по сравнении с иммунотоксином, не содержащим таргетный агент) взаимодействовали с клетками мишенями и вызывали значительный цитотоксический эффект.
Представленные выше технологии являются генно-инженерными способами получения бифункциональных агентов, в которых оба модуля являются белковыми молекулами с относительно высоким уровнем протеолитической деградации целевых молекул. Показано, что предлагаемые цитотоксические модули являются белками с высокой устойчивостью к биодеградации, в то время как пептидные модули доставки склонны к относительно быстрому разрушению в организме.
Так же известен способ получения аналогов бифункциональных хелатирующих агентов для целевой сцинтиграфии, представляющий конъюгацию моноклонального антитела и технеция-99 [Kumar Mishra et al. Journal of Drug Targeting. 2004; 12; 9-10].
Одним из наиболее близких аналогов разрабатываемого способа химической конъюгации пептоида MOG35-55 и константного домена иммуноглобулина человека является способ конъюгации антитела, специфичного к рецептору эпидермального фактора роста, и хелатирующего агента DOTA-Ph-AI для терапии и визуализации раковых опухолей [Puja Panwar et al. Journal Cancer Biology and Therapy. 2005; 4; 8; 854-860]. Прототипом создаваемого способа получения бифункциональной молекулы является конъюгация белкового препарата полноразмерного антитела анти-EGFr и небелкового хелатирующего агента DOTA-Ph-AI с последующей очисткой полученного конъюгата с помощью гель-фильтрационной хроматографии. Отличительной чертой разработанного нами способа конъюгации для получения бифункциональной молекулы Fc-пептоид AMogP3 является использование кросс-сшивающего линкера NHS-PEG2-малеимид.
Способы, описывающие во всех деталях полный цикл получения конъюгатов пептоида - аналога пептида MOG35-55 и константного домена тяжелой цепи иммуноглобулина человека, на настоящий момент не описаны.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Изобретение решает задачу создания терапевтического высокоспецифичного бифункционального агента для терапии рассеянного склероза (PC).
Технический результат достигается за счет увеличения эффективности конъюгации пептоидного аналога аутоантигена MOG35-55 с константным доменом тяжелой цепи иммуноглобулина человека.
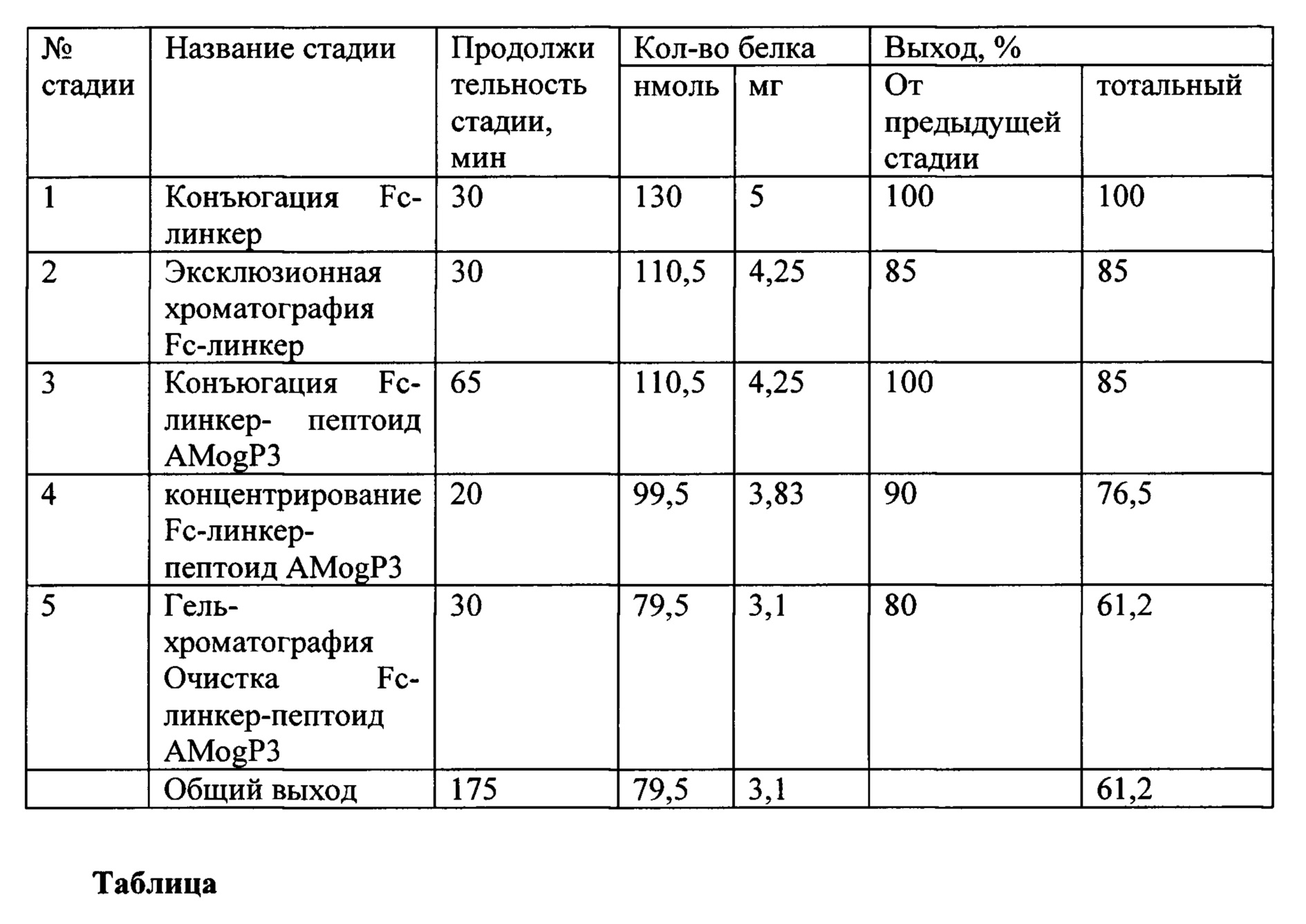
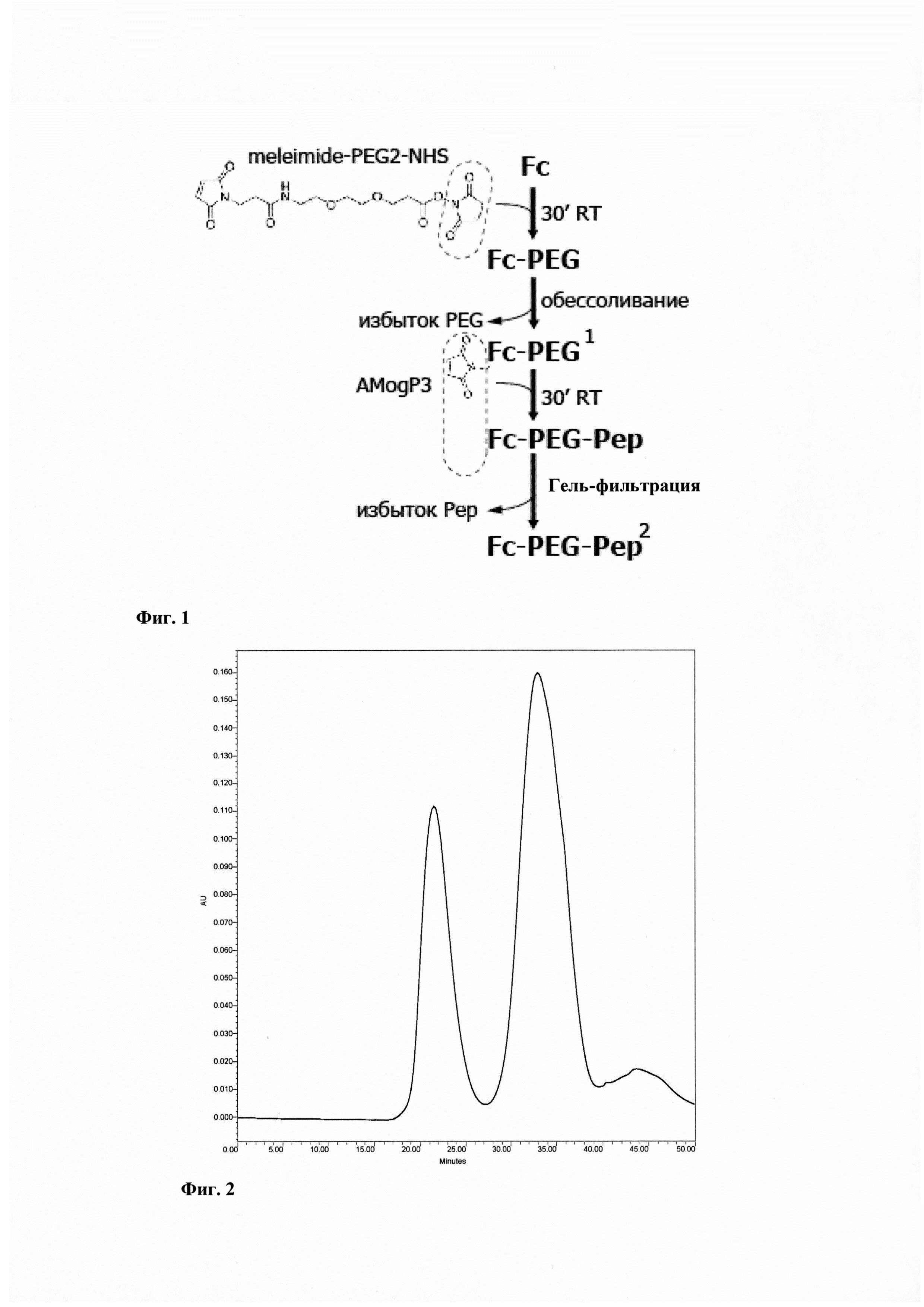
Поставленная задача решается за счет разработки способа создания бифункционального агента, состоящего из модуля доставки - пептоидого аналога аутоантигена MOG35-55, химически конъюгированного с цитотоксическим модулем - константным доменом тяжелой цепи иммуноглобулина человека. Разработан и оптимизирован способ химической конъюгации пептоида AMogP3, несущего свободную тиольную группу, и константного домена тяжелой цепи иммуноглобулина человека с использованием бифункционального кросс-сшивающего реагента линкера NHS-PEG2-малеимид, в условиях соотношения реагентов Fc : линкер : пептоид = 1:10:2, оптимальной длины кросс-сшивающего реагента 17.6 ангстрем. Конъюгация константного домена иммуноглобулина человека и пептоидного аналога аутоантигена MOG35-55 для терапии рассеянного склероза проводится в четыре стадии (Фиг. 1):
1) Конъюгация рекомбинантного модуля Fc с бифункциональным линкером
2) Очистка полученного фрагмента Fc-линкер от непрореагировавшего линкера с помощью эксклюзионной хроматографии
3) Конъюгация полученного фрагмента Fc-линкер с пептоидным модулем AMogP3
4) Очистка полученного бифункционального агента Fc-линкер-пептоидный модуль AMogP3 от непрореагировавшего пептоида AMogP3 с помощью гель-фильтрационной хроматографии
Длительность одного полного цикла выделения и очистки составляет 3 часа; выход целевого продукта составляет 61,2%.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Изобретение иллюстрируют следующие примеры:
Пример 1. Конъюгация Fc-линкер
1.1. Смешивают следующие ингредиенты:
- Буфер для конъюгации: фосфатно-солевой буфер (PBS, рН 7.2), 4 тМ ЭДТА. Объем - 2.5 мл.
- Очищенный препарат рекомбинантного Fc 5.0 мг (130 нмоль) - 0.5 мл с концентрацией 10 мг/мл (в буфере PBS, рН 7.2).
- линкер SM(PEG)2 1.3 мкмоль (молярное соотношение 1:10) - 5.4 мкл с концентрацией 250 тМ
1.2. Инкубируют 30 мин. в закрытой пробирке объемом 15 мл при комнатной температуре при постоянном деликатном перемешивании с помощью орбитального шейкера.
1.3. Для удаления непрореагировавшего линкера SM(PEG)2 проводят экслюзионную хроматографию с использованием хроматографической колонки HiTrap Desalting Column 5 мл (GE Healthcare Life Sciences):
- Буфер нанесения: фосфатно-солевой буфер (PBS, рН 7.2), 4 гаМ ЭДТА.
- Скорость потока: 1 мл/мин
- Время выхода очищенной фракции Fc-линкер: с 1.5 мин по 3 мин
1.4. Проводят 2 инжекции по 1.5 мл реакционной смеси в каждой. После проведения хроматографии объединяют фракции с 1.5 по 3.0 минуты (всего 3 мл). Продолжительность каждой инжекции: 15 мин
Пример 2. Конъюгация Fc-линкер-пептоид AMogP3
1.1. Смешивают следующие ингредиенты:
- 3 мл очищенного препарата Fc-линкера (полученного в примере 1)
- 260 нмоль пептоида AMogP3 - 130 мкл 2 тМ р-ра
1.2. Инкубируют 30 мин. в закрытой пробирке объемом 15 мл при комнатной температуре при постоянном деликатном перемешивании с помощью орбитального шейкера.
1.3. Блокируют свободные малеимидные группы повышением рН р-ра до 9.0. Для этого добавляют 350 мкл 1 М р-ра Tris-HCl (рН 9.0) и инкубируют 15 мин при комнатной температуре.
1.4. Для диссоциации неконъюгированного пептоида AMogP3 от белкового модуля (рекомбинантного Fc) добавляют к р-ру 320 мкл 1 М Gly-HCl (рН 2.5), инкубируют 20 мин при комнатной температуре.
1.5. Концентрируют р-р Fc-линкер-пептоид AMogP3 с помощью Amicon Ultracel (10000NMWL) до 0.5 мл (15 мин 4°С, 5000g.
1.6. Проводят гель-фильтрационную хроматографию с использованием хроматографической колонки Superdex 75 10/300 GL (GE Healthcare Life Sciences).
- Буфер нанесения: 0.1 М Gly-HCl рН 2.6, 300 mM NaCl.
- Скорость потока: 0.5 мл/мин
- Время выхода очищенной фракции Fc-линкер-пептоид AMogP3: с 19 мин по 25 мин
Типичная хроматограмма процесса очистки представлена на Фиг. 2.
1.7. Фракции с 19 по 25 минуты объединяют и нейтрализуют рН р-ра добавлением 1 М Tris-HCl рН 9.0 до значения рН 7.5
Временная и количественная характеристика цикла конъюгации и очистки бифункционального агента Fc-линкер-пептоид AMogP3 представлена в таблице.
Пример 3.
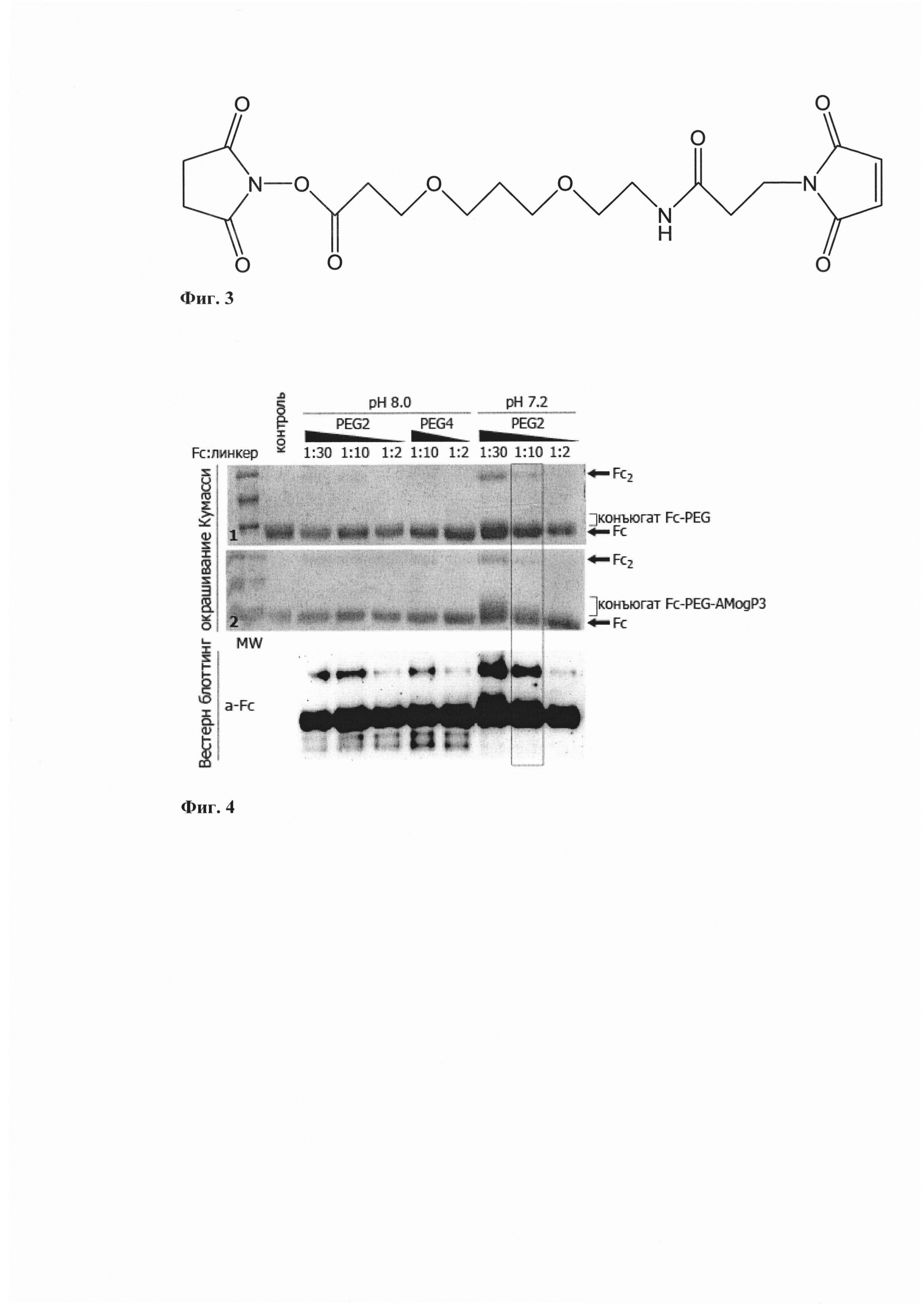
Для получения бифункционального агента AMogP3-Fc, состоящего из белкового модуля Fc-фрагмента иммуноглобулина человека, обеспечивающего специфичное взаимодействие с поверхностным маркером и одновременно способствующего элиминации, и из пептоидного аналога AMogP3, используют кросс-сшивающий реагент линкер SM(PEG)2, содержащий на одном конце NHS-группу для присоединения к аминогруппе константного домена иммуноглобулина человека, и на другом конце свободную малеимидную группу для присоединения к остатку цистеина пептоида (Фиг. 3). После проведения цикла конъюгации и очистки при использовании кросс-сшивающего линкера SM(PEG)2 длиной 17,6 ангстрем удается достигнуть эффективности первой стадии конъюгации с Fc-доменом не менее 95% при наименьшем содержании гомодимеров (Фиг. 4).
Пример 4.
Из-за значительно меньшего молекулярного веса пептоидного модуля по сравнению с белковым модулем разделение непрореагировавшего белкового модуля Fc с конъюгированным является крайне трудоемким и дорогостоящим процессом. Для исключения необходимости их разделения необходимо добиться содержания в реакционной смеси не менее 95% конъюгированного бифункционального агента. После проведения цикла конъюгации и очистки при использовании буфера PBS рН 7.2 и при соотношении пептидного модуля: кроссшивающего линкера 1:10 удается достигнуть не менее 95% выхода конъюгированного бифункционального агента (Фиг. 4).
Изобретение иллюстрируют следующие графические материалы:
Фиг. 1. - Схема конъюгации константного фрагмента иммуноглобулина человека (Fc) с пептоидом AMogP3 с использованием бифункционального линкера с реакционными сукцинимидной и малеимидной группами.
Фиг. 2. - Профиль гель-фильтрационной хроматографии с использованием колонки Superdex75 для разделения непрореагировавшего пептоида A-MogP3 от фракции Fc-пептоид AMogP3
Фиг. 3. - Схема бифункционального линкера SM(PEG)2
Фиг. 4. - Анализ различных условий конъюгации Fc - AMogP3c применением ПААГ (верхняя панель) и блоттинга по Вестерну (нижняя панель).
Таблица. Временная и количественная характеризация этапов конъюгации бифункционального агента 1 г (Fc-линкер-пептоид AMogP3).