Результат интеллектуальной деятельности: СПОСОБЫ СОЗДАНИЯ БАНКОВ КЛЕТОК СО СВЕРХВЫСОКОЙ ПЛОТНОСТЬЮ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет предварительной заявки на патент США № 62/052257, поданной 18 сентября 2014 г. Там, где это позволяет, вышеуказанная заявка включена посредством ссылки для любых и всех целей.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Создание банков клеток широко применяют для хранения исходных материалов на основе замороженных, охарактеризованных клеток, которые могут быть разморожены для применения в ряде областей, включая получение терапевтически значимых белков. Обычно исходный криоконсервированный материал хранят при более низких значениях плотности (например, приблизительно 1 или 2×107 клеток/мл) или центрифугируют с получением аликвот с более высокой плотностью для хранения. Исходные материалы с меньшей плотностью не позволяют эффективно инокулировать культуры большого объема, а способы концентрации могут повредить клетки, тем самым снижая жизнеспособность клеток замороженного исходного материала. По этим причинам предыдущие способы создания банков клеток являются относительно неэффективными и, в конечном счете, не позволяют быстро получать культуры клеток с высокой плотностью из замороженных исходных материалов. Соответственно, существует потребность в улучшенных способах создания банков клеток.
КРАТКОЕ ОПИСАНИЕ
Настоящее раскрытие предусматривает усовершенствованные способы создания банка клеток со сверхвысокой плотностью. В некоторых вариантах осуществления в способах по настоящему изобретению применяют усовершенствованные методы культивирования клеток в условиях перфузии, которые позволяют получать культуры клеток со сверхвысокой плотностью, которые можно криоконсервировать при неожиданно высоких плотностях клеток без необходимости каких-либо стадий концентрирования клеток, сохраняя при этом отличную жизнеспособность клеток для дальнейшего применения в получении культуры клеток.
Соответственно, в одном аспекте настоящее раскрытие предусматривает способ получения банка замороженных клеток со сверхвысокой плотностью непосредственно из популяции культивируемых клеток, при этом способ включает: культивирование клеток в перфузионном биореакторе с получением популяции клеток со сверхвысокой плотностью с концентрацией по меньшей мере 1,0×108 клеток/мл, где указанный перфузионный биореактор соединен с системой удерживания клеток; и добавление криопротектора к популяции клеток со сверхвысокой плотностью для получения банка замороженных клеток со сверхвысокой плотностью, при этом банк замороженных клеток со сверхвысокой плотностью характеризуется концентрацией по меньшей мере 1,0×108 клеток/мл, и при этом отсутствует дополнительная стадия концентрирования между культивированием клеток и добавлением криопротектора к популяции клеток со сверхвысокой плотностью.
В некоторых вариантах осуществления система удерживания клеток предусматривает систему фильтрации в переменном тангенциальном потоке, содержащую фильтр. В некоторых вариантах осуществления фильтр характеризуется площадью поверхности, составляющей по меньшей мере приблизительно 0,08 м2. В некоторых вариантах осуществления фильтр характеризуется площадью поверхности, составляющей от приблизительно 0,08 м2 до приблизительно 0,3 м2, от приблизительно 0,3 м2 до приблизительно 0,5 м2, от приблизительно 0,5 м2 до приблизительно 1,0 м2, от приблизительно 0,7 м2 до приблизительно 0,8 м2, от приблизительно 1,0 м2 до приблизительно 2,0 м2, от приблизительно 2,0 м2 до приблизительно 3,0 м2, от приблизительно 3,0 м2 до приблизительно 4,0 м2 или от приблизительно 4,0 м2 до приблизительно 5,5 м2. В некоторых вариантах осуществления фильтр характеризуется размером пор, выбранным из группы, состоящей из 0,2 мкм, 0,4 мкм и 0,65 мкм. В других вариантах осуществления фильтр характеризуется размером пор, выбранным из группы, состоящей из 0,7 мкм, 1,2 мкм и 7 мкм.
В некоторых вариантах осуществления популяция клеток со сверхвысокой плотностью характеризуется плотностью жизнеспособных клеток, выбранной из группы, состоящей из приблизительно 1,0×108 клеток/мл, приблизительно 1,1×108 клеток/мл, приблизительно 1,2×108 клеток/мл, приблизительно 1,3×108 клеток/мл, приблизительно 1,4×108 клеток/мл, приблизительно 1,5×108 клеток/мл, приблизительно 1,6×108 клеток/мл, приблизительно 1,7×108 клеток/мл, приблизительно 1,8×108 клеток/мл, приблизительно 1,9×108 клеток/мл и приблизительно 2,0×108 клеток/мл.
В некоторых вариантах осуществления криоконсервация включает добавление диметилсульфоксида (DMSO) к популяции клеток со сверхвысокой плотностью при конечной концентрации от приблизительно 5% до приблизительно 10% объем/объем. В некоторых вариантах осуществления криоконсервация включает замораживание по меньшей мере части популяции клеток со сверхвысокой плотностью в контейнере, подходящем для хранения в условиях криоконсервации.
В некоторых вариантах осуществления контейнер представляет собой флакон. В некоторых вариантах осуществления банк замороженных клеток со сверхвысокой плотностью содержит приблизительно 4,5×108 клеток/флакон.
В некоторых вариантах осуществления контейнер представляет собой криопакет. В некоторых вариантах осуществления объем криопакета составляет от приблизительно 5 до приблизительно 150 мл. В некоторых вариантах осуществления плотность клеток банка замороженных клеток со сверхвысокой плотностью составляет по меньшей мере приблизительно 1,0×108 клеток/мл.
В некоторых вариантах осуществления скорость перфузии в перфузионном биореакторе составляет от приблизительно 0,02 нл/клетку/сутки до приблизительно 0,5 нл/клетку/сутки. В некоторых вариантах осуществления скорость перфузии в перфузионном биореакторе составляет от 0 до 15 объемов реактора в сутки.
В некоторых вариантах осуществления рН культуры клеток перфузионного биореактора составляет от приблизительно 6,8 до приблизительно 7,2.
В некоторых вариантах осуществления концентрация растворенного кислорода (DO) в культуре клеток перфузионного биореактора составляет по меньшей мере приблизительно 30%.
В некоторых вариантах осуществления биореактор представляет собой биореактор в виде эластичного мешка. В некоторых вариантах осуществления биореактор содержит встроенный фильтр.
В некоторых вариантах осуществления банк замороженных клеток со сверхвысокой плотностью характеризуется жизнеспособностью клеток после размораживания по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90% или по меньшей мере приблизительно 95%.
В некоторых вариантах осуществления клетки представляют собой клетки млекопитающих. В некоторых вариантах осуществления клетки млекопитающих выбраны из группы, состоящей из CHO, CHO-DBX11, CHO-DG44, CHO-S, CHO-K1, Vero, BHK, HeLa, COS, MDCK, HEK-293, NIH-3T3, W138, BT483, Hs578T, HTB2, BT20, T47D, NS0, CRL7030, клеток HsS78Bst, PER.C6, SP2/0-Agl4 и гибридомных клеток. В некоторых вариантах осуществления клетки представляют собой трансфицированные клетки. В некоторых вариантах осуществления клетки экспрессируют терапевтический белок.
В некоторых вариантах осуществления перфузионный биореактор содержит биореактор в виде эластичного мешка; фильтр характеризуется площадью поверхности, составляющей по меньшей мере 0,3 м2, и величина номинально отсекаемой молекулярной массы (MWCO) составляет по меньшей мере 50 кДа; криопротектор, добавляемый к популяции клеток со сверхвысокой плотностью, представляет собой DMSO; и банк замороженных клеток со сверхвысокой плотностью содержит от приблизительно 5 до приблизительно 10% объем/объем DMSO.
В некоторых вариантах осуществления рН и DO культуры контролируют с помощью автоматизированных способов. В некоторых вариантах осуществления рН и DO культуры контролируют с помощью неавтоматизированных способов. В некоторых вариантах осуществления pH и DO контролируют с помощью любого одного или нескольких из следующих действий: регулирование смеси газов, которые вводят в культуру, регулирование скорости качания биореактора или регулирование угла качания биореактора. В некоторых вариантах осуществления биореактор качают при 15 об./мин. с углом качания 8°. В некоторых вариантах осуществления биореактор качают при 22 об./мин. с углом качания 10°. В некоторых вариантах осуществления биореактор качают при 25 об./мин. с углом качания 12°.
В некоторых вариантах осуществления популяцию клеток со сверхвысокой плотностью охлаждают и поддерживают при температуре приблизительно 4°С до и во время добавления криопротектора и распределения. В некоторых вариантах осуществления популяцию клеток со сверхвысокой плотностью поддерживают при температуре от приблизительно 20°C до приблизительно 26°C во время добавления криопротектора и распределения. В некоторых вариантах осуществления популяцию клеток со сверхвысокой плотностью поддерживают при неконтролируемой низкой температуре с применением бани с ледяной водой во время добавлении криопротектора и распределения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1 представляет собой графическое изображение способа создания банка клеток со сверхвысокой плотностью.
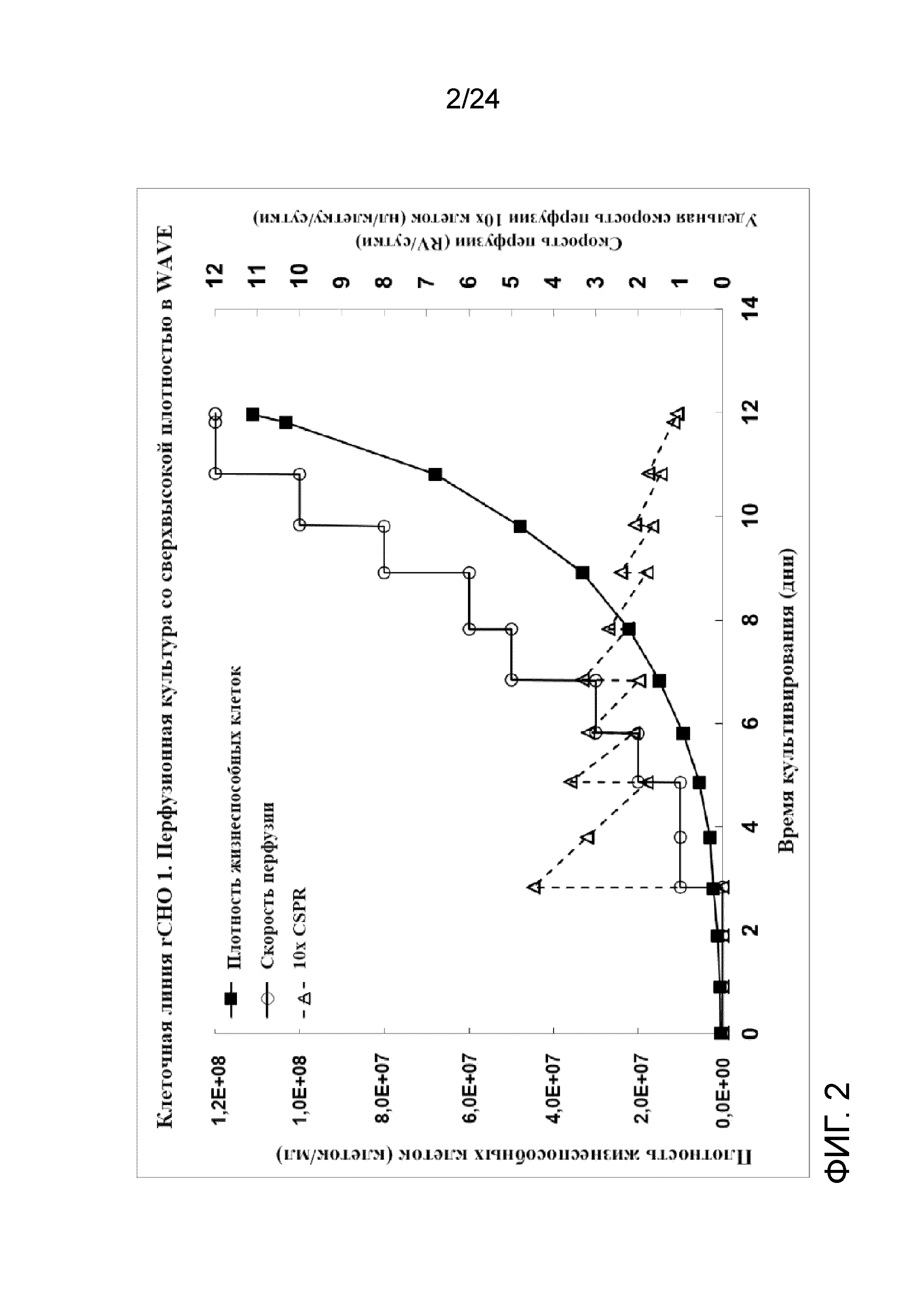
Фигура 2 представляет собой график, отображающий плотность жизнеспособных клеток (клеток/мл), скорость перфузии (RV(объем реактора)/сутки) и относительную скорость перфузии клеток 10X (нл/клетку/сутки) в иллюстративной культуре клеточной линии rCHO 1.
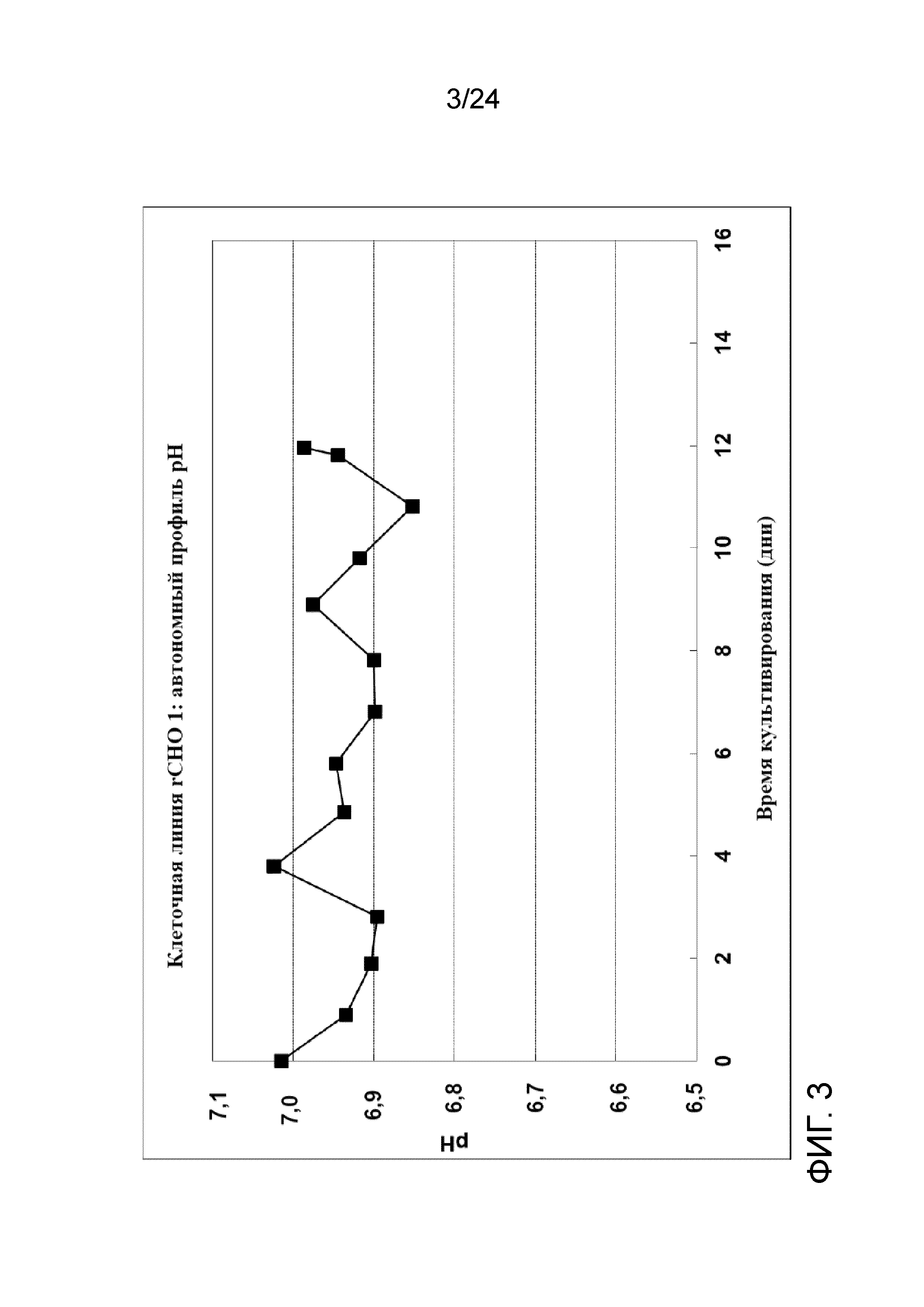
Фигура 3 представляет собой график, отображающий автономный профиль рН в культуре клеточной линии rCHO 1.
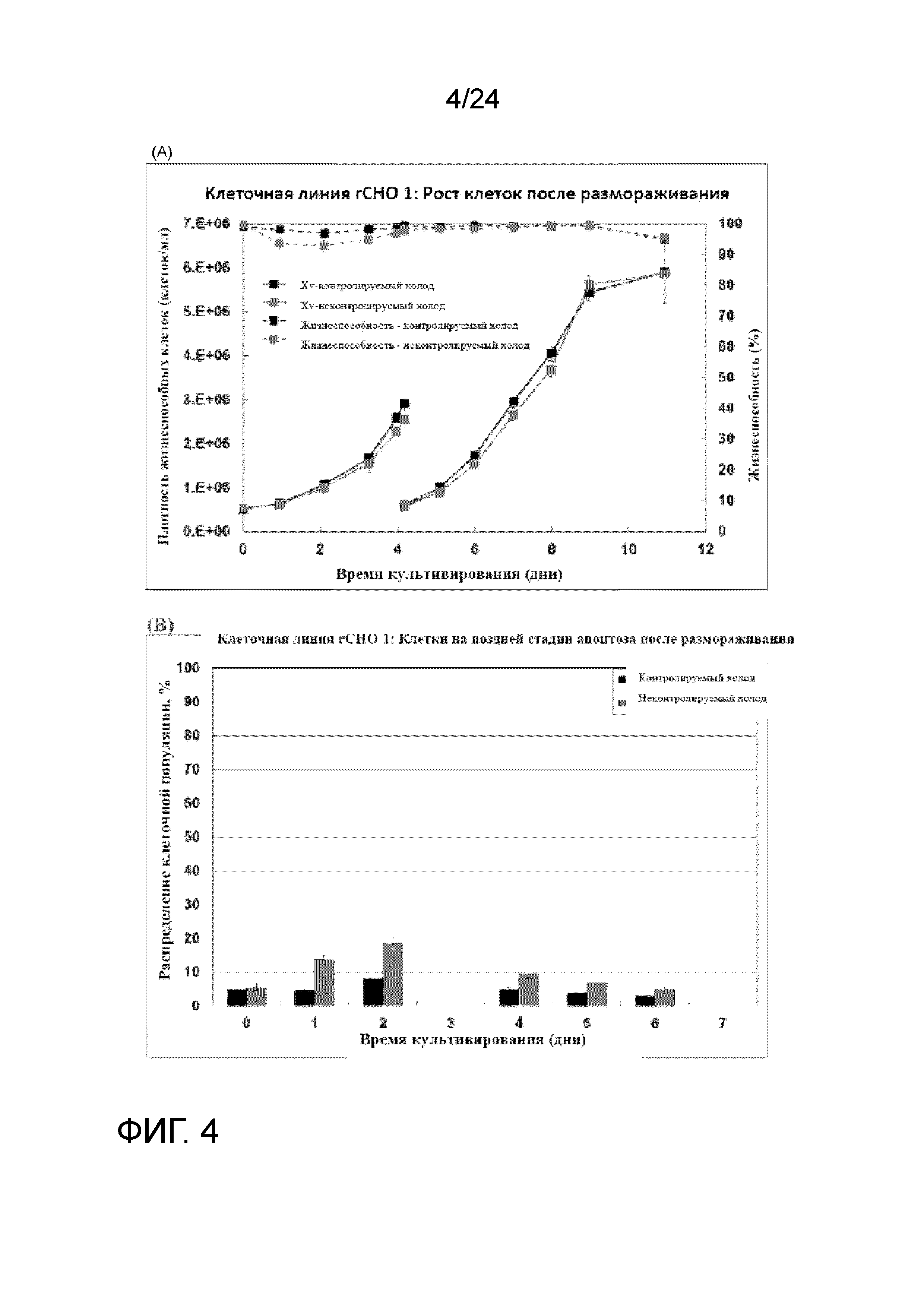
Фигура 4A-C представляет собой серию графиков, отображающих профиль роста клеток после размораживания (А), процент клеток на этапе позднего апоптоза после размораживания (В) и удельную продуктивность (единицы/Е9 клеток/сутки) для аликвоты объемом 5 мл со сверхвысокой плотностью (HD) банка клеток клеточной линии rCHO 1.
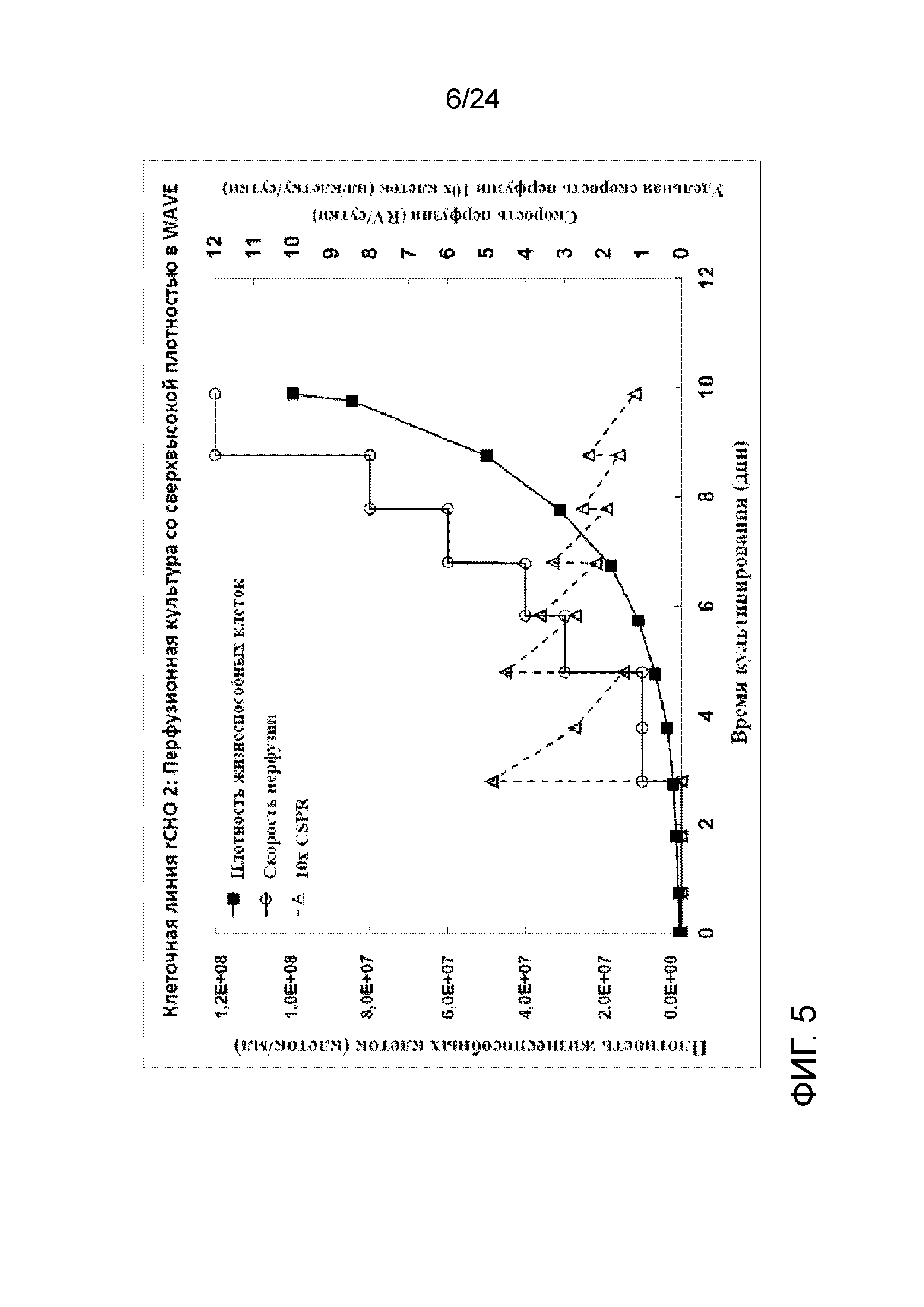
Фигура 5 представляет собой график, отображающий плотность жизнеспособных клеток (клеток/мл), скорость перфузии (RV/сутки) и удельную скорость перфузии клеток 10X (нл/клетку/сутки) в иллюстративной культуре клеточной линии rCHO 2.
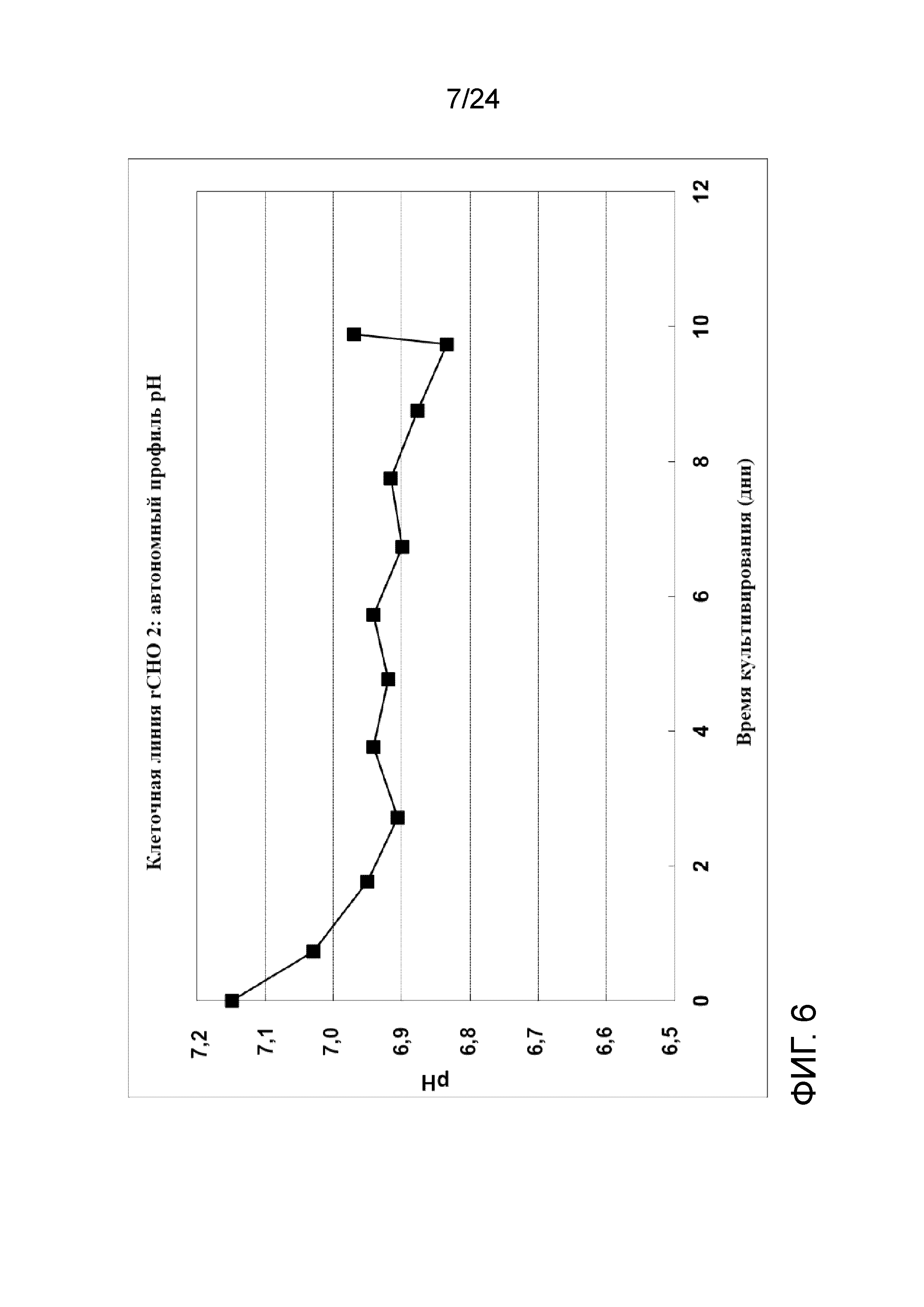
Фигура 6 представляет собой график, отображающий автономный профиль рН в культуре клеточной линии rCHO 2.
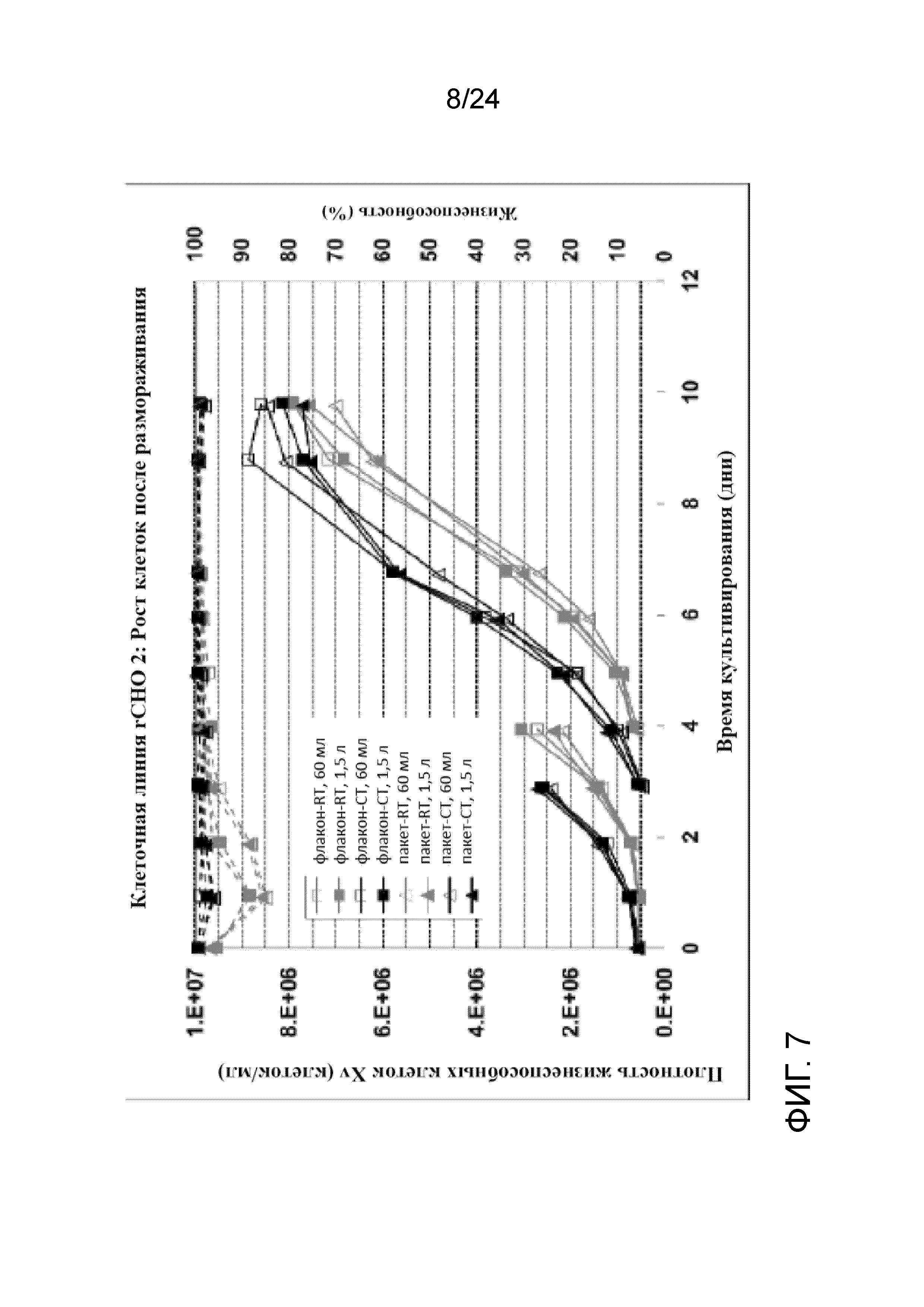
Фигура 7 представляет собой график, отображающий рост клеток на основе плотности жизнеспособных клеток Xv (клеток/мл, сплошные линии) и жизнеспособности (пунктирные линии) для клеточной линии rCHO 2 при посеве 0,5×106 жизнеспособных клеток/мл во встряхиваемых колбах объемом 250 мл и 3 л.
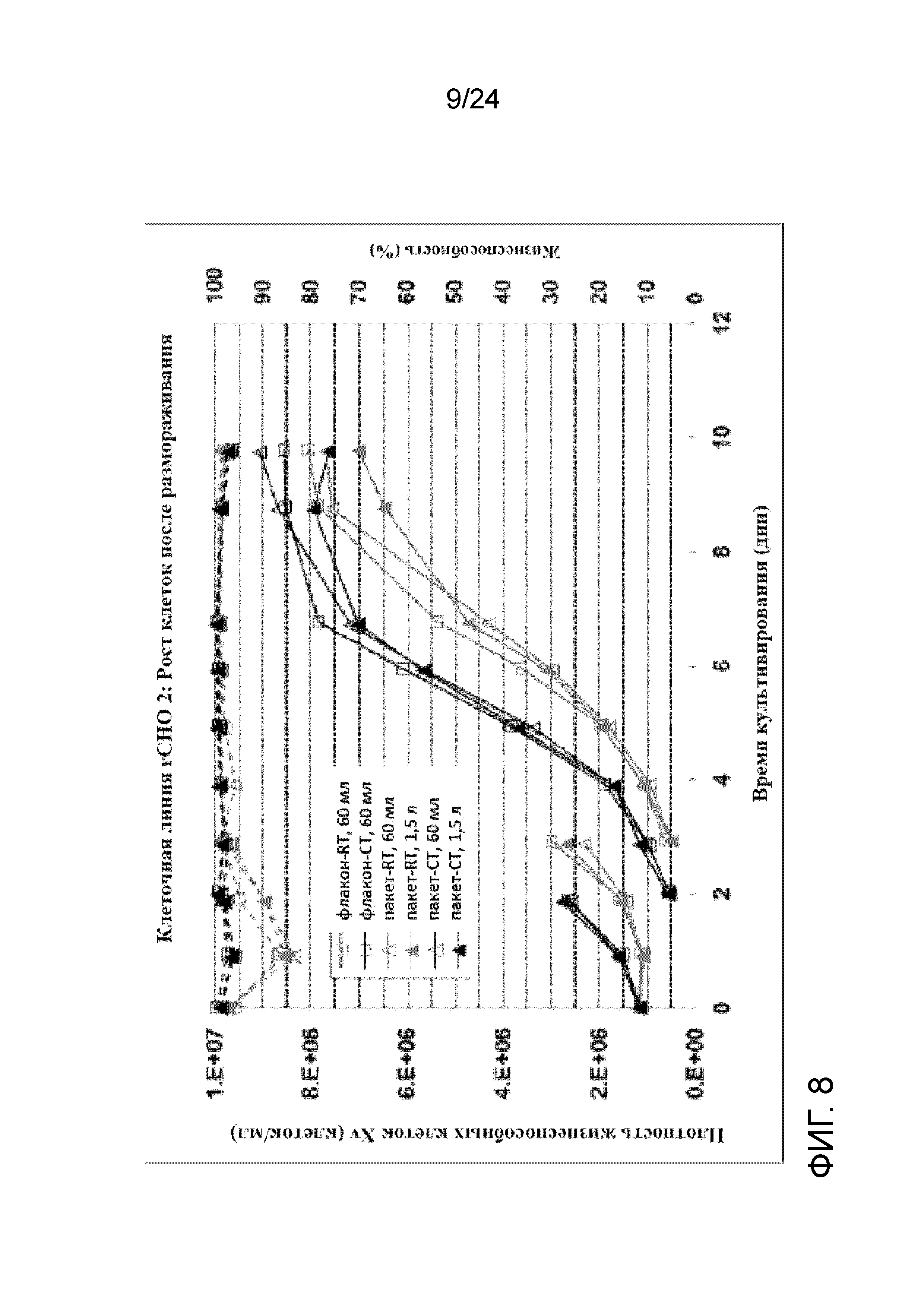
Фигура 8 представляет собой график, отображающий рост клеток на основе плотности жизнеспособных клеток Xv (клеток/мл, сплошные линии) и жизнеспособности (пунктирные линии) для клеточной линии rCHO 2 при посеве 1,0×106 жизнеспособных клеток/мл во встряхиваемых колбах объемом 250 мл и 3 л.
Фигура 9 представляет собой график, отображающий процент клеток на этапе позднего апоптоза и мертвых клеток в культуре клеточной линии rCHO 2 при посеве 0,5×106 жизнеспособных клеток/мл во встряхиваемых колбах объемом 250 мл и 3 л.
Фигура 10 представляет собой график, отображающий процент клеток на этапе позднего апоптоза и мертвых клеток в культуре клеточной линии rCHO 2 при посеве 1,0×106 жизнеспособных клеток/мл во встряхиваемых колбах объемом 250 мл и 3 л.
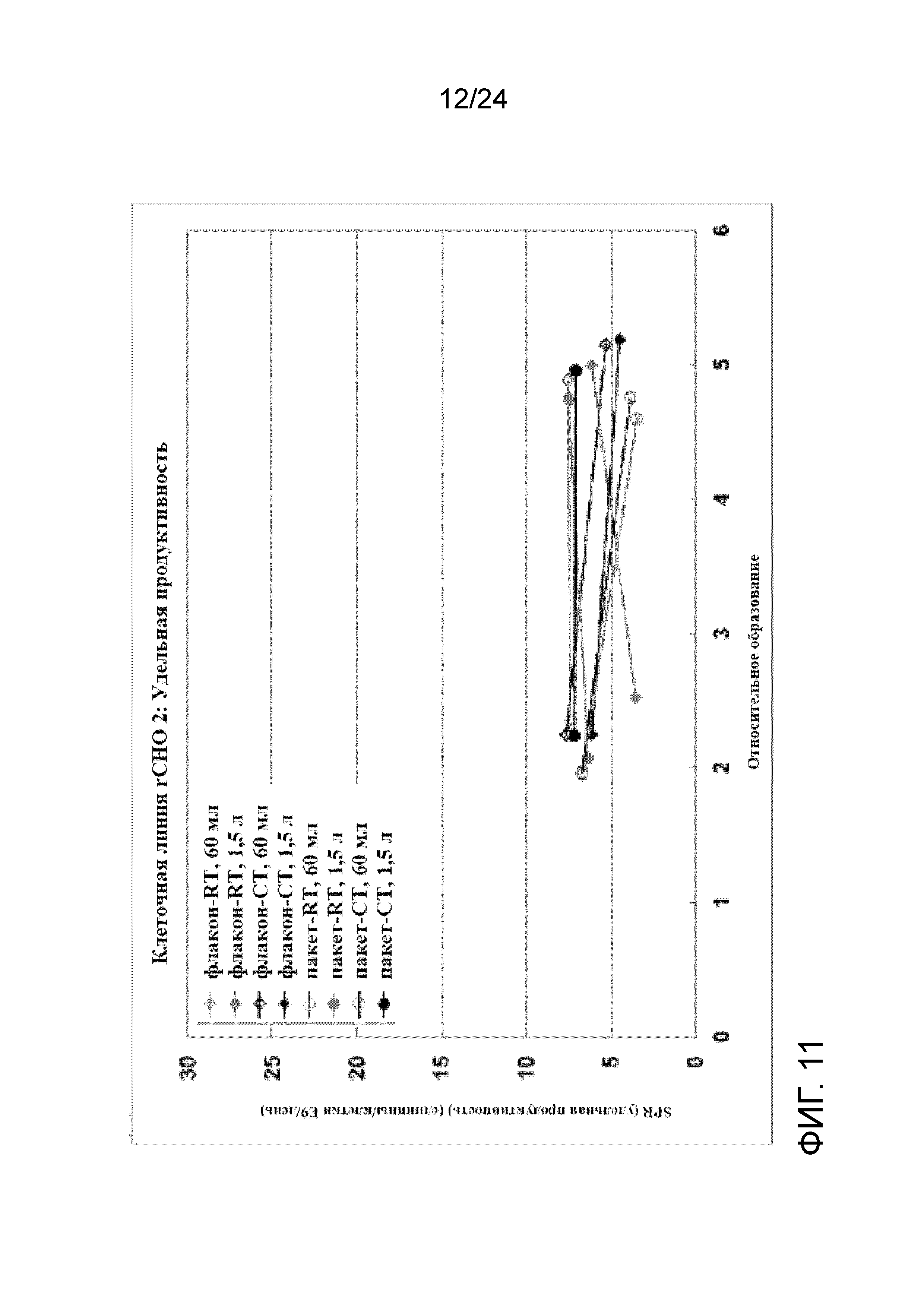
Фигура 11 представляет собой график, отображающий удельную продуктивность (SPR) в культурах клеточной линии rCHO 2 во встряхиваемых колбах при посеве 0,5×106 жизнеспособных клеток/мл во встряхиваемых колбах объемом 250 мл и 3 л.
Фигура 12 представляет собой график, отображающий удельную продуктивность (SPR) в культурах клеточной линии rCHO 2 во встряхиваемых колбах при посеве 1,0×106 жизнеспособных клеток/мл во встряхиваемых колбах объемом 250 мл и 3 л.
Фигура 13 представляет собой график, отображающий рост клеток в мешках WAVE на основе плотности жизнеспособных клеток Xv (клеток/мл, сплошные линии) и жизнеспособности (пунктирные линии) для клеточной линии rCHO 2.
Фигура 14 представляет собой график, отображающий процент клеток на этапе позднего апоптоза и мертвых клеток в культуре клеточной линии rCHO 2.
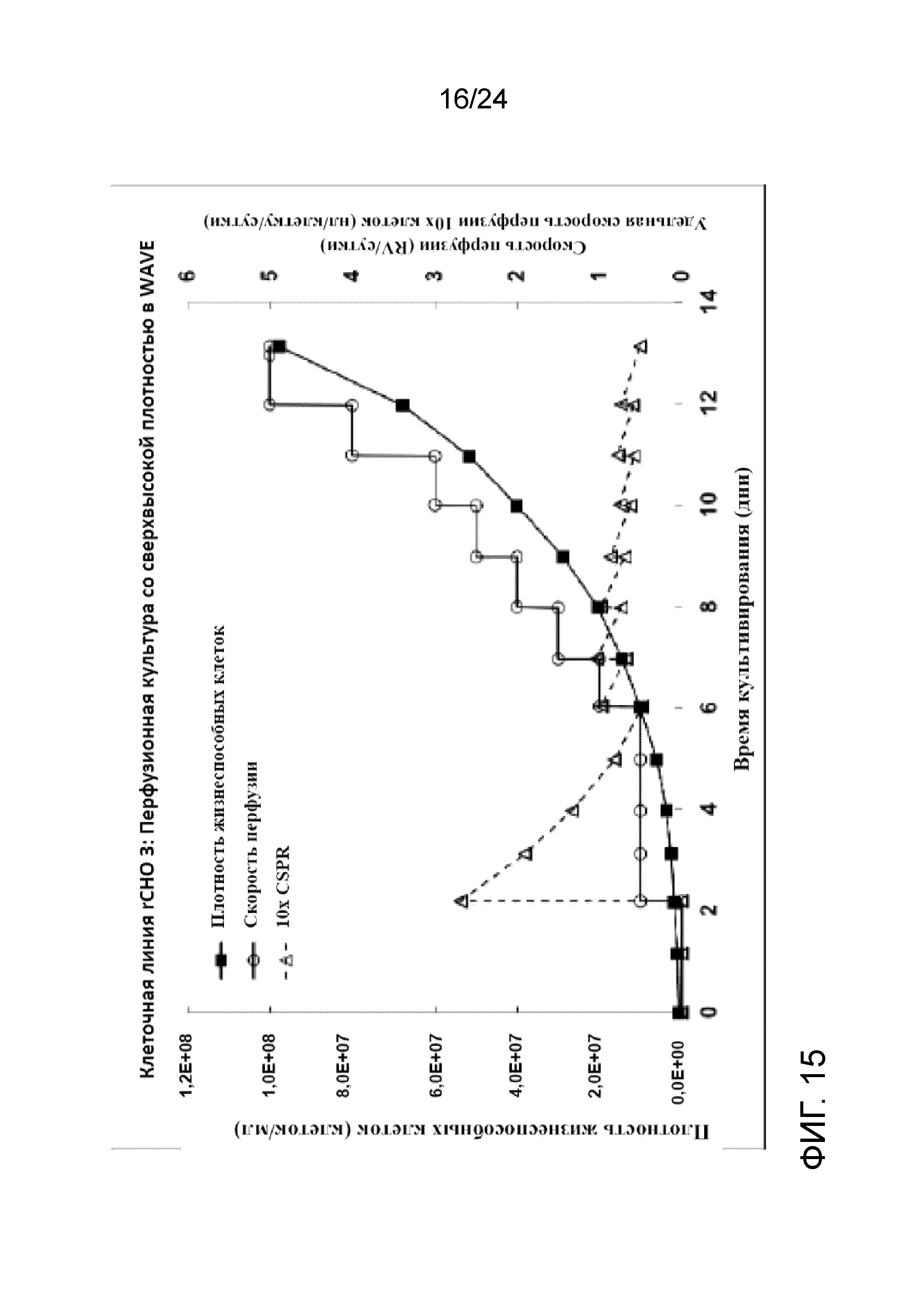
Фигура 15 представляет собой график, отображающий плотность жизнеспособных клеток (клеток/мл), скорость перфузии (RV/сутки) и удельную скорость перфузии клеток 10X (нл/клетку/сутки) в иллюстративной культуре клеточной линии rCHO 3.
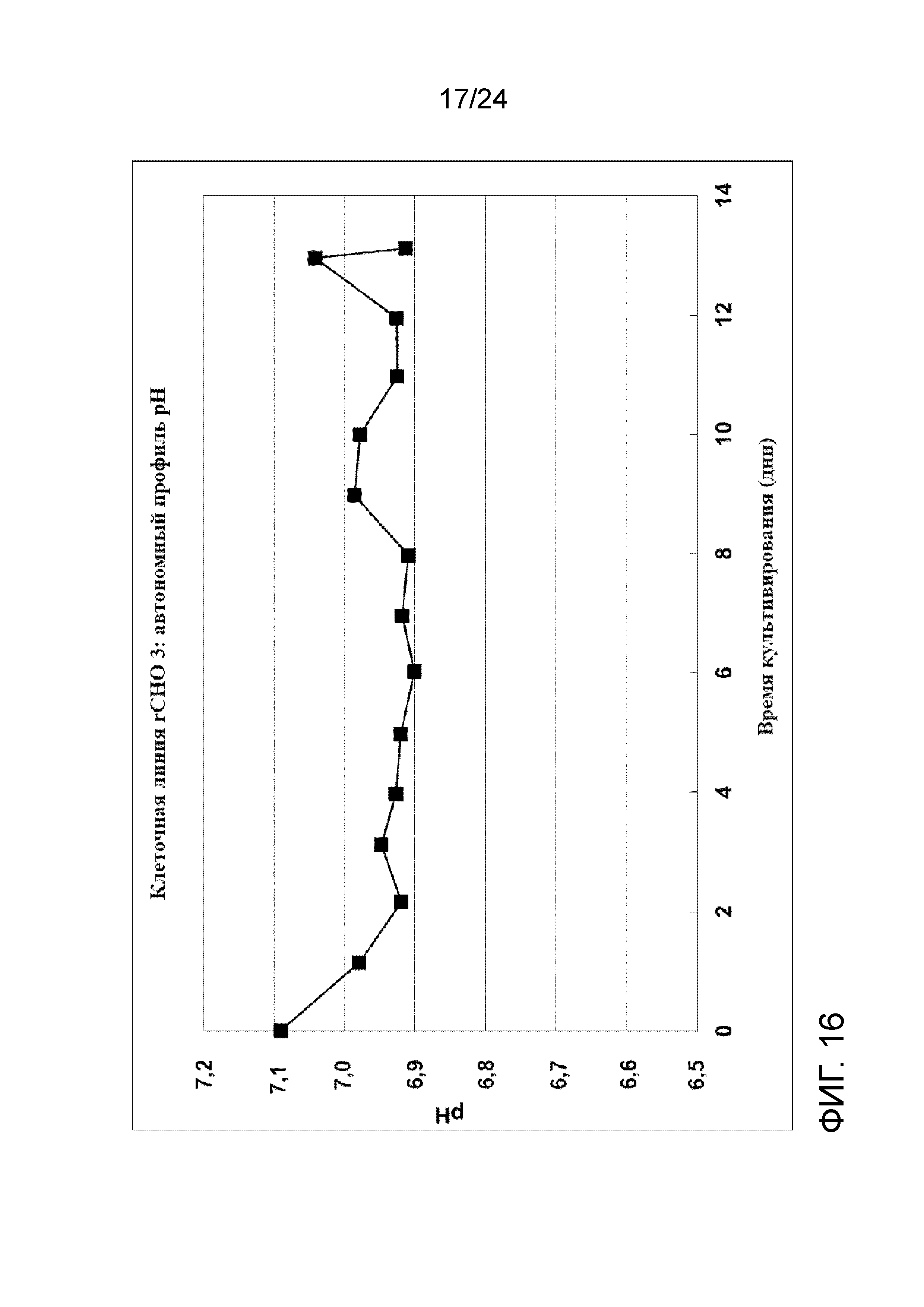
Фигура 16 представляет собой график, отображающий автономный профиль рН в культуре клеточной линии rCHO 3.
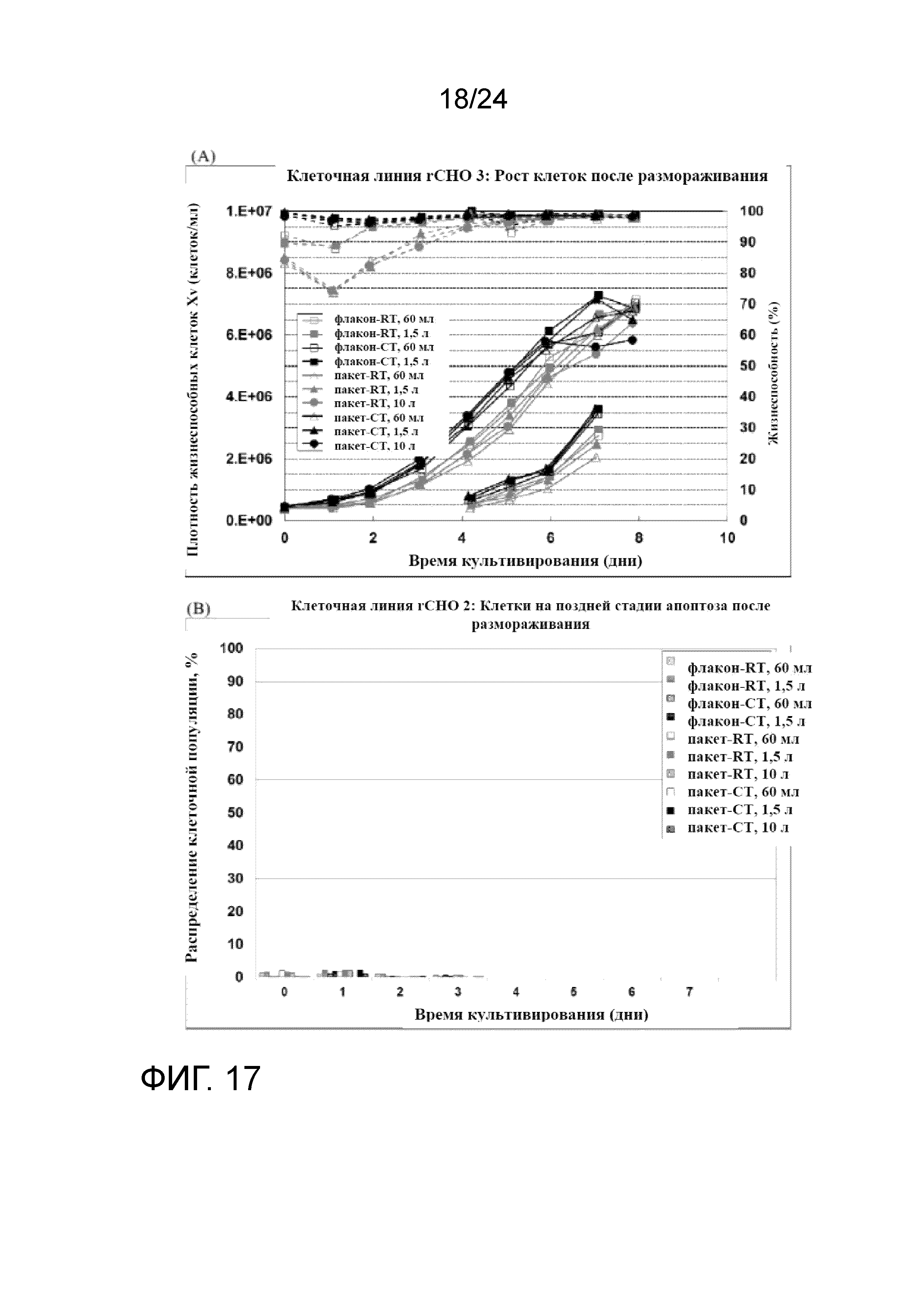
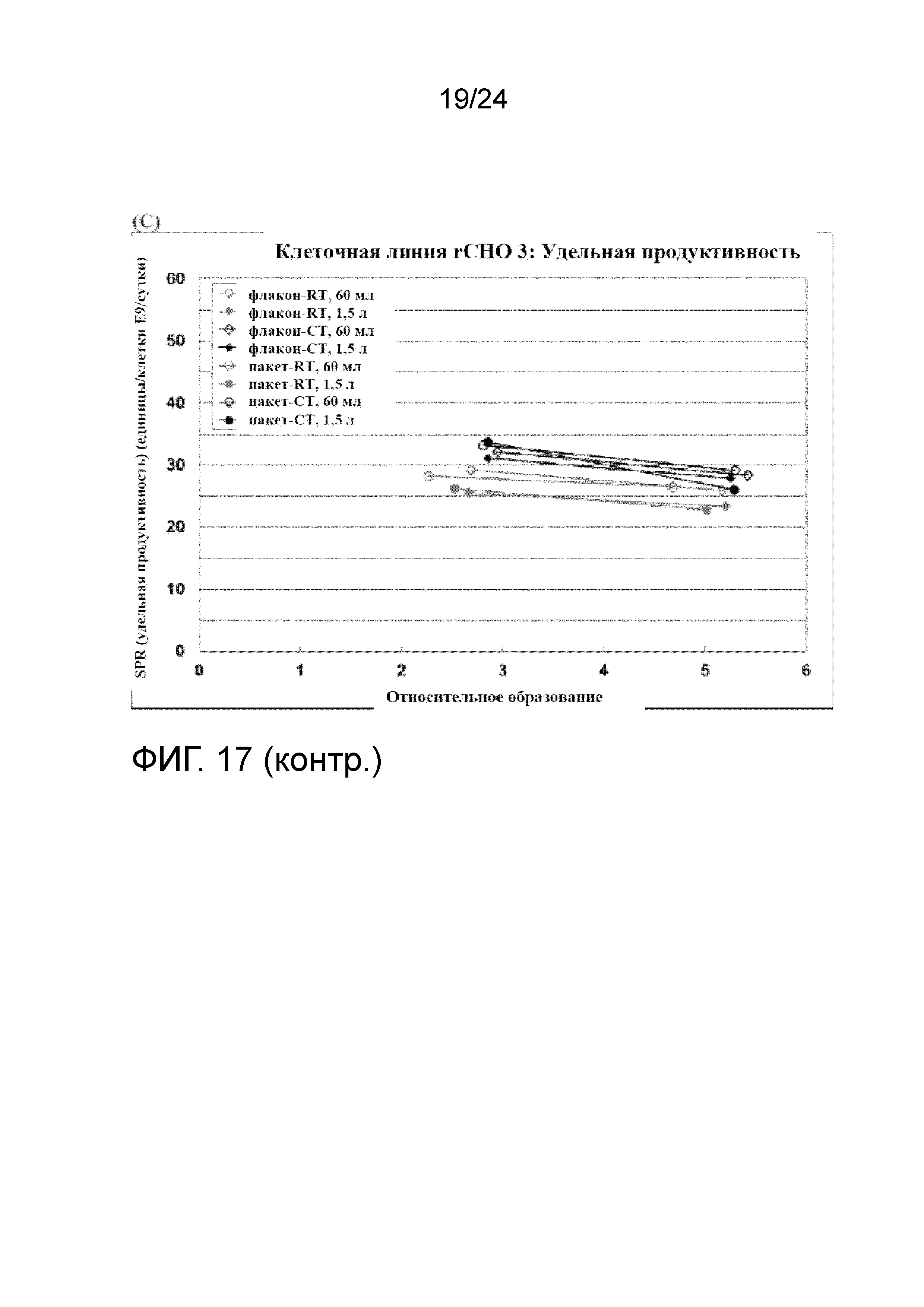
Фигура 17A-C представляет собой серию графиков, отображающих рост клеток (сплошные линии) и жизнеспособность (пунктирные линии) (A); процент клеток на этапе позднего апоптоза и мертвых клеток (B); и удельную продуктивность (SPR) (C) в культурах клеточной линии rCHO 3 во встряхиваемых колбах.
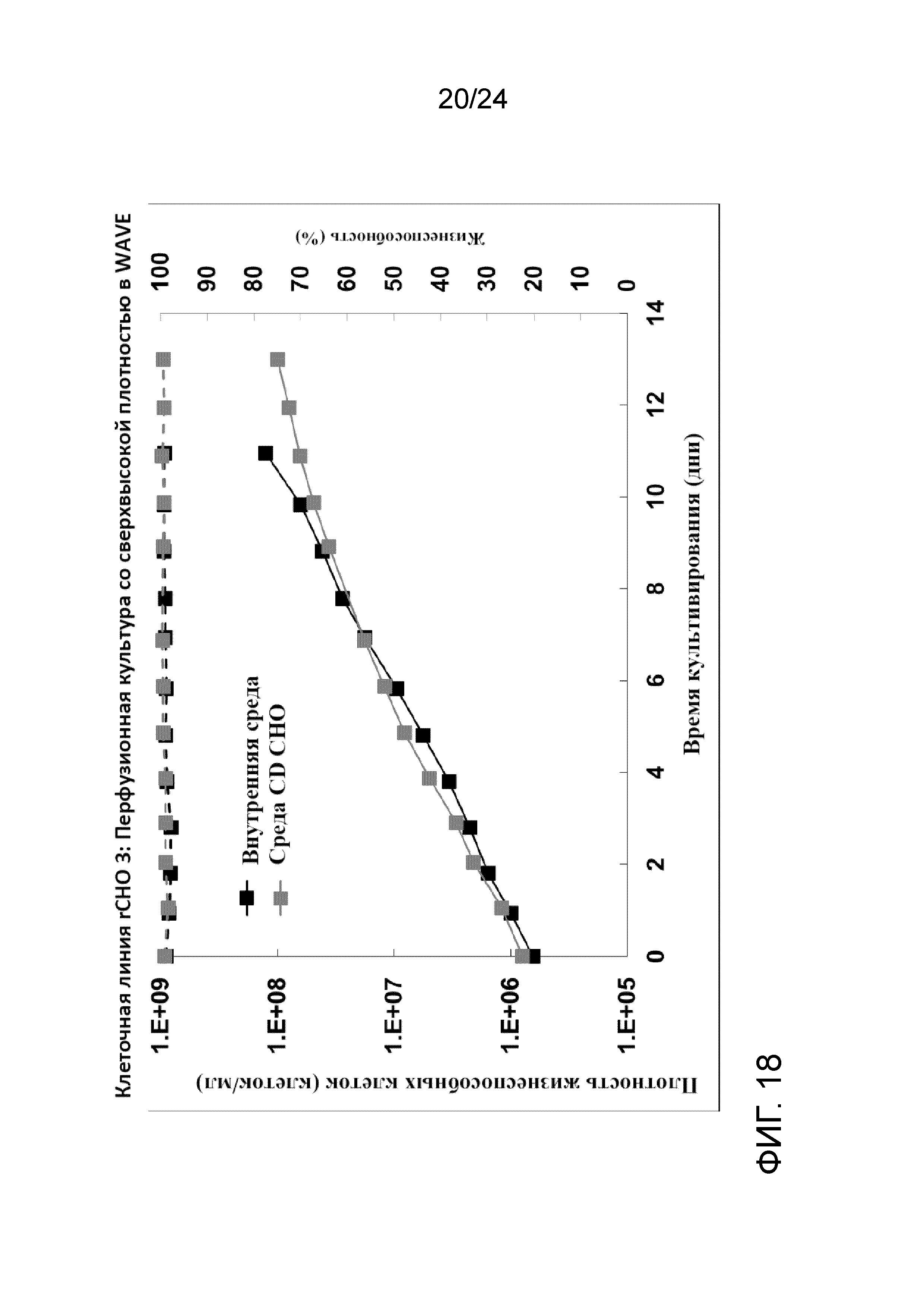
Фигура 18 представляет собой график, на котором сравнивают плотность жизнеспособных клеток (клеток/мл, сплошные линии) и жизнеспособность (пунктирные линии) с внутренней средой (черный цвет) и средой CD CHO (серый цвет) в иллюстративной культуре клеточной линии rCHO 3.
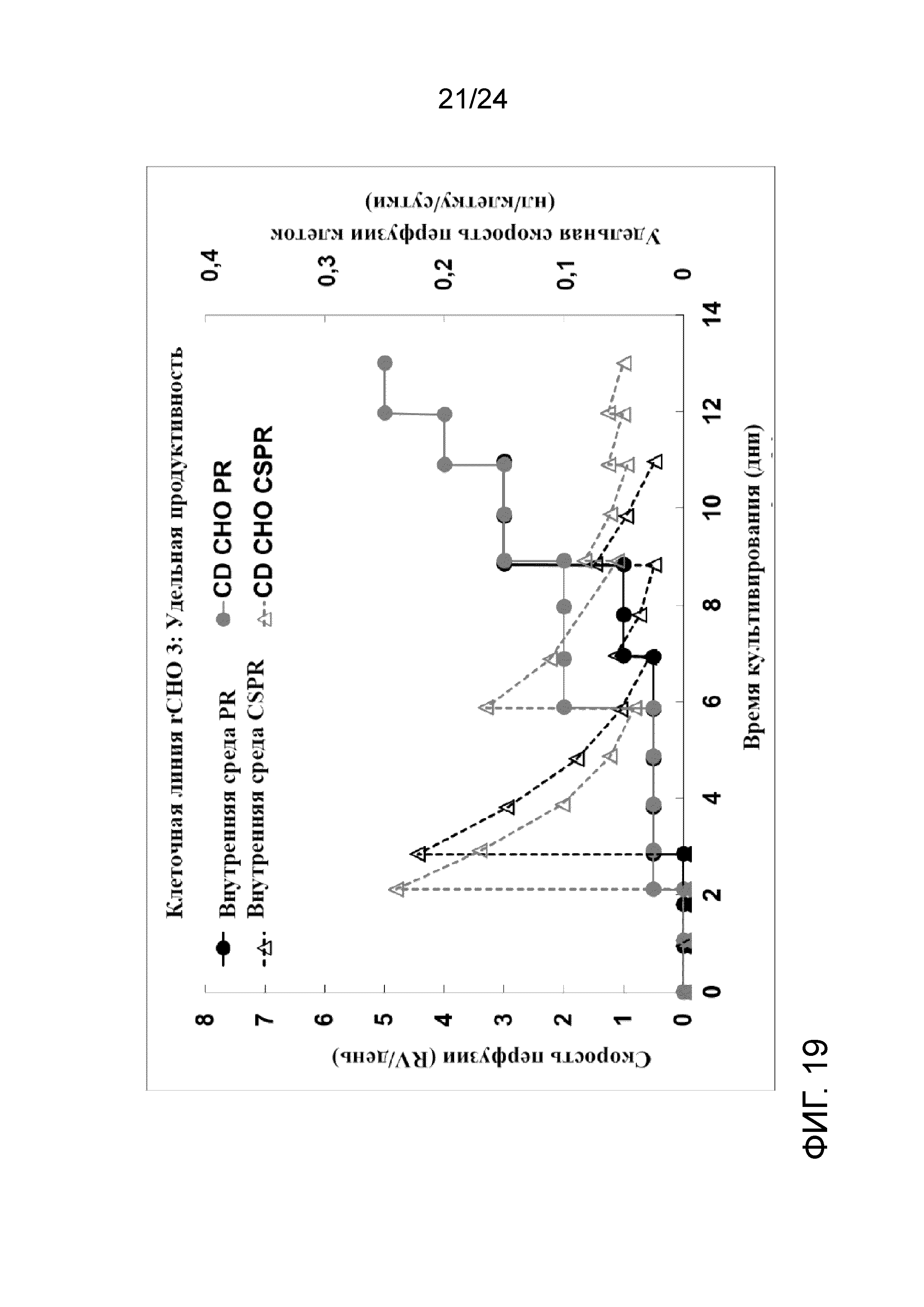
Фигура 19 представляет собой график, на котором сравнивают скорость перфузии (круги, сплошные линии) и удельную скорость перфузии клеток (треугольники, пунктирные линии) с внутренней средой (черный цвет) и средой CD CHO (серый цвет) в иллюстративной культуре клеточной линии rCHO 3.
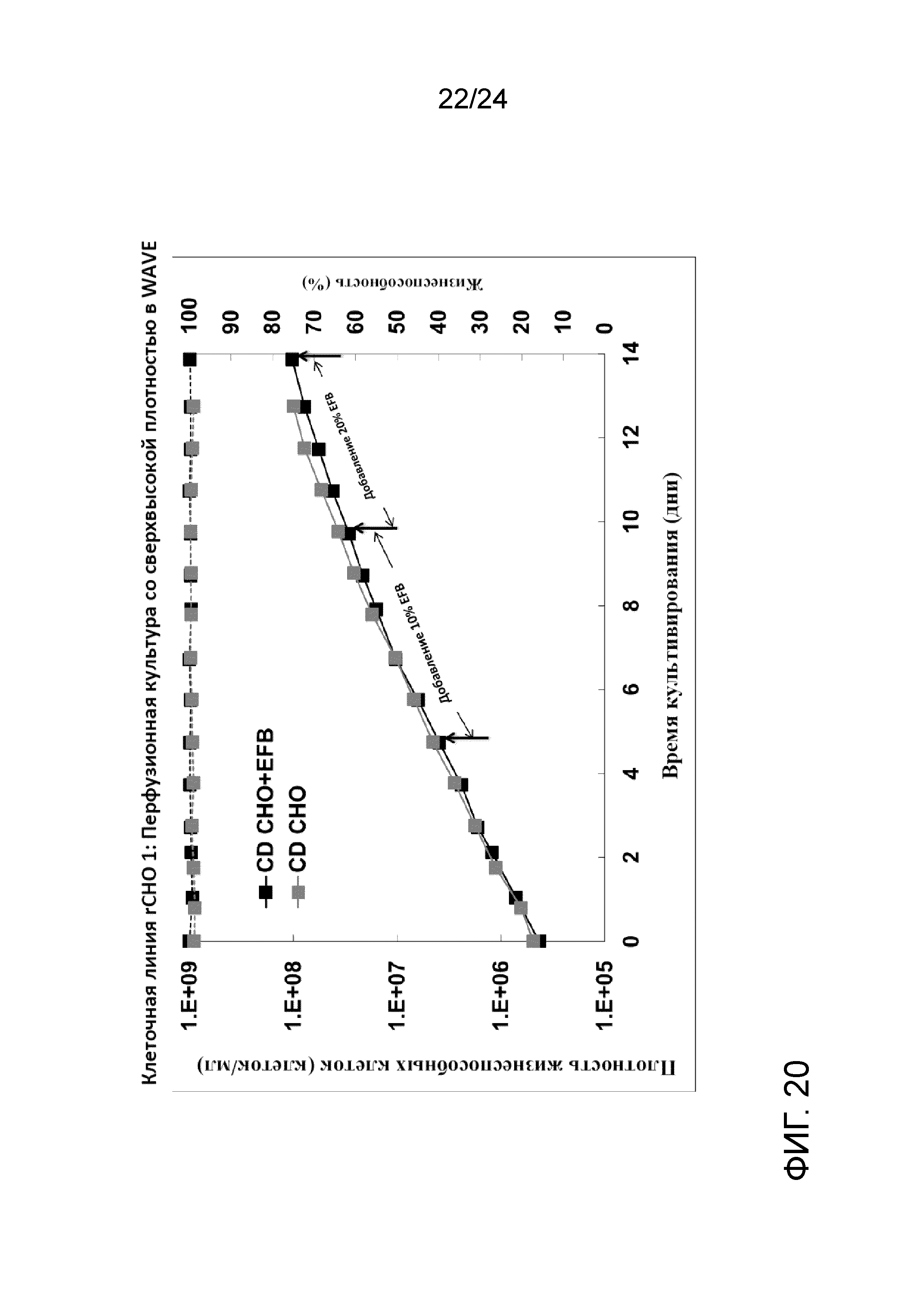
Фигура 20 представляет собой график, на котором сравнивают плотность жизнеспособных клеток (клеток/мл, сплошные линии) и жизнеспособность (пунктирные линии) со средой CD СНО, дополненной Efficient Feed B, (черный цвет) и средой CD CHO (серый цвет) в иллюстративной культуре клеточной линии rCHO1.
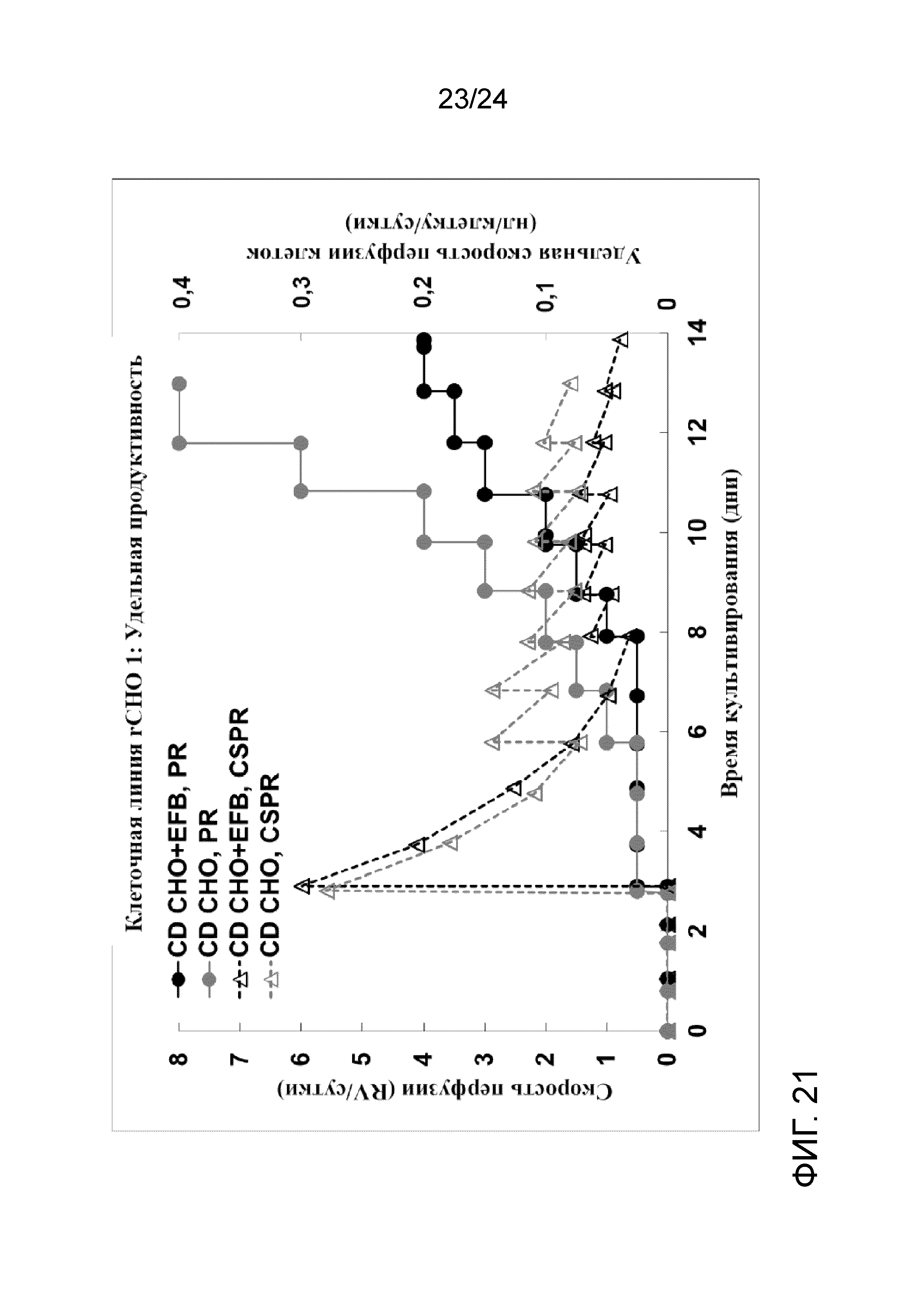
Фигура 21 представляет собой график, на котором сравнивают скорость перфузии (круги, сплошные линии) и удельную скорость перфузии клеток (треугольники, пунктирные линии) со средой CD СНО, дополненной Efficient Feed B, (черный цвет) и средой CD CHO (серый цвет) в иллюстративной культуре клеточной линии rCHO 1.
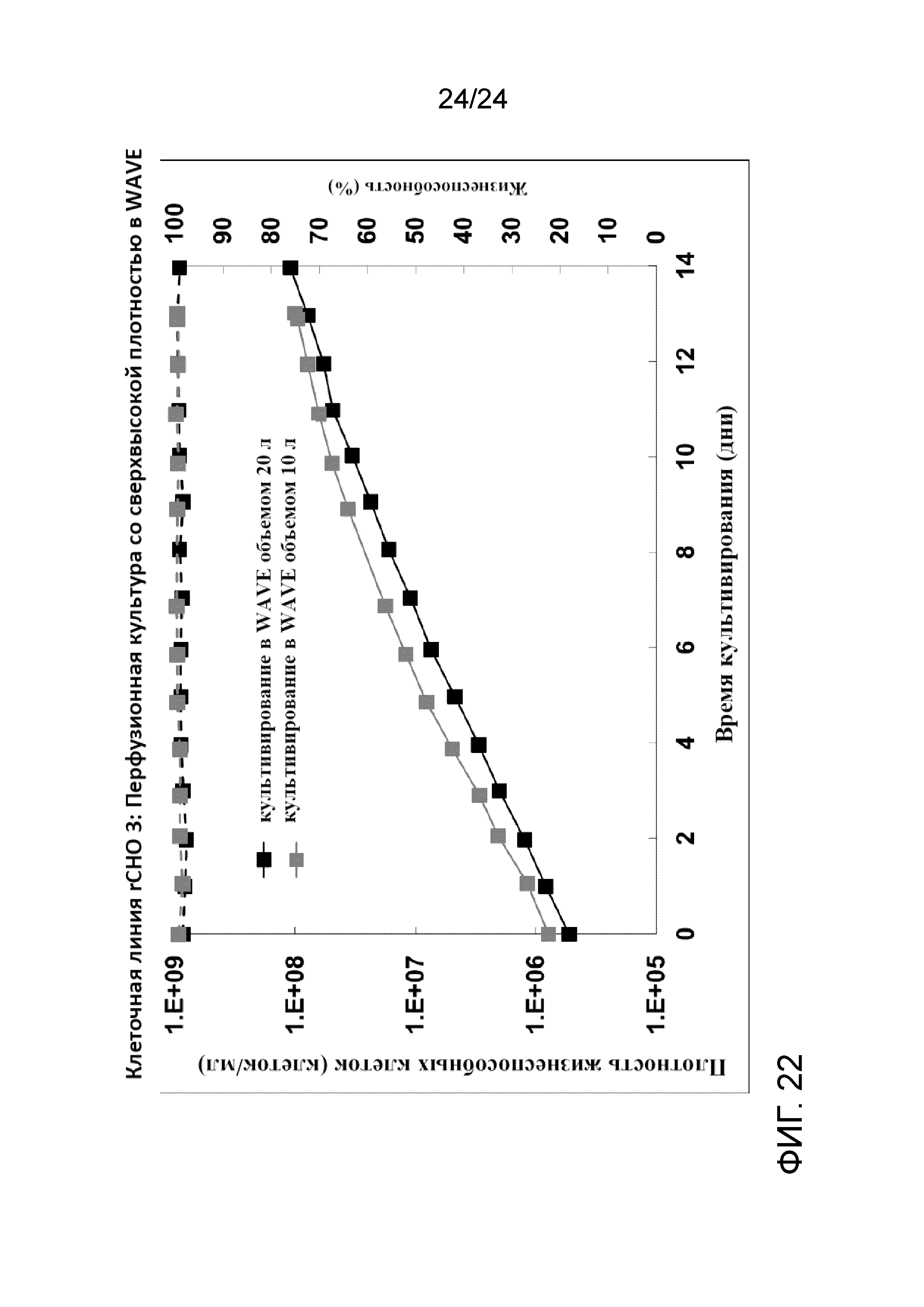
Фигура 22 представляет собой график, отображающий плотность жизнеспособных клеток (клеток/мл, сплошные линии) и жизнеспособность (пунктирные линии) с применением биореактора WAVE объемом 20 л (рабочий объем 10 л, черный цвет) и биореактора WAVE объемом 10 л (рабочий объем 5 л, серый цвет) в иллюстративной культуре клеточной линии rCHO 3.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее раскрытие обеспечивает способ создания криобанка клеток со сверхвысокой плотностью, который включает применение системы культивирования в условиях перфузии, связанной с устройством для удерживания клеток, отличающимся от центрифужного.
I. Определения
Применяемое в данном документе выражение "периодическое культивирование" относится к способу культивирования клеток, в котором в порцию свежей среды для культивирования инокулируют клетки, которые быстро входят в логарифмическую фазу роста и в котором питательную среду для культуры не удаляют непрерывно и не заменяют свежей средой.
Применяемое в данном документе выражение "периодическое культивирование с подпиткой" относится к способу культивирования клеток, в котором в порцию свежей среды для культивирования сначала инокулируют клетки, а дополнительные питательные вещества для культивирования подают (непрерывно или дискретными приращениями) в культуру во время процесса культивирования с или без периодического сбора клеток и/или продукта до прекращения культивирования.
Применяемое в данном документе выражение "культивирование в условиях перфузии" относится к способу культивирования клеток, в котором в порцию свежей среды инокулируют клетки, которые быстро входят в логарифмическую фазу роста (как указано выше) и в котором питательную среду непрерывно удаляют из культуры и заменяют свежей средой.
Применяемое в данном документе выражение "биореактор" относится к сосуду для культивирования клеток.
В одном варианте осуществления биореактор представляет собой "биореактор в виде эластичного мешка". "Биореактор в виде эластичного мешка" представляет собой стерильную камеру, способную принимать жидкую среду и инокулят клеток, который дополнительно содержит соединители, порты, адаптеры и гибкие трубки. В одном варианте осуществления камера изготовлена из пластика. В конкретном варианте осуществления камера изготовлена из многослойного листового прозрачного пластика. В другом конкретном варианте осуществления камера изготовлена из многослойного листового прозрачного пластика и содержит контактный слой с жидкостью, изготовленный из сополимера этилена с винилацетатом/полиэтилена низкой плотности USP класса VI, в то время как наружный слой изготовлен из полиэтилена низкой плотности.
Кроме того, соединители, порты и адаптеры могут быть изготовлены из любого вида пластика, включая без ограничения полиэтилен, полипропилен и поликарбонат; в то время как трубки могут быть изготовленыиз любого вида пластика, включая без ограничения термопластичный эластомер или силикон (например, силикон на платиновой основе).
Подходящие биореакторы в виде эластичного мешка можно обычно найти в данной области техники и включают без ограничения те, которые описаны в патенте США № 6544788, который включен в данный документ посредством ссылки во всей своей полноте.
Биореактор в виде эластичного мешка может быть частично наполнен средой для культивирования, а затем заполнен воздухом до жесткости. Затем он может быть помещен на качающуюся платформу (например, качающийся блок BASE20/50EHT от GE Life Sciences), которая перемещается назад и вперед посредством заданного угла качания и заданной скорости качания. Это качательное движение вызывает волнообразные перемещения в среде для культивирования, способствуя перемешиванию и переносу кислорода для улучшения характеристики клеточной культуры. Заданный угол качания может составлять по меньшей мере приблизительно 4 градуса, например, приблизительно 4 градуса, 5 градусов, 6 градусов, 7 градусов, 8 градусов, 9 градусов, 10 градусов, 11 градусов или 12 градусов. Кроме того, заданную скорость качания можно задавать как скорость оборотов в минуту (об./мин.), которая составляет по меньшей мере приблизительно 6 об./мин, например, приблизительно 6 об./мин., приблизительно 7 об./мин., 8 об./мин., 9 об./мин., 10 об./мин., 11 об./мин., 12 об./мин., 13 об./мин., 14 об./мин., 15 об./мин., 16 об./мин., 17 об./мин., 18 об./мин., 19 об./мин., 20 об./мин., 21 об./мин., 22 об./мин., 23 об./мин., 24 об./мин., 25 об./мин., 26 об./мин., 27 об./мин., 28 об./мин., 29 об./мин., 30 об./мин., 31 об./мин., 32 об./мин., 33 об./мин., 34 об./мин., 35 об./мин., 36 об./мин., 37 об./мин., 38 об./мин., 39 об./мин. или 40 об./мин. В конкретном варианте осуществления скорость оборотов в минуту составляет приблизительно 22 об./мин.
Применяемое в данном документе выражение "система удерживания клеток" относится ко всем устройствам, способным отделять клетки и отработанные продукты из среды с помощью фильтра. Фильтры могут включать мембранные, керамические или металлические фильтры любой формы, включая спиральные, трубчатые или пластинчатые. Фильтры могут иметь разные площади поверхности. Например, площадь поверхности фильтра может составлять от приблизительно 0,08 м2 до приблизительно 5,5 м2, например, приблизительно 0,08 м2, 0,09 м2, 0,1 м2, 0,2 м2, 0,3 м2, 0,4 м2, 0,5 м2, 0,6 м2, 0,7 м2, 0,77 м2, 0,8 м2, 0,9 м2, 1,0 м2, 1,1 м2, 1,2 м2, 1,3 м2, 1,4 м2, 1,5 м2, 1,6 м2, 1,7 м2, 1,8 м2, 1,9 м2, 2,0 м2, 2,1 м2, 2,2 м2, 2,3 м2, 2,4 м2, 2,5 м2, 2,6 м2, 2,7 м2, 2,8 м2, 2,9 м2, 3,0 м2, 3,1 м2, 3,2 м2, 3,3 м2, 3,4 м2, 3,5 м2, 3,6 м2, 3,7 м2, 3,8 м2, 3,9 м2, 4,0 м2, 4,1 м2, 4,2 м2, 4,3 м2, 4,4 м2, 4,5 м2, 4,6 м2, 4,7 м2, 4,8 м2, 4,9 м2, 5,0 м2, 5,1 м2, 5,2 м2, 5,3 м2, 5,4 м2 или 5,5 м2. В некоторых вариантах осуществления величина номинально отсекаемой молекулярной массы (MWCO) фильтрующего модуля составляет от приблизительно 10 килодальтон (кДа) до приблизительно 100 кДа, например, она составляет приблизительно 10 кДа, 20 кДа, 30 кДа, 40 кДа, 50 кДа, 60 кДа, 70 кДа, 80 кДа, 90 кДа или 100 кДа. В других вариантах осуществления размер ячеек фильтрующего модуля составляет от приблизительно 0,1 мкм до приблизительно 7 мкм, например, приблизительно 0,1 мкм, 0,2 мкм, 0,3 мкм, 0,4 мкм, 0,5 мкм, 0,6 мкм, 0,7 мкм, 0,8 мкм, 0,9 мкм, 1,0 мкм, 1,1 мкм, 1,2 мкм, 1,3 мкм, 1,4 мкм, 1,5 мкм, 1,6 мкм, 1,7 мкм, 1,8 мкм, 1,9 мкм, 2,0 мкм, 2,1 мкм, 2,2 мкм, 2,3 мкм, 2,4 мкм, 2,5 мкм, 2,6 мкм, 2,7 мкм, 2,8 мкм, 2,9 мкм, 3,0 мкм, 3,1 мкм, 3,2 мкм, 3,3 мкм, 3,4 мкм, 3,5 мкм, 3,6 мкм, 3,7 мкм, 3,8 мкм, 3,9 мкм, 4,0 мкм, 4,1 мкм, 4,2 мкм, 4,3 мкм, 4,4 мкм, 4,5 мкм, 4,6 мкм, 4,7 мкм, 4,8 мкм, 4,9 мкм, 5,0 мкм, 5,1 мкм, 5,2 мкм, 5,3 мкм, 5,4 мкм, 5,5 мкм, 5,6 мкм, 5,7 мкм, 5,8 мкм, 5,9 мкм, 6,0 мкм, 6,1 мкм, 6,2 мкм, 6,3 мкм, 6,4 мкм, 6,5 мкм, 6,6 мкм, 6,7 мкм, 6,8 мкм, 6,9 мкм или 7,0 мкм.
Применяемое в данном документе выражение "криоконсервация" относится к способу, посредством которого клетки, ткани или любые другие вещества, восприимчивые к повреждению, вызванному временем или ферментативной или химической активностью, сохраняют путем охлаждения и хранения при температурах ниже нуля.
Применяемое в данном документе выражение "создание криобанка" относится к способу, посредством которого клетки смешивают с криопротектором (например, DMSO с гидроксиэтилкрахмалом (HES) или без него) и помещают в контейнер, подходящий для хранения в условиях криоконсервации. Эти контейнеры затем замораживают с применением методов, хорошо известных в данной области техники, и хранят при низких температурах, обычно от приблизительно -130°С до приблизительно -196°С. Коллекция клеток, полученных данным способом, представляет собой банк клеток.
В одном варианте осуществления банк клеток представляет собой банк клеток со сверхвысокой плотностью. Применяемое в данном документе выражение "банк клеток со сверхвысокой плотностью" относится к аликвотам созданного криобанка клеток, которые были заморожены при сверхвысокой плотности, при этом плотность составляет по меньшей мере приблизительно 1×108 жизнеспособных клеток/мл, например, приблизительно 1×108 жизнеспособных клеток/мл, приблизительно 1,1×108 жизнеспособных клеток/мл, приблизительно 1,2×108 жизнеспособных клеток/мл, приблизительно 1,3×108 жизнеспособных клеток/мл, приблизительно 1,4×108 жизнеспособных клеток/мл, приблизительно 1,5×108 жизнеспособных клеток/мл, приблизительно 1,6×108 жизнеспособных клеток/мл, приблизительно 1,7×108 жизнеспособных клеток/мл, приблизительно 1,8×108 жизнеспособных клеток/мл, приблизительно 1,9×108 жизнеспособных клеток/мл, приблизительно 2×108 жизнеспособных клеток/мл, приблизительно 3×108 жизнеспособных клеток/мл, приблизительно 4×108 жизнеспособных клеток/мл или приблизительно 5×108 жизнеспособных клеток/мл. Клетки могут быть заморожены в соответствии с любым способом, доступным в данной области техники, и в любом контейнере, подходящем для хранения в условиях криоконсервации.
В другом варианте осуществления банк клеток представляет собой главный банк клеток. Применяемое в данном документе выражение "главный банк клеток" относится к культуре клеток (например, полностью охарактеризованных клеток), которая была выращена из одного клона, распределена в контейнеры для хранения (например, распределена в контейнеры за одну операцию) и помещена на хранение в условиях криоконсервации, как описано выше. В некоторых вариантах осуществления клетки пригодны для последующего применения в получении культуры клеток и дальнейшего получения терапевтически значимых белков, продуцируемых ею.
В другом варианте осуществления банк клеток представляет собой рабочий банк клеток. Применяемое в данном документе выражение "рабочий банк клеток" относится к культуре клеток (например, полностью охарактеризованных клеток), которая была выращена из одного флакона главного банка клеток или из двух объединенных флаконов главного банка клеток, распределена в контейнеры для хранения (например, распределена в контейнеры за одну операцию) и помещена на хранение в условиях криоконсервации, как описано выше. В некоторых вариантах осуществления клетки пригодны для последующего применения в получении культуры клеток и дальнейшего получения терапевтически значимых белков, продуцируемых ею.
В другом варианте осуществления банк клеток представляет собой мини банк клеток. Применяемое в данном документе выражение "мини-банк" относится к аликвотам клеток, которые были криоконсервированы в соответствии со способами "создания криобанка" (описанными выше), но состоят из меньшего количества образцов, чем обычно применяют для создания банка клеток. Данный тип банка, как правило, можно применять для оптимизации условий, рассматриваемых для криоконсервации клеточной линии, перед созданием банков клеток, таких как "главный банк клеток". В качестве примера "мини-банк" применяют для определения оптимальной плотности клеток для способа создания банка клеток со сверхвысокой плотностью, описанного в настоящем раскрытии.
Применяемое в данном документе выражение "контейнер, пригодный для хранения в условиях криоконсервации" включает любой контейнер, который можно применять в условиях, подходящих для хранения клеток, от приблизительно -130°C до приблизительно -196°C. Эти контейнеры включают без ограничения флаконы, которые изготовлены из материалов, пригодных для криоконсервирования. Данные материалы включают полимеры (например, политетрафторэтилен, полистирол, полиэтилен или полипропилен). Кроме того, можно применять поверхностную обработку поверхности флакона для криоконсервирования для улучшения условий криоконсервации (например, гидрофильные покрытия, которые снижают адсорбцию и денатурацию). В иллюстративных вариантах осуществления объем флакона может составлять более чем приблизительно 0,1 мл, например, объем флакона может составлять приблизительно 0,1 мл, приблизительно 0,5 мл, приблизительно 0,75 мл, приблизительно 1 мл, приблизительно 1,5 мл, приблизительно 2 мл, приблизительно 2,5 мл, приблизительно 4,5 мл, приблизительно 10 мл, приблизительно 15 мл, приблизительно 20 мл, приблизительно 25 мл или приблизительно 50 мл. Контейнер также может представлять собой криопакет, объем которого может составлять приблизительно 30 мл, приблизительно 50 мл, приблизительно 100 мл, приблизительно 150 мл, приблизительно 200 мл, приблизительно 300 мл, приблизительно 400 мл или приблизительно 500 мл.
Применяемое в данном документе выражение "криопакет" относится к стерильной камере, которая способна принимать жидкую среду, подходит для хранения клеток от приблизительно -130°С до приблизительно -196°С и может дополнительно содержать соединители, порты, адаптеры и гибкие трубки. Криопакет может быть изготовлен из любого подходящего материала, включая без ограничения полимеры, такие как политетрафторэтилен (PTFE), полистирол, полиэтилен, полипропилен, фторированный этиленпропилен (FEP), полиолефин и этиленвинилацетат (EVA). Иллюстративные криопакеты включают без ограничения пакеты для криоконсервации KryoSure® (Saint-Gobain), пакеты PermaLife ™ (OriGen Biomedical), пакеты для замораживания CryoStore (OriGen Biomedical), биоконтейнеры Freeze-Pak™ (Charter Medical) и пакеты, описанные в предварительной заявке на патент США № 62/037181 (Merial Ltd., компания Sanofi), которая включена в данный документ посредством ссылки во всей своей полноте. В некоторых вариантах осуществления криопакет может поддерживать систему закрытой фазы создания банка клеток (например, посредством применения по меньшей мер двух стерильно свариваемых трубок, позволяющих наполнять "закрытую систему" пакета).
Применяемое в данном документе выражение "встряхиваемая колба" относится к сосуду, применяемому в качестве колбы для культивирования, в которой среду и клеточную культуру постоянно перемешивают во время инкубации.
Применяемое в данном документе выражение "система посева во встряхиваемой колбе" относится к способу распространения клеток, в котором аликвоту клеток сначала культивируют (высевают) во встряхиваемой колбе и выращивают в ней. Клетки культивируют в соответствии с их скоростью роста и обычно разделяют в более крупные и/или несколько сосудов во время их роста до тех пор, пока биомасса не достигнет уровня, достаточного для инокуляции биореактора.
Применяемое в данном документе выражение "плотность посевного материала" относится к начальной плотности клеток, при которой инокулируют в колбу или биореактор.
Применяемое в данном документе выражение "терапевтически значимый белок" относится к любому белку, который можно применять для осуществления лечения заболевания или нарушения или для лечения заболевания или нарушения у животного, включая млекопитающих, таких как мыши, крысы, обезьяны, приматы и люди. Такие белки могут включать без ограничения связывающие полипептиды, такие как моноклональные антитела, слитые белки Fc, антикоагулянты, факторы крови, морфогенетические белки костей, искусственные белковые каркасы, ферменты, факторы роста, гормоны, интерфероны, интерлейкины и тромболитики.
Применяемое в данном документе выражение "связующий полипептид" или "связывающий полипептид" относится к полипептиду (например, антителу), который содержит по меньшей мере один сайт связывания, который ответственен за избирательное связывание с представляющим интерес целевым антигеном (например, антигеном человека). Иллюстративные сайты связывания включают вариабельный домен антитела, сайт связывания лиганда рецептора или сайт связывания рецептора лиганда. В определенных аспектах связывающие полипептиды содержат многочисленные (например, два, три, четыре или более) сайты связывания.
Применяемое в данном документе выражение "антитело" относится к таким скоплениям (например, молекулам интактного антитела, фрагментам антитела или их вариантам), которые обладают значительной известной специфической иммунореактивной активностью к представляющему интерес антигену (например, ассоциированному с опухолью антигену). Антитела и иммуноглобулины содержат легкие и тяжелые цепи с межцепочечной ковалентной связью между ними или без нее. Основные структуры иммуноглобулинов у позвоночных организмов относительно хорошо изучены.
Общее выражение "антитело" включает пять различных классов антител, которые можно различить по биохимическим свойствам. Все пять классов антител несомненно входят в объем настоящего раскрытия; последующее обсуждение будет, в основном, направлено на молекулы иммуноглобулина класса IgG. Что касается IgG, иммуноглобулины включают две идентичные легкие цепи с молекулярной массой приблизительно 23000 дальтон и две идентичные тяжелые цепи с молекулярной массой 53000-70000 дальтон. Эти четыре цепи соединены дисульфидными связями в конфигурации "Y", где соединение легких цепей с тяжелыми цепями начинается в устье "Y" и продолжается по вариабельной области.
Применяемое в данном документе выражение "растворенный кислород" или "DO" представляет собой процент растворенного газообразного кислорода, присутствующего в данной жидкости (такой, как среда для культивирования клеток), на основе насыщенности воздуха.
Применяемое в данном документе выражение "удельная скорость перфузии клеток" (CSPR) относится к скорости, с которой среду для культивирования клеток подают в клеточную культуру, выраженной как объем среды, добавляемый на жизнеспособную клетку в сутки (Ozturk, SS. Engineering challenges in high density culture systems. Cytotechnology. 1996; 22:3-16).
Применяемое в данном документе выражение "приблизительно" относится к диапазону допуска 10% вокруг указанного значения. Поэтому, когда выражение "приблизительно" применяют для изменения указанного значения, указанный диапазон будет охватывать любое число в пределах ± 0,01%, 0,02%, 0,05%, 0,1%, 0,2%, 0,5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10% от указанного значения.
II. Культивирование клеток в условиях перфузии
Традиционное культивирование клеток включает способ "периодического" культивирования. В таком виде культивирования в порцию свежей среды инокулируют клетки, которые быстро входят в логарифмическую фазу роста. Поскольку данные клетки растут и делятся, они потребляют доступные питательные вещества из среды и выделяют вредные отработанные продукты. Со временем культура входит в фазу стационарного роста и, наконец, в фазу отмирания. Хотя модификации способа "периодического" культивирования сделали его более эффективным с течением времени, созданные модифицированные протоколы периодического культивирования все же приводят к циклам быстрого роста и отмирания. Кроме того, способ "периодического" культивирования характеризуется ограниченной способностью достигать необходимых уровней плотности клеток, чтобы обеспечить создание банков клеток со сверхвысокой плотностью.
Способ "периодического культивирования с подпиткой" относится к дальнейшему усовершенствованию метода культивирования клеток по сравнению с традиционными методами "периодического" культивирования. Хотя этот процесс допускает более высокий рост плотности клеток, он по-прежнему ограничен в своей способности обеспечивать эффективный рост клеточных культур с высокой плотностью и, следовательно, эффективно образовывать клетки для создания банка клеток с высокой плотностью.
В предпочтительных вариантах осуществления в настоящем изобретении применяют способ культивирования в условиях перфузии. Культивирование в условиях перфузии представляет собой способ выращивания клеток, в котором в порцию свежей среды инокулируют клетки, которые быстро входят в логарифмическую фазу роста (как указано выше) и в котором питательную среду непрерывно удаляют из культуры и заменяют свежей средой. Таким образом, культура постоянно получает свежую среду с высоким содержанием питательных веществ, в то время как среда, содержащая отработанные продукты и более низкие уровни питательных веществ, удаляется. Этот вид культивирования позволяет поддерживать логарифмический рост клеток, и в котором по меньшей мере половина объема культуры меняется за сутки, и значения плотности клеток могут быть намного выше, чем при традиционном или модифицированном периодическом культивировании (увеличение от 2 до более чем 10 раз). В одном варианте осуществления настоящего изобретения удельная скорость перфузии клеток (CSPR) может составлять от приблизительно 0,02 нл/клетку-1/сутки-1 до приблизительно 0,5 нл/клетку-1/сутки-1; например, может составлять приблизительно 0,02 нл/клетку-1/сутки-1, 0,025 нл/клетку-1/сутки-1, 0,05 нл/клетку-1/сутки-1, 0,1 нл/клетку-1/сутки-1, 0,2 нл/клетку-1/сутки-1, 0,3 нл/клетку-1/сутки-1, 0,4 нл/клетку-1/сутки-1 или 0,5 нл/клетку-1/сутки-1. В другом варианте осуществления настоящего изобретения скорость перфузии может быть измерена в объемах реактора в сутки и может составлять от 0 до 15 объемов реактора в сутки, например, может составлять приблизительно 0 объемов реактора в сутки, приблизительно 0,5 объема реактора в сутки, приблизительно 1 объем реактора в сутки, приблизительно 2 объема реактора в сутки, приблизительно 3 объема реактора в сутки, приблизительно 4 объема реактора в сутки, приблизительно 5 объемов реактора в сутки, приблизительно 6 объемов реактора в сутки, приблизительно 7 объемов реактора в сутки, приблизительно 8 объемов реактора в сутки, приблизительно 9 объемов реактора в сутки, приблизительно 10 объемов реактора в сутки, приблизительно 11 объемов реактора в сутки, приблизительно 12 объемов реактора в сутки, приблизительно 13 объемов реактора в сутки, приблизительно 14 объемов реактора в сутки или приблизительно 15 объемов реактора в сутки. В конкретном варианте осуществления культивирование в условиях перфузии можно проводить в биореакторе с минимум одной погружной трубкой.
В некоторых вариантах осуществления рН, температура, концентрация растворенного кислорода (DO) и осмолярность культуры можно скорректировать, чтобы максимально увеличить жизнеспособность и продуктивность культуры. Один из способов контроля DO и pH культур осуществляется с помощью автоматического регулятора с обратной связью. Такой тип автоматического регулятора работает с применением микропроцессорных компьютеров для контроля и регулирования pH и DO культуры и тем самым поддержания оптимальных условий для роста клеток. Однако такие автоматические системы управления с обратной связью являются дорогостоящими. Соответственно, в некоторых вариантах осуществления могут применять неавтоматический способ управления данными параметрами. В одном иллюстративном варианте осуществления можно применять любое из: регулирование подаваемой газовой смеси в культуру, регулирование скорости качания WAVE® или регулирование угла качания культуры для управления выбранными параметрами (например, pH или DO). В некоторых вариантах осуществления могут применяться как автоматическое управление с обратной связью, так и неавтоматическое управление.
В одном варианте осуществления исходный уровень газообразного диоксида углерода составляет приблизительно 10%, а исходный уровень газообразного кислорода составляет приблизительно 20% при расходе воздуха около 0,2 литра в минуту (л/мин.). Если pH не превышает 6,9, заданное значение CO2 может быть снижено с 10% до 5%. Если через момент времени pH все еще не превышает 6,9, заданное значение CO2 может быть дополнительно уменьшено с 5% до 0%. Если через момент времени pH все еще не превышает 6,9, скорость перфузии можно увеличить. Если DO составляет не более 45%, заданное значение O2 должно быть увеличено с 20% до 30%. Если через момент времени DO составляет не более 45%, уровень O2 должен быть увеличен с 30% до 40%, скорость качания должна быть увеличена до 25 об./мин., а угол качания должен быть изменен примерно до 12°.
i. Среда для культивирования клеток
В способах по настоящему изобретению можно применять любой тип среды для культивирования, подходящий для культивирования клеток. Рекомендации по выбору подходящей среды для клеток хорошо известны в данной области техники и представлены, например, в главах 8 и 9 в Freshney, R. I. Culture of Animal Cells (руководство по основным методам), 4-е издание 2000, Wiley-Liss; и в Doyle, A., Griffiths, J.B., Newell, D.G. Cell & Tissue Culture: Laboratory Procedures 1993, John Wiley & Sons. Каждая из этих ссылок включена в данный документ посредством ссылки во всей полноте. В данной области техники известны другие способы получения и поддержания клеточных культур в условиях без содержания компонентов животного происхождения и белков (включая способы, касающиеся клеток СНО), такие как описанные в международных заявках на патенты № WO 97/05240, № WO 96/26266 и № WO 00/11102, а также в патентах США № 6100061, № 6475725 и № 8084252. Каждый из предыдущих документов включен в данный документ посредством ссылки во всей своей полноте. В одном варианте осуществления настоящего изобретения можно применять среду без содержания компонента животного происхождения (ADC). Традиционная синтетическая среда с минимальными требованиями может содержать неорганические соли, аминокислоты, витамины, источник углеводов и воду. В конкретном варианте осуществления настоящего изобретения средой, которую можно применять, является CD-CHO (GIBCO, Invitrogen Corp., среда, не содержащая компонентов животного происхождения, которая химически определена и не содержит белков, гидролизатов или компонентов неизвестного происхождения). Кроме того, среда может содержать дополнительные компоненты, включая глютамин и/или метотрексат, или другие факторы, которые могут способствовать росту или адгезии. В конкретном варианте осуществления дополнительным компонентом могут являться GLUTAMAX-1 или L-глутамин, добавленные в количестве от приблизительно 2 мМ до приблизительно 8 мМ, например, приблизительно 2 мМ, приблизительно 3 мМ, приблизительно 4 мМ, приблизительно 5 мМ, приблизительно 6 мМ, приблизительно 7 мМ или приблизительно 8 мМ.
ii. Клетки-хозяева и векторы экспрессии
В некоторых вариантах осуществления клетки, задействованные в способе создания банка клеток по настоящему изобретению, представляют собой клетки-хозяева, несущие экспрессионную конструкцию для экспрессии терапевтически значимого белка или другого представляющего интерес полипептида. Любую клетку, которая может быть применена для экспрессии представляющего интерес полипептида (например, связывающего полипептида), можно применять в соответствии с описанными в данном документе способами. Клетки могут необязательно содержать встречающиеся в природе или рекомбинантные последовательности нуклеиновых кислот; например, вектор экспрессии, который кодирует представляющий интерес полипептид. Вектор экспрессии может необязательно содержать подходящие регуляторы транскрипции и трансляции и может быть сконструирован с применением технологии рекомбинантной ДНК, известной в данной области техники. Векторы экспрессии могут быть перенесены в любую клетку-хозяин методами, известными в данной области техники, и затем трансформированные клетки могут быть культивированы в соответствии со способом по настоящему изобретению для создания банка клеток с высокой плотностью. Кроме того, банк клеток с высокой плотностью можно затем размораживать и культивировать в соответствии с методами, известными в данной области техники, с целью получения интересующего кодируемого белка и, если необходимо, такой белок можно затем очищать.
В некоторых вариантах осуществления для получения терапевтически значимых белков можно применять различные системы экспрессии клетки-хозяина. Кроме того, система экспрессии клетки-хозяина может быть системой клетки млекопитающего (например, CHO, CHO-DBX11, CHO-DG44, CHO-S, CHO-K1, Vero, BHK, HeLa, COS, MDCK, HEK-293, NIH-3T3, W138, BT483, Hs578T, HTB2, BT20, T47D, NS0, CRL7030, HsS78Bst, PER.C6, SP2/0-Agl4 и гибридомные клетки), несущей рекомбинантные экспрессионные конструкции, содержащие промоторы, полученные из генома клеток млекопитающего. Системы экспрессии на основе вируса также можно применять совместно с клетками млекопитающего (см., например, Logan et al., 1984, Proc. Nat. Acad. Sci. USA 8: 355-359, включенный в данный документ посредством ссылки во всей полноте). Эффективность экспрессии можно повысить путем включения элементов, включая (без ограничения) подходящие элементы энхансера транскрипции и терминаторы транскрипции (см., например, Bittner et al., 1987, Methods in Enzymol. 153:516-544, включенный в данный документ посредством ссылки во всей полноте).
В других вариантах осуществления можно выбрать штамм клетки-хозяина, который модулирует экспрессию вставленных последовательностей или который модифицирует и обрабатывает генный продукт определенным желаемым образом. Различные клетки-хозяева имеют характерные и специфические механизмы посттрансляционной обработки и модификации белков и генных продуктов. Можно выбирать подходящие клеточные линии или системы-хозяева для обеспечения правильной модификации и обработки экспрессированного полипептида (например, связывающего полипептида). Такие клетки включают, например, устойчивые клеточные линии млекопитающих и клетки животных, а также линии клеток насекомых, клетки грибов и дрожжевые клетки.
iii. Биореакторы
Любой биореактор, подходящий для культивирования клеток в условиях перфузионной культуры, можно применять в способах по настоящему изобретению. Биореактор можно инокулировать с применением аликвоты клеток с соответствующей плотностью посевного материала (такой, как флакон клеток или клетки исходной культуры, например, из встряхиваемой колбы или системы посева во встряхиваемой колбе, которые были культивированы до данной плотности). Соответствующая плотность посевного материала для культуры зависит от нескольких факторов, включая вид применяемых клеток и биореактор, в который производят инокуляцию. Соответствующую плотность посевного материала можно определить с применением способов, доступных в данной области техники.
В определенных вариантах осуществления биореактор может быть одноразовым, например биореактор может представлять собой эластичный мешок или пластиковую колбу, которые соединены с устройством удерживания клеток посредством гибких трубок. Конструкция может необязательно включать трубку подачи и трубку вывода или трубку для инокуляции, которые могут быть стерильно сварены или соединены с источником эукариотических клеток. В некоторых вариантах осуществления объем биореактора составляет по меньшей мере приблизительно 1 л, например, приблизительно 1 л, 2 л, 5 л, 10 л, 20 л, 50 л, 75 л, 85 л, 100 л, 150 л или 400 л. В конкретном варианте осуществления настоящего изобретения биореактор представляет собой эластичный мешок объемом 10 л, который был оборудован одной или двумя погружными трубками, которые применяют для удаления среды или продукта. Примерами одноразовых биореакторов являются биореакторы для клеток WAVE® в виде мешка (GE Healthcare, Pittsburgh, PA), такой как биореактор WAVE® объемом 20 л. Данные системы перфузионного биореактора, среди других документов, описаны в Singh, 1999, Disposable bioreactor for cell culture using wave-induced agitation, Cytotechnology, p.149-158, включенном в данный документ посредством ссылки во всей полноте.
Рабочий объем реактора представляет собой объем, занимаемый культурой. Рабочий объем может составлять, например, приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70% или более от культуры, но предпочтительно не более чем приблизительно 75%.
Кроме того, биореактор может быть не одноразовым. Например, биореактор может быть изготовлен из нержавеющей стали или стекла. Другие биореакторы, подходящие для применения по настоящему изобретению, включают без ограничения встряхиваемые колбы, сосуды с мешалкой, барботажные сосуды и одноразовые мешки, которые могут перемешиваться путем качания, встряхивания или перемешивания.
В одном варианте осуществления биореактор может быть связан с системой удерживания клеток, включая без ограничения встроенные фильтры, картридж-сетки, системы фильтрации в тангенциальном потоке (TFF) и системы фильтрации в переменном тангенциальном потоке (ATF).
III. Удерживание клеток
Культивирование в условиях перфузии обусловлено способностью удалять обедненную на питательные вещества и содержащую отработанные продукты среду из культуры, при этом сводя к минимуму повреждение клеток. В первоначальных способах удерживания клеток, в которых обедненную среду отделяли от культивируемых клеток, часто повреждали клетки, например, создавая силу сдвига. Такое повреждение клеток приводило к закупориванию фильтров и отказу перфузионных устройств, многие из которых были внутри системы культивирования. Соответственно, в одном аспекте настоящее раскрытие предусматривает способ, который использует "систему удерживания клеток", позволяющую заменять среду.
В одном варианте осуществления применяемый вид системы удерживания клеток представляет собой фильтр "встроенного" типа, в котором фильтр расположен в камере биореактора и может свободно перемещаться внутри камеры. Фильтр может быть соединен с одной из трубок, выходящих из камеры, что позволяет отбирать фильтрованную среду из культуры. Один пример фильтра "встроенного" типа можно найти в патенте США № 6544788, включенном в данный документ посредством ссылки во всей полноте.
В другом варианте осуществления применяемая система удерживания клеток представляет собой систему фильтрации в тангенциальном потоке (TFF). В системе TFF среду для культивирования циркулируют из сосуда для культивирования через фильтрующий модуль, а затем обратно в сосуд для культивирования с помощью насоса, прикрепленного к трубопроводу между фильтрующим модулем и сосудом для культивирования, создавая тангенциальный поток через фильтрующий модуль. Второй насос помещен на сторону фильтрата в фильтрующем модуле и используется для управления скоростью, с которой удаляется фильтрат. Применение мембранных фильтров с полыми волокнами является предпочтительным в такой системе, поскольку их легче стерилизовать и обеспечивать поддержание равномерного потока через фильтрующий модуль. Однако, когда в такой системе применяют фильтры из полых волокон, они склонны к закупориванию, поскольку однонаправленный поток приводит к агрегации твердых частиц на входе в просвет.
В конкретном варианте осуществления тип применяемой системы удерживания клеток представляет собой систему с переменным тангенциальным потоком (ATF). В системе удерживания клеток типа ATF отсек для фильтрования соединен с сосудом для хранения на одном конце и диафрагменным насосом на другом. Насос сначала перемещает среду из сосуда через фильтрующий элемент в насос, а затем разворачивает ее, чтобы отправить среду из насоса через фильтр и обратно в сосуд, создавая двунаправленный или переменный поток. Это называется переменным тангенциальным потоком (ATF), поскольку на фильтровальном модуле существует переменный тангенциальный поток, т. е. есть один поток в том же направлении к поверхностям мембраны фильтрующего модуля (тангенциально к этой поверхности), и существует другой поток, который по существу перпендикулярен к этим поверхностям. Такой тип фильтрации встречается в литературе с 2000 года и сводится к быстрому, с низким сдвигом, однородному потоку. Фильтрации ATF можно достигнуть способами, известными в данной области техники, такими как описаны в патенте США № 6544424, который включен в данный документ посредством ссылки во всей его полноте. Кроме того, системы переменного тангенциального потока коммерчески доступны от таких производителей, как Refine Technology и включают различные модели, такие как системы ATF2, ATF4, ATF6, ATF8 и ATF10.
В другом конкретном варианте осуществления изобретения фильтр представляет собой трубчатый мембранный фильтр и, кроме того, может представляет собой фильтр с полыми волокнами.
Как указано выше, способы по настоящему изобретению обеспечивают эффективный рост клеток до сверхвысоких плотностей. В конкретном варианте осуществления настоящего изобретения культуру выращивают до плотности по меньшей мере приблизительно 1×108 клеток/мл, например, до приблизительно 1×108 клеток/мл, приблизительно 1,1×108 клеток/мл, приблизительно 1,2×108 клеток/мл, приблизительно 1,3×108 клеток/мл, приблизительно 1,4×108 клеток/мл, приблизительно 1,5×108 клеток/мл, приблизительно 1,6×108 клеток/мл, приблизительно 1,7×108 клеток/мл, приблизительно 1,8×108 клеток/мл, приблизительно 1,9×108 клеток/мл или приблизительно 2×108 клеток/мл. Рост культуры до таких высоких концентраций позволяет немедленно криоконсервировать исходные материалы с высокой плотностью без дальнейшей концентрации клеточной популяции посредством центрифужных или нецентрифужных способов.
IV. Криоконсервация и создание банка клеток
Криоконсервация относится к способу, посредством которого клетки, ткани или любые другие вещества, восприимчивые к повреждению, вызванному временем или ферментативной или химической активностью, сохраняют путем охлаждения и хранения при температурах ниже нуля. Важность криоконсервации важных клеточных линий нельзя недооценивать, так как (среди других важных преимуществ) это позволяет поддерживать такие линии без поддержания их в постоянной культуре, уменьшает риск загрязнения и снижает риск генетического дрейфа.
При применении способов криоконсервации жизненно важно достигать и поддерживать эти низкие температуры, не вызывая дополнительных повреждений за счет образования льда во время процесса замораживания. В способах в данной области техники традиционно используют вещества, которые уменьшают повреждение при замораживании клеток, называемые криопротекторами. Криопротекторы могут быть добавлены в среду клеточных культур до процесса замораживания. В конкретном варианте осуществления применяемый криопротектор может представлять собой один или несколько из глицерина или диметилсульфоксида (DMSO). Кроме того, криопротектор может быть добавлен с гидроксиэтилкрахмалом (HES) или без него. В еще одном конкретном варианте осуществления DMSO может быть добавлен в концентрации по меньшей мере приблизительно 5%, например, он может быть добавлен в концентрации приблизительно 5%, приблизительно 6%, приблизительно 7%, приблизительно 8%, приблизительно 9%, приблизительно 10%, приблизительно 11%, приблизительно 12%, приблизительно 13%, приблизительно 14%, приблизительно 15%, приблизительно 16%, приблизительно 17%, приблизительно 18%, приблизительно 19% или приблизительно 20%.
Культуру с добавленным криопротектором можно затем распределять в контейнеры, подходящие для хранения в условиях криоконсервации. В одном варианте осуществления этот контейнер может представлять собой флакон, изготовленный из материала, который может включать (без ограничения) полимеры, такие как политетрафторэтилен, полистирол, полиэтилен или полипропилен. В конкретном варианте осуществления флакон может иметь дополнительную поверхностную обработку для улучшения условий криоконсервации (например, гидрофильные покрытия, которые снижают адсорбцию и денатурацию). В иллюстративных вариантах осуществления объем флакона может составлять более чем приблизительно 0,1 мл, например, объем флакона может составлять приблизительно 0,1 мл, приблизительно 0,5 мл, приблизительно 0,75 мл, приблизительно 1 мл, приблизительно 1,5 мл, приблизительно 2 мл, приблизительно 2,5 мл, приблизительно 4,5 мл, приблизительно 10 мл, приблизительно 15 мл, приблизительно 20 мл, приблизительно 25 мл или приблизительно 50 мл. В другом варианте осуществления контейнер также может представлять собой криопакет, объем которого составляет более чем приблизительно 30 мл, например, объем криопакета может составлять приблизительно 30 мл, приблизительно 50 мл, приблизительно 100 мл, приблизительно 150 мл, приблизительно 200 мл, приблизительно 300 мл, приблизительно 400 мл или приблизительно 500 мл. Криопакет может быть изготовлен из любого подходящего материала, включая без ограничения полимеры, такие как политетрафторэтилен, полистирол, полиэтилен, полипропилен, фторированный этиленпропилен (FEP), полиолефин и этиленвинилацетат (EVA). Иллюстративные одноразовые биореакторы включают без ограничения пакеты для криоконсервации KryoSure®, пакеты PermaLife ™ (OriGen Biomedical), пакеты для замораживания CryoStore (OriGen Biomedical), биоконтейнеры Freeze-Pak™ (Charter Medical) и пакеты, описанные в предварительной заявке на патент США № 62/037181 (Merial Ltd., компания Sanofi), которая включена в данный документ посредством ссылки во всей своей полноте.
Эти контейнеры затем замораживают с применением методов и устройств, хорошо известных в данной области техники, перед их хранением при низких температурах, обычно от приблизительно -130°С до приблизительно -196°С. В одном варианте осуществления применяемая методика замораживания может заключаться в регулировании скорости и медленном замораживании (также называемая медленным программируемым замораживанием или SPF). Коллекция клеток, полученная таким способом, представляет собой банк клеток.
В одном варианте осуществления банк клеток может представлять собой без ограничения банк клеток со сверхвысокой плотностью, главный банк клеток, рабочий банк клеток или мини-банк.
V. Определение жизнеспособности клеток
Как указано выше, способы по настоящему изобретению обеспечивают создание банка клеток с высокой плотностью, сохраняя при этом отличную жизнеспособность клеток для последующего применения. Применяемое в данном документе выражение "жизнеспособность клеток" может быть определено как количество или процент жизнеспособных клеток в данном образце. Жизнеспособность клеток может быть определена с применением любого способа, доступного в данной области техники, в любой момент описанного способа создания банка клеток со сверхвысокой плотностью. Обычно применяемые способы определения жизнеспособности клеток в значительной степени основаны на принципе, что живые клетки обладают интактными клеточными мембранами, которые не пропускают определенные красители, такие как трипановый синий (диазокраситель), эозин или пропидиум, тогда как мертвые клетки этим не обладают.
В одном варианте осуществления трипановый синий может применяться для окрашивания порции клеток и, таким образом, для определения наличия клеток с неповрежденными мембранами (не окрашенными) и присутствия клеток с разрушенными мембранами (синий). Затем эти клетки могут быть подсчитаны для определения количества как живых, так и мертвых клеток в культуре и представлены в процентах, чтобы указать относительную жизнеспособность культуры.
В конкретном варианте осуществления жизнеспособность клеток может быть определена с применением культуры, которая была выращена до сверхвысокой плотности, но еще не была заморожена (то есть до замораживания или до оттаивания культуры). В конкретном варианте осуществления жизнеспособность клеток может быть определена с применением культуры, которая была заморожена, а затем разморожена (то есть культура после замораживания или после размораживания).
В конкретном варианте осуществления жизнеспособность клеток составляет по меньшей мере приблизительно 60%, например, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90% или приблизительно 95%. В некоторых вариантах осуществления жизнеспособность клеток после размораживания составляет по меньшей мере приблизительно 80%, например, составляет по меньшей мере приблизительно 85%, 90% или 95%, включая до 100%.
VI. Терапевтически значимые белки
Клетки, полученные способом создания криобанка клеток со сверхвысокой плотностью по настоящему изобретению, могут быть применены на более поздней стадии получения белка. Например, клетки, размноженные в биореакторе и замороженные в аликвотах банка с высокой плотностью в соответствии со способами по настоящему изобретению, могут быть применены при получении биологических веществ, включая терапевтически значимые белки. Такие биологические вещества могут включать без ограничения: вирусы (см., например, WO 200138362), связывающие полипептиды, такие как антитела, например, моноклональные антитела и их фрагменты, например Fab-фрагменты; слитые белки Fc, антикоагулянты, факторы крови, морфогенетические белки костей, искусственные белковые каркасы, ферменты, факторы роста, гормоны, интерфероны, интерлейкины и тромболитики. Данные биологические вещества могут быть получены любым способом, доступным в данной области техники. В одном варианте осуществления настоящее изобретение относится к способу получения биологического вещества, при этом способ включает культивирование клеток, способных экспрессировать биологическое вещество в условиях, подходящих для получения биологического вещества, где клетки были получены из банка замороженных клеток со сверхвысокой плотностью, полученных с применением культивирования в условиях перфузии. Биологическое вещество может быть (без ограничения) белком (например, любым терапевтически значимым белком).
Примеры
Настоящее изобретение дополнительно иллюстрируют следующие примеры, которые не должны рассматриваться как дополнительное ограничение. Содержание фигур и всех ссылок, патентов и опубликованных заявок на патенты, цитируемых в данной заявке, полностью включены в данный документ посредством ссылки во всей их полноте.
Пример 1. Общие способы
Следующие условия были общими для экспериментов, изложенных в примерах 3-6 ниже.
Задавали значение pH 7,0 ± 0,1. рН культуры поддерживали на заданном значение посредством автоматической системы управления с обратной связью с помощью регулятора WAVE POD. Автоматический регулятор изменял концентрацию CO2 в газе в свободном пространстве и дополнительно регулировал добавление основания (CO2/схема управления основанием). Когда регулятор регистрировал рН ниже выбранного заданного значения pH, сначала предпринимали попытку достичь заданного значения pH за счет снижения уровня CO2. Если заданный уровень рН не был достигнут в течение указанного времени, добавляли основание. При рН, превышающем заданное значение рН, концентрацию CO2 увеличивали.
Задавали значение DO (растворенный кислород) ≥ 40%. DO культуры поддерживали на заданном значение посредством автоматической системы управления с обратной связью с помощью регулятора WAVE POD. Концентрацию кислорода автоматически изменяли с 21% до 50% (схема контроля концентрации O2). Дополнительный чистый газообразный кислород подавали вручную в свободное пространство в комбинации с ручным регулированием условий качания для сохранения DO ≥ 40%. В частности, когда текущий DO составлял приблизительно 40%, а концентрация O2 через регулятор POD была увеличена с 21% до >30%, скорость и угол качания увеличивали с 22 об./мин./10° до 25 об./мин./12°. Если O2 по показаниям POD снова становился > 30%, скорость и угол качания увеличивали с 25 об./мин./12° до 30 об./мин./12°, или подавали чистый O2 в свободное пространство (последнему отдавали предпочтение). Наконец, объемный процент чистого O2 в газе постепенно увеличивали для увеличения общего содержания O2 в свободном пространстве. Стратегия добавления вручную приводила к увеличению приблизительно на 10% в сутки путем регулирования соотношения контролируемых объемов между газообразным кислородом по показаниям POD (21% -50%, обеспечиваемого регулятором POD) и дополнительным чистым газообразным кислородом (100%, контролируемого по ротаметру). Общий расход газа несколько повышали, чтобы облегчить перенос газа.
CSPR (удельную скорость перфузии клеток) культур поддерживали почти постоянной, ежедневно увеличивая скорость перфузии на основании измеренной плотности клеток.
Пример 2. Разработка и внедрение протокола создания банка клеток со сверхвысокой плотностью
Протокол создания криобанка клеток со сверхвысокой плотностью клеток начинали с флакона объемом 2 мл с клетками главного банка клеток (рабочий объем 1,5 мл) с приблизительной плотностью 2,0-2,4×107 жизнеспособных клеток/мл (нормальное условие криоконсервации клеток). Затем клетки выращивали путем культивирования в условиях перфузии. После добавления DMSO в клеточную культуру, такую культуру клеток со сверхвысокой плотностью распределяли в отдельные флаконы объемом 5 мл (рабочий объем приблизительно 4,5 мл) или криопакеты (рабочий объем приблизительно 100 мл), подходящие для криоконсервации и хранения в качестве банка клеток со сверхвысокой плотностью (по меньшей мере приблизительно 10×107 клеток/мл). Схематическое изображение этого протокола показано на фигуре 1.
Пример 3. Культивирование клеток со сверхвысокой плотностью и создание банка клеток с применением rCHO 1.
Параметры для следующего эксперимента были следующими:
1) CO2 уменьшали до 0%, когда Xv ≥ приблизительно 3×107 жизнеспособных клеток/мл (на 9-е сутки), затем при необходимости добавляли основание;
2) Скорость и угол качания WAVE: изначально 22 об./мин./10° (со 0 суток по 8-е сутки); увеличивали до 25 об./мин./12°, когда O2 по показаниям POD увеличивался с 21% до > 30% (на 8-е сутки), а затем до 30 об./мин./12° (на 9-е сутки) для облегчения переноса газа (подачи O2 и удаления CO2);
3) Дополнительный чистый O2 (100%): подавали вручную в свободное пространство, когда O2 по показаниям POD > 30% и Xv ≥ приблизительно 6×107 жизнеспособных клеток/мл (на 11-е сутки);
4) Общий расход газа: 0,2 л/мин. (литров в минуту) с 0 суток по 10-е сутки, увеличивали до 0,4 л/мин. на 10-е сутки, когда Xv > 4×107 жизнеспособных клеток/мл, а затем до приблизительно 0,5 л/мин. на 11-е сутки (O2 по POD: чистый O2=3:1, общий O2: приблизительно 62%); и
5) Удельная скорость перфузии клеток: целевой показатель ≥ приблизительно 0,2 нл/клетку/сутки изначально; скорость перфузии увеличивали постепенно до 12 RV/сутки (примечание: RV определяется как объем реактора). CSPR в последний сутки составляла от 0,1 нл/клетку/сутки до 0,2 нл/клетку/сутки.
6) Система посева и среда биореактора: CD CHO с 4 мМ L-глутамина
7) Биореактор: перфузионный биореактор GE custom Cellbag объемом 10 л с двумя погружными трубками; рабочий объем: 5 л;
8) Инокулят биореактора: система посева во встряхиваемой колбе; плотность посевного материала: приблизительно 5×105 жизнеспособных клеток/мл
9) Способы удерживания клеток: ATF4 (размер пор 0,2 мкм)
10) Температура клеточной культуры: 37°C
11) Замораживание: камера замораживания с регулируемой скоростью CryoMed™
Культивирование клеток cо сверхвысокой плотностью (UHD) и создание банка клеток (после замораживания и размораживания) тестировали на линии клеток rCHO 1. Значение Xv перфузионной культуры достигло приблизительно 1,11×108 жизнеспособных клеток/мл на 12-е сутки с высокой жизнеспособностью (> 97% на протяжении всего процесса). На фигуре 2 показаны плотность жизнеспособных клеток (клеток/мл), скорость перфузии в объемах реактора/сутки и CSPR 10X (удельная скорость перфузии клеток 10X в нл/клетку/сутки) перфузионной культуры со сверхвысокой плотностью. На фигуре 3 показан автономный профиль рН культуры. Культуру собирали непосредственно без концентрирования для создания двух банков UHD во флаконах объемом 5 мл при двух температурах хранения DMSO: хорошо контролируемой холодной температуре, с применением обшитой мешалки с температурой 4°C и неконтролируемой холодной температуре с применением мешалки, охлажденной на ледяной водяной бане. На фигуре 4А-С показаны параметры после замораживания флаконов UHD объемом 5 мл, полученных при вышеупомянутых условиях культивирования клеток. Оба банка UHD показывали быстрый рост клеток после замораживания, очень высокую жизнеспособность и низкий уровень апоптоза. Тем не менее, более эффективный контроль температуры в обшитой мешалке приводил к незначительному улучшению последующего восстановления банка и росту по сравнению с более пассивным контролем температуры на ледяной водяной бане.
Пример 4. Культивирование клеток со сверхвысокой плотностью и создание банка клеток с применением rCHO 2.
Параметры для следующего эксперимента были следующими:
1) CO2 уменьшали до 0%, когда Xv≥ приблизительно 5×107 жизнеспособных клеток/мл (на 9-е сутки), затем при необходимости добавляли основание.
2) Скорость и угол качания WAVE: изначально 22 об./мин./10° (со 0 суток по 7-е сутки); увеличивали до 25 об./мин./12°, когда O2 по показаниям POD увеличивался с 21% до > 30% (на 7-е сутки) для облегчения переноса газа (для подачи O2 и удаления CO2).
3) Дополнительный чистый O2 (100%): подавали вручную в свободное пространство, когда O2 по показаниям POD > 30% и Xv ≥ приблизительно 3×107 жизнеспособных клеток/мл (на 8-е сутки).
4) Изначально общий расход газа составлял 0,2 л/мин. (со 0 суток по 8-е сутки) и увеличивали до 0,4 л/мин. на 8-е сутки, когда Xv ≥ приблизительно 3×107 жизнеспособных клеток/мл (O2 по POD: чистый O2=3:1, общий O2: приблизительно 62%), и затем до приблизительно 0,5 л/мин. на 9-е сутки (O2 по POD: чистый O2=1:1, общий O2: приблизительно 75%).
5) Удельная скорость перфузии клеток: целевой показатель ≥ 0,2 нл/клетку/сутки изначально, но скорость перфузии увеличивали постепенно до 12 RV/сутки. В последние сутки 0,1 нл/клетку-сутки< CSPR <0,2 нл/клетку/сутки.
6) Система посева и среда биореактора: CD CHO с 4 мМ L-глутамина
7) Биореактор: перфузионный биореактор GE custom Cellbag объемом 10 л с одной погружной трубкой; рабочий объем: 5 л;
8) Инокулят биореактора: система посева во встряхиваемой колбе; плотность посевного материала: приблизительно 5×105 жизнеспособных клеток/мл
9) Способы удерживания клеток: ATF4 (размер пор 0,2 мкм)
10) Температура клеточной культуры: 37°C
11) Замораживание: камера замораживания с регулируемой скоростью CryoMed™
Культивирование клеток со сверхвысокой плотностью и создание банка клеток (после замораживания и размораживания) тестировали на линии клеток rCHO 2. На фигуре 5 показаны плотность жизнеспособных клеток (клеток/мл), скорость перфузии в объемах реактора/сутки и CSPR 10X (удельная скорость перфузии клеток 10X в нл/клетку/сутки) перфузионной культуры со сверхвысокой плотностью. На фигуре 6 показан автономный профиль рН культуры. Культуру собирали для получения флаконов UHD (со сверхвысокой плотностью) объемом 5 мл и криопакетов UHD объемом 100 мл для криоконсервации при двух разных условиях хранения DMSO: 1) комнатной температуре (RT, приблизительно 22-25°C); и 2) контролируемой холодной температуре (CT, приблизительно 5°С с применением обшитой мешалки с температурой 4°С).
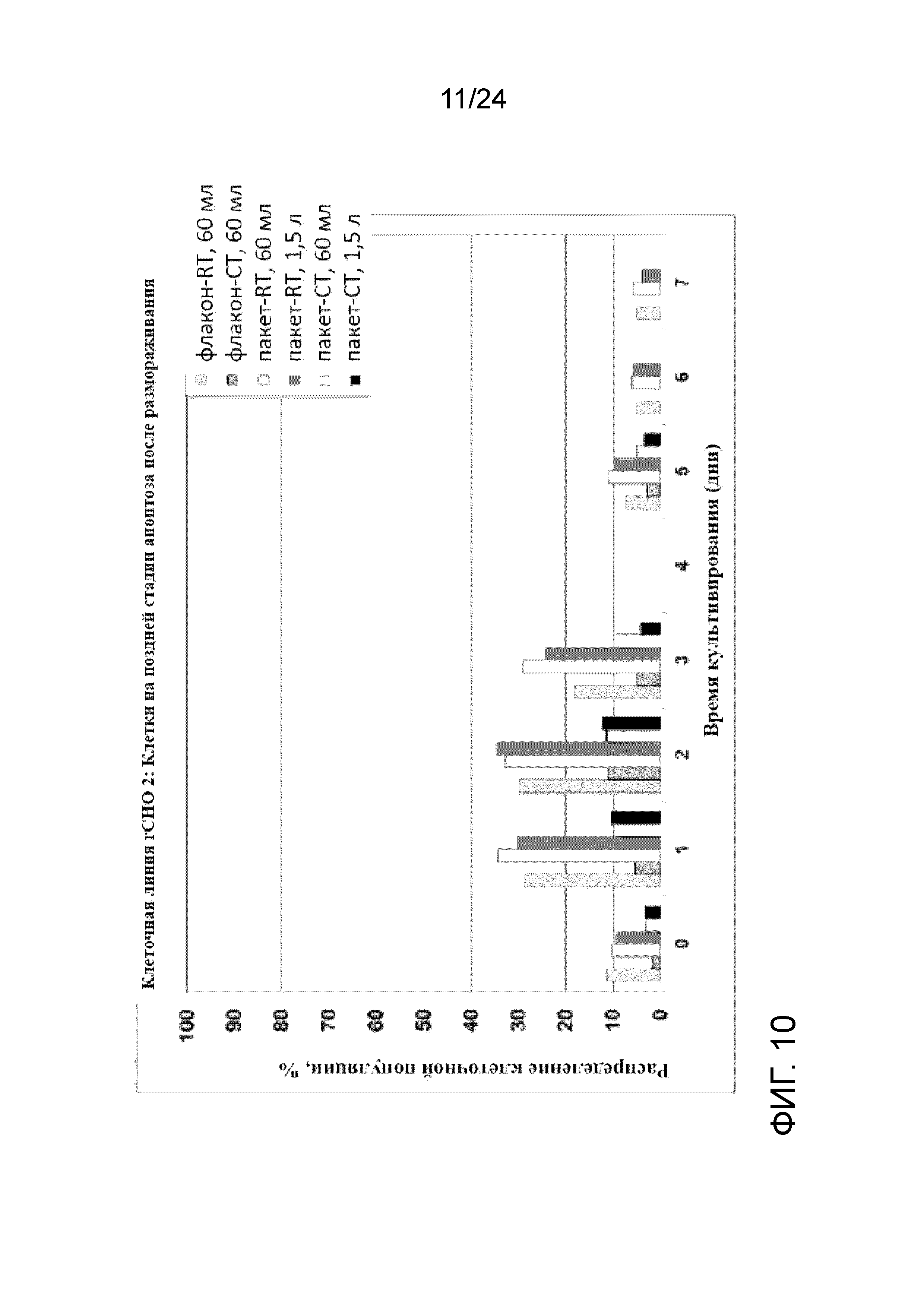
На фигурах 7 и 8 представлены графики, показывающие профили роста клеток (Xv, сплошные линии) и жизнеспособности (пунктирные линии) во встряхиваемых колбах объемом 250 мл и 3 л для флаконов и пакетов UHD, полученных при вышеупомянутых условиях культивирования клеток при комнатной температуре и в условиях хорошо контролируемого холодного хранения (RT и CT, соответственно). Данные флаконы UHD хорошо восстанавливались с быстрым ростом клеток после замораживания, высокой жизнеспособностью, низким апоптозом и сопоставимой продуктивностью при посеве в концентрации 0,5×106 жизнеспособных клеток/мл и 1,0×106 жизнеспособных клеток/мл во встряхиваемые колбы объемом 250 мл и 3 л. Никакой разницы между криопакетами и криофлаконами UHD не наблюдали при каждом из условий хранения с точки зрения роста, жизнеспособности, апоптоза и продуктивности после размораживания. Однако флаконы и пакеты, полученные при хорошо контролируемой низкой температуре с применением обшитой мешалки с температурой 4°C, характеризовались более быстрым ростом, более высокой жизнеспособностью и более низким апоптозом по сравнению с теми, что были получены при комнатной температуре. На фигурах 9 и 10 показаны профили апоптоза после размораживания банков UHD при посеве в концентрации 0,5×106 жизнеспособных клеток/мл и 1,0×106 жизнеспособных клеток/мл, соответственно, а на фигурах 11 и 12 отображена удельная продуктивность (SPR, RT- комнатная температура, CT- хорошо контролируемая холодная температура)
Пример 5. Создание банка клеток со сверхвысокой плотностью в биореакторе WAVE объемом 20 л с применением rCHO 2.
Параметры для следующего эксперимента были следующими:
1) Банк клеток: криопакет UHD объемом 100 мл, полученный в примере 2
2) Среда биореактора: CD CHO с 4 мМ L-глутамина.
3) Биореактор после замораживания: GE Cellbag объемом 20 л; рабочий объем: 10 л.
4) Инокулят биореактора: культура после размораживания из размороженного криопакета; плотность посевного материала: приблизительно 5×105 жизнеспособных клеток/мл.
5) Температура биореактора: 37°C, O2: 20%, CO2: 5%, скорость и угол качания: 22 об./мин./8°
Размораживали один криопакет UHD объемом 100 мл. В один биореактор WAVE (А) объемом 20 л с общим рабочим объемом 10 л непосредственно инокулировали 50 мл размороженной культуры. Другие 50 мл медленно сначала разбавляли холодной средой для уменьшения потенциального повреждения клеток, индуцированного большим осмотическим градиентом, которые затем инокулировали во второй биореактор WAVE (B) объемом 20 л с общим рабочим объемом 10 л. Оба биореактора работали при одинаковых условиях. Аликвоты из обоих биореакторов переносили в контрольные встряхиваемые колбы (рабочий объем 60 мл) для сравнения роста. Культуры в биореакторах также сравнивали с культурами во встряхиваемых колбах (встряхиваемые колбы объемом 60 мл/250 мл и встряхиваемые колбы объемом 1,5 л/3 л) с инокулятом из другого размороженного криопакета объемом 100 мл.
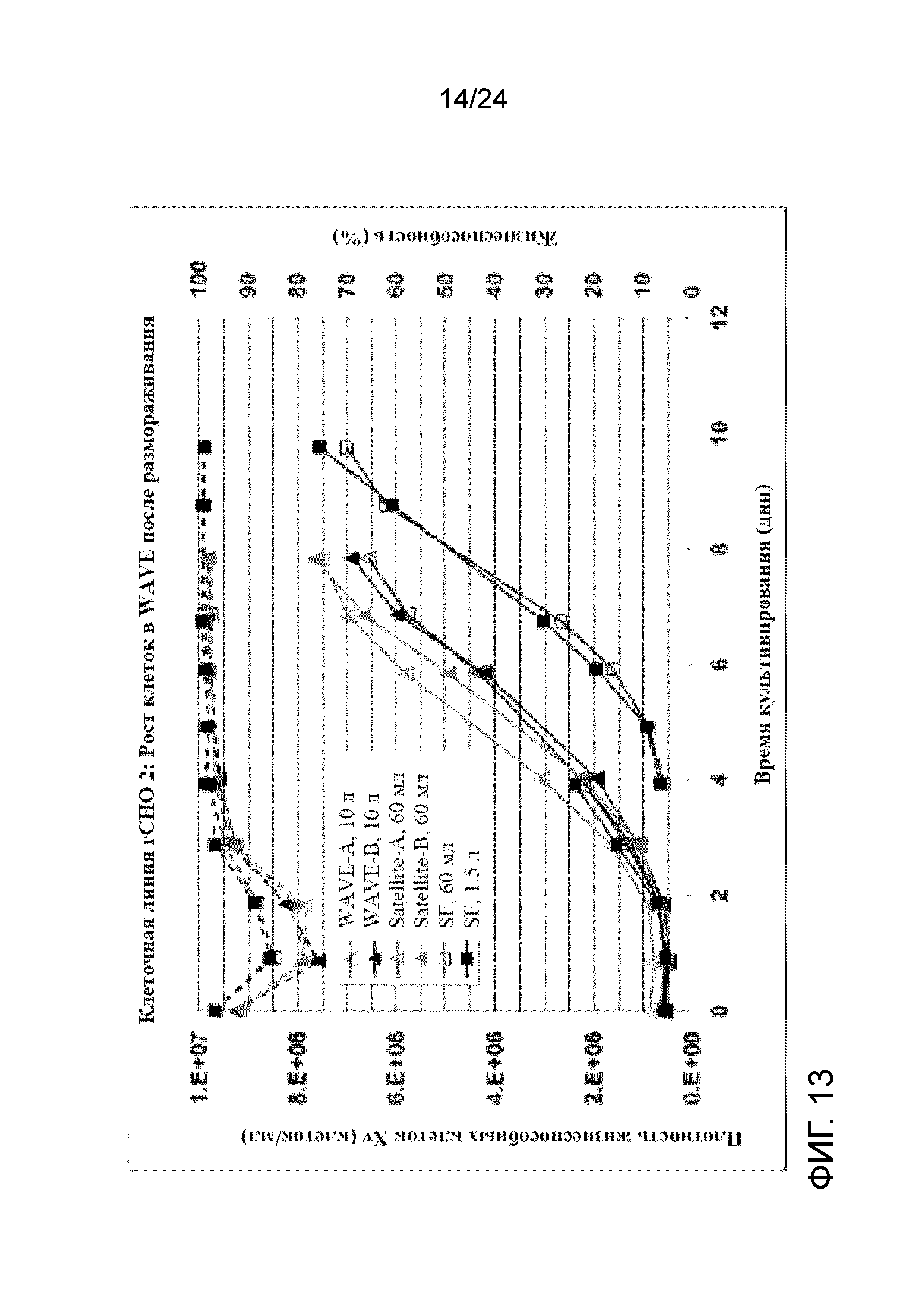
Культуры их двух WAVE показали очень сопоставимые характеристики с точки зрения роста, жизнеспособности и апоптоза после размораживания клеток. И культуры в обоих биореакторах были очень сопоставимы не только с теми, что были в контролируемых встряхиваемых колбах, но также и с теми, что были разморожены и выращены во встряхиваемых колбах. Эти данные говорят о том, что один криопакет UHD можно непосредственно размораживать в двух биореакторах WAVE объемом 20 л без медленного разбавления холодной средой с получением сопоставимых характеристик со встряхиваемыми колбами, что сделает способ системы посева полностью закрытым, от размораживания пакета до роста в биореакторе WAVE.
На фигуре 13 представлен график, демонстрирующий профиль роста клеток (Xv сплошные линии) и жизнеспособность (пунктирные линии) в мешках WAVE объемом 20 л для криопакета UHD клеточной линии rCHO 2, полученных в соответствии с вышеупомянутыми условиями культивирования клеток при комнатной температуре, показанными в примере 2.
Пример 6. Культивирование клеток со сверхвысокой плотностью и создание банка клеток с применением rCHO 3.
Параметры для следующего эксперимента были следующими:
1) CO2 уменьшали до 0%, когда Xv≥ приблизительно 2×107 жизнеспособных клеток/мл (на 8-е сутки), затем при необходимости добавляли основание.
2) Скорость и угол качания WAVE: изначально 22 об./мин./10° (со 0 суток по 7-е сутки); увеличивали до 25 об./мин./12°, когда O2 по показаниям POD увеличивался с 21% до > 30% (на 7-е сутки) для облегчения переноса газа (для подачи O2 и удаления CO2).
3) Дополнительный чистый O2 (100%): подавали вручную в свободное пространство, когда O2 по показаниям POD > 30% и Xv ≥ приблизительно 3×107 жизнеспособных клеток/мл (на 9-е сутки).
4) Общий расход газа: 0,2 л/мин. изначально (со 0 суток по 9-е сутки) и увеличивали до 0,4 л/мин. на 9-е сутки, когда Xv ≥ приблизительно 3×107 жизнеспособных клеток/мл (O2 по POD: чистый O2=3:1, общий O2: приблизительно 62%), и затем до приблизительно 0,5 л/мин. на 10-й сутки (O2 по POD: чистый O2=1:1, общий O2: приблизительно 75%), до приблизительно 0,6 л/мин. на 12-е сутки (O2 по POD: чистый O2=1:2, общий O2: приблизительно 83%).
5) Удельная скорость перфузии клеток: перфузию начинали при 0,5 RV/сутки на 2-е сутки и увеличивали постепенно для поддержания низкой CSPR ≥ 0,05 нл/клетку/сутки
6) Система посева и среда биореактора: CD CHO с 4 мМ L-глутамина
7) Биореактор: перфузионный биореактор GE custom Cellbag объемом 10 л с одной погружной трубкой; рабочий объем: 5 л;
8) Инокулят биореактора: система посева во встряхиваемой колбе; плотность посевного материала: приблизительно 5×105 жизнеспособных клеток/мл
9) Способы удерживания клеток: ATF4 (размер пор 0,2 мкм)
10) Температура клеточной культуры: 37°C
11) Замораживание: камера замораживания с регулируемой скоростью CryoMed™
12) Оценка созданного банка клеток: оценивали встряхиваемую колбу (два пассажа) и WAVE объемом 20 л (один пассаж), Xv, жизнеспособность, апоптоз, продуктивность.
13) Среда для оценки созданного банка клеток: CD CHO с 4 мМ L-глутамина
Культивирование клеток со сверхвысокой плотностью и создание банка клеток (после замораживания и размораживания) тестировали на линии клеток rCHO 3. На фигуре 15 показаны плотность жизнеспособных клеток (клеток/мл), скорость перфузии в объемах реактора/сутки и CSPR 10X (удельная скорость перфузии клеток 10X в нл/клетку/сутки) перфузионной культуры со сверхвысокой плотностью. На фигуре 16 показан автономный профиль рН культуры. Флаконы UHD (со сверхвысокой плотностью) объемом 5 мл и пакеты UHD объемом 100 мл получали с применением перфузионной культуры со сверхвысокой плотностью при двух различных условиях хранения DMSO: 1) комнатной температуре (RT, приблизительно 22-25°C); и 2) контролируемой холодной температуре (CT, приблизительно 5°С с применением обшитой мешалки с температурой 4°С).
Все размороженные культуры из флаконов UHD и пакетов UHD хорошо восстановились, демонстрируя быстрый рост, низкий апоптоз и сопоставимую продуктивность. Пакеты и флаконы UHD, полученные в условиях хорошо контролируемого холодного хранения, были сопоставимы с теми, что были получены при комнатной температуре, демонстрируя более быстрый рост и более высокую жизнеспособность (> 95%) в первом пассаже. Пакет UHD после размораживания имел сопоставимые характеристики во встряхиваемых колбах и биореакторах WAVE. Это также предполагает, что один криопакет UHD можно непосредственно размораживать в двух биореакторах WAVE объемом 20 л, что сделает способ системы посева полностью закрытым, от размораживания пакета до роста в биореакторе WAVE. Фигура 17А представляет собой график, демонстрирующий профили роста клеток (Xv, сплошные линии) и жизнеспособности (пунктирные линии) во встряхиваемых колбах объемом 250 мл и 3 л, и биореакторах WAVE объеом 20 л для флаконов и пакетов UHD, полученных при вышеупомянутых условиях культивирования клеток при комнатной температуре и в условиях хорошо контролируемого холодного хранения (RT и CT, соответственно). На фигуре 17 B и C показаны профили апоптоза после размораживания и удельная продуктивность (SPR).
Пример 7. Снижение применения среды в способе культивирования со сверхвысокой плотностью в условиях перфузии с применением rCHO 3.
Клеточную линию rCHO 3 выращивали при низкой удельной скорости перфузии клеток (CSPR), составляющей ≥ 0,025 нл/клетку/сутки, применяя внутреннюю разработанную среду. Для культивирования в условиях перфузии применяли обычный WAVE Cellbag объемом 10 л, связанный с ATF4. Культура достигала плотности жизнеспособных клеток приблизительно 1,25×108 жизнеспособных клеток/мл на 11-е сутки со скоростью перфузии до 3 объемов реактора/сутки. Жизнеспособность культуры составляла > 97% в процессе культивирования в биореакторе. Применение среды снижали до приблизительно 50% по сравнению с теми же условиями культивирования с применением коммерческой среды. Однако, наблюдаемый рост клеток был несколько более быстрый, чем при применении коммерческой среды CD CHO. Культуру непосредственно собирали (и без концентрирования), для создания банков UHD во флаконах объемом 5 мл и криопакетах объемом 100 мл при хорошо контролируемой холодной температуре хранения DMSO с применением обшитой мешалки с температурой 4°С. Исследования после создания банков продемонстрировали, что банки UHD как во флаконах, так и в криопакетах хорошо восстанавливаются после размораживания во встряхиваемых колбах с показателями быстрого роста, высокой жизнеспособности (> 95%) и сопоставимой продуктивности. Кроме того, один криопакет размораживали в двух биореакторах WAVE объемом 20 л и он демонстрировал сопоставимый рост и жизнеспособность клеток по отношению к результатам во встряхиваемых колбах. Фигура 18 представляет собой график, на котором сравнивают плотность жизнеспособных клеток (клеток/мл, сплошные линии) и жизнеспособность (пунктирные линии) с внутренней средой (черный цвет) и средой CD CHO (серый цвет) в иллюстративной культуре клеточной линии rCHO 3. Фигура 19 представляет собой график, на котором сравнивают скорость перфузии (круги, сплошные линии) и удельную скорость перфузии клеток (треугольники, пунктирные линии) с внутренней средой (черный цвет) и средой CD CHO (серый цвет) в иллюстративной культуре клеточной линии rCHO 3.
Пример 8. Снижение применения среды в способе культивирования со сверхвысокой плотностью в условиях перфузии с применением rCHO 1.
Клеточную линию rCHO 1 выращивали с применением коммерческой среды CD СНО, дополненной Efficient Feed B (EFB), и поддерживали при низкой удельной скорости перфузии клеток (CSPR), при ≥ 0,04 нл/клетку/сутки. Для культивирования в условиях перфузиии применяли перфузионный биореактор GE WAVE Cellbag объемом 10 л со встроенным фильтром. Для сравнения также тестировали коммерческую среду CD CHO без какой-либо питательной добавки. Культура без добавления EFB достигала плотности жизнеспособных клеток приблизительно 1,0×108 жизнеспособных клеток/мл на 13-е сутки со скоростью перфузии до 8 объемов реактора/сутки. При добавлении 10% EFB в среду CD CHO с 5-х суток по 10-е сутки и 20% EFB со 10-х суток по 14-е сутки культура достигла плотности жизнеспособных клеток приблизительно 1,03×108 жизнеспособных клеток/мл на 14-е сутки при скорости перфузии до 4 объемов реактора/сутки. Следовательно, при добавлении EFB достигали сопоставимой перфузионной клеточной культуры UHD при снижении применения среды на приблизительно 50%. Фигура 20 представляет собой график, на котором сравнивают плотность жизнеспособных клеток (клеток/мл, сплошные линии) и жизнеспособность (пунктирные линии) со средой CD СНО, дополненной Efficient Feed B (черный цвет), и средой CD CHO (серый цвет) в иллюстративной культуре клеточной линии rCHO1. Фигура 21 представляет собой график, на котором сравнивают скорость перфузии (круги, сплошные линии) и удельную скорость перфузии клеток (треугольники, пунктирные линии) со средой CD СНО, дополненной Efficient Feed B (черный цвет), и средой CD CHO (серый цвет) в иллюстративной культуре клеточной линии rCHO 1.
Пример 9. Увеличение масштабов способа с получением сверхвысокой плотности в условиях перфузии с применением rCHO 3. A
WAVE Cellbag объемом 20 л настраивали для соединения с ATF4 для обеспечения перфузионной культуры UHD в объеме 10 л. Тестировали рост клеточной линии rCHO 3 в коммерческой среде CD CHO. Культура достигала плотности жизнеспособных клеток приблизительно 1,1×108 жизнеспособных клеток/мл на 14-е сутки со скоростью перфузии до 5 объемов реактора/сутки. Удельную скорость перфузии клеток (CSPR) поддерживали при ≥ 0,04 нл/клетку/сутки и жизнеспособность составляла >97%. Рост клеток был сопоставим при применении WAVE Cellbag объемом 10 л с рабочим объемом 5 л. На фигуре 22 отображена плотность жизнеспособных клеток (клеток/мл, сплошные линии) и жизнеспособность (пунктирные линии) с применением биореактора WAVE объемом 20 л (рабочий объем 10 л, черный цвет) и биореактора WAVE объемом 10 л (рабочий объем 5 л, серый цвет) в иллюстративной культуре клеточной линии rCHO 3. Культуру удавалось непосредственно собрать для получения приблизительно 90 x криопакетов объемом 100 мл.
Пример 10. Оценка банков со сверхвысокой плотностью в криопакетах после хранения в течение года в камерах замораживания в условиях хранения в парах жидкого азота с применением rCHO 2 и rCHO 3.
Криопакеты UHD объемом 100 мл (приблизительно 1,0×108 жизнеспособных клеток/мл, 100 мл на криопакет) из клеточных линий rCHO 2 и 3 тестировали на характеристики после размораживания и сравнивали с 0 моментом времени (когда банки замораживали и переносили для хранения в пары жидкого N2 в течение ночи). Наблюдали сопоставимый клеточный рост, жизнеспособность и продуктивность после размораживания в 0 момент времени и в течение одного года.