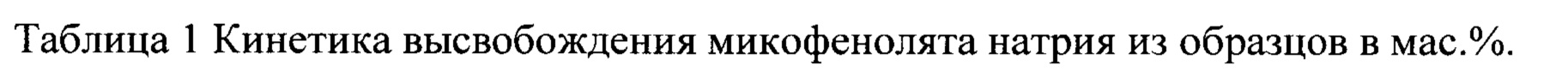Результат интеллектуальной деятельности: Экструдат с микофенолятом натрия для получения пероральной твердой лекарственной формы
Вид РИД
Изобретение
Настоящее изобретение относится к композиции, представляющей собой экструдат содержащий микофенолят натрия и пригодной для получения пероральной твердой лекарственной формы предназначенной для использования в качестве иммунодепрессанта для лечения или предупреждения отторжения трансплантата органа или ткани. Причем действующее вещество находится в указанной лекарственной форме в виде твердой дисперсии, а также к способу получения указанной лекарственной формы.
Микофенольная кислота, также называемая в данном описании МФК, впервые была выделена в 1896 г. и ее интенсивно исследовали в качестве лекарственного средства, представляющего потенциальный коммерческий интерес. Известно, что она обладает противоопухолевой, противовирусной, иммунодепрессантной, противопсориазной и противовоспалительной активностью [см., например, W.A. Lee и др. Pharmaceutical Research (1990), 7, стр. 161-166 и ссылки, указанные в этой публикации]. Известны публикации о МФК в качестве противоракового агента специалистов фирмы Lilly, см., например, M.J. Sweeney и др., Cancer Research (1972), 32, 1795-1802 и специалистов фирмы ICI, см., например, GB 1157099 и GB 1203328, и в качестве иммунодепрессантного агента, см., например, A. Mitsui и др. J. Antibiotics (1969) 22, стр. 358-363. В вышеуказанной статье W.A. Lee и др. имеются сведения о том, что были предприняты попытки увеличить биологическую доступность или специфичность МФК путем синтеза производных. Считалось, что недостаточная биологическая доступность кислоты вызывается неопределенными факторами, такими как комплексообразование лекарства в желудочно-кишечном тракте, узкое окно абсорбции, метаболизм до абсорбции и т. д. Было описано, что препарат на основе морфолиноэтилового эфира, также известного как мофетил микофенолята (иногда называемого в настоящем описании МФМ), обладает значительно более высокой биологической доступностью, чем МФК (100% для МФМ и 43% для МФК). Это производное недавно начало поступать в продажу в качестве иммунодепрессанта для лечения или предупреждения отторжения трансплантата органа или ткани, применяемого в суточных дозах от приблизительно 200 мг до приблизительно 3 г перорально, например, приблизительно 2 г перорально. Соблюдение пациентом режима и схемы лечения МФМ не является идеальным, в том числе из-за побочных действий, например, побочных действий в отношении желудочно-кишечного тракта, происхождение которых неизвестно. Наиболее широко представленной на современном рынке лекарственных препаратов – является кишечнорастворимая форма лекарственного препарата, описанная в патенте RU 2203659. Кишечнорастворимая форма или ее имитация при помощи замедленного растворения оболочки раскрытая в WO 2006/024479 улучшают показатели биологической доступности и стабильности препарата.
Технология получения ядра твердой лекарственной формы, в процессе развития препарата, претерпевала несколько модификаций. В WO 03/032978 раскрыта технология получения ядра методом грануляции с использованием неводного растворителя. Согласно исследованиям, проведенным авторами, раскрытая в заявке WO 03/032978 технология, позволяет получать лекарственную форму приемлемого размера и предохраняет действующее вещество от контакта с водой.
Используемые сокращения
МФК - микофенольная кислота;
МФМ - мофетил микофенолята;
АФС – активная фармацевтическая субстанция;
ПЭГ – полиэтиленгликоль;
ГПМЦ – гидроксипропилметилцеллюлоза;
Краткое описание фигур
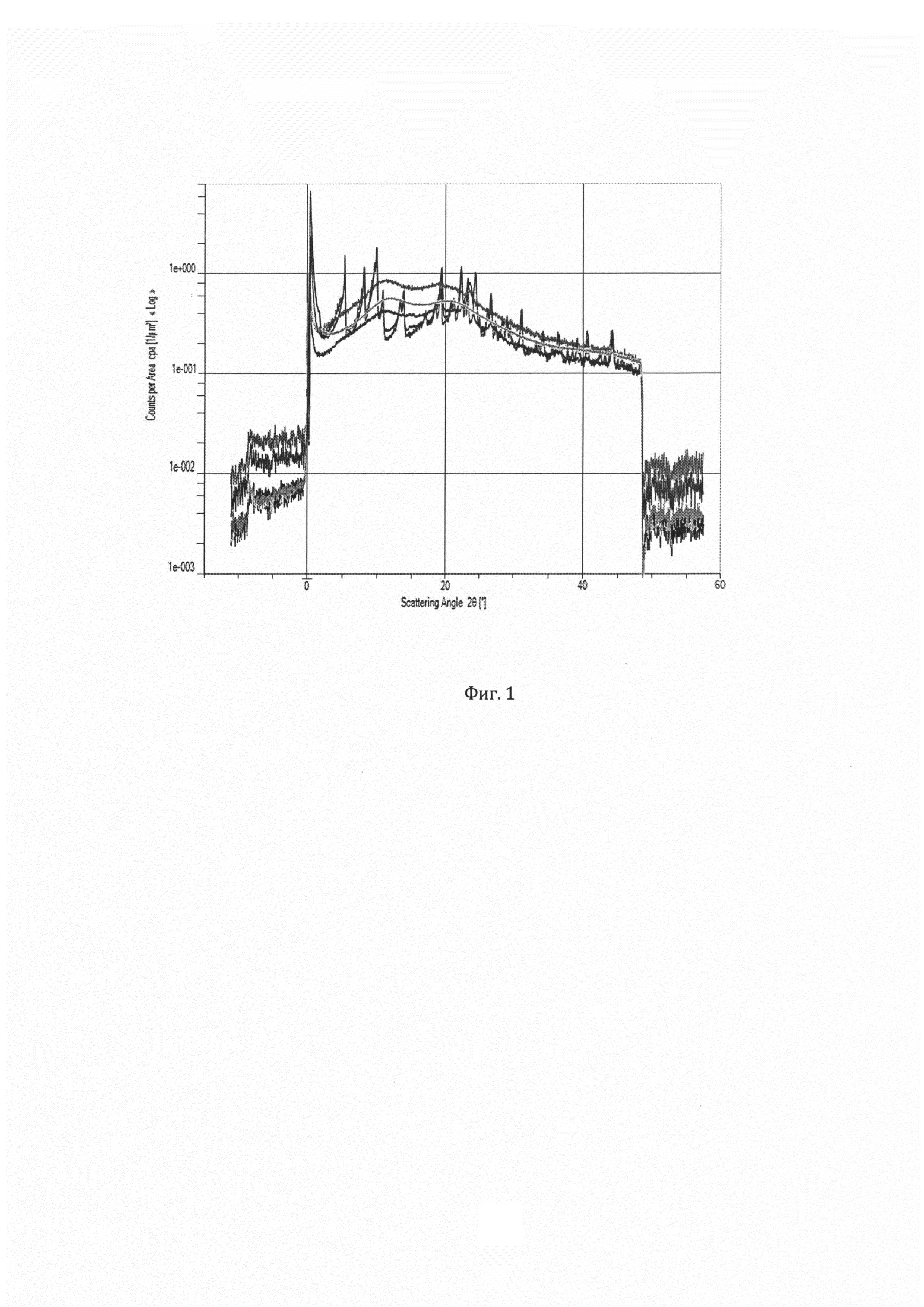
Фигура 1. Анализ степени кристалличности фармацевтической композиции по примеру 3 проанализированного с помощью МалоУглового Рентгеновского Рассеяния -SAXS (Anton Paar). Красный цвет – АФС, синий – смесь полимеров входящих в состав экструдата, зеленый – экструдат полимеров, черный – экструдат полимеров и АФС в кристаллической форме ( по примеру 3), желтый - экструдат полимеров и АФС в аморфной форме (экструдат по примеру 22).
Фигура 2. Анализ степени кристалличности фармацевтической композиции по примеру 3 проанализированного с помощью МалоУглового Рентгеновского Рассеяния -SAXS (Anton Paar). Красный цвет – АФС, синий – смесь полимеров входящих в состав экструдата, зеленый – экструдат полимеров, черный – экструдат полимеров и АФС в кристаллической форме после 1 месяца хранения, желтый - экструдат полимеров и АФС в аморфной форме (экструдат по примеру 22) после 1 месяца хранения.
Фигура 3. Анализ степени кристалличности фармацевтической композиции по примеру 13проанализированного с помощью МалоУглового Рентгеновского Рассеяния -SAXS (Anton Paar). Красный цвет – АФС, синий – смесь полимеров входящих в состав экструдата, зеленый – экструдат полимеров, черный – экструдат полимеров и АФС в кристаллической форме, желтый - экструдат полимеров и АФС в аморфной форме (экструдат по примеру 23).
Несмотря на обширность работ проведённых, к настоящему моменту, в целях улучшения лекарственной формы микофенольной кислоты, остается потребность в разработке более удобной технологии и более приемлемой лекарственной форме.
Технологический процесс получения ядра твердой лекарственной формы микофенольной кислоты или ее фармацевтически приемлемой соли, с использованием органических (неводных) растворителей имеет ряд недостатков:
- необходимость контроля остаточных органических растворителей в готовой лекарственной форме;
- взрыво/пожароопасное производство
- усложнение мероприятий, связанных с охраной труда и окружающей среды.
- дополнительные технологические стадии и, соответственно, потери.
При создании изобретения неожиданно было установлено, что содержащие микофенолят натрия, в практически безводной форме, фармацевтически приемлемые пероральные твердые лекарственные средства, можно получать без использования органических растворителей и по сокращенному технологическому процессу, без использования стадии грануляции. Более конкретно, с помощью использования экструзии, причем, сохраняется хорошо изученная кристаллическая форма микофенолята натрия.
Хотя ниже предлагаемые в изобретении композиции конкретно описаны на примере таблеток, можно изготавливать и другие типы пероральных твердых лекарственных средств, например, шипучие таблетки, быстро распадающиеся таблетки, матриксные таблетки, минитаблетки, многослойные таблетки, таблетки с импульсным высвобождением, пеллеты, капсулы, гранулы или порошки, помещенные, например, в саше или пузырек, причем указанные формы подпадают под объем настоящего изобретения.
Согласно изобретению, предлагаемое лекарственное средство содержит активное вещества в количестве от 5,0 масс.% до 95,0 % от массы лекарственной формы, а также фармацевтически приемлемые вспомогательные вещества в количестве от 5,0% до 95,0% от массы готовой лекарственной формы.
Наряду с активным веществом фармацевтическая композиция может при этом содержать обычные вспомогательные вещества, принятые в технологии приготовления лекарственных средств, такие как связующие, наполнители, консерванты, регуляторы текучести, смягчители, смачиватели, диспергаторы, эмульгаторы, растворители, антиокислители и/или пропелленты, пролонгаторы действия Sucker et al.: Pharmazeutische Technologie, Thieme-Verlag, Stuttgard, 1991.
В качестве наполнителя фармацевтическая композиция может содержать одно или несколько веществ из следующих: сахара и их производные (лактоза, модифицированная лактоза, сахароза, глюкоза, маннит, модифицированный маннит, сорбит, фруктоза), полисахариды (целлюлоза и ее производные, крахмал, модифицированный крахмал, декстрин, декстроза, декстрат, мальтодекстрин, кальций и его соли (фосфаты, карбонаты, хлориды), магний и его производные (оксид, карбонат, стеарат), кросповидон, коповидоны, циклодекстрины, альгиновая кислота и ее соли, сахарин и его соли, натрий и его соли (хлорид, цитрат, фумарат, карбонат), аспартам, молочная кислота и ее соли, янтарная кислота, аскорбиновая кислота, тартаровая кислота, коллоидная двуокись кремния, цикламат, бензойная кислота и ее соли, парабены и их соли.
Предпочтительно, фармацевтическая композиция содержит от 0,3 до 60 масс.% перечисленных выше наполнителей (в пересчете на 100 мас.% всей твердой лекарственной формы).
Фармацевтически приемлемый полимер можно выбрать из группы, включающей растворимые в воде полимеры, диспергирующиеся в воде полимеры и набухающие в воде полимеры и любые их смеси. Полимеры считаются растворимыми в воде, если они образуют прозрачный гомогенный раствор в воде. После растворения при 20°C в воде при концентрации 2% (мас./об.) растворимый в воде полимер предпочтительно обладает кажущейся вязкостью, равной от 1 до 5000 мПа·с, более предпочтительно - от 1 до 700 мПа·с и наиболее предпочтительно - от 5 до 100 мПа·с. Диспергирующимися в воде полимерами являются такие, которые при взаимодействии с водой образуют коллоидные дисперсии, а не прозрачный раствор. При взаимодействии с водой или водными растворами набухающие в воде полимеры обычно образуют каучукообразный гель.
Предпочтительно, если фармацевтически приемлемый полимер, использующийся в настоящем изобретении, обладает значением Tg, равным не ниже 40°C, предпочтительно - не ниже +50°C, наиболее предпочтительно - от 80 до 120°C. "Tg" обозначает температуру стеклования. Методики определения значений Tg для органических полимеров описаны в публикации "Introduction to Physical Polymer Science", 2nd Edition by L.H.Sperling, published by John Wiley & Sons, Inc., 1992. Значение Tg можно рассчитать как взвешенную сумму значений Tg для гомополимеров, образованных из каждого отдельного мономера, i, которые входят в полимер: Tg=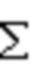 Wi Xi, где W означает выраженное в процентах массовое содержание мономера i в органическом полимере и Х означает значение Tg для гомополимера, образованного из мономера i. Значения Tg для гомополимеров приведены в публикации "Polymer Handbook", 2nd Edition by J.Brandrup и E.H.Immergut, Editors, published by John Wiley & Sons, Inc., 1975.
Wi Xi, где W означает выраженное в процентах массовое содержание мономера i в органическом полимере и Х означает значение Tg для гомополимера, образованного из мономера i. Значения Tg для гомополимеров приведены в публикации "Polymer Handbook", 2nd Edition by J.Brandrup и E.H.Immergut, Editors, published by John Wiley & Sons, Inc., 1975.
Например, предпочтительные фармацевтически приемлемые полимеры можно выбрать из группы, включающей водорастворимые полимеры, подходящие для использования в составе фармацевтической композиции по настоящему изобретению, включают, но не ограничиваются следующими веществами: гомополимеры и сополимеры N-виниллактамов, особенно гомополимеры и сополимеры N-винилпирролидона, например поливинилпирролидон (PVP), сополимеры N-винилпирролидона и винил-ацетата или винилпропионата; высокомолекулярные полиалкилен-оксиды, такие как полиэтиленоксид и полипропиленоксид и сополимеры этиленоксида и пропиленоксида;полиакрилаты и полиметакрилаты, такие как метакриловая кислота/этилакрилатные сополимеры, метакриловая кислота/метилметакрилатные сополимеры, бутилметакрилат/2-диметиламиноэтилметакрилатные сополимеры, поли(гидроксиалкилакрилаты), поли(гидроксиалкилметакрилаты); полиакриламиды;винилацетатные полимеры, такие как сополимеры винилацетата и кротоновой кислоты; поливиниловый спирт; олиго- и полисахариды, такие как каррагинаны; сложные эфиры целлюлозы и простые эфиры целлюлозы, в частности метилцеллюлозу и этилцеллюлозу, гидроксиалкилцеллюлозы, гидроксиаэтилцеллюлозы, в частности гидроксипропилметилцеллюлозу, в частности гидроксипропилцеллюлозу, сукцинаты целлюлозы, в частности сукцинат гидроксипропилметилцеллюлозы или ацетатсукцинат гидроксипропилметилцеллюлозы. В преимущественном воплощении указанный гидрофильный полимер включает поливинилпирролидон, полиалкиленоксид, в частности полиэтиленоксид и/или производное целлюлозы, в частности гидроксипропилметилцеллюлоза.
Водонерастворимые полимеры, которые могут использоваться в настоящем изобретении включают, но не ограничиваются следующими веществами: целлюлоза микрокристаллическая, гипролоза (гидрокси-пропилцеллюлоза) низкозамещенная.
Различные добавки, содержащиеся в обработанной в расплаве смеси или даже в самом активном ингредиенте (ингредиентах), могут оказывать пластифицирующее воздействие на полимер и тем самым снижать Tg полимера, так что конечная обработанная в расплаве смесь обладает немного меньшим значением Tg, чем исходный полимер, использовавшийся для ее приготовления. Обычно конечная экструдированная из расплава смесь обладает значением Tg, равным 10°C или выше, предпочтительно - 15°C или выше, более предпочтительно - 20°C или выше и наиболее предпочтительно - 30°C или выше.
Указанный низкоплавкий компонент, предпочтительно компонент с температурой плавления или диапазоном плавления, или около 37°C, но не слишком высокой. Преимущественно низкоплавкий компонент не быстро термически деструктирует около его температуры плавления. К примеру, температура плавления или диапазон плавления второго компонента находиться в диапазонах от около температуры окружающей среды до 100°C, в частности в диапазаонах от 40°C до 100°C. Преимущественно, температура плавления или диапазон плавления второго компонента не должен превышать 90°C, преимущественно температура плавления или диапазон плавления второго компонента находиться в диапазонах от >40°C до 90°C. Преимущественно, второй компонент является компонентом, который быстро остывает. Подходящими компонентами, которые могут быть использованы как второй компонент включают гидрофильные полимеры, такие как, к примеру, полиалкиленгликоль, в частности полиэтиленгликоль, полиалкиленоксид, в частности полиэтиленоксид, поливиниловый спирт, гидрокисметилцеллюлоза, гидрокисэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, и их смесь. Пластификаторы могут внедряться в зависимости от полимера и требования способа. Они преимущественно, когда используются в способе экструзии горячего расплава, снижают температуру стеклования полимера. Пластификаторы также помогают в снижении вязкости расплава полимера и, тем самым, позволяют снижать температуру обработки и вращения экструдера во время экструзии горячего расплава. Примеры пластификаторов, которые могут быть использованы в настоящем изобретении, включат в себя пластификаторы типа цитратных сложных эфиров, такие как триэтилцитрат, цитратфталат; пропиленгликоль; глицерин; полиэтиленгликоль с низкой молекулярной массой (ПЭГ) с молекулярными массами в диапазоне от 400 до 8000, такой как PEG 600, PEG 1000, PEG 1500, PEG 3000, PEG 4000, PEG 6000 или PEG 7000; триацетин; дибутилсебацинат, трибутилсебацинат; дибутилтартрат, дибутилфталат, но не ограничиваются ими. Он предпочтительно присутствует в количестве в диапазоне от 0% до 40% от массы готовой композиции.
Предпочтительно, фармацевтическая композиция содержит от 0,4 до 49,0 масс.% перечисленных выше водорастворимых полимеров, поверхностно-активные вещества, смазывающие вещества, наполнители до массы 100% всей готовой лекарственной формы.
Предпочтительно, фармацевтическая композиция содержит от 0,4 до 49,0 масс.% перечисленных выше водорастворимых полимеров, по меньшей мере, водонерастворимый полимер от 0,30 до 19 масс.% от массы всей готовой лекарственной формы, смазывающие вещества, поверхностно-активные вещества, наполнители до массы 100% всей готовой лекарственной формы.
Согласно варианту осуществления, настоящее изобретение может содержать один или несколько разрушающихся агентов, которые могут включать в себя кроскармеллозу натрия, кросповидон, гликолят натрия крахмала, зерновой крахмал, картофельный крахмал, кукурузный крахмал и модифицированные крахмалы, силикаты кальция, низкозамещенную гидроксипропилцеллюлозу, но не ограничиваются ими. Количество разрушающегося агента предпочтительно находится в диапазоне от 1% до 10% от массы композиции.
Соответственно, настоящее изобретение может дополнительно включать в себя одно или несколько смазывающих веществ и глидантов, которые могут включать в себя стеариновую кислоту и ее производные или сложные эфиры, такие как стеарат натрия, стеарат магния и стеарат кальция, и соответствующие сложные эфиры, такие как стеарилфумарат натрия; тальк и диоксид кремния соответственно, но не ограничиваются ими. Количество смазки и/или глиданта предпочтительно находится в диапазоне от 0,25 %масс до 5 %масс от массы композиции.
Поверхностно-активные вещества, подходящие для использования в составе фармацевтической композиции по настоящему изобретению, включают, но не ограничиваются следующими веществами: полисорбат 80 (например, полисорбат марки ТВИН-80), макрогол 6000 (полиэтиленгликоль 6000), полоксамеры с гидрофильно-липофильным балансом больше 16 (например, Poloxamer 124, Poloxamer 188, Poloxamer 237, Poloxamer 338, Poloxamer 407).
Предпочтительно, фармацевтическая композиция содержит от 0,3 до 5,0 масс.% , предпочтительно 3 мас.%, поверхностно-активных веществ (в пересчете на 100 мас.% всей твердой лекарственной формы).
В контексте настоящего описания понятие «фармакологически эффективное количество» обозначает количество действующего вещества, которое прекращает или ослабляет развитие состояния, подлежащего лечению, или которое иным образом приводит к полному или частичному излечению состояния или к его временному облегчению. Такое количество можно определять с помощью стандартных экспериментов.
Вариант осуществления настоящего изобретения относится к таблетке, содержащей от 50 до 500 мг микофенольной кислоты или микофенолята, например, от 100 до приблизительно 500 мг микофенольной кислоты или микофенолята, предпочтительно от приблизительно 180 до приблизительно 360 мг микофенольной кислоты или от приблизительно 160 до приблизительно 385 мг микофенолята.
Согласно настоящему изобретению предпочтительно следует применять мононатриевую соль. Ее можно получать в кристаллической форме путем перекристаллизации, например, из смеси ацетон/этанол при необходимости в присутствии воды; tпл 189-191°С.
В дозированных формах, соответствующих настоящему изобретению, активный ингредиент содержится в виде твердой дисперсии. Термин "твердая дисперсия" определяет систему в твердом состоянии (в отличие от жидкого или газообразного состояния), включающую по меньшей мере два компонента, в которой один компонент равномерно диспергирован в другом компоненте или компонентах. Например, активный ингредиент или комбинация активных ингредиентов диспергирована в матрице, включающей фармацевтически приемлемый полимер (полимеры).
Существует обширная литература, в которой описаны указанные выше, а также другие эксципиенты и методы (см., в частности. Handbook of Pharmaceutical Excipients, 2-е изд., под ред. Ainley Wade и Paul J. Weller, изд-во American Pharmaceutical Association, Washington, USA, и изд-во Pharmaceutical Press, London; и Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik and angrenzende Gebiete, 4-е изд., под ред. Н.Р. Fiedler, изд-во Editio Cantor, Aulendorfn более ранние издания, которые включены в настоящее описание в качестве ссылки).
Примеры веществ, улучшающих скольжение, включают, например, коллоидный диоксид кремния, например, коллоидный диоксид кремния, например, Aerosil® 200, трисиликат магния, порошкообразную целлюлозу, крахмал, тальк или трехосновный фосфат кальция. Предпочтительно можно применять Aerosil® 200.
Примеры замасливателей включают, например, стеарат Mg, Al или Са, ПЭГ 4000-8000, гидрогенизированное касторовое масло, глицерилмоностеарат или тальк. Предпочтительно можно применять стеарат магния.
Для обеспечения конкретных требуемых свойств таблетки можно с помощью стандартных экспериментов выбирать одну или несколько из указанных добавок.
Количество применяемой добавки каждого типа, например, наполнителя или разбавителя, разрыхлителя, связующего вещества, вещества, улучшающего скольжение или замасливателя, можно легко оценивать с помощью обычных в данной области методов.
Абсолютные количества каждой добавки и относительные соотношения с другими добавками зависят также от требуемых свойств таблетки и их можно выбирать с помощью стандартных экспериментов. Например, можно выбрать обладающий ускоренным и/или замедленным высвобождением МФК или микофенолята тип таблетки с количественным контролем высвобождения действующего вещества или с неконтролируемым высвобождением.
В таблетке, предлагаемой в настоящем изобретении, в качестве предпочтительных вспомогательных веществ применяют стеарат магния, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, полиэтиленгликоль, поливинилпирролидон и кремния диоксид коллоидный, крахмал прежелатинизированный. Количество применяемых добавок должно зависеть от количества используемой МФК или микофенолята. Стеарат, например стеарат магния, предпочтительно применяют в количестве от 0,1 до 5,0 мас.%, например от 0,5 до 2,0 маснаиболее предпочтительно 1мас.% Диоксид кремния предпочтительно применяют в количестве от 0,1 до 10 мас.%, например от 0,5 до 5,0 мас наиболее предпочтительно 1мас.% .%, наиболее предпочтительно 1 масс%. Крахмал прежелатинизированный используют в качестве наполнителя в количестве от 0,3 %масс до 60 %масс от массы готовой лекарственной формы, предпочтительно 4 мас.%. Гидроксипропилметилцеллюлозу используют в количестве от 3,0 масс% до 50,0 масс% от массы готовой лекарственной формы, предпочтительно в количестве 4 масс%. Гидроксипропилцеллюлозу используют в количестве от 3,0 масс% до 50,0 масс% от массы готовой лекарственной формы, предпочтительно в количестве 7 масс%. Полиэтиленгликоль используют в количестве от 3,0 масс% до 50,0 масс% от массы готовой лекарственной формы, предпочтительно в количестве 13,0 масс%. Поливинилпирролидон используют в количестве от 3,0 масс% до 50,0 масс% от массы готовой лекарственной формы, предпочтительно в количестве 18,5масс%. Комбинацию поливинилпирролидона и полиэтиленгликоля используют в количестве от 3,0 масс% до 95,0 масс% от массы готовой лекарственной формы. Комбинацию поливинилпирролидона и гидроксипропилметилцеллюлозы используют в количестве от 3,0 масс% до 95,0 масс% от массы готовой лекарственной формы. Комбинацию гидроксипропилметилцеллюлозы и полиэтиленгликоля используют в количестве от 3,0 масс% до 95,0 масс% от массы готовой лекарственной формы. Комбинацию поливинилпирролидона, гидроксипропилметилцеллюлозы и полиэтиленгликоля используют в количестве от 3,0 масс% до 95,0 масс% от массы готовой лекарственной формы..%.
Еще одним объектом изобретения является описанная выше таблетка, имеющая энтеросолюбильное покрытие. Энтеросолюбильное покрытие можно наносить не только на таблетки, но также и на другие указанные выше пероральные лекарственные формы, например, гранулы, которые затем можно спрессовывать в таблетки, или на лекарственное вещество, представляющее собой МФК или микофенолят.
В контексте настоящего описания понятие «энтеросолюбильное покрытие» означает любое фармацевтически приемлемое покрытие, которое предотвращает высвобождение действующего вещества в желудке и которое разлагается в достаточной степени в кишечном тракте, предпочтительно в верхнем отделе кишечного тракта (при контакте с приблизительно нейтральными или щелочными кишечными соками), обеспечивая поглощение действующего вещества стенками кишечного тракта. Тесты in vitro, позволяющие определять, можно ли классифицировать покрытие как энтеросолюбильное или нет, опубликованы в фармакопее различных стран.
Пероральные твердые лекарственные формы изготавливают путем:
(I) смешения микофенольной кислоты или микофенолята с фармацевтически приемлемыми полимером,
(II) экструзией смеси, полученной на стадии (I),
(III) приготовление готовой лекарственной формы.
В том случае, если готовая лекарственноя форма представляет собой таблетку, то проводят последовательно:
- измельчение экструдата, полученного на стадии (II),
- опудривание вспомогательными веществами измельченного экструдата,
таблетирование (прессование) массы
Стадию экструзии (II) можно осуществлять как в термоплатичном варианте (с нагреванием), так и без нагревания, используя достаточно пластичную массу для экструзии.
Экструзия из горячего расплава обеспечивает несколько преимуществ по сравнению с традиционными фармацевтическими способами обработки, включая отсутствие растворителей, малое количество этапов обработки, непрерывный режим работы, возможность образования твердых дисперсий и улучшенная биодоступность (ср. М.М.Crowley et al., Drug Dev Ind Pharm 2007, 33 (9), 909-26; и M.A.Repka et al., ibid, 33 (10), 1043-57).
Плавление и/или перемешивание проводят в аппарате, предназначенном для этой цели. Особенно подходящими являются экструдеры или месильные машины. Подходящие экструдеры включают одношнековые экструдеры, экструдеры со шнеками, находящимися в зацеплении, или даже многошнековые экструдеры, предпочтительно - двушнековые экструдеры, в которых шнеки могут вращаться в одном или в противоположных направлениях, и необязательно снабженные месильными дисками или другими шнековыми элементами, предназначенными для перемешивания или диспергирования расплава. Следует понимать, что рабочая температура также будет зависеть от типа использующегося экструдера или типа конфигурации экструдера. Часть энергии, необходимой для плавления, перемешивания и растворения компонентов в экструдере, можно получить от нагревающих элементов. Однако трение и сдвиговые перемещения материала в экструдере также может привести к выделению в смеси существенного количества энергии и способствовать образованию однородного расплава компонентов.
Экструдат, выходящий из экструдера, по консистенции находится в диапазоне от пастообразного до вязкого.
Один/несколько компонентов будут плавиться, а другие компоненты будут диспергироватся в данном расплаве. Плавление обычно включает нагрев выше точки размягчения полимера. Приготовление дисперсии может происходить множеством путей. Смешивание компонентов может иметь место до, во время или после образования твердой дисперсии. Например, компоненты могут сначала смешиваться, а затем дисперсия экструдируется, или могут одновременно смешиваться и экструдироваться..
Обычно температура расплава находится в интервале от 60ºС до 140ºС, более предпочтительно от приблизительно 80ºС до приблизительно 120ºС.
Подходящие экструдеры включают в себя одночервячные экструдеры, сцепленные червяные экструдеры или еще многочервячные экструдеры, предпочтительно двухчервячные экструдеры, которые могут быть со-вращающимися или противо-вращающимися и, необязательно, оборудованными месильными дисками. Будет понятно, что рабочие температуры будут также определяться типом экструдера или типом конфигурации внутри используемого экструдера.
Экструдаты могут быть в форме шариков, гранул, трубы, нити или цилиндра, и они могут быть далее переработаны в любую желаемую форму.
Используемый в данном описании термин "экструдаты" относится к твердым дисперсиям одного или нескольких лекарственных средств с одним или несколькими полимерами и, необязательно, фармацевтически приемлемыми наполнителями.
Описанный выше процесс может включать дополнительно нанесение покрытия на микофенольную кислоту или микофенолят и/или гранулы и/или таблетку. Нанесение покрытия можно осуществлять любым пригодным способом.
Полученный экструдат смеси микофенолята натрия и, по меньшей мере, одного фармацевтически приемлемого полимера, характеризуется тем, что содержит микофенолят в кристаллической форме. Сохранение кристаллической формы микофенолята натрия позволяет получать твердые пероральные лекарственные формы с прогнозируемым профилем растворимости, что является важным для сохранения фармакокинетических свойств лекарственных препаратов.
Экструдат содержит микофенолят натрия предпочтительно в количестве 64-76% от массы экструдата.
Экструдат содержит фармацевтически приемлемый полимер предпочтительно с температурой стеклования не ниже 40 0С. Экструдат содержит фармацевтически приемлемый полимер наиболее предпочтительно с температурой стеклования не ниже 50 0С. Экструдат содержит фармацевтически приемлемый полимер предпочтительно с температурой стеклования 80-120 0С. Экструдат могут получать при температуре экструзии 60-1400С, Нижняя граница температуры ограничена возможностью получения экструдата и зависит от температуры стеклования выбранного полимера. Наиболее предпочтительно экструзию проводят при температуре 80-1200С.
При необходимости пленочное покрытие может представлять собой энтеросолюбильное покрытие. Пленочное покрытие обычно включает полимерный пленкообразующий материал, такой как гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу или акрилатные или метакрилатные сополимеры. Кроме пленкообразующего полимера пленочное покрытие может дополнительно включать пластификатор, например, полиэтиленгликоль, поверхностно-активное вещество, например, типа Tween® и необязательно пигмент, например, диоксид титана или оксиды железа. каротиноиды, индиготин, например, индикотиновый лак, или хлорофилл. Пленочное покрытие также может включать тальк в качестве средства, препятствующего слипанию. Пленочное покрытие обычно составляет не менее 5% мае. от массы дозированной формы.
Экструдат можно применять для получения пероральной твердой лекарственной формы.
Полученные твердые лекарственный формы могут применяться в качестве иммунодепрессивных агентов при лечении пациаентов с аутоиммунными заболеваниями, состояниями, расстройствами, а так же пациентов с трансплантированными органами, тканями, клетками.
Приведенные ниже примеры предназначены для дополнительной иллюстрации настоящего изобретения без наложения ограничений.
Пример 1

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30
(I) смешивают;
(II) экструдируют при температуре 120±5 0С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ К 100 LV, Kollidon® 30, коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки
(V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 2

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30 (I) смешивают;
(II) экструдируют при температуре 120±5°С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ К 100 LV, коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 3

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30
(I) смешивают;
(II) экструдируют при температуре 120±5°С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с крахмалом прежелатинизированным, коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 4

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30, Клуцель EXF
(I) смешивают;
(II) экструдируют при температуре 120±5°С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ К 100 LV, коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 5

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30
(I) смешивают;
(II) экструдируют при температуре 105±5°С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с крахмалом прежелатинизированным, коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 6

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30
(I) смешивают;
(II) экструдируют при температуре 105±5°С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с крахмалом прежелатинизированным, коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 7

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30, Poloxamer 407
(I) смешивают;
(II) экструдируют при температуре 120±5°С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 8


Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30, Poloxamer 338
(I) смешивают;
(II) экструдируют при температуре 120±5°С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 9
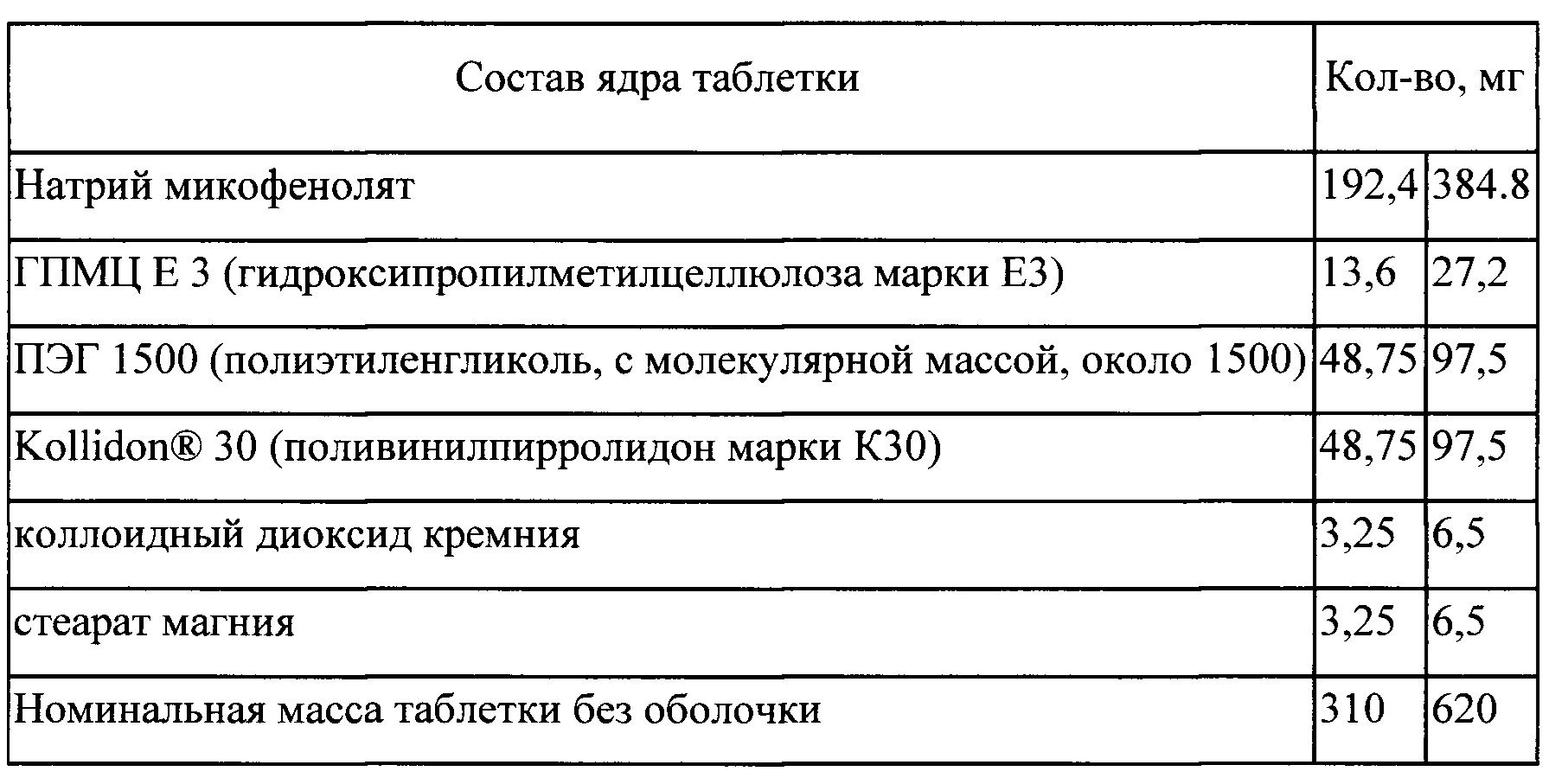
Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30 (1/2 часть)
(I) смешивают;
(II) экструдируют при температуре 120±5°С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ Е3, Kollidon® 30 (1/2 часть) коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 10
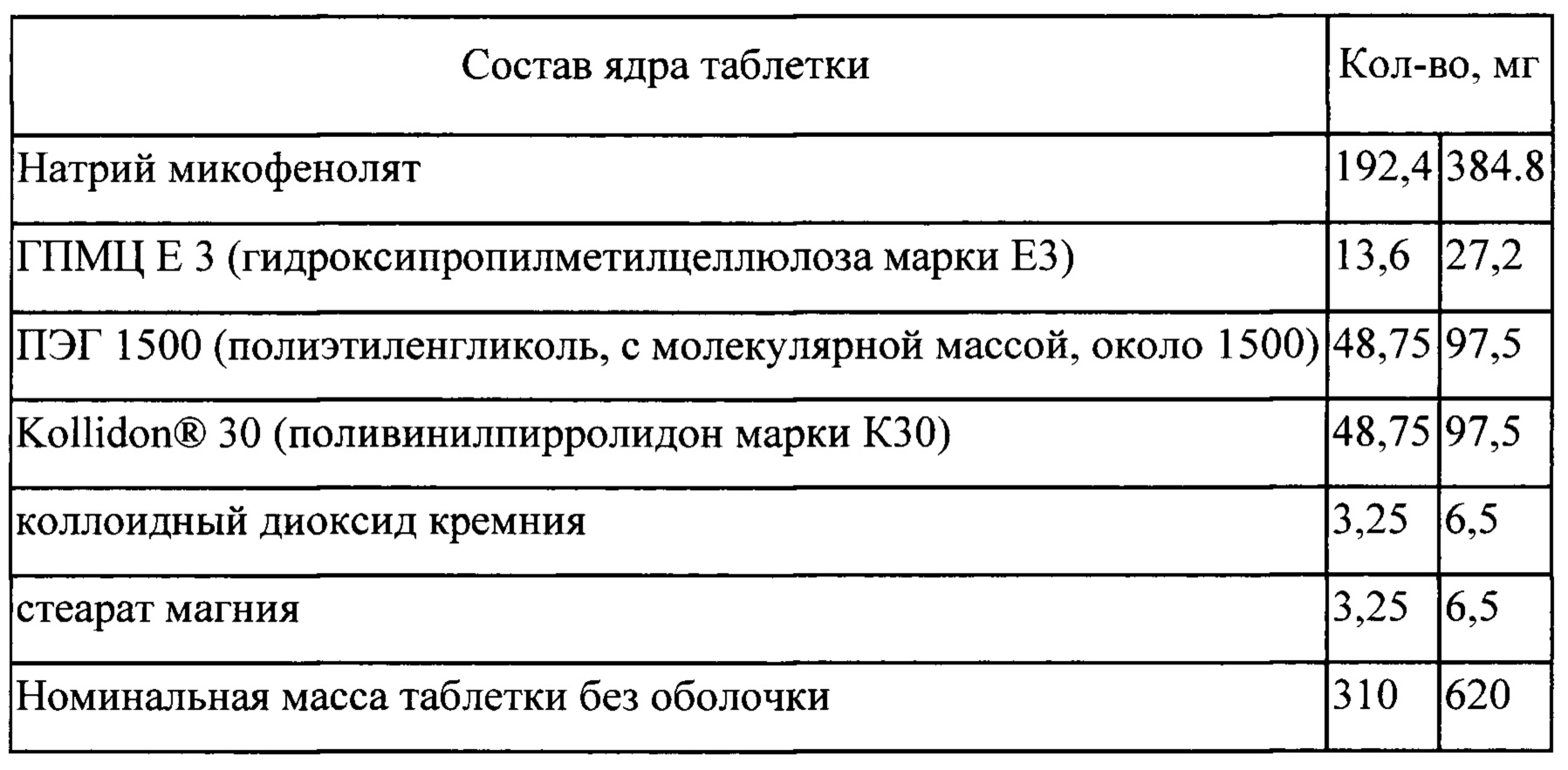
Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30 (1/2 часть)
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 60±5; 125±5; 130±5; 135±5°С
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ ЕЗ, Kollidon® 30 (1/2 часть) коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 11

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30 (1/2 часть)
(I) смешивают;
(II) экструдируют при температуре 120±5°С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ Е15, Kollidon® 30 (1/2 часть) коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 12

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30 (1/2 часть)
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 60±5; 125±5; 130±5; 135±5°С
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ Е15, Kollidon® 30 (1/2 часть) коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 13


Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30,
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 80±5; 120±5; 80±5°С;
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ Е3, коллоидным диоксидом кремния, Kollidon® 17 и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 14
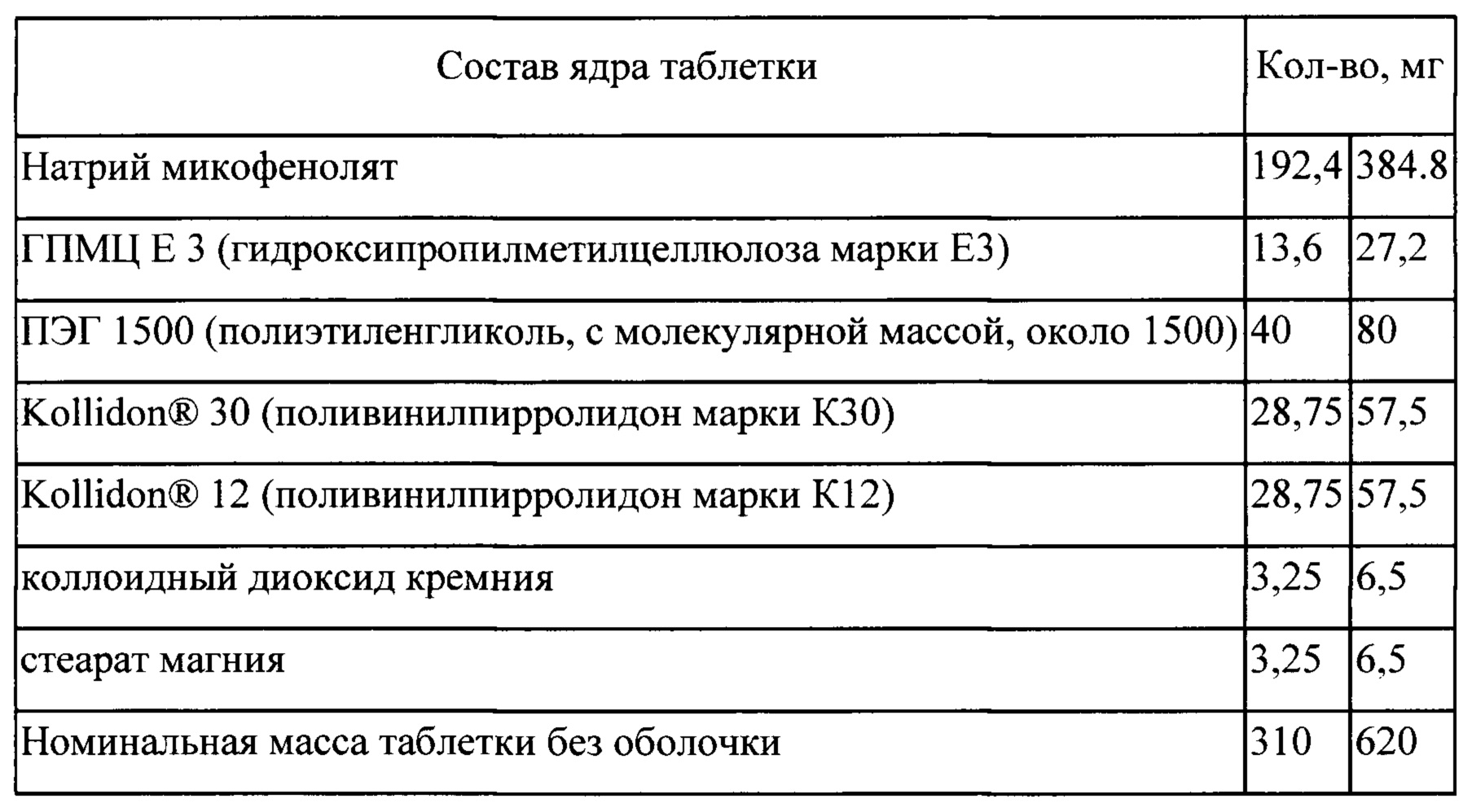
Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30,
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 60±5; 125±5; 130±5; 135±5°С
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ Е3, коллоидным диоксидом кремния, Kollidon® 12 и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 15

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 12 (1/2 часть общего количества),
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 60±5; 125±5; 130±5; 135±5°С
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ Е3, коллоидным диоксидом кремния, Kollidon® 12 (оставшаяся часть) и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 16
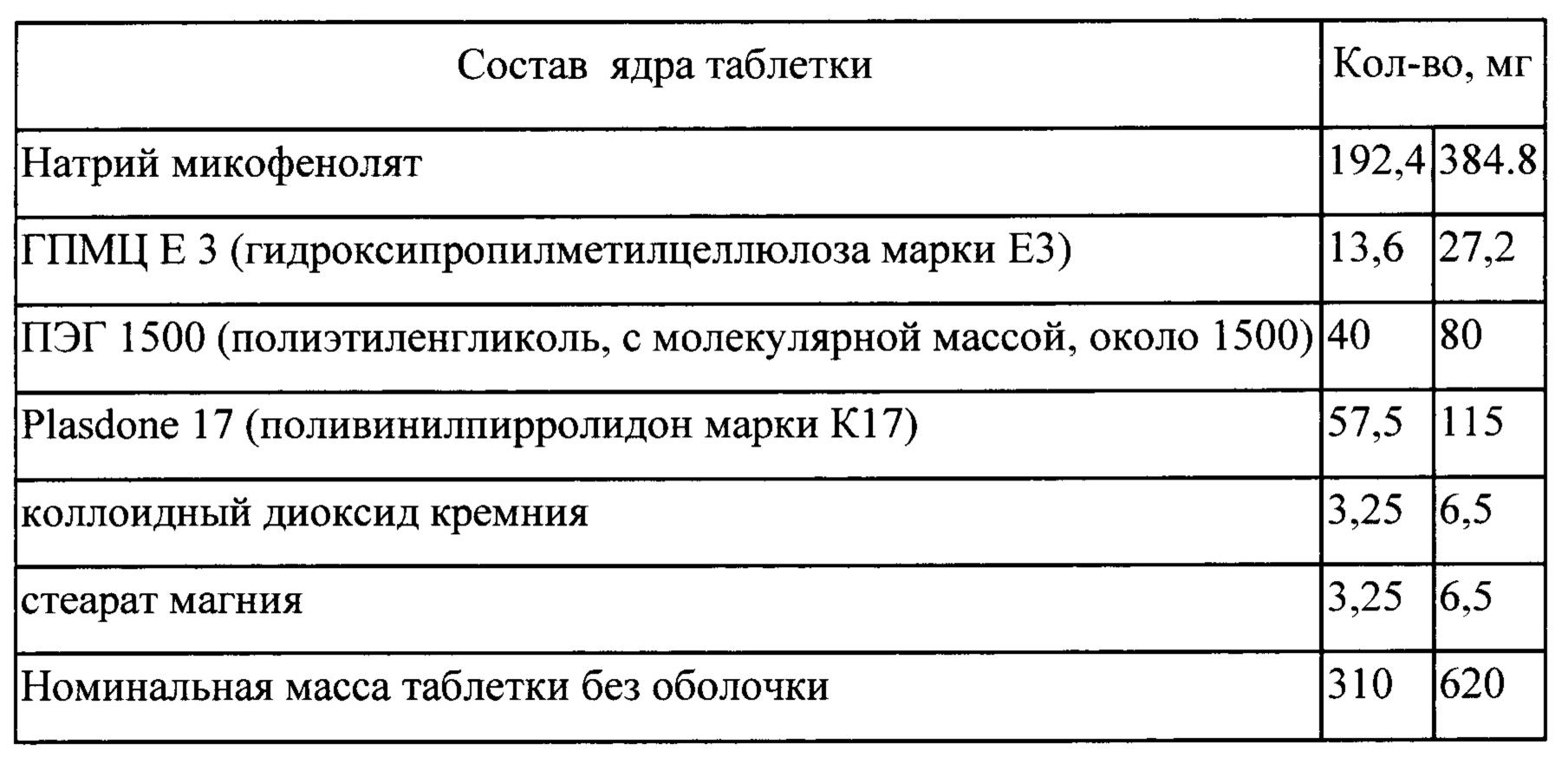
Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Plasdone 17 (1/2 часть общего количества),
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 60±5; 125±5; 130±5; 135±5°С
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ Е3, коллоидным диоксидом кремния, Plasdone 17 (оставшаяся часть) и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 17
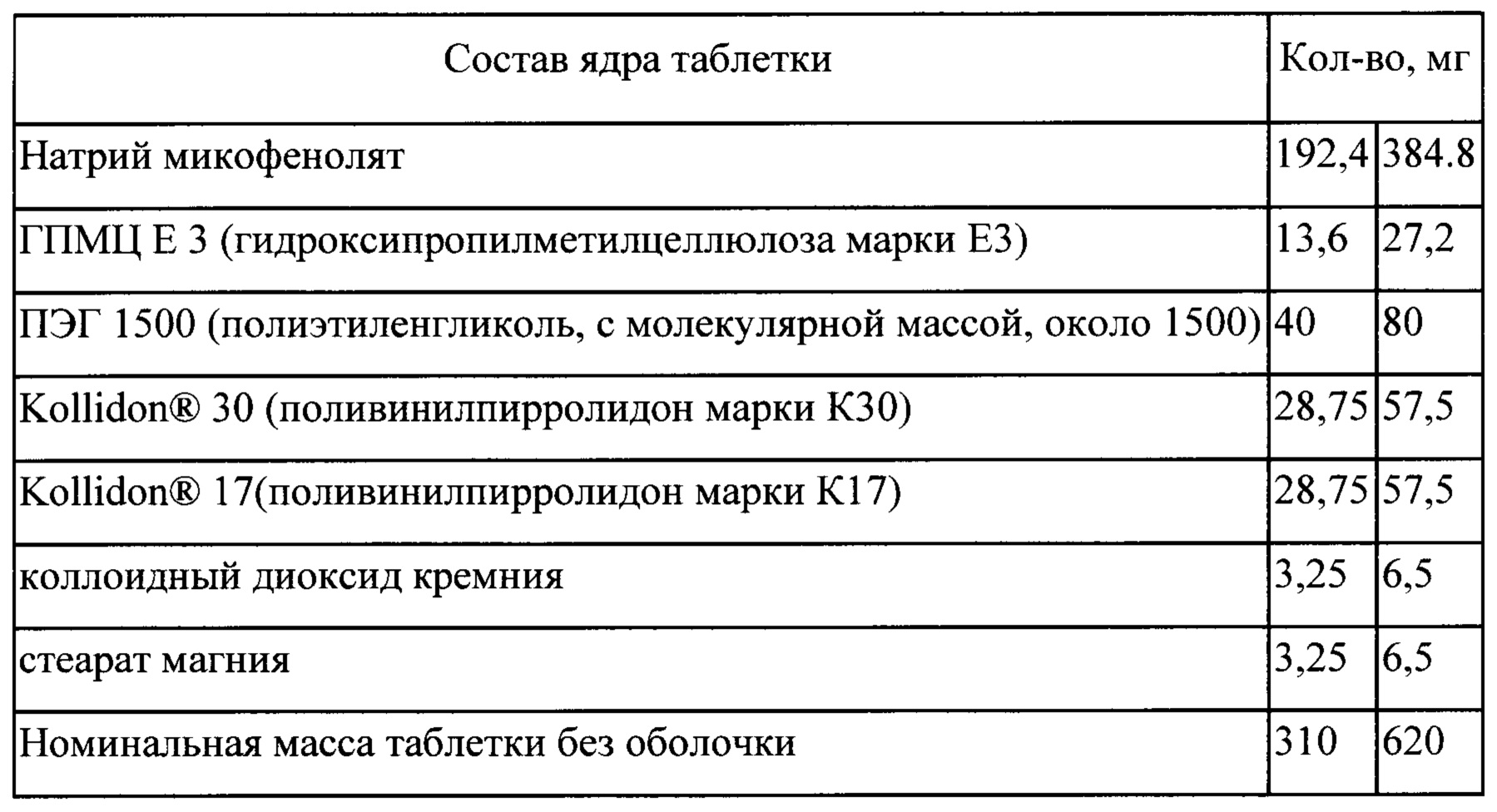
Процесс
Входящие в состав таблетки компоненты: натрий микофенолят (85% от общего количества), ПЭГ 1500, Kollidon® 30,
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 60±5; 125±5; 130±5; 135±5°С
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ Е3, коллоидным диоксидом кремния, Kollidon® 17, натрий микофенолятом (оставшаяся часть) и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 18


Процесс
Входящие в состав таблетки компоненты: натрий микофенолят (, ПЭГ 1500, Kollidon® 30,
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 60±5; 125±5; 130±5; 135±5°С
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ Е3, коллоидным диоксидом кремния, Kollidon® 12 и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 19


Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Plasdone 17 (1/2 от общего количества),
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 60±5; 125±5; 130±5; 135±5°С
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ ЕЗ, коллоидным диоксидом кремния, Plasdone 17 (оставшуюся часть) и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 20
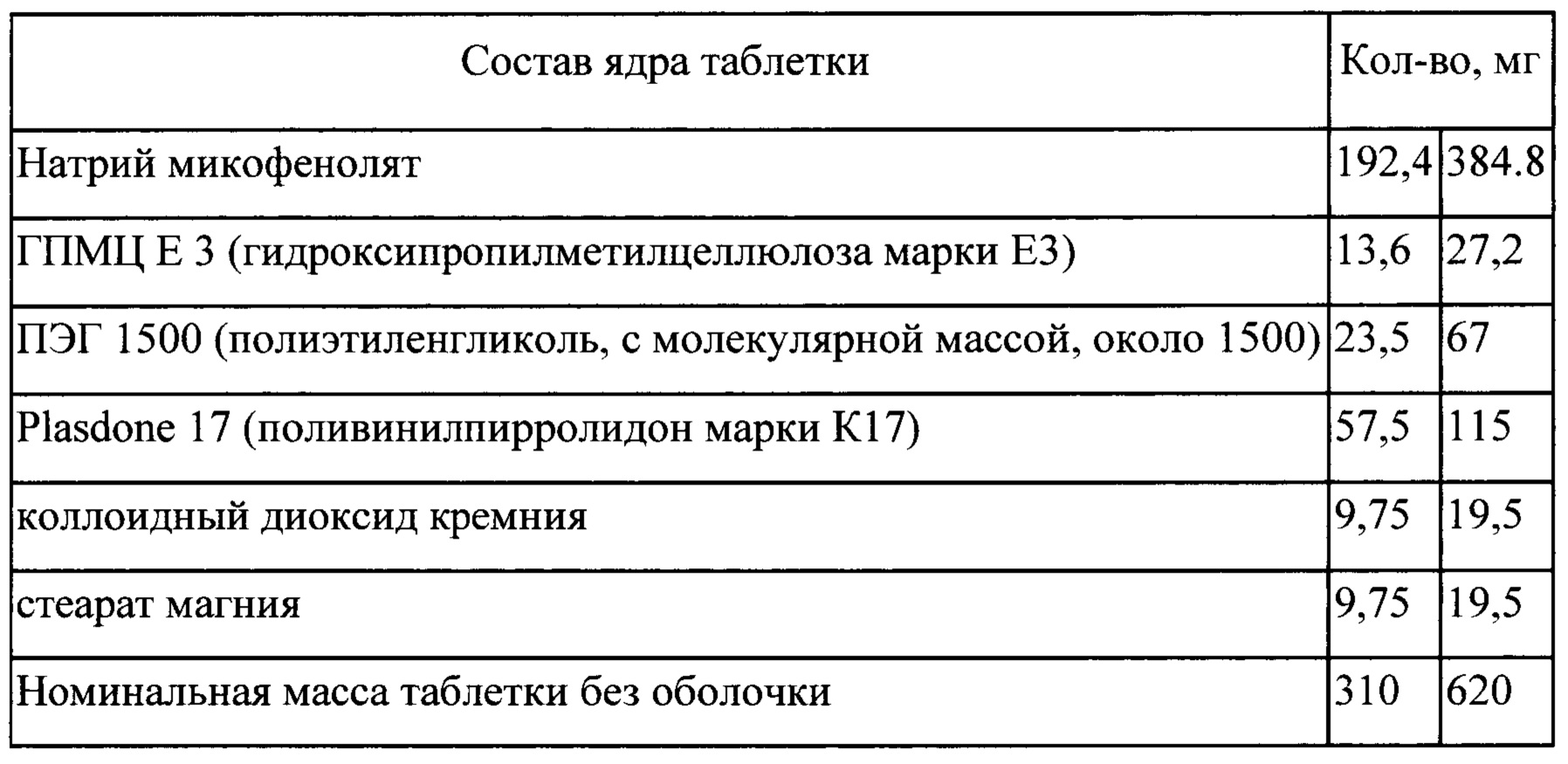
Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Plasdone 17 (1/2 от общего количества),
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 60±5; 125±5; 130±5; 135±5°С
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ Е3, коллоидным диоксидом кремния, Plasdone 17 (оставшуюся часть) и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 21
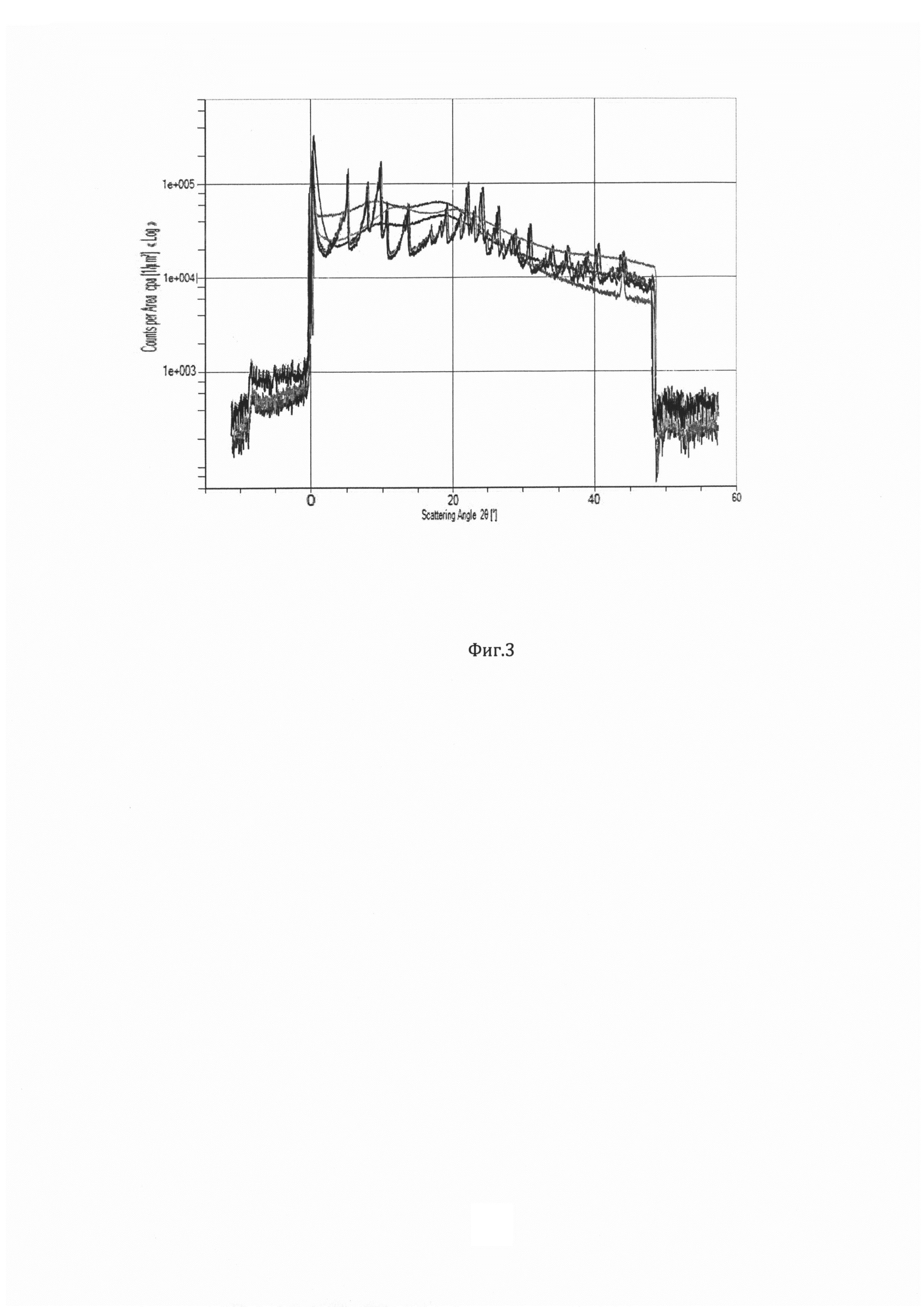
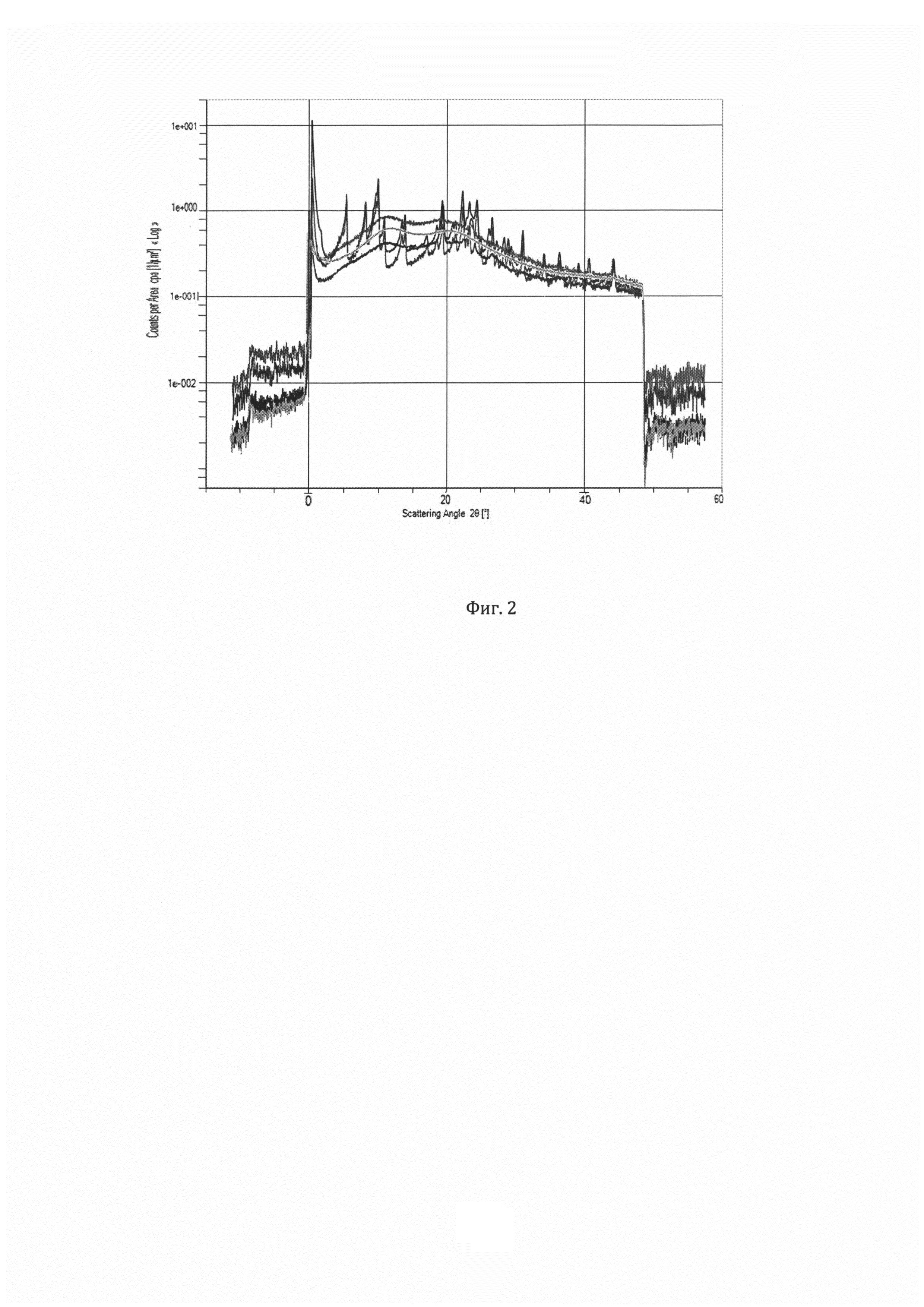
Система SAXSpace - МалоУгловое Рентгеновское Рассеяние (SAXS или МУРР) это недеструктивный метод для исследования кристалличности и ориентации материалов, стабильности дисперсий. Экструдат (пример 3) и компоненты входящие в состав экструдата были анализированы с помощью SAXS на предмет кристалличности материалов. Наличие у экструдата по примеру 3 характеристически выраженных пиков в области до 5 - 10 градусов указывает на то что АФС находится в кристаллическом состоянии в свежеприготовленном экструдате (Фигура 1) и в течение 1 месяца хранения экструдата при 20°C/60HD в течение 2 месяцев (Фигура 2), в отличие от экструдата по примеру 22, у которого указанные пики отсутствуют, что говорит, о том, что АФС в экструдате находится в аморфном состоянии.
Аналогичным образом были проанализированы все экструдаты по примерам 1-20 и установлено, что во всех микофенолят натрия находится в кристаллической форме.
Пример 22

Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 80±5; 145±5; 160±5; 180±5; 200±5; 145±5°С.
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с крахмалом прежелатинизированным, коллоидным диоксидом кремния и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 23
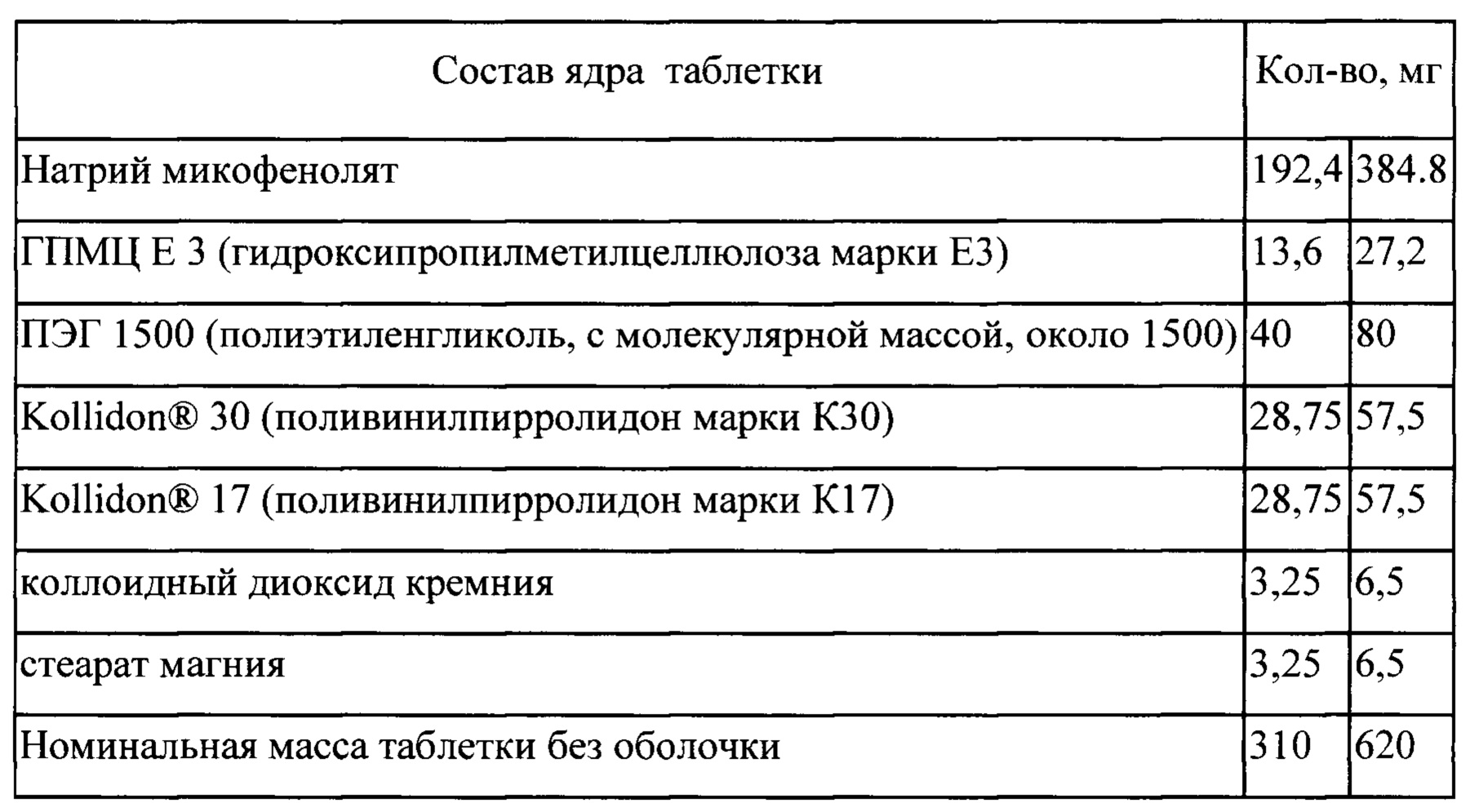
Процесс
Входящие в состав таблетки компоненты: натрий микофенолят, ПЭГ 1500, Kollidon® 30,
(I) смешивают;
(II) экструдируют при температуре в следующих последовательных температурных режимах 145±5; 160±5; 180±5; 200±5; 145±5°С.
(III) измельчают экструдат;
(IV) смешивают измельченный экструдат с ГПМЦ ЕЗ, коллоидным диоксидом кремния, Kollidon® 17 и стеаратом магния; спрессовывают в таблетки (V) на таблетки наносят покрытие в машине для нанесения покрытия.
Пример 24
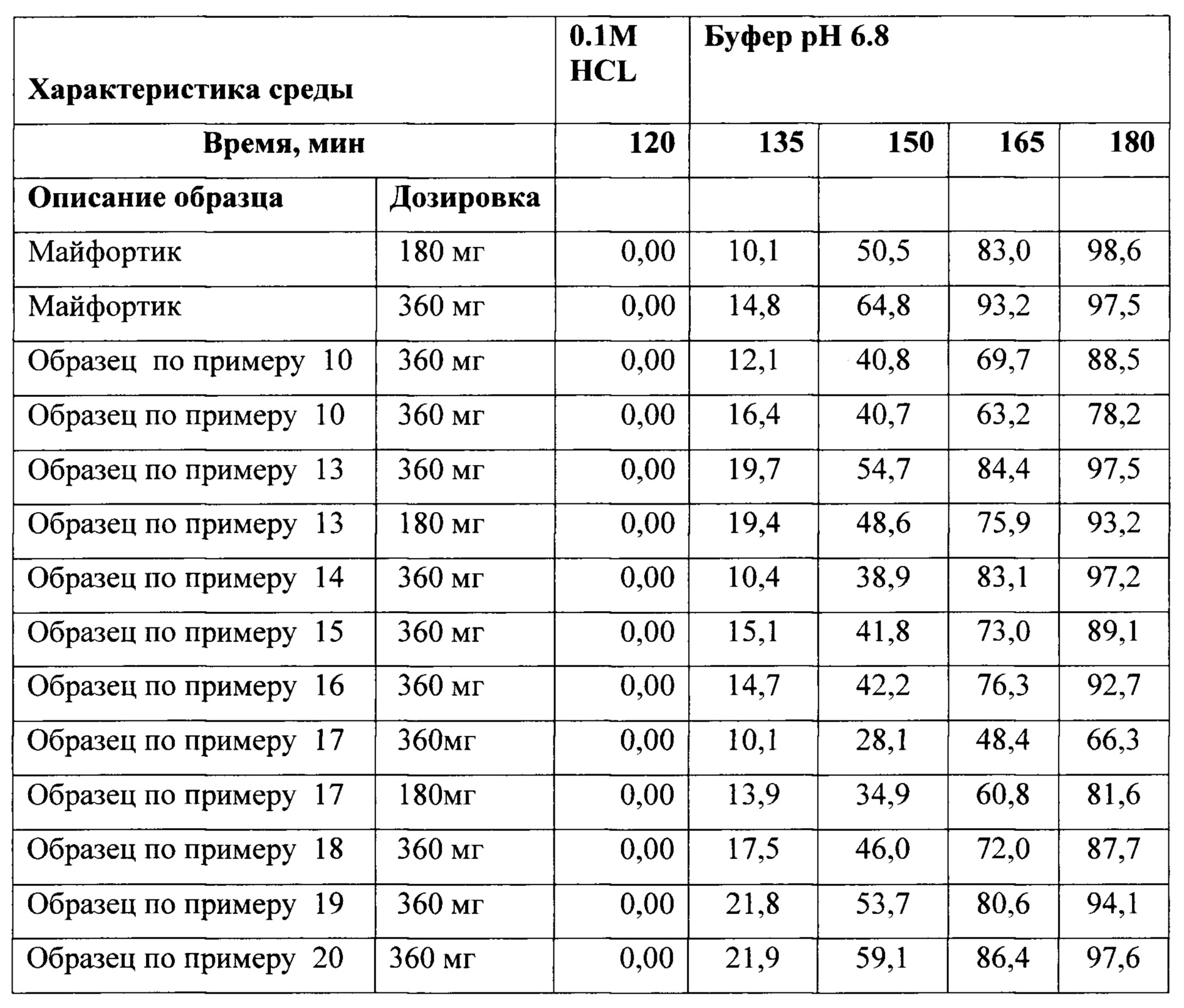
Система SAXSpace - МалоУгловое Рентгеновское Рассеяние (SAXS или МУРР) это недеструктивный метод для исследования кристалличности и ориентации материалов, стабильности дисперсий. Экструдат (пример 13) и компоненты входящие в состав экструдата были анализированы с помощью SAXS на предмет кристалличности материалов. Наличие у экструдата по примеру 13 характеристически выраженных пиков в области до 5-10 градусов указывает на то, что АФС находится в кристаллическом состоянии в свежеприготовленном экструдате (Фигура 3), в отличие от экструдата по примеру 23, у которого указанные пики отсутствуют, что говорит о том, что АФС в экструдате находится в аморфном состоянии.
Таким образом, неожиданно обнаруженное свойство микофенолята натрия сохранять кристаллическую форму при его экструзии с фармацевтически приемлемым полимером позволит не только упростить производство пероральной твердой лекарственной формы, но и избавит от необходимости использования органических растворителей, при этом профиль высвобождения действующего вещества из полученных ЛП будет сопоставим с хорошо изученными лекарственными формами (см. табл. 1).