Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ ИНДОЦИАНИНА В КАЧЕСТВЕ МАРКЕРА НАНОЧАСТИЦ
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к применению индоцианина зеленого (ИЦЗ) в качестве оптической метки наночастиц, содержащих лекарственное вещество белковой природы.
В наши дни в результате развития сферы биотехнологии на коммерческом уровне производится огромное количество пептидных и белковых препаратов. В последнее десятилетие возрос интерес к созданию и выпуску биологических препаратов, предназначенных для лечения ряда заболеваний со значительной нереализованной потребностью медицины. Клиническая разработка препаратов таких типов невозможна без специального технического оснащения, в отличие от традиционно используемых препаратов на основе малых молекул. Пероральный прием препаратов является самым распространенным способом приема, но он, как правило, невозможен в случае пептидных и белковых препаратов. Основной причиной низкой биодоступности биопрепаратов при пероральном приеме является досистемное ферментативное расщепление и затрудненное проникновение в кровоток. В последние десятилетия был досконально изучен механизм всасывания макромолекулярных препаратов из желудочно-кишечного тракта (ЖКТ), а также барьеры, препятствующие всасыванию в ЖКТ. Были испытаны различные методы преодоления этих барьеров и стратегии, направленные на разработку безопасных и эффективных систем для перорального приема белков. Пероральный прием пептидов и белков все еще вызывает значительные трудности и является объектом многих фармакологических исследований.
Перенос препаратов на основе белков затрудняется следующим:
- Большинство терапевтических пептидов и белков гидрофильно и имеет значение LogP<0. Таким образом, они не могут подвергнуться трансцеллюлярной абсорбции путем пассивной диффузии.
- Размеры параклеточного пространства находятся в пределах 10 и 30-50А°, и параклеточный путь невозможен для всасывания макромолекул, так как он ограничен сравнительно малыми гидрофильными молекулами, которые могут пройти сквозь такое пространство.
В то время как некоторые белки активно всасываются через клеточную апикальную мембрану клеток тонкого кишечника, после связывания с клеточными рецепторами, лишь незначительная их часть выходит на базолатеральной мембране и выделяется в кровоток в неизмененной форме. Несмотря на это, все чаще появляются данные о том, что значительное количество пептидов и белков (достаточное для проявления фармакологического эффекта) может всасываться при условии, что они защищены от воздействия протеолитических ферментов в ЖКТ.
Для увеличения биодоступности биологических препаратов при пероральном приеме может быть эффективна стратегия, направленная на повышение их проникновения или использование ингибиторов протеаз в качестве добавок (см. Innovations in the Delivery of Peptides. Business Insights, (2012), 1-242., A. Sood, et. al. Chem. Rev. 101, (2001), 3275-3303., Leone-Bay, M. Sato, et. al., Pharmaceut. Res. 18 (2001) 964-970., A. LeoneBay, K.H. Ho, et. al., J. Med. Chem. 39, (1996), 2571-2578, S. Lee, et. al., Diabetologia 48, (2005), 405-411., M. Kidron, et. al., Diabet. Med. 21, (2004), 354-357., S.J. Wu, J.R. Robinson, J. Control. Release 62, (1999), 171-177.)
Несмотря на то что эти методы могут успешно применяться в лаборатории, они все еще не признаются большинством практикующих врачей и регулирующих органов. Использование ингибиторов ферментов в ходе долгосрочной терапии остается спорным вопросом из-за возможного всасывания нежелательных белков, нарушения усвоения питательных белков и стимуляции секреции протеаз в результате обратной регуляции.
Была изучена стратегия модулирования проницаемости клеток кишечника через плотные контакты (Tight Junctions) для стимулирования параклеточного переноса молекул препарата. Токсин ZOT (Zonula Occludens toxin), хитозан, тиолированные полимеры и Pz-пептид демонстрируют выраженную способность к повышению всасывания макромолекулярных препаратов. Однако вероятно, данная стратегия также может вызвать вопросы, связанные с безопасностью. После открытия плотного контакта стимулируется перенос не только препаратов, но также потенциально токсичных или нежелательных молекул, присутствующих в ЖКТ.
Поэтому в данном случае подходящим вариантом может быть использование систем доставки лекарственных веществ (СДЛВ), таких как гидрогели, наночастицы, микросферы, и систем доставки лекарственных средств на основе липидов (например, наноэмульсий, липосом и твердых липидных наночастиц), которые направлены на защиту пептидов и белков от ферментативного распада и которые способны модулировать перенос препарата.
В частности, при работе с биоразлагаемыми веществами СДЛВ в наномасштабе (<1 мкМ) обладает следующими преимуществами:
- пригодна для доставки лекарственных средств с гидрофобными, амфипатическими и гидрофильными свойствами;
- хорошо биосовместима благодаря биоразлагаемости и низкой токсичности;
- может служить в качестве средства контролируемого высвобождения лекарственного вещества в организме;
- может вводиться различными путями, включая пероральный.
Используемые сокращения
СДЛВ - система доставки лекарственных веществ НЧ- наночастицы
ПМГК - сополимер поли(молочной-ко-гликолевой кислоты)
ПМК - поли(молочная кислота)
БСА - бычий сывороточный альбумин
ФИТС - флуоресцеинизотиоцианат
ИЦ3 - Индоцианин зеленый
СЭМ - сканирующий электронный микроскоп
MTS - 3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолий
Papp - коэффициент видимой проницаемости.
ДМФ - диметилформамид
ДХМ - дихлорметан
ТФК - трифторуксусная кислота
ПВС - поливиниловый спирт
ДДВ - бидистиллят воды
ДСН - додецилсульфат натрия
ЭИ - эффективность инкапсулирования
К3 - коэффициент загрузки
СП - содержание препарата
ИПД - индекс полидисперсности
ИКС - искусственная кишечная среда
ВП - высвобождение препарата
PMS - феназинметасульфат
КЛСМ - Конфокальная лазерная сканирующая микроскопия.
На схеме 1 приведен меченый пептид.
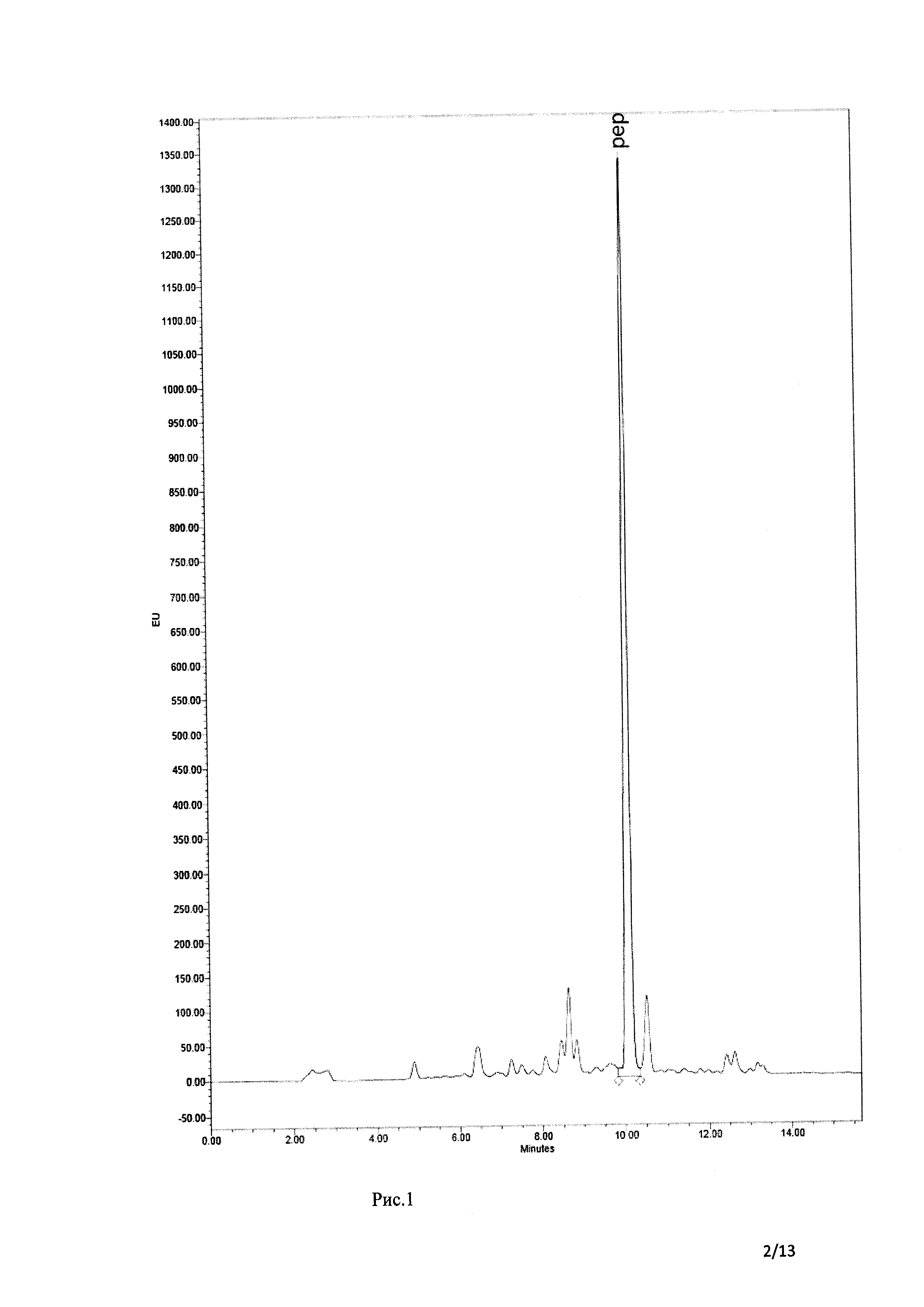
Рис. 1 ВЭЖХ хроматограмма неочищенного пептида-ФИТЦ 10-мера, сделанная хроматографом Alliance Waters с использованием многоволнового детектора флуоресценции 2 475 на длине волны 485/528 нм и анализ МС время-пролетной ионизацией лазерной десорбции с использованием матрицы.
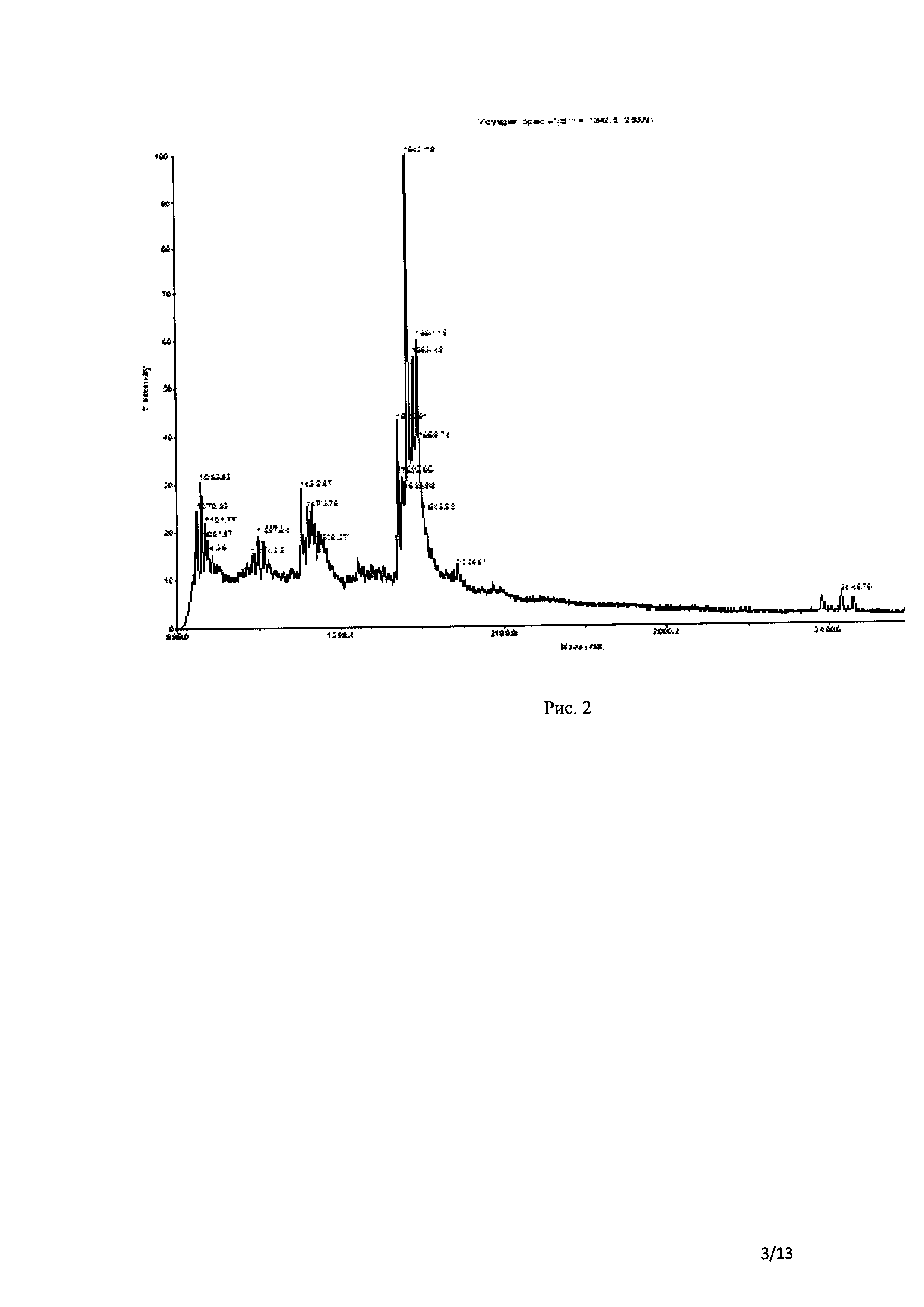
Рис. 2 ВЭЖХ хроматограмма очищенного продукта. Чистота пептидов и Mw были определена прибором Voyager DE-Pro MALDI-TOF (ABI) (В) с использованием α-циано 4-гидроксикоричной кислоты в 0,1% ТХК: АЦН (1:1) в качестве матрицы в линейно-положительном режиме.
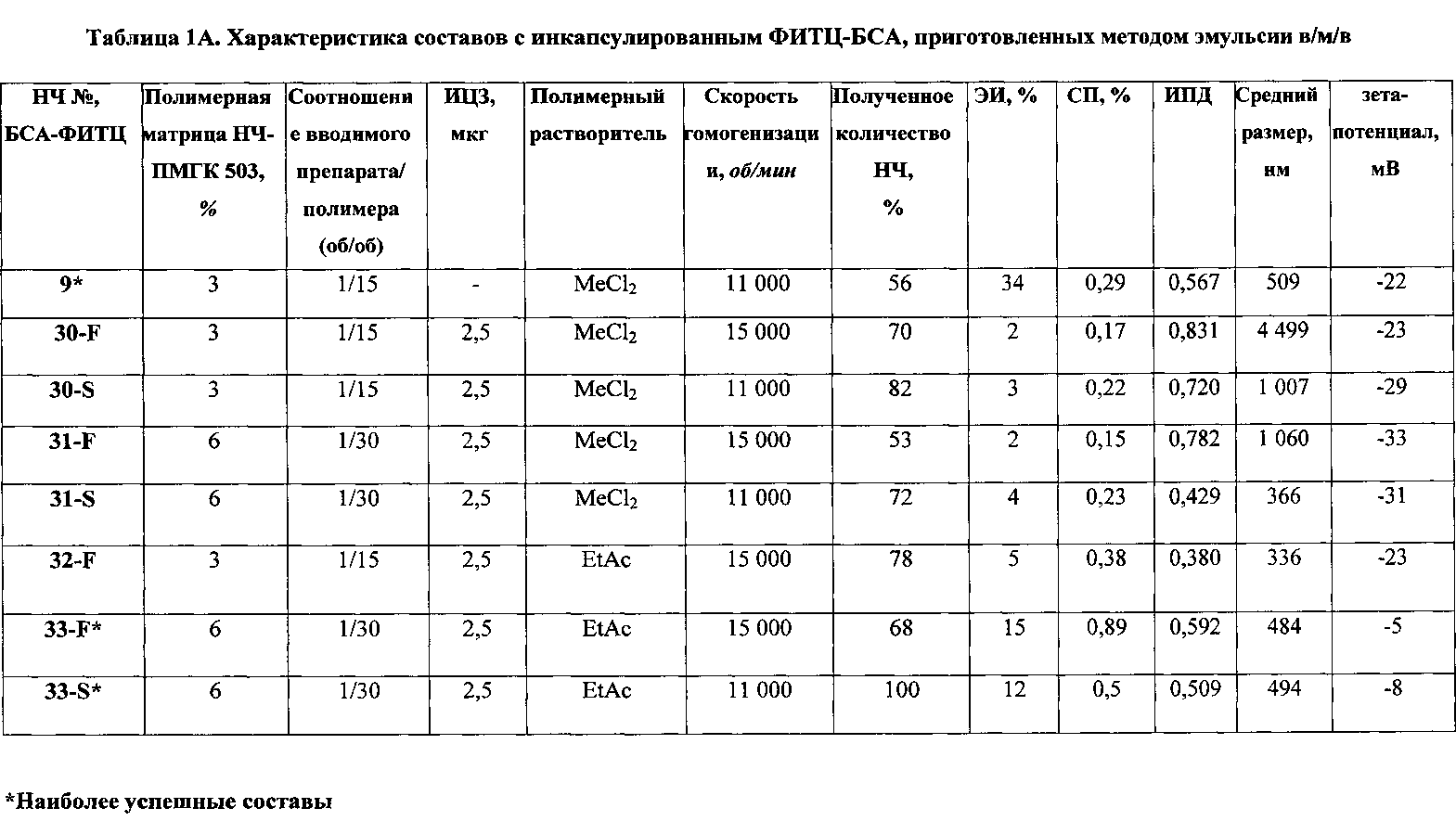
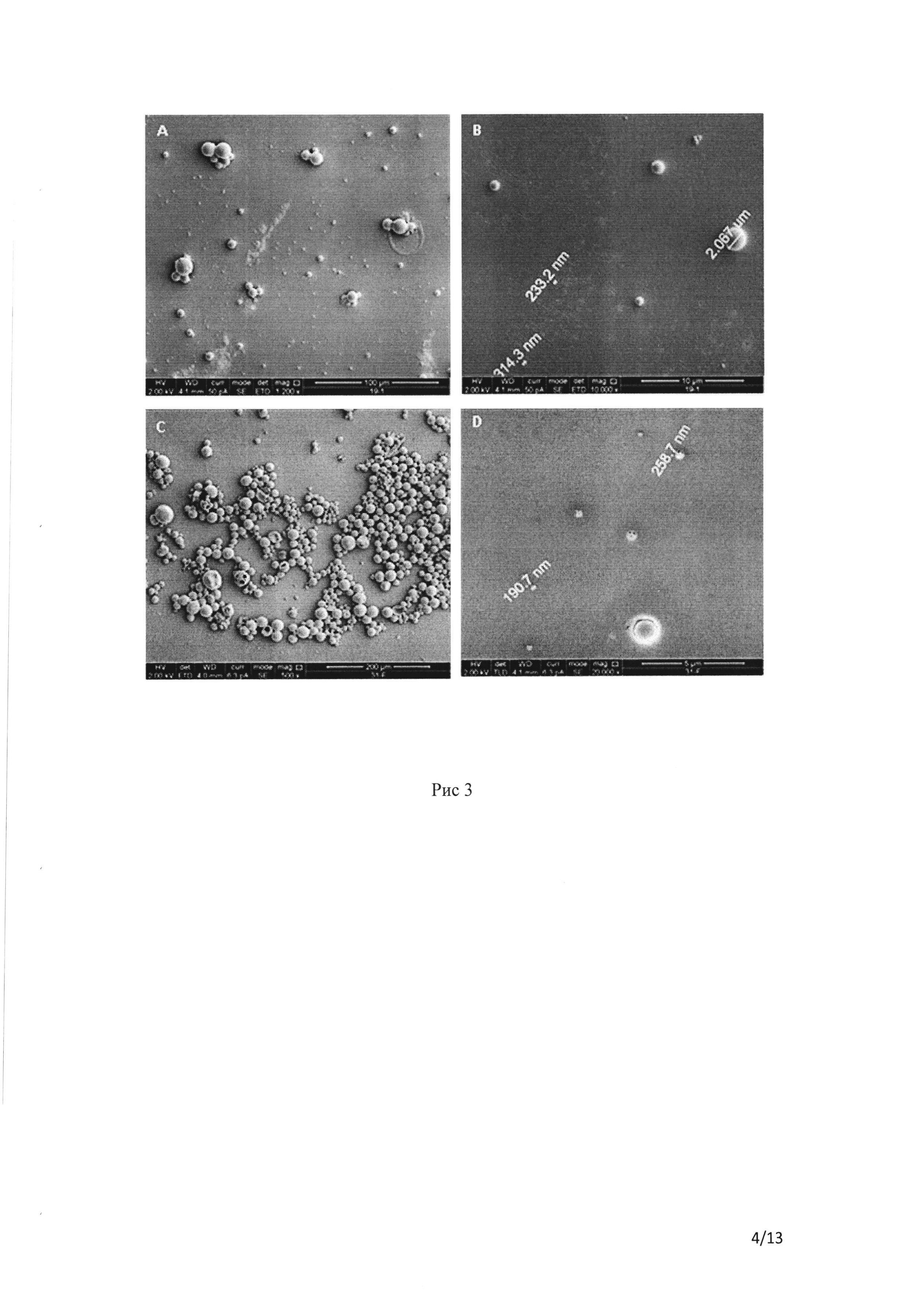
Рис. 3 СЭМ суспензии наночастиц, содержащей БСА-ФИТЦ, приготовленной из полимера ΠΜΓΚ-RG 503 с использованием MeCl2 в качестве растворителя. Частицы были созданы методом двойной эмульсии с использованием 0,5% сахарозы в качестве крио- и лиопротектора. А и В демонстрируют НЧ №9 (таблица 1А), а С и D демонстрируют НЧ №31-F, помеченные ИЦЗ (таблица 1А).
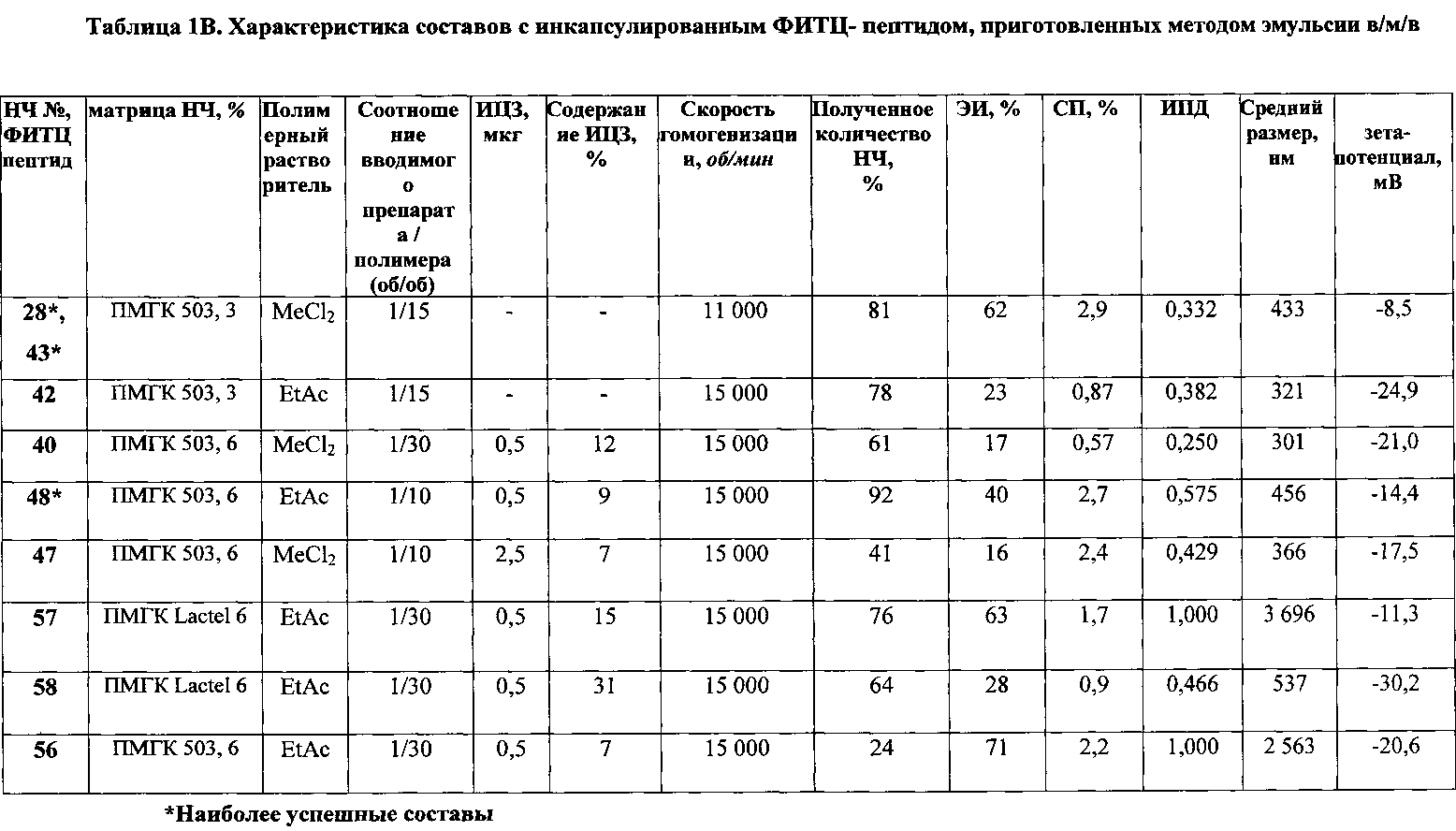
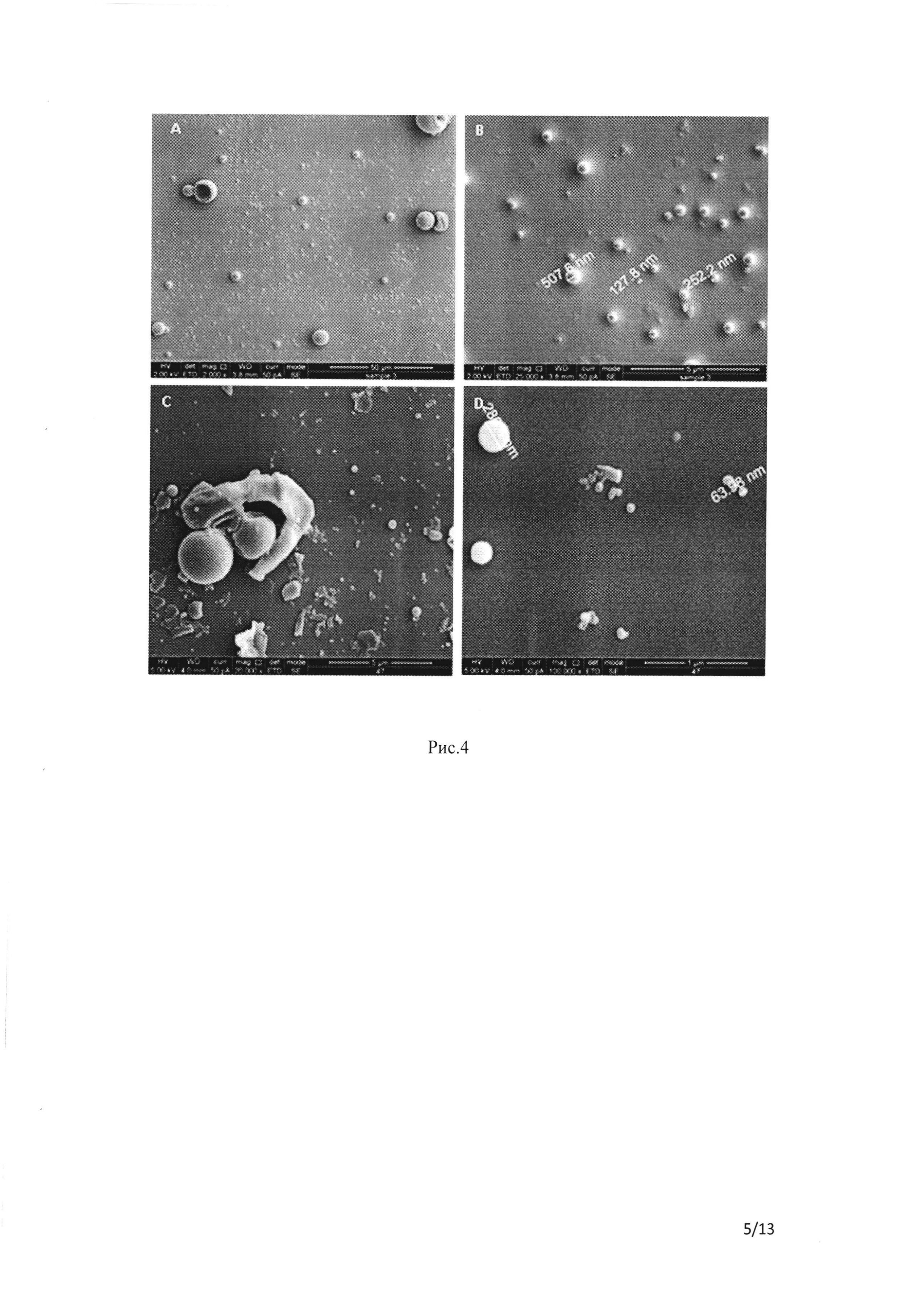
Рис. 4 СЭМ суспензии наночастиц, содержащей ФИТЦ пептид, приготовленной из полимера ΠΜΓΚ-RG 503 с использованием MeCl2 в качестве растворителя. Частицы были созданы методом двойной эмульсии с использованием 5% сахарозы в качестве крио- и лиопротектора. А и В демонстрируют НЧ №28 (таблица 1В), а С и D демонстрируют НЧ №47, помеченные ИЦЗ (таблица 1В).
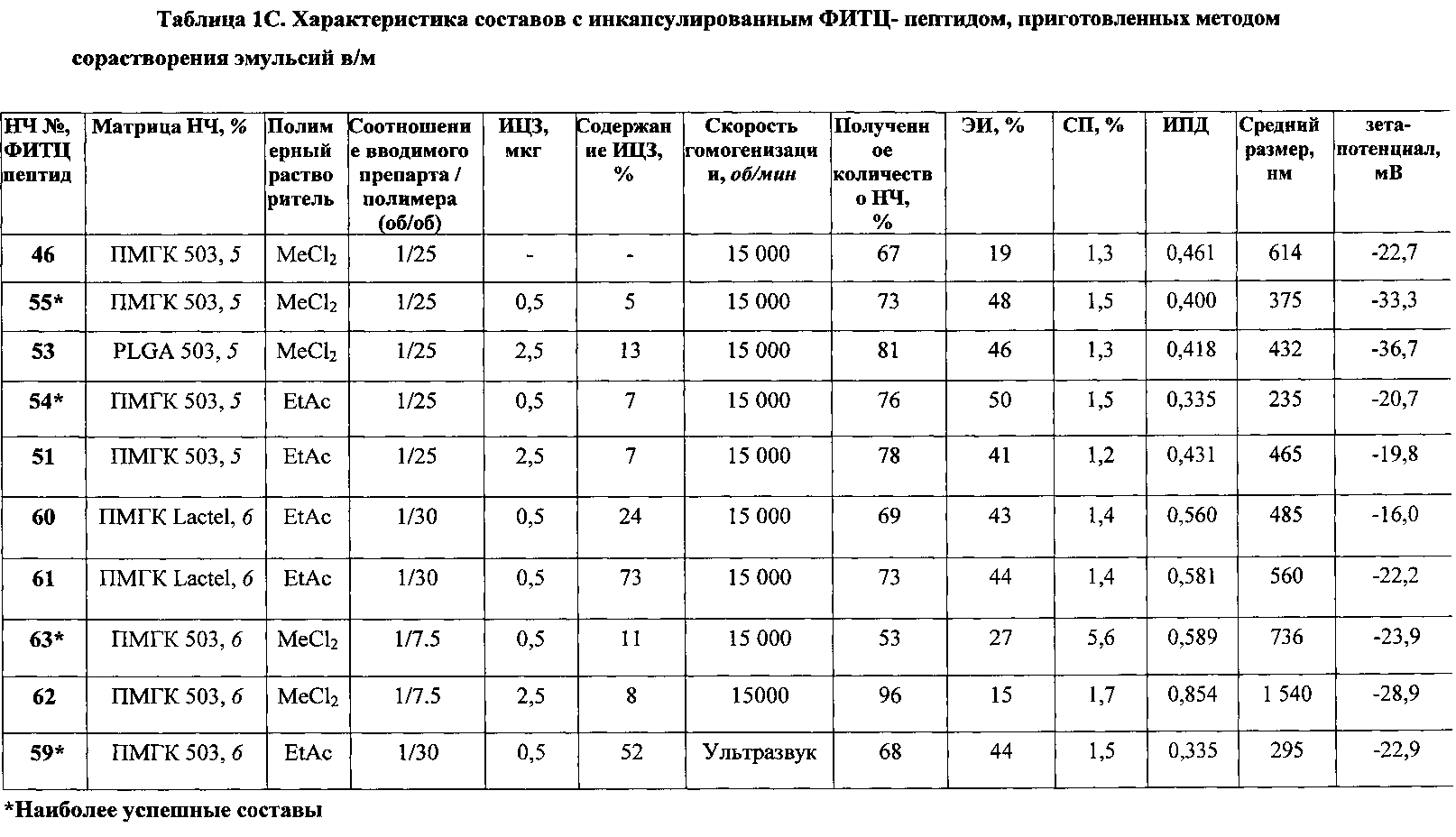
Рис. 5 СЭМ лиофилизированного порошка наночастиц №48, содержащих ФИТЦ пептид (таблица 1В)
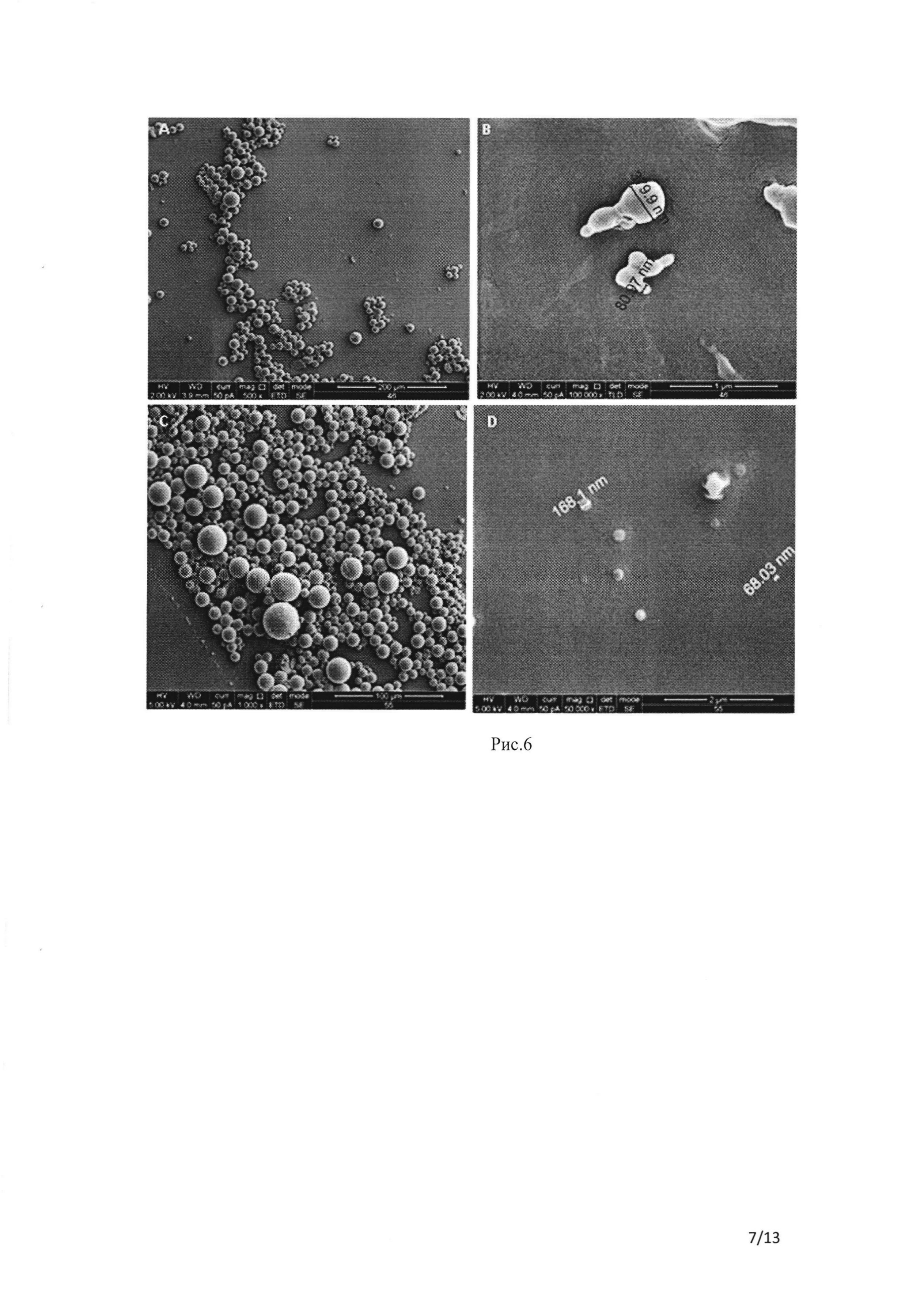
Рис. 6 СЭМ суспензии наночастиц, содержащей ФИТЦ пептид, приготовленной из полимера ΠΜΓΚ-RG 503 с использованием MeCl2 в качестве растворителя. Частицы были созданы методом сорастворения эмульсии м/в с использованием 5% сахарозы в качестве крио- и лиопротектора. А и В демонстрируют НЧ №46 (таблица 1С), а С и D демонстрируют НЧ №55, помеченные ИЦЗ (таблица 1С).
Рис. 7 СЭМ суспензии наночастиц №59 (таблица 1С), содержащей ФИТЦ пептид, приготовленной из полимера ΠΜΓΚ-RG 503 с использованием MeCl2 в качестве растворителя. Частицы были созданы методом сорастворения эмульсии м/в с использованием 5% сахарозы в качестве крио- и лиопротектора с помощью обработки ультразвуком.
Рис. 8 СЭМ суспензии наночастиц №56, 57, 58, меченых ИЦЗ (таблица 1В), содержащей ФИТЦ пептид, приготовленной из полимера ΠΜΓΚ-RG 503 (A), Lactel А 9 (В) или Lactel All (С) с использованием MeCl2 в качестве растворителя. Частицы были созданы методом двойной эмульсии в/м/в с использованием 5% сахарозы в качестве крио- и лиопротектора.
Рис. 9 СЭМ суспензии наночастиц №54, 60, 61, меченых ИЦЗ (таблица 1С), содержащей ФИТЦ пептид, приготовленной из полимера ΠΜΓΚ-RG 503 (A), Lactel А 9 (В) или Lactel All (С) с использованием EtAc в качестве растворителя. Частицы были созданы методом сорастворения м/в с использованием 5% сахарозы в качестве крио- и лиопротектора.
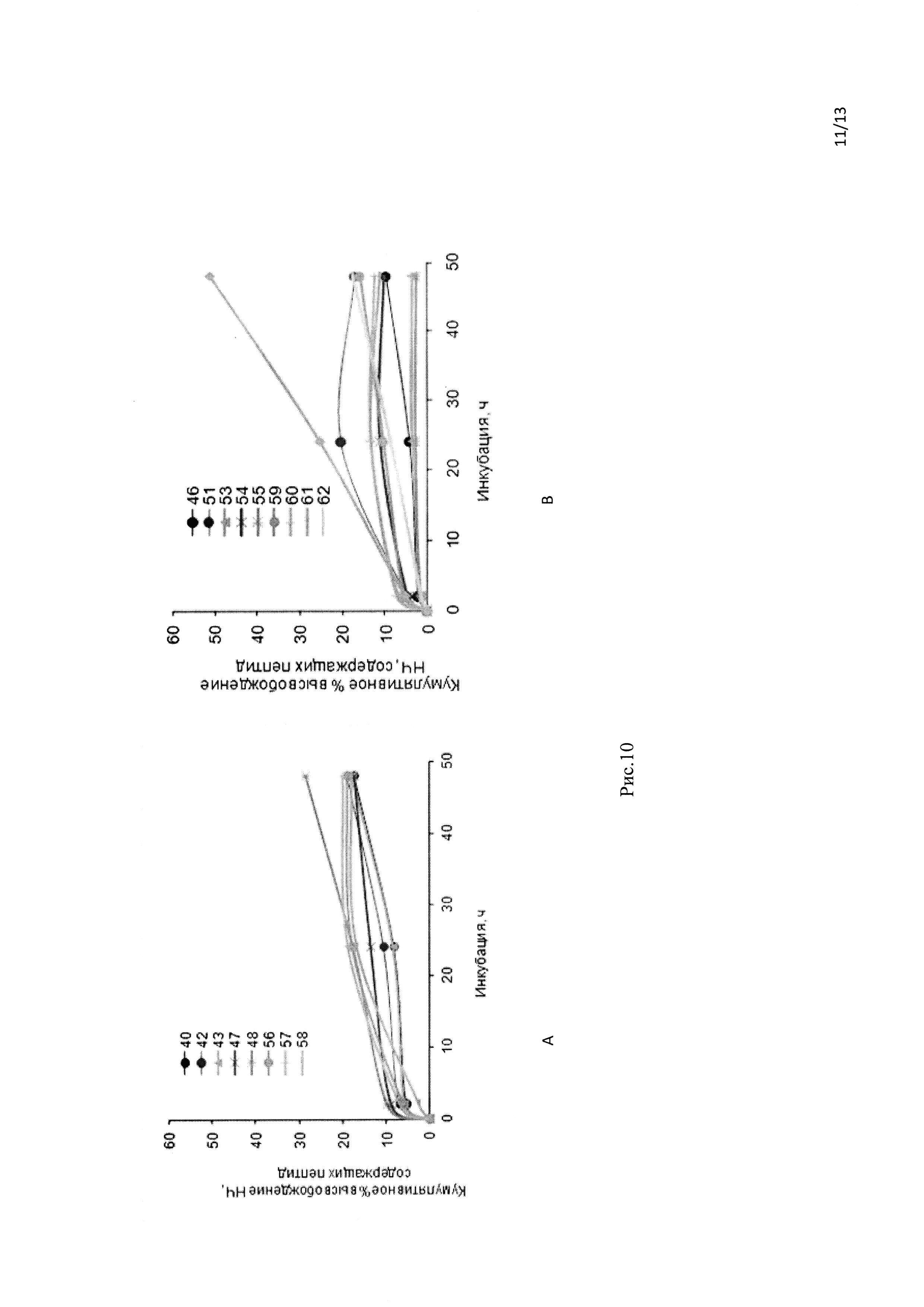
Рис. 10 Кинетика кумулятивного высвобождения ФИТЦ пептида из составов на основе НЧ, приготовленных методом двойной эмульсии (А) и методом сорастворения м/в (В) в ИКС.
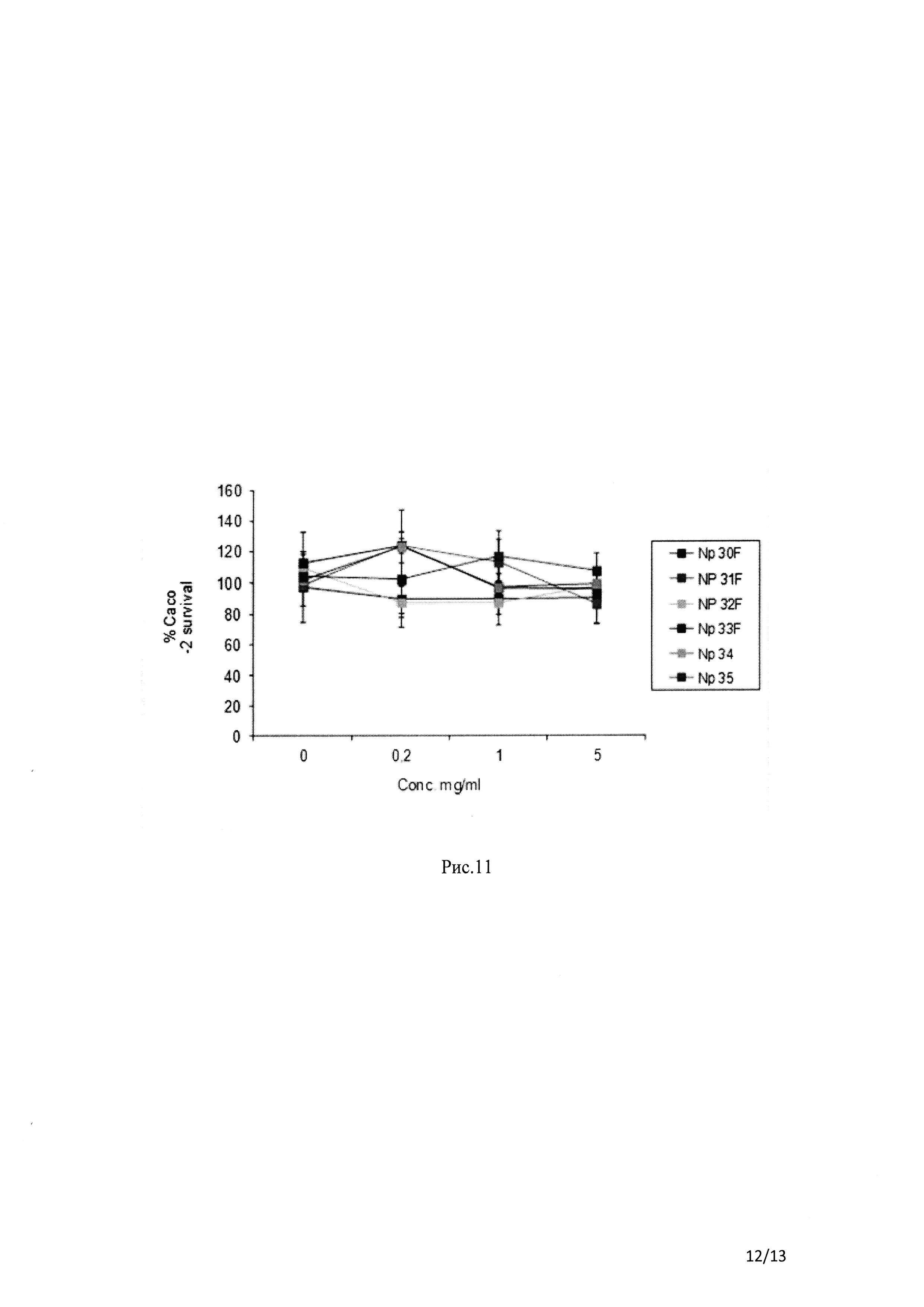
Рис. 11 Влияние составов на основе НЧ, содержащих БСА-ФИТЦ на жизнеспособность клеток Сасо-2, оцененное методом MTS.
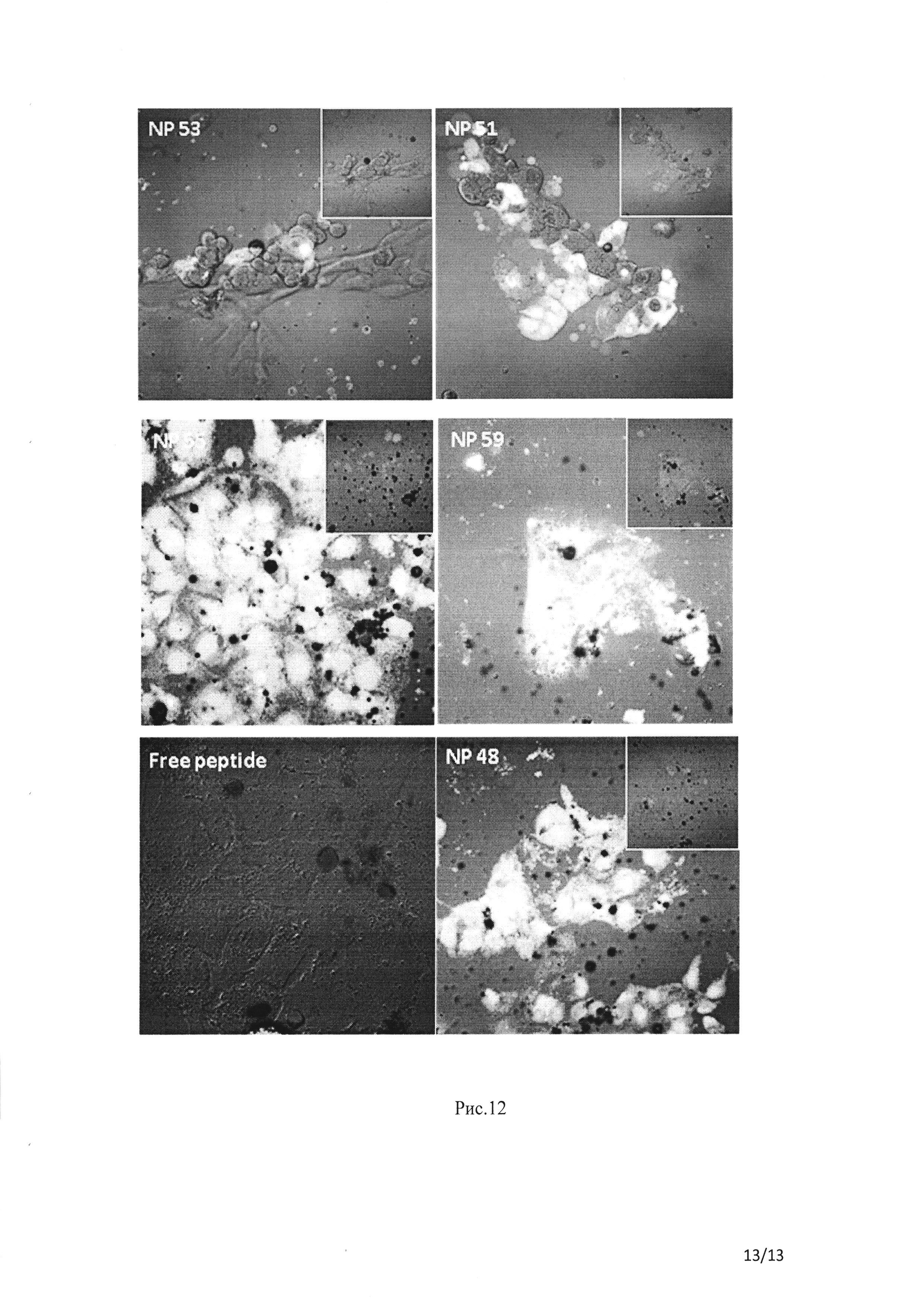
Рис. 12 Распределение в клетках Сасо-2 ФИТЦ пептида (зеленый) после 4 ч инкубации с различными составами. Обработанные Сасо-2 клетки были изучены с помощью конфокального лазерного сканирующего микроскопа Fluoview 300 (КЛСМ, «Олимпус», Пенсильвания, США).
Самым хорошо изученным классом полимеров, с точки зрения токсикологических и клинических данных, являются алифатические поли(эфир)ы, состоящие из молочной и гликолевой кислоты. Их соответствующие полимеры, поли(молочная кислота), поли(гликолевая кислота) и сополимер поли(молочной-ко-гликолевой кислоты) нашли широкое коммерческое применение в качестве систем доставки лекарственных средств в нанодиапазоне. Поли(лактид-ко-гликолид) (PLGA) представляет собой «золотой стандарт» биоразлагаемых полимеров. Свойство этих сополимеров могут быть модифицированы за счет изменения соотношения PLA и PLG, что отражается в увеличении сроков биоразложения от нескольких дней до нескольких недель при повышении содержания PLA в СДЛС.
Говоря в целом, наноразмеры стимулируют перенос частиц через эпителий слизистых оболочек. Было показано, что 100 нм частицы поли(молочной-ко-гликолевой кислоты) (ПМГК) распределялись по всему подслизистому слою, в то время как 10 мм частицы были преимущественно локализованы на над-эпителиальном слое тканей. В своей совокупности, наноразмерные носители, состоящие из биосовместимых полимеров, считаются перспективными для разработки системы пероральной доставки макромолекул.
ПМГК и ПМК высоко биосовместимы и биоразлагаемы. Они использовались с восьмидесятых годов в различных целях in vivo (для биоразлагаемых имплантатов, контролируемого высвобождения препаратов). Так как поглощение частиц кишечными клетками зависит от размера частиц, то их размер является одним из важнейших условий успешной пероральной доставки наночастиц. В нашем исследовании ПМГК была выбрана в качестве наиболее подходящего носителя препаратов, при этом, в создании наночастиц были использованы различные виды ПМГК, а так же сама полимолочная кислота, как крайний вид сополимера.
В результате проведенных исследований были разработаны СДЛВ в виде НЧ меченные оптической меткой с действующим веществом белковой природы.
Примерный количественный состав СДЛВ приведен в таблице 2.

Пояснения к составу:
1) Полимер - основная составляющая наночастиц, эмульгатор может быть практически удален в техническом процессе, лиопротектор может быть не использован, а пептид эффективен в микродозировках, то может получиться, что основная масса придется на полимер.
2) Для наночастиц на основе полимеров возможна загрузка до примерно 60%.
3) Эмульгатор может быть как практически удален в технологическом процессе, так и выступать не только в роли эмульгатора, но и лиопротектора.
4) Изобретение может быть реализовано в виде суспензии наночастиц (лиопротектора - 0%), так и в виде твердой лекарственной формы, полученной с помощью лиофилизации, тогда лиопротектор (например, манитол) может быть использован в качестве наполнителя.
Эффективными для доставки действующего вещества являются наночастицы,
имеющие средний размер не более 500 нм. Из известных исследований Anne des Rieux, et. al., Transport of nanoparticles across an in vitro model of the human intestinal follicle associated epithelium, European journal of pharmaceutical sciences 30(2007) 380-391 и G.J. Russell-Jones, et. al., Lectin-mediated transport of nanoparticles across Caco-2 and OK cells, Int. J. Pharm. 190 (1999) 165-174, в которых изучен транспорт наночастиц с максимальным размером 500 нм, субъективно следует, что именно такова верхняя граница частиц со значимым проникновением (RU 2145498).
Важной задачей данного исследования была разработка систем доставки на основе наночастиц, которые позволяют эффективно отслеживать (in vitro и in vivo) как носитель, так и действующее вещество. Методы флуоресцентной микроскопии становятся важными инструментами в доклинических исследованиях. Одной из основных причин разработки новых флуоресцентных зондов для использования в клинических условиях является необходимость трассеров ближнего ИК-диапазона, обеспечивающих высокое отношение сигнала к фону. Спектральные свойства этих жидкостей, таким образом, определяют узкое «оптическое окно», между 650 и 900 нм, в котором поглощение света основными тканевыми компонентами, такими как окси- и деокси- гемоглобин (λmax<600 nm) и воды (λmax>1150 nm) минимально, следовательно, это дает возможность свету проникать намного глубже, как правило, на глубину в несколько сантиметров. Кроме того, авто-флуоресценция тканей также уменьшается в ближней инфракрасной области в сравнении с видимым диапазоном. Следовательно, использование красителя ближней инфракрасной области позволяет обойти недостатки классических методов визуализации и открывает новые аналитические возможности (Altinoglu EI, Adair JH. Near infrared imaging with nanoparticles, Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2010; 2(5): 461-77). Индоцианин зеленый (ИЦЗ, эмиссия ≈800 нм), единственный флуоресцентный краситель ближней инфракрасной области с поглощающей/излучающей длиной волн >700 нм в настоящее время, который был одобрен Управлением по контролю за качеством пищевых продуктов и медикаментов для применения у человека.
Важным критерием при выборе оптической метки являются следующие параметры - низкая токсичность и низкая иммуногенность. К сожалению, многие оптические метки в ближней инфракрасной области обладают следующими недостатками: обесцвечивание, не специфическое связывание с белками, биологическое и химическое разрушение, и их агрегация, которые значительно ослабляют способность диагностировать сигнал метки.
Эти недостатки оптических меток сделали рациональным развитие альтернативных оптических меток, таких как меченые наночастицы (Altinoglu EI, Adair JH. Near infrared imaging with nanoparticles, Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2010; 2(5): 461-77). В отличие от низкомолекулярных органических красителей, использование флуоресцентных нанозондов может увеличить разрешающую способность системы - уменьшить порог чувствительности (лучшие оптические свойства in vivo) и изучить биораспределение систем доставки благодаря определению флуоресцентного сигнала. Полупроводящие нанокристаллы (Quantum dots, QD), золотые наночастицы (gold NP) и биодеградируемые наночастицы являются наиболее оптимальными оптическими метками, среди них биодеградируемые наночастицы являются наиболее подходящими для их использования in vivo по сравнению с полупроводящими нанокристаллами и золотыми наночастицами вследствие их большей безопасности.
По этой причине мы нашли высокоцелесообразной разработку наночастиц на основе биодеградируемых полимеров, меченых ИЦЗ. Индоцианин является амфифильным красителем. Следовательно, он может быть инкапсулирован в гидрофильное пространство НЧ, как описано в статье Subhash НМ. (Subhash НМ. et. al., Optical detection of indocyanine green encapsulated biocompatible poly (lactic-co-glycolic) acid nanoparticles with photothermal optical coherence tomography, Opt Lett. 2012 Mar 1; 37(5): 981-3). Данная ссылка показывает, что индоцианин может быть инкапсулирован во внутреннее гидрофильное пространство НЧ. Этот подход позволяет увеличить стабильность оптической метки, но делает затруднительным изучение фармакокинетических параметров НЧ, их био-распределение, и их безопасность, так как любое нарушение целостности мембраны НЧ или их разведение, обычно происходящее в ЖКТ, вызовет выход оптической метки из гидрофильного пространства НЧ в гидрофильное внешнее пространство. Более того, инкапсуляция оптической метки и активного вещества в одно и тот же пространство будет отрицательно влиять на загрузку оптической метки и особенно активного вещества, в данном случае белка. В нашем случае, мы предлагаем включать ИЦЗ в НЧ для маркировки самих НЧ. Данный подход позволяет отслеживать интернализацию НЧ и инкапсулированного активного вещества параллельно, не влияя на оптические свойства каждой метки, в нашем случае меченого белка или пептида с клетками, и их внутриклеточное распределение. В нашем случае, маркировка самих НЧ позволяет в дальнейшем изучать фармакокинетические параметры НЧ, их био-распределение и их безопасность параллельно с активным веществом, меченым белком или пептидом. Данные свойства являются очень важной характеристикой для регуляторных органов, так как на сегодняшний день токсичность НЧ не изучена до конца и это является препятствием для более широкого внедрения и более широкого применения НЧ in vivo.
В качестве моделей лекарственного вещества белковой природы нами были выбраны две молекулы - БСА-ФИТЦ и декапептид-ФИТЦ светящиеся в видимом спектре -что позволило нам эффективно охарактеризовать полученные наночастицы по параметрам, включающим морфологию, размер, содержание препарата (СП), кинетику высвобождения препарата в моделированной кишечной жидкости, внутриклеточное распределение и транспорт в кишечнике.
Возможность осуществления изобретения подтверждается, но не ограничивается примерами.
Пример 1 Получение меченых модельных белков
Материалы
БСА-ФИТЦ, молибдат аммония, 4-амино-2-нафтил-4-сульфореагент, индоцианин зеленый, ПМГК-поли(молочная-ко-гликолевая кислота) (50:50) RG 503, поливиниловый спирт, плюроник® F-127 были приобретены у компании «Сигма-Элдрич» (Сент-Луис, Миссури, США).
1,2-дипальмитоил-sn-глицеро-3-фосфохолин (ДПФХ), 1,2-димиристоил-sn-глицеро-3-фосфохолин (ДМФХ), 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-(лиссамин родамин В сульфонил) (аммониевая соль), 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (ДОФЭ) и холестерин были приобретены у компании «Аванти Полар Липидс» («Алабастер», Алабама, США).
Свойства пептидов
Модельный декапептид был синтезирован твердофазным синтезом пептидов (ТФСП) компанией «Сигма-Элдрич» (WYPA10, Реховот, Израиль).
Последовательность пептидов
FMOC-Trp-Tyr-Phe-Ser-Tyr-Tyr-Leu-Lys-Prol-Ala-MBHA-смола,
где боковые цепи Trp, tyr, Ser и Lys защищены
Мечение пептидов
Для этого связанный со смолой пептид был вначале увеличен в ДМФА в течение 60 мин, и 9-флуоренилметоксикарбонил был удален путем инкубации в 20% пиперидине в ДМФ в течение 20 минут и после этого еще 10 минут с последующей промывкой в ДМФ (×4) и ДХМ (×4). После этого, 4 экв связующего вещества Fmoc-6-Ahx-COOH (HSX-Fmoc) было соединено с пептидом (30 мин инкубации) после предварительной активации 1Н-7-азабензотриазол-1-ил) -1,1,3,3-тетраметил урониевым гексафторфосфатом (4 экв, HATU 2), гидроксибензотриазолом (4 экв, НОВТ) и N,N-диизопропилэтиламином (4 экв, диизопропилэтиламин) в течение 2 мин. Затем 9-флуоренилметоксикарбонил связывающего вещества был удален, как описано ранее.
Затем 4 экв флуоресцеинизотиоцианата (ФИТЦ) были связаны с пептидом с использованием связывающего вещества в присутствии диизопропилэтиламина путем его инкубации в течение 24 часов с последующим промыванием ДМФ (×4) и ДХМ (×4).
Пептид и его боковые защитные группы были удалены из смолы путем инкубации в течение 2 часов с использованием трифторуксусной кислоты/дистиллированной деионизированной воды/фенола/триэтилсилана (88/5/5/2 об/ об). Меченый пептид (схема 1) был осажден холодным диэтиловым эфиром и его избыток был удален аргоном. Процедуру повторили (Рис. 1).
Структурная формула представлена на схеме 1
C97H111N15O20S
Точный вес: 1837.79
Молекулярная масса: 1839.07
Мг/экв: 1838.79 (100.0%), 1837.79 (93.5%), 1839.79 (63.1%), 1840.80 (18.5%), 1840.79 (7.7%), 1841.80 (7.0%), 1838.78 (5.9%), 1840.78 (4.9%), 1839.78 (4.4%), 1841.79 (4.1%), 1842.80 (2.1%), 1842.79 (1.2%)
С, 63.35; Н, 6.08; N, 11.42; 0,17.40; S, 1.74 Очистка пептида ВЭЖХ (рис. 2):
- Колонка: Agilent Luna C18-2 250×4,6
- Температура колонки: 40°C
- Объем введения: 100 мкл
- Раствор А: 0,1% трифторуксусная кислота (ТФК); Раствор В: ацетонитрил
- Градиент (табл. 3)


Пример 2 Приготовление наночастиц (НЧ) на основе ПМГК с моделью белка
ПМГК RG 503 (50:50) и ПМГК Lactel были использованы в качестве материала для наночастиц, метиленхлорид (MeCl2) или этилацетат (EtAc) были использованы в качестве органических растворителей, поливиниловый спирт (ПВС) или плюроник F-127 (PF-127) были использованы в качестве стабилизаторов эмульсии, и ФИТЦ-БСА или ФИТЦ-пептид 10-мер были модельными белками, используемыми для инкапсуляции НЧ. Индоцианин зеленый (ИЦЗ) был использован в качестве маркера НЧ.
Процедура наноинкапсуляции была основана на методах двойной эмульсии (в/м/в) и сорастворения м/в. В методе двойной эмульсии ПМГК растворяют в органическом растворителе, а затем ФИТЦ-БСА растворяется в ДДВ, содержащей 2% ПВС, а ФИТЦ-пептид растворяют в метаноле: ДДВ (1:4 в/в), содержащую 1% БСА и 2% ПВС добавляют к раствору ПМГК при различных соотношениях ПМГК/препарата и гомогенизируют при 11000 или 15000 оборотах в минуту в течение 2 мин, или ультразвуком в ледяной ванне в течение 1 мин. Эту в/м эмульсию затем выливают в эмульгирующий раствор в ДДВ при различных соотношениях фазы и снова гомогенизируют при 11000 или 15000 оборотах в минуту в течение 2 мин или ультразвуком в ледяной ванне в течение 1 мин.
При использовании метода сорастворения м/в ПМГК растворяют в органическом растворителе, а затем ФИТЦ - ептид, растворенный в метаноле, добавляют в раствор ПМГК при разных соотношениях ПМГК/препарата белка и гомогенизируют при 15000 оборотов в минуту в течение 2 мин или ультразвуком в ледяной ванне в течение 1 мин. Эту в/м эмульсию затем выливают в эмульгирующий раствор в ДДВ при различных соотношениях фазы и снова гомогенизируют при 11000 или 15000 оборотах в минуту в течение 2 мин или ультразвуком в ледяной ванне в течение 1 мин.
В обоих случаях эмульсию перемешивали в течение 1-2 часов, чтобы удалить органический растворитель, а затем остаточный растворитель выпаривали на вакуумном испарителе («Лабконко», Миссури, США). Готовые суспензии затем промывали 3 раза с пониженным содержанием дейтерия на центрифуге при 14000 оборотов в минуту в течение 25 мин для устранения не инкапсулированного препарата. Твердые вещества были собраны и погружены в жидкий азот, а затем лиофилизированы («Лабконко», Миссури, США) в течение ночи, с использованием 5% сахарозы в качестве лиопротектора. Количество произведенных НЧ колебалось между 37-81% (таблицы 1А и В).
Пример 3 Оценка физико-химических характеристик НЧ
Подготовка образцов для анализа растровым электронным микроскопом:
Для этого наночастицы на основе ПМГК были суспендированны в ДДВ для получения 0,25-1% суспензии и обработаны ультразвуком в течение 60 сек. Одну каплю суспензии поместили на кремниевую подложку, высушили и покрыли золотом. В другом варианте подготовки, высушенные НЧ были обездвижены, помещены на кремниевую подложку и также покрыты золотом. После этого, в обоих случаях наночастицы на основе ПМГК были изучены под сканирующим электронным микроскопом сверхвысокого разрешения MagellanTM 400L («ФЭИ», Орегон, США).
Определение размера и зета-потенциала
Распределение размера и зета-потенциал содержащих белок наночастиц на основе ПМГК измеряли при 25°C с использованием прибора Zetasizer Nano-Z, «Малверн Инструменте Лтд», Малверн, Великобритания. Для этого 1 мг нагруженных белком наночастиц на основе ПМГК развели в 1 мл фильтрованной ДДВ и исследовали.
Оценка эффективности инкапсуляции препарата в НЧ на основе ПМГК
Для этого 2 мг НЧ растворили в 1 мл 0,1 M NaOH/0,5% ДСН путем встряхивания. 250 мкл дисперсий было сразу проверено на предмет флуоресценции на сканере Odyssey («ЛИ-КОР Биосайнсес», Линкольн, Небраска, США) при чувствительности 2 и эмиссии 800 на 96-луночном планшете, а затем инкубировано при температуре 37°C в течение 2 часов. После этого образцы центрифугировали в течение 5 мин при 14000 об/мин, чтобы получить прозрачный супернатант. 250 мкл супернатанта собрали и анализировали на предмет флуоресценции с помощью многорежимного планшета-ридера («БиоТек», Вермонт, США) при ex485/em525 с чувствительностью 50.
Эффективность инкапсуляции препарата (ЭИ) была оценена с помощью стандартной кривой препарата в 1% 0,1 M NaOH/0,5% ДСН после 2 часов инкубации при температуре 37°С в соответствии с следующим уравнением:
ЭИ(%)=100×X/Y,
где:
X - количество модельного пептида в полученном образце, мг;
Y - количество модельного пептида внесенного в тех. процесс, мг;
Дополнительно гравиметрически было измерено содержание препарата в НЧ в соответствии с соотношением препарат/НЧ в/в × 100.
Результаты
Сравнительная характеристика НЧ на основе ПМГК, содержащих ФИТЦ-БСА или ФИТЦ-пептид, приготовленных методом эмульсии в/м/в.
Включение ИЦЗ сильно повлияло на эффективность НЧ: КЗ, ЭИ и СП резко упали (таблица 1А), в то время как их размер резко увеличился (таблица 1А, сравните С и D с А и В на рисунке 3).
В случае с составами, содержащими ФИТЦ-пептид, как и в случае с составами с ФИТЦ-БСА, маркировка препаратов с увеличенным количеством ИЦЗ снижает КЗ, ЭИ, СП и увеличивает объем составов (сравните НЧ №28, 43 с НЧ №40 (соотношение препарат/ПМГК - 1/30) и 47 (соотношение препарат/ПМГК - 1/10), соответственно, в таблице 1В). Обратите внимание, что увеличение объемов не было обнаружено ДРС, но было обнаружено с помощью СЭМ (рисунок 4С, D), а ДРС не определяет большие (микронные) частицы. Замена раствора ПМГК на EtAc улучшила ЭИ НЧ (сравните НЧ №40, 47 с НЧ №56 в таблице 1В) и морфологию, анализированную с помощью СЭМ (данные не представлены). Лучшим составом по всем параметрам был исследованный состав №48 (соотношение препарат/ПМГК 1/10, таблица 1В и рисунок 4). Лиофилизированный состав №48 (сухая форма), изображенный на рисунке 5, продемонстрировал, что образованные НЧ были сферическими частицами нанодиапазона (100-200 нм). Дополнительным параметром выбора, который наблюдался исключительным для НЧ №48, являлась производительность процесса; было достигнуто массивное образование частиц, и оно показано на рисунке 4 и в таблице 1В (полученные НЧ). Использование полимеров ПМГК Lactel уступает ПМГК Bhoeringer 503, так как в одном случае были сформированы большие НЧ (НЧ №57, таблица 1В) неправильной формы, а в другом (НЧ №58, таблица 1В) ЭИ была довольно низкой. Сравнение НЧ на рисунке 8 с помощью СЭМ, полученного из ПМГК RG-503 (НЧ №56, масштаб А - 100 мкмоль), Lactel 9 (НЧ №57, масштаб В - 20 мкмоль) или Lactel A11 (НЧ №58, масштаб С - 100 мкмоль), показывает, что использование ПМГК Lactel приводило к образованию больших НЧ.
Использование низкого количества ИЦЗ (0,5 мкг) было во всех случаях более предпочтительным, нежели высокого (2,5 мкг) количества ИЦЗ (данные не представлены).
Опять же, значения индекса полидисперсности (ИПД) НЧ, подготовленных в исследовании, согласуется с формированием довольно гетерогенной популяции (ИПД>0,3).
Сравнительная характеристика НЧ на основе ПМГК, содержащих ФИТЦ пептид, приготовленных методом сорастворения эмульсии м/в.
Второй метод сорастворения эмульсии м/в был опробован для подготовки НЧ, содержащих пептид, из-за отличной растворимости ФИТЦ-пептида в спиртовом растворителе, таком как метанол. При использовании данного метода, как ни удивительно, НЧ без ИЦЗ демонстрируют меньшую производительность (сравните НЧ №46 с НЧ №53 и 55, таблица 1С, рисунок 6).
Добавление пептида сначала в спирт, а затем в метиленхлорид дало прозрачный раствор. Пептид был, вероятно, сольватирован гидрофильными водородными связями, формирующими кластеры спирта вокруг молекулы, которые не могли быть вытеснены избытком метиленхлорида. Когда в качестве полимерного растворителя использовался этилацетат, препарат осаждался из спиртового раствора, давая в результате мутную суспензию. Более гидрофильный растворитель, этилацетат, взаимодействовал со спиртом и десольватировал пептид, который практически не растворим в этилацетате. Такой эффект не влияет на эффективность НЧ (сравните НЧ №51, 54 с 53, 55 в таблице 1С).
Основным недостатком данного метода подготовки НЧ был их большой размер (рисунок 7). Поэтому для подготовки эмульсии м/в была протестирована обработка ультразвуком, а не гомогенизация. Такой метод позволил уменьшить размер формируемых НЧ (НЧ №59 в таблице 1С и рисунке 7) и добиться хороших показателей ЭИ и СП.
Сравнение с помощью СЭМ НЧ на рисунке 9, полученных из ПМГК RG-503 (НЧ №54, A), Lactel А9 (НЧ №60, В) или Lactel A11 (НЧ №61, С), показывает, что использование ПМГК Lactel приводило к образованию больших НЧ. Подготовка НЧ с 4-кратным количеством препарата (соотношение препарата/ПМГК - 1/7,5 вместо 1/25 или 30 для всех препаратов) была успешной в случае низкого (0,5 мкг) количества ИЦЗ, и мы смогли получить высокий показатель СП пептида в 5,6% (НЧ №63 в таблице 1С).
Пример 4 Оценка высвобождения лекарственного препарата из НЧ
Для этого 100 мкл 2 мг НЧ были диспергированы вначале в 250 мкл моделированной кишечной жидкости (ИКС, стандарт Фармакопеи США, рН 6,8) и проверены на предмет флуоресценции с помощью многорежимного планшета-ридера («БиоТек», Вермонт, США) при ex485/em525 с чувствительностью 70 сразу же после подготовки для определения общей флуоресценции.
НЧ в указанном количестве были диспергированы в 250 мкл ИКС и инкубированы в 250 мкл ИКС в течение 2, 4 и 24 часов при температуре 37°C с встряхиванием при 50 оборотах в минуту. В конце инкубационного периода 500 мкл инкубационной среды было помещено в пробирки Эппендорф и прокручено при 14000 об/мин в течение 12 или 25 мин, соответственно. Далее, эта среда была проанализирована на предмет флуоресценции с помощью многорежимного планшета-ридера («БиоТек», Вермонт, США) при ex485/em525 с чувствительностью 70 и возвращена в среду инкубации. Высвобождение лекарственного препарата (ВП) оценивалось в соответствии со стандартной кривой препарата в ИКС сразу после приготовления и после инкубации в течение 2, 4 и 24 часов при температуре 37°C при встряхивании при 50 об/мин при температуре 37°C в соответствии с следующим уравнением:
ВП (%)=100×W/Z,
где:
W - количество модельного пептида, перешедшего в инкубационную среду, мг;
Z - количественное содержание пептида в образце взятом для анализа, мг.
Результаты
Кинетика высвобождения БСА-ФИТЦ и ФИТЦ пептида из НЧ в ИКС
Сополимер ПМГК подвергается деградации путем гидролиза или биодеградации путем расщепления его основных эфирных связей в олигомеры и, наконец, мономеры. Деградация сополимера ПМГК является коллективным процессом объемной диффузии, поверхностной диффузии, объемной эрозии и поверхностной эрозии. Обычно наблюдается двухфазная кривая для высвобождения препарата в результате биодеградации ПМГК. «Взрывное» высвобождение препарата зависит от типа препарата, концентрации препарата и полимерной гидрофобности. Препарат на поверхности, в контакте со средой, высвобождается в зависимости от растворимости, а также проникновения воды в полимерную матрицу. Во второй фазе препарат высвобождается постепенно через толстый слой с малым количеством препарата. «Взрывное» высвобождение белковых препаратов из НЧ также является проблемой, так как оно снижает способность препарата на основе белка достигать цели в связи с деградацией.
Как видно на рисунке 10, «взрывное» высвобождение ФИТЦ-пептида было ликвидировано во всех НЧ, подготовленных как методом эмульсии в/м/в (рисунок 10А), так и методом сорастворения м/в (рисунок 10 В) с Τ ½ больше чем 48 ч.
Пример 5 Исследование культур клеток.
Клеточные культуры
Клеточная линия карциномы толстой кишки человека Сасо-2 была получена из Американской коллекции типовых культур (АТСС, Манассас, Вирджиния). Клетки Сасо-2 выращивают в полной минимальной эссенциальной среде Игла, модифицированной по способу Дульбекко (DMEM). Клеточные линии хранились при температуре 37°C в 5% СО2 инкубаторе с водяной рубашкой.
Анализ пролиферации клеток
Прежде всего, была проведена оценка цитотоксичности подготовленных составов. Отсутствие цитотоксичности было оценено анализом MTS с помощью набора CellTiter 96® AQueous, состоящего из растворов нового тетразолийного соединения [3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолий, внутренняя соль, MTS] и реагента электронной связи (феназинметасульфат) PMS, где MTS биоредуцирован клетками до формазанового продукта, который является растворимым в культуральной среде, и поглощение формазанового продукта может быть измерено при 490 нм. Для этого клетки Сасо-2 высеяли в 96-луночный планшет на 4×104 клеток/мл (8×103/лунка) и дали им адаптироваться и расти в течение 48 часов. Затем 50 мкл исследованных соединений было добавлено в исследованные лунки и инкубировалось в течение 4 или 24 часа в сутки. В конце периода инкубации инкубационная среда была удалена, клетки промыли ФСБ и инкубировали в свежей среде до 24 ч, и затем жизнеспособность клеток была протестирована с помощью анализа MTS.
Оценка включения клеткой НЧ
Конфокальная лазерная сканирующая микроскопия (КЛСМ) была использована для оценки эффективности клеточного поглощения. Для анализа КЛСМ клетки Сасо-2 высевали на пленки, закрытые стеклянной крышкой, в 8-луночные планшеты при плотности 5×104 клетки/см2. После культивирования в течение 48 часов культуральную среду удаляли, а клетки промывали два раза, используя среду культивирования без фенолового красного красителя. После этого было добавлено 0,4 мл содержащих препарат НЧ, разведенных в среде культивирования без фенолового красного красителя в нетоксичных концентрациях, и клетки инкубировали в течение 4 ч при температуре 37°C. В конце инкубационного периода растворы образца были удалены, клетки промыли три раза в среде культивирования без фенолового красного красителя и изучили с помощью конфокального лазерного сканирующего микроскопа Fluoview 300 («Олимпус», Пенсильвания, США).
Результаты
Клеточная линия Сасо-2, полученная из человеческой колоректальной раковой опухоли, стала созданной в пробирке моделью для определения потенциального всасывания препарата через стенки кишечника человека. При культивации на полупроницаемые мембраны, Сасо-2 клетки дифференцируются в высоко функциональный эпителиальном барьере с выраженными морфологическими и биохимическими свойствами, схожими с эпителием тонкого кишечника.
Таким образом, потенциальную токсичность НЧ (рисунок 11), оценивали с помощью метода MTS после 24 ч инкубации с клетоками Сасо-2. На рисунке И показано, что все составы были нетоксичными в любой из исследованных концентраций.
Касательно клеточного распределения НЧ. НЧ, приготовленные методом в/м/в, сравнивали по их распределению в Сасо-2 с использованием меченого пептида (зеленое окрашивание) и ИЦЗ (красное окрашивание) с увеличением количества ИЦЗ (НЧ №51 и 53 соответственно). Наши результаты показывают, что НЧ, помеченные большим количеством ИЦЗ (НЧ №53), демонстрируют как измеряемую эффективность (см. таблицу 1 В), так и низкое поглощение клеточного пептида (рисунок 12). Согласно КЛСМ изображениям, НЧ №48 были выбраны как лучший состав.
Оба состава (НЧ 55 и 59), подготовленные методом сорастворения в/м, показали хорошее клеточное распределение (вкладыши на рисунке 12) и доставку пептида к клеткам. Оцененный во всех случаях свободный ФИТЦ-пептид продемонстрировал очень низкое клеточное распределение (рисунок 12).
Таким образом, включение ИЦЗ в НЧ имеет огромное влияние на характерные свойства НЧ, такие как формирование НЧ, размер НЧ, ЭИ модельных пептидов: ФИТЦ-пептид и ФИТЦ-BSA.
Нами впервые доказана принципиальная возможность использования ИЦЗ в качестве метки НЧ на основе ПМГК и ПМК с инкапсулированными лекарственными веществами белковой природы для изучения механизма проникновения и распределения
НЧ и включенного вещества в клетках кишечника, с последующим изучением фармакокинетических параметров и биораспределения НЧ и оценкой их потенциальной токсичности.