Результат интеллектуальной деятельности: КОМПОЗИЦИЯ ДЛЯ РЕГУЛЯЦИИ МИКРОЭЛЕМЕНТНОГО ОБМЕНА В ПОЛОСТИ РТА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к инновационному синергетическому комплексу, представляющему собой композицию для применения в полости рта, содержащую комбинацию гидроксиапатита, природного минерала бишофита, морской соли, аспартата магния, глюконата цинка и глюконата меди. Изобретение может быть использовано при уходе за полостью рта, а также для профилактики заболеваний полости рта (зубов, десен, слизистой оболочки).
УРОВЕНЬ ТЕХНИКИ
Состояние полости рта имеет важное значение для общего здоровья и благополучия на протяжении всей жизни. В течение последних десятилетий основными направлениями поиска новых решений в стоматологии являются вопросы профилактики и лечения кариеса зубов, а также профилактики и лечения некариозных заболеваний.
Кариес зубов является многофакторным заболеванием, вызываемым одновременным взаимодействием пищевых сахаров, зубного налета, организма и времени. Пищевые углеводы метаболизируются бактериями зубного налета, производя ряд органических кислот (Geddes, 1975), вызывая падение рН внутри зубного отложения. Ниже «критического рН» зубная эмаль начинает подвергаться деминерализации, а возникающие с определенной частотой падения рН приводят к образованию начального очага кариеса, характеризующегося потерей подповерхностных эмальных минералов с относительно неповрежденным поверхностным слоем (Arends and Christoffersen, 1986). С дальнейшим развитием поражения кислотной деминерализацией, структура эмали, лежащая в основе поверхности, разрушается и формируются поверхностные переломы и клинически детектируемая полость. В конечном итоге поражение прогрессирует в дентин и может привести к разрушению всего зуба.
Другими, способствующими факторами кариеса зубов, являются саливация, буферная емкость, то есть способность слюны нейтрализовать кислоты и поддерживать рН, а также наличие некоторых защитных ферментов и молекул в слюне (American Academy of Pediatric Dentistry, 2013). Однако в научной литературе механизмы деминерализации-минерализации эмали и роли микроэлементов в этих процессах недостаточно подробно раскрыты.
Минеральный компонент зубной эмали представляет собой, в основном, замещенный гидроксиапатит (ГАП) кальция, стехиометрическая формула которого Са10(PO4)6(ОН)2. Внутри эмали некоторое количество ионов может выходить из ГАП с формированием элементарных замен, например, кальция на натрий, магний, цинк и т.д.; карбонат может замещать фосфат, а фторид - гидроксил (Featherstone, 1999; Robinson et al., 2000; Robinson, 2009). Эти дефекты и замены могут оказать глубокое влияние на свойства ГАП, особенно в отношении его растворимости при низком рН. В частности, дефицитные по кальцию и богатые карбонатом области кристалла особенно чувствительны к кислотной деминерализации, тогда как замена фтором гидроксила может повысить устойчивость к кислотной деминерализации (Featherstone, Goodman and McLean, 1979). Биологические апатиты состоят в том числе и из карбонатированных апатитов, характеризующихся наличием различных количеств замещающих ионов, либо включенных в решетку апатита, либо просто адсорбированных на поверхности кристалла, в том числе анионных (например, F-, Cl-, SiO44- и СО32-) и/или катионные замещения (например, Na+, Mg2+, K+, Sr2+, Zn2+, Ва2+, Al3+). Фактически зародышеобразование и рост фосфатов кальция в биологических системах происходят в среде, богатой ионами, что влияет как на кинетику кристаллизации, так и на термодинамику и, следовательно, на их стабильность (Cacciotti, 2015).
Уже давно предложено, что микроэлементы оказывают влияние на циклах деминерализации-реминерализации зубов. Участие следовых количеств металлов в процессе дименерализации-реминерализации структуры зуба опирается на тот факт, что концентрация элементов, измеренная на поверхности эмали (на глубине 0-20 мкм) выше, чем среднее значение по всей эмали. Самые низкие значения найдены для стронция, в то время как высокие для свинца.
Соотношения между изменениями в количестве микроэлементов слюны и частотой возникновения кариеса были исследованы в нескольких работах (Duggal, Chawlaand Curzon, 1991; Watanabeef al., 2011). В частности, наличие кариеса оказалось в обратной корреляции с уровнем Си. При этом показано, что уровень деминерализации эмали ингибируется Си (S.. Brookes et al., 2003), проявляя кариостатический эффект. Также показано, что уровень цинка в слюне у детей с активным кариесом достоверно выше, чем у здоровых детей контрольной группы (Sekhri et al., 2018). Для фторида установлена реминерализующая способность, особенно, когда рН слюны падает. Другие элементы, такие как фосфор, медь, молибден, кальций, магний, барий, стронций и алюминий также ассоциированы с низким уровнем кариеса. Однако некоторые элементы, такие как железо, марганец и калий, связаны с высокой частотой возникновения кариеса. Примечательно, что наиболее представленные микроэлементы эмали, также являются мажорными в слюне (Na, Mg, K, and Zn) (Grad, 1954; Borella, Fantuzzi and Aggazzotti, 1994; Sekhri et al., 2018), иллюстрируя значимость изучения концентраций микроэлементов в слюне. Несколько авторов свидетельствуют о том, что существует связь между концентрацией элементов в слюне и частотой возникновения заболеваний периодонта и кариеса зубов у различных групп населения (Edgar, 1990; Duggal, Chawla and Curzon, 1991; Zalchik, V.E., Bagirov, 1991; Borella, Fantuzzi and Aggazzotti, 1994; Hussein et al., 2013). Zaichk и Bagirov (Zalchik, V.E., Bagirov, 1991) обнаружили, что у взрослых с большей частотой заболеваний пародонта наблюдается повышенная концентрация Fe, Sc, Mn, Cr, Co, Cu, Se, Ag и Hg, а также снижение концентрации Zn в нестимулированной слюне. Дугтал и соавт. (Duggal, Chawla and Curzon, 1991) обнаружили, что концентрация Си показала постоянную обратную зависимость от заболеваемости кариесом у детей, в то время как элементы Fe и Mn демонстрировали прямую связь с кариесом зубов. Весьма важным показателем состояния слюны является и ионная сила, от величины которой зависит активность ионов, в том числе и минерализующих компонентов (Са2+ и HPO42-). Установлено, что показатели активности ионов Са2+ и НРО42- в слюне намного выше, чем в плазме крови, что и обусловливает минерализующую функцию ротовой жидкости. Таким образом, при оценке минерализации и деминерализации эмали зубов важное значение имеет концентрация кальция и фосфора, рН и ионная сила слюны (Бекжанова, 2009; Vijayaprasad, К.Е., Ravichandra, К.S., Vasa, A.A., Suzan, 2010; Н. Li, М. Liu, 2011; Скрипкина, 2011).
Присутствие ионов микроэлементов может не только влиять на процессы реминерализации эмали. Известно, что клеточная стенка грамотрицательных бактерий содержит слои как пептидогликана, так и липополисахарида, влияющие на проницаемость молекул (Gayathri et al., 2018). Согласно последним исследованиям, ионы, присутствующие в некоторых композициях, могут реагировать с группами -SH белков, тем самым участвуя в бактериальной инактивации (Guzman, Dille and Godet, 2012). При объяснении того, как ионы могут препятствовать росту микроорганизмов, рассматриваются три механизма (Hajipour et al., 2012). Во-первых, это проникновение ионов через клеточную мембрану в сочетании с изменением регуляции продукции АТФ и репликации ДНК. Во-вторых, фиксация ионов на клеточных мембранах электростатическими силами, которые нарушают целостность клетки и влияют на свободный транспорт протонов и других молекул внутрь и из клетки. И, наконец, индукция кислородного стресса путем образования свободных радикалов (также называемых активных форм кислорода: АФК), которые нарушают нормальную функцию и могут необратимо повредить бактерии (их мембраны, ДНК и митохондрии), что приводит к гибели бактерий.
Таким образом, данные свидетельствуют о том, что возникновению кариозного процесса в зубе предшествует изменение количественного состава веществ ротовой жидкости, а именно, изменяется соотношение фосфатов, карбонатов и микроэлементов. Микроэлементы, присутствующие в минорных количества в эмали, также могут управлять процессами реминерализации-деминерализации, кинетикой и термодинамикой роста кристаллов биологического гидроксиапатита, однако точный механизм и оптимальная форма доставки таких компонентов требуют изучения.
Изменение концентрации минеральных веществ в слюне также влияет на гомеостаз полости рта и реминерализирующий потенциал ротовой жидкости. В добавление влияние ионов микроэлементов на жизнеспособность бактериальных пленок открывает потенциальные возможности для терапии заболеваний полости рта, которые могут быть вызваны их абберантным ростом, а именно применительно к поражениям зубной эмали у шейки зубов и примыкающей слизистой оболочки десен.
Одновременно с этим все еще требуются решения по разработке комплексного средства, которое обеспечивало бы реминерализующий, противокариесный, снижающий зубной налет эффект на зубной эмали в области шейки зубов и примыкающей слизистой оболочки десен, а также противовоспалительный, десенситивный, противоотечный и регенерирующий эффект в отношении десен рта.
Авторы настоящего изобретения видят необходимость и возможность решения данной проблемы через создание инновационной комбинации для полости рта, состоящего из следующих компонентов.
Гидроксиапатит - является близким минералом к апатитовому кристаллу зубной эмали, известный для использования в качестве реминерализующего агента против ранних повреждений кариесом (Tschoppe et al., 2011; de Carvalho et al., 2014; IIJIMA et al., 2017). Предполагается, что фосфат кальция работает за счет инфильтрации в микропоры при кариесе, где он действует в качестве ядра кристаллизации, непрерывно привлекая большое количество ионов кальция и фосфата из пероральных жидкостей в очаг поражения, способствуя естественным процессам реминерализации (Amaechi and van Loveren, 2013; Van Loveren С. M. C. D. N. J. M. Huysmans, A.Lussi, H.-P- Weber, 2013). Помимо реминерализующих свойств, исследования по локальному применению гидроксиапатита показали наличие антиадгезионных свойств, которые могут быть использованы для контроля биомиметической биопленки (Lelli et al., 2014; Kensche et al., 2017). Микроорганизмы обладают способностью прикрепляться к свободным частицам гидроксиапатита, содержащимся в зубной пасте или ополаскивателе рта, и таким образом, удаляются из полости рта, в итоге лишаясь возможности колонизировать эмаль (Kensche et al., 2017). Также известно, что гидроксиапатит образует защитный слой на поверхности эмали (Lelli et al., 2014). Из всех фаз кальция фосфата, гидроксиапатит состава Са5(РО4)3(ОН) обладает наиболее близким сходством к натуральной эмали (Enax and Epple, 2018). При этом молярной соотношение Са/Р как правило составляет 1,67 (Alioui, Bouras and Bollinger, 2019). Дополнительно, такие ионы как Zn2+, Sr2+, Mg2+, Pb2+, Na+, СО32-, а также молекулы воды могут быть включены в кристалл апатита искусственно (Brown, P.W., Constantz, 1994; Dorozhkin and Epple, 2002; Enax and Epple, 2018). Присутствие некоторых из этих катионов в костях может активно участвовать в формировании и реабсорбции кости.
Фактически, дефицит ионов Mg2+ снижает скорость роста остеобластов (Rude et al., 2003), приводя к уменьшению плотности костной массы, в то время как ионы Zn2+ способствуют образованию кости, увеличивая эту скорость роста (Kawamura et al., 2000а). Показано, что магний - и цинкзамещенные материалы ГАП демонстрируют превосходную биосовместимость и биологические свойства. Вместе с тем известно, что кальций и магний входят в состав зубной эмали как минимум до глубины в 900 мкм (Klimuszko et al., 2018), при этом отмечается прямая корреляция между концентрацией магния и кальция в эмали на глубине 150-900 мкм.
Магний присутствует в зубной эмали в основном в форме фосфата магния и является элементом, влияющим на качество и анатомию твердых тканей зуба (Lagocka, R, Jakubowska, К, Lipski, М, Buczkowska-Radlinska, J, Chlubek, D, Opalko, 2003). Ионы магния приводят к торможению роста кристаллов путем замены ионов кальция в гидроксиапатите (Teruel et al., 2015), выполняя важную роль в регуляции роста кристаллов гидроксиапатита. Этот минерал может также влиять на активность щелочной фосфатазы, которая катализирует образование соответствующих кристаллов гидроксиапатита и может препятствовать превращению аморфного фосфата кальция в кристаллическую форму. Кроме того, магний также является компонентом органического матрикса эмали (Aoba, 1996). Гидроксиапатит, легированный цинком и магнием, сохраняет структуру ГАП, но катионное замещение металлов приводит к значительным изменениям формы кристалла и размера (Gopi et al., 2012; Kaygili and Keser, 20IS). Указанные добавки способствуют повышению ингибирующей активности ГАП в отношении C. albicans (Alioui, Bouras and Bollinger, 2019). Показано, что Zn-ГАП с количеством ионов Zn менее 1,2 мас. % представляют эффективную биоактивность и антибактериальные свойства (Ito et al., 2000; Kawamura et al., 2000b; Sogo et al., 2002; Stanic et al., 2010), в частности на рост бактерий и грибов, включая Е. coli, S. aureus, Candida albicans (С. albicans) и Streptococcus mutans (S. mutans) (Chung et al., 2006; Velard et al., 2010; Thian et al., 2013), при этом содержание цинка более 1000 ppm необходимо для проявления антимикробного эффекта. По механизму действия было высказано предположение, что ионы Zn образуют прочные связи с тиольными, имидазольными, аминными и карбоксильными группами, вызывая структурные изменения и влияя на проницаемость и транспорт мембран, что приводит к гибели клеток (Stanic et al., 2010).
Таким образом, для данной композиции был выбран гидроксиапатит, замещенный магнием и цинком, обладающий улучшенными свойствами.
Концепция реминерализации фосфатами кальция в отдельности, а также в сочетании с другими замещающими катионами реализована в современных продуктах для ухода за полостью рта.
Бишофит - природный ископаемый минерал, в состав которого входят почти 70 макро- и микроэлементов. На 80-90% бишофит состоит из солей магния (хлористого магния 420-430 г/л, плотность 1,30-1,32 г/см3, рН: 4,5-4,7). Используется на территории бывшего СССР как бальнеологическое средство лечения при топическом применении с 1980-х гг (Сысуев ББ. Технологические и фармакологические исследования минерала бишофит как источника магнийсодержащих лекарственных средств. Диссертация на соискание ученой степени доктора фармацевтических наук. Волгоградский государственный медицинский университет, 2012). В больших количествах содержится в грязи и рапе озера Эльтон в Волгоградской области. В ряде публикаций показаны благоприятные эффекты бишофита при различных состояниях. Так, продемонстрировано противовоспалительное действие на модели атопического дерматита (Спасов АА, Мазанова ЛС, Мотов АА, Оробинская ТА, Сысуев ББ. Влияние мази минерала бишофит на течение контактного аллергического дерматита, вызванного 2,4- динитрохлорбензолом. Экспериментальная И Клиническая Фармакология 2009; 72:37-9), в клинических исследованиях при ревматоидном артрите (Зборовский АБ, Мартемьянов в. Ф, Сидорова ЕА, Мозговая ЕЕ, Зборовская ИА. Бишофит в лечении больных ревматоидным артритом. Терапевтический Архив 2003; 75:29-32). В отношении кожных покровов бишофит обладал регенерирующим действием при криотравме (Спасов АА, Мазанова ЛС, Мотов АА, Оробинская ТА, Сысуев ББ. Регенерирующая активность гидрофильной мази минерала бишофит при острой локальной криотравме. Экспериментальная И Клиническая Фармакология 2008; 71:39-41). На моделях животных и в клинических исследованиях было показано, что препараты с содержанием бишофита обладают иммуномодулирующим действием, стимулируя фагоцитоз в поврежденной слизистой полости рта, подавляют воспалительный процесс при гингивите, периодонтите (Спасов АА, Темкин Э.С., Островский О.В., Калинина Н.В., Герчиков Л.В., Михальченко В.Ф., et al. Экспериментально-клиническое обоснование применения препарата поликатан при заболеваниях пародонта. Стоматология 1999; 78:16-9; Спасов А.А, Островский О.В, Смирнова Л.А, Герчиков Л.В., Темкин Э.С. Противовоспалительное действие минерала бишофит. Экспериментальная И Клиническая Фармакология 1998; 61:64-6.). На животных показано, что бишофит обладает малой токсичностью [Сысуев Б.Б., Иежица И.Н., Лебедева С.А. Изучение токсичности пероральных форм раствора минерала бишофит. Фундаментальные Исследования 2013:680-3; Сысуев Б.Б., Спасов А.А., Мазанова Л.С. Изучение токсичности очищенного раствора минерала бишофит. Современные проблемы науки и образования 2013;1.), что позволило укрепить концепцию применения препаратов на основе бишофита в клинической практике. Существуют технологии получения бишофита для создания различных лекарственных форм (Сысуев Б.Б. Технологические и фармакологические исследования минерала бишофит как источника магнийсодержащих лекарственных средств. Диссертация на соискание ученой степени доктора фармацевтических наук. Волгоградский государственный медицинский университет, 2012).
Магний, один из компонентов бишофита, является важнейшим макроэлементом, универсальным регулятором биохимических и физиологических процессов, что определяется, прежде всего, его кофакторной ролью в ферментах и модулирующей функцией в ионных каналах. Являясь вторым по распространенности катионом внутри клетки, магний участвует в энергетическом, пластическом и электролитном обмене. По современным представлениям дефицит магния приводит к изменениям, которые являются ключевыми в развитии целого ряда патологических состояний: дефициту функционально-активных ферментов; развитию генерализованного воспаления с последующей системной дисплазией соединительной ткани; критическому изменению соотношения Ca:Mg и, как следствие, нарушению электролитного обмена, основных биохимических и физиологических процессов. Считается, что магний играет роль в образовании кариеса, отложении и минерализации костей (Lilley et al., 200S), а также оказывает непосредственно стимулирующие действие на пролиферацию остеобластов (Suchanek et al., 2004). Натрий хлорид - второй по уровню содержания компонент бишофита. Известно, что эта соль обладает антибактериальным эффектом, в первую очередь благодаря своему осмотическому действию, а также влияет на заряд на поверхности деминерализованного дентина. Недавно также было показано, что в определенных концентрациях хлорид натрия изменяет экспрессию генов, кодирующих гликозилтрансферазы у S. mutans, таким образом регулируя потенциал прикрепления биопленок к поверхности зуба (Nagavi-Alhoseiny et al., 2019). В минорном количестве в бишофите содержится калия сульфат и магния сульфат - растворимые соли. Известно, что содержащие калий зубные пасты обладают десенсибилизирующим и успокаивающим эффектом, в первую очередь за счет снижения проводимости в нерве пульпы (Hu et al., 2018). Сульфат может регулировать процессы реминерализации в зубной эмали за счет влияния на фосфат-ионы (Liu et al., 2012).
Морская соль - состоит преимущественно из натрия хлорида (>99%), с минорными включениями магния, кальция, стронция, лития, железа, молибдена, цинка, селена, свинца, меди, марганца и кобальта (Condo, 1999). Механизм действия соли основан на нескольких активностях: стимулирование выделения слюны, гидросолевой обмен, противоотечное действие, и реминерализация. В человеческой слюне концентрация хлорида натрия составляет 0,006-0,46%. Зубные пасты и ополаскиватели как правило содержат 5-15% морской соли или хлорида натрия, стимулируя интенсивное слюноотделение, оказывающее протективное действие в полости рта. Локальные высокие концентрации соли (гипертонические растворы), за счет дегидратации кожи ли слизистой, запускают механизм, по которому клетки требуют воды и таким образом, запускают гидросолевой обмен на клеточном уровне. Осмотическое действие или обмен позволяют минералам быть абсорбированными через кожу, избыток жидкости дренируется, метаболические отходы удаляются и происходит эффективная детоксикация. Морская соль обладает вяжущим действием, способствуя заживлению за счет снижения воспаления и сокращения десневой ткани. Минералы натуральной морской соли помогают заживлению воспаленной кожи и мембран слизистых благодаря своим противовоспалительным свойствам. Натуральная морская моль также обладает антисептическими и антибактериальными свойствами. Благодаря осмотическому действию, морская соль может проникать через полупроницаемые мембраны бактерий, вызывать сморщивание и дегидратацию. Также осмотическое действие морской соли объясняет ее противоотечное действие и снижение сморщивания десен, которые присутствует при гингивитах. Ополаскиватели рта с морской солью обладают также бенефициарным эффектом благодаря повышению рН во рту, что способствует снижению колонизации патогенными бактериями.
Аспартат магния. Считается, что магний играет роль в образовании кариеса, отложении и минерализации костей (Lilley et al., 2005), а также оказывает непосредственно стимулирующие действие на пролиферацию остеобластов (Suchanek et al., 2004). Для аспарагиновой кислоты было показано, что она может ускорять кинетику кристаллизации стабилизированного апатита и кристаллизацию в зонах микротрещин внутри коллагеновых фибрилл (Matsumoto et al., 2006). Также согласно предыдущим исследованиям, показано, что кислотные аминокислоты усиливают активацию остеобластов и минерализующие процессы (Sarig, 2004; Boanini et al., 2006). Аспарагиновая кислота является одной из незаменимых аминокислот в организме человека, которая широко используется в качестве биохимического реагента (Rajda et al., 1999; Ohzeki et al., 2007) и может быть доступна их пищи и слюны (Rajda et al., 1999). Однако непосредственное добавление кислоты в композиции может оказывать негативный эффект на стабильность рецептуры, а также вызывать повышенную чувствительность зубов, поэтому применение в виде соли представляется более целесообразным.
Микроэлементы, такие как цинк и медь, активно участвуют в ферментных системах, ответственных за обмен костного матрикса (Branca, Valtuefla and Vatuena, 2001). Цинк является составной частью примерно 300 ферментов, включая те, которые необходимы для метаболизма костей (костный щелочной фосфат) (Vallee and Falchuk, 1993). Медь является еще одним микроэлементом, участвующим в метаболизме костей в качестве кофактора лизилоксидазы, одного из основных ферментов, участвующих в сшивании коллагена. Исследования на животных позволяют предположить, что дефицит Cu связан со снижением прочности костей и ухудшением качества костей, что приводит к остеопоротическим поражениям (Medeiros et al., 1997).
Глюконат цинка выступает в роли эффективного источника цинка, и в этом ключе используется в составах зубных паст. Цинк вызывает различные изменения пероральных микроорганизмов за счет своего антибактериального эффекта, уменьшая зубной налет и оказывая противокариесный эффект (Kim, 2007). Цинк - наиболее часто используемый металл для ингибирования образования летучих соединений серы (ЛСС), благодаря своей низкой токсичности, отсутствию эффекта окрашивания зубов. Предполагается, что цинк образует сульфиды низкой растворимости с прекурсорами ЛСС, таким образом, ингибируя продуцирование ЛСС до тех пор, пока ионы цинка доступны для реакции в ротовой полости. При этом начальная растворимость солей цинка в воде не влияет на его ингибирующие свойства. Происходит блокирование выделения H2S в ротовой полости. Известно, что использование глюконата цинка в небных адгезивных таблетках обладает эффективностью в снижении неприятного запаха по механизму инактивации летучих серных соединений (Sterer et al., 2008). Непосредственно использование глюконата цинка в пастах позволяет также эффективно снижать появление неприятного запаха во рту, что было успешно показано в исследовании на людях (Young and Jonski, 2011). Кроме того, есть данные, что цинк может выступать в качестве усилителя антимикробной активности других компонентов. Помимо этого, цинк является незаменимым компонентом многих специфических ферментов (Keilin, D., Mann, 1940; Vallee,. L., Wacker, 1970), а также участвует в ранних фазах метаболизма коллагена (McClain et al., 1973). Показано, что уровень цинка в поврежденных тканях десен возрастает. Кроме того, цинк нивелирует остановку синтеза коллагена под влиянием летучих соединений серы, а хлорид цинка ингибирует опосредованную матриксной металлопротеазой деградацию коллагена в дентине (Toledano et al., 2012). Известно, что метил меркаптан (представитель ЛСС) супрессирует синтез внутри- и внеклеточного коллагена в фибробластах десен in vitro (Johnson, Yaegaki and Tonzetich, 1996). Добавление цинка нивелирует этот отрицательный эффект. Предполагается, что применение цинка приводит к уменьшению воспаления полости рта и может оказаться альтернативным методом лечения рецидивирующего афтозного стоматита (Kim et al., 2015). Цинк хлорид обладает также антиоксидантной и противовоспалительной активностями. В условиях цинк-дефицитной среды нарушается морфология, поляризация десневых фибробластов, развивается окислительный стресс, снижается пролиферация, активируется каспаза-3 (Rudolf and Cervinka, 2010). В работе (Williamson, Yukna and Gandor, 1984) было показано, что пероральное применение цинка способствует более быстрому заживлению ран после биопсий тканей десен, взятых у собак. При этом концентрация цинка в поврежденных деснах значимо вырастает по сравнению со здоровыми даже без применения цинка. Etzel et al. (Etzel et al., 1982) показали, что хомяки, которым вводили эндотоксины из двух штаммов бактерий, концентрировали цинк в тканях десны. Аналогичные результаты in vitro, проведенные Aleo (Etzel et al., 1982), показали, что добавки цинка могут обратить пагубное влияние эндотоксина на культивируемые фибробласты и что цинк защищает от воздействия эндотоксина. Wallace et al. (Wallace, Ringsdorf and Cheraskin, 1978) описали усиленное заживление биопсийных ран, когда цинк вводили их пациентам. Также цинк обладает протективным действием в отношении индуцируемого колита in vivo (Rohweder et al., 1998).
Влияние микроэлементов, таких как цинк и медь, на деминерализацию и реминерализацию зубов было описано ранее (Abdullah et al., 2006; Churchley et al., 2011). Сообщалось, что цинк снижает растворимость эмали (Churchley et al., 2011; Lynch, 2011). Также было высказано предположение, что цинк включается в эмаль во время реминерализации in situ, несмотря на умеренный уровень увеличения концентрации цинка (Matsunaga et al., 2009). Брукс и соавт. также продемонстрировали, что медь оказывает прямое защитное действие на растворение эмали в кислой среде (S.J. Brookes et al., 2003).
В настоящей композиции выбрана органическая форма соли цинка (Sierpinska et al., 2014).
Глюконат меди. Известно, что растворимые соединения меди, как и цинка связываются с сульфид-анионами в водной среде, являясь сильными лигандами, при этом их активность сопоставима (Waer, 1997). Однако есть данные, что в отличие от цинка, ионы меди ингибируют также образование метилмеркаптана. Было также продемонстрировано, что Cu ингибирует продукцию кислоты ацидогенными бактериями (Stephan, 1949) таким образом, снижение концентрации Си влияет на выработку кислоты, и его включение обеспечивает противокариесный эффект. Известно, что глюконат анион может хелатировать Са+2 и другие металлы. Включение его в композицию, может способствовать формированию кальций-децифитного апатита с увеличением возможности других бивалентных металлов инкорпорироваться в реминерализующуюся эмаль, позволяя достичь более близкого к биологическому состава апатита. Также, благодаря хелатирующиму эффекту глюконата в отношении иона кальция, состав композиции предполагает более эффективное локальное высвобождение цинка и меди, повышая их эффективную концентрацию вблизи эмали. Третий аспект: глюконат хелатирует кальций, увеличивая отрицательный заряд на апатите, и способствуя тем самым привлечению аспартата для создания нового центра нуклеации и активации реминерализующего процесса. Все эти особенности могут объяснить механизм синергетического действия заявленного мультикомплекса.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом варианте выполнения заявленное изобретение относится к композиции для применения в составе средства для ухода за полостью рта, содержащей, % мас.:
|
Средство для ухода за полостью рта может представлять собой зубную пасту, гель, спрей, жевательную резинку, пенку, эликсир, мазь, бальзам или ополаскиватель.
Гидроксиапатит Ca-Mg-Zn может содержаться в количестве около, % мас.: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40.
Гидроксиапатит Ca-Mg-Zn может содержаться в количестве, % мас.: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40.
Бишофит может содержаться в количестве около, % мас.: 0,01, 0,05, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9 или 4,0.
Бишофит может содержаться в количестве, % мас.: 0,01, 0,05, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9 или 4,0.
Соль морская израильская тип 0 может содержаться в количестве около, % мас: 0,001, 0,005, 0,01, 0,015, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2.
Соль морская израильская тип 0 может содержаться в количестве, % мас.: 0,001, 0,005, 0,01, 0,015, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2.
Комбинация Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве около, % мас: 0,001, 0,005, 0,01, 0,015, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2.
Комбинация Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве, % мас.: 0,001, 0,005, 0,01, 0,015, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2.
Аспартат магния в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве около, % мас: 0,01, 0,05, 0,1, 0,5, 1,5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99.
Аспартат магния в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве, % мас.: 0,01, 0,05, 0,1, 0,5, 1,5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99.
Глюконат меди в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве около, % мас: 0,01, 0,05, 0,1, 0,5, 1,5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99.
Глюконат меди в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве, % мас: 0,01, 0,05, 0,1, 0,5, 1,5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99.
Глюконат цинка в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве около, % мас: 0,01, 0,05, 0,1, 0,5, 1,5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99.
Глюконат цинка в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве, % мас.: 0,01, 0,05, 0,1, 0,5, 1,5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99.
Комбинация Аспартат магния, Глюконат меди, Глюконат цинка может содержать от около 0,2 до около 0,5%мас. магния, от около 0,05 до около 0,1% мас. меди, от около 0,4 до около 0,9% мас. цинка. Альтернативно, комбинация Аспартат магния, Глюконат меди, Глюконат цинка может содержать от 0,2 до 0,5% мас. магния, от 0,05 до 0,1% мас. меди, от 0,4 до 0,9% мас. цинка. Например, около 0,2, около 0,3, около 0,4 или около 0,5% мас. магния; около 0,05% мас., около 0,01% мас., около 0,02% мас., около 0,03% мас., около 0,04% мас., около 0,05% мас., около 0,06% мас., около 0,07% мас., около 0,08% мас., около 0,09% мас. или около 0,1% мас. меди; около 0,4% мас., около 0,5% мас., около 0,6% мас., около 0,7% мас., около 0,8% мас. или около 0,9% мас. цинка. Альтернативно, 0,2, 0,3, 0,4 или 0,5% мас. магния; 0,05% мас., 0,01% мас., 0,02% мас., 0,03% мас., 0,04% мас., 0,05% мас., 0,06% мас., 0,07% мас., 0,08% мас., 0,09% мас. или 0,1% мас. меди; 0,4% мас., 0,5% мас., 0,6% мас., 0,7% мас., 0,8% мас. или 0,9% мас. цинка.
Во втором варианте выполнения заявленное изобретение относится к зубной пасте, содержащей композицию по изобретению.
Техническими эффектами от применения заявленной композиции являются следующие.
Реминерализующий эффект - улучшение процессов реминерализации эмали за счет:
- включения катионов магния и цинка из бишофита и глюконата, которые замещаясь в гидроксиапатит, изменяют его кристаллические и морфологические свойства в положительную сторону и будут поддерживать эффективную концентрацию для кальций-магнийзамещенного гидроксиапатита;
- включения в состав композиции аспартата магния, который, во-первых, являясь органической аминоксилотой, может являться затравкой для новых центров нуклеации, а во-вторых, будет повышать локальную эффективную концентрацию магния;
- включения в состав глюконата, который будет хелатировать кальций из апатита, обеспечивая наличия центров элементарной замены в гидроксиапатите.
Также процесс реминерализации способствует снижению чувствительности зубной эмали. Эффект достигается за счет восстановления структуры эмали - результат заполнения микроповреждений минералами гидроксиапатита.
Антимикробный эффект - обеспечивает повышение антимикробной активности зубной эмали за счет включений растворимого глюконата цинка, где цинк обладает доказанной антимикробной активностью. Помимо этого, за счет того, что глюконат хелатирует кальций, будет обеспечена более адресная доставка цинка к зубной эмали, обеспечивая более эффективное антимикробное действие на биопленки зубного налета и десен.
Обеспечение свежести дыхания за счет блокировки ЛСС за счет включения ионов цинка и меди.
Регенерирующий ткани десен эффект - за счет обеспечения усиления синтеза коллагена в тканях десен за счет включения ионов цинка и меди.
Обеспечивает более мощный противоотечный и анельгизирующий эффект с маскировкой вкуса (в отличие от средств с более высоким содержанием морской соли) за счет повышения ионной силы в околодесневом пространстве, а также за счет применения органической соли цинка (и магния).
Обеспечивает активацию клеточных реакций, в том числе, за счет повышения активности магний-, цинк- и медь-зависимых ферментов.
Обеспечивает поддержание локально устойчивого рН за счет создания буферной емкости в присутствии повышенного количества бивалентных металлов, что опять же повышает эффективность реминерализации и способствует противокариесному эффекту.
Обеспечивает повышение слюнообразования после применения пасты, а вместе с ним усиление реминерализующей способности композиции и противокариесному эффекту.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Заявленное изобретение относится к композиции и зубной пасте, ее содержащей, для профилактики заболеваний полости рта (зубов, десен, слизистой оболочки).
В первом варианте выполнения заявленное изобретение относится к композиции для применения в составе средства для ухода за полостью рта, содержащей, % мас.:
|
В качестве альтернативы, изобретение относится к композиции для применения в составе средства для ухода за полостью рта, содержащей, % мас.:
|
В качестве альтернативы, изобретение относится к композиции для применения в составе средства для ухода за полостью рта, содержащей, % мас.:
|
где наполнителем, необязательно, является вода.
В качестве альтернативы, изобретение относится к композиции для применения в составе средства для ухода за полостью рта, содержащей, % мас.:
|
где наполнителем, необязательно, является вода.
Гидроксиапатит Ca-Mg-Zn (гидроксиапатит, обогащенный магнием и цинком; цинк-магний замещенный (модифицированный) гидроксиапатит; гидроксиапатитный комплекс кальция/магния/цинка) представляет собой коммерчески доступный продукт, уже находящий применение в зубных пастах (напр., «SILVER» от SPLAT). Гидроксиапатит кальция (ГАП) - Са10(PO4)6(ОН)2 - аналог минеральной компоненты костной ткани - широко используют в медицине и косметологии. Размеры кристаллов ГА в дентине меньше, чем в эмали. ГАП биосовместим со средой организма человека, остеокондуктивен и является идеальным инертным носителем для клеточных культур. Для придания специфических свойств используют химическое модифицирование, в частности, анионное и катионное замещение кальция. Особый интерес представляет модифицированный гидроксиапатит кальция. Выбор ионов связан с их биологической ролью в организме. Уменьшение площади удельной поверхности при увеличении содержания замещающего иона (цинка, магния) связывается с увеличением степени агрегированности частиц. Частицы меньшего размера, как известно, имеют больший радиус кривизны поверхности и, следовательно, большую активность и степень агрегированности. С увеличением количества замещающего иона в структуре ГАП происходит увеличение размеров частиц. Для цинк- и магнийсодержащих ГАП со степенью катионного замещения до 0,2% частичное замещение кальция на цинк и магний в гидроксиапатите приводит к уменьшению размера частиц, повышению площади поверхности и биологической активности цинк и магний-замещенного ГАП, а значит их использование в качестве компонентов обеспечивает большую эффективность. Результаты исследований биологической активности для цинк-замещенного ГАП свидетельствует о существенно большей биологической (бактерицидной) активности по сравнению с ГА. Такой модифицированный ГА доступен на рынке.
Гидроксиапатит Ca-Mg-Zn может содержаться в количестве около, % мас.: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10,11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40; или гидроксиапатит Ca-Mg-Zn может содержаться в количестве, % мас.: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40.
Бишофит, такой как гранулированный бишофит Соль "Древнего моря", представляет собой коммерчески доступный продукт, уже применяемый в зубных пастах (напр., BishEffect от ТОВ "ЖАРДIН KOCMETIK"). Бишофит может содержаться в количестве около, % мас.: 0,01, 0,05, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9 или 4,0; или бишофит может содержаться в количестве, % мас.: 0,01, 0,05, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9 или 4,0.
Соль морская израильская тип 0 представляет собой коммерчески доступный продукт. Соль морская израильская тип 0 может содержаться в количестве около, % мас.: 0,001, 0,005, 0,01, 0,015, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2; или соль морская израильская тип 0 может содержаться в количестве, % мас.: 0,001, 0,005, 0,01, 0,015, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2.
Аспартат магния, Глюконат меди, Глюконат цинка каждый являются коммерчески доступными продуктами от разных поставщиков. Комбинация Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве около, % мас.: 0,001, 0,005, 0,01, 0,015, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2; или комбинация Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве, % мас.: 0,001, 0,005, 0,01, 0,015, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2.
Аспартат магния в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве около, % мас.: 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99; или Аспартат магния в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве, % мас.: 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99.
Глюконат меди в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве около, % мас.: 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99; или Глюконат меди в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве, % мас.: 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99.
Глюконат цинка в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве около, % мас.: 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99; или Глюконат цинка в указанной комбинации Аспартат магния, Глюконат меди, Глюконат цинка может содержаться в количестве, % мас.: 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99.
Во втором варианте выполнения заявленное изобретение относится к зубной пасте, содержащей композицию по изобретению.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Включенные в настоящий раздел примеры не являются ограничивающими заявленное изобретение и приведены лишь с целью иллюстрации и подтверждения достижения ожидаемых технических результатов. Эти примеры являются одними из многих экспериментальных данных, полученных авторами изобретения, которые подтверждают эффективность средств, находящихся в пределах объема изобретения.
Были проведены следующие клинические исследования по оценке эффективности.
Пример 1.
В экспериментальных группах с участием пациентов использовали композиции, которые в качестве активных ингредиентов включали заявленный комплекс, содержащий гидроксиапатит (гидроксиапатит, обогащенный кальцием, магнием и цинком) в виде 10% суспензии - 5% масс., природный минерал бишофит - 1,34%, соль морскую израильскую тип 0-0,1%, комбинацию аспартат магния + глюконат меди + глюконат цинка - 0,1% (Таблица 1).

В качестве базы для включения компонентов применялась зубная паста с составом, приведенным в Таблице №2.
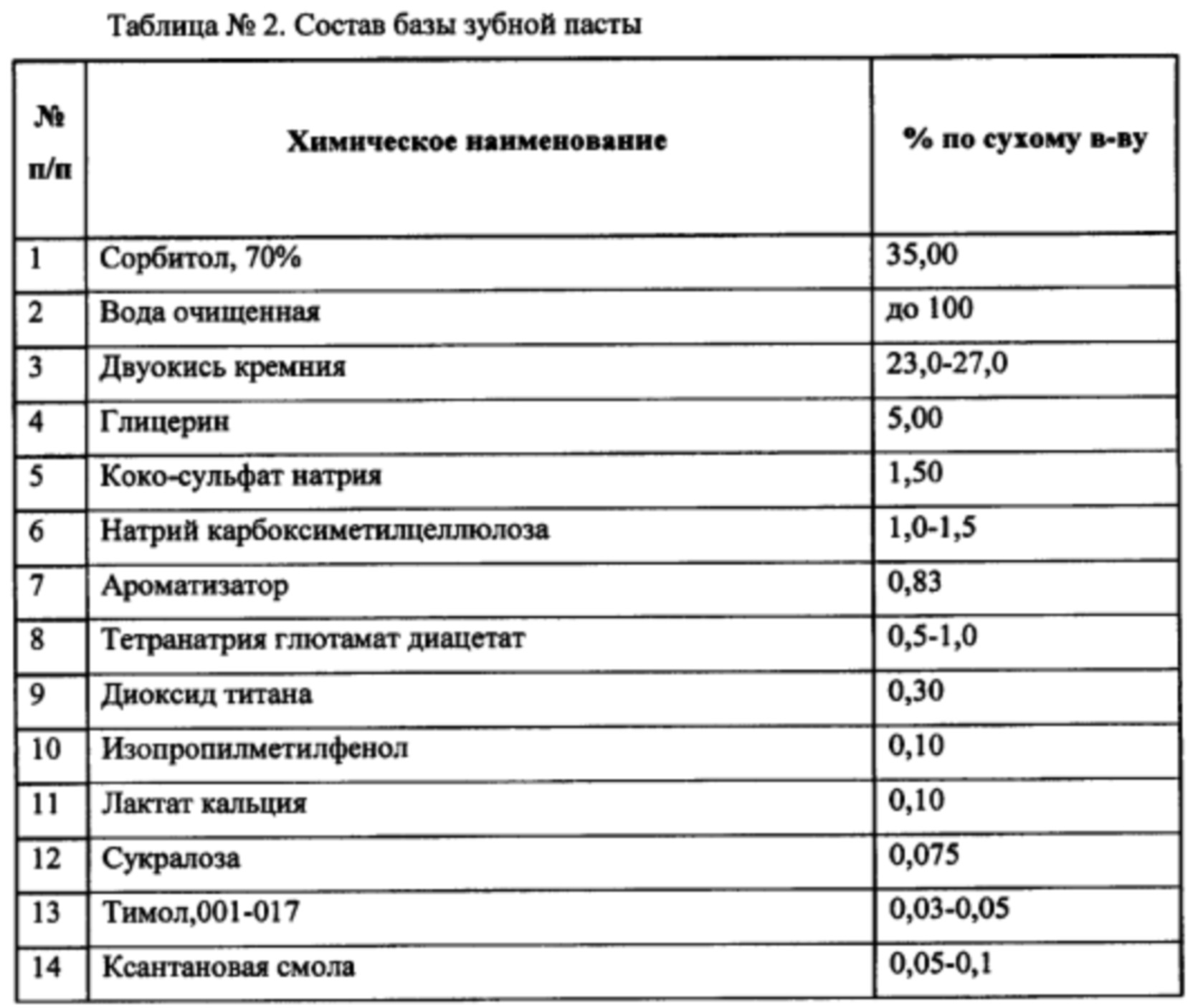
Проведено проспективное рандомизированное двойное слепое исследование на 120 субъектах (64 мужчины и 56 женщин), рандомизированных в три равные половозрастные группы. Пациенты применяли композиции в виде зубной пасты 2 раза в день на протяжении 6 недель.
Параметром для оценки эффективности действия препаратов выступал средний индекс кровоточивости десен (GBI), определяемый врачом-стоматологом. Кроме этого, оценивали функциональное состояние эмали методом определения скорости кислотной растворимости эмали по кальцию и КОСРЭ-гестом (клиническое определение скорости реминерализации эмали).
Для всех количественных данных вычисляли групповое среднее арифметическое (М), медиану (Me), стандартное отклонение (SD) и стандартную ошибку среднего (SEM), интерквартильные размахи, 90%ДИ. Полученные результаты обрабатывали с помощью ПО IBM SPSS Statistics 22.0 (StatSoft, Россия). Вероятность различий показателей средних в группах определяли с использованием критерия Манна-Уитни. Различия считали достоверными при уровне значимости р<0,05.
Результаты.
Через 6 недель после начала исследования наблюдали выраженные изменения оцениваемых показателей в группах исследования. В группе 1, применявшей композицию с комплексом гидроксиаппатит (гидроксиапатит, обогащенный кальцием, магнием и цинком) в виде 10% суспензии - 5% масс., природный минерал бишофит - 1,34%, соль морскую израильскую тип 0-0,1%, комбинацию аспартат магния + глюконат меди + глюконат цинка, значение GBI на конец исследования составило 0,04±0,02, что меньше по сравнению с начальными показателями (0,16±0,03; Р<0,05). В группе 2, применявшей комбинацию аспартат магния + глюконат меди + глюконат цинка, было отмечено слабо выраженное изменение GBI, на конец исследования его значение составило 0,12±0,03 по сравнению с начальными показателями (0,17±0,02; Р>0,05), в группе 3, применявшей композицию с гидроксиапатитом, достоверных изменений также не наблюдалось - GBI на начало исследования составлял 0,16±0,03, по завершении исследования - 0,15±0,02; Р>0,05.
Таким образом, использование пасты с комплексом гидроксиапатит (гидроксиапатит, обогащенный кальцием, магнием и цинком) в виде 10% суспензии - 5% масс., природный минерал бишофит - 1,34%, соль морскую израильскую тип 0-0,1%, комбинацию аспартат магния + глюконат меди + глюконат цинка, привело к уменьшению выраженности гингивита, причем данный эффект был достоверно выражен по сравнению с использованием гидроксиапатита и комбинацию аспартат магния + глюконат меди + глюконат цинка, что говорит о синергизме действия входящих в комплекс компонентов.
При анализе функционального состояния эмали были выявлены следующие особенности.
После применения зубной пасты с комплексом гидроксиапатит (гидроксиапатит, обогащенный кальцием, магнием и цинком) в виде 10% суспензии - 5% масс., природный минерал бишофит - 1,34%, соль морскую израильскую тип 0-0,1%, комбинацию аспартат магния + глюконат меди + глюконат цинка скорость реминерализации эмали выросла в 4 раза, что говорит о высоких реминерализующих способностях слюны под действием пасты (Р<0,05). В группе 2 реминерализующая способность композиции в сочетании с базовым составом зубной пасты достоверно не изменилась, в то время как в группе 3 реминерализующая функция возрастала в 2,3 раза (Р<0,05).
Скорость кислотной растворимости эмали по кальцию определяли с помощью метода кислотной биопсии. Максимальное снижение выхода кальция произошло в группе пасты с комплексом гидроксиапатит (гидроксиапатит, обогащенный кальцием, магнием и цинком) в виде 10% суспензии - 5% масс., природный минерал бишофит - 1,34%, соль морскую израильскую тип 0- 0,1%, комбинацию аспартат магния+глюконат меди + глюконат цинка - в начале исследования 45,0 мкг/мл, после применения пасты на 33% меньше - 30 мкг/мл. В группе 2 - наблюдалось снижение на 9%, в группе 3 наблюдали достоверное снижение на 14,1%.
Таким образом, применение комплекса гидроксиапатит (гидроксиапатит, обогащенный кальцием, магнием и цинком) в виде 10% суспензии - 5% масс., природный минерал бишофит - 1,34%, соль морскую израильскую тип 0-0,1%, комбинацию аспартат магния + глюконат меди + глюконат цинка позволяет добиться улучшения функциональных свойств эмали (скорость реминерализации увеличилась в 4 раза, а скорость кислотной растворимости эмали упала на 33%) за счет достоверного синергетического действия, входящих в состав комплекса компонентов, что, в свою очередь, эффективно сказывается на снижении чувствительности зубной эмали.
Пример 2.
В экспериментальных группах с участием пациентов использовали композиции, которые в качестве активных ингредиентов включали заявленный комплекс, содержащий гидроксиапатит (гидроксиапатит, обогащенный кальцием, магнием и цинком) в виде 10% суспензии - 5% масс., природный минерал бишофит - 1,34%, соль морскую израильскую тип 0-0,1%, комбинацию аспартат магния + глюконат меди + глюконат цинка - 0,1% (Таблица №3).


В качестве базы для включения компонентов применялась зубная паста с составом, приведенным в Таблице №2 (Пример 1).
Проведено проспективное рандомизированное двойное слепое исследование на 120 субъектах (58 мужчин, 62 женщины) в 5 равных половозрастных группах. Пациенты применяли композиции в виде зубной пасты 2 раза в день на протяжении 8 недель. Параметром для оценки эффективности действия препаратов выступал средний индекс кровоточивости десен (GBI), определяемый врачом-стоматологом. Также для оценки кариесорезисентности полости рта использовали параметр концентрации лактобактерий и S. mutans в слюне и зубном налете, показывающие порог риска развития кариеса зубов, а также рН слюны, отражающей буферную емкость слюны и скорость саливации.
При первичном осмотре выявили у пациентов следующее распределение по наличию S. mutans в зубном налете и ацидофильных бактерий в слюне (Таблица №4).
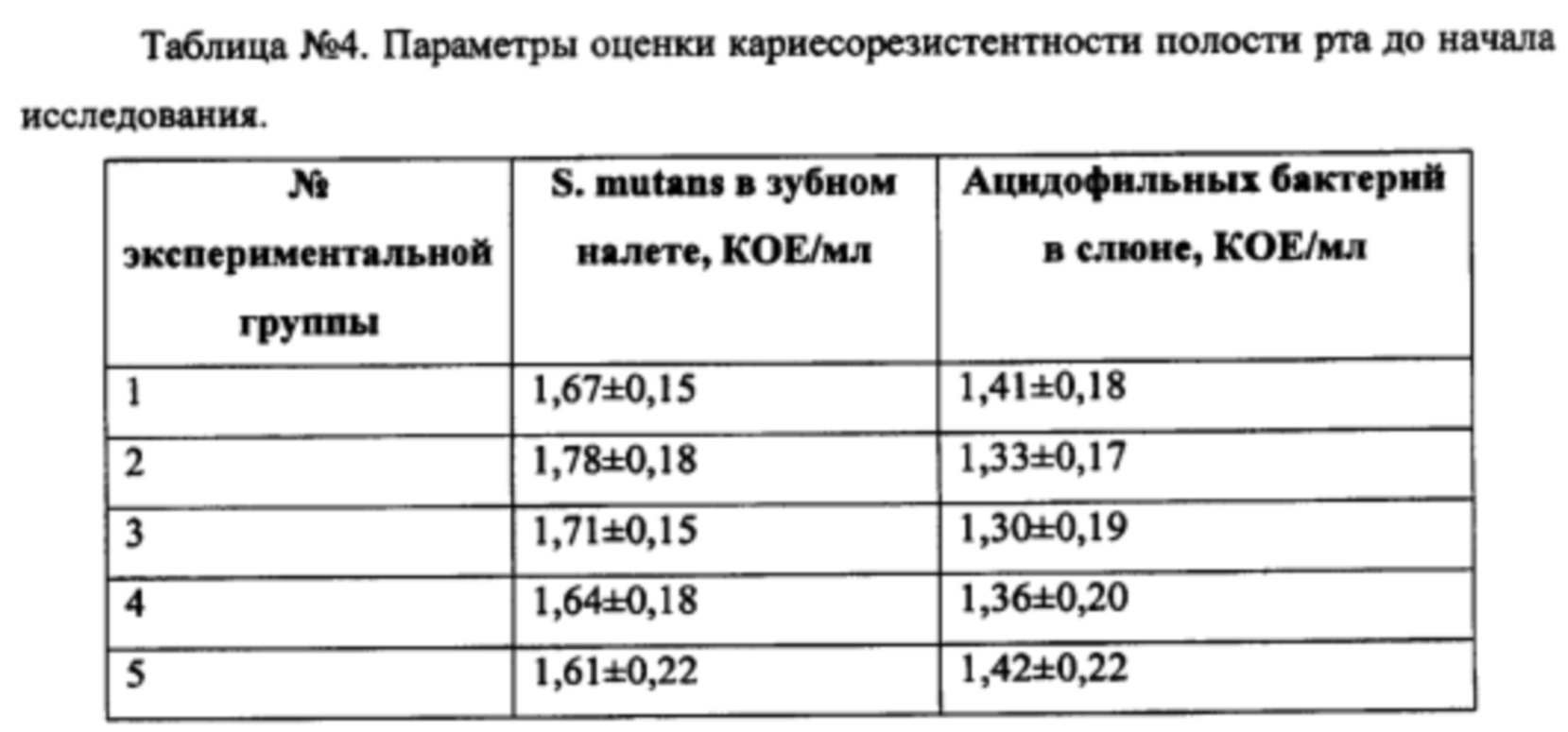
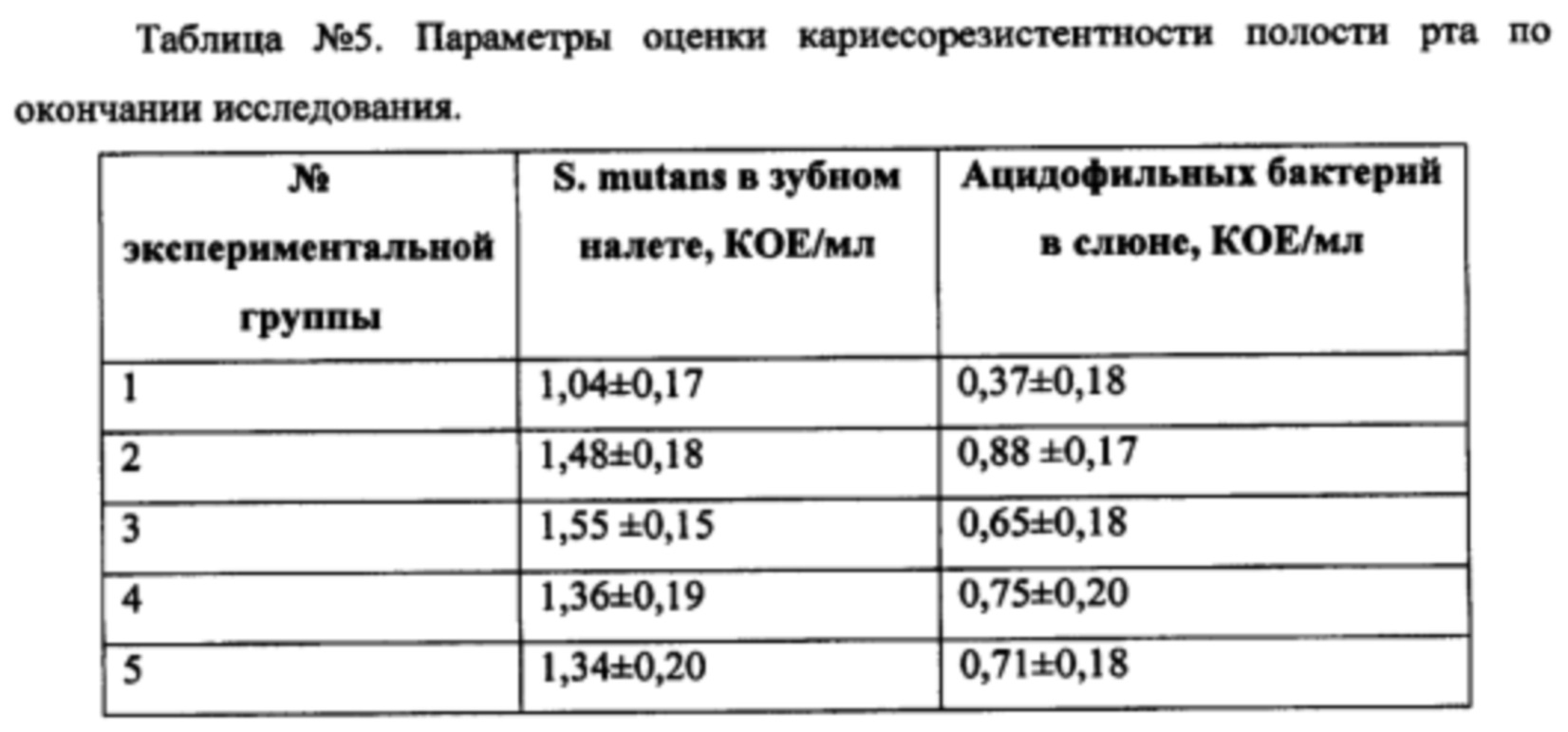
По окончании исследования у пациентов в группе композиции было отмечено существенное и достоверное снижение уровня стрептококков в зубном налете и лактобактерий в стимулированной слюне. В остальных группах показатели кариесорезистентности по S. mutans не демонстрировали достоверного снижения, в то время как по уровню ацидофильных бактерий в слюне достоверное улучшение наблюдалось во всех группах; однако, максимальный эффект наблюдался в группе 1, и его величина достоверно отличалась от значений в группах монокомпонентов комплекса (Таблица №5).
При оценке буферной емкости слюны до начала исследования наблюдалось следующее распределение по группам (Таблица №6).
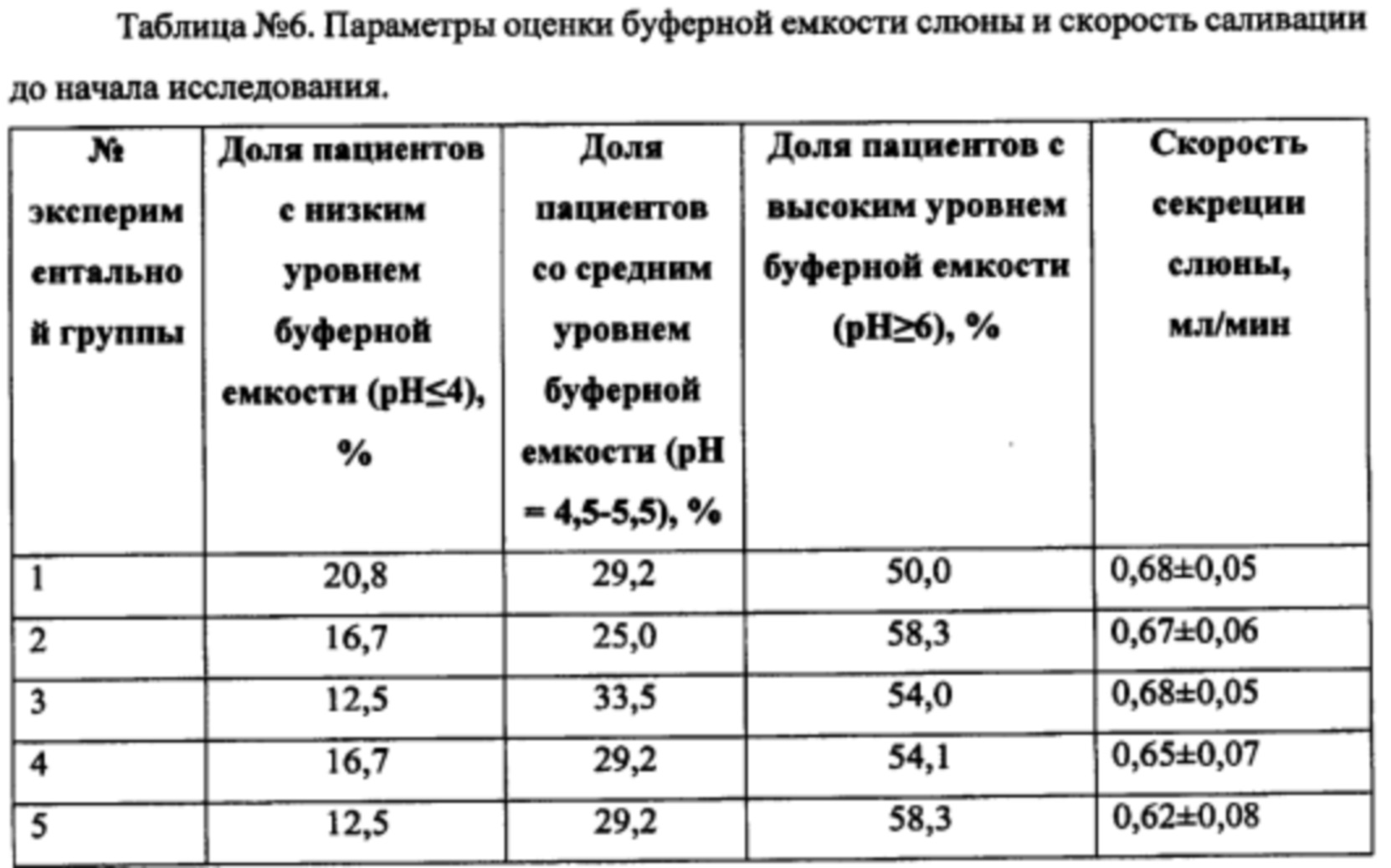
Через 8 недель применения зубных паст экспериментальных групп наблюдали следующие изменения (Таблица №7).
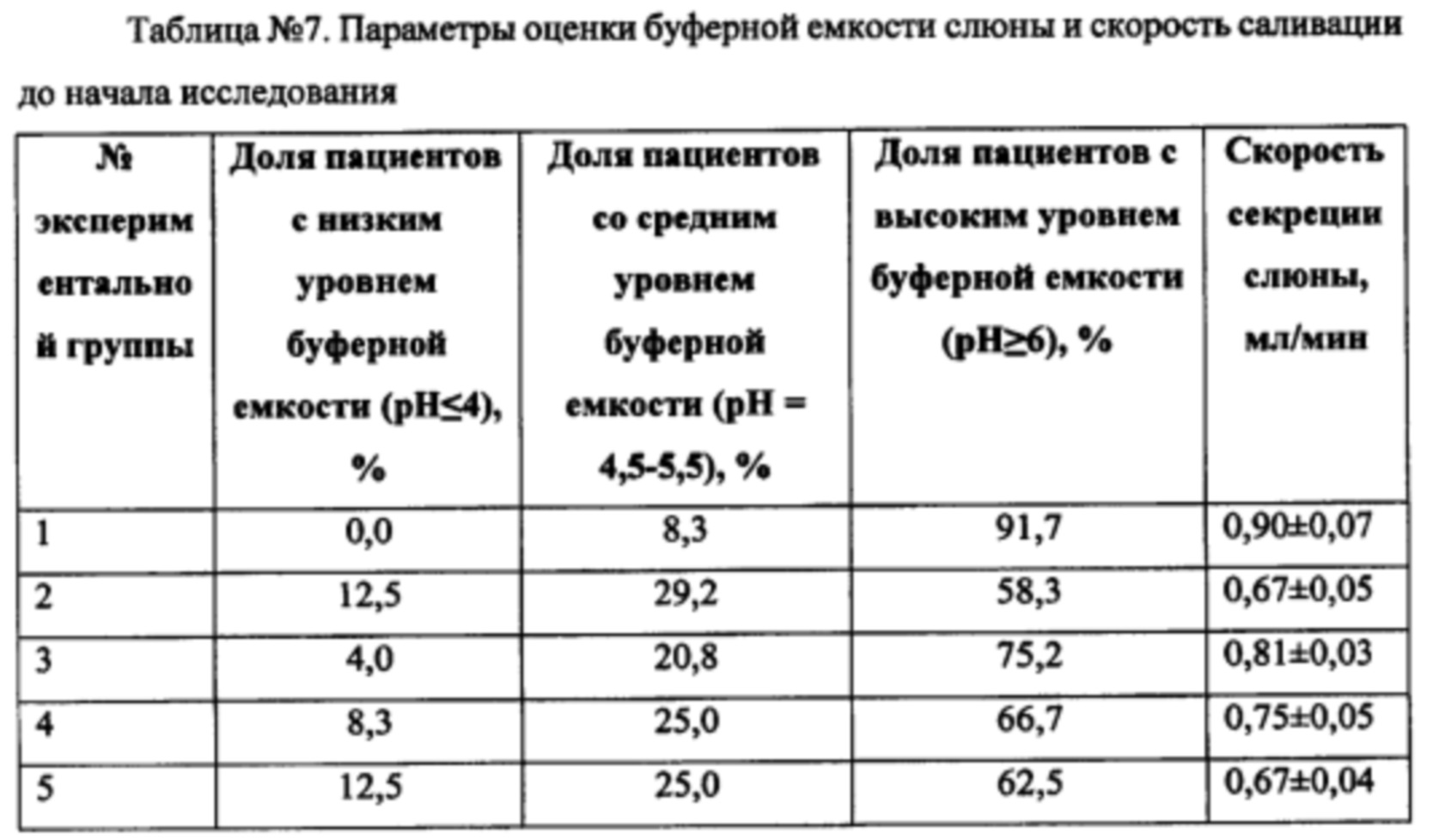
Достоверное изменение буферной емкости зафиксировано в группе 1, при этом в группе 3 также наблюдалось сонаправленная коррекция буферной емкости, однако лишь на уровне тренда. Скорость саливации также достоверно улучшилась в группах заявляемой композиции, а также в группах, содержащих морскую соль и бишофит, в то время как в группах 2 и 5 достоверных отличий не наблюдали. Поскольку в группе 1 наблюдали максимально выраженный эффект по показателю буферной емкости слюны и скорости саливации, можно сделать вывод, что эффект достигается за счет синергетического действия компонентов состава, обеспечивая повышение устойчивости ротовой полости к образованию зубного налета, а также развитию гингивита и кариеса.
Пример 3.
В экспериментальных группах с участием пациентов использовали композиции, которые в качестве активных ингредиентов включали заявленный комплекс, содержащий гидроксиапатит (гидроксиапатит, обогащенный кальцием, магнием и цинком) в виде 10% суспензии - 5% масс., природный минерал бишофит - 1,34%, соль морскую израильскую тип 0-0,1%, комбинацию аспартат магния + глюконат меди + глюконат цинка - 0,1% (Таблица №8).

В качестве базы для включения компонентов применялась зубная паста с составом, приведенным в Таблице №2 (Пример 1).
Проведено проспективное рандомизированное двойное слепое исследование на 50 субъектах (24 мужчине, 26 женщин) в 2 равных половозрастных группах. Пациенты применяли композиции в виде зубной пасты 2 раза в день на протяжении 10 недель. Параметром для оценки эффективности действия композиций зубных паст выступал рН слюны, отражающий буферную емкость слюны и скорость саливации.
При оценке буферной емкости слюны до начала исследования наблюдалось следующее распределение по группам (Таблица №9).
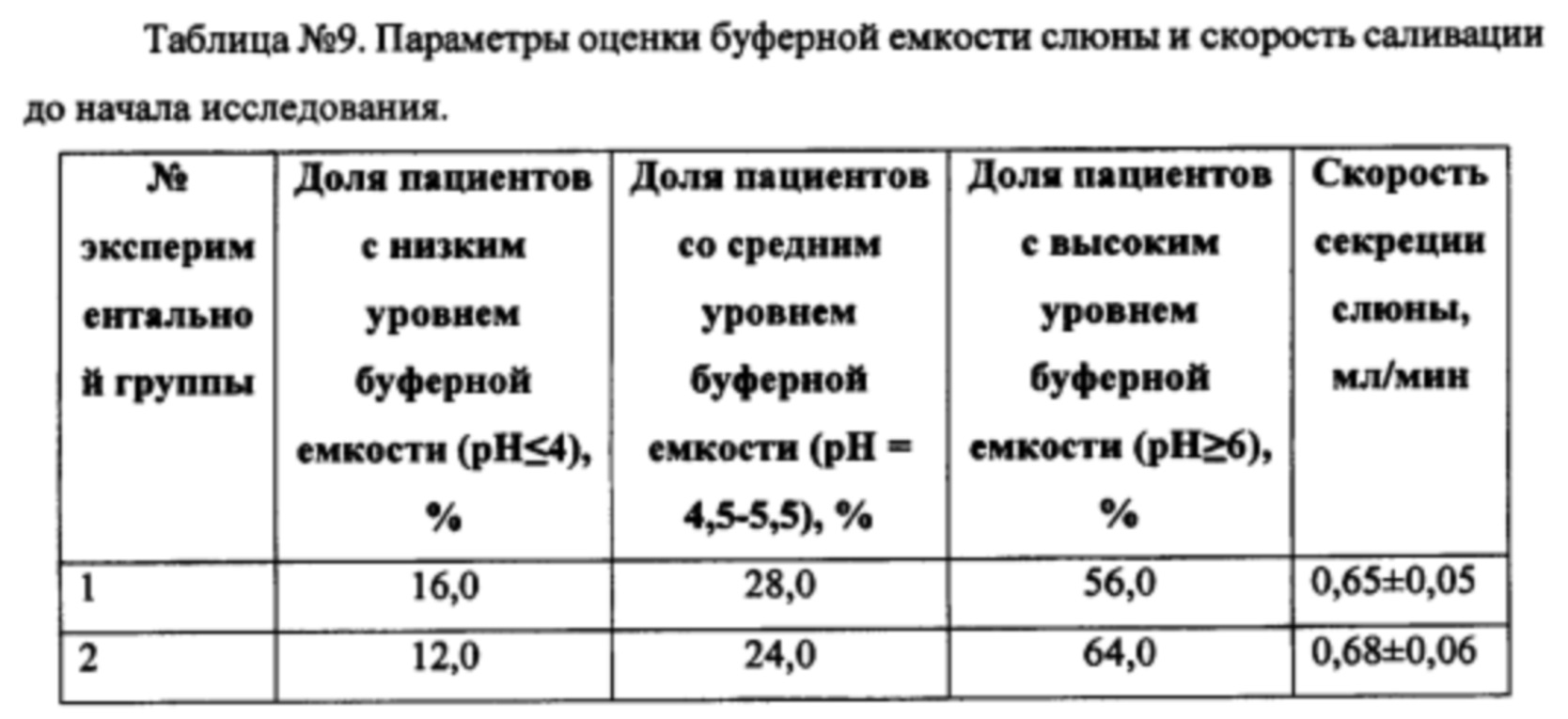
Через 10 недель применения зубных паст экспериментальных групп наблюдали следующие изменения (Таблица №10).

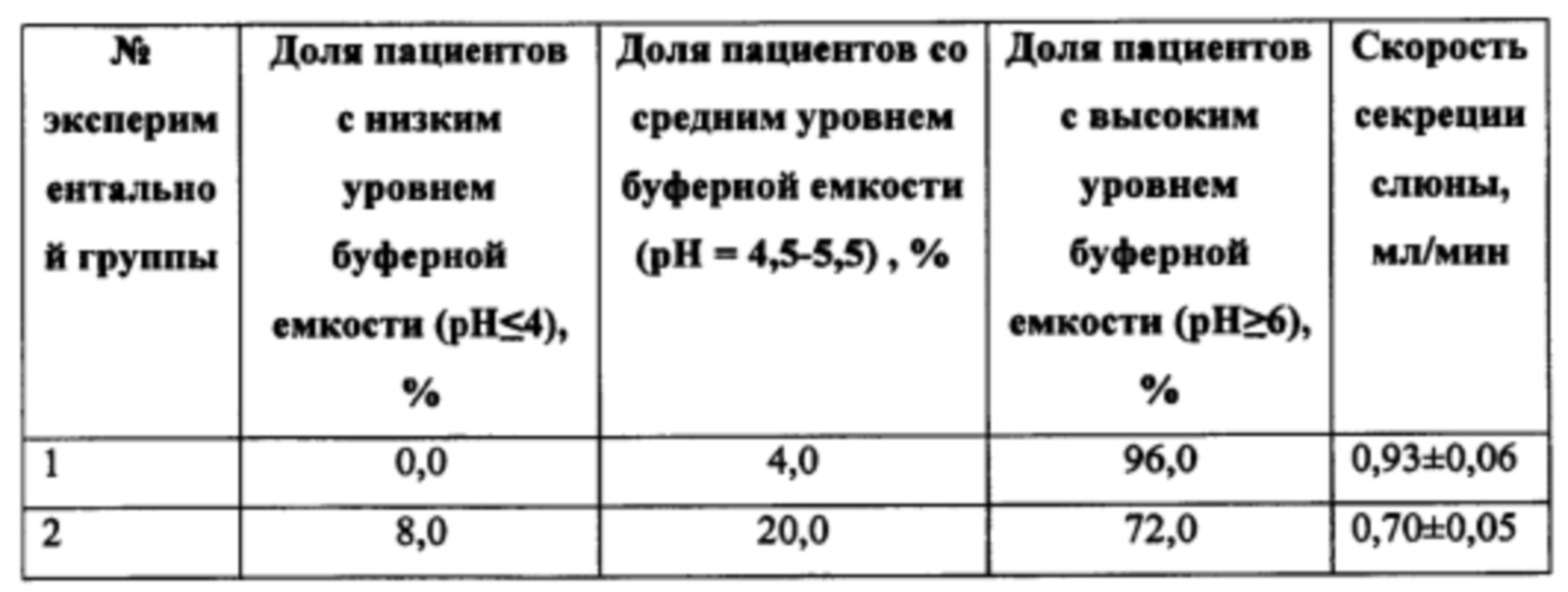
Достоверное изменение буферной емкости и увеличение скорости саливации зафиксировано в группе с заявленной композицией, в то время как в группе плацебо достоверных отличий не обнаружено. Таким образом, по показателю буферной емкости слюны и скорости саливации, можно сделать вывод, что наблюдаемый эффект достигается за счет уникальности действия компонентов состава, обеспечивая повышение устойчивости ротовой полости к образованию зубного налета, а также развитию гингивита и кариеса за счет влияния на буферную емкость слюны и скорость слюноотделения.
Пример 4.
В экспериментальных группах с участием пациентов использовали композиции, которые в качестве активных ингредиентов включали заявленный комплекс, содержащий ГАП кальция, обогащенный магнием и цинком, в виде 10% суспензии - 5% масс., природный минерал бишофит - 1,34% мас., 0,1% мас. соли морской израильской тип 0, 0,0024-0,006% мае аспартата магния, 0,00035-0,00070% мае глюконата меди, 0,0028-0,0070% мае глюконат цинка (Таблица №11).

В качестве базы для включения компонентов применялась зубная паста с составом, приведенным в Таблице №2 (Пример 1).
Проведено проспективное рандомизированное двойное слепое исследование на 50 субъектах (28 мужчин, 22 женщины) в 2 равных половозрастных группах. Пациенты применяли композиции в виде зубной пасты 2 раза в день на протяжении 8 недель. Параметрами для оценки эффективности действия заявленного комплекса выступал уровень лактобактерий и Streptococcus mutans в слюне и зубном налете, показывающие порог риска развития кариеса зубов, а также рН слюны, отражающий буферную емкость слюны и скорость саливации.
При первичном осмотре выявили у пациентов следующее распределение по наличию S. mutans в зубном налете и ацидофильных бактерий в слюне (Таблица №12).

По окончании исследования у пациентов в группе композиции было отмечено существенное и достоверное снижение уровня стрептококков в зубном налете и лактобактерий в стимулированной слюне. В группе без заявленного комплекса показатели кариесорезистентности по S. mutans демонстрировали тенденцию к снижению, в то время как по уровню ацидофильных бактерий в слюне достоверное улучшение наблюдалось и в этой группе; однако, эффект в группе заявленного комплекса был достоверно выше, чем в группе пасты базового состава (Таблица №13).
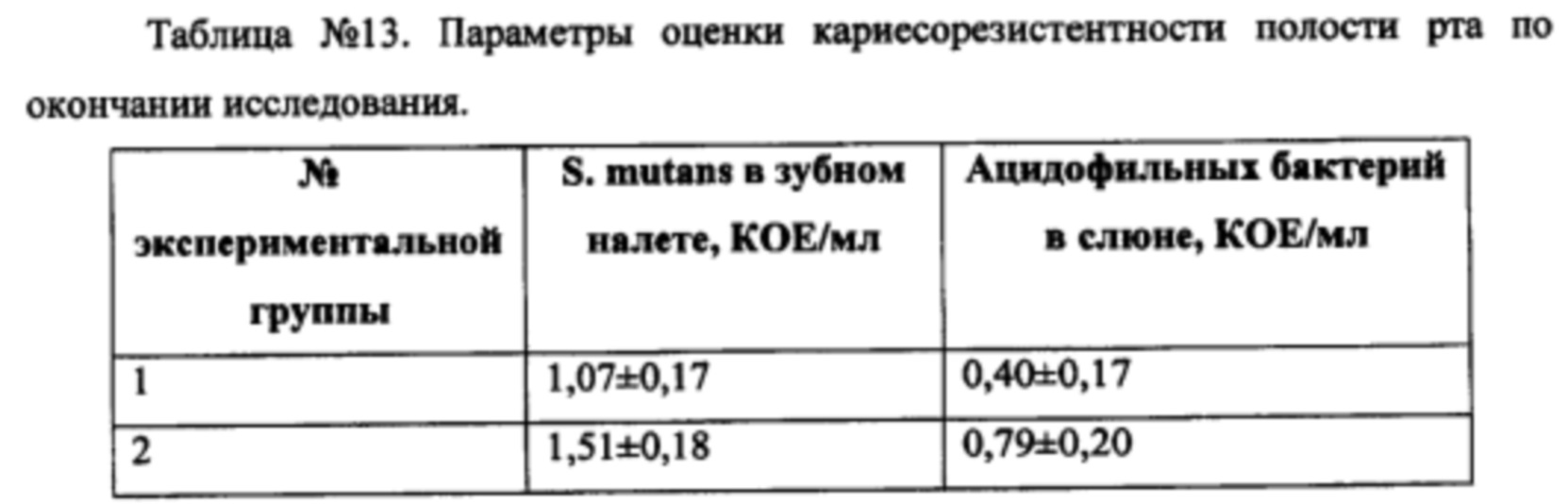
При оценке буферной емкости слюны и скорости саливации до начала исследования наблюдалось следующее распределение по группам (Таблица №14):
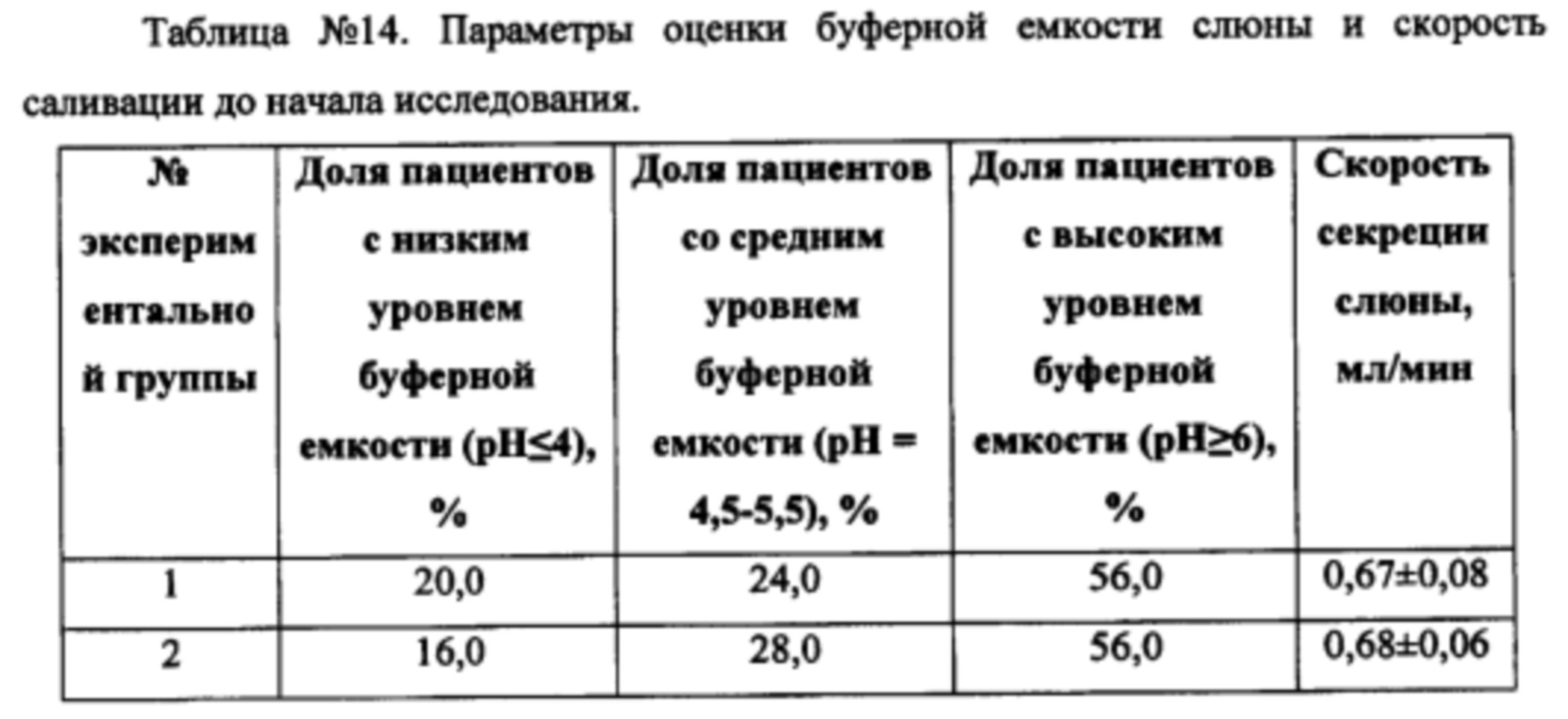
Через 8 недель применения зубных паст экспериментальных групп наблюдали следующие изменения (Таблица №15).
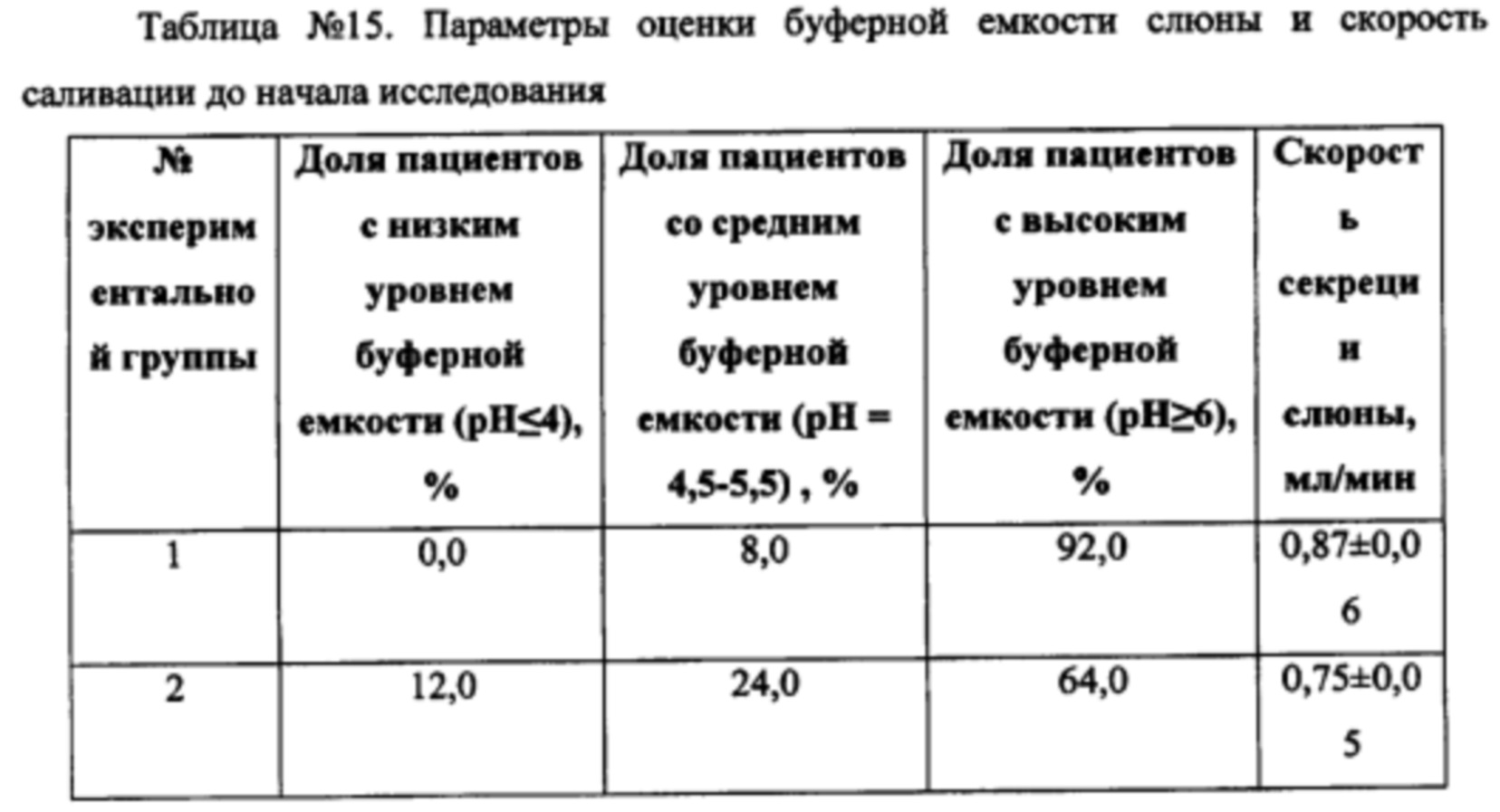
Достоверное изменение буферной емкости и увеличение скорости саливации зафиксировано в группе с заявленной композицией, в то время как в группе с базовым составом достоверных отличий не обнаружено. Таким образом, по показателю буферной емкости слюны и скорости саливации, можно сделать вывод, что наблюдаемый эффект достигается за счет уникальности действия компонентов состава заявленного комплекса, обеспечивая повышение устойчивости ротовой полости к образованию зубного налета, а также развитию гингивита и кариеса за счет влияния на буферную емкость слюны и скорость слюноотделения.
Список литературы.
1. Бекжанова, О. Е. (2009) 'Взаимосвязь физико-химических показателей смешанной слюны и кариеса зубов у больных сахарным диабетом', Врач-аспирант. Edited by Э. X. К. О. Е. Бекжанова. Врач-аспирант, 9, pp. 811-816.
2. Зборовский АБ, Мартемьянов в. Ф, Сидорова ЕА, Мозговая ЕЕ, Зборовская ИА. Бишофит в лечении больных ревматоидным артритом. Терапевтический Архив 2003; 75:29-32.
3. Скрипкина, Г.И. (2011) 'Типы микрокристаллизации слюны в совокупности с физико-химическими параметрами ротовой жидкости у кариесрезистентных детей школьного возраста', Институт Стоматологии, 1, pp. 118-131.
4. Спасов АА, Мазанова Л.С., Мотов А.А., Оробинская Т.А., Сысуев Б.Б. Влияние мази минерала бишофит на течение контактного аллергического дерматита, вызванного 2,4- динитрохлорбензолом. Экспериментальная И Клиническая Фармакология 2009; 72:37-9.
5. Спасов А.А., Мазанова Л.С., Мотов А.А., Оробинская Т.А., Сысуев Б.Б. Регенерирующая активность гидрофильной мази минерала бишофит при острой локальной криотравме. Экспериментальная И Клиническая Фармакология 2008; 71:39-41.
6. Спасов А.А., Островский О.В., Смирнова Л.А., Герчиков Л.В., Темкин Э.С. Противовоспалительное действие минерала бишофит. Экспериментальная И Клиническая Фармакология 1998; 61:64-6.
7. Спасов А.А., Темкин Э.С, Островский О.В., Калинина Н.В., Герчиков Л.В., Михальченко В.Ф. et al. Экспериментально-клиническое обоснование применения препарата поликатан при заболеваниях пародонта. Стоматология 1999; 78:16-9.
8. Сысуев Б.Б. Технологические и фармакологические исследования минерала бишофит как источника магнийсодержащих лекарственных средств. Диссертация на соискание ученой степени доктора фармацевтических наук. Волгоградский государственный медицинский университет, 2012
9. Сысуев Б.Б., Иежица И.Н., Лебедева С.А. Изучение токсичности пероральных форм раствора минерала бишофит. Фундаментальные Исследования 2013:680-3.
10. Сысуев Б.Б., Спасов А.А., Мазанова Л.С. Изучение токсичности очищенного раствора минерала бишофит. Современные проблемы науки и образования 2013; 1.
11. Abdullah, A. Z. et al. (2006) 'The effect of copper on demineralization of dental enamel.', Journal of dental research, 85(11), pp. 1011-5. doi: 10.1177/154405910608501107.
12. Alioui, H., Bouras, O. and Bollinger, J.-C. (2019) 'Toward an efficient antibacterial agent: Zn- and Mg-doped hydroxyapatite nanopowders', Journal of Environmental Science and Health, Part A, pp. 1-13. doi: 10.1080/10934529.2018.1550292.
13. Amaechi, В. T. and van Loveren, C. (2013) 'Fluorides and Non-Fluoride Remineralization Systems', in Toothpastes, pp. 15-26. doi: 10.1159/000350458
14. American Academy of Pediatric Dentistry (2013) 'Guideline on caries-risk assessment and management for infants, children, and adolescents.', Pediatric dentistry, 35(5), pp. E157-64. Available at: http://www.ncbi.nlm.nih.gov/pubmed/24290544.
15. Aoba, T. (1996) 'Recent observations on enamel crystal formation during mammalian amelogenesis.', The Anatomical record, 245(2), pp. 208-18. doi: 10.1002/(SICI)1097-0185(199606)245:2<208::Aro-AR8>3.0.CO;2-S.
16. Arends, J. and Christoffersen, J. (1986) "The Nature of Early Caries Lesions in Enamel', Journal of Dental Research, 65(1), pp. 2-11. doi: 10.1177/00220345860650010201.
17. Boanini, E. et al. (2006) 'Nanocomposites of hydroxyapatite with aspartic acid and glutamic acid and their interaction with osteoblast-like cells.', Biomaterials, 27(25), pp. 4428-33. doi: 10.1016/j.biomaterials.2006.04.019.
18. Borella, P., Fantuzzi, G. and Aggazzotti, G. (1994) 'Trace elements in saliva and dental caries in young adults', Science of The Total Environment, 153(3), pp. 219-224. doi: 10.1016/0048-9697(94)90201-1.
19. Branca, F., Valtuefla, S. and Vatuefla, S. (2001) 'Calcium, physical activity and bone health-building bones for a stronger future.', Public health nutrition, 4(1 A), pp. 117-23. Available at: http.//www.ncbi.nlm.nih.gov/pubmed/11255501.
20. Brookes, S.. et al. (2003) 'Copper ions inhibit the demineralisation of human enamel', Archives of Oral Biology, 48(1), pp.25-30. doi: 10.1016/S0003-9969(02)00162-0.
21. Brookes, S.J. et al. (2003) 'Copper ions inhibit the demineralisation of human enamel.', Archives of oral biology, 48(1), pp. 25-30. Available at: http://www.ncbi.nlm.nih.gov/pubmed/12615138.
22. Brown, P.W., Constantz, В. (1994) Hydroxyapatite and related materials. Boca Raton: CRC Press.
23. Cacciotti, I. (2015) 'Cationic and Anionic Substitutions in Hydroxyapatite', in Handbook of Bioceramics and Biocomposites. Cham: Springer International Publishing, pp. 1-68. doi: 10.1007/978-3-319-09230-0_7-1.
24. de Carvalho, F.G. et al. (2014) 'In vitro effects of nano-hydroxyapatite paste on initial enamel carious lesions.', Pediatric dentistry, 36(3), pp. 85-9. Available at: http://www.ncbi.nlm.nih.gov/pubmed/24960376.
25. Chung, R.-J. et al. (2006) 'Antimicrobial effects and human gingival biocompatibility of hydroxyapatite sol-gel coatings.', Journal of biomedical materials research. Part B, Applied biomaterials, 76(1), pp. 169-78. doi: 10.1002/jbm.b.30365.
26. Churchley, D. et al. (2011) 'Protection against enamel demineralisation using toothpastes containing o-cymen-5-ol, zinc chloride and sodium fluoride', International Dental Journal, 61, pp.55-59. doi: 10.1111/j.1875-595X.2011.00050.x.
27. Condo, S.G. (1999) 'Gingiva, teeth and sea salt', American Journal or Deruislry, 12(1).
28. Dorozhkin, S.V and Epple, M. (2002) 'Biological and medical significance of calcium phosphates.', Angewandte Chemie (International ed. in English), 41(17), pp. 3130-46. doi: 10.1002/1521-3773(20020902)41:17<3130::AID-ANIE3130>3.0.CO;2-1.
29. Duggal, M.S., Chawla, H.S. and Curzon, M.E.J. (1991) 'A study of the relationship between trace elements in saliva and dental caries in children', Archives of Oral Biology, 36(12), pp. 881-884. doi: 10.1016/0003-9969(91)90118-E.
30. Edgar, W.M. (1990) 'Saliva and dental health. Clinical implications of saliva: report of a consensus meeting', British Dental Journal, 169(4), pp. 96-98. doi: 10.1038/sj.bdj.4807284.
31. Enax, J. and Epple, M. (2018) 'Synthetic Hydroxyapatite as a Biomimetic Oral Care Agent.', Oral health & preventive dentistry, 16(1), pp. 7-19. doi: 10.3290/j.ohpd.a39690.
32. Etzel, K.R. et al. (1982) 'Endotoxin-induced changes in copper and zinc metabolism in the Syrian hamster.', The Journal of nutrition, 112(12), pp. 2363-73. doi: 10.1093/jn/112.12.2363.
33. Featherstone, J.D. (1999) 'Prevention and reversal of dental caries: role of low level fluoride.', Community dentistry and oral epidemiology, 27(1), pp. 31-40. Available at: http://www.ncbi.nlm.nih.gov/pubmed/10086924.
34. Featherstone, J.D., Goodman, P. and McLean, J.D. (1979) 'Electron miscroscope study of defect zones in dental enamel.', Journal of ultrastructure research, 67(2), pp. 117-23. Available at: http://www.ncbi.nlm.mh.gov/pubmed/469984.
35. Gayathri, B. et al. (2018) 'Magnesium incorporated hydroxyapatite nanoparticles: Preparation, characterization, antibacterial and larvicidal activity', Arabian Journal of Chemistry, 11(5), pp. 645-654. doi: 10.1016/j.arabjc.2016.05.010.
36. Geddes, D. A. (1975) 'Acids produced by human dental plaque metabolism in situ.', Caries research, 9(2), pp. 98-109. doi: 10.1159/000260149.
37. Gopi, D. et al. (2012) 'Spectroscopic investigation on formation and growth of mineralized nanohydroxyapatite for bone tissue engineering applications', Spectrochimica
38. Acta Part A: Molecular and Biomolecular Spectroscopy, 92, pp. 194-200. doi: 10.1016/j.saa.2012.02.069.
39. Grad, B. (1954) 'Diurnal, age, and sex changes in the sodium and potassium concentration of human saliva.', Journal of gerontology, 9(3), pp.276-86. Available at: http://www.ncbi.nlm.nih.gov/pubmed/13184110.
40. Guzman, M., Dille, J. and Godet, S. (2012) 'Synthesis and antibacterial activity of silver nanoparticles against gram-positive and gram-negative bacteria', Nanomedicine: Nanotechnology, Biology and Medicine, 8(1), pp. 37-45. doi: 10.1016/j.nano.2011.05.007.
41. H. Li, M. Liu, M.D. (2011) 'An experiment on the attrition of acid deminer-alized dentine in vitro', Aust. Dent. J., 56(31), pp. 63-67.
42. Hajipour, M. J. et al. (2012) 'Antibacterial properties of nanoparticles', Trends in Biotechnology, 30(10), pp. 499-511. doi: 10.1016/j.tibtech.2012.06.004.
43. Hu, M.-L. et al. (2018) 'Effect of desensitizing toothpastes on dentine hypersensitivity: A systematic review and meta-analysis', Journal of Dentistry, 75, pp.12-21. doi: 10.1016/j.jdent.2018.05.012.
44. Hussein, A. S. et al. (2013) 'Salivary trace elements in relation to dental caries in a group of multi-ethnic schoolchildren in Shah Alam, Malaysia.', European journal of paediatric dentistry: official journal of European Academy of Paediatric Dentistry, 14(2), pp. 113-8. Available at: http://www.ncbi.nlm.mh.gov/pubmed/23758460.
45. IIJIMA, M. et al. (2017) 'The effects of single application of pastes containing ion-releasing particles on enamel demineralization', Dental Materials Journal, 36(4), pp. 461-468. doi: 10.4012/dmj.2016-307.
46. Ito, A. et al. (2000) 'Preparation, solubility, and cytocompatibility of zinc-releasing calcium phosphate ceramics.', Journal of biomedical materials research, 50(2), pp. 178-83. Available at: http://www.ncbi.nlm.nih.gov/pubmed/10679682.
47. Johnson, P., Yaegaki, K. and Tonzetich, J. (1996) 'Effect of methyl mercaptan on synthesis and degradation of collagen.', Journal of periodontal research, 31(5), pp. 323-9. Available at: http://www.ncbi.nlm.nih.gov/pubmed/8858536.
48. Kawamura, H. et al. (2000a) 'Stimulatory effect of zinc-releasing calcium phosphate implant on bone formation in rabbit femora.', Journal of biomedical materials research, 50(2), pp. 184-90. doi: 10.1002/(SICI)1097-4636(200005)50:2<184::AID-JBM13>3.0. CO;2-3.
49. Kawamura, H. et al. (2000b) 'Stimulatory effect of zinc-releasing calcium phosphate implant on bone formation in rabbit femora.', Journal of biomedical materials research, 50(2), pp. 184-90. Available at: http://www.ncbi.nlm.nih.gov/pubmed/10679683.
50. Kaygili, O. and Keser, S. (2015) 'Sol-gel synthesis and characterization of Sr/Mg, Mg/Zn and Sr/Zn co-doped hydroxyapatites', Materials Letters, 141, pp. 161-164. doi: 10.1016/j.matlet.2014.11.078.
51. Keilin, D., Mann, Т. (1940) 'Zinc in Carbonic Anhydrase', Nature Lond, 145, p. 304.
52. Kensche, A. et al. (2017) 'Efficacy of a mouthrinse based on hydroxyapatite to reduce initial bacterial colonisation in situ', Archives of Oral Biology, 80, pp. 18-26. doi: 10.1016/j.archoralbio.2017.03.013.
53. Kim, J. et al. (2015) 'Anti-inflammatory effects of zinc in PMA-treated human gingival fibroblast cells.', Medicina oral, patologia oral у cirugia bucal, 20(2), pp. e180-7. Available at: http://www.ncbi.nlm.nih.gov/pubmed/25662537.
54. Kim, Y.-J. (2007) 'Effects of Zinc on Oral Bacteria and Volatile Sulfur Compound (VSC) in Oral Cavity', Journal of Oral Medicine and Pain, 32(3), pp. 273-281.
55. Klimuszko, E. et al. (2018) 'Evaluation of calcium and magnesium contents in tooth enamel without any pathological changes: in vitro preliminary study', Odontology, 106(4), pp.369-376. doi: 10.1007/s10266-018-0353-6.
56. Lagocka, R, Jakubowska, K, Lipski, M, Buczkowska-Radlinska, J, Chlubek, D, Opalko, K. (2003) 'The content of magnesium in superfcial layers of human enamel and its infuence on susceptibility of enamel to caries', J Elementol, 8, pp. 159-167.
57. Lelli, M. et al. (2014) 'Remineralization and repair of enamel surface by biomimetic Zn-carbonate hydroxyapatite containing toothpaste: a comparative in vivo study', Frontiers in Physiology, 5. doi: 10.3389/fphys.2014.00333.
58. Lilley, K. J. et al. (2005) 'Cement from magnesium substituted hydroxyapatite', Journal of Materials Science: Materials in Medicine, 16(5), pp. 455-460. doi: 10.1007/s10856-005-6986-3.
59. Liu, Y. et al. (2012) 'Removal of high-concentration phosphate by calcite: Effect of sulfate andpH', Desalination, 289, pp. 66-71. doi: 10.1016/j.desal.2012.01.011.
60. Van Loveren С.M. C. D. N. J. M. Huysmans, A. Lussi, H.-P- Weber, E. (2013) Toothpastes: Monographs in oral science. Basel: Karger.
61. Lynch, R. J. M. (2011) 'Zinc in the mouth, its interactions with dental enamel and possible effects on caries; a review of the literature', International Dental Journal, 61, pp. 46-54. doi: 10.1111/j.1875-595X.2011.00049.x.
62. Matsumoto, Т. et al. (2006) 'Role of acidic amino acid for regulating hydroxyapatite crystal growth.', Dental materials journal, 25(2), pp. 360-4. Available at: http://www.ncbi.nlm.nih.gov/pubmed/16916241.
63. Matsunaga, T. et al. (2009) 'Synchrotron radiation microbeam X-ray fluorescence analysis of zinc concentration in remineralized enamel in situ.', Archives of oral biology, 54(5), pp. 420-3. doi: 10.1016/j.archoralbio.2009.01.015.
64. McClain, P. E. et al. (1973) 'Influence of zinc deficiency on synthesis and cross-linking of rat skin collagen.', Biochimica et biophysica acta, 304(2), pp. 457-65. Available at: http://www.ncbi.nlm.nih.gov/pubmed/4710769.
65. Medeiros, D. M. et al. (1997) 'Femurs from rats fed diets deficient in copper or iron have decreased mechanical strength and altered mineral composition', The Journal of Trace Elements in Experimental Medicine, 10(3), pp. 197-203. doi: 10.1002/(SICI)1520-670X(1997)10:3<197::AID-JTRA7>3.0.CO;2-8.
66. Nagavi-Alhoseiny, A. A. et al. (2019) 'Effect of sodium chloride on gene expression of Streptococcus mutans and zeta potential of demineralized dentin.', Journal of oral biology and craniofacial research, 9(1), pp. 1-4. doi: 10.1016/j.jobcr.2018.08.002.
67. Ohzeki, T. et al. (2007) 'The Effect of intravitreal N-methyl-DL-aspartic acid on the electroretinogram in Royal College of surgeons rats.', Japanese journal of ophthalmology, 51(3), pp. 165-74. doi: 10.1007/s10384-007-0420-y.
68. Rajda, C. et al. (1999) 'Amino acids in the saliva of patients with migraine.', Headache, 39(9), pp. 644-9. Available at: http://www.ncbi.nlm.nih.gov/pubmed711279959.
69. Robinson, C. et al. (2000) "The chemistry of enamel caries.', Critical reviews in oral biology and medicine: an official publication of the American Association of Oral Biologists, 11(4), pp. 481-95. Available at: http://www.ncbi.nlm.nih.gov/pubmed/11132767.
70. Robinson, C. (2009) 'Fluoride and the caries lesion: interactions and mechanism of action.', European archives of paediatric dentistry: official journal of the European Academy of Paediatric Dentistry, 10(3), pp. 136-40. Available at: http://www.ncbi.nlm.nih.gov/pubmed/19772842.
71. Rohweder, J. et al. (1998) '[Zinc acts as a protective agent on the mucosal barrier in experimental TNBS colitis].', Langenbecks Archiv fur Chirurgie. Supplement. Kongressband. Deutsche Gesellschaft fur Chirurgie. Kongress, 115(Suppl I), pp. 223-7. Available at: http://www.ncbi.nlm.nih.gov/pubmed714518248.
72. Rude, R.K. et al. (2003) 'Magnesium Deficiency: Effect on Bone and Mineral Metabolism in the Mouse', Calcified Tissue International, 72(1), pp. 32-41. doi: 10.1007/s00223-001-1091-1.
73. Rudolf, E. and Cervinka, M. (2010) 'Responses of human gingival and periodontal fibroblasts to a low-zinc environment.', Alternatives to laboratory animals: ATLA, 38(2), pp. 119-38. Available at: http://www.ncbi.nlm.nih.gov/pubmed/20507184.
74. Sarig, S. (2004)' Aspartic acid nucleates the apatite crystallites of bone: a hypothesis.', Bone, 35(1), pp. 108-13. doi: 10.1016/j.bone.2004.02.020.
75. Sekhri, P. et al. (2018) 'Estimation of Trace Elements in Mixed Saliva of Caries Free and Caries Active Children', Journal of Clinical Pediatric Dentistry, 42(2), pp. 135-139. doi: 10.17796/1053-4628-42.2.9.
76. Sierpinska, T. et al. (2014) 'Copper deficit as a potential pathogenic factor of reduced bone mineral density and severe tooth wear', Osteoporosis International, 25(2), pp. 447-454. doi: 10.1007/s00198-013-2410-x.
77. Sogo, Y. et al. (2002) 'The most appropriate (Ca+Zn)/P molar ratio to minimize the zinc content of ZnTCP/HAP ceramic used in the promotion of bone formation.', Journal of biomedical materials research, 62(3), pp. 457-63. doi: 10.1002/jbm.10200.
78. Stanil, V. et al. (2010) 'Synthesis, characterization and antimicrobial activity of copper and zinc-doped hydroxyapatite nanopowders', Applied Surface Science, 256(20), pp. 6083-6089. doi: 10.1016/j.apsusc.2010.03.124.
79. Stephan, R. J. (1949) 'In vitro studies of the effects of some chemical substances on the growth of oral microorganisms and on their ability to dissolve tooth salts', J Dent Res, 28, p. 652.
80. Sterer, N. et al. (2008) 'Oral malodor reduction by a palatal mucoadhesive tablet containing herbal formulation', Journal of Dentistry, 36(7), pp. 535-539. doi: 10.1016/j.jdent.2008.04.001.
81. Suchanek, W.L. et al. (2004) 'Preparation of magnesium-substituted hydroxyapatite powders by the mechanochemical-hydrothermal method.', Biomaterials, 25(19), pp. 4647-57. doi: 10.1016/j.biomaterials.2003.12.008.
82. Teruel, J. de D. et al. (2015) 'Comparison of chemical composition of enamel and dentine in human, bovine, porcine and ovine teeth.', Archives of oral biology, 60(5), pp. 768-75. doi: 10.1016/j.archoralbio.2015.01.014.
83. Thian, E. S. et al. (2013) 'Zinc-substituted hydroxyapatite: a biomaterial with enhanced bioactivity and antibacterial properties', Journal of Materials Science: Materials in Medicine, 24(2), pp. 437-445. doi: 10.1007/s10856-012-4817-x.
84. Toledano, M. et al. (2012) 'Zinc-Inhibited MMP-Mediated Collagen Degradation after Different Dentine Demineralization Procedures', Caries Research, 46(3), pp. 201-207. doi: 10.1159/000337315.
85. Tschoppe, P. et al. (2011) 'Enamel and dentine remineralization by nano-hydroxyapatite toothpastes.', Journal of dentistry, 39(6), pp. 430-7. doi: 10.1016/j.jdent.2011.03.008.
86. Vallee,. L., Wacker, W. E. С.M. (1970) 'Metalloproteins', The Proteins. Edited by H.N. (ed). New-York: Academic Press, 2(5).
87. Vallee, B. L. and Falchuk, К. H. (1993) "The biochemical basis of zinc physiology.', Physiological reviews, 73(1), pp. 79-118. doi: 10.1152/physrev.l993.73.1.79.
88. Velard, F. et al. (2010) "The effect of zinc on hydroxyapatite-mediated activation of human polymorphonuclear neutrophils and bone implant-associated acute inflammation.', Biomaterials, 31(8), pp. 2001-9. doi: 10.1016/j.biomaterials.2009.11.066.
89. Vijayaprasad, К.E., Ravichandra, K.S., Vasa, A.A., Suzan, S. (2010) 'Relation of salivary calcium, phosphorus and alkaline phosphatase with the incidence of dental caries in children', J. Indian Soc. Pedod. Prev. Dent., 28(3), pp. 156-161.
90. Waer, S. M. (1997) "The Effect of Some Metal Ions on Volatile Sulfur-Containing Compounds Originating from the Oral Cavity', Acta Odontologica Scandinavica, 55(4), pp. 261-264. doi: 10.3109/00016359709115425.
91. Wallace, S.L., Ringsdorf, W.M. and Cheraskin, E. (1978) 'Zinc and oral wound healing.', Dental survey, 54(9), pp. 16-22. Available at: http://www.ncbi.nlm.nih.gov/pubmed/288705.
92. Watanabe, K. et al. (2011) 'Al and Fe levels in mixed saliva of children related to elution behavior from teeth and restorations', Journal of Trace Elements in Medicine and Biology, 25(3), pp. 143-148. doi: 10.1016/j.jtemb.2011.05.003.
93. Williamson, С.E., Yukna, R.A. and Gandor, D.W. (1984) 'Zinc Concentration in Normal and Healing Gingival Tissues in Beagle Dogs', Journal of Periodontology, 55(3), pp. 170-174. doi: 10.1902/jop.1984.55.3.170.
94. Young, A. and Jonski, G. (2011) 'Effect of a single brushing with two Zn-containing toothpastes on VSC in morning breath: a 12 h, randomized, double-blind, cross-over clinical study.', Journal of breath research, 5(4), p. 046012. doi: 10.1088/1752-7155/5/4/046012.
95. Zalchik, V. E., Bagirov, S. (1991) 'The chemical element content of mixed unstimulated saliva from a healthy subject', Stomatologiia, 70(1), pp. 14-17.

