Результат интеллектуальной деятельности: ЛИОФИЛИЗИРОВАННЫЙ БИОЛОГИЧЕСКИЙ БИОДЕГРАДИРУЕМЫЙ МИНЕРАЛИЗОВАННЫЙ КОСТНОПЛАСТИЧЕСКИЙ МАТЕРИАЛ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к биотехнологии, и может быть использовано для изготовления лиофилизированного биологического биодеградируемого минерализованного костнопластического материала на основе головок бедренной кости человека для применения в стоматологии, травматологии-ортопедии, онкологии, челюстно-лицевой хирургии для замещения дефектов костной ткани, в том числе в условиях инфекционного процесса, для пролонгированной локальной антибактериальной терапии, матрицы для импрегнации биологически активным веществом и/или заселения культурой клеток.
Постоянный рост количества высокотехнологичных травматолого-ортопедических операций ведет к увеличению количества больных с повторными операциями, что повышает потребность и создает острый дефицит в остеозамещающих материалах. Одним из наиболее широко применяемых для замещения костных дефектов является аллогенная кость, объемы которой весьма ограничены, и чаще всего для заготовки применяют трупную кость. При этом в ходе эндопротезирования тазобедренного сустава, одной из наиболее распространенных ортопедических операций во всем мире, выполняется удаление головки бедренной кости, как правило, с последующей ее утилизацией. Однако, головка бедренной кости представляет собой сферическое образование, состоящее из 25-50 см губчатой кости, что позволяет рассматривать ее для изготовления остеопластического биологического материала.
Процесс заготовки костного материала предполагает очистку нативной костной ткани до костного матрикса и последующую стерилизацию [Lomas R, Drummond О, Kearney JN. Processing of whole femoral head allografts: A method for improving clinical efficacy and safety. Cell Tissue Bank. 2000; 1 (3): 193-200. DOI: 10.1023/A:1026512312385. PMID: 15256945]. Известно, что на остеокондуктивные и остеокондуктивные свойства костного материала существенное влияние оказывают методики, применяемые для его очистки и стерилизации: химический состав растворов для экспозиции и промывания, характер физического воздействия, время и температура воздействия [Beebe KS, Benevenia J, Tuy BE, DePaula CA, Harten RD, Enneking WF. Effects of a new allograft processing procedure on graft healing in a canine model: a preliminary study. Clin Orthop Relat Res. 2009; 467 (1): 273-80. DOI: 10.1007/s 11999-008-0444-8. PMID: 18712453.]. Также показано, что наличие даже остаточных концентраций некоторых веществ, может приводить к воспалительным реакциям в окружающих тканях и инкапсуляции материала [Hernigou Р., Pariat J., Queinnec S., Homma Y., Flouzat Lachaniette C.H., Chevallier N., Rouard H. Supercharging irradiated allografts with mesenchymal stem cells improves acetabular bone grafting in revision arthroplasty. Int Orthop.2014 Sep; 38(9): 1913-21. DOI: 10.1007/s00264-014-2285-2. PMID: 24509980].
Различают минерализованные и деминерализованные костные трансплантаты, которые отличаются химическим составом отмытого костного матрикса, что определяет их жесткость и другие прочностные свойства, которые влияют на особенности применения этих материалов в клинической практике. Кроме того в последние годы все больше внимания уделяют приданию остеопластическим материалам дополнительных свойств, путем заселения костного матрикса культурой клеток, импрегнацией биологически-активными веществами [Yi Н., Rehman F., Zhao Ch., Liu В., He N. Recent advances in nano scaffolds for bone repair Bone Research 2016 (4), 16050; doi:10.1038/boneres.2016.50] или антибиотиками [Winkler H., Haiden P. Allograft Bone as Antibiotic Carrier. J. Bone Joint Infect. 2017; 2(1): 52-62. doi: 10.7150/jbji. 17466].
Проведенный патентный поиск позволил выявить группу методов получения костнопластических костных материалов, в которых основой очистки являются длительные экспозиции костной ткани в растворах агрессивных химических веществ большой концентрации: 6% раствор перекиси водорода и смесь этанола с хлороформом (Способ изготовления имплантов из губчатой костной ткани, Патент РФ №2172104), 10% раствор перекиси водорода (Способ получения костного трансплантата, Патент РФ №2223104; Способ изготовления аллотрансплантата вертлужной впадины, Патент РФ №2377959). Недостатками данных методов является длительное воздействие концентрированного раствора перекиси водорода, что приводит к разрушению костного коллагена и снижению прочностных и остеоиндуктивных свойств аллокости [DePaula СА, Truncale KG, Gertzman АА, Sunwoo МН, Dunn MG. Effects of hydrogen peroxide cleaning procedures on bone graft osteoinductivity and mechanical properties. Cell Tissue Bank. 2005; 6 (4): 287-98. DOI: 10.1007/s10561-005-3148-2. PMID: 16308768]. Кроме того, длительная экспозиция костной ткани в этанол-содержащих растворах также снижает остеоиндуктивный потенциал, а хлороформ, как токсическое вещество, запрещен к применению при заготовке тканей с 2012 года [Dock NL, Osborne JC, Brubaker SA. Standards for Tissue Banking. 13th ed. American Association of Tissue Banks: March 1, 2012. 349]. способные оказывать негативное влияние на свойства конечного продукта, в ряде случаев требующие специализированного оборудования.
К другой группе можно отнести методы, комбинирующие химическое и физическое воздействие для очистки и стерилизации остеопластических материалов.
Из предшествующего уровня техники известен способ (Способ удаления костного мозга из губчатых костных трансплантатов, Патент РФ №2166252), где применяют комбинацию обработки химическими веществами, отмывки проточной водой и воздействие 1 минуту низкочастотными ультразвуковыми колебаниями с частотой 24,5-28,5 кГц для удаления костного мозга из губчатых костных трансплантатов. В процессе отмывки предлагается использовать липосистемы, перекись водорода и спиртоэфирный раствор. Недостатком данного способа является применение для обезжиривания спиртоэфирного раствора, что требует тщательной последующей отмывки спиртом и дистиллированной водой, поскольку остатки спиртоэфирной смеси обладают провоспалительным и цитотоксическим действием, что может привести к нарушению ремоделирования костной ткани в области замещенного дефекта. Кроме того, данный способ не предлагает возможного метода стерилизации полученных материалов.
Известен способ (Fages J, et al. Viral inactivation of human bone tissue using supercritical fluid extraction. ASAIO J 1998,44:289-293) получения стерильного биологического костного матрикса, когда обезжиривание распиленных костей проводят методом сверхкритической флюидной экстракции при 50°С со скоростью потока СO2 - 2 кг/ч, давлением 250 бар в течение 10 минут на 1 г костной ткани. Для депротеинизации выполняют экспозицию костной ткани в 35% растворе перекиси водорода в течение 24 часов при 40°С; удаление остаточных липидов с замачиванием в течение 1 часа в 1 М растворе гидроксида натрия при 20°С, последующую нейтрализацию в водном растворе NaH2PO4 (12 г/л) в течение 30 минут. Далее авторы предлагают выполнить обработку костной ткани при 20°С в течение 3 часов 95% этанолом, затем в течение 2 часов - 100% этанолом, после чего полученный материал сушат на воздухе 12 часов при 40°С. Для стерилизации высушенные образцы упаковывают и обрабатывают гамма-облучением при 25 кГрей. Существенными недостатками данного способа являются использование высококонцентрированного раствора перикиси водорода и 100%) этанола, что вызывает денатурацию коллагена (Yang Н., Shu Z. The extraction of collagen protein from pigskin. Journal of Chemical and Pharmaceutical Research, 2014, 6(2):683-687). Кроме того, обычная сушка образцов костной ткани перед радиационной стерилизацией не позволяет уменьшить содержание воды в получаемых образцах. При этом известно [Nguyen Н, Morgan DA, Forwood MR. Sterilization of allograft bone: effects of gamma irradiation on allograft biology and biomechanics. Cell Tissue Bank. 2007; 8 (2): 93-105. DOI: 10.1007/s 10561-006-9020-1. PMID: 17063262.], что бактерицидное действие ионизирующего излучения обусловлено двумя основными механизмами - прямое разрушение ДНК клеток и опосредованное разрушение образующимися вследствие радиолиза молекул воды свободными радикалами, которые не только повреждают клетки бактерий и вирусов, но и матрикс костной ткани, что снижает механическую прочность и ухудшает последующий процесс ремоделирования костнопластического материала в организме реципиента.
Наиболее близким к заявляемому является способ получения биорезорбируемого биологического матрикса для замещения дефектов костной ткани (Биорезорбируемый биологический матрикс для замещения дефектов костной ткани и способ его плучения, Патент RU 2665962), который позволяет получить материал, обладающий повышенной остео- и биоинтеграцией, высокой биосовместимостью и отсутствием иммунореактивности со стороны реципиента. Однако наличие этапа деминерализации изменяет состав костного матрикса, делает его мягким, что ограничивает его использование, к примеру, при реконструктивных операциях, требующих замещения костей запястья, предплюсны, когда имплантируемый материал должен выдерживать определенную нагрузку. Кроме того, недостатками данного способа являются использование на стадии делипидирования токсических веществ - хлороформа и толуола.
Задачей настоящего изобретения является изготовление безопасного лиофилизированного биологического биодеградируемого минерализованного костнопластического материала на основе головок бедренной кости человека с отсутствием токсичности, хорошими показателями восстановления естественной структуры кости, биосовместимости с окружающими тканями и возможностью его использования в качестве матрицы для культуры ММСК.
Технический результат состоит в получении биологического биодеградируемого материала, обладающего хорошей механической прочностью за счет сохраненного минерализованного костного матрикса, высокой безопасностью в отношении угрозы заражения вирусными инфекциями, биосовместимостью с тканями человека и возможностями использования в качестве матрикса для импрегнации антимикробными и/или биологически активными веществами, обладающего хорошей способностью элюции импрегнированных растворов, а также в виде скаффолда для заселения культурами клеток человека с целью создания биоинженерных конструкций.
Сущность изобретения заключается в совокупности существенных признаков, а именно сбор и хранение головок бедренной кости от прижизненных доноров, прошедших контроль на инфицирование вирусными гепатитами В и С и ВИЧ, применение циклической очистки фрагментов кости от клеточных элементов, миелоидно-жирового костного мозга и растворимых белков до минерально-коллагенового матрикса основанной на комбинации физических факторов: покачивающих движений, ультразвуковой кавитации, орбитального вращения и центробежной силы без применения агрессивных химических веществ в условиях нагревания до температуры, не превышающей пороговую для деградации белков внеклеточного матрикса кости с возможной импрегнацией антибиотиком и/или биологически активным веществом, последующей лиофилизацией упаковкой, и стерилизацией.
Предлагаемый способ изготовления биологического биодеградируемого минерализованного костнопластического материала на основе головок бедренной кости человека состоит из последовательных этапов: 1. Сбор и хранение головок бедренной кости от прижизненных доноров, 2. Механическая очистка с фракционированием и первичной экспозицией, 3. Циклическая физико-химическая очистка фрагментированного материала, с дополнительной импрегнацией антибиотиком и/или биологически активным веществом, 4. Лиофилизация и упаковка, 5. Стерилизация.
1. Сбор и хранение головок бедренной кости от прижизненных доноров включает помещение в условиях операционной удаленной головки бедренной кости в трехслойную стерильную упаковку с обязательной маркировкой, позволяющей идентифицировать донора для последующего контроля результатов исследования его крови на вирусные гепатиты В, С и ВИЧ. При получении положительного результата любого исследования -головка бедренной кости подлежит утилизации. Промаркированная упаковка с донорской головкой бедренной кости помещается и хранится в условиях холодильной камеры при -80°С - -85°С с одним циклом замораживания.
2. Механическая очистка с макроскопической оценкой костной структуры и выбором фрагментов условно-здоровой губчатой кости, фракционированием и первичной экспозицией включает в себя разморозку нативных головок бедренной кости при комнатной температуре, механическую очистку кости от мягких тканей и хряща, визуальную оценку состояния головки и ее фракционирование.
В одном из вариантов на крошку с фракцией 0,5-10 мм.
В одном из вариантов на пластины толщиной 3-5 мм.
В одном из вариантов на блоки с длиной одной из сторон 5-20 мм.
В одном из вариантов головку распиливают на 2 половины.
Далее проводят экспозицию полученных фрагментов в 3% растворе перекиси водорода в течение 24-48 часов при комнатной температуре (соотношение ткани к раствору не менее 1:4) со сменой раствора через 24 часа.
3. Циклическая физико-химическая очистка фрагментированного материала от клеточных элементов, миелоидно-жирового костного мозга и растворимых белков до минерально-коллагенового матрикса заключается в отмывании полученных фрагментов в водяной шейкерной бане в течение 1 часа в дистиллированной воде, предварительно разогретой до 40-57°С, с последующим промыванием в течение 15 минут проточной водой под давлением и дальнейшим отмыванием, включающим комбинацию физических методов очистки в шейкерной бане, ультразвуковом кавитаторе, орбитальном шейкере при экспозиции в растворе гидрокарбоната натрия (цикл А), дистиллированной воде (цикл Б), 3% растворе перекиси водорода (цикл В), 70% этаноле (цикл Г):
- цикл А - промывание фрагментов материала водным 10% раствором гидрокарбоната натрия (соотношение материал:раствор не менее 1:2) для эмульгации жиров с параллельным воздействием различных физических факторов а) в водяной шейкерной бане 20 минут при температуре 40-57°С, с последующим промыванием проточной водой под давлением в течение 10-15 минут, далее б) экспозиция фрагментов в 10%) водном растворе гидрокарбоната натрия в ультразвуковом кавитаторе 10-20 минут при температуре 40-57°С с последующей промывкой проточной водой под давлением в течение 10-15 минут, далее в) экспозиция фрагментов в 10% водном растворе гидрокарбоната натрия в орбитальном шейкере 220 об/минуту в течение 10-20 минут с последующей промывкой проточной водой под давлением в течение 10-15 минут.
- цикл Б - промывание фрагментов материала дистиллированной водой (соотношение материал/раствор не менее 1/2) с параллельным воздействием различных физических факторов при условиях описанных выше в цикле А а), б), в), далее г) центрифугирование при 1850g 15 минут. Цикл Б повторяют до отсутствия видимого осадка после центрифугирования, но не менее 3-х раз. В среднем требуется 3-5 циклов, а зависимости от размера фрагментов материала.
- цикл В - промывание фрагментов материала 3% раствором перекиси водорода, предварительно разогретой до 40-57°С с параллельным воздействием различных физических факторов при условиях описанных выше в цикле А а), б), в) и однократной отмывкой дистиллированной водой при температуре 40-57°С в орбитальном шейкере 15 минут (соотношение материал: раствор не менее 1:2).
- цикл Г блоки промывают раствором этанола 70% при температуре 40-57°С с параллельным воздействием различных физических факторов при условиях описанных выше в цикле А а), б), в).
В заключение этапа материал 3-х кратно промывают дистиллированной водой при температуре 40-57°С в орбитальном шейкере по 15 минут (соотношение материал:раствор не менее 1:2). Блоки высушивают в течение 4-24 часов в термостате при температуре 45°С, после чего выполняют заморозку при температуре -80°С.
В одном из вариантов осуществления способа полученный на предыдущем этапе материал до лиофилизации может быть импрегнирован любым водорастворимым антибиотиком и/или биологически активным веществом, включая морфогенетические белки и другие факторы роста и дифференцировки клеток, причем раствор антибиотика и/или биологически активного вещества может быть приготовлен на основе дистиллированной воды, физиологического раствора, с добавлением природного полимера, в том числе коллагена или его производных, или желатина, или целлюлозы, или поливинилпирролидона, в одном из способов с добавлением раствора диметилсульфоксида. Раствор должен полностью покрывать импрегнируемый костный материал.
В одном из вариантов осуществления способа проводят экспозицию заготовленного материала в приготовленном растворе антибиотика и/или биологически активного вещества в орбитальном шейкере 160 об/минуту при температуре 20-37°С в течение 3-24 часов.
В одном из вариантов осуществления способа проводят экспозицию заготовленного материала в приготовленном растворе антибиотика и/или биологически активного вещества в ультразвуковом кавитаторе при температуре 20-37°С в течение 10-20 мин.
Далее материал извлекают из раствора, охлаждают в течение 1 часа до 4-6°С с последующей заморозкой 1 час в морозильной камере -18-25°С, затем при температуре -80°С не менее 1 часа.
4. Лиофилизация и упаковка проводится следующим образом: замороженный фрагментированный материал лиофилизируют 40 часов в сублимационной установке при отрицательном давлении с постепенным нагревом от -40°С до +40°С, нагреванием на +20°С каждые 8 часов, с достижением остаточной влажности 3-5%. Далее материал пакуют в двойную полиэтиленовую упаковку.
5. Конечную стерилизацию выполняют ионизирующим излучением - потоком быстрых электронов на радиационно-технологической установке с линейным ускорителем электронов УЭЛР-10-10-С2 дозой излучения 20±5 кГр.
Применение разных физических методов в совокупности обеспечивает разнонаправленное действие при отмывке минерально-коллагенового матрикса. Ультразвуковые колебания низкой частоты, воздействуя через жидкую среду на биосистемы, вызывают возникновение переменного звукового давления, акустических течений, микротоков, капиллярных волн, что ведет к разрыву к разрыву клеточных мембран, разрушению коллоидов, белковых комплексов и макромолекул. За счет того, что ультразвуковая волна способна распространятся на весь фрагмент ткани, разрушение происходит и в труднодоступных местах. Центрифугирование позволяет использовать эффект центробежной силу, что способствует отторжению органических компонентов минерально-коллагенового матрикса губчатого вещества кости и осаждению их на дне сосуда.
Водяная шейкерная баня за счет орбитального движения позволяет выполнять механическую очистку -вымывание фрагментов костно-жирового комплекса, частиц клеток, продуктов деградации белков, жиров в жидкую среду при нагревании 40-57°С при сохранении волокон костного коллагена, а продольные колебания шейкера с частотой 220 об/мин обеспечивают достаточное вымывание разрушенных органических компонентов клеток и содержимого костного мозга из межтрабекулярных пространств костного матрикса.
Для эмульгации жиров и деградации клеточных белков в технологическом процессе применяют 10% раствор гидрокарбоната натрия, 3% раствор перекиси водорода и 70% этиловый спирт, эффект которых усиливается за счет нагревания раствора до 40-57°С.
Импрегнация антибиотиком и/или биологически активным веществом позволяет придать материалу антимикробные свойства для применения его в условиях инфицированных дефектов костей и суставов в составе комплексной терапии и/или повысить его регенеративные свойства, за счет импрегнацией костного материала факторами роста и дифференцировки клеток. Для импрегнации полученного биологического биодеградируемого минерализованного костнопластического материала могут быть импользованы, к примеру, ванкомицин, гентамицин, тобрамицин, фосфомицин и любые другие водорастворимые антибиотики, устойчивые к ионизирующему излучению 20±5 кГр. Аналогичные характеристики требуются для биологически активных веществ.
Изготовленный данным способом аллогенный биологический биодеградируемый минерализованный материал может быть представлен в различных формах. Изготовление материала в виде крошки фракцией 0,5-10 мм позволяет применять его для импакционной пластики малых костных дефектов в стоматологии, челюстно-лицевой хирургии, онкологии, в виде пластин толщиной 3-5 мм - для импакционной пластики дефектов трубчатых костей в травматологии-ортопедии, онкологии, в виде блоков с одной из сторон 2-30 мм - для замещения дефектов при ортопедических операциях на кисти, стопе, в виде полусферы - для реконструктивных операциях на позвоночнике и голеностопном суставе. Помимо восстановления дефектов костной ткани материал также можно применять в качестве матрицы для импрегнации антибиотиком и/или биологически активным веществом или заселения культурой клеток. Длительная элюция антибиотика позволяет использовать материал для локальной антибактериальной терапии при замещении костных дефектов в условиях инфекции.
Изобретение позволяет получить биологический биодеградируемый минерализованный костнопластический материал на основе головок бедренной кости человека, который характеризуется высокой безопасностью, так как для его получения используют нативные головки бедренных костей от прижизненных доноров с отрицательными результатами исследования на вирусные гепатиты В и С, ВИЧ, неповрежденной минерализованной трехмерной структурой, очищенной от костно-жирового компонента кости, липидов, белков клеток, клеточного дебриса, хорошими показателями восстановления естественной структуры кости, биосовместимости с окружающими тканями, отсутствием цитотоксичности и возможностью его использования в качестве матрицы для импрегнации антибиотиком и/или биологически активным веществом или заселения культурой клеток.
На фигурах изображены:
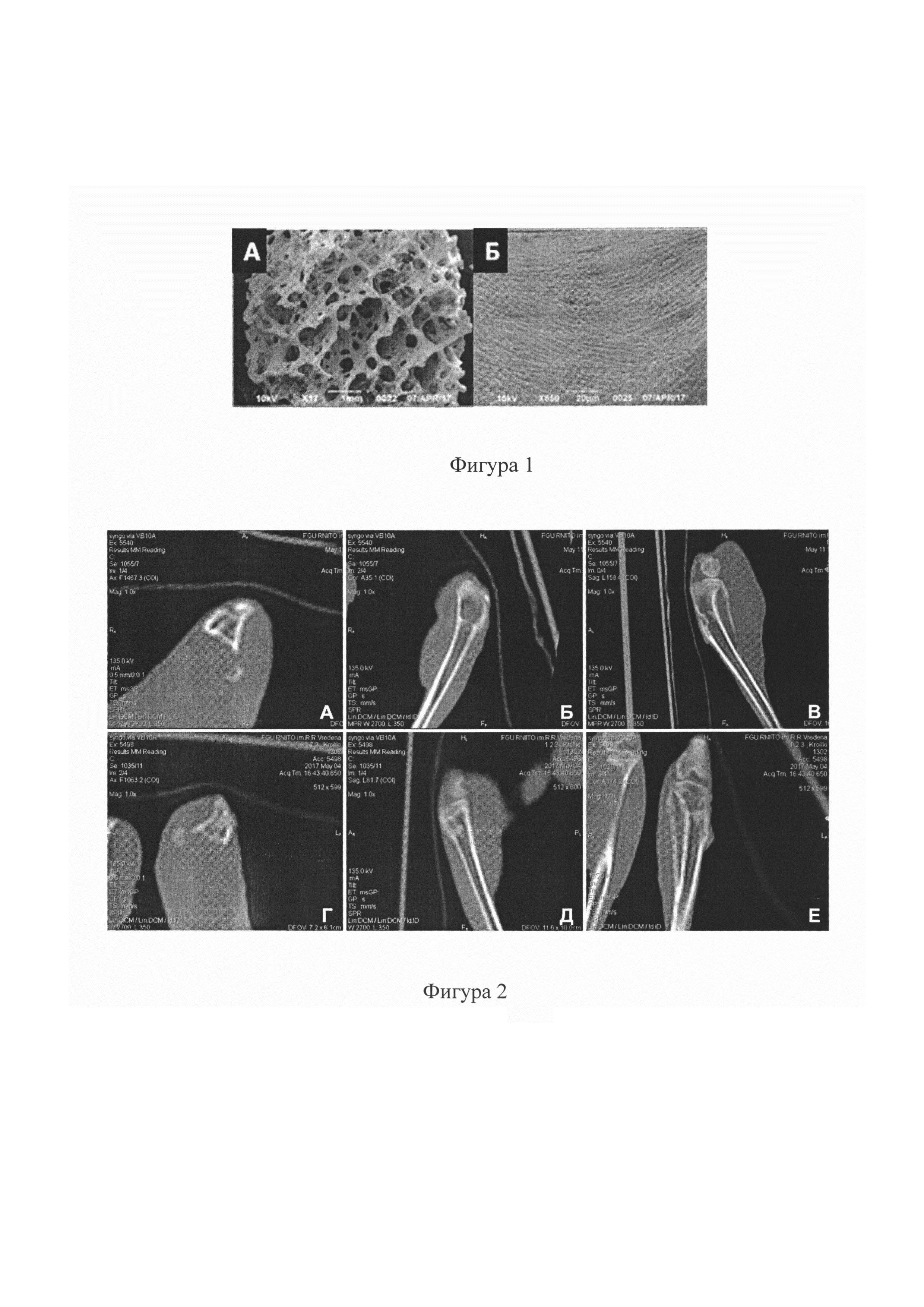
Фигура 1. Микрофотографии лиофилизированного биологического биодеградируемого минерализованного костнопластического материала, изготовленного заявляемым способом. СЭМ. Напыление золото-палладий. Контрольный штрих указан на рисунке. (А - общий вид блока с сохранением архитектоники губчатой кости и отсутствием инородных включений и клеточных элементов в межтрабекулярном пространстве, Б -визуализируется четкая направленность и плотность коллагеновых волокон костно-минерального матрикса).
Фигура 2. Результаты МСКТ проксимального отдела большеберцовой кости в области дефекта на 90-е сутки после замещения дефекта (А, Б, В - экспериментальная группа с замещением дефекта лиофилизированным биологическим биодеградируемым минерализованным костнопластическим материалом, изготовленным заявляемым способом; Г, Д, Е - контрольная группа с замещением дефекта остеопластическим материалом, заготовленным методом термической стерилизации).
Результаты оценки свойств полученного материала приведены для раскрытия характеристик настоящего изобретения, в связи с чем, их не следует рассматривать как ограничивающие объем изобретения.
Из головок бедренной кости был получен вышеуказанным способом материал в виде кубиков с размером стороны 5 мм.
Для определения влияния остаточных биологических компонентов костных трансплантатов на рост ММСК использовали модифицированную среду, которую получали путем инкубации костных кубов в стандартной культуральной среде DMEM без бычьей сыворотки. Определение жизнеспособности ММСК через 72 часа роста в модифицированной среде DMEM проводили методом МТТ. Обнаружили, что при культивировании ММСК в среде, модифицированной костными кубами после обработки гамма-излучением, степень снижения жизнеспособности клеток по сравнению с контролем была значимо ниже, чем после термической стерилизации в приборе Lobator-SD2 (Telos GmbH, Германия) и химической стерилизации (Патент РФ №2235462 Савельев ВИ, Губин АВ. Жидкая среда для низкотемпературной консервации биологических трансплантатов. Патент РФ №2235462. 2004): 1,02±0,02 (Р<0,1), 1,07±0,02 (Р<0,02) и 0,12±0,02(Р<0,0001), соответственно.
Для определения стерильности изготавливаемого материала после конечной стерилизации выполняли бактериологическое исследование полученных образцов с инкубацией в жидких питательных средах. Не менее 3 образцов из 5 партий. Роста микроорганизмов ни в одном из образцов получено не было.
Далее проводили оценку жизнеспособности ММСК (цитотоксичность), после их заселения в костные блоки. В каждый блок засевали 250000 клеток в стандартной культуральной среде DMEM с 15% бычьей сыворотки и инкубировали в течение 3 и 7 дней. Результаты теста МТТ показали сравнимый уровень жизнеспособности клеток в исследуемых блоках после термической стерилизации в приборе Lobator-SD2 (Telos GmbH, Германия) и при изготовлении образцов заявляемым способом: 0,352±0,022 и 0,363±0,116 через 3 дня, 0,601±0,116 и 0,497±0,207 через 7 дней, соответственно.
Кроме этого, качество очистки определяли визуально при оценке фотоизображений минерально-коллагенового матрикса губчатого вещества полученных образцов материалов, выполненных с помощью сканирующей электронной микроскопии (СЭМ) на разных увеличениях кратности 14 до 650 (Фигура 1). Данные фотоизображений СЭМ, подтверждают отсутствие инородных включений в межтрабекулярном пространстве, соответствие трехмерной микроархитектуры нормальному строению губчатого вещества костной ткани, сохранение плотного расположения пучков коллагена.
Для исследования длительности антимикробной активности при импрегнации изготовленного предлагаемым способом материала ванкомицином, готовили чипсы минерально-коллагенового костного матрикса из пластин губчатого вещества головок бедренных костей толщиной 3 мм. После выполнения циклической физико-химической очистки фрагментированного материала от клеточных элементов, миелоидно-жирового костного мозга и растворимых белков до минерально-коллагенового матрикса, полученные пластины помещали в контейнеры и заливали приготовленным раствором ванкомицина в 0,9% растворе NaCl в концентрации 100 мг/мл до полного покрытия материала. Выполняли экспозицию материала в орбитальном шейкере 24 часа при частоте колебаний 160 в мин и температуре 37.0°С. Далее материал извлекали из раствора, охлаждали 1 час до 4-6°С с последующей заморозкой 1 час в морозильной камере -18 - -25°С, затем при температуре -80°С не менее 1 часа, с последующей лиофилизацией и стерилизацией в условиях описанных выше. Из готового импрегнированного ванкомицином костнопластического материала готовили 3 насвески 1,32±0,18 г, которые помещали в бакпечатки, заливали 15 мл 0,9% раствора NaCl, инкубировали в орбитальном шейкере, 24 часа с частотой колебаний 120/мин при температуре 37,0 С.Через сутки инкубационный раствор удаляли и заливали свежий раствор, а в инкубационном определяли концентрацию ванкомицина методом ВЭЖХ. Процедуру повторяли ежедневно до определения концентрации ванкомицина менее 4 мкг/мл (минимальная подавляющая концентрация ванкомицина для большинства штаммов стафилококков). Эксперимент продемонстрировал, что 1,32±0,18 грамм костнопластического материала, полученный предлагаемым способом, поддерживал при ежедневном 15-кратном разведении эффективную концентрацию ванкомицина до 10 суток, включительно, при этом в 1-е сутки концентрация ванкомицина в инкубационном растворе составила 23 353,6±168,3 мкг/мл, на 10-е сутки 5,76±1,12 мкг/мл
Исследование био совместимости с окружающими тканями, возможности резорбции, остеоинтеграции и ремоделирования образцов материала, полученных предлагаемым способом, было выполнено в эксперименте in vivo. Содержание и использование лабораторных животных выполняли в соответствии с Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных целей (counici of European communities derective 86/609/ESS, Страсбург 1986) и требованиями «ИСО 10993-2».
Эксперимент in vivo выполнен на 24 кроликах породы Шиншилла с формированием стандартизированного полостного дефекта в зоне проксимального метаэпифиза большеберцовой кости и последующим замещением дефекта. В условиях стерильной операционной под внутривенным наркозом животному после обработки операционного поля раствором йода и кожного разреза производили доступ к большеберцовой кости. При помощи стоматологического бора выполняли трепанацию большеберцовой кости с отверстием округлой формы диаметром 6-8 мм. Далее формировали полостной дефект костным булавовидным бором диаметром 8 мм глубиной до эндоста противоположной стороны кортикальной стенки (до 10-12 мм) Животным экспериментальной группа (n=12) дефект заполняли костной крошкой из материала, полученного предлагаемым способом, животным контрольной группы (n=12) остеопластическим материалом из головки бедренной кости, заготовленным без применения каких-либо химических веществ методом термической стерилизации в приборе Lobator-SD2 (Telos GmbH, Германия). Всем животным выполняли мультисканирующую компьютерную томографию на 7, 21, 45 и 90 сутки после оперативного вмешательства. Гистоморфологические исследования выполняли в обеих группах на 7, 21, 45 и 90 сутки наблюдения, окраску препаратов проводили гематоксилином и эозином, и методом Маллори.
У животных контрольной группы гистологически установлены признаки воспалительной реакции в области замещенного дефекта, вплоть до инкапсуляции, которая сопровождала весь процесс костного ремоделирования и протекала до 90 суток эксперимента, что не было отмечено в экспериментальной группе. Формирование зрелой костной ткани отмечено на 21 сутки в контрольной и на 45-е сутки в экспериментальной группах. Явления эндостального и десмального остеогенеза в экспериментальной группе животных, свидетельствуют о наличии остеоиндуктивного потенциала у материала, полученного заявляемым способом. В контрольной группе формирование регенерата происходило преимущественно за счет эндостального костеобразования. Резорбция экспериментального материала зафиксирована на 21 сутки, резорбции материала второй группы - к 45 суткам. На 90-е сутки наблюдения в обеих группах отмечалось восстановление кости как органа с наличием костного мозга в костно-мозговом канале. По данным МСКТ, участки просветления в зоне дефекта были отмечены в экспериментальной группе на 21-е сутки, в группе контроля - на 45-е, при этом на снимках контрольной группы участки просветления были расположены неравномерно, формировалась зона отграничения материала по периметру. К 90 суткам в экспериментальной группе наступало ремоделирование имплантированного материала, в контрольной - определялась неполная резорбция материала (фигура 2).
Выполненный заявителями поиск существующих способов, включал анализ патентов, источников научной литературы, содержащих информацию о существующих способах, аналогичных заявленному. Способы, описанные выше в качестве примеров патентов других авторов, содержат отдельные технические решения, наиболее близкий «аналог- прототип» предполагает деминерализацию получаемого материала, кроме того в этап отмывки костной ткани основан на химической обработке с применением токсических веществ - хлороформа и толуола. Заявляемый способ позволяет изготовить безопасный биологический биодеградируемый минерализованный костнопластический материал на основе головок бедренной кости человека, полученных от прижизненных доноров, прошедших контроль на инфицирование вирусными гепатитами В и С и ВИЧ, путем применения циклической очистки фрагментов кости от клеточных элементов, миелоидно-жирового костного мозга и растворимых белков до минерально-коллагенового матрикса, основанной на комбинации физических факторов: ультразвуковой кавитации, орбитального вращения, покачивающих движений и центробежной силы без применения агрессивных химических веществ в условиях нагревания до температуры, не превышающей пороговую для деградации белков внеклеточного матрикса кости, с возможностью импрегнации антибиотиком и/или биологически активным последующей лиофилизацией, упаковкой, и стерилизацией потоком быстрых электронов. Следовательно, заявляемый способ соответствует критерию «новизна».
Таким образом, как видно из приведенных выше результатов исследований, биологический биодеградируемый минерализованный костнопластический материал на основе головок бедренной кости человека, изготовленный заявляемым способом подтвердил свою стерильность, безопасность, отсутствием токсичности, хорошие показатели восстановления естественной структуры кости, биосовместимости с окружающими тканями и возможностью его использования в качестве матрицы для культуры ММСК в серии экспериментов in vivo и in vitro, а также длительной, не менее 10 суток, элюцией импрегнированного вещества. Эти достоинства позволяют использовать данный способ для изготовления нового безопасного биологического биодеградируемого минерализованного костнопластического материала.