Результат интеллектуальной деятельности: Способ диагностики лейкоза крупного рогатого скота с использованием ПЦР в режиме реального времени
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, молекулярной биологии, молекулярно-генетической диагностики и ветеринарной медицины и может найти применение, как в ранней диагностике инфекционных заболеваний животных, так и в научных исследованиях для обнаружения и типирования вируса лейкоза крупного рогатого скота методом полимеразной цепной реакции в режиме «реального времени».
Лейкоз - хроническое заболевание опухолевой природы, этиологическим агентом которого является вирус лейкоза крупного рогатого скота (ВЛКРС), Болезнь широко распространен в мировом масштабе и представляет серьезную угрозу скотоводческой отрасли разных стран, создает потенциальную опасность для генофонда племенного молочного скота и при отсутствии планомерной борьбы имеет тенденцию к распространению. Заболевание свойственно всем видам животных, но для крупного рогатого скота (КРС) имеет особо важное значение.
Установлена высокая степень сходства вируса лейкоза крупного рогатого скота (ВЛКРС) с вирусом Т - клеточного лейкоза человека (HTLV-1, HumanT- cell leukemia virus), который имеет с ним близкое морфологическое и эволюционное родство, относится также к семейству Retroviridae, что свидетельствует об их общем пути в процессе эволюции
Проблема, требует неотложного решения, в связи с вступлением России во Всемирную Торговую организацию и необходимостью соблюдения требований Технического регламента на молоко (Федеральный закон от 12.06.2008 №88-ФЗ «Технический регламент на молоко и молочную продукцию»), согласно которому «Сырое молоко должно быть получено от здоровых сельскохозяйственных животных на территории, благополучной в отношении инфекционных и других общих для человека и животных заболеваний».
Поэтому разработка эффективных способов профилактики и борьбы с лейкозом крупного рогатого скота является одной из важнейших задач не только ветеринарной медицины, животноводства, но и биологии, и экологии в целом, имеющих непосредственное отношение к безопасности здоровья человека.
Особенно актуальным стал поиск высокочувствительных методов для ранней диагностики по выявлению вируса лейкоза крупного рогатого скота не только в крови взрослых животных, но и в крови телят до 6-ти месячного возраста, а также в сборном молоке коров, что позволит ускорить сроки оздоровления хозяйств от лейкоза.
Впервые достоверно описана морфология вируса лейкоза крупного рогатого скота (ВЛКРС) в 1969 году Miller и соавт. в ультратонких срезах, стимулированных фитогемагглютинином культур лимфоцитов от коров с лимфосаркомой (Miller и др., 1976). В нашей стране ВЛКРС был выделен из первично трипсинизированной культуры клеток лимфатического узла больной лейкозом коровы в 1973 г. в Институте вирусологии им. Д.И. Ивановского РАМН (Жданов и соавт.), в Институте микробиологии им. Кирхенштейна, АН Латвии (Кукайн и соавт.), во Всероссийском институте экспериментальной ветеринарии РАСХН (Валихов и соавт., 1992).
Зрелые вирионы ВЛКРС состоят из центрально расположенного электронно-плотного нуклеотида, диаметр которого варьирует от 40 до 90 нм и наружной оболочки. Между оболочкой и нуклеотидом имеется электронно-прозрачная зона. Внешняя вирусная оболочка отличается лабильностью, и диаметр вириона колеблется от 73 до 120 нм. На поверхности мембраны регистрируют шишкообразные выступы длиной 10-12 нм.
BLV имеет следующую генетическую структуру: s-LTR-gag-pol-env-pXbl-LTR-3. LTR состоит из 530 пар оснований. Донорный сайт сплайсинга находится в R-участке. За LTR идет лидерная последовательность в 97 пар. Первую открытую рамку считывания составляет ген gag (нуклеотиды 628-1806). Данный ген кодирует трансляцию группоспецифического белка - предшественника структурных белков, в частности р24. Через 500 пар после концевого триплета gag начинается вторая рамка считывания для pol, кодирующая 852 аминокислоты (позиции 2317-4875). Ген pol кодирует полипептиды, обладающие ревертазной (РНК-зависимой ДНК-полимеразной) активностью. Возможно, что этот же ген кодирует эндонуклеазу. Третью рамку составляет ген env (позиции 4821-6368) и кодирует 515 аминокислот, составляющих поверхностный гликопротеид gp51 и трансмембранный белок gp30, которые непосредственно участвуют в инфицировании клетки и вызывают сильный иммунный ответ у инфицированных животных (Валихов, 1993).
Согласно современной классификации Международного комитета по номенклатуре и токсаномии вирус лейкоза крупного рогатого скота (ВЛКРС) относится к роду Deltaretrovirus семейства Retroviridae, в который наряду с ним входят Т-лимфотропные вирусы человека и обезьян - humanT-cellleukemia/lumphotropicvirusesIandII (HTLV-I и II), simianT-cellleukemia/lumphotropicvirusesIandII (STVL-I и II) (Van Regenmortel M.H.V. etal.,2000, Орлянкин с соавт., 2000).
Возникновение и развитие лейкозного процесса связано с внедрением в организм вируса лейкоза крупного рогатого скота. Внедрение вируса вызывает ответную реакцию организма, которую устанавливают выявлением в сыворотке крови животных антител к антигену ВЛКРС. На этой стадии абсолютное большинство животных пожизненно остается в состоянии бессимптомного вирусоносительства. У отдельных, чаще всего взрослых животных, несущих у 0,4-2,5% коров с гематологическими проявлениями болезни.
Основой противоэпизоотических мероприятий при инфекционных болезнях животных, в том числе при лейкозе крупного рогатого скота, является прижизненная диагностика заболевания. Эффективность ее определяется специфичностью, чувствительностью, воспроизводимостью результатов, а также легкостью технического выполнения или технологичностью и низкой стоимостью.
В настоящее время диагностика лейкоза крупного рогатого скота возможна с использованием многочисленных иммунологических, иммунохимических, биофизических, радиометрических методов, однако, в силу целого ряда объективных и субъективных причин, они не нашли широкого применения в ветеринарной практике.
В настоящее время основными методами диагностики лейкоза остаются клинический, серологический реакция иммунодиффузии (РИД) и иммуноферментный анализ (ИФА); и гематологический методы и патоморфологические методы служат для уточнения диагноза. Они утверждены Департаментом ветеринарии Минсельхозпрода РФ и являются обязательными при диагностике лейкоза крупного рогатого скота.
Однако в силу особенностей инфекционного процесса плановые методы диагностики, неприменимы для ранней диагностики, поскольку ориентированы на выявление иммунного ответа организма (не ранее 5-6-месячного возраста телят). В связи с этим, наиболее современный метод - молекулярно-генетическая диагностика, в частности ПЦР-анализ, за счет обнаружения ДНК самого вируса применим даже для новорожденных телят и, кроме того, обладает значительно большей точностью по сравнению с серологическими методами. Это объясняет ежегодно растущий интерес, как со стороны самих хозяйств, так и надзорных органов именно к этому виду диагностики.
ПЦР (полимеразная цепная реакция) - селективная амплификация (фактически, клонирование) некоего фрагмента ДНК in vitro. Особенность ПЦР состоит в том, что амплификации подвергается область, находящаяся между участками отжига праймеров, первичная структура которых должна быть известна (или задана) заранее.
Необходимо изменить отношение к оценке значимости результатов серологических исследований. В настоящее время диагноз инфицирования вирусом лейкоза крупного рогатого скота устанавливают на основании выявления в реакции иммунодиффузии (РИД) антител к этому вирусу в сыворотке крови. Выявление инфицированных животных должно быть сигналом для проведения противолейкозных мероприятий даже при отсутствии клинических и гематологических признаков болезни. Несвоевременное удаление инфицированных ВЛКРС животных приводит к еще большему распространению инфекции, развитию заболевания у значительной части животных и увеличению доли молодняка, инфицированного внутриутробно. Это значительно затрудняет проведение оздоровительных мероприятий. Раннее выявление инфицированности имеет очень большое значение. В связи с этим, одной из проблем в профилактике лейкоза крупного рогатого скота является поиск более чувствительных методов диагностики инфекции, индуцированной ВЛКРС, таких как метод иммуноферментного анализа (ИФА) и полимеразной цепной реакции (ПЦР) (Гулюкин и др., 2003).
Это обусловливает необходимость использования методов молекулярной биологии, таких, как полимеразная цепная реакция (ПЦР), главным достоинством которой является специфичность, чувствительность. Кроме этого, мультиплексный вариант ПЦР является быстрым методом для выявления нескольких возбудителей водной реакции.
Определение нуклеотидной последовательности амплифицированного в ПЦР участка вирусного генома и последующий анализ полученных данных подтверждает специфичность реакции и позволяет идентифицировать и дифференцировать штаммы и изоляты вирусов. Однако метод выявления и дифференциации вирусов этой группы не был разработан в Российской Федерации.
Известен способ диагностики лейкоза крупного рогатого скота методом полимеразной цепной реакции (ПЦР), заключающийся в использовании прямого и обратного олигонуклеотидных праймеров для выявления фрагмента гена pol провируса лейкоза крупного рогатого скота с электрофоретическим определением размера фрагмента нуклеотидной последовательности. В качестве праймеров используют однонуклеотиды следующей структуры:
PF2: 5'-TGAACGGACAAATGGACTGCTC-3';
PR2: 5'-CCGACAGAGAGCGAGGAGAG-3'.
При постановке ПЦР этим способом размер продукта амплификации составляет 438 пар нуклеотидов (п.н.). Однако данный способ требует проведения дополнительной стадии электрофоретической детекции, что повышает длительность анализа и вероятность возникновения контаминации (патент RU №2445370 С1, опубл. 20.03.12 г. Бюл. №8).
Известен способ дифференциации варианта tax гена вируса лейкоза крупного рогатого скота, заключающийся в проведении ПЦР с использованием праймеров, способных выявить полную последовательность tax гена ВЛКРС с целью дальнейшего выявления мутаций в кодируемых этим геном аминокислотных последовательностях и определения вариантов tax гена ВЛКРС. В частности, используются следующие праймеры:
Tax AG ТСТ AGA GCT GAC GTC ТСТ GTC TG 3
Tax АСС TCG AGA TGG САА GTG TTG TTG GTT GG 3
(способ диагностики лейкоза крупного рогатого скота методом полимеразной цепной реакции, патент №2445370 [1]).
Известен также способ выявления ДНК провируса лейкоза КРС методами ПЦР в режиме реального времени (RT-PCR) и «гнездовой» ПЦР (nested-PCR). Предлагаемые праймеры, комплементарные области гена pol имеют следующую структуру:
Pol (outer, sense) 5-ATGTTATCAAGCCCTGGCTGC-3
Pol ( outer, antisense) 5-CTTGGTTGTCAGTCAAGG-3
Pol (nested, sense) 5-CTACCTTGCAGATCTCATC-3
Pol (nested, antisense) 5-GCTTGTCGAAGCTCTGCAATGC-3
Для использования метода ПЦР в режиме реального времени необходимо вместе с праймерами - Pol (nested, sense) 5 - CTACCTTGCAGATCTCATC-3 и Pol (nested, antisense) 5 - GCTTGTCGAAGCTCTGCAATGC-3 добавлять в реакционную смесь дополнительно синтезированный зонд - Pol (molecularbeacon) 5 (FAM)-CGAGCACACCCACTACCCGCCGGCCGCTCG-dabcyl-3 с флюоресцентной меткой, благодаря чему и происходит детекция сигнала флюоресценции при применении данного метода. Объем реакционной смеси составляет 100 мкл (способ диагностики лейкоза крупного рогатого скота методом полимеразной цепной реакции, патент №2445370)
Метод «гнездовой» ПЦР (nested-PCR) подразумевает использование двух пар праймеров (всего четыре праймера) - outer (I раунд) и nested (II раунд). Объем реакционной смеси составляет 50 мкл.
При постановке ПЦР обоими методами размер продукта на выходе составляет 202 п.н. (способ диагностики лейкоза крупного рогатого скота методом полимеразной цепной реакции, патент №2445370).
Известные способы выявления ДНК провируса ВЛКРС: в аналоге не обеспечивали детекцию участка консервативного гена pol провируса ВЛКРС; в прототипе при использовании метода ПЦР в режиме реального времени дополнительно необходим зонд с флюоресцентной меткой, а при использовании метода «гнездовой» ПЦР необходима вторая пара праймеров для обнаружения искомого участка.
Существует способ обнаружения провируса лейкоза крупного рогатого скота, основанный на выявлении фрагмента LTR (Long Terminal Repeat) - последовательности провируса лейкоза (патент RU №2558252 С2, опубл. 27.07.15 г. бюл. №21). Определение размера амплифицированного фрагмента нуклеотидной последовательности осуществляется путем электрофоретического разделения в агарозном геле. В качестве праймеров используются олигонуклеотиды: BL1.F 5-GAGTTAGCGGCACCAGAAGC-3 и BL1.R 5-ATAGAGCTCGCGGTGGTCTC-3. Продукт синтеза составляет 175 пар нуклеотидов. Данный способ требует проведения дополнительной стадии электрофоретической детекции, что повышает длительность анализа и вероятность возникновения контаминации
Известен способ экспресс-диагностики лейкоза крупного рогатого скота методомполимеразной цепной реакции в режиме реального времени, включающий использование прямого и обратного олигонуклеотидного праймера, с добавлением в реакционную смесь олигонуклеотидного зонда с флуоресцентной меткой для выявления фрагментагена р24 провируса лейкоза крупного рогатого скота следующей структуры:
PF - 5'-GGCACCGGGTTCGCAAGTAT-3';
PR - 5'-CGGTTAGGCTGGTCATGTGGCC-3';
зонд RTp24 - AAACACTACGACTTGCAATCTTACAGGCCGAC, меченный с 5'-концафлуоресцентным красителем ROX и с 3'-конца гасителем RTQ2. Размер ампликона - 140 п.н., обнаруживается за счет детекции сигнала флуоресценции (патент RU 2644233 С2, опубл. 08.02.2018, бюл. №4).
Все вышеперечисленные способы ориентированы на выявление ДНК образованного в клетке провируса, но они не фланкируют область env-гена, ассоциированного с проявлением атипичных форм лейкоза. Кроме того, эти методы не позволяют определить генотип выявленного ВЛКРС.
Техническим результатом, на достижение которого направлено данное изобретение, является достоверный, высокочувствительный и высокоспецифичный способ выявления фрагмента env-гена провирусной ДНК ВЛКРС в биологическом материале в короткие сроки.
Технической задачей изобретения является разработка высокоспецифичного и чувствительного способа диагностики ДНК провируса лейкоза крупного рогатого скота на ранней стадии заболевания методом ПЦР с детекцией в режиме реального времени (ПЦР-РВ).
Технический результат изобретения заключается в формировании реакционных смесей для проведения ПЦР-РВ в целях дифференциации на основе SNP-типирования 3 генетических вариантов ВЛКРС, циркулирующих на территории Ставропольского края.
Для постановки реакции используется пара специфичных праймеров, комплиментарных областям, фланкирующим консервативный участок гена env (гена белка оболочки gp51), и 3 флуоресцентно-меченых олигонуклеотидных зонда, специфичных к аллелям ДНК разных генотипов вируса лейкоза (условно обозначены как G1, G2 и G3), имеющих следующий нуклеотидный состав (5'-3'-):
Прямой праймер - CCTTCCCAGACTGTGCTATATG;
Обратный праймер - TCCAGAGCTGGAGATGGT;
Специфичная часть зонда G1 - TCCCTGGGCTCCCGAAATACTAGT;
Специфичная часть зонда G2 - TCCCTGGGCTCCCGAAATATTAGT;
Специфичная часть зонда G3 -TCCCTGGGCTCCCGAGATATTAGT.
Температура отжига прямого и обратного праймера составляет 62,0°С, зондов -68°С, GC-состав - 50%, 55,6% и 54%, 50% и 54% соответственно, праймеры фланкируют консервативный фрагмент гена gp51 ВЛКРС, самокомплиментарные участки внутри каждого праймера и между прямым и обратным отсутствуют.
Характеристика разработанных праймеров и зондов приведена в таблице 1.
Разработка способа диагностики вируса лейкоза крупного рогатого скота осуществлялась следующим образом.
На основании литературных данных и проведенного генотипирования 29 изолятов вируса лейкоза крупного рогатого скота, выделенных из цельной крови серопозитивных коров черно-пестрой голштинизированной и красной степной пород в возрасте старше 4 лет из животноводческих хозяйств 4 районов Ставропольского края, методом секвенирования участка гена env провируса ВЛКРС длиной 444 п.н., были выявлены 3 генетических варианта ВЛКРС, циркулирующих на данной территории.
Биоинформационный анализ нуклеотидных последовательностей участков гена env изолятов ВЛКРС позволил выявить комплекс однонуклеотидных полиморфизмов (SNP) в вариабельной области гена env, позволяющий дифференцировать каждый из трех генетических вариантов, которые, впоследствии, были использованы в качестве мишени при конструировании ПЦР тест-системы для обнаружения ВЛКРС.
Выбор пар праймеров и зондов, а также проверка их качества и термодинамический анализ осуществляли с помощью компьютерной программы Vector NTI 11 (Invitrogen, США). Праймеры проверяли на отсутствие гомологии с последовательностями других вирусов и генома человека программой BLAST с помощью web-pecypca Национального центра биотехнологической информации (NCBI) (http://blast.ncbi.nlm.nih.gov/). Оценка специфичности сконструированных праймеров подтвердила гомологичность выбранной пары праймеров с нуклеотидной последовательностью гена env и отсутствие значимой гомологии с нуклеотидными последовательностями других видов вирусов.
Дизайн каждого из отобранных праймеров и зондов осуществлен в полном соответствии с требованиями, предъявляемыми к олигонуклеотидам:
 степень гомологии праймеров и комплиментарность выбранной области;
степень гомологии праймеров и комплиментарность выбранной области;
 отсутствие самокоплементарных участков внутри праймеров и комплементарности
отсутствие самокоплементарных участков внутри праймеров и комплементарности
друг другу. Необходимо, чтобы не образовывались вторичные структуры праймера, «димеры», которые впоследствии блокируют реакцию или приводят к появлению неспецифической амплификации;
 близость значений температуры плавления праймеров (разница 3-5°С). Это ключевой параметр. Завышение температуры отжига приводит к отсутствию синтеза ампликона и, как следствие - ложноотрицательному результату ПЦР, а занижение - увеличивает вероятность появления неспецифических продуктов, усложняет анализ результатов ПЦР и ведет к интерпретации их как ложноположительных.
близость значений температуры плавления праймеров (разница 3-5°С). Это ключевой параметр. Завышение температуры отжига приводит к отсутствию синтеза ампликона и, как следствие - ложноотрицательному результату ПЦР, а занижение - увеличивает вероятность появления неспецифических продуктов, усложняет анализ результатов ПЦР и ведет к интерпретации их как ложноположительных.
Праймеры и зонды были синтезированы на автоматических ДНК-синтезаторах в коммерческом сервисном центре и очищены с помощью полиакриламидного геля (ПААГ) и высокоэффективной жидкостной хроматографии (ВЭЖХ) (чистота продукта 98%).
Состав реакционной смеси (табл. 2) подобран таким образом, чтобы концентрация ионов MgCl2 обеспечивала оптимальную скорость и точность работы фермента Taq-полимеразы, а концентрация дНТФ, праймеров, зондов и объем пробы способствовали повышению специфичности реакции.
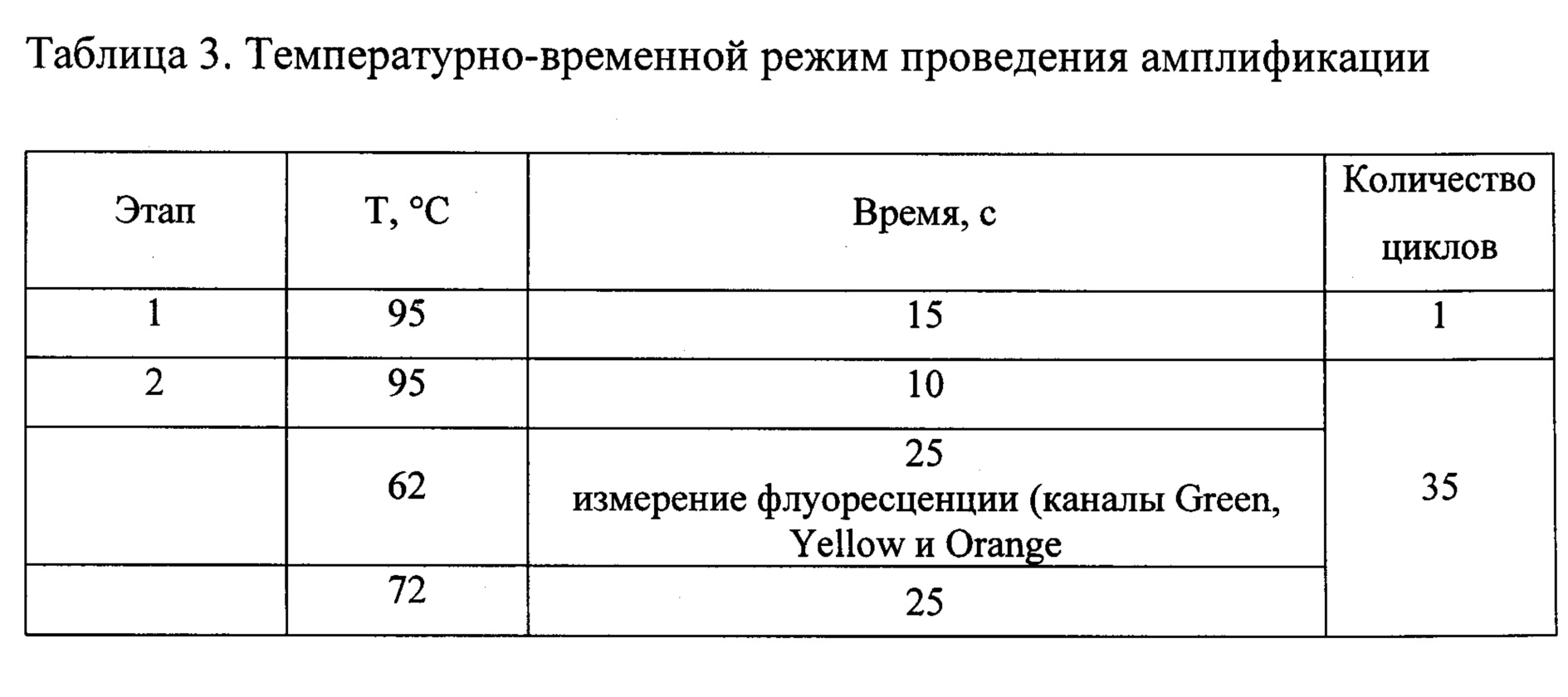
Амплификацию проводили в объеме реакционной смеси 25 мкл в соответствии с температурно-временным режимом реакции, отраженным в таблице 3.
ПЦР проводили на термоциклере Rotor-Gene Q (Qiagen, Германия).
Учет результатов ПЦР для SNP-типирования проводили на основании регистрации флуоресцентных сигналов по каналам Green, Yellow и Orange и по наличию (или отсутствию) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» в соответствующей графе в таблице результатов).
Пример 1. Проверка эффективности способа диагностики ВЛКРС.
Клиническим материалом служили образцы периферической крови крупного рогатого скота из неблагополучного по лейкозу хозяйства, положительно реагирующих в реакции иммунодиффузии (Правила по профилактике и борьбе с лейкозом крупного рогатого скота, утвержденные приказом Минсельхозпрода РФ от 11 мая 1999 г. №359) в количестве 30 проб.
Принцип интерпретации результатов следующий: образец считается принадлежащим к генотипу G1, если в таблице результатов по каналу для флуорофора Green определено значение порогового цикла Ct, не превышающее граничное значение (пороговое значение Ct для положительных проб по каналу FAM/Green брали не более 40). При этом кривая флуоресценции пересекает пороговую линию на участке характерного экспоненциального подъема флуоресценции. Образец не относится к генотипу G1, если для данной пробы в таблице результатов по каналу не определено значение порогового цикла Ct.
Аналогично по каналу Yellow интерпретируется принадлежность к генотипу G2, а по каналу Orange - G3 (пороговое значение Ct для положительных проб не более 30 и 40 соответственно).
Анализ проб показал в 22 случаях из 30 наличие принадлежность к генотипу G3, 5 случаях - G1, в 3 случаях - G2, отрицательный результат в отрицательных контролях выделения и амплификации. В связи с этим, результаты испытаний считали достоверными.
Техническим результатом заявленного изобретения является достоверный, высокочувствительный и высокоспецифичный способ генотипирования фрагмента ДНК провируса лейкоза крупного рогатого скота в биологическом материале на ранней стадии заболевания. При этом компьютерный анализ показал отсутствие реакции на гомологичные и гетерологичные организмы.
Предложенный способ апробирован с положительными результатами и регулярной воспроизводимостью этих результатов в 2018 году на 90 пробах ДНК, выделенных из периферической крови крупного рогатого скота 3 хозяйств Ставропольского края. Работу проводили на базе ГБУ СК «Ставропольская краевая ветеринарная лаборатория» (г. Светлоград).
Предлагаемый способ может быть использован как в диагностике, так и в научных исследованиях для обнаружения и типирования ДНК провируса лейкоза у крупного рогатого скота методом полимеразной цепной реакции в режиме реального времени.
Сущность изобретения поясняется таблицами и рисунками, в которых отображается следующая информация.


Сопоставительный анализ заявляемого изобретения показал, что совокупность существенных признаков заявленного способа, не известна из уровня техники и значит, соответствует условию патентоспособности «Новизна».
В уровне техники не было выявлено признаков, совпадающих с отличительными признаками заявленного изобретения и влияющих на достижение заявленного технического результата, поэтому заявленное изобретение соответствует условию патентоспособности «Изобретательский уровень».
Приведенные сведения подтверждают возможность применения заявляемого способа в области биотехнологии, молекулярной биологии, молекулярно-генетической диагностики и ветеринарной медицины для ранней диагностики лейкоза крупного рогатого скота, и поэтому соответствует условию патентоспособности «Промышленная применимость».
Источники информации
1. Антонова О.С., Рудницкая Г.Е., Тупик А.Н., Буляница А.Л., Евстрапов А.А., Курочкин В.Е. Полимеразная цепная реакция: приборная и методическая реализация. Обзор аналитических характеристик // Научное приборостроение. 2011. Т. 21. №4. С. 5-21.
2. Бикбулатова С.М., Чемерис Д.А., Никоноров Ю.М., Машков О.И., Гарафутдинов P.P., Чемерис А.В., Вахитов В.А. Способы детекции результатов полимеразной цепной реакции в режиме реального времени // Вестник Башкирск. ун-та. 2012. №1. - С. 59-67.
3. Валихов А.Ф. Биологические свойства вируса лейкоза крупного рогатого скота. Диагностика и профилактика инфекции. Автореф. дисс. доктора биол. наук /Валихов А.Ф.- М. - 1992. - 36 с.
4. Генджиева О.Б. Филогенетическое сравнение вируса лейкоза крупного рогатого скота // Вестник Калмыцкого университета. 2012. №2 (14). С. 10-16.
5. Гулюкин М.И., Козырева Н.Г., Генджиева О.Б., Иванова Л.А. Генотипирование изолятов ВЛКРС, распространенных на территории республики Калмыкия // Ветеринария Кубани. 2012. №4. С. 4-7.
6. Зинатов Ф.Ф. Молекулярная генодиагностика лейкоза крупного рогатого скота: Автореф. дис… канд. биол. наук /Ф.Ф. Зинатов. - Казань. - 2008. - 25 с.
7. Колупаев В.Е. Преимущества метода ПЦР в реальном времени (Real Time PCR) // Лаб.мед. 2002. №5. С. 110-112.
8. Орлянкин Б.Г. Классификация ретровирусов и характеристика вирусов лейкоза крупного рогатого скота / Б.Г. Орлянкин, М.И. Гулюкин, Н.В. Замараева, К.Ю. Кунаков// Ветеринария. - 2000. - №5. - С. 14-17.
9. Смирнов П.Н. Генотипическое разнообразие вируса лейкоза крупного рогатого скота разной породной принадлежности / П.Н. Смирнов, Н.В. Грачева, В.А. Белявская, В.А. Рябинина // Аграрный вестник Урала. - 2009. - №7 (61), - Екатеринбург, 2009 - С. 89-91.
10. Beier, D. Identification of different BLV proviruses isolates by PCR, RFLP, and DNA sequencing /D. Beier, P. Blankestein, O. Marquardt, J. Kuzmak // Berl Munch Tieraztl Wschr. - 2001. - P. 252. - 256.
11. Cairns M.J., Turner R., Sun L.Q. Homogeneous real-time detection and quantification of nucleic acid amplification using restriction enzyme digestion // Biochemical and Biophysical Research Communications. 2004. V. 318. P. 684-690.
12. Felmer R.G. Molecular analysis of a 444 bp fragment of the BLV gp51 env gene reveals a high frequency of non-silent point mutations and suggest the presence of two subgroups of BLV in Chile // Vet.Microbiology 108(2005)39-47.
13. Koo K., Jaykus L. A. Detection of single nucleotide polymorphisms within the Listeria genus using an 'asymmetric' fluorogenic probe set and fluorescence resonance energy transfer based-PCR // Letters of Applied Microbiology. 2002. V. 35. P. 513-517.
14. Licursi M, Inoshima Y, Wu D, Yokoyama T, Gonzales E.T, Sentsui H. 2002. Genetic heterogeneity bovine leukemia virus genotypes and its relation to humoral responses in hosts // Virus Research. 86: 101-110.
15. Miller J.M. Infectivity tests of secretions and excretions from cattle infected with bovine leukemia virus / J.M. Miller, M.Y. Van der Maaten // J. Nate. Cancer Tnst - 1969. - V. 62. - P. 425-428.
16. Rola-Luszczak M. The molecular characterization of bovine leukaemia virus isolates from Eastern Europe and Siberia and its impaction phylogeny / M. Rola-Luszczak, A. Pluta, M. Olech, I. Donnik, M. Petropavlovskiy, A. Gerilovych, I. Vinogradova, B. Choudhury, J. Kuzmak // PLoS One. - 2013. - Vol. 8. - №3. Available at: http://dx.plos.org/10.1371/journal.pone.0058705.
17. White R.A., Blainey P.C., Fan C.H., Quake S.R. Digital PCR provides sensitive and absolute calibration for high throughput sequencing // BMC Genomics. 2009. V. 10, N 116. P. 1-12.
18. Weisenberger D.J., Trinh B.N., Campan M. et al. DNA methylation analysis by digital bisulfite genomic sequencing and digital MethyLight // Nucleic Acids Research. 2008. V. 36, N 14. P. 4689-4698.
19. Zimmermann B.G., Gril S., Holzgreve W. et al. Digital PCR: a powerful new tool for noninvasive prenatal diagnosis? // Prenat. Diagn. 2008. V. 28. P. 1087-1093.