Результат интеллектуальной деятельности: СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ОБЛЕГЧЕНИЯ МИГРЕНИ
Вид РИД
Изобретение
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка претендует на преимущества и приоритет временной заявки США №62/015727, поданной 23 июня 2014 г., и временной заявки США №62/109386, поданной 29 января 2015 г., каждая из которых включена в данный документ в полном объеме посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Мигрень представляет собой первичное эпизодическое болевое расстройство в виде головной боли, ассоциированное с рецидивирующими истощающими приступами, которые часто плохо контролируются существующими методами фармакотерапии, сфокусированными на сосудистых триггерах. Началу приступов мигрени часто предшествуют мерцательная скотома или мигреневая аура, вызванные явлением кортикальной распространяющейся депрессии (РД); см. Ayata, Headache, 50: 725-30, 2010; Eikerman-Haerter et al., Curr. Neurol. Neurosci. Rep., 10: 167-73, 2010; и 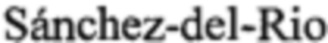 et al., Curr. Opin. Neurol., 17 (3): 289-93, 2004). РД представляет собой медленно распространяющееся угнетение электрокортикографической активности, инициируемое локальным увеличением внеклеточного калия и высвобождением глутамата, что создает самораспространяющуюся волну медленной деполяризации в больших областях коры головного мозга. Мигрень с аурой испытывают приблизительно 15-30% лиц, страдающих от мигрени.
et al., Curr. Opin. Neurol., 17 (3): 289-93, 2004). РД представляет собой медленно распространяющееся угнетение электрокортикографической активности, инициируемое локальным увеличением внеклеточного калия и высвобождением глутамата, что создает самораспространяющуюся волну медленной деполяризации в больших областях коры головного мозга. Мигрень с аурой испытывают приблизительно 15-30% лиц, страдающих от мигрени.
[0003] Центральная нервная система (ЦНС) млекопитающих использует большое количество нейроактивных пептидов для осуществления специализированной сигнализации в головном мозге и спинном мозге, включая нейроактивные пептиды соматостатин, холецистокинин, ВКП (вазоактивный кишечный пептид), вещество Р, энкефалин, нейропептид Y (НПY), нейротензин, ТВГ (тиреотропинвысвобождающий гормон), ХЦК (холецистокинин) и динорфин (см. общее описание в The Biochemical Basis of Neuropharmacology, Cooper, Bloom and Roth, 5th ed., Oxford University Press, New York, 1986). Старательное изучение сложных сигнальных путей, действующих в ЦНС, привело к идентификации специфических рецепторов, модулируемых этими нейроактивными пептидами, представляющими важные терапевтические мишени для различных расстройств, связанных с ЦНС.
[0004] Рецептор N-метил-D-аспартата (NMDA) (NMDAR) является одним из таких рецепторов, задействованным в нейродегенеративных расстройствах, включая связанную с инсультом гибель клеток головного мозга, судорожные синдромы, и в процессах обучения и памяти. NMDAR также играет центральную роль в модулировании нормальной синаптической передачи, синаптической пластичности и эксайтотоксичности в центральной нервной системе. NMDAR дополнительно принимает участие в долгосрочном потенцировании (LTP). LTP представляет собой устойчивое усиление нейрональных соединений, лежащих в основе процессов обучения и памяти (см. Bliss and Collingridge, 1993, Nature 361: 31-39).
[0005] Были охарактеризованы два общих класса глутаматных рецепторов в центральной нервной системе (ЦНС). Они представляют собой метаботропные глутаматные рецепторы, представляющие собой сигнальные белки, принадлежащие к семейству рецепторов, сопряженных с G-белками, и ионотропные глутаматные рецепторы (Muir and Lees, Stroke, 1995, 26, 503-513). Ионотропный класс дополнительно делится на подтипы рецепторов АМПК, каината и NMDA по активирующим их селективным лигандам.
[0006] Были разработаны агонистические и антагонистические соединения на основе NMDA-модулирующей малой молекулы для потенциального терапевтического применения. Однако многие из них ассоциированы с очень узкими значениями терапевтических индексов и нежелательными побочными эффектами, включая галлюцинации, атаксию, иррациональное поведение и значительную токсичность, которые ограничивают их эффективность и/или безопасность.
[0007] Таким образом, сохраняется потребность в улучшенных способах лечения мигрени и других родственных болезней с помощью соединений, обеспечивающих повышенную эффективность и сниженные нежелательные побочные эффекты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] В некоторых вариантах реализации изобретения, настоящее изобретение относится к способам лечения мигрени, включающим введение нуждающемуся в этом пациенту фармацевтически эффективного количества пептида GLYX. В некоторых вариантах реализации изобретения, мигрень может представлять собой эпизодическую мигрень, хроническую мигрень ретинальную мигрень, офтальмоплегическую мигрень ацефалгическую мигрень, мигренозное расстройство, менструальную мигрень, абдоминальную мигрень, детские периодические синдромы и/или кластерную головную боль. В некоторых вариантах реализации изобретения, мигрень представляет собой мигрень без ауры (обычную мигрень). В некоторых вариантах реализации изобретения, мигрень представляет собой мигрень с аурой (классическую мигрень). В некоторых вариантах реализации изобретения, мигрень сопровождается аллодинией.
[0009] Например, раскрытые соединения могут функционально взаимодействовать с или модулировать действие глицинового сайта NMDAR для лечения мигрени (например, эпизодической мигрени, хронической мигрени, ретинальной мигрени, офтальмоплегической мигрени, ацефалгической мигрени, мигренозного расстройства, менструальной мигрени, абдоминальной мигрени, детских периодических синдромов или кластерной головной боли).
[0010] В некоторых вариантах реализации изобретения, настоящее изобретение относится к способам лечения, подавления и/или предотвращения кортикальной распространяющейся депрессии (РД), включающим введение нуждающемуся в этом пациенту фармацевтически эффективного количества пептида GLYX. В некоторых вариантах реализации изобретения, настоящее изобретение относится к лечению или облегчению долгосрочных постмигренозных осложнений у пациента, нуждающегося в этом, включающему введение пациенту фармацевтически эффективного количества пептида GLYX.
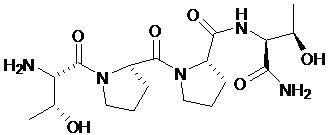
[0011] В некоторых вариантах реализации изобретения, пептид GLYX имеет следующую структуру:
или является его фармацевтически приемлемой солью, или его производным, обладающими активностью частичного агониста NMDAR.
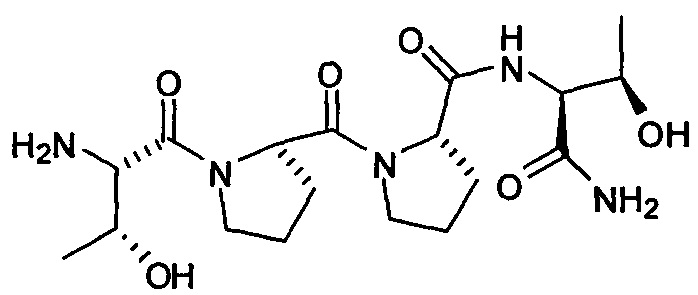
[0012] В одном аспекте, изобретение относится к способу лечения мигрени у пациента, нуждающегося в этом, включающему введение указанному пациенту фармацевтически эффективного количества соединения, представленного формулой:
или его фармацевтически приемлемой соли.
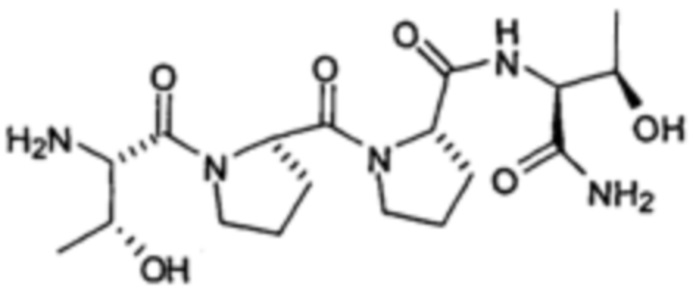
[0013] В другом аспекте, изобретение относится к способам лечения, подавления и/или предотвращения кортикальной распространяющейся депрессии у пациента, нуждающегося в этом, включающим введение указанному пациенту фармацевтически эффективного количества соединения, представленного формулой:
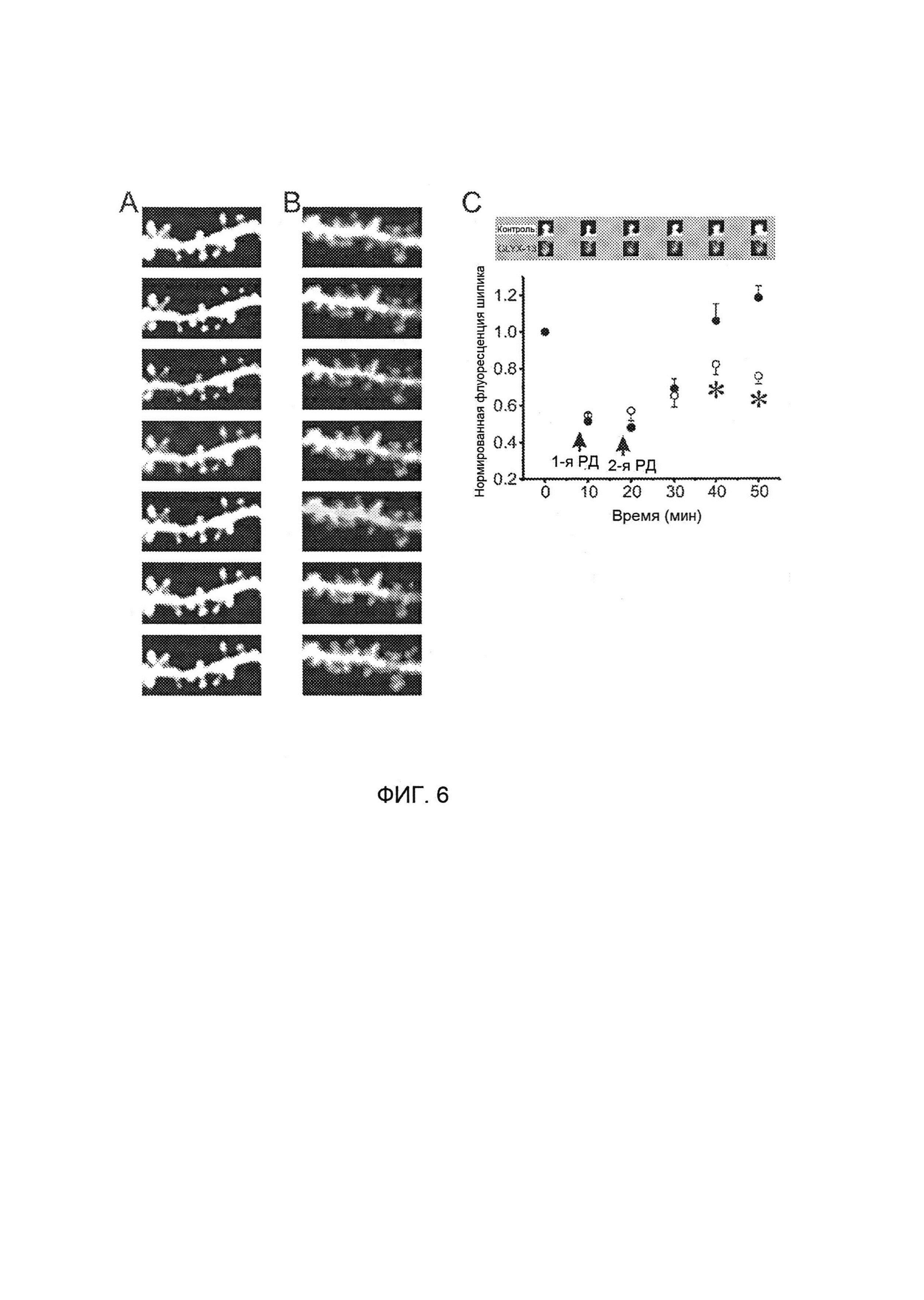
или его фармацевтически приемлемой соли.
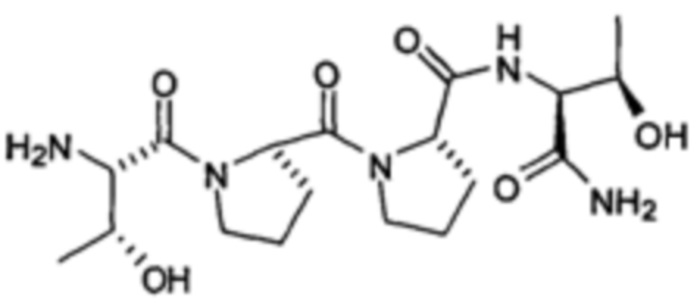
[0014] В другом аспекте, изобретение относится к способам лечения или облегчения долгосрочных постмигренозных осложнений у пациента, нуждающегося в этом, включающим введение указанному пациенту фармацевтически эффективного количества соединения, представленного формулой:
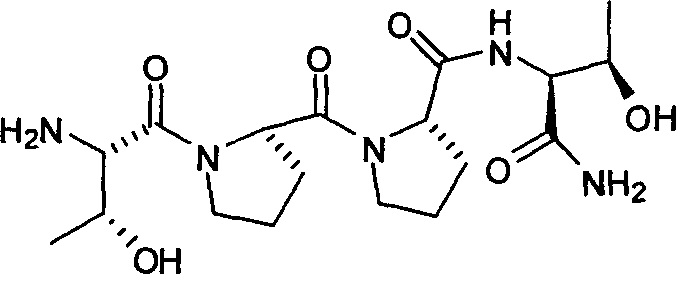
[0015] или его фармацевтически приемлемой соли.
[0016] Как описано более детально ниже, лекарственные средства, являющиеся эффективными для введения при ауре, будут полезны пациенту, например, позволяя осуществлять вмешательство на ранней стадии мигрени. Предусматривается, что способы, описанные в данном документе, являются применимыми для лечения мигрени с аурой, включающего введение пептида GLYX при ауре.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
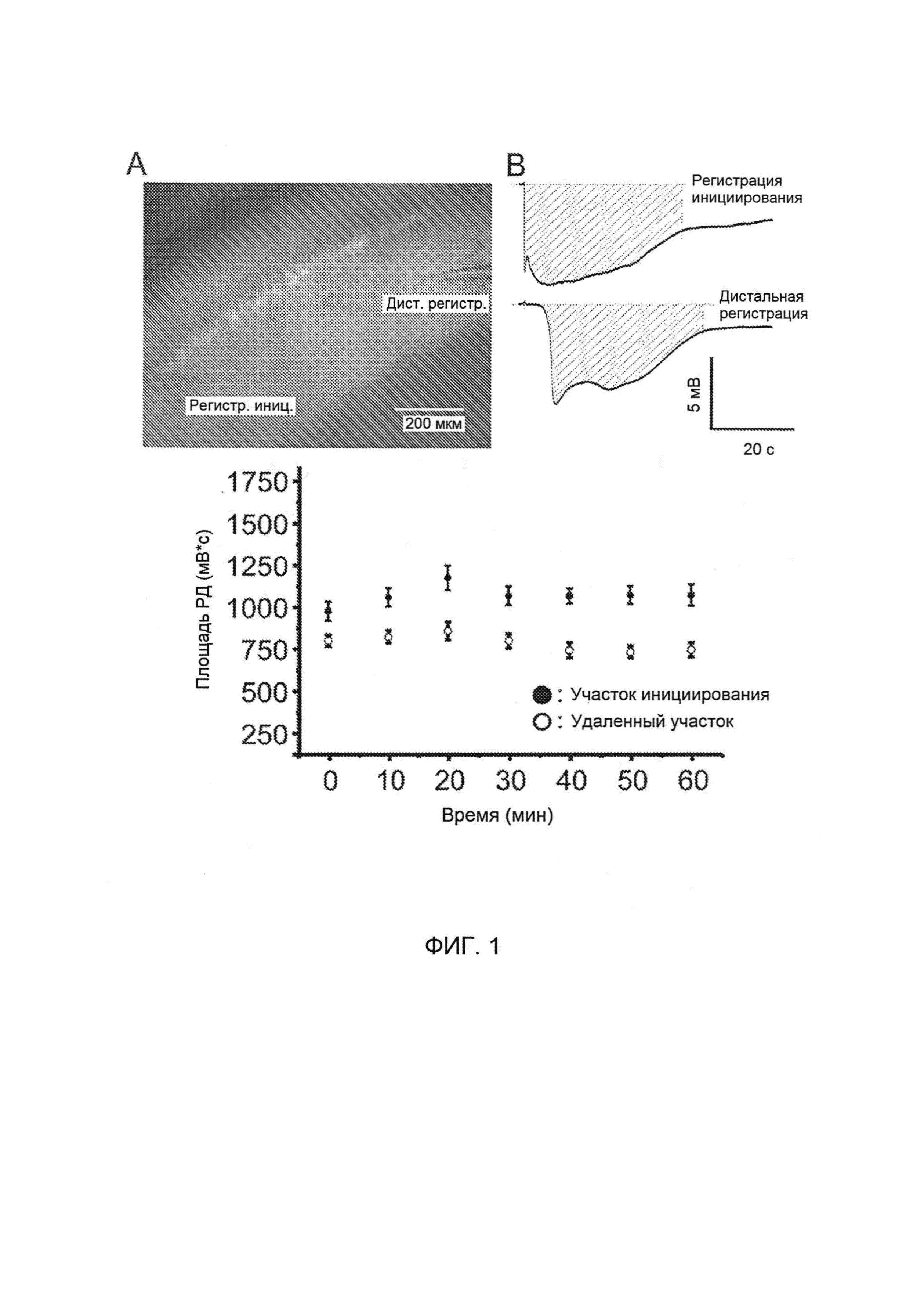
[0017] На Фигуре 1 изображена фокальная распространяющаяся депрессия (РД), индуцированная высоким уровнем [K+], в поле СА1 срезов гиппокампа, вызывающая изменение свечения, отражающее распространяющуюся волну массовой деполяризации нейронов и глии.
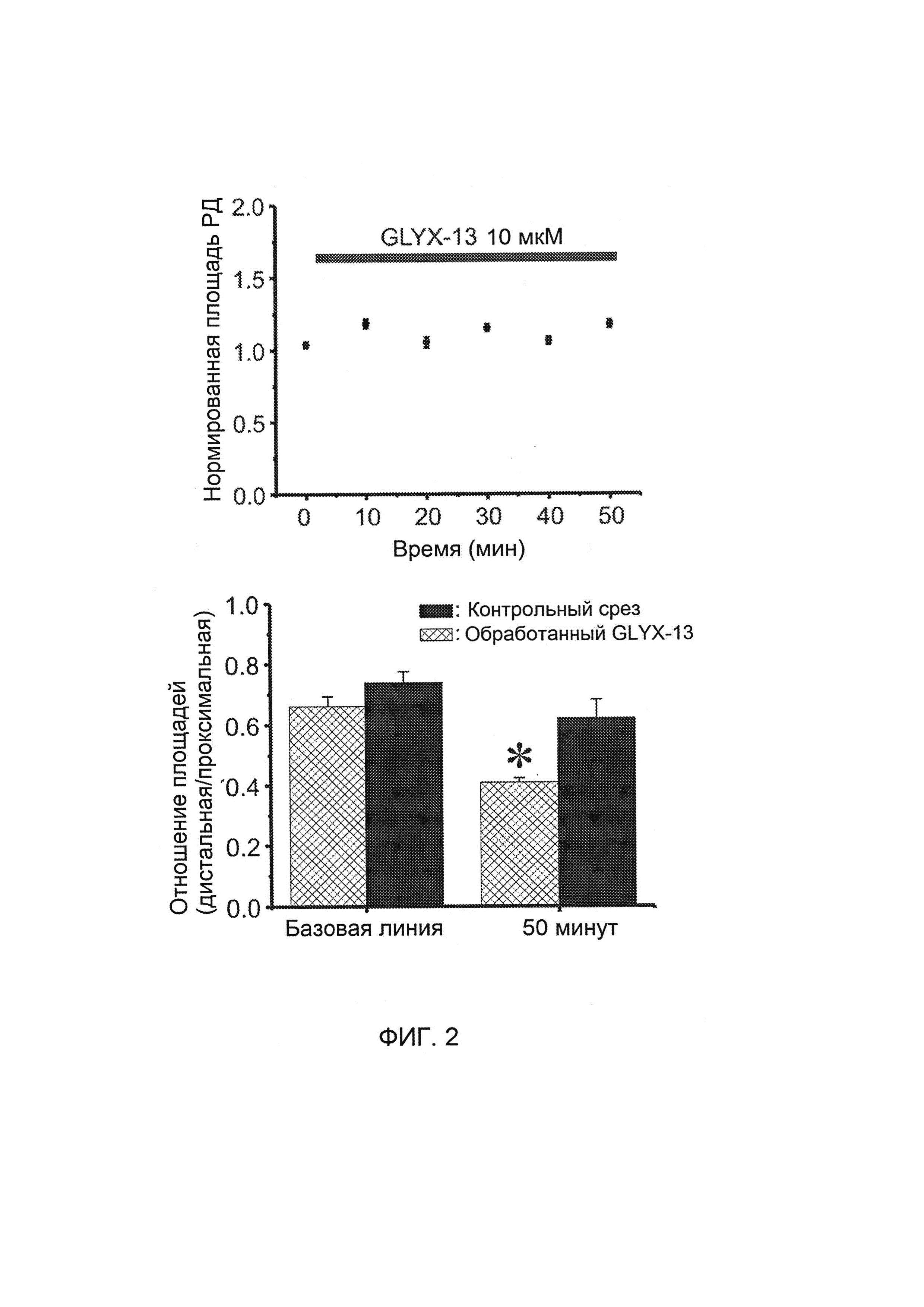
[0018] На Фигуре 2 представлены данные для РД, вызванной в срезах головного мозга; не наблюдалось значительных различий между базовыми областями индивидуальных последовательных эпизодов РД в точке инициации (критерий множественного сравнения Бонферрони, Р>0,20), что указывает на то, что GLYX-13 не влияет на инициирование РД.
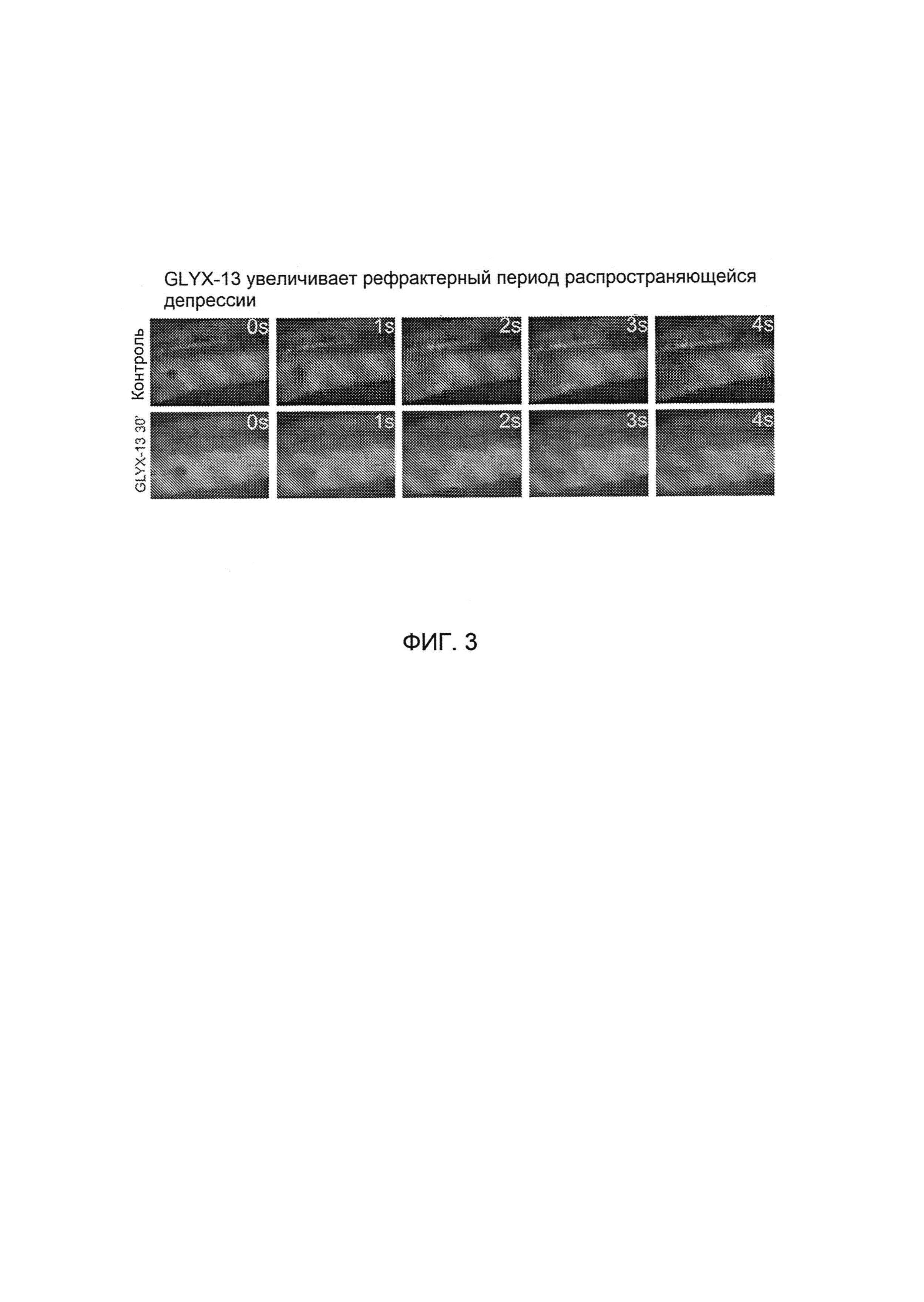
[0019] На Фигуре 3 представлены данные, демонстрирующие, что GLYX-13 увеличивает рефрактерный период инициирования РД. РД может быть успешно вызвана через пять минут после предшествующей РД в контрольном срезе (контроль), но не вызывается в срезе, обработанном GLYX-13 (GLYX-13 30').
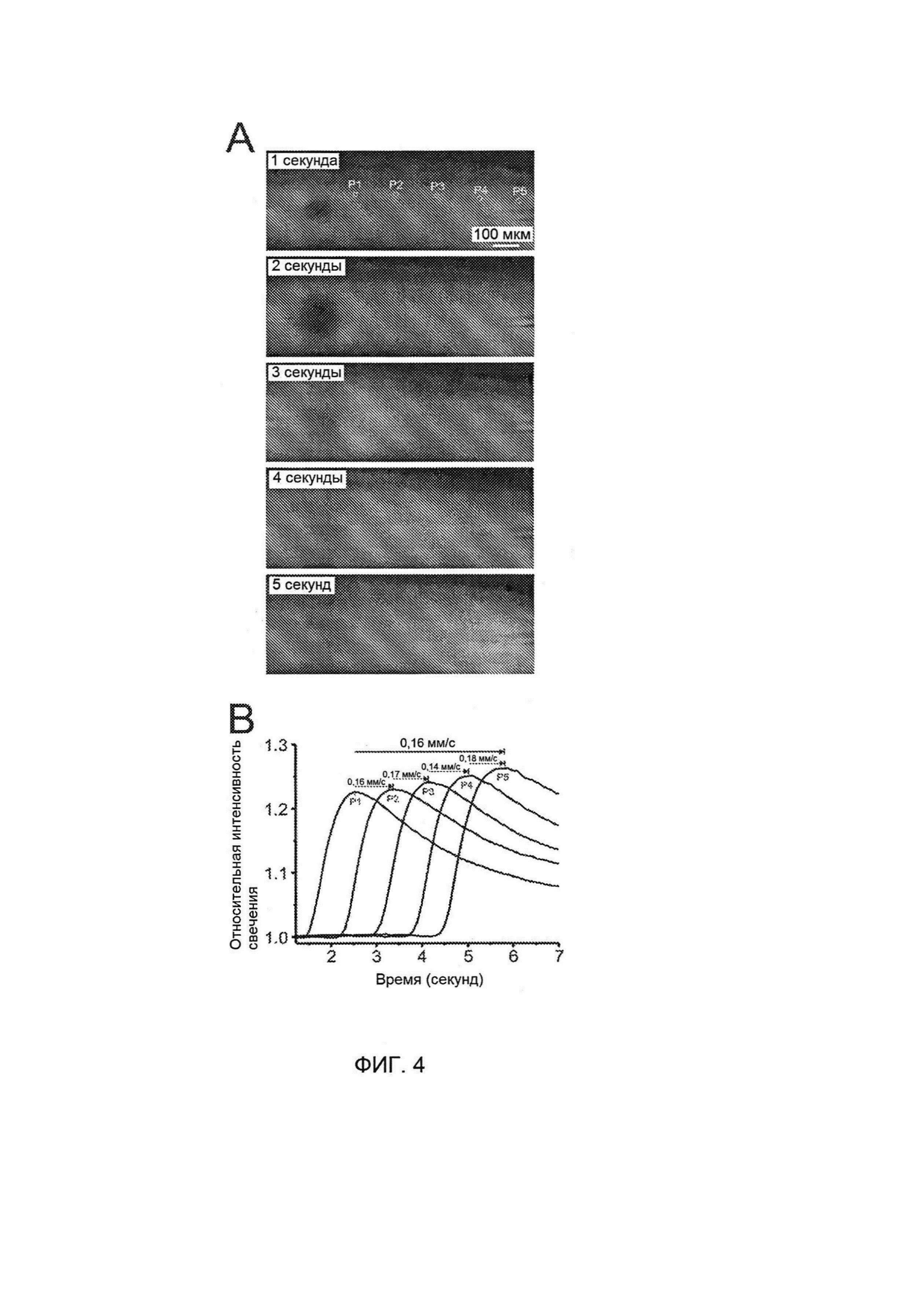
[0020] На Фигуре 4А показано, что "аура" РД в виде повышенной светимости расходится от инициирующей пипетки и распространяется по срезу, и может быть использована для расчета скорости проводимости РД (Фигура 4В).
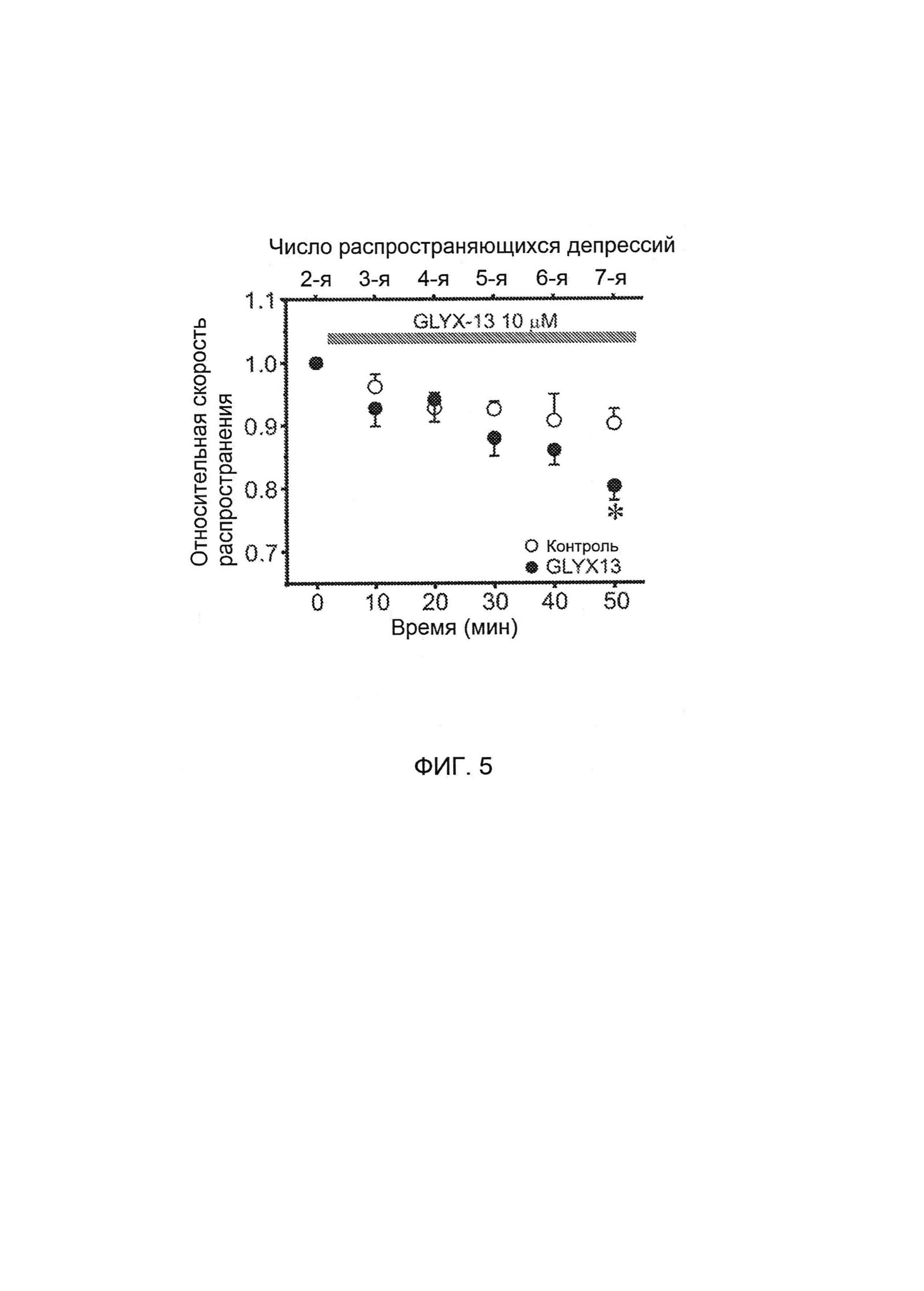
[0021] На Фигуре 5 представлен однофакторный дисперсионный анализ (ANOVA) с повторными измерениями для анализа 6 последовательных РД с целью проверки стабильности скорости в повторных эпизодах РД и возможного влияния GLYX-13 на скорость проводимости РД.
[0022] На Фигуре 6А представлено сокращение шипиков в ответ на два эпизода РД в контрольном пирамидальном нейроне, тогда как на Фигуре 6В проиллюстрирован этот же процесс в присутствии 10 мкмоль/л GLYX-13; на Фигуре 6С указано, что GLYX-13 обеспечивал восстановление размеров шипика после РД.
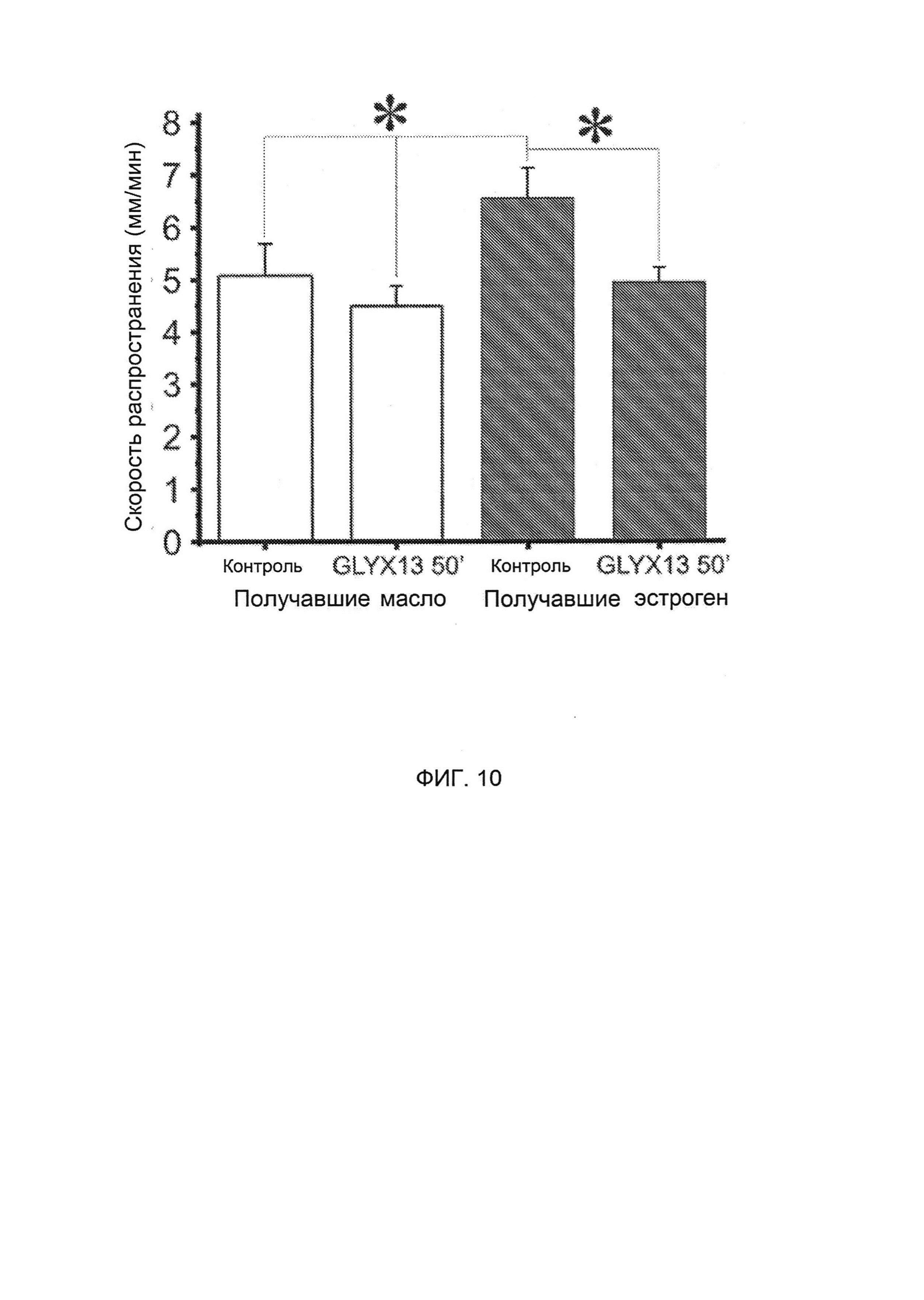
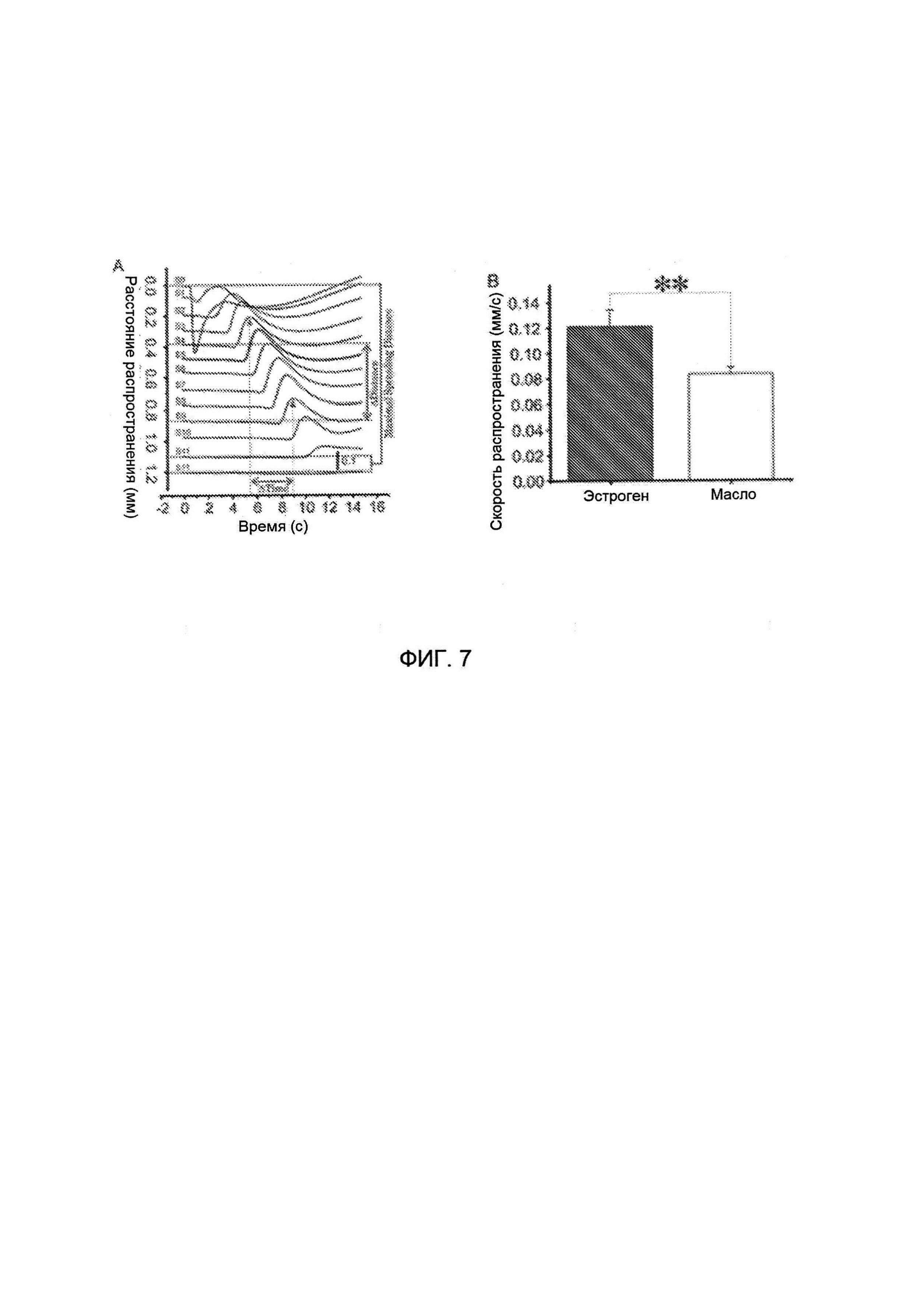
[0023] На Фигуре 7А показано расстояние распространения, а на Фигуре 7В показана скорость продвижения распространяющейся депрессии (у получавших эстроген и не получавших масла) крыс, указывающую на то, что скорость распространения была выше, чем у получавших масло крыс.
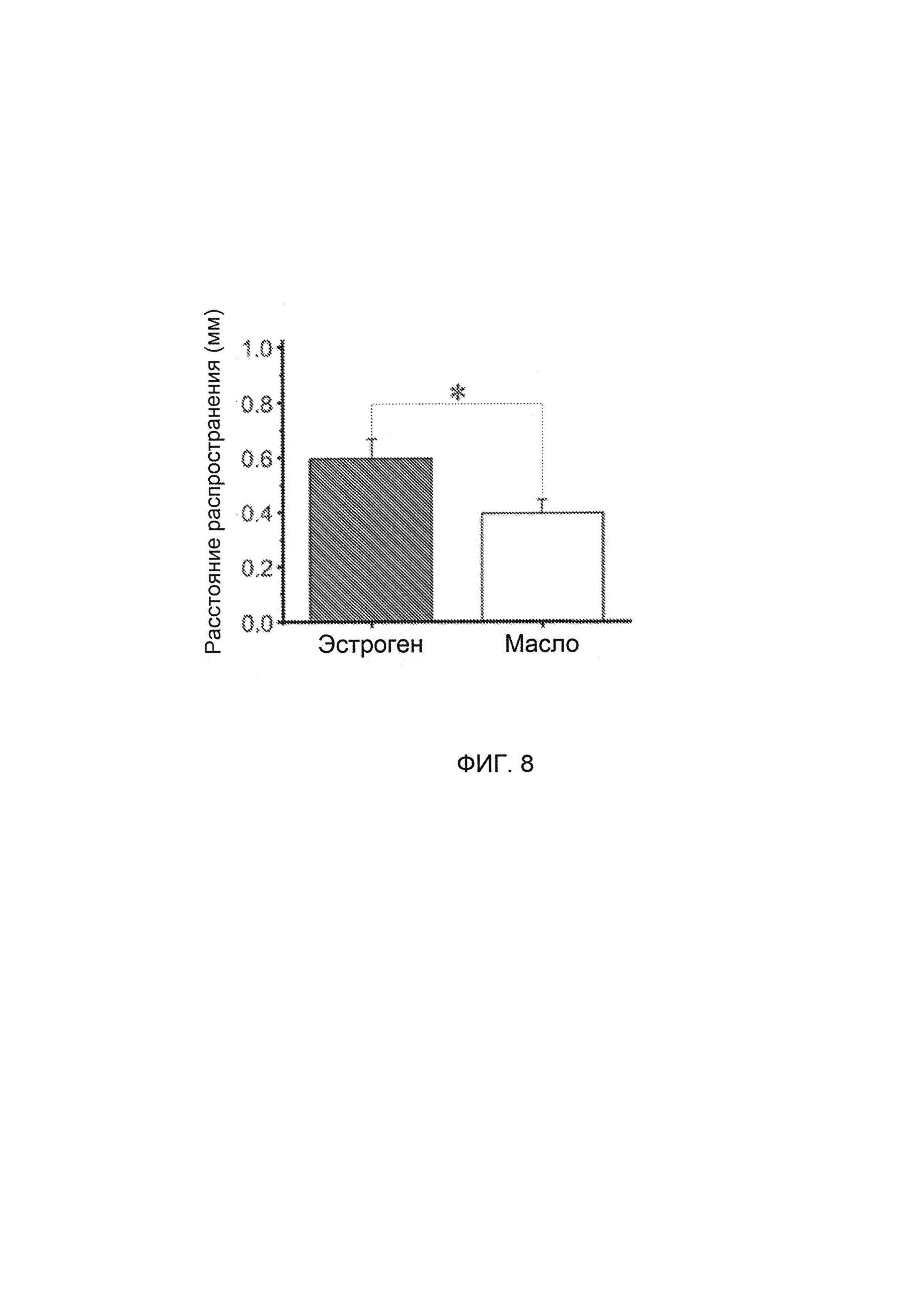
[0024] На Фигуре 8 показано, что РД в срезах получавших эстроген крыс распространялась дальше, чем у получавших масло крыс.
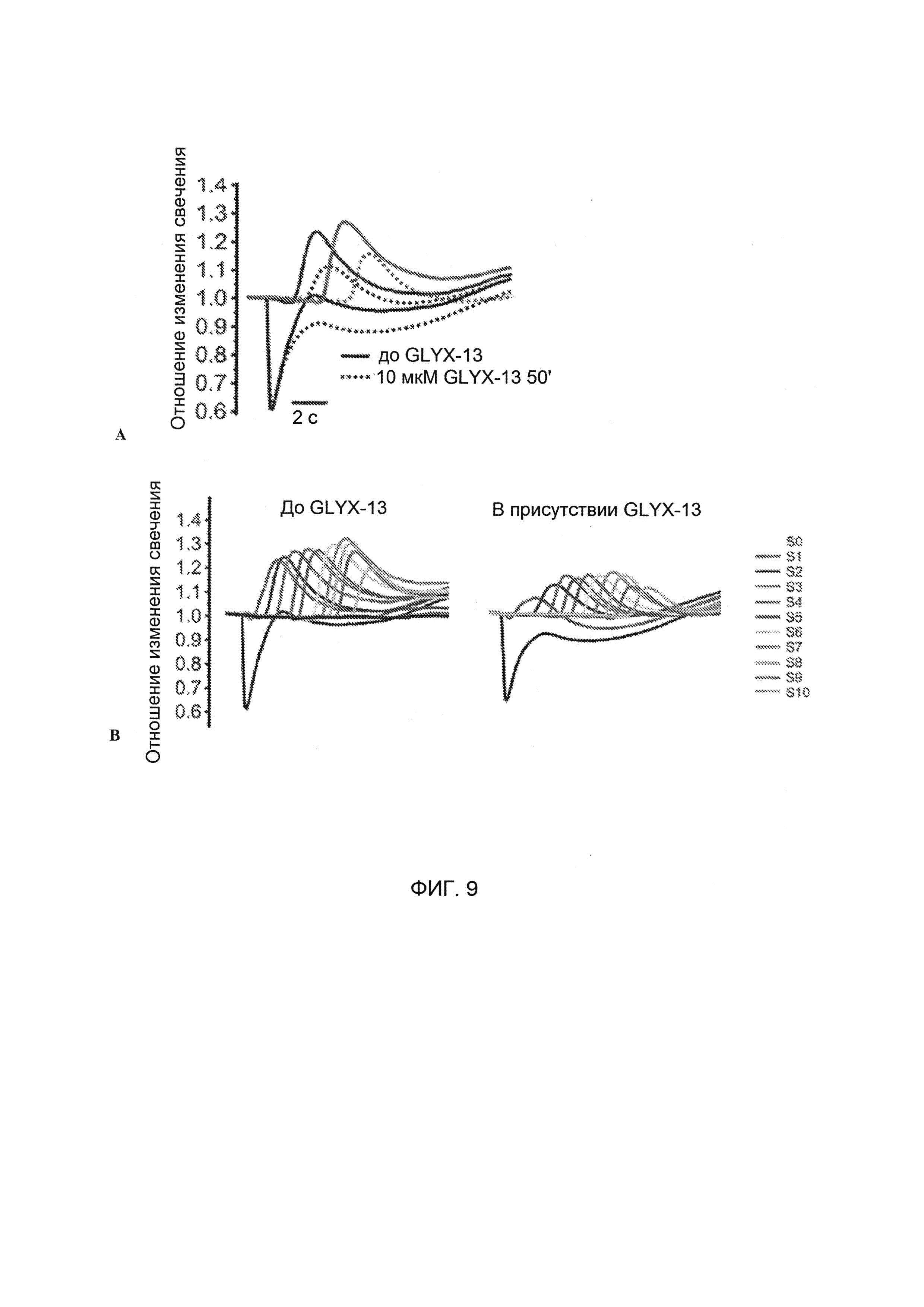
[0025] На Фигуре 9А показано, что изменения свечения, ассоциированные с РД в эксперименте на крысах, происходили с задержкой в присутствии GLYX-13; на Фигуре 9В показано, что РД индуцировалась в присутствии GLYX-13.
[0026] На Фигуре 10 показано влияние GLYX-13 на скорость распространения РД у получавших эстроген крыс до и после применения GLYX-13 (F(1,8)=3,l; р<0,05); и сравнение предварительного воздействия GLYX-13 для двух групп (F(1,8)=4,2; р<0,05).
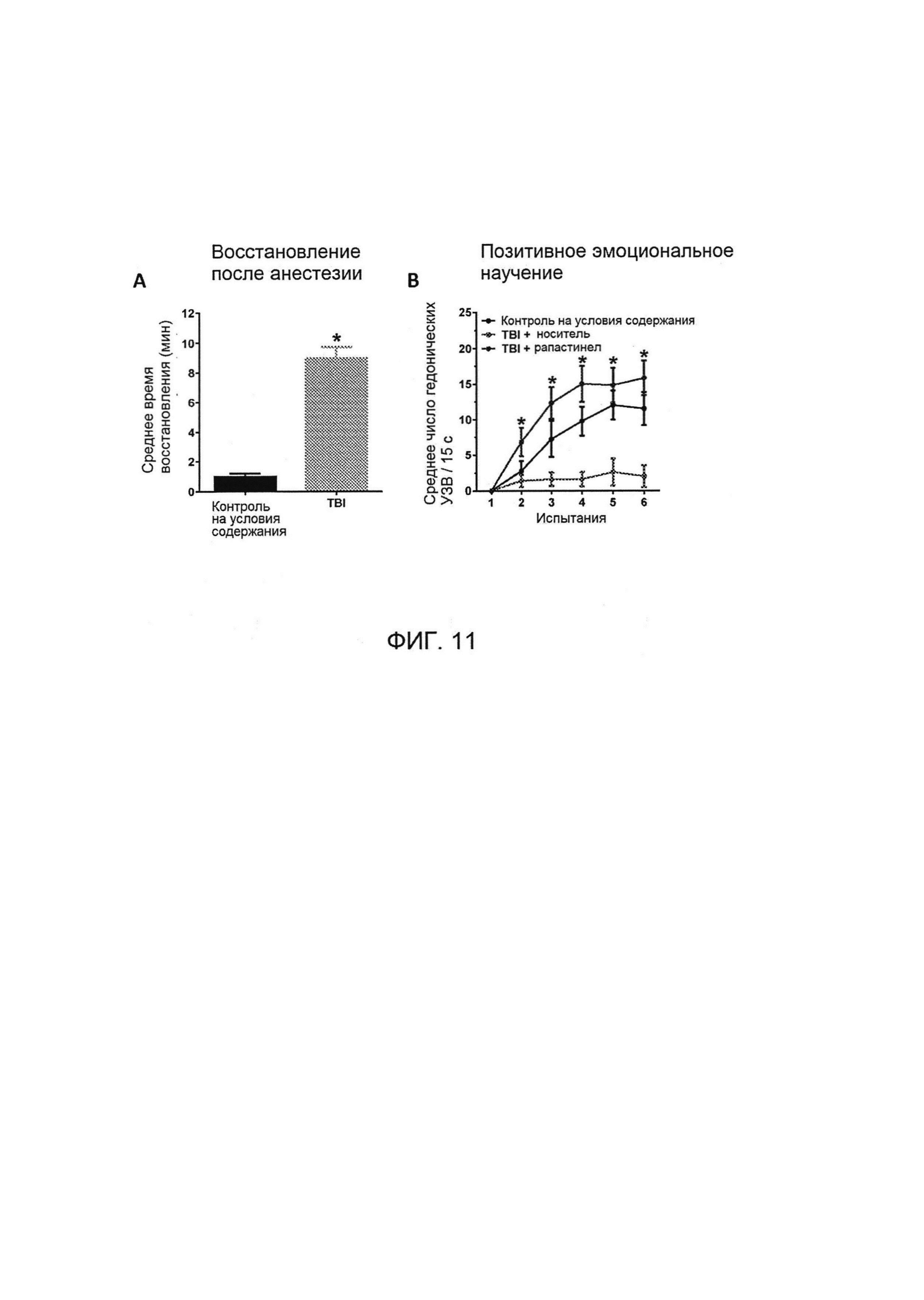
[0027] На Фигурах 11А-11В показано восстановление индуцированных ударной волной дефицитов научения с помощью рапастинела (3 мг/кг, внутривенно (IV); через 1 час после воздействия ударной волны) в PEL-испытаниях через 24 часа после воздействия ударной волны. На Фигуре 11А представлены данные о времени восстановления после воздействия ударной волны (от латентного состояния до нормальной способности к передвижению). На Фигуре 11В продемонстрированы результаты разового 3-х минутного сеанса тестирования позитивного эмоционального научения (PEL), проводимого через 24 часа после воздействия ударной волны, с использованием межсубъектного плана. N=4-6 на группу. * Р<0,05 (Фигура 11А) дисперсионный анализ, или (Фигура 11В) апостериорный критерий PLSD Фишера, рапастинел + ТПГМ (травматическое поражение головного мозга) / носитель + ТПГМ.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Классификации мигрени
[0028] Мигрени впервые были всесторонне классифицированы в 1988 г. Международное общество головной боли (The International Headache Society) недавно обновило свою классификацию головных болей в 2004 г. В соответствии с этой классификацией мигрени представляют собой первичные головные боли, наряду с головными болями напряжения и кластерными головными болями, в числе прочих.
[0029] Мигрени делятся на несколько подклассов (некоторые из которых включают дальнейшие подгруппы):
[0030] Мигрень без ауры, или "обычная мигрень", включает мигрень, не сопровождающуюся аурой.
[0031] Мигрень с аурой, или "классическая мигрень", обычно включает мигрень, сопровождающуюся аурой. Реже, аура может возникать без головной боли или с немигренозной головной болью. Две другие разновидности представляют собой семейную гемиплегическую мигрень и спорадическую гемиплегическую мигрень, при которой особа испытывает мигрени с аурой и с сопровождающей моторной слабостью. Если у близкого родственника наблюдается такое же состояние, то оно называется "семейным", иначе оно называется "спорадическим". Другой разновидностью является мигрень базилярного типа, при которой головная боль и аура сопровождаются затрудненным разговором, головокружением, звоном в ушах, или рядом других симптомов, связанных со стволом головного мозга, но не моторной слабостью. Первоначально считалось, что этот тип вызывается спазмами базилярной артерии, которая питает ствол головного мозга. Основные принципы диагностики мигрени с аурой приведены, например, в Eriksen et al., European Journal of Neurology 11: 583-591, 2004, и в Международной классификации головных болей (International Classification of Headache Disorders, Second Edition (ICHD-II)). Подтипы мигрени с аурой включают разновидности, указанные в ICHD-II, такие как типичная аура с мигренью (IHS 1.2.1), типичная аура с немигренозной головной болью (IHS 1.2.2), типичная аура без головной боли (IHS 1.2.3), семейная гемиплегическая мигрень (IHS 1.2.4), спорадическая гемиплегическая мигрень (IHS 1.2.5), и мигрень базилярного типа (IHS 1.2.6).
[0032] Детские периодические синдромы, которые обычно являются предшественниками мигрени, включают циклическую рвоту (нерегулярные интенсивные периоды рвоты), абдоминальную мигрень (абдоминальная боль, обычно сопровождаемая тошнотой), и доброкачественное позиционное головокружение у детей (нерегулярные приступы головокружения).
[0033] Ретинальная мигрень включает мигрень, сопровождающуюся зрительными расстройствами или даже временной слепотой на один глаз.
[0034] Осложнения мигрени описывают мигрень и/или ауры, имеющие необычно большую продолжительность или необычно большую частоту, или ассоциированные с судорожным припадком или поражением головного мозга.
[0035] Вероятная мигрень описывает состояния, имеющие некоторые характеристики мигреней, но при которых данных недостаточно для уверенной постановки диагноза мигрени (в присутствии сопутствующего чрезмерного употребления лекарственных средств).
[0036] Хроническая мигрень является осложнением мигреней, и представляет собой головную боль, соответствующую диагностическим критериям мигрени и ощущаемую на протяжении более длительного периода времени. Более конкретно, в течение не менее чем 15 дней/месяц на протяжении более 3 месяцев.
[0037] Существует четыре возможные фазы мигрени, хотя не все эти фазы обязательно ощущаются: (1) продром, возникающий за несколько часов или дней до головной боли; (2) аура, которая непосредственно предшествует головной боли; (3) болевая фаза, также известная как фаза головной боли; и (4) постдром, представляющий собой эффекты, испытываемые после окончания приступа мигрени.
[0038] Продромальные или предостерегающие симптомы наблюдаются у около 60% пациентов с мигренями, с началом в диапазоне от двух часов до двух дней до появления боли или ауры. Такие симптомы могут включать широкий спектр проявлений, включая: изменение настроения, раздражительность, депрессию или эйфорию, усталость, тягу к определенным продуктам питания, ригидность мышц (особенно шеи), запор или диарею, и чувствительность к запахам или шуму. Они могут возникать у особ, страдающих мигренью с аурой или мигренью без ауры.
[0039] Аура представляет собой транзиторное фокальное неврологическое явление, которое возникает до или во время головной боли. Она возникает постепенно на протяжении нескольких минут и обычно продолжаются менее 60 минут. Симптомы могут быть визуальными, сенсорными или моторными по характеру и многие люди испытывают по несколько симптомов. Визуальные эффекты возникают наиболее часто; они наблюдаются в до 99% случаев, и в более чем 50% случаев не сопровождаются сенсорными или моторными эффектами. Расстройства зрения часто заключаются в мерцательной скотоме (участок частичных изменений в поле зрения, который мерцает и может нарушать способность человека читать или вести машину). Они типично возникают в центральной части поля зрения и затем распространяются к краям зигзагообразными линиями, которые описывались как похожие на фортификационные укрепления или стены замка. Обычно линии являются черно-белыми, но некоторые люди также видят цветные линии. Некоторые люди теряют часть своего поля зрения (что известно как гемианопсия), тогда как другие испытывают потерю четкости изображения.
[0040] Вторым наиболее распространенным типом являются сенсорные ауры; они наблюдаются у 30-40% людей с аурами. Часто возникает ощущение покалывания с одного бока в руке и предплечье и распространяется на область носа-рта с того же бока. Обычно после завершения покалывания возникает ощущение онемения с потерей чувства положения. Другие симптомы фазы ауры могут включать: расстройства речи или языковые расстройства, головокружение, и реже моторные проблемы. Моторные симптомы указывают на гемиплегическую мигрень, и ощущение слабости часто продолжается более часа, в отличие от других аур.
[0041] Аура может также возникать без последующей головной боли. Ацефалгические мигрени, также известные как бессимптомные мигрени, наблюдаются относительно редко и включают ауру и другие симптомы, но без последующей головной боли (т.е., без болевой фазы).
[0042] Во время болевой фазы, головная боль обычно является односторонней, пульсирующей, и имеет интенсивность от умеренной до тяжелой. Она обычно возникает постепенно и усиливается при физической активности. В более чем 40% случаев, однако, боль может быть двусторонней, и обычно ассоциирована с болью в шее. Двусторонняя боль особенно часто наблюдается у лиц, страдающих мигренями без ауры. Реже, боль может возникать сначала в задней или в верхней части головы. Боль обычно продолжается от 4 до 72 часов у взрослых, однако у маленьких детей часто продолжается менее 1 часа. Частота приступов является непостоянной, от нескольких раз на протяжении жизни до нескольких раз в неделю, со средним значением около раз в месяц.
[0043] Боль часто сопровождается тошнотой, рвотой, чувствительностью к свету, чувствительностью к звукам, чувствительностью к запахам, усталостью и раздражительностью. При базилярной мигрени, представляющей собой мигрень с неврологическими симптомами, связанными со стволом головного мозга или с неврологическими симптомами с обоих боков тела, обычные эффекты включают: ощущение головокружения, предобморочное состояние и спутанность сознания. Тошнота наблюдается у почти 90% людей, а рвота - примерно у трети. Другие симптомы могут включать: неясное зрение, заложенный нос, диарею, частое мочеиспускание, бледность или потение. Могут наблюдаться припухлость или чувствительность кожи головы, а также ригидность шеи.
[0044] Эффекты мигрени могут сохраняться на протяжении нескольких дней после окончания основной головной боли; это состояние называется постдромом мигрени. Многие сообщают о болезненном ощущении в области мигрени, и некоторые сообщают о нарушении мышления на протяжении нескольких дней после окончания головной боли. Пациент может ощущать усталость и испытывать головную боль, когнитивные проблемы, желудочно-кишечные симптомы, изменения настроения и слабость.
Пептиды GLYX
[0045] GLYX-13 представляет собой недавно разработанный быстродействующий антидепрессант длительного действия с беспрецедентным модулирующим воздействием на активацию рецепторов N-метил-D-аспартат глутамата (NMDAR). Этот агент, который воздействует на облигатный коагонистический глициновый сайт рецептора NMDA, необходимый для его активации, нормализует активацию этого критического рецептора, усиливая ее в тех случаях, когда она слишком понижена, и подавляя ее, если она слишком высока. Благодаря такому действию, GLYX-13 может усиливать индукцию долгосрочного потенцирования (LTP), в то же время подавляя LTD (долговременную депрессию), синаптической силы, и восстанавливать нормальное LTP в срезах гиппокампа стареющих животных.
[0046] В используемом в данном документе значении, термин "пептид GLYX" относится к пептиду, обладающему активностью частичного агониста/антагониста глицинового сайта NMDAR. Пептиды GLYX могут быть получены хорошо известными рекомбинантными методами или путем синтеза, например, как описано в патентах США №5763393 и 4086196, включенных в данный документ в качестве ссылок. В некоторых вариантах реализации изобретения, GLYX относится к тетрапептиду, имеющему аминокислотную последовательность Thr-Pro-Pro-Thr, или L-треонил-L-пролил-L-пролил-L-треонинамид.
[0047] Например, GLYX-13 относится к соединению, представленному в виде формулы:
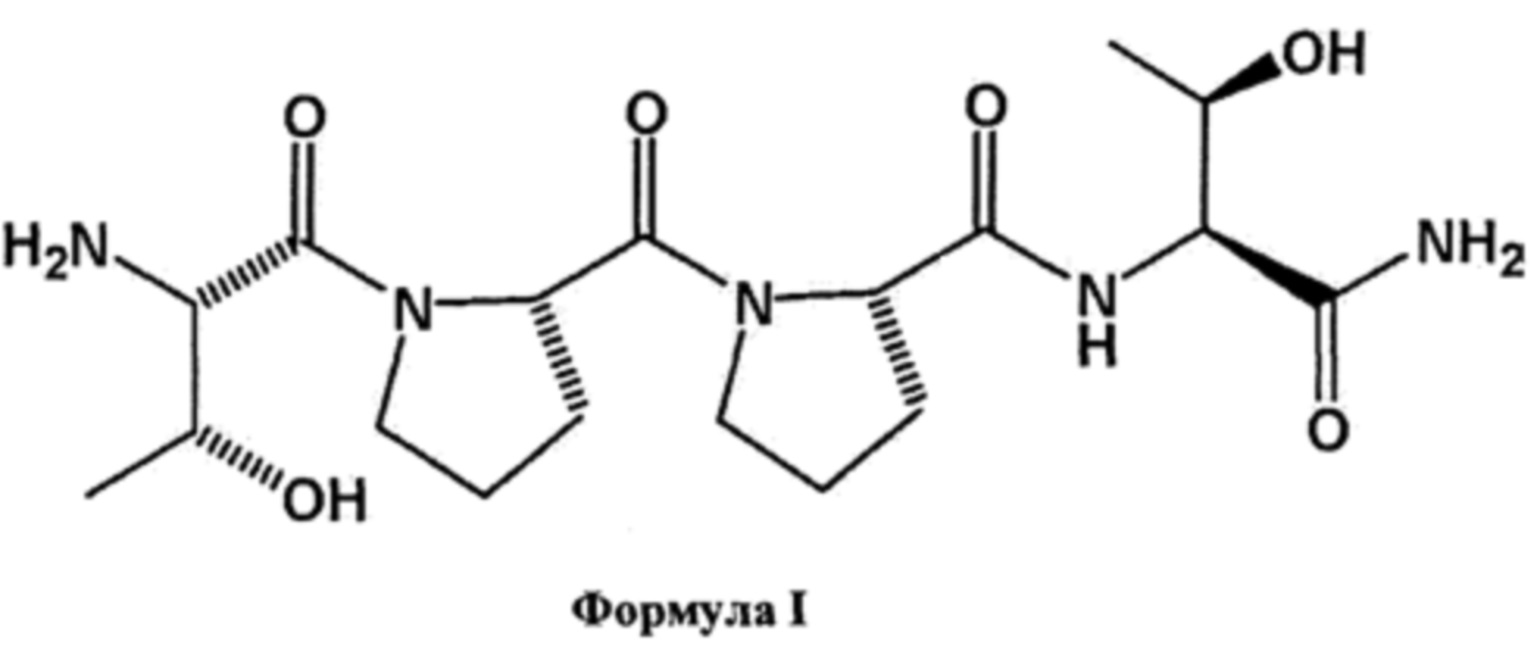
[0048] Также предусматриваются полиморфы, гомологи, гидраты, сольваты, свободные основания и/или пригодные солевые формы GLYX-13, такие как, без ограничений, ацетатная соль. Пептид может находиться в циклизованной или нециклизованной форме, как дополнительно описано в патенте США №5763393. В некоторых вариантах реализации изобретения, аналог GLYX-13 может содержать инсерцию или делецию фрагмента одной или нескольких из групп Thr или Pro, такую как делеция фрагмента СН2, ОН или NH2. В других вариантах реализации изобретения, GLYX-13 может быть необязательно замещен одним или несколькими галогенами, С1-С3 алкилом (необязательно замещенным галогеном или аминогруппой), гидроксилом и/или аминогруппой. Частичные агонисты глицинового сайта NMDAR раскрыты в патентах США №№5763393, 6107271, и Wood et al., NeuroReport, 19, 1059-1061, 2008, содержание которых в полном объеме включено в данный документ посредством ссылок.
[0049] Следует понимать, что пептиды, раскрытые в данном документе, могут содержать как природные, так и неприродные аминокислоты, например, все природные аминокислоты (или их производные), все неприродные аминокислоты (или их производные), или смесь природных и неприродных аминокислот. Например, одна, две, три или больше аминокислот в GLYX-13 могут иметь каждая, независимо, D- или L-конфигурацию.
[0050] GLYX-13 может воздействовать преимущественно на NR2B-CO держащие NMDAR, и может не демонстрировать классические побочные эффекты известных модуляторов NMDAR, таких как СРС-101,606 и кетамин. В некоторых вариантах реализации изобретения, антимигренозный или другой терапевтический эффект по существу без седативного действия может создаваться GLYX-13 при введении субъекту в терапевтически эффективных количествах. В других вариантах реализации изобретения, GLYX-13 может не обладать потенциалом злоупотребления (например, может не вызывать привыкание).
[0051] В некоторых вариантах реализации изобретения, GLYX-13 может увеличивать фосфорилирование серина-845 GluR1 AMPА. В некоторых вариантах реализации изобретения, киназа 3β гликогенсинтазы (GSK-3β) может активироваться GLYX-13. В некоторых случаях, уровни β-катенина могут изменяться после введения GLYX-13.
[0052] В некоторых вариантах реализации изобретения, GLYX-13 или композиция, содержащая GLYX-13, может обеспечивать лучшую активность in vivo при внутривенном (в/в) введении и/или уровень концентрации в головном мозге, по сравнению с уровнями в плазме.
[0053] Дополнительно, GLYX-13 может иметь широкий терапевтический индекс по сравнению с антагонистами глицинового сайта, такими как L-701,324, или другими антагонистами глицинового сайта, имеющими узкие терапевтические индексы, что приводит к очень узкому диапазону доз между терапевтическими эффектами и атаксией. Например, L-701,324 обладает противосудорожным действием в дозах, вызывающих атаксию (Bristow, et al, JPET 279:492-501, 1996). Аналогично, ряд соединений, входящих в состав Мерц (Merz compounds), обладают противосудорожным действием в дозах, вызывающих атаксию (Parsons, et al., JPET283:1264-1275, 1997).
Способы
[0054] В одном аспекте, данное изобретение относится к способу лечения мигрени у пациента, нуждающегося в этом, включающему стадию, в которой вводят указанному пациенту фармацевтически эффективное количество соединения, представленного формулой:
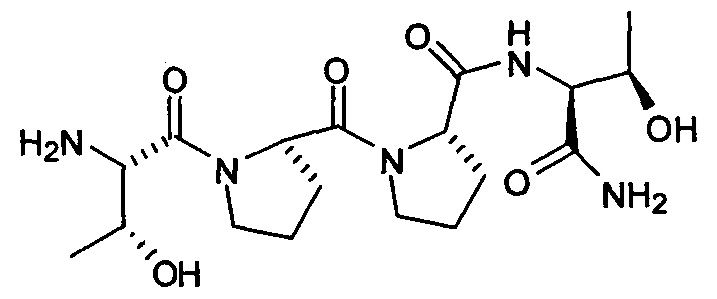
или его фармацевтически приемлемой соли.
[0055] В некоторых вариантах реализации изобретения, соединение вводят пациенту в дозе от около 0,01 мг/кг до около 1000 мг/кг или от около 1 мг/кг до около 500 мг/кг соединения.
[0056] В некоторых вариантах реализации изобретения, мигрень представляет собой эпизодическую мигрень, хроническую мигрень, ретинальную мигрень, офтальмоплегическую мигрень, ацефалгическую мигрень, мигренозное расстройство, менструальную мигрень, абдоминальную мигрень, детские периодические синдромы, или кластерную головную боль.
[0057] В некоторых вариантах реализации изобретения, мигрень представляет собой эпизодическую мигрень, хроническую мигрень, ретинальную мигрень, офтальмоплегическую мигрень, ацефалгическую мигрень или кластерную головную боль.
[0058] В некоторых вариантах реализации изобретения, мигрень представляет собой мигрень с аурой (классическую мигрень).
[0059] В некоторых вариантах реализации изобретения, мигрень представляет собой мигрень без ауры (обычную мигрень).
[0060] В некоторых вариантах реализации изобретения, мигрень сопровождается аллодинией.
[0061] В некоторых вариантах реализации изобретения, способ включает стадию, в которой вводят от около 1 до 10 мг/кг, от около 10 мг/кг до около 250 мг/кг, от около 20 мг/кг до около 150 мг/кг, от около 30 мг/кг до около 125 мг/кг, от около 40 мг/кг до около 110 мг/кг, от около 50 мг/кг до около 100 мг/кг, от около 60 мг/кг до около 90 мг/кг, или от около 70 мг/кг до около 90 мг/кг соединения.
[0062] В некоторых вариантах реализации изобретения, способ включает стадию, в которой вводят около 1 мг/кг, около 2,5 мг/кг, около 5 мг/кг, около 10 мг/кг, около 15 мг/кг, около 20 мг/кг, около 25 мг/кг, около 30 мг/кг, около 50 мг/кг, около 70 мг/кг, или около 100 мг/кг соединения.
[0063] В некоторых вариантах реализации изобретения, способ включает стадию, в которой вводят соединение примерно дважды в день, примерно каждый день, раз в 2 дня, раз в 3 дня, раз в 4 дня, раз в 5 дней, примерно раз в неделю, примерно раз в две недели, или примерно раз в четыре недели.
[0064] В другом аспекте, изобретение относится к способам лечения, подавления, или предотвращения кортикальной распространяющейся депрессии или болезни или состояния, вызванных кортикальной распространяющейся депрессией, у пациента, нуждающегося в этом, включающим стадию, в которой вводят указанному пациенту фармацевтически эффективное количество соединения, представленного формулой:
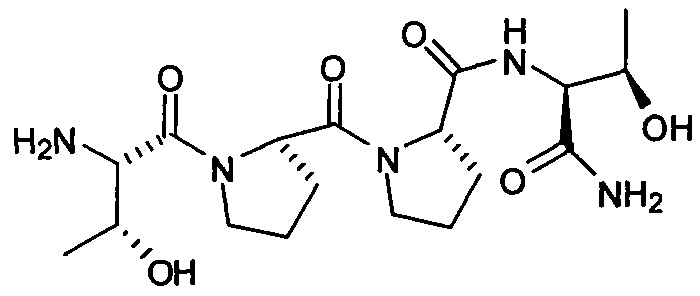
или его фармацевтически приемлемой соли.
[0065] В другом аспекте, изобретение относится к способам лечения или облегчения долгосрочных постмигренозных осложнений у пациента, нуждающегося в этом, включающим стадию, в которой вводят указанному пациенту фармацевтически эффективное количество соединения, представленного формулой:
или его фармацевтически приемлемой соли.
[0066] В некоторых вариантах реализации изобретения, соединение вводят пациенту в дозе от около 0,01 мг/кг до около 1000 мг/кг соединения. В некоторых вариантах реализации изобретения, соединение вводят пациенту в дозе от около 1 мг/кг до около 500 мг/кг соединения.
[0067] В некоторых вариантах реализации изобретения, способ включает стадию, в которой вводят от около 1 мг/кг до 10 мг/кг, от около 1 мг/кг до 20 мг/кг; от около 10 мг/кг до около 250 мг/кг, от около 20 мг/кг до около 150 мг/кг, от около 30 мг/кг до около 125 мг/кг, от около 40 мг/кг до около 110 мг/кг, от около 50 мг/кг до около 100 мг/кг, от около 60 мг/кг до около 90 мг/кг, или от около 70 мг/кг до около 90 мг/кг соединения.
[0068] В некоторых вариантах реализации изобретения, способ включает стадию, в которой вводят около 20 мг/кг, около 25 мг/кг, около 30 мг/кг, около 50 мг/кг, около 70 мг/кг, 1 мг/кг, 5 мг/кг, 10 мг/кг, 15 мг/кг, 20 мг/кг или около 100 мг/кг соединения.
[0069] В некоторых вариантах реализации изобретения, способ включает стадию, в которой вводят соединение примерно дважды в день, примерно каждый день, раз в 2 дня, раз в 3 дня, раз в 4 дня, раз в 5 дней, примерно раз в неделю, или примерно раз в две недели или, например, раз в месяц.
[0070] В некоторых вариантах реализации изобретения, способ дополнительно включает стадию, в которой соединение совместно вводят с опиоидом, антидепрессантом, противоэпилептическим средством, нестероидным противовоспалительным лекарственным средством (NSAID), агонистом рецептора серотонина 5HT1B/1D, антагонистом N-метил-D-аспартата или противовоспалительным соединением.
[0071] Активация NMDAR может промотировать или даже быть существенной для явления РД во многих экспериментальных ситуациях. Таким образом, соединения, которые предотвращают чрезмерную активацию NMDAR, могут выступать в качестве важных новых терапий для уменьшения, и даже предотвращения, начальных проявлений приступов мигрени. Например, GLYX-13, описываемый ниже, угнетает продуцирование и распространение РД в срезах гиппокампа in vitro. В некоторых экспериментах, GLYX-13 может полностью предотвращать индуцирование РД путем локального увеличения внеклеточной концентрация калия, и/или может замедлять скорость распространения РД или даже полностью ее блокировать. Кроме того, GLYX-13 может улучшать возврат дендритных шипиков к их оригинальным размерам после РД. Например, в данном документе предусматриваются способы лечения мигрени у пациентов профилактически и/или при обострении. Такое введение может снижать тяжесть (или в некоторых вариантах реализации изобретения, прекращать) приступы мигрени у пациентов.
[0072] В некоторых вариантах реализации изобретения, пациент является человеком. Предполагаемые пациенты включают пациентов женского пола и/или пациентов подросткового возраста.
[0073] Также в данном документе предусматриваются способы лечения мигрени (например, эпизодической мигрени, хронической мигрени, ретинальной мигрени, офтальмоплегической мигрени, ацефалгической мигрени, мигренозного расстройства, менструальной мигрени, абдоминальной мигрени, детских периодических синдромов или кластерной головной боли) у невосприимчивых к лечению пациентов, или лечения рефрактерной мигрени, например, пациентов, страдающих от мигрени, которая не откликается, и/или не откликалась, на соответствующие курсы лечения по меньшей мере одним, или по меньшей мере двумя другими соединениями или терапевтическими средствами. Например, в данном документе предусматриваются способы лечения мигрени (например, эпизодической мигрени, хронической мигрени, ретинальной мигрени, офтальмоплегической мигрени, ацефалгической мигрени, мигренозного расстройства, менструальной мигрени, абдоминальной мигрени, детских периодических синдромов или кластерной головной боли) у невосприимчивого к лечению пациента, включающие следующие стадии, в которых а) необязательно идентифицируют пациента как невосприимчивого к лечению, и b) вводят эффективную дозу GLYX-13 указанному пациенту. В некоторых вариантах реализации изобретения, мигрень представляет собой мигрень с аурой.
[0074] В данном документе, в варианте реализации изобретения, предусматриваются способы острого лечения мигрени (например, эпизодической мигрени, хронической мигрени, ретинальной мигрени, офтальмоплегической мигрени, ацефалгической мигрени, мигренозного расстройства, менструальной мигрени, абдоминальной мигрени, детских периодических синдромов или кластерной головной боли) у пациента, нуждающегося в этом, включающие стадию, в которой вводят эффективное количество пептида GLYX, например, в виде разовой дозы. Например, в данном документе предусматриваются, в варианте реализации изобретения, способы лечения мигрени у пациента, нуждающегося в этом, в начале приступа мигрени, включающие стадию, в которой остро вводят (например, разовую дозу) эффективное количество GLYX-13. Такие способы могут избавить пациента от по меньшей мере одного симптома мигрени на период около 2 недель или меньше, 1 неделя или меньше, 1 день или меньше, или 1 час или меньше (например 15 минут или меньше, полчаса или меньше), после указанного введения. В некоторых вариантах реализации изобретения, такие способы могут избавлять пациента от по меньшей мере одного симптома мигрени на период около 1 дня или больше, 1 неделя или больше, или 2 недели или больше, после указанного введения. Например, в данном документе предусматривается способ, включающий стадию, в которой вводят эффективное количество пептида GLYX пациенту, страдающему от мигрени, где указанный пациент по существу избавляется от по меньшей мере одного симптома мигрени значительно раньше после первого введения пептида GLYX, по сравнению с тем же пациентом при введении другого лекарственного средства для лечения мигрени. Квалифицированному специалисту в данной области техники будет понятно, что такие способы острого введения могут быть предпочтительными в условиях больницы или для амбулаторных пациентов. Способы, описанные в данном документе, также могут быть полезны для лечения аллодинии, возникающей при мигрени с аурой.
[0075] Способы по настоящему изобретению также могут быть использованы при лечении пациентов с депрессией, страдающих от травматического поражения головного мозга, эпилепсии, или с риском инсульта. Например, в данном документе предусматривается, в варианте реализации изобретения, способ лечения травматического поражения головного мозга, включающий стадию, в которой вводят эффективное количество пептида GLYX, например, GLYX-13. В другом варианте реализации изобретения, предусматривается способ лечения эпилепсии, включающий стадию, в которой вводят эффективное количество пептида GLYX, например, GLYX-13.
[0076] В дополнение к сердечно-сосудистым состояниям, особы, страдающие от мигрени с аурой, могут иметь повышенный риск других неврологических и/или физиологических состояний и расстройств. Было показано, например, что совпадение мигрени с аурой с глубокой депрессией или попыткой самоубийства повышает риск развития неспровоцированного судорожного припадка (Hesdorffer et al., Epilepsy Res. 75 (2-3): 220-223, 2007). Другие состояния, ассоциированные с мигренью с аурой, включают значительно повышенные маркеры активности NO, повышенную частоту случаев депрессии и значительно повышенную, по сравнению с населением в целом, корреляцию генетического биомаркера с инсультом (Etminan et al., № MJ 330 (7482): 63, 2005). Особа, страдающая мигренью имеющая, или имеющая повышенный риск, любого из этих состояний, может принимать лекарственные средства для лечения или ведения этих болезней, и такие лекарственные средства могут нежелательно взаимодействовать с используемыми в настоящее время лекарственными средствами для лечения мигрени с аурой. Как показано в данном документе, некоторые из этих состояний имеют противопоказания к триптановой терапии (например, инсульт и терапия суматриптаном). Более того, Управление по контролю за пищевыми продуктами и медикаментами США (FDA) выпустило в 2006 г. медицинскую памятку, касающуюся серотонинового синдрома, представляющего собой опасное для жизни состояние, которое может возникать при использовании триптана вместе с определенными антидепрессантами, являющимися ингибиторами повторного поглощения серотонина (SSRI) или селективными ингибиторами повторного поглощения серотонина/норэпинефрина (SNRI). Соответственно, способы, описанные в данном документе, могут быть использованы для лечения пациентов с депрессией или пациентов, страдающих от, или имеющих повышенный риск, инсульта.
Дозировки
[0077] Дозировка любых композиций в соответствии с настоящим описанием будет меняться в зависимости от симптомов, возраста и веса тела пациента, природы и тяжести расстройства, требующего лечения или профилактики, пути введения и формы композиции по изобретению. Любая из композиций по изобретению может быть введена в виде разовой дозы или в виде кратных доз. Дозировки композиций в соответствии с настоящим описанием могут быть легко определены методами, известными квалифицированным специалистам в данной области техники, или как описано в данном документе. В общем, удовлетворительные результаты могут быть получены при введении соединения человеку в суточной дозировке, составляющей, например, от 0,05 мг до 3000 мг (в пересчете на твердую форму), например, от около 10 мг до около 500 мг, или например, от около 1 до около 200 мг/кг. Диапазоны доз включают, например, значения в пределах 10-1000 мг (например, 50-800 мг). В некоторых вариантах реализации изобретения, вводят 50, 100, 150, 200, 225, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 или 1000 мг соединения. Как альтернативный вариант, дозируемое количество может быть рассчитано с использованием веса тела пациента. Например, доза соединения, или его фармацевтической композиции, вводимая пациенту, может иметь значение в диапазоне 1-500 мг/кг (например, 5-250 мг/кг). В типовых неограничительных вариантах реализации изобретения, доза может иметь значение в диапазоне 5-200 мг/кг (например, 1, 2, 2,5, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 мг/кг) или в диапазоне 15-100 мг/кг (например, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мг/кг). В типовых неограничительных вариантах реализации изобретения, доза может иметь значение в диапазоне 1-15 мг/кг, 50-100 мг/кг, 60-90 мг/кг, или 70-80 мг/кг.
[0078] GLYX-13 может обеспечивать высокий терапевтический индекс. Например, GLYX-13 может быть терапевтически эффективным при внутривенном (в/в) или подкожном введении дозы в диапазоне от около 1 до около 10 мг/кг, от около 10 до около 200 мг/кг, например, около 30 мг/кг, около 75 мг/кг, или около 100 мг/кг. В некоторых вариантах реализации изобретения, атаксия не возникает, например, при дозе 500 мг/кг внутривенно.
[0079] Терапевтически эффективное количество пептида GLYX, необходимое для использования в терапии, меняется в зависимости от формы состояния, лечение которого проводится, желательной продолжительности времени лечения, возраста и состояния пациента, и в конечном счете определяется лечащим врачом. Желательная доза может быть удобно введена в виде разовой дозы, сохраняющей эффективность в течение двух недель, одной недели, 6, 5, 4, 3, 2 или 1 дня, или в виде кратных доз, которые вводят с подходящими интервалами, например, в виде двух, трех, четырех или больше кратных доз в день.
[0080] Может существовать необходимость в определении эффективной дозы или количества, и любых возможных эффектов, влияющих на определение моментов времени введения композиции для любой конкретной композиции в соответствии с данным документом. Это может осуществляться с помощью рутинного эксперимента, как описано в данном документе, с использованием одной или нескольких групп животных (предпочтительно, по меньшей мере 5 животных в группе), или путем проведения испытаний на людях, при необходимости. Эффективность любой композиции по изобретению и способ лечения или профилактики можно оценить путем введения композиции и оценки эффекта введения путем измерения одного или нескольких соответствующих показателей, и сравнения значений этих показателей после проведения лечения со значениями этих же показателей до лечения.
[0081] Точное время введения и количество любой конкретной композиции по изобретению, которые обеспечивают наиболее эффективное лечение данного пациента, будут зависеть от активности, фармакокинетических характеристик и биодоступности композиции по изобретению, физиологического состояния пациента (включая возраст, пол, тип и стадию болезни, общее физическое состояние, восприимчивость к данной дозировке и типу медикаментозного лечения), пути введения и т.п. Приведенные в данном документе рекомендации могут быть использованы для оптимизации лечения, например, определения оптимального времени введения и/или количества, не выходящей за рамки рутинных экспериментов, заключающихся в контроле состояния субъекта и регулировке дозировки и/или времени введения.
[0082] Во время проведения лечения субъекта, здоровье пациента можно контролировать путем измерения одного или нескольких соответствующих показателей в предварительно определенные моменты времени в период проведения лечения. Лечение, включая состав, количества, время введения и технологию приготовления композиции, можно оптимизировать в соответствии с результатами такого контроля. Можно проводить периодические повторные осмотры пациента для определения степени улучшения путем измерения тех же параметров. На основании таких повторных определений может проводиться коррекция количества (количеств) вводимой композиции по изобретению и, возможно, времени введения.
[0083] Лечение может начинаться с низких дозировок, меньших, чем оптимальная доза соединения. После этого, дозировка может повышаться небольшими шагами до достижения оптимального терапевтического эффекта.
[0084] Использование композиций по изобретению может приводить к снижению требуемой дозировки любого индивидуального агента, входящего в состав композиций, поскольку начало и продолжительность эффекта действия разных агентов могут налагаться.
[0085] Токсичность и терапевтическая эффективность композиций по изобретению могут быть определены с помощью стандартных фармацевтических процедур на клеточных культурах или экспериментальных животных, например, для определения LD50 и ED50.
[0086] Данные, полученные в результате анализов клеточных культур и исследований на животных, могут быть использованы при составлении композиций в диапазоне дозировок, предназначенном для людей. Дозировка любой композиции по изобретению, предпочтительно, находится в диапазоне значений концентраций в кровообращении, включающем ED50, с незначительной токсичностью или без токсичности. Дозировка может меняться в этом диапазоне в зависимости от используемой формы дозировки и используемого пути введения. Для композиций в соответствии с данным документом, терапевтически эффективная доза может быть сначала оценена на основании анализов на клеточных культурах.
[0087] В некоторых вариантах реализации изобретения, пептид GLYX вводят в качестве профилактического средства (т.е., до фазы продрома). В некоторых вариантах реализации изобретения, пептид GLYX вводят во время продрома. В некоторых вариантах реализации изобретения, пептид GLYX вводят при ауре. "При ауре" означает любое время после появления ауры и до начала мигренозной боли. В некоторых вариантах реализации изобретения, пептид GLYX вводят после начала мигренозной боли. В некоторых вариантах реализации изобретения, пептид GLYX вводят во время постдрома, например, для уменьшения его симптомов.
[0088] Термин "предотвращать", в используемом в данном документе значении, относится к профилактическому лечению или лечению, предотвращающему появление одного или нескольких симптомов или состояний болезни, расстройства или состояний, описанных в данном документе (например, боль или мигрень с аурой и с аллодинией или без нее). Профилактическое лечение может быть начато, например, до ("предэкспозиционная профилактика") или после ("постэкспозиционная профилактика") события, предшествующего началу проявления болезни, расстройства или состояний (например, при мигреневой ауре). Профилактическое лечение, включающее стадию, в которой вводят пептид GLYX, описанный в данном документе, или его фармацевтически приемлемую соль или сольват, или его фармацевтическую композицию, может быть острым, кратковременным или хроническим. Вводимые дозы могут меняться в ходе профилактического лечения. См. также: Kaniecki et al., "Treatment of Primary Headache: Preventive Treatment of Migraine." B: Standards of Care for Headache Diagnosis and Treatment. Chicago (IL): National Headache Foundation; 2004, p. 40-52.
Композиции
[0089] Пептиды GLYX в соответствии с данным документом могут быть введены с помощью различных средств, в зависимости от их предполагаемого применения, как хорошо известно в данной области техники. Например, если композиции в соответствии с данным документом должны быть введены перорально, они могут быть приготовлены в виде таблеток, капсул, гранул, порошков или сиропов. Как альтернативный вариант, композиции в соответствии с данным документом могут быть введены парентерально в виде инъекций (внутривенных, внутримышечных или подкожных), препаратов для капельного вливания, или суппозиториев. Для применения путем введения через слизистую оболочку глаза, композиции в соответствии с данным документом могут быть приготовлены в виде глазных капель или глазных мазей. Эти композиции могут быть приготовлены с помощью обычных средств и, при желании, композиции могут быть смешаны с любой обычной добавкой, такой как эксципиент, связующее, разрыхляющее вещество, смазывающее вещество, модификатор лекарственных веществ, солюбилизатор, суспендирующая добавка, эмульгатор или агент для нанесения покрытия.
[0090] Также может быть введена ДНК, кодирующая пептиды GLYX, включенная в экспрессионный вектор, с использованием любых известных способов введения, для экспрессии пептидов GLYX in vivo.
[0091] В композициях в соответствии с данным изобретением, в состав рецептуры композиции могут входить смачивающие агенты, эмульгаторы и смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красящие вещества, антиадгезионные агенты, агенты для нанесения покрытий, подсластители, вкусовые вещества и ароматизаторы, консерванты и антиоксиданты.
[0092] Композиции по изобретению могут быть пригодны для орального, местного (включая буккальное и сублингвальное), ректального, вагинального, в виде аэрозоля и/или парентерального введения. Композиции могут удобно иметь вид унифицированных дозированных форм и могут быть приготовлены любыми способами, хорошо известными специалистам в области фармацевтики. Количество композиции, которое может быть объединено с материалом носителя, для получения разовой дозы, меняется в зависимости субъекта, получающего лечение, и конкретного способа введения.
[0093] Способы приготовления таких композиций включают стадию объединения композиций в соответствии с настоящим описанием с носителем и, необязательно, одним или несколькими вспомогательными ингредиентами. В общем, композиции получают путем равномерного и тщательного смешивания агентов с жидкими носителями, или тонкодисперсными твердыми носителями, или обоими, и затем, при необходимости, формования продукта.
[0094] Композиции, пригодные для орального введения, могут иметь форму капсул, крахмальных капсул, пилюль, таблеток, леденцов (использующих в качестве основы вкусовое вещество, обычно сахарозу, и гуммиарабик или трагакант), порошков, гранул, или раствора или суспензии в водной или неводной жидкости, или жидкой эмульсии типа "масло в воде" или "вода в масле", или эликсира или сиропа, или пастилок (использующих инертную основу, такую как желатин и глицерин, или сахарозу и гуммиарабик), каждая из которых содержит заданное количество композиции по изобретению в качестве активного ингредиента. Композиции в соответствии с данным документом могут быть также введены в виде болюса, электуария или пасты.
[0095] В твердых дозированных формах для орального введения (капсулы, таблетки, пилюли, драже, порошки, гранулы и т.п.), композицию по изобретению смешивают с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия или дикальцийфосфат, и/или любой из следующих материалов: (1) наполнители или инертные наполнители, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связующие, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или гуммиарабик; (3) увлажняющие вещества, такие как глицерин; (4) разрыхляющие вещества, такие как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; (5) вещества, замедляющие растворение, такие как парафин; (6) ускорители всасывания, такие как четвертичные аммониевые соединения; (7) смачивающие агенты, такие как, например, цетиловый (acetyl) спирт и глицеринмоностеарат; (8) абсорбенты, такие как каолиновая и бентонитовая глина; (9) смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и их смеси; и (10) красящие вещества. В случае капсул, таблеток и пилюль, композиции могут также содержать буферные агенты. Твердые композиции схожего типа также могут быть использованы в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочные сахара, а также высокомолекулярные полиэтиленгликоли и т.п.
[0096] Таблетка может быть приготовлена путем прессования или формования, необязательно, с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки могут быть приготовлены с использованием связующего (например, желатина или гидроксипропилметилцеллюлозы), смазывающего вещества, инертного разбавителя, консерванта, разрыхлителя (например, крахмалгликолята натрия или сшитой карбоксиметилцеллюлозы натрия), поверхностно-активного или диспергирующего агента. Формованные таблетки могут быть приготовлены путем формования в подходящей машине смеси композиции по изобретению, увлажненной инертным жидким разбавителем. Таблетки и другие твердые дозированные формы, такие как драже, капсулы, пилюли и гранулы, могут необязательно иметь надрезы или быть изготовлены с покрытиями или оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные специалистам в области приготовления фармацевтических композиций.
[0097] Жидкие дозированные формы для орального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к композиции по настоящему изобретению, жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в данной области техники, такие как, например, воду или другие растворители, солюбилизаторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этиловый эфир угольной кислоты, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное, масло зародышей, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана, циклодекстрины и их смеси.
[0098] Суспензии, в дополнение к композициям по изобретению, могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическую целлюлозу, мета-гидроксид алюминия, бентонит, агар-агар и трагакант, и их смеси.
[0099] Композиции для ректального или вагинального введения могут быть приготовлены в виде суппозитория, который может быть изготовлен путем смешения композиции по настоящему изобретению с одним или несколькими пригодными нераздражающими эксципиентами или носителями, включающими, например, какао-масло, полиэтиленгликоль, воск для суппозиториев или салицилат, которые являются твердыми при комнатной температуре, но жидкими при температуре тела и, поэтому, будут плавиться в полостях тела и высвобождать активный агент. Композиции, пригодные для вагинального введения, также включают пессарии, тампоны, кремы, гели, пасты, пенки или композиции спреев, содержащие носители, считающиеся пригодными для использования в данной области техники.
[00100] Дозированные формы для трансдермального введения композиций по изобретению включают порошки, спреи, жидкие мази, пасты, кремы, примочки, гели, растворы и пластыри.
[00101] Композиции для местного введения в глаз по настоящему изобретению могут иметь форму растворов, гелей, жидких мазей, суспензий или твердых вставок, приготовленных таким образом, чтобы разовая доза содержала терапевтически эффективное количество активного компонента или некоторое кратное ему количество, в случае комбинированной терапии.
[00102] Фармацевтические композиции по настоящему изобретению, пригодные для парентерального введения, включают композицию по изобретению в комбинации с одним или несколькими фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями, или стерильными порошками, которые могут быть восстановлены до стерильных растворов или дисперсий для инъекций непосредственно перед использованием, и которые могут содержать антиоксиданты, буферы, бактериостатические средства, растворенные вещества, делающие композицию изотонической с кровью предполагаемого реципиента, или суспендирующими агентами или загустителями.
[00103] Примеры пригодных водных и неводных носителей, которые могут быть использованы в фармацевтических композициях по настоящему изобретению, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), и их пригодные смеси, растительные масла, такие как оливковое масло, и пригодные для инъекций органические эфиры, такие как этилолеат, и циклодекстрины. Требуемая текучесть может поддерживаться, например, путем использования материалов для нанесения покрытий, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий, и путем использования поверхностно-активных веществ.
Комбинированная терапия
[00104] Любые пептиды GLYX, описанные в данном документе (например, GLYX-13), могут быть использованы по отдельности или в комбинации с другими агентами для лечения или предотвращения любых болезней или состояний, описанных в данном документе. Например, в некоторых методах комбинированного лечения, дозировки одного или нескольких терапевтических соединений могут быть снижены по сравнению со стандартными дозировками при их введении по отдельности.
[00105] Способы по изобретению также включают стадию, в которой совместно вводят пептид GLYX с опиоидом, антидепрессантом, противоэпилептическим средством, нестероидным противовоспалительным лекарственным средством (NSAID), агонистом рецептора серотонина 5HT1B/1D, антагонистом. N-метил-D-аспартата, или противовоспалительным соединением.
[00106] Описание настоящего изобретения относится, в некоторых вариантах реализации изобретения, к использованию пептида или пептидов GLYX, отдельно или в комбинации с одним или несколькими другими методами лечения антидепрессантами, такими как трициклические антидепрессанты, ингибитор моноаминоксидазы (MAO-I), селективный ингибитор повторного поглощения серотонина (SSRI), и двойные и тройные ингибиторы поглощения и/или анксиолитические лекарственные средства, для производства медикаментов для лечения мигрени (например, эпизодической мигрени, хронической мигрени, ретинальной мигрени, офтальмоплегической мигрени, ацефалгической мигрени, мигренозного расстройства, менструальной мигрени, абдоминальной мигрени, детских периодических синдромов или кластерной головной боли). Типичные примеры лекарственных средств, которые могут быть использованы в комбинации с пептидом GLYX, включают анафранил, адалин, авентил, элавил, норпрамин, памелор, пертофран, синекван, сурмонтил, тофранил, вивактил, парнат, нардил, марплан, целекса, лексапро, лувокс, паксил, прозак, золофт, веллбутрин, эффексор, ремерон, цимбалта, дезирел (тразодон) и лудиомилл.
[00107] В некоторых вариантах реализации изобретения, опиоид выбирают из группы, состоящей из алфентанила, буторфанола, бупренорфина, декстроморамида, дезицина, декстропропоксифена, кодеина, дигидрокодеина, дифеноксилата, эторфина, фентанила, гидрокодона, гидроморфона, кетобемидона, топерамида, леворфанола, левометадона, мептазинола, метадона, морфина, морфин-6-глюкуронида, налбуфина, налоксона, оксикодона, оксиморфона, пентазоцина, петидина, пиритрамида, пропоксифена, ремифентанила, сульфентанила, тилидина и трамадола.
[00108] В некоторых вариантах реализации изобретения, антидепрессант выбирают из группы, состоящей из адиназолама, алапроклата, аминептина, комбинации амитриптилин/хлордиазепоксид, атипамезола, азамиансерина, базинаприна, бефуралина, бифемелана, бинодалина, бипенамола, брофаромина, кароксазона, церикламина, цианопрамина, цимоксатона, циталопрама, клемепрола, кловоксамина, клазепинила, деанола, демексиптилина, дибензепина, дотиепина, дроксидопа, энефексина, эстазолама, этоперидона, фемоксетина, фенгабина, фезоламина, флуотрацена, идазоксана, индалпина, инделоксазина, иприндола, левопротилина, литиума, литоксетина, лофепрамина, медифоксамина, метапрамина, метралиндола, миансерина, милнаципрана, минаприна, миртазапина, монтирелина, небрацетама, нефопама, ниаламида, номифензина, норфлуоксетина, оротирелина, оксафлозана, пиназепама, пирлиндола, пизотилина, ритансерина, ролипрама, серклоремина, сетиптилина, сибутрамина, сулбутиамина, сулпирида, тенилоксазина, тозалинона, тиролиберина, тианептина, тифлукарбина, тразодона, тофенацина, тофизопама, толоксатона, томоксетина, вералиприда, вилоксазина, виквалина, зимелидина и зометапина.
[00109] В некоторых вариантах реализации изобретения, противоэпилептическое средство выбирают из группы, состоящей из карбамазепина, флупиртина, габапентина, ламотригина, окскарбазепина, фенитоина, ретигабина, топирамата и валпроата.
[00110] В некоторых вариантах реализации изобретения, нестероидное противовоспалительное лекарственное средство (NSAID) выбирают из группы, состоящей из ацеметацина, аспирина, целекоксиба, деракоксиба, диклофенака, дифлунисала, этензамида, этофенамата, эторикоксиба, фенопрофена, флуфенаминовой кислоты, флурбипрофена, лоназолака, лорноксикама, ибупрофена, индометацина, изоксикама, кебузона, кетопрофена, кеторолака, напроксена, набуметона, нифлуминовой кислоты, сулиндака, толметина, пироксикама, меклофенамовой кислоты, мефенамовой кислоты, мелоксикама, метамизола, мофебутазона, оксифенбутазона, парекоксиба, фенидона, фенилбутазона, пироксикама, пропацетамола, пропифеназона, рофекоксиба, салициламида, супрофена, тиапрофеновой кислоты, теноксикама, валдекоксиба, 4-(4-циклогексил-2-метилоксазол-5-ил)-2-фторбензолсульфонамида, N-[2-(циклогексилокси)-4-нитрофенил]метансульфонамида, 2-(3,4-дифторфенил)-4-(3-гидрокси-3-метилбутокси)-5-[4-(метилсульфонил)фенил]-3(2Н)-пиридазинона и 2-(3,5-дифторфенил)-3-[4-(метилсульфонил)фенил]-2-циклопентен-1-она.
[00111] В некоторых вариантах реализации изобретения, агонист рецептора серотонина 5HT1B/1D выбирают из группы, состоящей из элетриптана, фроватриптана, наратриптана, ризатриптана, суматриптана и золмитриптана.
[00112] В некоторых вариантах реализации изобретения, антагонист N-метил-D-аспартата выбирают из группы, состоящей из амантадина, аптиганела, бесонпродила, будипина, конантокина G, делуцемина, дексанабинола, декстрометорфана, декстропропоксифена, фелбамата, флуорофелбамата, гациклидина, глицина, ипеноксазона, кайтоцефалина, кетамина, кетобемидона, ланицемина, ликостинела, мидафотела, мемантина, D-метадона, D-морфина, милнаципрана, нерамексана, орфенадрина, ремацемида, сульфазоцина, FPL-12495 (метаболит рацемида), топирамат, (αR)-α-амино-5-хлор-1-(фосфонометил)-1Н-бензимидазол-2-пропановой кислоты, 1-аминоциклопентанкарбоновой кислоты, [5-(аминометил)-2-[[[(5S)-9-хлор-2,3,6,7-тетрагидро-2,3-диоксо-1Н-,5Н-пиридо[1,2,3-de]хиноксалин-5-ил]ацетил]амино]фенокси]уксусной кислоты, α-амино-2-(2-фосфоноэтил)циклогексанпропановой кислоты, α-амино-4-(фосфонометил)бензолуксусной кислоты, (3Е)-2-амино-4-(фосфонометил)-3-гептеновой кислоты, 3-[(1Е)-2-карбокси-2-фенилэтенил]-4,6-дихлор-1Н-индол-2-карбоновой кислоты, 8-хлор-2,3-дигидропиридазино[4,5-b]хинолин-1,4-дион-5-оксидной соли с 2-гидрокси-N,N,N-триметилэтанаммонием, N'-[2-хлор-5-(метилтио)фенил]-N-метил-N-[3-(метилтио)фенил]гуанидина, N'-[2-хлор-5-(метилтио)фенил]-N-метил-N-[3-[(R)-метилсульфинил]фенил]гуанидина, 6-хлор-2,3,4,9-тетрагидро-9-метил-2,3-диоксо-1Н-индено[1,2-b]пиразин-9-уксусной кислоты, 7-хлортиокинуреновой кислоты, (3S,4aR,6S,8aR)-декагидро-6-(фосфонометил)-3-изохинолинкарбоновой кислоты, (-)6,7-дихлор-1,4-дигидро-5-[3-(метоксиметил)-5-(3-пиридинил)-4-Н-1,2,4-триазол-4-ил]-2,3-хиноксалиндиона, 4,6-дихлор-3-[(Е)-(2-оксо-1-фенил-3-пирролидинилиден)метил]-1Н-индол-2-карбоновой кислоты, rel-(2R,4S)-5,7-дихлор-1,2,3,4-тетрагидро-4-[[(фениламино)карбонил]амино]-2-хинолинкарбоновой кислоты, rel-(3R,4S)-3,4-дигидро-3-[4-гидрокси-4-(фенилметил)-1-пиперидинил]-2Н-1-бензопиран-4,7-диола, 2-[(2,3-дигидро-1Н-инден-2-ил)амино]ацетамида, 1,4-дигидро-6-метил-5-[(метиламино)метил]-7-нитро-2,3-хиноксалиндиона, [2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты, (2R,6S)-1,2,3,4,5,6-гексагидро-3-[(2S)-2-метоксипропил]-6,11,11-триметил-2,6-метано-3-бензазоцин-9-ола, 2-гидрокси-5-[[(пентафторфенил)метил]амино]бензойной кислоты, 1-[2-(4-гидроксифенокси)этил]-4-[(4-метилфенил)метил]-4-пиперидинола, 1-[4-(1Н-имидазол-4-ил)-3-бутинил]-4-(фенилметил)пиперидина, 2-метил-6-фенилэтинил)пиридина, 3-(фосфонометил)-L-фенилаланина и 3,6,7-тетрагидро-2,3-диоксо-N-фенил-1Н,5Н-пиридо[1,2,3-dе]хиноксалин-5-ацетамида.
[00113] В некоторых вариантах реализации изобретения, противовоспалительное соединение выбирают из группы, состоящей из аспирина, целекоксиба, кортизона, деракоксиба, дифлунисала, этерикоксиба, фенопрофена, ибупрофена, кетопрофена, напроксена, преднизолона, сулиндака, толметина, пироксикама, мефенамовой кислоты, мелоксикама, фенилбутазона, рофекоксиба, супрофена, валдекоксиба, 4-(4-циклогексил-2-метилоксазол-5-ил)-2-фторбензолсульфонамида, N-[2-(циклогексилокси)-4-нитрофенил]-метансульфонамида, 2-(3,4-дифторфенил)-4-(3-гидрокси-3-метилбутокси)-5-[4-(метилсульфонил)фенил]-3(2Н)пиридазинона и 2-(3,5-дифторфенил)-3-[4-(метилсульфонил)фенил]-2-циклопентен-1-она.
[00114] Раскрытое изобретение имеет многочисленные аспекты, проиллюстрированные следующими неограничительными примерами.
ПРИМЕРЫ
Пример 1
[00115] В исследованиях, описанных в данном документе, использовали внеклеточный многопозиционный электрофизиологический мониторинг скорости распространения РД, и двухфотонную лазерную сканирующую микроскопию для визуализации, в реальном масштабе времени, изменений размера дендритных шипиков, вызванных РД, в срезах гиппокампа in vitro. Исследовали эффект нового функционального частичного агониста глицинового сайта GLYX-13 рецептора NMDAR на пороговое значение и скорость распространения РД, и эффекты реального времени РД на морфологию дендритного шипика. GLYX-13 время от времени полностью предотвращал индукцию РД локальным увеличением внеклеточной концентрации калия, и стабильно замедлял ее скорость распространения. Прохождение РД через поле СА1 гиппокампа вызывало быстрое сокращение дендритных шипиков, которое обращалось после восстановления нейрональной деполяризации. GLYX-13 улучшал скорость и степень возвращения дендритных шипиков к их оригинальным размерам и положениям после РД, что указывает на то, что данное лекарственное средство и другие вещества, модулирующие активность рецептора NMDA, могут защищать синаптические соединения в головном мозге от возможных повреждений в результате повторяющихся приступов мигрени.
Общие методы
Лекарственные средства
[00116] Все растворы для наружного применения и пэтч-пипеткок готовили с использованием деионизированной дистиллированной воды (сопротивление >18 Мом * см-2; Milli-Q system). Химические вещества для изготовления растворов для вне- и внутриклеточного применения были приобретены у фирмы Sigma-Aldrich (St. Louis, МО, USA). AlexaFluor 594 был приобретен у фирмы Molecular Probes.
Приготовление срезов и внеклеточная регистрация
[00117] Эксперименты проводили на срезах гиппокампа крыс Sprague-Dawley® в возрасте от 14 до 21 дней (Taconic Farms, Hudson, NY). Крыс подвергали глубокой анестезии изофлураном, умерщвляли, и головной мозг быстро извлекали и помещали в оксигенированную (95% О2 - 5% СО2) охлажденную льдом искусственную цереброспинальную жидкость (иЦСЖ), содержащую (в ммоль/л):, 126 NaCl, 2,5 KCl, 2,6 СаСl2, 1,3 MgCl2, 1,25 NaH2PO4, 26 NaHCO3 и 11 глюкозы. Головной мозг подвергали гемисекции, фронтальные доли отсекали, и индивидуальные полушария приклеивали с помощью цианоакрилатного клея к предметному столику, погруженному в охлажденную льдом иЦСЖ, непрерывно оксигенируемую во время приготовления срезов. Корональные срезы толщиной 400 мкм, включающие гиппокамп, разрезали с использованием вибрационного микротома (Leica 1200s), и переносили в сопрягаемую клапанную камеру для инкубации при комнатной температуре в течение минимум 1 часа перед переносом в сопрягаемую камеру типа Haas (Haas-style interface chamber) для регистрации при 32°С. Проводили перфузию срезов с помощью иЦСЖ (4 мл/мин; иЦСЖ ммоль/л: NaCl 126; KCl 3; NaH2PO4 1,25; MgCl 1,3; СаСl2 2,5; NaHCO3 26; глюкоза 10), насыщенной 95% O2/5% СO2 перед началом эксперимента, и все лекарственные средства наносили из ванны.
[00118] Внеклеточную регистрацию проводили с использованием прибора MultiClamp 700В (Axon Instruments) с Clampex (v. 9), фильтрация на 1 кГц и дискретизация при 3 кГц. Низкоомные отводящие электроды (1-2 МОм после наполнения иЦСЖ), изготовленные из тонкостенного боросиликатного стекла, вставляли в область апикального дендрита терминального поля коллатерали Шаффера в лучистом слое поля СА1, на расстоянии приблизительно 150 мм от пипетки, инициирующей РД, для мониторинга распространения РД. Регистрационная камера для погруженных образцов была установлена на вертикальном микроскопе Zeiss Axioskop 2FS, оснащенном инфракрасной дифференциальной интерференционно-контрастной (DIC) оптикой. Для визуализации изменений свечения среза, вызванных РД, использовали 10х объектив. Изменения свечения регистрировали каждые 100 мс с помощью охлаждаемой ПЗС-камеры (CoolSNAP HQ), контролируемой с помощью системы управления PTI. Электрофизиологические данные анализировали с помощью программы Clampfit 9. Данные визуализации оцифровывали и реконструировали с использованием программы Image J (NIH).
[00119] Биполярный стимулирующий электрод из нержавеющей стали (FHC, Bowdoin, ME) помещали в коллатерально-коммиссуральные волокна Шаффера в поле СА3, и прикладывали импульсный ток с интенсивностью стимула, рассчитанной на достижение приблизительно 50% от максимального полевого возбуждающего постсинаптического потенциала пВПСП через каждые 30 с (от 50 до 100 пА; длительность 100 мкс). Электрическое стимулирование изолятора ISO-Flex контролировали с помощью восьмиимпульсного генератора Master (AMPI, Jerusalem, Israel) и инициировали с помощью Multiclamp 700В (Molecular Devices, Sunnyvale, СА). Сигналы оцифровывали с помощью Digidata 1322 и регистрировали с использованием усилителя Multiclamp 700В. Тангенс угла наклона зависимости пВПСП измеряли методом линейной интерполяции на участке 20-80% от максимального обратного отклонения, и величина наклона должна была оставаться стабильной в пределах плюс-минус 10% в течение по меньшей мере 15 мин перед началом эксперимента. Данные анализировали с использованием Clampfit (Version 9; Axon Instrument) на IBM-совместимом персональном компьютере. Вызванные пВПСП (50% от максимальной амплитуды, 2-4 мВ) регистрировали в поле апикального дендрита в лучистом слое в течение по меньшей мере 30 мин стабильного базового периода.
Индукция распространяющейся депрессии гиппокампа
[00120] Острые корональные срезы гиппокампа переносили в регистрационную камеру для погруженных образцов на предметном столике микроскопа и проводили перфузию подогретой иЦСЖ (32°С), причем уровень внеклеточного [K+] увеличивался до 8 ммоль/л при скорости перфузии 3 мл/мин. Распространяющуюся депрессию инициировали выдавливанием 3М KCl из стеклянной пипетки. Импульсы давления 55-69 кПа (8-10 psi) продолжительностью 50-100 мс создавали с помощью Picospritzer II (Parker Hannifin, Hollis, NH). Значения сопротивления пипетки, наполненной 3М KCl, составляли 2±0,2 МОм.
Анализ сокращения/восстановления дендритного шипика методом динамической визуализации
[00121] После накачки пирамидального нейрона СА1 в срезе гиппокампа Alexa Fluor 594 (100 мкмоль/л) в течение 15 минут, третичные дендриты визуализировали с использованием специально адаптированного двухфотонного лазерного сканирующего микроскопа Olympus BX61WI, оснащенного 60х/1,1 нА водноиммерсионным инфракрасным объективом с 4х цифровым увеличением, как описано ранее (Zhang et al., 2008). Использовали режим сканирования XYZ в диапазоне +/-3 мкм от слоя фокусировки во избежание отклонений при перемещении, с интервалом шага по оси z 0,5 мкм, и каждое изображение формировалось в течение 0,45 секунд, при времени прохождения однорядного глубинного профиля 7 секунд. Принимались повышенные меры предосторожности для того, чтобы избежать как насыщения флуоресценции, так и появления каких-либо признаков фототоксичности малых дендритных шипиков от избытка возбуждающего света. Измерения глубинных профилей повторяли с интервалами 5 мин для уменьшения возможного фотообесцвечивания красителя и фототоксичности. Для возбуждения использовали лазер Mai/Tai (Solid-State Laser, Mountain View, СА), настроенный на длину волны 810 нм, и получением изображений управляли с помощью прикладной программы Olympus FluoviewFV300 (Olympus America, Melville, NY). Эпифлуоресценцию детектировали с максимально раскрытой точечной дифрагмой фотоумножителей конфокальной лазерной сканирующей головки, и спектральное окно эмиссии оптимизировали по отношению сигнал-фон. В пути трансфлуоресценции использовали 565 нм дихроическое зеркало для разделения зеленой и красной флуоресценции, и пропускали через эмиссионные фильтры HQ525/50 и HQ605/50, соответственно, для устранения пропускаемого или отраженного света возбуждения (Chroma Technology, Rockingham, VT), и детектировали одновременно двумя фотоумножителями. На Фигурах представлены сжатые изображения полного 6 мкм Z-профиля, и эти проекции были использованы для расчета интенсивности как показателя объема шипика.
Анализы данных
[00122] Регистрируемые сигналы пропускали через восьмиполюсный бесселевский низкочастотный фильтр с частотой отсечки 1 кГц и дискретизировали с помощью Clampex (V. 9) с интервалом 100 мкс. После определения значений тангенса угла наклона пВПСП с помощью Clampfit (V. 9), данные дополнительно обрабатывали с помощью программы Origin 6.1 (Microcal Software, MA) и готовили презентации с помощью CorelDraw 10 (Corel, Ottawa, Ontario, Canada). Все данные анализировали методом однофакторного дисперсионного анализа (ANOVA) или с помощью t-критерия Стьюдента с использованием прикладной программы SPSS (SPSS Inc., Chicago, IL). Уровень значимости был задан равным Р<0,05. Данные представлены как среднее ± стандартная ошибка средней (SEM) для всех экспериментов.
Результаты
Фокальная распространяющаяся депрессия, индуцированная высоким [K+], в поле СА1 срезов гиппокампа
[00123] В искусственной цереброспинальной жидкости (иЦСЖ) с уровнем [K+]о, повышенным до 8 ммоль/л при 32°С, однократное локальное выдавливание (100 мс) 3М [K+]о на поле в поле СА1 лучистого слоя (Фигура 1, слева вверху) с большой вероятностью индуцировало РД, которая распространялась со скоростью распространения 9±5,4 мм/мин (n=16) по всему полю СА1 гиппокампа. РД, характеризующаяся отрицательным сдвигом потенциала поля (Фигура 1, вверху справа) продемонстрировала максимальный сдвиг, равный -8±1,5 мВ (n=30) в синаптическом слое лучистого слоя поля СА1 гиппокампа, который, как правило, продолжался более 45 секунд.
[00124] РД индуцировали каждые 10 минут для проверки того, будет ли область отрицательного сдвига потенциала (Фигура 1, вверху справа, заштрихованная область), представляющая собой меру эффективной величины и продолжительности проводимости K+ во внеклеточном пространстве, оставаться стабильной при повторных РД. Хотя области отрицательного сдвига потенциала, зарегистрированные с инициирующего электрода, были больше, чем у дистального отводящего электрода, расположенного на расстоянии 600 мкм (Фигура 1, внизу), не наблюдалось значительных различий в амплитуде или скорости распространения индивидуальных эпизодов последовательно повторяющихся РД, вызываемых с интервалами 10 минут на любом из участков (критерий множественного сравнения Бонферрони, Р>0,20). Эти результаты показывают, что воспроизводимые отрицательные сдвиги потенциала РД могут стабильно повторно вызываться в поле СА1 гиппокампа, по меньшей мере первые десять (раз).
GLYX-13 угнетает распространение и увеличивает рефрактерный период распространяющейся депрессии гиппокампа
[00125] Для проверки гипотезы о том, что новый частичный агонист коагонистического сайта глицина рецептора NMDA, GLYX-13, может повышать порог или предотвращать РД путем регуляции активации рецептора NMDA в диапазоне физиологических значений и предотвращения избыточной активации, GLYX-13 наносили из ванны при 1, 10 или 50 мкмоль/л на срезы гиппокампа в течение 30 мин до кратковременного выброса высокого [K+] (1 ммоль/л в пэтч-пипетке) в лучистый слой поля СА1 и пытались вызвать РД. Зависимость доза-отклик строили на основании времени выброса высокого [K+] сначала в нативных срезах, и затем после 30-минутного нанесения в ванне GLYX-13 в каждой из трех тестируемых концентраций (1, 10 или 50 мкмоль/л), регистрируя при этом потенциал постоянного тока (DC) для детектирования РД.
[00126] После того как сначала были вызваны по меньшей мере три РД в не содержащей лекарственных препаратов иЦСЖ, проводили перфузию срезов GLYX-13 и продолжали вызывать РД через каждые десять минут. Как показано на Фигуре 2, сверху, для 10 мкмоль/л GLYX-13 не наблюдалось значительных различий между базовыми значениями для областей индивидуальных последовательных эпизодов РД в сайте инициации (критерий множественного сравнения Бонферрони, Р>0,20), что указывает на то, что GLYX-13 не влияет на инициирование РД.
[00127] Затем тестировали GLYX-13 с целью проверки, меняется ли соотношение амплитуд РД в ближнем (проксимальном) и дальнем (дистальном) участках регистрации при повторных РД. Проводили перфузию среза 10 мкмоль/л GLYX-13 и продолжали вызывать РД через каждые десять минут (Фигура 2, внизу). Критерий множественного сравнения Бонферрони (Р>0,20) снова показал отсутствие значительных различий между областями индивидуальных последовательных эпизодов РД в контрольных срезах. GLYX-13 не влиял на инициирование отрицательного сдвига потенциала РД на проксимальном участке регистрации.
[00128] Амплитуды РД на участке инициации коррелировали с площадями отрицательного сдвига потенциала РД на удаленном участке регистрации (Фигура 2, внизу). Таким образом, отношение проксимальной/дистальной площадей без GLYX-13 и в его присутствии было сопоставимым. Как показано на Фигуре 2, внизу, отношение площадей удаленного участка и участка инициирования резко снижалось в присутствии 10 мкмоль/л GLYX-13 при вызывании шестой РД (6-я РД). Двухфакторный дисперсионный анализ показал наличие трех значительных эффектов: 1) эффекты времени повторных РД в одном и том же срезе (F(1,12)=5,17, р<0,05) для всех экспериментов; 2) эффекты обработки лекарственным средством (F(1,12)=5,07, р<0,05); и 3) взаимодействие эффектов времени и обработки (F(1,12)=30,91, р<0,01). Эти результаты показывают, что повторяющиеся отрицательные сдвиги потенциала РД изменяют отношение амплитуд между удаленным участком и участком инициирования; и что это снижение заметно усиливалось GLYX-13. Эти результаты показывают, что GLYX-13 может в значительной степени подавлять распространение РД в головном мозге, особенно после многократных событий РД.
[00129] В ранее проведенных исследованиях было продемонстрировано, что GLYX-13 может ограничивать распространение РД путем уменьшения амплитуды отрицательного сдвига потенциала поля и замедления скорости проводимости, причем величина этих эффектов была наибольшей после многократных РД. В результате сокращения интервалов между инициированием РД было обнаружено, что каждая РД в контрольных срезах имеет абсолютный рефрактерный период, равный 3-4 минутам, до следующей успешной РД (n=7). 10 мкмоль/л GLYX-13 увеличивали этот рефрактерный период до 5-6 минут (n=6). Как показано на Фигуре 3, РД может быть успешно вызвана через пять минут после предшествующей РД в контрольном срезе (контроль), но не вызывается в срезе, обработанном GLYX 13 (GLYX-13 30').
Измерение распространения РД с использованием характеристических изменений оптической плотности, вызываемых индуцированными РД сдвигами объема внеклеточного пространства
[00130] РД вызывает глубокое сокращение объема внеклеточного пространства, поскольку жидкость устремляется в деполяризованные клетки, они набухают, и это можно заметить по изменению характеристической оптической плотности in vivo. Такие изменения интенсивности свечения также можно легко детектировать в срезах головного мозга с использованием дифференциальной интерференционной контрастной (DIC) микроскопии в проходящем свете. На Фигуре 4А показано, что "аура" РД в виде повышенной светимости расходится от инициирующей пипетки и распространяется по срезу, и может быть использована для расчета скорости проводимости РД (Фигура 4В). Временная зависимость повышенной светимости хорошо коррелирует с максимальным отрицательным сдвигом потенциала РД при использовании результатов электрофизиологических измерений. Таким образом, расчеты временной зависимости изменения свечения от расстояния дают точный и удобный способ измерения скорости проводимости РД.
[00131] Для определения того, будут ли повторные РД демонстрировать такую же скорость проводимости, проводили измерения изменений свечения в 5 точках, расположенных на расстоянии 150 мкм, как схематически показано в верхней части Фигуры 4А. Однофакторный дисперсионный анализ с повторными измерениями показал, что РД сохраняет стабильную скорость прохождения от Р1 до Р5 (F(5,35)=2,42, р>0,05) в индивидуальном срезе. Таким образом, может быть использована скорость прохождения от Р1 до Р5 для тестирования стабильности РД в последовательных эпизодах. Средняя скорость распространения РД составляла 9,07±0,55 мм/мин, со значениями в диапазоне от 7,54 до 11,14 мм/мин (n=16).
[00132] Для тестирования того, сохраняется ли при повторных эпизодах РД стабильная скорость, и влияет ли GLYX-13 на скорость проводимости РД, использовали дисперсионный анализ с повторными измерениями для анализа 6 последовательных РД, как показано на Фигуре 5. Анализ выявил значительные различия между контрольным и обработанным GLYX-13 срезами (F(1,50)=3,66, р<0,01). На последовательность РД приходилось 38,5% полной дисперсии, что указывает на то, что скорость распространения РД значительно замедляется с увеличением числа РД (F(5,50)=14,01, р<0,01). Хотя эффект GLYX-13 на скорость распространения РД по всем повторным РД не достигает уровня значимости по результатам двухфакторного дисперсионного анализа, наблюдается существенное взаимодействие между числом РД и обработкой GLYX-13 (F(5,50)=2,53, Р<0,05), указывающее на то, что GLYX-13 (закрашенные кружки) значительно снижает скорость распространения РД только к седьмой РД.
Распространяющаяся депрессия вызывает обратимое сокращение объема дендритных шипиков пирамидальных нейронов СА1.
[00133] Анатомическая микроархитектура дендритов пирамидальных нейронов в головном мозге является поразительно лабильной в ответ на различные стимулы. Было показано, что деполяризация, недостаточность кислорода/глюкозы и N-метил-D-аспартат вызывают сокращение дендритных шипиков пирамидальных нейронов СА1 гиппокампа in vitro. Для изучения отклика шипиков на РД, одиночные пирамидальные нейроны СА1 наполняли флуоресцентным красителем AlexaFluor-594 и визуализировали форму дендритного шипика с использованием стопки последовательных срезов по z-оси (с шагом 0,2 мкм, общая протяженность 5 мкм), полученных методом 2-фотонной лазерной сканирующей микроскопии. Через тридцать минут после достижения в результате накачки AlexaFluror-594 в пирамидальные нейроны СА1 равновесного распределения в нейроне, инициировали РД путем кратковременного выброса высокого [K+] (1М в пэтч-пипетке) в лучистый слой поля СА1 срезов гиппокампа, где аксоны коллатерали Шаффера контактируют с апикальными дендритами пирамидальных нейронов СА1. Как показано на Фигуре 6А и 6В, деполяризация, создаваемая РД, вызывает существенное сокращение шипиков, определяемое по амплитуде флуоресценции сложенной z-стопки, причем объем шипика полностью восстанавливается через 20-30 минут после первой РД. Это подтверждает, что одним из последствий РД-индуцированной деполяризации является изменение морфологии дендритного шипика.
GLYX-13 улучшает восстановление дендритного шипика после распространяющейся депрессии
[00134] Наконец, изучали эффекты GLYX-13 на динамическую морфологическую реакцию дендритных шипиков на РД. Была исследована способность GLYX-13 уменьшать сокращение шипиков в ответ на РД или улучшать их восстановление. Фигура 6А иллюстрирует сокращение шипиков в ответ на два эпизода РД в контрольном пирамидальном нейроне, а Фигура 6В показывает этот же процесс в присутствии 10 мкмоль/л GLYX-13. Дисперсионный анализ с повторными измерениями достигает уровня значимости (F(8,64)=17,53, р<0,001) для результатов измерений интенсивности флуоресценции дендритных шипиков, таких как изображенные в верхней части Фигуры 6С, и указывает, что эта значимость связана преимущественно с периодами времени после РД (F(8,64)=6,18, р<0,01), демонстрируя, что, хотя GLYX-13 (закрашенные кружки) не влияют на сокращение, вызванное РД, он обеспечивает восстановление размера шипика после РД (F(8,64)=2,81,p<0,05).
Пример 2
[00135] Приготовление среза гиппокампа: Эксперименты проводили с использованием крыс Sprague-Dawley® (Taconic Farms) в возрасте от 14 до 21 дней. Крысы подвергали глубокой анестезии изофлураном, умерщвляли, и головной мозг быстро извлекали и помещали в оксигенированную (95% O2 - 5% СO2) охлажденную льдом искусственную цереброспинальную жидкость (иЦСЖ), содержащую (в ммоль/л): 126 NaCl, 2,5 KCl, 2,6 СаСl2, 1,3 MgCl2, 1,25 NaH2PO4, 26 NaHCO3 и 11 глюкозы. Головной мозг подвергали гемисекции, фронтальные доли отсекали, и индивидуальные полушария приклеивали с помощью цианоакрилатного клея к предметному столику, погруженному в охлажденную льдом иЦСЖ, непрерывно оксигенируемую во время приготовления срезов. Корональные срезы толщиной 400 мкм, содержащие гиппокамп, вырезали с использованием вибрационного микротома (Leica 1200s), и переносили в сопрягаемую клапанную камеру для инкубации при комнатной температуре в течение минимум 1 часа перед началом эксперимента.
[00136] Индукция распространяющейся депрессии гиппокампа: Острые корональные срезы гиппокампа переносили в регистрационную камеру для погруженных образцов на предметном столике микроскопа и проводили перфузию подогретой иЦСЖ (32 градуса Цельсия), причем внеклеточный [K+] повышался до 8 ммоль/л при скорости перфузии 3 мл/мин. Распространяющуюся депрессию инициировали выдавливанием 3М KCl из стеклянной пипетки. Импульсы давления 55-69 кПа (8-10 psi), как правило, с продолжительностью 50 мс, создавали с помощью прибора picospritzer. Значения сопротивления пипетки, наполненной 3М KCl, составляли 2±0,2 МОм.
[00137] Методы электрофизиологической регистрации: Внеклеточную регистрацию проводили с использованием прибора MultiClamp 700В (Axon Instruments) с Clampex (v. 9), фильтрация на 1 кГц и дискретизация при 3 кГц. Низкоомные (1-2 МОм после наполнения иЦСЖ) отводящие электроды, изготовленные из тонкостенного боросиликатного стекла, вставляли в область апикальных дендритов терминального поля коллатерали Шаффера в лучистом слое поля СА1, на расстоянии приблизительно 150 мм от пипетки, инициирующей РД, для мониторинга распространения РД. Регистрационная камера для погруженных образцов была установлена на вертикальном микроскопе Zeiss Axioskop 2FS, оснащенном инфракрасной дифференциальной интерференционной контрастной (DIC) оптикой. Для визуализации изменений свечения среза, вызванных РД, использовали 10х объектив. Изменения свечения регистрировали каждые 100 мс с помощью охлаждаемой ПЗС-камеры (CoolSNAP HQ), контролируемой с помощью системы управления PTI. Электрофизиологические данные анализировали с помощью программы Clampfit 9. Данные визуализации оцифровывали и реконструировали с использованием программы ImageJ (NIH). Все эксперименты проводили в соответствии с утвержденным протоколом, соответствующим рекомендациям Национального института здравоохранения.
[00138] Результаты Примера 1 анализировали применительно к женщинам и пациентам подросткового возраста. Экспериментальный протокол использовали для инициирования распространения деполяризации (РД) в поле СА1 внутримозговых срезов гиппокампа in vitro. Для улучшения визуального наблюдения расстояния распространяющейся депрессии от участка инициирования и скорости распространения РД на большем расстоянии, 10х объектив в соответствии с примером 1 заменили на 4х объектив для увеличения области наблюдения до 1,6 мм. Регистрационная камера была модифицирована для проведения перфузии срезов с обеих сторон, более эффективная перфузия не только обеспечивала достаточное количество кислорода в срезе головного мозга, но также помогала поддерживать стабильную внеклеточную среду, поскольку каждый эпизод распространяющейся депрессии вызывал резкое изменение как внеклеточного, так и внутриклеточного ионного состава.
[00139] В данные групповые исследования были включены две группы овариэктомизированных самок крыс Sprague-Dawley® в возрасте 2 месяцев. Одна группа овариэктомизированных крыс получала ежедневные инъекции эстрогена в течение 7 дней начиная с 7-го дня после операции, в то время как другим делали инъекции только масляного носителя в качестве контроля в течение 7 дней перед началом экспериментов.
[00140] Изменения свечения после выдавливания 3М калия визуально относили к группам неудачи (<100 мм), локального распространения (>100 мм; <800 мм); или полного распространения (>800 мм). Были проведены попытки индукции РД в 39 срезах от 8 крыс, получавших масло, и 35 срезах от 7 крыс, получавших эстроген. В Таблице 1 приведены результаты определения частоты случаев РД, вызываемых одним и тем же методом в двух группах. В группе, получавшей масло, показатель неудач был значительно выше, чем в группе, получавшей эстроген (критерий хи-квадрат, Р=0,014), что указывает на то, что эстроген сам по себе усиливает склонность тканей мозга демонстрировать РД при фокальной деполяризации.


[00141] Изменения свечения использовали для оценки скорости переноса распространяющейся депрессии, как показано на Фигуре 7 ниже. Скорости распространения рассчитывали как для локализированных, так и для полных РД, индуцированных фокальным выдавливанием 3М калия, путем деления расстояния РД между участками наблюдения на время, потребовавшееся для прохождения РД расстояния между этими участками наблюдения. Как изображено на Фигуре 7, средняя скорость распространения в срезах получавших эстроген крыс составляла 0,121±0,013 мм/с, что значительно больше скорости распространения в срезах крыс, получавших масляный контроль (0,083±0,005 мм/с, Р<0,05, t-критерий Стьюдента). Эти данные показывают, что эстроген играет значительную роль в усилении как склонности, так и скорости РД в гиппокампе и, возможно, также в неокортексе.
[00142] Были проведены исследования того, как эстроген влияет на тяжесть РД путем измерения максимального расстояния распространения РД от участка инициирования. Как показано на Фиг. 8, конечная точка распространения по пути коллатерали Шаффера, приблизительно определяемая путем усреднения расстояния точки, в которой наблюдаются минимально детектируемые изменения свечения (>5% изменений по сравнению с базовой линией), от точки инициирования, и расстояния до близко расположенной точки наблюдения, в которой изменения свечения являются недетектируемыми, и измерения этого расстояния от точки инициирования. Как показано на Фигуре 8, РД в срезах получавших эстроген крыс проходила значительно большее расстояние (0,594±0,071 мм; n=18), чем РД в срезах получавших масло крыс (0,394±0,051 мм; n=16, Р<0,05, t-критерий Стьюдента). Таким образом, РД у получавших эстроген крыс не только легче вызывалась, но и распространялась на большие расстояния.
[00143] Затем к перфузату добавляли 10 мкмоль/л GLYX-13 после индуцирования 2 РД с интервалом в 10 минут, и продолжали индуцировать РД через каждые 10 минут для определения того, наблюдается ли влияние на скорость и интенсивность РД. Фигура 9 показывает типичные различия РД, вызванных в срезе получавшей эстроген крысы, до введения GLYX-13 и после 50 минут обработки 10 мкм GLYX-13 в ванне. Проводили измерения изменений свечения в 10 точках наблюдения для оценки эффектов GLYX-13 на РД. Хотя РД по-прежнему легко инициировалась, как показано на Фигуре 9В, Фигура 9А четко показывает, что изменения свечения, ассоциированные с РД, замедлялись в присутствии GLYX-13. Парный t-критерий Стьюдента показал, что GLYX-13 значительно снижал среднюю скорость распространения РД с 6,56±0,57 мм/мин до 4,96±0,28 мм/мин (n=5, Р<0,01, парный t-критерий Стьюдента). Такие же эксперименты были проведены в срезах гиппокампа получавших масло крыс. Хотя GLYX-13 снижал среднюю скорость распространения РД с 5,09±0,61 мм/мин до 4,50±0,39 мм/мин (n=5), данное снижение не достигало статистической значимости.
[00144] Был также проведен двухфакторный дисперсионный анализ с повторными измерениями для изучения эффекта GLYX-13 на скорость распространения РД в двух группах. Как показано на Фигуре 10, первый значимый эффект наблюдается у получавших эстроген крыс до и после применения GLYX-13 (F(1,8)=3,l; р<0,05); и второй значимый эффект возникает в результате предварительного введения GLYX-13 при сравнении двух групп (F(1,8)=4,2; р<0,05). Эти результаты показывают, что GLYX-13 проявляет более сильный эффект у получавших эстроген крыс, значительно замедляя скорость продвижения РД до уровня получавших масло крыс.
Пример 3
Способы
Животные
[00145] Взрослые самцы (в возрасте 2-3 месяцев) крыс Sprague-Dawley® (РД) были приобретены у фирмы Harlan (США). Крыс содержали в клетках Lucite с подстилкой из древесной щепы тополя осинообразного, с циклом свет-темнота 12 часов: 12 часов (свет включали в 5 часов), и со свободным доступом к корму для крыс Purina® (USA) и водопроводной воде на протяжении исследований. Индуцирование травматического поражения головного мозга
[00146] Индуцировали травматическое поражение головного мозга единичной ударной волной в модификации для крыс в соответствии с протоколом Goldstein et al. (Goldstein, L.E., et al. (2012) "Chronic traumatic encephalopathy in blast-exposed military veterans and a blast neurotrauma mouse model," Science Translational Medicine 4:134ra160.) Взрослых самцов крыс Sprague-Dawley® анестезировали изофлураном, вставляли в оба уха крысы ушные вкладыши, и воздействовали на крысу единичной ударной волной около 290 кПа (42 PSI) гелия, генерируемой прокалыванием полиэфирной пленки толщиной 0,36 мм (0,014 дюйма). Животные контроля на условия содержания были размещены за пределами радиуса воздействия ударной волны. Затем, животным вводили дозу рапастинела (3 мг/кг, внутривенно (IV)) или 0,9% стерильного солевого носителя (1 мл/кг, внутривенно) через 1 час после воздействия ударной волны. Крыс сначала подвергали анестезии с использованием 3,5-4% изофлурана, затем их уши защищали с помощью вспененных вкладышей размером 1,5×1,5 мм (ушные вкладыши Pura-Fit, Moldex-Metric INC, Culver City, California). Крыс помещали в торакальные держатели для грызунов с доступом к голове (Stoelting, USA) для защиты их тел, обеспечивающей возможность свободного движения головой, с размещением концов алюминиевых ударных труб (183×61 см; L-3 Applied Technologies, USA) в 10 см от голов. На крыс воздействовали один раз ударной волной гелия около 290 кПа (42 PSI), генерируемой прокалыванием полиэфирной пленки толщиной 0,36 мм (0,014 дюйма). Животные контроля на условия содержания были размещены за пределами радиуса воздействия ударной волны. Животным давали дозу рапастинела (3 мг/кг, внутривенно) или 0,9% стерильный солевой носитель (1 мл/кг, внутривенно) через 1 час после воздействия ударной волны. Регистрировали латентное состояние до выхода из анестезии (Фигура 11А). Момент прихода в сознание определяли по проявлению мигательного и выпрямительного рефлексов и нормальной способности передвигаться (нормальная ритмическая походка, некруговая походка, полное поддерживание веса тела, некоторые проявления обнюхивания и исследовательского поведения). Животным вводили дозу GLYX-13 (3 мг/кг, внутривенно) или 0,9% стерильного солевого носителя (1 мл/кг, внутривенно) через 1 час после воздействия ударной волны. N=4-6 на группу; * Р<0,05 (Фигура 11А) дисперсионный анализ.
[00147] Позитивное эмоциональное научение (PEL) На Фигуре 11В представлены результаты однократного 3-минутного сеанса тестирования позитивного эмоционального научения (PEL), проведенного через 24 часа после воздействия ударной волны, с использованием межсубъектного плана. N=4-6 на группу. Апостериорный критерий PLSD Фишера использовали для оценки результатов (рапастинел + ТПГМ / носитель + ТПГМ).
[00148] Проводили неспецифическую активную контактную игру, как было описано ранее (Burgdorf, J., et al. (2011) "Positive emotional learning is regulated in the medial prefrontal cortex by GluN2B-containing NMDA receptors," Neuroscience 192: 515-523), и тестирование выполняли через 3 часа и 2 недели после введения дозы. Экспериментатор инициировал неспецифическую активную контактную игру правой рукой. Животные участвовали 3 мин в неспецифической активной контактной игре, которая состояла из чередующихся 15 с блоков неспецифической игры и 15 секунд отсутствия стимулирования. Высокочастотные ультразвуковые вокализации (УЗВ) регистрировали и анализировали по сонограмме с помощью Avasoft SASlab Pro (Germany), как было описано ранее (там же). Проводили количественные определения частотно модулированных 50 кГц УЗВ, зарегистрированных во время каждого из периодов отсутствия стимулирования, для измерения PEL. До проведения испытаний животных не приучали к игре со стимулированием.
Результаты
[00149] Как показано на Фигуре 11А, животные, подвергнутые ТПГМ, продемонстрировали большие значения времени восстановления после анестезии по сравнению с животными контроля на условия содержания [F(1, 13)=41,7, Р<0,05]. Как показано на Фигуре 11В, рапастинел (3 мг/кг, внутривенно) избавлял от ТПГМ-индуцированного угнетения позитивного эмоционального научения [F(2,12)=10,0, Р<0,05; апостериорный критерий PLSD Фишера рапастинел + ТПГМ / носитель + ТПГМ, контроль условий содержания/ носитель + ТПГМ vs., Р<0,05]. Кроме того, время восстановления после анестезии не коррелировало в значительной степени с показателями PEL [r(15)=-0,14, Р>0,05]. В тесте позитивного эмоционального научения, разовая доза рапастинела (3 мг/кг, внутривенно) полностью восстанавливала дефициты научения и эмоций, индуцированные ТПГМ. Таким образом, в данной предклинической модели, рапастинел демонстрировал эффективность при лечении основных когнитивных и аффективных симптомов ТПГМ, и рапастинел, по-видимому, обладает терапевтическим потенциалом для лечения РТРД.
ЭКВИВАЛЕНТЫ
[00150] Хотя были описаны конкретные варианты реализации данного изобретения, приведенное выше описание изобретения является иллюстративным и неограничительным. Большое количество вариантов осуществления настоящего изобретения будут очевидными для квалифицированных специалистов в данной области техники после ознакомления с данным описанием. Полный объем настоящего изобретения должен определяться пунктами формулы изобретения, вместе с их полным объемом эквивалентов, вместе с такими вариантами.
[00151] Если не указано иное, все численные значения, выражающие количества ингредиентов, реакционные условия, параметры, описательные признаки и т.д., использованные в тексте описания и формуле изобретения, должны рассматриваться как видоизмененные во всех случаях термином "около". Соответственно, если не будет указано иное, численные параметры, приведенные в тексте описания и приложенной формуле изобретения, являются приблизительными значениями, которые могут изменяться в зависимости от желательных свойств, которые должны быть достигнуты согласно данному описанию.
[00152] Все публикации и патенты, упоминаемые в данном документе, включая перечисленные ниже, настоящим включены в качестве ссылок в полном объеме, как если бы для каждой индивидуальной публикации или патента было конкретно и индивидуально указано, что они включены в качестве ссылок. В случае конфликта, главенствующей является данная заявка, включая любые приведенные в ней определения.