Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ ПОРИСТЫХ НАНОСТРУКТУР Fe2O3 ДЛЯ ПРЕОДОЛЕНИЯ УСТОЙЧИВОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к медицине, а именно к потенцированию действия антибиотиков и может быть использовано для лечения ран кожного покрова и мягких тканей, инфицированных множественно-устойчивыми бактериями.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Известно использование оксидов металлов в медицине, в том числе на основе оксидов железа [Viet Long, N., Minh Thi, C., Yong, Y., Cao, Y., Wu, H., Nogami, M. Synthesis and characterization of Fe-based metal and oxide based nanoparticles: discoveries and research highlights of potential applications in biology and medicine //Recent patents on nanotechnology. – 2014. – Т. 8. – №. 1. – С. 52-61; Long M. et al. Emerging nanoclay composite for effective hemostasis //Advanced Functional Materials. – 2018. – Т. 28. – №. 10. – С. 1704452.].
Известно применение наночастиц на основе оксидов железа для диагностики и лечения опасных опухолей и раковых заболеваний путем адресной доставки лекарств и/или магнитной гипертермии [US5284144 A, опубл. 08.02.1994, US7842281 В2, опубл. 30.11. 2010, US7829140 В1, опубл. 09.11. 2010].
Также наночастицы на основе оксидов железа используются в качестве контрастного средства визуализации и термической абляции при магнитно-резонансной терапии и комплексной терапии [Lodhia J, Mandarano G, Ferris NJ, Eu P, Cowell SF. Development and use of iron oxide nanoparticles (Part 1): Synthesis of iron oxide nanoparticles for MRI. Biomed Imaging Interv J 2010; 6(2): e12; Mandarano G, Lodhia J, Eu P, Ferris NJ, Davidson R, Cowell SF. Development and use of iron oxide nanoparticles (Part 2): The application of iron oxide contrast agents in MRI. Biomed Imaging Interv J 2010; 6(2): e13].
Известен продукт в виде агломератов оксигидроксидов металлов, выбранных из группы, состоящей из Al, Fe, Mg, Ti или их смеси [RU2560432C2, опубл. 20.08.2015]. Предложенные агломераты, в том числе Fe образованы множеством элементов, имеющих размеры от 200 до 500 нм и представляющих собой низкоразмерные складчатые структуры, имеющие складки и грани неправильной формы. Структуры обладают локально высоким уровнем напряженности электрического поля на упомянутых складках, гранях и ребрах граней, составляющим 106-107 В/м. Изобретение обеспечивает получение агломератов оксигидратов, которые могут быть использованы в качестве сорбентов или в качестве средства, обладающего ранозаживляющей и антибактериальной активностью, а также для угнетения пролиферативной активности опухолевых клеток. Продукт также раскрыт в Международной заявке [WO2014189412 опубл. 27.11.2014]. В вышеприведённом раскрыт способ получения оксигидроксида железа (FeOOH). Для получения агломератов низкоразмерных складчатых структур оксигидроксида железа использовали биметаллические наночастицы Fe-Al с примесью алюминия не более 10% масс. Биметаллический нанопорошок Fe-Al с размером частиц около 100 нм получали параллельным электрическим взрывом железной и алюминиевой проволоки в атмосфере азота при соотношении Fe: Al=90:10% масс. 20 г порошка заливали 2000 мл дистиллированной воды и нагревали при постоянном перемешивании до 60°C. Контролировали и поддерживали pH реагирующей смеси на уровне 9,0 раствором аммиака. Реакцию проводили в течение 60 мин. Затем суспензию отфильтровывали, промывали дистиллированной водой до нейтральной реакции промывных вод и сушили при температуре 90°C в течение 4 часов.
Получаемый продукт - композиция оксигидроксида (FeOOH/AlOOH) не оказывает потенцирующего действия по отношению к антибиотикам. В отличие от соединений железа AlOOH является не биорезорбируемым материалом и может накапливаться в организме. Для получения оксигидроксида железа используется дорогостоящий нанопорошок Fe-Al (200 $/кг), полученный электрическим взрывом двух проволочек. К тому же метод получения не обеспечивает полного окисления железа до оксигидроксида железа.
Известен способ получения пористого материала на основе гематита [A FACILE SYNTHESIS OF POROUS HEMATITE NANOMATERIALS AND THEIR FAST SORPTION OF CR (VI) IN WASTEWATER // J. Chil. Chem. Soc, 57, No 4 (2012), С.: 1372-1374]. Пористый наноматериал (a-Fe2O3) может быть просто получен из нейтрального раствора аморфного гидроксида железа (III) (Fe (OH)3) методом выпаривания в открытой кварцевой колбе в вакуумной сушильной печи. Результаты показывают, что полученные частицы a-Fe2O3 при 180°C в течение 2 часов или около того имеют почти веретенообразную форму. Каждый из микрошпинделей a-Fe2O3 образован множеством ультрадисперсных наночастиц a-Fe2O3 и имеет пористую структуру. Приготовленные пористые порошки a-Fe2O3 имеют высокую площадь поверхности (~ 78 м2/г) и могут быстро удалять ионы Cr (VI) в сточных водах при комнатной температуре.
К недостаткам известного способа можно отнести характеристики получаемого материала, а именно низкая величина удельной поверхности, материал микропористый размер пор 60-100 нм.
Известен способ получения эллипсоидов гематита в гидротермальных условиях [Chengliang Han, Jie Han, Qiankun L,1 and Jingsong Xie Wet // Chemical Controllable Synthesis of Hematite Ellipsoids with Structurally Enhanced Visible Light Property The Scientific World JournalVolume 2013, Article ID 410594, 5 с. http://dx.doi.org/10.1155/2013/410594]. Результаты показали, что продукт был мезопористым α-Fe2O3 и имел почти эллиптическую форму. Каждый эллипсоид гематита размером 500 nm на 120 nm (длина осей) был упакован многими наночастицами α-Fe2O3 (~20 nm). Значения давления пара в реакционных системах сыграли важную роль в образовании пористых гематитовых эллипсоидов. Оптические тесты показали, что микро/наноструктурированный эллиптический гематит проявлял улучшенные свойства видимого света при комнатной температуре. Образование этих пористых гематитовых эллипсоидов можно объяснить ориентированной сборкой наночастиц α-Fe2O3 под давлением пара.
К недостаткам данного способа можно отнести характеристики получаемых материалов, а именно размер получаемых эллипсоидов. Для получения эллипсоидов необходима высокая температура (180°С) и повышенное давление.
Как можно видеть из вышеприведенного уровня техники оксиды и оксигидроксиды металлов разной геометрической формы и размеров используются в медицине при магнитно-резонансоной терапии опухолевых заболеваний, адресной доставки лекарств, а также, как средства, обладающие как адсорбирующим действием, так и ранозаживляющим и антибактериальным действием. Однако ранее в вышеприведенных аналогах не раскрыто такое свойство пористых наноструктур Fe2O3 (гематита) как влияние на изменение чувствительности бактерий при контакте с ними и антибиотиками, обусловливая тем самым потенцирование действия антибиотиков различного принципа действия на резистентные штаммы микроорганизмов. Также все еще существует потребность в создании новых способов получения пористых наноструктур Fe2O3 с ранее не известными характеристиками и свойствами.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее раскрытие основано на неожиданном наблюдении, что пористые наноструктуры Fe2O3 (гематит), имеющие удельную поверхность не менее 50 м2/г; положительный дзета-потенциал, у которых отношение объема мезопор к объему микропор больше или равно 2 обладают свойством повышать чувствительность резистентных штаммов бактерий к антибиотикам.
Таким образом, в основу изобретения поставлена задача разработки способа получения вышеописанных пористых наноструктур Fe2O3, обладающих свойством повышать чувствительность резистентных штаммов бактерий к антибиотикам.
Другой задачей настоящего изобретения является применение вышеописанных пористых наноструктур Fe2O3 для преодоления устойчивости (резистентности) бактерий к антибиотикам за счёт повышения чувствительности резистентных штаммов бактерий к антибиотикам.
Еще одной задачей настоящего изобретения является разработка способа лечения у субъекта инфицированной раны, позволяющий преодолеть устойчивость к антибиотикам, за счёт обработки раны субъекта эффективным количеством антибиотика, в комбинации или раздельно с эффективным количеством вышеупомянутого Fe2O3.
И еще одной задачей настоящего изобретения является разработка продукта, содержащего упомянутый пористый Fe2O3 и антибиотик (например, один или более чем один антибиотик), в виде комбинированного препарата для одновременного или последовательного применения в лечении инфицированной раны субъекта.
Технический результат - уменьшение дозы антибиотика, возможность применения низкотоксичных антибиотиков.
Поставленная задача достигается тем, что пористые наноструктуры Fe2O3 (гематит), обладающие свойством повышать чувствительность резистентных штаммов бактерий к антибиотикам, имеют удельную поверхность не менее 50 м2/г и положительный дзета-потенциал и имеют отношение объема мезопор к объему микропор большее или равное 2.
Предпочтительно, что упомянутые структуры имеют удельную поверхность не менее от 120 м2/г, дзета-потенциал, измеренный в воде при 25°С в диапазоне не менее +30 мВ.
Кроме того, они имеют развитую систему мезопор со средним размером в диапазоне от 2 до 50 нм и микропор со средним размером менее 2 нм.
При этом упомянутые пористые наноструктуры Fe2O3 имеют размер в диапазоне от 50 до 200 нм и представляют собой эллипсовидные частицы, состоящие из множества фрагментов размером от 2 до 5 нм.
Предлагаемый способ получения вышеописанных пористых наноструктур Fe2O3 (гематита), обладающих свойством повышать чувствительность резистентных штаммов бактерий к антибиотикам, включает:
– получение промежуточного металлоорганического золя железа Fe (CH3COO)3;
– добавление к полученному упомянутому золю железа дистиллированной воды и кипячении его в течение 5-7 часов при атмосферном давлении для полного превращения Fe (CH3COO)3 в пористые наноструктуры Fe2O3;
– проведение охлаждения полученной смеси до комнатной температуры;
– фильтрование осадка;
– промывание водой и сушка при температуре при 120-125°С в течение не менее 3 часов, при которых достигается остановка изменения массы, связанная с удалением адсорбированной воды.
При этом промежуточный металлоорганический золь железа получают путем добавления с постоянным перемешиванием раствора хлорида железа (III) FeCl3 с концентрацией 1,5±0,01 М к раствору ацетата натрия CH3COONa с концентрацией 2,2±0,01 М в соотношении 1:1, и последующее перемешивание полученной смеси в течение 15-20 мин.
При времени кипячения менее 5 часов не достигается полной конверсии Fe(CH3COO)3 в Fe2O3 и удаления образующейся уксусной кислоты (CH3COOH). Большее время кипячения – более 7 часов приводит к перекристаллизации наноструктур Fe2O3 и уменьшению величины удельной поверхности.
Поставленная задача достигается также тем, что пористые наноструктуры Fe2O3 (гематит), имеющие величину удельной поверхности не менее 50 м2/г, положительный дзета-потенциал и отношение объема мезопор к объему микропор большее или равное 2, применяют в качестве средства преодоления устойчивости (резистентности) бактерий к антибиотикам, за счёт повышения чувствительности резистентных штаммов бактерий к антибиотикам.
При меньших значениях величины удельной поверхности эффективность преодоления резистентности будет уменьшаться, так как при меньших значениях удельной поверхности снижается количество активных поверхностных центров, отвечающих за адсорбционные и ионообменные свойства пористых наноструктур Fe2O3.
При отрицательных значениях дзета-потенциала будет снижаться эффективность преодоления устойчивости, что связано с уменьшением адсорбционной способности по отношению к анионным молекулам, в том числе, бета-лактамазы.
Другая задача достигается тем, что предлагаемый способ преодоления устойчивости, к, по меньшей мере, одному антибиотику в отношении как грамположительной, так и грамотрицательной бактерии, включает приведение бактерии в контакт c вышеописанными пористыми наноструктурами вместе с антибиотиком.
Кроме того, бактерия представляет собой грамотрицательную и выбрана из родов Pseudomonas, и Escherichia, предпочтительно, где бактерия представляет собой одну из Pseudomonas aeruginosa, E.coli, которые устойчивы к одному или более антибиотикам, выбранным из пенициллина, метициллина, нитроцефина, грамицидина, гентамицина, цефтриаксона, цефтазидима, ампициллина; или представляет собой их клинический штамм или клинический изолят.
Кроме того, бактерия представляет собой грамположительную и выбрана из рода S. aureus и представляет собой клинический штамм или клинический изолят MRSA, которые устойчивы к одному или более антибиотикам, выбранным из пенициллина, метициллина, нитроцефина, грамицидина, ванкомицина, сультасина и ампициллина.
При том, что антибиотик выбран из β-лактамов, аминогликозидов, катионных полипептидов, тетрациклинов, полипептидных антибиотиков и хинолонов, предпочтительно из β-лактамов (пенициллина, метициллина, ампициллина, нитроцефина цефтриаксона, цефтазидима), катионных полипептидов (грамицидина) и аминогликозидов (гентамицина), а также комбинированного препарата сультасина на основе ампициллина и сульбактама.
Предпочтительно упомянутые структуры используют для лечения у субъекта инфицированной раны, позволяющие преодолеть устойчивость к антибиотикам как за счёт обработки раны субъекта эффективным количеством антибиотика, так и введения субъекту антибиотика, например, внутримышечно в комбинации или раздельно с эффективным количеством упомянутого Fe2O3.
Еще одна задача достигается тем, что предлагаемый в настоящем изобретении продукт содержит пористые наноструктуры вышеописанного оксида железа Fe2O3 (гематит) и, по меньшей мере, один антибиотик в виде комбинированного препарата для одновременного или последовательного применения для преодоления устойчивости к антибиотику вышеперечисленных бактерий, где упомянутые структуры имеют величину удельной поверхности не менее 120 м2/г, соотношение объем мезопор/объем микропор не мене 2 и дзета-потенциал в воде при 25°С не менее +30 мВ.
Синтезированные пористые наноструктуры оксида железа Fe2O3 (гематит) предназначены для лечения поверхностных ран, инфицированных резистентными штаммами бактерий. Лечение осуществляется с применением антибиотиков, при этом использование наноструктур Fe2O3 позволяет значительно снизить минимальные действующие концентрации лекарственных препаратов.
Потенцирование действия антибиотиков предлагаемыми пористыми наноструктурами оксида железа Fe2O3 (гематит) происходит за счет изменения чувствительности бактерий к антибиотикам. Изменение чувствительности обусловлено несколькими факторами, а именно: за счет изменения мембранного потенциала бактерий в присутствии наноструктур Fe2O3, связанного с перераспределения ионов вблизи бактериальной мембраны, в том числе изменения кислотности; ингибирования ферментов разрушающих антибиотики за счет адсорбции на поверхности наноструктур; за счет блокирования рецепторов, отвечающих за выработку ферментов, расщепляющих антибиотики, вызванного изменением потенциала бактериальной мембраны в присутствие наноструктур.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
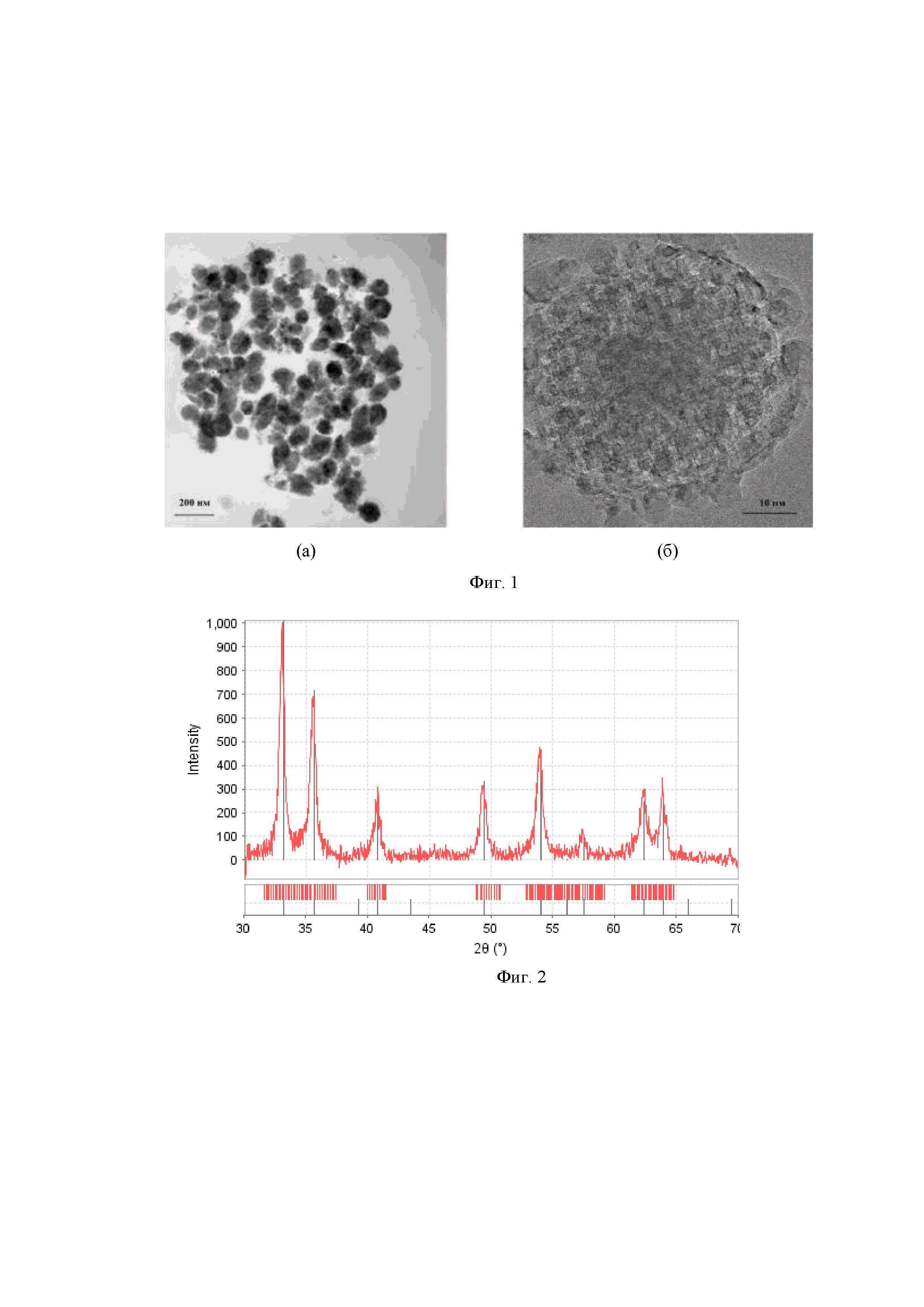
Фиг. 1 – Изображения наноструктур Fe2O3, полученные методом просвечивающей электронной микроскопии при различном увеличении: (а) ПЭМ-изображение и (б) ПЭМ-изображение высокого разрешения наноструктур Fe2O3.
Фиг. 2 – Рентгенограмма образца наноструктур Fe2O3. Основные рефлексы соответствуют Fe2O3-гематит.
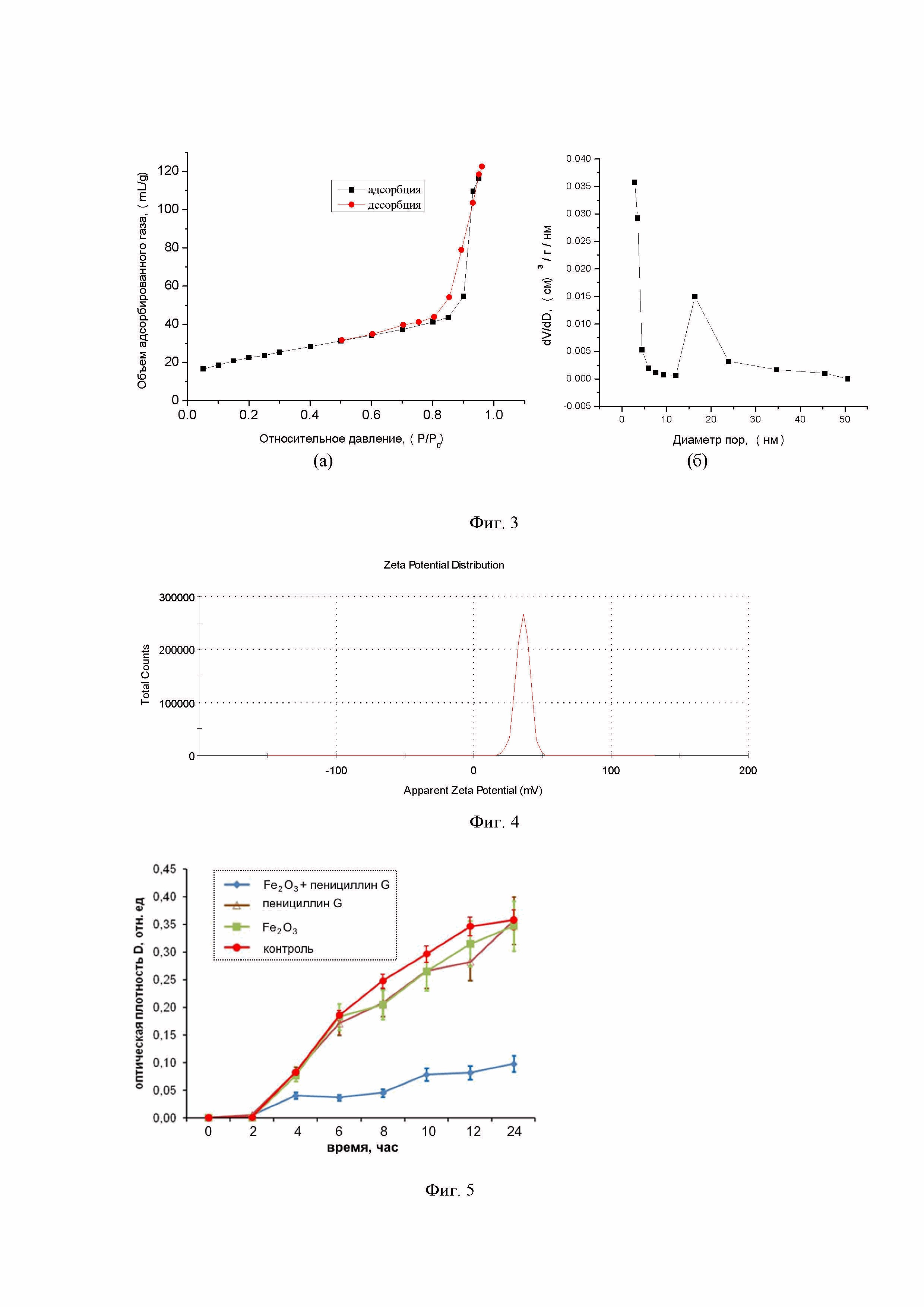
Фиг. 3 – Изотерма адсорбции-десорбции азота (а) и распределение пор по размерам наноструктур Fe2O3 (б)
Фиг. 4 – Дзета-потенциал наноструктур Fe2O3.
Фиг. 5 – графики и изображения показывают преодоление устойчивости метициллин-резистентного золотистого стафилококка (MRSA) к бензилпенициллину (пенициллину G) при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с пенициллином G в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 в концентрации 1 мг/мл в комбинации с пенициллином G (50 мкг/мл).
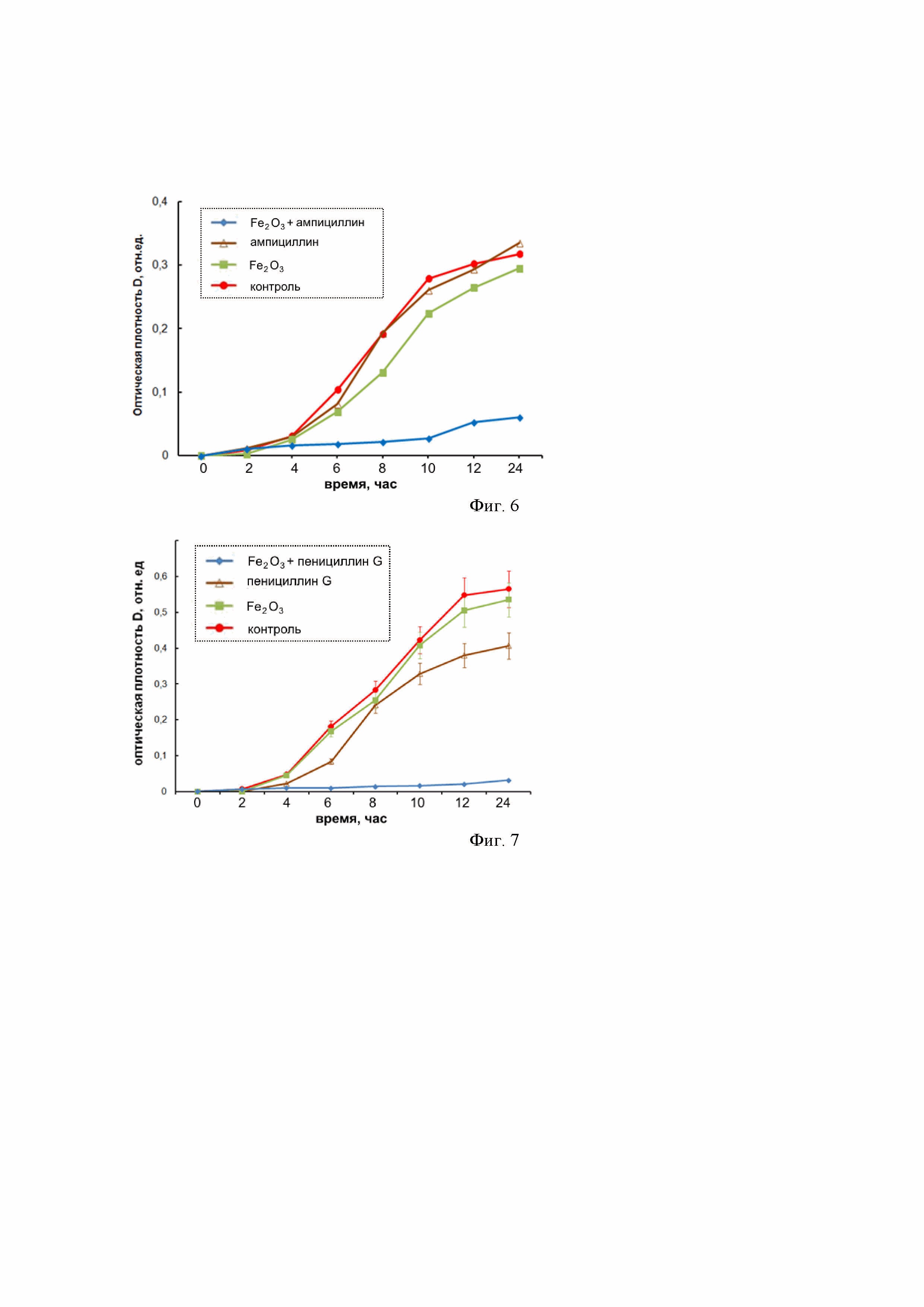
Фиг. 6 – графики показывают преодоление устойчивости метициллин-резистентного золотистого стафилококка (MRSA) к ампициллину при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с ампициллином в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с ампициллином (50 мкг/мл).
Фиг. 7 – графики и изображения показывают преодоление устойчивости синегнойной палочки (P. aeruginosa) к бензилпенициллину (пенициллину G) при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с AlOOH в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с пенициллином G в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с пенициллином G (50 мкг/мл).
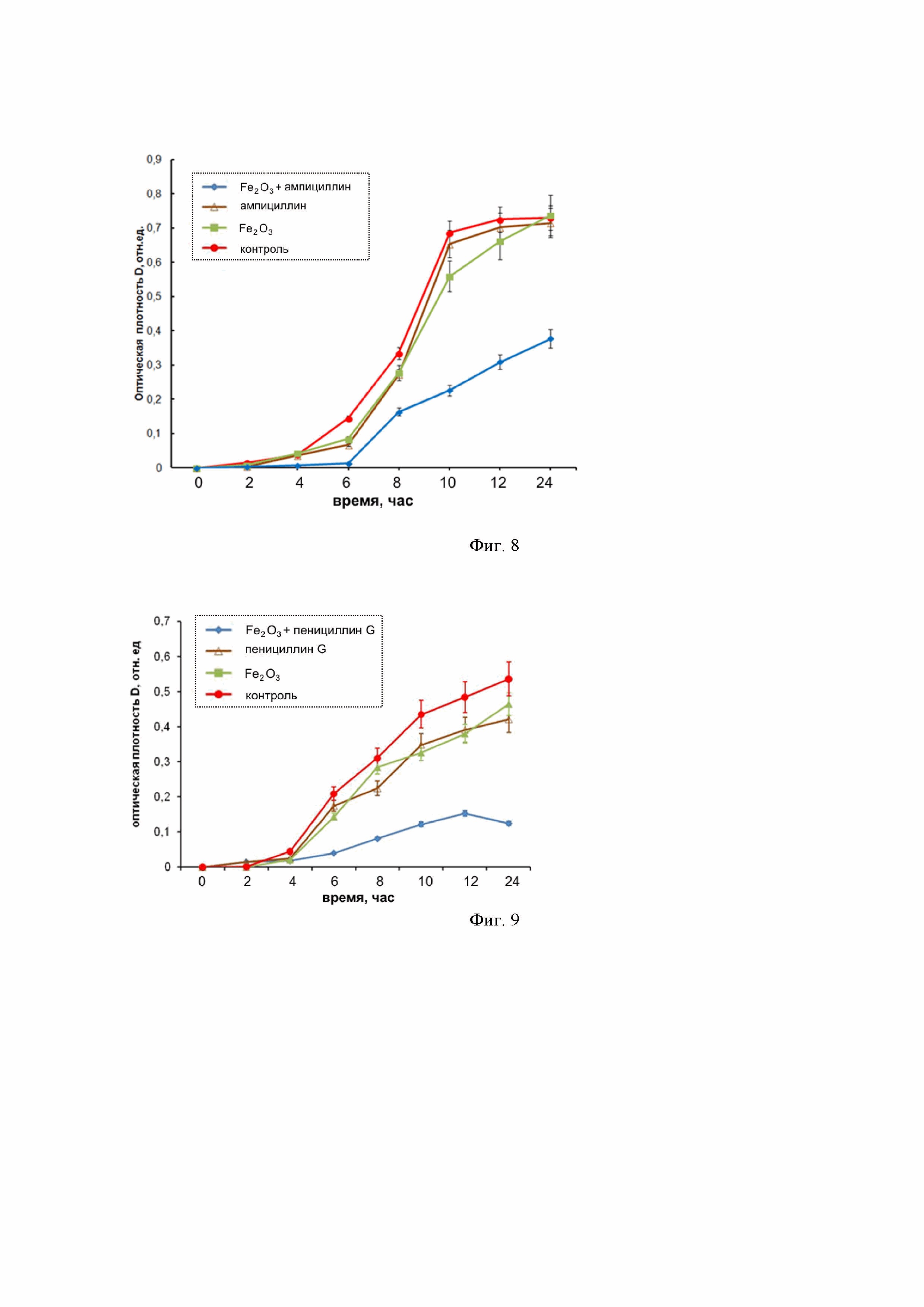
Фиг. 8 – графики показывают преодоление устойчивости синегнойной палочки (P. aeruginosa) к ампициллину при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с ампициллином в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с ампициллином (50 мкг/мл).
Фиг. 9 – графики и изображения показывают преодоление устойчивости кишечной палочки (E. coli) к бензилпенициллину (пенициллину G) при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с пенициллином G в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с пенициллином G (50 мкг/мл).
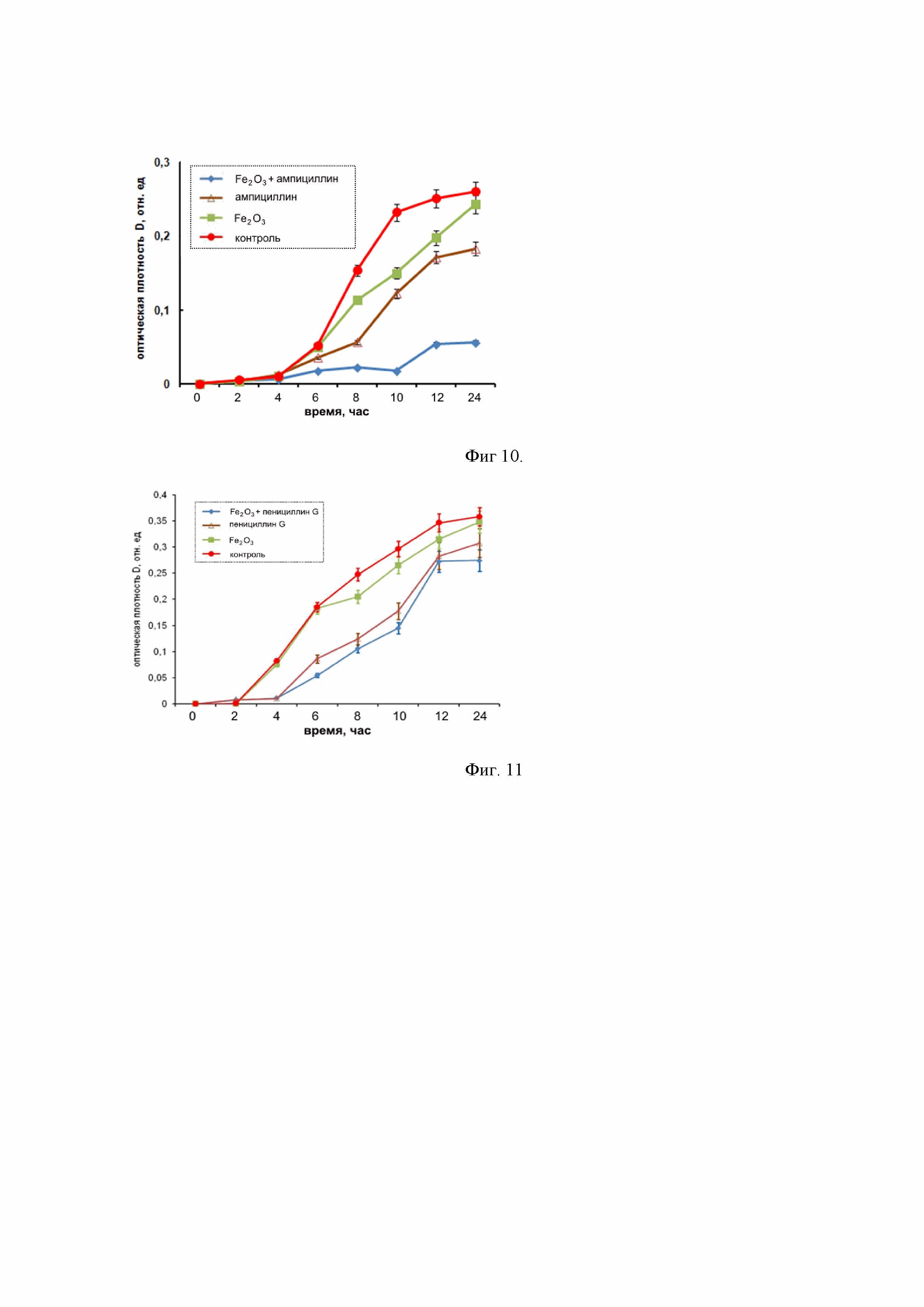
Фиг. 10 – графики показывает преодоление устойчивости кишечной палочки (E. coli) к ампициллину при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с ампициллином в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с ампициллином (50 мкг/мл).
Фиг. 11 – (сравнительный пример) показывает преодоление устойчивости метициллин-резистентного золотистого стафилококка (MRSA) к бензилпенициллину (пенициллину G) при применении наноструктур Fe2O3 (ГТС) – полученных гидротермальным синтезом по примеру 7 с низкой удельной поверхностью: отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 (ГТС) в концентрации 1 мг/мл (зеленая кривая); б – отсутствие ингибирующего эффекта при инкубировании только с пенициллином G в концентрации 50 мкг/мл (фиолетовая кривая); в – слабая противомикробная активность при применении наноструктур Fe2O3 (ГТС) с концентрацией 1 мг/мл в комбинации с пенициллином G (50 мкг/мл) – синяя кривая.
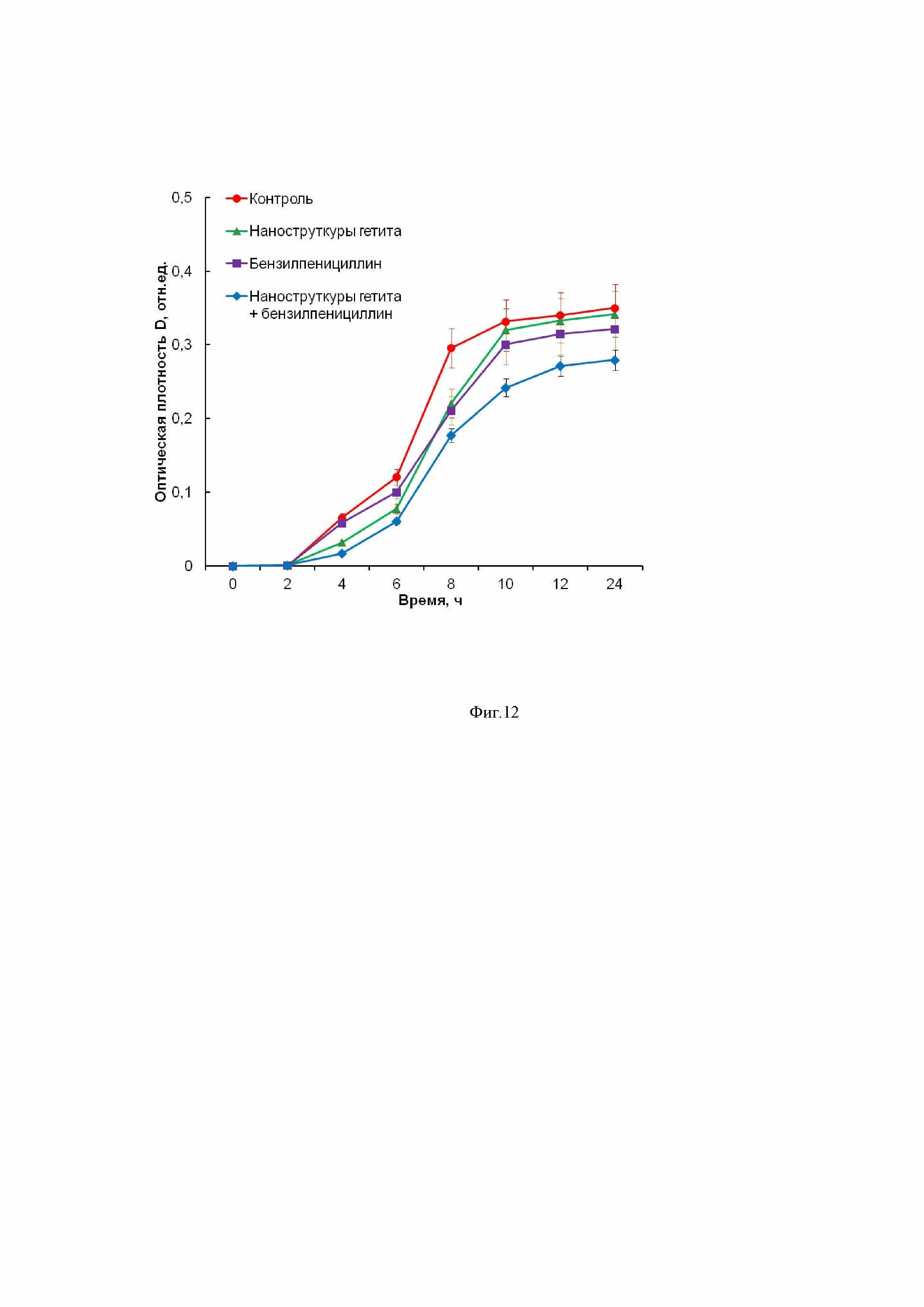
Фиг. 12 - (сравнительный пример) показывает преодоление устойчивости метициллин-резистентного золотистого стафилококка (MRSA) к бензилпенициллину (пенициллину G) при применении наноструктур гетита – полученных по примеру 8: отсутствие ингибирующего эффекта при инкубировании только с наноструктурами гетита в концентрации 1 мг/мл (зеленая кривая); б – отсутствие ингибирующего эффекта при инкубировании только с пенициллином G в концентрации 50 мкг/мл (фиолетовая кривая); в – слабая противомикробная активность при применении наноструктур гетита с концентрацией 1 мг/мл в комбинации с пенициллином G (50 мкг/мл) – синяя кривая.
Синтезированные наноструктуры предназначены для лечения поверхностных ран, инфицированных резистентными штаммами бактерий. Лечение осуществляется с применением антибиотиков, при этом использование наноструктур Fe2O3 позволяет значительно снизить минимальные действующие концентрации лекарственных препаратов.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Для подтверждения технического результата в экспериментах in vitro были использованы эллипсовидные пористые структуры оксида железа Fe2O3 (Фиг. 1) с высокой удельной поверхностью 126 м2/г (Фиг. 3) и дзета-потенциалом +35,8 мВ (Фиг. 4), с соотношением объем мезопор/объем микропор равным 2,48, далее «наноструктуры Fe2O3».
Для синтеза вышеописанных наноструктур Fe2O3 была использована методика с использованием промежуточного металлоорганического золя железа. В стеклянную колбу объемом 500 мл помещали 100 мл раствора CH3COONa с концентрацией 2,2 М. К раствору, при постоянном перемешивании, добавляли 100 мл раствора FeCl3 с концентрацией 1,5 М и перемешивали в течение 15-20 мин. Затем смесь нагревали до кипения и кипятили в течение 6 ч при постоянном перемешивании с обратным холодильником. К образовавшемуся золю добавляли 100 мл дистиллированной воды и кипятили в течение 6 ч. Далее охлаждали реакционную смесь до комнатной температуры, отфильтровывали образовавшийся осадок, промывали дистиллированной водой (не менее 1000 мл) и сушили при 120°С в течение 4 ч. В результате были получены эллипсовидные наноструктуры со средним размером 125 нм, состоящие из фрагментов со средним размером 3,5 нм (Фиг. 1). По составу наноструктуры Fe2O3 соответствуют фазе гематита (Фиг. 2). По данным адсорбции-десорбции азота, наноструктуры Fe2O3 имеют петлю гистерезиса в области капиллярной конденсации, что свидетельствует о мезопористой структуре образца. Средний размер мезопор – 17.1 нм, объём мезопор – 0,234 см3/г, микропор – менее 2 нм, объём микропор – 0,094 см3/г. Соотношение объема мезопор к объему микропор составило 2,48. Величина удельной поверхности, рассчитанная методом БЭТ (Брунауэр-Эммет-Теллер) составила 126 м2/г (Фиг. 3). Дзета-потенциал наноструктур Fe2O3 измеренный в воде при температуре 25 °С и рН7 составляет 35,8 мВ (Фиг. 4).
Пример 1. Преодоление устойчивости к пенициллину G метициллин-резистентного золотистого стафилококка (MRSA)
Бактериальный рост оценивали в 96-луночных микропланшетах (объем лунки 300 мкл) по изменению оптической плотности бактериальной суспензии при λ=620 нм. В качестве отрицательного контроля использовали культуру MRSA без добавления антибактериальных агентов. Оптическую плотность определяли при помощи планшетного спектрофотометра Thermo Scientific Multiskan FC (Thermo Fisher Scientific, США). Бактериальную культуру MRSA в концентрации 105 КОЕ/мл помещали в жидкую питательную среду, содержащую наноструктуры Fe2O3 в концентрации 1 мг/мл, при которой ингибирующий эффект (эффект подавления роста клеток) отсутствует. Кроме того, в лунки добавляли антибиотик пенициллин G в концентрации 50 мкг/мл, при которой ингибирующий эффект также отсутствует. Параллельно проводили контрольные исследования с бактериальными культурами, находящимися в контакте с наноструктурами Fe2O3 и пенициллином G по отдельности. Кинетику роста бактерий в лунках оценивали по изменению оптической плотности среды относительно контроля. На фиг. 5 приведены кинетические кривые роста бактериальной культуры MRSA в жидкой питательной среде, оцененные по изменению оптической плотности суспензии в течение 24 ч инкубации, показывающие преодоление устойчивости метициллин-резистентного золотистого стафилококка (MRSA) к бензилпенициллину (пенициллину G) при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с пенициллином G в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с пенициллином G (50 мкг/мл).
Пример. 2 Преодоление устойчивости к ампициллину метициллин-резистентного золотистого стафилококка (MRSA)
Бактериальный рост оценивали в 96-луночных микропланшетах (объем лунки 300 мкл) по изменению оптической плотности бактериальной суспензии при λ=620 нм. В качестве отрицательного контроля использовали культуру MRSA без добавления антибактериальных агентов. Оптическую плотность определяли при помощи планшетного спектрофотометра Thermo Scientific Multiskan FC (Thermo Fisher Scientific, США). Бактериальную культуру MRSA в концентрации 105 КОЕ/мл помещали в жидкую питательную среду, содержащую наноструктуры Fe2O3 в концентрации 1 мг/мл, при которой ингибирующий эффект (эффект подавления роста клеток) отсутствует. Кроме того, в лунки добавляли антибиотик ампициллин в концентрации 50 мкг/мл, при которой ингибирующий эффект также отсутствует. Параллельно проводили контрольные исследования с бактериальными культурами, находящимися в контакте с наноструктурами Fe2O3 и ампициллином по отдельности. Кинетику роста бактерий в лунках оценивали по изменению оптической плотности среды относительно контроля. На Фиг. 6 приведены кинетические кривые роста бактериальной культуры MRSA в жидкой питательной среде, оцененные по изменению оптической плотности суспензии в течение 24 ч инкубации, показывающие преодоление устойчивости метициллин-резистентного золотистого стафилококка (MRSA) к ампициллину при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с ампициллином в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с ампициллином (50 мкг/мл).
Пример 3. Преодоление устойчивости к пенициллину G синегнойной палочки (P. aeruginosa)
Бактериальный рост оценивали в 96-луночных микропланшетах (объем лунки 300 мкл) по изменению оптической плотности бактериальной суспензии при λ=620 нм. В качестве отрицательного контроля использовали культуру P. aeruginosa без добавления антибактериальных агентов. Оптическую плотность определяли при помощи планшетного спектрофотометра Thermo Scientific Multiskan FC (Thermo Fisher Scientific, США). Бактериальную культуру P. aeruginosa в концентрации 105 КОЕ/мл помещали в жидкую питательную среду, содержащую наноструктуры Fe2O3 в концентрации 1 мг/мл, при которой ингибирующий эффект (эффект подавления роста клеток) отсутствует. Кроме того, в лунки добавляли антибиотик пенициллин G в концентрации 50 мкг/мл, при которой ингибирующий эффект также отсутствует. Параллельно проводили контрольные исследования с бактериальной культурой P. aeruginosa, находящейся в контакте с наноструктурами Fe2O3 и пенициллином G по отдельности. Кинетику роста бактерий P. aeruginosa в лунках оценивали по изменению оптической плотности среды относительно контроля. На фиг. 7 приведены кинетические кривые роста бактериальной культуры P. aeruginosa в жидкой питательной среде, оцененные по изменению оптической плотности суспензии в течение 24 ч инкубации, показывающие преодоление устойчивости синегнойной палочки (P. aeruginosa) к бензилпенициллину (пенициллину G) при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с пенициллином G в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с пенициллином G (50 мкг/мл).
Пример 4 Преодоление устойчивости к ампициллину синегнойной палочки (P. aeruginosa)
Бактериальный рост оценивали в 96-луночных микропланшетах (объем лунки 300 мкл) по изменению оптической плотности бактериальной суспензии при λ=620 нм. В качестве отрицательного контроля использовали культуру P. aeruginosa без добавления антибактериальных агентов. Оптическую плотность определяли при помощи планшетного спектрофотометра Thermo Scientific Multiskan FC (Thermo Fisher Scientific, США). Бактериальную культуру P. aeruginosa в концентрации 105 КОЕ/мл помещали в жидкую питательную среду, содержащую наноструктуры Fe2O3 в концентрации 1 мг/мл, при которой ингибирующий эффект (эффект подавления роста клеток) отсутствует. Кроме того в лунки добавляли антибиотик ампициллин в концентрации 50 мкг/мл, при которой ингибирующий эффект также отсутствует. Параллельно проводили контрольные исследования с бактериальной культурой P. aeruginosa, находящейся в контакте с наноструктурами Fe2O3 и ампициллином по отдельности. Кинетику роста бактерий P. aeruginosa в лунках оценивали по изменению оптической плотности среды относительно контроля. На фиг. 8 приведены кинетические кривые роста бактериальной культуры P. aeruginosa в жидкой питательной среде, оцененные по изменению оптической плотности суспензии в течение 24 ч инкубации, показывающие преодоление устойчивости синегнойной палочки (P. aeruginosa) к ампициллину при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с ампициллином в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с ампициллином (50 мкг/мл).
Пример 5 Преодоление устойчивости к бензилпенициллину кишечной палочки (E. coli)
Бактериальный рост оценивали в 96-луночных микропланшетах (объем лунки 300 мкл) по изменению оптической плотности бактериальной суспензии при λ=620 нм. В качестве отрицательного контроля использовали культуру E. coli без добавления антибактериальных агентов. Оптическую плотность определяли при помощи планшетного спектрофотометра Thermo Scientific Multiskan FC (Thermo Fisher Scientific, США). Бактериальную культуру E. coli в концентрации 105 КОЕ/мл помещали в жидкую питательную среду, содержащую наноструктуры Fe2O3 в концентрации 1 мг/мл, при которой ингибирующий эффект (эффект подавления роста клеток) отсутствует. Кроме того в лунки добавляли антибиотик пенициллин G в концентрации 50 мкг/мл, при которой ингибирующий эффект также отсутствует. Параллельно проводили контрольные исследования с бактериальной культурой E. coli, находящейся в контакте с наноструктурами Fe2O3 и пенициллином G по отдельности. Кинетику роста бактерий P E. coli в лунках оценивали по изменению оптической плотности среды относительно контроля. На фиг. 9 приведены кинетические кривые роста бактериальной культуры E. coli в жидкой питательной среде, оцененные по изменению оптической плотности суспензии в течение 24 ч инкубации, показывающие преодоление устойчивости кишечной палочки (E. coli) к бензилпенициллину (пенициллину G) при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с пенициллином G в концентрации 50 мкг/мл; в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с пенициллином G (50 мкг/мл).
Пример 6. Преодоление устойчивости к ампициллину кишечной палочки (E. coli)
Бактериальный рост оценивали в 96-луночных микропланшетах (объем лунки 300 мкл) по изменению оптической плотности бактериальной суспензии при λ=620 нм. В качестве отрицательного контроля использовали культуру E. coli без добавления антибактериальных агентов. Оптическую плотность определяли при помощи планшетного спектрофотометра Thermo Scientific Multiskan FC (Thermo Fisher Scientific, США). Бактериальную культуру E. coli в концентрации 105 КОЕ/мл помещали в жидкую питательную среду, содержащую наноструктуры Fe2O3 в концентрации 1 мг/мл, при которой ингибирующий эффект (эффект подавления роста клеток) отсутствует. Кроме того, в лунки добавляли антибиотик ампициллин в концентрации 50 мкг/мл, при которой ингибирующий эффект также отсутствует. Параллельно проводили контрольные исследования с бактериальной культурой E. coli, находящейся в контакте с наноструктурами Fe2O3 и ампициллином по отдельности. Кинетику роста бактерий E. coli в лунках оценивали по изменению оптической плотности среды относительно контроля. На Фиг. 10 приведены кинетические кривые роста бактериальной культуры в жидкой питательной среде, оцененные по изменению оптической плотности суспензии в течение 24 ч инкубации, показывающие преодоление устойчивости кишечной палочки (E. coli) к ампициллину при применении наноструктур Fe2O3: а – отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 в концентрации 1 мг/мл; б – отсутствие ингибирующего эффекта при инкубировании только с ампициллином в концентрации 50 мкг/мл;в – выраженная противомикробная активность при применении наноструктур Fe2O3 (1 мг/мл) в комбинации с ампициллином (50 мкг/мл).
Пример 7. Сравнительный пример
Для подтверждения технического результата предлагаемых в настоящем изобретении наноструктур Fe2O3 в сравнении с другими подобными структурами в экспериментах in vitro были использованы трехмерные структуры гематита с низкой удельной поверхностью 32 м2/г и дзета-потенциалом в воде при 25°С равным +24 мВ (далее – наноструктуры Fe2O3 (ГТС)).
Структуры синтезировали в гидротермальных условиях (ГТС) при 200°С, в течение 6 часов: в дистиллированную воду объемом 500 мл, помещали 5 г эллипсовидных пористых наноструктур Fe2O3. Суспензию обрабатывали в ультразвуковой ванне в течение 5 минут и переливали в автоклав гидротермального синтеза с тефлоновой вставкой. Автоклав плотно закрывали, нагревали до 200°С и выдерживали в течение 12 часов. Далее, после остывания автоклава до комнатной температуры, продукты реакции отфильтровывали с помощью вакуумного насоса и сушили при 120°С в течение 2 часов.
Бактериальный рост оценивали в 96-луночных микропланшетах (объем лунки 300 мкл) по изменению оптической плотности бактериальной суспензии при λ=620 нм. В качестве положительного контроля брали культуру без антибактериальных агентов. Оптическую плотность определяли при помощи планшетного спектрофотометра Thermo Scientific Multiskan FC (Thermo Fisher Scientific, США). Культуры микроорганизмов в концентрации 105 КОЕ/мл помещали в жидкую питательную среду, содержащую наноструктуры Fe2O3 (ГТС) в концентрации 1 мг/мл, при которой ингибирующий эффект (эффект подавления роста клеток) отсутствует. После инкубирования в микропланшетах при 37°С в течение различных промежутков времени (0, 1, 2, 3 ч) в лунки добавляли антибиотик в определенной концентрации, при которой ингибирующий эффект также отсутствует. Параллельно проводили контрольные исследования с бактериальными культурами, находящимися в контакте с наноструктурами Fe2O3 (ГТС) и антибиотиками по отдельности. Кинетику роста бактерий в лунках оценивали по изменению оптической плотности среды относительно контроля. Количество живых бактерий определяли путем посева культур на плотный питательный агар в чашки Петри после инкубирования при 37°С в течение 24 часов. Выводы: показано, что синтезированные в гидротермальных условиях при 200°С, в течение 12 часов наноструктуры Fe2O3 (ГТС) с величиной удельной поверхности 32 м2/г и дзета-потенциалом в воде при 25°С равным +24 мВ оказывают менее выраженное действие на бактерии, вызывающее преодоление их устойчивости к антибиотикам.
На фиг. 11 приведены кинетические кривые роста бактериальных культур в жидкой питательной среде, оцененные по изменению оптической плотности суспензии в течение 24 ч инкубации, показывающие преодоление устойчивости MRSA к бензилпенициллину (пенициллину G) при применении наноструктур Fe2O3 (ГТС) с низкой удельной поверхностью, полученных в гидротермальных условиях при 200°С, в течение 12 часов (ГТС): отсутствие ингибирующего эффекта при инкубировании только с наноструктурами Fe2O3 (ГТС) в концентрации 1 мг/мл (зеленая кривая); б – отсутствие ингибирующего эффекта при инкубировании только с пенициллином G в концентрации 50 мкг/мл (фиолетовая кривая); в – слабая противомикробная активность при применении наноструктур Fe2O3 (ГТС) с концентрацией 1 мг/мл в комбинации с пенициллином G (50 мкг/мл) – синяя кривая.
Пример 8. Сравнительные пример
Для подтверждения технического результата предлагаемых в настоящем изобретении наноструктур Fe2O3 в сравнении с другими подобными структурами в экспериментах in vitro были также использованы микропористые структуры гетита с высокой удельной поверхностью 312 м2/г, размером пор менее 2 нм, с соотношением объем мезопор / объем микропор 0,24 и дзета-потенциалом в воде при 25 °С равным +32 мВ (далее – наноструктуры гетита).
Наноструктруры гетита синтезировали следующим образом в стакан объемом 250 мл помещали 50 раствора FeCl3 с концентрацией 0,5 М. При постоянном перемешивании добавляли небольшими порциями (по 3-5 мл) 1 М раствор NH4OH до создания рН≈9-10. Между введением каждой порции выдерживали 5 минут для наступления равновесия. Затем полученный осадок отфильтровывали, промывали до нейтральной реакции фильтрата и высушивали при 120°С в течении 2 часов.
Бактериальный рост оценивали в 96-луночных микропланшетах (объем лунки 300 мкл) по изменению оптической плотности бактериальной суспензии при λ=620 нм. В качестве положительного контроля брали культуру без антибактериальных агентов. Оптическую плотность определяли при помощи планшетного спектрофотометра Thermo Scientific Multiskan FC (Thermo Fisher Scientific, США). Культуры микроорганизмов в концентрации 105 КОЕ/мл помещали в жидкую питательную среду, содержащую наноструктуры гетита в концентрации 1 мг/мл, при которой ингибирующий эффект (эффект подавления роста клеток) отсутствует. После инкубирования в микропланшетах при 37°С в течение различных промежутков времени (0, 1, 2, 3 ч) в лунки добавляли антибиотик в определенной концентрации, при которой ингибирующий эффект также отсутствует. Параллельно проводили контрольные исследования с бактериальными культурами, находящимися в контакте с наноструктурами гетита и антибиотиками по отдельности. Кинетику роста бактерий в лунках оценивали по изменению оптической плотности среды относительно контроля. Количество живых бактерий определяли путем посева культур на плотный питательный агар в чашки Петри после инкубирования при 37°С в течение 24 часов.
Выводы: показано, что синтезированные наноструктуры гетита с высокой удельной поверхностью 312 м2/г, размером пор менее 2 нм, с соотношением объем мезопор / объем микропор 0,24 и дзета-потенциалом в воде при 25°С равным +32 мВ оказывают менее выраженное действие на бактерии, вызывающее преодоление их устойчивости к антибиотикам.
На фиг. 12 приведены кинетические кривые роста бактериальных культур в жидкой питательной среде, оцененные по изменению оптической плотности суспензии в течение 24 ч инкубации, показывающие преодоление устойчивости MRSA к бензилпенициллину (пенициллину G) при применении наноструктур гетита с с высокой удельной поверхностью 312 м2/г, размером пор менее 2 нм, с соотношением объем мезопор / объем микропор 0,24 и дзета-потенциалом в воде при 25 °С равным +32 мВ, полученных осаждением щелочью из раствора FeCl3: отсутствие ингибирующего эффекта при инкубировании только с наноструктурами гетита в концентрации 1 мг/мл (зеленая кривая); б – отсутствие ингибирующего эффекта при инкубировании только с пенициллином G в концентрации 50 мкг/мл (фиолетовая кривая); в – слабая противомикробная активность при применении наноструктур гетита с концентрацией 1 мг/мл в комбинации с пенициллином G (50 мкг/мл) – синяя кривая.
Пример 9. Исследование в экспериментах in vivo преодоления устойчивости бактерий с использованием элипсовидных пористых структур оксида железа Fe2O3 с высокой удельной поверхностью, использованных в экспериментах in vitro (далее – наноструктуры Fe2O3)
В качестве экспериментальных животных использованы самцы белых крыс породы “Vistar” весом от 254 до 346 г. При этом животные были разделены на 2 группы по 5 самцов в группе.
Первая группа: лечение одной раны проводилось наноструктурами Fe2O3, другая рана не подвергалась лечению.
Вторая группа: лечение ран проводилось внутримышечным введением пенициллина, при этом одна из ран также обрабатывалась наноструктурами Fe2O3.
В асептических условиях после двукратной обработки зоны вмешательства 70% спиртом, на предварительно депилированной коже подлопаточной области животных, формировали круглое сквозное отверстие диаметром 1,0 см. В качестве обезболивания использовался раствор кетамина путем внутримышечного его введения из расчета 0,3 мг на 1 кг веса. После наступления наркотического сна, крысу укладывали на бок и формировали модельные раны: контрольная (левая) и опытная (правая).
Далее дно и края ран инфицировали 24-часовой взвесью клинического штамма MRSA - суспензия бактерий в физиологическом растворе хлорида натрия приготовленная по оптическому стандарту мутности МакФарланда с концентрацией бактерий 1×109 КОЕ/мл. Процедуру инфицирования ран проводили путем однократного их орошения 1,0 мл приготовленной суспензии бактерии с обязательным глухим хирургическим сшиванием краев, который создавал и обеспечивал благоприятные условия для успешного их инфицирования.
Далее на 3 сутки после инфицирования и сшивания краев ран проводили удаление шовных материалов и приступали к лечению.
При этом инфицированные MRSA контрольные раны не подвергали местному лечению, а опытные раны лечили с применением образцов наноструктур Fe2O3. У первой группы экспериментальных животных местное лечение ран проводили без применения антибиотиков. У третьей группы местное лечение дополняли системным ежедневным внутримышечным введением раствора пенициллина в течении 7 суток (10 мг/кг 1 раз в сутки). При этом к лечению ран приступали на 3 сутки от начала исследования и инфицирования ран.
Местное лечение опытных ран 1 группы экспериментальных животных проводили путем равномерного нанесения на ее поверхность микроложки (~2 мг) наноструктур Fe2O3 по схеме: 1-4 сутки ежедневно, далее через день. При этом контрольные раны не подвергали местному лечению. Местное лечение опытных ран 2–й группы животных проводили также с равномерным нанесением на ее поверхность микроложки (~2 мг) наноструктур Fe2O3 по схеме: 1-4 сутки ежедневно и далее через день с внутримышечным введением раствора пенициллина из расчета 10 мг/кг веса 1 раз в сутки. При этом контрольные раны этих групп также не подвергали местному лечению и использовались для сравнения динамики заживления пенициллином. В процессе проведения исследования изучали общее состояния животных, проводили микробиологическое исследование поверхности ран, оценивали состояния и течения регенераторных процессов.
Особенности течения раневого процесса и динамику регенераторных изменений оценивали по таким показателям как: наличие и характер воспалительной реакции, состояние краев и дна раны, сроки очищение ран от гнойного экссудата и некротических тканей, начала появление и характер грануляций, сроки начала эпителизации и закрытие ран (ЗР в %). Показатель ЗР рассчитывали, как процентное отношение разницы исходного размера раны и текущего размера к исходному размеру раны.
Результаты проведенных исследований по данным анализа показателей общего состояние животных свидетельствуют, о том, что у большинства из них (80%) первые 2-3 суток при удовлетворительном общем состоянии отмечали некоторое снижение двигательной активности, связанное с нанесенными им травмами, а также результатом успешного инфицирования ран с занесением в организм инфекционного агента и развитием гнойно–воспалительного процесса. Дальнейшее наблюдение за динамикой этих показателей свидетельствуют о постепенном восстановлении исходной двигательной активности спустя 2-3 суток от начала эксперимента. Подтверждением такой положительной динамики явилась и тенденция увеличения веса животных на 8-12 % от исходных данных, начиная с 5 суток и до конца исследования. Данный факт был обусловлен купированием воспроизведенного гнойно-воспалительного процесса местным применением наноструктур Fe2O3, снижением степени интоксикации организма, очищением ран от гнойного экссудата и некротических масс, дополнительным характером обезболивающего их влияния на раневой процесс. Такая положительная динамика течения была лучше отмечена у экспериментальных животных 2 группы, когда местное лечение комбинировалась внутримышечным применением пенициллина.
В группе животных, у которых местное лечение ран проводилось с применением наноструктур Fe2O3, на 3-5 сутки наблюдения наличие отека, гиперемии, припухлости и местной гипертермии окружающих тканей, а также свободного гнойного экссудата обнаружены не были. Однако раны у данной группы животных покрывались толстой коричневой коркой со следами оксида железа, иногда выступающие над окружающей кожной поверхностью и плотно прилипающих ко дну и ее краям. При удалении последних были отмечены неровные очертания (фестончатые) краев ран, чистое глубокое дно и без наличия кровотечения. Размеры ран в эти сроки наблюдения составили 1,1×0,8 cм, что было больше на 10,2 % по сравнению с исходными размерами опытных ран контрольной группы исследуемых животных. При этом показатели контрольных ран (без лечения) не претерпевали существенных изменений.
В группе животных где лечение инфицированных ран проводилось местным применением наноструктур Fe2O3 в сочетании с антибиотиком в течении 3-5 суток наблюдения в динамике течения раневого процесса существенных изменений не происходили и размеры ран оставались на уровне 1,05-1,1 см (при исходном 10 мм), а индекс ЗР составлял -10%. При этом опытные раны были покрыты коричневой коркой со следами оксида железа, выступающие у некоторых над окружающей поверхностью кожного покрова и плотно прилипших с их дном. Если на 2-3 сутки наблюдения после удаления корок глубокое дно ран у большинства из них оставались покрытыми сероватым налетом, а края имели неровные очертания, то к 5 суткам визуализировалось неглубокое чистое дно с отсутствием кровотечения, с ровными краями ран со следами свежих грануляций, исходящих преимущественно со дна.
Полная эпителизация опытных и контрольных ран животных первой группы на 6 сутки были отмечены только у 2 животных, в то же время у остальных опытных ран размер сохранялся в пределах 4,4 мм, а у контрольных он был равен 4,6 мм. При этом у некоторых из них еще сохранялись признаки продуктивного воспалительного процесса с наличием легкой гиперемии краев ран, но чистого дна, покрывающего грануляционной тканью. Следовательно индекс ЗР в опытной группе составлял 56%, а в контрольной 54%. При этом раны покрывались корками (следы оксида железа). В опытной группе они были выраженными и отличались ярким коричневым цветом по сравнению с ранами контрольных групп. К указанному сроку все раны имели чистое дно ровные края и отмечалось начало формирования грануляционной ткани, исходящее преимущественно со дна.
На 8 сутки у всех животных сохранялось наличие соответствующих ран, покрытых корками. Причем процесс коркообразования был наиболее выражен в опытных, где для лечения ран использовались наноструктуры Fe2O3. Средний размер ран к указанному сроку наблюдения в группе опытных составлял 2,6 мм, а в контрольных он был равен 3,1 мм. Индекс ЗР у опытных и контрольных ран составляли 74% и 69%, соответственно.
Дальнейшие наблюдения за ранами животных показали, что на 10 сутки у ран, подвергавшихся лечению наноструктурами Fe2O3 в комбинации с пенициллином, было отмечено их полное заживления. В группе, где лечение проходило без антибиотика, первыми эпителизировались опытные раны (12 сутки), а в 13-14 сутки контрольные. В ходе визуального наблюдения над опытными ранами было отмечено, что наноструктуры Fe2O3 при контакте с инфекционным агентом и его производными (гнойный экссудат, гнойный налет и некротические массы) обладают мощным адсорбирующим действием. Наноструктуры Fe2O3 оптимизируют процессы тканевой регенерации, оказывая позитивное влиянии на соединительнотканную ткань.
Таким образом, при лечении ран лабораторных животных, инфицированных метициллин-резистентным золотистым стафилококком (MRSA), пористыми наноструктурами Fe2O3 в комбинации с пенициллином (внутримышечное введением раствора пенициллина дозой 10 мг/кг 1 раз в сутки), ранозаживление происходит быстрее, чем при лечении наноструктурами и пенициллином по отдельности. На 8 сутки лечения индексе заживления раны (ЗР) при лечении наноструктуры Fe2O3 и пенициллином составил 74 %, при лечении только пенициллином индекс ЗР составил 69%, при лечении только наноструктурами ЗР составил 54%. Быстрое заживление обусловлено подавлением жизнеспособности патогенной микрофлоры за счет изменения чувствительности MRSA к пенициллину в присутствие наноструктур Fe2O3. Данные потенцирующего действия приведены в таблице 1.
Таблица 1
|