Результат интеллектуальной деятельности: АЗОТСОДЕРЖАЩИЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ ВИЧ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
[0001]
Настоящее изобретение относится к новому соединению, обладающему противовирусной активностью, более конкретно к препарату против ВИЧ.
УРОВЕНЬ ТЕХНИКИ
[0002]
Известно, что среди вирусов вирус иммунодефицита человека (далее сокращенно обозначаемый ВИЧ), который является одним из типов ретровирусов, является причиной синдрома приобретенного иммунодефицита (далее сокращенно обозначаемого СПИД). В качестве терапевтического средства от СПИДа в настоящее время в основном используют ингибиторы обратной транскриптазы (AZT, 3TC и т.д.), ингибиторы протеазы (индинавир и т.д.) и ингибитор интегразы (ралтегравир и т.д.), но были обнаружены проблемы побочных эффектов, такие как проблемы с почками, и появление устойчивых резистентных вирусов, и ожидается, что будут разработаны препараты против ВИЧ, имеющие другой механизм действия.
[0003]
Кроме того, было сообщено, что, поскольку легко появляются резистентные вирусы, при лечении СПИДа настоящее время эффективна множественная лекарственная терапия. В качестве препаратов против ВИЧ клинически использовались три типа ингибиторов обратной транскриптазы, ингибиторов протеазы и ингибиторов интегразы, но средства, имеющие одинаковый механизм действия, часто проявляют перекрестную резистентность или демонстрируют только аддитивный эффект, и существует потребность в разработке препаратов против ВИЧ, имеющих другой механизм действия.
[0004]
Препараты против ВИЧ с боковой цепью карбоксиалкильного типа в шестичленном кольцевом ядре, таком как бензол или пиридин, на их конденсированном кольце описаны в патентных документах 1-32 и 36. В частности, пятичленный гетероцикл, конденсированный с производным бензола, описан в патентном документе 28 (WO2013/159064), патентном документе 29 (WO2012/145728) и т.д. Кроме того, в патентном документе 16 (WO2012/140243) и патентном документе 36 (WO2014/057103) описаны производные бензола, имеющие различные заместители. Кроме того, препараты против ВИЧ, имеющие боковые цепи карбоксиалкильного типа в 5-членном кольцевом ядре, описаны в патентных документах 33-35. Однако нигде в литературе не описаны трициклические соединения настоящего изобретения.
Кроме того, патенты, относящиеся к препаратам против ВИЧ, таким как новые ингибиторы интегразы, приведены в непатентном документе 1.
ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0005]
Патентный документ 1: WO2007/131350
Патентный документ 2: WO2009/062285
Патентный документ 3: WO2009/062288
Патентный документ 4: WO2009/062289
Патентный документ 5: WO2009/062308
Патентный документ 6: WO2010/130034
Патентный документ 7: WO2010/130842
Патентный документ 8: WO2011/015641
Патентный документ 9: WO2011/076765
Патентный документ 10: WO2012/033735
Патентный документ 11: WO2012/003497
Патентный документ 12: WO2012/003498
Патентный документ 13: WO2012/065963
Патентный документ 14: WO2012/066442
Патентный документ 15: WO2012/102985
Патентный документ 16: WO2012/140243
Патентный документ 17: WO2013/012649
Патентный документ 18: WO2013/002357
Патентный документ 19: WO2013/025584
Патентный документ 20: WO2013/043553
Патентный документ 21: WO2013/073875
Патентный документ 22: WO2013/062028
Патентный документ 23: WO2013/103724
Патентный документ 24: WO2013/103738
Патентный документ 25: WO2013/123148
Патентный документ 26: WO2013/134113
Патентный документ 27: WO2013/134142
Патентный документ 28: WO2013/159064
Патентный документ 29: WO2012/145728
Патентный документ 30: WO2013/157622
Патентный документ 31: WO2014/009794
Патентный документ 32: WO2014/028384
Патентный документ 33: WO2012/137181
Патентный документ 34: WO2014/053665
Патентный документ 35: WO2014/053666
Патентный документ 36: WO2014/057103
Непатентный документ 1: Expert. Opin. Ther. Patents (2014)24(6)
[0006]
Кроме того, автором настоящей заявки была подана патентная заявка, относящаяся к ингибиторам репликации ВИЧ на основе трициклического производного (WO2014/119636, WO2015/147247, WO2015/174511).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
[0007]
Целью настоящего изобретения является предоставление нового соединения, обладающего противовирусной активностью. Предпочтительно, настоящее изобретение предлагает препарат против ВИЧ, оказывающий ингибирующее воздействие на репликацию ВИЧ. Более предпочтительно, настоящее изобретение предлагает также эффективный новый препарат против ВИЧ против мутантных штаммов и резистентных штаммов ВИЧ, имеющий основную структуру, которая отличается от структуры традиционных препаратов против ВИЧ. Кроме того, настоящее изобретение предлагает также промежуточные продукты его синтеза и способ его производства.
СРЕДСТВА РЕШЕНИЯ ПРОБЛЕМЫ
[0008]
В результате интенсивных исследований авторы настоящего изобретения обнаружили азотсодержащие трициклические производные, пригодные в качестве ингибиторов репликации ВИЧ. Кроме того, авторы настоящего изобретения обнаружили, что соединения настоящего изобретения и содержащая их фармацевтическая композиция пригодны в качестве противовирусных препаратов (примеры: препараты против ретровирусов, препараты против ВИЧ, препараты против HTLV-1 (вирус T-клеточного лейкоза человека типа 1: вирус T-клеточного лейкоза человека типа 1), препараты против FIV (вирус иммунодефицита кошачьих: вирус СПИДа кошачьих), препараты против SIV (вирус иммунодефицита обезьян: вирус ВИЧ обезьян)), особенно препаратов против ВИЧ, препаратов против СПИД или терапевтических средств для родственных заболеваний и т.п., тем самым выполнив настоящее изобретение.
Настоящее изобретение относится к нижеследующим п.п. (1)-(23), (1C)-(18C), (1B)-(16B) и (1A)-(21A).
[0009]
(1) Соединение, представленное следующей формулой (I):
[Химическая формула 1]
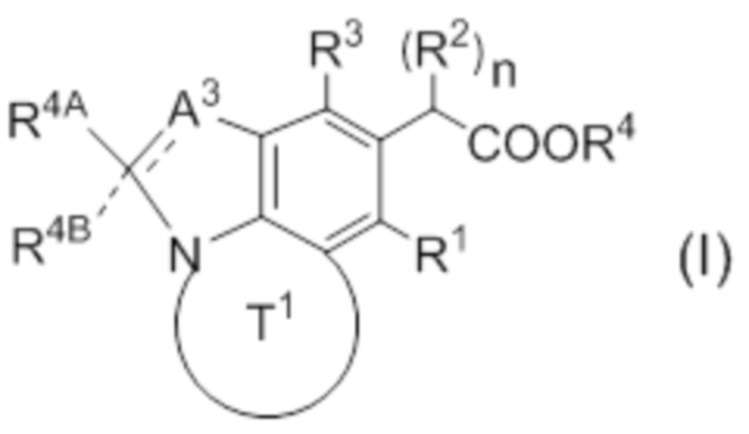
или его фармацевтически приемлемая соль,
причем прерывистая линия обозначает наличие или отсутствие связи,
A3 представляет собой CR3A, CR3AR3B, N или NR3C;
каждый R3A, R3B, R4A и R4B независимо представляют собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкинил или замещенный или незамещенный неароматический карбоциклил;
R3C представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный неароматический карбоциклил;
кольцо T1 представляет собой замещенный или незамещенный азотсодержащий неароматический гетероцикл;
R1 представляет собой водород, галоген, циано или замещенный или незамещенный алкил;
каждый R2 независимо представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси или замещенный или незамещенный неароматический карбоциклилокси;
n представляет собой 1 или 2;
R3 представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил; и
R4 представляет собой водород или карбоксилзащитную группу;
при условии, что исключены следующие соединения.
[Химическая формула 2]

(2) Соединение или его фармацевтически приемлемая соль по п. 1, представленные следующей формулой (I'):
[Химическая формула 3]
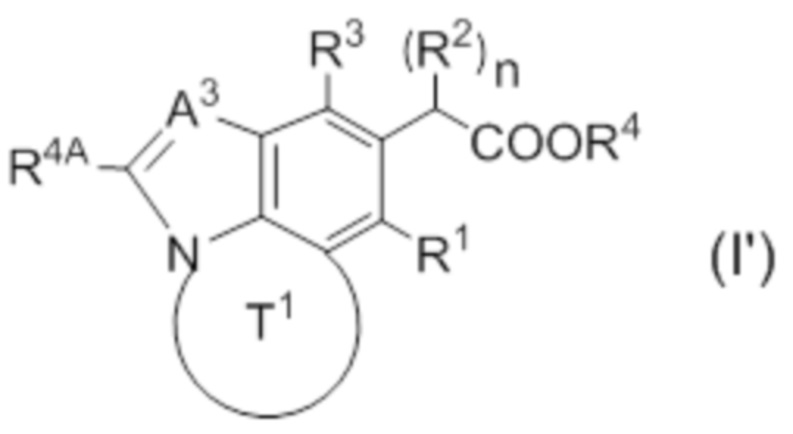
в которой A3 представляет собой CR3A или N; R3A представляет собой водород или галоген; другие символы совпадают с определенными в (1).
(3) Соединение или его фармацевтически приемлемая соль в соответствии с (1) или (2), в которых субструктура, представленная формулой:
[Химическая формула 4]

представляет собой субструктуру, представленную следующей формулой:
[Химическая формула 5]
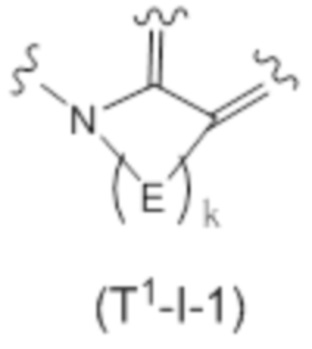
в которой каждый E независимо представляет собой -NRa-, -O-, -S-, -SO2-, -SO- или -CRbRc-;
каждый Ra независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1, -COORa1, -SORa2, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5;
каждый Ra1, Ra2 и Ra3 независимо представляют собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Ra4 и Ra5 независимо представляют собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
Ra6 представляет собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Rb независимо представляет собой водород, галоген, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоциклил;
каждый Rc независимо представляет собой водород, галоген, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоциклил; или
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связанным атомом углерода с образованием карбонила, замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла; и/или
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием моноциклического замещенного или незамещенного неароматического карбоцикла или моноциклического замещенного или незамещенного неароматического гетероцикла; или
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи; и/или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с данным атомом азота и данным атомом углерода с образованием моноциклического замещенного или незамещенного ароматического гетероцикла или моноциклического замещенного или незамещенного неароматического гетероцикла; или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи;
два Rb на двух атомах углерода, которые не являются соседними друг для друга, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении; или
Ra на атоме азота и Rb на атоме углерода, который не является соседним для атома азота, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO-, -SO2-, в произвольном положении; и
k представляет собой целое число от 2 до 7.
(4) Соединение или его фармацевтически приемлемая соль в соответствии с (3), в которых субструктура, представленная формулой:
[Химическая формула 6]

представляет собой субструктуру, представленную любой из следующих формул:
[Химическая формула 7]

в которых
Q представляет собой -NRa-, -O-, -S- или -CRbRc-,
L представляет собой -SO2-, -SO- или -CRbRc-;
m представляет собой целое число от 0 до 5; и
другие символы совпадают с определенными в (3).
(5) Соединение или его фармацевтически приемлемая соль в соответствии с (4), которые представлены следующей формулой (I-1-1) или (I-2-1):
[Химическая формула 8]
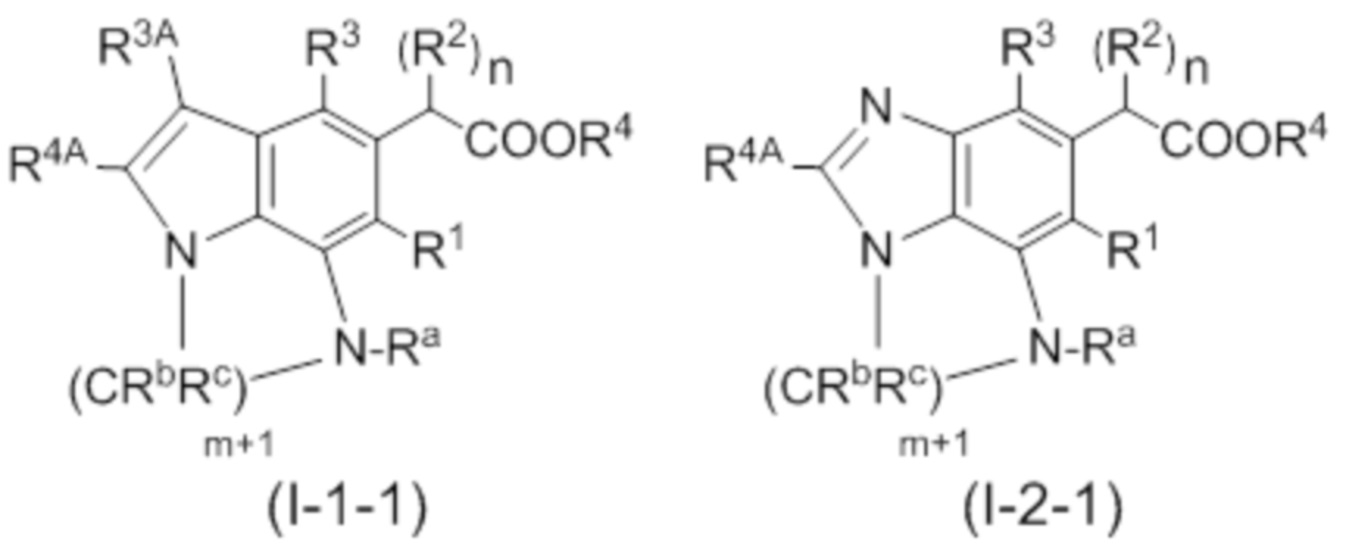
в которой R3A представляет собой водород; R4A, R1, R2, R3, R4 и n совпадают с определенными в (1); Ra, Rb и Rc совпадают с определенными в (3), и m совпадает с определенным в (4).
(6) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1)-(5), в которых R4A представляет собой галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкинил или замещенный или незамещенный неароматический карбоциклил.
(7) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1)-(6), в которых R1 представляет собой алкил, циано или галоген.
(8) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1)-(7), в которых n представляет собой 1; и R2 представляет собой алкилокси.
(9) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1)-(8), в которых R4 представляет собой водород.
(10) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1)-(6), в которых R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
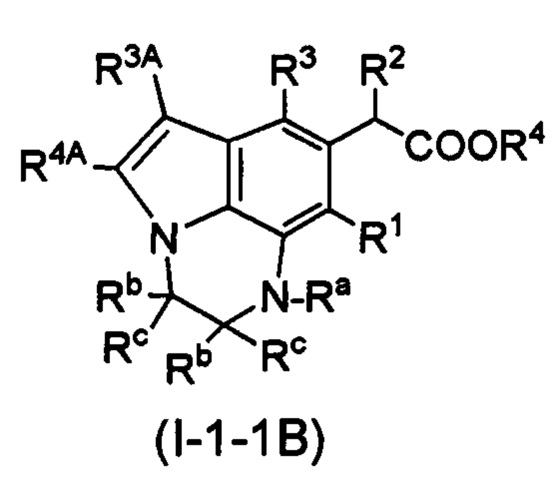
(11) Соединение или его фармацевтически приемлемая соль в соответствии с (3), в которых R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; R4 представляет собой водород; R3 представляет собой замещенный или незамещенный ароматический карбоциклил или замещенный или незамещенный неароматический гетероциклил; Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1, -CONRa4Ra5, -SO2Ra3, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил или замещенный или незамещенный неароматический гетероциклилалкил; каждый Rb независимо представляет собой водород, галоген, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоциклил; каждый Rc независимо представляет собой водород, галоген, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоциклил; или Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с данными атомом азота и атомом углерода с образованием моноциклического замещенного или незамещенного ароматического гетероцикла или моноциклического замещенного или незамещенного неароматического гетероцикла, или два Rb на соседних атомах углерода соединены вместе с каждым связанным атомом углерода с образованием моноциклического замещенного или незамещенного неароматического карбоцикла или моноциклического замещенного или незамещенного неароматического гетероцикла; и k представляет собой целое число от 3 до 5.
(12) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (4)-(6), в которых Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1, -CONRa4Ra5 или -SO2Ra3; Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; R3 представляет собой замещенный или незамещенный ароматический карбоциклил или замещенный или незамещенный неароматический гетероциклил; и R4 представляет собой водород.
(13) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (4)-(6), в которых m представляет собой целое число от 1 до 3; R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; R4 представляет собой водород; R3 представляет собой замещенный или незамещенный ароматический карбоциклил или замещенный или незамещенный неароматический гетероциклил; Ra и Rb на соседних атоме азота и атоме углерода соединены вместе с каждым атомом, образующим кольцо, который связан с Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, соединены вместе с каждым связанным атомом с образованием замещенного или незамещенного моноциклического ароматического гетероцикла или замещенного или незамещенного моноциклического неароматического гетероцикла, два Rb на соседних атомах углерода соединены вместе с каждым атомом углерода с образованием замещенного или незамещенного моноциклического неароматического карбоцикла или замещенного или незамещенного моноциклического неароматического гетероцикла, или Rb и Rc на одном и том же атоме углерода соединены вместе со связанным атомом углерода с образованием карбонила, замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла.
(14) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (4)-(6), в которых Ra представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил или замещенный или незамещенный неароматический гетероциклилалкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; R3 представляет собой замещенный или незамещенный ароматический карбоциклил или замещенный или незамещенный неароматический гетероциклил; и R4 представляет собой водород.
(15) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (4) или (5), в которых R4A представляет собой галоген, циано, алкил или галогеналкил; Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1, -CONRa4Ra5, -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; R3 представляет собой замещенный или незамещенный ароматический карбоциклил или замещенный или незамещенный неароматический гетероциклил; и R4 представляет собой водород.
(16) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (4) или (5), в которых R4A представляет собой галоген, циано, алкил или галогеналкил; Ra представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил или замещенный или незамещенный неароматический гетероциклилалкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; R3 представляет собой замещенный или незамещенный ароматический карбоциклил или замещенный или незамещенный неароматический гетероциклил; и R4 представляет собой водород.
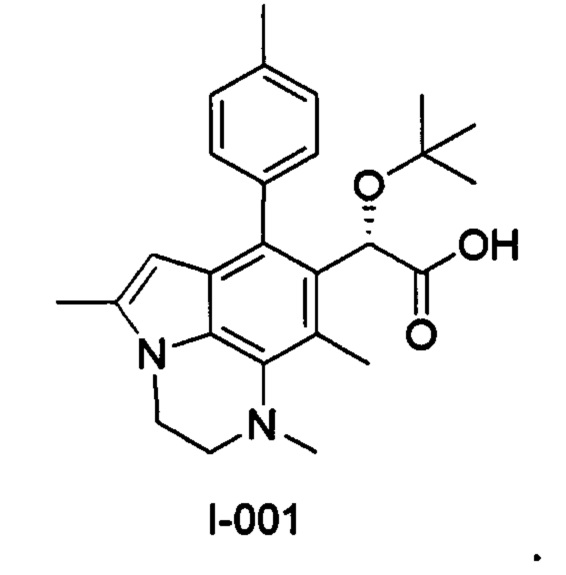
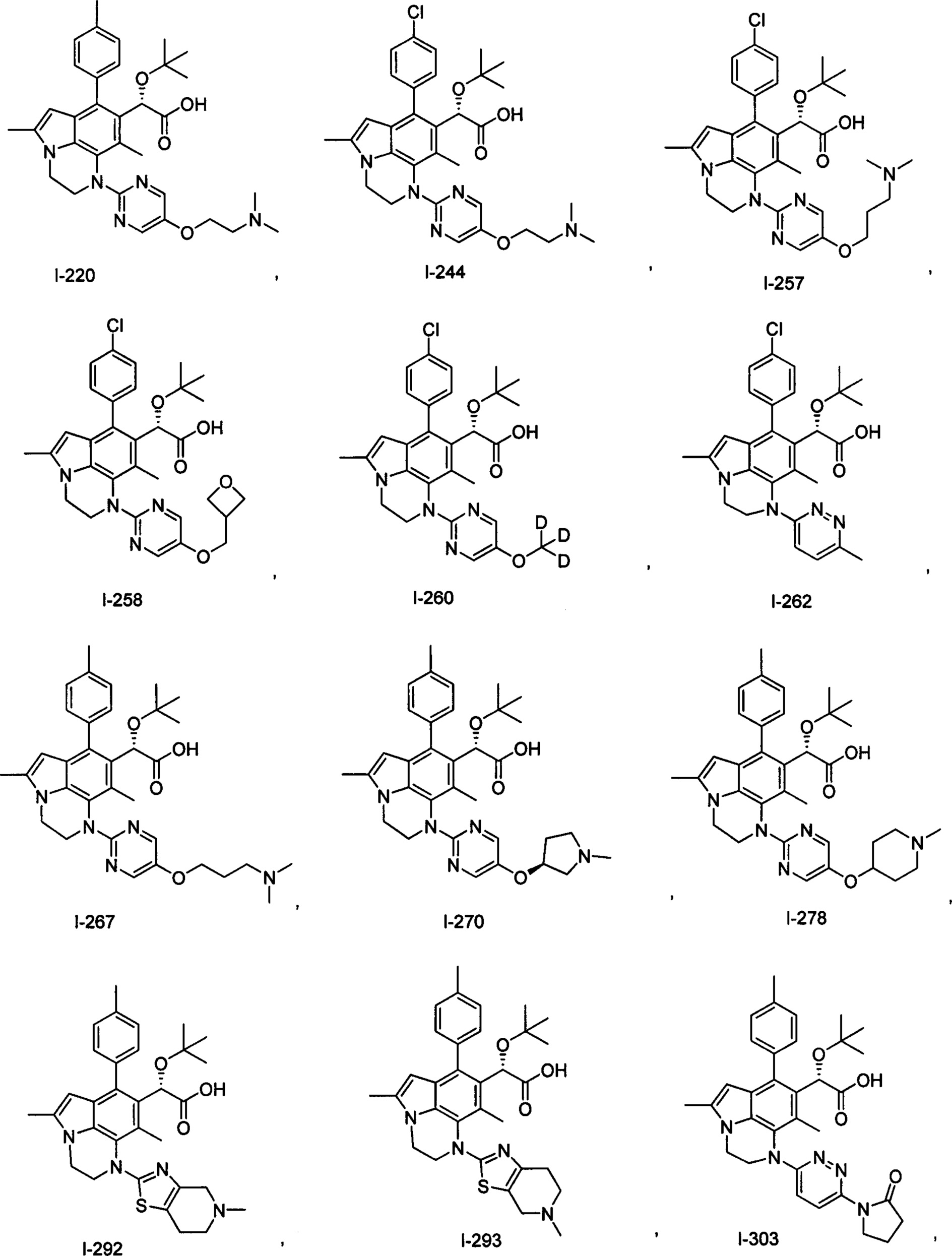
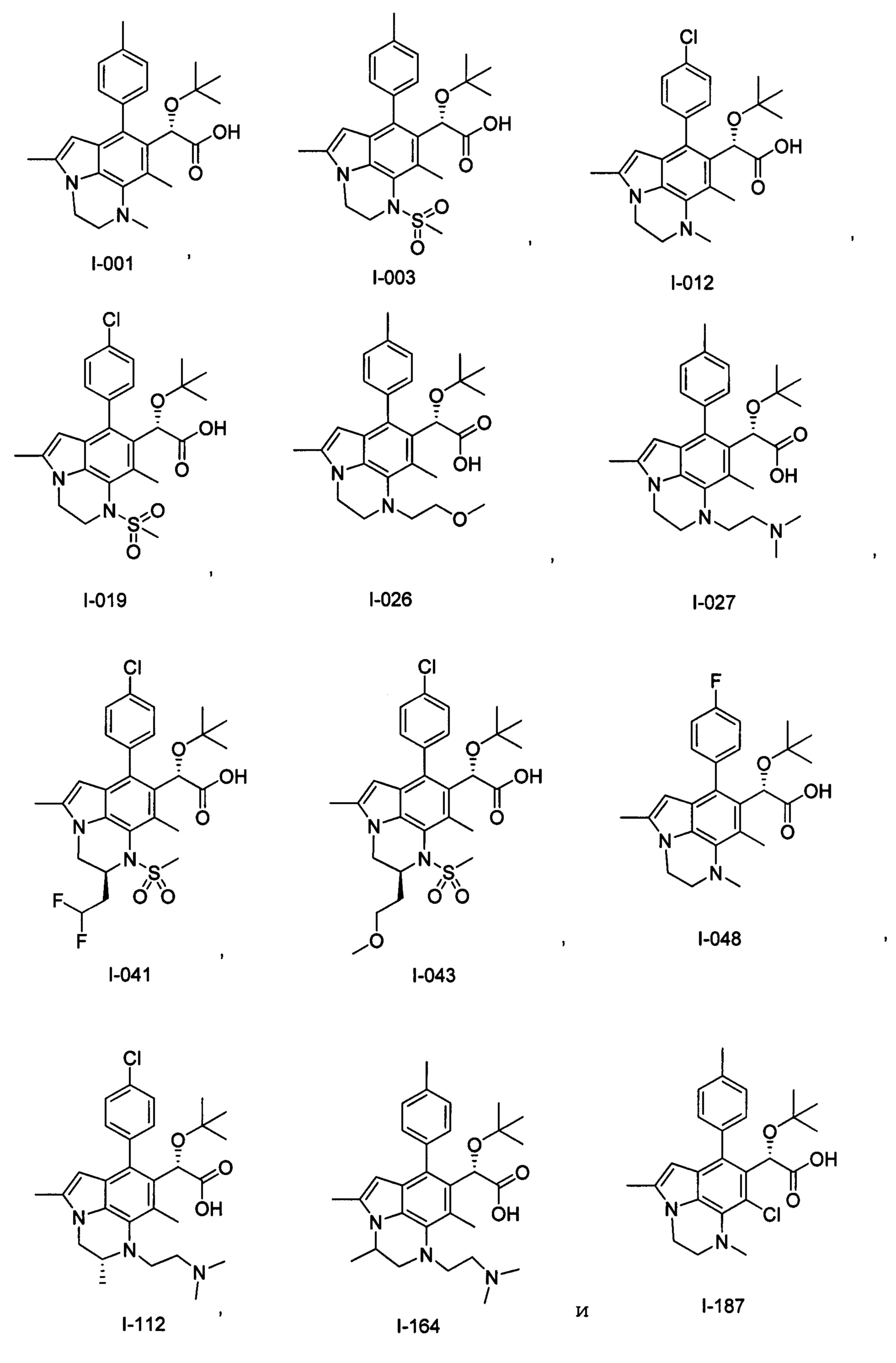
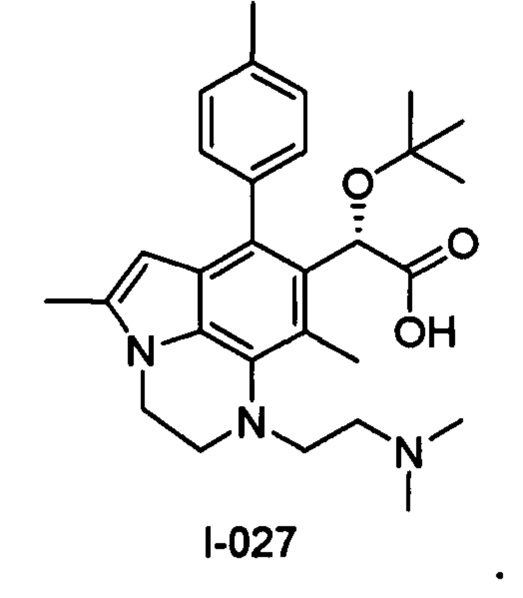
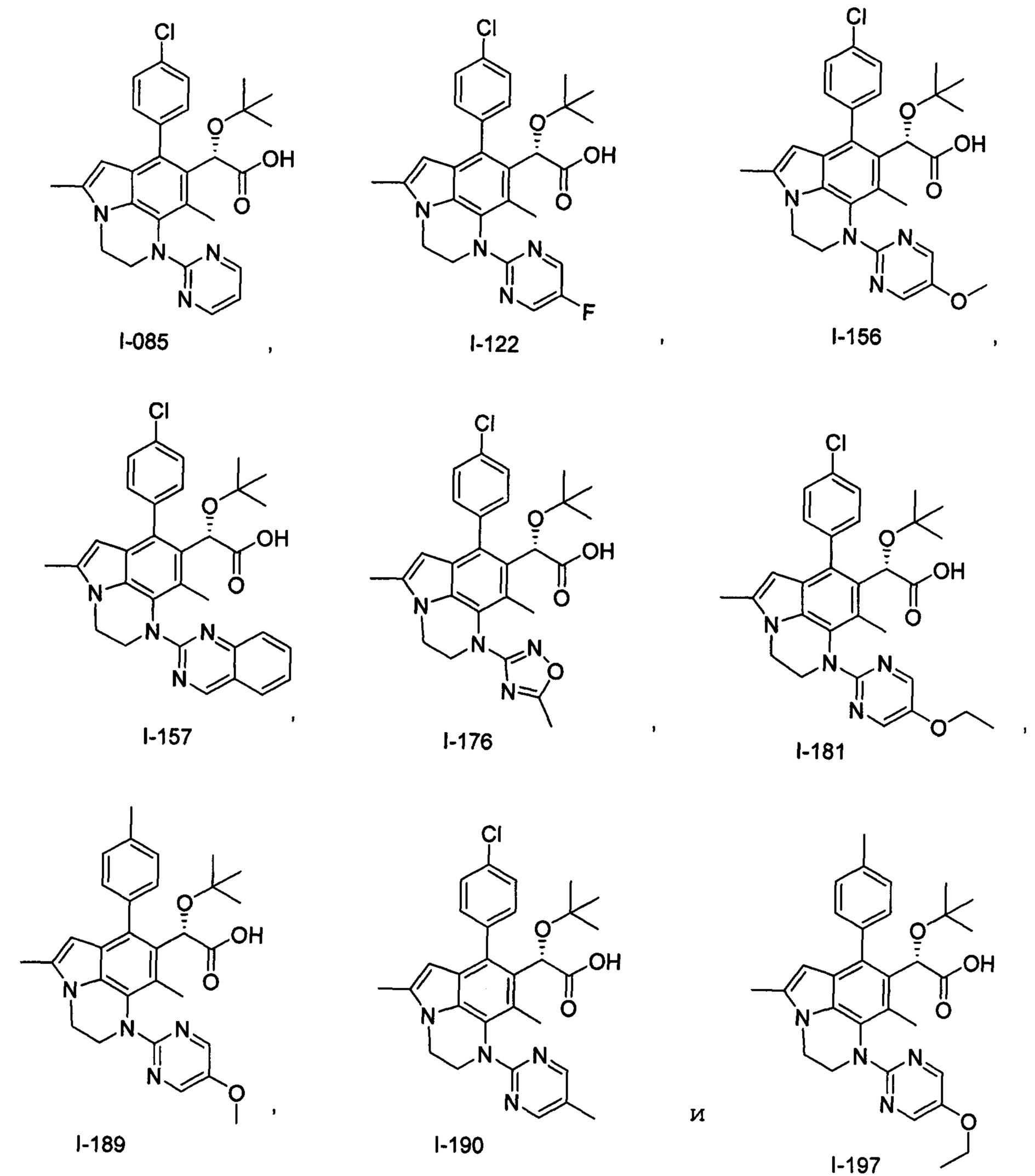
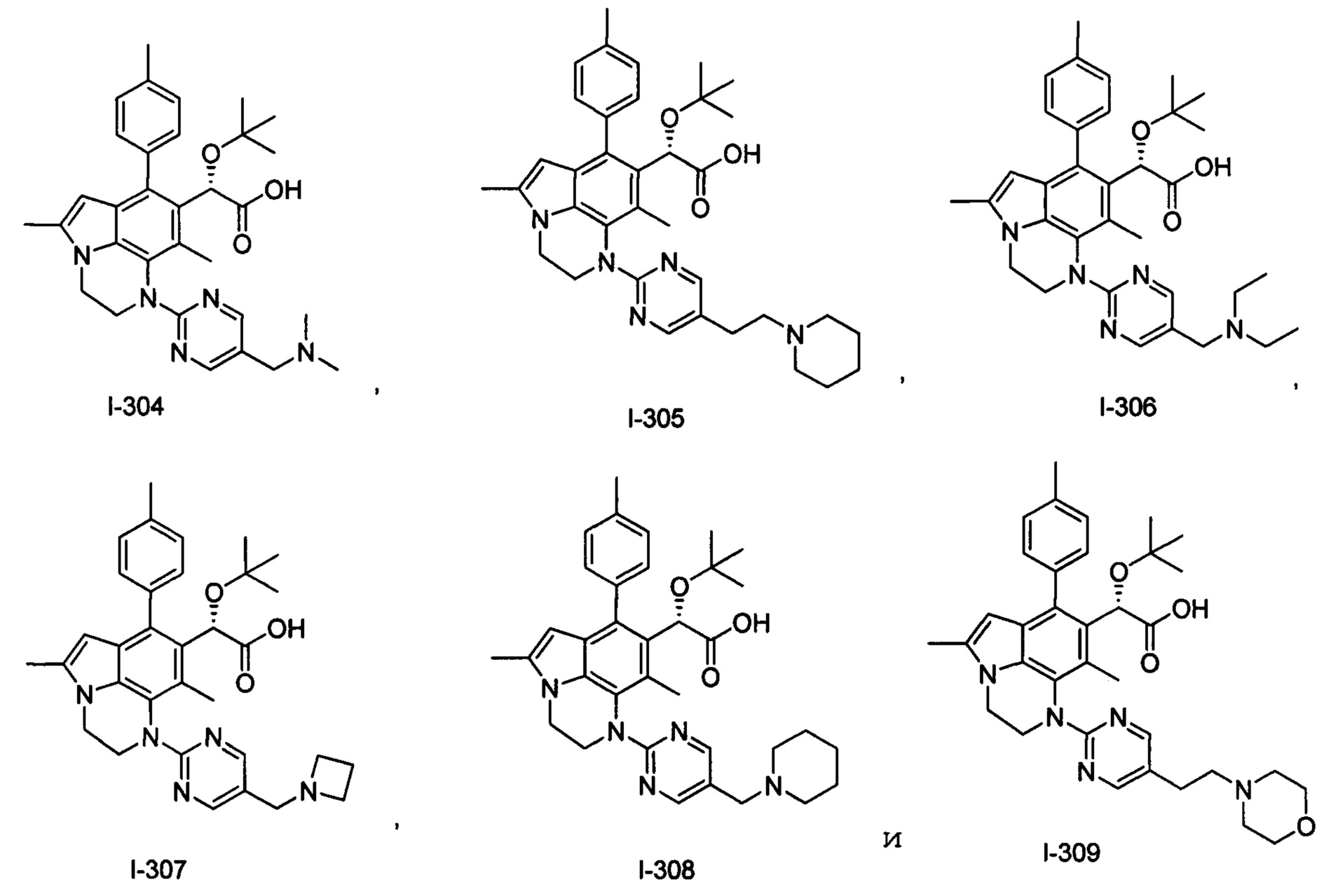
(17) Соединение или его фармацевтически приемлемая соль в соответствии с (1), которые представляют собой любые из I-001, I-003, I-012, I-019, I-026, I-027, I-041, I-043, I-048, I-085, I-112, I-122, I-156, I-157, I-164, I-176, I-181, I-187, I-189, I-190 и I-197.
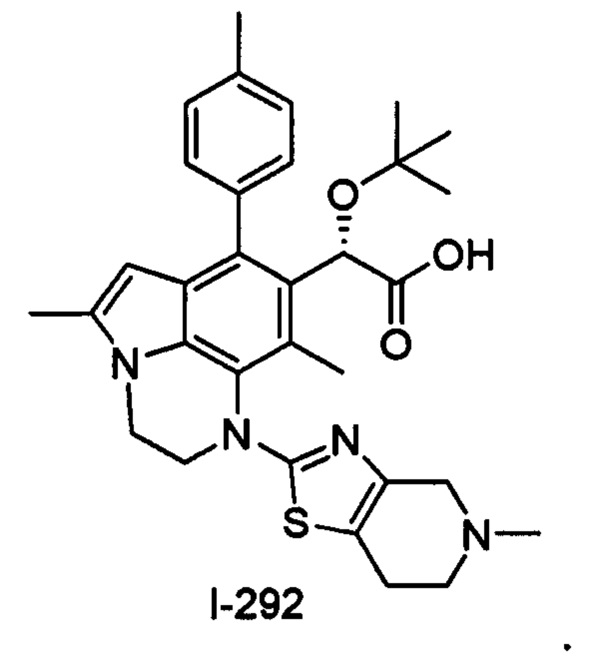
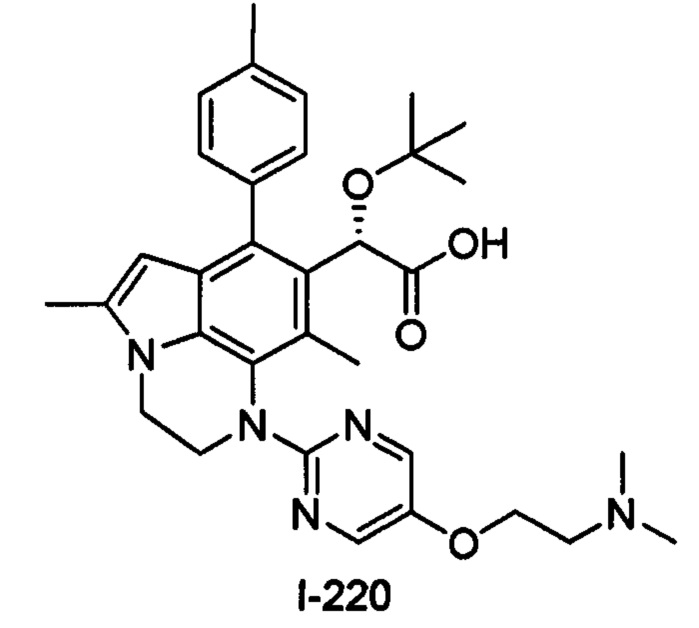
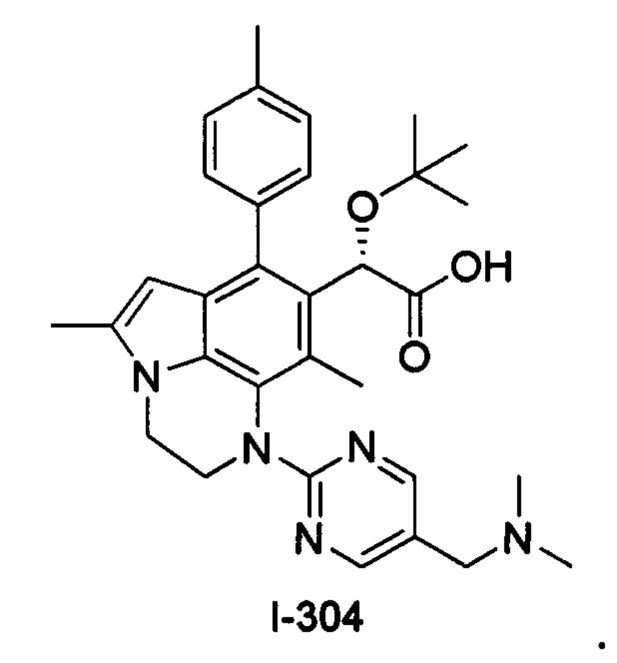
(18) Соединение или его фармацевтически приемлемая соль в соответствии с (1), которые представляют собой любые из I-220, I-244, I-257, I-258, I-260, I-262, I-267, I-270, I-278, I-292, I-293, I-303, I-304, I-305, I-306, I-307, I-308 и I-309.
(19) Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль в соответствии с любым из (1)-(18).
(20) Фармацевтическая композиция в соответствии с (19), обладающая противовирусной активностью.
(21) Фармацевтическая композиция в соответствии с (19), обладающая активностью против ВИЧ.
(22) Способ лечения или предупреждения инфекционного заболевания ВИЧ, который содержит введение соединения или его фармацевтически приемлемой соли в соответствии с любым из (1)-(18).
(23) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1)-(18) для лечения или предупреждения инфекционного заболевания ВИЧ.
[0010]
(1C) соединение, представленное следующей формулой (I):
[Химическая формула 9]

или его фармацевтически приемлемая соль,
причем прерывистая линия обозначает наличие или отсутствие связи,
A3 представляет собой CR3A, CR3AR3B, N или NR3C;
каждый R3A, R3B, R4A и R4B независимо представляют собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкинил или замещенный или незамещенный неароматический карбоциклил;
R3C представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный неароматический карбоциклил;
кольцо T1 представляет собой замещенный или незамещенный азотсодержащий неароматический гетероцикл;
R1 представляет собой водород, галоген, циано или замещенный или незамещенный алкил;
каждый R2 независимо представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси или замещенный или незамещенный неароматический карбоциклилокси;
n представляет собой 1 или 2;
R3 представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
R4 представляет собой водород или карбоксилзащитную группу;
при условии, что исключены следующие соединения.
[Химическая формула 10]

[0011]
(2C) Соединение или его фармацевтически приемлемая соль в соответствии с (1C), в которых субструктура, представленная формулой:
[Химическая формула 11]

представляет собой субструктуру, представленную следующей формулой:
[Химическая формула 12]

в которой каждый E независимо представляет собой -NRa-, -O-, -S-, -SO2-, -SO- или -CRbRc-;
Ra представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1, -COORa1, -SORa2, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5;
каждый Ra1, Ra2 и Ra3 независимо представляют собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Ra4 и Ra5 независимо представляют собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
Ra6 представляет собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил;
каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; или
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связанным атомом углерода с образованием карбонила, замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла; и/или
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием замещенного или незамещенного моноциклического неароматического карбоцикла или замещенного или незамещенного моноциклического неароматического гетероцикла; или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с каждым связанным атомом кольца с образованием замещенного или незамещенного моноциклического ароматического гетероцикла или замещенного или незамещенного моноциклического неароматического гетероцикла; или
два Rb на двух атомах углерода, которые не являются соседними друг для друга, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO-, -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении; или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO-, -SO2-, в произвольном положении; и/или
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи; или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи; и k представляет собой целое число от 2 до 7.
[0012]
(3C) Соединение или его фармацевтически приемлемая соль в соответствии с (2C), в которых субструктура, представленная формулой:
[Химическая формула 13]

представляет собой субструктуру, представленную любой из следующих формул:
[Химическая формула 14]

в которых Q представляет собой -NRa-, -O-, -S- или -CRbRc-,
L представляет собой -SO2-, -SO- или -CRbRc-;
m представляет собой целое число от 0 до 5;
другие символы совпадают с определенными выше.
[0013]
(4C) Соединение или его фармацевтически приемлемая соль в соответствии с (2C) или (3C), которые представлены следующей формулой (I-1-1) или (I-2-1):
[Химическая формула 15]

в которой каждый символ совпадает с определенным выше.
[0014]
(5C) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1C)-(4C), в которых любой из R4A и R5B представляет собой галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкинил или замещенный или незамещенный неароматический карбоциклил.
[0015]
(6C) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1C)-(5C), в которых R1 представляет собой алкил, циано или галоген.
[0016]
(7C) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1C)-(6C), в которых n представляет собой 1; R2 представляет собой алкилокси.
[0017]
(8C) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1C)-(7C), в которых R4 представляет собой водород.
[0018]
(9C) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (1C)-(5C), в которых R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0019]
(10C) Соединение или его фармацевтически приемлемая соль в соответствии с (2C), в которых R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; R4 представляет собой водород; Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1, -CONRa4Ra5, -SO2Ra3, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил или замещенный или незамещенный неароматический гетероциклилалкил; каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; или Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, соединены вместе с каждым связанным атомом кольца с образованием замещенного или незамещенного моноциклического ароматического гетероцикла или замещенного или незамещенного моноциклического неароматического гетероцикла, или два Rb на соседних атомах углерода соединены вместе с каждым связанным атомом углерода с образованием замещенного или незамещенного моноциклического неароматического карбоцикла или замещенного или незамещенного моноциклического неароматического гетероцикла; и k представляет собой целое число от 3 до 5.
[0020]
(11C) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (3C)-(5C), в которых Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1, -CONRa4Ra5 или -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0021]
(12C) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (3C)-(5C), в которых m представляет собой целое число от 1 до 3; R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; R4 представляет собой водород, Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, соединены вместе с каждым связанным атомом кольца с образованием замещенного или незамещенного моноциклического ароматического гетероцикла или замещенного или незамещенного моноциклического неароматического гетероцикла, или два Rb на соседних атомах углерода соединены вместе с каждым связанным атомом углерода с образованием замещенного или незамещенного моноциклического неароматического карбоцикла или замещенного или незамещенного моноциклического неароматического гетероцикла.
[0022]
(13C) Соединение или его фармацевтически приемлемая соль в соответствии с любым из (3C)-(5C), в которых Ra представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил или замещенный или незамещенный неароматический гетероциклилалкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0023]
(14C) Соединение или его фармацевтически приемлемая соль в соответствии с (3C) или (4C), в которых R3A представляет собой водород, галоген, алкил или галогеналкил; R3B представляет собой водород; R4A представляет собой галоген, циано, алкил, галогеналкил или неароматический карбоциклил; R4B представляет собой водород; Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1 или -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0024]
(15C) Соединение или его фармацевтически приемлемая соль в соответствии с (3C) или (4C), в которых R3A представляет собой водород, галоген, алкил или галогеналкил; R4A представляет собой галоген, циано, алкил, галогеналкил или неароматический карбоциклил; Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1 или -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0025]
(16C) Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль в соответствии с любым из (1C)-(15C).
[0026]
(17C) Фармацевтическая композиция в соответствии с (16C), обладающая противовирусной активностью.
[0027]
(18C) Фармацевтическая композиция в соответствии с (16C), обладающая активностью против ВИЧ.
[0028]
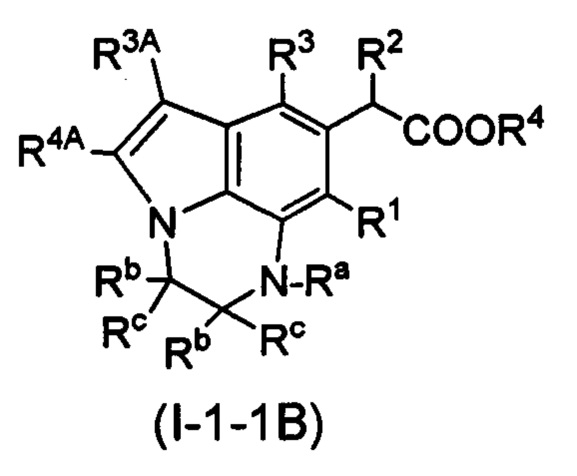
(1B) Соединение, представленное следующей формулой (I):
[Химическая формула 16]

или его фармацевтически приемлемая соль,
причем прерывистая линия обозначает наличие или отсутствие связи,
A3 представляет собой CR3A, CR3AR3B, N или NR3C;
каждый R3A, R3B, R4A и R4B независимо представляют собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкинил или замещенный или незамещенный неароматический карбоциклил;
R3C представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный неароматический карбоциклил;
кольцо T1 представляет собой замещенный или незамещенный азотсодержащий неароматический гетероцикл;
R1 представляет собой водород, галоген, циано или замещенный или незамещенный алкил;
каждый R2 независимо представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси или замещенный или незамещенный неароматический карбоциклилокси;
n представляет собой 1 или 2;
R3 представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
R4 представляет собой водород или карбоксилзащитную группу;
при условии, что исключены следующие соединения.
[Химическая формула 17]

[0029]
(2B) Соединение или его фармацевтически приемлемая соль в соответствии с приведенным выше (1B), в которых субструктура, представленная формулой:
[Химическая формула 18]

представляет собой субструктуру, представленную следующей формулой:
[Химическая формула 19]

в которой каждый E независимо представляет собой -NRa-, -O-, -S-, -SO2-, -SO- или -CRbRc-;
Ra представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1, -COORa1, -SORa2, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5 или -COCONRa4Ra5;
каждый Ra1, Ra2 и Ra3 независимо представляют собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Ra4 и Ra5 независимо представляют собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил;
каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; или
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связанным атомом углерода с образованием карбонила, замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла; и/или
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием замещенного или незамещенного моноциклического неароматического карбоцикла или замещенного или незамещенного моноциклического неароматического гетероцикла; или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с каждым связанным атомом кольца с образованием замещенного или незамещенного моноциклического ароматического гетероцикла или замещенного или незамещенного моноциклического неароматического гетероцикла; или
два Rb на атомах углерода, которые не являются соседними друг для друга, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -CO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении; или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи; или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи; и
k представляет собой целое число от 2 до 7.
[0030]
(3B) Соединение или его фармацевтически приемлемая соль в соответствии с приведенным выше (2B), в которых субструктура, представленная формулой:
[Химическая формула 20]

представляет собой субструктуру, представленную любой из следующих формул:
[Химическая формула 21]

в которой
Q представляет собой -NRa-, -O-, -S- или -CRbRc-,
L представляет собой -SO2-, -SO- или -CRbRc-;
m представляет собой целое число от 0 до 5;
другие символы совпадают с определенными выше.
[0031]
(4B) Соединение или его фармацевтически приемлемая соль в соответствии с приведенным выше (2B) или (3B), которые представлены следующей формулой (I-1-1) или (I-2-1):
[Химическая формула 22]

в которой каждый символ совпадает с определенным выше.
[0032]
(5B) Соединение или его фармацевтически приемлемая соль в соответствии с любым из приведенных выше (1B)-(4B), в которых R1 представляет собой алкил, циано или галоген.
[0033]
(6B) Соединение или его фармацевтически приемлемая соль в соответствии с любым из приведенных выше (1B)-(5B), в которых n представляет собой 1; и R2 представляет собой алкилокси.
[0034]
(7B) Соединение или его фармацевтически приемлемая соль в соответствии с любым из приведенных выше (1B)-(6B), в которых R4 представляет собой водород.
[0035]
(8B) Соединение или его фармацевтически приемлемая соль в соответствии с любым из приведенных выше (1B)-(4B), в которых R1 представляет собой алкил или галоген; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0036]
(9B) Соединение или его фармацевтически приемлемая соль в соответствии с любым из приведенных выше (2B)-(4B), в которых Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1, -CONRa4Ra5 или -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0037]
(10B) Соединение или его фармацевтически приемлемая соль в соответствии с любым из приведенных выше (2B)-(4B), в которых m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; R4 представляет собой водород, Ra на атоме азота и Rb на атоме углерода соединены вместе с каждым связанным атомом кольца с образованием замещенного или незамещенного моноциклического ароматического гетероцикла или замещенного или незамещенного моноциклического неароматического гетероцикла, или два Rb на соседних атомах углерода соединены вместе с каждым связанным атомом углерода с образованием замещенного или незамещенного моноциклического неароматического карбоцикла или замещенного или незамещенного моноциклического неароматического гетероцикла.
[0038]
(11B) Соединение или его фармацевтически приемлемая соль в соответствии с любым из приведенных выше (2B)-(4B), в которых Ra представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил или замещенный или незамещенный неароматический гетероциклилалкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0039]
(12B) Соединение или его фармацевтически приемлемая соль в соответствии с приведенным выше (2B) или (3B), в которых R3A представляет собой водород, галоген, алкил или галогеналкил; R3B представляет собой водород; R4A представляет собой водород, галоген, циано, алкил, галогеналкил или неароматический карбоциклил; R4B представляет собой водород; Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1 или -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0040]
(13B) Соединение или его фармацевтически приемлемая соль в соответствии с приведенным выше (2B) или (3B), в которых R3A представляет собой водород, галоген, алкил или галогеналкил; R4A представляет собой водород, галоген, циано, алкил, галогеналкил или неароматический карбоциклил; Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1 или -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0041]
(14B) Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль в соответствии с любым из приведенных выше (1B)-(13B).
[0042]
(15B) Фармацевтическая композиция в соответствии с приведенным выше (14B), обладающая противовирусной активностью.
[0043]
(16B) Фармацевтическая композиция в соответствии с приведенным выше (14B), обладающая активностью против ВИЧ.
[0044]
(1A) Cоединение, представленное следующей формулой (I):
[Химическая формула 23]

или его фармацевтически приемлемая соль,
причем прерывистая линия обозначает наличие или отсутствие связи,
A3 представляет собой CR3A, CR3AR3B, N или NR3C;
каждый R3A, R3B, R4A и R4B независимо представляют собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкинил или замещенный или незамещенный неароматический карбоциклил;
R3C представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный неароматический карбоциклил;
кольцо T1 представляет собой замещенный или незамещенный азотсодержащий неароматический гетероцикл, два атома, которые не являются соседними друг для друга, образующие гетероцикл, могут образовывать мостик с замещенным или незамещенным алкиленом, замещенным или незамещенным алкениленом или замещенным или незамещенным алкиниленом;
R1 представляет собой водород, галоген или замещенный или незамещенный алкил;
каждый R2 независимо представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси или замещенный или незамещенный неароматический карбоциклилокси;
n представляет собой 1 или 2;
R3 представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил; и
R4 представляет собой водород или карбоксилзащитную группу;
при условии, что исключены следующие соединения.
[Химическая формула 24]

[0045]
(1A') Соединение, представленное следующей формулой (I'):
[Химическая формула 25]

или его фармацевтически приемлемая соль,
в которых A3 представляет собой CR3A или N;
каждый R3A и R4A независимо представляют собой водород, галоген, циано, замещенный или незамещенный алкил или замещенный или незамещенный неароматический карбоциклил;
кольцо T1 представляет собой замещенный или незамещенный азотсодержащий неароматический гетероцикл, два атома, которые не являются соседними друг для друга, образующие гетероцикл, могут образовывать мостик с замещенным или незамещенным алкиленом, замещенным или незамещенным алкениленом или замещенным или незамещенным алкиниленом;
R1 представляет собой водород, галоген или замещенный или незамещенный алкил;
каждый R2 независимо представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси или замещенный или незамещенный неароматический карбоциклилокси;
n представляет собой 1 или 2;
R3 представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил; и
R4 представляет собой водород или карбоксилзащитную группу,
при условии, что исключены следующие соединения.
[Химическая формула 26]
[0046]
(2A) Соединение или его фармацевтически приемлемая соль в соответствии с приведенным выше (1A), в которых часть, представленная формулой:
[Химическая формула 27]

представляет собой структуру, представленную любой из следующих формул:
[Химическая формула 28]

в которых
Ra представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1, -SORa2 или -SO2Ra3;
Ra1, Ra2 и Ra3 представляют собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
m представляет собой целое число от 0 до 5;
L представляет собой -SO2-, -SO-, -CO- или -CRbRc-;
каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил;
каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; или
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе с образованием оксогруппы; или
Rb и/или Rc на соседних атомах углерода могут быть соединены вместе с соседними атомами углерода с образованием замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла; или
Ra и Rb и/или Rc на атоме углерода, соседнем для атома азота, связанного с Ra, могут быть соединены вместе с соседними связанными атомом азота и атомом углерода с образованием замещенного или незамещенного ароматического гетероцикла или замещенного или незамещенного неароматического гетероцикла.
[0047]
(2A') Соединение или его фармацевтически приемлемая соль в соответствии с приведенным выше (1A'), в которых часть, представленная формулой:
[Химическая формула 29]

представляет собой структуру, представленную любой из следующих формул:
[Химическая формула 30]

в которых Ra представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, -CORa1, -SORa2 или -SO2Ra3;
Ra1, Ra2 и Ra3 представляют собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, или замещенный или незамещенный неароматический карбоциклил;
m представляет собой целое число от 0 до 5;
L представляет собой -SO2-, -SO-, -CO- или -CRbRc-;
каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил;
каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; или
Rb и Rc на одном и том же углероде могут быть соединены вместе с образованием оксогруппы.
(3A) Соединение или его фармацевтически приемлемая соль в соответствии с приведенными выше (2A) или (2A'), которые представляют собой следующую формулу (I-1-1) или (I-2-1).
[Химическая формула 31]

[0048]
(4A) Соединение или его фармацевтически приемлемая соль в соответствии с любым из приведенных выше (1A)-(3A) и (1A')-(2A'), в которых R1 представляет собой алкил.
[0049]
(5A) Соединение или его фармацевтически приемлемая соль в соответствии с любым из приведенных выше (1A)-(4A) и (1A')-(2A'), в которых n представляет собой 1; и R2 представляет собой алкилокси.
[0051]
(6A) Соединение или его фармацевтически приемлемая соль в соответствии с любым из приведенных выше (1A)-(5A), (1A')-(2A'), в которых R4 представляет собой водород.
[0052]
(7A) Соединение или его фармацевтически приемлемая приемлемая соль в соответствии с любым из приведенных выше (1A)-(3A), (1A')-(2A'), в которых R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0053]
(8A) Соединение или его фармацевтически приемлемая соль в соответствии с приведенными выше (2A), (2A') или (3A), в которых Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1 или -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0054]
(8A') Соединение или его фармацевтически приемлемая соль в соответствии с приведенными выше (2A') или (3A), в которых Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1 или -SO2Ra3; каждый Rb и Rc независимо представляют собой водород, галоген или алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0055]
(9A) Соединение или его фармацевтически приемлемая соль в соответствии с приведенными выше (2A) или (3A), в которых m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; R4 представляет собой водород, Ra и Rb и/или Rc на атоме углерода, соседнем для атома азота, связанного с Ra, соединены вместе с соседними атомом азота и атомом углерода с образованием замещенного или незамещенного моноциклического ароматического гетероцикла или замещенного или незамещенного моноциклического неароматического гетероцикла, или по меньшей мере один из Rb и/или Rc на соседних атомах углерода соединен вместе с соседним атомом углерода с образованием замещенного или незамещенного моноциклического неароматического карбоцикла или замещенного или незамещенного моноциклического неароматического гетероцикла.
[0056]
(10A) Соединение или его фармацевтически приемлемая соль в соответствии с приведенными выше (2A) или (3A), в которых Ra представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил или замещенный или незамещенный неароматический гетероциклилалкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0057]
(11A) Соединение или его фармацевтически приемлемая соль в соответствии с приведенным выше (2A), в которых R3A представляет собой водород, галоген, алкил или галогеналкил; R3B представляет собой водород; R4A представляет собой водород, галоген, циано, алкил, галогеналкил или неароматический карбоциклил; R4B представляет собой водород; Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1 или -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или алкил; каждый Rc независимо представляет собой водород, галоген или алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0058]
(11A') Соединение или его фармацевтически приемлемая соль в соответствии с приведенными выше (2A') или (3A), в которых R3A представляет собой водород, галоген, алкил или галогеналкил; R4A представляет собой водород, галоген, циано, алкил, галогеналкил или неароматический карбоциклил; Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1 или -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или алкил; каждый Rc независимо представляет собой водород, галоген или алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0059]
(12A) Соединение или его фармацевтически приемлемая соль в соответствии с приведенным выше (3A), в которых R3A представляет собой водород, галоген, алкил или галогеналкил; R4A представляет собой водород, галоген, циано, алкил, галогеналкил или неароматический карбоциклил; Ra представляет собой водород, замещенный или незамещенный алкил, -CORa1 или -SO2Ra3; каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил; каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил; m представляет собой целое число от 1 до 3; R1 представляет собой алкил; n представляет собой 1; R2 представляет собой алкилокси; и R4 представляет собой водород.
[0060]
(13A) Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль в соответствии с любым из приведенных выше (1A)-(12A), (1A'), (2A'), (8A') и (11A').
[0061]
(14A) Фармацевтическая композиция в соответствии с приведенным выше (13A), обладающая противовирусной активностью.
[0062]
(15A) Фармацевтическая композиция в соответствии с приведенным выше (13A), обладающая активностью против ВИЧ.
[0063]
(16A) Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль в соответствии с любым из приведенных выше (1)-(16), (1A)-(12A), (1A'), (2A'), (8A') и (11A') для перорального введения.
(17A) Фармацевтическая композиция в соответствии с (16A), которая представляет собой таблетку, порошок, гранулу, капсулу, пилюлю, пленку, суспензию, эмульсию, эликсир, сироп, лимонад, спирт, ароматическую воду, экстракт, отвар или настойку.
(18A) Фармацевтическая композиция в соответствии с (17A), которая представляет собой таблетку с покрытием из сахара, таблетку с пленочным покрытием, таблетку с кишечнорастворимым покрытием, таблетку с замедленным высвобождением, таблетку-пастилку, подъязычную таблетку, буккальную таблетку, жевательную таблетку, таблетку для перорального диспергирования, сухой сироп, мягкую капсулу, микрокапсулу или капсулу с замедленным высвобождением.
(19A) Фармацевтическая композиция в соответствии с любым из приведенных выше (1)-(16), (1A)-(12A), (1A'), (2A'), (8A') и (11A') для парентерального введения.
(20A) Фармацевтическая композиция в соответствии с (19A) для кожного, подкожного, внутривенного, внутриартериального, внутримышечного, внутрибрюшинного, трансмукозального, ингаляционного, трансназального, офатальмического, во внутреннее ухо или вагинального введения.
(21A) Фармацевтическая композиция в соответствии с (19A) или (20A), которая представляет собой инъекцию, инфузию, глазные капли, капли в нос, ушные капли, аэрозоль, ингаляцию, лосьон, пропитку, линимент, ополаскиватель для полости рта, клизму, мазь, пластырь, желе, крем, повязку, катаплазму, порошок для наружного применения или суппозиторий.
(22A) Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль в соответствии с любым из приведенных выше (1)-(16), (1A)-(12A), (1A'), (2A'), (8A') и (11A'), для педиатрического или гериатрического пациента.
(23A) Фармацевтическая композиция, содержащая комбинацию соединения или его фармацевтически приемлемой соли в соответствии с любым из приведенных выше (1)-(16), (1A)-(12A), (1A'), (2A'), (8A') и (11A') и ингибитора обратной транскриптазы, ингибитора протеазы, ингибитора интегразы или другого препарата против ВИЧ.
(24A) Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль в соответствии с любым из приведенных выше (1)-(16), (1A)-(12A), (1A'), (2A'), (8A') и (11A'), для комбинированного лечения с помощью ингибитора обратной транскриптазы, ингибитора протеазы, ингибитора интегразы или другого препарата против ВИЧ.
[0064]
Настоящее изобретение также предлагает следующее изобретение.
Способ лечения или предупреждения вирусной инфекции (пример: ВИЧ-инфекции), отличающийся введением человеку приведенного выше соединения или его фармацевтически приемлемой соли.
Приведенное выше соединение или его фармацевтически приемлемая соль для лечения или предупреждения вирусной инфекции (пример: ВИЧ-инфекция).
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0065]
Соединение настоящего изобретения обладает активностью ингибирования репликации вируса, в частности ВИЧ (пример: ВИЧ-1), мутантного вируса и резистентного вируса. Соответственно, соединение настоящего изобретения полезно для предупреждения или лечения вирусных инфекций (пример: СПИД) и т.п. Кроме того, настоящее изобретение предлагает промежуточный продукт синтеза противовирусного препарата.
СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0066]
Все значения терминов, используемых в настоящем документе, описаны ниже. Каждый термин, один или в сочетании с другим словом, используется в одном и том же значении.
[0067] В формуле (I) прерывистая линия обозначает наличие или отсутствие связи. Любая из двух прерывистых линий в формуле (I) обозначает наличие связи, а другая обозначает отсутствие связи. Если прерывистая линия в кольце обозначает наличие связи, прерывистая линия, которая связана с R4B, обозначает отсутствие связи, A3 представляет собой CR3A или N, и R4B отсутствует. Если прерывистая линия в кольце обозначает отсутствие связи, прерывистая линия, которая связана R4B, обозначает наличие связи, A3 обозначает CR3AR3B или NR3C. В этом случае R4B представляет собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкинил или замещенный или незамещенный неароматический карбоциклил.
"Галоген" включает атом фтора, атом хлора, атом брома и атом йода. Особенно предпочтительны атом фтора и атом хлора.
[0068]
"Алкил" включает C1-C15, предпочтительно C1-C10, более предпочтительно C1-C6 и, более предпочтительно, C1-C4 линейную или разветвленную углеводородную группу. Например, он включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, н-гептил, изогептил, н-октил, изооктил, н-нонил, н-децил и т.п.
Предпочтительным вариантом осуществления "алкила" является метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил. Более предпочтительным вариантом осуществления является метил, этил, н-пропил, изопропил, трет-бутил.
[0069]
"Алкенил" включает C2-C15, предпочтительно C2-C10, более предпочтительно C2-C6 и, более предпочтительно, C2-C4 линейную или разветвленную углеводородную группу, содержащую одну или несколько двойных связей в любом положении(ях). Например, винил, аллил, пропенил, изопропенил, бутенил, изобутенил, пренил, бутадиен, пентенил, изопентенил, пентадиенил, гексенил, изогексенил, гексадиенил, гептенил, октенил, ноненил, деценил, ундеценил, додеценил, тридеценил, тетрадеценил, пентадеценил и т.п.
Предпочтительным вариантом осуществления "алкенила" является винил, аллил, пропенил, изопропенил, бутенил.
[0070]
"Алкинил" включает C2-C10, предпочтительно C2-C8, более предпочтительно C2-C6 и, более предпочтительно, C2-C4 линейную или разветвленную углеводородную группу, содержащую одну или несколько тройных связей в любом положении(ях). Например, он включает этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил и т.п. Они могут также содержать двойную связь в любом доступном положении.
Предпочтительным вариантом осуществления "алкинила" является этинил, пропинил, бутинил или пентинил.
[0071]
"Алкилен" включает C1-C15, предпочтительно C1-C10, более предпочтительно C1-C6 и, более предпочтительно, C1-C4 линейную или разветвленную двухвалентную углеводородную группу. Например, он включает метилен, этилен, триметилен, пропилен, тетраметилен, пентаметилен, гексаметилен и т.п.
[0072]
"Алкенилен" включает C2-C15, предпочтительно C2-C10, более предпочтительно C2-C6 и, более предпочтительно, C2-C4 линейную или разветвленную двухвалентную углеводородную группу, содержащую одну или несколько двойных связей в любом положении(ях). Например, он включает винилен, пропенилен, бутенилен, пентенилен и т.п.
[0073]
"Алкинилен" включает C2-C15, предпочтительно C2-C10, более предпочтительно C2-C6 и, более предпочтительно, C2-C4 линейную или разветвленную двухвалентную углеводородную группу, содержащую одну или несколько тройных связей в любом положении(ях). Кроме того, он может содержать двойную связь(и) в любом положении(ях). Например, он включает этинилен, пропинилен, бутинилен, пентинилен, гексинилен и т.п.
[0074]
"Алкилокси" обозначает группу, в которой вышеупомянутый "алкил" связан с атомом кислорода. Например, он включает метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси, трет-бутилокси, изобутилокси, втор-бутилокси, пентилокси, изопентилокси, гексилокси и т.п.
Предпочтительным вариантом осуществления "алкилокси" является метокси, этокси, н-пропилокси, изопропилокси или трет-бутилокси.
[0075]
"Алкенилокси" обозначает группу, в которой вышеупомянутый "алкенил" связан с атомом кислорода. Например, он включает винилокси, аллилокси, 1-пропенилокси, 2-бутенилокси, 2-пентенилокси, 2-гексенилокси, 2-гептенилокси, 2-октенилокси и т.п.
[0076]
"Алкинилокси" обозначает группу, в которой вышеупомянутый "алкинил" связан с атомом кислорода. Например, он включает этинилокси, 1-пропинилокси, 2-пропинилокси, 2-бутинилокси, 2-пентинилокси, 2-гексинилокси, 2-гептинилокси, 2-октинилокси и т.п.
[0077]
"Ароматический карбоцикл" включает циклическое ароматическое углеводородное кольцо, которое является моноциклическим или полициклическим, содержащим два кольца или больше. Например, примером может служить бензольное кольцо, нафталиновое кольцо, антраценовое кольцо, фенантреновое кольцо и т.п.
Вариант осуществления "ароматического карбоцикла" включает бензольное кольцо, нафталиновое кольцо. Другой вариант его осуществления включает бензольное кольцо.
[0078]
"Ароматический карбоциклил" обозначает циклическую углеводородную группу, которая является моноциклической или полициклической, содержащей два кольца или больше. Например, примером может служить фенил, нафтил, антрил, фенантрил и т.п.
Предпочтительный вариант осуществления "ароматического карбоциклила" включает фенил.
[0079]
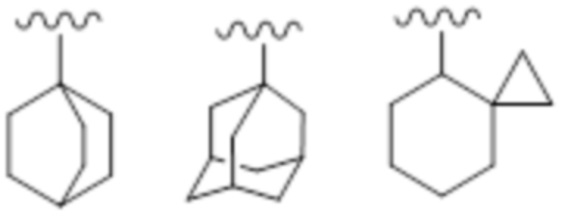
"Неароматический карбоцикл" включает циклическое насыщенное углеводородное кольцо или циклическое ненасыщенное неароматическое углеводородное кольцо, которое является моноциклическим или полициклическим, содержащим два кольца или больше. "Неароматический карбоцикл", который является полициклическим, содержащим два кольца или больше, включает конденсированное кольцо, в котором неароматический карбоцикл, который является моноциклическим или полициклическим, содержащим два кольца или больше, конденсирован с кольцом вышеупомянутого "ароматического карбоцикла".
Кроме того, "неароматический карбоцикл" также включает кольцо, содержащее мостик, или кольцо, образующее спирокольцо.
[0080]
[Химическая формула 32]

Моноциклический неароматический карбоцикл, предпочтительно, представляет собой C3-C16, более предпочтительно C3-C12 и, более предпочтительно, C3-C8. Например, примером может служить циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, циклононан, циклодекан, циклопропен, циклобутен, циклопентен, циклогексен, циклогептен, циклогексадиен и т.п.
Неароматический карбоцикл, который является полициклическим, содержащим два кольца или больше, предпочтительно, представляет собой C8-C13, более предпочтительно C9-C10. Например, примером может служить индан, инден, аценафталин, тетрагидронафталин, флуорен и т.п.
[0081]
"Неароматический карбоциклил" обозначает циклическую насыщенную углеводородную группу или циклический ненасыщенный неароматический углеводород, который является моноциклическим или полициклическим, содержащим два кольца или больше. Неароматический карбоциклил, который является полициклическим, содержащим два кольца или больше, включает конденсированную циклическую группу, в которой неароматический карбоциклил, который является моноциклическим или полициклическим, содержащим два кольца или больше, конденсирован с кольцом вышеупомянутого "ароматического карбоциклила".
Кроме того, "неароматический карбоциклил" также включает группу, содержащую мостик, или группу, образующую спирокольцо, как указано ниже.
[0082]
[Химическая формула 33]
[0083]
[Химическая формула 34]
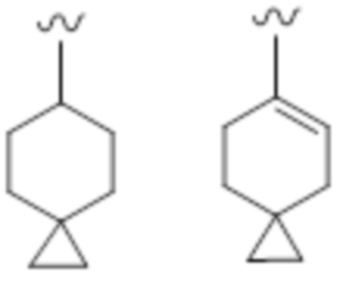
Моноциклический неароматический карбоциклил, предпочтительно, представляет собой C3-C16, более предпочтительно C3-C12 и, более предпочтительно, C4-C8. Например, примером может служить циклоалкил, циклоалкенил и т.п.
"Циклоалкил", предпочтительно, представляет собой C3-C10, более предпочтительно C3-C7, и включает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил и т.п.
"Циклоалкенил" включает циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклогексадиенил и т.п.
Неароматический карбоциклил, который является полициклическим, содержащим два кольца или больше, предпочтительно, представляет собой C8-C13, более предпочтительно C9-10. Например, примером может служить инданил, инденил, аценафтил, тетрагидронафтил, флуоренил, дигидроинденил и т.п.
[0084]
"Неароматический карбоциклилокси" обозначает группу, в которой "неароматический карбоцикл" связан с атомом кислорода. Часть "неароматического карбоцикла" в "неароматическом карбоциклилокси" также является такой же, как вышеупомянутый "неароматический карбоциклил". Например, примером может служить циклопропилокси, циклогексилокси, циклогексенилокси и т.п.
[0085]
"Азотсодержащий неароматический гетероцикл" включает циклическое неароматическое кольцо, которое является моноциклическим или полициклическим, содержащим два кольца или больше, содержащим по меньшей мере один атом азота в качестве атома кольца. Кроме того, он может содержать в кольце один или несколько одинаковых или различных гетероатомов, выбранных из атома кислорода, атома серы и атома азота.
"Азотсодержащий неароматический гетероцикл, который является полициклическим, содержащим два кольца или больше" включает азотсодержащий неароматический гетероцикл, который является моноциклическим или полициклическим, содержащим два кольца или больше, конденсированных с каждым кольцом(ами) "ароматического карбоцикла", "неароматического карбоцикла" и/или "ароматического гетероцикла".
Кроме того, "азотсодержащий неароматический гетероцикл" включает кольцо, имеющее мостиковую структуру, или кольцо, образующее спирокольцо. То есть он также включает кольца, имеющие мостик из замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена, замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкинилена, или замещенного или незамещенного алкинилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, и кольца, которые образуют спирокольцо с замещенным или незамещенным алкиленом, замещенным или незамещенным алкиленом, содержащим одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенным или незамещенным алкениленом, замещенным или незамещенным алкениленом, содержащим одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенным или незамещенным алкиниленом или замещенным или незамещенным алкиниленом, содержащим одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении. Например, примером могут служить следующие кольца.
[0086]
[Химическая формула 35]

Моноциклический азотсодержащий неароматический гетероцикл, предпочтительно, является 5-12-членным, более предпочтительно 5-8-членным. Например, он включает тиазолидин, пирролидин, пирролин, имидазолидин, имидазолин, пиразолидин, пиразолин, пиперидин, пиперазин, морфолин, тиоморфолин, дигидропиридин, тетрагидропиридин, дигидротиазолин, тетрагидротиазолин, тетрагидроизотиазолин, дигидрооксазин, гексагидроазепин, тетрагидродиазепин, тетрагидропиридазин, гексагидропиримидин, тиазин и т.п.
Азотсодержащий неароматический гетероцикл, который является полициклическим, содержащим два кольца или больше, предпочтительно, является 9-20-членным, более предпочтительно 8- 16-членным. Например, он включает индолин, изоиндолин и т.п.
Предпочтительным является азотсодержащий неароматический гетероцикл, который является моноциклическим или полициклическим, содержащим два кольца или больше, бициклический азотсодержащий неароматический гетероцикл включает конденсированное кольцо, мостиковое кольцо и спирокольцо.
Предпочтительным вариантом осуществления мостикового азотсодержащего неароматического гетероцикла является бициклический азотсодержащий неароматический гетероцикл, который имеет мостик из замещенного или незамещенного алкилена, замещенного или незамещенного алкенилена, содержащего одну или две группы, выбранные из -O-, -NRa-, -S-, -CO-, -SO-, -SO2-, в произвольном положении, замещенного или незамещенного алкилена или замещенного или незамещенного алкенилена, содержащего одну или две группы, выбранные из -O-, -NRa-, -S-, -CO-, -SO-, -SO2-, в произвольном положении.
Предпочтительным вариантом осуществления азотсодержащего неароматического гетероцикла, который представляет собой спирокольцо, является бициклический азотсодержащий неароматический гетероцикл, образованный замещенным или незамещенным алкиленом, состоящим из двух заместителей на одном и том же атоме углерода как кольцевом атоме кольца T1, соединенных вместе, или бициклический азотсодержащий неароматический гетероцикл, образованный замещенным или незамещенным алкиленом, содержащим одну или две группы, выбранные из -O-, -NRa-, -S-, -CO-, -SO- и -SO2.
Предпочтительным вариантом осуществления конденсированного азотсодержащего неароматического гетероцикла является 9 или 10-членный бициклический азотсодержащий неароматический гетероцикл.
[0087]
"Ароматический гетероцикл" включает ароматическое кольцо, которое является моноциклическим или полициклическим, содержащим два кольца или больше, содержащее один или несколько одинаковых или различных гетероатомов, произвольно выбранных из O, S и N.
"Ароматический гетероцикл, который является полициклическим, содержащим два кольца или больше" включает ароматический гетероцикл, который является моноциклическим или полициклическим, содержащим два кольца или больше, конденсированный с кольцом вышеупомянутого "ароматического карбоцикла".
Моноциклический ароматический гетероцикл, предпочтительно, представляет собой 5-8-членное кольцо, более предпочтительно 5 или 6-членное кольцо. Например, примером может служить пиррол, имидазол, пиразол, пиридин, пиридазин, пиримидин, пиразин, триазол, триазин, тетразол, фуран, тиофен, изоксазол, оксазол, оксадиазол, изотиазол, тиазол, тиадиазол и т.п.
Бициклический ароматический гетероцикл, предпочтительно, представляет собой 8-18-членное кольцо, более предпочтительно 9 или 10-членное кольцо. Например, примером может служить индолин, изоиндолин, индазолин, индолидин, хинолин, изохинолин, циннолин, фталазин, хиназолин, нафтиридин, хиноксалин, пурин, путеридин, бензимидазол, бензизоксазол, бензоксазол, бензоксадиазол, бензоизотиазол, бензотиазол, бензотиадиазол, бензофуран, изобензофуран, бензотиофен, бензотриазол, имидазопиридин, триазолопиридин, имидазотиазол, пиридинопиридазин, оксазолопиридин, тиазолопиридин и т.п.
Ароматический гетероцикл, который является полициклическим, содержащим три кольца или больше, предпочтительно, представляет собой 11-26-членное кольцо, более предпочтительно 13 или 14-членное кольцо. Например, примером может служить карбазол, акридин, ксантен, фенотиазин, феноксатиин, феноксазин, дибензофуран и т.п.
[0088]
"Ароматический гетероциклил" обозначает ароматическую циклическую группу, которая является моноциклической или полициклической, содержащей два кольца или больше, содержащую один или несколько одинаковых или различных гетероатомов, выбранных из O, S, и N.
Ароматический гетероциклил, который является полициклическим, содержащим два кольца или больше, включает ароматический гетероциклил, который является моноциклическим или полициклическим, содержащим два кольца или больше, конденсированным с кольцом вышеуказанного "ароматического карбоциклила".
Моноциклический ароматический гетероциклил, предпочтительно, представляет собой 5-10-членное кольцо, более предпочтительно 5 или 6-членное кольцо. Например, примером могут служить пирролил, имидазолил, пиразолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазолил, триазинил, тетразолил, фурил, тиенил, изоксазолил, оксазолил, оксадиазолил, изотиазолил, тиазолил, тиадиазолил и т.п.
Ароматический гетероциклил, который является полициклическим, содержащим два кольца или больше, предпочтительно представляет собой 8-18-членное кольцо, более предпочтительно 9 или 10-членное кольцо. Например, примером могут служить индолил, изоиндолил, индазолил, индолизинил, хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, нафтиридинил, хиноксалинил, пуринил, птеридинил, бензимидазолил, бензизоксазолил, бензоксазолил, бензоксадиазолил, бензизотиазолил, бензотиазолил, бензотиадиазолил, бензофурил, изобензофурил, бензотиенил, бензотриазолил, имидазопиридил, триазолопиридил, имидазотиазолил, пиридинопиридазинил, оксазолопиридил, тиазолопиридил и т.п.
Ароматический гетероциклил, который является полициклическим, содержащим три кольца или больше, предпочтительно, представляет собой 11-26-членное кольцо, более предпочтительно 13 или 14-членное кольцо. Например, примером могут служить карбазолил, акридинил, ксантенил, фенотиазинил, феноксатиинил, феноксазинил, дибензофурил и т.п.
[0089]
"Неароматический гетероцикл" включает неароматическое кольцо, которое является моноциклическим или полициклическим, содержащим два кольца или больше, содержащее один или несколько одинаковых или различных гетероатомов, произвольно выбранных из O, S и N.
"Неароматический гетероцикл, который является полициклическим, содержащим два кольца или больше", включает конденсированное кольцо, в котором неароматический гетероцикл, который является моноциклическим или полициклическим, содержащим два кольца или больше, конденсирован с кольцом вышеуказанных "ароматического карбоцикла", "неароматического карбоцикла" и/или "ароматического гетероцикла".
Кроме того, "неароматический гетероцикл" также включает кольцо, содержащее мостик, или кольцо, образующее спирокольцо, как указано ниже.
[0090]
[Химическая формула 36]
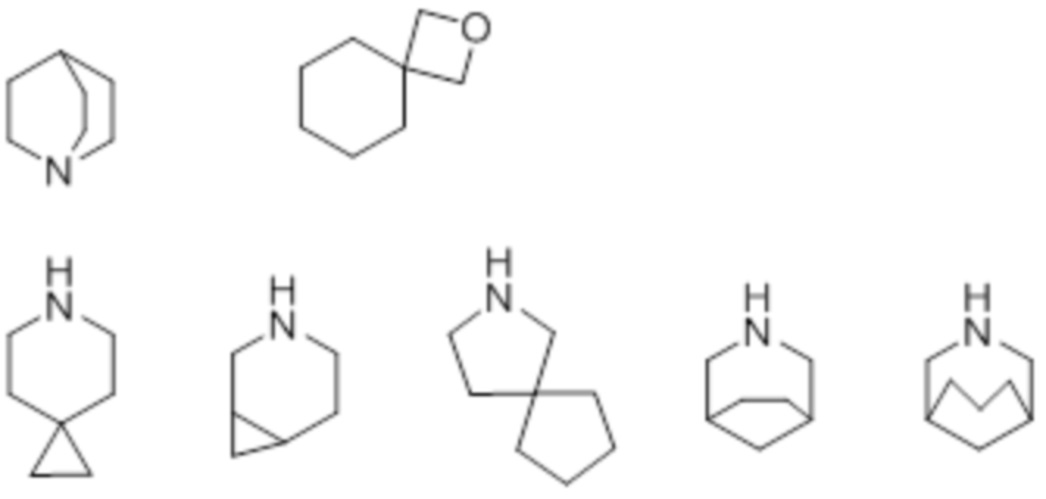
Моноциклический неароматический гетероцикл, предпочтительно, представляет собой 3-8 членное кольцо, более предпочтительно 5 или 6-членное кольцо. Например, он включает диоксан, тииран, оксиран, оксетан, оксатиоран, азетидин, тиан, тиазолидин, пирролидин, пирролин, имидазолидин, имидазолин, пиразолидин, пиразолин, пиперидин, пиперазин, морфолин, тиоморфолин, дигидропиридин, тетрагидропиридин, тетрагидрофуран, тетрагидропиран, дигидротиазолин, тетрагидротиазолин, тетрагидроизотиазолин, дигидрооксадин, гексагидроазепин, тетрагидродиазепин, тетрагидропиридазин, гексагидропиримидин, диоксолан, диоксазин, азиридин, диоксолин, оксепан, тиолан, тиазин и т.п.
Неароматический гетероцикл, который является полициклическим, содержащим два кольца или больше, предпочтительно, представляет собой 8-20-членное кольцо, более предпочтительно 8-16-членное кольцо. Например, он включает индолин, изоиндолин, хроман, изохроман и т.п.
[0091]
"Неароматический гетероциклил" обозначает неароматическую циклическую группу, которая является моноциклической или полициклической, содержащей два кольца или больше, содержащую один или несколько одинаковых или различных гетероатомов, произвольно выбранных из O, S и N.
"Неароматический гетероциклил, который является полициклическим, содержащим два кольца или больше, включает конденсированную циклическую группу, в которой неароматический гетероциклил, который является моноциклическим или полициклическим, содержащим два кольца или больше, конденсирован с кольцом вышеупомянутого "ароматического карбоциклила", "неароматического карбоциклила" и/или "ароматического гетероциклила".
Кроме того, "неароматический гетероциклил" также включает кольца, имеющие мостик из замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена, замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкинилена или замещенного или незамещенного алкинилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, и кольца, которые образуют спирокольцо с замещенным или незамещенным алкиленом, замещенным или незамещенным алкиленом, содержащим одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенный или незамещенный алкенилен, замещенным или незамещенным алкениленом, содержащим одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенным или незамещенным алкиниленом или замещенным или незамещенным алкиниленом, содержащим одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении. Например, примером могут служить следующие кольца.
[Химическая формула 37]
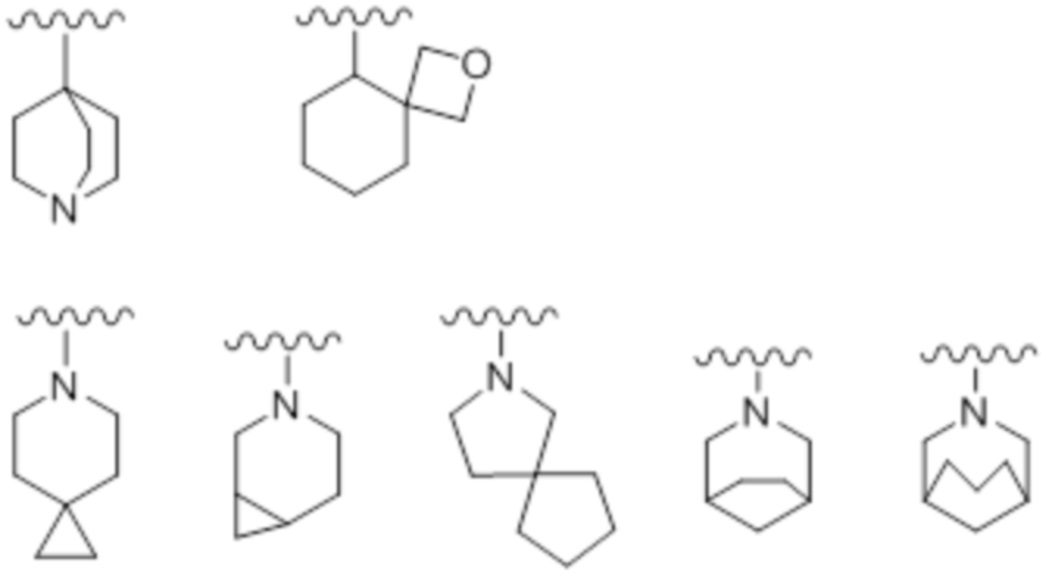
[0092]
Моноциклический неароматический гетероциклил, предпочтительно, представляет собой 3-8-членное кольцо, более предпочтительно 5 или 6-членное кольцо. Например, он включает диоксанил, тииранил, оксиранил, оксетанил, оксатиоланил, азетидинил, тианил, тиазолидинил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидинил, пиперазинил, морфолинил, морфолино, тиоморфолинил, тиоморфолино, дигидропиридил, тетрагидропиридил, тетрагидрофурил, тетрагидропиранил, дигидротиазолил, тетрагидротиазолил, тетрагидроизотиазолил, дигидрооксадинил, гексагидроазепинил, тетрагидродиазепинил, тетрагидропиридазинил, гексагидропиримидинил, диоксоланил, диоксадинил, азиридинил, диоксолинил, оксепанил, тиоланил, тиинил, тиазинил и т.п.
Неароматический гетероциклил, который является полициклическим, содержащим два кольца или больше, предпочтительно, представляет собой 8-20 членное кольцо, более предпочтительно 8-16 членное кольцо. Например, он включает индолинил, изоиндолинил, хроманил, изохроманил, дигидробензофурил, бензодиоксолил, бензодиоксанил, бензоморфолинил и т.п.
[0093]
"Карбоксилзащитная группа" обозначает защитную группу, которая превращается в карбоксигруппу путем гидролиза или реакции снятия защиты. Предпочтительными примерами карбоксилзащитной группы являются алкил (например: метил, этил, т-бутил) и аралкил (например: бензил), более предпочтительным примером является C1-C4 алкил.
[0094]
Заместители "замещенного или незамещенного алкила", "замещенного или незамещенного алкенила", "замещенного или незамещенного алкинила", "замещенного или незамещенного алкилокси", "замещенного или незамещенного алкенилокси", "замещенного или незамещенного алкинилокси", "замещенного или незамещенного алкилена", "замещенного или незамещенного алкенилена" и "замещенного или незамещенного алкинилена" включают следующую группу заместителей. Атом углерода в любом положении(ях) может быть связан с одной или несколькими из одинаковых или различных групп, выбранных из следующей группы заместителей. Заместителей, предпочтительно, от 1 до 4, более предпочтительно от 1 до 3.
Группа заместителей: галоген, гидрокси, карбокси, формил, формилокси, сульфанил, сульфино, сульфо, тиоформил, тиокарбокси, дитиокарбокси, тиокарбамоил, циано, нитро, нитрозо, азидо, гидрадино, уреидо, амидино, гуанидино, триалкилсилил, алкилокси, алкенилокси, алкинилокси, галогеналкилокси, алкилкарбонил, алкенилкарбонил, алкинилкарбонил, алкилсульфонил, алкенилсульфонил, алкинилсульфонил, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилсульфонилокси, алкенилсульфонилокси, алкинилсульфонилокси, алкилоксикарбонил, алкенилоксикарбонил, алкинилоксикарбонил, алкилсульфанил, алкенилсульфанил, алкинилсульфанил, алкилсульфинил, алкенилсульфинил, алкинилсульфинил, замещенный или незамещенный амино, замещенный или незамещенный имино, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический гетероциклилокси, замещенный или незамещенный неароматический гетероциклилокси, замещенный или незамещенный ароматический карбоциклилкарбонил, замещенный или незамещенный неароматический карбоциклилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный неароматический гетероциклилкарбонил, замещенный или незамещенный ароматический карбоциклилоксикарбонил, замещенный или незамещенный неароматический карбоциклилоксикарбонил, замещенный или незамещенный ароматический гетероциклилоксикарбонил, замещенный или незамещенный неароматический гетероциклилоксикарбонил, замещенный или незамещенный ароматический карбоциклилалкилокси, замещенный или незамещенный неароматический карбоциклилалкилокси, замещенный или незамещенный ароматический гетероциклилалкилокси, замещенный или незамещенный неароматический гетероциклилалкилокси, замещенный или незамещенный ароматический карбоциклилалкилсульфанил, замещенный или незамещенный неароматический карбоциклилалкилсульфанил, замещенный или незамещенный ароматический гетероциклилалкилсульфанил, замещенный или незамещенный неароматический гетероциклилалкилсульфанил, замещенный или незамещенный ароматический карбоциклилалкилоксикарбонил, замещенный или незамещенный неароматический карбоциклилалкилоксикарбонил, замещенный или незамещенный ароматический гетероциклилалкилоксикарбонил, замещенный или незамещенный неароматический гетероциклилалкилоксикарбонил, замещенный или незамещенный ароматический карбоциклсульфанил, замещенный или незамещенный неароматический карбоциклсульфанил, замещенный или незамещенный ароматический гетероциклсульфанил, замещенный или незамещенный неароматический гетероциклсульфанил, замещенный или незамещенный ароматический карбоциклсульфонил, замещенный или незамещенный неароматический карбоциклсульфонил, замещенный или незамещенный ароматический гетероциклсульфонил и замещенный или незамещенный неароматический гетероциклсульфонил.
[0095]
Заместители на кольце "замещенного или незамещенного ароматического карбоциклила", "замещенного или незамещенного неароматического карбоциклила", "замещенного или незамещенного ароматического гетероциклила", "замещенного или незамещенного неароматического гетероциклила", "замещенного или незамещенного азотсодержащего неароматического гетероцикла", "замещенного или незамещенного ароматического карбоцикла", "замещенного или незамещенного неароматического карбоцикла", "замещенного или незамещенного ароматического гетероцикла", "замещенного или незамещенного неароматического гетероцикла", "замещенного или незамещенного ароматического карбоциклилокси", "замещенного или незамещенного неароматического карбоциклилокси", "замещенного или незамещенного ароматического гетероциклилокси", "замещенного или незамещенного неароматического гетероциклилокси", "замещенного или незамещенного ароматического карбоциклилкарбонила", "замещенного или незамещенного неароматического карбоциклилкарбонила", "замещенного или незамещенного ароматического гетероциклилкарбонила", "замещенного или незамещенного неароматического гетероциклилкарбонила", "замещенного или незамещенного ароматического карбоциклилоксикарбонила", "замещенного или незамещенного неароматического карбоциклилоксикарбонила", "замещенного или незамещенного ароматического гетероциклилоксикарбонила", "замещенного или незамещенного неароматического гетероциклилоксикарбонила", "замещенного или незамещенного ароматического карбоциклилалкилокси", "замещенного или незамещенного неароматического карбоциклилалкилокси", "замещенного или незамещенного ароматического гетероциклилалкилокси", "замещенного или незамещенного неароматического гетероциклилалкилокси", "замещенного или незамещенного ароматического карбоциклилалкилсульфанила", "замещенного или незамещенного неароматического карбоциклилалкилсульфанила", "замещенного или незамещенного ароматического гетероциклилалкилсульфанила", "замещенного или незамещенного неароматического гетероциклилалкилсульфанила", "замещенного или незамещенного ароматического карбоциклилалкилоксикарбонила", "замещенного или незамещенного неароматического карбоциклилалкилоксикарбонила", "замещенного или незамещенного ароматического гетероциклилалкилоксикарбонила", "замещенного или незамещенного неароматического гетероциклилалкилоксикарбонила", "замещенного или незамещенного ароматического карбоциклсульфанила", "замещенного или незамещенного неароматического карбоциклсульфанила", "замещенного или незамещенного ароматического гетероциклсульфанила", "замещенного или незамещенного неароматического гетероциклсульфанила", "замещенного или незамещенного ароматического карбоциклсульфонила", "замещенного или незамещенного неароматического карбоциклсульфонила", "замещенного или незамещенного ароматического гетероциклсульфонила" и "замещенного или незамещенного неароматического гетероциклсульфонила" включают следующую группу заместителей. Атом в любом положении(ях) на кольце может быть связан с одной или несколькими из одинаковых или различных групп, выбранных из следующей группы заместителей. Заместители, предпочтительно, представляют собой от 1 до 4, более предпочтительно от 1 до 3 групп.
Группа заместителей: галоген, гидрокси, карбокси, формил, формилокси, сульфанил, сульфино, сульфо, тиоформил, тиокарбокси, дитиокарбокси, тиокарбамоил, циано, нитро, нитрозо, азидо, гидрадино, уреидо, амидино, гуанидино, триалкилсилил, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, алкинил, галогеналкил, гидроксиалкил, алкилокси, алкенилокси, алкинилокси, галогеналкилокси, алкилоксиалкил, алкилоксиалкилокси, алкилкарбонил, алкенилкарбонил, алкинилкарбонил, алкилсульфонил, алкенилсульфонил, алкинилсульфонил, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилсульфонилокси, алкенилсульфонилокси, алкинилсульфонилокси, алкилоксикарбонил, алкенилоксикарбонил, алкинилоксикарбонил, алкилсульфанил, алкенилсульфанил, алкинилсульфанил, алкилсульфинил, алкенилсульфинил, алкинилсульфинил, замещенный или незамещенный амино, замещенный или незамещенный имино, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический гетероциклилокси, замещенный или незамещенный неароматический гетероциклилокси, замещенный или незамещенный ароматический карбоциклилкарбонил, замещенный или незамещенный неароматический карбоциклилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный неароматический гетероциклилкарбонил, замещенный или незамещенный ароматический карбоциклилоксикарбонил, замещенный или незамещенный неароматический карбоциклилоксикарбонил, замещенный или незамещенный ароматический гетероциклилоксикарбонил, замещенный или незамещенный неароматический гетероциклилоксикарбонил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, замещенный или незамещенный ароматический карбоциклилалкилокси, замещенный или незамещенный неароматический карбоциклилалкилокси, замещенный или незамещенный ароматический гетероциклилалкилокси, замещенный или незамещенный неароматический гетероциклилалкилокси, замещенный или незамещенный ароматический карбоциклилалкилсульфанил, замещенный или незамещенный неароматический карбоциклилалкилсульфанил, замещенный или незамещенный ароматический гетероциклилалкилсульфанил, замещенный или незамещенный неароматический гетероциклилалкилсульфанил, замещенный или незамещенный ароматический карбоциклилалкилоксикарбонил, замещенный или незамещенный неароматический карбоциклилалкилоксикарбонил, замещенный или незамещенный ароматический гетероциклилалкилоксикарбонил, замещенный или незамещенный неароматический гетероциклилалкилоксикарбонил, замещенный или незамещенный ароматический карбоциклилалкилокси алкил, замещенный или незамещенный неароматический карбоциклилалкилокси алкил, замещенный или незамещенный ароматический гетероциклилалкилокси алкил, замещенный или незамещенный неароматический гетероциклилалкилокси алкил, замещенный или незамещенный ароматический карбоциклсульфанил, замещенный или незамещенный неароматический карбоциклсульфанил, замещенный или незамещенный ароматический гетероциклсульфанил, замещенный или незамещенный неароматический гетероциклсульфанил, замещенный или незамещенный ароматический карбоциклсульфонил, замещенный или незамещенный неароматический карбоциклсульфонил, замещенный или незамещенный ароматический гетероциклсульфонил, замещенный или незамещенный неароматический гетероциклсульфонил, -CORa1, -COORa1, -SOSORa2, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCOCONRa4Ra5 и -C(NRa6)NRa4Ra5, причем каждый Ra1, Ra2 и Ra3 зависимо представляют собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил; каждый Ra4 и Ra5 зависимо представляют собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил; Ra6 представляет собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил.
[0096]
"Замещенный или незамещенный неароматический карбоциклил", "замещенный или незамещенный неароматический гетероциклил" и "замещенный или незамещенный азотсодержащий неароматический гетероцикл" включают вариант, замещенный "оксо".
[0097]
[Химическая формула 38]

[0098]
Неароматический карбоцикл "замещенного или незамещенного неароматического карбоциклилокси" и ароматический гетероцикл "замещенного или незамещенного азотсодержащего неароматического гетероцикла" также включают вариант, необязательно замещенный "оксо", как описано выше. Например, кольцо T1 необязательно замещено оксо, как указано ниже.
[0099]
[Химическая формула 39]
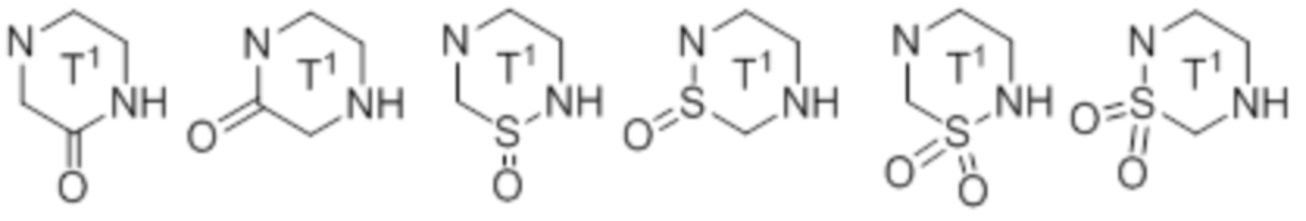
[0100]
"Замещенный или незамещенный амино" включает амино, необязательно замещенный одной или двумя группами, выбранными из следующей группы заместителей.
Группа заместителей: гидрокси, циано, алкил, алкенил, алкинил, галогеналкил, галогеналкенил, галогеналкинил, алкилокси, алкенилокси, алкинилокси, галогеналкилокси, галогеналкенилокси, галогеналкинилокси, алкенилкарбонил, алкинилкарбонил, галогеналкилкарбонил, галогеналкенилкарбонил, галогеналкинилкарбонил, алкилсульфонил, галогеналкилсульфонил, замещенный или незамещенный карбамоил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, замещенный или незамещенный ароматический карбоциклилкарбонил, замещенный или незамещенный неароматический карбоциклилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный неароматический гетероциклилкарбонил, замещенный или незамещенный ароматический карбоциклилкарбамоил, замещенный или незамещенный неароматический карбоциклилкарбамоил, замещенный или незамещенный ароматический гетероциклилкарбамоил, и замещенный или незамещенный неароматический гетероциклилкарбамоил.
Вариант осуществления "замещенного или незамещенного амино" включает амино, метиламино, диметиламино, этиламино, диэтиламино, этилметиламино, циклопропиламино, циклогексиламино, бензиламино, ацетиламино, бензоиламино, метилсульфониламино, тетрагидропираниламино, тетрагидрофураниламино, морфолиноамино, морфолиниламино, пиперидиниламино, пиперазиниламино и т.п. Другой вариант его осуществления включает амино, метиламино, диметиламино, этилметиламино, диэтиламино, ацетиламино, метилсульфониламино, тетрагидропираниламино, тетрагидрофураниламино, морфолиноамино, пиперидиниламино и т.п.
[0101]
"Триалкилсилил" обозначает группу, в которой три "алкильные" группы, описанные выше, связаны с атомом кремния. Эти три алкила могут быть одинаковыми или различными. Например, он включает триметилсилил, триэтилсилил, трет-бутилдиметилсилил и т.п.
[0102]
"Галогеналкил" обозначает группу, в которой один или несколько "галогенов", описанных выше, связаны с вышеуказанным "алкилом". Например, он включает монофторметил, монофторэтил, монофторпропил, 2,2,3,3,3-пентафторпропил, монохлорметил, трифторметил, трихлорметил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 1,2-дибромэтил, 1,1,1-трифторпропан-2-ил и т.п.
Предпочтительным вариантом осуществления "галогеналкила" является трифторметил, трихлорметил и т.п.
[0103]
"Галогеналкилокси" обозначает группу, в которой вышеупомянутый "галогеналкил" связан с атомом кислорода. Например, он включает монофторметокси, монофторэтокси, трифторметокси, трихлорметокси, трифторэтокси, трихлорэтокси и т.п.
Предпочтительным вариантом осуществления "галогеналкилокси" является трифторметокси или трихлорметокси.
[0104]
"Алкилкарбонил" обозначает группу, в которой вышеупомянутый "алкил" связан с карбонильной группой. Например, он включает метилкарбонил, этилкарбонил, пропилкарбонил, изопропилкарбонил, трет-бутилкарбонил, изобутилкарбонил, втор-бутилкарбонил, пентилкарбонил, изопентилкарбонил, гексилкарбонил и т.п.
Предпочтительным вариантом осуществления "алкилкарбонила" является метилкарбонил, этилкарбонил или н-пропилкарбонил.
[0105]
"Алкенилкарбонил" обозначает группу, в которой вышеупомянутый "алкенил" связан с карбонильной группой. Например, он включает этиленилкарбонил, пропенилкарбонил и т.п.
[0106]
"Алкинилкарбонил" обозначает группу, в которой вышеупомянутый "алкинил" связан с карбонильной группой. Например, он включает этинилкарбонил, пропинилкарбонил и т.п.
[0107]
"Алкилсульфонил" обозначает группу, в которой вышеупомянутый "алкил" связан с сульфонильной группой. Например, он включает метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, трет-бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил и т.п.
Предпочтительным вариантом осуществления "алкилсульфонила" является метилсульфонил или этилсульфонил.
[0108]
"Алкенилсульфонил" обозначает группу, в которой вышеупомянутый "алкенил" связан с сульфонильной группой. Например, он включает этиленилсульфонил, пропенилсульфонил и т.п.
[0109]
"Алкинилсульфонил" обозначает группу, в которой вышеупомянутый "алкинил" связан с сульфонильной группой. Например, он включает этинилсульфонил, пропинилсульфонил и т.п.
[0110]
"Алкилкарбонилокси" обозначает группу, в которой вышеупомянутый "алкилкарбонил" связан с атомом кислорода. Например, он включает метилкарбонилокси, этилкарбонилокси, пропилкарбонилокси, изопропилкарбонилокси, трет-бутилкарбонилокси, изобутилкарбонилокси, втор-бутилкарбонилокси и т.п.
Предпочтительным вариантом осуществления "алкилкарбонилокси" является метилкарбонилокси или этилкарбонилокси.
[0111]
"Алкенилкарбонилокси" обозначает группу, в которой вышеупомянутый "алкенилкарбонил" связан с атомом кислорода. Например, он включает этиленилкарбонилокси, пропенилкарбонилокси и т.п.
[0112]
"Алкинилкарбонилокси" обозначает группу, в которой вышеупомянутый "алкинилкарбонил" связан с атомом кислорода. Например, он включает этинилкарбонилокси, пропинилкарбонилокси и т.п.
[0113]
"Алкилсульфонилокси" обозначает группу, в которой вышеупомянутый "алкилсульфонил" связан с атомом кислорода. Например, он включает метилсульфонилокси, этилсульфонилокси, пропилсульфонилокси, изопропилсульфонилокси, трет-бутилсульфонилокси, изобутилсульфонилокси, втор-бутилсульфонилокси и т.п.
Предпочтительным вариантом осуществления "алкилсульфонилокси" является метилсульфонилокси или этилсульфонилокси.
[0114]
"Алкенилсульфонилокси" обозначает группу, в которой вышеупомянутый "алкенилсульфонил" связан с атомом кислорода. Например, он включает этиленилсульфонилокси, пропенилсульфонилокси и т.п.
[0115]
"Алкинилсульфонилокси" обозначает группу, в которой вышеупомянутый "алкинилсульфонил" связан с атомом кислорода. Например, он включает этинилсульфонилокси, пропенилсульфонилокси и т.п.
[0116]
"Алкилоксикарбонил" обозначает группу, в которой вышеупомянутый "алкилокси" связан с карбонильной группой. Например, он включает метилоксикарбонил, этилоксикарбонил, пропилоксикарбонил, изопропилоксикарбонил, трет-бутилоксикарбонил, изобутилоксикарбонил, втор-бутилоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, гексилоксикарбонил и т.п.
Предпочтительным вариантом осуществления "алкилоксикарбонила" является метилоксикарбонил, этилоксикарбонил или пропилоксикарбонил.
[0117]
"Алкенилоксикарбонил" обозначает группу, в которой вышеупомянутый "алкенилокси" связан с карбонильной группой. Например, он включает этиленилоксикарбонил, пропенилоксикарбонил и т.п.
[0118]
"Алкинилоксикарбонил" обозначает группу, в которой вышеупомянутый "алкинилокси" связан с карбонильной группой. Например, он включает этинилоксикарбонил, пропинилоксикарбонил и т.п.
[0119]
"Алкилсульфанил" обозначает группу, в которой атом водорода, прикрепленный к атому серы сульфанильной группы, заменен на вышеуказанный "алкил". Например, он включает метилсульфанил, этилсульфанил, н-пропилсульфанил, изопропилсульфанил и т.п.
[0120]
"Алкенилсульфанил" обозначает группу, в которой атом водорода, прикрепленный к атому серы сульфанильной группы, заменен на вышеуказанный "алкенил". Например, он включает этиленилсульфанил, пропенилсульфанил и т.п.
[0121]
"Алкинилсульфанил" обозначает группу, в которой атом водорода, прикрепленный к атому серы сульфанильной группы, заменен на вышеуказанный "алкинил". Например, он включает этинилсульфанил, пропинилсульфанил и т.п.
[0122]
"Алкилсульфинил" обозначает группу, в которой вышеупомянутый "алкил" связан с сульфинильной группой. Например, он включает метилсульфинил, этилсульфинил, н-пропилсульфинил, изопропилсульфинил и т.п.
[0123]
"Алкенилсульфинил" обозначает группу, в которой вышеупомянутый "алкенил" связан с сульфинильной группой. Например, он включает этиленилсульфинил, пропенилсульфинил и т.п.
[0124]
"Алкинилсульфинил" обозначает группу, в которой вышеупомянутый "алкинил" связан с сульфинильной группой. Например, он включает этинилсульфинил, пропинилсульфинил и т.п.
[0125]
"Замещенный или незамещенный имино" включает имино, необязательно замещенный группой, выбранной из следующей группы заместителей.
Группа заместителей: гидрокси, алкил, алкенил, алкинил, галогеналкил, галогеналкенил, галогеналкинил, алкилокси, алкенилокси, алкинилокси, галогеналкилокси, галогеналкенилокси, галогеналкинилокси, алкилкарбонил, алкенилкарбонил, алкинилкарбонил, галогеналкилкарбонил, галогеналкенилкарбонил, галогеналкинилкарбонил, амино, алкиламино, галогеналкиламино, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил и замещенный или незамещенный неароматический гетероциклил.
[0126]
Вариант осуществления "замещенного или незамещенного имино" включает имино, метилимино, этилимино, циклопропилимино, циклогексилимино, ацетилимино, тетрагидропиранилимино, тетрагидрофуранилимино, морфолиноимино, морфолинилимино, пиперидинилимино, пиперазинилимино и т.п.
[0127]
"Гидроксиалкил" обозначает группу, в которой атом(ы) водорода, прикрепленный к атому углерода вышеупомянутого "алкила", заменен на одну или несколько гидроксильных групп. Например, он включает гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 1-гидроксипропил, 2-гидроксипропил, 1,2-гидроксиэтил и т.п.
Предпочтительным вариантом осуществления "гидроксиалкила" является гидроксиметил.
[0128]
"Алкилоксиалкил" обозначает группу, в которой вышеупомянутый "алкилокси" связан с вышеупомянутым "алкилом". Например, он включает метоксиметил, метоксиэтил, этоксиметил и т.п.
[0129]
"Алкилоксиалкилокси" обозначает группу, в которой вышеупомянутый "алкилокси" связан с вышеупомянутым "алкилокси". Например, он включает метоксиметокси, метоксиэтокси, этоксиметокси, этоксиэтокси и т.п.
[0130]
"Замещенный или незамещенный карбамоил" включает карбамоил, необязательно замещенный одной или несколькими группами, выбранными из следующей группы заместителей.
Группа заместителей: гидрокси, циано, амино, алкил, алкенил, алкинил, галогеналкил, галогеналкенил, галогеналкинил, гидроксиалкил, алкиламино, алкилкарбонил, алкенилкарбонил, алкинилкарбонил, алкилсульфонил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил и замещенный или незамещенный неароматический гетероциклилалкил.
Вариант осуществления "замещенного или незамещенного карбамоила" включает карбамоил, N-метилкарбамоил, N,N-диметилкарбамоил, N-этил-N-метилкарбамоил, N,N-диэтилкарбамоил, N-н-пропиламинокарбамоил, N-изопропилкарбамоил, N-морфолинокарбамоил, N-тетрагидрофуранилкарбамоил, N-пиперидилкарбамоил, N-тетрагидропираниларбамоил, N-бензилкарбамоил, N-ацетилкарбамоил, N-метилсульфонилкарбамоил, N-(2,2,2-трифторэтил)карбамоил, N-(2-гидрокси-1-метилэтил)карбамоил и т.п. Другой вариант его осуществления включает карбамоил, N-метилкарбамоил, N,N-диметилкарбамоил, N-н-пропиламинокарбамоил, N-изопропилкарбамоил, N-морфолинокарбамоил, N-тетрагидрофуранилкарбамоил, N-пиперидилкарбамоил, N-тетрагидропираниларбамоил, N-метилсульфонилкарбамоил, N-(2,2,2-трифторэтил)карбамоил, N-(2-гидрокси-1-метилэтил)карбамоил и т.п.
[0131]
"Замещенный или незамещенный сульфамоил" включает аминосульфонил, необязательно замещенный одной или несколькими группами, выбранными из следующей группы заместителей.
Группа заместителей: алкил, алкенил, алкинил, галогеналкил, галогеналкенил, галогеналкинил, гидроксиалкил, алкилкарбонил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил и замещенный или незамещенный неароматический гетероциклилалкил.
Вариант осуществления "замещенного или незамещенного сульфамоила" включает сульфамоил, N-метилсульфамоил, N,N-диметилсульфамоил, N-этил-N-метилсульфамоил, N,N-диэтилсульфамоил, N-н-пропиламиносульфамоил, N-изопропилсульфамоил, N-морфолиносульфамоил, N-тетрагидрофуранилсульфамоил, N-пиперидилсульфамоил, N-тетрагидропиранилсульфамоил, N-бензилсульфамоил, N-ацетилсульфамоил, N-метилсульфонилсульфамоил и т.п. Другой вариант его осуществления включает сульфамоил, N-метилсульфамоил, N,N-диметилсульфамоил, N-н-пропиламиносульфамоил, N-изопропилсульфамоил, N-морфолиносульфамоил, N-тетрагидрофуранилсульфамоил, N-пиперидилсульфамоил, N-тетрагидропиранилсульфамоил, N-метилсульфонилсульфамоил и т.п.
[0132]
Часть "ароматического карбоцикла" в "ароматическом карбоциклилокси", "ароматическом карбоциклилкарбониле", "ароматическом карбоциклилоксикарбониле", "ароматическом карбоциклсульфаниле", "ароматическом карбоциклсульфониле", "ароматическом карбоциклилалкиле", "ароматическом карбоциклилалкилокси", "ароматическом карбоциклилалкилсульфаниле", "ароматическом карбоциклилалкилоксикарбониле", "ароматическом карбоциклилалкилоксиалкиле", "ароматическом карбоциклилкарбамоиле" является такой же, как вышеупомянутый "ароматический карбоциклил".
[0133]
Заместитель(и) на части "ароматического карбоцикла" в "замещенном или незамещенном ароматическом карбоциклилокси", "замещенном или незамещенном ароматическом карбоциклилкарбониле", "замещенном или незамещенном ароматическом карбоциклилоксикарбониле", "замещенном или незамещенном ароматическом карбоциклсульфаниле", "замещенном или незамещенном ароматическом карбоциклсульфониле", "замещенном или незамещенном ароматическом карбоциклилалкиле", "замещенном или незамещенном ароматическом карбоциклилалкилокси", "замещенном или незамещенном ароматическом карбоциклилалкилсульфаниле", "замещенном или незамещенном ароматическом карбоциклилалкилоксикарбониле", "замещенном или незамещенном ароматическом карбоциклилалкилоксиалкиле" и "замещенном или незамещенном ароматическом карбоциклилкарбамоиле" является (являются) таким же, как заместитель(и) на вышеупомянутом "замещенном или незамещенном ароматическом карбоциклиле".
[0134]
Часть "неароматического карбоциклилалкила" в "неароматическом карбоциклилалкиле", "неароматическом карбоциклилкарбониле", "неароматическом карбоциклилоксикарбониле", "неароматическом карбоциклсульфаниле", "неароматическом карбоциклсульфониле", "неароматическом карбоциклилалкиле", "неароматическом карбоциклилалкилокси", "неароматическом карбоциклилалкилсульфаниле", "неароматическом карбоциклилалкилоксикарбониле", "неароматическом карбоциклилалкилоксиалкиле", "неароматическом карбоциклилкарбамоиле", "неароматическом карбоцикламино" является такой же, как вышеупомянутый "неароматический карбоциклил".
[0135]
Заместитель(и) на части "неароматического карбоцикла" в "замещенном или незамещенном неароматическом карбоциклилокси", "замещенном или незамещенном неароматическом карбоциклилкарбониле", "замещенном или незамещенном неароматическом карбоциклилоксикарбониле", "замещенном или незамещенном неароматическом карбоциклсульфаниле", "замещенном или незамещенном неароматическом карбоциклсульфониле", "замещенном или незамещенном неароматическом карбоциклилалкиле", "замещенном или незамещенном неароматическом карбоциклилалкилокси", "замещенном или незамещенном неароматическом карбоциклилалкилсульфаниле", "замещенном или незамещенном неароматическом карбоциклилалкилоксикарбониле", "замещенном или незамещенном неароматическом карбоциклилалкилоксиалкиле" и "замещенном или незамещенном неароматическом карбоциклилкарбамоиле" является (являются) таким же, как заместитель(и) на вышеупомянутом "замещенном или незамещенном неароматическом карбоциклиле".
[0136]
Часть "ароматического гетероцикла" в "ароматическом гетероциклилокси", "ароматическом гетероциклилкарбониле", "ароматическом гетероциклилоксикарбониле", "ароматическом гетероциклсульфаниле", "ароматическом гетероциклсульфониле", "ароматическом гетероциклилалкиле", "ароматическом гетероциклилалкилокси", "ароматическом гетероциклилалкилсульфаниле", "ароматическом гетероциклилалкилоксикарбониле", "ароматическом гетероциклилалкилоксиалкиле" и "ароматическом гетероциклилкарбамоиле" является такой же, как вышеупомянутый "ароматический гетероциклил".
[0137]
Заместитель(и) на части "ароматического гетероцикла" в "замещенном или незамещенном ароматическом гетероциклилокси", "замещенном или незамещенном ароматическом гетероциклилкарбониле", "замещенном или незамещенном ароматическом гетероциклилоксикарбониле", "замещенном или незамещенном ароматическом гетероциклсульфаниле", "замещенном или незамещенном ароматическом гетероциклсульфониле", "замещенном или незамещенном ароматическом гетероциклилалкиле", "замещенном или незамещенном ароматическом гетероциклилалкилокси", "замещенном или незамещенном ароматическом гетероциклилалкилсульфаниле", "замещенном или незамещенном ароматическом гетероциклилалкилоксикарбониле", "замещенном или незамещенном ароматическом гетероциклилалкилоксиалкиле" и "замещенном или незамещенном ароматическом гетероциклилкарбамоиле" является (являются) таким же, как заместитель(и) на вышеупомянутом "замещенном или незамещенном ароматическом гетероциклиле".
[0138]
Часть "неароматического гетероцикла" в "неароматическом гетероциклилокси", "неароматическом гетероциклилкарбониле", "неароматическом гетероциклилоксикарбониле", "неароматическом гетероциклсульфаниле", "неароматическом гетероциклсульфониле", "неароматическом гетероциклилалкиле", "неароматическом гетероциклилалкилокси", "неароматическом гетероциклилалкилсульфаниле", "неароматическом гетероциклилалкилоксикарбониле", "неароматическом гетероциклилалкилоксиалкиле", "неароматическом гетероциклилкарбамоиле" и "неароматическом гетероцикламино" является такой же, как вышеупомянутый "неароматический гетероциклил".
[0139]
Заместитель(и) на части "неароматического гетероцикла" в "замещенном или незамещенном неароматическом гетероциклилокси", "замещенном или незамещенном неароматическом гетероциклилкарбониле", "замещенном или незамещенном неароматическом гетероциклилоксикарбониле", "замещенном или незамещенном неароматическом гетероциклсульфаниле", "замещенном или незамещенном неароматическом гетероциклсульфониле", "замещенном или незамещенном неароматическом гетероциклилалкиле", "замещенном или незамещенном неароматическом гетероциклилалкилокси", "замещенном или незамещенном неароматическом гетероциклилалкилсульфаниле", "замещенном или незамещенном неароматическом гетероциклилалкилоксикарбониле", "замещенном или незамещенном неароматическом гетероциклилалкилоксиалкиле" и "замещенном или незамещенном неароматическом гетероциклилкарбамоиле" является (являются) таким же, как заместитель(и) на вышеупомянутом "замещенном или незамещенном неароматическом гетероциклиле".
[0140]
Часть "алкила" в "ароматическом карбоциклилалкиле", "неароматическом карбоциклилалкиле", "ароматическом гетероциклилалкиле", "неароматическом гетероциклилалкиле", "ароматическом карбоциклилалкилокси", "неароматическом карбоциклилалкилокси", "ароматическом гетероциклилалкилокси", "неароматическом гетероциклилалкилокси", "ароматическом карбоциклилалкилсульфаниле", "неароматическом карбоциклилалкилсульфаниле", "ароматическом гетероциклилалкилсульфаниле", "неароматическом гетероциклилалкилсульфаниле", "ароматическом карбоциклилалкилоксикарбониле", "неароматическом карбоциклилалкилоксикарбониле", "ароматическом гетероциклилалкилоксикарбониле", "неароматическом гетероциклилалкилоксикарбониле", "ароматическом карбоциклилалкилоксиалкиле", "неароматическом карбоциклилалкилоксиалкиле", "ароматическом гетероциклилалкилоксиалкиле", и "неароматическом гетероциклилалкилоксиалкиле" является такой же, как вышеупомянутый "алкил".
[0141]
Заместитель(и) части "алкила" в "замещенном или незамещенном ароматическом карбоциклилалкиле", "замещенном или незамещенном неароматическом карбоциклилалкиле", "замещенном или незамещенном ароматическом гетероциклилалкиле", "замещенном или незамещенном неароматическом гетероциклилалкиле", "замещенном или незамещенном ароматическом карбоциклилалкилокси", "замещенном или незамещенном неароматическом карбоциклилалкилокси", "замещенном или незамещенном ароматическом гетероциклилалкилокси", "замещенном или незамещенном неароматическом гетероциклилалкилокси", "замещенном или незамещенном ароматическом карбоциклилалкилсульфаниле", "замещенном или незамещенном неароматическом карбоциклилалкилсульфаниле", "замещенном или незамещенном ароматическом гетероциклилалкилсульфаниле", "замещенном или незамещенном неароматическом гетероциклилалкилсульфаниле", "замещенном или незамещенном ароматическом карбоциклилалкилоксикарбониле", "замещенном или незамещенном неароматическом карбоциклилалкилоксикарбониле", "замещенном или незамещенном ароматическом гетероциклилалкилоксикарбониле", "замещенном или незамещенном неароматическом гетероциклилалкилоксикарбониле", "замещенном или незамещенном ароматическом карбоциклилалкилоксиалкиле", "замещенном или незамещенном неароматическом карбоциклилалкилоксиалкиле", "замещенном или незамещенном ароматическом гетероциклилалкилоксиалкиле" и "замещенном или незамещенном неароматическом гетероциклилалкилоксиалкиле" является (являются) таким же, как заместитель(и) на вышеупомянутом "замещенном или незамещенном алкиле".
[0142]
"Ароматический карбоциклилокси" обозначает группу, в которой "ароматический карбоцикл" связан с атомом кислорода. Например, он включает фенилокси, нафтилокси и т.п.
[0143]
"Ароматический карбоциклилкарбонил" обозначает группу, в которой "ароматический карбоцикл" связан с карбонильной группой. Например, он включает фенилкарбонил, нафтилкарбонил и т.п.
[0144]
"Ароматический карбоциклилоксикарбонил" обозначает группу, в которой вышеупомянутый "ароматический карбоциклилокси" связан с карбонильной группой. Например, он включает фенилоксикарбонил, нафтилоксикарбонил и т.п.
[0145]
"Ароматический карбоциклсульфанил" обозначает группу, в которой атом водорода, прикрепленный к атому серы сульфанильной группы, заменен на вышеуказанный "ароматический карбоцикл". Например, он включает фенилсульфанил, нафтилсульфанил и т.п.
[0146]
"Ароматический карбоциклсульфонил" обозначает группу, в которой "ароматический карбоцикл" связан с сульфонильной группой. Например, он включает фенилсульфонил, нафтилсульфонил и т.п.
[0147]
"Неароматический карбоциклилкарбонил" обозначает группу, в которой "неароматический карбоцикл" связан с карбонильной группой. Например, он включает циклопропилкарбонил, циклогексилкарбонил, циклогексенилкарбонил и т.п.
[0148]
"Неароматический карбоциклилоксикарбонил" обозначает группу, в которой вышеупомянутый "неароматический карбоциклилокси" связан с карбонильной группой. Например, он включает циклопропилоксикарбонил, циклогексилоксикарбонил, циклогексенилоксикарбонил и т.п.
[0149]
"Неароматический карбоциклсульфанил" обозначает группу, в которой атом водорода, прикрепленный к атому серы сульфанильной группы, заменен на вышеуказанный "неароматический карбоцикл". Например, он включает циклопропилсульфанил, циклогексилсульфанил, циклогексенилсульфанил и т.п.
[0150]
"Неароматический карбоциклсульфонил" обозначает группу, в которой "неароматический карбоцикл" связан с сульфонильной группой. Например, он включает циклопропилсульфонил, циклогексилсульфонил, циклогексенилсульфонил и т.п.
[0151]
"Ароматический гетероциклилокси" обозначает группу, в которой "ароматический гетероцикл" связан с атомом кислорода. Например, он включает пиридилокси, оксазолилокси и т.п.
[0152]
"Ароматический гетероциклилкарбонил" обозначает группу, в которой "ароматический гетероцикл" связан с карбонильной группой. Например, он включает пиридилкарбонил, оксазолилкарбонил и т.п.
[0153]
"Ароматический гетероциклилоксикарбонил" обозначает группу, в которой вышеупомянутый "ароматический гетероциклилокси" связан с карбонильной группой. Например, он включает пиридилоксикарбонил, оксазолилоксикарбонил и т.п.
[0154]
"Неароматический гетероциклилокси" обозначает группу, в которой "неароматический гетероцикл" связан с атомом кислорода. Например, он включает пиперидинилокси, тетрагидрофурилокси и т.п.
[0155]
"Неароматический гетероциклилкарбонил" обозначает группу, в которой "неароматический гетероцикл" связан с карбонильной группой. Например, он включает пиперидинилкарбонил, тетрагидрофурилкарбонил и т.п.
[0156]
"Неароматический гетероциклилоксикарбонил" обозначает группу, в которой вышеупомянутый "неароматический гетероциклилокси" связан с карбонильной группой. Например, он включает пиперидинилоксикарбонил, тетрагидрофурилоксикарбонил и т.п.
[0157]
"Неароматический гетероциклсульфанил" обозначает группу, в которой атом водорода, прикрепленный к атому серы сульфанильной группы, заменен на "неароматический гетероцикл". Например, он включает пиперидинилсульфанил, тетрагидрофурилсульфанил и т.п.
[0158]
"Неароматический гетероциклсульфонил" обозначает группу, в которой "неароматический гетероцикл" связан с сульфонильной группой. Например, он включает пиперидинилсульфонил, тетрагидрофурилсульфонил и т.п.
[0159]
"Ароматический карбоциклилалкил" или "аралкил" обозначает алкил, замещенный одним или несколькими "ароматическими карбоциклилами", описанными выше. Например, он включает бензил, фенэтил, фенилпропенил, бензгидрил, тритил, нафтилметил, группу в соответствии с формулой:
[0160]
[Химическая формула 40]

и т.п.
Предпочтительным вариантом осуществления "ароматического карбоциклилалкила" является бензил, фенэтил или бензгидрил.
[0161]
"Неароматический карбоциклилалкил" обозначает алкил, замещенный одним или несколькими "неароматическими карбоциклилами", описанными выше. Кроме того, "неароматический карбоциклилалкил" также включает "неароматический карбоциклилалкил", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом". Например, он включает циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, группу в соответствии с формулой:
[0162]
[Химическая формула 41]

и т.п.
[0163]
"Ароматический гетероциклилалкил" обозначает алкил, замещенный одним или несколькими "ароматическими гетероциклилами", описанными выше. Кроме того, "ароматический гетероциклилалкил" также включает "ароматический гетероциклилалкил", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом" и/или "неароматическим карбоциклилом". Например, он включает пиридилметил, фуранилметил, имидазолилметил, индолилметил, бензотиофенилметил, оксазолилметил, изоксазолилметил, тиазолилметил, изотиазолилметил, пиразолилметил, изопиразолилметил, пирролидинилметил, бензоксазолилметил, группы в соответствии с формулой:
[0164]
[Химическая формула 42]
и т.п.
[0165]
"Неароматический гетероциклилалкил" обозначает алкил, замещенный одним или несколькими "неароматическими гетероциклилами", описанными выше. Кроме того, "неароматический гетероциклилалкил" также включает "неароматический гетероциклилалкил", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом", "неароматическим карбоциклилом" и/или "ароматическим гетероциклилом". Например, тетрагидропиранилметил, морфолинилэтил, пиперидинилметил, пиперазинилметил, группы в соответствии с формулой:
[0166]
[Химическая формула 43]
и т.п.
[0167]
"Ароматический карбоциклилалкилокси" обозначает алкилокси, замещенный одним или несколькими "ароматическими карбоциклилами", описанными выше. Например, он включает бензилокси, фенэтилокси, фенилпропенилокси, бензгидрилокси, тритилокси, нафтилметилокси, группу в соответствии с формулой:
[0168]
[Химическая формула 44]

и т.п.
[0169]
"Неароматический карбоциклилалкилокси" обозначает алкилокси, замещенный одним или несколькими "неароматическими карбоциклилами", описанными выше. Кроме того, "неароматический карбоциклилалкилокси" также включает "неароматический карбоциклилалкилокси", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом". Например, он включает циклопропилметилокси, циклобутилметилокси, циклопентилметилокси, циклогексилметилокси, группу в соответствии с формулой:
[0170]
[Химическая формула 45]

и т.п.
[0171]
"Ароматический гетероциклилалкилокси" обозначает алкилокси, замещенный одним или несколькими "ароматическими гетероциклилами", описанными выше. Кроме того, "ароматический гетероциклилалкилокси" также включает "ароматический гетероциклилалкилокси", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом" и/или "неароматическим карбоциклилом". Например, он включает пиридилметилокси, фуранилметилокси, имидазолилметилокси, индолилметилокси, бензотиофенилметилокси, оксазолилметилокси, изоксазолилметилокси, тиазолилметилокси, изотиазолилметилокси, пиразолилметилокси, изопиразолилметилокси, пирролидинилметилокси, бензоксазолилметилокси, группы в соответствии с формулой:
[0172]
[Химическая формула 46]
и т.п.
[0173]
"Неароматический гетероциклилалкилокси" обозначает алкилокси, замещенный одним или несколькими "неароматическими гетероциклилами", описанными выше. Кроме того, "неароматический гетероциклилалкилокси" также включает "неароматический гетероциклилалкилокси", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом", "неароматическим карбоциклилом" и/или "ароматическим гетероциклилом". Например, он включает тетрагидропиранилметилокси, морфолинилэтилокси, пиперидинилметилокси, пиперазинилметилокси, группы в соответствии с формулой:
[0174]
[Химическая формула 47]
и т.п.
[0175]
"Ароматический карбоциклилалкилсульфанил" обозначает алкилсульфанил, замещенный одним или несколькими "ароматическими карбоциклилами", описанными выше. Например, он включает бензилсульфанил, фенэтилсульфанил, фенилпропинилсульфанил, бензгидрилсульфанил, тритилсульфанил, нафтилметилсульфанил и т.п.
[0176]
"Неароматический карбоциклилалкилсульфанил" обозначает алкилсульфанил, замещенный одним или несколькими "неароматическими карбоциклилами", описанными выше. Кроме того, "неароматический карбоциклилалкилсульфанил" также включает "неароматический карбоциклилалкилсульфанил", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом". Например, он включает циклопропилметилсульфанил, циклобутилметилсульфанил, циклопентилметилсульфанил, циклогексилметилсульфанил и т.п.
[0177]
"Ароматический гетероциклилалкилсульфанил" обозначает алкилсульфанил, замещенный одним или несколькими "ароматическими гетероциклилами", описанными выше. Кроме того, "ароматический гетероциклилалкилсульфанил" также включает "ароматический гетероциклилалкилсульфанил", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом" и/или "неароматическим карбоциклилом". Например, он включает пиридилметилсульфанил, фуранилметилсульфанил, имидазолилметилсульфанил, индолилметилсульфанил, бензотиофенилметилсульфанил, оксазолилметилсульфанил, изоксазолилметилсульфанил, тиазолилметилсульфанил, изотиазолилметилсульфанил, пиразолилметилсульфанил, изопиразолилметилсульфанил, пирролидинилметилсульфанил, бензоксазолилметилсульфанил и т.п.
[0178]
"Неароматический гетероциклилалкилсульфанил" обозначает алкилсульфанил, замещенный одним или несколькими "неароматическими гетероциклилами", описанными выше. Кроме того, "неароматический гетероциклилалкилсульфанил" также включает "неароматический гетероциклилалкилсульфанил", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом", "неароматическим карбоциклилом" и/или "ароматическим гетероциклилом". Например, он включает тетрагидропиранилметилсульфанил, морфолинилэтилсульфанил, пиперидинилметилсульфанил, пиперазинилметилсульфанил и т.п.
[0179]
"Ароматический карбоциклилалкилоксикарбонил" обозначает алкилоксикарбонил, замещенный одним или несколькими "ароматическими карбоциклилами", описанными выше. Например, он включает бензилоксикарбонил, фенэтилоксикарбонил, фенилпропинилоксикарбонил, бензогидрилоксикарбонил, тритилоксикарбонил, нафтилметилоксикарбонил, группу в соответствии с формулой:
[0180]
[Химическая формула 48]
и т.п.
[0181]
"Неароматический карбоциклилалкилоксикарбонил" обозначает алкилоксикарбонил, замещенный одним или несколькими "неароматическими карбоциклилами", описанными выше. Кроме того, "неароматический карбоциклилалкилоксикарбонил" также включает "неароматический карбоциклилалкилоксикарбонил" в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом". Например, он включает циклопропилметилоксикарбонил, циклобутилметилоксикарбонил, циклопентилметилоксикарбонил, циклогексилметилоксикарбонил, группу в соответствии с формулой:
[0182]
[Химическая формула 49]

и т.п.
[0183]
"Ароматический гетероциклилалкилоксикарбонил" обозначает алкилоксикарбонил, замещенный одним или несколькими "ароматическими гетероциклилами", описанными выше. Кроме того, "ароматический гетероциклилалкилоксикарбонил" также включает "ароматический гетероциклилалкилоксикарбонил", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом" и/или "неароматическим карбоциклилом". Например, он включает пиридилметилоксикарбонил, фуранилметилоксикарбонил, имидазолилметилоксикарбонил, индолилметилоксикарбонил, бензотиофенилметилоксикарбонил, оксазолилметилоксикарбонил, изоксазолилилметилоксикарбонил, тиазолилметилоксикарбонил, изотиазолилметилоксикарбонил, пиразолилметилоксикарбонил, изопиразолилметилоксикарбонил, пирролидинилметилоксикарбонил, бензоксазолилметилоксикарбонил, группы в соответствии с формулой:
[0184]
[Химическая формула 50]

и т.п.
[0185]
"Неароматический гетероциклилалкилоксикарбонил" обозначает алкилоксикарбонил, замещенный одним или несколькими "неароматическими гетероциклилами", описанными выше. Кроме того, "неароматический гетероциклилалкилоксикарбонил" также включает "неароматический гетероциклилалкилоксикарбонил", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом", "неароматическим карбоциклилом" и/или "ароматическим гетероциклилом". Например, он включает тетрагидропиранилметилокси, морфолинилэтилокси, пиперидинилметилокси, пиперазинилметилокси, группы в соответствии с формулой:
[0186]
[Химическая формула 51]

и т.п.
[0187]
"Ароматический карбоциклилалкилоксиалкил" обозначает алкилоксиалкил, замещенный одним или несколькими "ароматическими карбоциклилами". Например, он включает бензилоксиметил, фенэтилоксиметил, фенилпропинилоксиметил, бензгидрилоксиметил, тритилоксиметил, нафтилметилоксиметил, группу в соответствии с формулой:
[0188]
[Химическая формула 52]
и т.п.
[0189]
"Неароматический карбоциклилалкилоксиалкил" обозначает алкилоксиалкил, замещенный одним или несколькими "неароматическими карбоциклилами". Кроме того, "неароматический карбоциклилалкилоксиалкил" включает "неароматический карбоциклилалкилоксиалкил", в котором алкильная часть замещена вышеупомянутым "ароматическим карбоциклилом". Например, он включает циклопропилметилоксиметил, циклопропилметилоксиметил, циклопропилметилоксиметил, циклопропилметилоксиметил, группу в соответствии с формулой:
[0190]
[Химическая формула 53]

и т.п.
[0191]
"Ароматический гетероциклилалкилоксиалкил" обозначает алкилоксиалкил, замещенный одним или несколькими "ароматическими гетероциклилами", описанными выше. Кроме того, "ароматический гетероциклилалкилоксиалкил" также включает "ароматический гетероциклилалкилоксиалкил", в котором алкильная часть, прикрепленная к "неароматическому карбоциклилу", замещена вышеупомянутым "ароматическим карбоциклилом" и/или "неароматическим карбоциклилом". Например, он включает пиридилметилоксиметил, фуранилметилоксиметил, имидазолилметилоксиметил, индолилметилоксиметил, бензотиофенилметилоксиметил, оксазолилметилоксиметил, изоксазолилилметилоксиметил, тиазолилметилоксиметил, изотиазолилметилоксиметил, пиразолилметилоксиметил, изопиразолилметилоксиметил, пирролидинилметилоксиметил, бензоксазолилметилоксиметил, группы в соответствии с формулой:
[0192]
[Химическая формула 54]

и т.п.
[0193]
"Неароматический гетероциклилалкилоксиалкил" обозначает алкилоксиалкил, замещенный одним или несколькими "неароматическими гетероциклилами", описанными выше. Кроме того, "неароматический гетероциклилалкилокси" также включает "неароматический гетероциклилалкилокси", в котором алкильная часть, прикрепленная к "неароматическому гетероциклу", замещена вышеупомянутым "ароматическим карбоциклилом", "неароматическим карбоциклилом" и/или "ароматическим гетероциклилом". Например, тетрагидропиранилметилоксиметил, морфолинилэтилоксиметил, пиперидинилметилоксиметил, пиперазинилметилоксиметил, группы в соответствии с формулой:
[0194]
[Химическая формула 55]
и т.п.
[0195]
Настоящее изобретение предлагает множество соединений, охватываемых следующими соединениями (I) или (I').
[0196]
[Химическая формула 56]

Предпочтительные варианты осуществления каждой группы приведены в качестве примера ниже. Соединения в соответствии с возможными комбинациями, указанными ниже, являются предпочтительными.
[0197]
R1 представляет собой водород, галоген или замещенный или незамещенный алкил, более предпочтительно галоген или алкил и, более предпочтительно, алкил.
[0198]
Каждый R2 независимо представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси, замещенный или незамещенный неароматический карбоциклилокси (предпочтительно, замещенный или незамещенный циклоалкилокси или замещенный или незамещенный циклоалкенилокси). Предпочтительным является замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси или замещенный или незамещенный алкенилокси. Более предпочтительным является замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, особенно предпочтительным является алкилокси. Предпочтительным алкилокси является C1-C6 или C1-C4 линейный или разветвленный алкилокси, более предпочтительным является т-бутилокси. Предпочтительный вариант осуществления заместителя(ей) "замещенного или незамещенного" R2 включает гидрокси, алкилокси, галоген, галогеналкил, галогеналкилокси, амино, алкиламино и т.п.
[0199]
n представляет собой 1 или 2, предпочтительно 1.
[0200]
Если n представляет собой 1, R2, предпочтительно, принимает следующую стерическую структуру.
[0201]
[Химическая формула 57]
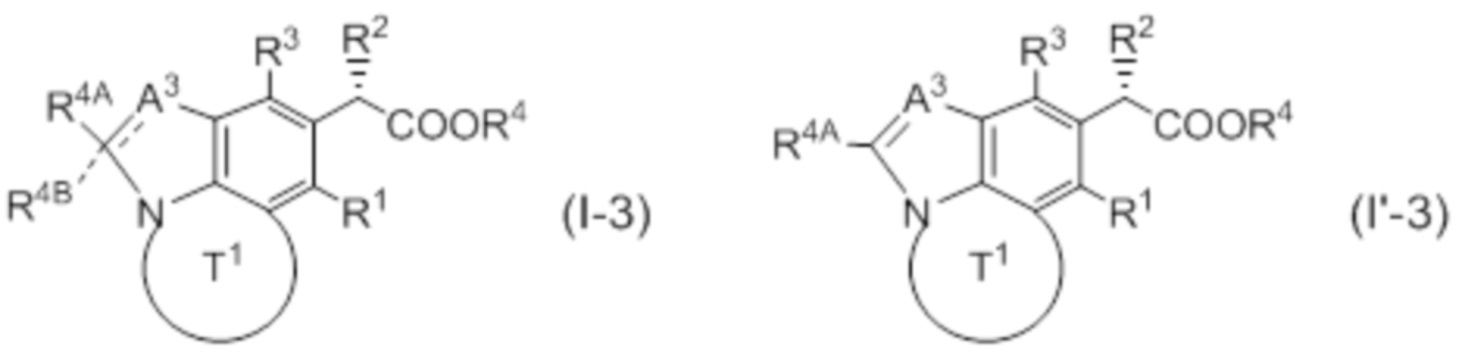
[0202]
R3 представляет собой замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил. Предпочтительно, он представляет собой замещенный или незамещенный ароматический карбоциклил. Примерами заместителей на этом кольце могут служить следующие R31-R35.
R3 представляет собой, предпочтительно, замещенный или незамещенный ароматический карбоциклил или замещенный или незамещенный неароматический циклил, предпочтительно 5-7-членное кольцо, и может быть конденсированным и иметь мостиковую структуру. Часть конденсированного кольца является 5-10-членной, может быть моноциклической или бициклической. "Замещенный или незамещенный ароматический карбоциклил" включает фенильную группу, иллюстрируемую следующей формулой.
Другим предпочтительным вариантом осуществления R3 является ароматический карбоциклил, который, необязательно, замещен галогеном, алкилом и/или алкилокси, неароматический карбоциклил, который, необязательно, замещен галогеном, алкилом и/или алкилокси, ароматический гетероциклил, который, необязательно, замещен галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, который, необязательно, замещен галогеном, алкилом и/или алкилокси. Более предпочтительным вариантом осуществления R3 является галоген, ароматический карбоциклил который, необязательно, замещен алкилом и/или алкилокси, или неароматический гетероциклил, который, необязательно, замещен галогеном, алкилом и/или алкилокси.
[0203]
[Химическая формула 58]
Каждый R31, R32, R33, R34 и R35 независимо представляют собой, предпочтительно, атом водорода, галоген, гидрокси, амино, алкил, циклоалкил, алкенил, алкинил, галогеналкил, алкилокси, алкенилокси, алкинилокси галогеналкил, галогеналкилокси, карбокси, карбамоил или алкиламино, более предпочтительно атом водорода, галоген, гидрокси, амино, алкил или алкилокси, более предпочтительно атом водорода, фтор, хлор, бром, гидрокси, амино, метил, этил или метилокси, особенно предпочтительно атом водорода, галоген, гидрокси, метил или этил.
Каждые R31 и R32, R32 и R33, R33 и R34 и R34 и R35 могут быть независимо соединены вместе с соседним атомом с образованием замещенного или незамещенного ароматического карбоцикла, замещенного или незамещенного неароматического карбоцикла, замещенного или незамещенного ароматического гетероцикла или замещенного или незамещенного неароматического гетероцикла. Эти кольца, предпочтительно, представляют собой 5-8-членное кольцо, более предпочтительно 5 или 6-членное кольцо, более предпочтительно 6-членное кольцо.
[0204]
Неароматический карбоцикл и неароматический гетероцикл в R3, необязательно, замещен "оксо", как указано выше.
Заместитель(и) на кольце "замещенного или незамещенного ароматического карбоцикл", "замещенного или незамещенного неароматического карбоцикла", "замещенного или незамещенного ароматического гетероцикла", "замещенного или незамещенного неароматического гетероцикла" в R3 включают заместитель на кольце вышеупомянутого "замещенного или незамещенного ароматического карбоциклила", "замещенного или незамещенного неароматического карбоциклила", "замещенного или незамещенного ароматического гетероциклила", "замещенного или незамещенного неароматического гетероциклила".
[0205]
Две группы которые не являются соседними друг для друга в R31, R32, R33, R34 и R35, могут быть соединены вместе с образованием мостиковой структуры. Мостиковая структура включает замещенный или незамещенный алкилен и замещенный или незамещенный алкенилен. Заместитель(и) "замещенного или незамещенного" представляет(ют) собой, предпочтительно, алкил, циклоалкил, циклоалкилалкил, алкокси, алкоксиалкил, галоген, галогенированный алкил, амино, алкиламино, гидрокси, оксо, карбокси, карбамоил или фенил, более предпочтительно галоген, алкил, алкокси, амино, гидрокси и/или оксо, более предпочтительно метил, этил, F, Br, амино, гидрокси и т.п.
[0206]
R3, более предпочтительно, представляет собой фенил или неароматический карбоцикл, который может быть конденсированным с одним или двумя карбоциклами или гетероциклами (например: 5-7-членное кольцо). Более предпочтительным примером является циклил, проиллюстрированный ниже. Кольцо карбоцикла, гетероцикла, фенила, неароматического карбоцикла или нижеследующего циклила может иметь от 1 до 4 одинаковых или различных заместителей (например: галоген, гидрокси, алкокси, амино, моно- или диалкиламино, алкил, галогенированный алкил, гидроксиалкил, аминоалкил, оксо, циано).
[0207]
R3, более предпочтительно, представляет собой следующие группы.
[0208]
[Химическая формула 59]

[0209]
[Химическая формула 60]
[0210]
[Химическая формула 61]
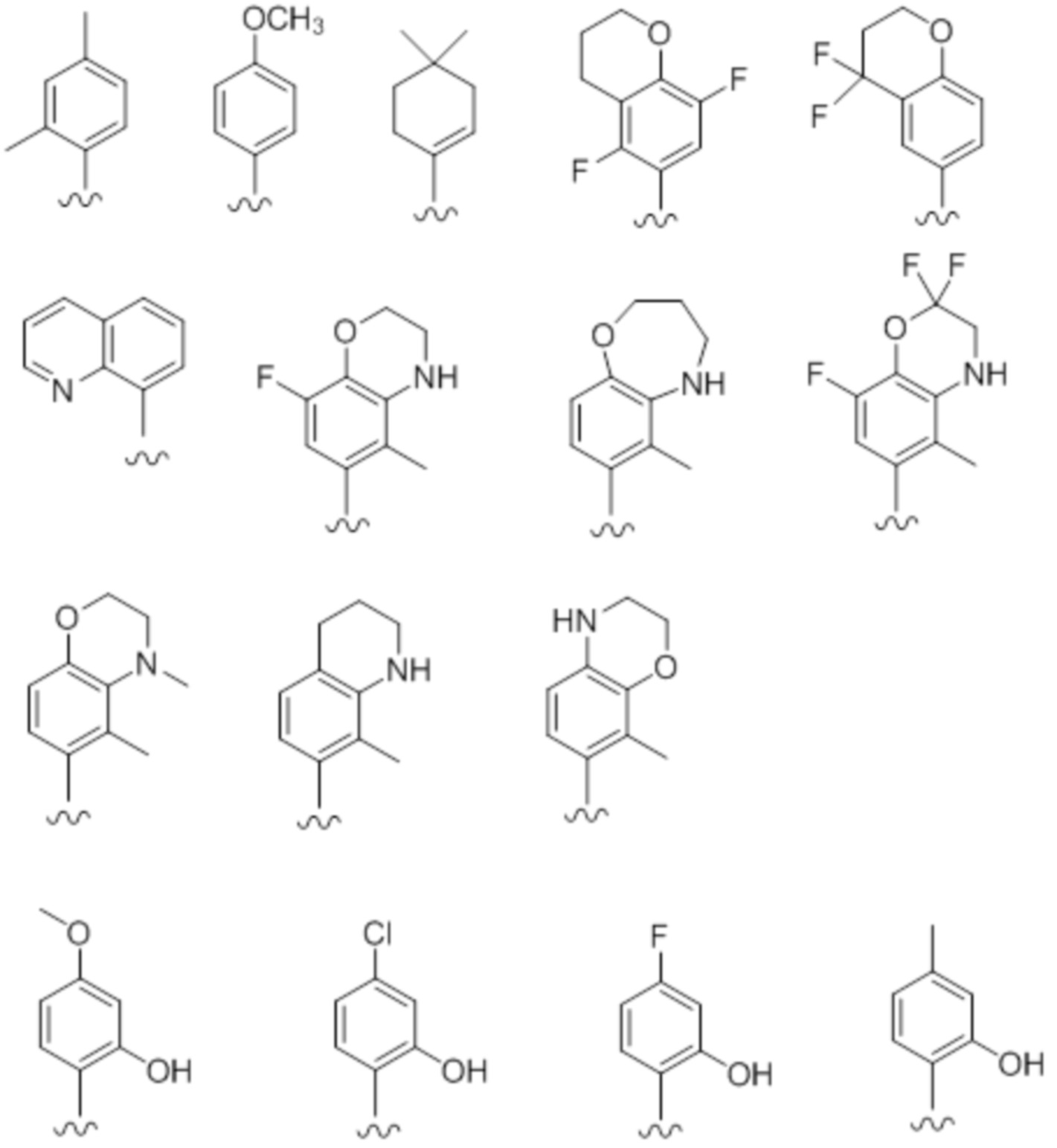
[0211]
R3 может представлять собой циклический амин, имеющий связь на атоме N, предпочтительно насыщенный циклический амин. Циклический амин представляет собой 5-7-членный гетероцикл, который может быть замещенным, конденсированным и/или мостиковым, и он может содержать атом N, атом O и/или атом S в качестве атома кольца. Заместитель(и) представляет(ют) собой, предпочтительно, алкил, циклоалкил, оксо, гидрокси, галоген, алкокси и т.п. Циклический амин проиллюстрирован ниже.
[0212]
[Химическая формула 62]

[0213]
R3 может представлять собой замещенный или незамещенный неароматический карбоциклил, имеющий одну или две двойные связи в кольце, или замещенный или незамещенный неароматический гетероциклил, имеющий одну или две двойные связи в кольце. Карбоциклил или гетероциклил, предпочтительно, представляет собой 5-7-членное кольцо. Заместитель(и) представляет(ют) собой, предпочтительно, алкил, циклоалкил, оксо, гидрокси, галоген, алкокси и т.п.
[0214]
[Химическая формула 63]

[0215]
Кроме того, R3 может быть выбран из следующих групп.
[0216]
[Химическая формула 64]

[0217]
Более предпочтительно, R3 может быть выбран из следующих групп.
[0218]
[Химическая формула 65]

[0219]
Один вариант осуществления изомеров соединения (I), (I'), (I-1), (I-2), (I-3), (I'-3), (I-1-1), (I-1A), (1-AA), (I'-1A), (A-1-1A), (I-1-1B), (I-1-1C), (I-1-1D), (I-1-1E) и (I-2-1) включает стереоизомеры, идентифицированные по направлению кольца R3, но настоящее изобретение включает все эти изомеры и рацематы.
[0220]
R4 представляет собой водород или карбоксилзащитную группу, предпочтительно водород. Соединение, в котором R4 отличается от водорода и может быть превращено в водород с помощью гидролиза или реакции снятия защиты карбоксилзащитной группы, является особенно полезным в качестве промежуточного продукта синтеза. Кроме того, соединение, в котором R4 отличается от водорода и может быть превращено в водород внутри тела, также полезно в качестве пролекарства. Примерами карбоксилзащитных групп являются, предпочтительно, алкил (например: метил, этил, т-бутил) и аралкил (например: бензил), более предпочтительно C1-C4 алкил.
[0221]
A3 представляет собой CR3A, CR3AR3B, N или NR3C, предпочтительно CR3A или N, более предпочтительно CR3A.
В другом варианте осуществления предпочтительными являются следующие соединения.
[0222]
[Химическая формула 66]

где каждое определение совпадает с определенным выше.
[0223]
Каждый R3A, R3B, R4A и R4B независимо представляют собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкинил или замещенный или незамещенный неароматический карбоциклил (предпочтительно, замещенный или незамещенный циклоалкил). Примерами заместителя(ей) "замещенного или незамещенного" являются от 1 до 4, предпочтительно 1 или 2, одинаковых или различных заместителей, выбранных из алкилокси, гидрокси, галогена, галогеналкила, галогеналкилокси, амино, алкиламино и ароматического карбоциклилалкилокси.
R3C представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный неароматический карбоциклил.
Более предпочтительно, R3A представляет собой водород, галоген, алкил или циано, и R4A представляет собой алкил, замещенный водородом, галогеном, циано, алкилом, галогеналкилом, гидрокси или алкилокси, алкинил или 3-6-членный циклоалкил.
R3A, более предпочтительно, представляет собой водород или галоген. R3A, особенно предпочтительно, представляет собой водород, фтор или хлор. R4A, более предпочтительно, представляет собой алкил, замещенный галогеном, циано, алкилом, галогеналкилом, гидрокси или алкилокси, алкинил или 3-6-членный циклоалкил. R4A, особенно предпочтительно, представляет собой галоген, циано, C1-3 алкил, галоген C1-3 алкил, C2-3 алкинил, или 3-4-членный циклоалкил.
[0224]
В другом варианте осуществления предпочтительными являются следующие соединения.
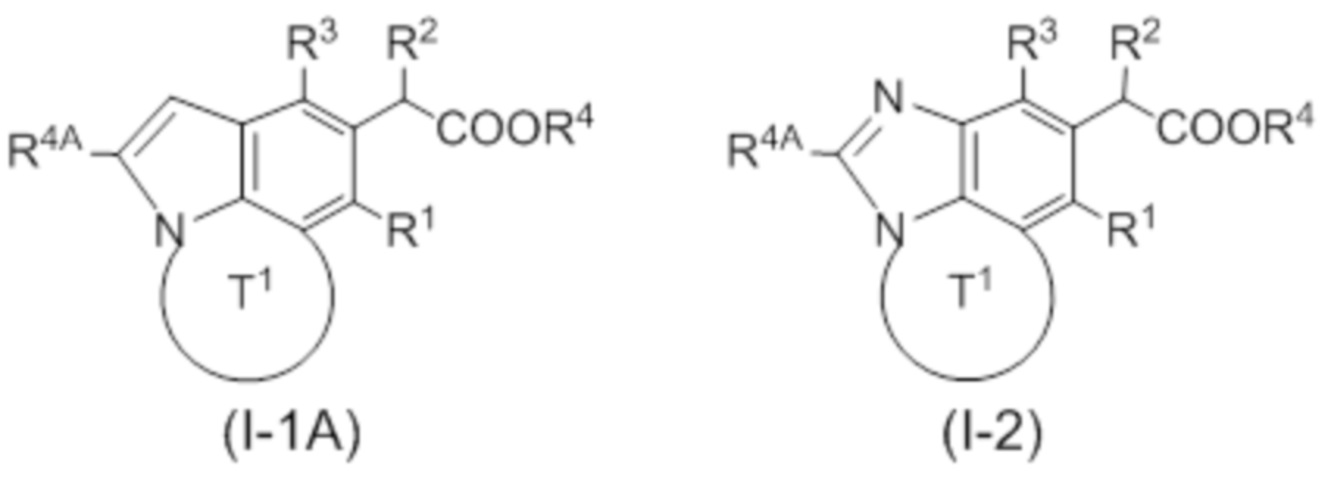
где каждое определение совпадает с определенным выше.
[0225]
Кольцо T1 представляет собой замещенный или незамещенный азотсодержащий неароматический гетероцикл. Кольцо T1, предпочтительно, представляет собой 5-12-членное кольцо, более предпочтительно 5-10-членное кольцо. Кольцо T1, более предпочтительно, представляет собой 5-8-членное кольцо. Кольцевые атомы кольца T1, предпочтительно, содержат один или два атома N, один или два атома N и один атом O или один или два атома N и один атом S. Более предпочтительно, кольцевые атомы кольца T1 содержат два атома N, два атома N и один атом S или один атом N и один атом O. Кольцо T1 может быть моноциклическим, конденсированным кольцом или спирокольцом, а также иметь мостиковую структуру. Предпочтительным является 5-8-членное моноциклическое кольцо, 9-12-членное конденсированное кольцо или 9-11-членное спирокольцо, кольцо может также быть конденсированным C1-3 алкиленом, который, необязательно, содержит гетероатом(ы).
[0226]
Каждый заместитель кольца T1 независимо представляет собой оксо, гидрокси, галоген, амино, алкиламино, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, -CORa1, -SORa2, -SO2Ra3, -NRa4Ra5 (каждый Ra1, Ra2, Ra3, Ra4 и Ra5 независимо представляют собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический гетероциклилокси, замещенный или незамещенный неароматический гетероциклилокси, замещенный или незамещенный ароматический карбоциклсульфанил, замещенный или незамещенный неароматический карбоциклсульфанил, замещенный или незамещенный ароматический гетероциклсульфанил, замещенный или незамещенный неароматический гетероциклсульфанил, замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный ароматический карбоциклилкарбонил, замещенный или незамещенный неароматический карбоциклилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный неароматический гетероциклилкарбонил, замещенный или незамещенный ароматический карбоциклилоксикарбонил, замещенный или незамещенный неароматический карбоциклилоксикарбонил, замещенный или незамещенный ароматический гетероциклилоксикарбонил, замещенный или незамещенный неароматический гетероциклилоксикарбонил, замещенный или незамещенный ароматический карбоциклилкарбонилокси, замещенный или незамещенный неароматический карбоциклилкарбонилокси, замещенный или незамещенный ароматический гетероциклилкарбонилокси, замещенный или незамещенный неароматический гетероциклилкарбонилокси, формил, замещенную или незамещенную аминогруппу или замещенный или незамещенный карбамоил), или его примером могут служить от 1 до 4, предпочтительно от 1 до 2, одинаковых или различных заместителей, выбранных из Ra, Rb и Rc, описанных ниже.
Примеры заместителя(ей) на кольце T1 включают от 1 до 4, предпочтительно 1 или 2, одинаковых или различных заместителей, выбранных из алкила, алкенила, алкинила, алкилокси, гидрокси, алкилоксиалкила, гидроксиалкила, галогена, галогеналкила, галогеналкилокси, амино, алкиламино, диалкиламино, триалкилсилила, неароматического карбоцикламино, замещенного или незамещенного фенила (примеры заместителя(ей): алкил, алкилокси, гидрокси, галоген), замещенного или незамещенного фенилокси (примеры заместителя(ей): алкил, алкилокси, гидрокси, галоген), замещенного или незамещенного бензилокси (примеры заместителя: алкил, алкилокси, гидрокси, галоген), замещенного или незамещенного ароматического гетероциклила (например: 5-6-членного кольца (примеры заместителя(ей): алкил, алкилокси, гидрокси, галоген)), замещенного или незамещенного неароматического гетероциклила (например: 4-6-членного кольца (примеры заместителя(ей): алкил, алкилокси, гидрокси, галоген)) и неароматического гетероцикламино.
[0227]
Другой вариант осуществления заместителя(ей) на кольце T1 включает каждый независимо от 1 до 4, предпочтительно 1 или 2, одинаковых или различных заместителей, выбранных из оксо или Ra, Rb и Rc, описанных ниже.
[0228]
Другой вариант осуществления заместителей на кольце T1 представляет собой независимо водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1, -COORa1, -SORa2, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5;
причем каждый Ra1, Ra2 и Ra3 независимо представляют собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Ra4 и Ra5 независимо представляют собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
Ra6 представляет собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил.
[0229]
Два атома, образующие азотсодержащий неароматический гетероцикл кольца T1, которые не являются соседними друг для друга, могут образовывать мостик с помощью замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкинилена или замещенного или незамещенного алкинилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении. Примеры заместителя(ей) на алкилене, алкенилене или алкинилене включают метил, этил, галоген, гидрокси, алкилокси, галогеналкил, галогеналкилокси, амино, метиламино, карбамоил, фенил и т.п.
[0230]
Кольцо T1, предпочтительно, включает структуру, проиллюстрированную ниже.
[0231]
[Химическая формула 67]
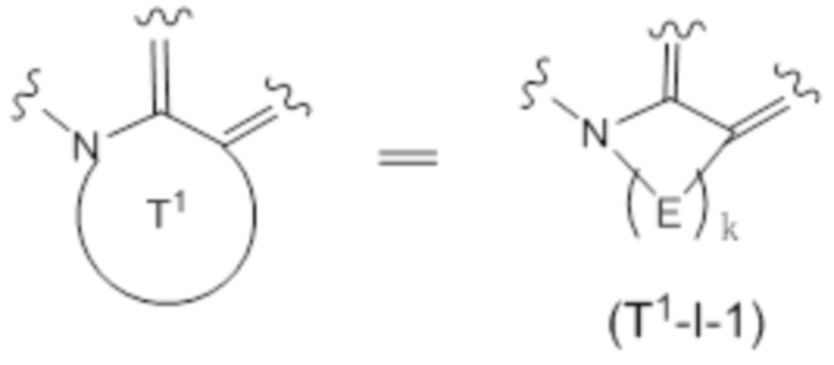
где каждое определение совпадает с определенным выше.
[0232]
Каждый E независимо представляет собой -NRa-, -O-, -S-, -SO2-, -SO- или -CRbRc-. Более предпочтительно, каждый E независимо представляет собой -NRa-, -O- или -CRbRc-.
[0233]
Ra представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1, -SORa2, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5, причем каждый Ra1, Ra2 и Ra3 независимо представляют собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил, каждый Ra4 и Ra5 независимо представляют собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил, Ra6 представляет собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил. Примеры заместителей Ra включают алкил, алкенил, алкинил, алкилокси, гидрокси, алкилоксиалкил, гидроксиалкил, галоген, галогеналкил, галогеналкилокси, амино, алкиламино, диалкиламино, аминоалкил, алкилоксиалкил, алкилсульфониламиноалкил, алкилкарбониламино, алкилкарбониламиноалкил, алкилоксиалкилоксикарбониламино, алкиламиноалкил, диалкиламиноалкил, аминоалкилокси, алкиламиноалкилокси, диалкиламиноалкилокси, диалкиламиноалкилоксиалкил, алкилкарбониламино, карбамоил, алкилкарбамоил, диалкилкарбамоил, бензил, галогенированный бензил, ароматический карбоциклил, который, необязательно, замещен галогеном, алкилом, алкилокси, циклоалкилом и/или галогеналкилом, неароматический карбоциклил, который, необязательно, замещен галогеном, алкилом, алкилокси, оксо и/или галогеналкилом, ароматический гетероциклил, который, необязательно, замещен галогеном, алкилом, алкенилом, гидроксиалкилом, алкилокси, циклоалкилом, неароматическим карбоциклилом, неароматическим гетероциклилом и/или галогеналкилом, неароматический гетероциклил, который, необязательно, замещен галогеном, алкилом, алкилокси, оксо и/или галогеналкилом, ароматический карбоциклилалкил, который, необязательно, замещен галогеном, алкилом и/или галогеналкилом, неароматический карбоцикл, который, необязательно, замещен галогеном, алкилом и/или галогеналкилом, ароматический гетероциклилалкил, который, необязательно, замещен галогеном, алкилом и/или галогеналкилом, неароматический гетероциклилалкил, который, необязательно, замещен галогеном, алкилом и/или галогеналкилом, неароматический гетероциклил, который, необязательно, замещен алкилгалогеном, неароматический карбоцикламино, неароматический гетероциклилалкил, который, необязательно, замещен оксо, галогеном и/или алкилом, триалкилсилил. Заместители могут присутствовать в количестве от одного до четырех. Если присутствует ряд заместителей, они могут быть одинаковыми или различными. Ra, предпочтительно, представляет собой алкил, замещенный водородом, C1-C6 алкилом, C1-C6 галогеналкилом, алкиламино или диалкиламино, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1 или -SO2Ra3. Каждый Ra1, Ra2 и Ra3 независимо представляют собой алкил, замещенный водородом, C1-C6 алкилом или алкиламино или диалкиламино. Предпочтительные варианты осуществления Ra4 и Ra5 каждый независимо представляют собой водород, гидрокси, C1-C6 алкил, замещенный или незамещенный ароматический карбоциклил (примеры заместителя(ей): галоген, алкил, алкилокси, галогеналкил, амино, моноалкиламино, диалкиламино и т.д.) или замещенный или незамещенный ароматический гетероциклил (примеры заместителя(ей): галоген, алкил, алкилокси, галогеналкил, амино, моноалкиламино, диалкиламино и т.д.). Предпочтительные варианты осуществления R6a представляют собой водород или C1-C6 алкил.
Другой вариант осуществления Ra включает замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил или замещенный или незамещенный неароматический гетероциклилалкил. Заместитель(и) "замещенного или незамещенного" включает(ют) галоген, гидрокси, карбокси, циано, уреидо, замещенную или незамещенную аминогруппу, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, замещенный или незамещенный карбамоил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный карбамоил, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический гетероциклилокси, замещенный или незамещенный неароматический гетероциклилокси и т.п.
Предпочтительно, он включает галоген, алкил, алкилокси, галогеналкил, гидроксиалкил, галогеналкилокси гидроксиалкилокси, аминоалкилокси, алкилсульфониламиноалкилокси, алкилоксиалкилокси, триалкилсилил алкилоксиалкилокси, диалкиламиноалкилокси, карбамоил, моноалкилкарбамоил, который, необязательно, замещен одной или несколькими группами, выбранными из группы заместителей A, алкилоксикарбониламино, который, необязательно, замещен одной или несколькими группами, выбранными из группы заместителей A, диалкилкарбамоил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, алкилсульфониламино, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, алкилкарбониламино, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, ароматический карбоциклилалкилокси, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический гетероциклилалкилокси, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, ароматический гетероциклилалкилокси, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, ароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, неароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, неароматический карбоциклилокси, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, ароматический карбоциклилокси, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, ароматический гетероциклилокси, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, неароматический карбоциклилокси, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, неароматический гетероциклилокси, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B и т.п. Если присутствует ряд заместителей, они могут быть одинаковыми или различными.
Группа заместителей A: галоген, амино, гидрокси, карбокси, оксо, моноалкиламино, диалкиламино, карбамоил, моноалкилкарбамоил, диалкилкарбамоил, алкилокси, галогеналкилокси, сульфамоил, моноалкилсульфамоил, диалкилсульфамоил, алкилоксиалкилокси, галогеналкилоксиалкилокси, алкилкарбонил, алкилсульфонил, алкилкарбониламино, алкилкарбонил(алкил)амино, алкилсульфониламино, алкилсульфонил(алкил)амино, триалкилсилил, алкил и/или галогеноароматический карбоциклил, неароматический карбоциклил, необязательно замещенный оксо, алкилом и/или галогеном, алкилом и/или галогеноароматическим гетероциклилом, неароматический гетероциклил, необязательно замещенный оксо, алкилом и/или галогеном, алкилом и/или галогеноароматическим карбоциклилокси, неароматический карбоциклилокси, необязательно замещенный оксо, алкилом и/или галогеном, алкилом и/или галогеноароматическим гетероциклилокси, неароматический гетероциклилокси, необязательно замещенный оксо, алкилом и/или галогеном.
Группа заместителей B: галоген, амино, гидрокси, карбокси, оксо, моноалкил амино, диалкил амино, карбамоил, моноалкилкарбамоил, диалкилкарбамоил, алкил, галогеналкил, алкилокси, галогеналкилокси, гидроксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, сульфамоил, моноалкилсульфамоил, диалкилсульфамоил, алкилоксиалкил, алкилоксиалкилокси, галогеналкилоксиалкил, галогеналкилоксиалкилокси, алкилкарбониламино, алкилкарбонил(алкил)амино, алкилсульфониламино, алкилсульфонил(алкил)амино, алкил и/или галогеноароматический карбоциклил, неароматический карбоциклил, необязательно замещенный оксо, алкилом и/или галогеном, алкилом и/или галогеноароматическим гетероциклилом, неароматический гетероциклил, необязательно замещенный оксо, алкилом и/или галогеном, алкилом и/или галогеноароматическим карбоциклилокси, неароматический карбоциклилокси, необязательно замещенный оксо, алкилом и/или галогеном, алкилом и/или галогеноароматическим гетероциклилокси, неароматический гетероциклилокси, необязательно замещенный оксо, алкилом и/или галогеном, алкилом и/или галогеноароматическим карбоциклилалкил, неароматический карбоциклилалкил, необязательно замещенный оксо, алкилом и/или галогеном, алкилом и/или галогеноароматическим гетероциклилалкилом, неароматический гетероциклилалкил, необязательно замещенный оксо, алкилом и/или галогеном, алкилом и/или галогеноароматическим карбоциклилалкилокси, неароматический карбоциклилалкилокси, необязательно замещенный оксо, алкилом и/или галогеном, алкилом и/или галогеноароматическим гетероциклилалкилокси, неароматический гетероциклилалкилокси, необязательно замещенный оксо, алкилом и/или галогеном.
[0234]
Каждый Rb независимо представляет собой водород, галоген или замещенный или незамещенный алкил, предпочтительно водород, галоген или алкил. Примеры заместителя(ей) включают галоген, гидрокси, алкилокси, галогеналкил, галогеналкилокси, амино, алкиламино, карбамоил, алкилкарбамоил, фенил, галогенированный фенил, ароматический карбоциклил (например: 6 или 10-членное кольцо), неароматический карбоциклил (например: 5-7-членное кольцо), ароматический гетероциклил (например: 5 или 6-членное кольцо), неароматический гетероциклил (например: 5-7-членное кольцо).
[0235]
Каждый Rc независимо представляет собой водород, галоген или замещенный или незамещенный алкил, предпочтительно водород, галоген или алкил. Примерами заместителя(ей) "замещенного или незамещенного" являются галоген, гидрокси, алкилокси, галогеналкил, галогеналкилокси, амино, алкиламино, карбамоил, алкилкарбамоил, фенил, галогенированный фенил, ароматический карбоциклил (например: 6 или 10-членное кольцо), неароматический карбоциклил (например: 5-7-членное кольцо), ароматический гетероциклил (например: 5-6-членное кольцо), неароматический гетероциклил (например: 5-7-членное кольцо) и т.п.
[0236]
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связывающим атомом углерода с образованием карбонила, замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла;
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием моноциклического замещенного или незамещенного неароматического карбоцикла или моноциклического замещенного или незамещенного неароматического гетероцикла;
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с каждым связанным атомом кольца с образованием моноциклического замещенного или незамещенного ароматического гетероцикла или моноциклического замещенного или незамещенного неароматического гетероцикла;
два Rb на двух атомах углерода, которые не являются соседними друг для друга, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении;
Ra и Rb на атоме азота и атоме углерода, которые не являются соседними, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи;
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи.
[0237]
Rb и/или Rc на соседних атомах углерода в кольце T1 могут быть соединены вместе с соседними атомами углерода с образованием замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла, предпочтительно замещенного или незамещенного 5 или 6-членного неароматического гетероцикла. Примеры заместителя(ей) включают галоген, алкил, гидрокси, алкилокси, галогеналкил, галогеналкилокси и т.п.
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с соседними атомом азота и атомом углерода с образованием замещенного или незамещенного ароматического гетероцикла или замещенного или незамещенного неароматического гетероцикла, предпочтительно замещенного или незамещенного 5 или 6-членного ароматического гетероцикла или замещенного или незамещенного 5 или 6-членного неароматического гетероцикла. Примеры заместителя(ей) включают галоген, алкил, алкилокси, галогеналкил, галогеналкилокси и т.п.
[0238]
k представляет собой целое число от 2 до 7, предпочтительно целое число от 3 до 5.
[0239]
Более предпочтительно, кольцо T1 включает структуру, иллюстрируемую следующей формулой:
[Химическая формула 68]
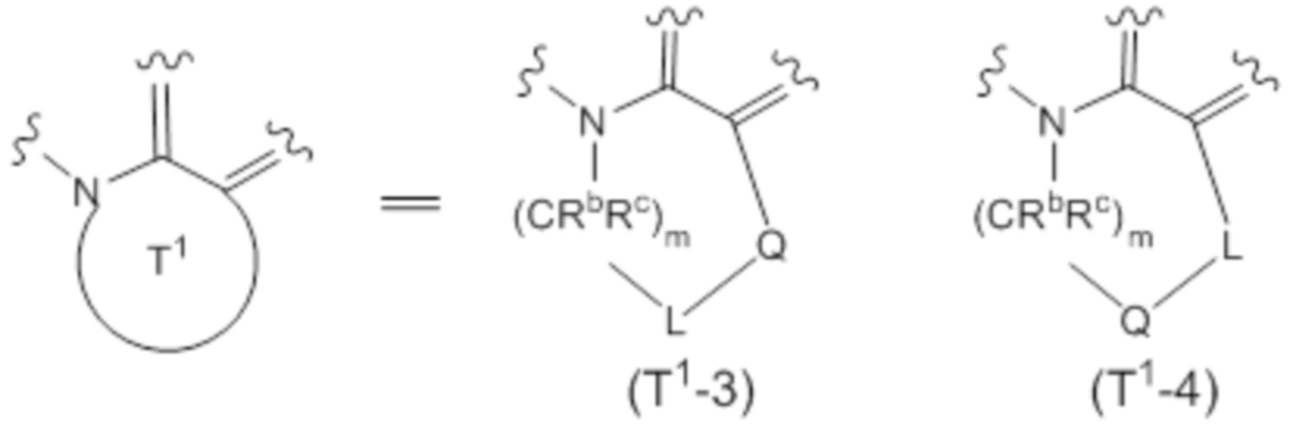
где каждое определение совпадает с определенным выше.
[0240]
L представляет собой -SO2-, -SO- или -CRbRc-, предпочтительно -SO2- или -CRbRc.
[0241]
Q представляет собой -NRa-, -O-, -S- или -CRbRc-, предпочтительно -NRa-, -O- или -CRbRc-.
[0242]
m представляет собой целое число от 0 до 5, предпочтительно целое число от 1 до 3.
[0243]
Более предпочтительно, кольцо T1 включает структуру, иллюстрируемую следующей формулой:
[Химическая формула 69]

где каждое определение совпадает с определенным выше.
[0244]
Предпочтительные варианты осуществления соединений настоящего изобретения показаны ниже. Примерами соединений, показанных в следующих вариантах осуществления, могут служить все комбинации этих иллюстративных вариантов осуществления.
(Варианты осуществления 1)
Формула (I) представляет собой следующую формулу (I'):
[Химическая формула 70]

в которой A3 представляет собой CR3A или N;
R3A представляет собой водород или галоген;
R2 представляет собой алкилокси;
n представляет собой 1;
R4 представляет собой водород;
R1 представляет собой галоген или алкил;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил; и
кольцо T1 представляет собой замещенный или незамещенный 5-12-членный азотсодержащий неароматический гетероциклил, содержащий два атома N, два атома N и один атом S или один атом N и один атом O.
[0245]
(Вариант осуществления 2)
Формула (I) представляет собой следующую формулу (I'-AA):
[Химическая формула 71]

в которой A3 представляет собой CR3A или N;
R3A представляет собой водород или галоген; R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
Q представляет собой -NRa-, -O- или -CRbRc-;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1, -COORa1, -SORa2, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5;
каждый Ra1, Ra2 и Ra3 независимо представляют собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Ra4 и Ra5 независимо представляют собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
Ra6 представляет собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил; и
каждый Rb независимо представляет собой водород, галоген, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоцикл;
каждый Rc независимо представляет собой водород, галоген, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоцикл;
Rb и Rc на одном атоме углерода могут быть соединены вместе со связанным атомом углерода с образованием карбонила, замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла;
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием моноциклического замещенного или незамещенного неароматического карбоцикла или моноциклического замещенного или незамещенного неароматического гетероцикла;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи;
Ra и Rb на соседних атоме азота и атоме углерода могут быть соединены вместе с каждым связывающим атомом кольца с образованием моноциклического замещенного или незамещенного ароматического гетероцикла или моноциклического замещенного или незамещенного неароматического гетероцикла;
Ra и Rb на соседних атоме азота и атоме углерода могут быть соединены вместе с образованием связи;
два Rb на атомах углерода, которые не совпадают и не являются соседними, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении;
Ra на атоме азота и Rb на атоме углерода, который не является соседним для данного атома азота, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи; и/или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи.
[0246]
(Вариант осуществления 3)
Формула (I) представляет собой следующую формулу (I'-1A):
[Химическая формула 72]

в которой A3 представляет собой CR3A или N;
R3A представляет собой водород или галоген; R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1, -COORa1, -SORa2, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5;
каждый Ra1, Ra2 и Ra3 независимо представляют собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Ra4 и Ra5 независимо представляют собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
Ra6 представляет собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Rb независимо представляет собой водород, галоген, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоцикл;
каждый Rc независимо представляет собой водород, галоген, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоцикл; и/или
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связывающим атомом углерода с образованием карбонила, замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла;
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связывающим атомом углерода с образованием моноциклического замещенного или незамещенного неароматического карбоцикла или моноциклического замещенного или незамещенного неароматического гетероцикла;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи;
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с каждым связанным атомом кольца с образованием моноциклического замещенного или незамещенного ароматического гетероцикла или моноциклического замещенного или незамещенного неароматического гетероцикла; или
Ra на атоме азота и Rb на атоме углерода могут быть соединены вместе с образованием связи;
два Rb на двух атомах углерода, которые не являются соседними друг для друга, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении;
Ra на атоме азота и Rb на атоме углерода, который не является соседним для атома азота, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи; и/или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи.
[0247]
(Вариант осуществления 4)
Формула (I) представляет собой следующую формулу (I-1-1A):
[Химическая формула 73]

в которой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1, -COORa1, -SORa2, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5;
каждый Ra1, Ra2 и Ra3 независимо представляют собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилокси, замещенную или незамещенную аминогруппу, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
каждый Ra4 и Ra5 независимо представляют собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил;
Ra6 представляет собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический гетероциклил или замещенный или незамещенный неароматический гетероциклил; и
каждый Rb независимо представляет собой водород, галоген, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоцикл;
каждый Rc независимо представляет собой водород, галоген, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоцикл; и/или
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связанным атомом углерода с образованием карбонила, замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи;
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием моноциклического замещенного или незамещенного неароматического карбоцикла или моноциклического замещенного или незамещенного неароматического гетероцикла;
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи;
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с каждым связанным атомом кольца с образованием моноциклического замещенного или незамещенного ароматического гетероцикла или моноциклического замещенного или незамещенного неароматического гетероцикла;
два Rb на двух атомах углерода, которые не являются соседними, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении;
Ra на атоме азота и Rb на атоме углерода, который не является соседним для атома азота, могут быть соединены вместе с образованием замещенного или незамещенного алкилена, замещенного или незамещенного алкилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении, замещенного или незамещенного алкенилена или замещенного или незамещенного алкенилена, содержащего одну или несколько групп, выбранных из -O-, -NRa-, -S-, -CO-, -SO- и -SO2-, в произвольном положении;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи; и/или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи.
[0248]
(Вариант осуществления 5)
Формула (I) представляет собой следующую формулу (I-1-1A):
[Химическая формула 74]

в которой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический карбоциклилалкил, замещенный или незамещенный неароматический карбоциклилалкил, замещенный или незамещенный ароматический гетероциклилалкил, замещенный или незамещенный неароматический гетероциклилалкил, -CORa1, -COORa1, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5;
каждый Ra1, Ra2 и Ra3 независимо представляют собой замещенный или незамещенный алкил, замещенный или незамещенный неароматический карбоциклил или замещенный или незамещенный ароматический гетероциклил;
каждый Ra4 и Ra5 независимо представляют собой водород, замещенный или незамещенный алкил, замещенный или незамещенный неароматический карбоциклил или замещенный или незамещенный ароматический гетероциклил;
Ra6 представляет собой водород; и
каждый Rb независимо представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоцикл;
каждый Rc независимо представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный ароматический карбоцикл; и/или
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связанным атомом углерода с образованием карбонила, замещенного или незамещенного неароматического карбоцикла или замещенного или незамещенного неароматического гетероцикла;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи;
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием моноциклического замещенного или незамещенного неароматического гетероцикла;
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи; и/или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с каждым связанным атомом кольца с образованием моноциклического замещенного или незамещенного ароматического гетероцикла или моноциклического замещенного или незамещенного неароматического гетероцикла.
[0249]
(Вариант осуществления 6)
Формула (I) представляет собой следующую формулу (I-1-1A):
[Химическая формула 75]

в которой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, алкенил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, неароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, ароматический карбоциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, ароматический гетероциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический гетероциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, -CORa1, -COORa1, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5;
каждый Ra1, Ra2 и Ra3 независимо представляют собой алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, или ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
каждый Ra4 и Ra5 независимо представляют собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, или ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
Ra6 представляет собой водород; и
каждый Rb независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, или ароматический карбоцикл, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
каждый Rc независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, или ароматический карбоцикл, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B; и/или
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связанным атомом углерода с образованием карбонила, неароматического карбоцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B, или неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием;
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием моноциклического неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B;
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи; и/или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с каждым связанным атомом кольца с образованием моноциклического ароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B, или моноциклического неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B.
[0250]
(Вариант осуществления 7)
Формула (I) представляет собой следующую формулу:
[Химическая формула 76]

в которой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный галогеном, алкилом и/или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, алкенил необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, неароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, ароматический карбоциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, ароматический гетероциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический гетероциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, -CORa1, -COORa1, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5;
каждый Ra1, Ra2 и Ra3 независимо представляют собой алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, или ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
каждый Ra4 и Ra5 независимо представляют собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, или ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
Ra6 представляет собой водород; и
каждый Rb независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, или ароматический карбоцикл, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
каждый Rc независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, или ароматический карбоцикл, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B; и/или
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связанным атомом углерода с образованием карбонила, неароматического карбоцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B, или неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B;
два Rb на соседних атомах углерода могут быть соединены вместе с образованием связи;
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием моноциклического неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B;
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с образованием связи; и/или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе со связанными атомами кольца с образованием моноциклического ароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B, или моноциклического неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B.
[0251]
(Вариант осуществления 8)
Формула (I) представляет собой следующую формулу:
[Химическая формула 77]

в котрой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, неароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, ароматический карбоциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, ароматический гетероциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический гетероциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, -COORa1, -COORa1, -SO2Ra3, -CONRa4Ra5, -CSNRa4Ra5, -COCONRa4Ra5 или -C(NRa6)NRa4Ra5;
каждый Ra1, Ra2 и Ra3 независимо представляют собой алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, или ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
каждый Ra4 и Ra5 независимо представляют собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, или ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
Ra6 представляет собой водород; и
каждый Rb независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, или ароматический карбоцикл, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
каждый Rc независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, или ароматический карбоцикл, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B; и/или
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связанным атомом углерода с образованием карбонила, неароматического карбоцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B, или неароматического гетероцикла, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием моноциклического неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B; и/или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с каждым связанным атомом кольца с образованием моноциклического ароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B, или моноциклического неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B.
[0252]
(Вариант осуществления 9)
Формула (I) представляет собой следующую формулу:
[Химическая формула 78]
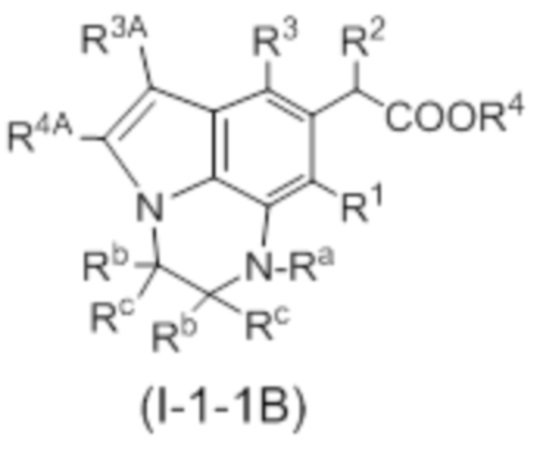
в которой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, -CORa1, -SO2Ra3 или -CONRa4Ra5;
каждый Ra1 и Ra3 независимо представляют собой алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, или ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
каждый Ra4 и Ra5 независимо представляют собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, или ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
каждый Rb независимо представляет собой водород или алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A; и
каждый Rc независимо представляет собой водород или алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A.
[0253]
(Вариант осуществления 10)
Формула (I) представляет собой следующую формулу:
[Химическая формула 79]

в которой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, неароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, неароматический карбоциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, или неароматический гетероциклилалкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A;
каждый Rb независимо представляет собой водород или алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A; и
каждый Rc независимо представляет собой водород или алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A.
[0254]
(Вариант осуществления 11)
Формула (I) представляет собой следующую формулу:
[Химическая формула 80]

в которой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
Rb и Rc на одном и том же атоме углерода могут быть соединены вместе со связанным атомом углерода с образованием карбонила, неароматического карбоцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B, или неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B;
два Rb на соседних атомах углерода могут быть соединены вместе с каждым связанным атомом углерода с образованием моноциклического неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B; или
Ra на атоме азота и Rb на атоме углерода, который является соседним для данного атома азота, могут быть соединены вместе с каждым связанным атомом кольца с образованием моноциклического ароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B, или моноциклического неароматического гетероцикла, необязательно замещенного одной или несколькими группами, выбранными из группы заместителей B; и другие Ra, Rb и Rc совпадают с определенными в приведенном выше варианте осуществления 8.
[0255]
(Вариант осуществления 12)
Формула (I) представляет собой следующую формулу:
[Химическая формула 81]

в которой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, галоген необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой водород, алкил, галогеналкил, аминоалкил, алкиламино алкил, диалкиламино алкил, алкилоксиалкил, алкилсульфонил или галогеналкилсульфонил;
каждый Rb независимо представляет собой водород, алкил, галогеналкил или алкилоксиалкил; и
каждый Rc независимо представляет собой водород, алкил, галогеналкил или алкилоксиалкил.
[0256]
(Вариант осуществления 13)
Формула (I) представляет собой следующую формулу:
[Химическая формула 82]

в которой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей E, или неароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей E; причем группа заместителей E представляет собой алкил, галоген, алкилокси, диалкиламиноалкилокси, алкиламиноалкилокси, аминоалкилокси, неароматический гетероциклилалкилокси, неароматический гетероциклилокси, необязательно замещенный алкилом и/или оксо, неароматический гетероциклил, необязательно замещенный алкилом и/или оксо, диалкиламиноалкил, алкиламиноалкил, аминоалкил, неароматический гетероциклилалкил и ароматический гетероциклил, необязательно замещенный алкилом;
каждый Rb независимо представляет собой водород, алкил, галогеналкил или алкилоксиалкил; и
каждый Rc независимо представляет собой водород, алкил, галогеналкил или алкилоксиалкил.
[0257]
(Вариант осуществления 14)
Формула (I) представляет собой следующую формулу:
[Химическая формула 83]

в которой R1 представляет собой алкил или галоген;
R2 представляет собой алкилокси;
R3 представляет собой ароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, неароматический карбоциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, ароматический гетероциклил, необязательно замещенный галогеном, алкилом и/или алкилокси, или неароматический гетероциклил;
R4 представляет собой водород;
R3A представляет собой водород или галоген;
R4A представляет собой алкил, необязательно замещенный циано, галогеном, гидрокси или алкилокси, галоген, алкинил или неароматический карбоциклил;
L представляет собой -SO2- или -CRbRc-;
m представляет собой 1 или 2;
каждый Ra независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, -CORa1, -SO2Ra3 или -CONRa4Ra5;
каждый Ra1 и Ra3 независимо представляют собой алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, или ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
каждый Ra4 и Ra5 независимо представляют собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, неароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B, или ароматический гетероциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B;
каждый Rb независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, или ароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B; и
каждый Rc независимо представляет собой водород, алкил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей A, или ароматический карбоциклил, необязательно замещенный одной или несколькими группами, выбранными из группы заместителей B.
[0258]
Соединение настоящего изобретения обладает сильной активностью ингибирования репликации ВИЧ. Кроме того, оно отлично подходит для различных полезных применений в фармакокинетике и/или безопасности и т.п. в качестве фармацевтического средства. Эти профили значительно улучшает разработка, например, типа или положения гетероатомов на кольце или типа или положения заместителей на кольце.
[0259]
Соединение настоящего изобретения включает все возможные изомеры, предпочтительно стереоизомеры (например кето-енольные изомеры, имин-енаминные изомеры, диастереоизомеры, атропизомеры, оптические изомеры, ротамеры и т.д.), рацематы или их смеси. Хотя эти изомеры часто легко разделяются оптическим разделением, кристаллизацией, хроматографическим разделением и т.п., они могут быть изображены одной и той же плоской структурной формулой. Кроме того, когда эти изомеры могут быть разделены хроматографическим разделением, они различаются по времени пика (RT).
[0260]
Один или несколько атомов водорода, атомов углерода и/или других атомов в соединениях, представленных формулой (I), формулой (I-1), формулой (I-2), формулой (I-1-1) и формулой (I-2-1), могут быть замещены изотопом водорода, углерода и/или другого атома. Примеры изотопов включают водород, углерод, азот, кислород, фосфор, серу, фтор, йод и хлор, такие как 2H, 3H, 11C, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F, 123I и 36Cl. Соединение, представленное формулой (I), также включает соединения, замещенные изотопом. Соединение, замещенное изотопом, также полезно в качестве фармацевтического средства и включает все радиоактивно меченные материалы соединений, представленных формулой (I), формулой (I-1), формулой (I-2), формулой (I-1-1) и формулой (I-2-1). Кроме того, "способ радиоактивного мечения" для получения "радиоактивно меченного материала" также включен в настоящее изобретение, и он полезен в качестве исследовательского и/или диагностического инструмента в фармакокинетических исследованиях метаболизма и анализах связывания.
[0261]
Радиоактивно меченный материал соединения, представленного формулой (I), может быть получен с помощью способа, хорошо известного в данной области техники. Например, меченное тритием соединение, представленное формулой (I) может быть получено, например, путем введения трития в конкретное соединение, представленное формулой (I), с помощью каталитического дегалогенирования с использованием трития. Этот способ включает в себя реакцию предшественника, в котором соединение, представленное формулой (I), подходящим образом замещено галогеном, с газом трития в присутствии подходящего катализатора, например Pd/C, в присутствии или в отсутствие основания. В качестве подходящего способа получения другого меченного тритием соединения можно привести документ Isotopes in the Physical and Biomedical Sciences, Vol. 1, Labeled Compounds (Part A), Chapter 6 (1987). 14C-меченное соединение может быть получено с использованием исходного материала, содержащего углерод 14C.
[0262]
Примеры фармацевтически приемлемой соли соединения, представленного формулой (I), включают соли соединения, представленного формулой (I), с щелочным металлом (например, литием, натрием, калием и т.д.), щелочноземельным металлом (например, кальцием, барием и т.д.), магнием, переходным металлом (например, цинком, железом и т.д.), аммиаком, органическим основанием (например, триметиламином, триэтиламином, дициклогексиламином, этаноламином, диэтаноламином, триэтаноламином, меглумином, диэтаноламином, этилендиамином, пиридином, пиколином, хинолоном и т.д.) и аминокислотой, или соли с неорганической кислотой (например, соляной кислотой, серной кислотой, азотной кислотой, угольной кислотой, бромистоводородной кислотой, фосфорной кислотой, йодистоводородной кислотой и т.д.) и органической кислотой (например, муравьиной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой, лимонной кислотой, молочной кислотой, винной кислотой, щавелевой кислотой, малеиновой кислотой, фумаровой кислотой, миндальной кислотой, глутаровой кислотой, яблочной кислотой, бензойной кислотой, фталевой кислотой, аскорбиновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, метансульфоновой кислотой, этансульфоновой кислотой и т.д.). Примеры включают, в частности, соли с соляной кислотой, серной кислотой, фосфорной кислотой, винной кислотой или метансульфоновой кислотой и т.п. Эти соли могут быть образованы с помощью обычно применяемого способа.
[0263]
Соединение настоящего изобретения или его фармацевтически приемлемая соль могут образовывать сольват (например, гидрат и т.д.) и/или кристаллический полиморф, и настоящее изобретение также включает такое множество сольватов и кристаллических полиморфов. "Сольват" может координироваться с молекулами растворителя (например, молекулами воды и т.д.) с любым числом.
[0264]
Соединение настоящего изобретения может быть получено, например, в соответствии с общим способом синтеза, описанным ниже. Кроме того, для проведения обычных экспериментов по органической химии могут быть проведены экстракция, очистка и т.п.
Синтез соединения настоящего изобретения может быть осуществлен в соответствии со способом, известным в данной области техники. Настоящее изобретение предлагает также промежуточные продукты и конечные соединения в следующих общих способах синтеза. Типы заместителя(ей) в каждом соединении и предпочтительные варианты осуществления соответствуют описанным выше.
[0265]
(Общий способ синтеза)
Соединение, представленное формулой (I), формулой (I-1), формулой (I-2), формулой (I-1-1) и формулой (I-2-1), может быть синтезировано путем соответствующего сочетания известных специалисту в данной области техники реакций с использованием широко известного соединения или коммерчески доступных реагентов. Предпочтительно, реакция образования конденсированного кольца, реакция образования боковых цепей, реакция восстановления, реакция окисления, реакция гидролиза, реакция Фриделя-Крафтса, реакция сочетания, защитная реакция, реакция снятия защиты и т.п. могут быть соответствующим образом подготовлены с использованием производных бензола или производных пиридина, содержащих уходящую группу(ы), такую как галоген и т.д., нитрогруппа(ы), (замещенная) аминогруппа(ы), (защищенная) аминогруппа(ы), алкильная группа(ы), (защищенная) гидроксигруппа(ы), сложноэфирная группа(ы) и т.п., в качестве исходных материалов. Кроме того, каждый заместитель (R3,-C(R2)n-COOR4, R1) на 6-членном материнском скелете может присутствовать в соединениях исходного материала или может быть введен после образования кольца T1.
В качестве реакционных растворителей можно соответствующим образом использовать, например, DMF, THF, диоксан, DME, тетрагидрофуран, ацетон, ацетонитрил, спирт (например: метанол, этанол), этилацетат, DMSO, дихлорметан, дихлорэтан, толуол, хлороформ, бензол, толуол, ксилол, воду или смешанный раствор, составленный из этих растворителей. В качестве оснований можно соответствующим образом использовать, например, пиридин, лутидин, триэтиламин, карбонат калия, карбонат натрия, карбонат цезия, гидрид натрия, N,N-диизопропилэтиламин и т.п.
[0266]
[1] Реакция, образующая кольцо T1
Кольцо T1, предпочтительно, формируют после синтеза соответствующих бициклических производных бензола. В одном варианте осуществления, когда кольцо T1 представляет собой T1-1, соединение (I) или соединение (I-X), включая их промежуточные продукты, могут быть синтезированы посредством следующих этапов. Реакция, например, может быть осуществлена в соответствии со способом, описанным в WO2004/094430.
[0267]
[Химическая формула 84]
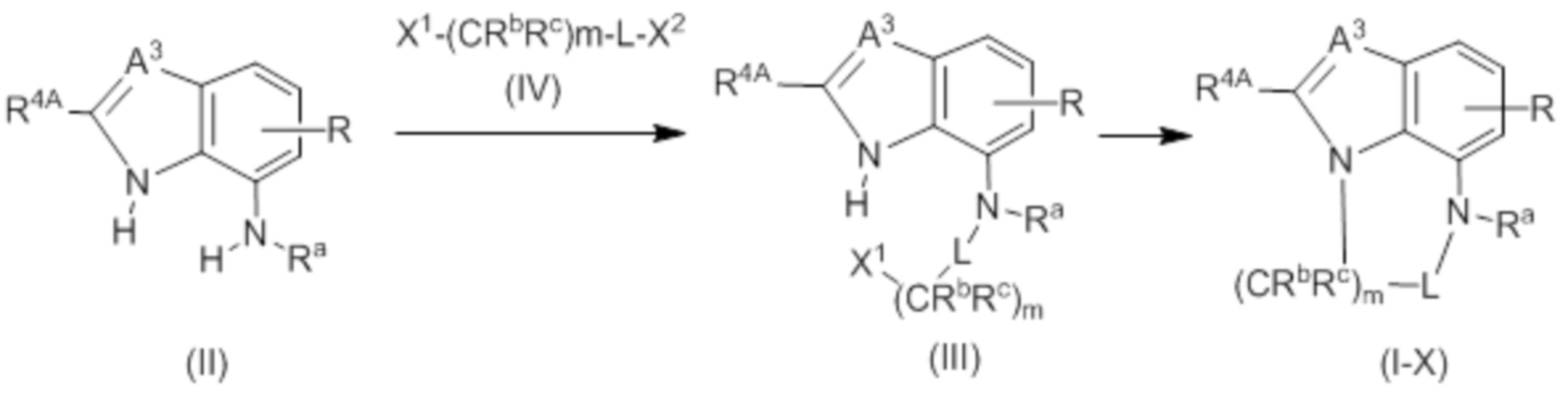
[0268]
где A3 представляет собой CR3A или N; R обозначает от одной до трех групп, выбранных из группы, состоящей из R3, -C(R2)nCOOR4, R1, и их комбинацию и заместитель, который может быть введен в эти заместители в соединении (I); X1 представляет собой уходящую группу (например: атом галогена) или альдегидную группу, или X1 соединен вместе с соседним (CRbRc) с образованием олефина или ацетилена; X2 представляет собой уходящую группу (например: атом галогена); другие символы совпадают с определенными выше.
[0269]
Когда соединение (I-X) представляет собой соединение (I), соединение (I-X) представлено следующей формулой.
[0270]
[Химическая формула 85]

[0271]
Вышеуказанные реакции подробно описаны ниже.
(1) В случае, когда L представляет собой C=O или SO2,
(Этап 1)
Соединение (III) может быть получено посредством реакции соединения (II) с соединением (IV) в присутствии оснований (например: пиридина) и подходящего реагента(ов) (например: DMAP), если необходимо, в растворителе (например: дихлорметане) при подходящей температуре (например: 0-100°C, предпочтительно при комнатной температуре) в течение подходящего промежутка времени (например: от нескольких минут до нескольких десятков часов).
(Этап 2)
Соединение (I-X) может быть получено посредством реакции соединения (III) в присутствии депротонирующих средств (например: гидрида натрия) в растворителе (например: DMF) при подходящей температуре (например: 0-150°C, предпочтительно приблизительно 100°C), когда A5 представляет собой N.
Соединение (I-X) может быть получено посредством проведения внутримолекулярной реакции Фриделя-Крафтса с использованием, например, соединения (III), в котором X1-(CRbRc)- представляет собой Cl-C(O)-, в присутствии кислоты Льюиса (например: хлорида алюминия, тетраизопропоксида титана(IV)), когда A5 представляет собой C.
[0272]
(2) В случае, когда L представляет собой -(CRbRc)-:
(2-1) когда A5 представляет собой N, соединение (II) подвергают реакции в присутствии оснований (например: карбоната цезия) в растворителе (например: DMF) при подходящей температуре (например: 0-100°C, предпочтительно при комнатной температуре) на этапе 1. На этапе 2 соединение (I-X) может быть получено посредством реакции соединения (III) в присутствии депротонирующих реагентов (например: гидрида натрия), если необходимо, при подходящей температуре (например: от комнатной температуры до 100°C).
(2-2) Когда A5 представляет собой C, соединение (I-X) может быть получено посредством реакции соединения (II), в котором, предпочтительно, Ra представляет собой -CORa1, -SORa2 или -SO2Ra3, в присутствии оснований (например: карбоната цезия) в растворителе (например: DMF, ацетонитриле) при подходящей температуре (например: 0-100°C, предпочтительно при комнатной температуре) на этапе 1. На этапе 2, например, соединение (I-X) может быть получено посредством проведения внутримолекулярной реакции Фриделя-Крафтса с использованием соединения (III), в котором X1-(CRbRc)- представляет собой Cl-C(O)-, и кислоты Льюиса (например: хлорида алюминия, хлорида титана(IV)).
[0273]
[2] Синтез соединения (I-1)
[0274]
[Химическая формула 86]

где X каждый независимо представляет собой уходящую группу, такую как галоген; другие символы совпадают с определенными выше.
[0275]
(Этап 1)
Соединение a3 получают посредством реакции соединения a1 и соединения a2 в соответствии с синтезом индола по Фишеру.
(Этап 2)
Соединение a4 получают посредством восстановления соединения a3.
Восстановление, предпочтительно, проводят с помощью нагревания с обратным холодильником порошка железа и хлорида аммония или хлорида олова(II) в этаноле.
(Этап 3)
Соединение a5 получают, подвергая соединение a4 реакции образования кольца T1, описанной выше [1].
(Этап 4)
Соединение a6 получают посредством реакции соединения a5, например, с реагентом бора (R3-бороновой кислотой) в присутствии реагента-переходного металла, лигандов (например: Pd2(dba)3/RuPhos) и оснований (например: карбоната натрия) в растворителе (например: смеси диоксана и воды) при подходящей температуре (например: температуре рефлюкса).
(Этап 5)
Соединение a7 получают посредством реакции соединения a6, например, с NBS в растворителе (например: DMF, дихлорметане), предпочтительно при температуре от комнатной до охлаждения льдом.
(Этап 6)
Соединение a9 получают посредством реакции соединения a7 и соединения a8 в соответствии с реакцией сочетания с силиловым енольным эфиром, содержащим метильную группу (Journal of the American Chemical Society, 2004, 126, 5182-5191).
(Этап 7)
Соединение (I-A-1) получают посредством реакции соединения a9 в присутствии оснований (например: гидроксида натрия) в растворителе (например: THF, смеси метанола и воды) при подходящей температуре (например: приблизительно 50°C). Соединение (I-1) также может быть превращено во множество эквивалентов карбоновых кислот или производных карбоновых кислот с помощью способов, известных специалисту в данной области техники.
[0276]
[2-1] Альтернативный способ синтеза соединения типа (I-1)
(Синтез соединения (I-1'))
[0277]
[Химическая формула 87]
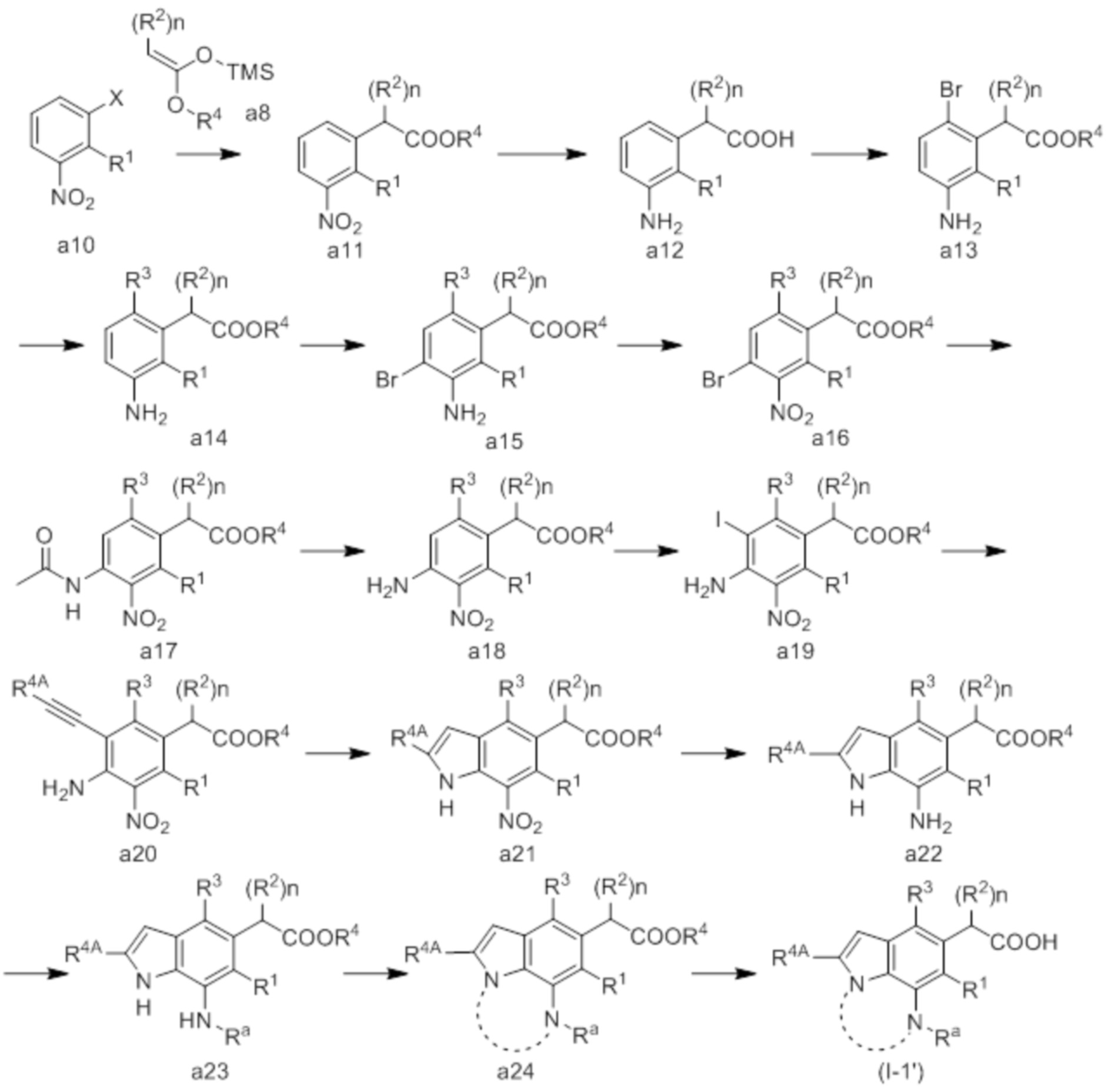
где дугообразная прерывистая линия обозначает образование кольца, кольцо представляет собой замещенный или незамещенный неароматический гетероцикл, другие символы совпадают с определенными выше.
[0278]
(Этап 1)
Соединение a11 может быть получено посредством реакции соединения a10 в DMF, DMA, THF, диоксане и т.п. или их смеси с фосфином, таким как три-т-бутилфосфин, трициклогексилфосфин, трифенилфосфин и т.п., катализатором, таким как дибензилиденацетонпалладий, ацетат палладия, дихлорбистрифенилфосфинпалладий и т.п., фторидом цинка и силиловым енольным эфиром a8 при 50°C-150°C, предпочтительно при 70°C-130°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов.
(Этап 2)
Соединение a12 может быть получено посредством реакции соединения a11 в растворителе, таком как уксусная кислота, соляная кислота, серная кислота или их смесь, с восстановителем, таким как цинк, железо, хлорид олова и т.п., при -20°C-80°C, предпочтительно при 0°C-60°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов. Или соединение a12 может быть получено посредством реакции соединения a11 в растворителе, таком как метанол, этилацетат, уксусная кислота и т.п. или их смесь, в присутствии катализатора, такого как Pd/C, Pd(OH)2, Ni Ренея и т.п., в атмосфере водорода при -30°C-80°C, предпочтительно 0°C-50°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов.
(Этап 3)
Соединение a13 может быть получено посредством реакции соединения a12 в растворителе, таком как дихлорметан, хлороформ, дихлорэтан и т.п. или их смесь, с бромирующим реагентом, таким как бром или NBS, при -50°C-50°C, предпочтительно -30°C-30°C, в течение 0,1-4 часов, предпочтительно 0,5-1 часа.
(Этап 4)
Соединение a14 может быть получено посредством реакции сочетания соединения a13 и R3-L. Примерами данной реакции являются кросс-сочетание Судзуки, кросс-сочетание Ульмана, кросс-сочетание Негиши, сочетание Стилла и т.п.
Соединение a14 может быть получено посредством реакции соединения a13 с замещенной бороновой кислотой, замещенным боратом, замещенным алкилом олова, замещенным галогенированным цинком, который доступен коммерчески или синтезирован с помощью известных способов, в присутствии палладиевого катализатора, такого как Pd(PPh3)4, Pd(OAc)2, Pd(PPh3)2Cl2, Pd(dppf)2Cl2 и т.п., и оснований, таких как карбонат калия, карбонат натрия, фосфонат калия и т.п., в растворителе, таком как диоксан, DMF, DME, THF, вода и т.п. или их смесь, при добавлении CuI, CsF и т.п., если необходимо, в атмосфере азота при 0°C-150°C, предпочтительно 60°C-120°C, в течение 0,5-24 часов, предпочтительно 1-12 часов.
(Этап 5)
Соединение a15 может быть получено аналогично этапу 3.
[0279]
(Этап 6)
Соединение a16 может быть получено посредством реакции соединения a15 в растворителе, таком как дихлорметан, хлороформ, дихлорэтан и т.п. или их смесь, с окислителем, таким как mCPBA, перуксусная кислота, при 0°C-120°C, предпочтительно 30°C-90°C, в течение 0,1-10 часов, предпочтительно 0,5-4 часов.
(Этап 7)
Соединение a17 может быть получено посредством реакции соединения a16 в растворителе, таком как толуол, DMF, DMA, THF, диоксан и т.п. или их смесь, в присутствии фосфина, такого как BINAP, ксантфос и т.п., катализатора, такого как дибензилиденацетонпалладий, ацетат палладия и т.п., основания, такого как карбонат цезия, карбонат калия и т.п., и ацетамида при 50°C-150°C, предпочтительно 70°C-130°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов.
(Этап 8)
Соединение a18 может быть получено посредством реакции соединения a17 в растворителе, таком как метанол, этанол и т.п. или их смесь, в присутствии основания, такого как карбонат цезия, карбонат калия и т.п., при 50°C-150°C, предпочтительно 70°C-130°C, в течение 0,1-10 часов, предпочтительно 0,5-4 часов.
(Этап 9)
Соединение a19 может быть получено посредством реакции соединения a18 с йодирующим реагентом, таким как йод и нитрат серебра или NIS, в растворителе, таком как метанол, этанол и т.п. или их смесь, при -50°C-50°C, предпочтительно -30°C-30°C, в течение 0,1-4 часов, предпочтительно 0,5-1 часа.
(Этап 10)
Соединение a20 может быть получено посредством реакции соединения a19 в растворителе, таком как DMF, DMA, THF, диоксан и т.п. или их смесь, с основанием, таким как Et3N, DIPEA и т.п., замещенным алкином, который доступен коммерчески или синтезирован с помощью известного способа, и катализатором, таким как PdCl2(PPh3)4, Pd(PPh3)4, PdCl2(dppf) и т.п., при 50°C-150°C, предпочтительно 70°C-130°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов.
[0280]
(Этап 11)
Соединение a21 может быть получено посредством реакции соединения a20 в растворителе, таком как DMF, THF и т.п. или их смесь, с основанием, таким как т-BuOK, карбонат калия и т.п., при -20°C-80°C, предпочтительно 0°C-60°C, в течение 0,1-4 часов, предпочтительно 0,5-1 часа.
(Этап 12)
Соединение a22 может быть получено аналогично этапу 2.
(Этап 13)
Соединение a23 может быть получено посредством реакции соединения a22 в растворителе, таком как дихлорметан, DMF, DMA и т.п. или их смесь, с основанием, таким как карбонат цезия, пиридин, Et3N и т.п., алкилирующим реагентом, который доступен коммерчески или синтезирован с помощью известного способа, таким как метилйодид, MsCl, AcCl, MeNCO и т.п., сульфонилирующим реагентом, хлорангидридом, изоцианатом при -50°C-50°C, предпочтительно -30°C-30°C, в течение 0,1-4 часов, предпочтительно 0,5-1 часа.
(Этап 14)
Соединение a24 может быть получено посредством реакции соединения a23 в растворителе, таком как DMF, DMF, THF и т.п. или их смесь, с основанием, таким как карбонат цезия, карбонат калия и т.п., алкилирующим реагентом, таким как 1,2-дибромэтан, 1,3-дибромпропан, хлорацетилхлорид, хлорметилсульфонилхлорид, оксалилхлорид и т.п., который доступен коммерчески или синтезирован с помощью известного способа, при -20°C-80°C, предпочтительно 0°C-60°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов.
В качестве альтернативы, когда Ra представляет собой алкилсульфонил и т.п., соединение a24 также может быть получено посредством реакции с основанием, таким как гидроксид натрия, в растворителе, таком как DMF, DMA, THF и т.п. или их смесь, при 0°C-30°C в течение 0,5-24 часов, предпочтительно 1-5 часов, после реакции в растворителе, таком как THF, толуол, дихлорметан и т.п., с добавлением реагента Мицунобу, такого как DEAD, DIAD или бис(2-метоксиэтил)азодикарбонат, и трифенилфосфина, три-н-бутилфосфина или трибутилфосфина и диола, в котором один спирт защищен, который доступен коммерчески или синтезирован с помощью известного способа, при -20°C-100°C, предпочтительно 0°C-30°C, в течение 0,5-24 часов, предпочтительно 1-5 часов, и затем превращения получаемой гидроксильной группы в общую группу для снятия защиты с помощью общего способа снятия защиты.
(Этап 15)
Соединение (I-1') может быть получено посредством реакции соединения a24 с основанием, таким как водный гидроксид натрия, водный гидроксид калия, водный гидроксид лития и т.п., в растворителе, таком как метанол, THF, диоксан и т.п. или их смесь, при 10°C-110°C, предпочтительно 30°C-90°C, в течение 0,1-8 часов, предпочтительно 0,5-1 часа.
[0281]
[2-2] Альтернативный синтез соединения тип (I-1) (соединения I-1'')
[0282]
[Химическая формула 88]
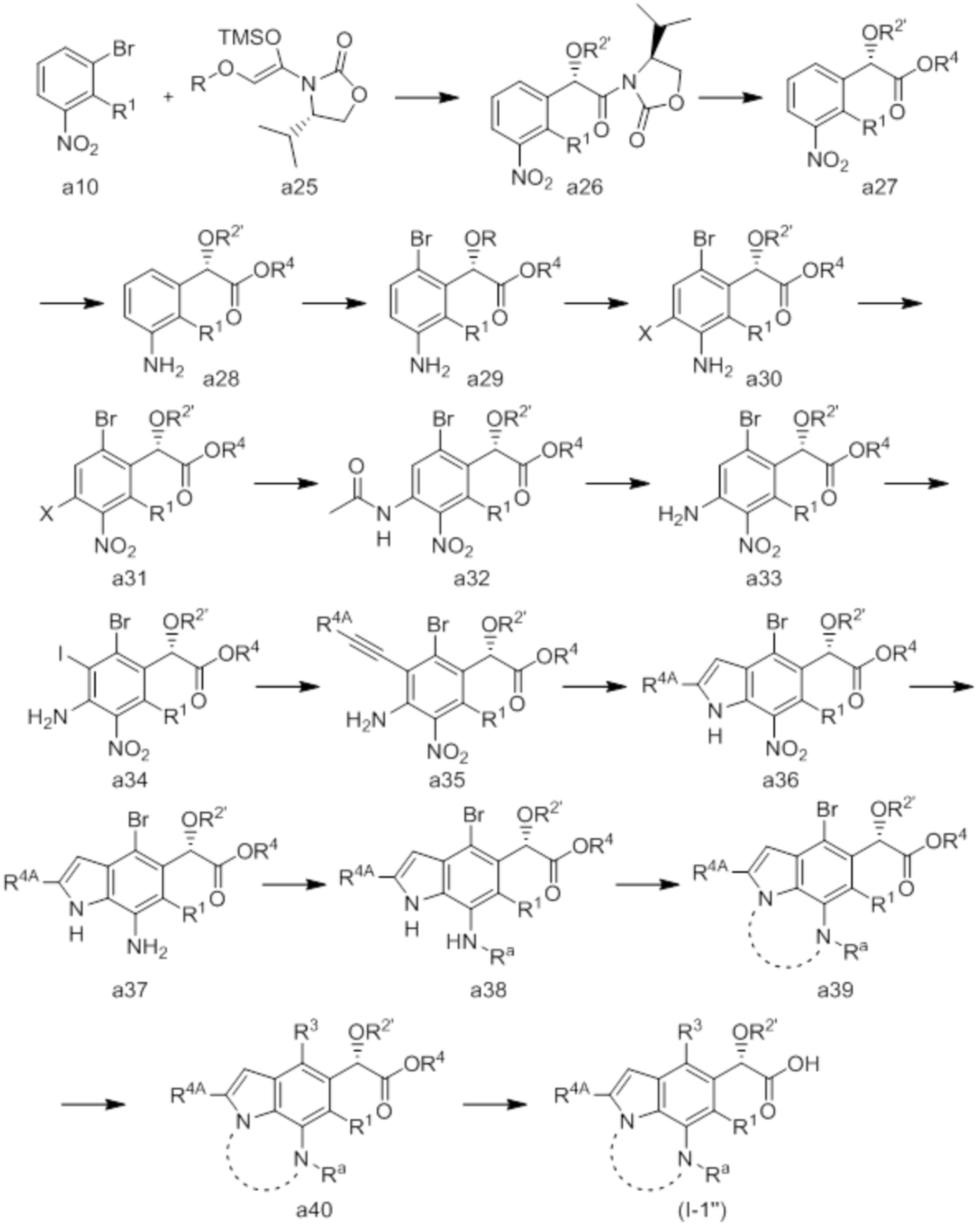
где R2' представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил или замещенный или незамещенный неароматический карбоцикл; X представляет собой галоген; другие символы совпадают с определенными выше.
[0283]
(Этап 1)
Он может быть осуществлен в соответствии с этапом 1 в синтезе соединения (I-1').
(Этап 2)
Производные карбоновых кислот могут быть получены посредством реакции соединения a26 в смеси THF-вода со смесью пероксида водорода и водного гидроксида лития при -20°C-10°C, предпочтительно -10°C-10°C, в течение 0,1-5 часов, предпочтительно 0,1-1 часа. Соединение a27 может быть получено посредством реакции получаемого производного карбоновой кислоты в растворителе, таком как DMF, DME, THF и т.п., с основанием, таким как карбонат калия, карбонат натрия и т.п., и галогенированным алкилом, таким как бензилбромид, метилйодид и т.п., при 0°C-100°C, предпочтительно 20°C-50°C, в течение 0,5-24 часов, предпочтительно 1-5 часов. Или соединение a27 может быть получено этерификацией с раствором дифенилдиазометана/диэтилового эфира и т.п.
(Этап 3)
Он может быть осуществлен в соответствии с этапом 2 в синтезе соединения (I-1').
(Этап 4)
Он может быть осуществлен в соответствии с этапом 3 в синтезе соединения (I-1').
(Этап 5)
Дибромпроизводное может быть синтезировано в соответствии с этапом 3 в синтезе соединения (I-1'). В этом случае оно может быть получено непосредственно из соединения a28 с использованием двух эквивалентов или большего количества реагентов. В качестве альтернативы, можно синтезировать производное брома/йода в соответствии с этапом 9 в синтезе соединения (I-1').
(Этап 6-16)
Он может быть осуществлен в соответствии с этапами 6, 7, 8, 9, 10, 11, 12, 13, 14, 4, 15 в синтезе соединения (I-1').
[0284]
[2-2-1] Альтернативный синтез соединения a27
[Химическая формула 89]

(Этап 1)
К раствору соединения a150, которое доступно коммерчески или синтезировано с помощью известного способа, в растворителе, таком как дихлорметан, толуол, ксилол, тетрагидрофуран и т.п. или их смесь, добавляют тионилхлорид или оксалилхлорид, и смесь подвергают реакции при 0°C-150°C, предпочтительно 50°C-120°C, в течение 0,5-24 часов, предпочтительно 1-6 часов. Затем, добавляют цианид натрия, цианид калия, цианид меди, цианид кремния и т.п. в растворителе, таком как дихлорметан, толуол, ксилол, тетрагидрофуран, ацетонитрил и т.п., и смесь подвергают реакции при 0°C-160°C, предпочтительно 25°C-100°C, в течение 1-24 часов, предпочтительно 1-5 часов, с получением соединения a151.
(Этап 2)
Соединение a151 растворяют в R4OH, к раствору добавляют кислоту, такую как концентрированная серная кислота, концентрированная соляная кислота и т.п., и смесь подвергают реакции при 0°C-150°C, предпочтительно 80°C-110°C, в течение 1-24 часов, предпочтительно 6-12 часов, затем превращают нитрильную группу в карбоксигруппу путем гидролиза, и затем этерифицируют с получением соединения a152.
(Этап 3)
Соединение a153 может быть получено посредством реакции раствора соединения a152 в дихлорметане, толуоле, метаноле, DMSO, ацетонитриле и т.п. с несимметричным рутениевым катализатором, соединениями-донорами водорода (например: соединение спирта, муравьиная кислота, формиатная соль и т.д.) и основаниями (например: карбонатом натрия, карбонатом калия, метоксидом натрия, триэтиламином, пиридином и т.д.) при -20°C-100°C, предпочтительно 0°C-80°C, в течение 0,1-24 часов, предпочтительно 0,1-5 часов.
(Этап 4)
Соединение a27 может быть получено посредством реакции раствора соединения a153 в тетрагидрофуране, DMF, толуоле и т.п. с основаниями (например: гидридом натрия, трет-бутоксидом калия, метоксидом натрия и т.д.) и R2'-I, R2'-Br, R2'-Cl и т.п., которые доступны коммерчески или синтезированы с помощью известного способа, при -20°C-100°C, предпочтительно 0°C-60°C, в течение 1-24 часов, предпочтительно 3-12 часов.
Или, когда R2' представляет собой трет-бутиловый эфир, соответствующее соединение a27 может быть получено посредством реакции соединения a153 в трет-бутилацетате с 0,2-3 эквивалентами 70% водного раствора хлорной кислоты при 0°C-60°C, предпочтительно 15°C-30°C, в течение 0,1-10 часов, предпочтительно 0,5-2 часов.
[0285]
[2-3] Синтез соединения (I-1''')
[Химическая формула 90]

где R3' и R3'' соединены вместе с соседним атомом азота с образованием неароматического гетероцикла; другие символы совпадают с определенными выше.
[0286]
(Этап 1)
Соединение a41 может быть получено посредством реакции соединения a36 в условиях отсутствия растворителя или в DMSO, DMF, ацетонитриле, метаноле, бутаноле и т.п. с основаниями, такими как аммоний, циклический амин, карбонат калия, триэтиламин, этилдиизопропиламин, т-бутоксид калия и т.п., при 0°C-200°C, предпочтительно 50°C-150°C, в течение 1-72 часов, предпочтительно 1-24 часов.
(Этап 2)
Он может быть проведен в соответствии с этапом 12, 13, 14, 15 в синтезе соединения (I-1').
[0287]
[2-4] Альтернативный синтез соединения типа (I-1)
[0288]
[Химическая формула 91]

где каждый символ совпадает с определенным выше.
[0289]
(Этап 1)
Соединение a43 может быть получено посредством реакции соединения a42 в растворителе, таком как гексан, THF, DMF и т.п. или их смесь, с 4,4'-ди-трет-бутил-2,2'-бипиридином, биспинаколдибором и в иридиевом катализаторе, таком как 1,5-циклооктадиенметоксииридий и т.п., при 50°C-150°C, предпочтительно 70°C-130°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов.
(Этап 2)
Соединение a44 может быть получено посредством реакции соединения a43 в растворителе, таком как DMF, DMA, THF, диоксан и т.п. или их смесь, с водным раствором основания, такого как K2CO3, Na2CO3, K3PO4 и т.п., алкенилгалогенидом, арилгалогенидом, алкилгалогенидом и катализатором, таким как PdCl2(dtbpf), Pd(PPh3)4, PdCl2(dppf) и т.п., при 50°C-150°C, предпочтительно 70°C-130°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов.
Или галогенированное соединение может быть получено посредством реакции соединения a43 в растворителе, таком как DMF, DMA, THF, диоксан, метанол, вода и т.п. или их смесь, с галогенированным металлом, таким как бромид меди(II), хлорид меди(II) и т.п., при 50°C-150°C, предпочтительно 70°C-130°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов. Кроме того, соединение a44 может быть получено путем превращения введенной галогеновой группы в арильную группу или алкинильную группу с помощью хорошо известной реакции сочетания.
(Этап 3)
Соединение (I-1'') может быть получено посредством реакции соединения a44 в растворителе, таком как метанол, THF, диоксан и т.п. или их смесь, с основанием, таким как водный раствор гидроксида натрия, водный раствор гидроксида калия, водный раствор гидроксида лития и т.п., при 10°C-110°C, предпочтительно 30°C-90°C, в течение 0,1-8 часов, предпочтительно 0,5-1 часа.
[0290]
[2-5] Синтез соединения (I-1'''')
[0291]
[Химическая формула 92]

где Hal представляет собой галоген; другие символы совпадают с определенными выше.
(Этап 1)
Соединение a45 может быть получено посредством реакции соединения a40 в растворителе, таком как DMF, DMA, THF, диоксан, уксусная кислота и т.п. или их смесь, с галогенирующим реагентом, таким как N-бромсукцинимид, 1-хлорметил-4-фтор-1,4-диазониабицикло[2.2.2]октана бис(тетрафторборат) (selectfluor (R)) и т.п., при -20°C-100°C, предпочтительно 0°C-60°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов.
(Этап 2)
Можно превратить галогеновую группу в арильную группу или алкинильную группу с помощью хорошо известной реакции сочетания.
(Этап 3)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0292]
[2-6] Синтез соединения (I-X)
[0293]
[Химическая формула 93]

где R представляет собой алкил и т.д.; другие символы совпадают с определенными выше.
(Этап 1)
Когда Ra соединения a47 представляет собой водород или содержит функциональную группу, такую как аминогруппа или гидроксильная группа, и R содержит карбоксигруппу, соединение a48 может быть получено посредством реакции соединения a47 в растворителе, таком как DMF, DMA, THF, диоксан, метиленхлорид и т.п. или их смесь, с конденсирующим средством, таким как дициклогексилкарбодиимид или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат и т.п., и добавками, такими как 1-гидрокси-7-азабензотриазол, 1-гидроксибензотриазол и т.п., при -20°C-100°C, предпочтительно 0°C-60°C, в течение 0,1-24 часов, предпочтительно 0,5-6 часов.
Или, когда Ra соединения a47 представляет собой водород или содержит функциональную группу, такую как аминогруппа или гидроксильная группа, и R содержит функциональную группу, такую как аминогруппа или гидроксильная группа, соединение a48 может быть получено посредством реакции соединения a47 в растворителе, таком как DMF, DMA, THF, диоксан, метиленхлорид и т.п. или их смесь, с 1,1'-карбонилдиимидазолом или оксалилхлоридом и т.д. при -20°C-100°C, предпочтительно 0°C-60°C в течение 0,1-24 часов, предпочтительно 0,5-6 часов.
Или, когда каждый Ra и R содержит алкенильную группу, соединение a48 может быть получено посредством реакции соединения a47 в растворителе, таком как DMF, DMA, THF, диоксан, метиленхлорид и т.п. или их смесь, в присутствии катализатора, такого как (1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден)дихлор(фенилметилен)(трициклогексилфосфин)рутений и т.п., при -20°C-100°C, предпочтительно 0°C-60°C, в течение 0,1-48 часов, предпочтительно 0,5-24 часов.
(Этап 2)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0294] Альтернативный синтез соединения типа (I-1')
[Химическая формула 94]
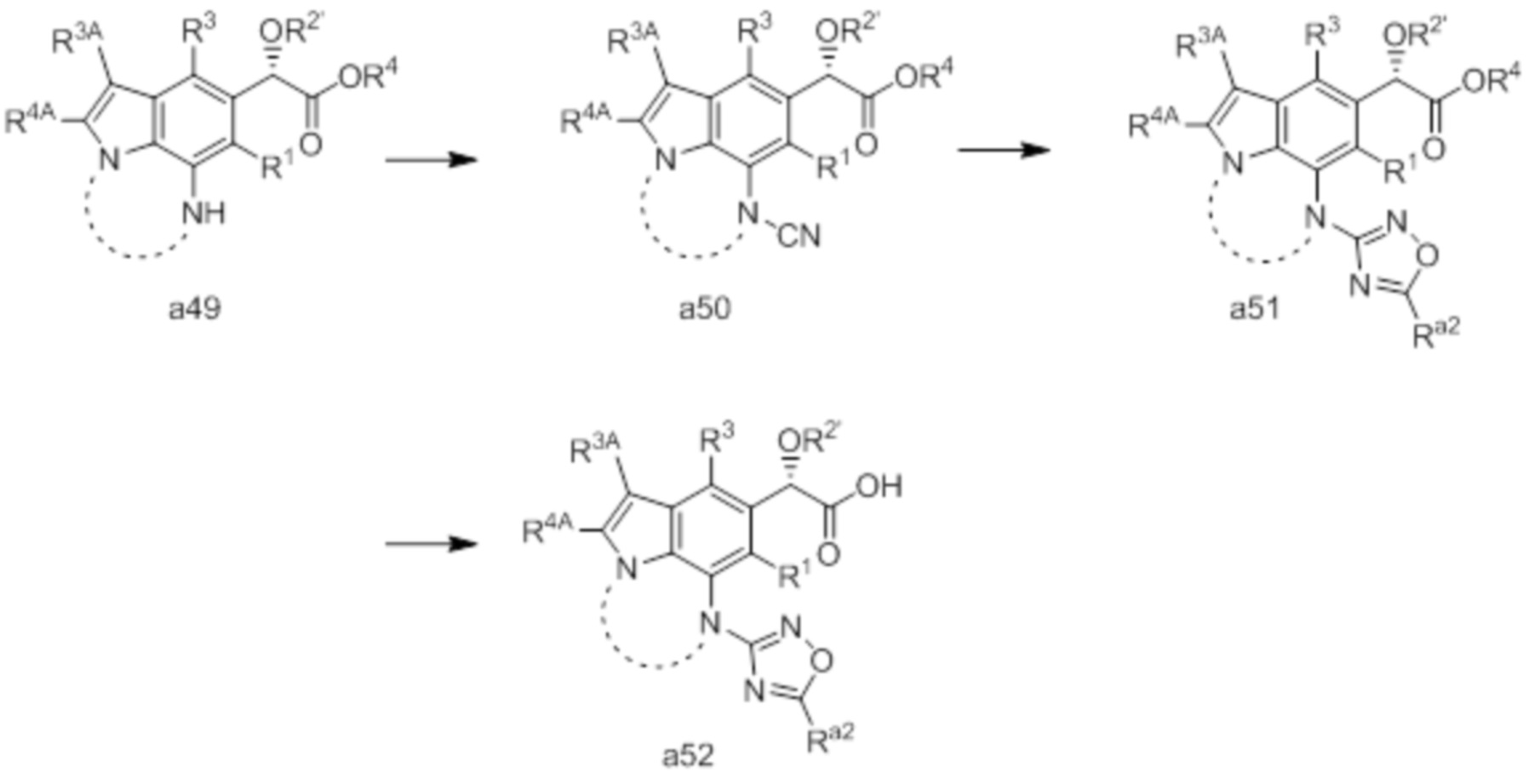
где Ra2 представляет собой замещенный или незамещенный алкил; другие символы совпадают с определенными выше.
(Этап 1)
Соединение a51 может быть получено посредством реакции соединения a49 в растворителе, таком как DMF, DMA, DMSO и т.п. или их смесь, с основанием, таким как карбонат калия, карбонат цезия и т.д., и цианогенбромидом при 0°C-80°C, предпочтительно 20°C-40°C, в течение 1-48 часов, предпочтительно 6-24 часов.
(Этап 2)
Гидроксильное производное гуанидина может быть получено посредством реакции соединения a50 в растворителе, таком как этанол, метанол, THF и т.п. или их смесь, с основанием и гидроксиламина гидрохлоридом, при 0°C-100°C, предпочтительно 60°C-80°C, в течение 0,1-24 часов, предпочтительно 0,5-6 часов.
Затем посредством их реакции в растворителе, таком как диглим и т.д., с хлорангидридом, соответствующим Ra2COCl, и основаниями, при 0°C-120°C, предпочтительно 60°C-100°C, в течение 0,1-24 часов, предпочтительно 0,5-6 часов, может быть получено соединение a51. Предпочтительные основания включают триэтиламин, пиридин и т.п.
(Этап 3)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0295]
[Химическая формула 95]

где Ra3 представляет собой водород или замещенный или незамещенный алкил; другие символы совпадают с определенными выше.
(Этап 1)
Соединение a53 может быть получено посредством реакции соединения a49 в растворителе, таком как дихлорметан, дихлорэтан и т.п. или их смесь, с TMSNCS, при 25°C-120°C, предпочтительно 60°C-100°C, в течение 1-48 часов, предпочтительно 6-24 часов.
(Этап 2)
В качестве альтернативы, соединение a54 может быть получено посредством реакции соединения a53 в растворителе, таком как этанол, метанол, THF и т.п. или их смесь, с основанием и Ra3COCH2Cl при 0°C-100°C, предпочтительно 60°C-90°C, в течение 0,1-24 часов, предпочтительно 0,5-6 часов. Предпочтительные основания включают триэтиламин, пиридин и т.п.
(Этап 3)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0296]
[Химическая формула 96]

где Ra4 представляет собой водород или замещенный или незамещенный алкил; другие символы совпадают с определенными выше.
(Этап 1)
Соединение a56 может быть получено посредством реакции соединения a49 в растворителе, таком как дихлорметан, хлороформ и т.п. или их смесь, с трифосгеном при 0°C-80°C, предпочтительно 25°C-40°C, в течение 1-48 часов, предпочтительно 6-24 часов.
(Этап 2)
Производное мочевины может быть получено посредством реакции соединения a56 в растворителе, таком как этанол, метанол, THF, вода и т.п. или их смесь, с основанием и Ra4COCH2NH2 при 0°C-100°C, предпочтительно 20°C-80°C, в течение 0,1-24 часов, предпочтительно 0,5-6 часов. Кроме того, соединение a57 может быть получено посредством реакции в растворителе, таком как THF, толуол и т.п., с реагентом Бургесса в герметичных условиях при 80°C-150°C, предпочтительно 100°C-120°C, в течение 0,1-24 часов, предпочтительно 0,5-6 часов. Предпочтительные основания включают гидрокарбонат натрия или гидрокарбонат калия.
(Этап 3)
Он может быть осуществлен в соответствии с этапом 15 в синтезе соединения (I-1').
[0297]
[Химическая формула 97]

(Этап 1)
Соединение a59 может быть получено посредством реакции соединения a49 в растворителе, таком как ацетонитрил, пропионитрил и т.п. или их смесь, с т-бутил(2-изотиоцианатэтокси)диметилсиланом при 25°C-120°C, предпочтительно 60°C-100°C, в течение 1-48 часов, предпочтительно 6-24 часов, а затем их реакции в растворителе, таком как THF, дихлорметан и т.п. или их смесь, с TBAF при 0°C-80°C, предпочтительно 20°C-40°C, 1-48 часов, предпочтительно 6-24 часов.
(Этап 2)
Соединение a60 может быть получено посредством реакции соединения a59 в растворителе, таком как этанол, метанол, THF и т.п. или их смесь, с оксидом ртути при 0°C-60°C, предпочтительно 20°C-40°C, в течение 1-7 дней, предпочтительно 3-5 дней.
(Этап 3)
Он может быть проведен в соответствии с этапом 15 синтеза соединения (I-1').
[0298]
Синтез соединения (I-1'-1)
[Химическая формула 98]

где каждый символ совпадает с определенным выше.
[0299]
(Этап 1)
Соединение a63 может быть получено посредством реакции соединения a62 в растворителе, таком как дихлорметан, дихлорэтан, толуол и т.п. или их смесь, с окислителем, таким как mCPBA, перуксусная кислота и т.д., при 0°C-120°C, предпочтительно 30°C-90°C, в течение 0,1-10 часов, предпочтительно 0,5-4 часов.
(Этап 2)
Соединение a64 может быть получено посредством реакции соединения a63 в растворителе, таком как DMSO, DMF, DMA и т.п. или их смесь, с первичным амином, таким как метиламин, этиламин, бензиламин и т.д., при 0°C-100°C, предпочтительно 20°C-80°C, 0,1-24 часов, предпочтительно 0,5-12 часов.
(Этап 3)
Соединение a65 может быть получено посредством реакции соединения a64 в растворителе, таком как DMF, DMA, THF и т.п. или их смесь, с фосфином, таким как три-т-бутилфосфин, трициклогексилфосфин, трифенилфосфин, катализатором, таким как дибензилиденацетонпалладий, ацетат палладия, дихлорбис(трифенилфосфин)палладий и т.д., фторидом цинка и силиловым енольным эфиром a8 при 50°C-150°C, предпочтительно 70°C-130°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов.
(Этап 4)
Соединение a66 может быть получено посредством реакции соединения a65 в растворителе, таком как дихлорметан, DMF, уксусная кислота и т.п. или их смесь, с галогенирующим реагентом, таким как NBS, NIS, йод и т.д., при -50°C-50°C, предпочтительно -30°C-30°C, в течение 0,1-8 часов, предпочтительно 0,5-4 часов.
(Этап 5)
Соединение a67 может быть получено посредством реакции соединения a66 в растворителе, таком как DMF, DMA, диоксан, вода и т.п. или их смесь, с водным раствором основания, такого как K2CO3, Na2CO3, K3PO4 и т.д., бороновой кислотой, которая доступна коммерчески или синтезирована с помощью известного способа, боратом и катализатором, таким как PdCl2(dtbpf), Pd(PPh3)4, PdCl2(dppf) tec., при 50°C-50°C, предпочтительно 70°C-130°C, в течение 0,1-8 часов, предпочтительно 0,5-2 часов.
(Этап 6)
Соединение a68 может быть получено посредством реакции соединения a67 в растворителе, таком как дихлорметан, DMF, DMA и т.п. или их смесь, с основанием, таким как триэтиламин, пиридин, DMAP и т.п., и метилхлорглиоксилатом при -40°C-40°C, предпочтительно 0°C-20°C, в течение 0,1-4 часов, предпочтительно 0,5-1 часа.
(Этап 7)
Соединение a69 может быть получено посредством реакции соединения a68 в растворителе, таком как этанол, метанол, THF, вода и т.п. или их смесь, с восстановителем, таким как гидросульфит натрия, железо, хлорид олова и т.п., при 0°C-100°C, предпочтительно 20°C-80°C, в течение 0,1-12 часов, возможно 0,5-6 часов.
(Этап 8)
Он может быть осуществлен в соответствии с этапом 4 в синтезе соединения 70.
(Этап 9)
Соединение a71 может быть получено из соединения a70 в растворителе, таком как THF, диэтиловый эфир, DME и т.п. или их смесь, с восстановителем, таким как комплекс боран-тетрагидрофуран, комплекс боран-диметилсульфид, при -20°C-50°C, предпочтительно 0°C-30°C, в течение 0,1-8 часов, предпочтительно 0,5-4 часов.
(Этап 10)
Соединение a72 может быть получено из соединения a71 в растворителе, таком как THF, DMF, толуол и т.п. или их смесь, с фосфином, таким как три-т-бутилфосфин, трициклогексилфосфин, трифенилфосфин, катализатором, таким как дибензилиденацетонпалладий, ацетат палладия, дихлорбис(трифенилфосфин)палладий, и енолятом металла, который доступен коммерчески или синтезирован с помощью известного способа, при 50°C-150°C, предпочтительно 70°C-130°C, 0,1-8 часов, предпочтительно 0,5-2 часов.
(Этап 11)
Соединение (I-1'-1) может быть получено посредством реакции соединения a72 в растворителе, таком как метанол, этанол, THF и т.п. или их смесь, с основанием, таким как водный раствор гидроксида натрия, водный раствор гидроксида калия, водный раствор гидроксида лития, при 10°C-110°C, предпочтительно 30°C-90°C, в течение 0,1-8 часов, предпочтительно 0,5-4 часов.
[0300]
Синтез соединения (I-1'-2)
[Химическая формула 99]
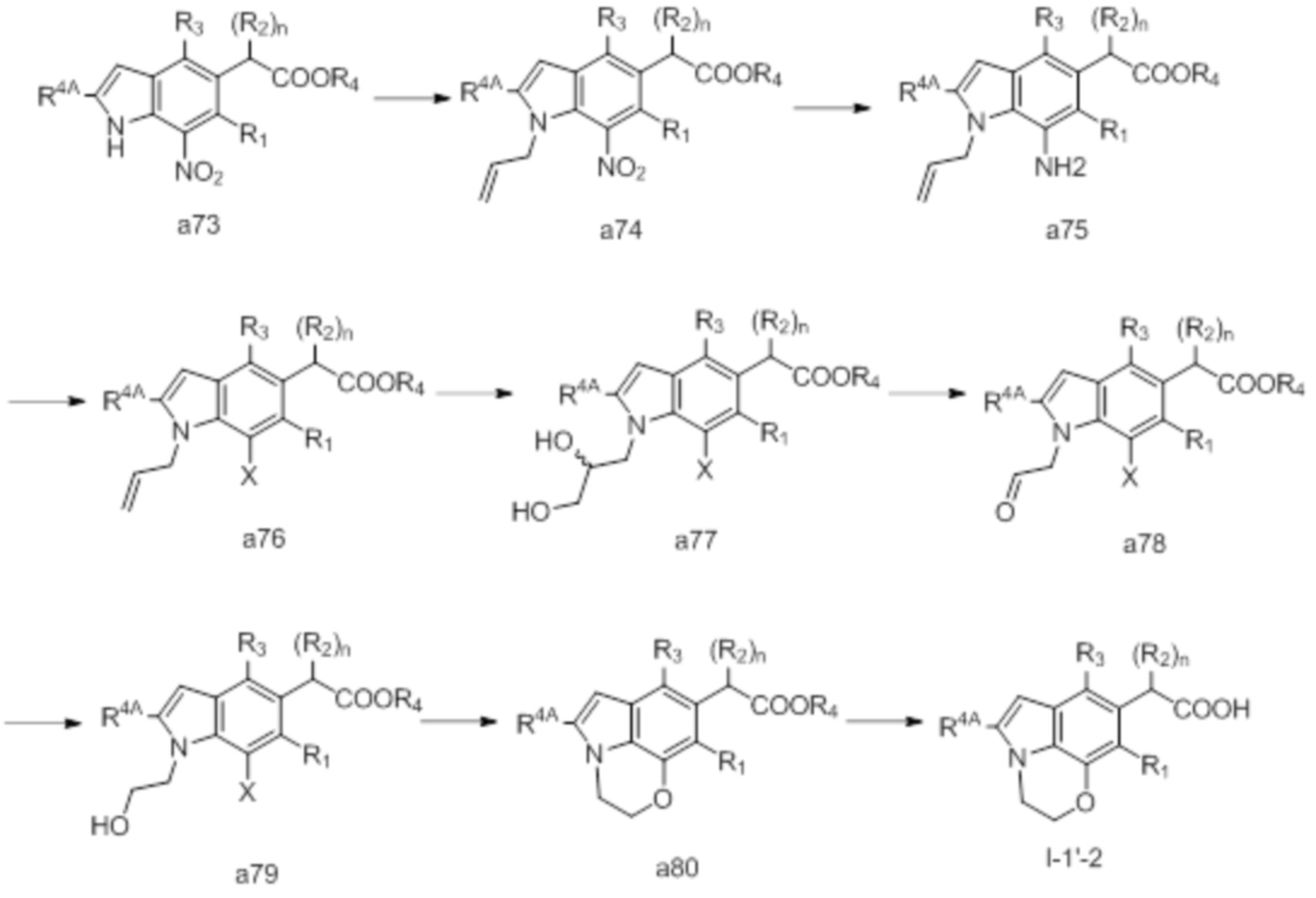
где каждый символ совпадает с определенным выше.
(Этап 1)
Соединение a74 может быть получено посредством реакции соединения a73 в растворителе, таком как DMF, DMA, THF и т.п. или их смесь, с аллилирующим реагентом, таким как аллилбромид, аллилхлорид, и основанием, таким как гидрид натрия, т-бутоксид калия, карбонат цезия, при -20°C-50°C, предпочтительно 0°C-30°C, в течение 0-4 часов, предпочтительно 0,5-2 часов.
(Этап 2)
Соединение a75 может быть получено посредством реакции соединения a74 в растворителе, таком как этанол, метанол, THF, вода и т.п. или их смесь, с восстановителем, таким как натрий гидросульфит, железо, хлорид олова, при 0°C-100°C, предпочтительно 20°C-80°C, в течение 0,1-8 часов, предпочтительно 0,5-4 часов.
(Этап 3)
Соединение a76 может быть получено посредством реакции соединения a75 в растворителе, таком как ацетонитрил, этилацетат, диметилсульфоксид и т.п. или их смесь, т-бутилнитрита, галогенированного металла, такого как йодид калия, бромид меди(I), хлорид меди(I), при 0°C-80°C, предпочтительно 20°C-60°C, 0,1-8 часов, предпочтительно 0,5-4 часов.
(Этап 4)
Соединение a77 может быть получено посредством реакции соединения a76 в растворителе, таком как этанол, THF, вода и т.п. или их смесь, с осматом(VI) калия и перйодатом натрия, при -10°C-60°C, предпочтительно 10°C-40°C, в течение 0,1-8 часов, предпочтительно 0,5-4 часов.
(Этап 5)
Соединение a78 может быть получено посредством реакции соединения a77 в растворителе, таком как этанол, THF, вода и т.п. или их смесь, с перйодатом натрия при -10°C-60°C, предпочтительно 10°C-40°C, в течение 0,1-4 часов, предпочтительно 0,5-2 часов.
(Этап 6)
Соединение a79 может быть получено посредством реакции соединения a78 в растворителе, таком как этанол, метанол, вода и т.п. или их смесь, с восстановителем, таким как боргидрат натрия, боргидрат лития, литий-алюминий гидрид и т.п., при -20°C-40°C, предпочтительно 0°C-20°C, в течение 0,1-4 часов, предпочтительно 0,5-2 часов.
(Этап 7)
Соединение a80 может быть получено посредством реакции соединения a79 в растворителе, таком как диоксан, DMF, толуол и т.п. или их смесь, с йодидом меди(I), лигандом, таким как 9,10-фенантролин, 2,2'-бипиридил, N,N-диметиламиноглицин и т.п., основанием, таким как карбонат калия, карбонат цезия, фосфат калия и т.п., при 80°C-180°C, предпочтительно 100°C-160°C, в течение 0,1-8 часов, предпочтительно 0,5-4 часов.
(Этап 8)
Соединение (I-1'-2) может быть получено посредством реакции соединения a80 в растворителе, таком как метанол, этанол, THF и т.п. или их смесь, с основанием, таким как водный раствор гидроксида натрия, водный раствор гидроксида калия, водный раствор гидроксида лития и т.п., при 10°C-110°C, предпочтительно 30°C-90°C, в течение 0,1-8 часов, предпочтительно 0,5-4 часов.
[0301]
Синтез соединения (I-1'-3) и соединения (I-1'-4)
[Химическая формула 100]
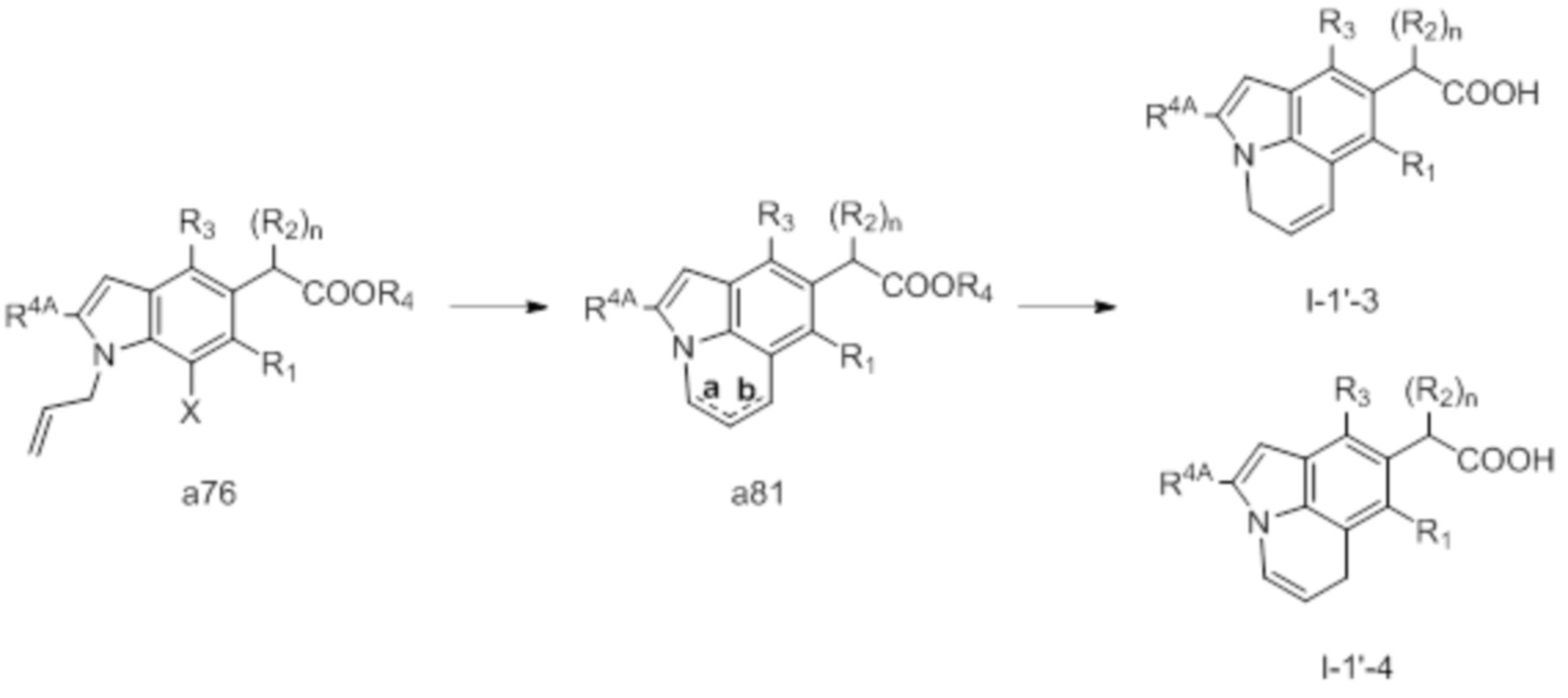
где прерывистая линия обозначает наличие или отсутствие связи, любая из прерывистой линии или прерывистой линии b обозначает только присутствие; каждый символ совпадает с определенным выше.
(Этап 1)
Соединение a81 может быть получено посредством реакции соединения a76 в растворителе, таком как DMF, диоксан, ацетонитрил и т.п. или их смесь, с основанием, таким как триэтиламин, ацетат калия, гидрокарбонат натрия и т.п., фосфином, таким как три-т-бутилфосфин, трициклогексилфосфин, три(o-толил)фосфин и т.п., и катализатором, таким как дибензилиденацетонпалладий, ацетат палладия, дихлорбистрифенилфосфинпалладий, при 50°C-150°C, предпочтительно 70°C-130°C, в течение 0,1-4 часов, предпочтительно 0,5-2 часов.
(Этап 2)
Соединение (I-1'-4) может быть получено посредством реакции соединения a81 в растворителе, таком как метанол, этанол, THF и т.п. или их смесь, с основанием, таким как водный раствор гидроксида натрия, водный раствор гидроксида калия, водный раствор гидроксида лития и т.п., при 10°C-110°C, предпочтительно 30°C-90°C, в течение 0,1-8 часов, предпочтительно 0,5-4 часов, и затем выделения с помощью колоночной хроматографии и т.д.
[0302]
[2-7] Другой синтез соединения a40
[Химическая формула 101]

где каждый символ совпадает с определенным выше.
(Этап 1)
Он может быть проведен в соответствии с этапом 4 в синтезе соединения (I-1').
(Этап 2)
Он может быть проведен в соответствии с этапом 2 в синтезе соединения (I-1').
(Этап 3)
Соединение a84 может быть получено посредством реакции соединения a83 в растворителе, таком как дихлорметан, DMF, DMA и т.п. или их смесь, с основанием, таким как пиридин, Et3N и т.п., и 2-(триметилсилил)этансульфонилхлоридом при -20°C-60°C, предпочтительно -0°C-30°C, в течение 1-24 часов, предпочтительно 5-18 часов.
(Этап 4)
Он может быть проведен в соответствии с этапом 14 в синтезе соединения (I-1').
(Этап 5)
Соединение a86 может быть получено посредством реакции соединения a85 в растворителе, таком как THF, диоксан и т.п. или их смесь, с ионом фтора, таким как фторид тетрабутиламмония, пиридин-HF, при 0°C-100°C, предпочтительно 20°C-60°C, в течение 1-24 часов, предпочтительно 10-20 часов.
(Этап 6)
Он может быть проведен в соответствии с этапом 13 в синтезе соединения (I-1'). Или он может быть проведен в соответствии с этапом 1 в синтезе a113.
[0303]
[2-8] Другой синтез соединения a40
[Химическая формула 102]

где каждый символ совпадает с определенным выше
(Этап 1)
Соединение a87 может быть получено посредством реакции соединения a84 в растворителе, таком как дихлорметан, DMF, DMA и т.п. или их смесь, с основанием, таким как карбонат цезия, пиридин, триэтиламин и т.п., алкилирующим средством, таким как метилйодид, этилбромацетат и т.д., которое доступно коммерчески или синтезировано с помощью известного способа, при -50°C-50°C, предпочтительно -30°C-30°C, в течение 0,1-4 часов, предпочтительно 0,5-1 часа.
(Этап 2)
Он может быть проведен в соответствии с этапом 5 в синтезе [2-7] соединения a40.
(Этап 3)
Он может быть проведен в соответствии с этапом 14 в синтезе соединения (I-1').
[0304]
[2-9] Другой синтез соединения a46
[Химическая формула 103]

где каждый символ совпадает с определенным выше.
(Этап 1)
Соединение a91 может быть получено посредством реакции соединения a90 в растворителе, таком как дихлорметан, DMF, DMA и т.п. или их смесь, с кислотой, такой как TFA, тозилат, соляная кислота и т.п., при -20°C-60°C, предпочтительно 0°C-40°C, в течение 0,1-4 часов, предпочтительно 0,5-2 часов.
(Этап 2)
Соединение a46 может быть получено посредством реакции соединения a91 в растворителе, таком как THF, DMF, толуол и т.п. или их смесь, с основанием, таким как гидрид натрия, трет-бутоксид калия, метоксид натрия и т.п., и алкилирующим средством, таким как R2'-I, R2'-Br, R2'-Cl и т.п., при -20°C-100°C, предпочтительно 0°C-60°C, в течение 1-24 часов, предпочтительно 3-12 часов.
[0305]
[2-10] Синтез соединения (I-1'-5)
[Химическая формула 104]

где каждый символ совпадает с определенным выше.
(Этап 1)
Он может быть проведен в соответствии с этапом 3 в синтезе соединения (I-1'-1).
(Этап 2)
Он может быть проведен в соответствии с этапом 4 в синтезе соединения (I-1'-1).
(Этап 3)
Он может быть проведен в соответствии с этапом 5 в синтезе соединения (I-1'-1).
(Этап 4)
Он может быть проведен в соответствии с этапом 7 в синтезе соединения (I-1'-1).
(Этап 5)
Соединение a97 может быть получено посредством реакции соединения a96 в растворителе, таком как дихлорметан, DMF, DMA и т.п. или их смесь, с основанием, таким как пиридин, триэтиламин и т.п., DMAP, и 2-нитробензолсульфонилхлорид при 0°C-80°C, предпочтительно 20°C-40°C, в течение 0,5-24 часов, предпочтительно 1-8 часов.
(Этап 6)
Он может быть проведен в соответствии с этапом 5 в другом синтезе [2-7] соединения a40.
(Этап 7)
Соединение a99 может быть получено посредством реакции соединения a98 в растворителе, таком как толуол, THF, дихлорметан и т.п. или их смесь, с реагентом Мицунобу, таким как DEAD, DIAD или бис(2-метоксиэтил)азодикарбоксилат, и трифенилфосфином, три-н-бутилфосфином или трибутилфосфином при -20°C-70°C, предпочтительно 0°C-30°C, в течение 0,1-12 часов, предпочтительно 0,5-2 часов.
(Этап 8)
Соединение a100 может быть получено посредством реакции соединения a99 в растворителе, таком как пиридин, лутидин и т.п. или их смесь, с TFAA, при 0°C-80°C, предпочтительно 20°C-40°C, в течение 0,5-24 часов, предпочтительно 1-4 часов.
(Этап 9)
Соединение a101 может быть получено посредством реакции соединения a100 в растворителе, таком как DMF, DMA и т.п. или их смесь, с основанием, таким как карбонат калия, карбонат цезия и т.п., и тиофенолом при -20°C-60°C, предпочтительно 0°C-20°C, в течение 0,5-24 часов, предпочтительно 1-8 часов.
(Этап 10)
Он может быть проведен в соответствии с этапом 4 в синтезе соединения (I-1'-1).
(Этап 11)
Он может быть проведен в соответствии с этапом 10 в синтезе соединения (I-1'-1).
(Этап 12)
Он может быть проведен в соответствии с этапом 11 в синтезе соединения (I-1'-1).
[0306]
[2-11] Другой синтез соединения (I-1''''-1)
[Химическая формула 105]

где A представляет собой связь, -O- или -NRa, R представляет собой водород, галоген или замещенный или незамещенный алкил, другие символы совпадают с определенными выше.
(Этап 1)
Соединение a104 может быть получено посредством реакции соединения a49 в растворителе, таком как дихлорметан, DMF, DMA и т.п. или их смесь, с основанием, таким как карбонат цезия, пиридин, триэтиламин и т.п., и соединением a100 при -50°C-50°C, предпочтительно -30°C-30°C, в течение 0,1-4 часов, предпочтительно 0,5-1 часа.
(Этап 2)
Соединение a105 может быть получено посредством реакции соединения a104 в растворителе, таком как метанол, этанол, тетрагидрофуран DMSO и т.п. или их смесь, с гидроксидом калия, гидроксидом натрия или гидроксидом лития и т.д., при -20°C-50°C, предпочтительно -5°C-20°C, в течение 0,1-24 часов, предпочтительно 1-6 часов.
(Этап 3)
Соединение a106 может быть получено посредством реакции соединения a105 в растворителе, таком как THF, диэтиловый эфир и т.п. или их смесь, с восстановителем, таким как комплекс боран-тетрагидрофуран, комплекс бор-диметилсульфид и т.д., при 0°C-100°C, предпочтительно 50°C-80°C, в течение 0,5-24 часов, предпочтительно 1-3 часов.
(Этап 4)
Соединение a107 может быть получено посредством реакции соединения a106 в растворителе, таком как DMF, DME, тетрагидрофуран, ацетон, ацетонитрил и т.п., с основанием карбонатом калия, карбонатом натрия, карбонатом цезия, гидридом натрия и т.п. и алкилирующим средством, которое доступно коммерчески или синтезировано с помощью известного способа, при -30°C-100°C, предпочтительно -10°C-50°C, в течение 0,5-24 часов, предпочтительно 1-5 часов. Или соединение a107 может быть получено посредством его реакции в растворителе, таком как дихлорметан, хлороформ и т.п., с галогенирующим средством, таким как трифторид N,N-диэтиламиносеры, при -30°C-100°C, предпочтительно -10°C-50°C, в течение 0,5-24 часов, предпочтительно 1-5 часов. Или соединение a107 может быть получено посредством его реакции с замещенным спиртом и замещенным амином в присутствии оснований при -30°C-50°C, предпочтительно -10°C-20°C, в течение 0,5-12 часов, предпочтительно 1-5 часов, после активации соединения 218 с активирующим средством, таким как метансульфонилхлорид, п-толуолсульфонилхлорид и т.д.
(Этап 5)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0307]
[2-12] Синтез соединения (I-1''''-2)
[Химическая формула 106]
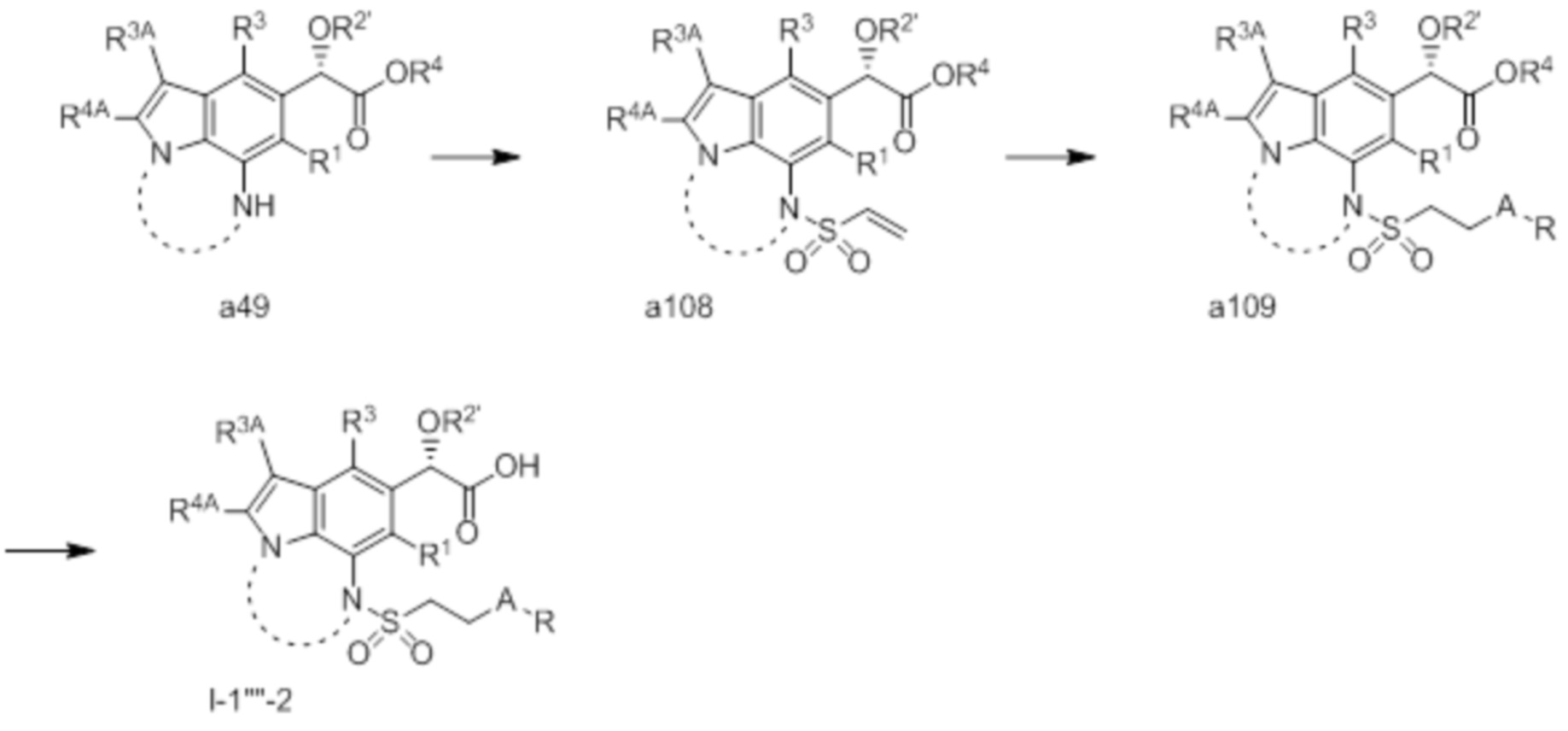
где каждый символ совпадает с определенным выше.
(Этап 1)
Соединение a108 может быть получено посредством реакции соединения a49 в растворителе, таком как пиридин, лутидин и т.п. или их смесь, с 2-хлорэтан-1-сульфонилхлоридом при 0°C-80°C, предпочтительно 20°C-40°C, в течение 1-8 часов, предпочтительно 2-4 часов.
(Этап 2)
Соединение a109 может быть получено посредством реакции соединения a108 в растворителе, таком как THF, DMF и т.п. или их смесь, с водным раствором гидроксида тетрабутиламмония или замещенным амином при 0°C-80°C, предпочтительно 20°C-40°C, в течение 0,5-8 часов, предпочтительно 1-4 часов.
(Этап 3)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0308]
[2-13] Синтез соединения (I-1''''-3)
(Синтез соединения a113)
[Химическая формула 107]
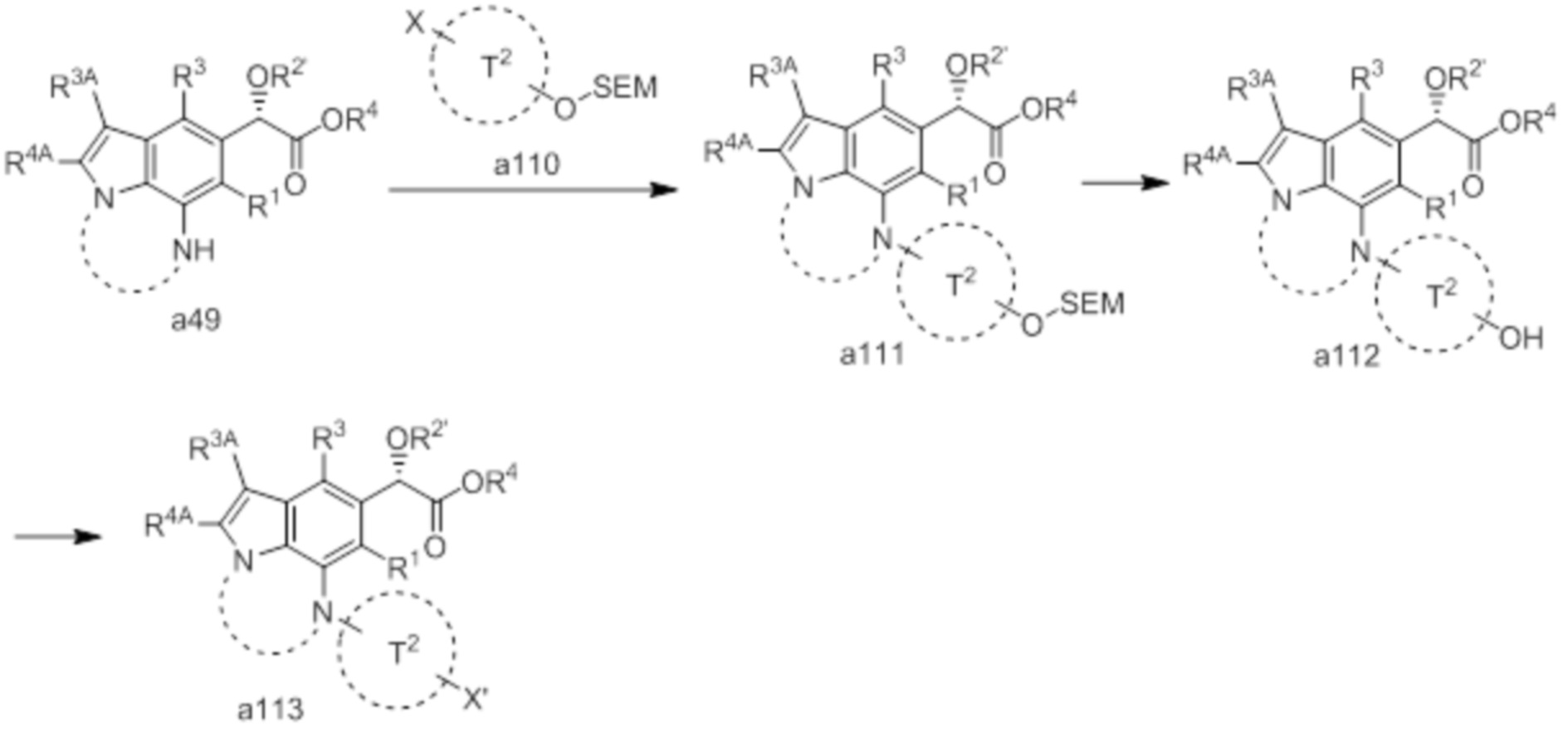
где кольцо T2 представляет собой замещенный или незамещенный неароматический карбоцикл, замещенный или незамещенный ароматический карбоцикл, замещенный или незамещенный неароматический карбоцикл или замещенный или незамещенный ароматический карбоцикл, X' представляет собой C1-6 алкилсульфонилокси, галоген C1-6 алкилсульфонилокси или замещенный или незамещенный арилсульфонилокси и т.д., другие символы совпадают с определенными выше.
(Этап 1)
Соединение a111 может быть получено посредством реакции соединения a49 в растворителе, таком как толуол, DMF, диоксан и т.п. или их смесь, с соединением a110, фосфином, таким как BINAP, ксантфос и т.д., катализатором, таким как дибензилиденацетонпалладий, ацетат палладия и т.д., и основанием, таким как карбонат цезия, трет-бутоксид натрия и т.д., при 40°C-120°C, предпочтительно 50°C-100°C, в течение 0,1-8 часов, предпочтительно 0,5-4 часов.
(Этап 2)
Соединение a112 может быть получено посредством реакции соединения a111 в растворителе, таком как THF, диоксан и т.п. или их смесь, с ионом фтора, таким как фторид тетрабутиламмония, пиридин-HF и т.д., при 40°C-100°C, предпочтительно 50°C-80°C, в течение 1-24 часов, предпочтительно 3-18 часов.
(Этап 3)
Соединение a113 может быть получено посредством реакции соединения a112 в растворителе, таком как толуол, DMF, диоксан и т.п. или их смесь, с основанием, таким как пиридин, триэтиламин и т.п., сульфонильным реагентом, таким как трифлатный реагент (например: N-фенил-бис(трифторметансульфонимид) и т.д.), мезилирующий реагент (например: метансульфонилхлорид, ангидрид метансульфоновой кислоты и т.д.) и т.п., при -10°C-60°C, предпочтительно 0°C-20°C, от 5 минут до 4 часов, предпочтительно от 10 минут до 1 часа.
(Синтез соединения (I-1''''-3))
[Химическая формула 108]
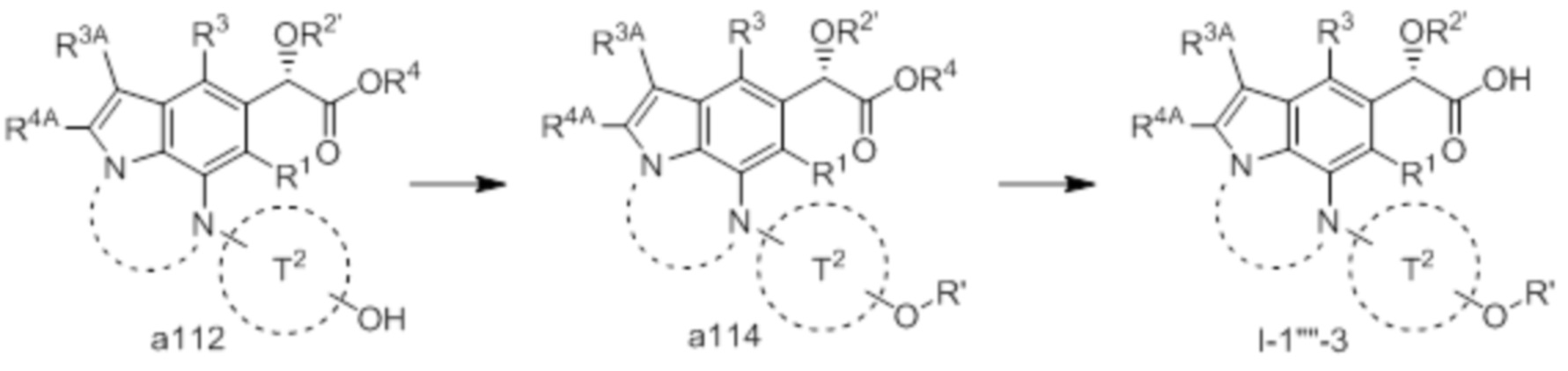
где R' представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный алкинил, замещенный или незамещенный неароматический карбоцикл, замещенный или незамещенный ароматический карбоцикл, замещенный или незамещенный неароматический гетероцикл или замещенный или незамещенный ароматический гетероцикл, другие символы совпадают с определенными выше.
(Этап 1)
Соединение a114 может быть получено посредством реакции соединения a112 в растворителе, таком как толуол, THF, дихлорметан и т.п. или их смесь, с реагентом Мицунобу, таким как DEAD, DIAD или бис(2-метоксиэтил)азодикарбоксилат, трифенилфосфином, три-н-бутилфосфином или трибутилфосфином и спиртом, замещенным R', который доступен коммерчески или синтезирован с помощью известного способа, при -20°C-100°C, предпочтительно 0°C-30°C, в течение 0,5-24 часов, предпочтительно 1-5 часов. Или соединение a114 может быть получено посредством его реакции в растворителе, таком как DMF, DME, тетрагидрофуран, ацетон, ацетонитрил и т.п., с основанием, таким как карбонат калия, карбонат натрия, карбонат цезия, гидрид натрия и т.п., и алкилирующим средством, которое доступно коммерчески или синтезировано с помощью известного способа, при -30°C-100°C, предпочтительно -10°C-50°C, в течение 0,5-24 часов, предпочтительно 1-5 часов.
(Этап 2)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0309]
[2-14] Синтез соединения (I-1''''-4)
[Химическая формула 109]

где P1 представляет собой защитную группу аминогруппы, такую как 9-флуоренилметилоксикарбонильная группа или бензилоксикарбонильная группа, другие символы совпадают с определенными выше.
(Этап 1)
Он может быть проведен в соответствии с этапом 1 в синтезе соединения a113.
(Этап 2)
Соединение a116 может быть получено посредством снятия защиты с помощью обычного способа, соответствующего каждой из защитных групп. Например, когда P1 представляет собой 9-флуоренилметилоксикарбонильную группу, соединение a116 может быть получено посредством реакции в растворителе, таком как дихлорметан, хлороформ и т.п. или их смесь, с основанием, таким как диэтиламин и т.д., при 0°C-100°C, предпочтительно 20°C-50°C, в течение 0,5-24 часов, предпочтительно 1-5 часов. Или, когда P1 представляет собой бензилоксикарбонильную группу, соединение a116 может быть получено посредством его реакции в растворителе, таком как метанол, этанол, этилацетат, тетрагидрофуран и т.п. или их смесь, с 5% или 10% палладированным углем, гидроксидом палладия, диоксидом платины и т.п. в атмосфере водорода, при 1-10 атм, предпочтительно 1-3 атм, при 0°C-60°C, предпочтительно 20°C-40°C, в течение 0,1-24 часов, предпочтительно 1-12 часов.
(Этап 3)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0310]
[2-15] Синтез соединения (I-1''''-5)
[Химическая формула 110]
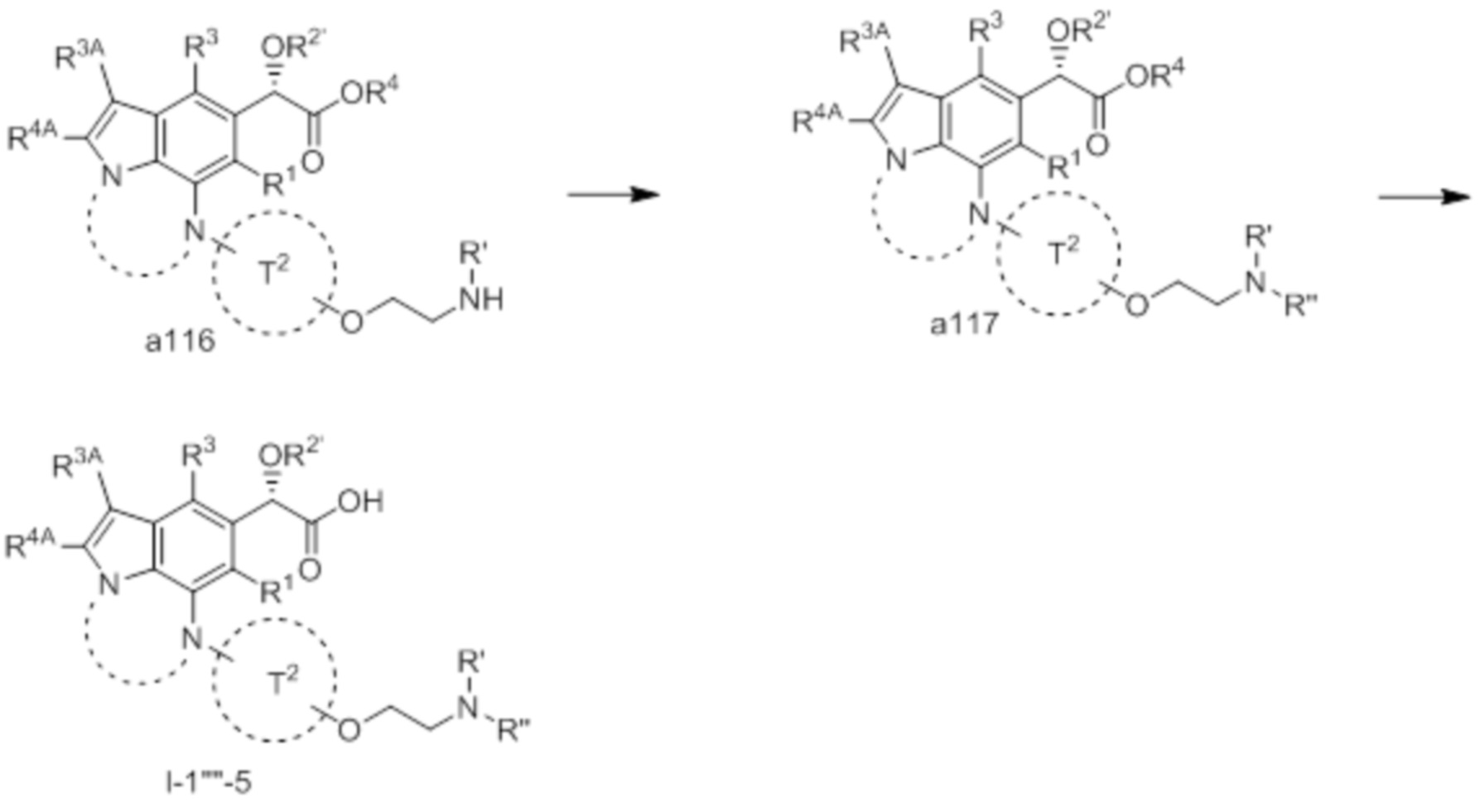
где R'' представляет собой замещенный или незамещенный алкил, замещенный или незамещенный ацил, замещенный или незамещенный алкилсульфонил или замещенный или незамещенный карбамоил, другие символы совпадают с определенными выше.
(Этап 1)
Он может быть проведен в соответствии с этапом 13 в синтезе соединения (I-1').
(Этап 2)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0311]
[2-16] Синтез соединения (I-1''''-6)
[Химическая формула 111]

где кольцо T3 представляет собой замещенный или незамещенный ароматический карбоцикл или замещенный или незамещенный ароматический гетероцикл, другие символы совпадают с определенными выше.
(Этап 1)
[2-13] Соединение a119 может быть получено посредством реакции соединения a118 в растворителе, таком как толуол, DMF, DMA, THF, диоксан и т.п. или их смесь, с фосфином, таким как BINAP, ксантфос и т.д., катализатором, таким как дибензилиденацетонпалладий, ацетат палладия и т.д., основанием, таким как карбонат цезия, карбонат калия и т.д., и дифенилметанимином при 50°C-150°C, предпочтительно 70°C-130°C, в течение 0,5-12 часов, предпочтительно 1-6 часов.
(Этап 2)
Соединение a120 может быть получено посредством реакции соединения a119 в растворителе, таком как дихлорметан, DMF, DMA и т.п. или их смесь, с основанием, таким как карбонат цезия, пиридин, триэтиламин и т.п., сульфонильным реагентом, хлорангидридом, изоцианатом, алкилирующим средством или арилирующим средством и т.д., такими как MsCl, AcCl, MeNCO и т.п., которые доступны коммерчески или синтезированы с помощью известного способа, при -50°C-50°C, предпочтительно -30°C-30°C, в течение 0,1-4 часов, предпочтительно 0,5-1 часа.
(Этап 3)
Соединение a121 может быть получено посредством реакции соединения a120 в растворителе, таком как DMF, DME, тетрагидрофуран, ацетон, ацетонитрил и т.п., с основанием, таким как карбонат калия, карбонат натрия, карбонат цезия, гидрид натрия и т.д., и алкилирующим средством или арилирующим средством, которые доступны коммерчески или синтезированы с помощью известного способа, при -30°C-100°C, предпочтительно -10°C-50°C, в течение 0,5-24 часов, предпочтительно 1-5 часов.
Оно может быть синтезирован, даже если поменять порядок этапа 2 и этапа 3.
(Этап 4)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0312]
[2-17] Синтез соединения (I-1''''-7)
[Химическая формула 112]
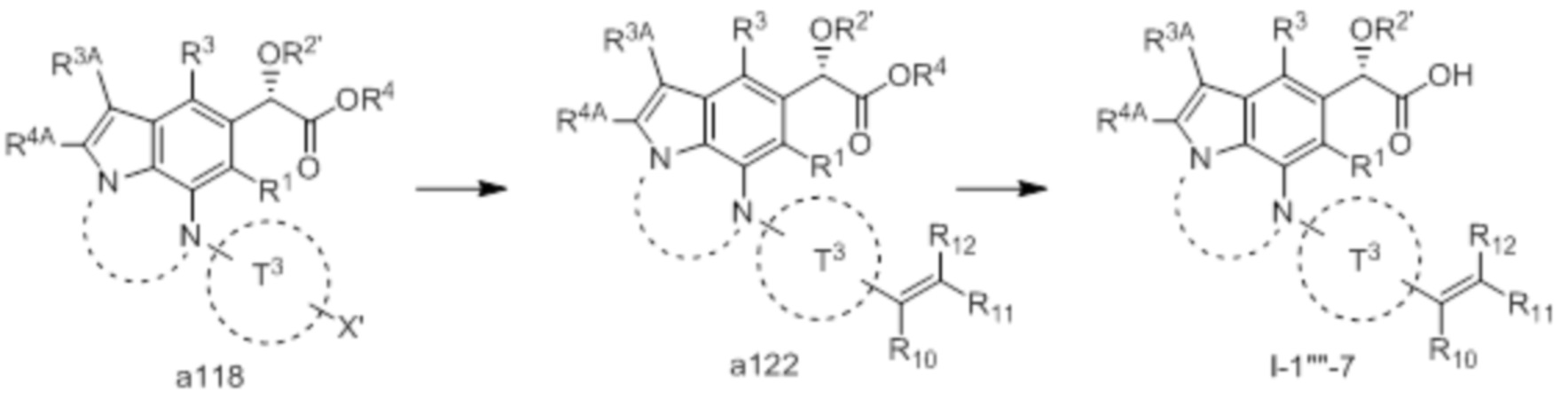
каждый R10, R11 и R12 независимо представляют собой водород, гидрокси, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, замещенный или незамещенный неароматический карбоцикл, замещенный или незамещенный ароматический карбоцикл, замещенный или незамещенный неароматический гетероцикл или замещенный или незамещенный ароматический гетероцикл, или R10 и R11 могут быть соединены вместе с каждым связывающим атомом углерода с образованием замещенного или незамещенного карбоцикла или замещенного или незамещенного гетероцикла, или R11 и R12 могут быть соединены вместе с каждым связывающим атомом углерода с образованием замещенного или незамещенного карбоцикла или замещенного или незамещенного гетероцикла.
(Этап 1)
Он может быть проведен в соответствии с этапом 4 в синтезе соединения (I-1').
(Этап 2)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0313]
[2-18] Синтез соединения (I-1''''-8)
[Химическая формула 113]

где каждый символ совпадает с определенным выше.
(Этап 1)
Соединение a123 может быть получено посредством реакции соединения a122 в растворителе, таком как метанол, этанол, тетрагидрофуран, этилацетат, уксусная кислота и т.п. или их смесь, с катализатором, таким как 5% или 10% палладий на угле, гидроксид палладия или диоксид платины и т.д., при 0°C-50°C, предпочтительно 15°C-25°C, в течение от 0,1 часа до 48 часов, предпочтительно от 1 часа до 24 часов, в атмосфере водорода при нормальном давлении или повышенном давлении.
(Этап 2)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0314]
[2-19] Синтез соединения (I-1''''-9)
[Химическая формула 114]
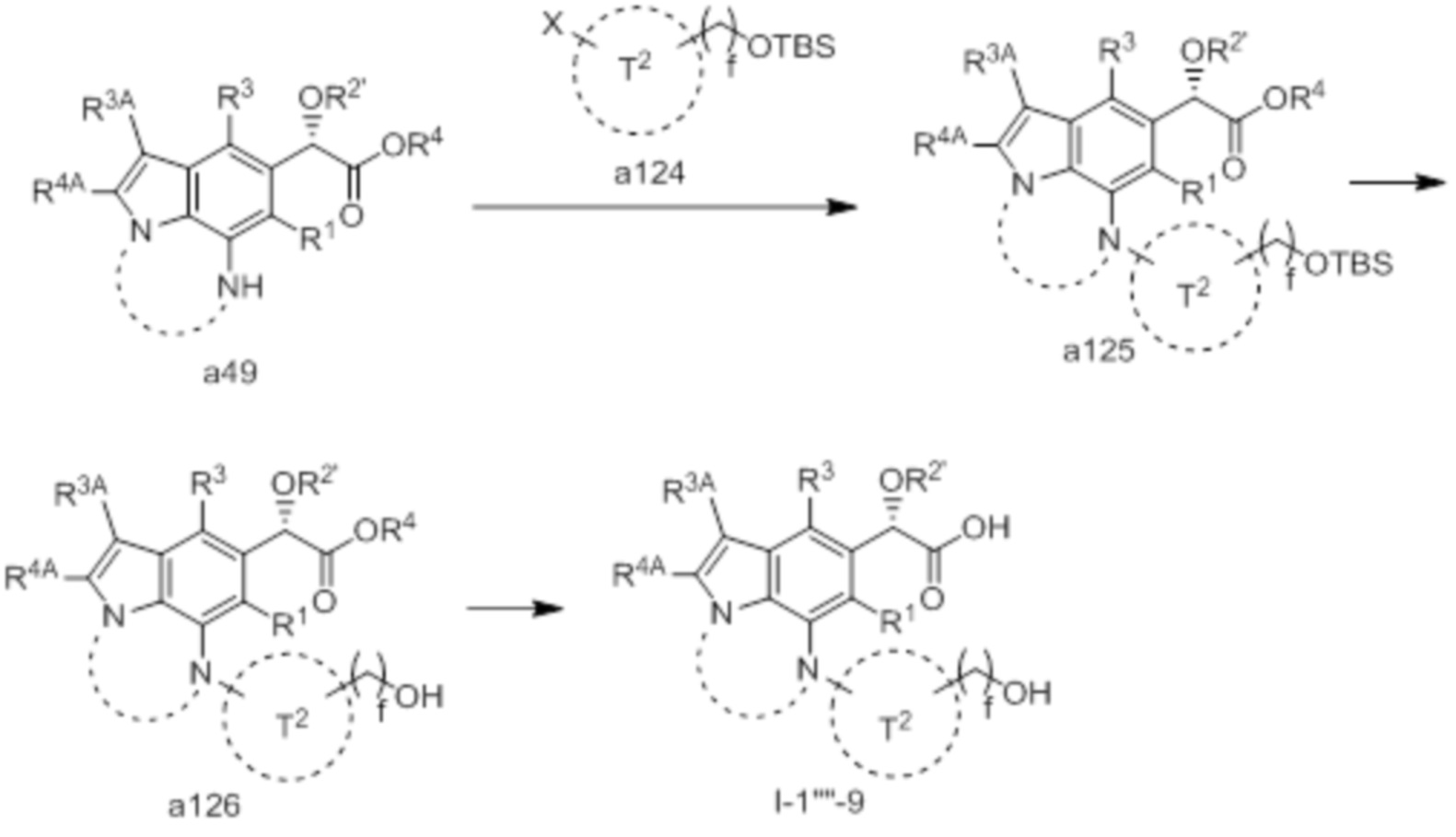
где f представляет собой целое число от 1 до 4, другие символы совпадают с определенными выше.
(Этап 1)
Он может быть проведен в соответствии с этапом 1 в синтезе соединения a113.
(Этап 2)
Соединение a126 может быть получено посредством реакции соединения a125 в растворителе, таком как THF, диоксан и т.п. или их смесь, с ионом фтора, таким как фторид тетрабутиламмония, пиридин-HF и т.д., при 0°C-100°C, предпочтительно 20°C-40°C, в течение от 1 часа до 24 часов, предпочтительно от 2 часов до 6 часов.
(Этап 3)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0315]
[2-19] Синтез соединения (I-1''''-9-1)
[Химическая формула 115]

где каждый символ совпадает с определенным выше.
(Этап 1)
Соединение a155 может быть получено посредством реакции соединения a126 в растворителе, таком как DMF, DME, тетрагидрофуран, ацетон, ацетонитрил и т.п., с основанием, таким как карбонат калия, карбонат натрия, карбонат цезия, гидрид натрия и т.д., и алкилирующим средством, которое доступно коммерчески или синтезировано с помощью известного способа, при -30°C-100°C, предпочтительно -10°C-50°C, в течение от 0,5 часа до 24 часов, предпочтительно от 1 часа до 5 часов. Или соединение a155 может быть получено посредством реакции спирта, соответствующего R'OH, который доступен коммерчески или синтезирован с помощью известного способа и растворен в растворителе, таком как THF, дихлорметан и т.д. или их смесь, с реагентом Мицунобу, таким как DEAD, DIAD или бис(2-метоксиэтил)азодикарбоксилат, трифенилфосфин, три-н-бутилфосфин или трибутилфосфин, и соединением a126 при -20°C-100°C, предпочтительно 0°C-30°C, в течение от 0,5 часа до 24 часов, предпочтительно от 1 часа до 5 часов.
(Этап 2)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0316]
[2-20] Синтез соединения (I-1''''-10)
[Химическая формула 116]

где каждый символ совпадает с определенным выше.
(Этап 1)
Соединение a127 может быть получено посредством реакции соединения a126 в растворителе, таком как метиленхлорид, ацетон, DMSO и т.д. или их смесь, с окислителем, таким как реагент Десса-Мартина, диоксид марганца, хлорохромат пиридиния и т.д., при 0°C-80°C, предпочтительно 20°C-45°C, в течение 0,5 часа до 5 часов, предпочтительно от 1 часа до 3 часов. Или оно может быть получено с помощью общего окисления Сверна.
(Этап 2)
Соединение a128 может быть получено посредством реакции соединения a127 в растворителе, таком как дихлорметан, THF, метанол и т.п. или их смесь, с уксусной кислотой или TFA и т.д. и амином, который доступен коммерчески или синтезирован с помощью известного способа, для получения имина в качестве реактивного промежуточного продукта, затем введения реакционного раствора в реакцию с восстановителем, таким как цианоборгидрид натрия или триацетоксиборгидрид натрия, комплекс пиколин-боран и т.д., при -30°C-60°C, предпочтительно 0°C-20°C, в течение от 0,1 часа до 24 часов, предпочтительно от 0,5 часа до 12 часов.
(Этап 3)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0317]
[2-21] Синтез соединения (I-1''''-11) и соединения (I-1''''-12)
[Химическая формула 117]

где каждый символ совпадает с определенным выше.
(Этап 1)
Он может быть проведен в соответствии с этапом 1 в синтезе соединения a113.
(Этап 2)
Он может быть проведен в соответствии с этапом 5 в синтезе [2-7] соединения a40.
(Этап 3)
Соединение a131 и соединение a132 могут быть получены посредством реакции соединения a130 в растворителе, таком как DMF, тетрагидрофуран, ацетонитрил и т.п., с основанием, таким как карбонат калия, карбонат натрия, карбонат цезия, гидрид натрия и т.п., и алкилирующим средством, которое доступно коммерчески или синтезировано с помощью известного способа, при -30°C-100°C, предпочтительно 0°C-50°C, в течение от 0,5 часа до 24 часов, предпочтительно от 1 часа до 5 часов.
(Этап 4)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0318]
[2-22] Синтез соединения (I-1''''-13)
[Химическая формула 118]

где каждый символ совпадает с определенным выше.
(Этап 1)
Он может быть проведен в соответствии с этапом 3 в синтезе [2-7] соединения a40.
(Этап 2)
Он может быть проведен в соответствии с этапом 4 в синтезе соединения (I-1').
(Этап 3)
Он может быть проведен в соответствии с этапом 14 в синтезе соединения (I-1').
(Этап 4)
Он может быть проведен в соответствии с этапом 5 в синтезе [2-7] соединения a40.
(Этап 5)
Он может быть проведен в соответствии с этапом 13 в синтезе соединения (I-1').
(Этап 6)
Соединение (I-1''''-13) может быть получено посредством реакции соединения a136 в растворителе, таком как THF, диоксан и т.п. или их смесь, с ионом фтора, таким как фторид тетрабутиламмония, пиридин-HF и т.п., при 0°C-100°C, предпочтительно 60°C-80°C, в течение от 1 часа до 24 часов, предпочтительно от 2 часов до 6 часов.
[0319]
[2-23] Синтез соединения (I-1''''-14)
[Химическая формула 119]

где кольцо T4 представляет собой замещенный или незамещенный неароматический карбоцикл или замещенный или незамещенный неароматический гетероцикл, другие символы совпадают с определенными выше.
(Этап 1)
Он может быть проведен в соответствии с этапом 4 в синтезе соединения (I-1'-1).
(Этап 2)
Соединение a138 может быть получено посредством реакции соединения a137 в растворителе, таком как толуол, ксилол, DMF, DMSO и т.п., с соединением a150, основанием, таким как 2,6-лутидин, N,N-диизопропилэтиламин, N,N'-диметил-1,2-этилендиамин и т.п., и йодидом меди(I) при 30°C-250°C, предпочтительно 80°C-200°C, от 0,1 часа до 10 часов, предпочтительно от 0,5 часа до 2 часов.
(Этап 3)
Он может быть проведен в соответствии с этапом 4 в синтезе соединения (I-1'-1).
(Этап 4)
Он может быть проведен в соответствии с этапом 13 в синтезе соединения (I-1'). Или он может быть проведен в соответствии с этапом 1 в синтезе соединения a113.
(Этап 5)
Он может быть проведен в соответствии с этапом 10 в синтезе соединения (I-1'-1).
(Этап 6)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0320]
[2-24] Синтез соединения (I-1''''-15)
[Химическая формула 120]

где каждый символ совпадает с определенным выше.
(Этап 1)
Он может быть проведен в соответствии с этапом 4, 5 в синтезе соединения (I-1'-2).
(Этап 2)
Он может быть проведен в соответствии с этапом 6 в синтезе соединения (I-1'-2).
(Этап 3)
Он может быть проведен в соответствии с этапом 4 в синтезе соединения (I-1''''-1).
(Этап 4)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0321]
[2-25] Синтез соединения (I-1''''-16)
[Химическая формула 121]

(Этап 1)
Соединение a147 может быть получено посредством реакции соединения a122 в растворителе, таком как THF, диэтиловый эфир и т.п., 9-борабицикло[3.3.1]нонана, соединения борана, такого как дисиамилборан, тексилборан и т.п., при -10°C-50°C, предпочтительно 0°C-25°C, в течение от 0,1 часа до 10 часов, предпочтительно от 0,5 часа до 5 часов, и затем реакции данной смеси с водой и окислителем пероксиборатом натрия тетрагидратом при 0°C-60°C, предпочтительно 25°C-50°C, в течение от 0,1 часа до 10 часов, предпочтительно от 0,5 часа до 5 часов.
(Этап 2)
Он может быть проведен в соответствии с этапом 3 в синтезе соединения (I-1''''-3).
(Этап 3)
Он может быть проведен в соответствии с этапом 4 в синтезе соединения (I-1''''-1).
(Этап 4)
Он может быть проведен в соответствии с этапом 15 в синтезе соединения (I-1').
[0322]
[3] Синтез соединения (I-2)
[0323]
[Химическая формула 122]
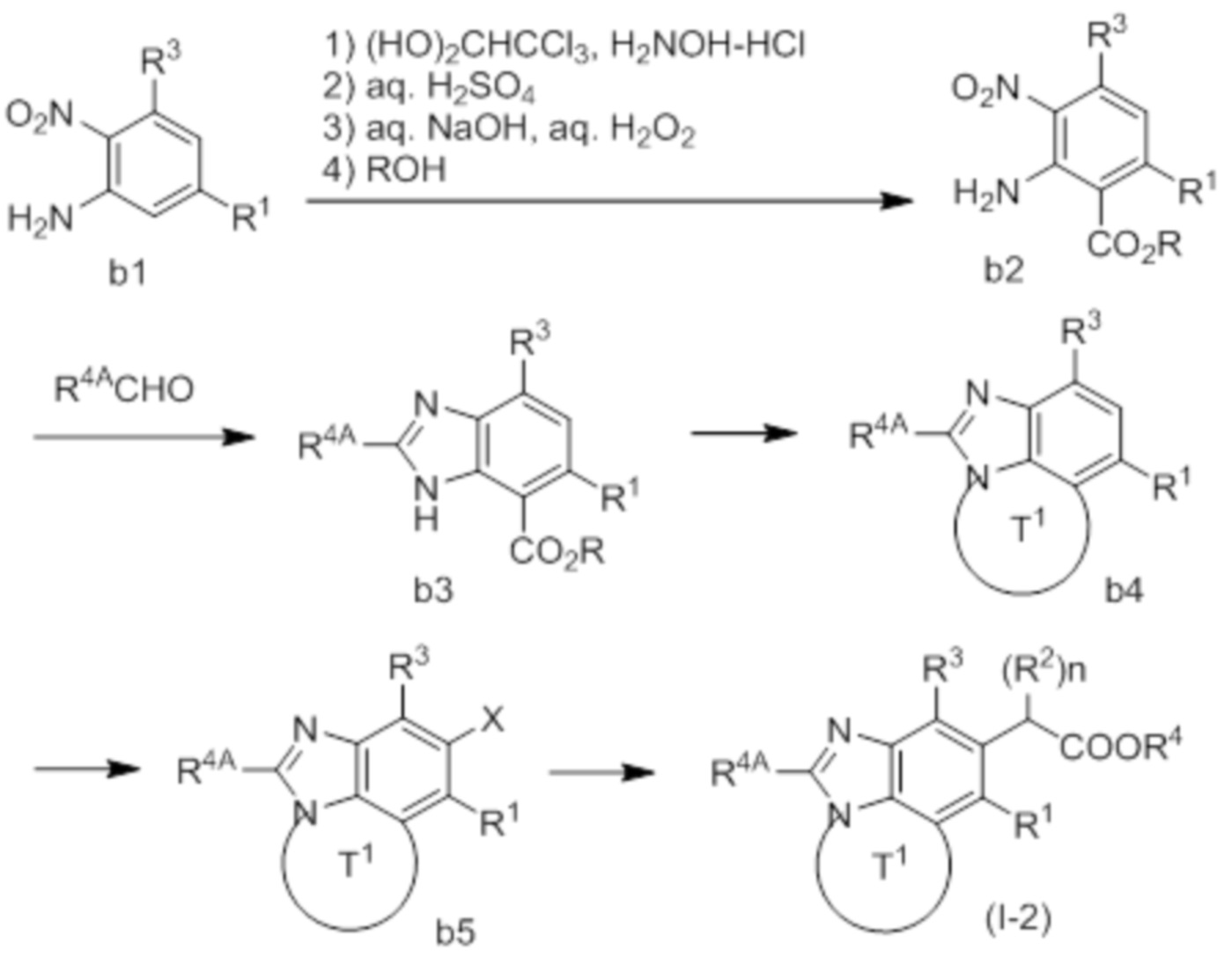
где R представляет собой алкил и т.д.; другие символы совпадают с определенными выше.
[0324]
(Этап 1)
Соединение b2 может быть получено посредством реакции соединения b1, например в соответствии со способом, описанным в Journal of Organic Chemistry, 2013, 78(17), 8217-8231.
(Этап 2)
Соединение b3 может быть получено посредством реакции соединения b2 с R4A-CHO, например в соответствии со способом, описанным в Angewandte Chemie, International Edition, 2012, 51(46), 11589-11593.
(Этап 3)
Сложноэфирная группа соединения b3 может быть превращена в карбоксильную группу посредством ее реакции в присутствии основания (например: гидроксида натрия) в растворителе (например: THF, смеси метанола и воды) при подходящей температуре (например: при температуре от комнатной до приблизительно 50°C). Затем его карбоксильная группа может быть превращена в аминогруппу посредством, например, реакции Курциуса с использованием DPPA. После этого соединение b4 может быть получено посредством проведения реакции в соответствии с реакцией образования кольца T1, описанной выше.
(Этап 4)
Соединение b5 может быть получено посредством реакции соединения b4 с галогенирующим средством (например: NIS) в растворителе (например: DMF, дихлорметане) при подходящей температуре (например: от охлаждения льдом до рефлюкса).
(Этап 5)
Он может быть проведен в соответствии с этапом 6, 7 в синтезе соединения (I-1).
[0325]
Конечное соединение, полученное с помощью описанного выше способа, может быть превращено в другое соединение настоящего изобретения с помощью хорошо известной специалисту в данной области техники химической модификации. Когда до и после каждой реакции присутствуют функциональные группы (например: гидрокси, амино, карбокси), необязательно может быть проведена реакция защиты или снятия защиты функциональных групп с помощью хорошо известной специалисту в данной области техники реакции (см: Organic Synthesis, T. W. Greene, John Wiley & Sons Inc. (1991).
[0326]
Соединение настоящего изобретения оказывает ингибирующее воздействие на репликацию ВИЧ, поэтому оно полезно в качестве терапевтического средства и/или профилактического средства против вирусных инфекций, таких как СПИД и т.п.
Соединения настоящего изобретения обладают активностью ингибирования репликации ВИЧ, например в следующем экспериментальном примере 1 и/или экспериментальном примере 2, предпочтительно, значение EC50 составляет 100 нМ или менее, более предпочтительно 50 нМ или менее, более предпочтительно 20 нМ или менее, особенно предпочтительно 10 нМ или менее. Также при оценке этой активности доступно значение EC90. Кроме того, предпочтительное соединение обладает сильной резистентностью к мутациям вируса. Более предпочтительное соединение обладает высоким значение C24/EC50 (C24: концентрация в крови через 24 часа после введения).
Соединение настоящего изобретения полезно в качестве фармацевтического средства, а также обладает активностью ингибирования репликации вируса, особенно ВИЧ (например: ВИЧ-1), его мутантных вирусов или его резистентных вирусов и обладает одним или несколькими из следующих отличных признаков.
a) противовирусная активность в присутствии белков сыворотки (например: PA-EC50, PA-EC90 и т.д.) является хорошей;
b) активность ингибирования ферментов CYP (например, CYP1A2, CYP2C9, CYP3A4, CYP2D6, CYP2C19 и т.д.) является слабой;
c) оно демонстрирует хорошую фармакокинетику, такую как высокая концентрация в крови, высокая оральная абсорбция, длительное действие, низкая миграция в ткани, подходящий клиренс, высокая биодоступность и т.п.;
d) оно не демонстрирует токсичности, такой как фототоксичность (например: фотогемолитическое воздействие и т.д.), мутагенность, кардиотоксичность (например: удлинение QTc и т.д.), гепатотоксичность, нефротоксичность, судороги и т.п.;
e) оно демонстрирует отсутствие необратимого ингибирования ферментов CYP (например, CYP3A4) в диапазоне концентраций, соответствующем описанным в настоящем документе условиям измерения, и низкую способность к MBI;
f) стабильность соединения (например, стабильность в растворе, стабильность в растворе, светостабильность, стабильность окраски и т.д. в различных жидкостях) и/или растворимость в воде являются высокими;
г) метаболическая стабильность является высокой;
h) оно не вызывает желудочно-кишечных расстройств (например: геморрагического энтерита, изъязвления желудочно-кишечного тракта, желудочно-кишечных кровотечений и т.д.);
i) низкая вероятность появления резистентности вирусов, вызванной самим настоящим соединением или его комбинацией с другими препаратами;
j) оно демонстрирует сильную эффективность в отношении резистентных вирусов.
[0327]
Фармацевтическую композицию по настоящему изобретению можно вводить перорально или парентерально. Способы парентерального введения включают кожное, подкожное, внутривенное, внутриартериальное, внутримышечное, внутрибрюшинное, трансмукозальное, ингаляционное, трансназальное, офатальмическое, во внутреннее ухо или вагинальное введение и т.п.
[0328]
В случае перорального введения можно получать любые формы, которые обычно используются, такие как пероральные твердые композиции (например, таблетки, порошок, гранулы, капсулы, драже, пленки и т.п.), пероральные жидкие композиции (например, суспензия, эмульсия, эликсир, сироп, лимонад, спирт, ароматическая вода, экстракт, отвар, настойка и т.п.) и т.п. Таблетки могут представлять собой таблетки с сахарным покрытием, таблетки с пленочным покрытием, таблетки с кишечнорастворимым покрытием, таблетки с замедленным высвобождением, таблетки-пастилки, подъязычные таблетки, буккальные таблетки, жевательные таблетки или таблетки для перорального диспергирования. Порошки и гранулы могут представлять собой сухие сиропы. Капсулы могут представлять собой мягкие капсулы, микрокапсулы или капсулы с замедленным высвобождением.
[0329]
В случае парентерального введения можно, предпочтительно, вводить любые формы, которые обычно используются, такие как инъекции, капли, препараты для наружного применения (например, офтальмологические капли, капли для носа, капли для ушей, аэрозоли, ингаляции, лосьон, инфузия, линимент, ополаскиватель для полости рта, клизма, мазь, пластырь, желе, крем, повязка, катаплазма, порошок для наружного применения, суппозиторий и т.п.) и т.п. Инъекциями могут представлять собой эмульсии типа М/В, В/М, М/В/М, В/М/В и т.п.
[0330]
Фармацевтическая композиция может быть получена путем смешивания эффективного количества соединения настоящего изобретения с различными фармацевтическими добавками, подходящими для композиции, такими как вспомогательные вещества, связующие вещества, увлажняющие средства, дезинтеграторы, смазывающие вещества, разбавители и т.п. Кроме того, фармацевтическая композиция может быть выполнена для педиатрических пациентов, гериатрических пациентов, серьезных случаев или операций путем надлежащего изменения эффективного количества соединения настоящего изобретения, композиции и/или различных фармацевтических добавок. Педиатрические фармацевтический композиции, предпочтительно, вводят пациентам до 12 или 15 лет. Кроме того, педиатрические фармацевтические композиции можно вводить пациентам пациенты младше 27 дней после рождения, от 28 дней до 23 месяцев после рождения, от 2 до 11 лет, или от 12 до 16 лет, или в 18 лет. Гериатрические фармацевтические композиции, предпочтительно вводят пациентам старше 65 лет или больше.
[0331]
При том, что дозировка фармацевтической композиции настоящего изобретения должна определяться с учетом возраста и веса пациента, типа и степени заболеваний, пути введения и т.п., обычная пероральная дозировка составляет 0,05-100 и, предпочтительно, 0,1-10 мг/кг в день. Для парентерального введения, хотя дозировка сильно зависит от путей введения, обычная дозировка составляет 0,005-10 и, предпочтительно, 0,01-1 мг/кг в день. Дозу можно вводить за от одного до нескольких приемов в день.
[0332]
Соединение настоящего изобретения может быть использовано в комбинации с ингибитором обратной транскриптазы, ингибитором протеазы, ингибитором интегразы, другим препаратом против ВИЧ и т.п. (далее сокращенно обозначаемым сопутствующим препаратом) с целью улучшения действия соединения, уменьшение дозированного количества соединения и т.п. При этом момент введения соединения настоящего изобретения и сопутствующего препарата не ограничен, и субъекту введения их можно вводить одновременно или можно вводить с разницей во времени. Кроме того, соединение настоящего изобретения и сопутствующий препарат можно вводить в виде двух типов препаратов, содержащих каждый активный ингредиент, или их можно вводить в виде одного препарата, содержащего оба активных ингредиента.
[0333]
Дозировочное количество сопутствующего препарата может быть соответствующим образом выбрано исходя из клинически используемой дозы. Кроме того, соотношение смешивания соединения настоящего изобретения с сопутствующим препаратом может быть соответствующим образом выбрано в зависимости от субъекта введения, пути введения, целевого заболевания, симптомов, комбинации и т.п. Например, когда субъект введения является человеком, можно использовать 0,01-100 весовых частей сопутствующего препарата на 1 весовую часть соединения настоящего изобретения.
Кроме того, соединение настоящего изобретения может быть использовано в области генной терапии для предотвращения распространение инфекции ретровирусных векторов в другие места, кроме целевых тканей, при использовании ретровирусного вектора на основе ВИЧ и MLV. В частности, когда вектор передается клеткам и т.п. в пробирке и затем возвращается в организм, с помощью предварительного введения соединения настоящего изобретения можно предотвратить ненужную инфекцию в организме.
Примеры ингибиторов обратной транскриптазы включают AZT, 3TC, диданозин, зальцитабин, санирубуджин, абакавир, тенофовир, эмтрицитабин, небирабин, эфавиренц, капраририн, этрацирин, делавирдин и т.п.
Примеры ингибиторов протеазы включают индинавир, ритонавир, саквинавир, нелфинавир, ампренавир, атазанавир, лопинавир, фосампренавир, дарунавир, атаназавир, бреканавир, типранавир и т.п.
Примеры ингибиторов интегразы включают ралтегравир, эльвитегравир, JTK-656, долутегравир (S-349572), S-265744 и т.п.
Примеры других препаратов против ВИЧ включают ингибиторы входа, такие как маравирок и викривирок и т.п., ингибиторы слияния, такие как энфувиртид, сифувиртид, альбувиртид и т.п.
[0334]
Далее настоящее изобретение будет описано более подробно со ссылкой на примеры и ссылочные примеры настоящего изобретения и тестовые примеры, но настоящее изобретение не ограничено этими примерами.
[0335]
(Условия измерений при ЖХ/МС)
(1) Колонка: ACQUITY UPLC (зарегистрированный товарный знак) BEH C18 (1,7 мкм, вн. д. 2,1×50 мм) (Waters)
Скорость потока: 0,8 мл/мин; длина волны детектирования УФ: 254 нм;
Подвижная фаза: [A] содержащий 0,1% муравьиной кислоты водный раствор, [B] содержащий 0,1% муравьиной кислоты раствор ацетонитрила
линейный градиент от 5% до 100% растворителя [B] проводили за 3,5 минуты, и 100% растворителя [B] поддерживали в течение 0,5 минуты.
[0336]
(2) Колонка: Shim-pack XR-ODS (2,2 мкм, вн. д. 50×3,0 мм) (Shimadzu)
Скорость потока: 1,6 мл/мин; длина волны детектирования УФ: 254 нм;
Подвижная фаза: [A] содержащий 0,1% муравьиной кислоты водный раствор, [B] содержащий 0,1% муравьиной кислоты раствор ацетонитрила
Градиент: линейный градиент от 10% до 100% растворителя [B] проводили за 3 минуты, и 100% растворителя [B] поддерживали в течение 0,5 минуты.
[0337]
(3) Колонка: ACQUITY UPLC (зарегистрированный товарный знак) BEH C18 (1,7 мкм i.d.2,1×50 мм) (Waters)
Скорость потока: 0,8 мл/мин; длина волны детектирования УФ: 254 нм;
Подвижная фаза: [A] содержащий 10 мМ карбоната аммония водный раствор, [B] раствор ацетонитрила
Градиент: линейный градиент от 5% до 100% растворителя [B] проводили за 3,5 минуты, и 100% растворителя [B] поддерживали в течение 0,5 минуты.
[0338]
(Сокращения)
BINAP: 2,2'-бис(дифенилфосфино)-1,1'-бинафтил
Cbz: бензилоксикарбонил
DEAD: диэтилазодикарбоксилат
DIAD: диизопропилазодикарбоксилат
DMA: N,N-диметилацетамид
DME: 12-диметоксиэтан
DMAP: N,N-диметил-4-аминопиридин
DMF: N,N-диметилформамид
DMSO: диметилсульфоксид
dtbpf: 1,1'-ди-трет-бутилфосфиноферроцен
Fmoc: 9-флуоренилметилоксикарбонил
HF: фторид водорода
IPE: изопропиловый эфир
Me: метил
Ms: метилсульфонил
mCPBA: метахлорпербензойная кислота
Ns: нозил-2-нитробензолсульфонил
Ph: фенил
PdCl2: хлорид палладия
Pd2(dba)3: трис(дибензилиденацетон)дипалладий (0)
p-Tol: п-толил
SEM: 2-(триметилсилил)этоксиметил
SES: 2-(триметилсилил)этансульфонил
tBu: трет-бутил
TBAF: фторид тетра-н-бутиламмония
TBS: трибутилсилил
THF: тетрагидрофуран
Tf: трифторметансульфонил
TFA: трифторуксусная кислота
TFAA: трифторуксусный ангидрид
TMS: триметилсилил
TIPS: триизопропилсилил
Ксантфос: 4,5-бис(дифенилфосфино)-9,9-диметил-9H-ксантен.
(Пример 1-A)
[0339]
Синтез соединения 6i
[Химическая формула 123]

Этап 1
К соединению 1i (18,4 г, 102 ммоль) добавляли тионилхлорид (48,9 г, 411 ммоль), и смесь нагревали с обратным холодильником в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении с получением соединения 2i (20,07 г, выход 99%) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,61(3H, s), 7,52(1H, t, J=8,0 Гц), 7,94(1H, d, J=8,0 Гц), 8,28(1H, d, J=8,0 Гц).
Этап 2
Цианид меди (9,91 г, 111 ммоль), ацетонитрил (100 мл), йодид натрия (30,1 г, 201 ммоль) добавляли в 4-горлую колбу в атмосфере азота, и смесь перемешивали в течение 5 минут при комнатной температуре. К ней добавляли соединение 2i (20,07 г, 101 ммоль) в растворе ацетонитрила (100 мл), и смесь перемешивали в течение 1 часа при комнатной температуре. Растворитель концентрировали при пониженном давлении, и к получаемому остатку добавляли дихлорметан (200 мл). Смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали, фильтрат концентрировали при пониженном давлении с получением соединения 3i (19,40 г, выход 100%) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,69(3H, s), 7,67(1H, t, J=8,0 Гц), 8,05(1H, d, J=8,0 Гц), 8,47(1H, d, J=8,0 Гц).
Этап 3
К соединению 3i (15,34 г, 81 ммоль) добавляли толуол (30 мл), бромид натрия (0,83 г, 8,1 ммоль) и 85 (вес/вес)% серную кислоту (26,1 мл, 403 ммоль), и смесь перемешивали в течение 1 часа при 70°C. Дополнительно туда добавляли 85 (вес/вес)% серную кислоту (26,1 мл, 403 ммоль), и смесь перемешивали в течение 2 часов при 70°C. После охлаждения реакционной смеси в ледяной бане туда добавляли метанол (150 мл), и смесь нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали в ледяной бане и экстрагировали этилацетатом после добавления воды (150 мл). Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным рассолом, сушили над безводным сульфатом магния, и растворитель концентрировали при пониженном давлении. Полученный остаток отверждали этилацетатом-гексаном с получением соединения 4i (11,45 г, выход 64%) в виде оранжевого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,58(3H, s), 3,96(3H, s), 7,49(1H, t, J=8,0 Гц), 7,84(1H, d, J=8,0 Гц), 7,96(1H, d, J=8,0 Гц).
Этап 4
N-((1S,2S)-2-аминоциклогексил)-п-толуолсульфонамид (5,27 мг, 0,02 ммоль), димер дихлор(п-цимол)рутения(II) (6,12 мг, 0,01 ммоль), DMSO (1 мл), триэтиламин (6,1 мг, 0,06 ммоль) добавляли в 3-горлую колбу в атмосфере азота, и смесь перемешивали в течение 1 часа при 80°C. После охлаждения смеси до комнатной температуры туда добавляли соединение 4i (893 мг, 4,0 ммоль), DMSO (3 мл), смесь муравьиная кислота-триэтиламин (молярное отношение 5: 2) (4 мл), и смесь перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой последовательно промывали водой, 1M соляной кислотой, водой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным рассолом, сушили над безводным сульфатом магния, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения 5i (872 мг, выход 97%) в виде оранжевого твердого вещества. По результатам анализа с помощью хиральной колонки для SFC (колонка IF производства Daicel: 4,6×259 мм, 3 мкм) оптическая чистота составила 90% э.и.
1H-ЯМР (CDCl3) δ: 2,51(3H, s), 3,56(1H, d, J=4,3 Гц), 3,79(3H, s), 5,47(1H, d, J=4,3 Гц), 7,35(1H, dd, J=7,8, 8,0 Гц), 7,58(1H, dd, J=1,0, 7,8 Гц), 7,72(1H, dd, J=1,0, 8,0 Гц).
Этап 5
Соединение 5i (5,04 г, 22,4 ммоль) растворяли в т-бутилацетате (50,5 мл), и туда добавляли 70% водный раствор хлорной кислоты (1,93 мл, 22,4 ммоль) при охлаждении льдом. Смесь перемешивали в течение 1 часа. Реакционную смесь выливали в 5% водный раствор бикарбоната натрия, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным рассолом и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении с получением неочищенного соединения 6i (6,14 г, выход неочищенного продукта 97,4%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,22 (s, 9H), 2,53 (s, 3H), 3,69 (s, 3H), 5,31 (s, 1H), 7,32-7,37 (m, 1H), 7,68 (d, J=7,6 Гц, 1H), 7,84 (d, J=7,6 Гц, 1H).
(Пример 1-B)
[0340]
Синтез соединения 14i
[Химическая формула 124]
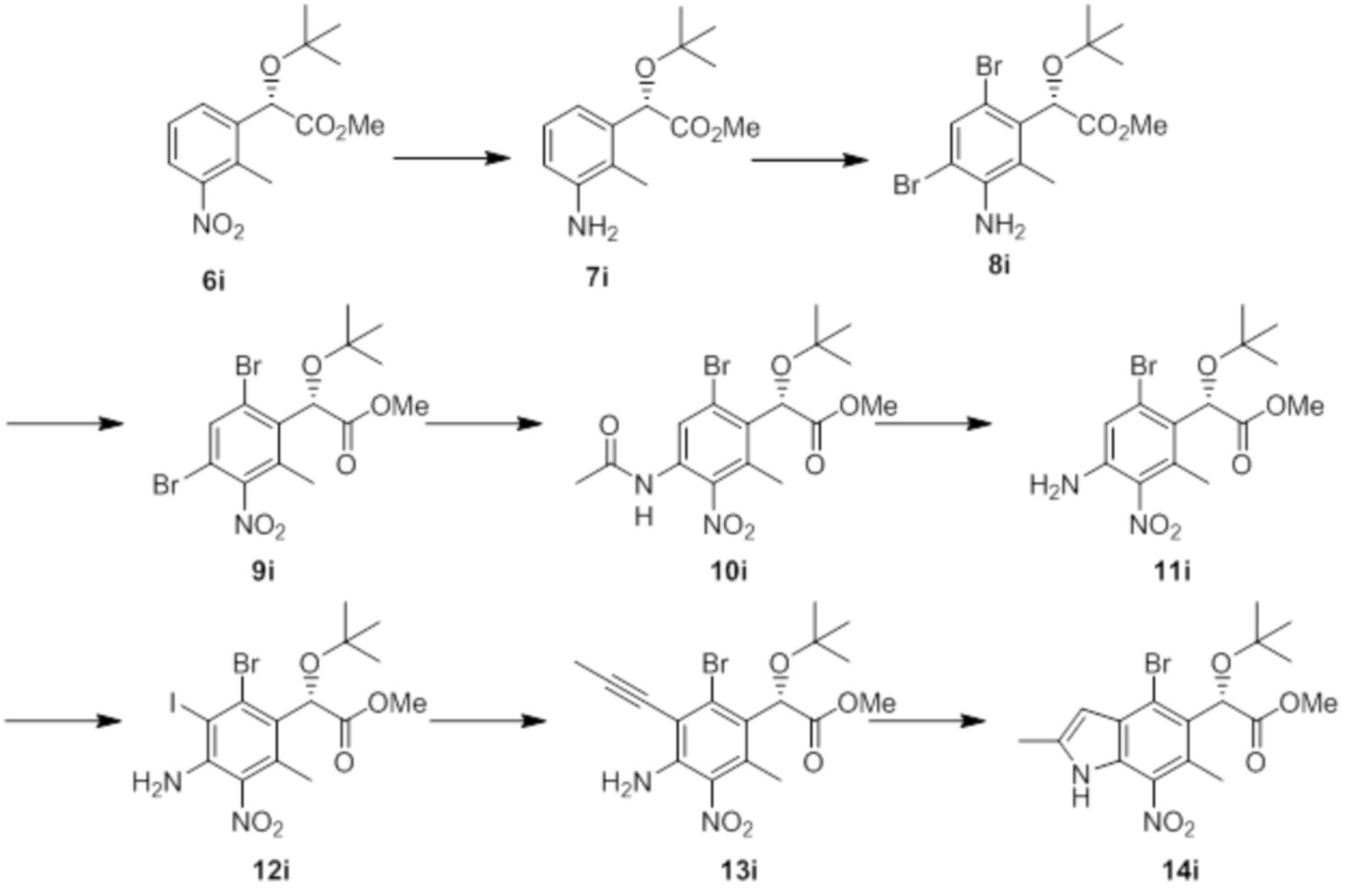
Этап 1
Неочищенное соединение 6i (30,0 г, 107 ммоль) растворяли в этаноле (150 мл) и воде (150 мл), и туда добавляли хлорид аммония (34,2 г, 640 ммоль), железо (17,87 г, 320 ммоль) при комнатной температуре. После того, как смесь перемешивали в течение 1 часа при комнатной температуре, смесь перемешивали в течение 2 часов при 60°C. Реакционную смесь фильтровали через целит, и фильтрат экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, насыщенным рассолом и сушили над безводным сульфатом магния. Растворитель концентрировали при пониженном давлении с получением неочищенного соединения 7i (27 г, выход неочищенного продукта 100%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,21 (s, 9H), 2,21 (s, 3H), 3,60 (brs, 2H), 3,65 (s, 3H), 5,22 (s, 1H), 6,63-6,68 (m, 1H), 6,97-7,04 (m, 1H).
Этап 2
Неочищенное соединение 7i (2,0 г) растворяли в DMA (10 мл), и туда добавляли NBS (3,12 г, 17,51 ммоль) на водяной бане. Смесь перемешивали в течение 1 часа при той же температуре. К реакционной смеси последовательно добавляли по каплям 20% водный раствор тиосульфата натрия и 5% водный раствор гидрокарбоната натрия, и смесь перемешивали в течение 10 минут при комнатной температуре. К смешанному раствору по каплям добавляли воду, и смесь перемешивали в течение 60 минут при комнатной температуре. Осажденное твердое вещество фильтровали с получением соединения 8i (2,5 г, выход 76,8%) в виде бледно-красного твердого вещества.
1H-ЯМР (CDCl3) δ: 1,21 (s, 9H), 2,26 (s, 3H), 3,67 (s, 3H), 4,13(brs, 2H), 5,71 (s, 1H), 7,54 (s, 1H).
Этап 3
К раствору соединения 8i (0,5 г, 1,22 ммоль) и йодида калия (60,6 мг, 0,37 ммоль) в ацетонитриле (4 мл) добавляли по каплям трет-бутилгидропероксид (0,4 мл, 4,64 ммоль) в течение 1 часа при 60°C, и смесь перемешивали при той же температуре в течение 1 часа. Реакционную смесь экстрагировали этилацетатом после последовательного добавления 20% водного раствора тиосульфата натрия и 5% водного раствора бикарбоната натрия. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель концентрировали при пониженном давлении с получением неочищенного соединения 9i (0,4 г, выход неочищенного продукта 76,2%) в виде бледно-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,22(s, 9H), 2,37(s, 3H), 3,71(s, 3H), 5,77(s, 1H), 7,77(s, 1H)
Этап 4
К суспензии соединения 9i (2,2 г, 5,01 ммоль), карбоната цезия (2,45 г, 7,52 ммоль), ацетамида (0,59 г, 10,0 ммоль), рац-BINAP (0,23 г, 0,38 ммоль) в толуоле (11 мл)/DMA (5,5 мл) добавляли бис(дибензилиденацетон)палладий(0) (144 мг, 0,25 ммоль) при 80°C, и смесь перемешивали в течение 1 часа при 110°C. Реакционную смесь экстрагировали этилацетатом после добавления 10% водного раствора хлорида аммония. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-уксусная кислота) с получением соединения 10i (1,8 г, выход 59,7%) в виде бледно-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,21(s, 9H), 2,17(s, 3H), 2,38(s, 3H), 3,70(s, 3H), 5,81(s, 1H), 7,85(s, 1H), 8,45(s, 1H)
Этап 5
К раствору соединения 10i (6 г, 14,38 ммоль) в метаноле (60 мл) добавляли карбонат калия (9,94 г, 71,9 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 3 часов. К реакционной смеси добавляли соляную кислоту 2 моль/л, и смесь экстрагировали хлороформом. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ-метанол) с получением соединения 11i (2,6 г, выход 48%) в виде желтого твердого вещества.
ЖХ/МС (ESI): m/z=374,95 [M+H]+, RT=2,21 мин, условия измерений при ЖХ/МС: (2)
Этап 6
К раствору соединения 11i (3,6 г, 9,59 ммоль) в этаноле (36 мл) добавляли нитрат серебра (3,26 г, 19,19 ммоль) и йод (4,87 г, 19,19 ммоль) при охлаждении льдом, и смесь перемешивали в течение 4 часов при комнатной температуре. Нерастворимые материалы отфильтровывали, и фильтрат экстрагировали хлороформом после добавления водного раствора бикарбоната натрия и водного раствора тиосульфата натрия. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 12i (4,5 г, выход 94%) в виде коричневого твердого вещества.
ЖХ/МС (ESI): m/z=499,10 [M-H]-, RT=2,49 мин, условия измерений при ЖХ/МС: (2)
Этап 7
К раствору соединения 12i (5 г, 9,83 ммоль) в DMF (30 мл) добавляли триэтиламин (4,09 мл, 29,5 ммоль), пропин (приблизительно 4% раствор в DMF, приблизительно 1,0 моль/л) (19,7 мл, 19,7 ммоль), йодид меди (374 мг, 0,20 ммоль), PdCl2 (PPh3)2 (690 мг, 0,983 ммоль), и смесь перемешивали в течение 3 часов при 65°C. Реакционную смесь экстрагировали этилацетатом после добавления 15% водного раствора хлорида аммония. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Затем получаемый остаток обрабатывали активированным углем после добавления метанола. Растворитель концентрировали при пониженном давлении с получением неочищенного соединения 13i (3,7 г, выход неочищенного продукта 91,1%) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,23(s, 9H), 2,22(s, 3H), 2,37(s, 3H), 3,70(s, 3H), 5,26(brs, 1H), 5,85(s, 1H), 7,85(s, 1H), 8,45(s, 1H)
Этап 8
К раствору соединения 13i (3,7 г, 8,93 ммоль) в THF (19 мл) добавляли раствор 1 моль/л TBAF·THF (31,2 мл, 31,2 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 12 часов. Реакционную смесь экстрагировали этилацетатом после добавления 15% водного раствора хлорида аммония. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток отверждали с помощью азеотропии с толуолом. Получаемый остаток фильтровали через силикагель с хлороформом/толуолом (1:1) (16 мл). Остаток отверждали с помощью н-гексана/толуола с получением соединения 14i (1,89 г, выход 51,2%) в виде бледно-зеленого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,23(s, 9H), 2,50(s, 3H), 2,72(s, 3H), 3,68(s, 3H), 6,05(s, 1H), 6,41(s, 1H), 9,43(brs, 1H)
[0341]
(Пример 1-C)
Синтез соединения 19i
[Химическая формула 125]

Этап 1
К раствору соединения 14i (2,12 г, 5,13 ммоль) в диметилформамиде (21,2 мл) добавляли 4-метилфенилбороновую кислоту (1,40 г, 10,26 ммоль), PdCl2 (dtbpf) (334 мг, 0,51 ммоль) и карбонат калия (2,12 г, 5,13 ммоль), и смесь перемешивали в атмосфере азота в течение 50 минут при 130°C. Реакционную смесь охлаждали до комнатной температуры и экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 15i в виде желтого твердого вещества (2,1 г, 90%).
MS(ESI) m/z: 425,27 [M+H]+, RT=3,04 мин, условия измерений при ЖХ/МС: (1)
Этап 2
К раствору соединения 15i (2,1 г, 4,95 ммоль) в этаноле (21 мл) и воде (4 мл) добавляли порошок железа (1,38 г, 24,7 ммоль) и хлорид аммония (2,65 г, 49,5 ммоль), и смесь перемешивали в течение 50 минут при 90°C. Реакционную смесь охлаждали до комнатной температуры и фильтровали через целит насыщенным водным раствором бикарбоната натрия и этилацетатом. Фильтрат экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии DIOL (гексан-этилацетат) с получением соединения 16i в виде коричневого твердого вещества (1,7 г, 87%).
MS(ESI) m/z: 395,25 [M+H]+, RT=2,68 мин, условия измерений при ЖХ/МС: (1)
Этап 3
К раствору соединения 16i (4,9 г, 12,4 ммоль) в дихлорметане (25 мл) добавляли пиридин (2,51 мл, 31,1 ммоль) и 2-триметилсилилэтилсульфонилхлорид (2,83 мл, 14,9 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа при комнатной температуре. Реакционный раствор экстрагировали дихлорметаном после добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой промывали водной соляной кислотой 2 моль/л и насыщенным рассолом, сушили над безводным сульфатом магния, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 17i (6,6 г, 86%, чистота 90%) в виде бесцветного пенообразного соединения.
MS(ESI) m/z: 559,38 [M+H]+, RT=3,01 мин, условия измерений при ЖХ/МС: (1)
Этап 4
К раствору соединения 17i (6,6 г, 10,7 ммоль) в диметилацетамиде (66 мл) добавляли карбонат цезия (9,05 г, 27,8 ммоль) и 1,2-дибромэтан (2,61 г, 13,9 ммоль), и смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь экстрагировали этилацетатом после добавления водной соляной кислоты 2 моль/л и воды. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 18i (6,2 г, 98%) в виде бесцветного пенообразного соединения.
MS(ESI) m/z: 602,52 [M+H2O]+, RT=2,25 мин, условия измерений при ЖХ/МС: (1)
Этап 5
К раствору соединения 18i (6,2 г, 10,5 ммоль) в тетрагидрофуране (15 мл) добавляли раствор 1 моль/л фторида тетрабутиламмония в тетрагидрофуране (27 мл, 27,0 ммоль), и смесь перемешивали в течение 1 часа при 60°C. Реакционную смесь экстрагировали этилацетатом после добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой промывали насыщенным рассолом, сушили над безводным сульфатом магния, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 19i (4,2 г, 96%) в виде бесцветного пенообразного соединения.
MS(ESI) m/z: 421,40 [M+H]+, RT=2,85 мин, условия измерений при ЖХ/МС: (1)
(Пример 1)
[0342]
[Химическая формула 126]

Первый этап
К раствору бис(пинаколато)дибора (136 мг, 0,535 ммоль) в гексане (2 мл) добавляли ди-трет-бутил-2,2'-бипиридин (28,7 мг, 0,107 ммоль) и 1,5-циклооктадиенметоксииридий (23,6 мг, 0,036 ммоль), и смесь перемешивали в атмосфере азота в течение 10 минут при 50°C. Затем туда добавляли THF (0,4 мл) и соединение 1 (150 мг, 0,357 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 2 (154 мг, выход 79%).
ЖХ/МС (ESI): m/z=547,00 [M+H]+
Второй этап
К раствору соединения 2 (70 мг, 0,128 ммоль) в DMF (1 мл) добавляли водный раствор 2 моль/л карбоната калия (0,192 мл, 0,384 ммоль), раствор 1 моль/л винилбромид·THF (1,28 мл, 1,28 ммоль), PdCl2 (dtbpf) (8,35 мг, 0,013 ммоль), и смесь перемешивали в атмосфере азота при 60°C в течение 30 минут. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 3 (32,3 мг, выход 57%).
ЖХ/МС (ESI): m/z=447,05 [M+H]+
Третий этап
К раствору соединения 3 (30 мг, 0,067 ммоль) в метаноле (2 мл) добавляли 10% Pd/C (10 мг, 0,004 ммоль), и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 30 минут. Затем реакционную смесь фильтровали через целит, и фильтрат концентрировали при пониженном давлении с получением соединения 4 (25 мг, выход 83%).
ЖХ/МС (ESI): m/z=449,10 [M+H]+
Четвертый этап
К раствору соединения 4 (25 мг, 0,056 ммоль) в этаноле (2 мл) и THF (2 мл) добавляли водный раствор 2 моль/л гидроксида натрия (0,279 мл, 0,58 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 4,5 часа. Реакционную смесь экстрагировали хлороформом после добавления соляной кислоты 2 моль/л. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ-метанол) с получением соединения I-6 (20 мг, выход 83%).
ЖХ/МС (ESI): m/z=435,10 [M+H]+
1H-ЯМР (CDCl3)δ: 0,90(s, 9H), 1,24-1,30(3H, m), 2,43(6H, s), 2,67-2,74(2H, m), 2,77(s, 3H), 3,39-3,45(2H, m), 3,95-4,01(2H, m), 5,59(1H, s), 5,92(1H, s), 7,41(1H, d, J=7,3 Гц), 7,58(1H, d, J=7,3 Гц), 10,0(1H, brs)
[0343]
(Пример 2)
[0344]
[Химическая формула 127]
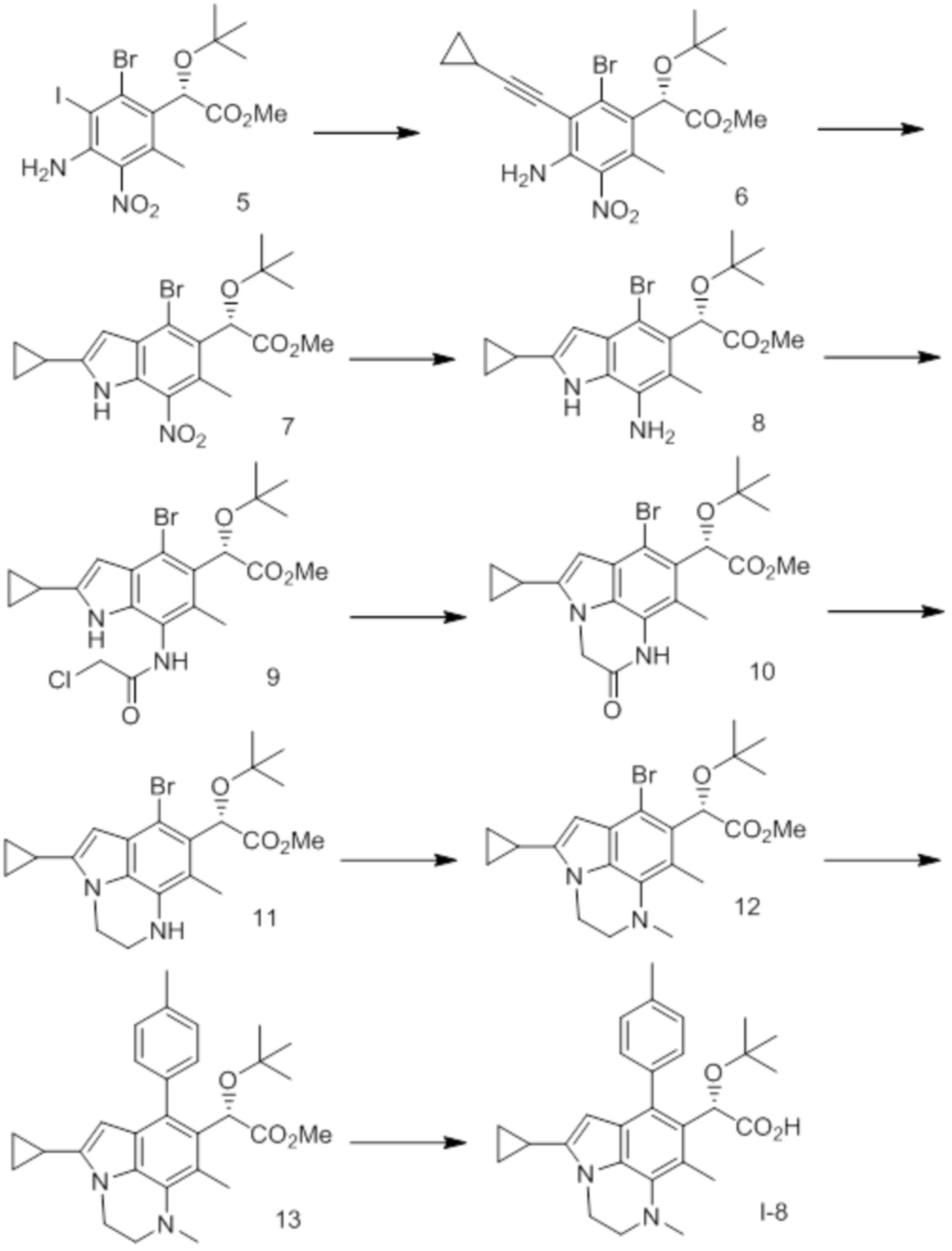
[0345]
Первый этап
К раствору соединения 5 (1,00 г, 2,00 ммоль) в DMF (10,0 мл) добавляли этинилциклопропан (0,339 мл, 4,00 ммоль), триэтиламин (0,832 мл, 6,00 ммоль), дихлорид бистрифенилфосфинпалладия (140 мг, 0,200 ммоль) и йодид меди(I) (76,0 мг, 0,400 ммоль), и смесь перемешивали в атмосфере азота в течение 1 часа 23 минут при 80°C. Реакционную смесь охлаждали до комнатной температуры и экстрагировали этилацетатом после добавления ледяной воды и насыщенного водного раствора хлорида аммония. Органический слой промывали насыщенным рассолом, сушили над безводным сульфатом натрия, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 6 (720 мг, выход 81,9%).
MS(ESI) m/z: 439,0, 441,0 [M+H]+
Второй этап
К раствору соединения 6 (718 мг, 1,63 ммоль) в THF (1,63 мл) добавляли раствор 1 моль/л TBAF в THF (2,45 мл, 2,45 ммоль), и смесь перемешивали в течение 6 часов 38 минут при 75°C. Реакционную смесь охлаждали до комнатной температуры, экстрагировали этилацетатом после добавления ледяной воды, насыщенного водного раствора хлорида аммония и водного раствора 2 моль/л соляной кислоты. Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом, сушили над безводным сульфатом натрия, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 7 (602 мг, выход 83,8%).
MS(ESI) m/z: 439,0, 441,0 [M+H]+
[0346]
Третий этап
К смешанному раствору соединения 7 (600 мг, 1,37 ммоль) в этаноле (10,0 мл) и воде (2,00 мл) добавляли хлорид аммония (1,09 г, 20,5 ммоль) и порошок железа (572 мг, 10,3 ммоль), и смесь перемешивали в течение 90 минут при 90°C. Реакционную смесь охлаждали до комнатной температуры и фильтровали через целит. Фильтрат экстрагировали этилацетатом после добавления ледяной воды, насыщенного водного раствора хлорида аммония и насыщенного водного раствора бикарбоната натрия. Органический слой промывали насыщенным рассолом, сушили над безводным сульфатом натрия, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 8 (420 мг, выход 75,1%).
MS(ESI) m/z: 409,1, 411,1 [M+H]+
Четвертый этап
К раствору соединения 8 (418 мг, 1,02 ммоль) в дихлорметане (4,18 мл) добавляли пиридин (0,0980 мл, 1,23 ммоль) и хлорацетилхлорид (0,124 мл, 1,53 ммоль) при охлаждении льдом, и смесь перемешивали при той же температуре в течение 48 минут. Реакционную смесь экстрагировали этилацетатом после добавления ледяной воды и водного раствора 2 моль/л соляной кислоты. Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом, сушили над безводным сульфатом натрия, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 9 (463 мг, выход 93,3%).
MS(ESI) m/z: 485,0, 487,0 [M+H]+
[0347]
Пятый этап
К раствору соединения 9 (460 мг, 0,947 ммоль) в DMF (4,60 мл) добавляли гидрид натрия (60 вес.%) (95,0 мг, 2,37 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение одного часа 42 минут. Реакционную смесь экстрагировали этилацетатом после добавления ледяной воды и водного раствора 2 моль/л соляной кислоты. Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом, сушили над безводным сульфатом натрия, и растворитель концентрировали при пониженном давлении. Получаемый остаток отверждали гексаном-этилацетатом с получением соединения 10 (288 мг, выход 67,7%).
MS(ESI) m/z: 449,0, 450,9 [M+H]+
Шестой этап
К раствору соединения 10 (287 мг, 0,639 ммоль) в THF (2,87 мл) добавляли комплекс боран-тетрагидрофуран (0,92 моль/л, раствор в THF) (2,08 мл, 1,92 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа 19 минут при 50°C. Реакционную смесь охлаждали до комнатной температуры и экстрагировали этилацетатом после последовательного добавления ледяной воды, насыщенного водного раствора хлорида аммония и насыщенного водного раствора бикарбоната натрия. Органический слой промывали насыщенным рассолом, сушили над безводным сульфатом натрия, и растворитель концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на аминосиликагеле (гексан-этилацетат) с получением соединения 11 (234 мг, выход 84,2%).
MS(ESI) m/z: 435,4, 437,4 [M+H]+
[0348]
Седьмой этап
К раствору соединения 11 (232 мг, 0,533 ммоль) в DMF (2,32 мл) добавляли карбонат калия (147 мг, 1,07 ммоль) и йодметан (0,100 мл, 1,56 ммоль), и смесь перемешивали при комнатной температуре в течение 14 часов 35 минут. Реакционную смесь экстрагировали этилацетатом после добавления ледяной воды и насыщенного водного раствора хлорида аммония. Органический слой промывали насыщенным рассолом, сушили над безводным сульфатом натрия, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 12 (211 мг, выход 88,1%).
MS(ESI) m/z: 449,3, 451,3 [M+H]+
Восьмой этап
К смешанному раствору соединения 12 (210 мг, 0,467 ммоль) в DMF (2,10 мл) и воды (0,210 мл) добавляли 4-метилфенилбороновую кислоту (95,0 мг, 0,701 ммоль), карбонат калия (129 мг, 0,935 ммоль) и PdCl2 (dtbpf) (30,5 мг, 0,0470 ммоль), и смесь перемешивали в атмосфере азота при 100°C 20 минут. Реакционную смесь охлаждали до комнатной температуры, экстрагировали этилацетатом после добавления ледяной воды и водного раствора 2 моль/л соляной кислоты. Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом, сушили над безводным сульфатом натрия, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 13 (192 мг, выход 89,2%).
MS(ESI) m/z: 461,6 [M+H]+
[0349]
Девятый этап
Соединение I-8 (123 мг, выход 66,8%) получали посредством реакции соединения 13 (190 мг, 0,412 ммоль) аналогично четвертому этапу в примере 1.
MS(ESI) m/z: 447,2 [M+H]+
[0350]
(Пример 3)
[0351]
[Химическая формула 128]
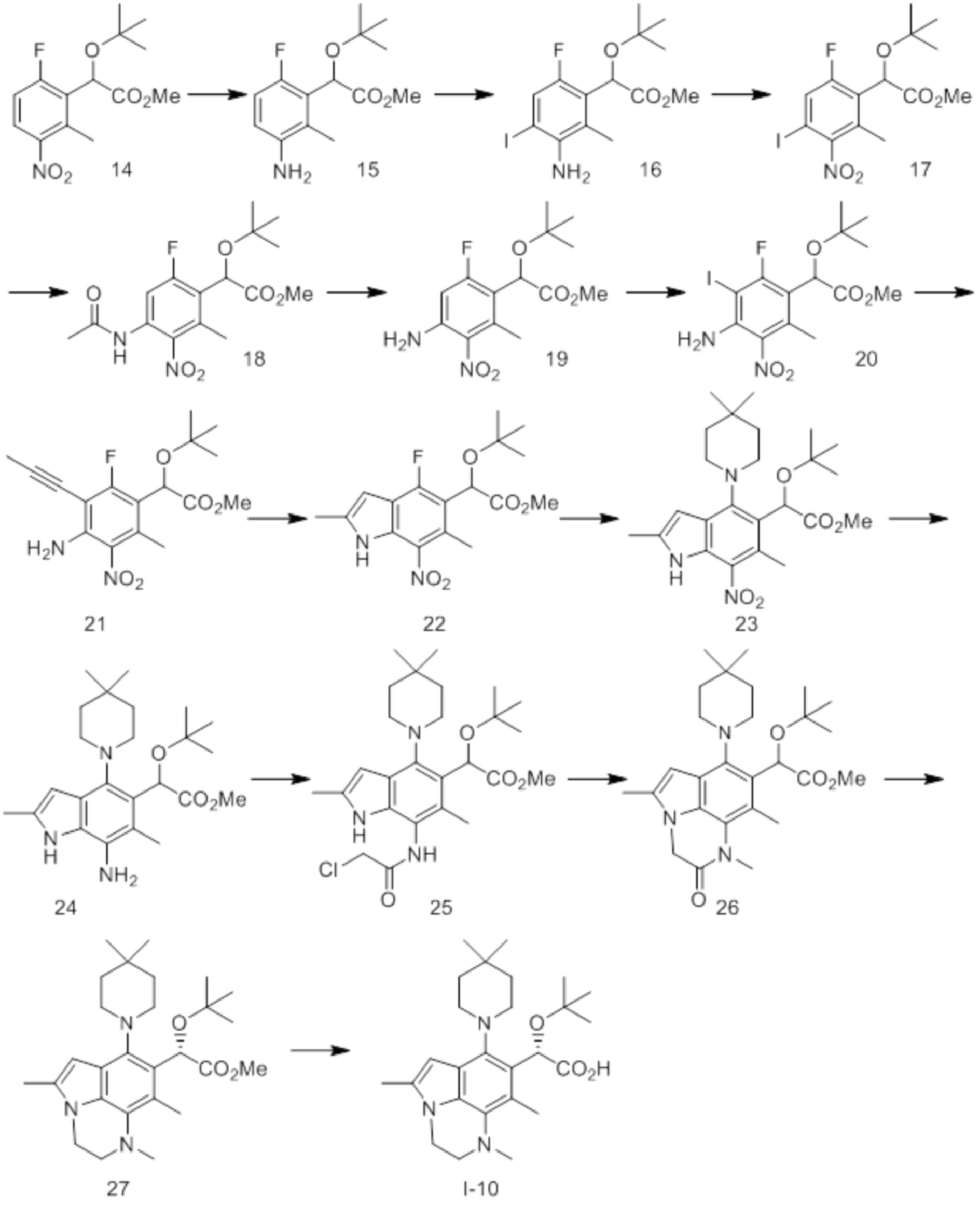
[0352]
Первый этап
К раствору соединения 14 (6,2 г, 20,7 ммоль) в метаноле (62 мл) добавляли 10% Pd/C (4,66 г, 2,07 ммоль), и смесь перемешивали в атмосфере водорода при 4 атм при комнатной температуре в течение 3 часов. Реакционную смесь фильтровали через целит, и растворитель фильтрата концентрировали при пониженном давлении с получением неочищенного продукта соединения 15 (5,77 г).
1H-ЯМР (CDCl3)δ: 6,76 (1H, t, J=9,2 Гц), 6,59 (1H, dd, J=8,7, 4,9 Гц), 5,56 (1H, s), 3,67 (3H, s), 3,48 (2H, s), 2,18 (3H, s), 1,21 (9H, s).
Второй этап
К смешанному раствору соединения 15 (5,77 г, 21,4 ммоль) в 1,2-дихлорэтане (29 мл) и метаноле (12 мл) добавляли дихлорйодат бензилтриметиламмония (7,46 г, 21,4 ммоль) и карбонат кальция (2,14 г, 21,4 ммоль) при 0°C, и смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь экстрагировали этилацетатом после добавления 10% водного раствора сульфита натрия. Органический слой промывали 10% водным раствором сульфита натрия и насыщенным рассолом и сушили с помощью безводного сульфата магния. После концентрирования получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 16 (2,4 г, выход 28%).
1H-ЯМР (CDCl3)δ: 7,31 (1H, d, J=9,1 Гц), 5,50 (1H, s), 3,95 (2H, s), 3,67 (3H, s), 2,25 (3H, s), 1,20 (9H, s).
[0353]
Третий этап
К раствору соединения 16 (2,4 г, 6,07 ммоль) в толуоле (24 мл) добавляли mCPBA (4,19 г, 24,3 ммоль) при 0°C, и смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь экстрагировали этилацетатом после добавления насыщенного водного раствора тиосульфата натрия. Органический слой промывали насыщенным водным раствором бикарбоната натрия (50 мл) и насыщенным рассолом (50 мл) и сушили над безводным сульфатом магния. После концентрирования получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 17 (1,56 г, выход 60%).
1H-ЯМР (CDCl3)δ: 7,47 (1H, d, J=8,6 Гц), 5,52 (1H, s), 3,71 (3H, s), 2,36 (3H, s), 1,21 (9H, s).
Четвертый этап
К раствору соединения 17 (1,56 г, 3,67 ммоль) в диоксане (15,6 мл) добавляли карбонат цезия (2,39 г, 7,34 ммоль), ацетамид (433 мг, 7,34 ммоль), рац-BINAP (343 мг, 0,55 ммоль), бис(дибензилиденацетон)палладий (211 мг, 0,37 ммоль), смесь перемешивали в атмосфере азота при 100°C в течение 4 часов. Реакционную смесь экстрагировали этилацетатом после добавления соляной кислоты 2 моль/л. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 18 (1,3 г, выход 99%).
1H-ЯМР (CDCl3)δ: 8,19 (1H, s), 8,03 (1H, d, J=11,6 Гц), 5,55 (1H, s), 3,71 (3H, s), 2,38 (3H, s), 2,20 (3H, s), 1,22 (9H, s).
[0354]
Пятый этап
К раствору соединения 18 (1,3 г, 3,65 ммоль) в метаноле (13 мл) добавляли карбонат калия (1,5 г, 11 ммоль), и смесь перемешивали в течение 5 часов при 60°C. После концентрирования растворителя реакционной смеси туда добавляли соляную кислоту 2 моль/л с последующей экстракцией этилацетатом, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток растворяли в метаноле (6 мл) и толуоле (6 мл), и туда добавляли раствор 2 моль/л триметилсилилдиазометана-гексана (1,8 мл, 3,7 мл). Смесь перемешивали в течение 1 часа при комнатной температуре и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ-метанол) с получением соединения 19 (800 г, выход 70%).
1H-ЯМР (CDCl3)δ: 6,37 (1H, d, J=11,3 Гц), 5,44 (1H, s), 4,89 (2H, s), 3,70 (3H, s), 2,39 (3H, s), 1,21 (9H, s).
Шестой этап
К раствору соединения 19 (800 мг, 2,55 ммоль) в этаноле (8,0 мл) добавляли нитрат серебра (865 мг, 5,1 ммоль) и йод (1,3 г, 5,1 ммоль), и смесь перемешивали в течение 2 часов при комнатной температуре. Нерастворимые материалы отфильтровывали через целит, и фильтрат экстрагировали этилацетатом после добавления водного раствора гидрокарбоната натрия и водного раствора тиосульфата натрия. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 20 (477 мг, выход 43%).
1H-ЯМР (CDCl3)δ: 5,47 (1H, s), 5,33 (2H, s), 3,71 (3H, s), 2,35 (3H, s), 1,21 (9H, s).
[0355]
Седьмой этап
К раствору соединения 20 (100 мг, 0,23 ммоль) в DMF (1,0 мл) добавляли триэтиламин (0,094 мл, 0,68 ммоль) и раствор 1 моль/л пропиндиметилформамида (0,45 мл, 0,45 ммоль), йодид меди (8,7 мг, 0,045 ммоль) и PdCl2(PPh3)2 (16 мг, 0,023 ммоль), и смесь перемешивали в атмосфере азота в течение 1 часа при 80°C. Реакционную смесь охлаждали до комнатной температуры и экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 21 (471 мг, выход 72%).
1H-ЯМР (CDCl3)δ: 5,49 (2H, s), 5,45 (1H, s), 3,69 (3H, s), 2,38 (3H, s), 2,19 (3H, s), 1,21 (9H, s).
Восьмой этап
К раствору соединения 21 (243 мг, 0,69 ммоль) в THF (2,4 мл) добавляли раствор 1 моль/л TBAF·THF (1,38 мл, 1,38 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 1 часа. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 22 (230 мг, выход 95%).
1H-ЯМР (CDCl3)δ: 9,56 (1H, s), 6,39 (1H, s), 5,73 (1H, s), 3,69 (3H, s), 2,73 (3H, s), 2,49 (3H, s), 1,22 (9H, s).
[0356]
Девятый этап
К раствору соединения 22 (290 мг, 0,82 ммоль) в DMSO (2,9 мл) добавляли карбонат калия (455 мг, 3,29 ммоль) и 4,4-диметилпиперидин (936 мг, 6,6 ммоль), и смесь перемешивали в атмосфере азота в течение 2 часов при 120°C. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования получаемый остаток очищали с помощью хроматографии на силикагеле DNH (гексан-этилацетат) с получением соединения 23 (140 мг, выход 38%).
MS(ESI) m/z: 446 [M+H]+
Десятый этап
К раствору соединения 23 (140 мг, 0,31 ммоль) в метаноле (1,4 мл) добавляли 10% Pd/C (350 мг, 0,15 ммоль), смесь перемешивали в атмосфере водорода при 4 атм в течение 15 часов. Реакционную смесь фильтровали через целит, и фильтрат концентрировали с получением соединения 24 (119 мг) в виде неочищенного продукта.
MS(ESI) m/z: 416 [M+H]+
[0357]
Одиннадцатый этап
Соединение 25 (117 мг) получали в виде неочищенного продукта посредством реакции соединения 24 (119 мг) аналогично четвертому этапу в примере 2.
MS(ESI) m/z: 492 [M+H]+
Двенадцатый этап
Соединение 26 (94 мг, выход 3 этапов 84%) получали посредством реакции соединения 25 (117 мг, 0,24 ммоль) аналогично пятому и седьмому этапам в примере 2.
MS(ESI) m/z: 470 [M+H]+
[0358]
Тринадцатый этап
Соединение 27 (23 мг, 25% выход) получали посредством реакции соединения 26 (94 мг, 0,20 ммоль) аналогично шестому этапу в примере 2.
MS(ESI) m/z: 456 [M+H]+
Четырнадцатый этап
К смешанному раствору соединения 27 (23 мг, 0,050 ммоль) в THF (0,23 мл), метаноле (0,23 мл) и воде (0,02 мл) добавляли водный раствор 2 ммоль/л гидроксида натрия (0,13 мл, 0,25 ммоль), и смесь перемешивали в атмосфере азота в течение 4 часов при 70°C. Реакционную смесь экстрагировали хлороформом после добавления соляной кислоты 0,1 ммоль/л. Органический слой отделяли от водного слоя с помощью фазового сепаратора органического слоя. После концентрирования органического слоя оптическое разделение проводили с помощью хроматографии DIOL (хлороформ-метанол) и жидкостной хроматографии с последующей очисткой с получением соединения I-10 (5 мг, выход 22%).
MS(ESI) m/z: 442 [M+H]+
[0359]
(Пример 4)
[0360]
[Химическая формула 129]

[0361]
Первый этап
К раствору соединения 28 (3,1 г, 7,32 ммоль) в DMF (30 мл) добавляли водный раствор 2 моль/л карбоната калия (7,32 мл, 14,65 ммоль), п-хлорфенилбороновую кислоту (1,72 мг, 11,0 ммоль) и PdCl2 (dppf) (536 мг, 0,732 ммоль), и смесь перемешивали в атмосфере азота в течение 1 часа при 100°C. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с помощью выпарного аппарата. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 29 (2,61 г, выход 78%).
ЖХ/МС (ESI): m/z=454,90 [M+H]+
Второй этап
Соединение 30 (239 мг, выход 82%) получали посредством реакции соединения 29 (300 мг, 0,659 ммоль) аналогично шестому этапу в примере 2.
ЖХ/МС (ESI): m/z=441,00 [M+H]+
[0362]
Третий этап
К раствору соединения 30 (80 мг, 0,181 ммоль) в пиридине (0,5 мл) добавляли метансульфоновый ангидрид (63,2 мг, 0,363 ммоль), и смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь экстрагировали хлороформом после добавления соляной кислоты 2 моль/л. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с помощью выпарного аппарата. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ-метанол) с получением соединения 31 (87,1 мг, выход 93%).
ЖХ/МС (ESI): m/z=519,00[M+H]+
Четвертый этап
Соединение I-19 (35 мг, выход 41%) получали посредством реакции соединения 31 (87,1 мг, 0,168 ммоль) аналогично четвертому этапу в примере 1.
ЖХ/МС (ESI): m/z=505,00 [M+H]+
1H-ЯМР (CDCl3)δ: 0,94(s, 9H), 2,34(s, 3H), 2,45(s, 3H), 3,08(s, 3H), 3,45(brs, 1H), 4,09-4,41(m, 3H), 5,41(s, 1H), 5,89(s, 1H), 7,37-7,47(m, 3H), 7,67-7,76(m, 1H)
[0363]
(Пример 5)
[0364]
[Химическая формула 130]
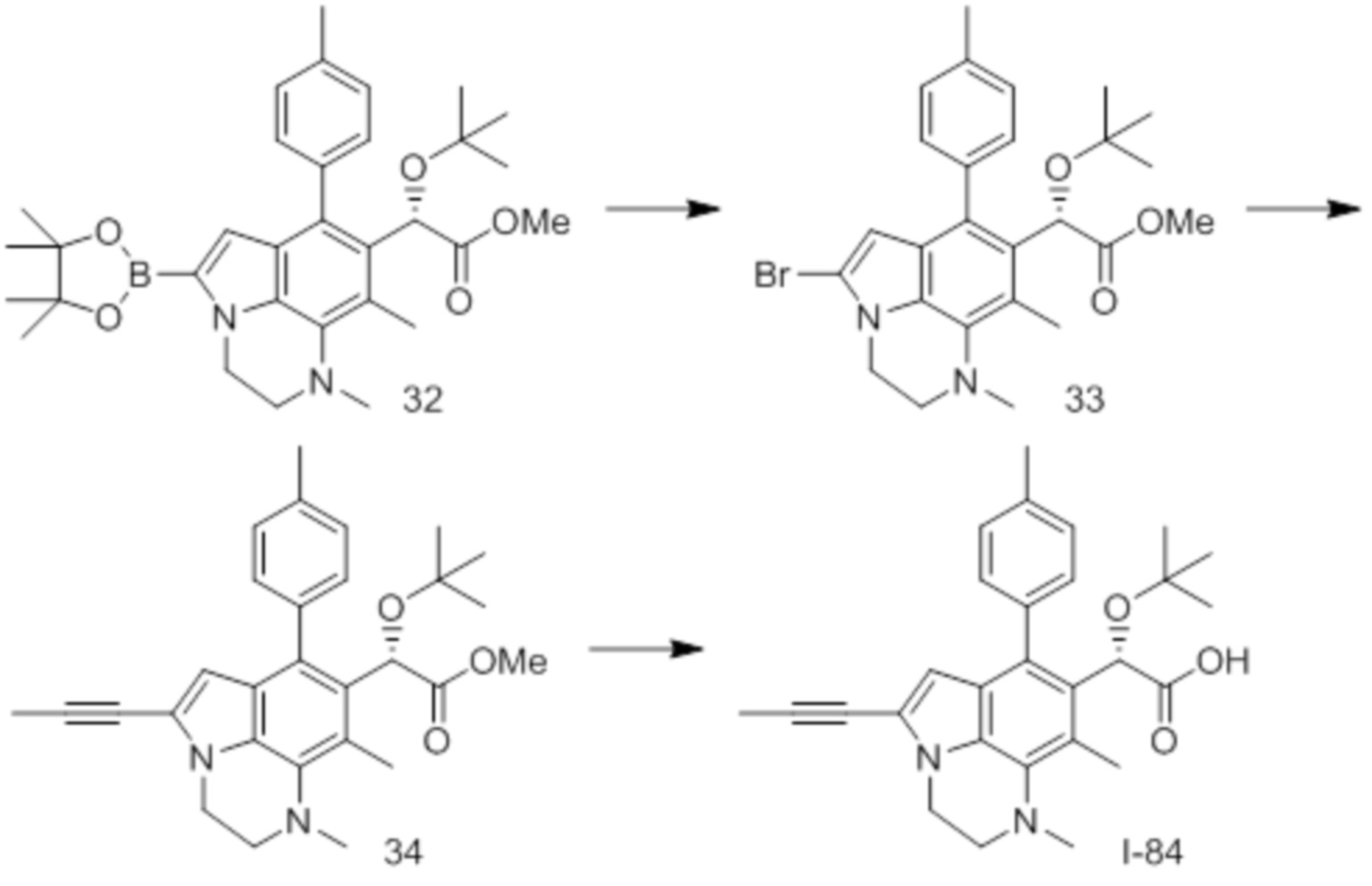
Первый этап
К смешанному раствору соединения 32 (300 мг, 0,549 ммоль) в метаноле (8 мл) и воде (2 мл) добавляли бромид меди(II) (368 мг, 1,65 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 30 минут. Реакционную смесь экстрагировали хлороформом после добавления воды. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением неочищенного продукта (187 мг) соединения 33.
MS(ESI) m/z: 499,00, 500,80 [M+H]+
Второй этап
К раствору неочищенного продукта соединения 33 (130 мг, 0,260 ммоль) в DMF (2 мл) добавляли триэтиламин (0,108 мл, 0,781 ммоль), йодид меди(I) (9,91 мг, 0,052 ммоль), дихлорид бис(трифенилфосфин)палладия(II) (18,3 мг, 0,026 ммоль) и раствор 1 моль/л пропин в DMF (0,521 мл, 0,521 ммоль), и смесь перемешивали в атмосфере азота в течение 3,5 часа при 60°C. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (этилацетат-гексан) с получением неочищенного продукта (83,0 мг) соединения 34.
MS(ESI) m/z: 459,2 [M+H]+
Третий этап
Соединение I-84 (26,0 мг, выход 3 этапов 16%) получали посредством реакции неочищенного продукта соединения 34 (80 мг, 0,174 ммоль) аналогично четвертому этапу в примере 1.
1H-ЯМР (CDCl3) δ: 0,90 (s, 9H), 2,10 (s, 3H), 2,42 (s, 3H), 2,43 (s, 3H), 2,77 (s, 3H), 3,37-3,44 (m, 2H), 4,05-4,12 (m, 2H), 5,59 (s, 1H), 6,34 (s, 1H), 7,22-7,27 (m, 2H), 7,37 (d, J=7,8 Гц, 1H), 7,57 (d, J=6,8 Гц, 1H), 10,01 (s, 1H).
[0365]
(Пример 6)
[0366]
[Химическая формула 131]
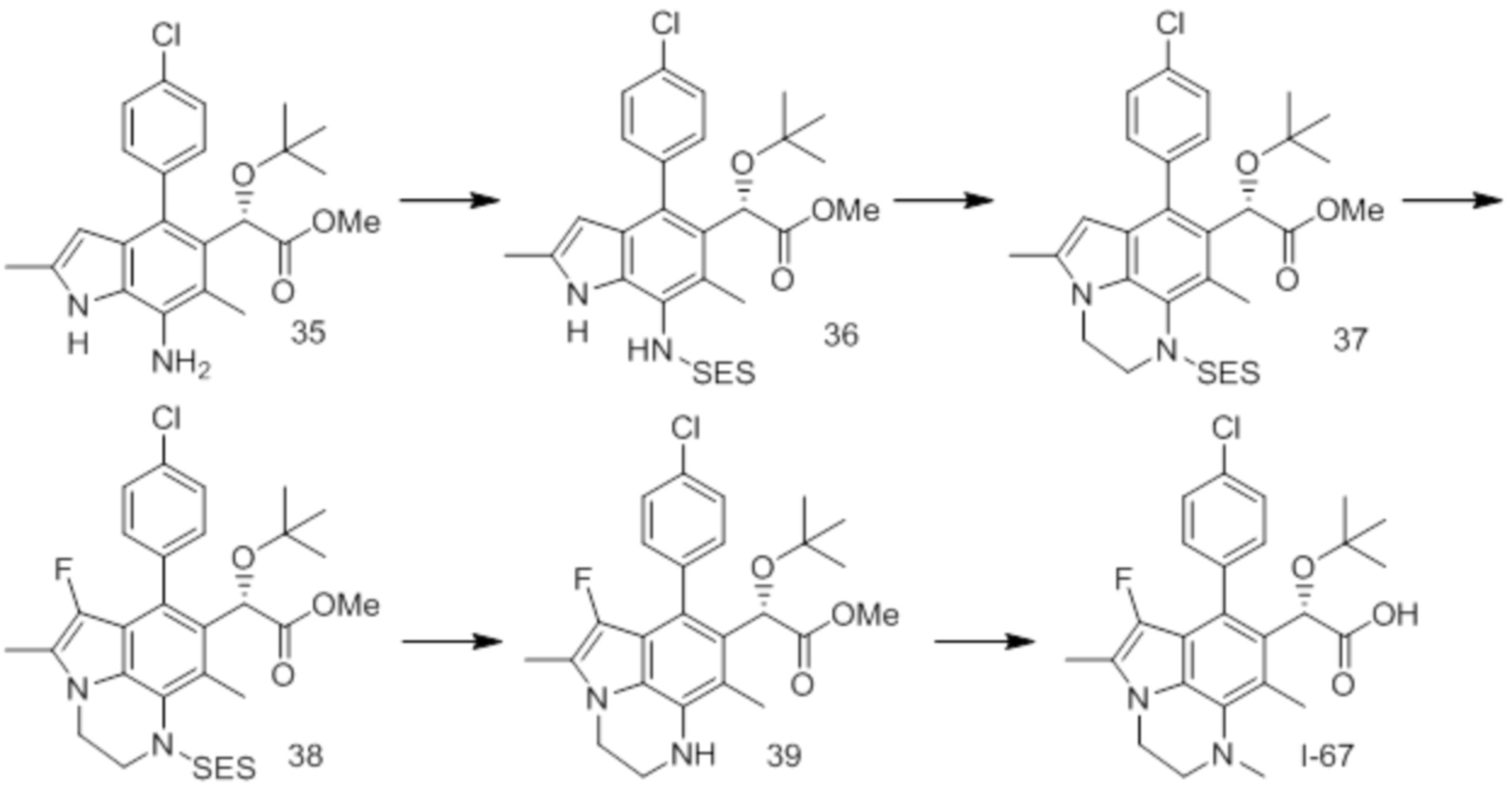
Первый этап
К раствору соединения 35 (5,92 г, 14,3 ммоль) и пиридина (2,88 мл, 35,6 ммоль) в дихлорметане добавляли раствор 2-(триметилсилил)этансульфонилхлорида (5,72 г, 28,5 ммоль) в дихлорметане при охлаждении льдом, смесь перемешивали в течение 16,5 часа при комнатной температуре. Реакционную смесь экстрагировали хлороформом после добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой промывали водным растворос 1 моль/л соляной кислоты и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 36 (7. 03 г, выход 85%).
1H-ЯМР (CDCl3) δ: 0,00 (s, 9H), 0,92 (s, 9H), 1,05-1,12 (m, 2H), 2,37 (s, 3H), 2,48 (s, 3H), 3,02-3,10 (m, 2H), 3,71 (s, 3H), 5,27 (s, 1H), 5,75-5,79 (m, 1H), 6,15 (s, 1H), 7,35-7,39 (m, 1H), 7,43-7,50 (m, 3H), 9,04 (s, 1H).
Второй этап
К раствору соединения 36 (1,14 г, 1,97 ммоль) в DMF (12 мл) добавляли карбонат цезия (1,29 г, 3,95 ммоль) и 1,2-дибромэтан (0,255 мл, 2,96 ммоль), и смесь перемешивали при комнатной температуре в течение 18,5 часа. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 37 (1,13 г, выход 95%).
MS(ESI) m/z: 605,1 [M+H]+
Третий этап
К раствору соединения 37 (30,0 мг, 0,050 ммоль) в ацетонитриле (1 мл) добавляли 1-хлорметил-4-фтор-1,4-диазониабицикло[2.2.2]октана бис(тетрафторборат) (selectfluor (R), 26,3 мг, 0,074 ммоль) при охлаждении льдом, и смесь перемешивали в течение 30 минут при охлаждении льдом. Реакционную смесь экстрагировали хлороформом после добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 38 (11,6 мг, выход 38%).
MS(ESI) m/z: 623,0 [M+H]+
Четвертый этап
К раствору соединения 38 (110 мг, 0,176 ммоль) в THF (2 мл) добавляли раствор 1 моль/л TBAF THF (0,353 мл, 0,353 ммоль), и смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь экстрагировали хлороформом после добавления воды. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 39 (73,0 мг, выход 90%).
MS(ESI) m/z: 459,0 [M+H]+
Пятый этап
Соединение I-67 (31,3 мг, выход 2 этапов 43%) получали посредством реакции соединения 39 (73,0 мг, 0,159 ммоль) аналогично седьмому этапу в примере 2 и четвертому этапу примера 1.
1H-ЯМР (CDCl3) δ: 0,93 (s, 9H), 2,30 (s, 3H), 2,42 (s, 3H), 2,76 (s, 3H), 3,39-3,48 (m, 2H), 3,87-3,94 (m, 2H), 5,43 (s, 1H), 7,38-7,44 (m, 3H), 7,67 (d, J=7,8 Гц, 1H), 9,96 (s, 1H).
[0367]
(Пример 7)
[0368]
[Химическая формула 132]

Первый этап
К смешанному раствору соединения 40 (1,78 г, 3,21 ммоль) в метаноле (10 мл) и THF (10 мл) добавляли 10% гидроксид палладия (451 мг, 0,321 ммоль), и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 3 часов. Нерастворимые материалы удаляли с помощью фильтрации целитом, и растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (хлороформ-метанол) с получением соединения 41 (1,50 г).
1H-ЯМР (CDCl3) δ: 0,90 (s, 9H), 2,45 (s, 3H), 2,47 (s, 3H), 2,81 (s, 3H), 3,39-3,47 (m, 2H), 3,75 (s, 3H), 4,42-4,49 (m, 1H), 4,50-4,56 (m, 1H), 5,47 (s, 1H), 7,05 (s, 1H), 7,26-7,30 (m, 2H), 7,32-7,36 (m, 1H), 7,42-7,47 (m, 1H).
Второй этап
К раствору соединения 41 (300 мг, 0,646 ммоль) в DMF (2 мл) добавляли аммиак 0,5 моль/л в 1,4-диоксане (6,46 мл, 3,23 ммоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (491 мг, 1,29 ммоль), и смесь перемешивали в течение 25 минут при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 42 (299 мг, выход 100%).
MS(ESI) m/z: 464,1 [M+H]+
Третий этап
К раствору соединения 42 (290 мг, 0,626 ммоль) в THF (3 мл) добавляли триэтиламин (0,173 мл, 1,25 ммоль) и трифторуксусный ангидрид (0,132 мл, 0,938 ммоль), и смесь перемешивали при комнатной температуре. Реакционную смесь экстрагировали хлороформом после добавления воды. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 43 (270 мг, выход 97%).
1H-ЯМР (CDCl3) δ: 0,89 (s, 9H), 2,44 (s, 3H), 2,46 (s, 3H), 2,82 (s, 3H), 3,43-3,52 (m, 2H), 3,75 (s, 3H), 4,16-4,24 (m, 2H), 5,45 (s, 1H), 6,80 (s, 1H), 7,24-7,30 (m, 3H), 7,41-7,44 (m, 1H).
Четвертый этап
К раствору соединения 43 (270 мг, 0,606 ммоль) в N,N- диметилацетамиде (2 мл) добавляли хлорид лития (257 мг, 6,06 ммоль), и смесь перемешивали в течение 19,5 часа при 120°C. Реакционную смесь экстрагировали этилацетатом после добавления водного раствора 2 моль/л соляной кислоты. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения I-39 (73,0 мг, выход 28%).
1H-ЯМР (DMSO-D6) δ: 0,79 (s, 9H), 2,38 (s, 3H), 2,40 (s, 3H), 2,73 (s, 3H), 3,37-3,43 (m, 2H), 4,18-4,28 (m, 2H), 5,30 (s, 1H), 6,81 (s, 1H), 7,27-7,36 (m, 3H), 7,43-7,49 (m, 1H).
[0369]
(Пример 8)
[0370]
[Химическая формула 133]
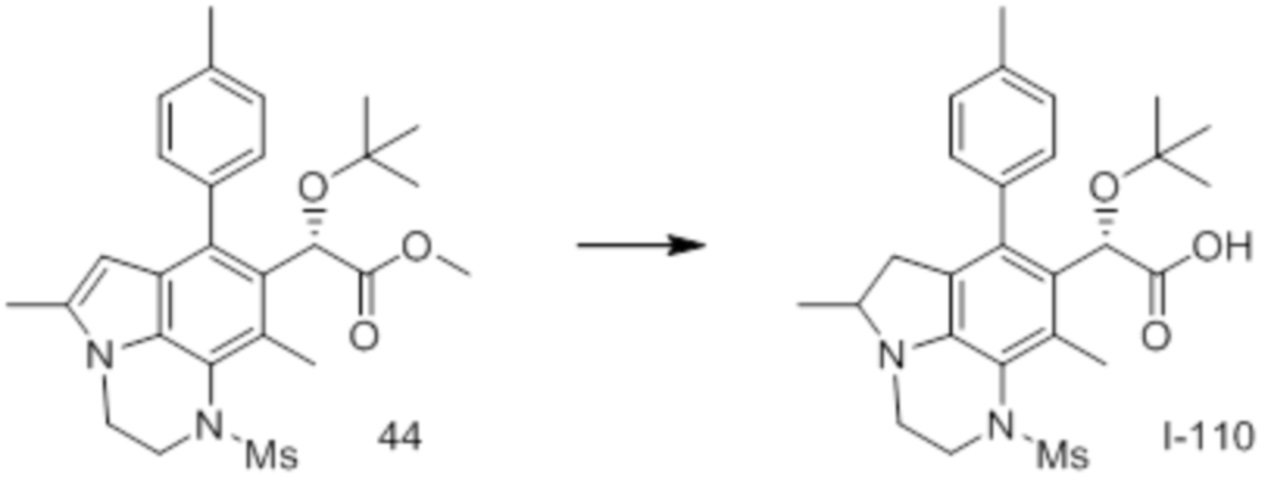
К раствору соединения 44 (150 мг, 0,301 ммоль) в метаноле (1,5 мл) добавляли 10% гидроксида палладия (84,0 мг, 0,060 ммоль), и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 26 часов. Нерастворимые материалы удаляли с помощью фильтрации целитом, и фильтрат концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (хлороформ-метанол). Смесь диастереомеров I-110 (9,0 мг, выход 2 этапов 6%) получали посредством реакции получаемого неочищенного продукта (45,0 мг) аналогично четвертому этапу в примере 1.
MS(ESI) m/z: 487,2 [M+H]+
[0371]
(Пример 9)
[0372]
[Химическая формула 134]
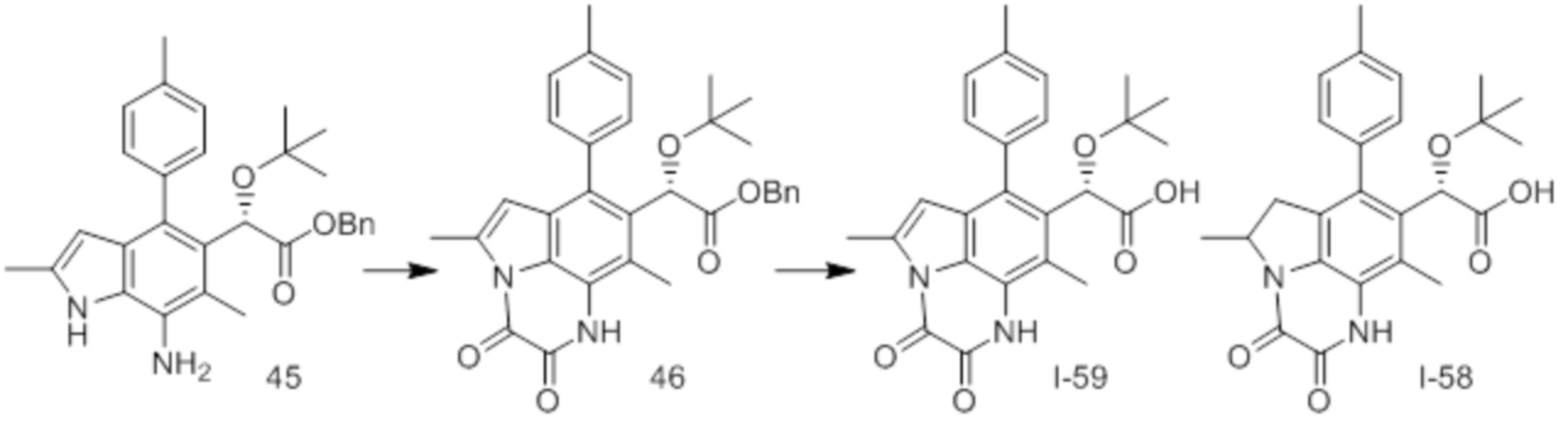
Первый этап
К раствору соединения 45 (50,0 мг, 0,106 ммоль) в THF (2 мл) добавляли 60% гидрид натрия (12,8 мг, 0,319 ммоль) при охлаждении льдом, и смесь перемешивали в атмосфере азота в течение 10 минут. К реакционной смеси добавляли оксалилхлорид (0,211 мл, 2,417 ммоль), и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 46 (22,3 мг, выход 40%).
1H-ЯМР (CDCl3) δ: 0,91 (s, 9H), 2,37 (s, 3H), 2,44 (s, 3H), 2,72 (s, 3H), 5,15 (d, J=12,1 Гц, 1H), 5,23 (d, J=12,1 Гц, 1H), 5,43 (s, 1H), 6,23 (s, 1H), 7,15 (d, J=7,6 Гц, 1H), 7,20-7,37 (m, 8H), 8,80 (s, 1H).
Второй этап
К раствору соединения 46 (22,0 мг, 0,042 ммоль) в этилацетате (2 мл) добавляли 5% палладиевый уголь (20,0 мг, 0,009 ммоль), и смесь перемешивали в атмосфере водорода в течение 1 часа при комнатной температуре. После того, как нерастворимые материалы отфильтровывали, фильтрат концентрировали при пониженном давлении. Получаемый остаток очищали с помощью высокоэффективной жидкостной хроматографии (0,1% муравьиной кислоты в воде - 0,1% муравьиной кислоты в ацетонитриле) с получением соединения I-59 (1,6 мг, выход 9%) и соединения I-58 (7,2 мг, выход 39%).
Соединение I-59: MS(ESI) m/z: 435 [M+H]+
Соединение I-58 (смесь диастереомеров): MS(ESI) m/z: 437 [M+H]+
[0373]
(Пример 10)
[0374]
[Химическая формула 135]
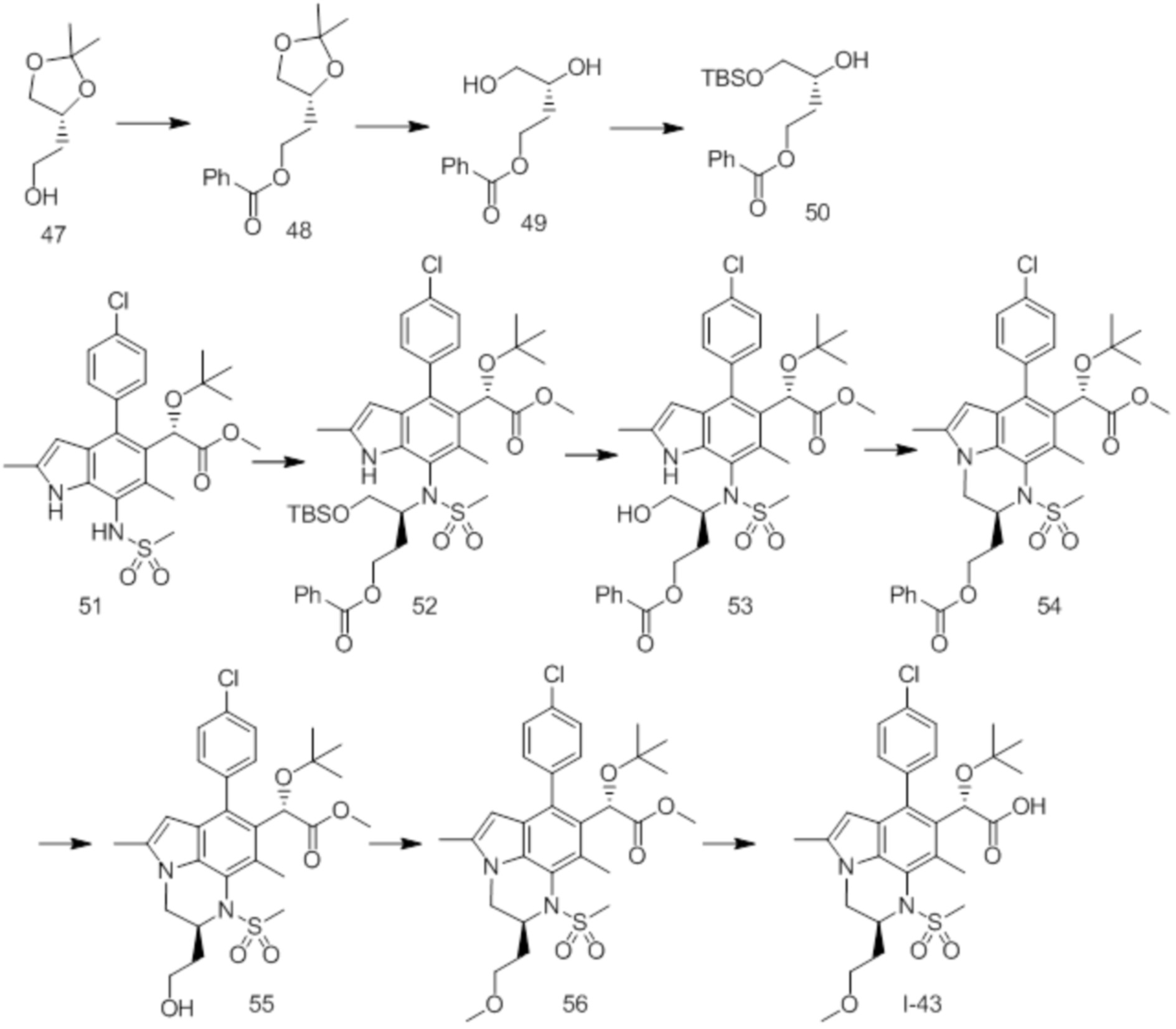
Первый этап
К раствору соединения 47 (4,64 мл, 33,2 ммоль) в дихлорметане (50 мл) добавляли триэтиламин (9,20 мл, 66,4 ммоль), 4-(диметиламино)пиридин (41,0 мг, 0,332 ммоль) и бензоилхлорид (5,78 мл, 49,8 ммоль), и смесь перемешивали в течение 16 часов при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 48 (8,24 г, выход 99%).
1H-ЯМР (CDCl3) δ: 1,37 (s, 3H), 1,43 (s, 3H), 1,97-2,12 (m, 2H), 3,65 (dd, J=8,0, 7,2 Гц, 1H), 4,13 (dd, J=8,0, 5,9 Гц, 1H), 4,28 (ddd, J=11,6, 7,2, 5,9 Гц, 1H), 4,40 (ddd, J=12,4, 6,6, 4,6 Гц, 1H), 4,50 (ddd, J=12,4, 5,3, 5,3 Гц, 1H), 7,44 (dd, J=7,3, 7,3 Гц, 2H), 7,57 (dd, J=7,3, 7,3 Гц, 1H), 8,03 (d, J=7,3 Гц, 2H).
Второй этап
Смешанный раствор соединения 48 (8,24 г, 32,9 ммоль) в уксусной кислоте (60 мл) и воде (25 мл) перемешивали в течение 5 часов при 60°C, а затем перемешивали в течение 6 часов при 80°C. Реакционную смесь концентрировали при пониженном давлении, туда добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 49 (3,49 г, выход 51%).
1H-ЯМР (CDCl3) δ: 1,82-1,99 (m, 3H), 2,63-2,75 (m, 1H), 3,50-3,59 (m, 1H), 3,66-3,75 (m, 1H), 3,85-3,93 (m, 1H), 4,39-4,46 (m, 1H), 4,64 (ddd, J=11,1, 9,1, 5,1 Гц, 1H), 7,45 (dd, J=7,3, 7,3 Гц, 2H), 7,57 (dd, J=7,3, 7,3 Гц, 1H), 8,04 (d, J=7,3 Гц, 2H).
Третий этап
К раствору соединения 49 (800 мг, 3,81 ммоль) в дихлорметане (8 мл) добавляли 4-(диметиламино)пиридин (23,3 мг, 0,190 ммоль) и триэтиламин (0,739 мл, 5,33 ммоль), и смесь перемешивали при охлаждении льдом в течение 5 минут. Туда добавляли по каплям раствор трет-бутилдиметилсилилхлорида (688 мг, 4,57 ммоль) в растворе дихлорметана (2 мл), и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь экстрагировали этилацетатом после добавления воды и насыщенного водного раствора хлорида аммония. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 50 (981 мг, выход 79%).
1H-ЯМР (CDCl3) δ: 0,08 (s, 6H), 0,91 (s, 9H), 1,80-1,97 (m, 2H), 2,52 (d, J=4,0 Гц, 1H), 3,51 (dd, J=9,9, 7,1 Гц, 1H), 3,69 (dd, J=9,9, 3,5 Гц, 1H), 3,82-3,90 (m, 1H), 4,46-4,54 (m, 2H), 7,44 (dd, J=7,3, 7,3 Гц, 2H), 7,56 (dd, J=7,3, 7,3 Гц, 1H), 8,04 (d, J=7,3 Гц, 2H).
Четвертый этап
К раствору соединения 50 (658 мг, 2,03 ммоль) и соединения 51 (500 мг, 1,01 ммоль) в THF (10 мл) добавляли трифенилфосфин (798 мг, 3,04 ммоль) и бис(2-метоксиэтил) азодикарбоновой кислоты (713 мг, 3,04 ммоль), и смесь перемешивали в течение 1,5 часа при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 52 (518 мг, выход 64%).
MS(ESI) m/z: 799 [M+H]+
Пятый этап
Соединение 53 (330 мг, выход 74%) получали посредством реакции соединения 52 (518 мг, 0,648 ммоль) аналогично четвертому этапу в примере 6.
MS(ESI) m/z: 685 [M+H]+
Шестой этап
К раствору соединения 53 (330 мг, 0,482 ммоль) в дихлорметане (4 мл) добавляли триэтиламин (0,200 мл, 1,45 ммоль) и метансульфонилхлорид (0,113 мл, 1,45 ммоль), и смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным рассолом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток растворяли в DMF (4 мл), туда добавляли 60% гидрид натрия (57,8 мг, 1,45 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь разбавляли этилацетатом, выливали в насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 54 (103 г, выход 32%).
1H-ЯМР (CDCl3) δ: 0,90 (s, 9H), 1,52-1,59 (m, 1H), 1,79-1,88 (m, 1H), 2,32 (s, 3H), 2,48 (s, 3H), 3,11 (s, 3H), 3,77 (s, 3H), 4,00 (d, J=12,4 Гц, 1H), 4,31-4,40 (m, 2H), 4,47 (dd, J=12,4, 4,3 Гц, 1H), 4,66-4,73 (m, 1H), 5,28 (s, 1H), 5,84 (s, 1H), 7,37-7,66 (m, 7H), 8,06 (d, J=7,3 Гц, 2H).
Седьмой этап
К смешанному раствору соединения 54 (103 мг, 0,154 ммоль) в метаноле (1 мл) и THF (1 мл) добавляли водный раствор 2 моль/л гидроксида натрия (0,500 мл, 1,00 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь экстрагировали этилацетатом после добавления водного раствора соляной кислоты. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 55 (78,4 мг, выход 90%).
1H-ЯМР (CDCl3) δ: 0,90 (s, 9H), 1,30-1,37 (m, 1H), 1,41-1,49 (m, 1H), 2,32 (s, 3H), 2,45 (s, 3H), 3,21 (s, 3H), 3,64-3,72 (m, 2H), 3,75 (s, 3H), 3,96 (d, J=12,1 Гц, 1H), 4,45 (dd, J=12,1, 4,7 Гц, 1H), 4,71-4,77 (m, 1H), 5,27 (s, 1H), 5,82 (s, 1H), 7,36-7,45 (m, 3H), 7,50-7,54 (m, 1H).
Восьмой этап
К раствору соединения 55 (73,0 мг, 0,130 ммоль) в DMF (1 мл) добавляли 60% гидрид натрия (7,8 мг, 0,194 ммоль) при охлаждении льдом, и смесь перемешивали в течение 10 минут. Туда добавляли йодметил (0,024 мл, 0,389 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь экстрагировали этилацетатом после добавления насыщенного водного раствора хлорида аммония. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 56 (58,3 мг, выход 78%).
1H-ЯМР (CDCl3) δ: 0,90 (s, 9H), 1,27-1,34 (m, 1H), 1,59-1,65 (m, 1H), 2,31 (s, 3H), 2,45 (s, 3H), 3,21 (s, 3H), 3,26-3,30 (m, 1H), 3,37 (s, 3H), 3,40-3,47 (m, 1H), 3,75 (s, 3H), 3,94 (d, J=12,4 Гц, 1H), 4,43 (dd, J=12,4, 4,3 Гц, 1H), 4,58-4,67 (m, 1H), 5,27 (s, 1H), 5,81 (s, 1H), 7,35-7,46 (m, 3H), 7,50-7,54 (m, 1H).
Девятый этап
Соединение I-43 (45,5 мг, 80% выход) получали посредством реакции соединения 56 (58,0 мг, 0,100 ммоль) аналогично четвертому этапу в примере 1.
1H-ЯМР (CDCl3) δ: 0,92 (s, 9H), 1,21-1,29 (m, 1H), 1,56-1,66 (m, 1H), 2,32 (s, 3H), 2,41 (s, 3H), 3,20-3,28 (m, 4H), 3,34-3,44 (m, 4H), 3,94 (d, J=12,4 Гц, 1H), 4,44 (dd, J=12,4, 4,4 Гц, 1H), 4,57-4,64 (m, 1H), 5,39 (s, 1H), 5,87 (s, 1H), 7,38-7,48 (m, 3H), 7,74-7,79 (m, 1H), 10,12 (s, 1H).
[0375]
(Пример 11)
[0376]
[Химическая формула 136]

Первый этап
К раствору соединения 35 (100 мг, 0,241 ммоль) в N,N-диметилацетамиде (2 мл) добавляли карбонат цезия (236 мл, 0,723 ммоль) и 2-хлорпиримидин (55,2 мг, 0,482 ммоль), и смесь перемешивали в течение 1 часа при 200°C при микроволновом облучении. Реакционную смесь экстрагировали этилацетатом после добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 57 (11,3 мг, выход 10%).
1H-ЯМР (CDCl3) δ: 0,93 (s, 9H), 2,33 (s, 3H), 2,44 (s, 3H), 3,70 (s, 3H), 5,31 (s, 1H), 5,80 (s, 1H), 6,68 (t, J=4,8 Гц, 1H), 6,90 (s, 1H), 7,37-7,47 (m, 3H), 7,50-7,55 (m, 1H), 8,36 (d, J=4,8 Гц, 2H), 8,55 (s, 1H).
Второй этап
К раствору соединения 57 (11,0 мг, 0,022 ммоль) в DMF (1 мл) добавляли большой избыток 60% гидрида натрия и 1,2-дибромэтана при охлаждении льдом, и смесь перемешивали в течение 14 часов при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления насыщенного водного раствора хлорида аммония. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (этилацетат) с получением соединения I-85 (1,7 мг, выход 15%).
MS(ESI) m/z: 505 [M+H]+
[0377]
(Пример 12)
[0378]
[Химическая формула 137]
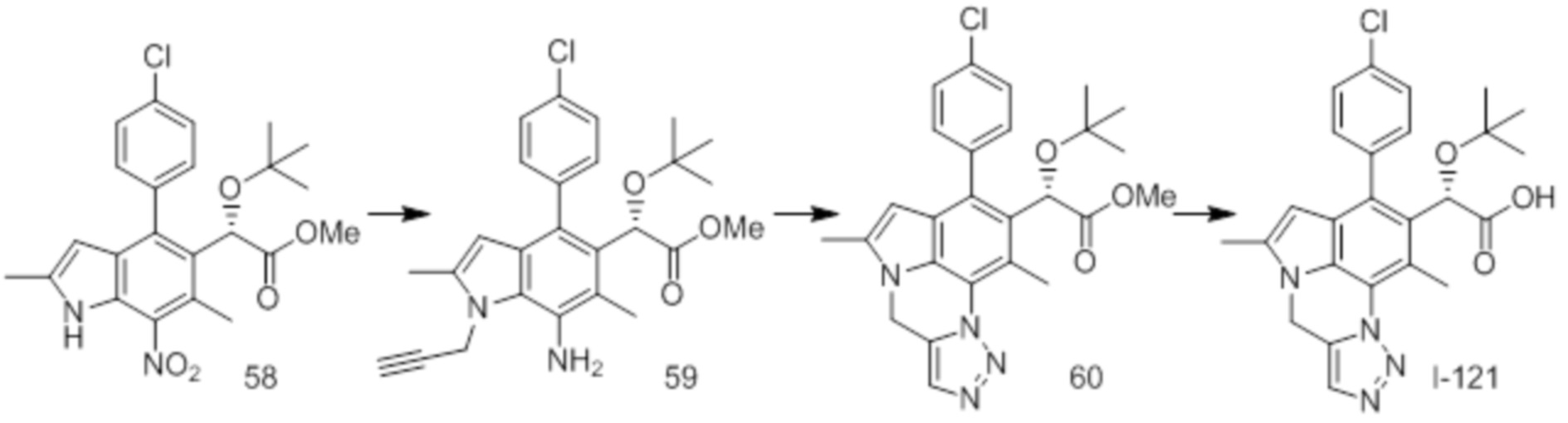
Первый этап
К раствору соединения 58 (850 мг, 1,91 ммоль) и 3-бромпроп-1-ина (455 мг, 3,82 ммоль) в DMF (5 мл) добавляли 60% гидрид натрия (153 мг, 3,82 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа при 0°C. После разбавления реакционной смеси этилацетатом туда добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток растворяли в этаноле (20 мл) и воде (3 мл), туда добавляли хлорид аммония (1,02 г, 19,1 ммоль) и порошок железа (1,07 г, 19,1 ммоль), и смесь перемешивали в течение 4 часов при 90°C. После удаления нерастворимых материалов с помощью фильтрации фильтрат концентрировали при пониженном давлении. Получаемый остаток экстрагировали хлороформом после добавления хлороформа и воды. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 59 (251 мг, выход 29%).
MS(ESI) m/z: 453 [M+H]+
Второй этап
К раствору соединения 59 (251 мг, 0,554 ммоль) в ацетонитриле (4 мл) добавляли триметилсилилазид (77,0 мг, 0,665 ммоль) и трет-бутилнитрит (86,0 мг, 0,831 ммоль), смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток растворяли в толуоле и перемешивали в течение 1 часа при 110°C. Реакционную смесь концентрировали при пониженном давлении, получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 60 (139 мг, выход 52%).
MS(ESI) m/z: 479 [M+H]+
Третий этап
Соединение I-121 (91,0 мг, выход 67%) получали посредством реакции соединения 60 (139 мг, 0,290 ммоль) аналогично четвертому этапу в примере 1.
1H-ЯМР (CDCl3) δ: 0,97 (s, 9H), 2,39 (s, 3H), 3,01 (s, 3H), 5,43 (d, J=15,1 Гц, 1H), 5,49 (s, 1H), 5,54 (d, J=15,1 Гц, 1H), 6,01 (s, 1H), 7,38-7,44 (m, 1H), 7,45-7,50 (m, 2H), 7,67-7,73 (m, 1H), 7,77 (s, 1H).
[0379]
(Пример 13)
[0380]
[Химическая формула 138]
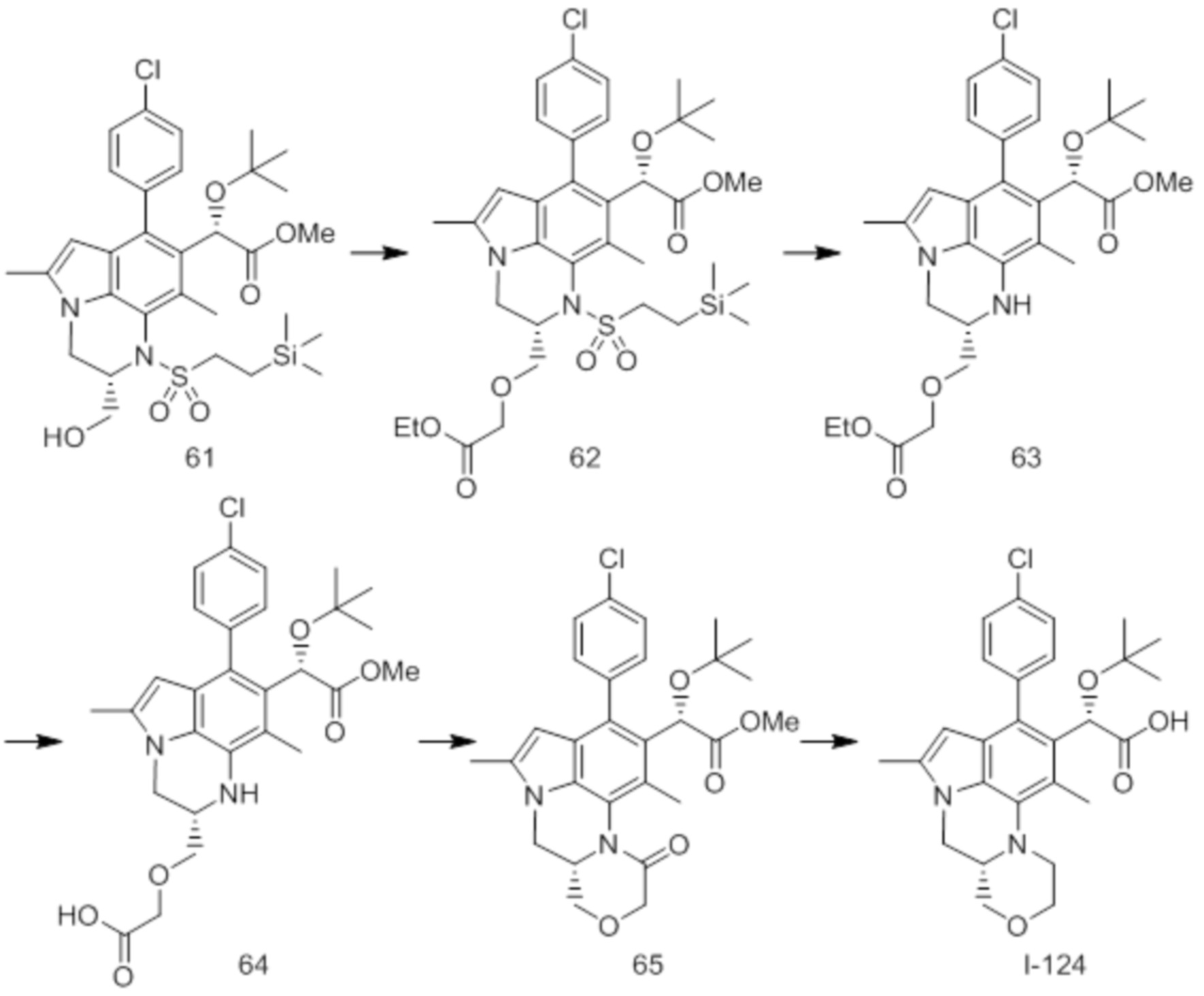
Первый этап
К раствору соединения 61 (100 мг, 0,157 ммоль) в DMF (2 мл) добавляли 60% гидрид натрия (12,6 мг, 0,315 ммоль) при охлаждении льдом, и смесь перемешивали в течение 10 минут при 0°C. К реакционной смеси добавляли бромэтилацетат (0,035 мл, 0,315 ммоль), и смесь перемешивали в течение 16 часов при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления насыщенного водного раствора хлорида аммония. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 62 (66,8 мг, выход 59%).
MS(ESI) m/z: 721 [M+H]+
Второй этап
К раствору соединения 62 (66,0 мг, 0,091 ммоль) в THF (2 мл) добавляли раствор 1 моль/л TBAF THF (0,500 мл, 0,500 ммоль), и смесь перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь разбавляли этилацетатом, туда добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат и хлороформ-метанол) с получением соединения 63 (39,7 мг, выход 78%).
1H-ЯМР (CDCl3) δ: 0,90 (s, 9H), 1,30 (t, J=7,2 Гц, 3H), 2,29 (s, 3H), 2,30 (s, 3H), 3,66-3,72 (m, 4H), 3,79-3,87 (m, 2H), 3,89-3,97 (m, 1H), 4,10-4,18 (m, 3H), 4,25 (q, J=7,2 Гц, 2H), 4,46 (s, 1H), 5,31 (s, 1H), 5,81 (s, 1H), 7,38-7,42 (m, 3H), 7,49-7,53 (m, 1H).
Третий этап
Соединение 64 (37,0 мг) получали посредством реакции соединения 63 (39,0 мг, 0,070 ммоль) аналогично седьмому этапу в примере 10.
1H-ЯМР (CDCl3) δ: 0,91 (s, 9H), 2,30 (s, 6H), 3,67-3,76 (m, 4H), 3,81-3,88 (m, 2H), 3,90-3,97 (m, 1H), 4,10-4,16 (m, 1H), 4,21 (d, J=17,0 Гц, 1H), 4,27 (d, J=17,0 Гц, 1H), 5,32 (s, 1H), 5,81 (s, 1H), 7,37-7,43 (m, 3H), 7,48-7,53 (m, 1H).
Четвертый этап
К раствору соединения 64 (37,0 мг, 0,070 ммоль) в DMF (1 мл) добавляли гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (39,9 мг, 0,105 ммоль) и N,N-диизопропилэтиламин (0,018 мл, 0,105 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 65 (34,6 мг, выход 97%).
1H-ЯМР (CDCl3) δ: 0,94 (s, 9H), 2,27 (s, 3H), 2,31 (s, 3H), 3,74 (s, 3H), 3,97-4,03 (m, 1H), 4,09-4,18 (m, 2H), 4,32-4,46 (m, 4H), 5,29 (s, 1H), 5,81 (s, 1H), 7,33-7,37 (m, 1H), 7,40-7,45 (m, 2H), 7,49-7,53 (m, 1H).
Пятый этап
Соединение I-124 (11,3 мг, выход 2 этапов 35%) получали посредством реакции соединения 65 (34,0 мг, 0,067 ммоль) аналогично шестому этапу в примере 2 и четвертому этапу в примере 1.
1H-ЯМР (CDCl3) δ: 0,91 (s, 9H), 2,36 (s, 3H), 2,38 (s, 3H), 2,94-2,99 (m, 2H), 3,24-3,30 (m, 1H), 3,86 (dd, J=11,9, 3,5 Гц, 1H), 3,90-3,97 (m, 2H), 4,02 (d, J=11,9 Гц, 1H), 4,21 (dd, J=11,9, 3,5 Гц, 1H), 4,42 (dd, J=11,9, 11,9 Гц, 1H), 5,41 (s, 1H), 5,89 (s, 1H), 7,41-7,46 (m, 3H), 7,68 (s, 1H), 9,88 (s, 1H).
[0381]
(Пример 14)
[0382]
[Химическая формула 139]

Первый этап
К раствору соединения 35 (500 мг, 1,21 ммоль) и пиридина (0,292 мл, 3,62 ммоль) в дихлорметане (5 мл) добавляли по каплям 2-хлорэтансульфонилхлорид (0,189 мл, 1,81 ммоль) при охлаждении льдом, и смесь перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 66 (342 мг, выход 56%).
1H-ЯМР (CDCl3) δ: 0,90 (s, 9H), 2,39 (s, 6H), 3,70 (s, 3H), 5,25 (s, 1H), 5,78 (s, 1H), 5,94 (d, J=9,9 Гц, 1H), 6,15-6,26 (m, 2H), 6,64 (dd, J=16,4, 9,9 Гц, 1H), 7,33-7,40 (m, 1H), 7,42-7,49 (m, 3H), 8,90 (s, 1H).
Второй этап
К раствору соединения 66 (242 мг, 0,479 ммоль), (R)-1-[(трет- бутилдиметилсилил)окси)]пента-4-ен-2-ола (311 мг, 1,44 ммоль) и трифенилфосфина (377 мг, 1,44 ммоль) в THF (2,42 мл) добавляли бис(2-метоксиэтил) азодикарбоновой кислоты (337 мг, 1,44 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 67 (179 мг, выход 53%).
MS(ESI) m/z: 703 [M+H]+
Третий этап
К раствору соединения 67 (177 мг, 0,252 ммоль) в дихлорметане (8,85 мл) добавляли катализатор Граббса второго поколения (21,3 мг, 0,025 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, и получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 68 (142 мг, выход 83%).
MS(ESI) m/z: 675 [M+H]+
Четвертый этап
К раствору соединения 68 (120 мг, 0,178 ммоль) в метаноле (1,8 мл) добавляли боргидрид натрия (269 мг, 7,11 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 40 минут. Реакционную смесь экстрагировали этилацетатом после добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой промывали насыщенным рассолом, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 69 (107 мг, выход 76%).
MS(ESI) m/z: 677 [M+H]+
Пятый этап
Соединение 70 (9,0 мг, выход 2 этапов 10%) получали посредством реакции соединения 69 (105 мг, 0,155 ммоль) аналогично четвертому этапу в примере 6 и шестому этапу в примере 10.
MS(ESI) m/z: 545 [M+H]+
Шестой этап
Соединение I-128 (7,7 мг, выход 88%) получали посредством реакции соединения 70 (9,0 мг, 0,017 ммоль) аналогично девятому этапу в примере 2.
MS(ESI) m/z: 531 [M+H]+
[0383]
(Пример 15)
[0384]
[Химическая формула 140]

Первый этап
К соединению 29 (120 мг, 0,264 ммоль) добавляли дифенил(2-пиридил)фосфин (259 мг, 1,06 ммоль) и диизопропилазодикарбоксилат (214 мг, 1,06 ммоль), и смесь перемешивали в течение 3 часов при 45°C. Реакционную смесь разбавляли этилацетатом, туда добавляли водный раствор бикарбоната натрия, и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 71 (64,0 мг, выход 51%).
1H-ЯМР (CDCl3) δ: 0,94 (s, 9H), 2,42 (s, 3H), 2,97 (s, 3H), 3,77 (s, 3H), 5,35 (s, 1H), 5,67-5,75 (m, 2H), 6,00 (s, 1H), 7,35-7,40 (m, 1H), 7,45-7,52 (m, 3H).
Второй этап
К раствору соединения 71 (64,0 мг, 0,133 ммоль) в THF (2 мл) добавляли водный раствор 2 моль/л гидроксида натрия (1,00 мл, 2,00 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 2 часов. Реакционную смесь экстрагировали этилацетатом после добавления воды и водного раствора 2 моль/л соляной кислоты. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения I-126 (50,0 мг, выход 81%).
1H-ЯМР (CDCl3) δ: 0,97 (s, 9H), 2,43 (s, 3H), 2,97 (s, 3H), 5,47 (s, 1H), 5,70 (d, J=16,2 Гц, 1H), 5,77 (d, J=16,2 Гц, 1H), 6,05 (s, 1H), 7,37-7,43 (m, 1H), 7,45-7,51 (m, 2H), 7,65-7,71 (m, 1H).
[0385]
(Пример 16)
[0386]
[Химическая формула 141]
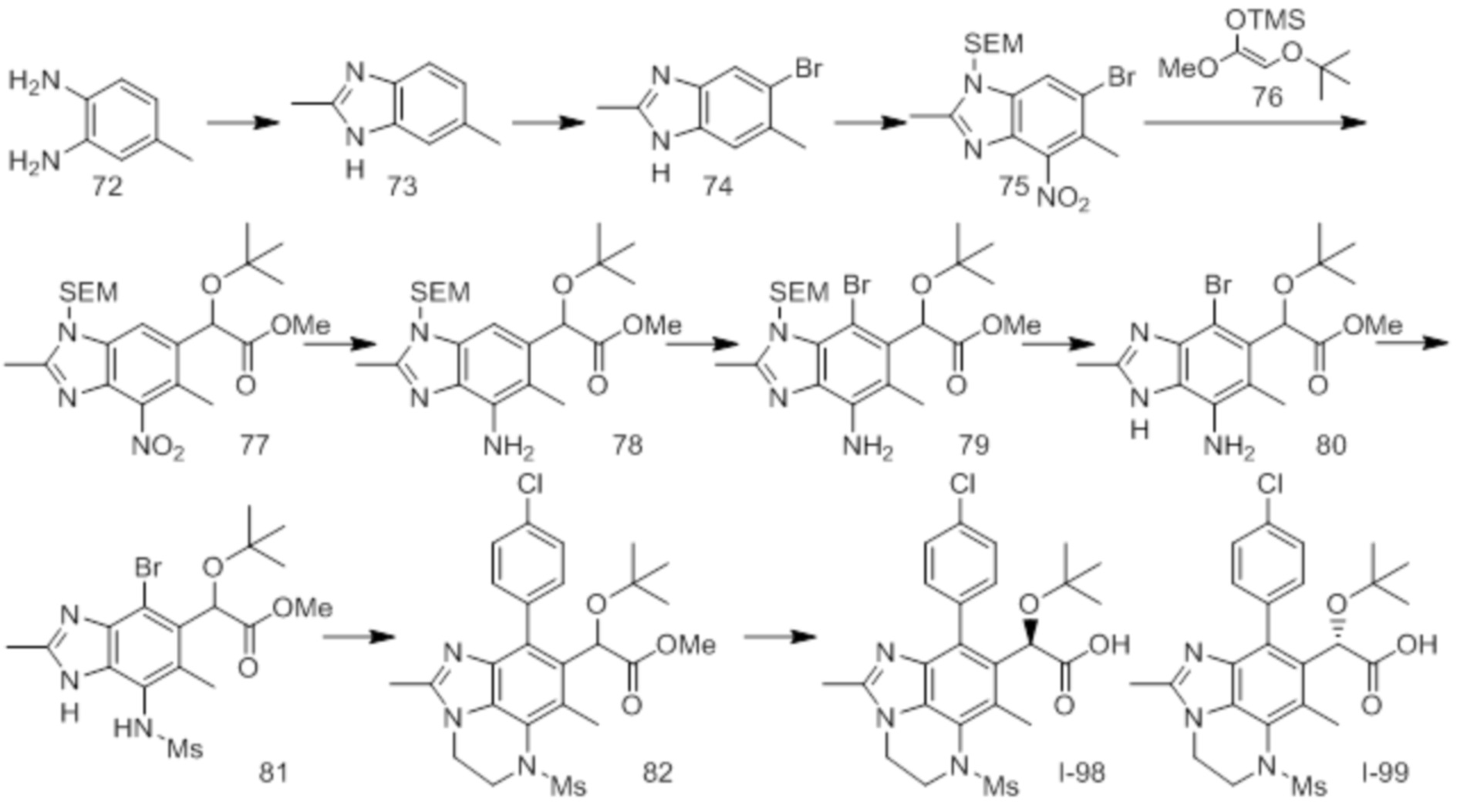
Первый этап
К суспензии соединения 72 (25,0 г, 203 ммоль) в воде (250 мл) добавляли хлорид аммония (1,86 г, 34,7 ммоль) и этилортоформиат (50,0 г, 328 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 10,5 часа. Реакционную смесь охлаждали до комнатной температуры и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток отверждали этилацетатом-диизопропиловым эфиром с получением соединения 73 (19,5 г, выход 65%).
MS(ESI) m/z: 146,9 [M+H]+
Второй этап
К раствору соединения 73 (19,1 г, 130 ммоль) в хлороформе (200 мл) добавляли N-бромсукцинимид (23,2 г, 130 ммоль) при охлаждении льдом, и смесь перемешивали в течение 25 минут при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, полученное твердое вещество собирали с помощью фильтрации и промывали водой с получением соединения 74 (25,4 г, выход 87%).
1H-ЯМР (DMSO-D6) δ: 2,41 (s, 3H), 2,46 (s, 3H), 7,43 (s, 1H), 7,66 (s, 1H), 11,70-12,71 (m, 1H).
Третий этап
К соединению 74 (1,00 г, 4,44 ммоль) добавляли концентрированную серную кислоту (5,00 мл) при охлаждении льдом, туда добавляли по каплям концентрированную азотную кислоту (1,00 мл), и смесь перемешивали при комнатной температуре в течение 35 минут. К реакционной смеси добавляли воду, и полученное твердое вещество собирали с помощью фильтрации и промывали водой. Полученное твердое вещество (1,04 г, 3,85 ммоль) суспендировали в DMF (20 мл), и туда добавляли 60% гидрид натрия (231 мг, 5,78 ммоль) и 2-(хлорметокси)этилтриметилсилан (1,02 мл, 5,78 ммоль) при охлаждении льдом, и смесь перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления водного раствора соляной кислоты. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 75 (206 мг, выход 2 этапов 12%).
1H-ЯМР (CDCl3) δ: 0,00 (s, 9H), 0,94 (t, J=8,1 Гц, 2H), 2,54 (s, 3H), 2,69 (s, 3H), 3,54 (t, J=8,1 Гц, 2H), 5,47 (s, 2H), 7,81 (s, 1H).
Четвертый этап
К раствору соединения 75 (200 мг, 0,500 ммоль) в DMF (2 мл) добавляли фторид цинка (155 мг, 1,50 ммоль), три-трет-бутилфосфин (0,024 мл, 0,100 ммоль), бис(дибензилиденацетон)палладий(0) (28,7 мг, 0,050 ммоль) и соединение 76 (327 мг, 1,50 ммоль), и смесь перемешивали в атмосфере азота в течение 1,5 часа при 100°C. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 77 (205 мг, выход 88%).
1H-ЯМР (CDCl3) δ: -0,04 (s, 9H), 0,89 (t, J=8,1 Гц, 2H), 1,24 (s, 9H), 2,51 (s, 3H), 2,68 (s, 3H), 3,52 (t, J=8,1 Гц, 2H), 3,67 (s, 3H), 5,36 (s, 1H), 5,50 (s, 2H), 7,86 (s, 1H).
Пятый этап
Соединение 78 (11,2 г, выход 92%) получали посредством реакции соединения 77 (13,0 г, 27,9 ммоль) аналогично третьему этапу в примере 1.
1H-ЯМР (CDCl3) δ: -0,06 (s, 9H), 0,87 (t, J=8,1 Гц, 2H), 1,24 (s, 9H), 2,30 (s, 3H), 2,61 (s, 3H), 3,51 (t, J=8,1 Гц, 2H), 3,64 (s, 3H), 4,27 (s, 2H), 5,35 (s, 1H), 5,42 (s, 2H), 7,09 (s, 1H).
Шестой этап
К раствору соединения 78 (10,9 г, 25,0 ммоль) в дихлорметане (110 мл) добавляли N-бромсукцинимид (4,90 г, 27,5 ммоль), и смесь перемешивали при охлаждении льдом в течение 20 минут. Реакционную смесь экстрагировали хлороформом после добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 79 (6,10 г, выход 47%).
1H-ЯМР (CDCl3) δ: -0,04 (s, 9H), 0,91 (t, J=8,1 Гц, 2H), 1,22 (s, 9H), 2,29 (s, 3H), 2,63 (s, 3H), 3,58-3,68 (m, 5H), 4,28 (s, 2H), 5,82 (d, J=10,9 Гц, 1H), 5,94 (d, J=10,9 Гц, 1H), 6,01 (s, 1H).
Седьмой этап
Соединение 80 (73,0 мг, выход 75%) получали посредством реакции соединения 79 (130 мг, 0,253 ммоль) аналогично четвертому этапу в примере 6.
1H-ЯМР (CDCl3) δ: 1,22 (s, 9H), 2,30 (s, 3H), 2,60 (s, 3H), 3,66 (s, 3H), 4,25 (s, 2H), 5,77 (s, 1H), 8,82 (s, 1H).
Восьмой этап
К раствору соединения 80 (300 мг, 0,781 ммоль) в дихлорметане (3 мл) добавляли пиридин (0,252 мл, 3,12 ммоль) и метансульфонилхлорид (0,122 мл, 1,56 ммоль), и смесь перемешивали при комнатной температуре 3,5 часа. Реакционную смесь экстрагировали хлороформом после добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью хроматографии на силикагеле (хлороформ-метанол) с получением соединения 81 (300 мг, выход 83%).
MS(ESI) m/z: 461,9, 463,8 [M+H]+
Девятый этап
Соединение 82 (230 мг, выход 2 этапов 68%) получали посредством реакции соединения 81 (300 мг, 0,649 ммоль) аналогично второму этапу в примере 6 и первому этапу в примере 4.
MS(ESI) m/z: 520,0 [M+H]+
Десятый этап
Карбоновую кислоту (140 мг, выход 63%) получали посредством реакции соединения 82 (230 мг, 0,442 ммоль) аналогично четвертому этапу в примере 1. Соединения I-98 и I-99 получали с помощью дополнительного оптического разделения.
Соединение I-98: MS(ESI) m/z: 506 [M+H]+
Соединение I-99: MS(ESI) m/z: 506 [M+H]+
(Пример 17)
[0387]
[Химическая формула 142]

Первый этап. Синтез соединения 84
К раствору соединения 83 (4,24 г, 10,1 ммоль) в диметилформамиде (12,7 мл) добавляли йодид натрия (2,27 г, 15,1 ммоль), карбонат калия (2,09 г, 15,1 ммоль), 2-хлор-N,N-диметилацетамид (1,09 мл, 10,6 ммоль), и смесь перемешивали в течение 4 часов при 40°C. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии DIOL (гексан-этилацетат (3% триэтиламин)) с получением соединения 84 (4,99 г, 97%) в виде желтого пенообразного соединения.
ЖХ/МС (ESI): m/z=506,49 [M+H]+, условия измерений при ЖХ/МС: (1)
Второй этап. Синтез соединения 85
К раствору соединения 84 (4,69 г, 9,28 ммоль) в тетрагидрофуране (9,4 мл) добавляли раствор 0,92 моль/л борана-тетрагидрофурана (30,2 мл, 27,8 ммоль) при охлаждении льдом, и смесь перемешивали при 40°C в течение 4 часов. Реакционную смесь экстрагировали этилацетатом после добавления водного раствора 10 вес.% лимонной кислоты. Органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К полученному остатку добавляли метанол (50 мл), смесь перемешивали при 90°C в течение 5 часов и концентрировали при пониженном давлении. К получаемому остатку добавляли этилацетат, и органический слой промывали водой и насыщенным рассолом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии DIOL (гексан-этилацетат (3% триэтиламин)) с получением соединения 85 (3,0 г, выход 65%) в виде белого пенообразного соединения.
ЖХ/МС (ESI): m/z=492,38 [M+H]+, условия измерений при ЖХ/МС: (1)
Третий этап. Синтез соединения I-27
К смешанному раствору соединения 85 (600 мг, 1,29 ммоль) в метаноле (4 мл) и THF (4 мл) добавляли водный раствор 2 моль/л гидроксида натрия (2,23 мл, 4,45 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 5,5 часа. Реакционную смесь доводили до pH7 с помощью соляной кислоты 1 моль/л. После добавления HP органический растворитель удаляли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии ODS (вода-ацетонитрил) с получением соединения I-27 (195 мг, выход 46%) в виде белого твердого вещества.
ЖХ/МС (ESI): m/z=478,38 [M+H]+, RT=1,70 мин, условия измерений при ЖХ/МС: (1)
1H-ЯМР (CDCl3) δ: 7,58 (1H, d, J=8,1 Гц), 7,39 (1H, d, J=7,1 Гц), 7,25-7,22 (2H, m), 5,91 (1H, s), 5,58 (1H, s), 3,94-3,89 (2H, m), 3,44-3,43 (2H, m), 3,03-2,94 (2H, m), 2,74-2,69 (2H, m), 2,42 (6H, s), 2,34-2,31 (9H, m), 0,90 (9H, s).
(Пример 18)
[0388]
[Химическая формула 143]

Первый этап. Синтез соединения 87
К раствору соединения 86 (460 мг, 1,084 ммоль) в DMF (4,6 мл) добавляли карбонат калия (300 мг, 2,167 ммоль) и метилйодид (60 мкл, 2,167 ммоль), и смесь перемешивали при 60°C в течение 20 минут. Туда добавляли метилйодид (60 мкл, 2,167 ммоль), и смесь перемешивали в течение 20 минут при 60°C. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой последовательно промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. Растворитель концентрировали при пониженном давлении, получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 87 (433 мг, выход 91%).
ЖХ/МС (ESI): m/z=439,3 [M+H]+, условия измерений при ЖХ/МС: (1)
Второй этап. Синтез соединения I-48
К смешанному раствору соединения 87 (430 мг, 0,961 ммоль) в этаноле (8,0 мл) и THF (4 мл) добавляли водный раствор 2 моль/л гидроксида натрия (4,9 мл), и смесь перемешивали при комнатной температуре в течение 1 часа, а затем перемешивали в течение 3 часов при 60°C. Смесь охлаждали до комнатной температуры и экстрагировали этилацетатом после добавления соляной кислоты 2 моль/л. Органический слой промывали насыщенным рассолом и сушили над безводным сульфатом магния. Растворитель концентрировали при пониженном давлении. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ) и очищали кристаллизацией с метанолом-IPE с получением соединения I-48 (115 мг, выход 27%).
ЖХ/МС (ESI): m/z=425,3[M+H]+, RT=2,20 мин, условия измерений при ЖХ/МС: (1)
1H-ЯМР (CDCl3) δ: 0,92 (s, 9H), 2,36 (s, 3H), 2,43 (s, 3H), 2,78 (s, 3H), 3,41-3,49 (m, 2H), 3,95-4,00 (m, 2H), 5,49 (s, 1H), 5,89 (s, 1H), 7,15 (m, 3H), 7,47 (brs,1H), 7,70 (brs,1H)
(Пример 19)
[0389]
[Химическая формула 144]

Первый этап. Синтез соединения 89
К раствору соединения 88 (1 г, 2,27 ммоль) в толуоле (10 мл) добавляли трет-бутоксид натрия (327 мг, 3,4 ммоль), 2-бром-5-метоксипиримидин (643 мг, 3,4 ммоль), 4,5-бис(дифенилфосфино)-9,9-метилксантен (394 мг, 0,68 ммоль) и Pd2(dba)3 (623 мг, 0,68 ммоль), и смесь перемешивали в атмосфере азота при 60°C в течение 1,5 часа. Туда добавляли трет-бутоксид натрия (327 мг, 3,4 ммоль) и 2-бром-5-метоксипиримидин (643 мг, 3,4 ммоль), и смесь перемешивали в атмосфере азота в течение 1,5 часа при 60°C. К реакционной смеси добавляли соляную кислоту 2 ммоль/л, фильтровали через целит, фильтрат экстрагировали хлороформом. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с помощью выпарного аппарата. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 89 (809 мг, 65%) в виде желтого пенообразного соединения.
ЖХ/МС (ESI): m/z=549,15 [M+H]+, условия измерений при ЖХ/МС: (1)
Второй этап. Синтез соединения I-156
К смешанному раствору соединения 89 (795 мг, 1,45 ммоль) в этаноле (4 мл) и THF (4 мл) добавляли водный раствор 2 моль/л гидроксида натрия (3,62 мл, 7,24 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 2,5 часа. Реакционную смесь экстрагировали хлороформом после добавления соляной кислоты 2 моль/л. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с помощью выпарного аппарата. Получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения I-156 (68,2 мг, выход 89%) в виде белого твердого вещества.
ЖХ/МС (ESI): m/z=535,15 [M+H]+, RT=3,27 мин, условия измерений при ЖХ/МС: (1)
1H-ЯМР (CDCl3) δ: 0,98(s, 9H), 2,20(s, 3H), 2,30(s, 3H), 3,83(s, 3H), 3,94-4,07(m, 3H), 4,88(brs, 1H), 5,49(s, 1H), 5,87(s, 1H), 7,41-7,47(m, 3H), 7,74(brs, 1H), 8,15(s, 2H)
(Пример 20)
[0390]
[Химическая формула 145]

Первый этап. Синтез соединения 90
К раствору соединения 30 (400 мг, 0,907 ммоль) в DMF (8,00 мл) добавляли цианогенбромид (152 мг, 1,36 ммоль) и карбонат калия (188 мг, 1,36 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Туда добавляли цианогенбромид (48,0 мг, 0,454 ммоль) и карбонат калия (62,7 мг, 0,454 ммоль), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь экстрагировали этилацетатом после добавления ледяной воды. Органический слой промывали насыщенным рассолом и сушили с помощью безводного сульфата натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 90 (346 мг, выход 82%).
ЖХ/МС (ESI): m/z=466,24 [M+H]+, условия измерений при ЖХ/МС: (1)
Второй этап. Синтез соединения 91
К раствору соединения 90 (344 мг, 0,738 ммоль) в этаноле (6,88 мл) добавляли гидрохлорид гидроксиламина (61,6 мг, 0,886 ммоль) и триэтиламин (90,0 мг, 0,886 ммоль), и смесь перемешивали при 60°C в течение 10 минут. Туда добавляли THF (2,00 мл), и смесь перемешивали при 60°C в течение 40 минут. Реакционную смесь экстрагировали этилацетатом после добавления ледяной воды. Органический слой промывали насыщенным рассолом и сушили с помощью безводного сульфата натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 91 (243 мг, выход 66%).
ЖХ/МС (ESI): m/z=499,08 [M+H]+, условия измерений при ЖХ/МС: (1)
Третий этап. Синтез соединения 92
К раствору соединений 91 (80,0 мг, 0,160 ммоль) в диглиме (1,60 мл) добавляли пиридин (19,0 мг, 0,240 ммоль) и ацетилхлорид (15,1 мг, 0,192 ммоль) при охлаждении льдом, и смесь перемешивали в течение 50 минут при комнатной температуре и перемешивали при 100°C в течение 90 минут. После охлаждения реакционную смесь экстрагировали этилацетатом после добавления ледяной воды и соляной кислоты 2 моль/л. Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 92 (76 мг, выход 91%).
ЖХ/МС (ESI): m/z=523,37 [M+H]+, условия измерений при ЖХ/МС: (1)
Четвертый этап. Синтез соединения I-176
К раствору соединения 92 (74,0 мг, 0,141 ммоль) в этаноле (1,42 мл) добавляли водный раствор 2 моль/л гидроксида натрия (0,354 мл), и смесь нагревали с обратным холодильником и перемешивали в течение 1 часа. После охлаждения реакционную смесь экстрагировали этилацетатом после добавления ледяной воды и соляной кислоты 2 моль/л. Органический слой промывали насыщенным рассолом и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат), и очищали кристаллизацией с гексаном с получением соединения I-176 (39,0 мг, выход 54%).
ЖХ/МС (ESI): m/z=509,4 [M+H]+, RT=2,54 мин, условия измерений при ЖХ/МС: (1)
1H-ЯМР (DMSO-d6) δ: 0,82 (s, 9H), 2,44 (s, 3H), 2,31 (s, 3H), 2,50 (s, 3H), 4,00-4,25 (m, 4H), 5,20 (s, 1H), 5,77 (s, 1H), 7,42 (m, 1H), 7,55-7,70 (m, 3H), 12,51 (brs,1H).
(Пример 21)
[0391]
[Химическая формула 146]

Первый этап. Синтез соединения 93
К раствору соединений 58 (2,20 г, 4,90 ммоль) в DMF (15,4 мл) добавляли аллилбромид (889 мг, 7,35 ммоль) и гидрид натрия (294 мг, 7,35 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа. Реакционную смесь экстрагировали этилацетатом после добавления насыщенного водного раствора хлорида аммония. Органический слой промывали насыщенным водным раствором хлорида аммония и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 93 (1,31 г, выход 73%).
ЖХ/МС (ESI): m/z=485,22 [M+H]+, условия измерений при ЖХ/МС: (1)
Второй этап. Синтез соединения 94
К смешанному раствору соединений 93 (1,00 г, 2,06 ммоль) в этаноле (20,0 мл) и воде (5,00 мл) добавляли дитионит натрия (4,22 г, 20,6 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 1 часа. После охлаждения реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 94 (553 мг, выход 59%).
ЖХ/МС (ESI): m/z=455,41 [M+H]+, условия измерений при ЖХ/МС: (1)
Третий этап. Синтез соединения 95
К смешанному раствору соединений 94 (451 мг, 0,991 ммоль) в ацетонитриле (8,62 мл) и воде (0,862 мл) добавляли йодид калия (823 мг, 4,96 ммоль) и трет-бутилнитрит (568 мг, 4,96 ммоль), и смесь перемешивали при 50°C 40 минут. После охлаждения реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой последовательно промывали водным раствором тиосульфата натрия и водой и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 95 (202 мг, выход 36%).
ЖХ/МС (ESI): m/z=566,24 [M+H]+, условия измерений при ЖХ/МС: (1)
Четвертый этап. Синтез соединения 96
К смешанному раствору соединений 95 (64,8 мг, 0,115 ммоль) в THF (1,94 мл) и воде (1,94 мл) добавляли осмат калия дигидрат (8,44 мг, 0,0230 ммоль) и перйодат натрия (73,5 мг, 0,344 ммоль), и смесь перемешивали в течение 4 часов при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой последовательно промывали водным раствором тиосульфата натрия, водой и насыщенным рассолом и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 96 (38,9 мг, выход 57%).
ЖХ/МС (ESI): m/z=600,33 [M+H]+, условия измерений при ЖХ/МС: (1)
Пятый этап. Синтез соединения 97
К смешанному раствору соединения 96 (45,0 мг, 0,0750 ммоль) в THF (0,900 мл) и воде (0,302 мл) добавляли перйодат натрия (48,1 мг, 0,225 ммоль), и смесь перемешивали в течение одного часа при комнатной температуре. Туда добавляли перйодат натрия (16,0 мг, 0,0750 ммоль), и смесь перемешивали в течение одного часа. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой последовательно промывали водным раствором тиосульфата натрия, водой и насыщенным рассолом и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении с получением соединения 97 (43,9 мг, выход 103%) в виде неочищенного продукта.
Шестой этап. Синтез соединения 98
К раствору соединения 97 (43,9 мг, 0,0750 ммоль) в метаноле (0,852 мл) добавляли боргидрид натрия (2,84 мг, 0,0750 ммоль) при охлаждении льдом, и смесь перемешивали в течение 50 минут. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь перемешивали в течение 30 минут при комнатной температуре. Смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали насыщенным рассолом и сушили с помощью безводного сульфата натрия. Растворитель концентрировали при пониженном давлении, получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 98 (33,2 мг, выход 78%).
ЖХ/МС (ESI): m/z=570,27 [M+H]+, условия измерений при ЖХ/МС: (1)
Седьмой этап. Синтез соединения 99
К раствору соединений 98 (27,5 мг, 0,0483 ммоль) в толуоле (1,38 мл) добавляли йодид меди (4,60 мг, 0,0242 ммоль), N,N-диметилглицин (4,98 мг, 0,0483 ммоль), карбонат цезия (31,4 мг, 0,0964 ммоль), и смесь перемешивали в течение 2 часов при 160°C при микроволновом облучении. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали насыщенным водным раствором хлорида аммония и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 99 (18,3 мг, выход 73%).
ЖХ/МС (ESI): m/z=442,32 [M+H]+, условия измерений при ЖХ/МС: (1)
Восьмой этап. Синтез соединения I-182
К смешанному раствору соединений 99 (17,0 мг, 0,0385 ммоль) в этаноле (0,340 мл) и THF (0,340 мл) добавляли водный раствор 2 моль/л гидроксида натрия (0,350 мл), и смесь нагревали с обратным холодильником и перемешивали в течение 3 часов. После охлаждения реакционную смесь экстрагировали хлороформом после добавления водного раствора 2 моль/л соляной кислоты (0,345 мл) и сушили с помощью безводного сульфата натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения I-182 (12,8 мг, выход 78%).
ЖХ/МС (ESI): m/z=428,31 [M+H]+, RT=2,59 мин, условия измерений при ЖХ/МС: (1)
(Пример 22)
[0392]
[Химическая формула 147]
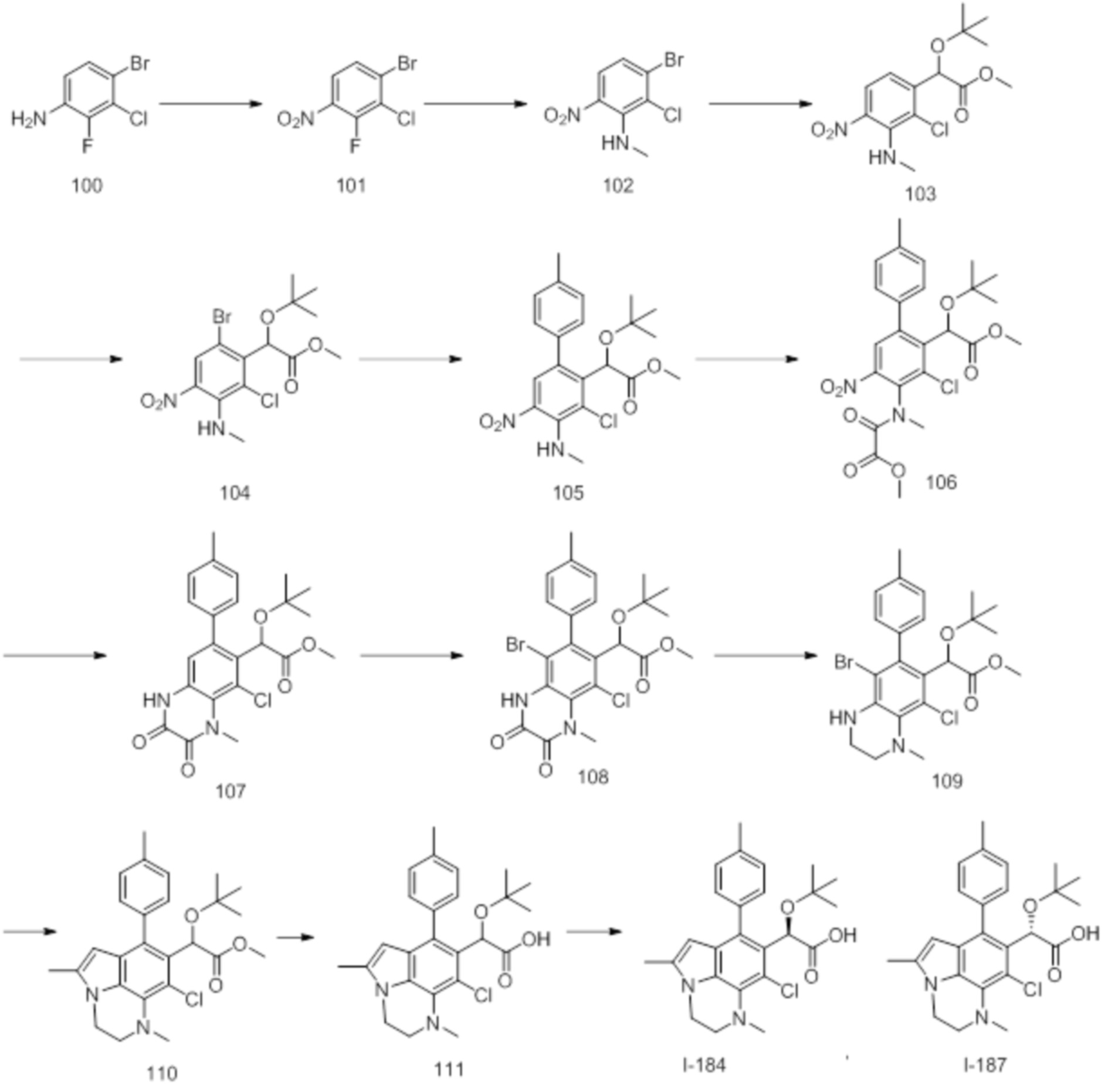
Первый этап. Синтез соединения 101
К раствору соединения 100 (10 г, 44,6 ммоль) в толуоле (150 мл) добавляли m-CPBA (43,9 мг, 178 ммоль), и смесь перемешивали в течение 22 часов при 50°C. После охлаждения туда добавляли хлороформ, и смесь фильтровали. Фильтрат последовательно промывали 10% водным раствором тиосульфата натрия, водой и насыщенным рассолом, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением соединения 101 (8,70 г) в виде неочищенного продукта.
Второй этап. Синтез соединения 102
К суспензии соединения 101 (8,70 г) в диметилсульфоксиде (113 мл) добавляли 40% водный раствор метиламина (11,5 мл, 134 ммоль), и смесь перемешивали в течение 15 часов при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 102 (1,67 г, выход 2 этапов 14%).
ЖХ/МС (ESI): m/z=264,99 [M+H]+, условия измерений при ЖХ/МС: (1)
Третий этап. Синтез соединения 103
К раствору соединения 102 (1,85 г, 7,00 ммоль) в DMF (13,0 мл) добавляли (Z)-((2-(трет-бутокси)-1-метоксивинил)окси)триметилсилан (3,06 г, 14,0 ммоль), ZnF2 (1,45 г, 14,0 ммоль) и бис(три-трет-бутилфосфин)палладий (357 мг, 0,700 ммоль), и смесь перемешивали в атмосфере азота в течение 2 часов при 100°C. После охлаждения к реакционной смеси добавляли этилацетат и воду, и смесь фильтровали. Получаемый фильтрат экстрагировали этилацетатом. Органический слой промывали водой и сушили с помощью безводного сульфата натрия. Растворитель концентрировали при пониженном давлении, получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 103 (1,93 г, выход 83%).
ЖХ/МС (ESI): m/z=331,01 [M+H]+, условия измерений при ЖХ/МС: (1)
Четвертый этап. Синтез соединения 104
К раствору соединений 103 (1,93 г, 5,83 ммоль) в DMF (19,3 мл) добавляли NBS (1,09 г, 6,13 ммоль) при охлаждении льдом, и смесь перемешивали в течение 2,5 часа при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и сушили с помощью безводного сульфата натрия. Растворитель концентрировали при пониженном давлении с получением соединения 104 (2,38 г, выход 100%) в виде неочищенного продукта.
ЖХ/МС (ESI): m/z=409,15 [M+H]+, условия измерений при ЖХ/МС: (1)
Пятый этап. Синтез соединения 105
К смешанному раствору соединения 104 (1,14 г, 2,78 ммоль) в DMF (5,70 мл) и воде (2,85 мл) добавляли п-толилбороновую кислоту (568 мг, 4,17 ммоль), карбонат калия (1,15 г, 8,35 ммоль) и PdCl2 (dtbpf) (181 мг, 0,278 ммоль), и смесь перемешивали в атмосфере азота в течение 30 минут при комнатной температуре. После охлаждения реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали водой и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 105 (991 мг, выход 85%).
ЖХ/МС (ESI): m/z=421,07 [M+H]+, условия измерений при ЖХ/МС: (1)
Шестой этап. Синтез соединения 106
К раствору соединения 105 (987 мг, 2,35 ммоль) в дихлорметане (5,94 мл) добавляли триэтиламин (475 мг, 4,69 ммоль), метилхлорглиоксилат (431 мг, 3,52 ммоль), DMAP (29,0 мг, 0,235 ммоль) при охлаждении льдом, и смесь перемешивали в течение 20 минут при комнатной температуре. Реакционную смесь экстрагировали этилацетатом после добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия и водой и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении с получением соединения 106 (1,11 г, выход 93%) в виде неочищенного продукта.
ЖХ/МС (ESI): m/z=507,30 [M+H]+, условия измерений при ЖХ/МС: (1)
Седьмой этап. Синтез соединения 107
К смешанному раствору соединения 106 (1,11 г, 2,19 ммоль) в THF (11,1 мл), метаноле (5,56 мл) и воде (2,78 мл) добавляли дитионит натрия (3,81 г, 21,9 ммоль), и смесь нагревали с обратным холодильником и перемешивали в течение 6 часов. После охлаждения реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой промывали насыщенным рассолом и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 107 (553 мг, выход 57%).
ЖХ/МС (ESI): m/z=445,30 [M+H]+, условия измерений при ЖХ/МС: (1)
Восьмой этап. Синтез соединения 108
К раствору соединения 107 (550 мг, 1,24 ммоль) в DMF (5,5 мл) добавляли NBS (264 мг, 1,48 ммоль), и смесь перемешивали в течение 1 часа при комнатной температуре и перемешивали в течение 1 часа при 60°C. Туда добавляли NBS (264 мг, 1,48 ммоль), и смесь перемешивали в течение 5 часов при 60°C. После охлаждения реакционную смесь экстрагировали этилацетатом после добавления воды. Органический слой последовательно промывали водой, насыщенным водным раствором гидрокарбоната натрия и водой и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении с получением соединения 108 (695 мг) в виде неочищенного продукта.
ЖХ/МС (ESI): m/z=523,22 [M+H]+, условия измерений при ЖХ/МС: (1)
Девятый этап. Синтез соединения 109
К раствору соединений 108 (695 мг) в THF (1,30 мл) добавляли раствор 0,90 моль/л комплекса боран-THF (29,0 мг, 0,235 ммоль) в THF при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 70 минут. Реакционную смесь экстрагировали этилацетатом после добавления метанола, этилацетата и насыщенного водного раствора гидрокарбоната натрия при охлаждении льдом. Органический слой промывали насыщенным рассолом и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 109 (491 мг, выход 80%).
ЖХ/МС (ESI): m/z=495,28 [M+H]+, условия измерений при ЖХ/МС: (1)
Десятый этап. Синтез соединения 110
К раствору соединения 109 (485 мг, 0,978 ммоль) в толуоле (3,40 мл) добавляли изопропенилацетат (294 мг, 2,93 ммоль), трибутил(метокси)олово (9412,93 ммоль), ацетат палладия (43,9 мг, 0,196 ммоль) и три(o-толил)фосфин (119 мг, 0,391 ммоль), и смесь перемешивали в атмосфере азота в течение 1 часа при 100°C. После охлаждения к реакционной смеси добавляли этилацетат и водный раствор 4 моль/л фторида калия, и смесь перемешивали в течение 1 часа и фильтровали. Фильтрат экстрагировали этилацетатом, и органический слой промывали насыщенным рассолом и сушили с помощью безводного сульфата натрия. Растворитель концентрировали при пониженном давлении, и получаемый остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 110 (296 мг, выход 67%).
ЖХ/МС (ESI): m/z=455,13 [M+H]+, условия измерений при ЖХ/МС: (1)
Одиннадцатый этап. Синтез соединений I-184 и 1-187
К смешанному раствору соединения 110 (232 мг, 0,510 ммоль) в этаноле (3,48 мл) и THF (1,50 мл) добавляли водный раствор 2 моль/л гидроксида натрия (2,65 мл), и смесь нагревали с обратным холодильником и перемешивали в течение 2 часов. После охлаждения реакционную смесь экстрагировали хлороформом после добавления водного раствора 2 моль/л соляной кислоты (2,70 мл) и сушили с помощью безводного сульфата натрия. Растворитель концентрировали при пониженном давлении, получаемый остаток кристаллизовали с этилацетатом, диизопропиловым эфиром и гексаном с получением соединения 111 (203 мг, выход 90%) в виде рацематов, и проводили оптическое разделение с получением оптически активного соединения I-184 (87 мг) и оптически активного соединения I-187 (84,7 мг).
Соединение I-184: ЖХ/МС (ESI): m/z=441 [M+H]+, RT=2,32 мин, условия измерений при ЖХ/МС: (1)
Соединение I-187: ЖХ/МС (ESI): m/z=441 [M+H]+, RT=2,32 мин, условия измерений при ЖХ/МС: (1)
(Пример 23)
[0393]
[Химическая формула 148]

Первый этап. Синтез соединения 113
Соединение 112 (450 мг, 0,696 ммоль) растворяли в толуоле (4,5 мл), затем туда добавляли дифенилметанимин (252 мг, 1,39 ммоль), 2,2'-бис(дифенилфосфино)-1,1'-нафтил (130 мг, 0,209 ммоль), трис(дибензилиденацетон)дипалладий (63,7 мг, 0,070 ммоль) и карбонат цезия (680 мг, 2,09 ммоль), и смесь перемешивали в атмосфере азота при 100°C в течение 3 часов. Туда добавляли тетрагидрофуран (10 мл) и соляную кислоту 2 моль/л (5 мл), и смесь перемешивали в течение 40 минут при комнатной температуре. Реакционную смесь экстрагировали этилацетатом (30 мл) после добавления воды (20 мл). Органический слой промывали водой (30 мл) и насыщенным рассолом (30 мл) и сушили над безводным сульфатом магния. После концентрирования получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 113 (271 мг, выход 76%) в виде оранжевой пены.
Условия измерений при ЖХ/МС: (1): m/z=514 [M+H]+
Второй этап. Синтез соединения 114
Соединение 113 (40 мг, 0,078 ммоль) растворяли в пиридине (0,7 мл). Туда добавляли метансульфонилхлорид (0,012 мл, 0,156 ммоль) при охлаждении льдом, и смесь перемешивали в течение 40 минут при комнатной температуре. Реакционную смесь экстрагировали этилацетатом (20 мл) после добавления воды (10 мл). Органический слой промывали соляной кислотой 2 моль/л (10 мл), водой (10 мл) и насыщенным рассолом (10 мл) и сушили над безводным сульфатом магния. После концентрирования получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 114 (41 мг, выход 81%) в виде желтой пены.
Условия измерений при ЖХ/МС: (1): m/z=592 [M+H]+
Третий этап. Синтез соединения 115
Соединение 114 (37 мг, 0,063 ммоль) и карбонат калия (43 мг, 0,313 ммоль) растворяли в N,N-диметилформамиде (0,7 мл). Туда добавляли метилйодид (0,020 мл, 0,313 ммоль) при комнатной температуре, и смесь перемешивали в течение 1,5 часа при комнатной температуре. Реакционную смесь экстрагировали этилацетатом (20 мл) после добавления воды (10 мл). Органический слой промывали водой (10 мл) и насыщенным рассолом (10 мл) и сушили над безводным сульфатом магния. После концентрирования получаемый остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 115 (34 мг, выход 89%) в виде желтой пены.
Условия измерений при ЖХ/МС: (1): m/z=606 [M+H]+
Четвертый этап. Синтез соединения I-201
Соединения 115 (34 мг, 0,056 ммоль) растворяли в тетрагидрофуране (0,5 мл) и этаноле (0,5 мл). Туда добавляли водный раствор 2 моль/л гидроксида натрия (0,5 мл), и смесь перемешивали в течение 3,5 часа при 80°C. Туда добавляли водный раствор 2 моль/л соляной кислоты (0,5 мл) и насыщенный рассол (30 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой сушили над безводным сульфатом магния. После концентрирования получаемый остаток очищали с помощью хроматографии на силикагеле (хлороформ-метанол) с получением соединения I-201 (29 мг, выход 87%).
Условия измерений при ЖХ/МС: (1): m/z=592 [M+H]+, RT=2,71
(Пример 24)
[0394]
[Химическая формула 149]
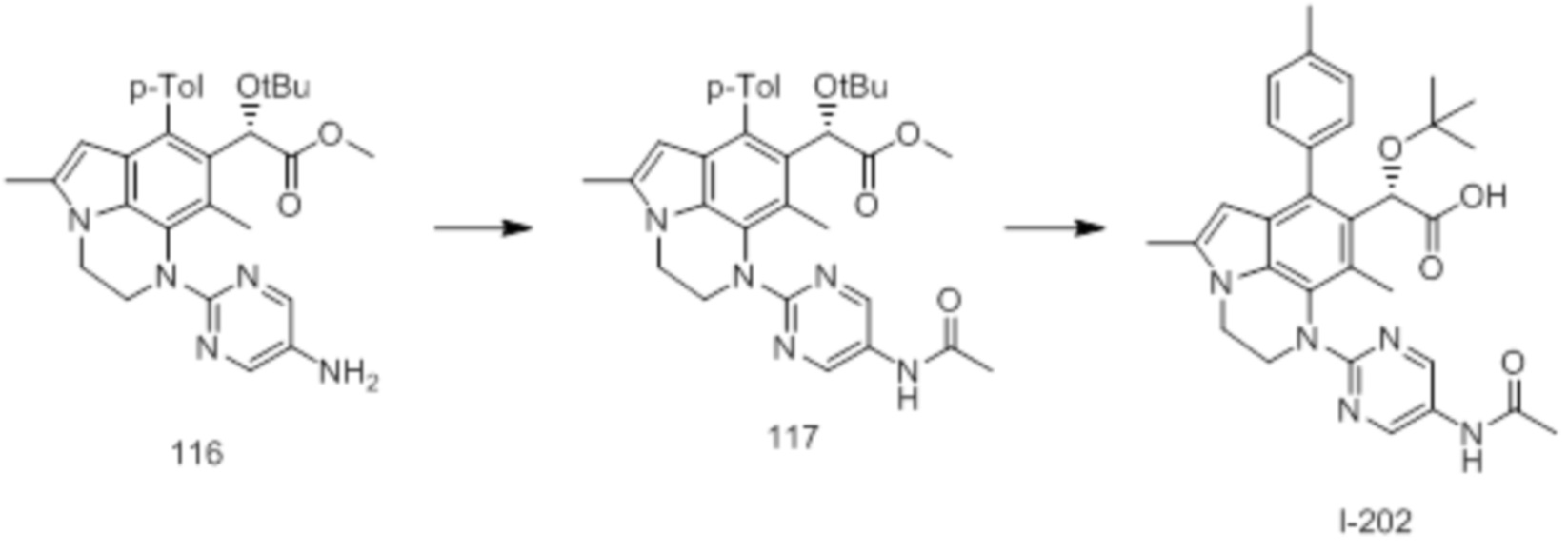
Этап 1. Синтез соединения 117
Соединение 116 (70 мг, 0,136 ммоль) и пиридин (0,022 мл, 0,237 ммоль) растворяли в дихлорметане (0,7 мл). Туда добавляли по каплям при охлаждении льдом ацетилхлорид (0,015 мл, 0,204 ммоль), и смесь перемешивали при комнатной температуре в течение 50 минут. Туда добавляли воду (10 мл), и смесь экстрагировали этилацетатом (20 мл). Органический слой промывали водой (10 мл) и насыщенным рассолом (10 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 117 (61 мг, 80% выход).
Условия измерений при ЖХ/МС: (1), m/z=556 [M+H]+.
Этап 2. Синтез соединения I-202
Соединение 117 (61 мг, 0,109 ммоль) растворяли в тетрагидрофуране (0,5 мл) и этаноле (0,5 мл). Туда добавляли водный раствор 2 моль/л гидроксида натрия (0,5 мл), и смесь перемешивали при 80°C в течение 2 часов. Туда добавляли водный раствор 2 моль/л соляной кислоты (0,5 мл) и насыщенный рассол (30 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью препаративной тонкослойной хроматографии (хлороформ-метанол) с получением соединения I-20 (18 мг, 28% выход). Условия измерений при ЖХ/МС: (1), m/z=542 [M+H]+, RT=2,43 мин.
(Пример 25)
[0395]
[Химическая формула 150]
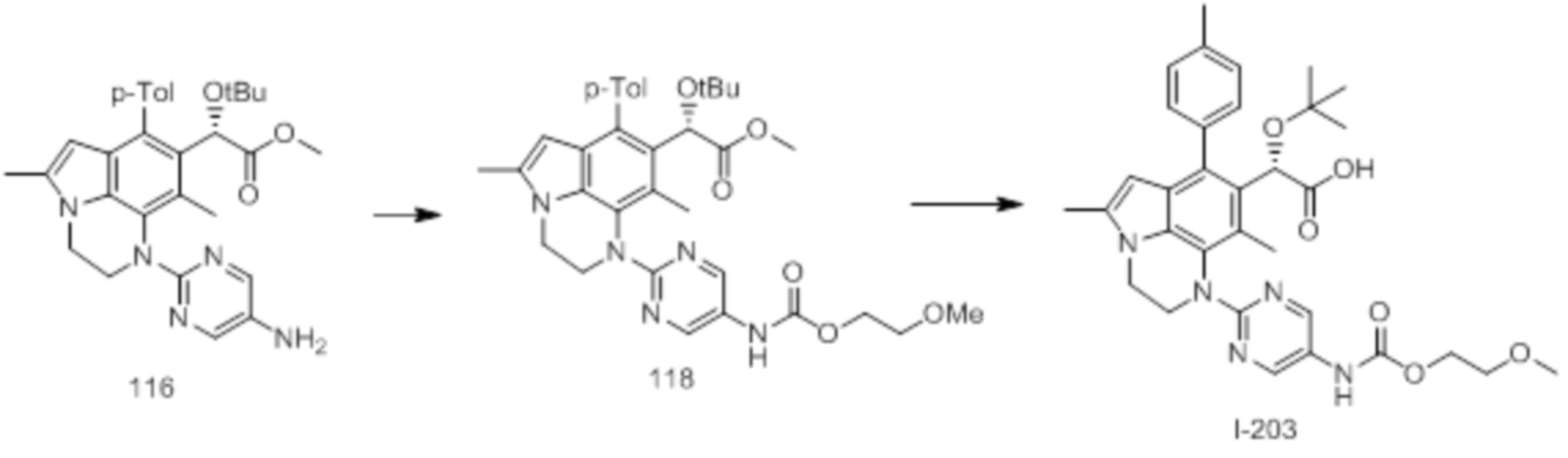
Этап 1. Синтез соединения 118
Соединение 116 (70 мг, 0,136 ммоль) и пиридин (0,022 мл, 0,273 ммоль) растворяли в метиленхлориде (0,7 мл). При охлаждении льдом к смеси добавляли по каплям 2-метоксиэтилхлорформиат (0,024 мл, 0,204 ммоль), и перемешивали при комнатной температуре в течение 1,5 часа. При охлаждении льдом туда добавляли по каплям 2-метоксиэтилхлорформиат (0,024 мл, 0,204 ммоль) и пиридин (0,022 мл, 0,273 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Туда добавляли воду (10 мл), и смесь экстрагировали этилацетатом (20 мл). Органический слой промывали водой (10 мл) и насыщенным рассолом (10 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 118 (64 мг, 77% выход) в виде желтой пены. Условия измерений при ЖХ/МС: (1), m/z=616 [M+H]+.
Этап 2. Синтез соединения I-203
Соединение 118 (64 мг, 0,104 ммоль) растворяли в N,N-диметилацетамиде (1,0 мл). К смеси добавляли хлорид лития (88 мг, 2,079 ммоль), и смесь перемешивали при 120°C в течение 20 часов. Туда добавляли водный раствор 2 моль/л соляной кислоты (0,5 мл) и воду (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью ВЭЖХ (0,1% муравьиной кислоты в воде - 0,1% муравьиной кислоты в ацетонитриле) с получением соединения I-203 (3 мг, 5% выход). Условия измерений при ЖХ/МС: (1), m/z=602 [M+H]+, RT=2,69 мин.
(Пример 26)
[0396]
[Химическая формула 151]
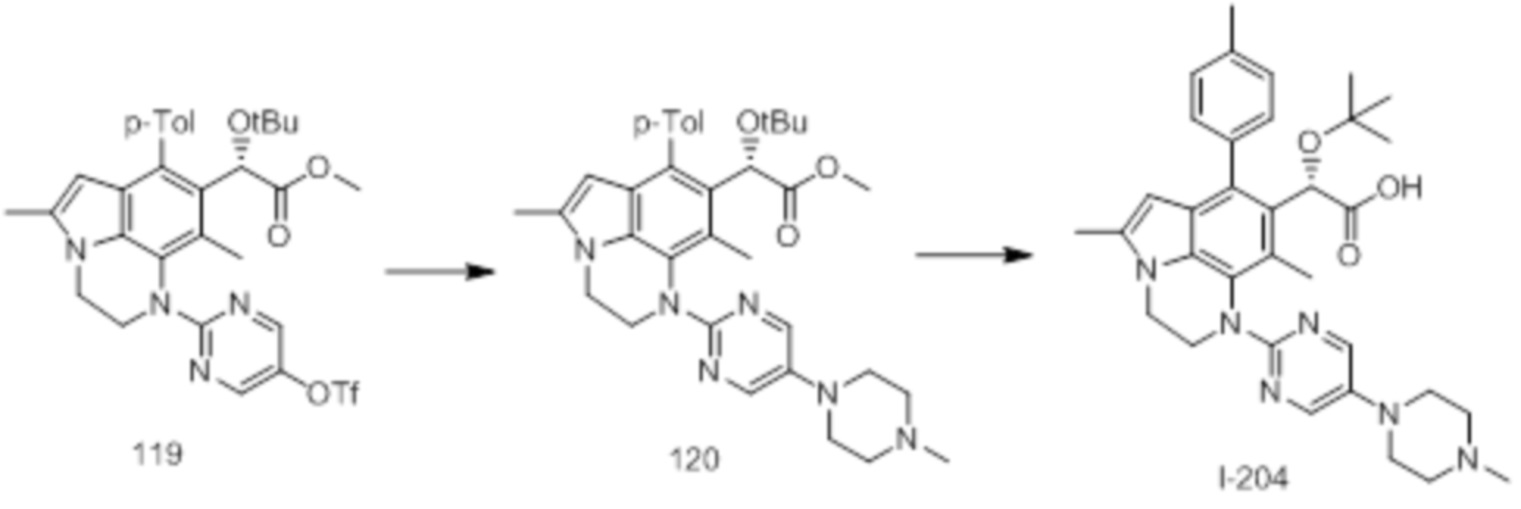
Этап 1. Синтез соединения 120
Трис(дибензилиденацетон)дипалладий (56,6 мг, 0,062 ммоль) и 2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил (87 мг, 0,186 ммоль) растворяли в толуоле (2 мл), и смесь перемешивали в атмосфере азота при 110°C в течение 2 минут. Туда добавляли соединение 119 (400 мг, 0,619 ммоль), 1-метилпиперазин (620 мг, 6,20 ммоль) и карбонат цезия (605 мг, 1,86 ммоль) в толуоле (2 мл), и смесь перемешивали в атмосфере азота при 110°C в течение 4 часов. Туда добавляли воду (30 мл), и смесь экстрагировали этилацетатом (50 мл). Органический слой промывали водой (30 мл) и насыщенным рассолом (30 мл), и затем сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле DIOL (этилацетат) с получением соединения 120 (173 мг, 47% выход) в виде оранжевой пены. Условия измерений при ЖХ/МС: (3), m/z=597 [M+H]+.
Этап 2. Синтез соединения I-204
Соединение 120 (171 мг, 0,287 ммоль) растворяли в тетрагидрофуране (1,0 мл) и этаноле (1,0 мл). Туда добавляли водный раствор 2 моль/л гидроксида натрия (1,5 мл), и перемешивали при 90°C в течение 3,5 часа. Туда добавляли водный раствор 2 моль/л соляной кислоты (1,5 мл) и насыщенный рассол (30 мл), и смесь экстрагировали этилацетатом (30 мл), органический слой сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью колоночной хроматографии на силикагеле DIOL (хлороформ-метанол) с получением соединения I-204 (120 мг, 72% выход). Условия измерений при ЖХ/МС: (1), m/z=583 [M+H]+, RT=2,35 мин.
(Пример 27)
[0397]
[Химическая формула 152]

Этап 1. Синтез соединения 122
Соединение 121 (450 мг, 1,515 ммоль), 2-(триметилсилил)этанол (538 мг, 4,55 ммоль), 1,10-фенантролин (54,6 мг, 0,303 ммоль), йодид меди (28,9 мг, 0,152 ммоль) и карбонат цезия (988 мг, 2,03 ммоль) растворяли в толуоле (0,75 мл), и смесь перемешивали в атмосфере азота при 115°C в течение 17 часов. Туда добавляли водный раствор 2 моль/л соляной кислоты (30 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой промывали насыщенным водным раствором бикарбоната натрия (30 мл) и воды (30 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на аминосиликагеле (гексан-этилацетат) с получением соединения 122 (282 мг, 65% выход) в виде бесцветного жидкого материала.
1H-ЯМР (CDCl3) δ: 7,38 (1H, d, J=8,0 Гц), 6,69 (1H, s), 6,63 (1H, d, J=8,0 Гц), 4,11 (2H, t, J=8,0 Гц), 2,31 (3H, s), 1,20 (2H, t, J=8,0 Гц), 0,01 (9H, s).
Этап 2. Синтез соединения 123
Соединение 122 (8,65 г, 30,1 ммоль) растворяли в тетрагидрофуране (87 мл), в атмосфере азота, туда добавляли раствор 1,6 моль/л н-бутиллития в гексане при -78°C (19,1 мл, 49,7 ммоль)), и смесь перемешивали в течение 30 минут при -78°C. Туда добавляли по каплям триизопропиловый эфир борной кислоты (14,0 мл, 60,2 ммоль), и смесь перемешивали при -78°C в течение 1 часа. Туда добавляли насыщенный водный раствор хлорида аммония (100 мл) и водный раствор 2 моль/л соляной кислоты (50 мл), и смесь экстрагировали этилацетатом (300 мл). Органический слой промывали водой (300 мл) и сушили над безводным сульфатом магния. После концентрирования остаток промывали гексаном с получением соединения 123 (5,33 г, 70% выход).
1H-ЯМР (CDCl3) δ: 7,70 (1H, d, J=7,4 Гц), 6,83 (1H, d, J=7,4 Гц), 6,70 (1H, s), 5,96 (2H, s), 4,14 (2H, t, J=8,2 Гц), 2,37 (3H, s), 1,21 (2H, t, J=8,2 Гц), 0,10 (9H, s).
Этап 3. Синтез соединения 124
При охлаждении льдом к раствору соединения 123-1 (9,0 г, 23,5 ммоль) в метиленхлориде (10 мл) добавляли пиридин (4,05 мл, 50,1 ммоль) и 2-триметилсилилхлорид (4,5 мл, 23,7 ммоль), смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагировали метиленхлоридом. Органический слой промывали соляной кислотой 1 моль/л и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 124 (5,6 г, 43,6% выход) в виде бесцветного твердого вещества. ЖХ/МС (ESI): m/z=546,99 [MH]-, RT=2,92 мин, условия измерений при ЖХ/МС: (1).
Этап 4. Синтез соединения 125
Соединение 124 (1,5 г, 2,74 ммоль) и карбонат цезия (2,68 г, 8,22 ммоль) растворяли в N,N-диметилформамиде (7,5 мл) при комнатной температуре, туда добавляли по каплям 1,2-дибромэтан (0,354 мл, 4,11 ммоль), и смесь перемешивали в течение 21 часа. Туда добавляли воду (50 мл), и смесь экстрагировали этилацетатом (50 мл). Органический слой промывали водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и сушили над безводным сульфатом магния. После концентрирования остаток промывали гексаном с получением соединения 125 (1,39 г, 88% выход). Условия измерений при ЖХ/МС: (1), m/z=573 [M+H]+.
Этап 5. Синтез соединения 126
Соединение 125 (1,4 г, 2,44 ммоль) растворяли в тетрагидрофуране (7,0 мл). Туда добавляли по каплям раствор 1 моль/л фторида тетрабутиламмония в тетрагидрофуране (7,32 мл, 7,32 ммоль) при комнатной температуре, смесь перемешивали при 60°C в течение 1 часа. Туда добавляли воду (50 мл), и смесь экстрагировали этилацетатом (50 мл). Органический слой промывали водой (50 мл) и насыщенным рассолом (50 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 126 (959 мг, 95% выход). Условия измерений при ЖХ/МС: (1), m/z=409 [M+H]+.
Этап 6. Синтез соединения 127
Соединение 126 (500 мг, 1,22 ммоль), соединение 123 (770 мг, 3,05 ммоль), дихлорид [1,1'-бис(ди-трет-бутилфосфино)ферроцен]палладия(II) (80 мг, 0,122 ммоль) и водный раствор 2 моль/л карбоната калия (1,83 мл, 3,66 ммоль) растворяли в N,N-диметилформамиде (5,0 мл), и смесь перемешивали в атмосфере азота при 120°C в течение 1 часа. Туда добавляли воду (30 мл), и смесь экстрагировали этилацетатом (50 мл). Органический слой промывали водой (30 мл) и насыщенным рассолом (30 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 127 (331 мг, 50% выход) в виде коричневой пены. Условия измерений при ЖХ/МС: (1), m/z=537 [M+H]+.
Этап 7. Синтез соединения 128
Соединение 127 (50 мг, 0,093 ммоль) растворяли в толуоле (0,7 мл), затем туда добавляли 2-бром-5-метоксипиримидин (70,4 мг, 0,373 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (16,2 мг, 0,028 ммоль), трис(дибензилиденацетон)дипалладий (12,8 мг, 0,014 ммоль) и трет-бутоксид натрия (35,8 мг, 0,373 ммоль), и смесь перемешивали в атмосфере азота при 60°C в течение 1 часа. Туда добавляли 2-бром-5-метоксипиримидин (70,4 мг, 0,373 ммоль) и трет-бутоксид натрия (35,8 мг, 0,373 ммоль), после перемешивания в течение 1,5 ч туда добавляли 2-бром-5-метоксипиримидин (70,4 мг, 0,373 ммоль) и трет-бутоксид натрия (35,8 мг, 0,373 ммоль), и смесь перемешивали в течение 1,5 часа. Туда добавляли воду (20 мл), и смесь экстрагировали этилацетатом (20 мл). Органический слой промывали водой (20 мл) и насыщенным рассолом (20 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 128 в виде неочищенного продукта. Получаемый неочищенный продукт непосредственно использовали в следующей реакции без дополнительной очистки. Условия измерений при ЖХ/МС: (1), m/z=645 [M+H]+.
Этап 8. Синтез соединения I-205
Соединение 128 (128 мг, 0,198 ммоль) растворяли в тетрагидрофуране (7,0 мл). Туда добавляли по каплям раствор 1 моль/л фторида тетрабутиламмония в тетрагидрофуране (0,595 мл, 0,595 ммоль) при комнатной температуре, смесь перемешивали при 80°C в течение 1,5 часа. Туда добавляли раствор 1 моль/л фторида тетрабутиламмония в тетрагидрофуране (0,595 мл, 0,595 ммоль), и смесь перемешивали в течение 1,5 часа, затем туда добавляли дополнительно раствор 1 моль/л фторида тетрабутиламмония в тетрагидрофуране (0,595 мл, 0,595 ммоль), и смесь перемешивали в течение 1,5 часа. Туда добавляли воду (30 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой промывали водой (30 мл) и насыщенным рассолом (30 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (хлороформ-метанол) с получением соединения I-205 (25 мг, 2 этапы, 31% выход) в виде коричневой пены. Условия измерений при ЖХ/МС: (1), m/z=531 [M+H]+, RT=2,66 мин.
(Пример 28)
[0398]
[Химическая формула 153]
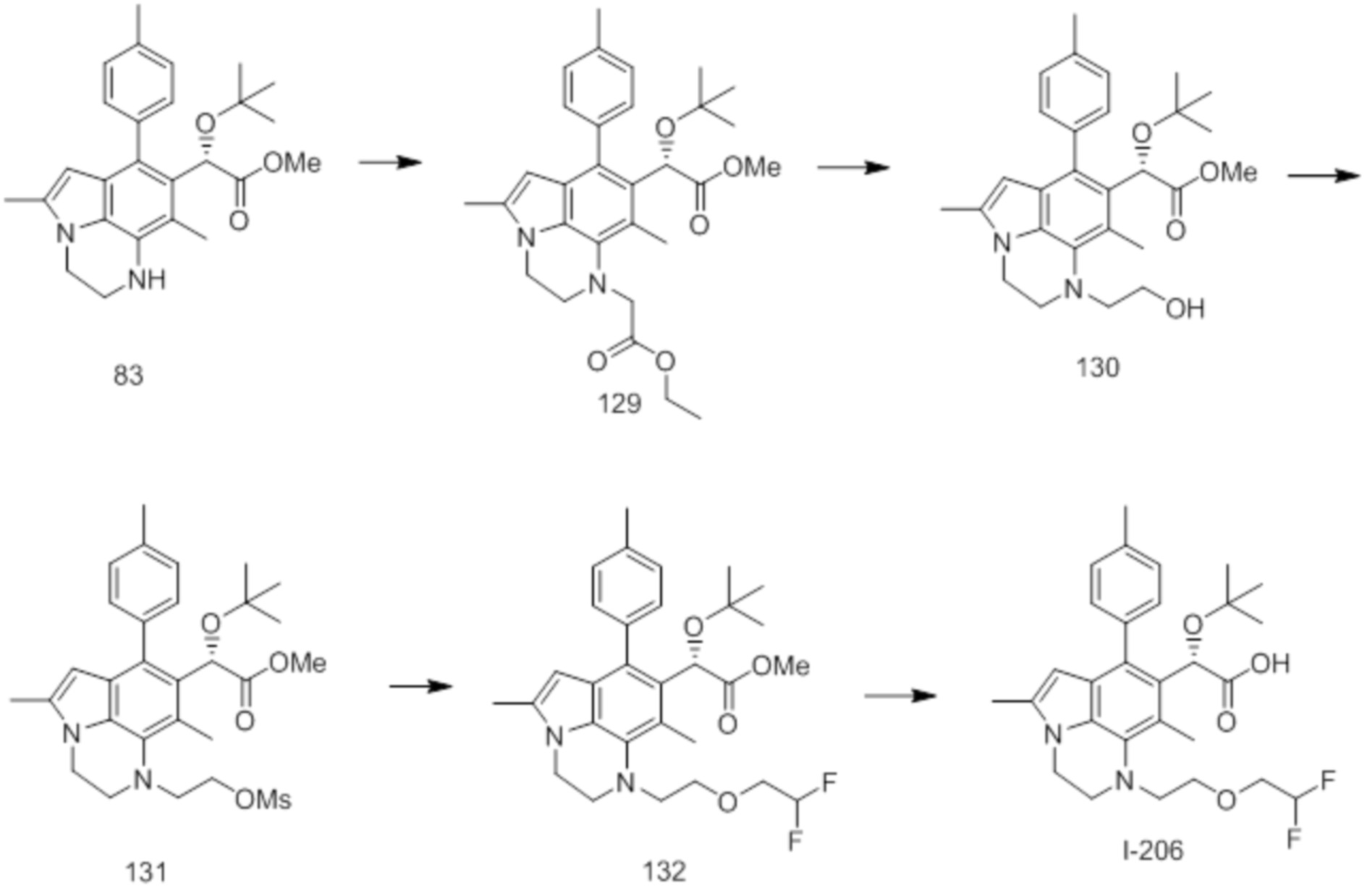
Этап 1. Синтез соединения 129
К раствору соединения 83 (400 мг, 0,951 ммоль) в диметилформамиде (4,0 мл) добавляли этилйодацетат (305 мг, 1,43 ммоль) и карбонат цезия (620 мг, 1,90 ммоль), смесь перемешивали при 70°C в течение 3 часов. Туда добавляли соляную кислоту 1 моль/л, и водный слой экстрагировали хлороформом, органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении получали соединение 129 (572 мг, 118% выход) в виде желтого твердого вещества. Соединение 129 непосредственно использовали для следующей реакции без дополнительной очистки. ЖХ/МС (ESI): m/z=507,21 [M+H]+, RT=3,07 мин, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения 130
При охлаждении льдом к раствору соединения 129 (572 мг, 1,13 ммоль) в этаноле (5,7 мл) добавляли водный раствор 2 моль/л гидроксида натрия (1,69 мл, 3,39 ммоль), затем смесь перемешивали при 0°C в течение 1 часа. Туда добавляли соляную кислоту 1 моль/л, и смесь экстрагировали хлороформом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении получали неочищенный продукт в виде желтой пены. При охлаждении льдом к раствору неочищенного продукта (470 мг, 0,98 ммоль) в тетрагидрофуране (6,0 мл) добавляли по каплям раствор 0,92 моль/л борана в тетрагидрофуране, и реакционную смесь нагревали до рефлюкса в течение 1 часа. Туда добавляли соляную кислоту 1 моль/л, и смесь экстрагировали хлороформом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле DIOL (гексан-этилацетат) с получением соединения 130 (339 мг, 64% выход) в виде белой пены. ЖХ/МС (ESI): m/z=465,27 [M+H]+, RT=2,57 мин, условия измерений при ЖХ/МС: (1).
Этап 3. Синтез соединения 131
При охлаждении льдом к раствору соединения 130 (1,40 г, 3,01 ммоль) в этилацетате (10 мл) добавляли триэтиламин (2,09 мл, 15,1 ммоль) и метансульфонилхлорид (0,939 мл, 12,1 ммоль), смесь перемешивали при комнатной температуре в течение 30 минут. Туда добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле DIOL (гексан-этилацетат) с получением соединения 131 (860 мг, 53% выход) в виде желтой пены. ЖХ/МС (ESI): m/z=545,30 [M+H]+, RT=2,87 мин, условия измерений при ЖХ/МС: (1).
Этап 4. Синтез соединения 132
К раствору 2,2-дифторэтан-1-ола (26,5 мг, 0,322 ммоль) в диметилформамиде (0,35 мл) добавляли последовательно раствор гидрида натрия (12,9 мг, 0,322 ммоль) и соединение 131 (35 мг, 0,064 ммоль), и смесь перемешивали при 80°C в течение 1 часа. Туда добавляли соляную кислоту 1 моль/л, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле DIOL (гексан-этилацетат) с получением соединения 132 (64 мг, 66% выход) в виде желтого маслянистого материала. ЖХ/МС (ESI): m/z=529,25 [M+H]+, RT=3,22 мин, условия измерений при ЖХ/МС: (1).
Этап 5. Синтез соединения I-206
К раствору соединения 132 (74 мг, 0,14 ммоль) в тетрагидрофуране (0,7 мл) и метаноле (0,7 мл) добавляли водный гидроксид натрия 2 моль/л (0,7 мл, 1,4 ммоль), смесь перемешивали при 90°C в течение 2 часов. Туда добавляли соляную кислоту 1 моль/л, и водный слой экстрагировали хлороформом. После концентрирования при пониженном давлении остаток очищали с помощью жидкостной хроматографии с получением соединения I-206 (32 мг, 49% выход) в виде желтого твердого вещества. ЖХ/МС (ESI): m/z=515,46 [M+H]+, RT=2,82 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 10,03 (1H, s), 7,57 (1H, d, J=6,7 Гц), 7,39 (1H, d, J=6,7 Гц), 7,25-7,23 (2H, br m), 5,92 (1H, s), 5,85 (1H, td, J=111,1, 4,3 Гц), 5,59 (1H, s), 3,96 (2H, dt, J=16,7, 6,4 Гц), 3,85 (2H, td, J=5,4, 2,3 Гц), 3,70 (2H, td, J=27,7, 4,1 Гц), 3,57-3,51 (2H, m), 3,12 (2H, dt, J=19,4, 7,4 Гц), 2,42 (3H, s), 2,40 (3H, s), 2,34 (3H, s), 0,90 (9H, s).
(Пример 29)
[0399]
[Химическая формула 154]

Этап 1. Синтез соединения 133
К раствору соединения 131 (100 мг, 0,184 ммоль) в диметилформамиде (1,0 мл) добавляли этоксид натрия (62,7 мг, 0,921 ммоль), и смесь перемешивали при 80°C в течение 1 часа. Туда добавляли соляную кислоту 1 моль/л, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле DIOL (гексан-этилацетат) с получением соединения 133 (21 мг, 23% выход) в виде желтого маслянистого материала. ЖХ/МС (ESI): m/z=493,24 [M+H]+, RT=3,16 мин, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения I-207
К раствору соединения 133 (21 мг, 0,043 ммоль) в тетрагидрофуране (0,5 мл) и метаноле (0,5 мл) добавляли водный гидроксид натрия 2 моль/л (0,5 мл, 1,0 ммоль), смесь перемешивали при 90°C в течение 1 часа. Туда добавляли соляную кислоту 1 моль/л, водный слой экстрагировали хлороформом, и органический слой концентрировали при пониженном давлении. Остаток очищали с помощью жидкостной хроматографии с получением соединения I-207 (3 мг, 15% выход) в виде желтого твердого вещества. ЖХ/МС (ESI): m/z=479,20 [M+H]+, RT=2,82, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 7,59 (1H, d, J=7,3 Гц), 7,39 (1H, d, J=7,4 Гц), 7,25-7,23 (2H, br m), 5,92 (1H, s), 5,58 (1H, s), 3,96 (2H, d, J=4,9 Гц), 3,76-3,74 (4H, m), 3,56-3,53 (2H, m), 3,26-2,91 (2H, m), 2,43-2,41 (6H, br m), 2,34 (3H, s), 1,23 (3H, t, J=6,8 Гц), 0,89 (9H, s).
(Пример 30)
[0400]
[Химическая формула 155]

Этап 1. Синтез соединения 134
При охлаждении льдом к раствору соединения 131 (50 мг, 0,184 ммоль) в метиленхлориде (2,5 мл) добавляли 20% водный раствор гидроксида калия (181 мг, 0,65 ммоль) и (бромдифторметил)триметилсилан (43,7 мг, 0,21 ммоль), и смесь перемешивали при 0°C в течение 1 часа. Туда добавляли воду, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью жидкостной хроматографии с получением соединения 134 (21 мг, 38% выход) в виде желтого маслянистого материала. ЖХ/МС (ESI): m/z=515,20 [M+H]+, RT=3,24 мин, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения I-208
К раствору соединения 134 (21 мг, 0,041 ммоль) в тетрагидрофуране (0,3 мл) и метаноле (0,3 мл) добавляли водный раствор 4 моль/л гидроксида лития (0,3 мл, 1,2 ммоль), смесь перемешивали при 80°C в течение 3 часов. Туда добавляли соляную кислоту 1 моль/л, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью жидкостной хроматографии с получением соединения I-208 (13 мг, 64% выход) в виде желтого твердого вещества.
ЖХ/МС (ESI): m/z=501,49 [M+H]+, RT=2,85 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 10,03 (1H, s), 7,57 (1H, d, J=7,8 Гц), 7,39 (1H, d, J=7,1 Гц), 7,24 (2H, d, J=10,0 Гц), 6,27 (1H, t, J=74,7 Гц), 5,93 (1H, s), 5,58 (1H, s), 4,17 (2H, t, J=5,7 Гц), 3,96 (2H, d, J=4,8 Гц), 3,51-3,48 (2H, br m), 3,25-3,05 (2H, m), 2,42 (3H, s), 2,41 (3H, s), 2,34 (3H, s), 0,90 (9H, s).
(Пример 31)
[0401]
[Химическая формула 156]
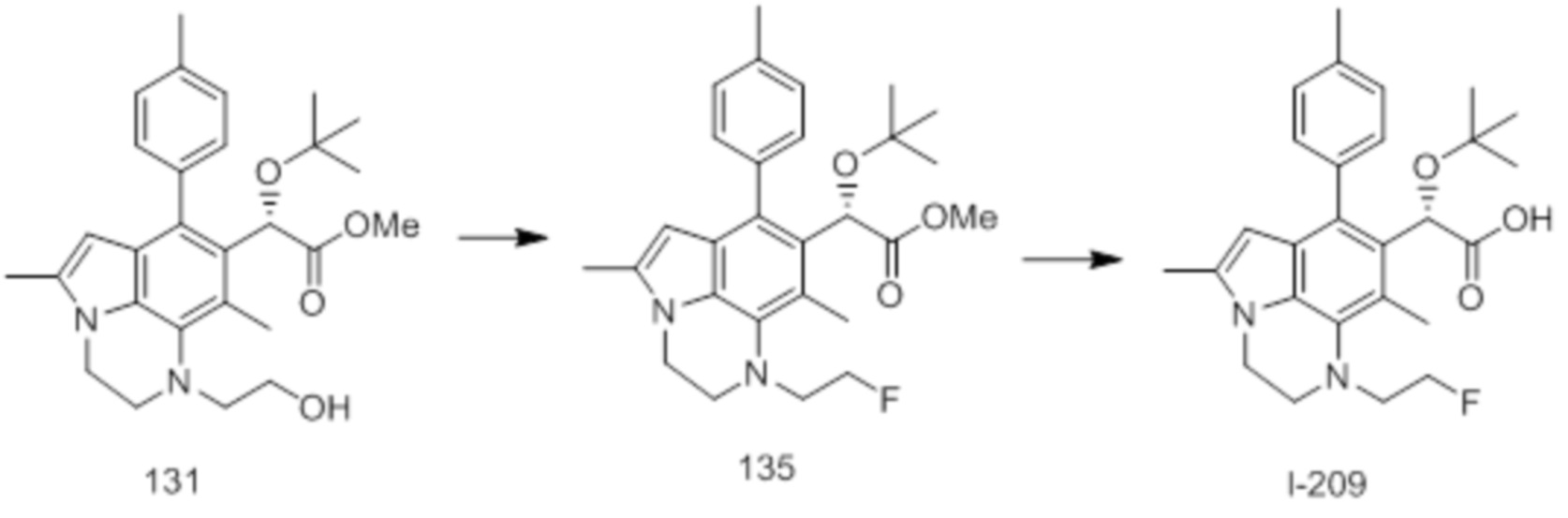
Этап 1. Синтез соединения 135
При охлаждении льдом к раствору соединения 131 (20 мг, 0,043 ммоль) в метиленхлориде (300 мкл) добавляли трифторид N,N-диэтиламиносеры (181 мг, 0,65 ммоль), смесь перемешивали при 0°C в течение 3 часов. Туда добавляли насыщенный водный раствор гидрокарбоната натрия, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью жидкостной хроматографии с получением соединения 135 (5 мг, 25% выход) в виде желтой пены. ЖХ/МС (ESI): m/z=467,25 [M+H]+, RT=3,02 мин, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения I-209
К раствору соединения 135 (5 мг, 10 мкмоль) в тетрагидрофуране (50 мкл) и метаноле (50 мкл) добавляли водный раствор 2 моль/л гидроксида натрия (50 мкл, 0,1 ммоль), смесь перемешивали при 80°C в течение 3 часов. Туда добавляли соляную кислоту 1 моль/л, водный слой экстрагировали метиленхлоридом, и органический слой концентрировали при пониженном давлении. Остаток очищали с помощью жидкостной хроматографии с получением соединения I-209 (1 мг, 21% выход) в виде желтого твердого вещества. ЖХ/МС (ESI): m/z=453,17 [M+H]+, RT=2,75 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 7,60 (1H, d, J=7,3 Гц), 7,40 (1H, d, J=7,3 Гц), 7,25-7,19 (2H, m), 5,93 (1H, s), 5,55 (1H, s), 4,74 (2H, dt, J=47,7, 4,4 Гц), 3,97 (2H, dd, J=11,1, 5,1 Гц), 3,53 (2H, t, J=4,9 Гц), 3,27-3,19 (2H, m), 2,42 (3H, s), 2,40 (3H, s), 2,34 (3H, s), 0,89 (9H, s).
(Пример 32)
[0402]
[Химическая формула 157]

Этап 1. Синтез соединения 136
При охлаждении льдом к раствору соединения 83 (100 мг, 0,238 ммоль) в пиридине (5 мл) добавляли 2-хлорэтан-1-сульфонилхлорид (58 мг, 0,357 ммоль), смесь перемешивали при комнатной температуре в течение 3 часов. Туда добавляли соляную кислоту 1 моль/л, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле с получением соединения 136 (99 мг, 82% выход) в виде желтого маслянистого материала.
1H-ЯМР (CDCl3) δ: 7,42 (1H, d, J=8,6 Гц), 7,33 (1H, d, J=6,3 Гц), 7,26-7,17 (2H, m), 6,57 (1H, dd, J=16,5, 10,0 Гц), 6,32 (1H, d, J=16,4 Гц), 5,95 (1H, d, J=9,9 Гц), 5,90 (1H, s), 5,42 (1H, s), 3,73-3,71 (4H, m), 2,45 (6H, br s), 2,29 (3H, s), 0,90 (9H, s).
Этап 2. Синтез соединения 137
К раствору соединения 136 (90 мг, 176 мкмоль) в тетрагидрофуране (3 мл) добавляли водный раствор 0,5 моль/л гидроксида тетрабутиламмония (3,42 мл, 1,76 ммоль), смесь перемешивали при комнатной температуре в течение 1 часа. Туда добавляли воду, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле с получением соединения 137 (45 мг, 48% выход) в виде бесцветной пены. ЖХ/МС (ESI): m/z=546,20 [M+H2O]+, RT=2,56 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 7,60 (1H, d, J=7,3 Гц), 7,40 (1H, d, J=7,3 Гц), 7,25-7,19 (2H, m), 5,93 (1H, s), 5,55 (1H, s), 4,74 (2H, dt, J=47,7, 4,4 Гц), 3,97 (2H, dd, J=11,1, 5,1 Гц), 3,53 (2H, t, J=4,9 Гц), 3,27-3,19 (2H, m), 2,42 (3H, s), 2,40 (3H, s), 2,34 (3H, s), 0,89 (9H, s).
Этап 3. Синтез соединения I-210
К раствору соединения 137 (45 мг, 85 мкмоль) в тетрагидрофуране (450 мкл) и метаноле (450 мкл) добавляли водный раствор 4 моль/л гидроксида лития (450 мкл, 1,8 ммоль), смесь перемешивали при 80°C в течение 3 часов. Туда добавляли соляную кислоту 1 моль/л, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле с получением соединения I-210 (1 мг, 2,3% выход) в виде желтого твердого вещества. ЖХ/МС (ESI): m/z=515,13 [M+H]+, RT=2,33 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 7,61 (1H, d, J=7,0 Гц), 7,35 (1H, d, J=7,3 Гц), 7,29-7,27 (2H, m), 5,93 (1H, s), 5,52 (1H, s), 4,22-4,13 (6H, br m), 3,40-3,36 (3H, m), 2,43 (6H, br s), 2,32 (3H, s), 0,91 (9H, s).
(Пример 33)
[0403]
[Химическая формула 158]
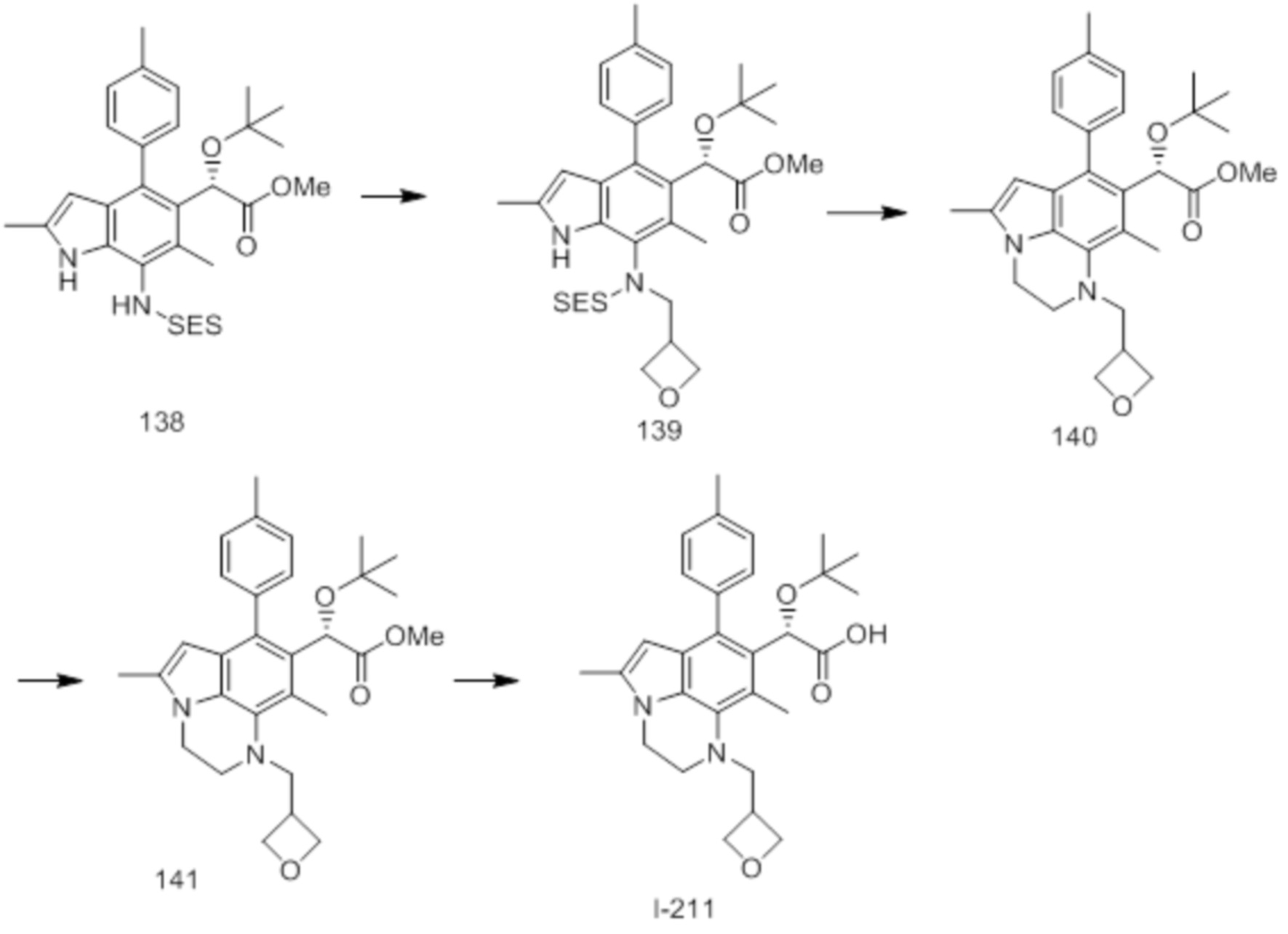
Этап 1. Синтез соединения 139
При охлаждении льдом к раствору соединения 138 (150 мг, 0,268 ммоль) в тетрагидрофуране (1,5 мл) добавляли оксетан-3-илметанол (35,5 мг, 0,403 ммоль), трифенилфосфин (106 мг, 0,403 ммоль) и бис(2-метоксиэтил)азокарбоксилат (94 мг, 0,403 ммоль), смесь перемешивали при комнатной температуре в течение 24 часов. Туда добавляли воду, водный слой экстрагировали этилацетатом, и органический слой промывали насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 139 (140 мг, выход 82,9%) в виде желтого маслянистого материала. ЖХ/МС (ESI): m/z=629,19 [M+H]+, RT=3,15 мин, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения 140
К раствору соединения 139 (140 мг, 223 мкмоль) в тетрагидрофуране (1,4 мл) добавляли раствор 1,0 моль/л фторида тетрабутиламмония (668 мкл, 668 мкмоль), смесь перемешивали при 60°C в течение 4 часов и при 80°C в течение 1 часа. Туда добавляли насыщенный водный раствор гидрокарбоната натрия, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 140 (60 мг, 58% выход) в виде желтого маслянистого материала. ЖХ/МС (ESI): m/z=465,16 [M+H]+, RT=2,45 мин, условия измерений при ЖХ/МС: (1).
Этап 3. Синтез соединения 141
При охлаждении льдом к раствору соединения 140 (60 мг, 129 мкмоль) в метиленхлориде (0,6 мл) добавляли гидроксид калия (36,2 мг, 0,65 ммоль) и дифенил(винил)трифторметансульфонат (94 мг, 258 мкмоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Туда добавляли соляную кислоту 0,1 моль/л, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 141 (44 мг, 86,7% выход) в виде желтого маслянистого материала. ЖХ/МС (ESI): m/z=491,19 [M+H]+, RT=2,61 мин, условия измерений при ЖХ/МС: (1).
Этап 4. Синтез соединения I-211
К раствору соединения 141 (44 мг, 90 мкмоль) в тетрагидрофуране (440 мкл) и метаноле (440 мкл) добавляли водный раствор 4 моль/л гидроксида лития (440 мкл, 1,76 ммоль), смесь перемешивали при 80°C в течение 3 часов. Туда добавляли соляную кислоту 1 моль/л, водный слой экстрагировали хлороформом, и органический слой концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (хлороформ-метанол) с получением соединения I-211 (10 мг, 23,4% выход) в виде желтого твердого вещества. ЖХ/МС (ESI): m/z=477,19 [M+H]+, RT=2,30 мин, условия измерений при ЖХ/МС: (3).
1H-ЯМР (CDCl3) δ: 7,57 (1H, d, J=7,3 Гц), 7,38 (1H, d, J=7,3 Гц), 7,27-7,25 (2H, m), 5,93 (1H, s), 5,59 (1H, s), 4,86 (2H, dd, J=14,3, 8,0 Гц), 4,55 (2H, q, J=5,7 Гц), 3,99-3,91 (2H, m), 3,52-3,45 (1H, m), 3,37-3,16 (4H, m), 2,42-2,40 (6H, br m), 2,34 (3H, s), 0,92 (9H, s).
(Пример 34)
[0404]
[Химическая формула 159]
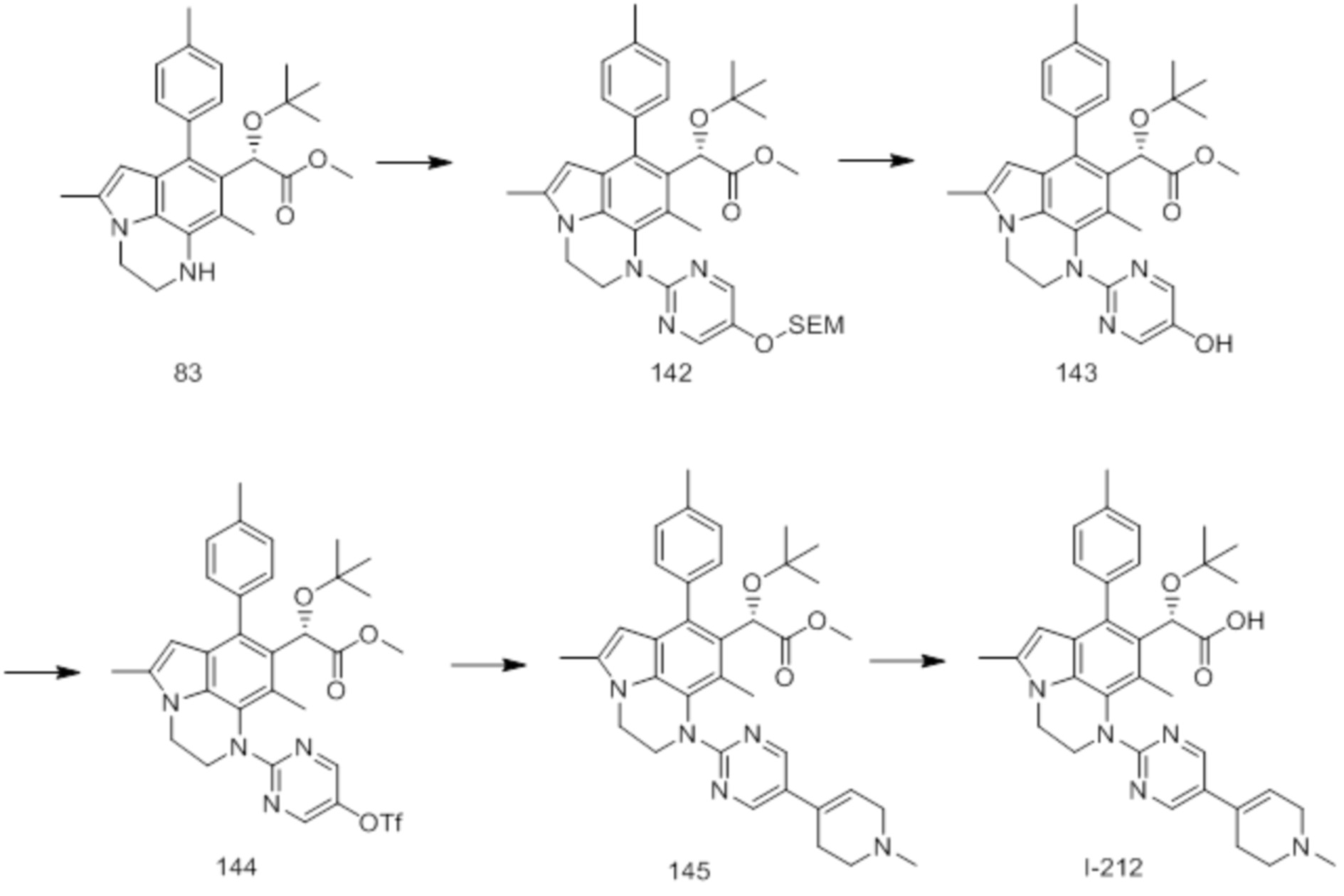
Этап 1
К раствору соединения 83 (9 г, 21,4 ммоль) в толуоле (90 мл) добавляли трет-бутоксид натрия (3,09 г, 32,1 ммоль), 2-бром-5-[(2-(триметилсилил)этокси)метокси]пиримидин (9,8 г, 32,1 ммоль), ксантфос (3,71 г, 6,42 ммоль) и дибензилиденацетонпалладий (2,94 г, 3,21 ммоль), смесь перемешивали в атмосфере азота при 60°C в течение 40 минут. Снова добавляли туда трет-бутоксид натрия (3,09 г, 32,1 ммоль), 2-бром-5-[(2-(триметилсилил)этокси)метокси]пиримидин (9,8 г, 32,1 ммоль), и смесь перемешивали в атмосфере азота при 60°C в течение 1 часа. Реакционную смесь добавляли к соляной кислоте 2 моль/л, и водный слой экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 142 (8,67 г, 63% выход) в виде желтой пены. ЖХ/МС (ESI): m/z=645,35 [M+H]+, RT=3,75 мин, условия измерений при ЖХ/МС: (1).
Этап 2
К раствору соединения 142 (8,67 г, 13,44 ммоль) в THF (86 мл) добавляли раствор 1 моль/л фторида тетрабутиламмония в THF (40,3 мл, 40,3 ммоль), смесь перемешивали с обратным холодильником при 60°C в течение 16 часов. Туда добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 143 (6,28 г, 91% выход) в виде желтой пены. ЖХ/МС (ESI): m/z=515,25 [M+H]+, RT=2,86 мин, условия измерений при ЖХ/МС: (1).
Этап 3
К раствору соединения 143 (500 мг, 0,972 ммоль) в DMF (5 мл) добавляли триэтиламин (0,202 мл, 1,457 ммоль) и N-фенил-бис(трифторметансульфонимид) (451 мг, 1,263 ммоль), смесь перемешивали при охлаждении льдом в течение 10 минут. Туда добавляли воду, и экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 144 (567 мг, 90% выход) в виде желтой пены. ЖХ/МС (ESI): m/z=647,15 [M+H]+, RT=3,47 мин, условия измерений при ЖХ/МС: (1).
Этап 4
К раствору соединения 144 (200 мг, 0,309 ммоль) в DMF (2 мл) добавляли водный раствор 2 моль/л карбоната калия (0,309 мл, 0,619 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксобороран-2-ил)-1,2,3,6-тетрагидропиридин (1,28 мл, 1,28 ммоль) и PdCl2(dtbpf) (20,16 мг, 0,031 ммоль), смесь перемешивали в атмосфере азота при 100°C в течение 30 минут. Туда добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 145 (190 мг, 100% выход) в виде коричневого маслянистого материала. ЖХ/МС (ESI): m/z=594,35 [M+H]+, RT=2,43 мин, условия измерений при ЖХ/МС: (1).
Этап 5
К раствору соединения 145 (70 мг, 0,118 ммоль) в этаноле (1 мл) и THF (1 мл) добавляли водный гидроксид натрия 2 моль/л (0,279 мл, 0,58 ммоль), смесь перемешивали с обратным холодильником в течение 3,5 часа. Туда добавляли соляную кислоту 2 моль/л, и смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ-метанол) с получением соединения I-212 (40 мг, 59% выход) в виде коричневого твердого вещества.
ЖХ/МС (ESI): m/z=580,30 [M+H]+, RT=2,21 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,97 (9H, s), 2,19 (3H, s), 2,29 (3H, s), 2,42 (3H, s), 2,43 (3H, s), 2,53 (2H, brs), 2,66-2,73 (2H, m), 3,13 (2H, brs), 4,04 (2H, brs), 5,59 (1H, s), 5,90 (1H, s), 6,00 (1H, s), 7,20-7,28 (2H, m), 7,39 (1H, d, J=7,1 Гц), 7,65 (1H, d, J=7,1 Гц).
(Пример 35)
[0405]
[Химическая формула 160]
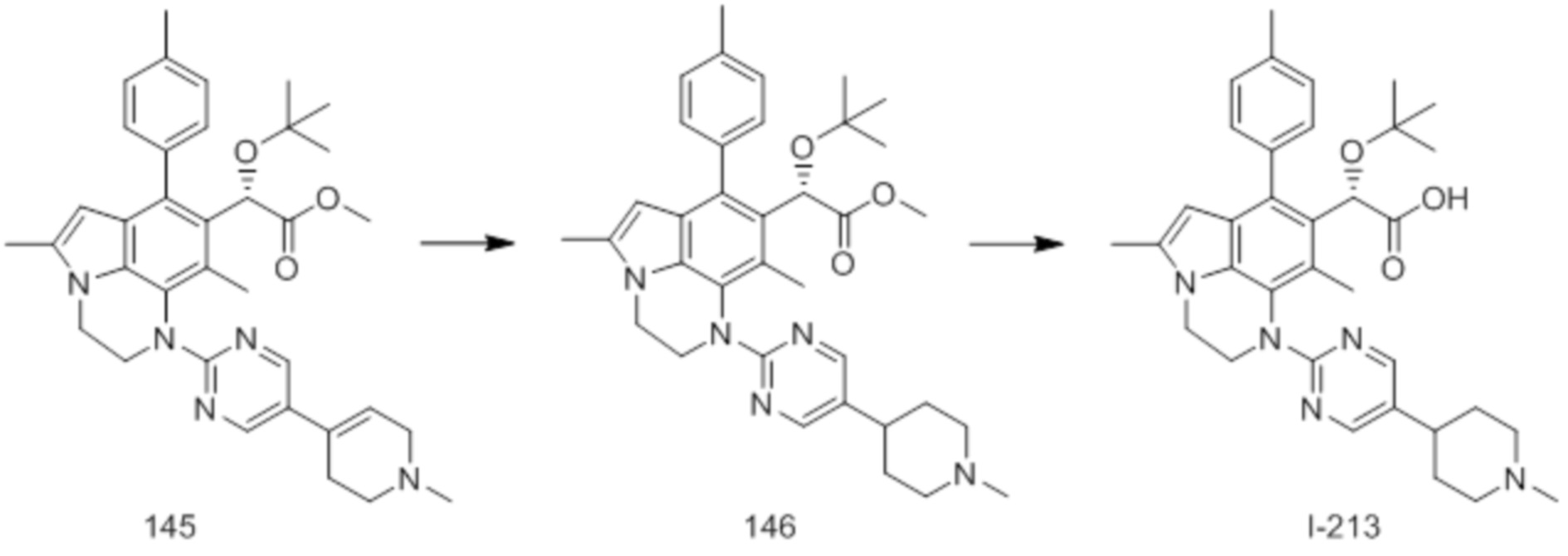
Этап 1
К раствору соединения 145 (120 мг, 0,202 ммоль) в метаноле (2 мл) добавляли гидроксид палладия (28,4 мг, 0,202 ммоль), смесь перемешивали в атмосфере водорода при комнатной температуре в течение 30 минут. Затем туда добавляли уксусную кислоту (2 мл), и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов 30 минут. Реакционную смесь фильтровали через целит, и фильтрат концентрировали с получением неочищенного соединения 146 (120 мг) в виде коричневого маслянистого материала. ЖХ/МС (ESI): m/z=596,35 [M+H]+, RT=2,37 мин, условия измерений при ЖХ/МС: (1).
Этап 2
К раствору соединения 146 (120 мг, 0,201 ммоль) в этаноле (1 мл) и THF (1 мл) добавляли водный раствор 2 моль/л гидроксида натрия (1,01 мл, 2,01 ммоль), смесь перемешивали с обратным холодильником в течение 3 часов. Туда добавляли соляную кислоту 2 моль/л, и смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью препаративной жидкостной хроматографии с получением соединения I-213 (10 мг, 9%, выход двух этапов) в виде коричневого твердого вещества. ЖХ/МС (ESI): m/z=582,30 [M+H]+, RT=2,21 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,97 (9H, s), 1,71-1,85 (4H, m), 2,00-2,10 (2H, m), 2,22 (3H, s), 2,28 (3H, s), 2,33 (3H, s), 2,35-2,40 (1H, m), 2,43 (3H, s), 2,98 (2H, d, J=12,0 Гц), 3,94-4,08 (2H, m), 5,59 (1H, s), 5,90 (1H, s), 7,22-7,27 (2H, m), 7,35-7,41 (1H, m), 7,64-7,70 (1H, m), 8,28 (2H, s).
(Пример 36)
[0406]
[Химическая формула 161]

Этап 1
К раствору соединения 147 (220 мг, 0,411 ммоль) в DMF (2 мл) добавляли карбонат цезия (268 мг, 0,823 ммоль) и метил-2-хлор-2,2-дифторацетат (0,086 мл, 0,823 ммоль), смесь перемешивали в атмосфере азота при 60°C в течение 15 минут. Туда добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 148 (94 мг, 39% выход) в виде желтой пены. ЖХ/МС (ESI): m/z=585,15 [M+H]+, RT=3,33 мин, условия измерений при ЖХ/МС: (1).
Этап 2
К раствору соединения 148 (96 мг, 0,201 ммоль) в этаноле (1 мл) и THF (1 мл) добавляли водный раствор 2 моль/л гидроксида натрия (0,41 мл, 0,82 ммоль), смесь перемешивали с обратным холодильником в течение 3 часов. Туда добавляли соляную кислоту 2 моль/л, и смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения I-214 (36 мг, 38% выход) в виде белого твердого вещества. ЖХ/МС (ESI): m/z=571,20 [M+H]+, RT=3,07 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,98 (9H, s), 2,22 (3H, s), 2,31 (3H, s), 3,96-4,15 (2H, m), 5,48 (1H, s), 5,88 (1H, s), 6,45 (1H, t, J=73 Гц), 7,39-7,49 (3H, m), 7,70-7,80 (1H, s), 8,30 (2H, s).
(Пример 37)
[0407]
[Химическая формула 162]

Этап 1
К раствору соединения 83 (1 г, 2,38 ммоль) в толуоле (10 мл) добавляли трет-бутоксид натрия (343 мг, 3,57 ммоль), 2-бром-5-метоксипиримидин (752 мг, 3,57 ммоль), ксантфос (413 мг, 0,713 ммоль) и дибензилиденацетонпалладий (327 мг, 0,357 ммоль), смесь перемешивали в атмосфере азота при 60°C в течение 30 минут. Затем снова добавляли туда трет-бутоксид натрия (343 мг, 3,57 ммоль) и 2-бром-5-метоксипиримидин (752 мг, 3,57 ммоль), и смесь перемешивали в атмосфере азота при 60°C в течение 30 минут. Реакционную смесь добавляли к водной соляной кислоте 2 моль/л и экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 149 (1,12 г, 89% выход) в виде желтой пены. ЖХ/МС (ESI): m/z=529,20 [M+H]+, RT=3,17 мин, условия измерений при ЖХ/МС: (1).
Этап 2
К раствору соединения 149 (1,13 г, 2,138 ммоль) в этаноле (6 мл) и THF (6 мл) добавляли раствор 2 моль/л гидроксида натрия (5,34 мл, 10,69 ммоль), смесь перемешивали с обратным холодильником в течение 3 часов. Туда добавляли соляную кислоту 2 моль/л, и смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения I-189 (919 мг, 84% выход) в виде желтой пены. ЖХ/МС (ESI): m/z=515,20 [M+H]+, RT=2,90 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,97 (9H, s), 2,20 (3H, s), 2,29 (3H, s), 2,43 (3H, s), 3,83 (3H, s), 3,94-4,15 (3H, m), 4,75-4,96 (1H, m), 5,61 (1H, s), 5,91 (1H, s), 7,22-7,28 (2H, m), 7,40 (1H, d, J=7,1 Гц), 7,66 (1H, d, J=7,1 Гц), 8,15 (2H, s).
(Пример 38)
[0408]
[Химическая формула 163]

Этап 1
К раствору соединения 89 (1 г, 1,821 ммоль) в дихлорметане (10 мл) добавляли трифторуксусную кислоту (10 мл), смесь перемешивали при комнатной температуре в течение 1 часа. Затем туда добавляли насыщенный водный раствор бикарбоната натрия, и смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 150 (831 мг, 93% выход) в виде желтой пены. ЖХ/МС (ESI): m/z=493,10 [M+H]+, RT=2,53 мин, условия измерений при ЖХ/МС: (1).
Этап 2
К раствору соединения 150 (60 мг, 0,122 ммоль) в диметилформамиде (10 мл) добавляли гидрид натрия (40,0 мг, 0,96 ммоль) и изопропилйодид (0,148 мл, 1,46 ммоль), смесь перемешивали при комнатной температуре в течение 2 часов. Затем туда добавляли насыщенный водный раствор хлорида аммония, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 151 (27 мг, 42% выход) в виде желтой пены. ЖХ/МС (ESI): m/z=535,15 [M+H]+, RT=3,09 мин, условия измерений при ЖХ/МС: (1).
Этап 3
К раствору соединения 151 (25 мг, 0,047 ммоль) в этаноле (0,5 мл) и THF (0,5 мл) добавляли раствор 2 моль/л гидроксида натрия (0,234 мл, 0,467 ммоль), смесь перемешивали с обратным холодильником в течение 2 часов. Затем туда добавляли соляную кислоту 2 моль/л, и реакционную смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле (хлороформ-метанол) с получением соединения I-215 (18,8 мг, 77% выход) в виде желтого твердого вещества.
ЖХ/МС (ESI): m/z=521,15 [M+H]+, RT=2,77 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,84 (3H, d, J=6,0 Гц), 1,07 (3H, d, J=6,0 Гц), 2,17 (3H, s), 2,31 (3H, s), 3,48 (1H, tt, J=6,0 Гц, 6,0 Гц), 3,83 (3H, s), 3,94-4,08 (2H, m), 4,14 (1H, brs), 4,84 (1H, brs), 5,38 (1H, s), 5,85 (1H, s), 7,32-7,60 (4H, m), 8,15 (2H, s).
(Пример 39)
[0409]
[Химическая формула 164]

Этап 1
К суспензии соединения 83 (100 мг, 0,238 ммоль), 2-бром-6-((трет-бутилдиметилсилокси)метил)пиридина (108 мг, 0,357 ммоль), дибензилиденацетонпалладия (32,7 мг, 0,036 ммоль) и ксантфоса (41,3 мг, 0,071 ммоль) в толуоле (1 мл) добавляли трет-бутоксид натрия (34,3 мг, 0,357 ммоль) при комнатной температуре, смесь перемешивали в атмосфере азота при 60°C в течение 2 часов. Туда добавляли насыщенный водный раствор хлорида аммония (3 мл) и воду (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой промывали водой (20 мл) и насыщенным рассолом (20 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 152 (162 мг, 89% выход) в виде коричневой пены. Условия измерений при ЖХ/МС: (1) ЖХ/МС (ESI): m/z=642,8 [M+H]+.
Этап 2
К раствору соединения 152 (134 мг, 0,209 ммоль) в THF (1,34 мл) добавляли раствор 0,92 моль/л TBAF в THF (0,681 мл, 0,626 ммоль), смесь перемешивали при комнатной температуре в течение 1,5 часа. Туда добавляли воду (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой промывали водой (20 мл) и насыщенным рассолом (20 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 153 (106 мг, 96% выход) в виде коричневой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=528,6 [M+H]+.
Этап 3
К раствору соединения 153 (50 мг, 0,095 ммоль) в этаноле (1 мл) и THF (1 мл) добавляли водный раствор 4 моль/л гидроксида лития (0,500 мл, 2,00 ммоль), смесь перемешивали с обратным холодильником в течение 2 часов. Туда добавляли соляную кислоту 1 моль/л (2 мл) и насыщенный рассол (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой сушили над безводным сульфатом натрия. После концентрирования остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ-метанол) с получением соединения I-216 (32,0 мг, 66% выход). Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=514,6 [M+H]+, RT=2,54 мин.
1H-ЯМР (CDCl3) δ: 0,96 (s, 9H), 2,18 (s, 3H), 2,31 (s, 3H), 2,44 (s, 3H), 3,61-3,81 (m, 1H), 3,92-3,99 (m, 2H), 4,27-4,47 (m, 1H), 4,71 (s, 2H), 5,63 (s, 1H), 5,96 (s, 1H), 6,26-6,33 (m, 1H), 6,62-6,71 (m, 1H), 7,20-7,31 (m, 2H), 7,38-7,47 (m, 2H), 7,59-7,67 (m, 1H).
(Пример 40)
[0410]
[Химическая формула 165]

Этап 1
При охлаждении льдом к соединению 153 (50,0 мг, 0,095 ммоль) в дихлорметане (1 мл) добавляли реагент Десса-Мартина (60,3 мг, 0,142 ммоль), смесь перемешивали в течение 1 часа, поднимая температуру до комнатной. Туда добавляли насыщенный водный раствор гидрокарбоната натрия (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой промывали насыщенным водным раствором гидрокарбоната натрия (20 мл) и насыщенным рассолом (20 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 154 (32,1 мг, 65% выход) в виде коричневой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=526,4 [M+H]+.
Этап 2
К раствору соединения 154 (30 мг, 0,057 ммоль) и морфолина (0,015 мл, 0,171 ммоль) в дихлорметане (0,9 мл), метаноле (0,9 мл) и уксусной кислоте (0,09 мл) добавляли комплекс пиколин-боран (9,2 мг, 0,086 ммоль), смесь перемешивали при комнатной температуре в течение 1 часа. Туда добавляли насыщенный водный раствор гидрокарбоната натрия (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой промывали насыщенным рассолом (20 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на аминосиликагеле (гексан-этилацетат) с получением соединения 155 (23,2 мг, 68% выход) в виде коричневой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=597,8 [M+H]+.
Этап 3
К раствору соединения 155 (22,0 мг, 0,037 ммоль) в этаноле (0,5 мл) и THF (0,5 мл) добавляли водный раствор 4 моль/л гидроксида лития (0,500 мл, 2,00 ммоль), смесь перемешивали с обратным холодильником в течение 3 часов. Туда добавляли соляную кислоту 1 моль/л (2 мл) и насыщенный рассол (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой сушили над безводным сульфатом натрия. После концентрирования остаток очищали с помощью колоночной хроматографии на силикагеле DIOL (гексан-этилацетат) с получением соединения I-217 (9,9 мг, 46% выход). Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=583,7 [M+H]+, RT=2,59 мин.
1H-ЯМР (CDCl3) δ: 0,95 (s, 9H), 2,18 (s, 3H), 2,31 (s, 3H), 2,44 (s, 3H), 2,54-2,68 (m, 4H), 3,65 (s, 2H), 3,72-3,81 (m, 4H), 3,89-3,97 (m, 2H), 4,24-4,40 (m, 1H), 4,61-4,80 (m, 1H), 5,62 (s, 1H), 5,95 (s, 1H), 6,26 (d, J=8,3 Гц, 1H), 6,89 (d, J=7,1 Гц, 1H), 7,24-7,32 (m, 2H), 7,37-7,45 (m, 2H), 7,61-7,66 (m, 1H).
(Пример 41)
[0411]
[Химическая формула 166]

Этап 1
К раствору соединения 30 (200 мг, 0,454 ммоль) в дихлорметане (2 мл) добавляли изоцианато-2-нитробензол (149 мг, 0,907 ммоль), смесь перемешивали при 80°C в течение 20 часов. Туда добавляли насыщенный водный раствор хлорида аммония (15 мл) и воду (15 мл), и смесь экстрагировали этилацетатом (50 мл). Органический слой промывали водой (30 мл) и насыщенным рассолом (30 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 156 (235 мг, 86% выход) в виде коричневой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=605,3 [M+H]+.
Этап 2
К раствору соединения 156 (190 мг, 0,314 ммоль) в этаноле (1,9 мл) и воде (0,38 мл) добавляли порошок железа (88,0 мг, 1,57 ммоль) и хлорид натрия (168 мг, 3,14 ммоль), смесь перемешивали при 90°C в течение 2,5 часа. Туда добавляли воду (30 мл) и этилацетат (50 мл), и удаляли нерастворимый материал с помощью фильтрации. Органический слой промывали водой (30 мл) и насыщенным рассолом (30 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 157 (108 мг, 60% выход) в виде коричневой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=575,4 [M+H]+.
Этап 3
К раствору соединения 157 (125 мг, 0,217 ммоль) в этаноле (1 мл) и THF (1 мл) добавляли водный раствор 4 моль/л гидроксида лития (0,543 мл, 2,17 ммоль), смесь перемешивали с обратным холодильником в течение 45 мин. Туда добавляли соляную кислоту 1 моль/л (3 мл) и насыщенный рассол (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой сушили над безводным сульфатом натрия. После концентрирования остаток очищали с помощью ВЭЖХ (0,1% муравьиной кислоты в воде - 0,1% муравьиной кислоты в ацетонитриле) с получением соединения I-218 (49,0 мг, 40% выход). Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=561,7 [M+H]+, RT=2,42 мин.
(Пример 42)
[0412]
[Химическая формула 167]
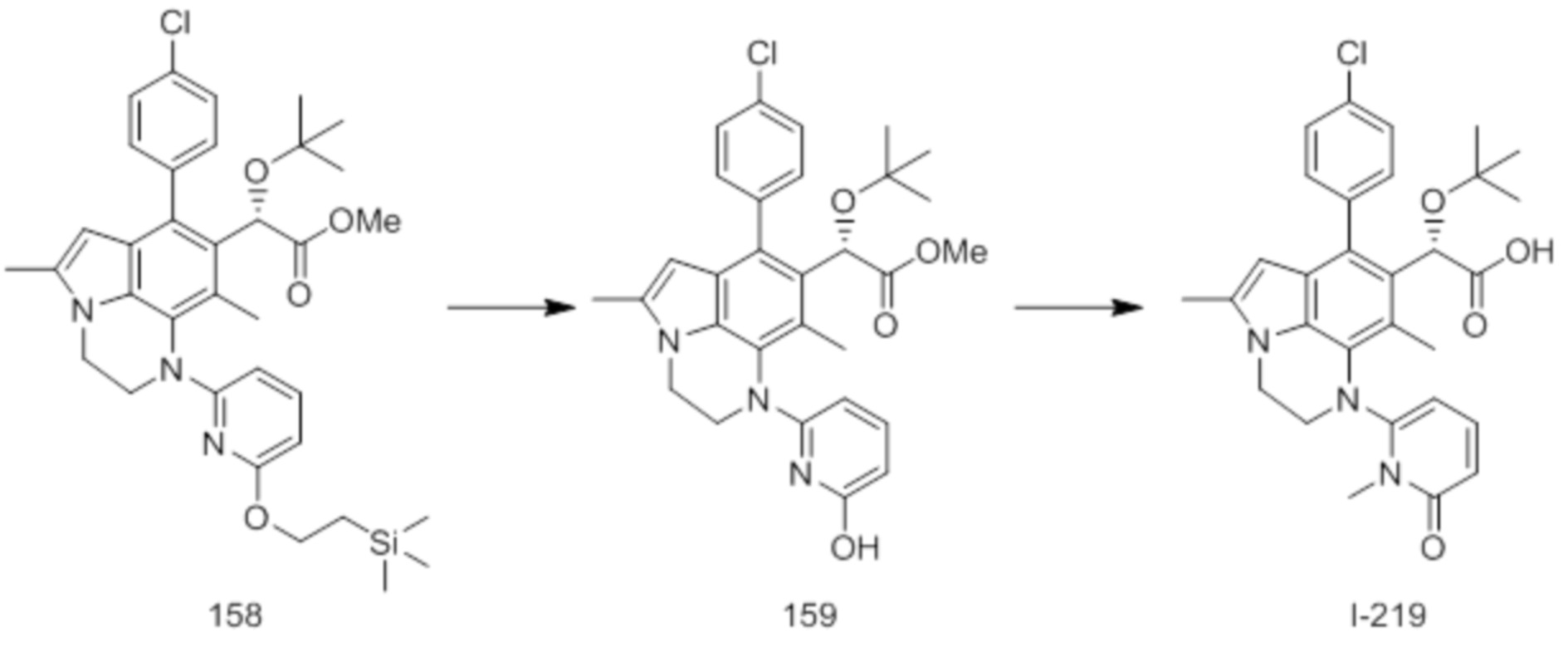
Этап 1
К раствору соединения 158 (135 мг, 0,213 ммоль), которое было синтезировано в соответствии с тем же способом, что и соединение 89 примера 19, в THF (0,675 мл) добавляли раствор 1 ммоль/л TBAF в THF (0,426 мл, 0,426 ммоль), смесь перемешивали при комнатной температуре в течение 1 дня. Туда добавляли раствор 1 ммоль/л TBAF в THF (0,426 мл, 0,426 ммоль), и смесь перемешивали при комнатной температуре в течение 3,5 часа и при 50°C в течение 1 дня. К реакционной смеси добавляли воду (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой промывали водой (20 мл) и насыщенным рассолом (20 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 159 (20 мг, 18% выход) в виде коричневой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=534,6 [M+H]+.
Этап 2
К раствору соединения 159 (20,0 мг, 0,037 ммоль) в DMF (1 мл) добавляли карбонат калия (10,4 мг, 0,075 ммоль), смесь перемешивали при комнатной температуре в течение 5 минут. Затем туда добавляли метилйодид (0,005 мл, 0,075 ммоль), и смесь перемешивали при комнатной температуре в течение 3,5 часа. К реакционной смеси добавляли воду (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой промывали водой (20 мл) и насыщенным рассолом (20 мл) и сушили над безводным сульфатом магния. После концентрирования остаток растворяли (20,0 мг) в этаноле (1 мл), туда добавляли водный раствор 2 моль/л гидроксида натрия (0,500 мл, 1,00 ммоль), и затем смесь перемешивали с обратным холодильником в течение 1,5 часа. Туда добавляли соляную кислоту 1 моль/л (1,5 мл) и насыщенный рассол (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой сушили над безводным сульфатом натрия. После концентрирования остаток очищали с помощью ВЭЖХ (0,1% муравьиной кислоты в воде - 0,1% муравьиной кислоты в ацетонитриле) с получением соединения I-219 (2,6 мг, 13% выход). Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=534,6 [M+H]+, RT=2,46 мин.
(Пример 43)
[0413]
[Химическая формула 168]
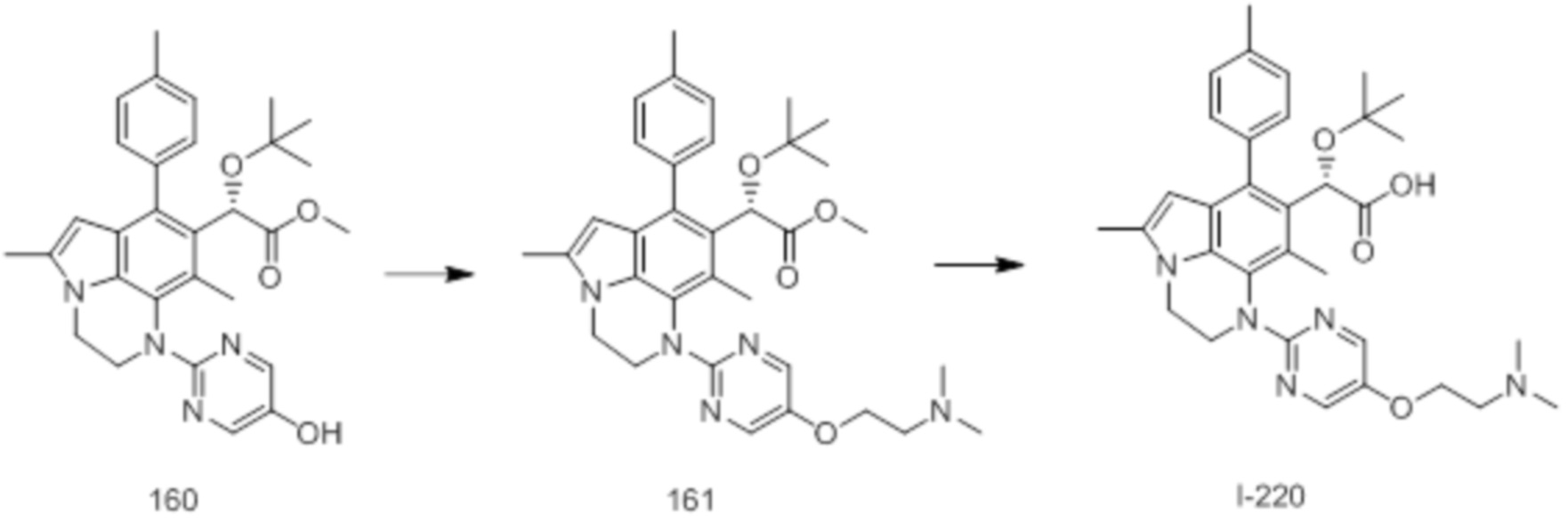
Этап 1. Синтез соединения 161
При охлаждении льдом к раствору соединения 160 (513 мг, 0,997 ммоль) в THF (5,1 мл) добавляли 2-(диметиламино)этанол (267 мг, 2,99 ммоль), трифенилфосфин (784 мг, 2,99 ммоль) и DIAD (605 мг, 2,99 ммоль), смесь перемешивали при комнатной температуре в течение 40 минут. При охлаждении льдом к реакционной смеси добавляли 2-(диметиламино)этанол (267 мг, 2,99 ммоль), трифенилфосфин (784 мг, 2,99 ммоль) и DIAD (605 мг, 2,99 ммоль), и смесь перемешивали при комнатной температуре в течение 80 минут. Туда добавляли этилацетат и воду, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным рассолом и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ-метанол) с получением соединения 161 (476 мг, 82% выход). ЖХ/МС (ESI): m/z=586,27 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения I-220
К раствору соединения 161 (476 мг, 0,812 ммоль) в этаноле (4,76 мл) добавляли раствор 2 моль/л гидроксида натрия (2,38 мл), и смесь перемешивали при 80°C в течение 140 минут. После охлаждения туда добавляли соляную кислоту 2 моль/л (2,30 мл), и смесь экстрагировали хлороформомом-метанолом (10:1). После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле DIOL (хлороформ-метанол) с получением соединения I-220 (250 мг, 54% выход). ЖХ/МС (ESI): m/z=572,27 [M+H]+, RT=2,28 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,96 (9H, s), 2,19 (3H, s), 2,29 (3H, s), 2,34 (6H, s), 2,43 (3H, s), 2,72 (2H, t, J=5,6 Гц), 3,88-4,19 (5H, m), 4,70-5,05 (1H, m), 5,59 (1H, s), 5,90 (1H, s), 7,21-7,30 (2H, m), 7,36-7,43 (1H, m), 7,61-7,71 (1H, m), 8,17 (2H, s).
(Пример 44)
[0414]
[Химическая формула 169]
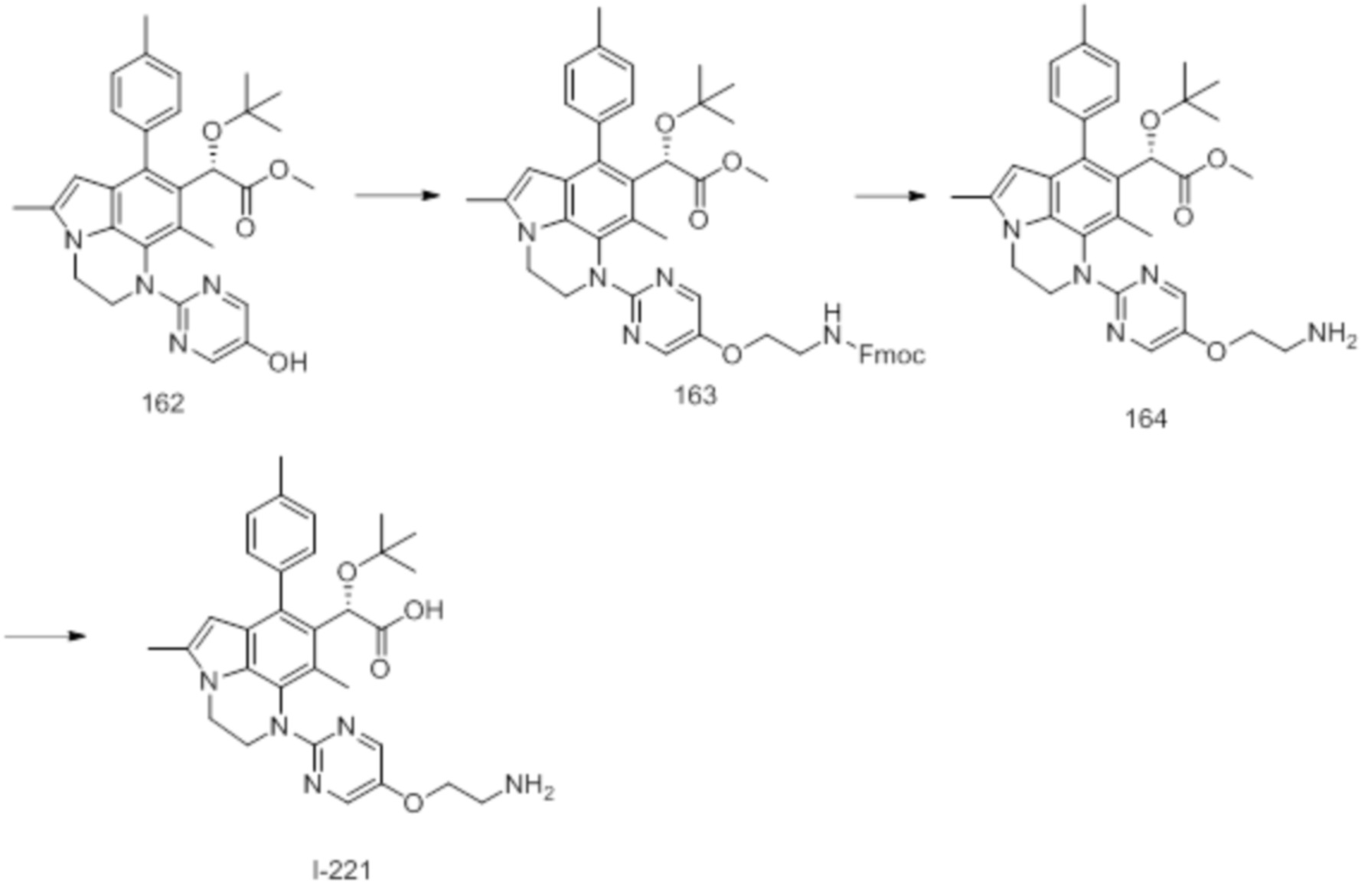
Этап 1. Синтез соединения 163
При охлаждении льдом к раствору соединения 162 (600 мг, 1,17 ммоль) в THF (6,0 мл) добавляли N-Fmoc-этаноламин (991 мг, 3,50 ммоль), трифенилфосфин (917 мг, 3,50 ммоль) и DIAD (707 мг, 3,50 ммоль), и смесь перемешивали при комнатной температуре в течение 40 минут. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 163 (493 мг, 54% выход). ЖХ/МС (ESI): m/z=780,14 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения 164
К раствору соединения 163 (493 мг, 0,632 ммоль) в дихлорметане (1,7 мл) добавляли диэтиламин (1,21 г, 16,6 ммоль), смесь перемешивали при комнатной температуре в течение 50 минут, при 35°C в течение 30 минут и при 40°C в течение 90 минут. После охлаждения растворитель концентрировали при пониженном давлении, остаток очищали с помощью колоночной хроматографии на силикагеле DIOL (хлороформ-метанол) с получением соединения 164 (276 мг, 78% выход). ЖХ/МС (ESI): m/z=558,23 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 3. Синтез соединения I-221
Аналогично этапу 2 примера 43, соединение I-221 (41,2 мг, 70% выход) получали из соединения 164 (60,0 мг, 0,108 ммоль). ЖХ/МС (ESI): m/z=544,75 [M+H]+, RT=2,67 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,88 (9H, s), 2,17 (3H, s), 2,31 (3H, s), 2,40 (3H, s), 2,79-4,11 (8H, m), 5,53 (1H, s), 5,96 (1H, s), 7,17-7,30 (2H, m), 7,38-7,46 (1H, m), 7,60-7,69 (1H, m), 8,01 (2H, brs).
(Пример 45)
[0415]
[Химическая формула 170]

Этап 1. Синтез соединения 165
При охлаждении льдом к раствору соединения 164 (150 мг, 0,269 ммоль) в дихлорметане (0,75 мл) добавляли пиридин (63,8 мг, 0,807 ммоль), мезилхлорид (37,0 мг, 0,323 ммоль) и DMAP (3,3 мг, 0,027 ммоль), и смесь перемешивали при комнатной температуре в течение 20 минут. При охлаждении льдом туда добавляли пиридин (21,3 мг, 0,269 ммоль) и мезилхлорид (30,8 мг, 0,269 ммоль), и смесь перемешивали в течение 30 минут. При охлаждении льдом туда добавляли пиридин (0,75 мл) и мезилхлорид (61,6 мг, 0,538 ммоль), и смесь перемешивали в течение 20 минут. Туда добавляли этилацетат и соляную кислоту 1 моль/л, и смесь экстрагировали этилацетатом. Органический слой промывали последовательно соляной кислотой 1 моль/л, насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 165 (146 мг, 85% выход). ЖХ/МС (ESI): m/z=636,71 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения I-222
Аналогично этапу 2 примера 43, соединение I-222 (45,9 мг, 78% выход) получали из соединения 165 (60,0 мг, 0,094 ммоль). ЖХ/МС (ESI): m/z=622,41 [M+H]+, RT=2,55 мин, условия измерений при ЖХ/МС: (1)
1H-ЯМР (CDCl3) δ: 0,96 (9H, s), 2,20 (3H, s), 2,29 (3H, s), 2,43 (3H, s), 3,02 (3H, s), 3,47-3,60 (2H, m), 3,89-4,21 (5H, m), 4,63-4,99 (2H, m), 5,61 (1H, s), 5,91 (1H, s), 7,22-7,31 (2H, m), 7,36-7,43 (1H, m), 7,61-7,69 (1H, m), 8,15 (2H, s), 9,85-10,30 (1H, brs).
(Пример 46)
[0416]
Синтез соединения I-223 и соединения I-224
[Химическая формула 171]
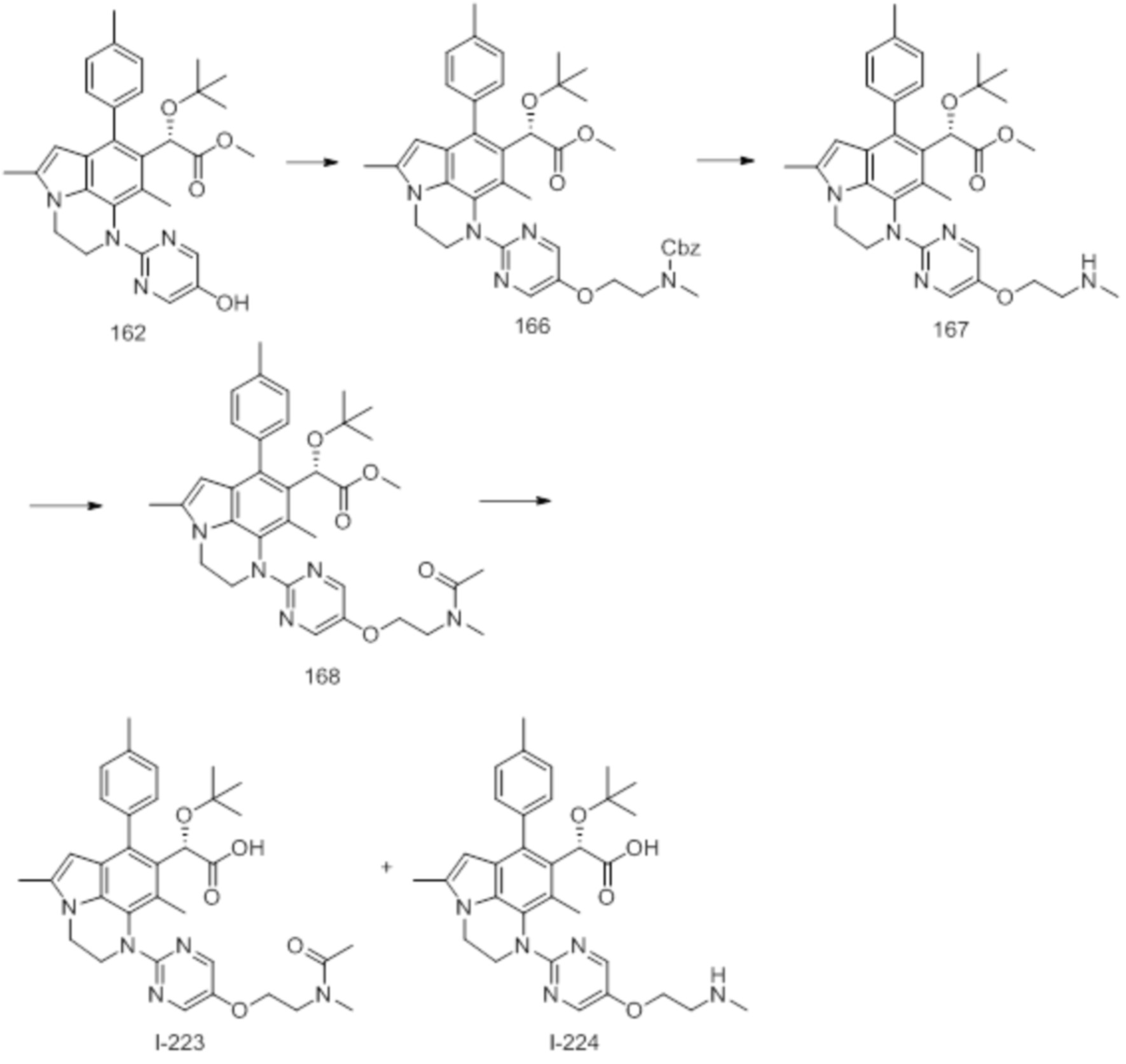
Этап 1. Синтез соединения 166
При охлаждении льдом к раствору соединения 162 (500 мг, 0,972 ммоль) в THF (5,0 мл) добавляли N,N-Cbz-метилэтаноламин (610 мг, 2,91 ммоль), трифенилфосфин (765 мг, 2,91 ммоль) и DIAD (589 мг, 2,91 ммоль), и смесь перемешивали при комнатной температуре в течение 20 минут. Затем, смесь оставляли при комнатной температуре на 14 часов. Растворитель концентрировали при пониженном давлении, остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 166 (498 мг, 73% выход). ЖХ/МС (ESI): m/z=706,51 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения 167
К раствору соединения 166 (250 мг, 0,354 ммоль) в THF (5,00 мл) и метаноле (5,00 мл) добавляли Pd-C (75,0 мг, 0,035 ммоль), и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали через целит, фильтрат концентрировали при пониженном давлении с получением соединения 167 (192 мг, 95% выход) в виде неочищенного продукта. ЖХ/МС (ESI): m/z=572,84 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 3. Синтез соединения 168
При охлаждении льдом к раствору соединения 167 (60 мг, 0,105 ммоль) в метаноле (0,420 мл) добавляли уксусный ангидрид (16,1 мг, 0,157 ммоль), и смесь перемешивали при комнатной температуре в течение 20 минут. Туда добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь перемешивали в течение 30 минут. Туда добавляли этилацетат и воду, и смесь экстрагировали этилацетатом. Органический слой промывали последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении с получением соединения 168 (62,8 мг, 98% выход) в виде неочищенного продукта. ЖХ/МС (ESI): m/z=614,42 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 4. Синтез соединения I-223 и соединения I-224
Аналогично этапу 2 примера 43, соединение I-223 (25,2 мг, 41% выход) и соединение I-224 (26,9 мг, 47% выход) получали из соединения 168 (62,8 мг, 0,102 ммоль).
Соединение I-223: ЖХ/МС (ESI): m/z=600,77 [M+H]+, RT=2,52 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,97 (9H, s), 2,07-2,24 (6H, m), 2,29 (3H, s), 2,43 (3H, s), 3,01 (1H, s), 3,16 (2H, s), 3,64-3,82 (2H, m), 3,91-4,23 (5H, m), 4,75-5,05 (1H, m), 5,54-5,68 (1H, m), 5,91 (1H, s), 7,21-7,32 (2H, m), 7,36-7,44 (1H, m), 7,62-7,70 (1H, m), 8,13 (2H, s), 10,07 (1H, br s).
Соединение I-224: ЖХ/МС (ESI): m/z=558,51 [M+H]+, RT=2,35 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,88 (9H, s), 2,16 (3H, s), 2,28 (3H, s), 2,42 (3H, s), 2,58 (3H, s), 2,80-3,07 (2H, m), 3,75-4,18 (6H, m), 4,65-5,06 (1H, m), 5,55 (1H, s), 5,95 (1H, s), 7,19-7,30 (2H, m), 7,39-7,46 (1H, m), 7,61-7,71 (1H, m), 8,07 (2H, s).
(Пример 47)
[0417]
[Химическая формула 172]
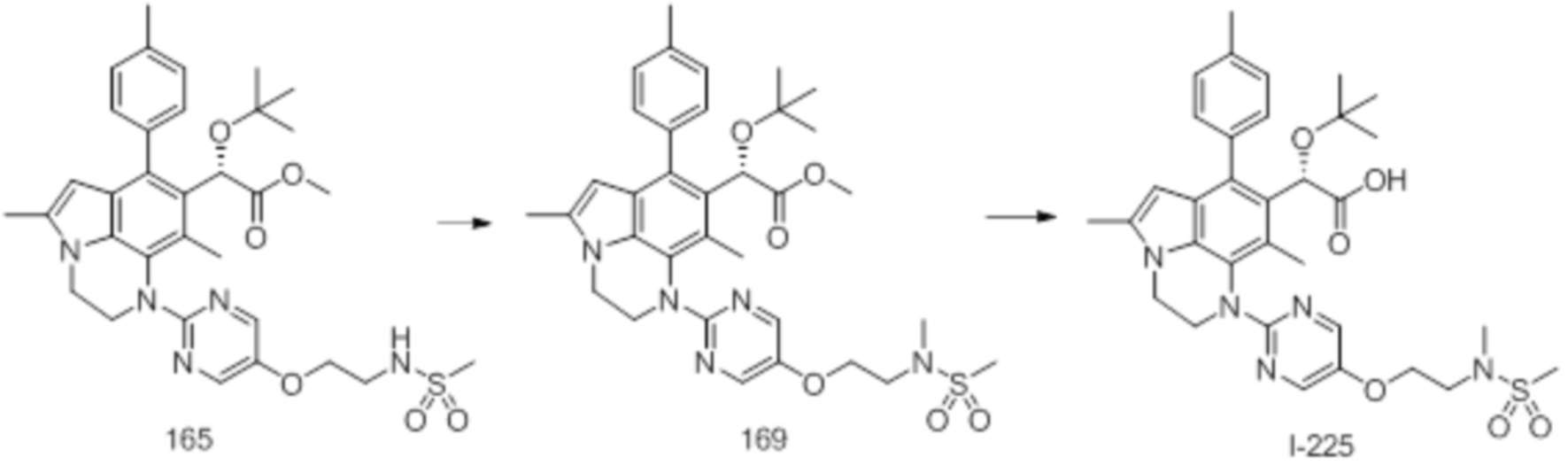
Этап 1. Синтез соединения 169
К раствору соединения 165 (60,0 мг, 0,094 ммоль) в DMF (0,60 мл) добавляли карбонат цезия (92,0 мг, 0,283 ммоль) и йодметан (26,8 мг, 0,189 ммоль), смесь перемешивали при комнатной температуре в течение 20 минут. Туда добавляли этилацетат и воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении с получением соединения 169 (62,6 мг) количественно в виде неочищенного продукта. ЖХ/МС (ESI): m/z=650,42 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения I-225
Аналогично этапу 2 примера 43, соединение I-225 (51,6 мг, 86% выход) получали из соединения 169 (61,1 мг, 0,094 ммоль). ЖХ/МС (ESI): m/z=636,42 [M+H]+, RT=2,67 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,97 (9H, s), 2,20 (3H, s), 2,29 (3H, s), 2,43 (3H, s), 2,88 (3H, s), 3,02 (3H, s), 3,57 (2H, t, J=5,3 Гц), 3,92-4,22 (5H, m), 4,74-4,99 (1H, m), 5,61 (1H, s), 5,91 (1H, s), 7,21-7,31 (2H, m), 7,36-7,43 (1H, m), 7,60-7,70 (1H, m), 8,15 (2H, s), 10,10 (1H, brs).
(Пример 48)
[0418]
[Химическая формула 173]

Этап 1. Синтез соединения 171
К раствору соединения 170 (10,0 г, 39,3 ммоль) в DMF (50,0 мл) добавляли триэтиламин (4,77 г, 47,2 ммоль) и аминоэтанол (2,40 г, 39,3 ммоль), смесь перемешивали при комнатной температуре в течение 30 минут. Туда добавляли имидазол (6,02 г, 88,0 ммоль) и триизопропилсилилхлорид (7,96 г, 41,3 ммоль), и смесь перемешивали в течение 30 минут. Туда добавляли DMAP (240 мг, 1,97 ммоль), и смесь перемешивали в течение 30 минут. Туда добавляли имидазол (6,02 г, 88,0 ммоль) и триизопропилсилилхлорид (7,96 г, 41,3 ммоль), и смесь перемешивали в течение 10 минут, затем оставляли при комнатной температуре на 12 часов. Туда добавляли этилацетат и воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 171 (15,9 г, 90% выход). ЖХ/МС (ESI): m/z=451,01 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 2. Синтез соединения 172
К раствору соединения 171 (15,9 г, 35,2 ммоль) в DMF (111 мл) добавляли (Z)-((2-(трет-бутокси)-1-метоксивинил)окси)триметилсилан (15,4 г, 70,3 ммоль), ZnF2 (7,27 г, 70,3 ммоль) и бис-три-трет-бутилфосфинпалладий (1,80 г, 3,52 ммоль), смесь перемешивали в атмосфере азота при 100°C в течение 2 часов. После охлаждения туда добавляли этилацетат и воду, и смесь фильтровали. После экстракции этилацетатом органический слой промывали водой и сушили с помощью безводного сульфата натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 172 (12,6 г, 69% выход). ЖХ/МС (ESI): m/z=517,22 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 3. Синтез соединения 173
При охлаждении льдом к раствору соединения 172 (12,5 г, 24,2 ммоль) в DMF (125 мл) добавляли NBS (5,16 г, 29,0 ммоль), смесь перемешивали при комнатной температуре в течение 4 часов и оставляли при комнатной температуре на 11 часов. Туда добавляли этилацетат и воду, и смесь экстрагировали этилацетатом. Органический слой промывали последовательно водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении соединение 173 (15,1 г) получали количественно в виде неочищенного продукта.
ЖХ/МС (ESI): m/z=595,13 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 4. Синтез соединения 174
К раствору соединения 173 (9,09 г, 15,3 ммоль) в DMF (45,5 мл) и воде (22,7 мл) добавляли в атмосфере азота п-толилбороновую кислоту (3,11 г, 22,9 ммоль), карбонат калия (6,32 г, 45,8 ммоль) и PdCl2(dtbpf) (994 мг, 1,53 ммоль), смесь перемешивали при 100°C в течение 30 минут. Туда добавляли этилацетат и воду, и смесь фильтровали. Затем смесь экстрагировали этилацетатом, органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 174 (5,96 г, 64% выход). ЖХ/МС (ESI): m/z=607,26 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 5. Синтез соединения 175
К раствору соединения 174 (117 мг, 0,193 ммоль) в этаноле (1,17 мл) и воде (0,29 мл) добавляли дитионит натрия (197 мг, 0,963 ммоль), и смесь перемешивали при 60°C в течение 1 часа. Туда добавляли этилацетат и воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После экстракции при пониженном давлении соединение 175 (113 мг) получали количественно в виде неочищенного продукта. ЖХ/МС (ESI): m/z=577,31 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 6. Синтез соединения 176
При охлаждении льдом к соединению 175 (111 мг, 0,193 ммоль) в дихлорметане (0,56 мл) добавляли пиридин (38,2 мг, 0,483 ммоль), 2-нитробензолсульфонилхлорид (64,2 мг, 0,290 ммоль) и DMAP (2,4 мг, 0,019 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут, затем смесь оставляли при комнатной температуре на 15 часов. Туда добавляли этилацетат и соляную кислоту 1 моль/л, и смесь экстрагировали этилацетатом. Органический слой промывали последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 176 (68,0 мг, 46% выход). ЖХ/МС (ESI): m/z=762,25 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 7. Синтез соединения 177
К раствору соединения 176 (1,77 г, 2,33 ммоль) в THF (8,85 мл) добавляли раствор 1 моль/л TBAF в THF (6,96 мл, 6,96 ммоль), и смесь перемешивали при 60°C в течение 3 часов. После охлаждения туда добавляли этилацетат и насыщенный раствор хлорида аммония, и смесь экстрагировали этилацетатом. Органический слой промывали последовательно водным насыщенным раствором хлорида аммония и насыщенным рассолом и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 177 (1,13 г, 80% выход). ЖХ/МС (ESI): m/z=606,14 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 8. Синтез соединения 178
Ппри охлаждении льдом к раствору соединения 177 (1,12 г, 1,85 ммоль) в THF (56,0 мл) добавляли трифенилфосфин (727 мг, 2,77 ммоль) и DIAD (561 мг, 2,77 ммоль), смесь перемешивали при комнатной температуре в течение 20 минут. Туда добавляли этилацетат и воду, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным рассолом и сушили с помощью безводного сульфата натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 178 (960 мг, 88% выход). ЖХ/МС (ESI): m/z=588,11 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 9. Синтез соединения 179
При охлаждении льдом к соединению 178 (850 мг, 1,45 ммоль) в пиридине (4,23 мл) добавляли TFAA (911 мг, 4,34 ммоль) и DMAP (530 мг, 4,34 ммоль), смесь перемешивали при комнатной температуре в течение 75 минут. Туда добавляли TFAA (455 мг, 2,17 ммоль), и смесь перемешивали при комнатной температуре в течение 40 минут. Туда добавляли этилацетат и соляную кислоту 1 моль/л, и смесь экстрагировали этилацетатом. Органический слой промывали последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 179 (966 мг, 98% выход). ЖХ/МС (ESI): m/z=701,65 [M+18]+, условия измерений при ЖХ/МС: (1).
Этап 10. Синтез соединения 180
При охлаждении льдом к раствору соединения 179 (956 мг, 1,40 ммоль) в DMF (9,57 мл) добавляли карбонат калия (386 мг, 2,79 ммоль) и тиофенол (231 мг, 2,10 ммоль), и смесь перемешивали при 0°C в течение 70 минут. Туда добавляли этилацетат и соляную кислоту 1 моль/л, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 180 (632 мг, 91% выход). ЖХ/МС (ESI): m/z=516,15 [M+18]+, условия измерений при ЖХ/МС: (1)
Этап 11. Синтез соединения 181
К раствору соединения 180 (632 г, 1,27 ммоль) в DMF (6,3 мл) добавляли NBS (225 мг, 1,267 ммоль), смесь перемешивали при комнатной температуре в течение 20 минут. Туда добавляли этилацетат и воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении соединение 181 (731 мг, 99% выход) получали в виде неочищенного продукта. ЖХ/МС (ESI): m/z=762,60 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 12 и 13. Синтез соединения 182
К раствору соединения 182 (727 мг, 1,26 ммоль) в толуоле (7,3 мл) добавляли изопропенилацетат (504 мг, 5,03 ммоль), трибутил(метокси)станнан (1,62 г, 5,03 ммоль), ацетат палладия (56,0 мг, 0,252 ммоль) и три(o-толил)фосфин (153 мг, 0,503 ммоль), смесь перемешивали в атмосфере азота при 100°C в течение 1 часа. Туда добавляли этилацетат и водный раствор 4 моль/л фторида калия, и смесь перемешивали в течение 1 часа и фильтровали. Фильтрат экстрагировали этилацетатом, и органический слой промывали насыщенным рассолом и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении к раствору полученного неочищенного продукта в метаноле (7,3 мл) и THF (7,3 мл) добавляли карбонат калия (1,74 г, 12,6 ммоль), и смесь перемешивали в течение 40 мин. Туда добавляли этилацетат и воду, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным рассолом и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 182 (460 мг, 83% выход) в виде рацемической формы. Выполнив дполнительное оптическое разделение, получали соединение 183 (194 мг, 35% выход) в виде оптически активной формы. ЖХ/МС (ESI): m/z=441,59 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 14 и 15. Синтез соединения 184
К раствору соединения 183 (60,0 мг, 0,136 ммоль) в толуоле (0,60 мл) добавляли трет-бутоксид натрия (19,6 мг, 0,204 ммоль), 2-бром-5-метоксипиримидин (38,6 г, 0,204 ммоль), ксантфос (31,5 мг, 0,054 ммоль) и дибензилиденацетонпалладий (24,9 мг, 0,027 ммоль), смесь перемешивали в атмосфере азота при 60°C в течение 70 минут. Туда добавляли трет-бутоксид натрия (19,6 мг, 0,204 ммоль) и 2-бром-5-метоксипиримидин (38,6 г, 0,204 ммоль) в атмосфере азота, и смесь перемешивали при 60°C в течение 45 минут. Туда добавляли этилацетат, воду и хлороформ, и смесь фильтровали. Фильтрат экстрагировали хлороформом и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 184 (72,1 мг, 97% выход). ЖХ/МС (ESI): m/z=549,19 [M+H]+, условия измерений при ЖХ/МС: (1).
Этап 14. Синтез соединения I-226
К раствору соединения 184 (72,1 мг, 0,131 ммоль) в этаноле (1,00 мл) добавляли раствор 2 моль/л гидроксида натрия (0,500 мл), и смесь перемешивали при 80°C в течение 160 минут. После охлаждения туда добавляли при охлаждении льдом соляную кислоту 2 моль/л (0,500 мл). Осажденные кристаллы собирали с помощью фильтрации с получением соединения I-226 (48,1 мг, 69% выход). ЖХ/МС (ESI): m/z=535,15 [M+H]+, RT=2,67 мин, условия измерений при ЖХ/МС: (1).
1H-ЯМР (CDCl3) δ: 0,95 (9H, s), 2,31 (3H, s), 2,43 (3H, s), 3,84 (3H, s), 3,94-4,23 (3H, m), 4,72-4,87 (1H, m), 5,56 (1H, brs), 5,98 (1H, brs), 7,21-7,32 (2H, m), 7,37-7,48 (1H, m), 7,61-7,74 (1H, m), 8,18 (2H, s).
(Пример 49)
[0419]
[Химическая формула 174]

Этап 1
Аналогично этапу 1 и 2 примера 19, соединение I-292 (60,0 мг, 56% выход 2 этапов) синтезировали с использованием соединения 83 (80,0 мг, 0,190 ммоль) и соединения 185 (66,5 мг, 0,285 ммоль). Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=559,20 [M+H]+, RT=2,10 мин.
1H-ЯМР (CDCl3) δ: 0,95 (s, 9H), 2,31 (s, 3H), 2,37 (s, 3H), 2,44 (s, 3H), 2,47 (s, 3H), 2,77-2,82 (m, 4H), 3,46 (s, 2H), 3,95-4,04 (m, 3H), 4,61-4,66 (m, 1H), 5,57 (s, 1H), 5,93 (s, 1H), 7,26-7,29 (m, 2H), 7,39 (d, J=6,6 Гц, 1H), 7,62 (d, J=7,1 Гц, 1H).
(Пример 50)
[0420]
[Химическая формула 175]
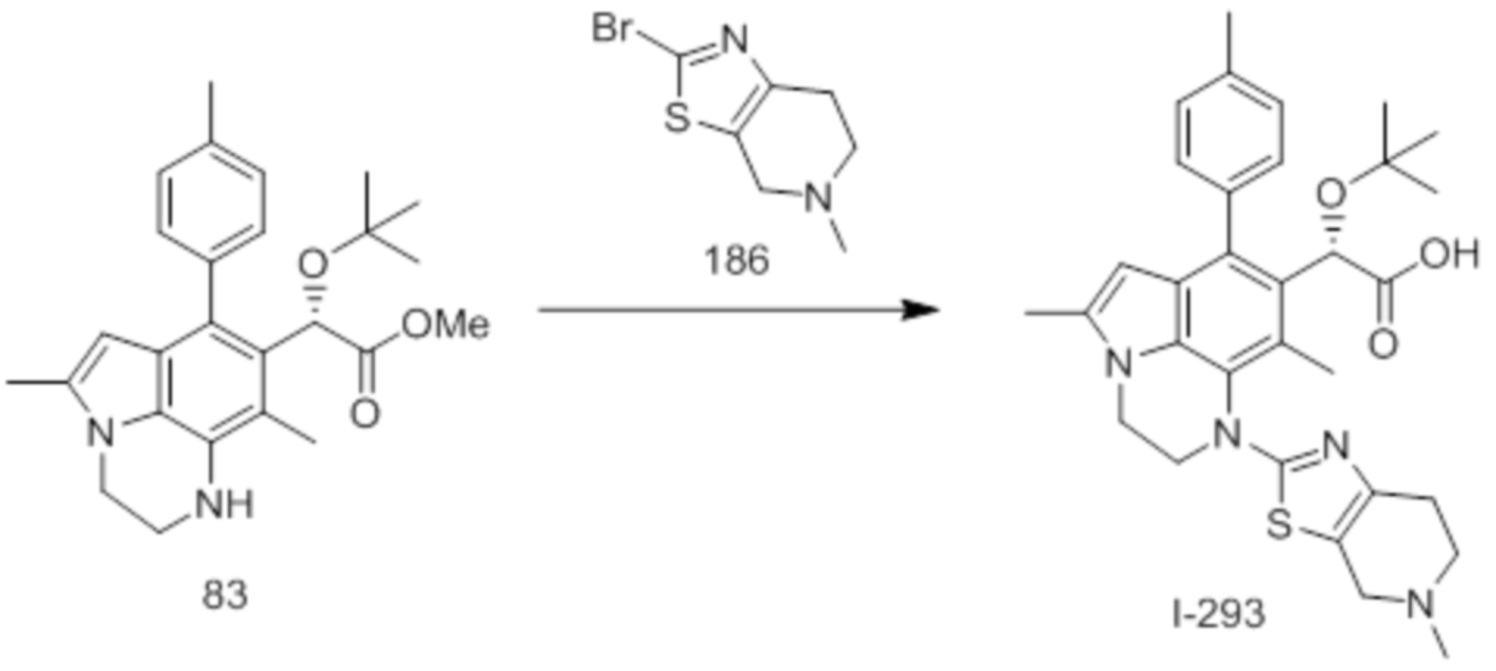
Этап 1
Аналогично этапу 1 и 2 примера 19, соединение I-293 (66,0 мг, выход 2 этапов 62%) синтезировали с использованием соединения 83 (80,0 мг, 0,190 ммоль) и соединения 186 (66,5 мг, 0,285 ммоль). Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=559,20 [M+H]+, RT=2,11 мин.
1H-ЯМР (CDCl3) δ: 0,94 (s, 9H), 2,30 (s, 3H), 2,37 (s, 3H), 2,43 (s, 3H), 2,49 (s, 3H), 2,78-2,86 (m, 4H), 3,50 (s, 2H), 3,93-4,07 (m, 3H), 4,56-4,67 (m, 1H), 5,56 (s, 1H), 5,93 (s, 1H), 7,24-7,30 (m, 2H), 7,39 (d, J=7,2 Гц, 1H), 7,62 (d, J=7,3 Гц, 1H).
(Пример 51)
[0421]
[Химическая формула 176]

Этап 1
При охлаждении в бане сухой лед-ацетон к раствору соединения 187 (1,80 г, 7,16 ммоль) в DMA (4 мл) добавляли по каплям раствор N-бромсукцинимида (1,01 г, 5,66 ммоль) в DMA (4 мл), и смесь перемешивали в течение 1 часа. Туда добавляли 10% водный раствор тиосульфата натрия (1 мл) и насыщенный водный раствор гидрокарбоната натрия и воду (10 мл), и смесь перемешивали при комнатной температуре. Туда добавляли метанол (4 мл) и воду (5 мл), и смесь перемешивали при комнатной температуре. Полученное твердое вещество собирали с помощью фильтрации и промывали 40% водным раствором метанола (50 мл) с получением соединения 188 (1,70 г, 72% выход) в виде бледно-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,22 (s, 9H), 2,20 (s, 3H), 3,63 (s, 2H), 3,68 (s, 3H), 5,78 (s, 1H), 6,51 (d, J=8,4 Гц, 1H), 7,21 (d, J=8,4 Гц, 1H).
Этап 2
К раствору соединения 188 (10,0 г, 30,3 ммоль), 4-толилбороновой кислоты (4,32 г, 31,8 ммоль) и палладия (987 мг, 1,51 ммоль) в DMF (50 мл) и воде (5 мл) добавляли карбонат натрия (8,37 г, 60,6 ммоль), и смесь перемешивали в атмосфере азота при 120°C в течение 1 часа. Туда добавляли воду (150 мл) и этилацетат (150 мл), и нерастворимый материал удаляли с помощью фильтрации. Органический слой промывали водой (2 раза по 100 мл) и насыщенным рассолом (100 мл). После этого туда добавляли активированный углерод и безводный сульфат магния, нерастворимый материал отфильтровывали, и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 189 (9,62 г, 93% выход) в виде коричневого маслянистого материала.
1H-ЯМР (CDCl3) δ: 0,89 (s, 9H), 2,20 (s, 3H), 2,40 (s, 3H), 3,65 (s, 2H), 3,75 (s, 3H), 5,32 (s, 1H), 6,69 (d, J=8,1 Гц, 1H), 6,93 (d, J=8,1 Гц, 1H), 7,18 (d, J=8,1 Гц, 2H), 7,24-7,37 (m, 2H).
Этап 3
К раствору соединения 189 (7,00 г, 20,5 ммоль) в дихлорметане (35 мл) и метаноле (35 мл) добавляли карбонат кальция (2,67 г, 26,7 ммоль) и дихлорйодат бензилтриметиламмония (8,56 г, 24,6 ммоль), и смесь перемешивали при комнатной температуре в течение 20 часов. При охлаждении льдом туда добавляли 10% бисульфит натрия (100 мл) и насыщенный водный раствор бикарбоната натрия (100 мл), и смесь экстрагировали этилацетатом (300 мл). Органический слой промывали водой (30 мл) и насыщенным рассолом (30 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 190 (8,42 г, 88% выход) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,88 (s, 9H), 2,28 (s, 3H), 2,39 (s, 3H), 3,75 (s, 3H), 4,14 (s, 2H), 5,25 (s, 1H), 7,17-7,32 (m, 4H), 7,47 (s, 1H).
Этап 4
Суспензию соединения 190 (3,00 г, 6,42 ммоль), циклолейцина (1,66 г, 12,8 ммоль), хлорида меди(I) (64,0 мг, 0,642 ммоль), N,N'-диметилэтилендиамина (0,137 мл, 1,28 ммоль) и фосфата трикалия (2,73 г, 12,8 ммоль) в DMSO (30 мл) перемешивали при 140°C в течение 1 часа. После охлаждения до комнатной температуры туда добавляли насыщенный раствор хлорида аммония (25 мл), воду (75 мл) и этилацетат (150 мл), и нерастворимый материал удаляли с помощью фильтрации. Органический слой промывали насыщенным рассолом (50 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 191 (1,69 г, 58% выход) в виде бледно-коричневой пены.
1H-ЯМР (CDCl3) δ: 0,89 (s, 9H), 1,68-1,84 (m, 6H), 2,21-2,33 (m, 5H), 2,40 (s, 3H), 3,74 (s, 3H), 3,83 (s, 1H), 5,22 (s, 1H), 6,41 (s, 1H), 7,17-7,33 (m, 4H), 7,44 (s, 1H).
Этап 5
При охлаждении льдом к раствору соединения 191 (1,68 г, 3,73 ммоль) в DMF (21 мл) добавляли N-бромсукцинимид (796 мг, 4,47 ммоль), и смесь перемешивали при охлаждении льдом в течение 30 минут. Туда добавляли воду (30 мл) и насыщенный водный раствор хлорида аммония (30 мл), и смесь экстрагировали этилацетатом (100 мл). Органический слой промывали насыщенным рассолом (30 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 192 (1,66 г, 79% выход) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,95 (s, 9H), 1,70-1,87 (m, 6H), 2,21-2,31 (m, 5H), 2,43 (s, 3H), 3,68 (s, 3H), 4,63 (s, 1H), 4,94 (s, 1H), 7,10-7,14 (m, 1H), 7,18-7,25 (m, 3H), 7,49 (s, 1H).
Этап 6
К раствору соединения 192 (165 мг, 0,312 ммоль) в DMF (1,65 мл) добавляли карбонат цезия (254 мг, 0,779 ммоль) и йодметан (0,097 мл, 1,56 ммоль), смесь перемешивали при комнатной температуре в течение 1,5 часа. Туда добавляли воду (30 мл), и смесь экстрагировали этилацетатом (50 мл). Органический слой промывали водой (30 мл) и насыщенным рассолом (30 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 193 (148 мг, 88% выход) в виде белой пены.
1H-ЯМР (CDCl3) δ: 0,96 (s, 9H), 1,58-1,87 (m, 6H), 1,87-2,02 (m, 1H), 2,32 (s, 3H), 2,40-2,50 (m, 4H), 3,34 (s, 3H), 3,70 (s, 3H), 4,62 (s, 1H), 4,98 (s, 1H), 7,09-7,14 (m, 1H), 7,20-7,25 (m, 3H).
Этап 7
К суспензии соединения 193 (145 мг, 0,267 ммоль), трибутил(метокси)станнана (0,230 мл, 0,800 ммоль), ацетата палладия (12,0 мг, 0,053 ммоль), три-(o-толил)фосфина (32,5 мг, 0,107 ммоль) в толуоле (7 мл) добавляли изопропенилацетат (0,145 мл 1,33 ммоль), смесь перемешивали в атмосфере азота при 100°C в течение 2 часов. После охлаждения туда добавляли этилацетат (2 мл) и водный фторид калия 4 моль/л (1,8 мл), смесь перемешивали в течение 1 часа, и нерастворимый материал удаляли с помощью фильтрации. Туда добавляли воду (30 мл), и смесь экстрагировали этилацетатом (50 мл). Органический слой промывали насыщенным рассолом (30 мл) и сушили над безводным сульфатом магния. Концентрированный остаток растворяли в уксусной кислоте (1,45 мл), и смесь перемешивали при 60°C в течение 45 минут. После концентрирования при пониженном давлении получаемую смесь разбавляли этилацетатом (30 мл). Органический слой промывали водой (20 мл), насыщенным водным раствором бикарбоната натрия (20 мл) и насыщенным рассолом (20 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 194 (112 мг, 83% выход).
1H-ЯМР (CDCl3) δ: 0,92 (s, 9H), 1,88-2,14 (m, 6H), 2,43 (s, 3H), 2,46 (s, 3H), 2,52-2,58 (m, 4H), 2,62-2,73 (m, 1H), 3,60 (s, 3H), 3,75 (s, 3H), 5,43 (s, 1H), 5,95 (s, 1H), 7,22-7,33 (m, 3H), 7,39-7,44 (m, 1H).
Этап 8
К соединению 194 (90,0 мг, 0,179 ммоль) добавляли раствор 0,92 моль/л борана в THF (0,973 мл, 0,895 ммоль), смесь перемешивали при комнатной температуре в течение 30 часов. Туда добавляли воду (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой промывали насыщенным рассолом (20 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на аминосиликагеле (гексан-этилацетат) с получением соединения 195 (63,1 мг, 72% выход) в виде белой пены.
1H-ЯМР (CDCl3) δ: 0,90 (s, 9H), 1,73-1,88 (m, 2H), 1,90-2,02 (m, 4H), 2,07-2,15 (m, 1H), 2,21-2,31 (m, 1H), 2,39 (s, 3H), 2,42 (s, 3H), 2,46 (s, 3H), 3,15 (s, 3H), 3,34 (d, J=14,1 Гц, 1H), 3,40 (d, J=14,1 Гц, 1H), 3,72 (s, 3H), 5,46 (s, 1H), 5,89 (s, 1H), 7,21-7,25 (m, 2H), 7,35-7,39 (m, 1H), 7,44-7,48 (m, 1H).
Этап 9
К раствору соединения 195 (60 мг, 0,123 ммоль) в этаноле (1 мл) добавляли водный гидроксид натрия 2 моль/л (0,5 мл, 1,00 ммоль), и смесь перемешивали с обратным холодильником в течение 2 часов. Туда добавляли водный раствор 1 моль/л соляной кислоты (1 мл) и насыщенный рассол (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (хлороформ - метанол) с получением соединения I-302 (56,7 мг, 97% выход) в виде белого твердого вещества. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=475,6 [M+H]+, RT=3,10 мин.
1H-ЯМР (CDCl3) δ: 0,91 (s, 9H), 1,72-1,89 (m, 2H), 1,90-2,04 (m, 4H), 2,05-2,13 (m, 1H), 2,23-2,33 (m, 1H), 2,37 (s, 3H), 2,42 (s, 3H), 2,47 (s, 3H), 3,13 (s, 3H), 3,35 (d, J=14,1 Гц, 1H), 3,40 (d, J=14,1 Гц, 1H), 5,58 (s, 1H), 5,93 (s, 1H), 7,23-7,26 (m, 2H), 7,37-7,42 (m, 1H), 7,53-7,57 (m, 1H).
(Пример 52)
[0422]
[Химическая формула 177]

Этап 1
К суспензии соединения 196 (1,00 г, 5,75 ммоль) в ацетонитриле (20 мл) добавляли 4-бромбутаноилхлорид (0,798 мл, 6,90 ммоль) и карбонат калия (1,99 г, 14,4 ммоль), и смесь перемешивали при комнатной температуре в течение 21 часа. Затем нерастворимый материал удаляли с помощью фильтрации, и раствор фильтрата концентрировали при пониженном давлении. Концентрированный остаток растворяли в хлороформе (50 мл) и промывали водой (30 мл). Водный слой повторно экстрагировали хлороформом (50 мл), органический слой сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (хлороформ-метанол), и полученное твердое вещество промывали гексаном с получением соединения 197 (990 мг, 71% выход) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,22 (tt, J=8,2, 7,2 Гц, 2H), 2,69 (t, J=8,2 Гц, 2H), 4,22 (t, J=7,2 Гц, 2H), 7,60 (d, J=9,4 Гц, 1H), 8,63 (d, J=9,4 Гц, 1H).
Этап 2
К суспензии соединения 83 (300 мг, 0,713 ммоль), соединения 197 (259 мг, 1,07 ммоль), дибензилиденацетонпалладия (98,0 мг, 0,107 ммоль) и RuPhos (66,6 мг, 0,143 ммоль) в толуоле (3 мл) добавляли трет-бутоксид натрия (103 мг, 1,07 ммоль) при комнатной температуре, и смесь перемешивали в атмосфере азота при 60°C в течение 20 часов. К реакционной смеси добавляли насыщенный раствор хлорида аммония (3 мл), воду (30 мл) и этилацетат (50 мл), и нерастворимый материал удаляли с помощью фильтрации. Органический слой промывали водой (30 мл) и насыщенным рассолом (30 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью хроматографии на силикагеле (гексан-этилацетат) с получением соединения 198 (191 мг, 46% выход) в виде коричневой пены.
1H-ЯМР (CDCl3) δ: 0,93 (s, 9H), 2,15-2,24 (m, 5H), 2,31 (s, 3H), 2,45 (s, 3H), 2,66 (t, J=8,1 Гц, 2H), 3,77 (s, 3H), 3,98-4,07 (m, 2H), 4,19-4,29 (m, 2H), 4,47-4,62 (m, 1H), 4,77-4,89 (m, 1H), 5,47 (s, 1H), 5,93 (s, 1H), 6,70 (d, J=9,8 Гц, 1H), 7,25-7,29 (m, 2H), 7,37-7,40 (m, 1H), 7,43-7,46 (m, 1H), 8,45 (d, J=9,8 Гц, 1H).
Этап 3
К раствору соединения 198 (130 мг, 0,223 ммоль) в диметилацетамиде (1,3 мл) добавляли хлорид лития (474 мг, 11,2 ммоль), смесь перемешивали при 120°C в течение 15 часов. Туда добавляли водную соляную кислоту 1 моль/л (1,5 мл) и воду (20 мл), и смесь экстрагировали этилацетатом (30 мл). Органический слой промывали водой (2 раза по 20 мл) и насыщенным рассолом (20 мл) и сушили над безводным сульфатом магния. После концентрирования остаток очищали с помощью ВЭЖХ (ацетонитрил- раствор формиата аммония) с получением соединения I-303 (28,0 мг, 22% выход) в виде коричневого твердого вещества. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=568,7 [M+H]+, RT=2,54 мин.
1H-ЯМР (CDCl3) δ: 0,96 (s, 9H), 2,14-2,24 (m, 5H), 2,32 (s, 3H), 2,43 (s, 3H), 2,66 (t, J=8,0 Гц, 2H), 3,99-4,11 (m, 2H), 4,13-4,43 (m, 3H), 4,88-5,14 (m, 1H), 5,60 (s, 1H), 5,95 (s, 1H), 6,69 (d, J=9,8 Гц, 1H), 7,24-7,30 (m, 2H), 7,40 (d, J=6,8 Гц, 1H), 7,63 (d, J=6,8 Гц, 1H), 8,46 (d, J=9,8 Гц, 1H).
(Пример 53)
[0423]
[Химическая формула 178]

Этап 1
К раствору соединения 199 (3,7 г, 5,72 ммоль) в DMF (37 мл) добавляли трибутилвинилолово (3,33 мл, 11,44 ммоль), хлорид лития (485 мг, 11,44 ммоль) и дихлорбистрифенилфосфинтрифенилфосфинпалладий (402 мг, 0,572 ммоль), и смесь перемешивали в атмосфере азота при 60°C в течение 30 минут. К смеси добавляли водный фторид калия, осажденное твердое вещество фильтровали, и раствор фильтрата экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 200 (2,64 г, 88% выход) в виде желтой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=525,25 [M+H]+, RT=3,30 мин.
Этап 2
К раствору соединения 200 (2 г, 3,81 ммоль) в THF (20 мл) и воде (4 мл) добавляли осмат(VI) калия дигидрат (70,2 мг, 0,191 ммоль) и перйодат натрия (3,26 г, 15,2 ммоль), и смесь перемешивали при комнатной температуре в течение 2,5 часа. Туда добавляли воду, и смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 201 (991 мг, 49% выход) в виде желтой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=527,20 [M+H]+, RT=3,07 мин.
Этап 3
При охлаждении льдом к соединению 201 (990 мг, 1,88 ммоль) в метаноле (10 мл) добавляли боргидрид натрия (71,1 мг, 1,88 ммоль), и смесь перемешивали при 0°C в течение 20 мин. Туда добавляли соляную кислоту 2 моль/л, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 202 (790 мг, 71% выход) в виде розового твердого вещества. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=529,25 [M+H]+, RT=2,77 мин.
Этап 4
При охлаждении льдом к раствору соединения 202 (100 мг, 0,189 ммоль) в дихлорметане (2 мл) добавляли трифенилфосфин (99 мг, 0,378 ммоль) и тетрабромид углерода (125 мг, 0,378 ммоль), смесь перемешивали в атмосфере азота при комнатной температуре в течение 50 минут. Затем туда добавляли раствор 2 моль/л диметиламина в THF (0,946 мл, 1,89 ммоль), и смесь перемешивали при комнатной температуре в течение 20 минут. Туда добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на аминосиликагеле (гексан-этилацетат) с получением соединения 203 (95,6 мг, 91% выход) в виде желтой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=556,25 [M+H]+, RT=2,45 мин.
Этап 5
К раствору соединения 203 (90 мг, 0,162 ммоль) в этаноле (1 мл) и THF (1 мл) добавляли водный раствор 2 моль/л гидроксида натрия (0,81 мл, 1,62 ммоль), смесь перемешивали с обратным холодильником в течение 7 часов. Туда добавляли соляную кислоту 2 моль/л, и смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле DIOL (хлороформ-метанол) с получением соединения I-304 (56,1 мг, 64% выход) в виде коричневого твердого вещества. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=542,20 [M+H]+, RT=2,22 мин.
1H-ЯМР (CDCl3) δ: 0,97 (9H, s), 1,12 (3H, s), 2,23 (3H, s), 2,29 (3H, s), 2,29 (3H, s), 2,43 (3H, s), 3,25-3,35 (2H, m), 3,59-3,69 (1H, m), 3,97-4,10 (2H, m), 5,59 (1H, s), 5,90 (1H, s), 7,22-7,29 (2H, m), 7,34-7,43 (1H, m), 7,62-7,71 (1H, m), 8,33 (2H, s).
(Пример 54)
[0424]
[Химическая формула 179]
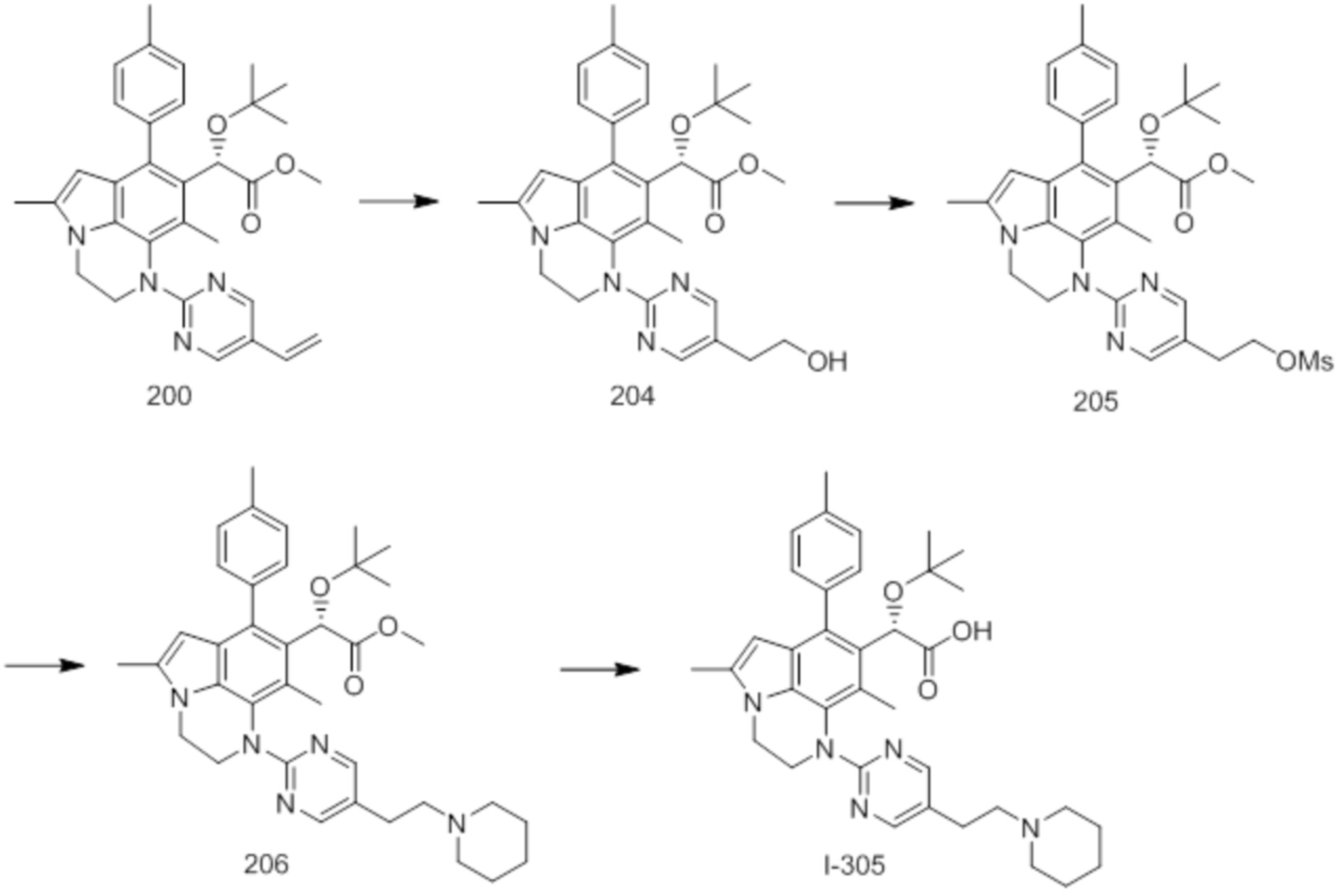
Этап 1
При охлаждении льдом к раствору соединения 200 (550 мг, 1,05 ммоль) в THF (5 мл) добавляли раствор 0,5 моль/л 9-борабицикло[3.3.1]нонана в THF (3,14 мл, 1,57 ммоль), и смесь перемешивали в атмосфере азота при 0°C в течение 4 часов. Затем туда добавляли воду (5 мл) и пербората натрия тетрагидрата (484 мг, 3,14 ммоль), и смесь перемешивали при комнатной температуре в течение 4,5 часа. Туда добавляли воду, и смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 204 (490 мг, 86% выход) в виде желтой пены.
Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=543,25 [M+H]+, RT=2,80 мин.
Этап 2
К раствору соединения 204 (270 мг, 0,498 ммоль) в дихлорметане (3 мл) добавляли триэтиламин (0,103 мл, 0,746 ммоль) и мезилхлорид (0,05 мл, 0,647 ммоль), смесь перемешивали в атмосфере азота при комнатной температуре в течение 10 минут. Туда добавляли воду, и смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) с получением соединения 205 (490 мг, 86% выход) в виде желтой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=621,2 [M+H]+, RT=3,00 мин.
Этап 3
К раствору соединения 205 (100 мг, 0,161 ммоль) в DMF (1 мл) добавляли пиперидин (0,159 мл, 1,61 ммоль) и мезилхлорид (0,05 мл, 0,647 ммоль), смесь перемешивали при 80°C в течение 1,5 часа. Туда добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью колоночной хроматографии на аминосиликагеле (гексан-этилацетат) с получением соединения 206 (86,3 мг, 88% выход) в виде желтой пены. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=610,30 [M+H]+, RT=2,86 мин.
Этап 4
К раствору соединения 206 (85 мг, 0,139 ммоль) в этаноле (1 мл) и THF (1 мл) добавляли водный раствор 2 моль/л гидроксида натрия (0,70 мл, 1,39 ммоль), смесь перемешивали с обратным холодильником в течение 4,5 часа. Туда добавляли соляную кислоту 2 моль/л, и смесь экстрагировали хлороформом. Органический слой промывали водой и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали с помощью хроматографии на силикагеле DIOL (хлороформ-метанол) с получением соединения I-305 (77,6 мг, 93% выход) в виде желтого твердого вещества. Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=542,20 [M+H]+, RT=2,22 мин.
1H-ЯМР (CDCl3) δ: 0,97 (9H, s), 1,23-1,28 (2H, m), 1,40-1,52 (2H, m), 1,54-1,69 (4H, m), 2,21 (3H, s), 2,29 (3H, s), 2,36-2,57 (4H, m), 2,43 (3H, s), 2,62-2,74 (2H, m), 3,95-4,07 (2H, m), 5,59 (1H, s), 5,90 (1H, s), 7,23-7,28 (2H, m), 7,34 (1H, f, J=7,2 Гц), 7,67 (1H, d, J=7,23 Гц), 8,27 (2H, s).
(Пример 55)
[0425]
[Химическая формула 180]
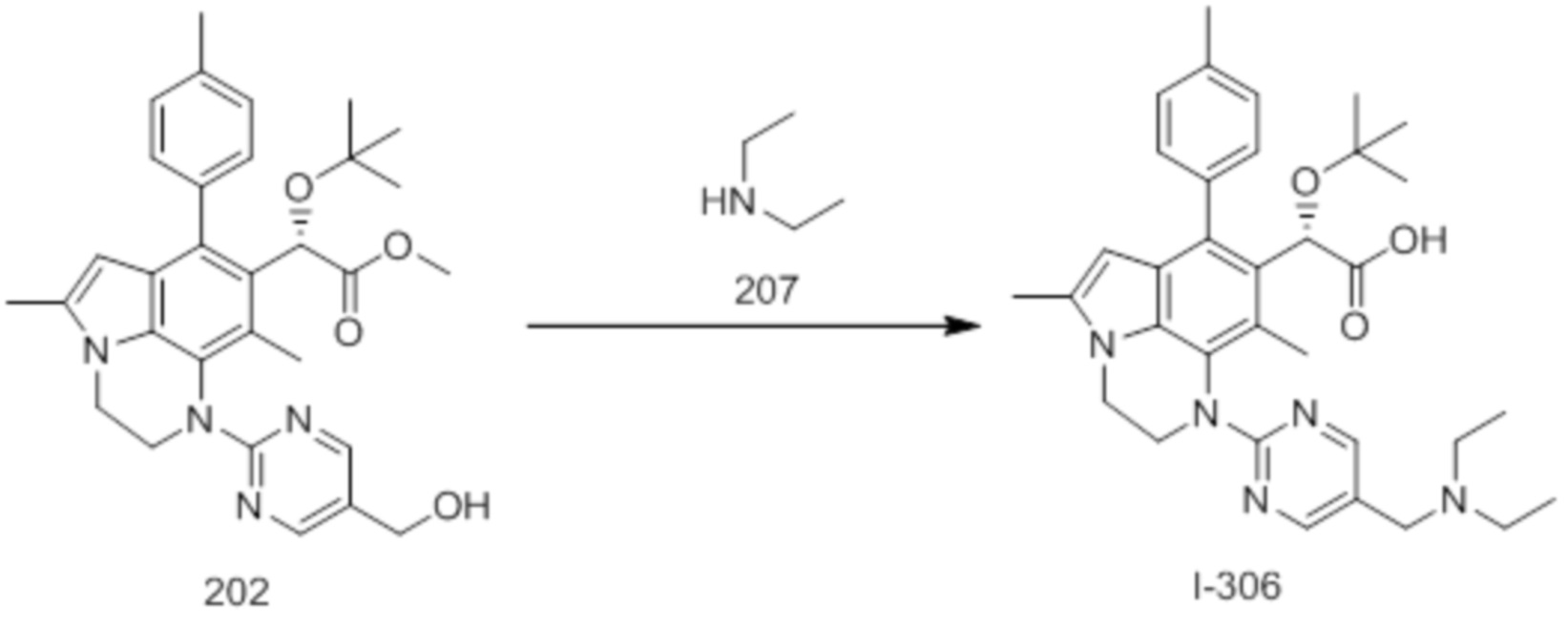
Этап 1
Аналогично этапам 4 и 5 примера 53, получали соединение I-306 (66,9 мг, 0,117 ммоль, 62% выход) в виде желтого твердого вещества из соединения 202 (100 мг, 0,189 ммоль) и соединения 207 (0,197 мл, 1,892 ммоль). Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=570,30 [M+H]+, RT=2,41 мин.
1H-ЯМР (CDCl3) δ: 0,96 (9H, s), 0,97-1,88 (10H, m), 2,22 (3H, s), 2,29 (3H, s), 2,42 (3H, s), 2,46-2,86 (2H, m), 3,39-3,74 (1H, m), 4,05 (2H, brs), 5,61 (1H, s), 5,91 (1H, s), 7,22-7,29 (2H, m), 7,35-7,42 (1H, m), 7,62-7,69 (1H, m), 8,41 (2H, brs).
(Пример 56)
[0426]
[Химическая формула 181]

Этап 1
Аналогично этапам 4 и 5 примера 53, получали соединение I-307 (56 мг, 0,105 ммоль, 56% выход) в виде желтого твердого вещества из соединения 202 (100 мг, 0,189 ммоль) и соединения 208 (0,128 мл, 1,892 ммоль). Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=554,25 [M+H]+, RT=2,35 мин.
1H-ЯМР (CDCl3) δ: 0,96 (9H, s), 2,04-2,12 (2H, m), 2,20 (3H, s), 2,29 (3H, s), 2,43 (3H, s), 3,16-3,23 (4H, m), 3,39-3,47 (2H, m), 3,95-4,08 (2H, m), 5,59 (1H, s), 5,90 (1H, s), 7,22-7,29 (2H, m), 7,35-7,40 (1H, m), 7,63-7,69 (1H, m), 8,32 (2H, s).
(Пример 57)
[0427]
[Химическая формула 182]

Этап 1
Аналогично этапам 4 и 5 примера 53, получали соединение I-308 (71,6 мг, 0,123 ммоль, 65% выход) в виде желтого твердого вещества из соединения 202 (100 мг, 0,189 ммоль) и соединения 209 (0,128 мл, 1,892 ммоль). Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=582,30 [M+H]+, RT=2,48 мин.
1H-ЯМР (CDCl3) δ: 0,98 (9H, s), 1,38-1,48 (2H, m), 1,52-1,60 (4H, m), 2,22 (3H, s), 2,28 (3H, s), 2,36 (4H, brs), 2,43 (3H, s), 3,35 (2H, s), 3,96-4,09 (2H, m), 5,59 (1H, s), 5,90 (1H, s), 7,23-7,29 (2H, m), 7,35-7,41 (1H, m), 7,63-7,70 (1H, m), 8,33 (2H, s).
(Пример 58)
[0428]
[Химическая формула 183]

Этап 1
Аналогично этапам 3 и 4 примера 54, получали соединение I-309 (75,6 мг, 0,126 ммоль, 80% выход) в виде желтого твердого вещества из соединения 205 (100 мг, 0,161 ммоль) и соединения 210 (0,139 мл, 1,611 ммоль).
Условия измерений при ЖХ/МС: (1), ЖХ/МС (ESI): m/z=598,30 [M+H]+, RT=2,35 мин.
1H-ЯМР (CDCl3) δ: 0,97 (9H, s), 2,21 (3H, s), 2,29 (3H, s), 2,43 (3H, s), 2,47-2,56 (6H, m), 2,61-2,68 (2H, m), 3,72 (4H, brs), 3,96-4,09 (2H, m), 5,60 (1H, s), 5,90 (1H, s), 7,23-7,29 (2H, m), 7,39 (1H, d, J=7,5 Гц), 7,66 (1H, d, J=7,5 Гц), 8,28 (2H, s).
[0429]
Следующие соединения были синтезированы с использованием коммерчески доступных соединений или вышеупомянутых промежуточных продуктов в соответствии с приведенными выше примерами или приведенными выше общими способами.
В таблицах "№ соед." обозначает номер соединения, "Структ." обозначает химическую структурную формулу, "Усл. изм." обозначает указанное выше условие измерения при ЖХ/МС (жидкостная хроматография/масс-спектрометрия), "RT(мин)" обозначает время удерживания (в минутах).
[0430]
[Таблица 1]
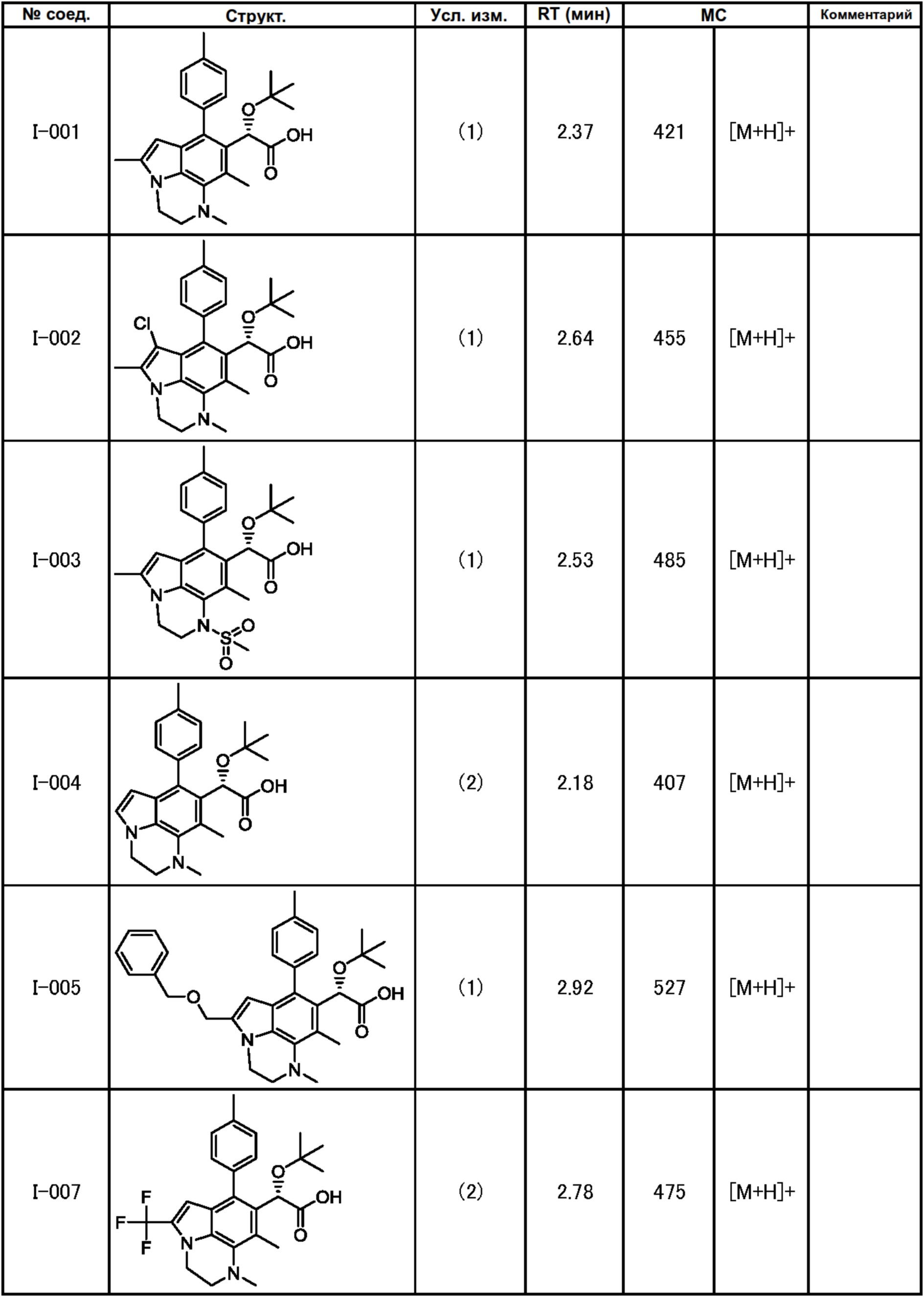
[0431]
[Таблица 2]

[0432]
[Таблица 3]

[0433]
[Таблица 4]

[Таблица 5]

[0434]
[Таблица 6]

[0435]
[Таблица 7]
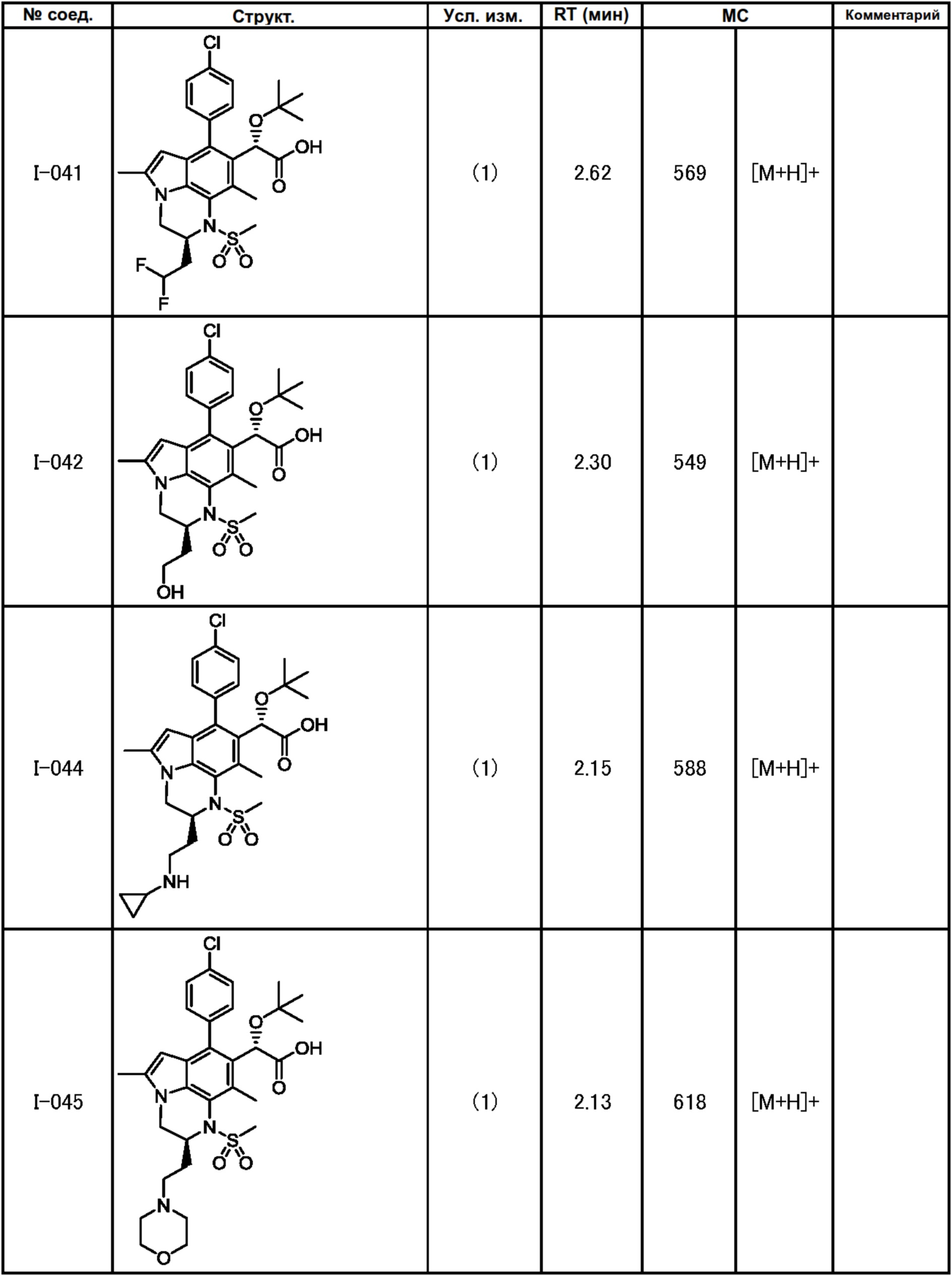
[0436]
[Таблица 8]
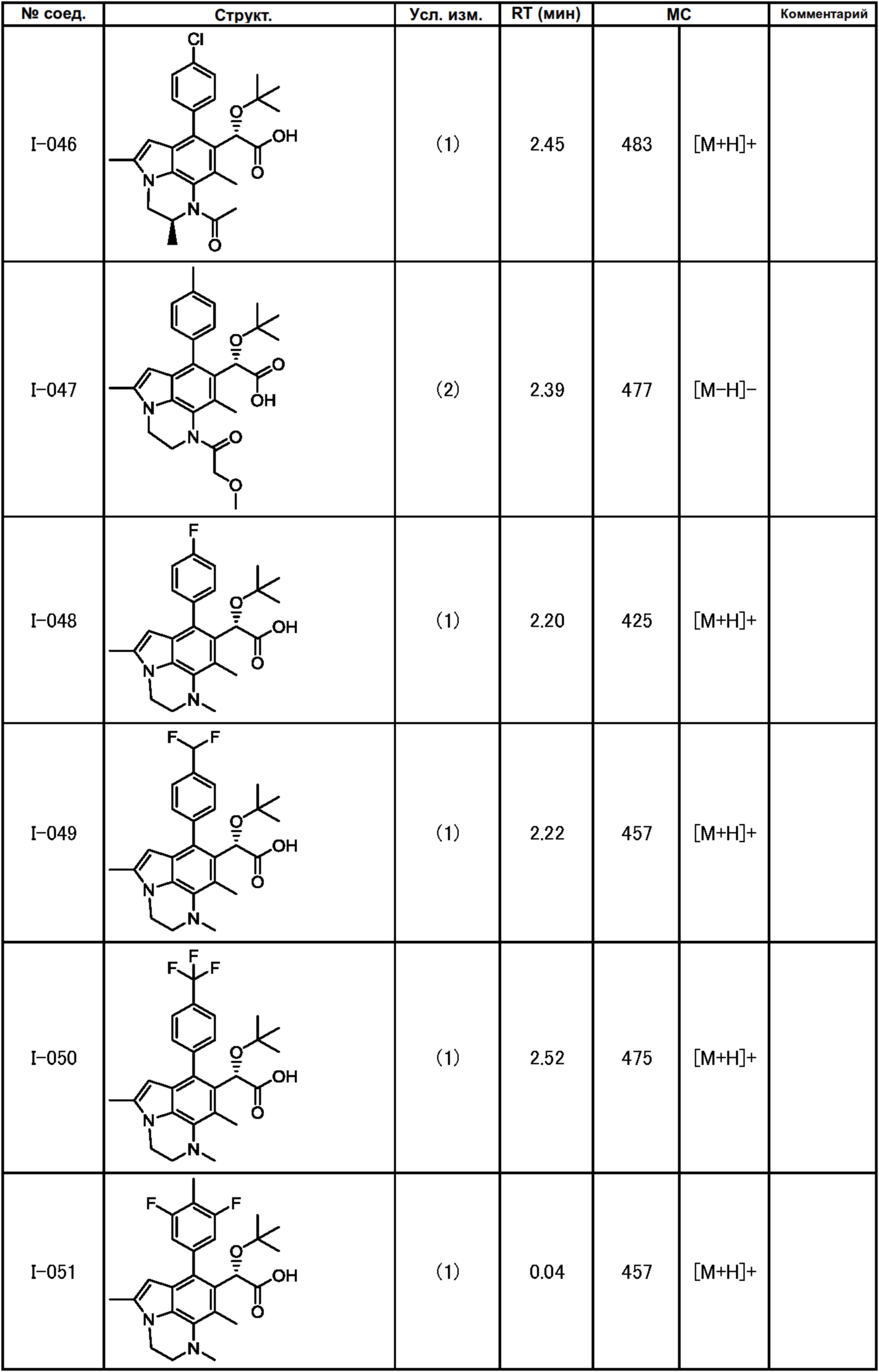
[Таблица 9]

[0437]
[Таблица 10]

[0438]
[Таблица 11]

[0439]
[Таблица 12]
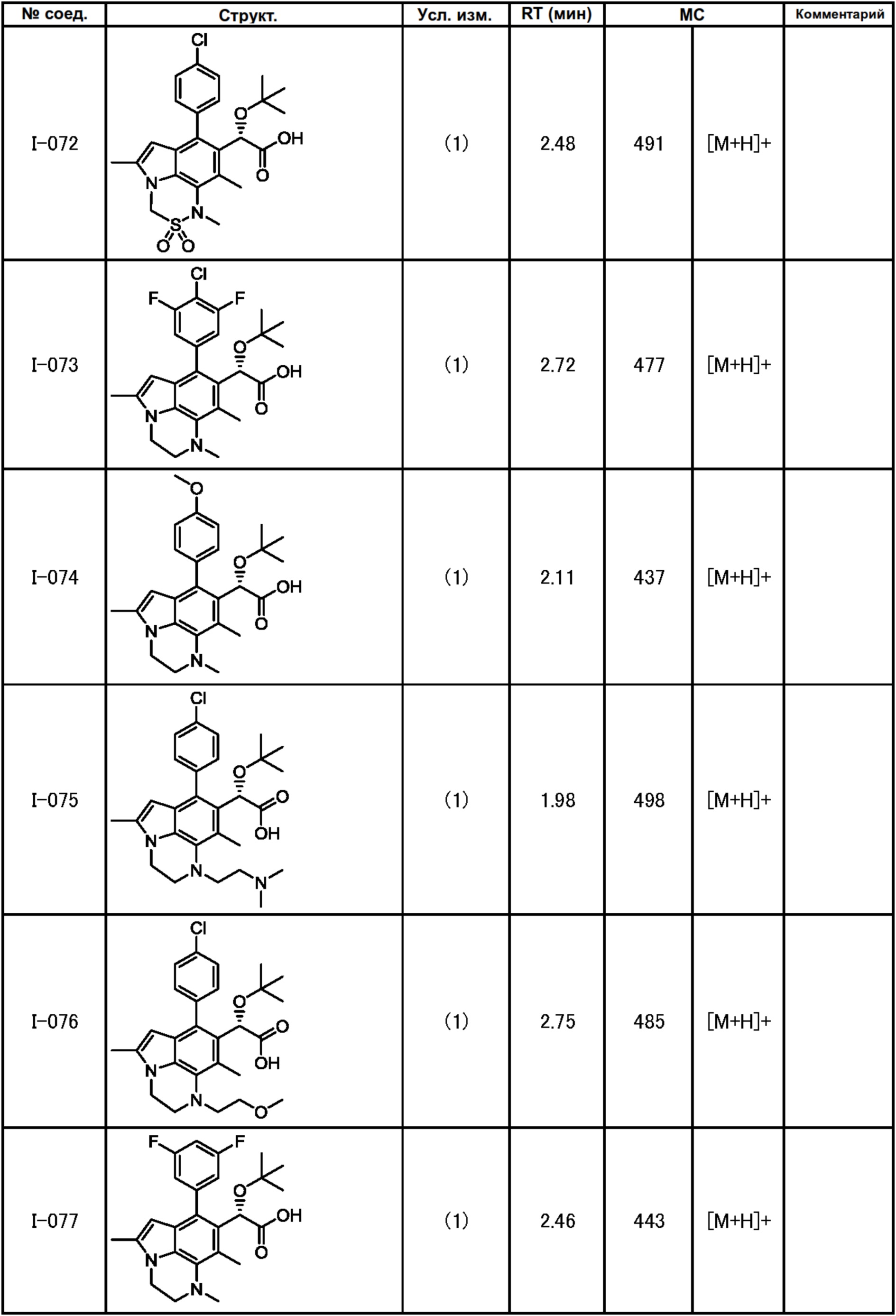
[0440]
[Таблица 13]

[0441]
[Таблица 14]

[0442]
[Таблица 15]

[Таблица 16]

[0443]
[Таблица 17]

[0444]
[Таблица 18]

[0445]
[Таблица 19]
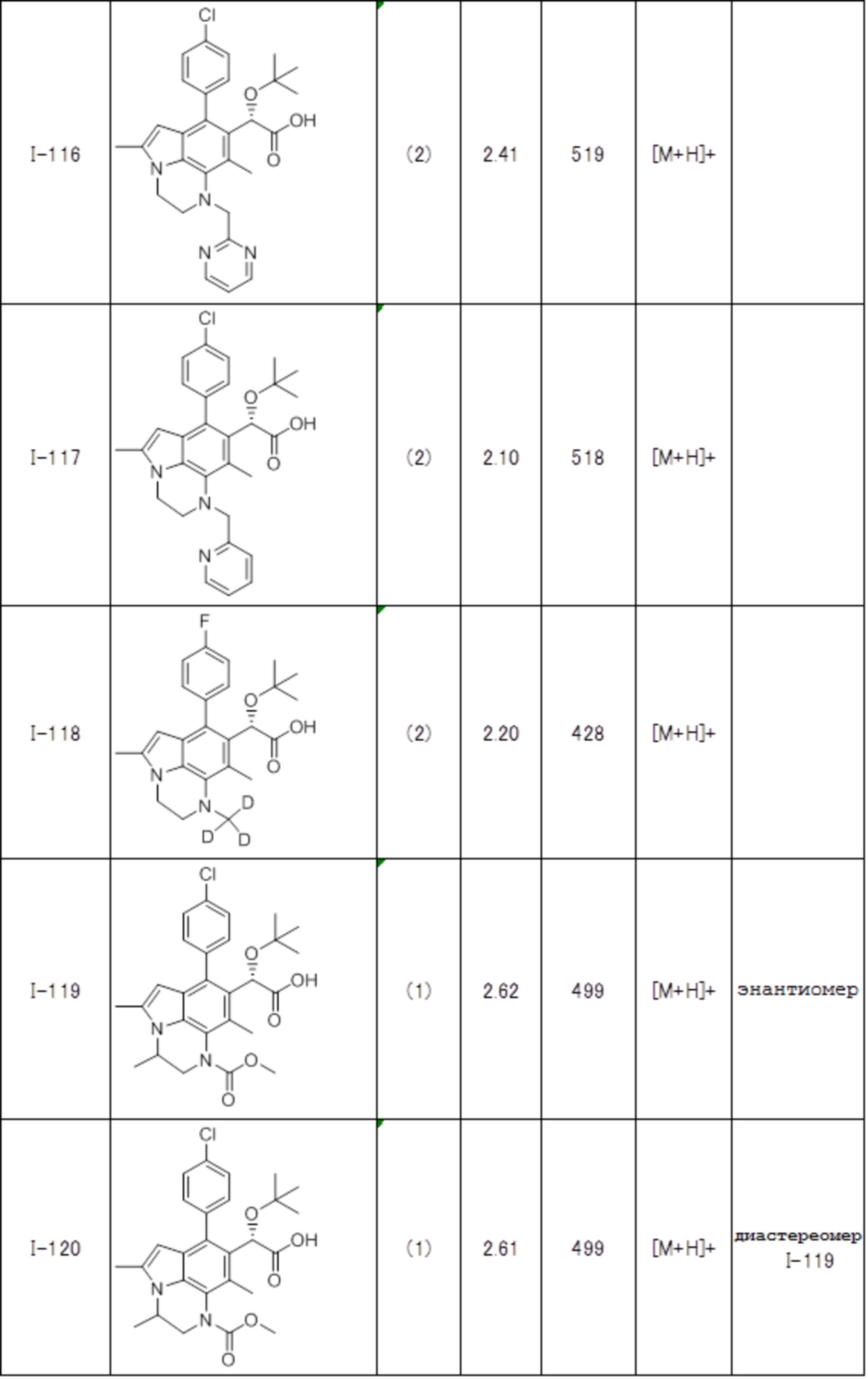
[0446]
[Таблица 20]
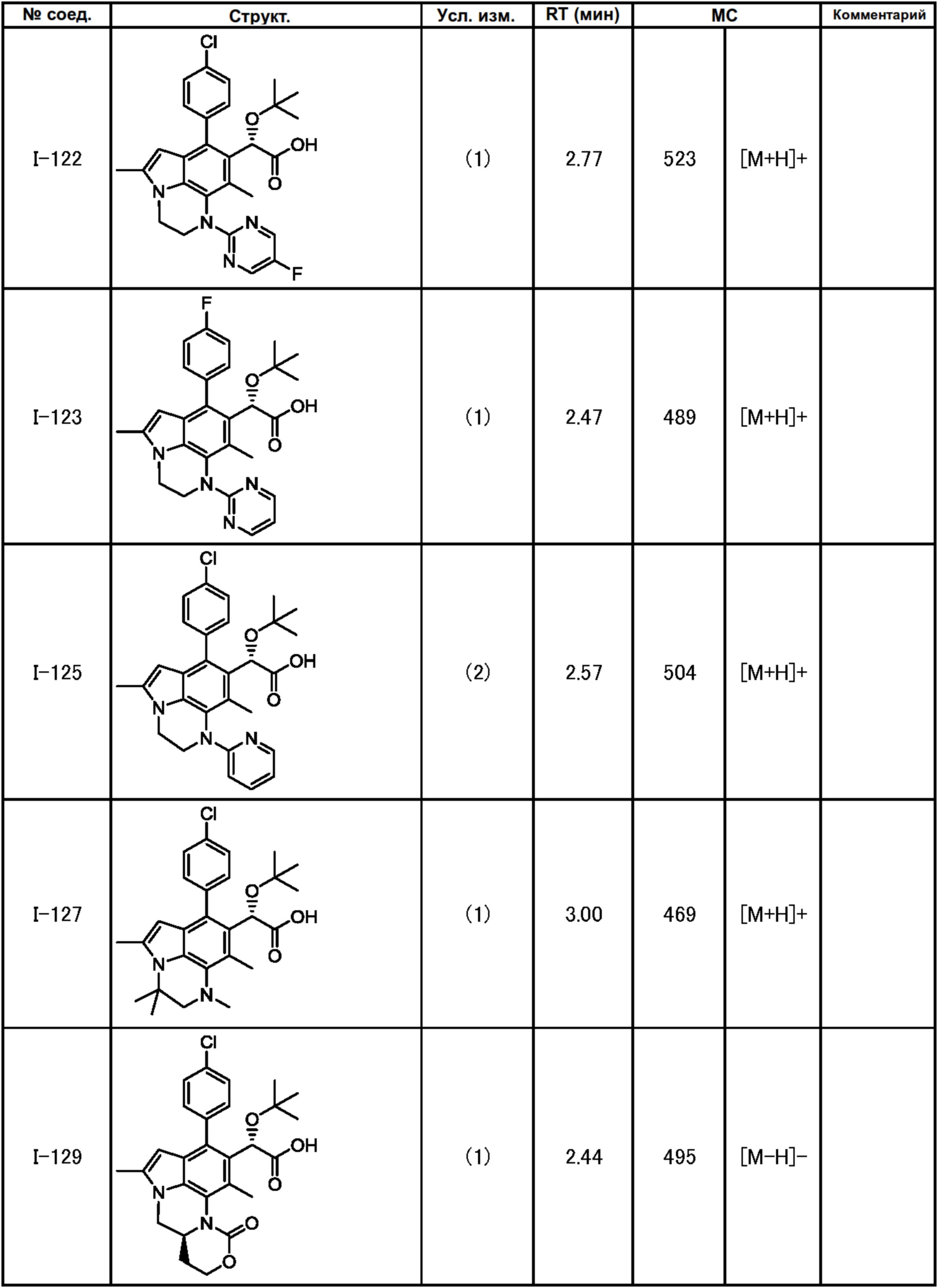
[0447]
[Таблица 21]
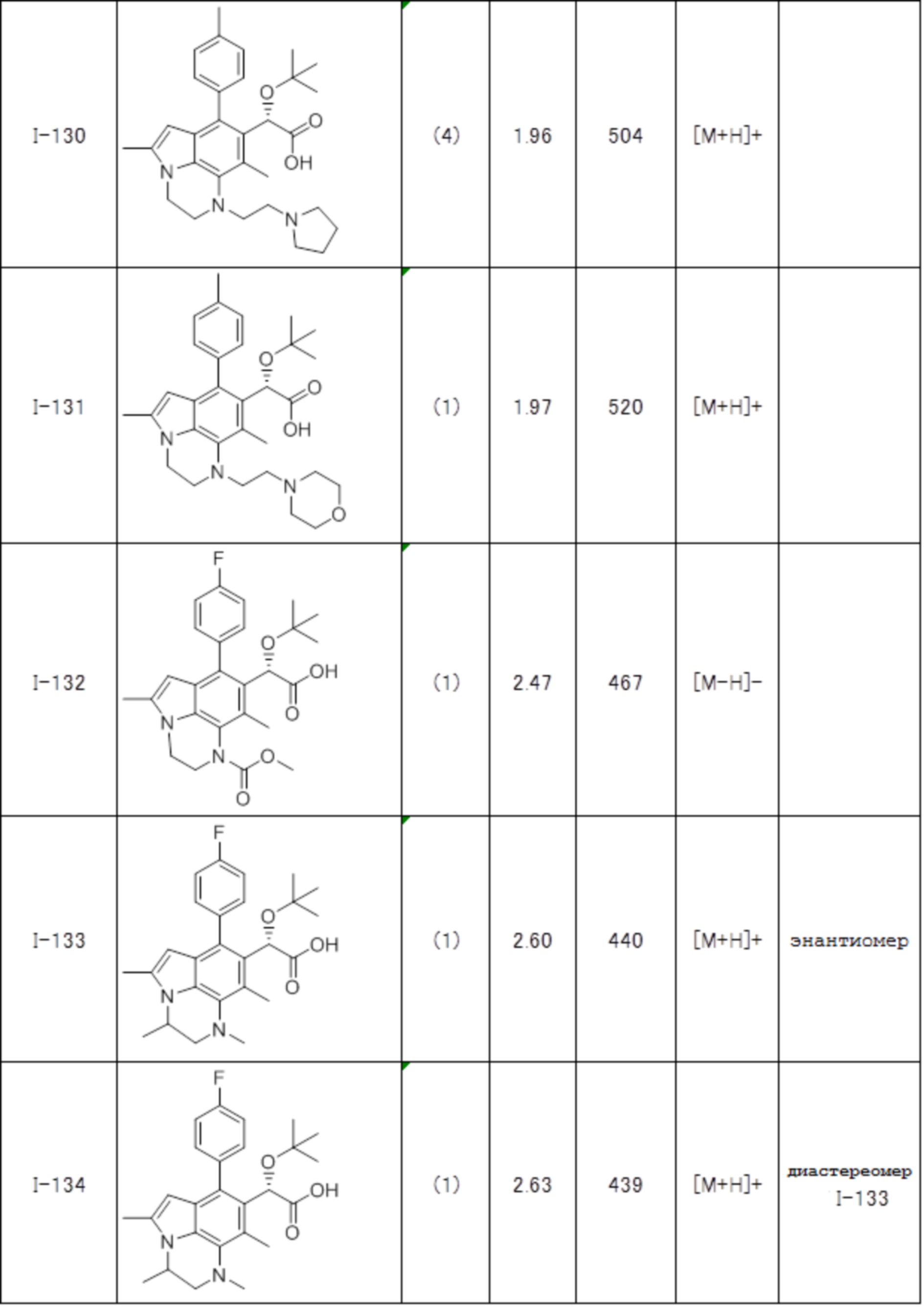
[0448]
[Таблица 22]

[0449]
[Таблица 23]
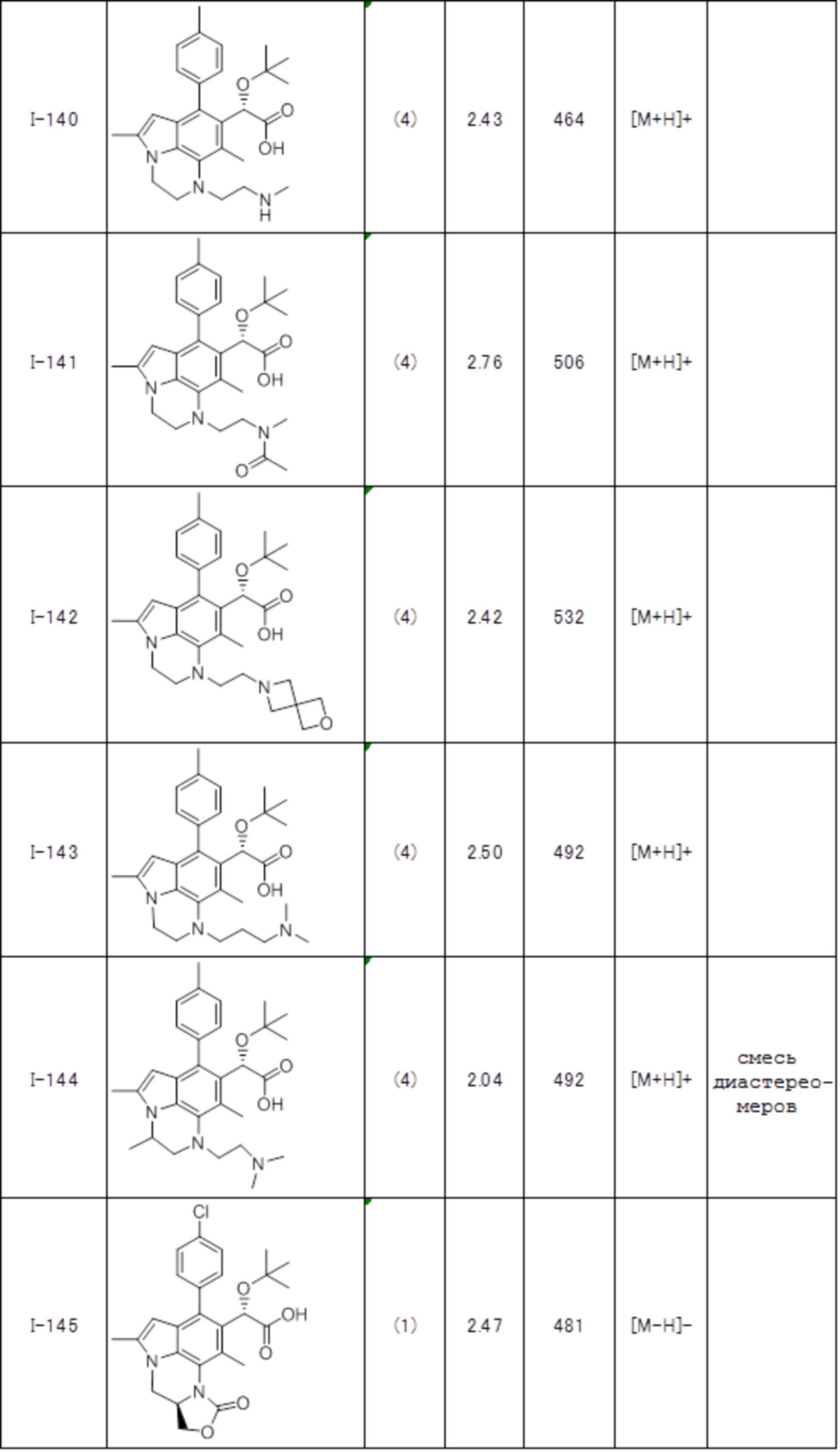
[0450]
[Таблица 24]

[0451]
[Таблица 25]

[0452]
[Таблица 26]

[0453]
[Таблица 27]

[0454]
[Таблица 28]

[0455]
[Таблица 29]

[0456]
[Таблица 30]

[0457]
[Таблица 31]
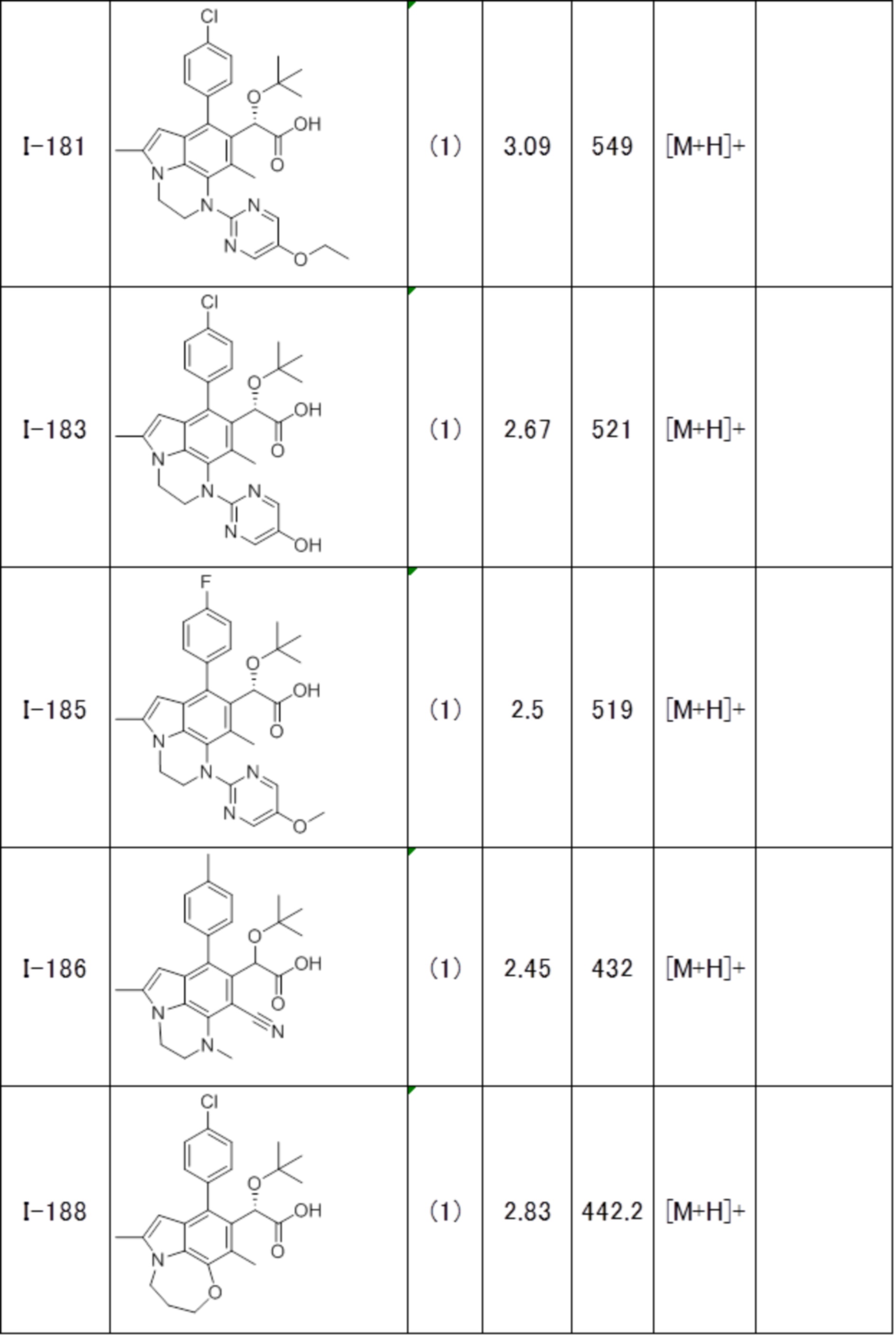
[0458]
[Таблица 32]

[0459]
[Таблица 33]

[0460]
[Таблица 34]

[0461]
[Таблица 35]

[0462]
[Таблица 36]
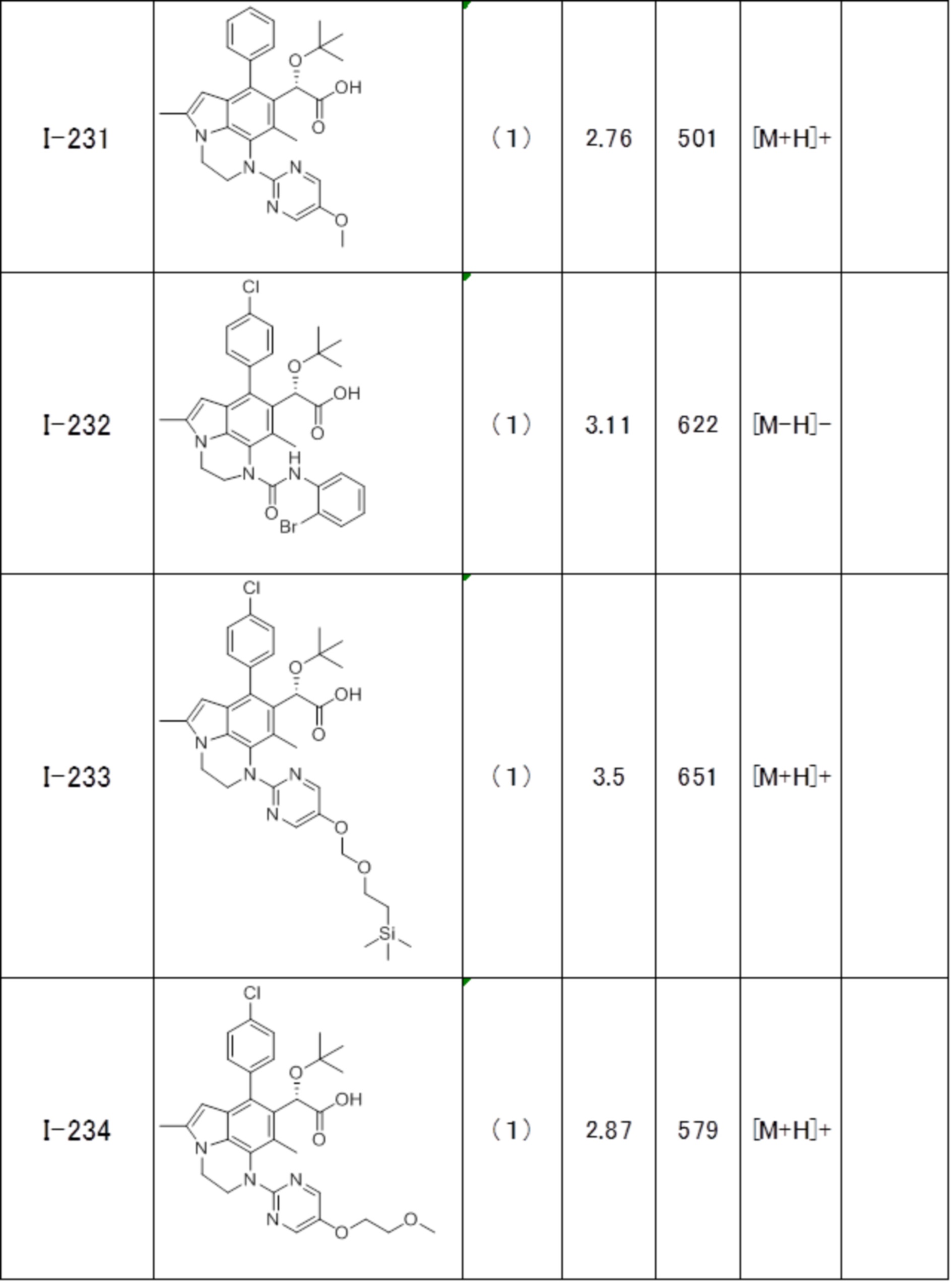
[0463]
[Таблица 37]

[0464]
[Таблица 38]

[0465]
[Таблица 39]
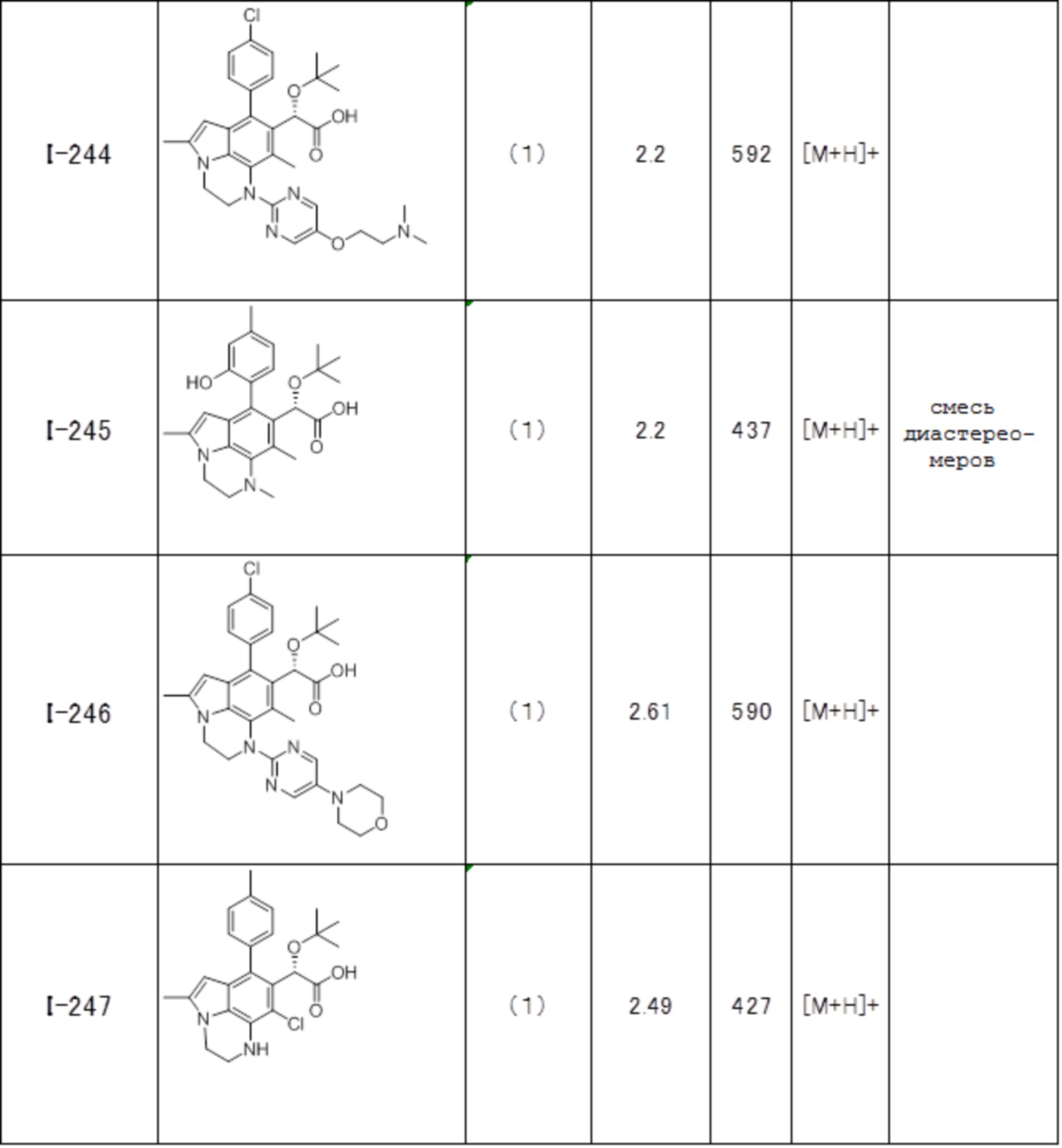
[0466]
[Таблица 40]

[0467]
[Таблица 41]

[0468]
[Таблица 42]
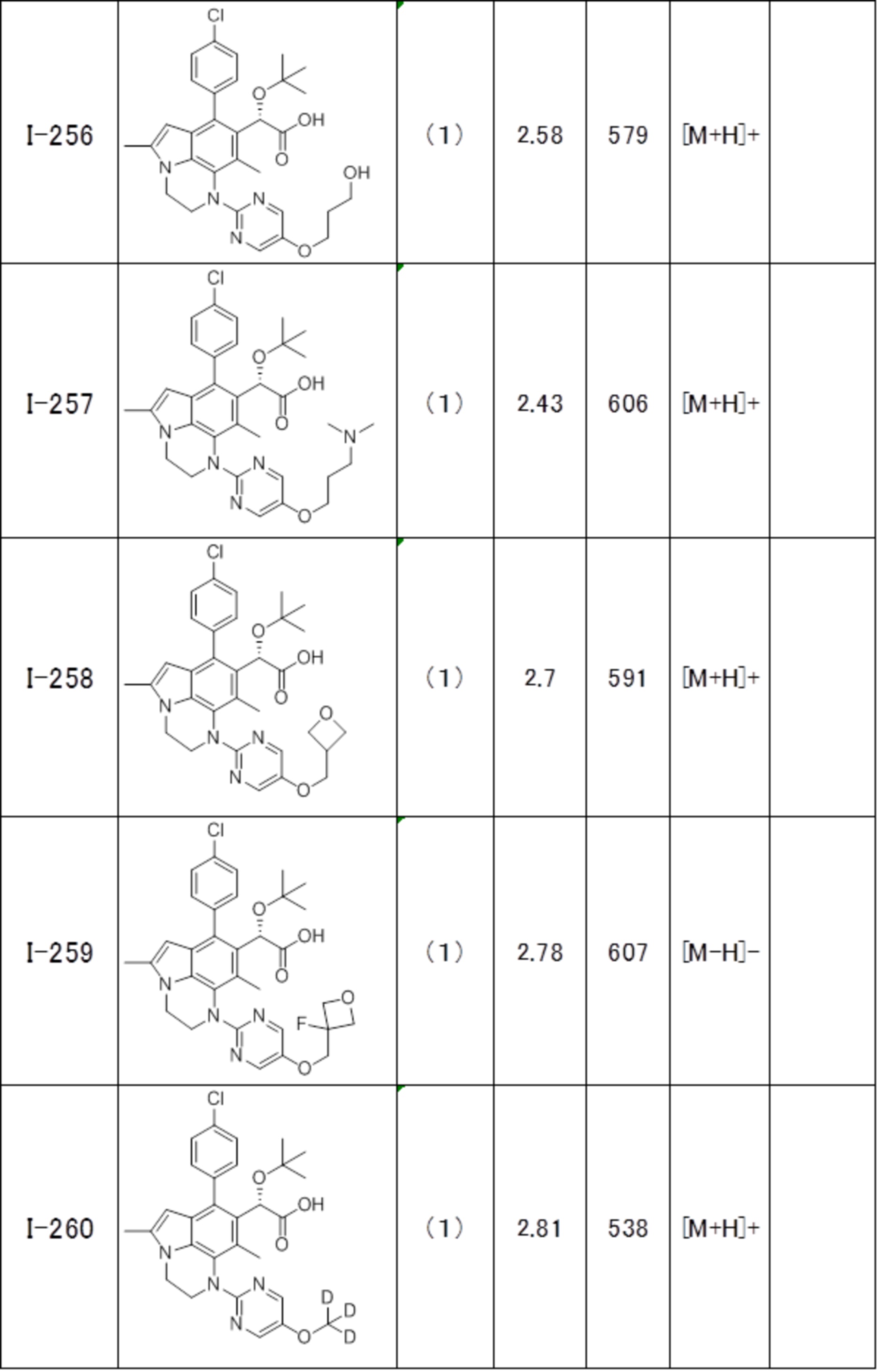
[0469]
[Таблица 43]

[0470]
[Таблица 44]
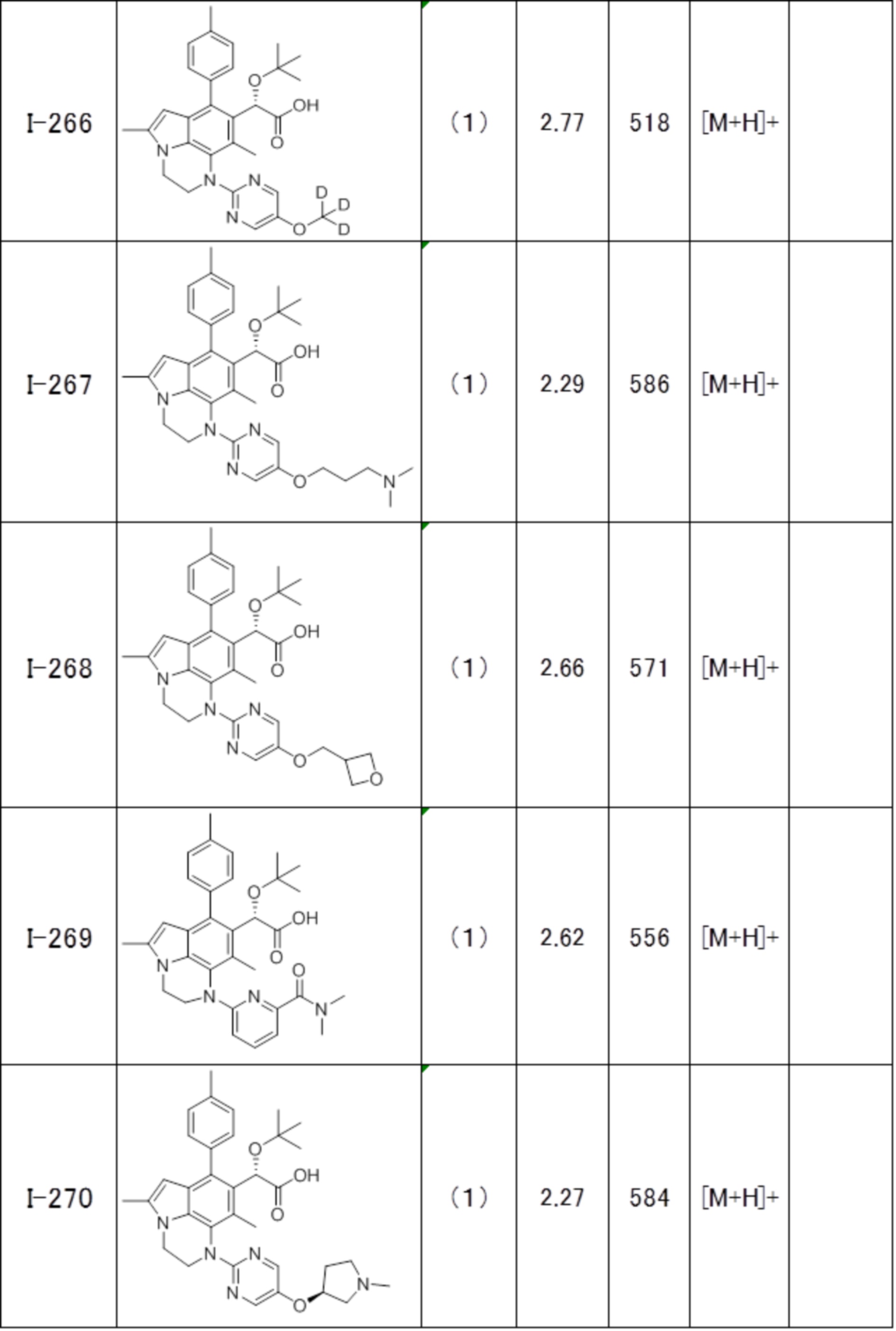
[0471]
[Таблица 45]

[0472]
[Таблица 46]

[0473]
[Таблица 47]

[0474]
[Таблица 48]
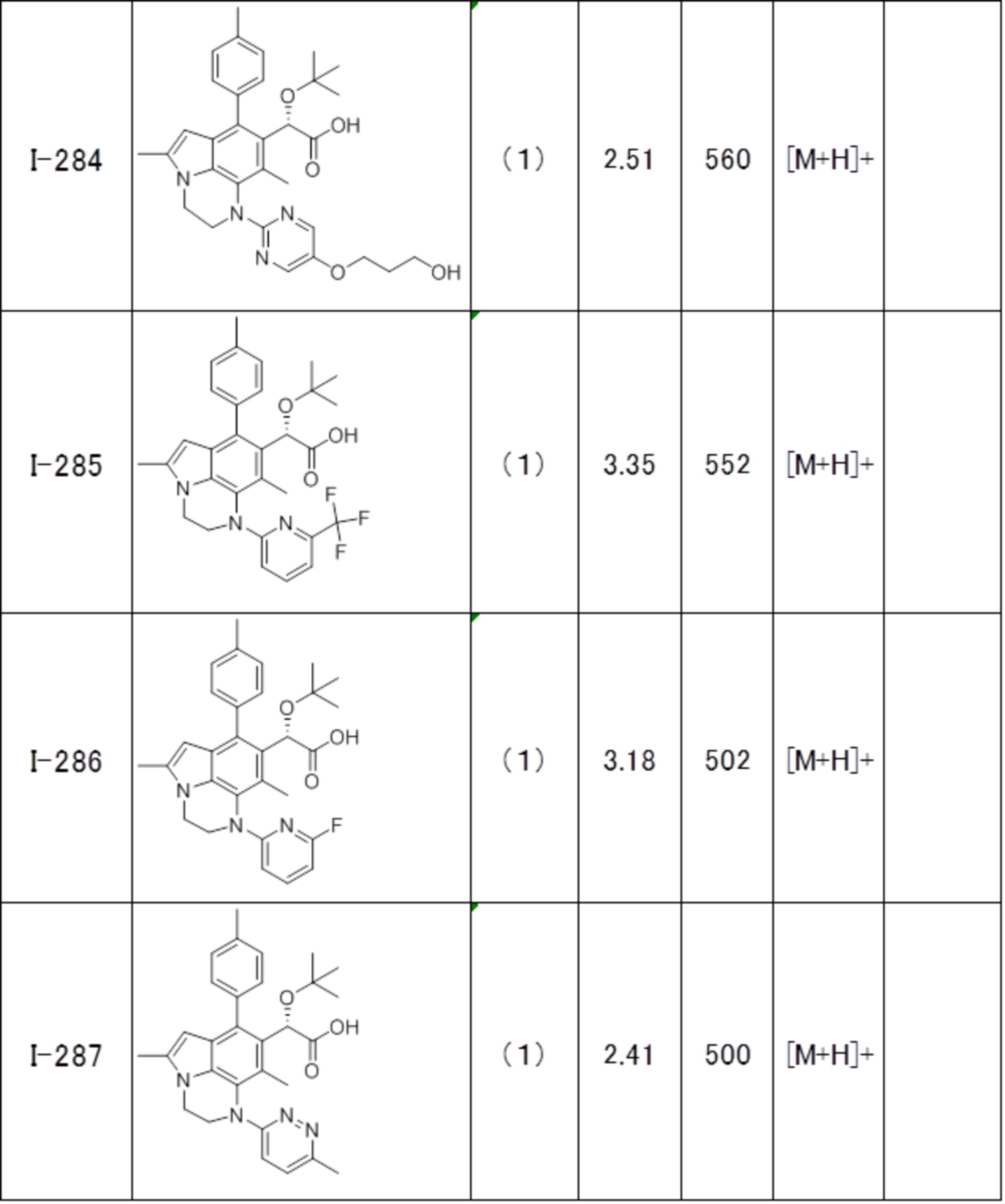
[0475]
[Таблица 49]
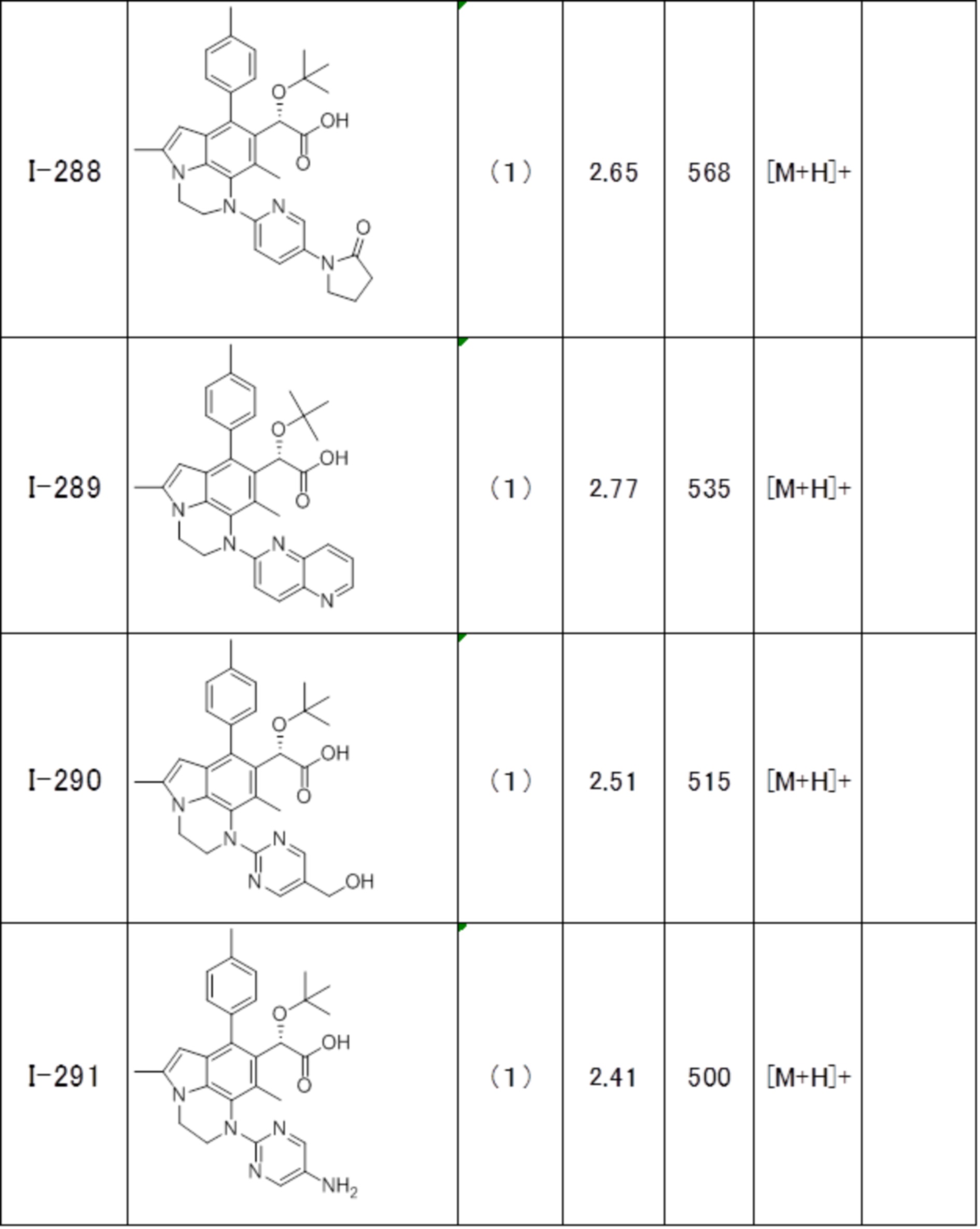
[0476]
[Таблица 50]

[0477]
[Таблица 51]
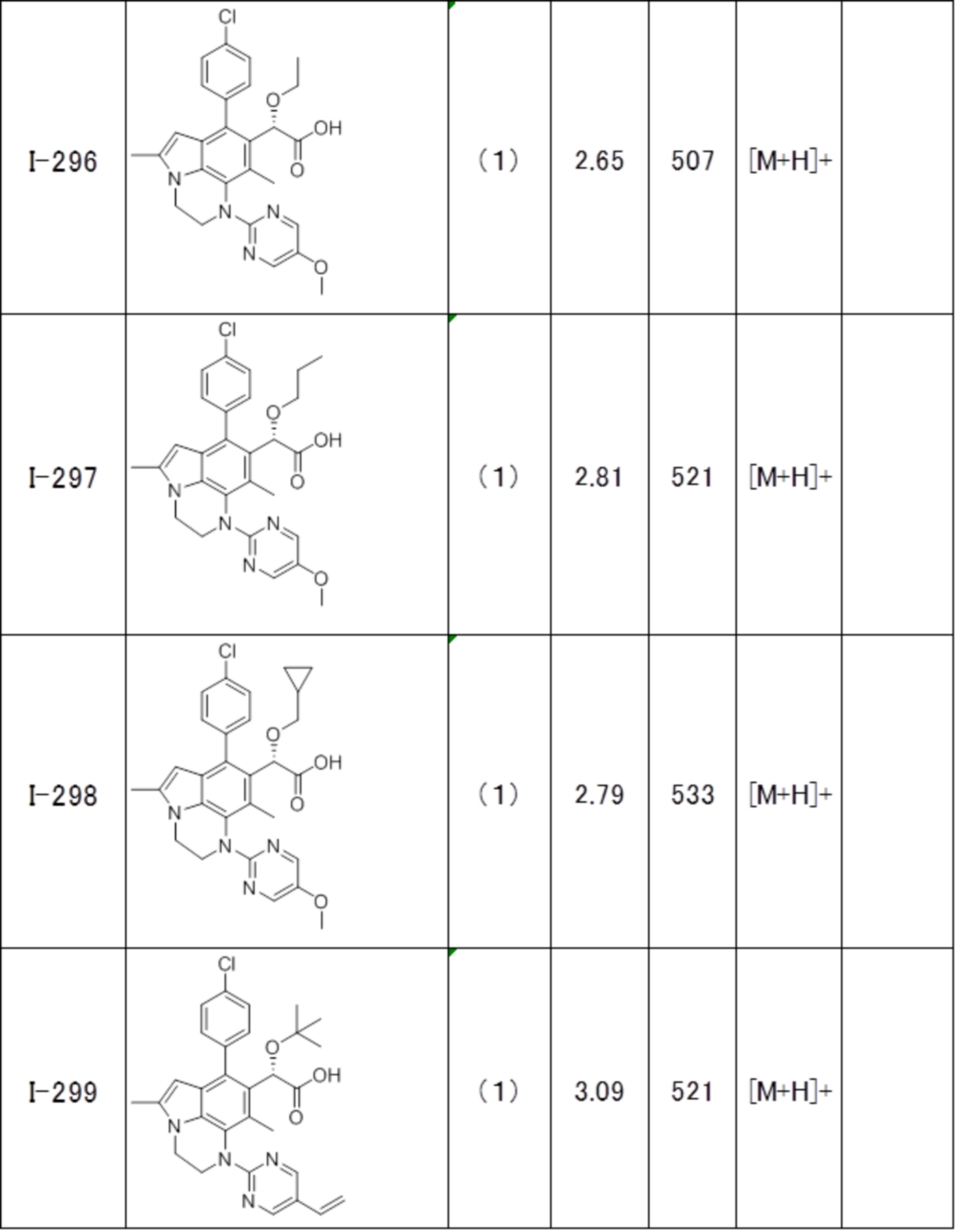
[0478]
[Таблица 52]
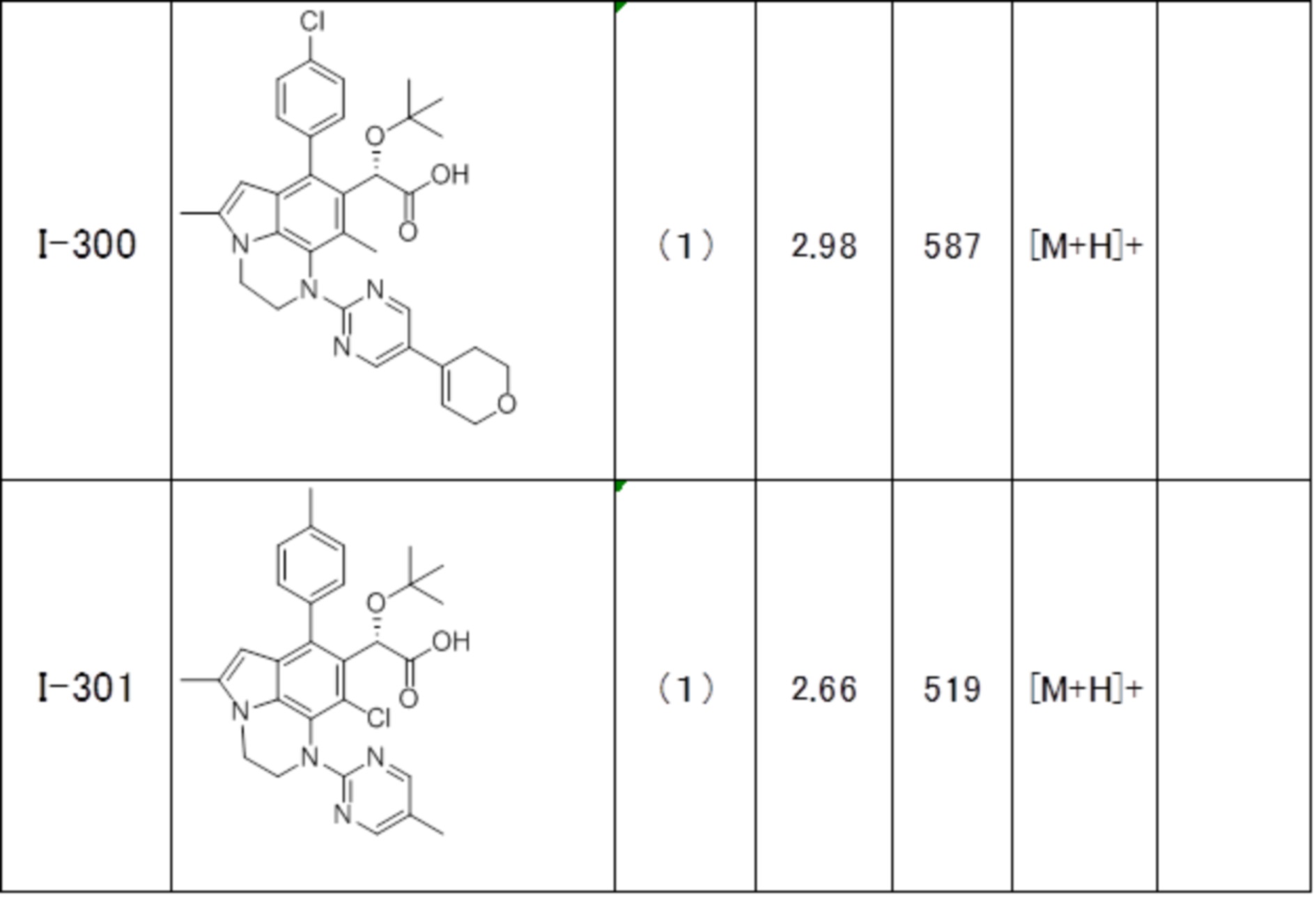
[0479]
[Таблица 53]
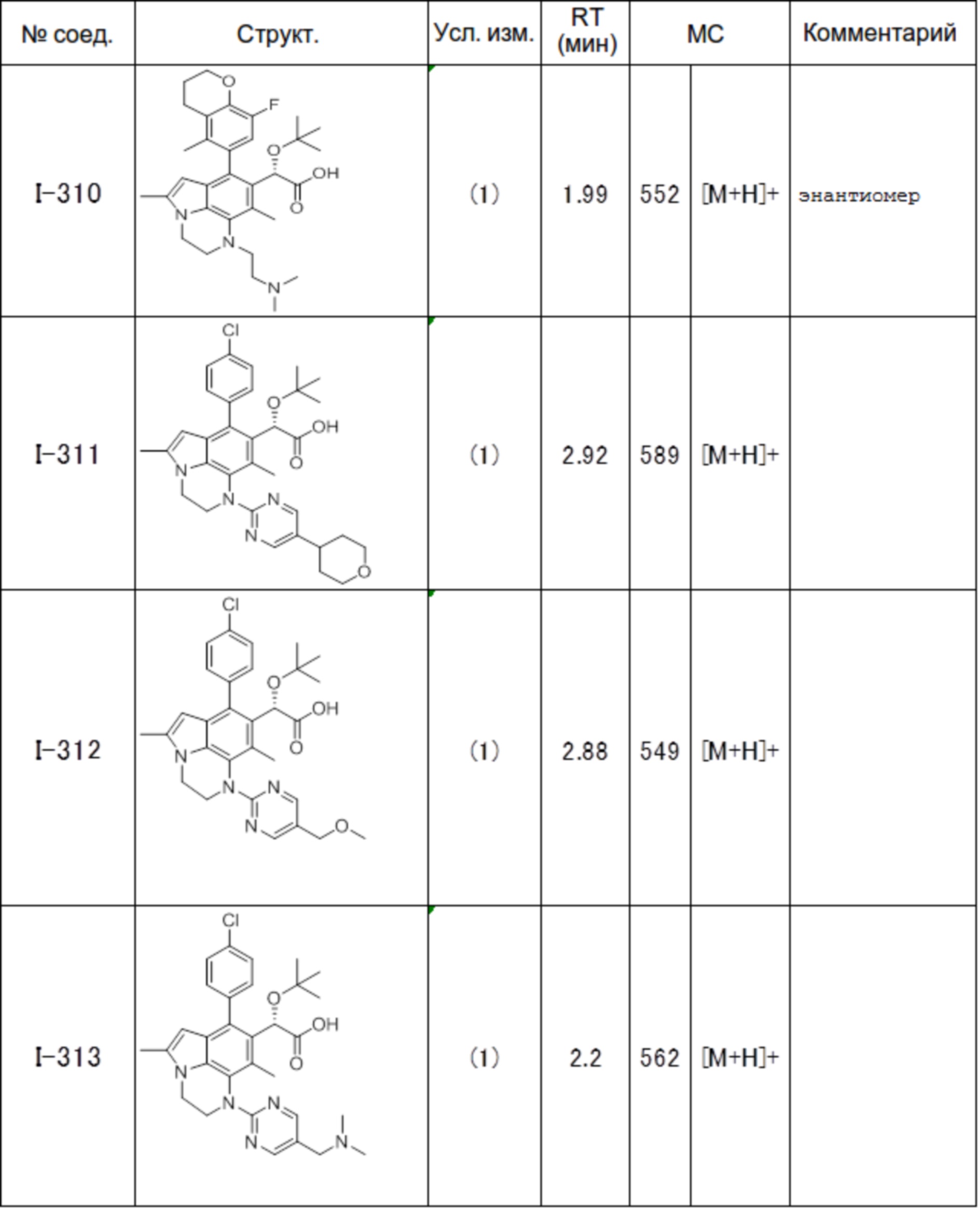
[0480]
[Таблица 54]

[0481]
[Таблица 55]

[0482]
[Таблица 56]

[0483]
[Таблица 57]

[0484]
[Таблица 58]

[0485]
[Таблица 59]

[0486]
[Таблица 60]

[0487]
[Таблица 61]
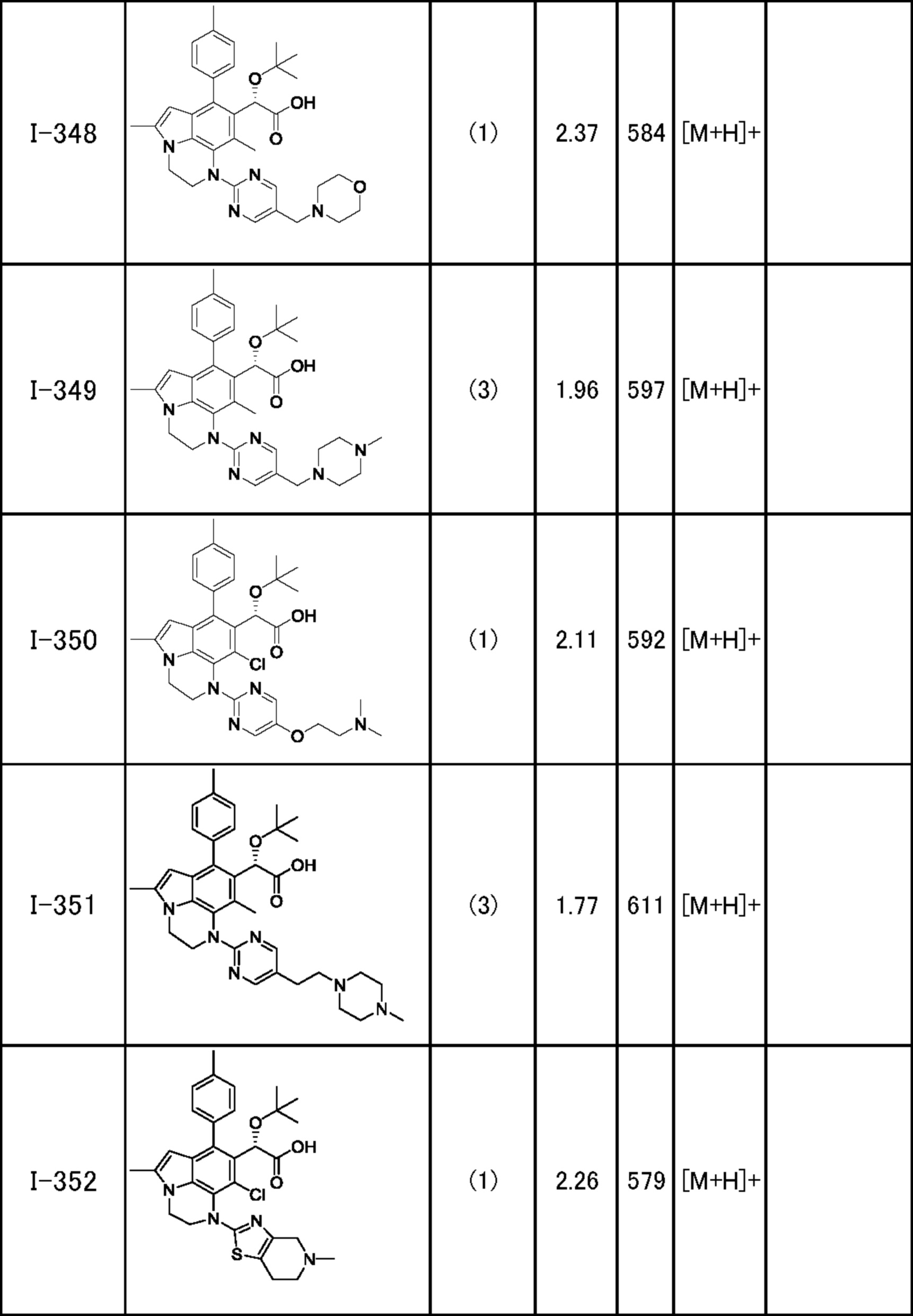
[0488]
[Таблица 62]
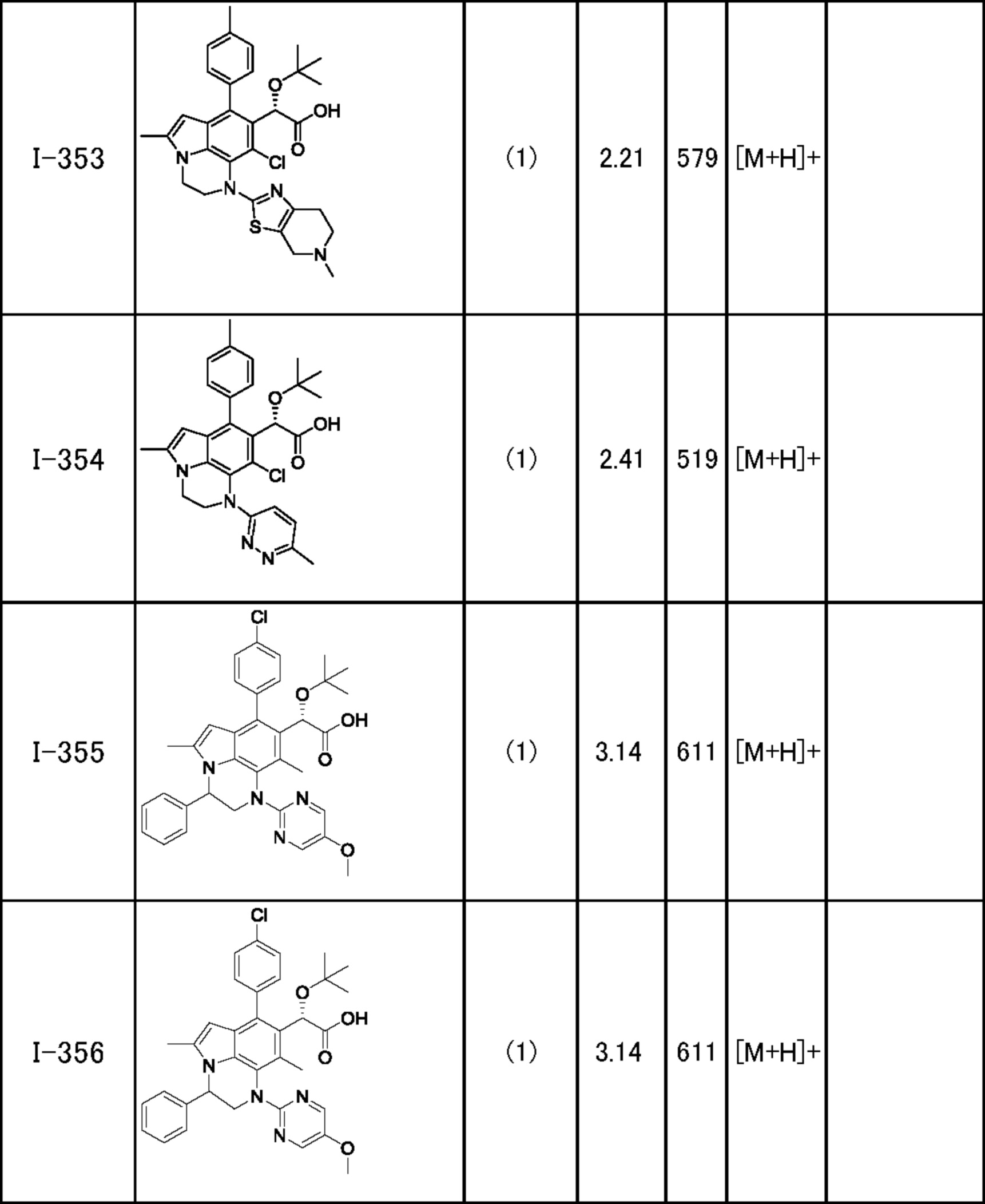
[0489]
Биологические анализы соединения настоящего изобретения описаны ниже.
[0490]
Тестовый пример 1: Анализ ингибирования репликации ВИЧ
Штамм Molt-4 clone8 человеческих T-клеток, персистентно инфицированных ВИЧ (штамм HTLV-IIIB), культивировали в среде RPMI-1640, дополненной 10% фетальной бычьей сывороткой, и супернатант фильтровали, затем измеряли титр вируса и хранили при -80°C. Каждое активное в отношении вируса иммунодефицита человека вещество разбавляли вышеуказанной культуральной средой до указанной концентрации, которую дозировали на 96-луночный микротитровальный планшет по 50 мкл. Затем по 100 мкл суспензии клеток MT-4 (2,5×104 клеток) дозировали в каждую лунку, затем туда добавляли по 50 мкл вышеуказанного ВИЧ-содержащего супернатанта, разведенного вышеуказанной культуральной средой (60 pfu (бляшкообразующих единиц)).
Смесь клеток культивировали при 37°C в инкубаторе с CO2 в течение четырех дней, затем по 30 мкл реагента MTT (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромида) (5 мг/мл в ФСБ) добавляли во все лунки с последующей инкубацией в течение 1 часа. На этом этапе MTT восстанавливался в живых клетках до нерастворимого формазана. Для извлечения генерируемого формазана по 150 мкл культурального супернатанта удаляли из всех лунок, затем туда добавляли по 150 мкл раствора для лизиса клеток (10% Triton X-100 и содержащий 0,4% (об./об.) HCl изопропанол) с последующим встряхиванием с помощью планшетного шейкера. Формазан измеряли с помощью микропланшет-ридера при OD 560 нм и 690 нм (опорная длина волны), и результаты сравнивали с контрольными лунками. EC50 и EC90 обозначают концентрации соединения, при которых цитотоксичность, вызванная вирусной инфекцией, ингибируется на 50% и 90%, соответственно.
[0491]
(Результат) Значения EC50 показаны ниже.
[Таблица 63]
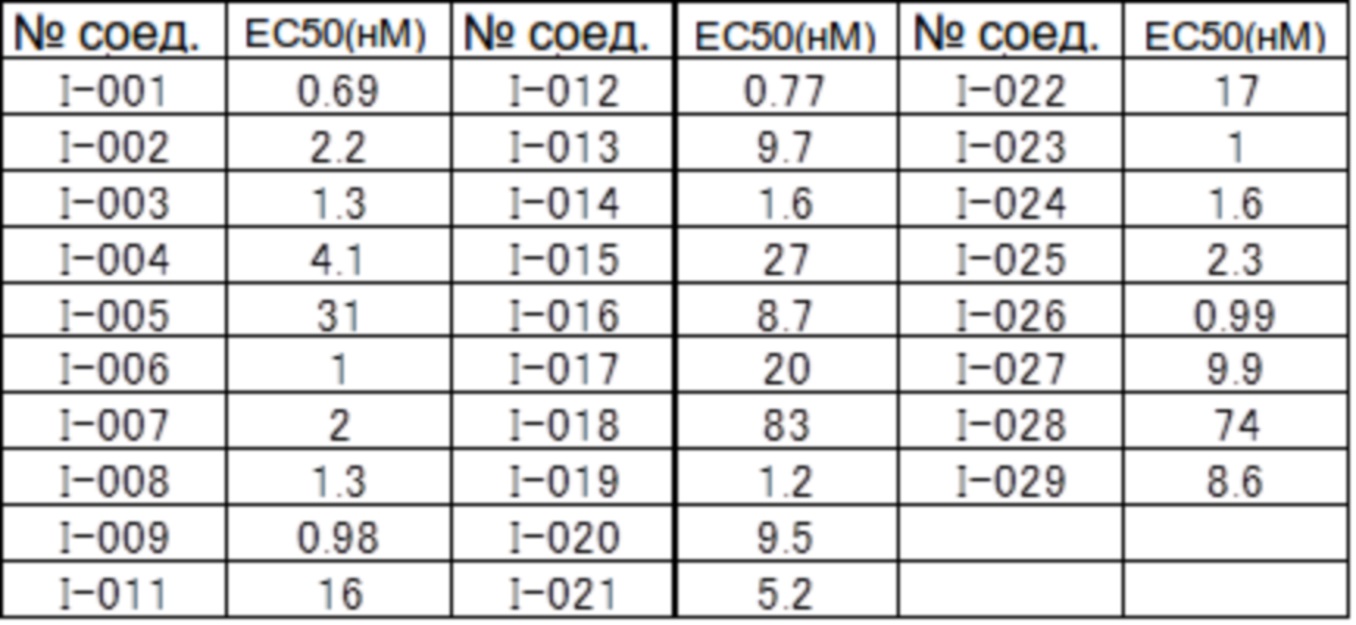
[Таблица 64]

[Таблица 65]

[Таблица 66]

[0492]
(Результат) Значения EC90 показаны ниже.
[Таблица 67]

[0493]
Тестовый пример 2: Анализ ингибирования репликации ВИЧ
Штамм Molt-4 clone8 человеческих T-клеток, персистентно инфицированных ВИЧ (штамм HTLV-IIIB), культивировали в среде RPMI-1640, дополненной 10% фетальной бычьей сывороткой, и супернатант фильтровали, затем измеряли титр вируса и хранили при -80°C. Полиморфные мутации наблюдаются у ВИЧ-1-инфицированных пациентов в аминокислотах 124 и 125 на гене ВИЧ-1 интегразы (IN). Точечную мутацию вводили в аминокислоты 124 и/или 125 гена IN рекомбинантного молекулярного клона ВИЧ-1 NL-432 для создания конструкции плазмиды мутантного вируса. Эти плазмиды мутантного вируса трансфицировали в клетки 293T, и через два дня супернатант фильтровали, и затем измеряли титр вируса и хранили при -80°C. Каждое активное в отношении ВИЧ вещество разбавляли культуральной средой, описанной выше, до указанной концентрации, которую дозировали на 96-луночный микротитровальный планшет по 50 мкл. Затем по 100 мкл суспензии клеток MT-4 (2,5×104 клеток) дозировали в каждую лунку, затем туда добавляли по 50 мкл ВИЧ-содержащего супернатанта, разведенного культуральной средой, описанной выше (60 pfu (бляшкообразующих единиц)).
Клетки культивировали при 37°C в инкубаторе с CO2 в течение четырех дней, затем по 30 мкл реагента MTT (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромида) (5 мг/мл в ФСБ) добавляли во все лунки с последующей инкубацией в течение 1 часа. На этом этапе MTT восстанавливался в живых клетках до нерастворимого формазана. Для извлечения генерируемого формазана по 150 мкл культурального супернатанта удаляли из всех лунок, затем туда добавляли по 150 мкл раствора для лизиса клеток (10% Triton X-100 и содержащий 0,4% (об/об) HCl изопропанол) с последующим встряхиванием с помощью планшетного шейкера. Формазан измеряли с помощью микропланшет-ридера при OD: 560 нм и 690 нм (опорная длина волны), и результаты сравнивали с контрольными лунками. EC50 обозначает концентрацию соединения, при которой цитотоксичность, вызванная вирусной инфекцией, ингибируется на 50%.
(Результат) Значения EC50 по отношению к вирусу с мутацией T125A около 125 аминокислоты показаны ниже.
[Таблица 68]

[Таблица 69]
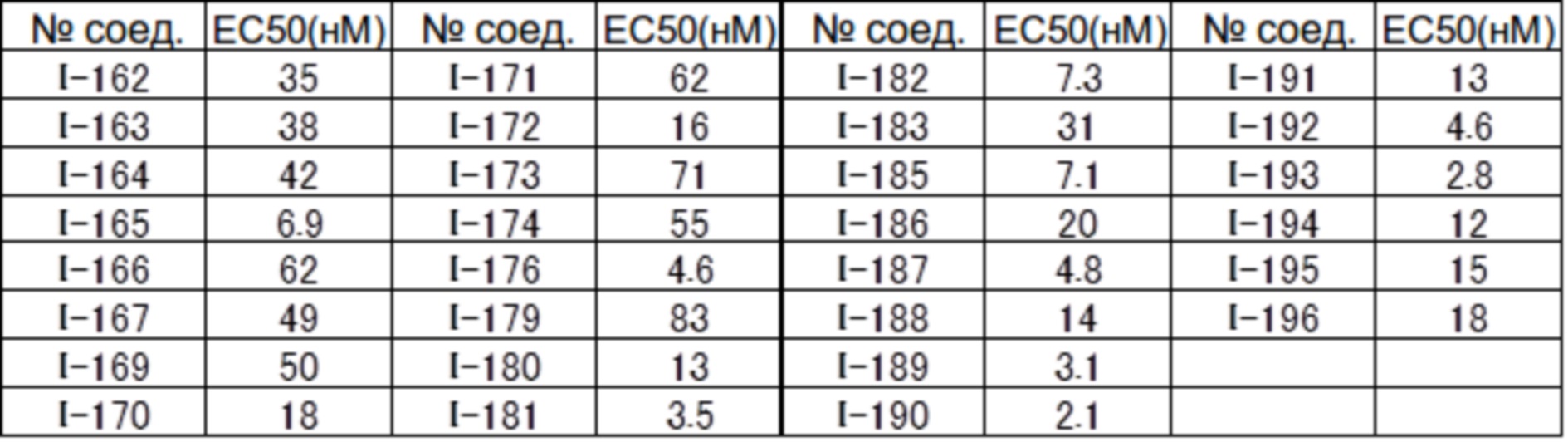
[Таблица 70]
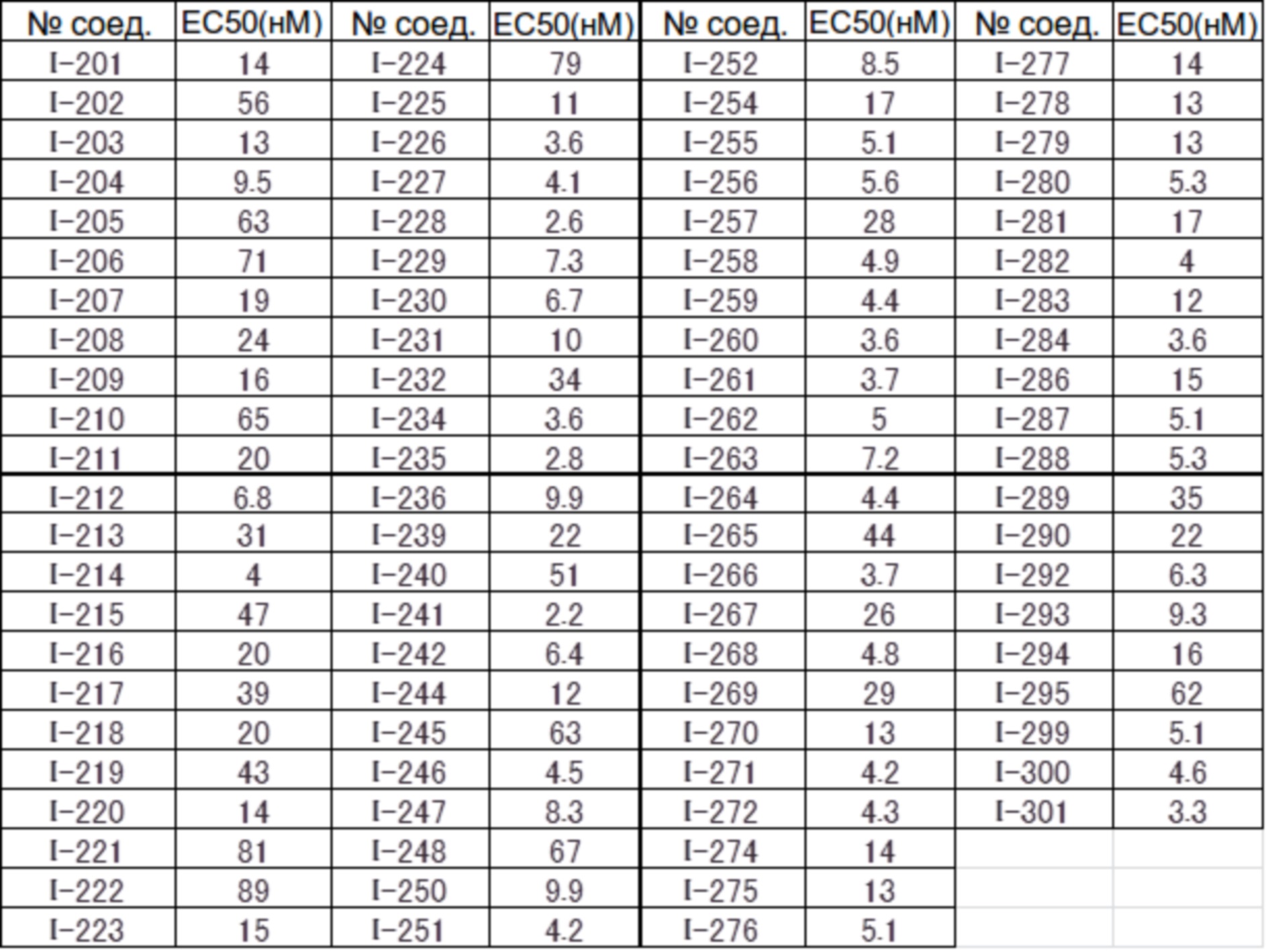
[Таблица 71]
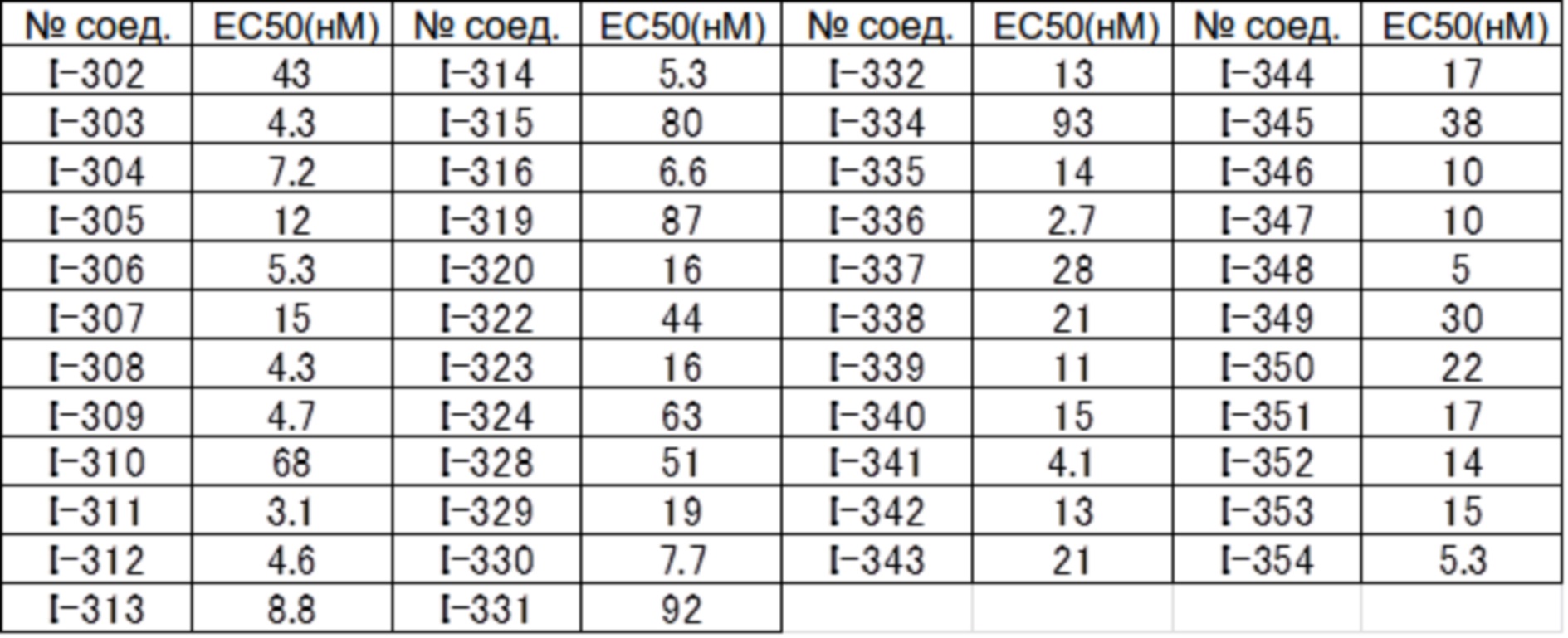
[0494]
Тестовый пример 3: Вычисление значения сдвига активности
Для подтверждения влияния человеческой сыворотки на активность против ВИЧ при необходимости добавляли человеческую сыворотку и определяли EC50 в этих условиях. Человеческую сыворотку (100 мкл на лунку) дозировали в каждое активное в отношении ВИЧ вещество, заранее дозированное в указанной концентрации по 50 мкл каждое на 96-луночный микротитровальный планшет, и планшет инкубировали при комнатной температуре в течение 1 часа. Для свободного от сыворотки планшета на 96-луночный микротитровальный планшет дозировали только культуральную среду (100 мкл на лунку). Клетки MT-4 (3×104 клеток на лунку) инфицировали раствором ВИЧ, разведенным до соответствующей концентрации (600 pfu на 50 мкл), по 3 мкл на лунку в требуемое число лунок и инкубировали при 37°C в течение 1 часа. Инфицированные клетки центрифугировали при 1200 об/мин в течение 5 минут, супернатант удаляли, и инфицированные клетки диспергировали в культуральную среду в необходимое количество лунок по 50 мкл на лунку. Суспензию инфицированных клеток дозировали на 96-луночный микротитровальный планшет, на котором заранее были подготовлены активное в отношении ВИЧ вещество и человеческая сыворотка. Смесь клеток смешивали с помощью планшетного шейкера и культивировали в инкубаторе с CO2 в течение 4 дней. EC50 в присутствии человеческой сыворотки рассчитывали аналогично тестовому примеру 1, и отношение EC50 в присутствии человеческой сыворотки и EC50 в отсутствие человеческой сыворотки рассчитывали в качестве значения сдвига активности. (Результат) Значение сдвига активности EC50 во время добавления 25% человеческой сыворотка приведено ниже.
[Таблица 72]

[Таблица 73]
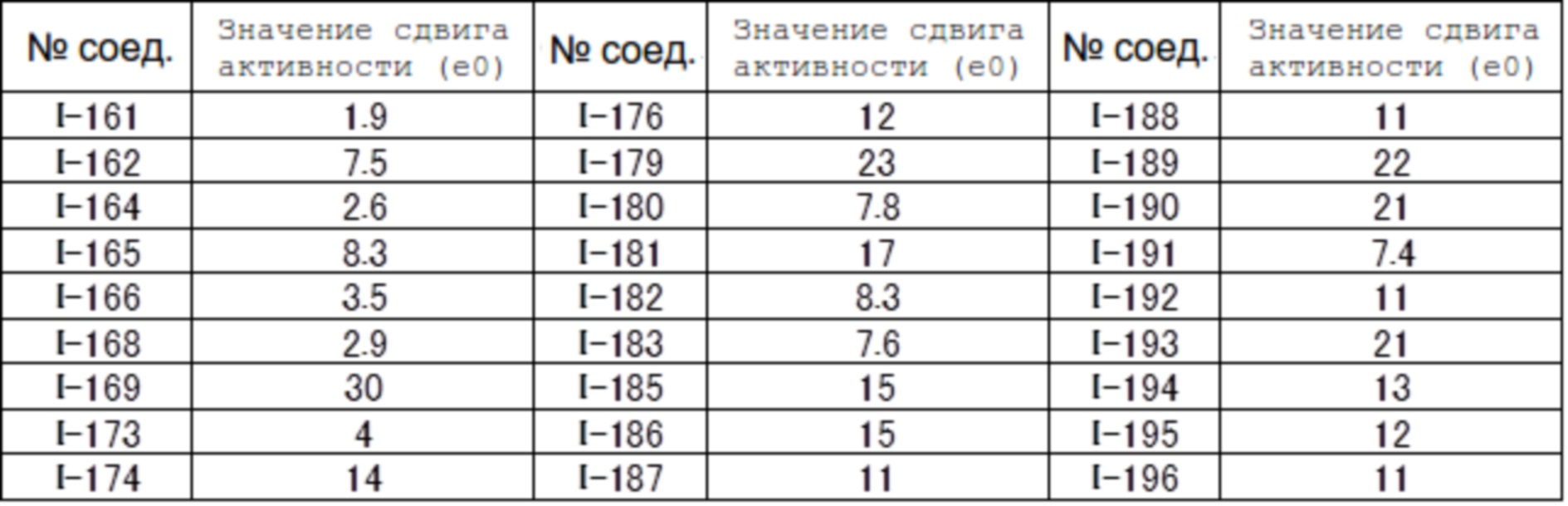
[Таблица 74]

[Таблица 75]

[Таблица 76]

В человеческой плазме соединение связывается с белками сыворотки, количество свободного активного соединения в плазме снижается, и противовирусная активность может снижаться. В области ВИЧ известно, что, если остаточная концентрация в плазме превышает значение PA-EC90 (EC90 с поправкой на белок), можно будет получить клиническую эффективность. Для того чтобы более точно предсказать клиническую противовирусную активность, PA-EC50 и/или PA-EC90 в присутствии 100% человеческой сыворотки экстраполировали по следующей формуле с использованием рассчитанного значения сдвига активности в присутствии 25% человеческой сыворотки.
PA-EC50=EC50×(сдвиг активности значение в присутствии 25% человеческой сыворотки)×4
PA-EC90=EC90×(сдвиг активности значение в присутствии 25% человеческой сыворотки)×4
В результате соединение настоящего изобретения продемонстрировало предпочтительные значение PA-EC50 и/или значение PA-EC90.
[0495]
Тестовый пример 4: Анализ ингибирования CYP
Используя коммерчески доступные объединенные микросомы печени человека и используя в качестве маркеров O-деэтилирование 7-этоксирезоруфина (CYP1A2), метилгидроксилирование толбутамида (CYP2C9), 4'-гидроксилирование мефенитоина (CYP2C19), O-деметилирование декстрометорфана (CYP2D6) и гидроксилирование терфенадина (CYP3A4) как реакции метаболизма типичных субстратов пяти основных форм ферментов CYP человека (CYP1A2, 2C9, 2C19, 2D6, 3A4), определяли степень ингибирования величины производства каждого метаболита тестируемым соединением.
Условия реакции были следующими: субстрат, этоксирезоруфин 0,5 мкмоль/л (CYP1A2), толбутамид 100 мкмоль/л (CYP2C9), S-мефенитоин 50 мкмоль/л (CYP2C19), декстрометорфан 5 мкмоль/л (CYP2D6), терфенадин 1 мкмоль/л (CYP3A4); продолжительность реакции, 15 минут; температура реакции, 37°C; фермент, объединенные микросомы печени человека, 0,2 мг белка на мл; концентрация тестируемого препарата, 1, 5, 10, 20 мкмоль/л (четыре точки).
Каждый из пяти видов субстратов, микросомы печени человека и тестируемый препарат в буфере Hepes 50 ммоль/л добавляли в качестве реакционного раствора на 96-луночный планшет в виде композиции, описанной выше, в качестве кофермента для инициирования в качестве маркеров реакций метаболизма добавляли NADPH, и, после инкубации при 37°C в течение 15 минут, добавляли раствор метанол/ацетонитрил=1/1 (об./об.) для остановки реакции. После центрифугирования при 3000 об/мин в течение 15 минут количество резоруфина (метаболит CYP1A2) в супернатанте определяли с помощью флуоресцентного многоканального счетчика, а количество гидроксида толбутамида (метаболит CYP2C9), 4'-гидроксида мефенитоина (метаболит CYP2C19), декстрорфана (метаболит CYP2D6) и терфенадинового спирта (метаболит CYP3A4) определяли с помощью ЖХ/МС/МС.
Реакционную систему, содержащую только DMSO, который представляет собой растворитель для растворения препарата, принимали в качестве контроля (100%), и рассчитывали остаточную активность (%), затем рассчитывали IC50 путем обратного предположения с помощью логистической модели с использованием концентрации и уровня ингибирования.
(Результат)
Результатом тестирования ингибирования CYP2C9 является то, что каждое соединение из I-026, I-027, I-041, I-043, I-048, I-112, I-122, I-156, I-157, I-164, I-181, I-189, I-190, I-197, I-220, I-244, I-257, I-258, I-260, I-262, I-267, I-270, I-278, I-292, I-293, I-303, I-304, I-305, I-306, I-307, I-308 и I-309 имело IC50 > 20 мкМ.
[0496]
Тестовый пример 5: Флуоресцентный тест на MBI CYP3A4
Флуоресцентный тест на MBI CYP3A4 предназначен для исследования усиления ингибирования CYP3A4 соединением по метаболической реакции. 7-Бензилокситрифторметилкумарин (7-BFC) дебензилируется ферментом CYP3A4 с получением 7-гидрокситрифторметилкумарина (HFC), метаболита, испускающего флуоресцентный свет. Тест проводили с использованием реакции получения 7-HFC в качестве эталона.
Условия реакции были следующими: субстрат, 7-BFC 5,6 мкмоль/л; продолжительность предварительной реакции, 0 или 30 минут; продолжительность реакции, 15 минут; температура реакции, 25°C (комнатная температура); содержание CYP3A4 (экспрессируемого в Eschericha coli), при предварительной реакции 62,5 пмоль/мл, при реакции 6,25 пмоль/мл (при 10-кратном разведении); концентрация тестируемого препарата, 0,625, 1,25, 2,5, 5, 10, 20 мкмоль/л (шесть точек).
Фермент в буфере K-Pi (pH 7,4) и раствор тестируемого препарата в качестве раствора для предварительной реакции добавляли на 96-луночный планшет таким образом, что получали его разведение 1/10 субстратом в буфере K-Pi, добавляли NADPH как кофактор для инициирования реакции в качестве эталона (без предварительной инкубации), и после предварительно определенной продолжительности реакции добавляли ацетонитрил/Tris (тригидроксиаминометан) 0,5 моль/л=4/1 (об/об) для остановки реакции. Кроме того, NADPH добавляли к остальному раствору для предварительной инкубации для инициирования предварительной инкубации (с предварительной инкубацией), и после предварительно определенного времени предварительной инкубации часть переносили на другой планшет таким образом, что получали его разведение 1/10 субстратом и буфером K-Pi для инициирования реакции в качестве эталона. После предварительно определенной продолжительности реакции добавляли ацетонитрил/Tris (тригидроксиаминометан) 0,5 моль/л=4/1 для остановки реакции. Для планшета, на котором были проведены все эталонные реакции, значение флуоресценции 7-HFC, который является метаболитом, измеряли с помощью флуоресцентного планшет-ридера. (Ex=420 нм, Em=535 нм)
Добавление к реакционной системе только DMSO, который представляет собой растворитель, растворяющий препарат, принимали в качестве контроля (100%), рассчитывали остаточную активность (%) при каждой концентрации тестируемого препарата, добавленной в качестве раствора, и рассчитывали IC50 путем обратного предположения с помощью логистической модели с использованием концентрации и уровня ингибирования. Случай, когда разность значений IC50 составляла 5 мкмоль/л или больше, определяли как (+), а случай, когда эта разность составляла 3 мкмоль/л или меньше, определяли как (-).
В результате соединения настоящего изобретения продемонстрировали хорошие результаты.
[0497]
Тестовый пример 6: Тест на MBI CYP3A4 (MDZ)
Тест на MBI CYP3A4 (MDZ) представляет собой тест для исследования способности соединения к необратимому ингибированию (MBI) CYP3A4 по усилению метаболической реакции. Ингибирование CYP3A4 оценивали с использованием реакции 1-гидроксилирования мидазолама (MDZ) объединенными микросомами печени человека в качестве эталона.
Условия реакции являются следующими: субстрат, MDZ 10 мкмоль/л; продолжительность предварительной реакции, 0 или 30 минут; продолжительность реакции субстрата, 2 минуты; температура реакции, 37°C; содержание белка в объединенных микросомах печени человека, во время предварительной реакции 0,5 мг/мл, во время реакции 0,05 мг/мл (при 10-кратном разведении); концентрации соединения настоящего изобретения, 1, 5, 10, 20 мкмоль/л (четыре точки).
Объединенные микросомы печени человека в буфере K-Pi (pH 7,4) и раствор соединения настоящего изобретения в качестве раствора для предварительной реакции добавляли на 96-луночный планшет в композиции предварительной реакции. Часть раствора для предварительной реакции переносили на другой 96-луночный планшет и разводили 1/10 субстратом в буфере K-Pi, добавляли NADPH в качестве кофактора, для того чтобы инициировать реакцию в качестве эталона (без предварительной инкубации). После предварительно определенной продолжительности реакции добавляли раствор метанол/ацетонитрил=1/1 (об./об.), для того чтобы остановить реакцию. С другой стороны, NADPH также добавляли к остальному раствору для предварительной реакции, для того чтобы инициировать предварительную инкубацию (с предварительной инкубацией). После предварительно определенного времени предварительной инкубации часть переносили на другой 96-луночный планшет и разводили 1/10 субстратом в буфере K-Pi, для того чтобы инициировать реакцию в качестве эталона. После предварительно определенной продолжительности реакции добавляли раствор метанол/ацетонитрил=1/1 (об./об.), для того чтобы остановить реакцию. После центрифугирования при 3000 об/мин в течение 15 минут определяли количество 1-гидроксимидазолама в супернатанте с помощью ЖХ/МС/МС.
Образец с добавлением к реакционной системе DMSO вместо раствора соединения настоящего изобретения принимали в качестве контроля (100%), поскольку DMSO использовали в качестве растворителя для растворения соединения настоящего изобретения. Остаточную активность (%) рассчитывали при каждой концентрации соединения настоящего изобретения, добавленной в качестве раствора, и значение IC рассчитывали путем обратного предположения с помощью логистической модели с использованием концентрации и уровня ингибирования. Сдвиг значения IC рассчитывали как "IC предварительной инкубации в 0 мин/IC предварительной инкубации в 30 мин". Когда сдвиг IC составлял 1,5 или больше, это определяли как положительный результат. Когда сдвиг IC составлял 1,0 или меньше, это определяли как отрицательный результат.
(Результат)
Соединения I-003, I-019, I-027, I-041, I-043, I-122, I-156, I-157, I-164, I-176, I-181, I-187, I-189, I-190, I-220, I-244, I-257, I-258, I-260, I-262, I-267, I-270, I-278, I-292, I-293, I-303, I-304, I-305, I-306, I-307, I-308 и I-309 оказались (-).
[0498]
Тестовый пример 7: Тест на метаболическую стабильность
Коммерчески доступные объединенные микросомы печени человека и тестируемое соединение вводили в реакцию на постоянное время, затем рассчитывали остаточный уровень с помощью сравнения прореагировавшего образца и непрореагировавшего образца, тем самым оценивая степень метаболизма тестируемого соединения в печени.
Реакцию (окислительную реакцию) проводили при 37°C в течение 0 минут или 30 минут в присутствии NADPH 1 ммоль/л в 0,2 мл буфера (Tris-HCl 50 ммоль/л, pH 7,4, хлорид калия 150 ммоль/л, хлорид магния 10 ммоль/л), содержащего 0,5 мг белка на мл микросом печени человека. После реакции 50 мкл реакционного раствора добавляли к 100 мкл метанола/ацетонитрила=1/1 (об./об.), смешивали и центрифугировали при 3000 об/мин в течение 15 минут. Тестируемое соединение в супернатанте определяли количественно с помощью ЖХ/МС/МС, и рассчитывали остаточное количество тестируемого соединения после реакции, принимая количество соединения при продолжительности реакции 0 минут за 100%. Реакцию гидролиза проводили в отсутствие NADPH, а реакция глюкуронирования шла в присутствии UDP-глюкуроновой кислоты 5 мМ вместо NADPH, за чем следовали аналогичные операции.
В результате соединения настоящего изобретения продемонстрировали хорошую метаболическую стабильность.
[0499]
Тестовый пример 8: Тест на растворимость
Растворимость соединения настоящего изобретения определяли в условиях добавления 1% DMSO. Раствор 10 ммоль/л соединения готовили с DMSO, и 6 мкл этого раствора добавляли к 594 мкл искусственного кишечного сока (воду и 118 мл раствора реагента NaOH 0,2 моль/л добавляли к 250 мл реагента дигидрофосфата калия 0,2 моль/л для получения 1000 мл) с pH 6,8. Смесь оставляли на 16 часов при 25°C, и смесь фильтровали под вакуумом. Фильтрат дважды разбавляли метанолом/водой=1/1(об./об.), и концентрацию соединения в фильтрате измеряли с помощью ВЭЖХ или ЖХ/МС/МС методом абсолютной калибровки.
В результате соединения настоящего изобретения продемонстрировали хорошую растворимость.
[0500]
Тестовый пример 9: Флуктуационный тест Эймса
Оценивали мутагенность соединения настоящего изобретения.
20 мкл хранившихся в замороженном виде крысиных тифозных бацилл (Salmonella typhimurium, штамм TA98, штамм TA100) инокулировали на 10 мл жидкой питательной среды (2,5% питательный бульон №2 Oxoid), и культивировали их до встряхивания при 37°C в течение 10 часов. 9 мл раствора бактерий штамма TA98 центрифугировали (2000 g, 10 минут) для удаления культурального раствора. Бактерии суспендировали в буфере F (K2HPO4: 3,5 г/л, KH2PO4: 1 г/л, (NH4)2SO4: 1 г/л, цитрата тринатрия дигидрат: 0,25 г/л, MgSO4 7H2O: 0,1 г/л), и суспензию добавляли к 110 мл среды Exposure (буфер Micro F, содержащий биотин: 8 мкг/мл, гистидин: 0,2 мкг/мл, глюкозу: 8 мг/мл). Штамм TA100 добавляли к 120 мл среды Exposure на 3,16 мл раствора бактерий для получения тестового раствора бактерий. Каждые 12 мкл раствора тестируемого вещества в DMSO (несколько стадий разведения от максимальной дозы 50 мг/мл в 2-3-кратном отношении), DMSO в качестве отрицательного контроля, раствор 50 мкг/мл 4-нитрохинолин-1-оксида в DMSO для штамма TA98, раствор 0,25 мкг/мл 2-(2-фурил)-3-(5-нитро-2-фурил)акриламида в DMSO для штамма TA100, оба в условиях, не активирующих метаболизм, раствор 40 мкг/мл 2-аминоантрацена в DMSO для штамма TA98, раствор 20 мкг/мл 2-аминоантрацена в DMSO для штамма TA100, оба в метаболических условиях, все в качестве положительного контроля, смешивали с 588 мкл тестового раствора бактерий (смешанный раствор 498 мкл тестового раствора бактерий и 90 мкл смеси S9 в условиях активации метаболизма), и культивировали при встряхивании при 37°C в течение 90 минут. 460 мкл раствора бактерий, на который воздействовало тестируемое вещество, смешивали с 2300 мкл среды Indicator (буфер Micro F, содержащий биотин: 8 мкг/мл, гистидин: 0,2 мкг/мл, глюкозу: 8 мг/мл, бромкрезоловый фиолетовый: 37,5 мкг/мл), каждые 50 мкл дозировали на микропланшет 48 лунок на дозу, и подвергали стационарному культивированию при 37°C в течение 3 дней. Поскольку лунка, содержащая бактерии, которые получили способность к пролиферации посредством мутации гена фермента, синтезирующего аминокислоту (гистидин), изменяла цвет с фиолетового на желтый из-за изменения pH, то подсчитывали лунки с пролиферацией бактерий, которые изменили цвет на желтый в 48 лунках на дозу, и проводили оценку путем сравнения с группой отрицательного контроля. (-) обозначает, что мутагенность является отрицательной, а (+) что является положительной.
В результате соединения настоящего изобретения не продемонстрировали мутагенность.
[0501]
Тестовый пример 10: Тест BA
Материалы и способы для исследования оральной абсорбции
(1) Животные: использовали мышей или крыс SD.
(2) Условия размножения: мышам или крысам SD позволяли свободно принимать твердый корм и стерилизованную водопроводную воду.
(3) Доза и группировка: вводили перорально или внутривенно в предварительно определенной дозе; группировка была следующей (доза зависит от соединения)
Пероральное введение: 1-30 мг/кг (n=2-3)
Внутривенное введение: 0,5-10 мг/кг (n=2-3)
(4) Приготовление раствора для дозировки: для перорального введения в состоянии раствора или суспензии; для внутривенного введения в солюбилизированном состоянии.
(5) Способ введения: при пероральном введении принудительно вводят в желудочек с помощью орального зонда; при внутривенном введении вводят из хвостовой вены с помощью шприца, снабженного иглой.
(6) Элементы оценки: кровь собирали с течением времени, и концентрацию препарата в плазме измеряли с помощью ЖХ/МС/МС.
(7) Статистический анализ: в отношении изменения концентрации в плазме площадь под кривой зависимости концентрации в плазме от времени (AUC) рассчитывали с помощью программы для нелинейного метода наименьших квадратов WinNonlin (зарегистрированный товарный знак), и биодоступность (BA) рассчитывали по AUC группы перорального введения и группы внутривенного введения.
В результате соединения настоящего изобретения продемонстрировали хорошую BA.
[0502]
Экспериментальный пример 11: Тест hERG
С целью оценки риска удлинения интервала QT на электрокардиограмме исследовали воздействие соединения настоящего изобретения на ток K+ задержанного выпрямления (IKr), который играет важную роль в процессе реполяризации желудочков, с использованием клеток HEK293, экспрессирующих канал человеческого гена специфических калиевых каналов сердца (hERG).
После удерживания мембранного потенциала клетки на -80 мВ с использованием пэтч-кламп метода в конфигурации "целая клетка" с использованием автоматической пэтч-кламп системы (PatchXpress 7000A, Axon Instruments Inc.) регистрировали IKr, индуцированный импульсной стимуляцией деполяризации при +40 мВ в течение 2 секунд, а затем импульсной стимуляции реполяризации при -50 мВ в течение 2 секунд. После стабилизации генерируемого тока внеклеточный раствор (NaCl: 135 ммоль/л, KCl: 5,4 ммоль/л, NaH2PO4: 0,3 ммоль/л, CaCl2・2H2O: 1,8 ммоль/л, MgCl2・6H2O: 1 ммоль/л, глюкоза: 10 ммоль/л, HEPES (4-(2-гидроксиэтил)-1- пиперазинэтансульфоновая кислота, 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота): 10 ммоль/л, pH=7,4), в котором тестируемое соединение было растворено в целевой концентрации, наносили на клетку в условиях комнатной температуры в течение 10 минут. По регистрации IKr измеряли абсолютное значение пикового следового тока на основании значения тока при мембранном потенциале покоя с использованием программного обеспечения для анализа (DataXpress ver.1, Molecular Devices Corporation). Затем рассчитывали ингибирование по отношению к пиковому следовому току до нанесения тестируемого вещества, и сравнивали его с группой нанесения носителя (0,1% раствора диметилсульфоксида) для оценки влияния тестируемого вещества на IKr.
В результате риск удлинения интервала QT на электрокардиограмме из-за соединений настоящего изобретения оказался низким.
[0503]
Тестовый пример 12: Тест растворимости порошка
Соответствующие количества тестируемых веществ помещают в соответствующие контейнеры. К соответствующим контейнерам добавляют по 200 мкл жидкости JP-1 (хлорид натрия 2,0 г, соляная кислота 7,0 мл и вода до 1000 мл), 200 мкл жидкости JP-2 (фосфатный буфер (pH 6,8) 500 мл и вода 500 мл) и 200 мкл TCA (таурохолат натрия) 20 ммоль/л и жидкости JP-2 (TCA 1,08 г и жидкость JP-2 до 100 мкл). В случае растворения всего количества тестируемого соединения после добавления тестовой жидкости тестируемое соединение добавляют по мере необходимости. Контейнеры закупоривают и встряхивают в течение 1 часа при 37°C. Смеси фильтруют, и по 100 мкл метанола добавляют к каждому из фильтратов (100 мкл) таким образом, что фильтраты становятся разбавленными в два раза. Если необходимо, отношение разбавления может быть изменено. В разбавлениях наблюдают за пузырьками и осадками, и затем контейнеры закупоривают и встряхивают. Количественную оценку проводят с помощью ВЭЖХ методом абсолютной калибровки.
В результате соединения настоящего изобретения продемонстрировали хорошую растворимость.
[0504]
Тестовый пример 13: Тест на фотогемолиз
Аликвоты суспензии красных кровяных телец (RBC) овцы, приготовленные со средой для достижения концентрации 2,5% об./об., дозировали на микропланшеты. Соединение настоящего изобретения растворяли с носителем для получения целевых концентраций, и затем эти растворы немедленно добавляли (в концентрации от 0,0008 до 0,1% вес./об.) на микропланшеты. Смеси на микропланшетах подвергали воздействию УФ облучения до 10 Дж/см2 (УФ-A и УФ-B, 290-400 нм) с помощью лампы GL20SE (SANKYO DENKI) и лампы FL20S-BLB (Panasonic). После УФ облучения смеси центрифугировали. Аликвоты супернатанта переносили на микропланшет. Поглощение супернатантов измеряли при 540 нм и 630 нм для оценки возможной фототоксичности. В данном исследовании были оценены две конечные точки, повреждение биомембраны (% от фотогемолитического индекса; PI) и гипероксидацию липидной мембраны (образование метгемоглобина; met-Hb), по поглощению при 540 нм и 630 нм, соответственно. PI и met-Hb оценивали по отрицательным критериям (-), PI<10% и изменение поглощения на 630 нм <0,05, соответственно. Все остальные результаты оценивали как положительные (+).
(Результат)
Соединения I-001, I-003, I-012, I-027, I-041, I-043, I-048, I-085, I-112, I-122, I-156, I-164, I-176, I-181, I-189, I-190, I-197, I-220, I-244, I-257, I-258, I-260, I-262, I-267, I-270, I-278, I-292, I-293, I-303, I-304, I-305, I-306, I-307, I-308 и I-309 оказались (-).
[0505]
Тестовый пример 14: Исследование выделения резистентных вирусов
Определенную концентрацию соединения настоящего изобретения, возможно в комбинации с несколькими препаратами, добавляют к культуральной среде ВИЧ-инфицированных клеток и непрерывно культивируют в присутствии препарата. Клетки или культуральный супернатант периодически собирают, и определяют мутацию на вирусном геноме по сравнению с исходной последовательностью.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0506]
Соединение настоящего изобретения полезно в качестве лекарственного средства, используемого в качестве терапевтического или профилактического средства при вирусном инфекционном заболевании, таком как СПИД, или его промежуточного продукта.