Результат интеллектуальной деятельности: Способ получения антигена вируса Зика, обладающего иммуногенными и антигенными свойствами
Вид РИД
Изобретение
Изобретение относится к вирусологии и биотехнологии, в частности к способу получения инактивированного, концентрированного и очищенного антигена вируса Зика (ZIKV) с сохранением биологически важных эпитопов структурного гликопротеина оболочки вириона (белка Е), вызывающих синтез нейтрализующих антител при иммунизации мышей линии Balb/c. Антиген ZIKV может быть использован:
- в качестве иммуногена в составе профилактической вакцины;
- в качестве антигена в клинической практике при разработке серологических тест-систем для выявления иммуноглобулинов классов IgM и IgG, специфичных к вирусу Зика, в сыворотках крови пациентов;
- в качестве иммуногена для иммунизации мышей линии Balb/c при получении препаратов гибридомных моноклональных антител, обычно используемых при разработке иммуноферментных тест-систем в формате «сэндвич» для выявления антигенов (вирусных маркеров);
- в качестве положительного контроля в тест-системах формата «сэндвич» для выявления антигенов (вирусных маркеров).
Вирус Зика (Zika virus, ZIKV), относящийся к роду Flavivirus семейства Flaviviridae, известный науке с середины XX века как африканский зооноз, арбовирус (т.е. передаваемый кровососущими членистоногими) и не опасный для людей, в течение 2015-2016 гг. вызвал эпидемию лихорадки Зика (ЛЗ) в 32-х странах Северной, Центральной и Южной Америки, Карибского и Тихоокеанского регионов. В феврале 2016 г. ВОЗ объявила чрезвычайную ситуацию по ЛЗ в области международного общественного здравоохранения. Это связано с широким распространением ZIKV на ранее не эндемичные для него географические зоны и предполагаемой ролью в развитии внутриутробной микроцефалии (http://www.who.int/emergencies/zika-virus/timeline-update/ru). В природе естественный цикл передачи ZIKV происходит трансмиссивным путем между комарами рода Aedes (виды Ае. africanus, Ае. aegypti и др.) и обезьянами, в то время как человек является случайным хозяином (Hayes Е.В. Zika virus outside Africa. / Emerg Infect Dis. 2009; 15(9): 1347-50. doi: 10.3201/eid1509.090442).
Врожденный синдром Зика (congenital Zika syndrome, CZS) характеризуется мертворождением либо выкидышем, а выжившие младенцы рождаются с аномалиями головного мозга (микроцефалией), неврологическими осложнениями и контрактурой скелетных мышц (Mohr E.L., Block L.N., Newman C.M. et al. Ocular and uteroplacental pathology in a macaque pregnancy with congenital Zika virus infection. / PLoS One. 2018; 13(1): e0190617. doi: 10.1371/journal.pone.0190617). Офтальмологические нарушения были выявлены у инфицированных детей как у имеющих микроцефалию так и у клинически здоровых на момент рождения (Tsui I., Moreira M.E.L., Rossetto J.D. et al. Eye Findings in Infants With Suspected or Confirmed Antenatal Zika Virus Exposure. Pediatrics. 2018 Sep 13. pii: e20181104. doi: 10.1542/peds. 2018-1104). ZIKV может вызывать патологию сетчатки (увеит) и у взрослых заболевших. Кроме того, у взрослых людей при ЛЗ могут развиваться тяжелые неврологические расстройства, например, острая воспалительная иммуноопосредованная полирадикулоневропатия, которая выражается в мышечной слабости, параличе дыхательных центров и легочных артерий (синдром Гийена-Барре) (Bandyopadhyay D., Qureshi А., Ashish K. et al. Effect of ZIKA virus on adult eyes. Eur J Intern Med. 2018; 47:e18-e19. doi:10.1016/j.ejim.2017.06.016).
На данный момент в мире нет коммерчески доступных вакцин против ZIKV, несмотря на широкие исследования в данном направлении. Рассматриваются различные подходы для получения вакцины: используются живые аттенуированные штаммы, вирус-векторные, рекомбинантные субъединичные, на основе вирусоподобных частиц (virus-like particles, VLPs) и платформы нового типа на основе рекомбинантных ДНК и РНК (Durbin А., Wilder-Smith A. An update on Zika vaccine developments. Expert Rev Vaccines. 2017. 16(8):781-787. DOI: 10.1080/14760584.2017.1345309), а также и традиционные варианты получения вакцины на основе инактивированного ZIKV. Вакцина на основе очищенного препарата штамма Puerto Rico PRVABC59, инактивированного 0,05%-ным формалином, обеспечивала защиту мышей линии BALB/c при внутримышечном заражении в дозе 102БОЕ/мл (бляшкообразующих единиц в миллилитре) бразильским штаммом ZIKV Brazil/ZKV2015, который проходит через плаценту и индуцирует фетальную микроцефалию и внутриутробное ограничение роста мышиных эмбрионов. Эта же экспериментальная вакцина стимулировала выработку нейтрализующих антител у иммунизированных макак резусов и их защиту при заражении в дозе 103БОЕ/мл как бразильским (Brazil/ZKV2015) так и пуэрториканским (PRVABC59) штаммами. Вирус не был обнаружен в сыворотке крови, моче, спинномозговой жидкости, ректальных и вагинальных секретах иммунизированных животных (Larocca R.A., Abbink P., Peron J.P. et al. Vaccine protection against Zika virus from Brazil. / Nature. 2016; 536(7617): 474-8. doi: 10.1038/nature18952). Вакцина на основе ZIKV, инактивированного формалином (не указана концентрация), разработана в США и прошла фазу I клинических испытаний в 2017 г. на добровольцах (Du L., Zhou Y., Jiang S. The latest advancements in Zika virus vaccine development. Expert Rev Vaccines. 2017; 16(10): 951-954. doi: 10.1080/14760584.2017.1363648).
Серологическое исследование по выявлению иммуноглобулинов М (IgM), обычно рано появляющихся в сыворотке крови заболевших, как правило, не является достаточно специфическим для подтверждения диагноза ЛЗ. Антитела класса IgM, специфичные к ZIKV, как и в случае с другими флавивирусами, циркулируют в кровотоке более 12 недель после заражения. Но антитела этого класса не проходят через плаценту, поэтому они могут быть хорошим маркером врожденной инфекции у новорожденных. Обнаружение в спинномозговой жидкости IgM, специфичных к ZIKV, является подтверждающим фактором неврологической инфекции (Cordeiro М.Т., Brito С.А., Pena L.J., Results of a Zika Virus (ZIKV) Immunoglobulin M-Specific Diagnostic Assay Are Highly Correlated With Detection of Neutralizing Anti-ZIKV Antibodies in Neonates With Congenital Disease. / J Infect Dis. 2016; 214(12): 1897-1904. doi: 10.1093/infdis/jiw477).
Проблема дифференциальной серологической диагностики представителей рода Flavivirus, особенно имеющих перекрывающиеся ареалы, затруднена из-за подобия их геномов и, соответственно, схожей антигенной структуры вирусных белков (Andrade D.V., Harris Е. Recent advances in understanding the adaptive immune response to Zika virus and the effect of previous flavivirus exposure. / Virus Res. 2017; pii: S0168-1702(17)30462-8. doi: 10.1016). В настоящее время большинство серийно выпускаемых за рубежом диагностических наборов для выявления антител методом ИФА на основе рекомбинантных белков Е или NS1 ZIKV, не обеспечивают достаточной специфичности из-за перекрестной активности этих антигенов с антителами, специфичными к DENV (Safronetz D., Sloan А, Stein DR. et al. Evaluation of 5 Commercially Available Zika Virus Immunoassays. Emerg Infect Dis. 2017; 23(9): 1577-1580. doi: 10.3201/eid2309.162043). Из трех коммерческих ИФА тест-систем по выявлению IgM, специфичных к ZIKV, более чувствительной оказалась система в формате MAC-ELISA (immunoglobulin М capture enzyme linked immunosorbent assay, ИФА для выявления антител класса IgM), в которой в качестве «подложки» для антител класса IgM сывороток пациентов использовали козьи антитела против человеческих IgM, сорбированные на пластик и для определения специфичности антител использовали антиген инактивированного препарата ZIKV (способ инактивации не описан) (Granger D., Hilgart Н., Misner L. et al. Serologic Testing for Zika Virus: Comparison of Three Zika Virus IgM-Screening Enzyme-Linked Immunosorbent Assays and Initial Laboratory Experiences. J Clin Microbiol. 2017;55(7): 2127-2136. doi: 10.1128/JCM.00580-17). В этой системе в качестве «детектирующих» (конъюгированных с пероксидазой) антител использовали МКА 6В6С-1, типоспецифические (группоспецифические) к флавивирусам, ранее полученные к вирусу Сент-Луис, который циркулирует в Северной Америке (Roehrig J.Т., Mathews J.H., Trent D.W. Identification of epitopes on the E glycoprotein of Saint Louis encephalitis virus using monoclonal antibodies. / Virology. 1983; 128(1): 118-26).
При исследовании иммунного статуса беременных женщин и детей, рожденных с микроцефалией, использовали прямой метод ИФА с сорбированным на пластик инактивированным антигеном цельновирионного ZIKV (способ инактивации не описан) (S Castanha РМ, Souza WV, Braga С. et al. Perinatal analyses of Zika- and dengue virus-specific neutralizing antibodies: A microcephaly case-control study in an area of high dengue endemicity in Brazil. PLoS Negl Trop Dis. 2019 Mar 11; 13(3): e0007246. doi: 10.1371/journal.pntd. 0007246).
Известно, что организация генома, структура и функции вирусных белков подобны у всех представителей рода Flavivirus (Yun S.I., Lee Y.M. et al. Zika virus: An emerging flavivirus. / J Microbiol. 2017; 55(3): 204-219. doi: 10.1007/s12275-017-7063-6). Наружный вирусный гликопротеин E флавивирусов, состоящий из трех доменов (I, II и III) является иммунодоминантной мишенью для сывороточных антител заболевших (Priyamvada L., Quicke K.M., Hudson W.H. Human antibody responses after dengue virus infection are highly cross-reactive to Zika virus. / ProcNatlAcadSci USA. 2016; 113(28): 7852-7. doi: 10.1073/pnas. 1607931113), более чем на 50% идентичен по структуре у большинства флавивирусов (Sirohi D., Chen Z., Sun L., Pierson T.C. et al. The 3.8  resolution cryo-EM structure of Zika virus. Science. 2016. 352(6284): 467-70. doi: 10.1126/science.aaf5316), а в петле слияния (в домене II) с инфицируемой клеткой идентичен по структуре на 100% (Priyamvada L., Cho A., Onlamoon N. et al. В Cell Responses during Secondary Dengue Virus Infection Are Dominated by Highly Cross-Reactive, Memory-Derived Plasmablasts. / J Virol. 2016. 90(12): 5574-85. doi: 10.1128/JVI. 03203-15). В связи с этим, при отсутствии доступных специфических антител против ZIKV (сывороток крови переболевших людей), для такого исследования можно использовать имеющиеся на данный момент антитела - поликлональные и моноклональные, специфичные к антигенно-родственным флавивирусам, как это было проведено в работе (Willis Е., Hensley S.E. Characterization of Zika virus binding and enhancement potential of a large panel of flavivirus murine monoclonal antibodies. / Virology. 2017 V.; 2(508): 1-6). Кроме того, показано, что МКА, специфичные к флавивирусам, могут быть перекрестно нейтрализующими (Fernandez Е., Dejnirattisai W., Сао В. et al. Human antibodies to the dengue virus E-dimer epitope have therapeutic activity against Zika virus infection. Nat Immunol. 2017; 18(11): 1261-1269. doi: 10.1038/ni.3849).
resolution cryo-EM structure of Zika virus. Science. 2016. 352(6284): 467-70. doi: 10.1126/science.aaf5316), а в петле слияния (в домене II) с инфицируемой клеткой идентичен по структуре на 100% (Priyamvada L., Cho A., Onlamoon N. et al. В Cell Responses during Secondary Dengue Virus Infection Are Dominated by Highly Cross-Reactive, Memory-Derived Plasmablasts. / J Virol. 2016. 90(12): 5574-85. doi: 10.1128/JVI. 03203-15). В связи с этим, при отсутствии доступных специфических антител против ZIKV (сывороток крови переболевших людей), для такого исследования можно использовать имеющиеся на данный момент антитела - поликлональные и моноклональные, специфичные к антигенно-родственным флавивирусам, как это было проведено в работе (Willis Е., Hensley S.E. Characterization of Zika virus binding and enhancement potential of a large panel of flavivirus murine monoclonal antibodies. / Virology. 2017 V.; 2(508): 1-6). Кроме того, показано, что МКА, специфичные к флавивирусам, могут быть перекрестно нейтрализующими (Fernandez Е., Dejnirattisai W., Сао В. et al. Human antibodies to the dengue virus E-dimer epitope have therapeutic activity against Zika virus infection. Nat Immunol. 2017; 18(11): 1261-1269. doi: 10.1038/ni.3849).
В нашей стране отсутствуют разработки вакцины против ZIKV, а также коммерчески доступные тест-системы для серологической диагностики ЛЗ и выявления вирусного антигена в биологических пробах. Отечественные научные статьи по решению данных проблем пока также не представлены. По Санитарным правилам РФ ZIKV относится ко II группе патогенности, также как и DENV, TBEV, WNV, поэтому представляет опасность для персонала в процессе работы с ним. В связи с этим, инфекционный препарат ZIKV, наработанный на культуре клеток, необходимо инактивировать и проводить контроль его биобезопасности. Иммунохимическое исследование сохранности биологически важных эпитопов вирусных белков инактивированного вирусного антигена необходимо проводить для анализа возможности его использования как при разработке профилактической вакцины так и при конструировании иммуноферментных тест-систем.
Ниже представлены известные способы инактивации ZIKV.
1. В плазме крови, предназначенной для трансфузии, прогреванием при 30°С в течение 60 минут с 1% сольвента (tri-n-butyl phosphate) и 1% детергента (octoxynol-9) % (вес/вес) или пастеризацией при 60°С в течение 120 минут  Pichotta A. et al. Inactivation of Zika virus by solvent/detergent treatment of human plasma and other plasma-derived products and pasteurization of human serum albumin. / Transfusion. 2017; 57(3pt2): 802-810).
Pichotta A. et al. Inactivation of Zika virus by solvent/detergent treatment of human plasma and other plasma-derived products and pasteurization of human serum albumin. / Transfusion. 2017; 57(3pt2): 802-810).
2. Полная инактивация более чем 5.99 log TCID50/мл (50%-ной инфекционной дозы для культуры клеток) ZIKV в эритроцитах была достигнута с использованием химических препаратов - amustalene (S-303) и glutathione (GSH) (Laughhunn A., Santa Maria F., Broult J. et al. Amustaline (S-303) treatment inactivates high levels of Zika virus in red blood cell components. / Transfusion. 2017; 57(3pt2): 779-789).
3. Нагревание при 58°C в присутствие 5 или 25%-го человеческого сывороточного белка вызывала инактивацию ZIKV на стадии нагрева, в отличие от вирусов диареи крупного рогатого скота, WNV и TBEV, которым для достижения инактивации потребовалось не менее 180 минут прогрева при аналогичной температуре. Эти данные свидетельствуют о невысокой термостабильности ZIKV по сравнению с антигенно-родственными вирусами (Farcet M.R., Kreil T.R. Zika virus is not thermostable: very effective virus inactivation during heat treatment (pasteurization) of human serum albumin. / Transfusion. 2017; 57(3pt2): 797-801).
4. Воздействие ультрафиолета в течение 10 минут способствовало полной инактивации ZIKV в присутствии 2,5% фетальной сыворотки плода коровы. Увеличение концентрации сыворотки снижало противовирусное действие ультрафиолета. Инфекционность ZIKV, содержащего 90% сыворотки, снижалась на 99,95%, когда препарат подвергался воздействию ультрафиолета в течение 60 минут, однако была обнаружена некоторая остаточная инфекционность. Полная потеря инфекционности ZIKV наблюдалась после воздействия: 1) 1%-ного раствора гипохлорита натрия, который содержит 95,2% активного хлора и часто используется для инактивации вирусов в жидких отходах в лабораториях BSL-2/3; 2) 2%-ного раствора параформальдегида, который используется для инактивации вирусов, используемых для исследования методом проточной цитометрии; 3) 2%-ного раствора глутаральдегида, который применяется для фиксации вирусов при подготовке препаратов для электронного микроскопического анализа  Harms М, Schubert A. et al. Inactivation and Environmental Stability of Zika Virus. Emerg Infect Dis. 2016; 22(9): 1685-7).
Harms М, Schubert A. et al. Inactivation and Environmental Stability of Zika Virus. Emerg Infect Dis. 2016; 22(9): 1685-7).
5. Обнаружение инфекционных частиц в грудном молоке инфицированных женщин вызывало обеспокоенность в отношении безопасности грудного вскармливания в районах передачи ZIKV. Но исследование показало, что вирус эффективно инактивируется в грудном молоке после длительного хранения (возможно, что это связано с влиянием на вирион липазы и жирных кислот) или при пастеризации при 62,5°С в течение 30 минут (Pfaender S., Vielle N.J., Ebert N. et al. Inactivation of Zika virus in human breast milk by prolonged storage or pasteurization. Virus Res. 2017; 228: 58-60).
За рубежом исследуется эффективность наработки препарата ZIKV на разных культурах клеток для получения инактивированных или живых аттенуированных штаммов в плане разработки производственного процесса получения вакцины (Vicenti I., Boccuto A., Giannini A. et al. Comparative analysis of different cell systems for Zika virus (ZIKV) propagation and evaluation of anti-ZIKV compounds in vitro. / Virus Res. 2018; 244: 64-70. doi: 10.1016/j.virusres.2017.11.003; Nikolay A., Castilho L.R., Reichl U. et al. Propagation of Brazilian Zika virus strains in static and suspension cultures using Vero and BHK cells. / Vaccine. 2018; 36(22): 3140-3145. doi: 10.1016/j. vaccine. 2017.03.018).
Известны следующие способы получения антигенов ZIKV:
1. Способ получения лизатов клеток Vero, инфицированных ZIKV (штаммы MR-766 и FSS 13025), инактивированных формалином в финальной концентрации 0,01% при 37°С в течение 24 часов. Эти вирусные препараты двух штаммов ZIKV были использованы в методах ИФА и иммуноблоттинга в качестве положительных контролей при исследовании со-экспрессии структурных (С, prM, Е) и неструктурных (NS2b/NS3) белков ZIKV в составе VLPs - кандидатов для разработки вакцины. В иммуноблоттинге, с помощью поликлональных и моноклональных антител, было показано, что в лизатах инфицированных клеток Vero содержатся вирусные белки - структурный гликопротеин Е (по белковым маркерам, между 49-62 кДа), структурный белок prM (20 кДа), структурный белок М (8 кДа), неструктурные белки NS3 (62 кДа) и NS2b (14 кДа). В сыворотках крови мышей линии Balb/c, иммунизированных как инактивированными ZIKV так и вирусоподобными частицами были обнаружены вируснейтрализующие антитела в титре от 1/100 до 1/10000, в зависимости от дозы антигенов при двухкратной иммунизации 1 мкг или 4 мкг, соответственно (Boigard Н., Alimova A., MartinG.R. et al. Zika virus-like particle (VLP) based vaccine. PLoSNegl Trop Dis. 2017 May 8; 11(5): e0005608).
2. Метод очистки супернатантов от культур клеток линии комаров (С6/36) и Vero, инфицированных ZIKV (штамм MR766), через 10-60%-ный градиент сахарозы. Концентрация очищенного белка не указана. Вирусные белки Е, NS1 и prM в очищенных препаратах выявлялись методом иммуноблоттинга с помощью специфических антител на уровне 55, 40 и 25 кДа, соответственно (Coelho S.V.A., Neris R.L.S., Papa М.Р. et al. Development of standard methods for Zika virus propagation, titration, and purification. J Virol Methods. 2017: 246:65-74).
3. Метод инактивации ZIKV (штамм PRVABC59) 0,02% раствором формальдегида при 22°С в течение 14 дней. Вирус был наработан на культуре клеток Vero и очищен из супернатанта методом ионообменной хроматографии. Было получено 0,35-0,45 мг очищенного препарата (не указан из какого объема вируссодержащей среды). Белок Е в очищенном препарате выявлялся специфическими антителами методом иммуноблоттинга на уровне 60 кДа. Иммунохимическими методами было обнаружено, что структурный белок Е вирусной оболочки инактивированных вирусных частиц сохраняет ключевые эпитопы, вызывающие синтез нейтрализующих антител. Иммунизация иммунодефицитных мышей линии AG129 инактивированным препаратом двухкратно в дозах 0,1 или 1 мкг, полностью защищала животных от летальных доз ZIKV (Baldwin W.R., Livengood J.A., Giebler H.A. et al. Purified Inactivated Zika Vaccine Candidates Afford Protection against Lethal Challenge in Mice. / Sci Rep. 2018; 8(1): 16509).
Известен способ инактивации ZIKV, пригодный для получения фармацевтической композиции. Вирус нарабатывают на культурах клеток комаров (например, линия С6/36) или млекопитающих (например, линия Vero) и инактивируют супернатант (вируссодержащую ростовую среду от инфицированных клеток) формальдегидом в концентрации 0,005-0,02% (вес/объем) в течение 3-14 дней при температуре 22°С. Определение остаточного инфекционного вируса определяют по цитопатическому действию (ЦПД) на эти культуры клеток (Livengood J.A., Giebler Н.., Dean Н. et al. Method for inactivating Zika virus and related metods. Международная заявка № WO 2019108976, МПК C12N 7/06, A61P 31/14, опубл. 06.06.2019).
Наиболее близким аналогом (прототипом) является способ получения инактивированного, концентрированного и очищенного антигена вируса Зика для получения вакцины против ZIKV (Заявка на патент Китая №CN 105749268, МПК А61К 39/12, опубл. 13.07.2016 г.). Вирус нарабатывают на монослое культуры клеток Vero. Вируссодержащую ростовую среду отделяют от инфицированных клеток (супернатант) путем осветления и фильтрации с последующей инактивацией вируссодержащего супернатанта формальдегидом из расчета 100-400 мкг/мл в течение 4-7 дней при температуре 37°С. Инактивированный супернатант осветляют центрифугированием, фильтруют для избавления от клеточного дебриса, концентрируют методом ультрафильтрации и в градиенте плотности сахарозы. Затем концентрированный вирусный препарат подвергают ультрафильтрации для избавления от сахарозы и очищают хроматографическим способом.
Недостатком выше указанных аналогов и прототипа является недостаточный выход антигена вируса Зика и жесткие условия инактивирования вируса с использованием формальдегида, что снижает возможность сохранения биологически важных эпитопов структурного гликопротеина оболочки вириона (белка Е).
Техническим результатом заявляемого изобретения является повышение выхода антигена вируса Зика, создание более щадящих условий инактивирования вируса за счет получения инактивированного, концентрированного и очищенного препарата ZIKV (штамм PRVABC59) из двух фракций вируссодержащих материалов: лизата инфицированных клеток Vero и супернатанта (культуральной ростовой среды от этих клеток) с сохранением биологически важных эпитопов структурного гликопротеина оболочки вириона (белка Е), вызывающих синтез нейтрализующих антител при иммунизации мышей линии Balb/c.
Указанный технический результат достигается тем, что в способе получения антигена вируса Зика, обладающего иммуногенными и антигенными свойствами, включающем наработку вируса на монослое культуры клеток Vero, инактивирование вируссодержащего материала формальдегидом, концентрирование и очистку полученного антигена, согласно изобретения, перед инактивацией всю вируссодержащую биомассу клеток Vero подвергают трехкратному замораживанию при минус 20°С и оттаиванию при температуре +20-22°С для разрушения клеточных мембран, инактивирование вируссодержащего материала в виде смеси суспензии клеток с разрушенными мембранами осуществляют раствором формальдегида в конечной концентрации в диапазоне 0,00016%-0,016% от объема при инкубации в течение 24 часов при 37°С с последующим контролем остаточной инфекционности инактивированного вируссодержащего препарата ZIKV на культуре клеток Vero, выращенных в 96-луночных планшетах, после чего проводят фракционирование инактивированного вируссодержащего материала центрифугированием при 3000 об./мин. в течение 10 мин на осадок клеток Vero и культуральную ростовую среду в виде супернатанта; на осадок клеток Vero воздействуют ультразвуком в течение 30 сек на льду с получением клеточного лизата, а концентрирование суммарных белков из фракции супернатанта осуществляют путем их осаждения 10%-ным раствором полиэтиленгликоля с молекулярной массой 6000 Да в течение 5 суток при температуре 4°С; очистку двух фракций вируссодержащего материала: лизата инфицированных клеток и концентрированной фракции ростовой среды в виде супернатанта осуществляют центрифугированием на градиенте 30%-го глицерина и 40%-го тартрата калия/натрия по методу Мейхи; осадки полученных очищенных концентрированных вирусных препаратов растворяют в 1 мл 0,05 М натрий-фосфатном буферном раствора (рН 8,0), готовят аликвоты по 100 мкл для хранения при минус 20°С и использования в качестве антигена.
Причем процесс культивирования вируса Зика на монослое культуры клеток Vero завершают после наблюдаемого в световой микроскоп 80%-ного цитопатического действия (ЦПД) вируса на инфицированные клетки.
Осадки полученных инактивированных, концентрированных и очищенных фракций вирусных препаратов подвергают иммунохимическому исследованию сохранности биологически важных эпитопов белка Е ZIKV методами ИФА и иммуноблотинга с помощью поликлональных и моноклональных антител, специфичных к инактивированному ZIKV и к антигенно-родственным вирусам TBEV, WNV и YFV, а также тестированию вируснейтрализующей активности поликлональных мышиных антител, специфичных к двум фракциям инактивированного, концентрированного и очищенного препарата ZIKV, на культуре клеток Vero с использованием инфекционного ZIKV.
В отличие от аналогов, описывающих использование только супернатантов от инфицированных клеток линии Vero, в представляемой заявке используют две фракции вируссодержащего материала, полученные от инфицированных клеток Vero: лизата инфицированных клеток (обработанных ультразвуком) и супернатанта (культуральной ростовой среды от инфицированных клеток), что увеличивает выход вирусного антигена. Кроме того, мы используем для инактивации меньшее количество формальдегида (0,016%, 0,0016%, 0,00016%) для сохранения биологически важных эпитопов структурного гликопротеина оболочки вириона (белка Е), а также короткий промежуток времени инактивации - 24 ч при 37°С. Отличается также метод очистки и концентрирования (на градиенте 30%-го глицерина и 40%-го тартрата калия/натрия).
Ниже представлен перечень чертежей.
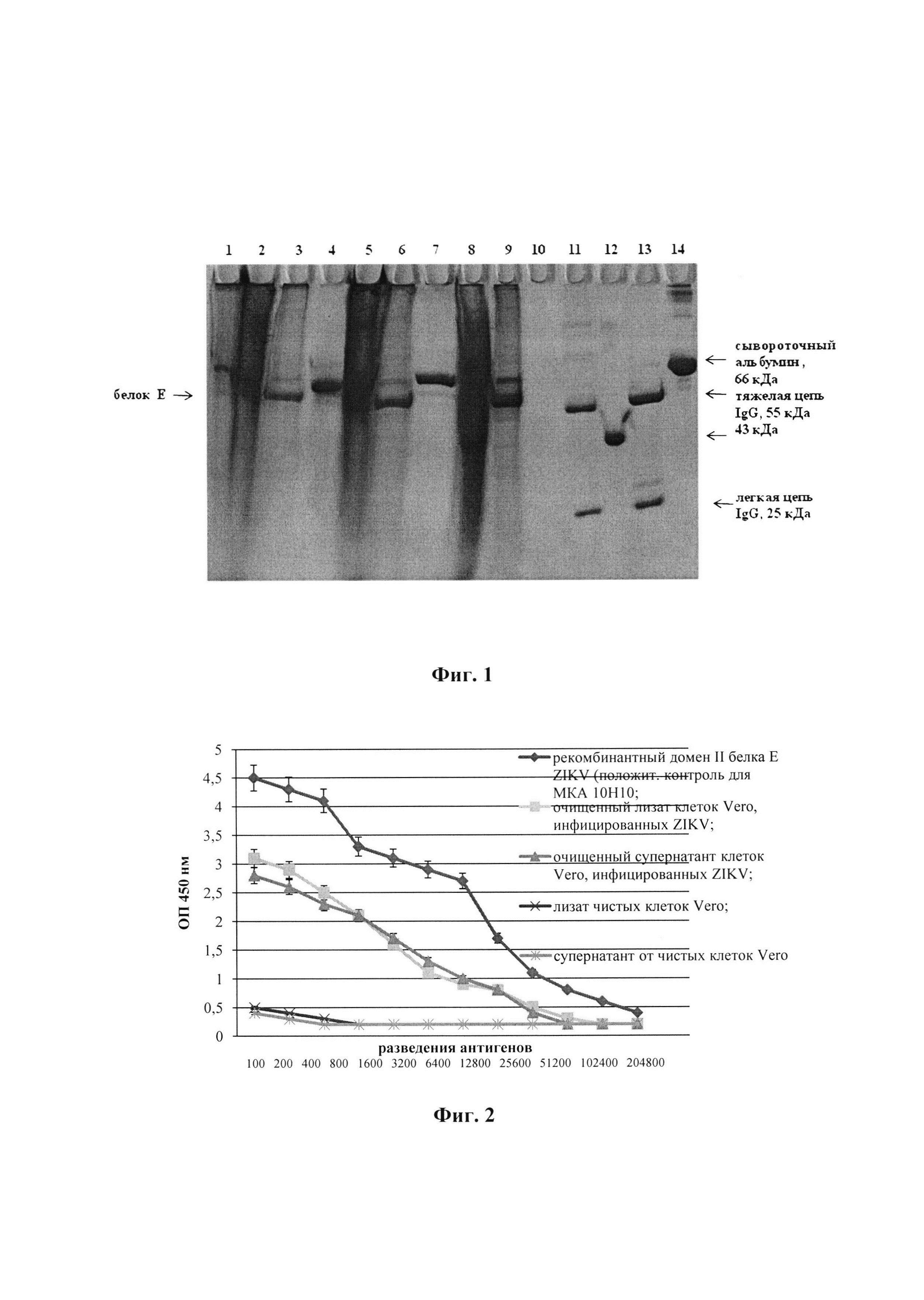
Фиг 1. Электрофоретическое разделение белков в инактивированных вирусных препаратах.
Примечания к фиг. 1: 1. лизат чистой культуры клеток Vero (10 мкл/дорожка); 2. инактивированный неочищенный лизат клеток Vero, содержащий ZIKV (10 мкл/дорожка); 3. очищенный в градиенте лизат клеток Vero, содержащий ZIKV (10 мкл/дорожка) 4. осажденный супернатант от чистой культуры клеток Vero (10 мкл/дорожка); 5. инактивированный неочищенный осажденный супернатант от инфицированных клеток (10 мкл/дорожка); 6. очищенный в градиенте осажденный супернатант от инфицированных клеток (10 мкл/дорожка); 7. препарат вакцины против вируса клещевого энцефалита (ссылка в разделе 8.3, табл. 4); (30 мкл/дорожка) 8. препарат вакцины против вируса желтой лихорадки (ссылка в разделе 8.3, табл. 4) (30 мкл/дорожка); 9. очищенный в градиенте лизат клеток Vero, содержащий инактивированный вирус Западного Нила (10 мкл/дорожка); 10. пустая дорожка; 11. препарат очищенных МКА 10Н10 (ссылка в разделе 8.3), (2 мкл/дорожка), (контроль местоположения кДа - тяжелая цепь и легкая цепь IgG - 55 и 25 кДа, соответсвенно); 12. препарат очищенного рекомбинантного домена II белка Е вируса Зика (5 мкл/дорожка) (в качестве маркера 43 кДа); 13. препарат очищенных МКА 9Е2 (ссылка в разделе 8.3), (2 мкл/дорожка), (контроль местоположения кДа - тяжелая цепь и легкая цепь IgG - 55 и 25 кДа, соответсвенно); 14. препарат бычьего сывороточного альбумина (концентрация 10 мг/мл) 1 мкл/дорожка, соответствует 10 мкг/мкл.
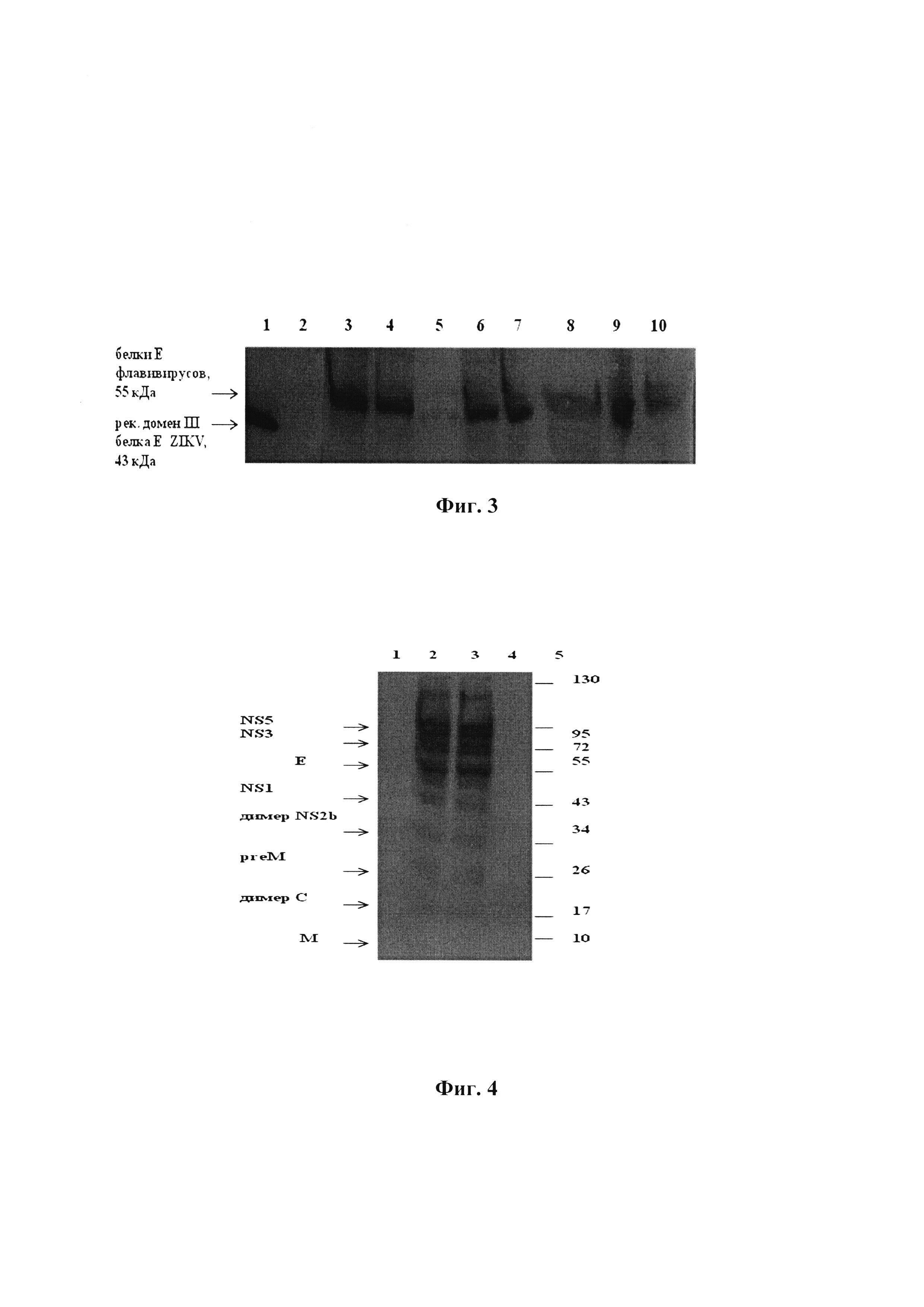
Фиг. 2. График титрования очищенных антигенов вируса Зика с родоспецифичными моноклональными антителами.
Примечания к фиг. 2: титрование антигенов проводили с разведения 1/100 двойным шагом; 1 - рекомбинантный белок - домен II белка Е ZIKV; 2, 3 - очищенные фракции: лизат клеток Vero и супернатант, соответственно, от вируссодержащего материала; 4, 5 - лизат неинфицированных клеток Vero (отрицательный контроль), фракция суммарных белков ростовой среды, осажденных 10% раствором полиэтиленгликоля с мм 6000, соответственно; МКА 10Н10; использованы в разведении (1/1000). Для истощения раствора МКА 10Н10 для снижения неспецифического фона проводили использовали лизат неинфицированных клеток Vero и фракцию суммарных белков ростовой среды (3% от объема раствора).
Конъюгат антивидовых антител (Gout anti mouse, Sigma) с пероксидазой хрена в рабочем разведении 1/10000.
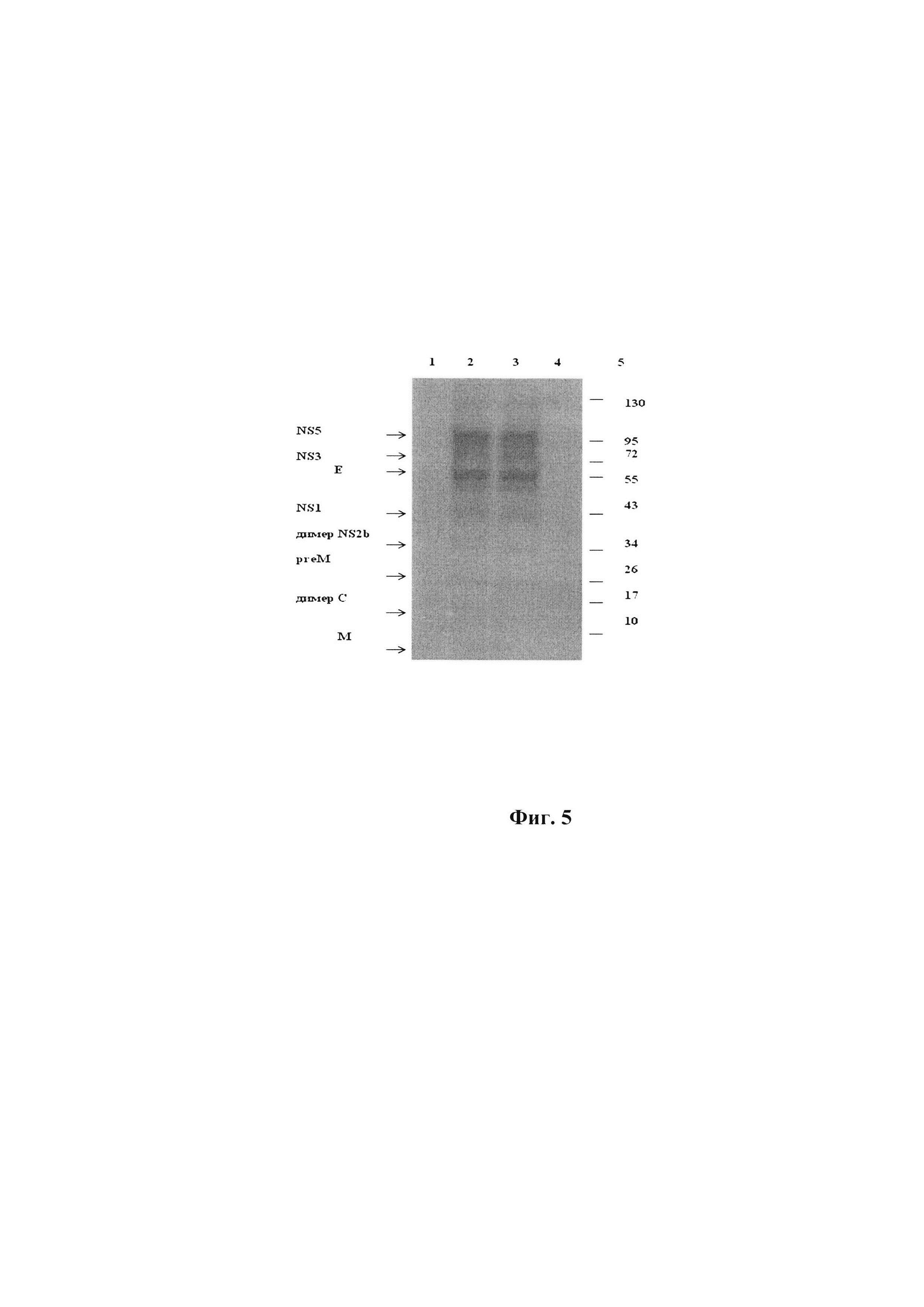
Фиг. 3. Иммуноблотинг инактивированных, концентрированных и очищенных препаратов вируса Зика с родоспецифичными МКА 10Н10.
Примечания к фиг. 3: 1. рекомбинантный белок - домен II белка Е ZIKV размером 43 кДа (5 мкл/дорожка); 2. лизат чистой культуры клеток Vero (10 мкл/дорожка); 3. инактивированный неочищенный лизат клеток Vero, содержащий ZIKV (10 мкл/дорожка); 4. очищенный в градиенте лизат клеток Vero, содержащий ZIKV (10 мкл/дорожка); 5. осажденный супернатант от чистой культуры клеток Vero (10 мкл/дорожка); 6. инактивированный неочищенный осажденный супернатант от инфицированных клеток(10 мкл/дорожка); 7. очищенный в градиенте осажденный супернатант от инфицированных клеток (10 мкл/дорожка); 8. препарат вакцины против вируса клещевого энцефалита (ссылка в разделе 8.3, табл. 4) (30 мкл/дорожка); 9. очищенный в градиенте лизат клеток Vero, содержащий инактивированный вирус Западного Нила (10 мкл/дорожка); 10. препарат вакцины против вируса желтой лихорадки (ссылка в разделе 8.3, табл. 4) (30 мкл/дорожка). Препараты очищенных МКА 10H10 использованы в разведении (1/500). Слева стрелкой указано местоположение белков Е флавивирусов на уровне 55 кДа.
Фиг. 4. Иммуноблотинг препаратов вируса Зика с антителами сыворотки крови мышей линии Balb/c, иммунизированных очищенным лизатом инфицированных клеток Vero.
Примечания к фиг. 4: 1. лизат чистой культуры клеток Vero (10 мкл/дорожка); 2. очищенный в градиенте лизат клеток Vero, содержащий ZIKV(10 мкл/дорожка) (10 мкл/дорожка); 3. очищенный в градиенте осажденный супернатант от инфицированных клеток Vero (10 мкл/дорожка); 4. осажденный супернатант от чистой культуры клеток Vero (10 мкл/дорожка); 5. местоположение маркеров молекулярной массы белков. Сыворотка крови мышей, иммунизированных очищенным лизатом инфицированных клеток (ссылка в табл. 3) использована в разведении (1/500). Слева стрелками обозначено местоположение вирусных белков.
Фиг. 5. Иммуноблотинг препаратов вируса Зика с антителами сыворотки крови мышей линии Balb/c, иммунизированных очищенным супернатантом ростовой среды от инфицированных клеток Vero.
Примечания к фиг. 5: 1. лизат чистой культуры клеток Vero (10 мкл/дорожка); 2. очищенный в градиенте лизат клеток Vero, содержащий ZIKV (10 мкл/дорожка); 3. очищенный в градиенте осажденный супернатант от инфицированных клеток Vero (10 мкл/дорожка); 4. осажденный супернатант от чистой культуры клеток Vero (10 мкл/дорожка); 5. местоположение маркеров молекулярной массы белков. Сыворотка крови мышей, иммунизированных очищенным супернатантом от инфицированных клеток (ссылка в табл. 3) использована в разведении (1/500). Слева стрелками обозначено местоположение вирусных белков, согласно литературным данным (ссылки в реферате).
Изобретение иллюстрируется следующими примерами выполнения способа получения антигена вируса Зика.
Пример 1. Наработка вирусного препарата и определение инфекционного титра.
В работе использован ZIKV (штамм PRVABC59) предоставленный доктором Jason Velez (CDC.) Штамм вируса был выделен из выворотки крови больного человека в 2015 г., наработан на культуре клеток Vero (клетки почки африканской зеленой мартышки). Получен из CDC в виде культуральной жидкости в объеме 0,5 мл с добавлением 20% сыворотки крови плода крупного рогатого скота. Все исследования с инфекционным материалом проводили на базе отдела «Коллекция микроорганизмов» ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора. Подразделение имеет лицензию и санитарно-эпидемиологическое разрешение на проведение работ с вирусами I и II группы патогенности. Работу проводили в соответствии с рекомендациями ВОЗ и требованиями Санитарных правил по работе с возбудителями I и II групп патогенности с требуемым уровнем биобезопасности.
ZIKV нарабатывается на культуре клеток Vero в течение шести суток при 37°С в культуральных флаконах 175 см2 в 100 мл питательной среды ДМЕМ (ФБУН ГНЦ ВБ «Вектор») с сульфатом гентамицина (РУП «Белмедпрепараты», Беларусь) 80 мг на 500 мл среды и 2% сыворотки крови плода крупного рогатого скота (Gibco), прогретой при 56°С в течение 30 минут для инактивации белков комплемента. При наблюдаемом в световой микроскоп 80%-ном цитопатическом действии (ЦПД) вируса на монослой инфицированных клеток, культуральные флаконы в горизонтальном положении (когда клетки покрыты ростовой средой) помещаются в холодильную камеру на минус 20°С. Содержимое культуральных флаконов подвергается 3-х кратному замораживанию (при минус 20°С/оттаиванию (при комнатной температуре) для разрушения клеточных мембран. Титр вируса в осветленном супернатанте составляет в тканевых цитопатических дозах - 105 ТЦПД50 /мл на культуре клеток Vero.
Пример 2. Инактивация вируссодержащего материала.
В пробирки с вируссодержащей культуральной жидкостью (по 25 мл) добавляется 8% раствор, приготовленный из 37%-ного формальдегида (Aldrich) в соответствии с данными табл. 1. Для удобства и точности внесения необходимого объема раствора формальдегида готовятся три его последовательных десятикратных разведения на культуральной среде ДМЕМ. Затем по 0,5 мл приготовленных разведений формальдегида добавляются в емкости с вируссодержащей жидкостью. Конечная концентрация формальдегида в вируссодержащей жидкости составляет 0,016%, 0,0016%, 0,00016% в пробирках №1, 2, 3, соответственно. В пробирку №4 (контроль вируса) формальдегид не добавляется. Все четыре пробирки с вируссодержащей культуральной жидкостью помещаются в термостат при 37°С на 24 часа.
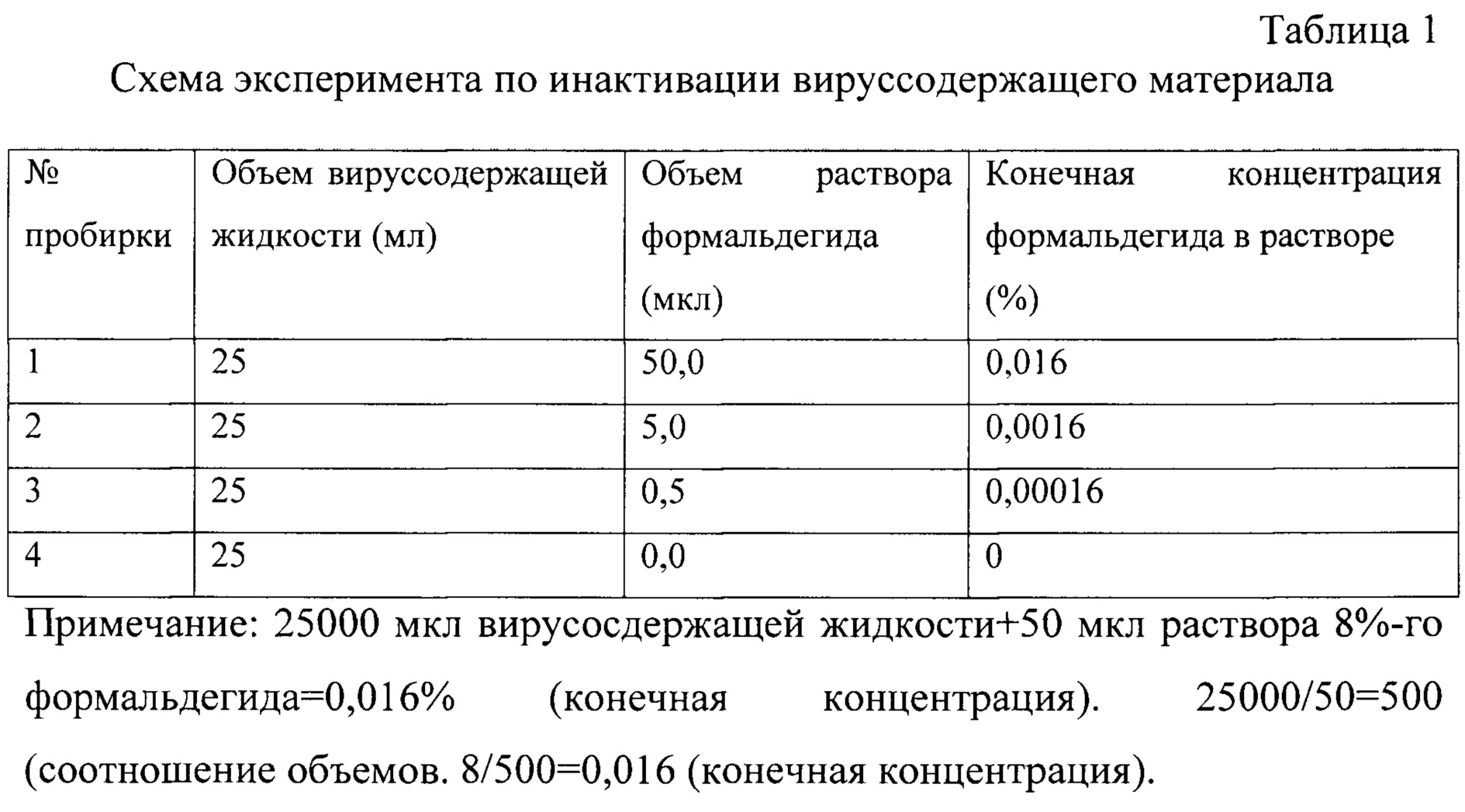
Пример 3. Проверка остаточной инфекционности вируссодержащей жидкости.
Культура клеток Vero в виде суточного монослоя, выращенная в культуральных флаконах 25 см2 инфицируется осветленной инактивированной культуральной жидкостью, в объеме 0,1 мл в соответствии с данными табл. 2. В качестве положительного контроля используется культуральная жидкость, содержащая ZIKV не инактивированный формальдегидом (культуральный флакон №4). В качестве отрицательного контроля используется культуральная среда ДМЕМ (культуральный флакон №5). После экспозиции при 37°С в течение 1 часа в культуральные флаконы добавляется поддерживающая ростовая среда ДМЕМ (с сульфатом гентамицина (80 мг на 500 мл среды) и 2% сыворотки крови плода крупного рогатого скота (прогретой при 56°С в течение 30 минут для инактивации белков комплемента) в объеме 10 мл. Культуральные флаконы помещаются в термостат при 37°С на семь суток.
Вывод: остаточная инфекционность ZIKV не выявляется ни в одном из исследованных образцов.

Пример 4. Концентрирование и очистка вируссодержащего материала.
Для концентрирования и очистки выбирается средняя концентрация раствора формальдегида - 0,0016%. Инактивированный в течение 24 часов при 37°С вируссодержащий материал (100 мл) фракционируется на осадок мембран клеток и супернатант центрифугированием при 3000 об./мин. в течение 10 мин.
Фракция осадка клеток отмывается ростовой средой без сыворотки и в объеме 1 мл этой среды подвергается воздействию ультразвука в течение 30 сек на льду и, после центрифугирования течение 10 мин при 3000 об./мин, осветленный лизат клеток наносится на градиент растворов: 30%-ного глицерина на 40%-м тартрате калия/натрия (AppliChhem), приготовленных на STE буферном растворе (0,001 М этилендиаминтетрауксусной кислоты, 0,1 М NaCl, 0,01 М трис HCl, рН 8,0). И центрифугируется при 25000 об./мин. 5 часов при 4°С.
К фракции супернатанта (ростовой культуральной среды, осветленной центрифугированием), добавляется 10% раствор полиэтиленгликоля (мол. массой 6000) для осаждения суммарных белков в течение 5 суток при температуре 4°С. Далее осадок суммарных белков в объеме 1 мл ростовой среды без сыворотки наносится на градиент 30%-го глицерина на 40%-м тартрате калия/натрия и центрифугируется при 25000 об./мин. - 5 часов при 4°С.
Осадки полученных очищенных концентрированных вирусных препаратов растворяются в 1 мл 0,05 М натрий-фосфатном буферном раствора (рН 8,0), готовят аликвоты по 100 мкл для хранения при минус 20°С.
Пример 5. Белковый электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-ПААГ).
Электрофорез вирусных белков проводится в разрешающем геле (состав: 30% акриламида; 1,5 М Tris (рН 8,8); 10% SDS; 10% аммония персульфата; TEMED (tetramethylethylenediamine) 1 мкл/мл) и концентрирующем геле (состав: 30% акриламида; 1 М Tris (рН 6,8); 10% SDS; 10% аммония персульфата; TEMED 1 мкл/мл) в различных буферных растворах (верхний: 5Х трис-глициновый буферный раствор рН 8,3 (состав: 1,25 мМ Tris; 1,25 М глицина; 0,5% SDS); нижний: 1X трис-ацетатный буферный раствор рН 8,0 (состав: 40 мМ Tris-HCl; 40 мМ уксусной кислоты; 2 мМ EDTA (этилендиаминтетрауксусная кислота). Биологический материал смешивается с буферным раствором для нанесения, кипятили 5 минут и наносится в верхний концентрирующий гель. SDS-ПААГ проводится при напряжении ~10 В/см в концентрирующем геле, ~180 В в разрешающем геле. Белки в составе полиакриламидного геля окрашиваются при помощи раствора Кумасси G-250. Из избытка краски избавляются кипячением полиакриламидного геля в дистиллированной воде.
Пример 6. Иммуноблоттинг.
Вирусные препараты после электрофореза переносятся на нитроцеллюлозную мембрану («Millipore», США) на аппарате Transpor («LKB», Швеция) в течение 1,5 часов при напряжении 80 В в 0,025М трис-HCl буфере, содержащем 0,192 М глицина (рН 8,3) и 20% этанола. Места неспецифического связывания насыщаются 1%-ным раствором казеина при 37°С в течение 2 часов в ТСБ-Т буфере (состав: трис-солевой буфер с твином, содержащий 0,15М NaCl; 0,02 М трис-HCl рН 7,4; 0,05% твин-20). Затем мембрану, содержащую вирусные белки, инкубируют с мышиными поликлональными или моноклональными антителами (в рабочих разведениях) 4 часа при 20-22°С в буфере ТСБ-Т, содержащем 0,5% казеина. После отмывки в ТСБ-Т буфере мембраны обрабатывают антивидовыми антителами, меченными пероксидазой хрена (Gout anti mouse, Sigma) в рабочем разведении 1/6000 в 0,5%-ном растворе казеина, в течение 2-х часов при 37°С. Затем мембрану промывают ТСБ-Т буфером и проявляют в растворе хромагена (1 мг/мл 3,3 диаминобензидин тетрагидрохлорида в 50 мМ трис-HCl буфере (рН 7,4), содержащем 0,145 М NaCl, 20% этанола и 0,03% перекиси водорода). В качестве отрицательного контроля используют лизат неинфицированных клеток Vero и фракцию суммарных белков ростовой среды, осажденных 10% раствором полиэтиленгликоля с мм 6000. Реакцию останавливают отмыванием мембраны в дистиллированной воде. Специфическое взаимодействие антител с вирусными белками проявляется в виде коричневых полос.
Пример 7. Твердофазный иммуноферментный анализ (ТИФА).
Для проведения непрямого ТИФА используют полистироловые планшеты (Nunk). Сенсибилизацию ячеек антигенами выполняют в объеме 100 мкл 0,05 М натрий-фосфатного буферного раствора (рН 8,0) в рабочих разведениях Сорбцию проводят при 22°С в течение 18 часов. Места неспецифического связывания насыщаются 1%-ным раствором казеина в ТСБ-Т (трис-солевой буфер с твином, содержащий 0,15 М NaCl; 0,02М трис-HCl рН 7,4; 0,05% твин-20) в течение 45 минут при 37°С. Затем раствор казеина удаляют и инкубируют антигены со специфическими мышиными антителами (в рабочих разведениях в 0,5%-ном растворе казеина в течение 1 часа при 37°С или 18 часов при 4°С). После трехкратной отмывки ТСБ-Т буфером в лунки добавляют по 100 мкл пероксидазного конъюгата антивидовых антител (Gout anti mouse, Sigma) в рабочем разведении 1/6000 в 0,5%-ном растворе казеина. Инкубируют 1 час при 37°С. Отмывку лунок осуществляют трехкратно с ТСБ-Т. Проявление проводят в течение 30 минут с использованием жидкого субстрата на основе ТМБ (3,3',5,5'-Tetramethylbenzidine). Блокируют реакцию добавлением 100 мкл 1 N HCl на каждую лунку и измеряют ОП субстратно-индикаторной смеси на спектрофотометре «Uniscan» при длине волны 450 нм. В качестве отрицательного контроля используют лизат неинфицированных клеток Vero и фракцию суммарных белков ростовой среды, осажденных 10% раствором полиэтиленгликоля с мм 6000.
Пример 8. Иммунохимическое исследование фракций инактивированного, концентрированного и очищенного препарата ZIKV.
8.1. Оценка степени очистки вирусных препаратов.
Методом белкового электрофореза (см. пример 5) оценивается степень очистки вирусных препаратов ZIKV и наличие белка Е - основного иммуногена на уровне 55 кДа (фиг. 1) при сравнении с маркерами - тяжелой и легкой цепи IgG очищенных препаратов МКА 10Н10 и 9Е2 - 55 и 25 кДа, соответственно. Концентрация очищенных препаратов ZIKV оценивалась визуально при сравнении с препаратом бычьего сывороточного альбумина с известной концентрацией - 10 мг/мл (рис. 1, дорожка 14). В результате, при нанесении очищенных вирусных препаратов в объеме 10 мкл, их концентрации соответствуют приблизительно 0,5 мг/мл. Такая же концентрация была определена на спектрофотометре при использовании набора «Bio-Rad Protein Assay Kit» в соответствии с рекомендациями производителя.
8.2. Иммунизация мышей и определение титра антител в сыворотках крови.
Исследования на животных проводили в соответствии с федеральными законами и правилами, касающихся животных и экспериментов с животными. Для иммунизации используют мышей линии Balb/c (самок весом 22 г) из вивария ФБУН ГНЦ ВБ "Вектор". В табл. 3 представлена схема 4-х кратной иммунизации. Кровь собирается посредством декапитации животных, усыпленных парами хлороформа, на 41-е сутки после первой иммунизации. Титр антител в сыворотках крови определяется методом ТИФА (см. пример 7). Результат титрования антител представлен ниже в табл. 4.

8.3. Исследование специфичности взаимодействия очищенных антигенов ZIKV с моноклональными и поликлональными антителами, специфичными к флавивирусам.
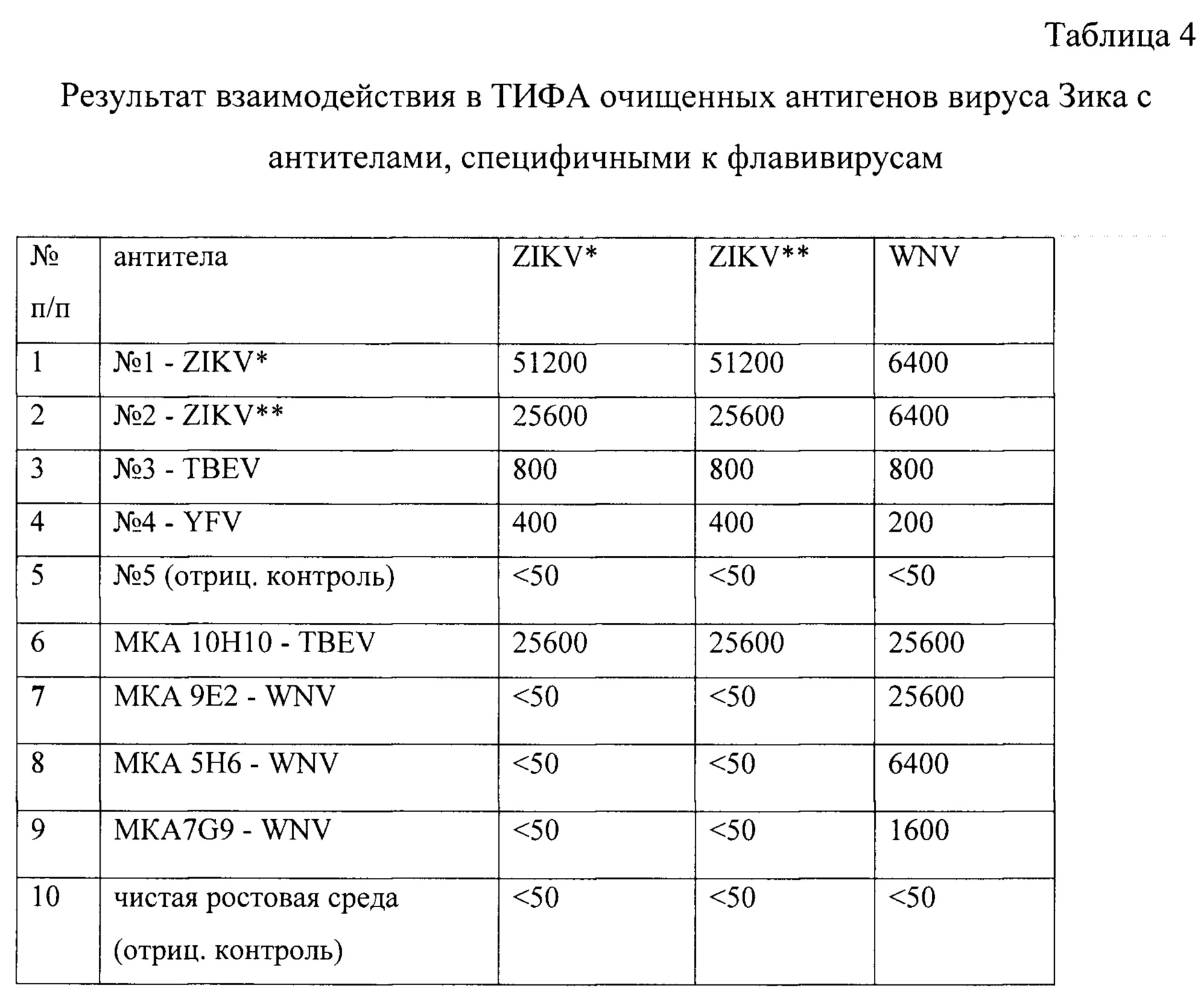
На фиг. 2 представлен график титрования антигенов ZIKV (очищенного лизата и супернатанта) с МКА 10Н10, специфичными к домену II белка Е инфекционного TBEV (Протопопова Е.В., Хусаинова А.Д., Коновалова С.Н. и др. Получение и характеризация антиидиотипических антител, несущих на своей поверхности гемагглютинирующие паратопы вируса клещевого энцефалита. Вопр. вирусол. 1996; 2: 50-53) и являющимися в в этой связи типоспецифичными, т.к. этот район 98-113 а.о. белка Е (пептид слияния с инфицируемой клеткой), по литературным данным, на 100% идентичен у флавивирусов, опасных для человека (Priyamvada L., Cho A., Onlamoon N. et al. В Cell Responses during Secondary Dengue Virus Infection Are Dominated by Highly Cross-Reactive, Memory-Derived Plasmablasts. / J Virol. 2016. 90(12): 5574-85. doi: 10.1128/JVI.03203-15). Кроме того, МКА 10H10 взаимодействуют с белком Е WNV и вируса Японского энцефалита (собственные неопубликованные данные). В качестве положительного контроля для МКА 10Н10 используется рекомбинантный белок - домен II белка Е ZIKV, который получен в прокариотической системе экспрессии части гена Е ZIKV и ранее описан (Шаньшин Д.В., Иматдинов И.Р., Никанорова Ю.В. и др. Получение продуцента рекомбинантного белка Е вируса Зика и его характеризация. / Материалы III международной конференция молодых ученых «Площадка открытых коммуникаций OpenBio-2016», Новосибирск, 2016, С 80-82). Как видно из результатов титрования антигенов (фиг. 2), в инактивированных препаратах ZIKV сохраняется, по крайней мере, эпитоп на домене II белка Е, узнаваемый МКА 10Н10, специфичными к домену II этого белка флавивирусов.
В табл. 4 представлены результаты взаимодействия антител, специфичных к антигенам ZIKV (очищенных фракций лизата и супернатанта от инфицированных клеток Vero) с гомологичными антигенами. Как и следовало ожидать, наблюдается перекрестная активность поликлональных антител, специфичных к TBEV и YFV с очищенными антигенами ZIKV. В то же время, МКА 9Е2, 5Н6 и 7G9, строго видоспецифичные к WNV (Razumov I.A., Kazachinskaia E.I., Ternovoi V.A., et al. Neutralizing monoclonal antibodies aganst Russian strain of the West Nile virus. / Viral Immunology. 2005; 18(3): 558-568) не взаимодействуют с антигенами ZIKV.
Антигенность инактивированных препаратов ZIKV проявляется также в их способности взаимодействовать с антителами в ИБ (см. пример 6). Как видно на фиг. 3, белок Е в полученных очищенных фракциях ZIKV (в лизате инфицированных клеток Vero и супернатанте от их ростовой среды), а также в очищенном WNV и вакцинных препаратах TBEV и YFV выявляется родоспецифичными МКА 10Н10.

Поликлональные антитела, специфичные к антигенам ZIKV, выявляют вирусные белки в гомологичных и гетерологичных вирусных препаратах (фиг. 4 и 5). По маркерам молекулярной массы белков и литературным данным, это белок Е (55 кДа) и, предположительно, NS5, NS3, NS1, димер NS2b, preM, димер С и М на уровне приблизительно 105, 70, 40, 28, 25, 11 и 8 кДа, соответственно.
8.4. Исследование вируснейтрализующей активности поликлональных мышиных антител, специфичных к инактивированным препаратам ZIKV, на культуре клеток Vero.
Чувствительная культура клеток.
Культура клеток Vero (клетки почки африканской зеленой мартышки) была выбрана для исследования на основании данных о том, что она поддерживает продуктивную репликацию ZIKV, вызывая цитопатическое действие (ЦПД), наблюдаемое в световой микроскоп (Chan J.F., Yip С.С., Tsang J.О. et al. Differential cell line susceptibility to the emerging Zika virus: implications for disease pathogenesis, non-vector-borne human transmission and animal reservoirs. Emerg Microbes Infect. 2016; 5:e93. doi: 10.1038/emi.2016.99).
Схема проведения реакции нейтрализации вируса.
По литературным данным для реакции нейтрализации вирусов, вызывающих дегенерацию зараженных однослойных тканевых культур используют титр вируса в 50-%-ной тканевой цитопатической дозе (ТЦПД50), обычно это 100 ТЦПД50 в лунке в объеме 100 мкл (Леннет Э., Шмидт Н. / Лабораторная диагностика вирусных и риккетсиозных заболеваний. Москва, «Медицина» 1974, с. 44, 95).
Культура клеток Vero выращивается до 80%-ного монослоя в 96-луночных стерильных культуральных планшетах в ростовой среде ДМЕМ с 10% фетальной сыворотки крови крупного рогатого скота (КРС). Вирусный препарат в виде ранее приготовленной культуральной среды (в трех инфекционных титрах - 105, 104 и 103 ТЦПД50/мл) перед нанесением на монослой клеток предварительно инкубируется в течение 1 часа при 37°С с мышиными сыворотками крови, полученными при иммунизации (см. табл. 3) (с разведения 1/50 двойной шаг в среде ДМЕМ с 2% КРС, прогретой при 56°С для инактивации белков комплемента). Далее с монослоя клеток удаляется ростовая среда и заливается суспензия вируса с антителами (сыворотками крови). После экспозиции в течение 1 часа при 37°С данные смеси удаляются, отмывается монослой клеток средой без сыворотки и заливается поддерживающая среда ДМЕМ с 2% прогретой КРС. Результаты учитываются визуально при ежедневном наблюдении в световой микроскоп, ЦПД вируса на клетки сравнивали с контрольными рядами: 1) титрование вируса на клетках; 2) клетки, незараженные вирусом, 3) клетки, незараженные вирусом, но обработанные сыворотками крови (тест на токсичность). Протоколы заполняются на каждые сутки наблюдений. В тот день, когда проходит ЦПД на клетки в лунках контрольного ряда титрования вируса (обычно на 7 сутки), учитывается результат титрования вируса в ТЦПД50/мл и результат его нейтрализации антителами.
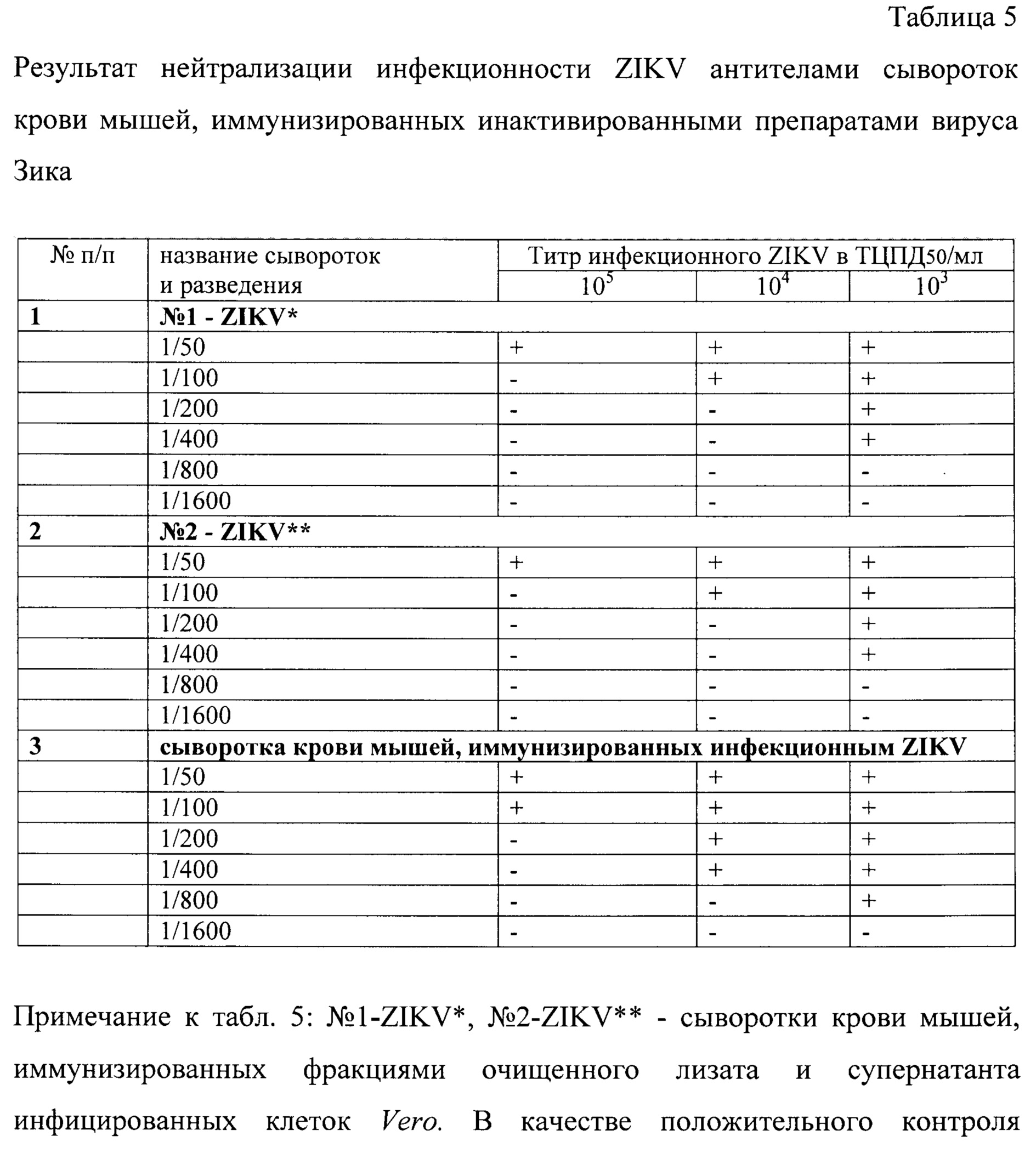
Как видно из результатов, представленных в табл. 5, инактивированные препараты ZIKV (очищенный лизат и супернатант) вызывают в организме иммунизированных мышей линии Balb/c синтез антител, которые в разведении 1/50, 1/100 и 1/400 нейтрализуют инфекционный ZIKV в титре от 105, 104 и 103 ТЦПД50/мл, соответственно.
Таким образом, заявляемое техническое решение позволяет получать из каждой фракции вируссодержащего материала (лизата и супернатанта инфицированных клеток Vero, с одного культурального флакона площадью 175 см2 в объеме 100 мл ростовой среды) инактивированные (биобезопасные), концентрированные и очищенные препараты ZIKV в концентрации 0,5 мг/мл с сохраненной антигенной структурой вирусного гликопротеина Е, вызывающей синтез нейтрализующих антител при иммунизации мышей линии Balb/c.